Предлагаемое изобретение относится к области химии, касается способа синтеза фосфатов металлов в степени окисления III вида RR'(PO4)3 и R1-xR'x(PO4)3, где R,R' - Al, Cr, Fe, Sb, La, Ce, Pr, Nd, Bi, которые обладают химической стойкостью и термической стабильностью. Высокая устойчивость позволяет применять их в специальной электротехнике как керамические изоляторы и ферромагнетики, в химической технологии как матрицы для иммобилизации токсичных промышленных отходов.
Известен синтез BiFe2(PO4)3 (Anand Theerthan. Effect of electric and magnetic stresses on ferroelectric single crystals and ceramics: Docteur.  Bordeaux 1, 2013. https://tel.archives-ouvertes.fr/tel-00914178/document) в виде поликристаллического порошка методом совместного осаждения солей из водного раствора и монокристаллов, выращенных расплавным методом. Для получения поликристаллического фосфата стехиометрические соотношения Bi2O3, Fe2O3 и (NH4)2HPO4 тщательно перемешивали в агатовой ступке. К исходной смеси добавили 2%-ный избыток (NH4)2HPO4 из-за неизбежного присутствия воды в нем. Затем смесь помещали в 3D планетарную мельницу вместе с этанолом для образования однородной суспензии. Полученную суспензию помещали в печь и выдерживали при температуре 110°С в течение 12 часов для удаления этанола и воды. Затем полученную смесь постепенно нагревали на воздухе до 400, 600 и 975°С в течение 15 часов с промежуточным измельчением. Для всех температурных ступеней скорость нагрева составляла 2°C⋅мин-1. После окончательной термообработки образец закаливали на воздухе до комнатной температуры. Недостатком метода является трудоемкость, значительные затраты времени, в том числе связанные с использованием трехмерной планетарной мельницы, использование исходных реагентов в синтезе не обосновано.
Bordeaux 1, 2013. https://tel.archives-ouvertes.fr/tel-00914178/document) в виде поликристаллического порошка методом совместного осаждения солей из водного раствора и монокристаллов, выращенных расплавным методом. Для получения поликристаллического фосфата стехиометрические соотношения Bi2O3, Fe2O3 и (NH4)2HPO4 тщательно перемешивали в агатовой ступке. К исходной смеси добавили 2%-ный избыток (NH4)2HPO4 из-за неизбежного присутствия воды в нем. Затем смесь помещали в 3D планетарную мельницу вместе с этанолом для образования однородной суспензии. Полученную суспензию помещали в печь и выдерживали при температуре 110°С в течение 12 часов для удаления этанола и воды. Затем полученную смесь постепенно нагревали на воздухе до 400, 600 и 975°С в течение 15 часов с промежуточным измельчением. Для всех температурных ступеней скорость нагрева составляла 2°C⋅мин-1. После окончательной термообработки образец закаливали на воздухе до комнатной температуры. Недостатком метода является трудоемкость, значительные затраты времени, в том числе связанные с использованием трехмерной планетарной мельницы, использование исходных реагентов в синтезе не обосновано.
При получении монокристаллов полученный в предыдущем методе порошок помещали в платиновый тигель и нагревали до полного плавления при 1125°C на воздухе в течение 6 ч со скоростью 2°C/мин. Затем расплав медленно охлаждали до 1000°C со скоростью 1.8°C/час. Затем образец охлаждали до комнатной температуры 24 часа. Выращенные кристаллы были в основном меньше миллиметра и имели форму иголок.
Недостатком метода являются высокая температура и значительные затраты времени, затрудняющие управление состоянием продукта синтеза.
В задачу изобретения положено создание нового способа синтеза фосфатов металлов в степени окисления III состава RR'(PO4)3 и R1-xR'x(PO4)3, где R,R' - Al, Cr, Fe, Sb, La, Ce, Pr, Nd, Bi.
Техническим результатом от использования изобретения является повышение реакционной способности шихты, сокращение продолжительности процесса и снижение температуры получения продукта.
Поставленная задача достигается тем, что способ синтеза фосфатов металлов в степени окисления III включает приготовление растворов солей металлов из исходных реагентов, в качестве которых используют нитраты, хлориды металлов, ацетат хрома, смешение растворов солей металлов с раствором кислоты H3PO4, поэтапную сушку реакционной смеси при температурах 90°С и 200°С для полного обезвоживания продукта, дальнейшую поэтапную термообработку реакционной смеси при температуре 600-1000°С в течение 12-48 часов, диспергирование и контроль химического и фазового состава методами электронно-зондового микроанализа и рентгенографии после каждой термообработки, при этом используют сочетания следующих катионов металлов в химическом составе поликристаллических RR'(PO4)3 фосфатов R - Bi, SbxBi1-x (0 ≤ x ≤ 1), R' - Fe2, Cr2, AlxCr2-x (0 ≤ x ≤ 0.5) или R - Sb, La, Ce, Pr, Nd, R' - Cr2; диспергирование осуществляют после каждой термообработки в течение 30 минут; осуществляют дополнительную термообработку образца при температуре последнего нагрева в случае появления на рентгенограмме аморфного гало, наличия нечетких дифракционных максимумов и асимметрии профилей дифракционных линий на рентгенограмме, свидетельствующих о наличии аморфной фазы и несовершенств кристаллической структуры в образце; для получения монокристаллов BiFe2(PO4)3 в качестве шихты используют поликристаллический фосфат, предварительно синтезированный способом по п. 1, который нагревают до температуры расплава, монокристаллы получают при понижении температуры расплава BiFe2(PO4)3 от 1080°С до 950°С со скоростью 2.7 град/ч и последующем охлаждении образца до комнатной температуры в течение 20 ч.
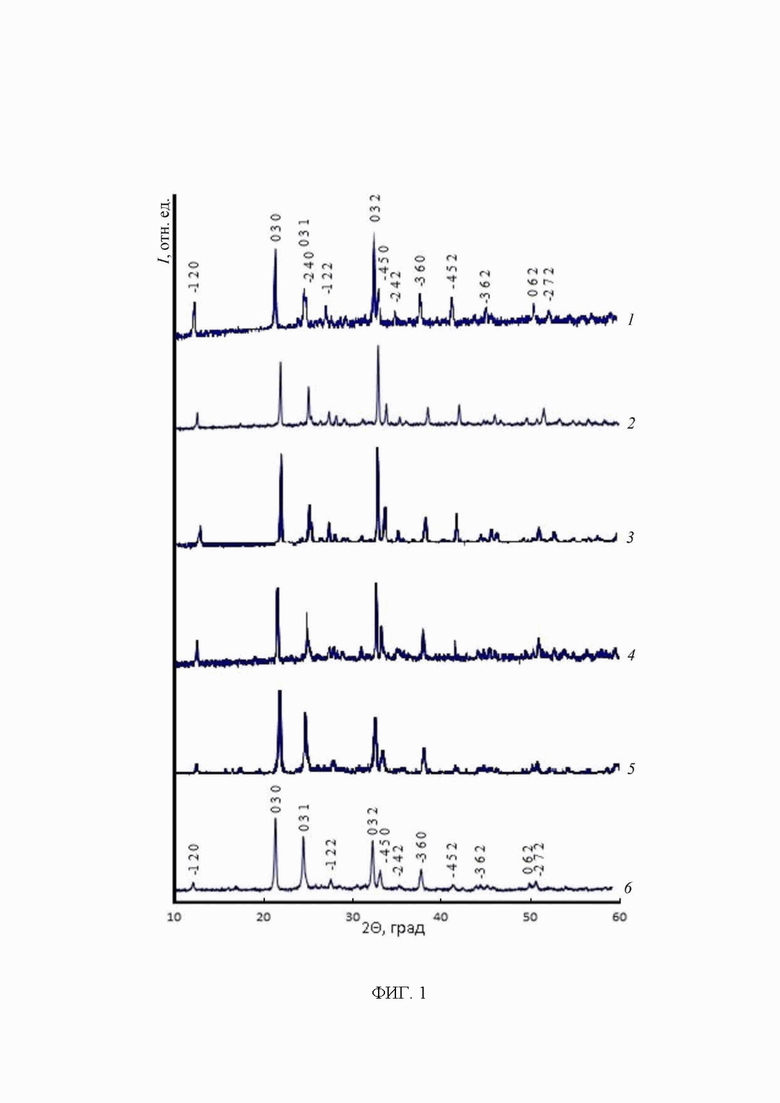
На фиг. 1 представлены рентгенограммы фосфатов, где: 1 - BiFe2(PO4)3, 2 - BiCr2(PO4)3, 3 - Sb0.25Bi0.75Cr2(PO4)3, 4 - Sb0.5Bi0.5Cr2(PO4)3, 5 - Sb0.75Bi0.25Cr2(PO4)3, 6 - SbCr2(PO4)3.
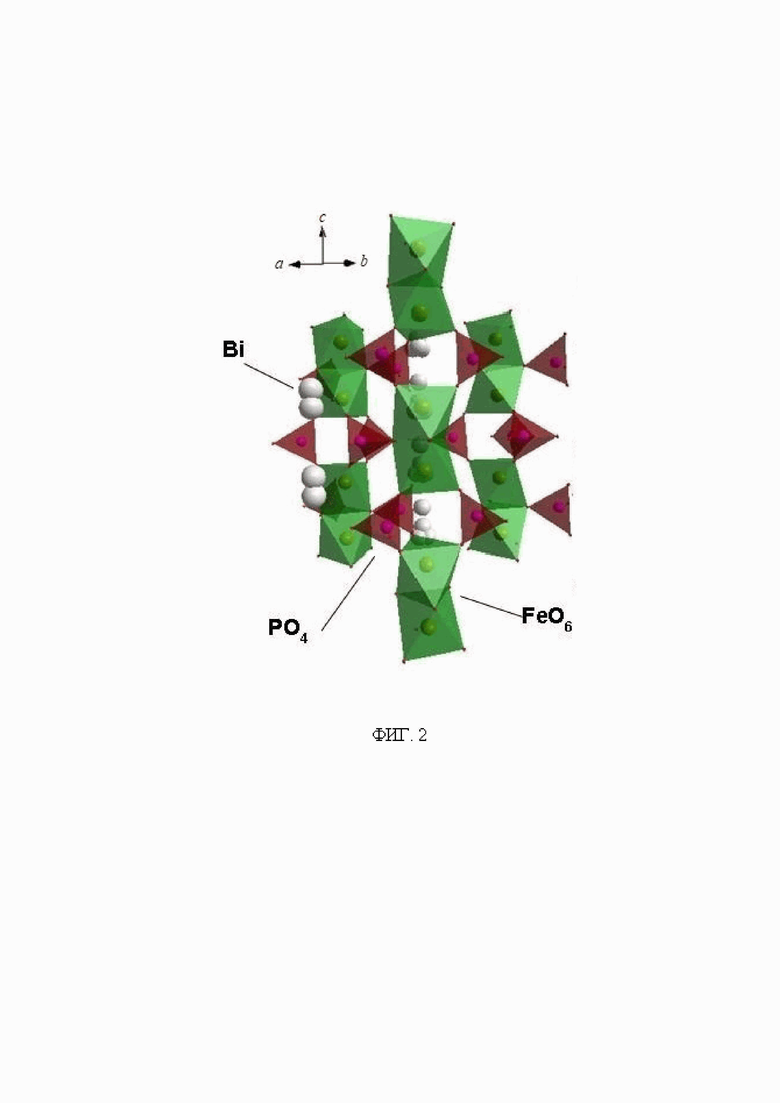
На фиг. 2 представлена структура фосфата BiFe2(PO4)3, аналога (α-CaMg2(SO4)3).
Предлагаемый способ синтеза фосфатов металлов в степени окисления III осуществляют следующим образом.
Предварительно проводят структурно-химический дизайн возможных новых фосфатов на основе кристаллохимических принципов. С учетом ионных радиусов металлов в степени окисления III прогнозируют вероятность нахождения атомов в сходных позициях кристаллической структуры (см. книгу В.С. Урусов. Теоретическая кристаллохимия, М.: Изд-во МГУ, 1987. - 275 с.). Близость ионных радиусов металлов и их одинаковая степень окисления III позволяет рассчитывать на их изоморфизм в фосфатах, то есть смешение в составе однофазного продукта - фосфата в эквивалентных позициях кристаллической структуры металлов близких ионных радиусов, отличающихся на 10-15%.
После теоретического этапа проводят эмпирический этап, включающий проведение различных анализов, позволяющих установить оптимальные промежуточные тепловые обработки, их продолжительность, температурную границу синтеза. Для этого используют синхронный дифференциально-термический и термогравиметрический анализ (ДТА-ТГ), позволяющие в динамике оценить температуры экзо- и эндотермических эффектов, связанных с фазовыми превращениями в образце. Помимо динамического определения температур промежуточных изотермических обработок и возможной температуры синтеза используют метод статического нагревания для определения минимального (оптимального) времени термообработки на каждой изотермической стадии. Суть метода заключается в поэтапном изотермическом нагреве образца, после которого проводятся рентгенофазовый и электронно-микрозондовый анализы, позволяющие определить изменение фазового и химического состава образца.
На эмпирическом этапе, также, определяют реагенты, использование которых позволит провести последующую твердофазную реакцию. Преимущественно, в качестве таких веществ используют нитраты, карбонаты, хлориды металлов, соли органических кислот, например, ацетат хрома. Их разложение при нагреве приводит к перестройке кристаллической структуры, вызывая большое количество дефектов кристаллической решетки, благоприятно влияющих на скорость протекания последующей твердофазной реакции. Использование термически устойчивых веществ (оксидов) требует более высоких температур для их активации и начала протекания реакции.
В дальнейшем осуществляют приготовление растворов солей металлов из исходных реагентов, смешение растворов солей металлов в степени окисления III с растворами кислоты H3PO4 или ее соли NH4H2PO4, поэтапную сушку реакционной смеси до полного обезвоживания продукта сначала при температуре 90°С, затем при температуре 200°С, дальнейшую термообработку реакционной смеси с диспергированием и контролем химического и фазового состава методами электронно-зондового микроанализа и рентгенографии после каждого нагрева.
Термообработку реакционной смеси осуществляют в течение 6-48 часов. Нагрев фосфата менее 6 часов приводит к неполной кристаллизации, и, следовательно, образец может быть неоднофазным. Термообработка более 48 часов не вызывает заметных изменений в сформированном однофазном кристаллическом образце, и является неоправданной затратой ресурсов.
Диспергирование смеси осуществляют после каждой термообработки, например, в течение 30 минут.
В случае появления на рентгенограмме аморфного гало, наличия нечетких дифракционных максимумов и асимметрии профилей дифракционных линий на рентгенограмме, свидетельствующих о наличии аморфной фазы и несовершенств кристаллической структуры в образце, осуществляют дополнительную термообработку образца при температуре последнего нагрева.
Ниже приведены примеры конкретного осуществления предлагаемого изобретения.
Пример 1.
Фосфат BiFe2(PO4)3 со структурой α-CaMg2(SO4)3 был спрогнозирован на основе кристаллохимических данных. Структурной основой фосфата I служит каркас {[Fe2(PO4)3]3-}3∞, в котором атомы Fe координированы шестью атомами кислорода от шести тетраэдров РО4 с расстоянием Fe-O 1.897-2.140 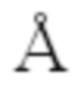 и P-O 1.508-1.559
и P-O 1.508-1.559 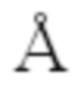 (рис. 2). Тетраэдры PO4 двумя вершинами скрепляют вершины двух сдвоенных гранями октаэдров FeO6, образуя колонку, и двумя другими вершинами присоединяются к соседним колонкам, образуя смешанный каркас. В пустотах каркаса располагаются атомы Bi, которые окружены шестью атомами кислорода (координационные полиэдры - тригональные призма Bi1 и антипризма Bi2). Расстояния Bi-О находятся в пределах 2.155-3.192
(рис. 2). Тетраэдры PO4 двумя вершинами скрепляют вершины двух сдвоенных гранями октаэдров FeO6, образуя колонку, и двумя другими вершинами присоединяются к соседним колонкам, образуя смешанный каркас. В пустотах каркаса располагаются атомы Bi, которые окружены шестью атомами кислорода (координационные полиэдры - тригональные призма Bi1 и антипризма Bi2). Расстояния Bi-О находятся в пределах 2.155-3.192 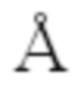 .
.
Для синтеза фосфата в качестве исходных реагентов были выбраны Fe2O3, Bi2O3, H3PO4. Их использование позволило провести процесс при наиболее низкой температуре.
Для получения 2 г фосфата BiFe2(PO4)3 на первом этапе к стехиометрической навеске Fe2O3 добавляли раствор соляной кислоты до полного растворения навески. К образовавшемуся раствору добавляли стехиометрическую навеску Bi2O3. Затем при постоянном перемешивании по каплям добавляли раствор фосфорной кислоты, взятый также в соответствии со стехиометрией образца (см. таблицу 1).
Реакционную смесь первоначально высушивали при температуре 90°С для удаления воды и далее при 200°С для полного обезвоживания продукта. В дальнейшем реакционную смесь подвергли термообработке при 600°С в течении 24 часов, после которой образец диспергировали в агатовой ступке в течение 30 минут с применением изопропилового или этилового спирта для обеспечения гомогенизации смеси. Затем образец снова обжигали в печи при температуре 800°С. Каждую стадию нагревания чередовали с диспергированием.

BiFe2(PO4)3, по данным рентгенофазового анализа (РФА) (рис. 1), кристаллизуется в структуре α-CaMg2(SO4)3 (пр. гр. P63/m), параметры его элементарной ячейки: a=14.3115(4), c=7.4311(2) 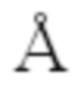 , V=1318.12(8)
, V=1318.12(8)  Данные электронно-зондового микроанализа показали однородность состава зерен, их состав отвечал формуле Bi1.01(2)Fe2.00(1)P3.00(2)O12 (таблица 5).
Данные электронно-зондового микроанализа показали однородность состава зерен, их состав отвечал формуле Bi1.01(2)Fe2.00(1)P3.00(2)O12 (таблица 5).
Данный способ синтеза превосходит способ описанный ранее (Anand Theerthan. Effect of electric and magnetic stresses on ferroelectric single crystals and ceramics: Docteur.  Bordeaux 1, 2013) тем, что он включает выбор исходных реагентов, благоприятно влияющих на скорость протекания последующей твердофазной реакции, приготовление растворов солей металлов из исходных реагентов, смешение растворов солей металлов с раствором кислоты H3PO4, поэтапную сушку реакционной смеси при температурах 90°С и 200°С для полного обезвоживания продукта, дальнейшую термообработку реакционной смеси в течение 12-48 часов и диспергирование в агатовой ступке (отличается от мельницы простотой очищения) на каждой стадии, меньшее число стадий синтеза, образование целевого продукта при более низкой температуре.
Bordeaux 1, 2013) тем, что он включает выбор исходных реагентов, благоприятно влияющих на скорость протекания последующей твердофазной реакции, приготовление растворов солей металлов из исходных реагентов, смешение растворов солей металлов с раствором кислоты H3PO4, поэтапную сушку реакционной смеси при температурах 90°С и 200°С для полного обезвоживания продукта, дальнейшую термообработку реакционной смеси в течение 12-48 часов и диспергирование в агатовой ступке (отличается от мельницы простотой очищения) на каждой стадии, меньшее число стадий синтеза, образование целевого продукта при более низкой температуре.
Для получения монокристаллов BiFe2(PO4)3 в качестве шихты использовали предварительно синтезированный поликристаллический фосфат. Монокристаллы получены при понижении температуры расплава BiFe2(PO4)3 от 1080 до 950°С со скоростью 2.7 град/ч. Затем образец охлаждали до комнатной температуры в течение 20 ч.
Данный способ синтеза превосходит способ описанный ранее (Anand Theerthan. Effect of electric and magnetic stresses on ferroelectric single crystals and ceramics: Docteur.  Bordeaux 1, 2013) тем, что нами используются более низкая температура расплава (1080°С вместо 1125°С), более высокая скорость его охлаждения от 1080 до 950°С (2.7 град/ч вместо 1.8 град/ч), меньшее последующее время охлаждения до комнатной температуры.
Bordeaux 1, 2013) тем, что нами используются более низкая температура расплава (1080°С вместо 1125°С), более высокая скорость его охлаждения от 1080 до 950°С (2.7 град/ч вместо 1.8 град/ч), меньшее последующее время охлаждения до комнатной температуры.
Пример 2.
Фосфаты SbxBi1-xCr2(PO4)3, (0 ≤ x ≤ 1) с ожидаемой структурой α-CaMg2(SO4)3 были спрогнозированы на основе кристаллохимических данных. В данном случае каркас структуры образуют октаэдры CrO6, тетраэдры PO4. Внекаркасные позиции занимают катионы большего радиуса - это Sb3+ и Bi3+ (одинаковые степени окисления, ионные радиусы близки).
Для получения данного ряда фосфатов использовали следующие реагенты: Sb2O3, Bi2O3, Cr(CH3COO)3 и H3PO4.
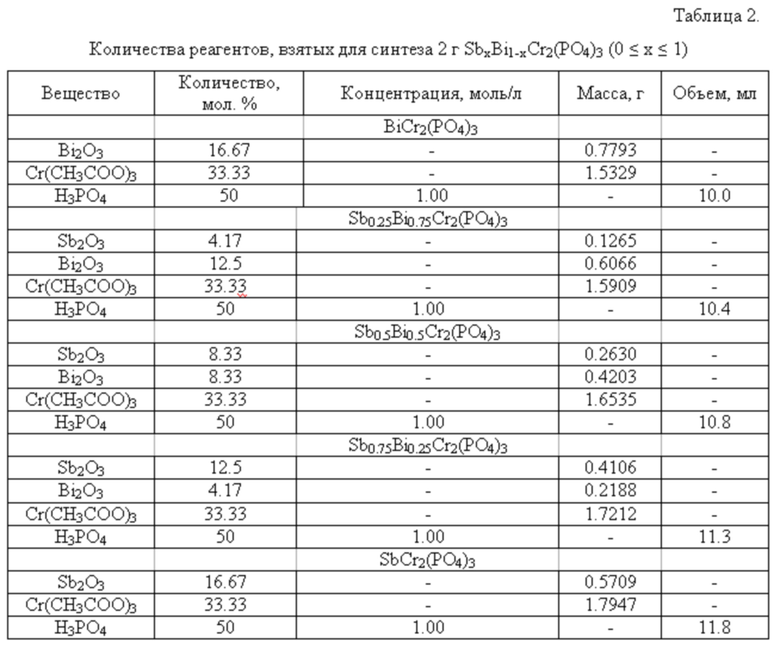
Для получения 2 г продукта на первом этапе к стехиометрической навеске Bi2O3 добавляли раствор соляной кислоты до полного растворения оксида. К образовавшемуся раствору добавляли стехиометрическую навеску Sb2O3, а после его растворения стехиометрическую навеску Cr(CH3COO)3. Затем при постоянном перемешивании по каплям добавляли раствор фосфорной кислоты, взятый также в соответствии со стехиометрией образца (см. таблицу 2).
Реакционную смесь первоначально высушивали при температуре 90°С для удаления воды и далее при 200°С для полного обезвоживания продукта. В дальнейшем реакционную смесь подвергли термообработке при 600°С в течении 24 часов, после которой образец диспергировали в агатовой ступке в течение 30 минут с применением изопропилового или этилового спирта для обеспечения гомогенизации смеси. Затем образец снова обжигали в печи при температурах 800, 900 и 1000°С. Каждую стадию нагревания чередовали с диспергированием. Конечная температура получения целевого продукта зависела от состава твердого раствора.
По данным рентгенографии все образцы состава SbxBi1-xCr2(PO4)3 (0 ≤ x ≤ 1) (рис. 1) кристаллизуются в структуре α-CaMg2(SO4)3 и образуют неограниченный твердый раствор. Данные электронно-зондового микроанализа показали однородность состава их зерен и соответствие ожидаемых (спрогнозированных) и фактических составов с учетом погрешности метода (таблица 5).
Пример 3.
Фосфаты BiAlxCr2-x(PO4)3, 0 ≤ x ≤ 0.5 с ожидаемой структурой α-CaMg2(SO4)3 были спрогнозированы на основе кристаллохимических данных. В данном случае каркас структуры образуют октаэдры CrO6 и AlO6 (одинаковые степени окисления, ионные радиусы близки), тетраэдры PO4. Внекаркасные позиции занимают катионы большего радиуса - Bi3+.
Для получения данного ряда фосфатов использовали следующие реагенты: Bi2O3, AlCl3, Cr(CH3COO)3 и H3PO4.
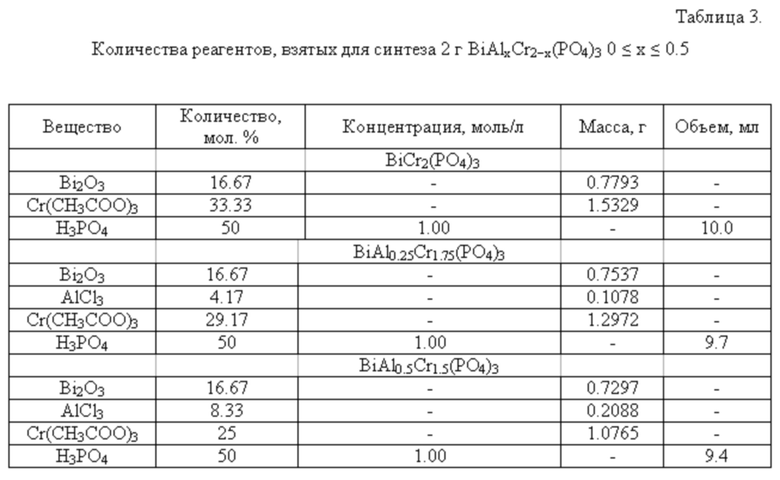
Для получения 2 г продукта на первом этапе к стехиометрической навеске Bi2O3 добавляли раствор соляной кислоты до полного растворения оксида. К образовавшемуся раствору добавляли стехиометрическую навеску AlCl3, а после ее растворения стехиометрическую навеску Cr(CH3COO)3. Затем при постоянном перемешивании по каплям добавляли раствор фосфорной кислоты, взятый также в соответствии со стехиометрией образца (см. таблицу 3).
Реакционную смесь первоначально высушивали при температуре 90°С для удаления воды и далее при 200°С для полного обезвоживания продукта. В дальнейшем реакционную смесь подвергли термообработке при 600°С в течении 24 часов, после которой образец диспергировали в агатовой ступке в течение 30 минут с применением изопропилового или этилового спирта для обеспечения гомогенизации смеси. Затем образец снова обжигали в печи при температурах 800 и 1000°С. Каждую стадию нагревания чередовали с диспергированием.
По данным рентгенографии все образцы состава BiAlxCr2-x(PO4)3 0 ≤ x ≤ 0.5 кристаллизуется в структуре α-CaMg2(SO4)3 и образуют ограниченный твердый раствор. Данные электронно-зондового микроанализа показали однородность состава их зерен и соответствие ожидаемых (спрогнозированных) и фактических составов с учетом погрешности метода (таблица 5).
Пример 4.
Фосфаты RCr2(PO4)3, где R=La, Ce, Pr, Nd, с ожидаемой структурой α-CaMg2(SO4)3 были спрогнозированы на основе кристаллохимических данных. В данном случае каркас структуры образуют октаэдры CrO6, тетраэдры PO4. Внекаркасные позиции занимают катионы большего радиуса - R3+.
Для получения данного ряда фосфатов использовали следующие реагенты: LaF3⋅0.5H2O, Ce(NO3)3⋅6H2O, Pr(NO3)3∙6H2O, Nd2O3, Cr(CH3COO)3 и H3PO4.
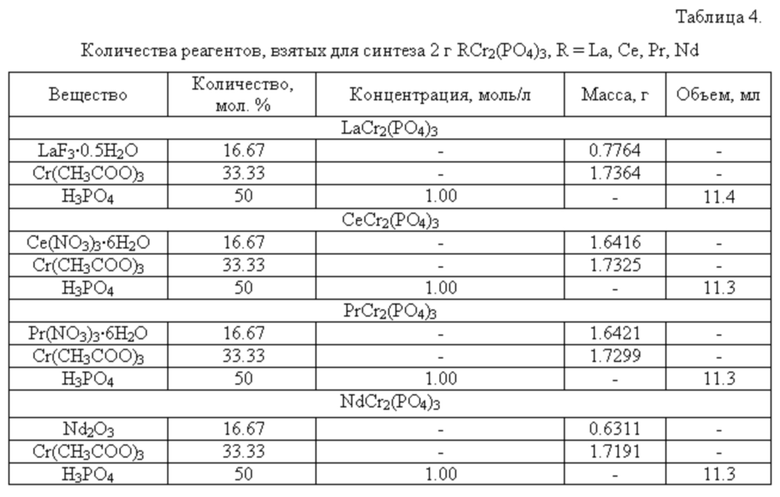
Для получения 2 г продукта на первом этапе к навеске LaF3⋅0.5H2O (или Ce(NO3)3⋅6H2O, или Pr(NO3)3⋅6H2O, или Nd2O3) добавляли раствор соляной кислоты до полного растворения навески. К образовавшемуся раствору добавляли Cr(CH3COO)3. Затем при постоянном перемешивании по каплям добавляли раствор фосфорной кислоты (см. таблицу 4).
Реакционную смесь первоначально высушивали при температуре 90°С для удаления воды и далее при 200°С для полного обезвоживания продукта. В дальнейшем реакционную смесь подвергли термообработке при 600°С в течении 24 часов, после которой образец диспергировали в агатовой ступке в течение 30 минут с применением изопропилового или этилового спирта для обеспечения гомогенизации смеси. Затем образец снова обжигали в печи при температурах 800, 1000 и 1200°С. Каждую стадию нагревания чередовали с диспергированием.
По данным рентгенографии все образцы состава RCr2(PO4)3 кристаллизуются в структуре α-CaMg2(SO4)3. Данные электронно-зондового микроанализа показали однородность состава их зерен и соответствие ожидаемых (спрогнозированных) и фактических составов с учетом погрешности метода (таблица 5).

Таким образом, повышение реакционной способности шихты достигается благодаря использованию в синтезе нитратов, карбонатов, хлоридов металлов, солей органических кислот (например, ацетат хрома), которые подвергаясь термическому разложению при воздействии температурного поля, увеличивают удельную поверхность и поверхностную активность реакционной зоны за счет перестройки кристаллической структуры и образования большого количества дефектов кристаллической решетки. Вследствие этого высокая активность такого материала приводит к увеличению скорости протекания последующей твердофазной реакции и формированию фазы продукта при более низкой температуре по сравнению с использованием термически устойчивых реагентов (оксидов), мало инициирующих реакцию и требующих более высоких температур для их активации и формирования требуемого продукта.
В представленных примерах в синтезе использованы катионы металлов: Bi3+, Fe3+, Cr3+, Sb3+, Al3+, La3+, Ce3+, Pr3+, Nd3+. Однако, синтез фосфатов может приводить к получению веществ с более широким спектром металлов в тех же степенях окисления, например, еще не изученных фосфатов RR'2(PO4)3 (R, R' - металлы в степени окисления III) и твердых растворов на их основе. Поэтому представленные примеры иллюстрируют предлагаемое изобретение, но не ограничивают его.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СИНТЕЗА СУЛЬФАТ-ФОСФАТОВ МЕТАЛЛОВ | 2016 |
|
RU2637244C1 |
| Способ конверсии изобутанола с его использованием | 2024 |
|
RU2824892C1 |
| ЭЛЕКТРОЛИТ ДЛЯ НАТРИЙ-ИОННЫХ АККУМУЛЯТОРОВ, СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ И АККУМУЛЯТОР НА ЕГО ОСНОВЕ | 2018 |
|
RU2707575C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОРАЗМЕРНОГО КАЛЬЦИЙ-ДЕФИЦИТНОГО КАРБОНАТСОДЕРЖАЩЕГО ГИДРОКСИАПАТИТА | 2014 |
|
RU2588525C1 |
| ФОСФАТЫ МЕТАЛЛОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2613979C2 |
| Способ получения твердого электролита LiAlTi(PO) для твердотельных литий-ионных аккумуляторов | 2023 |
|
RU2821885C1 |
| Способ получения активного электродного материала и активного композитного электродного материала для металл-ионных аккумуляторов, активный электродный материал и активный композитный электродный материал, электродная паста, электрод и металл-ионный аккумулятор на основе электродного материала | 2023 |
|
RU2804050C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИКРИСТАЛЛИЧЕСКИХ СЦИНТИЛЛЯЦИОННЫХ МАТЕРИАЛОВ В ФОРМЕ ПОРОШКОВ | 2017 |
|
RU2682554C1 |
| СПОСОБ ПОЛУЧЕНИЯ СЛОЖНЫХ ОКСИСУЛЬФИДНЫХ СОЕДИНЕНИЙ ЕВРОПИЯ И ПЕРЕХОДНОГО ЭЛЕМЕНТА | 2023 |
|
RU2835250C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОКРИСТАЛЛИЧЕСКОГО КРЕМНИЙЗАМЕЩЕННОГО ГИДРОКСИАПАТИТА | 2012 |
|
RU2500840C1 |
Изобретение может быть использовано при изготовлении керамических изоляторов и ферромагнетиков, матриц для иммобилизации токсичных промышленных отходов. Способ синтеза фосфатов металлов в степени окисления III включает приготовление растворов солей металлов из исходных реагентов, в качестве которых используют нитраты, хлориды металлов, ацетат хрома. Растворы солей металлов смешивают с раствором H3PO4 и проводят поэтапную сушку реакционной смеси при 90°С и 200°С для полного обезвоживания продукта. Затем проводят поэтапную термообработку реакционной смеси при 600-1000°С в течение 12-48 ч, диспергирование и контроль химического и фазового состава методами электронно-зондового микроанализа и рентгенографии после каждой термообработки. Используют сочетания следующих катионов металлов в химическом составе поликристаллических RR'(PO4)3 фосфатов: R - Bi, SbxBi1-x (0 ≤ x ≤ 1), R' - Fe2, Cr2, AlxCr2-x (0 ≤ x ≤ 0,5) или R - Sb, La, Ce, Pr, Nd, R' - Cr2. Изобретение позволяет повысить реакционную способность шихты, снизить продолжительность процесса и температуру получения продукта. 3 з.п. ф-лы, 2 ил., 5 табл., 4 пр.
1. Способ синтеза фосфатов металлов в степени окисления III включает приготовление растворов солей металлов из исходных реагентов, в качестве которых используют нитраты, хлориды металлов, ацетат хрома, смешение растворов солей металлов с раствором кислоты H3PO4, поэтапную сушку реакционной смеси при температурах 90°С и 200°С для полного обезвоживания продукта, дальнейшую поэтапную термообработку реакционной смеси при температуре 600-1000°С в течение 12-48 часов, диспергирование и контроль химического и фазового состава методами электронно-зондового микроанализа и рентгенографии после каждой термообработки, при этом используют сочетания следующих катионов металлов в химическом составе поликристаллических RR'(PO4)3 фосфатов: R - Bi, SbxBi1-x (0 ≤ x ≤ 1), R' - Fe2, Cr2, AlxCr2-x (0 ≤ x ≤ 0,5) или R - Sb, La, Ce, Pr, Nd, R' - Cr2.
2. Способ по п. 1, отличающийся тем, что диспергирование осуществляют после каждой термообработки в течение 30 минут.
3. Способ по п. 1, отличающийся тем, что осуществляют дополнительную термообработку образца при температуре последнего нагрева в случае появления на рентгенограмме аморфного гало, наличия нечетких дифракционных максимумов и асимметрии профилей дифракционных линий на рентгенограмме, свидетельствующих о наличии аморфной фазы и несовершенств кристаллической структуры в образце.
4. Способ по п. 1, отличающийся тем, что для получения монокристаллов BiFe2(PO4)3 в качестве шихты используют поликристаллический фосфат, предварительно синтезированный способом по п. 1, который нагревают до температуры расплава, монокристаллы получают при понижении температуры расплава BiFe2(PO4)3 от 1080°С до 950°С со скоростью 2,7 град./ч и последующем охлаждении образца до комнатной температуры в течение 20 ч.
| ЛАВРЕНОВ Д.А | |||
| и др | |||
| Синтез, фазообразование и термические свойства BiFe2(PO4)3 и Bi1−xSbхCr2(PO4)3, Сборник тезисов конференции "Кристаллохимия в пространстве и времени", Научные чтения, посвященные 70-летию кафедры кристаллографии и кристаллохимии Геологического факультета МГУ, 2019, Москва, КДУ, сс | |||
| Спускная труба при плотине | 0 |
|
SU77A1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСНОГО МЕТАЛЛОФОСФАТНОГО ПРОДУКТА (ВАРИАНТЫ) | 2014 |
|
RU2579378C2 |
| СПОСОБ СИНТЕЗА СУЛЬФАТ-ФОСФАТОВ МЕТАЛЛОВ | 2016 |
|
RU2637244C1 |
Авторы
Даты
2021-10-27—Публикация
2020-12-28—Подача