Область техники, к которой относится изобретение
Изобретение относится к области медицины и медико-технических технологий, а именно к интраоперационной диагностике и функциональной диагностике, и предназначено для обнаружения и распознавания локальных неоднородностей, отличающихся по оптическим свойствам от окружающих биологических тканей в области исследования. Возможно применение изобретения для различных видов оперативного вмешательства или инвазивных манипуляций, а также для зондирования через интактные кожные покровы. В частности, изобретение может быть использовано в нейрохирургии для обнаружения и распознавания нейроваскулярных структур, артериальных и венозных сосудов и нервов, в объеме биологической ткани во время проведения операций по удалению опухоли головного мозга, в том числе эндоскопическим трансназальным методом.
Уровень техники
Задача по обнаружению и распознаванию нейроваскулярных структур особенно актуальна в нейрохирургии при выполнении операций по удалению новообразований. Проблематика текущих способов резекции опухолей основания черепа эндоскопическим трансназальным методом заключается в сложности проведения самой операции. Патологическая ткань удаляется эндоскопическим инструментарием через пазухи носа кусочно, по несколько миллиметров. В процессе операции высок риск повреждения нейроваскулярных структур, находящихся в объеме опухолевой ткани. Повреждение черепно-мозгового нерва приводит к утрате функциональных возможностей мышц, связанных с травмированным нервом, утрате важных физиологических функций, существенному ухудшению качества жизни; повреждение артериального сосуда - к мгновенному летальному исходу.
Для минимизации повреждения нейроваскулярных структур, а также для повышения степени радикальности резекции опухолевой ткани применимы современные методы и технические средства диагностики и визуализации, такие как магнитно-резонансная томография (МРТ), рентгеновская компьютерная томография (КТ), позитронно-эмиссионная томография (ПЭТ), магнитно-резонансная спектроскопия, однофотонная эмиссионная компьютерная томография (ОЭКТ), рентгенография и ангиография. Перечисленные диагностические методы и соответствующие технические средства позволяют проводить предоперационную диагностику, предоставляя информацию об индивидуальных анатомических (васкуляризация), физиологических (скорость кровотока, перфузия) и метаболических особенностях тканей и органов пациента. Для предоперационного определения расположения нервов в опухоли также применяют систему диффузионной тензорной трактографии [Yoshino M., Kin T., Ito A., Saito T., Nakagawa D., Ino K., Saito N. Feasibility of diffusion tensor tractography for preoperative prediction of the location of the facial and vestibulocochlear nerves in relation to vestibular schwannoma // Acta Neurochirurgica. - 2015. - 157(6), Р. 939-946]. Существенным недостатком указанных предоперационных диагностических систем является невозможность их применения для локальной нейронавигации в ходе операционных вмешательств. Для дифференцирования тканей и клеток, оценки их функциональной активности и локальной гемодинамики применимы оптические системы, реализующие возможность проведения исследований с помощью Рамановской спектроскопии in vivo [Cordero E., Latka I., Matthus Ch., Schie I.W., Popp J. In-vivo Raman Spectroscopy: from basics to applications // J. Biomed. Opt. - 2018. - 23(7), 071210-1-23, doi: 10.1117/1.JBO.23.7.071210], широкополосной [Wisotzky E. L., Uecker, Arens Ph., Dommerich S., Hilsmann A., Eisert P. Intraoperative hyperspectral determination of human tissue properties // J. Biomed. Opt. - 2018. - 23(9), 091409-(1-8), doi: 10.1117/1.JBO.23.9.091409] и узкополосной [Gono K., Obi T., Yamaguchi M., et al. Appearance of enhanced tissue features in narrow-band endoscopic imaging // J. Biomed. Opt. - 2004. - 9(3), 568-577] спектроскопии, мультиспектральной визуализации [Bolton F.J., Bernat A.S., Bar-Am K., Levitz D., and Jacques S. Portable, low-cost multispectral imaging system: design, development, validation, and utilization // J. Biomed. Opt. - 2018. - 23(12), 121612, doi: 10.1117/1.JBO.23.12.121612], флуоресцентной спектроскопии и визуализации [Bachmann L., Zezell D.M., Adriana da Costa Ribeiro, and Gomes L., Siuiti A. Fluorescence Spectroscopy of Biological Tissues-A Review // Applied Spectroscopy Reviews. - 2006. - 41: 575-590, doi: 10.1080/05704920600929498; Sun Y., Hatami N., Yee M., et al. Fluorescence lifetime imaging microscopy for brain tumor image-guided surgery // Journal of Biomedical Optics. - 2010. - 15(5), 056022; Pogue B.W., Gibbs-Strauss S.L., Valdes P.A., Samkoe K.S., Roberts D.W., and Paulsen K.D. Review of Neurosurgical Fluorescence Imaging Methodologies // IEEE J. of Selected Topics in Quantum Electronics. - 2010. - Vol. 16, No. 3, doi: 10.1109/JSTQE.2009.2034541], оптоакустической (фотоакустической) визуализации [Ovsepian S.V., Olefir I., Westmeyer G., Razansky D., and Ntziachristos V. Pushing the boundaries of neuroimaging with optoacoustics // Neuron. - 2017. - 96, р. 966-988] и мультимодальных сочетанных решений. Однако использование указанных оптических систем имеет ряд ограничений, таких как малая глубина зондирования (до 1,5 мм), отсутствие стандартных методик применения в клинической практике, либо технических решений, применимых in situ для нейрохирургии с эндоскопическим трансназальным доступом.
Известно применение ультразвуковых допплерографических (УЗДГ) систем для интраоперационной идентификации кровеносных сосудов [Шарипов О. И. и др. Опыт применения интраоперационной ультразвуковой допплерографии в эндоскопической транссфеноидальной хирургии //Журнал "Вопросы нейрохирургии" имени НН Бурденко. - 2016. - Т. 80. - №. 2. - С. 15-20]. Наличие сосуда в объеме биоткани определяют по скорости и направлению кровотока в сосуде. Для сканирования операционного поля применяют комбинированное устройство с подвижной рабочей частью, что позволяет лоцировать сосуды в различных направлениях. Наличие артериального сосуда, глубину его залегания относительно поверхности опухоли оценивают по монитору в окне М-режима (M-Mode). Ограничения систем УЗДГ связаны с низкой мобильностью ультразвуковых датчиков в малом операционном поле и со сложностью обнаружения нервных структур в объеме ткани. Система ультразвуковой визуализации нервов и сосудов, представленная в [Smistad E., Johansen K.F., Iversen D.H., Reinertsen I. Highlighting nerves and blood vessels for ultrasound-guided axillary nerve block procedures using neural networks // J. Med. Imag. - 2018. - Vol. 5. No. 4. P. 044004], не предназначена для малого операционного поля с ограниченным доступом, например, эндоназальной нейрохирургии. Идентификацию нейроваскулярных структур с помощью системы ультразвуковой визуализации проводят путем анализа получаемых трудно однозначно интерпретируемых изображений.
Для идентификации черепных нервов известно применение систем триггерной электромиографии (т-ЭМГ, t-EMG) и спонтанной электромиографии (free run ЭМГ, f-EMG) [Thirumala P. D., Mohanraj S. K., Habeych M., et al. Value of Free-Run Electromyographic Monitoring of Extraocular Cranial Nerves during Expanded Endonasal Surgery (EES) of the Skull Base // Journal of Neurological Surgery Reports. - 2013. - 74: R1, doi:10.1055/s-0033-1346975]. Нейрофизиологическая идентификация черепных нервов в несколько раз снижает частоту их поражения, и как следствие, повышает качество жизни пациентов. Однако система т-ЭМГ позволяет идентифицировать только двигательные и смешанные нервы. К основным недостаткам систем т-ЭМГ также относятся широкая зона распространения тока по электропроводящим тканям, что может привести к возбуждению отдаленных нервных структур и к ложному ответу на стимуляцию, и необходимость регистрации отклика на стимуляцию дополнительными измерительными средствами вне области локализации нерва. Современной альтернативой электрической стимуляции нервов является оптическая инфракрасная (ИК) стимуляция [Cayce J. M., Wells J. D., Malphrus J. D., et al. Infrared neural stimulation of human spinal nerve roots in vivo // Neurophotonics. - 2015. - 2(1). - Р. 015007; Wells J., Konrad P., Kao C. et al. Pulsed laser versus electrical energy for peripheral nerve stimulation // Journal of Neuroscience Methods. - 2007. - 163(2). - P. 326-337], не требующая непосредственного контакта со стимулируемым нервом и оказывающая локальное воздействие. Однако подобные системы ИК-стимуляции на сегодняшний день находятся в стадии разработки, и их существенными ограничениями являются возможность обнаружения нерва только при его поверхностном залегании и необходимость использования дополнительных средств для регистрации отклика. Оптические системы для отражательной диффузионной и флуоресцентной спектроскопии [Balthasar A., Desjardins A.E., M. van der Voort, et al. Optical Detection of Peripheral Nerves: An in Vivo Human Study // Regional anesthesia and pain medicine. - 2012. - Vol. 37, No. 3, p. 277-82; Langhout G.C., Kuhlmann K.F.D., Schreuder P. In Vivo Nerve Identification in Head and Neck Surgery Using Diffuse Reflectance Spectroscopy // Laryngoscope Investigative Otolaryngology. - 2018. - 3. - P. 349-355] позволяют интраоперационно дифференцировать ткани по составу, например, по концентрациям гемоглобина и липидов. Однако данные системы используют для идентификации поверхностно расположенных тканей и структур, в том числе нервов, т.к. анализ глубинных слоев ткани нереализуем. Современные системы пространственно модулированной диффузионной визуализации (так называемые SFDI [Gioux S., Mazhar A., Cuccia D.J. Spatial frequency domain imaging in 2019: principles, applications, and perspectives // J. Biomed. Opt. - 2019. - 24(7), 071613, doi: 10.1117/1.JBO.24.7.071613]) обеспечивают бесконтактную количественную оценку оптических параметров биологических тканей, коэффициента поглощения и транспортного коэффициента рассеяния, но для малого поверхностного слоя не более 2-2,5 мм, что недостаточно для условий проведения нейрохирургических операций по удалению опухоли.
Наиболее близкой к заявляемой является система интраоперационного обнаружения и распознавания нейроваскулярных структур в объеме биологической ткани [Сафонова Л.П., Орлова В.Г., Шкарубо А.Н. Исследование нейроваскулярных структур с помощью фазово-модуляционной спектрофотометрии [Электронный ресурс]/ //Оптика и спектроскопия. - 2019. -том 126. №6. - С. 822-833. (DOI: 10.21883/OS.2019.06.47778.58-19). Версия на английском языке: Safonova L.P., Orlova V.G., Shkarubo A.N. The neurovascular structures research by phase modulation spectrophotometry // Optics and Spectroscopy, 2019, Vol. 126, No. 6, pp. 745-757 (https://rdcu.be/bM7sz)], состоящая из спектрометра с временным разрешением, персонального компьютера со специализированным программным обеспечением и линейного оптоволоконного датчика для отражательной диффузионной спектроскопии с расстояниями между источниками и приемниками 6 мм и 9 мм, с помощью которой осуществляют подповерхностное зондирование исследуемого объема биологической ткани на глубину 2-5 мм, первой длиной волны (λ1 < 806 нм, λ1 = 692 нм) и второй длиной волны (λ2 > 806 нм, λ2 = 834 нм) из красного и/или ближнего инфракрасного (КБИК) диапазона на основе фазово-модуляционного или иначе частотного подхода (FD - frequency domain) спектроскопического метода с временным разрешением. С помощью системы-прототипа определяют значения оптических параметров: коэффициентов поглощения для первой длины волны μa(λ1) и для второй длины волны μa(λ2), с поправкой на содержание воды в единице объема биологической ткани, и коэффициентов транспортного рассеяния μs'(λ1) для первой длины волны и μs'(λ2) для второй длины волны. По указанным оптическим параметрам оценивают производные параметры в виде отношений, и и/или физиологические параметры, такие как тканевая сатурация (StO2), концентрация общего гемоглобина ([tHb]) в единице исследуемого объема биологической ткани и индекс пульсовых гемодинамических колебаний этого объема. Применяют критерии сравнения получаемых производных и физиологических параметров с пороговыми значениями для обнаружения и распознавания нейроваскулярных структур, нервов, артериальных и венозных сосудов, с учетом предоперационной и диагностической информации об особенностях микроциркуляторного кровенаполнения исследуемого объема и его морфологической структуры на клеточном уровне.
Однако данная система-прототип характеризуется ограниченностью поля зрения в связи с использованием узконаправленного зондирования, реализуемого оптоволоконным датчиком линейной конфигурации, не инвариантностью к расположению нейроваскулярных структур при их наличии в исследуемом объеме биологический ткани и, как следствие, неравномерной чувствительностью к нейроваскулярным структурам при незначительных смещениях оптоволоконного датчика. Кроме того, при обнаружении и распознавании нейроваскулярных структур система-прототип не учитывает информативные пульсовую и дыхательную составляющие гемодинамических процессов, протекающих в исследуемом объеме биологической ткани. Существенным недостатком известной системы является неконтролируемая сила прижатия оптоволоконного датчика к поверхности исследуемого объема биологической ткани, что приводит к наличию двигательных артефактов в измерениях, вызванных тремором руки, и/или неконтролируемому пережатию биологической ткани в момент контактного зондирования исследуемого объема и, как следствие, к искажению полученных данных за счет изменения структурных и оптических параметров и снижению эффективности обнаружения и распознавания нейроваскулярных структур. Недостатком является также отсутствие оценок, качественных и/или количественных, типа артериального или венозного сосуда при его выявлении в исследуемом объеме биологической ткани. Кроме того, данная система не позволяет контролировать наличие возможного спазмирования артериальных сосудов исследуемого объема биологической ткани или питающей крупной артерии и степень ишемизации кровоснабжаемых ими тканей в процессе операции, что может приводить к значительному снижению эффективности и качества выполненной операции.
Технической проблемой является разработка системы, устраняющей перечисленные выше недостатки, характерные для аналогов.
Раскрытие изобретения
Технический результат изобретения заключается в получении достоверных данных о наличии нервов, крупных и малых артерий и вен в объеме биологической ткани на максимальной глубине не менее 5 мм во время проведения операций.
Заявляемая система является универсальной, может быть использована как для нейрохирургических операций открытого или эндоскопического, в том числе трансназального доступа, так и других видов оперативного вмешательства по удалению опухоли, а также в пластической и реконструктивной хирургии и, кроме того, для определения и распознавания нейроваскулярных структур через интактные кожные покровы, для оценки состояния тканей внутренней среды организма при хирургических вмешательствах, и инвазивных диагностических процедурах лапароскопического типа, а также для исследования поврежденных тканей с оценкой глубины повреждения и на всех этапах их лечения и восстановления, например, при ожогах и обморожениях.
Использование заявляемой системы повышает эффективность интраоперационного обнаружения и распознавания нейроваскулярных структур, что снижает риски их случайного повреждения в процессе проведения хирургического вмешательства, и как следствие, повышает качество оказываемой медицинской помощи. Система позволяет проводить количественную диагностику состояния различных тканей организма: на разную глубину (до 10 см) с требуемым разрешением по глубине, требуемой чувствительностью к структурным неоднородностям, по площади зондирования (площади картирования от нескольких мм2 до нескольких десятков см2), проводить объективную количественную оценку адекватности терапевтических процедур и мероприятий и качества лечения на всех этапах.
Указанный технический результат достигается тем, что система интраоперационного обнаружения и распознавания нейроваскулярных структур в объеме биологической ткани включает:
- оптико-хирургическое устройство для зондирования биологических тканей и хирургических манипуляций, выполненное на основе браншей;
- блок позиционного и/или силового контроля оптико-хирургического устройства (блок контроля положения), включающий датчик положения и/или датчик силы или силомоментный датчик, выполненный с возможностью контроля положения/перемещения и/или силы прижатия рабочего торца оптико-хирургического устройства к биологической ткани;
- блок преобразования сигналов, выполненный с возможностью формирования прямого и приема обратного оптических сигналов подповерхностного зондирования биологической ткани;
- блок управления и обработки (далее блок управления), выполненный с возможностью формирования управляющих сигналов для синхронизированной работы блока преобразования и блока контроля положения, а также с возможностью обработки принимаемых сигналов с упомянутых блоков, отображения диагностической информации и хранения получаемых данных,
при этом
блок преобразования сигналов выполнен с возможностью формирования излучения для отражательной диффузионной спектроскопии с временным разрешением, по меньшей мере, на двух длинах волн (λi, i=1…K, K≥2) из диапазона 650-950 нм;
оптико-хирургическое устройство выполнено с возможностью подповерхностного контактного зондирования биологической ткани на максимальную глубину не менее 5 мм, и снабжено, по меньшей мере, двумя группами оптоволокон для подвода прямого оптического сигнала подповерхностного зондирования биологической ткани, и, по меньшей мере, одним оптоволоконным жгутом для приема обратного сигнала; оптоволокна и оптоволоконный жгут (каждый, если их больше одного) одним концом выведены на рабочий торец устройства, а другим концом подключены к блоку преобразования сигналов, при этом группы оптоволокон на рабочем торце расположены вдоль отдельных несовпадающих полуосей, направленных от оптоволоконного жгута; каждая группа оптоволокон состоит, как минимум, из двух подгрупп, каждая из которых предназначена для подачи сигнала, по меньшей мере на двух длинах волн (λi, i=1…K, K≥2) из указанного диапазона, оптоволокна каждой подгруппы расположены друг от друга на расстоянии не более 1 мм, а каждая подгруппа - на определенном расстоянии (rj, j=1…M, M≥2) от приемного оптоволоконного жгута вдоль соответствующей полуоси;
блок управления выполнен с возможностью формирования вектора признаков для обнаружения и распознавания нейроваскулярных структур на основе сигналов, полученных с блока преобразования и блока контроля положения, по которым судят о наличии определенных нейроваскулярных структур в объеме биологической ткани, о тканевой сатурации и локальном кровенаполнении, в том числе о наличии или отсутствии гипоксии тканей.
Возможен вариант выполнения системы, при котором для формирования вектора признаков (для обнаружения и распознавания нейроваскулярных структур) блок преобразования сигналов выполнен с возможностью регистрации сигналов интенсивностей обратно рассеянного излучения для каждой длины волны λi и каждого rj с последующей обработкой в блоке управления и формированием параметров вектора признаков для обнаружения и распознавания нейроваскулярных структур:
- коэффициента(ов) поглощения μa(λi) и транспортного(ых) коэффициента(ов) рассеяния μs'(λi) для каждой группы оптоволокон и каждого оптоволоконного жгута, по которым определяют концентрацию общего гемоглобина ([tHb]) в единице исследуемого объема биологической ткани и тканевую сатурацию (StO2) - степень насыщения кислородом крови в сосудах исследуемого объема ткани, а также тангенс угла наклона транспортного коэффициента рассеяния от длины волны (Ds),
- амплитуд пульсовых (Ап) и дыхательных (Ад) колебаний и их отношения Ап/д=Ап/Ад для каждой пары (λi, rj), и/или
- вектора формы (), представляющего собой набор значений, характеризующих форму пульсовой волны, соответствующую крупному или малому артериальному сосуду 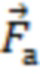 , крупному венозному сосуду
, крупному венозному сосуду 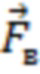 , или функциональной тканевой единице в размерах исследуемого объема биологической ткани
, или функциональной тканевой единице в размерах исследуемого объема биологической ткани 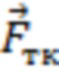 ,
,
а для каждой подгруппы источников, по меньшей мере, для двух длин волн из указанного диапазона определяют локальную амплитуду пульсовых колебаний концентрации общего гемоглобина (Δ[tHb]п),
при этом перечисленные параметры измеряют в статическом режиме, при котором давление оптоволоконного датчика P на поверхность исследуемого объема биологической ткани составляет P ≤ 0,2 мм рт.ст.
Возможен вариант реализации системы, в которой блок управления формирует вектор формы пульсовых колебаний  , определяющийся тремя переменными {N, AvCork, DIm}i,j , где
, определяющийся тремя переменными {N, AvCork, DIm}i,j , где
N - количество компонент фурье-спектра автокорреляционной функции пульсовой составляющей регистрируемой интенсивности обратно рассеянного излучения, амплитуда которых не менее 0,2 отн.ед.;
AvCork, k = 1…N - амплитуды этих компонент фурье-спектра автокорреляционной функции;
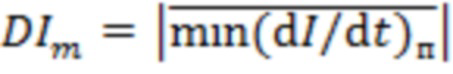 - среднее за период регистрации абсолютное значение локальных минимумов производной пульсовой составляющей регистрируемой интенсивности обратно рассеянного излучения по времени с шагом 0,2±0,003 с;
- среднее за период регистрации абсолютное значение локальных минимумов производной пульсовой составляющей регистрируемой интенсивности обратно рассеянного излучения по времени с шагом 0,2±0,003 с;
при этом форму пульсовой волны определяют как соответствующую функциональной тканевой единице в размерах исследуемого объема биологической ткани при получении следующих значений вектора формы:
 =
=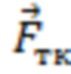 : N = 1; 0,6 ≤ AvCor1 ≤ 1;
: N = 1; 0,6 ≤ AvCor1 ≤ 1; 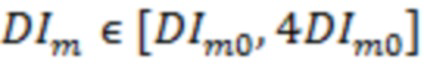 , -
, -
как соответствующую крупной артерии в исследуемом объеме биологической ткани при получении следующих значений вектора формы:
 =
=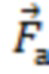 : N = 1; 0,8 ≤ AvCor1 ≤ 1; DIm > 4DIm0, -
: N = 1; 0,8 ≤ AvCor1 ≤ 1; DIm > 4DIm0, -
как соответствующую крупной вене в исследуемом объеме биологической ткани при получении следующих значений вектора формы:
 =
=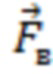 : N = 1 или N = 2; AvCork < 0,6, k = 1...N; DIm < DIm0, -
: N = 1 или N = 2; AvCork < 0,6, k = 1...N; DIm < DIm0, -
где DIm0 - пороговое значение DIm, определяемое для функциональной тканевой единицы в размерах исследуемого объема биологической ткани.
Возможен вариант исполнения системы, в котором блок управления выполнен с возможностью формирования выводов о наличии определенных нейроваскулярных структур при получении следующих совокупностей измеренных параметров:
- при {Ds > 0; [tHb] > [tHb]0; StO2 > (StO2)0; Ап/д > (Ап/д)0;  =
=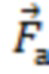 ; Δ[tHb]п > (Δ[tHb]п)0} (1) - о наличии в исследуемом объеме биологической ткани крупной артерии;
; Δ[tHb]п > (Δ[tHb]п)0} (1) - о наличии в исследуемом объеме биологической ткани крупной артерии;
- при {Ds > 0; [tHb] > [tHb]0; StO2 ≤ (StO2)0 или StO2 > (StO2)0; Ап/д < (Ап/д)0;  =
=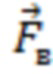 ; Δ[tHb]п ≤ (Δ[tHb]п)0} (2) - о наличии в исследуемом объеме биологической ткани крупной вены;
; Δ[tHb]п ≤ (Δ[tHb]п)0} (2) - о наличии в исследуемом объеме биологической ткани крупной вены;
- при {Ds0 < Ds < 0; [tHb] ≤ [tHb]0; StO2 ≤ (StO2)0; Ап/д ≤ (Ап/д)0;  =
=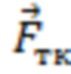 ; Δ[tHb]п < (Δ[tHb]п)0} (3) - о наличии в исследуемом объеме биологической ткани нерва диаметром от 1,5 мм и более;
; Δ[tHb]п < (Δ[tHb]п)0} (3) - о наличии в исследуемом объеме биологической ткани нерва диаметром от 1,5 мм и более;
- при {Ds ≤ Ds0; [tHb] ≥ [tHb]0; StO2 ≥ (StO2)0; Ап/д ≥ (Ап/д)0;  =
=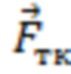 ; Δ[tHb]п ≥ (Δ[tHb]п)0} (4) - о наличии в исследуемом объеме биологической ткани, по меньшей мере, одной малой артерии;
; Δ[tHb]п ≥ (Δ[tHb]п)0} (4) - о наличии в исследуемом объеме биологической ткани, по меньшей мере, одной малой артерии;
- при {Ds0 < Ds < 0; [tHb] > [tHb]0; StO2 ≥ (StO2)0; Ап/д > (Ап/д)0;  =
=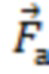 ; Δ[tHb]п > (Δ[tHb]п)0} (5) - о наличии в исследуемом объеме биологической ткани части крупной артерии, когда объем цельной крови сосуда в исследуемом объеме биологической ткани не приводит к Δμs'(λ) > 0;
; Δ[tHb]п > (Δ[tHb]п)0} (5) - о наличии в исследуемом объеме биологической ткани части крупной артерии, когда объем цельной крови сосуда в исследуемом объеме биологической ткани не приводит к Δμs'(λ) > 0;
- при {Ds0 ≤ Ds < 0; [tHb] ≥ [tHb]0; StO2 ≤ (StO2)0; Ап/д ≤ (Ап/д)0;  =
=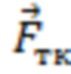 ; Δ[tHb]п ≤ (Δ[tHb]п)0} (6) - о наличии в исследуемом объеме биологической ткани, по меньшей мере, одной малой вены,
; Δ[tHb]п ≤ (Δ[tHb]п)0} (6) - о наличии в исследуемом объеме биологической ткани, по меньшей мере, одной малой вены,
где [tHb]0, Ds0, (StO2)0, (Ап/д)0, (Δ[tHb]п)0 - пороговые значения упомянутых параметров, измеренные для функциональной тканевой единицы в размерах исследуемого объема биологической ткани. Значения параметров Ds, [tHb] и StO2 определяют для каждой группы оптоволокон на рабочем торце оптико-хирургического устройства и каждого приемного оптоволоконного жгута или, как минимум, единственного, а Ап/д,  и Δ[tHb]п определяют, по меньшей мере, для одной подгруппы излучателей этой группы.
и Δ[tHb]п определяют, по меньшей мере, для одной подгруппы излучателей этой группы.
Существует вариант реализации системы, в которой блок контроля положения и блок управления выполнены с возможностью проводить измерения параметров, обнаружение и распознавание нейроваскулярных структур в статическом режиме, при котором контролируемое давление P оптико-хирургического устройства на поверхность исследуемого объема биологической ткани составляет P ≤ 0,2 мм рт.ст., и в динамическом режиме с увеличением давления оптико-хирургического устройства на поверхность исследуемого объема биологической ткани с заданной постоянной скоростью VL ≤ 10 мм/мин при изменении силы от 0 до Fmax, соответствующей максимально допустимому для исследуемой биологической ткани уровню давления Pmax = Fmax/S, с учетом площади контакта S рабочего торца диагностического оптико-хирургического устройства с поверхностью исследуемого объема биологической ткани, где Pmax принимает значения от 70 мм рт.ст. для тканей головного мозга до 200 мм рт.ст. для тканей нижних конечностей, или при двухэтапном изменении давления Р от 0 до 20 мм рт.ст. и от 20 мм рт.ст. до Pmax.
Возможен вариант реализации системы, в которой блок управления выполнен с возможностью определения состояния спазмирования артериальных сосудов исследуемого объема биологической ткани или питающей крупной артерии по получению следующих совокупностей измеренных параметров {Ds0 ≤ Ds < 0; [tHb] < [tHb]0; StO2 < (StO2)0; Ап/д = 0 (при отсутствии пульсовых колебаний)} (7).
Возможен вариант реализации системы, в которой оптико-хирургическое устройство содержит блок разведения браншей, для регулирования пространственного положения браншей относительно исследуемой поверхности биологической ткани и относительно друг друга, выполненный с возможностью контроля со стороны блока контроля положения и со стороны блока управления, (с помощью сигналов обратной связи, формируемых при регулировании и отправляемых в блоки контроля положения и управления) и/или содержит блок стыковки с блоком позиционного и/или силового контроля для автоматизированного регулирования пространственного положения браншей относительно исследуемой поверхности биологической ткани и относительно друг друга, выполненный с возможностью управления со стороны блока контроля положения и со стороны блока управления по специальным управляющим сигналам.
Таким образом, заявляемая система позволяет устранить следующие недостатки, присущие наиболее близкому решению, известному из уровня техники:
- неиспользование или неполное использование информативной пульсовой и дыхательной составляющих гемодинамических процессов, протекающих в исследуемом объеме биологической ткани, для обнаружения и распознавания нейроваскулярных структур;
- неконтролируемое позиционирование и/или неконтролируемая сила прижатия оптоволоконного датчика к поверхности исследуемого объема биологической ткани, что приводит к наличию двигательных артефактов в измерениях, вызванных тремором руки, и/или неконтролируемому пережатию биологической ткани в момент контактного зондирования исследуемого объема и, как следствие, к искажению полученных данных за счет изменения структурных и оптических параметров и снижению эффективности обнаружения и распознавания нейроваскулярных структур;
- отсутствие оценок, качественных и/или количественных, типа артериального или венозного сосуда при его выявлении в исследуемом объеме биологической ткани;
- ограниченность поля зрения используемого в прототипе оптоволоконного датчика, неинвариантность его к расположению нейроваскулярных структур при их наличии в исследуемом объеме биологический ткани и, как следствие, неравномерная чувствительность к нейроваскулярным структурам при незначительных смещениях оптоволоконного датчика;
- отсутствие контроля за возможным спазмированием артериальных сосудов исследуемого объема биологической ткани или питающей крупной артерии и степенью ишемизации кровоснабжаемых ими тканей, особенно нервных, гипоксия и повреждение которых в процессе операции приводят к необратимым для пациента последствиям, что не позволяет говорить об эффективности и качестве выполненной операции,
- ограниченные функциональные возможности прототипа, низкая эффективность обнаружения и распознавания нейроваскулярных структур.
В отличие от наиболее близкого решения заявляемая система реализует:
- применение методов кратно-масштабного анализа регистрируемой интенсивности обратно рассеянного излучения и формирование комплексной характеристики пульсовых и дыхательных колебаний, определяющей наличие или отсутствие выраженных пульсовых колебаний, наличие или отсутствие дыхательных колебаний в исследуемом объеме биологической ткани, форму пульсовой волны, соответствующую крупной артерии, малой артерии, вынужденным пульсовым колебаниям венозного объема или функциональной тканевой единице;
- расширение набора критериев обнаружения и распознавания нейроваскулярных структур: крупных и малых артериальных и венозных сосудов и нервов, - с учетом предоперационной и интраоперационной диагностической информации и с учетом априорной физиологической информации;
- осуществление возможности реализации в условиях автоматизированного контроля позиционирования и/или силы прижатия используемого оптоволоконного датчика к поверхности исследуемого объема биологической ткани, с помощью блока контроля положения, оснащенного датчиками перемещения и/или силы, в двух режимах: статическом и динамическом;
- формирование и применение расширенного набора критериев для обнаружения и распознавания нейроваскулярных структур на основании спектроскопических измерений в статическом режиме автоматизированного контроля позиционирования и/или силы прижатия;
- возможность проведения двухэтапного динамического режима для подтверждения или обнаружения: на первом этапе - наличия венозного сосуда в исследуемом объеме биологической ткани; на втором этапе - дополнительного подтверждения наличия уже обнаруженного в статическом режиме артериального сосуда или обнаружения и распознавания артериального сосуда более глубинного залегания, не обнаруженного в статическом режиме, оценки калибра артериального сосуда по величине давления в сосуде;
- возможность дополнительного подтверждения, что исследуемая область биологической ткани является участком с микроциркуляторным руслом без нейроваскулярных включений: сосудов, типа артерий и вен, и нервов;
- обеспечение равномерности зондирования исследуемого объема биологической ткани и инвариантности способа к расположению нейроваскулярных структур, при их наличии в исследуемом объеме, за счет применения не менее двух групп излучателей в оптико-хирургическом устройстве и применения методов кратно-масштабного анализа к регистрируемой для каждого источника интенсивности обратно рассеянного излучения для выделения и анализа дыхательных и пульсовых колебаний;
- обеспечение контроля наличия возможного спазмирования артериальных сосудов исследуемого объема биологической ткани или питающей крупной артерии и степени ишемизации кровоснабжаемых ими биологических тканей по отклонениям контролируемых физиологических параметров от их начальных значений, регистрируемых интраоперационно, в сторону выраженной гипоксии тканей.
Перечисленные выше отличительные признаки заявляемой системы приводят к достижению следующих преимуществ по сравнению с наиболее близким техническим решением:
- к повышению эффективности распознавания нейроваскулярных структур за счет анализа комплекса значимых параметров в статическом и, при необходимости, в динамическом режимах, и получения более широкого спектра критериев, обеспечивающих определение в т.ч. типа структуры, за счет автоматизированного контроля позиционирования и/или силы прижатия используемого оптико-хирургического устройства к поверхности исследуемого объема биологической ткани, что обеспечивает отсутствие неинформативных двигательных артефактов и искажений оптических параметров, обеспечивает стабильность и воспроизводимость параметров, по которым на основании соответствующих критериев принимается решение, за счет повышения равномерности зондирования исследуемого объема биологической ткани и инвариантности результата к расположению нейроваскулярных структур;
- к повышению универсальности за счет повышения глубины обнаружения и распознавания артериальных сосудов при контролируемом автоматизированном вдавливании оптико-хирургического устройства в исследуемую ткань без увеличения его габаритов и размеров исследуемой области , за счет обеспечения инвариантности способа к расположению нейроваскулярных структур в исследуемом объеме биологической ткани путем применения не менее двух групп излучателей оптико-хирургического устройства и анализа интенсивности обратно рассеянного излучения для каждого источника;
- к расширению функциональных возможностей системы на единой методологической основе за счет контроля возможного спазмирования артериальных сосудов исследуемого объема биологической ткани или питающей крупной артерии и степени ишемизации кровоснабжаемых ими биологических тканей с помощью предложенного вектора признаков и соответствующих критериев оценки спазмирования и ишемизации;
- повышению качества оказываемой медицинской помощи ввиду снижения или предотвращения нередких в нейрохирургической практике случаев повреждения нейроваскулярных структур и внезапного неконтролируемого спазмирования крупных артерий при случайном резком механическом воздействии на них.
Реализуемый с помощью предлагаемой системы алгоритм (способ) диагностики не имеет ограничений, если пространственное разрешение и минимальный зондируемый объем согласованы с характерными размерами нейроваскулярных структур, подлежащих обнаружению и распознаванию, и изменения оптических параметров, значимые для обнаружения и распознавания нейроваскулярных структур, минимум в 2 раза превосходят соответствующую шумовую характеристику.
Краткое описание чертежей
Изобретение поясняется иллюстративным материалом, где на фиг. 1 представлена блок-схема варианта реализации системы; на фиг. 2 представлены продольный разрез оптико-хирургического устройства (а), вид сверху варианта рабочего торца браншей круглого сечения (б), поперечное сечение оптико-хирургического устройства с группами оптоволокон и/или оптоволоконным жгутом (в), вариант элемента блока разведения браншей - в разрезе (г); на фиг. 3 отображены отдельные примеры схем расположения на рабочем торце оптико-хирургического устройства групп и подгрупп излучателей относительно приемника; на фиг. 4 отражены вариант выполнения рабочего торца малогабаритного оптико-хирургического устройства с секторным расположением приемника и излучателей в сомкнутом состоянии (а), устройство в режиме зондирования биологической ткани с разомкнутыми браншами (б) и вид сечения рабочей торцевой поверхности секторного типа (в); на фиг. 5 представлены варианты конструкций рабочего торца оптико-хирургического устройства, в поперечном сечении, когда равномерность зондирования обеспечивается увеличением количества точечных источников (а) и/или приемников (б), наличием линейки или матрицы приемников (в) или увеличением количества раздвижных браншей (г); на фиг. 6 представлена структура блока преобразования для реализации отражательной диффузионной спектроскопии с временным разрешением; на фиг. 7 отражен экспериментальный макет системы; на фиг. 8 представлены объект исследования (а): сосуды, нервы, мягкие ткани руки человека, - и результаты (б) правильного обнаружения и распознавания нейроваскулярных структур относительно мягких тканей, мышечной и кожно-жировой, по измеряемым методом спектроскопии с временным разрешением оптическим параметрам с реализацией возможности изменения глубины зондирования ткани; на фиг. 9 представлен возможный вид отображения информации на экране монитора блока управления и отображения; на фиг. 10 представлены результаты, получаемые с силомоментного датчика блока контроля положения.
В таблице 1 представлены примеры распознавания нейроваскулярных структур с помощью системы и по параметрам прототипа на основе критериальных значений параметров, соответствующих функциональной тканевой единице.
Осуществление изобретения
Для более однозначного понимания сущности заявленного изобретения ниже представлены основные термины и определения, используемые в рамках настоящего описания.
Функциональная тканевая единица (ФТЕ) в размере исследуемого объема биологической ткани представляет собой комплекс специализированных клеток ткани, клеток и неклеточного компонента соединительной ткани, кровеносных и лимфатических микрососудов, окончаний нервных волокон и мельчайших артериальных и венозных сосудов диаметрами менее 0,5 мм. Основой ФТЕ определенного органа или ткани является микроциркуляторно-тканевая система, морфофункциональные особенности которой подробно рассматривают авторы работы [Крупаткин А.И., Сидоров В.В. Функциональная диагностика состояния микроциркуляторно-тканевых систем: Колебания, информация, нелинейность. Изд.2-е. - М.: ЛЕНАНД, 2016. - 496 с.]. Функциональные тканевые единицы разных органов имеют различия на структурном и функциональном уровнях: гистологические различия на уровне клеток разных тканей, различия в соединительнотканной структуре, в строении микрососудистой сети и на уровне кровеносных сосудов крупнее (диаметром более 250 мкм) сосудов микроциркуляторного уровня (диаметром 3 мкм - 250 мкм). В следствие указанных различий, ФТЕ имеют разные физические свойства: оптические, акустические, электрические. Оптические параметры определяемой таким образом ФТЕ, коэффициенты поглощения и транспортные коэффициенты рассеяния на разных длинах волн, характеризуются высокой биологической вариабельностью. Поэтому разработка способов обнаружения и распознавания в объеме ФТЕ таких структур, как нервы и цельная кровь в сосудах, имеющих значительно меньшую биологическую вариабельность морфофункциональных и физических свойств, требует предварительной оценки и учета измеряемых параметров ФТЕ в применяемых критериях.
С учетом функциональных возможностей применяемого метода спектроскопии с временным разрешением для ФТЕ в размерах относительно малого исследуемого объема биологической ткани с указанной максимальной глубиной зондирования не менее 5 мм соотношение между калибром сосуда и его размером принято следующим:
- крупный сосуд, артерия или вена определяется как сосуд с диаметром 2,0 мм и выше;
- малый сосуд, артерия или вена, имеет диаметр от 0,5 мм до 2,0 мм;
распознаваемые нервы диаметром 1,5-5 мм и выше.
В рамках настоящего изобретения исследования проведены для руки человека от кисти до середины предплечья. Функциональной тканевой единицей являлся объем ткани на внешней стороне середины предплечья, полученные значения параметров Ds0, [tHb]0, (StO2)0, (Ап/д)0, DIm0 и (Δ[tHb]п)0 рассматривались как пороговые.
Возможность осуществления функций заявленной системы продемонстрирована с помощью устройства, обобщенная структурная схема которого представлена на фиг. 1 и фиг. 6. Схема включает в себя следующие конструктивные единицы:
1 - блок преобразования сигналов, реализующий метод диффузионной спектроскопии с временным разрешением на основе частотного подхода (FD, frequency domain) или  подхода (TD, time domain), содержащий 1.1 - радиочастотный генератор, 1.2 - блок формирования излучения с мультиплексированием по времени для зондирования биологической ткани, как минимум, на двух длинах волн, 1.3 - блок приема излучения, рассеянного в исследуемой биологической ткани (5) в обратном направлении, 1.4 - блок аналоговой обработки сигнала, регистрируемого блоком приема излучения (1.3);
подхода (TD, time domain), содержащий 1.1 - радиочастотный генератор, 1.2 - блок формирования излучения с мультиплексированием по времени для зондирования биологической ткани, как минимум, на двух длинах волн, 1.3 - блок приема излучения, рассеянного в исследуемой биологической ткани (5) в обратном направлении, 1.4 - блок аналоговой обработки сигнала, регистрируемого блоком приема излучения (1.3);
2 - оптико-хирургическое устройство для отражательной диффузионной спектроскопии, с помощью которого осуществляют подповерхностное картирование исследуемого объема биологической ткани необходимым количеством длин волн указанного красного и ближнего инфракрасного (КБИК) диапазона на необходимую глубину с необходимым пространственным разрешением, имеющий необходимый вариант технического исполнения, содержащий (фиг. 2): 2.1 - бранши, 2.2 - рабочий торец. 2.3 - блок разведения браншей, 2.4 - группы оптоволокон и/или оптоволоконный жгут;
3 - блок контроля положения для позиционирования оптико-хирургического устройства относительно исследуемой биологической ткани, оснащенный датчиком силы или силомоментным датчиком 3.1 и датчиком перемещения 3.2 и имеющее узел крепления оптико-хирургического устройства 3.3;
4 - блок управления структурными элементами 1-3 системы, включающий микроконтроллерный блок управления и цифровой обработки сигналов 4.1 и персональный компьютер с программным обеспечением и блоком отображения и хранения информации 4.2;
5 - исследуемая биологическая ткань;
6 - видеорегистратор для освещения и регистрации изображения операционного пространства, поверхности исследуемого объема биологической ткани.
Устройством, представленным на фиг. 1, управляет оператор (и/или врач).
Конструкция оптико-хирургического устройства 2 определяется медицинской задачей, типом доступа к исследуемому объему биологической ткани 5, размером операционного поля доступного для проведения зондирования, свойствами исследуемого объема биологической ткани (размерами, формой поверхности, биомеханическими и оптическими свойствами), необходимым количеством зондирующих длин волн КБИК диапазона, необходимой глубиной зондирования, необходимой чувствительностью и необходимым пространственным разрешением. Пример конструкции оптико-хирургического устройства для отражательной диффузионной спектроскопии и реализации функций системы представлен на фиг. 2, указанные позиции основных элементов расшифрованы выше. В литературных данных представлены также варианты выполнения оптических датчиков, которые могут быть модернизированы и использованы при реализации заявляемой системы [Utzinger U., Richards-Kortum R.R. Fiber optic probes for biomedical optical spectroscopy // Journal of Biomedical Optics. - 2003. - Vol. 8. - No. 1. - P. 121-147].
Для интраоперационного обнаружения и распознавания нейроваскулярных структур в объеме биологической ткани оптико-хирургическим устройством 2 для отражательной диффузионной спектроскопии осуществляют подповерхностное зондирование исследуемого объема биологической ткани 5, например, опухолевой.
Подповерхностное зондирование исследуемого объема биологической ткани 5 осуществляют на основе спектроскопического метода с временным разрешением на максимальную глубину не менее 5 мм, как минимум, первой длиной волны (λ1) и второй длиной волны (λ2), λ1 < λ2, из КБИК диапазона от 650 нм до 950 нм, таких, что обеспечиваются стандартные требования к выбору длин волн для отражательной диффузионной спектроскопии:
- глубина зондирования биоткани z при одинаковых расстояниях r между источниками и приемником на разных длинах волн не должна существенно различаться [Choi J.H., Wolf M., Toronov V., et al. Noninvasive determination of the optical properties of adult brain: near-infrared spectroscopy approach // Journal of Biomedical Optics. - 2004, vol. 9, No. 1, p. 221-229]:
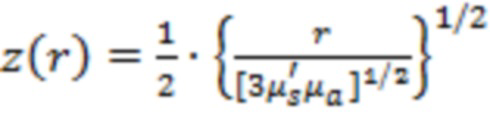 ;
;
- физиологически значимые минимальные изменения [HbO2] и [HHb] должны быть различимы при измерениях, и погрешности определения [HbO2] и [HHb] должны быть минимальны при выбранных длинах волн с учетом шумовых характеристик используемого средства измерения. Рекомендуемые комбинации длин волн, применяемые в спектроскопии биотканей для диапазона 650 - 950 нм, приведены в [Scholkmann F., Kleiser S., Metz A. J., Zimmermann R., Pavia J. M., Wolf U., Wolf M. A review on continuous wave functional near-infrared spectroscopy and imaging instrumentation and methodology // NeuroImage. - 2014, vol. 85, Part 1, p. 6-27].
Указанным критериям при выборе двух длин волн, например, соответствуют 690±10 нм и 830±10 нм.
Подробно спектроскопический метод с временным разрешением и варианты его технической реализации в виде частотного (FD) или временного (TD) подходов рассмотрены, соответственно, в [Оптическая биомедицинская диагностика. В 2 т. Т. 1 / Пер. с англ. под ред. В. В. Тучина. - М.: Физматлит, 2007. - 560 с.; Wolf, M., Ferrari, M., Quaresima, V. Progress of near-infrared spectroscopy and topography for brain and muscle clinical applications // Journal of Biomedical Optics. - 2007, vol. 12, N 6, p. 062104 (1-14); Fantini S., Franceschini M.A., and Gratton E. Semi-infinite-geometry boundary problem for light migration in highly scattering media: a frequency-domain study in the diffusion approximation // Journal of Optical Society of America. - 1994. Vol. 11. N 10. p. 2128; Fantini, S., Franceschini, M.A., Maier, J.S., et.al. Frequency-domain multichannel optical detector for non-invasive tissue spectroscopy and oximetry // Optical engineering. - 1995, Vol. 34, No. 1, p.32-42; US6,216,021 B1] - для FD и [Оптическая биомедицинская диагностика. В 2 т. Т. 1 / Пер. с англ. под ред. В.В. Тучина. - М.: Физматлит, 2007. - 560 с.; Wolf, M., Ferrari, M., Quaresima, V. Progress of near-infrared spectroscopy and topography for brain and muscle clinical applications // Journal of Biomedical Optics. - 2007, vol. 12, N 6, p. 062104 (1-14); Torricelli, A., Contini, D., Pifferi, A., et.al. Time domain functional NIRS imaging for human brain mapping // NeuroImage. - 2014, Vol. 85, p. 28-50] - для TD.
Перед применением оптико-хирургического устройства, в зависимости от технической реализации способа, может потребоваться калибровка датчика в соответствии с инструкцией по эксплуатации спектрометра в условиях необходимого уровня засветки операционного поля, допустимого для реализации предлагаемого способа, и на блоках с известными оптическими свойствами, близкими к оптическим свойствам исследуемого объема биологической ткани, как, например, для тканей головного мозга, μa ~ 0,1 (см-1) и μs' ~ 10 (см-1). Допустимый уровень засветки зависит от конструкции оптико-хирургического устройства, условий калибровки, типа приемника диффузно рассеянного в обратном направлении излучения, аппаратно-программной реализации способа.
В процессе зондирования исследуемого объема биологической ткани 5 регистрируют параметры обратно рассеянного излучения, соответствующие спектроскопическому методу с временным разрешением, с частотой дискретизации не менее 20 Гц. Для частотного подхода такими параметрами являются средний уровень интенсивности, амплитуда модуляции и сдвиг фаз регистрируемого модулированного сигнала по отношению к опорному сигналу [Оптическая биомедицинская диагностика. В 2 т. Т. 1 / Пер. с англ. под ред. В. В. Тучина. - М.: Физматлит, 2007. - 560 с.; Wolf, M., Ferrari, M., Quaresima, V. Progress of near-infrared spectroscopy and topography for brain and muscle clinical applications // Journal of Biomedical Optics. - 2007, vol. 12, N 6, p. 062104 (1-14); Fantini S., Franceschini M.A., and Gratton E. Semi-infinite-geometry boundary problem for light migration in highly scattering media: a frequency-domain study in the diffusion approximation // Journal of Optical Society of America. - 1994. Vol. 11. N 10. p. 2128; Fantini, S., Franceschini, M.A., Maier, J.S., et.al. Frequency-domain multichannel optical detector for non-invasive tissue spectroscopy and oximetry // Optical engineering. - 1995, Vol. 34, No. 1, p. 32-42; US 6,216,021 B1]. Определяют значения оптических параметров, как минимум, для двух длин волн КБИК диапазона: коэффициентов поглощения для первой длины волны μa(λ1) и для второй длины волны μa(λ2), λ1 < λ2, с поправкой на содержание воды в единице объема биологической ткани (5), и коэффициентов транспортного рассеяния μs'(λ1) для первой длины волны и μs'(λ2) для второй длины волны, допуская, что основными поглотителями излучения КБИК диапазона в исследуемом объеме биологической ткани являются вода, оксигенированный и дезоксигенированный гемоглобин. Определение оптических параметров осуществляют спектрометром (1) с временным разрешением, например, с фазово-модуляционным частотным режимом (frequency domain, FD), как в ”OxiplexTS“ (ISS, Inc., США), со специализированным программным обеспечением, как, например, “OxiTS”, реализующим расчет оптических параметров, коэффициентов поглощения μa(λ1) и μa(λ2) и транспортных коэффициентов рассеяния μs'(λ1) и μs'(λ2), по параметрам обратно рассеянного излучения и известным из литературы уравнениям [Оптическая биомедицинская диагностика. В 2 т. Т. 1 / Пер. с англ. под ред. В.В. Тучина. - М.: Физматлит, 2007. - 560 с.; Fantini S., Franceschini M.A., and Gratton E. Semi-infinite-geometry boundary problem for light migration in highly scattering media: a frequency-domain study in the diffusion approximation // Journal of Optical Society of America. - 1994. Vol. 11. N 10. p. 2128; Fantini, S., Franceschini, M.A., Maier, J.S., et.al. Frequency-domain multichannel optical detector for non-invasive tissue spectroscopy and oximetry // Optical engineering. - 1995, Vol. 34, No. 1, p. 32-42; US6,216,021 B1]. Дополнительные примеры спектрометров, реализующих подход с временным разрешением, приведены в [Оптическая биомедицинская диагностика. В 2 т. Т. 1 / Пер. с англ. под ред. В.В. Тучина. - М.: Физматлит, 2007. - 560 с.; Wolf, M., Ferrari, M., Quaresima, V. Progress of near-infrared spectroscopy and topography for brain and muscle clinical applications // Journal of Biomedical Optics. - 2007, vol. 12, N 6, p. 062104 (1-14); Torricelli, A., Contini, D., Pifferi, A., et.al. Time domain functional NIRS imaging for human brain mapping // NeuroImage. - 2014, Vol. 85, p. 28-50; Spichtig S., Hornung R., Brown D.W., Haensse D., and Wolf M. Multifrequency frequency-domain spectrometer for tissue analysis // Review of scientific instruments. - 2009, Vol. 80, p. 024301(1-7)]. Перечень спектрометров, обеспечивающих измерение абсолютных значений оптических параметров μa и μs', как минимум, на двух длинах волн, представлен в [Wolf, M., Ferrari, M., Quaresima, V. Progress of near-infrared spectroscopy and topography for brain and muscle clinical applications // Journal of Biomedical Optics. - 2007, vol. 12, N 6, p. 062104 (1-14)].
На основании указанных оптических параметров в блоке управления и обработки (4) оценивают производный параметр (Ds) в виде отношения 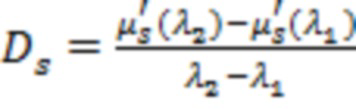 и по известным соотношениям, представленным в [Сафонова Л.П., Орлова В.Г., Шкарубо А.Н. Исследование нейроваскулярных структур с помощью фазово-модуляционной спектрофотометрии [Электронный ресурс]/ //Оптика и спектроскопия. - 2019. -том 126. №6. - С. 822-833. (DOI: 10.21883/OS.2019.06.47778.58-19). Версия на английском языке: Safonova L.P., Orlova V.G., Shkarubo A.N. The neurovascular structures research by phase modulation spectrophotometry // Optics and Spectroscopy, 2019, Vol. 126, No. 6, pp. 745-757 (https://rdcu.be/bM7sz); Оптическая биомедицинская диагностика. В 2 т. Т. 1 / Пер. с англ. под ред. В. В. Тучина. - М.: Физматлит, 2007. - 560 с.], рассчитывают физиологические параметры, такие как концентрации оксигенированного гемоглобина ([HbO2]), дезоксигенированного гемоглобина ([HHb]) и общего гемоглобина ([tHb] = [HbO2] + [HHb]) в единице исследуемого объема биологической ткани и тканевая сатурация (StO2 = 100*[HbO2] / [tHb]).
и по известным соотношениям, представленным в [Сафонова Л.П., Орлова В.Г., Шкарубо А.Н. Исследование нейроваскулярных структур с помощью фазово-модуляционной спектрофотометрии [Электронный ресурс]/ //Оптика и спектроскопия. - 2019. -том 126. №6. - С. 822-833. (DOI: 10.21883/OS.2019.06.47778.58-19). Версия на английском языке: Safonova L.P., Orlova V.G., Shkarubo A.N. The neurovascular structures research by phase modulation spectrophotometry // Optics and Spectroscopy, 2019, Vol. 126, No. 6, pp. 745-757 (https://rdcu.be/bM7sz); Оптическая биомедицинская диагностика. В 2 т. Т. 1 / Пер. с англ. под ред. В. В. Тучина. - М.: Физматлит, 2007. - 560 с.], рассчитывают физиологические параметры, такие как концентрации оксигенированного гемоглобина ([HbO2]), дезоксигенированного гемоглобина ([HHb]) и общего гемоглобина ([tHb] = [HbO2] + [HHb]) в единице исследуемого объема биологической ткани и тканевая сатурация (StO2 = 100*[HbO2] / [tHb]).
Регистрацию и расчет параметров выполняют в автоматизированном режиме посредством программного обеспечения, установленного на персональном компьютере, как, например, “OxiTS” для спектрометра ”OxiplexTS“.
В общем случае применения не менее двух длин зондирующих волн λi, i=1,2,…,n, физиологические параметры оценивают по измеренным коэффициентам поглощения:
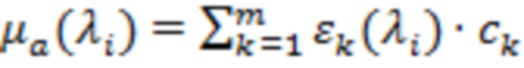 , (1)
, (1)
где 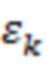 - молярные коэффициенты экстинкции, мкМ-1⋅ см-1;
- молярные коэффициенты экстинкции, мкМ-1⋅ см-1; 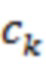 - соответствующие концентрации, мкМ=мкмоль/л, основных учитываемых биологических хромофоров: воды, оксигенированного (HbO2) и дезоксигенированного (HHb) гемоглобина, липидов и др. В случае двух зондирующих длин волн λ1 и λ2, λ1 < λ2, предполагают процент водонасыщения исследуемого объема биологической ткани (70-80%), пренебрегают вкладом липидов, если λ2 < 900 нм, и на основании соотношения (1) по измеренным значениям μa с поправкой на содержание воды оценивают [HbO2] и [HHb], [tHb]=[HbO2]+[HHb] и StO2=([HbO2]/[tHb])⋅100%. Применение трех и более зондирующих длин волн позволяет повысить точность оценки физиологических параметров [tHb] и StO2, но существенно повышает сложность и стоимость технической реализации. Ошибка при учете концентрации воды в диапазоне водонасыщения ткани от 70 до 80% не превышает десятых долей процента, в широком диапазоне водонасыщения от 50 до 90% максимальная ошибка - менее 2%.
- соответствующие концентрации, мкМ=мкмоль/л, основных учитываемых биологических хромофоров: воды, оксигенированного (HbO2) и дезоксигенированного (HHb) гемоглобина, липидов и др. В случае двух зондирующих длин волн λ1 и λ2, λ1 < λ2, предполагают процент водонасыщения исследуемого объема биологической ткани (70-80%), пренебрегают вкладом липидов, если λ2 < 900 нм, и на основании соотношения (1) по измеренным значениям μa с поправкой на содержание воды оценивают [HbO2] и [HHb], [tHb]=[HbO2]+[HHb] и StO2=([HbO2]/[tHb])⋅100%. Применение трех и более зондирующих длин волн позволяет повысить точность оценки физиологических параметров [tHb] и StO2, но существенно повышает сложность и стоимость технической реализации. Ошибка при учете концентрации воды в диапазоне водонасыщения ткани от 70 до 80% не превышает десятых долей процента, в широком диапазоне водонасыщения от 50 до 90% максимальная ошибка - менее 2%.
Производный параметр Ds, см-1/мкм, 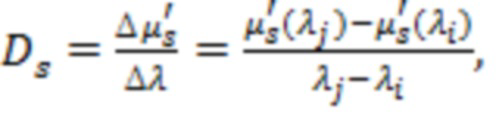 играет ключевую роль в обнаружении крупных сосудов и нервов. При наличии измеренных значений μs' на трех и более длинах волн Ds оценивают как тангенс угла линейного наклона аппроксимирующей зависимости μs'(λ) в силу специфики уменьшения μs' биологических тканей с увеличением λ [Оптическая биомедицинская диагностика. В 2 т. Т. 1 / Пер. с англ. под ред. В.В. Тучина. - М.: Физматлит, 2007. - 560 с.; Jacques S. L. Topical Review. Optical properties of biological tissues: a review // Phys. Med. Biol. - 2013, Vol. 58, p. R37-R61].
играет ключевую роль в обнаружении крупных сосудов и нервов. При наличии измеренных значений μs' на трех и более длинах волн Ds оценивают как тангенс угла линейного наклона аппроксимирующей зависимости μs'(λ) в силу специфики уменьшения μs' биологических тканей с увеличением λ [Оптическая биомедицинская диагностика. В 2 т. Т. 1 / Пер. с англ. под ред. В.В. Тучина. - М.: Физматлит, 2007. - 560 с.; Jacques S. L. Topical Review. Optical properties of biological tissues: a review // Phys. Med. Biol. - 2013, Vol. 58, p. R37-R61].
Для крупного кровеносного сосуда в исследуемом объеме биологической ткани Δμs' > 0 или Ds > 0, что определяется существенным отличием значений фактора анизотропии большинства мягких биологических тканей (мышечной, тканей мозга и др.), находящихся в диапазоне от 0,7 до 0,95 от значений фактора анизотропии для цельной крови 0,997-0,999, и изменением характера распространения зондирующего излучения в исследуемом объеме биологической ткани [Оптическая биомедицинская диагностика. В 2 т. Т. 1 / Пер. с англ. под ред. В. В. Тучина. - М.: Физматлит, 2007. - 560 с.].
Используемые для обнаружения и распознавания нейроваскулярных структур по соответствующим критериям значения параметров Ds, StO2 и [tHb] определяют усреднением за период регистрации не менее 15 с.
Методы кратно-масштабного анализа применяют к регистрируемому сигналу интенсивности обратно рассеянного излучения, например, к среднему уровню или амплитуде модуляции в случае применения спектроскопии с частотным режимом, ко всем реализуемым с помощью оптико-хирургического устройства длинам волн и расстояниям от излучателей до приемника. Выполняют вейвлет-декомпозицию сигнала и последующий Фурье-анализ выделенных частотных составляющих [Крупаткин А.И., Сидоров В.В. Функциональная диагностика состояния микроциркуляторно-тканевых систем: Колебания, информация, нелинейность. Изд. 2-е. - М.: ЛЕНАНД, 2016. - 496, C. 167-229] с выделением максимальных пиков, соответствующих пульсовому (0,8-3,0 Гц) и дыхательному (0,2-0,4 Гц) диапазонам.
Таким образом формируют характеристику наличия или отсутствия выраженных пульсовых колебаний, наличия или отсутствия дыхательных колебаний в исследуемом объеме биологической ткани и определяют амплитуды пульсовых (Ап) и дыхательных (Ад) колебаний, и их отношение Ап/д = Ап/Ад. Определяют вектор формы ( ), представляющий собой набор значений, характеризующих форму пульсовой волны, соответствующую крупному или малому артериальному сосуду
), представляющий собой набор значений, характеризующих форму пульсовой волны, соответствующую крупному или малому артериальному сосуду 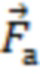 , крупному венозному сосуду
, крупному венозному сосуду 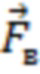 , или функциональной тканевой единице в размерах исследуемого объема биологической ткани
, или функциональной тканевой единице в размерах исследуемого объема биологической ткани 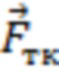 . В одном из вариантов осуществления изобретения вектор формы пульсовых колебаний
. В одном из вариантов осуществления изобретения вектор формы пульсовых колебаний 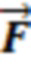 определяют тремя переменными {N, AvCork, DIm}i,j , где
определяют тремя переменными {N, AvCork, DIm}i,j , где
N - количество компонент фурье-спектра автокорреляционной функции пульсовой составляющей регистрируемой интенсивности обратно рассеянного излучения, амплитуда которых не менее 0,2 отн.ед.;
AvCork, k = 1…N - амплитуды этих компонент фурье-спектра автокорреляционной функции;
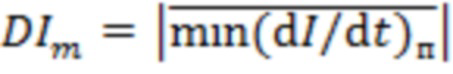 - среднее за период регистрации абсолютное значение локальных минимумов производной пульсовой составляющей регистрируемой интенсивности обратно рассеянного излучения по времени с шагом 0,2±0,003 с.
- среднее за период регистрации абсолютное значение локальных минимумов производной пульсовой составляющей регистрируемой интенсивности обратно рассеянного излучения по времени с шагом 0,2±0,003 с.
При этом форму пульсовой волны определяют как соответствующую функциональной тканевой единице исследуемой биологической ткани в размерах исследуемого объема при получении следующих значений вектора формы:
 =
= : N = 1; 0,6 ≤ AvCor1 ≤ 1;
: N = 1; 0,6 ≤ AvCor1 ≤ 1; 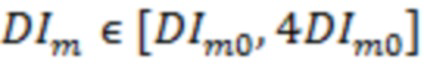 ;
;
- как соответствующую крупной артерии в исследуемом объеме биологической ткани при получении следующих значений вектора формы:
 =
=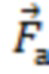 : N = 1; 0,6 ≤ AvCor1 ≤ 1; DIm > 4DIm0;
: N = 1; 0,6 ≤ AvCor1 ≤ 1; DIm > 4DIm0;
- как соответствующую крупной вене в исследуемом объеме биологической ткани при получении следующих значений вектора формы:
 =
=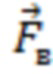 : N = 1 или N = 2; AvCork < 0,6, k = 1...N; DIm < DIm0,
: N = 1 или N = 2; AvCork < 0,6, k = 1...N; DIm < DIm0,
где DIm0 - пороговое значение DIm, определяемое для функциональной тканевой единицы в размерах исследуемого объема биологической ткани.
Формы пульсовой волны, соответствующие крупной артерии, малой артерии и вынужденным пульсовым колебаниям венозного объема крови при выраженной дикротической фазе и удвоении частоты колебаний или слабо выраженным вынужденным пульсовым колебаниям микроциркуляторного объема крови, могут быть определены качественно в соответствии с публикациями [Физиология человека. В 3-х томах. Т. 2. Пер. с англ./ Под ред. Р. Шмидта и Г. Тевса. - М.: Мир, 1996. - С. 556-559, 626-639; Лелюк В.Г., Лелюк С.Э. Церебральное кровообращение и артериальное давление. - М.: Реальное время, 2004. - 304 с.].
В одном из вариантов осуществления изобретения определяют локальную амплитуду пульсовых колебаний концентрации общего гемоглобина (Δ[tHb]п) для каждой подгруппы источников и соответствующего расстояния (r) от приемника, как минимум, по двум длинам волн из указанного диапазона. При этом Δ[tHb]п определяют по регистрируемым сигналам интенсивности обратно рассеянного излучения I(λi) с использованием известных соотношений: модифицированного закона Бугера-Ламберта-Бера [Оптическая биомедицинская диагностика. В 2 т. Т. 1 / Пер. с англ. под ред. В.В. Тучина. - М.: Физматлит, 2007. - 560 с.], выражения для суммарного коэффициента поглощения на каждой длине волны с учетом соответствующего количества анализируемых хромофоров, расчетной формулы для дифференциального фактора длины (DPF) на основе измеряемых в статическом режиме для соответствующей группы излучателей оптических параметров μa(λi) и μs'(λi) и формул для определения концентраций оксигенированного и дезоксигенированного гемоглобина по μa(λi):
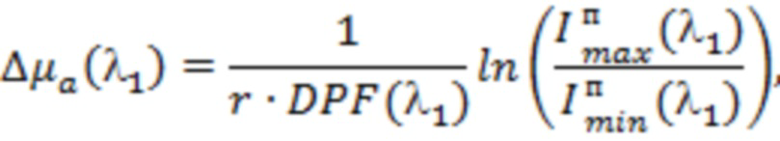
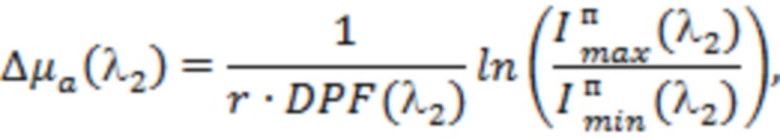
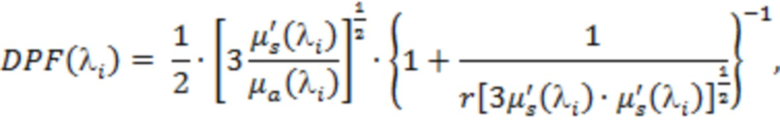
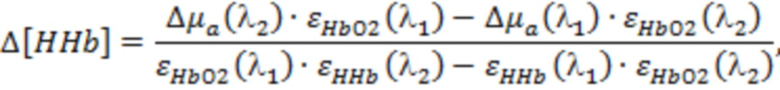
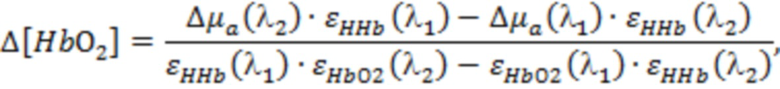
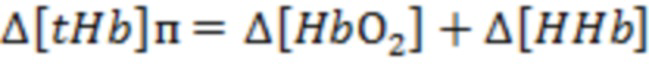 ,
,
где 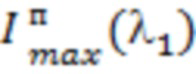 и
и 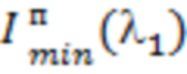 соответственно максимальное и минимальное значение интенсивности обратно рассеянного излучения, соответствующее пульсовому изменению.
соответственно максимальное и минимальное значение интенсивности обратно рассеянного излучения, соответствующее пульсовому изменению.
При этом перечисленные параметры измеряют в статическом режиме, при котором давление оптико-хирургического устройства P на поверхность исследуемого объема биологической ткани составляет P ≤ 0,2 мм рт.ст.
Вывод о наличии определенных нейроваскулярных структур делают по получению следующих совокупностей измеренных параметров:
- при {Ds > 0; [tHb] > [tHb]0; StO2 > (StO2)0; Ап/д > (Ап/д)0;  =
= ; Δ[tHb]п > (Δ[tHb]п)0} (1) - о наличии в исследуемом объеме биологической ткани крупной артерии;
; Δ[tHb]п > (Δ[tHb]п)0} (1) - о наличии в исследуемом объеме биологической ткани крупной артерии;
- при {Ds > 0; [tHb] > [tHb]0; StO2 ≤ (StO2)0 или StO2 > (StO2)0; Ап/д < (Ап/д)0;  =
= ; Δ[tHb]п ≤ (Δ[tHb]п)0} (2) - о наличии в исследуемом объеме биологической ткани крупной вены;
; Δ[tHb]п ≤ (Δ[tHb]п)0} (2) - о наличии в исследуемом объеме биологической ткани крупной вены;
- при {Ds0 < Ds < 0; [tHb] ≤ [tHb]0; StO2 ≤ (StO2)0; Ап/д ≤ (Ап/д)0;  =
=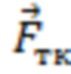 ; Δ[tHb]п < (Δ[tHb]п)0} (3) - о наличии в исследуемом объеме биологической ткани нерва диаметром от 1,5 мм и более;
; Δ[tHb]п < (Δ[tHb]п)0} (3) - о наличии в исследуемом объеме биологической ткани нерва диаметром от 1,5 мм и более;
- при {Ds ≤ Ds0; [tHb] ≥ [tHb]0; StO2 ≥ (StO2)0; Ап/д ≥ (Ап/д)0;  =
=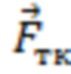 ; Δ[tHb]п ≥ (Δ[tHb]п)0} (4) - о наличии в исследуемом объеме биологической ткани, по меньшей мере, одной малой артерии;
; Δ[tHb]п ≥ (Δ[tHb]п)0} (4) - о наличии в исследуемом объеме биологической ткани, по меньшей мере, одной малой артерии;
- при { Ds0 < Ds < 0; [tHb] > [tHb]0; StO2 ≥ (StO2)0; Ап/д > (Ап/д)0;  =
=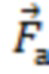 ; Δ[tHb]п > (Δ[tHb]п)0} (5) - о наличии в исследуемом объеме биологической ткани части крупной артерии, когда объем цельной крови сосуда в исследуемом объеме биологической ткани не приводит к изменениям Δμs'(λ) > 0;
; Δ[tHb]п > (Δ[tHb]п)0} (5) - о наличии в исследуемом объеме биологической ткани части крупной артерии, когда объем цельной крови сосуда в исследуемом объеме биологической ткани не приводит к изменениям Δμs'(λ) > 0;
- при { Ds0 ≤ Ds < 0; [tHb] > [tHb]0; StO2 ≤ (StO2)0; Ап/д ≤ (Ап/д)0;  =
=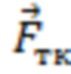 ; Δ[tHb]п ≤ (Δ[tHb]п)0} (6) - о наличии в исследуемом объеме биологической ткани, по меньшей мере, одной малой вены,
; Δ[tHb]п ≤ (Δ[tHb]п)0} (6) - о наличии в исследуемом объеме биологической ткани, по меньшей мере, одной малой вены,
где [tHb]0, Ds0, (StO2)0, (Ап/д)0, (Δ[tHb]п)0 - пороговые значения упомянутых параметров, измеренные для функциональной тканевой единицы в размерах исследуемого объема биологической ткани,
причем значения параметров Ds, [tHb] и StO2 определяют для каждой группы излучателей и соответствующего приемника.
Для распознавания нейроваскулярной структуры в исследуемом объеме биологической ткани необходимо и достаточно выполнения критериев для Ds, [tHb] и StO2 хотя бы для одной группы излучателей и соответствующего приемника и выполнения критериев для Ап/д,  и Δ[tHb]п хотя бы для одной подгруппы излучателей этой группы.
и Δ[tHb]п хотя бы для одной подгруппы излучателей этой группы.
Величина Ds0 зависит от типа, состава и строения исследуемой биологической ткани, например, типа, состава и строения опухолевой ткани. Пороговое значение [tHb]0 для исследуемой ткани без нервов и крупных сосудов, оценивают по известным зависимостям [Сафонова Л.П., Орлова В.Г., Шкарубо А.Н. Исследование нейроваскулярных структур с помощью фазово-модуляционной спектрофотометрии [Электронный ресурс]//Оптика и спектроскопия. - 2019. -том 126. №6. - С. 822-833. (DOI: 10.21883/OS.2019.06.47778.58-19). Версия на английском языке: Safonova L.P., Orlova V.G., Shkarubo A.N. The neurovascular structures research by phase modulation spectrophotometry // Optics and Spectroscopy, 2019, Vol. 126, No. 6, pp. 745-757 (https://rdcu.be/bM7sz); Оптическая биомедицинская диагностика. В 2 т. Т. 1 / Пер. с англ. под ред. В.В. Тучина. - М.: Физматлит, 2007. - C. 468] через кровенаполнение или объемный кровоток, соответствующие физиологической норме или с учетом увеличенной перфузии биологической ткани, например, опухолевой, что выявляется на этапе предоперационной диагностики, например, с помощью рентгеновской компьютерной томографии. Значения параметров [tHb]0 и Ds0 < 0, соответствующие типу исследуемой биологической ткани по клеточному составу и структуре и характеру кровоснабжения на микроциркуляторном уровне, но без нейроваскулярных включений, можно оценивать по данным спектроскопических измерений с временным разрешением непосредственно в начале операции на исследуемой биологической ткани, например, подлежащей иссечению, и/или с привлечением априорной/предоперационной диагностической информации об исследуемой биологической ткани.
Наличие нерва в исследуемом объеме биологической ткани будет характеризоваться меньшими значениями [tHb] и StO2 по сравнению с аналогичными значениями типового объема ткани без нервов и крупных сосудов, что определяется характерным строением и молекулярным составом нерва, с высоким содержанием липидов (порядка 70%). При наличии нерва, Ds принимает значения Ds0 < Ds < 0 по сравнению с величиной Ds0 для исследуемой ткани, например, аденомы гипофиза, опухолевой ткани, структура жировой ткани характеризуется значениями Ds0 < 0, близкими к нулю.
Предлагаемые критерии обнаружения и распознавания нейроваскулярных структур в исследуемом объеме биологической ткани инвариантны к выбору подхода (временного или частотного) спектроскопического метода с временным разрешением и доступны для интерпретации и анализа, т.к. отражают физиологические процессы в исследуемом объеме биологической ткани.
Систему осуществляют с автоматизированным контролем позиционирования и/или силы прижатия используемого оптико-хирургического устройства (2) к поверхности исследуемого объема биологической ткани (5), с помощью устройства позиционирования (3), оснащенного датчиками силы (3.1) и перемещения (3.2) и узлом крепления (3.3) оптико-хирургического устройства. Это происходит следующим образом. Оптико-хирургическое устройство вставляют и жестко закрепляют в узле крепления (3.3) блока позиционирования (3), в котором встроены датчики силы (3.1) и перемещения (3.2). Регистрация и отображение текущих значений силы и перемещения происходит с помощью блока управления (4) и соответствующего программного обеспечения. Примерами устройства позиционирования являются используемые в нейрохирургии устройства [Chan S., Conti F., Salisbury K., Blevins N.H. Virtual Reality Simulation in Neurosurgery: Technologies and Evolution // Neurosurgery. - 2013. - Vol. 72: A154-A164] или универсальные коллаборативные роботы типа настольных миниманипуляторов [Каталог промышленных роботов. Настольные минироботы [Электронный ресурс] Режим доступа: http://robotforum.ru/promyishlennyie-robotyi.html]. Датчики силы и перемещений (силомоментные датчики), используемые в подобных устройствах позиционирования [Силомоментные датчики. ForceKit от Weiss-Robotics. [Электронный ресурс] Режим доступа: http://ant-company.ru/catalog/forcesensor/forcekit/] применимы для реализации предлагаемой системы.
При этом определяют и контролируют зависимости силы прижатия (F) от перемещения оптико-хирургического устройства (x) и силы прижатия от времени (t) с частотой дискретизации не менее 20 Гц в двух режимах:
1) статическом, когда сила прижатия соответствует нулевому или минимальному давлению (P ≤ 0,2 мм рт.ст.) датчика на поверхность исследуемого объема биологической ткани с учетом площади поверхности контакта (S), или
2) динамическом, когда реализуют метод вдавливания оптико-хирургического устройства в исследуемый объем биологической ткани с заданной постоянной скоростью (VL ≤ 10 мм/мин) при изменении силы от 0 до Fmax, соответствующей максимально допустимому для исследуемой биологической ткани уровню давления (Pmax = Fmax/S, мм рт.ст.), или при двухэтапном изменении давления от 0 до 20 мм рт.ст. и от 20 мм рт.ст. до Pmax.
В статическом режиме на основании спектроскопических измерений формируют и применяют расширенный набор критериев обнаружения и распознавания нейроваскулярных структур на основе параметров Ds, [tHb], StO2, Ап/д,  и Δ[tHb]п.
и Δ[tHb]п.
Затем выполняют двухэтапные измерения в динамическом режиме. На первом этапе осуществляют начальное нагружение, увеличивая силу прижатия оптико-хирургического устройства к поверхности исследуемого объема биологической ткани от 0 до 20 мм рт.ст. с заданной постоянной скоростью VL. При этом при выполнении критериев обнаружения венозного сосуда в статическом режиме и при наличии на первом этапе нагружения относительно резкого, более 25 %, уменьшения параметров μa(λi) и [tHb], отражающего снижение кровенаполнения исследуемого объема биологической ткани, и при прекращении дыхательных колебаний в регистрируемых сигналах дополнительно подтверждают наличие крупного венозного сосуда в исследуемом объеме биологической ткани.
На втором этапе динамического режима проводят дальнейшее нагружение с заданной постоянной скоростью VL до максимально допустимого для исследуемой биологической ткани давления Pmax, где Pmax принимает значения от 70 мм рт.ст. для тканей головного мозга до 200 мм рт.ст. для тканей нижних конечностей, что определяется локализацией артериальных сосудов исследуемого объема биологической ткани по отношению к сердцу и величиной давления в них с учетом гидростатического давления [Лелюк В.Г., Лелюк С.Э. Церебральное кровообращение и артериальное давление. - М.: Реальное время, 2004. - 304 с.].
Проводят регистрацию зависимостей силы прижатия (F) от перемещения оптико-хирургического устройства (x) и силы прижатия (F) от времени (t) с частотой дискретизации не менее 20 Гц, на основании которых выявляют наличие артериального сосуда на глубине, большей максимальной глубины зондирования в статическом режиме, а также оценивают величину сосуда по значению давления в сосуде. Вывод о наличии артериального сосуда на глубине, большей максимальной глубины зондирования в статическом режиме, делают при выявлении пульсовых колебаний силы F(t) с максимумом в диапазоне частот сердечных сокращений от 0,8 до 3,0 Гц с использованием методов кратно-масштабного анализа дискретных сигналов в реальном времени, включая метод оконного преобразования Фурье и вейвлет-преобразование. Значение давления (P) артериального сосуда определяют по формуле P = F/S , где F - значение силы прижатия оптико-хирургического устройства в момент времени tк, соответствующий концу пульсовых колебаний или Fmax, если пульсовые колебания не прекратились, S - площадь контакта оптико-хирургического устройства с поверхностью исследуемого объема биологической ткани. При получении значения 70≤P≤90 мм рт.ст. делают вывод о наличии малой артерии на глубине, большей максимальной глубины зондирования в статическом режиме; при получении P > 90 мм рт.ст. делают вывод о наличии крупной артерии на глубине, большей максимальной глубины зондирования в статическом режиме.
При уменьшении на первом и втором этапах двухэтапного динамического режима параметров μa(λi) и [tHb], характеризующих кровенаполнение исследуемого объема биологической ткани, менее чем на 25% по сравнению со значениями, полученными в статическом режиме, для всех групп источников, дополнительно подтверждают отсутствие в исследуемой области биологической ткани крупных сосудов.
Одной из наиболее простых конструкций рабочего торца (Фиг. 2, а, б) оптико-хирургического устройства 2, удовлетворяющей условию повышения равномерности зондирования по сравнению с прототипом, является секторный вариант с одним приемником и восемью источниками (Фиг. 3, Фиг. 4, в), реализующий два линейных варианта минимальной конфигурации - по два расстояния от приемника до подгрупп излучателей и по две длины волны из КБИК диапазона в каждой подгруппе. В сомкнутом состоянии датчик имеет минимальные габариты для ввода в операционное поле (Фиг. 2, а, Фиг. 4, а), в рабочем состоянии с разведенными браншами (Фиг. 4, б) обеспечивает необходимую глубину зондирования исследуемого объема. Допустимый диапазон углов раскрытия браншей определяется конструкцией оптико-хирургического устройства с требуемым доступом к операционному полю с учетом размеров операционного пространства. Угол раскрытия определяет величину зондируемого объема биологической ткани.
Отдельный линейный вариант размещения приемников и источника на торце оптико-хирургического устройства, соответствующий прототипу [Сафонова Л.П., Орлова В.Г., Шкарубо А.Н. Исследование нейроваскулярных структур с помощью фазово-модуляционной спектрофотометрии [Электронный ресурс]/ //Оптика и спектроскопия. - 2019. - том 126. №6. - С. 822-833. (DOI: 10.21883/OS.2019.06.47778.58-19). Версия на английском языке: Safonova L.P., Orlova V.G., Shkarubo A.N. The neurovascular structures research by phase modulation spectrophotometry // Optics and Spectroscopy, 2019, Vol. 126, No. 6, pp. 745-757 (https://rdcu.be/bM7sz)], не обеспечивает равномерности зондирования исследуемого объема и не реализуем для эндоскопической трансназальной нейрохирургии ввиду использования датчика с большими габаритными размерами, в два с половиной раза превышающими допустимые, например, для эндоназальной нейрохирургии, где максимальный поперечный диаметр не превышает 6 мм, и отсутствием возможности использования раздвижных браншей с источниками и приемниками оптического излучения.
Более сложные варианты конструкций рабочего торца оптико-хирургического устройства представлены на Фиг. 5, где равномерность зондирования обеспечивается увеличением количества источников (Фиг. 5, а) и/или приемников (Фиг. 5, б), наличием линейки приемников (Фиг. 5, в) или увеличением количества раздвижных браншей (Фиг. 5, г). Распределенные, а не точечные, источники с равномерной засветкой исследуемого объема не обеспечивают пространственного разрешения и пространственной чувствительности к нейроваскулярным структурам в исследуемом объеме.
Инвариантность способа к расположению нейроваскулярных структур при их наличии в исследуемом объеме биологический ткани обеспечивают за счет подповерхностного картирования исследуемого объема, предполагающего распределение по поверхности рабочего торца оптико-хирургического устройства (2) источников зондирующего излучения используемых длин волн КБИК диапазона и приемников обратно рассеянного в биологической ткани излучения для повышения или обеспечения равномерности зондирования исследуемого объема и пространственной чувствительности к нейроваскулярным структурам, максимально возможными для используемой технической реализации метода КБИК спектроскопии с временным разрешением с определенным количеством источников длин волн λi , i=1…N, N≥2 и требуемым количеством подгрупп излучателей с расстояниями rj, j=1…M, M≥2, от приемника, обеспечивающими максимальную глубину зондирования, не менее 5 мм, для каждой группы излучателей.
Примеры схем расположения групп и подгрупп излучателей относительно приемника приведены на фиг. 3 и фиг. 5.
Пространственное разрешение и чувствительность системы определяются величиной минимально необходимого для реализации спектроскопического метода с временным разрешением [Оптическая биомедицинская диагностика. В 2 т. Т. 1 / Пер. с англ. под ред. В.В. Тучина. - М.: Физматлит, 2007. - 560 с., Гл. 3, Гл. 7] исследуемого объема биологической ткани, обеспечиваемого при расстояниях от излучателей до приемника не менее 5 мм, и количеством каналов измерения спектрометра.
Кроме того, заявляемая система позволяет контролировать наличие возможного спазмирования крупных артерий и степень ишемизации кровоснабжаемых ими биологических тканей по отклонениям контролируемых физиологических параметров от их начальных значений, регистрируемых интраоперационно, в сторону выраженной гипоксии тканей, StO2 < (StO2)0, и сниженного кровотока [tHb] < [tHb]0. Для этого тем же устройством (2) для отражательной диффузионной спектроскопии с необходимой периодичностью мониторируют в статическом режиме участки органа или ткани, подлежащие контролю на предмет возможной ишемизации вследствие спазмирования артериальных сосудов исследуемого объема или кровоснабжающей их магистральной артерии, снижения локального кровотока и тканевой сатурации до критического уровня и ниже. Регистрируемые значения StO2 и [tHb] не должны быть меньше критических для биологических тканей значений: StO2 ≤ 55%, что определяется соотношением между поставкой кислорода кровью, адекватной потреблению кислорода в тканях [Физиология человека. В 3-х томах. Т.2. Пер. с англ./ Под ред. Р. Шмидта и Г. Тевса. - М.: Мир, 1996. - С. 556-559, 626-639]; критическое значение [tHb] определяется допустимым для исследуемой ткани уровнем кровотока, для оценки можно использовать известные соотношения [Оптическая биомедицинская диагностика. В 2 т. Т. 1 / Пер. с англ. под ред. В.В. Тучина. - М.: Физматлит, 2007. - 560 с.; Физиология человека. В 3-х томах. Т. 2. Пер. с англ. / Под ред. Р. Шмидта и Г. Тевса. - М.: Мир, 1996. - С. 556-559, 626-639].
При реализации способа с количеством длин волн больше двух предпочтитетльно выполнение следующих условий: 1) как минимум две из применяемых длин волн должны соответствовать критерию λ1 < 806 нм и λ2 > 806 нм при выполнении указанных выше требований к глубине зондирования и точности оценки определяемых концентраций биологических хромофоров; 2) λ3 = (930±5) нм, что соответствует спектральному пику поглощения липидов, оценка концентрации которых будет дополнительным критерием для обнаружения и распознавания нервов; 3) одна из длин волн может быть выбрана из диапазона 900-950 нм, дополнительно к λ3~930 нм, что позволит количественно оценивать концентрацию воды в исследуемом объеме биологической ткани, повысить точность определения концентраций оксигенированного и дезоксигенированного гемоглобина, липидов, воды и других определяемых хромофоров (например, цитохром-оксидазы, коллагена, миоглобина и др.) в зависимости от практического применения способа и общего количества используемых длин волн, отличных от указанных; 4) остальные длины волн могут быть выбираны из диапазона 650-950 отличными от уже выбранных.
Возможность использования разработанной системы, а также достижение технического результата, продемонстрировано на представленных ниже данных.
Исследования нейроваскулярных структур проводились с помощью спектрофотометрического прибора «OxiplexTS» (ISS, Inc., USA) с двухволновым (692 нм и 834 нм) фазово-модуляционным режимом измерений (FD-режим) (Фиг. 7) с использованием минимальной секторной конфигурации макета оптико-хирургического устройства диаметром 12 мм и рабочими расстояниями от излучателей до приемника 6 мм и 9 мм, изготовленного ООО «НТЦ Волоконно-оптических устройств» (г. Москва, РФ).
С целью обнаружения и распознавания крупных венозных и артериальных сосудов исследовались in vivo области с различной анатомией сосудистого русла и нервов на руке и предплечье добровольцев (Фиг. 8, а). Для кожных покровов и мягких мышечных тканей руки максимальная сила прижатия Fmax не превышает 10 Н.
Для верификации полученных результатов при распознавании крупных сосудов одновременно со спектроскопией применялся метод ультразвуковой допплерографии сосудов. Верификация наличия нерва в исследуемом объеме применялась ультразвуковая визуализация исследуемой конечности.
Автоматизированный контроль перемещений оптико-хирургического устройства и силы прижатия осуществлялся с помощью силомоментной установки «Инстрон» (Фиг. 7, б) при одномоментной регистрации данных спектроскопии с помощью «OxiplexTS» (Фиг.7, в) на руке и предплечье испытуемого.
Результаты применения кратно-масштабного анализа, вейвлет преобразования и спектрального фурье-анализа для выделения и анализа пульсовой и дыхательной компонент в сигналах интенсивности обратно рассеянного излучения, регистрируемых для отдельных источников, представлены на Фиг. 9.
Примеры анализа формы пульсовых колебаний и определения соответствующих векторов формы представлены в Таблице 1.
Работоспособность, значимость и эффективность введенного комплекса показателей и критериев обнаружения и распознавания артерий, вен и нервов подтверждают результаты исследований, представленные в Таблице 1. Примеры распознавания приведены для предлагаемого способа в сравнении с прототипом. Пороговые значения соответствуют функциональной тканевой единице исследуемого объема ткани наружной поверхности середины предплечья. Расширение вектора признаков параметрами 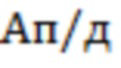 ,
,  и Δ[tHb]п позволяет, в отличие от прототипа, распознавать малые артерии и вены и наличие малого объема крови крупной артерии в исследуемом объеме биологической ткани, а также состояние спазмирования артерий в исследуемом объеме или спазмирования питающей магистральной артерии.
и Δ[tHb]п позволяет, в отличие от прототипа, распознавать малые артерии и вены и наличие малого объема крови крупной артерии в исследуемом объеме биологической ткани, а также состояние спазмирования артерий в исследуемом объеме или спазмирования питающей магистральной артерии.
Эффективность контроля перемещений и силы прижатия в процессе динамического режима измерений демонстрируют результаты, представленные на Фиг. 10. Для исследуемой области с крупным венозным сосудом, локтевой веной (диаметром более 2 мм) на этапе статических измерений условие Ds < 0 не выполнялось. На первом этапе динамического режима измерений, при нагружении от 0 до 20 мм рт.ст. обнаруживается наличие крупной вены с малым давлением в сосуде (менее 20 мм рт.ст.), о чем свидетельствует и уменьшение параметров μa(692), μa(834) и [tHb], характеризующих кровенаполнение исследуемого объема биологической ткани, более чем на 25% от значений в статическом режиме измерений. На втором этапе нагружения в динамическом режиме обнаруживается наличие крупной артерии - локтевой - в исследуемой области, что подтверждается появлением пульсаций силы прижатия F(t), сохраняющихся до Fmax, что соответствует давлению в сосуде более 90 мм рт.ст. При этом изменения μs'(834) и μs'(692) соответствовали Ds > 0.
Повышение чувствительности секторного оптико-хирургического устройства к локальным неоднородностям исследуемого объема биологической ткани по сравнению с линейным датчиком прототипа подтверждается разной локальной динамикой (пульсовой и дыхательной) для излучателей разных подгрупп и результатами измерений, проводимых на неоднородных фантомах биологических тканей с включениями, имитирующими крупные сосуды по оптическим параметрам.
Таким образом, проведенные исследования продемонстрировали возможность осуществления изобретения с достижением заявляемого результата.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИНТРАОПЕРАЦИОННОГО ОБНАРУЖЕНИЯ И РАСПОЗНАВАНИЯ НЕЙРОВАСКУЛЯРНЫХ СТРУКТУР В ОБЪЁМЕ БИОЛОГИЧЕСКОЙ ТКАНИ | 2020 |
|
RU2736307C1 |
| ОПТИКО-ХИРУРГИЧЕСКОЕ УСТРОЙСТВО ДЛЯ ОБНАРУЖЕНИЯ И РАСПОЗНАВАНИЯ НЕЙРОВАСКУЛЯРНЫХ СТРУКТУР В ОБЪЁМЕ БИОЛОГИЧЕСКОЙ ТКАНИ | 2021 |
|
RU2767895C1 |
| СПОСОБ МАЛОИНВАЗИВНОГО ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ БОЛЬШИХ И ГИГАНТСКИХ ОПУХОЛЕЙ ОСНОВАНИЯ ЧЕРЕПА ЭНДО-ЭКСТРАСЕЛЛЯРНОЙ ЛОКАЛИЗАЦИИ | 2003 |
|
RU2228718C1 |
| СПОСОБ ВЫБОРА ТАКТИКИ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ НОВООБРАЗОВАНИЙ ВЕНТРАЛЬНЫХ ОТДЕЛОВ ЗАДНЕЙ ЧЕРЕПНОЙ ЯМКИ ПРИ ЭНДОСКОПИЧЕСКОМ ЭНДОНАЗАЛЬНОМ ТРАНСКЛИВАЛЬНОМ ДОСТУПЕ | 2023 |
|
RU2806968C1 |
| СПОСОБ КОМПЛЕКСНОЙ ОЦЕНКИ СОСТОЯНИЯ АРТЕРИАЛЬНОГО РУСЛА | 2019 |
|
RU2731414C1 |
| Способ пластики и герметизации дефекта твердой мозговой оболочки в области костного дефекта основания черепа | 2019 |
|
RU2685678C1 |
| СПОСОБ ОЦЕНКИ КОРРЕКТНОСТИ УСТАНОВКИ ПОТОКОНАПРАВЛЯЮЩЕГО СТЕНТА | 2024 |
|
RU2834685C1 |
| СПОСОБ ВИЗУАЛИЗАЦИИ АРТЕРИАЛЬНЫХ И ВЕНОЗНЫХ СОСУДОВ ОСНОВАНИЯ ЧЕРЕПА И ГОЛОВНОГО МОЗГА ЧЕЛОВЕКА ДЛЯ ИХ ТОПОГРАФО-АНАТОМИЧЕСКОГО ИССЛЕДОВАНИЯ | 2016 |
|
RU2621419C1 |
| Способ передней трансоральной атланто-окципитальной стабилизации | 2019 |
|
RU2685806C1 |
| НАВИГАЦИЯ С ПОМОЩЬЮ ОПТОВОЛОКОННОГО ДАТЧИКА ДЛЯ ВИЗУАЛИЗАЦИИ И МОНИТОРИНГА СОСУДОВ | 2013 |
|
RU2686954C2 |
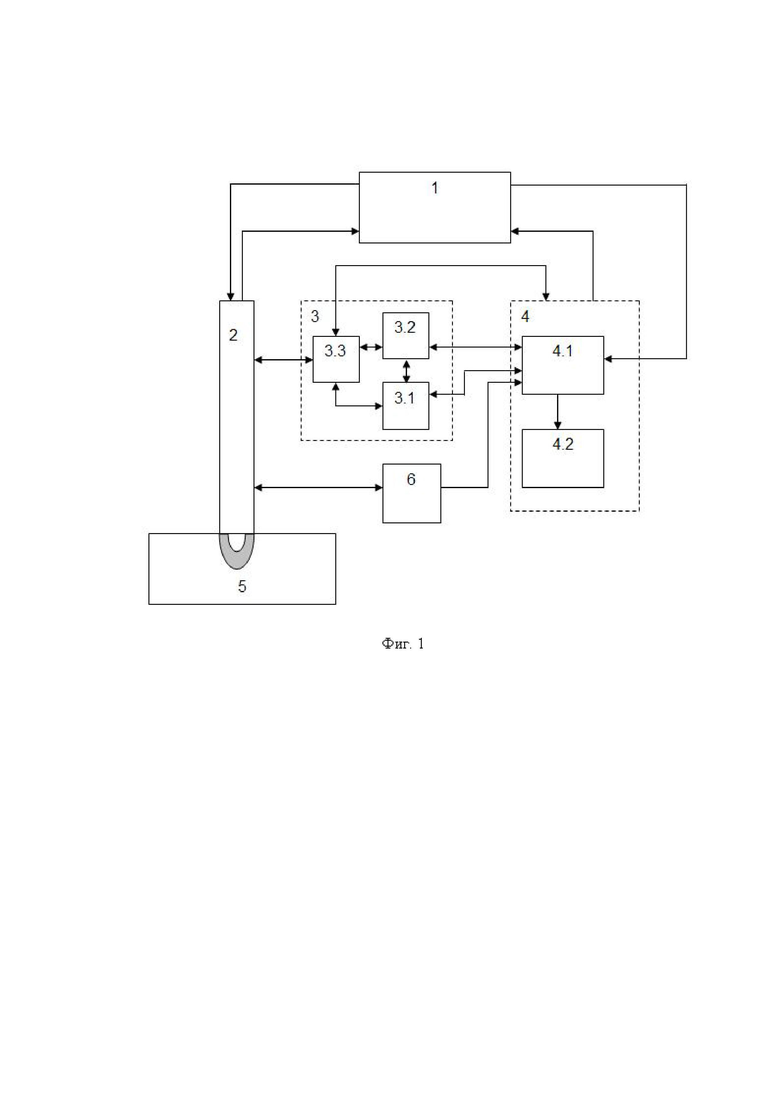
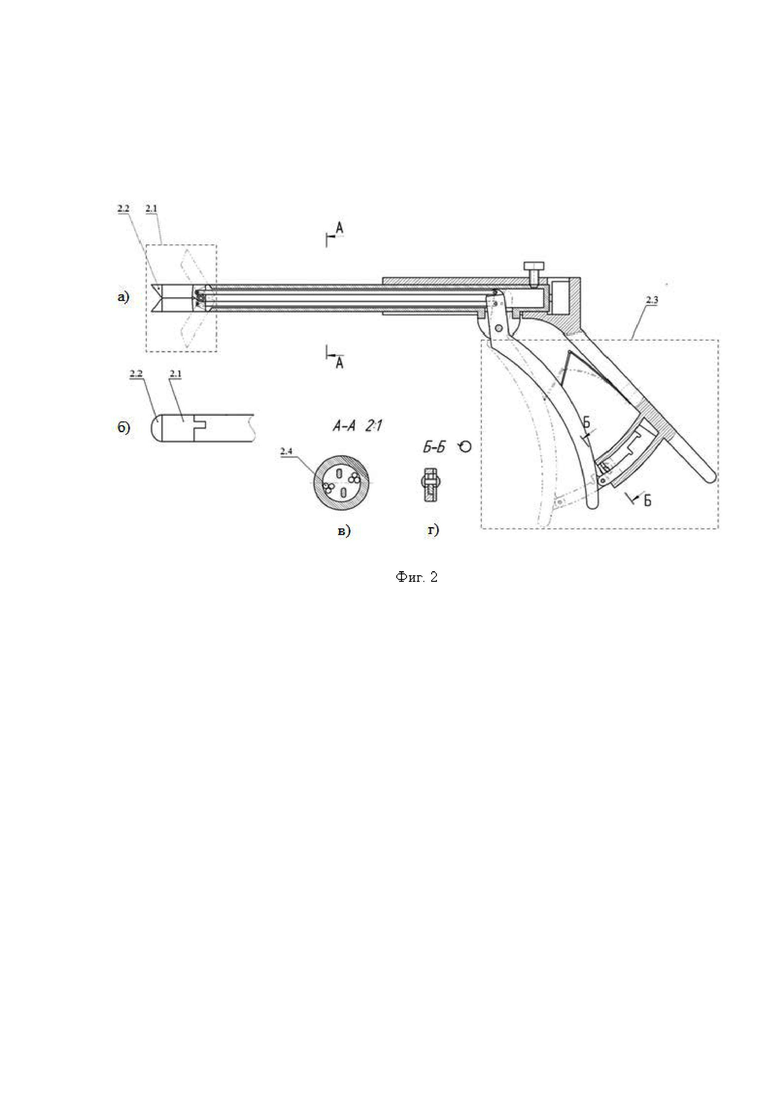
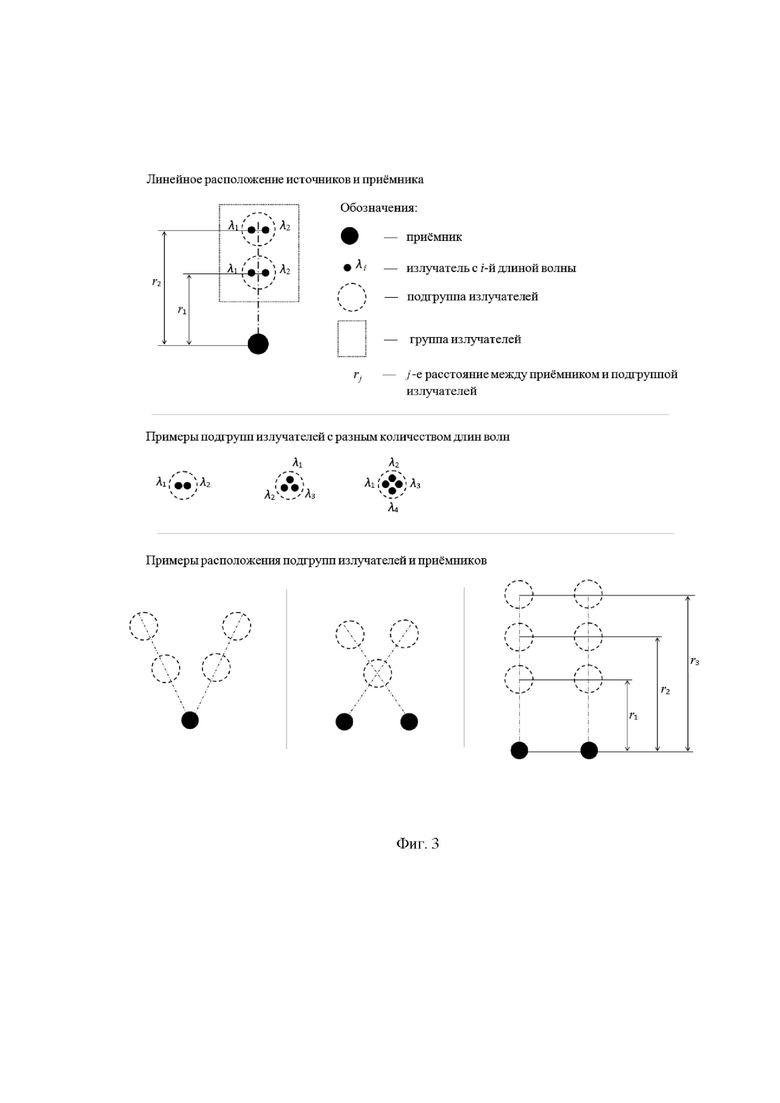
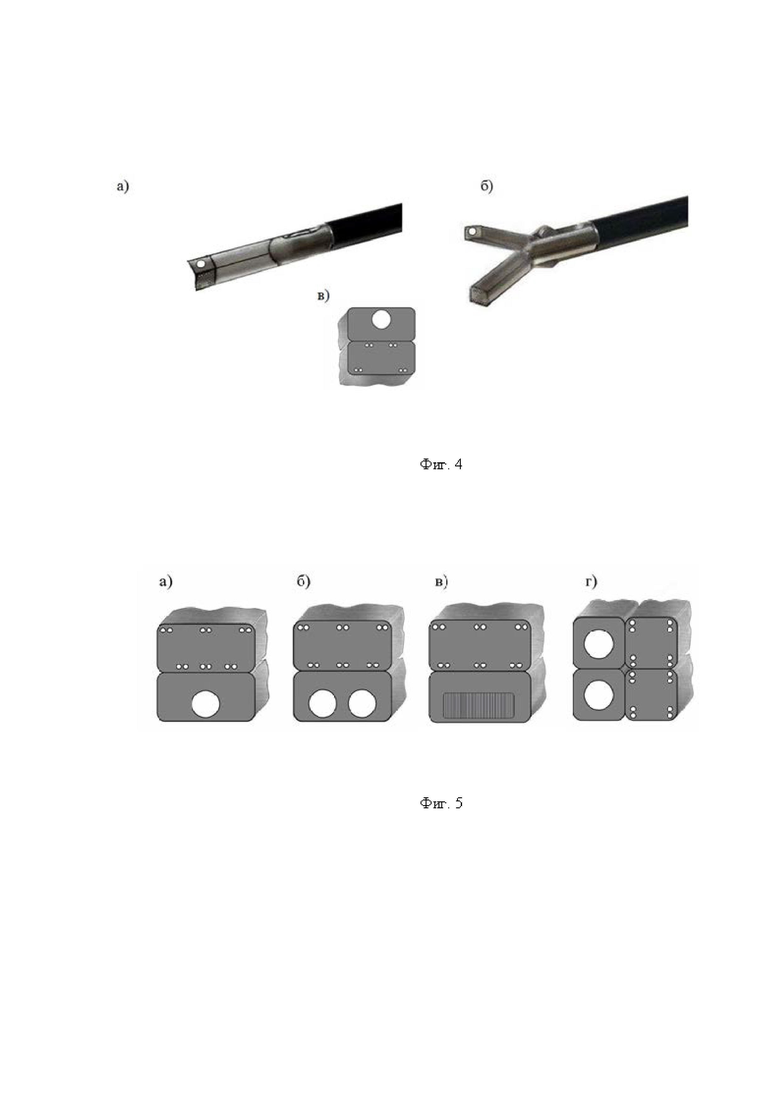
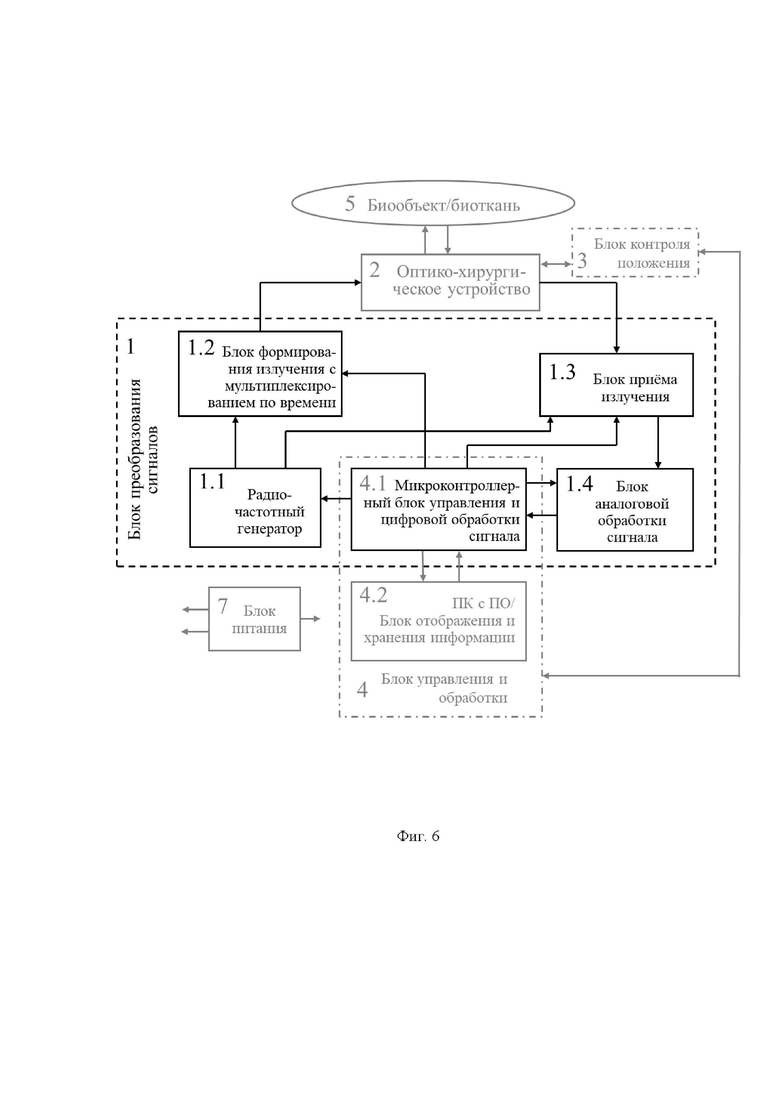
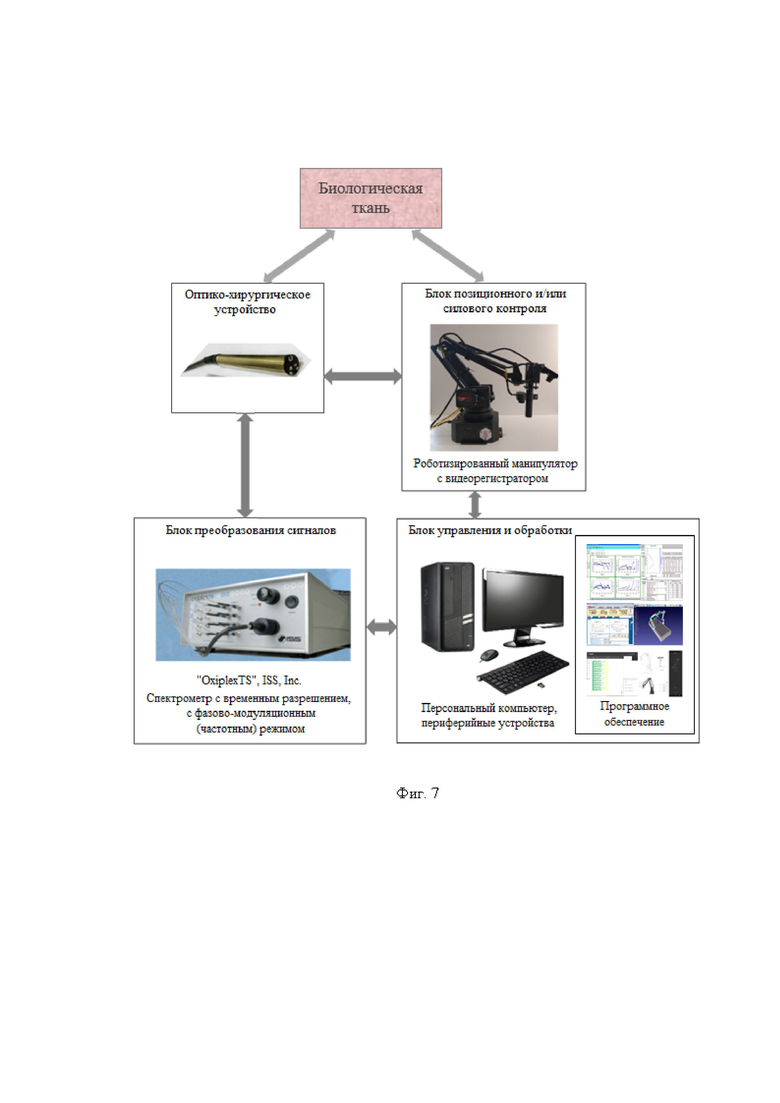
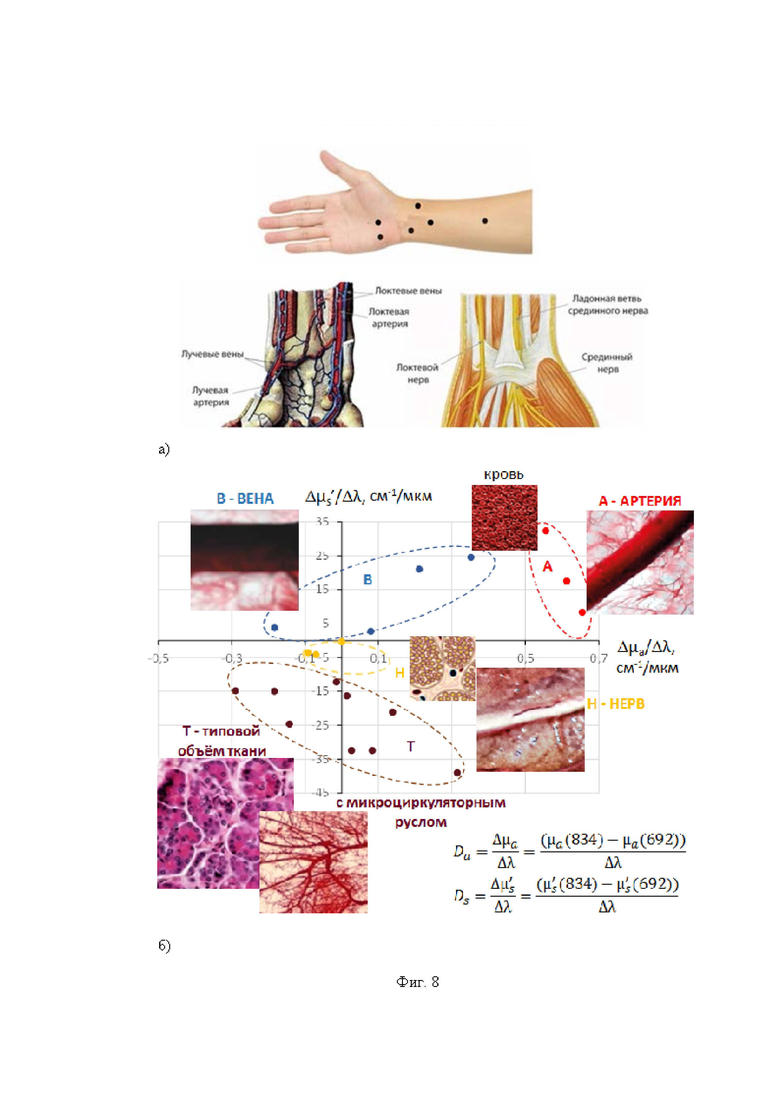

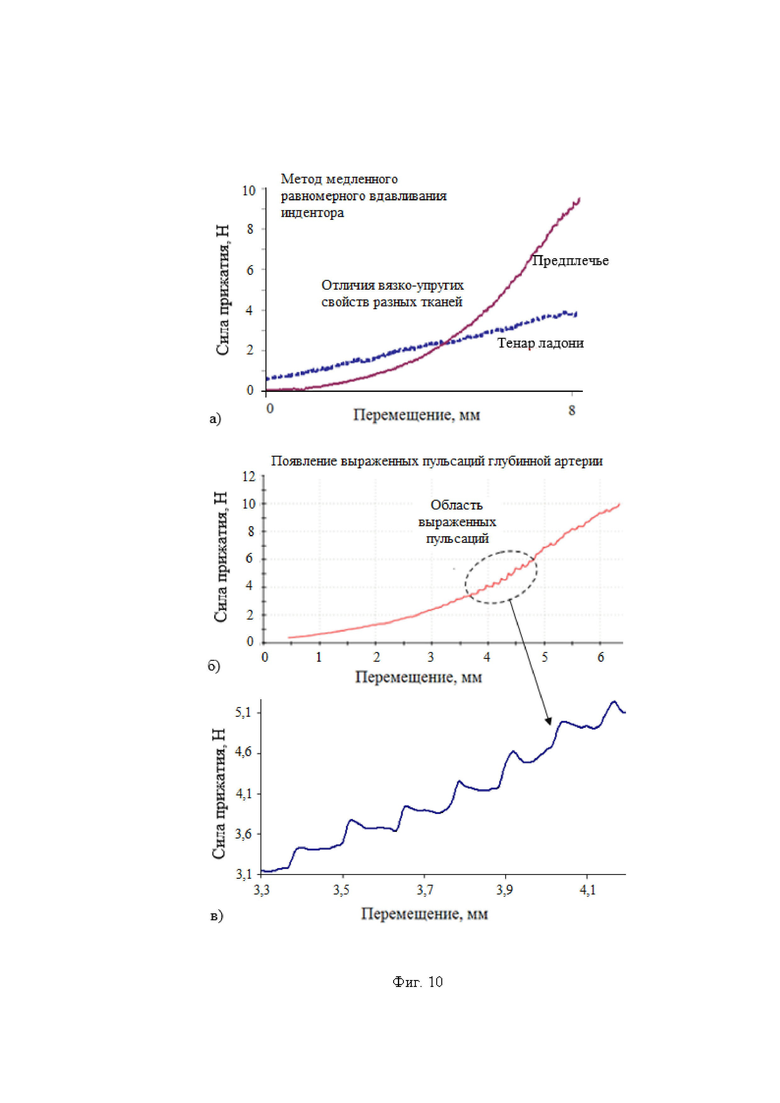
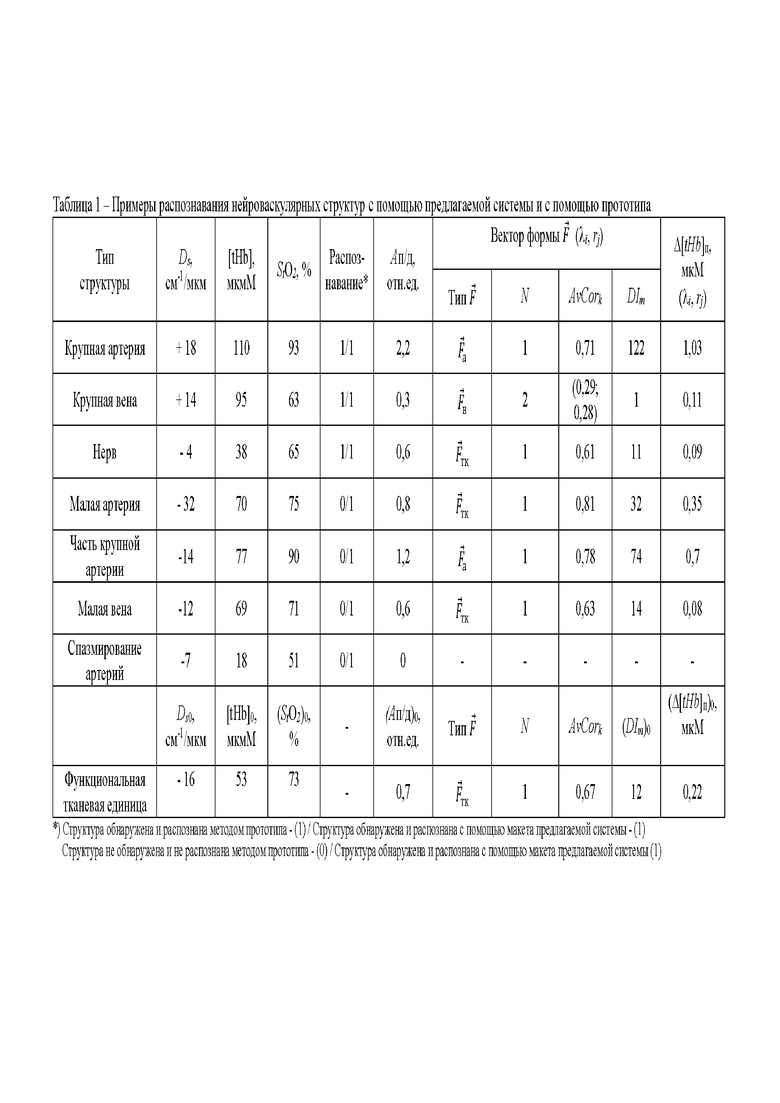
Изобретение относится к области медицины и медико-технических технологий, а именно к интраоперационной диагностике и функциональной диагностике, и может быть использовано для обнаружения и распознавания локальных неоднородностей, отличающихся по оптическим свойствам от окружающих биологических тканей в области исследования. Система для интраоперационного обнаружения и распознавания нейроваскулярных структур в объёме биологической ткани включает: оптико-хирургическое устройство для зондирования биологических тканей и хирургических манипуляций, выполненное на основе браншей; блок позиционного и/или силового контроля оптико-хирургического устройства, включающий датчик положения и/или датчик силы или силомоментный датчик, выполненный с возможностью контроля перемещения и/или силы прижатия рабочего торца оптико-хирургического устройства к биологической ткани; блок преобразования сигналов, выполненный с возможностью формирования прямого и приема обратного оптических сигналов подповерхностного зондирования биологической ткани; блок управления и обработки, выполненный с возможностью формирования управляющих сигналов для синхронизированной работы блока преобразования и блока контроля положения, а также с возможностью обработки принимаемых сигналов с упомянутых блоков, отображения диагностической информации и хранения получаемых данных. Блок преобразования сигналов выполнен с возможностью формирования излучения для отражательной диффузионной спектроскопии с временным разрешением по меньшей мере на двух длинах волн (λi, i=1..K, K≥2) из диапазона 650-950 нм. Оптико-хирургическое устройство выполнено с возможностью подповерхностного контактного зондирования биологической ткани на максимальную глубину не менее 5 мм и снабжено по меньшей мере двумя группами оптоволокон для подвода прямого оптического сигнала подповерхностного зондирования биологической ткани и по меньшей мере одним оптоволоконным жгутом для приема обратного сигнала. Оптоволокна и оптоволоконный жгут, каждый, если их больше одного, одним концом выведены на рабочий торец устройства, а другим концом подключены к блоку преобразования сигналов. Группы оптоволокон на рабочем торце расположены вдоль отдельных несовпадающих полуосей, направленных от оптоволоконного жгута. Каждая группа оптоволокон состоит как минимум из двух подгрупп. Каждая подгруппа предназначена для подачи сигнала по меньшей мере на двух длинах волн (λi, i=1..K, K≥2) из указанного диапазона. Оптоволокна каждой подгруппы расположены друг от друга на расстоянии не более 1 мм, а каждая подгруппа - на определённом расстоянии (rj, j=1..M, M≥2) от приёмного оптоволоконного жгута вдоль соответствующей полуоси. Блок управления выполнен с возможностью формирования вектора признаков для обнаружения и распознавания нейроваскулярных структур на основе сигналов, полученных с блока преобразования и блока контроля положения, по которым судят о наличии определенных нейроваскулярных структур в объёме биологической ткани, о тканевой сатурации и локальном кровенаполнении, в том числе о наличии или отсутствии гипоксии тканей. Технический результат изобретения заключается в получении достоверных данных о наличии нервов, крупных и малых артерий и вен в объеме биологической ткани на максимальной глубине не менее 5 мм во время проведения операций. 6 з.п. ф-лы, 10 ил., 1 табл.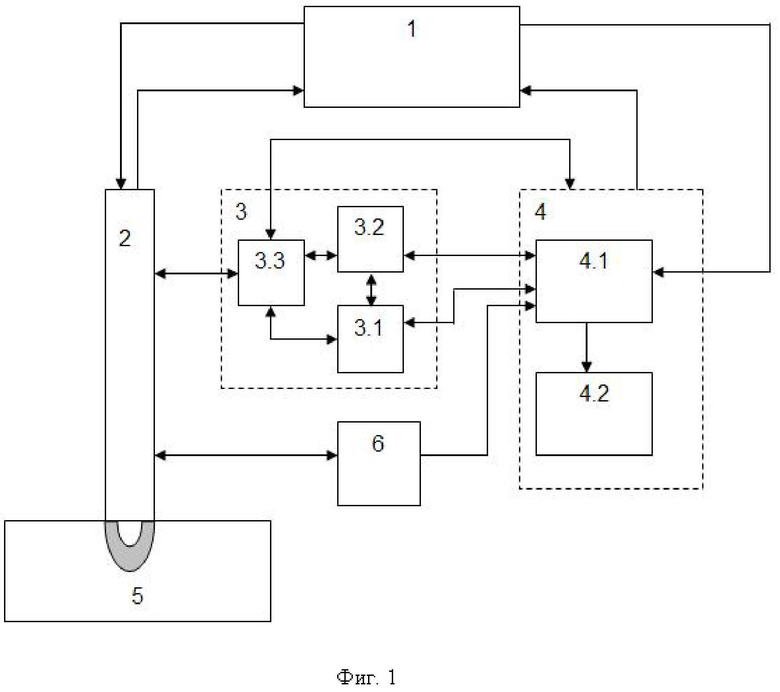
1. Система для интраоперационного обнаружения и распознавания нейроваскулярных структур в объеме биологической ткани, включающая:
- оптико-хирургическое устройство для зондирования биологических тканей и хирургических манипуляций, выполненное на основе браншей;
- блок позиционного и/или силового контроля оптико-хирургического устройства, включающий датчик положения и/или датчик силы или силомоментный датчик, выполненный с возможностью контроля перемещения и/или силы прижатия рабочего торца оптико-хирургического устройства к биологической ткани;
- блок преобразования сигналов, выполненный с возможностью формирования прямого и приема обратного оптических сигналов подповерхностного зондирования биологической ткани;
- блок управления и обработки, выполненный с возможностью формирования управляющих сигналов для синхронизированной работы блока преобразования и блока контроля положения, а также с возможностью обработки принимаемых сигналов с упомянутых блоков, отображения диагностической информации и хранения получаемых данных,
при этом
блок преобразования сигналов выполнен с возможностью формирования излучения для отражательной диффузионной спектроскопии с временным разрешением по меньшей мере на двух длинах волн (λi, i=1…K, K≥2) из диапазона 650-950 нм;
оптико-хирургическое устройство выполнено с возможностью подповерхностного контактного зондирования биологической ткани на максимальную глубину не менее 5 мм и снабжено по меньшей мере двумя группами оптоволокон для подвода прямого оптического сигнала подповерхностного зондирования биологической ткани и по меньшей мере одним оптоволоконным жгутом для приема обратного сигнала; оптоволокна и оптоволоконный жгут, каждый, если их больше одного, одним концом выведены на рабочий торец устройства, а другим концом подключены к блоку преобразования сигналов, при этом группы оптоволокон на рабочем торце расположены вдоль отдельных несовпадающих полуосей, направленных от оптоволоконного жгута; каждая группа оптоволокон состоит как минимум из двух подгрупп, каждая из которых предназначена для подачи сигнала по меньшей мере на двух длинах волн (λi, i=1…K, K≥2) из указанного диапазона, оптоволокна каждой подгруппы расположены друг от друга на расстоянии не более 1 мм, а каждая подгруппа - на определенном расстоянии (rj, j=1…M, M≥2) от приемного оптоволоконного жгута вдоль соответствующей полуоси;
блок управления выполнен с возможностью формирования вектора признаков для обнаружения и распознавания нейроваскулярных структур на основе сигналов, полученных с блока преобразования и блока контроля положения, по которым судят о наличии определенных нейроваскулярных структур в объеме биологической ткани, о тканевой сатурации и локальном кровенаполнении, в том числе о наличии или отсутствии гипоксии тканей.
2. Система по п. 1, отличающаяся тем, что для формирования вектора признаков для обнаружения и распознавания нейроваскулярных структур блок преобразования сигналов выполнен с возможностью регистрации сигналов интенсивностей обратно рассеянного излучения для каждой длины волны λi и каждого rj с последующей обработкой в блоке управления и формированием параметров вектора признаков для обнаружения и распознавания нейроваскулярных структур:
- коэффициента(ов) поглощения μa(λi) и транспортного(ых) коэффициента(ов) рассеяния μs'(λi) для каждой группы оптоволокон и каждого оптоволоконного жгута, по которым определяют концентрацию общего гемоглобина ([tHb]) в единице исследуемого объема биологической ткани и тканевую сатурацию (StO2) - степень насыщения кислородом крови в сосудах исследуемого объема ткани, а также тангенс угла наклона транспортного коэффициента рассеяния от длины волны (Ds),
- амплитуд пульсовых (Ап) и дыхательных (Ад) колебаний и их отношения Ап/д=Ап/Ад для каждой пары (λi, rj), и/или
- вектора формы (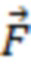 ), представляющего собой набор значений, характеризующих форму пульсовой волны, соответствующую крупному или малому артериальному сосуду
), представляющего собой набор значений, характеризующих форму пульсовой волны, соответствующую крупному или малому артериальному сосуду 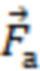 , крупному венозному сосуду
, крупному венозному сосуду 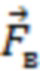 , или функциональной тканевой единице в размерах исследуемого объема биологической ткани
, или функциональной тканевой единице в размерах исследуемого объема биологической ткани  ,
,
а для каждой подгруппы источников по меньшей мере для двух длин волн из указанного диапазона - с возможностью определения локальной амплитуды пульсовых колебаний концентрации общего гемоглобина (Δ[tHb]п).
3. Система по п. 1, отличающаяся тем, что блок управления выполнен с возможностью формирования вектора формы пульсовых колебаний 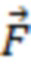 , определяющегося тремя переменными {N, AvCork, DIm}i,j, где
, определяющегося тремя переменными {N, AvCork, DIm}i,j, где
N - количество компонент фурье-спектра автокорреляционной функции пульсовой составляющей регистрируемой интенсивности обратно рассеянного излучения, амплитуда которых не менее 0,2 отн.ед.;
AvCork, k = 1…N - амплитуды этих компонент фурье-спектра автокорреляционной функции;
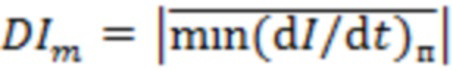 - среднее за период регистрации абсолютное значение локальных минимумов производной пульсовой составляющей регистрируемой интенсивности обратно рассеянного излучения по времени с шагом 0,2±0,003 с;
- среднее за период регистрации абсолютное значение локальных минимумов производной пульсовой составляющей регистрируемой интенсивности обратно рассеянного излучения по времени с шагом 0,2±0,003 с;
при этом форму пульсовой волны определяют как соответствующую функциональной тканевой единице в размерах исследуемого объема биологической ткани при получении следующих значений вектора формы:
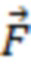 =
=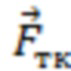 : N = 1; 0,6 ≤ AvCor1 ≤ 1;
: N = 1; 0,6 ≤ AvCor1 ≤ 1; 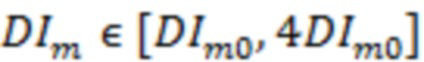 , -
, -
как соответствующую крупной артерии в исследуемом объеме биологической ткани при получении следующих значений вектора формы:
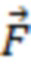 =
=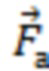 : N = 1; 0,6 ≤ AvCor1 ≤ 1; DIm > 4DIm0, -
: N = 1; 0,6 ≤ AvCor1 ≤ 1; DIm > 4DIm0, -
как соответствующую крупной вене в исследуемом объеме биологической ткани при получении следующих значений вектора формы:
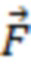 =
=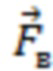 : N = 1 или N = 2; AvCork < 0,6, k = 1...N; DIm < DIm0,
: N = 1 или N = 2; AvCork < 0,6, k = 1...N; DIm < DIm0,
где DIm0 - пороговое значение DIm, определяемое для функциональной тканевой единицы в размерах исследуемого объема биологической ткани.
4. Система по п. 1, отличающаяся тем, что блок управления выполнен с возможностью формирования выводов о наличии определенных нейроваскулярных структур при получении следующих совокупностей измеренных параметров:
- при {Ds > 0; [tHb] > [tHb]0; StO2 > (StO2)0; Ап/д > (Ап/д)0; 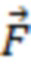 =
=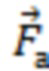 ; Δ[tHb]п > (Δ[tHb]п)0} (1) - о наличии в исследуемом объеме биологической ткани крупной артерии;
; Δ[tHb]п > (Δ[tHb]п)0} (1) - о наличии в исследуемом объеме биологической ткани крупной артерии;
- при {Ds > 0; [tHb] > [tHb]0; StO2 ≤ (StO2)0 или StO2 > (StO2)0; Ап/д < (Ап/д)0; 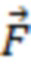 =
=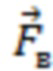 ; Δ[tHb]п ≤ (Δ[tHb]п)0} (2) - о наличии в исследуемом объеме биологической ткани крупной вены;
; Δ[tHb]п ≤ (Δ[tHb]п)0} (2) - о наличии в исследуемом объеме биологической ткани крупной вены;
- при {Ds0 < Ds < 0; [tHb] ≤ [tHb]0; StO2 ≤ (StO2)0; Ап/д ≤ (Ап/д)0; 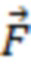 =
=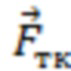 ; Δ[tHb]п < (Δ[tHb]п)0} (3) - о наличии в исследуемом объеме биологической ткани нерва диаметром от 1,5 мм и более;
; Δ[tHb]п < (Δ[tHb]п)0} (3) - о наличии в исследуемом объеме биологической ткани нерва диаметром от 1,5 мм и более;
- при {Ds ≤ Ds0; [tHb] ≥ [tHb]0; StO2 ≥ (StO2)0; Ап/д ≥ (Ап/д)0; 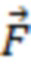 =
=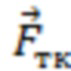 ; Δ[tHb]п ≥ (Δ[tHb]п)0} (4) - о наличии в исследуемом объеме биологической ткани по меньшей мере одной малой артерии;
; Δ[tHb]п ≥ (Δ[tHb]п)0} (4) - о наличии в исследуемом объеме биологической ткани по меньшей мере одной малой артерии;
- при {Ds0 < Ds < 0; [tHb] > [tHb]0; StO2 ≥ (StO2)0; Ап/д > (Ап/д)0; 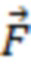 =
=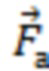 ; Δ[tHb]п > (Δ[tHb]п)0} (5) - о наличии в исследуемом объеме биологической ткани части крупной артерии, когда объем цельной крови сосуда в исследуемом объеме биологической ткани не приводит к изменениям Δμs'(λ) > 0;
; Δ[tHb]п > (Δ[tHb]п)0} (5) - о наличии в исследуемом объеме биологической ткани части крупной артерии, когда объем цельной крови сосуда в исследуемом объеме биологической ткани не приводит к изменениям Δμs'(λ) > 0;
- при { Ds0 ≤ Ds < 0; [tHb] ≥ [tHb]0; StO2 ≤ (StO2)0; Ап/д ≤ (Ап/д)0; 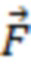 =
=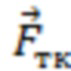 ; Δ[tHb]п ≤ (Δ[tHb]п)0} (6) - о наличии в исследуемом объеме биологической ткани по меньшей мере одной малой вены,
; Δ[tHb]п ≤ (Δ[tHb]п)0} (6) - о наличии в исследуемом объеме биологической ткани по меньшей мере одной малой вены,
где [tHb]0, Ds0, (StO2)0, (Ап/д)0, (Δ[tHb]п)0 - пороговые значения упомянутых параметров, измеренные для функциональной тканевой единицы в размерах исследуемого объема биологической ткани,
причем значения параметров Ds, [tHb] и StO2 определяют для каждой группы оптоволокон на рабочем торце оптико-хирургического устройства и каждого приемного оптоволоконного жгута или как минимум единственного, а Ап/д, 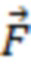 и Δ[tHb]п определяют по меньшей мере для одной подгруппы излучателей этой группы.
и Δ[tHb]п определяют по меньшей мере для одной подгруппы излучателей этой группы.
5. Система по п. 1, отличающаяся тем, что блок контроля положения и блок управления выполнены с возможностью измерения параметров, обнаружения и распознавания нейроваскулярных структур в статическом режиме, при котором контролируемое давление P оптико-хирургического устройства на поверхность исследуемого объема биологической ткани составляет P ≤ 0,2 мм рт.ст., и в динамическом режиме с увеличением давления оптико-хирургического устройства на поверхность исследуемого объема биологической ткани с заданной постоянной скоростью VL ≤ 10 мм/мин при изменении силы от 0 до Fmax, соответствующей максимально допустимому для исследуемой биологической ткани уровню давления Pmax = Fmax/S, с учетом площади контакта S рабочего торца диагностического оптико-хирургического устройства с поверхностью исследуемого объема биологической ткани, где Pmax принимает значения от 70 мм рт.ст. для тканей головного мозга до 200 мм рт.ст. для тканей нижних конечностей, или при двухэтапном изменении давления Р от 0 до 20 мм рт.ст. и от 20 мм рт.ст. до Pmax.
6. Система по п. 1, отличающаяся тем, что блок управления выполнен с возможностью определения состояния спазмирования артериальных сосудов исследуемого объема биологической ткани или питающей крупной артерии по получению следующих совокупностей измеренных параметров {Ds0 ≤ Ds < 0; [tHb] < [tHb]0; StO2 < (StO2)0; Ап/д = 0 (при отсутствии пульсовых колебаний)}.
7. Система по п. 1, отличающаяся тем, что оптико-хирургическое устройство содержит блок разведения браншей для регулирования пространственного положения браншей относительно исследуемой поверхности биологической ткани и относительно друг друга, и/или содержит блок стыковки с блоком позиционного и/или силового контроля для автоматизированного регулирования пространственного положения браншей относительно исследуемой поверхности биологической ткани и относительно друг друга, выполненный с возможностью управления со стороны блока контроля положения и со стороны блока управления по специальным управляющим сигналам.
| УСТРОЙСТВО ДЛЯ ФЛУОРЕСЦЕНТНОЙ НАВИГАЦИИ В НЕЙРОХИРУРГИИ | 2017 |
|
RU2661029C1 |
| WO 2019023584 A1, 31.01.2019 | |||
| Сафонова Л.П | |||
| Исследование нейроваскулярных структур с помощью фазово-модуляционной спектрофотометрии | |||
| Оптика и спектроскопия | |||
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
| Улей | 1923 |
|
SU822A1 |
| Возможности спектрофотометрии для обнаружения и распознавания нейроваскулярных структур / Л.П | |||
| Сафонова и др | |||
| // Медицинская | |||
Авторы
Даты
2021-11-02—Публикация
2021-05-13—Подача