Изобретение относится к химии природных соединений, конкретно - синтезу 2,3-дезокси-Δ2(3)-экдистероидов следующей формулы:
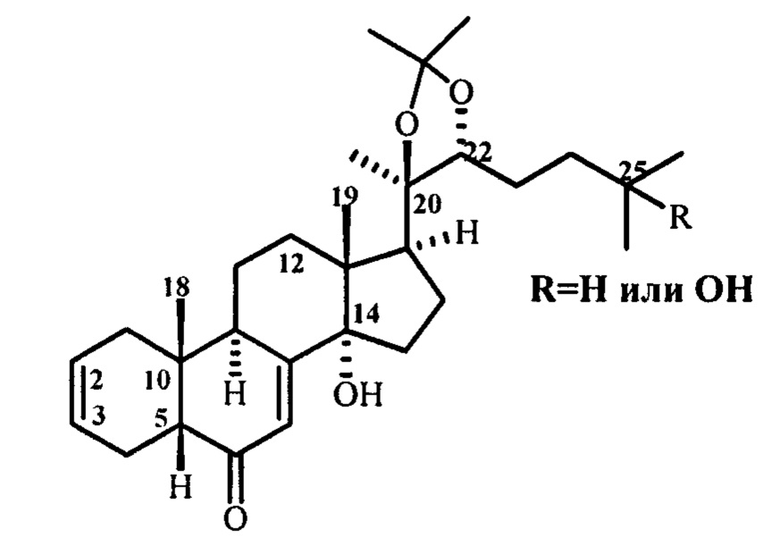
Экдистероиды - гормоны линьки и метаморфоза насекомых, впервые выделенные в нанограммовых количествах из насекомых, а затем обнаруженные во многих видах растений в более высоких концентрациях (1-3% от воздушно-сухой массы растений). Эти природные соединения в настоящее время составляют обширную группу соединений (>500), обладающих родственной химической структурой. Наиболее доступными и хорошо изученными экдистероидами являются 20-гидроксиэкдизон (20Е) и его 25-дезоксипроизводное - понастерон А, для которых выявлен широкий спектр биологической активности [Ахрем А.А., Ковганко Н.В. Экдистероиды: Химия и биологическая активность. Минск: Наука и техника. 1989, 325]. В синтезе некоторых труднодоступных экдистероидов [R. Lafont, J. Harmatha, F. Marion-Poll, L. Dinan, I. D. Wilson, The Ecdysone Handbook. Third Edition, http://ecdybase.org, 2002, (accessed 02 April 2020)], а также структурно-родственных им стероидов [Т. Amagata, Μ. Doi, Μ. Tohgo, K. Minoura, Α. Numata. Chem. Commun. 1999, 14, 1321] бывает необходимым изменение ориентации 2,3-дигидроксильных групп. В природной молекуле цис-гликольная фрагмент кольца А имеет 2β,3β-ориентацию, тогда как в понастероне В, в морских стероидах и в брассиностероидах цис-диольный фрагмент α-ориентирован. Стратегия синтеза такого рода структур базируется на гидроксилировании двойной связи кольца А стероидной структуры, генерированной при 2,3-дезоксигенировании.
Известный метод генерации Δ2(3)-связи в ряду экдистероидов описан единственным примером, описанном в реакции дидезоксигенирования 2,3-димезилата 20Е (1) [S. Homvisasevongsa, A. Chuaynugul, N. Chimnoi, A. Suksamrarn. Tetrahedron, 2004, 60, 3433]. Для этого, согласно приведенной методике, гетерогенную смесь, содержащую раствор производного 20Е в диметилформамиде (ДМФА), Zn, NaI нагревают (80°С) в течение 72 ч. Затем, в результате водной обработки реакционной смеси и разделения продуктов с помощью колоночной хроматографии получают целевой Δ2(3)-экдистероид (2) с выходом 75%.
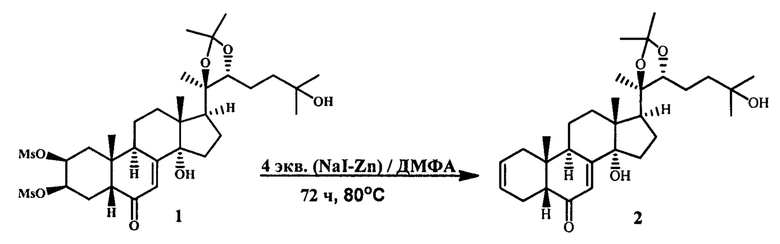
Однако, использование данного метода для генерации двойной связи в кольце А для других экдистероидов дает очень низкие выходы целевых продуктов.
Задачей предлагаемого изобретения является разработка селективного и эффективного метода синтеза известных и новых 2,3-дезокси-Δ2(3)-экдистероидов.
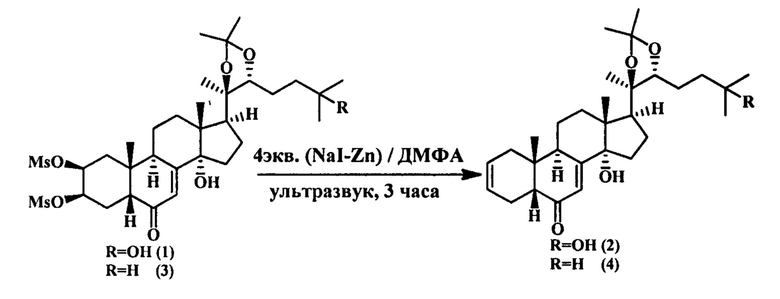
Это достигается тем, что синтез целевых Δ2(3)-стероидов (2) и (4) осуществляют посредством проведения реакции дидезоксигенирования стартовых 2,3-О-димезилатов (1) и (3) в условиях ультразвукового сопровождения их реакционных растворов в ДМФА с NaI и Zn (цинковая пыль) в течение 3 ч.
Сокращение времени воздействия ультразвука приводит к уменьшению конверсии и выхода целевого 2,3-дезокси-Δ2(3)-экдистероида. Длительное термическое воздействие (80°С, 72 ч) приводит к снижению целевого Δ2(3)-стероида, увеличению выхода побочных продуктов.
Заявляемый метод и его воспроизводимость продемонстрирована на следующих примерах синтеза (20R,22R)-14α,25-дигидрокси-20,22-(изопропилидендиокси)-5β-холеста-2,7-диен-6-она (2) и (20R,22R)-14α-гидрокси-20,22-(изопропилидендиокси)-5β-холеста-2,7-диен-6-она (4) из 25-ангидропроизводного 20Е (3) по следующей схеме реакции:
Преимущества разработанного способа перед известным заключаются в следующем.
1. Высокая хемоселективность реакции с удовлетворительным выходом целевого 2,3-дезокси-Δ2(3)-экдистероида (75-80%).
2. Существенно меньшее время реакции (в 24 раза).
Сущность способа демонстрируется следующими примерами.
Пример 1. Получение (20R,22R)-14α,25-дигидрокси-20,22-(изопропилидендиокси) -5β-холеста-2,7-диен-6-она (2). На раствор 2,3-OMs производного экдистероида (1) (0.68 г, 1 мМ) в 4 мл диметилформамида в присутствии йодистого натрия (0.6 г, 4 мМ) и цинка (цинковой пыли) (0.26 г, 4 мМ) воздействовали ультразвуком (22 кГц, 20 Вт) в течение 3 ч. Далее в реакционную смесь добавляли 8 мл дистиллированной воды и экстрагировали СНСl3 (3×30 мл), органический слой промывали насыщенным раствором NaCl, упаривали. Сухой остаток хроматографировали на колонке (12 г SiO2, элюент хлороформ). Выделяли 0.57 г (82%) соединения (2) (Rƒ 0.53, Sorbfil, CHCl3-МеОН, 10:1), т. пл. 117-119°С, [α]D20+80.9° (с 0.77, CHCl3).
Спектральные характеристики соединения (2): Спектр ЯМР 1Н [S. Homvisasevongsa, A. Chuaynugul, N. Chimnoi, A. Suksamrarn. Tetrahedron, 2004, 60, 3433]. ЯМР 13C (500 МГц, CDCl3), δ , м.д.: 17.17 (C18), 21.43 (C11), 21.83 (С21), 23.48 (С16, С23), 23.57 (С19), 26.85 и 28.98 (20,22-Ме2С), 29,17 (С26), 29,68 (С27), 30.93 (С15), 31.14 (С12), 31.90 (С9), 31.92 (С4), 34.64 (С1), 35.30 (С10), 41.40 (С24), 49.07 (С5, С13, С17), 70.37 (С25), 82.00 (С22), 84.43 (С20), 85.70 (С14), 106.96 (20,22-Ме2С), 120.42 (С7), 124.82 (С2), 125.73 (С3), 207.94 (С6), 209.89 (С20), 213.10 (С14).
Примеры №2-3, приведенные в таблице, демонстрируют влияние соотношения реагентов и времени реакции на выход целевого Δ2(3)-экдистероида (2), эксперименты реализованы при ультразвуковом сопровождении, аналогично примеру 1.

Полученные данные (таблица) демонстрируют уменьшение выхода целевого продукта при уменьшении реагентов (Пример 2) или времени реакции (Пример 3).
Пример 4. Получение (20R,22R)-14α-гидрокси-20,22-(изопропилидендиокси) -5β-холеста-2,7-диен-6-она (4). На раствор 2,3-OMs производного экдистероида (3) (0.66 г, 1 мМ) в 4 мл диметилформамида в присутствии йодистого натрия (0.6 г, 4 мМ) и цинка (цинковой пыли) (0.26 г, 4 мМ) воздействовали ультразвуком (22 кГц, 20 Вт) в течение 3 ч. Далее в реакционную смесь добавляли 8 мл дистиллированной воды и экстрагировали CHCl3(3×30 мл), органический слой промывали насыщенным раствором NaCl, упаривали. Сухой остаток хроматографировали на колонке (10 г SiO2, элюент хлороформ). Выделяли 0.35 г (75%) соединения (4) (Rƒ 0.57, Sorbfil, -МеОН, 20:1), т. пл. 170-172°С, [α]D20+116.0° (с 0.14, CHCl3).
Спектр ЯМР 1H, CDCl3, δ, м.д.: 0.80 с (3Н, Н3С18), 1.02 с (3Н, Н3С19), 0.91 д (3Н, Н3С27, J 6.5 Гц), 0.92 д (3Н, Н3С26, J 6.5 Гц), 1.07 с (3Н, Н3С19), 1.13 с (3Н, Н3С21), 1.33 с и 1.42 (6Н, 20,22-Ме2С), 1.58-2.25 м (18Н, СН, СН2), 2.27 м (1Н, Н17), 3.63 дд (1Н, Н22, J 9.5 Гц, 2.5 Гц), 5.54 д (1Н, Н2, J 9.5 Гц), 5.71 д (1H, Н3, J 10 Гц), 5.79 с (1Н, Н7). Спектр ЯМР 13С, CDCl3, δ , м.д.: 17.21 (С18), 21.44 (С11, С16), 21.85 (С21), 22.50 (С27), 22.62 (С26), 23.48 (С19), 26.84 (С23), 26.88 и 28.29 (20,22-Ме2С), 29.05 (С25), 31.02 (С4, С15), 31.98 (С12), 34.65 (С1, С9), 35.30 (С10), 36.46 (С24), 49.15 (С13, С17), 49.25 (С5), 81.71 (С22), 83.14 (С20), 85.76 (С14), 106.73 (20,22-Ме2С), 120.40 (С7), 124.81 (С2), 125.73 (С2), 163.87 (С8), 202.17 (С6). Масс-спектр MALDI TOF, m/z: 509.321 [М+K]+(вычислено: C30H46O4K 509.334).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛПЕРЕГРУППИРОВАННОГО ЭКДИСТЕРОИДА - 2,3:20,22-ДИАЦЕТОНИДА 9α,13α-ЭПОКСИ-14β-МЕТИЛ-13-ДЕМЕТИЛ-14-ДЕЗОКСИ-7,8-ДИГИДРО-20-ГИДРОКСИЭКДИЗОНА | 2010 |
|
RU2443709C1 |
| СПОСОБ ПОЛУЧЕНИЯ ШИДАСТЕРОНА | 2001 |
|
RU2183641C1 |
| СПОСОБ ПОЛУЧЕНИЯ (8R)-8,13-ЦИКЛО-13,14-СЕКО-5β-ПРЕГН-2-ЕН-6,14,20-ТРИОНА | 2017 |
|
RU2677344C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭКДИСТЕРОИДОВ | 2003 |
|
RU2230749C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭКДИСТЕРОИДОВ РАСТЕНИЯ РОДА SERRATULA αЭКДИЗОНА, βЭКДИЗОНА И ИНОКОСТЕРОНА | 1997 |
|
RU2138509C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3-МОНОАЦЕТОНИДА 20-ГИДРОКСИЭКДИЗОНА | 2007 |
|
RU2351604C1 |
| СРЕДСТВО "ЭКДИСТЕРОН-80", ОБЛАДАЮЩЕЕ КАРДИОПРОТЕКТОРНОЙ, АДАПТОГЕННОЙ, АНТИГИПОКСИЧЕСКОЙ, ГАСТРОПРОТЕКТОРНОЙ, ТЕРМОПРОТЕКТОРНОЙ, АНАБОЛИЧЕСКОЙ И АКТОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ, И СПОСОБ ЕГО ПРОИЗВОДСТВА | 2006 |
|
RU2321420C1 |
| АГЕНТ РЕГУЛИРОВАНИЯ ДИФФЕРЕНЦИАЦИИ КЛЕТОК КОЖИ, КУЛЬТУРАЛЬНАЯ СРЕДА ДЛЯ КЛЕТОК ИЛИ ТКАНЕЙ И СПОСОБ РЕГУЛИРОВАНИЯ ДИФФЕРЕНЦИАЦИИ КЛЕТОК КОЖИ | 1993 |
|
RU2143884C1 |
| СПОСОБ ПОЛУЧЕНИЯ 24-ЭПИБРАССИНОЛИДА | 2004 |
|
RU2272044C1 |
| СПОСОБ 11 БЕТА-ГИДРОКСИЛИРОВАНИЯ ДЕЛЬТА-3-КЕТОСТЕРОИДОВ | 2008 |
|
RU2399674C2 |
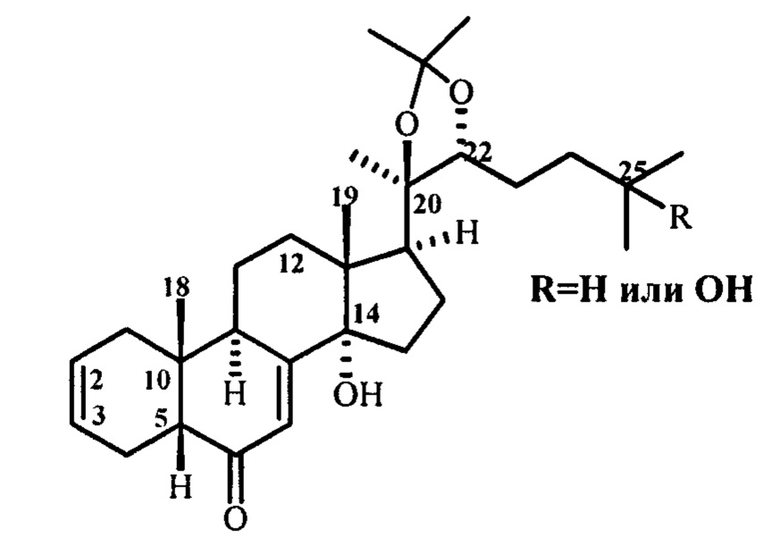
Изобретение относится к области химии. Описан способ получения 2,3-дезокси- Δ2(3)-экдистероидов формулы:
 .
.
Способ осуществляют реакцией дидезоксигенирования экдистероидов в растворе диметилформамида в присутствии смеси 4 моль-эквивалентов NaI (йодистого натрия) и Zn (цинковой пыли) с применением ультразвука в течение 3 ч. Затем обрабатывают реакционную смесь водой и разделяют продукты с помощью колоночной хроматографии на силикагеле. Способ позволяет эффективно, селективно и количественно получать конфигурационно-однородные Δ2(3)-прекурсоры, используемые для синтеза биологически активных стероидов. 1 табл., 4 пр.
Способ получения 2,3-дезокси-Δ2(3)-экдистероидов следующей структуры:
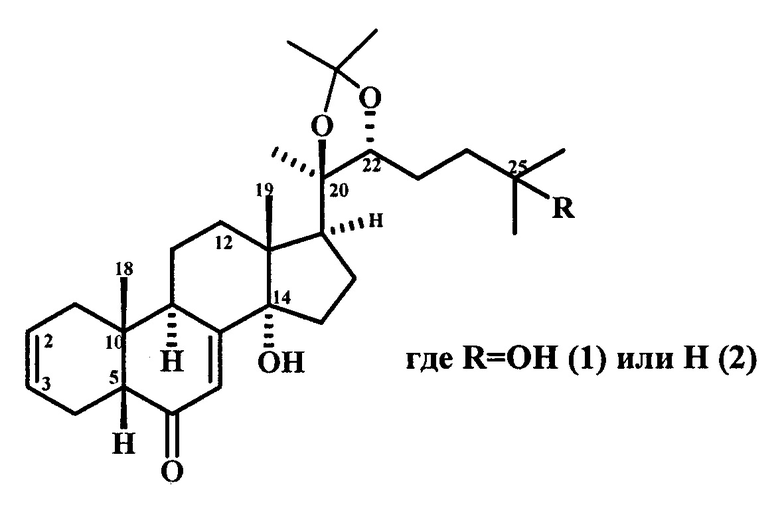
реакцией дидезоксигенирования экдистероидов в растворе диметилформамида в присутствии смеси 4 моль-эквивалентов йодистого натрия и Zn (цинковой пыли), последующей обработкой реакционной смеси водой и разделением продуктов с помощью колоночной хроматографии, отличающийся тем, что реакционный раствор 2,3-O-димезилата-20.22-ацетонида 20-гидроксиэкдизона или его 25-ангидропроизводного в диметилформамиде со смесью NaI и Zn (цинковая пыль) подвергают ультразвуковой обработке в течение 3 часов.
| Rimma G | |||
| Savchenko et al., "Sonochemically assisted 2,3-dideoxygenation and skeletal rearrangement of ecdysteroid derivatives" Ultrasonics - Sonochemistry, 2019, 52, p | |||
| Способ получения целлюлозы из стеблей хлопчатника | 1912 |
|
SU505A1 |
| Sureeporn Homvisasevongsa et al., "Stereoselective synthesis and moulting activity of 2,3-diepi-20-hydroxyecdysone and 2,3-diepi-5a-20-hydroxyecdysone" Tetrahedron, 2004, | |||
Авторы
Даты
2021-11-22—Публикация
2020-07-27—Подача