Область техники
Изобретение относится к химической и химико-фармацевтической промышленности и представляет собой способ получения (S)-2-((3-(4-морфолинил-3-фторфенил)-2-оксазолидин-5-ил)метил)изоиндолин-1,3-диона, одного из ключевых полупродуктов для синтеза антибактериального агента Линезолид.
Уровень техники
Препараты на основе оксазолидинонов являются одним из новых и эффективных классов синтетических антибактериальных веществ [О.А. Phillips et al., Expert Opinion on Therapeutic Patents, 2016, 26 (5), 591-605; K.J. Shaw, Annals of the New York Academy of Sciences, 2011, 1241, 48-70; D.J. Diekema, et al., Lancet, 2001, 358 (9297), 1975-1982]. Первым и наиболее эффективным препаратом в этом ряду является Линезолид, используемый для лечения тяжелых инфекционных заболеваний, вызванных грамположительными бактериями, резистентными к другим антибактериальным средствам [D.L. Stevens et al, Expert Review of Anti-infective Therapy, 2004, 2(1), 51-59; M.S. Bolhuis et al., Clinical Infectious Diseases, 2018, 67(3), S327-S335]. Данный препарат эффективен в отношении подавляющего большинства клинически значимых грамположительных бактерий, таких как Enterococcus faecium и Enterococcus faecalis (включая ванкомицин-устойчивые энтерококки), золотистый стафилококк (включая метициллин-устойчивый золотистый стафилококк, англ. MRSA), Streptococcus agalactiae, пневмококк, Streptococcus pyogenes, зеленящие стрептококки, Listeria monocytogenes и Corynebacterium и другие. На сегодняшний день Линезолид является антибиотиком группы резерва, применяемых для лечения подтвержденных или подозреваемых инфекций, вызванных бактериальными возбудителями с множественной лекарственной устойчивостью. В виду неуклонного роста резистентности бактерий и высокой востребованности препарата Линезолид в Российской Федерации разработка и усовершенствование как методов получения самой фармацевтической субстанции, как и полупродуктов для синтеза Линезолида, является критически важной задачей химико-фармацевтической промышленности.
В литературе представлено значительное количество способов получения Линезолида из различных исходных. Поскольку процессы получения этого антибиотика являются многостадийными (≥6 стадий), многие схемы синтеза дублируют ряд стадий, отличаясь отдельными операциями. Ключевой стадией каждого метода синтеза является формирование критически важного для наличия антибактериальной активности фрагмента - оксазолидинона. При этом, именно гетероциклизация оксазолидинона в синтезе антибиотика Линезолид, как правило, представляет основную сложность. В связи с этим поиск эффективных, экономичных и хорошо масштабируемых способов получения ключевых полупродуктов для синтеза субстанции Линезолид представляет наибольшую ценность среди прочих.
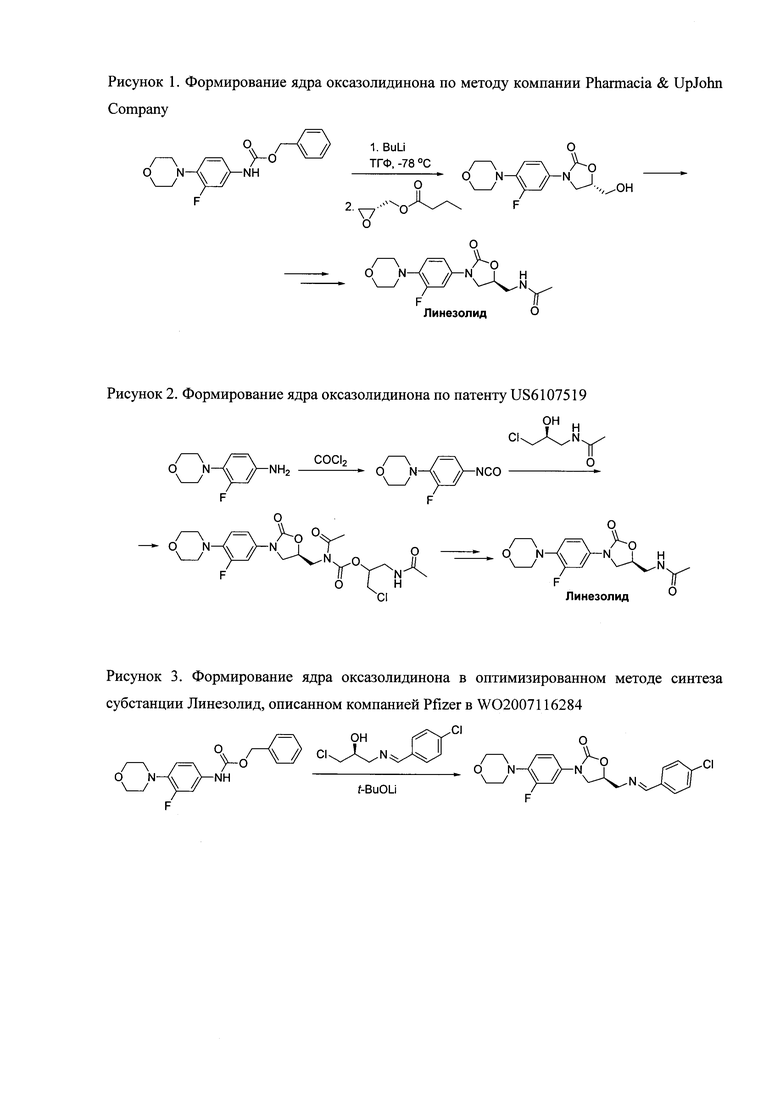
Ниже приведены примеры формирования оксазолидинона в различных схемах синтеза субстанции Линезолид. Исторически первый метод, разработанный Pharmacia & UpJohn Company в 1997 году [M.R. Barbachyn et al., 1999, Patent US 5880118], основан на использовании дорогостоящего и пожароопасного реагента - бутиллития, который требует использования абсолютированных растворителей, а также специального оборудования для работы в инертной атмосфере (рисунок 1), что малопригодно для химической промышленности.
Рисунок 1.
В патенте 1999 года Pharmacia & UpJohn Company представлена оптимизированная схема синтеза Линезолида, в которой удалось значительно сократить число стадий (рисунок 2) [В.A. Pearlman, 2000, Patent US 6107519]. Однако на одной из стадий авторы использовали крайне токсичный газ фосген, применение которого в промышленном масштабе сильно ограничено из-за его отравляющих свойств.
Рисунок 2.
В патенте 2007 года [R.J. Imbordino et al., 2007, WO 2007116284], разработанном Pfizer, предложена усовершенствованная схема получения фармацевтической субстанции Линезолид (рисунок 3), которая позволяет избежать использования бутиллития, азида натрия, а также фосгена. Особенностью этого патента является детальное описание методик химических превращений, позволяющих проводить конверсию по 250-400 г сырья за одну стадию. Тем не менее, воспроизведение первой стадии процесса по схеме 3 оказалось затруднитетельно.
Рисунок 3.
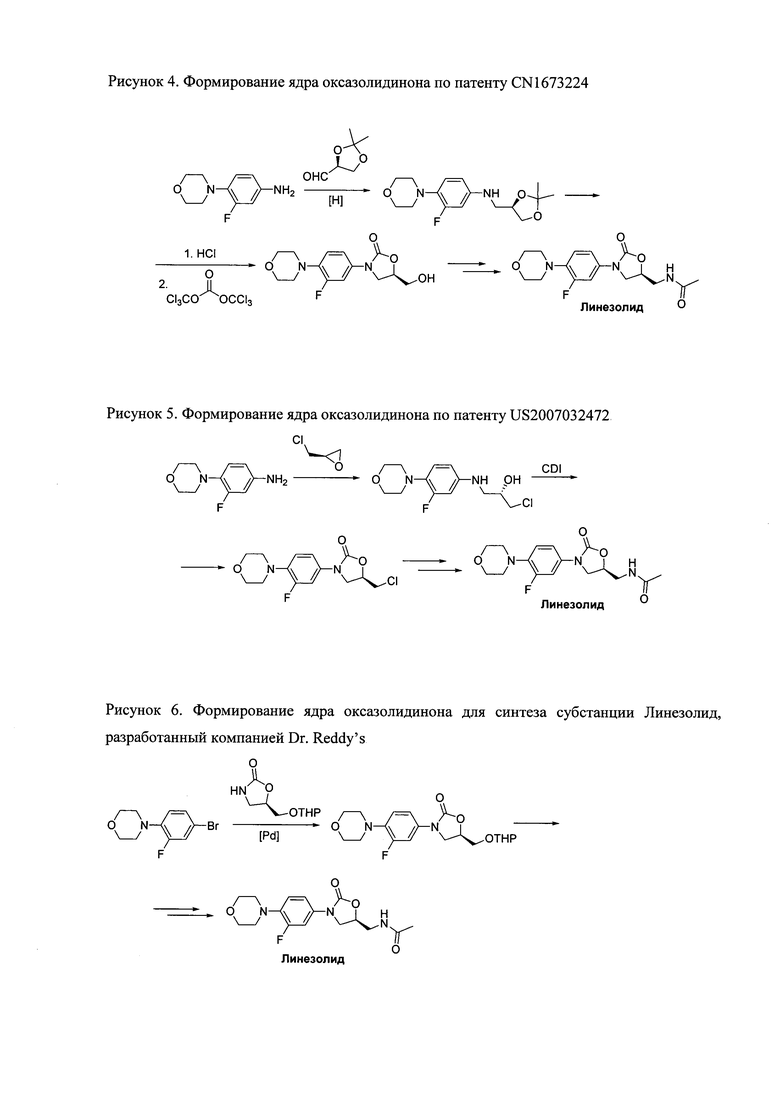
Другой способ образования оксазолидинового ядра основан на реакции восстановительного аминирования защищенного глицеринового альдегида производным анилина, последующем расщеплении изопропилиденовой защитной группы кислотой и обработкой гексахлордиметилкарбонатом (рисунок 4) [Патент CN 1673224, 2004]. Данные реагенты достаточно дешевы и безопасны, однако заявленный выход на стадии циклизации оказался довольно низким.
Рисунок 4.

Патент US 2007032472 раскрывает детали еще одного метода синтеза Линезолида, основанного на раскрытии энантиомерно-чистого эпихлоргидрина (рисунок 5) [D.M. Rao et al., 2007, Patent US 2007/0032472]. Схема выглядит довольно перспективно с точки зрения последующего масштабирования и доступности реагентов. Однако ряд экспериментов показывает, что добиться полной конверсии исходного сырья на первой стадии не удается. Более того, образуется смесь продуктов с наилучшим соотношением продукт-примесь 85:15, которую трудно разделить, не прибегая к хроматографии.
Рисунок 5.
Палладий-каталлизируемое кросс-сочетание арилгалогенидов с оксазолидинонами наряду с другими подходами было адаптировано для синтеза Линезолида (рисунок 6) [В. Mallesham et al., Organic Letters 2003, 5(7), 963-965]. К недостаткам данной схемы для последующего масштабирования можно отнести высокую стоимость катализаторов на основе палладия, умеренный выход на стадии арилирования. Другую сложность представляет получение самого оптически чистого оксазолидинона.
Рисунок 6.
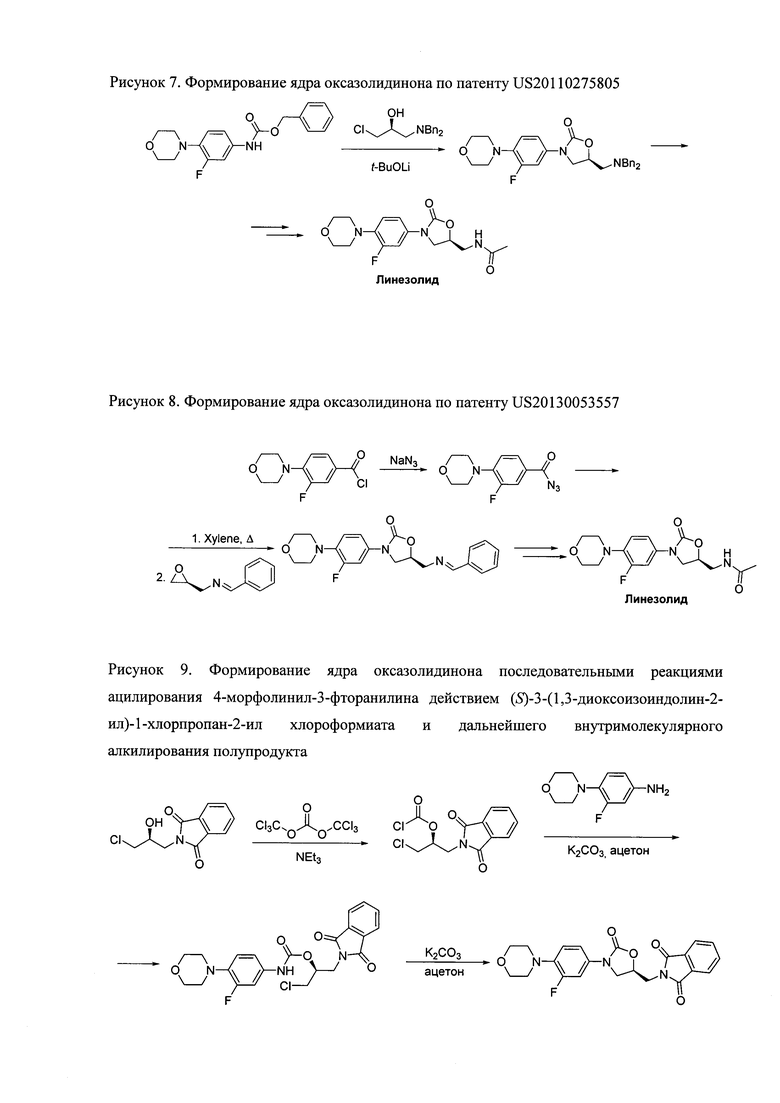
В 2011 году был опубликован патент US 20110275805, в котором сообщается о методе синтеза Линезолида, основанном на взаимодействии производного N-Cbz-анилина с N,N-дибензилзащищенным 1-амино-3-хлор-2-пропанолом (рисунок 7) [Q. Wang et al., 2011, Patent US 2011/0275805]. С точки зрения технологичности, данный способ представляет интерес, однако все попытки воспроизвести стадию циклизации не привели к удовлетворительному выходу полупродукта.
Рисунок 7.
В патенте US 20130053557 авторы предложили метод получения Линезолида, ключевой реакцией которого является взаимодействие изоцианатов с эпоксидами, приводящее к оксазолидинонам (рисунок 8) [J.R. McCarthy, 2013, Patent US 2013/0053557]. Методология предполагает использование токсичных азида натрия или фосгена для генерации изоцианата, что, как отмечалось выше, представляет трудность для промышленного синтеза субстанции линезолида.
Рисунок 8.
Другим вариантом формирования оксазолидинонового цикла является процесс, состоящий из последовательных реакций ацилирования 4-морфолинил-3-фторанилина действием (S)-3-(1,3-диоксоизоиндолин-2-ил)-1-хлорпропан-2-ил хлороформиата и дальнейшего внутримолекулярного алкилирования полупродукта (рисунок 9) [R. Tammana et al., ARKIVOC 2012, 6, 45-56]. Подход имеет очевидный потенциал с позиции промышленной технологии, однако заявленные авторами выходы оказались в разы ниже реализуемых на практике, что говорит о необходимости тщательной оптимизации процесса. Ключевой проблемой метода является низкая химическая стабильность (S)-3-(1,3-диоксоизоиндолин-2-ил)-1-хлорпропан-2-ил хлороформиата, который авторы методики предлагают выделять в индивидуальном виде. Результаты воспроизведения этой схемы показали, что значительное снижение выхода целевого (S)-2-((3-(4-морфолинил-3-фторфенил)-2-оксазолидин-5-ил)метил)изоиндолин-1,3-диона происходит главным образом при попытках выделения и очистки неустойчивого (S)-3-(1,3-диоксоизоиндолин-2-ил)-1-хлорпропан-2-ил хлороформиата. Поэтому новые технологические решения, направленные на оптимизацию эффективности данного химического процесса, представляют значительный практический интерес с позиции получения фармацевтической субстанции Линезолид.
Рисунок 9.
Раскрытие изобретения
В заявленном нами способе получения (S)-2-((3-(4-морфолинил-3-фторфенил)-2-оксазолидин-5-ил)метил)изоиндолин-1,3-диона (3) из (S)-2-(2-гидрокси-3-хлорпропил)изоиндолин-1,3-диона (1) и 4-морфолинил-3-фторанилина (2) три стадии химического процесса формирования оксазолидинонового ядра совмещены в одну без выделения и очистки промежуточных веществ (рисунок 10). Важными преимуществами данного «однореакторного» метода является высокий и воспроизводимый выход целевого соединения, а также удобство и масштабируемость процесса, что свидетельствует о перспективах внедрения изобретения в химическую промышленность.
Условно этот процесс может быть разделен на три независимых стадии (рисунок 10), которые, однако, согласно настоящему изобретению, возможно и необходимо проводить без выделения и очистки веществ, образующихся на каждой из технологических операций. Именно благодаря тщательному подбору условий протекания каждой из стадий удалось: а) проводить каждую химическую реакцию таким образом, чтобы все компоненты, включая продукты, не оказывали существенного снижения выхода последующей реакции; б) организовать процесс с использованием сравнительно дешевых и безопасных реактивов, растворителей и отсутствием технологически сложных операций. Большая эффективность «однореакторного» способа, по сравнению с классическим трехстадийным вариантом, в котором каждый из полупродуктов 1а и 1b выделяется в индивидуальной форме, главным образом, достигается за счет снижения потерь при выделении и очистке полупродуктов 1а и 1b. Очевидно, что (S)-3-(1,3-диоксоизоиндолин-2-ил)-1-хлорпропан-2-ил хлороформиат (1а) является реакционноспособным веществом, которое разлагается даже при действии влаги. Данное изобретение призвано организовать синтетический процесс таким образом, чтобы минимизировать время, в течение которого (S)-3-(1,3-диоксоизоиндолин-2-ил)-1-хлорпропан-2-ил хлороформиат (1а) может вступить в побочные реакции, трансформировав его в значительно более стабильный (S)-3-(1,3-диоксоизоиндолин-2-ил)-1-хлорпропан-2-ил-(4-морфолинил-3-фторфенил)карбамат (1b). Количественная различие в эффективности «однореакторного» и трехстадийного способов достигает 20% в зависимости от выбранных растворителей и реагентов. С другой стороны, изобретение позволяет сократить количество технологических стадий и исключить из процесса такие операции, как экстракция, промывание, отгонка растворителя и др.
Согласно заявленному способу первую стадию - генерацию (S)-3-(1,3-диоксоизоиндолин-2-ил)-1-хлорпропан-2-ил хлороформиата (1а) проводят действием гексахлордиметилкарбоната на (S)-2-(2-гидрокси-3-хлорпропил)изоиндолин-1,3-дион (1) в мольном соотношении близком к 1:3 в инертном растворителе в присутствии органического или неорганического основания. Предпочтительно проведение реакции в диапазоне температур от 0 до 25°С в атмосфере инертного газа. На втором этапе (ацилирование аминогруппы 4-морфолинил-3-фторанилина 2) к реакционной массе со стадии 1, содержащей хлороформиат 1а, прибавляют раствор, содержащий 4-морфолинил-3-фторанилин (2) и органическое основание в инертном растворителе, идентичном, используемому на первой стадии. Возможным также является использование неорганического основания, которое добавляется к реакционной смеси непосредственно по завершению первой химической реакции. 4-Морфолинил-3-фторанилин (2) и основание берутся в мольном соотношении от 1:1:1 до 1:1,2:1 к количеству (S)-2-(2-гидрокси-3-хлорпропил)изоиндолин-1,3-диона (1) на первой стадии, соответственно. Для проведения третьей части процесса (внутримолекулярное N-алкилирование) к реакционной массе, содержащей (S)-3-(1,3-диоксоизоиндолин-2-ил)-1-хлорпропан-2-ил-(4-морфолинил-3-фторфенил)карбамат (1b) прибавляют неорганическое основание предпочтительно в мольном соотношении от 1:1 до 1,5:1 по отношению к (S)-2-(2-гидрокси-3-хлорпропил)изоиндолин-1,3-диону (1), взятому на первой стадии. Возможным и предпочтительным является объединение второй и третьей стадий в одну, что достигается добавлением к реакционной массе с хлорформиатом 1а раствора, содержащего 4-морфолинил-3-фторанилин (2), и неорганического основания в мольном соотношении 2,0-2,5:1 к количеству (S)-2-(2-гидрокси-3-хлорпропил)изоиндолин-1,3-диона (1), взятого для первой стадии.
Рисунок 10.
Термин "инертный органический растворитель" означает растворитель, не вступающий в химические реакции в условиях процесса, описываемого в тексте. Перечень инертных органических растворителей включает, например, бензол, толуол, ацетонитрил, тетрагидрофуран, N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидон, диметилсульфоксид, сульфолан, хлороформ, дихлорметан, дихлорэтан, этилацетат, ацетон, метилэтилкетон, диоксан, пиридин и т.п. Если не указано иное, растворители, использованные в реакциях по настоящему изобретению, являются инертными растворителями.
Термин "инертный газ" означает одноатомный газ с очень низкой химической реактивностью. Перечень инертных газов включает азот, аргон.
Термин "основание" по теории Брёнстеда означает соединение или ион, способный принимать (отщеплять) протон от кислоты. Перечень неорганических оснований включает, например, не ограничиваясь, карбонаты щелочных и щелочноземельных металлов (карбонат калия, карбонат цезия, карбонат лития, карбонат кальция и т.д.), гидриды щелочных и щелочноземельных металлов (гидрид лития, гидрид натрия, гидрид кальция) и т.д. Перечень органических оснований включает, например, не ограничиваясь, пиридин, 4-(диметиламино)пиридин, третичные амины (триэтиламин, этилдиизопропиламин, 1,4-диазобициклоктан и т.д.), соли спиртов и щелочных металлов (метоксид натрия, этоксид натри, трет-бутоксид, калия, трет-бутоксид лития и т.д.), 1,8-диазабицикло[5.4.0]ундец-7-ен и т.д.
Строение целевого вещества - (S)-2-((3-(4-морфолинил-3-фторфенил)-2-оксазолидин-5-ил)метил)изоиндолин-1,3-диона (3) подтверждено методами ЯМР, ИК и масс-спектроскопии высокого разрешения. Перечисленные ниже примеры лишь иллюстрируют детали осуществления настоящего изобретения, а не для ограничения объема притязаний.
Пример 1
Получение (S)-2-((3-(4-морфолинил-3-фторфенил)-2-оксазолидин-5-ил)метил)изоиндолин-1,3-диона (3)
К раствору (S)-2-(2-гидрокси-3-хлорпропил)изоиндолин-1,3-диона (1, 2.0 г, 8.4 ммоль) и гексахлордиметилкарбоната (0.82 г, 2.8 ммоль) в тетрагидрофуране (20 мл), предварительно охлажденному до 0°С, в токе инертного аргона медленно прибавляют раствор триэтиламина (1.2 мл, 8.4 ммоль) в тетрагидрофуране (5 мл) и перемешивают смесь при комнатной температуре 2.5 ч. К реакционной смеси прибавляют раствор 4-морфолинил-3-фторанилина (6, 1.7 г, 8.4 ммоль) и триэтиламина (1.2 мл, 8.4 ммоль) в тетрагидрофуране (10 мл) и перемешивают 1 ч при комнатной температуре. После этого к реакционной массе прибавляют безводный поташ (1.7 г, 12.6 ммоль), иодид калия (0.14 г, 0.84 ммоль) и тетрабутиламмонийбромид (0.27 г, 0.84 ммоль) и перемешивают суспензию 12 ч при 50°С. Протекание реакции контролируют методом ТСХ : элюент хлористый метилен-этилацетат = 90:10. Соединение 1 Rƒ=0.65; соединение 1a Rƒ=0.90; соединение 3 Rƒ=0.50. Реакционную смесь охлаждают до комнатной температуры, разбавляют хлороформом (50 мл) и водой (50 мл), промывают органический слой насыщенным раствором NaCl (3×30 мл) и водой (2×30 мл). Экстракт сушат над безводным сульфатом натрия и упаривают растворитель в вакууме. Остаток очищают переосаждением петролейным эфиром из хлористого метилена. Выход оксазолидинона 3 1.85 г (52%), светло-серый порошок. Т. пл.=204-206°С. IR (KBr): ν 3099 (Ar-Н), 2963 (С-Н), 1751 (С=O), 1711 (С=О), 1218 (С-О-С) cm-1. ЯМР 1Н (400 МГц, CDCl3), δ, м.д., J (Гц): 7.87-7.85 (2Н, м, 2СН); 7.76-7.74 (2Н, м, 2СН); 7.38 (1H, дд, J1=14.5, J2=2.7, СН); 7.11-7.08 (1Н, м, СН); 6.90 (1Н, т, J=9.0, СН); 5.00-4.93 (1Н, м, CH2CHCH2); 4.15-4.06 (2Н, м, СН2); 3.99-3.94 (1H, м, СН2); 3.88-3.83 (5Н, м, СН2, 2СН2); 3.04-3.02 (4Н, м, 2СН2). HRMS (ESI) вычислено для C22H21FN3O5 [М+Н]+: 426.1416; найдено: 426.1424.
Пример 2
Получение (S)-2-((3-(4-морфолинил-3-фторфенил)-2-оксазолидин-5-ил)метил)изоиндолин-1,3-диона (3)
К раствору (S)-2-(2-гидрокси-3-хлорпропил)изоиндолин-1,3-диона (1, 2.0 г, 8.4 ммоль) и гексахлордиметилкарбоната (0.82 г, 2.8 ммоль) в ацетоне (20 мл), предварительно охлажденному до 0°С, в токе аргона медленно прибавляют раствор триэтиламина (1.2 мл, 8.4 ммоль) в ацетоне (5 мл) и перемешивают смесь при комнатной температуре 2.5 ч. К реакционной смеси прибавляют раствор 4-морфолинил-3-фторанилина (6, 1.7 г, 8.4 ммоль) и триэтиламина (1.2 мл, 8.4 ммоль) в ацетоне (10 мл) и перемешивают 1 ч при комнатной температуре. После этого к реакционной массе прибавляют безводный поташ (1.7 г, 12.6 ммоль), иодид калия (0.14 г, 0.84 ммоль) и тетрабутиламмонийбромид (0.27 г, 0.84 ммоль) и перемешивают суспензию 12 ч при 50°С. Протекание реакции контролируют методом ТСХ : элюент хлористый метилен-этилацетат = 90:10. Соединение 1 Rƒ=0.65; соединение 1a Rƒ=0.90; соединение 3 Rƒ=0.50. Реакционную массу охлаждают до комнатной температуры, разбавляют хлороформом (50 мл) и водой (50 мл), промывают органический слой насыщенным раствором NaCl (3×30 мл) и водой (2×30 мл). Экстракт сушат над безводным сульфатом натрия и упаривают растворитель в вакууме. Остаток очищают переосаждением петролейным эфиром из хлористого метилена. Выход оксазолидинона 3 2.32 г (65%), серый порошок. Т. пл.=204-206°С.
Пример 3
Получение (S)-2-((3-(4-морфолинил-3-фторфенил)-2-оксазолидин-5-ил)метил)изоиндолин-1,3-диона (3)
К раствору (S)-2-(2-гидрокси-3-хлорпропил)изоиндолин-1,3-диона (1, 2.0 г, 8.4 ммоль) и гексахлордиметилкарбоната (0.82 г, 2.8 ммоль) в хлороформе (20 мл), предварительно охлажденному до 0°С, в токе аргона медленно прибавляют раствор триэтиламина (1.2 мл, 8.4 ммоль) в хлороформе (5 мл) и перемешивают смесь при комнатной температуре 2.5 ч. К реакционной смеси прибавляют раствор 4-морфолинил-3-фторанилина (6, 1.7 г, 8.4 ммоль) и триэтиламина (1.2 мл, 8.4 ммоль) в хлороформе (10 мл) и перемешивают 1 ч при комнатной температуре. После этого к реакционной массе прибавляют безводный поташ (1.7 г, 12.6 ммоль), иодид калия (0.14 г, 0.84 ммоль) и тетрабутиламмонийбромид (0.27 г, 0.84 ммоль) и перемешивают суспензию 24 ч при 50°С. Протекание реакции контролируют методом ТСХ : элюент хлористый метилен-этилацетат = 90:10. Соединение 1 Rƒ=0.65; соединение 1a Rƒ=0.90; соединение 3 Rƒ=0.50. Реакционную массу охлаждают до комнатной температуры, разбавляют хлороформом (30 мл) и водой (50 мл), промывают органический слой насыщенным раствором NaCl (3×30 мл) и водой (2×30 мл). Экстракт сушат над безводным сульфатом натрия и упаривают растворитель в вакууме. Остаток очищают переосаждением петролейным эфиром из хлористого метилена. Выход оксазолидинона 3 1.96 г (55%), серый порошок. Т. пл.=204-206°С.
Пример 4
Получение (S)-2-((3-(4-морфолинил-3-фторфенил)-2-оксазолидин-5-ил)метил)изоиндолин-1,3-диона (3)
К раствору (S)-2-(2-гидрокси-3-хлорпропил)изоиндолин-1,3-диона (1, 2.0 г, 8.4 ммоль) и гексахлордиметилкарбоната (0.82 г, 2.8 ммоль) в ацетоне (20 мл), предварительно охлажденному до 0°С, в токе аргона медленно прибавляют раствор пиридина (0.68 мл) в ацетоне (5 мл) и перемешивают смесь при комнатной температуре 2.5 ч. К реакционной смеси прибавляют раствор 4-морфолинил-3-фторанилина (6, 1.7 г, 8.4 ммоль) и пиридина (0.68 мл) в ацетоне (10 мл) и перемешивают 1 ч при комнатной температуре. После этого к реакционной массе прибавляют безводный поташ (1.7 г, 12.6 ммоль), иодид калия (0.14 г, 0.84 ммоль) и тетрабутиламмонийбромид (0.27 г, 0.84 ммоль) и перемешивают суспензию 24 ч при 50°С. Протекание реакции контролируют методом ТСХ : элюент хлористый метилен-этилацетат = 90:10. Соединение 1 Rƒ=0.65; соединение 1a Rƒ=0.90; соединение 3 Rƒ=0.50. Реакционную массу охлаждают до комнатной температуры, разбавляют хлороформом (50 мл) и водой (50 мл), промывают органический слой насыщенным раствором NaCl (3×30 мл) и водой (2×30 мл). Экстракт сушат над безводным сульфатом натрия и упаривают растворитель в вакууме. Остаток очищают переосаждением петролейным эфиром из хлористого метилена. Выход оксазолидинона 3 2.57 г (72%), светло-серый порошок. Т. пл.=204-206°С.
Пример 5
Получение (S)-2-((3-(4-морфолинил-3-фторфенил)-2-оксазолидин-5-ил)метил)изоиндолин-1,3-диона (3)
К раствору (S)-2-(2-гидрокси-3-хлорпропил)изоиндолин-1,3-диона (1, 2.0 г, 8.4 ммоль) и гексахлордиметилкарбоната (0.82 г, 2.8 ммоль) в ацетоне (20 мл), предварительно охлажденному до 0°С, в токе аргона медленно прибавляют раствор пиридина (0.68 мл, 8.4 ммоль) в ацетоне (5 мл) и перемешивают смесь при комнатной температуре 2.5 ч. К реакционной смеси прибавляют раствор 4-морфолинил-3-фторанилина (6, 1.7 г, 8.4 ммоль) в ацетоне (10 мл), безводный поташ (1.16 г, 8.4 ммоль) и перемешивают 2 ч при комнатной температуре. После этого к реакционной массе прибавляют безводный поташ (1.7 г, 12.6 ммоль), иодид калия (0.14 г, 0.84 ммоль) и тетрабутиламмонийбромид (0.27 г, 0.84 ммоль) и перемешивают суспензию 24 ч при 50°С. Протекание реакции контролируют методом ТСХ : элюент хлористый метилен-этилацетат = 90:10. Соединение 1 Rƒ=0.65; соединение 1a Rƒ=0.90; соединение 3 Rƒ=0.50. Реакционную массу охлаждают до комнатной температуры, разбавляют хлороформом (50 мл) и водой (50 мл), промывают органический слой насыщенным раствором NaCl (3×30 мл) и водой (2×30 мл). Экстракт сушат над безводным сульфатом натрия и упаривают растворитель в вакууме. Остаток очищают переосаждением петролейным эфиром из хлористого метилена. Выход оксазолидинона 3 2.50 г (70%), светло-серый порошок. Т. пл.=204-206°С.
Пример 6
Получение (S)-2-((3-(4-морфолинил-3-фторфенил)-2-оксазолидин-5-ил)метил)изоиндолин-1,3-диона (3)
К раствору (S)-2-(2-гидрокси-3-хлорпропил)изоиндолин-1,3-диона (1, 2.0 г, 8.4 ммоль) и гексахлордиметилкарбоната (0.82 г, 2.8 ммоль) в ацетоне (20 мл), предварительно охлажденному до 0°С, в токе инертного газа медленно прибавляют раствор пиридина (0.68 мл, 8.4 ммоль) в ацетоне (5 мл) и перемешивают смесь при комнатной температуре 2.5 ч. К реакционной смеси прибавляют раствор 4-морфолинил-3-фторанилина (6, 1.7 г, 8.4 ммоль) в ацетоне (10 мл), безводный поташ (2.86 г, 21.0 ммоль), иодид калия (0.14 г, 0.84 ммоль) и тетрабутиламмонийбромид (0.27 г, 0.84 ммоль) и перемешивают суспензию 24 ч при 50°С. Протекание реакции контролируют методом ТСХ : элюент хлористый метилен-этилацетат = 90:10. Соединение 1 Rƒ=0.65; соединение 1a Rƒ=0.90; соединение 3 Rƒ=0.50. Реакционную массу охлаждают до комнатной температуры, разбавляют хлороформом (50 мл) и водой (50 мл), промывают органический слой насыщенным раствором NaCl (3×30 мл) и водой (2×30 мл). Экстракт сушат над безводным сульфатом натрия и упаривают растворитель в вакууме. Остаток очищают переосаждением петролейным эфиром из хлористого метилена. Выход оксазолидинона 3 2.68 г (75%), светло-серый порошок. Т. пл.=204-206°С.
Пример 7
Получение (S)-2-((3-(4-морфолинил-3-фторфенил)-2-оксазолидин-5-ил)метил)изоиндолин-1,3-диона (3)
К раствору (S)-2-(2-гидрокси-3-хлорпропил)изоиндолин-1,3-диона (1, 2.0 г, 8.4 ммоль) и гексахлордиметилкарбоната (0.82 г, 2.8 ммоль) в ацетоне (20 мл), предварительно охлажденному до 0°С, в токе аргона медленно прибавляют раствор пиридина (0.68 мл, 8.4 ммоль) в ацетоне (5 мл) и перемешивают смесь при комнатной температуре 2.5 ч. К реакционную смесь охлаждают до 10°С и прибавляют раствор 4-морфолинил-3-фторанилина (6, 1.7 г, 8.4 ммоль), в ацетоне (10 мл) и безводный карбонат цезия (5.73 г, 17.6 ммоль), иодид калия (0.14 г, 0.84 ммоль) и тетрабутиламмонийбромид (0.27 г, 0.84 ммоль) и перемешивают суспензию 24 ч при 50°С. Протекание реакции контролируют методом ТСХ : элюент хлористый метилен-этилацетат = 90:10. Соединение 1 Rƒ=0.65; соединение 1a Rƒ=0.90; соединение 3 Rƒ=0.50. Реакционную массу охлаждают до комнатной температуры, разбавляют хлороформом (50 мл) и водой (50 мл), промывают органический слой насыщенным раствором NaCl (3×30 мл) и водой (2×30 мл). Экстракт сушат над безводным сульфатом натрия и упаривают растворитель в вакууме. Остаток очищают переосаждением петролейным эфиром из хлористого метилена. Выход оксазолидинона 3 2.86 г (80%), светло-серый порошок. Т. пл.=204-206°С.
Пример 8
Получение (S)-2-((3-(4-морфолинил-3-фторфенил)-2-оксазолидин-5-ил)метил)изоиндолин-1,3-диона (3)
К раствору (S)-2-(2-гидрокси-3-хлорпропил)изоиндолин-1,3-диона (1, 20.0 г, 84.0 ммоль) и гексахлордиметилкарбоната (8.2 г, 28.0 ммоль) в ацетоне (200 мл), предварительно охлажденному до 0°С, в токе аргона медленно прибавляют раствор пиридина (6.8 мл, 84.0 ммоль) в ацетоне (50 мл) и перемешивают смесь при комнатной температуре 2.5 ч. К реакционной смеси прибавляют раствор 4-морфолинил-3-фторанилина (6, 17.0 г, 84.0 ммоль) в ацетоне (100 мл) и безводный карбонат цезия (57.3 г, 176.0 ммоль), иодид калия (1.4 г, 8.4 ммоль) и тетрабутиламмонийбромид (2.7 г, 8.4 ммоль) и перемешивают суспензию 24 ч при 50°С. Протекание реакции контролируют методом ТСХ : элюент хлористый метилен-этилацетат = 90:10. Соединение 1 Rƒ=0.65; соединение 1a Rƒ=0.90; соединение 3 Rƒ=0.50. Реакционную массу охлаждают до комнатной температуры, разбавляют хлороформом (50 мл) и водой (50 мл), промывают органический слой насыщенным раствором NaCl (3×30 мл) и водой (2×30 мл). Экстракт сушат над безводным сульфатом натрия и упаривают растворитель в вакууме. Остаток очищают переосаждением петролейным эфиром из хлористого метилена. Выход оксазолидинона 3 2.86 г (80%), светло-серый порошок. Т. пл.=204-206°С.
| название | год | авторы | номер документа |
|---|---|---|---|
| УЛУЧШЕННЫЙ ПРОЦЕСС ПОЛУЧЕНИЯ ЛИНЕЗОЛИДА | 2016 |
|
RU2766082C1 |
| ОКСАЗОЛИДИНОНОВЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ПРОТИВОБАКТЕРИАЛЬНЫХ СРЕДСТВ | 2016 |
|
RU2794494C2 |
| НОВЫЕ СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИЙ МЛЕКОПИТАЮЩИХ | 2019 |
|
RU2798336C2 |
| БИЦИКЛИЧЕСКИЕ ОКСАЗИН- ИЛИ ТИАЗИН-ОКСАЗОЛИДИНОНЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И СПОСОБЫ ЛЕЧЕНИЯ МИКРОБНЫХ ИНФЕКЦИЙ | 1995 |
|
RU2128660C1 |
| Оксазолидиноны на основе производных пиридоксина, обладающие антибактериальной активностью | 2024 |
|
RU2836570C1 |
| ПРОИЗВОДНЫЕ АМИНОКИСЛОТ ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 2020 |
|
RU2837702C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ С ПОМОЩЬЮ ЗАМЕЩЕННЫХ ОКСАЗОЛИДИНОНОВ | 2002 |
|
RU2321407C9 |
| ЗАМЕЩЕННЫЕ ОКСАЗОЛИДИНОНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ И ПРИМЕНЕНИЕ ЗАМЕЩЕННЫХ ОКСАЗОЛИДИНОНОВ | 2000 |
|
RU2297415C2 |
| Замещенные оксазолидиноны, способы их получения, лекарственное средство на их основе и применение замещенных оксазолидинонов | 2000 |
|
RU2836548C9 |
| ПРОИЗВОДНЫЕ 1-ФЕНИЛ 2-ПИРИДИНИЛАЛКИЛОВЫХ СПИРТОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ | 2012 |
|
RU2617401C2 |

Изобретение относится к способу получения субстанции (S)-2-((3-(4-морфолинил-3-фторфенил)-2-оксазолидин-5-ил)метил)изоиндолин-1,3-диона формулы I. Технический результат: разработан новый однореакторный способ получения (S)-2-((3-(4-морфолинил-3-фторфенил)-2-оксазолидин-5-ил)метил)изоиндолин-1,3-диона формулы I, который является полупродуктом для синтеза антибиотика Линезолид. 4 з.п. ф-лы, 10 ил., 8 пр.

1. Способ получения (S)-2-((3-(4-морфолинил-3-фторфенил)-2-оксазолидин-5-ил)метил)изоиндолин-1,3-диона формулы I,
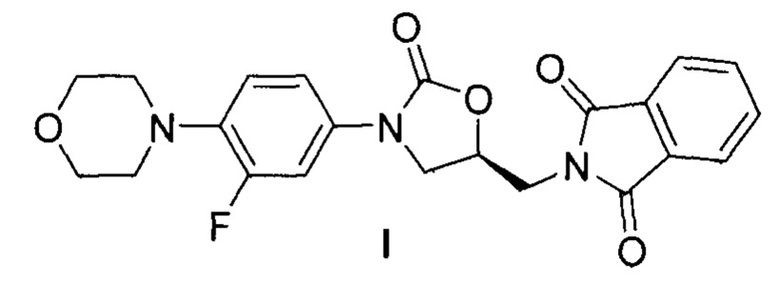
заключающийся в «однореакторном» последовательном проведении процессов хлорформилирования (S)-2-(2-гидрокси-3-хлорпропил)изоиндолин-1,3-диона гексахлордиметилкарбонатом в присутствии третичного амина или пиридина в качестве основания в инертном органическом растворителе с образованием (S)-3-(1,3-диоксоизоиндолин-2-ил)-1-хлорпропан-2-ил хлороформиата, ацилирования образовавшимся (S)-3-(1,3-диоксоизоиндолин-2-ил)-1-хлорпропан-2-ил хлороформиатом 4-морфолинил-3-фторанилина в присутствии карбоната щелочного металла, субстехиометрических количеств четвертичной аммонийной соли и иодида щелочного металла с образованием (S)-3-(1,3-диоксоизоиндолин-2-ил)-1-хлорпропан-2-ил-(4-морфолинил-3-фторфенил)карбамата и дальнейшей циклизации (S)-3-(1,3-диоксоизоиндолин-2-ил)-1-хлорпропан-2-ил-(4-морфолинил-3 -фторфенил)карбамата в соединение формулы I, без выделения и очистки полупродуктов.
2. Способ получения вещества формулы I по п. 1, в котором в качестве инертного растворителя для всех трех стадий используется ацетон.
3. Способ получения вещества формулы I по п. 1, в котором в качестве основания на первой стадии используется пиридин в мольном соотношении от 1,0:1 до 1,5:1 к исходному веществу ((S)-2-(2-гидрокси-3-хлорпропил)изоиндолин-1,3-диону), а для второй и третьей стадий используется карбонат калия или цезия в мольном соотношении от 2,0:1 до 2,5:1 к исходному веществу.
4. Способ получения вещества формулы I по п. 1, в котором в качестве четвертичной аммонийной соли используется тетрабутиламмоний бромид в мольном соотношении от 0,05:1 до 0,15:1 к исходному веществу.
5. Способ получения вещества формулы I по п. 1, в котором в качестве иодида щелочного металла используется иодид калия или иодид натрия в мольном соотношении от 0,05:1 до 0,15:1 к исходному веществу.
| R | |||
| Tammana et al., An expeditious construction of 3-aryl-5-(substituted methyl)-2-oxazolidinones: a short and efficient synthesis of Linezolid, ARKIVOC, 6, стр.: 45-56, 2012 | |||
| Farzad Kobarfard et al, Synthesis of Aminoquinoline-Based Aminoalcohols and Oxazolidinones and Their Antiplasmodial Activity, Chem Biol Drug Des, 79: стр.: 326-331, 2012 | |||
| RU |
Авторы
Даты
2021-11-22—Публикация
2020-12-16—Подача