Причинами снижения физической работоспособности является тяжелая и длительная работа, нервное переутомление, хронические заболевания, длительная химиотерапия (Cordeiro et al., 2017; Dougherty et al., 2019; Воронков и др., 2019). В клинической практике для коррекции снижения физической и умственной работоспособности используют препараты различных фармакологических групп, в том числе объединенных в общий класс «актопротекторы» (Oliynyk and Oh, 2012). Одними из основных представителей класса актопротекторов являются 2 препарата - бемитил и бромантан (Oliynyk and Oh, 2012).
По своей химической структуре бемитил является гидробромидом 2-этилтиобензимидазола (Zarubina et al., 2005). Наиболее близким по структуре к исследуемым агентам (патентуемому соединению) являются бензоиламиноадамантаны, адамантановые производные пара-хлорфеноксиуксусной кислоты и другие структурно близкие соединения, которые давно используются в медицине как средства для повышения резистентности человека к экстремальным факторам окружающей среды, но не как прямые стимуляторы физической работоспособности при нормальных условиях (Морозов и др., 1996; Spasov et al., 2000). К таким соединениям относится бромантан (N-(4-бромфенил)адамантан-2-амин). Бромантан является допингом с психостимулирующим действием и внесен в список запрещенных препаратов WADA (Docherty, 2008). Основными побочными эффектами у препаратов, обладающих психостимулирующими и антиастеническими свойствами, является эйфория, развитие патологического пристрастия, необходимость длительного и частого применения, нарушение оперантной деятельности (Ахапкина и Ахапкин, 2012). Поэтому изыскание новых низкотоксичных веществ, имеющих широкий спектр фармакологического действия и способных повышать физическую работоспособность, как в обычных, так и в экстремальных условиях является задачей первостепенной и необходимой.
Поставленная цель достигается применением в качестве актопротекторного средства соединений, представляющих собой производные 5,7-диметил-1,3-диазаадамантана общей формулой 1 (включая пространственные изомеры, в том числе оптически активные формы),
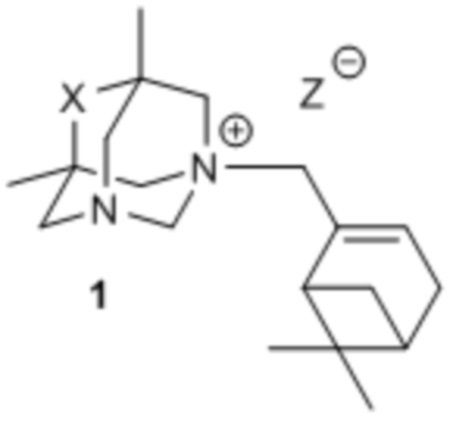
где X: CO, CH2, C=NOH, а Z может быть галогеном или нитро-группой, проявляющих актопротекторные свойства.
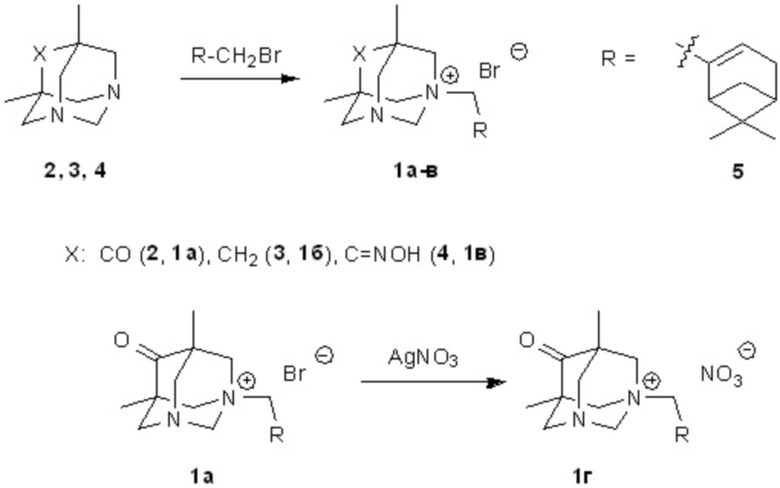
Четвертичные аммониевые соли общей формулы 1 могут быть синтезированы взаимодействием 5,7-диметил-1,3-диазаадамантанов 2, 3, 4 с терпеновыми галогенидами в соответствии с ниже представленной схемой. Замена противоиона с галогена на нитрат может быть выполнена, например, обменной реакцией с нитратом серебра.
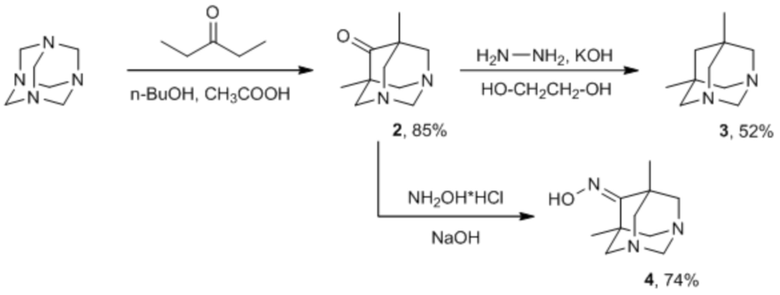
Необходимые 5,7-диметил-1,3-диазаадамантаны 2-4 могут быть получены с хорошими выходами (52-85%), исходя из доступных гексаметилентетрамина и диэтилкетона (пентан-3-она) в соответствии со схемой (Ponomarev et al., 2015; Suslov et al., 2017):
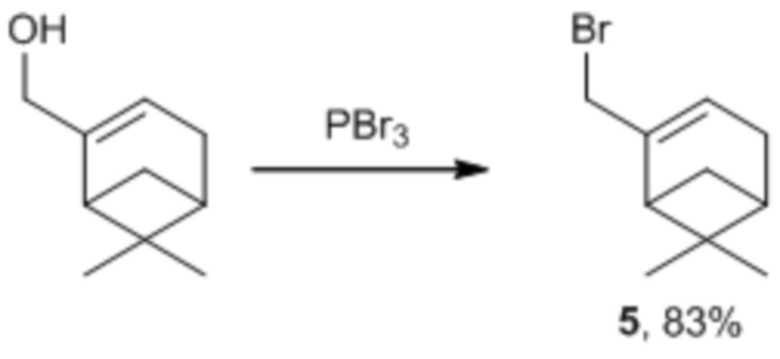
Миртенил бромид 5 может быть получен из коммерчески доступного миртенола в соответствии со следующей схемой (Khomenko et al., 2017; Dvornikova et al, 2007):
Структура полученных соединений типа 1 подтверждена данными ЯМР-спектроскопии, масс-спектрометрии и элементного анализа.
Актопротекторную активность соединений 1а-г исследовали на двух стандартных тестах (Миронов и Бунятян, 2012): тест Порсолта (предельного плавания) и бег на тредбане до отказа в сравнении с ближайшим аналогом бромантаном. Тест Порсолта (предельное плавание) в классическом его исполнении предназначен для оценки депрессивного поведения (Porsolt et al., 1977), однако этот тест также широко используется для оценки эффективности стимуляторов работоспособности в условиях неизбегаемого стресса. Тест предельного плавания представляет собой комбинированный жесткий вид стресса, сочетающий физический и эмоциональный компоненты (Каркищенко и др., 2012). Эффективными считали соединения, применение которых приводило к повышению работоспособности хотя бы в одном тесте.
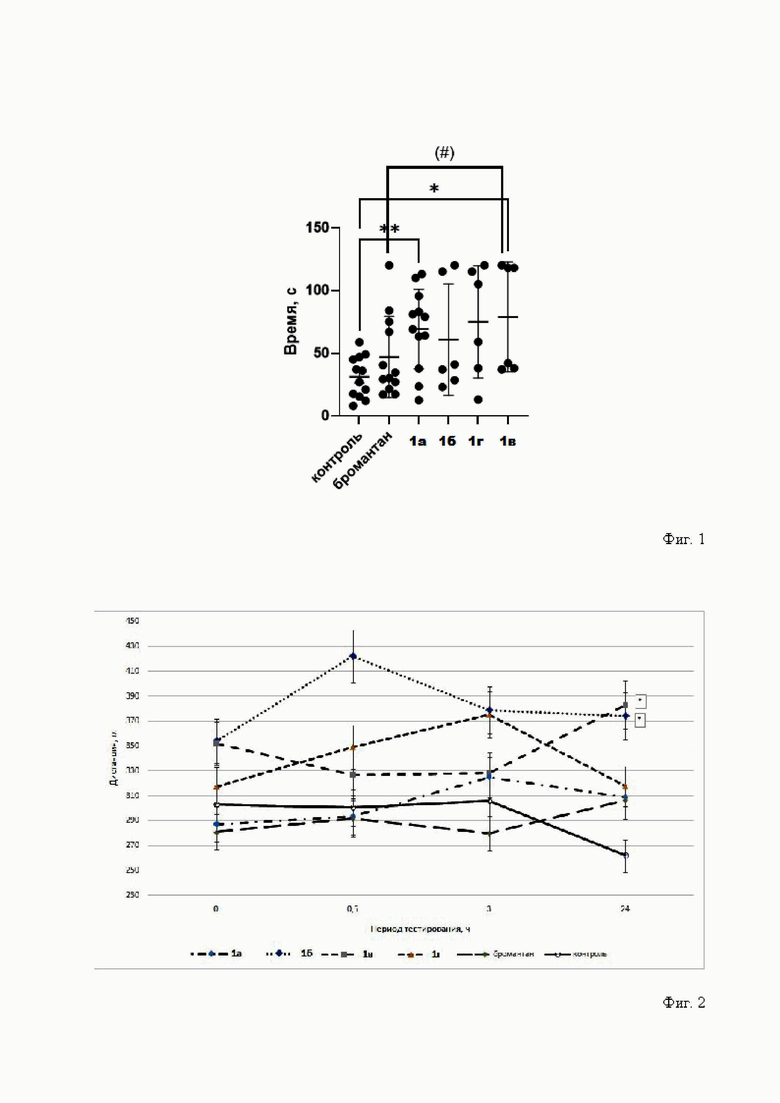
В тесте предельного плавания мышей было установлено, что из производных 5,7-диметилдиазаадамантанона, содержащих фрагмент (-)-миртеналя и оксогруппу (С=О) в 6 положении, только соединение 1а, вводимое в дозе 10 мг/кг, статистически достоверно повышало уровень физической работоспособности мышей в 2 раза относительно интактного контроля. Производное соединения 1а, соединение 1б с метиленовой группой в 6 положении не влияло на время плавания. Другие производные: 1в с оксимной группой C=NOH в 6 положении и 1г с анионом [NO3]- вместо галогена, увеличивали время плавания в 1.7 и 2.4 раз соответственно. В данных условиях только соединение 1в достоверно увеличивало время плавания относительно группы бромантана в 1.7 раз (фиг. 1).
В тесте бега на тредбане «до отказа» после однократного введения соединений было установлено, что соединения 1б и 1в достоверно увеличивают дистанцию бега относительно контрольной группы через 24 часа после введения (на 42% и 46%, соответственно) (фиг. 2). Препарат сравнения бромантан не оказал достоверного влияния на дистанцию бега животных относительно контрольной группы.
Представленные результаты свидетельствуют о более выраженном, чем у бромантана, влиянии новых соединений на физическую выносливость в данных условиях.
При оценке влияния соединений на двигательно-исследовательскую активность животных в тесте «открытое поле» через 30 минут после введения исследуемых соединений показано, что исследуемые агенты 1б, 1а и препарат сравнения бромантан относительно интактного контроля снижают общее время движения, увеличивают время неподвижного момента (Таблица 1). Это может быть связано с тем, что первые стрессовые минуты в открытом поле у интактных мышей значительно усиливают количество движений и пройденной дистанции, а исследуемые агенты не вызывают такой острой реакции на открытое поле. Введение 1г не повлияло на поведение мышей в открытом поле и все показатели на уровне интактного контроля. Введение соединения 1в снизило почти в 1,5 раза дистанцию и время, проведенное в центре. В целом результат в тесте «открытое поле» можно интерпретировать как отсутствие психостимулирующего эффекта у исследуемых агентов, что облегчает возможное пролонгированное применение.
Изучение острой токсичности соединения 1а показало, что оно является малотоксичным (LD50=2375 мг/кг).
Краткое описание чертежей:
На фиг. 1 представлено влияние производных 1а-г и бромантана на выносливость мышей в тесте предельного плавания.
Где: * - достоверность различий по отношению к контрольной группе при p<0.05 (U-критерий Манна-Уитни),
# - различия на уровне тенденции по отношению к группе с введением бромантана 0.05<p<0.1 (р=0.06) (U-критерий Манна-Уитни).
На фиг. 2 показано влияние производных 1а-г и бромантана на выносливость мышей в тесте бега на тредбане «до отказа».
Где: *- достоверность различий по отношению к контрольной группе при p<0.05 (U-критерий Манна-Уитни).
Данные представлены как среднее значение ± стандартное отклонение.
Фиг. 3 – Беговая дорожка с мышами и «зоной усталости», при тесте на физическую выносливость по методике бега "до отказа" на шестидорожечном тредбане FT-200.
Спектральные исследования выполнены в Химическом Сервисном Центре коллективного пользования СО РАН.
Изобретение иллюстрируется следующими примерами:
Пример 1. Синтез 1-(2-(6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метил)-5,7-диметил-6-оксо-1,3-диазаадамантан бромида 1а
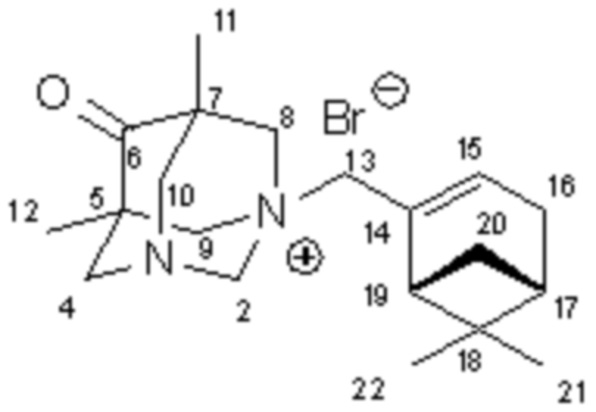
К раствору 0.90 г (5 ммоль) 5,7-диметил-1,3-диазаадамантан-6-она 2 в 10 мл сухого бензола добавили 1.07 г (5 ммоль) (-)-2-(бромметил)-6,6-диметилбицикло[3.1.1]гепт-2-ена 5. Смесь нагрели до кипения и выдержали 4 часа. Выпавший осадок четвертичной соли 1а отделили, промыли бензолом, этилацетатом и высушили в вакуум-эксикаторе. Получили 1.70 г продукта. Выход 87%.
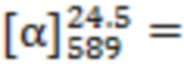
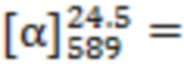 -10.284 (C = 0.564 г/100 мл, MeOH). Масс-спектр: m/z= 314.2351 [C20H31ON2Br]+. Рассчитано: m/z= 394.1614. Элементный анализ, (%). Найдено: С, 59.85; Н, 8.65; Br, 21.09; N, 7.45; O, 2.96. C20H31ON2Br. Вычислено (%): C, 60.76; H, 7.90; Br, 20.21; N, 7.09; O, 4.05. Тпл = 205.7 °C, с разложением.
-10.284 (C = 0.564 г/100 мл, MeOH). Масс-спектр: m/z= 314.2351 [C20H31ON2Br]+. Рассчитано: m/z= 394.1614. Элементный анализ, (%). Найдено: С, 59.85; Н, 8.65; Br, 21.09; N, 7.45; O, 2.96. C20H31ON2Br. Вычислено (%): C, 60.76; H, 7.90; Br, 20.21; N, 7.09; O, 4.05. Тпл = 205.7 °C, с разложением.
ЯМР 1Н (CDCl3, 500 МГц): 0.80 и 1.05 (2с, по 3Н, Н11, Н12), 1.04 (с, 3Н, Н22), 1.07 (д, 1Н, J20анти,20син=9.3, Н20анти), 1.28 (с, 3Н, Н21), 2.09-2.17 (м, 1Н, Н17), 2.27-2.44 (м, 3Н, Н16, H16’, H19), 2.44-2.51 (м, 1Н, Н20син), 2.92 (д, J=13.5, 2Н), 3.40 (дд, J=11.8, 2Н), 3.77 (м, все J<3.5, 2Н), 4.3 (шдд, J=12.5, 2H) – 4NCH2, 4.49-4.55 (м, 2H, Н2), 5.44 (м, 2H, 2J=11.6, 4J=4.8, H13) 6.15-6.17 (м, 1Н, Н15). ЯМР 13C (CDCl3, 125 МГц): 77.97 т. (С2), 64.87 и 65.16 (2т, C8, С9), 65.22 (т, C13) 45.44, 45.55 (2с, С5, С7), 206.21 (с, С6), 61.98, 62.09 (2т, С4, C10), 15.34 (2к, двойной интенсивности, С11, С12), 134.51 (с, С14), 136.20 (д, С15), 31.73 (т, С16), 39.51 (д, С17), 37.99 (с, С18), 46.60 (д, С19), 31.86 (т, С20), 25.76 (к, С21), 21.29 (к, С22).
Пример 2. Синтез 1-(2-(6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метил)-5,7-диметил-1,3-диазаадамантан бромида 1б
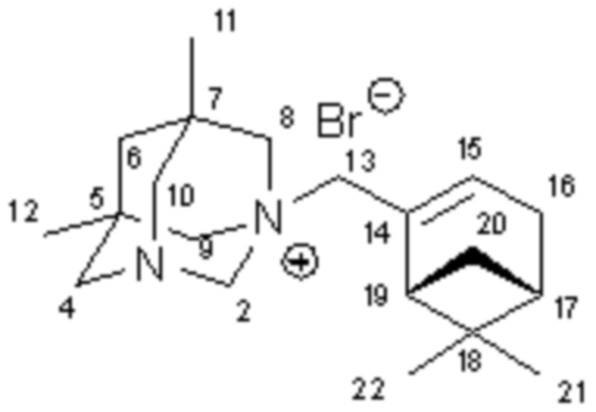
К раствору 0.33 г (2 ммоль) 5,7-диметил-1,3-диазаадамантана 3 в 10 мл сухого бензола добавили 0.43 г (2 ммоль) (-)-2-(бромметил)-6,6-диметилбицикло[3.1.1]гепт-2-ена 5. Смесь нагрели до кипения и выдержали 4 часа. Выпавший осадок четвертичной соли 1б отделили, промыли бензолом, этилацетатом и высушили в вакуум-эксикаторе. Получили 0.62 г продукта. Выход 82%.
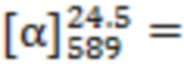
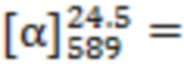 -10.075 (C = 0.536 г/100 мл, MeOH). Масс-спектр: m/z= 301.2642 [C20H33N2Br]+. Рассчитано: m/z= 380.1822. Элементный анализ, (%). Найдено (%): С, 63.01; Н, 9.61; Br, 19.98. N, 7.40. C20H33N2Br. Вычислено (%): C, 62.98; H, 8.72; Br, 20.95; N, 7.35. Тпл= 205.2 °C, с разложением.
-10.075 (C = 0.536 г/100 мл, MeOH). Масс-спектр: m/z= 301.2642 [C20H33N2Br]+. Рассчитано: m/z= 380.1822. Элементный анализ, (%). Найдено (%): С, 63.01; Н, 9.61; Br, 19.98. N, 7.40. C20H33N2Br. Вычислено (%): C, 62.98; H, 8.72; Br, 20.95; N, 7.35. Тпл= 205.2 °C, с разложением.
ЯМР 1Н (CDCl3, 500 МГц): 0.80 и 0.87 (2с, по 3Н, Н11, Н12), 0.87 (с, 3Н, Н22), 1.08 (д, 1Н, J20анти,20син=8.7, Н20анти), 1.26 (с, 3Н, Н21), 1.55 (кв, 2H, J=12.6, H6) 2.06-2.14 (м, 1Н, Н17), 2.26-2.40 (м, 3Н, Н16, H16’, H19), 2.42-2.49 (м, 1Н, Н20син), 2.69 (д, 2Н, J=13.4), 3.12 (д, J=13.4, 2Н), 3.29 (дд, J=11.4, 2Н), 3.73 (д, J=11.4, 2Н) – 4NCH2, 4.13 (шдд, 2H, J=12.6, H13), 4.78 (кв, 2H, J=11.4, H13), 6.15-6.17 (м, 1Н, Н15). ЯМР 13C (CDCl3, 125 МГц): 78.55 т. (С2), 64.87 и 65.16 (2т, C8, С9), 65.22 (т, C13) 45.44, 45.55 (2с, С5, С7), 31.80 (т, С6), 59.60, 59.62 (2т, С4, C10), 22.90 (2к, двойной интенсивности, С11, С12), 134.87 (с, С14), 135.39 (д, С15), 29.06 (т, С16), 39.54 (д, С17), 37.90 (с, С18), 46.77 (д, С19), 29.11 (т, С20), 25.81 (к, С21), 21.38 (к, С22).
Пример 3. Синтез 1-(2-(6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метил)-5,7-диметил-6-гидроксилимино-1,3-диазаадамантан бромида 1в
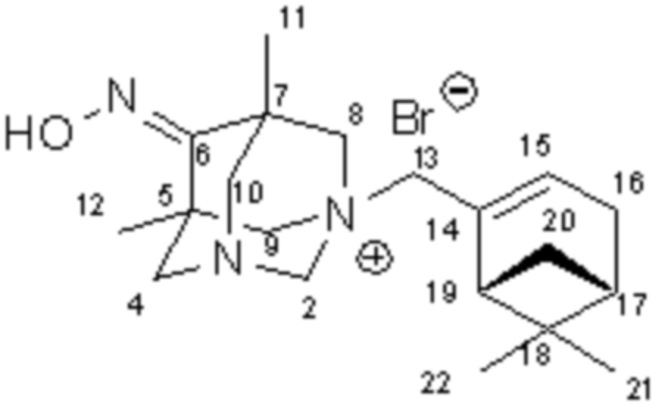
К раствору 0.2 г (1 ммоль) оксима 5,7-диметил-1,3-диазаадамантан-6-она 4 в 10 мл тетрагидрофурана добавили 0.215 г (1 ммоль) (-)-2-(бромметил)-6,6-диметилбицикло[3.1.1]гепт-2-ена 5. Кипятили смесь в течение двух часов. Выпавший осадок четвертичной соли 1в отделили, промыли тетрагидрофураном, этилацетатом и высушили в вакуум-эксикаторе. Получено 0.40 г продукта. Выход 93%.
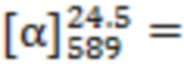
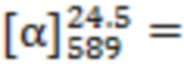 -6.320 (C = 0.538 г/100 мл, MeOH). Масс-спектр: m/z= 312.2437 [C20H32ON3Br]+. Рассчитано: m/z= 409.1723. Элементный анализ, (%). Найдено (%): С, 57.04; Н, 8.59; Br, 19.56; N, 9.92; O, 4.89. C20H32ON3Br Вычислено (%): C, 58.53; H, 7.86; Br, 19.47; N, 10.24; O, 3.90. Тпл= 175.7 °C, с разложением.
-6.320 (C = 0.538 г/100 мл, MeOH). Масс-спектр: m/z= 312.2437 [C20H32ON3Br]+. Рассчитано: m/z= 409.1723. Элементный анализ, (%). Найдено (%): С, 57.04; Н, 8.59; Br, 19.56; N, 9.92; O, 4.89. C20H32ON3Br Вычислено (%): C, 58.53; H, 7.86; Br, 19.47; N, 10.24; O, 3.90. Тпл= 175.7 °C, с разложением.
ЯМР 1Н (CDCl3, 500 МГц): 0.94 и 1.38 (2с, по 3Н, Н11, Н12), 0.795 (с, 3Н, Н22), 1.30 (д, 1Н, J20анти,20син=8.8, Н20анти), 1.285 (с, 3Н, Н21), 2.07-2.12 (м, 1Н, Н17), 2.19-2.24 (м, 1Н, Н16), 2.24-2.31 (дм, 1H, H16’), 2.37-2.47 (дм, 2H, H19, Н20син), 2.92 (д, 1Н, J=13.0), 3.05 (кв, 2H), 3.18 (д, 1H, J=13.3), 3.31-3.60 (дм, 4Н) – 4NCH2, 3.60-3.84 (дм, 2H, Н2), 4.44-4.76 (дм, 2H, H13) 5.93-6.05 (м, 1Н, Н15), 10.85-10.94 (м, 1H, N-OH). ЯМР 13C (CDCl3, 125 МГц): 77.22 т. (С2), 65.22 и 65.39 (2т, C8, С9), 65.57 (т, C13) 37.10, 37.94 (2с, С5, С7), 152.40 (с, С6), 60.70, 60.79 (2т, С4, C10), 18.30 и 18.34 (2к, С11, С12), 134.37 (с, С14), 134.55 (д, С15), 30.65 (т, С16), 39.51 (д, С17), 37.56 (с, С18), 46.22 (д, С19), 31.48 (т, С20), 25.79 (к, С21), 21.13 (к, С22).
Пример 4. Синтез 1-(2-(6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метил)-5,7-диметил-1,3-диазаадамантан нитрата 1г
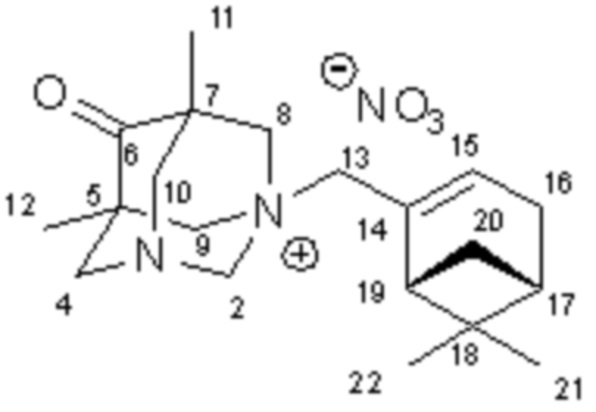
К раствору 0.20 г (0.5 ммоль) 1-(2-(6,6-диметилбицикло[3.1.1]гепт-2-ен-2-ил)метил)-5,7-диметил-6-оксо-1,3-диазаадамантан бромида 1а в 5 мл метанола добавили раствор 0.087 г (0.5 ммоль) нитрата серебра в 5 мл метанола. Через 2 часа осадок хлорида серебра отделили, фильтрат упарили в вакууме. Остаток перекристаллизовали из этилацетата. Получено 0.137 г продукта. Выход 72%.
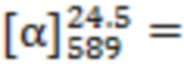
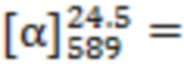 -6.695 (C = 0.478 г/100 мл, MeOH). Масс-спектр: m/z= 314.2349 [C20H31O4N3]+. Рассчитано: m/z= 377.2309. Элементный анализ, (%). Найдено (%): С, 61.18; Н, 8.87; N, 11.62; O, 18.33. C20H31O4N3. Вычислено (%): C, 63.64; H, 8.28; N, 11.13; O, 16.95. Тпл= 167.3 °C, с разложением.
-6.695 (C = 0.478 г/100 мл, MeOH). Масс-спектр: m/z= 314.2349 [C20H31O4N3]+. Рассчитано: m/z= 377.2309. Элементный анализ, (%). Найдено (%): С, 61.18; Н, 8.87; N, 11.62; O, 18.33. C20H31O4N3. Вычислено (%): C, 63.64; H, 8.28; N, 11.13; O, 16.95. Тпл= 167.3 °C, с разложением.
ЯМР 1Н (CDCl3, 500 МГц): 0.78 и 1.01 (2с, по 3Н, Н11, Н12), 1.03 (с, 3Н, Н22), 1.07 (д, 1Н, J20анти,20син=5.8, Н20анти), 1.27 (с, 3Н, Н21), 2.10-2.15 (м, 1Н, Н17), 2.26-2.29 (м, 1Н, Н16), 2.29-2.42 (дм, 2H, H16’, H19), 2.44-2.50 (м, 1Н, Н20син), 2.94 (д, J=12.6, 2Н), 3.46 (шдд, J=11.8, 2Н), 3.60 (дм, J=13.6, 2Н), 4.00 (шдд, J=12.5, 2Н), 4.09 (дд, J=12.5, 2H) – 4NCH2, 5.00 (дд, J=11.3, J=10.4, 2H, H13), 6.05-6.12 (м, 1Н, Н15). ЯМР 13C (CDCl3, 125 МГц): 78.63 т. (С2), 65.35 и 65.52 (2т, C8, С9), 66.13 (т, C13) 45.41, 45.52 (2с, С5, С7), 206.24 (с, С6), 62.37, 62.45 (2т, С4, C10), 15.25 (2к, двойной интенсивности, С11, С12), 134.54 (с, С14), 136.04 (д, С15), 31.70 (т, С16), 39.56 (д, С17), 37.96 (с, С18), 46.68 (д, С19), 31.93 (т, С20), 25.80 (к, С21), 21.23 (к, С22).
Пример 5. Физическую выносливость оценивали по методике предельного плавания мышей с грузом 10% от массы тела. Груз прикреплялся к основанию хвоста. Животное помещали в индивидуальный стеклянный цилиндр (высота 30 см, диаметр 8 см), наполненные водой (24-26°С). Критерием влияния препаратов на физическую выносливость служило время плавания животного до утомления, о котором свидетельствует погружение животного на дно, после чего животное сразу извлекали из воды и обсушивали (Гаврев и др., 2010; Каркищенко, 2010; Каркищенко и др., 2012). Исследуемые соединения вводились внутрибрюшинно за 30 минут до плавания в дозах 10 мг/кг. В качестве препарата сравнения был выбран бромантан (Воронина и др., 2017), который в дозе 50 мг/кг вводили внутрибрюшинно – аналогично исследуемым агентам. В опытных и контрольных группах использовалось 8 особей.
По тесту предельного плавания мышей было установлено, что из производных 5,7-диметилдиазаадамантанона, содержащих фрагмент (-)-миртеналя и оксогруппу (С=О) в 6 положении, соединение 1а, вводимое в дозе 10 мг/кг, статистически достоверно повышало уровень физической работоспособности мышей в 2 раза относительно интактного контроля. Производное соединения 1а, соединение 1б с метиленовой группой в 6 положении не влияло на время плавания. Другие производные: 1в с оксимной группой C=NOH в 6 положении и 1г с анионом [NO3]- вместо галогена, увеличивали время плавания в 1.7 и 2.4 раз соответственно. В данных условиях только соединение 1в достоверно увеличивало время плавания относительно группы бромантана в 1.7 раз (фиг. 1).
Пример 6. Физическую выносливость оценивали по методике бега "до отказа" на шестидорожечном тредбане FT-200, Chengdu Technology and Market Co., Ltd (Китай) (Dougherty et al., 2016). Предварительно мышей ежедневно в течение двух дней тренировали бегать при скорости движения 10 м/мин, в течение 10 минут с углом наклона 10° от горизонтальной плоскости. На третий день проводили исходное тестирование. Первые 10 минут скорость движения составляла 10 м/мин, последующее 5 минут скорость была 15 м/мин, начиная с 15 минуты скорость увеличивали на 2 единицы каждые 2 минуты.
В эксперименте рассчитывали дистанцию бега в соответствии со скоростью и временем бега для каждой мыши по формуле:
S=Ʋ1*Ƭ1+Ʋ2*Ƭ2 + … + Ʋn*Ƭn, где
S – пройденная дистанция, м;
Ʋ – скорость движения ленты, м/мин;
Ƭ – время, движения ленты при определенной скорости, мин;
n–число периодов смены скоростей.
В данном тесте состояние, подобное утомлению у животных, определяется как нахождение в течение 5-ти последовательных секунд в «зоне усталости». «Зона усталости» определяется как область, включающая нижнюю часть беговой дорожки в пределах размера одной длины сетки с током, а также самой сетки (на рисунке отмечено черным прямоугольником) (фиг. 3).
На четвертый и пятый день проводили тестирование по методике аналогичной третьему дню через 0.5, 3.0 и 24 часа после введения исследуемых агентов соответственно. Фиксировали время бега животного, пройденную дистанцию.
Статистическую обработку данных проводили с использованием программы Statistica 6.0. Данные представлены в виде средних арифметических и стандартных ошибок среднего. Сравнения между группами проводили при помощи непараметрического U-критерия Манна–Уитни (Mann–Whitney U Test). Для сравнения показателей изменений на одной и той же выборке внутри одной группы, но в разных условиях использовали W-критерий Уилкоксона. За достоверный уровень значимости принимали p≤0.05. Различия на уровне тенденции рассматривали при значениях 0.05<p<0.1.
В тесте бега на тредбане «до отказа» после однократного введения соединений было установлено, что соединения 1б и 1в достоверно увеличили дистанцию бега относительно контрольной группы через 24 часа после введения (на 42% и 46% соответственно) (фиг. 2). Препарат сравнения бромантан не оказал достоверного влияния на дистанцию бега животных относительно контрольной группы.
Представленные данные свидетельствуют о более выраженном, чем у бромантана, влиянии новых соединений на физическую работоспособность в данных условиях.
Пример 7. Тест «открытое поле» широко применяется в фармакологическом скрининге и фенотипировании животных (Фурсенко и др., 2015). Данный тест оценивает двигательное и исследовательское поведение животных и позволяет выявлять значительные нарушения в нервно-мышечной, сенсорной и вегетативной системах организма и оценивать более тонкие функциональные изменения, связанные с индивидуальным и социальным поведением животных в ответ на введение различных фармакологических агентов.
При оценке влияния соединений на двигательно-исследовательскую активность животных в тесте «открытое поле» через 30 минут после введения исследуемых соединений показано, что исследуемые агенты 1б, 1а и препарат сравнения бромантан относительно интактного контроля снижают общее время движения, увеличивают время неподвижного момента (Таблица 1). Это может быть связано с тем, что первые стрессовые минуты в открытом поле у интактных мышей значительно усиливают количество движений и пройденной дистанции, а исследуемые агенты не вызывают такой острой реакции на открытое поле.
Введение 1г не повлияло на поведение мышей в открытом поле и все показатели на уровне интактного контроля. Введение соединения 1в снизило почти в 1,5 раза дистанцию и время, проведенное в центе поля.
Таблица 1. Горизонтальная активность в тесте открытое поле (в сравнении с интактным контролем)
Примечание: *- достоверность различий по отношению к интактному контролю при p<0.05(U-критерий Манна-Уитни)
Данные представлены как среднее значение (M) ± стандартное отклонение (SD)
Пример 8. При определении LD50 соединения 1а оценивали количественный эффект по смертности/выживаемости животных. LD50 рассчитывали по методам Кербера и Першина (Беленький, 1959). Соединение вводили внутрижелудочно зондом. При летальных дозах гибель животных происходила в интервале 7 – 10 мин при введении больших доз - 3500, 5000 мг/кг доходя до 30 минут при введении 2500 мг/кг. У мышей при летальных дозах наблюдались судороги по типу клонических, посинение хвоста, морды. При вскрытии, при макроскопическом осмотре внутренних органов (печень, почки, легкие, сердце, селезенка, кишечник) изменения не были выявлены.
LD50 для 1а определяли в рабочем интервале, нижняя граница которого – все 6 мышей живы, верхняя – все 6 мышей погибли.
1. Метод Кёрбера (1931). Метод требует одинаковое количество животных в группе, достаточным количеством является 6 животных в группе (Таблица 2).
LD50 = LD100 – Σ (z*d)/m, где
LD100 – доза, при которой наблюдается гибель 100% животных;
d – интервал между каждыми двумя смежными дозами;
z – среднее арифметическое из числа животных, у которых наблюдалась учитываемая реакция под влиянием каждых двух смежных доз;
m – число животных в каждой группе.
Таблица 2. Обработка материала по изучению токсичности 1а с помощью метода Кёрбера
LD50 = 5000 - 15750/6 = 5000 - 2625 = 2375 мг/кг
2. Метод Першина (1939, 1950) (Таблица 3)
LD50 = Σ[(a+b)*(m-n)]/200, где
a и b – величины смежных доз;
m и n – соответствующие этим дозам частоты смертельных исходов в процентах.
Таблица 3. Обработка материала по изучению токсичности 1а для определения LD50 по формуле Г.Н. Першина
LD50 = 475000/200 = 2375 мг/кг
Список использованной литературы
Docherty, J. R. (2008). Pharmacology of stimulants prohibited by the World Anti-Doping Agency (WADA). Br. J. Pharmacol. 154, 606–622. doi: 10.1038/bjp.2008.124.
Dougherty, J. P., Springer, D. A., and Gershengorn, M. C. (2016). The Treadmill Fatigue Test: A Simple, High-throughput Assay of Fatigue-like Behavior for the Mouse. J. Vis. Exp. JoVE. doi:10.3791/54052.
Oliynyk, S., and Oh, S. (2012). The Pharmacology of Actoprotectors: Practical Application for Improvement of Mental and Physical Performance. Biomol. Ther. 20, 446–456. doi: 10.4062/biomolther.2012.20.5.446.
Porsolt, R. D., Bertin, A., and Jalfre, M. (1977). Behavioral despair in mice: a primary screening test for antidepressants. Arch. Int. Pharmacodyn. Ther. 229, 327–336.
Spasov, A. A., Khamidova, T. V., Bugaeva, L. I., and Morozov, I. S. (2000). Adamantane derivatives: Pharmacological and toxicological properties (review). Pharm. Chem. J. 34, 1–7. doi: 10.1007/BF02524549.
Zarubina, I. V., Nurmanbetova, F. N., and Shabanov, P. D. (2005). Bemithyl potentiates the antioxidant effect of intermittent hypoxic training. Bull. Exp. Biol. Med. 140, 190–193. doi: 10.1007/s10517-005-0442-8.
Ахапкина, В. И., Ахапкин, Р. В. (2012). Фундаментальные основы модуляторной концепции и классификация модуляторных лекарственных средств. РМЖ 20, 933–951.
Беленький, М. Л. (1959) Элементы количественной оценки фармакологического эффекта. Акад. наук Латв. ССР, Рига
Воронина, Т. А., Капица, И. Г., Иванова, Е. А. (2017). Сравнительное исследование влияния мексидола и милдроната на физическую работоспособность в эксперименте. Журнал Неврологии и Психиатрии им C.С. Корсакова 117, 71–74.
Каркищенко, В. Н., Фокин, Ю. В., Казакова, Л. Х., Алимкина, О. В., Касинская, Н. В. (2012). Методики изучения физиологических функций лабораторных животных для доклинических исследований в спортивной медицине. Биомедицина, 15–21.
Миронов, А. Н., Бунятян, Н. Д. (2012). Руководство по проведению доклинических исследований лекарственных средств. Часть первая. Гриф и К. Москва.
Морозов, И. С., Арцимович, Н. Г., Климова, Н. В., Фадеева, Т. А., Зайцева, Н. М., Галушина, Т. С., и др. (1996). 2-(пара-бромбензоил) или 2-(пара-хлорбензоил) аминоадамантаны, повышающие резистентность организма к действию экстремальных факторов среды обитания и обладающие иммуностимулирующей активностью — SU 1646256. Available at: http://patents.su/1-1646256-2-para-brombenzoil-ili-2-para-khlorbenzoil-aminoadamantany-povyshayushhie-rezistentnost-organizma-k-dejjstviyu-ehkstremalnykh-faktorov-sredy-obitaniya-i-obladayushhie-immunostimuli.html [Accessed February 2, 2018].
Фурсенко, Д. В., Хоцкин, Н. В., Куликов, В. А., Куликов, А. В. (2015). Поведенческое фенотипирование мышей с нокаутом по фактору некроза опухоли. Вавиловский Журнал Генетики и Селекции 19, 394-398–398. doi: 10.18699/VJ15.050.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 5,7-ДИМЕТИЛ-1,3-ДИАЗААДАМАНТАН-6-ОНА, СОДЕРЖАЩИЕ МОНОТЕРПЕНОВЫЙ ОСТАТОК, НОВЫЕ АНАЛЬГЕЗИРУЮЩИЕ СРЕДСТВА | 2014 |
|
RU2564446C1 |
| ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ (S)-N-[4-(1-АДАМАНТИЛ)БЕНЗОИЛ]-α-АМИНОКИСЛОТ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2009 |
|
RU2417988C2 |
| Средство для ингибирования фермента тирозил-ДНК-фосфодиэстеразы 1 человека на основе фенилкумаринов, сенсибилизирующее опухоли к действию противоопухолевых агентов | 2019 |
|
RU2724878C1 |
| Амиды, сочетающие адамантановый и монотерпеновый фрагменты, используемые в качестве ингибиторов ортопоксвирусов | 2019 |
|
RU2712135C1 |
| N-ГЕТАРИЛЗАМЕЩЕННЫЕ 4-ГИДРОКСИ-1-МЕТИЛ-2,2-ДИОКСО-1H-2λ,1-БЕНЗОТИАЗИН-3-КАРБОКСАМИДЫ, ПРОЯВЛЯЮЩИЕ АНАЛЬГЕТИЧЕСКУЮ АКТИВНОСТЬ | 2013 |
|
RU2544853C1 |
| Диэтил 2,2-диалкилмалонат и 2,2-диалкил-1,3-диметоксипропан, содержащие 6,6-диметилбицикло[3.1.1]гептановый фрагмент природного происхождения, способ их получения и титан-магниевый катализатор полимеризации пропилена, содержащий эти соединения в своем составе | 2023 |
|
RU2819723C1 |
| ПРОИЗВОДНЫЕ ПИРИДОКСИНА С АНТИХОЛИНЭСТЕРАЗНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2550080C1 |
| ХИРАЛЬНЫЕ МИРТАНИЛСУЛЬФОНАМИДЫ | 2019 |
|
RU2725878C1 |
| ФТОРИРОВАННЫЕ 4-ФУРФУРИЛ-3,4-ДИГИДРО-2Н-БЕНЗО[1,4]ТИАЗИН-1,1-ДИОКСИДЫ, ОБЛАДАЮЩИЕ ВЫСОКОЙ АРИТМИЧЕСКОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2626239C1 |
| СРЕДСТВО ДЛЯ ИНГИБИРОВАНИЯ ФЕРМЕНТА ТИРОЗИЛ-ДНК-ФОСФОДИЭСТЕРАЗЫ 1 ЧЕЛОВЕКА | 2015 |
|
RU2612875C1 |

Изобретение относится к области медицинской химии и фармакологии, а именно к новым четвертичным аммониевым солям, конкретно к производным 5,7-диметил-1,3-диазаадамантана, содержащим монотерпеноидные фрагменты, общей формулы 1, включая пространственные изомеры, в том числе оптически активные формы, где X: CO, CH2, C=NOH, а Z может быть галогеном или нитро-группой, обладающие актопротекторным действием. Технический результат: актопротекторное действие производных 5,7-диметил-1,3-диазаадамантана формулы 1. 3 ил., 3 табл., 8 пр.
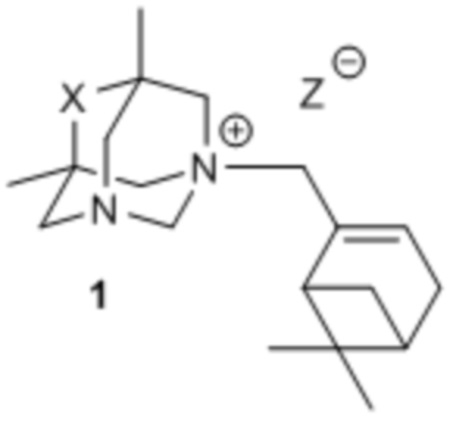
Соединения, представляющие собой производные 5,7-диметил-1,3-диазаадамантана общей формулой 1, включая пространственные изомеры, в том числе оптически активные формы,
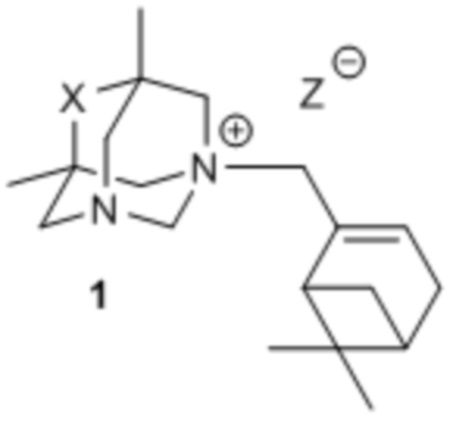
где X: CO, CH2, C=NOH, а Z может быть галогеном или нитро-группой, проявляющие актопротекторные свойства.
| Oliynyk, Sergiy и др.: "The Pharmacology of Actoprotectors: Practical Application for Improvement of Mental and Physical Performance", Biomolecules and Therapeutics, 2012, 20(5), с.446-456 doi:10.4062/biomolther.2012.20.5.446 реферат, фиг.1 соединение В | |||
| Микрометр для слепых | 1948 |
|
SU75943A1 |
| ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ (S)-N-[4-(1-АДАМАНТИЛ)БЕНЗОИЛ]-α-АМИНОКИСЛОТ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2009 |
|
RU2417988C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ХЛОРБЕНЗОИЛАМИНОАДАМАНТАНА, ПОВЫШАЮЩАЯ ФИЗИЧЕСКУЮ РАБОТОСПОСОБНОСТЬ В УСЛОВИЯХ ВЫСОКИХ И НИЗКИХ ТЕМПЕРАТУР | 2016 |
|
RU2704126C2 |
| WO 2019099731 | |||
Авторы
Даты
2021-11-25—Публикация
2021-04-21—Подача