Предлагаемое изобретение относится к области биотехнологии и, в частности, к генетической инженерии и может быть использовано для выявления генетического материала (РНК) коронавируса SARS-CoV2 в диагностических целях.
Вирус SARS-CoV2, относящийся к роду Betacoronavirus, является причиной пандемии коронавирусной инфекции COVID-19, которая продолжается по состоянию на октябрь 2020. Пандемия охватила все страны мира, общее количество зараженных согласно докладу ВОЗ от 20 октября 2020 составило более 40 миллионов человек с более чем 1,1 миллиона зарегистрированных смертельных случаев (данные на 18 октября 2020 г), из которых 1,45 миллиона инфицированных зарегистрировано в России. Как следствие, возникла чрезвычайно острая потребность в диагностических тестах для выявления РНК вируса SARS-CoV2.
Наиболее распространенные используемые тест-системы основаны на ПЦР в режиме реального времени, совмещенной с обратной транскрипцией (ОТ-ПЦР в реальном времени). ОТ-ПЦР позволяет получить результаты в течение 1,5-2 часов с момента начала анализа РНК. Вместе с тем, в связи с резко возросшей нагрузкой на диагностические лаборатории и ограниченным количеством специальных приборов для проведения ОТ-ПЦР (амплификаторов) время выполнения анализа стало фактором, лимитирующим общее количество тестов, проводимых в течение рабочего дня. Иными словами, в целях увеличения пропускной способности лабораторий представляется необходимой разработка более быстрых диагностических методов.
За последние 30 лет на фоне бурного развития молекулярной биологии было разработано множество различных подходов амплификации нуклеиновых кислот, альтернативных ПЦР. Многие из них подразумевают уход от использования циклического нагревания-охлаждения реакционных смесей и проведение амплификации ДНК при постоянной температуре - это методы изотермической амплификации (NASBA, RPA, LAMP, HDA, MDA, RCA, SDA и ряд других подходов [1-3]. Проведение реакции при постоянной температуре позволяет отказаться от использования сложных и дорогостоящих амплификаторов, за счет чего становится возможным миниатюризация оборудования для проведения реакции амплификации и разработка устройств для тестирования вне лабораторий у постели больного (point-of-care). В ряду методов изотермической амплификации особое место занимает изотермическая петлевая амплификация (LAMP, loop-mediated isothermal amplification) [4]. LAMP основана на использовании цепь-вытесняющей активности некоторых ДНК-полимераз и 2-3 пар олигонуклеотидных праймеров. Детекция результатов амплификации может осуществляться невооруженным глазом колориметрически, с помощью флуоресцентных интеркалирующих красителей или зондов, турбидиметрически или электрохимически, как в режиме реального времени, так и по окончанию реакции. На основе LAMP было разработано множество тестов для выявления инфекционных агентов человека, а также сельскохозяйственных животных и растений, в том числе вирусов гриппа, Зика, возбудителей туберкулеза и малярии [5-8]. Чувствительность и специфичность LAMP не уступают ПЦР; вместе с тем, LAMP более устойчива к ингибиторам и позволяет получить результаты тестирования в 2-3 раза быстрее (30-40 мин против 1,5-2 часов).
В силу своих преимуществ перед ПНР при сохранении чувствительности и специфичности, LAMP является перспективным методом для создания диагностических тестов для выявления РНК вируса SARS-CoV2. В течение 2020 года было создано несколько подобных тестов, часть из которых прошла сертификацию и используется в реальной клинической практике [9-11]. Следует отметить, что основное внимание исследователей было сосредоточено на создании тестов на основе LAMP для диагностики у постели больного вне лабораторий. В большинстве работ детекция результатов LAMP в реальном времени использовалась для оптимизации методики и проверки аналитических характеристик, в то время как детекция результатов финального варианта теста осуществлялась визуально, по окраске реакционной смеси. Вместе с тем, LAMP может использоваться в режиме реального времени в рамках диагностических лабораторий, что позволит экономить аппаратное время и увеличить пропускную способность тестирования.
Мультиплексирование - амплификации двух и более фрагментов ДНК в одной реакционной смеси. С помощью мультиплексирования появляется возможность детектировать одновременно несколько патогенов и уменьшается себестоимость тестирования. Кроме того, при мультиплексировании достигается одновременная амплификация внутреннего контроля реакции или внутреннего контроля выделения ДНК или РНК из образца, что позволяет отслеживать качество выделения тестируемых образцов нуклеиновых кислот и работоспособность реагентов для обратной транскрипции и амплификации. Однако в силу специфики процесса амплификации и продуктов реакции LAMP ее мультиплексирование является сложной задачей. Так, у ДНК-полимераз, используемых в LAMP, отсутствует 5'-3'-экзонуклеазная активность, что делает невозможным использование гидролизуемых флуоресцентно-меченых-зондов. Продуктом LAMP является конкатемерные последовательности, составленные из повторяющихся амплифицированных фрагментов, что ограничивает разделение продуктов амплификации по длине без дополнительных манипуляций. Мультиплексирование LAMP возможно с помощью модифицированных олигонуклеотидов, в том числе флуоресцентно меченых, или плавления продуктов амплификации в присутствии интеркалирующих красителей [12-14]. В последнем случае различение продуктов происходит за счет характеристических для каждого продукта температур плавления.
Наиболее близким к заявляемому способу - прототипом, является способ выявления ДНК S. aureus, L. monocytogenes и S. spp, путем выделения ДНК из анализируемой пробы, проведения мультиплексной LAMP с тремя наборами праймеров, комплементарных участкам геномов этих организмов в одной пробирке с помощью LAMP, плавления с высоким разрешением в этой же пробирке продуктов амплификации. На последней стадии способа проводят анализ результатов плавления с высоким разрешения и определение температур плавления амплифицированных фрагментов. Наличие ДНК микроорганизма в анализируемой пробе устанавливают по появлению характеристического пика плавления, соответствующего продукту амплификации участка генома микроорганизма [12].
Недостатком данного способа является его длительность, связанная с затратой времени на проведение плавления с высоким разрешением, которое в несколько раз больше, чем время, затрачиваемое на проведение обычного плавления фрагментов ДНК.
Задачей изобретения является разработка более быстрого способа выявления РНК вируса SARS-CoV2 с помощью мультиплексной изотермической петлевой амплификации, сопряженной с реакцией обратной транскрипции.
Технический результат: сокращение длительности способа выявления РНК вируса SARS CoV2.
Поставленная задача достигается предлагаемым способом, заключающимся в следующем.
Проводят изотермическую петлевую амплификацию (LAMP) РНК, выделенной из анализируемой пробы, в которую предварительно добавляют фаг MS2, с помощью специально подобранных олигонуклеотидных праймеров, комплементарных участку геномной РНК коронавируса SARS-CoV2 и геномной РНК бактериофага MS2. Амплификацию двух фрагментов ДНК, комплементарных геномной РНК коронавируса SARS-CoV2 и геномной РНК бактериофага MS2, осуществляют одновременно в одной реакционной смеси, используя обратную транскриптазу и большой фрагмент Gss-полимеразы. Детекцию результатов амплификации проводят с помощью интеркалирующего флуоресцентного красителя. Непосредственную амплификацию проводят в термоциклере для проведения обычной ПЦР, либо в приборе для ПЦР в реальном врмени. Присутствие РНК коронавируса SARS-CoV2 в анализируемой пробе устанавливают путем анализа кривых плавления амплифицированных фрагментов по появлению пика плавления со специфической температурой.
В качестве мишеней для праймеров LAMP были выбраны консервативные регионы геномной РНК вируса SARS-CoV2, кодирующей участок белка Е, а также участок генома фага MS2. Праймеры подбирали в соответствии с рекомендациями, размещенными на сайте primerexplorer.jp. Эффективность амплификации с помощью подобранных праймеров оценивали, проводя LAMP с фрагментами РНК вируса SARS-CoV2 и фага MS2. Концентрацию РНК-стандартов измеряли с помощью цифровой капельной ПЦР на платформе QX200 (Bio-Rad; США).
Разработанный новый способ выявления РНК коронавируса SARS-CoV2 позволяет детектировать в режиме реального времени генетический материал вируса в течение 40 минут с пределом детекции не менее 20 копий вирусной РНК в реакционной смеси, вместе с одновременной амплификацией контрольного фрагмента РНК MS2.
Изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример 1.
LAMP проводили в реакционном объеме 20 мкл, содержавшем 1× реакционный буфер для Bst-полимеразы (20 мМ Tris-HCl рН 8,8, 10 мМ (NH4)2SO4, 150 мМ KCl, 0,1% Tween-20, 2 мМ М MgSO4), 1,4 мМ каждого дНТФ, 1х праймеров на SARS-CoV2 (по 0,2 мкМ внешних праймеров (F3/B3), 0,6 мкМ петлевых праймеров (LF/BF), 1,6 мкМ внутренних праймеров (FIP/BIP)), 0,5х праймеров на MS2 (по 0,1 мкМ внешних праймеров (F3/B3), 0,3 мкМ петлевых праймеров (LF/BF), 0,8 мкМ внутренних праймеров (FIP/BIP)), последовательности которых представлены в таблице 1, РНК-матрицу (тип и количество матрицы указаны ниже), 100 е.а. обратной транскриптазы M-MuLV, 2 е.а. большого фрагмента Gss-полимеразы из Geobacillus sp. 777 [15], интеркалирующий краситель SYTO-82 до концентрации 1 мкМ. Реакцию проводили в амплификаторе CFX96 (Bio-Rad; США). Программа включала в себя следующие стадии: 10 мин обратной транскрипции при 50°С, отжиг праймеров и элонгацию при температуре 64°С 90 циклов длиной 20 с каждый с регистрацией сигнала флуоресценции на канале FAM; определение температуры плавления продуктов амплификации в диапазоне 70-95°С после амплификации для определения наработанных продуктов амплификации. Результаты изотермической амплификации оценивали по параметру Tt (time-to-threshold - времени до пересечения кривой накопления продукта амплификации порогового значения) и графикам плавления продуктов LAMP.
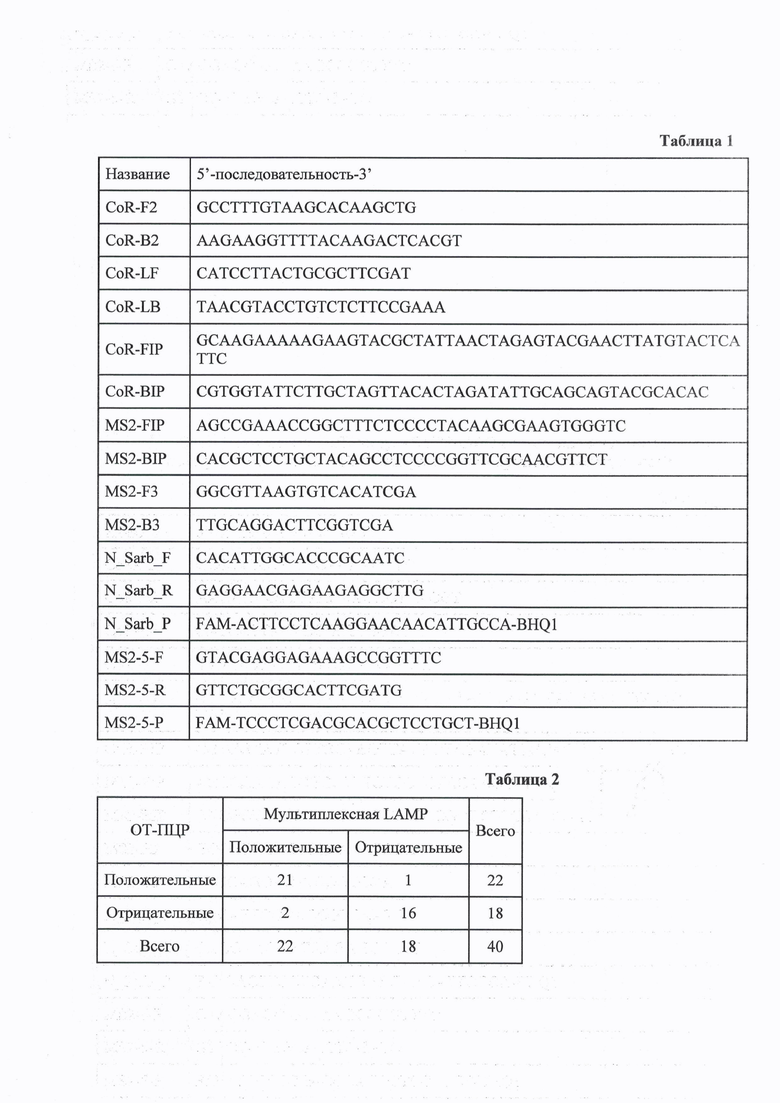
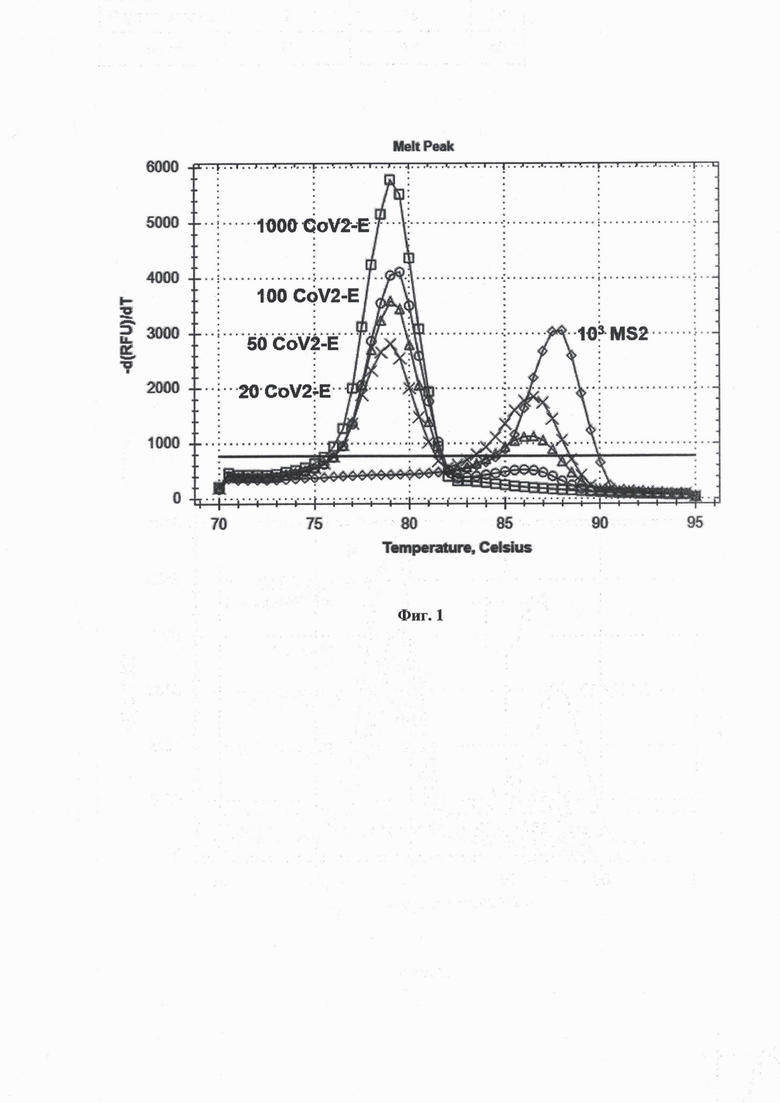
Предел детекции РНК коронавируса SARS-CoV2 с помощью мультиплексной LAMP оценивали, варьируя количество РНК CoV2-E в пределах 100-10 копий на фоне 12000 копий РНК MS2 в реакционной смеси.
Всего использовали 4 концентрации РНК CoV2-E: 100, 50, 20 и 10 копий в реакционной смеси, с каждой концентрацией проводили LAMP с праймерами MS2-CoV2-E в 20 технических повторах в одном запуске. Наличие РНК CoV2-E определяли по появлению соответствующего пика на графике плавления продуктов амплификации. Результаты анализа кривых плавления продуктов LAMP при установлении предела детекции дуплекса MS2-CoV2 показаны на фиг. 1. На фиг. 1 видны характеристические пики плавления продуктов LAMP, полученные с моноплексом CoV2-E и 103 копий РНК CoV2-Е (выделено квадратами), с моноплексом MS2 и 103 копий РНК MS2 (выделено ромбами), с дуплексом MS2-CoV2-E 12000 копиями на реакцию РНК MS и РНК CoV2-E: 100 копиями (выделено окружностями), 50 копиями (выделено тругольниками) и 20 копиями (выделено крестами).
Пик плавления CoV2-E присутствовал во всех 20 технических повторах для концентраций РНК CoV2-E 100, 50, 20 молекул в реакционной смеси, а также в 16 из 20 технических повторах для концентрации РНК CoV2-E 10 молекул на реакцию. Таким образом, предел детекции мультиплексной LAMP составлял не менее 20 молекул РНК SARS-CoV2 в реакционной смеси. Полученный предел детекции соответствует аналогичным показателям для ранее опубликованных тест-систем для выявления РНК коронавируса SARS-CoV2.
Пример 2.
Валидацию заявляемого способа (мультиплексная LAMP MS2-CoV2-E) проводили на 40 клинических образцах назофарингеальных мазков, полученных от пациентов ЦНМТ ИХФБМ СО РАН. Все участвовавшие пациенты подписали информированное согласие на проведение исследования. РНК из образцов выделяли с помощью комплекта реагентов для выделения РНК/ДНК из клинического материала «РИБО-преп», после чего проводили тестирование двумя методами: ОТ-ПЦР в режиме реального времени с помощью праймеров, рекомендованных ВОЗ [16] (таблица 1) и мультиплексной LAMP MS2-CoV2-E. Результаты сравнения мультиплексной LAMP MS2-CoV2-E с ОТ-ПЦР в реальном времени представлены в таблице 2.
Из 40 образов, результаты тестирования обоими методами совпали для 37. При этом для двух негативных по ОТ-ПЦР образцов, тестированных как позитивные по LAMP, показатель Cq ОТ-ПРЦ в реальном времени превышал 35. Таким образом, конкордантность результатов мультиплексной LAMP с ОТ-ПЦР в реальном времени составила 92%.
Таким образом, разработанный новый способ выявления РНК коронавируса SARS-CoV2 позволяет детектировать в режиме реального времени генетический материал вируса в течение 40 минут с пределом детекции не менее 20 копий вирусной РНК в реакционной смеси, вместе с одновременной амплификацией контрольного фрагмента РНК MS2.
Источники информации:
1. Compton J. Nucleic acid sequence-based amplification. // Nature. 1991. Vol. 350, №6313. P. 91-92.
2. Fire A., Xu S.Q. Rolling replication of short DNA circles. // Proc. Natl. Acad. Sci. U. S. A. 1995. Vol. 92, №10. P. 4641-4645.
3. Notomi T. et al. Loop-mediated isothermal amplification of DNA. // Nucleic Acids Res. 2000. Vol. 28, №12. P. E63.
4. Notomi T. et al. Loop-mediated isothermal amplification of DNA. // Nucleic Acids Res. 2000. Vol. 28, №12. P. E63.
5. Yongkiettrakul S. et al. Simple detection of single nucleotide polymorphism in Plasmodium falciparum by SNP-LAMP assay combined with lateral flow dipstick. // Parasitol. Int. 2017. Vol. 66, №1. P. 964-971.
6. Global Tuberculosis Programme. The use of loop-mediated isothermal amplification (ТВ-LAMP) for the diagnosis of pulmonary tuberculosis: policy guidance. 38 p.
7. Guo X.G. et al. Rapid and reliable diagnostic method to detect Zika virus by real-time fluorescence reverse transcription loop-mediated isothermal amplification // AMB Express. Springer Verlag, 2018. Vol. 8, №1.
8. Poon L.L.M. et al. Detection of human influenza A viruses by loop-mediated isothermal amplification // J. Clin. Microbiol. J Clin Microbiol, 2005. Vol. 43, №1. P. 427-430.
9. Broughton J. et al. Rapid Detection of 2019 Novel Coronavirus SARS-CoV-2 Using a CRISPR-based DETECTR Lateral Flow Assay // medRxiv Prepr. Serv. Heal. Sci. medRxiv, 2020.
10. Park G.S. et al. Development of Reverse Transcription Loop-Mediated Isothermal Amplification Assays Targeting Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) // J. Mol. Diagnostics. Elsevier B.V., 2020. Vol. 22, №6. P. 729-735.
11. Kitagawa Y. et al. Evaluation of rapid diagnosis of novel coronavirus disease (COVID-19) using loop-mediated isothermal amplification // J. Clin. Virol. Elsevier B.V., 2020. Vol. 129.
12. Dong J. et al. Single-color multiplexing by the integration of high-resolution melting pattern recognition with loop-mediated isothermal amplification // Chem. Commun. Royal Society of Chemistry, 2019. Vol. 55, №17. P. 2457-2460.
13. Tanner N. a, Zhang Y., Evans T.C. Simultaneous multiple target detection in real-time loop-mediated isothermal amplification. // Biotechniques. 2012. Vol. 53, №2. P. 81-89.
14. Higgins O. et al. Evaluation of an internally controlled multiplex Tth endonuclease cleavage loop-mediated isothermal amplification (TEC-LAMP) assay for the detection of bacterial meningitis pathogens // Int. J. Mol. Sci. MDPI AG, 2018. Vol. 19, №2.
15. Oscorbin LP., Boyarskikh U.A., Filipenko M.L. Large Fragment of DNA Polymerase I from Geobacillus sp. 777: Cloning and Comparison with DNA Polymerases I in Practical Applications. // Mol. Biotechnol. 2015. Vol. 57, №10. P. 947-959.
16. Corman V. et al. Diagnostic detection of Wuhan coronavirus 2019 by realtime RT-PCR.
Предлагаемое изобретение относится к области биотехнологии и, в частности, к генетической инженерии. Проводят изотермическую петлевую амплификацию с помощью специально подобранных олигонуклеотидных праймеров, комплементарных участку геномной РНК коронавируса SARS-CoV2 и геномной РНК бактериофага MS2, при этом амплификацию двух фрагментов ДНК, комплементарных геномной РНК коронавируса SARS-CoV2 и геномной РНК бактериофага MS2, осуществляют одновременно в одной реакционной смеси. Детекция результатов амплификации происходит в реальном времени так и после амплификации с помощью интеркалирующего флуоресцентного красителя по анализу кривых плавления амплифицированных фрагментов. Технический результат: сокращение длительности способа выявления РНК вируса SARS-CoV2. 1 з.п. ф-лы, 1 ил., 2 табл., 2 пр.
1. Способ выявления РНК вируса SARS-CoV2 с помощью мультиплексной изотермической петлевой амплификации с обратной транскрипцией, включающий выделение РНК из анализируемой пробы, проведение изотермической петлевой амплификации с помощью олигонуклеотидных праймеров с последующей детекцией результатов амплификации посредством плавления продуктов амплификации, отличающийся тем, что проводят амплификацию двух фрагментов ДНК, комплементарных геномной РНК коронавируса SARS-CoV2 и геномной РНК бактериофага MS2, при этом амплификацию осуществляют одновременно в одной реакционной смеси, используя обратную транскриптазу, большой фрагмент Gss-полимеразы, набор олигонуклеотидных праймеров, представленный в таблице 1, и интеркалирующий краситель, а детекцию РНК коронавируса SARS-CoV2 осуществляют путем анализа кривых плавления амплифицированных фрагментов по появлению пика плавления со специфической температурой.
2. Способ по п. 1, отличающийся тем, что геномную РНК бактериофага MS2 добавляют в анализируемую пробу перед амплификацией.
| CN 111154922 B, 04.08.2020 | |||
| CN 111549176 A, 18.08.2020 | |||
| CN 111187856 B, 13.11.2020 | |||
| НАБОР ПРАЙМЕРОВ И СПОСОБ ОПРЕДЕЛЕНИЯ БАКТЕРИИ ВИДА Dickeya solani | 2016 |
|
RU2642313C1 |
| Харченко Е.П., Коронавирус SARS-CoV-2: особенности структурных белков, контагиозность и возможные иммунные коллизии, Эпидемиология и вакцинопрофилактика, 2020, 19: 2, стр.21. | |||
Авторы
Даты
2021-12-06—Публикация
2020-12-04—Подача