ЗАЯВЛЕНИЕ О ПРИОРИТЕТЕ
[0001] Настоящее изобретение притязает на приоритет, в соответствии со ст. 35 U.S.C. 119(e), по предварительной заявке на патент США 62/383,818, поданной 6 сентября 2016, которая включена в настоящее описание во всей своей полноте посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0002] Настоящее изобретение относится к составу с немедленным высвобождением (R)-2-амино-3-фенилпропил карбамата (APC) и способам его применения для лечения заболеваний.
УРОВЕНЬ ТЕХНИКИ
[0003] APC представляет собой аналог фенилаланина, который, как было показано, является полезным для лечения множества различных заболеваний, включая чрезмерную дневную сонливость, катаплексию, нарколепсию, усталость, депрессию, биполярное расстройство, фибромиалгию и другие. См., например, патенты США №№ 8,232,315; 8,440,715; 8,552,060; 8,623,913; 8,729,120; 8,741,950; 8,895,609; 8,927,602; 9,226,910; и 9,359,290; и заявки на патент США 2012/0004300 и 2015/0018414. Способы получения APC (который также известен под другими названиями) и родственных соединений можно найти в патентах США №№ 5,955,499; 5,705,640; 6,140,532 и 5,756,817. Все указанные выше патенты и заявки на патент включены в настоящее описание во всей своей полноте посредством ссылки.
[0004] Настоящее изобретение позволяет преодолеть недостатки в данной области техники, предлагая составы АРС с немедленным высвобождением, подходящие для лечения расстройств, чувствительных к АРС.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0005] Настоящее изобретение относится к разработке составов APC с немедленным высвобождением. Изобретение дополнительно относится к применению составов для лечения расстройств, чувствительных к APC.
[0006] Соответственно, один из аспектов изобретения относится к прессованной таблетке с немедленным высвобождением для пероральной доставки АРС, содержащей:
APC или его фармацевтически приемлемую соль в количестве примерно 90-98% от массы таблетки;
по меньшей мере одно связующее вещество в количестве примерно 1-5% от массы таблетки; и
по меньшей мере один лубрикант в количестве примерно 0,1-2% от массы таблетки;
где из таблетки высвобождается по меньшей мере 85% APC или его фармацевтически приемлемой соли в течение менее 15 минут после введения таблетки субъекту.
[0007] Изобретение также относится к пероральной лекарственной форме АРС с немедленным высвобождением, содержащей:
APC или его фармацевтически приемлемую соль в количестве примерно 90-98% от массы пероральной лекарственной формы;
по меньшей мере одно связующее вещество в количестве примерно 1-5% от массы пероральной лекарственной формы; и
по меньшей мере один лубрикант в количестве примерно 0,1-2% от массы пероральной лекарственной формы;
где пероральная лекарственная форма высвобождает по меньшей мере 85% АРС или его фармацевтически приемлемой соли в течение менее 15 минут после введения пероральной лекарственной формы субъекту.
[0008] Изобретение также относится к прессованной таблетке с немедленным высвобождением для пероральной доставки АРС, содержащей АРС или его фармацевтически приемлемую соль в количестве примерно 90-98% от массы таблетки; причем скорости растворения АРС или его фармацевтически приемлемой соли в таблетке практически идентичны при рН 1,2, рН 4,5 и рН 6,8.
[0009] Помимо этого, изобретение относится к способу лечения расстройства, поддающегося лечению APC, например нарколепсии, катаплексии, чрезмерной дневной сонливости, лекарственной зависимости, половой дисфункции, усталости, фибромиалгии, синдрома дефицита внимания/гиперактивности, синдрома беспокойных ног, депрессии, биполярного расстройства или ожирения у нуждающегося в этом субъекта, или содействия нуждающемуся в этом субъекту в прекращении курения, включающий введение субъекту прессованной таблетки по изобретению.
[0010] Настоящее изобретение более подробно раскрыто в приведенных ниже примерах со ссылками на прилагаемые чертежи.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
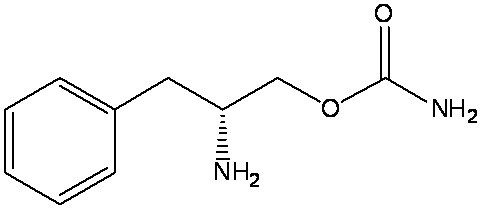
[0011] На фиг.1 показана скорость растворения таблеток с немедленным высвобождением APC.
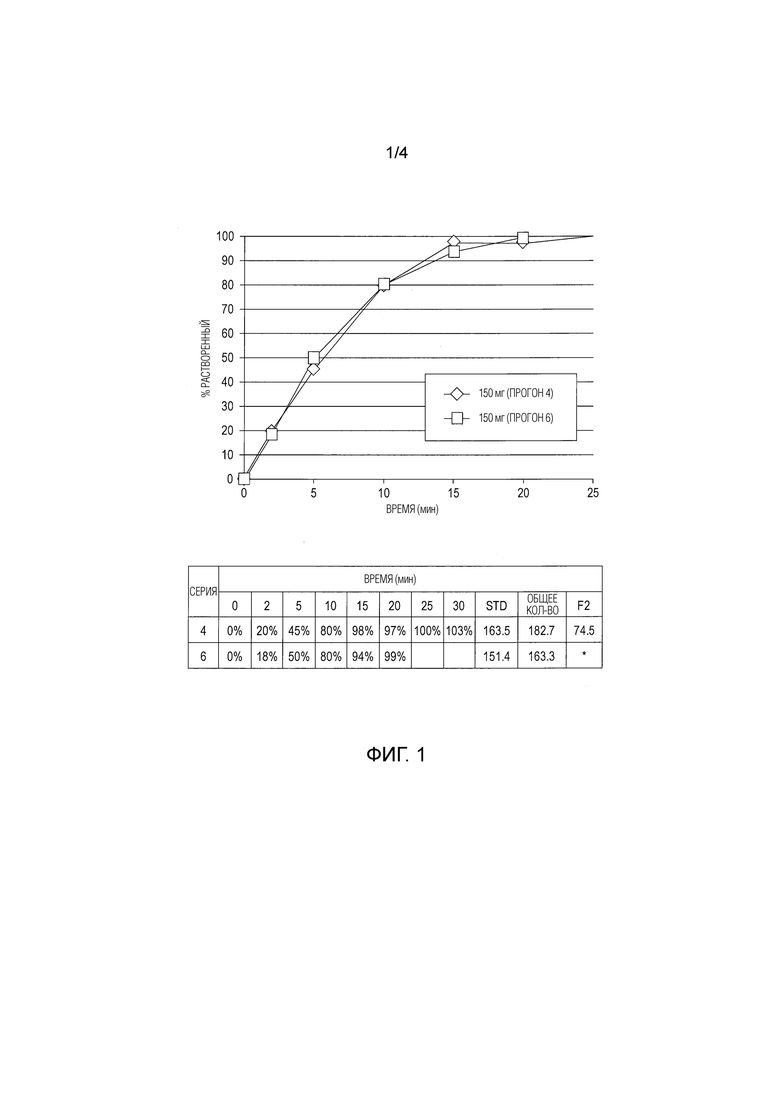
[0012] На фиг.2 показано влияние покрытия на скорость растворения таблеток с немедленным высвобождением APC.
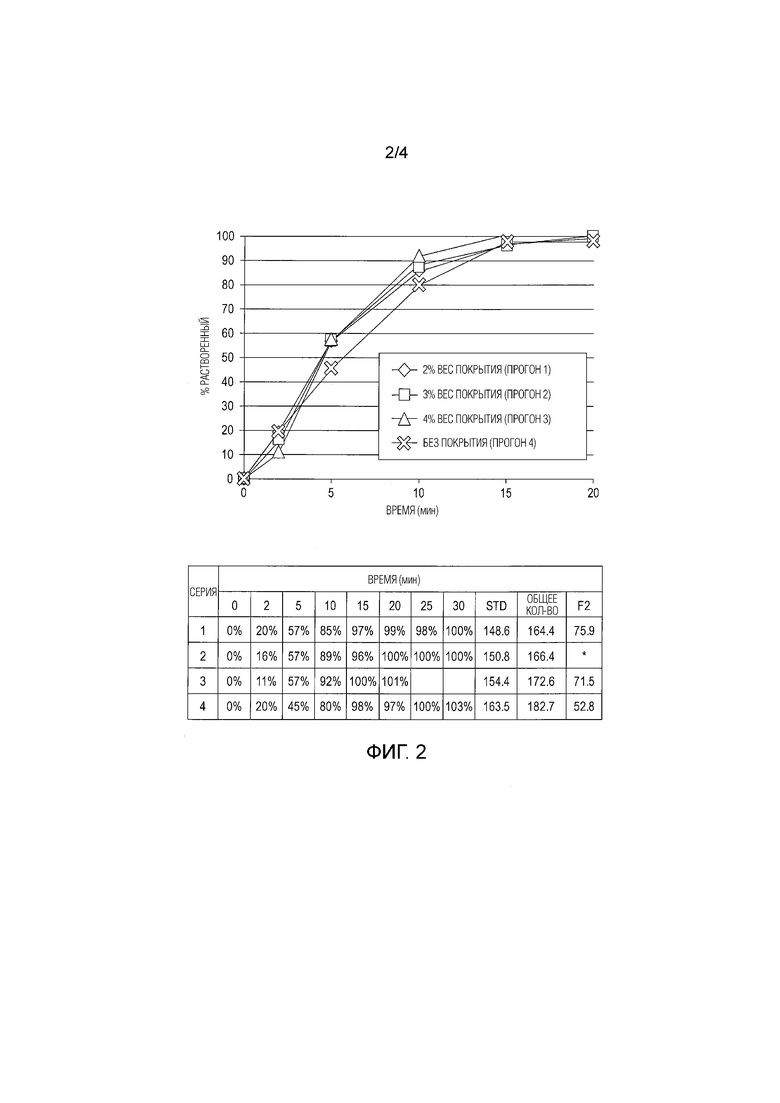
[0013] На фиг.3 показано влияние размера таблеток с немедленным высвобождением APC на скорость их растворения.
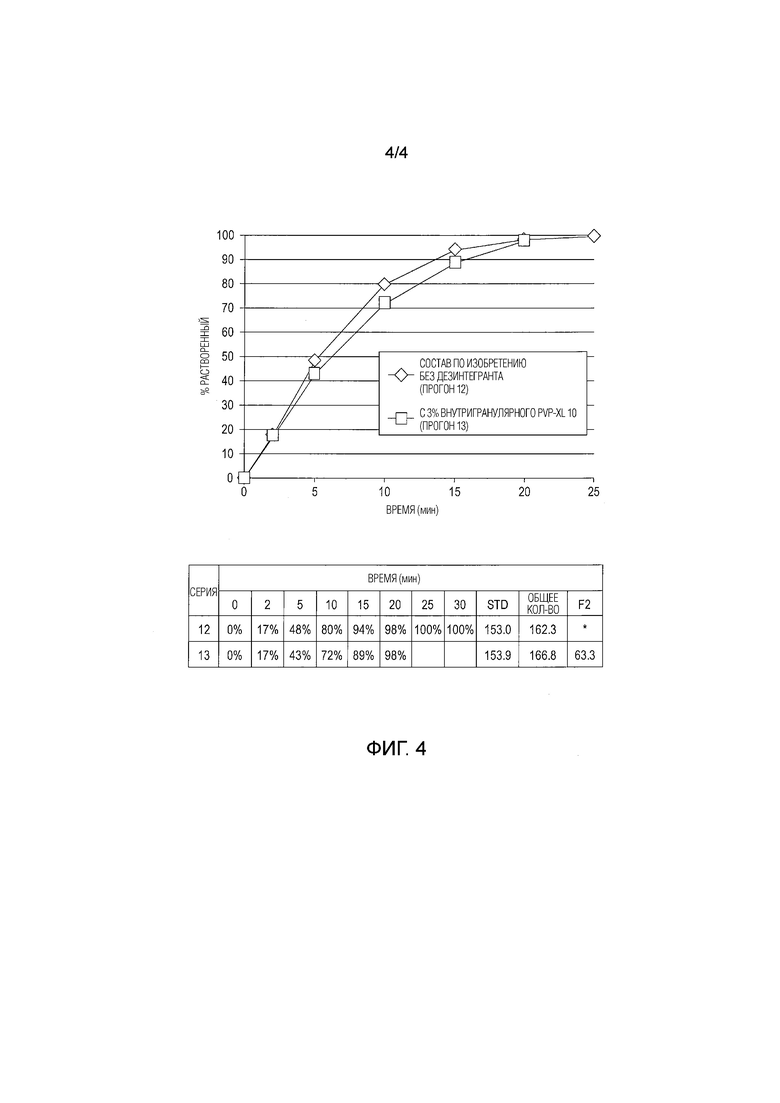
[0014] На фиг.4 показано влияние дезинтегранта на скорость растворения таблеток с немедленным высвобождением АРС.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0015] Реализация настоящего изобретения возможна в различных формах и не должна рассматриваться как ограниченная вариантами осуществления, изложенными в настоящем описании. Скорее, эти варианты осуществления предоставлены для того, чтобы настоящее раскрытие было полным и завершенным и продемонстрировало специалистам в данной области техники полный объем изобретения. Например, признаки, проиллюстрированные в отношении одного варианта осуществления, могут быть включены в другие варианты осуществления, а признаки, проиллюстрированные в отношении конкретного варианта осуществления, могут быть удалены из этого варианта осуществления. Кроме того, многочисленные варианты осуществления и дополнения к предложенным в настоящем описании вариантам осуществления, которые не выходят за пределы объема настоящего изобретения, будут очевидны для специалистов в данной области техники в свете настоящего раскрытия.
[0016] Если не указано иное, все технические и научные термины, используемые в данном описании, имеют значение, которое обычно понимают специалисты в области техники, к которой относится настоящее изобретение. Терминология, используемая в описании изобретения в настоящей заявке, предназначена только для описания конкретных вариантов осуществления и не предназначена для ограничения изобретения.
[0017] Если из контекста в явном виде не следует иное, специально подразумевается, что различные признаки изобретения, представленные в настоящей заявке, могут использоваться в любой комбинации.
[0018] Кроме того, настоящее изобретение также подразумевает, что в некоторых вариантах осуществления изобретения любой признак или комбинация признаков, изложенных в настоящей заявке, могут быть исключены или опущены.
[0019] С целью иллюстрации, если в описании указано, что комплекс включает компоненты A, B и C, следует понимать, что любой из A, B или C или их комбинации может быть опущен и удален по отдельности или в любой комбинации.
[0020] Все публикации, заявки на патенты, патенты и другие документы, упомянутые в настоящей заявке, включены в описание во всей своей полноте посредством ссылки.
[0021] Как используется в настоящем описании, единственное число может означать один или более чем один. Например, клетка может означать одну клетку или множество клеток.
[0022] Также, как используется в настоящей заявке, «и/или» относится и охватывает любые возможные комбинации одного или более связанных перечисленных элементов, а также отсутствие комбинаций при интерпретации альтернативы («или»).
[0023] Кроме того, термин «примерно», используемый в настоящем описании, когда относится к измеряемому значению, такому как количество соединения или агента по настоящему изобретению, доза, время, температура и т.п., предназначен для охвата разброса значений ±10%, ±5%, ±1%, ±0,5% или даже ±0,1% от указанного количества.
[0024] Термин «состоит по существу из» (и грамматические варианты) применительно к композициям по настоящему изобретению означает, что композиция может содержать дополнительные компоненты, если дополнительные компоненты не изменяют композицию существенным образом. Термин «по существу измененный» применительно к композиции относится к увеличению или снижению терапевтической эффективности композиции, по меньшей мере, примерно на 20% или более по сравнению с эффективностью композиции, состоящей из перечисленных компонентов.
[0025] Используемый в настоящей заявке термин «терапевтически эффективное количество» или «эффективное количество» относится к такому количеству композиции, соединения или агента по настоящему изобретению, которое оказывает модулирующий эффект, который, например, может быть благоприятным для субъекта, страдающего от расстройства, заболевания или болезненного состояния, включая улучшение состояния субъекта (например, по одному или более симптомам), задержку или уменьшение прогрессирования состояния, задержку начала расстройства и/или изменение клинических параметров, заболевания или болезненного состояния и т.д., как хорошо известно в данной области. Например, терапевтически эффективное количество или эффективное количество может относиться к количеству композиции, соединения или агента, которое улучшает состояние субъекта на по меньшей мере 5%, например, на по меньшей мере 10%, на по меньшей мере 15%, на по меньшей мере 20%, на по меньшей мере 25%, на по меньшей мере 30%, на по меньшей мере 35%, на по меньшей мере 40%, на по меньшей мере 45%, на по меньшей мере 50%, на по меньшей мере 55%, на по меньшей мере 60%, на по меньшей мере 65%, на по меньшей мере 70%, на по меньшей мере 75%, на по меньшей мере 80%, на по меньшей мере 85%, на по меньшей мере 90%, на по меньшей мере 95% или на по меньшей мере 100%.
[0026] «Лечить» или «лечащий», или «лечение» относится к любому типу действия, которое оказывает модулирующий эффект, который, например, может быть благоприятным, для субъекта, страдающего от расстройства, заболевания или болезненного состояния, включая улучшение состояния субъекта (например, по одному или более симптомам), задержку или уменьшение прогрессирования состояния и/или изменение клинических параметров, заболевания или болезненного состояния и т.д., как хорошо известно в данной области.
[0027] «Нарушение, поддающееся лечению APC» относится к любому расстройству, при котором введение APC субъекту приводит к лечению одного или более симптомов расстройства у субъекта. Примеры таких расстройств включают, без ограничения, нарколепсию, катаплексию, чрезмерную дневную сонливость, лекарственную зависимость, половую дисфункцию, усталость, фибромиалгию, синдром дефицита внимания/гиперактивности, синдром беспокойных ног, депрессию, биполярное расстройство или ожирение.
[0028] «Фармацевтически приемлемый», как используется в настоящем описании, означает материал, который не является биологически или иным образом нежелательным, т.е., материал может быть введен индивидууму вместе с композициями по настоящему изобретению, не вызывая существенных вредных биологических эффектов или не оказывая вредного воздействия на любые другие компоненты композиции, в которой он содержится. Материал, естественно, должен быть выбран для минимизации любой деградации активного ингредиента и минимизации любых неблагоприятных побочных эффектов у субъекта, как хорошо известно специалисту в данной области техники (см., например, Remington's Pharmaceutical Science; 21-е изд. 2005 г.).
[0029] «Одновременно» означает достаточно близко по времени для получения комбинированного эффекта (т.е., одновременно может означать в то же самое время или два или более события, которые происходят через короткий промежуток времени или следуют друг за другом). В некоторых вариантах осуществления введение двух или более соединений «одновременно» означает, что два соединения вводят достаточно близко по времени, чтобы присутствие одного соединения изменило биологические эффекты другого. Два соединения могут быть введены в одном и том же или разных составах или последовательно. Одновременное введение может быть осуществлено путем смешивания соединений перед введением или путем введения соединений в двух разных составах, например, в один и тот же момент времени, но в разных анатомических местах или разными путями введения.
[0030] Настоящее изобретение относится к составам и дозированным формам для немедленного высвобождения АРС или его фармацевтически приемлемой соли. Описанные в настоящей заявке составы подходят для немедленного высвобождения высоких доз лекарственных веществ, которые хорошо растворимы в воде. В конкретных вариантах осуществления составы с немедленным высвобождением предоставляются в виде стандартной лекарственной формы, а в некоторых вариантах осуществления состав с немедленным высвобождением предоставляется в виде таблетки с немедленным высвобождением.
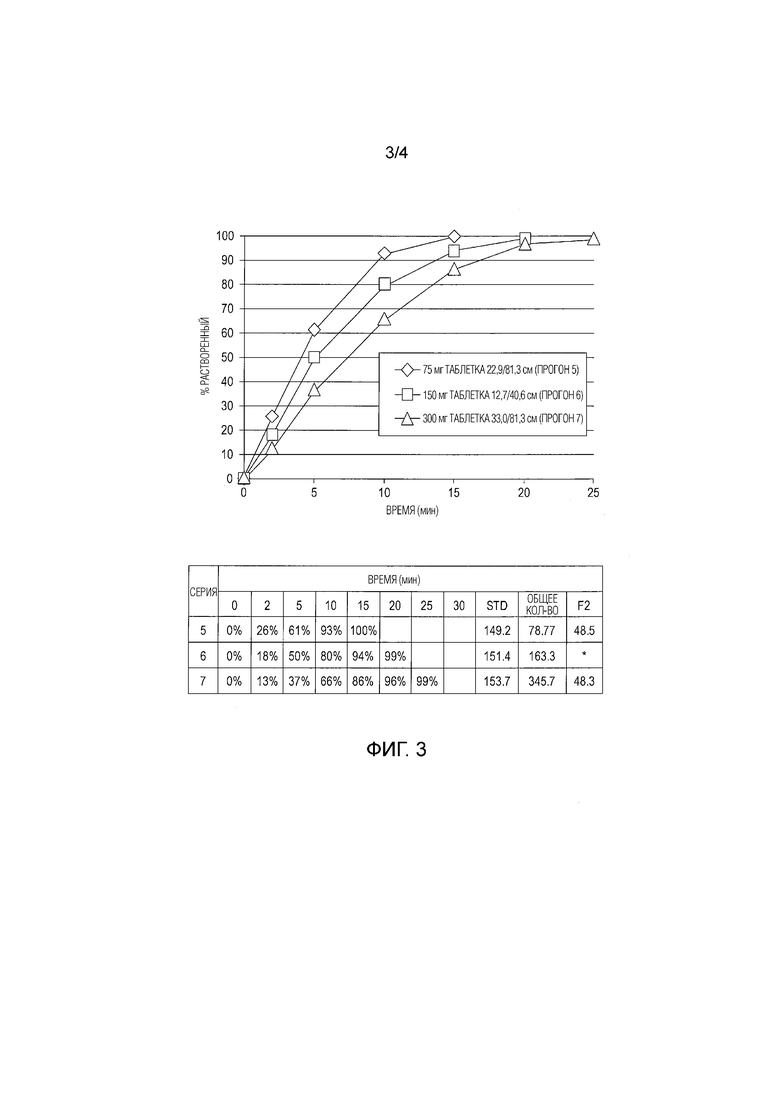
[0031] В определенных вариантах осуществления композиции с немедленным высвобождением APC, описанные в настоящей заявке, содержат терапевтически эффективное количество APC или его альтернативной соли. Структура свободного основания APC приведена ниже в виде формулы I.
 (I).
(I).
[0032] Введение APC в твердой форме сопряжено с несколькими проблемами. Пациенты, получающие АРС, могут испытывать трудности при введении твердых лекарств через ротовую полость из-за болезненных состояний, затрудняющих процесс манипуляции и глотания. Соответственно, желательно, чтобы размер таблетки был как можно меньшим и при этом включал наибольшее количество активного ингредиента, сохраняя желаемый профиль растворения. Кроме того, желательно иметь состав, который быстро растворяется и с целью ускорения растворения не содержит высоких уровней эксципиентов.
[0033] Соответственно, один из аспектов изобретения относится к прессованной таблетке с немедленным высвобождением для пероральной доставки АРС, содержащей:
APC или его фармацевтически приемлемую соль в количестве примерно 90-98% от массы таблетки;
по меньшей мере одно связующее вещество в количестве примерно 1-5% от массы таблетки; и
по меньшей мере, один лубрикант в количестве примерно 0,1-2% от массы таблетки;
где из таблетки высвобождается по меньшей мере 85% APC или его фармацевтически приемлемой соли в течение менее 15 минут после введения таблетки субъекту.
[0034] В одном из вариантов осуществления таблетка содержит:
APC или его фармацевтически приемлемую соль в количестве примерно 91-95% от массы таблетки;
по меньшей мере одно связующее вещество в количестве примерно 2-3% от массы таблетки;
по меньшей мере один лубрикант в количестве примерно 0,1-1% от массы таблетки; и
необязательно, косметическое пленочное покрытие в количестве примерно 3-4% от массы таблетки;
где из таблетки высвобождается по меньшей мере 85% АРС или его фармацевтически приемлемой соли в течение менее 15 минут после введения таблетки субъекту.
[0035] В одном из вариантов осуществления таблетка содержит:
APC или его фармацевтически приемлемую соль в количестве примерно 93,22% от массы таблетки;
по меньшей мере одно связующее вещество (например, гидроксипропилцеллюлозу) в количестве примерно 2,87% от массы таблетки;
по меньшей мере один лубрикант (например, стеарат магния) в количестве примерно 0,52% от массы таблетки; и
необязательно, косметическое пленочное покрытие (например, Опадрай желтый (Opadry® II yellow)) в количестве примерно 3-4% от массы таблетки;
где из таблетки высвобождается по меньшей мере 85% АРС или его фармацевтически приемлемой соли в течение менее 15 минут после введения таблетки субъекту.
[0036] Изобретение также относится к пероральной лекарственной форме с немедленным высвобождением АРС, содержащей:
APC или его фармацевтически приемлемую соль в количестве примерно 90-98% от массы пероральной лекарственной формы;
по меньшей мере одно связующее вещество в количестве примерно 1-5% от массы пероральной лекарственной формы; и
по меньшей мере один лубрикант в количестве примерно 0,1-2% от массы пероральной лекарственной формы;
где из пероральной лекарственной формы высвобождается по меньшей мере 85% АРС или его фармацевтически приемлемой соли в течение менее 15 минут после введения пероральной лекарственной формы субъекту.
[0037] Составы и стандартные лекарственные формы, представленные в настоящем описании, могут быть использованы для достижения немедленного высвобождения АРС, а также фармацевтически приемлемых солей, гидратов, изомеров, включая таутомеры, сольваты и комплексы АРС.
[0038] Подходящие соли АРС включают, без ограничения, ацетат, адипат, альгинат, аспартат, бензоат, бутират, цитрат, фумарат, гликолят, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат, малонат, метансульфат, никотинат, нитрат, оксалат, пальмоат, пектинат, персульфат, гидроксинаптоат, пивалат, пропионат, салицилат, сукцинат, сульфат, тартрат, тиоцианат, тозилат и ундеканоат. Другие кислоты, такие как щавелевая кислота, хотя сами по себе не являются фармацевтически приемлемыми, могут быть использованы для получения солей, полезных в качестве промежуточных соединений при получении соединений по изобретению и их фармацевтически приемлемых кислых аддуктов. В некоторых вариантах осуществления соль представляет собой гидрохлоридную соль.
[0039] Соединения описанных в настоящей заявке составов включают соединения, имеющие кватернизацию любой основной азотсодержащей группы.
[0040] Для простоты в настоящем описании не обсуждается вопрос стереоизомерии. Специалистам в данной области будет понятно, что соединения по изобретению могут содержать один или более асимметричных центров и, таким образом, могут находиться в виде рацематов и рацемических смесей и отдельных оптических изомеров. Все такие изомерные формы этих соединений в явном виде включены в настоящее изобретение.
[0041] Если не указано иное, структуры, изображенные в настоящем описании, также подразумевают включение соединений, которые отличаются только наличием одного или более изотопно обогащенных атомов. Например, соединения, имеющие приведенные в настоящем описании структуры, за исключением замены водорода дейтерием или тритием или замены углерода 13C или 14C-обогащенным углеродом, входят в объем настоящего изобретения. Такие соединения полезны, например, в качестве аналитических инструментов или зондов в биологических анализах.
[0042] В настоящем описании также не обсуждается вопрос, касающийся полиморфов, гидратов, клатратов, сольватов, соединений включения, изомеров или других форм соединения. Все такие формы этих соединений в явном виде включены в настоящее изобретение.
[0043] Кроме того, соединения по изобретению включают пролекарства соединений, которые превращаются в активное соединение in vivo. Например, соединение может быть модифицировано для улучшения клеточной проницаемости (например, путем этерификации полярных групп), а затем преобразовано с участием клеточных ферментов для получения активного агента. Способы маскировки заряженных или реактивных фрагментов в виде пролекарства известны специалистам в данной области (см., например, P. Korgsgaard-Larsen and H. Bundgaard, A Textbook of Drug Design and Development, Reading U.K., Harwood Academic Publishers, 1991).
[0044] Термин «пролекарство» относится к соединениям, которые быстро трансформируются in vivo с получением исходного соединения вышеуказанной формулы, например, путем гидролиза в крови, см., например, в документах: T. Higuchi and V. Stella, Prodrugs as Novel delivery Systems, Vol. 14 of the A.C.S. Symposium Series и Edward B. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987, оба из которых включены в настоящее описание в качестве ссылки. См. также патент США № 6680299. Типичные пролекарства включают пролекарство, которое метаболизируется in vivo в организме субъекта до активного лекарственного вещества, обладающего активностью описанных здесь соединений, где пролекарство представляет собой сложный эфир спиртовой группы или группы карбоновой кислоты, если такая группа присутствует в соединении; амид аминогруппы или группу карбоновой кислоты, если такие группы присутствуют в соединении; уретан аминной группы, если такая группа присутствует в соединении; ацеталь или кеталь спиртовой группы, если такая группа присутствует в соединении; основание N-Манниха или имин аминогруппы, если такая группа присутствует в соединении; или основание Шиффа, оксим, ацеталь, сложный эфир енола, оксазолидин или тиазолидин карбонильной группы, если такая группа присутствует в соединении, как описано, например, в патенте США № 6680324 и патенте США № 6680322.
[0045] Используемый в настоящем описании термин «фармацевтически приемлемое пролекарство» (и аналогичные термины) относится к тем пролекарствам соединений по настоящему изобретению, которые в рамках здравого медицинского суждения подходят для применения в контакте с тканями людей и/или других животных, не вызывая чрезмерной токсичности, раздражения, аллергического ответа и т.п., обеспечивают разумное соотношение риск/польза и являются эффективными при применении по назначению соединений, а также, по возможности, цвиттерионных форм соединений по изобретению.
[0046] В некоторых вариантах осуществления из таблетки высвобождается по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% APC или его фармацевтически приемлемой соли, содержащейся в ней, в течение менее 15 минут после введения таблетки субъекту, например, менее 15, 14, 13, 12, 11, 10, 9, 8, 7, 6 или 5 минут. В некоторых вариантах осуществления из таблетки высвобождается по меньшей мере 95%, 96%, 97%, 98% или 99% APC или его фармацевтически приемлемой соли, содержащейся в ней, в течение менее 30 минут после введения таблетки субъекту.
[0047] В определенных вариантах осуществления таблетка не содержит дезинтегранта. Термин «дезинтегрант», используемый в настоящем описании, относится к агенту, добавляемому в таблетку для ускорения разрушения таблетки в водной среде. Преимущество таблеток по настоящему изобретению заключается в том, что они скорее растворяются, чем распадаются. В настоящем изобретении присутствие дезинтегранта в составе может фактически замедлять высвобождение АРС.
[0048] В некоторых вариантах осуществления APC или его фармацевтически приемлемая соль присутствует в количестве примерно 90%, 90,5%, 91%, 91,5%, 92%, 92,5%, 93%, 93,5%, 94%, 94,5%, 95% 95,5%, 96%, 96,5%, 97%, 97,5% или 98% от массы таблетки или имеющем любое другое значение или находящемся в любом диапазоне в указанных пределах. В некоторых вариантах осуществления APC или его фармацевтически приемлемая соль присутствует в количестве от примерно 90% до примерно 98%, от примерно 92% до примерно 98%, от примерно 94% до примерно 98%, от примерно 96% до примерно 98%, от примерно 90% до примерно 92%, от примерно 90% до примерно 94%, от примерно 90% до примерно 96%, от примерно 92% до примерно 94%, от примерно 92% до примерно 96% или от примерно 94% до примерно 96%.
[0049] В некоторых вариантах осуществления по меньшей мере одно связующее вещество присутствует в количестве примерно 1%, 1,5%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5% или 5% от массы таблетки или имеющем любое другое значение или находящемся в любом диапазоне в указанных пределах. В определенных вариантах осуществления по меньшей мере одно связующее вещество присутствует в количестве от примерно 1% до примерно 5%, от примерно 2% до примерно 5%, от примерно 3% до примерно 5%, от примерно 4% до примерно 5%, примерно 1% до примерно 2%, от примерно 1% до примерно 3%, от примерно 1% до примерно 4%, от примерно 2% до примерно 3%, от примерно 2% до примерно 4% или от примерно 3% до примерно 4%. Таблетка может содержать по меньшей мере одно связующее вещество, например, 1, 2, 3, 4, 5 или более связующих веществ.
[0050] В определенных вариантах осуществления по меньшей мере одно связующее вещество выбирают из по меньшей мере одного из: гидроксипропилцеллюлозы, этилцеллюлозы, гидроксипропилметилцеллюлозы, поливинилового спирта, гидроксиэтилцеллюлозы, повидона, коповидона, прежелатинизированного крахмала, декстрина, желатина, мальтодекстрина, крахмала, зеина, акации, альгиновой кислоты, карбомеров (сшитых полиакрилатов), полиметакрилатов, натрий-карбоксиметилцеллюлозы, гуаровой смолы, гидрогенизированного растительного масла (типа 1), метилцеллюлозы, силиката магния и натрий-алюминий альгината или любой их комбинации. В некоторых вариантах по меньшей мере одно связующее вещество представляет собой гидроксипропилцеллюлозу.
[0051] В определенных вариантах осуществления по меньшей мере один лубрикант присутствует в количестве примерно 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1,0%, 1,1%, 1,2%, 1,3%, 1,4%, 1,5%, 1,6%, 1,7%, 1,8%, 1,9% или 2,0% от массы таблетки или имеющем любое другое значение или находящемся в любом диапазоне в указанных пределах. В некоторых вариантах осуществления по меньшей мере один лубрикант присутствует в количестве от примерно 0,1% до примерно 2,0%, от примерно 0,5% до примерно 2,0%, от примерно 1,0% до примерно 2,0%, от примерно 1,5% до примерно 2,0%, от примерно 0,1% до примерно 0,5%, от примерно 0,1% до примерно 1,0%, от примерно 0,1% до примерно 1,5%, от примерно 0,5% до примерно 1,0%, от примерно 0,5% до примерно 1,5% или от примерно 1,0% до примерно 1,5%. Таблетка может содержать по меньшей мере один лубрикант, например 1, 2, 3, 4, 5 или более лубрикантов. Когда состав с немедленным высвобождением предоставляется в виде таблетированной лекарственной формы, могут быть достигнуты еще более низкие уровни лубриканта с использованием системы «пуффер» (puffer) при таблетировании. Такие системы известны в данной области техники, являются коммерчески доступными и позволяют наносить лубрикант непосредственно на поверхность пуансона и матрицы, а не по всей площади состава.
[0052] В определенных вариантах осуществления, по меньшей мере, один лубрикант выбирают из, по меньшей мере, одного из: стеарата магния, стеариновой кислоты, стеарата кальция, гидрогенизированного касторового масла, гидрогенизированного растительного масла, легкого минерального масла, стеарата магния, минерального масла, полиэтиленгликоля, бензоата натрия, натрия стеарилфумарат и стеарата цинка или любой их комбинации. В некоторых вариантах осуществления по меньшей мере один лубрикант представляет собой стеарат магния. В других вариантах осуществления стеарат магния можно использовать в сочетании с одним или более другими лубрикантами или поверхностно-активными веществами, такими как лаурилсульфат натрия. В частности, для преодоления потенциальных гидрофобных свойств стеарата магния, случае его использования, также может быть включен лаурилсульфат натрия (Remington: Science and Practice of Pharmacy, 20th edition, Gennaro, Ed., Lippincott Williams & Wilkins (2000)).
[0053] В некоторых вариантах осуществления по меньшей мере одно связующее вещество представляет собой гидроксипропилцеллюлозу. В некоторых вариантах осуществления по меньшей мере один лубрикант представляет собой стеарат магния. В некоторых вариантах осуществления по меньшей мере одно связующее вещество представляет собой гидроксипропилцеллюлозу, и по меньшей мере один лубрикант представляет собой стеарат магния.
[0054] В определенных вариантах осуществления таблетка имеет покрытие. Покрытие может быть, без ограничения, цветным покрытием.
[0055] В некоторых вариантах осуществления APC или его фармацевтически приемлемая соль представляет собой гидрохлорид APC.
[0056] Таблетка может иметь любую форму, которая подходит для немедленного высвобождения и позволяет высвобождать по меньшей мере 85% АРС или его фармацевтически приемлемой соли в течение менее 15 минут после введения таблетки субъекту. В некоторых вариантах осуществления отношение площади поверхности к объему таблетки является максимальным, что способствует быстрому растворению. В некоторых вариантах осуществления таблетка имеет продолговатую форму.
[0057] Таблетка может содержать любое количество АРС или его фармацевтически приемлемой соли, подходящее для введения в виде стандартной лекарственной формы. В некоторых вариантах осуществления таблетка содержит от примерно 1 до примерно 1000 мг лекарственного вещества или количество в любом диапазоне, или любое количество в указанных пределах, например, от примерно 10 до примерно 500 мг, например, примерно 37,5 мг, примерно 75 мг, примерно 150 мг или примерно 300 мг.
[0058] АРС или его фармацевтически приемлемую соль можно получать или синтезировать способами, известными в данной области техники и описанными в настоящей заявке. Схемы реакций для синтеза APC подробно описаны в патентах США №№ 5760640; 5756817; 5955499; и 6,140,532, все из которых включены в настоящее описание во всей своей полноте посредством ссылки.
[0059] «Немедленное высвобождение», как используется в настоящем описании, относится к композиции, из которой АРС или его фармацевтически приемлемую соль, гидрат, изомер, таутомер, сольват или комплекс высвобождается по существу полностью в желудочно-кишечном тракте пользователя в течение менее примерно 15 минут, обычно от 1 до 15 минут после введения. Такая скорость доставки позволяет лекарственному веществу абсорбироваться в желудочно-кишечном тракте способом, биоэквивалентным для перорального раствора. Такая быстрая абсорбция обычно характерна для стандартной лекарственной формы с немедленным высвобождением, такой как таблетка, капсулированная таблетка или капсула, если лекарственное вещество, включенное в такую лекарственную форму, растворяется в верхней части желудочно-кишечного тракта.
[0060] Скорости высвобождения могут быть измерены стандартными методами оценки скорости растворения. Например, стандартные условия могут быть такими, как описано в руководстве FDA (например, 50 об/мин, 37°C, метод USP 2 (2 лопасти), среды с pH 1,2 и pH 6,8, 900 мл, 1 тестируемое изделие на сосуд).
[0061] «Скорость растворения», как используется в настоящем документе, относится к количеству лекарственного вещества, высвобождаемому in vitro в среду высвобождения из лекарственной формы в единицу времени.
[0062] «Биодоступность», как используется в данном документе, относится к оцениваемой площади под кривой или AUC активного лекарственного вещества в системном кровообращении после перорального введения в лекарственной форме, как описано в настоящем документе, по сравнению с AUC активного лекарственного вещества в системном кровообращении после внутривенного введения активного лекарственного вещества. AUC зависит от степени всасывания лекарственного вещества в желудочно-кишечном тракте.
[0063] Продукты считаются «биоэквивалентными», если относительные средние значения Cmax, AUC(0-t) и AUC(0-∞) тестируемого продукта относительно контрольного продукта находятся в пределах от 80% до 125%.
[0064] Термин «AUC(0-t)» означает площадь под кривой концентрации в плазме от момента времени 0 до момента времени t.
[0065] Термин «AUC(0-∞)» означает площадь под кривой концентрации в плазме от момента времени 0 до бесконечности.
[0066] «Cmax» относится к максимальной концентрации APC в плазме.
[0067] «Tmax» относится ко времени достижения максимальной концентрации заданного лекарственного вещества в плазме.
[0068] «t1/2» относится ко времени уменьшения концентрации в плазме на 50% во время конечной фазы выведения лекарственного вещества.
[0069] Составы с немедленным высвобождением, подходящие для перорального введения, могут содержать стандартные лекарственные формы, такие как таблетки, капсулы или наполненные капсулы, которые могут доставлять терапевтически эффективную дозу АРС после приема пациентом одной или более из указанных лекарственных форм, каждая из которых может обеспечить дозу, например, от примерно 1 до примерно 1000 мг АРС. Кроме того, лекарственные формы с немедленным высвобождением могут иметь форму или насечки, облегчающие подбор дозы путем разламывания таблетки.
[0070] Состав и структура дозированной формы с немедленным высвобождением, как раскрыто в данном описании, могут быть подобраны для обеспечения немедленного высвобождения, удовлетворяющего конкретной потребности в дозировке. В частности, состав и структура дозированных форм, как описано в настоящем документе, могут быть подобраны для обеспечения любой комбинации описанных здесь характеристик эффективности немедленного высвобождения. В конкретных вариантах осуществления, например, лекарственная форма с немедленным высвобождением, как описано в настоящем документе, обеспечивает быстрое начало действия, высвобождая более чем примерно 85%, например, более чем примерно 90% или 95% лекарственного вещества, содержащегося в ней, в пределах период времени, выбранного из менее чем 15 минут, менее чем 12 минут, менее чем 10 минут и менее чем 5 минут после введения.
[0071] Кроме того, скорость высвобождения лекарственного вещества из описанной в настоящей заявке лекарственной формы с немедленным высвобождением при необходимости может быть подобрана таким образом, чтобы обеспечивался нужный режим дозирования или была достигнута целевая доза. В одном из вариантов осуществления лекарственная форма с немедленным высвобождением может быть приготовлена для доставки до 1000 мг АРС. В конкретных вариантах осуществления общее количество лекарственного вещества, содержащегося в лекарственной форме с немедленным высвобождением в соответствии с настоящим описанием, может составлять от примерно 10 до примерно 500 мг. Например, в некоторых таких вариантах осуществления общее количество лекарственного вещества может быть выбрано из примерно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 525, 550, 575, 600, 625, 650, 675, 700, 725, 750, 775, 800, 825, 850, 875, 900, 925, 950, 975 или 1000 мг или любого диапазона или любого значения указанных пределах. В некоторых таких вариантах осуществления общее количество лекарственного вещества может составлять от примерно 10 до примерно 1000 мг, от примерно 10 до примерно 500 мг, от примерно 10 до примерно 300 мг, от примерно 30 до примерно 1000 мг, от примерно 30 до примерно 500 мг, от примерно 30 до примерно 300 мг, от примерно 100 до примерно 1000 мг, от примерно 10 до примерно 500 мг, от примерно 100 до примерно 300 мг, от примерно 150 до примерно 1000 мг, от примерно 150 до примерно 500 мг или от примерно 150 до примерно 300 мг.
[0072] Составы с немедленным высвобождением, представленные в настоящем описании, обычно включают АРС и некоторый уровень лубриканта для облегчения изготовления из составов стандартной лекарственной формы. Следовательно, в некоторых вариантах осуществления составы, описанные в настоящей заявке, включают комбинацию АРС и лубриканта, как описано в настоящей заявке, и в некоторых таких вариантах осуществления составы с немедленным высвобождением по существу не содержат других эксципиентов или вспомогательных веществ. В других вариантах осуществления составы с немедленным высвобождением, описанные в настоящей заявке, включают комбинацию APC, лубриканта и связующего вещества, как описано в настоящей заявке, и в некоторых таких вариантах осуществления составы с немедленным высвобождением по существу не содержат других эксципиентов или вспомогательных веществ. Хотя составы с немедленным высвобождением, описанные в настоящей заявке, могут быть приготовлены из комбинации лекарственного вещества с одним или более из: лубриканта и связующего вещества, а в некоторых вариантах осуществления описанные в настоящей заявке составы могут включать один или более дополнительных эксципиентов, выбранных, например, из наполнителей, вспомогательных средств для прессования, разбавителей, дезинтегрантов, красителей, ароматизаторов, буферных агентов, покрытий, глидантов или других подходящих эксципиентов.
[0073] Составы с немедленным высвобождением, описанные в настоящей заявке, могут быть изготовлены при помощи стандартных технологий, таких как влажное гранулирование, вальцевание, грануляция в псевдоожиженном слое и смешивание сухих порошков. Подходящие способы изготовления составов с немедленным высвобождением и стандартных лекарственных форм, описанных в настоящей заявке, представлены, например, в Remington, 20-е издание, глава 45 (Пероральные твердые лекарственные формы). Было обнаружено, что даже без связующих веществ или не являющихся лубрикантами эксципиентов, таких как вспомогательные средства для прессования, методы влажной грануляции могут обеспечивать жидкие гранулы с характеристиками прессования, подходящими для формирования стандартных лекарственных форм, описанных в настоящей заявке. Следовательно, в определенных вариантах осуществления, в которых для составов с немедленным высвобождением желательным является содержание лекарственного вещества, превышающее примерно 85%, 90% или 95% по массе, для получения описанных в настоящей заявке составов с немедленным высвобождением можно использовать методы влажной грануляции. В вариантах осуществления, описанных в приведенных в настоящем описании примерах в процессе влажной грануляции можно использовать обычные органические или водные растворители. Подходящие процессы влажной грануляции могут быть выполнены методами грануляции в псевдоожиженном слое, с высоким усилием сдвига или низким усилием сдвига (грануляция влажной массы), известными в данной области техники.
[0074] В дополнение к одному или более APC, лубриканту и связующему веществу, где это желательно, описанные в настоящей заявке составы с немедленным высвобождением могут также включать наполнители или вспомогательные средства для прессования, выбранные по меньшей мере из одного из: лактозы, карбоната кальция, сульфата кальция, прессуемых сахаров, декстратов, декстрина, декстрозы, каолина, карбоната магния, оксида магния, мальтодекстрина, маннита, микрокристаллической целлюлозы, порошкообразной целлюлозы и сахарозы. Если используется наполнитель или вспомогательное средство для прессования, в некоторых вариантах осуществления они могут быть включены в состав с немедленным высвобождением в количестве от 1 до 15 мас.%.
[0075] Из описанных в настоящей заявке составов с немедленным высвобождением могут быть изготовлены традиционными методами стандартные лекарственные формы, подходящие для перорального введения, такие как, например, заполненные капсулы, прессованные таблетки или капсулы, или другие лекарственные формы, подходящие для перорального введения. Описанные лекарственные формы с немедленным высвобождением могут быть адаптированы для перорального введения для достижения и сохранения терапевтического уровня АРС в течение предварительно выбранного интервала времени. В определенных вариантах осуществления лекарственная форма с немедленным высвобождением, описанная в настоящей заявке, может содержать твердую пероральную лекарственную форму любой нужной формы и размера, включая круглую, овальную, продолговатую, цилиндрическую или многоугольную форму. В одном из таких вариантах осуществления поверхности лекарственной формы с немедленным высвобождением могут быть плоскими, круглыми, вогнутыми или выпуклыми. В некоторых вариантах осуществления форма может быть выбрана для получения максимальной площади поверхности, например, для увеличения скорости растворения лекарственной формы.
[0076] В частности, если составы с немедленным высвобождением получают в виде таблетки, таблетки с немедленным высвобождением содержат относительно большой процент и абсолютное количество АРС и, следовательно, предполагается, что они улучшат комплаентность и удобство для пациента, освобождая от необходимости принимать большие количества жидкостей или жидких/твердых суспензий. Одна или более таблеток с немедленным высвобождением, описанных в настоящей заявке, могут вводиться перорально, например с небольшим интервалом, для обеспечения терапевтически эффективной для субъекта дозы АРС за относительно короткий период времени. Например, растворение 10-1000 мг таблетки, приготовленной в соответствии с настоящим описанием, может обеспечить примерно 80-100% АРС у субъекта в течение примерно 10-15 минут.
[0077] При желании или необходимости, наружная поверхность описанной в настоящей заявке лекарственной формы с немедленным высвобождением может быть покрыта влагозащитным слоем с использованием материалов и способов, известных в данной области техники. Например, если АРС, доставляемый в стандартной лекарственной форме, является в высокой степени гигроскопичным, обеспечение влагозащитного слоя поверх описанной в настоящей заявке лекарственной формы с немедленным высвобождением может оказаться желательным. Например, защита от воды описанной в настоящей заявке лекарственной формы с немедленным высвобождением во время хранения может быть обеспечена или улучшена путем нанесения на таблетку покрытия из практически растворимого или нерастворимого в воде полимера. Полезные нерастворимые в воде или водостойкие полимеры для покрытия включают этилцеллюлозу и поливинилацетаты. Другие нерастворимые в воде или водостойкие полимеры для нанесения покрытия включают полиакрилаты, полиметакрилаты или т.п. Подходящие водорастворимые полимеры включают поливиниловый спирт и HPMC. Другие подходящие водорастворимые полимеры включают PVP, HPC, HPEC, PEG, HEC и т.п.
[0078] При желании или необходимости, наружная поверхность описанной в настоящей заявке лекарственной формы с немедленным высвобождением может быть покрыта цветным покрытием или другим эстетическим или функциональным слоем с использованием материалов и способов, известных в данной области техники.
[0079] АРС является хорошо растворимым в воде соединением, но зависящим от рН. Растворимость уменьшается примерно в 20 раз при pH 7, как показано в таблице 1. Специалист в данной области может ожидать, что такое большое снижение растворимости приведет к изменению растворения, поскольку растворимость обуславливает градиент, который, как правило, определяет растворение. Неожиданно оказалось, что APC имеет постоянную скорость растворения при различных значениях pH, выше и ниже точки перегиба на кривой растворимости. Кроме того, постоянно наблюдали отсутствие влияния рН среды в дозах от 37,5 до 300 мг.
[0080] Таким образом, один из аспектов изобретения относится к прессованной таблетке с немедленным высвобождением для пероральной доставки АРС, содержащей АРС или его фармацевтически приемлемую соль в количестве примерно 90-98% от массы таблетки; причем таблетка имеет практически идентичные скорости растворения АРС или его фармацевтически приемлемой соли при кислом рН и нейтральном рН, например, примерно рН 1,2, рН 4,5 и примерно 6,8. Используемый в настоящем описании термин «по существу идентичные скорости растворения» определяется как отношение времени, в течение которого из лекарственной формы высвобождается доля АРС в одном состоянии, ко времени, в течение которого из дозированной формы высвобождается такая же доля АРС в другом состоянии, составляющее от примерно 1,3 до примерно 0,7
[0081] В некоторых вариантах осуществления из таблетки высвобождается по меньшей мере 85%, например по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% содержащегося в ней АРС или его фармацевтически приемлемой соли в течение менее 15 минут после введения таблетки субъекту.
[0082] В определенных вариантах осуществления таблетка содержит, по существу состоит или состоит из описанных выше компонентов и имеет одну или более из описанных выше характеристик.
[0083] В настоящей заявке раскрыты способы лечения состояний, поддающихся лечению APC, путем введения эффективного количества одной или более описанных в настоящей заявке лекарственных форм. Например, настоящие лекарственные формы можно вводить для лечения субъекта, нуждающегося в лечении нарколепсии, катаплексии, чрезмерной дневной сонливости, лекарственной зависимости, половой дисфункции, усталости, фибромиалгии, синдрома дефицита внимания/гиперактивности, синдрома беспокойных ног, депрессии, биполярного расстройства или ожирения, или содействия нуждающемуся в этом субъекту в прекращении курения. См., например, патенты США №№ 8,232,315; 8440715; 8552060; 8623913; 8729120; 8741950; 8895609; 8927602; 9226910; и 9 359 290; и публикаций США № 2012/0004300 и 2015/0018414; каждые из которых включены настоящее описание во всей своей полноте посредством ссылки в отношении подлежащего лечению расстройства.
[0084] Раскрытые в настоящей заявке лекарственные формы также могут быть предоставлены в виде набора, содержащего отдельно упакованный контейнер, содержащий множество таблеток с немедленным высвобождением, причем эти таблетки могут быть упакованы по отдельности, например, в оболочке из фольги или в блистерной упаковке. Таблетки могут быть упакованы с или без влагопоглотителей или других материалов для предотвращения попадания воды. Также могут быть включены инструкции или справочные средства, такие как печатные этикетки, с описанием способа их введения, например последовательно в течение предварительно выбранного периода времени и/или через предварительно выбранные интервалы, для получения желаемых уровней APC in vivo в течение заданных периодов времени, необходимых для лечения выбранного состояния.
[0085] Суточная доза от примерно 1 до примерно 2000 мг АРС или его фармацевтически приемлемой соли может быть введена для достижения терапевтических результатов, раскрытых в данном описании. Например, ежедневная доза составляет примерно 10-1000 мг, например примерно 20-500 мг, в виде одной или разделенных доз. В некоторых вариантах осуществления суточная доза может составлять от примерно 0,01 до примерно 150 мг/кг массы тела, например, от примерно 0,2 до примерно 18 мг/кг массы тела.
[0086] В одном из вариантов осуществления изобретения АРС вводят субъекту по мере необходимости для лечения расстройства. Соединение можно вводить непрерывно или периодически. В одном из вариантов осуществления соединение вводят субъекту более одного раза в сутки, например, 2, 3 или 4 раза в сутки или один раз каждые 1, 2, 3, 4, 5, 6 или 7 дней. В другом варианте осуществления соединение вводят субъекту не чаще, чем один раз в неделю, например, не чаще, чем один раз каждые две недели, один раз в месяц, один раз каждые два месяца, один раз каждые три месяца, один раз каждые четыре месяца, один раз каждые пять месяцев, один раз каждые шесть месяцев или более. В дополнительном варианте осуществления соединение вводят по двум или более различным схемам, например, сначала более часто (например, для повышения до определенного уровня, например, один раз в сутки или более), а затем реже (например, один раз в неделю или менее). В других вариантах осуществления соединение можно вводить по любой схеме введения с перерывами между введениями. В одном из примеров соединение можно вводить не чаще, чем раз в три дня, каждые четыре дня, каждые пять дней, каждые шесть дней, каждые семь дней, каждые восемь дней, каждые девять дней или каждые десять дней или более. Введение можно продолжать в течение одной, двух, трех или четырех недель или одного, двух или трех месяцев или более. Необязательно, после перерыва соединение можно вводить по той же или другой схеме. Перерыв может составлять одну, две, три или четыре недели или более в зависимости от фармакодинамического воздействия соединения на субъекта. В другом варианте осуществления соединение можно вводить до достижения определенного уровня, который затем поддерживается на постоянном уровне с последующим постепенным снижением дозы.
[0087] В одном из аспектов изобретения АРС доставляется субъекту одновременно с дополнительным терапевтическим агентом. Дополнительный терапевтический агент может быть доставлен в той же композиции, что и указанное соединение, или в отдельной композиции. Дополнительное терапевтическое средство может доставляться субъекту по другому графику введения или другим путем по сравнению с соединением. Дополнительным терапевтическим агентом может быть любой агент, который приносит пользу субъекту. Другие агенты включают, без ограничения, стимуляторы, антипсихотики, антидепрессанты, агенты от неврологических расстройств и химиотерапевтические агенты. Одним из терапевтических агентов, который можно вводить в течение того же самого периода, является Xyrem®, коммерчески доступный от Jazz Pharmaceuticals, который предназначен для лечения нарколепсии и катаплексии. См. патенты США №№ 8,952,062 и 9,050,302.
[0088] Настоящее изобретение находит применение в исследованиях, а также в ветеринарии и медицине. Подходящими субъектами обычно являются млекопитающие. Используемый здесь термин «млекопитающее» включает, без ограничения, людей, приматов, не являющихся людьми, крупный рогатый скот, овец, коз, свиней, лошадей, кошек, собак, кроликов, грызунов (например, крыс или мышей) и т.д. Люди включают новорожденных, младенцев, подростков, взрослых и пожилых людей.
[0089] В конкретных вариантах осуществления субъект представляет собой человека, у которого имеется расстройство, поддающееся лечению АРС. В других вариантах осуществления субъект, в отношении которого используются способы по изобретению, представляет собой животную модель расстройства, поддающегося лечению АРС.
[0090] Субъект может быть субъектом, «нуждающимся» в способах по настоящему изобретению, например, нуждающимся в терапевтических эффектах способов по изобретению. Например, субъект может быть субъектом, который страдает от расстройства, поддающегося лечению APC, имеет подозрение на наличие расстройства, поддающегося лечению APC, и/или относительно которого предполагается, что он страдает от расстройства, поддающегося лечению APC, и способы и композиции по изобретению используются для терапевтического и/или профилактического лечения.
[0091] Настоящее изобретение более подробно поясняется в приведенных ниже неограничивающих примерах.
Пример 1
Состав с немедленным высвобождением
(R)-2-амино-3-фенилпропилкарбамата гидрохлорида
[0092] Составы АРС для таблеток с немедленным высвобождением разрабатывали с целью достижения 85% растворения в течение менее 15 минут. Величины доз составляли 75 мг, 150 мг и 300 мг. Для увеличения скорости высвобождения количество АРС на таблетку было максимальным. Было обнаружено, что состав АРС со связующим веществом и лубрикантом обеспечивает максимальное растворение.
[0093] Таблетки готовили методом сухого смешивания просеянной гидроксипропилцеллюлозы (HPC ExF, Ashland, 1,00 г) и APC (без измельчения, 19,00 г), последующей влажной грануляцией в смесителе ударного действия с добавлением 4 г воды порциями по 0,5 г. При 3 г образовалось достаточное количество гранул, а при 4 г они были слегка переувлажненными. Гранулы просеивали во влажном состоянии, частично высушивали для удаления 0,7 г влаги и снова просеивали во влажном состоянии перед сушкой при 60°С в течение примерно 1 часа. Стеарат магния (0,75% состава) добавляли при перемешивании в пластиковом контейнере путем переворачивания контейнера 24 раза.
[0094] Гранулы активного вещества прессовали в стандартном круглом пуансоне 13/32ʺ (0,33/0,81 м), 380 мг, с усилием в 1 тонну, приложенным прессом Carver, с получением величины дозы 300 мг. Остальные таблетки прессовали, используя усилие в 1 тонну и пуансоны различного размера.
[0095] На таблетки наносили цветное покрытие (Aquarius Cool Vanilla BI-1800, Ashland/Aqualon; гидроксипропилметилцеллюлозу, диоксид титана, триацетин, полисорбат) до 2-4% по массе при помощи устройства для нанесения покрытия из воздушной суспензии Caleva.
[0096] Испытания на растворимость проводили в соответствии с инструкциями FDA при стандартных условиях (50 об/мин, 37°C, метод USP 2 (2 лопасти), среда с pH 1,2 и pH 6,8, 900 мл, 1 испытуемое изделие на сосуд, грузила для капсул). Образцы отбирали через 0, 2, 5, 10, 15, 20, 25 и 30 минут с точностью 2 секунды. Через 30 минут скорость перемешивания увеличивали до 150 об/мин в течение по меньшей мере 1 минуты или до тех пор, пока, согласно визуальной оценке, весь материал не растворился или не диспергировался. Затем скорость снова устанавливали, равной до 50 об/мин, и отбирали образец, показывающий общую растворенную дозу. Образцы 1,00 мл разбавляли в 8,00 мл деионизированной воды и затем анализировали, используя УФ (Shimadzu UV-1200).
[0097] Было показано, что испытание на растворение является воспроизводимым (фиг. 1). Контрольные таблетки по 150 мг (без покрытия) тестировали в отдельные дни в различных средах, приготовленных одинаковым способом, и в различном порядке повторного использования сред.
[0098] Цветное покрытие не приводило к заметному замедлению растворения (фиг. 2), хотя через 2 минуты наблюдалась слабая тенденция к этому (более высокая масса приводила к некоторой задержке, меньшему растворению). Профиль указывает на более быстрое растворение после 2 минут по сравнению с контрольными таблетками без покрытия. Однако это может быть следствием особенности процесса нанесения покрытия (распыление воды и сушка в устройстве для нанесения воздушной суспензии), а не самого покрытия. При использовании 3% целевого покрытия в качестве контроля все профили аналогичны (F2>50) и практически полное растворение происходит в течение 15 минут.
[0099] На фиг. 3 представлены три дозы, полученные путем варьирования размера таблеток при обычной грануляции. Растворение замедляется по мере увеличения размера таблетки, отражая, как и ожидалось, более низкие значения отношения площадь поверхности/объем. Все таблетки растворяются на >85% за 15 минут, но таблетка с наибольшей дозой имела предельное значение растворения (86%). Увеличение отношения площадь поверхности/объем при использовании продолговатой таблетки привело к статистически значимому увеличению скорости растворения.
[0100] Также является важным влияние рН среды. Хотя APC разрабатывается в виде продукта с немедленным высвобождением, согласно требованиям FDA необходимо сравнение профилей в трех средах, включая pH 6,8 (представляющий pH кишечника). АРС хорошо растворим в воде или кислых средах (530 мг/мл), но его растворимость намного ниже при рН 6,8 (26 мг/мл) (см. таблицу 1). Следует отметить, что согласно данным в таблице 2, 20-кратное снижение растворимости, по-видимому, не оказывает влияния на динамику растворения. Использованные среды представляли собой 0,1 н HCl, рН 1,2; ацетатный буфер, рН 4,5; и фосфатный буфер, рН 6,8. Эксперименты по изучению растворения проводили, используя 12 таблеток на дозу, аппарат 1 (корзинка), объем среды 900 мл, 37°С, 100 об/мин. На таблетки было нанесено белое полимерное покрытие системы Opadry.
Таблица 1. Растворимость APC в 0,2 М фосфатных буферах
Таблица 2. Растворение АРС
[0101] В качестве компенсации ожидаемого более низкого растворения при рН 6,8 (что не наблюдалось, согласно описанному выше), одну серию экспериментов по изучению растворения выполняли, используя таблетки, изготовленные из композиции, содержащей 3% супердезинтегранта (PVP-XL10). Результаты, показанные на фиг. 4 подтверждают, что супердезинтегрант не ускоряет высвобождение из таблетки, которая скорее растворяется, чем разрушается. Фактически, он может замедлить растворение на более поздних стадиях, из-за небольшого вызываемого им набухания.
ПРИМЕР 2
Диапазоны составов для таблеток с немедленным высвобождением
[0102] Материалы включали связующее вещество, лекарственное вещество, необязательный разбавитель и лубрикант. Связующее вещество выбирали из гидроксипропилцеллюлозы (Klucel ExF PH, Ashland), гидроксипропилметилцеллюлозы (HPMC E5 premium LV, Dow), повидона (PVP K30 или Kollidon 30, BASF) и крахмала 1500 (Colorcon). Лубриканты выбирали из стеарата магния (Sigma Aldrich/Riedel-de-Haen), стеарата кальция (Strem Chemicals) и стеарилфумарата натрия (Spectrum). Необязательным разбавителем был маннит (EMD).
[0103] Если не указано иное, все эксперименты проводили следующим образом. Связующее вещество, лекарственное вещество и необязательный разбавитель энергично смешивали в пластиковом контейнере, и полученную массу перемешивали вручную с добавлением воды, составляющей примерно 13% от сухой массы. Затем влажные гранулы пропускали через сито 16 меш, сушили в сушильном шкафу при 60°С в течение не менее 1 часа и затем второй раз пропускали через сито 16 меш. Исходя из выхода сухих гранул, взвешивали расчетное количество лубриканта, которое добавляли в цилиндрический пластиковый контейнер, и закрывали контейнер, а затем осторожно перемешивали вручную, поворачивая контейнер 24 раза под углом примерно 45 градусов. Гранулирование и смешивание, включающее 5 г или более материала, проводили в цилиндрическом полипропиленовом контейнере размером 2×2 дюйма (5,08×5,08 см) (диаметр×длина), а при меньших количествах использовали контейнер размером 1×2 (2,54×5,08 см) дюйма.
[0104] Смешанные гранулы взвешивали в четырех аликвотах по 375±2 мг, каждую из которых, в свою очередь, добавляли в стандартный круглый выпуклый пуансон 13/32 дюйма (33,02/81, см) и прессовали с приложением усилия в 1 метрическую тонну и временем удерживания, равным примерно 5 секундам. Каждые две таблетки характеризовали по массе, твердости с помощью твердомера Scheuniger 6D и толщине с помощью штангенциркуля. Две другие таблетки тестировали на растворение в приборе USP 2 (лопасти), в 900 мл 0,1 н HCl при 37°С и при 50 об/мин, две таблетки на сосуд. Образцы по 0,5 мл из каждого сосуда отбирали через 0, 5, 10, 15 и 30 минут. Через 30 минут скорость перемешивания увеличивали до 150-200 об/мин и поддерживали до растворения оставшейся части таблеток. Затем из сосудов снова брали образцы для определения общего растворенного количества в качестве основы для нормализации. Затем каждый образец разбавляли 8,50 мл деионизированной воды и сканировали на УФ-спектрофотометре при 215 нм (Shimadzu UV-1200) с использованием 1,0 см кварцевой проточной кюветы. Строили калибровочную кривую, охватывающую наблюдаемый диапазон поглощения, путем аппроксимации стандартов квадратичной функцией, из чего получали значения концентрации. Результаты растворения нормализовали к общей концентрации для каждого сосуда в конце испытания растворения.
[0105] Для изучения влияния уровня связующего вещества выполняли пять отдельных процессов грануляции, в каждом из которых использовали 5 г смеси с уровнями связующего вещества в диапазоне от 0 до 10%, путем смешивания связующего вещества (HPC ExF 0-0,50 г) и лекарственного вещества (APC 4,5-5,0 г), используя стандартную процедуру. Высушенные гранулы (4,8-5,0 г) смешивали с 37 мг лубриканта (0,75%) и прессовали. Свойства таблетки и профиль растворения приведены в таблице 3. Согласно результатам, увеличение количества связующего вещества приводит к увеличению твердости, а также приводит к уменьшению скорости растворения.
Таблица 3. Влияние уровня связующего вещества (HPC-ExF), 0-10%
[0106] Для изучения влияния уровня лубриканта (стеарата магния), 15 г смеси сначала гранулировали в соответствии со стандартной процедурой. Затем полученные гранулы делили на порции по 2,0 г, и каждую порцию смешивали отдельно с различным количеством стеарата магния. Уровень связующего вещества составлял 3%. Результаты показаны в таблице 4. Согласно результатам, увеличение уровня лубриканта оказывает слабое влияние на твердость, но в значительной степени уменьшает растворение.
Таблица 4. Влияние уровня лубриканта (стеарата магния), связующее вещество зафиксировано на уровне 3% HPC
[0107] Для изучения влияния уровня APC при постоянном количестве лубриканта и связующего вещества сначала выполняли грануляцию двух смесей по 6 г, используя 3% HPC ExF в качестве связующего вещества. Один процесс грануляции выполняли без разбавителя, т.е. с 97% APC, в то время как другой раствор содержал маннит в количестве, достаточном для уменьшения нагрузки APC до 86%. Затем гранулы двух указанных процессов грануляции смешивали в пропорциях, позволяющих получить пять смесей гранул по 2 г с уровнями APC от 86 до 97%, соответствующими уровням до смешивания. Смешивание выполняли в следующих пропорциях 2,0/0 г, 0/2,0 г, 1,5/0,5 г, 1,0/1,0 г и 0,5/1,5 г гранул с высокой и низкой нагрузкой АРС, соответственно. Затем каждую смесь смешивали с 15 мг стеарата магния (уровень 0,75%). Результаты представлены в таблице 5. Данные показывают, что тестируемый диапазон АРС не оказывает существенного влияния на растворение.
Таблица 5. Влияние загрузки API (связующее HPC ExF на уровне 3% и стеарат магния в качестве лубриканта на уровне 0,75%)
[0108] Для изучения влияния типа связующего вещества оценивали четыре связующих вещества (HPMC E5, PVP K30, HPC ExF и крахмал 1500) при двух уровнях каждого из них (2% и 5%) путем выполнения процесса грануляции 5 г смеси. Результаты показаны в Таблице 6.
Таблица 6. Влияние типа и уровня связующего вещества (2% или 5%) при фиксированном количестве стеарата магния, 0,75%
[0109] Для оценки влияния типа лубриканта выполняли один процесс грануляции 15 г смеси, содержащей 3% HPC ExF, без разбавителя. Высушенные гранулы затем разделяли на 5 г аликвоты. Затем каждую аликвоту смешивали с одним из трех лубрикантов (стеарат магния, стеарат кальция или стеарилфумарат натрия - «SSF»), при стандарте 24 оборота. После изготовления исходного набора таблеток остатки гранул из каждой смеси для грануляции энергично встряхивали в течение 1 минуты для оценки последствия чрезмерного перемешивания. Результаты стандартного и чрезмерного перемешивания приведены в таблице 7. Чрезмерное перемешивание не оказало существенного влияния на свойства таблеток, но повлияло на растворение для всех лубрикантов.
Таблица 7. Влияние типа лубриканта и чрезмерного перемешивания
[0110] Вышеизложенное иллюстрирует настоящее изобретение и не должно рассматриваться как его ограничение. Изобретение определено приведенной ниже формулой изобретения с эквивалентами в пунктах формулы изобретения, которые включены в формулу изобретения. Все публикации, патентные заявки, патенты, патентные публикации и любые другие ссылки, цитируемые в данном документе, включены во всей своей полноте посредством ссылки, относящейся к предложению и/или параграфу, в котором представлена указанная ссылка.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ЗАМЕДЛЕННОГО ВЫСВОБОЖДЕНИЯ, СОДЕРЖАЩИЕ АПЛИНДОР И ЕГО ПРОИЗВОДНЫЕ | 2004 |
|
RU2376988C2 |
| ФАРМАЦЕВТИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ И КОМПОЗИЦИИ ФЕНИЛЭФРИНА ДЛЯ АБСОРБЦИИ В ОБОДОЧНОЙ КИШКЕ | 2007 |
|
RU2454225C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ПРОЛОНГИРОВАННОГО ВЫСВОБОЖДЕНИЯ ФЕНИЛЭФРИНА | 2007 |
|
RU2450803C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ РЕИНА ИЛИ ДИАЦЕРЕИНА | 2008 |
|
RU2484816C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ ИНГИБИТОРА ГИСТОНДИАЦЕТИЛАЗЫ В КОМБИНАЦИИ С БЕНДАМУТИНОМ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2609833C2 |
| ТВЕРДЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ ОНДАНСЕТРОНА С ПРОЛОНГИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ ДЛЯ ЛЕЧЕНИЯ СИМПТОМОВ ТОШНОТЫ, РВОТЫ И ДИАРЕИ | 2015 |
|
RU2706708C2 |
| ПЕРОРАЛЬНАЯ ДОЗИРОВАННАЯ ФОРМА ГАБАПЕНТИНА ЗАМЕДЛЕННОГО ВЫСВОБОЖДЕНИЯ | 2005 |
|
RU2440112C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ ГЕПАТОЦЕЛЛЮЛЯРНОЙ КАРЦИНОМЫ | 2017 |
|
RU2769251C2 |
| Твердые композиции на основе бетагистина для перорального применения с непульсирующим пролонгированным высвобождением | 2018 |
|
RU2774644C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2017 |
|
RU2770081C2 |
Группа изобретений относится к области фармацевтики и медицины, а именно к прессованной таблетке с немедленным высвобождением и пероральной лекарственной форме с немедленным высвобождением для пероральной доставки (R)-2-амино-3-фенилпропилкарбамата, которые сожержат: 90-98 мас.% (R)-2-амино-3-фенилпропилкарбамата или его фармацевтически приемлемой соли; 1-5 мас.% по меньшей мере одного связующего вещества; 0,1-1,4 мас.% по меньшей мере одного лубриканта; причем из таблетки высвобождается по меньшей мере 85% (R)-2-амино-3-фенилпропилкарбамата или его фармацевтически приемлемой соли в течение менее 15 мин после введения таблетки субъекту; где связующее вещество выбрано из гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы и повидона, а лубрикант выбран из стеарата магния, стеарата кальция и стеарилфумарата натрия. Также группа изобретений относится к способам лечения нарколепсии, катаплексии, чрезмерной дневной сонливости, лекарственной зависимости, половой дисфункции, усталости, фибромиалгии, синдрома дефицита внимания/гиперактивности, синдрома беспокойных ног, депрессии, биполярного расстройства или ожирения у нуждающегося в этом субъекта, или содействия нуждающемуся в этом субъекту в прекращении курения, включающий введение субъекту указанных таблетки или лекарственной формы. Группа изобретений обеспечивает лекарственные формы с высвобождением по меньшей мере 85% действующего вещества в течение 15 мин при различных значениях рН. 4 н. и 27 з.п. ф-лы, 4 ил., 7 табл., 2 пр.
1. Прессованная таблетка с немедленным высвобождением для пероральной доставки (R)-2-амино-3-фенилпропилкарбамата, содержащая:
(R)-2-амино-3-фенилпропилкарбамат или его фармацевтически приемлемую соль в количестве примерно 90-98% от массы таблетки;
по меньшей мере, одно связующее вещество в количестве примерно 1-5% от массы таблетки; и
по меньшей мере, один лубрикант в количестве примерно 0,1-1,4% от массы таблетки;
причем из таблетки высвобождается по меньшей мере 85% содержащегося в ней (R)-2-амино-3-фенилпропилкарбамата или его фармацевтически приемлемой соли в течение менее 15 мин после введения таблетки субъекту,
в которой по меньшей мере одно связующее вещество выбрано из по меньшей мере одного из гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы и повидона; и
в которой по меньшей мере один лубрикант выбран из по меньшей мере одного из стеарата магния, стеарата кальция и стеарилфумарата натрия.
2. Прессованная таблетка с немедленным высвобождением по п.1, где из таблетки высвобождается по меньшей мере 95% содержащегося в ней (R)-2-амино-3-фенилпропилкарбамата или его фармацевтически приемлемой соли в течение менее 15 мин после введения таблетки субъекту.
3. Прессованная таблетка с немедленным высвобождением по п.1 или 2, где таблетка не содержит дезинтегрант.
4. Прессованная таблетка с немедленным высвобождением по любому из пп.1-3, содержащая:
(R)-2-амино-3-фенилпропилкарбамат или его фармацевтически приемлемую соль в количестве примерно 90-98% от массы таблетки;
гидроксипропилцеллюлозу в количестве примерно 1-5% от массы таблетки; и
стеарат магния в количестве примерно 0,1-2% от массы таблетки.
5. Прессованная таблетка с немедленным высвобождением по любому из пп.1-4, дополнительно содержащая покрытие.
6. Прессованная таблетка с немедленным высвобождением по п.5, в которой покрытие представляет собой цветное покрытие.
7. Прессованная таблетка с немедленным высвобождением по любому из пп.1-6, в которой (R)-2-амино-3-фенилпропилкарбамат или его фармацевтически приемлемая соль представляет собой (R)-2-амино-3-фенилпропилкарбамата гидрохлорид.
8. Прессованная таблетка с немедленным высвобождением по любому из пп.1-7, где таблетка имеет продолговатую форму.
9. Прессованная таблетка с немедленным высвобождением по любому из пп.1-8, где таблетка содержит примерно 300 мг (R)-2-амино-3-фенилпропилкарбамата или его фармацевтически приемлемой соли.
10. Прессованная таблетка с немедленным высвобождением по любому из пп.1-8, где таблетка содержит примерно 150 мг (R)-2-амино-3-фенилпропилкарбамата или его фармацевтически приемлемой соли.
11. Прессованная таблетка с немедленным высвобождением по любому из пп.1-8, где таблетка содержит примерно 75 мг (R)-2-амино-3-фенилпропилкарбамата или его фармацевтически приемлемой соли.
12. Прессованная таблетка с немедленным высвобождением по любому из пп.1-8, где таблетка содержит примерно 37,5 мг (R)-2-амино-3-фенилпропилкарбамата или его фармацевтически приемлемой соли.
13. Прессованная таблетка с немедленным высвобождением по любому из пп.1-12, где таблетка имеет практически идентичные скорости растворения (R)-2-амино-3-фенилпропилкарбамата или его фармацевтически приемлемой соли при рН 1,2, рН 4,5 и рН 6,8.
14. Способ лечения нарколепсии, катаплексии, чрезмерной дневной сонливости, лекарственной зависимости, половой дисфункции, усталости, фибромиалгии, синдрома дефицита внимания/гиперактивности, синдрома беспокойных ног, депрессии, биполярного расстройства или ожирения у нуждающегося в этом субъекта, или содействия нуждающемуся в этом субъекту в прекращении курения, включающий введение субъекту прессованной таблетки с немедленным высвобождением по любому из пп.1-13.
15. Способ по п.14, в котором таблетку вводят один раз в сутки.
16. Способ по п.14, в котором таблетку вводят более одного раза в сутки.
17. Пероральная лекарственная форма с немедленным высвобождением для пероральной доставки (R)-2-амино-3-фенилпропилкарбамата, содержащая:
(R)-2-амино-3-фенилпропилкарбамат или его фармацевтически приемлемую соль в количестве примерно 90-98% от массы пероральной лекарственной формы;
по меньшей мере одно связующее вещество в количестве примерно 1-5% от массы пероральной лекарственной формы; и
по меньшей мере один лубрикант в количестве примерно 0,1-1,4% от массы пероральной лекарственной формы;
где из пероральной лекарственной формы высвобождается по меньшей мере 85% (R)-2-амино-3-фенилпропилкарбамата или его фармацевтически приемлемой соли в течение менее 15 мин после введения пероральной лекарственной формы субъекту,
в которой по меньшей мере одно связующее вещество выбрано из по меньшей мере одного из гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы и повидона; и
в которой по меньшей мере один лубрикант выбран из по меньшей мере одного из стеарата магния, стеарата кальция и стеарилфумарата натрия.
18. Пероральная лекарственная форма с немедленным высвобождением по п.17, где из пероральной лекарственной формы высвобождается по меньшей мере 95% содержащегося в ней (R)-2-амино-3-фенилпропилкарбамата или его фармацевтически приемлемой соли в течение менее 15 минут после введения таблетки субъекту.
19. Пероральная лекарственная форма с немедленным высвобождением по п.17 или 18, где пероральная лекарственная форма не содержит дезинтегрант.
20. Пероральная лекарственная форма с немедленным высвобождением по любому из пп.17-19, содержащая:
(R)-2-амино-3-фенилпропилкарбамат или его фармацевтически приемлемую соль в количестве примерно 90-98% от массы пероральной лекарственной формы;
гидроксипропилцеллюлозу в количестве примерно 1-5% от массы пероральной лекарственной формы; и
стеарат магния в количестве примерно 0,1-2% от массы пероральной лекарственной формы.
21. Пероральная лекарственная форма с немедленным высвобождением по любому из пп.17-20, дополнительно содержащая покрытие.
22. Пероральная лекарственная форма с немедленным высвобождением по п.21, в которой покрытие представляет собой цветное покрытие.
23. Пероральная лекарственная форма с немедленным высвобождением по любому из пп.17-22, в которой (R)-2-амино-3-фенилпропилкарбамат или его фармацевтически приемлемая соль представляет собой (R)-2-амино-3-фенилпропилкарбамата гидрохлорид.
24. Пероральная лекарственная форма с немедленным высвобождением по любому из пп.17-23, где пероральная лекарственная форма содержит примерно 300 мг (R)-2-амино-3-фенилпропилкарбамата или его фармацевтически приемлемой соли.
25. Пероральная лекарственная форма с немедленным высвобождением по любому из пп.17-23, где пероральная лекарственная форма содержит примерно 150 мг (R)-2-амино-3-фенилпропилкарбамата или его фармацевтически приемлемой соли.
26. Пероральная лекарственная форма с немедленным высвобождением по любому из пп.17-23, где пероральная лекарственная форма содержит примерно 75 мг (R)-2-амино-3-фенилпропилкарбамата или его фармацевтически приемлемой соли.
27. Пероральная лекарственная форма с немедленным высвобождением по любому из пп.17-23, где пероральная лекарственная форма содержит примерно 37,5 мг (R)-2-амино-3-фенилпропилкарбамата или его фармацевтически приемлемой соли.
28. Пероральная лекарственная форма с немедленным высвобождением по любому из пп.17-27, где пероральная лекарственная форма имеет практически идентичные скорости растворения (R)-2-амино-3-фенилпропилкарбамата или его фармацевтически приемлемой соли при рН 1,2, рН 4,5 и рН 6,8.
29. Способ лечения нарколепсии, катаплексии, чрезмерной дневной сонливости, лекарственной зависимости, половой дисфункции, усталости, фибромиалгии, синдрома дефицита внимания/гиперактивности, синдрома беспокойных ног, депрессии, биполярного расстройства или ожирения у нуждающегося в этом субъекта, или содействия нуждающемуся в этом субъекту в прекращении курения, включающий введение субъекту лекарственной формы по любому из пп.17-28.
30. Способ по п.29, где пероральную лекарственную форму вводят один раз в сутки.
31. Способ по п.29, где пероральную лекарственную форму вводят более одного раза в сутки.
| US 2014275244 A1, 18.09.2014 | |||
| US 2011111027 A1, 12.05.2011 | |||
| ПЕРЦЕВ И.М | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Т | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| - Харьков: УкрФА | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| Телефонная трансляция | 1922 |
|
SU464A1 |
| US 2014350098 А1, 27.11.2014. | |||
Авторы
Даты
2022-01-18—Публикация
2017-09-06—Подача