Перекрестная ссылка на родственные заявки
[0001] По настоящей патентной заявке испрашивается приоритет по патентной заявке США № 62/261815, зарегистрированной 1 декабря 2015 года, специально включенной в настоящее описание в качестве ссылки в полном объеме.
Область изобретения
[0002] Настоящее изобретение относится к области трансдукции (трансфекции) клеток с использованием нуклеиновой кислоты, например, плазмид. Более конкретно, изобретение относится к композициям и способам получения трансдуцированных клеток, необязательно, продуцирующих вектор на основе аденоассоциированного вируса (AAV).
Введение
[0003] Несколько публикаций и патентных документов процитированы на всем протяжении настоящей заявки для описания уровня техники, к которому относится настоящее изобретение. Каждая из этих ссылок включена в настоящее описание в качестве ссылки в полном объеме.
Сущность изобретения
[0004] Изобретение относится к композициям нуклеиновых кислот (плазмид), таких как нуклеиновая кислота, кодирующая белок или транскрибирующаяся в представляющий интерес транскрипт, и полиэтиленимина (PEI), необязательно, в комбинации с клетками. В одном из вариантов осуществления композиция включает смесь плазмиды/PEI, содержащую множество компонентов: (a) одну или несколько плазмид, содержащих нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и/или нуклеиновые кислоты, кодирующие хелперные белки; (b) плазмиду, содержащую нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт; и (c) раствор полиэтиленимина (PEI). В конкретных аспектах плазмиды находятся в диапазоне молярного соотношения от приблизительно 1:0,01 до приблизительно 1:100 или диапазоне молярного соотношения от приблизительно 100:1 до приблизительно 1:0,01, и смесь компонентов (a), (b) и (c), необязательно, инкубируют в течение периода времени от приблизительно 10 секунд до приблизительно 4 часов.
[0005] В дополнительных вариантах осуществления композиции нуклеиновых кислот (плазмид) и полиэтиленимина (PEI) дополнительно содержат клетки. В конкретных аспектах клетки приводят в контакт со смесью компонентов плазмиды/PEI (a), (b) и/или (c).
[0006] В дополнительных вариантах осуществления композиции нуклеиновых кислот (плазмид) и полиэтиленимина (PEI), необязательно в комбинации с клетками, дополнительно содержат свободный PEI. В конкретных аспектах клетки приводят в контакт со свободным PEI.
[0007] В различных дополнительных вариантах осуществления клетки приводят в контакт со смесью компонентов (a), (b) и/или (c) в течение по меньшей мере приблизительно 4 часов, или от приблизительно 4 часов до приблизительно 140 часов, или от приблизительно 4 часов до приблизительно 96 часов. В конкретных аспектах клетки приводят в контакт со смесью компонентов (a), (b) и/или (c) и, необязательно, свободным PEI в течение по меньшей мере приблизительно 4 часов.
[0008] Композиции по изобретению могут находиться в контейнере. В конкретных аспектах контейнер является флаконом, планшетом, мешком или биореактором и, необязательно, является стерильным, и/или контейнер, необязательно, подходит для поддержания жизнеспособности или роста клеток.
[0009] Плазмиды, композиции и способы по настоящему изобретению включают, помимо прочего, нуклеиновые кислоты, кодирующие вирусные белки, такие как белки капсида AAV. Такие плазмиды и клетки могут контактировать со свободным PEI. В конкретных аспектах плазмиды и/или клетки приводят в контакт со свободным PEI в течение по меньшей мере приблизительно 4 часов, или от приблизительно 4 часов до приблизительно 140 часов, или от приблизительно 4 часов до приблизительно 96 часов.
[0010] Настоящее изобретение также относится к способам получения трансфицированных клеток, включающим получение плазмиды, получение раствора, содержащего полиэтиленимин (PEI), и смешивание нуклеиновой кислоты (плазмиды) с раствором PEI для получения смеси плазмиды/PEI. В конкретных аспектах такие смеси инкубируют в течение периода времени в диапазоне от приблизительно 10 секунд до приблизительно 4 часов. В таких способах клетки затем приводят в контакт со смесью плазмиды/PEI для получения культуры клеток с плазмидой/PEI; затем к полученной культуре клеток с нуклеиновой кислотой/PEI добавляют свободный PEI для получения культуры клеток со свободным PEI/плазмидой/PEI; а затем полученную культуру клеток со свободным PEI/плазмидой/PEI инкубируют в течение по меньшей мере приблизительно 4 часов, таким образом, получая трансфицированные клетки. В конкретных аспектах плазмида содержит нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт.
[0011] Кроме того, настоящее изобретение относится к способам получения трансфицированных клеток, продуцирующих рекомбинантный вектор AAV, включающим получение одной или нескольких плазмид, содержащих нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и/или нуклеиновые кислоты, кодирующие хелперные белки; получение плазмиды, содержащей нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт; получение раствора, содержащего полиэтиленимин (PEI); смешивание указанных выше плазмид с раствором PEI, где плазмиды находятся в диапазоне молярного соотношения от приблизительно 1:0,01 до приблизительно 1:100 или в диапазоне молярного соотношения от приблизительно 100:1 до приблизительно 1:0,01, для получения смеси плазмиды/PEI (и, необязательно, инкубацию смеси плазмиды/PEI в течение периода времени в диапазоне от приблизительно 10 секунд до приблизительно 4 часов); приведение клеток в контакт со смесью плазмиды/PEI) для получения культуры клеток с плазмидой/PEI; добавление свободного PEI к полученной культуре клеток с плазмидой/PEI для получения культуры клеток со свободным PEI/плазмидой/PEI и инкубацию культуры клеток со свободным PEI/плазмидой/PEI в течение по меньшей мере приблизительно 4 часов и, таким образом, получение трансфицированных клеток, продуцирующих рекомбинантный вектор AAV, содержащий нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт.
[0012] Кроме того, настоящее изобретение относится к способам получения рекомбинантного вектора AAV, содержащего нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт, включающим получение одной или нескольких плазмид, содержащих нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и/или нуклеиновые кислоты, кодирующие хелперные белки; получение плазмиды, содержащей нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт; получение раствора, содержащего полиэтиленимин (PEI); смешивание указанных выше плазмид с раствором PEI, где плазмиды находятся в диапазоне молярного соотношения от приблизительно 1:0,01 до приблизительно 1:100 или в диапазоне молярного соотношения от приблизительно 100:1 до приблизительно 1:0,01, для получения смеси плазмиды/PEI (и, необязательно, инкубацию смеси плазмиды/PEI в течение периода времени в диапазоне от приблизительно 10 секунд до приблизительно 4 часов); приведение клеток в контакт с полученной смесью плазмиды/PEI, как описано, для получения культуры клеток с плазмидой/PEI; добавление свободного PEI к полученной культуре клеток с плазмидой/PEI, как описано, для получения культуры клеток со свободным PEI/плазмидой/PEI; инкубацию полученной культуры клеток с плазмидой/PEI или культуры клеток со свободным PEI/плазмидой/PEI в течение по меньшей мере приблизительно 4 часов для получения трансфицированных клеток; сбор полученных трансфицированных клеток и/или полученной среды для культивирования трансфицированных клеток для получения сбора клеток и/или среды для культивирования; и выделение и/или очистку рекомбинантного вектора AAV из полученного сбора клеток и/или среды для культивирования и, таким образом, получение рекомбинантного вектора AAV, содержащего нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт.
[0013] Кроме того, настоящее изобретение относится к способам получения трансфицированных клеток, продуцирующих рекомбинантный вектор AAV с нуклеиновой кислотой, кодирующей белок или транскрибирующейся в представляющий интерес транскрипт. В одном из вариантов осуществления способ включает получение смеси компонентов (i) одной или нескольких плазмид, содержащих нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и/или нуклеиновые кислоты, кодирующие хелперные белки, (ii) плазмиды, содержащей нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт; и (iii) раствора полиэтиленимина (PEI); смешивание плазмид (i) и (ii) с раствором PEI (iii) таким образом, что плазмиды находятся в диапазоне молярного соотношения от приблизительно 1:0,01 до приблизительно 1:100 или диапазоне молярного соотношения от приблизительно 100:1 до приблизительно 1:0,01, для получения смеси плазмиды/PEI (и, необязательно, инкубацию смеси плазмиды/PEI в течение периода времени в диапазоне от приблизительно 10 секунд до приблизительно 4 часов); приведение клеток в контакт с полученной смесью плазмиды/PEI для получения культуры клеток с плазмидой/PEI; добавление свободного PEI к культуре клеток с плазмидой/PEI для получения культуры клеток со свободным PEI/плазмидой/PEI; и инкубацию культуры клеток с плазмидой/PEI или культуры клеток со свободным PEI/плазмидой/PEI в течение по меньшей мере приблизительно 4 часов для получения трансфицированных клеток, продуцирующих рекомбинантный вектор AAV, содержащий нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт.
[0014] Способы и композиции по изобретению могут включать одну или несколько стадий или признаков. Неограничивающий пример стадии или признака включает стадию сбора полученных трансфицированных клеток и/или сбора полученной среды для культивирования трансфицированных клеток для получения сбора клеток и/или среды для культивирования. Дополнительный неограничивающий пример стадии или признака включает выделение и/или очистку рекомбинантного вектора AAV из сбора клеток и/или среды для культивирования и, таким образом, получение рекомбинантного вектора AAV, содержащего нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт.
[0015] Кроме того, настоящее изобретение относится к способам получения рекомбинантного вектора AAV, включающего нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт. В одном из вариантов осуществления способ включает получение смеси компонентов (i) одной или нескольких плазмид, содержащих нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и/или нуклеиновые кислоты, кодирующие хелперные белки, (ii) плазмиды, содержащей нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт; и (iii) раствор полиэтиленимина (PEI), смешивание плазмид (i) и (ii) с раствором PEI (iii) таким образом, что плазмиды находятся в диапазоне молярного соотношения от приблизительно 1:0,01 до приблизительно 1:100 или в диапазоне молярного соотношения от приблизительно 100:1 до приблизительно 1:0,01, для получения смеси плазмиды/PEI (и, необязательно, инкубацию смеси плазмиды/PEI в течение периода времени приблизительно от 10 секунд до приблизительно 4 часов); приведение клеток в контакт с полученной смесью плазмиды/PEI для получения культуры клеток с плазмидой/PEI; добавление свободного PEI к полученной культуре клеток с плазмидой/PEI для получения культуры клеток со свободным PEI/плазмидой/PEI; инкубацию культуры клеток с плазмидой/PEI или культуры клеток со свободным PEI/плазмидой/PEI в течение по меньшей мере приблизительно 4 часов для получения трансфицированных клеток; сбор полученных трансфицированных клеток и/или полученной среды для культивирования трансфицированных клеток для получения сбора клеток и/или среды для культивирования; и выделение и/или очистку рекомбинантного вектора AAV из полученного сбора клеток и/или среды для культивирования и, таким образом, получение рекомбинантного вектора AAV, содержащего нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт.
[0016] Кроме того, настоящее изобретение относится к способам получения рекомбинантного вектора AAV, включающего нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт. В одном из вариантов осуществления способ включает получение смеси компонентов (i) одной или нескольких плазмид, содержащих нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и/или нуклеиновые кислоты, кодирующие хелперные белки; (ii) плазмиды, содержащей нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт; и (iii) раствор полиэтиленимина (PEI), где плазмиды (i) и (ii) находятся в диапазоне молярного соотношения от приблизительно 1:0,01 до приблизительно 1:100 или в диапазоне молярного соотношения от приблизительно 100:1 до приблизительно 1:0,01, и где смесь компонентов (i), (ii) и (iii), необязательно, инкубируют в течение периода времени приблизительно от 10 секунд до приблизительно 4 часов; приведение клеток в контакт с полученной смесью для получения культуры клеток с плазмидой/PEI; добавление свободного PEI к полученной культуре клеток с плазмидой/PEI для получения культуры клеток со свободным PEI/плазмидой/PEI; инкубацию культуры клеток с плазмидой/PEI или культуры клеток со свободным PEI/плазмидой/PEI в течение по меньшей мере приблизительно 4 часов для получения трансфицированных клеток; сбор полученных трансфицированных клеток и/или полученной среды для культивирования трансфицированных клеток для получения сбора клеток и/или среды для культивирования; и выделение и/или очистку рекомбинантного вектора AAV из полученного сбора клеток и/или среды для культивирования и, таким образом, получение рекомбинантного вектора AAV, содержащего нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт.
[0017] Композиции и способы также могут включать одну или несколько дополнительных стадий или признаков. Такие стадии или признаки включают, в качестве неограничивающих примеров, инкубацию культуры клеток с плазмидой/PEI, или культуры клеток со свободным PEI/плазмидой/PEI, или культуры клеток с нуклеиновой кислотой/PEI в течение периода времени в диапазоне от приблизительно 4 часов до приблизительно 140 часов или от приблизительно 4 часов до приблизительно 96 часов. Такие стадии или признаки включают, в качестве неограничивающих примеров, следующее: смесь плазмиды/PEI имеет массовое соотношение PEI:плазмида в диапазоне от приблизительно 0,1:1 до приблизительно 5:1 или массовое соотношение PEI:плазмида в диапазоне от приблизительно 5:1 до приблизительно 0,1:1, или культура клеток со свободным PEI/плазмидой/PEI имеет массовое соотношение PEI:плазмида в диапазоне от приблизительно 0,1:1 до приблизительно 5:1 или массовое соотношение PEI:плазмида в диапазоне от приблизительно 5:1 до приблизительно 0,1:1. Такие стадии или признаки включают, в качестве неограничивающих примеров, случаи, когда смесь плазмиды/PEI имеет массовое соотношение PEI:плазмида в диапазоне от приблизительно 1:1 до приблизительно 5:1 или массовое соотношение PEI:плазмида в диапазоне от приблизительно 5:1 до приблизительно 1:1; или когда культура клеток со свободным PEI/плазмидой/PEI имеет массовое соотношение PEI:плазмида в диапазоне от приблизительно 1:1 до приблизительно 5:1 или массовое соотношение PEI:плазмида в диапазоне от приблизительно 5:1 до приблизительно 1:1.
[0018] Формы PEI (свободный PEI, общий PEI, смесь плазмиды/PEI или клетки, приведенные в контакт со смесью плазмиды/PEI), применимые в композициях и способах по настоящему изобретению, включают гидролизованный линейный полиэтиленимин. В конкретных аспектах PEI (свободный PEI, общий PEI, смесь плазмиды/PEI или клетки, приведенные в контакт со смесью плазмиды/PEI) содержит гидролизованный линейный полиэтиленимин с молекулярной массой в диапазоне от приблизительно 4000 до приблизительно 160000 и/или в диапазоне от приблизительно от 2500 до приблизительно 250000 в пересчете на свободное основание или гидролизованный линейный полиэтиленимин с молекулярной массой приблизительно 40000 и/или приблизительно 25000 в пересчете на свободное основание.
[0019] В различных вариантах осуществления молярное соотношение азота (N) в общем PEI и фосфата (P) в плазмиде находится в диапазоне от приблизительно 1:1 до приблизительно 50:1 (N:P) в культуре клеток со свободным PEI/плазмидой/PEI. В других вариантах осуществления молярное соотношение азота (N) в общем PEI и фосфата (P) в плазмиде составляет приблизительно 5:1, 6:1, 7:1, 8:1, 9:1 или 10:1 (N:P) в культуре клеток со свободным PEI/плазмидой/PEI.
[0020] Композиции и способы по изобретению могут включать смеси плазмиды/PEI, инкубируемые в течение периода времени. В конкретных аспектах время инкубации находится в диапазоне от приблизительно 30 секунд до приблизительно 4 часов. В более конкретных аспектах время инкубации смеси плазмиды/PEI находится в диапазоне от приблизительно 1 минуты до приблизительно 30 минут.
[0021] Композиции и способы по изобретению могут включать PEI в различных количествах, выраженных в молярном соотношении или по массе. В конкретных вариантах осуществления количество свободного PEI находится в диапазоне от приблизительно 10% до приблизительно 90% общего PEI, или количество свободного PEI находится в диапазоне от приблизительно 25% до приблизительно 75% общего PEI, или количество свободного PEI составляет приблизительно 50% общего PEI.
[0022] Композиции и способы по изобретению могут включать PEI, добавляемый к плазмидам и/или клеткам в различные моменты времени. В конкретных вариантах осуществления свободный PEI добавляют к клеткам до, во время или после того, как смесь плазмиды/PEI приводят в контакт с клетками.
[0023] Композиции и способы по изобретению включают клетки млекопитающих (например, клетки HEK 293E или HEK 293F). Такие клетки могут являться адгезивными клетками или могут находиться в суспензионной культуре. В конкретных аспектах клетки выращивают или поддерживают в бессывороточной среде для культивирования.
[0024] Композиции и способы по изобретению могут включать клетки с конкретными плотностями, и/или в конкретных фазах роста клеток, и/или с конкретной жизнеспособностью. В конкретных вариантах осуществления клетки имеют плотность в диапазоне от приблизительно 1×105 клеток/мл до приблизительно 1×108 клеток/мл при контакте со смесью плазмиды/PEI и/или при контакте со свободным PEI. В дополнительных конкретных вариантах осуществления жизнеспособность клеток при контакте со смесью плазмиды/PEI или свободным PEI составляет приблизительно 60% или более 60%, или где клетки находятся в логарифмической фазе роста во время контакта со смесью плазмиды/PEI, или жизнеспособность клеток во время контакта со смесью плазмиды/PEI или свободным PEI составляет приблизительно 90% или более 90%, или где клетки находятся в логарифмической фазе роста во время контакта со смесью плазмиды/PEI или свободным PEI.
[0025] Кодируемые упаковывающие белки AAV включают, например, AAV rep и/или AAV cap. Такие упаковывающие белки AAV включают, например, белки AAV rep и/или AAV cap любого серотипа AAV.
[0026] Кодируемые хелперные белки включают, например, аденовирусные E2 и/или E4, белки VARNA и/или не-AAV хелперные белки.
[0027] Композиции и способы по изобретению могут включать нуклеиновую кислоту (плазмиды) в конкретных количествах или соотношениях. В конкретных вариантах осуществления общее количество плазмиды, содержащей нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт, и одной или нескольких плазмид, содержащих нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и/или нуклеиновые кислоты, кодирующие хелперные белки, находится в диапазоне от приблизительно 0,1 мкг до приблизительно 15 мкг на мл клеток. В дополнительных конкретных вариантах осуществления молярное соотношение плазмиды, содержащей нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт, и одной или нескольких плазмид, содержащих нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и/или нуклеиновые кислоты, кодирующие хелперные белки, находится в диапазоне от приблизительно 1:5 до приблизительно 1:1, или в диапазоне от приблизительно 1:1 до приблизительно 5:1.
[0028] Плазмиды могут включать нуклеиновые кислоты в разных или одинаковых плазмидах. В одном из вариантов осуществления первая плазмида содержит нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и вторая плазмида содержит нуклеиновые кислоты, кодирующие хелперные белки. В более конкретных вариантах осуществления молярное соотношение плазмиды, содержащей нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт, и первой плазмиды, содержащей нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и второй плазмиды, содержащей нуклеиновые кислоты, кодирующие хелперные белки, находится в диапазоне приблизительно 1-5:1:1, или 1:1-5:1, или 1:1:1-5.
[0029] Композиции и способы по изобретению включают векторы AAV любого серотипа или его варианта. В одном из вариантов осуществления рекомбинантный вектор AAV содержит любой из серотипов AAV 1-12, белок капсида VP1, VP2 и/или VP3 AAV или модифицированный белок капсида VP1, VP2 и/или VP3 AAV или его вариант, или белок капсида VP1, VP2 и/или VP3 AAV дикого типа. В дополнительных конкретных вариантах осуществления вектор AAV имеет серотип AAV или псевдотип AAV, где псевдотип AAV содержит серотип капсида AAV, отличающийся от серотипа ITR.
[0030] Композиции и способы по изобретению, относящиеся к векторам AAV или включающие их, также могут включать другие элементы. Неограничивающие примеры таких элементов включают: интрон, элемент контроля экспрессии, один или несколько инвертированных концевых повторов (ITR) аденоассоциированного вируса (AAV) и/или филлерную полинуклеотидную последовательность. Такие элементы могут находиться в нуклеиновой кислоте, кодирующей белок или транскрибирующейся в представляющий интерес транскрипт, или фланкировать ее, или элемент контроля экспрессии может быть функционально связан с нуклеиновой кислотой, кодирующей белок или транскрибирующейся в представляющий интерес транскрипт, или ITR AAV могут фланкировать 5'- или 3'-конец нуклеиновой кислоты, кодирующей белок или транскрибирующейся в представляющий интерес транскрипт, или филлерная полинуклеотидная последовательность может фланкировать 5'- или 3'-конец нуклеиновой кислоты, кодирующей белок или транскрибирующейся в представляющий интерес транскрипт.
[0031] Элементы контроля экспрессии включают конститутивные или регулируемые контрольные элементы, такие как тканеспецифический элемент контроля экспрессии или промотор (например, обеспечивающий экспрессию в печени).
[0032] ITR может принадлежать к любому из серотипов AAV2 или AAV6 или их комбинации. Векторы AAV могут включать любой белок капсида VP1, VP2 и/или VP3, имеющий 75% или более идентичности последовательности по отношению к любому из белков капсида VP1, VP2 и/или VP3 AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV10, AAV11 или AAV-2i8, или содержать модифицированный белок капсида VP1, VP2 и/или VP3 или его вариант, выбранный из любого из серотипов AAV AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV10, AAV11 и AAV-2i8.
[0033] В композициях и способах по изобретению клетки можно субкультивировать, например, при плотности клеток, сниженной посредством разведения или удаления клеток из культуры. В одном из вариантов осуществления клетки субкультивируют до достижения сниженной плотности клеток перед контактом со смесью плазмиды/PEI.
[0034] В композициях и способах по изобретению клетки можно использовать при различных плотностях. В одном из вариантов осуществления клетки культивируют или субкультивируют до достижения плотности клеток в диапазоне от приблизительно 0,1×106 клеток/мл до приблизительно 5,0×106 клеток/мл перед контактом со смесью плазмиды/PEI.
[0035] В композициях и способах по изобретению клетки можно приводить в контакт с PEI (свободным PEI, общим PEI, смесью плазмиды/PEI) в течение короткого или длительного периода времени. В одном из вариантов осуществления клетки приводят в контакт со смесью плазмиды/PEI в период от 2 до 5 дней после субкультивирования. В другом варианте осуществления клетки приводят в контакт со смесью плазмиды/PEI в период от 3 до 4 дней после субкультивирования.
[0036] Композиции и способы по изобретению обеспечивают улучшенную эффективность трансфекции клеток и/или рекомбинантное получение векторов с помощью клеток. В одном из вариантов осуществления количество плазмиды, встраиваемой в трансфицированные клетки, составляет по меньшей мере на 50% больше при использовании стадии добавления свободного PEI к культуре клеток с плазмидой/PEI по сравнению с отсутствием добавления свободного PEI к культуре клеток с плазмидой/PEI. В другом варианте осуществления количество полученного рекомбинантного вектора на основе AAV составляет по меньшей мере 50% или больше при использовании стадии добавления свободного PEI к культуре клеток с плазмидой/PEI по сравнению с отсутствием добавления свободного PEI к культуре клеток с плазмидой/PEI. В дополнительном варианте осуществления количество полученного рекомбинантного вектора на основе AAV составляет в 1-5, 5-10 или 10-20 раз больше при использовании стадии добавления свободного PEI к культуре клеток с плазмидой/PEI по сравнению с отсутствием добавления свободного PEI к культуре клеток с плазмидой/PEI.
Краткое описание чертежей
[0037] На фигуре 1 показана эффективность трансфекции с использовании PEI "Max" 40 кДа (A) и PEI 25 кДа (B), растворенного в Трис-HCl или H2O, при использовании плазмидной ДНК в количестве 2,8, 5,6 и 11,2 мкг/мл. PEI "Max" 40 кДа демонстрировал соответствующую более высокую эффективность трансфекции по сравнению с PEI 25кДа.
[0038] На фигуре 2A-2B показан эффект свободного PEI в отношении эффективности трансфекции и получения вектора rAAV в 12-луночных планшетах. A) Трансфекция клеток 293F с использованием трех плазмид (pAAV-eGFP-WRPE, pAAV-Rep2/Cap2, pAD2-Helper) в бессывороточной суспензионной культуре в 12-луночных планшетах. B) Эффект свободного PEI в отношении титра rAAV. Массовое соотношение PEI/ДНК составляло 2:1 или 4:1 при добавлении свободного PEI при трансфекции или без него. Использовали количество ДНК 2,8 мкг/мл при молярном соотношении трех плазмид 1:1:1. Сначала разбавленный PEI смешивали с разведенной ДНК в массовом соотношении 1:1 для получения комплексов. Избыток PEI разводили в 50 мкл среды для культивирования, а затем добавляли непосредственно к клеткам.
[0039] На фигуре 3A-3B показан эффект свободного PEI в отношении эффективности трансфекции и титра rAAV в колбах с мешалкой. A) Эффективность трансфекции повышалась при использовании свободного PEI. B) Эффект свободного PEI в отношении титра rAAV. Массовое соотношение PEI/ДНК составляло 2:1, и количество ДНК составляло 2,8 мкг/мл. 1/2 и 1/3 количества PEI использовали в качестве свободного PEI при трансфекции.
[0040] На фигуре 4 показана кривая роста и жизнеспособность клеток 293F в биореакторе. Клетки высевали в количестве 0,25×106 клеток/мл (модуль 1), 0,35×106 клеток/мл (модуль 2) и 0,5×106 клеток/мл (модуль 3). Плотность клеток (N) и жизнеспособность (V) регистрировали каждые 12 часов в течение 7 дней культивирования клеток в биореакторе.
[0041] На фигуре 5A-5B показана трансфекция клеток в биореакторе. A) Клетки 293F, трансфицированные с использованием трех плазмид в течение до 72 часов. GFP-положительные клетки определяли с использованием инвертированного флуоресцентного микроскопа. B) Эффективность трансфекции измеряли с помощью проточной цитометрии. 50-60% GFP-положительных клеток определяли через 48-72 часов после трансфекции. Эффективность трансфекции была схожей для трансфекции в день 3 и трансфекции в день 4.
[0042] На фигуре 6A-6B показан титр rAAV и анализ функционирования вектора. A) Титр вектора был значимо выше при трансфекции в день 4, чем в день 3, что оценивали посредством qPCR. Наиболее высокий титр составлял 1,38E+11 ВГ/мл в условиях трансфекции в день 4 и скорости перемешивания 150 об./мин. B) Функционирование вектора измеряли посредством анализа трансдукции. Тот же объем лизатов клеток добавляли к клеткам HEK 293. GFP-положительные клетки определяли с использованием инвертированного флуоресцентного микроскопа. Результаты трансдукции соответствовали титру rAAV, т.е. более высокий титр коррелировал с более высоким коэффициентом трансдукции.
Подробное описание
[0043] Настоящее изобретение относится к композициям и способам трансдукции клеток с использованием молекулы, такой как нуклеиновая кислота (например, плазмида), с высокой эффективностью. При такой высокой эффективности трансдукции клеток, в случае трансдукции с использованием нуклеиновой кислоты, кодирующей белок или содержащей последовательность, транскрибирующуюся в представляющий интерес транскрипт, можно получать белок и/или транскрипт с высокой эффективностью. Кроме того, такие клетки при трансдукции с использованием последовательностей, таких как плазмиды, кодирующие вирусные упаковывающие белки и/или хелперные белки, могут продуцировать рекомбинантные векторы, включающие нуклеиновую кислоту, кодирующую белок или содержащую последовательность, транскрибирующуюся в представляющий интерес транскрипт, с помощью которых, в свою очередь, можно получать рекомбинантные вирусные векторы с высоким выходом.
[0044] Изобретение относится к платформе для трансдукции клеток и/или получения вирусного (например, AAV) вектора, включающей признаки, отличающиеся от существующих способов получения вирусного (например, AAV) вектора "промышленного стандарта". Композиции и способы по изобретению отличаются смешиванием PEI с нуклеиновыми кислотами в конкретных условиях. Смешивание PEI с нуклеиновыми кислотами приводит к PEI-индуцированному эффективному уплотнению нуклеиновых кислот с образованием стандартных комплексов, названных полиплексами. Способ встраивания нуклеиновых кислот в клетки включает получение нуклеиновых кислот, смешанных с PEI, в конкретных условиях и нанесение полученной смеси на клетки. Кроме того, композиции и способы по изобретению отличаются клетками, приводимыми в контакт со свободным PEI, или приведением клеток в контакт со свободным PEI, в конкретном порядке в отношении стадии нанесения смеси PEI/нуклеиновые кислоты на клетки. Композиции и способы по изобретению отличаются: 1) высокой эффективностью трансдукции/трансфекции клеток с использованием нуклеиновой кислоты; 3) уникальной комбинацией реагентов и стадий способа, приводящей к неожиданному значительному выходу вектора; и 4) модульной платформой, которую можно использовать для получения различных вариантов серотипов/капсида AAV.
[0045] Термины "нуклеиновая кислота" и "полинуклеотид" в настоящем описании используют взаимозаменяемо для обозначения всех форм нуклеиновой кислоты, олигонуклеотидов, включая дезоксирибонуклеиновую кислоту (ДНК) и рибонуклеиновую кислоту (РНК). Нуклеиновые кислоты и полинуклеотиды включают геномную ДНК, кДНК, антисмысловую ДНК, сплайсированную или несплайсированную мРНК, рРНК, тРНК и ингибиторную ДНК или РНК (РНКи, например, малую или короткую шпилечную (sh)РНК, микроРНК (мкРНК), малую или короткую интерферирующую миРНК, транс-сплайсированную РНК или антисмысловую РНК). Нуклеиновые кислоты и полинуклеотиды включают природные, синтетические и преднамеренно модифицированные или измененные последовательности (например, вариант нуклеиновой кислоты).
[0046] Термин "нуклеиновая кислота" или "плазмида" также может относиться к последовательности, кодирующей белок. Такие белки могут являться белком дикого типа или вариантом белка, модифицированным или химерным белком. Термин "вариант белка" может означать модифицированный белок таким образом, что модифицированный белок имеет изменение аминокислоты по сравнению с белком дикого типа.
[0047] Белки, кодируемые нуклеиновой кислотой или плазмидой, включают терапевтические белки. Неограничивающие примеры включают фактор свертывания крови (например, фактор XIII, фактор IX, фактор X, фактор VIII, фактор VIIa или белок C), CFTR (трансмембранный регуляторный белок кистозного фиброза), антитело, белок пигментного эпителия сетчатки 65 кДа (RPE65), эритропоэтин, рецептор LDL, липопротеинлипазу, орнитинтранскарбамилазу, β-глобин, α-глобин, спектрин, α-антитрипсин, аденозиндезаминазу (ADA), транспортер металлов (ATP7A или ATP7), сульфамидазу, фермент, вовлеченный в лизосомную болезнь накопления (ARSA), гипоксантин-гуанин-фосфорибозилтрансферазу, β-25-глюкоцереброзидазу, сфингомиелиназу, лизосомальную гексозаминидазу, дегидрогеназу альфа-кетокислот с разветвленной цепью, гормон, фактор роста (например, инсулиноподобные факторы роста 1 и 2, фактор роста тромбоцитов, эпидермальный фактор роста, фактор роста нервов, нейротрофический фактор-3 и -4, нейротрофический фактор мозга, глиальный фактор роста, трансформирующий фактор роста α и β и т.д.), цитокин (например, интерферон-α, интерферон-β, интерферон-γ, интерлейкин-2, интерлейкин-4, интерлейкин-12, гранулоцитарно-макрофагальный колониестимулирующий фактор, лимфотоксин, и т.д.), продукт гена "самоубийства" (например, тимидинкиназу вируса простого герпеса, цитозиндезаминазу, дифтерийный токсин, цитохром P450, дезоксицитидинкиназу, фактор некроза опухоли и т.д.), белок резистентности к лекарственному средству (например, обеспечивающий резистентность к лекарственному средству, используемому в противоопухолевой терапии), опухолевый супрессорный белок (например, p53, Rb, Wt-1, NF1, продукт гена болезни Гиппеля-Линдау (VHL), белок аденоматозного полипоза толстой кишки (APC)), пептид с иммуномодулирующими свойствами, толерогенный или иммуногенный пептид или белковые T-регитопы, или hCDR1, инсулин, глюкокиназу, гуанилатциклазу 2D (LCA-GUCY2D), эскортный белок Rab 1 (хороидеремия), LCA 5 (LCA-леберцилин), орнитин-кетоксилота-аминотрансферазу (гиратная атрофия), ретиношизин 1 (X-сцепленный ретиношизис), USH1C (синдром Ашера 1C), ГТФазу X-сцепленного пигментного ретинита (XLRP), MERTK (AR-формы RP: пигментный ретинит), DFNB1 (коннексин-26-ассоциированная глухота), ACHM 2, 3 и 4 (ахроматопсия), PKD-1 или PKD-2 (поликистоз почек), TPP1, CLN2, генетические недостаточности, приводящие к лизосомным болезням накопления (например, сульфатазы, N-ацетилглюкозамин-1-фосфаттрансферазы, катепсина A, GM2-AP, NPC1, VPC2, белков-активаторы сфинголипидов и т.д.), одну или несколько нуклеаз с цинковыми пальцами для редактирования генома или донорные последовательности, используемые в качестве матриц репарации для редактирования генома.
[0048] Термин "нуклеиновая кислота" или "плазмида" также может относиться к последовательности, приводящей к транскрипту при ее транскрипции. Такие транскрипты могут являться РНК, такой как ингибиторная РНК (РНКи, например, малая или короткая шпилечная (sh)РНК, микроРНК (мкРНК), малая или короткая интерферирующая миРНК, транс-сплайсированная РНК или антисмысловая РНК).
[0049] Неограничивающие примеры включают ингибиторные нуклеиновые кислоты, ингибирующие экспрессию: гена гентингтина (HTT), гена, ассоциированного с денторубропаллидолуизиановой атрофией (например, атрофина 1, ATN1); гена рецептора андрогенов на X-хромосоме при спинобульбарной мышечной атрофии, атаксина-1, -2, -3 и -7 человека, потенциалозависимого кальциевого канала Cav2,1 P/Q, кодируемого CACNA1A, TATA-связывающего белка, противоположной цепи атаксина 8, также известной как ATXN8OS, бета-изоформы регуляторной субъединицы B серин/треонин-протеинфосфатазы 2A 55 кДа при спиноцеребеллярной атаксии (тип 1, 2, 3, 6, 7, 8, 12, 17), FMR1 (ген 1 задержки умственного развития при ломкой X-хромосоме) при синдроме Мартина-Белл, FMR1 (ген 1 задержки умственного развития при ломкой X-хромосоме) при треморе/атаксии, ассоциированной с ломкой X-хромосоме, FMR1 (ген 2 задержки умственного развития при ломкой X-хромосоме) или члена 2 семейства AF4/FMR2 при задержке умственного развития при ломкой X-хромосоме; миотонин-протеинкиназу (MT-PK) при миотонической дистрофии; фратаксин при атаксии Фридрейха; мутант гена супероксиддисмутазы 1 (SOD1) при боковом амиотрофическом склерозе; гена, участвующего в патогенезе болезни Паркинсона и/или болезни Альцгеймера; аполипопротеина B (APOB) и пропротеинконвертазы субтилизина/кексина типа 9 (PCSK9), гиперхолистеринемия; Tat ВИЧ, гена трансактиватора транскрипции вируса иммунодефицита человека, при ВИЧ-инфекции; TAR ВИЧ, TAR ВИЧ, гена чувствительного трансактивируемого элемента вируса иммунодефицита человека при ВИЧ-инфекции; C-C-хемокинового рецептора (CCR5) при ВИЧ-инфекции; нуклеопротеина капсида вируса саркомы Рауса (RSV) при инфекции RSV, печень-специфической микроРНК (miR-122) при инфекции вирусом гепатита C; p53, острая почечная недостаточность или отсроченная функция почечного трансплантата; протеинкиназы N3 (PKN3) при рецидивирующих или метастазирующих солидных злокачественных новообразованиях на поздней стадии; LMP2, LMP2, также известных как субъединица протеасомы бета-типа 9 (PSMB 9), метастазирующая меланома; LMP7, также известного как субъединица протеасомы бета-типа 8 (PSMB 8), метастазирующая меланома; MECL1, также известного как субъединица протеасомы бета-типа 10 (PSMB 10), метастазирующая меланома; фактора роста эндотелия сосудов (VEGF) при солидных опухолях; кинезинового белка веретена при солидных опухолях, апоптотического супрессора B-клеточного CLL/лимфомы (BCL-2) при хроническом миелолейкозе; рибонуклеотидредуктазы M2 (RRM2) при солидных опухолях; фурина при солидных опухолях; поло-подобная киназы 1 (PLK1) при опухолях печени, диацилглицерол-ацилтрансферазы 1 (DGAT1) при гепатите C, бета-катенина при семейном аденоматозном полипозе; бета-2-адрегенргического рецептора, глаукома; RTP801/Redd1, также известного как белок индуцируемого повреждением ДНК транскрипта 4, при диабетическом макулярном отеке (DME) или возрастной дегенерации желтого пятна; рецептора фактора роста эндотелия сосудов I (VEGFR1) при возрастной дегенерации желтого пятна или хориоидальной неоваскуляризации, каспазы 2 при передней неартериитной ишемической невропатии зрительного нерва; мутантного белка кератина 6A N17K при врожденной пахионихии; геномных/генных последовательностей вируса гриппа A при инфекции гриппа; геномных/генных последовательностей коронавируса при инфекции с тяжелым острым респираторным синдромом (SARS); геномных/генных последовательностей респираторно-синцитиального вируса при инфекции респираторно-синцитиальным вирусом; геномных/генных последовательностей филовируса Эбола при лихорадке Эбола; геномных/генных последовательностей вируса гепатита B и C при гепатите B и C; геномных/генных последовательностей вируса простого герпеса (HSV) при инфекции HSV, геномных/генных последовательностей вируса Коксаки B3 при инфекции вирусом Коксаки B3; сайленсинге патогенного аллеля гена (аллеле-специфичный сайленсинг), подобного торсину A (TOR1A), при первичной дистонии, пансайленсинге класса I и HLA-аллеле-специфичном сайленсинге при трансплантации; мутантный ген родопсина (RHO) при аутосомно-доминантном наследственном пигментном ретините (adRP); или ингибиторную нуклеиновую кислоту, связывающуюся с транскриптом любого из указанных выше генов или последовательностей.
[0050] Нуклеиновые кислоты (плазмиды) могут являться одноцепочечными, двухцепочечными или триплексными, линейными или кольцевыми и могут иметь любую длину. При описании нуклеиновых кислот (плазмид) последовательность или структуру конкретного полинуклеотида можно представлять в настоящем описании в соответствии с общепринятым описанием последовательности в 5'-3'-направлении.
[0051] "Плазмида" является формой нуклеиновой кислоты или полинуклеотида, как правило, имеющей дополнительные элементы для экспрессии (например, транскрипции, репликации и т.д.) или воспроизводства (репликации) плазмиды. В рамках изобретения, термин "плазмида" также можно использовать для обозначения такой нуклеиновой кислоты или полинуклеотидных последовательностей. Таким образом, во всех аспектах композиции и способы по настоящему изобретению применимы к нуклеиновым кислотам и полинуклеотидам, например, для встраивания нуклеиновой кислоты или полинуклеотида в клетки, для трансдукции (трансфекции) клеток с использованием нуклеиновой кислоты или полинуклеотида, для получения трансдуцированных (трансфицированных) клеток, содержащих нуклеиновую кислоту или полинуклеотид, для получения клеток, продуцирующих вирусные (например, AAV) векторы, для получения вирусных (например, AAV) векторов, для получения среды для культивирования клеток, содержащей вирусные (например, AAV) векторы, и т.д.
[0052] Композиции и способы по изобретению включают полиэтиленимин (PEI). PEI является катионным полимером и способен образовывать стабильный комплекс с нуклеиновой кислотой, обозначаемый как полиплекс. Не желая быть связанными какой-либо теорией, полагают, что полиплекс встраивается в клетки посредством эндоцитоза.
[0053] PEI может являться линейным PEI или разветвленным PEI. PEI может находиться в форме соли или свободного основания. В конкретных вариантах осуществления PEI является линейным PEI, таким как, необязательно, гидролизованный линейный PEI. Гидролизованный PEI может являться полностью или частично гидролизованным. Гидролизованный линейный PEI содержит большую долю свободного (протонируемого) азота по сравнению с негидролизованным линейным PEI, как правило, содержащим по меньшей мере на 1-5% больше свободного (протонируемого) азота по сравнению с негидролизованным линейным PEI, более типично - на 5-10% больше свободного (протонируемого) азота по сравнению с негидролизованным линейным PEI, или наиболее типично - на 10-15% больше свободного (протонируемого) азота по сравнению с негидролизованным линейным PEI.
[0054] В конкретных вариантах осуществления PEI может иметь молекулярную массу в диапазоне от приблизительно 4000 до приблизительно 160000 и/или от приблизительно 2500 до приблизительно 250000 в пересчете на свободное основание. В дополнительных конкретных вариантах осуществления PEI может иметь молекулярную массу приблизительно 40000 и/или приблизительно 25000 в пересчете на свободное основание. В частности, линейный PEI с молекулярной массой приблизительно 40000 и/или приблизительно 25000 в пересчете на свободное основание. Кроме того, также можно использовать химически модифицированный линейный PEI или разветвленный PEI. PEI коммерчески доступен (например, Polysciences, Inc., Warrington, PA, USA).
[0055] В композициях и способах по настоящему изобретению нуклеиновую кислоту, такую как плазмида, смешивают с PEI для получения смеси или раствора PEI. Такую смесь или раствор можно обозначать как "смесь плазмиды/PEI" или "смесь нуклеиновой кислоты/PEI". Таким образом, термины "смесь плазмиды/PEI" и "смесь нуклеиновой кислоты/PEI" означают, что PEI смешивают с нуклеиновой кислотой/плазмидой. Как указано в настоящем описании, PEI, таким образом, можно смешивать с нуклеиновой кислотой (плазмидой) до или, по существу, одновременно с контактом с клетками для трансдукции.
[0056] В рамках изобретения, термин "свободный PEI" означает PEI, по существу или полностью не содержащий нуклеиновую кислоту (плазмиду). Как указано в настоящем описании, PEI, таким образом, может находиться в форме свободного PEI. Таким образом, "смесь плазмиды/PEI" или "смесь нуклеиновой кислоты/PEI" отличаются от свободного PEI. Если свободный PEI является, по существу, свободным, количество присутствующих последовательностей нуклеиновой кислоты (плазмиды) будет составлять не более приблизительно 5%, как определяют по молекулярной массе или по массе. Разумеется, количество может составлять менее 5%, например, приблизительно 4,5% или менее, приблизительно 4% или менее, приблизительно 3,5% или менее, приблизительно 3% или менее, приблизительно 2,5% или менее, приблизительно 2% или менее, приблизительно 1,5% или менее, приблизительно 1% или менее или приблизительно 0,5% или менее.
[0057] В рамках изобретения, термин "общий PEI" означает сумму PEI, присутствующего в смеси PEI/плазмиды, и свободного PEI. Таким образом, общий PEI включает PEI, смешанный с плазмидой, и PEI, по существу или полностью не содержащий последовательности нуклеиновой кислоты, такие как плазмида.
[0058] Описание количеств PEI, соотношений, композиций, растворов, растворителей и буферов, pH, солей и времени и длительности контакта с клетками и инкубации применимо к любому, любым двум или всем трем из: 1) PEI в смеси плазмиды/PEI или смеси нуклеиновой кислоты/PEI; 2) PEI как свободного PEI (т.е. PEI, по существу или полностью не содержащего нуклеиновую кислоту или полинуклеотидные последовательности, такие как плазмида; и 3) общий PEI (PEI в смеси плазмиды/PEI или смеси нуклеиновой кислоты/PEI+свободный PEI).
[0059] В конкретных вариантах осуществления PEI является раствором, таким как водные растворы (например, в воде). В дополнительных конкретных вариантах осуществления PEI является закисленным или нейтрализованным PEI. Термин "закисленный PEI" означает раствор PEI, полученный посредством растворения PEI в кислом растворителе. Кислотность закисленного раствора PEI, как правило, соответствует pH от приблизительно 0 до приблизительно 3,0, более типично - pH от приблизительно 0,5 до приблизительно 2,0. Термин "нейтрализованный PEI" означает раствор PEI, полученный посредством растворения PEI в нейтральном растворителе или буфере. Нейтрализованные растворы PEI могут иметь pH в диапазоне от приблизительно 6,0 до приблизительно 8,0, как правило, pH в диапазоне от приблизительно 6,5 до приблизительно 7,5, более типично - pH в диапазоне от приблизительно 6,8 до приблизительно 7,2, и наиболее типично - pH в диапазоне от приблизительно 7,0 до приблизительно 7,2, например, приблизительно 7,1.
[0060] Для достижения или поддержания pH раствора PEI в указанном выше диапазоне без нарушения активности PEI при трансфекции можно использовать любой растворитель или буфер. Примеры кислых растворителей включают неорганические кислоты, такие как соляная кислота (HCl), и органические кислоты с pH в кислом диапазоне, такие как раствор глицина-соляной кислоты. Неограничивающие примеры нейтральных растворителей/буферов включают Трис (основание тризма) и HEPES. Буферы могут иметь диапазон от приблизительно 1 мМ до приблизительно 100 мМ, более типично - от приблизительно 2 мМ до приблизительно 50 мМ, и наиболее типично - от приблизительно 5 мМ до приблизительно 20 мМ.
[0061] Растворы PEI, необязательно, могут включать соли. Неограничивающие примеры солей включают соли натрия (Na), калия (K) и магния (Mg). В конкретных аспектах концентрации соли в растворе PEI находятся в диапазоне от приблизительно 50 мМ до приблизительно 500 мМ, более типично - от приблизительно 100 мМ до приблизительно 250 мМ, и наиболее типично - от приблизительно 125 мМ до приблизительно 175 мМ.
[0062] Смесь нуклеиновых кислот (плазмид) и PEI получают посредством смешивания нуклеиновых кислот (плазмид) и PEI в растворе. Смешивание можно осуществлять в любом растворе, совместимом с трансдукцией клеток с использованием PEI. Неограничивающие примеры приведены в настоящем описании. После смешивания смесь нуклеиновых кислот (плазмид)/PEI можно инкубировать в течение периода времени от приблизительно 1 минуты до приблизительно 8 часов; от приблизительно 10 секунд до приблизительно 4 часов; от приблизительно 1 минуты до приблизительно 60 минут; от приблизительно 1 минуты до приблизительно 30 минут; от приблизительно 10 минут до приблизительно 45 минут; от приблизительно 10 минут до приблизительно 30 минут и/или от приблизительно 20 минут до приблизительно 30 минут. Как правило, периоды времени включают приблизительно 1 минуту, приблизительно 5 минут, приблизительно 10 минут, приблизительно 15 минут, приблизительно 20 минут и приблизительно 30 минут.
[0063] PEI и нуклеиновые кислоты (плазмида) смешивают в соотношении, которое не ограничено. Типичные соотношения включают смесь плазмид в диапазоне молярного (или массового) соотношения от приблизительно 1:0,01 до приблизительно 1:100 или в диапазоне молярного (или массового) соотношения от приблизительно 100:1 до приблизительно 1:0,01 для получения смеси плазмиды/PEI. Более типичные молярные (или массовые) соотношения включают смесь плазмид в диапазоне молярного (или массового) соотношения от приблизительно 1:1 до приблизительно 1:5 или в диапазоне молярного (или массового) соотношения от приблизительно 1:2 до приблизительно 1:4 для получения смеси плазмиды/PEI. В дополнительных вариантах осуществления массовое соотношение PEI:плазмида находится в диапазоне от приблизительно 0,1:1 до приблизительно 5:1 или в диапазоне от приблизительно 5:1 до приблизительно 0,1:1. В дополнительных вариантах осуществления культура клеток со свободным PEI/плазмидой/PEI имеет массовое соотношение PEI:плазмида в диапазоне от приблизительно 0,1:1 до приблизительно 5:1 или массовое соотношение PEI:плазмида в диапазоне от приблизительно 5:1 до приблизительно 0,1:1. В конкретных вариантах осуществления смесь плазмиды/PEI имеет массовое соотношение PEI:плазмида в диапазоне от приблизительно 1:1 до приблизительно 5:1 или в диапазоне от приблизительно 5:1 до приблизительно 1:1. В других конкретных вариантах осуществления культура клеток со свободным PEI/плазмидой/PEI имеет массовое соотношение PEI:плазмида в диапазоне от приблизительно 1:1 до приблизительно 5:1 или в диапазоне от приблизительно 5:1 до приблизительно 1:1.
[0064] Количество нуклеиновых кислот (плазмид), используемых для получения композиций и способов трансдукции клеток, варьируется. В конкретных вариантах осуществления молярное соотношение азота (N) в общем PEI и фосфата (P) в плазмиде находится в диапазоне от приблизительно 1:1 до приблизительно 50:1 (N:P) в культуре клеток со свободным PEI/плазмидой/PEI, или молярное соотношение азота (N) в общем PEI и фосфата (P) в плазмиде составляет приблизительно от 1:1 до 10:1 (N:P) в культуре клеток со свободным PEI/плазмидой/PEI, или молярное соотношение азота (N) в общем PEI и фосфата (P) в плазмиде составляет приблизительно 5:1, 6:1, 7:1, 8:1, 9:1 или 10:1 (N:P) в культуре клеток со свободным PEI/плазмидой/PEI. В дополнительных конкретных вариантах осуществления общее количество плазмиды, содержащей нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт, и одной или нескольких плазмид, содержащих нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и/или нуклеиновые кислоты, кодирующие хелперные белки, находится в диапазоне от приблизительно 0,1 мкг до приблизительно 15 мкг на мл клеток.
[0065] Нанесение смеси нуклеиновых кислот (плазмиды)/PEI на клетки осуществляют посредством добавления смеси нуклеиновых кислот (плазмид)/PEI к клеткам таким образом, что смесь нуклеиновых кислот (плазмиды)/PEI контактирует с клетками. Клетки, к которым добавляют (приводят в контакт) смесь нуклеиновых кислот (плазмид)/растворов PEI, могут являться адгезивными клетками или клетками в суспензии. Такие клетки могут включать сокультуры с другими клетками.
[0066] Клетки для достижения трансдукции клеток приводят в контакт со смесью нуклеиновых кислот (плазмид)/PEI в течение периода времени, не являющегося ограниченным. Контакт клеток со свободным PEI, как правило, осуществляют одновременно (или сразу после) или после приведения клеток в контакт со смесью нуклеиновых кислот (плазмид)/PEI. Если необходим временной интервал между приведением клеток в контакт со смесью нуклеиновой кислоты (плазмиды)/PEI и приведением клеток в контакт со свободным PEI, временной интервал может составлять от приблизительно 1 секунды до приблизительно 140 часов, как правило, от приблизительно 1 секунды до приблизительно 96 часов, более типично - от приблизительно 1 секунды до приблизительно 48 или приблизительно 72 часов, наиболее типично - от приблизительно 1 секунды до приблизительно 24 часов, или менее, например, приблизительно 16, приблизительно 12, приблизительно 8 или приблизительно 6 часов или менее.
[0067] В случае длительного контакта клетки могут подвергаться цитотоксическому воздействию PEI, приводящему к повышенному количеству погибших (нежизнеспособных) клеток, что, таким образом, снижает эффективность трансфекции. Время инкубации после приведения клеток в контакт с общим PEI может находиться в диапазоне от секунд до дней. В частности, клетки можно приводить в контакт с нуклеиновыми кислотами (плазмидой)/PEI или общим PEI, например, в течение периода времени от приблизительно 1 минуты до приблизительно 48 часов; от приблизительно 1 минуты до приблизительно 24 часов; от приблизительно 1 минуты до приблизительно 16 часов; от приблизительно 1 минуты до приблизительно 8 часов; от приблизительно 1 минуты до приблизительно 4 часов; от приблизительно 1 минуты до приблизительно 120 минут; от приблизительно 5 минут до приблизительно 60 минут; от приблизительно 10 минут до приблизительно 45 минут или от приблизительно 10 минут до приблизительно 30 минут.
[0068] Для снижения цитотоксичности PEI среду для культивирования можно заменять свежей средой для культивирования после приведения клеток в контакт с нуклеиновыми кислотами (плазмидами)/PEI. Замена среды для культивирования после трансфекции может минимизировать цитотоксичность PEI без значительной утраты эффективности трансфекции клеток.
[0069] Клетки для трансфекции, до или во время контакта со смесью плазмиды/PEI или контакта со свободным PEI, имеют плотность в диапазоне от приблизительно 1×105 клеток/мл до приблизительно 1×108 клеток/мл при контакте со смесью плазмиды/PEI или при контакте со свободным PEI. Как правило, клетки имеют плотность в диапазоне от приблизительно 2×105 клеток/мл до приблизительно 5×106 клеток/мл. Более типично, клетки имеют плотность в диапазоне от приблизительно 3×105 клеток/мл до приблизительно 3×106 клеток/мл, например, от приблизительно 4×105 клеток/мл до приблизительно 2×106 клеток/мл или от приблизительно 3×105 клеток/мл до приблизительно 1×106 клеток/мл.
[0070] Клетки для трансфекции, до или во время контакта со смесью плазмиды/PEI и/или контакта со свободным PEI, необязательно, может находиться в логарифмической (экспоненциальной) фазе роста. Клетки для трансфекции, до или во время контакта со смесью плазмиды/PEI и/или контакта со свободным PEI, необязательно, могут иметь 60% или более 60% жизнеспособности, например, 70%, 80%, или 90% или более 90% жизнеспособности.
[0071] Клетки, которые можно приводить в контакт, как указано в настоящем описании, включают клетки млекопитающих, такие как клетки человека. Такие клетки могут являться первичными клетками или линиями клеток, способными расти или поддерживать жизнеспособность in vitro или адаптированными для культивирования ткани in vitro. Примеры линий клеток включают клетки HEK (эмбриональные клетки почки человека), включающие клетки HEK293, такие как клетки HEK293F (293F) и HEK293T (293T).
[0072] Более типично, такие клетки, приведенные в контакт, как указано в настоящем описании, можно обозначать как "клетки-хозяева". Термин "клетка-хозяин" означает, например, микроорганизмы, дрожжевые клетки, клетки насекомых и клетки млекопитающих, которые можно использовать, или используемые, в качестве реципиентов нуклеиновой кислоты (плазмиды), кодирующей упаковывающие белки, такие как упаковывающие белки AAV, нуклеиновой кислоты (плазмиды), кодирующей хелперные белки, нуклеиновой кислоты (плазмиды), кодирующей белок или транскрибирующейся в представляющий интерес транскрипт, или другой трансферной нуклеиновой кислоты (плазмиды). Термин включает потомство исходной клетки, подвергнутой трансдукции или трансфекции. Таким образом, в рамках изобретения, термин "клетка-хозяин", как правило, относится к клетке, трансдуцированной или трансфицированной с использованием экзогенной последовательности нуклеиновой кислоты. Следует понимать, что потомство одной родительской клетки, необязательно, может быть полностью идентичным исходному родителю по морфологии или геномному или общему комплементу нуклеиновой кислоты по причине природной, случайной или преднамеренной мутации.
[0073] Многочисленные среды для выращивания клеток, подходящие для поддержания жизнеспособности клеток или обеспечения роста и/или пролиферации клеток, коммерчески доступны или их легко можно получать. Примеры таких сред включают бессывороточные среды для выращивания эукариотических клеток, такие как среда для поддержания жизнеспособности или обеспечения роста клеток млекопитающих (например, человека). Неограничивающие примеры включают среду Хэма F12 или F12K (Sigma-Aldrich), среду FreeStyle (FS) F17 (Thermo-Fisher Scientific), MEM, DMEM, RPMI-1640 (Thermo-Fisher Scientific) и их смеси. Такую среду можно дополнять витаминами, и/или микроэлементами, и/или солями, и/или аминокислотами, такими как незаменимые аминокислоты для клеток млекопитающих (например, человека).
[0074] Термины "трансдуцировать" и "трансфицировать" относятся к встраиванию молекулы, такой как нуклеиновая кислота (плазмида), в клетку-хозяина. Клетка "трансдуцирована" или "трансфицирована", если экзогенную нуклеиновую кислоту вводят через мембрану клетки. Таким образом, "трансдуцированная клетка" является клеткой, в которую встраивают "нуклеиновую кислоту" или "полинуклеотид", или ее потомством, в которое встроена экзогенная нуклеиновая кислота. В конкретных вариантах осуществления "трансдуцированная" клетка (например, у млекопитающего, такая как клетка ткани или клетка органа) представляет собой генетическое изменение в клетке после встраивания экзогенной молекулы, например, нуклеиновой кислоты (например, трансгена). "Трансдуцированные" клетки можно выращивать, и встраиваемая нуклеиновая кислота транскрибируется, и/или экспрессируется белок.
[0075] В "трансдуцированной" или "трансфицированной" клетке нуклеиновая кислота (плазмида) может встраиваться или не встраиваться в геномную нуклеиновую кислоту клетки реципиента. Если встроенная нуклеиновая кислота встраивается в нуклеиновую кислоту (геномную ДНК) клетки или организм реципиента, она может стабильно поддерживаться в этой клетке или организме и далее передаваться или наследоваться потомством (клетками или организмами) клетки или организма реципиента. В конечном итоге, встроенная нуклеиновая кислота может существовать в клетке реципиента или организме-хозяине экстрахромосомно или лишь транзиторно. Известен ряд способов (см., например, Graham et al. (1973) Virology, 52:456, Sambrook et al. (1989) Molecular Cloning, a laboratory manual, Cold Spring Harbor Laboratories, New York, Davis et al. (1986) Basic Methods in Molecular biology, Elsevier, и Chu et al. (1981) Gene 13:197). Такие способы можно использовать для встраивания одной или нескольких экзогенных ДНК в подходящие клетки-хозяева.
[0076] Термин "вектор" относится к небольшой молекуле нуклеиновой кислоты-носителю, плазмиде, вирусу (например, вектору AAV) или другому средству, на которое можно воздействовать посредством инсерции или встраивания нуклеиновой кислоты. Такие векторы можно использовать для генетической манипуляции (т.е. "клонирующие векторы"), для встраивания/переноса полинуклеотидов в клетки и для транскрипции или трансляции встраиваемого полинуклеотида в клетках. "Экспрессирующий вектор" является специализированным вектором, содержащим ген или последовательность нуклеиновой кислоты с необходимыми регуляторными областями, необходимыми для экспрессии в клетке-хозяине. Векторная последовательность нуклеиновой кислоты, как правило, содержит, по меньшей мере, участок начала репликации для воспроизведения в клетке и, необязательно, дополнительные элементы, такие как гетерологичная полинуклеотидная последовательность, элемент контроля экспрессии (например, промотор, энхансер), интрон, ITR, селективный маркер (например, резистентности к антибиотику), сигнал полиаденилирования. В целях по изобретению термин "вектор", как указано в настоящем описании, входит в объем термина "плазмида" так, как этот термин используют в настоящем описании.
[0077] Вирусный вектор получен или основан на одном или нескольких элементах нуклеиновой кислоты, содержащих вирусный геном. Конкретные вирусные векторы включают лентивирус, псевдотипированный лентивирус и парвовирусные векторы, такие как векторы на основе аденоассоциированного вируса (AAV).
[0078] Термин "рекомбинантный", как определение вектора, такого как рекомбинантный вирус, например, лентивирусные или парвовирусные (например, AAV) векторы, а также определение последовательностей, таких как рекомбинантные полинуклеотиды и полипептиды, означает, что композиции подвергнуты манипуляции (т.е. сконструированы) в таком виде, в котором, как правило, не встречается в природе. Конкретным примером рекомбинантного вектора, такого как вектор AAV, будет случай, когда полинуклеотид, как правило, не присутствующий в вирусном (например, AAV) геноме дикого типа, встраивают в вирусный геном, т.е. он является гетерологичным. Хотя термин "рекомбинантный" не всегда используют в настоящем описании по отношению к векторам, таким как вирусные векторы и векторы AAV, а также последовательностям, таким как полинуклеотиды, рекомбинантные формы, включающие полинуклеотиды, конкретно включены в настоящее описание, несмотря на любое такое упущение.
[0079] Рекомбинантный вирусный "вектор" или "вектор AAV" получен из генома вируса дикого типа, такого как AAV, с использованием молекулярных способов для удаления генома дикого типа из вируса (например, AAV) и его замены неактивной нуклеиновой кислотой, такой как нуклеиновая кислота, транскрибируемая в транскрипт или кодирующая белок. Как правило, в случае AAV одну или обе последовательности инвертированных концевых повторов (ITR) генома AAV сохраняют в векторе AAV. "Рекомбинантный" вирусный вектор (например, AAV) отличается от вирусного (например, AAV) генома, т.к. весь или часть вирусного генома заменяют ненативной (т.е. гетерологичной) последовательностью относительно вирусной (например, AAV) геномной нуклеиновой кислотой. Таким образом, встраивание ненативной последовательности определяет вирусный вектор (например, AAV) как "рекомбинантный" вектор, который в случае AAV можно обозначать как "вектор rAAV".
[0080] Последовательность рекомбинантного вектора (например, лентивирусного, парвовирусного, AAV) можно упаковывать, как обозначают в настоящем описании, в виде "частицы" для последующего инфицирования (трансдукции) клетки ex vivo, in vitro или in vivo. Если последовательность рекомбинантного вектора инкапсидирована или упакована в частицу AAV, частицу также можно обозначать как "rAAV". Такие частицы включают белки, инкапсидирующие или упаковывающие векторный геном. Конкретные примеры включают вирусные белки оболочки и, в случае AAV, белки капсида, такие как AAV VP1, VP2 и VP3.
[0081] Векторный "геном" относится к части последовательности рекомбинантной плазмиды, в конечном итоге, упаковываемой или инкапсидированной с образованием вирусной (например, AAV) частицы. В случаях, когда рекомбинантные плазмиды используют для конструирования или производства рекомбинантных векторов, векторный геном не включает часть "плазмиды", не соответствующую последовательности векторного генома рекомбинантной плазмиды. Эту не-векторную часть генома рекомбинантной плазмиды обозначают как "остов плазмиды", важный для клонирования и амплификации плазмиды, процесса, необходимого для воспроизведения и получения рекомбинантного вируса, но не упаковываемый или инкапсидированный в вирусные (например, AAV) частицы. Таким образом, термин "векторный "геном"" относится к нуклеиновой кислоте, упаковываемой или инкапсидированной вирусом (например, AAV).
[0082] Термины "пустой капсид" и "пустая частица" относятся к вириону AAV, включающему белковую оболочку AAV, но в котором отсутствует вся или часть нуклеиновой кислоты, кодирующей белок или транскрибирующейся в представляющий интерес транскрипт, фланкируемой ITR AAV. Таким образом, пустой капсид не переносит нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт, в клетку-хозяина. Однако, составы пустых капсидов применимы в иных случаях, таких как ELISA.
[0083] Термин "упаковывающие белки" относится к не-AAV вирусным и/или клеточным функциям, от которых зависит репликация AAV. Таким образом, термин охватывает белки и РНК, необходимые для репликации AAV, включая вещества, участвующие в активации транскрипции генов AAV, стадие-специфичном сплайсинге AAV мРНК, репликации ДНК AAV, синтезе продуктов экспрессии Cap и сборке капсида AAV. Вирусные вспомогательные функции можно извлекать из любого из известных хелперных вирусов, таких как аденовирус, герпесвирус (иной, чем вирус простого герпеса типа 1) и вирус осповакцины.
[0084] В рамках изобретения, термин "упаковывающие белки AAV" относятся к полученным из AAV последовательностям, функционирующим в транс-положении для продуктивной репликации AAV. Таким образом, упаковывающие белки AAV кодируются основными открытыми рамками считывания (ORF) AAV, rep и cap. Показано, что белки rep обладают множеством функций, включая, среди прочего: распознавание, связывание и никирование точки начала репликации ДНК AAV; ДНК-хеликазная активность и модуляция транскрипции с промоторов AAV (или других гетерологичных промоторов). Белки cap (капсида) выполняют необходимые функции упаковки. Упаковывающие белки AAV используют в настоящем изобретении для восполнения функций AAV в транс-положении, отсутствующих у векторов AAV.
[0085] Термин "нуклеиновые кислоты, кодирующие упаковывающие белки AAV", как правило, относится к молекуле нуклеиновой кислоты, включающей нуклеотидные последовательности, обеспечивающие функции AAV, отсутствующие у вектора AAV, которые будут использовать для получения рекомбинантного вектора AAV для трансдукции. Нуклеиновые кислоты, кодирующие упаковывающие белки AAV, общеупотребительны для обеспечения транзиторной экспрессии генов rep и/или cap AAV для восполнения отсутствующих функций AAV, необходимых для репликации AAV; однако, в конструкциях нуклеиновой кислоты отсутствуют ITR AAV, и они не могут ни реплицироваться, ни упаковывать сами себя. Нуклеиновые кислоты, кодирующие упаковывающие белки AAV, могут находиться в форме плазмиды, фага, транспозона, космиды, вируса или вириона. Описан ряд конструкций нуклеиновых кислот, таких как общеупотребительные плазмиды pAAV/Ad и pIM29+45, кодирующие продукты экспрессии Rep и Cap. См., например, Samulski et al. (1989) J. Virol. 63:3822-3828; и McCarty et al. (1991) J. Virol. 65:2936-2945. Описан ряд векторов, кодирующих продукты экспрессии Rep и/или Cap (например, патенты США №№ 5139941 и 6376237).
[0086] Термин "нуклеиновые кислоты, кодирующие хелперные белки", как правило, относится к молекулам нуклеиновой кислоты, включающим нуклеотидные последовательности, кодирующие белки, обеспечивающие хелперные функции. Вектор с нуклеиновыми кислотами, кодирующими хелперные белки, можно трансфицировать в подходящую клетку-хозяина, где вектор затем способен поддерживать продукцию вирионов AAV в клетке-хозяине. Из термина конкретно исключены инфекционные вирусные частицы в том виде, в котором они существуют в природе, такие как вирусные частицы аденовируса, герпесвируса или вируса осповакцины.
[0087] Таким образом, векторы с хелперными белками могут находиться в форме плазмиды, фага, транспозона или космиды. В частности, показано, что для хелперных функций не требуется полный комплект генов аденовируса. Например, показано, что аденовирусные мутанты, неспособные к репликации ДНК и синтезу с использованием поздних генов, делают возможной репликацию AAV. Ito et al., (1970) J. Gen. Virol. 9:243; Ishibashi et al, (1971) Virology 45:317.
[0088] Показано, что мутанты в областях E2B и E3 поддерживают репликацию AAV, что свидетельствует о том, что области E2B и E3, вероятно, не участвуют в обеспечении хелперной функции. Carter et al:, (1983) Virology 126:505. Однако, аденовирусы, дефективные по области E1 или с делетированной областью E4, неспособны поддерживать репликацию AAV. Таким образом, в случае аденовирусных хелперных белков области EIA и E4, вероятно, прямо или косвенно необходимы для репликации AAV. Laughlin et al., (1982) J. Virol. 41:868; Janik et al., (1981) Proc. Natl. Acad. Sci. USA 78:1925; Carter et al., (1983) Virology 126:505. Другие охарактеризованные мутанты Ad включают: EIB (Laughlin et al. (1982), выше; Janik et al. (1981), выше; Ostrove et al., (1980) Virology 104:502); E2A (Handa et al., (1975) J. Gen. Virol. 29:239; Strauss et al., (1976) J. Virol. 17:140; Myers et al., (1980) J. Virol. 35:665; Jay et al., (1981) Proc. Natl. Acad. Sci. USA 78:2927; Myers et al., (1981) J. Biol. Chem. 256:567); E2B (Carter, Adeno-Associated вирус Хелперн Functions, в I CRC Handbook of Parvoviruses (P. Tijssen ed., 1990)); E3 (Carter et al. (1983), выше) и E4 (Carter et al.(1983), выше; Carter (1995)).
[0089] Исследования хелперных белков, получаемых с помощью аденовирусов, имеющих мутации в E1B, показали, что E1 B55k необходима для продукции вирионов AAV, в то время как E1B 19k - нет. Кроме того, в международной публикации № WO 97/17458 и Matshushita et al., (1998) Gene Therapy 5:938-945 описывают векторы с хелперной функцией, кодирующие различные гены Ad. Пример хелперного вектора содержит кодирующую область РНК VA аденовируса, кодирующую область ORF6 E4 аденовируса, кодирующую область E2A 72 кДа аденовируса, кодирующую область E1A аденовируса и область E1B аденовируса, в которой отсутствует интактная кодирующая область E1 BS5k (см., например, международную публикацию № WO 01/83797).
[0090] Термин "трансген" в настоящем описании используют в отношении нуклеиновой кислоты, предназначенной для встраивания или встраиваемой в клетку или организм. Трансгены включают любую нуклеиновую кислоту, такую как ген, транскрибируемый в транскрипт или кодирующий полипептид или белок.
[0091] Термин "элемент контроля экспрессии" относится к последовательностям нуклеиновой кислоты, влияющим на экспрессию функционально связанной нуклеиновой кислоты. Контрольные элементы, включая элементы контроля экспрессии, как указано в настоящем описании, такие как промоторы и энхансеры, векторные последовательности, включая векторы AAV, могут включать один или несколько "элементов контроля экспрессии". Как правило, такие элементы включают для облегчения правильной транскрипции гетерологичного полинуклеотида и правильной трансляции (например, промотор, энхансер, сигнал сплайсинга для интронов, поддержания правильной рамки считывания гена, чтобы сделать трансляцию мРНК в рамке считывания, и стоп-кодоны и т.д.). Такие элементы, как правило, действуют в цис-положении, их обозначают как "цис-действующий" элемент, но они также могут действовать в транс-положении.
[0092] Контроль экспрессии может осуществляться на уровне транскрипции, трансляции, сплайсинга, стабильности информации и т.д. Как правило, элемент контроля экспрессии, модулирующий транскрипцию, расположен рядом с 5'-концом (т.е. "выше") транскрибируемой нуклеиновой кислоты. Элементы контроля экспрессии также могут локализоваться на 3'-конце (т.е. "ниже") транскрибируемой последовательности или в транскрипте (например, в интроне). Элементы контроля экспрессии могут локализоваться смежно или на расстоянии от транскрибируемой последовательности (например, 1-10, 10-25, 25-50, 50-100, от 100 до 500 или более нуклеотидов от полинуклеотида), даже на значительном расстоянии. Тем не менее, вследствие ограничений по длине конкретных векторов, таких как векторы AAV, элементы контроля экспрессии, как правило, будут находиться в пределах от 1 до 1000 нуклеотидов от транскрибируемой нуклеиновой кислоты.
[0093] Функционально, экспрессия функционально связанной нуклеиновой кислоты, по меньшей мере, частично контролируется элементом (например, промотором) таким образом, что элемент модулирует транскрипцию нуклеиновой кислоты и, при необходимости, трансляцию транскрипта. Конкретным примером элемента контроля экспрессии является промотор, как правило, локализующийся в 5'-направлении от транскрибируемой последовательности. Промотор, как правило, повышает степень экспрессии функционально связанной нуклеиновой кислоты по сравнению со степенью экспрессии в отсутствие промотора.
[0094] В рамках изобретения, термин "энхансер" может относиться к последовательности, локализованной смежно с гетерологичным полинуклеотидом. Энхансерные элементы, как правило, локализуются выше промоторного элемента, но также функционируют и могут локализоваться ниже последовательности нуклеиновой кислоты или в ней. Таким образом, энхансерный элемент может локализоваться в 100 парах оснований, 200 парах оснований или 300 или более парах оснований выше или ниже нуклеиновой кислоты. Энхансерные элементы, как правило, повышают экспрессию функционально связанной нуклеиновой кислоты относительно экспрессии, обеспечиваемой промоторным элементом.
[0095] Экспрессирующая конструкция может содержать регуляторные элементы, регулирующие экспрессию в конкретном типе клеток или ткани. Элементы контроля экспрессии (например, промоторы) включают элементы, активные в конкретном типе ткани или клеток, обозначаемые в настоящем описании как "тканеспецифические элементы контроля экспрессии/промоторы". Тканеспецифические элементы контроля экспрессии, как правило, активны в конкретных клетках или ткани (например, печени). Элементы контроля экспрессии, как правило, активны в конкретных клетках, тканях или органах, т.к. они распознаются транскрипционными активаторными белками или другими регуляторами транскрипции, уникальными для конкретного типа клеток, ткани или органа. Такие регуляторные элементы известны специалистам в этой области (см., например, Sambrook et al. (1989) и Ausubel et al. (1992)).
[0096] Встраивание тканеспецифических регуляторных элементов в плазмиды по настоящему изобретению обеспечивает, по меньшей мере, частичный тканевой тропизм для экспрессии нуклеиновой кислоты. Примерами промоторов, активных в печени, являются промотор TTR, промотор альфа 1-антитрипсина человека (hAAT); промотор альбумина, Miyatake, et al. J. Virol., 71:5124-32 (1997); основной промотор вируса гепатита B, Sandig, et al., Gene Ther. 3:1002-9 (1996); альфа-фетопротеина (AFP), Arbuthnot, et al., Hum. Gene. Ther., 7:1503-14 (1996)], помимо прочего. Примером энхансера, активного в печени, является HCR-1 и HCR-2 аполипопротеина E (apoE) (Allan et al., J. Biol. Chem., 272:29113-19 (1997)).
[0097] Элементы контроля экспрессии также включают универсальные или промискуитетные промоторы/энхансеры, способные регулировать экспрессию полинуклеотида во множестве различных типов клеток. Такие элементы включают, в качестве неограничивающих примеров, последовательности предраннего промотора/энхансера цитомегаловируса (CMV), промоторные/энхансерные последовательности вируса саркомы Рауса (RSV) и другие вирусные промоторы/энхансеры, активные во множестве типов клеток млекопитающих, или синтетические элементы, не обнаруживаемые в природе (см., например, Boshart et al, Cell, 41:521-530 (1985)), промотор SV40, промотор дигидрофолатредуктазы, промотор цитоплазматического β-актина и промотор фосфоглицеринкиназы (PGK).
[0098] Элементы контроля экспрессии также могут обеспечивать экспрессию регулируемым образом, т.е. сигнал или стимулы повышают или снижают экспрессию функционально связанного гетерологичного полинуклеотида. Регулируемый элемент, повышающий экспрессию функционально связанного полинуклеотида в ответ на сигнал или стимулы, также обозначают как "индуцибельный элемент" (т.е. индуцируемый сигналом). Конкретные неограничивающие примеры включают гормон (например, стероид)-индуцибельный промотор. Как правило, степень повышения или снижения, обеспечиваемая такими элементами, пропорциональна степени присутствующего сигнала или стимулов; чем выше сигнал или стимулы, тем выше повышение или снижение экспрессии. Конкретные неограничивающие примеры включают цинк-индуцибельный промотор металлотионина (MT) овцы; стероид-индуцибельный промотор вируса рака молочных желез мыши (MMTV); промоторную систему полимеразы T7 (WO 98/10088); тетрациклин-репрессируемую систему (Gossen, et al., Proc. Natl. Acad. Sci. USA, 89:5547-5551 (1992)); тетрациклин-индуцибельную систему (Gossen, et al., Science. 268:1766-1769 (1995); см. также Harvey, et al., Curr. Opin. Chem. Biol. 2:512-518 (1998)); RU486-индуцибельную систему (Wang, et al., Nat. Biotech. 15:239-243 (1997) и Wang, et al., Gene Ther. 4:432-441 (1997)); и рапамицин-индуцибельную систему (Magari, et al., J. Clin. Invest. 100:2865-2872 (1997); Rivera, et al., Nat. Medicine. 2:1028-1032 (1996)). Другими регулируемыми контрольными элементами, которые могут быть применимы в этом контексте, являются элементы, регулируемые конкретным физиологическим состоянием, например, температурой, острой фазой, стадией развития.
[0099] Элементы контроля экспрессии также включают нативные элементы для нуклеиновой кислоты. Нативный контрольный элемент (например, промотор) можно использовать, когда желательно, чтобы экспрессия гетерологичного полинуклеотида имитировала нативную экспрессию. Нативный элемент можно использовать, если экспрессия гетерологичного полинуклеотида подлежит регуляции в зависимости от времени или стадии развития, или тканеспецифическим образом, или в ответ на конкретные транскрипционные стимулы. Также можно использовать другие нативные элементы контроля экспрессии, такие как интроны, участки полиаденилирования или консенсусные последовательности Козак.
[0100] Термин "функционально связанный" означает, что регуляторные последовательности, необходимые для экспрессии кодирующей последовательности, помещают в соответствующие положения относительно кодирующей последовательности для воздействия на экспрессию кодирующей последовательности. Это же определение иногда применимо к расположению кодирующих последовательностей и элементов контроля транскрипции (например, промоторов, энхансеров и элементов терминации) в экспрессирующем векторе. Это определение также иногда применимо к расположению последовательностей нуклеиновой кислоты первой и второй молекулы нуклеиновой кислоты, где получают гибридную молекулу нуклеиновой кислоты.
[0101] В примере элемента контроля экспрессии, функционально связанного с нуклеиновой кислотой, взаимосвязь является такой, что контрольный элемент модулирует экспрессию нуклеиновой кислоты. Более конкретно, например, то, что две последовательности ДНК являются функционально связанными, означает, что две ДНК расположены (в цис- или транс-положении) в такой взаимосвязи, что по меньшей мере одна из последовательностей ДНК способна производить физиологический эффект в отношении другой последовательности.
[0102] Таким образом, дополнительные элементы для векторов включают, в качестве неограничивающих примеров, элемент контроля экспрессии (например, промотор/энхансер), сигнал терминации транскрипции или стоп-кодон, 5'- или 3'-нетранслируемые области (например, последовательности полиаденилирования (поли-A)), фланкирующие последовательность, такие как одна или несколько копий последовательности ITR AAV, или интрон.
[0103] Дополнительные элементы включают, например, филлерные или спейсерные полинуклеотидные последовательности, например, для улучшения упаковки и снижения наличия контаминирующей нуклеиновой кислоты. В векторы AAV, как правило, можно встраивать вставки ДНК, имеющие размер в диапазоне, как правило, от приблизительно 4 т.п.н. до приблизительно 5,2 т.п.н. или немного больше. Таким образом, в случае более коротких последовательностей включение спейсера или филлера для корректировки длины для приближения к нормальному размеру или до нормального размера геномной последовательности вируса, подходящей для упаковки вектора AAV в вирусную частицу. В различных вариантах осуществления филлерная/спейсерная последовательность нуклеиновой кислоты является нетранслируемым (не кодирующим белок) сегментом нуклеиновой кислоты. В случае последовательности нуклеиновой кислоты размером менее 4,7 т.п.н. филлерная или спейсерная полинуклеотидная последовательность имеет длину, которая при комбинировании (например, встраивании в вектор) с последовательностью, дает общую длину приблизительно 3,0-5,5 т.п.н., или приблизительно 4,0-5,0 т.п.н., или приблизительно 4,3-4,8 т.п.н.
[0104] Интрон также может функционировать в качестве филлерной или спейсерной полинуклеотидной последовательности для достижения длины для упаковывания вектора AAV в вирусную частицу. Интроны и фрагменты интронов, функционирующие в качестве филлерной или спейсерной полинуклеотидной последовательности, также могут повышать экспрессию.
[0105] "Полипептиды", "белки" и "пептиды", кодируемые "нуклеиновой кислотой" или "плазмидами", включают полноразмерные нативные последовательности, как в природных белках дикого типа, а также функциональные подпоследовательности, модифицированные формы или варианты последовательности при условии, что подпоследовательность, модифицированная форма или вариант сохраняют некоторую степень функциональности нативного полноразмерного белка. Например, белок может включать делецию, замену или добавление и сохранять, по меньшей мере, частичную функцию или активность.
[0106] Термины "модифицировать" или "вариант" и их грамматические варианты означают, что нуклеиновая кислота или полипептид отличаются от референсной последовательности. Модифицированные последовательности и варианты последовательностей, таким образом, могут иметь, по существу, ту же, повышенную или сниженную экспрессию, активность или функцию относительно референсной последовательности, но сохраняют, по меньшей мере, частичную активность или функцию референсной последовательности.
[0107] Неограничивающие примеры модификаций включают одну или несколько замен нуклеотидов или аминокислот (например, 1-3, 3-5, 5-10, 10-15, 15-20, 20-25, 25-30, 30-40, 40-50, 50-100, 100-150, 150-200, 200-250, 250-500, 500-750, 750-850 или больше нуклеотидов или остатков).
[0108] Примером модификации аминокислот является консервативная аминокислотная замена или делеция (например, подпоследовательностей или фрагментов) референсной последовательности. В конкретных вариантах осуществления модифицированная последовательность или вариант последовательности сохраняет, по меньшей мере, часть функции или активности немодифицированной последовательности.
[0109] Включены формы нуклеиновых кислот, принадлежащие млекопитающим и не-млекопитающим, являющиеся транскрибируемыми, и нуклеиновые кислоты, кодирующие белки. Таким образом, настоящее изобретение включает гены и белки не-млекопитающих, млекопитающих, иных, чем люди, и людей, функционирующие, по существу, так же, как и гены и белки человека.
[0110] После продукции рекомбинантных вирусных (например, AAV) векторов, как указано в настоящем описании, при желании, вирусные (например, rAAV) вирионы можно очищать и/или выделять из клеток-хозяев множеством общепринятых способов. Такие способы включают хроматографию на колонках, использование градиента CsCl и т.п. Например, можно использовать множество стадий очистки на колонках, таких как очистка на анионообменной колонке, аффинной колонке и/или катионообменной колонке. (См., например, международную публикацию № WO 02/12455 и публикацию заявки США № 20030207439). Альтернативно или дополнительно, можно использовать стадии использования градиента CsCl. (См., например, публикацию заявки США №№ 20120135515 и 20130072548) Кроме того, если патогенный вирус используют для экспрессии упаковывающих и/или хелперных белков, остаточный вирус можно инактивировать различными способами. Например, аденовирус можно инактивировать посредством нагревания до температуры приблизительно 60°C в течение, например, 20 минут или более. Посредством этой обработки эффективно инактивируют хелперный вирус, т.к. AAV является термостабильным, в то время как хелперный аденовирус является термолабильным.
[0111] Термин "выделенный", при использовании в качестве определения композиции, означает, что композиции получены руками человека или отделены, полностью или, по меньшей мере, частично, от своего природного окружения in vivo. Как правило, выделенные композиции, по существу, не содержат один или несколько материалов, с которыми они, как правило, связаны в природе, например, одно или несколько загрязнений, таких как белок, нуклеиновая кислота, липид, углевод, клеточная мембрана.
[0112] Что касается молекул РНК, термин "выделенный", главным образом, относится к молекуле РНК, кодируемой выделенной молекулой ДНК, как определено выше. Альтернативно, термин может относиться к молекуле РНК, в достаточной степени отделенной от молекул РНК, с которыми она связана в своем природном состоянии (т.е. в клетках или тканях), таким образом, что она существует в "по существу, чистой" форме (термин "по существу, чистый" определен ниже).
[0113] Что касается белка, термин "выделенный белок" или "выделенный и очищенный белок" иногда используют в настоящем описании. Этот термин, главным образом, относится к белку, полученному посредством экспрессии выделенной молекулы нуклеиновой кислоты. Альтернативно, этот термин может относиться к белку, в достаточной степени отделенному от других белков, с которыми он был бы связан в природе, таким образом, что он существует в "по существу, чистой" форме.
[0114] Термин "выделенный" не исключает комбинации, полученные руками человека, например, последовательность рекомбинантного вектора (например, rAAV) или вирусная частица, упаковывающая или инкапсидирующая векторный геном и фармацевтический состав. Термин "выделенный" также не исключает альтернативные физические формы композиции, такие как гибриды/химеры, мультимеры/олигомеры, модификации (например, фосфорилирование, гликозилирование, липидирование), дериватизированные формы или формы, экспрессируемые в клетках-хозяевах, полученные руками человека.
[0115] Термин "по существу, чистый" относится к препарату, содержащему по меньшей мере 50-60% по массе интересующего соединения (например, нуклеиновой кислоты, олигонуклеотида, белка и т.д.). Препарат может содержать по меньшей мере 75% по массе или приблизительно 90-99% по массе интересующего соединения. Чистоту измеряют способами, подходящими для интересующего соединения (например, хроматографическими способами, с помощью электрофореза в агарозном или полиакриламидном геле, анализа ВЭЖХ и т.п.).
[0116] Молекулы нуклеиновой кислоты, экспрессирующие векторы (например, векторные геномы), плазмиды можно получать способами рекомбинантной ДНК. Доступность информации о нуклеотидной последовательности делает возможным получение выделенных молекул нуклеиновой кислоты множеством способов. Например, нуклеиновые кислоты (например, плазмиды) можно получать различными стандартными способами клонирования, технологии рекомбинантных ДНК, посредством клеточной экспрессии или трансляции in vitro и химического синтеза. Чистоту можно определять посредством секвенирования, электрофореза в геле и т.п. Например, нуклеиновые кислоты можно выделять с использованием гибридизации или компьютерных способов скрининга баз данных. Такие способы включают, в качестве неограничивающих примеров: (1) гибридизацию библиотек геномной ДНК или кДНК с использованием зондов для детекции гомологичных нуклеотидных последовательностей; (2) скрининг антител для детекции полипептидов, имеющих общие структурные признаки, например, с использованием библиотеки экспрессии; (3) полимеразную цепную реакцию (ПЦР) геномной ДНК или кДНК с использованием праймеров, способных отжигаться на интересующей последовательности нуклеиновой кислоты; (4) компьютерные поиски родственных последовательностей в базах данных последовательностей и (5) дифференциальный скрининг библиотеки вычитаемых нуклеиновых кислот.
[0117] Нуклеиновые кислоты можно поддерживать в виде ДНК в любом удобном клонирующем векторе. В одном из вариантов осуществления нуклеиновые кислоты поддерживают в плазмиде. Альтернативно, нуклеиновые кислоты можно поддерживать в векторе, подходящем для экспрессии в клетках млекопитающих.
[0118] Нуклеиновые кислоты, векторы, экспрессирующие векторы (например, rAAV) и рекомбинантные вирусные частицы, способы и применение по настоящему изобретению делают возможным лечение генетических заболеваний. В случае заболеваний, связанных с недостаточностями, перенос генов можно использовать для внесения нормального гена в поврежденные ткани для заместительной терапии, а также для создания моделей заболеваний на животных с использованием антисмысловых мутаций. В случае заболевания, связанного с несбалансированностью, перенос генов можно использовать для воспроизведения состояния заболевания в модельной системе, которую затем можно использовать в рамках усилий по противодействию заболеваний. Также можно использовать сайт-специфического встраивания последовательностей нуклеиновой кислоты для коррекции дефектов.
[0119] Вирусные векторы, такие как лентивирусные и парвовирусные векторы, включая серотипы и варианты AAV, обеспечивают средства для доставки нуклеиновой кислоты в клетки ex vivo, in vitro и in vivo, кодирующие белки таким образом, что клетки экспрессируют кодируемый белок. AAV являются вирусами, применимыми в качестве векторов для генной терапии, т.к. они могут проникать в клетки и встраивать нуклеиновую кислоту/генетический материал таким образом, что нуклеиновая кислота/генетический материал могут стабильно поддерживаться в клетках. Кроме того, с помощью этих вирусов можно встраивать нуклеиновую кислоту/генетический материал, например, в конкретные участки. Т.к. AAV не ассоциированы с инфекционным заболеванием у людей, векторы AAV способны доставлять гетерологичные полинуклеотидные последовательности (например, терапевтические белки и средства) пациентам-людям, не вызывая значительной инфекции AAV или заболевания.
[0120] Вирусные векторы, которые можно использовать, включают в качестве неограничивающих примеров векторы на основе аденоассоциированного вируса (AAV) множества серотипов (например, AAV-1-AAV-12 и др.) и гибридные/химерные векторы AAV, лентивирусные векторы и векторы на основе псевдотипированных лентивирусов (например, вируса Эбола, вируса везикулярного стоматита (VSV) и вируса иммунодефицита кошек (FIV)), векторы на основе вируса простого герпеса, аденовирусные векторы (с тканеспецифическими промоторами/энхансерами или без них), векторы на основе вируса осповакцины, ретровирусные векторы, лентивирусные векторы, невирусные векторы и др.
[0121] AAV и лентивирусные частицы можно использовать в качестве средств для эффективной доставки генов. Такие вирионы обладают рядом желаемых признаков для такого применения, включая тропизм к делящимся и неделящимся клеткам. Ранний опыт клинического использования этих векторов также не показал устойчивой токсичности, и иммунные ответы были минимальными или неопределимыми. Известно, что AAV инфицирует широкий спектр типов клеток in vivo и in vitro с помощью рецептор-опосредованного эндоцитоза или трансцитоза. Эти векторные системы тестируют на людях, исследуя эпителий сетчатки, печень, скелетные мышцы, дыхательные пути, головной мозг, суставы и гемопоэтические стволовые клетки. Невирусные векторы, например, на основе плазмидной ДНК или миниколец, также являются подходящими векторами для переноса генов.
[0122] Таким образом, в различных вариантах осуществления изобретения вектор включает лентивирусный или парвовирусный вектор, такой как аденовирусный вектор. В конкретных вариантах осуществления рекомбинантный вектор является парвовирусным вектором. Парвовирусы являются небольшими вирусами с одноцепочечным ДНК-геномом. "Аденоассоциированные вирусы" (AAV) входят в семейство парвовирусов.
[0123] Векторы AAV и лентивирусные векторы, как правило, не включают вирусные гены, ассоциированные с патогенезом инфекции. Такие векторы, как правило, содержат один или несколько генов AAV дикого типа, делетированные полностью или частично, например, гены rep и/или cap, но сохраняют по меньшей мере одну функциональную фланкирующую последовательность ITR, при необходимости, для спасения, репликация и упаковки рекомбинантного векторов в частицу вектора AAV. Например, включены только необходимые части вектора, например, элементы ITR и LTR, соответственно. Векторный геном AAV, таким образом, будет включать последовательности, необходимые в цис-положении для репликации и упаковки (например, функциональные последовательности ITR).
[0124] Рекомбинантный вектор AAV, а также способы и их применения включают любой вирусный штамм или серотип. В качестве неограничивающего примера, рекомбинантный вектор AAV может быть основан на любом геноме AAV, например, такого как AAV-1, -2, -3, -4, -5, -6, -7, -8, -9, -10, -11, -12 или AAV-2i8. Такие векторы могут быть основаны на одном штамме или серотипе (или подгруппе или варианте) или отличаться друг от друга. В качестве неограничивающего примера, рекомбинантный вектор AAV, основанный на геноме одного серотипа, может иметь серотип, идентичный серотипу одного или нескольких белков капсида, упаковывающих вектор. Кроме того, рекомбинантный векторный геном AAV может быть основан на геноме серотипа AAV (например, AAV2), отличающемся от одного или нескольких белков капсида AAV, упаковывающих вектор. Например, векторный геном AAV может быть основан на AAV2, в то время как по меньшей мере один из трех белков капсида может относиться, например, к AAV1, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12 или AAV-2i8 или его варианту. Варианты AAV включают варианты и химеры капсидов AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12 и AAV-2i8.
[0125] В конкретных вариантах осуществления векторы на основе аденоассоциированного вируса (AAV) включают AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12 и AAV-2i8, а также их варианты (например, варианты капсида, такие как инсерции, добавления, замены и делеции аминокислот), например, как указано в WO 2013/158879 (международная заявка № PCT/US2013/037170), WO 2015/013313 (международная заявка № PCT/US2014/047670) и US 2013/0059732 (заявка США № 13/594773, в которой описывают LK01, LK02, LK03 и т.д.).
[0126] AAV и варианты AAV серотипов (например, варианты капсида) (например, последовательности VP1, VP2 и/или VP3) могут отличаться или не отличаться от других серотипов AAV, включая, например, AAV1-AAV12 (например, отличающиеся от последовательностей VP1, VP2 и/или VP3 любого из серотипов AAV1-AAV12).
[0127] В рамках изобретения, термин "серотип" представляет собой различие, используемое для обозначения AAV, имеющего капсид, серологически отличающийся от других серотипов AAV. Серологическое различие определяют на основе отсутствия перекрестной реактивности между антителами против одного AAV по сравнению с другим AAV. Такие различия перекрестной реактивности, как правило, являются результатом различий в последовательностях/антигенных детерминантах белков капсида (например, по причине различий последовательностей VP1, VP2 и/или VP3 серотипов AAV). Несмотря на вероятность того, что варианты AAV, включая варианты капсида, могут серологически не отличаться от референсного серотипа AAV или другого серотипа AAV, они отличаются по меньшей мере одним нуклеотидом или аминокислотным остатком по сравнению с референсным или другим серотипом AAV.
[0128] В рамках традиционного определения, термин "серотип" означает, что представляющий интерес вирус тестируют против сыворотки, специфичной для всех существующих и охарактеризованных серотипов, на нейтрализующую активность, и не обнаруживают антитела, нейтрализующие представляющий интерес вирус. С открытием все большего количества изолятов природного вируса и/или получением мутантов капсида могут возникать или не возникать серологические различия с любым из существующих в настоящее время серотипов. Таким образом, в случае, если новый вирус (например, AAV) не имеет серологических отличий, этот новый вирус (например, AAV) будет относиться к подгруппе или варианту соответствующего серотипа. Во многих случаях серологическое тестирование на нейтрализующую активность еще предстоит провести на мутантных вирусах с модификациями последовательности капсида для определения того, принадлежат ли они к другому серотипу в соответствии с общепринятым определением серотипа. Таким образом, для краткости и во избежание повторения термин "серотип" в широком смысле относится к серологически отличающимся вирусам (например, AAV), а также вирусам (например, AAV), не отличающимся серологически, которые могут относиться к подгруппе или варианту указанного серотипа.
[0129] В различных примерах вариантов осуществления вектор AAV, относящийся к референсному серотипу, содержит полинуклеотид, полипептид или подпоследовательность, включающую или состоящую из последовательности, по меньшей мере на 80% или более (например, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 99,1%, 99,2%, 99,3%, 99,4%, 99,5%, и т.д.) идентичной одному или нескольким из AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12 или AAV-2i8 (например, такой как ITR или последовательности VP1, VP2 и/или VP3).
[0130] Композиции, способы и применение по изобретению включают последовательности AAV (полипептиды и нуклеотиды) и их подпоследовательности, проявляющие менее 100% идентичности последовательности по отношению к референсному серотипу AAV, такому как AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12 или AAV-2i8, но отличающиеся и неидентичные известным генам или белкам AAV, таким как гены или белки AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12 или AAV-2i8 и т.д. В одном из вариантов осуществления полипептид AAV или его подпоследовательность включает или состоит из последовательности, по меньшей мере на 75% или более идентичную, например, на 80%, 85%, 85%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,1%, 99,2%, 99,3%, 99,4%, 99,5% и т.д., на 100% идентичную любой референсной последовательности AAV, такого как AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12 или AAV-2i8 (например, белку капсида VP1, VP2 и/или VP3 или ITR), или ее подпоследовательности. В конкретных аспектах вариант AAV содержит 1, 2, 3, 4, 5, 5-10, 10-15, 15-20 или более замен аминокислот.
[0131] Рекомбинантные векторы AAV, включая AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12 или AAV-2i8 и варианты последовательности, родственные, гибридные и химерные последовательности можно конструировать рекомбинантными способами, известными специалистам в этой области, так, чтобы они включали одну или несколько последовательностей нуклеиновой кислоты (трансгенов), фланкированных одной или несколькими функциональными последовательностями ITR AAV.
[0132] Нуклеиновые кислоты (плазмиды), векторы, рекомбинантные векторы (например, rAAV) и рекомбинантные вирусные частицы можно включать в фармацевтические композиции. Такие фармацевтические композиции применимы, в частности, для введения и доставки индивидууму in vivo или ex vivo. В конкретных вариантах осуществления фармацевтические композиции содержат фармацевтически приемлемый носитель или эксципиент. Такие эксципиенты включают любое фармацевтическое средство, само по себе не индуцирующее иммунный ответ, вредный для индивидуума, которому вводят композицию, и которое можно вводить без нежелательной токсичности.
[0133] В рамках изобретения, термин "фармацевтически приемлемый" и "физиологически приемлемый" означает биологически приемлемый состав, газообразный, жидкий или твердый, или их смесь, подходящий для одного или нескольких путей введения, доставки in vivo или контакта. "Фармацевтически приемлемая" или "физиологически приемлемая" композиция является материалом, не являющимся биологически или иным образом нежелательным, например, материал можно вводить индивидууму, не вызывая существенные нежелательные биологические эффекты. Таким образом, такую фармацевтическую композицию можно использовать, например, при введении индивидууму нуклеиновой кислоты, вектора, вирусной частицы или белка.
[0134] Фармацевтически приемлемые эксципиенты включают, в качестве неограничивающих примеров, жидкости, такие как вода, физиологический раствор, глицерин, сахара и этанол. В них также можно включать фармацевтически приемлемые соли, например, соли неорганических кислот, такие как гидрохлориды, гидробромиды, фосфаты, сульфаты и т.п.; и соли органических кислот, такие как ацетаты, пропионаты, малонаты, бензоаты и т.п. Кроме того, в таких средствах могут присутствовать вспомогательные вещества, такие как увлажнители или эмульгаторы, pH-буферные вещества и т.п.
[0135] Фармацевтическую композицию можно предоставлять в виде соли и ее можно получать с использованием многих кислот, включая, в качестве неограничивающих примеров, соляную, серную, уксусную, молочную, винную, яблочную, янтарную кислоту и т.д. Соли имеют тенденцию к большей растворимости в водных или других протонных растворителях, чем соответствующие свободные основания. В других случаях препарат может представлять собой лиофилизированный порошок, который может содержать любое или все из следующего: 1-50 мМ гистидина, 0,1%-2% сахарозы и 2-7% маннита, при диапазоне pH от 4,5 до 5,5, который комбинируют с буфером перед использованием.
[0136] Фармацевтические композиции включают растворители (водные или неводные), растворы (водные или неводные), эмульсии (например, "масло-в-воде" или "вода-в-масле"), суспензии, сиропы, эликсиры, дисперсионные и суспензионные среды, покрытия, изотонические и стимулирующие абсорбцию или замедляющие средства, совместимые с фармацевтическим введением или контактом или доставкой in vivo. Водные или неводные растворители, растворы и суспензии могут включать суспендирующие средства и загустители. Такие фармацевтически приемлемые носители включают таблетки (покрытые или непокрытые), капсулы (твердые или мягкие), микрочастицы, порошок, гранулы и кристаллы. В композиции также можно включать вспомогательные активные соединения (например, консерванты, антибактериальные, противовирусные и противогрибковые средства).
[0137] Фармацевтические композиции можно составлять так, чтобы они были совместимыми с конкретным путем введения или доставки. Таким образом, фармацевтические композиции включают носители, дилюенты или эксципиенты, подходящие для введения различными путями.
[0138] Композиции и способы могут быть стерильными. Композиции можно получать и способы можно осуществлять в контейнерах, подходящих для таких способов. Такие контейнеры включают чашки, флаконы, роллерные флаконы, мешки, биореакторы, сосуды, пробирки и т.д. Контейнеры можно делать из материалов, включающих, в качестве неограничивающих примеров, стекло, пластик и полимеры, такие как полистирол, полибутилен, полипропилен и т.д.
[0139] Композиции и стадии способа можно осуществлять в определенном порядке или перегруппированном порядке. Стадии способа можно осуществлять постадийно или с временными интервалами. Другими словами, можно осуществлять стадию способа, а затем следует временной интервал до следующей стадии, такие интервалы находятся в диапазоне, например, от приблизительно 1 секунды до приблизительно 60 секунд; от приблизительно 1 минуты до приблизительно 60 минут; от приблизительно 1 часа до приблизительно 24 часов; от приблизительно 1 дня до приблизительно 7 дней или от приблизительно 1 недели до приблизительно 48 недель.
[0140] Способы получения аденовирусных векторов описаны в патентах США №№ 5998205; 6228646; 6093699 и 6100242 и международных патентных заявках №№ WO 94/17810 и WO 94/23744, включенных в настоящее описание в качестве ссылки в полном объеме.
[0141] Настоящее изобретение применимо в получении клеток и векторов для медицинского применения у людей и ветеринарного применения. Таким образом, подходящие индивидуумы включают млекопитающих, таких как люди, а также не являющиеся человеком млекопитающие. Термин "индивидуум" относится к животному, как правило, млекопитающему, такому как люди, не являющиеся человеком приматы (обезьяны, гиббоны, гориллы, шимпанзе, орангутаны, макаки), домашние животные (собаки и кошки), сельскохозяйственные животные (домашняя птица, такая как курицы и утки, лошади, коровы, козы, овца, свиньи) и экспериментальные животные (мышь, крыса, кролик, морская свинка). Люди включают плод, новорожденных, младенцев, подростков и взрослых индивидуумов. Индивидуумы включают модели заболеваний на животных, например, мышиные и другие модели нарушений свертываемости крови на животных, таких как HemA и другие модели, известные специалистам в этой области.
[0142] В рамках изобретения, термин "стандартная лекарственная форма" относится к физически дискретным единицам, применимым в качестве однократных доз для индивидуума, подлежащего лечению; каждая единица содержит заранее определенное количество, необязательно, с фармацевтическим носителем (эксципиентом, дилюентом, средством или наполнителем), которое при введении в одной или нескольких дозах вычисляют для получения желаемого эффекта (например, профилактического или терапевтического эффекта). Стандартные лекарственные формы могут находиться, например, в ампулах и сосудах, которые могут включать жидкую композицию или композицию в лиофилизированной форме; можно добавлять стерильный жидкий носитель, например, перед введением или доставкой in vivo. Отдельные стандартные лекарственные формы можно включать в многодозовые наборы или контейнеры. Последовательности рекомбинантного вектора (например, rAAV), рекомбинантные вирусные частицы и их фармацевтические композиции можно упаковывать в однодозовую или многодозовую стандартную лекарственную форму для простоты введения и единообразия дозирования.
[0143] Изобретение относится к наборам с упаковочным материалом и одним или несколькими компонентами в нем. Набор, как правило, включает ярлык или упаковочный вкладыш, включающий описание компонентов или инструкции по использованию компонентов. Набор может содержать комплект таких компонентов, например, нуклеиновую кислоту (плазмиду), PEI, клетки.
[0144] Термин "набор" относится к физической структуре, в которой размещают один или несколько компонентов набора. С помощью упаковочного материала можно поддерживать компоненты в стерильной форме, и его можно получать из материала, общеупотребительного для таких целей (например, бумаги, гофрированного волокна, стекла, пластика, фольги, ампул, сосудов, пробирок и т.д.).
[0145] Ярлыки или вкладыши могут включать маркировку одного или нескольких компонентов набора. Ярлыки или вкладыши могут включать информацию о производителе, номере партии, месте и дате производства, дате истечения срока годности. Ярлыки или вкладыши могут включать информацию о производителе, номере партии, месте и дате производства. Ярлыки или вкладыши могут включать инструкции по использованию одного или нескольких компонентов набора для осуществления способа, применению или протокол производства. Инструкции могут включать инструкции по получению композиций или практического осуществления любого из способов, представленных в настоящем описании.
[0146] Ярлыки или вкладыши включают "печатный материал", например, бумагу или картон, отдельный или прикрепленный к компоненту, набору или упаковочному материалу (например, коробке), или прикрепленный к ампуле, пробирке или сосуду, содержащим компонент набора. Ярлыки или вкладыши могут дополнительно включать машиночитаемые материалы, такие как отпечатанная этикетка со штрих-кодом, диск, оптический диск, такой как CD- или DVD-ROM/RAM, DVD, MP3, магнитная пленка или средства для хранения в электронном виде, такие как RAM и ROM, или их гибриды, такие как магнитные/оптические средства хранения, FLASH-устройства или карты памяти.
[0147] Если не указано иначе, все технические и научные термины, используемые в настоящем описании, обладают тем же значением, которое общепринято понятно специалисту в области, к которой принадлежит изобретение. Хотя в практическом осуществлении или тестировании настоящего изобретения можно использовать способы и материалы, схожие или эквивалентные представленным в настоящем описании, подходящие способы и материалы представлены в настоящем описании.
[0148] Все патенты, патентные заявки, публикации и другие ссылки, ссылки на GenBank и ссылки на ATCC, указанные в настоящем описании, включены в настоящее описание в качестве ссылок в полном объеме. В случае конфликта настоящее описание, включая определения, будет обладать приоритетом.
[0149] Различные термины, относящиеся к биологическим молекулам по изобретению, используют в настоящем описании выше, а также на всем протяжении описания и формулы изобретения.
[0150] Все из признаков, представленных в настоящем описании, можно комбинировать в любой комбинации. Каждый признак, представленный в настоящем описании, можно заменять альтернативным признаком, служащим той же, эквивалентной или схожей цели. Таким образом, если конкретно не указано иное, описываемые признаки (например, PEI, плазмида, вектор (например, rAAV или рекомбинантная вирусная частица) являются примером класса эквивалентных или схожих признаков.
[0151] В рамках изобретения, формы в единственном числе включают формы во множественном числе, если контекст четко не указывает на иное. Таким образом, например, ссылка на "плазмиду" или "нуклеиновую кислоту" включает множество таких плазмид или нуклеиновых кислот, ссылка на "вектор" включает множество таких векторов, и ссылка на "вирус" или "частицу" включает множество таких вирусов/частиц.
[0152] В рамках изобретения, все числовые значения или числовые диапазоны включают целые числа в пределах таких диапазонов и доли таких значений или целых чисел в пределах таких диапазонов, если контекст четко не указывает на иное. Таким образом, в качестве иллюстрации, ссылка 80% или большую идентичность, включает 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94% и т.д., а также 81,1%, 81,2%, 81,3%, 81,4%, 81,5% и т.д., 82,1%, 82,2%, 82,3%, 82,4%, 82,5% и т.д.
[0153] Ссылка на целое значение с определением "больше (выше)" или "меньше" включает любое количество, больше или меньше референсного количества, соответственно. Таким образом, например, ссылка на "менее 100" включает 99, 98, 97 и т.д. вплоть до числа один (1); и "менее 10" включает 9, 8, 7 и т.д. вплоть до числа один (1).
[0154] В рамках изобретения, все числовые значения или диапазоны включают доли значений и целые числа в пределах таких диапазонов и долей целых чисел в пределах таких диапазонов, если контекст четко не указывает на иное. Таким образом, в качестве иллюстрации, ссылка на числовой диапазон, такой как 1-10, включает 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, а также 1,1, 1,2, 1,3, 1,4, 1,5 и т.д. Таким образом, ссылка на диапазон 1-50 включает 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 и т.д., до 50 и включая 50, а также 1,1, 1,2, 1,3, 1,4, 1,5 и т.д., 2,1, 2,2, 2,3, 2,4, 2,5 и т.д.
[0155] Ссылка на серию диапазонов включает диапазоны, в которых комбинируют значения границ различных диапазонов в сериях. Таким образом, в качестве иллюстрации, ссылка на серию диапазонов, например, 1-10, 10-20, 20-30, 30-40, 40-50, 50-60, 60-75, 75-100, 100-150, 150-200, 200-250, 250-300, 300-400, 400-500, 500-750, 750-850, включает диапазоны 1-20, 1-30, 1-40, 1-50, 1-60, 10-30, 10-40, 10-50, 10-60, 10-70, 10-80, 20-40, 20-50, 20-60, 20-70, 20-80, 20-90, 50-75, 50-100, 50-150, 50-200, 50-250, 100-200, 100-250, 100-300, 100-350, 100-400, 100-500, 150-250, 150-300, 150-350, 150-400, 150-450, 150-500 и т.д.
[0156] Настоящее изобретение, в целом, представлено в настоящем описании с использованием утвердительного языка для описания многочисленных вариантов осуществления и аспектов. Настоящее изобретение также конкретно включает варианты осуществления, из которых полностью или частично исключен конкретный объект, такой как вещества или материалы, стадии и условия способа. Например, из определенных вариантов осуществления или аспектов по изобретению исключены материалы и/или стадии способа. Таким образом, даже притом, что настоящее изобретение, в целом, не представлено в настоящем описании в терминах того, что в него не включают, в настоящем описании представлены аспекты, не исключенные конкретно.
[0157] Описан ряд вариантов осуществления изобретения. Несмотря на это, специалист в этой области, не отклоняясь от сущности и объема изобретения, может осуществлять различные изменения и модификации изобретения для его адаптации к различному применению и условиям. Таким образом, следующие примеры представлены в иллюстративных целях, а не для какого-либо ограничения заявленного объема изобретения.
ПРИМЕР 1
[0158] Этот пример включает описание различных материалов и способов.
[0159] Культура клеток: клетки FreeStyle™ 293F (293F,) приобретенные в Thermo Fisher Scientific (Invitrogen™, Thermo Fisher Scientific, R790-07), культивировали в среде для экспрессии FreeStyle™ F17 (F17) (Gibco кат. № A13835-01) или среде для экспрессии FreeStyle™ 293 (FS) (Gibco кат. № 12338-018), дополненной 4 мМ GlutaMAX (Life Technologies, кат. № 35050-061). Клетки культивировали в различных устройствах для культивирования клеток, включая колбы с мешалкой и биореакторы. В случае культивирования в колбе с мешалкой (Bellco Glass, кат. № 1965-83100 или Corning, кат. № 3152) клетки культивировали в инкубаторе при 37°C с перемешиванием при 70 об./мин. и во влажной атмосфере 8% CO2; в случае биореакторов (параллельная система биореакторов DASGIP, Eppendorf) культуру клеток контролировали с помощью программируемых параметров (DO 30%, pH 7,2, 170 или 150 об./мин.). Как правило, клетки высевали в количестве 0,25-0,5×106/мл, субкультивировали каждые 2-3 дня, когда плотность клеток достигала приблизительно 1,6-2×106/мл, посредством добавления свежих сред для культивирования клеток. Плотность клеток и жизнеспособность определяли с использованием гемоцитометра после окрашивания трипановым синим.
[0160] Плазмиды: для получения рекомбинантных векторов на основе аденоассоциированных вирусов (rAAV) использовали три плазмиды: 1) трансгенную плазмиду, содержащую eGFP, фланкированный ITR; 2) упаковывающую плазмиду, содержащую гены rep и cap серотипа 2 AAV; и 3) аденовирусную хелперную плазмиду, содержащую гены E2, E4 и VARNA аденовируса. Все плазмиды приобретены и произведены в Aldevron.
[0161] Получение растворов PEI: Линейный полиэтиленимин (PEI) 25 кДа (Polysciences, кат. № 23966-2), PEI "Max" 40 кДа ((Polysciences, кат. № 24765-2, гидрохлоридная соль линейного PEI 25 кДа) и PEIpro (Polyplus, кат. № 115-010) использовали в качестве реагентов для трансфекции. Для большинства исследований по трансфекции PEI "Max" растворяли в 5 мМ Трис для получения раствора 0,5 мг/мл и доводили pH до 7,10. PEI 25 кДа сначала растворяли в горячей воде с температурой 80°C, после охлаждения добавляли буфер Трис для получения 0,5 мг/мл PEI в 5 мМ буферном растворе Трис, pH 7,10. Для некоторых исследований, в которых PEI "Max" 40 кДа сравнивали с PEI 25 кДа в отношении трансфекции, PEI 40 кДа и 25 кДа растворяли в 5 мМ буфере Трис с 150 мМ NaCl или без него или в воде с 150 мМ NaCl или без него, pH доводили до 7,10.
[0162] Трансфекция: клетки 293F выращивали в колбах с мешалкой в среде FS или среде F17 с добавкой 4 мМ GlutaMAX™. За день до трансфекции клетки субкультивировали посредством добавления свежих сред, в день трансфекции плотность клеток определяли с использованием гемоцитометра и клетки дополнительно разводили свежими средами FS или средами F17 до конечной плотности 0,35-1×106 клеток/мл, трансфекцию осуществляли в лунках с суспензионными культурами клеток или колбах с мешалкой.
[0163] Три плазмиды, описанные выше, использовали в трансфекции в молярном соотношении 1:1:1. Общее количество ДНК, используемое для трансфекции, составляло от 0,7 до 11,2 мкг на мл культуры клеток. Комплекс PEI/ДНК получали с использованием другого соотношения PEI и ДНК, инкубировали при комнатной температуре в течение от 1 мин до 30 мин, затем комплексы ДНК/PEI по каплям добавляли к культуре клеток. Для оценки эффекта свободного PEI в отношении эффективности трансфекции и производительности rAAV молекулы PEI получали так, как описано выше, без инкубации с ДНК и добавляли к культуре клеток сразу после добавления комплексов ДНК/PEI. Образцы, включая клетки и среды для культивирования клеток, получали через 24, 48 и 72 ч. после трансфекции для оценки эффективности трансфекции и других анализов и культуру клеток собирали через 72 ч. после трансфекции.
[0164] Эффективность трансфекции оценивали с использованием инвертированного флуоресцентного микроскопа (Leica) или проточного цитометра (Becton Dickinson Biosciences). eGFP-положительные клетки определяли с использованием флуоресцентного микроскопа. Процентную долю GFP-положительных клеток оценивали с использованием проточного цитометра BD FACS Canto.
[0165] Получение векторов rAAV в биореакторах: для масштабирования способа получения вектора использовали 2-литровую параллельную систему биореакторов DASGIP (Eppendorf), оборудованную двумя наклонными лопастными мешалками. В исследованиях конечный рабочий объем доводили до 400 мл. Перемешивание осуществляли при 150 об./мин. или 170 об./мин., температуру поддерживали при 37°C, и pH составлял 7,2 в течение культивирования клеток. Растворенный кислород поддерживали на уровне 30% посредством доведения газовой смеси кислорода, диоксида углерода и воздуха. Все эти параметры подвергали мониторингу и контролировали с помощью контрольной системы DASGIP с использованием программного обеспечения DASGIP Control 4.0. Клетки 293F, культивируемые в среде F17, инокулировали при плотности клеток 0,4×106 клеток/мл с жизнеспособностью более 95%. Клетки субкультивировали в день 2 или день 3 после высевания посредством добавления свежей среды, плотность клеток составляла приблизительно 0,4-0,7×106 клеток/мл после субкультивирования. Через двадцать четыре часа после субкультивирования клетки трансфицировали с использованием комплекса PEI/ДНК, как описано в подписях, и плотность клеток составляет приблизительно 1×106 клеток/мл при трансфекции. Массовое соотношение PEI/ДНК составляло 2:1, при этом 1/2 PEI представляла собой свободный PEI при трансфекции. Образцы отбирали каждые 24-72 ч.
[0166] Количественный анализ векторов rAAV: векторы rAAV высвобождались из сбора трансфицированных клеток 293F при осуществлении трех циклов замораживания/размораживания или трехкратного пропускания через Microfluidizer™ (Microfluidics). Клеточный детрит осаждали посредством центрифугирования и собирали супернатанты для ПЦР в реальном времени и анализов трансдукции.
[0167] Копийность векторного генома AAV определяли с использованием полимеразной цепной реакции в реальном времени (Q-ПЦР) (QuanStudio 7, Life Technologies) с TaqMan Master Mix (кат. № 4304437, Life technologies). 10 мкл клеточного лизата обрабатывали 7,6 ед. ДНКазы I (кат. № 79254, Qiagen) для расщепления контаминирующей неукапованной ДНК, а затем обрабатывали 0,2% SDS/5 мМ ЭДТА/0,2M NaCl при 95°C в течение 10 мин для инактивации ДНКазы I и высвобождения векторной ДНК. С помощью праймеров и зонда определяли последовательность трансгена eGFP: прямой праймер: 5'-GCACAAGCTGGAGTACAACTA-3', обратный праймер 5'-TGTTGTGGCGGATCTTGAA-3' и зонд 5'-/56-FAM/AGCAGAAGA/ZEN/ACGGCATCAAGGTGA/3IABkFQ/-3'. Для получения стандартной кривой плазмиду pAAV-eGFP-WRPE линеаризировали посредством расщепления HindIII-HF и использовали в серийных разведениях 1:5 от 1×108 до 1,28×103 копий гена. Все образцы анализировали в трех параллелях.
[0168] Анализы трансдукции осуществляли посредством добавления 50 мкл клеточных лизатов к клеткам HEK 293, высеянным в 48-луночные планшеты. В каждую лунку добавляли этопозид во время трансдукции до конечной концентрации 3 мкМ. После 48 ч. инкубации GFP-положительные клетки оценивали с использованием инвертированного флуоресцентного микроскопа.
ПРИМЕР 2
[0169] Этот пример включает описание различных результатов.
[0170] Эффект сред для трансфекции в отношении эффективности трансфекции и получения rAAV: для разработки масштабируемой системы бессывороточной суспензионной культуры для крупномасштабного получения вектора rAAV несколько сред, подходящих для суспензионной культуры клеток, включая среду FS, среду F17, SFM4Transfx-293 и др., оценивали на рост клеток 293F. Исследования показали, что среда FS293 и среда F17 поддерживают хороший рост клеток - плотность клеток достигала 2,5-3×106 клеток/мл в колбе с мешалкой. Эти две среды также поддерживают эффективную трансфекцию генов в клетки 293F.
[0171] Эффект свободного PEI в отношении эффективности трансфекции и получения rAAV: Высокая эффективность трансфекции - это шаг к достижению высокой продукции rAAV. Полиэтиленимин (PEI), в качестве реагента для трансфекции, использовали для трансфекции клеток 293F в суспензионной культуре.
[0172] Среди множества оцениваемых параметров молярное соотношение азота (N) в молекуле PEI и фосфата (P) в ДНК (соотношение N:P) значительно влияет на эффективность трансфекции, от очень плохой трансфекции до высокоэффективной трансфекции, когда соотношение N:P меняли с низкого на высокое. При высоком соотношении N:P, таком как соотношение N:P 30, также обнаруживали цитотоксичность при его использовании для трансфекции.
[0173] Исследовали несколько различных молекул PEI, включая PEI "Max" 40 кДа, PEI 25 кДа, PEIPro и др. Молекулы PEI получали с использованием буфера Трис или воды DI с 150 мМ NaCl или без него при pH 7,1, подходящее количество плазмидной ДНК смешивали с молекулами PEI при фиксированном соотношении N:P, инкубировали при комнатной температуре в течение различных периодов времени, таких как 1 минута, 5 минут, 10 минут, 15 минут, 20 минут и до 30 минут, а затем использовали для трансфекции клеток.
[0174] Данные свидетельствовали о том, что PEI "Max" 40 кДа и PEI 25 кДа обеспечивали высокую эффективность трансфекции клеток, при этом PEI "Max" 40 кДа обеспечивал неизменно высокую эффективность трансфекции (фиг. 1). Таким образом, основную часть данных получали с использованием PEI "Max" 40 кДа в качестве реагента для трансфекции.
[0175] Векторы RAAV получали посредством трансфекции клеток 293F с использованием трех плазмид, как описано в материалах и способах. Для культивирования клеток 293F и получения векторов rAAV использовали различные устройства для культивирования клеток, включая 12-луночный планшет, колбу с мешалкой для культивирования клеток и биореактор. Для трансфекции клеток получали смесь PEI/ДНК с массовым соотношением 2:1 и 4:1. Различные количества ДНК на мл культуры клеток тестировали на эффективность трансфекции и для трансфекции, как правило, использовали молярное соотношение 1:1:1 среди трех плазмид. Клетки 293F культивировали в бессывороточной суспензионной культуре с использованием среды FS и среды F17.
[0176] PEI-опосредованный перенос генов является очень сложным биологическим клеточным процессом, включающим связывание с клеточными рецепторами, эндоцитоз, внутриклеточный транспорт, проникновение в ядро и экспрессию генов, которые представляют собой лишь немногие из ключевых стадий. Не желая быть связанными какой-либо теорией, полагают, что соответствующее количество свободных молекул PEI может повышать эффективность трансфекции и, в свою очередь, повышать продукцию rAAV.
[0177] Как указано на фиг. 2A, эффективность трансфекции клеток значительно улучшали при добавлении свободных молекул PEI к культуре клеток сразу после добавления комплекса ДНК/PEI к культуре клеток по сравнению с эффективностью трансфекции при использовании лишь комплекса ДНК/PEI. Это явление, когда свободный PEI улучшал эффективность трансфекции, наблюдали в 12-луночных планшетах для клеточных культур (фиг. 2A), колбах с мешалкой для культивирования клеток и биореакторе. Кроме того, продукция вектора rAAV соответствующим образом повышалась при добавлении свободных молекул PEI при трансфекции - получали в 2-3 раз больше вектора rAAV (фиг. 2B).
[0178] Открытие того, что свободный PEI повышает эффективность трансфекции и продукцию rAAV, дополнительно тестировали в более крупномасштабной культуре клеток, колбах с мешалкой и биореакторах. Результаты трансфекции в колбах с мешалкой со свободным PEI или без него (фиг. 3) соответствовали обнаруженному в случае 12-луночных планшетов, а именно в том, что эффективность трансфекции значительно повышалась при использовании в трансфекции свободного PEI, и производительность rAAV повышалась в 2-3 раза, с 1,3E+10 векторных геномов (ВГ) на мл клеточного лизата без свободного PEI до приблизительно 2,4E+10 ВГ/мл со свободным PEI.
[0179] Статус роста клеток при трансфекции также оказывал значительное влияние на продукцию вектора rAAV в биореакторе. Для дополнительной оценки способов улучшения продукции rAAV тестировали статус роста клеток для определения влияния на выход вектора rAAV. В суспензионной культуре клеток клетки высевали в количестве 0,25×106 клеток/мл, 0,35×106 клеток/мл и 0,5×106 клеток/мл и получали кривую роста клеток в течение 7 дней культивирования клеток (фиг. 4) в 2-литровом биореакторе. Фазы роста клеток определяли приблизительно и фазу экспоненциального роста определяли в период от 48 до 84 ч. Пик плотности клеток составлял 4,8-5,8×106 клеток/мл в день 6, а затем плотность клеток начинала снижаться. Жизнеспособность клеток в течение культивирования составляла более 90%.
[0180] Для трансфекции и получения rAAV клетки 293F инокулировали при плотности клеток 0,4×106 клеток/мл с жизнеспособностью более 95% в 2-литровом биореакторе с рабочими объемами приблизительно 400 мл. При попытке идентифицировать лучшее временное окно в течение культивирования клеток для трансфекции плазмиды и получения rAAV обнаруживали, что трансфекция клеток при разном статусе культивирования клеток также имела достоверный эффект в отношении выхода rAAV.
[0181] Затем клетки субкультивировали в день 2 или день 3 после высевания клеток посредством добавления свежих сред для культивирования клеток для снижения плотности клеток, плотности клеток находились в диапазоне 0,4-0,7×106 клеток/мл. Затем клетки трансфицировали через 24 часа после субкультивирования с использованием PEI-опосредованного способа трансфекция, как описано. Как правило, плотности клеток при трансфекции будут достигать от 7E+05 клеток/мл до 1,3E+06 клеток/мл сред. Условия двух независимых экспериментов и соответствующие результаты приведены в таблице 1.
Таблица 1. Получение вектора rAAV в биореакторе
Трансфекция (TF)
[0182] По-видимому, субкультивирование клеток в день 3 после высевания и трансфекция клеток в день 4 после высевания приводили к значимо более высокой производительности rAAV по сравнению с субкультивированием клеток в день 2 после высевания и трансфекции в день 3 после высевания.
[0183] Важно отметить, что эффективность трансфекции, по-видимому, не отличалась между этими двумя сравниваемыми условиями, на что указывают данные, представленные на фиг. 5. Как показано, фиг. 5A представляет собой сравнение эффективности трансфекции, на что указывает экспрессия гена eGFP, и на фиг. 5B представлены более количественные данные FACS, позволяющие предполагать, что приблизительно 50% клеток были трансфицированы во всех тестируемых условиях; однако титр вектор был значимо выше при трансфекции в день 4 при оценке посредством qPCR (фиг. 6A), в 2 раза выше, в 5 раз выше, иногда даже в 7-8 выше при трансфекции в день 4 по сравнению с трансфекцией в день 3. Наиболее высокий титр составлял 1,38E+11 ВГ/мл в условиях трансфекции в день 4 и скорости перемешивания 150 об./мин.
[0184] Трансдукционную функцию rAAV-GFP из этих экспериментов оценивали посредством трансдукции клеток HEK 293, что соответствовало анализу qPCR, когда к клеткам HEK 293 добавляли один и тот же объем клеточного лизата для каждого условия получения, более высокую трансдукцию наблюдали в случае образцов при трансфекции в день 4 по сравнению с образцом при трансфекции в день 3 (фиг. 6B). Эти данные свидетельствуют о том, что стадия роста клеток и метаболический статус могут играть важную роль в получении rAAV и эффективности трансфекции, и что может иметь место клеточное метаболическое окно, более достижимое для биосинтеза rAAV.
[0185] Недавно разработанная система PEI-опосредованного получения rAAV является полностью масштабируемой, соответствующей cGMP, многофункциональной платформой для получения rAAV, которую можно использовать для получения любых серотипов векторов rAAV в бессывороточной суспензионной культуре клеток. В комбинации с PEI в качестве реагента для трансфекции, таком как высокоэффективные молекулы PEI "Max" 40 кДа, добавление свободного PEI при трансфекции и обнаружение подходящей стадии роста примированных клеток для трансфекции позволяли достигать очень высокой производительности rAAV в условиях суспензионной культуры клеток, составляющей приблизительно в 10 раз больше, чем в схожих системах бессывороточных суспензионных культур, описанных в литературе (см. таблицу 2).
Таблица 2. Сравнение выхода вектора в способах с использованием бессывороточной суспензионной культуры клеток с литературными данными (ссылки)
[0186] Хотя конкретные варианты осуществления изобретения описаны и проиллюстрированы примерами выше, не следует понимать, что настоящее изобретение ограничено такими вариантами осуществления. Можно осуществлять различные модификации без отклонения от объема и сущности изобретения, описанных в следующей формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| УСИЛИВАЮЩИЕ АГЕНТЫ ДЛЯ ПОВЫШЕНИЯ ТРАНСФЕКЦИИ КЛЕТОК И/ИЛИ ПРОДУКЦИИ ВЕКТОРА rAAV | 2018 |
|
RU2802520C2 |
| ПОЛНОСТЬЮ МАСШТАБИРУЕМЫЙ СПОСОБ ПРОИЗВОДСТВА rAAV НА ОСНОВЕ КОЛОНОК | 2017 |
|
RU2754467C2 |
| АДЕНОАССОЦИИРОВАННЫЕ ВИРУСНЫЕ ВЕКТОРЫ ДЛЯ ЛЕЧЕНИЯ МИОЦИЛИНОВОЙ (MYOC) ГЛАУКОМЫ | 2015 |
|
RU2746991C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ РЕКОМБИНАНТНЫХ ВИРУСНЫХ ВЕКТОРОВ | 2020 |
|
RU2820972C2 |
| ВЕКТОРЫ, СОДЕРЖАЩИЕ СПЕЙСЕРНЫЕ/ФИЛЛЕР ПОЛИНУКЛЕОТИДНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2725813C2 |
| ВАРИАНТЫ РЕКОМБИНАНТНЫХ AAV И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2738421C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ И ПРЕДОТВРАЩЕНИЯ ДЕГЕНЕРАЦИИ ЖЕЛТОГО ПЯТНА | 2015 |
|
RU2703145C2 |
| ГЕННОЕ РЕДАКТИРОВАНИЕ ГЛУБОКИХ ИНТРОННЫХ МУТАЦИЙ | 2016 |
|
RU2759335C2 |
| АДЕНОАССОЦИИРОВАННЫЕ ВИРУСНЫЕ ВЕКТОРЫ ДЛЯ ЛЕЧЕНИЯ МИОЦИЛИНОВОЙ (MYOC) ГЛАУКОМЫ | 2015 |
|
RU2718047C2 |
| МОДИФИЦИРОВАННЫЕ ГЕНЫ АТАКСИИ ФРИДРЕЙХА И ВЕКТОРЫ ДЛЯ ГЕННОЙ ТЕРАПИИ | 2016 |
|
RU2743792C2 |

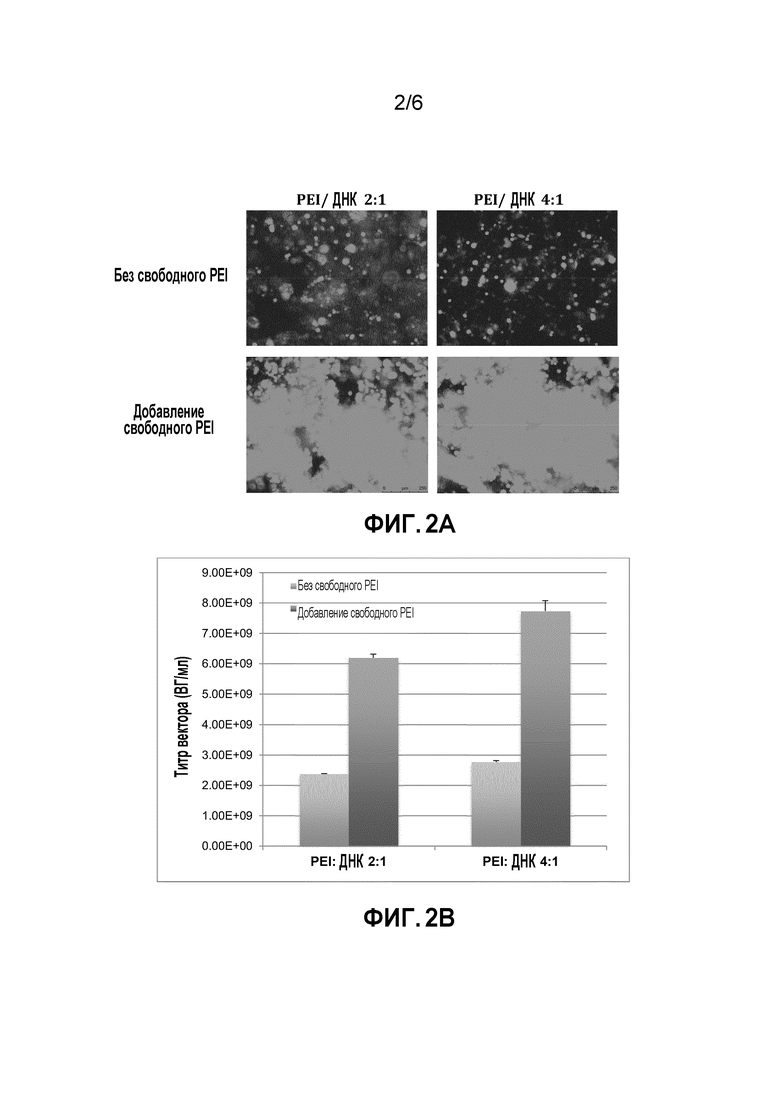
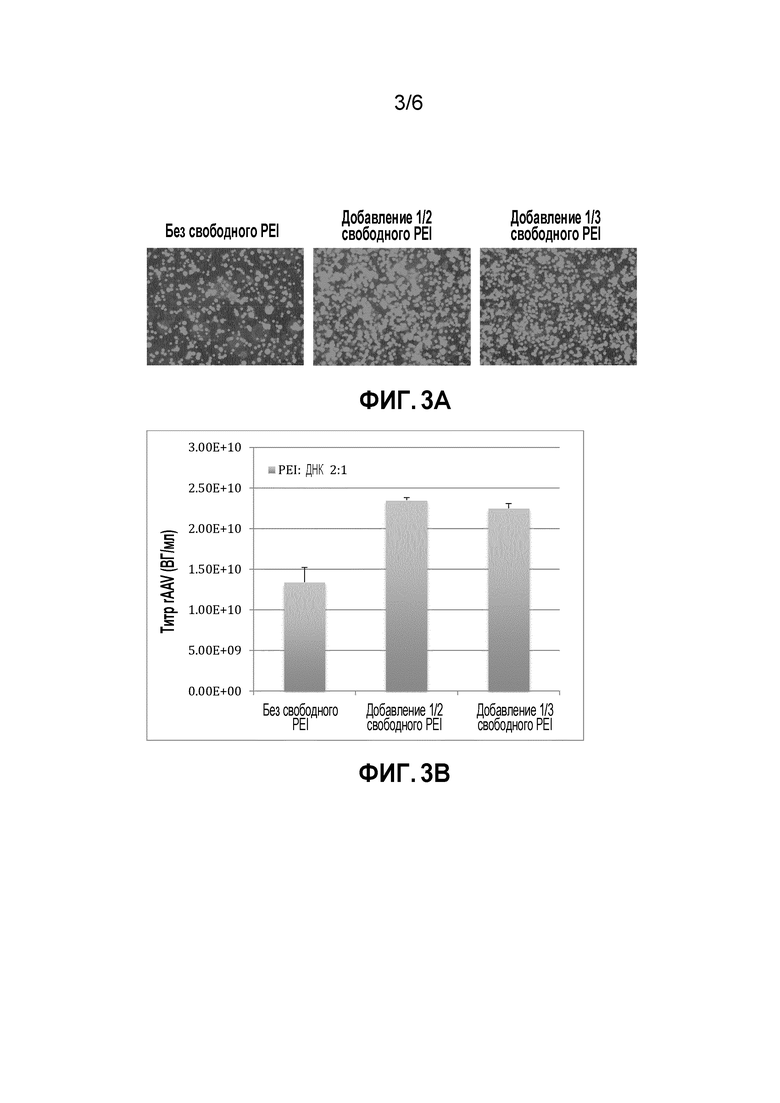
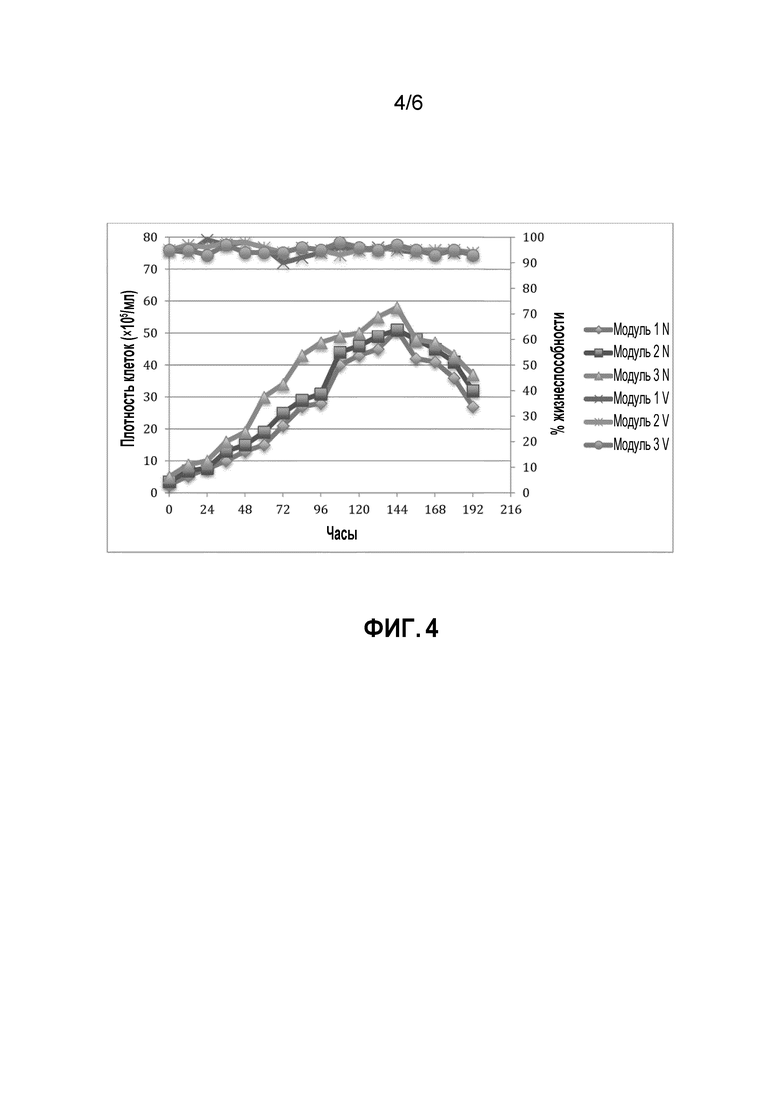
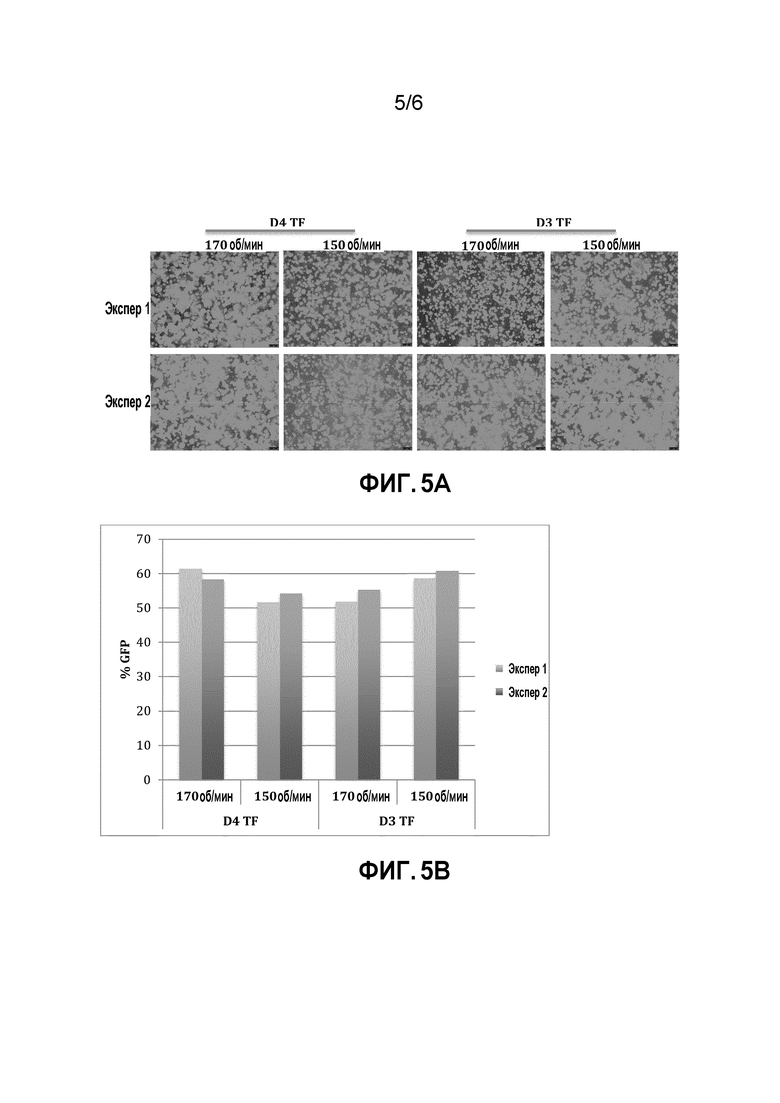
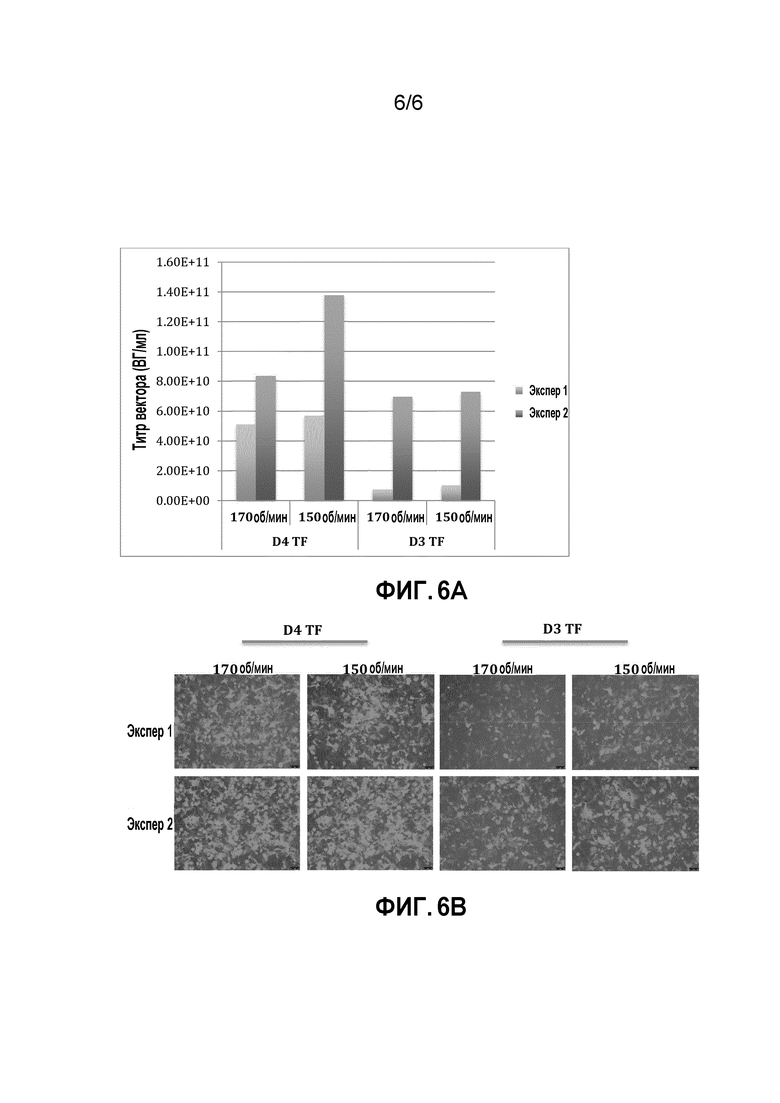
Изобретение относится к биотехнологии. Описывают способы и композиции для трансфекции клеток с использованием плазмид. В определенных вариантах осуществления описывают способы и композиции, в которых эффективность трансфекции значительно повышают посредством приведения трансдуцированных клеток в контакт с полиэтиленимином (PEI), не содержащим нуклеиновую кислоту, в течение трансфекции. Также описывают терапевтически применимые векторы на основе аденоассоциированных вирусов, полученные с использованием описываемых способов и композиций. Изобретение расширяет арсенал терапевтических средств. 6 н. и 52 з.п. ф-лы, 6 ил., 2 табл., 5 пр.
1. Композиция для трансфекции клеток, содержащая смесь, причем указанная смесь содержит компоненты:
(a) одну или несколько плазмид, содержащих нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и/или нуклеиновые кислоты, кодирующие хелперные белки;
(b) плазмиду, содержащую нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт; и
(c) раствор полиэтиленимина (PEI),
где указанные плазмиды находятся в диапазоне молярного соотношения от приблизительно 1:0,01 до приблизительно 1:100, и где указанные компоненты (a), (b) и (c) содержат смесь плазмиды/PEI и, необязательно, инкубированы в течение периода времени от приблизительно 10 секунд до приблизительно 4 часов;
(d) клетки, где указанные клетки приводят в контакт с указанной смесью плазмиды/PEI, и где указанная смесь плазмиды/PEI содержит культуру клеток с плазмидой/PEI; и
(e) свободный PEI, где указанный свободный PEI и указанная культура клеток с плазмидой/PEI содержат культуру клеток со свободным PEI/плазмидой/PEI;
где указанные клетки контактировали с указанной смесью плазмиды/PEI и указанным свободным PEI в течение по меньшей мере 4 часов.
2. Композиция по п. 1, где указанные клетки приводят в контакт с указанной смесью плазмиды/PEI и указанным свободным PEI в течение периода времени в диапазоне от приблизительно 4 часов до приблизительно 140 часов.
3. Композиция по п. 1, где указанные клетки приводят в контакт с указанной смесью плазмиды/PEI и указанным свободным PEI в течение периода времени в диапазоне от приблизительно 4 часов до приблизительно 96 часов.
4. Композиция по любому из пп. 1-3, где указанные клетки продуцируют рекомбинантный вектор AAV, содержащий нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт.
5. Композиция по любому из пп. 1-4, где указанная композиция содержит контейнер, необязательно, включающий флакон, планшет, мешок или биореактор, указанный контейнер, необязательно, является стерильным и/или, необязательно, подходит для поддержания жизнеспособности или роста клеток.
6. Композиция по п. 1, дополнительно содержащая плазмиду, содержащую нуклеиновые кислоты, кодирующие белки капсида AAV.
7. Способ получения трансфицированных клеток, продуцирующих рекомбинантный вектор AAV, содержащий нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт, включающий:
(a) получение одной или нескольких плазмид, содержащих нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и нуклеиновые кислоты, кодирующие хелперные белки;
(b) получение плазмиды, содержащей нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт;
(c) получение раствора, содержащего полиэтиленимин (PEI);
(d) смешивание плазмид, полученных на стадиях (a) и (b), с раствором PEI, полученным на стадии (c), где указанные плазмиды находятся в диапазоне молярного соотношения от приблизительно 1:0,01 до приблизительно 1:100, для получения смеси плазмиды/PEI и, необязательно, инкубацию указанной смеси плазмиды/PEI в течение периода времени в диапазоне от приблизительно 10 секунд до приблизительно 4 часов;
(e) приведение клеток в контакт с указанной смесью плазмиды/PEI, полученной на стадии (d), для получения культуры клеток с плазмидой/PEI;
(f) добавление свободного PEI к указанной культуре клеток с плазмидой/PEI, полученной на стадии (e), для получения культуры клеток со свободным PEI/плазмидой/PEI; и
(g) инкубацию указанной культуры клеток со свободным PEI/плазмидой/PEI, полученной на стадии (f), в течение по меньшей мере 4 часов или приблизительно 4 часов и, таким образом, получение трансфицированных клеток, продуцирующих рекомбинантный вектор AAV, содержащий нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт.
8. Способ по п. 7, дополнительно включающий стадию сбора указанных трансфицированных клеток, полученных на стадии (g), и/или среды для культивирования указанных трансфицированных клеток, полученной на стадии (g), для получения сбора клеток и/или среды для культивирования.
9. Способ по п. 7, дополнительно включающий выделение и/или очистку рекомбинантного вектора AAV из указанных трансфицированных клеток и/или среды для культивирования из указанных трансфицированных клеток, полученных на стадии (g), и, таким образом, получение рекомбинантного вектора AAV, содержащего нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт.
10. Способ получения рекомбинантного вектора AAV, содержащего нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт, включающий стадии:
(a) получения одной или нескольких плазмид, содержащих нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и нуклеиновые кислоты, кодирующие хелперные белки;
(b) получения плазмиды, содержащей нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт;
(c) получения раствора, содержащего полиэтиленимин (PEI);
(d) смешивания указанных плазмид, полученных на стадиях (a) и (b), с указанным раствором PEI, полученным на стадии (c), где указанные плазмиды находятся в диапазоне молярного соотношения от приблизительно 1:0,01 до приблизительно 1:100, для получения смеси плазмиды/PEI и, необязательно, инкубацию смеси плазмиды/PEI в течение периода времени в диапазоне от приблизительно 10 секунд до приблизительно 4 часов;
(e) приведения клеток в контакт с указанной смесью плазмиды/PEI, полученной на стадии (d), для получения культуры клеток с плазмидой/PEI;
(f) добавления свободного PEI к указанной культуре клеток с плазмидой/PEI, полученной на стадии (e), для получения культуры клеток со свободным PEI/плазмидой/PEI;
(g) инкубации указанной культуры клеток с плазмидой/PEI, полученной на стадии (e), или указанной культуры клеток со свободным PEI/плазмидой/PEI, полученной на стадии (f), в течение по меньшей мере 4 часов или приблизительно 4 часов для получения трансфицированных клеток;
(h) сбора указанных трансфицированных клеток, полученных на стадии (g), и/или среды для культивирования трансфицированных клеток, полученной на стадии (g), для получения сбора клеток и/или среды для культивирования; и
(i) выделения и/или очистки рекомбинантного вектора AAV от указанного сбора клеток и/или среды для культивирования, полученного на стадии (h), и, таким образом, получения рекомбинантного вектора AAV, содержащего нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт.
11. Способ получения трансфицированных клеток, продуцирующих рекомбинантный вектор AAV, содержащий нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт, включающий стадии:
(a) получения смеси компонентов (i), (ii) и (iii):
(i) одной или нескольких плазмид, содержащих нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и нуклеиновые кислоты, кодирующие хелперные белки;
(ii) плазмиды, содержащей нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт; и
(iii) раствора полиэтиленимина (PEI),
(b) смешивания указанных плазмид (i) и (ii) с указанным раствором PEI (iii) таким образом, что указанные плазмиды находятся в диапазоне молярного соотношения от приблизительно 1:0,01 до приблизительно 1:100, для получения смеси плазмиды/PEI и, необязательно, инкубации указанной смеси плазмиды/PEI в течение периода времени в диапазоне от приблизительно 10 секунд до приблизительно 4 часов;
(c) приведения клеток в контакт с указанной смесью плазмиды/PEI, полученной на стадии (b), для получения культуры клеток с плазмидой/PEI;
(d) добавления свободного PEI к указанной культуре клеток с плазмидой/PEI, полученной на стадии (c), для получения культуры клеток со свободным PEI/плазмидой/PEI;
(e) инкубации указанной культуры клеток с плазмидой/PEI, полученной на стадии (c), или указанной культуры клеток со свободным PEI/плазмидой/PEI, полученной на стадии (d), в течение по меньшей мере 4 часов или приблизительно 4 часов для получения трансфицированных клеток, продуцирующих рекомбинантный вектор AAV, содержащий нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт.
12. Способ по п. 11, дополнительно включающий стадию (f) сбора трансфицированных клеток, полученных на стадии (e), и/или среды для культивирования трансфицированных клеток, полученной на стадии (e), для получения сбора клеток и/или среды для культивирования; и/или выделения и/или очистки рекомбинантного вектора AAV от сбора клеток и/или среды для культивирования, полученного на указанной стадии (f), и, таким образом, получение рекомбинантного вектора AAV, содержащего нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт.
13. Способ получения рекомбинантного вектора AAV, содержащего нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт, включающий стадии:
(a) получения смеси компонентов (i), (ii) и (iii):
(i) одной или нескольких плазмид, содержащих нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и нуклеиновые кислоты, кодирующие хелперные белки;
(ii) плазмиды, содержащей нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт; и
(iii) раствор полиэтиленимина (PEI),
(b) смешивания указанных плазмид (i) и (ii) с указанным раствором PEI (iii) таким образом, что указанные плазмиды находятся в диапазоне молярного соотношения от приблизительно 1:0,01 до приблизительно 1:100, для получения смеси плазмиды/PEI и, необязательно, инкубации указанной смеси плазмиды/PEI в течение периода времени от приблизительно 10 секунд до приблизительно 4 часов;
(c) приведения клеток в контакт с указанной смесью плазмиды/PEI, полученной на стадии (b), для получения культуры клеток с плазмидой/PEI;
(d) добавления свободного PEI к указанной культуре клеток с плазмидой/PEI, полученной на стадии (c), для получения культуры клеток со свободным PEI/плазмидой/PEI;
(e) инкубации указанной культуры клеток с плазмидой/PEI, полученной на стадии (c), или указанной культуры клеток со свободным PEI/плазмидой/PEI, полученной на стадии (d), в течение по меньшей мере 4 часов или приблизительно 4 часов для получения трансфицированных клеток;
(f) сбора указанных трансфицированных клеток, полученных на стадии (e), и/или среды для культивирования трансфицированных клеток, полученной на стадии (e), для получения сбора клеток и/или среды для культивирования; и
(g) выделения и/или очистки рекомбинантного вектора AAV из сбора клеток и/или среды для культивирования, полученного на стадии (f), и, таким образом, получения рекомбинантного вектора AAV, содержащего нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт.
14. Способ получения рекомбинантного вектора AAV, содержащего нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт, включающий стадии:
(a) получения смеси компонентов (i), (ii) и (iii):
(i) одной или нескольких плазмид, содержащих нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и нуклеиновые кислоты, кодирующие хелперные белки;
(ii) плазмиды, содержащей нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт; и
(iii) раствор полиэтиленимина (PEI),
где указанные плазмиды (i) и (ii) находятся в диапазоне молярного соотношения от приблизительно 1:0,01 до приблизительно 1:100, и где смесь компонентов (i), (ii) и (iii), необязательно, инкубируют в течение периода времени от приблизительно 10 секунд до приблизительно 4 часов;
(b) приведения клеток в контакт со смесью, полученной на стадии (a), для получения культуры клеток с плазмидой/PEI;
(c) добавления свободного PEI к указанной культуре клеток с плазмидой/PEI, полученной на стадии (b), для получения культуры клеток со свободным PEI/плазмидой/PEI;
(d) инкубации указанной культуры клеток с плазмидой/PEI, полученной на стадии (b), или указанной культуры клеток со свободным PEI/плазмидой/PEI, полученной на стадии (c), в течение по меньшей мере 4 часов или приблизительно 4 часов для получения трансфицированных клеток;
(e) сбора указанных трансфицированных клеток, полученных на стадии (d), и/или среды для культивирования трансфицированных клеток, полученной на стадии (d), для получения сбора клеток и/или среды для культивирования; и
(f) выделения и/или очистки рекомбинантного вектора AAV от сбора клеток и/или среды для культивирования, полученного на стадии (e), и, таким образом, получения рекомбинантного вектора AAV, содержащего нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт.
15. Способ по любому из пп. 8-14, где указанную культуру клеток с плазмидой/PEI, или указанную культуру клеток со свободным PEI/плазмидой/PEI инкубируют в течение периода времени в диапазоне от приблизительно 4 часов до приблизительно 140 часов.
16. Способ по любому из пп. 8-15, где указанную культуру клеток с плазмидой/PEI или указанную культуру клеток со свободным PEI/плазмидой/PEI инкубируют в течение периода времени в диапазоне от приблизительно 4 часов до приблизительно 96 часов.
17. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где указанная смесь плазмиды/PEI имеет массовое соотношение PEI:плазмида в диапазоне от приблизительно 0,1:1 до приблизительно 5:1 или массовое соотношение PEI:плазмида в диапазоне от приблизительно 5:1 до приблизительно 0,1:1, или где указанная культура клеток со свободным PEI/плазмидой/PEI имеет массовое соотношение PEI:плазмида в диапазоне от приблизительно 0,1:1 до приблизительно 5:1 или массовое соотношение PEI:плазмида в диапазоне от приблизительно 5:1 до приблизительно 0,1:1.
18. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где указанная смесь плазмиды/PEI имеет массовое соотношение PEI:плазмида в диапазоне от приблизительно 1:1 до приблизительно 5:1 или массовое соотношение PEI:плазмида в диапазоне от приблизительно 5:1 до приблизительно 1:1; или где указанная культура клеток со свободным PEI/плазмидой/PEI имеет массовое соотношение PEI:плазмида в диапазоне от приблизительно 1:1 до приблизительно 5:1 или массовое соотношение PEI:плазмида в диапазоне от приблизительно 5:1 до приблизительно 1:1.
19. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где PEI из указанной смеси плазмиды/PEI и/или свободный PEI содержит гидролизованный линейный полиэтиленимин.
20. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где PEI из указанной смеси плазмиды/PEI и/или указанный свободный PEI содержит гидролизованный линейный полиэтиленимин с молекулярной массой в диапазоне от приблизительно 4000 дальтон (Дa) до приблизительно 160000 Да и/или в диапазоне от приблизительно 2500 Да до приблизительно 250000 Да в пересчете на свободное основание.
21. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где PEI из указанной смеси и/или указанный свободный PEI содержит гидролизованный линейный полиэтиленимин с молекулярной массой приблизительно 40000 Да и/или приблизительно 25000 Да в пересчете на свободное основание.
22. Композиция по любому из пп. 1-6 или способ по пп. 8-16, где молярное соотношение азота (N) в общем PEI и фосфата (P) в плазмиде находится в диапазоне от приблизительно 1:1 до приблизительно 50:1 (N:P) в указанной культуре клеток со свободным PEI/плазмидой/PEI.
23. Композиция по любому из пп. 1-6 или способ по пп. 8-16, где молярное соотношение азота (N) в общем PEI и фосфата (P) в плазмиде составляет приблизительно 5:1, 6:1, 7:1, 8:1, 9:1 или 10:1 (N:P) в указанной культуре клеток со свободным PEI/плазмидой/PEI.
24. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где указанную смесь инкубируют в течение периода времени в диапазоне от приблизительно 30 секунд до приблизительно 4 часов.
25. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где указанную смесь плазмиды/PEI инкубируют в течение периода времени в диапазоне от приблизительно 1 минуты до приблизительно 30 минут.
26. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где количество свободного PEI находится в диапазоне от приблизительно 10% до приблизительно 90% общего PEI.
27. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где количество свободного PEI находится в диапазоне от приблизительно 25% до приблизительно 75% общего PEI.
28. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где количество свободного PEI составляет приблизительно 50% общего PEI.
29. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где указанный свободный PEI добавляют к указанным клеткам до, во время или после приведения указанной смеси плазмиды/PEI в контакт с указанными клетками.
30. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где указанные клетки находятся в суспензионной культуре.
31. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где указанные клетки выращивают или поддерживают в бессывороточной среде для культивирования.
32. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где указанные клетки имеют плотность в диапазоне от приблизительно 1×105 клеток/мл до приблизительно 1×108 клеток/мл при контакте с указанной смесью плазмиды/PEI и/или с указанным свободным PEI.
33. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где жизнеспособность указанных клеток при контакте с указанной смесью плазмиды/PEI или указанным свободным PEI составляет приблизительно 60% или более 60%, или где указанные клетки находятся в логарифмической фазе роста при контакте с указанной смесью плазмиды/PEI.
34. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где жизнеспособность указанных клеток при контакте с указанной смесью плазмиды/PEI или указанным свободным PEI составляет приблизительно 90% или более 90%, или где указанные клетки находятся в логарифмической фазе роста при контакте с указанной смесью плазмиды/PEI или указанным свободным PEI.
35. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где кодируемые упаковывающие белки AAV включают rep AAV и/или cap AAV.
36. Композиция или способ по п. 35, где кодируемые упаковывающие белки AAV включают белки rep AAV и/или cap AAV любого серотипа AAV.
37. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где кодируемые хелперные белки содержат белки E2 и/или E4 аденовируса, белки VARNA и/или не-AAV хелперные белки.
38. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где указанные клетки являются клетками млекопитающих.
39. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где указанные клетки являются клетками HEK 293E или HEK 293F.
40. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где общее количество плазмиды, содержащей нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт, и одной или нескольких плазмид, содержащих нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и нуклеиновые кислоты, кодирующие хелперные белки, находится в диапазоне от приблизительно 0,1 мкг до приблизительно 15 мкг на мл клеток.
41. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где молярное соотношение плазмиды, содержащей нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт, и одной или нескольких плазмид, содержащих нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и/или нуклеиновые кислоты, кодирующие хелперные белки, находится в диапазоне от приблизительно 1:5 до приблизительно 1:1.
42. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где указанные одна или несколько плазмид содержат первую плазмиду, содержащую нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и вторую плазмиду, содержащую нуклеиновые кислоты, кодирующие хелперные белки.
43. Композиция или способ по п. 42, где молярное соотношение плазмиды, содержащей нуклеиновую кислоту, кодирующую белок или транскрибирующуюся в представляющий интерес транскрипт, и первой плазмиды, содержащей нуклеиновые кислоты, кодирующие упаковывающие белки AAV, и второй плазмиды, содержащей нуклеиновые кислоты, кодирующие хелперные белки, находится в диапазоне приблизительно 1-5:1:1, или 1:1-5:1, или 1:1:1-5.
44. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где рекомбинантный вектор AAV имеет любой из серотипов AAV 1-12, белок капсида VP1, VP2 и/или VP3 AAV, или модифицированный белок капсида VP1, VP2 и/или VP3 AAV или его вариант, или белок капсида VP1, VP2 и/или VP3 AAV дикого типа.
45. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где вектор AAV имеет серотип AAV или псевдотип AAV, где указанный псевдотип AAV имеет серотип капсида AAV, отличающийся от серотипа ITR.
46. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где вектор AAV дополнительно содержит интрон, элемент контроля экспрессии, один или несколько инвертированных концевых повторов (ITR) аденоассоциированного вируса (AAV) и/или филлерную полинуклеотидную последовательность.
47. Композиция или способ по п. 46, где интрон находится в нуклеиновой кислоте, кодирующей белок или транскрибирующейся в представляющий интерес транскрипт, или фланкирует ее, или где элемент контроля экспрессии функционально связан с нуклеиновой кислотой, кодирующей белок или транскрибирующейся в представляющий интерес транскрипт, или где ITR AAV фланкируют 5'- или 3'-конец нуклеиновой кислоты, кодирующей белок или транскрибирующейся в представляющий интерес транскрипт, или где филлерная полинуклеотидная последовательность фланкирует 5'- или 3'-конец нуклеиновой кислоты, кодирующей белок или транскрибирующейся в представляющий интерес транскрипт.
48. Композиция или способ по п. 46, где элемент контроля экспрессии содержит конститутивный или регулируемый контрольный элемент, или тканеспецифический элемент контроля экспрессии, или промотор.
49. Композиция или способ по п. 46, где элемент контроля экспрессии содержит элемент, обеспечивающий экспрессию в печени.
50. Композиция или способ по п. 46, где ITR содержит один или несколько ITR любого из серотипов AAV2 или AAV6 или их комбинацию.
51. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где вектор AAV содержит белок капсида VP1, VP2 и/или VP3, имеющий 75% или более идентичности последовательности по отношению к любому из белков капсид VP1, VP2 и/или VP3 AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV10, AAV11 или AAV-2i8, или содержит модифицированный белок капсида VP1, VP2 и/или VP3 или его вариант, выбранный из любого из серотипов AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV10, AAV11 и AAV-2i8 AAV.
52. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где клетки субкультивируют до достижения сниженной плотности клеток перед контактом с указанной смесью плазмиды/PEI.
53. Композиция по любому из пп. 1-6 или способ по любому из пп. 8-16, где клетки субкультивируют до достижения плотности клеток в диапазоне от приблизительно 0,1×106 клеток/мл до приблизительно 5,0×106 клеток/мл перед контактом с указанной смесью плазмиды/PEI.
54. Композиция или способ по любому из пп. 52 или 53, где клетки приводят в контакт с указанной смесью плазмиды/PEI в пределах периода от 2 до 5 дней после субкультивирования.
55. Композиция или способ по любому из пп. 52 или 53, где клетки приводят в контакт с указанной смесью плазмиды/PEI в пределах периода от 3 до 4 дней после субкультивирования.
56. Способ по любому из пп. 7-55, где количество плазмиды, встраиваемой в указанные трансфицированные клетки, составляет по меньшей мере на 50% больше при использовании стадии добавления свободного PEI к культуре клеток с плазмидой/PEI по сравнению с отсутствием добавления свободного PEI к культуре клеток с плазмидой/PEI.
57. Способ по любому из пп. 7-55, где количество полученного рекомбинантного вектора на основе AAV составляет по меньшей мере на 50% или более больше при использовании стадии добавления свободного PEI к культуре клеток с плазмидой/PEI по сравнению с отсутствием добавления свободного PEI к культуре клеток с плазмидой/PEI.
58. Способ по любому из пп. 7-55, где количество полученного рекомбинантного вектора на основе AAV составляет в 1-5, 5-10 или 10-20 раз больше при использовании стадии добавления свободного PEI к культуре клеток с плазмидой/PEI по сравнению с отсутствием добавления свободного PEI к культуре клеток с плазмидой/PEI.
| US 20140323556 A1, 30.10.2014 | |||
| JP 2008500049 A, 10.01.2008 | |||
| WO 2004047872 A2, 10.06.2004 | |||
| CN 103329852 B, 07.10.2015 | |||
| US 20020160501 A1, 31.10.2002 | |||
| WO 2014201252 A2, 18.12.2014 | |||
| МОЛЕКУЛЯРНЫЙ КОМПЛЕКС ДЛЯ ТРАНСФЕКЦИИ КЛЕТОК МЛЕКОПИТАЮЩИХ, СОДЕРЖАЩИЙ ПЛАЗМИДНУЮ ДНК, МОДИФИЦИРОВАННЫЙ ПОЛИЭТИЛЕНИМИН И МОЛЕКУЛЫ-ЛИГАНДЫ | 2005 |
|
RU2303064C2 |
Авторы
Даты
2022-03-15—Публикация
2016-12-01—Подача