Область техники
Настоящее изобретение относится к микроорганизму из рода Corynebacterium и к способу получения пуринового нуклеотида с его использованием.
Предшествующий уровень техники
Пуриновые нуклеотиды, такие как 5'-инозинмонофосфат (далее в настоящем документе ИМФ), 5'-ксантозинмонофосфат (далее в настоящем документе КсМФ), 5'-гуанозинмонофосфат (далее в настоящем документе ГМФ), 5'-адениловая кислота (далее в настоящем документе АМФ) и т.д., являются промежуточными соединениями системы биосинтеза нуклеиновых кислот. Эти промежуточные соединения играют физиологически важную роль in vivo и широко применяются в пищевой промышленности, медицине и т.д. Среди них ИМФ со вкусом мяса и ГМФ со вкусом грибов широко применяют в качестве добавок к пищевым приправам. Кроме того, известно, что при смешивании этих двух веществ с глутаматом натрия (мононатриевой солью глутаминовой кислоты, МНГ) их вкус и аромат значительно усиливаются, и поэтому комплексную составную приправу, в которой объединены эти три вещества, широко используют.
В то же время, примеры способа получения пуринового нуклеотида могут включать: (1) способ ферментативного расщепления рибонуклеиновой кислоты (РНК), выделенной из клеток дрожжей; (2) способ получения в результате ферментации путем культивирования микроорганизма, продуцирующего пуриновый нуклеотид, и непосредственного извлечения этого пуринового нуклеотида из культуральной жидкости; (3) способ химического фосфорилирования нуклеозида, полученного в результате ферментации; и (4) способ ферментативного фосфорилирования нуклеозида, полученного в результате ферментации, и т.д. (патент KR №10-1049023, публикация патента JP №4363042, патент KR №10-1210704 и Agri. Biol. Chem., 36(9), 1511-1522). Среди них, хотя способ (1) имеет проблемы с поставкой/требованием к исходному сырью и экономической эффективностью, способ (2) широко используют благодаря его экономическим и экологическим преимуществам. В то же время, в случае получения ГМФ (одного из пуриновых нуклеотидов) недостаток заключается в его низком выходе из-за проблем, связанных с проницаемостью клеточной мембраны, и, следовательно, также используют способ получения ГМФ путем ферментативного превращения КсМФ, полученного посредством микробной ферментации.
Однако, при получении пуринового нуклеотида путем ферментации с использованием микроорганизма этот микроорганизм может претерпевать стресс под действием температуры, рН, осмотического давления, недостатка питательных веществ и окислительных факторов. Среди этих факторов неизбежным является окислительный стресс, основной причиной которого становятся образующиеся под действием ферментации активные формы кислорода (АФК), которые могут вызвать аномальный рост микроорганизма.
Описание изобретения Техническая задача изобретения
Авторы изобретения исследовали продуктивность по пуриновым нуклеотидам и приложили усилия к ее повышению путем преодоления окислительного стресса, который может возникать в процессе ферментации микроорганизма. В результате они подтвердили, что при инактивации конкретного белка в микроорганизме продуктивность по пуриновым нуклеотидам повышается, а также поддерживается рост микроорганизма, тем самым осуществив настоящее изобретение.
Техническое решение
Задача настоящего изобретения состоит в предложении продуцирующего пуриновый нуклеотид микроорганизма рода Corynebacterium, в котором белок, состоящий из аминокислотной последовательности SEQ ID NO: 1, инактивирован.
Другая задача настоящего изобретения состоит в предложении способа получения пуринового нуклеотида с использованием этого микроорганизма.
Еще одна задача настоящего изобретения состоит в предложении способа повышения продукции пуринового нуклеотида в микроорганизме рода Corynebacterium, включающего инактивацию белка по настоящему изобретению в микроорганизме рода Corynebacterium.
Еще одна задача настоящего изобретения состоит в предложении применения этого микроорганизма для получения пуринового нуклеотида. Полезные эффекты изобретения
Микроорганизм, продуцирующий пуриновые нуклеотиды, по настоящему изобретению, может продуцировать пуриновые нуклеотиды с высокой эффективностью. В дополнение, полученные пуриновые нуклеотиды могут находить применение не только для корма животных или кормовых добавок для животных, но также в различных продуктах (например, пищевых продуктах или пищевых добавках для потребления человеком, приправах, фармацевтических препаратах и т.д.). Лучший способ осуществления изобретения
Ниже приведено подробное описание настоящего изобретения. В то же время, соответствующие описания и воплощения, раскрытые в настоящем изобретении, можно также применять к другим описаниям и воплощениям. Таким образом, все комбинации раскрытых в настоящем документе элементов входят в объем настоящего изобретения. Кроме того, объем настоящего изобретения не ограничен представленным ниже подробным описанием.
Для достижения указанных выше целей в одном аспекте настоящего изобретения предложен микроорганизм рода Corynebacterium, продуцирующий пуриновый нуклеотид, в котором белок, состоящий из аминокислотной последовательности SEQ ID NO: 1, инактивирован.
В конкретном воплощении изобретения предложен Corynebacterium stationis, продуцирующий пуриновый нуклеотид, в котором белок, состоящий из аминокислотной последовательности SEQ ID NO: 1, инактивирован.
Используемый в настоящем документе термин «пуриновый нуклеотид» в целом относится к соединению, которое имеет пуриновый нуклеозид и в котором фосфатная группа связана с сахарной группировкой нуклеозида сложноэфирной связью.
Конкретно, пуриновый нуклеотид может представлять собой по меньшей мере один пуриновый нуклеотид, выбранный из группы, состоящей из ИМФ, КсМФ, ГМФ и АМФ, но также без ограничений могут быть включены пуриновые нуклеотиды, выход продукции которых можно повысить путем инактивации белка, состоящего из аминокислотной последовательности SEQ ID NO: 1.
Используемый в настоящем документе термин «белок, состоящий из аминокислотной последовательности SEQ ID NO: 1», относится к белку, кодируемому геном из группы семейства WhiB, и в частности, он может представлять собой регулятор транскрипции белка WhiB. Этот белок включает четыре консервативных остатка цистеина, которые образуют кластер, чувствительный к кислороду и оксидам азота (4Fe-4S), и известно, что этот белок играет важную роль в проявлении различных биологических свойств актиномицетов. Известно, что его идентифицированные к настоящему времени функции состоят в участии в общих клеточных функциях (например, в патогенезе, антибиотикорезистентности, клеточном росте и т.д.), но их детальные функции и механизмы недостаточно хорошо изучены.
Этот белок, имеющий аминокислотную последовательность SEQ ID NO: 1 согласно настоящему изобретению, может представлять собой белок, включающий аминокислотную последовательность SEQ ID NO: 1, белок, по существу состоящий из аминокислотной последовательности SEQ ID NO: 1, или белок, состоящий из аминокислотной последовательности SEQ ID NO: 1, но белок не ограничен ими.
Дополнительно белок согласно настоящему изобретению может представлять собой белок, состоящий из аминокислотной последовательности, раскрытой как SEQ ID NO: 1, но любая последовательность, обладающая активностью, идентичной активности этого белка, может быть включена без ограничений, и специалист в данной области техники может получить информацию о последовательности из известных баз данных (например, GenBank Национального центра биотехнологической информации (NCBI) и т.д.). Дополнительно белок, имеющий аминокислотную последовательность SEQ ID NO: 1 согласно настоящему изобретению, может представлять собой белок, включающий аминокислотную последовательность SEQ ID NO: 1, или белок, включающий аминокислотную последовательность, обладающую гомологией или идентичностью аминокислотной последовательности SEQ ID NO: 1 по меньшей мере на 60%, 70%, 80%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 97%, 98% или 99%. Кроме того, очевидно, что любой белок, имеющий аминокислотную последовательность с делецией, модификацией, заменой или добавлением в участке последовательности, также может входить в объем настоящего изобретения, если аминокислотная последовательность этого белка имеет любое из указанных выше значений гомологии или идентичности и проявляет биологическую активность, соответствующую указанному выше белку.
Кроме того, любой полипептид, кодируемый полинуклеотидом, который гибридизуется в жестких условиях с зондом, который может быть получен из последовательностей известного гена (например, последовательностей, полностью или частично комплементарных нуклеотидной последовательности, кодирующей полипептид, составляющий описанный выше белок) и обладает идентичной активностью с белком, состоящим из аминокислотной последовательности SEQ ID NO: 1, может быть включен без ограничений.
То есть, в настоящем изобретении, хотя он описан как «белок или полипептид, включающий аминокислотную последовательность с конкретным SEQ ID NO», «белок или полипептид, состоящий из аминокислотной последовательности с конкретным SEQ ID NO», или «белок или полипептид, имеющий аминокислотную последовательность с конкретным SEQ ID NO», очевидно, что любой белок, который имеет аминокислотную последовательность с делецией, модификацией, заменой, консервативной заменой или добавлением в участке последовательности, может быть также включен в объем настоящего изобретения, если этот белок обладает идентичной или соответствующей активностью с полипептидом, состоящим из аминокислотной последовательности с конкретным SEQ ID NO: например, в случае, если последовательность, которая не изменяет функцию белка, присоединяют к N-концу и/или С-концу аминокислотной последовательности, в случае, если аминокислотная последовательность имеет природную мутацию, или в случае, если аминокислотная последовательность имеет молчащую мутацию или консервативную замену.
Термин «консервативная замена» относится к замене одной аминокислоты другой аминокислотой, обладающей сходными структурными и/или химическими свойствами. Такая аминокислотная замена, как правило, может в целом происходить на основе сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природы остатков. Например, положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин; отрицательно заряженные (кислые) аминокислоты включают глутаминовую кислоту и аспарагиновую кислоту; ароматические аминокислоты включают фенилаланин, триптофан и тирозин; и гидрофобные аминокислоты включают аланин, валин, изолейцин, лейцин, метионин, фенилаланин, тирозин и триптофан.
Используемый в настоящем документе термин «полинуклеотид» имеет значение, в целом охватывающее молекулу ДНК или РНК, и нуклеотид (т.е. основное структурное звено полинуклеотида) может включать не только природные нуклеотиды, но также их аналоги, в которых сахарная или основная группировка модифицирована (см. Scheit, Nucleotide Analogs, John Wiley, New York (1980); Uhlman and Peyman, Chemical Reviews, 90:543-584 (1990)).
Полинуклеотидная последовательность гена, кодирующего белок, имеющий аминокислотную последовательность SEQ ID NO: 1, может быть получена из известной базы данных (например, GenBank NCBI и т.д.), но не ограничена ею.
Полинуклеотид может представлять собой полинуклеотид, кодирующий белок, имеющий аминокислотную последовательность SEQ ID NO: 1 согласно настоящему изобретению, или полинуклеотид, кодирующий белок, обладающий гомологией или идентичностью белку по настоящему изобретению на 60%, 70%, 80%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 97%, 98% или 99%.
Конкретно белок, имеющий аминокислотную последовательность SEQ ID NO: 1, может кодироваться полинуклеотидом, обладающим гомологией или идентичностью полинуклеотидной последовательности SEQ ID NO: 2 на по меньшей мере 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100%. Тем не менее очевидно, что любая полинуклеотидная последовательность, кодирующая белок, обладающий активностью, соответствующей активности белка, состоящего из аминокислотной последовательности SEQ ID NO: 1, может быть включена в объем настоящего изобретения без ограничений.
Кроме того, очевидно, что на основании вырожденности генетического кода любой полинуклеотид, который может транслироваться в белок, состоящий из такой же аминокислотной последовательности, или белок, обладающий гомологией с ней, может быть также включен в объем настоящего изобретения. Дополнительно нуклеотидная последовательность может представлять собой любую последовательность, способную гибридизоваться с зондом, который может быть получен из последовательности известного гена (например, последовательности, полностью или частично комплементарной описанным выше нуклеотидным последовательностям), в жестких условиях, чтобы кодировать белок, обладающий активностью белка, состоящего из аминокислотной последовательности SEQ ID NO: 1.
Термин «жесткие условия» относится к условиям, которые обеспечивают специфичную гибридизацию между полинуклеотидами. Такие условия конкретно описаны в литературе (например, J. Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; F.M. Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., New York). Эти условия могут включать условия, при которых осуществляется гибридизация между генами, обладающими высокой гомологией или идентичностью, например гомологией или идентичностью 40% или выше, в частности 70% или выше, 80% или выше, 85% или выше и 90% или выше, более конкретно 95% или выше, еще более конкретно 97% или выше и наиболее конкретно 99% или выше, при этом гибридизация между генами, обладающими более низкой гомологией или идентичностью, чем указанные выше значения гомологии или идентичности, не осуществляется; или выполнение стандартных условий отмывки для гибридизации по Саузерну, т.е. однократной, в частности двух- или трехкратной отмывки при концентрации соли и температуре, соответствующим отмывке при 60°С 1×SSC (натрийцитратный буфер с хлоридом натрия) с 0,1% додецилсульфатом натрия (ДСН), в частности при 60°С 0,1×SSC с 0,1%) ДСН и более конкретно 68°С 0,1×SSC и 0,1% ДСН. Для гибридизации требуется, чтобы две нуклеиновые кислоты имели комплементарную(ые) последовательность(и), хотя между основаниями может(гут) быть несовпадение(я), в зависимости от жесткости гибридизации. Термин «комплементарный» используют для описания взаимосвязи между азотистыми основаниями нуклеотидов, которые могут гибридизоваться друг с другом. Например, что касается ДНК, аденозин комплементарен тимину, тогда как цитозин комплементарен гуанину. Соответственно, настоящее изобретение может также включать выделенные фрагменты нуклеиновой кислоты, комплементарные полноразмерной последовательности, а также по существу подобные последовательности нуклеиновых кислот.
В частности, полинуклеотиды, обладающие гомологией или идентичностью, могут быть обнаружены при температуре плавления (Tm) 55°С при использовании условий гибридизации, включающих стадию гибридизации, и при использовании описанных выше условий. Значение Tm может дополнительно составлять 60°С, 63°С или 65°С, но температура не ограничена ими и может быть соответствующим образом отрегулирована специалистом в данной области техники в зависимости от задачи.
Жесткость, подходящая для гибридизации полинуклеотидов, зависит от длины и степени комплементарности полинуклеотидов, и эти переменные хорошо известны в данной области техники (см. Sambrook et al., выше, 9.50-9.51 и 11.7-11.8).
Используемый в настоящем документе термин «гомология» или «идентичность» относится к степени идентичности между двумя данными аминокислотными последовательностями или нуклеотидными последовательностями и может быть выражен в процентах. Эти термины «гомология» и «идентичность» могут быть часто использованы взаимозаменяемо. В настоящем описании гомологичная последовательность, обладающая идентичной или подобной активностью с данной аминокислотной последовательностью или полинуклеотидной последовательностью, характеризуется в «% гомологии».
Гомологию или идентичность последовательности консервативных полинуклеотидов или полипептидов определяют с помощью стандартного алгоритма выравнивания, и вместе с ним можно использовать штрафы на гэпы по умолчанию, установленные используемой программой. Фактически гомологичные или идентичные последовательности могут гибридизоваться друг с другом в умеренных условиях или в условиях высокой жесткости вдоль всей полноразмерной последовательности или по меньшей мере около 50%, 60%, 70%, 80% или 90% или более от всей длины. При гибридизации также учитывают полинуклеотиды, включающие вырожденный(е) кодон(ы) вместо кодона(ов).
Наличие или отсутствие гомологии, подобия или идентичности полинуклеотидных или полипептидных последовательностей можно определить с использованием компьютерных алгоритмов, известных в данной области техники (например, программы FASTA с использованием параметров по умолчанию, раскрытых в работе Pearson et al. (1988) [Proc. Natl. Acad. Sci. USA 85: 2444]). Альтернативно, для этого определения можно использовать алгоритм Нидлмана-Вунша (1970, J. Mol. Biol. 48: 443-453), выполняемый в программе Needleman свободно распространяемого пакета программ EMBOSS (The European Molecular Biology Open Software Suite) (Rice et al., 2000, Trends Genet. 16: 276-277) (версия 5.0.0 или более поздняя версия) (включая пакет программ GCG (Devereux, J., et al, Nucleic Acids Research 12: 387 (1984)), BLASTP, BLASTN, FASTA (Atschul, [S.] [F.,] [ETAL., J Molec Biol 215]: 403 (1990); Guide to Huge Computers, Martin J. Bishop, [ED.,] Academic Press, San Diego, 1994, and [CARILLO ETA/.] (1988) SIAM J Applied Math 48: 1073). Например, гомологию, подобие или идентичность можно определить с помощью программы BLAST базы данных Национального центра биотехнологической информации или ClustalW.
Например, гомологию, подобие или идентичность между полинуклеотидами или полипептидами можно определить путем сравнения информации о данной последовательности с помощью компьютерной программы GAP, представленной в работе Needleman et al. (J Mol Biol. 48: 443 (1970)), как раскрыто в работе Smith and Waterman (Adv. Appl. Math (1981) 2: 482). Кратко, программа GAP определяет гомологию, подобие или идентичность как количество аналогичных выровненных символов (т.е. нуклеотидов или аминокислот), деленное на общее количество символов в более короткой из двух последовательностей. Параметры по умолчанию для программы GAP могут включать: (1) унарную матрицу сравнений (включающую значение 1 для идентичности и значение 0 для неидентичности) и взвешенную матрицу сравнений Gribskov, et al., (Nucl. Acids Res. 14: 6745 (1986)), как описано в работе Schwartz and Dayhoff, eds. (Atlas Of Protein Sequence And Structure, National Biomedical Research Foundation, pp. 353-358 (1979) или EDNAFULL (матрица замен, версия EMBOSS от NCBI NUC4.4)); (2) штраф 3,0 за каждый гэп и дополнительный штраф 0,10 за каждый символ в каждом гэпе (или штраф на открытие гэпа 10 и штраф на удлиление гэпа 0,5); и (3) отсутствие штрафа на концевые гэпы. Таким образом, используемый в настоящем документе термин «гомология» или «идентичность» относится к соответствию между последовательностями.
В настоящем изобретении продуцирующий пуриновый нуклеотид микроорганизм рода Corynebacterium может представлять собой микроорганизм, в котором белок, состоящий из аминокислотной последовательности SEQ ID NO: 1, инактивирован.
В частности, инактивацию белка, включающего аминокислотную последовательность SEQ ID NO: 1, можно использовать взаимозаменяемо в том же смысле, что инактивация белка семейства WhiB, инактивация регулятора транскрипции WhiB или инактивация белка, кодируемого геном, включающим полинуклеотидную последовательность SEQ ID NO: 2.
Используемое в настоящем документе выражение «белок, включающий аминокислотную последовательность SEQ ID NO: 1, инактивирован» означает, что экспрессия белка, включающего аминокислотную последовательность SEQ ID NO: 1, полностью отсутствует; или белок может экспрессироваться, но не обладает или обладает пониженной активностью по сравнению с родительским штаммом или немодифицированным штаммом. Дополнительно указанное выше выражение означает, что белок WhcEDBA, кодируемый геном из группы семейства WhiB, не обладает активностью, или его активность снижена по сравнению с родительским штаммом или немодифицированным штаммом. В частности, описанное выше снижение означает понятие, включающее случай, где активность белка снижается вследствие мутации, делеции и т.д. в гене, кодирующем белок, по сравнению с активностью белка, которой исходно обладал микроорганизм; случай, где степень общей внутриклеточной активности белка ниже по сравнению с нативным штаммом дикого типа или со штаммом до модификации, вследствие ингибирования экспрессии гена, кодирующего белок, или ингибирования трансляции этого гена и т.д.; и комбинацию обоих случаев.
В настоящем изобретении было впервые подтверждено, что инактивация описанного выше белка связана с продуктивностью по пуриновым нуклеотидам.
В настоящем изобретении инактивация может быть достигнута путем применения различных способов, известных в данной области техники. Примеры этих способов включают: 1) способ делеции всего гена, кодирующего белок, или его участка; 2) способ модификации последовательности контроля экспрессии для снижения экспрессии гена, кодирующего белок; 3) способ модификации последовательности гена, кодирующего белок, с тем чтобы устранить или ослабить активность белка; 4) способ введения антисмыслового олигонуклеотида (например, антисмысловой РНК), который комплементарно связывается с транскриптом гена, кодирующего белок; 5) способ, при котором присоединение рибосомы становится невозможным за счет образования вторичной структуры в результате присоединения последовательности, комплементарной последовательности Шайна-Дальгарно (SD), к фронтальному концу последовательности SD гена, кодирующего белок; 6) способ генно-инженерного конструирования на основе обратной транскрипции (reverse transcription engineering, RTE), в котором обратно транскрибированный промотор присоединяют к 3'-концу открытой рамки считывания (ОРС) полинуклеотидной последовательности гена, кодирующего белок; и инактивация может быть достигнута путем комбинирования этих способов, но способы конкретно не ограничены ими.
В частности, способ делеции всего гена, кодирующего белок, или его участка может быть выполнен путем замещения полинуклеотида, кодирующего эндогенный целевой белок, в пределах хромосомы полинуклеотидом или геном-маркером, имеющим частичную делецию в нуклеиново-кислотной последовательности, с использованием вектора для встраивания в хромосому микроорганизма. В качестве примера способа делеции всего полинуклеотида или его участка можно использовать способ делеции полинуклеотида за счет гомологической рекомбинации, но способ не ограничен этим.
Дополнительно способ делеции всего гена, кодирующего белок, или его участка можно выполнять таким образом, чтобы индуцировать мутацию в гене под действием света (например, ультрафиолетовых лучей) или химических веществ и отобрать из полученных мутантов штаммы, в которых делетирован целевой ген. Описанный выше способ делеции гена включает способ на основе технологии рекомбинантных ДНК. В технологии рекомбинантных ДНК, например, может иметь место способ, в котором гомологическая рекомбинация осуществляется путем введения в микроорганизм нуклеотидной последовательности, гомологичной целевому гену в микроорганизме, или вектора, содержащего такую нуклеотидную последовательность.
Дополнительно нуклеотидная последовательность или вектор, которые вводят, могут включать в себя доминантный селективный маркер, но не ограничены этим.
Дополнительно способ модификации последовательности контроля экспрессии может быть выполнен путем применения различных способов, известных в данной области техники. В качестве примеров этого способа модификацию последовательности контроля экспрессии можно выполнять путем индуцирования мутации в полинуклеотидной последовательности за счет делеции, вставки, неконсервативной или консервативной замены или их комбинации таким образом, чтобы дополнительно ослабить активность последовательности контроля экспрессии; или путем замещения полинуклеотидной последовательности другой полинуклеотидной последовательностью, обладающей ослабленной активностью. Последовательность контроля экспрессии может включать последовательность промотора, оператора, последовательность, кодирующую сайт связывания рибосомы, последовательности, контролирующие терминацию транскрипции и трансляции, и т.д., но последовательность контроля экспрессии не ограничена ими.
Дополнительно способ модификации последовательности гена можно выполнять путем индуцирования мутации в последовательности гена за счет делеции, вставки, неконсервативной или консервативной замены или их комбинации таким образом, чтобы дополнительно ослабить активность белка; или путем замещения последовательности гена последовательностью гена, улучшенной так, чтобы он обладал ослабленной активностью, или последовательностью гена, улучшенной так, чтобы он не обладал активностью, но способ модификации последовательности гена не ограничен ими.
При использовании в настоящем документе термин «микроорганизм, продуцирующий пуриновый нуклеотид» или «микроорганизм, обладающий способностью продуцировать пуриновый нуклеотид» относится к микроорганизму, обладающему природной способностью продуцировать пуриновый нуклеотид; или к микроорганизму, которому обеспечивают способность продуцировать пуриновый нуклеотид, которой не обладал родительский штамм. В частности, микроорганизм может представлять собой такой микроорганизм, в котором инактивирован белок, имеющий аминокислотную последовательность SEQ ID NO: 1, белок семейства WhiB или регулятор транскрипции WhiB, таким образом обладающий способностью продуцировать пуриновый нуклеотид.
В настоящем изобретении «микроорганизм рода Corynebacterium» может включать все микроорганизмы рода Corynebacterium. В частности, микроорганизм рода Corynebacterium может представлять собой Corynebacterium stationis, Corynebacterium glutamicum, Corynebacterium phocae, Corynebacterium flavescens, Corynebacterium humireducens, Corynebacterium halotolerans, Corynebacterium pollutisoli, Corynebacterium marinum, Corynebacterium freiburgense, Corynebacterium cystitidis, Corynebacterium durum, Corynebacterium pilosum или Corynebacterium testudinoris, и более конкретно Corynebacterium stationis, но микроорганизм не ограничен ими.
В то же время, хотя уже известно, что микроорганизм рода Corynebacterium может продуцировать пуриновые нуклеотиды, этот микроорганизм обладает существенно низкой способностью продуцировать нуклеотиды, и ген, действующий на механизм их продуцирования, или принцип этого механизма не был известен. Соответственно, продуцирующий пуриновый нуклеотид микроорганизм рода Corynebacterium по настоящему изобретению относится к микроорганизму рода Corynebacterium дикого типа как таковому; к микроорганизму рода Corynebacterium, в котором усилена или инактивирована активность гена, ассоциированного с механизмом продуцирования пуриновых нуклеотидов, обладающему за счет этого улучшенной способностью продуцировать пуриновый нуклеотид; или к микроорганизму рода Corynebacterium, в котором введена или усилена активность экзогенного гена, обладающему за счет этого улучшенной способностью продуцировать пуриновый нуклеотид. В частности, микроорганизм рода Corynebacterium может представлять собой Corynebacterium stationis, в котором усилен путь биосинтеза пуриновых нуклеотидов, и это усиление может означать усиление активности белка, вовлеченного в этот путь биосинтеза. Альтернативно, микроорганизм рода Corynebacterium может представлять собой Corynebacterium stationis, в котором инактивирована активность белка, вовлеченная в путь биодеградации пуриновых нуклеотидов или их предшественника(ов).
В частности, в случае, когда пуриновый нуклеотид представляет собой 5'-инозинмонофосфат (ИМФ), примеры белка, вовлеченного в путь биосинтеза пуриновых нуклеотидов, могут включать по меньшей мере один белок, выбранный из группы, состоящей из амидофосфорибозилтрансферазы (PurF), фосфорибозиламино-глицинлигазы (PurD), фосфорибозилглицинамид-формилтрансферазы (PurN), фосфорибозилформилглицинамидинсинтазы (PurL), AIR синтетазы (FGAM циклазы), фосфорибозиламиноимидазолкарбоксилазы, фосфорибозиламиноимидазолсукцинокарбоксамидсинтазы, аденилосукцинатлиазы (ADSL), фосфорибозиламиноимидазолкарбоксамидформилтрансферазы и инозинмонофосфатсинтазы.
Дополнительно в случае, когда пуриновый нуклеотид представляет собой 5'-ксантозинмонофосфат (КсМФ), примеры белка, активность которого усилена, могут в дополнение к группе, состоящей из указанных выше белков, также включать ИМФ-дегидрогеназу.
Дополнительно в случае, когда пуриновый нуклеотид представляет собой 5'-гуанозинмонофосфат (ГМФ), примеры белка, активность которого усилена, могут в дополнение к группе, состоящей из указанных выше белков, также включать ИМФ-дегидрогеназу и/или ГМФ-синтазу.
Дополнительно в случае, когда пуриновый нуклеотид представляет собой 5'-адениловую кислоту (АМФ), примеры белка, активность которого усилена, могут в дополнение к группе, состоящей из указанных выше белков, также включать аденилосукцинатсинтазу (purA).
Более конкретно, белок, вовлеченный в путь биосинтеза пуриновых нуклеотидов, может представлять собой амидофосфорибозилтрансферазу (PurF), но белок не ограничен этим.
В другом аспекте настоящего изобретения предложен способ получения пуриновых нуклеотидов, включающий стадию культивирования описанного выше микроорганизма по настоящему изобретению в среде.
Описанный выше способ получения может дополнительно включать стадию извлечения пуриновых нуклеотидов.
Микроорганизм и пуриновые нуклеотиды являются такими, как описано выше.
Используемый в настоящем документе термин «культивирование» означает, что микроорганизм выращивают в надлежащих и искусственно контролируемых условиях окружающей среды. В настоящем изобретении способ культивирования микроорганизма рода Corynebacterium можно выполнять способами, широко известными в данной области техники. В частности, культивирование можно выполнять непрерывно в периодическом процессе, в периодическом процессе с подпиткой или в периодическом процессе с многократной подпиткой, но способ культивирования не ограничен этим.
Стадию культивирования микроорганизма можно выполнять, как известно в данной области техники, в периодической культуре, непрерывной культуре, культуре с подпиткой и т.д., но стадия культивирования микроорганизма не ограничена ими. Среда и другие условия культивирования, используемые для культивирования микроорганизма по настоящему изобретению, не имеют конкретных ограничений, но для культивирования микроорганизма можно использовать любую стандартную среду. В частности, микроорганизм по настоящему изобретению можно культивировать в аэробных условиях в стандартной среде, содержащей подходящий источник углерода, источник азота, источник фосфора, неорганическое соединение, аминокислоту и/или витамин и т.д., при регулировании температуры, рН и т.д. Среда для культивирования штамма Corynebacterium известна (например, Manual of Methods for General Bacteriology by the American Society for Bacteriology, Washington D.C., USA, 1981).
Источники углерода, которые можно использовать в среде, включают сахариды и углеводы (например, глюкозу, сахарозу, лактозу, фруктозу, мальтозу, крахмал и целлюлозу), масла и жиры (например, соевое масло, подсолнечное масло, арахисовое масло и кокосовое масло), жирные кислоты (например, пальмитиновую кислоту, стеариновую кислоту и линолевую кислоту), спирты (например, глицерин и этанол), органические кислоты (например, уксусную кислоту) и т.д. Эти вещества можно использовать отдельно или в виде смеси, но без ограничений.
Источники азота, которые можно использовать в среде, включают пептон, дрожжевой экстракт, мясной сок, солодовый экстракт, кукурузный сироп, муку из бобовых и мочевину или неорганическое соединение (например, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония) и т.д. Источники азота можно также использовать отдельно или в виде смеси, но без ограничений.
Источники фосфора, которые можно использовать в среде, могут включать дигидрофосфат калия, гидрофосфат калия и соответствующие соли, содержащие натрий. Дополнительно в культуральную среду можно включать соль металла (например, сульфат магния или сульфат железа), требуемую для роста. Наконец, в культуральную среду в дополнение к вышеперечисленным веществам можно включать незаменимые вещества для роста (например, аминокислоты и витамины). Дополнительно можно использовать предшественники, подходящие для культуральной среды. Перечисленное выше исходное сырье можно добавлять в периодическом режиме культивирования или в непрерывном режиме культивирования в процессе культивирования способом, подходящим для культуральной среды.
Значение рН культуральной среды можно регулировать в ходе культивирования микроорганизма, используя основное соединение (например, гидроксид натрия, гидроксид калия и аммиак) или кислое соединение (например, фосфорную кислоту или серную кислоту) соответствующим способом. Дополнительно можно предотвращать образование пены с помощью пеногасителя (например, сложного эфира полигликоля и жирной кислоты). Дополнительно для поддержания аэробного состояния культуральной среды в культуральную среду можно вводить кислород или кислородсодержащий газ (например, воздух). Температуру культуральной среды обычно можно поддерживать при значениях от 20°С до 45°С и, в частности, от 25°С до 40°С. Процесс культивирования можно продолжать до получения требуемого количества L-аминокислоты и, в частности, в течение 10-160 часов.
Пуриновые нуклеотиды, продуцируемые в описанном выше процессе культивирования, могут высвобождаться в среду или оставаться в клетках.
Способ получения пуриновых нуклеотидов по настоящему изобретению после стадии культивирования может дополнительно включать стадию извлечения пуриновых нуклеотидов из микроорганизма или среды.
Извлечение пуриновых нуклеотидов может быть выполнено стандартным, известным в данной области техники способом. В качестве способа извлечения можно использовать центрифугирование, фильтрование, анионообменную хроматографию, кристаллизацию и т.д. Например, культуральную среду можно центрифугировать при низкой скорости для извлечения биомассы и полученный супернатант можно разделять с помощью ионообменной хроматографии, но способ извлечения не ограничен этим, и требуемые пуриновые нуклеотиды можно извлекать из культивируемого микроорганизма или из среды соответствующим известным в данной области техники способом.
Стадия извлечения может дополнительно включать процесс разделения и/или процесс очистки.
Еще в одном аспекте настоящего изобретения предложено применение продуцирующего пуриновый нуклеотид микроорганизма рода Corynebacterium, в котором белок, включающий аминокислотную последовательность SEQ ID NO: 1, инактивирован, для повышения продукции пуриновых нуклеотидов.
Еще в одном аспекте настоящего изобретения предложен способ повышения продукции пуриновых нуклеотидов, включающий стадию инактивации белка, включающего аминокислотную последовательность SEQ ID NO: 1 согласно настоящему изобретению, в микроорганизме рода Corynebacterium.
Термины «пуриновый нуклеотид», «белок, включающий аминокислотную последовательность SEQ ID NO: 1», «инактивация» и «микроорганизм рода Corynebacterium» являются такими, как описано выше.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Далее настоящее описание изобретения будет подробно раскрыто с помощью репрезентативных воплощений изобретения. Тем не менее, эти репрезентативные воплощения изобретения предназначены только для иллюстративных целей и не предназначены ограничивать объем настоящего изобретения.
Пример 1. Получение рекомбинантного вектора для цели инактивации белка семейства WhiB
Белок семейства WhiB был выбран в качестве белка-мишени инактивации для повышения способности продуцировать пуриновый нуклеотид.
Пример 1-1. Отбор белка семейства WhiB Corynebacterium stationis
Белок семейства WhiB был отобран путем скрининга генома штамма Corynebacterium stationis АТСС 6872 дикого типа, и среди генов в геноме был отобран один тип гена, который считают вовлеченным в продуцирование пуриновых нуклеотидов.
На основании нуклеотидных последовательностей, представленных в Genbank Национального института здравоохранения (NIH)(США), было подтверждено, что этот ген представляет собой регулятор транскрипции WhiB.
Пример 1-2. Получение кодирующего белок фрагмента гена для инактивации белка семейства WhiB
Хромосомные гены штамма АТСС 6872, представляющего собой штамм Corynebacterium stationis дикого типа, выделяли с помощью набора реактивов G-spin для выделения суммарной ДНК (Intron, кат. №17045). Затем проводили полимеразную цепную реакцию (ПЦР), используя хромосомные гены в качестве матрицы.
Затем для инактивации белка семейства WhiB эндогенные активности этих белков устраняли путем делеции генов, кодирующих эти белки; или уровни экспрессии этих белков минимизировали путем ослабления активности генов, кодирующих эти белки.
В частности, эндогенные активности описанных выше генов устраняли с помощью вектора, полученного в соответствии с Примером 1-2-1, и каждый из эндогенных кодонов-инициаторов (т.е. ATG) указанного выше штамма заменяли на GTG или TTG с помощью вектора, полученного в Примере 1-2-2. Известно, что эффективность кодона GTG или TTG для экспрессии белка ниже по сравнению с кодоном ATG.
Пример 1-2-1. Получение вектора для делеции гена, кодирующего белок семейства WhiB
Чтобы получить вектор с целью делеции гена, кодирующего белок семейства WhiB, каждый из фрагментов гена (deletion-A и deletion-B) получали путем проведения ПЦР с использованием геномной ДНК штамма АТСС 6872 в качестве матрицы вместе с парой праймеров SEQ ID NO: 3 и SEQ ID NO: 4 и парой праймеров SEQ ID NO: 5 и SEQ ID NO: 6, соответственно. В частности, ПЦР проводили в следующих условиях: денатурация при 94°С в течение 5 минут; 25 циклов денатурации при 94°С в течение 30 секунд, отжига при 55°С в течение 30 секунд и полимеризации при 72°С в течение 2 минут; и полимеризация при 72°С в течение 7 минут.
В результате могут быть получены два полинуклеотидных фрагмента (т.е. фрагмент 1026 п.о. deletion-A и фрагмент 1044 п.о. deletion-B). Используя эти два фрагмента в качестве матриц, проводили ПЦР с перекрывающимися праймерами вместе с праймерами SEQ ID NO: 3 и SEQ ID NO: 6, и, таким образом, получили продукт ПЦР 2050 п.о. (далее в настоящем документе обозначен как «фрагмент deletion))).
Полученный фрагмент «deletion» обрабатывали ферментом рестрикции XbaI (New England Biolabs, г. Беверли, штат Массачусетс, США) и лигировали с вектором pDZ, обработанным тем же ферментом рестрикции, используя лигазу Т4 (New England Biolabs, г. Беверли, штат Массачусетс, США). Полученным геном трансформировали Е. coli DH5α и отбирали трансформанты на среде Лурия-Бертани (LB), содержащей канамицин, а затем получали ДНК с использованием набора реактивов DNA-spin для выделения суммарной плазмидной ДНК (iNtRON).
Вектор, полученный описанным выше методом, нацеленный на делецию гена, кодирующего белок семейства WhiB, был назван «pDZ-deletion».
Пример 1-2-2. Получение вектора для снижения экспрессии белка семейства WhiB
Чтобы получить вектор, нацеленный на ослабление активности гена, кодирующего белок семейства WhiB, кодон-инициатор штамма АТСС 6872 (т.е. ATG) модифицировали до TTG или GTG.
Сначала, чтобы получить штамм, в котором кодон-инициатор модифицирован до TTG, каждый из фрагментов гена (alt-A и alt-B, где кодон-инициатор модифицирован до TTG или GTG) получали путем проведения ПЦР с использованием геномной ДНК штамма АТСС 6872 в качестве матрицы вместе с парой праймеров SEQ ID NO: 7 и SEQ ID NO: 8 и парой праймеров SEQ ID NO: 9 и SEQ ID NO: 10, соответственно. В результате могут быть получены два полинуклеотида (т.е. фрагмент 974 п.о. alt-A и фрагмент 982 п.о. alt-B). Используя эти два фрагмента в качестве матриц, проводили ПЦР с перекрывающимися праймерами вместе с праймерами SEQ ID NO: 7 и SEQ ID NO: 10, и, таким образом, получили продукт ПЦР 1955 п.о. (далее в настоящем документе обозначен как «фрагмент alt»).
Дополнительно, чтобы получить штамм, в котором кодон-инициатор модифицирован до GTG, каждый из фрагментов гена (alt-A и alt-B) получали путем проведения ПЦР с использованием геномной ДНК штамма АТСС 6872 в качестве матрицы вместе с парой праймеров SEQ ID NO: 7 и SEQ ID NO: 11 и парой праймеров SEQ ID NO: 12 и SEQ ID NO: 10, соответственно. В результате могут быть получены два полинуклеотида (т.е. фрагмент 974 п.о. alt-A и фрагмент 982 п.о. alt-B). Используя эти два фрагмента в качестве матриц, проводили ПЦР с перекрывающимися праймерами вместе с праймерами SEQ ID NO: 7 и SEQ ID NO: 10, и, таким образом, получили продукт ПЦР 1955 п.о. (далее в настоящем документе обозначен как «фрагмент alg»).
Условия для каждой ПЦР в этом случае являются такими, как описано ниже: денатурация при 94°С в течение 5 минут; 25 циклов денатурации при 94°С в течение 30 секунд, отжига при 55°С в течение 30 секунд и полимеризации при 72°С в течение 2 минут; и полимеризация при 72°С в течение 7 минут.
Каждый из полученных фрагментов гена обрабатывали ферментом рестрикции XbaI (New England Biolabs, г. Беверли, штат Массачусетс, США) и лигировали с вектором pDZ, обработанным тем же ферментом рестрикции, используя лигазу Т4 (New England Biolabs, г. Беверли, штат Массачусетс, США). Каждым из полученных генов трансформировали Е. coli DH5α и отбирали трансформанты на среде LB, содержащей канамицин, а затем получали ДНК с использованием набора реактивов DNA-spin для выделения суммарной плазмидной ДНК (iNtRON).
Векторы, полученные описанным выше методом, нацеленные на ослабление активности гена, кодирующего белок семейства WhiB, были названы «pDZ-alt» и «pDZ-alg», соответственно.
В данном случае последовательности праймеров, используемых для получения векторов, представлены в Таблице 1 ниже.

Пример 2. Получение штамма, в котором инактивирован белок семейства WhiB, с использованием штамма дикого типа, продуцирующего пуриновые нуклеотиды, и оценка его способности продуцировать пуриновые нуклеотиды Пример 2-1. Получение штамма, в котором инактивирован белок семейства WhiB, с использованием штамма, имеющего происхождение от штамма дикого типа, продуцирующего КсМФ среди прочих пуриновых нуклеотидов
Штамм Corynebacterium stationis KCCM-10530 (патент KR №10-0542568) трансформировали каждым из двух видов векторов (т.е. pDZ-alt и pDZ-alg) индивидуально методом электропорации и сначала отбирали колонии, выросшие на селективной среде, содержащей канамицин (25 мг/л).
Затем штаммы, в которых делетирован ген, кодирующий белок семейства WhiB, или кодон-инициатор модифицирован до ослабленной формы (т.е. ATG→TTG или ATG→GTG), получали посредством процесса вторичного кроссинговера, основанного на гомологии между эндогенным геном штаммов и полинуклеотидами, включенными в описанные выше векторы.
Затем штамм, в котором делетирован ген, кодирующий белок семейства WhiB, отбирали с использованием праймеров SEQ ID NO: 13 и SEQ ID NO: 6. При проведении ПЦР с использованием указанных выше праймеров штамм дикого типа продуцировал фрагмент 1680 п. о., тогда как в штамме с делетированным геном был выявлен фрагмент 1414 п.о.
Дополнительно был отобран штамм, в котором ослаблена активность гена, кодирующего белок семейства WhiB, с помощью ПЦР с нарушенным спариванием оснований. Мутация ATG→TTG была отобрана с использованием праймеров SEQ ID NO: 14 и SEQ ID NO: 6, тогда как мутация ATG→GTG была отобрана с использованием праймеров SEQ ID NO: 15 и SEQ ID NO: 6. Поскольку каждая из SEQ ID NO: 14 и SEQ ID NO: 15 включает в себя Τ или G на 3'-конце вместо А, который находится в нуклеотидной последовательности штамма дикого типа, фрагменты ПЦР удалось обнаружить только при наличии мутации. Окончательное подтверждение штаммов, которые были сначала подтверждены методом ПЦР с нарушенным спариванием оснований, было получено путем анализа последовательности гена.
Наконец, штаммы, полученные описанным выше методом, были названы следующим образом: штамм, в котором делетирован ген, кодирующий белок семейства WhiB, был назван CN02-1545; штамм, в котором активность указанного выше гена ослаблена вследствие замены кодона-инициатора на форму TTG, был назван CJX-1546; и штамм, в котором активность указанного выше гена ослаблена вследствие замены кодона-инициатора на форму GTG, был назван CJX-1547.
В данном случае последовательности праймеров, использованных для получения штаммов, представлены в Таблице 2 ниже.
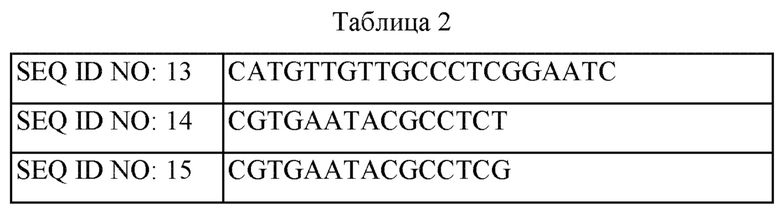
В этом случае штамм CN02-1545 был депонирован в Международном Корейском Центре Культур Микроорганизмов (KCCM) 7 ноября 2017 г. в соответствии с условиями Будапештского договора, и ему был присвоен номер доступа KCCM12152P.
Пример 2-2. Оценка способности продуцировать КсМФ у штамма, в котором инактивирован белок семейства WhiB
Чтобы измерить способность продуцировать КсМФ у штамма Corynebacterium stationis KCCM-10530, который продуцирует КсМФ среди прочих пуриновых нуклеотидов, и штаммов CN02-1545, CJX-1546 и CJX-1547, полученных в Примере 2-1, использовали описанный ниже метод культивирования.
Описанную ниже посевную среду (5 мл) распределяли в пробирки (диаметр: 18 мм), простерилизованные в автоклаве стандартным методом, засевали используемым штаммом и культивировали при встряхивании при 30°С при 180 об/мин в течение 18 часов. Полученную в результате культуру использовали в качестве раствора посевной культуры. Каждую из ферментационной среды, основной среды и дополнительной стерильной среды стерилизовали в автоклаве стандартным методом и распределяли в предварительно простерилизованные в автоклаве колбы Эрленмейера емкостью 500 мл для встряхивателя в количестве 29 мл и 10 мл, соответственно, подвергали фагоцитозу раствором посевной культуры (1 мл) и культивировали в течение 72 часов. Скорость вращения устанавливали на 200 об/мин и регулировали температуру до 30°С.
Использовали среду описанного ниже состава. После завершения культивирования количество продуцируемого КсМФ измеряли методом с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ), и результаты представлены в Таблице 3 ниже. Концентрация накопленного КсМФ указана как «5'-ксантилат натрия ⋅ 7H2O».
КсМФ: посевная среда для колб
Глюкоза 30 г/л, пептон 15 г/л, дрожжевой экстракт 15 г/л, NaCl 2,5 г/л, мочевина 3 г/л, аденин 150 мг/л, гуанин 150 мг/л, рН 7,2.
КсМФ: среда для продуцирования в колбах (основная среда)
Глюкоза 60 г/л, сульфат магния 10 г/л, хлорид кальция 10 мг/л, сульфат железа 20 мг/л, сульфат марганца 10 мг/л, сульфат цинка 10 мг/л, сульфат меди 1 мг/л, биотин 100 мкг/л, тиамин 5 мг/л, аденин 30 мг/л, гуанин 30 мг/л, рН 7,2.
КсМФ: среда для продуцирования в колбах (дополнительная стерильная среда) Дигидрофосфат калия 10 г/л, гидрофосфат калия 10 г/л, мочевина 7 г/л, сульфат аммония 5 г/л.
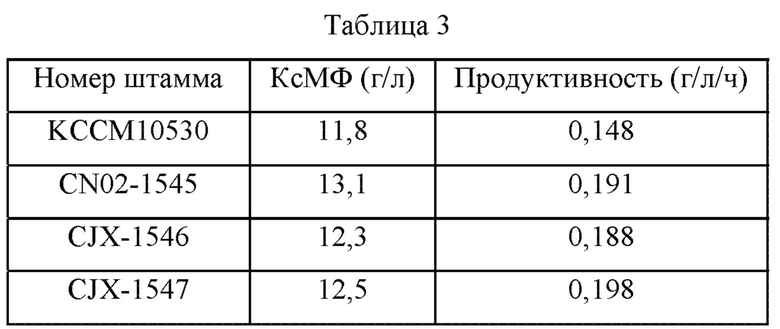
В частности, в Таблице 3 продуктивность представляет собой количество КсМФ, продуцируемого в единицу времени час в момент времени 48 часов после завершения культивирования.
Как показано в Таблице 3, было подтверждено, что родительский штамм (т.е. штамм KCCM10530) после завершения культивирования в колбе продуцировал КсМФ в концентрации 11,8 г/л; для штамма CN02-1545 было продемонстрировано увеличение количества продуцируемого КсМФ на 1,3 г/л; для штамма CJX-1546 было продемонстрировано увеличение количества продуцируемого КсМФ на 0,5 г/л; и для штамма CJX-1547 было продемонстрировано увеличение количества продуцируемого КсМФ на 0,7 г/л. Эти результаты подтвердили, что количество продуцируемого КсМФ указанных выше штаммов увеличилось на 11%, 4% и 6%, соответственно, по сравнению с родительским штаммом.
Кроме того, в то время как родительский штамм (т.е. KCCM10530) показал продуктивность 0,148 г/л/ч, штамм CN02-1545 показал продуктивность 0,191 г/л/ч, штамм CJX-1546 показал продуктвность 0,188 г/л/ч, и штамм CJX-1547 показал продуктивность 0,198 г/л/ч. Эти результаты подтвердили, что продуктивность указанных выше штаммов по КсМФ повысилась на 29%, 27% и 34%, соответственно, по сравнению с родительским штаммом.
Описанные выше результаты свидетельствуют о том, что при инактивации белка семейства WhiB согласно настоящему изобретению в штамме продукция в нем пуриновых нуклеотидов повышается.
Пример 3. Получение штамма, в котором инактивирован белок семейства WhiB, с использованием мутантного штамма, продуцирующего пуриновые нуклеотиды, в котором усилен ген пути биосинтеза пуринов, и оценка его способности продуцировать пуриновые нуклеотиды
Пример 3-1. Получение штамма, в котором инактивирован белок семейства WhiB, с использованием мутантного штамма, продуцирующего КсМФ среди прочих пуриновых нуклеотидов
Штамм, в котором инактивирован ген, кодирующий белок семейства WhiB, получали с использованием штамма-продуцента КсМФ, в котором усилен ген пути биосинтеза пуринов. В частности, штамм-продуцент КсМФ, в котором усилен ген пути биосинтеза пуринов, представляет собой модифицированный штамм KCCM-10530 с усиленным геном PurF, в котором кодон-инициатор гена purF (т.е. GTG) преобразован в ATG. Штамм KCCM-10530, в котором усилен ген purF пути биосинтеза пуринов, был назван CJX-1544 [KCCM-10530_purF(g1a)]. Штамм CJX-1544 [KCCM-10530_purF(g1a)] трансформировали вектором pDZ-deletion, представляющим собой рекомбинантный вектор, полученный в Примере 1, методом электропорации. Сначала отбирали колонии, выросшие на селективной среде, содержащей канамицин (25 мг/л).
Затем штамм, в котором делетирован ген, кодирующий белок семейства WhiB, получали в результате процесса вторичного кроссинговера с использованием гомологии между эндогенным геном указанного выше штамма и полинуклеотидом, включенным в указанный выше вектор. Затем штамм, в котором делетирован ген, кодирующий белок семейства WhiB, получали таким же образом, как описано в Примере 2, с использованием праймеров SEQ ID NO: 13 и SEQ ID NO: 6.
Наконец, штамм, в котором делетирован ген, кодирующий белок семейства WhiB, полученный описанным выше методом, был назван CJX-1553.
Пример 3-2. Оценка способности продуцировать КсМФ среди прочих пуриновых нуклеотидов у штамма, в котором инактивирован ген, кодирующий белок семейства WhiB
Чтобы измерить способность продуцировать КсМФ у штамма CJX-1544, в котором усилен ген пути биосинтеза пуринов (т.е. purF), и штамма CJX-1553, полученного в Примере 3-1, использовали такой же метод культивирования, как описано в Примере 2-2. После завершения культивирования количество продуцируемого КсМФ в каждом штамме измеряли методом с использованием ВЭЖХ, и результаты представлены в Таблице 4 ниже.
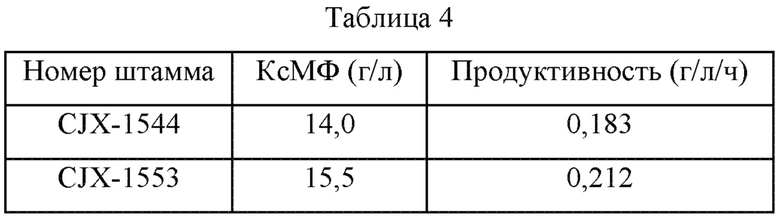
В частности, в Таблице 4 продуктивность представляет собой количество КсМФ, продуцируемого в единицу времени час в момент времени 48 часов после завершения культивирования.
Как показано в Таблице 4, было подтверждено, что количество продуцируемого КсМФ в штамме CJX-1553 увеличилось на 1,5 г/л по сравнению с родительским штаммом (т.е. CJX-1544), в котором усилен ген пути биосинтеза пуринов (т.е. purF). На основании полученного выше результата было подтверждено, что количество продуцируемого КсМФ в штамме CJX-1553 увеличилось на 10,7% по сравнению с его родительским штаммом (т.е. CJX-1544).
Дополнительно было подтверждено, что родительский штамм (т.е. CJX-1544) показал продуктивность 0,183 г/л/ч, а штамм CJX-1553 показал продуктивность 0,212 г/л/ч. На основании полученного выше результата было подтверждено, что продуктивность штамма CJX-1553 по КсМФ увеличилась на 16% по сравнению с его родительским штаммом (т.е. CJX-1544).
Пример 4. Получение штамма, в котором инактивирован белок семейства WhiB, с использованием штамма дикого типа, продуцирующего пуриновые нуклеотиды, и оценка его способности продуцировать пуриновые нуклеотиды
Пример 4-1. Получение штамма, в котором инактивирован белок семейства WhiB, с использованием штамма, имеющего происхождение от штамма дикого типа, продуцирующего ИМФ среди прочих пуриновых нуклеотидов
Штамм Corynebacterium stationis KCCM-10610 (патент KR №10-0588577) трансформировали каждым из двух видов векторов (т.е. pDZ-alt и pDZ-alg), полученных согласно Примеру 1, индивидуально методом электропорации, и сначала отбирали колонии, выросшие на селективной среде, содержащей канамицин (25 мг/л).
Затем штаммы, в которых кодон-инициатор гена, кодирующего белок семейства WhiB, модифицирован до ослабленной формы (т.е. ATG→TTG или ATG→GTG), получали посредством процесса вторичного кроссинговера, основанного на гомологии между эндогенным геном штамма и полинуклеотидами, включенными в описанные выше векторы.
Штамм, в котором ослаблена активность гена, кодирующего белок семейства WhiB, отбирали с помощью ПЦР с нарушенным спариванием оснований. Мутация ATG→TTG была отобрана с использованием праймеров SEQ ID NO: 14 и SEQ ID NO: 6, при этом мутация ATG→TTG была отобрана с использованием праймеров SEQ ID NO: 15 и SEQ ID NO: 6. Поскольку каждая из SEQ ID NO: 14 и SEQ ID NO: 15 включает в себя Τ или G на 3'-конце вместо А, который находится в нуклеотидной последовательности штамма дикого типа, фрагменты ПЦР удалось обнаружить только при наличии мутации. Окончательное подтверждение штаммов, которые были сначала подтверждены методом ПЦР с нарушенным спариванием оснований, было получено путем анализа последовательности гена.
Наконец, штаммы, полученные описанным выше методом, были названы следующим образом: а именно, штамм, в котором активность гена, кодирующего белок семейства WhiB, ослаблена вследствие замены кодона-инициатора на форму TTG, был назван CJI-2078; и штамм, в котором активность указанного выше гена ослаблена вследствие замены кодона-инициатора на форму GTG, был назван CJI-2077.
Пример 4-2. Оценка способности продуцировать ИМФ среди прочих пуриновых нуклеотидов у штамма, в котором инактивирован ген, кодирующий белок семейства WhiB
Чтобы измерить способность продуцировать ИМФ у штамма Corynebacterium stationis KCCM-10610, который представляет собой штамм, продуцирующий ИМФ среди прочих пуриновых нуклеотидов, и штаммов CJI-2078 и CJI-2077, полученных в Примере 4-1, использовали описанный ниже метод культивирования.
Описанную ниже посевную среду (5 мл) инокулировали в каждой простерилизованной в автоклаве пробирке (диаметр: 18 мм), культивировали при встряхивании при 30°С в течение 24 часов, и полученную в результате культуру использовали в качестве раствора посевной культуры. Среду для продуцирования (29 мл) распределяли в колбы Эрленмейера емкостью 250 мл для встряхивателя, предварительно простерилизованные в автоклаве при 121°С в течение 15 мин, и инокулировали раствором посевной культуры (2 мл) и культивировали в течение 4-5 суток. Условия культивирования были следующими: скорость вращения устанавливали на 170 об/мин, температуру устанавливали на 30°С и рН доводили до 7,5.
Использовали среду описанного ниже состава. После завершения культивирования количество продуцируемого ИМФ измеряли методом с использованием ВЭЖХ, и результаты представлены в Таблице 5 ниже.
ИМФ: посевная среда
Глюкоза 10 г/л, пептон 10 г/л, мясной экстракт 10 г/л, дрожжевой экстракт 10 г/л, NaCl 2,5 г/л, аденин 100 мг/л, гуанин 100 мг/л, рН 7,2. ИМФ: среда для продуцирования
Глутамат натрия 1 г/л, хлорид аммония 10 г/л, сульфат магния 12 г/л, хлорид кальция 0,1 г/л, сульфат железа 20 мг/л, сульфат марганца 20 мг/л, сульфат цинка 20 мг/л, сульфат меди 5 мг/л, L-цистеин 23 мг/л, аланин 24 мг/л, никотиновая кислота 8 мг/л, биотин 45 мкг/л, тиамин HCl 5 мг/л, аденин 30 мг/л, фосфорная кислота (85%) 19 г/л, глюкоза 26 г/л, фруктоза 14 г/л (добавленная).
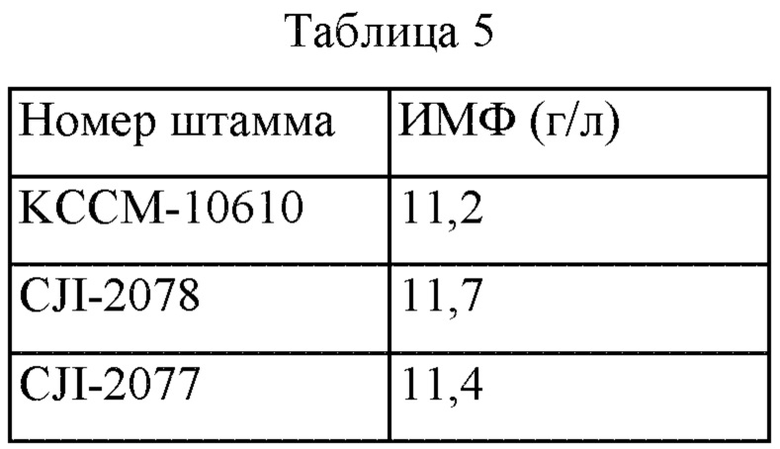
Как показано в Таблице 5 выше, было подтверждено, что количество продуцируемого ИМФ увеличилось на 0,5 г/л в штамме CJI-2078 и на 0,2 г/л в штамме CJI-2077 по сравнению с их родительским штаммом (т.е. KCCM-10610). Эти результаты подтвердили, что количество продуцируемого ИМФ в этих штаммах увеличилось на 4,5% и 1,8%, соответственно, по сравнению с родительским штаммом.
Пример 5. Получение штамма, в котором инактивирован белок семейства WhiB, с использованием мутантного штамма, продуцирующего пуриновые нуклеотиды, в котором усилен ген пути биосинтеза пуринов, и оценка его способности продуцировать пуриновые нуклеотиды
Пример 5-1. Получение штамма, в котором инактивирован белок семейства WhiB, с использованием мутантного штамма, продуцирующего ИМФ среди прочих пуриновых нуклеотидов
Штамм, в котором инактивирован ген, кодирующий белок семейства WhiB, получали с использованием штамма-продуцента ИМФ, в котором усилен ген пути биосинтеза пуринов. В частности, штамм-продуцент ИМФ, в котором усилен ген пути биосинтеза пуринов, представляет собой модифицированный штамм KCCM-10610 с усиленным геном PurF (т.е. геном пути биосинтеза пуринов), в котором кодон-инициатор гена purF (т.е. GTG) преобразован в ATG. Штамм KCCM-10610, в котором усилен ген purF пути биосинтеза пуринов, был назван CJI-1964 [KCCM-10610_purF(g1a)]. Штамм CJI-1964[KCCM-10610_purF(g1a)] трансформировали двумя видами векторов (т.е. pDZ-alt и pDZ-alg), полученными в Примере 1, методом электропорации, и штаммы, в которых кодон-инициатор гена, кодирующего белок семейства WhiB, модифицирован до ослабленной формы (т.е. ATG→TTG или ATG→GTG), получали таким же образом, как описано в Примере 4-1.
Наконец, штаммы, полученные описанным выше методом, были названы следующим образом: а именно, штамм, в котором активность гена, кодирующего белок семейства WhiB, ослаблена вследствие замены кодона-инициатора на форму TTG, был назван CJI-2081; и штамм, в котором активность указанного выше гена ослаблена вследствие замены кодона-инициатора на форму GTG, был назван CJI-2080.
Пример 5-2. Оценка способности продуцировать ИМФ среди прочих пуриновых нуклеотидов у штамма, в котором инактивирован ген, кодирующий белок семейства WhiB
Чтобы измерить способность продуцировать ИМФ у штамма CJI-1964, в котором усилен ген пути биосинтеза пуринов, и штаммов CJI-2081 и CJI-2080, полученных в Примере 5-1, использовали такой же метод культивирования, как описано в Примере 4-2. После завершения культивирования количество продуцируемого ИМФ в каждом штамме измеряли методом с использованием ВЭЖХ, и результаты представлены в Таблице 6 ниже.
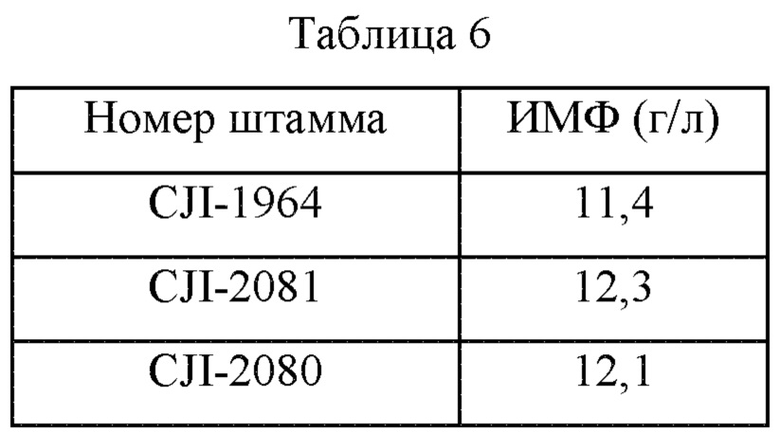
Как показано в Таблице 6 выше, было подтверждено, что количество продуцируемого ИМФ увеличилось на 0,9 г/л в штамме CJI-2081 и на 0,7 г/л в штамме CJI-2080 по сравнению с их родительским штаммом (т.е. CJI-1964). Эти результаты подтвердили, что количество продуцируемого ИМФ в этих штаммах увеличилось на 7,8% и 6,1%, соответственно, по сравнению с родительским штаммом.
Таким образом, было подтверждено, что при инактивации в штамме регулятора транскрипции белка семейства WhiB этот штамм может продуцировать пуриновые нуклеотиды с более высоким выходом по сравнению с его родительским штаммом или другими немодифицированными микроорганизмами. Дополнительно эти результаты свидетельствуют о том, что при инактивации в штамме белка семейства WhiB этот штамм может продуцировать пуриновые нуклеотиды с более высоким выходом по сравнению с его родительским штаммом или другими немодифицированными микроорганизмами.
На основании описанного выше специалист в области техники, к которой относится настоящее изобретение, сможет понять, что настоящее изобретение может быть применимо в других конкретных формах без изменения технических концепций или существенных характеристик настоящего изобретения. В связи с этим раскрытые в настоящем документе репрезентативные воплощения предназначены только для иллюстративных целей, и их не следует истолковывать как ограничивающие объем настоящего изобретения. Напротив, предусмотрено, что настоящее изобретение охватывает не только иллюстративные воплощения, но также различные альтернативы, модификации, эквиваленты и другие воплощения, которые могут быть включены в сущность и объем настоящего изобретения, как определено прилагаемой формулой изобретения.
--->
<110> CJ CheilJedang Corporation
<120> A MICROORGANISM OF THE GENUS CORYNEBACTERIUM PRODUCING PURINE
NUCLEOTIDE AND A METHOD FOR PRODUCING PURINE NUCLEOTIDE BY USING THE SAME
<130> OPA18458
<150> PCT/KR2019/001117
<151> 2019-01-25
<160> 15
<170> KoPatentIn 3.0
<210> 1
<211> 121
<212> PRT
<213> Corynebacterium sp.
<400> 1
Met Arg Leu Cys Val Asp Lys Gln Lys Glu Arg Gln Met Thr Val Ser
1 5 10 15
Leu Lys Met Ser Thr Gln Ala Asp Thr Tyr Asn Ala Thr Thr Pro Glu
20 25 30
Arg Gly Glu Trp Val Thr Gln Ala Lys Cys Arg Asn Gly Asp Pro Asp
35 40 45
Ala Leu Phe Val Arg Gly Ala Glu Gln Arg Lys Ala Ala Val Ile Cys
50 55 60
Arg His Cys Pro Val Leu Asn Glu Cys Arg Ala Asp Ala Leu Asp Asn
65 70 75 80
Arg Val Glu Phe Gly Val Trp Gly Gly Leu Thr Glu Arg Gln Arg Arg
85 90 95
Ala Leu Leu Arg Lys Asn Pro His Ile Thr Asn Trp Ala Asp Tyr Leu
100 105 110
Ala Gln Gly Gly Glu Leu Glu Gly Ile
115 120
<210> 2
<211> 366
<212> DNA
<213> Corynebacterium sp.
<400> 2
atgagattat gtgtggataa gcagaaggag cgccagatga ccgtgagctt gaagatgtca 60
actcaggcgg acacctacaa tgcgacaacc ccagaacgcg gggagtgggt gacgcaagct 120
aagtgtcgaa atggtgaccc tgatgcactt tttgtgcgcg gtgcggagca gcgtaaagct 180
gccgttattt gccgtcactg tcctgtcctt aatgaatgtc gagcagatgc tctagataac 240
cgcgtggaat tcggtgtctg gggcggacta actgagcgcc agcgccgtgc gttgctgcgc 300
aaaaacccac acatcactaa ctgggctgat tatctcgccc aaggtggaga actagaagga 360
atctaa 366
<210> 3
<211> 32
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 3
tgctctagag atctagcacg cctaaagagt cg 32
<210> 4
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 4
gtaggtgtcc gcctgagttg 20
<210> 5
<211> 44
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 5
caactcaggc ggacacctac tcactaactg ggctgattat ctcg 44
<210> 6
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 6
tgctctagag gtgcccttca tcatcaggt 29
<210> 7
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 7
cgcggatccc agccattagg taaggtgctt g 31
<210> 8
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 8
agaggcgtat tcacgctctg 20
<210> 9
<211> 46
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 9
cagagcgtga atacgcctct tgagattatg tgtggataag cagaag 46
<210> 10
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 10
cgcggatccc gaggatacaa agcccacga 29
<210> 11
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 11
cgaggcgtat tcacgctctg 20
<210> 12
<211> 46
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 12
cagagcgtga atacgcctcg tgagattatg tgtggataag cagaag 46
<210> 13
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 13
catgttgttg ccctcggaat c 21
<210> 14
<211> 15
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 14
cgtgaatacg cctct 15
<210> 15
<211> 15
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 15
cgtgaatacg cctcg 15
<---
Группа изобретений относится к микроорганизму из рода Corynebacterium, продуцирующему пуриновый нуклеотид, и к способу получения пуринового нуклеотида с его использованием. Предложен микроорганизм Corynebacterium stationis, продуцирующий пуриновый нуклеотид и имеющий повышенную продуктивность по пуриновому нуклеотиду, в котором белок, состоящий из аминокислотной последовательности SEQ ID NO: 1, инактивирован. При этом где пуриновый нуклеотид представляет собой по меньшей мере один пуриновый нуклеотид, выбранный из группы, состоящей из 5'-инозинмонофосфата (ИМФ) и 5'-ксантозинмонофосфата (КсМФ). Предложены также способ получения пуринового нуклеотида с использованием указанного микроорганизма и способ повышения продукции пуринового нуклеотида. Группа изобретений обеспечивает повышение продуктивности пуриновых нуклеотидов. 3 н. и 4 з.п. ф-лы, 6 табл., 5 пр.
1. Микроорганизм Corynebacterium stationis, продуцирующий пуриновый нуклеотид и имеющий повышенную продуктивность по пуриновому нуклеотиду, в котором белок, состоящий из аминокислотной последовательности SEQ ID NO: 1, инактивирован, и где пуриновый нуклеотид представляет собой по меньшей мере один пуриновый нуклеотид, выбранный из группы, состоящей из 5'-инозинмонофосфата (ИМФ) и 5'-ксантозинмонофосфата (КсМФ).
2. Микроорганизм Corynebacterium stationis по п. 1, в котором по меньшей мере один белок, вовлеченный в путь биосинтеза указанного пуринового нуклеотида, дополнительно модифицирован так, что усиливается продуктивность по пуриновому нуклеотиду.
3. Микроорганизм Corynebacterium stationis по п. 2, где указанный по меньшей мере один белок выбран из группы, состоящей из амидофосфорибозилтрансферазы (PurF), фосфорибозиламино-глицинлигазы (PurD), фосфорибозилглицинамид-формилтрансферазы (PurN), фосфорибозилформилглицинамидинсинтазы (PurL), AIR синтетазы (FGAM циклазы), фосфорибозиламиноимидазолкарбоксилазы, фосфорибозиламиноимидазолсукцинокарбоксамидсинтазы, аденилосукцинатлиазы (ADSL), фосфорибозиламиноимидазолкарбоксамидформилтрансферазы, инозинмонофосфатсинтазы, ИМФ-дегидрогеназы и аденилосукцинатсинтазы (purA).
4. Микроорганизм Corynebacterium stationis по п. 2, где модификация состоит в усилении активности белка амидофосфорибозилтрансферазы (PurF).
5. Способ получения пуринового нуклеотида, включающий культивирование микроорганизма Corynebacterium stationis по любому из пп. 1-4 в среде,
где пуриновый нуклеотид представляет собой по меньшей мере один пуриновый нуклеотид, выбранный из группы, состоящей из 5'-инозинмонофосфата (ИМФ) и 5'-ксантозинмонофосфата (КсМФ).
6. Способ по п. 5, дополнительно включающий извлечение указанного пуринового нуклеотида из культивируемого Corynebacterium stationis или из среды после культивирования.
7. Способ повышения продукции пуринового нуклеотида, включающий инактивацию белка, состоящего из аминокислотной последовательности SEQ ID NO: 1, в микроорганизме рода Corynebacterium.
| US 20160222394 A1, 04.08.2016 | |||
| Приспособление к металлорежущим станкам для центрирования крупногабаритных деталей | 1951 |
|
SU94087A1 |
| МИКРООРГАНИЗМЫ Corynebacterium С ПОВЫШЕННОЙ ПРОДУКЦИЕЙ 5'- ИНОЗИНОВОЙ КИСЛОТЫ И СПОСОБ ПОЛУЧЕНИЯ НУКЛЕИНОВЫХ КИСЛОТ С ИХ ИСПОЛЬЗОВАНИЕМ | 2010 |
|
RU2482178C1 |
| СПОСОБ ПОЛУЧЕНИЯ КСАНТОЗИН-5'-МОНОФОСФАТА, ШТАММ CORYNEBACTERIUM AMMONIAGENES - ПРОДУЦЕНТ КСАНТОЗИН-5'-МОНОФОСФАТА (ВАРИАНТЫ) | 2000 |
|
RU2209249C2 |
| PEIFER S | |||
| ET AL | |||
| Metabolic engineering of the purine biosynthetic pathway in Corynebacterium glutamicum results in increased intracellular pool sizes of IMP and hypoxanthine | |||
| Microb Cell Fact | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Published | |||
Авторы
Даты
2022-03-15—Публикация
2019-01-25—Подача