Область техники
Настоящее описание относится к полинуклеотиду, обладающему промоторной активностью, композиции для экспрессии гена, содержащей этот полинуклеотид, микроорганизму, содержащему ген, способу получения пуриновых нуклеотидов с использованием этого микроорганизма и применению полинуклеотида.
Предшествующий уровень техники
Вещество нуклеиновых кислот 5'-инозинмонофосфат (далее в настоящем документе IMP) является промежуточным соединением метаболической системы биосинтеза нуклеиновых кислот, используемым в различных областях (например, в лекарственных средствах, различных областях медицинского применения и т.д.). Кроме того, наряду с 5'-гуанинмонофосфатом (далее в настоящем документе GMP) IMP является веществом, широко применяемым в качестве приправы пищевых продуктов или пищевой добавки. Известно, что IMP сам воспроизводит мясной вкус и аромат и, подобно GMP, усиливает вкус и аромат моноглутамата натрия (MSG), и в связи с этим он привлек внимание в качестве вкусовой нуклеиновокислотной приправы для пищевых продуктов.
Способы получения IMP могут включать способ ферментативного разложения рибонуклеиновой кислоты, выделенной из дрожжевых клеток, способ химического фосфорилирования инозина, полученного в результате ферментации (Agri. Biol. Chem., 36, 1511(1972) и др.), способ культивирования микроорганизма, непосредственно продуцирующего IMP, и выделения IMP из культуральной среды и т.д. Среди этих способов наиболее широко применяют способ, в котором используют микроорганизм, способный непосредственно продуцировать IMP.
Дополнительно способ получения GMP может включать способ преобразования ксантозин-5'-монофосфата (далее в настоящем документе ХМР), полученного в результате микробной ферментации, в GMP с использованием коринеформного микроорганизма, и способ первращения ХМР, полученного в результате микробной ферментации, в GMP с использованием Escherichia coli. Из этих способов, при получении GMP способом, в котором сначала получают ХМР, а затем его превращают в GMP, продуктивность ХМР (т.е. предшественника реакции превращения в ходе микробной ферментации) должна быть повышена, и кроме того, GMP, уже полученный в ходе всего процесса реакции превращения, а также продуцируемый ХМР необходимо защитить от потерь.
Между тем, так как ферменты по своей природе не всегда проявляют оптимальные, требуемые для промышленного применения свойства, связанные с их активностью, стабильностью, субстратной специфичностью к определенным оптическим изомерам и т.д., были предприняты многочисленные попытки усовершенствования ферментов, чтобы улучшить их желаемое применение посредством модификации аминокислотных последовательностей. Среди них в некоторых случаях для улучшения функции ферментов были применены рациональное конструирование и сайт-направленный мутагенез ферментов; однако недостатки этих способов состоят в том, что информация о структуре целевого фермента является недостаточной, или неясна корреляция структуры и функции, и поэтому их невозможно применять эффективно. В данном случае, сообщалось, что активность фермента можно повысить путем усовершенствования фермента способом направленного развития, в котором для получения ферментов с желаемыми признаками проводят скрининг библиотеки вариантов ферментов, сконструированной посредством случайной модификации генов, кодирующих эти ферменты.
Подробное описание
Техническая задача
Авторы настоящего изобретения провели обширное исследование получения пуриновых нуклеотидов посредством микробной ферментации с высоким выходом. В результате они обнаружили промоторы, которыя являются более эффективными для более высокой продуктивности пуриновых нуклеотидов, что привело к осуществлению настоящего изобретения.
Техническое решение
Задачей настоящего изобретения является разработка полинуклеотида, обладающего промоторной активностью.
Другой задачей настоящего изобретения является предложение композиции для экспрессии гена, содержащей этот полинуклеотид.
Еще одной задачей настоящего изобретения является предложение вектора, содержащего полинуклеотид и ген, кодирующий целевой белок.
Еще одной задачей настоящего изобретения является предложение микроорганизма рода Corynebacterium, содержащего этот вектор.
Еще одной задачей настоящего изобретения является предложение микроорганизма рода Corynebacterium, содержащего полинуклеотид и ген, кодирующий целевой белок.
Еще одной задачей настоящего изобретения является предложение способа получения пуриновых нуклеотидов, включающего культивирование указанного микроорганизма рода Corynebacterium в питательной среде.
Еще одной задачей настоящего изобретения является применение полинуклеотида для повышения экспрессии целевого белка.
Полезные эффекты изобретения
При культивировании микроорганизма рода Corynebacterium с использованием полинуклеотида, обладающего новой промоторной активностью по настоящему изобретению, можно получить пуриновые нуклеотиды с высоким выходом. Кроме того, полученные пуриновые нуклеотиды можно использовать не только в корме для животных или кормовых добавках для животных, но также в таких различных продуктах, как пищевые продукты, пищевые добавки, лекарственные средства и т.д.
Лучший способ осуществления изобретения
Настоящее подробное описание изобретения приведено ниже. В то же время, соответствующие описания и воплощения, раскрытые в настоящем описании изобретения, могут быть также применены к другим описаниям и воплощениям. Таким образом, все комбинации различных элементов, раскрытые в настоящем описании, входят в объем настоящего изобретения. Кроме того, объем настоящего изобретения не ограничен приведенным ниже конкретным описанием.
Для достижения вышеуказанных целей в одном аспекте настоящего описания предложен полинуклеотид SEQ ID NO: 1, обладающий промоторной активностью, в котором полинуклеотидная последовательность включает замену по меньшей мере одного нуклеотида. В частности, в настоящем описании предложен полинуклеотид SEQ ID NO: 1, обладающий промоторной активностью, в котором полинуклеотидная последовательность включает замену по меньшей мере одного нуклеотида, и замена в полинуклеотиде представляет собой по меньшей мере одну замену, выбранную из группы, состоящей из замены 143го нуклеотида и замены 189го нуклеотида.
В другом аспекте настоящего описания предложен полинуклеотид, обладающий промоторной активностью, где в полинуклеотидной последовательности SEQ ID NO: 1 (1) 143ый нуклеотид заменен тимином (Т); (2) 189ый нуклеотид заменен тимином (Т); или (3) 143ый нуклеотид заменен тимином (Т) и 189ый нуклеотид заменен тимином (Т).
Используемый в настоящем документе термин «полинуклеотид» относится к нити ДНК, длина которой превышает определенную длину, в виде нуклеотидного полимера, который представляет собой длинную цепь нуклеотидных мономеров, соединенных ковалентными связями.
Используемый в настоящем документе термин «полинуклеотид, обладающий промоторной активностью» относится к области ДНК, расположенной в непосредственной близости к области, вовлеченной в транскрипцию целевого гена, включающей РНК-полимеразу, энхансер и т.д., для экспрессии целевого гена, соединенного с ней ниже по направлению транскрипции. Для цели настоящего описания полинуклеотид можно использовать в качестве ослабленного промотора общего применения, например, в качестве промотора, который может ослаблять экспрессию аденилосукцинатсинтетазы. Дополнительно полинуклеотид относится к полинуклеотиду, вовлеченному в продукцию пуриновых нуклеотидов или ее усиление, но полинуклеотид не ограничен этим.
Используемая в настоящем документе SEQ ID NO: 1 относится к полинуклеотидной последовательности, обладающей промоторной активностью. Полинуклеотидная последовательность SEQ ID NO: 1 может быть получена из базы генетических данных GenBank Национального центра биотехнологической информации США (NCBI), которая является известной базой данных. В одном воплощении изобретения полинуклеотидная последовательность SEQ ID NO: 1 может быть выделена из микроорганизма рода Corynebacterium, но микроорганизм не ограничен им.
Дополнительно полинуклеотид может быть таким, что в последовательности SEQ ID NO: 1 143ий нуклеотид и/или 189ый нуклеотид заменен другим нуклеотидом. Такой полинуклеотид может относиться к нуклеотидной последовательности SEQ ID NO: 1 и/или нуклеотидной последовательности, обладающей 80%-ной, 85%-ной, 90%-ной, 95%-ной, 96%-ной, 97%-ной, 98%-ной или 99%-ной или более гомологией или идентичностью нуклеотидной последовательности SEQ ID NO: 1, где 143ий нуклеотид и/или 189ый нуклеотид заменен другим нуклеотидом. Нуклеотидная последовательность, обладающая гомологией или идентичностью, может представлять собой последовательность в указанном выше диапазоне за исключением последовательности, обладающей 100%-ной идентичностью, или может представлять собой последовательность, обладающую менее чем 100%-ной идентичностью.
В одном воплощении изобретения полинуклеотидная последовательность по настоящему изобретению может быть такой, где в полинуклеотидной последовательности SEQ ID NO: 1 (1) 143ый нуклеотид заменен тимином (Т); (2) 189ый нуклеотид заменен тимином (Т); или (3) 143ый нуклеотид заменен тимином (Т) и 189ый нуклеотид заменен тимином (Т), но полинуклеотидная последовательность не ограничена ими. В частности, полинуклеотидная последовательность по настоящему описанию может включать нуклеотидную последовательность SEQ ID NO: 2, SEQ ID NO: 3 или SEQ ID NO: 4, но полинуклеотидная последовательность не ограничена ими. Более конкретно в полинуклеотидной последовательности по настоящему описанию полинуклеотид, в котором 143ый нуклеотид заменен тимином (Т), может состоять из нуклеотидной последовательности SEQ ID NO: 2; полинуклеотид, в котором 189ый нуклеотид заменен тимином (Т), может состоять из нуклеотидной последовательности SEQ ID NO: 3; или полинуклеотид, в котором 143ый нуклеотид заменен тимином (Т) и 189ый нуклеотид заменен тимином (Т), может состоять из нуклеотидной последовательности SEQ ID NO: 4, но полинуклеотидная последовательность по настоящему описанию не ограничена ими. Полинуклеотид может быть таким, что обладает 80%-ной, 85%-ной, 90%-ной, 95%-ной, 96%-ной, 97%-ной, 98%-ной или 99%-ной или более гомологией или идентичностью нуклеотидной последовательности SEQ ID NO: 2, SEQ ID NO: 3 или SEQ ID NO: 4. Полинуклеотидная последовательность, обладающая гомологией или идентичностью, может представлять собой последовательность в указанном выше диапазоне за исключением последовательности, обладающей 100%-ной идентичностью, или может представлять собой последовательность, обладающую менее чем 100%-ной идентичностью.
Кроме того, очевидно, что в настоящем описании также можно использовать любой полинуклеотид, имеющий полинуклеотидную последовательность с делецией, модификацией, заменой или добавлением в участке последовательности, если этот полинуклеотид обладает активностью, эквивалентной или соответствующей полинуклеотиду, состоящему из нуклеотидной последовательности соответствующей SEQ ID NO, даже если в настоящем описании он описан как «полинуклеотид, имеющий нуклеотидную последовательность определенной SEQ ID NO». Например, если вариант полинуклеотида обладает активностью, идентичной или соответствующей активности полипептида, это не исключает добавления нонсенс-последовательности выше или ниже по направлению транскрипции соответствующей SEQ ID NO, природной мутации или молчащей мутации, в дополнение к конкретной модификации в положении 143 или 189, при условии, что в результате этот вариант обладает определенной активностью, и такое добавление последовательности или мутации также находятся в пределах объема настоящего изобретения.
Гомология и идентичность относятся к степени родства между двумя данными нуклеотидными последовательностями и могут быть выражены в процентах.
Термины «гомология» и «идентичность» можно часто использовать взаимозаменяемо друг с другом.
Гомология или идентичность последовательности консервативного полинуклеотида может быть определена с помощью стандартного алгоритма выравнивания и установленных программой штрафов на введение гэпа по умолчанию, которые можно использовать в комбинации. По существу гомологичные или идентичные последовательности могут гибридизоваться в условиях умеренной или высокой жесткости по всей длине последовательности или около 50%, около 60%, около 70%, около 80% или около 90% всей длины последовательности. Что касается гибридизуемых полинуклеотидов, можно также рассматривать полинуклеотиды, включающие вместо кодона вырожденный кодон.
Наличие или отсутствие гомологии, подобия или идентичности каких-либо двух нуклеотидных последовательностей можно определить, например, с помощью известного компьютерного алгоритма, такого как программа FASTA, используя параметры по умолчанию, как описано в работе Pearson et al. (1988) (Proc. Natl. Acad. Sci. USA 85]: 2444). Альтернативно их можно определить, используя алгоритм Нидлмана - Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), выполняемый программой Нидлмана в пакете программ EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277) (версия 5.0.0 или более поздняя) (включая пакет программ GCG (Devereux, J., et al., Nucleic Acids Research 12: 387 (1984)), BLASTP, BLASTN, FASTA (Atschul, [S.] [F.] et al., J Molec Biol 215]: 403 (1990); Guide to Huge Computers, Martin J. Bishop, [ED.,] Academic Press, San Diego, 1994, и [CARILLO ETA/.](1988) SIAM J Applied Math 48: 1073). Например, гомологию, подобие или идентичность можно определить с помощью программ BLAST или ClustalW Национального центра биотехнологической информации.
Гомологию, подобие или идентичность полинуклеотидов можно определять путем сравнения информации о последовательности с помощью компьютерной программы GAP (например, Needleman et al. (1970), J Mol Biol 48: 443), как описано в работе Smith and Waterman, Adv. Appl. Math (1981) 2:482. В кратком описании программа GAP определяет подобие как результат деления количества выровненных символов (т.е. нуклеотидов или аминокислот), являющихся подобными, на общее количество символов в более короткой из двух последовательностей. Параметры программы GAP по умолчанию могут включать: (1) однокомпонентную матрицу сравнений (содержащую значение 1 для идентичности и 0 для отсутствия идентичности) и взвешенную матрицу сравнений или матрицу замен EDNAFULL (версия EMBOSS NCBI NUC4.4) Gribskov et al. (1986) Nucl. Acids Res. 14: 6745, как описано в Schwartz and Dayhoff, eds., Atlas Of Protein Sequence And Structure, National Biomedical Research Foundation, pp. 353-358 (1979); (2) штраф 3,0 за каждый гэп и дополнительный штраф 0,10 для каждого символа в каждом гэпе (или штраф на открытие гэпа 10, штраф на удлинение гэпа 0,5); и (3) отсутствие штрафа для концевых гэпов. Таким образом, используемый в настоящем документе термин «гомология» или «идентичность» отражает родственность между последовательностями.
Дополнительно в связи с вырожденностью кодонов или с учетом предпочтительных кодонов в биологическом организме, в котором должен экспрессироваться полинуклеотид, в кодирующей области полинуклеотида можно проводить различные модификации в пределах объема изобретения, не изменяющие полинуклеотидную последовательность. Любая нуклеотидная последовательность, в которой 143ий нуклеотид и/или 189ый нуклеотид нуклеотидной последовательности SEQ ID NO: 1 заменена другим нуклеотидом, может быть включена без ограничений. Дополнительно без ограничений может быть включена любая нуклеотидная последовательность с заменой 143 го нуклеотида и/или 189 го нуклеотида нуклеотидной последовательности SEQ ID NO: 1 другим нуклеотидом, способная гибридизоваться в жестких условиях с любым зондом, который может быть получен из известных последовательностей гена (например, последовательностей, комплементарных всей описанной выше нуклеотидной последовательности или ее участку).
Термин «жесткие условия» относится к условиям, которые обеспечивают специфичную гибридизацию между полинуклеотидами. Такие условия конкретно описаны в ссылках (например, J Sambrook et al.). Например, эти условия могут включать условия, при которых проходит гибридизация между генами, обладающими высокой гомологией, 40% или выше, в частности, 80% или выше, 85% или выше и 90% или выше, более конкретно 95% или выше, даже более конкретно 97% или выше и наиболее конкретно 99% или выше, при этом гибридизация между генами, обладающими более низкой гомологией, чем описано выше, не происходит; или гибридизация происходит один раз, в частности, два или три раза, в условиях отмывки, общепринятых для Саузерн-гибридизации, при 60°С в 1-кратном стандартном солевом растворе SSC (3 М NaCl, 0,3 М цитрат натрия) с 0,1% додецилсульфатом натрия (ДСН), в частности, при концентрации соли и температуре, соответствующих 60°С, 0,1-кратному SSC с 0,1% ДСН, и более конкретно 68°С, 0,1-кратному SSC и 0,1% ДСН.
Для гибридизации требуется, чтобы две нуклеиновые кислоты имели комплементарные последовательности, хотя несовпадения между основаниями могут возможно зависеть от жесткости гибридизации. Термин «комплементарный» используют для описания взаимосвязи между основаниями нуклеотидов, которые могут гибридизоваться друг с другом. Например, что касается ДНК, аденозин комплементарен тимину, а цитозин комплементарен гуанину. Соответственно, настоящее описание может также включать изолированные фрагменты нуклеиновой кислоты, комплементарные как всей последовательности, так и по существу подобным нуклеиновокислотным последовательностям.
В частности, наличие гомологии полинуклеотидов можно определить при температуре отжига (Tm) 55°С, используя условия гибридизации, которые включают стадию гибридизации и применение описанных выше условий. Дополнительно значение Tm может составлять 60°С, 63°С или 65°С, но эта температура не ограничена этими значениями и может быть соответствующим образом отрегулирована специалистами в данной области техники в соответствии с подразумеваемой целью.
Жесткость, подходящая для гибридизации полинуклеотидов, зависит от длины и степени комплементарности полинуклеотидов, и соответствующие переменные хорошо известны в данной области техники (см. Sambrook et al. выше, разделы 9.50-9.51 и 11.7-11.8).
Еще в одном аспекте настоящего описания предложена композиция для экспрессии гена, содержащая полинуклеотид.
Композиция для экспрессии гена относится к композиции, способной к экспрессии гена, который может экспрессироваться под контролем промотора по настоящему описанию. Например, композиция для экспрессии гена может включать полинуклеотид, обладающий новой промоторной активностью, и может дополнительно включать без ограничений любой компонент, способный осуществлять действие полинуклеотида в качестве промотора. В композиции для экспрессии гена по настоящему описанию полинуклеотид может находиться в такой форме включения в вектор, чтобы экспрессировать ген, функционально связанный с клеткой-хозяином, в которую вводят полинуклеотид.
Еще в одном другом аспекте настоящего описания предложен полинуклеотид, обладающий промоторной активностью, или вектор, включающий полинуклеотид и ген, кодирующий целевой белок. В частности, целевой белок может представлять собой аденилосукцинатсинтетазу, но не ограничен ею.
Используемый в настоящем документе термин «вектор» относится к конструкции ДНК, содержащей нуклеотидную последовательность, кодирующую целевой полинуклеотид, функционально связанный с соответствующей контрольной последовательностью таким образом, что целевой полипептид экспрессируется в соответствующем хозяине. Контрольная последовательность может включать промотор для инициации транскрипции, любую последовательность оператора для контроля такой транскрипции, последовательность, кодирующую соответствующий сайт связывания рибосомы на мРНК, и последовательность для контроля терминации транскрипции и трансляции. После трансформации соответствующей клетки-хозяина вектор может реплицироваться или функционировать независимо от генома хозяина, либо интегрировать в сам геном.
Вектор, используемый в настоящем описании, может быть конкретно не ограничен, если этот вектор способен реплицироваться в клетке-хозяине, и можно использовать любой вектор, известный в данной области техники. Примеры обычно используемого вектора могут включать природные или рекомбинантные плазмиды, космиды, вирусы и бактериофаги. Например, в качестве фагового вектора или космидного вектора можно использовать pWE15, М13, MBL3, MBL4, IXII, ASHII, APII, t10, t11, Charon4A, Charon21A и т.д., а в качестве плазмидного вектора можно использовать векторы на основе плазмид pBR, pUC, pBluescriptII, pGEM, pTZ, pCL, pET и т.д. В частности, можно использовать вектор pDZ, pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322, pMW118, pCC1BAC и т.д.
В одном воплощении изобретения целевой полинуклеотид можно встраивать в хромосому посредством вектора для вставки в хромосому. Вставку полинуклеотида в хромосому можно выполнить, используя любой известный в данной области техники способ, например, посредством гомологичной рекомбинации, но способ не ограничен ею. В вектор может быть дополнительно включен селективный маркер для подтверждения вставки вектора в хромосому. Селективный маркер был использован для отбора клеток, трансформированных вектором (т.е. для подтверждения вставки целевой молекулы нуклеиновой кислоты), и можно использовать маркеры, способные обеспечивать селективные фенотипы (например, лекарственную устойчивость, ауксотрофию, устойчивость к цитотоксическим агентам и экспрессию поверхностных полипептидов). В условиях обработки селективными агентами выживать или экспрессировать другие фенотипические признаки могут только клетки, способные к экспрессии селективных маркеров, и таким образом можно отбирать трансформированные клетки.
Еще в одном аспекте настоящего описания предложен микроорганизм рода Corynebacterium, включающий вектор, причем вектор включает полинуклеотид, обладающий промоторной активностью по настоящему описанию, и ген, кодирующий целевой белок.
Дополнительно еще в одном аспекте настоящего описания предложен микроорганизм рода Corynebacterium, включающий полинуклеотид, обладающий промоторной активностью по настоящему описанию, и ген, кодирующий целевой белок.
В частности, микроорганизм может представлять собой микроорганизм, полученный путем трансформации вектором, который включает полинуклеотид, обладающий промоторной активностью, и ген, кодирующий целевой белок; или микроорганизм, включающий полинуклеотид, обладающий промоторной активностью, и ген, кодирующий целевой белок, но микроорганизм не ограничен ими.
Используемый в настоящем документе термин «трансформация» относится к процессу введения в клетку-хозяина вектора, включающего полинуклеотид, кодирующий целевой белок, так чтобы кодируемый полинуклеотидом белок мог экспрессироваться в клетке-хозяине. Если трансформированный полинуклеотид может экспрессироваться в клетке-хозяине, то не имеет значения, встроен ли трансформированный полинуклеотид в хромосому клетки-хозяина и локализован на ней или локализован вне хромосомы. Дополнительно полинуклеотид включает ДНК или РНК, кодирующую целевой белок. Полинуклеотид можно вводить в любой форме, если этот полинуклеотид можно ввести в клетку-хозяина и экспрессировать в ней. Например, полинуклеотид можно ввести в клетку-хозяина в форме экспрессионной кассеты, которая представляет собой генную конструкцию, включающую все элементы, требующиеся для ее автономной экспрессии. Экспрессионная кассета может включать промотор, сигнал терминации транскрипции, сайт связывания рибосомы и сигнал терминации трансляции, которые могут быть функционально связаны с полинуклеотидом. Экспрессионная кассета может иметь форму самостоятельно реплицирующегося экспрессионного вектора. Дополнительно в клетку-хозяина можно вводить полинуклеотид, функционально связанный с последовательностью, требующейся для экспрессии в клетке-хозяине, но полинуклеотид не ограничен им.
Дополнительно термин «функционально связанный» относится к функциональной связи между последовательностью гена и промоторной последовательностью, которая инициирует и опосредует транскрипцию полинуклеотида, обладающего промоторной активностью по настоящему описанию.
Используемый в настоящем документе термин «микроорганизм, включающий полинуклеотид и целевой белок» относится к микроорганизму, в котором экспрессия целевого белка находится под контролем полинуклеотида. Микроорганизм может представлять собой микроорганизм, способный продуцировать пуриновые нуклеотиды, микроорганизм, от природы обладающий слабой способностью к продукции пуриновых нуклеотидов, или микроорганизм, обеспечиваемый способностью продуцировать пуриновые нуклеотиды, родительский штамм которого не обладает способностью продуцировать пуриновые нуклеотиды. В частности, микроорганизм может представлять собой микроорганизм, обладающий активностью аденилосукцинатсинтетазы, например, микроорганизм, включающий полинуклеотид, в нуклеотидной последовательности которого SEQ ID NO: 1 143ий нуклеотид и/или 189ый нуклеотид заменен другим нуклеотидом, но микроорганизм не ограничен им. Более конкретно, микроорганизм может представлять собой микроорганизм, включающий полинуклеотид, обладающий промоторной активностью, в котором по меньшей мере один нуклеотид в полинуклеотидной последовательности SEQ ID NO: 1 заменен. Замена в полинуклеотиде может включать замену 143го нуклеотида тимином (Т) и/или замену 143го нуклеотида тимином (Т).
Что касается клетки-хозяина или микроорганизма, в целях настоящего описания любая клетка-хозяин или любой микроорганизм, способные продуцировать пуриновые нуклеотиды в результате включения полинуклеотида и целевого белка, могут входить в объем настоящего изобретения.
В настоящем изобретении, микроорганизм, способный продуцировать пуриновые нуклеотиды, можно использовать взаимозаменяемо с микроорганизмом, продуцирующим пуриновые нуклеотиды, и микроорганизмом, обладающим способностью продуцировать пуриновые нуклеотиды.
Для целей настоящего описания термин «пуриновый нуклеотид» относится к нуклеотиду, имеющему структуру на основе пурина, например, IMP, ХМР или GMP, но пуриновый нуклеотид не ограничен ими.
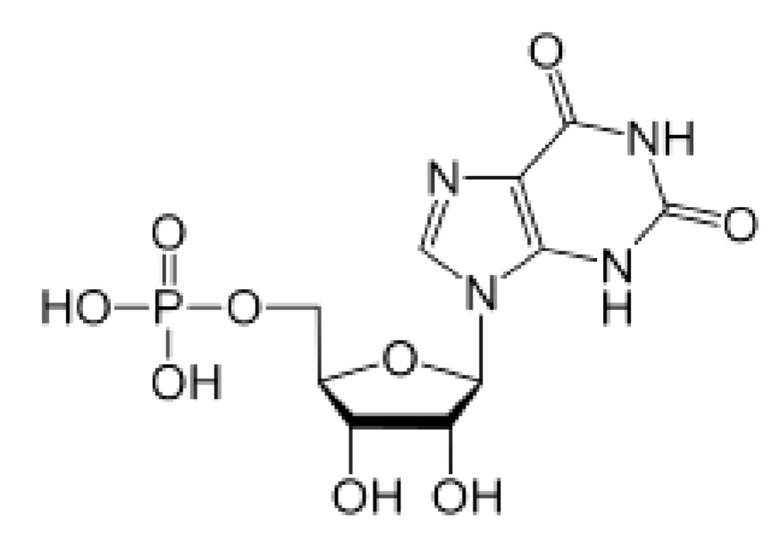
В частности, термин «5'-инозинмонофосфат (IMP)» представляет собой вещество нуклеиновой кислоты, состоящее из соединения приведенной ниже формулы 1.
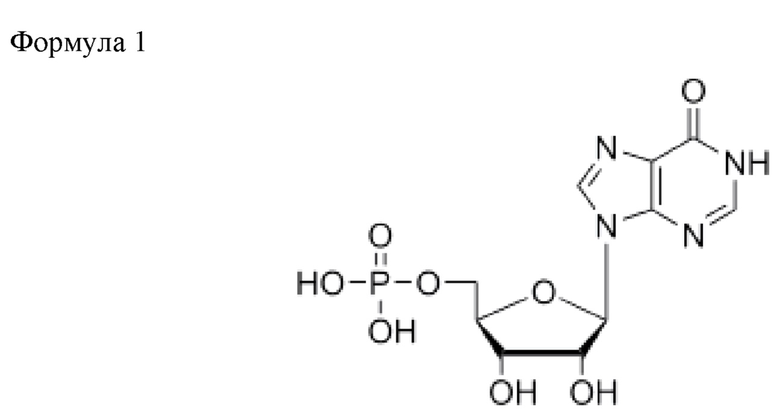
IMP также называется по номенклатуре ИЮПАК 5'-инозинмонофосфат или 5'-инозиновая кислота, и IMP широко используют в пищевых продуктах в качестве усилителя вкуса и аромата наряду с ХМР или GMP.
Термин «5'-гуанинмонофосфат (GMP)» представляет собой вещество нуклеиновой кислоты, состоящее из соединения приведенной ниже формулы 2.
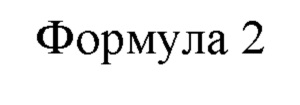
GMP также называется по номенклатуре ИЮПАК [(2R,3S,4R,5R)-5-(2-амино-6-оксо-1,6-дигидро-9Н-пурин-9-ил)-3,4-дигидротетрагидро-2-фуранил]метилдигидрофосфат, 5'-гуанидиловая кислота, 5'-гуаниловая или гуаниловая кислота. GMP может находится в форме соли и широко применяется в качестве пищевой добавки, такой как гуанилат натрия, двузамещенный гуанилат натрия и гуанилат кальция. GMP может быть получен путем преобразования из ХМР, но способ получения GMP не ограничен этим. Как подтверждено в одном воплощении настоящего изобретения, промотор по настоящему описанию может увеличить продукцию ХМР, a GMP может быть также получен из ХМР, в результате чего увеличивается количество продукции GMP. Таким образом, очевидно, что GMP также входит в объем настоящего описания.
Используемый в настоящем описании термин «5'-ксантозинмонофосфат (ХМР)» представляет собой промежуточное вещество в метаболизме пуринов, состоящее из соединения формулы 3 ниже.
ХМР также называется по номенклатуре ИЮПАК 5'-инозимонофосфат или 5'-ксантиловая кислота. ХМР может образовываться из IMP под действием дегидрогеназы или может быть превращен в GMP под действием синтазы GMP. Дополнительно ХМР может образовываться из ХТР под действием дезоксирибонуклеозидтрифосфатпирофосфогидролазы, которая представляет собой фермент, активность которого включает активность ХТР-азы.
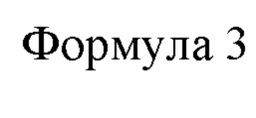
Используемый в настоящем документе термин «микроорганизм, продуцирующий пуриновые нуклеотиды» включает как микроорганизм дикого типа, так и микроорганизмы, в которых произошла естественная или искусственная генетическая модификация, и этот микроорганизм может представлять собой микроорганизм, в котором конкретный механизм усилен или ослаблен по таким причинам, как вставка экзогенного гена, усиление или инактивация активности эндогенного гена и т.д. Микроорганизм может представлять собой микроорганизм, в котором произошла генетическая модификация или повышение его активности для предусмотренной продукции пуриновых нуклеотидов. Для цели настоящего описания микроорганизм, продуцирующий пуриновые нуклеотиды, отличается тем, что обладает повышенной продуктивностью желаемых пуриновых нуклеотидов, обусловленной содержанием в нем полинуклеотида, и, в частности, микроорганизм может представлять собой микроорганизм рода Corynebacterium. В частности, микроорганизм, продуцирующий пуриновые нуклеотиды, или микроорганизм, способный к продукции пуриновых нуклеотидов, может представлять собой микроорганизм, в котором усилены или ослаблены некоторые из генов, вовлеченных в путь биосинтеза пуриновых нуклеотидов, или усилены или ослаблены некоторые из генов, вовлеченных в путь распада пуриновых нуклеотидов, либо усилена или ослаблена часть гена(-ов), вовлеченная в путь распада пуриновых нуклеотидов. Например, микроорганизм может представлять собой микроорганизм, в котором усилена экспрессия гена purF, кодирующего фосфорибозилпирофосфатамидотрансферазу, или экспрессия гена pur А. Дополнительно, в зависимости от пуринового нуклеотида, может осуществляться контроль экспрессии гена guaB, представляющего собой ген, который кодирует инозин-5'-монофосфатдегидрогеназу. В частности, если пуриновый нуклеотид представляет собой IMP, экспрессия guaB может быть ослаблена, а если пуриновый нуклеотид представляет собой ХМР или GMP, экспрессия guaB может быть усилена.
Используемый в настоящем документе термин «микроорганизм рода Corynebacterium, продуцирующий 5'-пуриновые нуклеотиды» относится к микроорганизму рода Corynebacterium, обладающему способностью продуцировать пуриновые нуклеотиды естественным путем или в результате модификации. В частности, при использовании в настоящем документе, микроорганизм рода Corynebacterium, обладающий способностью продуцировать пуриновые нуклеотиды, может представлять собой микроорганизм рода Corynebacterium, обладающий улучшенной способностью к продукции пуриновых нуклеотидов за счет включения полинуклеотида, обладающего промоторной активностью по настоящему изобретению, или за счет трансформации вектором, включающим этот полинуклеотид и ген, кодирующий целевой белок.
«Микроорганизм рода Corynebacterium, обладающий улучшенной способностью к продукции пуриновых нуклеотидов» относится к микроорганизму, обладающему улучшенной способностью к продукции пуриновых нуклеотидов по сравнению с родительским штаммом до его трансформации или с немодифицированным микроорганизмом. «Немодифицированный микроорганизм» относится к самому штамму дикого типа, к микроорганизму, не включающему модифицированный белок, продуцирующему пуриновые нуклеотиды, или микроорганизм, который не был трансформирован вектором, включающим полинуклеотид и ген, кодирующий целевой белок.
При использовании в настоящем документе «микроорганизм рода Corynebacterium» может конкретно представлять собой Corynebacterium glutamicum, Corynebacterium ammoniagenes, Brevibacterium lactofermentum, Brevibacterium flavum, Corynebacterium thermoaminogenes, Corynebacterium efficiens, Corynebacterium stationis и т.д., но микроорганизм рода Corynebacterium необязательно ограничен ими.
Еще в одном аспекте настоящего изобретения предложен способ получения целевого вещества, включающий культивирование микроорганизма рода Corynebacterium в среде. В одном воплощении способ по настоящему изобретению может дополнительно включать стадию выделения целевого вещества из микроорганизма или из культуральной среды после стадии культивирования. В частности, целевое вещество может представлять собой пуриновые нуклеотиды, но не ограничено ими.
В описанном выше способе культивирование микроорганизма можно осуществлять известным способом периодического культивирования, непрерывного культивирования, периодического культивирования с подпиткой и т.д., но способ культивирования конкретно не ограничен ими. В частности, условия культивирования могут быть конкретно не ограничены, но соответствующий рН (например, от рН 5 до рН 9, в частности, от рН 6 до рН 8 и наиболее конкретно рН 6,8) можно регулировать, используя основное соединение (например, гидроксид натрия, гидроксид калия или аммиак) или кислотное соединение (например, фосфорную кислоту или серную кислоту), а аэробные условия можно поддерживать, добавляя в культуру кислород или кислородсодержащую газовую смесь. Температуру культивирования можно поддерживать при 20°С - 45°С и, в частности, от 25°С до 40°С, и проводить культивирование в течение от около 10 часов до около 160 часов, но условия не ограничены этим. Пуриновые нуклеотиды, продуцируемые культурой, могут секретироваться в питательную среду или оставаться внутри клеток.
Кроме того, в используемой культуральной среде в качестве источника углерода можно по отдельности или в комбинации использовать сахариды и углеводы (например, глюкозу, сахарозу, лактозу, фруктозу, мальтозу, мелассы, крахмал и целлюлозу), масла и жиры (например, соевое масло, подсолнечное масло, арахисовое масло и кокосовое масло), жирные кислоты (например, пальмитиновую кислоту, стеариновую кислоту и линолевую кислоту), спирты (например, глицерин и этанол), органические кислоты (например, уксусную кислоту) и т.д., но источник углерода не ограничен ими. В качестве источника азота можно по отдельности или в комбинации использовать азотсодержащее органическое соединение (например, пептон, дрожжевой экстракт, мясной экстракт, солодовый экстракт, жидкий кукурузный экстракт, соевую муку и мочевину) или неорганическое соединение (например, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония, и нитрат аммония) и т.д., но источник азота не ограничен ими. В качестве источника фосфора можно по отдельности или в комбинации использовать дигидрофосфат калия, двузамещенный фосфат калия, соответствующую им натрийсодержащую соль и т.д., но источник фосфора не ограничен ими. Дополнительно в среду можно также включать незаменимые вещества, стимулирующие рост, такие как другие соли металлов (например, сульфат магния или сульфат железа), аминокислоты и витамины.
Способ выделения пуриновых нуклеотидов, продуцируемых на стадии культивирования настоящего изобретения, заключается в сборе целевых пуриновых нуклеотидов из культуры с использованием подходящего известного в данной области техники способа, соответствующего способу культивирования. Например, можно использовать центрифугирование, фильтрование, анионообменную хроматографию, кристаллизацию, высокоэффективную жидкостную хроматографию (ВЭЖХ) и т.д., и целевые пуриновые нуклеотиды можно выделять из питательной среды или микроорганизма, используя подходящий известный в данной области техники способ.
Дополнительно стадия выделения может включать процесс очистки. Процесс очистки можно выполнять, используя подходящий известный в данной области техники способ. Таким образом, выделенные пуриновые нуклеотиды могут быть в очищенной форме или в микробной ферментационной жидкости, содержащей пуриновые нуклеотиды (Introduction to Biotechnology and Genetic Engineering, A. J. Nair, 2008).
Дополнительно для цели настоящего изобретения в том случае, когда микроорганизм содержит полинуклеотид, обладающий описанной выше промоторной активностью, этот микроорганизм отличается тем, что количество целевого вещества увеличивается. В частности, если штамм рода Corynebacterium дикого типа совсем не обладает способностью продуцировать пуриновые нуклеотиды или продуцирует лишь их следовое количество, даже если это возможно, количество продуцируемых микроорганизмом по настоящему изобретению пуриновых нуклеотидов может быть увеличено за счет включения полинуклеотида, обладающего промоторной активностью.
Еще в одном другом аспекте настоящего изобретения предложено применение полинуклеотида для повышения экспрессии целевого белка.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение будет подробно описано путем иллюстративных воплощений. Тем не менее, специалистам в области техники, к которой относится настоящее изобретение, будет очевидно, что эти иллюстративные воплощения предложены только в целях иллюстрации и не предназначены для ограничения объема настоящего описания.
Пример 1. Получение штамма, продуцирующего IMP, на основе штамма дикого типа
Штамм рода Corynebacterium дикого типа совсем неспособен продуцировать IMP или, даже если это возможно, продуцирует его лишь в следовых количествах. Поэтому штамм, продуцирующий IMP, был получен на основе штамма дикого типа Corynebacterium stationis АТСС6872 (Американская коллекция типовых культур). Более конкретно, был получен штамм, в котором усилена активность гена purF, кодирующего фосфорибозилпирофосфатамидотрансферазу, и ослаблена активность гена guaB, кодирующего IMP.
Пример 1-1. Получение штамма с усиленным геном purF
Для получения штамма, в котором модифицирован стартовый кодон гена purF, сначала был получен инсерционный вектор, содержащий ген purF. В частности, для клонирования гена purF в инсерционном векторе проводили полимеразную цепную реакцию (ПЦР) с использованием геномной ДНК Corynebacterium stationis АТСС6872 в качестве матрицы и набора праймеров SEQ ID NO: 6 и 7 и SEQ ID NO: 8 и 9 в течение 30 циклов денатурации при 94°С в течение 30 с, отжига при 55°С в течение 30 с и удлинения при 72°С в течение 2 мин. ПЦР проводили снова, используя в качестве матрицы два фрагмента ДНК, полученные с помощью описанной выше ПЦР, и набор праймеров SEQ ID NO: 6 и 9 в течение 30 циклов денатурации при 94°С в течение 30 с, отжига при 55°С в течение 30 с и удлинения при 72°С в течение 2 мин с получением фрагментов ДНК. Полученные фрагменты ДНК подвергали ферментативному расщеплению ферментом рестрикции XbaI и клонировали в векторе pDZ (патент Кореи №10-0924065 и публикация международного патента WO 2008-033001), расщепленном тем же ферментом. Полученный таким путем вектор был обозначен как pDZ-purF-gla.
Corynebacterium stationis АТСС6872 трансформировали рекомбинантным вектором pDZ-purF-gla методом электропорации, и штаммы, в которых вектор был встроен в хромосому в результате гомологической рекомбинации, отбирали на среде, содержащей 25 мг/л канамицина. Штаммы, полученные путем первичного отбора, подвергали вторичному кроссинговеру, и эти отобранные штаммы секвенировали, в результате чего был отобран конечный штамм, в котором произошла модификация. Этот штамм был обозначен как штамм 6872-purF(g1a).
Пример 1-2. Получение штамма с ослабленным геном guaB
Чтобы получить штамм, в котором модифицирован стартовый кодон гена guaB, сначала был получен инсерционный вектор, содержащий ген guaB. В частности, для клонирования гена guaB в инсерционном векторе проводили ПЦР с использованием геномной ДНК Corynebacterium stationis АТСС6872 в качестве матрицы и набора праймеров SEQ ID NO: 11 и 12 и SEQ ID NO: 13 и 14. ПЦР снова проводили, используя в качестве матрицы полученные выше продукты ПЦР и набор праймеров SEQ ID NO: 11 и 14, и полученные фрагменты ДНК клонировали, как описано в примере 1-1. Полученный таким образом вектор был обозначен как pDZ-guaB-alt. Этот вектор таким же путем вводили в штамм 6872-purF(gla), и, наконец, был отобран штамм, в который была введена описанная выше модификация. Конечный отобранный штамм, продуцирующий IMP, был обозначен как CJI2330.

Пример 1-3. Титриметрический анализ ферментации CJI2330
После розлива питательной среды для посевной культуры (2 мл) в пробирки (диаметр: 18 мм) пробирки стерилизовали в автоклаве. Каждый из штаммов АТСС6872 и CJI2330 инокулировали и инкубировали при 30°С в течение 24 часов при встряхивании и использовали в качестве посевной культуры. Среду для ферментации разливали по 29 мл в плоскодонные конические колбы Эрленмейера емкостью 250 мл, предназначенные для лабораторного шейкера, и стерилизовали в автоклаве при 121°С в течение 15 мин. Питательную среду инокулировали посевной культурой (2 мл) и культивировали в течение 3 суток. Условия культивирования регулировали при 170 об/мин, 30°С и рН 7,5.
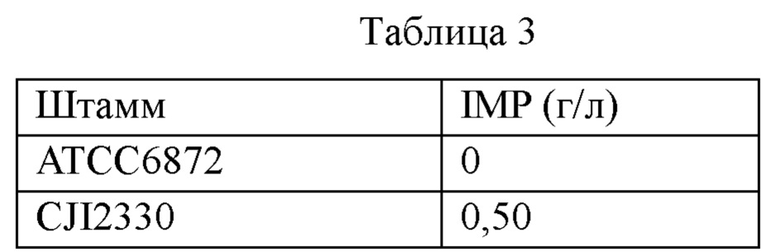
После завершения культивирования количество продуцируемого IMP определяли методом ВЭЖХ (SHFMAZDU LC20A), и результаты культивирования представлены ниже в таблице 3. Приведенные ниже результаты позволяют предположить, что CJI2330 обладает способностью продуцировать IMP.
- Питательная среда для посевной культуры: 1% глюкозы, 1% пептона, 1% мясного экстракта, 1% дрожжевого экстракта, 0,25% хлорида натрия, 100 мг/л аденина, 100 мг/л гуанина, рН 7,5
- Питательная среда для ферментации: 0,1% глутамата натрия, 1% хлорида аммония, 1,2% сульфата магния, 0,01% хлорида кальция, 20 мг/л сульфата железа, 20 мг/л сульфата марганца, 20 мг/л сульфата цинка, 5 мг/л сульфата меди, 23 мг/л L-цистеина, 24 мг/л аланина, 8 мг/л никотиновой кислоты, 45 мкг/л биотина, 5 мг/л тиамина гидрохлорида, 30 мг/л аденина, 1,9% фосфорной кислоты (85%), 2,55% глюкозы, 1,45%) фруктозы
Пример 2. Определение модификации, при которой ослаблена активность промотора purA
Чтобы уменьшить экспрессию аденилосукцинатсинтетазы для улучшения способности к продукции пуриновых нуклеотидов, была получена библиотека вариантов гена purA, кодирующего аденилосукцинатсинтетазу, и предприняты попытки обнаружения модификации, ослабляющей промотор, при которой в результате ослабления промоторной активности увеличивалась продукция пуриновых нуклеотидов.
Пример 2-1. Получение вектора, содержащего промотор purA
Для получения библиотеки вариантов промотора pur А, сначала был получен экспрессионный вектор зеленого флуоресцентного белка (GFP), содержащий промотор pur A SEQ ID NO: 1. ПЦР проводили, используя в качестве матрицы геномную ДНК Corynebacterium stationis АТСС6872 и набор праймеров SEQ ID NO: 15 и SEQ ID NO: 16, в течение 30 циклов денатурации при 94°С в течение 30 с, отжига при 55°С в течение 30 с и удлинения при 72°С в течение 2 мин. Полученные фрагменты ДНК подвергали ферментативному расщеплению KpnI и EcoRV и клонировали в векторе р117-gfp (публикация заявки на патент Кореи №10-0620092), уже расщепленном теми же ферментами рестрикции, и полученный таким путем вектор был обозначен как p117-PpurA-gfp.

Пример 2-2. Получение библиотеки вариантов промотора purA
Библиотеку вариантов гена purA получали на основе вектора, полученного в примере 2-1. Для получения библиотеки использовали набор реактивов для ПЦР с ошибками (набор реактивов для случайного мутагенеза методом ПЦР Clontech Diversify®). ПЦР проводили в условиях возникновения модификаций, используя набор праймеров SEQ ID NO: 15 и 17. В частности, в условиях, при которых может произойти от 2 до 4 модификаций на 1000 пар оснований (п.о.), подогрев проводили при 94°С в течение 30 секунд с последующими 25 циклами процесса: при 94°С в течение 30 секунд и при 68°С в течение 1 минуты 30 секунд. Полученный таким путем продукт ПЦР подвергали ПЦР с использованием мегапраймера (от 500 нг до 125 нг) в течение 25 циклов процесса: при 95°С в течение 50 секунд, 60°С в течение 50 секунд и 68°С в течение 12 мин, обрабатывали ферментом DpnI и трансформировали штамм DH5a Е. coli и рассевали на плотной питательной среде Лурия-Бертани (LB), содержащей 25 мг/л канамицина. После отбора 20 различных видов трансформированных колоний, из них получали плазмиды и проводили анализ их последовательности. В результате было подтверждено, что в различные участки были введены модификации с частотой 3,5 модификаций/килобаза (кб). Было собрано около 10 000 трансформированных колоний Е. coli и выделены их плазмиды, которые были обозначены как «библиотека р117-PpurA-gfp».
Пример 3. Оценка полученной библиотеки и отбор вариантов
Пример 3-1. Оценка библиотеки
Библиотекой p117-PpurA-gfp, полученной в примере 2-2, трансформировали штамм CJI2330, полученный в примере 1, методом электропорации, и штамм рассевали на питательной среде, содержащей 25 мг/л канамицина, в результате чего получили 5000 колоний со вставкой модифицированного вектора. Эти колонии были обозначены как CJI2330_p117-PpurA(mtl) - CJI2330_p117-PpurA(mt5000).
- Питательная среда: 1% пептона, 1% мясного экстракта, 0,25% хлорида натрия, 1% дрожжевого экстракта, 2% агара, рН 7,2.
Каждую из полученных 5000 колоний инокулировали в 200 мкл стерилизованной в автоклаве питательной среды для посевной культуры, культивировали в 96-луночном планшете с глубокими лунками при встряхивании при 30°С и 1200 об/мин в течение 24 часов с помощью встряхивателя для микропланшетов (TAITEC) и использовали в качестве посевной культуры. Стерилизованную в автоклаве питательную среду для ферментации (290 мкл) разливали в 96-луночный планшет с глубокими лунками, инокулировали в нее по 20 мкл каждой посевной культуры и культивировали при встряхивании в таких же условиях, как описано выше, в течение 72 часов с получением клеток. Затем собранные клетки промывали однократно фосфатно-солевым буферным раствором (80 г хлорида натрия, 2 г хлорида калия, 14,4 г фосфата натрия, 2,4 г фосфата калия и 0,8 л стерильной воды), ресуспендировали в том же буферном растворе и измеряли интенсивность флуоресценции. Интенсивность флуоресценции измеряли путем облучения светом при длине волны возбуждения 488 нм и измерения испускаемого света при длине волны 511 нм с помощью ридера для микропланшетов, и на основании этого измеряли уровень экспрессии гена зеленого флуоресцентного белка (GFP). В результате измерения были отобраны две мутантные колонии (т.е. PpurA(mt3) и PpurA(mt378)), в которых интенсивность флуоресценции была ослаблена по сравнению с PpurA-gfp дикого типа.
Пример 3-2. Подтверждение модификации в промоторе purA
Для подтверждения модификации гена в мутантном штамме на каждом из штаммов PpurA(mt3) и PpurA(mt378) проводили ПЦР, используя набор праймеров SEQ ID NO: 15 и 17, и проводили секвенирование продукта ПЦР, в результате которого было подтверждено наличие модификации в промоторе pur А.
В частности, было подтверждено, что PpurA(mt3) включает нуклеотидную последовательность, в которой 189ый нуклеотид полинуклеотидной последовательности SEQ ID NO: 1 заменен тимином (Т). Дополнительно было подтверждено, что PpurA(mt378) включает нуклеотидную последовательность, в которой 143ий нуклеотид полинуклеотидной последовательности SEQ ID NO: 1 заменен тимином (Т). Соответственно, в примерах, приведенных в настоящем документе ниже, была предпринята попытка подтверждения, может ли описанная выше модификация влиять на количество продуцируемого пуринового нуклеотида в каждом микроорганизме рода Corynebacterium.
Пример 4. Подтверждение способности штамма-продуцента IMP, полученного из АТСС6872, к продукции IMP
Из АТСС6872 получали штамм-продуцент EVIP, вводили в этот штамм модификацию, подтвержденную в примере 3, и подтверждали способность этого штамма к продукции IMP.
Пример 4-1. Отбор штамма-продуцента IMP, полученного из АТСС6872
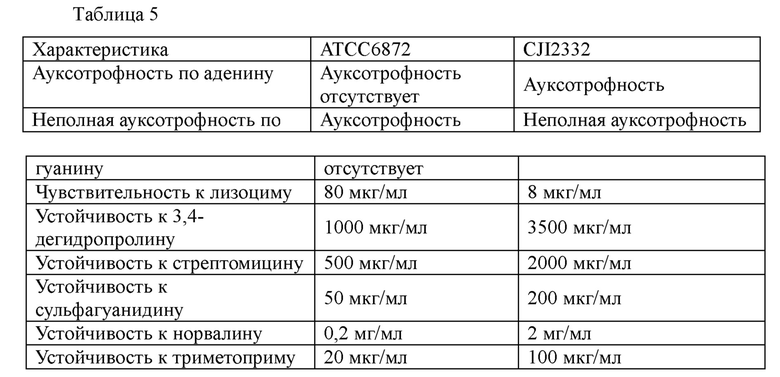
Для получения штамма-продуцента IMP, полученного из штамма АТСС6872, культуру АТСС6872 суспендировали в фосфатном буфере (рН 7,0) или цитратном буфере (рН 5,5) при плотности от 107 клеток/мл до 108 клеток/мл и обрабатывали УФ светом при комнатной температуре или при 32°С в течение от 20 мин до 40 мин для индукции мутации. Штамм дважды промывали 0,85%-ным раствором хлорида натрия и после разведения рассевали на минимальной питательной среде, содержащей 1,7%-ный агар с добавлением вещества, обеспечивающего устойчивость, в соответствующей концентрации, в результате чего получили колонии. Каждую колонию культивировали в питательной среде, а затем культивировали в питательной среде для посевной культуры в течение 24 часов. После культивирования каждой колонии в питательной среде для ферментации в течение 3-4 суток отбирали колонии, характеризующиеся самой лучшей продукцией IMP, накапливаемого в среде для культивирования. Для получения штамма, продуцирующего IMP в высокой концентрации, путем последовательного проведения соответствующих процедур получали ауксотрофность по аденину, неполную ауксотрофность по гуанину, чувствительность к лизоциму, устойчивость к 3,4-дегидропролину, устойчивость к стрептомицину, устойчивость к сульфагуанидину, устойчивость к норвалину и устойчивость к триметоприму. В результате был отобран штамм CJI2332, обладающий устойчивостью к указанным выше веществам и отличной продуктивностью IMP. Было проведено сравнение видов устойчивости штамма CJI2332 относительно АТСС6872, результаты которого показаны в таблице 7 ниже.
- Минимальная питательная среда: 2% глюкозы, 0,3% сульфата натрия, 0,1% однозамещенного фосфата калия, 0,3% двузамещенного фосфата калия, 0,3% сульфата магния, 10 мг/л хлорида кальция, 10 мг/л сульфата железа, 1 мг/л сульфата цинка, 3,6 мг/л хлорида марганца, 20 мг/л L-цистеина, 10 мг/л пантотената кальция, 5 мг/л тиамина гидрохлорида, 30 мкг/л биотина, 20 мг/л аденина, 20 мг/л гуанина, рН доводят до 7,3.
Штамм CJI2332 был депонирован в Корейском центре культур микроорганизмов (КССМ) 22 июня 2018 г. согласно условиям Будапештского договора, и ему был присвоен номер доступа КССМ12277Р.
Пример 4-2. Титриметрический анализ ферментации CJI2332
После розлива питательной среды для посевной культуры (2 мл) в пробирки (диаметр: 18 мм) пробирки стерилизовали в автоклаве. Каждый из штаммов АТСС6872 и CJI2332 инокулировали и инкубировали при 30°С в течение 24 часов при встряхивании и использовали в качестве посевной культуры. Среду для ферментации разливали по 29 мл в плоскодонные конические колбы Эрленмейера емкостью 250 мл, предназначенные для лабораторного шейкера, и стерилизовали в автоклаве при 121°С в течение 15 мин. Питательную среду инокулировали посевной культурой (2 мл) и культивировали в течение 3 суток. Условия культивирования регулировали при 170 об/мин, 30°С и рН 7,5.
После завершения культивирования количество продуцируемого IMP определяли методом ВЭЖХ (SHrMAZDU LC20A), и результаты культивирования представлены ниже в таблице 8.

Пример 4-3. Получение инсерционного вектора, содержащего модификацию промотора purA
Для введения отобранных в примере 3 модификаций в штаммы был получен инсерционный вектор. Для получения вектора для введения модификаций PpurA(c143t), PpurA(a189t) и PpurA(c143t, a189t) использовали описанные ниже способы.
ПЦР проводили, используя в качестве матрицы геномную ДНК штамма АТСС6872 и набор праймеров SEQ ID NO: 18 и 19 и SEQ ID NO: 20 и 21. ПЦР проводили следующим образом: денатурация при 94°С в течение 5 мин; 20 циклов денатурации при 94°С в течение 30 сек, отжига при 55°С в течение 30 сек и полимеризации при 72°С в течение 1 мин; и полимеризация при 72°С в течение 5 мин. ПЦР снова проводили аналогичным образом, используя в качестве матрицы полученные фрагменты ДНК и набор праймеров SEQ ID NO: 18 и 21, и каждый из полученных таким путем фрагментов гена подвергали ферментативному расщеплению XbaI. Каждый из фрагментов ДНК клонировали в линейном векторе pDZ, расщепленном ферментом XbaI используя лигазу Т4, в результате чего был получен вектор pDZ-purA(c143t)-purA.
Затем проводили ПЦР, используя в качестве матрицы геномную ДНК штамма АТСС6872 и набор праймеров SEQ ID NO: 18 и 22 и SEQ ID NO: 23 и 21. ПЦР проводили следующим образом: денатурация при 94°С в течение 5 мин; 20 циклов денатурации при 94°С в течение 30 сек, отжига при 55°С в течение 30 сек и полимеризации при 72°С в течение 1 мин; и полимеризация при 72°С в течение 5 мин. ПЦР снова проводили аналогичным образом, используя в качестве матрицы полученные фрагменты ДНК и набор праймеров SEQ ID NO: 18 и 21, и каждый из полученных таким путем фрагментов гена подвергали ферментативному расщеплению XbaI. Каждый из фрагментов ДНК клонировали в линейном векторе pDZ, ферменативно расщепленном XbaI используя лигазу Т4, в результате чего был получен вектор pDZ-purA(a189t)-purA.
Чтобы изучить влияние введения двух модификаций одновременно, был дополнительно получен вектор, в который были введены две модификации. Затем проводили сайт-направленный мутагенез, используя в качестве основы полученный вектор pDZ-purA(c143t). В частности, проводили ПЦР, используя наборы праймеров SEQ ID NO: 24 и 25, в следующих условиях: 18 циклов денатурации при 94°С в течение 30 с, отжига при 55°С в течение 30 с и полимеризации при 68°С в течение 1 мин; и полимеризация при 72°С в течение 12 мин.
Каждый из полученных продуктов подвергали ферментативному расщеплению DpnI, трансформировали в DH5a и в результате получили вектор pDZ-PpurA(c143t, a189t)-purA.

Пример 4-4. Введение вариантов промотора purA в штаммы CJI2330 и CJI2332, полученные из АТСС6872, и их оценка
В каждый полученный из штамма дикого типа штамм-продуцент EVfP CJI2330, полученный в примере 1, и штамм CJI2332, отобранный в примере 4-1, вводили модификацию промотора purA и проводили количественную оценку IMP, продуцируемого каждым штаммом. Чтобы подтвердить наличие модификации в промоторе purA штамма CJI2332, геномную ДНК штамма CJI2332 амплифицировали методом ПЦР. В частности, сначала амплифицировали фрагменты промотора pur А методом ПЦР, используя в качестве матрицы геномную ДНК штамма CJI2332 и набор праймеров SEQ ID NO: 15 и 21, в которой ПЦР проводили путем 28 циклов денатурации при 94°С в течение 1 мин, отжига при 58°С в течение 30 с и полимеризации при 72°С в течение 1 мин с использованием ДНК-полимеразы Taq. Был проведен анализ полученных в результате нуклеотидных последовательностей амплифицированных фрагментов промотора pur А, и в результате было подтверждено, что нуклеотидная последовательность промотора pur А штамма CJI2332 является такой же, как последовательность у штамма Corynebacterium stationis АТСС6872 дикого типа.
Затем штамм CJI2330 и штамм CJI2332 трансформировали векторами pDZ-PpurA(c143t)-purA, pDZ-PpurA(a189t)-purA и pDZ-PpurA(c143t, a189t)-purA и отбирали штаммы, в которых каждый из этих векторов был встроен в хромосому, посредством рекомбинации гомологичных последовательностей, на питательной среде, содержащей 25 мг/л канамицина. Отобранные первичные штаммы подвергали вторичному кроссинговеру, и, таким образом, отбирали штаммы, в которые была введена модификация промотора целевого гена. Для подтверждения введения модификации гена в конечные трансформированные штаммы, проводили ПЦР, используя набор праймеров SEQ ID NO: 15 и 21, и продукты ПЦР подтверждали анализом их нуклеотидных последовательностей. В результате подтвердили, что в штаммы введена модификация гена. Полученные таким путем штаммы были обозначены как CJI2330_PpurA(c143t)-purA, CJI2330_PpurA(a189t)-purA, CJI2330_PpurA(c143t, a189t)-purA, CJI2332_PpurA(c143t)-purA и CJI2332_PpurA(a189t)-purA, CJI2332_PpurA(c143t, a189t)-purA.
Штамм CJI2332_PpurA(c143t)-purA назван CJI2352 и депонирован в Корейском центре культур микроорганизмов (КССМ) 10 сентября 2018 г. согласно условиям Будапештского договора, и ему был присвоен номер доступа КССМ12315Р. Дополнительно полученный штамм CJI2332_PpurA(a189t)-purA назван CJI2365 и депонирован в Корейском центре культур микроорганизмов (КССМ) 10 сентября 2018 г. согласно условиям Будапештского договора, и ему был присвоен номер доступа КССМ12314Р.
Была проведена оценка способности каждого штамма к продукции IMP. После завершения культивирования количество продуцируемого IMP определяли способом с использованием ВЭЖХ, и результаты культивирования представлены ниже в таблице 10.

Пример 5. Подтверждение способности к продукции 5'-ксантиловой кислоты (ХМР) при введении варианта промотора purA
Пример 5-1. Отбор штаммов-продуцентов ХМР, полученных из АТСС6872
Для получения штамма-продуцента 5'-ксантозинмонофосфата (ХМР), полученного из штамма АТСС6872, штамм Corynebacterium stationis АТСС6872 суспендировали в фосфатном буфере (рН 7,0) или цитратном буфере (рН 5,5) при плотности от 107 клеток/мл до 108 клеток/мл и обрабатывали УФ светом при комнатной температуре или при 32°С в течение от 20 мин до 40 мин для индукции мутации. Штамм дважды промывали 0,85%-ным раствором хлорида натрия и после разведения рассевали на минимальной питательной среде, содержащей 1,7%-ный агар с добавлением вещества, обеспечивающего устойчивость, в соответствующей концентрации, в результате чего получили колонии. Каждую колонию культивировали в питательной среде, а затем культивировали в питательной среде для посевной культуры в течение 24 часов. После культивирования каждой колонии в питательной среде для ферментации в течение 3-4 суток отбирали колонии, характеризующиеся самой лучшей продукцией ХМР, накапливаемого в среде для культивирования. В частности, штаммы были отобраны из тех колоний, которые могли расти в питательной среде с добавлением фтортриптофана в соответствии с концентрациями (среда с добавкой), и более конкретно из тех, которые могут расти в среде с концентрацией фтортриптофана 100 мг/л и имеют улучшенную концентрацию 5'-ксантиловой кислоты. Отобранный штамм был обозначен как CJX1664.
- Минимальная питательная среда: глюкоза 20 г/л, однозамещенный фосфат калия 1 г/л, двузамещенный фосфат калия 1 г/л, мочевина 2 г/л, сульфат аммония 3 г/л, сульфат магния 1 г/л, хлорид кальция 100 мг/л, сульфат железа 20 мг/л, сульфат марганца 10 мг/л, сульфат цинка 10 мг/л, биотин 30 мкг/л, тиамина гидрохлорид 0,1 мг/л, сульфат меди 0,8 мг/л, аденин 20 мг/л, гуанин 20 мг/л, рН 7,2
- Среда с добавкой: среда, в которой в минимальную среду добавлен фтортриптофан в концентрации 10 мг/л, 20 мг/л, 50 мг/л, 70 мг/л, 100 мг/л и 200 мг/л
Биохимические характеристики штамма CJX1664 показаны в таблице 11 ниже. Как видно из таблицы 11, что штамм CJX1664 может расти в среде с добавкой, в которую добавлен фтортриптофан в концентрации 100 мг/л.

Штамм CJX1664 был депонирован в Корейском центре культур микроорганизмов (КССМ) 6 июля 2018 г. согласно условиям Будапештского договора, и ему был присвоен номер доступа КССМ12285Р.
Пример 5-2. Титриметрический анализ ферментации CJX1664
После розлива питательной среды для посевной культуры (2 мл) в пробирки (диаметр: 18 мм) пробирки стерилизовали в автоклаве. Каждый из штаммов АТСС6872 и CJX1664 инокулировали и инкубировали при 30°С в течение 24 часов при встряхивании и использовали в качестве посевной культуры. Среду для ферментации разливали по 29 мл в плоскодонные конические колбы Эрленмейера емкостью 250 мл, предназначенные для лабораторного шейкера, и стерилизовали в автоклаве при 121°С в течение 15 мин. Питательную среду инокулировали посевной культурой (2 мл) и культивировали в течение 3 суток. Условия культивирования регулировали при 170 об/мин, 30°С и рН 7,5.
После завершения культивирования количество продуцируемого ХМР определяли способом с использованием ВЭЖХ (SHFMAZDU LC20A), и результаты культивирования представлены ниже в таблице 12.

Пример 5-3. Введение вариантов в штамм CJX1664 и их оценка
Чтобы подтвердить наличие модификации в промоторе pur А штамма CJX1664, отобранного в примере 5-1, геномную ДНК штамма CJX1664 амплифицировали методом ПЦР. В частности, сначала амплифицировали фрагменты промотора purA методом ПЦР, используя в качестве матрицы геномную ДНК штамма CJX1664 и праймеры SEQ ID NO: 17 и 18, в которой ПЦР проводили путем 28 циклов денатурации при 94°С в течение 1 мин, отжига при 58°С в течение 30 с и полимеризации при 72°С в течение 1 мин с использованием ДНК-полимеразы Taq. Был проведен анализ полученных в результате нуклеотидных последовательностей амплифицированных фрагментов промотора pur А, и в результате было подтверждено, что нуклеотидная последовательность промотора pur А штамма CJI2332 является такой же, как последовательность штамма Corynebacterium stationis АТСС6872 дикого типа.
Каждым из векторов, полученных в примере 4-3, трансформировали штамм CJX1664, и отбирали штаммы, в которых каждый из векторов был встроен в хромосому посредством рекомбинации гомологичных последовательностей, на питательной среде, содержащей 25 мг/л канамицина. Отобранные первичные штаммы подвергали вторичному кроссинговеру, и, таким образом, отбирали штаммы, в которые была введена модификация промотора целевого гена. Наличие введенной модификации гена в конечном трансформированном штамме подтверждали в анализе нуклеотидных последовательностей.
Проводили оценку способности штаммов CJX1664, CJX1664_PpurA(c143t)-purA, CJX1664_PpurA(a189t)-purA и CJX1664_PpurA(c143t, a189t)-purA к продукции ХМР. После завершения культивирования количество продуцируемого ХМР определяли способом с использованием ВЭЖХ, и результаты культивирования представлены ниже в таблице 13.
Штамм CJX1664_PpurA(c143t)-purA назван CJX1680 и депонирован в Корейском центре культур микроорганизмов (КССМ) 10 сентября 2018 г. согласно условиям Будапештского договора, и ему был присвоен номер доступа КССМ12311Р. Дополнительно полученный штамм CJX1664_PpurA(a189t)-purA назван CJX1668 и депонирован в Корейском центре культур микроорганизмов (КССМ) 10 сентября 2018 г. согласно условиям Будапештского договора, и ему был присвоен номер доступа КССМ12310Р.

Как видно из таблицы 13 выше, было подтверждено, что штаммы CJX1664_PpurA(c143t)-purA, CJX1664_PpurA(a189t)-purA и CJX1664_PpurA(c143t, a189t)-purA характеризуются увеличением количества продуцируемого ХМР приблизительно на 27% по сравнению со штаммом CJX1664 (т.е. штаммом-продуцентом ХМР на основе штамма АТСС6872).
На основании вышеописанного специалист в области техники, к которой относится настоящее описание, сможет понять, что настоящее описание может быть воплощено в других конкретных формах без изменения технических концепций или неотъемлемых характеристик настоящего описания. В связи с этим описанные в настоящем документе примеры воплощений изобретения предназначены только для иллюстративных целях и не должны быть истолкованы как ограничивающие объем настоящего описания. Напротив, подразумевают, что настоящее описание включает не только примеры воплощений, но также различные альтернативы, модификации, эквиваленты и другие воплощения изобретения, которые могут быть включены в сущность и объем настоящего описания, которые определены прилагаемой формулой изобретения.
Изобретение относится к полинуклеотиду, обладающему промоторной активностью, рекомбинантному микроорганизму, его содержащему, и способу получения пуриновых нуклеотидов с использованием указанного микроорганизма. Предложен полинуклеотид, обладающий новой промоторной активностью, в котором в полинуклеотидной последовательности SEQ ID NO: 1 (1) 143-й нуклеотид заменен тимином (T); (2) 189-й нуклеотид заменен тимином (T); или (3) 143-й нуклеотид заменен тимином (T) и 189-й нуклеотид заменен тимином (T). Также предложен рекомбинантный микроорганизм рода Corynebacterium для получения пуриновых нуклеотидов, содержащий вышеуказанный полинуклеотид, функционально связанный с геном, кодирующим целевой белок. Также предложен способ получения пуриновых нуклеотидов, включающий культивирование вышеуказанного рекомбинантного микроорганизма рода Corynebacterium в среде. Изобретение обеспечивает получение пуриновых нуклеотидов с высоким выходом. 3 н. и 4 з.п. ф-лы, 11 табл., 5 пр.
1. Полинуклеотид, обладающий промоторной активностью, где в полинуклеотидной последовательности SEQ ID NO: 1 (1) 143-й нуклеотид заменен тимином (T); (2) 189-й нуклеотид заменен тимином (T); или (3) 143-й нуклеотид заменен тимином (T) и 189-й нуклеотид заменен тимином (T).
2. Полинуклеотид по п. 1, содержащий нуклеотидную последовательность SEQ ID NO: 2, SEQ ID NO: 3 или SEQ ID NO: 4.
3. Рекомбинантный микроорганизм рода Corynebacterium для получения пуриновых нуклеотидов, содержащий полинуклеотид по п. 1, функционально связанный с геном, кодирующим целевой белок.
4. Микроорганизм по п. 3, где целевой белок представляет собой аденилосукцинатсинтетазу.
5. Микроорганизм по п. 3, где микроорганизм рода Corynebacterium представляет собой Corynebacterium stationis.
6. Способ получения пуриновых нуклеотидов, включающий культивирование микроорганизма рода Corynebacterium по п. 3 в среде.
7. Способ по п. 6, дополнительно включающий выделение пуриновых нуклеотидов из микроорганизма или культуральной среды после культивирования.
| УСТРОЙСТВО ЗАЩИТЫ СИСТЕМЫ ПИТАНИЯ ПРИ ГАЗОПЛАМЕННОЙ ОБРАБОТКЕ МАТЕРИАЛОВ | 2000 |
|
RU2169063C1 |
| US 8034767 В2, 11.10.2011 | |||
| SUSANNE PEIFER et | |||
| al | |||
| Metabolic engineering of the purine biosynthetic pathway in Corynebacterium glutamicum results in increased intracellular pool sizes of IMP and hypoxanthine | |||
| Microb Cell Fact | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| MIROSLAV PATEK et al., Corynebacterium glutamicum promoters: a practical | |||
Авторы
Даты
2020-09-14—Публикация
2019-04-08—Подача