ОБЛАСТЬ ТЕХНИКИ
[0001]
Настоящее изобретение относится к способу редактирования ДНК в бесклеточной системе.
Испрашивается приоритет Японской Патентной заявки No. 2018-142274, поданной 30 июля 2018 г., содержание которой приведено в настоящем документе в качестве ссылки.
УРОВЕНЬ ТЕХНИКИ
[0002]
Геномное секвенирование представляет собой способ, в котором используют специфическую для последовательности-мишени нуклеазу для модификации гена-мишени преднамеренным образом. Примеры известных нуклеаз, которые можно использовать, включают такие эндонуклеазы, как CRISPR-Cas9, ZFN и TALEN. С использованием способов геномного секвенирования, целевые последовательности ДНК можно редактировать внутри клеток в широком разнообразии видов от бактерий до человека (Непатентные документы 1-3). Специфические для последовательности-мишени эндонуклеазы представляют собой ферменты, расщепляющие двойную цепь ДНК, и таким образом, для получения редактированного генома-мишени, после расщепления двойной цепи ДНК, необходимо осуществлять внутриклеточный процесс репарации ДНК. В тех случаях, когда новую последовательность ДНК необходимо вставить в геном, процесс репарации функционирует посредством гомологичной рекомбинации. Посредством введения фрагмента ДНК, содержащего гомологичную последовательность в участке расщепления в клетках в ходе расщепления двойной цепи ДНК, желательную последовательность ДНК можно вставлять в участок расщепления посредством рекомбинации с использованием гомологичной последовательности. Кроме того, в тех случаях, когда необходимо делетировать короткую последовательность из нескольких оснований, процесс репарации функционирует посредством соединения негомологичных концов (NHEJ). В этих случаях, репарация участка расщепления посредством NHEJ вызывает делецию или мутацию оснований.
[0003]
Расщепление двойной цепи ДНК посредством специфической для последовательности-мишени эндонуклеазы не только функционирует как запускающий фактор для этих процессов внутриклеточной репарациии, но также имеет функцию отрицательного отбора, в которой нередактированная оставшаяся ДНК избирательно инактивируется. Иными словами, редактированная ДНК больше не может подвергаться расщеплению специфической для последовательности-мишени эндонуклеазой, и таким образом, амплифицируется внутри клеток посредством процесса репликации, в то время как нередактированная ДНК продолжает оставаться экспонированной для атаки двухцепочечного расщепления, что означает, что внутриклеточная амплификация супрессирована.
[0004]
В Escherichia coli (E. coli), последовательности ДНК также можно модифицировать в клетках без использования специфической для последовательности-мишени эндонуклеазы. Известные примеры таких систем включают системы с использованием рекомбинационного фермента RecET из профага (Непатентный документ 4) и системы с использованием рекомбинационного фермента Red из фага λ (Непатентные документы 5 и 6). В этих системах, конец двухцепочечного фрагмента ДНК, вводимого в E. coli, является одноцепочечным, и реакция рекомбинации направляется посредством спаривания этой части и одноцепочечной части, экспонированной в ходе репликации ДНК в геноме. Даже когда фрагмент не представляет собой двухцепочечный фрагмент ДНК, посредством введения короткой одноцепочечной ДНК, а именно, олиго-ДНК, в E. coli, эта олиго-ДНК может спариваться с экспонированной одиночной цепью, вводя замену основания в геном (Непатентный документ 7).
[0005]
Несмотря на то, что эффективность этого типа замены основания посредством олиго-ДНК в E. coli является низкой, недавно опубликован также способ улучшения этой эффективности с использованием системы CRISPR-Cas9 для расщепления последовательности-мишени в качестве отрицательного отбора (Непатентный документ 8).
[0006]
С другой стороны, способ, в котором используют полимеразную цепную реакцию (ПЦР) уже известен в качестве способа редактирования ДНК в бесклеточных системах. Например, с использованием ДНК-праймера, содержащего мутацию, такую как замена, делеция или добавление основания, или т.п., для амплификации ДНК-матрицы способом ПЦР, и амплификации продукта лигирования фрагментов ДНК способом ПЦР, продукт, имеющий последовательность ДНК, которая была искусственно редактирована, можно получать без использования клеток.
[0007]
Систему расщепления последовательности-мишени с использованием CRISPR-Cas9 также можно использовать in vitro. Например, опубликовано клонирование области 100 т.п.о. из генома в плазмиду E. coli с использованием CRISPR-Cas9 (Непатентный документ 9). В этом сообщении, расщепление генома в участке-мишени посредством CRISPR-Cas9 и реакцию сборки между расщепленным фрагментом и плазмидой проводят в пробирке.
[0008]
Кроме того, известные способы соединения друг с другом фрагментов ДНК в бесклеточных системах включают способ In-Fusion (Патентный документ 1), способ сборки Гибсона (Патентные документы 2 и 3) и способ рекомбинационной сборки (Патентный документ 4).
[0009]
Несмотря на то, что способ ПЦР широко используют в качестве способа амплификации ДНК в бесклеточной системе, из-за процессивности используемого фермента, существует предел длины ДНК, которую можно амплифицировать. В способе ПЦР, амплификация ДНК с длинной цепью, превышающей 50 т.п.о., обычно является проблематичной.
[0010]
Одним способом, опубликованным для амплификации этого типа ДНК с длинной цепью в бесклеточной системе, является система репликации in vitro для амплификации кольцевой ДНК, имеющей последовательность точки начала репликации oriC (Патентные документы 5-7). Этот способ называют способом циклической реакции репликации (RCR), и он является способным к амплификации ДНК с длинной цепью 50 т.п.о. или более, которую трудно амплифицировать способом ПЦР.
[0011]
Типы способов редактирования ДНК с использованием клеток, описанные выше, требуют передовых способов для введения ферментов, необходимых для культивирования и реакции, в клетки, а также требуют значительного времени и усилий. Кроме того, в тех случаях, когда для последовательности ДНК, полученной посредством редактирования, показана токсичность для клеток, возникает другая проблема в том, что целевой продукт может не поддаваться получению. Кроме того, фактическое введение ДНК в клетки становится более сложным, по мере увеличения длины цепи ДНК.
ЛИТЕРАТУРА ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
Патентные документы
[0012]
Патентный документ 1: Публикация патента США No. 7575860
Патентный документ 2: Публикация патента США No. 7776532
Патентный документ 3: Публикация патента США No. 8968999
Патентный документ 4: Международная публикация патента No. 2019/009361
Патентный документ 5: Международная публикация патента No. 2016/080424
Патентный документ 6: Международная публикация патента No. 2017/199991
Патентный документ 7: Международная публикация патента No. 2018/159669
Непатентные документы
[0013]
Непатентный документ 1: Carroll, D. (2014) Genome Engineering with Targetable Nucleases. Annual Review of Biochemistry, 83, 409-439.
Непатентный документ 2: Mougiakos, I., Bosma, E.F., de Vos, W.M., van Kranenburg, R. and van der Oost, J. (2016) Next Generation Prokaryotic Engineering: The CRISPR-Cas Toolkit. Trends in Biotechnology, 34, 575-587.
Непатентный документ 3: Mougiakos, I., Bosma, E.F., Ganguly, J., van der Oost, J. and van Kranenburg, R. (2018) Hijacking CRISPR-Cas for high-throughput bacterial metabolic engineering: advances and prospects. Current Opinion in Biotechnology, 50, 146-157.
Непатентный документ 4: Zhang, Y., Buchholz, F., Muyrers, J.P. and Stewart, A.F. (1998) A new logic for DNA engineering using recombination in Escherichia coli. Nature genetics, 20, 123-128.
Непатентный документ 5: Datsenko, K.A. and Wanner, B.L. (2000) One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proceedings of the National Academy of Sciences of the United States of America, 97, 6640-6645.
Непатентный документ 6: Yu, D., Ellis, H.M., Lee, E.C., Jenkins, N.A., Copeland, N.G. and Court, D.L. (2000) An efficient recombination система for chromosome engineering in Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America, 97, 5978-5983.
Непатентный документ 7: Ellis, H.M., Yu, D., DiTizio, T. and Court, D.L. (2001) High efficiency mutagenesis, repair, and engineering of chromosomal DNA using single-stranded oligonucleotides. Proceedings of the National Academy of Sciences of the United States of America, 98, 6742-6746.
Непатентный документ 8: Ronda, C., Pedersen, L.E., Sommer, M.O.A. and Nielsen, A.T. (2016) CRMAGE: CRISPR Optimized MAGE Recombineering. Scientific Reports, 6, 1-11.
Непатентный документ 9: Wang, H., Li, Z., Jia, R., Yin, J., Li, A., Xia, L., Yin, Y., Muller, R., Fu, J., Stewart, A.F., and Zhang, Y. (2017) ExoCET: exonuclease in vitro assembly combined with RecET recombination for highly efficient direct DNA cloning от complex genomes. Nucleic Acids Research, 10.1093/nar/gkx1296.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Проблемы, подлежащие решению посредством изобретению
[0014]
Настоящее изобретение относится к способу редактирования ДНК в бесклеточной системе, позволяющему осуществлять весь способ от стадии избирательной амплификации до конечного продукта редактирования ДНК без использования клеток.
Средства для решения проблем
[0015]
В результате интенсивных исследований, авторы настоящего изобретения открыли, что посредством комбинирования способа либо амплификации ДНК при постоянной температуре в бесклеточной системе, либо амплификации ДНК посредством повторяющейся инкубации при двух температурах не выше, чем 65°C, в бесклеточной системе, со способом редактирования ДНК, который можно использовать в бесклеточной системе, продукт редактированной ДНК можно амплифицировать без использования клеток. Кроме того, авторы настоящего изобретения также открыли, что посредством включения стадии специфического расщепления нередактированной ДНК, выход продукта редактированной ДНК можно очень сильно улучшать. В результате дальнейших исследований на основании этих открытий, авторы настоящего изобретения смогли завершить настоящее изобретение.
[0016]
Иными словами, настоящее изобретение включает следующие аспекты.
[1] Способ редактирования ДНК в бесклеточной системе, включающий следующие стадии:
(1) стадия введения делеции, замены или добавления в участок-мишень ДНК в бесклеточной системе, и
(2) стадия амплификации, в бесклеточной системе, ДНК, в которую делеция, замена или добавление введены на стадии (1), где ДНК амплифицируют в условиях температуры с инкубацией при температуре в диапазоне от 20°C до 80°C.
[2] Способ редактирования ДНК в бесклеточной системе в соответствии с [1], включающий следующие стадии:
(1) стадия введения делеции, замены или добавления в участок-мишень ДНК в бесклеточной системе, и
(2) стадия амплификации, в бесклеточной системе, ДНК, в которую делеция, замена или добавление введены на стадии (1), где ДНК амплифицируют в условиях температуры либо с инкубацией при постоянной температуре, либо с инкубацией при повторяющемся цикле температур, в котором инкубацию проводят при двух температурах 65°C или ниже.
[3] Способ редактирования ДНК в бесклеточной системе в соответствии с [1] или [2], включающий следующие стадии:
(1) стадия введения делеции, замены или добавления в участок-мишень ДНК в бесклеточной системе, и
(2) стадия амплификации, в бесклеточной системе, ДНК, в которую делеция, замена или добавление введены на стадии (1), где ДНК амплифицируют в условиях температуры либо с инкубацией при фиксированной температуре в диапазоне от 20°C до 80°C, либо с инкубацией при повторяющемся цикле температур, в котором инкубацию проводят при двух температурах 65°C или ниже.
[4] Способ в соответствии с любым из [1] - [3], где стадию (2) проводят в присутствии искусственного фермента для расщепления ДНК, специфически расщепляющего ДНК, в которую не введены делеция, замена или добавление.
[5] Способ в соответствии с [4], где искусственный фермент для расщепления ДНК представляет собой искусственную нуклеазу или направляемую РНК нуклеазу.
[6] Способ в соответствии с [4], где искусственный фермент для расщепления ДНК представляет собой CRISPR-Cas9.
[7] Способ в соответствии с любым из [1] - [6], где ДНК представляет собой кольцевую ДНК.
[8] Способ в соответствии с [7], где стадия (2) включает следующие стадии:
(2-1) стадия получения реакционной смеси из: реакционного раствора, содержащего (a) первую группу ферментов, которая катализирует репликацию кольцевой ДНК, (b) вторую группу ферментов, которая катализирует реакцию лигирования фрагментов Оказаки и синтезирует две сестринские кольцевые ДНК, формирующие катенан, и (c) третью группу ферментов, которая катализирует реакцию разделения двух сестринских кольцевых ДНК; и кольцевую ДНК, в которую делеция, замена или добавление введены на стадии (1); и
(2-2) стадия инкубации реакционной смеси, полученной на стадии (2-1), либо при фиксированной температуре в диапазоне от 20°C до 80°C, либо при повторяющемся цикле температур, в котором инкубацию проводят при двух температурах 65°C или ниже.
[9] Способ в соответствии с [8], где кольцевая ДНК содержит последовательность точки начала репликации, которая может связываться с ферментом, имеющим активность DnaA.
[10] Способ в соответствии с [7], где на стадии (2), кольцевую ДНК амплифицируют посредством амплификации по типу катящегося кольца.
[11] Способ в соответствии с любым из [1] - [10], где стадия (1) включает следующие стадии:
(1-1) стадия расщепления ДНК в участке-мишени для получения по меньшей мере одной линейной ДНК посредством вынуждения искусственного фермента для расщепления ДНК действовать на ДНК;
(1-2) стадия получения реакционного раствора, содержащего линейную ДНК, полученную на стадии (1-1), один или несколько типов фрагментов ДНК и белок, имеющий активность рекомбиназы семейства RecA; и
(1-3) стадия соединения друг с другом линейной ДНК и одного или нескольких типов фрагментов ДНК в областях, в которых последовательности оснований являются гомологичными, или в областях, в которых последовательности оснований являются комплементарными, таким образом, с образованием ДНК, в которой каждый из одного или нескольких типов фрагментов ДНК вставлен в участок-мишень ДНК-матрицы.
[12] Способ в соответствии с любым из [1] - [10], где стадия (1) включает следующую стадию:
стадия проведения реакции репликации ДНК в присутствии одноцепочечной ДНК, используемой для введения делеции, замены или добавления, где одноцепочечная ДНК может гибридизоваться с участком-мишенью ДНК в условиях реакции репликации.
[13] Способ в соответствии с любым из [1] - [12], где на стадии (2), ДНК амплифицируют в условиях температуры с инкубацией при цикле температур, в котором повторяют инкубацию при 30°C или выше и инкубацию при 27°C или ниже.
[14] Способ в соответствии с любым из [1] - [13], где размер ДНК, в которую введены делеция, замена или добавление, составляет 50 т.п.о. или больше.
Эффекты изобретения
[0017]
С использованием способа из аспектов, описанных выше, можно получить способ и т.п. для амплификации продукта редактированной ДНК, и в частности, продукта редактированной ДНК с длинной цепью, без использования клеток. Кроме того, с использованием способа из вышеуказанных аспектов, ДНК можно амплифицировать в условиях сравнительно низкой температуры, и таким образом, посредством комбинирования этого способа со способами, как доказано, сложными для комбинирования с общепринятыми способами амплификации ДНК, такими как способы специфического для последовательности расщепления ДНК с использованием искусственных ферментов для расщепления ДНК, таких как CRISPR-Cas9, продукты редактированной ДНК можно амплифицировать с хорошей эффективностью.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0018]
ФИГ. 1 представляет собой схематическую диаграмму, иллюстрирующую линеаризацию ДНК с длинной цепью с oriC посредством специфического для последовательности расщепления посредством Cas9, вставку линейной ДНК в линеаризованную кольцевую ДНК способом лигирования (рекомбинационной сборки, RA) молекул ДНК с использованием последовательностей гомологичных концов, амплификацию кольцевой ДНК после вставки посредством RCR (циклической реакции репликации).
ФИГ. 2A представляет собой диаграмму, иллюстрирующую структуру pOri8 (кольцевой ДНК 9,5 т.п.о.).
ФИГ. 2B представляет собой диаграмму, иллюстрирующую специфическое для последовательности расщепление pOri8 посредством CRISPR-Cas9.
ФИГ. 3A представляет собой диаграмму, иллюстрирующую структуру pMSR227 (кольцевой ДНК 205 т.п.о.).
ФИГ. 3B представляет собой диаграмму, иллюстрирующую специфическое для последовательности расщепление pMSR227 посредством CRISPR-Cas9.
ФИГ. 4 представляет собой схематическую диаграмму, иллюстрирующую, что посредством проведения RCR в присутствии CRISPR-Cas9, амплификацию немодифицированной ДНК-матрицы ингибируют, и целевой продукт лигирования можно специфически амплифицировать.
ФИГ. 5 представляет собой схематическую диаграмму, иллюстрирующую, что посредством добавления CRISPR-Cas9, которая расщепляет ДНК-матрицу, но не расщепляет ДНК, в которую вставлен lacZ, в реакционную систему и проведения RCR, кольцевую ДНК, имеющую вставленный lacZ, можно амплифицировать с высокой эффективностью.
ФИГ. 6A представляет собой диаграмму, иллюстрирующую структуру pMSR227 (205 т.п.о.), имеющей вставленный lacZ (3,3 т.п.о.).
ФИГ. 6B представляет собой диаграмму, подтверждающую структуру pMSR227 со вставкой lacZ посредством расщепления рестрикционным ферментом XhoI.
ФИГ. 7 представляет собой схематическую диаграмму, иллюстрирующую стадию проведения циркуляризации посредством лигирования двух фрагментов ДНК с длинной цепью из примера 3 посредством RA, посредством двух адаптерных фрагментов.
ФИГ. 8 представляет собой диаграмму, иллюстрирующую амплификацию кольцевой ДНК с длинной цепью посредством RA-RCR в примере 3.
ФИГ. 9 представляет собой диаграмму, подтверждающую размер плазмиды, собранной из E. coli, которая была трансформирована продуктом лигирования 183 т.п.о. из примера 3.
ФИГ. 10 представляет собой диаграмму, подтверждающую структуру продукта лигирования 183 т.п.о., полученного в примере 3.
ФИГ. 11A представляет собой диаграмму, иллюстрирующую структуру модифицированной посредством lacZ pPKOZ (pPKOZins и pPKOZmis), использованной в примере 4.
ФИГ. 11B представляет собой диаграмму, иллюстрирующую тестовую систему из примера 4.
ФИГ. 12 представляет собой диаграмму, иллюстрирующую частичные последовательности ниже инициирующих кодонов lacZ wt, lacZ ins и lacZ mis (соответствующие последовательности оснований показаны в SEQ ID NO: 58-60), использованные в примере 4, и последовательность (SEQ ID NO: 17, SUE1355) олигонуклеотида (30-членника), использованного для введения замены основания.
ФИГ. 13A представляет собой диаграмму, иллюстрирующую результаты исследования эффектов длины и концентрации олигонуклеотида, использованного для введения замены основания, на эффективность амплификации плазмиды, имеющей введенную замену основания (а именно, долю голубых колоний). Диаграмма показывает результаты электрофореза.
ФИГ. 13B представляет собой диаграмму, иллюстрирующую результаты исследования эффектов длины и концентрации олигонуклеотида, использованного для введения замены основания, на эффективность амплификации плазмиды, имеющей введенную замену основания (а именно, долю голубых колоний). Диаграмма показывает результаты бело-голубого определения колоний трансформантов E. coli.
ФИГ. 14A представляет собой диаграмму, иллюстрирующую результаты исследования эффекта концентрации олигонуклеотида, использованного для введения замены основания, на эффективность амплификации плазмиды, имеющей введенную замену основания (а именно, долю голубых колоний). Диаграмма показывает результаты электрофореза.
ФИГ. 14B представляет собой диаграмму, иллюстрирующую результаты исследования эффекта концентрации олигонуклеотида, использованного для введения замены основания, на эффективность амплификации плазмиды, имеющей введенную замену основания (а именно, долю голубых колоний). Диаграмма показывает результаты бело-голубого определения колоний трансформантов E. coli.
ФИГ. 15A представляет собой диаграмму, иллюстрирующую, что посредством добавления CRISPR-Cas9, которая специфически расщепляет плазмиду, перед введением замены основания, в реакционную систему и проведения RCR, являлось возможным достигать доли введения замены основания, близкой к 100%. Диаграмма показывает результаты электрофореза.
ФИГ. 15B представляет собой диаграмму, иллюстрирующую, что посредством добавления CRISPR-Cas9, которая специфически расщепляет плазмиду, перед введением замены основания, в реакционную систему и проведения RCR, являлось возможным достигать доли введения замены основания, близкой к 100%. Диаграмма показывает результаты бело-голубого определения колоний трансформантов E. coli.
ФИГ. 16A представляет собой диаграмму, иллюстрирующую структуру pOri93Zins.
ФИГ. 16B представляет собой диаграмму, иллюстрирующую результаты исследования эффекта концентрации олигонуклеотида, использованного для введения замены основания, на эффективность амплификации плазмиды, имеющей введенную замену основания (а именно, долю голубых колоний), для ДНК с длинной цепью. Диаграмма показывает результаты электрофореза.
ФИГ. 16C представляет собой диаграмму, иллюстрирующую результаты исследования эффекта концентрации олигонуклеотида, использованного для введения замены основания, на эффективность амплификации плазмиды, имеющей введенную замену основания (а именно, долю голубых колоний) для ДНК с длинной цепью. Диаграмма показывает результаты бело-голубого определения колоний трансформантов E. coli.
ФИГ. 17A представляет собой диаграмму, иллюстрирующую, что, для ДНК с длинной цепью, посредством добавления CRISPR-Cas9, которая специфически расщепляет плазмиду, перед введением замены основания, в реакционную систему и проведения RCR, являлось возможным достигать доли введения замены основания, близкой к 100%. Диаграмма показывает результаты электрофореза.
ФИГ. 17B представляет собой диаграмму, иллюстрирующую, что, для ДНК с длинной цепью, посредством добавления CRISPR-Cas9, которая специфически расщепляет плазмиду, перед введением замены основания, в реакционную систему и проведения RCR, являлось возможным достигать доли введения замены основания, близкой к 100%. Диаграмма показывает результаты бело-голубого определения колоний трансформантов E. coli.
ФИГ. 18A представляет собой диаграмму, иллюстрирующую частичную последовательность (SEQ ID NO: 61) около инициирующего кодона pPKOZins, использованную в примере 9, и последовательность (SEQ ID NO: 56) олигонуклеотида (60-членника), использованного для модификации (замены 3 оснований).
ФИГ. 18B представляет собой диаграмму, иллюстрирующую частичную последовательность (SEQ ID NO: 62) около инициирующего кодона pPKOZ, использованную в примере 9, и последовательность (SEQ ID NO: 57) олигонуклеотида (60-членника), использованного для модификации (вставки 4 оснований).
ФИГ. 18C представляет собой диаграмму, иллюстрирующую результаты исследования эффекта концентрации олигонуклеотида, использованного для модификации (замены 3 оснований или вставки 4 оснований) на эффективность амплификации плазмиды, имеющей замену 3 оснований или вставку 4 оснований (а именно, долю голубых колоний в случае замены 3 оснований, и долю белых колоний в случае вставки 4 оснований). Диаграмма показывает результаты электрофореза.
ФИГ. 18D представляет собой диаграмму, иллюстрирующую результаты исследования эффекта концентрации олигонуклеотида, использованного для модификации (замены 3 оснований), на эффективность амплификации плазмиды, имеющей замену 3 оснований (а именно, долю голубых колоний). Диаграмма показывает результаты бело-голубого определения колоний трансформантов E. coli.
ФИГ. 18E представляет собой диаграмму, иллюстрирующую результаты исследования эффекта концентрации олигонуклеотида, использованного для модификации (вставки 4 оснований), на эффективность амплификации плазмиды, имеющей вставку 4 оснований (а именно, долю белых колоний). Диаграмма показывает результаты бело-голубого определения колоний трансформантов E. coli.
ФИГ. 18F представляет собой диаграмму, иллюстрирующую участок расщепления EcoRI для pPKOZ(wt).
ФИГ. 18G представляет собой диаграмму, иллюстрирующую участок расщепления EcoRI для pPKOZ4ins.
ФИГ. 18H представляет собой диаграмму, иллюстрирующую результаты, подтверждающие плазмиду с вставкой 4 оснований посредством обработки рестрикционным ферментом. Диаграмма показывает результаты электрофореза.
ФИГ. 19A иллюстрирует структуру pK30V_insAC.
ФИГ. 19B представляет собой диаграмму, иллюстрирующую тестовую систему из примера 10.
ФИГ. 19C представляет собой диаграмму, показывающую последовательность (SEQ ID NO: 68) vioA ins из pP30V_insAC, использованную в примере 10, и последовательность (SEQ ID NO: 65, SUE4577) олигонуклеотида (60-членника), использованного для введения замены основания.
ФИГ. 19D представляет собой диаграмму, показывающую последовательность (SEQ ID NO: 69) vioA ins vioC ins из pP30V_insAC, использованную в примере 10, и последовательность (SEQ ID NO: 66, SUE4381) олигонуклеотида (60-членника), использованного для введения замены основания.
ФИГ. 19E представляет собой диаграмму, иллюстрирующую результаты исследования эффекта времени реакции с олигонуклеотидом, использованным для введения замены основания, на долю плазмид, имеющих одновременную замену основания в двух локализациях (а именно, долю фиолетовых колоний. Диаграмма показывает результаты цветного определения колоний трансформантов E. coli.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[0019]
I. Способ редактирования ДНК в бесклеточной системе
Настоящее изобретение относится к способу редактирования ДНК в бесклеточной системе, где способ (в настоящем описании, иногда обозначаемый как способ по настоящему изобретению) включает следующие стадии:
(1) стадия введения делеции, замены или добавления в участок-мишень ДНК в бесклеточной системе, и
(2) стадия амплификации, в бесклеточной системе, ДНК, в которую делеция, замена или добавление введены на стадии (1), где ДНК амплифицируют в условиях температуры с инкубацией при температуре в диапазоне от 20°C - 80°C.
[0020]
По настоящему изобретению, выражение «редактирование ДНК в бесклеточной системе» относится к модификации участка-мишени в ДНК и затем амплификации полученной ДНК без использования клеток. В этом описании, ДНК до модификации иногда обозначена как ДНК-матрица. В общепринятых системах с использованием клеток, является необходимым либо вводить в клетки ДНК, которая была модифицирована вне клеток, либо вводить в клетки фермент или т.п., необходимый для модификации ДНК, существующей внутри клеток, и культивирование и т.п. клеток не только требует передовых способов, но также требует значительных времени и усилий. По настоящему изобретению, абсолютно никаких клеток не используют в способах модификации и амплификации ДНК, и таким образом, модифицированную ДНК можно получать эффективно.
[0021]
По настоящему изобретению, ДНК-матрица может являться одноцепочечной или двухцепочечной. В тех случаях, когда ДНК-матрица является одноцепочечной, двойная цепь формируется на стадии (1) или (2) способа по настоящему изобретению. Соответственно, с использованием способа по настоящему изобретению, можно получать двухцепочечную ДНК, в которой участок-мишень в ДНК-матрице модифицирован. Кроме того, ДНК-матрица может представлять собой либо кольцевую ДНК, либо линейную ДНК.
[0022]
Размер ДНК, имеющей введенные делецию, замену или добавление, может меняться, в зависимости от способа, использованного на стадиях (1) и (2), и например, может составлять по меньшей мере 1 т.п.о. (1000-членник), по меньшей мере 5 т.п.о., по меньшей мере 8,8 т.п.о., по меньшей мере 9,5 т.п.о., по меньшей мере 10 т.п.о., по меньшей мере 20 т.п.о., по меньшей мере 30 т.п.о., по меньшей мере 40 т.п.о., по меньшей мере 50 т.п.о., по меньшей мере 60 т.п.о., по меньшей мере 70 т.п.о., по меньшей мере 80 т.п.о., по меньшей мере 90 т.п.о., по меньшей мере 100 т.п.о., по меньшей мере 101 т.п.о., по меньшей мере 183 т.п.о., по меньшей мере 200 т.п.о., по меньшей мере 205 т.п.о., по меньшей мере 300 т.п.о., по меньшей мере 500 т.п.о., по меньшей мере 1000 т.п.о. или по меньшей мере 2000 т.п.о. На стадии (2), в тех случаях, когда используют способ RCR, описанный ниже, можно получать модифицированную ДНК размера, который невозможно амплифицировать с использованием общепринятых способов ПЦР, такого как размер по меньшей мере 50 т.п.о., по меньшей мере 60 т.п.о., по меньшей мере 70 т.п.о., по меньшей мере 80 т.п.о., по меньшей мере 90 т.п.о., по меньшей мере 100 т.п.о., по меньшей мере 101 т.п.о., по меньшей мере 183 т.п.о., по меньшей мере 200 т.п.о., по меньшей мере 205 т.п.о., по меньшей мере 300 т.п.о., по меньшей мере 500 т.п.о., по меньшей мере 1000 т.п.о. или по меньшей мере 2000 т.п.о.. С другой стороны, не существует конкретных ограничений верхнего предела для размера ДНК, имеющей введенные делецию, замену или добавление, и например, можно использовать размер приблизительно 10000 т.п.о.
[0023]
I-1. Стадия (1)
Стадия (1) в способе по настоящему изобретению представляет собой стадию модификации ДНК в бесклеточной системе. «Бесклеточная система» представляет собой систему, в которой не используют напрямую клетки, такие как E. coli, но вместо этого, используют ферменты или т.п., существующие в различных клетках, таких как E. coli. По настоящему изобретению, «модификация» ДНК означает замену нуклеотида в цепи ДНК на другой нуклеотид, делецию одного или нескольких нуклеотидов в цепи ДНК, вставку одного или нескольких нуклеотидов между нуклеотидами в цепи ДНК, или добавление одного или нескольких нуклеотидов к концу цепи ДНК. В настоящем описании, вставка и добавление нуклеотида совместно обозначены как «добавление». Кроме того, соединение фрагмента ДНК с другим фрагментом ДНК, также включено в определение «добавление».
[0024]
Количество делетированных, замененных или добавленных нуклеотидов может представлять собой любое количество из одного или более. Хотя и без ограничения, количество нуклеотидов составляет, предпочтительно, по меньшей мере 1 нуклеотид, по меньшей мере 2 нуклеотида, по меньшей мере 3 нуклеотида, по меньшей мере 4 нуклеотида, по меньшей мере 5 нуклеотидов, по меньшей мере 8 нуклеотидов, по меньшей мере 10 нуклеотидов, по меньшей мере 12 нуклеотидов, по меньшей мере 15 нуклеотидов, по меньшей мере 18 нуклеотидов или по меньшей мере 20 нуклеотидов. Кроме того, верхний предел количества делетированных, замененных или добавленных нуклеотидов может меняться, в зависимости от размера ДНК-матрицы, и например, может составлять не более, чем 5000 нуклеотидов, не более, чем 4000 нуклеотидов, не более, чем 3000 нуклеотидов, не более, чем 2000 нуклеотидов, не более, чем 1000 нуклеотидов, не более, чем 500 нуклеотидов, не более, чем 300 нуклеотиды, не более, чем 200 нуклеотидов, не более, чем 150 нуклеотидов, не более, чем 120 нуклеотидов, не более, чем 100 нуклеотидов, не более, чем 80 нуклеотидов, не более, чем 70 нуклеотидов, не более, чем 50 нуклеотидов, или не более, чем 30 нуклеотидов. Например, с использованием способа по настоящему изобретению, один или несколько полных генов могут быть делетированы, заменены или добавлены в ДНК-матрице. Нуклеотиды могут быть также делетированы, заменены или добавлены в двух или более локализациях одновременно в одной ДНК.
[0025]
Не существует конкретных ограничений для модификации ДНК в бесклеточной системе, и можно использовать общепринятые способы введения сайт-специфической мутации из этой области техники. Кроме того, можно использовать также способы соединения множества ДНК, такие как способ RA (см. Патентный документ 4). В конкретном примере способа RA, получают реакционный раствор, содержащий два или более типов фрагментов ДНК и белок, имеющий активность рекомбиназы семейства RecA. Затем, в реакционном растворе, два или более типов фрагментов ДНК соединяют друг с другом в областях, в которых последовательности оснований являются гомологичными, или в областях, в которых последовательности оснований являются комплементарными, таким образом, получая линейную или кольцевую ДНК.
[0026]
Примеры способов введения сайт-специфической мутации включают способы, в которых реакцию репликации ДНК проводят в присутствии одноцепочечной ДНК, такой как олигонуклеотид, содержащий желательную мутацию (например, замену, делецию или добавление), таким образом, получая двухцепочечную ДНК, имеющую введенную мутацию. Одноцепочечную ДНК, используемую по настоящему изобретению, можно получать, например, известными способами, такими как способы химического синтеза. Кроме того, две или более одноцепочечные ДНК можно использовать для введения мутаций в двух или более локализациях в одной ДНК одновременно. В настоящем описании, одноцепочечная ДНК, содержащая мутацию, использованная для введения этой мутации, также обозначена как одноцепочечная ДНК для введения мутации.
[0027]
Например, в способе, в котором реакцию репликации ДНК проводят в присутствии одноцепочечной ДНК для введения мутации, одноцепочечную ДНК, сконструированную таким образом, чтобы содержать желательную мутацию, подвергают гибридизации в одноцепочечной области, экспонированной в реакции репликации ДНК-матрицы, и вставляют в комплементарную цепь. Посредством проведения дальнейшей реакции репликации ДНК с использованием полученной таким образом двухцепочечной ДНК в качестве матрицы, можно получать двухцепочечную ДНК, имеющую мутацию в обеих цепях.
[0028]
В реакции репликации ДНК можно использовать способ амплификации ДНК в бесклеточной системе, такой как описанный на стадии (2). В предпочтительном варианте осуществления, посредством проведения реакции репликации ДНК таким же способом, как реакция амплификации на стадии (2), описанная ниже, введение мутации со стадии (1) и амплификацию ДНК со стадии (2) можно комбинировать. Посредством комбинирования введения мутации и амплификации ДНК в бесклеточной системе, введение мутации в ДНК и амплификацию можно проводить в одной реакции. Реакция репликации ДНК в бесклеточной системе, и в частности, с использованием способа RCR для вставки одноцепочечной ДНК, содержащей мутацию, в ДНК, позволяющая введение сайт-специфической мутации, ранее не была известна.
[0029]
В общепринятой реакция амплификации ДНК с использованием праймера, праймер предписывает область амплификации, и когда одноцепочечную ДНК для введения мутации добавляют в реакционную систему, она может также функционировать как псевдо-праймер. В результате, цепь ДНК синтезируется также с одноцепочечной ДНК, содержащей мутацию, и существует ник между этой цепью ДНК и синтетической цепью ДНК, который продвигается от фактического праймера до точки перед одноцепочечной ДНК, содержащей мутацию, что означает, что полноразмерный целевой продукт невозможно получить. Для соединения ника, 5'-конец одноцепочечной ДНК, содержащей мутацию, необходимо фосфорилировать и затем подвергать действию лигазы, что означает, что количество стадий увеличивается. Соответственно, когда одноцепочечную ДНК для введения мутации используют по настоящему изобретению, в реакции репликации ДНК, предпочтительно, используют способ амплификации ДНК, такой как способ RCR, в котором не используют праймер.
[0030]
Не существует конкретных ограничений длины одноцепочечной ДНК, используемой для введения сайт-специфической мутации, при условии, что одноцепочечная ДНК может гибридизоваться с участком-мишенью в условиях реакции репликации ДНК. Длину можно устанавливать подходящим образом, в соответствии со способом, используемым для реакции репликации ДНК, и например, она может составлять по меньшей мере 10 оснований, по меньшей мере 15 оснований, по меньшей мере 20 оснований, по меньшей мере 30 оснований, по меньшей мере 40 оснований, по меньшей мере 50 оснований или по меньшей мере 60 оснований, и может составлять не более, чем 5000 оснований, не более, чем 4000 оснований, не более, чем 3000 оснований, не более, чем 2000 оснований, не более, чем 1000 оснований, не более, чем 500 оснований, не более, чем 100 оснований, не более, чем 80 оснований, не более, чем 75 оснований, не более, чем 70 оснований или не более, чем 65 оснований. Длина одноцепочечной ДНК для введения мутации может составлять, например, от 40 оснований до 75 оснований, от 50 оснований до 70 оснований, или от 55 оснований до 65 оснований. Когда одноцепочечная ДНК для введения мутации гибридизуется с участком-мишенью, поскольку последовательность одноцепочечной ДНК для введения мутации и последовательность участка-мишени не совпадают полностью, только частичная область одноцепочечной ДНК для введения мутации должна гибридизоваться с участком-мишенью. Является предпочтительным, чтобы оба конца одноцепочечной ДНК для введения мутации гибридизовались с участками-мишенями ДНК-матрицы. Протяженность гибридизации с ДНК-матрицей может отличаться, в зависимости от длины одноцепочечной ДНК, и например, может составлять по меньшей мере 5 оснований, по меньшей мере 10 оснований, по меньшей мере 20 оснований, по меньшей мере 30 оснований, по меньшей мере 40 оснований, по меньшей мере 50 оснований, по меньшей мере 60 оснований или по меньшей мере 100 оснований от конца.
[0031]
Не существует конкретных ограничений концентрации одноцепочечной ДНК для введения мутации в реакционной системе, при условии, что реакция репликации ДНК может проходить. Концентрацию можно устанавливать подходящим образом, в соответствии со способом, используемым для реакции репликации ДНК, и например, концентрация относительно общего объема реакционного раствора для репликации ДНК может составлять по меньшей мере 0,1 мкМ (мкмоль/л), по меньшей мере 0,15 мкМ, по меньшей мере 0,2 мкМ, по меньшей мере 0,25 мкМ, или по меньшей мере 0,3 мкМ, и может составлять не более, чем 3 мкМ, не более, чем 2,5 мкМ, не более, чем 2,0 мкМ, не более, чем 1,5 мкМ, не более, чем 1,0 мкМ или не более, чем 0,6 мкМ. Когда способ RCR используют для реакции репликации ДНК, концентрация одноцепочечной ДНК для введения мутации в реакционной системе, относительно общего объема реакционного раствора для репликации ДНК, может составлять, например, от 0,1 мкМ до 1,5 мкМ, от 0,15 мкМ до 1,0 мкМ, от 0,2 мкМ до 0,6 мкМ, или от 0,3 мкМ до 0,6 мкМ.
[0032]
В данной области техники, множество способов уже известны для соединения множества ДНК. В одном аспекте настоящего изобретения, способ рекомбинационной сборки (далее в настоящем описании сокращенно обозначенный как способ RA, см. Патентный документ 4) можно использовать для соединения множества ДНК.
Вариант осуществления, в котором множество ДНК соединяют с использованием способа RA, описан ниже.
[0033]
<Способ RA>
Способ RA представляет собой способ, в котором фрагменты ДНК, имеющие области, в которых последовательности оснований являются гомологичными (далее в настоящем описании обозначено просто как «гомологичная область») или области, в которых последовательности оснований являются комплементарными (далее в настоящем описании обозначено просто как «комплементарная область») соединяют друг с другом в гомологичных областях или комплементарных областях для получения линейной или кольцевой ДНК. В способе RA, реакцию лигирования проводят в присутствии белка рекомбиназы семейства RecA, и таким образом, эффективность лигирования является необычайно хорошей.
[0034]
В настоящем описании, выражение «последовательности оснований являются гомологичными» означает, что «последовательности оснований являются идентичными», в то время как выражение «последовательности оснований являются комплементарными» означает, что «последовательности оснований являются взаимно комплементарными».
[0035]
Конкретно, в способе RA, получают реакционный раствор, содержащий два или более типов фрагментов ДНК и белок, имеющий активность рекомбиназы семейства RecA (далее в настоящем описании иногда обозначено как «белок рекомбиназа семейства RecA»), и затем два или более типов фрагментов ДНК соединяют друг с другом, в реакционном растворе, в областях, в которых последовательности оснований являются гомологичными или комплементарными. Этим способом получают линейную или кольцевую ДНК. В следующем ниже описании, линейная или кольцевая ДНК, полученная посредством соединения двух или более фрагментов ДНК, иногда обозначена как «продукт лигирования».
[0036]
В способе RA, фрагменты ДНК, которые соединяют, могут представлять собой линейные двухцепочечные фрагменты ДНК или одноцепочечные фрагменты ДНК. Иными словами, линейные двухцепочечные фрагменты ДНК можно соединять друг с другом, можно соединять линейный двухцепочечный фрагмент ДНК и одноцепочечный фрагмент ДНК, или можно соединять одноцепочечные фрагменты ДНК. Один или несколько типов линейных двухцепочечных фрагментов ДНК и один или несколько типов одноцепочечных фрагментов ДНК можно также соединять. В тех случаях, когда линейные двухцепочечные фрагменты ДНК соединяют друг с другом, или соединяют линейный двухцепочечный фрагмент ДНК и одноцепочечный фрагмент ДНК, два фрагмента соединяют друг с другом в гомологичной области. В тех случаях, когда соединяют одноцепочечные фрагменты ДНК, два фрагмента соединяют друг с другом в комплементарной области.
[0037]
В тех случаях, когда по меньшей мере один из фрагментов ДНК, соединяемых способом RA, представляет собой линейный двухцепочечный фрагмент ДНК, реакционный раствор, упомянутый выше, также содержит экзонуклеазу.
[0038]
Когда линейные двухцепочечные фрагменты ДНК соединяют способом RA, сначала 3' → 5'-экзонуклеаза действует на первый линейный двухцепочечный фрагмент ДНК и второй линейный двухцепочечный фрагмент ДНК, имеющие гомологичные области, переводя гомологичные области в одиночные цепи. Затем белок рекомбиназа семейства RecA действует на одноцепочечные гомологичные области, вынуждая комплементарные гомологичные области соединяться друг с другом, таким образом, соединяя первый линейный двухцепочечный фрагмент ДНК и второй линейный двухцепочечный фрагмент ДНК. Укорочение цепи ДНК посредством 3' → 5'-экзонуклеазы можно проводить только для одного из первого линейного двухцепочечного фрагмента ДНК и второго линейного двухцепочечного фрагмента ДНК. Например, гомологичная область первого линейного двухцепочечного фрагмента ДНК, переведенного в одноцепочечное состояние, может действовать на гомологичную область второго линейного двухцепочечного фрагмента ДНК в двухцепочечном состоянии, таким образом, соединяя два фрагмента друг с другом.
[0039]
В способе RA, когда линейные двухцепочечные фрагменты ДНК соединяют друг с другом, или соединяют линейный двухцепочечный фрагмент ДНК и одноцепочечный фрагмент ДНК, поскольку двухцепочечный фрагмент ДНК сначала укорачивают посредством экзонуклеазы для перевода гомологичной области в одноцепочечную форму, и реакцию лигирования затем проводят в присутствии белка рекомбиназы семейства RecA, эффективность лигирования является необычайно хорошей. В результате, с использованием способа RA, соединения множества линейных двухцепочечных фрагментов ДНК, которое обычно являлось проблематичным, можно достигать в одной реакции.
[0040]
В способе RA, в случае, когда одноцепочечные фрагменты ДНК соединяют друг с другом, белок рекомбиназа семейства RecA быстро формирует филаменты на каждом из одноцепочечных фрагментов ДНК, таким образом, супрессируя любое расщепление посредством экзонуклеазы. Затем, действие белка рекомбиназы семейства RecA вызывает связывание комплементарных гомологичных областей, таким образом, соединяя одноцепочечные фрагменты ДНК.
[0041]
Количество фрагментов ДНК, соединенных способом RA, может составлять два (два фрагмента) или более, и например, может составлять по меньшей мере 4 (4 фрагмента), по меньшей мере 5 (5 фрагментов), по меньшей мере 7 (7 фрагментов), по меньшей мере 10 (10 фрагментов) или по меньшей мере 20 (20 фрагментов). Не существует конкретных ограничений верхнего предела количества фрагментов ДНК, которые можно соединять способом RA, но как правило, соединяют количество не более, чем 100 (100 фрагментов). В способе RA, посредством оптимизации условий реакции и т.п., например, приблизительно 50 линейных двухцепочечных фрагментов ДНК можно соединять друг с другом. Фрагменты ДНК, соединенные в способе RA, все могут представлять собой различные фрагменты ДНК, или могут включать два или более фрагментов одинакового фрагмента ДНК.
[0042]
Каждый из двух или более типов фрагментов ДНК, соединенных в способе RA, включает гомологичную область или комплементарную область для соединения по меньшей мере с одним другим типом фрагмента ДНК. В способе RA, когда линейные двухцепочечные фрагменты ДНК соединяют друг с другом, или соединяют линейный двухцепочечный фрагмент ДНК и одноцепочечный фрагмент ДНК, сначала, одну цепь линейного двухцепочечного фрагмента ДНК укорачивают посредством экзонуклеазы для перевода гомологичной области в одноцепочечное состояние. Соответственно, гомологичная область, предпочтительно, существует на конце линейного двухцепочечного фрагмента ДНК, но может также существовать около конца. Например, основание в концевой части гомологичной области со стороны конца линейного двухцепочечного фрагмента ДНК находится, предпочтительно, в пределах 300 оснований от этого конца, более предпочтительно, в пределах 100 оснований от конца, даже более предпочтительно, в пределах 30 оснований от конца, и еще более предпочтительно, в пределах 10 оснований от конца. С другой стороны, в тех случаях, когда одноцепочечные фрагменты ДНК соединяют друг с другом, поскольку расщепление экзонуклеазой ингибируется посредством филаментов белка рекомбиназы семейства RecA, комплементарные области могут существовать в любом месте в одноцепочечных фрагментах ДНК.
[0043]
Последовательности оснований гомологичных областей или комплементарных областей могут представлять собой одинаковые последовательности оснований во всех соединяемых фрагментах ДНК, но для достижения соединения в желательном порядке, последовательности оснований, предпочтительно, отличаются для каждого типа соединяемого фрагмента ДНК. Например, для соединения двухцепочечного фрагмента ДНК A, двухцепочечного фрагмента ДНК B и двухцепочечного фрагмента ДНК C в этом порядке, гомологичная область a предоставлена на нижнем конце двухцепочечного фрагмента ДНК A и на верхнем конце двухцепочечного фрагмента ДНК B, и гомологичная область b предоставлена на нижнем конце двухцепочечного фрагмента ДНК B и на верхнем конце двухцепочечного фрагмента ДНК C. В результате, двухцепочечный фрагмент ДНК A и двухцепочечный фрагмент ДНК B соединяют в гомологичной области a, и двухцепочечный фрагмент ДНК B и двухцепочечный фрагмент ДНК C соединяют в гомологичной области b, что означает, что можно получать линейную ДНК, в которой двухцепочечный фрагмент ДНК A, двухцепочечный фрагмент ДНК B и двухцепочечный фрагмент ДНК C соединены в этом порядке. В этом случае, посредством предоставления также гомологичной области c на нижнем конце двухцепочечного фрагмента ДНК C и на верхнем конце двухцепочечного фрагмента ДНК A, двухцепочечный фрагмент ДНК A и двухцепочечный фрагмент ДНК B соединяют в гомологичной области a, двухцепочечный фрагмент ДНК B и двухцепочечный фрагмент ДНК C соединяют в гомологичной области b, и двухцепочечный фрагмент ДНК C и двухцепочечный фрагмент ДНК A соединяют в гомологичной области c, что означает, что можно получать кольцевую ДНК, в которой двухцепочечный фрагмент ДНК A, двухцепочечный фрагмент ДНК B и двухцепочечный фрагмент ДНК C соединены в этом порядке.
[0044]
Гомологичные области и комплементарные области могут иметь любые последовательности оснований, способные подвергаться специфической гибридизации одиночных цепей в реакционном растворе для лигирования, и длину в парах оснований и соотношение GC, и т.п. можно определять подходящим образом со ссылкой на типичные способы дизайна зондов и праймеров. Как правило, длина в парах оснований гомологичной области должна составлять по меньшей мере определенную длину, чтобы ингибировать неспецифическую гибридизацию и обеспечивать точное соединение целевых линейных двухцепочечных фрагментов ДНК, однако, если длина в парах оснований гомологичной области является слишком большой, тогда существует возможность, что эффективность лигирования может ухудшаться. В способе RA, длина в парах оснований гомологичной области или комплементарной области составляет, предпочтительно, по меньшей мере 10 пар оснований (п.о.), более предпочтительно, по меньшей мере 15 п.о., даже более предпочтительно, по меньшей мере 20 п.о., и особенно предпочтительно, 60 п.о. или более. Кроме того, длина в парах оснований гомологичной области или комплементарной области составляет, предпочтительно, не более, чем 500 п.о., более предпочтительно, не более, чем 300 п.о., и даже более предпочтительно, 200 п.о. или менее.
[0045]
В способе RA, не существует конкретных ограничений длины соединяемых фрагментов ДНК, и например, в случае линейного двухцепочечного фрагмента ДНК, длина составляет, предпочтительно, по меньшей мере 50 п.о., более предпочтительно, по меньшей мере 100 п.о., и даже более предпочтительно, 200 п.о. или более. В случае одноцепочечного фрагмента ДНК, длина составляет, предпочтительно, по меньшей мере 50 о., более предпочтительно, по меньшей мере 100 о., и даже более предпочтительно, 200 о. или более. В способе RA, можно соединять даже двухцепочечные фрагменты ДНК 325 т.п.о. Кроме того, длина соединенных фрагментов ДНК может отличаться для каждого фрагмента.
[0046]
В способе RA, линейные двухцепочечные фрагменты ДНК, которые соединяют друг с другом, могут представлять собой любую двухцепочечную структуру, в которой либо целая область, либо частичная область гомологичной области состоит из двух гибридизованных одноцепочечных ДНК. Иными словами, линейные двухцепочечные фрагменты ДНК могут представлять собой полные линейные двухцепочечные фрагменты ДНК, не имеющие пропусков или ников, или могут представлять собой линейные фрагменты ДНК, включающие одноцепочечную структуру в одной или множестве локализаций. Например, линейные двухцепочечные фрагменты ДНК, которые соединяют, могут иметь тупые концы или липкие концы. С использованием способа RA, можно соединять линейный двухцепочечный фрагмент ДНК с тупыми концами и линейный двухцепочечный фрагмент ДНК с липкими концами.
[0047]
Молярное соотношение между каждыми фрагментами ДНК, содержащимися в реакционном растворе, предпочтительно, согласовано с соотношением количества молекул каждого фрагмента ДНК, составляющих целевой продукт лигирования. Посредством предоставления подходящего количества молекул каждого фрагмента ДНК в реакционной системе на старте реакции лигирования, реакцию лигирования можно проводить более эффективно. Например, в случае, когда фрагменты ДНК, которые все являются различными, соединяют друг с другом, молярные концентрации различных фрагментов ДНК, включенных в реакционный раствор, являются, предпочтительно, равными.
[0048]
Не существует конкретных ограничений общего количества фрагментов ДНК, включенных в реакционный раствор. Для обеспечения того, чтобы достаточное количество продукта лигирования можно было легко получать, общая концентрация фрагментов ДНК, включенных в реакционный раствор в начальной точке реакции лигирования, относительно общего объема реакционного раствора, составляет, предпочтительно, по меньшей мере 0,01 нМ (нмоль/л), более предпочтительно, по меньшей мере 0,1 нМ, даже более предпочтительно, по меньшей мере 0,3 нМ, особенно предпочтительно, по меньшей мере 5,09 нМ, и наиболее предпочтительно, 6,7 нМ или более. Для достижения более высокой эффективности лигирования, более подходящей для соединения множества фрагментов, общая концентрация фрагментов ДНК, включенных в реакционный раствор в начальной точке реакции лигирования, составляет, предпочтительно, не более, чем 100 нМ, более предпочтительно, не более, чем 96,027 нМ, даже более предпочтительно, не более, чем 50 нМ, особенно предпочтительно, не более, чем 25 нМ, и наиболее предпочтительно, 20 нМ или менее.
[0049]
В способе RA, не существует конкретных ограничений размера продукта лигирования, полученного в реакции лигирования. Размер полученного продукта лигирования составляет, например, предпочтительно, по меньшей мере 1 т.п.о. (длину 1000 оснований), более предпочтительно, по меньшей мере 5 т.п.о., даже более предпочтительно, по меньшей мере 10 т.п.о., особенно предпочтительно, по меньшей мере 13 т.п.о., и наиболее предпочтительно, 20 т.п.о. или более. С использованием способа RA, можно также получать продукты лигирования длиной по меньшей мере 183 т.п.о., предпочтительно, по меньшей мере 208 т.п.о., более предпочтительно, по меньшей мере 300 т.п.о., даже более предпочтительно, по меньшей мере 500 т.п.о., и особенно предпочтительно, по меньшей мере 2000 т.п.о. С другой стороны, хотя не существует конкретных ограничений верхнего предела для размера продукта лигирования, полученного в реакции лигирования, верхний предел может, например, составлять приблизительно 10000 т.п.о.
[0050]
Экзонуклеаза, используемая в способе RA, представляет собой фермент, который последовательно гидролизует от 3'-конца или 5'-конца линейной ДНК. При условии, что экзонуклеаза, используемая в способе RA, имеет ферментную активность, способную к последовательному гидролизу от 3'-конца или 5'-конца линейной ДНК, не существует конкретных ограничений типа или биологического источника экзонуклеазы. Например, примеры ферментов, которые последовательно гидролизуют от 3'-конца (3' → 5'-экзонуклеазы) включают специфические для линейной двухцепочечной ДНК 3' → 5'-экзонуклеазы, такие как экзонуклеаза III семейства AP (апуриновые/апиримидиновые) эндонуклеазы, и специфические для одноцепочечной ДНК 3' → 5'-экзонуклеазы, такие как белки суперсемейства DnaQ. Примеры экзонуклеазы III семейства эндонуклеаз AP включают экзонуклеазу III (происходящую из E. coli), ExoA (гомолог экзонуклеазы III bacillus subtilis), Mth212 (гомолог экзонуклеазы III архей) и эндонуклеазу I AP (гомолог экзонуклеазы III человека). Примеры белков суперсемейства DnaQ включают экзонуклеазу I (происходящую из E. coli), экзонуклеазу T (РНКазу T), экзонуклеазу X, субъединицу эпсилон ДНК-полимеразы III, ДНК-полимеразу I, ДНК-полимеразу II, ДНК-полимеразу T7, ДНК-полимеразу T4, фрагмент Кленова ДНК-полимеразы 5, ДНК-полимеразу Phi29, рибонуклеазу III (РНКазу D) и олигорибонуклеазу (ORN). Примеры ферментов, которые последовательно гидролизуют от 5'-конца (5' → 3'-экзонуклеазы), включают экзонуклеазу λ, экзонуклеазу VIII, экзонуклеазу T5, экзонуклеазу T7 и экзонуклеазу RecJ.
[0051]
В отношении достижения хорошего баланса между процессивностью укорочения линейных двухцепочечных фрагментов ДНК и эффективностью лигирования в присутствии белка рекомбиназы семейства RecA, экзонуклеаза, используемая в способе RA, предпочтительно, представляет собой 3' → 5'-экзонуклеазу. Среди таких экзонуклеаз, специфические для линейной двухцепочечной ДНК 3' → 5'-экзонуклеазы являются более предпочтительными, экзонуклеазы семейства эндонуклеаз III AP являются даже более предпочтительными, и экзонуклеаза III является особенно желательной.
[0052]
Экзонуклеаза, включенная в реакционный раствор в способе RA, предпочтительно, включает как специфическую для линейной двухцепочечной ДНК 3' → 5'-экзонуклеазу, так и специфическую для одноцепочечной ДНК 3' → 5'-экзонуклеазу. Посредством комбинирования специфической для одноцепочечной ДНК 3' → 5'-экзонуклеазы со специфической для линейной двухцепочечной ДНК 3' → 5'-экзонуклеазой, эффективность лигирования можно дополнительно улучшать, по сравнению со случаем, когда специфическую для линейной двухцепочечной ДНК 3' → 5'-экзонуклеазу используют отдельно. Хотя причина такого улучшения эффективности лигирования в результате комбинирования обоих типов 3' → 5'-экзонуклеаз является не полностью ясной, предполагают, что специфические для линейной двухцепочечной ДНК 3' → 5'-экзонуклеазы часто имеют сложности с нацеливанием на 3'-выступающий конец, но этот 3'-выступающий конец расщепляется посредством специфической для одноцепочечной ДНК 3' → 5'-экзонуклеазы, что приводит к ускорению реакции лигирования специфической для линейной двухцепочечной ДНК 3' → 5'-экзонуклеазы и RecA. Кроме того, даже в тех случаях, когда линейный фрагмент ДНК, подлежащий соединению, имеет тупой конец или 5'-выступающий конец, использование специфической для одноцепочечной ДНК 3' → 5'-экзонуклеазы в комбинации со специфической для двухцепочечной ДНК 3' → 5'-экзонуклеазой улучшает эффективность лигирования, но предполагают, что 3'-выступающий конец, сформированный вторично внутри продукта лигирования, сформированного посредством специфической для линейной двухцепочечной ДНК 3' → 5'-экзонуклеазы и RecA, расщепляется посредством специфической для одноцепочечной ДНК 3' → 5'-экзонуклеазы, приводя к дальнейшему улучшению эффективности лигирования.
[0053]
Концентрация экзонуклеазы в реакционном растворе для лигирования в способе RA в начальной точке реакции лигирования, например, относительно общего объема реакционного раствора, составляет, предпочтительно, от 1 до 1000 мЕд./мкл, более предпочтительно, от 5 до 1000 мЕд./мкл, даже более предпочтительно, от 5 до 500 мЕд./мкл, особенно предпочтительно, от 10 до 150 мЕд./мкл, и наиболее предпочтительно, от 80 до 150 мЕд./мкл. В частности, в тех случаях, когда экзонуклеаза представляет собой специфическую для линейной двухцепочечной ДНК 3' → 5'-экзонуклеазу, концентрация специфической для линейной двухцепочечной ДНК 3' → 5'-экзонуклеазы в реакционном растворе в начальной точке реакции лигирования составляет, например, относительно общего объема реакционного раствора, предпочтительно, от 5 до 500 мЕд./мкл, более предпочтительно, от 5 до 250 мЕд./мкл, даже более предпочтительно, от 5 до 150 мЕд./мкл, особенно предпочтительно, от 10 до 150 мЕд./мкл, и наиболее предпочтительно, от 80 до 150 мЕд./мкл. Кроме того, когда экзонуклеаза представляет собой специфическую для одноцепочечной ДНК 3' → 5'-экзонуклеазу, концентрация специфической для одноцепочечной ДНК 3' → 5'-экзонуклеазы, относительно общего объема реакционного раствора, составляет, предпочтительно, от 1 до 1000 мЕд./мкл, более предпочтительно, от 100 до 1000 мЕд./мкл, и даже более предпочтительно, от 200 до 1000 мЕд./мкл. Когда специфическую для линейной двухцепочечной ДНК 3' → 5'-экзонуклеазу и специфическую для одноцепочечной ДНК 3' → 5'-экзонуклеазу используют в комбинации, концентрацию каждой экзонуклеазы в реакционном растворе в начальной точке реакции лигирования можно устанавливать на предпочтительную концентрацию каждой экзонуклеазы, описанную выше.
[0054]
В настоящем описании, белок рекомбиназа семейства RecA обозначает белок, который полимеризуется на одноцепочечной или двухцепочечной ДНК с формированием филамента, имеет активность гидролиза по отношению к нуклеозид-трифосфатам, таким как АТФ (аденозин-трифосфат), и имеет функцию (активность рекомбиназы семейства RecA) поиска гомологичной области и проведения гомологичной рекомбинации. Примеры белка рекомбиназы семейства RecA включают гомологи RecA прокариот, гомологи RecA бактериофага, гомологи RecA архей и гомологи RecA эукариот. Примеры гомологов RecA прокариот включают RecA E. coli; RecA происходящую из высоко термофильных бактерий, включая бактерии Thermus, такие как Thermus thermophiles и Thermus aquaticus, бактерии Thermococcus, бактерии Pyrococcus и бактерии Thermotoga; и RecA, происходящую из устойчивых к радиоактивному облучению бактерий, таких как Deinococcus radiodurans. Примеры гомологов RecA бактериофага включают UvsX фага T4, примеры гомологов RecA архей включают RadA, и примеры гомологов RecA эукариот включают Rad51 и его паралоги, и Dcm1. Аминокислотные последовательности этих гомологов RecA можно получать из баз данных, таких как NCBI (http://www.ncbi.nlm.nih.gov/).
[0055]
Белок рекомбиназа семейства RecA, используемая в способе RA, может представлять собой белок дикого типа, или может представлять собой вариант, сохраняющий активность рекомбиназы семейства RecA, в который введены одна или несколько мутаций, делетирующих, добавляющих или заменяющих 1-30 аминокислот в белке дикого типа. Примеры вариантов включают варианты, имеющие мутации замены аминокислот, улучшающие функцию поиска гомологичных областей в белках дикого типа, варианты, имеющие различные типы меток, добавленных к N-концу или C-концу белков дикого типа, и варианты, улучшающие термоустойчивость (Международная публикация патента No. 2016/013592). Примеры меток, которые можно использовать, включают типы меток, широко используемых в экспрессии или очистке рекомбинантных белков, такие как метка His, метка HA (гемагглютинин), метка Myc и метка Flag. Выражение «белок дикого типа рекомбиназа семейства RecA» обозначает белок, имеющий такую же аминокислотную последовательность, как последовательность белка рекомбиназы семейства RecA, содержащегося в организме, выделенном из естественной среды.
[0056]
Белок рекомбиназа семейства RecA, используемая в способе RA, предпочтительно, представляет собой вариант, сохраняющий активность рекомбиназы семейства RecA. Примеры таких вариантов включают мутант F203W, в котором фенилаланин из 203-го аминокислотного остатка RecA E. coli заменен на триптофан, и мутанты среди различных гомологов RecA, в которых фенилаланин, соответствующий 203-му фенилаланину из RecA E. coli, заменен на триптофан.
[0057]
Не существует конкретных ограничений количества белка рекомбиназы семейства RecA в реакционном растворе для лигирования в способе RA. Концентрация белка рекомбиназы семейства RecA в реакционном растворе в начальной точке реакции лигирования способом RA, например, относительно общего объема реакционного раствора, составляет, предпочтительно, от 0,01 мкМ до 100 мкМ (мкмоль/л), более предпочтительно, от 0,1 мкМ до 100 мкМ, даже более предпочтительно, от 0,1 мкМ до 50 мкМ, еще более предпочтительно, от 0,5 мкМ до 10 мкМ, и особенно предпочтительно, от 1,0 мкМ до 5,0 мкМ.
[0058]
Чтобы белок рекомбиназа семейства RecA проявлял активность рекомбиназы семейства RecA, необходим нуклеозид-трифосфат или дезоксинуклеотид-трифосфат. Соответственно, реакционный раствор для проведения реакции лигирования по настоящему изобретению содержит по меньшей мере один из нуклеозид-трифосфата или дезоксинуклеотид-трифосфата. Нуклеозид-трифосфат, включенный в реакционный раствор для лигирования в способе RA, представляет собой, предпочтительно, один или несколько нуклеозид-трифосфатов, выбранных из группы, состоящей из АТФ, ГТФ (гуанозин-трифосфата), ЦТФ (цитидин-трифосфата), УТФ (уридин-трифосфата) и m5УТФ (5-метилуридин-трифосфата), и использование АТФ является особенно желательным. Дезоксинуклеотид-трифосфат, включенный в реакционный раствор для лигирования в способе RA, представляет собой, предпочтительно, один или несколько дезоксинуклеотид-трифосфатов, выбранных из группы, состоящей из дАТФ (дезоксиаденозин-трифосфата), дГТФ (дезоксигуанозин-трифосфата), дЦТФ (дезоксицитидин-трифосфата) и dTTP (дезокситимидин-трифосфата), и использование дАТФ является особенно желательным. Не существует конкретных ограничений общего количества нуклеозид-трифосфата и дезоксинуклеотид-трифосфата, включенных в реакционный раствор, при условии, что количество является достаточным для обеспечения того, чтобы белок рекомбиназа семейства RecA проявлял активность рекомбиназы семейства RecA. Концентрация нуклеозид-трифосфата или концентрация дезоксинуклеотид-трифосфата в реакционном растворе в способе RA в начальной точке реакции лигирования, например, относительно общего объема реакционного раствора, составляет, предпочтительно, по меньшей мере 1 мкМ (мкмоль/л), более предпочтительно, по меньшей мере 10 мкМ, даже более предпочтительно, по меньшей мере 30 мкМ и особенно предпочтительно, 100 мкМ или более. С другой стороны, если концентрация нуклеозид-трифосфата в реакционном растворе является слишком высокой, существует возможность, что эффективность лигирования множества фрагментов может фактически ухудшаться. Соответственно, концентрация нуклеозид-трифосфата или концентрация дезоксинуклеотид-трифосфата в реакционном растворе в начальной точке реакции лигирования, относительно общего объема реакционного раствора, составляет, предпочтительно, не более, чем 1000 мкМ, более предпочтительно, не более, чем 500 мкМ, и даже более предпочтительно, 300 мкМ или менее.
[0059]
Чтобы белок рекомбиназа семейства RecA проявлял активность рекомбиназы семейства RecA, и экзонуклеаза проявляла активность экзонуклеазы, необходимы ионы магния (Mg2+). Соответственно, реакционный раствор для проведения реакции лигирования в способе RA должен содержать источник ионов магния. Источник ионов магния представляет собой материал, предоставляющий ионы магния в реакционном растворе. Примеры источника ионов магния включают соли магния, такие как ацетат магния [Mg(OAc)2], хлорид магния [MgCl2] и сульфат магния [MgSO4]. Предпочтительным источником ионов магния является ацетат магния.
[0060]
Не существует конкретных ограничений источника концентрации ионов магния в реакционном растворе для лигирования в способе RA, при условии, что концентрация является достаточной, чтобы белок рекомбиназа семейства RecA проявлял активность рекомбиназы семейства RecA, и чтобы экзонуклеаза проявляла активность экзонуклеазы. Концентрация источника ионов магния в реакционном растворе в начальной точке реакции лигирования, например, относительно общего объема реакционного раствора, составляет, предпочтительно, по меньшей мере 0,5 мМ (ммоль/л), и составляет, более предпочтительно, 1 мМ или более. С другой стороны, если концентрация источника ионов магния в реакционном растворе является слишком высокой, существует возможность, что активность экзонуклеазы может становиться слишком сильной, приводя к ухудшению эффективности лигирования для множества фрагментов. Соответственно, концентрация источника ионов магния в реакционном растворе в начальной точке реакции лигирования, например, относительно общего объема реакционного раствора, составляет, предпочтительно, не более, чем 20 мМ, более предпочтительно, не более, чем 15 мМ, даже более предпочтительно, не более, чем 12 мМ, и еще более предпочтительно, 10 мМ или менее.
[0061]
Реакционный раствор для проведения реакции лигирования в способе RA получают, например, посредством добавления фрагментов ДНК, белка рекомбиназы семейства RecA, экзонуклеазы, по меньшей мере одного из нуклеозид-трифосфата и дезоксинуклеотид-трифосфата, и источника ионов магния в буферный раствор. Не существует конкретных ограничений буферного раствора, при условии, что он является пригодным для использования в рамках диапазона от pH 7 до 9, и предпочтительно, при pH 8. Примеры буфера включают трис-HCl, трис-ацетат (трис-OAc), Hepes-KOH, фосфатный буфер, MOPS-NaOH и трицин-HCl. Предпочтительные буферы включают трис-HCl и трис-OAc. Не существует конкретных ограничений концентрации буферного раствора, и концентрацию может подходящим образом выбирать специалист в данной области. В случае трис-HCl или трис-OAc, например, концентрация буферного раствора, относительно общего объема реакционного раствора, может составлять от 10 мМ (ммоль/л) до 100 мМ, предпочтительно, от 10 мМ до 50 мМ, и более предпочтительно, 20 мМ.
[0062]
В дополнение к фрагментам ДНК, рекомбинантному ферментному белку семейства RecA, экзонуклеазе, по меньшей мере одному из нуклеозид-трифосфата и дезоксинуклеотид-трифосфата, и источнику ионов магния, реакционный раствор для проведения реакции лигирования в способе RA, предпочтительно, также содержит регенерирующий фермент для нуклеозид-трифосфата или дезоксинуклеотид-трифосфата, и субстрат для этого фермента. Посредством регенерации нуклеозид-трифосфата или дезоксинуклеотид-трифосфата в реакционном растворе, множество фрагментов ДНК можно соединять более эффективно. Примеры комбинаций регенерирующего фермента и его субстрата, используемых для регенерации нуклеозид-трифосфата или дезоксинуклеотид-трифосфата, включают комбинацию креатинкиназы и креатинфосфата, комбинацию пируваткиназы и фосфоенолпирувата, комбинацию ацетаткиназы и ацетилфосфата, комбинацию полифосфаткиназы и полифосфата, и комбинацию нуклеозид-дифосфаткиназы и нуклеозид-трифосфата. Нуклеозид-трифосфат, используемый в качестве субстрата (источника подачи фосфата) для нуклеозид-дифосфаткиназы, может представлять собой любой из АТФ, ГТФ, ЦТФ и УТФ. Дополнительным примером регенерирующего фермента является миокиназа.
[0063]
Не существует конкретных ограничений концентрации регенерирующего нуклеозид-трифосфат фермента или концентрации субстрата для этого фермента в реакционном растворе для проведения реакции лигирования в способе RA, при условии, что концентрации являются достаточными, чтобы позволять регенерацию нуклеозид-трифосфата в реакционном растворе в ходе реакции лигирования. Например, в случае, когда используют креатинкиназу и креатинфосфат, концентрация креатинкиназы в реакционном растворе для лигирования по настоящему изобретению, относительно общего объема реакционного раствора, составляет, предпочтительно, от 1 нг/мкл до 1000 нг/мкл, более предпочтительно, от 5 нг/мкл до 1000 нг/мкл, даже более предпочтительно, от 5 нг/мкл до 500 нг/мкл, особенно предпочтительно, от 5 нг/мкл до 250 нг/мкл, и наиболее предпочтительно, от 20 нг/мкл до 250 нг/мкл, и концентрация креатинфосфата, относительно общего объема реакционного раствора, составляет, предпочтительно, от 0,4 мМ до 20 мМ (ммоль/л), более предпочтительно, от 0,4 мМ до 10 мМ, даже более предпочтительно, от 1 мМ до 7 мМ, и особенно предпочтительно, от 4 мМ до 7 мМ.
[0064]
В случае, когда множество фрагментов соединяют в желательном порядке, последовательность оснований гомологичной области или комплементарной области является, предпочтительно, различной для каждой комбинации фрагментов ДНК, подлежащих соединению. Однако, в условиях одинаковой температуры, гомологичная область, имеющая высокое содержание G (основания гуанина) и C (основания цитозина), имеет тенденцию к более быстрому формированию вторичной структуры в одиночной цепи, в то время как гомологичная область, имеющая высокое содержание A (основания аденина) и T (основания тимина) имеет тенденцию к низкой эффективности гибридизации, что означает, что существует возможность уменьшения эффективности лигирования. Посредством супрессии формирования вторичной структуры одноцепочечной ДНК и стимуляции специфической гибридизации, можно способствовать соединению фрагментов ДНК.
[0065]
Соответственно, вещество, которое супрессирует формирование вторичной структуры одноцепочечной ДНК и способствует специфической гибридизации, предпочтительно, добавляют в реакционный раствор для проведения реакции лигирования в способе RA. Примеры этого вещества включают диметилсульфоксид (DMSO) и хлорид тетраметиламмония (TMAC). DMSO супрессирует формирование вторичной структуры из пар оснований, богатых GC. TMAC способствует специфической гибридизации. В способе RA, в тех случаях, когда это вещество, которое супрессирует формирование вторичной структуры одноцепочечной ДНК и способствует специфической гибридизации, включено в реакционный раствор для проведения реакции лигирования, не существует конкретных ограничений концентрации вещества, при условии, что эффект вещества в стимуляции соединения фрагментов ДНК реализован. Например, когда DMSO используют в качестве этого вещества, концентрация DMSO в реакционном растворе для проведения реакции лигирования в способе RA, относительно общего объема реакционного раствора, составляет, предпочтительно, от 5% по объему (об./об.) до 30% по объему (об./об.), более предпочтительно, от 8% по объему до 25% по объему, и даже более предпочтительно, от 8% по объему до 20% по объему. Когда TMAC используют в качестве этого вещества, концентрация TMAC в реакционном растворе для проведения реакции лигирования в способе RA составляет, предпочтительно, от 60 мМ до 300 мМ, более предпочтительно, от 100 мМ до 250 мМ, и даже более предпочтительно, от 100 мМ до 200 мМ, и концентрация 150 мМ является особенно желательной.
[0066]
Кроме того, вещество, оказывающее макромолекулярный эффект скученности, предпочтительно, также добавляют в реакционный раствор для проведения реакции лигирования в способе RA. Макромолекулярный эффект скученности может улучшать взаимодействие между молекулами ДНК и способствовать соединяю фрагментов ДНК. Примеры таких веществ включают полиэтиленгликоль (PEG) 200-20000, поливиниловый спирт (PVA) 200-20,000, декстран 40-70, фиколл 70 и бычий сывороточный альбумин (BSA). В способе RA, в тех случаях, когда это вещество, оказывающее макромолекулярный эффект скученности, включено в реакционный раствор для лигирования, не существует конкретных ограничений концентрации вещества, при условии, что можно достигать эффекта стимуляции лигирования фрагментов ДНК. Например, когда PEG 8000 используют в качестве этого вещества, концентрация PEG 8000, включенного в реакционный раствор для проведения реакции лигирования в способе RA, относительно общей массы реакционного раствора, составляет, предпочтительно, от 2% по массе (масс./масс.) до 20% по массе (масс./масс.), более предпочтительно, от 2% по массе до 10% по массе, и даже более предпочтительно, от 4% по массе до 6% по массе.
[0067]
Источник ионов щелочного металла также можно включать в реакционный раствор для проведения реакции лигирования в способе RA. Источник ионов щелочного металла представляет собой вещество, предоставляющее ионы щелочного металла в реакционном растворе. Ионы щелочного металла, вводимые в реакционный раствор для проведения реакции лигирования в способе RA, представляют собой, предпочтительно, ионы натрия (Na+) или ионы калия (K+). Примеры источника ионов щелочного металла включают глутамат калия [KGlu], аспартат калия, хлорид калия, ацетат калия [KOAc], глутамат натрия, аспартат натрия, хлорид натрия и ацетат натрия. Источник ионов щелочного металла, вводимый в реакционный раствор для проведения реакции лигирования в способе RA, представляет собой, предпочтительно, глутамат калия или ацетат калия, и глутамат калия является особенно предпочтительным в отношении улучшения эффективности лигирования для множества фрагментов. Не существует конкретных ограничений концентрации источника ионов щелочного металла в реакционном растворе в начальной точке реакции лигирования, и например, концентрацию можно доводить таким образом, чтобы концентрация ионов щелочного металла в реакционном растворе, относительно общего объема реакционного раствора, составляла, предпочтительно, по меньшей мере 10 мМ (ммоль/л), и более предпочтительно, находилась в рамках диапазона от 30 мМ до 300 мМ, и даже более предпочтительно, в рамках диапазона от 50 мМ до 150 мМ.
[0068]
Восстанавливающее средство можно также добавлять в реакционный раствор для проведения реакции лигирования в способе RA. Примеры восстанавливающего средства включают дитиотреитол (DTT), β-меркаптоэтанол (2-меркаптоэтанол), трис(2-карбоксиэтил)фосфин (TCEP) и глутатион. Предпочтительное восстанавливающее средство представляет собой DTT. Восстанавливающее средство можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 1,0 мМ (ммоль/л) до 15,0 мМ (ммоль/л), предпочтительно, от 2,0 мМ до 10,0 мМ, и более предпочтительно, от 4,0 мМ до 10,0 мМ.
[0069]
В способе RA, реакцию лигирования проводят посредством инкубации реакционного раствора, который получают посредством добавления, в буферный раствор, двух или более типов фрагментов ДНК, рекомбинантного ферментного белка семейства RecA, нуклеозид-трифосфата и источника ионов магния, и при необходимости, добавления также одного или нескольких веществ, выбранных из группы, состоящей из экзонуклеазы, набора из регенерирующего нуклеозид-трифосфат фермента и его субстрата, вещества, которое супрессирует формирование вторичной структуры одноцепочечной ДНК и способствует специфической гибридизации, вещества, оказывающего макромолекулярный эффект скученности, источника ионов щелочного металла и восстанавливающего средства, где инкубацию проводят в изотермических условиях при температуре, при которой рекомбинантный ферментный белок семейства RecA и экзонуклеаза в реакционном растворе могут проявлять свои соответствующие ферментные активности. Температура реакции для реакции лигирования находится, предпочтительно, в рамках диапазона температур от 25°C до 48°C, и более предпочтительно, в рамках диапазона температур от 27°C до 45°C. В частности, в тех случаях, когда длина гомологичной области или комплементарной области составляет по меньшей мере 50 оснований, температура реакции для реакции лигирования находится, предпочтительно, в рамках диапазона температур от 30°C до 45°C, более предпочтительно, в рамках диапазона температур от 37°C до 45°C, даже более предпочтительно, в рамках диапазона температур от 40°C до 43°C, и температура 42°C является особенно желательной. С другой стороны, в тех случаях, когда длина гомологичной области или комплементарной области составляет 50 оснований или менее, температура реакции для реакции лигирования находится, предпочтительно, в рамках диапазона температур от 27°C до 43°C, более предпочтительно, в рамках диапазона температур от 27°C до 37°C, и даже более предпочтительно, в рамках диапазона температур от 27°C до 33°C. Применительно к способу RA, термин «изотермические условия» означает, что температуру поддерживают в рамках диапазона ±3°C или ±1°C от установленной температуры в ходе реакции. Не существует конкретных ограничений времени реакции для реакции лигирования, и например, время, как правило, составляет от 15 минут до 6 часов, предпочтительно, от 15 минут до 3 часов, и более предпочтительно, от 1 часа до 3 часов.
[0070]
Пропуски и ники существуют в продукте лигирования (линейной или кольцевой ДНК), полученном в реакции лигирования. Пропуск представляет собой состояние, при котором один или множество последовательных нуклеотидов отсутствуют в двухцепочечной ДНК. Ник представляет собой состояние, при котором фосфодиэфирная связь между соседними нуклеотидами в двухцепочечной ДНК расщеплена. Соответственно, в способе RA, пропуски и ники в полученном продукте лигирования, предпочтительно, репарируют с использованием ферментов для репарации пропусков и дНТФ после завершения реакции лигирования. Посредством репарации этих пропусков и ников, продукт лигирования можно переводить в полную двухцепочечную ДНК.
[0071]
Конкретно, пропуски и ники в продукте лигирования можно репарировать посредством добавления ферментов для репарации пропусков и дНТФ в реакционный раствор после реакции лигирования, и затем инкубации полученной смеси в течение предопределенного времени в изотермических условиях при температуре, при которой ферменты для репарации пропусков могут проявлять активность фермента. Не существует конкретных ограничений типа или биологического источника ферментов, составляющих ферменты для репарации пропусков, при условии, что ферменты являются способными к репарации пропусков и ников в двухцепочечной ДНК. Например, комбинацию фермента, имеющего активность ДНК-полимеразы, и фермента, имеющего активность ДНК-лигазы, можно использовать в качестве ферментов для репарации пропусков. При использовании ДНК-лигазы, происходящей из E. coli, в качестве ДНК-лигазы, кофактор NAD (никотинамид аденин динуклеотид) также включают в реакционный раствор на уровне концентрации, относительно общего объема реакционного раствора, составляющем, как правило, от 0,01 мМ до 1,0 мМ (ммоль/л), и предпочтительно, приблизительно 0,25 мМ. Обработку ферментами для репарации пропусков можно проводить, например, при 25°C - 40°C, и предпочтительно, при 30°C, в течение периода 5 минут - 120 минут, предпочтительно, 10 минут - 60 минут, и более предпочтительно, 30 минут.
[0072]
Термин дНТФ представляет собой общий термин, включающий дАТФ, дГТФ, дЦТФ и dTTP. Концентрация дНТФ в реакционном растворе в начальной точке реакции репарации, например, относительно общего объема реакционного раствора, может находиться в рамках диапазона от 0,01 мМ (ммоль/л) до 1 мМ (ммоль/л), предпочтительно, в рамках диапазона от 0,05 мМ до 1 мМ, и более предпочтительно, в рамках диапазона от 0,25 мМ до 1 мМ.
[0073]
При получении фрагментов ДНК для способа RA, можно использовать ферменты для специфического для последовательности расщепления ДНК, такие как рестрикционные ферменты и искусственные ферменты для расщепления ДНК. Даже в случаях, когда ДНК-матрица является длинной, и выбор подходящего рестрикционного фермента является сложным, если используют искусственный фермент для расщепления ДНК, тогда ДНК можно специфически расщеплять в желательном участке-мишени.
[0074]
В настоящем описании, термин «искусственный фермент для расщепления ДНК» описывает фермент, полученный искусственно, который может специфически узнавать желательную последовательность и расщеплять ДНК, и включает искусственные нуклеазы и направляемые РНК нуклеазы. Искусственные нуклеазы представляют собой искусственные ферменты, полученные посредством соединения домена, который специфически связывается с ДНК, и домена, который расщепляет ДНК, и известные примеры включают нуклеазы с цинковыми пальцами (ZFN) и нуклеазы TALE (TALEN). Кроме того, направляемые РНК нуклеазы представляют собой комплексы короткой РНК, известной как направляющая РНК (нРНК), которая узнает последовательность-мишень, и фермента, который расщепляет ДНК, и известные примеры включают CRISPR-Cas9 и т.п.. По настоящему изобретению, можно использовать любой тип искусственного фермента для расщепления ДНК, но использование искусственной нуклеазы или направляемой РНК нуклеазы является предпочтительным, и использование CRISPR-Cas9 является более предпочтительным.
[0075]
В одном варианте осуществления, в котором используют искусственный фермент для расщепления ДНК в способе RA, стадия (1) может, например, включать следующие стадии:
(1-1) стадия расщепления ДНК в участке-мишени для получения по меньшей мере одной линейной ДНК посредством вынуждения искусственного фермента для расщепления ДНК действовать на ДНК;
(1-2) стадия получения реакционного раствора, содержащего линейную ДНК, полученную на стадии (1-1), один или несколько типов фрагментов ДНК, и белок, имеющий активность рекомбиназы семейства RecA; и
(1-3) стадия соединения друг с другом линейной ДНК и одного или нескольких типов фрагментов ДНК в областях, в которых последовательности оснований являются гомологичными, или в областях, в которых последовательности оснований являются комплементарными, таким образом, с образованием ДНК, в которой каждый из одного или нескольких типов фрагментов ДНК вставлен в участок-мишень ДНК-матрицы.
[0076]
ДНК, обрабатываемая искусственным ферментом для расщепления ДНК на стадии (1-1) (а именно, ДНК-матрица) может являться линейной или кольцевой. С использованием искусственного фермента для расщепления ДНК, ДНК-матрицу можно расщеплять в желательном участке-мишени. Один или несколько типов фрагментов ДНК на стадии (1-2) содержат гомологичную область или комплементарную область для соединения с расщепленным участком, полученным на стадии (1-1), посредством линейной ДНК и искусственного фермента для расщепления ДНК. Посредством соединения друг с другом гомологичных областей или комплементарных областей, ДНК, полученная после соединяя на стадии (1-3), имеет конфигурацию, в которой другая последовательность ДНК вставлена в участке расщепления ДНК-матрицы. Стадию (1-2) и стадию (1-3) можно проводить таким же способом, как способ RA, описанный выше.
[0077]
В другом варианте осуществления, стадия (1) по настоящему изобретению может представляет собой стадию, в которой множество ДНК соединяют способом In-Fusion.
Способ In-Fusion представляет собой способ проведения реакции лигирования с использованием фермента In-Fusion, который имеет функцию узнавания и слияния гомологичных последовательностей концевых 15 оснований каждого двухцепочечного фрагмента ДНК. Конкретно, сначала ПЦР используют для добавления гомологичной области, состоящей из одинаковой последовательности оснований, к концам целевых двухцепочечных фрагментой ДНК, подлежащих соединению. Два двухцепочечных фрагмента ДНК с добавленной гомологичной областью из 15 оснований на обоих концах смешивают с ферментом In-Fusion и инкубируют, таким образом, соединения фрагменты ДНК. Принципы способа In-Fusion описаны, например, в Nucleic Acids Research, 2007, Vol. 35, No. 1, pp. 143 to 151. Способ In-Fusion можно также осуществлять с использованием коммерчески доступных реагентов, таких как изготовленные в Takara Bio Inc.
[0078]
Кроме того, в другом варианте осуществления, стадия (1) по настоящему изобретению может представлять собой стадию, в которой множество ДНК соединяют способом сборки Гибсона.
Способ сборки Гибсона представляет собой способ, в котором дистальную область первой молекулы ДНК и проксимальную область второй молекулы ДНК расщепляют посредством фермента, имеющего активность экзонуклеазы, соответствующие гомологичные области (области, имеющие идентичность последовательности достаточной длины для обеспечения специфической гибридизации друг с другом) переводят в одноцепочечные состояния, затем гомологичные области специфически гибридизуют и соединяют, и затем пропуски и ники репарируют, таким образом получая полный продукт лигирования двухцепочечной ДНК. Иными словами, способ сборки Гибсона включает образование одноцепочечных выступающих 3'-концов и гибридизацию между фрагментами с использованием экзонуклеазы, репарацию пропусков между гибридизованными фрагментами с использованием ДНК-полимеразы, и соединение ников с использованием ДНК-лигазы. Способ сборки Гибсона можно также осуществлять с использованием коммерчески доступных реагентов, таких как изготовленные в New England Biolabs Ltd.
[0079]
I-2. Стадия (2)
Стадия (2) в способе по настоящему изобретению представляет собой стадию амплификации ДНК, которая была модифицирована на стадии (1) в бесклеточной системе, где ДНК амплифицируют в условиях температуры с инкубацией при температуре в диапазоне от 20°C до 80°C. Среди различных вариантов, ДНК, предпочтительно, амплифицируют в условиях температуры либо с инкубацией при постоянной температуре, либо с инкубацией при повторяющемся цикле температур, в котором инкубацию проводят при двух температурах 65°C или ниже, и более предпочтительно, амплифицируют в условиях температуры либо с инкубацией при фиксированной температуре в диапазоне от 20°C до 80°C, либо с инкубацией при повторяющемся цикле температур, в котором инкубацию проводят при двух температурах 65°C или ниже.
[0080]
Общепринятые способы, известные в данной области техники можно использовать для амплификации ДНК в бесклеточной системе. В данной области техники, известны различные способы для амплификации ДНК при постоянной температуре (например, см. J. Li и J. Macdonald, Biosensors and Bioelectronics, Vol. 64, pp. 196 to 211 (2015)). В одном аспекте, ДНК можно амплифицировать с использованием способа циклической реакции репликации (в дальнейшем в настоящем документе обозначаемого как способ RCR, см. Патентные документы 5-7). В тех случаях, когда стадию (2) проводят способом RCR, ДНК-матрица представляет собой кольцевую ДНК.
[0081]
Примеры способов, отличных от RCR, которые можно использовать по настоящему изобретению включают зависимую от хеликазы амплификацию (HAD) (Vincent, M., Xu, Y., Kong, H., 2004. EMBO Rep. 5 (8), 795 to 800), рекомбиназную полимеразную амплификацию (RPA) (Piepenburg, O., Williams, C.H., Stemple, D.L., Armes, N.A., 2006. PLoS. Biol. 4 (7), e204), амплификацию по типу катящегося кольца (RCA) (Fire, A., Xu, S.Q., 1995. Proc. Natl. Acad. Sci. 92 (10), 4641 to 4645), амплификацию с разветвленным удлинением (RAM) (Zhang, D.Y., Brandwein, M., Hsuih, T., Li, H.B., 2001. Mol. Diagn. 6 (2), 141 to 150), амплификацию с множественным вытеснением цепи (MDA) (Dean, F.B., Nelson, J.R., Giesler, T.L., Lasken, R.S., 2001. Genome Res. 11 (6), 1095 to 1099, and Spits, C., Le Caignec, C., De Rycke, M., Van Haute, L., Van Steirteghem, A., Liebaers, I., Sermon, K., 2006. Nat. Protoc. 1 (4), 1965 to 1970), и петлевую изотермическую амплификацию (LAMP) (Notomi, T., Okayama, H., Masubuchi, H., Yonekawa, T., Watanabe, K., Amino, N., Hase, T., 2000. Nucleic Acids Res. 28 (12), E63). Любой из этих способов можно использовать обычным образом. Используемый способ можно выбирать подходящим образом в соответствии с такими факторами, как форма (линейная или кольцевая) ДНК, подвергаемой амплификации.
[0082]
На стадии (2), в тех случаях, когда ДНК, имеющую введенные делецию, замену или добавление, амплифицируют в условиях температуры, включающих инкубацию при постоянной температуре, не существует конкретных ограничений изотермических условий, при условии, что реакция амплификации ДНК или реакция репликации ДНК проходит удовлетворительно, но постоянная температура представляет собой, например, фиксированную температуру в рамках оптимального диапазона температур для ДНК-полимеразы. Примеры изотермических условий включают фиксированную температуру, составляющую по меньшей мере 20°C, по меньшей мере 25°C или по меньшей мере 30°C, и не более, чем 80°C, не более, чем 65°C, не более, чем 60°C, не более, чем 50°C, не более, чем 45°C, не более, чем 40°C, не более, чем 35°C, или 33°C или ниже. Кроме того, изотермические условия могут представлять собой фиксированную температуру, включенную в диапазон от 20°C до 80°C, фиксированную температуру, включенную в диапазон от 20°C до 65°C, фиксированную температуру, включенную в диапазон от 25°C до 50°C, фиксированную температуру, включенную в диапазон от 25°C до 40°C, фиксированную температуру, включенную в диапазон от 30°C до 33°C, или температуру приблизительно 30°C. В настоящем описании, такие выражения как «инкубировать при постоянной температуре», «поддерживать температуру в изотермических условиях» и «проводить реакцию при постоянной температуре», означают, что температуру поддерживают в рамках диапазона температур ±7°C, ±5°C, ±3°C или ±1°C относительно температуры, установленной для реакции. Время, в течение которого температуру поддерживают, можно устанавливать подходящим образом, в соответствии с желательным количеством амплифицированного продукта целевой кольцевой ДНК, но оно, как правило, лежит в диапазоне от 1 часа до 24 часов, и предпочтительно, от 18 часов до 21 часа.
[0083]
На стадии (2), в тех случаях, когда ДНК, имеющей введенные делецию, замену или добавление, амплифицируют в условиях температуры с инкубацией ДНК при повторяющемся цикле температур, в котором инкубацию проводят при двух температурах 65°C или ниже, где первая температура представляет собой температуру, при которой инициация репликации кольцевой ДНК является возможной, и вторая температура представляет собой температуру, при которой инициация репликации ингибируется и могут проходить реакции удлинения ДНК. Первая температура может составлять по меньшей мере 30°C, и например, может находиться в рамках диапазона от 30°C до 80°C, от 30°C до 50°C, от 30°C до 40°C, или может составлять 37°C. Не существует конкретных ограничений инкубации, проводимой при первой температуре, но время на один цикл может находиться в рамках диапазона от 10 секунд до 10 минут, и составляет, предпочтительно, одну минуту. Вторая температура может составлять не выше чем 27°C, и например, может находиться в рамках диапазона от 10°C до 27°C, от 16°C до 25°C, или может составлять 24°C. Не существует конкретных ограничений инкубации, проводимой при второй температуре, но время, предпочтительно, устанавливают в соответствии с длиной кольцевой ДНК, подвергаемой амплификации, и например, время на один цикл может находиться в рамках диапазона от 1 секунд до 10 секунд на 1000 оснований. Количество циклов из цикла температур не является конкретно ограниченным, и может составлять от 10 циклов до 50 циклов, от 20 циклов до 45 циклов, от 25 циклов до 45 циклов, или может составлять 40 циклов.
[0084]
В способе по настоящему изобретению, после стадии (1), можно включать стадию специфического расщепления ДНК, в которую не введены делеция, замена или добавление, с использованием искусственного фермента для расщепления ДНК. Из-за расщепления ДНК, в которую не введены делеция, замена или добавление, эта ДНК не амплифицируется способами амплификации ДНК, описанными выше, и таким образом, выход ДНК, в которую делеция, замена или добавление введены, можно очень сильно улучшать. В одном варианте осуществления, можно использовать два или более искусственных ферментов для расщепления ДНК которые расщепляют различные последовательности. Например, в тех случаях, когда две или более ДНК-матрицы используют на стадии (1), два или более искусственных ферментов для расщепления ДНК можно использовать для специфического расщепления каждой из ДНК-матриц. Альтернативно в тех случаях, когда одну ДНК-матрицу используют на стадии (1), но мутации вводят в двух или более локализациях, два или более искусственных ферментов для расщепления ДНК можно использовать для специфического расщепления последовательностей, в которые мутация не введена в каждом из участков введения мутации.
[0085]
В настоящем описании, экспрессии «специфическое расщепление ДНК, в которую не введены делеция, замена или добавление», означает, что ДНК, в которую не введены делеция, замена или добавление расщепляется, но ДНК, в которую делеция, замена или добавление введены, не расщепляется. Искусственный фермент для расщепления ДНК, осуществляющий этот тип функции, можно получать с использованием обычных способов. Например, когда CRISPR-Cas9 используют в качестве искусственного фермента для расщепления ДНК, посредством конструирования направляющей РНК, которая может связываться с областью, содержащей последовательность до делеции, замены или добавления, ДНК, в которую не введены делеция, замена или добавление, можно специфически расщеплять.
[0086]
Этот тип специфического расщепления посредством искусственного фермента для расщепления ДНК для ДНК, в которую не введены делеция, замена или добавление, можно осуществлять после стадии (1) но до стадии (2).
[0087]
Эти искусственные ферменты для расщепления ДНК, как правило, легко инактивируются посредством термической обработки, и могут иногда терять функциональность в системах для реакции амплификации ДНК, требующих инкубации при высокой температуре 94°C или выше, такой, какая необходима в реакции ПЦР. Стадия (2) в способе по настоящему изобретению не включает инкубацию при высокой температуре 94°C или выше, и таким образом, обработку с использованием искусственного фермента для расщепления ДНК можно проводить одновременно с реакцией амплификации ДНК. Соответственно, в предпочтительном варианте осуществления, стадию (2) можно проводить в присутствии искусственного фермента для расщепления ДНК, специфически расщепляющего ДНК, в которую не введены делеция, замена или добавление. В таком случае, выход ДНК, в которую введены делеция, замена или добавление, можно очень сильно увеличивать без увеличения количества стадий реакции.
[0088]
Вариант осуществления амплификации ДНК способом RCR описан ниже в качестве одного аспекта настоящего изобретения.
[0089]
<Способ RCR>
В одном варианте осуществления, стадию (2) способа по настоящему изобретению можно проводить с использованием способа RCR. Способ RCR представляет собой способ амплификации кольцевой ДНК, включающий следующие стадии:
(2-1) стадия получения реакционной смеси из: реакционного раствора, содержащего (a) первую группу ферментов, которая катализирует репликацию кольцевой ДНК, (b) вторую группу ферментов, которая катализирует реакцию лигирования фрагментов Оказаки и синтезирует две сестринские кольцевые ДНК, формирующие катенан, и (c) третью группу ферментов, которая катализирует реакцию разделения двух сестринских кольцевых ДНК; и кольцевую ДНК, в которую делеция, замена или добавление введены на стадии (1); и
(2-2) стадия инкубации реакционной смеси, полученной на стадии (2-1), либо изотермически, а именно, при фиксированной температуре в рамках диапазона от 20°C до 80°C, либо при повторяющемся цикле температур, в котором инкубацию проводят при двух температурах 65°C или ниже.
[0090]
1. Кольцевая ДНК
Кольцевая ДНК, используемая в качестве матрицы в способе RCR, является, предпочтительно, двухцепочечной. Примеры кольцевой ДНК, используемой в качестве матрицы, включают природную кольцевую ДНК, такую как кольцевые хромосомы микроорганизмов, кольцевую ДНК, образованную посредством соединения отдельного фрагмента ДНК с ДНК, полученной посредством расщепления природной кольцевой ДНК посредством обработки ферментом или т.п., и затем циркуляризации полученного продукта, кольцевую ДНК, полученную посредством подвергания ДНК, существующей в линейном состоянии в природе, обработке для циркуляризации, и кольцевую ДНК, синтезированную полностью искусственно. Кольцевая ДНК может содержать или может не содержать последовательность точки начала репликации, с которой может связываться белок для инициации репликации, но предпочтительно, содержит последовательность точки начала репликации, с которой может связываться белок для инициации репликации, и более предпочтительно, содержит последовательность точки начала репликации (oriC), которая может связываться с ферментом, имеющим активность DnaA.
[0091]
Комбинации последовательностей точки начала репликации и белков для инициации репликации которые могут связываться с этими последовательностями, хорошо известны в данной области техники (например, см. Cell, Volume 54, Issue 7, Pages 915 to 918 (1988), и любую из этих комбинаций можно использовать по настоящему изобретению. Примеры этих типов комбинаций включают oriC и фермент, имеющий активность DnaA (например, последовательность точки начала репликации, существующая в бактериях, таких как E. coli или Bacillus subtilis, и белок DnaA), последовательность точки начала репликации из pSC101 и repA pSC101, последовательность точки начала репликации из P1 и repA P1, последовательность точки начала репликации из F и белок E, последовательность точки начала репликации из R1 и repA R1, ori γ R6K и белок π, последовательность точки начала репликации из λ и белок λ0, последовательность точки начала репликации из φ82 и белок φ820, последовательность точки начала репликации из φ80 и белок φ800, последовательность точки начала репликации из RK2 и белок trfA RK2, и последовательность точки начала репликации из P4 и белок α.
[0092]
Белок для инициации репликации и последовательность точки начала репликации можно получать на основании информации о последовательности, зарегистрированной в публичных базах данных, таких как NCBI (http://www.ncbi.nlm.nih.gov/). Кроме того, последовательность точки начала репликации можно также получать посредством клонирования фрагмента ДНК, способного к связыванию с белком для инициации репликации, и затем анализа последовательности оснований этого фрагмента.
[0093]
Кольцевая ДНК, используемая в качестве матрицы по настоящему изобретению, может представлять собой кольцевую ДНК, которая уже содержит последовательность точки начала репликации, или может представлять собой ДНК, полученную посредством введения последовательности точки начала репликации в кольцевую ДНК, которая исходно не содержит последовательность точки начала репликации.
[0094]
В тех случаях, когда кольцевая ДНК, используемая в качестве матрицы, не содержит последовательность точки начала репликации, с которой может связываться белок для инициации репликации, репликацию ДНК инициируют посредством формирования промежуточного продукта рекомбинации ДНК (D-петли) или формирования промежуточного продукта транскрипции ДНК (R-петли).
[0095]
Кольцевая ДНК, используемая в качестве матрицы по настоящему изобретению, может также содержать, в зависимости от намеченной цели, последовательность маркерного гена устойчивости к лекарственному средству, устойчивого к канамицину, ампициллину или тетрациклину, или т.п.
[0096]
Кольцевая ДНК, используемая в качестве матрицы по настоящему изобретению, может представляет собой очищенную ДНК, но может также находиться в форме суспензии, такой как экстракт бактериальных клеток, содержащий кольцевую ДНК. Кроме того, один тип кольцевой ДНК можно использовать в качестве матрицы, однако, смесь множества типов кольцевой ДНК, такую как библиотека ДНК, можно использовать в одной пробирке в качестве матрицы.
[0097]
Не существует конкретных ограничений количества ДНК-матрицы, используемого на одну реакцию, и одну молекулу кольцевой ДНК можно привлекать в качестве матрицы на одну реакцию.
[0098]
Не существует конкретных ограничений длины кольцевой ДНК, используемой в качестве матрицы по настоящему изобретению, и например, длина может составлять по меньшей мере 1 т.п.о. (длину 1000 оснований), по меньшей мере 5 т.п.о. (длину 5000 оснований), по меньшей мере 8 т.п.о. (длину 8000 оснований), по меньшей мере 8,8 т.п.о. (длину 8800 оснований), по меньшей мере 9,5 т.п.о. (длину 9500 оснований), по меньшей мере 10 т.п.о. (длину 10000 оснований), по меньшей мере 50 т.п.о. (длину 50000 оснований), по меньшей мере 100 т.п.о. (длину 100000 оснований), по меньшей мере 101 т.п.о. (длину 101000 оснований), по меньшей мере 183 т.п.о. (длину 183000 оснований), по меньшей мере 200 т.п.о. (длину 200000 оснований), по меньшей мере 205 т.п.о. (длину 205000 оснований), по меньшей мере 500 т.п.о. (длину 500000 оснований), по меньшей мере 1000 т.п.о. (длину 1000000 оснований), или по меньшей мере 2000 т.п.о. (длину 2000000 оснований). С другой стороны, хотя не существует конкретных ограничений верхнего предела для кольцевой ДНК, верхний предел можно, например, устанавливать на приблизительно 10000 т.п.о.
[0099]
По настоящему изобретению, при использовании кольцевой ДНК, описанной выше, в качестве матрицы, эту ДНК можно амплифицировать по меньшей мере в 10 раз, 50 раз, 100 раз, 200 раз, 500 раз, 1000 раз, 2000 раз, 3000 раз, 4000 раз, 5000 раз или 10000 раз.
[0100]
2. Первая, вторая и третья группы ферментов
2-1. Первая группа ферментов
В настоящем описании, «первая группа ферментов» обозначает группу ферментов, которая катализирует репликацию кольцевой ДНК.
[0101]
2-1-1. Случаи, когда кольцевая ДНК содержит последовательность точки начала репликации
Группу ферментов, описанную, например, в Kaguni J M & Kornberg A. Cell. 1984, 38:183-90, можно использовать в качестве первой группы ферментов, катализирующих репликацию кольцевой ДНК. Конкретно, примеры первой группы ферментов включают один или несколько ферментов или групп ферментов, выбранных из группы, состоящей из белков для инициации репликации (таких как ферменты, имеющие активность DnaA), одного или нескольких типов нуклеоидных белков, ферментов или групп ферментов, имеющих активность ДНК-гиразы, связывающих одноцепочечную ДНК белков (SSB), ферментов, имеющих активность ДНК-хеликазы (таких как ферменты, имеющие активность хеликазы DnaB), ферментов, имеющих активность загрузчика ДНК-хеликаз, ферментов, имеющих активность ДНК-праймазы, ферментов, имеющих активность фиксации ДНК, и ферментов или групп ферментов, имеющих активность ДНК-полимеразы III* (но исключая ферменты, в которых фиксация удалена из холофермента ДНК-полимеразы III), все из которых описаны ниже, или комбинацию всех из вышеупомянутых ферментов или групп ферментов.
[0102]
Не существует конкретных ограничений биологических источников белков для инициации репликации, при условии, что белок имеет активность инициатора по отношению к последовательности точки начала репликации, существующей в кольцевой ДНК. Кроме того, не существует конкретных ограничений биологических источников ферментов, имеющих активность DnaA, при условии, что фермент имеет активность инициатора, сходную с активностью инициаторного белка DnaA E. coli, и например, DnaA, происходящую из E. coli, можно использовать обеспечивающим преимущество образом. Белок для инициации репликации можно включать в форме мономера в реакционный раствор в концентрации в рамках диапазона от 1 нМ (нмоль/л) до 10 мкМ (мкмоль/л) относительно общего объема реакционного раствора, и, предпочтительно, включать в концентрации в рамках диапазона от 1 нМ до 5 мкМ, 1 нМ до 3 мкМ, 1 нМ до 1,5 мкМ, 1 нМ до 1,0 мкМ, 1 нМ до 500 нМ, 50 нМ до 200 нМ, или 50 нМ до 150 нМ, и более предпочтительно, включать в концентрации 100 нМ, хотя изобретение не ограничено этой концентрацией.
[0103]
Термин «нуклеоидные белки» относится к белкам, содержащимся в нуклеоиде. Не существует конкретных ограничений биологических источников одного или нескольких типов нуклеоидных белков, используемых по настоящему изобретению, при условии, что фермент имеет активность, сходную с нуклеоидным белком E. coli, и например, происходящий из E. coli IHF, а именно, комплекс (гетеродимер или гомодимер) одного или нескольких белков, выбранных из группы, состоящей из IhfA и IhfB, или происходящий из E. coli HU, а именно комплекс hupA и hupB, можно использовать обеспечивающим преимущество образом. Происходящий из E. coli гетеро- или гомодимер IHF можно включать в реакционный раствор в концентрации в рамках диапазона от 5 нМ (нмоль/л) до 400 нМ относительно общего объема реакционного раствора, и, предпочтительно, включать в концентрации в рамках диапазона от 5 нМ до 200 нМ, 5 нМ до 100 нМ, 5 нМ до 50 нМ, 10 нМ до 50 нМ, 10 нМ до 40 нМ или 10 нМ до 30 нМ, и более предпочтительно, включать в концентрации 20 нМ, хотя изобретение не ограничено этой концентрацией. Происходящий из E. coli HU можно включать в реакционный раствор в концентрации в рамках диапазона от 1 нМ до 50 нМ, и, предпочтительно, включать в концентрации в рамках диапазона от 5 нМ до 50 нМ или 5 нМ до 25 нМ, хотя изобретение не ограничено этими диапазонами.
[0104]
Не существует конкретных ограничений биологических источников ферментов или групп ферментов, имеющих активность ДНК-гиразы, при условии, что фермент имеет активность сходную с активностью ДНК-гиразы E. coli. Например, комплекс происходящих из E. coli GyrA и GyrB можно использовать обеспечивающим преимущество образом. Комплекс происходящих из E. coli GyrA и GyrB можно включать в форме гетеротетрамера в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 20 нМ (нмоль/л) до 500 нМ, и предпочтительно, в рамках диапазона от 20 нМ до 400 нМ, 20 нМ до 300 нМ, 20 нМ до 200 нМ, 50 нМ до 200 нМ, или 50 нМ до 100 нМ, и более предпочтительно, включать в концентрации 50 нМ, хотя изобретение не ограничено этой концентрацией.
[0105]
Не существует конкретных ограничений биологических источников связывающих одноцепочечную ДНК белков (SSB), при условии, что фермент имеет активность сходную с активностью связывающего одноцепочечную ДНК белка E. coli, однако, например, происходящий из E. coli SSB можно использовать обеспечивающим преимущество образом. Происходящий из E. coli SSB можно включать в форме гомотетрамера в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 20 нМ (нмоль/л) до 1000 нМ, и предпочтительно, в рамках диапазона от 20 нМ до 500 нМ, 20 нМ до 300 нМ, 20 нМ до 200 нМ, 50 нМ до 500 нМ, 50 нМ до 400 нМ, 50 нМ до 300 нМ, 50 нМ до 200 нМ, 50 нМ до 150 нМ, 100 нМ до 500 нМ или 100 нМ до 400 нМ, и более предпочтительно, включать в концентрации 400 нМ, хотя изобретение не ограничено этой концентрацией.
[0106]
Не существует конкретных ограничений биологических источников ферментов, имеющих активность хеликазы DnaB, при условии, что фермент имеет активность, сходную с активностью DnaB E. coli, однако, например, происходящий из E. coli DnaB можно использовать обеспечивающим преимущество образом. Происходящий из E. coli DnaB можно включать в форме гомогексамера в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 5 нМ (нмоль/л) до 200 нМ, и предпочтительно, в рамках диапазона от 5 нМ до 100 нМ, 5 нМ до 50 нМ, или 5 нМ до 30 нМ, и более предпочтительно, включать в концентрации 20 нМ, хотя изобретение не ограничено этой концентрацией.
[0107]
Не существует конкретных ограничений биологических источников ферментов, имеющих активность загрузчика ДНК-хеликазы, при условии, что фермент имеет активность, сходную с активностью DnaC E. coli, однако, например, происходящий из E. coli DnaB можно использовать обеспечивающим преимущество образом. Происходящий из E. coli DnaC можно включать в форме гомогексамера в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 5 нМ (нмоль/л) до 200 нМ, и предпочтительно, в рамках диапазона от 5 нМ до 100 нМ, 5 нМ до 50 нМ, или 5 нМ до 30 нМ, и более предпочтительно, включать в концентрации 20 нМ, хотя изобретение не ограничено этой концентрацией.
[0108]
Не существует конкретных ограничений биологических источников ферментов, имеющих активность ДНК-праймазы, при условии, что фермент имеет активность, сходную с активностью DnaG E. coli, однако, например, происходящий из E. coli DnaG можно использовать обеспечивающим преимущество образом. Происходящий из E. coli DnaG можно включать в форме мономера в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 20 нМ (нмоль/л) до 1000 нМ, и предпочтительно, в рамках диапазона от 20 нМ до 800 нМ, 50 нМ до 800 нМ, 100 нМ до 800 нМ, 200 нМ до 800 нМ, 250 нМ до 800 нМ, 250 нМ до 500 нМ, или 300 нМ до 500 нМ, и более предпочтительно, включать в концентрации 400 нМ, хотя изобретение не ограничено этой концентрацией.
[0109]
Не существует конкретных ограничений биологических источников ферментов, имеющих активность фиксации ДНК, при условии, что фермент имеет активность, сходную с активностью DnaN E. coli, однако, например, происходящий из E. coli DnaN можно использовать обеспечивающим преимущество образом. Происходящий из E. coli DnaG можно включать в форме гомодимера в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 10 нМ (нмоль/л) до 1000 нМ, и предпочтительно, в рамках диапазона от 10 нМ до 800 нМ, 10 нМ до 500 нМ, 20 нМ до 500 нМ, 20 нМ до 200 нМ, 30 нМ до 200 нМ, или 30 нМ до 100 нМ, хотя изобретение не ограничено этим диапазоном концентраций.
[0110]
Не существует конкретных ограничений биологических источников ферментов или групп ферментов, имеющих активность ДНК-полимеразы III*, при условии, что фермент или группа ферментов имеет активность, сходную с активностью комплекса ДНК-полимеразы III* E. coli, и например, группы ферментов, содержащие любой из происходящих из E. coli DnaX, HolA, HolB, HolC, HolD, DnaE, DnaQ и HolE, предпочтительно, группы ферментов, содержащие комплекс происходящих из E. coli DnaX, HolA, HolB и DnaE, и более предпочтительно, группы ферментов, содержащие комплекс происходящих из E. coli DnaX, HolA, HolB, HolC, HolD, DnaE, DnaQ и HolE, можно использовать обеспечивающим преимущество образом. Происходящий из E. coli комплекс ДНК-полимеразы III* можно включать в форме гетеромультимера в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 2 нМ (нмоль/л) до 50 нМ, и предпочтительно, в рамках диапазона от 2 нМ до 40 нМ, 2 нМ до 30 нМ, 2 нМ до 20 нМ, 5 нМ до 40 нМ, 5 нМ до 30 нМ, или 5 нМ до 20 нМ, и более предпочтительно, включать в концентрации 5 нМ, хотя изобретение не ограничено этой концентрацией.
[0111]
2-1-2. Случаи, когда кольцевая ДНК не содержит последовательность точки начала репликации
В тех случаях, когда кольцевая ДНК не содержит последовательность точки начала репликации и D-петлю используют для инициации репликации, примеры ферментов, которые можно использовать для первой группы ферментов, включают рекомбинационные ферменты (такие как RecA или его гомологи (такие как UvsX фага T4)), ферменты, имеющие функцию введения рекомбинационного фермента в ДНК (такие как RecO, RecR и его гомологи (такие как UvsY-UvsX)), и группы белков праймосомы, имеющие функцию введения хеликазы в D-петлю (такие как PriA, PriB, PricC и DnaT).
В тех случаях, когда кольцевая ДНК не содержит последовательность точки начала репликации, и R-петлю используют для инициации репликации, примеры ферментов, которые можно использовать для первой группы ферментов, включают РНК-полимеразы, и группы белков праймосомы, имеющие функцию введения хеликазы в R-петлю (такие как PriA, PriB, PricC и DnaT).
[0112]
2-2. Вторая группа ферментов
В настоящем описании, «вторая группа ферментов» обозначает группу ферментов, которая катализирует реакцию лигирования фрагментов Оказаки и синтезирует две сестринские кольцевые ДНК, формирующие катенан.
[0113]
По настоящему изобретению, две сестринские кольцевые ДНК, формирующие катенан, описывают состояние, в котором две кольцевые ДНК, синтезированные посредством реакции репликации ДНК, являются связанными.
[0114]
Примеры второй группы ферментов которая катализирует реакцию лигирования фрагментов Оказаки и синтезирует две сестринские кольцевые ДНК, формирующие катенан, включают один или несколько ферментов, выбранных из группы, состоящей из ферментов, имеющих активность ДНК-полимеразы I, ферментов, имеющих активность ДНК-лигазы, и ферментов, имеющих активность РНКазыH, или комбинацию этих ферментов.
[0115]
Не существует конкретных ограничений биологических источников ферментов, имеющих активность ДНК-полимеразы I, при условии, что фермент имеет активность, сходную с активностью ДНК-полимеразы I E. coli, однако, например, происходящую из E. coli ДНК-полимеразу I можно использовать обеспечивающим преимущество образом. Происходящую из E. coli ДНК-полимеразу I можно включать в форме мономера в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 10 нМ (нмоль/л) до 200 нМ (нмоль/л), и предпочтительно, в рамках диапазона от 20 нМ до 200 нМ, 20 нМ до 150 нМ, 20 нМ до 100 нМ, 40 нМ до 150 нМ, 40 нМ до 100 нМ, или 40 нМ до 80 нМ, и более предпочтительно, включать в концентрации 50 нМ, хотя изобретение не ограничено этой концентрацией.
[0116]
Не существует конкретных ограничений биологических источников ферментов, имеющих активность ДНК-лигазы, при условии, что фермент имеет активность, сходную с активностью ДНК-лигазы E. coli, однако, например, происходящую из E. coli ДНК-лигазу или ДНК-лигазу фага T4 можно использовать обеспечивающим преимущество образом. Происходящую из E. coli ДНК-лигазу можно включать в форме мономера в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 10 нМ (нмоль/л) до 200 нМ (нмоль/л), и предпочтительно, в рамках диапазона от 15 нМ до 200 нМ, 20 нМ до 200 нМ, 20 нМ до 150 нМ, 20 нМ до 100 нМ, или 20 нМ до 80 нМ, и более предпочтительно, включать в концентрации 50 нМ, хотя изобретение не ограничено этой концентрацией.
[0117]
Не существует конкретных ограничений биологических источников ферментов, имеющих активность РНКазыH, при условии, что фермент имеет активность, разрушающую цепь РНК из гибрида РНК:ДНК, однако, например, происходящую из E. coli РНКазуH можно использовать обеспечивающим преимущество образом. Происходящую из E. coli РНКазуH можно включать в форме мономера в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 0,2 нМ (нмоль/л) до 200 нМ (нмоль/л), и предпочтительно, в рамках диапазона от 0,2 нМ до 200 нМ, 0,2 нМ до 100 нМ, 0,2 нМ до 50 нМ, 1 нМ до 200 нМ, 1 нМ до 100 нМ, 1 нМ до 50 нМ, или 10 нМ до 50 нМ, и более предпочтительно, включать в концентрации 10 нМ, хотя изобретение не ограничено этой концентрацией.
[0118]
2-3. Третья группа ферментов
В настоящем описании, «третья группа ферментов» обозначает группу ферментов, которая катализирует реакцию разделения двух сестринских кольцевых ДНК.
[0119]
Примеры третьей группы ферментов, которая катализирует реакцию разделения двух сестринских кольцевых ДНК, включают группы ферментов, описанные, например, в Peng H & Marians K J. PNAS. 1993, 90: 8571 to 8575. Конкретные примеры третьей группы ферментов включают один или несколько ферментов, выбранных из группы, состоящей из ферментов, имеющих активность топоизомеразы IV, ферментов, имеющих активность топоизомеразы III, и ферментов, имеющих активность хеликазы RecQ, все из которых описаны ниже; или комбинацию этих ферментов.
[0120]
Не существует конкретных ограничений биологических источников ферментов, имеющих активность топоизомеразы III, при условии, что фермент имеет активность, сходную с активностью топоизомеразы III E coli, однако, например, происходящую из E. coli топоизомеразу III можно использовать обеспечивающим преимущество образом. Происходящую из E. coli топоизомеразу III можно включать в форме мономера в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 20 нМ (нмоль/л) до 500 нМ (нмоль/л), и предпочтительно, в рамках диапазона от 20 нМ до 400 нМ, 20 нМ до 300 нМ, 20 нМ до 200 нМ, 20 нМ до 100 нМ, или 30 нМ до 80 нМ, и более предпочтительно, включать в концентрации 50 нМ, хотя изобретение не ограничено этой концентрацией.
[0121]
Не существует конкретных ограничений биологических источников ферментов, имеющих активность хеликазы RecQ, при условии, что фермент имеет активность, сходную с активностью RecQ E coli, однако, например, происходящий из E. coli RecQ можно использовать обеспечивающим преимущество образом. Происходящий из E. coli RecQ можно включать в форме мономера в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 20 нМ (нмоль/л) до 500 нМ (нмоль/л), и предпочтительно, в рамках диапазона от 20 нМ до 400 нМ, 20 нМ до 300 нМ, 20 нМ до 200 нМ, 20 нМ до 100 нМ, или 30 нМ до 80 нМ, и более предпочтительно, включать в концентрации 50 нМ, хотя изобретение не ограничено этой концентрацией.
[0122]
Не существует конкретных ограничений биологических источников ферментов, имеющих активность топоизомеразы IV, при условии, что фермент имеет активность, сходную с активностью топоизомеразы IV E coli, однако, например, происходящую из E. coli топоизомеразу IV, представляющую собой комплекс ParC и ParE, можно использовать обеспечивающим преимущество образом. Происходящую из E. coli топоизомеразу IV можно включать в форме тетрамера в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 0,1 нМ (нмоль/л) до 50 нМ (нмоль/л), и предпочтительно, в рамках диапазона от 0,1 нМ до 40 нМ, 0,1 нМ до 30 нМ, 0,1 нМ до 20 нМ, 1 нМ до 40 нМ, 1 нМ до 30 нМ, 1 нМ до 20 нМ, 1 нМ до 10 нМ или 1 нМ до 5 нМ, и более предпочтительно, включать в концентрации 5 нМ, хотя изобретение не ограничено этой концентрацией.
[0123]
В первой, второй и третьей группах ферментов, описанных выше, можно использовать коммерчески доступные продукты, или их можно выделять из микроорганизмов или т.п. и затем очищать по необходимости. Выделение ферментов из микроорганизмов и последующую очистку можно проводить подходящим образом с использованием способов, общеупотребительных для специалиста в данной области.
[0124]
Когда ферменты, отличные от происходящих из E. coli ферментов, описанных выше, используют в качестве первой, второй и третьей группы ферментов, эти другие ферменты можно использовать в рамках диапазона концентраций, приводящего к единице активности фермента, эквивалентной единице, полученной для диапазона концентраций, указанного выше для происходящих из E. coli ферментов.
[0125]
Реакционный раствор, содержащий бесклеточную систему экспрессии белка для вышеуказанных ферментов, можно просто смешивать с кольцевой ДНК, представляющей собой матрицу, таким образом, образуя жидкую реакционную смесь для репликации или амплификации кольцевой ДНК. Бесклеточная система экспрессии белка может представлять собой бесклеточную систему трансляции, в которой тотальная РНК, мРНК или продукт транскрипции in vitro или т.п., содержащие РНК, состоящую из последовательности, комплементарной последовательности оснований гена, кодирующего каждый из вышеуказанных ферментов, функционируют в качестве РНК-матрицы, или может представлять собой бесклеточную систему транскрипции-трансляции, в которой ген, кодирующий каждый фермент, или экспрессирующий вектор, содержащий ген, кодирующий каждый фермент, функционирует в качестве ДНК-матрицы.
[0126]
Вариант осуществления амплификации кольцевой ДНК с использованием способа RCR описаны ниже в способах RCR I-V. В этих способах RCR I-V, термины «последовательность точки начала репликации, которая может связываться с ферментом, имеющим активность DnaA», и «oriC» можно читать с значением «последовательность точки начала репликации», и термин «фермент, имеющий активность DnaA», можно читать с значением «белок для инициации репликации, который может связываться с последовательностью точки начала репликации».
[0127]
<Способ RCR I>
В одном варианте осуществления, способ RCR по настоящему изобретению включает стадию получения реакционной смеси из реакционного раствора, содержащего вышеупомянутые группы ферментов с первой по третью, и кольцевую ДНК, представляющую собой матрицу (см. Патентный документ 5).
[0128]
Не существует конкретных ограничений состава реакционного раствора, содержащего группы ферментов с первой по третью, при условии, что реакция репликации ДНК может проходить, и например, можно использовать раствор, полученный посредством добавления, в буферный раствор, такой как буферный раствор трис-HCl, раствора, полученного посредством добавления группы ферментов с первой по третью в раствор, содержащий рНТФ, дНТФ, источник ионов магния и источник АТФ, и т.п. Кроме того, реакционный раствор может также содержать дополнительные компоненты, такие как компоненты, ингибирующие образование вторичных продуктов. Конкретные примеры реакционного раствора проиллюстрированы в примерах, описанных ниже.
[0129]
Способ RCR I также включает стадию поддержания температуры вышеуказанной реакционной смеси в изотермических условиях. Не существует конкретных ограничений изотермический условий, при условии, что реакция репликации ДНК может проходить, и например, температуру можно устанавливать на постоянную температуру в рамках диапазона от 20 до 80°C, представляющую собой оптимальную температуру для ДНК-полимеразы, можно устанавливать на постоянную температуру в рамках диапазона от 25°C до 50°C, или можно устанавливать на приблизительно 30°C - 33°C. Время, в течение которого поддерживают температуру, можно устанавливать подходящим образом в соответствии с количеством амплифицированного продукта кольцевой ДНК, представляющего собой мишень, и например, можно устанавливать на время в рамках диапазона от 1 часа до 24 часов, или время от 16 часов до 21 часа.
[0130]
В зависимости от намеченной цели, способ RCR I может также включать стадию очистки амплифицированного продукта целевой кольцевой ДНК после вышеуказанной стадии поддержания температуры реакционной смеси в изотермических условиях. Очистку кольцевой ДНК можно проводить подходящим образом с использованием способов, общеупотребительных для специалиста в данной области.
[0131]
Кольцевую ДНК, которая была амплифицирована с использованием способа RCR I, можно использовать для последующих целей, таких как трансформация, либо в форме реакционной смеси, полученной после реакции, либо в подходящим образом очищенной форме.
[0132]
<Способ RCR II>
В одном варианте осуществления, способ RCR по настоящему изобретению включает следующую стадию:
(II-1) стадия получения реакционной смеси из кольцевой ДНК, представляющей собой матрицу, и реакционного раствора, содержащего:
первую группу ферментов, которая катализирует репликацию кольцевой ДНК,
вторую группу ферментов, которая катализирует реакцию лигирования фрагментов Оказаки и синтезирует две сестринские кольцевые ДНК, формирующие катенан,
третью группу ферментов, которая катализирует реакцию разделения двух сестринских кольцевых ДНК,
буферный раствор,
АТФ,
ГТФ, ЦТФ и УТФ,
дНТФ,
источник ионов магния, и
источник ионов щелочного металла, где кольцевая ДНК содержит последовательность точки начала репликации (точки начала репликации хромосомы (oriC)), которая может связываться с ферментом, имеющим активность DnaA (см. Патентный документ 6).
[0133]
В этом варианте осуществления, способ по настоящему изобретению может также включать, перед стадией (II-1), описанной выше, стадию предварительной инкубации реакционного раствора. Иными словами, способ по настоящему изобретению может включать следующие стадии:
(II-1-1) стадия предварительной инкубации реакционного раствора, содержащего:
первую группу ферментов, которая катализирует репликацию кольцевой ДНК,
вторую группу ферментов, которая катализирует реакцию лигирования фрагментов Оказаки и синтезирует две сестринские кольцевые ДНК, формирующие катенан,
третью группу ферментов, которая катализирует реакцию разделения двух сестринских кольцевых ДНК,
буферный раствор,
АТФ,
ГТФ, ЦТФ и УТФ,
дНТФ,
источник ионов магния, и
источник ионов щелочного металла; и
(II-1-2) стадия получения реакционной смеси из вышеуказанного реакционного раствора и кольцевой ДНК, представляющей собой матрицу, где кольцевая ДНК содержит последовательность точки начала репликации (точки начала репликации хромосомы (oriC)), которая может связываться с ферментом, имеющим активность DnaA.
[0134]
Предварительную инкубацию можно проводить посредством поддержания температуры, например, при температуре в рамках диапазона от 0°C до 40°C, 10°C до 40°C, 15°C до 37°C или 16°C до 30°C, в течение периода в рамках диапазона от 5 минут до 60 минут, 5 минут до 45 минут, 5 минут до 30 минут, 15 минут до 60 минут, 15 минут до 45 минут, или 15 минут до 30 минут. При условии, что предварительную инкубацию проводят при температуре реакционного раствора, поддерживаемой в рамках вышеуказанного диапазона температур, температура может немного меняться в ходе предварительной инкубации.
[0135]
Хотя и без ограничения теорией, в способе RCR II, цикл репликации обычно повторяют, таким образом, амплифицируя кольцевую ДНК экспоненциально. В способе по настоящему изобретению, кольцевую ДНК, упомянутую выше, используют в качестве матрицы, и затем ДНК можно амплифицировать по меньшей мере в 10 раз, 50 раз, 100 раз, 200 раз, 500 раз, 1000 раз, 2000 раз, 3000 раз, 4000 раз, 5000 раз или 10000 раз.
[0136]
Кольцевая ДНК, которую смешивают с реакционным раствором, является такой, как описано выше в разделе, озаглавленном «1. Кольцевая ДНК». Не существует конкретных ограничений количества ДНК-матрицы, использованного на реакцию, и например, ДНК-матрицу можно добавлять в реакционный раствор в концентрации, относительно общего объема реакционного раствора на старте реакции, не более, чем 10 нг/мкл, не более, чем 5 нг/мкл, не более, чем 1 нг/мкл, не более, чем 0,8 нг/мкл, не более, чем 0,5 нг/мкл, или 0,3 нг/мкл или менее. С другой стороны, нижний предел количества ДНК-матрицы, использованного на реакцию, не является конкретно ограниченным, и например, может составлять 7,5 фг/мкл, 0,67 пг/мкл, 1 пг/мкл, 10 пг/мкл, 14 пг/мкл, 50 пг/мкл или 75 пг/мкл. Кроме того, на старте реакции, одну молекулу кольцевой ДНК на реакцию можно вводить в качестве матрицы и затем использовать в амплификации.
[0137]
Не существует конкретных ограничений буферного раствора, включенного в реакционный раствор, при условии, что буферный раствор является пригодным для использования в рамках диапазона pH 7-9, и предпочтительно, при pH 8. Примеры буферного раствора включают трис-HCl, трис-OAc, Hepes-KOH, фосфатный буферный раствор, MOPS-NaOH и трицин-HCL. Предпочтительные буферные растворы включают трис-HCl и трис-OAc. Не существует конкретных ограничений концентрации буферного раствора, которую может подходящим образом выбирать специалист в данной области, но в случае трис-HCl или трис-OAc, концентрация буферного раствора, например, относительно общего объема реакционного раствора, может быть выбрана в рамках диапазона от 10 мМ (ммоль/л) до 100 мМ (ммоль/л) или от 10 мМ до 50 мМ, или может составлять 20 мМ.
[0138]
АТФ обозначает аденозин-трифосфат. Концентрация АТФ, включенного в реакционный раствор на старте реакции, например, относительно общего объема реакционного раствора, может находиться в рамках диапазона от 0,1 мМ (ммоль/л) до 3 мМ (ммоль/л), находится, предпочтительно, в рамках диапазона от 0,1 мМ до 2 мМ, от 0,1 мМ до 1,5 мМ, или от 0,5 мМ до 1,5 мМ, и более предпочтительно, составляет 1 мМ.
[0139]
ГТФ, ЦТФ и УТФ обозначают гуанозин-трифосфат, цитидин-трифосфат и уридин-трифосфат, соответственно. Концентрация каждого из ГТФ, ЦТФ и УТФ, включенных в реакционный раствор на старте реакции, например, относительно общего объема реакционного раствора, может находиться в рамках диапазона от 0,1 мМ (ммоль/л) до 3,0 мМ (ммоль/л), и находится, предпочтительно, в рамках диапазона от 0,5 мМ до 3,0 мМ, или от 0,5 мМ до 2,0 мМ.
[0140]
Кроме того, дНТФ представляет собой общий термин для дезоксиаденозин-трифосфата (дАТФ), дезоксигуанозин-трифосфата (дГТФ), дезоксицитидин-трифосфата (дЦТФ) и дезокситимидин-трифосфата (dTTP). Концентрация дНТФ, включенного в реакционный раствор на старте реакции, например, относительно общего объема реакционного раствора, может находиться в рамках диапазона от 0,01 мМ (ммоль/л) до 1 мМ (ммоль/л), находится, предпочтительно, в рамках диапазона от 0,05 мМ до 1 мМ, или от 0,1 мМ до 1 мМ, и более предпочтительно, находится в рамках диапазона от 0,25 мМ до 1 мМ.
[0141]
Источник ионов магния представляет собой вещество, предоставляющее ионы магния (Mg2+) в реакционном растворе. Примеры источника ионов магния включают Mg(OAc)2, MgCl2 и MgSO4. Mg(OAc)2 является предпочтительным источником ионов магния. Концентрация источника ионов магния, включенного в реакционный раствор на старте реакции, относительно общего объема реакционного раствора, может составлять концентрацию, предоставляющую, например, от 5 мМ (ммоль/л) до 50 мМ (ммоль/л) ионы магния, и предпочтительно, 1 мМ ионы магния, в реакционном растворе.
[0142]
Источник ионов щелочного металла представляет собой вещество, предоставляющее ионы щелочного металла в реакционном растворе. Примеры ионов щелочного металла включают ионы натрия (Na+) и ионы калия (K+). Примеры источника ионов щелочного металла включают глутамат калия, аспартат калия, хлорид калия, ацетат калия, глутамат натрия, аспартат натрия, хлорид натрия и ацетат натрия. Предпочтительные источники ионов щелочного металла включают глутамат калия и ацетат калия. Концентрация источника ионов щелочного металла, включенного в реакционный раствор на старте реакции, относительно общего объема реакционного раствора, может составлять концентрацию, предоставляющую по меньшей мере 100 мМ (ммоль/л), предпочтительно, от 100 мМ до 300 мМ, и более предпочтительно, 50 мМ, ионы щелочного металла в реакционном растворе, хотя изобретение не ограничено этой концентрацией. В комбинации с более ранним применением, 150 мМ можно вычитать из вышеуказанной концентрации источника ионов щелочного металла.
[0143]
Реакционный раствор, использованный в способе RCR II, может также содержать ингибитор неспецифической адсорбции белка или ингибитор неспецифической адсорбции нуклеиновой кислоты. Является предпочтительным, чтобы реакционный раствор содержал как ингибитор неспецифической адсорбции белка, так и ингибитор неспецифической адсорбции нуклеиновой кислоты. Посредством включения одного или нескольких ингибиторов неспецифической адсорбции, выбранных из группы, состоящей из ингибиторов неспецифической адсорбции белка и ингибиторов неспецифической адсорбции нуклеиновой кислоты, в реакционный раствор, улучшают эффективность реакции. Считают, что один или несколько ингибиторов неспецифической адсорбции, выбранных из группы, состоящей из ингибиторов неспецифической адсорбции белка и ингибиторов неспецифической адсорбции нуклеиновой кислоты, ингибируют по меньшей мере один тип неспецифической адсорбции, выбранный из группы, состоящей из адсорбции между белками и адсорбции между белком и кольцевой ДНК, а также ингибируют адгезию белков и кольцевой ДНК к поверхностям реакционного сосуда, таким образом, улучшая эффективность реакции.
[0144]
Ингибиторы неспецифической адсорбции белка представляют собой белки, не относящиеся к реакции амплификации в способе по настоящему изобретению. Примеры этих типов белков включают бычий сывороточный альбумин (BSA), лизоцим, желатин, гепарин и казеин. Ингибитор неспецифической адсорбции белка можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, находящейся в рамках диапазона от 0,02 мг/мл до 2,0 мг/мл, предпочтительно, в рамках диапазона от 0,1 мг/мл до 2,0 мг/мл, 0,2 мг/мл до 2,0 мг/мл, или 0,5 мг/мл до 2,0 мг/мл, и более предпочтительно, в концентрации 0,5 мг/мл, хотя изобретение не ограничено этой концентрацией.
[0145]
Ингибиторы неспецифической адсорбции нуклеиновой кислоты представляют собой молекулы нуклеиновой кислоты или родственные нуклеиновой кислоте молекулы, не относящиеся к реакции амплификации в способе по настоящему изобретению. Примеры этих типов молекул нуклеиновой кислоты или родственных нуклеиновой кислоте молекул включают тРНК (транспортную РНК), рРНК (рибосомную РНК), мРНК (матричную РНК), гликоген, гепарин, олиго-ДНК, поли(I-C) полиинозин-полицитидин, поли(dI-dC) (полидезоксиинозин-полидезоксицитидин), поли(A) (полиаденин) и поли(дA) (полидезоксиаденин). Ингибитор неспецифической адсорбции нуклеиновой кислоты можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, находящейся в рамках диапазона от 1 нг/мкл до 500 нг/мкл, предпочтительно, в рамках диапазона от 10 нг/мкл до 500 нг/мкл, 10 нг/мкл до 200 нг/мкл, или 10 нг/мкл до 100 нг/мкл, и более предпочтительно, в концентрации 50 нг/мкл, хотя изобретение не ограничено этой концентрацией. В комбинации с более ранним применением, в тех случаях, когда тРНК выбрана в качестве ингибитора неспецифической адсорбции нуклеиновой кислоты, 50 нг/мкл можно вычитать из вышеуказанной концентрации тРНК.
[0146]
Реакционный раствор, используемый в способе по настоящему изобретению, может также содержать стабилизирующий ДНК фактор. Считают, что посредством включения стабилизирующего ДНК фактора в реакционный раствор, расщепление ДНК супрессируют, обеспечивая защиту ДНК-матрицы и амплифицированного продукта. Добавление стабилизирующего ДНК фактора приводит к улучшению выхода целевого продукта. В частности в тех случаях, когда ДНК-матрица представляет собой кольцевую ДНК с длинной цепью, ДНК-матрица и амплифицированный продукт более подвержены разрушению, и таким образом добавление стабилизирующего ДНК фактора обеспечивает преимущество. Стабилизирующий ДНК фактор не является конкретно ограниченным, и например, может быть выбран из группы, состоящей из глюкозы, сахарозы, диметилсульфоксида (DMSO), бычьего сывороточного альбумина (BSA), гликолевого эфира диаминтетраацетата (EGTA), батокупроиндисульфоната динатрия (BDA), пеницилламина, Tiron (1,2-дигидроксибензол-3,5-сульфоната), диэтилентриаминпентаацетата (DTPA), этилендиаминтетраацетата (ЭДТА), белка Dps (происходящего из E. coli), и белка металлотионеина (происходящего из человека). Среди них, DTPA, Tiron, BDA, белок Dps и BSA оказывают действие, улучшающее эффективность реакции амплификации кольцевой ДНК, и являются таким образом особенно предпочтительными. DTPA и Tiron можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 0,01 мМ (ммоль/мл) до 0,3 мМ (ммоль/мл), предпочтительно, в рамках диапазона от 0,05 мМ до 0,25 мМ, и более предпочтительно, в концентрации 0,25 мМ, хотя изобретение не ограничено этой концентрацией. BDA можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 0,01 мМ (ммоль/мл) до 0,5 мМ (ммоль/мл), и предпочтительно, в рамках диапазона от 0,05 мМ до 0,3 мМ, хотя изобретение не ограничено этим диапазоном концентраций. Белок Dps можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 0,3 мкМ (мкмоль/мл) до 3,0 мМ (мкмоль/мл), и предпочтительно, в рамках диапазона от 0,3 мкМ до 1,5 мкМ, хотя изобретение не ограничено этим диапазоном концентраций. BSA можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 0,02 мг/мл до 2,0 мг/мл, предпочтительно, в рамках диапазона от 0,1 мг/мл до 2,0 мг/мл, от 0,2 мг/мл до 2,0 мг/мл, или от 0,5 мг/мл до 2,0 мг/мл, и более предпочтительно, включать в концентрации 0,5 мг/мл, хотя изобретение не ограничено этой концентрацией.
[0147]
Реакционный раствор, используемый в способе RCR II, может также содержать специфическую для линейной ДНК экзонуклеазу или хеликазу RecG. Реакционный раствор, предпочтительно, также содержит как специфическую для линейной ДНК экзонуклеазу, так и хеликазу RecG. Посредством включения одного или нескольких веществ, выбранных из группы, состоящей из специфических для линейной ДНК экзонуклеаз и хеликаз RecG, в реакционный раствор, количество линейной ДНК, полученной посредством двухцепочечного расщепления или т.п. в реакции амплификации, можно уменьшать, получая в результате эффект улучшения выхода целевого сверхспирального продукта.
[0148]
Реакционный раствор, используемый в способе RCR II, может также содержать хеликазу RecG или специфическую для одноцепочечной ДНК экзонуклеазу. Реакционный раствор предпочтительно, также содержит как хеликазу RecG, так и специфическую для одноцепочечной ДНК экзонуклеазу. Посредством включения одного или нескольких веществ, выбранных из группы, состоящей из хеликаз RecG и специфических для одноцепочечной ДНК экзонуклеаз, в реакционный раствор, количество вторичных продуктов амплификации низкой молекулярной массы, полученных в реакции амплификации, можно уменьшать, получая в результате эффект улучшения выхода целевого сверхспирального продукта.
[0149]
Реакционный раствор, используемый в способе RCR II, может также содержать специфическую для линейной ДНК экзонуклеазу или специфическую для одноцепочечной ДНК экзонуклеазу. Реакционный раствор предпочтительно, также содержит как специфическую для линейной ДНК экзонуклеазу, так и специфическую для одноцепочечной ДНК экзонуклеазу. Посредством включения одного или нескольких веществ, выбранных из группы, состоящей из специфических для линейной ДНК экзонуклеаз и специфических для одноцепочечной ДНК экзонуклеаз, в реакционный раствор, количество линейной ДНК, полученной посредством двухцепочечного расщепления или т.п. в реакции амплификации, можно уменьшать, получая в результате эффект улучшения выхода целевого сверхспирального продукта.
[0150]
Специфические для линейной ДНК экзонуклеазы представляют собой ферменты, которые последовательно гидролизуют 5'-конец или 3'-конец линейной ДНК. При условии, что специфическая для линейной ДНК экзонуклеаза имеет активность, способную к последовательному гидролизу от 5'-конца или 3'-конца линейной ДНК, не существует конкретных ограничений типа или биологического источника экзонуклеазы. Например, можно использовать RecBCD, экзонуклеазу λ, экзонуклеазу III, экзонуклеазу VIII, экзонуклеазу T5, экзонуклеазу T7 и АТФ-зависимую ДНКазу Plasmid-SafeTM (epicentre), и т.п. Предпочтительная специфическая для линейной ДНК экзонуклеаза представляет собой RecBCD. Экзонуклеазу линейной ДНК можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 0,001 Ед./мкл до 1,0 Ед./мкл, предпочтительно, в рамках диапазона от 0,005 Ед./мкл до 1,0 Ед./мкл, от 0,01 Ед./мкл до 1,0 Ед./мкл, от 0,05 Ед./мкл до 1,0 Ед./мкл, от 0,08 Ед./мкл до 1,0 Ед./мкл или от 0,1 Ед./мкл до 1,0 Ед./мкл, хотя изобретение не ограничено этим диапазоном концентраций. Единица (Ед.) активности фермента экзонуклеазы линейной ДНК представляет собой единицу, показывающую ферментную активность, где количество фермента, необходимое для получения 1 нмоль дезоксирибонуклеотида из линейной ДНК, растворимой в кислоте, в реакции при 37°C в течение 30 минут, считают составляющим 1 Ед.
[0151]
Хеликаза RecG представляет собой фермент, который считают являющимся хеликазой, решающей проблему вторичных структур ДНК, возникающих в результате столкновения между репликационными вилками в ходе терминации реакции удлинения. Не существует конкретных ограничений биологического источника хеликазы RecG, при условии, что фермент имеет активность, сходную с активностью происходящего из E. coli RecG, и например, происходящий из E. coli RecG можно использовать обеспечивающим преимущество образом. Происходящий из E. coli RecG можно включать в форме мономера в реакционный раствор в концентрации в рамках диапазона от 100 нМ (нмоль/л) до 800 нМ (нмоль/л) относительно общего объема реакционного раствора, и, предпочтительно, включать в концентрации в рамках диапазона от 100 нМ до 500 нМ, от 100 нМ до 400 нМ, или от 100 нМ до 300 нМ, и более предпочтительно, включать в концентрации 60 нМ, хотя изобретение не ограничено этой концентрацией. Хеликазу RecG можно использовать в рамках диапазона концентраций, приводящего к единице активности фермента, эквивалентной единице, полученной для диапазона концентраций, указанного выше, для происходящего из E. coli RecG.
[0152]
Специфическая для одноцепочечной ДНК экзонуклеаза представляет собой фермент, который последовательно гидролизует нуклеотид на 5'-конце или 3'-конце одноцепочечной ДНК. При условии, что специфическая для одноцепочечной ДНК экзонуклеаза имеет активность, способную к последовательному гидролизу нуклеотида на 5'-конце или 3'-конце одноцепочечной ДНК, не существует конкретных ограничений типа или биологического источника экзонуклеазы. Например, можно использовать экзонуклеазу I (exo I), RecJ и экзонуклеазу T и т.п. Предпочтительная специфическая для одноцепочечной ДНК экзонуклеаза представляет собой exo I. Специфическую для одноцепочечной ДНК экзонуклеазу можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 0,1 Ед./мкл до 1,0 Ед./мкл, предпочтительно, в рамках диапазона от 0,15 Ед./мкл до 1,0 Ед./мкл, от 0,2 Ед./мкл до 1,0 Ед./мкл, или от 0,2 Ед./мкл до 0,5 Ед./мкл, хотя изобретение не ограничено этим диапазоном концентраций. Единица (Ед.) активности фермента exo I представляет собой единицу, показывающую ферментную активность, где количество фермента, необходимое для получения 10 нмоль дезоксирибонуклеотида из одноцепочечной ДНК, растворимой в кислоте, в реакции при 37°C в течение 30 минут, считают составляющим 1 Ед. Кроме того, единица (Ед.) активности фермента RecJ представляет собой единицу, показывающую ферментную активность, где количество фермента, необходимое для получения 0,05 нмоль дезоксирибонуклеотида из одноцепочечной ДНК, растворимой в кислоте, в реакции при 37°C в течение 30 минут, считают составляющим 1 Ед.
[0153]
Реакционный раствор, используемый в способе RCR II, может также содержать соль аммония. Примеры соли аммония включают сульфат аммония, хлорид аммония и ацетат аммония. Особенно предпочтительные соли аммония включают сульфат аммония и ацетат аммония. Соль аммония можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 0,1 мМ (ммоль/л) до 100 мМ (ммоль/л), предпочтительно, в рамках диапазона от 0,1 мМ до 50 мМ, от 1 мМ до 50 мМ, или от 1 мМ до 20 мМ, и более предпочтительно, в концентрации 4 мМ, хотя изобретение не ограничено этой концентрацией.
[0154]
В тех случаях, когда происходящую из E. coli ДНК-лигазу используют в качестве фермента, имеющего активность ДНК-лигазы во второй группе ферментов, кофактор NAD (никотинамидадениндинуклеотид) также включают в реакционный раствор. NAD можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 0,01 мМ (ммоль/л) до 1,0 мМ (ммоль/л), предпочтительно, в рамках диапазона от 0,1 мМ до 1,0 мМ, или от 0,1 мМ до 0,5 мМ, и более предпочтительно, в концентрации 0,25 мМ, хотя изобретение не ограничено этой концентрацией.
[0155]
Реакционный раствор, используемый в способе RCR II, может также включать восстанавливающее средство. Примеры предпочтительных восстанавливающих средств включают DTT, β-меркаптоэтанол (2-меркаптоэтанол), трис(2-карбоксиэтил)фосфин (TCEP) и глутатион. Предпочтительное восстанавливающее средство представляет собой DTT. Восстанавливающее средство можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 1,0 мМ (ммоль/л) до 15,0 мМ (ммоль/л) и предпочтительно, от 2,0 мМ до 10,0 мМ или от 4,0 мМ до 8,0 мМ.
[0156]
Реакционный раствор, используемый в способе RCR II, может также включать фермент и субстрат для регенерации АТФ. Примеры комбинаций регенерирующего АТФ фермента и субстрата включают комбинацию креатинкиназы и креатинфосфата, и комбинацию пируваткиназы и фосфоенолпирувата. Одним примером регенерирующего АТФ фермента является миокиназа. Предпочтительная комбинация регенерирующего АТФ фермента и субстрата представляет собой комбинацию креатинкиназы и креатинфосфата.
[0157]
Первая, вторая и третья группы ферментов, включенных в реакционный раствор, являются такими, как описано выше в разделе, озаглавленном «2. Первая, вторая и третья группы ферментов».
[0158]
В одном аспекте первая группа ферментов, используемая в способе RCR II, может включать комбинацию фермента, имеющего активность DnaA, одного или нескольких типов нуклеоидных белков, фермента или группы ферментов, имеющих активность ДНК-гиразы, связывающего одноцепочечную ДНК белка (SSB), фермента, имеющего активность хеликазы DnaB, фермента, имеющего активность загрузчика ДНК-хеликазы, фермента, имеющего активность ДНК-праймазы, фермента, имеющего активность фиксации ДНК, и фермента или группы ферментов, имеющих активность ДНК-полимеразы III*. Один или несколько типов нуклеоидных белков могут представлять собой IHF или HU, фермент или группа ферментов, имеющих активность ДНК-гиразы, могут представлять собой комплекс, состоящий из GyrA и GyrB, фермент, имеющий активность хеликазы DnaB, может представлять собой хеликазу DnaB, фермент, имеющий активность загрузчика ДНК-хеликазы, может представлять собой загрузчик хеликазы DnaC, фермент, имеющий активность ДНК-праймазы, может представлять собой праймазу DnaG, фермент, имеющий активность фиксации ДНК, может составлять фиксатор DnaN, и фермент или группа ферментов, имеющих активность ДНК-полимеразы III*, могут представлять собой фермент или группу ферментов, содержащие любой из DnaX, HolA, HolB, HolC, HolD, DnaE, DnaQ и HolE.
[0159]
В другом аспекте, вторая группа ферментов, используемая в способе RCR II, может включать комбинацию фермента, имеющего активность ДНК-полимеразы I, и фермента, имеющего активность ДНК-лигазы. Альтернативно, вторая группа ферментов может включать комбинацию фермента, имеющего активность ДНК-полимеразы I, фермента, имеющего активность ДНК-лигазы, и фермента, имеющего активность РНКазыH.
[0160]
В другом аспекте, третья группа ферментов, используемая в способе RCR II, может включать один или несколько ферментов, выбранных из группы, состоящей из ферментов, имеющих активность топоизомеразы III, и ферментов, имеющих активность топоизомеразы IV. Альтернативно, третья группа ферментов может включать комбинацию фермента, имеющего активность топоизомеразы III и фермент, имеющий активность хеликазы RecQ. Альтернативно, третья группа ферментов может включать комбинацию фермента, имеющего активность топоизомеразы III, фермента, имеющего активность хеликазы RecQ, и фермента, имеющего активность топоизомеразы IV.
[0161]
В одном аспекте, стадию (II-2) можно проводить в эмульсии вода-в-масле. Эмульсию вода-в-масле можно получать посредством добавления минерального масла и поверхностно-активного вещества в реакционную смесь, полученную на стадии (II-1), и перемешивания полученной смеси. Типы и количества минерального масла и поверхностно-активного вещества может подходящим образом выбирать специалист в данной области.
[0162]
Способ RCR II может также включать, после стадии (II-2), стадию разведения раствора по меньшей мере в 5 раз реакционным раствором, не содержащим группы ферментов с первой по третью, и затем поддержания полученного раствора при указанной температуре. Разведение групп ферментов супрессирует любую новую инициацию репликации, однако, позволяет частично завершенным реакциям удлинения репликации, формирования катенана и разделения продолжать прохождение под действием остаточных ферментов. Кроме того, побочные продукты, полученные в результате включения ников или т.п. в ходе реакции, также можно репарировать на этой стадии под действием остаточной лигазы и т.п. Соответственно, можно ожидать, что переход от промежуточных продуктов или побочных продуктов амплификации к конечному продукту можно специфически стимулировать, обеспечивая улучшение выхода кольцевой ДНК, имеющей целевую сверхспиральную структуру.
[0163]
Способ RCR II может также включать, после стадии (II-2), стадию проведения обработки с использованием одного или нескольких типов экзонуклеаз, выбранных из группы, состоящей из специфических для линейной ДНК экзонуклеаз и специфических для одноцепочечной ДНК экзонуклеаз. Посредством проведения обработки с использованием одного или нескольких типов экзонуклеаз, выбранных из группы, состоящей из специфических для линейной ДНК экзонуклеаз и специфических для одноцепочечной ДНК экзонуклеаз, линейную ДНК, представляющую собой побочный продукт, полученный в ходе реакции амплификации, можно разрушать и удалять. Использованные типы и количества одного или нескольких типов экзонуклеаз, выбранных из группы, состоящей из специфических для линейной ДНК экзонуклеаз и специфических для одноцепочечной ДНК экзонуклеаз, может являться таким же, как описано выше. Обработку с использованием одного или нескольких типов экзонуклеаз, выбранных из группы, состоящей из специфических для линейной ДНК экзонуклеаз и специфических для одноцепочечной ДНК экзонуклеаз, можно проводить, например, при 25°C - 40°C в течение 30 минут - 3 часов.
[0164]
Способ RCR II может также включать, после стадии (II-2), стадию проведения обработки ферментами для репарации пропусков. Ферменты для репарации пропусков представляют собой группу ферментов, которые репарируют пропуски, что описывает состояние, в котором один или множество последовательных нуклеотидов отсутствуют в двухцепочечной ДНК, или ники, что описывает состояние, в котором фосфодиэфирная связь между соседними нуклеотидами в двухцепочечной ДНК расщеплена, таким образом, позволяя переход к полной двухцепочечной сверхспиральной ДНК. Посредством проведения обработки ферментами для репарации пропусков, ДНК, содержащую пропуски или ники, полученную в качестве побочных продуктов в ходе реакции амплификации, можно репарировать, получая эффект, улучшающий выход целевого сверхспирального продукта.
[0165]
Не существует конкретных ограничений типа или биологического источника ферментов для репарации пропусков, при условии, что ферменты являются способными к репарации пропусков и ников в двухцепочечной ДНК. Например, можно использовать комбинацию ферментов или группу ферментов, имеющих активность экзонуклеазы III, ДНК-полимеразы I, ДНК-лигазы и ДНК-гиразы. Фермент, имеющий активность экзонуклеазы III, можно использовать в концентрации 5 мЕд./мкл - 100 мЕд./мкл, однако, изобретение не ограничено этой концентрацией. Единица (Ед.) активности фермента экзонуклеазы III представляет собой единицу, показывающую ферментную активность, где количество фермента, необходимое для получения 1 нмоль дезоксирибонуклеотида из двухцепочечной ДНК, растворимой в кислоте, в реакции при 37°C в течение 30 минут, считают составляющим 1 Ед. Каждый из ферментов или группы ферментов, имеющих активность ДНК-полимеразы I, ДНК-лигазы и ДНК-гиразы, можно использовать в концентрации, указанной выше, применительно к вышеупомянутым первой или второй группам ферментов, хотя изобретение не ограничено этими значениями. Обработку с использованием ферментов для репарации пропусков можно проводить, например, при 25°C - 40°C в течение 5 минут - 120 минут, и предпочтительно, в течение 10 минут - 60 минут.
[0166]
В зависимости от цели, способ RCR II может также включать, после стадии (II-2), стадию очистки амплифицированного продукта кольцевой ДНК. Очистку кольцевой ДНК можно проводить подходящим образом, с использованием способов, общеупотребительных для специалиста в данной области.
[0167]
Кольцевую ДНК, которая была амплифицирована с использованием способа RCR II, можно использовать для последующих целей, таких как трансформация, либо в форме реакционной смеси, полученной после реакции, либо в подходящим образом очищенной форме.
[0168]
<Способ RCR III>
В одном варианте осуществления, способ по настоящему изобретению включает следующие стадии:
(III-1) стадия получения реакционной смеси из кольцевой ДНК, представляющей собой матрицу, и реакционного раствора, содержащего:
первую группу ферментов, которая катализирует репликацию кольцевой ДНК,
вторую группу ферментов, которая катализирует реакцию лигирования фрагментов Оказаки и синтезирует две сестринские кольцевые ДНК, формирующие катенан, и
третью группу ферментов, которая катализирует реакцию разделения двух сестринских кольцевых ДНК; и
(III-2) стадия реакции в реакционной смеси, полученной на стадии (III-1), где
кольцевая ДНК содержит последовательность точки начала репликации (точки начала репликации хромосомы (oriC)), которая может связываться с ферментом, имеющим активность DnaA, и также содержит по меньшей мере один тип последовательности, выбранный из группы, состоящей из пары последовательностей ter, каждая из которых вставлена в направлении наружу относительно oriC, и последовательности оснований, узнаваемой XerCD, и
в тех случаях, когда кольцевая ДНК имеет последовательности ter, реакционный раствор со стадии (III-1) также содержит белок, имеющий активность связывания с последовательностями ter и ингибирования репликации, в то время как в тех случаях, когда кольцевая ДНК имеет последовательность оснований, узнаваемую XerCD, реакционный раствор со стадии (III-1) также содержит белок XerCD (см. Патентный документ 7).
[0169]
Способом RCR III реплицируют или амплифицируют кольцевую ДНК. В настоящем описании, репликация кольцевой ДНК обозначает получение молекул, которые являются такими же, как кольцевая ДНК матрицы. Репликацию кольцевой ДНК можно подтверждать по увеличению количества кольцевой ДНК в реакционной смеси после реакции, относительно количества кольцевой ДНК матрицы на старте реакции. Является предпочтительным, чтобы репликация кольцевой ДНК описывала процесс, в котором количество кольцевой ДНК в реакционной смеси относительно количества кольцевой ДНК на старте реакции увеличивается по меньшей мере в 2 раза, 3 раза, 5 раз, 7 раз или 9 раз. Амплификация кольцевой ДНК означает, что репликация кольцевой ДНК проходит таким образом, что количество кольцевой ДНК в реакционной смеси увеличивается экспоненциально, относительно количества кольцевой ДНК матрицы на старте реакции. Соответственно, амплификация кольцевой ДНК представляет собой один аспект репликации кольцевой ДНК. В настоящем описании, амплификация кольцевой ДНК описывает процесс, в котором количество кольцевой ДНК в реакционной смеси, относительно количества кольцевой ДНК, которая функционирует в качестве матрицы на старте реакции, увеличивается по меньшей мере в 10 раз, 50 раз, 100 раз, 200 раз, 500 раз, 1000 раз, 2000 раз, 3000 раз, 4000 раз, 5000 раз или 10000 раз.
[0170]
Кольцевая ДНК, которую смешивают с реакционным раствором, является такой, как описано выше в разделе, озаглавленном «1. Кольцевая ДНК». Не существует конкретных ограничений количества ДНК-матрицы, использованной на реакцию, и например, ДНК-матрицу можно добавлять в реакционный раствор в концентрации, относительно общего объема реакционного раствора на старте реакции, не более, чем 10 нг/мкл, не более, чем 5 нг/мкл, не более, чем 1 нг/мкл, не более, чем 0,8 нг/мкл, не более, чем 0,5 нг/мкл, не более, чем 0,1 нг/мкл, не более, чем 75 пг/мкл, не более, чем 50 пг/мкл, не более, чем 14 пг/мкл, не более, чем 5 пг/мкл, не более, чем 1 пг/мкл, не более, чем 0,67 пг/мкл, не более, чем 0,5 пг/мкл, не более, чем 50 фг/мкл, не более, чем 7,5 фг/мкл, не более, чем 5 фг/мкл, или 0,5 фг/мкл или менее. Кроме того, на старте реакции, одну молекулу кольцевой ДНК на реакцию можно вводить в качестве матрицы и затем использовать в репликации или амплификации.
[0171]
Кольцевая ДНК, которая функционирует в качестве матрицы, используемая в способе RCR III, содержит по меньшей мере одну последовательность, выбранную из группы, состоящей из пары последовательностей ter, каждая из которых вставлена в направлении наружу относительно oriC, и последовательностей оснований, узнаваемых XerCD. В тех случаях, когда кольцевая ДНК имеет последовательности ter, реакционный раствор со стадии (III-1) также содержит белок, имеющий активность связывания с последовательностями ter и ингибирования репликации, в то время как в тех случаях, когда кольцевая ДНК имеет последовательность оснований, узнаваемую XerCD, реакционный раствор со стадии (III-1) также содержит белок XerCD.
[0172]
В качестве одного или нескольких белков, выбранных из группы, состоящей из белков, имеющих активность связывания с последовательностями ter и ингибирования репликации, и белков XerCD, можно использовать коммерчески доступные продукты, или их можно выделять из микроорганизмов или т.п. и затем очищать по необходимости. Выделение ферментов из микроорганизмов и последующую очистку можно проводить подходящим образом с использованием способов, общеупотребительных для специалиста в данной области.
[0173]
Комбинирование последовательностей ter в ДНК и белка, имеющего активность связывания с последовательностями ter и ингибирования репликации, представляет собой механизм для терминации репликации. Этот механизм открыт во множестве типов бактерий, и например, в E. coli известен как система Tus-ter (Hiasa, H., and Marians, K. J., J. Biol. Chem., 1994, 269: 26959 to 26968; Neylon, C., et al., Microbiol. Mol. Biol. Rev., September 2005, pp. 501 to 526) и в бактериях Bacillus известен как система RTP-ter (Vivian, et al., J. Mol. Biol., 2007, 370: 481 to 491). В способе RCR III, с использованием этого механизма, образование мультимеров ДНК в качестве побочных продуктов можно супрессировать. Не существует конкретных ограничений биологического источника комбинации последовательностей ter в ДНК и белка, имеющего активность связывания с последовательностями ter и ингибирования репликации.
[0174]
В одном предпочтительном варианте осуществления, в способе RCR III используют комбинацию последовательностей ter и белка Tus. Последовательности ter, используемые в комбинации с белком Tus, могут представлять собой последовательность, содержащую 5'-GN[A/G][T/A]GTTGTAAC[T/G]A-3' (SEQ ID NO: 23), или более предпочтительно, 5'-G[T/G]A[T/A]GTTGTAAC[T/G]A-3' (SEQ ID NO: 24), 5'-GTATGTTGTAACTA-3' (SEQ ID NO: 25), 5'-AGTATGTTGTAACTAAAG-3' (SEQ ID NO: 26), 5'-GGATGTTGTAACTA-3' (SEQ ID NO: 27), 5'-GTATGTTGTAACGA-3' (SEQ ID NO: 28), 5'-GGATGTTGTAACTA-3' (SEQ ID NO: 29), 5'-GGAAGTTGTAACGA-3' (SEQ ID NO: 30), или 5'-GTAAGTTGTAACGA-3' (SEQ ID NO: 31). Хотя не существует конкретных ограничений источника белка Tus, происходящий из E. coli белок Tus является предпочтительным. Белок Tus можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 1 нМ (нмоль/л) до 200 нМ (нмоль/л), и предпочтительно, в рамках диапазона от 2 нМ до 200 нМ, от 2 нМ до 100 нМ, от 5 нМ до 200 нМ, от 5 нМ до 100 нМ, от 10 нМ до 100 нМ, от 20 нМ до 100 нМ, или от 20 нМ до 80 нМ, хотя изобретение не ограничено этими диапазонами.
[0175]
В другом предпочтительном варианте осуществления, в способе RCR III используют комбинацию последовательностей ter и белка RTP. Последовательности ter, используемые в комбинации с белком RTP, представляют собой последовательности, имеющие длину 23-30 оснований, содержащие 5'-AC[T/A][A/G]ANNNNN[C/T]NATGTACNAAAT-3' (SEQ ID NO: 32), или предпочтительно, содержащие 5'-ACTAATT[A/G]A[A/T]C[T/C]ATGTACTAAAT-3' (SEQ ID NO: 33), 5'-ACTAATT[A/G]A[A/T]C[T/C]ATGTACTAAATTTTCA-3' (SEQ ID NO: 34), 5'-GAACTAATTAAACTATGTACTAAATTTTCA-3' (SEQ ID NO: 35), или 5'-ATACTAATTGATCCATGTACTAAATTTTCA-3' (SEQ ID NO: 36). В тех случаях, когда последовательность, имеющая длину 23-30 оснований, содержащая любую из SEQ ID NO: 10-12 выбрана в качестве последовательности ter, последовательность может иметь идентичность последовательности с SEQ ID NO: 13 или 14 по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 95%. Хотя не существует конкретных ограничений источника белка RTP, белки RTP происходящие из бактерий Bacillus, являются предпочтительными, и белок RTP, происходящий из Bacillus subtilis, является более предпочтительным. Белок Tus можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 1 нМ (нмоль/л) до 200 нМ (нмоль/л), и предпочтительно, в рамках диапазона от 2 нМ до 200 нМ, 2 нМ до 100 нМ, 5 нМ до 200 нМ, 5 нМ до 100 нМ, 10 нМ до 100 нМ, 20 нМ до 100 нМ, или 20 нМ до 80 нМ, хотя изобретение не ограничено этими диапазонами.
[0176]
Применительно к последовательностям ter, выражение «вставлены в направлении наружу относительно oriC» означает, что последовательности ter вставлены в таком направлении, что действие комбинации с белком, имеющим активность связывания с последовательностями ter и ингибирования репликации, позволяет репликацию в направлении наружу от oriC, но не позволяет и терминирует репликацию в направлении к oriC. Соответственно, выражение «пара последовательностей ter, каждая из которых вставлена в направлении наружу относительно oriC», использованное применительно к последовательностям ter, означает, что последовательность, содержащая любую из последовательностей, показанных в SEQ ID NO: 1-14, вставлена в качестве одной последовательности ter с 5'-стороны от oriC, и последовательность, содержащая последовательность, комплементарную любой из последовательностей, показанных в SEQ ID NO: 1-14, вставлена в качестве другой последовательности ter с 3'-стороны от oriC.
[0177]
Последовательности ter могут существовать в любых положениях, при условии, что каждая из пары последовательностей ter вставлена в направлении наружу относительно oriC. Например, пара последовательностей ter может существовать в областях, далеко удаленных от oriC, или может существовать в области, близкой или соседней с обеими сторонами oriC. В тех случаях, когда пара последовательностей ter существует в области, близкой или соседней с обеими сторонами oriC, oriC и пару последовательностей ter можно получать в форме функциональной кассеты, обеспечивающей те преимущества, что введение oriC и пары последовательностей ter в ДНК является более простым, и стоимость получения кольцевой ДНК, используемой в качестве матрицы, можно уменьшать.
[0178]
Комбинация последовательности, узнаваемой XerCD в ДНК, и белка XerCD функционирует в механизме разделения мультимеров ДНК (Ip, S. C. Y., et al., EMBO J., 2003, 22: 6399 to 6407). Белок XerCD представляет собой комплекс XerC и XerD. Известные последовательности, узнаваемые белком XerCD, включают последовательность dif, последовательность cer и последовательность psi (Colloms, et al., EMBO J., 1996, 15(5): 1172 to 1181; Arciszewska, L. K., et al., J. Mol. Biol., 2000, 299: 391 to 403). В способе по настоящему варианту осуществления, с использованием этого механизма, образование мультимеров ДНК в качестве побочных продуктов можно супрессировать. Не существует конкретных ограничений биологического источника комбинации последовательности, узнаваемой XerCD в ДНК, и белка XerCD. Кроме того, известны стимулирующие факторы для XerCD, и например, функцию для dif стимулирует белок FtsK (Ip, S. C. Y., et al., EMBO J., 2003, 22: 6399 to 6407). В одном аспекте, белок FtsK можно включать в реакционный раствор в способе RCR III.
[0179]
Последовательность, узнаваемая XerCD, может представлять собой последовательность, содержащую 5'-GGTGCG[C/T][A/G][T/C]AANNNNNNTTATG[T/G]TAAA[T/C]-3' (SEQ ID NO: 37), 5'-GGTGCG[C/T]A[T/C]AANNNNNNTTATG[T/G]TAAAT-3' (SEQ ID NO: 38), 5'-GGTGCGC[A/G][T/C]AANNNNNNTTATGTTAAA[T/C]-3' (SEQ ID NO: 39), 5'-GGTGCG[C/T][A/G]CAANNNNNNTTATG[T/G]TAAA[T/C]-3' (SEQ ID NO: 40), 5'-GGTGCGCATAANNNNNNTTATGTTAAAT-3' (SEQ ID NO: 41), 5'-GGTGCGTACAANNNNNNTTATGGTAAAT-3' (SEQ ID NO: 42), 5'-GGTGCGCGCAANNNNNNTTATGTTAAAC-3' (SEQ ID NO: 43), 5'-GGTGCGCATAATGTATATTATGTTAAAT-3' (SEQ ID NO: 44/последовательность dif),
5'-GGTGCGTACAAGGGATGTTATGGTAAAT-3' (SEQ ID NO: 45/последовательность cer) или 5'-GGTGCGCGCAAGATCCATTATGTTAAAC-3' (SEQ ID NO: 46/последовательность psi), или последовательность, комплементарную любой из этих последовательностей. Часть от основания 1 до 11 в SEQ ID NO: 15-24 представляет участок связывания XerC, и часть от основания 18 до 28 в SEQ ID NO: 15-24 представляет участок связывания XerD. Поскольку часть от основания 12 до 17 в SEQ ID NO: 15-21 (часть из 6 оснований, указанная посредством NNNNNN) не является областью связывания для XerC или XerD, не существует конкретных ограничений последовательности этой части. Последовательность 12-го - 17-го оснований в SEQ ID NO: 15-21 (часть из 6 оснований, указанная посредством NNNNNN) может иметь идентичность последовательности с последовательностью 12-го - 17-го оснований в SEQ ID NO: 22-24 по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, или по меньшей мере 95%.
[0180]
Белок XerCD, предпочтительно, представляет собой белок XerCD, происходящий из E. coli. Белок XerCD можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 1 нМ (нмоль/л) до 200 нМ (нмоль/л), и предпочтительно, в рамках диапазона от 5 нМ до 200 нМ, 5 нМ до 150 нМ, 10 нМ до 200 нМ, 10 нМ до 150 нМ, 20 нМ до 200 нМ, 20 нМ до 150 нМ или 20 нМ до 100 нМ, хотя изобретение не ограничено этими диапазонами.
[0181]
Последовательность, узнаваемая XerCD, может существовать в любом положении в кольцевой ДНК. Например, последовательность, узнаваемая XerCD, может существовать в области, далеко удаленной от oriC, или может существовать в области, близкой или соседней с oriC. В тех случаях, когда последовательность, узнаваемая XerCD, существует в области, близкой или соседней с oriC, oriC и последовательность, узнаваемую XerCD, можно получать в форме функциональной кассеты, обеспечивающей те преимущества, что введение oriC и последовательности, узнаваемой XerCD, в ДНК является более простым, и стоимость получения кольцевой ДНК, используемой в качестве матрицы, можно уменьшать.
[0182]
В настоящем описании, идентичность (%) между двумя последовательностями оснований можно определять посредством визуальной проверки и математического расчета. Кроме того, идентичность (%) можно также определять с использованием компьютерных программ. Примеры таких компьютерных программ для сравнения последовательностей включают программу BLASTN, которую можно использовать на веб-сайте Национальной библиотеки медицины США (http://www.ncbi.nlm.nih.gov/blast/bl2seq/bls.html) (Altschul et al. (1990) J. Mol. Biol. 215: 403 to 10) (версии 2.2.7), или алгоритм WU-BLAST2.0. Установку стандартных параметров по умолчанию в WU-BLAST2.0 можно проводить с использованием параметров, описанных на следующем сайте в интернет (http://blast.wustl.edu).
[0183]
Первая, вторая и третья группы ферментов, включенных в реакционный раствор, являются такими, как описано выше в разделе, озаглавленном «2. Первая, вторая и третья группы ферментов».
[0184]
В одном аспекте первая группа ферментов, используемая в способе RCR III, может включать комбинацию фермента, имеющего активность DnaA, одного или нескольких типов нуклеоидных белков, фермента или группы ферментов, имеющих активность ДНК-гиразы, связывающего одноцепочечную ДНК белка (SSB), фермента, имеющего активность хеликазы DnaB, фермента, имеющего активность загрузчика ДНК-хеликазы, фермента, имеющего активность ДНК-праймазы, фермента, имеющего активность фиксации ДНК, и фермента или группы ферментов, имеющих активность ДНК-полимеразы III*. Один или несколько типов нуклеоидных белков могут представлять собой IHF или HU, фермент или группа ферментов, имеющих активность ДНК-гиразы, могут представлять собой комплекс, состоящий из GyrA и GyrB, фермент, имеющий активность хеликазы DnaB, может представлять собой хеликазу DnaB, фермент, имеющий активность загрузчика ДНК-хеликазы, может представлять собой загрузчик хеликазы DnaC, фермент, имеющий активность ДНК-праймазы, может представлять собой праймазу DnaG, фермент, имеющий активность фиксации ДНК, может представлять собой фиксатор DnaN, и фермент или группа ферментов, имеющих активность ДНК-полимеразы III*, могут представлять собой фермент или группу ферментов, содержащие любой из DnaX, HolA, HolB, HolC, HolD, DnaE, DnaQ и HolE.
[0185]
В другом аспекте вторая группа ферментов, используемая в способе RCR III, может включать комбинацию фермента, имеющего активность ДНК-полимеразы I, и фермента, имеющего активность ДНК-лигазы. Альтернативно, вторая группа ферментов может включать комбинацию фермента, имеющего активность ДНК-полимеразы I, фермента, имеющего активность ДНК-лигазы, и фермента, имеющего активность РНКазыH.
[0186]
В другом аспекте, третья группа ферментов, используемая в способе RCR III, может включать один или несколько ферментов, выбранных из группы, состоящей из ферментов, имеющих активность топоизомеразы III и ферментов, имеющих активность топоизомеразы IV. Альтернативно, третья группа ферментов может включать комбинацию фермента, имеющего активность топоизомеразы III и фермента, имеющего активность хеликазы RecQ. Альтернативно, третья группа ферментов может включать комбинацию фермента, имеющего активность топоизомеразы III, фермента, имеющего активность хеликазы RecQ, и фермента, имеющего активность топоизомеразы IV.
[0187]
Реакционный раствор может также содержать буферный раствор, АТФ, ГТФ, ЦТФ, УТФ, дНТФ, источник ионов магния и источник ионов щелочного металла.
[0188]
Не существует конкретных ограничений буферного раствора, включенного в реакционный раствор, при условии, что он является пригодным для использования в рамках диапазона от pH 7 до 9, и предпочтительно, при pH 8. Примеры буфера включают трис-HCl, Hepes-KOH, фосфатный буфер, MOPS-NaOH и трицин-HCl. Предпочтительный буфер представляет собой трис-HCl. Не существует конкретных ограничений концентрации буферного раствора, и концентрацию может подходящим образом выбирать специалист в данной области. В случае трис-HCl, например, концентрация буферного раствора, относительно общего объема реакционного раствора, может находиться в рамках диапазона от 10 мМ (ммоль/л) до 100 мМ или от 10 мМ до 50 мМ, или можно выбирать концентрацию 20 мМ.
[0189]
АТФ обозначает аденозин-трифосфат. Концентрация АТФ, содержащегося в реакционном растворе на старте реакции, например, относительно общего объема реакционного раствора, может находиться в рамках диапазона от 0,1 мМ (ммоль/л) до 3 мМ (ммоль/л), находится, предпочтительно, в рамках диапазона от 0,1 мМ до 2 мМ, от 0,1 мМ до 1,5 мМ, или от 0,5 мМ до 1,5 мМ, и более предпочтительно, составляет 1 мМ.
[0190]
ГТФ, ЦТФ и УТФ обозначают гуанозин-трифосфат, цитидин-трифосфат и уридин-трифосфат соответственно. Концентрация каждого из ГТФ, ЦТФ и УТФ, включенных в реакционный раствор на старте реакции, например, относительно общего объема реакционного раствора, может находиться в рамках диапазона от 0,1 мМ (ммоль/л) до 3,0 мМ (ммоль/л) и находится, предпочтительно, в рамках диапазона от 0,5 мМ до 3,0 мМ, или от 0,5 мМ до 2,0 мМ.
[0191]
Кроме того, дНТФ представляет собой общий термин для дезоксиаденозин-трифосфата (дАТФ), дезоксигуанозин-трифосфата (дГТФ), дезоксицитидин-трифосфата (дЦТФ) и дезокситимидин-трифосфата (dTTP). Концентрация дНТФ, включенных в реакционный раствор на старте реакции, например, относительно общего объема реакционного раствора, может быть установлена в рамках диапазона от 0,01 мМ (ммоль/л) до 1 мМ (ммоль/л), находится, предпочтительно, в рамках диапазона от 0,05 мМ до 1 мМ, или от 0,1 мМ до 1 мМ, и более предпочтительно, находится в рамках диапазона от 0,25 мМ до 1 мМ.
[0192]
Источник ионов магния представляет собой вещество, предоставляющее ионы магния (Mg2+) в реакционном растворе. Примеры источника ионов магния включают Mg(OAc)2, MgCl2 и MgSO4. Mg(OAc)2 является предпочтительным источником ионов магния. Концентрация источника ионов магния, включенного в реакционный раствор на старте реакции, относительно общего объема реакционного раствора, может составлять концентрацию, предоставляющую, например, от 5 мМ (ммоль/л) до 50 мМ (ммоль/л) ионов магния, и предпочтительно, 1 мМ ионов магния, в реакционном растворе.
[0193]
Источник ионов щелочного металла представляет собой вещество, предоставляющее ионы щелочного металла в реакционном растворе. Примеры ионов щелочного металла включают ионы натрия (Na+) и ионы калия (K+). Примеры источника ионов щелочного металла включают глутамат калия, аспартат калия, хлорид калия, ацетат калия, глутамат натрия, аспартат натрия, хлорид натрия и ацетат натрия. Предпочтительные источники ионов щелочного металла включают глутамат калия и ацетат калия. Концентрация источника ионов щелочного металла, включенного в реакционный раствор на старте реакции, относительно общего объема реакционного раствора, может составлять концентрацию, предоставляющую, например, по меньшей мере 100 мМ (ммоль/л), предпочтительно, от 100 мМ до 300 мМ, и более предпочтительно, 50 мМ, ионов щелочного металла в реакционном растворе, хотя изобретение не ограничено этой концентрацией. В комбинации с более ранним применением, 150 мМ можно вычитать из вышеуказанной концентрации источника ионов щелочного металла.
[0194]
Реакционный раствор может также содержать ингибитор неспецифической адсорбции белка или ингибитор неспецифической адсорбции нуклеиновой кислоты. Является предпочтительным, чтобы реакционный раствор содержал как ингибитор неспецифической адсорбции белка, так и ингибитор неспецифической адсорбции нуклеиновой кислоты. Включение одного или нескольких ингибиторов неспецифической адсорбции, выбранных из группы, состоящей из ингибиторов неспецифической адсорбции белка и ингибиторов неспецифической адсорбции нуклеиновой кислоты, в реакционный раствор позволяет ингибирование по меньшей мере одного типа неспецифической адсорбции, выбранной из группы, состоящей из адсорбции между белками и адсорбции между белком и кольцевой ДНК, и может также ингибировать адгезию белков и кольцевой ДНК к поверхностям реакционного сосуда, что означает, что можно ожидать улучшения эффективности реакции.
[0195]
Ингибиторы неспецифической адсорбции белка представляют собой белки, не относящиеся к реакции репликации или амплификации в способе по настоящему варианту осуществления. Примеры этих типов белков включают бычий сывороточный альбумин (BSA), лизоцим, желатин, гепарин и казеин. Ингибитор неспецифической адсорбции белка можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, находящейся в рамках диапазона от 0,02 мг/мл до 2,0 мг/мл, предпочтительно, в рамках диапазона от 0,1 мг/мл до 2,0 мг/мл, 0,2 мг/мл до 2,0 мг/мл, или 0,5 мг/мл до 2,0 мг/мл, и более предпочтительно, в концентрации 0,5 мг/мл, хотя изобретение не ограничено этой концентрацией.
[0196]
Ингибиторы неспецифической адсорбции нуклеиновой кислоты представляют собой молекулы нуклеиновой кислоты или родственные нуклеиновой кислоте молекулы, не относящиеся к реакции репликации или амплификации в способе RCR III. Примеры этих типов молекул нуклеиновой кислоты или родственных нуклеиновой кислоте молекул включают тРНК (транспортную РНК), рРНК (рибосомную РНК), мРНК (матричную РНК), гликоген, гепарин, олиго-ДНК, поли(I-C) полиинозин-полицитидин, поли(dI-dC), (полидезоксиинозин-полидезоксицитидин), поли(A) (полиаденин) и поли(дA) (полидезоксиаденин).
[0197]
Ингибитор неспецифической адсорбции нуклеиновой кислоты можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, находящейся в рамках диапазона от 1 нг/мкл до 500 нг/мкл, предпочтительно, в рамках диапазона от 10 нг/мкл до 500 нг/мкл, 10 нг/мкл до 200 нг/мкл, или 10 нг/мкл до 100 нг/мкл, и более предпочтительно, в концентрации 50 нг/мкл, хотя изобретение не ограничено этой концентрацией. В комбинации с более ранним применением, в тех случаях, когда тРНК выбрана в качестве ингибитора неспецифической адсорбции нуклеиновой кислоты, 50 нг/мкл можно вычитать из вышеуказанной концентрации тРНК.
[0198]
Реакционный раствор может также содержать специфическую для линейной ДНК экзонуклеазу или хеликазу RecG. Реакционный раствор предпочтительно, также содержит как специфическую для линейной ДНК экзонуклеазу, так и хеликазу RecG. Посредством включения одного или нескольких веществ, выбранных из группы, состоящей из специфических для линейной ДНК экзонуклеаз и хеликаз RecG, в реакционный раствор, количество линейной ДНК, полученной посредством двухцепочечного расщепления или т.п. в реакции репликации или амплификации, можно уменьшать, получая в результате эффект улучшения выхода целевого сверхспирального продукта.
[0199]
Специфические для линейной ДНК экзонуклеазы представляют собой ферменты, которые последовательно гидролизуют от 5'-конца или 3'-конца линейной ДНК. При условии, что специфическая для линейной ДНК экзонуклеаза имеет активность, способную к последовательному гидролизу от 5'-конца или 3'-конца линейной ДНК, не существует конкретных ограничений типа или биологического источника экзонуклеазы. Например, можно использовать RecBCD, экзонуклеазу λ, экзонуклеазу III, экзонуклеазу VIII, экзонуклеазу T5, экзонуклеазу T7 и АТФ-зависимую ДНКазу Plasmid-SafeTM (epicentre) и т.п.. Предпочтительная специфическая для линейной ДНК экзонуклеаза представляет собой RecBCD. Специфическую для линейной ДНК экзонуклеазу можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 0,01 Ед./мкл до 1,0 Ед./мкл, и предпочтительно, в рамках диапазона от 0,08 Ед./мкл до 1,0 Ед./мкл, или от 0,1 Ед./мкл до 1,0 Ед./мкл, хотя изобретение не ограничено этим диапазоном концентраций. Единица (Ед.) активности фермента экзонуклеазы линейной ДНК представляет собой единицу, показывающую ферментную активность, где количество фермента, необходимое для получения 1 нмоль дезоксирибонуклеотида из линейной ДНК, растворимой в кислоте, в реакции при 37°C в течение 30 минут, считают составляющим 1 Ед.
[0200]
Хеликаза RecG представляет собой фермент, который считают являющимся хеликазой, решающей проблему вторичных структур ДНК, возникающих в результате столкновения между репликационными вилками в ходе терминации реакции удлинения. Не существует конкретных ограничений биологического источника хеликазы RecG, при условии, что фермент имеет активность, сходную с активностью происходящего из E. coli RecG, и например, происходящий из E. coli RecG можно использовать обеспечивающим преимущество образом. Происходящий из E. coli RecG можно включать в форме мономера в реакционный раствор в концентрации в рамках диапазона от 100 нМ (нмоль/л) до 800 нМ (нмоль/л) относительно общего объема реакционного раствора, и, предпочтительно, включать в концентрации в рамках диапазона от 100 нМ до 500 нМ, от 100 нМ до 400 нМ, или от 100 нМ до 300 нМ, и более предпочтительно, включать в концентрации 60 нМ, хотя изобретение не ограничено этой концентрацией. Хеликазу RecG можно использовать в рамках диапазона концентраций, приводящего к единице активности фермента, эквивалентной единице, полученной для диапазона концентраций, указанного выше, для происходящего из E. coli RecG.
[0201]
Реакционный раствор может также содержать соль аммония. Примеры соли аммония включают сульфат аммония, хлорид аммония и ацетат аммония. Особенно предпочтительная соль аммония представляет собой сульфат аммония. Соль аммония можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 0,1 мМ (ммоль/л) до 100 мМ (ммоль/л), предпочтительно, в рамках диапазона от 0,1 мМ до 50 мМ, от 1 мМ до 50 мМ, или от 1 мМ до 20 мМ, и более предпочтительно, в концентрации 4 мМ, хотя изобретение не ограничено этой концентрацией.
[0202]
В тех случаях, когда происходящую из E. coli ДНК-лигазу используют в качестве фермента, имеющего активность ДНК-лигазы во второй группе ферментов, кофактор NAD (никотинамидадениндинуклеотид) также включают в реакционный раствор. NAD можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 0,01 мМ (ммоль/л) до 1,0 мМ, предпочтительно, в рамках диапазона от 0,1 мМ до 1,0 мМ, или от 0,1 мМ до 0,5 мМ, и более предпочтительно, в концентрации 0,25 мМ, хотя изобретение не ограничено этой концентрацией.
[0203]
Реакционный раствор, используемый в способе RCR III, может также включать восстанавливающее средство. Примеры предпочтительных восстанавливающих средств включают DTT, β-меркаптоэтанол и глутатион. Предпочтительное восстанавливающее средство представляет собой DTT.
[0204]
Реакционный раствор, используемый в способе RCR III, может также включать фермент и субстрат для регенерации АТФ. Примеры комбинаций регенерирующего АТФ фермента и субстрата включают комбинацию креатинкиназы и креатинфосфата, и комбинацию пируваткиназы и фосфоенолпирувата. Одним примером регенерирующего АТФ фермента является миокиназа. Предпочтительная комбинация регенерирующего АТФ фермента и субстрата представляет собой комбинацию креатинкиназы и креатинфосфата.
[0205]
Вышеупомянутая стадия (III-2) представляет собой стадию реакции в реакционной смеси, полученной на стадии (III-1). Стадия (III-2) может представлять собой, например, стадию реакции в реакционной смеси в рамках диапазона от 15°C до 80°C, от 15°C до 50°C, или от 15°C до 40°C. Стадия (III-2) представляет собой, предпочтительно, стадию поддержания температуры в изотермических условиях. Не существует конкретных ограничений изотермических условий, при условии, что реакция репликации ДНК может проходить, и например, температуру можно устанавливать на постоянную температуру в рамках диапазона от 20 до 80°C, представляющую собой оптимальную температуру для ДНК-полимеразы, можно устанавливать на постоянную температуру в рамках диапазона от 25°C до 50°C, можно устанавливать на постоянную температуру в рамках диапазона от 25°C до 40°C, или можно устанавливать на приблизительно 30°C - 33°C. В настоящем описании, такие выражения как «поддерживать температуру в изотермических условиях» и «проводить реакцию при постоянной температуре» означают, что температуру поддерживают в рамках вышеуказанного диапазона температур в ходе реакции. Время, в течение которого поддерживают температуру, можно устанавливать подходящим образом в соответствии с количеством реплицированного продукта или амплифицированного продукта кольцевой ДНК, представляющего собой мишень, и например, можно устанавливать на время в рамках диапазона от 1 до 24 часов, или от 16 до 21 часа.
[0206]
Альтернативно, стадию, на которой реакционную смесь, полученную на стадии (III-1), инкубируют при цикле температур, в котором повторяют инкубацию при 30°C или выше и инкубацию при 27°C или ниже, можно включать в качестве вышеуказанной стадии (III-2). Не существует конкретных ограничений инкубации при 30°C или выше, при условии, что температура позволяет инициацию репликации кольцевой ДНК, содержащей oriC, и например, температура может находиться в рамках диапазона от 30°C до 80°C, от 30°C до 50°C, от 30° до 40°C, или может составлять 37°C. Не существует конкретных ограничений длительности инкубации при 30°C или выше, и время на один цикл может составлять от 10 секунд до 10 минут, или может составлять 1 минуту. Не существует конкретных ограничений инкубации при 27°C или ниже, при условии, что температура супрессирует инициацию репликации, но позволяет проходить реакциям удлинения ДНК, и например, температура может находиться в рамках диапазона от 10°C до 27°C, от 16°C до 25°C, или может составлять 24°C. Не существует конкретных ограничений инкубации, проводимой при 27°C или ниже, но время, предпочтительно, устанавливают в соответствии с длиной кольцевой ДНК, подвергаемой амплификации, и например, время на один цикл может находиться в рамках диапазона от 1 секунд до 10 секунд на 1000 оснований. Количество циклов для цикла температур не является конкретно ограниченным, и может составлять от 10 циклов до 50 циклов, от 20 циклов до 45 циклов, от 25 циклов до 45 циклов, или может составлять 40 циклов.
[0207]
В зависимости от цели, способ RCR III может также включать, после вышеуказанной стадии поддержания температуры реакционной смеси в изотермических условиях, стадию очистки реплицированного продукта или амплифицированного продукта кольцевой ДНК. Очистку кольцевой ДНК можно проводить подходящим образом с использованием способов, общеупотребительных для специалиста в данной области.
[0208]
Кольцевую ДНК, которая была реплицирована или амплифицирована с использованием способа RCR III, можно использовать для последующих целей, таких как трансформация, либо в форме реакционной смеси, полученной после реакции, либо в подходящим образом очищенной форме.
[0209]
<Способ RCR IV>
Известно, что, сходным образом с комбинацией XerCD и dif, использование комбинации Cre и последовательности узнавания loxP может управлять разделением мультимеров ДНК (Ip, S. C. Y., et al., EMBO J., 2003, 22: 6399 to 6407). Авторы настоящего изобретения открыли, что даже с использованием комбинации фермента для разделения мультимеров ДНК и его последовательности узнавания вместо комбинации XerCD и dif в способе RCR III, образование мультимеров ДНК в качестве побочных продуктов можно супрессировать.
[0210]
В одном варианте осуществления, настоящее изобретение включает следующие стадии:
(IV-1) стадия получения реакционной смеси из кольцевой ДНК, представляющей собой матрицу, и реакционного раствора, содержащего:
первую группу ферментов, которая катализирует репликацию кольцевой ДНК,
вторую группу ферментов, которая катализирует реакцию лигирования фрагментов Оказаки и синтезирует две сестринские кольцевые ДНК, формирующие катенан, и
третью группу ферментов, которая катализирует реакцию разделения двух сестринских кольцевых ДНК; и
(IV-2) стадия реакции в реакционной смеси, полученной на стадии (IV-1), где
кольцевая ДНК содержит последовательность точки начала репликации (точки начала репликации хромосомы (oriC)), которая может связываться с ферментом, имеющим активность DnaA, и также содержит по меньшей мере один тип последовательности, выбранный из группы, состоящей из пары последовательностей ter, каждая из которых вставлена в направлении наружу относительно oriC, и последовательности оснований, узнаваемой ферментом для разделения мультимеров ДНК, и
в тех случаях, когда кольцевая ДНК имеет последовательности ter, реакционный раствор со стадии (IV-1) также содержит белок, имеющий активность связывания с последовательностями ter и ингибирования репликации, в то время как в тех случаях, когда кольцевая ДНК имеет последовательность оснований, узнаваемую ферментом для разделения мультимеров ДНК, реакционный раствор со стадии (IV-1) также содержит фермент для разделения мультимеров ДНК (см. Патентный документ 7).
[0211]
Иными словами, способ RCR IV представляет собой способ, в котором «XerCD» и «последовательность оснований, узнаваемая XerCD» из способа RCR III расширены до «фермента для разделения мультимеров ДНК» и «последовательности оснований, узнаваемой ферментом для разделения мультимеров ДНК» соответственно. Соответственно, описания, описанные выше в разделе, озаглавленном <Способ RCR III>, для различных конфигураций способа RCR III, можно также применять к способу RCR IV.
[0212]
Фермент для разделения мультимеров ДНК представляет собой фермент, который, посредством вызова генетической рекомбинации, может управлять разделением мультимеров ДНК. Фермент для сайт-специфической рекомбинации, который может узнавать специфическую последовательность оснований и вызывать генетическую рекомбинацию в участке этой последовательности оснований, можно использовать в качестве фермента для разделения мультимеров ДНК. специфическая последовательность оснований, узнаваемая ферментом для разделения мультимеров ДНК, обозначена как «последовательность оснований, узнаваемая ферментом для разделения мультимеров ДНК». Посредством проведения генетической рекомбинации с использованием комбинации фермента для разделения мультимеров ДНК и последовательности оснований, узнаваемой ферментом для разделения мультимеров ДНК, мультимеры ДНК можно разделять. В способе RCR IV, с использованием этого механизма, образование мультимеров ДНК в качестве побочных продуктов можно супрессировать. В качестве фермента для разделения мультимеров ДНК можно использовать коммерчески доступные продукты, или его можно выделять из микроорганизмов или т.п. и затем очищать по необходимости. Выделение фермента из микроорганизма и последующую очистку можно проводить подходящим образом с использованием способов, общеупотребительных для специалиста в данной области.
[0213]
Примеры комбинации ферментов для разделения мультимеров ДНК и последовательности оснований, узнаваемой ферментом для разделения мультимеров ДНК, включают XerCD и последовательность dif; Cre и последовательность loxP (Siegel, R. W., et al.., FEBS Lett., 2001, 499(1-2): 147 to 153; Araki, K., et al., Nucleic Acids Res.: 1997, 25(4): 868 to 872); происходящий из почкующихся дрожжей (Saccharomyces verevisiae) рекомбинантный фермент FLP и последовательность FRT (Broach, J. R., et al., Cell, 1982, 29(l): 227 to 234); происходящий из бактериофага D6 рекомбинантный фермент DreO и последовательность rox (Anastassiadis, K., et al., Dis. Model. Meeh., 2009, 2: 508 to 515); происходящий из Zygosacchromyces rouxii рекомбинантный фермент R и последовательность RS (Araki, H., et al., J. Mol. Biol., 1985, 182(2): 191 to 203); и рекомбинантный фермент серинового семейства (например, Gin, γδ, Tn3 и Hin) и его последовательность узнавания (Smith, M. C., et al., Mol. Microbiol., 2002, 44: 299), хотя изобретение не ограничено этими комбинациями.
[0214]
XerCD и последовательность dif являются такими, как описано выше в разделе, озаглавленном <Способ RCR III>.
[0215]
Не существует конкретных ограничений биологического источника комбинации Cre и последовательности loxP. Cre, предпочтительно, представляет собой происходящий из бактериофага P1 белок Cre. Cre можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 0,01 мЕд./мкл до 200 мЕд./мкл, и предпочтительно, в рамках диапазона от 0,1 мЕд./мкл до 150 мЕд./мкл, от 0,1 мЕд./мкл до 100 мЕд./мкл, от 0,5 мЕд./мкл до 100 мЕд./мкл, от 0,5 мЕд./мкл до 80 мЕд./мкл, от 0,1 мЕд./мкл до 50 мЕд./мкл, от 1 мЕд./мкл до 50 мЕд./мкл или от 1 мЕд./мкл до 30 мЕд./мкл, хотя изобретение не ограничено этими диапазонами.
[0216]
Последовательность loxP, узнаваемая Cre, может представлять собой последовательность, содержащую консенсус loxP, представленный 5'-ATAACTTCGTATAGCATACATTATACGAAGTTAT-3' (SEQ ID NO: 47), мутантную последовательность loxP, представленную 5'-ATAACTTCGTATAGtATACATTATACGAAGTTAT-3' (SEQ ID NO: 48/lox511), 5'-ATAACTTCGTATAGgATACtTTATACGAAGTTAT-3' (SEQ ID NO: 49/lox2272), 5'-ATAACTTCGTATAtacctttcTATACGAAGTTAT-3' (SEQ ID NO: 50/loxFAS), 5'-ATAACTTCGTATAGCATACATTATACGAAcggta-3' (SEQ ID NO: 51/lox RE) или 5'-taccgTTCGTATAGCATACATTATACGAAGTTAT-3' (SEQ ID NO: 52/lox LE) (где каждая буква нижнего регистра показывает мутантное основание относительно консенсуса), или последовательность, комплементарную любой из этих последовательностей.
[0217]
Происходящий из почкующихся дрожжей (Saccharomyces verevisiae) рекомбинантный фермент FLP можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 1 нМ (нмоль/л) до 200 нМ (нмоль/л), и предпочтительно, в рамках диапазона от 5 нМ до 200 нМ, от 5 нМ до 150 нМ, от 10 нМ до 200 нМ, от 10 нМ до 150 нМ, от 20 нМ до 200 нМ, от 20 нМ до 150 нМ или от 20 нМ до 100 нМ, хотя изобретение не ограничено этими диапазонами. Последовательность FRT, узнаваемая FLP, может представлять собой последовательность, содержащую 5'-GAAGTTCCTATTCTCTAGAAAGTATAGGAACTTC-3' (SEQ ID NO: 53), или комплементарную ей последовательность.
[0218]
Происходящий из бактериофага D6 рекомбинантный фермент DreO можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 1 нМ (нмоль/л) до 200 нМ (нмоль/л), и предпочтительно, в рамках диапазона от 5 нМ до 200 нМ, от 5 нМ до 150 нМ, от 10 нМ до 200 нМ, от 10 нМ до 150 нМ, от 20 нМ до 200 нМ, от 20 нМ до 150 нМ или от 20 нМ до 100 нМ, хотя изобретение не ограничено этими диапазонами. Последовательность rox, узнаваемая DreO, может представлять собой последовательность, содержащую 5'-TAACTTTAAATAATGCCAATTATTTAAAGTTA-3' (SEQ ID NO: 54), или комплементарную ей последовательность.
[0219]
Происходящий из Zygosacchromyces rouxii рекомбинантный фермент R можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 1 нМ (нмоль/л) до 200 нМ (нмоль/л), и предпочтительно, в рамках диапазона от 5 нМ до 200 нМ, от 5 нМ до 150 нМ, от 10 нМ до 200 нМ, от 10 нМ до 150 нМ, от 20 нМ до 200 нМ, от 20 нМ до 150 нМ или от 20 нМ до 100 нМ, хотя изобретение не ограничено этими диапазонами. Последовательность RS, узнаваемая ферментом R, может представлять собой последовательность, содержащую последовательность, описанную в Araki, H. et al. (J. Mol. Biol., 1985, 182(2): 191 to 203), или комплементарную ей последовательность.
[0220]
Рекомбинантный фермент серинового семейства (γδ, Tn3, Gin и Hin) можно включать в реакционный раствор в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 1 нМ (нмоль/л) до 200 нМ (нмоль/л) и предпочтительно, в рамках диапазона от 5 нМ до 200 нМ, от 5 нМ до 150 нМ, от 10 нМ до 200 нМ, от 10 нМ до 150 нМ, от 20 нМ до 200 нМ, от 20 нМ до 150 нМ, или от 20 нМ до 100 нМ, хотя изобретение не ограничено этими диапазонами. Кроме того, каждое из γδ и Tn3, и их последовательности узнавания res, может представлять собой последовательность, содержащую последовательность, описанную в Grindley N. D. F. et al. (Cell, 1982, 30: 19 to 27) или комплементарную ей последовательность. Кроме того, каждое из Gin и его последовательности узнавания может представлять собой последовательность, содержащую последовательность, описанную в Kahmann. R. et al. (Cell, 1985, 41: 771 to 780), или комплементарную ей последовательность. Кроме того, каждое из Hin и его последовательности узнавания может представлять собой последовательность, содержащую последовательность, описанную в Glasgow. A. C. et al. (J. Biol. Chem., 1989, 264: 10072 to 10082), или комплементарную ей последовательность.
[0221]
Последовательность, узнаваемая ферментом для разделения мультимеров ДНК, может существовать в любом положении в кольцевой ДНК. Например, последовательность, узнаваемая ферментом для разделения мультимеров ДНК, может существовать в области, близкой или соседней с oriC, или может существовать в области, далеко удаленной от oriC.
[0222]
<Способ RCR V]
В одном варианте осуществления, способ по настоящему изобретению включает следующие стадии:
(V-1) стадия получения кольцевой ДНК, содержащей oriC, посредством:
добавления транспозона oriC и транспозазы в буферный раствор для формирования транспосомы oriC, где транспозон oriC представляет собой линейную ДНК, содержащую последовательность точки начала репликации (точки начала репликации хромосомы (oriC)), которая может связываться с ферментом, имеющим активность DnaA, и последовательности внешнего конца (OE) на обоих концах последовательности точки начала репликации;
и реакции транспосомы oriC с кольцевой ДНК, которая не содержит oriC, в буферном растворе, для осуществления реакции переноса;
(V-2) стадия получения реакционной смеси из кольцевой ДНК, содержащей oriC, полученной на стадии (V-1), и реакционного раствора, содержащего:
первую группу ферментов, которая катализирует репликацию кольцевой ДНК,
вторую группу ферментов, которая катализирует реакцию лигирования фрагментов Оказаки и синтезирует две сестринские кольцевые ДНК, формирующие катенан, и
третью группу ферментов, которая катализирует реакцию разделения двух сестринских кольцевых ДНК; и
(V-3) стадия реакции в реакционной смеси, полученной на стадии (V-2) (см. Патентный документ 7).
[0223]
Хотя и без ограничения теорией, способ RCR V представляет собой способ получения кольцевой ДНК, содержащей oriC, с использованием транспозона для введения oriC в кольцевую ДНК, которая не содержит oriC, и затем репликации или амплификации этой кольцевой ДНК, содержащей oriC. Определения применительно к репликации и амплификации кольцевой ДНК являются такими, как описано выше применительно к способу RCR III.
[0224]
Кольцевая ДНК, содержащая oriC, которую смешивают с реакционным раствором, является такой, как описано выше в разделе, озаглавленном «1. Кольцевая ДНК». Количество кольцевой ДНК, содержащей oriC, которое используют на реакцию, является таким, как описано выше для количества ДНК-матрицы в способе RCR III.
[0225]
Кроме того, описания групп ферментов, включенных в реакционный раствор, и других компонентов, которые можно включать в реакционный раствор, являются такими же, как в способе RCR III. Кроме того, вышеуказанную стадию (V-3) проводят таким же способом, как стадию (III-2) в способе RCR III. Тот факт, что способ RCR V может также включать стадию очистки реплицированного продукта или амплифицированного продукта кольцевой ДНК, и использование кольцевой ДНК, которая была реплицирована или амплифицирована с использованием способа RCR V, также являются такими же, как описано для способа RCR III.
[0226]
Последовательности OE на обоих концах транспозона oriC могут представлять собой любые последовательности, известные специалисту в данной области как последовательности, узнаваемые транспозазой, и могут быть использованы в качестве последовательностей OE. В предпочтительном варианте осуществления, последовательность OE содержит последовательность, показанную в SEQ ID NO: 55 (5'-CTGTCTCTTATACACATCT-3') или комплементарную ей последовательность, где последовательность OE, содержащая последовательность, показанную в SEQ ID NO: 55, вставлена на 5'-конце линейной ДНК на стадии (1), и последовательность OE, содержащая последовательность, комплементарную последовательности, показанной в SEQ ID NO: 55, вставлена на 3'-конце линейной ДНК.
[0227]
Концентрация транспозона oriC, использованного для формирования транспосомы oriC на вышеуказанной стадии (V-1), относительно общего объема реакционного раствора, может находиться в рамках диапазона от 20 нМ (нмоль/л) до 200 нМ (нмоль/л), и составляет, предпочтительно, от 40 нМ до 160 нМ.
[0228]
Не существует конкретных ограничений биологического источника транспозазы, при условии, что она представляет собой фермент, который узнает последовательность OE, формирует транспосому и переносит транспозон ДНК в кольцевую ДНК, однако, например, происходящую из E. coli транспозазу можно использовать обеспечивающим преимущество образом. Высоко активный мутантный (E54K, L372P) белок Tn5 является особенно предпочтительным (Goryshin, I. Y., and Reznikoff, W. S., J. Biol. Chem., 1998, 273: 7367 to 7374). В качестве транспозазы можно использовать коммерчески доступный продукт, или его можно выделять из микроорганизмов или т.п., и затем очищать по необходимости. Выделение из микроорганизмов и последующую очистку можно проводить подходящим образом с использованием способов, общеупотребительных для специалиста в данной области. В тех случаях, когда высоко активный мутантный (E54K, L372P) белок Tn5 используют в качестве транспозазы, концентрация белка, использованного для формирования транспосомы oriC на вышеуказанной стадии (V-1), относительно общего объема реакционного раствора, может находиться в рамках диапазона от 50 нМ (нмоль/л) до 200 нМ (нмоль/л), и находится, предпочтительно, в рамках диапазона от 80 нМ до 150 нМ.
[0229]
Не существует конкретных ограничений буферного раствора, используемого на стадии (V-1), при условии, что он является пригодным для использования в рамках диапазона pH от 6 до 9, и предпочтительно, при pH 7,5. Примеры буфера включают трис-ацетат (трис-OAc), трис-HCl, Hepes-KOH, фосфатный буфер, MOPS-NaOH и трицин-HCl. Предпочтительные буферы включают трис-OAc и трис-HCl. Не существует конкретных ограничений концентрации буферного раствора, и концентрацию может подходящим образом выбирать специалист в данной области, однако, в случае, например, трис-OAc или трис-HCl, концентрацию буферного раствора, относительно общего объема реакционного раствора, можно выбирать в рамках диапазона от 10 мМ (ммоль/л) до 100 мМ, или от 10 мМ до 50 мМ, или она может составлять 20 мМ.
[0230]
На стадии (V-1), стадию формирования транспосомы oriC проводят посредством поддержания температуры при приблизительно 30°C в течение приблизительно 30 минут.
[0231]
Реакцию переноса со стадии (V-1) проводят при оптимальной температуре для транспозазы, например, 37°C. Время, необходимое для реакции переноса может подходящим образом выбирать специалист в данной области, и например, оно может составлять приблизительно 15 минут. Кроме того, в реакцию переноса на стадии (V-1), тРНК можно добавлять. Концентрацию добавленной тРНК в реакции переноса на стадии (v-1), например, относительно общего объема реакционного раствора, можно выбирать от в рамках диапазона от 10 нг/мкл до 200 нг/мкл, или от 30 нг/мкл до 100 нг/мкл, или она может составлять 50 нг/мкл.
[0232]
В одном аспекте, кольцевая ДНК, содержащая oriC, на стадии (V-2) может дополнительно содержать по меньшей мере один тип последовательности, выбранный из группы, состоящей из пары последовательностей ter, каждая из которых вставлена в направлении наружу относительно oriC, и последовательности оснований, узнаваемой ферментом для разделения мультимеров ДНК, таким как XerCD или Cre. В таких случаях, когда кольцевая ДНК имеет последовательности ter, реакционный раствор на вышеуказанной стадии (V-2) также содержит белок, имеющий активность связывания с последовательностями ter и ингибирования репликации, в то время как, когда кольцевая ДНК имеет последовательность оснований, узнаваемую ферментом для разделения мультимеров ДНК, таким как XerCD или Cre, реакционный раствор со стадии (V-2) также содержит фермент для разделения мультимеров ДНК, такой как XerCD или Cre.
[0233]
Альтернативно, в другом аспекте, по меньшей мере один тип последовательности, выбранный из группы, состоящей из пары последовательностей ter, каждая из которых вставлена в направлении наружу относительно oriC, и последовательности оснований, узнаваемой ферментом для разделения мультимеров ДНК, таким как XerCD или Cre, можно получать таким образом, чтобы они содержали часть транспозона oriC, что означает, что по меньшей мере один тип последовательности, выбранный из группы, состоящей из пары последовательностей ter и последовательности оснований, узнаваемой ферментом для разделения мультимеров ДНК, таким как XerCD или Cre, можно также вводить в кольцевую ДНК с использованием транспозона. Иными словами, в этом аспекте, линейная ДНК на стадии (V-1) также содержит по меньшей мере один тип последовательности, выбранный из группы, состоящей из пары последовательностей ter, каждая из которых вставлена в направлении наружу относительно oriC, и последовательности оснований, узнаваемой ферментом для разделения мультимеров ДНК, таким как XerCD или Cre, где, когда линейная ДНК имеет последовательности ter, реакционный раствор на стадии (V-2) также содержит белок, имеющий активность связывания с последовательностями ter и ингибирования репликации, в то время как, когда кольцевая ДНК имеет последовательность оснований, узнаваемую ферментом для разделения мультимеров ДНК, таким как XerCD или Cre, реакционный раствор со стадии (V-2) также содержит белок XerCD.
[0234]
В этом случае, определения и описания по меньшей мере для одного типа последовательности, выбранного из группы, состоящей из пары последовательностей ter, каждая из которых вставлена в направлении наружу относительно oriC, и последовательности оснований, узнаваемой ферментом для разделения мультимеров ДНК, таким как XerCD или Cre, и по меньшей мере для одного типа материала, выбранного из группы, состоящей из белка, имеющего активность связывания с последовательностями ter и ингибирования репликации, и фермента для разделения мультимеров ДНК, такого как XerCD или Cre, являются такими, как подробно описано выше применительно к способу RCR III или способу RCR IV.
[0235]
В одном аспекте способ RCR V может также включать стадию (V-4) удаления транспозона oriC из реплицированной или амплифицированной кольцевой ДНК в продукте реакции со стадии (V-3).
[0236]
Стадия удаления транспозона oriC может включать обработку транспозазой в концентрации, относительно общего объема реакционного раствора, в рамках диапазона от 0,1 нМ (нмоль/л) до 30 нМ (нмоль/л), предпочтительно, от 1 нМ до 20 нМ, и более предпочтительно, от 3 нМ до 10 нМ, и обработку для перевода конца ДНК в одиночную цепь с использованием зависимой от линейной двухцепочечный ДНК экзонуклеазы одноцепочечной ДНК, такой как ExoIII. Буферный раствор, используемый в обработке транспозазой, может представлять собой буферный раствор, используемый на стадии (V-1). Буферный раствор, используемый в обработке экзонуклеазой одноцепочечной ДНК, может представлять собой буферный раствор любого состава, который обеспечивает условия, в которых может действовать экзонуклеаза одноцепочечной ДНК.
[0237]
Кроме того, стадия удаления транспозона oriC может также включать обработку с использованием рестрикционного фермента, соответствующего участку для рестрикционного фермента, содержащегося в последовательности транспозона oriC. Целью этой обработки является специфическое расщепление транспозона oriC. Соответственно, в этом случае, выбирают рестрикционный фермент, соответствующий участку для рестрикционного фермента, включенному в транспозон oriC, но не включенному ни в какую область вне области транспозона oriC в реплицированной или амплифицированной кольцевой ДНК. CRISPR-Cas9 можно использовать вместо рестрикционного фермента для двухцепочечного расщепления, которое является специфическим для области, содержащейся в транспозоне oriC. В таком случае, последовательность, специфическая для области, содержащейся в транспозоне oriC, обозначена как направляющая РНК.
[0238]
В другом варианте осуществления, стадию (2) по настоящему изобретению можно проводить посредством амплификации по типу катящегося кольца (также обозначенной как «способ RCA»).
[0239]
Способ RCA представляет собой способ амплификации кольцевой ДНК с использованием ДНК-полимеразы, имеющей активность замены цепи, и первого и второго праймера. Способ RCA можно осуществлять с использованием общепринятых способов, и например, можно осуществлять в соответствии со следующим способом. Сначала, первый праймер гибридизуют с кольцевой ДНК, и затем используют в качестве точки начала для проведения реакции удлинения с использованием ДНК-полимеразы, имеющей активность замены цепи. Даже когда ДНК-полимераза, имеющая активность замены цепи, достигает точки начала полимеразной реакции в кольцевой ДНК, синтез продолжается, в то время как уже синтезированная цепь открепляется. В результате, одноцепочечную ДНК, в которой последовательность ДНК одного витка исходной кольцевой ДНК повторяющимся образом соединена с этой же последовательностью, получают в качестве амплифицированного продукта. Второй праймер гибридизуют с этой одноцепочечной ДНК. Множество вторых праймеров можно гибридизовать с одной одноцепочечной ДНК. Посредством проведения реакций удлинения от этого множества вторых праймеров с использованием ДНК-полимеразы, имеющей активность замены цепи, синтез комплементарной цепи продолжается, в то время как ДНК, синтезированная от второго праймера, гибридизованного в вышележащей локализации, открепляет ДНК, синтезированную от второго праймера, гибридизованного в нижележащей локализации. Затем первый праймер гибридизуется с одноцепочечной ДНК, синтезированной от второго праймера, и происходит новая реакция репликации. Таким образом, последовательность исходной кольцевой ДНК амплифицируют экспоненциально, и получают мультимеры ДНК, в которых исходная кольцевая последовательность ДНК соединена повторяющимся образом. Посредством расщепления этих мультимеров с использованием подходящего фермента для расщепления ДНК, и проведения циркуляризации с использованием ДНК-лигазы, можно получать мономерные реплицированные продукты исходной кольцевой ДНК. Мономерные реплицированные продукты исходной кольцевой ДНК можно также получать посредством циркуляризации мультимеров ДНК с использованием системы сайт-специфической рекомбинации, такой как Cre-loxP.
[0240]
«Первый праймер» представляет собой праймер, который связывается с кольцевой ДНК-мишенью, в то время как «второй праймер» представляет собой праймер, который связывается с последовательностью, комплементарной кольцевой ДНК, с которой связывается первый праймер. Случайные праймеры можно использовать в качестве первого и второго праймеров. Длина праймеров, как правило, составляет приблизительно 6-9 оснований.
[0241]
Общепринятые ферменты можно использовать в качестве ДНК-полимеразы, имеющей активность замены цепи, и примеры включают ДНК-полимеразу бактериофага Phi29, ДНК-полимеразу Bst, ДНК-полимеразу Csa и ДНК-полимеразу 96-7. Можно использовать также коммерчески доступные ферменты. Условия реакции можно устанавливать подходящим образом в соответствии с ДНК-полимеразой, которую используют.
[0242]
II. Набор для редактирования ДНК в бесклеточной системе
Настоящее изобретение также относится к набору, содержащему компоненты, необходимые для введения делеции, замены или добавления в участке-мишени ДНК в бесклеточной системе, и компоненты, необходимые для амплификации, в бесклеточной системе, ДНК, в которую введены делеция, замена или добавление.
[0243]
Компоненты, необходимые для введения делеции, замены или добавления в участке-мишени ДНК, меняются в зависимости от способов, используемых для осуществления способа по настоящему изобретению, однако, например, могут включать одноцепочечную ДНК (такую как химически синтезированный олигонуклеотид), содержащую желательную мутацию (например, замену, делецию или добавление), и ДНК-полимеразу, и т.п. Кроме того, в тех случаях, когда используют способ RA, примеры компонентов, включенных в набор по настоящему изобретению, включают белок рекомбиназу семейства RecA, экзонуклеазу, регенерирующий нуклеозид-трифосфат или дезоксинуклеотид-трифосфат фермент и его субстрат, нуклеозид-трифосфат, дезоксинуклеотид-трифосфат, источник ионов магния, источник ионов щелочного металла, диметилсульфоксид, хлорид тетраметиламмония, полиэтиленгликоль, дитиотреитол и буферный раствор.
[0244]
Компоненты, необходимые для амплификации, в бесклеточной системе, ДНК, в которую введены делеция, замена или добавление, меняются в зависимости от способов, используемых для осуществления способа по настоящему изобретению. Например, в тех случаях, когда используют способ RCR, примеры компонентов, содержащихся в наборе по настоящему изобретению, включают один или несколько ферментов или групп ферментов, выбранных из группы, состоящей из белков для инициации репликации, одного или нескольких типов нуклеоидных белков, ферментов или групп ферментов, имеющих активность ДНК-гиразы, связывающих одноцепочечную ДНК белков (SSB), ферментов, имеющих активность ДНК-хеликазы (таких как ферменты, имеющие активность хеликазы DnaB), ферментов, имеющих активность загрузчика ДНК-хеликазы, ферментов, имеющих активность ДНК-праймазы, ферментов, имеющих активность фиксации ДНК, и ферментов или групп ферментов, имеющих активность ДНК-полимеразы III*.
[0245]
Набор по настоящему изобретению может также включать дополнительные составляющие компоненты, такие как реакционный буфер или его концентрат, в зависимости от способа, используемого для осуществления способа по настоящему изобретению. Примеры этих дополнительных составляющих компонентов включают компоненты, необходимые для осуществления способов RCR I-V, описанных выше.
[0246]
Набор по настоящему изобретению может также включать искусственный фермент для расщепления ДНК, для специфического расщепление ДНК, в которую не введены делеция, замена или добавление.
[0247]
Набор по настоящему изобретению может также включать документацию, описывающую протокол для осуществления способа или настоящего изобретения с использованием набора. Протокол может быть записан на поверхности контейнера, содержащего набор.
ПРИМЕРЫ
[0248]
Настоящее изобретение описано ниже более подробно на основании серий примеров. Однако, настоящее изобретение не ограничено объемом следующих примеров.
[0249]
[Пример 1] Подтверждение специфичности для последовательности CRISPR-Cas9
С использованием плазмиды 9,5 т.п.о. (pOri8) или плазмиды 205 т.п.о. (pMSR227), подтверждали специфичность для последовательности расщепления посредством CRISPR-Cas9. Плазмиды pOri8 (ФИГ. 2A) и pMSR227 (ФИГ. 3A) представляют собой плазмиды, описанные в Su'etsugu et al, Nucleic Acids Res. 2017 Nov 16;45(20): 11525 to 11534.
[0250]
Десять нг/мкл pOri8 или pMSR227, 100 нМ нРНК_Km (направляющей РНК, полученной в соответствии с системой Alt-R (зарегистрированное торговое наименование) CRISPR-Cas9 от Integrated DNA Technologies, Inc., последовательность узнавания: UGGUUAAUUGGUUGUAACAC (SEQ ID NO: 1)), 20 нМ Cas9 (Alt-R (зарегистрированное торговое наименование) S.p. HiFi Cas9 нуклеаза 3NLS, Integrated DNA Technologies, Inc.), 0,8 Ед./мкл мышиного ингибитора РНКаз (M0314, New England Biolabs Ltd.) и буфер R8 (добавленный для доведения общего объема смеси до 10 мкл) (состав, как показано в таблице 2) смешивали, и полученную смесь инкубировали при 30°C в течение 30 минут. Затем, добавляли 10 Ед. рестрикционного фермента SacI (в случае pOri8) или XhoI (в случае pMSR227), и смесь инкубировали при 37°C в течение одного часа. Концентрация каждого из компонентов в реакционном растворе представляет концентрацию относительно общего объема реакционного раствора. Затем, проводили электрофорез в 0,5% агарозном геле, и фрагменты ДНК детектировали посредством окрашивания SYBR green I.
[0251]
Как проиллюстрировано на ФИГ. 2B, сверхспиральную ДНК pOri8 расщепляли и линеаризовали в зависимости от нРНК_Km, имеющей последовательность узнавания ниже гена устойчивости к канамицину. Результат обработки SacI выявил, что, как ожидали, при расщеплении фрагмента 9,5 т.п.о. получены фрагменты 5,6 т.п.о. и 3,8 т.п.о.
[0252]
Кроме того, как проиллюстрировано на ФИГ. 3B, сверхспиральную ДНК pMSR227 расщепляли и линеаризовали в зависимости от Cas9 и нРНК_Km. Результат обработки XhoI выявил, что, как ожидали, фрагмент 7,6 т.п.о. исчез. Фрагмент 6,8 т.п.о., полученный посредством расщепления фрагмента 7,6 т.п.о. посредством XhoI, перекрывался с другим фрагментом XhoI, но полоса подтверждена как имеющая расширение.
[0253]
[Пример 2] CRISPR-RCR
Для реакции амплификации ДНК после реакции RA, посредством проведения RCR в присутствии CRISPR-Cas9, подтверждено, что амплификация немодифицированной ДНК-матрицы ингибирована, и целевой продукт лигирования можно было специфически амплифицировать (ФИГ. 4).
[0254]
Сначала, ДНК-матрицу (pOri8 или pMSR227) расщепляли и линеаризовали посредством Cas9 с использованием реакции, описанной ниже. А именно, 10 нг/мкл pOri8 (9,5 т.п.о.) или pMSR227 (205 т.п.о.), 100 нМ нРНК_Km, 20 нМ Cas9, 0,8 Ед./мкл мышиного ингибитора РНКаз и буфер R8 (добавленный для доведения общего объема смеси до 5 мкл) смешивали, и полученную смесь инкубировали при 30°C в течение 30 минут. Концентрация каждого из компонентов в реакционном растворе представляет концентрацию относительно общего объема реакционного раствора.
[0255]
Затем, с использованием реакции RA, описанной ниже, расщепленный посредством Cas9 фрагмент и фрагмент lacZ (полученный с использованием способа, описанного ниже) соединяли. Реакционный раствор для расщепления посредством Cas9, описанный выше (0,5 мкл), содержащий 5 нг расщепленного посредством Cas9 фрагмента, фрагмента lacZ (1,7 нг в случае pOri8, 0,09 нг в случае pMSR227), 50 нг/мкл тРНК (R8759, Sigma-Aldrich Corporation), и реакционный раствор для RA (состава, описанного ниже, добавленный для доведения общего объема смеси до 5 мкл) смешивали, и после инкубации при 42°C в течение одного часа и затем инкубации при 65°C в течение 2 минут, смесь оставляли стоять на льду. Концентрация каждого из компонентов в реакционном растворе представляет концентрацию относительно общего объема реакционного раствора.
[0256]
Получение фрагмента lacZ: с использованием pPKOZ (Su'etsugu et al, Nucleic Acids Res. 2017 Nov 16;45(20): 11525 to 11534) в качестве матрицы, и с использованием праймеров SUE1510 и SUE1511, ПЦР проводили для получения префрагмента lacZ. С использованием этого префрагмента lacZ в качестве матрицы, и с использованием праймеров SUE1638 и SUE1639, ПЦР проводили для получения фрагмента lacZ, имеющего конец, гомологичный 60 парам оснований (последовательность, общая для обеих pOri8 и pMSR227) на расщепленном посредством CRISPR-Cas9 конце ниже гена устойчивости к канамицину.
[0257]
[Таблица 1]
Последовательности праймеров: Гомологичные концевые последовательности показаны в верхнем регистре
[0258]
Состав реакционного раствора для RA: 1 мкМ RecA дикого типа (полученный из экспрессирующего RecA штамма E. coli, и очищенный посредством стадий, включающих преципитацию полиэтиленимином, преципитацию сульфатом аммония и аффинную хроматографию на колонке), 80 мЕд./мкл экзонуклеазы III (2170A, Takara Bio Inc.), 1 Ед./мкл экзонуклеазы I (M0293, New England Biolabs Ltd.), 20 мМ трис-HCl (pH 8,0), 4 мМ DTT, 1 мМ ацетат магния, 50 мМ глутамат калия, 100 мкМ АТФ, 150 мМ хлорид тетраметиламмония (TMAC), 5% по массе PEG8000, 10% по объему DMSO, 20 нг/мкл креатинкиназы (10127566001, Sigma-Aldrich Corporation) и 4 мМ креатинфосфата. Концентрация каждого из компонентов в реакционном растворе для RA представляет концентрацию относительно общего объема реакционного раствора для RA.
[0259]
Продукт реакции RA подвергали реакции амплификации RCR следующим образом. А именно, реакционный раствор для RCR вер. 2 (состава, описанного ниже, где концентрация каждого из компонентов в реакционном растворе для RCR вер. 2 представляет концентрацию относительно общего объема реакционного раствора для RCR вер. 2, добавленного для доведения общего объема смеси до 4,5 мкл), 100 нМ нРНК_Km и 1 нМ Cas9 смешивали, и полученную смесь предварительно инкубировали при 30°C в течение 30 минут. Концентрации нРНК_Km и Cas9 в реакционном растворе представляют концентрации относительно общего объема реакционного раствора. Когда реакцию проводили в отсутствие CRISPR-Cas9, 100 нМ нРНК_Km и 1 нМ Cas9 не добавляли, и дополнительный реакционный раствор для RCR вер. 2 добавляли для доведения объема. Затем добавляли 0,5 мкл продукта реакции RA, цикл, включающий инкубацию при 37°C в течение одной минуты и затем инкубацию при 24°C в течение 30 минут, повторяли 40 раз, и затем полученный продукт разводили в 5 раз буфером R8, и дополнительную инкубацию проводили при 30°C в течение 30 минут. Затем, 1 мкл продукта RCR предоставляли для электрофореза в 0,5% агарозном геле и детектировали посредством окрашивания SYBR Green I.
[0260]
[Таблица 2]
Реакционный раствор для RCR вер. 2
[0261]
В таблице, SSB представляет собой происходящий из E. coli SSB, IHF представляет собой происходящий из E. coli комплекс IhfA и IhfB, DnaG представляет собой происходящий из E. coli DnaG, фиксатор представляет собой происходящий из E. coli DnaN, PolIII* представляет собой комплекс ДНК-полимеразы III*, представляющий собой комплекс, сформированный из происходящих из E. coli DnaX, HolA, HolB, HolC, HolD, DnaE, DnaQ и HolE, DnaB представляет собой происходящий из E. coli DnaB, DnaC представляет собой происходящий из E. coli DnaC, DnaA представляет собой происходящий из E. coli DnaA, РНКазаH представляет собой происходящий из E. coli РНКазуH, лигаза представляет собой происходящую из E. coli ДНК-лигазу, PolI представляет собой происходящую из E. coli ДНК-полимеразу I, GyrA представляет собой происходящий из E. coli GyrA, GyrB представляет собой происходящий из E. coli GyrB, Topo IV представляет собой комплекс происходящих из E. coli ParC и ParE, Topo III представляет собой происходящую из E. coli топоизомеразу III, RecQ представляет собой происходящий из E. coli RecQ, RecG представляет собой происходящий из E. coli RecG, RecJ представляет собой происходящий из E. coli RecJ, ExoI представляет собой происходящий из E. coli ExoI, и ExoIII представляет собой происходящий из E. coli ExoIII.
[0262]
SSB получали из экспрессирующего SSB штамма E. coli и очищали посредством стадий, включающих преципитацию сульфатом аммония и ионообменную хроматографию на колонке.
IHF получали из экспрессирующего IhfA и IhfB штамма E. coli, и очищали посредством стадий, включающих преципитацию сульфатом аммония и аффинную хроматографию на колонке.
DnaG получали из экспрессирующего DnaG штамма E. coli, и очищали посредством стадий, включающих преципитацию сульфатом аммония, анионообменную хроматографию на колонке и гель-проникающую хроматографию на колонке.
Фиксатор получали из экспрессирующего DnaN (фиксатор) штамма E. coli, и очищали посредством стадий, включающих преципитацию сульфатом аммония и анионообменную хроматографию на колонке.
PolIII* получали из экспрессирующего DnaX, HolA, HolB, HolC, HolD, DnaE, DnaQ и HolE штамма E. coli, и очищали посредством стадий, включающих преципитацию сульфатом аммония, аффинную хроматографию на колонке и гель-проникающую хроматографию на колонке.
DnaB и DnaC получали из экспрессирующего DnaB и DnaC штамма E. coli, и очищали посредством стадий, включающих преципитацию сульфатом аммония, аффинную хроматографию на колонке и гель-проникающую хроматографию на колонке.
DnaA получали из экспрессирующего DnaA штамма E. coli, и очищали посредством стадий, включающих преципитацию сульфатом аммония, преципитацию посредством диализа и гель-проникающую хроматографию на колонке.
GyrA и GyrB получали из смеси экспрессирующего GyrA штамма E. coli и экспрессирующего GyrB штамма E. coli, и очищали посредством стадий, включающих преципитацию сульфатом аммония, аффинную хроматографию на колонке и гель-проникающую хроматографию на колонке.
Topo IV получали из смеси экспрессирующего ParC штамма E. coli и экспрессирующего ParE штамма E. coli, и очищали посредством стадий, включающих преципитацию сульфатом аммония, аффинную хроматографию на колонке и гель-проникающую хроматографию на колонке.
Topo III получали из экспрессирующего Topo III штамма E. coli, и очищали посредством стадий, включающих преципитацию сульфатом аммония и аффинную хроматографию на колонке.
RecQ получали из экспрессирующего RecQ штамма E. coli, и очищали посредством стадий, включающих преципитацию сульфатом аммония, аффинную хроматографию на колонке и гель-проникающую хроматографию на колонке.
RecG получали из экспрессирующего RecG штамма E. coli, и очищали посредством стадий, включающих преципитацию сульфатом аммония и аффинную хроматографию на колонке.
В качестве RecJ использовали коммерчески доступный фермент (M0264, New England Biolabs Ltd.)
В качестве ExoI использовали коммерчески доступный фермент (см. состав вышеуказанного реакционного раствора для RA).
В качестве ExoIII использовали коммерчески доступный фермент (см. состав вышеуказанного реакционного раствора для RA).
В качестве каждой из РНКазаH, лигазы и PolI использовали коммерчески доступный происходящий из E. coli фермент (Takara Bio Inc.).
[0263]
Кроме того, посредством трансформации продуктом RCR E. coli и проведения бело-голубого определения колоний, исследовали долю продукта со вставкой lacZ в продукте RCR. В случае pOri8, 1 мкл продукта RCR разводили в 10 раз буфером TE, и 1 мкл разведенного раствора затем использовали для трансформации E. coli штамма DH5α с использованием химического способа. В случае pMSR227, 1 мкл продукта RCR разводили в 10 раз буфером TE, и 2 мкл разведенного раствора затем использовали для трансформации E. coli штамма HST08 с использованием способа электропорации. После трансформации, каждую E. coli рассевали на чашку LB, содержащую 50 мкг/мл канамицина, 0,1 мМ (ммоль/л) IPTG и 40 мкг/мл X-gal относительно общего объема чашки LB, и полученную смесь инкубировали в течение ночи при 37°C. Рассчитывали долю количества голубых колоний относительно общего количества колоний.
[0264]
Результаты проиллюстрированы на ФИГ. 5. В случае pOri8, сверхспиральную ДНК 13 т.п.о., представляющую целевой продукт со вставкой lacZ, подвергали зависимой от RA амплификация RCR. Амплификацию премодифицированной сверхспиральной ДНК 9,5 т.п.о. супрессировали в присутствии нРНК и Cas9. Результаты бело-голубого определения колоний трансформантов также выявили долю голубых колоний (показано как «Голубая колония» на этой фигуре) менее, чем 6%, в отсутствие нРНК и Cas9, которая увеличивалась до 95% в присутствии нРНК и Cas9. На этой фигуре, «Ввод» представляет собой образец, который не подвергали амплификации RCR.
[0265]
В случае pMSR227, сверхспиральную ДНК 208 т.п.о., как считают, представляющую целевой продукт со вставкой lacZ, амплифицировали посредством RCR в присутствии нРНК и Cas9. Кроме того, результаты бело-голубого определения колоний трансформантов выявили долю голубых колоний 0%, в отсутствие нРНК и Cas9, которая увеличивалась до 12 колоний из 13 в присутствии нРНК и Cas9, подтверждая, что целевой продукт со вставкой lacZ получен с высокой эффективностью.
[0266]
Кроме того, плазмиду выделяли из голубой колонии, полученной из образца, подвергнутого модификации вставки lacZ (3,3 т.п.о.) в pMSR227, и подтверждение структуры проводили посредством расщепления рестрикционным ферментом XhoI (ФИГ. 6A). Как ожидали, фрагмент 7,6 т.п.о., наблюдаемый до модификации, исчез, и полоса около 11 т.п.о. потемнела, подтверждая образование продукта со вставкой lacZ (ФИГ. 6B).
[0267]
[Пример 3] Бесклеточный синтез ДНК с длинной цепью
С использованием способа амплификации RCR и способа лигирования RA, две кольцевые ДНК с длинной цепью соединяли, и полученную кольцевую ДНК с более длинной цепью амплифицировали (ФИГ. 7).
[0268]
Сначала pOri80 (85 т.п.о.) и pOri93Cm (94 т.п.о.) расщепляли и линеаризовали в специфических участках посредством CRISPR-Cas9 с использованием следующего способа. А именно, 10 нг/мкл pOri80 (85 т.п.о.) или pOri93Cm (94 т.п.о.), 100 нМ нРНК_Km (в случае pOri80) или нРНК_007 (в случае pOri93Cm, направляющую РНК, полученную в соответствии с системой Alt-R (зарегистрированное торговое наименование) CRISPR-Cas9 от Integrated DNA Technologies, Inc., последовательность узнавания: CCUUUAGUUACAACAUACUC (SEQ ID NO: 2)), 20 нМ Cas9, 0,8 Ед./мкл мышиного ингибитора РНКаз и буфер R8 (добавленный для доведения общего объема смеси до 5 мкл) смешивали, и полученную смесь инкубировали при 30°C в течение 30 минут. Концентрация каждого из компонентов в реакционном растворе представляет концентрацию относительно общего объема реакционного раствора.
[0269]
pOri93Cm получали следующим способом. А именно, геномный фрагмент 93 т.п.о. продукта расщепления XbaI геномной ДНК E. coli штамма (DGF-298WΔ100::revΔ234::SC) соединяли и циркуляризовали с фрагментом после лигирования, содержащим oriC и ген устойчивости к хлорамфениколу (фрагмент Cm-oriC, 1,3 т.п.о., SEQ ID NO: 11), с использованием способа RA. Последовательности 60 пар оснований на двух концах фрагмента Cm-oriC являются гомологичными с двумя соответствующими концами геномного фрагмента 93 т.п.о. После амплификации RCR кольцевой ДНК, проводили трансформацию E. coli, и очищенную сверхспиральную плазмиду из полученной колонии E. coli использовали в качестве pOri93Cm.
[0270]
Полученные два фрагмента ДНК с длинной цепью соединяли посредством следующей реакции RA с использованием адаптера lacZ (3,4 т.п.о.) и адаптера Am (1,1 т.п.о.). Конкретно, 5 нг (0,5 мкл) расщепленного посредством Cas9 фрагмента pOri80, 5 нг (0,5 мкл) расщепленного посредством Cas9 фрагмента pOri93Cm, адаптер lacZ (3,4 т.п.о., 27 пг), адаптер Am (1,1 т.п.о., 86 нг), 50 нг/мкл тРНК, и реакционный раствор для RA (см. Пример 2, добавленный для доведения общего объема смеси до 5 мкл) смешивали, и после инкубации при 42°C в течение 3 часов и затем инкубации при 65°C в течение 2 минут, смесь оставляли стоять на льду. Концентрация каждого из компонентов в реакционном растворе представляет концентрацию относительно общего объема реакционного раствора.
[0271]
Последовательности из 60 пар оснований на обоих концах каждого адаптера представляют собой последовательности, гомологичные двум концам двух фрагментов ДНК с длинной цепью, и посредством лигирования и циркуляризации четырех фрагментов посредством RA, получали ДНК с общей длиной 183 т.п.о. (ФИГ. 7).
Адаптер lacZ получали посредством проведения ПЦР с использованием pPKOZ в качестве матрицы, и с использованием праймеров SUE1756 и SUE1823.
Адаптер Am получали посредством проведения ПЦР с использованием плазмиды pUC4K (GE Healthcare Inc.) в качестве матрицы, и с использованием праймеров SUE1753 и SUE1822.
[0272]
После циркуляризации лигированием, реакцию амплификации RCR проводили следующим образом. Реакционный раствор для RCR вер. 2 (добавленный для доведения общего объема смеси до 4,5 мкл), 100 нМ нРНК_Km, 100 нМ нРНК_007 и 2 нМ Cas9 смешивали, и полученную смесь предварительно инкубировали при 30°C в течение 30 минут. Каждая из концентраций нРНК_Km, нРНК_007 и Cas9 в реакционном растворе представляет концентрацию относительно общего объема реакционного раствора. Когда реакцию проводили в отсутствие CRISPR-Cas9, 100 нМ нРНК_Km, 100 нМ нРНК-007 и 2 нМ Cas9 не добавляли, и дополнительные реакционный раствор для RCR вер. 2 добавляли для доведения объема. Затем, добавляли 0,5 мкл продукта реакции RA, цикл, включающий инкубацию при 37°C в течение одной минуты и затем инкубацию при 24°C в течение 30 минут, повторяли 40 раз, и затем полученный продукт разводили в 5 раз буфером R8, и проводили дополнительную инкубацию при 30°C в течение 30 минут. Затем, 1 мкл продукта RCR предоставляли для электрофореза в 0,5% агарозном геле и детектировали посредством окрашивания SYBR Green I.
[0273]
Кроме того, посредством трансформации продуктом RCR E. coli и проведения бело-голубого определения колоний, исследовали долю целевого соединенного продукта в продукте RCR. Конкретно, 1 мкл продукта RCR разводили в 10 раз буфером TE, и 2 мкл разведенного раствора затем использовали для трансформации E. coli штамма HST08 с использованием способа электропорации. После трансформации, E. coli рассевали на чашку LB, содержащую 12,5 мкг/мл хлорамфеникола, 0,1 мМ IPTG и 40 мкг/мл X-gal, относительно общего объема чашки LB, и полученную смесь инкубировали в течение ночи при 37°C. Рассчитывали долю количества голубых колоний относительно общего количества колоний (голубая колония).
[0274]
Результаты проиллюстрированы на ФИГ. 8. В случае, когда RCR проводили в отсутствие нРНК и Cas9, премодифицированные сверхспиральные ДНК 94 т.п.о. и 85 т.п.о. являлись в основном амплифицированными. В отличие от этого, когда RCR проводили в присутствии нРНК и Cas9, амплификацию ДНК 94 т.п.о. и 85 т.п.о. супрессировали, и амплификацию ДНК наблюдали для размера, близкого к сверхспиральной ДНК 205 т.п.о., которую подвергали амплификации RCR в качестве контроля (pMSR227). На этой фигуре, «Ввод» представляет собой образец до амплификации RCR.
Трансформацию E. coli проводили с использованием этого амплифицированного продукта, и результаты использования бело-голубого определения для детекции этих колоний, имеющих ген lacZ, среди всех устойчивых к хлорамфениколу колоний, выявил, что все 21 колонии представляли собой целевые голубые колонии (на этой фигуре, отмечено как «Голубая колония на чашке Cm»).
[0275]
Восемь из полученных голубых колоний отбирали, плазмиду выделяли из каждой колонии, и затем размер подтверждали посредством электрофореза в агарозном геле, для всех колоний показан размер близкий к ожидаемой сверхспиральной ДНК 205 т.п.о. (ФИГ. 9).
[0276]
Кроме того, одну из полученных плазмид (названную pOri183) расщепляли с использованием рестрикционного фермента SacI, и структуру подтверждали посредством электрофореза в геле в пульсирующем поле (ФИГ. 10). Получен результат, по существу соответствующий паттерну расщепления (размеры показаны справа от полос), ожидаемому из последовательности оснований. Для маркеров размера, не только использовали лестницу маркеров, но и сверхспиральный (SC) продукт pMSR227 и ее расщепленный XhoI продукт, для которых известны структуры, также подвергали одновременному электрофорезу.
[0277]
[Пример 4] Разработка способа введения замены оснований в комбинации с RCR
Сначала проводили исследование того, можно ли способ введения замены оснований с использованием олиго-ДНК применять для RCR.
Тестовая система проиллюстрирована на ФИГ. 11B и ФИГ. 12. Модифицированные посредством lacZ pPKOZ (pPKOZins и pPKOZmis, ФИГ. 11A) получали посредством способа ПЦР QuikChange с использованием pPKOZ (8,8 т.п.о.) в качестве матрицы.
[0278]
При получении pPKOZins, SUE818 и SUE819 использовали в качестве праймеров. pPKOZins представляет собой плазмиду, имеющую одно основание, вставленное в кодирующей области lacZ (ФИГ. 12). Из-за мутации сдвига рамки считывания, lacZ дикого типа не экспрессируется, и таким образом колонии E. coli, трансформированной с использованием pPKOZins, не выглядят голубыми при бело-голубом определении (ФИГ. 11B).
[0279]
При получении pPKOZmis, SUE1415 и SUE1416 использовали в качестве праймеров. pPKOZmis представляет собой плазмиду, имеющую одно основание, замененное в кодирующей области lacZ (ФИГ. 12). Из-за нонсенс-мутации, lacZ дикого типа не экспрессируется, и таким образом колонии E. coli, трансформированной с использованием pPKOZmis, не выглядят голубыми при бело-голубом определении (ФИГ. 11B).
[0280]
SUE1354 - SUE1357 использовали в качестве олиго-ДНК для возвращения этого мутантного lacZ к lacZ дикого типа.
[0281]
[Таблица 3]
Последовательности праймеров: Замененные (вставленные) основания показаны в верхнем регистре
ttttacaacgtcgtgactg
[0282]
С использованием pPKOZins, имеющей мутацию сдвига рамки считывания lacZ в качестве матрицы, реакцию RCR проводили в присутствии 20-членных - 60-членных олиго-ДНК для модификации следующим образом. А именно, реакционный раствор для RCR вер. 1 (состава, описанного ниже, где концентрация каждого из компонентов в реакционном растворе для RCR вер. 1 представляет концентрацию относительно общего объема реакционного раствора для RCR вер. 1, добавленный для доведения общего объема смеси до 5 мкл), 1 или 3 мкМ олиго-ДНК для модификации (20-60-членных) и 75 пг/мкл pPKOZins смешивали, и полученную смесь инкубировали при 30°C в течение 18 часов. Концентрация каждого из компонентов в реакционном растворе представляет концентрацию относительно общего объема реакционного раствора. Затем, 1 мкл продукта RCR предоставляли для электрофореза в 0,5% агарозном геле и детектировали посредством окрашивания SYBR Green I.
[0283]
[Таблица 4]
Реакционный раствор для RCR вер. 1 (не включающий стимулирующие факторы)
[0284]
Компоненты в реакционном растворе для RCR вер. 1 являются такими же, как описанные выше для реакционного раствора для RCR вер. 2.
[0285]
Кроме того, посредством трансформации продуктом RCR E. coli и проведения бело-голубого определения колоний, исследовали долю мутации lacZ, модифицированной до формы дикого типа, в продукте RCR. Конкретно, 0,25 мкл продукта RCR использовали для трансформации E. coli штамма DH5α с использованием химического способа. После трансформации, E. coli рассевали на чашку LB, содержащую 25 мкг/мл канамицина, 0,1 мМ IPTG и 40 мкг/мл X-gal, и полученную смесь инкубировали в течение ночи при 37°C. Рассчитывали количество голубых колоний относительно общего количества колоний.
[0286]
Результаты проиллюстрированы на ФИГ. 13A и ФИГ. 13B. За исключением случаев, когда добавляли 30 мкМ 40-членные или 60-членные олиго-ДНК для модификации, наблюдали удовлетворительную амплификацию (ФИГ. 13A). На этой фигуре, «Ввод» представляет собой случай доведения с использованием 3,8 нг ДНК-матрицы.
Кроме того, проведение бело-голубого определения колоний трансформантов E. coli подтвердило, что модификация мутации lacZ до дикого типа происходила с наивысшей эффективностью 5,5% в образце, в который добавляли 1 мкМ 60-членные олиго-ДНК для модификации.
[0287]
[Пример 5] Исследование концентрации для 60-членных олиго-ДНК (ins/mis)
Для улучшения эффективности модификации, исследовали использование концентрации олиго-ДНК.
С использованием следующего способа, pPKOZins или pPKOZmis использовали в качестве матрицы, и реакции RCR проводили в присутствии различных концентраций 60-членных олиго-ДНК для модификации. Реакционный раствор для RCR вер. 1 (добавленный для доведения общего объема смеси до 5 мкл), 0-3 мкМ 60-членные олиго-ДНК для модификации (SUE1357) и 75 пг/мкл pPKOZins или 14 пг/мкл pPKOZmis смешивали, и полученную смесь инкубировали при 30°C в течение 19 часов. Затем, 1 мкл продукта RCR предоставляли для электрофореза в 0,5% агарозном геле и детектировали посредством окрашивания SYBR Green I.
[0288]
Кроме того, посредством трансформации продуктом RCR E. coli и проведения бело-голубого определения колоний, исследовали долю мутации lacZ, модифицированной до формы дикого типа, в продукте RCR. Конкретно, 0,25 мкл продукта RCR использовали для трансформации E. coli штамма DH5α с использованием химического способа. После трансформации, E. coli рассевали на чашку LB, содержащую 25 мкг/мл канамицина, 0,1 мМ IPTG и 40 мкг/мл X-gal, относительно общего объема чашки LB, и полученную смесь инкубировали в течение ночи при 37°C. Рассчитывали количество голубых колоний относительно общего количества колоний.
[0289]
Результаты проиллюстрированы на ФИГ. 14A и ФИГ. 14B. На ФИГ. 14A, «Ввод» представляет собой случаи доведения с использованием 3,8 нг pPKOZins или 0,72 нг pPKOZmis. Результаты проведения бело-голубых определений колоний трансформантов E. coli подтвердили, что либо для pPKOZins, либо для pPKOZmis, модификация мутации lacZ до дикого типа происходила с наивысшей эффективностью 20% или выше в образце, в который добавляли 0,3 мкМ олиго-ДНК для модификации (ФИГ. 14B).
[0290]
[Пример 6] Увеличение эффективности ROGE с использованием CRISPR-Cas9
С использованием такой же тестовой системы, как в примере 5, RCR проводили в присутствии CRISPR-Cas9 для исследования того, может ли быть увеличена эффективность модификации мутации lacZ до дикого типа.
[0291]
Следующим образом, с использованием pPKOZins в качестве матрицы, реакцию RCR проводили в присутствии 0,3 мкМ 60-членных олиго-ДНК для модификации. Конкретно, реакционный раствор для RCR вер. 1 (добавленный для доведения общего объема смеси до 5 мкл), 0,3 мкМ 60-членные олиго-ДНК для модификации (SUE1357), 0-20 нМ Cas9, 100 нМ нРНК_Zins (направляющую РНК, полученную в соответствии с системой Alt-R (зарегистрированное торговое наименование) CRISPR-Cas9 от Integrated DNA Technologies, Inc., последовательность узнавания: ACCAUGAUUACGGAUUCACU (SEQ ID NO: 20)) и 7,5 фг/мкл pPKOZins смешивали, и полученную смесь инкубировали при 30°C в течение 21 часа. Концентрация каждого из компонентов в реакционном растворе представляет концентрацию относительно общего объема реакционного раствора. Полученный продукт разводили в 5 раз буфером R8 и проводили дополнительную инкубацию при 30°C в течение 30 минут. Затем, 2,5 мкл продукта RCR предоставляли для электрофореза в 0,5% агарозном геле и детектировали посредством окрашивания SYBR Green I.
В этом случае, нРНК_Zins представляет собой направляющую РНК, которая специфически узнает последовательность lacZins до модификации.
[0292]
Кроме того, посредством трансформации продуктом RCR E. coli и проведения бело-голубого определения колоний, исследовали долю мутации lacZ, модифицированной до формы дикого типа, в продукте RCR. Конкретно, 0,25 мкл продукта RCR использовали для трансформации E. coli штамма DH5α с использованием химического способа. После трансформации, E. coli рассевали на чашку LB, содержащую 25 мкг/мл канамицина, 0,1 мМ IPTG и 40 мкг/мл X-gal относительно общего объема чашки LB, и полученную смесь инкубировали в течение ночи при 37°C. Рассчитывали количество голубых колоний относительно общего количества колоний.
[0293]
Результаты проиллюстрированы на ФИГ. 15A и ФИГ. 15B. В отсутствие олиго-ДНК для модификации, добавление как Cas9, так и нРНК_Zins, очень сильно супрессировало амплификацию сверхспиральной ДНК посредством RCR (ФИГ. 15A). В отличие от этого, в присутствии олиго-ДНК для модификации, даже когда добавляли CRISPR-Cas9, детектировали амплифицированный продукт сверхспиральной ДНК (ФИГ. 15A). Кроме того, результаты бело-голубого определения колоний трансформантов подтвердили, что посредством добавления Cas9 и нРНК_Zins, в присутствии олиго-ДНК для модификации, почти весь амплифицированный продукт был модифицирован до формы lacZ дикого типа (ФИГ. 15B).
[0294]
[Пример 7] ROGE для ДНК с длинной цепью
С использованием такой же тестовой системы, как в примере 5, проводили исследование того, можно ли способ введения замены оснований с использованием олиго-ДНК использовать для RCR ДНК с длинной цепью.
[0295]
Следующим образом, реакцию RCR проводили с использованием содержащей oriC кольцевой ДНК 101 т.п.о., имеющей мутацию lacZins (pOri93Zins) (ФИГ. 16A), в качестве матрицы. Конкретно, реакционный раствор для RCR вер. 1 (добавленный для доведения общего объема смеси до 5 мкл), 0-3 мкМ 60-членные олиго-ДНК для модификации (SUE1357), 30 нг/мкл ДНК лямбда и 0,67 пМ pOri93Zins смешивали, полученную смесь инкубировали при 33°C в течение 18 часов, и затем полученный продукт разводили в 5 раз буфером R8 и проводили дополнительную инкубацию при 30°C в течение 30 минут. Концентрация каждого из компонентов в реакционном растворе представляет концентрацию относительно общего объема реакционного раствора. Затем, 2,5 мкл продукта RCR предоставляли для электрофореза в 0,5% агарозном геле и детектировали посредством окрашивания SYBR Green I.
[0296]
В этом случае, pOri93Zins получали с использованием следующего способа. А именно, геномный фрагмент 93 т.п.о. продукта расщепления XbaI геномной ДНК E. coli штамма (DGF-298WΔ100::revΔ234::SC) соединяли и циркуляризовали с фрагментом после лигирования, содержащим oriC, ген устойчивости к канамицину и мутантный ген lacZins (фрагмент KOZins), с использованием способа RA. Фрагмент KOZins (8,6 т.п.о.) получали посредством ПЦР с использованием pKOZins в качестве матрицы и с использованием праймеров SUE1745 и SUE1746. Последовательности на двух концах фрагмента KOZins являются гомологичными двум соответствующим концам геномного фрагмента 93 т.п.о. После реакции RA, кольцевую ДНК амплифицировали посредством RCR и трансформировали в E. coli, и очищенную сверхспиральную плазмиду из полученной колонии E. coli использовали в качестве pOri93Zins.
[0297]
[Таблица 5]
Последовательности праймеров: Гомологичные концевые последовательности показаны в верхнем регистре
[0298]
Кроме того, посредством трансформации продуктом RCR E. coli и проведения бело-голубого определения колоний, исследовали долю мутации lacZ, модифицированной до формы дикого типа, в продукте RCR. Конкретно, 0,2 мкл продукта RCR использовали для трансформации E. coli штамма HST08 с использованием способа электропорации. После трансформации, E. coli рассевали на чашку LB, содержащую 25 мкг/мл канамицина, 0,1 мМ IPTG и 40 мкг/мл X-gal, относительно общего объема чашки LB, и полученную смесь инкубировали в течение ночи при 37°C. Рассчитывали количество голубых колоний относительно общего количества колоний.
[0299]
Результаты проиллюстрированы на ФИГ. 16B и ФИГ. 16C. Когда концентрация олиго-ДНК для модификации составляла 1 мкМ или выше, детектировали ингибирование реакции амплификации (ФИГ. 16B). На ФИГ. 16B, «Ввод» представляет собой случай доведения с использованием 0,02 нг ДНК-матрицы.
Кроме того, результаты бело-голубого определения колоний трансформантов показали, что в присутствии 0,3 мкМ олиго-ДНК для модификации, мутация lacZins была модифицирована до lacZ дикого типа в 5,4% амплифицированных продуктов (ФИГ. 16C).
[0300]
[Пример 8] Увеличение эффективности ROGE для ДНК с длинной цепью с использованием CRISPR-Cas9
С использованием такой же тестовой системы, как в примере 6, проводили исследование, можно ли увеличение эффективности модификации, обеспечиваемое посредством CRISPR-Cas9, использовать для RCR ДНК с длинной цепью.
[0301]
С использованием кольцевой ДНК pOri93Zins, подвергнутой обработке для удаления не являющейся необходимой линейной ДНК в качестве матрицы, реакцию RCR проводили в присутствии 0,3 мкМ 60-членных олиго-ДНК для модификации, способом, описанным ниже. Конкретно, реакционный раствор для RCR вер. 1 (добавленный для доведения общего объема смеси до 5 мкл), 0,3 мкМ 60-членные олиго-ДНК для модификации (SUE1357), 3 нг/мкл ДНК лямбда, 10 нМ Cas9, 100 нМ нРНК_Zins (направляющую РНК, полученную в соответствии с системой Alt-R (зарегистрированное торговое наименование) CRISPR-Cas9 от Integrated DNA Technologies, Inc., последовательность узнавания: ACCAUGAUUACGGAUUCACU (SEQ ID NO: 20)) и 1 пМ pOri93Zins смешивали. Концентрация каждого из компонентов в реакционном растворе представляет концентрацию относительно общего объема реакционного раствора. Затем, проводили 40 циклов инкубации с использованием цикла температур, включающего инкубацию при 37°C в течение одной минуты и затем инкубацию при 24°C в течение 30 минут, и затем полученный продукт разводили в 5 раз буфером R8 и проводили дополнительную инкубацию при 30°C в течение 30 минут. Затем, 2,5 мкл продукта RCR предоставляли для электрофореза в 0,5% агарозном геле и детектировали посредством окрашивания SYBR Green I.
[0302]
Кроме того, посредством трансформации продуктом RCR E. coli и проведения бело-голубого определения колоний, исследовали долю мутации lacZ, модифицированной до формы дикого типа, в продукте RCR. Конкретно, 0,2 мкл продукта RCR использовали для трансформации E. coli штамма HST08 с использованием способа электропорации. После трансформации, E. coli рассевали на чашку LB, содержащую 25 мкг/мл канамицина, 0,1 мМ IPTG и 40 мкг/мл X-gal относительно общего объема чашки LB, и полученную смесь инкубировали в течение ночи при 37°C. Рассчитывали количество голубых колоний относительно общего количества колоний.
[0303]
Результаты проиллюстрированы на ФИГ. 17A и ФИГ. 17B. В отсутствие олиго-ДНК для модификации, добавление как Cas9, так и нРНК_Zins, очень сильно супрессировало амплификацию сверхспиральной ДНК посредством RCR (ФИГ. 17A). В отличие от этого, в присутствии олиго-ДНК для модификации, даже когда CRISPR-Cas9 добавляли, детектировали амплифицированный продукт сверхспиральной ДНК (ФИГ. 17A).
[0304]
Кроме того, результаты бело-голубого определения колоний трансформантов подтвердили, что посредством добавления Cas9 и нРНК_Zins, в присутствии олиго-ДНК для модификации, почти весь амплифицированный продукт был модифицирован до формы lacZ дикого типа (ФИГ. 17B).
[0305]
[Пример 9] Замена и вставка множества оснований
С использованием такой же тестовой системы, как в примере 5, проводили исследование того, можно ли заменять или вставлять множество оснований с использованием олиго-ДНК для модификации.
[0306]
В случае замены множества оснований, pPKOZins использовали в качестве матрицы, и использовали олиго-ДНК для модификации с синонимичным кодоном из-за замены 3 оснований. pPKOZins имеет мутацию сдвига рамки считывания из-за вставки одного основания кодирующей области lacZ, и колонии E. coli выглядят белыми. Олиго-ДНК для модификации включает, вблизи участка замены 3 оснований, последовательность, возвращающую вставку одного основания до формы дикого типа. Ожидают, что плазмида, переведенная в дикий тип (голубая колония E. coli) посредством модификации, также подверглась одновременному введению замены 3 оснований (ФИГ. 18A).
[0307]
С другой стороны, в случае вставки множества оснований, pPKOZ использовали в качестве матрицы, и использовали олигонуклеотид для модификации, образующий последовательность узнавания EcoRI из-за вставки 4 оснований (ФИГ. 18B). Вставка 4 оснований вводит мутацию сдвига рамки считывания, и поскольку ген lacZ не синтезируется, ожидают, что колонии E. coli будут выглядеть белыми. Поскольку pPKOZ уже имеет участок EcoRI в одной локализации (ФИГ. 18F), вставка 4 оснований приводит к получению плазмиды, имеющей участки EcoRI в двух локализациях (ФИГ. 18G).
[0308]
С использованием pPKOZins или pPKOZ в качестве матрицы, реакции RCR проводили в присутствии различных концентраций олиго-ДНК для модификации способом, описанным ниже. Конкретно, реакционный раствор для RCR вер. 1 (добавленный для доведения общего объема смеси до 5 мкл), 0 мкМ - 0,6 мкМ 60-членные олиго-ДНК для модификации (SUE4386 или SUE4387) и 50 пг/мкл pPKOZins или pPKOZ смешивали. Концентрация каждого из компонентов в реакционном растворе представляет концентрацию относительно общего объема реакционного раствора. Затем, реакционный раствор инкубировали при 33°C в течение 18 часов, и затем полученный продукт разводили в 5 раз буфером R8, и проводили дополнительную инкубацию при 30°C в течение 30 минут. Затем, 2,5 мкл продукта RCR предоставляли для электрофореза в 0,5% агарозном геле и детектировали посредством окрашивания SYBR Green I.
[0309]
[Таблица 6]
Последовательности праймеров: Гомологичные концевые последовательности показаны в верхнем регистре
[0310]
Кроме того, посредством трансформации продуктами RCR E. coli и проведения бело-голубого определения колоний, исследовали долю голубых колоний в случае, когда использовали pPKOZins, и долю белых колоний в случае, когда использовали pPKOZ. Конкретно, 0,2 мкл каждого продукта RCR использовали для трансформации E. coli DH5α с использованием химического способа. После трансформации, E. coli рассевали на чашку LB, содержащую 25 мкг/мл канамицина, 0,1 мМ IPTG и 40 мкг/мл X-gal, относительно общего объема чашки LB, и полученную смесь инкубировали в течение ночи при 37°C. Рассчитывали количество голубых колоний или белых колоний относительно общего количества колоний.
[0311]
Результаты проиллюстрированы на ФИГ. 18C, ФИГ. 18D и ФИГ. 18E. Результаты бело-голубого определения колоний трансформантов E. coli подтвердили, что, как для pPKOZins, так и для pPKOZ, lacZ был модифицирован с наивысшей эффективностью (7,3% и 3,6%, соответственно) в образце, в который добавляли 0,3 мкМ олиго-ДНК для модификации (ФИГ. 18D и ФИГ. 18E).
[0312]
Чтобы убедиться, действительно ли достигнута модификация последовательности-мишени, четыре из плазмид, полученных из голубых колоний в тестах модификации с использованием pPKOZins в качестве матрицы, подвергали анализу последовательности, и во всех четырех случаях, были вставлены целевые замены 3 оснований.
[0313]
Кроме того, семь из плазмид, полученных из белых колоний в тестах вставки 4 оснований с использованием pPKOZ в качестве матрицы, подвергали обработке рестрикционным ферментом следующим образом для подтверждения вставки 4 оснований. Конкретно, 10×буфер H (добавленный для доведения общего объема смеси до 20 мкл), 0,75 Ед./мкл EcoRI и 2 мкл каждой плазмиды смешивали, и каждую полученную смесь инкубировали при 37°C в течение одного часа. Такую же обработку рестрикционным ферментом проводили для плазмид, полученных из голубых колоний, которые считали немодифицированными. После обработки, 4 мкл продукта обработки рестрикционным ферментом предоставляли для электрофореза в 0,5% агарозном геле и детектировали посредством окрашивания SYBR Green I.
[0314]
Результаты проиллюстрированы на ФИГ. 18H. Во всех из семи модифицированных плазмид, которые подвергали обработке рестрикционным ферментом, детектировали два фрагмента в результате ожидаемых расщеплений в двух локализациях, подтверждая, что достигнута модификация с использованием целевой последовательности для вставки 4 оснований. В немодифицированных плазмидах (wt), расщепление детектировали только в одной локализации (ФИГ. 18H).
[0315]
[Пример 10] Одновременная замена оснований во множестве локализаций
Тестирование проводили следующим образом с использованием пути биосинтеза виолацеина. Виолацеин является вторичным метаболитом, продуцируемым на основе триптофана с использованием продуктов пяти генов (vioA, vioB, vioC, vioD и vioE). У E. coli, в тех случаях, когда все пять генов проявляют функциональность, для колоний показана фиолетовая окраска (ФИГ. 19B). В отсутствие vioC, продукция продолжается настолько далеко, как до промежуточного продукта биосинтеза виолацеина, и для колоний показана темно-коричневая окраска (ФИГ. 19B). Кроме того, в отсутствие vioA или в случае двойного нокаута vioA и vioC, не синтезируется окрашенного продукта, и колония остается белой (ФИГ. 19B). С использованием этого варианта окраски колоний, проводили тестирование того, можно ли возвращать мутантную плазмиду с двойным нокутом vioA, vioC к плазмиде vioA, vioC дикого типа посредством одновременной замены основания в двух отдельных областях для vioA и vioC, с использованием внешнего вида фиолетовой колонии в качестве показателя детекции.
[0316]
Плазмида pK30V_insAC, которую использовали, имеет одно основание, вставленное в кодирующей области каждого из vioA и vioC (ФИГ. 19A). Эту pK30V_insAC получали с использованием pK30V в качестве матрицы, посредством проведения двух последовательных вставок 1 основания в комбинации с реакцией RCR. Первую вставку проводили с использованием SUE4384 (SEQ ID NO: 64) в качестве олиго-ДНК для достижения вставки 1 основания в vioC, с плазмидой pK30V_insC, полученной из полученной таким образом темно-коричневой колонии, и затем проводили вторую вставку с использованием pK30V_insC в качестве матрицы, с использованием SUE4579 (SEQ ID NO: 63) для введения вставки 1 основания в vioA, с плазмидой pK30V_insAC, полученной из полученной таким образом белой колонии. Поскольку vioA и vioC не экспрессируются из-за мутации сдвига рамки считывания, колонии E. coli, трансформированной с использованием pK30V_insAC, являются белыми и не проявляют окраски.
[0317] pK30V получали посредством подвергания области ДНК pETm6-vioABECD (Jones et al., Sci. Rep. (2015) 5, 11301), которая кодирует ген vioABECD, лигированию и циркуляризации способом RA с фрагментом ДНК 3,5 т.п.о., содержащим oriC, представленный SEQ ID NO: 67, ген устойчивости к канамицину и LacI.
[0318]
SUE4577 (SEQ ID NO: 65) и SUE4381 (SEQ ID NO: 66) использовали в качестве олиго-ДНК для возвращения мутантов vioA и vioC до форм дикого типа (ФИГ. 19C и ФИГ. 19D).
[0319]
С использованием pK30V_insAC, имеющей мутации сдвига рамки считывания в vioA и vioC в качестве матрицы, реакцию RCR проводили следующим образом. Конкретно, реакционный раствор для RCR вер. 1 (добавленный для доведения общего объема смеси до 5 мкл), 0,15 мкМ 60-членные олиго-ДНК для модификации (SUE4577 и SUE4381) и 50 пг/мкл pK30V_insAC смешивали, и полученную смесь инкубировали при 33°C в течение 6 часов, 12 часов или 18 часов. Концентрация каждого из компонентов в реакционном растворе представляет концентрацию относительно общего объема реакционного раствора.
[0320]
[Таблица 7]
Последовательности праймеров: Гомологичные концевые последовательности показаны в верхнем регистре
gGGGCACGAAGTTCACATTATAGAAAAACGT
TCAAGGGCATTAGAAGGTTACGCAATAGATG
[0321]
Затем, посредством трансформации продуктами RCR E. coli и проведения цветного определения колоний, исследовали долю колоний, в которых мутации vioA и vioC были модифицированы до форм дикого типа, в продукте RCR. Конкретно, 1 мкл продукта RCR использовали непосредственно для трансформации E. coli штамма BL21 Star (DE3) (Thermo Fisher Scientific Inc.) с использованием химического способа. После трансформации, E. coli рассевали на чашку LB, содержащую 25 мкг/мл канамицина и 10 мкМ IPTG, относительно общего объема чашки LB, и полученную смесь инкубировали в течение ночи при 30°C. Рассчитывали количество фиолетовых колоний относительно общего количества колоний.
[0322]
Результаты показаны на ФИГ. 19E. Результаты трансформации E. coli продуктом RCR в каждое время выявили детекцию фиолетовых колоний с эффективностью приблизительно 0,3-0,7%. Эти результаты подтвердили, что две локализации мутации vioA и мутации vioC были одновременно модифицированы до форм дикого типа (ФИГ. 19E).
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
[0323]
С использованием способа из варианта осуществления настоящего изобретения, можно предоставлять способ амплификации продуктов редактированной ДНК, и в частности, продуктов редактированной ДНК с длинной цепью, без использования клеток.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ В ПРОИЗВОЛЬНОМ ТЕКСТОВОМ ФОРМАТЕ
[0324]
SEQ ID NO: 1 нРНК_Km
SEQ ID NO: 2 нРНК_007
SEQ ID NO: 3 SUE1510
SEQ ID NO: 4 SUE1511
SEQ ID NO: 5 SUE1638
SEQ ID NO: 6 SUE1639
SEQ ID NO: 7 SUE1753
SEQ ID NO: 8 SUE1756
SEQ ID NO: 9 SUE1822
SEQ ID NO: 10 SUE1823
SEQ ID NO: 11 фрагмент Cm-oriC
SEQ ID NO: 12 SUE818
SEQ ID NO: 13 SUE819
SEQ ID NO: 14 SUE1415
SEQ ID NO: 15 SUE1416
SEQ ID NO: 16 SUE1354
SEQ ID NO: 17 SUE1355
SEQ ID NO: 18 SUE1356
SEQ ID NO: 19 SUE1357
SEQ ID NO: 20 нРНК_Zins
SEQ ID NO: 21 SUE1745
SEQ ID NO: 22 SUE1746
SEQ ID NO: 23 последовательность ter (консенсус)
SEQ ID NO: 24 последовательность ter (консенсус)
SEQ ID NO: 25 последовательность ter (terA, B, D, E или H)
SEQ ID NO: 26 последовательность ter (terA, B, D, E или H)
SEQ ID NO: 27 последовательность ter (terC)
SEQ ID NO: 28 последовательность ter (terF)
SEQ ID NO: 29 последовательность ter (terG)
SEQ ID NO: 30 последовательность ter (terI)
SEQ ID NO: 31 последовательность ter (terJ)
SEQ ID NO: 32 последовательность ter (консенсус Bacillus)
SEQ ID NO: 33 последовательность ter (консенсус Bacillus subtilis)
SEQ ID NO: 34 последовательность ter (консенсус Bacillus subtilis)
SEQ ID NO: 35 последовательность ter (terVII)
SEQ ID NO: 36 последовательность ter (terIX)
SEQ ID NO: 37 последовательность, узнаваемая XerCD (консенсус)
SEQ ID NO: 38 последовательность, узнаваемая XerCD (консенсус, dif и cer)
SEQ ID NO: 39 последовательность, узнаваемая XerCD (консенсус, dif и psi)
SEQ ID NO: 40 последовательность, узнаваемая XerCD (консенсус, cer и psi)
SEQ ID NO: 41 последовательность dif
SEQ ID NO: 42 последовательность cer
SEQ ID NO: 43 последовательность psi
SEQ ID NO: 44 последовательность dif
SEQ ID NO: 45 последовательность cer
SEQ ID NO: 46 последовательность psi
SEQ ID NO: 47 консенсусная последовательность loxP
SEQ ID NO: 48 последовательность lox511
SEQ ID NO: 49 последовательность lox2272
SEQ ID NO: 50 последовательность loxFAS
SEQ ID NO: 51 последовательность lox RE
SEQ ID NO: 52 последовательность lox LE
SEQ ID NO: 53 последовательность FRT
SEQ ID NO: 54 последовательность rox
SEQ ID NO: 55 последовательность внешнего конца (OE)
SEQ ID NO: 56 SUE4386
SEQ ID NO: 57 SUE4387
SEQ ID NO: 58 частичная последовательность ниже инициирующего кодона lacZ wt
SEQ ID NO: 59 частичная последовательность ниже инициирующего кодона lacZ ins
SEQ ID NO: 60 частичная последовательность ниже инициирующего кодона lacZ mis
SEQ ID NO: 61 частичная последовательность вблизи инициирующего кодона pPKOZins
SEQ ID NO: 62 частичная последовательность вблизи инициирующего кодона pPKOZ
SEQ ID NO: 63 SUE4579
SEQ ID NO: 64 SUE4384
SEQ ID NO: 65 SUE4577
SEQ ID NO: 66 SUE4381
SEQ ID NO: 67 фрагмент ДНК (3,5 т.п.о.) для получения pK30V
SEQ ID NO: 68 vioA ins
SEQ ID NO: 69 vioC ins
СПИСКИ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> OriCiro Genomics, Inc.
<120> СПОСОБ РЕДАКТИРОВАНИЯ ДНК В БЕСКЛЕТОЧНОЙ СИСТЕМЕ
<130> OSP93284
<150> JP2018-142274
<151> 2018-07-30
<160> 69
<170> PatentIn версии 3.5
<210> 1
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для нРНК_Km
<400> 1
ugguuaauug guuguaacac 20
<210> 2
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для нРНК_007
<400> 2
ccuuuaguua caacauacuc 20
<210> 3
<211> 77
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE1510
<400> 3
cgatgagttt ttctaatcag aattggttaa ttggttgtaa ctttagttac aacatactac 60
gacaggtttc ccgactg 77
<210> 4
<211> 78
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE1511
<400> 4
agccgccgtc ccgtcaagtc agcgtaatgc tctgccagtg ctttagttac aacatacttt 60
tccttacgcg aaatacgg 78
<210> 5
<211> 54
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE1638
<400> 5
ttgcagtttc atttgatgct cgatgagttt ttctaatcag aattggttaa ttgg 54
<210> 6
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE1639
<400> 6
aagttcgatt tattcaacaa agccgccgtc ccgtcaagt 39
<210> 7
<211> 84
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE1753
<400> 7
ttgcagtttc atttgatgct cgatgagttt ttctaatcag aattggttaa ttggttgtaa 60
atatgagtaa acttggtctg acag 84
<210> 8
<211> 80
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE1756
<400> 8
aagttcgatt tattcaacaa agccgccgtc ccgtcaagtc agcgtaatgc tctgccagtg 60
tttccttacg cgaaatacgg 80
<210> 9
<211> 80
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE1822
<400> 9
cgcatccggc agggtttatt attgtttttt cgctctaggt cggcttgaga aagacctgag 60
cacttttcgg ggaaatgtgc 80
<210> 10
<211> 79
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE1823
<400> 10
tttaataccc aggatccatt taacataata tacattatgc gcacctttag ttacaacata 60
acgacaggtt tcccgactg 79
<210> 11
<211> 1298
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для фрагмента Cm-oriC
<400> 11
gttgagaaag gtgattatca ccatgcgaat taacgaagtt tttacggagg gaaacaatct 60
cgtaagaggt tccaactttc accataatga aataagatca ctaccgggcg tattttttga 120
gttatcgaga ttttcaggag ctaaggaagc taaaatggag aaaaaaatca ctggatatac 180
caccgttgat atatcccaat ggcatcgtaa agaacatttt gaggcatttc agtcagttgc 240
tcaatgtacc tataaccaga ccgttcagct ggatattacg gcctttttaa agaccgtaaa 300
gaaaaataag cacaagtttt atccggcctt tattcacatt cttgcccgcc tgatgaatgc 360
tcatccggaa ttccgtatgg caatgaaaga cggtgagctg gtgatatggg atagtgttca 420
cccttgttac accgttttcc atgagcaaac tgaaacgttt tcatcgctct ggagtgaata 480
ccacgacgat ttccggcagt ttctacacat atattcgcaa gatgtggcgt gttacggtga 540
aaacctggcc tatttcccta aagggtttat tgagaatatg tttttcgtct cagccaatcc 600
ctgggtgagt ttcaccagtt ttgatttaaa cgtggccaat atggacaact tcttcgcccc 660
cgttttcacc atgggcaaat attatacgca aggcgacaag gtgctgatgc cgctggcgat 720
tcaggttcat catgccgtct gtgatggctt ccatgtcggc agaatgctta atgaattaca 780
acagtactgc gatgagtggc agggcggggc gtaagaagat ccggcagaag aatggagtat 840
gttgtaacta aagataactt cgtataatgt atgctatacg aagttataca gatcgtgcga 900
tctactgtgg ataactctgt caggaagctt ggatcaaccg gtagttatcc aaagaacaac 960
tgttgttcag tttttgagtt gtgtataacc cctcattctg atcccagctt atacggtcca 1020
ggatcaccga tcattcacag ttaatgatcc tttccaggtt gttgatctta aaagccggat 1080
ccttgttatc cacagggcag tgcgatccta ataagagatc acaatagaac agatctctaa 1140
ataaatagat cttcttttta atacccagga tccatttaac ataatataca ttatgcgcac 1200
ctttagttac aacatactca ggtctttctc aagccgacct agagcgaaaa aacaataata 1260
aaccctgccg gatgcgatgc tgacgcatct tatccggc 1298
<210> 12
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE818
<400> 12
gattacggat tcactcggcc gtcgttttac 30
<210> 13
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE819
<400> 13
gtaaaacgac ggccgagtga atccgtaatc 30
<210> 14
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE1415
<400> 14
ccatgattac ggattaactg gccgtcgttt 30
<210> 15
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE1416
<400> 15
aaacgacggc cagttaatcc gtaatcatgg 30
<210> 16
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE1354
<400> 16
ttacggattc actggccgtc 20
<210> 17
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE1355
<400> 17
catgattacg gattcactgg ccgtcgtttt 30
<210> 18
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE1356
<400> 18
atgaccatga ttacggattc actggccgtc gttttacaac 40
<210> 19
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE1357
<400> 19
ggaaacagct atgaccatga ttacggattc actggccgtc gttttacaac gtcgtgactg 60
<210> 20
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для нРНК_Zins
<400> 20
accaugauua cggauucacu 20
<210> 21
<211> 85
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE1745
<400> 21
gttgagaaag gtgattatca ccatgcgaat taacgaagtt tttacggagg gaaacaatct 60
caaccaatta accaattctg attag 85
<210> 22
<211> 81
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE1746
<400> 22
gccggataag atgcgtcagc atcgcatccg gcagggttta ttattgtttt ttcgctctag 60
acatgtcaat acttgccctt g 81
<210> 23
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности ter
<220>
<221> неопределенный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> неопределенный признак
<222> (3)..(3)
<223> r представляет собой a или g
<220>
<221> неопределенный признак
<222> (4)..(4)
<223> w представляет собой a или t
<220>
<221> неопределенный признак
<222> (13)..(13)
<223> k представляет собой g или t
<400> 23
gnrwgttgta acka 14
<210> 24
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности ter
<220>
<221> неопределенный признак
<222> (2)..(2)
<223> k представляет собой g или t
<220>
<221> неопределенный признак
<222> (4)..(4)
<223> w представляет собой a или t
<220>
<221> неопределенный признак
<222> (13)..(13)
<223> k представляет собой g или t
<400> 24
gkawgttgta acka 14
<210> 25
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности ter (ter A, B, D, E или H)
<400> 25
gtatgttgta acta 14
<210> 26
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности ter (ter A, B, D, E или H)
<400> 26
agtatgttgt aactaaag 18
<210> 27
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности ter (terC)
<400> 27
ggatgttgta acta 14
<210> 28
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности ter (terF)
<400> 28
gtatgttgta acga 14
<210> 29
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности ter (terG)
<400> 29
ggatgttgta acta 14
<210> 30
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности ter (terI)
<400> 30
ggaagttgta acga 14
<210> 31
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности ter (terJ)
<400> 31
gtaagttgta acga 14
<210> 32
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности ter (Bacillus)
<220>
<221> неопределенный признак
<222> (3)..(3)
<223> w представляет собой a или t
<220>
<221> неопределенный признак
<222> (4)..(4)
<223> r представляет собой a или g
<220>
<221> неопределенный признак
<222> (6)..(10)
<223> n представляет собой a, c, g или t
<220>
<221> неопределенный признак
<222> (11)..(11)
<223> y представляет собой t или c
<220>
<221> неопределенный признак
<222> (12)..(12)
<223> n представляет собой a, c, g или t
<220>
<221> неопределенный признак
<222> (19)..(19)
<223> n представляет собой a, c, g или t
<400> 32
acwrannnnn ynatgtacna aat 23
<210> 33
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности ter (Bacillus subtilis)
<220>
<221> неопределенный признак
<222> (8)..(8)
<223> r представляет собой a или g
<220>
<221> неопределенный признак
<222> (10)..(10)
<223> w представляет собой a или t
<220>
<221> неопределенный признак
<222> (12)..(12)
<223> y представляет собой c или t
<400> 33
actaattraw cyatgtacta aat 23
<210> 34
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности ter (Bacillus subtilis)
<220>
<221> неопределенный признак
<222> (8)..(8)
<223> r представляет собой a или g
<220>
<221> неопределенный признак
<222> (10)..(10)
<223> w представляет собой a или t
<220>
<221> неопределенный признак
<222> (12)..(12)
<223> y представляет собой c или t
<400> 34
actaattraw cyatgtacta aattttca 28
<210> 35
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности ter (terVII)
<400> 35
gaactaatta aactatgtac taaattttca 30
<210> 36
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности ter (terIX)
<400> 36
atactaattg atccatgtac taaattttca 30
<210> 37
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид, узнаваемый XerCD
<220>
<221> неопределенный признак
<222> (7)..(7)
<223> y представляет собой c или t
<220>
<221> неопределенный признак
<222> (8)..(8)
<223> r представляет собой a или g
<220>
<221> неопределенный признак
<222> (9)..(9)
<223> y представляет собой c или t
<220>
<221> неопределенный признак
<222> (12)..(17)
<223> n представляет собой a, c, g или t
<220>
<221> неопределенный признак
<222> (23)..(23)
<223> k представляет собой g или t
<220>
<221> неопределенный признак
<222> (28)..(28)
<223> y представляет собой c или t
<400> 37
ggtgcgyrya annnnnntta tgktaaay 28
<210> 38
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид, узнаваемый XerCD (dif и cer)
<220>
<221> неопределенный признак
<222> (7)..(7)
<223> y представляет собой c или t
<220>
<221> неопределенный признак
<222> (9)..(9)
<223> y представляет собой c или t
<220>
<221> неопределенный признак
<222> (12)..(17)
<223> n представляет собой a, c, g или t
<220>
<221> неопределенный признак
<222> (23)..(23)
<223> k представляет собой g или t
<400> 38
ggtgcgyaya annnnnntta tgktaaat 28
<210> 39
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид, узнаваемый XerCD (dif и psi)
<220>
<221> неопределенный признак
<222> (8)..(8)
<223> r представляет собой a или g
<220>
<221> неопределенный признак
<222> (9)..(9)
<223> y представляет собой c или t
<220>
<221> неопределенный признак
<222> (12)..(17)
<223> n представляет собой a, c, g или t
<220>
<221> неопределенный признак
<222> (28)..(28)
<223> y представляет собой c или t
<400> 39
ggtgcgcrya annnnnntta tgttaaay 28
<210> 40
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид, узнаваемый XerCD (dif и psi)
<220>
<221> неопределенный признак
<222> (7)..(7)
<223> y представляет собой c или t
<220>
<221> неопределенный признак
<222> (8)..(8)
<223> r представляет собой a или g
<220>
<221> неопределенный признак
<222> (12)..(17)
<223> n представляет собой a, c, g или t
<220>
<221> неопределенный признак
<222> (23)..(23)
<223> k представляет собой g или t
<220>
<221> неопределенный признак
<222> (28)..(28)
<223> y представляет собой c или t
<400> 40
ggtgcgyrca annnnnntta tgktaaay 28
<210> 41
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности dif
<220>
<221> неопределенный признак
<222> (12)..(17)
<223> n представляет собой a, c, g или t
<400> 41
ggtgcgcata annnnnntta tgttaaat 28
<210> 42
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности cer
<220>
<221> неопределенный признак
<222> (12)..(17)
<223> n представляет собой a, c, g или t
<400> 42
ggtgcgtaca annnnnntta tggtaaat 28
<210> 43
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности psi
<220>
<221> неопределенный признак
<222> (12)..(17)
<223> n представляет собой a, c, g или t
<400> 43
ggtgcgcgca annnnnntta tgttaaac 28
<210> 44
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности dif
<400> 44
ggtgcgcata atgtatatta tgttaaat 28
<210> 45
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности cer
<400> 45
ggtgcgtaca agggatgtta tggtaaat 28
<210> 46
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности psi
<400> 46
ggtgcgcgca agatccatta tgttaaac 28
<210> 47
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для консенсусной последовательности loxP
<400> 47
ataacttcgt atagcataca ttatacgaag ttat 34
<210> 48
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности lox511
<400> 48
ataacttcgt atagtataca ttatacgaag ttat 34
<210> 49
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности lox2272
<400> 49
ataacttcgt ataggatact ttatacgaag ttat 34
<210> 50
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности loxFAS
<400> 50
ataacttcgt atataccttt ctatacgaag ttat 34
<210> 51
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности lox RE
<400> 51
ataacttcgt atagcataca ttatacgaac ggta 34
<210> 52
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности lox LE
<400> 52
taccgttcgt atagcataca ttatacgaag ttat 34
<210> 53
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности FRT
<400> 53
gaagttccta ttctctagaa agtataggaa cttc 34
<210> 54
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности rox
<400> 54
taactttaaa taatgccaat tatttaaagt ta 32
<210> 55
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для последовательности внешнего конца (OE)
<400> 55
ctgtctctta tacacatct 19
<210> 56
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE4386
<400> 56
ggaaacagct atgaccatga ttacggatag cctggccgtc gttttacaac gtcgtgactg 60
<210> 57
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE4387
<400> 57
ggaaacagct atgaccatga ttacggatga attcactggc cgtcgtttta caacgtcgtg 60
<210> 58
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для частичной последовательности lacZ wt
<400> 58
atgaccatga ttacggattc actggccgtc gttttacaa 39
<210> 59
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для частичной последовательности lacZ ins
<400> 59
atgaccatga ttacggattc actcggccgt cgttttacaa 40
<210> 60
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для частичной последовательности lacZ mis
<400> 60
atgaccatga ttacggatta actggccgtc gttttacaa 39
<210> 61
<211> 61
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для частичной последовательности pPKOZins
<400> 61
ggaaacagct atgaccatga ttacggattc actcggccgt cgttttacaa cgtcgtgact 60
g 61
<210> 62
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для частичной последовательности pPKOZ
<400> 62
ggaaacagct atgaccatga ttacggattc actggccgtc gttttacaac gtcgtgactg 60
<210> 63
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE4579
<400> 63
gtgtgtgcaa ttacattagc tcgttcaagt ggcattagaa ggttacgcaa tagatgtcta 60
<210> 64
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE4384
<400> 64
gcctgacggc aatctatcta gcgaaacaag gggcacgaag ttcacattat agaaaaacgt 60
<210> 65
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE4577
<400> 65
ggatagtgtg tgcaattaca ttagctcgtt caagggcatt agaaggttac gcaatagatg 60
<210> 66
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для SUE4381
<400> 66
ggcagcctga cggcaatcta tctagcgaaa caagggcacg aagttcacat tatagaaaaa 60
<210> 67
<211> 3450
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для получения pK3OV
<400> 67
tgatgcctcc gtgtaagggg gatttctgtt catgggggta atgataccga tgaaacgaga 60
gaggatgctc acgatacggg ttactgatga tgaacatgcc cggttactgg aacgttgtga 120
gggtaaacaa ctggcggtat ggatgcggcg ggaccagaga aaaatcactc agggtcaatg 180
ccagcgcttc gttaatacag atgtaggtgt tccacagggt agccagcagc atcctgcgat 240
gcagatccgg aacataatgg tgcagggcgc tgacttccgc gtttccagac tttacgaaac 300
acggaaaccg aagaccattc atgttgttgc tcaggtcgca gacgttttgc agcagcagtc 360
gcttcacgtt cgctcgcgta tcggtgattc attctgctaa ccagtaaggc aaccccgcca 420
gcctagccgg gtcctcaacg acaggagcac gatcatgcta gtcatgcccc gcgcccaccg 480
gaaggagctg actgggttga aggctctcaa gggcatcggt cgagatcccg gtgcctaatg 540
agtgagctaa cttacattaa ttgcgttgcg ctcactgccc gctttccagt cgggaaacct 600
gtcgtgccag ctgcattaat gaatcggcca acgcgcgggg agaggcggtt tgcgtattgg 660
gcgccagggt ggtttttctt ttcaccagtg agacgggcaa cagctgattg cccttcaccg 720
cctggccctg agagagttgc agcaagcggt ccacgctggt ttgccccagc aggcgaaaat 780
cctgtttgat ggtggttaac ggcgggatat aacatgagct gtcttcggta tcgtcgtatc 840
ccactaccga gatgtccgca ccaacgcgca gcccggactc ggtaatggcg cgcattgcgc 900
ccagcgccat ctgatcgttg gcaaccagca tcgcagtggg aacgatgccc tcattcagca 960
tttgcatggt ttgttgaaaa ccggacatgg cactccagtc gccttcccgt tccgctatcg 1020
gctgaatttg attgcgagtg agatatttat gccagccagc cagacgcaga cgcgccgaga 1080
cagaacttaa tgggcccgct aacagcgcga tttgctggtg acccaatgcg accagatgct 1140
ccacgcccag tcgcgtaccg tcttcatggg agaaaataat actgttgatg ggtgtctggt 1200
cagagacatc aagaaataac gccggaacat tagtgcaggc agcttccaca gcaatggcat 1260
cctggtcatc cagcggatag ttaatgatca gcccactgac gcgttgcgcg agaagattgt 1320
gcaccgccgc tttacaggct tcgacgccgc ttcgttctac catcgacacc accacgctgg 1380
cacccagttg atcggcgcga gatttaatcg ccgcgacaat ttgcgacggc gcgtgcaggg 1440
ccagactgga ggtggcaacg ccaatcagca acgactgttt gcccgccagt tgttgtgcca 1500
cgcggttggg aatgtaattc agctccgcca tcgccgcttc cactttttcc cgcgttttcg 1560
cagaaacgtg gctggcctgg ttcaccacgc gggaaacggt ctgataagag acaccggcat 1620
actctgcgac atcgtataac gttactggtt tcacattcac caccctgaat tgactctctt 1680
ccgggcgcta tcatgccata ccgcgaaagg ttttgcgcca ttcgatggtg tccgggatct 1740
cgacgctctc ccttatgcga ctcctgcatt aggaagcagc ccagtagtag gttgaggccg 1800
ttgagcaccg ccgccgcaag gaatggtgca tgcaaggaga tggcgcccaa cagtcccccg 1860
gccacggggc ctgccaccat acccacgccg aaacaagcgc tcatgagccc gaagtggcga 1920
gcccgatctt ccccatcggt gatgtcggcg atataggtta aataccctgt agcggtatag 1980
ataaaacgtt ggtttgcaaa aaaaatcctt agctttcgct aaggatctgc attagaaaaa 2040
ctcatcgagc atcaaatgaa actgcaattt attcatatca ggattatcaa taccatattt 2100
ttgaaaaagc cgtttctgta atgaaggaga aaactcaccg aggcagttcc ataggatggc 2160
aagatcctgg tatcggtctg cgattccgac tcgtccaaca tcaatacaac ctattaattt 2220
cccctcgtca aaaataaggt tatcaagtga gaaatcacca tgagtgacga ctgaatccgg 2280
tgagaatggc aaaagcttat gcatttcttt ccagacttgt tcaacaggcc agccattacg 2340
ctcgtcatca aaatcactcg catcaaccaa accgttattc attcgtgatt gcgcctgagc 2400
gagacgaaat acgcgatcgc tgttaaaagg acaattacaa acaggaatcg aatgcaaccg 2460
gcgcaggaac actgccagcg catcaacaat attttcacct gaatcaggat attcttctaa 2520
tacctggaat gctgttttcc cggggatcgc agtggtgagt aaccatgcat catcaggagt 2580
acggataaaa tgcttgatgg tcggaagagg cataaattcc gtcagccagt ttagtctgac 2640
catctcatct gtaacatcat tggcaacgct acctttgcca tgtttcagaa acaactctgg 2700
cgcatcgggc ttcccataca atcgatagat tgtcgcacct gattgcccga cattatcgcg 2760
agcccattta tacccatata aatcagcatc catgttggaa tttaatcgcg gcctcgagca 2820
agacgtttcc cgttgaatat ggctcataac acgttccttg tattacgtta caagtataac 2880
acaaagtttt ttatgttgtc aagtttatgt aagcagacag ttttattgtt catgatgata 2940
tatttttatc ttgtgcaatg taacatcaga gattttgaga cacaacgtgg ctttgaagat 3000
ccggcagaag aatggagtat gttgtaacta aagataactt cgtataatgt atgctatacg 3060
aagttataca gatcgtgcga tctactgtgg ataactctgt caggaagctt ggatcaaccg 3120
gtagttatcc aaagaacaac tgttgttcag tttttgagtt gtgtataacc cctcattctg 3180
atcccagctt atacggtcca ggatcaccga tcattcacag ttaatgatcc tttccaggtt 3240
gttgatctta aaagccggat ccttgttatc cacagggcag tgcgatccta ataagagatc 3300
acaatagaac agatctctaa ataaatagat cttcttttta atacccagga tcctttagtt 3360
acaacatact caggtctttc tcaagccgac cgccagcaac cgcacctgtg gcgccggtga 3420
tgccggccac gatgcgtccg gcgtagccta 3450
<210> 68
<211> 61
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для vioA со вставкой одного основания
<400> 68
ggatagtgtg tgcaattaca ttagctcgtt caagtggcat tagaaggtta cgcaatagat 60
g 61
<210> 69
<211> 61
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетический нуклеотид для vioC со вставкой одного основания
<400> 69
ggcagcctga cggcaatcta tctagcgaaa caaggggcac gaagttcaca ttatagaaaa 60
a 61
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ДНК И НАБОР ДЛЯ СВЯЗЫВАНИЯ ФРАГМЕНТОВ ДНК | 2018 |
|
RU2769465C2 |
| СПОСОБ АМПЛИФИКАЦИИ КОЛЬЦЕВОЙ ДНК | 2017 |
|
RU2748736C2 |
| СПОСОБ РЕПЛИКАЦИИ ИЛИ АМПЛИФИКАЦИИ КОЛЬЦЕВОЙ ДНК | 2018 |
|
RU2752611C2 |
| ЗОНД НУКЛЕИНОВОЙ КИСЛОТЫ И СПОСОБ ДЕТЕКТИРОВАНИЯ ГЕНОМНЫХ ФРАГМЕНТОВ | 2014 |
|
RU2733888C2 |
| Способ безметочного одномолекулярного секвенирования ДНК и устройство для его реализации | 2017 |
|
RU2679494C1 |
| СЛОЖНЫЕ КОМПЛЕКСЫ СВЯЗАННОЙ НА ПОВЕРХНОСТИ ТРАНСПОСОМЫ | 2020 |
|
RU2790295C2 |
| СПОСОБЫ АМПЛИФИКАЦИИ ДНК ДЛЯ СОХРАНЕНИЯ СТАТУСА МЕТИЛИРОВАНИЯ | 2018 |
|
RU2754038C2 |
| СПОСОБ АМПЛИФИКАЦИИ ДНК И КОМПОЗИЦИЯ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2000 |
|
RU2260055C2 |
| СПОСОБ БЕЗМЕТОЧНОГО ОДНОМОЛЕКУЛЯРНОГО СЕКВЕНИРОВАНИЯ ДНК И УСТРОЙСТВО ДЛЯ ЕГО РЕАЛИЗАЦИИ НА ОСНОВЕ ЗАРЯДОЧУВСТВИТЕЛЬНОГО СЕНСОРА | 2021 |
|
RU2780050C1 |
| МУЛЬТИПЛЕКСНОЕ ДЕТЕКТИРОВАНИЕ НУКЛЕИНОВЫХ КИСЛОТ | 2014 |
|
RU2733887C2 |
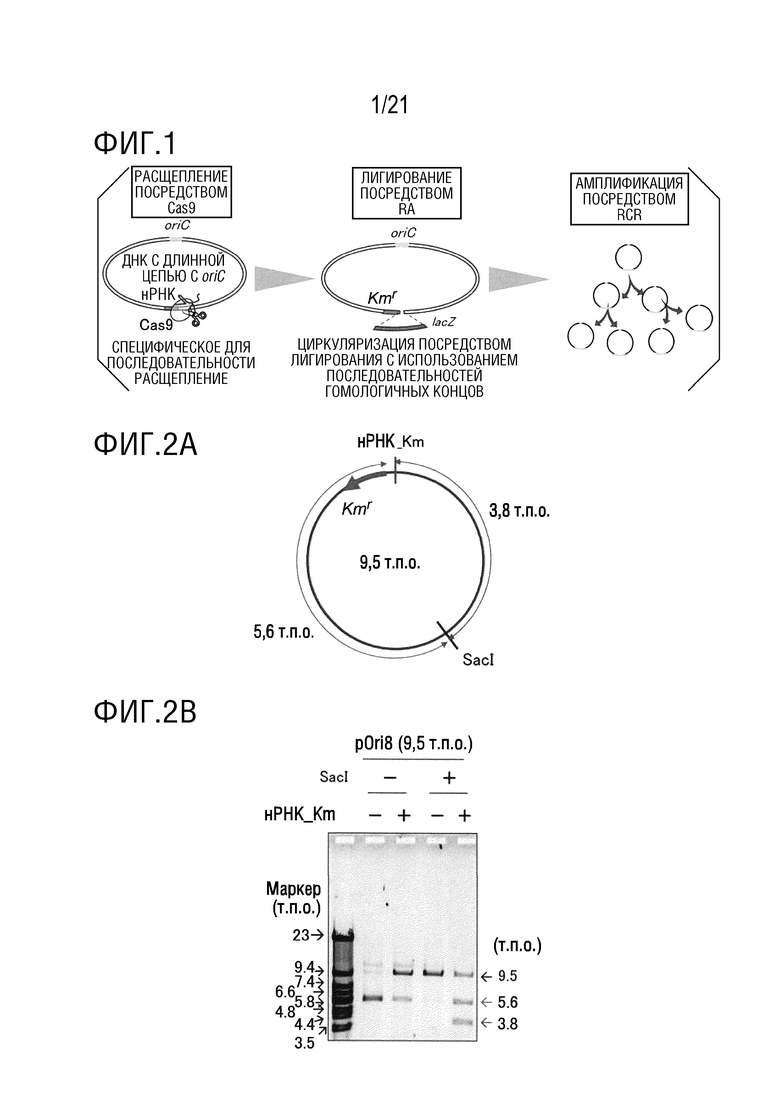
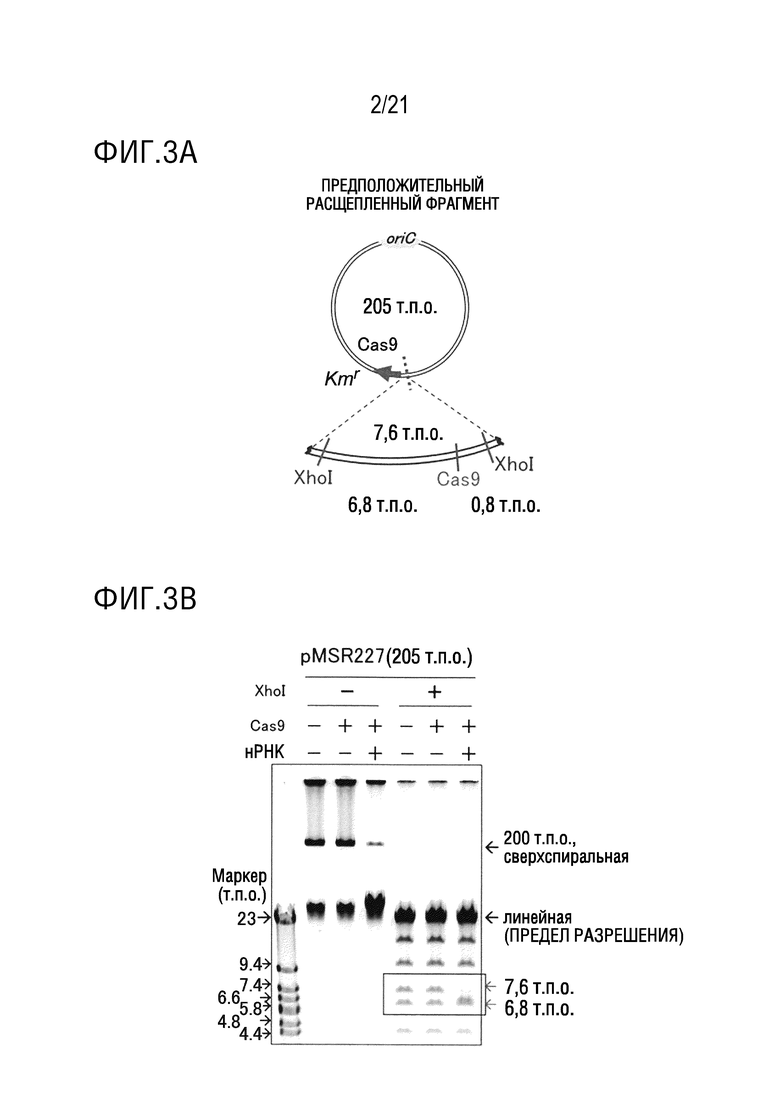
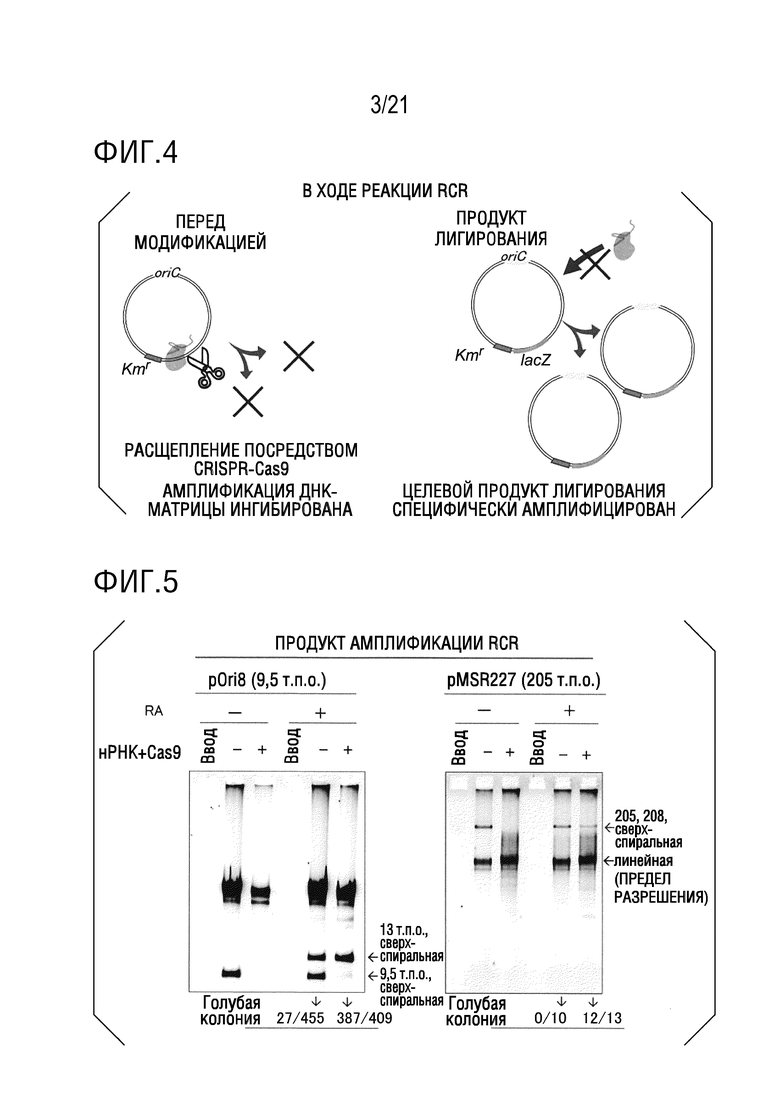
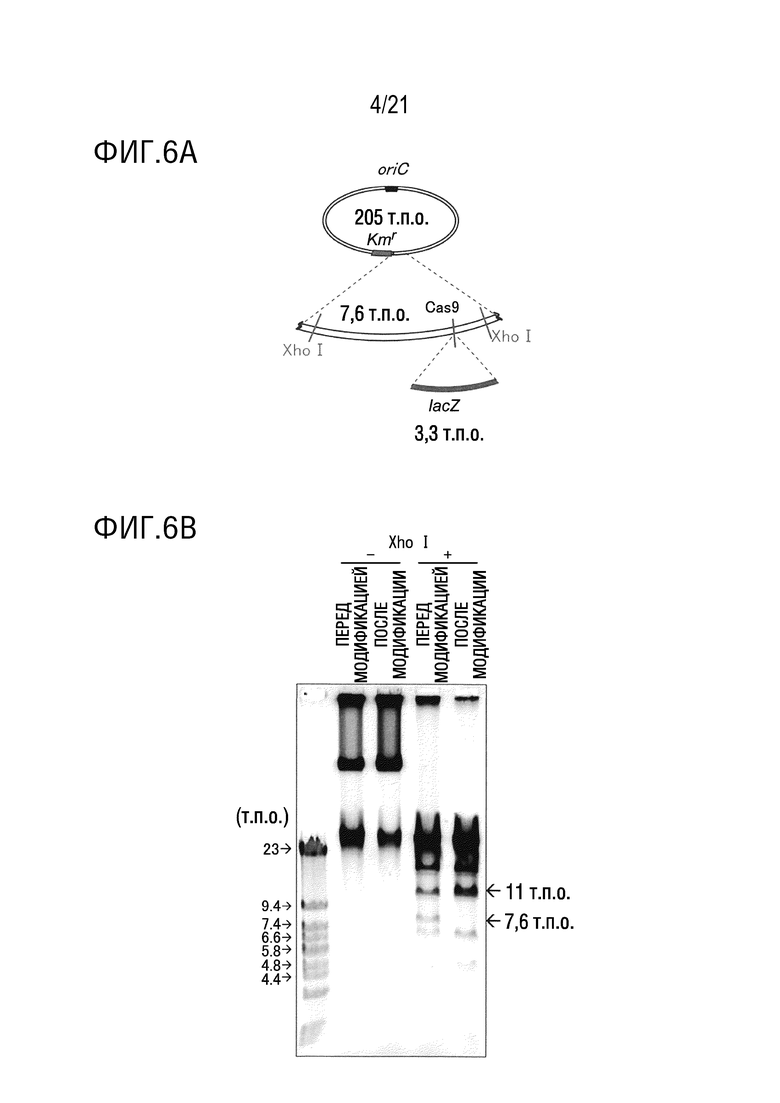
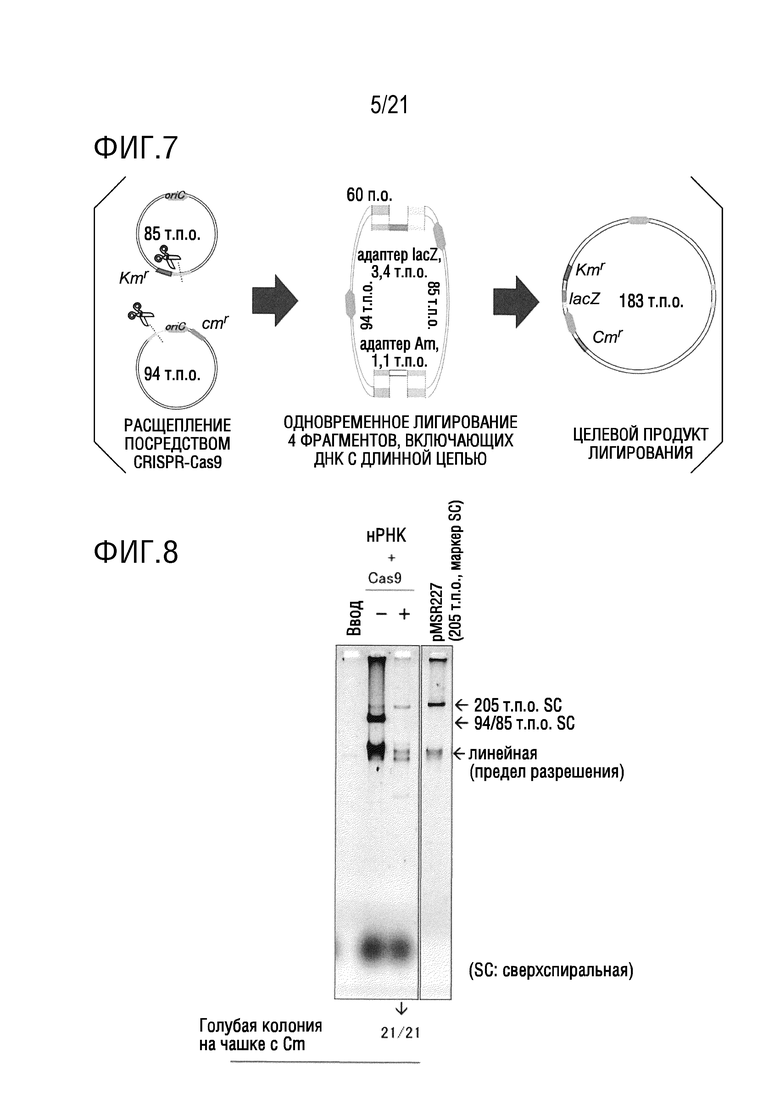
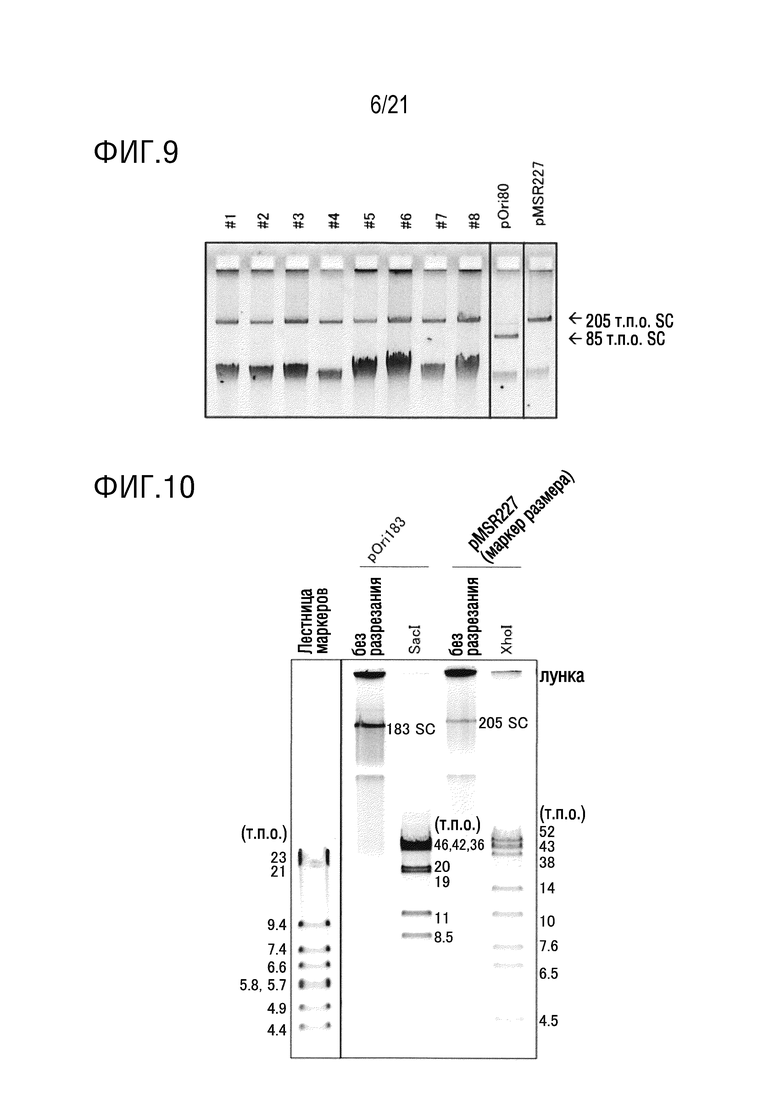
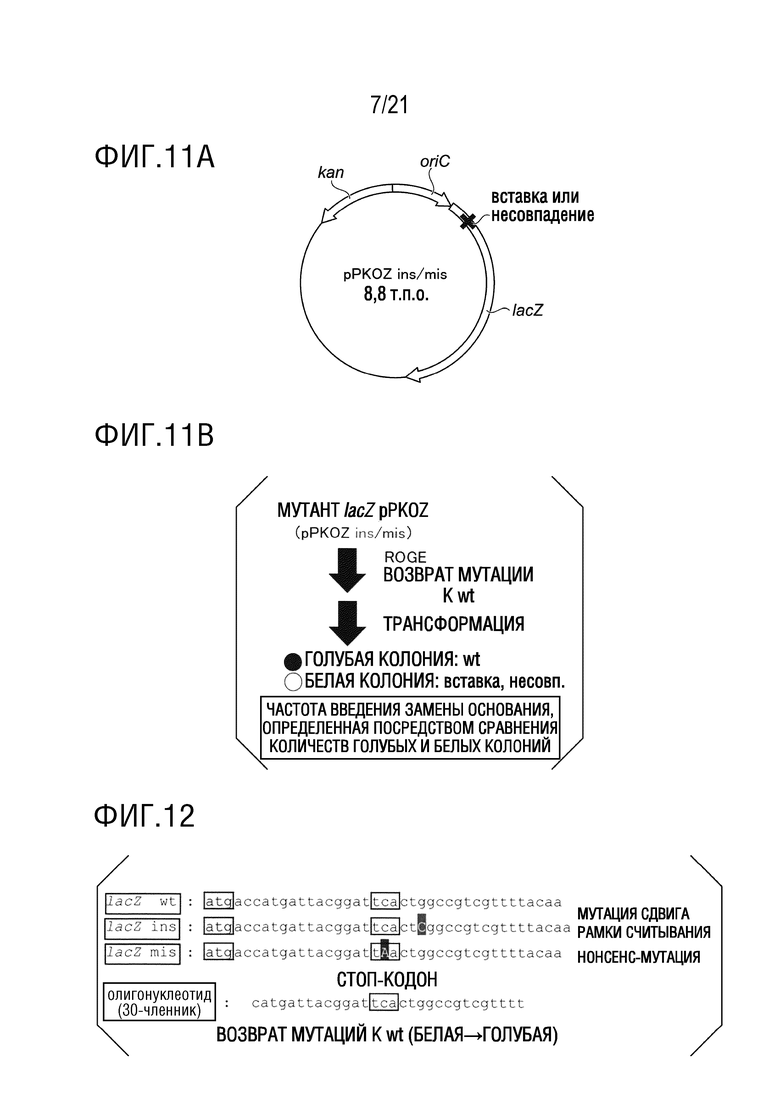
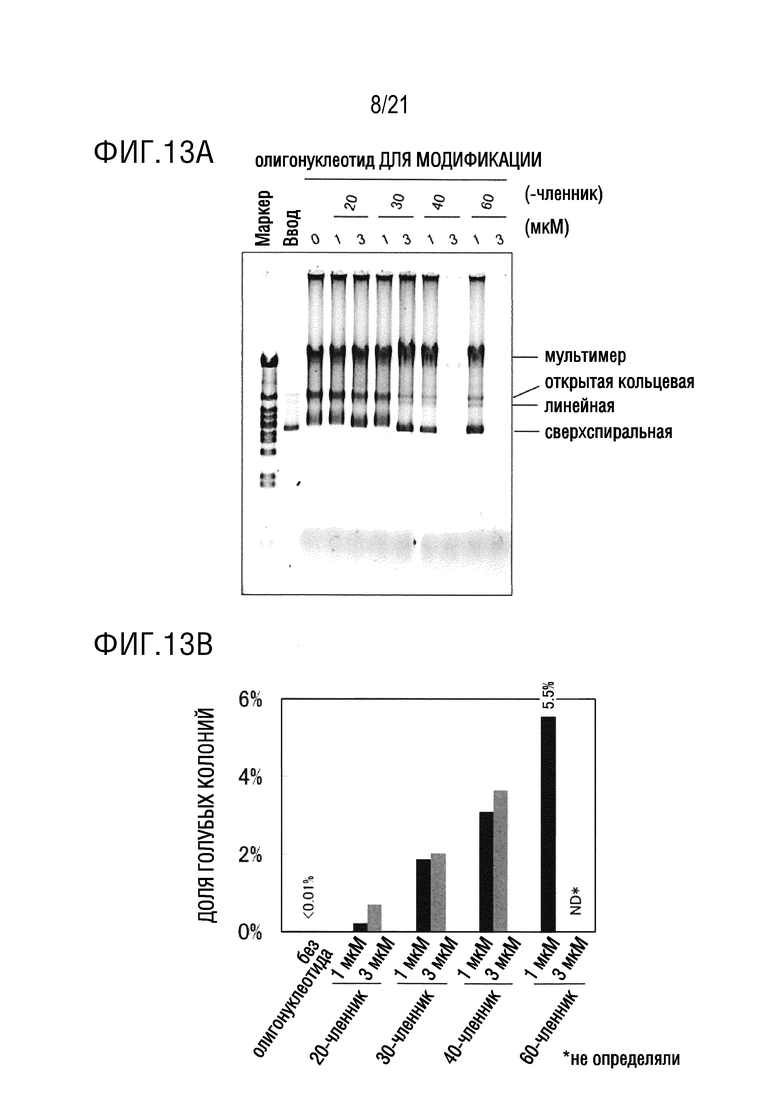
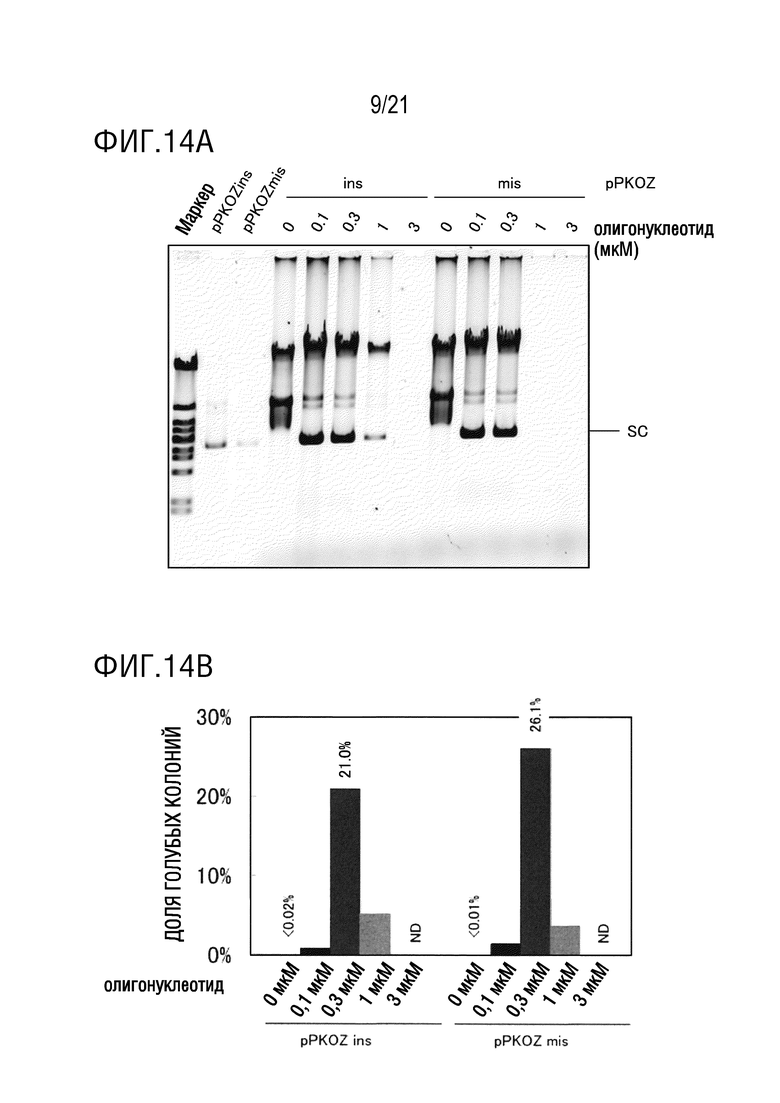
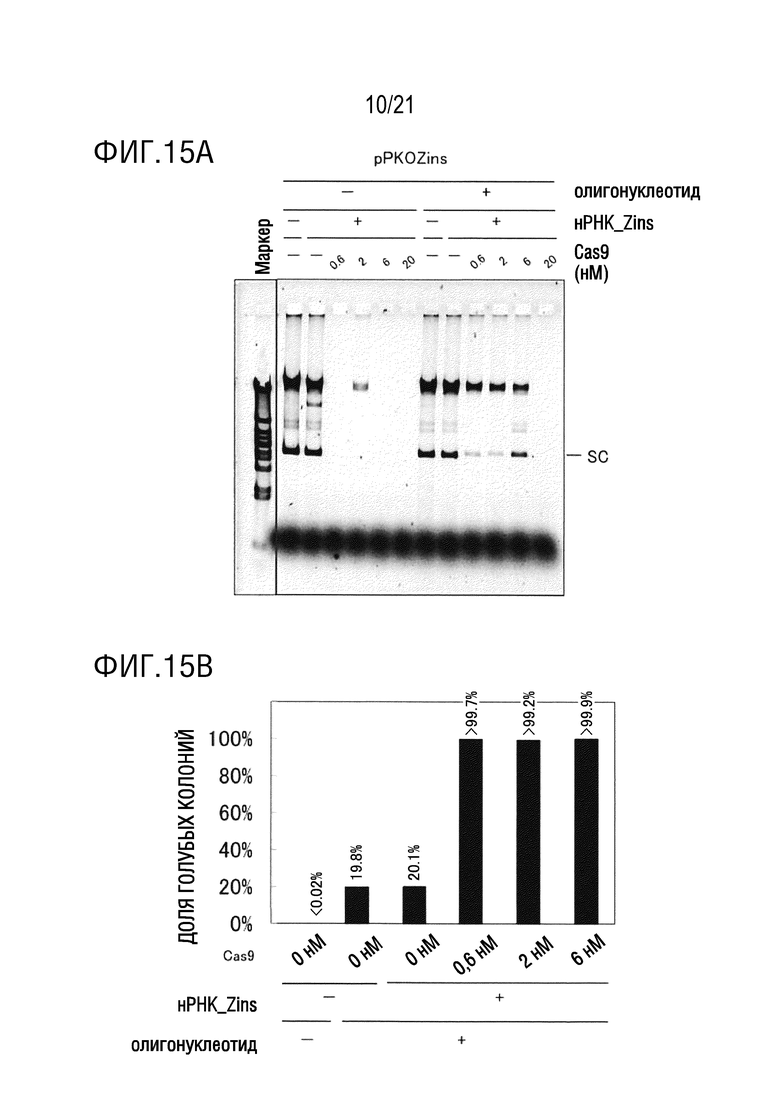
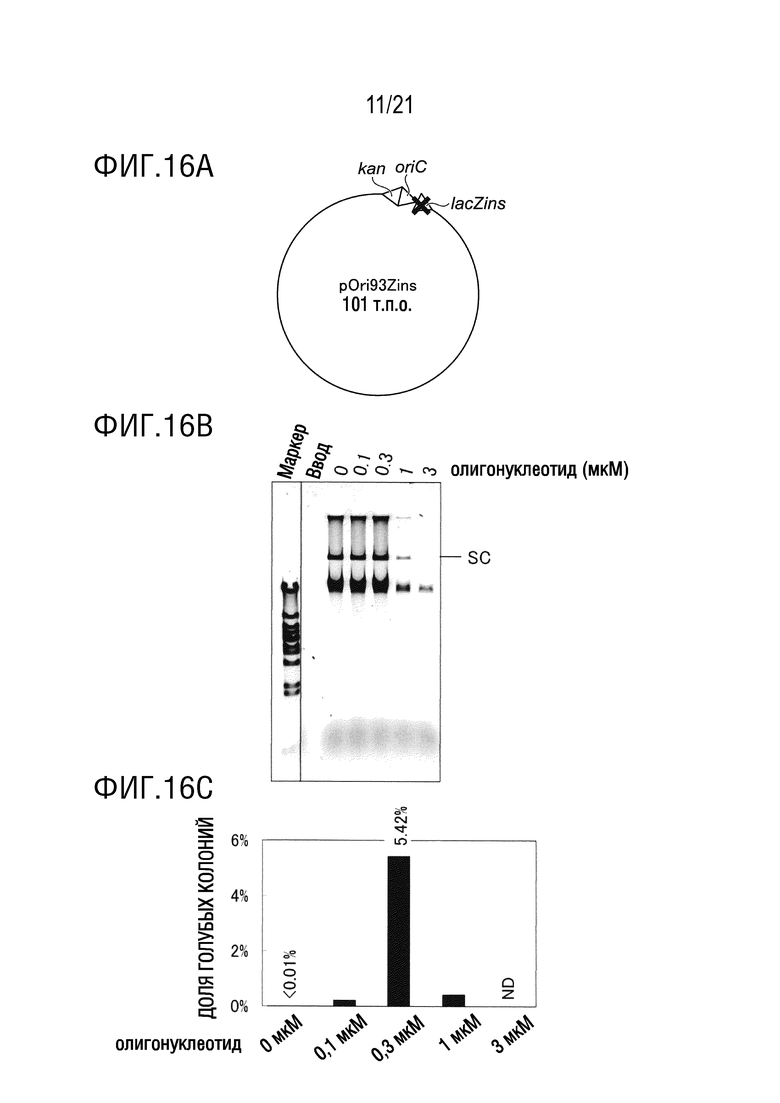
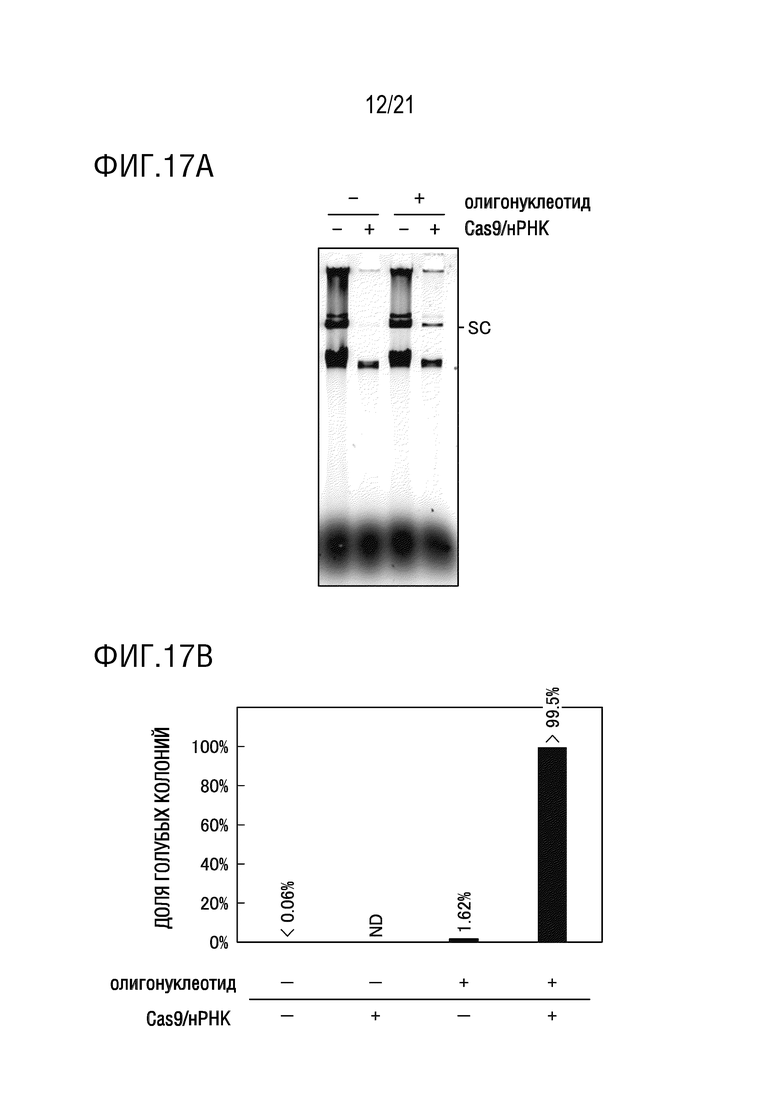


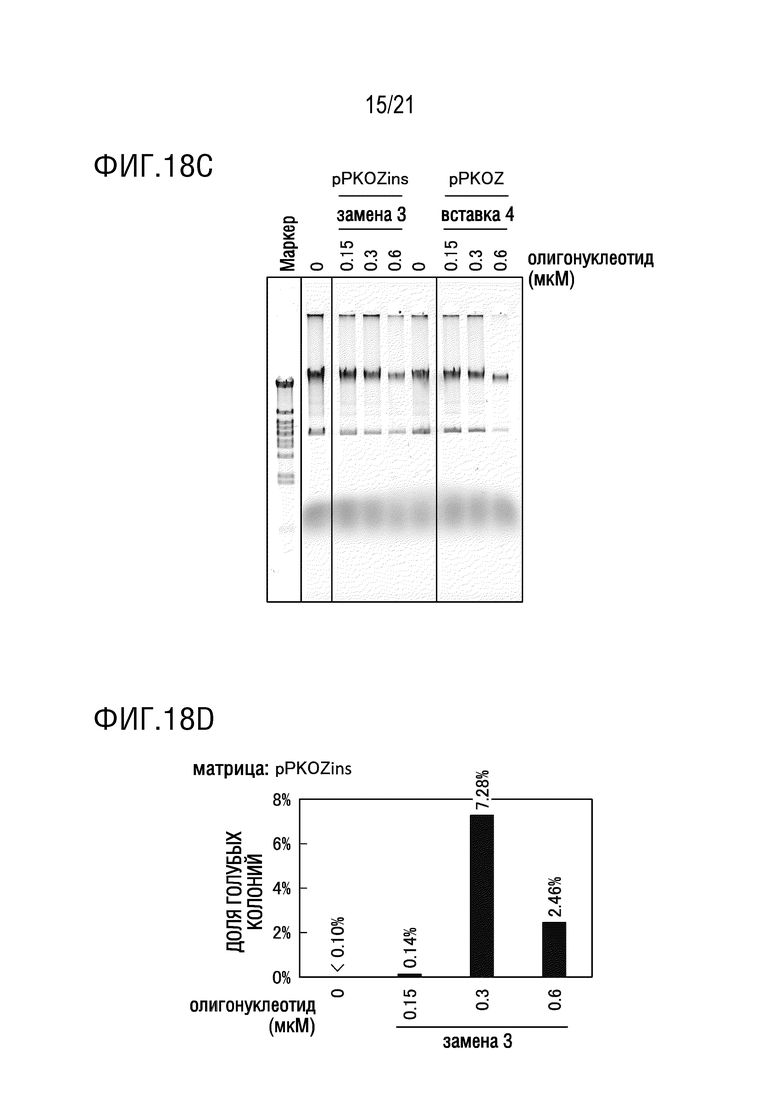
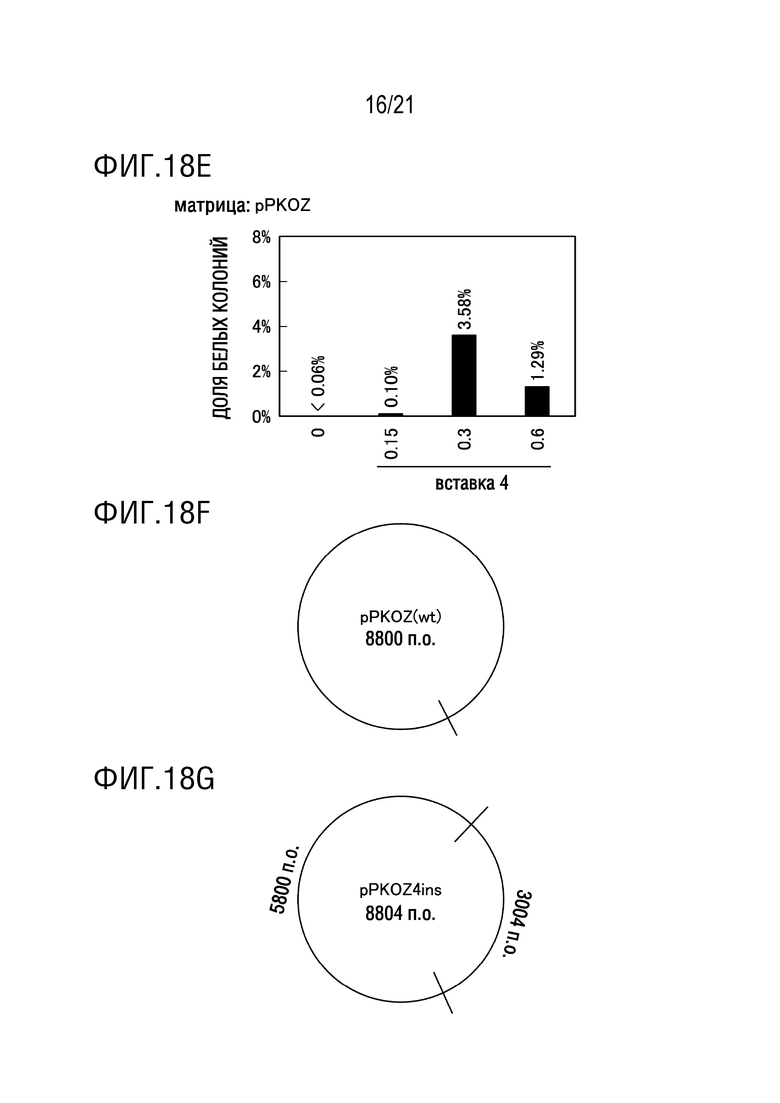
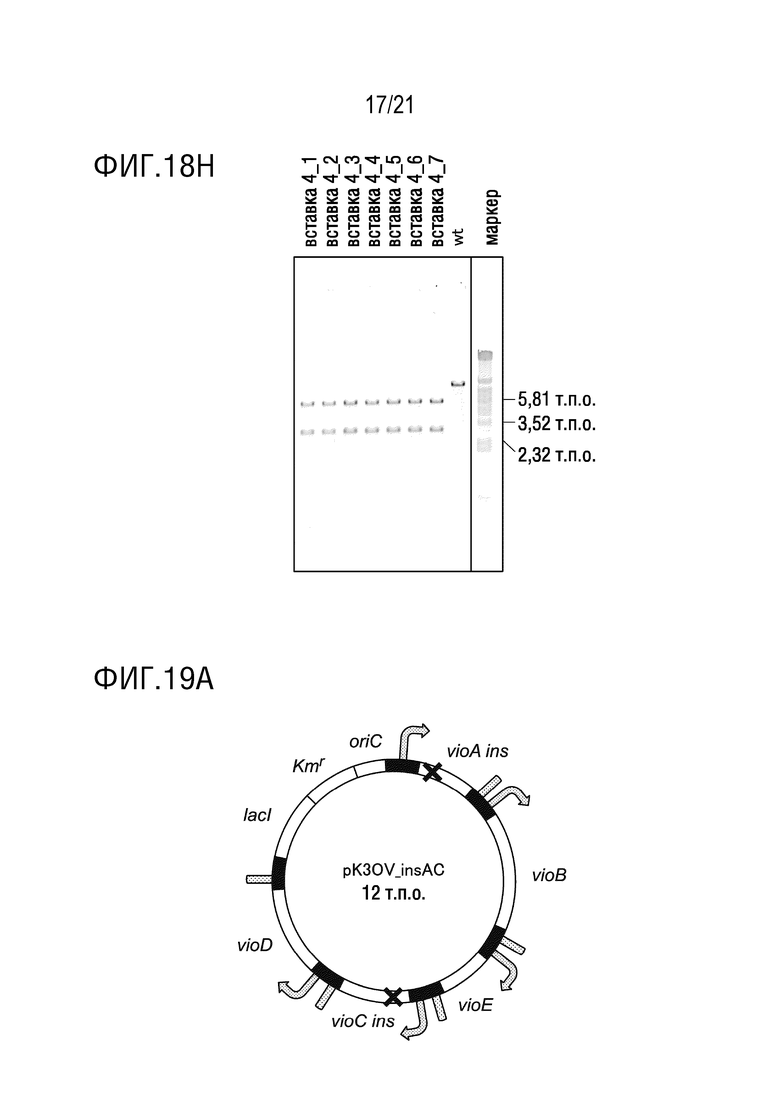
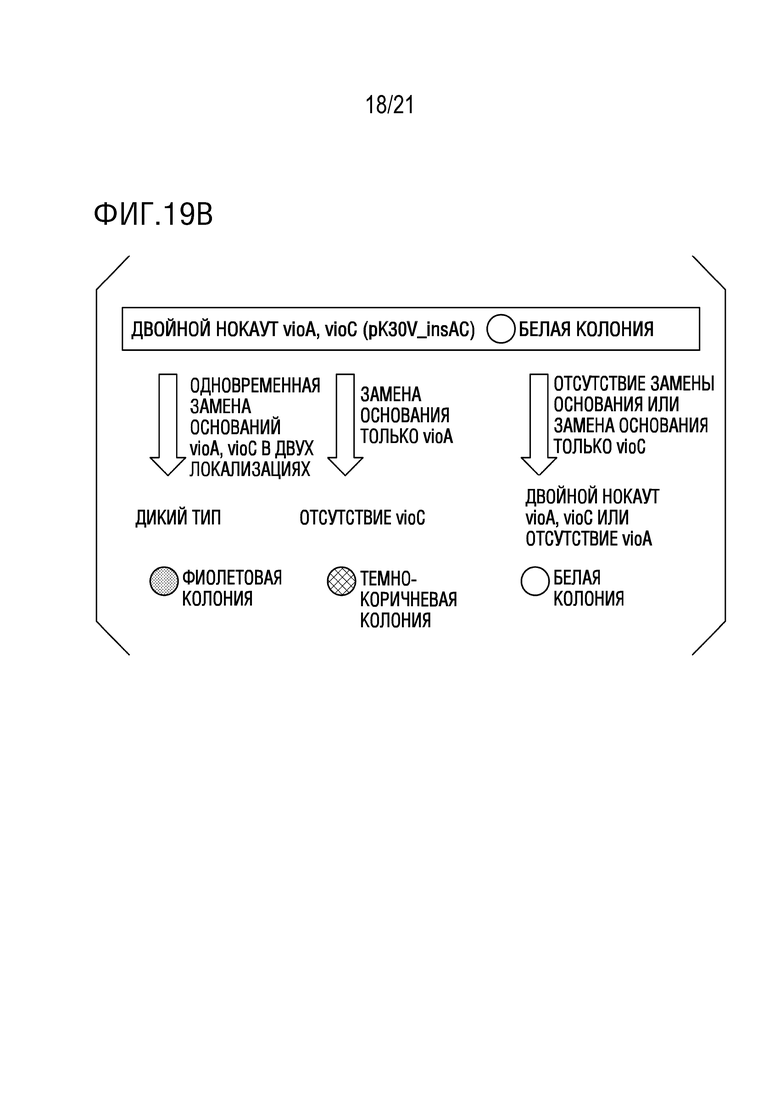

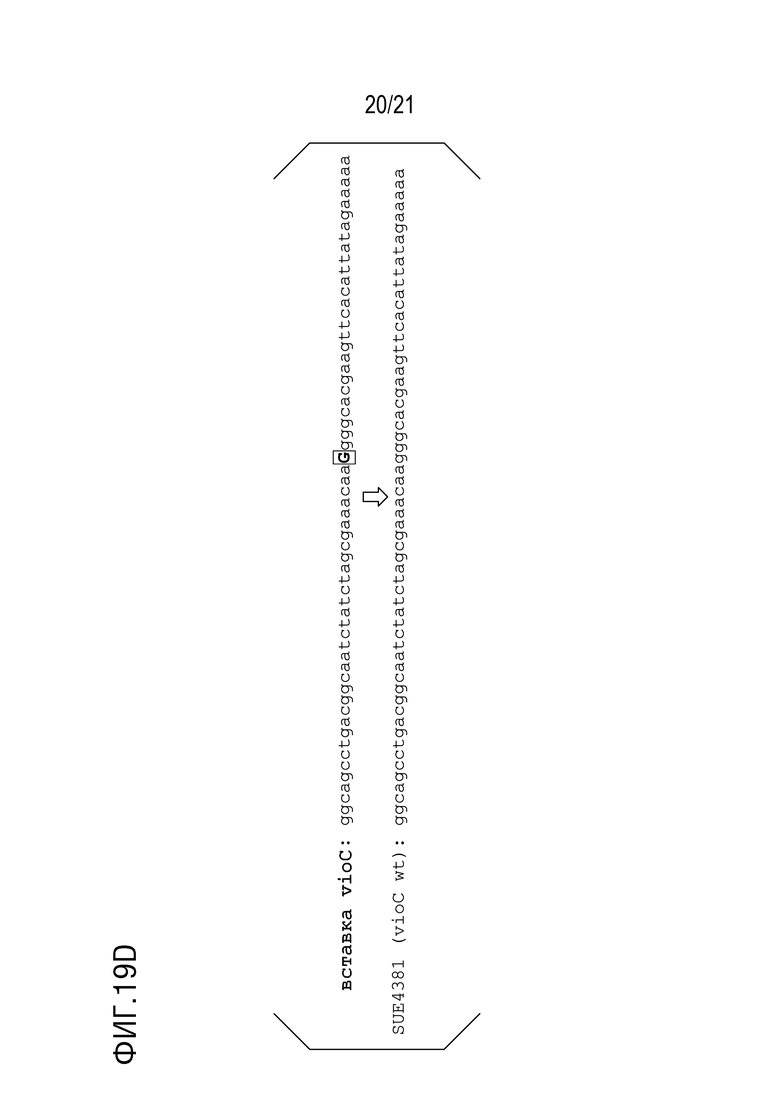
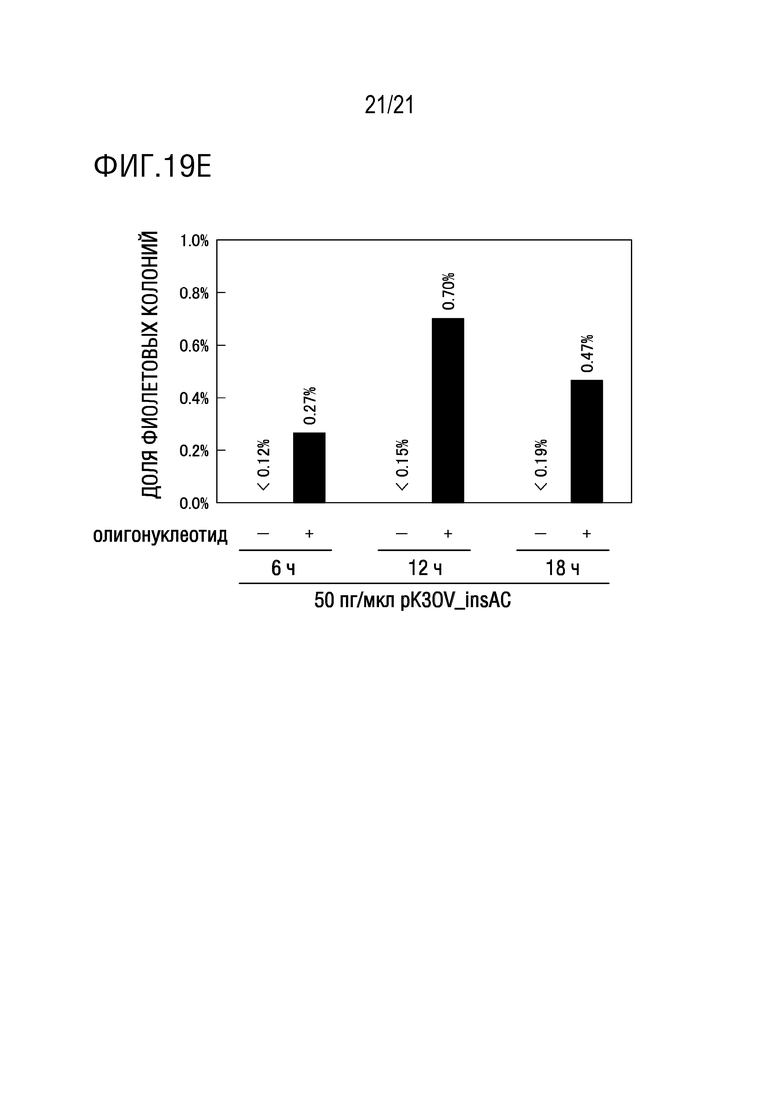
Изобретение относится к области биотехнологии, в частности к способу редактирования ДНК в бесклеточной системе, включающему стадию введения делеции, замены или добавления в участок-мишень ДНК в бесклеточной системе и стадию амплификации в бесклеточной системе ДНК, где ДНК амплифицируют в условиях температуры с инкубацией при температуре в диапазоне от 20 до 80°C и где стадию проведения реакции репликации ДНК проводят в присутствии одноцепочечной ДНК. Также раскрыт способ редактирования ДНК в бесклеточной системе, где стадию амплификации проводят в присутствии искусственного фермента для расщепления ДНК, специфически расщепляющего ДНК, в которую не введены делеция, замена или добавление. Изобретение эффективно для редактирования ДНК в бесклеточной системе с улучшенным выходом продукта редактированной ДНК. 2 н. и 12 з.п. ф-лы, 19 ил., 7 табл., 10 пр.
1. Способ редактирования ДНК в бесклеточной системе, включающий следующие стадии:
(1) стадия введения делеции, замены или добавления в участок-мишень ДНК в бесклеточной системе и
(2) стадия амплификации, в бесклеточной системе, ДНК, в которую делеция, замена или добавление введены на стадии (1), где ДНК амплифицируют в условиях температуры с инкубацией при температуре в диапазоне от 20 до 80°C,
где стадия (1) включает следующие стадии:
стадия проведения реакции репликации ДНК в присутствии одноцепочечной ДНК, используемой для введения делеции, замены или добавления, где одноцепочечная ДНК может гибридизоваться с участком-мишенью ДНК в условиях реакции репликации.
2. Способ редактирования ДНК в бесклеточной системе по п.1, включающий следующие стадии:
(1) стадия введения делеции, замены или добавления в участок-мишень ДНК в бесклеточной системе и
(2) стадия амплификации, в бесклеточной системе, ДНК, в которую делеция, замена или добавление введены на стадии (1), где ДНК амплифицируют в условиях температуры либо с инкубацией при постоянной температуре, либо с инкубацией при повторяющемся цикле температур, в котором инкубацию проводят при двух температурах 65°C или ниже.
3. Способ редактирования ДНК в бесклеточной системе по п.1 или 2, включающий следующие стадии:
(1) стадия введения делеции, замены или добавления в участок-мишень ДНК в бесклеточной системе и
(2) стадия амплификации, в бесклеточной системе, ДНК, в которую делеция, замена или добавление введены на стадии (1), где ДНК амплифицируют в условиях температуры либо с инкубацией при фиксированной температуре в диапазоне от 20 до 80°C, либо с инкубацией при повторяющемся цикле температур, в котором инкубацию проводят при двух температурах 65°C или ниже.
4. Способ по любому из пп. 1-3, где стадию (2) проводят в присутствии искусственного фермента для расщепления ДНК, специфически расщепляющего ДНК, в которую не введены делеция, замена или добавление.
5. Способ редактирования ДНК в бесклеточной системе, включающий следующие стадии:
(1) стадия введения делеции, замены или добавления в участок-мишень ДНК в бесклеточной системе и
(2) стадия амплификации, в бесклеточной системе, ДНК, в которую делеция, замена или добавление введены на стадии (1), где ДНК амплифицируют в условиях температуры с инкубацией при фиксированной температуре в диапазоне от 20 до 80°C,
где стадия (1) включает следующие стадии:
(1-3) стадия соединения друг с другом линейной ДНК и одного или нескольких типов фрагментов ДНК в областях, в которых последовательности оснований являются гомологичными, или в областях, в которых последовательности оснований являются комплементарными, таким образом, с образованием ДНК, в которой каждый из одного или нескольких типов фрагментов ДНК вставлен в участок-мишень ДНК-матрицы, и
стадию (2) проводят в присутствии искусственного фермента для расщепления ДНК, специфически расщепляющего ДНК, в которую не введены делеция, замена или добавление.
6. Способ по п.4 или 5, где искусственный фермент для расщепления ДНК представляет собой искусственную нуклеазу или направляемую РНК нуклеазу.
7. Способ по п.4 или 5, где искусственный фермент для расщепления ДНК представляет собой CRISPR-Cas9.
8. Способ по любому из пп. 1-7, где ДНК представляет собой кольцевую ДНК.
9. Способ по п.8, где стадия (2) включает следующие стадии:
(2-1) стадия получения реакционной смеси из: реакционного раствора, содержащего (a) первую группу ферментов, которая катализирует репликацию кольцевой ДНК, (b) вторую группу ферментов, которая катализирует реакцию лигирования фрагментов Оказаки и синтезирует две сестринские кольцевые ДНК, формирующие катенан, и (c) третью группу ферментов, которая катализирует реакцию разделения двух сестринских кольцевых ДНК; и кольцевую ДНК, в которую делеция, замена или добавление введены на стадии (1); и
(2-2) стадия инкубации реакционной смеси, полученной на стадии (2-1), либо при фиксированной температуре в диапазоне от 20 до 80°C, либо при повторяющемся цикле температур, в котором инкубацию проводят при двух температурах 65°C или ниже.
10. Способ по п.9, где кольцевая ДНК содержит последовательность точки начала репликации, которая может связываться с ферментом, имеющим активность DnaA.
11. Способ по п.8, где на стадии (2), кольцевую ДНК амплифицируют посредством амплификации по типу катящегося кольца.
12. Способ по п. 5, где стадия (1) включает следующие стадии до стадии (1-3):
(1-1) стадия расщепления ДНК в участке-мишени для получения по меньшей мере одной линейной ДНК посредством вынуждения искусственного фермента для расщепления ДНК действовать на ДНК; и
(1-2) стадия получения реакционного раствора, содержащего линейную ДНК, полученную на стадии (1-1), один или несколько типов фрагментов ДНК и белок, имеющий активность рекомбиназы семейства RecA.
13. Способ по любому из пп. 1-4, где на стадии (2) ДНК амплифицируют в условиях температуры с инкубацией при цикле температур, в котором повторяют инкубацию при 30°C или выше и инкубацию при 27°C или ниже.
14. Способ по любому из пп. 1-13, где размер ДНК, в которую введены делеция, замена или добавление, составляет 50 т.п.о. или больше.
| BRETT M | |||
| SANSBURY et al., CRISPR-Directed In Vitro Gene Editing of Plasmid DNA Catalyzed by Cpf1 (Cas12a) Nuclease and a Mammalian Cell-Free Extract, CRISPR J., 2018 Apr 1; 1(2): 191-202 | |||
| WO2017199991 A1, 23.11.2017 | |||
| WO2017123921 A1, 20.07.2017 | |||
| JP2016077180 A, 16.05.2016 | |||
| СПОСОБ АМПЛИФИКАЦИИ МАТРИЧНОЙ НУКЛЕИНОВОЙ КИСЛОТЫ | 2001 |
|
RU2284357C2 |
Авторы
Даты
2022-03-15—Публикация
2019-07-30—Подача