Изобретение относится к медицине, а именно к терапии и инфекционным болезням, и может быть использовано для определения количества циркулирующих эндотелиальных клеток и активированных тромбоцитов при диагностике поражения сосудистого эндотелия, в том числе при SARS-CoV-2.
На сегодняшний день ангиотензин-превращающий фермент 2 (АПФ2) однозначно определен как транспортер в клетку-мишень, в частности, для вируса SARS-CoV-2 (Severe acute respiratory syndrome-related coronavirus 2 - тяжелый острый респираторный синдром, связанный с коронавирусом 2) и играет решающую роль в патогенезе заболевания COVID-19 (coronavirus disease, кронавирусное заболевание - 2019). Так как АПФ2 в большом количестве представлен в эндотелиальных клетках, выстилающих стенку сосуда, вирус SARS-CoV-2 проникает в эндотелиоциты, реплицируется в них и выходит в кровоток, что в итоге приводит к гибели клеток. Клетки отделяются от стенки сосуда (десквамация эндотелиальных клеток), формируя циркулирующий эндотелий и оголяя тромбогенную и провоспалительную субэндотелиальную поверхность (денудация сосудов), что в свою очередь приводит, во-первых, к активации тромбоцитов, обусловливающей развитие выраженной коагулопатии, и, во-вторых, к периваскулярному воспалению и отеку тканей.
Эндотелиоциты (эндотелиальные клетки, ЭК) сосудистой стенки характеризуются выраженной морфологической неоднородностью. Это плоские вытянутые клетка мезенхимного происхождения, толщиной около 0,1-2 мкм, диаметром 10-40 мкм. Ядро расположено центрально, более или менее крупное, круглой или овальной формы. Неприкрепленные к сосудистой стенке циркулирующие эндотелиальные клетки (ЦЭК) представляют собой зрелые и дифференцированные клетки полигональной или округлой формы. Точное происхождение ЦЭК в настоящее время до конца не определено. Считается, что ЦЭК могут появляться в крови в результате их нормального процесса рециркуляции в виде жизнеспособных клеток и у здоровых лиц представлены в незначительном количестве. А также вследствие воздействия патогенов, сердечно-сосудистых нарушений или воспалительных заболеваний (иммуноопосредованных васкулитах, злокачественных новообразованиях и др.), в результате чего число ЦЭК в кровотоке повышается. Поэтому уровень ЦЭК в периферической крови считается отражением системного повреждения эндотелия и квалифицируется как достоверный и воспроизводимый маркер для оценки его повреждения/дисфункции.
Поскольку характерным и наиболее опасным следствием патологического процесса, характерного для поражения сосудистого эндотелия, особенно при SARS-CoV-2, является образование артериальных и венозных тромбов, препятствующих кровоснабжению органов и газообмену в легких, то естественно, что одним из важнейших факторов развития патологического процесса является активация тромбоцитов. Поэтому концентрация активированных тромбоцитов является важным показателем.
Исходя из анализа литературных источников, наиболее часто используемым методом оценки количества ЦЭК является поточная флуориметрия, с помощью которой выявляют пул ЦЭК как события CD45- (дифференцировка гемопоэтических клеток), сочетание нуклеотропного (ядерного) красителя Syto16+ и маркера CD31+ для исключения тромбоцитов, а остальные события анализируются по экспрессии эндотелиального антигена CD146 (в этом случае контаминация Т-лимфоцитами исключается негативностью окрашивания по CD45) [Mancuso Р, 2009; Gian PF, 2010; Kraan J, 2012].
Однако при поражении эндотелиоцитов, например, вирусом SARS-CoV-2 данный способ не эффективен, так как он учитывает только зрелые здоровые полноценные и целостные ядерные клетки с экспрессией эндотелиального антигена. Однако еще в 70-е годы прошлого века ЦЭК были определены не только как интактные, содержащие ядра клетки, но и как уже поврежденные и погибшие клетки, безъядерные клеточные «каркасы».
Задачей изобретения является создание эффективного способа определения количества циркулирующих эндотелиальных клеток и активированных тромбоцитов, позволяющего выявлять поражение сосудистого эндотелия и, следовательно, своевременно начать терапию, направленную на коррекцию патологического процесса, а также оценить эффективность применяемой терапии.
Технический результат заключается в повышении эффективности способа.
Это достигается тем, что в заявляемом способе выявления поражения сосудистого эндотелия, включающем определение количества циркулирующих эндотелиальных клеток и активированных тромбоцитов в крови пациентов методом последовательного гейтирования, где подсчет циркулирующих эндотелиальных клеток ведут по фракциям CD45-CD31+CD42b-, а подсчет активированных тромбоцитов CD45-CD31+CD42b+, и по количеству циркулирующих эндотелиальных клеток и активированных тромбоцитов выявляют поражение сосудистого эндотелия.
Поскольку заболевания, связанные с поражением сосудистого эндотелия, особенно при SARS-CoV-2, проявляются выраженной эндотелиальной дисфункцией, данный подход подсчета ЦЭК по фракции CD45-CD31+CD42b- дает возможность учитывать не только зрелые здоровые и целостные, интактные, содержащие ядра, клетки, а все ЦЭК в кровотоке, в том числе погибшие десквамированные ЭК, представленные в виде безъядерных клеточных «каркасов». А поскольку характерным и наиболее опасным следствием эндотелиальной дисфункции является образование артериальных и венозных тромбов, последовательное гейтирование CD45-CD31+CD42b+ дает хорошую возможность оценить количество активированных тромбоцитов, адгезированных на клетках мононуклеарной фракции, а также их агрегатов.
Осуществление способа.
Определение количества ЦЭК в периферической крови осуществляют на проточном цитометре FACS Canto II ("Becton Dickinson", США) с использованием флуорисцентных моноклональных антител против следующих антигенов: CD45, конъюгированный с FITC (fluorescein isothiocyanate, флуоресцеин изотиоцианат, Becton Dickinson, BD Biosciences, США), как панлейкоцитарный маркер, CD42b (ГП Ib), конъюгированный с АРС (allophycocyanin, аллофикоцианин, Becton Dickinson, BD Biosciences, США), для идентификации тромбоцитов и CD31, конъюгированный с РЕ (phycoerythrin, фикоэритрин, Becton Dickinson, BD Biosciences, США), как маркер эндотелиальных клеток.
Для исследования используют цельную венозную кровь, в качестве антикоагулянта - 3,8% цитрат натрия в соотношении кровь/антикоагулянт - 9/1. В 50 мкл образца вносят антитела с флуорисцентной меткой в концентрации, предложенной производителем. Инкубируют 30 мин при комнатной температуре в темноте. Для лизиса эритроцитов в пробу вносят 900 мкл холодной (4°С) бидистеллированной воды, пипетировали 20-30 сек, изотоничность клеточной суспензии восстанавливают внесением 300 мкл 0.6 М раствора NaCl. Объем доводят до 2 мл раствором 2% BSA/PBS (150 mM NaCl, 10 mM sodium phosphate, рН 7.4), после чего клетки осаждают центрифугированием в условиях 300 g 5 мин при комнатной температуре и ресуспендируют для анализа в конечном объеме 300 мкл 1% раствора параформальдегида в 2% BSA/PBS.
Непосредственно перед анализом в пробу вносят 50 мкл частиц для счета размером 10 мкм с известной концентрацией (Flow-Count Fluorospheres, Becton Coulter, США). Сбор и анализ данных проводят с использованием программного обеспечения  (Becton Dickinson, BD Biosciences). Количество ЦЭК определяют методом последовательного гейтирования. В "окне" бокового/прямого светорассеивания (side scattering/forward scattering, SSC/FSC) выделяют гейт тромбоцитов P1 и мононуклеаров Р2.
(Becton Dickinson, BD Biosciences). Количество ЦЭК определяют методом последовательного гейтирования. В "окне" бокового/прямого светорассеивания (side scattering/forward scattering, SSC/FSC) выделяют гейт тромбоцитов P1 и мононуклеаров Р2.
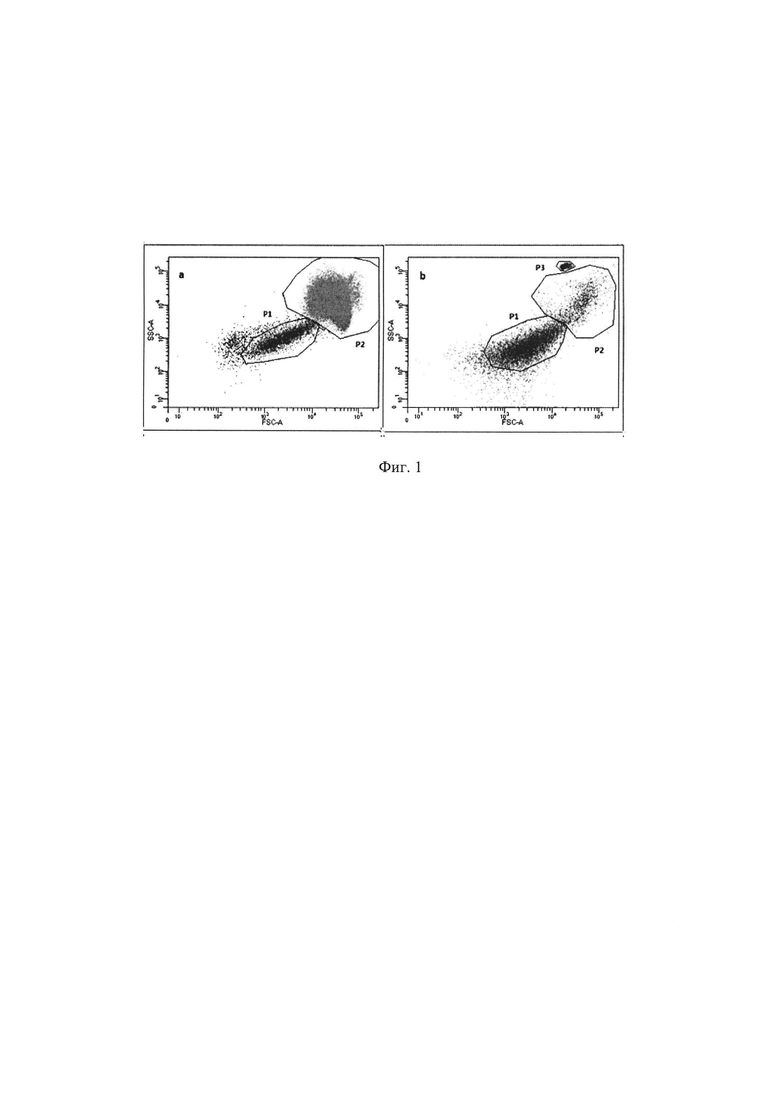
На Фиг. 1 показан анализ ЦЭК методом проточной цитометрии. (а) - цельная кровь, (b) - проба после лизиса эритроцитов, Р1 - тромбоцитарная фракция, Р2 - мононуклеары, Р3 - частицы для счета.
Из гейта Р2 на дот-плоте CD45-FITC/CD31-PE выделяют CD45-негативную фракцию Q4. В связи с наличием небольшого количества антигена CD31 на поверхности тромбоцитов, ЦЭК принято определять, как негативную фракцию по отношению к тромбоцитарному маркеру (дот-плот CD42b-APC/CD31-PE, гейт Q4-1). Однако, поскольку COVID-19 связан с выраженной эндотелиальной дисфункцией и индукцией агрегации тромбоцитов, данное последовательное гейтирование дает хорошую возможность оценить количество активных тромбоцитов и их агрегатов, как фракцию CD31+CD42b+ в гейте мононуклеаров, по сравнению с образцами здоровых доноров. Также способ позволяет в гейте Р2 определить область, содержащую события, превосходящие по размеру частицы для счета, т.е. заведомо больше 10 мкм, тем самым отделив предположительно целые клетки от их осколков, а также от крупных тромбоцитов и их агрегатов. И в данной области также производят оценку событий по фракциям: CD45-CD31+/CD45-CD31+CD42b-/CD45-CD31+CD42b+.
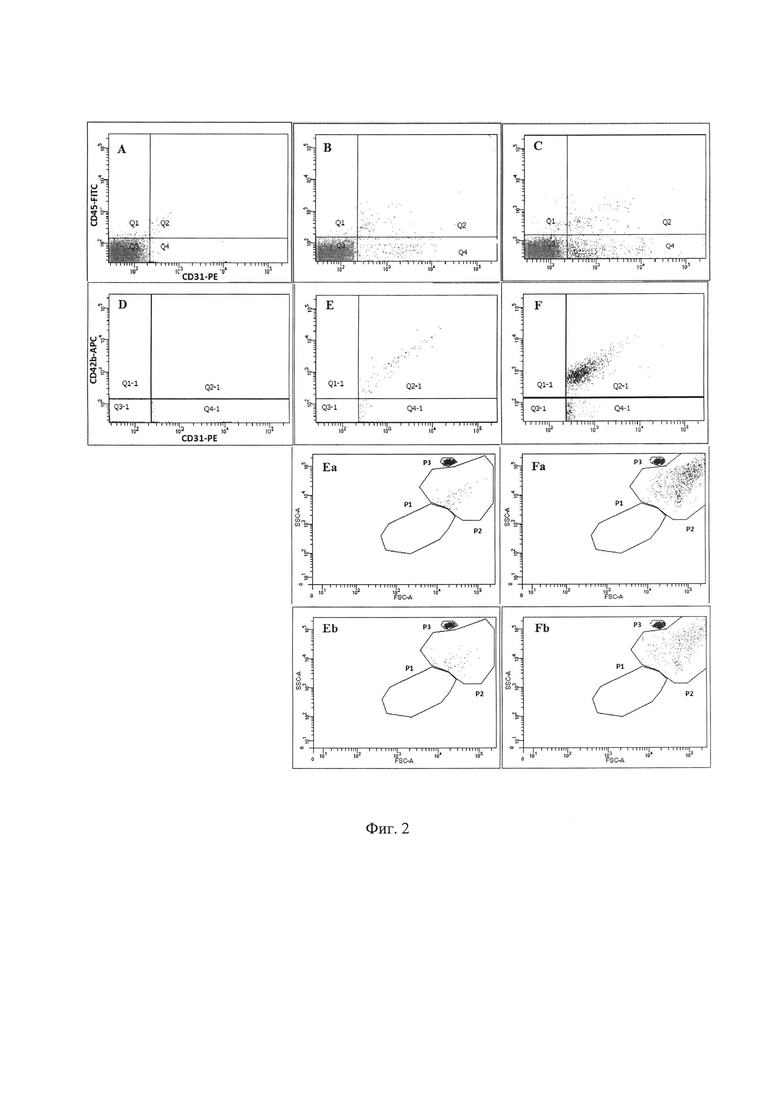
На Фиг. 2 показано последовательное гейтирование и анализ фракций клеток, (а) и (d) - отрицательные контроли, (b) и (е) - здоровые доноры, (с) и (f) - пациент с covid-19. Подсчет ЦЭК вели по фракции CD45-CD31+ (Q4), количество истинных ЭК можно оценить по фракции CD31+CD42b- (кадры на Фиг. 2 - Е, F - Q4-1, кадры на Фиг. 2 - Eb, Fb), количество истинных тромбоцитов, детектируемых в гейте Р2 (Фиг. 1), можно оценить по фракции CD31+CD42b+ (кадры на Фиг. 2 - Е, F - Q2-1, кадры на Фиг. 2 - Еа, Fa) - у всех пациентов на дот-плоте (F, Fa) отчетливо детектируется тромбоцитарная фракция, а количество событий в гейте Q4-1 (кадры на Фиг. 2 - F, Fb) - эндотелиальные клетки.
Все события регистрируют до достижения 1000 событий в гейте частиц для счета (Р3). Концентрацию клеток в мкл в пробе считают по формуле, предложенной производителем. В качестве отрицательного контроля анализируют пробы без добавления конъюгированных антител. Из всех результатов вычитают фоновые значения отрицательного контроля.
Примеры осуществления способа.
Пример 1. Больной Н., мужчина, 53 года, карта 21080-20, ПЦР на COVID-19 - положительный, поступил на 8-й день начала симптомов с диагнозом: подозрение на новую коронавирусную инфекцию (COVID-19). При поступлении в стационар состояние средней степени тяжести, выраженный интоксикационный синдром, лихорадка. Жалобы при поступлении: сухой кашель, слабость, повышение температуры до 38.5, плохо сбивается. В отделении мазок на COVID-19 - отрицательный, результат компьютерной томографии легких - КТ1. ЧСС 85 уд/мин, ЧДД 20 в мин, SpO2 99%, t=36,2°С, сознание ясное. Общий анализ крови: гемоглобин 155 г/л, эритроциты 5,3×10^12/л, лейкоциты 5,8×10^9/л, нейтрофилы 58%, лимфоциты 33%, тромбоциты 182,0×10^3/л, СОЭ 10 мм/ч, CRB 25 мг/л. Коагулограмма: D-димер 87 нг/мл, протромбиновое время 18,8 сек, фибриноген 4,95 г/л, АЧТВ 50,8 сек, Биохимия: ИЛ-6 6,2 пг/мл, ферритин 214,2 нг/мл, альбумин 45,7 г/л, креатинин 93,7 мкмоль/л, рН крови 7,42. Уровень ЦЭК в крови в день госпитализации - 1035,15/мкл, уровень активированных тромбоцитов 1829,78/мкл.
Пример 2. Больной С., мужчина, 43 года, карта 20953-20, ПЦР на COVID-19 - положительный, поступил на 4-й день начала симптомов с диагнозом: подозрение на новую коронавирусную инфекцию (COVID-19). При поступлении в стационар состояние средней степени тяжести, выраженный интоксикационный синдром, лихорадка. Жалобы при поступлении: сухой кашель, слабость, повышение температуры до 38.5, плохо сбивается. В отделении мазок на COVID-19 - отрицательный, результат компьютерной томографии легких - КТ1. ЧСС 80 уд/мин, ЧДД 18 в мин, SpO2 99%, t=39°С, сознание ясное. Общий анализ крови: гемоглобин 146 г/л, эритроциты 5,0×10^12/л, лейкоциты 4,2×10^9/л, нейтрофилы 65%, лимфоциты 22%, тромбоциты 151,0×10^3/л, СОЭ 6 мм/ч, CRB 9,83 мг/л. Коагулограмма: D-димер 299 нг/мл, протромбиновое время 13,9 сек, фибриноген 4,4 г/л, АЧТВ 39,1 сек, Биохимия: ИЛ-6 10,5 пг/мл, ферритин 598,7 нг/мл, альбумин 42,7 г/л, креатинин 90,8 мкмоль/л, рН крови 7,40. Уровень ЦЭК в крови в день госпитализации - 410,02/мкл, уровень активированных тромбоцитов 807,20/мкл.
Пример 3. Больной С., мужчина, 56 лет, карта 20958-20, ПЦР на COVID-19 - отрицательный, поступил на 2-й день начала симптомов с диагнозом: подозрение на новую коронавирусную инфекцию (COVID-19). При поступлении в стационар состояние средней степени тяжести, выраженный интоксикационный синдром, лихорадка. Жалобы при поступлении: слабость, повышение температуры до 38.5. В отделении мазок на COVID-19 - отрицательный, результат компьютерной томографии легких - КТ0. ЧСС 80 уд/мин, ЧДД 18 в мин, SpO2 99%, t=36,6°С, сознание ясное. Общий анализ крови: гемоглобин 146 г/л, эритроциты 4,7×10^12/л, лейкоциты 6,4×10^9/л, нейтрофилы 67%, лимфоциты 17%, тромбоциты 148,0×10^3/л, СОЭ 6 мм/ч, CRB 19,5 мг/л. Коагулограмма: D-димер 134 нг/мл, протромбиновое время 13,9 сек, фибриноген 4,1 г/л, АЧТВ 26 сек, Биохимия: ИЛ-6 1,81 пг/мл, ферритин 516,5 нг/мл, альбумин 40,4 г/л, креатинин 86,8 мкмоль/л, рН крови 7,41. Уровень ЦЭК в крови в день госпитализации - 383,34/мкл, уровень активированных тромбоцитов 946,50/мкл.
Пример 4. Больная Л., женщина, 86 лет, карта 21250-20, ПЦР на COVID-19 - положительный, поступил на 6-й день начала симптомов с диагнозом: подозрение на новую коронавирусную инфекцию (Covid-19). При поступлении в стационар состояние средней степени тяжести, выраженный интоксикационный синдром, лихорадка. Жалобы при поступлении: слабость, повышение температуры до 38.5. В отделении мазок на COVID-19 - положительный, результат компьютерной томографии легких - КТ0. ЧСС 80 уд/мин, ЧДД 16 в мин, SpO2 96%, t=36,5°С, сознание ясное. Общий анализ крови: гемоглобин 102 г/л, эритроциты 3,1×10^12/л, лейкоциты 3,6×10^9/л, нейтрофилы 74%, лимфоциты 17%, тромбоциты 163,0×10^3/л, СОЭ 90 мм/ч, CRB 41,9 мг/л. Коагулограмма: D-димер 245 нг/мл, протромбиновое время 27,2 сек, фибриноген 5,12 г/л, АЧТВ 46,8 сек, Биохимия: ИЛ-6 - 10,28 пг/мл, альбумин 32,2 г/л, креатинин 106,3 мкмоль/л, рН крови 7,29. Уровень ЦЭК в крови в день госпитализации 351,73/мкл, уровень активированных тромбоцитов 939,59/мкл.
Пример 5. Больной Л., мужчина, 85 лет, карта 21243-20, ПЦР на Covid-19 - положительный, поступил на 7-й день начала симптомов с диагнозом: подозрение на новую коронавирусную инфекцию (COVID-19). При поступлении в стационар состояние средней степени тяжести, выраженный интоксикационный синдром, лихорадка. Жалобы при поступлении: слабость, повышение температуры до 38.5, сухой кашель. В отделении мазок на COVID-19 - отрицательный, результат компьютерной томографии легких - КТ1. ЧСС 88 уд/мин, ЧДД 22 в мин, SpO2 95%, t=38°С, сознание ясное. Общий анализ крови: гемоглобин 119 г/л, эритроциты 4,2×10^12/л, лейкоциты 2,9×10^9/л, нейтрофилы 56%, лимфоциты 33%, тромбоциты 147,0×10^3/л, СОЭ 42 мм/ч, CRB 35,6 мг/л. Коагулограмма: D-димер 363 нг/мл, протромбиновое время 11,8 сек, фибриноген 4,78 г/л, АЧТВ 29 сек, Биохимия: ИЛ-6 - 11,56 пг/мл, ферритин 138,3 нг/мл, альбумин 38,4 г/л, креатинин 118,3 мкмоль/л, рН крови 7,32. Уровень ЦЭК в крови в день госпитализации - 360,62/мкл, уровень активированных тромбоцитов 1173,74/мкл.
Заявляемым способом было проанализировано 10 образцов условно здоровых доноров и 10 пациентов с подтвержденным заболеванием COVID-19 в первый день госпитализации: 6 мужчин, 4 женщины в возрасте от 43 до 86 лет. Так количество событий CD45-CD31+CD42b-, определенных как ЦЭК, у больных составило 562,17±415,95 в мкл против 4,69±1,48 в мкл у здоровых (р=0,007), а событий CD45-CD31+CD42b+, определенных, как активные адгезированные тромбоциты, у больных составило 1139,20±152,15 мкл против 7,65±2,47 мкл у здоровых (р=0,003).
Таким образом, заявляемый способ позволяет эффективно определить количество циркулирующих эндотелиальных клеток и активированных тромбоцитов в крови пациентов, для диагностики поражения сосудистого эндотелия, в том числе при SARS-CoV-2, что дает возможность своевременно начать терапию, направленную на коррекцию патологического процесса, а также впоследствии оценить эффективность применяемой терапии.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИАГНОСТИКИ РАЗВИТИЯ СТЕНОЗИРОВАНИЯ СТЕНТОВ | 2014 |
|
RU2566287C1 |
| Способ определения комплемент-активирующей функции антител к SARS-CoV-2 для прогнозирования тяжести течения COVID-19 | 2023 |
|
RU2818351C1 |
| Способ определения степени риска развития сердечно-сосудистых осложнений при COVID-19 | 2021 |
|
RU2768575C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЯЖЕСТИ СИСТЕМНОЙ ВОСПАЛИТЕЛЬНОЙ РЕАКЦИИ В ОРГАНИЗМЕ ЧЕЛОВЕКА ПРИ ЗАБОЛЕВАНИЯХ | 2022 |
|
RU2808416C1 |
| СПОСОБ ФУНКЦИОНАЛЬНОЙ И КОЛИЧЕСТВЕННОЙ ОЦЕНКИ ТРОМБОЦИТАРНО-МОНОЦИТАРНЫХ КОМПЛЕКСОВ В ОБРАЗЦАХ ЦЕЛЬНОЙ ПЕРИФЕРИЧЕСКОЙ КРОВИ | 2020 |
|
RU2762820C1 |
| СПОСОБ ОЦЕНКИ ТЯЖЕСТИ ТЕЧЕНИЯ ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКИ С ПОЧЕЧНЫМ СИНДРОМОМ | 2009 |
|
RU2392858C1 |
| Способ прогнозирования неблагоприятного исхода развития заболевания при коронавирусной инфекции | 2023 |
|
RU2835545C1 |
| Способ прогнозирования риска развития хронической плацентарной недостаточности при сроке беременности 6-8 недель у женщин с циркуляцией АФА и отягощенным акушерским анамнезом | 2024 |
|
RU2830335C1 |
| СПОСОБ ДЕТЕКЦИИ ВНЕКЛЕТОЧНОЙ ДНК В ЦЕЛЬНОЙ ПЕРИФЕРИЧЕСКОЙ КРОВИ С ИСПОЛЬЗОВАНИЕМ ПРОТОЧНОЙ ЦИТОМЕТРИИ | 2022 |
|
RU2815709C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СОСТАВА ИНДИВИДУАЛЬНЫХ ВНЕКЛЕТОЧНЫХ ВЕЗИКУЛ В КРОВИ ЧЕЛОВЕКА | 2014 |
|
RU2583940C1 |
Изобретение относится к медицине, а именно к терапии и инфекционным болезням, и касается способа выявления поражения сосудистого эндотелия. Способ выявления поражения сосудистого эндотелия, включающий определение количества циркулирующих эндотелиальных клеток и активированных тромбоцитов в крови пациентов методом последовательного гейтирования, где подсчет циркулирующих эндотелиальных клеток ведут по фракциям CD45-CD31+CD42b-, а подсчет активированных тромбоцитов - CD45-CD31+CD42b+, и по количеству циркулирующих эндотелиальных клеток и активированных тромбоцитов выявляют поражение сосудистого эндотелия. Количество событий CD45-CD31+CD42b-, определенных как циркулирующие эндотелиальные клетки, у больных составляет 562,17±415,95 в мкл против 4,69±1,48 в мкл у здоровых; а количество событий CD45-CD31+CD42b+, определенных как активированные тромбоциты, у больных составляет 1139,20±152,15 в мкл против 7,65±2,47 в мкл у здоровых. Способ позволяет выявлять поражение сосудистого эндотелия и, следовательно, своевременно начать терапию, направленную на коррекцию патологического процесса, а также оценить эффективность применяемой терапии. 5 пр., 2 ил.
Способ выявления поражения сосудистого эндотелия, включающий определение количества циркулирующих эндотелиальных клеток и активированных тромбоцитов в крови пациентов методом последовательного гейтирования, где подсчет циркулирующих эндотелиальных клеток ведут по фракциям CD45-CD31+CD42b-, а подсчет активированных тромбоцитов - CD45-CD31+CD42b+, и по количеству циркулирующих эндотелиальных клеток и активированных тромбоцитов выявляют поражение сосудистого эндотелия, где количество событий CD45-CD31+CD42b-, определенных как циркулирующие эндотелиальные клетки, у больных составляет 562,17±415,95 в мкл против 4,69±1,48 в мкл у здоровых; а количество событий CD45-CD31+CD42b+, определенных как активированные тромбоциты, у больных составляет 1139,20±152,15 в мкл против 7,65±2,47 в мкл у здоровых.
| СПОСОБ ДИАГНОСТИКИ РАЗВИТИЯ СТЕНОЗИРОВАНИЯ СТЕНТОВ | 2014 |
|
RU2566287C1 |
| ЭКСПРЕСС-АНАЛИЗЫ АКТИВАЦИИ Т-КЛЕТОК, ОСНОВАННЫЕ НА ИЗМЕРЕНИИ РНК С ИСПОЛЬЗОВАНИЕМ ПРОТОЧНОЙ ЦИТОМЕТРИИ | 2013 |
|
RU2671707C2 |
| Васильева В А | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| Диссер | |||
| к.м.н | |||
| Москва, 2018, 118с. | |||
| CKE Wong et al | |||
| Levels of a subpopulation of platelets, but not circulating endothelial | |||
Авторы
Даты
2022-03-15—Публикация
2021-03-03—Подача