Изобретение относится к области молекулярной биологии и генной инженерии, а именно к области создания новой технологии хранения биоматериалов и представляет собой основополагающий элемент этой технологии.
Более детально, предлагаемое изобретение относится к области создания генетической конструкция для повышения радиационной устойчивости клеток насекомого Polypedilum vanderplanki. Радиационная устойчивость - это устойчивость живых организмов к действию ионизирующих излучений. Ионизирующее излучение (радиация) - поток фотонов, элементарных частиц или атомных ядер, способный ионизировать вещество. Клетки Polypedilum vanderplanki с повышенной радиационной устойчивостью могут быть использованы для получения и консервации биоматериалов с целью их (биоматериалов) длительного хранения и транспортировки в условиях повышенного радиационного фона, например – для консервации инактивируемых обезвоживанием ферментов.
Разрабатываемый метод предполагает использование генетической конструкции для получения клеток Polypedilum vanderplanki, способных развиваться, синтезировать биотехнологические продукты и переходить в обезвоженное состояние с сохранением жизнеспособности (ангидробиоз) в условиях повышенного радиационного фона. Основой предлагаемого подхода является разработка генетической конструкции, содержащей в своем составе последовательность гена PDiap1 в соответствии с Фиг. 1, и культура клеток насекомого Polypedilum vanderplanki.
В настоящее время существует насущная проблема в области длительного хранения живых клеток. Известные технологии зачастую требуют сверхнизкие температуры, однако такие технические решения характеризуются низкой эффективностью, поскольку помимо дороговизны и нестабильности систем холодного хранения, восстановление жизнеспособных клеток из замороженного состояния является сложной задачей, и обычно выживает только небольшая часть клеток.
Разработанное техническое решение в целом нацелено на создание нового метода хранения биоматериала посредством сохранения рекомбинантных белков в составе культуры клеток насекомого Polypedilum vanderplanki, способных к выживанию без воды (ангидробиозу). Разрабатываемая на указанном явлении ангидробиоза биотехнология предполагает резкое удешевление хранения биоматериала (например, белков) и независимость от глубокой заморозки.
Из исследованного уровня техники, а именно из научной литературы, установлено, что P. vandeplanki представляет собой уникальный пример адаптации к неблагоприятным условиям окружающей среды, таким как действие высокой температуры, радиация и других [Watanabe M. et al. Biological effects of anhydrobiosis in an African chironomid, Polypedilum vanderplanki on radiation tolerance // Int. J. Radiat. Biol. 2006. Vol. 82. P. 587–592] [1]. Этот организм является единственным в мире видом насекомого, способного к индукции ангидробиоза (аметаболического состояния, при котором на 99% теряется вода из клеток организма) [Gusev O. et al. Comparative genome sequencing reveals genomic signature of extreme desiccation tolerance in the anhydrobiotic midge // Nat. Commun. Nature Publishing Group, 2014. Vol. 5. P. 4784] [2]. Выделенные из Polypedilum vanderplanki культуры клеток также способны переносить обезвоживание [Watanabe K. et al. Air-dried cells from the anhydrobiotic insect, Polypedilum vanderplanki, can survive long term preservation at room temperature and retain proliferation potential after rehydration // Cryobiology. 2016. Vol. 73(1). P. 93-98] [3]. Данная способность Polypedilum vanderplanki и выделенных из него культур клеток обусловлена свойственным этому насекомому сложным сочетанием молекулярных факторов, защищающих структуру и активность клеточных компонентов при обезвоживании.
Из исследованного заявителем уровня техники выявлено, что на основе исследований экстремофилов, которые могут выживать в течение многих лет в сухом состоянии, были разработаны методы и протоколы, имитирующие молекулярный феномен ангидробиоза в культурах эукариотических клеток [Li S. et al. Late embryogenesis abundant proteins protect human hepatoma cells during acute desiccation // Proc Natl Acad Sci U S A. 2012. Vol. 109(51). P. 20859-64] [4]. Описанная технология стабилизации использует трегалозу, молекулу невосстанавливающего сахара, в качестве среды для высушивания [4]. Клетки млекопитающихс введённой в них трегалозой, могут быть высушены, и до 98 % клеток жизнеспособны после регидрации. Недостатком метода является чрезвычайно низкая длительность, в течение которой клетки сохраняют жизнеспособность в высушенном состоянии, которая составляет несколько секунд. Таким образом, метод демонстрирует принципиальную возможность высушивания клеток с сохранением жизнеспособности, но не применим в реальных условиях для их консервации [4]. Кроме того, метод не предполагает увеличение радиационной устойчивости клеток.
Известно изобретение по патенту WO2010025764 Insect-derived promoters for foreign proteins expression in insect cells (Промоторы, полученные из насекомых, для экспрессии чужеродных белков в клетках насекомых) [5]. Сущностью является способ разработки полинуклеотидных последовательностей, регулирующих экспрессию, которые включают: а) Выделение любой полинуклеотидной последовательности, содержащей соответствующие им регуляторные полинуклеотидные последовательности, которые расположены выше открытых рамок считывания генов, кодирующих белки семейства гексамеринов. б) Амплификация регуляторных полинуклеотидных последовательностей стадии а) обычными способами. В настоящем изобретении были выделены из насекомых (Trichoplusia ni) регуляторные полинуклеотидные последовательности, которые управляют экспрессией основных белков насекомых (гексамеринов) на конкретных стадиях эволюции личинки. Указанные регуляторные полинуклеотидные последовательности способствуют более сильной экспрессии чужеродных генов в бакуловирусной системе, чем обычный промотор полиэдрина. Кроме того, комбинация новых промоторов, полученных из личинок, по изобретению [5], с известным промотором pL увеличивала уровни экспрессии бакуловируса до 61-375% (в зависимости от времени заражения) по сравнению с обычными бакуловирусами, используемыми в биотехнологической промышленности.
Недостатком является невозможность использования изобретения для экспрессии чужеродных генов в клетках Polypedilum vanderplanki, что существенно ограничивает область применения известного способа. Кроме того, метод не предполагает увеличение радиационной устойчивости клеток.
Известно изобретение по патенту WO1998044141 Insect expression vectors (Векторы экспрессии насекомых) [6]. Сущностью является челночный вектор для трансформации клеток насекомых (челночный вектор – вектор, функциональный в клетках не менее чем двух различных организмов). В изобретении предложены челночный вектор насекомых и способы использования таких векторов для стабильной трансформации разнородных клеточных линий насекомых для экспрессии гетерологичных белков. Изобретение обеспечивает систему отбора трансформированных клеток насекомых, основанную на устойчивости к антибиотикам семейства блеомицин / флеомицин, включая антибиотик зеоцин. Раскрыты эффективные промоторы, полученные из предранних промоторов бакуловируса, для использования в управлении экспрессией гетерологичных белков, включая селектируемые маркеры, в трансформированных клетках насекомых по изобретению. Раскрыты векторы на основе транспозонов, которые обеспечивают индуцируемую транспозицию для оптимизации экспрессии гетерологичного белка и незаметные маркеры для облегчения отбора желаемых трансформантов.
Недостатком изобретения является неприменимость для экспрессии генов в клетках Polypedilum vanderplanki, что существенно ограничивает область его (прототипа) применения. Кроме того, метод не предполагает увеличение радиационной устойчивости клеток.
Из исследованного заявителем уровня техники выявлено также техническое решение RU2626590C2 под названием «Генетическая конструкция для экспрессии генов в клетках насекомого Polypedilum vanderplanki» [7], сущность которого заключается в генетической конструкции, обеспечивающей экспрессию чужеродных генов в культуре клеток насекомого Polypedilum vanderplanki. Описанная в изобретении генетическая конструкция содержит выделенный из последовательности ДНК Polypedilum vanderplanki промотор P121 с указанной в изобретении последовательностью, или аналогичный промотор со сходством нуклеотидной последовательности не менее 86%. Вектор по способу предназначен для экспрессии в клетках Polypedilum vanderplanki. По совокупности совпадающих признаков способ наиболее близок к заявленному техническому решению и выбран заявителем в качестве прототипа.
Согласно прототипу, известная генетическая конструкция может быть использована для экспрессии чужеродных генов в клетках насекомого Polypedilum vanderplanki и получения соответствующих биотехнологических продуктов. Предполагается применение указанной генетической конструкции для консервации, хранения и транспортировки биотехнологических продуктов, основанных на обезвоживании клеток Polypedilum vanderplanki, содержащих полученный биотехнологический продукт.
Недостатком является то, что используемые в изобретении [7] клетки Polypedilum vanderplanki, несмотря на свою повышенную устойчивость к воздействию радиации по сравнению с иными культурами клеток, демонстрируют значительное снижение жизнеспособности под воздействием ионизирующей радиации. Следствием указанного недостатка является невозможность его использования для экспрессии чужеродных генов и получения и использования соответствующих биотехнологических продуктов в клетках Polypedilum vanderplanki в условиях высокого радиационного фона, что существенно ограничивает область применения известного способа.
Таким образом, указанные выше недостатки методов хранения клеток в замороженном состоянии и в высушенном состоянии указывают на потребность в разработке конструкций и способов, которые позволят осуществить сухое хранение клеток при температурах окружающей среды, с сохранением жизнеспособности клеток и сохранением активности синтезированных в этих клетках биотехнологических продуктов после регидратации, в условиях высокого радиационного фона – например, при очистке заражённых радиацией сточных вод или в условиях автоматического культивирования клеток в условиях повышенного радиационного фона для последующего использования синтезированных в них биотехнологических продуктов с возможностью их (продуктов) консервации в высушенных клетках Pv11.
Целью и техническим результатом заявленного технического решения является создание генетической конструкции, обеспечивающей повышение радиационной устойчивости клеток насекомого Polypedilum vanderplanki.
Сущностью заявленного технического решения является генетическая конструкция для экспрессии чужеродных генов в клетках насекомого Polypedilum vanderplanki в условиях повышенного радиационного фона, включающая выделенный из последовательности ДНК Polypedilum vanderplanki ген, кодирующий белок PDiap1, c нуклеотидной последовательностью SEQ ID NO: 1, промотор pGAPDH, участок полиаденилирования, точку начала репликации PUC и ген устойчивости к антибиотику канамицин.
Заявленное техническое решение иллюстрируется Фиг. 1 – Фиг.4.
Фиг. 1 – Сравнение нуклеотидных последовательностей промотора PGAPDH и промотора P121; отличающиеся нуклеотиды выделены серым цветом, отсутствующие в одной из последовательностей нуклеотиды обозначены дефисами.
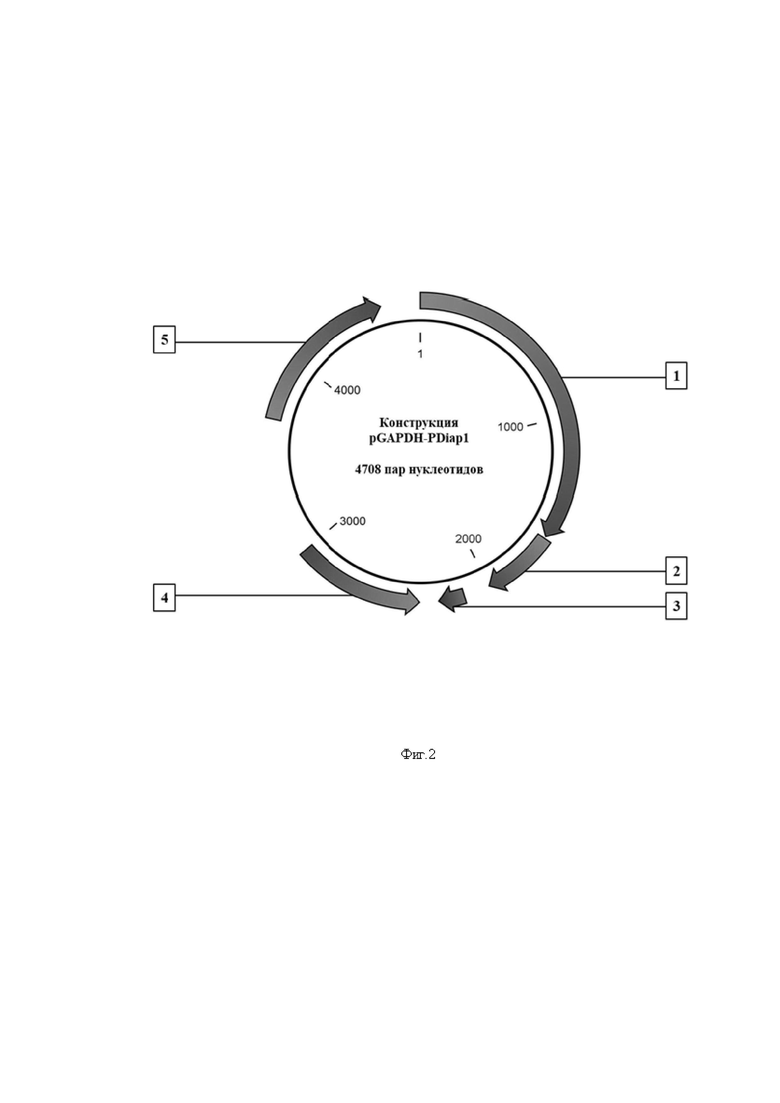
Фиг. 2 – Физическая карта генетической конструкции pGAPDH-PDiap1, где:
1 – промотор pGAPDH;
2 – ген PDiap1;
3 – участок полиаденилирования;
4 – точка начала репликации PUC;
5 – ген устойчивости к антибиотику канамицин.
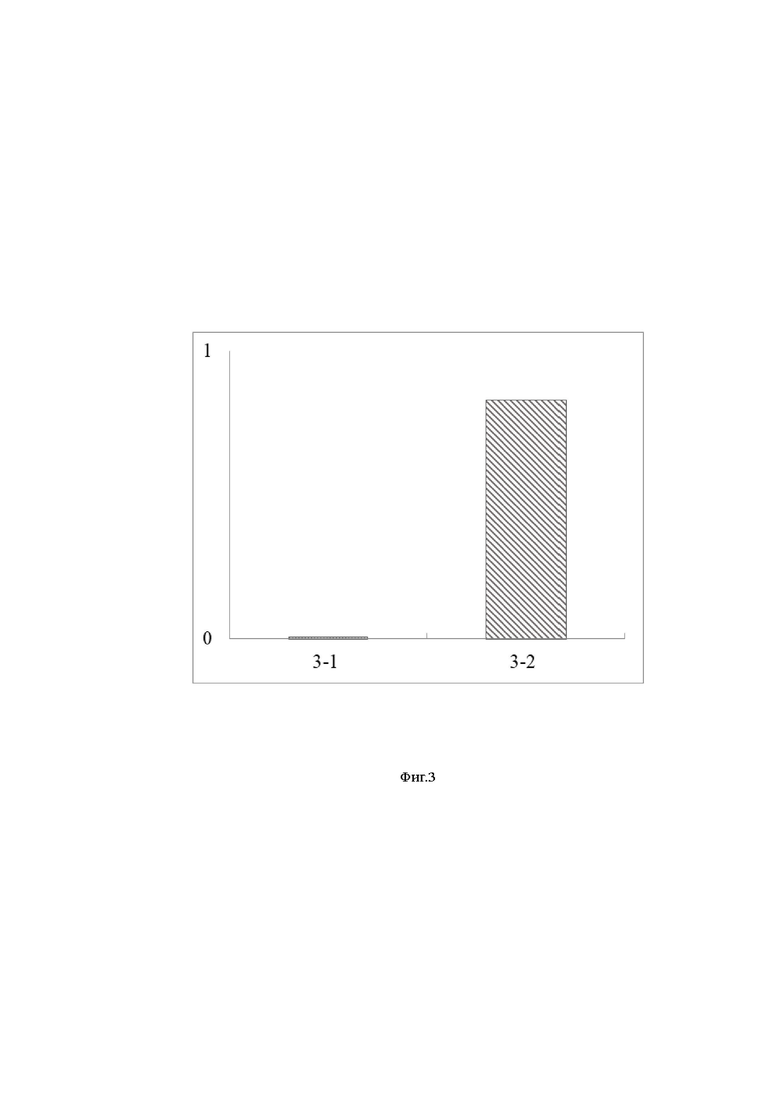
Фиг. 3 – Экспериментально полученная диаграмма содержания, где:
– по оси ординат приведен уровень экспрессии гена PDiap1 относительно контрольного гена экспрессии EFα1,
– по оси абсцисс указаны культуры клеток:
– 3-1 – культура клеток Pv11 с конструкцией pGAPDH-PDiap1,
– 3-2 – культура клеток Pv11.
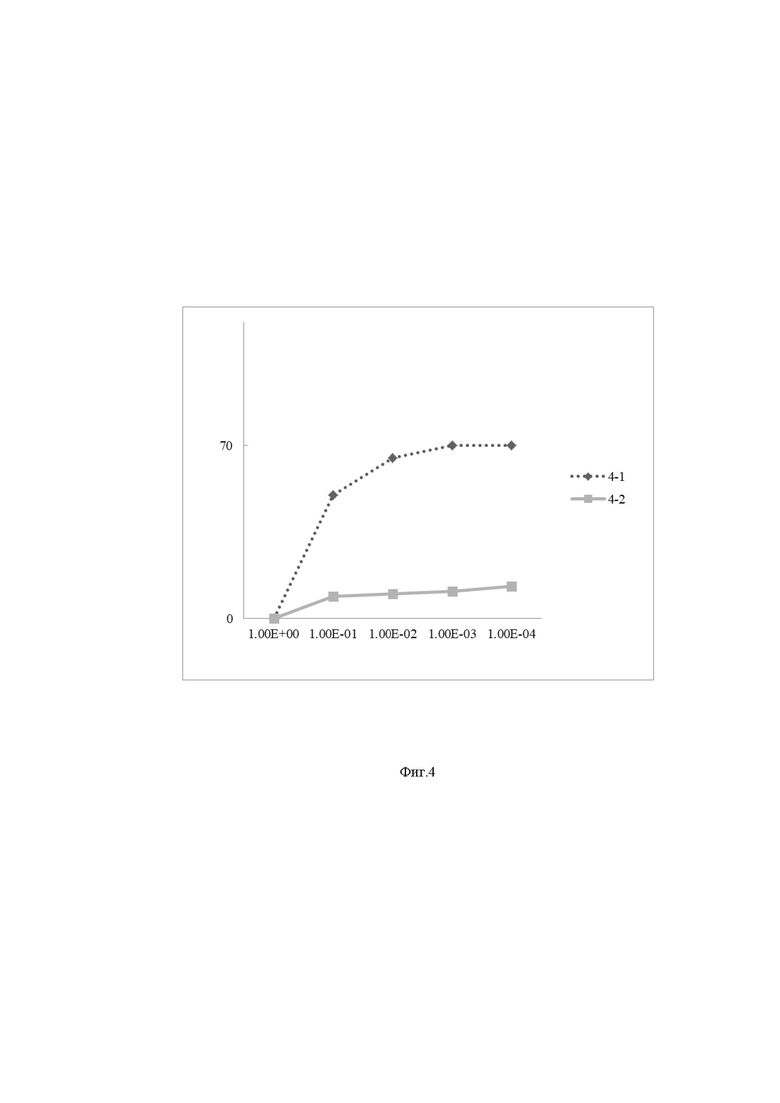
Фиг. 4 – Кривая выживаемости культур клеток, где:
– по оси ординат приведена доля γ излучения (Гр),
– по оси абсцисс приведена доля выживаемости,
– кривая 4-1 – культуры клеток Pv11 с конструкцией pGAPDH-PDiap1,
– кривая 4-2 – культуры клеток Pv11.
Поставленная цель и заявленный технический результат достигаются тем, что создают генетическую конструкцию, включающую выделенный из последовательности ДНК Polypedilum vanderplanki ген белка PDiap1 (Putative Death-associated inhibitor of apoptosis 1). Повышение радиационной устойчивости клеток Polypedilum vanderplanki достигается за счёт ингибирования процессов клеточной гибели (апоптоза) за счёт защитного действия указанного белка PDiap1, при его повышенной экспрессии. Ген PDiap1 в заявляемой генетической конструкции находится под управлением более слабого промотора, чем промотор P121 описанный в прототипе [7], имеющего сходство к промотору Р121 не более 50%, например – под управлением промотора pGAPDH указанной последовательности, со сходством к промотору Р121 не более 32%.
Далее заявителем приведено осуществление заявленного технического решения, которое демонстрируется следующим примером.
ПРИМЕР, демонстрирующий технологию получения генетической конструкции, включающей нуклеотидную последовательность белка PDiap1, и повышение радиационной устойчивости клеток Polypedilum vanderplanki.
1 - Получают экземпляры насекомого Polypedilum vanderplanki, например – путем культивирования в лабораторных условиях.
2 - Из Polypedilum vanderplanki выделяют общую ДНК, например – с использованием коммерческого набора Nucleospin tissue kit (производства фирмы Macherey Nagel, Германия).
3 - Получают фрагмент ДНК c гéном, кодирующим белок PDiap1 (гéном PDiap1), например – путем ПЦР, используя в качестве матрицы ДНК, содержащую ген PDiap1 (например – плазмиду pIZT/V5-His производства фирмы Thermo Fisher Scientific,США) и праймеры, например – SEQ ID NO: 2, SEQ ID NO: 3. Нуклеотидная последовательность белка PDiap1(SEQ ID NO: 1). Для ПЦР (здесь и далее в тексте) используют высокоточную полимеразу, например – полимеразу Q5 производства фирмы New England Biolabs, США.
4 - Получают несущий элемент заявляемой генетической конструкции, а именно, модифицированную генетическую конструкцию pIZ/V5-His (производства фирмы Thermo Fisher Scientific, США). Модификацию генетической конструкции pIZ/V5-His выполняют путем замены промотора OpiE2 на промотор pGAPDH. Указанный промотор, выделенный из Polypedilum vanderplanki, обеспечивает экспрессию генов в клетках Pv11 и обладает сходством к промотору 121, использованному в прототипе [7], не более 32% (Фиг. 1). Специфический фрагмент ДНК, содержащий нуклеотидную последовательность промотора pGAPDH, обеспечивающий экспрессию генов получают в полимеразной цепной реакции (ПЦР) с использованием общей ДНК Polypedilum vanderplanki в качестве матрицы и праймеры с последовательностью SEQ ID NO: 4, SEQ ID NO: 5. Фрагмент ДНК с нужной частью генетической конструкции pIZ/V5-His получают в полимеразной цепной реакции (ПЦР) с использованием в качестве матрицы генетической конструкции pIZ/V5-His и праймеров с последовательностью SEQ ID NO: 6, SEQ ID NO: 7. Замену промотора проводят известным путём соединения полученных фрагментов ДНК методом Гибсона [Gibson D.G. et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. // Nat. Methods. 2009. Vol. 6, № 5. P. 343–345] [8], например с использованием
коммерческого набора Gibson Assembly (производства фирмы New England Biolabs, США) в стандартных условиях, в соответствии с рекомендациями производителя.
Таким образом, заменой гена устойчивости получают промежуточную генетическую конструкцию с промотором pGAPDH, являющуюся несущим элементом заявляемой генетической конструкции.
5 – Встраивают фрагмент ДНК с геном PDiap1 в полученную промежуточную генетическую конструкцию, например – методом клонирования.
Для этого, фрагмент ДНК с геном PDiap1 и промежуточную генетическую конструкцию обрабатывают ферментами рестрикции BamHIII и XhoI в стандартных условиях в соответствии с рекомендациями производителя (фирмы New England Biolabs, США). Встраивают фрагмент ДНК с геном PDiap1 в промежуточную генетическую конструкцию за счёт обработки ферментом ДНК-лигазой (например, Т4 лигазой производства фирмы New England Biolabs, США) в стандартных условиях в соответствии с рекомендациями производителя.
6 - По завершении описанных действий получают генетическую конструкцию pGAPDH-PDiap1, Фиг. 2. На Фиг. 2 основным элементом конструкции pGAPDH-PDiap1 является промотор pGAPDH, обеспечивающий экспрессию встроенных в конструкцию генов (в приведённом ПРИМЕРЕ - гена PDiap1) и ген, кодирующий белок-ингибитор апоптоза PDiap1 Polypedilum vanderplanki, как наиболее индуцируемый в ходе ангидробиоза и самый экспрессируемый в ангидробиозе из генов белков, содержащих домен ингибирования апоптоза.
7 - Полученную генетическую конструкцию с геном PDiap1, например – конструкцию pGAPDH-PDiap1 используют для трансфекции (введения ДНК в клетки) ранее выделенной из насекомого Polypedilum vanderplanki [Nakahara Y. et al. Cells from an anhydrobiotic chironomid survive almost complete desiccation // Cryobiology. Elsevier Inc., 2010. Vol. 60, № 2. P. 138–146] [9] культуры клеток Pv11. Жизнеспособность культуры клеток Pv11 должна составлять не менее 90% при определении окраской трипановым синим – это условие обеспечивают использованием культуры клеток Pv11 в логарифмической фазе роста.
8 - Осуществляют трансфекцию, например, с использованием прибора NEPA21 (фирмы NepaGene, Япония) стандартным методом электропорации [Cohen S.N. et al. Construction of biologically functional bacterial plasmids in vitro. // Proc. Natl. Acad. Sci. U. S. A. 1973. Vol. 70, № 11. P. 3240–3244] [10], основанном на подаче импульсов электрического тока на суспензию клеток с внесённой генетической конструкцией.
9 - Далее выявляют оптимальную плотность суспензии клеток Pv11 – при трансфекции составляет 10 млн клеток/мл, концентрация генетической конструкции в суспензии клеток 1 мкг/мл. Параметры импульсов электрического тока устанавливают, например, в соответствии с Таблицей. Работу с прибором осуществляют в соответствии с рекомендациями производителя.
Таблица
Параметры импульсов электрического тока для трансфекции культуры клеток Pv11 конструкцией pGAPDH-PDiap1.
10 - В контрольном варианте осуществляют аналогичную процедуру с использованием клеток Pv11 без генетической конструкции.
11 - После завершения трансфекции клетки Pv11 культивируют в стандартных условиях, например в питательной среде IPL, температура от +24 до +25 °С, при плотности клеточной суспензии от 2х104 до 1х106 клеток/мл.
12 - Наличие экспрессии гена PDiap1 в клетках Pv11 проверяют через 24 часа после трансфекции, например за счёт проведения количественного ПЦР (qPCR) с использованием указанных праймеров (SEQ ID NO: 8, SEQ ID NO: 9), в расчёте на 1x103 клеток, результат приведен на Фиг. 3, где по оси ординат приведен уровень экспрессии гена PDiap1 относительно контрольного гена экспрессии EFα1, а на оси абсцисс приведено количество экспрессии.
13 - Далее наблюдают уровень выживаемости клеток у культуры с конструкцией pGAPDH-PDiap1 с устойчивостью к ионизирующим лучам и контрольной культурой. Результат приведен на Фиг. 4, где по оси ординат приведена доля γ излучения (Гр), а на оси абсцисс приведена доля выживаемости. Анализ данных, представленных на Фиг. 4, позволяет сделать вывод о том, что по сравнению с кривой 4-1 (культуры клеток Pv11 с конструкцией pGAPDH-PDiap1) кривая 4-2 (культуры клеток Pv11) более крутая, из чего следует, что заявленная генетическая конструкция является в 6 раз более устойчивой к радиации по сравнению с прототипом.
Состоявшаяся и установленная экспрессия гена PDiap1 подтверждает достижение цели заявляемого изобретения – сконструированная в соответствии с описанием предполагаемого изобретения, содержащая промотор pGAPDH и белок PDiap1, генетическая конструкция pGAPDH-PDiap1 обеспечивает экспрессию гена PDiap1 в выделенной из насекомого Polypedilum vanderplanki культуре клеток Pv11 в условиях повышенного радиационного фона. Повышенная экспрессия гена PDiap1, по сравнению с фоновым уровнем, приводит к повышению выживаемости клеток Polypedilum vanderplanki за счёт ингибирования процесса апоптоза, приводящего к гибели клеток под действием ионизирующей радиации.
Использование более слабого, чем в прототипе, промотора, позволяет сократить энергетические затраты клеток Polypedilum vanderplanki на синтез белка PDiap1. В свою очередь, это увеличивает эффективность использования клеток Polypedilum vanderplanki – например, для получения и использования биотехнологических продуктов, с возможностью их консервации в высушенном состоянии.
В заявленном техническом решении заявителем реализована поставленная цель: создана генетическая конструкция, обеспечивающая повышение радиационной устойчивости клеток Polypedilum vanderplanki, доказательством служит Фиг. 4, на которой продемонстрировано увеличение устойчивости клеток Polypedilum vanderplanki (на примере клеток Pv11) к действию радиации, после экспрессии в ней заявляемой генетической конструкции. Приведённый пример показывает осуществимость заявляемого способа с использованием стандартного оборудования и материалов. Полезность заявляемого способа для применения в биотехнологиях, например – для получения используемых в аналитической деятельности и диагностике инактивируемых обезвоживанием ферментов, обеспечивается возможностью использования клеток Polypedilum vanderplanki c увеличенной радиационной устойчивостью для получения биотехнологических продуктов, продемонстрированной ранее [7]. Ключевой особенностью клеток Polypedilum vanderplanki в соответствии с заявляемым способом, является их повышенная радиационная устойчивость, что принципиально расширяет возможность использования клеток Polypedilum vanderplanki для получения биотехнологических продуктов с возможностью их безводного хранения. Таким образом, заявленная генетическая конструкция может быть использована для получения и/или применения биотехнологических продуктов (например, ферментов) в условиях повышенного радиационного фона.
На основании изложенного выше можно сделать вывод, что заявителем достигнуты поставленные цели и заявленный технический результат, а именно – создана генетическая конструкция, включающую выделенный из последовательности ДНК Polypedilum vanderplanki ген, кодирующий белок PDiap1 (Putative Death-associated inhibitor of apoptosis 1), повышающая радиационную устойчивость клеток Polypedilum vanderplanki.
Заявленное техническое решение удовлетворяет критерию «новизна», предъявляемому к изобретениям, так как при определении уровня техники не выявлены средства, которым присущи признаки, идентичные (то есть совпадающие по исполняемой ими функции и форме выполнения этих признаков) всем признакам, перечисленным в формуле предполагаемого изобретения, включая характеристику назначения.
Заявленное техническое решение удовлетворяет критерию «изобретательский уровень», т.к. не является очевидным для специалиста в данной области техники и из исследованного уровня техники заявителем не выявлены технические решения, совпадающие по технической сущности с предлагаемым решением, и не установлена известность влияния отличительных признаков на полученный технический результат.
Заявленное техническое решение соответствует критерию «промышленная применимость», предъявляемому к изобретениям, может быть осуществлено с применением стандартного оборудования и известных приемов.
ИСПОЛЬЗОВАННЫЕ ИСТОЧНИКИ
[1] Watanabe M. et al. Biological effects of anhydrobiosis in an African chironomid, Polypedilum vanderplanki on radiation tolerance // Int. J. Radiat. Biol. 2006. Vol. 82. P. 587–592].
[2] Gusev O. et al. Comparative genome sequencing reveals genomic signature of extreme desiccation tolerance in the anhydrobiotic midge // Nat. Commun. Nature Publishing Group, 2014. Vol. 5. P. 4784.
[3] Watanabe K. et al. Air-dried cells from the anhydrobiotic insect, Polypedilum vanderplanki, can survive long term preservation at room temperature and retain proliferation potential after rehydration // Cryobiology. 2016. Vol. 73(1). P. 93-98.
[4] Li S. et al. Late embryogenesis abundant proteins protect human hepatoma cells during acute desiccation // Proc Natl Acad Sci U S A. 2012. Vol. 109(51). P. 20859-64.
[5] Патент WO2010025764 2006.01 C12N 15/85 AOlK 67/033 C12N 15/866. Приоритет от 02.09.2008. Опубл. 11.03.2010. Описание изобретения.
[6] Патент WO1998044141 2006.01 C07K 14/575 C07K 14/79 C12N 15/69 C12N 15/85 C12N 9/64. Приоритет от 26.03.1998. Опубл. 08.10.1998. Описание изобретения.
[7] Патент RU 2626590 С2 МПК-2015.01 C12N 15/00 C12N 15/79 C12N 15/63. Приоритет от 18.12.2015. Опубл. 22.06.2017. Описание изобретения.
[8] Gibson D.G. et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. // Nat. Methods. 2009. Vol. 6, № 5. P. 343–345.
[9] Nakahara Y. et al. Cells from an anhydrobiotic chironomid survive almost complete desiccation // Cryobiology. Elsevier Inc., 2010. Vol. 60, № 2. P. 138–146.
[10] Cohen S.N. et al. Construction of biologically functional bacterial plasmids in vitro. // Proc. Natl. Acad. Sci. U. S. A. 1973. Vol. 70, № 11. P. 3240–3244.
--->
SEQUENCE LISTING
<110> федеральное государственное автономное образовательное учреждение
высшего образования "Казанский (Приволжский) федеральный университет"
(ФГАОУ ВО КФУ)) (federalnoe gosudarstvennoe avtonomnoe obrazovatelnoe
uchrezhdenie vysshego obrazovaniya "Kazanskij (Privolzhskij) federalnyj
universitet" (FGAOU VO KFU))
<120> Генетическая конструкция c геном белка-ингибитора апоптоза,
предназначенная для экспрессии чужеродных генов в клетках насекомого
Polypedilum vanderplanki в
условиях повышенного радиационного фона
<140> 2021108416/20(018071)
<141> 29.03.2021
<160> 9
<170> BiSSAP 1.3.6
<210> 1
<211> 369
<212> DNA
<213> Polypedilum vanderplanki
<400> 1
atgaagaatt tttttgttca agatgaatta attaatttgg attcctataa tttatataag 60
gaaattgatc gacaaaaatc atttattgaa aaccattggt ctaaccaatt tgtgaaatat 120
gaagatttag ctcaaattgg attttatttt ttaaggagac ctgatatcgt atgctgtaga 180
ttttgtgatg ttgttttggg tgaatttgaa gaaaatgata ttcctttaaa agaacaccaa 240
aaattttcac caaattgtcc attacttctg aaaagattca cgaagaacat tccaatcaat 300
caatcaaaac ttgataaaat tttaccgaaa agttacccga tgaatatggt tgatctaaaa 360
tatttctag 369
<210> 2
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер I для получения гена, кодирующего белок PDiap1
<400> 2
ctggctagcg tttaaactta atgaagaatt tttttgtt 38
<210> 3
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер II для получения гена, кодирующего белок PDiap1
<400> 3
tttaaacggg ccctctagac gaaatatttt agatcaacc 39
<210> 4
<211> 85
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер I для получения промотора pGAPDH
<400> 4
cgtattggac gtttggtcct ggatccccac cctcgagaag cttggcggcc gctctagatg 60
ataaagcgcg gttcgaaggt aagcc 85
<210> 5
<211> 55
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер II для получения промотора pGAPDH
<400> 5
tgcaaataaa agatcaagtt gaattcagac atgataagat acattgatga gtttg 55
<210> 6
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер I для получения плазмиды pIZT/V5-His
<400> 6
aacttgatct tttatttgca cac 23
<210> 7
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер II для получения плазмиды pIZT/V5-His
<400> 7
aggaccaaac gtccaatac 19
<210> 8
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер I для проведения количественного ПЦР (qPCR)
<400> 8
aaggaaattg atcgacaaaa atcattt 27
<210> 9
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер II для проведения количественного ПЦР (qPCR)
<400> 9
ttagatcaac catattcatc gggt 24
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Генетическая конструкция для повышения радиационной устойчивости культуры клеток насекомого P. vanderplanki | 2021 |
|
RU2763049C1 |
| ГЕНЕТИЧЕСКАЯ КОНСТРУКЦИЯ ДЛЯ ЭКСПРЕССИИ ГЕНОВ В КЛЕТКАХ НАСЕКОМОГО POLYPEDILUM VANDERPLANKI | 2015 |
|
RU2626590C2 |
| СПОСОБ КОНСЕРВАЦИИ И РАСКОНСЕРВАЦИИ ЖИВЫХ КЛЕТОК | 2016 |
|
RU2683375C2 |
| Микроорганизм рода Corynebacterium, продуцирующий L-аминокислоты, и способ получения L-аминокислот с его использованием | 2022 |
|
RU2824668C1 |
| ПОЛИВАЛЕНТНЫЙ РЕКОМБИНАНТНЫЙ ВИРУС ОСПЫ СВИНЕЙ | 2017 |
|
RU2766008C2 |
| ПЛАЗМИДА ДЛЯ ВЫЯВЛЕНИЯ МЕЗЕНХИМАЛЬНОГО СОСТОЯНИЯ КЛЕТКИ | 2019 |
|
RU2715643C1 |
| МИКРООРГАНИЗМЫ ДЛЯ ПОЛУЧЕНИЯ L-ТИРОЗИНА И СПОСОБ ПОЛУЧЕНИЯ L-ТИРОЗИНА С ИХ ИСПОЛЬЗОВАНИЕМ | 2020 |
|
RU2779461C1 |
| СПОСОБ ПРОДУЦИРОВАНИЯ СЕРОСОДЕРЖАЩЕЙ АМИНОКИСЛОТЫ ИЛИ ЕЕ ПРОИЗВОДНОГО | 2020 |
|
RU2814546C2 |
| Нуклеиновокислотная последовательность для обнаружения наличия трансгенного трансформанта сои DBN9004 в биологическом образце, набор, содержащий такую последовательность, и способ такого обнаружения | 2017 |
|
RU2743397C2 |
| Микроорганизм, экспрессирующий белок, происходящий из Shewanella atlantica, и способ получения L-аминокислоты с его использованием | 2021 |
|
RU2826633C1 |

Изобретение относится к генетической конструкции для экспрессии чужеродных генов в клетках насекомого Polypedilum vanderplanki в условиях повышенного радиационного фона. Предложенная генетическая конструкция включает выделенный из последовательности ДНК Polypedilum vanderplanki ген, кодирующий белок PDiap1, c нуклеотидной последовательностью SEQ ID NO: 1, промотор pGAPDH, участок полиаденилирования, точку начала репликации PUC и ген устойчивости к антибиотику канамицин. Изобретение обеспечивает повышение радиационной устойчивости клеток насекомого Polypedilum vanderplanki. 4 ил., 1 табл., 1 пр.
Генетическая конструкция для экспрессии чужеродных генов в клетках насекомого Polypedilum vanderplanki в условиях повышенного радиационного фона, включающая выделенный из последовательности ДНК Polypedilum vanderplanki ген, кодирующий белок PDiap1, c нуклеотидной последовательностью SEQ ID NO: 1, промотор pGAPDH, участок полиаденилирования, точку начала репликации PUC и ген устойчивости к антибиотику канамицин.
| ГЕНЕТИЧЕСКАЯ КОНСТРУКЦИЯ ДЛЯ ЭКСПРЕССИИ ГЕНОВ В КЛЕТКАХ НАСЕКОМОГО POLYPEDILUM VANDERPLANKI | 2015 |
|
RU2626590C2 |
| WO 1998044141 A2, 08.10.1998 | |||
| WO 2010025764 A1, 11.03.2010 | |||
| US 7939647 B2, 10.05.2011 | |||
| VORONINA, T.A., ET AL | |||
| New group of transmembrane proteins associated with desiccation tolerance in the anhydrobiotic midge Polypedilum vanderplanki | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2022-03-16—Публикация
2021-03-29—Подача