Область техники
Настоящее изобретение относится к биотехнологии и генной инженерии, а именно касается генетической конструкции, позволяющей оценивать мезенхимальное состояние клеток человека. Представленная конструкция включают помимо стандартных элементов для функционирования конструкции участок промотера нейронального кадгерина (CDH2) с нуклеотидной последовательностью Cdh2 - SEQ ID NO:l, а также флуорофоры. Решение можно реализовать в высокопроизводительном поиске лекарственных средств, а также для выявления факторов, влияющих на эффективность метастазирования.
Уровень техники
Причиной более 90% смертельных исходов при онкологических заболеваниях является развитие метастазов [Каприн А.Д., Старинский В., Петрова Г.В. Злокачественные новообразования в России в 2015 году (заболеваемость и смертность). 2015; Samatov T.R. et al. Novel biomarkers in cancer: The whole is greater than the sum of its parts // Seminars in Cancer Biology. 2016] Малигнизация опухолевых клеток сопровождается фенотипическими и функциональными изменениями, которые приводят к повышению пролиферативной активности и инвазивного потенциала. Приобретение клетками инвазивного фенотипа обусловлено процессом эпителиально-мезенхимальной трансформации (ЭМТ) [Samatov T.R. et al. Modelling the metastatic cascade by in vitro microfluidic platforms. // Prog. Histochem. Cytochem. 2015. Vol. 49, №4. P. 21-29]. При ЭМТ происходит разрушение межклеточных контактов, перестройка цитоскелета, а также повышение уровня экспрессии ряда генов-маркеров мезехимального состояния, таких как виментин, десмин и интегрин α5β1. Многочисленные исследования показали, что данный процесс ассоциирован с ключевыми стадиями процесса метастазирования [Yang J., Weinberg R.A. Epithelial-mesenchymal transition: at the crossroads of development and tumor metastasis. // Dev. Cell. 2008. Vol. 14, №6. P. 818-829]. Таким образом ЭМТ рассматривается как потенциальная мишень при разработке противоопухолевых препаратов [Marcucci F., Stassi G., De Maria R. Epithelial-mesenchymal transition: a new target in anticancer drug discovery // Nat. Rev. Drug Discov. Nature Publishing Group, 2016. Vol. 15, №5. P. 311-325].
В отличии от большинства систем скрининга противоопухолевых препаратов, основанных на измерении активности определенных молекулярных мишеней, все описанные на сегодняшний день подходы к выявлению молекул-ингибиторов ЭМТ основаны на регистрации изменения фенотипа модельных клеток. Это объясняется комплексностью процесса перехода клетки из эпителиального состояния в мезенхимальное. Так, стимулами данного процесса могут являться гипоксия, механический стресс, иммунный ответ, состав внеклеточного матрикса и противоопухолевые препараты [Marcucci F., Stassi G., De Maria R. Epithelial-mesenchymal transition: a new target in anticancer drug discovery // Nat. Rev. Drug Discov. Nature Publishing Group, 2016. Vol. 15, №5. P. 311-325]. В ряде работ были предприняты попытки идентифицировать отдельные молекулярные мишени для ингибирования ЭМТ, однако полученные данные являются противоречивыми [Reka А.K. et al. Identifying inhibitors of epithelial-mesenchymal transition by connectivity map-based systems approach. // J. Thorac. Oncol. 2011. Vol. 6, №11. P. 1784-1792; Polireddy K. et al. Targeting Epithelial-Mesenchymal Transition for Identification of Inhibitors for Pancreatic Cancer Cell Invasion and Tumor Spheres Formation. // PLoS One. 2016. Vol. 11, №10. P. e0164811; Lotz-Jenne C. et al. A high-content EMT screen identifies multiple receptor tyrosine kinase inhibitors with activity on TGFβ receptor. // Oncotarget. 2016. Vol. 7, №18].
Одним из способов определения соединений, влияющих на процесс ЭМТ, является регистрация изменения уровня экспрессии генов-маркеров эпителиального и мезенхимального состояний.
Из уровня техники известен способ выявления циркулирующих опухолевых клеток, сущность которого заключается в сборе цельной крови пациентов, удалении эритроцитов, выделении рибонуклеиновых кислот (РНК) опухолевых клеток и проведении полимеразной цепной реакции (ПЦР) с специфичными праймерами к генам-маркерам эпителиального (ЕРСАМ, CDH1, KRT7, KRT19 и KRT20) и мезенхимального (CDH2, виментин, фибронектин, ММР9 и AKT2) состояния с регистрацией сигнала флуориметрическим детектором. Данное решение также применимо и к культурам клеток (CN 106868101, 2017-06-20). Недостатком данного способа является высокая длительность процедур выделения РНК и ПЦР, что не позволяет использовать данное решение для высокопроизводительного поиска лекарств.
Из уровня техники также известен способ определения и типирования циркулирующих опухолевых клеток, сущность которого заключается в регистрации количества клеток, находящихся в эпителиальном или в мезенхимальном состоянии, методом проточной цитометрии и антител, меченных флуорофорами, специфичных к белкам-маркерам эпителиального (ЕРСАМ, CDH1, KRT5, KRT7, KRT8, KRT16, KRT17, KRT18, KRT19, KRT20) и мезенхимального (CDH2, виментин, фибронектин, ММР2, ММР3, ММР9, AKT2, ZEB1, FOXC1, FOXC2, SNAI1, SNAI2, SERPINE1) состояния (CN 106996975, 2017-08-01). Недостатком данного способа является длительность процедуры проточной цитометрии, высокой стоимости используемых антител и оборудования.
Из уровня техники также известен способ выявления терапевтических мишеней, ассоциированных с ЭМТ, который заключается в определение содержания РНК генов-мишеней нейронального кадгерина и белков-мишеней в опухолевых тканях методами ПЦР, иммуноблоттинга, секвенирования и масс-спектрометрии (US 20130137584, 2013-05-30). Недостатком данного способа является отсутствие маркеров эпителиального состояния, что не позволяет оценивать соотношение клеток, находящихся в эпителиальном и мезенхимальном состоянии клеток, а также низкую производительность, что не позволяет использовать данный способ для высокопроизводительного поиска лекарств.
Из уровня техники также известен способ определения ЭМТ, который заключается в магнитной сепарации опухолевых клеток из цельной крови пациента с последующей оценкой уровня экспрессии генов-маркеров мезенхимального состояния (CDH2, виментин, фибронектин, Snail1, Snail2, Twist1 и др.) и стволовых клеток (FGF2, BMI1, ALDH1, CD44, CD24, KRT19 и др.) методом ПЦР (WO 200936968, 2009-03-26). Недостатком данного способа является высокая длительность процедур выделения РНК и ПЦР, что не позволяет использовать данный способ для высокопроизводительного поиска лекарств.
Наиболее близким решением является способ определения состояния клеток с использованием флуоресцентных репортеров, описанный в работе [Toneff M.J. et al. The Z-cad dual fluorescent sensor detects dynamic changes between the epithelial and mesenchymal cellular states // BMC Biol. 2016. Vol. 14, №1. P. 1-16], которой заключается в применении разработанного клеточного сенсора для слежения за динамикой перехода из эпителиального в мезенхимальные состояние и обратно. В качестве репортера эпителиального состояния используется флуоресцентный белок RFP, экспрессируемый под промотором CDH1, а в качестве маркера мезенхимального состояния - флуоресцентный белок GFP 3'-некодируемой областью (3'-UTR) ZEB1. Недостатком данного сенсора является механизм активации репортера мезенхимального состояния, которая указывает не на транскрипционную регуляцию транскрипционного фактора CDH2, а на его пост-транскрипционную регуляцию с помощью микроРНК.
Отличительной чертой ЭМТ является снижение уровня экспрессии эпителиального кадгерина (Е-кадгерина, ген CDH1), что приводит к разрушению межклеточных контактов. Подавление экспрессии генов, кодирующих белки эпителиальных клеточных контактов, сопровождается активацией генов, способствующих мезенхимальной адгезии. В частности, понижение экспрессии Е-кадгерина сопровождается повышением экспрессии мезенхимального нейронального кадгерина, N-кадгерина (CDH2). В результате у клеток появляется аффинность к мезенхимальным клеткам за счет гомотипичных белковых взаимодействий N-кадгеринов. Эти взаимодействия слабее, чем гомотипичные взаимодействия Е-кадгеринов, и способствуют клеточной миграции и инвазии [Theveneau Е., Mayor R. Cadherins in collective cell migration of mesenchymal cells // Current Opinion in Cell Biology. 2012. Vol. 24, №5. P. 677-684]. Таким образом, определение уровней экспрессии генов CDH1 и CDH2 может быть использовано для определения мезенхимального или эпителиального состояния клетки.
Раскрытие изобретения
Задачей настоящее изобретения является создание генетической конструкции, обеспечивающей быструю и достоверную оценку мезенхимального состояния клетки.
Сущностью заявленного технического решения является генетическая конструкция, способная обеспечивать экспрессию различных флуорофоров в клетках человека, находящихся в мезенхимальном состоянии.
Техническим результатом заявляемой группы изобретений является сокращение по времени выявление фенотипического состояния клеток до 2-3 часов, с высокой степенью достоверности.
Поставленная задача решается плазмидой для трансфекции в клетки человека для выявления их мезенхимального состояния, включающей участок с нуклеотидной последовательностью промотера гена-маркера мезенхимального состояния и по меньшей мере одну последовательность флуоресцентного белка, при этом участок нуклеотидной последовательности флуоресцентного белка находится под контролем промотера гена-маркера мезенхимального состояния, при этом в качестве гена-маркера мезенхимального состояния используют нейрональный кадгерин человека с нуклеотидной последовательностью SEQ ID NO: 1.
Также поставленная задача решается клеточными линиями человека, трансфицированными заявляемой плазмидой для изучения влияния лекарственных средств на фенотипическое состояние клеток мезенхимального состояния.
Таким образом была создана генетическая конструкция, включающая участок промотера нейронального кадгерина (CDH2) с нуклеотидной последовательностью SEQ ID NO:1, а также флуорофор для использования при скрининге противоопухолевых препаратов.
Краткое описание чертежей
Заявленное техническое решение иллюстрируется следующими материалами.
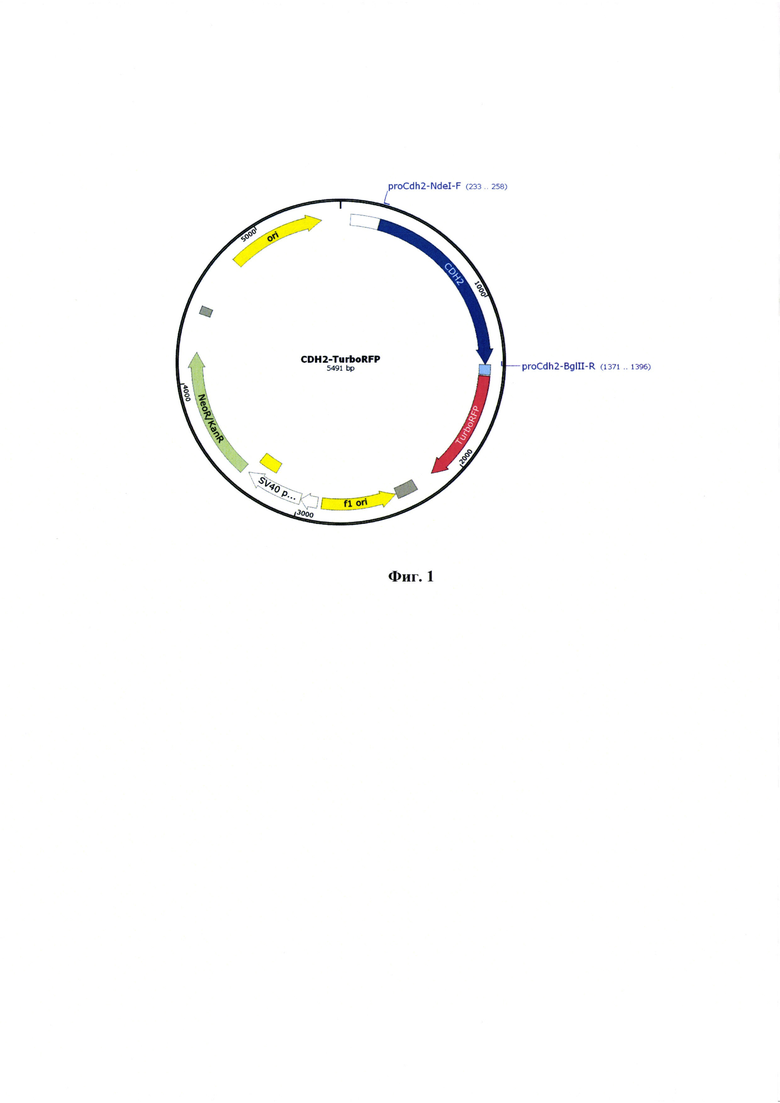
Фиг. 1 - Физическая карта генетической конструкции CDH2-TurboRFP.
Фиг. 2 - Фотография флюоресценции культуры клеток HEK-293, находящихся в мезенхимальном состоянии, экспрессирующих ген RFP после трансфекции конструкцией CDH2-TurboRFP.
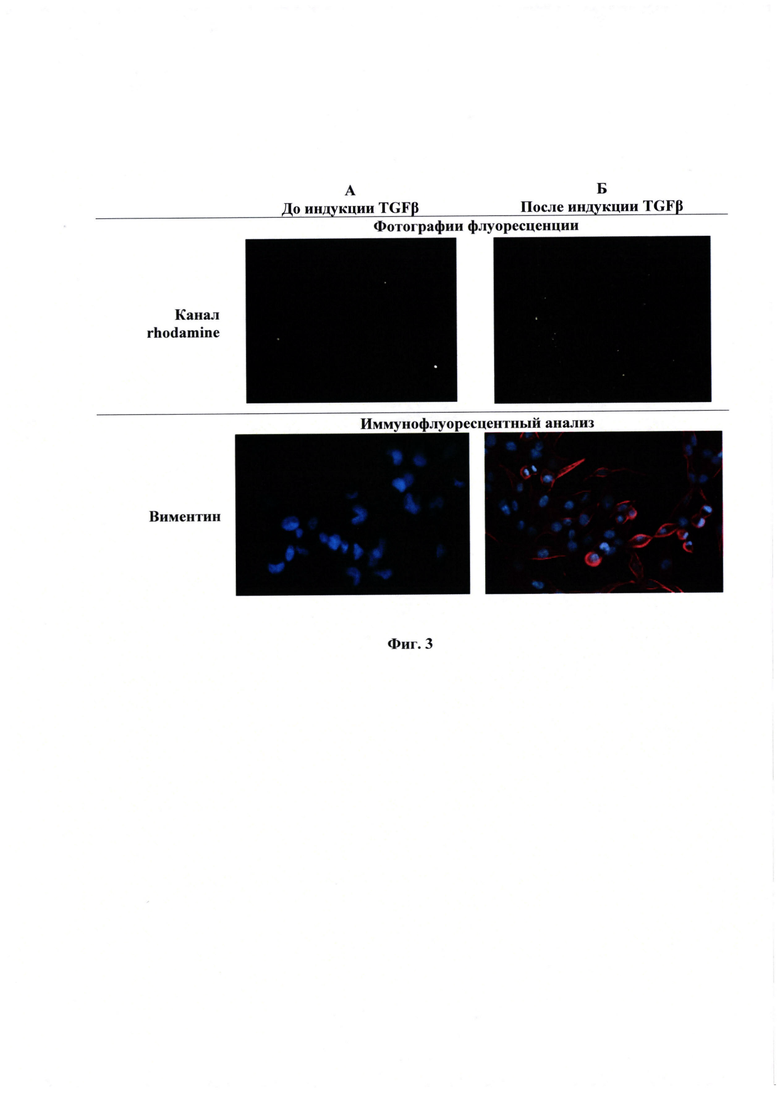
Фиг. 3 - Фотография флюоресценции и культуры клеток иммунофлуоресцентный анализ состояния клеток MDA-MB-231 до индукции (А), фотография флюоресценции и культуры клеток иммунофлуоресцентный анализ состояния клеток MDA-MB-231 после индукции (Б).
Осуществление изобретения
Средства и методы конструирования широко известны и описаны [Lundblad, R., Macdonald, F. (Ed.). Handbook of Biochemistry and Molecular Biology, Fourth Edition. 2010. Boca Raton: CRC Press].
Получение конструкций проводят, выделяя общую ДНК из первичных клеток или клеточных линий человека с использованием предназначенных для этого коммерческих наборов, например, PureLink™ Genomic DNA Mini Kit (Thermo Scientific, США) или аналогичных. Для этого отбирают образец ткани или проводят культивирование клеток в лабораторных условиях, отделяют клетки от культуральной среды центрифугированием, и далее следуют инструкции производителя. Отдельно синтезируются праймеры, специфичные к началу и концу промотера нейронального кадгерина (CDH2). Праймеры должны дополнительно содержать участки с последовательностями, распознаваемыми эндонуклеазами рестрикции, аналогичные тем, что присутствуют в выбранном векторе, например SacI, SaiI, XbaI, XhoI и др., причем при выборе сайтов рестрикции необходимо руководствоваться тем, содержащиеся в векторе последовательности флуоресцентных белков, должны находиться под контролем промотера CDH2. Для этого встраиваемая последовательность промотера CDH2 должна находиться на 5' конце последовательности последовательности флуоресцентного белка.
Затем проводят реакцию ПЦР с праймерами и используя полученную ДНК в качестве матрицы, а также коммерчески-доступных высокоточных полимераз, например Q5® High-Fidelity DNA Polymerase в буфере High GC Enhancer (New England Biolabs, США).
При выборе вектора руководствуются не только наличием необходимых сайтов рестрикции, но и наличием регуляторных элементов. В качестве векторов для создания генетических векторов могут быть использованы любые коммерческие векторы, содержащие ген устойчивости к антибиотикам для возможности селекции, например, ампициллин, канамицин, зеомицин и др., регуляторные элементы для экспрессии в эукариотических клетках, селективный маркер для возможности селекции плазмиды в бактериях, SV40 концевой интрон, poly(А)-сигнал, последовательность флуорофора, например, pNeoEGFP, pTurboRFP-PRL и другие. В качестве флуорофоров могут быть использованы и флуоресцентные белки, способные экспрессироваться в эукариотических клетках, например, зеленый флуоресцентный белок, красный флуоресцентный белок, синий флуоресцентный белок и другие.
Полученные в результате реакции ПЦР фрагменты и выбранный вектор подвергаются рестрикции по соответствующим сайтам. После этого, продукты рестрикции очищают, проводя электрофорез в 1% агарозном геле и выделяя с использованием коммерчески-доступных наборов для выделения из агарозного геля, innuPREP Gel Extraction Kit (Analytik Jena, Германия). Очищенный продукты рестрикции смешивают следующим образом: рестрицированный фрагмент промотора эпителиального кадгерина смешивают с рестрицированным вектором, рестрицированный фрагмент промотора нейронального кадгерина смешивают с рестрицированным вектором. Полученные смеси лигируют с использованием коммерчески-доступных лигаз, например, с помощью набора Quick Ligation™ Kit (New England Biolabs, США). После проведения лигирования, проводят трансфекцию клеток линий человека. В качестве клеточных линий могут быть использованы любые иммортализованные клеточные культуры человека, за исключением эмбриональных клеток человека. Так, например, могут быть использованы клеточные линии: SH-SY5Y, MCF-7, А-549, MDA-MB-231, DU-4477 и другие. Трансфекцию проводят с использованием и по протоколу коммерчески-доступных реагентов для трансфекции, например, Turbofect (Thermo Scientific Fisher).
Затем проводят селекцию на антибиотике, к которому в векторе содержится ген устойчивости, например, на ампициллине, канамицине, зеомицине и др. Для этого проводят культивирование клеток в среде, содержащей соответствующий антибиотик, например, 700 мкг/мл G-418 (Thermo Fischer Scientific) в течение трех недель со сменой среды каждые 3 дня. В результате получают клетки, трансфецированные вектором, содержащим участок промотера CDH2.
После этого полученные клетки используют для изучения воздействия лекарственных соединений на эпителиальное и/или мезенхимальное состояние трансфецированных клеток. Для этого проводят культивирование клеток в планшетах, в среде, содержащей различные концентрации изучаемого вещества или различные изучаемые соединения. После инкубации в течение 3-5 часов, проводят визуализацию клеток проводили с использованием флуоресцентного микроскопа, например, Carl Zeiss Axio Observer Z1 на канале флуоресценции rhodamine (для RFP) и в фазовом контрасте. По соотношению количества клеток, видимых на канале rhodamine до и после инкубации с изучаемым соединением, оценивают его эффективность.
Осуществление заявленного технического решения демонстрируется следующими примерами.
Пример 1
В примере продемонстрирован процесс получения генетической конструкции, включающей участок промотора нейронального кадгерина (CDH2) с нуклеотидной последовательностью SEQ ID NO:l, а также флуорофор на основе генетической последовательности pTurboRFP-N.
При выборе длины клонируемого участка промотора CDH2 учитывали два фактора: фрагмент промотора должен содержать сайты связывания с известными факторами транскрипции данных генов и в то же время обладать минимальным размером во избежание сложностей при амплификации.
В отличие от Е-кадгерина, регуляция N-кадгерина изучена мало. На удалении -1375 п.н. от старт-кодона находится предполагаемый центра связывания транскрипционных факторов STAT1 и STAT3. При этом на участке промотора CDH2 -176 - -922 п.н. присутствуют сайты связывания регулятора ЭМТ MZF1 [Cardamone M.D. et al. ERalpha as ligand-independent activator of CDH-1 regulates determination and maintenance of epithelial morphology in breast cancer cells. // Proc. Natl. Acad. Sci. U.S.A. 2009. Vol. 106, №18. P. 7420-7425]. В работе [Yang H. et al. TGF-β-activated SMAD3/4 complex transcriptionally upregulates N-cadherin expression in non-small cell lung cancer // Lung Cancer. Elsevier Ireland Ltd, 2015. Vol. 87, №3. P. 249-257] было изучено влияние длины промоторной области CDH2 на экспрессию N-кадгерина при ЭМТ, индуцированной TGFβ. В исследовании были использованы репортерные плазмиды с люциферазой, экспрессия которой управлялась участками промоторной области CDH2 различной длины (250-1500 п.н. от старт-кодона). Было показано, что наибольшей TGFβ-зависимой экспрессией обладали конструкции с фрагментами промотора CDH2 длиной 1460 и 1078 п.н. При этом для TGFβ-зависимой экспрессии люциферазы в клетках рака легких А549 было достаточно участка промотора от -1078 до -891 п.н. Авторами было показано, что этот участок промотора CDH2 содержит 4 сайта связывания транскрипционных факторов (Е-бокс, SBE1, SRY и SBE2). В то же время, в остеобластах и в клетках глиомы А172 для экспрессии гена-репортера (люциферазы) было достаточно участка промотора длиной 335 п.н. [Le  S.,
S.,  О., Marie P.J. Sp1/Sp3 and the myeloid zinc finger gene MZF1 regulate the human N-cadherin promoter in osteoblasts // Exp. Cell Res. 2005. Vol. 302, №1. P. 129-142]. Для создания репортерной системы был амплифицирован участок промоторной области CDH2 от -1443 до -292 п.н.
О., Marie P.J. Sp1/Sp3 and the myeloid zinc finger gene MZF1 regulate the human N-cadherin promoter in osteoblasts // Exp. Cell Res. 2005. Vol. 302, №1. P. 129-142]. Для создания репортерной системы был амплифицирован участок промоторной области CDH2 от -1443 до -292 п.н.
Культивируют любые клетки человека, например клетки линии SH-SY5Y или HEK-293 в культуральных флаконах с площадью поверхности 25 см2 в 5 мл среды DMEM (Gibco, США) с добавлением 10% фетальной бычьей сыворотки (HyClone, Thermo Scientific, США) и 0,1% пенициллин/стрептомицина (Gibco, США). Из клеток выделяют общую ДНК, например, с использованием специализированного коммерческого набора Nucleospin tissue kit (производства фирмы Macherey Nagel, Германия). Последовательность участка промотера CDH2 представлена последовательностью SEQ ID NO:1. Данный фрагмент получают с использование выделенной ДНК в качестве матрицы, специфичных праймеров, представленных последовательностям SEQ ID NO:2 и SEQ ID NO:3, а также высокоточной полимеразы, например Q5® High-Fidelity DNA Polymerase в буфере High GC Enhancer (New England Biolabs, США).
После проведения амплификации промоторный участок гена CDH2 клонируют по сайтам рестрикции NdeI и BblII, с использованием соответствующих эндонуклеаз рестрикции (Thermo Fischer, США). Затем проводят электрофорез для полученных реакционных смесей в 0,5% агарозном геле, фрагменты с нужной массой выделяют с помощью набора innuPREP Gel Extraction Kit (Analytik Jena, Германия). Очищенный фрагмент промотора CDH2 лигируют с помощью набора Quick Ligation™ Kit (New England Biolabs, США) с предварительно рестрицированой плазмидой pTurboRFP-N (Евроген, Россия),. В результате был получен репортер CDH2-TurboRFP (Фиг. 1).
Пример 2
Накопление флуорофора в клетках, находящихся в мезенхимальном состоянии (на примере клеток линии HEK-293).
Полученной в примере 1 репортерной конструкцией CDH2-TurboRFP трансфецируют клетки мезенхимального (HEK-293) фенотипа. Трансфекцию проводят с помощью трансфекционного агента Turbofect (Thermo Scientific Fisher) в двух повторах. Для получения стабильных линий клетки инкубируют в селективной среде, содержащей 700 мкг/мл G-418 (Thermo Fischer Scientific) в течение трех недель со сменой среды каждые 3 дня. Визуализацию клеток проводят с использованием микроскопа Carl Zeiss Axio Observer Z1 на каналах флуоресценции rhodamine (для RFP) и в фазовом контрасте. На Фиг. 2 представлена фотография культуры клеток мезенхимального фенотипа (HEK-293). Установленная флюоресценция на канале флуоресценции rhodamine свидетельствует о наличии красного флуоресцентного белка в данных клетках и об успешной экспрессии гена красного флуоресцентного белка с использованием генетической конструкции-репортера мезенхимального состояния.
Пример 3
Изменение количества флуорофора в клетках при изменении их фенотипа. Полученную в примере 1 репортерную конструкцию CDH2-TurboRFP трансфецируют в клетки MDA-MB-231 как указано в примере 2. Проводят визуализацию клеток с использованием микроскопа Carl Zeiss Axio Observer Z1 на канале флуоресценции rhodamine (для RFP) и в фазовом контрасте. Клетки культивируют, как указано во примере 2, затем меняют среду на бессывороточную и культивируют еще 24 часа. После этого индуруют ЭМТ с помощью раствора TGFβ (5нг/мл) в бессывороточной среде и инкубируют в течение 72 часов. Затем часть клеток клеток повторно визуализируют с использованием флуоресцентного микроскопа, другую часть клеток фиксируют в 4% формальдегиде в фосфатном буфере (0,01 М фосфатно-солевой буфер) в течение 20 минут при комнатной температуре, а затем обрабатывают 10% метанолом при -20°С в течение 5 минут. Клетки отмывают в фосфатном буфере и блокируют 1 час в 2% бычьей фетальной сыворотке в фосфатном буфере. Затем клетки инкубируют в течение двух часов с первичными антителами к виментину (Abcam), в качестве маркера мезенхимального состояния. Далее клетки промывают 5 раз по 5 минут фосфатным буфером, а затем инкубируют один час с вторичными антителами, конъюгированными с флуоресцентными метками AlexaFluor555 (1:1000, Abcam), и промывают 5 раз по 5 минут буфером ПБС. Клетки окрашивают DAPI (1:2000), промывают дважды ПБС и анализируют при помощи флуоресцентного микроскопа Фиг. 3.
Из данных, представленных на Фиг. 3 видно, что данные иммунофлуоресцентного анализа и фотографий флуоресценции репортера сходятся. В клетка после индукции наблюдается экспрессия виментина и накопление красного флуоресцентного белка.
Приведенные примеры осуществления предлагаемого изобретения показывают его осуществимость с использованием стандартного оборудования и материалов, полезность для применения в биотехнологиях, например, для высокопроизводительного поиска лекарств - ингибиторов ЭМТ.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Федеральное государственное бюджетное учреждение «Национальный медицинский исследовательский центр радиологии» Министерства здравоохранения Российской Федерации (ФГБУ «НМИЦ радиологии» Минздрава России)
<120> ПЛАЗМИДА ДЛЯ ВЫЯВЛЕНИЯ МЕЗЕНХИМАЛЬНОГО СОСТОЯНИЯ КЛЕТКИ
<160> SEQ ID NО:1
<210> 2
<211> 1152
<212> DNA
<213> Artificial sequence
<400> 2
1 ACGTTAGGCT CCCAAGGAGA caccgccccc ccttccccac cattcttcat
51 ctccattaga ttccctaccg cggaccaaag atgaacctgc taccaatcaa
101 gttcctgccc aagttatttt atttcccgca gcccctccac ctgccggggc
151 ggtgctcggc gcactctagg cttccctccg gcgacccccc gcgggctgca
201 gcaaaatacg gggcgcttcg gcggggcggg ggcgggcggc tgccgcggat
251 ccggccggct acagccgcag cttggtggcc tccgattggc cacgacgcgg
301 gcggggaggc tcggcggagg agggaggcgg gggcgagggc ggcggcggcg
351 gcgggaggaa taggagaggg gagcgggccg cgcagccagg cagcgcgtgg
401 ggcgagcgcg gggagagcgg cggcggctcg cccaggtcgc gcagcggagg
451 ccgagcgggg tgcgcggtcg gcgacggagg gcggcgcgcg cgagtgagcg
501 gcgcagggcg aggaccggcg ggcgggtgcc ggtgcgcggg cagcaggggc
551 ggctgcggca gcagctgcgc gggacggagc cgcggcggga gagaccgcgc
601 cggcccctcg cctcaccccc ttgcggccga ggccggagaa cagtctccaa
651 ctcgccgggg gaccggaaag aggagccgag aagcgcccct cggcccccac
701 gcagcggagg cgcggagtgg cgggactgct gctctttgtg ggtgcagcac
751 gcacgacccg gagcgccctc cccgcggcgc tgtccccggc gtcttcgtcg
801 cgccgagcgg ccctggagcg gggacccgga ggaagcaaaa ccacgagccc
851 gaaacctcgc gtggcggagc tcttggggag cgccatccgc tccacttcca
901 cctccacatC CTCCACCGGC CAAGGTCCCC GCCGCTGCAT CCCTCGCGGC
951 TTCCGCTGCG CTCCGGGCCG GAGCCGAGCC GCCTGCGCTG CCACAGCAGC
1001 CGCCTCCACA CACTCGCAGA CGCTCACACG CTCTCCCTCC CTGTTCCCCC
1051 GCCCCCTCCC CAGCTCCTTG ATCTCTGGGT CTGTTTTATT ACTCCTGGTG
1101 CGAGTCCCGC GGACTCCGCG GCCCGCTATT TGTCATCAGC TCGCTCTCCA
1151 TT
160> SEQ ID NО:2
<210> 5
<211> 32
<212> DNA
213> Artificial sequence
<223> proCDH2-NdeI-F
<400> 5
1 TAAGCACATA TGACGTTAGG CTCCCAAGGA GA
160> SEQ ID NО:3
<210> 6
<211> 32
<212> DNA
213> Artificial sequence
<223> proCDH2-BglII-R
<400> 6
1 ATTCGTAGAT CTAATGGAGA GCGAGCTGAT GA
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ФЛУОРЕСЦЕНТНЫЕ РЕПОРТЕРНЫЕ СИСТЕМЫ ДЛЯ ОЦЕНКИ ЭПИТЕЛИАЛЬНОГО И/ИЛИ МЕЗЕНХИМАЛЬНОГО СОСТОЯНИЯ КЛЕТКИ | 2017 |
|
RU2705251C2 |
| ПЛАЗМИДА ДЛЯ ВЫЯВЛЕНИЯ ЭПИТЕЛИАЛЬНОГО СОСТОЯНИЯ КЛЕТКИ ЧЕЛОВЕКА | 2019 |
|
RU2716054C1 |
| Способ количественной оценки доли клеток в эпителиально-мезенхимальном переходе в асцитической жидкости и солидных опухолях рака яичников | 2018 |
|
RU2704814C1 |
| СПОСОБ ИНГИБИРОВАНИЯ РАДИАЦИОННО-ИНДУЦИРОВАННОГО УВЕЛИЧЕНИЯ КОЛИЧЕСТВА СТВОЛОВЫХ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА | 2022 |
|
RU2800366C2 |
| Способ определения снижения радиационно-индуцированной миграции клеток рака молочной железы человека линии MCF-7 | 2022 |
|
RU2789099C2 |
| КОМПЛЕКС IPP В КАЧЕСТВЕ МАРКЕРА ЛЕЧЕНИЯ ЭРЛОТИНИБОМ | 2011 |
|
RU2600828C2 |
| УСЛОВНО РЕПЛИЦИРУЮЩИЙ АДЕНОВИРУС | 2012 |
|
RU2642293C2 |
| СПОСОБ ПРИМЕНЕНИЯ AXL В КАЧЕСТВЕ МАРКЕРА ЭПИТЕЛИАЛЬНО-МЕЗЕНХИМАЛЬНОГО ПЕРЕХОДА | 2010 |
|
RU2586493C2 |
| МОДИФИЦИРОВАННЫЕ ЗЕЛЕНЫЕ ФЛУОРЕСЦЕНТНЫЕ БЕЛКИ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2006 |
|
RU2412250C2 |
| ФЛУОРЕСЦИРУЮЩИЕ БЕЛКИ И ХРОМОПРОТЕИНЫ ИЗ ВИДОВ HYDROZOA, НЕ ОТНОСЯЩИХСЯ К AEQUOREA, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2003 |
|
RU2338785C2 |

Изобретение относится к биотехнологии и представляет собой плазмиду для трансфекции в клетки человека для выявления их мезенхимального состояния в отношении процесса эпителиально-мезенхимальной трансформации, включающую участок с нуклеотидной последовательностью SEQ ID NO:1 промотера гена-маркера мезенхимального состояния, в качестве которого используют нейрональный кадгерин человека, и по меньшей мере одну последовательность флуоресцентного белка TurboGFP, при этом участок нуклеотидной последовательности флуоресцентного белка находится под контролем промотера гена-маркера мезенхимального состояния. Изобретение можно использовать в высокопроизводительном поиске лекарственных средств, а также при изучении факторов, влияющих на эффективность метастазирования. 3 ил., 3 пр.
Плазмида для трансфекции в клетки человека для выявления их мезенхимального состояния в отношении процесса эпителиально-мезенхимальной трансформации, включающая участок с нуклеотидной последовательностью SEQ ID NO:1 промотера гена-маркера мезенхимального состояния, в качестве которого используют нейрональный кадгерин человека, и по меньшей мере одну последовательность флуоресцентного белка TurboGFP, при этом участок нуклеотидной последовательности флуоресцентного белка находится под контролем промотера гена-маркера мезенхимального состояния.
| ШЕВЧЕНКО Е | |||
| К | |||
| И ДР: "Эффективная трансдукция стромальных клеток жировой ткани человека с помощью рекомбинантного аденоассоциированного вируса", КЛЕТОЧНАЯ ТРАНСПЛАНТОЛОГИЯ И ТКАНЕВАЯ ИНЖЕНЕРИЯ, Т | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| TONEFF M | |||
| J | |||
| ET AL: "The Z-cad dual fluorescent sensor detects dynamic changes between the epithelial and mesenchymal cellular states", | |||
Авторы
Даты
2020-03-02—Публикация
2019-06-24—Подача