ОБЛАСТЬ ТЕХНИКИ
Предложены микроорганизм, экспрессирующий чужеродный белок, и способ получения L-аминокислоты с его использованием. Микроорганизм, экспрессирующий чужеродный белок, может иметь улучшенную способность экспортировать и/или продуцировать L-аминокислоты по сравнению с диким типом.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Микроорганизмы рода Corynebacterium представляют собой грамположительные микроорганизмы, которые широко используются в получении L-аминокислоты. L-аминокислоту используют в корме для животных, фармацевтической и косметической промышленности для людей и получают посредством ферментации с использованием штамма Corynebacterium.
Было предпринято много попыток улучшить способ получения L-аминокислоты с использованием штамма Corynebacterium. Среди них были проведены исследования по улучшению штамма Corynebacterium, продуцирующего L-аминокислоту, путем уничтожения конкретного гена или ослабления экспрессии с использованием технологии рекомбинантной ДНК. Кроме того, были проведены исследования по изучению влияния на продуцирование L-аминокислоты амплификации гена, участвующего в биосинтезе каждой L-аминокислоты, и по улучшению штамма Corynebacterium, продуцирующего L-аминокислоту. Тем не менее все еще остается необходимость в разработке штамма с улучшенной продуктивностью L-аминокислоты.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ЗАДАЧА
В одном примере предложен микроорганизм, экспрессирующий чужеродный белок. Чужеродный белок представляет собой белок, происходящий из микроорганизма, гетерогенного данному микроорганизму, и может представлять собой белок, функция экспорта лизина которого недавно обнаружена в настоящем изобретении. Микроорганизм, экспрессирующий чужеродный белок, может иметь улучшенную экспортирующую способность и/или продуктивность L-аминокислоты по сравнению с гомогенным микроорганизмом, который не экспрессирует чужеродный белок.
В другом примере предложена композиция для получения L-аминокислоты, содержащая микроорганизм, экспрессирующий чужеродный белок.
В другом примере предложена способ получения L-аминокислоты, включающий культивирование микроорганизма, экспрессирующего чужеродный белок.
Микроорганизм может представлять собой микроорганизм рода Corynebacterium.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
В настоящем описании с целью увеличения продуктивности микроорганизма рода Corynebacterium по L-аминокислоте, была предпринята попытка улучшить штамм посредством поиска и введения нового экспортирующего белка для L-аминокислоты. Описанное здесь использование L-лизина в качестве репрезентативного примера, в общем случае, представляет собой способ повышения выхода L-лизина для штамма или увеличения количества продукта, L-лизина, в час для того, чтобы увеличить продуктивность по лизину. Белок, экспортирующий L-лизин, представляет собой мембранный белок, экспортирующий лизин, продуцируемый посредством биосинтеза, и улучшение этого белка важно для увеличения выхода лизина и продуктивности. Однако увеличение уровня экспрессии белка, экспортирующего L-лизин (lysE, Ncgl1214), которым обладают микроорганизмы рода Corynebacterium, имеет ограничение в улучшении продуктивности по лизину.
Соответственно, в настоящем изобретении был проведен поиск нового чужеродного белка, экспортирующего L-аминокислоты, с высокой активностью по экспорту L-аминокислот, и путем введения его в штамм, продуцирующий лизин, был получен рекомбинантный штамм с улучшенной способностью к экспортированию и/или продуцированию L-аминокислот.
В настоящем описании, в качестве репрезентативного примера нового чужеродного экспортирующего L-аминокислоту белка, были обнаружены новый экспортирующий L-аминокислоту белок, происходящий из Shewanella atlantica, и ген, кодирующий его, и в результате его экспрессии микроорганизмом, продуцирующим L-аминокислоту, было подтверждено, что экспортирующая способность/продуктивность L-аминокислоты была значительно улучшена по сравнению с микроорганизмом, в котором ген не экспрессировался.
В одном примере предложен микроорганизм, экспрессирующий чужеродный белок. Чужеродный белок представляет собой белок, происходящий из микроорганизма, гетерогенного для данного микроорганизма, и может представлять собой белок, функция экспорта лизина которого была недавно обнаружена. Микроорганизм, экспрессирующий чужеродный белок, может иметь улучшенную экспортирующую способность и/или продуктивности по L-аминокислоте, например L-лизину или L-аргинину.
В другом примере представлена композиция для получения L-аминокислоты, содержащий микроорганизм, экспрессирующий чужеродный белок.
В другом примере предложен способ получения L-аминокислоты, включающий культивирование микроорганизма, экспрессирующего чужеродный белок.
Микроорганизм может представлять собой микроорганизм рода Corynebacterium.
L-аминокислота может включать L-лизин или L-аргинин.
Ниже это будет описано более подробно.
В настоящем описании чужеродный белок может представлять собой белок, происходящий из микроорганизма, принадлежащего к другому роду, чем родительский штамм (микроорганизм до мутации), или к другим видам микроорганизма, и, например, он может быть мембранным белком, происходящим из микроорганизма, иного чем микроорганизм, принадлежащий к роду Corynebacterium, который представляет собой белок, обладающий способностью экспортировать L-лизин или L-аргинин, недавно обнаруженный в настоящем изобретении. В одном примере чужеродный белок может быть мембранным белком, происходящим из микроорганизма рода Shewanella, например Shewanella atlantica (например представленным аминокислотной последовательностью SEQ ID NO: 1); белком (например мембранным белком), имеющим идентичность или гомологию последовательности 60% или более, 70% или более, 75% или более, 80% или более, 85% или более, 90% или более, 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, 99% или более, 99,5% или более, или 99,9% или более с указанным белком.
Микроорганизм может содержать или экспрессировать один или более типов чужеродного белка. Микроорганизм, экспрессирующий чужеродный белок, может быть рекомбинантным микроорганизмом, в который введен полинуклеотид, кодирующий чужеродный белок, описанный выше. В одном примере полинуклеотид, кодирующий белок с SEQ ID NO: 1, может быть представлен нуклеиновокислотной последовательностью SEQ ID NO: 2 или последовательностью, имеющей идентичность или гомологию последовательности 60% или более, 70% или более, 75% или более, 80% или более, 85% или более, 90% или более, 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, 99% или более, 99,5% или более, или 99,9% или более с нуклеиновокислотной последовательностью SEQ ID NO: 2.
Микроорганизм, экспрессирующий чужеродный белок, может быть микроорганизмом, продуцирующим L-аминокислоту, имеющим способность продуцировать и/или экспортировать L-аминокислоту.
В настоящем описании термин "микроорганизм, продуцирующий L-аминокислоту" может быть использован для обозначения случая, когда микроорганизм имеет повышенную продуктивность и/или экспортирующую способность в отношении L-аминокислоты, как микроорганизм с экспортирующей способностью и/или продуктивностью с отношении L-аминокислот, подвергнутый мутации для экспрессии чужеродного белка, как описано выше, и/или микроорганизм, обладающий экспортирующей способностью и/или продуктивностью с отношении L-аминокислот, как микроорганизм, не обладающий экспортирующей способностью и/или продуктивностью с отношении L-аминокислот, который подвергнут мутации для экспрессии чужеродного белка. В настоящем описании термин "микроорганизм" охватывает одноклеточные бактерии и может использоваться взаимозаменяемо с "клеткой". В настоящем описании, для того чтобы отличить микроорганизм до мутации для экспрессии чужеродного белка от мутантного микроорганизма, он может быть назван как "родительский микроорганизм (или родительский штамм) или клетка-хозяин".
L-аминокислота может представлять собой L-лизин или L-аргинин, например L-лизин.
В одном примере микроорганизм может быть выбран из всех микроорганизмов, обладающих способностью экспортировать L-аминокислоту и продуктивностью по L-аминокислоте. В одном примере микроорганизм, например родительский штамм до мутации, может представлять собой (1) микроорганизм, обладающий способностью экспортировать L-аминокислоту и продуктивностью по L-аминокислоте в природных условиях или (2) микроорганизм, обладающий способностью экспортировать L-аминокислоту и продуктивностью по L-аминокислоте или улучшенной способностью экспортировать L-аминокислоту и продуктивностью по L-аминокислоте при введении мутации в микроорганизм, обладающий способностью экспортировать L-аминокислоту и продуктивностью по L-аминокислоте в природных условиях, или штамм, имеющий значительно более низкую способность экспортировать L-аминокислоту и продуктивностью по L-аминокислоте.
В одном конкретном примере микроорганизм может быть одним или более типом, выбранным из группы, состоящей из (1) микроорганизма, обладающего способностью экспортировать L-аминокислоту и/или продуктивностью по L-аминокислоте в природных условиях или (2) всех микроорганизмов рода Corynebacterium, обладающих способностью экспортировать L-аминокислоту и продуктивностью по L-аминокислоте или с улучшенной способностью экспортировать L-аминокислоту и продуктивностью по L-аминокислоте при введении мутации в микроорганизм, обладающий способностью экспортировать L-аминокислоту и продуктивностью по L-аминокислоте в природных условиях, или штамм, имеющий значительно более низкую способность экспортировать L-аминокислоту и продуктивностью по L-аминокислоте. Микроорганизм рода Corynebacterium может включать Corynebacterium glutamicum, Corynebacterium ammoniagenes, Brevibacterium lactofermentum, Brevibacterium flavum, Corynebacterium thermoaminogenes, Corynebacterium efficiens и тому подобные, но не ограничен ими. Более конкретно, микроорганизм рода Corynebacterium может представлять собой Corynebacterium glutamicum.
В одном примере микроорганизм, экспрессирующий чужеродный белок, может представлять собой микроорганизм, в который введена мутация для экспрессии чужеродного белка. По этой причине микроорганизм, мутированный для экспрессии чужеродного белка, может иметь увеличенную способность экспортировать L-аминокислоту и продуктивностью по L-аминокислоте по сравнению с гомогенным немодифицированным микроорганизмом. Немодифицированный микроорганизм представляет собой микроорганизм, который не экспрессирует чужеродный белок, и может означать гомогенный микроорганизм, в который не введена мутация для экспрессии чужеродного белка, или микроорганизм до введения мутации.
В настоящем описании "мутация для экспрессии чужеродного белка" может означать все манипуляции, которые позволяют родительскому штамму экспрессировать вышеописанный чужеродный белок. В одном примере мутация для экспрессии чужеродного белка моет вводить полинуклеотид, кодирующий чужеродный белок, или рекомбинантный вектор, включающий его, в родительский штамм.
"Микроорганизм, в который введена мутация для экспрессии чужеродного белка" или " микроорганизм, мутированный для экспрессии чужеродного белка" может представлять собой микроорганизм, в который введен полинуклеотид, кодирующий чужеродный белок, или рекомбинантный вектор, содержащий его, и по сравнению с немодифицированным микроорганизмом, ему придается или у него увеличивается способность экспортировать L-аминокислоту и продуктивность по L-аминокислоте.
В одном примере родительский штамм может быть дикого типа или мутантным, где способность экспортировать L-аминокислоту и продуктивность по L-аминокислоте увеличены, например контролируется (увеличивается (улучшается) или уменьшается (ингибируется) активность белка, вовлеченного в биосинтез или метаболизм L-аминокислоты, по сравнению с диким типом, без ограничения этим.
В одном конкретном примере микроорганизм, продуцирующий L-аминокислоту, в котором экспрессируется чужеродный белок, может иметь номер доступа КССМ_12828Р.
В настоящем описании то, что полинуклеотид (который может использоваться взаимозаменяемо с "геном") или полипептид (который может использоваться взаимозаменяемо с "белком") "содержит конкретную нуклеиновокислотную последовательность или аминокислотную последовательность, состоит из конкретной нуклеиновокислотной последовательности или аминокислотной последовательности, или представляет конкретную нуклеиновокислотную последовательность или конкретную аминокислотную последовательность" представляет собой взаимозаменяемое выражение с эквивалентным значением и может означать, что полинуклеотид или полипептид обязательно содержит конкретную нуклеиновокислотную последовательность или аминокислотную последовательность, и может быть истолковано, как содержащий "по существу эквивалентную последовательность", в которой мутация (делеция, замена, модификация и/или дополнение) добавлена к конкретной нуклеиновокислотной последовательности или аминокислотной последовательности в диапазоне поддержания исходной функции и/или желательной функции полинуклеотид а или полипептида (или не исключая мутацию).
В одном примере, нуклеиновокислотная последовательность или аминокислотная последовательность, представленная в настоящем описании, может содержать модификацию посредством обычного мутагенеза, например прямой эволюции и/или сайт-направленного мутагенеза, и тому подобного, в пределах диапазона поддержания исходной функции и/или желательной функции. В настоящем описании, если не указано иное, то, что полинуклеотид или полипептид "содержит конкретную нуклеиновокислотную последовательность или аминокислотную последовательность или состоит из этой последовательности", может означать, что полинуклеотид или полипептид (1) обязательно содержит конкретную нуклеиновокислотную последовательность или аминокислотную последовательность, или (2) состоит из аминокислотной последовательности, имеющей гомологию 60% или более, 65% или более, 70% или более, 75% или более, 80% или более, 85% или более, 90% или более, 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, 99% или более, 99,5% или более, или 99,9% или более с конкретной нуклеиновокислотной последовательностью или аминокислотной последовательностью, и сохраняет исходную функцию и/или желательную функцию. В настоящем описании исходная функция может представлять собой лизин-экспортирующую функцию белка (в случае аминокислотной последовательности) или функцию кодирования белка, обладающего лизин-экспортирующей функцией (в случае нуклеиновокислотной последовательности), и желательная функция может означать функцию увеличения или обеспечения микроорганизма экспортирующей функцией и/или продуктивностью по L-аминокислоте (например по L-лизину, L-аргинину или их комбинации).
Здесь термин "гомология" или "идентичность" означает степень сходства между двумя заданными аминокислотными последовательностями или нуклеотидными последовательностями и может быть выражена в виде процента. Термины гомология и идентичность часто используются взаимозаменяемо.
Гомология или идентичность последовательности консервативного полинуклеотида или полипептида определяется при помощи стандартного алгоритма выравнивания и штрафа за пропуск по умолчанию, установленного используемой программой. По существу, гомологичная или идентичная последовательность может быть гибридизована при умеренных или очень жестких условиях со всей последовательностью или по меньшей мере с примерно 50%, 60%, 70%, 80% или 90% полной длины. Очевидно, что гибридизация включает полинуклеотиды, содержащие общие кодоны или кодоны с учетом вырожденности кодонов в полинуклеотидах.
Обладают ли последовательности двух любых полинуклеотидов или полипептидов гомологией, сходством или идентичностью можно определить с использованием известного компьютерного алгоритма, такого как программа "FASTA", например с использованием параметра по умолчанию, как в Pearson et al (1988) [Proc. Natl. Acad. Sci. USA 85]: 2444. Иным образом, это может быть определено с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), как продемонстрировано в программе Needleman пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277) (версия 5.0.0 или позже) (включая GCG пакет программ (Devereux, J. et al. Nucleic Acids Research 12: 387 (1984)), BLASTP, BLASTN, FASTA (Atschul, [S.] [F.,] [ET AL. J MOLEC BIOL 215]: 403 (1990); Guide to Huge Computers, Martin J. Bishop, [ED.,] Academic Press, San Diego,1994, и [CARILLO ETA/.](1988) SIAM J Applied Math 48: 1073). Например, используя BLAST или базу данных ClustalW Национального центра биотехнологической информации, можно определить гомологию, сходство или идентичность.
Гомологию, сходство или идентичность полинуклеотид а или полипептида можно определить путем сравнения информации о последовательности, представленной у Smith and Waterman, Adv. Appl. Math (1981) 2:482, например, с использованием компьютерной программы GAP, такой как Needleman et al. (1970), J Mol Biol. 48:443. В кратком изложении, программа GAP может быть определена, как величина, полученная в результате деления общего числа символов в более короткой из двух последовательностей на число одинаково расположенных символов (а именно нуклеотидов или аминокислот). Параметр по умолчанию для программы GAP может включать (1) бинарную матрицу сравнения (включающую значение 1 для идентичности и 0 для неидентичности) и матрицу сравнения с отягощением согласно Gribskov et al (1986) Nucl. Acids Res. 14: 6745, описанную в Schwartz and Dayhoff, eds., Atlas Of Protein Sequence And Structure, National Biomedical Research Foundation, pp. 353-358 (1979) (или EDNAFULL (EMBOSS версия NCBI NUC4.4) матрица замен); (2) штраф в размере 3,0 за каждый разрыв и дополнительный штраф 0,10 за каждый символ в каждом разрыве (или штраф за открытие разрыва 10, штраф за продление разрыва 0,5); и (3) отсутствие штрафа за конечный разрыв.
Кроме того, наличие гомологии, сходства или идентичности между двумя полинуклеотидными или полипептидными последовательностями может быть подтверждено путем сравнения последовательностей в эксперименте саузерн-гибридизации в определенных жестких условиях, и определенные подходящие условия гибридизации могут быть определены посредством способа, известного специалистам в данной области, в рамках диапазона соответствующей технологии (например, J. Sambrook et al. Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; F.M. Ausubel et al. Current Protocols in Molecular Biology, John Wiley & Sons, Inc., New York). Нуклеиновокислотная последовательность, описанная в настоящем описании, может иметь различные модификации в области кодирования в пределах диапазона, который не меняет аминокислотную последовательность и/или функцию белка, экспрессируемого из области кодирования, принимая во внимание предпочтительный кодон в микроорганизме для экспрессии белка (лизин-экспортирующего белка) из-за вырожденности кодона.
В одном примере полинуклеотид, содержащий конкретную нуклеиновокислотную последовательность, представленную в настоящем описании, можно рассматривать, как содержащий не только эту конкретную нуклеиновокислотную последовательность или по существу эквивалентную ей нуклеиновокислотную последовательность, но также полинуклеотидный фрагмент, содержащий нуклеиновокислотную последовательность, комплементарную данной конкретной нуклеиновокислотной последовательности. В частности, полинуклеотид, обладающий комплементарностью, может быть гибридизован при значении Тm, соответственно отрегулированном специалистами в данной области в зависимости от цели, например при значении Tm 55°С, 60°С, 63°С или 65°С, и проанализирован в условиях, описанных ниже: эти условия конкретно описаны в известной литературе. Например, условие, при котором гены, имеющие высокую комплементарность, составляющую 60% или более, 65% или более, 70% или более, 75% или более, 80% или более, 85% или более, 90% или более, 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, 98% или более, 99,5% или более, или 99,9% или более, гибридизуются, а гены, имеющие более низкую комплементарность, не гибридизуются, или обычные условия отмывки при саузерн-гибридизации, которые представляют собой однократную отмывку, в частности, отмывку от двух до 3 раз, при концентрации соли и температуре, соответствующей 60°С, 1x SSC (солевой буфер с цитратом натрия), и 0,1%(м/об) SDS (додецилсульфат натрия); 60°С, 0,1х SSC, и 0,1% SDS; или 68°С, 0,1х SSC и 0,1% SDS, или тому подобное, но не ограничено этими условиями. При гибридизации может потребоваться, чтобы два нуклеотида имели комплементарную последовательность, или несоответствие между основаниями может быть разрешено в соответствии с уровнем жесткости гибридизации. Термин "комплементарный" может быть использован для описания взаимоотношений между нуклеотидными основаниями, способными гибридизоваться друг с другом. Например, в случае ДНК, аденозин комплементарен тимину, а цитозин комплементарен гуанину. Подходящий уровень жесткости гибридизации полинуклеотидов зависит от длины полинуклеотидов и степени комплементарности, и это хорошо известно в соответствующей технической области (см. Sambrook et al. supra, 9.50-9.51, 11.7-11.8).
Введение полинуклеотида или вектора может быть выполнено посредством выбора известного способа трансформации специалистами в данной области. В настоящем описании термин "трансформация" означает введение полинуклеотида, кодирующего целевой белок (чужеродный белок) или вектор, содержащий его, в клетку-хозяин для экспрессии белка, кодируемого полинуклеотидом, в этой клетке-хозяине. При условии, что он может экспрессироваться в клетке-хозяине, независимо от того, встроен ли он и расположен в хромосоме клетки-хозяина или расположен вне хромосомы, трансформирующий полинуклеотид может включать их все. Кроме того, полинуклеотид включает ДНК и/или РНК, кодирующие целевой белок. При условии, что полинуклеотид введен и экспрессируется в клетке-хозяине, форма, в которой он вводится, не имеет ограничения. Например, полинуклеотид может быть введен в клетку-хозяин в форме экспрессионной кассеты, которая представляет собой структуру генов, содержащую все элементы, необходимые для ее экспрессии самой по себе. Экспрессионная кассета может, как правило, содержать регуляторные элементы, такие как промотор, который функционально связан с полинуклеотидом, сигнал завершения транскрипции, сайт связывания рибосом и/или сигнал завершения трансляции и тому подобное. Экспрессионная кассета может находиться в форме экспрессионного вектора, способного к саморепликации. Кроме того, полинуклеотид может быть введен в клетку-хозяин в своей собственной форме и функционально связан с последовательностью, необходимой для экспрессии в клетке-хозяине. Вышеприведенный термин "функционально связанный" может означать, что элементы, регулирующие экспрессию (например промотор), и полинуклеотид функционально связаны так, чтобы элементы, регулирующие экспрессию, осуществляли регуляцию транскрипции (например инициацию транскрипции) полинуклеотида, кодирующего целевой белок (чужеродный белок). Функциональное связывание может быть осуществлено с использованием метода генетической рекомбинации, известного в данной области, и, например, может быть осуществлено посредством обычного сайт-специфического расщепления ДНК и лигирования, но не ограничивается этим.
Способ трансформации полинуклеотида в клетку-хозяин может быть осуществлен посредством любого метода введения нуклеиновой кислоты в клетку (микроорганизм), и может быть осуществлен посредством надлежащим образом выбранного метода трансформации, известного в данной области, в соответствии с клеткой-хозяином. Примером известного метода трансформации могут являться электропорация, осаждение фосфатом кальция (САР04), осаждение хлоридом кальция (CACL2), микроинъекция, осаждение полиэтиленгликолем (PEG) (полиэтиленгликоль-опосредованный захват), метод с использованием DEAE-декстрана (диэтиламиноэтилдекстран), метод катионных липосом, липофекция, метод с использованием ацетата лития-ВМ80(диметилсульфоксид) и тому подобное, но без ограничения ими.
Введение (вставка) полинуклеотида в геном клетки-хозяина (хромосому) может быть выполнено посредством подходящего выбора специалистами известного метода, и, например, может быть выполнено с использованием системы РНК-управляемой эндонуклеазы (или системы CPJSPR; например одной или более, выбранных из группы, состоящей из (а) РНК-управляемой эндонуклеазы (например белка Cas9, и т.д.), ее кодирующего гена, или вектора, содержащего такой ген; и (б) смеси, содержащей направляющую РНК (например, одиночную направляющую РНК (sgRNA), и т.д.), ее кодирующую ДНК, или вектор, содержащий ДНК (например смесь белка РНК-управляемой эндонуклеазы и направляющая РНК, и т.д.), комплекс (например слитый белок рибонуклеиновой кислоты (RNP), рекомбинантный вектор (например вектор, содержащий вместе ген, кодирующий РНК-управляемую эндонуклеазу, и ДНК, кодирующую направляющую РНК и т.д.)), но не ограничен ими.
В настоящем описании изобретения термин "вектор" означает ДНК-продукт, содержащий нуклеотидную последовательность полинуклеотида, кодирующего целевой белок, функционально связанный с подходящей регуляторной последовательностью так, чтобы экспрессировать целевой белок в подходящей клетке-хозяине. Регуляторная последовательность может содержать промотор, способный инициировать транскрипцию, любую последовательность оператора для регуляции транскрипции, последовательность, кодирующую подходящий сайт связывания мРНК с рибосомой, и/или последовательность, регулирующую окончание транскрипции и/или трансляции. Вектор может экспрессироваться независимо от генома клетки-хозяина или может быть интегрирован в геном клетки-хозяина, после трансформации в подходящую клетку-хозяина.
Используемый здесь вектор конкретно не ограничен, при условии, что он способен реплицироваться в клетке-хозяина, и может быть выбран из всех широко используемых векторов. Пример широко используемого вектора может включать природные или рекомбинантные плазмиды, космиды, вирусы, бактериофаги и тому подобное. Например, для вектора, такого как фаговый вектор или космидный вектор, могут использоваться pWE15, М13, MBL3, MBL4, IXII, ASHII, APII, t10, t11, Charon4A, и Charon21 А, и тому подобные, а в качестве плазмидного вектора могут использоваться вектор на основе pBR, вектор на основе pUC, вектор на основе pBluescriptII, вектор на основе pGEM, вектор на основе pTZ, вектор на основе pCL и вектор на основе рЕТ и тому подобные. В частности, векторы pDZ, pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322, pMW118, pCClBAC и тому подобные могут быть представлены в качестве примера, без ограничения ими.
Используемый здесь вектор может быть известным экспрессионным вектором и/или вектором для вставки полинуклеотида в хромосому клетки-хозяина. Вставка полинуклеотида в хромосому клетки-хозяина может быть выполнена любым известным в данной области способом, например посредством гомологичной рекомбинации или системы CRISPR, но не ограничена ими. Вектор может дополнительно содержать селективный маркер для подтверждения вставки в хромосому. Селективный маркер позволяет выделить клетку, трансформированную вектором, то есть подтверждает вставку полинуклеотида, и он может быть выбран среди генов, обеспечивающих селективные фенотипы, такие как лекарственная устойчивость, ауксотрофная потребность, устойчивость к цитотоксическим агентам или экспрессия поверхностного белка, и использован. Поскольку выживают только клетки, экспрессирующие селективный маркер или проявляющие другие признаки экспрессии в среде, обработанной селективным агентом, трансформированные клетки могут быть выбраны.
В другом примере предложен способ увеличения экспортирующей активности и/или продуктивности по L-аминокислоте у микроорганизма или способ придания экспортирующей активности и/или продуктивности по L-аминокислоте микроорганизму, включающий введение (трансформацию) вышеупомянутого чужеродного белка, кодирующего его полинуклеотида или рекомбинантного вектора, содержащего такой полинуклеотид, в микроорганизм.
Чужеродный белок, полинуклеотид и микроорганизм являются такими, как описано выше.
В другом примере предложен способ получения L-аминокислоты, включающий культивирование вышеупомянутого микроорганизма, продуцирующего L-аминокислоту, в среде. Способ может дополнительно включать извлечение L-аминокислоты из культивируемого микроорганизма, среды или из обоих, после культивирования.
В этом способе культивирование микроорганизма можно выполнять посредством известного метода периодического культивирования, метода непрерывного культивирования, стационарного культивирования с подпиткой и тому подобного, без ограничения ими. Поэтому условия культивирования особенно не ограничены, но оптимальный рН (например рН 5-9, в частности рН 6-8, наиболее конкретно рН 6,8) может быть отрегулирован с использованием основного соединения (например: гидроксида натрия, гидроксида калия или аммиака) или кислотного соединения (например: фосфорной кислоты или серной кислоты), и аэробное состояние можно поддерживать путем введения в культуру кислорода или кислородсодержащей газовой смеси. Температура культивирования может поддерживаться при 20-45°С или 25-40°С, и культивирование может продолжаться в течение примерно 10-160 часов, но не ограничивается этим. L-аминокислота, продуцируемая при культивировании, может выделяться в среду или оставаться в клетках.
В среде, используемой при культивировании, можно отдельно использовать один или более видов, выбранных из группы, состоящей из сахара и углевода (например: глюкозы, сахарозы, лактозы, фруктозы, мальтозы, мелассы, крахмала и целлюлозы), масла и жира (например: соевого масла, подсолнечного масла, арахисового масла и кокосового масла), жирной кислоты (например: пальмитиновой кислоты, стеариновой кислоты и линолевой кислоты), спирта (например: глицерина и этилового спирта), органической кислоты (например: уксусной кислоты) и тому подобного, или смешать и использовать два или более видов из них, в качестве источника углерода, без ограничения этим. В качестве источника азота, один или более видов, выбранных из группы, состоящей из азотсодержащих органических соединений (например: пептона, дрожжевого экстракта, мясного сока, солодового экстракта, жидкого кукурузного экстракта, соевой муки и мочевины), неорганических соединений (например: сульфата аммония, хлорида аммония, фосфата аммония, карбоната аммония и нитрата аммония) и тому подобного, могут быть использованы отдельно или в смеси двух или более из них, но без ограничения ими. В качестве источника фосфора, один или более видов, выбранных из группы, состоящей из дигидрофосфата калия, гидрофосфата калия, соответствующих им натрий-содержащих солей и тому подобного, могут быть использованы отдельно или в смеси двух или более из них, но без ограничения ими. Кроме того, среда может содержать существенное для роста вещество, такое как другие соли металлов (например: сульфат магния или сульфат железа), аминокислота и/или витамины.
Выделение L-аминокислоты можно представлять собой сбор необходимой аминокислоты из среды, культурального раствора или микроорганизма с использованием известного в данной области подходящего метода в соответствии с методом культивирования. Например, выделение может быть выполнено посредством одного или более методов, выбранных из центрифугирования, фильтрации, анионообменной хроматографии, кристаллизации, ВЭЖХ и тому подобного. Метод выделения L-аминокислоты может дополнительно включать очистку до, одновременно или после этого.
ПОЛЕЗНЫЕ ЭФФЕКТЫ
В настоящем описании предложен методика увеличения экспортирующей способности и/или продуктивности по L-аминокислоте микроорганизма, и для этого предложены чужеродный белок, экспортирующая способность которого в отношении L-аминокислоты была недавно обнаружена, и методика, способная улучшить продуктивность по L-аминокислоте по сравнению с родительским штаммом, посредством введения чужеродного белка в микроорганизм.
ПРИНЦИП ИЗОБРЕТЕНИЯ
Ниже настоящее изобретение будет описано более подробно с помощью примеров, но они носят только иллюстративный характер и не предназначены для ограничения объема настоящего изобретения. Специалистам в данной области очевидно, что описанные ниже примеры могут быть модифицированы без отклонения от сущности изобретения.
Пример 1: Поиск и селекция L-лизин-экспортирующего гена Для того, чтобы найти экспортирующий ген с более высокой экспортирующей способностью по L-лизину по сравнению с экспортером L-лизина (lysE, Ncgl1214), которым от природы обладает микроорганизм рода Corynebacterium, был выполнен поиск RPS-BLAST с использованием базы данных NCBI CDD (Common Domain Database) и поиск BLAST с использованием базы данных белков KEGG. Были выбраны белки-кандидаты, рассматриваемые, как мембранные белки, способные экспортировать L-лизин.
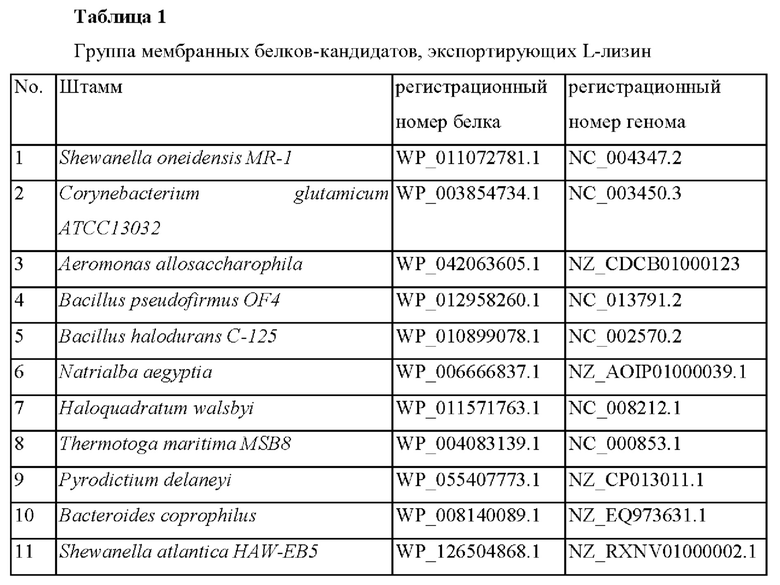
Пример 2: Создание вектора со встроенным геном чужеродного мембранного белка
Мембранный белок, полученный из Shewanella atlantica (Sat), выбранный в Примере 1, имеет аминокислотную последовательность SEQ ID NO: 1. Информация (номер доступа NZ_RXNV01000002.1) о генах, кодирующих мембранный белок и окружающих последовательности нуклеиновых кислот, была получена из U.S. National Institutes of Health (NIH GenBank). Был выполнен синтез ДНК на основе соответствующей последовательности генов (Cosmo genetech, Korea). Для амплификации генов была выполнена ПЦР (SolgTM Pfu-X ДНК-полимераза) с использованием синтезированной ДНК в качестве матрицы и праймеров (Таблица 2) с SEQ ID NO: 3 и 4 (Таблица 3). В результате был получен фрагмент гена из 639 п. н., включающий ген (SEQ ID NO: 2) из 609 п.н.

Для обеспечения промотора gapA, происходящего из Corynebacterium glutamicum, выполняли ПЦР (SolgTM Pfu-X ДНК-полимераза) с использованием геномной ДНК Corynebacterium glutamicum АТСС 13032 в качестве матрицы и праймеров (Таблица 2) с SEQ ID NO: 5 и 6 (Таблица 3). Амплифицированный сайт промотора gapA, и полученный фрагмент гена, происходящего из Shewanella atlantica, и вектор pDZTn, расщепленный с помощью рестриктазы Ndel (корейский патент 10-1126041), соединяли с использованием метода сборки Гибсона (DG Gibson et al. NATURE METHODS, VOL.6 NO.5, MAY 2009, NEBuilder HiFi DNA Assembly Master Mix), и затем трансформировали в клетки Е. coli DH5a и наносили мазками на твердую среду LB, содержащую канамицин (25 мг/л). Для выбора колонии, трансформированной вектором, в котором были соединены необходимый ген и pDZTn, выполняли ПЦР с использованием праймеров с SEQ ID NO: 7 и 8. Плазмида была получена с использованием общеизвестного метода экстракции плазмиды из выбранной колонии, и эта плазмида была названа pDZTn-PgapA-Sat.
Пример 3: Получение штамма с введенным чужеродным мембранным белком
После трансформации штамма Corynebacterium glutamicum КССМ11016Р, продуцирующего L-лизин (Корейский патент No. 10-0159812), с использованием полученного вектора pDZTn-PgapA-Sat при помощи электропорации (Appl. Microbiol.Biotechnol. (1999) 52:541-545), посредством вторичного кроссинговера, был получен штамм, в который был введен PgapA-Sat между генами транспозона. Используя праймеры (Таблица 4) с SEQ ID NO: 9 и SEQ ID NO: 10, пригодные для амплификации примыкающих сайтов, включающих положение, в которое был введен соответствующий ген, выполняли ПЦР и секвенирование, и соответствующая манипуляция с геном была подтверждена. Штамм, полученный таким образом, был назван Corynebacterium glutamicum KCCM11016P::PgapA-Sat.

Пример 4: Сравнение продуктивности по L-аминокислоте в штамме КССМ11016Р с введенным чужеродным мембранным белком
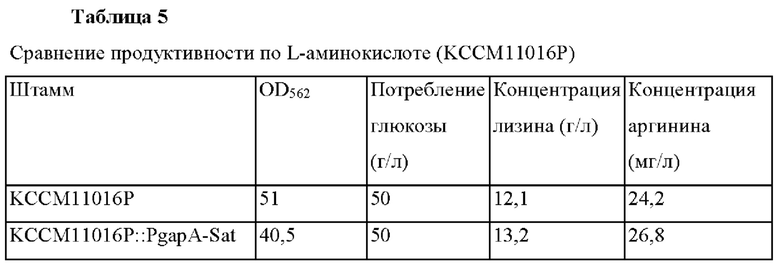
Сравнили количество микробных клеток, способность потреблять глюкозу и продуктивность по аминокислотам путем культивировании штамма KCCM11016P::PgapA-Sat и контрольной группы КССМ11016Р следующим методом.
Сначала каждый штамм инокулировали в 250 мл колбу с угловыми перегородками, содержащую 25 мл среды для посева и культивировали с перемешиванием при 30°С в течение 20 часов при 200 об/мин. 1 мл посевного культурального раствора инокулировали в 250 мл колбу с угловыми перегородками, содержащую 24 мл среды для продуцирования и культивировали с перемешиванием при 37°С в течение 42 часов при 200 об/мин. После окончания культивирования измеряли выход L-аминокислоты посредством ВЭЖХ. Эксперимент повторяли 3 раза и результат для культуры (среднее значение) показан на Таблице 5.
<Среда для посева (рН 7,0)>
Глюкоза 20 г, пептон 10 г, дрожжевой экстракт 5 г, мочевина 1,5 г, KH2PO4 4 г, K2HPO4 8 г, MgSO4⋅7H2O 0,5 г, биотин 0,1 мг, тиамин HCl 1 мг, кальций-пантотеновая кислота 22 мг, никотинамид 2 мг (на основе 1 литра дистиллированной воды).
<Среда для продуцирования (рН 7,0)>
Глюкоза 45 г, (NH4)2SO4 15 г, соевый белок 10 г, меласса 10 г, KH2PO4 0,55 г, MgSO4⋅7H2O 0,6 г, биотин 0,9 мг, тиамина гидрохлорид 4,5 мг, кальций-пантотеновая кислота 4,5 мг, никотинамид 30 мг, MnSO4 9 мг, FeSO4 9 мг, ZnSO4 0,45 мг, CnSO4 0,45 мг, СаСОз 30 г (на основе 1 литра дистиллированной воды).
Штамм KCCM11016P::PgapA-Sat (Corynebacterium glutamicum САО3-1486) был на международном уровне депонирован в Корейском Центре Культур Микроорганизмов (КССМ), международном депозитарном органе, в соответствии с Будапештским договором от 29 октября 2020 г и получил номер доступа КССМ 12828Р.
Пример 5: Сравнение продуктивности по L-аминокислоте в штамме КССМ10770Р с введенным чужеродным мембранным белком
Штамм, в который был введен ген PgapA-Sat в положение транспозона в геноме штамма Corynebacterium glutamicum КССМ10770Р (Корейский патент 10-0924065), был получен с использованием способа, описанного в Примере 3. Полученный таким образом штамм был назван Corynebacterium glutamicum KCCM10770P::PgapA-Sat.
При культивировании штамма KCCM10770P::PgapA-Sat и контрольной группы КССМ10770Р сравнивали количество микробных клеток, способность потреблять глюкозу и аминокислотную продуктивность (метод оценки см. в Примере 4). Эксперимент повторяли 3 раза и результат для культуры (среднее значение) показан в Таблице 6.

Как видно из Таблицы 6, штамм KCCM10770P::PgapA-Sat показал повышенную аминокислотную продуктивность по сравнению с контрольным штаммом КССМ10770Р.
Пример 6: Сравнение продуктивности по L-аминокислоте штамма CJ3P с введенным чужеродным мембранным белком
Штамм, в который был введен ген PgapA-Sat, был получен с использованием метода, описанного в Примере 3, в положение транспозона в геноме штамма Corynebacterium glutamicum CJ3P (US 9556463 В2), обладающего продуктивностью по L-лизину, путем введения 3 видов мутантов [pyc(P458S), hom(V59A), lysC(T3111)] в штамм дикого типа. Полученный таким образом штамм был назван Corynebacterium glutamicum CJ3P::PgapA-Sat.
При культивировании штамма CJ3P::PgapA-Sat и контрольной группы CJ3P сравнивали количество микробных клеток, способность потреблять глюкозу и аминокислотную продуктивность (метод оценки см. в Примере 4). Эксперимент повторяли 3 раза и результат для культуры (среднее значение) показан в Таблице 7.
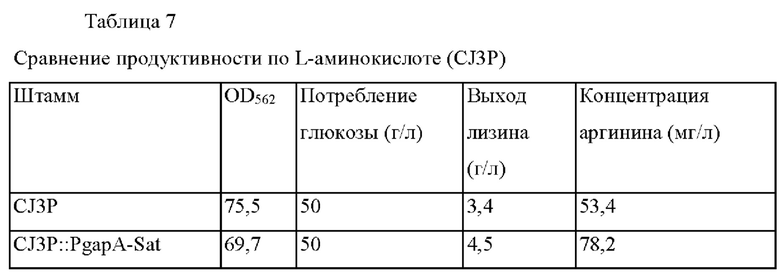
Как показано в Таблице 7, штамм CJ3P::PgapA-Sat показал повышенную аминокислотную продуктивность по сравнению с контрольным штаммом CJ3P.
Из вышеприведенного описания специалисты в области техники, к которой относится настоящая заявка, поймут, что настоящая заявка может быть реализована в других конкретных формах без изменения ее технической сущности или основных характеристик. В связи с этим следует понимать, что примеры, описанные выше, являются иллюстративными во всех аспектах, а не ограничивающими. Объем настоящей заявки следует понимать, как включающий все измененные или модифицированные формы, полученные из значения и объема формулы изобретения, описанной ниже, и их эквивалентные понятия, а не приведенное выше подробное описание.
[Номер доступа]
Название депозитарного органа: Корейский Центр Культур Микроорганизмов (КССМ).
Номер доступа: КССМ12828 ВР. Дата депонирования: 20201029.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CJ CheilJedang Corporation
<120> Микроорганизм, экспрессирующий белок, происходящий из
Shewanella Atlantica и способ получения L-аминокислоты
с его использованием.
<130> OPP20214406KR
<150> KR 10-2020-0171739
<151> 2020-12-09
<160> 10
<170> koPatentIn 3.0
<210> 1
<211> 202
<212> PRT
<213> Artificial Sequence
<220>
<223> мембранный белок, происходящий из Shewanella atlantica (Sat)
<400> 1
Met Gln Ala Phe Ile Gln Gly Val Gly Ile Gly Gly Ser Leu Ile Met
1 5 10 15
Ala Val Gly Ala Gln Asn Ala Phe Val Leu Lys Gln Gly Leu Lys Arg
20 25 30
Ser His Ser Leu Pro Ile Ala Gly Leu Cys Ser Leu Ile Asp Ala Leu
35 40 45
Met Ile Thr Ala Gly Val Ala Gly Leu Gly His Leu Ile Leu Ala Phe
50 55 60
Pro Leu Ile Lys Asp Ile Ala Ser Ile Gly Gly Ala Ile Phe Leu Leu
65 70 75 80
Val Tyr Gly Ala Lys Ala Leu Arg Ser Ser Phe Asn Glu Gln Thr Ile
85 90 95
Ser Gln Gly Ala Thr Lys Gly Thr Glu Thr Leu Lys Ala Ala Val Leu
100 105 110
Thr Thr Leu Gly Ile Ser Leu Leu Asn Pro His Leu Tyr Leu Asp Thr
115 120 125
Val Val Leu Leu Gly Ser Ile Ser Ala Gln Phe Glu Gly Val Asp Arg
130 135 140
Pro Leu Phe Gly Ala Gly Ala Val Leu Ala Ser Phe Val Trp Phe Phe
145 150 155 160
Ser Leu Ser Phe Gly Ala Arg Tyr Leu Ser Pro Leu Phe Gln Asn Pro
165 170 175
Lys Ala Trp Ser Tyr Leu Asp Arg Phe Ile Cys Met Thr Met Trp Thr
180 185 190
Ile Ala Ala Val Leu Leu Trp Pro Tyr Leu
195 200
<210> 2
<211> 609
<212> DNA
<213> Artificial Sequence
<220>
<223> Sat-кодирующая нуклеотидная последовательность
<400> 2
atgcaggcat ttattcaggg tgtaggaatt ggcggaagcc ttattatggc ggtgggcgca 60
caaaatgcgt ttgtattaaa gcaggggctg aagcgttcgc actctttacc cattgccgga 120
ctgtgttcat tgatcgatgc cttaatgata acggctggtg tggcaggcct gggtcatttg 180
attttggcct ttccattgat taaggatatt gccagtattg gtggggcgat cttcttgctg 240
gtttatggtg caaaggcttt aaggtcttcg tttaatgagc aaaccatatc tcaaggtgcg 300
acgaaaggga ctgaaaccct taaagctgcg gtgttgacaa ctttgggtat tagtttgctc 360
aacccgcatc tgtatctgga cacggttgtc ttgcttggta gcatcagtgc tcagtttgaa 420
ggtgttgacc gtcctctgtt tggcgcaggt gccgtactgg catcgtttgt gtggtttttt 480
agtttaagtt ttggtgcgag atacttaagt ccattatttc aaaaccctaa agcctggagc 540
tatttagaca ggtttatctg catgactatg tggaccattg cggcggtctt gttatggcct 600
tacttgtaa 609
<210> 3
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> Sat-F_праймер
<400> 3
tagaggagac acaacatgca ggcatttatt caggg 35
<210> 4
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> Sat-R_праймер
<400> 4
tagatgtcgg gcccattaca agtaaggcca taacaa 36
<210> 5
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> PgapA-F_праймер
<400> 5
aatgagttcc tcgagaaacg accgagccta ttggg 35
<210> 6
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> PgapA-R_праймер
<400> 6
taaatgcctg catgttgtgt ctcctctaaa gattg 35
<210> 7
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> pDZTn-1_праймер
<400> 7
acgacgctgg tatttctccc 20
<210> 8
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> pDZTn-2_праймер
<400> 8
tgattgtcga tatgaccggg 20
<210> 9
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Tn-1_праймер
<400> 9
taaggcaccg cagaatgtag 20
<210> 10
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Tn-2_праймер
<400> 10
taggactcac catcaccggc 20
<---
Изобретение относится к биотехнологии. Предложен микроорганизм рода Corynebacterium для продуцирования L-аминокислоты, где L-аминокислота представляет собой L-лизин или L-аргинин, экспрессирующий мембранный белок с SEQ ID NO: 1, происходящий из Shewanella atlantica, или мембранный белок, происходящий из рода Shewanella, имеющий гомологию последовательности по меньшей мере 90% или более с этим белком. Также предложен способ получения L-аминокислоты, где L-аминокислота представляет собой L-лизин или L-аргинин, с использованием указанного микроорганизма рода Corynebacterium. Изобретение обеспечивает увеличение продуцирования L-лизина и L-аргинина. 2 н. и 4 з.п. ф-лы, 7 табл., 6 пр.
1. Микроорганизм рода Corynebacterium для продуцирования L-аминокислоты, где L-аминокислота представляет собой L-лизин или L-аргинин, экспрессирующий мембранный белок с SEQ ID NO: 1, происходящий из Shewanella atlantica, или мембранный белок, происходящий из рода Shewanella, имеющий гомологию последовательности по меньшей мере 90% или более с этим белком.
2. Микроорганизм рода Corynebacterium по п. 1, в который введен полинуклеотид, кодирующий мембранный белок.
3. Микроорганизм рода Corynebacterium по п. 2, где полинуклеотид представлен SEQ ID NO: 2 или последовательностью нуклеиновой кислоты, имеющей гомологию последовательности, составляющую по меньшей мере 90% или более с этим полинуклеотидом.
4. Микроорганизм рода Corynebacterium по любому из пп. 1-3, где продуктивность по L-лизину или L-аргинину увеличена по сравнению с микроорганизмом рода Corynebacterium, который не экспрессирует мембранный белок.
5. Микроорганизм рода Corynebacterium по любому из пп. 1-3, где микроорганизм рода Corynebacterium представляет собой Corynebacterium glutamicum.
6. Способ получения L-аминокислоты, где L-аминокислота представляет собой L-лизин или L-аргинин, включающий культивирование микроорганизма рода Corynebacterium по любому из пп. 1-3 в среде и извлечение L-лизина или L-аргинина из культивируемого микроорганизма, среды или их обоих.
| БАКТЕРИЯ - ПРОДУЦЕНТ L-АМИНОКИСЛОТЫ И СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ (ВАРИАНТЫ) | 2005 |
|
RU2316588C1 |
| база данных UniProtKB, A0A431WD72_9GAMM, 08.05.2019 | |||
| Найдено онлайн: https://www.uniprot.org/uniprotkb/A0A431WD72/entry Дата обращения 18.12.2023 | |||
| СПОСОБ МИКРОБИОЛОГИЧЕСКОГО ПОЛУЧЕНИЯ АМИНОКИСЛОТ ПУТЕМ ПОВЫШЕННОЙ АКТИВНОСТИ ЭКСПОРТ-НОСИТЕЛЕЙ | 1996 |
|
RU2225883C2 |
| US 2012015409 A1, 19.01.2012. | |||
Авторы
Даты
2024-09-16—Публикация
2021-11-29—Подача