Область изобретения
Настоящее изобретение относится к способу продуцирования серосодержащей аминокислоты или производного этой серосодержащей аминокислоты.
Уровень техники
L-аминокислоты получают в промышленности с помощью методов ферментации с использованием микроорганизмов, принадлежащих роду Brevibacterium, роду Corynebacterium, роду Escherichia и им подобных. В таких способах продуцирования используют бактериальные штаммы, выделенные из природного источника, их искусственные мутантные штаммы или штаммы, модифицированные для обеспечения повышенной активностью фермента, вовлеченного в биосинтез L-аминокислоты, посредством технологии рекомбинантных ДНК.
При этом, серосодержащие аминокислоты используют в качестве ингредиентов для синтеза кормов для животных, пищевых добавок, фармацевтических инъецируемых жидкостей и лекарственных средств, и были проведены исследования по биологическому получению серосодержащих аминокислот и их производных.
Например, в заявке на патент США No. US 2009-0298135 А1 раскрыто получение 0,8 г/л L-метионина путем делетирования гена metJ из генома Escherichia coli и сверхэкпрессии белка YjeH, который представляет собой экспортер L-метионина. Также сообщалось, что полипептиды BrnF и BrnE являются экспортерами L-метионина Corynebacterium glutamicum (С. Troschel et al., Journal of Bacteriology, pp. 3786-3794, June 2005).
При этом, при продуцировании серосодержащих аминокислот количество NADPH, потребленного микроорганизмами, может варьировать в зависимости от восстановительной способности источника серы. Например, в то время как сульфиды, которые не требуют NADPH, имеют самый большой теоретический выход, сульфаты, которые требуют четыре молекулы NADPH, имеют низкий теоретический выход. Однако сульфиды являются невыгодными в том аспекте, что они, как известно, вызывают повреждение клеток и имеют низкую стабильность. Следовательно, высокий выход можно ожидать в случае использования тиосульфата, который представляет собой источник серы с низкой потребностью в NADPH и высокой внутриклеточной стабильностью, при продуцировании серосодержащих аминокислот. Однако самостоятельные исследования по эффективному использованию тиосульфата у микроорганизмов Corynebacterium glutamicum не были проведены.
Техническая задача
Авторы настоящего изобретения неожиданно обнаружили, что белок, кодируемый геном ssuD, вовлечен в использование тиосульфата, и подтвердили, что микроорганизм, модифицированный так, чтобы иметь повышенную активностью этого белка, обладает повышенной способностью продуцировать серосодержащие аминокислоты с использованием тиосульфата в качестве источника серы, тем самым осуществив настоящее изобретение.
Техническое решение
В настоящем изобретении предложен способ продуцирования серосодержащей аминокислоты и производного серосодержащей аминокислоты, включающий культивирование генетически модифицированного микроорганизма в культуральной среде, содержащей тиосульфат, где микроорганизм содержит генетическую модификацию для повышения активности белка, кодируемого геном ssuD, по сравнению с немодифицированным микроорганизмом.
В настоящем изобретении предложен микроорганизм, продуцирующий серосодержащую аминокислоту или производное серосодержащей аминокислоты, содержащий генетическую модификацию для повышения активности белка, кодируемого геном ssuD, по сравнению с немодифицированным микроорганизмом.
В настоящем изобретении предложена композиция для продуцирования серосодержащей аминокислоты или производного серосодержащей аминокислоты, включающая микроорганизм, содержащий генетическую модификацию для повышения активности белка, кодируемого геном ssuD, по сравнению с немодифицированным микроорганизмом, или его культуру и тиосульфат.
В настоящем изобретении предложено применение белка, кодируемого геном ssuD, в качестве тиосульфатредуктазы.
В настоящем изобретении предложено применение микроорганизма, содержащего генетическую модификацию для повышения активности белка, кодируемого геном ssuD, по сравнению с немодифицированным микроорганизмом, для продуцирования серосодержащей аминокислоты или производного серосодержащей аминокислоты.
Полезные эффекты
Серосодержащие аминокислоты или их производные можно получать в промышленном масштабе с использованием микроорганизма, композиции и способа получения серосодержащей аминокислоты или производного серосодержащей аминокислоты с использованием такого(ой) же микроорганизма и композиции по настоящему изобретению, и таким образом их можно эффективно использовать в получении полезных продуктов, включая серосодержащие аминокислоты или их производные.
Наилучшее воплощение изобретения
Далее настоящее изобретение будет описано более подробно. При этом, каждое описание и воплощение, раскрытое в настоящем изобретении, можно применять здесь к различным описаниям и воплощениям. Другими словами, все комбинации различных компонентов, раскрытых в настоящем изобретении, включены в объем настоящего изобретения. Более того, объем настоящего изобретения не ограничен описаниями, предложенными ниже.
Специалисты в данной области техники будут понимать или способны определить, используя только рутинные эксперименты, множество воплощений, эквивалентных конкретным воплощениям настоящего изобретения. Подразумевается, что объем настоящего изобретения охватыватывает такие эквивалетные воплощения.
В одном аспекте настоящего изобретения предложен генетически модифицированный микроорганизм, продуцирующий серосодержащую аминокислоту или производное серосодержащей аминокислоты.
В другом аспекте настоящего изобретения предложен способ продуцирования серосодержащей аминокислоты и производного серосодержащей аминокислоты, включающий культивирование генетически модифицированного микроорганизма в культуральной среде, содержащей тиосульфат.
Микроорганизм может содержать генетическую модификацию для повышения активности белка, кодируемого геном ssuD.
В настоящем изобретении предложен способ продуцирования серосодержащей аминокислоты и производного серосодержащей аминокислоты, включающий культивирование генетически модифицированного микроорганизма в культуральной среде, содержащей тиосульфат, где микроорганизм может содержать генетическую модификацию для повышения активности белка, кодируемого геном ssuD, по сравнению с микроорганизмом до модификации. В одном воплощении настоящего изобретения указанный способ может представлять собой способ увеличения продуцирования серосодержащих аминокислот или производных серосодержащих аминокислот указанным микроорганизмом.
Способ продуцирования может включать приведение микроорганизма, имеющего повышенную активность белка, кодируемого геном ssuD, по сравнению с естественной активностью, или его культуры в контакт с тиосульфатом.
Используемое в настоящем документе выражение "белок, кодируемый геном ssuD" относится к белку, кодируемому геном ssuD, или белку, экспрессируемому геном ssuD, и может быть обозначен как "белок SsuD " (здесь и далее, обозначен как " белок SsuD"). Традиционно считается известным, что белок SsuD вовлечен в расщепление сульфоната (R-SO3), в частности, как алкансульфонатмонооксигеназа, известная как сульфонатмонооксигеназа. Однако не известно вовлечен ли белок SsuD в использование тиосульфата более, чем органического сульфата.
В настоящем изобретении было впервые выявлено, что белок SsuD вовлечен в использование тиосульфата, в частности, что он служит в качестве редуктазы, которая восстанавливает тиосульфат, и было подтверждено, что продуцирование серосодержащей аминокислоты может быть увеличено путем повышения активности белка SsuD.
Белок SsuD по настоящему изобретению может представлять собой белок, кодируемый геном ssuD, и может быть обозначен как "белок SsuD", "тиосульфатредуктаза", или традиционно обозначен как "алкансульфонатмонооксигеназа". В одном воплощении белок SsuD по настоящему изобретению может представлять собой "сульфонатмонооксигеназу" или "тиосульфатредуктазу", полученную из микроорганизма, принадлежащего роду Corynebacterium, в частности белок, получивший название "флавинзависимой оксидоредуктазы класса LLM", полученный из микроорганизма, принадлежащего роду Corynebacterium. В частности, белок SsuD может иметь происхождение из Corynebacterium glutamicum, Corynebacterium crudilactis, Corynebacterium deserti, Corynebacterium efficiens, Corynebacterium callunae, Corynebacterium stationis, Corynebacterium singulare, Corynebacterium halotolerans, Corynebacterium striatum, Corynebacterium ammoniagenes, Corynebacterium pollutisoli, Corynebacterium imitans, Corynebacterium testudinoris, Corynebacterium callunae, Corynebacterium crenatum, Corynebacterium deserti, Corynebacterium flavescens, Corynebacterium pacaense или Corynebacterium suranareeae, более конкретно Corynebacterium glutamicum, не ограничиваясь ими. Аминокислотная последовательность белка SsuD может быть доступна из известной базы данных, например, Национального центра биотехнологической информации США (NCBI).
В одном воплощении белок SsuD может содержать аминокислотную последовательность SEQ ID NO: 43 или аминокислотную последовательность, имеющую по меньшей мере 80%, 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% гомологии или идентичности с аминокислотной последовательностью SEQ ID NO: 43. Также очевидно, что любой белок, имеющий аминокислотную последовательность, включающую делецию, модификацию или добавление нескольких аминокислот, попадает в объем настоящего изобретения, при условии, что аминокислотная последовательность сохраняет вышеописанную гомологию или идентичность и эффекты, эквивалентные эффектам указанного полипептида.
Кроме того, любой полипептид, обладающий активностью сульфонатмонооксигеназы и активностью по восстановлению тиосульфата и кодируемый полинуклеотидом, гибридизуемым с зондом, сконструированным с использованием известных генных последовательностей, например, нуклеотидной последовательности, полностью или частично комплементарной данному полинуклеотиду, в строгих условиях, также может быть включен без ограничений.
То есть, хотя в настоящем изобретении используют выражение "белок или полипептид, содержащий аминокислотную последовательность заданной SEQ ID NO", "белок или полипептид, состоящий из аминокислотной последовательности заданной SEQ ID NO" или "белок или полипептид, имеющий аминокислотную последовательность заданной SEQ ID NO", очевидно, что любой белок, включающий делецию, модификацию, замену, консервативную замену или добавление одной или нескольких аминокислот, можно использовать в настоящем изобретении при условии, что белок обладает активностью идентичной или эквивалентной активности полипептида, состоящего из аминокислотной последовательности SEQ ID NO. Например, можно использовать добавление последовательности, не изменяющее функцию белка, на N-конце и/или С-конце аминокислотной последовательности, природную мутацию, молчащую мутацию в ней или консервативную замену в ней.
При использовании в настоящем документе термин "консервативная замена" относится к замене одной аминокислоты на другую аминокислоту, обладающую похожими структурными и/или химическими свойствами. Такая аминокислотная замена обычно может происходить на основании сходства полярности, заряда, растворимости, гидрофобности, гидрофильно ста и/или амфипатической природы остатка.
В одном воплощении настоящего изобретения белок SsuD может кодироваться полинуклеотидом, имеющим нуклеотидную последовательность SEQ ID NO: 8, не ограничиваясь этим.
Использумый в настоящем документе термин "полинуклеотид" имеет инклюзивное значение, включающее молекулы ДНК и РНК, и нуклеотид, представляющий собой базовую структурную единицу полинуклеотида, может включать не только природный нуклеотид, но также аналог, в котором сахар или основание модифицированы (Scheit, Nucleotide Analogs, John Wiley, New York (1980); Uhlman and Peyman, Chemical Reviews, 90: 543-584 (1990)).
Полинуклеотид может представлять собой полинуклеотид (ген ssuD), кодирующий белок SsuD по настоящему изобретению. Полинуклеотид по настоящему изобретению может включать различные модификации, сделанные в кодирующей области, при условии, что не изменяется аминокислотная последовательность полипептида, экспрессируемого с кодирующей области, вследствие вырожденности генетического кода или с учетом кодонов, предпочтительных для живого организма, в котором экспрессируется белок. Полинуклеотид по настоящему изобретению может представлять собой, например, полинуклеотид, кодирующий полипептид, имеющий по меньшей мере 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% гомологии или идентичности с белком SsuD по настоящему изобретению. В частности, полинуклеотид, кодирующий белок, содержащий аминокислотную последовательность, имеющую по меньшей мере 80% гомологии или идентичности с аминокислотной последовательностью SEQ ID NO: 43, может представлять собой полинуклеотиды, имеющие по меньшей мере 80%, 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% гомологии или идентичности с нуклеотидной последовательностью SEQ ID NO: 8.
Кроме того, очевидно, что может быть включен любой полинуклеотид, который может транслироваться в белок, содержащий аминокислотную последовательность, имеющую по меньшей мере 80% гомологии или идентичности с SEQ ID NO: 43, вследствие вырожденности генетического кода. Альтернативно, любой полинуклеотид, кодирующий белок, содержащий аминокислотную последовательность, имеющую по меньшей мере 80% идентичности с аминокислотной последовательностью SEQ ID NO: 43, и гибридизуемый с зондом, сконструированным с использованием известных генных последовательностей, например, с нуклеотидной последовательности полностью или частично комплементарной данной полинуклеотидной последовательности, в строгих условиях, может быть включен без ограничения. Термин "строгие условия" обозначает условия, дающие возможность специфической гибридизации между полинуклеотидами. Такие условия подробно раскрыты в известных документах (Например, J. Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; F. M. Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., New York). Например, строгие условия могут включать проведение гибридизации между генами, имеющими высокую степень гомологии или идентичности, например, 70% или более гомологии или идентичности, 80% или более, 85% или более, в частности 90% или более, более конкретно 95% или более, еще более конкретно 97% или более, или наиболее конкретно 99% или более, без проведения гибридизации между генами, имеющими меньшую степень гомологии или идентичности, чем указанная выше степень гомологии или идентичности, или однократную промывку, в частности двукратную или трехкратную промывку в традиционных условиях промывки для гибридизации по Саузерну при концентрации соли и температуре 60°С, 1×SSC и 0,1% SDS, в частности 60°С, 0,1×SSC, 0,1% SDS и более конкретно 68°С, 0,1×SSC и 0,1% SDS.
Для гибридизации необходимо, чтобы два полинуклеотида имели комплементарные последовательности, хотя основания могут не соответствовать в зависимости от степени строгости гибридизации. Термин "комплементарный" используют для описания взаимодействия между основаниями нуклеотидов, способными гибридизоваться друг с другом. Например, в отношении ДНК аденозин комплементарен тимину, а цитозин комплементарен гуанину. Таким образом, настоящее изобретение может включать не только по существу похожую нуклеотидную последовательность, но также и полинуклеотидный фрагмент который является отдельным, но комплементарен полной последовательности.
В частности, полинуклеотиды, имеющие гомологию или идентичность с полинуклеотидом по настоящему изобретению, могут быть определены с помощью условий гибридизации, включающих процесс гибридизации, выполненный при значении Tm 55°С и в вышеописанных условиях. Также, значение Tm может составлять 60°С, 63°С или 65°С, но не ограничиваясь этим, и может быть подходящим образом установлена специалистом в данной области техники в соответствии с поставленными задачами.
Подходящая степень строгости условий для гибридизации полинуклеотидов может зависеть от длин и степени комплементарности полинуклеотидов, и ее параметры хорошо известны в данной области техники (Sambrook et al., supra, 9.50-9.51, 11.7-11.8).
При использовании в настоящем документе термин "гомология" или "идентичность" относятся к степени родства между двумя аминокислотными последовательностями или нуклеотидными последовательностями, и она может быть выражена в процентах. Термины "гомология" и "идентичность" часто можно использовать взаимозаменяемо.
Гомологию или идентичность последовательностей консервативных полинуклеотидов или полипептидов можно определить по стандартному алгоритму выравнивания, и в нем можно использовать штрафы за пропуск в последовательности, по умолчанию установленные в программе. По существу, гомологичные или идентичные последовательности могут гибридизоваться друг с другом по меньшей мере примерно на 50%, 60%, 70%, 80% или 90% от полной последовательности или полной длины в умеренно или очень строгих условиях. Очевидно, что полинуклеотиды, содержащие вырожденные кодоны, также можно принимать во внимание при гибридизации.
Гомологию, сходство или идентичность между двумя полинуклеотидными или полипептидными последовательностями можно определить с помощью любого компьютерного алгоритма, известного в данной области техники, например, программы "FASTA", с использованием параметров по умолчанию, введенных Pearson et al. (1988) Proc. Natl. Acad. Sci. USA 85: 2444. Альтернативно, гомологию, сходство или идентичность можно определить с помощью алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), который реализован в программе Needleman пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et at, 2000, Trends Genet. 16: 276-277) (версия 5.0.0 или более поздняя) (включающем пакет программ GCG (Devereux, J. et al., Nucleic Acids Research 12: 387 (1984)), BLASTP, BLASTN, FASTA (Atschul, S.F., et al., J MOLEC BIOL 215: 403 (1990); Guide to Huge Computers, Martin J. Bishop, ed., Academic Press, San Diego, 1994, and CARILLO et al. (1988) SIAM J Applied Math 48: 1073). Например, гомологию, сходство или идентичность можно определить с использованием BLAST из базы данных Национального центра биотехнологической информации США или ClustalW.
Гомологию, сходство или идентичность между полинуклеотидами или полипептидами можно определить путем сравнения информации о последовательностях с использованием компьютерной программы GAP, представленной Needleman et al., (1970), J Mol Biol. 48: 443, как раскрыто в Smith and Waterman, Adv. Appl. Math (1981) 2: 482. Вкратце, программа GAP определяет сходство как число выровненных символов (то есть, нуклеотидов или аминокислот), которые являются одинаковыми, разделенное на общее число символов в более короткой из двух последовательностей. Параметры по умолчанию для программы GAP могут включать: (1) бинарную матрицу сравнения (включающую значение 1 для совпадений и 0 для несовпадений) и взвешенную матрцу сравнения от Gribskov et al. (1986), Nucl. Acids Res. 14: 6745, как описано Schwartz and Dayhoff, eds., Atlas Of Protein Sequence and Structure, National Biomedical Research Foundation, pp. 353-358 (1979) (или матрица замен EDNAFULL (версия NCBI NUC4.4 EMBOSS)); (2) штраф 3,0 за каждый пропуск и дополнительный штраф 0,10 за каждый символ в каждом пропуске (или штраф за внесение пропуска 10 и штраф за продление пропуска 0,5) и (3) отсутствие штрафа за окончание пропуска.
Также, гомологию, сходство или идентичность последовательностей между двумя данными полинуклеотидами или полипептидами можно определить путем сравнения их последовательностей путем гибридизации по Саузерну в определенных строгих условиях, и определенные строгие условия гибридизации входят в объем данной технологии, и их можно определить способом, хорошо известным специалисту средней квалификации в данной области техники (Например, J. Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; F. M. Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., New York).
При использовании в настоящем документе термин "усиление" активности полипептида или белка относится к увеличению активности полипептида по сравнению с его естественной активностью. Термин "усиление" можно использовать взаимозаменяемо с терминами "повышающая регуляция (up-regulation)", "сверхэкспрессия", "увеличение" и им подобными.
В этом отношении увеличение может включать проявление активности, которой не было изначально, или проявление повышенной активности по сравнению с естественной активностью либо активностью до модификации. Термин "естественная активность" относится к активности определенного полипептида или белка, которой исходно обладал родительский штамм или немодифицированный микроорганизм до трансформации, при которой микроорганизм трансформируют путем генетической модификации, вызванной природным или искусственным фактором. Этот термин можно использовать взаимозаменяемо с выражением "активность до модификации". "Усиление" или "увеличение" активности полипептида или белка по сравнению с естественной активностью означает, что активность определенного полипептида или белка улучшена по сравнению с активностью, которой исходно обладает родительский штамм или немодифицированный микроорганизм до трансформации.
Термин "увеличение активности" может обозначать увеличение, достигнутое путем введения чужеродного полипептида или белка, или усиления активности эндогенного полипептида или белка, в частности достигнутое путем усиления активности эндогенного полипептида или белка. Это усиление активности полипептида или белка можно определить на основании увеличения степени активности полипептида или белка, уровня его экспрессии или количества производимого им продукта.
При использовании в настоящем документе выражение "усиление или увеличение активности белка, кодируемого геном ssuD, или белка SsuD" также может быть обозначено как "генетическая модификация для повышения активности белка, кодируемого геном ssuD", и оно означает, что активность белка повышена по сравнению с естественной активностью.
Увеличение активности белка SsuD может включать как увеличение активности путем введения чужеродного белка SsuD, так и увеличение активности эндогенного белка SsuD.
При использовании в настоящем документе термин "введение белка" относится к обеспечению активности определенного белка у микроорганизма, у которого исходно нет этого белка, или усилению активности белка по сравнению с естественной активностью белка или активностью до модификации. Например, введение белка может относится к введению определенного белка, введению полинуклеотида, кодирующего определенный белок, в хромосому микроорганизма, или введение вектора, содержащего полинуклеотид, кодирующий определенный белок, в микроорганизм, тем самым обеспечивая активность белка.
Усиление активности полипептида или белка может быть достигнуто путем применения различных способов, хорошо известных в данной области техники без ограничения, при условии, что активность целевого полипептида или белка усилена по сравнению с таковой у микроорганизма до модификации. В частности, можно использовать любые методы генетической инженерии и/или белковой инженерии, хорошо известные в данной области техники, как и обычные методы молекулярной биологии, не ограничиваясь ими (Sitnicka et al. Functional Analysis of Genes. Advances in Cell Biology. 2010, Vol. 2.1-16, Sambrook et al. Molecular Cloning 2012 и так далее).
В частности, в настоящем изобретении усиление активности может быть достигнуто путем:
(1) увеличения числа копий гена или полинуклеотида, кодирующего полипептид или белок, в клетке;
(2) замены области регуляции экспрессии гена, кодирующего полипептид или белок, на хромосоме последовательностью с более высокой активностью;
(3) модификации последовательности оснований, кодирующей инициирующий кодон или участок 5'-UTR (5'-нетранслируемой области) полипептида или белка;
(4) модификации нуклеотидной последовательности на хромосоме для усиления активности полипептида или белка;
(5) введения чужеродного полинуклеотида, обладающего активностью данного полипептида или белка, или кодон-оптимизированного варианта полинуклеотида; или
(6) модификации для усиления активности путем любой комбинации вышеописанных способов, не ограничиваясь ими.
Способ усиления активности полипептида или белка методом белковой инженерии может быть выполнен путем модификации или химической модификации поверхностного участка, выбранного путем анализа трехмерной структуры полипептида или белка, не ограничиваясь этим.
Увеличение числа копий гена или полинуклеотида, кодирующего полипептид или белок, описанный в (1) выше, может быть выполнено любым способом, хорошо известным в данной области техники, например, путем введения вектора, который реплицируется и функционирует независимо от клетки-хозяина и функционально связан с геном или полинуклеотидом, кодирующим полипептид или белок, в клетку-хозяина. Альтернативно, увеличение числа копий может быть выполнено путем введения вектора, который функционально связан с геном и способен вставлять ген или полинуклеотид в хромосому клетки-хозяина, в клетку-хозяина, но не ограничиваясь этим.
Замена области регуляции экспрессии (или последовательности регуляции экспрессии) гена, кодирующего полипептид или белок, на хромосоме последовательностью с более высокой активностью, описанная в (2) выше, может быть выполнена любым способом, известным в данной области техники, например путем введения мутации в последовательность путем делеции, вставки, неконсервативной или консервативной замены или любой их комбинации или путем замены этой последовательности на последовательность с более высокой активностью для дополнительного усиления активности области регуляции экспрессии. Область регуляции экспрессии может содержать промотор; последовательность оператора; последовательность, кодирующую сайт связывания с рибосомой, и последовательность для регуляции терминации транскрипции и трансляции, не ограничиваясь ими. Например, способ может быть выполнен путем присоединения более сильного гетерологичного промотора вместо естественного промотора, не ограничиваясь этим.
Примеры более сильных промоторов, известных в данной области техники, могут включать промоторы cj1-cj7 (Патент США No. US 7662943 В2), промотор lac, промотор trp, промотор trc, промотор tac, промотор PR фага лямбда, промотор PL, промотор tet, промотор lysCP1 (US 2010-0317067 A1), промотор spl1, промотор spl7, промотор spl13 (US 10584338 B2), промотор gap А, промотор EF-Tu, промотор groEL, промотор асеА или асеВ, промотор 02 (Патент США No. US 10273491 В2), промотор tkt и промотор yccA, не ограничиваясь ими.
Модификация последостельности оснований, кодирующей инициирующий кодон или участок 5'-UTR полипептида или белка, описанная в (3) выше, может быть выполнена любым способом, известным в данной области техники, например, путем замены естественного кодона инициации на другой кодон инициации с более высоким уровнем экспрессии полипептида или белка, не ограничиваясь этим.
Модификация нуклеотидной последовательности на хромосоме для усиления активности полипептида или белка, описанная в (4) выше, может быть выполнена любым способом, известным в данной области техники, например путем индуцирования модификации последовательности регуляции экспрессии путем делеции, вставки, неконсервативной или консервативной замены, или любой их комбинации для дальнейшего усиления активности нуклеотидной последовательности или замены последовательности нуклеотидной последовательностью, модифицированной для повышения активности. Замена может представлять собой вставку гена в хромосому путем гомологичной рекомбинации, не ограничиваясь этим. Вектор, используемый при этом, может дополнительно содержать селективный маркер для определения вставки в хромосому.
Введение чужеродного полинуклеотида, обладающего активностью полипептида или белка, описанное в (5) выше, может быть выполнено любым способом, известным в данной области техники, например путем введения чужеродного полинуклеотида, кодирующего полипептид или белок, обладающий активностью идентичной/подобной активности полипептида или белка, или введения кодон-оптимизированного варианта этого полинуклеотида в клетку-хозяина. Происхождение или последовательность чужеродного полинуклеотида конкретно не ограничены, при условии, что чужеродный полинуклеотид проявляет активность идентичную/подобную активности полипептида или белка. Кроме этого, в клетку-хозяина может быть введен чужеродный полинуклеотид, кодон-оптимизированный для оптимизированной транскрипции и трансляции в клетке-хозяине. Введение может быть выполнено любым известным способом трансформации, подходящим образом выбранным специалистом средней квалификации в данной области техники. Поскольку введенный полинуклеотид экспрессируется в клетке-хозяине, продуцируется полипептид или белок, за счет чего повышается его активность.
Наконец, комбинация вышеописанных способов, описанная в (6), может быть выполнена путем применения одного или более чем одного способа, описанного в (1)-(5).
Усиление активности полипептида или белка, как описано выше, может представлять собой повышение активности или концентрации полипептида или белка по сравнению с активностью или концентрацией полипептида или белка, экспрессируемого в штаммах микроорганизмов дикого типа или немодифицированных микроорганизмов, либо увеличение количества продукта, полученного посредством этого полипептида или белка, не ограничиваясь этим.
При использовании в настоящем документе термин "штамм до модификации" или "микроорганизм до модификации" не исключает штаммы, содержащие природные мутации в микроорганизмах, и может относиться к штамму дикого типа или природного типа либо к штамму до трансформации путем генетической модификации вследствие природного или искусственного фактора. Термины "штамм до модификации" или "микроорганизм до модификации" можно использовать взаимозаменяемо с терминами "немутированный штамм", "немодифицированный штамм", "немутированный микроорганизм", "немодифицированный микроорганизм" или "референсный микроорганизм".
При использовании в настоящем документе термин "вектор" относится к конструкции ДНК, содержащей нуклеотидную последовательность полинуклеотида, кодирующего целевой белок, и функционально связанную с подходящей регуляторной последовательностью, так чтобы обладать способностью экспрессировать целевой белок в подходящей клетке-хозяине. Регуляторная последовательность может включать промотор, способный инициировать транскрипцию, любую операторную последовательность для регуляции транскрипции, последовательность, кодирующую подходящий мРНК-сайт связывания рибосомы, и последовательность для регуляции терминации транскрипции и трансляции. Когда подходящую клетку-хозяина трансформируют вектором, вектор может реплицироваться или функционировать независимо от генома хозяина или может быть интегрирован в геном хозяина. Например, полинуклеотид, кодирующий целевой белок, может быть вставлен в хромосому с помощью вектора для вставки в хромосому в клетках. Вставку полинуклеотида в хромосому можно выполнять любым способом, известным в данной области техники, например, гомологичной рекомбинацией, но не ограничиваясь этим. Вектор может дополнительно содержать селективный маркер для определения вставки в хромосому. Селективный маркер используют для отбора клеток, которые трансформированы вектором, то есть, для подтверждения вставки требуемых молекул нуклеиновой кислоты, и примеры селективных маркеров могут включать маркеры, обеспечивающие селектируемые фенотипы, такие как толерантность к лекарственным средствам, потребность в питательных веществах, устойчивость к цитотоксическим агентам или экспрессия поверхностного полипептида. Только клетки, экспрессирующие селективный маркер, способны выживать или демонстрировать различные фенотипы в условиях окружающей среды, обработанной селективным агентом, и таким образом можно отбирать трансформированные клетки.
Вектор, используемый в настоящем изобретении, конкретно не ограничен, и можно использовать любой вектор, известный в данной области техники. Примеры векторов, обычно используемых в данной области техники, могут включать природную или рекомбинатную плазмиду, космиду, вирус и бактериофаг. Например, pWE15, М13, MBL3, MBL4, IXII, ASHII, APII, t10, t11, Charon4A и Charon21A можно использовать в качестве фагового вектора или космидного вектора. В качестве плазмидного вектора можно использовать тип pBR, тип pUC, тип pBluescriptII, тип pGEM, тип pTZ, тип pCL и тип рЕТ. В частности, можно использовать pDZ, pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322, pMW118 и pCC1BAC. Однако настоящее воплощение не ограничено ими.
При использовании в настоящем документе термин "трансформация" относится к процессу введения вектора, содержащего полинуклеотид, кодирующий целевой белок в клетку-хозяина или микроорганизм таким образом, что полипептид, кодируемый полинуклеотидом, экспрессируется в клетке-хозяине. Трансформированный полинуклеотид может присутствовать либо в форме, вставленной в хромосому клетки-хозяина, либо в форме, локализованной вне хромосомы, при условии, что белок экспрессируется в клетке-хозяине. Кроме того, полинуклеотид включает ДНК и/или РНК, кодирующую целевой белок. Полинуклеотид может быть введен в клетку-хозяина в любой форме, при условии, что полинуклеотид введен в клетку-хозяина, и полипептид экспрессируется в ней. Например, полинуклеотид может быть введен в клетку-хозяина в форме экспрессионной кассеты, которая представляет собой генетическую конструкцию, включающую все существенные элементы, необходимые для саморепликации. Экспрессионная кассета обычно может содержать промотор, функционально связанный с полинуклеотидом, сигнал терминации транскрипции, сайт связывания с рибосомой и сигнал терминации трансляции. Экспрессионная кассета может находиться в форме самореплицирующегося вектора экспрессии. Также полинуклеотид может быть введен в клетку-хозяина в его исходной форме и функционально связан с последовательностью, необходимой для экспрессии в клетке-хозяине, не ограничиваясь этим.
Кроме того, при использовании в настоящем документе термин "функционально связанный" относится к функциональной связи между последовательностью промотора, которая дает возможность инициации и процесса прохождения транскрипции полинуклеотида, кодирующего целевой белок по настоящему изобретению, и последовательностью гена.
Способы трансформации вектором по настоящему изобретению включают любые способы, дающие возможность введения нуклеиновой кислоты в клетку-хозяина, и могут быть выполнены любыми подходящими стандартными методами, хорошо известными в данной области техники, выбранными в соответствии с клеткой-хозяином. Например, можно использовать электропорацию, осаждение фосфатом кальция (CaPO4), осаждение хлоридом кальция (CaCl2), микроинъекцию, полиэтиленгликолевый метод (PEG), DEAE-декстрановый метод, катионно-липосомный метод и метод с ацетатом лития-DMSO, однако настоящее изобретение не ограничено этим.
Микроорганизм по настоящему изобретению может включать как микроорганизмы дикого типа, так и микроорганизмы, содержащие природные или искусственные генетические модификации, и любой микроорганизм, в который введена тиосульфатредуктаза, или содержащий тиосульфатредуктазу по настоящему изобретению, может быть включен сюда без ограничения.
Микроорганизм по настоящему изобретению может содержать по меньшей мере одно из тиосульфатредуктазы по настоящему изобретению; полинуклеотида, кодирующего такую тиосульфатредуктазу, и вектора, содержащего такой полинуклеотид.
Микроорганизм может представлять собой микроорганизм, продуцирующий L-аминокислоты и/или их производные.
При использовании в настоящем документе термин "микроорганизм, продуцирующий L-аминокислоты и/или их производные" включает как микроорганизм, от природы обладающий способностью продуцировать L-аминокислоты/их производные, так и микроорганизм, полученный путем придания способности продуцировать L-аминокислоты/их производные родительскому штамму, неспособному продуцировать L-аминокислоты или их производные. В частности, любой микроорганизм, содержащий генетическую модификацию для продуцирования целевой L-аминокислоты или ее производных, благодаря наличию определенного механизма, ослабленного или усиленного за счет введения экзогенного гена либо усиления или инактивации активности эндогенного гена.
Например, микроорганизм может представлять собой микроорганизм, у которого путь биосинтеза L-аминокислоты усилен или путь ее расщепления ослаблен. Например, микроорганизм может представлять собой микроорганизм, у которого путь биосинтеза L-метионина усилен.
Например, микроорганизм может представлять собой микроорганизм, у которого активность белка-репрессора биосинтеза метионина и цистеина (McbR) или белка MetJ ослаблена или устранена, или микроорганизм, у которого способность продуцировать метионин усилена и/или увеличена путем усиления активности метионин синтазы (MetH) или сульфитредуктазы (CysI). Альтернативно, микроорганизм может представлять собой микроорганизм, у которого экспрессия гена, кодирующего фермент, вовлеченный в путь биосинтеза L-аминокислоты усилен, или фермент, вовлеченный в путь расщепления L-аминокислоты ослаблен/инактивирован.
В частности, примеры белков или генов, экспрессию которых можно контролировать для усиления пути биосинтеза L-аминокислот или ослабления/инактивации пути их расщепления, являются такими, как указано далее. Они представлены в следующем порядке: белок; репрезентативный ген, кодирующий белок, и его репрезентативный номер ЕС. Первая буква названия белка является заглавной буквой, а название гена обозначено курсивом. Например, можно использовать тиосульфат-серотрансферазу, такую как Rdl2p, GlpE, PspE, YgaP, ThiI, YbbB, SseA, YnjE, YceA, YibN, NCgl0671, NCgl1369, NCgl2616, NCgl0053, NCgl0054, NCGl2678 и NCgl2890; сульфитредуктазу, cysI; транспортную систему тиосульфат/сульфат, cysPUWA (EC 3.6.3.25); 3'-фосфоаденозин-5'-фосфосульфат-редуктазу, cysH (EC 1.8.4.8); сульфитредуктазу, cysJI (EC 1.8.1.2); цистеин-синтазу A, cysK (EC 2.5.1.47); цистеин-синтазу В, cysM (EC 2.5.1.47); серин-ацетилтрансферазу, cysE (EC 2.3.1.30); систему расщепления глицина, gcvTHP-lpd (EC 2.1.2.10, EC 1.4.4.2, EC 1.8.1.4); липоилсинтазу, lipA (EC 2.8.1.8); липоил-протеинлигазу, lipB (EC 2.3.1.181); фосфоглицерат дегидрогеназу, serA (EC 1.1.1.95); 3-фосфосерин-фосфатазу, serB (EC 3.1.3.3); 3-фосфосерин/фосфогидрокситреонин-аминотрансферазу, serC (EC 2.6.1.52); серин-гидроксиметилтрансферазу, glyA (EC 2.1.2.1); аспартокиназу I (EC 2.7.2.4); гомосерин-дегидрогеназу I, thrA (EC 1.1.1.3); аспартаткиназу, lysC (EC 2.7.2.4); гомосерин-дегидрогеназу, hom (EC 1.1.1.3); гомосерин-О-ацетилтрансферазу, metA (EC 2.3.1.31); гомосерин-О-сукцинилтрансферазу, metA (EC 2.3.1.46); цистатионин-гамма-синтазу, metB (EC 2.5.1.48); β-C-S-лиазу, aecD (EC 4.4.1.8, бета-лиаза); цистатионин-бета-лиазу, metC (EC 4.4.1.8); В12-независимую гомоцистеин- S-метилтрансферазу, metE (EC 2.1.1.14); метионин-синтазу, metH (EC 2.1.1.13); метилентетрагидрофолатредуктазу, metF (EC 1.5.1.20); экспортер L-метионина BrnFE; экспортер валина YgaZH (B2682, B2683), ygaZH (b2682, b2683); экспортер YjeH, b4141; пиридиннуклеотид-трансгидрогеназу PntAB, pntAB (EC 1.6.1.2); О-сукцинил-гомосерин-сульфгидрилазу, MetZ (EC 2.5.1.48) и фосфоенолпируват карбоксилазу, Рус (ЕС 4.1.1.31). Путь биосинтеза L-аминокислот может быть усилен, или путь их расщепления может быть ослаблен путем усиления активности одного или более чем одного белка, описанного выше, или нескольких белков, составляющих систему, либо путем сверхэкспрессии полинуклеотидов, кодирующих такие белки. Альтернативно, по меньшей мере один белок, выбранный из глюкозо-6-фосфат изомеразы, pgi (ЕС 5.3.1.9); гомосеринкиназы, thrB (ЕС 2.7.1.39); S-аденозинметионин-синтазы, metK (ЕС 2.5.1.6); дигидродипиколинат-синтазы, dapA (ЕС 4.2.1.52); фосфоенолпируват-карбоксикиназы, pck (ЕС 4.1.1.49); формилтетрагидрофолат-гидролазы, purU (ЕС 3.5.1.10); пируваткиназы I, pykF (ЕС 2.7.1.40); пируваткиназы II, рукА (ЕС 2.7.1.40); цистатионин-γ-лиазы, cg3086 (ЕС 4.4.1.1); цистатионин-β-синтазы, cg2344 (ЕС 4.2.1.22); регуляторного белка Cg3031, cg3031; белка-репрессора биосинтеза метионина и цистеина McbR, mcbR; белка-репрессора транскрипции Met, metJ; транспортера L-метионина MetQNL metQ, metN, metI; N-ацилтрансферазы, yncA; sRNA (малая РНК) fnrS и транспортера L-метионина, metP, может быть инактивирован или ослаблен, либо экспрессия гена, кодирующего белок, может быть подавлена или устранена.
Однако, это только примеры, и микроорганизм может представлять собой микроорганизм, у которого экспрессия гена, кодирующего фермент, вовлеченный в различные известные пути биосинтеза L-аминокислот, усилена или экспрессия гена, кодирующего фермент, вовлеченный в пути расщепления L-аминокислот, ослаблена/инактивирована, не ограничиваясь этим. Микроорганизм, продуцирующий L-аминокислоту, может быть получен различными способами, известными в данной области техники. Усиление активности белка и увеличение экспрессии гена описаны выше.
При использовании в настоящем документе термин "инактивация" или "ослабление" полипептида или белка представляет собой понятие, включающее как уменьшение, так и устранение активности по сравнению с естественной активностью. Термины "инактивация" или "ослабление" можно использовать взаимозаменяемо с термином "понижающая регуляция", "снижение" и "уменьшение". Инактивация или ослабление может включать случай, когда активность белка уменьшена или устранена по сравнению с естественной активностью микроорганизма путем мутации гена, кодирующего белок, модификации последовательности регуляции экспрессии или полной либо частичной делеции гена; случай, когда общая активность белка в клетке ниже, чем активность в нативных штаммах или немодифицированных штаммах, вследствие ингибирования экспрессии или трансляции гена, кодирующего этот белок; случай, когда ген не экспрессируется, и случай, когда активность отсутствует, несмотря на то, что ген экспрессируется.
В настоящем изобретении инактивация/ослабление белка может быть достигнута(то) различными способами, хорошо известными в данной области техники, не ограничиваясь этим (Nakashima N. et al., Bacterial cellular engineering by genome editing and gene silencing. Int J Mol Sci. 2014; 15(2): 2773-2793, Sambrook et al. Molecular Cloning 2012, etc.).
Примеры способов включают:
(1) полную или частичную делецию гена, кодирующего белок,
(2) модификацию области регуляции экспрессии (или последовательности регуляции экспрессии) для уменьшения экспрессии гена, кодирующего белок,
(3) модификацию последовательности гена, кодирующего белок, для устранения или ослабления активности белка,
(4) введение антисмыслового олигонуклеотида (например, введение антисмысловой РНК), комплементарно связывающегося с транскриптом гена, кодирующего белок,
(5) добавление последовательности, комплементарной последовательности Шайна-Дальгарно гена, кодирующего белок, выше по течению от последовательности Шайна-Дальгарно для образования вторичной структуры, предупреждающей связывание рибосомы с этой последовательностью,
(6) добавление промотора для обратной транскрипции на 3'-конец открытой рамки считывания (ORF) нуклеотидной последовательности гена, кодирующего белок (Технология обратной транскрипции, RTE), или любую их комбинацию, не ограничиваясь ими.
В частности, полная или частичная делеция гена, кодирующего белок, может быть выполнена путем замены полинуклеотида, кодирующего естественный целевой белок в хромосоме, на полинуклеотид с делецией нескольких нуклеотидов или маркерный ген с помощью вектора для вставки в хромосому в микроорганизме. В качестве примера полной или частичной делеции полинуклеотида можно использовать способ делеции полинуклеотида путем гомологичной рекомбинации, не ограничиваясь этим.
Кроме того, полную или частичную делецию гена можно выполнять путем индуцирования мутации с помощью излучения, такого как УФ-излучение, или химического вещества, и отбора мутантных штаммов с делецией целевого гена. Получение делеции гена может включать способ с использованием технологии рекомбинантной ДНК. Технологию рекомбинантной ДНК можно применять путем индуцирования гомологичной рекомбинации путем вставки нуклеотидной последовательности или вектора, имеющей(его) гомологию с целевым геном, в микроорганизм. Дополнительно, вставленная нуклеотидная последовательность или вектор может содержать доминантный селективный маркер, не ограничиваясь этим.
Кроме того, может быть выполнена модификация последовательности регуляции экспрессии путем применения различных способов, хорошо известных в данной области техники. Например, модификация может быть выполнена путем индуцирования мутации в области регуляции экспрессии (последовательности регуляции экспрессии) путем делеции, вставки, неконсервативной или консервативной замены или любой их комбинации для дополнительного снижения активности области регуляции экспрессии (последовательность регуляции экспрессии) или путем замены последовательности на последовательность, имеющую более слабую активность. Область регуляции экспрессии может содержать промотор, последовательность оператора, последовательность, кодирующую сайт связывания с рибосомой, и последовательность регуляции терминации транскрипции и трансляции, не ограничиваясь ими.
Также модификация последовательности гена может быть выполнена путем индуцирования мутации в последовательности гена путем делеции, вставки, неконсервативной или консервативной замены или любой их комбинации для дополнительного снижения активности полипептида или путем замены этой последовательноти на последовательность гена, модифицированную с тем, чтобы иметь более слабую активность, или последовательность гена, модифицированную с тем, чтобы не иметь активности, не ограничиваясь этим.
Например, экспрессия гена может быть подавлена или ослаблена путем образования кодона терминации путем введения мутации в последовательность гена.
Однако вышеописанные способы представляют собой исключительно примеры, и специалисты средней квалификации в данной области техники могут получить микроорганизм, продуцирующий L-аминокислоты и/или их производные, с ипользованием любых способов, известных в данной области техники.
L-аминокислота и/или ее производное может представлять собой серосодержащую аминокислоту и/или производное серосодержащей аминокислоты.
При использовании в настоящем документе термин "серосодержащая аминокислота" или "производное серосодержащей аминокислоты" относится к аминокислоте, содержащей серу, или ее производному, в частности таковым, выбранным из метионина, цистеина, цистина, лантионина, гомоцистеина, гомоцистина, гомолантионина и таурина, но не ограничиваясь ими; любая аминокислота, содержащая серу, и ее производные могут быть включены в объем настоящего изобретения без ограничения.
Микроорганизм по настоящему изобретению может представлять собой микроорганизм, принадлежащий роду Corynebacterium sp., роду Escherichia sp., или роду Lactobacillus sp., не ограничиваясь ими. Микроорганизм может включать любой микроорганизм, обладающий повышенной способностью продуцировать L-аминокислоты и/или их производные путем усиления естественной активности белка SsuD или введения чужеродного белка SsuD без ограничения.
"Микроорганизм, принадлежащий роду Corynebacterium", может включать любые микроорганизмы, принадлежащие роду Corynebacterium. В частности, микроорганизм может представлять собой Corynebacterium glutamicum, Corynebacterium crudilactis, Corynebacterium crenatum, Corynebacterium deserti, Corynebacterium efficiens, Corynebacterium callunae, Corynebacterium stationis, Corynebacterium singulare, Corynebacterium halotolerans, Corynebacterium striatum, Corynebacterium ammoniagenes, Corynebacterium pollutisoli, Corynebacterium imitans, Corynebacterium testudinoris или Corynebacterium flavescens, и более конкретно Corynebacterium glutamicum, Corynebacterium callunae, Corynebacterium crenatum, Corynebacterium stationis, Corynebacterium ammoniagenes или Corynebacterium deserti, еще более конкретно Corynebacterium glutamicum, но не ограничиваясь ими.
"Микроорганизм, принадлежащий роду Escherichia", может включать любые микроорганизмы, принадлежащие роду Escherichia. В частности, микроорганизм может представлять собой Escherichia coli, но не ограничиваясь этим.
Микроорганизм по настоящему изобретению может представлять собой любой микроорганизм, содержащий тиосульфатредуктазу по настоящему изобретению и использующий тиосульфат в качестве источника серы.
Способ продуцирования по настоящему изобретению может включать культивирование микроорганизма по настоящему изобретению в культуральной среде, содержащей тиосульфат.
При использовании в настоящем документе термин "культивирование" относится к выращиванию микроорганизма в подобранных подходящим образом условиях. Процесс культивирования по настоящему изобретению может быть проведен в соответствии с подходящей средой и условиями культивирования, известными в данной области техники. Процесс культивирования может быть легко адаптирован для использования специалистом в данной области техники в соответствии с выбранным штаммом. Культивирование микроорганизма может быть выполнено в периодическом процессе, непрерывном процессе, периодическом процессе с подпиткой и так далее, известных в данной области техники, не ограничиваясь ими.
При использовании в настоящем документе термин "культуральная среда" относится к материалу, в котором смешаны питательные вещества, необходимые для культивирования микроорганизма, в качестве основных ингредиентов, а также запасы питательных веществ и факторы роста, как и вода, которые необходимы для выживания и роста. В частности, хотя культуральная среда и другие условия культивирования для культивирования микроорганизма по настоящему изобретению конкретно не ограничены, при условии что культуральные среды являются такими, которые обычно используют при культивировании микроорганизмов, микроорганизм по настоящему изобретению можно культивировать в обычной среде, содержащей подходящие источники углерода, источники азота, источники фосфора, неорганические соединения, аминокислоты и/или витамины в аэробных условиях при контролировании температуры, рН и тому подобного.
В настоящем изобретении источники углерода могут включать углеводы, такие как глюкоза, сахароза (saccharose), лактоза, фруктоза, сахароза и мальтоза; сахарные спирты, такие как маннит и сорбит; органические кислоты, такие как пировиноградная кислота, молочная кислота и лимонная кислота; и аминокислоты, такие как глутаминовая кислота, метионин и лизин. Кроме того, можно использовать натуральные органические питательные вещества, такие как гидролизаты крахмала, мелассу, сырую мелассу, рисовые отруби, маниоку, жмых сахарного тростника и кукурузный экстракт, и в частности можно использовать углеводы, такие как глюкоза и стерильная предварительно обработанная меласса (то есть, меласса, конвертированная в восстановленные сахара), и подходящие количества любых других источников углерода также можно использовать без ограничения. Эти источники углерода можно использовать по отдельности или в комбинации по меньшей мере двух из них, но не ограничиваясь этим.
Источники азота могут включать неорганические источники азота, такие как аммиак, сульфат аммония, хлорид аммония, ацетат аммония, фосфат аммония, карбонат аммония и нитрат аммония; и органические источники азота, такие как аминокислоты, например, глутаминовую кислоту, метионин и глутамин, пептон, NZ-амин, мясной экстракт, дрожжевой экстракт, солодовый экстракт, кукурузный экстракт, гидролизат казеина, рыбу или продукты ее переработки и обезжиренный соевый жмых или продукты его переработки. Эти источники азота можно использовать по отдельности или в комбинации по меньшей мере двух из них, не ограничиваясь этим.
Источники фосфора могут включать дигидрофосфат калия, гидрофосфат калия или соответствующие им натрийсодержащие соли. В качестве неорганических соединений можно использовать хлорид натрия, хлорид кальция, хлорид железа, сульфат магния, сульфат железа, сульфат марганца, карбонат кальция и тому подобное. Также дополнительно можно включать аминокислоты, витамины и/или подходящие предшественники. Эти компоненты и предшественники можно добавлять в культуральную среду в периодическом или непрерывном процессе, не ограничиваясь ими.
Также во время процесса культивирования микроорганизма в культуральную среду можно добавлять такие соединения как гидроксид аммония, гидроксид калия, аммиак, ортофосфорная кислота и серная кислота в подходящем способе для подведения рН культуральной среды. Также, во время культивирования можно добавлять пеногаситель, такой как полигликолевый сложный эфир жирной кислоты, для ингибирования образования пены. Дополнительно в культуральную среду можно вводить кислород или кислородсодержащий газ для поддержания культуральной среды в аэробных условиях, или азот, водород либо газообразный диоксид углерода можно вводить в культуральную среду для поддержания культуральной среды в анаэробных и микроаэробных условиях без введения каких-либо других газов, однако настоящее воплощение не ограничено этим.
Температуру культуральной среды можно поддерживать в диапазоне от 25°С до 40°С, более конкретно от 30°С до 37°С, не ограничиваясь этим. Культивирование можно продолжать до получения желаемого количества продукта, например, в течение от 0,5 часов до 60 часов, не ограничиваясь этим.
Термин "источник серы" по настоящему изобретению можно использовать взаимозаменяемо с термином "источник, обеспечивающий серой", и он относится к серосодержащему веществу, доступному для продуцирования серосодержащей аминокислоты.
При культивировании микроорганизма источник серы может представлять собой важный фактор для определения метаболического пути у микроорганизма. Однако факторы, вовлеченные в транспорт различных источников серы, и факторы, вовлеченные в их расщепление, точно не выявлены. Например, хотя известно, что Corynebacterium glutamicum дикого типа использует различные источники серы, известно, что белок SsuD не вовлечен в транспорт сульфата или сульфита, но вовлечен только в транспорт алифатического сульфоната (D.J. Koch, С. Ruckert, D.A. Rey, A. Mix, A. Puhler, J. Kalinowski. 2005. Role of the ssu and seu Genes of Corynebacterium glutamicum ATCC 13032 in Utilization of Sulfonates and Sulfonate Esters as Sulfur Sources. AEM. 71.10.6104 6114. 2005). To есть, белок, транспортирующий источник серы в клетку, обладает субстратной специфичностью. Кроме того, после того как источник серы транспортирован в клетку, фермент, расщепляющий источник серы, может варьировать, и метаболический путь, использующий его, также может варьировать в зависимости от структуры и функциональной группы источника серы. Например, известно, что, когда в качестве источника серы используют сульфат, CysZ транспортирует сульфат, и CysDN, CysH и CysI участвуют до тех пор, пока сульфид не продуцирован (Bolten, Christoph J., Hartwig Schroder, Jeroen Dickschat, and Christoph Wittmann. Towards Methionine Overproduction in Corynebacterium glutamicum Methanethiol and Dimethyldisulfide as Reduced Sulfur Sources. J. Microbiol. Biotechnol. (2010), 20(8), 1196-1203). Однако в случае, когда в качестве источника серы для продуцирования серосодержащих аминокислот используется тиосульфат, факторы, используемые для транспорта и расщепления тиосульфата, пока достоверно не выявлены.
Источник серы может представлять собой тиосульфат. В частности, в настоящем изобретении источник серы может включать тиосульфат, например, тиосульфат аммония или тиосульфат натрия или смесь тиосульфата и органического или неорганического серосодержащего соединения, такого как сульфит, восстановленного сырья, например H2S, сульфида, производного сульфида, метилмеркаптана, тиогликолята, тиоцианата и тиомочевины. Альтернативно, источник серы может не содержать никого другого вещества, кроме тиосульфата. Однако настоящее воплощение не ограничено этим.
Способ продуцирования серосодержащих аминокислот или производных серосодержащих аминокислот может включать выделение серосодержащих аминокислот или производных серосодержащих аминокислот из микрорганизма или культуральной среды.
Стадию выделения можно выполнять путем сбора требуемых серосодержащих аминокислот или производных серосодержащих аминокислот с помощью подходящего способа, известного в данной области техники в соответствии со способом культивирования по настоящему изобретению, такого как способ периодического культивирования, непрерывного культивирования или периодического культивирования с подпиткой. Например, можно использовать центрифугирование, фильтрование, обработку агентом осаждения белков (высаливание), экстракцию, ультразвуковое разрушение, ультрафильтрацию, диализ, различные хроматографические методы, такие как хроматография на молекулярных ситах (гель-проникающая), адсорбционная хроматография, ионообменная хроматография и аффинная хроматография, высокоэффективная жидкостная хроматография (HPLC), и любую их комбинацию, не ограничиваясь этим.
Стадия выделения может дополнительно включать процесс очистки. Процесс очистки может быть выполнен с использованием подходящего способа, известного в данной области техники.
В другом аспекте настоящего изобретения предложена композиция для продуцирования серосодержащей аминокислоты или производного серосодержащей аминокислоты, где композиция включает микроорганизм, обладающий повышенной активностью белка, кодируемого геном ssuD, по сравнению с естественной активностью, или его культуру и тиосульфат.
Белок, кодируемый геном ssuD, микроорганизм, тиосульфат и серосодержащая аминокислота являются такими, как описано выше.
Культура может быть получена путем культивирования микроорганизма по настоящему изобретению в культуральной среде.
Композиция для продуцирования серосодержащей аминокислоты или производного серосодержащей аминокислоты по настоящему изобретению может дополнительно включать любой компонент, который может способствовать продуцированию серосодержащей аминокислоты или производного серосодержащей аминокислоты, и этот компонент может быть подходящим образом выбран из таковых, известных в данной области техники.
В другом аспекте настоящего изобретения предложено применение белка, кодируемого геном ssuD, в качестве тиосульфатредуктазы.
В другом аспекте настоящего изобретения предложено применение микроорганизма, содержащего генетическую модификацию для повышения активности белка, кодируемого геном ssuD, по сравнению с немодифицированным микроорганизмом для продуцирования серосодержащих аминокислот или производных серосодержащих аминокислот.
Белок, кодируемый геном ssuD, микроорганизм, культуры, тиосульфат и серосодержащая аминокислота являются такими, как описано выше.
Примеры
Здесь и далее настоящее изобретение будет описано более подробно со ссылкой на следующие примеры и экспериментальные примеры. Однако следующие примеры и экспериментальные примеры представлены исключительно для иллюстрации настоящего описания и не ограничивают объем настоящего изобретения.
Пример 1: Получение рекомбинантного вектора для делеции гена mcbR
Сначала для того, чтобы получить штамм, продуцирующий метионин в качестве репрезентативной серосодержащей аминокислоты, использовали штамм Corynebacterium glutamicum АТСС 13032 для получения вектора для инактивирования известного гена mcbR, кодирующего белок-регулятор транскрипции метионина и цистеина (J. Biotechnol. 103: 51-65, 2003).
В частности, для того, чтобы делетировать ген mcbR из хромосомы штамма Corynebacterium glutamicum АТСС 13032, получали рекомбинантный плазмидный вектор в соответствии со следующим способом.
На основании нуклеотидной последовательности, размещенной в GenBank Национального института здравоохранения США (NIH), были получены ген mcbR и фланкирующие последовательности (SEQ ID NO: 1) Corynebacterium glutamicum.
ПЦР проводили с использованием хромосомной ДНК Corynebacterium glutamicum АТСС 13032 в качестве матрицы и праймеров SEQ ID NO: 2, 3, 4 и 5. ПЦР проводили в следующих условиях: денатурация при 95°С в течение 5 минут; 30 циклов денатурации при 95°С в течение 30 секунд, отжига при 53°С в течение 30 секунд и полимеризации при 72°С в течение 30 секунд; и полимеризация при 72°С в течение 7 минут. В результате были получены фрагменты ДНК 700 п.н., соответственно.
Вектор pDZ (Патент США No. US 9109242 В2), неспособный к репликации в Corynebacterium glutamicum, и амплифицированные фрагменты гена mcbR обрабатывали ферментом рестрикции SmaI для вставки в хромосому с последующим клонированием методом изотермической сборки. Escherichia coli DH5α трансформировали этим вектором и высевали на твердую среду LB, содержащую 25 мг/л канамицина. Колонии, трансформированные вектором, в который с помощью ПЦР был вставлен фрагмент, имеющий делецию целевого гена, отбирали, и затем плазмида была выделена методом экстракции плазмид и обозначена как pDZ-ΔmcbR.
Пример 2: Получение и культивирование штамма с делецией гена mcbR
Штамм АТСС 13032 трансформировали методом электропорации вектором pDZ-ΔmcbR, полученным в Примере 1 выше, путем гомологичной хромосомной рекомбинации (Van der Rest et al., Appl Microbiol Biotechnol 52: 541-545, 1999). Затем проводили вторую рекомбинацию в твердой среде, содержащей сахарозу. После завершения второй рекомбинации трансформированный штамм Corynebacterium glutamicum, имеющий делецию гена mcbR, идентифицировали путем проведения ПЦР с использованием SEQ ID NO: 6 и 7, и рекомбинантный штамм получил название СМ02-0618.
Штамм СМ02-0618 был депонирован в Корейском центре культур микроорганизмов в соответствии с Будапештским соглашением 4 января 2019 года с номером доступа KCCM12425P.
Для анализа способности полученного штамма СМ02-0618 продуцировать L-метионин этот штамм и родительский штамм, штамм Corynebacterium glutamicum АТСС 13032, культивировали следующим образом.
Corynebacterium glutamicum АТСС 13032 и Corynebacterium glutamicum СМ02-0618 инокулировали в колбу на 250 мл с угловыми перегородками, содержащую 25 мл посевной среды, и культивировали со встряхиванием при 30°С в течение 20 часов при 200 об./мин. Затем 1 мл этого культурального бульона инокулировали в колбу на 250 мл с угловыми перегородками, содержащую 24 мл продукционной среды, и культивировали со встряхиванием при 30°С в течение 48 часов при 200 об./мин. Состав посевной среды и продукционной среды был следующим. В продукционной среде (NH4)2S2O3, представляющий собой один из типов тиосульфата, использовали в качестве источника серы.
Посевная среда (рН 7,0)
20 г глюкозы, 10 г пептона, 5 г дрожжевого экстракта, 1,5 г мочевины, 4 г KH2PO4, 8 г K2HPO4, 0,5 г MgSO4⋅7H2O, 100 мкг биотина, 1000 мкг тиамин-HCl, 2000 мкг пантотената кальция и 2000 мкг никотинамида (из расчета на 1 л дистиллированной воды).
Продукционная среда (рН 8,0)
50 г глюкозы, 12 г (NH4)2S2O3, 5 г дрожжевого экстракта, 1 г KH2PO4, 1,2 г MgSO4⋅7H2O, 100 мкг биотина, 1000 мкг тиамин-HCL, 2000 мкг пантотената кальция, 3000 мкг никотинамида, 30 г СаСО3 и 1 мкг цианокобаламина (витамина В12) (из расчета на 1 л дистиллированной воды).
Штаммы культивировали в соответствии с вышеописанным способом культивирования и анализировали концентрации L-метионина, содержащегося в культуральном бульоне, и они представлены в Таблице 1 ниже.
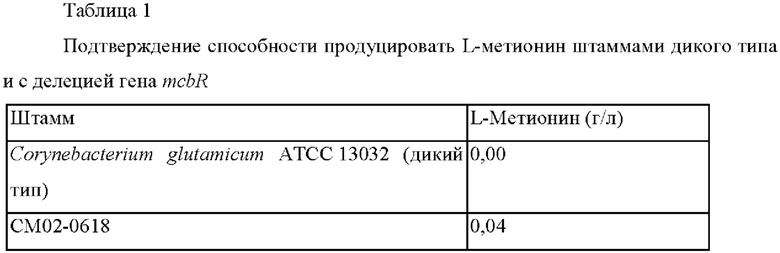
В результате было подтверждено, что способность штамма с делецией mcbR продуцировать L-метионин увеличена на 0,04 г/л по сравнению с таковой у контрольного штамма. Также было подтверждено, что метионин продуцировался даже при использовании тиосульфата в качестве единственного источника серы. На основании этих данных предположили, что белок, вовлеченный в использование тиосульфата, может присутствовать у микроорганизма, принадлежащего роду Corynebacterium.
Пример 3: Выбор гена, вовлеченного в использование тиосульфата, анализом транскриптов
Тиосульфат-специфические белки штаммов рода Corynebacterium не известны. Однако, как подтверждено в Примере 2, штамм СМ02-0618 продуцировал метионин, когда тиосульфат использовали в качестве единственного истояника серы, и поэтому был проведен эксперимент для выбора белка, вовлеченного в использование тиосульфата.
Более подробно, после культивирования штамма СМ02-0618, полученного в Примере 2, при изменении только источника серы (сульфат аммония и тиосульфат аммония) был выполнен транскриптомный анализ (анализ уровней РНК). Использовали такой же способ культивирования, как в Примере 2.
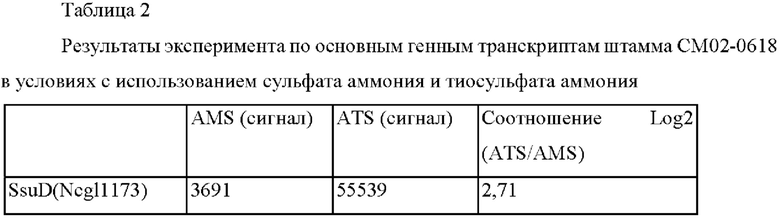
На основании результатов этого эксперимента было подтверждено, что уровень РНК гена, кодирующего SsuD (Ncgl1173), который традиционно известен как сульфонат-монооксигеназа, был значильно повышен.
Таким образом, было подтверждено, что белок SsuD не реагирует с сульфатом, но специфически реагирует с тиосульфатом, и, следовательно, можно предположить, что этот белок вовлечен в использование тиосульфата.
Пример 4: Подтверждение действия штамма с делецией по гену ssuD
Для идентификации инактивирующего действия белка SsuD, выбранного в качестве белка, специфически взаимодействующего с тиосульфатом в Примере 3, был получен вектор для делетирования гена ssuD.
Пример 4-1: Получение вектора для делетирования гена ssuD
Для делетирования гена ssuD из хромосомы штамма Corynebacterium АТСС 13032 рекомбинантный плазмидный вектор был получен в соответствии со следующим способом.
На основании нуклеотидных последовательностей, размещенных в GenBank Национального института здравоохранения США (NIH), были получены ген ssuD и фланкирующие последовательности (SEQ ID NO: 8) Corynebacterium glutamicum.
Для делетирования гена ssuD проводили ПЦР с использованием хромосомной ДНК Corynebacterium glutamicum АТСС 13032 в качестве матрицы и праймеров SEQ ID NO: 9, 10, 11 и 12. ПЦР проводили в следующих условиях: денатурация при 95°С в течение 5 минут; 30 циклов денатурации при 95°С в течение 30 секунд, отжига при 53°С в течение 30 секунд и полимеризации при 72°С в течение 30 секунд; и полимеризация при 72°С в течение 7 минут. В результате были получены фрагменты ДНК 700 п.н., соответственно.
Вектор pDZ, не способный реплицироваться в Corynebacterium glutamicum, и амплифицированные фрагменты гена ssuD обрабатывали ферментом рестрикции SmaI для вставки в хромосому с последующим клонированием методом изотермической сборки. Escherichia coli DH5α трансформировали этим вектором и высевали на твердую среду LB, содержащую 25 мг/л канамицина. Колонии, трансформированные вектором, в который с помощью ПЦР был вставлен фрагмент, имеющий делецию целевого гена, отбирали, и затем плазмида была получена методом экстракции плазмид и обозначена как pDZ-ΔSsuD.
Пример 4-2: Получение и культивирование щтамма с делецией гена ssuD
Штамм 13032/ΔmcbR трансформировали методом электропорации вектором pDZ-ΔSsuD, полученным в Примере 4-1 выше, путем гомологичной хромосомной рекомбинации (Van der Rest et al., Appl Microbiol Biotechnol 52: 541-545, 1999). Затем проводили вторую рекомбинацию в твердой среде, содержащей сахарозу. После завершения второй рекомбинации трансформированный штамм Corynebacterium glutamicum, имеющий делецию гена mcbR, идентифицировали путем проведения ПЦР с использованием SEQ ID NO: 13 и 14, и рекомбинантный штамм получил название Corynebacterium glutamicum CM02-0618/ΔSsuD.
Пример 4-3: Анализ способности штамма с делецией гена ssuD продуцировать метионин
Для анализа способности продуцировать L-метионин полученного штамма CM02-0618/ΔSsuD этот штамм и родительский штамм, штамм Corynebacterium glutamicum АТСС 13032, культивировали следующим образом.
Corynebacterium glutamicum АТСС 13032, Corynebacterium glutamicum СМ02-0618, полученный в Примере 2, и CM02-0618/ΔSsuD инокулировали в колбу на 250 мл с угловыми перегородками, содержащую 25 мл посевной среды, и культивировали со встряхиванием при 30°С в течение 20 часов при 200 об./мин. Затем 1 мл этого культурального бульона инокулировали в колбу на 250 мл с угловыми перегородками, содержащую 24 мл продукционной среды, и культивировали со встряхиванием при 30°С в течение 48 часов при 200 об./мин. Состав посевной среды и продукционной среды был следующим.
Посевная среда (рН 7,0)
20 г глюкозы, 10 г пептона, 5 г дрожжевого экстракта, 1,5 г мочевины, 4 г KH2PO4, 8 г K2HPO4, 0,5 г MgSO4⋅7H2O, 100 мкг биотина, 1000 мкг тиамин-HCl, 2000 мкг пантотената кальция и 2000 мкг никотинамида (из расчета на 1 л дистиллированной воды).
Продукционная среда (рН 8,0)
50 г глюкозы, 12 г (NH4)2S2O3, 5 г дрожжевого экстракта, 1 г KH2PO4, 1,2 г MgSO4⋅7H2O, 100 мкг биотина, 1000 мкг тиамин-HCL, 2000 мкг пантотената кальция, 3000 мкг никотинамида и 30 г СаСО3 (из расчета на 1 л дистиллированной воды).
Штаммы культивировали в соответствии с вышеописанным способом культивирования и анализировали концентрации L-метионина, содержащегося в культуральном бульоне, и они представлены в Таблице 3 ниже.
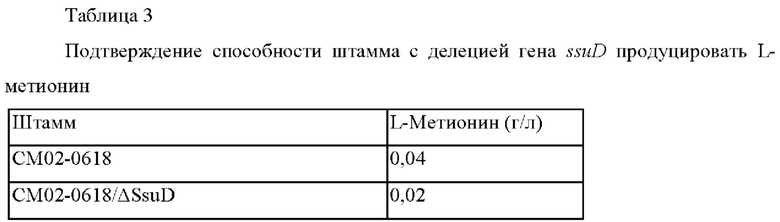
В результате было подтверждено, что способность штамма с делецией гена ssuD продуцировать L-метионин снижена примерно на 50% по сравнению с таковой у контрольного штамма. На основании этого было подтверждено, что белок SsuD представляет собой белок, вовлеченный в использование тиосульфата.
Пример 5: Получение и культивирование штамма с повышенной экспрессией гена ssuD
Был получен вектор для усиления активности белка SsuD, выбранного в качестве белка, специфически реагирующего с тиосульфатом в Примере 3.
Пример 5-1: Получение вектора для повышения экспрессии гена ssuD
Для дополнительной вставки гена ssuD в хромосому Corynebacterium АТСС 13032 был получен плазмидный вектор в соответствии со следующим способом.
Сначала был получен вектор для делетирования Ncgl1464 (Транспозаза), чтобы вставить ген ssuD.
На основании нуклеотидных последовательностей, размещенных в GenBank Национального института здравоохранения США (NIH), были получены ген Ncgl1464 и фланкирующие последовательности (SEQ ID NO: 15) Corynebacterium glutamicum. Для делетирования гена Ncgl1464 проводили ПЦР с использованием хромосомной ДНК Corynebacterium glutamicum АТСС 13032 в качестве матрицы и праймеров SEQ ID NO: 16, 17, 18 и 19. ПЦР проводили в следующих условиях: денатурация при 95°С в течение 5 минут; 30 циклов денатурации при 95°С в течение 30 секунд, отжига при 53°С в течение 30 секунд и полимеризации при 72°С в течение 30 секунд; и полимеризация при 72°С в течение 7 минут. В результате были получены фрагменты ДНК, соответственно.
Вектор pDZ, не способный реплицироваться в Corynebacterium glutamicum, и амплифицированные фрагменты гена Ncgl1464 обрабатывали ферментом рестрикции SmaI для вставки в хромосому с последующим клонированием методом изотермической сборки. Escherichia coli DH5α трансформировали этим вектором и высевали на твердую среду LB, содержащую 25 мг/л канамицина. Колонии, трансформированные вектором, в который с помощью ПЦР был вставлен фрагмент, имеющий делецию целевого гена, отбирали, и затем плазмида была получена методом экстракции плазмид и обозначена pDZ-ΔNcgl1464.
Затем для получения фрагментов гена ssuD проводили ПЦР с использованием хромосомной ДНК Corynebacterium glutamicum АТСС 13032 в качестве матрицы и SEQ ID NO: 20 и 21. Дополнительно промотор PgapA использовали для усиления экспрессии гена ssuD. Для их получения проводили ПЦР с использованием хромосомной ДНК Corynebacterium glutamicum АТСС 13032 в качестве матрицы с использованием праймеров SEQ ID NO: 22 и 23. ПЦР проводили в следующих условиях: денатурация при 95°С в течение 5 минут; 30 циклов денатурации при 95°С в течение 30 секунд, отжига при 53°С в течение 30 секунд и полимеризации при 72°С в течение 30 секунд; и полимеризация при 72°С в течение 7 минут. В результате были получены фрагменты гена ssuD и фрагменты промотора gapA.
Вектор pDZ-ΔNcgl1464, не способный реплицироваться в Corynebacterium glutamicum, обрабатывали ферментом рестрикции ScaI с последующей реакцией IST вместе с двумя амплифицированными фрагментами ДНК. Escherichia coli DH5α трансформировали вектором и высевали на твердую среду LB, содержащую 25 мг/л канамицина. Колонии, трансформированные этим вектором, в который был вставлен целевой ген с помощью ПЦР, отбирали, и затем плазмида была получена методом экстракции плазмид и обозначена как pDZ-ΔNcgl1464-PgapASsuD.
Пример 5-2: Получение и культивирование штамма с повышенной экспрессией гена ssuD
Штамм СМ02-0618 трансформировали методом электропорации векторами pDZ-ΔNcgl1464 и pDZ-ΔNcgl1464-PgapASsuD, полученными в Примере 5-1 выше, путем гомологичной хромосомной рекомбинации (Van der Rest et al., Appl Microbiol Biotechnol 52: 541-545, 1999). Затем проводили вторую рекомбинацию в твердой среде, содержащей сахарозу. После завершения второй рекомбинации трансформированный штамм Corynebacterium glutamicum с делецией гена Ncgl1464 и штамм Corynebacterium glutamicum, имеющий как делецию гена Ncgl1464, так и вставку гена ssuD, идентифицировали путем проведения ПЦР с использованием праймеров SEQ ID NO: 24 и 25. Штамм с делецией гена Ncgl1464 получил название CM02-0618/ΔNcgl1464, а штамм, имеющий как делецию тепа, Ncgl1464, так и вставку гена ssuD, получил название СМ02-0736.
Штамм СМ02-0736 был депонирован в Корейском центре культур микроорганизмов в соответствии с Будапештским соглашением 2 мая 2019 года с номером доступа KCCM12512P.
Пример 5-3: Анализ способности штамма с повышенной экспрессией гена ssuD продуцировать метионин
Для анализа способности полученных штаммов CM02-0618/ΔNcgl1464 и СМ02-0736 продуцировать L-метионин эти штаммы и ролительский штамм, штамм СМ02-0618, культивировали следующим образом.
Каждый из штаммов СМ02-0618, CM02-0618/ΔNcgl1464 и СМ02-0736 инокулировали в колбу на 250 мл с угловыми перегородками, содержащую 25 мл посевной среды, и культивировали со встряхиванием при 30°С в течение 20 часов при 200 об./мин. Затем 1 мл этого культурального бульона инокулировали в колбу на 250 мл с угловыми перегородками, содержащую 24 мл продукционной среды, и культивировали со встряхиванием при 30°С в течение 48 часов при 200 об./мин. Состав посевной среды и продукционной среды был следующим.
Посевная среда (рН 7,0)
20 г глюкозы, 10 г пептона, 5 г дрожжевого экстракта, 1,5 г мочевины, 4 г KH2PO4, 8 г K2HPO4, 0,5 г MgSO4⋅7H2O, 100 мкг биотина, 1000 мкг тиамин-HCl, 2000 мкг пантотената кальция и 2000 мкг никотинамида (из расчета на 1 л дистиллированной воды).
Продукционная среда (рН 8,0)
50 г глюкозы, 12 г (NH4)2S2O3, 5 г дрожжевого экстракта, 1 г KH2PO4, 1,2 г MgSO4⋅7H2O, 100 мкг биотина, 1000 мкг тиамин-HCL, 2000 мкг пантотената кальция, 3000 мкг никотинамида, 30 г СаСО3 и 1 мкг цианокобаламина (витамина В12) (из расчета на 1 л дистиллированной воды).
Штаммы культивировали в соответствии с вышеописанным способом культивирования и анализировали концентрации L-метионина, содержащегося в культуральном бульоне, и они представлены в Таблице 4 ниже.
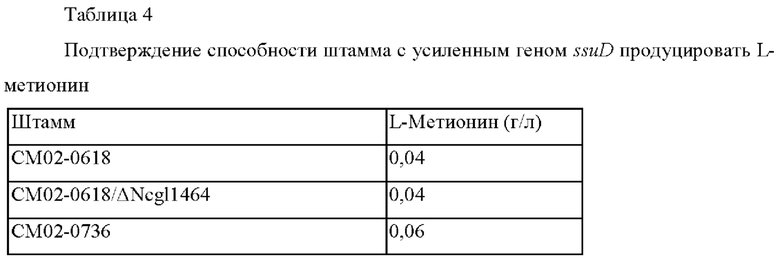
В результате было подтверждено, что способность штамма с повышенной экспрессией гена ssuD продуцировать L-метионин была увеличена примерно на 50% при усилении экспрессии гена ssuD по сравнению с таковой у контрольного штамма. Также, было подтверждено, что белок SsuD вовлечен в использование тиосульфата, как подтверждено в Примере 4.
Пример 6: Сравнительное культивирование с тиосульфатом и другим сульфонатом
Белок SsuD известен как белок, вовлеченный в десульфирование сульфоната. Сульфонат имеет структуру R-SO3, где R представляет собой органическую группу, и отличается от тиосульфата, который имеет структуру S-SO3.
Поэтому действие тиосульфата на продукцию метионина определяли путем сравнительного эксперимента с использованием сульфоната.
Штаммы Corynebacterium glutamicum СМ02-0618 и СМ02-0736 инокулировали в колбу на 250 мл с угловыми перегородками, содержащую 25 мл посевной среды, и культивировали со встряхиванием при 30°С в течение 20 часов при 200 об./мин. Затем 1 мл этого культурального бульона инокулировали в колбу на 250 мл с угловыми перегородками, содержащую 24 мл продукционной среды, и культивировали со встряхиванием при 30°С в течение 48 часов при 200 об./мин. Состав посевной среды и продукционной среды был следующим.
Посевная среда (рН 7,0)
20 г глюкозы, 10 г пептона, 5 г дрожжевого экстракта, 1,5 г мочевины, 4 г KH2PO4, 8 г K2HPO4, 0,5 г MgSO4⋅7H2O, 100 мкг биотина, 1000 мкг тиамин-HCl, 2000 мкг пантотената кальция и 2000 мкг никотинамида (из расчета на 1 л дистиллированной воды).
Продукционная среда (рН 8,0)
50 г глюкозы, 12 г (NH4)2S2O3, метансульфонат или этансульфонат (в зависимости от источника серы), 5 г дрожжевого экстракта, 1 г KH2PO4, 1,2 г MgSO4⋅7H2O, 100 мкг биотина, 1000 мкг тиамин-HCL, 2000 мкг пантотената кальция, 3000 мкг никотинамида, 30 г СаСО3 и 1 мкг цианокобаламина (витамина В12) (из расчета на 1 л дистиллированной воды).
Штаммы культивировали в соответствии с вышеописанным способом культивирования и анализировали концентрации L-метионина, содержащегося в культуральном бульоне, и они представлены в Таблице 5 ниже.
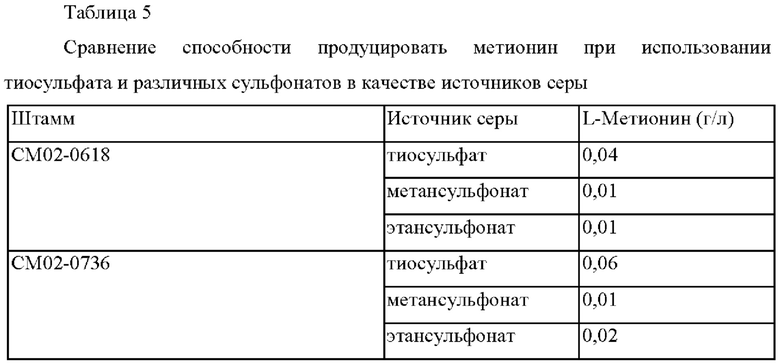
В результате, в случае, когда тиосульфат использовали в качестве источника серы для каждого штамма, продукция метионина увеличивалась на величину вплоть до 600% по сравнению со случаем использования сульфоната в качестве источника серы.
На основании этого было подтверждено, что продукция метионина была самой высокой при использовании тиосульфата в качестве источника серы, и также было подтверждено, что усиление активности белка SsuD вовлечено в такое увеличение продукции метионина.
Пример 7: Получение метионин-продуцирующего штамма, обладающего повышенной экспрессией генов metH и cysI, без делетирования гена mcbR
Пример 7-1: Получение рекомбинантного вектора для усиления как гена metH, так и гена cysI
Для определения того, могут ли быть получены различные серосодержащие аминокислоты путем усиления активности белка SsuD по настоящему изобретению и использования тиосульфата в качестве источника серы, вышеописанный эксперимент был проведен с другим метионин-продуцирующим штаммом. Сначала, для получения метионин-продуцирующего штамма без делетирования mcbR был получен вектор для усиления как гена metH (Ncgl1450), кодирующего метионинсинтазу, так и гена cysI (Ncgl2718), кодирующего сульфитредуктазу у штамма АТСС 13032.
Конкретно, был получен рекомбинантный плазмидный вектор для дополнительной вставки генов metH и cysI в хромосому Corynebacterium glutamicum АТСС 13032 в соответствии со следующим способом. На основании нуклеотидных последовательностей, размещенных в GenBank Национального института здравоохранения США (NIH), были получены ген metH и фланкирующие последовательности (SEQ ID NO: 26), а также ген cysI и фланкирующие последовательности (SEQ ID NO: 27) Corynebacterium glutamicum.
Сначала был получен вектор для делетирования Ncgl1201 (Транспозаза) для вставки эти генов. На основании нуклеотидных последовательностей, размещенных в GenBank Национального института здравоохранения США (NIH), были получены ген Ncgl1021 и фланкирующие последовательности (SEQ ID NO: 28) Corynebacterium glutamicum. Для делетирования гена Ncgl1021 проводили ПЦР с использованием хромосомной ДНК Corynebacterium glutamicum АТСС 13032 в качестве матрицы и праймеров SEQ ID NO: 29, 30, 31 и 32. ПЦР проводили в следующих условиях: денатурация при 95°С в течение 5 минут; 30 циклов денатурации при 95°С в течение 30 секунд, отжига при 53°С в течение 30 секунд и полимеризации при 72°С в течение 30 секунд; и полимеризация при 72°С в течение 7 минут. В результате были получены фрагменты ДНК. Вектор pDZ, не способный реплицироваться в Corynebacterium glutamicum, и амплифицированные фрагменты гена Ncgl1021 обрабатывали ферментом рестрикции Xbal для вставки в хромосому с последующим клонированием методом изотермической сборки. Escherichia coli DH5α трансформировали вектором и высевали на твердую среду LB, содержащую 25 мг/л канамицина. Колонии, трансформированные вектором, в который с помощью ПЦР был вставлен фрагмент, имеющий делецию целевого гена, отбирали, и затем плазмида была получена методом экстракции плазмид и обозначена pDZ-ΔNcgl1021.
Затем, для получения генов metH и cysI проводили ПЦР с использованием хромосомной ДНК Corynebacterium glutamicum АТСС 13032 в качестве матрицы и праймеров SEQ ID NO: 33, 34, 35 и 36. Дополнительно промотор Pcj7 использовали для усиления экспрессии гена metH и промотор Pspl1 использовали для усиления экспрессии гена cysl. Для их получения проводили ПЦР с использованием хромосомной ДНК Corynebacterium ammoniagenes АТСС 6872 в качестве матрицы и с использованием праймеров SEQ ID NO: 37 и 38 для промотора Pcj7, и ПЦР проводили с использованием ДНК известного вектора spl1-GFP (US 10584338 В2) в качестве матрицы и с использованием праймеров SEQ ID NO: 39 и 40 для промотора Pspl1. ПЦР проводили в следующих условиях: денатурация при 95°С в течение 5 минут; 30 циклов денатурации при 95°С в течение 30 секунд, отжига при 53°С в течение 30 секунд и полимеризации при 72°С в течение 30 секунд; и полимеризация при 72°С в течение 7 минут. В результате были получены фрагменты ДНК генов metH и cysI, промотор Pcj7 (US 7662943 В2) и промотор Pspl1 (US 10584338 В2).
Вектор pDZ-ΔNcgl1021, не способный реплицироваться в Corynebacterium glutamicum, обрабатывали ферментом рестрикции ScaI и четыре амплифицированных фрагмента ДНК обрабатывали ферментом рестрикции ScaI с последующей реакцией IST. Escherichia coli DH5α трансформировали вектором и высевали на твердую среду LB, содержащую 25 мг/л канамицина. Колонии, трансформированные вектором, в который целевой ген был вставлен путем ПЦР, отбирали, и затем плазмида была получена методом экстракции плазмид и обозначена как pDZ-ΔNcgl1021-Pcj7metH-Pspl1cysI.
Пример 7-2: Разработка L-Метионин-продуцирующего штамма и выявление продукции L-Метионина с использованием этого штамма
Штамм АТСС 13032 трансформировали методом электропорации векторами pDZ-ΔNcgl1021 и pDZ-ΔNcgl1021-Pcj7metH-Pspl1cysI, полученными в Примере 7-1 выше, путем гомологичной хромосомной рекомбинации (Van der Rest et al., Appl Microbiol Biotechnol 52: 541-545, 1999). Затем проводили вторую рекомбинацию в твердой среде, содержащей сахарозу. После завершения второй рекомбинации вставку в гене Pcj7-metH-Pspl1cysI в трансформированном штамме Corynebacterium glutamicum выявляли с использованием SEQ ID NO: и 41 и 42. Рекомбинантные штаммы получили названия Corynebacterium glutamicum 13032/ΔNcgl1021 (штамм, трансформированный pDZ-ΔNcgl1021) и СМ02-0753 (трансформированный pDZ-ΔNcgl1021-Pcj7metH-Pspl1cysIn).
Для анализа способности полученных штаммов 13032/ΔNcgl1021 и СМ02-0753 продуцировать L-метионин эти штаммы и родительский штамм, штамм Corynebacterium glutamicum АТСС 13032, культивировали следующим образом.
Corynebacterium glutamicum АТСС 13032 и штаммы по настоящему изобретению, то есть, Corynebacterium glutamicum 13032/ΔNcgl1021 и СМ02-0753 инокулировали в колбу на 250 мл с угловыми перегородками, содержащую 25 мл посевной среды, и культивировали со встряхиванием при 30°С в течение 20 часов при 200 об./мин. Затем 1 мл этой культурального бульона инокулировали в колбу на 250 мл с угловыми перегородками, содержащую 24 мл продукционной среды, и культивировали со встряхиванием при 30°С в течение 48 часов при 200 об./мин. Состав посевной среды и продукционной среды был следующим.
Посевная среда (рН 7,0)
20 г глюкозы, 10 г пептона, 5 г дрожжевого экстракта, 1,5 г мочевины, 4 г KH2PO4, 8 г K2HPO4, 0,5 г MgSO4⋅7H2O, 100 мкг биотина, 1000 мкг тиамин-HCl, 2000 мкг пантотената кальция и 2000 мкг никотинамида (из расчета на 1 л дистиллированной воды).
Продукционная среда (рН 8,0)
50 г глюкозы, 12 г (NH4)2S2O3, 5 г дрожжевого экстракта, 1 г KH2PO4, 1,2 г MgSO4⋅7H2O, 100 мкг биотина, 1000 мкг тиамин-HCL, 2000 мкг пантотената кальция, 3000 мкг никотинамида, 30 г СаСО3 и 1 мкг цианокобаламина (витамина В12) (из расчета на 1 л дистиллированной воды).
Штаммы культивировали в соответствии с вышеописанным способом культивирования и анализировали концентрации L-метионина, содержащегося в культуральном бульоне, и они представлены в Таблице 6 ниже.
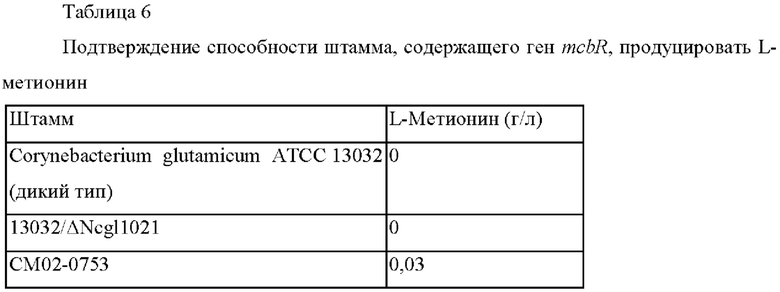
В результате было подтверждено, что способность штамма, в котором присутствует ген mcbR и гены metH и cysI сверхэкспрессируются, продуцировать L-метионин повышена по сравнению с таковой у контрольных штаммов. На основании этого было подтверждено, что штамм, в котором гены metH и cysI сверхэкспрессируются без делетирования гена mcbR, обладает способностью продуцировать метионин, и этот штамм использовали в следующем эксперименте.
Пример 8: Разработка L-Метионин-продуцирующего штамма, обладающего повышенной активностью SsuD и содержащего mcbR, и определение способности продуцировать L-Метионин
Штамм, обладающий повышенной активностью белка SsuD, получали с использованием метионин-продуцирующего штамма, полученного в Примере 7, и затем определяли его способность продуцировать L-метионин.
Пример 8-1: Получение штамма, обладающего повышенной активностью SsuD
Конкретно, штамм СМ02-0753 из Примера 7 трансформировали методом электропорации вектором pDZ-ΔNcgl464-PgapASsuD, полученным в Примере 5 путем гомологичной хромосомной рекомбинации (Van der Rest et al., Appl Microbiol Biotechnol 52: 541-545, 1999). Затем проводили вторую рекомбинацию в твердой среде, содержащей сахарозу.
После завершения второй рекомбинации вставку гена PgapA-SsuD в сайт Ncgl1464 трансформированного Corynebacterium glutamicum выявляли с использованием SEQ ID NO: 23 и 24. Полученный рекомбинантный штамм получил название Corynebacterium glutamicum СМ02-0756.
СМ02-0756 был депонирован в Корейском центре культур микроорганизмов в соответствии с Будапештским соглашением 2 мая 2019 года с номером доступа KCCM12513P.
Пример 8-2: Определение способности полученного штамма продуцировать метионин
Для анализа способности штамма СМ02-0753, полученного в Примере 7, и штамма СМ02-0756, полученного в Примере 8-1, продуцировать L-метионин штаммы культивировали следующим образом.
Штаммы Corynebacterium glutamicum СМ02-0753 и СМ02-0756 инокулировали в колбу на 250 мл с угловыми перегородками, содержащую 25 мл посевной среды, и культивировали со встряхиванием при 30°С в течение 20 часов при 200 об./мин. Затем 1 мл этого культурального бульона инокулировали в колбу на 250 мл с угловыми перегородками, содержащую 24 мл продукционной среды, и культивировали со встряхиванием при 30°С в течение 48 часов при 200 об./мин. Состав посевной среды и продукционной среды был следующим.
Посевная среда (рН 7,0)
20 г глюкозы, 10 г пептона, 5 г дрожжевого экстракта, 1,5 г мочевины, 4 г KH2PO4, 8 г K2HPO4, 0,5 г MgSO4⋅7H2O, 100 мкг биотина, 1000 мкг тиамин-HCl, 2000 мкг пантотената кальция и 2000 мкг никотинамида (из расчета на 1 л дистиллированной воды).
Продукционная среда (рН 8,0)
50 г глюкозы, 12 г (NH4)2S2O3, 5 г дрожжевого экстракта, 1 г KH2PO4, 1,2 г MgSO4⋅7H2O, 100 мкг биотина, 1000 мкг тиамин-HCL, 2000 мкг пантотената кальция, 3000 мкг никотинамида, 30 г СаСО3 и 1 мкг цианокобаламина (витамина В12) (из расчета на 1 л дистиллированной воды).
Штаммы культивировали в соответствии с вышеописанным способом культивирования и анализировали концентрации L-метионина, содержащегося в культуральном бульоне, и они представлены в Таблице 7 ниже.

В результате было подтверждено, что выход L-метионина был увеличен у метионин-продуцирующего штамма, содержащего mcbR, вследствие повышения активности белка SsuD и использования тиосульфата в качестве источника серы.
Эти результаты показывают, что серосодержащие аминокислоты или производные серосодержащих аминокислот можно продуцировать с использованием тиосульфата в качестве источника серы путем повышения активности белка SsuD, который, как впервые подтверждено в настоящем изобретении, представляет собой белок, вовлеченный в использование тиосульфата.
Вышеописанное описание настоящего изобретения представлено для иллюстративных целей, и специалисту в данной области техники будет понятно, что различные изменения и модификации могут быть сделаны без изменения технической идеи и существенных признаков настоящего изобретения. Таким образом, очевидно, что вышеописанные воплощения являются иллюстративными во всех аспектах и не ограничивают объем настоящего изобретения. Следовательно, объем настоящего изобретения определен не подробным описанием, а прилагаемой формулой изобретения и ее эквивалентами, и все варианты в пределах объема прилагаемой формулы изобретения следует рассматривать как включенные в настоящее описание.
--->
<110> CJ CheilJedang Corporation
<120> METHOD OF PRODUCING SULFUR-CONTAINING AMINO ACID OR
DERIVATIVE
THEREOF
<130> OPA20066
<150> KR 10-2019-0077999
<151> 2020-06-28
<160> 43
<170> KoPatentIn 3.0
<210> 1
<211> 2642
<212> DNA
<213> Corynebacterium glutamicum
<400> 1
ctcccgcgca ctgctgcaat ccgcaccgtg cccaatgatg gtggttcgcc cacctgagaa
60
gattaagaag tagtttcttt taagtttcga tgccccggtt tcctgatttt gtgcagggag
120
gccggggcat tggtgtttgc gggttagttc gggccattcg aaagggagaa accaagggca
180
gccagacaga cgtgccaaga atctggattt ccgccaggtt ttggcacgcc cgtctggttt
240
aggcaatgag ataccgaaca cacgtgccaa aagttcggct ttttcgccga tcttgtcacg
300
cctgcctggt ttgtcttgta aagagtgatt tcatggccga gactcctaaa agtttgacct
360
cacaggattg cttctaaggg cctctccaat ctccactgag gtacttaatc cttccgggga
420
attcgggcgc ttaaatcgag aaattaggcc atcacctttt aataacaata caatgaataa
480
ttggaatagg tcgacacctt tggagcggag ccggttaaaa ttggcagcat tcaccgaaag
540
aaaaggagaa ccacatgctt gccctaggtt ggattacatg gatcattatt ggtggtctag
600
ctggttggat tgcctccaag attaaaggca ctgatgctca gcaaggaatt ttgctgaaca
660
tagtcgtcgg tattatcggt ggtttgttag gcggctggct gcttggaatc ttcggagtgg
720
atgttgccgg tggcggcttg atcttcagct tcatcacatg tctgattggt gctgtcattt
780
tgctgacgat cgtgcagttc ttcactcgga agaagtaatc tgctttaaat ccgtagggcc
840
tgttgatatt tcgatatcaa caggcctttt ggtcattttg gggtggaaaa agcgctagac
900
ttgcctgtgg attaaaacta tacgaaccgg tttgtctata ttggtgttag acagttcgtc
960
gtatcttgaa acagaccaac ccgaaaggac gtggccgaac gtggctgcta gcgcttcagg
1020
caagagtaaa acaagtgccg gggcaaaccg tcgtcgcaat cgaccaagcc cccgacagcg
1080
tctcctcgat agcgcaacca accttttcac cacagaaggt attcgcgtca tcggtattga
1140
tcgtatcctc cgtgaagctg acgtggcgaa ggcgagcctc tattcccttt tcggatcgaa
1200
ggacgccttg gttattgcat acctggagaa cctcgatcag ctgtggcgtg aagcgtggcg
1260
tgagcgcacc gtcggtatga aggatccgga agataaaatc atcgcgttct ttgatcagtg
1320
cattgaggaa gaaccagaaa aagatttccg cggctcgcac tttcagaatg cggctagtga
1380
gtaccctcgc cccgaaactg atagcgaaaa gggcattgtt gcagcagtgt tagagcaccg
1440
cgagtggtgt cataagactc tgactgattt gctcactgag aagaacggct acccaggcac
1500
cacccaggcg aatcagctgt tggtgttcct tgatggtgga cttgctggat ctcgattggt
1560
ccacaacatc agtcctcttg agacggctcg cgatttggct cggcagttgt tgtcggctcc
1620
acctgcggac tactcaattt agtttcttca ttttccgaag gggtatcttc gttgggggag
1680
gcgtcgataa gccccttctt tttagcttta acctcagcgc gacgctgctt taagcgctgc
1740
atggcggcgc ggttcatttc acgttgcgtt tcgcgcctct tgttcgcgat ttctttgcgg
1800
gcctgttttg cttcgttgat ttcggcagta cgggttttgg tgagttccac gtttgttgcg
1860
tgaagcgttg aggcgttcca tggggtgaga atcatcaggg cgcggttttt gcgtcgtgtc
1920
cacaggaaga tgcgcttttc tttttgtttt gcgcggtaga tgtcgcgctg ctctaggtgg
1980
tgcactttga aatcgtcggt aagtgggtat ttgcgttcca aaatgaccat catgatgatt
2040
gtttggagga gcgtccacag gttgttgctg acccaataga gtgcgattgc tgtggggaat
2100
ggtcctgtga ggccaaggga cagtgggaag atcggcgcga ggatcgacat cacgatcatg
2160
aacttcagca tgccgttaga gaatccggat gcgtaatcgt tggtttggaa gctgcggtac
2220
atggacatcg ccatgttgat tgcggtgagg attgcggctg tgatgaacag tggcaaaacg
2280
aaactaagaa cttccgcctg cgtggtgctc aaatatttta gctgctcagt gggcatcgaa
2340
acataagcgg gcagaggcac attgctcacg cgaccagcga ggaaagattc cacttcctca
2400
ggagttagga agccgatcga ctggaagacg ggattttcca aaccaccttc agggcgagcc
2460
atgcggagaa gtgcccagta aagaccaagg acaatcggta tctggatcag cccaggcaca
2520
caacctgcca gcgggttaat gccgtattcc ttattcaaat cattctggcg cttctgcaac
2580
tcccgaatgg acgcttcatc gtactttccc ttgtattctt cccggagcgc agcgcggtga
2640
gg
2642
<210> 2
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 2
tcgagctcgg tacccctgcc tggtttgtct tgta
34
<210> 3
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 3
cggaaaatga agaaagttcg gccacgtcct ttcgg
35
<210> 4
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 4
aggacgtggc cgaactttct tcattttccg aaggg
35
<210> 5
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 5
ctctagagga tccccgtttc gatgcccact gagca
35
<210> 6
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 6
aatctggatt tccgccaggt
20
<210> 7
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 7
cttcctaact cctgaggaag
20
<210> 8
<211> 3146
<212> DNA
<213> Corynebacterium glutamicum
<400> 8
ccatggagaa cctggagaat gaggtgctgc gtcgttccac gcaggttccg gtgattgttc
60
tcgtgggtac cccgcgcagc cctgattcgg agcagttgaa gtcggatctg accacgcttg
120
ctgctgaaag tggcaggaag ttcattttcg gttatgtcaa tgctgatacc gatgctgatg
180
tggcccaggt gtttggggtg cagggcttgc cgtcggtgat tgctgtggca gcgggacgcc
240
ctctggctga tttccagggc ggacagccag cggatgcact aaagcagtgg actgatcagg
300
tggttcaggc tgtgggtgga cagctggaag gactgccaga ggaggccaca gacggcgaac
360
aagaagacgc tcctgtggaa gacccccgct tcgatgctgc cactgatgct ctaaaccgtg
420
gcgctttcga tgaggcgatt gcggtttatg agtccatttt ggcgcaggag ccaaacaacg
480
ctgatgcgaa gcaggcacgc gataccgcaa agctgttggg ccggcttgcc acggtggatc
540
cttcggtgga tgttgtcgct gctgcagatg ctgatccaac aaacgttgat ctggcctaca
600
cagcagctga cgcggctgtt gttgcgggtg atcctgaggc tgcctttgat cgtttaattg
660
ctctgctgac catcagcgct ggcgatcaga agaatcaggt gaaggaacgt ttgctggagc
720
tgtttggcat gtttgagacc gccgatcccc gtgtgctgca ggcgcgagga aagatggcca
780
gcgcgctgtt ctaaaaccac tctctatcca gaaaaatata gaccgcttag tcttttccag
840
gactaagtgg tctacatttt tacccaaaat gcagctcacg caatagacat ctcggtctat
900
atacttgcca ccttcgcgcc ctgcaaatcc ccacactact tatatccagc ccgaaaataa
960
tacttctctc tagacgaagc ggtctgttta agtatgtgcc atgacattaa ctttccattg
1020
gttcctatcc acttcaggcg attcccgcgg catcatcggc ggcggtcacg gtgcagaaaa
1080
atccggcacc tcccgcgaat tgagccacag ctacctcaag cagttggcgc tagctgccga
1140
gaccaacggt tttgaatctg tcctgacacc aacgggcacg tggtgcgaag atgcgtggat
1200
tactgacgct tctttgattg aggcgacaaa acgcttgaag ttcctcgttg cgcttcgccc
1260
tgggcagatt ggacctacgc tgtctgctca aatggcttct actttccagc gtctgtctgg
1320
caaccgtttg ctgatcaatg tggtcaccgg tggggaagat gcggagcagc gtgcgtttgg
1380
tgatttcttg aacaaggagg agcgctacgc ccgtaccgga gaattcttgg atatcgtgag
1440
ccgcttgtgg cgaggcgaaa ccgtcacgca ccacggtgaa cacctgcagg tggagcaagc
1500
tagccttgcg catccgccag agattattcc ggagattctt tttggtggat cgtcgccagc
1560
tgcaggtgag gtggctgcac gttatgcgga cacctatctc acgtggggtg aaactcccga
1620
tcaggtggcg cagaaaatca actggatcaa cgagctagca gcacagcgcg gccgggaact
1680
gcgccatgga atccgcttcc atgtgatcac ccgcgatacg tctgaagaag catgggtggt
1740
ggcagagaag ttgattagcg gggtcactcc agaacaggtc gctaaggctc aagccgggtt
1800
tgcaacgtct aagtcggagg ggcagcgccg gatggctgag ctgcacagca agggtcgtgc
1860
ctttactagt ggctcaactg ctcgtgatct ggaggtgtat cccaatgtgt gggcaggcgt
1920
cggtttgctt cgcggaggtg caggaacagc ccttgtgggc tcgcatgaag aggtcgccga
1980
tcgcatcgaa gaatacgcag cactcggctt ggatcagttt gtactgtcgg gttatccaaa
2040
cttggaggag gccttccact tcggtgaggg tgtgattccg gagctgctgc gccgcggtgt
2100
ggatatcaaa aatcaagaat cacgagtttt ggaacctgtt gggtaaacgg gaagaacgag
2160
acgtcgataa gcaaatttct taaggaacct gacatgacta caaccttgac tcgccccaaa
2220
atcgcgctgc ccgcgcgcat ctattcaccg cttgcggtgc ttgttttctg gcagctcggc
2280
tcgagcctgg gcgccatccc ggagcggatt ctgccggcac caaccacgat cttggccgcc
2340
agctgggagg tcgccacaaa tggcacgctt ctcgacgccc tcctcgtctc aagccaacgc
2400
gtccttctag gcttcgccct cggtgctgtc ctaggcattt ccctaggtgt attgacaggc
2460
atgtccagat ttgcagacac cgccgttgat ccgctcattc aagctgcccg cgcgctgcct
2520
cacctgggtc ttgtgccgct gtttatcatc tggttcggta tcggtgagct gccgaaagta
2580
ctgattatta gcctcggcgt gctgtatccg ctgtacctca acaccgccag cgggttcagg
2640
caaattgatc caaagcttct ggaagccggc cacgtgatgg gcttcggatt tttccagagg
2700
ttgcggacca tcatcattcc ttctgccgcg ccgcaacttt ttgtcggcct gcgccaagca
2760
agtgcggccg cctggctctc actgatcgtg gcggaacagg tcaacgcccg cgaaggactc
2820
ggcttcctca tcaacaatgc gcgcgatttt taccgcaccg acctcgttat tttcggcctc
2880
attgtctacg ccagcctcgg tctgctgtct gaagcgctga tcagagcttg ggaacgtcac
2940
accttccgct accgaaacgc ataagaaagt tgctcgccat gactgccaca ttgtcactca
3000
aacccgcagc cactgtccgt ggattgcgca aatcatacgg aactaaagaa gtcctccaag
3060
gaatcgacct caccatcaac tgcggcgaag taaccgcgct gatcggacgc tcaggttcag
3120
gaaaatccac catcctgcgc gtgttg
3146
<210> 9
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 9
tcgagctcgg taccctggtt caggctgtgg gtgga
35
<210> 10
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 10
tcttcccgta gtactggcac atacttaaac agacc
35
<210> 11
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 11
gtatgtgcca gtactacggg aagaacgaga cgtcg
35
<210> 12
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 12
ctctagagga tcccctcgcg cgcattgttg atgag
35
<210> 13
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 13
ccaggtgttt ggggtgcagg
20
<210> 14
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 14
aatccacgga cagtggctgc
20
<210> 15
<211> 3161
<212> DNA
<213> Corynebacterium glutamicum
<400> 15
agacgattct ggaaggccac tttcttttga tcctggcggc gatttttcgg tgcttggtag
60
cggaatgtca atcgagacca agcgtccccc ggcgggtcga ttttttggtc tcgaatgaca
120
gtttcgctct ctggaaactc tcagtgtcag gtcagtggtg aaccaccatc cttagcaagg
180
agttcatcat gtccatcccc ttctcagtcc ttcaggacta cctggatctg atcagtcccg
240
aagccttacc ccagatccca cagcccccgg cccctgcccc cacagcaccc cagctaccac
300
cggcgccgga cccacacagc atcgagtggc cgatcttccc accagatcga atctccgcca
360
acgggcgacg ctactacgag ccacaaacac gactcgagtt catgcggatc tacaccaccc
420
tgccgcacgg ctaccgccag cccttcctta aagccaacaa catcggccac tgcaccgttc
480
gaacctggct agcagcaata agcaccttca gccgacttcc ccatgctttt gatgatgccc
540
accgcttcgg gatcgaacgc accaccccag tcgacgatgt caccacacta acggctgatg
600
acaaacgtga cctggtcata ggatacttag ctcaaccaca cggtcagggc cagcaattcc
660
tcacgtttta ccaactccgt aagcacacca tcatggcctg gtgcgccgct atgaccgacg
720
gggacttaga cgctgatatc tcaccccgcc agatcgggtt gatgaccacc cgaaccgtgg
780
tcgaaatcgt tcgactacgc cacatgattg cccaacaact agaaagagcc acgatcatgg
840
aaaacgagta cctcaaagaa atcgcagcgc tgaagaaaga actcgcgcac tacaagcaaa
900
aagaccatca gaatcaaatg gtgatcgata tcttgggaaa agctattggg accaggccca
960
atcctggcga gggcttagac gaggaggacg ccacctaaac gtggatgagc aacgcgcctt
1020
tgatcaagga ctcaaggaag aaaacacctt gatcacagat ctcaccacct gtgccaggct
1080
gagccataac aaggcattac ggctgatcaa gctgtcgaaa tcaacggcgt attaccgcaa
1140
caagccgcgt ccccgtcctg caccgaaacc tgtcctgcag gccgtgccag caccaacagc
1200
acctggtgtg gaacccacac cagagccttg gcaggggaag gagccagcag tgtcgtcggt
1260
gcgtcaagcg ttggcagaac acgaacgcca gttcattgtt gatgcgatca ccgcgtaccc
1320
acaactgagc gttagtgggg tgtttaacat gttgtttaac aaaggcatct accgcgcatc
1380
actacgtaca tggtggcgtg ttgccaagca gcacaagttg ttacacaaag accgagtcag
1440
tgccctgtcc ccggggaaac gatcaccaac gccacgggtt aagccgaggt tggaagcaac
1500
acagcctggt caggtggtgt gttgggatgt gacgttcttg ccgtcgctgg tacgtggtaa
1560
gacctatgcg ttgcatctgg cgattgattt gttttcccgc aagattgttg gggcgaaggt
1620
cgcgccgacg gaaaatacct ccaccgcggt ggagttgtta acgcaggtgt tagcggataa
1680
tccgggtgtg gtgacggtgc attcggataa tgggtcggcg atgacatcga cgagggtgcg
1740
gcggttgtta gcggatcatg gtgtggcgtt gtcgttgatt cggccgcggg tgagtgatga
1800
taatgcgttt gtggagtcgg tgtttcatac gttgaagtat cggccgtttt atccgaaggt
1860
gtttgcatcg atggatcagg cccgggtgtg ggtggaggag tttgtggtgt attacaacac
1920
ggttcatccg cattctggtg tggctgggca tactccgcag tcggtgtttg atggtagttg
1980
gagggcggct cataggttgc gtgtgcaggc gttggatgcc cattaccggc agttcccgca
2040
gcggtatgtg gggcggccgg tggttcagga agttgctggt gtggtgcgtc ttaatggtgc
2100
gcgtgatgat gggtctgtac aggagagggt tggtggtgta gcgtcgctgt taagtgcttg
2160
agttagcatg tgttcttatc gcccccctgg ttcacaaacc cctggcagcg agcggaaaag
2220
tgcattttta ggccaagggc cctcggatct tcgagcgctt tggtctcttt tgcacgtctg
2280
accgaaccag atcacctaga aacgccaaag gccccgcaag tatcaaacct gcggggcctt
2340
tgaggtacct gtttcctatt ttgttgactt aggaagctgc gcacggcgga taaccaaacc
2400
gcacagcaag gcagccactc cccacgcggt gagccagaac tgctccacga cataaacctg
2460
aatagttgga agcaaacgac ttacgatcac cagggctaca gcgatgctca aagaaatgat
2520
ctgtgtcttt gagcttggct cgtacttgct ggtggtagcg aatgcgccga gaatgatcga
2580
ggcaacgagg atcagaagga atcctggagt gatcacaaat gggctcagca tgccggcggt
2640
aaacagctca attgctgcaa acaccaacaa aaccagacct aaggctacga aagctccacc
2700
gatgcggatt gctgccggaa ctttacgcca gctggcacgg ccttcgaggc tggtgagctt
2760
ttttaatgat cttcccgatg ctgaactcat aatgtgacat accctactag ttctcgtacc
2820
atccccacac aattgacctg ccaagagtgt ggaaatacag gttgaagcct agaacagtgg
2880
gggtagcgtc gggggcgatg tcgagttttt ccacatcaag tgcatgaact gcgaagaggt
2940
aacggtgcgg tgcgtggcca gctggaggtt gcgctccgta gaagccacgc ttgccggaat
3000
cacccttgag ggaaactacg ccttcgatgc cgccgagggt ttcatcgcca gcaccggtgg
3060
ggatctccgt gacagttgtg gggatgttaa acactgccca gtgccagaaa ccagcgccgg
3120
ttggggcatc tgggtcgagg caggtgatcg cgagggattt g
3161
<210> 16
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 16
tcgagctcgg tacccttttt tggtctcgaa tgaca
35
<210> 17
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 17
catgctaaca gtactgttta ggtggcgtcc tcctc
35
<210> 18
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 18
gtatgtgcca gtactacggg aagaacgaga cgtcg
35
<210> 19
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 19
ctctagagga tcccctcgcg cgcattgttg atgag
35
<210> 20
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 20
tagaggagac acaacatgac attaactttc cattg
35
<210> 21
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 21
acacatgcta acagtttacc caacaggttc caaaa
35
<210> 22
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 22
cgccacctaa acagtgaagc ctaaaaacga ccgag
35
<210> 23
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 23
gaaagttaat gtcatgttgt gtctcctcta aagat
35
<210> 24
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 24
ctggcggcga tttttcggtg
20
<210> 25
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 25
cgcgatcacc tgcctcgacc
20
<210> 26
<211> 5666
<212> DNA
<213> Corynebacterium glutamicum
<400> 26
tgtcatgctt ccggaggtgc gcagggctcg agactccgga aagctatttg ccactccgat
60
gtttgggtca ctcgacgaga tacgtgctga tcacctaatt tggtgcacag ggtttcggcc
120
ggcgattagg ccagttcgtc aacttctcaa acacggacaa ccaaaggttc ctggtcttta
180
tttagtaggc tacggagatt ggacgggacc tgggtctgcg actatcacag gggtcgggct
240
ttatgccaag cgagcagcca aagagattgc cgcgtcagtc ggcaaagtcg ttaaatagtt
300
tgaaggctaa gaacttaatg ttaaagcgaa aattgttttg acacctcaac taatgcagcg
360
atgcgttctt tccagaatgc tttcatgaca gggatgctgt cttgatcagg caggcgtctg
420
tgctggatgc cgaagctgga tttattgtcg cctttggagg tgaagttgac gctcactcga
480
gaatcatcgg ccaaccattt ggcattgaat gttctaggtt cggaggcgga ggttttctca
540
attagtgcgg gatcgagcca ctgcgcccgc aggtcatcgt ctccgaagag cttccacact
600
ttttcgaccg gcaggttaag ggttttggag gcattggccg cgaacccatc gctggtcatc
660
ccgggtttgc gcatgccacg ttcgtattca taaccaatcg cgatgccttg agcccaccag
720
ccactgacat caaagttgtc cacgatgtgc tttgcgatgt gggtgtgagt ccaagaggtg
780
gcttttacgt cgtcaagcaa ttttagccac tcttcccacg gctttccggt gccgttgagg
840
atagcttcag gggacatgcc tggtgttgag ccttgcggag tggagtcagt catgcgaccg
900
agactagtgg cgctttgcct gtgttgctta ggcggcgttg aaaatgaact acgaatgaaa
960
agttcgggaa ttgtctaatc cgtactaagc tgtctacaca atgtctactt cagttacttc
1020
accagcccac aacaacgcac attcctccga atttttggat gcgttggcaa accatgtgtt
1080
gatcggcgac ggcgccatgg gcacccagct ccaaggcttt gacctggacg tggaaaagga
1140
tttccttgat ctggaggggt gtaatgagat tctcaacgac acccgccctg atgtgttgag
1200
gcagattcac cgcgcctact ttgaggcggg agctgacttg gttgagacca atacttttgg
1260
ttgcaacctg ccgaacttgg cggattatga catcgctgat cgttgccgtg agcttgccta
1320
caagggcact gcagtggcta gggaagtggc tgatgagatg gggccgggcc gaaacggcat
1380
gcggcgtttc gtggttggtt ccctgggacc tggaacgaag cttccatcgc tgggccatgc
1440
accgtatgca gatttgcgtg ggcactacaa ggaagcagcg cttggcatca tcgacggtgg
1500
tggcgatgcc tttttgattg agactgctca ggacttgctt caggtcaagg ctgcggttca
1560
cggcgttcaa gatgccatgg ctgaacttga tacattcttg cccattattt gccacgtcac
1620
cgtagagacc accggcacca tgctcatggg ttctgagatc ggtgccgcgt tgacagcgct
1680
gcagccactg ggtatcgaca tgattggtct gaactgcgcc accggcccag atgagatgag
1740
cgagcacctg cgttacctgt ccaagcacgc cgatattcct gtgtcggtga tgcctaacgc
1800
aggtcttcct gtcctgggta aaaacggtgc agaataccca cttgaggctg aggatttggc
1860
gcaggcgctg gctggattcg tctccgaata tggcctgtcc atggtgggtg gttgttgtgg
1920
caccacacct gagcacatcc gtgcggtccg cgatgcggtg gttggtgttc cagagcagga
1980
aacctccaca ctgaccaaga tccctgcagg ccctgttgag caggcctccc gcgaggtgga
2040
gaaagaggac tccgtcgcgt cgctgtacac ctcggtgcca ttgtcccagg aaaccggcat
2100
ttccatgatc ggtgagcgca ccaactccaa cggttccaag gcattccgtg aggcaatgct
2160
gtctggcgat tgggaaaagt gtgtggatat tgccaagcag caaacccgcg atggtgcaca
2220
catgctggat ctttgtgtgg attacgtggg acgagacggc accgccgata tggcgacctt
2280
ggcagcactt cttgctacca gctccacttt gccaatcatg attgactcca ccgagccaga
2340
ggttattcgc acaggccttg agcacttggg tggacgaagc atcgttaact ccgtcaactt
2400
tgaagacggc gatggccctg agtcccgcta ccagcgcatc atgaaactgg taaagcagca
2460
cggtgcggcc gtggttgcgc tgaccattga tgaggaaggc caggcacgta ccgctgagca
2520
caaggtgcgc attgctaaac gactgattga cgatatcacc ggcagctacg gcctggatat
2580
caaagacatc gttgtggact gcctgacctt cccgatctct actggccagg aagaaaccag
2640
gcgagatggc attgaaacca tcgaagccat ccgcgagctg aagaagctct acccagaaat
2700
ccacaccacc ctgggtctgt ccaatatttc cttcggcctg aaccctgctg cacgccaggt
2760
tcttaactct gtgttcctca atgagtgcat tgaggctggt ctggactctg cgattgcgca
2820
cagctccaag attttgccga tgaaccgcat tgatgatcgc cagcgcgaag tggcgttgga
2880
tatggtctat gatcgccgca ccgaggatta cgatccgctg caggaattca tgcagctgtt
2940
tgagggcgtt tctgctgccg atgccaagga tgctcgcgct gaacagctgg ccgctatgcc
3000
tttgtttgag cgtttggcac agcgcatcat cgacggcgat aagaatggcc ttgaggatga
3060
tctggaagca ggcatgaagg agaagtctcc tattgcgatc atcaacgagg accttctcaa
3120
cggcatgaag accgtgggtg agctgtttgg ttccggacag atgcagctgc cattcgtgct
3180
gcaatcggca gaaaccatga aaactgcggt ggcctatttg gaaccgttca tggaagagga
3240
agcagaagct accggatctg cgcaggcaga gggcaagggc aaaatcgtcg tggccaccgt
3300
caagggtgac gtgcacgata tcggcaagaa cttggtggac atcattttgt ccaacaacgg
3360
ttacgacgtg gtgaacttgg gcatcaagca gccactgtcc gccatgttgg aagcagcgga
3420
agaacacaaa gcagacgtca tcggcatgtc gggacttctt gtgaagtcca ccgtggtgat
3480
gaaggaaaac cttgaggaga tgaacaacgc cggcgcatcc aattacccag tcattttggg
3540
tggcgctgcg ctgacgcgta cctacgtgga aaacgatctc aacgaggtgt acaccggtga
3600
ggtgtactac gcccgtgatg ctttcgaggg cctgcgcctg atggatgagg tgatggcaga
3660
aaagcgtggt gaaggacttg atcccaactc accagaagct attgagcagg cgaagaagaa
3720
ggcggaacgt aaggctcgta atgagcgttc ccgcaagatt gccgcggagc gtaaagctaa
3780
tgcggctccc gtgattgttc cggagcgttc tgatgtctcc accgatactc caaccgcggc
3840
accaccgttc tggggaaccc gcattgtcaa gggtctgccc ttggcggagt tcttgggcaa
3900
ccttgatgag cgcgccttgt tcatggggca gtggggtctg aaatccaccc gcggcaacga
3960
gggtccaagc tatgaggatt tggtggaaac tgaaggccga ccacgcctgc gctactggct
4020
ggatcgcctg aagtctgagg gcattttgga ccacgtggcc ttggtgtatg gctacttccc
4080
agcggtcgcg gaaggcgatg acgtggtgat cttggaatcc ccggatccac acgcagccga
4140
acgcatgcgc tttagcttcc cacgccagca gcgcggcagg ttcttgtgca tcgcggattt
4200
cattcgccca cgcgagcaag ctgtcaagga cggccaagtg gacgtcatgc cattccagct
4260
ggtcaccatg ggtaatccta ttgctgattt cgccaacgag ttgttcgcag ccaatgaata
4320
ccgcgagtac ttggaagttc acggcatcgg cgtgcagctc accgaagcat tggccgagta
4380
ctggcactcc cgagtgcgca gcgaactcaa gctgaacgac ggtggatctg tcgctgattt
4440
tgatccagaa gacaagacca agttcttcga cctggattac cgcggcgccc gcttctcctt
4500
tggttacggt tcttgccctg atctggaaga ccgcgcaaag ctggtggaat tgctcgagcc
4560
aggccgtatc ggcgtggagt tgtccgagga actccagctg cacccagagc agtccacaga
4620
cgcgtttgtg ctctaccacc cagaggcaaa gtactttaac gtctaacacc tttgagaggg
4680
aaaactttcc cgcacattgc agatcgtgcc actttaacta aggttgacgg catgattaag
4740
gcgattttct gggacatgga cggcacgatg gtggactctg agccacagtg gggcattgct
4800
acctacgagc tcagcgaagc catgggccgc cgcctcaccc cggagctccg ggaactcacc
4860
gtcggctcga gcctgccgcg caccatgcgc ttatgcgcag agcacgcagg cattacattg
4920
agcgacgcgg actacgagcg ctaccgggct ggcatgttcg cccgggtcca tgagcttttc
4980
gacgaatccc tcgtcccaaa tccaggcgtc accgaactcc tgacagagtt gaaggccctc
5040
gagatcccca tgttggtcac caccaacaca gagcgcgatc tcgcgacccg ttcagtcgca
5100
gccgtgggaa atgagttctt catcggttct atcgctggtg atgaagtccc aacagcaaag
5160
ccagcccccg acatgtacct cgaagcagca cgacgtgtgg gctttgaccc atcagagtgc
5220
ctcgtgttcg aagattccta caacggcatg ctgggcgctg ttactgcagg ttgccgcgtc
5280
attggtctgc acccagaaga agtccaagcg ccagaaggtg tagtgccttt gcgttccctc
5340
cacggtaaaa actctttcga aggtgtcacc gctgagatgg tcactgcctg gtaccaccag
5400
atcgagccgg caggtgtcgc aaaataaaac caggtggggg agtgaaatta ttcgactaat
5460
atcctccccc aaacacacat tgataactgt tgtgtggaag aatgtaccga gtgaagacat
5520
ttgactcgct gtacgaagaa cttcttaacc gtgctcagac ccgccctgaa gggtctggaa
5580
ccgtggccgc cttggataaa ggcatccatc atctaggtaa gaaggtcatc gaagaagccg
5640
gagaggtctg gattgcagcc gagtat
5666
<210> 27
<211> 3613
<212> DNA
<213> Corynebacterium glutamicum
<400> 27
tcctgtgggg tgaacttgac ctgtgctggg ccacgacgtc cgaaaacgtg cacttcagtg
60
gccttgtttt ctttgaggga gtcgtagacg ttgtcggaaa tttcggtgac tttgagctcg
120
tcgcctgtct tagccaggat gcgggctacg tcgaggccga cgttaccaac gccgataaca
180
gcgacggact gtgcagacag atcccaggag cgctcgaagc gtgggttgcc gtcgtagaag
240
ccaacgaact cgccggcacc gaaggagcct tctgcttcaa ttccggggat gttgaggtcg
300
cggtctgcaa ctgcgccggt ggagaacacg actgcatcgt agtagtcgcg gagttcttcg
360
acggtgatgt ctttgccgat ttcaatgtta ccgagcaggc gcaggcgtgg cttgtccaac
420
acgttgtgca gggacttaac gatgcccttg atgcgtgggt ggtctggagc aacgccgtaa
480
cggatgagtc cgaacggtgc aggcatttgc tcgaaaaggt caacgaacac ttcgcgctct
540
tcattgcgga tgaggaggtc ggatgcgtaa atgccagcag ggccagctcc gatgacggct
600
acgcgcaggg gagttgtcat gtgtttgaag ttgcctttcg tgagcccttt tatggaaaca
660
agggtgtgaa aatcaagtag ttaaaggtgt ttcaagtcca ggctgtttaa cactcctaga
720
ccgcttggtc tgtaaacgta gcagcgaaat gcgacaatgc gaagactttt gcttaattaa
780
attcaaactc catgaaaaaa ctagacagat cggtctatta tattcacggt gaacctaacc
840
taatatcccc aggttaattc atttaaacgg gcattaggtg actccattgc tttcagtctc
900
atgaatctaa tggttggtct agacagagcg gtacgtctaa gtttgcggat agatcaaacc
960
gagtgacatg tacttcacta gctctttaag gattaactcc ccatgacaac aaccaccgga
1020
agtgcccggc cagcacgtgc cgccaggaag cctaagcccg aaggccaatg gaaaatcgac
1080
ggcaccgagc cgcttaacca tgccgaggaa attaagcaag aagaacccgc ttttgctgtc
1140
aagcagcggg tcattgatat ttactccaag cagggttttt cttccattgc accggatgac
1200
attgccccac gctttaagtg gttgggcatt tacacccagc gtaagcagga tctgggcggt
1260
gaactgaccg gtcagcttcc tgatgatgag ctgcaggatg agtacttcat gatgcgtgtg
1320
cgttttgatg gcggactggc ttcccctgag cgcctgcgtg ccgtgggtga aatttctagg
1380
gattatgctc gttccaccgc ggacttcacc gaccgccaga acattcagct gcactggatt
1440
cgtattgaag atgtgcctgc gatctgggag aagctagaaa ccgtcggact gtccaccatg
1500
cttggttgcg gtgacgttcc acgtgttatc ttgggctccc cagtttctgg cgtagctgct
1560
gaagagctga tcgatgccac cccggctatc gatgcgattc gtgagcgcta cctagacaag
1620
gaagagttcc acaaccttcc tcgtaagttt aagactgcta tcactggcaa ccagcgccag
1680
gatgttaccc acgaaatcca ggacgtttcc ttcgttcctt cgattcaccc agaattcggc
1740
ccaggatttg agtgctttgt gggcggtggc ctgtccacca acccaatgct tgctcagcca
1800
cttggttctt ggattccact tgatgaggtt ccagaagtgt gggctggcgt cgccggaatt
1860
ttccgcgact acggcttccg acgcctgcgt aaccgtgctc gcctcaagtt cttggtggca
1920
cagtggggta ttgagaagtt ccgtgaagtt cttgagaccg aatacctcga gcgcaagctg
1980
atcgatggcc cagttgttac caccaaccct ggctaccgtg accacattgg cattcaccca
2040
caaaaggacg gcaagttcta cctcggtgtg aagccaaccg ttggacacac caccggtgag
2100
cagctcattg ccattgctga tgttgcagaa aagcacggca tcaccaggat tcgtaccacg
2160
gcggaaaagg aactgctctt cctcgatatt gagagaaaga accttactac cgttgcacgc
2220
gacctggatg aaatcggact gtactcttca ccttccgagt tccgccgcgg catcatttcc
2280
tgcaccggct tggagttctg caagcttgcg cacgcaacca ccaagtcacg agcaattgag
2340
cttgtcgacg aactggaaga gcgcctcggc gatttggatg ttcccatcaa gattgcactg
2400
aacggttgcc ctaactcttg tgcacgcacc caggtttccg acatcggatt caagggacag
2460
accgtcactg atgctgacgg caaccgcgtt gaaggtttcc aggttcacct gggcggttcc
2520
atgaacttgg atccaaactt cggacgcaag ctcaagggcc acaaggttat tgccgatgaa
2580
gtgggagagt acgtcactcg cgttgttacc cacttcaagg aacagcgcca cgaggacgag
2640
cacttccgcg attgggtcca gcgggccgct gaggaagatt tggtgtgagt cttcggagga
2700
aacccaatcc caaccgcaac caccctctgt actgcccata ctgcgcggga gaagttcttt
2760
tccccgatga gcaaacagaa ttcgcgtggt tgtgtgcgga ttgcaccaga gtttttgaag
2820
tgaaatatca cggccaggac gatccagtgc acaggccagc accagcaaag tccacatcgc
2880
aagcattaaa agaatctctc gaaagacaca aaagaggtga gtcgcaacaa tgagctttca
2940
actagttaac gccctgaaaa atactggttc ggtaaaagat cccgagatct cacccgaagg
3000
acctcgcacg accacaccgt tgtcaccaga ggtagcaaaa cataacgagg aactcgtcga
3060
aaagcatgct gctgcgttgt atgacgccag cgcgcaagag atcctggaat ggacagccga
3120
gcacgcgccg ggcgctattg cagtgacctt gagcatggaa aacaccgtgc tggcggagct
3180
ggctgcgcgg cacctgccgg aagctgattt cctctttttg gacaccggtt accacttcaa
3240
ggagaccctt gaagttgccc gtcaggtaga tgagcgctat tcccagaagc ttgtcaccgc
3300
gctgccgatc ctcaagcgca cggagcagga ttccatttat ggtctcaacc tgtaccgcag
3360
caacccagcg gcgtgctgcc gaatgcgcaa agttgaaccg ctggcggcgt cgttaagccc
3420
atacgctggc tggatcaccg gcctgcgccg cgctgatggc ccaacccgtg ctcaagcccc
3480
tgcgctgagc ttggatgcca ccggcaggct caagatttct ccaattatca cctggtcatt
3540
ggaggaaacc aacgagttca ttgcggacaa caacctcatc gatcacccac ttacccatca
3600
gggttatcca tca
3613
<210> 28
<211> 3311
<212> DNA
<213> Corynebacterium glutamicum
<400> 28
ctcattccag cgtcacgacg ttccgaaggt actggttacc tggcattggg cactaccgtt
60
tctgcagcac ttggaccagc cctagcactt tttgtcctag gaacatttga ttacgacatg
120
ctgtttatcg tggtcttggc aacctcggtc atctctttga tcgccgtcgt gttcatgtac
180
tttaagacca gcgaccctga gccttctggg gaaccagcca agttcagctt caaatctatt
240
atgaacccaa agatcatccc catcggcatc tttatcttgc ttatttgctt tgcttactct
300
ggcgtcattg cctacatcaa cgcatttgct gaagaacgcg atctgattac gggtgctgga
360
ttgttcttca ttgcctacgc agtatcaatg tttgtgatgc gcagcttcct tggcaaactg
420
caggaccgtc gcggagacaa cgtcgttatt tactttggat tgttcttctt cgttatttcc
480
ttgacgattt tgtcctttgc cacttccaac tggcacgttg tgttgtccgg agtcattgca
540
ggtctgggat acggcacttt gatgccagca gtgcagtcca tcgctgttgg tgtagtagac
600
aaaaccgaat tcggtacggc cttctccact ttgttcctgt ttgtggactt aggttttggc
660
tttggaccta ttatcctggg agcagtttct gcggcaattg gtttcggacc tatgtatgca
720
gcactggcag gtgtgggtgt gattgccgga atcttctacc tgttcacaca cgctcgcacc
780
gatcgagcta agaatggctt tgttaaacac ccagagcctg tcgctttagt tagctagttc
840
tttcagcttt ccctcccgat cagcgtaaac cggcccttcc ggttttgggg tacatcacag
900
aacctgggct agcggtgtag acccgaaaat aaacgagcct tttgtcaggg ttaaggttta
960
ggtatctaag ctaaccaaac accaacaaaa ggctctaccc atgaagtcta ccggcaacat
1020
catcgctgac accatctgcc gcactgcgga actaggactc accatcaccg gcgcttccga
1080
tgcaggtgat tacaccctga tcgaagcaga cgcactcgac tacacctcca cctgcccaga
1140
atgctcccaa cctggggtgt ttcgtcatca cacccaccgg atgctcattg atttacccat
1200
cgtcgggttt cccaccaaac tgtttatccg tctacctcgc taccgctgca ccaaccccac
1260
atgtaagcaa aagtatttcc aagcagaact aagctgcgct gaccacggta aaaaggtcac
1320
ccaccgggtc acccgctgga ttttacaacg ccttgctatt gaccggatga gtgttcacgc
1380
aaccgcgaaa gcacttgggc tagggtggga tttaacctgc caactagccc tcgatatgtg
1440
ccgtgagctg gtctataacg atcctcacca tcttgatgga gtgtatgtca ttggggtgga
1500
tgagcataag tggtcacata atagggctaa gcatggtgat gggtttgtca ccgtgattgt
1560
cgatatgacc gggcatcggt atgactcacg gtgtcctgcc cggttattag atgtcgtccc
1620
aggtcgtagt gctgatgctt tacggtcctg gcttggctcc cgcggtgaac agttccgcaa
1680
tcagatacgg atcgtgtcca tggatggatt ccaaggctac gccacagcaa gtaaagaact
1740
cattccttct gctcgtcgcg tgatggatcc attccatgtt gtgcggcttg ctggtgacaa
1800
gctcaccgcc tgccggcaac gcctccagcg ggagaaatac cagcgtcgtg gtttaagcca
1860
ggatccgttg tataaaaacc ggaagacctt gttgaccacg cacaagtggt tgagtcctcg
1920
tcagcaagaa agcttggagc agttgtgggc gtatgacaaa gactacgggg cgttaaagct
1980
tgcgtggctt gcgtatcagg cgattattga ttgttatcag atgggtaata agcgtgaagc
2040
gaagaagaaa atgcggacca ttattgatca gcttcgggtg ttgaaggggc cgaataagga
2100
actcgcgcag ttgggtcgta gtttgtttaa acgacttggt gatgtgttgg cgtatttcga
2160
tgttggtgtc tccaacggtc cggtcgaagc gatcaacgga cggttggagc atttgcgtgg
2220
gattgctcta ggtttccgta atttgaacca ctacattctg cggtgcctta tccattcagg
2280
gcagttggtc cataagatca atgcactcta aaacaggaag agcccgtaaa cctctgacta
2340
gcgtcaccct ctgattaagg cgaccgcgga tttaagagca gaggctgcca cgagcgcatc
2400
ttcacggctg tgtgttgtac taaaagtaca gcgcacagcc gttcgtgctt gatcctcctc
2460
aagccccaac gccagcaaca catgggatac ctctccggaa ccacaggcag aaccagggga
2520
gcacacaatg ccttggcgtt ccaattccag aagaacagtt tcagatccta tgctgtcgaa
2580
gagaaaagat gcgtgtccat caatgcgcat cctaggatgt ccagtcaggt gtgctcccgg
2640
gatagtgaga acttcctcga tgaattcgcc aagatctgga taggattccg ccctggccaa
2700
ttccaaggca gtggcaaagg cgatagcccc cgcaacgttt tccgtgccac tacgccgccc
2760
tttttcctgg ccgccgccat ggattaccgg ctccagggga agctttgacc ataacactcc
2820
aatcccttta ggcgcaccga atttatgacc cgacaaactt aacgcgtcaa ctcccaagtc
2880
aaaggttaaa tgtgcagctt gcactgcatc ggtgtgaaaa ggcgtactgc ttaccgccgc
2940
caactcagct atcggctgaa tggttcccac ctcattgttg gcataaccaa tgctgatcaa
3000
tgtggtgtcc ggcctgactg ctttgcggag accctccggg gagatcagcc cagtgtgatc
3060
gggggatagg taggtgatct cgaaatcatg aaacctttca agataagcag cagtttctag
3120
gacactgtca tgctcgatcg gggtggtgat gaggtgccgg ccacgaggat tagctaagca
3180
cgctcctttg atagcgaggt tgttggcttc tgatccaccc gacgtaaacg tcacctgtgt
3240
ggggcgtcct ccgataatgc gggccacccg agttcgagca tcctccagcc ccgcagaggc
3300
gagtcttccc a
3311
<210> 29
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 29
acccggggat cctctagaat gtttgtgatg cgcag
35
<210> 30
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 30
gtcagagagt acttacgctg atcgggaggg aaagc
35
<210> 31
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 31
atcagcgtaa gtactctctg actagcgtca ccctc
35
<210> 32
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 32
ctgcaggtcg actctagaaa agggattgga gtgtt
35
<210> 33
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 33
caacgaaagg aaacaatgtc tacttcagtt acttc
35
<210> 34
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 34
tagtcagaga gtgatttaga cgttaaagta ctttg
35
<210> 35
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 35
atcaaaacag atatcatgac aacaaccacc ggaag
35
<210> 36
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 36
cgctagtcag agagttcaca ccaaatcttc ctcag
35
<210> 37
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 37
ccgatcagcg taagtagaaa catcccagcg ctact
35
<210> 38
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 38
aactgaagta gacattgttt cctttcgttg ggtac
35
<210> 39
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 39
tactttaacg tctaaggtac cggcgcttca tgtca
35
<210> 40
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 40
ggtggttgtt gtcatgatat ctgttttgat ctcct
35
<210> 41
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 41
atccccatcg gcatctttat
20
<210> 42
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 42
cgatcacact gggctgatct
20
<210> 43
<211> 381
<212> PRT
<213> Corynebacterium glutamicum
<400> 43
Met Thr Leu Thr Phe His Trp Phe Leu Ser Thr Ser Gly Asp Ser Arg
1 5 10 15
Gly Ile Ile Gly Gly Gly His Gly Ala Glu Lys Ser Gly Thr Ser Arg
20 25 30
Glu Leu Ser His Ser Tyr Leu Lys Gln Leu Ala Leu Ala Ala Glu Thr
35 40 45
Asn Gly Phe Glu Ser Val Leu Thr Pro Thr Gly Thr Trp Cys Glu Asp
50 55 60
Ala Trp Ile Thr Asp Ala Ser Leu Ile Glu Ala Thr Lys Arg Leu Lys
65 70 75 80
Phe Leu Val Ala Leu Arg Pro Gly Gln Ile Gly Pro Thr Leu Ser Ala
85 90 95
Gln Met Ala Ser Thr Phe Gln Arg Leu Ser Gly Asn Arg Leu Leu Ile
100 105 110
Asn Val Val Thr Gly Gly Glu Asp Ala Glu Gln Arg Ala Phe Gly Asp
115 120 125
Phe Leu Asn Lys Glu Glu Arg Tyr Ala Arg Thr Gly Glu Phe Leu Asp
130 135 140
Ile Val Ser Arg Leu Trp Arg Gly Glu Thr Val Thr His His Gly Glu
145 150 155 160
His Leu Gln Val Glu Gln Ala Ser Leu Ala His Pro Pro Glu Ile Ile
165 170 175
Pro Glu Ile Leu Phe Gly Gly Ser Ser Pro Ala Ala Gly Glu Val Ala
180 185 190
Ala Arg Tyr Ala Asp Thr Tyr Leu Thr Trp Gly Glu Thr Pro Asp Gln
195 200 205
Val Ala Gln Lys Ile Asn Trp Ile Asn Glu Leu Ala Ala Gln Arg Gly
210 215 220
Arg Glu Leu Arg His Gly Ile Arg Phe His Val Ile Thr Arg Asp Thr
225 230 235 240
Ser Glu Glu Ala Trp Val Val Ala Glu Lys Leu Ile Ser Gly Val Thr
245 250 255
Pro Glu Gln Val Ala Lys Ala Gln Ala Gly Phe Ala Thr Ser Lys Ser
260 265 270
Glu Gly Gln Arg Arg Met Ala Glu Leu His Ser Lys Gly Arg Ala Phe
275 280 285
Thr Ser Gly Ser Thr Ala Arg Asp Leu Glu Val Tyr Pro Asn Val Trp
290 295 300
Ala Gly Val Gly Leu Leu Arg Gly Gly Ala Gly Thr Ala Leu Val Gly
305 310 315 320
Ser His Glu Glu Val Ala Asp Arg Ile Glu Glu Tyr Ala Ala Leu Gly
325 330 335
Leu Asp Gln Phe Val Leu Ser Gly Tyr Pro Asn Leu Glu Glu Ala Phe
340 345 350
His Phe Gly Glu Gly Val Ile Pro Glu Leu Leu Arg Arg Gly Val Asp
355 360 365
Ile Lys Asn Gln Glu Ser Arg Val Leu Glu Pro Val Gly
370 375 380
<---
Изобретение относится к биотехнологии. Предложен способ продуцирования серосодержащей аминокислоты или производного серосодержащей аминокислоты, включающий культивирование генетически модифицированного микроорганизма в культуральной среде, содержащей тиосульфат. При этом указанный микроорганизм включает генетическую модификацию для повышения активности белка, обладающего активностью тиосульфатредуктазы, кодируемого геном ssuD, по сравнению с немодифицированным микроорганизмом. Также предложена композиция для продуцирования серосодержащей аминокислоты или производного серосодержащей аминокислоты, содержащая тиосульфат и указанный микроорганизм или его культуру. Изобретение может быть эффективно использовано в получении серосодержащей аминокислоты или производного серосодержащей аминокислоты. 2 н. и 5 з.п. ф-лы, 7 табл., 8 пр.
1. Способ продуцирования серосодержащей аминокислоты или производного серосодержащей аминокислоты, включающий культивирование генетически модифицированного микроорганизма в культуральной среде, содержащей тиосульфат, где указанный микроорганизм включает генетическую модификацию для повышения активности белка, обладающего активностью тиосульфатредуктазы, кодируемого геном ssuD, по сравнению с немодифицированным микроорганизмом, где серосодержащая аминокислота или производное серосодержащей аминокислоты включает по меньшей мере одну(одно), выбранную(ое) из группы, состоящей из метионина, цистеина, цистина, лантионина, гомоцистеина, гомоцистина, гомолантионина и таурина.
2. Способ по п. 1, где белок, кодируемый геном ssuD, содержит аминокислотную последовательность, имеющую по меньшей мере 80% гомологии с SEQ ID NO: 43.
3. Способ по п. 1, где микроорганизм представляет собой микроорганизм, принадлежащий роду Corynebacterium или роду Escherichia sp.
4. Способ по п. 3, где микроорганизм представляет собой Corynebacterium glutamicum, Corynebacterium callunae, Corynebacterium deserti, Corynebacterium crenatum или Escherichia coli.
5. Способ по п. 1, дополнительно включающий выделение серосодержащей аминокислоты и производного серосодержащей аминокислоты из микроорганизма или культуральной среды.
6. Способ по п. 1, где генетическая модификация для повышения активности белка достигается путем: 1) увеличения числа копий полинуклеотида, кодирующего белок, в клетке; 2) замены области регуляции экспрессии полинуклеотида, кодирующего белок, на последовательность с более высокой активностью по сравнению с его естественной активностью; 3) модификации инициирующего кодона или 5′-UTR (5’-нетранслируемой области) полинуклеотида, кодирующего белок; 4) модификации нуклеотидной последовательности на хромосоме для повышения активности белка; 5) введения чужеродного полинуклеотида, обеспечивающего проявление активности белка, или кодон-оптимизированного варианта полинуклеотида, кодирующего белок, или 6) их комбинации.
7. Композиция для продуцирования серосодержащей аминокислоты или производного серосодержащей аминокислоты, где серосодержащая аминокислота или производное серосодержащей аминокислоты включает по меньшей мере одну(одно), выбранную(ое) из группы, состоящей из метионина, цистеина, цистина, лантионина, гомоцистеина, гомоцистина, гомолантионина и таурина, содержащая микроорганизм, включающий генетическую модификацию для повышения активности белка, обладающего активностью тиосульфатредуктазы, кодируемого геном ssuD, по сравнению с немодифицированным микроорганизмом, или его культуру; и тиосульфат.
| REY D.A | |||
| ET AL | |||
| The putative transcriptional repressor McbR, member of the TetR-family, is involved in the regulation of the metabolic network directing the synthesis of sulfur containing amino acids in Corynebacterium glutamicum | |||
| J Biotechnol | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Найдено онлайн: | |||
Авторы
Даты
2024-03-01—Публикация
2020-06-26—Подача