Область изобретения
Описание настоящего изобретения относится к микроорганизму рода Corynebacterium, продуцирующему L-аминокислоту, способу получения L-аминокислоты с его использованием, применению продукции L-аминокислоты и композиции для получения L-аминокислоты.
Предшествующий уровень техники
L-аминокислоты представляют собой основные структурные единицы белков и используются в качестве важных веществ для фармацевтического сырья, пищевых добавок, кормов для животных, питательных веществ, пестицидов, бактерицидов и т.п. Среди L-аминокислот L-лизин является незаменимой аминокислотой, которая не биосинтезируется в живом организме и, как известно, необходима для стимуляции роста, метаболизма кальция, стимуляции секреции желудочного сока и устойчивости к заболеваниям. L-лизин по-разному используют в кормах, медицинских изделиях, продуктах питания и т.п. Дополнительно, L-триптофан также представляет собой одну из незаменимых аминокислот и используется для кормовых добавок, инфузий, фармацевтических препаратов и материалов для здоровой пищи и т.п.
В то же самое время, штаммы рода Corynebacterium, в частности Corynebacterium glutamicum, являются грамположительными микроорганизмами, широко используемыми при продукции L-аминокислот и других полезных веществ. Было проведено много исследований для разработки микроорганизма с высокой эффективностью продукции и технологии ферментации для продукции аминокислот. Например, в основном использовали подходы, специфические для вещества-мишени для увеличения экспрессии гена, кодирующего фермент, вовлеченный в биосинтез аминокислот или для удаления ненужных генов при биосинтезе аминокислот в штамме рода Corynebacterium (Корейские патенты №10-0924065 и 10-1208480). В дополнение к этим способам также использовали способ удаления генов, которые не вовлечены в продукцию аминокислот и способ удаления генов, для которых конкретные функции в продукции аминокислот не известны. Тем не менее, все еще существует потребность в исследовании способа, способного эффективно продуцировать L-аминокислоты с высоким выходом.
Описание изобретения
Техническая проблема
Проблема, решаемая в соответствии с описанием настоящего изобретения, заключается в том, чтобы предложить микроорганизм рода Corynebacterium, в котором активность глюкозо-6-фосфат-1-дегидрогеназы и фруктокиназы усилена.
Техническое решение
Одна из задач в соответствии с описанием настоящего изобретения заключается в том, чтобы предложить микроорганизм рода Corynebacterium, продуцирующий L-аминокислоту, в котором активность глюкозо-6-фосфат-1-дегидрогеназы и фруктокиназы усилена.
Еще одна задача в соответствии с описанием настоящего изобретения заключается в том, чтобы предложить способ получения L-аминокислоты с использованием микроорганизма.
Еще одна задача в соответствии с описанием настоящего изобретения заключается в том, чтобы предложить использование микроорганизма, продуцирующего L-аминокислоту.
Еще одна задача в соответствии с описанием настоящего изобретения заключается в том, чтобы предложить композицию для получения L-аминокислоты, включающую микроорганизм; и/или культуру микроорганизма.
Благоприятные эффекты
Микроорганизм рода Corynebacterium, в котором активность глюкозо-6-фосфат-1-дегидрогеназы и фруктокиназы усилена, может продуцировать L-аминокислоту с высокой эффективностью.
Подробное описание предпочтительных воплощений
Описание настоящего изобретения будет подробно описано далее. В то же самое время, каждое раскрытое здесь описание и воплощение может применяться в отношении, соответственно, других описаний и воплощений. То есть, все комбинации различных раскрытых здесь элементов оказываются в объеме в соответствии с описанием настоящего изобретения. Кроме того, объем в соответствии с описанием настоящего изобретения не ограничен конкретным описанием, представленным ниже. Дополнительно, множество работ и патентных документов цитируется в описании настоящего изобретения. Содержимое цитированных работ и патентных документов включены здесь путем ссылки, и степень технической области, к которой относится описание настоящего изобретения, и содержание в соответствии с описанием настоящего изобретения будут описаны более ясно.
В одном из аспектов в соответствии с описанием настоящего изобретения предложен микроорганизм рода Corynebacterium, продуцирующий L-аминокислоту, в котором активность глюкозо-6-фосфат-1-дегидрогеназы и фруктокиназы усилена.
Использованный здесь термин «L-аминокислота» может включать все L-аминокислоты, которые могут продуцироваться микроорганизмом из множества отличающихся видов источников углерода при помощи метаболических процессов. В частности, L-аминокислота может включать основные аминокислоты, такие как L-лизин, L-аргинин, L-гистидин и т.п., неполярные аминокислоты, такие как L-валин, L-лейцин, L-глицин, L, изолейцин, L-аланин, L-пролин, L-метионин и т.п., полярные аминокислоты, такие как L-серин, L-треонин, L-цистеин, L-аспарагин, L-глутамин и т.п., ароматические аминокислоты, такие как L-фенилаланин, L-тирозин, L-триптофан и т.п., и кислотные аминокислоты, такие как L-глутаминовая кислота, L-аспарагиновая кислота и т.п. Конкретней, L-аминокислота здесь может представлять собой L-лизин или L-триптофан, но не ограничена этим.
Используемый здесь термин «глюкозо-6-фосфат-1-дегидрогеназа» (далее называемая как «Zwf») вовлечена в пентозо-фосфатный путь, который представляет собой метаболический путь и играет роль при восстановлении NADP+ (никотинамидадениндинуклеотидфосфат) до NADPH (восстановленный никотинамидадениндинуклеотидфосфат), окисляя глюкозо-6-фосфат.
Для задачи в соответствии с описанием настоящего изобретения этот белок также может быть назван «G6PD», «G6PDH», «глюкозо-6-фосфат-дегидрогеназа» или «Zwf». Ген, кодирующий этот белок, может представлять собой, например, ген zwf, но не ограничен этим. В описании настоящего изобретения «ген zwf» может быть использован взаимозаменяемо с «геном, кодирующим глюкозо-6-фосфат-1-дегидрогеназу». Дополнительно, этот белок может представлять собой, например, тот же самый белок, как белок, полученный из Corynebacterium glutamicum, но не ограничен этим при условии того, что он может увеличивать продукцию L-аминокислоты.
Zwf может иметь аминокислотную последовательность или состоять из аминокислотной последовательности в соответствии с SEQ ID NO: 1 или SEQ ID NO: 3, или может включать аминокислотную последовательность, представленную в SEQ ID NO: 1 или SEQ ID NO: 3, но не ограничен этим. Последовательности в соответствии с SEQ ID NO: 1 или SEQ ID NO: 3 могут быть подтверждены в NCBI (национальный центр биотехнологической информации) GenBank, представляющей собой известную базу данных.
Zwf может включать нуклеотидную последовательность, кодирующую аминокислотную последовательность, представленную в SEQ ID NO: 2 или SEQ ID NO: 4, но не ограничен этим. Последовательности в соответствии с SEQ ID NO: 2 или SEQ ID NO: 4 могут быть подтверждены в NCBI GenBank, представляющей собой известную базу данных.
В частности, Zwf может иметь аминокислотную последовательность в соответствии с SEQ ID NO: 1 или SEQ ID NO: 3 и/или аминокислотную последовательность, обладающую гомологией или идентичностью по меньшей мере 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%, или более чем 99% с SEQ ID NO: 1 или SEQ ID NO: 3. Дополнительно, понятно то, что Zwf, имеющий аминокислотную последовательность, в которой часть аминокислотной последовательности удалена, модифицирована, заменена или добавлена, может попадать в объем описания настоящего изобретения, при условии того, что аминокислотная последовательность обладает такой гомологией или идентичностью и демонстрирует функцию, соответствующую Zwf.
Использованный здесь термин «фруктокиназа» (далее называемая как «CscK») относится к ферменту, катализирующему реакцию продуцирования D-фруктозо-6-фосфата и ADP (аденозиндифосфата) путем переноса фосфата в присутствии АТР.
Для задачи в соответствии с описанием настоящего изобретения этот белок также может быть назван «киназа фруктозы», «фруктокиназа» или «CscK». Ген, кодирующий этот белок, может представлять собой, например, ген csck, но не ограничен этим. В описании настоящего изобретения «ген csck» может быть использован взаимозаменяемо с «геном, кодирующим фруктокиназу». Дополнительно, этот белок может представлять собой, например, тот же самый белок такой как, полученный из Escherichia coli, но не ограничен этим при условии того, что он может увеличивать продукцию L-аминокислот.
CscK может обладать или состоять из аминокислотной последовательности в соответствии с SEQ ID NO: 5, или может включать аминокислотную последовательность, представленную в SEQ ID NO: 5, но не ограничен этим. Последовательность в соответствии с SEQ ID NO: 5 может быть подтверждена в соответствии с NCBI GenBank, представляющей собой известную базу данных.
CscK может включать нуклеотидную последовательность, кодирующую аминокислотную последовательность, представленную в SEQ ID NO: 6, но не ограничен этим. Последовательность в соответствии с SEQ ID NO: 6 может быть подтверждена в соответствии с NCBI GenBank, представляющей собой известную базу данных.
В частности, CscK может представлять собой аминокислотную последовательность в соответствии с SEQ ID NO: 5 и/или аминокислотную последовательность, обладающую гомологией или идентичностью по меньшей мере 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% или больше чем 99% с SEQ ID NO: 5. Дополнительно, понятно то, что CscK, имеющий аминокислотную последовательность, в которой часть аминокислотной последовательности удалена, модифицирована, заменена или добавлена, может оказаться в объеме в соответствии с описанием настоящего изобретения при условии того, что аминокислотная последовательность обладает такой гомологией или идентичностью и демонстрирует функцию, соответствующую CscK.
Использованный здесь термин «гомология» или «идентичность» относится к степени соответствия между двумя данными аминокислотными последовательностями или нуклеотидными последовательностями, и может быть выражена в виде процентной доли. Термины гомология и идентичность часто могут быть использованы взаимозаменяемо друг с другом.
Гомология или идентичность последовательности консервативных полинуклеотидов или полипептидов может быть определена при помощи стандартных алгоритмов выравнивания и может быть использована с определенным штрафом за пропуск, установленным в использованной программе. В частности, ожидают то, что гомологичные или идентичные последовательности как правило гибридизуются полностью или по меньшей мере приблизительно 50%, 60%, 70%, 80% или 90% относительно всей длины последовательности в условиях умеренной или высокой строгости. Также рассматриваются полинуклеотиды, которые содержат вырожденные кодоны вместо кодонов в гибридизующихся полинуклеотидах.
Гомология или идентичность полипептидных или полинуклеотидных последовательностей может быть определена при помощи, например, алгоритма BLAST в литературе (смотри Karlin and Altschul, Pro. Natl. Acad. Sci. USA, 90, 5873 (1993)), или FASTA в соответствии с Pearson (смотри: Methods Enzymol, 183, 63, 1990). На основе алгоритма разработана BLAST, представляющая собой программу, названную BLASTN или BLASTX (смотри http://www.ncbi.nlm.nih.gov). Кроме того, обладает ли аминокислотная или полинуклеотидная последовательность гомологией, сходством или идентичностью друг с другом, может быть установлено путем сравнения последовательностей в эксперименте по Саузерн-гибридизации в определенных строгих условиях, и определенные подходящие условия гибридизации находятся в пределах уровня техники, и может быть определено при помощи способа, известного специалистам в данной области техники (например, J. Sambrook et at., Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; F. M. Ausubel et al, Current Protocols in Molecular Biology).
В частности, «микроорганизм, продуцирующий L-аминокислоту», включает все микроорганизмы дикого типа, или естественным или искусственным образом генетически модифицированные микроорганизмы. В частности, он может представлять собой микроорганизм, в котором конкретный механизм ослаблен или усилен вследствие встраивания чужеродного гена, или усиления или инактивации активности эндогенного гена, и он может представлять собой микроорганизм, в котором возникает генетическая мутация или усилена активность, продуцирующая L-аминокислоты, для продукции желаемой L-аминокислоты. Для задачи в соответствии с описанием настоящего изобретения микроорганизм, продуцирующий L-аминокислоту, обладает свойством, при котором способность получать желаемую L-аминокислоту, увеличивается путем усиления экспрессии или активности белков Zwf и Csck, и может представлять собой генетически модифицированный микроорганизм или рекомбинантный микроорганизм, но не ограничен этим.
Используемый здесь термин «усиление активности» белка означает то, что активность белка увеличивается по сравнению с эндогенной активностью. «Эндогенная активность» относится к активности конкретного белка, исходно проявляемой родительским штаммом перед трансформацией или не модифицированным микроорганизмом, когда характеристики изменяются путем генетической модификации, вызванной природными или искусственными факторами, и может быть использовано взаимозаменяемо с «активностью перед модификацией». «Усиление» активности белка по сравнению с его эндогенной активностью означает то, что активность этого белка усиливается по сравнению с активностью конкретного белка, исходно демонстрируемой родительским штаммом перед трансформацией или не модифицированным микроорганизмом.
«Усиление активности» может быть достигнуто путем введения чужеродного белка или путем усиления активности эндогенного белка, и, в частности, может быть достигнуто путем усиления активности эндогенного белка. Усиление активности этого белка может быть подтверждено путем увеличения уровня активности этого белка, уровня экспрессии или количества продукта, продуцируемого из этого белка.
Для усиления активности можно применять различные способы, хорошо известные в области техники, и не ограничены при условии того, что они могут усиливать активность белка-мишени по сравнению с активностью микроорганизма перед модификацией. В частности, может быть использована генетическая инженерия и/или белковая инженерия, хорошо известные специалистам в данной области техники, которые представляют собой способы, обычные для молекулярной биологии, но способы не ограничены ими (например, Sitnicka et at. Functional Analysis of Genes. Advances in Cell Biology. 2010, Vol. 2. 1-16; Sambrook et al. Molecular Cloning 2012; и т.п.).
В описании настоящего изобретения, этот белок-мишень для усиления активности, то есть белок-мишень может представлять собой Zwf и Csck, но не ограничен этим.
В частности, усиление активности этого белка в соответствии с описанием настоящего изобретения может быть достигнуто путем:
1) увеличения числа копий гена, кодирующего этот белок, в клетках;
2) замены последовательности, регулирующей экспрессию гена, кодирующего этот белок, на хромосоме на последовательность, демонстрирующую сильную активность;
3) модификации нуклеотидной последовательности, кодирующей стартовый кодон или 5'-UTR генного транскрипта, кодирующего этот белок;
4) модификации аминокислотной последовательности таким образом, что активность этого белка усиливается;
5) модификации полинуклеотидной последовательности, кодирующей этот белок, таким образом, что активность этого белка усиливается (например, модификация последовательности гена, кодирующего этот белок, таким образом, что кодируется белок, который модифицируется для усиления активности);
6) введения чужеродного полинуклеотида, демонстрирующего активность этого белка, или варианта полинуклеотида с оптимизированными кодонами;
7) оптимизации кодона полинуклеотида, кодирующего этот белок;
8) анализа третичной структуры этого белка и, таким образом, выбора и модификации экспонируемого сайта, или его химической модификации; или
9) комбинации двух или более чем двух, выбранных из (1)-(8), но не ограничиваясь этим.
Конкретнее, (1) способ увеличения числа копий в клетке гена, кодирующего этот белок, может быть осуществлен при помощи любого способа, известного в области техники, например, путем введения вектора, который функционально связан с геном, кодирующим этот белок, и способен реплицироваться и функционировать независимо от клетки-хозяина, в клетку-хозяина. Этот способ может быть осуществлен путем введения в клетку-хозяина вектора, функционально связанного с геном и способного встраивать ген в хромосому клетки-хозяина, но не ограничиваясь этим.
Используемый здесь термин «вектор» относится к конструкции ДНК, содержащей полинуклеотидную последовательность, кодирующую белок-мишень, функционально связанную с подходящей регуляторной последовательностью, таким образом, чтобы обеспечивать экспрессию белка-мишени в подходящей клетке-хозяине. Последовательность, регулирующая экспрессию, может включать промотор, способный инициировать транскрипцию, любую операторную последовательность для регуляции транскрипции, последовательность, кодирующую подходящий сайт для связывания с рибосомой на мРНК, и последовательность, регулирующую прекращение транскрипции и трансляции. После трансформации в подходящую клетку-хозяина вектор может реплицироваться или функционировать независимо от генома хозяина или сам может быть интегрирован в геном.
Вектор, используемый в описании настоящего изобретения не ограничен конкретным образом, и может быть использован любой вектор, известный в области техники. Примеры обычно используемого вектора могут включать природные или рекомбинантные плазмиды, космиды, вирусы и бактериофаги. Например, в качестве фагового вектора или космидного вектора могут быть использованы pWE15, М13, MBL3, MBL4, IXII, ASHII, APII, t10, t11, Charon4A и Charon21A и т.п., и в качестве плазмидного вектора могут быть использованы векторы на основе pDZ, pBR, pUC, pBluescriptII, pGEM, pTZ, pCL, pET и т.п. В частности, могут быть использованы векторы pDZ, pDC, pDCM2, pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322, pMW118, pCC1BAC и т.п.
Использованный здесь термин «трансформация» относится к введению рекомбинантного вектора, содержащего полинуклеотид, кодирующий белок-мишень, в клетку-хозяина таким образом, что этот белок, кодируемый полинуклеотидом, может экспрессироваться в клетке-хозяине. При условии того, что трансформированный полинуклеотид может экспессироваться в клетке-хозяине, не важно, встроен ли трансформированный полинуклеотид в хромосому клетки-хозяина и расположен в ней или расположен экстрахромосомно, и могут быть включены оба случая. Способ трансформирования вектора включает любой способ введения в клетку нуклеиновой кислоты, и может быть осуществлен путем выбора подходящего стандартного способа, известного в области техники, в зависимости от клетки-хозяина. Например, трансформация может быть осуществлена путем электропорации, путем осаждения фосфатом кальция (CaPO4), осаждения хлоридом кальция (CaCl2), микроинъекции, методики с полиэтиленгликолем (PEG), методики с DEAE (диэтиламиноэтил)-декстраном, способа с использованием катионных липосом, способа с ацетата лития-DMSO (диметилсульфоксид) и т.п., но способ не ограничен этим.
Кроме того, используемый здесь термин «функционально связанный» означает то, что полинуклеотидная последовательность функционально связана с промоторной последовательностью или областью, регулирующей экспрессию, которая инициирует и опосредует транскрипцию полинуклеотида, кодирующего белок-мишень в соответствии с описанием настоящего изобретения. Функциональная связка может быть получена с использованием способа генетической рекомбинации, хорошо известного в области техники, и сайт-специфического расщепления ДНК, и связка может быть получена с использованием ферментов для расщепления и лигирования и т.п., известных в области техники, но не ограничивается этим.
2) Способ замены последовательности, регулирующей экспрессию гена, кодирующего этот белок, на хромосоме на последовательность, обладающую сильной активностью, может быть осуществлен при помощи любого способа, известного в области техники, например, путем индукции модификации в последовательности путем делеции, вставки, не консервативной или консервативной замены последовательности нуклеиновой кислоты или путем их комбинации для дополнительного усиления активности последовательности, регулирующей экспрессию, или путем замены последовательности на последовательность нуклеиновой кислоты, обладающую более сильной активностью. Последовательность, регулирующая экспрессию, может включать без ограничения промотор, операторную последовательность, последовательность, кодирующую сайт связывания с рибосомой, последовательность, регулирующую терминацию транскрипции или трансляции и т.п.Способ, в частности, может включать связывание сильного гетерологического промотора вместо исходного промотора, но не ограничивается этим.
Примеры сильного промотора могут включать промоторы CJ1-CJ7 (патент США №US 7662943 В2), промотор lac, промотор trp, промотор trc, промотор tac, промотор PR фага лямбда, промотор PL, промотор tet и промотор rmf и т.п., но не ограничены ими, и могут включать все замены на более сильный промотор по сравнению с его эндогенной активностью.
3) Способ модификации нуклеотидной последовательности стартового кодона или 5'-UTR генного транскрипта, кодирующего этот белок, может быть достигнуто при помощи любого из способов, известных в области техники, например, путем замены эндогенного инициирующего кодона этого белка на другой инициирующий кодон, обладающий более высоким уровнем экспрессии этого белка по сравнению с эндогенным инициирующим кодоном, но не ограничивается этим.
4) и 5) Способы модификации аминокислотной последовательности или полинуклеотидной последовательности могут быть осуществлены при помощи любого из способов, известных в области техники, например, путем индукции модификации последовательности путем делении, вставки, не консервативной или консервативной замены полинуклеотидной последовательности или их комбинации для дополнительного усиления активности полинуклеотидной последовательности или путем замены последовательности на полинуклеотидную последовательность, модифицированную таким образом, чтобы обладать более сильной активностью. Замена, в частности, может быть осуществлена путем встраивания гена в хромосому путем гомологичной рекомбинации, но не ограничиваясь этим. Используемый здесь вектор может дополнительно включать селективный маркер для подтверждения встраивания в хромосому. Селективный маркер предназначен для отбора клеток, трансформированных вектором, то есть для подтверждения встраивания вводимого гена, и могут быть использованы маркеры, которые обеспечивают селектируемые фенотипы, такие как устойчивость к лекарственным средствам, ауксотрофия, устойчивость к агентам, токсичным для клеток, или экспрессия поверхностных белков. Только клетки, экспрессирующие селективный маркер, способны выживать или демонстрировать различные фенотипы в среде, обработанной селективным агентом, и, таким образом, могут быть отобраны трансформированные клетки.
6) Способ введения чужеродного полинуклеотида, обладающего активностью этого белка, может быть осуществлен при помощи любого из способов, известных в области техники, например путем введения в клетку-хозяина чужеродного полинуклеотида, кодирующего белок, который демонстрирует активность, идентичную или похожую на активность этого белка или его варианта полинуклеотида с оптимизированными кодонами. Чужеродный полинуклеотид может быть использован без ограничения независимо от его происхождения или последовательности при условии того, что он демонстрирует активность, идентичную или похожую на активность этого белка. Кроме того, чужеродный полинуклеотид может быть введен в клетку-хозяина путем оптимизации его кодонов таким образом, что в клетке-хозяине достигается оптимизированная транскрипция и трансляция. Введение может быть осуществлено специалистами в данной области техники путем подходящего выбора способа трансформации, известного в области техники, и экспрессия введенного полинуклеотида в клетке-хозяине обеспечивает получение этого белка, таким образом, увеличивая его активность.
7) Способ оптимизация кодона полинуклеотида, кодирующего этот белок, может быть осуществлен путем оптимизации кодона эндогенного полинуклеотида для увеличения транскрипции или трансляции в клетке-хозяине, или путем оптимизации его кодонов таким образом, чтобы дать возможность для достижения оптимизированной транскрипции и трансляции чужеродного полинуклеотида в клетке-хозяине.
8) Способ анализа третичной структуры этого белка и, таким образом, отбора и модификации экспонируемого сайта или его химической модификации может быть осуществлен, например, путем сравнения информации о последовательности анализируемого полипептида с базой данных, в которой хранится информация о последовательностях известных белков, для определения кандидатов белков-матриц в соответствии со степенью сходства последовательности, и, таким образом, подтверждения структуры, основанной на информации, таким образом, отбора и трансформации или модификации экспонируемого сайта, который предполагается модифицировать или химически модифицировать.
Такое усиление активности этого белка может означать то, что активность или концентрация соответствующего белка увеличивается относительно активности или концентрации этого белка, экспрессируемого в микроорганизме дикого типа или микроорганизме до модификации, или то, что количество продукта, продуцируемого из этого белка увеличивается, но не ограничен этим. Использованный здесь термин «штамм перед модификацией» или «микроорганизм перед модификацией» не исключают штамм, содержащий мутацию, которая может возникать в микроорганизме естественным путем, и может относиться к самому штамму дикого типа, или штамму до того, как характеристика изменена вследствие генетической модификации, вызванной природными или искусственными факторами. В описании настоящего изобретения модификация характеристик может представлять собой усиление активности Zwf и CscK. «Штамм перед модификацией» или «микроорганизм перед модификацией» могут быть использованы взаимозаменяемо с «не мутантным штаммом», «не модифицированным штаммом», «не мутантным микроорганизмом», «не модифицированным микроорганизмом» или «референсным микроорганизмом».
В описании настоящего изобретения ссылка на микроорганизм не ограничена конкретным образом при условии того, что он представляет собой микроорганизм, который продуцирует L-аминокислоту, и мутантные штаммы, обладающие усиленной способностью продуцировать L-аминокислоту, по сравнению с диким типом также включены без ограничения. Их примеры включают штаммы, в которых одна или более чем одна генетическая модификация добавлена в штаммы Corynebacterium glutamicum KCCM11016P (Корейский патент №10-0159812), KCCM10770P (Корейский патент №10-0924065) и CJ3P (Binder et al. Genome Biology 2012, 13:R40), продуцирующих L-лизин, или Corynebacterium glutamicum KCCM12218P (Корейский патент №10-2035844), продуцирующей L-триптофан, для усиления путей биосинтеза штаммы, но не ограничены ими.
Для задачи в соответствии с описанием настоящего изобретения микроорганизм, продуцирующий L-аминокислоту, может представлять собой любой микроорганизм, при условии того, что он представляет собой микроорганизм, способный продуцировать L-аминокислоту, в котором активности Zwf и Csck усилены при помощи вышеописанного способа. Использованный здесь «микроорганизм, продуцирующий L-аминокислоту», может быть использован взаимозаменяемо с «L-аминокислоту-продуцирующим микроорганизмом» или «микроорганизмом, обладающим способностью продуцировать L-аминокислоту», и, в частности, микроорганизмом рода Corynebacterium, но не ограничен ими.
Использованный здесь «микроорганизм рода Corynebacterium» может включать все микроорганизмы рода Corynebacterium. В частности, он может представлять собой Corynebacterium glutamicum, Corynebacterium crudilactis, Corynebacterium deserti, Corynebacterium efficiens, Corynebacterium callunae, Corynebacterium stationis, Corynebacterium singulare, Corynebacterium halotolerans, Corynebacterium striatum, Corynebacterium ammoniagenes, Corynebacterium pollutisoli, Corynebacterium imitans, Corynebacterium testudinoris или Corynebacterium flavescens, и, конкретней, Corynebacterium glutamicum.
В то же самое время, известно то, что микроорганизмы рода Corynebacterium могут продуцировать L-аминокислоту; тем не менее, их продуктивность является слишком низкой, и гены или не все механизмы, вовлеченные в продукцию L-аминокислоты, выявлены до настоящего времени. Соответственно, «микроорганизм рода Corynebacterium, продуцирующий L-аминокислоту», сам может представлять собой природный микроорганизм дикого типа, микроорганизм рода Corynebacterium, обладающий усиленной способностью продуцировать L-аминокислоту, путем усиления или инактивации активности генов, вовлеченных в механизм продукции L-аминокислот, или микроорганизм рода Corynebacterium, обладающий усиленной способностью продуцировать L-аминокислоту, путем введения или усиления активности чужеродного гена.
В еще одном аспекте в соответствии с описанием настоящего изобретения предложен способ продукции L-аминокислоты, включающий: культивирование микроорганизма в соответствии с описанием настоящего изобретения в среде; и выделение L-аминокислоты из микроорганизма или среды.
Микроорганизм в соответствии с описанием настоящего изобретения является тем же самым, как описано выше.
В способе в соответствии с описанием настоящего изобретения культивирование микроорганизма рода Corynebacterium может быть осуществлено с использованием любого из условий культивирования и способов, известных в области техники.
Использованный здесь термин «культивирование» означает то, что микроорганизму дают возможность расти в подходящих и искусственно контролируемых условиях окружающей среды. В описании настоящего изобретения способ продукции L-аминокислоты с использованием микроорганизма для продукции L-аминокислоты может быть осуществлен с использованием способа, широко известного в области техники. В частности, культивирование может быть осуществлено при помощи способа периодического культивирования, культивирования подпитываемой культуры или непрерывного культивирования с периодическим подпитыванием культуры, но не ограничивается ими. Среда, используемая для культивирования должна удовлетворять требованиям конкретного штамма подходящим путем. Культуральная среда для штаммов Corynebacterium известна в области техники (например, Manual of Methods for General Bacteriology by the American Society for Bacteriology, Washington D.C., USA, 1981).
Источники углерода, которые могут быть использованы в среде, могут включать сахара и углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, мальтоза, крахмал и целлюлоза; масла и жиры, такие как соевое масло, подсолнечное масло, касторовое масло и кокосовое масло; жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота; спирты, такие как глицерин и этанол; и органические кислоты, такие как уксусная кислота. Эти вещества могут быть использованы сами по себе или в смеси, но не ограничены этим.
Источники азота, которые могут быть использованы, могут включать пептон, дрожжевой экстракт, мясной экстракт, солодовый экстракт, жидкий кукурузный экстракт, соевый шрот и мочевину или неорганические соединения, такие как сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония. Эти источники азота также могут быть использованы сами по себе или в смеси, но не ограничиваются ими.
Источники фосфора, которые могут быть включены в среду, могут включать первичный кислый фосфат калия или вторичный кислый фосфат калия, или соответствующие содержащие натрий соли. Кроме того, культуральная среда может включать соль металла, такую как сульфат магния или сульфат железа, которые требуются для роста. Кроме того, в дополнение к описанным выше веществам могут быть использованы незаменимые ростовые вещества, такие как аминокислоты и витамины. Дополнительно, могут быть использованы предшественники, подходящие для культуральной среды. Эти вещества могут быть подходящим образом добавлены в культуру во время периодического культивирования или культивирования непрерывным образом, но не ограничиваются ими.
Основные вещества, такие как гидроксид натрия, гидроксид калия или аммиак, или кислые соединения, такие как фосфорная кислота или серная кислота, могут быть добавлены при культивировании микроорганизма подходящим образом, таким образом, корректируя рН культуры. Кроме того, может быть использован пеногаситель, такой как сложный эфир полигликоля и жирной кислоты, для подавления образования пузырьков. Чтобы поддерживать аэробные условия, кислород или содержащий кислород газ (например, воздух) может быть введен в культуру. Температура культуры может составлять обычно от 20°С до 45°С, конкретно, от 25°С до 40°С. Культивирование может продолжаться до тех пор, пока не будет продуцировано желаемое количество L-аминокислоты, и это, в частности, может быть достигнуто в течение от 10 часов до 160 часов, но не ограничиваясь этим.
Описание настоящего изобретения дополнительно может включать стадию приготовления среды перед стадией культивирования в способе в соответствии с описанием настоящего изобретения, но не ограничено этим.
L-аминокислота может быть выделена из культуры при помощи обычного способа, известного в области техники. Способы выделения могут включать центрифугирование, фильтрацию, хроматографию, кристаллизацию и т.п. Например, супернатант, полученный путем центрифугирования культуры с низкой скоростью и удаления биомассы, может быть отделен путем ионообменной хроматографии, но не ограничен этим.
Кроме того, стадия выделения может дополнительно включать процесс очистки, и процесс очистки может быть осуществлен при помощи подходящего способа, известного в области техники.
В еще одном аспекте в соответствии с описанием настоящего изобретения предложено применение продукции L-аминокислоты микроорганизмом, в соответствии с описанием настоящего изобретения.
Микроорганизм и L-аминокислота в соответствии с описанием настоящего изобретения являются такими, как описано выше.
В еще одном аспекте в соответствии с описанием настоящего изобретения предложена композиция для продукции L-аминокислоты, включающая: микроорганизм в соответствии с описанием настоящего изобретения; и/или культура микроорганизма.
Микроорганизм и L-аминокислота в соответствии с описанием настоящего изобретения являются такими, как описано выше.
Способ осуществления изобретения
Далее описание настоящего изобретения будет подробно описано в виде примеров. Тем не менее, эти примеры приведены исключительно для иллюстративных задач, и объем изобретения не ограничивается этими примерами.
Пример 1. Конструирование усиленных векторов
Пример 1-1. Конструирование векторов, в которых усилен ген глюкозо-6-фосфат-1-дегидрогеназы (zwf)-, полученный из Corynebacterium glutamicum АТСС13032
Эффект усиления гена подтверждали путем введения zwf в котором каждый из промотора SPL13 (US 10584338 В2) и промотора CJ7, полученных из Corynebacterium ammoniagenes (US 7662943 В2), связан с транспозоном Corynebacterium glutamicum АТСС13032.
zwf использовали для геномной ДНК Corynebacterium glutamicum АТСС13032 в качестве матрицы. Кроме того, праймеры, содержащие полинуклеотиды в соответствии с SEQ ID NO: 9 и 10 (Таблица 1) и SEQ ID NO: 13 и 14 (Таблица 2), получали на основе информации о нуклеотидной последовательности из NCBI (NC_003450.3), и ПЦР (полимеразную цепную реакцию) (полимераза ДНК Solg™ Pfu-X) осуществляли в условиях в соответствии с таблицей 4, таким образом, получая фрагменты гена zwf для получения векторов.

Для получения промотора SPL13 и промотора CJ7 из Corynebacterium ammoniagenes осуществляли ПЦР (полимераза ДНК Solg™ Pfu-X) (таблица 4) с использованием праймеров в соответствии с SEQ ID NO: 7 и 8 (таблица 1) и SEQ ID NO: 11 и 12 (таблица 2).
Амплифицированный SPL13, области промотора CJ7, фрагменты гена zwf и вектор pDZTn (US 8932861 В2), расщепленный ферментом рестрикции ScaI, связывали при помощи способа сборки Гибсона (D.G. Gibson et al., NATURE METHODS, Vol. 6 No. 5, MAY 2009, NEBuilder HiFi DNA Assembly Master Mix), и затем трансформировали в Е. coli DH5α и высевали на твердую среду LB (Луриа-Бертани), содержащую канамицин (25 мг/л). Для отбора колоний, трансформированных вектором, в котором желаемый ген и pDZTn связаны, осуществляли ПЦР с использованием праймеров в соответствии с SEQ ID NO: 47 и 48 (таблица 3). Плазмиды получали из отобранных колоний с использованием общеизвестного способа экстракции плазмид, и полученные в результате плазмиды были названы pDZTn-Pspl13-zwf(C.gl13032) и pDZTn-Pcj7-zwf(C.gl13032).
Пример 1-2. Конструирование векторов, в которых усилен ген глюкозо-6-фосфат-1-дегидрогеназы (zwf), полученный из Corynebacterium glutamicum АТСС13869
Эффект усиления гена zwf полученного из Corynebacterium glutamicum АТСС13869, подтверждали с использованием геномной ДНК Corynebacterium glutamicum АТСС13869 в качестве матрицы. Кроме того, праймеры, содержащие полинуклеотиды в соответствии с SEQ ID NO: 17 и 18 (таблица 5) и SEQ ID NO: 21 и 22 (таблица 6), получали на основе информации о гене Corynebacterium glutamicum АТСС13869 и окружающих нуклеотидных последовательностях, зарегистрированных в генетическом банке Национальных Институтов Здравоохранения (National Institutes of Health (NIH GenBank)), и ПЦР (полимераза ДНК Solg™ Pfu-X) осуществляли в условиях в соответствии с таблицей 4 для получения таким образом фрагменты гена zwf для получения векторов.

Для получения промотора SPL13 и промотора CJ7 из Corynebacterium ammoniagenes, осуществляли ПЦР (полимераза ДНК Solg™ Pfu-X) с использованием праймеров в соответствии с SEQ ID NO: 15 и 16 (таблица 5) и SEQ ID NO: 19 и 20 (таблица 6) в условиях в соответствии с таблицей 4.
Амплифицированный SPL13, области промотора CJ7, фрагменты гена zwf и вектор pDZTn (US 8932861 В2), расщепленный ферментом рестрикции ScaI, связывали при помощи способа сборки Гибсона (D.G. Gibson et al., NATURE METHODS, Vol. 6 No. 5, MAY 2009, NEBuilder HiFi DNA Assembly Master Mix) и затем трансформировали в Е. coli DH5α и высевали на твердую среду LB, содержащую канамицин (25 мг/л). Для отбора колоний, трансформированных вектором, в котором желаемый ген и pDZTn связаны, осуществляли ПЦР с использованием праймеров в соответствии с SEQ ID NO: 47 и 48 (таблица 3). Плазмиды получали из отобранных колоний с использованием общеизвестного способа экстракции плазмид, и полученные в результате плазмиды были названы pDZTn-Pspl13-zwf(C.gl13869) и pDZTn-Pcj7-zwf(C.gl13869).
Пример 1-3. Конструирование векторов, в которых усилен ген фруктокиназы (cscK), полученный из Escherichia coli.
Нуклеотидная последовательность гена фруктокиназы, полученного из Escherichia, уже была ясно идентифицирована и опубликована. Информация о гене cscK получена из Escherichia coli W (СР002967) в NCBI, и на основе информации получали праймеры, содержащие полинуклеотиды в соответствии с SEQ ID NO: 25 и 26 (таблица 7) и SEQ ID NO: 29 и 30 (таблица 8), и осуществляли ПЦР (полимераза ДНК Solg™ Pfu-X) в условиях, представленных в таблице 4, для получения таким образом фрагментов гена cscK для получения векторов.
Для получения промотора SPL13 и промотора CJ7 осуществляли ПЦР (полимераза ДНК Solg™ Pfu-X) с использованием праймеров в соответствии с SEQ ID NO: 23 и 24 (таблица 7) и SEQ ID NO: 27 и 28 (таблица 8) в условиях в соответствии с таблицей 4.
Амплифицированный SPL13, области промотора CJ7, фрагменты гена cscK(E.co) и вектор pDZTn (US 8932861 В2), расщепленный ферментом рестрикции ScaI, связывали при помощи способа сборки Гибсона (D.G. Gibson et al., NATURE METHODS, Vol. 6 No. 5, MAY 2009, NEBuilder HiFi DNA Assembly Master Mix) и затем трансформировали в Е. coli DH5α и высевали на твердую среду LB, содержащую канамицин (25 мг/л). Для отбора колоний, трансформированных вектором, в котором желаемый ген и pDZTn связаны, осуществляли ПЦР с использованием праймеров в соответствии с SEQ ID NO: 47 и 48 (таблица 3). Плазмиды получали из отобранных колоний с использованием общеизвестного способа экстракции плазмид, и полученные в результате плазмиды были названы pDZTn-Pspl13-cscK(E.co) и pDZTn-Pcj7-cscK(E.co).

Пример 1-4. Конструирование векторов, в которых усилены zwf, полученный из Corynebacterium glutamicum АТСС13032, и cscK, полученный из Escherichia coli
Векторы получали для подтверждения одновременного усиливающего эффекта двух генов путем подтверждения усиливающего эффекта отдельных генов примера 1-1 и примера 1-3.
Pspl13-zwf(C.gl13032) и Pcj7-cscK(E.co) получали на основе pDZTn-Pspl13-zwf(C.gl13032) в соответствии с примером 1-1 и pDZTn-Pcj7-cscK(E.co) в соответствии с примером 1-3 в качестве матриц, соответственно, путем получения праймеров, содержащих полинуклеотиды в соответствии с SEQ ID NO: 31 и 32 и SEQ ID NO: 33 и 34 (таблица 9), и осуществления ПЦР (полимераза ДНК Solg™ Pfu-X) в условиях в соответствии с таблицей 4. Амплифицированные фрагменты гена Pspl13-zwf(C.gl13032) и Pcj7-cscK(E.co) и вектор pDZTn (US 8932861 В2), расщепленный ферментом рестрикции ScaI, связывали при помощи способа сборки Гибсона (D.G. Gibson et al., NATURE METHODS, Vol. 6 No. 5, MAY 2009, NEBuilder HiFi DNA Assembly Master Mix), и затем трансформировали в Е. coli DH5α и высевали на твердую среду LB, содержащую канамицин (25 мг/л). Для отбора колоний, трансформированных вектором, в котором желаемый ген и pDZTn связаны, осуществляли ПЦР с использованием праймеров в соответствии с SEQ ID NO: 47 и 48 (таблица 3). Плазмиду получали из отобранных колоний с использованием общеизвестного способа экстракции плазмид, и полученная в результате плазмида был названа pDZTn-Pspl13-zwf(C.gl13032)_Pcj7-cscK(E.co).
Pcj7-zwf(C.gl13032) и Pspl13-cscK(E.co) получали на основе pDZTn-Pcj7- zwf(C.gl13032) в соответствии с примером 1-1 и pDZTn-Pspl13-cscK(E.co) в соответствии с примером 1-3 в качестве матриц, соответственно, путем получения праймеров, содержащих полинуклеотиды в соответствии с SEQ ID NO: 35 и 36 и SEQ ID NO: 37 и 38 (таблица 10), и осуществления ПЦР (полимераза ДНК Solg™ Pfu-X) в условиях в соответствии с таблицей 4, тем же самым образом, как изложено выше. Амплифицированные фрагменты гена Pcj7-zwf(C.gl13032) и Pspl13-cscK(E.co) и вектор pDZTn (US 8932861 В2), расщепленный ферментом рестрикции ScaI, связывали при помощи способа сборки Гибсона (D.G. Gibson et al, NATURE METHODS, Vol. 6 No. 5, MAY 2009, NEBuilder HiFi DNA Assembly Master Mix), и затем трансформировали в Е. coli DH5α и высевали на твердую среду LB, содержащую канамицин (25 мг/л). Для отбора колоний, трансформированных вектором, в котором желаемый ген и pDZTn связаны, осуществляли ПЦР с использованием праймеров в соответствии с SEQ ID NO: 47 и 48 (таблица 3). Плазмиду получали из отобранных колоний с использованием общеизвестного способа экстракции плазмид, и полученная в результате плазмида был названа pDZTn-Pcj7-zwf(C.gl13032)_Pspl13-cscK(E.co).


Пример 1-5. Конструирование векторов, в которых усилены zwf, полученный из Corynebacterium glutamicum АТСС13869, и cscK, полученный из Escherichia coli
Векторы получали для подтверждения одновременного усиливающего эффекта двух генов путем подтверждения усиливающего эффекта отдельных генов в соответствии с примером 1-2 и примером 1-3.
Pspl13-zwf(C.gl13869) и Pcj7-cscK(E.co) получали на основе pDZTn-Pspl13-zwf(C.gl13869) в соответствии с примером 1-2 и pDZTn-Pcj7-cscK(E.co) в соответствии с примером 1-3 в качестве матриц, соответственно, путем получения праймеров, содержащих полинуклеотиды в соответствии с SEQ ID NO: 39 и 40 и SEQ ID NO: 41 и 42 (таблица 11), и осуществления ПЦР (полимераза ДНК Solg™ Pfu-X) в условиях в соответствии с таблицей 4. Амплифицированные фрагменты гена Pspl13-zwf(C.gl13869) и Pcj7-cscK(E.co) и вектор pDZTn (патент США №8932861 В2), расщепленный ферментом рестрикции ScaI, связывали при помощи способа сборки Гибсона (D.G. Gibson et al, NATURE METHODS, Vol. 6 No. 5, MAY 2009, NEBuilder HiFi DNA Assembly Master Mix), и затем трансформировали в Е. coli DH5α и высевали на твердую среду LB, содержащую канамицин (25 мг/л). Для отбора колоний, трансформированных вектором, в котором желаемый ген и pDZTn связаны, осуществляли ПЦР с использованием праймеров в соответствии с SEQ ID NO: 47 и 48 (таблица 3). Плазмиду получали из отобранных колоний с использованием общеизвестного способа экстракции плазмид, и полученная в результате плазмида была названа pDZTn-Pspl13-zwf(C.gl13869)_Pcj7-cscK(E.co).
Pcj7-zwf(C.gl13869) и Pspl13-cscK(E.co) получали на основе pDZTn-Pcj7-zwf(C.gl13869) в соответствии с примером 1-2 и pDZTn-Pspl13-cscK(E.co) в соответствии с примером 1-3 в качестве матриц, соответственно, путем получения праймеров, содержащих полинуклеотиды в соответствии с SEQ ID NO: 43 и 44 и SEQ ID NO: 45 и 46 (Таблица 12), и осуществления ПЦР (полимераза ДНК Solg™ Pfu-X) в условиях в соответствии с таблицей 4, тем же самым образом, как изложено выше. Амплифицированные фрагменты гена Pcj7-zwf(C.gl13869) и Pspl13-cscK(E.co) и вектор pDZTn (патент США №8932861 В2), расщепленный ферментом рестрикции Seal, связывали при помощи способа сборки Гибсона (D.G. Gibson et al, NATURE METHODS, Vol. 6 No. 5, MAY 2009, NEBuilder HiFi DNA Assembly Master Mix), и затем трансформировали в Е. coli DH5α и высевали на твердую среду LB, содержащую канамицин (25 мг/л). Для отбора колоний, трансформированных вектором, в котором связывали желаемый ген и pDZTn, осуществляли ПЦР с использованием праймеров в соответствии с SEQ ID NO: 47 и 48 (таблица 3). Плазмиду получали из отобранных колоний с использованием общеизвестного способа экстракции плазмид, и полученная в результате плазмида была названа pDZTn-Pcj7-zwf(C.gl13869) Pspl13-cscK(E.co).

Пример 2. Конструирование усиленных штаммов
Пример 2-1. Конструирование штаммов, продуцирующих лизин, в которых усилен zwf, полученный из Corynebacterium glutamicum АТСС13032
Каждый из штаммов Corynebacterium glutamicum KCCM11016P (Корейский патент №10-0159812), KCCM10770P (Корейский патент №10-0924065) и CJ3P (Binder et al. Genome Biology 2012, 13:R40), продуцирующих L-лизин, трансформировали векторами pDZTn-Pspl13-zwf(C.gl13032) и pDZTn-Pcj7-zwf(C.gl13032), полученными в примере 1-1, путем электропорации (Appl. Microbiol. Biotechnol. (1999) 52:541-545), и подвергали вторичному кроссоверу для получения таким образом штаммов, в которые каждый из Pspl13-zwf(C.gl13032) и Pcj7-zwf(C.gl13032) встраивали между генами транспозона. Манипуляцию с генами подтверждали путем секвенирования генома и ПЦР с использованием праймеров в соответствии с SEQ ID NO: 47 и SEQ ID NO: 48 (таблица 3), которая может амплифицировать соседние области, включающие положение, в которое встроены гены. Полученные таким образом штаммы были названы Corynebacterium glutamicum KCCM11016P_Pspl13-zwf(C.gl13032), KCCM11016P_Pcj7-zwf(C.gl13032), KCCM10770P_Pspl13-zwf(C.gl13032), KCCM10770P_Pcj7-zwf(C.gl13032), CJ3P_Pspl13-zwf(C.gl13032) и CJ3P_Pcj7-zwf(C.gl13032).
Пример 2-2. Конструирование штаммов, продуцирующих триптофан, в которых усилен zwf, полученный из Corynebacterium glutamicum АТСС13869
Каждый из штаммов Corynebacterium glutamicum KCCM12218P (Корейский патент №10-2035844), продуцирующих L-триптофан, трансформировали векторами pDZTn-Pspl13-zwf(C.gl13869) и pDZTn-Pcj7-zwf(C.gl13869), полученными в примере 1-2, путем электропорации (Appl. Microbiol. Biotechnol. (1999) 52:541-545), и подвергали вторичному кроссоверу для получения таким образом штаммов, в которых каждый из Pspl13-zwf(C.gl13869) и Pcj7-zwf(C.gl13869) встраивали между генами транспозона. Манипуляцию с генами подтверждали путем геномного секвенирования и ПЦР с использованием праймеров в соответствии с SEQ ID NO: 47 и SEQ ID NO: 48 (таблица 3), которая может амплифицировать соседние области, включающие положение, в которое встроены гены. Полученные таким образом штаммы были названы Corynebacterium glutamicum KCCM12218P_Pspl13-zwf(C.gl13869) и KCCM12218P_Pcj7-zwf(C.gl13869).
Пример 2-3. Конструирование штаммов, продуцирующих лизин и триптофан, в которых усилен cscK, полученный из Escherichia coli
Каждый из штаммов Corynebacterium glutamicum KCCM11016P (Корейский патент №10-0159812), KCCM10770P (Корейский патент №10-0924065) и CJ3P (Binder et al. Genome Biology 2012, 13:R40), продуцирующих L-лизин, и штамм Corynebacterium glutamicum KCCM12218P (Корейский патент №10-2035844), продуцирующий L-триптофан, трансформировали векторами pDZTn-Pspl13-cscK(E.co) и pDZTn-Pcj7-cscK(E.co), полученными в примере 1-3, путем электропорации (Appl. Microbiol. Biotechnol. (1999) 52:541-545), и подвергали вторичному кроссоверу для получения таким образом штаммов, в которых каждый из Pspl13-cscK(E.co) и Pcj7-cscK(E.co) встраивали между генами транспозона. Манипуляцию с генами подтверждали путем геномного секвенирования и ПЦР с использованием праймеров в соответствии с SEQ ID NO: 47 и SEQ ID NO: 48 (таблица 3), которая может амплифицировать соседние области, включающие положение, в которое встроены гены. Полученные таким образом штаммы, продуцирующие лизин, были названы Corynebacterium glutamicum KCCM11016P_Pspl13-cscK(E.co), KCCM11016P_Pcj7-cscK(E.co), KCCM10770P_Pspl13-cscK(E.co), KCCM10770P_Pcj7-cscK(E.co), CJ3P_Pspl13-cscK(E.co) и CJ3P_Pcj7-cscK(E.co), и полученные таким образом штаммы, продуцирующие триптофан, были названы KCCM12218P_Pspl13-cscK(E.co) и KCCM12218P_Pcj7-cscK(E.co).
Пример 2-4. Конструирование штаммов, продуцирующих лизин, в которых усилены zwf полученный из Corynebacterium glutamicum ATCC13032, и cscK, полученный из Escherichia coli
Каждый из штаммов Corynebacterium glutamicum KCCM11016P (Корейский патент №10-0159812), KCCM10770P (Корейский патент №10-0924065) и CJ3P (Binder et al. Genome Biology 2012, 13:R40), продуцирующих L-лизин, трансформировали векторами pDZTn-Pspl13-zwf(C.gl13032)_Pcj7-cscK(E.co) и pDZTn-Pcj7-zwf(C.gl13032)_Pspl13-cscK(E.co), полученными в примере 1-4, путем электропорации (Appl. Microbiol. Biotechnol. (1999) 52:541-545), и подвергали вторичному кроссоверу для получения таким образом штаммов, в которых каждый из Pspl13-zwf(C.gl13032)_Pcj7-cscK(E.co) и Pcj7-zwf(C.gl13032)_Pspl13-cscK(E.co) встраивали между генами транспозона. Манипуляцию с генами подтверждали путем геномного секвенирования и ПЦР с использованием праймеров в соответствии с SEQ ID NO: 47 и SEQ ID NO: 48 (таблица 3), которая может амплифицировать соседние области, включающие положение, в которое встроены гены. Полученные таким образом штаммы были названы Corynebacterium glutamicum KCCM11016P_Pspll3-zwf(C.gll3032)_Pcj7-cscK(E.co), KCCM11016P_Pcj7-zwf(C.gl13032)_Pspl13-cscK(E.co), KCCM10770P_Pspl13-zwf(C.gl13032)_Pcj7-cscK(E.co), KCCM10770P_Pcj7-zwf(C.gl13032)_Pspl13-cscK(E.co), CJ3P_Pspl13-zwf(C.gl13032)_Pcj7-cscK(E.co) и CJ3P_Pcj7-zwf(C.gl13032)_Pspl13-cscK(E.co).
Пример 2-5. Конструирование штаммов, продуцирующих триптофан, в которых усилены zwf, полученный из Corynebacterium glutamicum АТСС13869, и cscK, полученный из Escherichia coli
Каждый из штаммов Corynebacterium glutamicum KCCM12218P (Корейский патент №10-2035844), продуцирующих L-триптофан, трансформировали векторами pDZTn-Pspl13-zwf(C.gl13869)_Pcj7-cscK(E.co) и pDZTn-Pcj7-zwf(C.gl13869)_Pspl13-cscK(E.co), полученными в примере 1-5, путем электропорации (Appl. Microbiol. Biotechnol. (1999) 52:541-545), и подвергали вторичному кроссоверу для получения таким образом штаммов, в которых каждый из Pspl13-zwf(C.gl13869)_Pcj7-cscK(E.co) и Pcj7-zwf(C.gl13869)_Pspl13-cscK(E.co) встраивали между генами транспозона. Манипуляцию с генами подтверждали путем геномного секвенирования и ПЦР с использованием праймеров в соответствии с SEQ ID NO: 47 и SEQ ID NO: 48 (таблица 3), которая может амплифицировать соседние области, включающие положение, в которое встроены гены. Полученные таким образом штаммы, продуцирующие L-триптофан, были названы Corynebacterium glutamicum KCCM12218P_Pspl13-zwf(C.gl13869) Pcj7-cscK(E.co) и KCCM12218P_Pcj7-zwf(C.gl13869)_Pspl13-cscK(E.co).
Пример 3. Сравнение способности продуцировать L-лизин или L-триптофан штаммами с усиленными zwf-, cscK
Пример 3-1. Сравнение способности продуцировать L-лизин штаммами с усиленными zwf, полученным из Corynebacterium glutamicum АТСС13032, и cscK, полученным из Escherichia coli
Каждый из штаммов, основанных на KCCM11016P, KCCM10770P и CJ3P, в которых zwf(C.gl13032) и cscK(E.co) одновременно усилены, полученных в примере 2-4, штаммов, основанных на KCCM11016P, KCCM10770P и CJ3P с усиленным zwf(C.gl13032), полученных в примере 2-1, и штаммов, основанных на KCCM11016P, KCCM10770P и CJ3P с усиленным cscK(E.co), полученных в примере 2-3, культивировали следующим образом для сравнения клеточной массы, способности потреблять сахар и способности продуцировать лизин.
Во-первых, каждый из штаммов высевали в колбу с угловыми перегородками объемом 250 мл, содержащую 25 мл среды для посева, и культивировали при 30°С в течение 20 часов при 200 об./мин при встряхивании. Затем 1 мл раствора среды для посева высевали в колбу с угловыми перегородками объемом 250 мл, содержащую 24 мл среды для продуцирования, и культивировали при 37°С в течение 42 часов при 200 об./мин при встряхивании. После завершения культивирования продукцию L-лизина измеряли при помощи ВЭЖХ (высокоэффективная жидкостная хроматография). Эксперимент повторяли 3 раза, и результаты культивирования (средние величины) представлены в таблицах 13, 14 и 15.
<Среда для посева (рН 7,0)>
20 г сахара-сырца, 10 г пептона, 5 г дрожжевого экстракта, 1,5 г мочевины, 4 г KH2PO4, 8 г K2HPO4, 0,5 г MgSO4⋅7H2O, 0,1 мг биотина, 1 мг тиамина-HCl, 22 мг пантотената кальция, 2 мг никотинамида (на основе 1 л дистиллированной воды).
<Среда для продуцирования (рН 7,0)>
45 г сахара-сырца, 15 г (NH4)2SO4, 10 г соевого белка, 10 г мелассы, 0,55 г KH2PO4, 0,6 г MgSO4⋅7H2O, 0,9 мг биотина, 4,5 мг тиамина-HCl, 4,5 мг пантотената кальция, 30 мг никотинамида, 9 мг MnSO4, 9 мг FeSO4, 0,45 мг ZnSO4, 0,45 мг CuSO4, 30 г СаСО3 (на основе 1 л дистиллированной воды).
Подтверждено то, что полученные выше штаммы, продуцирующие лизин, в которых zwf(C.gl13032) и cscK(E.co) индивидуально или одновременно усилены, демонстрировали эффект улучшения выхода на 1,2%Р-2,6%Р по сравнению с родительским штаммом KCCM11016P в соответствии с представленным в таблице 13 ниже. Поскольку 4 моль NADPH (восстановленный никотинамидадениндинуклеотидфосфат) требуется для получения 1 моль лизина в Corynebacterium, увеличение способности потреблять NADPH в штамме, продуцирующем лизин, тесно связано с увеличенным выходом (Kjeld Raunkjaer Kjeldsen et al., Biotechnol. Bioeng., 2009 Feb 1;102(2):583-97.). В описании настоящего изобретения способность потреблять NADPH улучшается путем индивидуального усиления гена zwf в штамме KCCM11016P, таким образом, подтверждая эффект улучшения продукции на 0,9 г/л. Кроме того, улучшающее действие 2,1 г/л, которое увеличивалось на 15,2% по сравнению с родительским штаммом KCCM11016P, подтверждали путем введения гена cscK(E.co), таким образом, внутриклеточная фруктоза, образуемая при использовании сахара-сырца, в Corynebacterium, может быть непосредственно использована. Наконец, путем одновременного усиления cscK и zwf максимизировалась редуцирующая способность посредством гена zwf таким образом, подтверждая то, что эффект улучшения выхода лизина значительно увеличивался по сравнению с индивидуальным усилением путем оценки штамма KCCM11016P_Pspl13-zwf(C.gl13032)_Pcj7-cscK(E.co).
Как представлено в таблицах 14 и 15, тот же самый усиливающий эффект генов был обнаружен в других штаммах, продуцирующих лизин, KCCM10770P и CJ3P. Когда одновременно усилены гены zwf (C.gl13032) и cscK(E.co) по сравнению с индивидуально усиленными штаммами, тогда результаты улучшенной продукции 1,9 г/л и 1,6 г/л, которые увеличивались на 22,1% и 27,1%, соответственно, обнаруживали по сравнению с родительским штаммом.
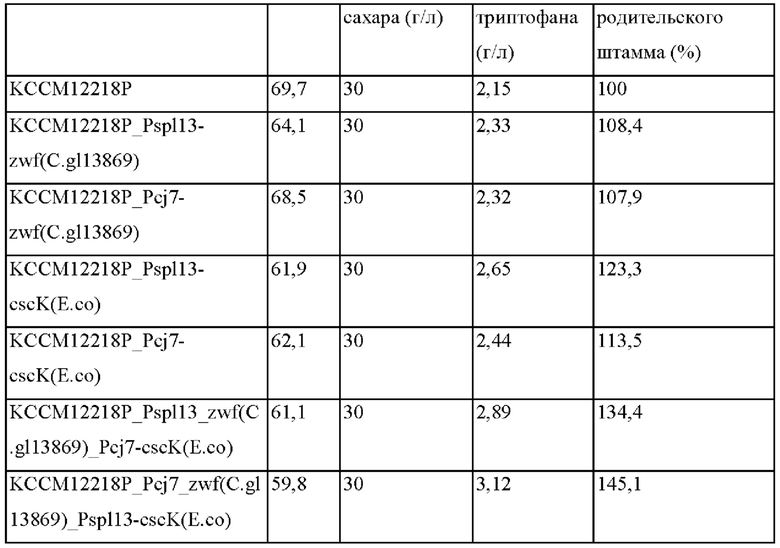
Пример 3-2. Сравнение способности продуцировать L-триптофан штаммами с усиленными zwf, полученным из Corynebacterium glutamicum АТСС13869, и cscK, полученным из Escherichia coli
Каждый из штаммов, основанных на KCCM12218P, в которых одновременно усилены zwf(C.gl13869) и cscK(E.co), полученных в примере 2-5, штаммов, основанных на KCCM12218P, с усиленным zwf(C.gl13869), полученных в примере 2-2, и штаммов, основанных на KCCM12218P, в которых усилены cscK(E.co), полученных в примере 2-3, культивировали следующим образом для сравнения клеточной массы, способности потреблять сахар и способности продуцировать триптофан.
Во-первых, каждый штамм высевали в колбу с угловыми перегородками объемом 250 мл, содержащую 25 мл среды для посева, и культивировали при 30°С в течение 20 часов при 200 об./мин при встряхивании. Затем 1 мл раствора среды для посева высевали в колбу с угловыми перегородками объемом 250 мл, содержащую 24 мл среды для продуцирования, и культивировали при 37°С в течение 42 часов при 200 об./мин при встряхивании. После завершения культивирования продукцию L-триптофана измеряли при помощи ВЭЖХ. Эксперимент повторяли 3 раза, и результаты культивирования (средние величины) представлены в таблице 16.
<Среда для посева (рН 7,0)>
20 г сахара-сырца, 10 г пептона, 5 г дрожжевого экстракта, 1,5 г мочевины, 4 г KH2PO4, 8 г K2HPO4, 0,5 г MgSO4⋅7H2O, 100 мкг биотина, 1000 мкг тиамина-НС1, 2000 мкг пантотената кальция, 2000 мкг никотинамида (на основе 1 л дистиллированной воды).
<Среда для продуцирования (рН 7,0)>
30 г сахара-сырца, 15 г (NH4)2SO4, 1,2 г MgSO4⋅7H2O, 1 г KH2PO4, 5 г дрожжевого экстракта, 900 мкг биотина, 4500 мкг тиамина-HCl, 4500 мкг пантотената кальция, 30 г СаСО3 (на основе 1 л дистиллированной воды).
Полученные выше штаммы, продуцирующие триптофан, в которых гены zwf(C.gl13869) и cscK(E.co) индивидуально усилены, продемонстрировали увеличение выхода триптофана на 0,58-1,67% по сравнению с родительским штаммом KCCM12218P в соответствии с представленным в таблице 16. В частности, усиление экспрессии гена cscK обладало большим действием в отношении улучшения выхода триптофана, чем усиление гена zwf и последнее возникает вследствие того, что сахар-сырец распадается внутри клетки, и часть продуцируемой фруктозы превращается в фруктозо-6-фосфат и вводится в процесс гликолиза без высвобождения за пределы клетки. Вследствие этого явления предполагается то, что высвобожденную фруктозу использовали в качестве предшественника триптофана без потребления запасов PEP (фосфоенолпирувата), который использовался во время притока фруктозы. Кроме того, предполагается то, что усиление выхода триптофана вследствие экспрессии гена zwf улучшало внутриклеточные концентрации PRPP (фосфорибозилпирофосфата) и Е4Р (енол-4-фосфата), которые использовались в качестве предшественников триптофана. В штаммах, в которых одновременно усилены два гена zwf и cscK, интегрированы факторы, улучшающие выход триптофана, и продукция триптофана улучшалась на 34%-45% по сравнению с родительским штаммом KCCM12218P, таким образом, подтверждая то, что выход триптофана значительно улучшался по сравнению с тем случаем, когда два гена усилены индивидуально.

В соответствии с вышеизложенным специалист в данной области техники, к которому относится описание настоящего изобретения, будет в состоянии понять то, что описание настоящего изобретения может быть воплощено в других специфических формах без изменения технической концепции или существенных характеристик в соответствии с описанием настоящего изобретения. В этой связи примеры раскрытых здесь воплощений приведены исключительно для иллюстративных целей и не должны быть истолкованы как ограничивающие объем в соответствии с описанием настоящего изобретения. Таким образом, объем в соответствии с описанием настоящего изобретения обозначен формулой изобретения, а не предшествующим описанием. Все изменения, которые осуществляются в значении и диапазоне эквивалентности формулы изобретения, должны быть охвачены в объеме в соответствии с описанием настоящего изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CJ CheilJedang Corporation
<120> МИКРООРГАНИЗМ РОДА CORYNEBACTERIUM, ПРОДУЦИРУЮЩИЙ L-АМИНОКИСЛОТЫ,
И СПОСОБ ПРОДУКЦИИ L-АМИНОКИСЛОТ С ЕГО ИСПОЛЬЗОВАНИЕМ
<130> OPA22014
<150> KR 10-2021-0030087
<151> 2021-03-08
<160> 48
<170> KoPatentIn 3.0
<210> 1
<211> 484
<212> PRT
<213> Artificial Sequence
<220>
<223> zwf (C.gl 13032)
<400> 1
Met Val Ile Phe Gly Val Thr Gly Asp Leu Ala Arg Lys Lys Leu Leu
1 5 10 15
Pro Ala Ile Tyr Asp Leu Ala Asn Arg Gly Leu Leu Pro Pro Gly Phe
20 25 30
Ser Leu Val Gly Tyr Gly Arg Arg Glu Trp Ser Lys Glu Asp Phe Glu
35 40 45
Lys Tyr Val Arg Asp Ala Ala Ser Ala Gly Ala Arg Thr Glu Phe Arg
50 55 60
Glu Asn Val Trp Glu Arg Leu Ala Glu Gly Met Glu Phe Val Arg Gly
65 70 75 80
Asn Phe Asp Asp Asp Ala Ala Phe Asp Asn Leu Ala Ala Thr Leu Lys
85 90 95
Arg Ile Asp Lys Thr Arg Gly Thr Ala Gly Asn Trp Ala Tyr Tyr Leu
100 105 110
Ser Ile Pro Pro Asp Ser Phe Thr Ala Val Cys His Gln Leu Glu Arg
115 120 125
Ser Gly Met Ala Glu Ser Thr Glu Glu Ala Trp Arg Arg Val Ile Ile
130 135 140
Glu Lys Pro Phe Gly His Asn Leu Glu Ser Ala His Glu Leu Asn Gln
145 150 155 160
Leu Val Asn Ala Val Phe Pro Glu Ser Ser Val Phe Arg Ile Asp His
165 170 175
Tyr Leu Gly Lys Glu Thr Val Gln Asn Ile Leu Ala Leu Arg Phe Ala
180 185 190
Asn Gln Leu Phe Glu Pro Leu Trp Asn Ser Asn Tyr Val Asp His Val
195 200 205
Gln Ile Thr Met Ala Glu Asp Ile Gly Leu Gly Gly Arg Ala Gly Tyr
210 215 220
Tyr Asp Gly Ile Gly Ala Ala Arg Asp Val Ile Gln Asn His Leu Ile
225 230 235 240
Gln Leu Leu Ala Leu Val Ala Met Glu Glu Pro Ile Ser Phe Val Pro
245 250 255
Ala Gln Leu Gln Ala Glu Lys Ile Lys Val Leu Ser Ala Thr Lys Pro
260 265 270
Cys Tyr Pro Leu Asp Lys Thr Ser Ala Arg Gly Gln Tyr Ala Ala Gly
275 280 285
Trp Gln Gly Ser Glu Leu Val Lys Gly Leu Arg Glu Glu Asp Gly Phe
290 295 300
Asn Pro Glu Ser Thr Thr Glu Thr Phe Ala Ala Cys Thr Leu Glu Ile
305 310 315 320
Thr Ser Arg Arg Trp Ala Gly Val Pro Phe Tyr Leu Arg Thr Gly Lys
325 330 335
Arg Leu Gly Arg Arg Val Thr Glu Ile Ala Val Val Phe Lys Asp Ala
340 345 350
Pro His Gln Pro Phe Asp Gly Asp Met Thr Val Ser Leu Gly Gln Asn
355 360 365
Ala Ile Val Ile Arg Val Gln Pro Asp Glu Gly Val Leu Ile Arg Phe
370 375 380
Gly Ser Lys Val Pro Gly Ser Ala Met Glu Val Arg Asp Val Asn Met
385 390 395 400
Asp Phe Ser Tyr Ser Glu Ser Phe Thr Glu Glu Ser Pro Glu Ala Tyr
405 410 415
Glu Arg Leu Ile Leu Asp Ala Leu Leu Asp Glu Ser Ser Leu Phe Pro
420 425 430
Thr Asn Glu Glu Val Glu Leu Ser Trp Lys Ile Leu Asp Pro Ile Leu
435 440 445
Glu Ala Trp Asp Ala Asp Gly Glu Pro Glu Asp Tyr Pro Ala Gly Thr
450 455 460
Trp Gly Pro Lys Ser Ala Asp Glu Met Leu Ser Arg Asn Gly His Thr
465 470 475 480
Trp Arg Arg Pro
<210> 2
<211> 1545
<212> DNA
<213> Artificial Sequence
<220>
<223> zwf (C.gl 13032)
<400> 2
gtgagcacaa acacgacccc ctccagctgg acaaacccac tgcgcgaccc gcaggataaa 60
cgactccccc gcatcgctgg cccttccggc atggtgatct tcggtgtcac tggcgacttg 120
gctcgaaaga agctgctccc cgccatttat gatctagcaa accgcggatt gctgccccca 180
ggattctcgt tggtaggtta cggccgccgc gaatggtcca aagaagactt tgaaaaatac 240
gtacgcgatg ccgcaagtgc tggtgctcgt acggaattcc gtgaaaatgt ttgggagcgc 300
ctcgccgagg gtatggaatt tgttcgcggc aactttgatg atgatgcagc tttcgacaac 360
ctcgctgcaa cactcaagcg catcgacaaa acccgcggca ccgccggcaa ctgggcttac 420
tacctgtcca ttccaccaga ttccttcaca gcggtctgcc accagctgga gcgttccggc 480
atggctgaat ccaccgaaga agcatggcgc cgcgtgatca tcgagaagcc tttcggccac 540
aacctcgaat ccgcacacga gctcaaccag ctggtcaacg cagtcttccc agaatcttct 600
gtgttccgca tcgaccacta tttgggcaag gaaacagttc aaaacatcct ggctctgcgt 660
tttgctaacc agctgtttga gccactgtgg aactccaact acgttgacca cgtccagatc 720
accatggctg aagatattgg cttgggtgga cgtgctggtt actacgacgg catcggcgca 780
gcccgcgacg tcatccagaa ccacctgatc cagctcttgg ctctggttgc catggaagaa 840
ccaatttctt tcgtgccagc gcagctgcag gcagaaaaga tcaaggtgct ctctgcgaca 900
aagccgtgct acccattgga taaaacctcc gctcgtggtc agtacgctgc cggttggcag 960
ggctctgagt tagtcaaggg acttcgcgaa gaagatggct tcaaccctga gtccaccact 1020
gagacttttg cggcttgtac cttagagatc acgtctcgtc gctgggctgg tgtgccgttc 1080
tacctgcgca ccggtaagcg tcttggtcgc cgtgttactg agattgccgt ggtgtttaaa 1140
gacgcaccac accagccttt cgacggcgac atgactgtat cccttggcca aaacgccatc 1200
gtgattcgcg tgcagcctga tgaaggtgtg ctcatccgct tcggttccaa ggttccaggt 1260
tctgccatgg aagtccgtga cgtcaacatg gacttctcct actcagaatc cttcactgaa 1320
gaatcacctg aagcatacga gcgcctcatt ttggatgcgc tgttagatga atccagcctc 1380
ttccctacca acgaggaagt ggaactgagc tggaagattc tggatccaat tcttgaagca 1440
tgggatgccg atggagaacc agaggattac ccagcgggta cgtggggtcc aaagagcgct 1500
gatgaaatgc tttcccgcaa cggtcacacc tggcgcaggc cataa 1545
<210> 3
<211> 514
<212> PRT
<213> Artificial Sequence
<220>
<223> zwf(C.gl 13869)
<400> 3
Met Ser Thr Asn Thr Thr Pro Thr Ser Trp Thr Asn Pro Leu Arg Asp
1 5 10 15
Pro Gln Asp Lys Arg Leu Pro Arg Ile Ala Gly Pro Ser Gly Met Val
20 25 30
Ile Phe Gly Val Thr Gly Asp Leu Ala Arg Lys Lys Leu Leu Pro Ala
35 40 45
Ile Tyr Asp Leu Ala Asn Arg Gly Leu Leu Pro Pro Gly Phe Ser Leu
50 55 60
Val Gly Tyr Gly Arg Arg Glu Trp Ser Lys Glu Asp Phe Glu Lys Tyr
65 70 75 80
Val Arg Asp Ala Ala Ser Ala Gly Ala Arg Thr Glu Phe Arg Glu Asn
85 90 95
Val Trp Glu Arg Leu Ala Glu Gly Met Glu Phe Val Arg Gly Asn Phe
100 105 110
Asp Asp Asp Ala Ala Phe Asp Asn Leu Ala Ala Thr Leu Lys Arg Ile
115 120 125
Asp Lys Thr Arg Gly Thr Ala Gly Asn Trp Ala Tyr Tyr Leu Ser Ile
130 135 140
Pro Pro Asp Ser Phe Thr Ala Val Cys His Gln Leu Glu Arg Ser Gly
145 150 155 160
Met Ala Glu Ser Thr Glu Glu Ala Trp Arg Arg Val Ile Ile Glu Lys
165 170 175
Pro Phe Gly His Asn Leu Glu Ser Ala His Glu Leu Asn Gln Leu Val
180 185 190
Asn Ala Val Phe Pro Glu Ser Ser Val Phe Arg Ile Asp His Tyr Leu
195 200 205
Gly Lys Glu Thr Val Gln Asn Ile Leu Ala Leu Arg Phe Ala Asn Gln
210 215 220
Leu Phe Glu Pro Leu Trp Asn Ser Asn Tyr Val Asp His Val Gln Ile
225 230 235 240
Thr Met Ala Glu Asp Ile Gly Leu Gly Gly Arg Ala Gly Tyr Tyr Asp
245 250 255
Gly Ile Gly Ala Ala Arg Asp Val Ile Gln Asn His Leu Ile Gln Leu
260 265 270
Leu Ala Leu Val Ala Met Glu Glu Pro Ile Ser Phe Val Pro Ala Gln
275 280 285
Leu Gln Ala Glu Lys Ile Lys Val Leu Ser Ala Thr Lys Pro Cys Tyr
290 295 300
Pro Leu Asp Lys Thr Ser Ala Arg Gly Gln Tyr Ala Ala Gly Trp Gln
305 310 315 320
Gly Ser Glu Leu Val Lys Gly Leu Arg Glu Glu Asp Gly Phe Asn Pro
325 330 335
Glu Ser Thr Thr Glu Thr Phe Ala Ala Cys Thr Leu Glu Ile Thr Ser
340 345 350
Arg Arg Trp Ala Gly Val Pro Phe Tyr Leu Arg Thr Gly Lys Arg Leu
355 360 365
Gly Arg Arg Val Thr Glu Ile Ala Val Val Phe Lys Asp Ala Pro His
370 375 380
Gln Pro Phe Asp Gly Asp Met Thr Val Ser Leu Gly Gln Asn Ala Ile
385 390 395 400
Val Ile Arg Val Gln Pro Asp Glu Gly Val Leu Ile Arg Phe Gly Ser
405 410 415
Lys Val Pro Gly Ser Ala Met Glu Val Arg Asp Val Asn Met Asp Phe
420 425 430
Ser Tyr Ser Glu Ser Phe Thr Glu Glu Ser Pro Glu Ala Tyr Glu Arg
435 440 445
Leu Ile Leu Asp Ala Leu Leu Asp Glu Ser Ser Leu Phe Pro Thr Asn
450 455 460
Glu Glu Val Glu Leu Ser Trp Lys Ile Leu Asp Pro Ile Leu Glu Ala
465 470 475 480
Trp Asp Ala Asp Gly Glu Pro Glu Asp Tyr Pro Ala Gly Thr Trp Gly
485 490 495
Pro Lys Ser Ala Asp Glu Met Leu Ser Arg Asn Gly His Thr Trp Arg
500 505 510
Arg Pro
<210> 4
<211> 1545
<212> DNA
<213> Artificial Sequence
<220>
<223> zwf(C.gl 13869)
<400> 4
gtgagcacaa acacgacccc caccagctgg acaaacccac tgcgcgaccc gcaggataaa 60
cgactccccc gcatcgctgg cccttccggc atggtgatct tcggtgtcac tggcgacttg 120
gctcgaaaga agctgcttcc cgccatttat gatctagcaa accgcggatt gctgccccca 180
ggattctcgt tggtaggtta cggccgccgc gaatggtcca aagaagactt tgaaaaatac 240
gtacgcgatg ccgcaagtgc tggtgctcgt acggaatttc gtgaaaatgt ttgggagcgc 300
ctcgccgagg gtatggaatt tgttcgcggc aactttgatg atgatgcagc tttcgacaac 360
ctcgctgcaa cactcaagcg catcgacaaa acccgcggca ccgccggcaa ctgggcttac 420
tacctgtcca ttccaccaga ttccttcaca gcggtctgcc accagctgga gcgttccggc 480
atggctgaat ccaccgaaga agcatggcgc cgcgtgatca tcgagaagcc tttcggccac 540
aacctcgaat ccgcacacga gctcaaccag ctggtcaacg cagtcttccc agaatcttct 600
gtgttccgca tcgaccacta tttgggcaag gaaacagttc aaaacatcct ggctctgcgt 660
tttgctaacc agctgtttga gccactgtgg aactccaact acgttgacca cgtccagatc 720
accatggctg aagatatcgg cttgggtgga cgtgctggtt actacgacgg catcggtgca 780
gcccgcgacg tcatccagaa ccacctgatc cagctcttgg ctctggttgc catggaagaa 840
ccaatttctt tcgtgccagc gcagctgcag gcagaaaaga tcaaggtgct ctctgcgaca 900
aagccatgct acccattgga taaaacctcc gctcgtggtc agtacgctgc cggttggcag 960
ggctctgagt tagtcaaggg acttcgcgaa gaagatggct tcaaccctga gtccaccact 1020
gagacttttg cggcttgtac cttagagatc acgtctcgtc gctgggctgg tgtgccgttc 1080
tacctgcgca ccggtaagcg tcttggtcgc cgtgttactg agattgccgt ggtgtttaaa 1140
gacgcaccac accagccttt cgacggcgac atgactgtat cccttggcca aaacgccatc 1200
gtgattcgcg tgcagcctga tgaaggtgtg ctcatccgct tcggttccaa ggttccaggt 1260
tctgccatgg aagtccgtga cgtcaacatg gacttctcct actcagaatc cttcactgaa 1320
gaatcacctg aagcatacga gcgcctcatt ttggatgcgc tgttggatga atccagcctc 1380
ttccccacca acgaggaagt ggaactgagc tggaagattc tggatccaat tcttgaagca 1440
tgggacgccg atggagaacc agaggattac ccagcaggta cgtggggtcc aaagagcgct 1500
gatgaaatgc tttcccgcaa cggtcacacc tggcgcaggc cataa 1545
<210> 5
<211> 304
<212> PRT
<213> Artificial Sequence
<220>
<223> cscK(E.coli)
<400> 5
Met Ser Ala Lys Val Trp Val Leu Gly Asp Ala Val Val Asp Leu Leu
1 5 10 15
Pro Glu Ser Asp Gly Arg Leu Leu Pro Cys Pro Gly Gly Ala Pro Ala
20 25 30
Asn Val Ala Val Gly Ile Ala Arg Leu Gly Gly Thr Ser Gly Phe Ile
35 40 45
Gly Arg Val Gly Asp Asp Pro Phe Gly Ala Leu Met Gln Arg Thr Leu
50 55 60
Leu Thr Glu Gly Val Asp Ile Thr Tyr Leu Lys Gln Asp Glu Cys His
65 70 75 80
Arg Thr Ser Thr Val Leu Val Asp Leu Asn Asp Gln Gly Glu Arg Ser
85 90 95
Phe Thr Phe Met Val Arg Pro Ser Ala Asp Leu Phe Leu Glu Thr Thr
100 105 110
Asp Leu Pro Cys Trp Arg His Gly Glu Trp Leu His Leu Cys Ser Ile
115 120 125
Ala Leu Ser Ala Glu Pro Ser Arg Thr Ser Ala Phe Thr Ala Met Thr
130 135 140
Ala Ile Arg His Ala Gly Gly Phe Val Ser Phe Asp Pro Asn Ile Arg
145 150 155 160
Glu Asp Leu Trp Gln Asp Glu His Leu Leu Arg Leu Cys Leu Arg Gln
165 170 175
Ala Leu Gln Leu Ala Asp Val Val Lys Leu Ser Glu Glu Glu Trp Arg
180 185 190
Leu Ile Ser Gly Lys Thr Gln Asn Asp Gln Asp Ile Cys Ala Leu Ala
195 200 205
Lys Glu Tyr Glu Ile Ala Met Leu Leu Val Thr Lys Gly Ala Glu Gly
210 215 220
Val Val Val Cys Tyr Arg Gly Gln Val His His Phe Ala Gly Met Ser
225 230 235 240
Val Asn Cys Val Asp Ser Thr Gly Ala Gly Asp Ala Phe Val Ala Gly
245 250 255
Leu Leu Thr Gly Leu Ser Ser Thr Gly Leu Ser Thr Asp Glu Arg Glu
260 265 270
Met Arg Arg Ile Ile Asp Leu Ala Gln Arg Cys Gly Ala Leu Ala Val
275 280 285
Thr Ala Lys Gly Ala Met Thr Ala Leu Pro Cys Arg Gln Glu Leu Glu
290 295 300
<210> 6
<211> 915
<212> DNA
<213> Artificial Sequence
<220>
<223> cscK(E.coli)
<400> 6
atgtcagcca aagtatgggt tttaggggat gcggtcgtag atctcttgcc agaatcagac 60
gggcgcctac tgccttgtcc tggcggcgcg ccagctaacg ttgcggtggg aatcgccaga 120
ttaggcggaa caagtgggtt tataggtcgg gtgggggatg atccttttgg tgcgttaatg 180
caaagaacgc tgctaactga gggagtcgat atcacgtatc tgaagcaaga tgaatgtcac 240
cggacatcca cggtgcttgt cgatctgaac gatcaagggg aacgttcatt tacgtttatg 300
gtccgcccca gtgccgatct ttttttagag acgacagact tgccctgctg gcgacatggc 360
gaatggttac atctctgttc aattgcgttg tctgccgagc cttcgcgtac cagcgcattt 420
actgcgatga cggcgatccg gcatgccgga ggttttgtca gcttcgatcc taatattcgt 480
gaagatctat ggcaagacga gcatttgctc cgcttgtgtt tgcggcaggc gctacaactg 540
gcggatgtcg tcaagctctc ggaagaagaa tggcgactta tcagtggaaa aacacagaac 600
gatcaggata tatgcgccct ggcaaaagag tatgagatcg ccatgctgtt ggtgactaaa 660
ggtgcagaag gggtggtggt ctgttatcga ggacaagttc accattttgc tggaatgtct 720
gtgaattgtg tcgatagcac gggggcggga gatgcgttcg ttgccgggtt actcacaggt 780
ctgtcctcta cgggattatc tacagatgag agagaaatgc gacgaattat cgatctcgct 840
caacgttgcg gagcgcttgc agtaacggcg aaaggggcaa tgacagcgct gccatgtcga 900
caagaactgg aatag 915
<210> 7
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 1
<400> 7
gcagaaggaa tgagttcctc ggcgcttcat gtcaacaatc 40
<210> 8
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 2
<400> 8
tgttttgatc tcctccaata atc 23
<210> 9
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 3
<400> 9
tattggagga gatcaaaaca gtgagcacaa acacg 35
<210> 10
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 4
<400> 10
gttattagat gtcgggccca ttatggcctg cgccaggtgt 40
<210> 11
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 5
<400> 11
gcagaaggaa tgagttcctc agaaacatcc cagcgctact 40
<210> 12
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 6
<400> 12
gagtgtttcc tttcgttggg tac 23
<210> 13
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 7
<400> 13
cccaacgaaa ggaaacactc gtgagcacaa acacg 35
<210> 14
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 8
<400> 14
gttattagat gtcgggccca ttatggcctg cgccaggtgt 40
<210> 15
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 9
<400> 15
gcagaaggaa tgagttcctc ggcgcttcat gtcaacaatc 40
<210> 16
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 10
<400> 16
tgttttgatc tcctccaata atc 23
<210> 17
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 11
<400> 17
tattggagga gatcaaaaca gtgagcacaa acacg 35
<210> 18
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 12
<400> 18
gttattagat gtcgggccca ttatggcctg cgccaggtgt 40
<210> 19
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 13
<400> 19
gcagaaggaa tgagttcctc agaaacatcc cagcgctact 40
<210> 20
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 14
<400> 20
gagtgtttcc tttcgttggg tac 23
<210> 21
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 15
<400> 21
cccaacgaaa ggaaacactc gtgagcacaa acacg 35
<210> 22
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 16
<400> 22
gttattagat gtcgggccca ttatggcctg cgccaggtgt 40
<210> 23
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 17
<400> 23
gcagaaggaa tgagttcctc ggcgcttcat gtcaacaatc 40
<210> 24
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 18
<400> 24
tgttttgatc tcctccaata atc 23
<210> 25
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 19
<400> 25
tattggagga gatcaaaaca atgtcagcca aagta 35
<210> 26
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 20
<400> 26
gttattagat gtcgggccca ctattccagt tcttgtcgac 40
<210> 27
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 21
<400> 27
gcagaaggaa tgagttcctc agaaacatcc cagcgctact 40
<210> 28
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 22
<400> 28
gagtgtttcc tttcgttggg tac 23
<210> 29
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 23
<400> 29
cccaacgaaa ggaaacactc atgtcagcca aagtatgggt 40
<210> 30
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 24
<400> 30
gttattagat gtcgggccca ctattccagt tcttgtcgac 40
<210> 31
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 25
<400> 31
gcagaaggaa tgagttcctc ggcgcttcat gtcaacaatc 40
<210> 32
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 26
<400> 32
ggatgtttct ttatggcctg cgcca 25
<210> 33
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 27
<400> 33
caggccataa agaaacatcc cagcg 25
<210> 34
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 28
<400> 34
gttattagat gtcgggccca ctattccagt tcttgtcgac 40
<210> 35
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 29
<400> 35
gcagaaggaa tgagttcctc agaaacatcc cagcgctact 40
<210> 36
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 30
<400> 36
atgaagcgcc ttatggcctg cgcca 25
<210> 37
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 31
<400> 37
caggccataa ggcgcttcat gtcaa 25
<210> 38
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 32
<400> 38
gttattagat gtcgggccca ctattccagt tcttgtcgac 40
<210> 39
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 33
<400> 39
gcagaaggaa tgagttcctc ggcgcttcat gtcaacaatc 40
<210> 40
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 34
<400> 40
ggatgtttct ttatggcctg cgcca 25
<210> 41
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 35
<400> 41
caggccataa agaaacatcc cagcg 25
<210> 42
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 36
<400> 42
gttattagat gtcgggccca ctattccagt tcttgtcgac 40
<210> 43
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 37
<400> 43
gcagaaggaa tgagttcctc agaaacatcc cagcgctact 40
<210> 44
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 38
<400> 44
atgaagcgcc ttatggcctg cgcca 25
<210> 45
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 39
<400> 45
caggccataa ggcgcttcat gtcaa 25
<210> 46
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 40
<400> 46
gttattagat gtcgggccca ctattccagt tcttgtcgac 40
<210> 47
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 41
<400> 47
acgacgctgg tatttctccc 20
<210> 48
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер 42
<400> 48
tgattgtcga tatgaccggg 20
<---
Изобретение относится к биотехнологии. Предложен микроорганизм рода Corynebacterium, продуцирующий L-аминокислоту, в котором активность глюкозо-6-фосфат-1-дегидрогеназы и фруктокиназы усилена по сравнению с его эндогенной активностью, где L-аминокислота представляет собой L-лизин или L-триптофан. Также предложены способ получения L-аминокислоты с использованием указанного микроорганизма и применение указанного микроорганизма для получения L-аминокислоты, где L-аминокислота представляет собой L-лизин или L-триптофан. Изобретение обеспечивает получение L-лизина или L-триптофана с увеличенным выходом. 3 н. и 4 з.п. ф-лы, 16 табл., 3 пр.
1. Микроорганизм рода Corynebacterium, продуцирующий L-аминокислоту, в котором активность глюкозо-6-фосфат-1-дегидрогеназы и фруктокиназы усилена по сравнению с его эндогенной активностью, где L-аминокислота представляет собой L-лизин или L-триптофан.
2. Микроорганизм по п. 1, где глюкозо-6-фосфат-1-дегидрогеназа состоит из аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 3.
3. Микроорганизм по п. 1, где фруктокиназа состоит из аминокислотной последовательности SEQ ID NO: 5.
4. Микроорганизм по п. 1, где микроорганизм рода Corynebacterium представляет собой Corynebacterium glutamicum.
5. Способ получения L-аминокислоты, включающий культивирование микроорганизма по любому из пп. 1-4 в среде; и выделение L-аминокислоты из микроорганизма или среды, где L-аминокислота представляет собой L-лизин или L-триптофан.
6. Способ по п. 5, где микроорганизм рода Corynebacterium представляет собой Corynebacterium glutamicum.
7. Применение микроорганизма по любому из пп. 1-4 для получения L-аминокислоты, где L-аминокислота представляет собой L-лизин или L-триптофан.
| WO 2012134253 A2, 04.10.2012 | |||
| BECKER | |||
| J | |||
| et al., Metabolic flux engineering of 1-lysine production in Corynebacterium glutamicum-over expression and modification of G6P dehydrogenase | |||
| Journal of Biotechnology | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Способ получения нерастворимых лаков основных красителей в субстанции и на волокнах | 1923 |
|
SU132A1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Устройство для смены карт и прижима их к игольной доске жаккардовой машины | 1953 |
|
SU98969A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
Авторы
Даты
2024-08-12—Публикация
2022-02-21—Подача