Область техники, к которой относится изобретение
Изобретение относится к области органического синтеза, в частности к способу синтеза 3-арилиндан-1-онов методом суперэлектрофильной активации в трифторметансульфоновой кислоте 3-арилакрилонитрилов (коричных нитрилов).
Уровень техники
Благодаря высокой протонирующей способности и низкой нуклеофильности, суперкислоты Бренстеда находят широкое применение в современном органическом синтезе [1]. В таких средах происходит «суперэлектрофильная активация» органических соединений, которая заключается в протонировании основных центров молекул с образованием высокореакционноспособных катионных интермедиатов [2]. Реакция Фриделя-Крафтса, проводимая с применением кислотных катализаторов - кислот Бренстеда или кислот Льюиса, стала классическим методом органического синтеза.
В данном изобретении кислоты Бренстеда применяются для суперэлектрофильной активации 3-арилакрилонитрилов (или коричных нитрилов) в реакции Фриделя-Крафтса с ароматическими соединениями, т.е. с π-нуклеофилами (схема 1).

В результате, протонирование двойной связи исходных 3-арилакрилонитрилов (или коричных нитрилов) приводит к образованию дикатионных интермедиатов А [3], которые реагируют с ароматическими соединениями (схема 2). На данной стадии формируется 3,3-диарильный катион В, обладающий реакционноспособным электрофильным центром, может подвергаться последующей циклизации, если ароматическое кольцо обладает достаточной нуклеофильностью. Это приводит к катиону С, который является N-протонированной формой соответствующего имина. Гидролиз реакционной смеси в конечном итоге дает инданоны 2. Следует отметить, что инданоны являются очень важными соединениями благодаря их биологической активности [4-6].
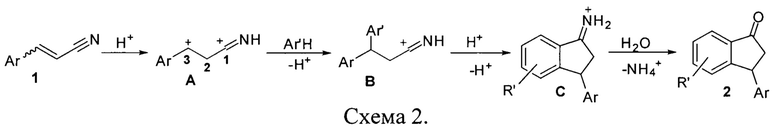
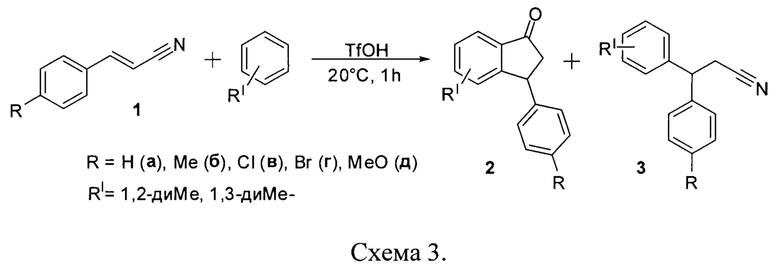
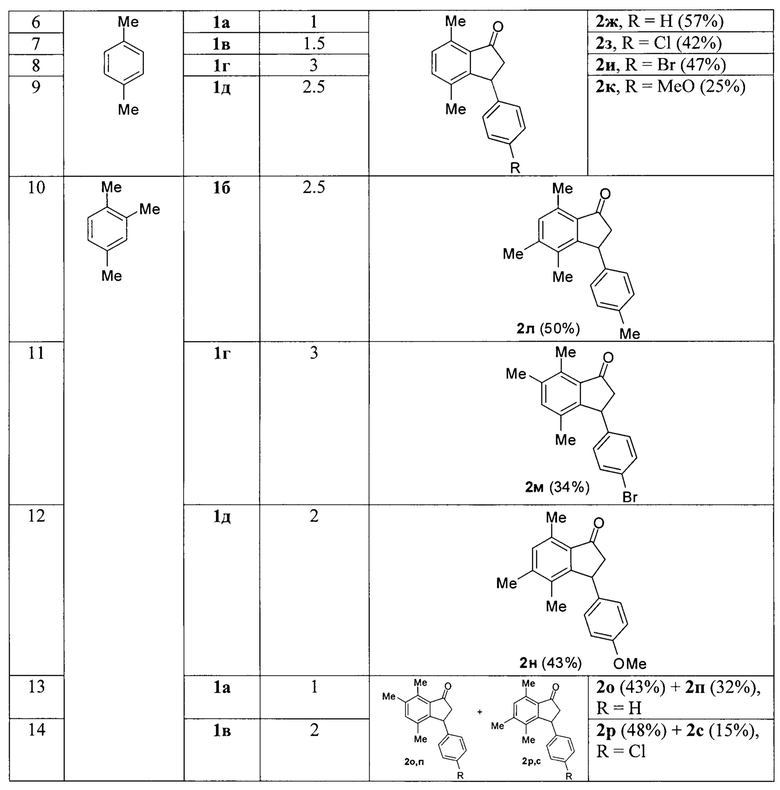
В данном изобретении предлагается проведение протонирования 3-арилакрилонитрилов (или коричных нитрилов) в растворе суперкислоты, что приводит к образованию интермедиатов катионового типа, которые способны взаимодействовать с ароматическими соединениями (Схема 2). В результате данного процесса происходит образование индан-1-онов 2 (Схема 2). При контактировании с нуклеофилами, обладающими относительно низкой π-нуклеофильностью (ароматическими соединенями, в которых R=1,2-диМе-, 1,3-диМе-), реакция осложнялась параллельным процессом образования 3,3-диарилпропилнитрилов как например изображено на схеме 3.
Наиболее близкими предлагаемому способу получения индан-1-оновявляются:
Аналог 1: Rh(I)-катализированное гидроацилирование алкеналей с использованием ионных жидкостей (IL) в качестве реакционной среды, давало циклопентанон или производные циклогептенона с хорошими выходами (схема 4). Так, использование комплекса Rh(I) [Rh(dppe)]ClO4, полученного из [Rh(nbd)-(dppe)]ClO4 в атмосфере водорода при гидроацилировании 2-(1-фенилвинил)бензальднгида с использованием [BMI][NTf2] в качестве реакционной среды приводило к 3-фенилинденону с количественным выходом (схема 2) [7].
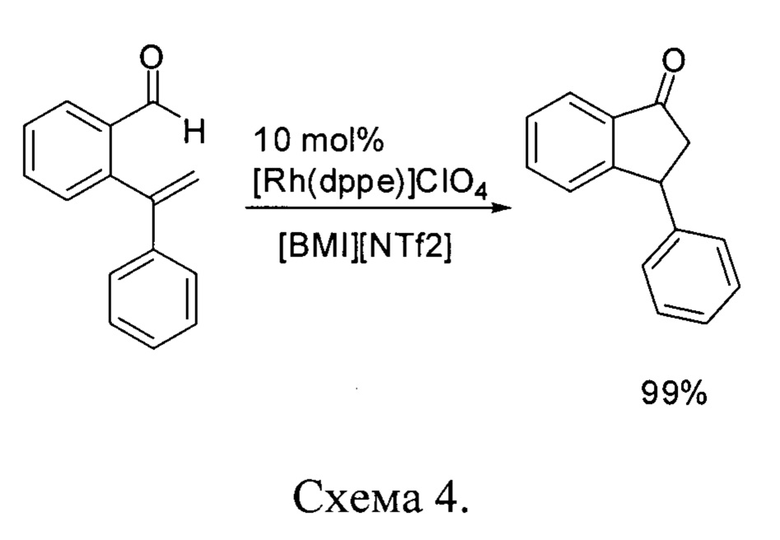
Реакция проходит за час с количественным выходом (>99%), но проводится с использованием дорогостоящего рутениевого катализатора в ионной жидкости в атмосфере водорода.
Аналог 2: Двухстадийный синтез включающий альдольные конденсации производного ацетофенона с бензальдегидами с последующей кислотно-опосредованной циклизацией (схема 5) [8].
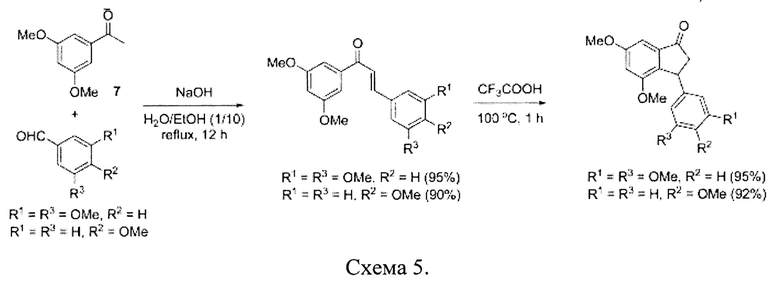
Данный способ подходит для синтеза различных замещенных инданонов, однако происходит образование двух изомеров: 4- и 6-метокси. 6-метоксиизомер является преобладающим продуктом (88%), но некоторое количество 4-изомера обнаружено с помощью ЯМР-спектроскопии (<3%). Разделение двух компонентов требовало тщательной колоночной хроматографии (CH2Cl2, силикагель). Кроме того, обе стадии проходят при сильном нагревании, а на первую стадию затрачивается 12 часов.
Аналог 3: 3-Фенилинданон получен из 2-бензил-1-этинилбензола, с выходом 84% в присутствии [IPrAuCl]/[AgNTf2] (5 мол.%) и N-оксида 8-метилхинолина (3 экв.) в горячем дихлорэтане (80°С, 3 часа) (схема 6). Это превращение проходит через образование промежуточного а-карбонил-золота-карбеноида, который подвергается последующей вставке С-Н с получением 3-фенилинданона [9].

Эта реакция применима лишь для синтеза незамещенного 3-фенилинданона и проводится в течение длительного времени при высокой температуре с использованием дорогостоящего катализатора.
Раскрытие изобретения
Предложенная технология получения 3-арилиндан-1-онов отличается использованием на ключевой стадии нестандартного метода суперэлектрофильной активации 3-арилакрилонитрилов (или коричных нитрилов), что позволяет в одну стадию с высоким выходом получить требуемую молекулярную структуру 3-арилиндан-1-онов. Но реакция гидроарилирования в случаях 1,2-диМе-бензола, 1,3-диМе-бензола осложняется побочными процессами образования 3,3-диарилпропилнитрилов, которые снижают выход конечного продукта.
Целью настоящего изобретения является разработка способа синтеза 3-арилиндан-1-онов в ходе реакции гидроарилирования двойной углеродной связи 3-арилакрилонитрилов (или коричных нитрилов). Как указывалось выше, протонирование 3-арилакрилонитрилов при растворении в суперкислоте приводит к образованию катионов, которые вступают в реакцию электрофильного замещения с ароматическими соединениями (Схема 2). В результате данного процесса происходит образование 3-арилиндан-1-онов. При контактировании с ароматическими соединениями, обладающими относительно низкой π-нуклеофильностью (схема 3) (ароматическими соединенями, в которых R=1,2-диМе, 1,3-диМе-) осложнялось процессами образования побочных продуктов реакции - 3,3-диарилпропилнитрилов (схема 3, таблица 1).

Термин ароматический относительно алкилируемых соединений включает замещенные производные бензола. Замещенные ароматические соединения, которые могут здесь алкилироваться, должны обладать по крайней мере одним водородным атомом, непосредственно связанным с ароматическим ядром. Ароматическое кольцо может быть замещено одним-тремя метилами, которые не мешают реакции алкилирования/гидроарилирования.
Приемлемые метилзамещенные 1,2-диметилбензол; 1,3-диметилбензол; 1,4-диметилбензол и 1,2,4-триметилбензол (высокоπ-нуклеофильные соединения).
Правдоподобный механизм образования 3,3-диарилпропилнитрилов представлен на схеме 7[10]. Взаимодействие N,С-дипротонированного вида В с аренами происходит в электрофильном центре С3 дикатиона В, приводя к N-протонированной форме пропаннитрила С [11]. Гидролиз последнего дает нитрил 3.

Технический результат, получаемый при реализации данного изобретения, заключается в повышении эффективности синтеза и конечного выхода целевого продукта реакции гидроарилирования, снижении себестоимости растворного синтеза и в исключении металло-органических катализиторов, а также реакций, требующих применения высокотоксичных реагентов.
Указанный технический результат достигается тем, что процесс осуществляется в 4 стадии:
1) Смешение суперкислоты и ароматического реагента
2) Порционное добавление/прикапывание исходного 3-арилакрилонитрила (или коричного нитрила) 1 таким образом, чтобы он всегда находился в избытке ароматического соединения и суперкислоты.
3) Выдерживание реакционной смеси/раствора в необходимом температурном диапазоне 20°С в течение периода времени, не менее 1 часа.
4) Разложение реакционной смеси водой, экстракция и очистка продуктов.
Заявляемое изобретение имеет следующие отличительные признаки и преимущества:
1. Использование в качестве исходных соединений коммерчески доступных и легко синтезируемых 3-арилакрилонитрилов (или коричных нитрилов), ароматических соединений и суперкислот Бренстеда
2. Использование на ключевой стадии процесса метода суперэлектрофильной активации непредельных соединений в условиях катализа суперкислотами Бренстеда, что позволяет в одну стадию формировать индан-1-оновую структуру с высокими выходами.
3. Повышение выхода за счет подавления побочных реакций образования 3,3-диарилпропилнитрилов, что требует увеличения времени синтеза.
4. Способ не предполагает использования дорогостоящих реакций кросс-сочетания с катализаторами на основе драгоценных металлов для реакций с труднодоступными борорганическими соединениями, что значительно удешевляет синтетическую методику.
5. Способ не предполагает использования специального оборудования для создания критически низких температур ниже -20°С.
Апробация данного изобретения проводилась на базе Санкт-Петербургского Государственного Лесотехнического университета. Применение данного изобретения иллюстрируется приведенными ниже примерами, которые следует воспринимать как иллюстрацию возможностей данного метода, и не могут рассматриваться как ограничивающие возможности настоящего изобретения.
Спектры ЯМР записывали на приборах Bruker AVANCE III 400 (рабочие частоты 400 и 100 МГц для 1Н, и 13С, соответственно) и BrukerAM-500 (рабочие частоты 500и 125.76 МГц для 1Н и 13С соответственно). В качестве внутренних стандартов использовали остаточные сигналы CHCl3 (δ: 7.26 м.д.) в спектрах ЯМР 1Н, CDCl3 (δ: 77.0 м.д.) в спектрах ЯМР 13С, CFCl3 (δ: 0.0 м.д.) в спектрах ЯМР 19F. Хромато-масс-спектральный анализ выполняли на приборе G2570A GC/MS DAgilent Technologies 6850 с с капиллярной колонкой HP-5MS (30 м × 0.25 мм), толщина неподвижной фазы 0.25 мкм. Масс-спектры высокого разрешения регистрировали на приборе Varian 902-MS MALDI Mass Spectrometer со сверхпроводящим магнитом 9.4 Тесла. Контроль за ходом реакции и чистоту соединений осуществляли методом ТСХ на пластинах SilufolUV-254. Для разделения реакционных смесей использовали силикагель Merck 60.
Исходный 3-фенилакрилонитрил (коричный нитрил) 1а был получен реакцией циннамальдегида с гидрохлоридом гидроксиламина в ДМСО по методике, описанной в работе [12]. Там же представлены его спектральные характеристики. Замещенные нитрилы 1б-д были получены по реакции Мизороки-Хека [13].
Общая методика синтеза 3-арилпропеннитрилов (1б-д) по реакции Мизороки-Хека. Раствор йодоарена (1-1,5 ммоль) в 5 мл ДМФА и раствор акрилонитрила (1,5-2 ммоль) в 5 мл ДМФ смешивали и перемешивали магнитом в атмосфере аргона. Полученный раствор нагревали до 125-127°С, затем добавляли Pd(OAc)2 (0,07-0,09 ммоль), P(Ph)3 (0,10-0,20 ммоль) и K2CO3 (0,30-0,040 ммоль). Реакционную смесь перемешивали магнитно при 125-127°С в течение 4-6 ч в атмосфере аргона, затем выливали в воду (100 мл). Продукт реакции экстрагировали EtOAc (3 × 100 мл). Объединенные органические слои промывали водой (2 х 100 мл), насыщенным водным раствором NH4Cl (2 × 100 мл) и снова водой (2 × 100 мл) и сушили Na2SO4. После выпаривания растворителя при пониженном давлении продукт реакции выделяли тонкослойной хроматографией (элюент - петролейный эфир: этилацетат, 20: 1 об.). Целевые нитрилы 1б-д были получены в виде смесей Е-, Z-изомеров.
(E/Z)-3-(4-Methylphenyl)propenenitrile (1б). Выход 50%. Бесцветное масло. Смесь E-/Z-rooMepoB. 1Н NMR (400 MHz, CDCl3): δ (E-изомер) 2.38(s, 3Н), 5.81(d, J=16.8 Hz, CH, 1H), 7.21(d, J=8 Hz, 2H),7.34(d, J=8 Hz, 2H), 736(d,J=16.8 Hz, CH, 1H). 1H NMR (400 MHz, CDCl3): δ (Z-изомер) 2.39(s, 3H), 5.37(d,J=12 Hz, CH, 1H), 7.08(d,J=12 Hz, CH, 1H), 7.24(d, J=8 Hz, 2H), 7.71(d, J=8Rz, 2H).
(E/Z)-3-(4-Chlorophenyl)propenenitrile (1в). Выход 47%. Твердое соединение. Смесь Е-/Z-изомеров. 1Н NMR (400 MHz, CDCl3): δ (Е- изомер) 5.85(d,J=76 Hz, CH, 1H), 7.33(d,J=76 Hz, CH, 1H), 7.30-7.36(m, 2H), 7.52(d,J=8 Hz, 2H). 1H NMR (400 MHz, CDCl3): δ (Z- изомер) 5.46(d, J=72 Hz, CH, 1H), 7.02(d,J=72 Hz, CH, 1H), 7.28 -7.39(m, 2H), 7.72(d, J=8.4 Hz, 2H).
(E/Z)-3-(4-Bromophenyl)propenenitrile (1 г). Выход 61%). Твердое соединение. Смесь Е-/Z-изомеров. 1Н NMR (400 MHz, CDCl3): δ (Е- изомер) 5.88 (d, J=16.8 Hz, CH, 1H), 7.31(d, J=8 Hz, 2H), 7.34(d,J=76.5 Hz, CH, 1H), 7.55(d, J=8 Hz, 2H). 1H NMR (400 MHz, CDCl3): δ (Z- изомер) 5.54(d, J=12 Hz, CH, 1H), 7.07 (d, J=12 Hz, CH, 1H), 7.58 (d, J=8.4 Hz, 2H), 7.67(d, J=8.4 Hz, 2H).
(E/Z)-3-(4-Methoxyphenyl)propenenitrile (1д). Выход 35%). Бесцветное масло. Смесь Е-/Z-изомеров. 1Н NMR (400 MHz, CDCl3): 1H NMR (400 MHz, CDCl3): δ (Ti-isomer) 5.71(d, J=76 Hz, CH, 1H), 6.91(d, J=8.8 Hz, 2H) 7.28(d, J=76 Hz, CH, 1H), 7.39(d, J=8.8 Hz, 2H). 1H NMR (400 MHz, CDCl3): δ (Z-isomer) 5.28(d,J=72 Hz, CH, 1H), 6.94(d, J=8 Hz, 2H),7.03(d,J=72 Hz, CH, 1H), 7.79(d, J=8 Hz, 2H)
Общая методика синтеза 3-арилпропеннитрила 1 с аренами в TfOH.
3-Арилпропеннитрил 1 (0,22-0,78 ммоль) добавляли к смеси арена [бензол - 1 мл, другие арены - 1,2-1,7 экв.)] В TfOH (1-2 мл). Реакционную смесь перемешивали магнитным способом при комнатной температуре в течение 1-3 часов (точное время каждого эксперимента приведены в таблице 1). Затем смесь гасили водой (100 мл). Продукты реакции экстрагировали EtOAc (3-100 мл), объединенные экстракты промывали водой (2-60 мл), насыщенным водным раствором NaHCO3 (100 мл), снова водой (2-60 мл) и сушили Na2SO4. После выпаривания растворителя при пониженном давлении полученный остаток подвергали колоночной или тонкослойной хроматографии на силикагеле, используя смеси петролейный эфир-бензол-дихлорметан (20: 1: 0,05, об.) Или смеси петролейный эфир-этилацетат (20: 1: 0,05, об.), Соответственно, для элюирования, чтобы получить чистые продукты реакции. Выходы продуктов определяли после хроматографического выделения (см. Таблицу 1)
Получение и свойства 5,6-диметил-3-фенилиндан-1-она (2а), 6,7-диметил-3-фенилиндан-1-он (3b), 4,7-диметил-3-фенилиндан- 1-он (3g), соответствуют литературным данным [17]. 4,6,7-триметил-3-фенилиндан-1-он (2о), 4,5,7-триметил-3-фенилиндан-1-он (2р) бочные нитрилы 3а и 3б ранее были нами зарегистрированы [10].
5,6-Dimethyl-3-phenylindan-1-one (2а). Белое твердое вещество. 1Н NMR (CDCl3, 400 MHz): 2.28 s (3Н, СН3), 2.32 s (3Н, СН3), 2.65 dd (1Н, J=19, 3 Hz, ОС-СНА), 3.19 dd (1Н, J=19, 8 Hz, O=C-CHB), 4.49 dd (1H, J=8, 3 Hz, Ph-CH), 7.02 s (1Harom.), 7.11-7.13 m (2Harom.), 7.24-7.33 m (3Harom.), 7.57 s (1Harom.). 13C NMR (CDCl3, 100 MHz): 19.9 (CH3), 20.9 (CH3), 44.2 (CH), 47.2 (CH2), 123.8, 126.9, 127.7, 128.9, 135.1, 137.0, 144.2, 145.5, 156.3, 205.9 (C=O). GC-MS, m/z (Irel., %): 236 M+ (100), 221 (53), 208 (17), 193 (28), 178 (27), 165 (9), 152 (4), 115 (9), 89 (6). IR (KBr), ν, cm-1: 3103, 2921, 1706 (C=O), 1601, 1454. HRMS: calcdfor [M+Na]+ 259.1093, C17H16NaO+, found 259.1093
6.7- Dimethyl-3-phenylindan-l-one (2б). Бесцветное масло. 1H NMR (CDCl3, 400 MHz): 2.32 s (3H, CH3), 2.65 s (3H, CH3), 2.70 d (1H, J=4 Hz, О=C-CHA), 3.19 dd (1H, J=19, 8, Hz, О=C-CHB), 4.44 dd (1H, J=8, 4 Hz, Ph-CH), 6.96 d (1Harom. J=8 Hz), 7.12 d (2Harom. J=7 Hz), 7.21-7.24 m (1Harom), 7.28-7.31 m (3Harom.). 13C NMR (CDCl3, 100 MHz): 13.8(CH3), 19.2(CH3), 43.3(CH), 47.9(CH2), 123.8, 126.9, 127.7, 128.9, 134.1, 136.3, 136.9, 137.0, 144.5, 156.8, 207.4 (C=O). GC-MS, m/z (Irel., %): 236 M+ (100), 235 М+ (18), 221 (57.5), 208 (23), 193 (33), 178 (32), 165 (10), 115 (11), 89 (6). IR (neat), ν, cm-1: 1659 (C=О). HRMS: calcdfor [M+Na]+ 259.1093, C17H16NaO+, found 259.1093.
3-(4-Chlorophenyl)-6,7-dimethylindan-1-one (2в) получен в смеси с нитрилом 1в выход 33%; бесцветное масло; IR (KBr), ν, cm-1: 1704 (С=О); lH NMR (400 MHz, CDCl3): δ 2.32(s, 3Н), 2.66(s, 3Н), 2.60(dd, J=19.0, 4.0Hz, О=С-СНА 1H), 3.18(dd, J=19.0, 5.0Hz, ОС-СНА1Н), 4.49(dd, J=8.4Hz, Ar-СН, 1Н), 6.93 (d, J=8.0 Hz, 2H), 7.05(d, J=8.0Hz, 1H), 7.26(d, J=8.0Hz, 2H), 7.31(d, J=8.0Hz, 2H); 13C NMR (100 MHz, CDCl3): δ 13.8(CH3), 19.8(CH3), 42.7(CH), 47.8(CH2), 123.7(CarH), 129.0 (CarH), 129.1(CarH), 132.7(0,,), 134.1(Car), 136.4(CarH), 137.1(Car), 137.2(Car), 143.0(Car), 156.2(Car), 206.8 (C=O); MS, m/z: calcd. forC17H15ClNaO+[M+Na]+ 293.0704, found 293.0693.
3-(4-Bromophenyl)-6,7-dimethylindan-l-one (2 г) получен в смеси с нитрилом 1 г выход 42%; бесцветное масло; IR (KBr), ν, cm-1: 1709 (С=O); 1Н NMR (400 MHz, CDCl3): δ 2.32(s, 3Н), 2.65(s, 3Н), 2.60(dd, J=4.0, 19.(Ml, O=C-CHA1H), 3.18(dd, J=19.0, 5.0Hz, O=С-СНА 1H), 4.41(dd, J=8.0, 4.0Hz, Ar-СН,1Н), 6.93(d, J=8.0Hz, 1H), 6.99(d, J=8.0Hz, 2H), 7.31(d, J=8.0Hz,1H), 7.41(d, J=8.0Uz, 2H); 13C NMR (100 MHz, CDCl3): δ 13.8(CH3), 19.2(CH3),42.8(CH), 47.7(CH2), 120.7 (Car), 123.7(CarH), 129.5(CarH), 132.0(CarH), 134.1 (Car), 136.4(CarH), 137.1 (Car), 137.2 (Car), 143.6 (Car), 156.1 (Car), 206.8 (C=O); MS, m/z: calcd. for C17H16BrO+[M+H]+315.0379, found 315.0371.
3-(4-Bromophenyl)-5,6-dimethylindan-l-one (2д) получен в смеси с нитрилом 1 г выход 53%; бесцветное масло; IR (KBr), ν, cm-1: 1709 (С=O); 1Н NMR (400 MHz, CDCl3): δ 2.28(s, 3Н), 2.32(s, 3Н), 2.58(dd, J=19.0, 3.6 Hz, O=C-CHA1H), 3.18(dd, J=19.0, 8.0Hz, O=С-СНА 1H), 4.49(dd, J=8.0, 3.6Hz, Ar-CH, 1H), 6.98(s, 1H), 6.99(d, J=8.0Hz, 2H), 7.42(d, J=8.0Hz, 2H), 7.57(s, J=8.0Hz, 1H); 13C NMR (100 MHz, CDCl3): δ 19.9(CH3), 20.9(CH3),43.6(CH), 47.0(CH2), 120.8(Car), 123.9(CarH), 127.4(CarH), 129.7(CarH), 132.1(CarH), 135.1(Car), 137.3 (Car), 143.3 (Car), 145.7 (Car), 155.6 (Car), 205.4 (C=O); MS, m/z: calcd. for C17H16BrO+[M+H]+ 315.0379, found 315.0369.
5,7-Dimethyl-3-phenylindan-1-one (2e) выход 21%; бесцветное масло; IR (KBr), ν, cm-1: 3027, 2918, 2849, 1705 (C=O), 1603, 1453; 1H NMR (400 MHz, CDCl3): δ 2.31(s, 3H), 2.65(s, 3H), 2.65(dd, J=18.8, 4.0 Hz, O=C-CHA,1H) 3.17 (dd, J=18.8, 8.4 Hz, O=C-CHB,1H), 4.44(dd, J=8.4, 4.0 Hz, Ph-CH,1H), 6.84(s, 1H), 6.95(s, 1H), 7.13(m, 2H), 7.24(m, 1H), 7.29-7.33(m, 2H); 13C NMR (100 MHz, CDCl3): δ 18.2(CH3), 22.0(CH3), 43.9(CH), 47.6(CH2), 124.7(CarH), 126.9(CarH), 127.8(CarH), 128.9(CarH), 131.0(CarH), 131.9(Car), 138.6(Car), 144.4(Car), 145.6(Car), 159.4(Car), 206.5 (C=O); MS, m/z: calcd. forC17H17O+[M+H]+237.1274, found 237. 1274.
4,7-Dimethyl-3-phenylindan-1-one (3g). Белое твердое вещество. 1H NMR (CDCl3, 400 MHz): 1.97 s (3Н, CH3), 2.68 s (3Н, CH3), 2.56 dd (1Н, J=18.8, 2 Hz, O=C-CHA), 3.19 dd (1H, J=18.8, 8.4 Hz, O=C-CHB), 4.51 dd (1H, J=8.4, 2 Hz, Ph-CH), 7.02 d (2Harom., J=8.0 Hz), 7.10 d (1Harom., J=7.5 Hz), 7.17-7.27 m (4Harom.). 13C NMR (CDCl3, 100 MHz): 18.2(CH3), 43.4(CH), 48.2(CH2), 126.7, 127.5, 128.9, 130.3, 133.8, 134.6, 135.9, 136.0, 144.2, 156.3, 207.6 (C=O). GC-MS, m/z (Irel., %): 236 [М]+ (100), 235 (11), 221 (52), 193 (27), 178 (25), 158 (8), 115 (11). IR, ν, cm-1: 3028, 2916, 1703(C=O), 1582, 1494, 1454. HRMS:calcdfor [M+Na]+259.1093,C17H16NaO+, found 259.1093.
3-(4-Chlorophenyl)-4,7-dimethylindan-l-one (2з) получен в смеси с нитрилом 1в выход 42%; бесцветное масло; IR (KBr), ν, cm-1: 1706 (С=O); 1Н NMR (400 MHz, CDCl3): δ 1.96(s, 3Н), 2.66(s, 3Н), 2.50 (dd, J=79.2,2.SHz, O=С-СНА 1Н,), 3.18(dd,J=19.2, 8.8Hz, O=С-СНА 1H,), 4.49(dd,J=8.4, 2.4Hz, Ar-СН, 1Н,), 6.95(d, J=8.4 Hz, 2Н), 7.10(d, J=8.0 Hz, 1H), 7.22-7.24(m, 3H); 13C NMR (100 MHz, CDCl3): δ 18.1(CH3),18.2(CH3), 42.7(CH), 48.9(CH2), 128.8 (CarH), 129.1 (CarH), 130.5 (CarH), 132.5 (Car), 133.7 (Car), 134.5 (Car), 136.0 (CarH), 136.1 (Car), 142.8 (Car), 155.7 (Car), 207.1 (C=O); MS, m/z: calcd. forC17H15ClNaO+[M+Na]+293.0704, found 293.0690.
3-(4-Bromophenyl)-4,7-dimethylindan-l-one (2и) получен в смеси с нитрилом 1 г выход 47%; бесцветное масло; IR (KBr), ν, cm-1: 1707 (С=O); 1Н NMR (400 MHz, CDCl3): δ 1.96(s, 3H), 2.66(s, 3H), 2.50(dd,J=19.2, 2.4Hz, O=С-СНА,1Н), 3.18(dd, J=19.2, 8.4Hz, O=C-CHA 1H), 4.47(dd, J=8.4, 2.4Hz, Ar-CH 1H), 6.89(d, J=8.4Bz, 2H), 7.10(d, J=7.6Hz, 1H), 7.23(d, J=7.6Hz, 1H), 7.38(d, J=8.4Bz, 2H); 13C NMR (100 MHz, CDCl3): δ 18.2(CH3), 42.8(CH), 47.9(CH2), 120.5 (Car), 129.2(CarH), 130.5 (CarH),132.0(CarH), 133.7 (Car), 134.5 (Car), 136.0(CarH), 136.1 (Car), 143.3 (Car), 155.6(Car), 207.0 (C=O); MS, m/z: calcd. forC17H15BrNaO+[M+Na]+337.0198, found 337.0207.
3-(4-Methoxyphenyl)-4,7-dimethylindan-l-one (2к) получен в смеси с нитрилом 1д выход 25%; бесцветное масло; IR (KBr), ν, cm-1: 1704 (С=O); 1Н NMR (400 MHz, CDCl3): δ 1.97(s, 3H), 2.66(s, 3H), 3.77(s, 3H, ОСН3), 2.53(dd,J=19.2, 2.4Hz, O=С-СНА 1Н,), 3.17(dd,J=19.2, 8.4Hz, O=С-СНА 1Н), 4.46(dd,J=8.4, 2.4Hz, Ar-CH 1Н), 6.79(d, J=8.4Hz, 2H), 6.93(d, J=8.4Hz, 2H), 7.08(d, J=7.6Hz, 1H), 7.21 (d, J=7.6Hz, 1H); 13C NMR (100 MHz, CDCl3): δ 18.2 (2CH3), 42.6(CH), 48.3(CH2), 55.4(OCH3), 114.3 (CarH), 128.4 (CarH), 130.2 (CarH), 131.5(C), 133.8(0, 134.5 (Car), 135.9 (CarH), 136.3 (Car), 158.3 (Car), 207.9 (Car); MS, m/z: calcd. forC18H19O2+[M+H]+ 267.1380, found 267.1369.
3-(4-Methylphenyl)-4,5,7-trimethyl-indan-l-one (2 л) получен в смеси с нитрилом 16 выход 50%; бесцветное масло; IR (KBr), ν, cm-1: 1692 (С=O); 1Н NMR (400 MHz, CDCl3): δ 1.91(s, 3H), 2.27(s, 3H), 2.29(s, 3H), 2.52(dd, J=18.8, 2.0 Hz, O=С-СНА 1H), 2.64(s, 3H), 3.17(dd, J=18.8, 8.4Uz, O=С-СНв 1H), 4.49(dd, J=8.4, 2.0 Hz, Ar-CH, 1H), 6.88(d, J=5.0Hz, 2H), 6.99(s, 1H, H-6), 7.05(d, J=8.0Hz, 2H); 13C NMR (100 MHz, CDCl3): δ 14.7(CH3), 18.1(CH3), 20.3(CH3), 21.1(CH3),43.1(CH), 48.6(CH2), 127.3(CarH), 129.6(CarH), 132.1(Car), 132.3(CarH), 132.9(0, 135.4(Car), 136.0(Car), 141.8(Car), 144.2(Car), 156.7(Car), 207.4 (C=O); MS, m/z: calcd. for C19H20ONa+[M+Na]+287.1406, found 287.1405.
3-(4-Bromophenyl)-4,6,7-trimethylindan-1-one (3м) получен в смеси с нитрилом 1 г выход 34%; бесцветное масло; IR (KBr), ν, cm-1: 1700 (С=O); 1H NMR (400 MHz, CDCl3): δ 1.93(s, 3H), 2.30(s, 3H), 2.62(s, 3H), 2.50(dd, J=19.2, 2.0 Hz, O=С-СНА 1H), 3.19(dd, J=19.2, 8.0 Hz, O=C-CHB1H), 4.41(dd, J=8,2Hz, Ar-CH,1H), 6.89(d, J=8.4Hz, 2H), 7.15(s, 1H, H-5), 7.37(d, J=8.4Hz,2H); 13C NMR (100 MHz, CDCl3): δ 13.4(CH3), 18.1(CH3), 19.1(CH3), 42.1(CH), 48.3(CH2), 120.4(C), 129.2(CarH), 132.0(CarH), 133.0(Car), 134.4(Car), 134.5(0, 137.6(Car), 138.0(CarH), 143.6(Car), 153.5(Car), 207.4 (C=O); MS, m/z: calcd. for C18H18BrO+[M+H]+329.0536, found 329.0530.
3-(4-Methoxyphenyl)-4,5,7-trimethylindan-l-one (2 т) получен в смеси с нитрилом 1д выход 43%; бесцветное масло; IR (KBr), ν, cm-1: 1701 (С=O); 1Н NMR (400 MHz, CDCl3): δ 1.91(s, 3H), 2.27(s, 3H), 2.50(dd, J=18.8, 2.0Hz, O=С-СНА, 1H), 2.63(s, 3H), 3.16(dd, J=18.8, 8.4Hz, O=C-CHB,1H), 3.77(s, OCH3, 3H), 4.48(dd, J=8.4, 2.0Hz, Ar-CH, 1H), 6.78(d,, J=8.4Hz, 2H), 6.91(d, J=8.4 Hz, 2H), 6.99 (s, 1H, H-6); 13C NMR (100 MHz, CDCl3): δ 14.7(CH3), 18.1(CH3), 20.3(CH3),42.7(CH), 48.7(CH2), 55.4(OCH3), 114.3(CarH), 128.3(CarH), 132.1(Car), 132.3(01), 132.8(Car), 135.4(Car), 137.0(Car), 144.3 (Car), 156.8(Car), 158.2(Car), 207.5 (C=O); MS, m/z: calcd. forC19H20O2+[M+H]+281.1536, found 281.1535.
4,6,7-Trimethyl-3-phenylindan-l-one (2o). Белое твердое вещество. 1H NMR (CDCl3, 400 MHz): 1.94 s (3H, CH3), 2.30 s (3H, CH3), 2.63 s (3H, CH3), 2.56 dd (1H, J=19.2, 2 Hz, OC-CHA), 3.19 dd (1H, J=19.2, 8.4 Hz, OC-CHA), 4.45 dd (1H, J=8.4, 2 Hz, Ph-CH), 7.01 d (2Harom, J=1.2 Hz), 7.14 s (1Harom), 7.16-7.19 m (1Harom), 7.24 d (2Harom, J=7.2), 13C NMR (CDCl3, 100 MHz):14.7(CH3), 18.11(CH3), 20.36(CH3), 43.5(CH), 48.5(CH2), 126.5, 127.4, 128.9, 132.1, 132.4, 132.9, 135.5, 144.3, 144.9, 156.4, 207.2 (C=O). GC-MS, m/z (Irel., %): 250 M+ (100), 235 (64), 207 (30), 192 (20), 173 (9), 128 (9), 115 (9.5), 91 (5), 77 (5). IR, ν, cm-1: 3026, 2921, 1707 (C=O), 1601, 1579, 1494, 1454. HRMS: calcdfor [M+Na]+ 273.1249, C18H18NaO+, found 273.1250.
4,5,7-Trimethyl-3-phenylindan-l-one (2п). Бесцветное масло. 1H NMR (CDCl3, 400 MHz): 1.89 s (3H, CH3), 2.27 s (3H, CH3), 2.54 dd (1H, J=19.2, 2 Hz, O=C-CHA), 2.64 s (3H, CH3), 3.19 dd (1H, J=19.2, 8.4 Hz, O=C-CHA), 4.45 dd (1H, J=8.4, 2 Hz, Ph-CH), 6.99 m (3Harom.), 7.18-7.20 m (1Harom.), 7.23-7.26 m (2Harom.). 13C NMR (CDCl3, 100 MHz): 13.3(CH3), 17.96(CH3), 18.94(CH3), 42.5(CH), 48.7(CH2), 126.6, 127.5, 128.9, 133.1, 134.3, 134.5, 137.3, 137.9, 144.5, 154.2, 208.0 (C=O). GC-MS, m/z (Irel., %): 250 M+ (100), 235 (60), 207 (20), 192 (19.7), 173 (9), 128 (11), 115 (11), 91 (6), 77 (5). IR (KBr), ν, cm-1: 3110, 2920, 1707 (C=O), 1579, 1450. HRMS: calcdfor [M+Na]+273.1249,C18H18NaO+, found 273.1250
3-(4-Chlorophenyl)-4,6,7-trimethylindan-l-one (2p) получен в смеси с нитрилом 1в выход 48%; Бесцветное масло; 1Н NMR (400 MHz, CDCl3): δ 1.93(s, 3H), 2.30(s, 3H), 2.50(dd, J=18.8, 2.0 Hz, O=С-СНА 1H), 2.62(s, 3H), 3.19(dd, J=18.8, 8.4Hz, O=С-СНв 1H), 4.43(dd, J=8.4, 2.0Hz, Ar-CH,1H), 6.95(d, J=8.4Hz, 2H), 7.15(s, 1H, H-5), 7.22 (d, J=8.4 Hz, 2H); 13C NMR (100 MHz, CDCl3): δ 13.4(CH3), 18.1(CH3), 19.1(CH3),42.0(CH), 48.4(CH2), 128.8(CarH), 129.1(CarH), 132.4(Car), 133.0(Car), 134.4(Car), 134.5(Car), 137.6(0, 138.0(CarH), 143.1(0, 153.6(Car), 207.4 (C=O); MS, m/z: calcd. for C18H18ClO+[M+H]+285.1041, found 285.1049.
3-(4-Chlorophenyl)-4,5,7-trimethylindan-l-one (2c) получен в смеси с нитрилом 1в выход 15%; Бесцветное масло; 1Н NMR (400 MHz, CDCl3): δ 1.89(s, 3H), 2.27(s, 3H), 2.48(dd, J=19.0, 2.0 Hz, O=C-CHA1H), 2.63(s, 3H), 3.18(dd, J=19.0, 8.0 Hz, O=C-CHB1H), 4.51(dd, J=8.0, 2.0 Hz, Ar-CH, 1H), 6.93(d, Uar,J=8.4Uz, 2H), 7.02(s, 1H, H-6), 7.22(d, HarJ=5.4Hz, 2H); 13C NMR (100 MHz, CDCl3): δ 14.8(CH3), 18.1(CH3), 20.4(CH3), 42.8(CH), 48.3(CH2), 128.7(CarH), 129.1(CarH), 131.9(Car), 132.3(Car), 132.6(CarH), 135.7(Car), 143.4(Car), 144.5(Car), 155.9(Car), 206.7 (C=O); MS, m/z: calcd. for C18H18ClO+ [M+H]+ 285.1041, found 285.1043
Список литературы
[1] Olah G.A., Prakash G.K.S., Molnár Á., Sommer J. Superacid Chemistry, Second Edition. 2nd ed. Hoboken: Wiley-Interscience, 2008. 850 p.
[2] Olah G.A., Klumpp D.A. Superelectrophiles and Their Chemistry. Hoboken: Wiley-Interscience, 2007. 312 p.
[3] Gorbunova Y., Zakusilo D., Vasilyev A.Cirmamonitrile as a precursor of a bi-centered electrophile in reactions with arenes in triflic acid. Tetrahedron Letters.-2019, 60, 14, 961-964.
[4] Turek, M.; Szczęsna, D.; Koprowski, M.; Bałczewski P. Beilstein J. Org. Chem., 2017, 13, 451-494.
[5] Patil, S.A.; Patil, R.; Patil, S.A. Eur. J. Med. Chem., 2017, 138, 182-198.
[6] Menezes, J. C. J. M. D. S. RSC Adv., 2017, 7, 9357-9372.
[7] Oonishi Y., Ogura J., Sato Y.Rh(I)-catalyzed intramolecularhydroacylation in ionic liquids. Tetrahedron Letters, 2007, 48, 7505-7507.
[8]Lee В.H., Choi Y.L., Shin S., Heo J.-N.Stereoselective Palladium-Catalyzed r-Arylation of 3-Aryl-l-Indanones: An Asymmetric Synthesis of (+)-Pauciflorol F. J. Org. Chem. 2011, 76, 6611-6618.
[9] Vasu D., Hung H.-H, BhuniaS., GawadeS. A., Das A., Liu R.-S. Gold-Catalyzed Oxidative Cyclization of 1,5-Enynes Using External Oxidants. Angew. Chem. Int. Ed. 2011, 50, 6911 - 6914.
[10] Gorbunova Y., Zakusilo D., Vasilyev A.Cirmamonitrile as a precursor of a bi-centered electrophile in reactions with arenes in triflic acid. Tetrahedron Letters.-2019, 60, 14, 961-964.
[11] Olah G.A., Prakash G.K.S., Molnár Á., Sommer J. Superacid Chemistry, Second Edition. 2nd ed. Hoboken: Wiley-Interscience, 2008. 850 p.
[12] Chill, ST.; Mebane, R.C. Synthetic Commun.,2009, 39, 3601-3606.
[13] The Mizoroki-Heck Reaction, ed. M. Oesterich, Wiley, Chichester, UK, 2009 [14] Lee, D.; Yang, Y.; Yun, J. Org. Lett. 2007, 9, 2749-2751.
[15] Xue, F.; Zhu, Y.; Qi, X. J. Chem. Res, 2018, 42, 300-304.
[16] Takatsu, K.; Shintani, R.; Hayashi, T. Angew.Chem. Int. Ed, 2011, 50, 5548 -5552.
[17] Ramulu, B.V.; Niharika, P.; Satyanarayana, G. Synthesis, 2015, 26, 1255-1268.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ДИСПИРОИНДОЛИНОНОВ | 2018 |
|
RU2682678C1 |
| ПРОИЗВОДНОЕ КАРБОНОВОЙ КИСЛОТЫ С КОНДЕНСИРОВАННЫМИ КОЛЬЦАМИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 1997 |
|
RU2195448C2 |
| АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ, И СПОСОБ ЛЕЧЕНИЯ ВОСПАЛЕНИЯ | 1994 |
|
RU2130011C1 |
| АСИММЕТРИЧНАЯ ВСПОМОГАТЕЛЬНАЯ ГРУППА | 2013 |
|
RU2693381C2 |
| ХИМИЧЕСКИЙ СИНТЕЗ И ПРОТИВООПУХОЛЕВЫЙ И ПРОТИВОМЕТАСТАТИЧЕСКИЙ ЭФФЕКТЫ КОНЪЮГАТА ДВОЙНОГО ДЕЙСТВИЯ | 2011 |
|
RU2729419C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФУКОЗИЛИРОВАННОГО УГЛЕВОДА, СПОСОБ ПОЛУЧЕНИЯ ФУКОЗИЛИРОВАННОЙ СИАЛИЛИРОВАННОЙ УГЛЕВОДНОЙ МОЛЕКУЛЫ, РЕАКЦИОННАЯ СИСТЕМА IN VITRO | 1992 |
|
RU2125092C1 |
| СПОСОБ УЛУЧШЕНИЯ СТАБИЛЬНОСТИ УСИЛИТЕЛЕЙ СЛАДКОГО ВКУСА И КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ СТАБИЛИЗИРОВАННЫЙ УСИЛИТЕЛЬ СЛАДКОГО ВКУСА | 2011 |
|
RU2576451C2 |
| КОНДЕНСИРОВАННЫЕ ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ПИРИДИНОВЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПРОИЗВОДСТВА И ПРИМЕНЕНИЕ | 2014 |
|
RU2668074C2 |
| ПРОИЗВОДНЫЕ 3-КАРБОКСИ-4-АМИНОХИНОЛИНА, ПОЛЕЗНЫЕ КАК МОДИФИКАТОРЫ СЛАДКОГО ВКУСА | 2011 |
|
RU2605549C2 |
| ПИРАЗОЛ-4-ИЛ-ГЕТЕРОЦИКЛИЛ-КАРБОКСАМИДНЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ПРИМЕНЕНИЯ | 2012 |
|
RU2638552C2 |
Изобретение относится к способу получения 3-арилиндан-1-онов общей формулы 3, заключающемуся в том, что используется метод суперэлектрофильной активации в трифторметансульфоновой кислоте в реакции гидроарилирования 3-арилакрилонитрилов (коричных нитрилов) общей формулы 1 путем смешения суперкислоты и ароматического реагента, порционного добавления исходного 3-арилакрилонитрила (или коричного нитрила) (1) таким образом, чтобы он всегда находился в избытке aроматического соединения и суперкислоты, выдерживания реакционной смеси в необходимом температурном диапазоне 20°С в течение 1-3 часов и разложения водой с последующей экстракцией и очисткой продуктов. Технический результат: повышение эффективности синтеза и конечного выхода целевого продукта реакции гидроарилирования, снижение себестоимости растворного синтеза и исключение металлоорганических катализаторов, а также реакций, требующих применения высокотоксичных реагентов. 1 табл.

Способ получения 3-арилиндан-1-онов общей формулы 3, отличающийся тем, что используется метод суперэлектрофильной активации в трифторметансульфоновой кислоте в реакции гидроарилирования 3-арилакрилонитрилов (коричных нитрилов) общей формулы 1 путем смешения суперкислоты и ароматического реагента, порционного добавления исходного 3-арилакрилонитрила (или коричного нитрила) (1) таким образом, чтобы он всегда находился в избытке aроматического соединения и суперкислоты, выдерживания реакционной смеси в необходимом температурном диапазоне 20°С в течение 1-3 часов и разложения водой с последующей экстракцией и очисткой продуктов:
 ,
,
где R = метил, галогены: Cl, Br; R’ = Me, 1,2-диМе, 1,3-диМе, 1,4-диМе, 1,2,4-триМе.
| Yelizaveta Gorbunova et al, "Cinnamonitrile as a precursor of a bi-centered electrophile in reactions with arenes in triflic acid", Tetrahedron Letters, vol | |||
| Способ получения молочной кислоты | 1922 |
|
SU60A1 |
| Плавучий мост | 1921 |
|
SU961A1 |
| Способ получения 2-алкилиндана | 1976 |
|
SU615847A3 |
| CN 107082743 A, 22.08.2017. | |||
Авторы
Даты
2022-03-24—Публикация
2020-05-22—Подача