Область техники
Изобретение относится к области молекулярной биологии, вирусологии и биотехнологии. Изобретение может быть использовано для амплификации нуклеиновых кислот (НК) различного происхождения.
Предшествующий уровень техники
Стадия выделения, или экстракции, или очистки, нуклеиновых кислот, является одной из самых длительных и трудозатратных стадий при любом анализе нуклеиновых кислот. В связи с этим большой интерес представляют способы и композиции, позволяющие снизить продолжительность и трудоемкость этого процесса, в частности способы сравнительно грубого и непродолжительного лизиса биологического образца взамен полного процесса выделения нуклеиновых кислот, и способы амплификации, совместимые с такой грубой подготовкой биологического образца. В том числе представляют интерес способы проведения петлевой изотермической амплификации, совместимые с такой подготовкой биологического образца, т. к. петлевая изотермическая амплификация обладает свойствами, удобными для диагностики патогенов: быстрота проведения реакции, возможность ее проведения и оценки результата без высокотехнологичного оборудования, в частности, оценка результата может проводиться визуально, например, по изменению окраски или помутнению реакционной смеси.
Кроме того, распространенную проблему в молекулярной диагностике и молекулярной биологии вообще представляет то, что качество полученных образцов снижается при хранении и транспортировке. В частности, существенную проблему составляет опасность контакта анализируемых нуклеиновых кислот с нуклеазами, присутствующими в окружающей среде и самом образце. Однако если цель заключается в анализе нуклеиновых кислот вирусов (или других нуклеопротеидных частиц), то из-за того, что вирусные НК надежно упакованы в вирион, наибольшему риску деградации нуклеиновые кислоты вирусов подвергаются в процессе выделения НК, если вирион уже разрушен, а нуклеазы еще окончательно не инактивированы.
Известен патент RU2 252 964C2 «Способ и набор для синтеза нуклеиновой кислоты, имеющей нуклеотидную последовательность, где в одной цепи попеременно связаны комплементарные нуклеотидные последовательности», описывающий реакцию петлевой изотермической амплификации в общем виде, без уточнения состава реакционной смеси таким образом, что этот состав делает необязательной стадию выделения нуклеиновых кислот.
Известен ряд аналогов предлагаемого изобретения, позволяющих амплифицировать нуклеиновые кислоты из слабо очищенного или неочищенного образца.
Известен патент EP 1 476 573 B1 «Грубые биологические производные, пригодные для обнаружения нуклеиновых кислот», описывающая проведение амплификации НК (а именно обратной транскрипции) с использованием грубого лизата биологического образца в качестве источника матричной НК. В предлагаемом решении для получения лизата используется протеиназа, что повышает стоимость реакционной смеси, а также требует инактивации протеиназы прогреванием перед амплификацией.
Также известен патент EP 3642359 A1 «Способы обнаружения целевых ДНК непосредственно в грубых образцах путем полимеразной цепной реакции и генотипирования методом анализа кривых плавления с высоким разрешением», описывающий грубый лизис биологического образца с использованием протеиназ, последующую амплификацию НК в полимеразной цепной реакции (ПЦР) и анализ кривых плавления с высоким разрешением. Описанное в этом патенте техническое решение обладает теми же недостатками.
Известен патент EP 3334533 A1 «Мультиплексное обнаружение целевых нуклеиновых кислот непосредственно в образцах, содержащих кровь», которая предполагает добавление крови непосредственно в смесь для амплификации, при этом для обнаружения нуклеиновых кислот в образце используется возбуждение излучением с длиной волны более 620 нм, однако патент описывает не состав амплификационной смеси, а преодоление эффекта крови, затрудняющего считывание флуоресценции, кроме того, предполагается амплификация методом ПЦР (а не LAMP), который использует высокие температуры (и термостабильные полимеразы), что облегчает лизис образца, поэтому сравнительно просто подобрать состав реакционной смеси, обеспечивающий как лизис образца, так и амплификацию, тогда как LAMP требует другого состава реакционной смеси.
Также известен патент US 2019/0078154 «Способы и реагенты для полимеразной цепной реакции, совмещенной с обратной транскрипцией» на способ амплификации молекулы РНК, содержащейся в биологическом образце, методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР), при котором ОТ-ПЦР проводится в растворе, включающем: полярный апротонный растворитель, сывороточный альбумин и опционально неионный сурфактант и/или бетаинна вариант ОТ-ПЦР, при котором биологический образец не проходит стадию очистки РНК. Как указано выше, ПЦР и ОТ-ПЦР выдвигают другие требования к реакционной смеси, в том числе к реакционной смеси, способной лизировать помещенный в нее биологический образец, чем LAMP.
Известен патент US 6,825,340 B2 «Способы и реагенты для инактивации рибонуклеаз», описывающий инактивацию РНКазы А, РНКазы 1 и/или РНКазы Т1 в клеточном экстракте с помощью комбинации воздействия восстанавливающего агента с нагреванием. Данный патент посвящен только инактивации РНКаз, а не способу совмещения лизиса биологического образца или выделения нуклеиновых кислот и амплификации полученных нуклеиновых кислот в одной пробирке.
Ближайшим аналогом предлагаемого изобретения является международная патентная заявка WO 2020025947 A1 «Способы и составы для обнаружения микробов и вирусных частиц» на способ подготовки образца, полученного от субъекта, который может содержать один или более микробов или вирусных частиц, для прямой амплификации микробной или вирусной нуклеиновой кислоты полимеразой. Способ заключается в нагревании сосуда до температуры не менее 70ºС в присутствии реагента, который включает в себя детергент, растворитель и одну или более полимеразу нуклеиновых кислот. Данный способ требует нагревания образца до температуры не менее 70ºС, которая не является оптимальной для многих вариантов проведения амплификации, в частности, многих вариантов проведения изотермической амплификации, и требует применения термостабильной полимеразы.
Кроме того, высокая температура увеличивает вероятность разрушения НК, в особенности РНК. По этой причине указанная патентная заявка в своем предпочтительном варианте воплощения описывает прогревание образца при указанной температуре в течение не более 60 с, а в особенно предпочтительном варианте воплощения – не более 1,5 с. Такой подход неудобен, т.к. требует изменения настроек термостата или иного используемого нагревательного прибора или использования двух нагревательных приборов, использующих разные температуры нагревания. Кроме того, применимость данного подхода для петлевой изотермической амплификации (LAMP) ограничена, т.к. для LAMP наиболее предпочтительной и часто используемой является температура 60-65ºС, а не 70ºС.
Раскрытие изобретения
Задачей предлагаемого изобретения является создание быстрого и надежного способа, способного выявлять целевой аналит, а именно вирусную или микробную НК, с использованием одной реакционной смеси и в одной пробирке.
Техническая задача решается за счет того, что создан способ амплификации нуклеиновых кислот микроорганизмов или вирусов с ДНК-геномом, заключающийся в том, что образец помещают в реакционную смесь, содержащую ДНК-полимеразу с цепь-вытесняющей активностью, праймеры для петлевой изотермической амплификации, дезоксирибонуклеотиды, соли, а также детергент Triton™ X-100, бычий сывороточный альбумин, дитиотреитол, этилендиаминтетрауксусную кислоту, и инкубируют при температуре, выбранной в диапазоне от 50 до 69ºС, в одной пробирке, после чего производят детекцию результата амплификации, при этом итоговая смесь, образующаяся при смешивании образца с реакционной смесью, содержит:
детергент Triton™ X-100 - от 10 до 150 г/л,
бычий сывороточный альбумин - от 1 до 20 г/л,
дитиотреитол - от 6,25 до 18,75 ммоль/л,
этилендиаминтетрауксусную кислоту - от 0,5 до 1,5 ммоль/л (вариант 1). Для обеспечения флуоресцентного определения результата амплификации используют концентрацию бычьего сывороточного альбумина в оптимальном для прохождения реакции диапазоне от 5 до 20 г/л, а детекцию результата реакции амплификации проводят путем регистрации флуоресценции, для чего в реакционную смесь дополнительно вводят флуоресцентный краситель, а детекцию результата реакции амплификации нуклеиновых кислот, представляющих интерес, проводят визуально. Для обеспечения визуального определения результата амплификации с использованием рН-чувствительного красителя pH реакционной смеси находится в диапазоне от 8,0 до 10,0, а для поддержания буферной емкости используют концентрацию 2-амино-2-гидроксиметил-пропан-1,3-диола не более 500 мкмоль/л, при этом концентрация бычьего сывороточного альбумина находится в диапазоне от 1 до 5 г/л с обеспечением лучшего обнаружения изменения цвета. В варианте исполнения для стабильного хранения при комнатной температуре часть компонентов реакционной смеси высушена, а часть находится в растворе-активаторе, при этом компоненты реакционной смеси разделены и реакцию амплификации нуклеиновых кислот начинают путем объединения высушенных компонентов, раствора-активатора и образца.
По второму варианту создан способ амплификации нуклеиновых кислот микроорганизмов или вирусов с РНК-геномом, заключающийся в том, что образец помещают в реакционную смесь, содержащую ДНК-полимеразу с цепь-вытесняющей активностью, обратную транскриптазу, праймеры для петлевой изотермической амплификации, дезоксирибонуклеотиды, соли, а также содержит: детергент Triton™ X-100, бычий сывороточный альбумин, дитиотреитол, этилендиаминтетрауксусную кислоту, и инкубируют при температуре, выбранной в диапазоне от 50 до 69ºС, в одной пробирке, после чего производят детекцию результата амплификации (инкубации), при этом итоговая смесь, образующаяся при смешивании образца с реакционной смесью, содержит:
детергент Triton™ X-100 - от 10 до 150 г/л,
бычий сывороточный альбумин - от 1 до 20 г/л,
дитиотреитол - от 6,25 до 18,75 ммоль/л,
этилендиаминтетрауксусную кислоту - от 0,5 до 1,5 ммоль/л (вариант 2), при этом реакционная смесь дополнительно содержит ингибитор РНКаз небелковой природы, а ингибитором РНКаз является поливинилсульфоновая кислота или ее соль. Для обеспечения флуоресцентного определения результата амплификации концентрация бычьего сывороточного альбумина находится в оптимальном для прохождения реакции диапазоне от 5 до 20 г/л, а детекцию результата реакции амплификации нуклеиновых кислот, представляющих интерес, проводят путем регистрации флуоресценции, для чего в реакционную смесь дополнительно добавляют флуоресцентный краситель, а детекцию результата реакции амплификации нуклеиновых кислот, представляющих интерес, проводят визуально. Для обеспечения визуального определения результата амплификации с использованием рН-чувствительного красителя pH реакционной смеси используют в диапазоне от 8,0 до 10,0 а для поддержания буферной емкости используют концентрацию 2-амино-2-гидроксиметил-пропан-1,3-диола не более 500 мкмоль/л, при этом концентрация бычьего сывороточного альбумина находится в диапазоне от 1 до 5 г/л с обеспечением лучшего обнаружения изменения цвета. В варианте исполнения для стабильного хранения при комнатной температуре часть компонентов реакционной смеси высушена, а часть находится в растворе-активаторе, а компоненты реакционной смеси разделены и реакцию амплификации нуклеиновых кислот начинают путем объединения высушенных компонентов, раствора-активатора и образца.
Созданы тест-системы для обнаружения микроорганизмов или вирусов, заключающиеся в том, что используют созданный способ амплификации, а для обеспечения достоверности получаемых результатов тест-системы снабжены положительным и отрицательным контрольными образцами, а также инструкцией по применению, включающей правила интерпретации результатов анализа.
Краткое описание фигур
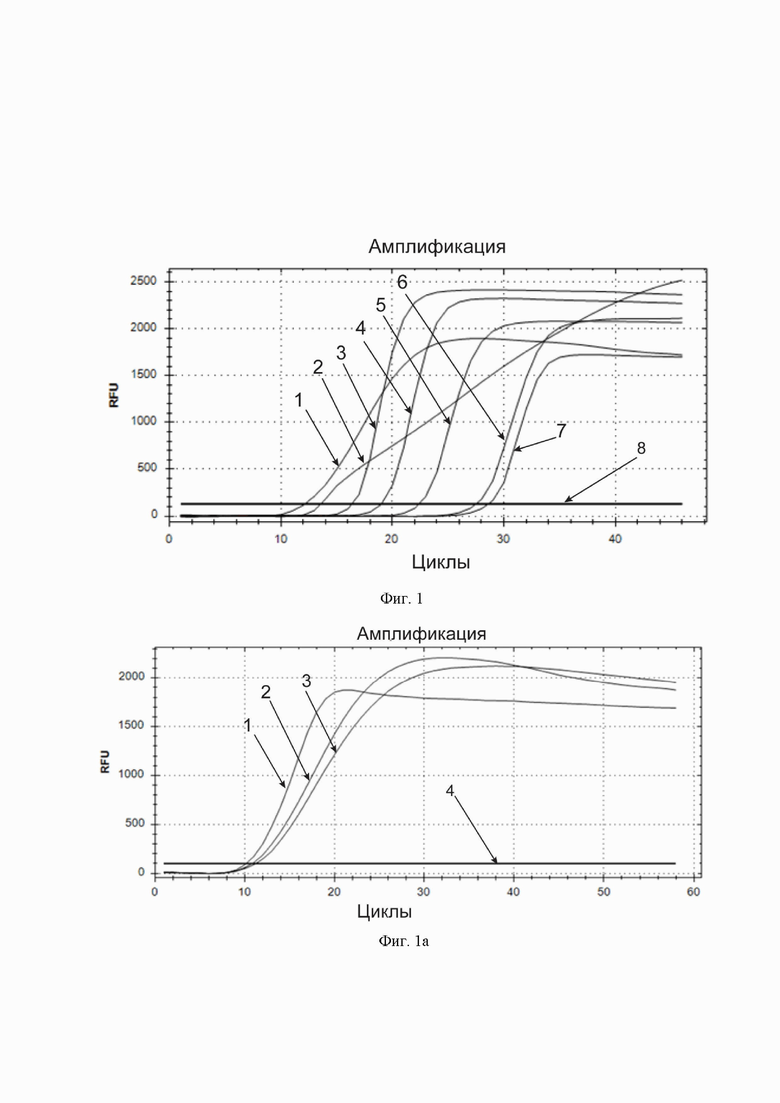
Фиг. 1. Кривые накопления флуоресцентного продукта амплификации и их зависимость от содержания Triton™X-100 в реакционной смеси. По горизонтальной оси – циклы амплификации. По вертикальной оси – относительные единицы флуоресценции. Горизонтальная линия, параллельная горизонтальной оси – пороговая линия (обозначена цифрой 8). Кривые накопления флуоресцентного продукта в порядке пересечения ими пороговой линии, слева направо: кривые для реакционной смеси, содержащей соответственно 1) 100, 2) 50, 3) 20, 4) 10, 5) 5, 6) 1 и 7) 0 г/л Triton™X-100.
Фиг. 1а. Кривые накопления флуоресцентного продукта амплификации и их зависимость от содержания Triton™X-100 в реакционной смеси. По горизонтальной оси – циклы амплификации. По вертикальной оси – относительные единицы флуоресценции. Горизонтальная линия, параллельная горизонтальной оси – пороговая линия (обозначена цифрой 4). Кривые накопления флуоресцентного продукта в порядке пересечения ими пороговой линии, слева направо: кривые для реакционной смеси, содержащей соответственно 1) 100, 2) 125, 3) 150 г/л Triton™X-100.
Фиг. 2. Кривые накопления флуоресцентного продукта амплификации и их зависимость от содержания БСА в реакционной смеси. По горизонтальной оси – циклы амплификации. По вертикальной оси – относительные единицы флуоресценции. Горизонтальная линия, параллельная горизонтальной оси – пороговая линия (обозначена цифрой 7). Кривые накопления флуоресцентного продукта в порядке пересечения ими пороговой линии, слева направо: кривые для реакционной смеси, содержащей соответственно 1) 20, 2) 15, 3) 10, 4) 5, 5) 2,5 и 6) 0 г/л БСА.
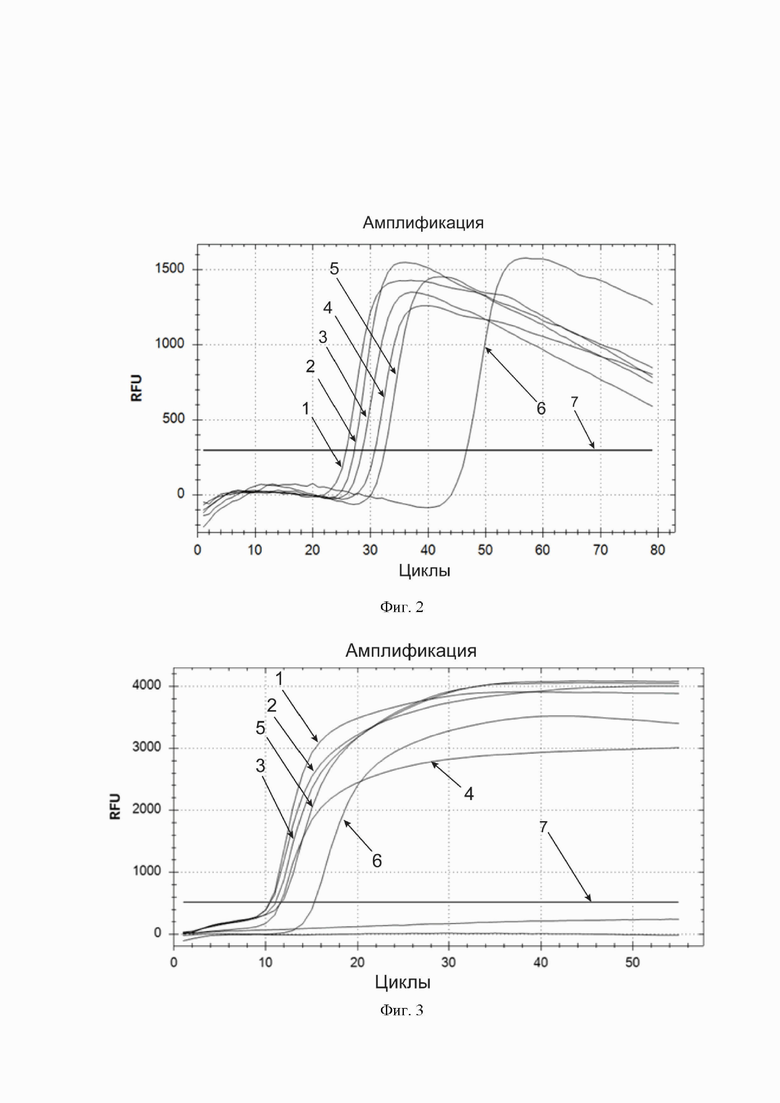
Фиг. 3. Кривые накопления флуоресцентного продукта амплификации и их зависимость от содержания ЭДТА в реакционной смеси. По горизонтальной оси – циклы амплификации. По вертикальной оси – относительные единицы флуоресценции. Горизонтальная линия, параллельная горизонтальной оси – пороговая линия (обозначена цифрой 7). Кривые накопления флуоресцентного продукта в порядке пересечения ими пороговой линии, слева направо: кривые для реакционной смеси, содержащей соответственно 1) 0,75, 2) 1, 3) 0,5, 4) 1,5, 5) 0,25 и 6) 2 ммоль/л ЭДТА. Ниже пороговой линии находятся кривые, полученные для отрицательных контрольных образцов.
Фиг. 4. Кривые накопления флуоресцентного продукта амплификации и их зависимость от содержания гуанидина гидрохлорида в реакционной смеси. По горизонтальной оси – циклы амплификации. По вертикальной оси – относительные единицы флуоресценции. Горизонтальная линия, параллельная горизонтальной оси – пороговая линия (обозначена цифрой 7). Кривые накопления флуоресцентного продукта в порядке пересечения ими пороговой линии, слева направо: кривые для реакционной смеси, содержащей соответственно 1) 40, 2) 50, 3) 60, 4) 30, 5) 20 и 6) 0 ммоль/л гуанидина гидрохлорида.
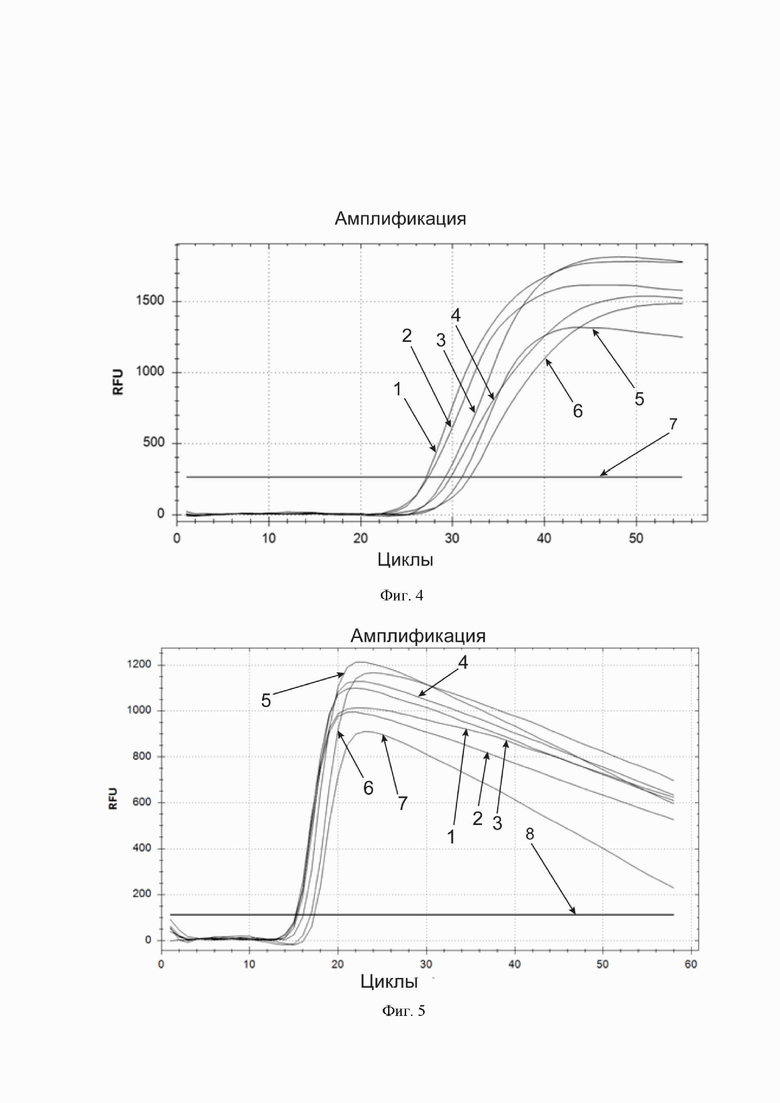
Фиг. 5. Кривые накопления флуоресцентного продукта амплификации и их зависимость от содержания дитиотреитола в реакционной смеси. По горизонтальной оси – циклы амплификации. По вертикальной оси – относительные единицы флуоресценции. Горизонтальная линия, параллельная горизонтальной оси – пороговая линия (обозначена цифрой 8). Кривые накопления флуоресцентного продукта в порядке пересечения ими пороговой линии, слева направо: кривые для реакционной смеси, содержащей соответственно 1) 18,75, 2) 12,5, 3) 6,25, 4) 25, 5) 37,5, 6) 50 и 7) 0 ммоль/л дитиотреитола.
Фиг. 6. Кривые накопления флуоресцентного продукта амплификации и их зависимость от содержания поливинилсульфоновой кислоты в реакционной смеси. По горизонтальной оси – циклы амплификации. По вертикальной оси – относительные единицы флуоресценции. Горизонтальная линия, параллельная горизонтальной оси – пороговая линия (обозначена цифрой 8). Кривые накопления флуоресцентного продукта в порядке пересечения ими пороговой линии, слева направо: кривые для реакционной смеси, содержащей соответственно 1) 0,00075; 2) 0,003; 3) 0,0003; 4) 0,0015; 5) 0; 6) 0,015 и 7) 0,06 % поливинилсульфоновой кислоты (массовая доля).
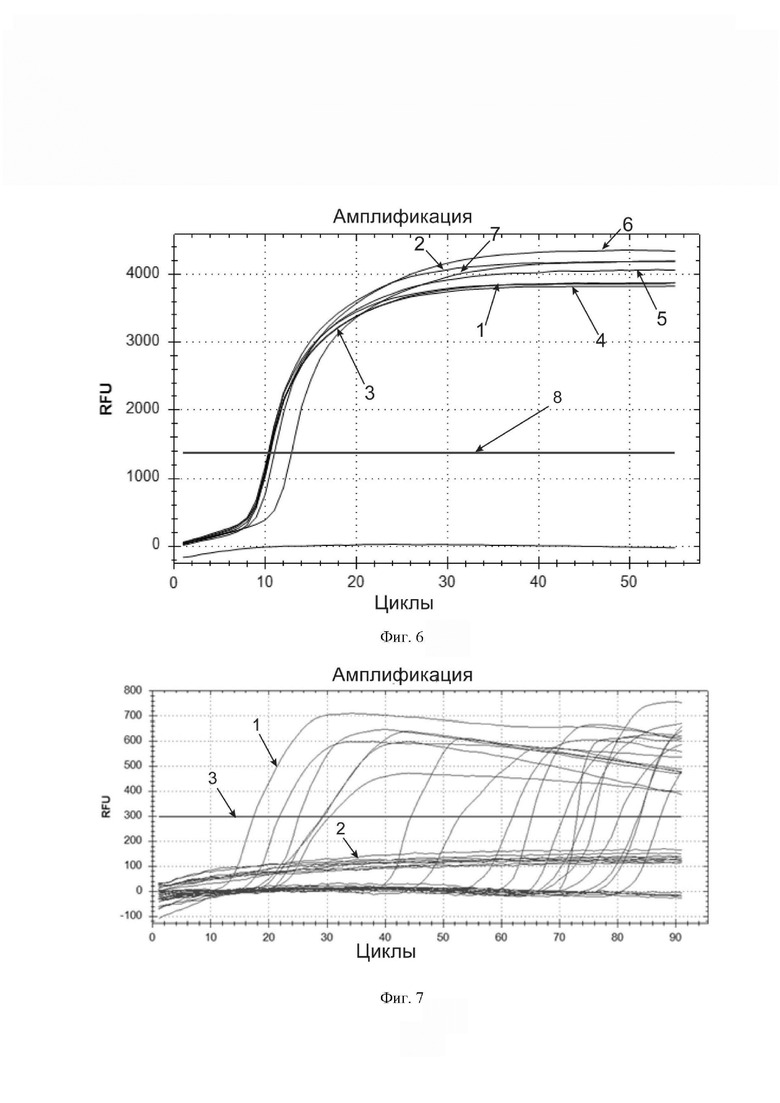
Фиг. 7. Результаты анализа серии клинических образцов на наличие вируса SARS-CoV-2 разработанной тест-системой. По горизонтальной оси – циклы амплификации. По вертикальной оси – относительные единицы флуоресценции. Горизонтальная линия, параллельная горизонтальной оси – пороговая линия (обозначена цифрой 3). Кривые S-образной (сигмообразной) формы (пример такой кривой обозначен цифрой 1), пересекающие пороговую линию и свидетельствующие об экспоненциальном накоплении продукта амплификации – кривые специфической амплификации, возникающие в присутствии вируса SARS-CoV-2 или специально сконструированного положительного контрольного образца. Пологие кривые (пример такой кривой обозначен цифрой 2), находящиеся под пороговой линией, возникают в результате вялотекущей неспецифической амплификации нуклеиновых кислот в образцах, не содержащих вирус, и не учитываются как положительный результат анализа.
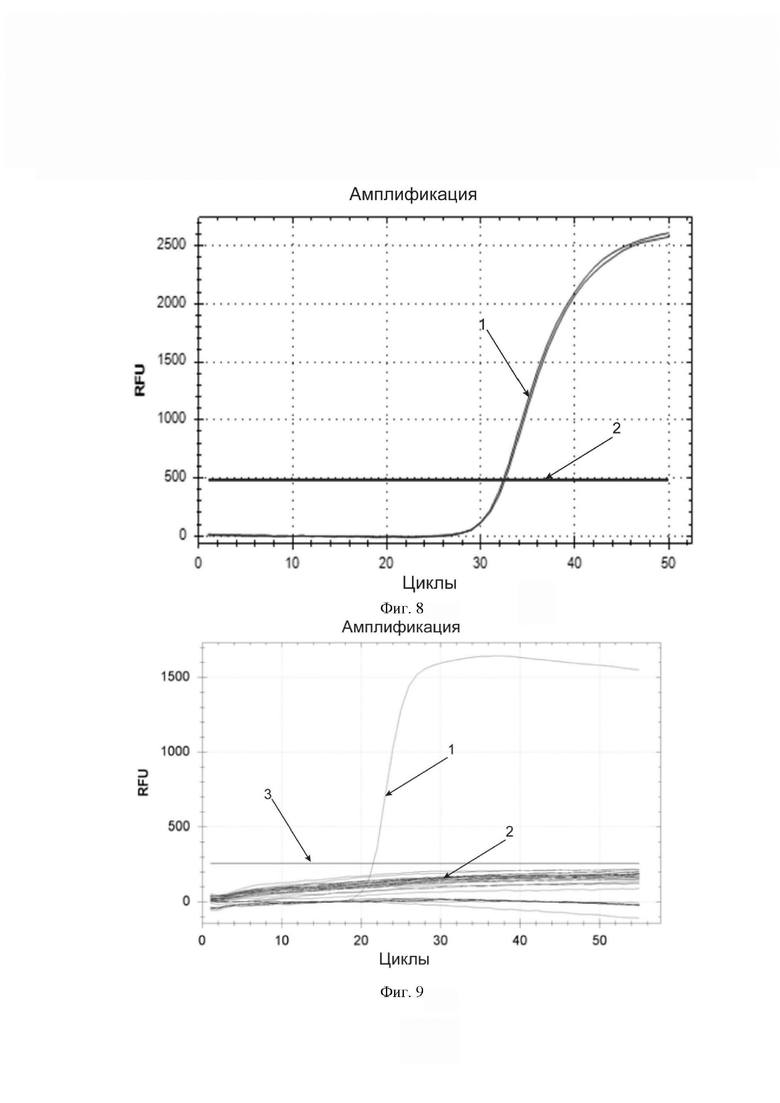
Фиг. 8. Пример кривых накопления флуоресцентного продукта, которые следует учитывать как положительный результат при анализе на наличие вируса SARS-CoV-2 разработанной тест-системой (приведен пример образцовой кривой, близкий по форме к идеальной сигмоидальной кривой). По горизонтальной оси – циклы амплификации. По вертикальной оси – относительные единицы флуоресценции. Горизонтальная линия, параллельная горизонтальной оси – пороговая линия (обозначена цифрой 2). Кривая S-образной (сигмообразной) формы (обозначена цифрой 1), пересекающая пороговую линию и свидетельствующая об экспоненциальном накоплении продукта амплификации – кривая специфической амплификации, возникающая в присутствии патогена или специально сконструированного положительного контрольного образца.
Фиг. 9. Специфичность обнаружения вируса SARS-CoV-2 разработанной тест-системой. По горизонтальной оси – циклы амплификации. По вертикальной оси – относительные единицы флуоресценции. Горизонтальная линия, параллельная горизонтальной оси – пороговая линия (обозначена цифрой 3). Единственная кривая, пересекающая пороговую линию (обозначена цифрой 1) – кривая накопления продукта амплификации последовательности нуклеотидов, специфической для вируса SARS-CoV-2 и входящей в состав положительного контрольного образца. Цифрой 2 обозначен пример кривой, возникающей при анализе разработанной тест-системой биологического образца, содержащего возбудитель респираторного заболевания иной, чем вирус SARS-CoV-2.
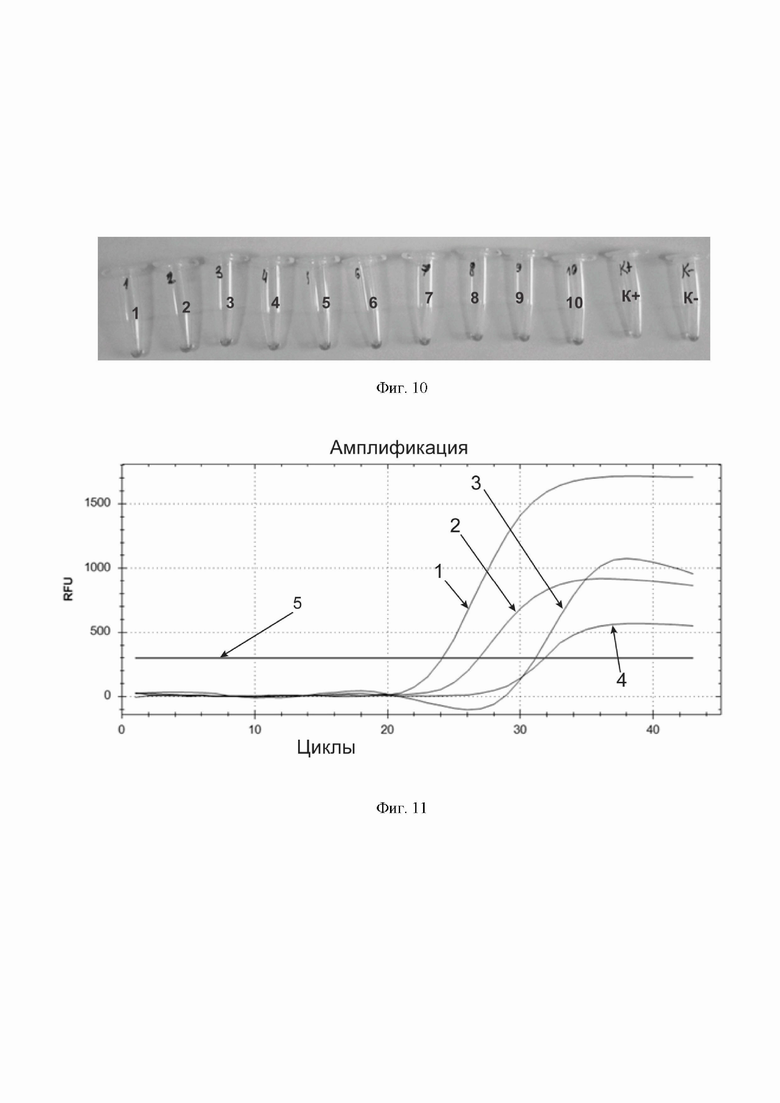
Фиг. 10. Специфичность обнаружения вируса SARS-CoV-2 разработанной тест-системой с колориметрической детекцией результата амплификации. Реакционная смесь меняет цвет при инкубации с положительным контрольным образцом, последовательность нуклеотидов которого соответствует последовательности нуклеотидов из генома вируса SARS-CoV-2, но не меняет цвет при инкубации с образцами, соответствующими иным микроорганизмам и вирусам, чем SARS-CoV-2 (на черно-белом изображении это можно видеть по просветлению смеси только в пробирке «К+»).
Фиг. 11. Сравнение разработанных тест-систем с флуоресцентной и колориметрической детекцией результата амплификации с аналогами производства «NewEnglandBiolabs». По горизонтальной оси – циклы амплификации. По вертикальной оси – относительные единицы флуоресценции. Горизонтальная линия, параллельная горизонтальной оси – пороговая линия (обозначена цифрой 5). Кривые накопления флуоресцентного продукта в порядке пересечения ими пороговой линии, слева направо: 1) для варианта тест-системы с флуоресцентной детекцией; 2) для варианта тест-системы с колориметрической детекцией с дополнительно добавленным флуоресцентным красителем SYBR® Green I; 3) для реакционной смеси Isothermal Amplification Buffer Pack, составленной из Bst 2.0 WarmStart™ DNA Polymerase и 10X Isothermal Amplification Buffer («NewEnglandBiolabs»); 4) для реакционной смеси WarmStart® Colorimetric LAMP 2X Master Mix (DNA & RNA) («NewEnglandBiolabs») с дополнительно добавленным флуоресцентным красителем SYBR® Green I.
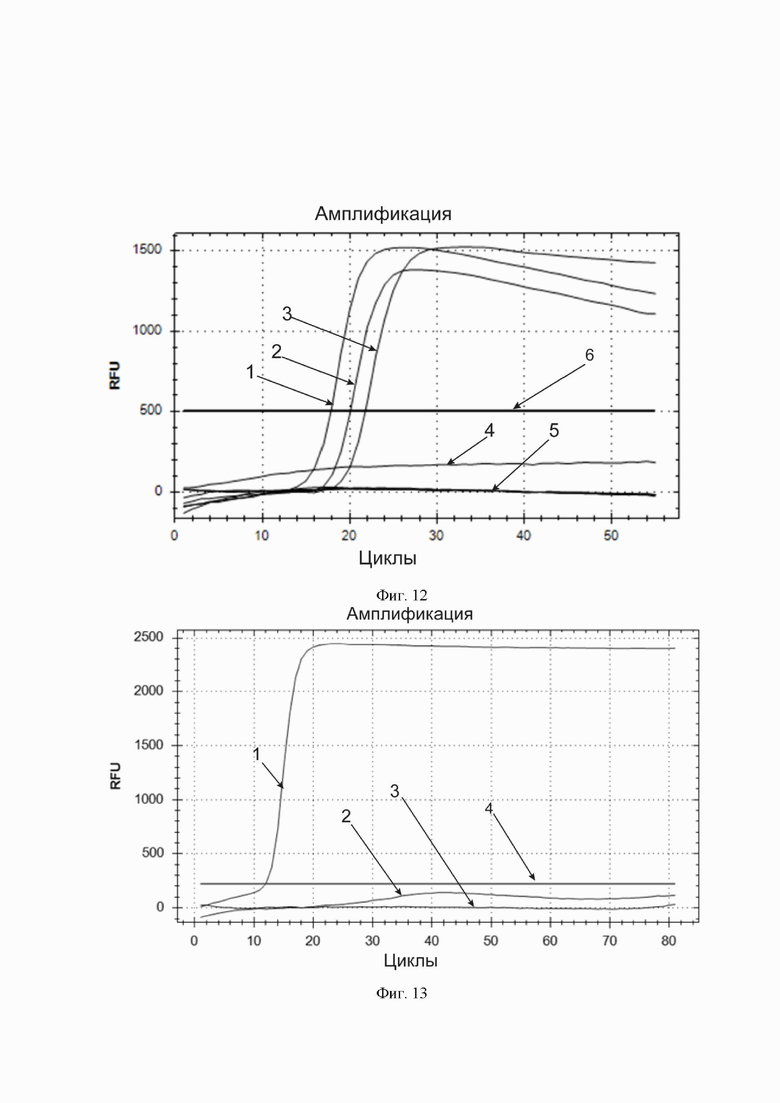
Фиг. 12. Обнаружение бактерии E. coli с помощью реакционной смеси, входящей в тест-систему с флуоресцентной детекцией результата амплификации и специфичных праймеров. По горизонтальной оси – циклы амплификации. По вертикальной оси – относительные единицы флуоресценции. Горизонтальная линия, параллельная горизонтальной оси – пороговая линия (обозначена цифрой 6). Кривые накопления флуоресцентного продукта в порядке пересечения ими пороговой линии, слева направо: накопление продукта амплификации для разведений 1) 106, 2) 105, 3) 104 КОЕ/мл; 4) кривая для 103 КОЕ/мл находится под пороговой линией, как и 5) кривая для отрицательного контрольного образца.
Фиг. 13. Специфическое обнаружение вируса гриппа штамма H1N1. По горизонтальной оси – циклы амплификации. По вертикальной оси – относительные единицы флуоресценции. Горизонтальная линия, параллельная горизонтальной оси – пороговая линия (обозначена цифрой 4). Единственная кривая, пересекающая пороговую линию (обозначена цифрой 1) – кривая накопления продукта амплификации последовательности нуклеотидов, специфической для вируса гриппа штамма H1N1. Кривые под пороговой линией (2, 3) соответствуют тестовым пробиркам, куда были внесены иные вирусы гриппа.
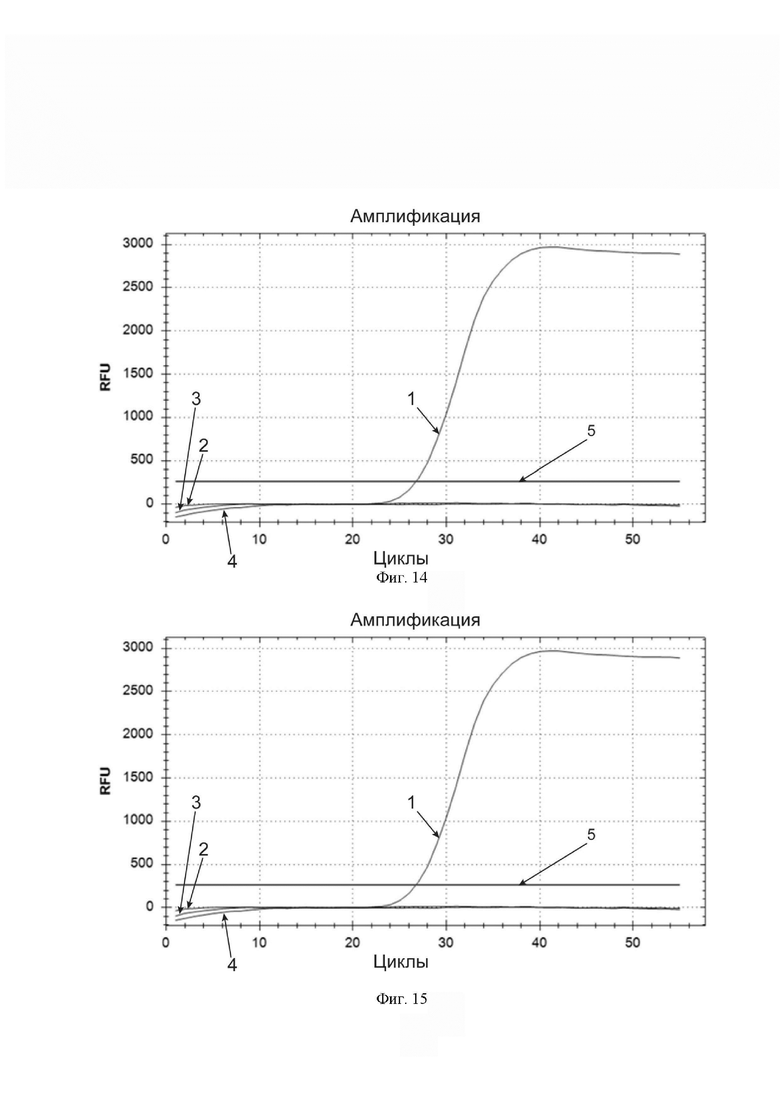
Фиг. 14. Специфическое обнаружение вируса гриппа штамма H3N2. По горизонтальной оси – циклы амплификации. По вертикальной оси – относительные единицы флуоресценции. Горизонтальная линия, параллельная горизонтальной оси – пороговая линия (обозначена цифрой 5). Единственная кривая, пересекающая пороговую линию (обозначена цифрой 1) – кривая накопления продукта амплификации последовательности нуклеотидов, специфической для вируса гриппа штамма H3N2. Кривые под пороговой линией соответствуют тестовым пробиркам, куда были внесены иные вирусы гриппа (2, 3) и отрицательный контрольный образец (4).
Фиг. 15. Специфическое обнаружение вируса гриппа В. По горизонтальной оси – циклы амплификации. По вертикальной оси – относительные единицы флуоресценции. Горизонтальная линия, параллельная горизонтальной оси – пороговая линия (обозначена цифрой 3). Единственная кривая, пересекающая пороговую линию (обозначена цифрой 1) – кривая накопления продукта амплификации последовательности нуклеотидов, специфической для вируса гриппа В. Кривые под пороговой линией соответствуют тестовым пробиркам, куда были внесены иные вирусы гриппа.
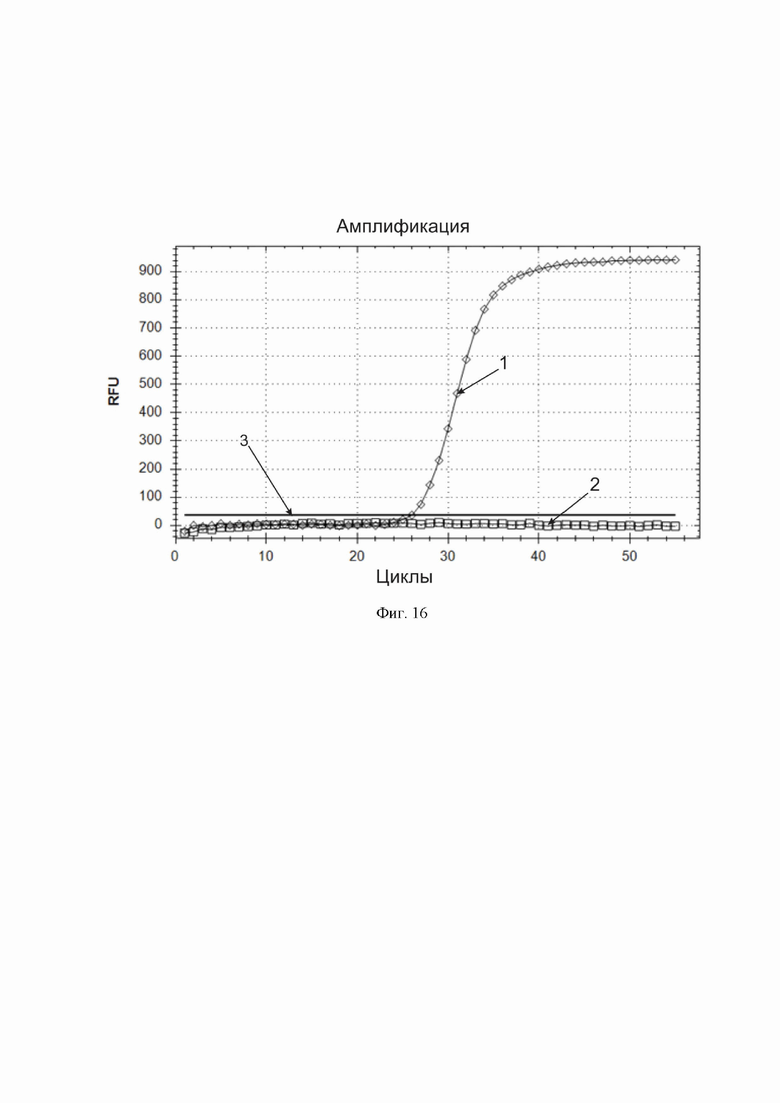
Фиг. 16. Доказательство эффективности тест-системы с флуоресцентной детекцией результата амплификации после вакуумной сушки реагентов, входящих в ее состав. По горизонтальной оси – циклы амплификации. По вертикальной оси – относительные единицы флуоресценции. Горизонтальная линия, параллельная горизонтальной оси – пороговая линия (обозначена цифрой 3). Единственная кривая, пересекающая пороговую линию (обозначена цифрой 1) – кривая накопления продукта амплификации последовательности НК, специфической для вируса SARS-CoV-2, полученная при анализе заведомо положительного на SARS-CoV-2 клинического образца. Кривые под пороговой линией (2) соответствуют тестовым пробиркам, куда были внесены отрицательные на SARS-CoV-2 клинические образцы.
Реализация изобретения
Разработан способ амплификации вирусных или микробных нуклеиновых кислот, содержащихся в биологическом образце с применением реакционной смеси, разработанной авторами и обладающей необходимыми свойствами для разрушения нуклеопротеидных частиц, лизиса биологического образца и инактивации нуклеаз одновременно с амплификацией целевой НК, способ использования такой реакционной смеси и тест-системы на основе такой реакционной смеси. Разработан способ использования реакционной смеси, включающий способы обнаружения амплификации целевой НК: флуоресцентный и колориметрический, в том числе визуальный. Разработаны тест-системы (варианты) на основе разработанной реакционной смеси, использующие как флуоресцентный, так и колориметрический способы обнаружения целевой НК, а именно НК патогенного вируса SARS-CoV-2, возбудителя заболевания COVID-19.
Предлагаемая реакционная смесь включает детергент Triton™ X-100 и восстанавливающий агент дитиотреитол, которые используются в настоящей реакционной смеси, помимо их стандартного назначения в составе амплификационных смесей (защита компонентов смеси от агрегации для детергентов, защита компонентов смеси от окисления для восстанавливающих агентов), для лизиса биологического образца и разрушения нуклеопротеидных, в частности вирусных, частиц. Их содержание в реакционной смеси подобрано таким образом, чтобы они, в сочетании с нагреванием до температуры амплификации, вызывали частичную или полную денатурацию белков образца и высвобождение НК из образца. При этом их содержание в реакционной смеси подобрано так, чтобы в сочетании с нагреванием до температуры амплификации не вызывать денатурацию ДНК-полимеразы Bst и не нарушать таким образом процесс амплификации НК (о чем можно судить по тому, что подобранные концентрации указанных веществ не сдвигают пороговый цикл амплификации в большую сторону, что соответствовало бы сдвигу вправо кривых амплификации на графике, а наоборот, способствуют оптимизации амплификации, что выражается в более быстром накоплении продукта амплификации и сдвигу кривых амплификации влево).
Подбор таких оптимальных концентраций стал возможен потому, что бактерия Geobacillus stearothermophilus, из которой изолирована полимераза Bst, является термофильной, вследствие чего ее белки обладают большей стабильностью в высокотемпературном диапазоне (диапазоне температур амплификации с использованием полимеразы Bst), чем белки клинически значимых биологических образцов, включая белки клеток человека, а также поражающих человека микробов и вирусов.
Также в предлагаемой в изобретении реакционной смеси используется бычий сывороточный альбумин (БСА), улучшающий параметры амплификации. Содержание всех указанных компонентов, а также ЭДТА (этилендиаминтетрауксусная кислота) оптимизировано для наилучшей амплификации.
Кроме того, реакционная смесь содержит компоненты, необходимые для петлевой изотермической амплификации НК: ДНК-полимеразу с цепь-вытесняющей активностью, праймеры, дезоксирибонуклеотиды (дезоксиаденозинтрифосфат, дезоксигуанозинтрифосфат, дезоксицитидинтрифосфат и дезокситимидинтрифосфат), соли.
Также было установлено, что добавление гуанидина вплоть до концентрации 60 ммоль/л улучшает протекание амплификации целевой НК в созданной реакционной смеси, однако гуанидин не был включен в ее состав, т. к. препарат НК часто и так оказывается загрязнен гуанидином в процессе выделения нуклеиновых кислот, что привносит гуанидин в реакционную смесь в том случае, если пользователь применяет в качества образца препарат выделенных НК, а не непосредственно биологический образец.
Предлагается также способ использования разработанной реакционной смеси, а именно способ амплификации, при котором разработанная реакционная смесь инкубируется при неизменной температуре, выбранной в диапазоне от 50 до 69ºС, в любом нагревательном приборе, способном поддерживать выбранную температуру инкубации с точностью до 0,5ºC, в течение времени, наилучшим образом подходящего для накопления преимущественно специфического продукта амплификации в количестве, совместимом с выбранным способом детекции продуктов амплификации, т. е. обычно не менее 15, но не более 30 минут.
Частными случаями разработанной реакционной смеси являются варианты реакционной смеси, предназначенные для конкретных способов детекции ДНК-продуктов амплификации. Так, для регистрации ДНК-продуктов амплификации в флуоресцентном варианте их детекции используется способность флуоресцентного красителя SYBR® GreenI связываться с двуцепочечной ДНК и продуцировать в этом состоянии более сильный сигнал флуоресценции, чем в несвязанном виде. Характеристиками этого красителя является предпочтительная длина волны излучения, используемого для возбуждения, составляющая 497 нм, и предпочтительная длина волны регистрируемого излучения 520 нм. Вместо SYBR® GreenI может быть использован другой флуоресцентный ДНК-связывающий краситель, известный специалистам в области молекулярной биологии.
Чтобы сделать возможной колориметрическую рН-зависимую детекцию результатов амплификации, реакционная смесь готовится с низким содержанием трис(гидроксиметил)аминометана и, как следствие, с низкой буферной емкостью. При синтезе цепи НК образуются протоны как побочный продукт, и благодаря вышеописанным особенностям реакционной смеси это приводит к сдвигу рН реакционной жидкости, что может быть обнаружено с помощью рН-чувствительных красителей, таких как феноловый красный, в результате использования которых возможно определить изменение окраски раствора визуально или с помощью колориметра.
Могут быть также использованы другие способы выявления амплификации НК, известные специалистам в области молекулярной биологии и конкретно в области LAMP, например, индикаторы ионов щелочноземельных металлов, такие как гидроксинафтоловый синий, или турбидиметрические способы.
Преимуществом предлагаемого изобретения является то, что в нем не используется лизис биологического образца с использованием протеиназы (типичное решение схожих задач), что удешевляет и упрощает техническое решение, в частности, снимает необходимость в прогревании реакционной смеси при высокой температуре перед этапом амплификации для инактивации протеиназы. Это делает реакционную смесь совместимой с источником нагрева, установленным только на одну температуру, и подходящей для использования методов изотермической амплификации.
Предлагаемое решение совмещает разрушение биологического образца, разборку вирионов или других нуклеопротеидных частиц, инактивацию нуклеаз и амплификацию НК в одной и той же пробирке, в один и тот же промежуток времени и с использованием одной и той же смеси, выступающей, таким образом, одновременно в качестве лизирующего буферного раствора, системы для выделения нуклеиновых кислот и реакционной смеси для амплификации. При этом полимераза вступает в конкуренцию с нуклеазами за нуклеиновые кислоты, что позволяет более успешно амплифицировать нуклеиновые кислоты – с меньшим риском того, что матричные НК будут разрушены нуклеазами еще до начала амплификации и не будут обнаружены при анализе.
Предлагаемое техническое решение позволяет проводить реакцию амплификации, а именно реакцию петлевой изотермической амплификации (LAMP), с использованием тех образцов, которые были отобраны даже в такую простую транспортную среду, как физиологический раствор (0,9% хлорид натрия). При этом компоненты реакционной смеси (РС) позволяют инактивировать нуклеазы, содержащиеся в образце, непосредственно при проведении реакции амплификации.
В варианте для анализа на содержание вирусов с РНК-геномом для лучшей сохранности РНК в реакционной смеси используется небелковый термостабильный ингибитор рибонуклеаз (РНКаз), например, поливинилсульфоновая кислота. Реакционная смесь для анализа образца на содержание РНК-вирусов содержит также обратную транскриптазу для синтеза кДНК, которая далее может служить матрицей для ДНК-полимеразы Bst.
Частными случаями использования разработанного способа амплификации являются разработанные тест-системы для выявления РНК коронавируса SARS-CoV-2, возбудителя респираторного заболевания COVID-19. РНК коронавирусов покрыта несколькими оболочками, липидной и белковыми, по этой причине разрушение капсида коронавирусов и высвобождение из него геномной РНК в относительно мягких температурных и химических условиях (под относительно мягкими условиями здесь понимаются условия, пригодные для амплификации высвобожденной РНК методом петлевой изотермической амплификации) представляет собой довольно сложную техническую задачу, которая успешно решается разработанной тест-системой.
В случае опасных вирусов, например, SARS-CoV-2, достоинством разработанной реакционной смеси является способность обезвреживать вирусы в процессе использования. О такой способности смеси говорит мировой опыт использования сходных смесей и сходных температурных условий, в частности, используемые химические и температурные условия удовлетворяют условиям, рекомендованным Центрами по контролю и профилактике заболеваний США для образцов, полученных от пациентов с подозрением на вирусную геморрагическую лихорадку, например, лихорадку Эбола [«Временное руководство по обращению с пациентами с подозрением на вирусную геморрагическую лихорадку в больницах США», http://www.cdc.gov/HAI/pdfs/bbp/VHFinterimGuidance05_19_05.pdf]. Более того, была также продемонстрирована способность взятой отдельно от нагревания 30-минутной инкубации образца с детергентом Triton™X-100 при комнатной температуре [Агентство общественного здоровья Англии, «Тестирование способов инактивации SARS-CoV-2: промежуточный отчет», 12 июня 2020, https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/898605/HCM-CoV2-006-v3_Triton_X-100_TCF.pdf; также E.I. Patterson и др. «Способы инактивации SARS-CoV-2 для дальнейших биологических исследований», bioRxiv, 2020] или прогревания при 65ºС (температура, используемая разработанной тест-системой) в течение 10 минут без детергента [DarnellME, TaylorDR. «Оценка способов инактивации коронавируса тяжелого острого респираторного синдрома в неклеточных производных крови», журнал Transfusion, 2006 Oct; 46(10): 1770–1777] убивать коронавирусы (SARS-CoV-2 и SARS-CoV) достаточно эффективно, чтобы способные к инфицированию вирусные частицы было невозможно обнаружить в образце вирусологическими методами.
Разработаны тест-системы, в которых разработанный способ амплификации вирусных или микробных нуклеиновых кислот, содержащихся в биологическом образце с использованием предложенной реакционной смеси снабжена положительным и отрицательным контрольным образцом для того, чтобы пользователь мог убедиться в протекании специфической реакции амплификации в данной постановке. Кроме того, в указанных тест-системах ферменты либо праймеры, необходимые для протекания реакции петлевой изотермической амплификации, отделены от основной реакционной смеси во избежание протекания неспецифических реакций до внесения образца, а также для увеличения стабильности компонентов при хранении. Как альтернатива, разработаны варианты исполнения тест-систем, в которых большая часть компонентов подвергнута вакуумной сушке или лиофилизации, а остальные компоненты включены в состав буферного раствора-разбавителя.
Изобретение подтверждается примерами.
Подбор оптимальных концентраций компонентов реакционной смеси, универсальных для амплификации НК микроорганизмов и вирусов как с ДНК-, так и с РНК-геномом, описан в примерах 1-5. В примере 6 описано исследование влияния поливинилсульфоновой кислоты, ингибитора РНКаз, который может быть использован для при анализе на содержание представляющих интерес РНК-геномов для лучшей их сохранности.
Пример 1
Оптимизация реакционной смеси по компоненту Triton™ X-100
В реакционной смеси для LAMP варьировали содержание компонента Triton™ X-100 и проводили реакцию на обнаружение РНК коронавируса SARS-CoV-2. Сравнивали получающиеся кривые (фиг. 1, 1а) по пороговым циклам, концентрация компонента, при которой пороговый цикл был наименьшим, принималась за оптимальную.
Сравнили результаты для диапазонов концентраций от 0 до 100 г/л Triton™ X-100 (в конечной реакционной смеси, получающейся после добавления образца), а также, в отдельной серии экспериментов, от 100 до 150 г/л. Наилучшие результаты в обоих случаях получили при использовании концентрации 100 г/л, концентрации в диапазоне от 10 до 100 г/л и от 100 до 150 г/л тоже также приводили к достаточно быстрому накоплению специфического продукта амплификации, что отображается в виде подъема кривой.
Пример 2
Оптимизация реакционной смеси по компоненту бычьего сывороточного альбумина (БСА)
В реакционной смеси для LAMP варьировали содержание компонента БСА и проводили реакцию на обнаружение коронавируса SARS-CoV-2. Сравнивали получающиеся кривые (фиг. 2) по пороговым циклам, концентрация компонента, при которой пороговый цикл был наименьшим, принималась за оптимальную.
БСА улучшал показатель порогового цикла во всех испытанных концентрациях от 1 до 20 г/л по сравнению со смесью без БСА. Наилучшие результаты получали при использовании концентрации 20 г/л (в конечной реакционной смеси, получающейся после добавления образца), однако сдвиг порогового цикла в сторону уменьшения был довольно малым по сравнению с концентрациями 15 и 10 г/л, при этом при высоких концентрациях БСА изменялся цвет реакционной смеси, что снижает ее пригодность для визуального колориметрического определения результата амплификации, а также снижалась стабильность смеси при замораживании-размораживании (выпадал осадок), поэтому было решено далее не повышать концентрацию БСА. Таким образом, наиболее благоприятным для амплификации был признан диапазон концентраций БСА от 5 до 20 г/л, а для визуального колориметрического определения результата амплификации - от 1 до 5 г/л.
Пример 3
Оптимизация реакционной смеси по компоненту ЭДТА
В реакционной смеси для LAMP варьировали содержание компонента ЭДТА и проводили реакцию на обнаружение коронавируса SARS-CoV-2. Сравнивали получающиеся кривые (фиг. 3) по пороговым циклам, концентрация компонента, при которой пороговый цикл был наименьшим, принималась за оптимальную.
Наилучшие результаты получали при использовании концентрации 0,75 ммоль/л (в конечной реакционной смеси, получающейся после добавления образца), ближайшие к ней исследованные значения (от 0,5 до 1,5 ммоль/л) были субоптимальными.
Пример 4
Совместимость реакционной смеси с наличием в ней гуанидина гидрохлорида
В реакционной смеси для LAMP варьировали содержание гидрохлорида гуанидина и проводили реакцию на обнаружение коронавируса SARS-CoV-2. Сравнивали получающиеся кривые (фиг. 4) по пороговым циклам, концентрация компонента, при которой пороговый цикл был наименьшим, принималась за оптимальную.
Наилучшие результаты получали при использовании концентрации 40 ммоль/л (в конечной реакционной смеси, получающейся после добавления образца), ближайшие к ней исследованные значения были субоптимальными.
Таким образом, было установлено, что добавление гуанидина вплоть до концентрации 60 ммоль/л улучшает протекание амплификации целевой НК в созданной реакционной смеси, однако препарат НК часто и так оказывается загрязнен гуанидином в процессе выделения нуклеиновых кислот, что привносит гуанидин в реакционную смесь в том случае, если пользователь применяет в качества образца препарат выделенных НК, а не непосредственно биологический образец, поэтому в дальнейшем в разработанной реакционной смеси гуанидин не использовался.
Пример 5
Оптимизация реакционной смеси по компоненту дитиотреитол
В реакционной смеси для LAMP варьировали содержание дитиотреитола и проводили реакцию на обнаружение коронавируса SARS-CoV-2. Сравнивали получающиеся кривые (фиг. 5) по пороговым циклам, концентрация компонента, при которой пороговый цикл был наименьшим, принималась за оптимальную.
Наилучшие результаты получали при использовании концентрации 18,75 ммоль/л дитиотреитола (в конечной реакционной смеси, получающейся после добавления образца), ближайшие к ней исследованные значения (от 6,25 до 12,5 ммоль/л) были субоптимальными.
Пример 6
Исследование возможности использования поливинилсульфоновой кислоты для ингибирования рибонуклеаз
В реакционной смеси для LAMP варьировали содержание поливинилсульфоновой кислоты и проводили реакцию на обнаружение коронавируса SARS-CoV-2. Сравнивали получающиеся кривые (фиг. 6) по пороговым циклам, концентрация компонента, при которой пороговый цикл был наименьшим, принималась за оптимальную.
В максимальной из использованных концентраций наблюдалось ингибирование реакции амплификации. В реакционных смесях со всеми остальными испытанными концентрациями амплификация проходила с приблизительно одинаковой скоростью, а ингибирования амплификации не наблюдали, что позволяет использовать данный ингибитор РНКаз как дополнительную (по отношению к воздействию нагревания в сочетании с детергентом Triton™ X-100 и восстанавливающим агентом дитиотреитолом) защиту представляющих интерес РНК от РНКаз.
Таким образом, проведя оптимизацию содержания отдельных компонентов реакционной смеси, как описано в примерах 1-5, и выбрав ту концентрацию каждого из этих компонентов, которая оказалась оптимальной в каждом из описанных экспериментов, получили реакционную смесь, подходящую для быстрого и надежного обнаружения патогенов непосредственно в биологических образцах (оптимизированные концентрации компонентов приведены в таблице 1).
Таблица 1. Состав оптимизированной реакционной смеси
Добавляя в эту смесь поливинилсульфоновую кислоту в концентрации, которую нашли оптимальной в примере 6, можно получить реакционную смесь, еще более пригодную для анализа образца на содержание патогенов с РНК-геномом. Кроме того, для анализа образца на содержание патогенов с РНК-геномом необходимо добавление в реакционную смесь обратной транскриптазы, что учитывалось при дальнейшей разработке тест-систем.
Температурный диапазон функционирования полимеразы Bst позволяет использовать ее при температуре инкубации реакционной смеси от 50 до 72ºС, однако предпочтительным диапазоном температур является 60-69ºС, позволяющий оптимальным образом совместить стабильность фермента и скорость его работы (и значит, сократить проведение анализа). Внутри этого диапазона для дальнейшего использования была выбрана температура амплификации 65ºС.
Дальнейшие примеры описывают применение заявляемого способа амплификации в составе тест-систем для обнаружения конкретных микроорганизмов или вирусов. Тест-системы включают в себя положительный и отрицательный контрольные образцы и инструкции пользователя, в которых описаны правила постановки анализа и интерпретации результатов исследования. Показана успешная и специфическая детекция в образце как ДНК- (пример 13), так и РНК-геномов (примеры 8-12, 14-15), представляющих интерес.
Пример 7
Подготовка образцов к анализу на содержание респираторного вируса, являющегося целевым аналитом, с применением заявляемого способа амплификации
Для подготовки образца к анализу в пробирку с 500 мкл физиологического раствора (0,9%-ный раствор хлорида натрия) вносили мазок из носоглотки и/или ротоглотки, энергичными вращательными движениями обеспечивали отделение биологического материала от зонда/тампона в раствор, стараясь не допустить разбрызгивания потенциально зараженной жидкости, после чего зонд/тампон дезактивировали, рассматривая его как инфекционно-опасный. В случае взятия назофарингеального и орофарингеального мазка от одного пациента биологический материал с обоих зондов/тампонов смывали в одной и той же пробирке для увеличения вирусной нагрузки. Образцы хранили в холодильнике при температуре от 2 до 8°С и транспортировали с соблюдением «холодовой цепи». Транспортной средой и/или средой для хранения образца при этом являлся физиологический раствор, в котором производился смыв.
Такая подготовка образца обеспечивает оптимальную концентрацию вируса в образце, низкую концентрацию потенциально интерферирующих веществ, а также не меняет рН образца. Сохранение рН образца в физиологическом диапазоне важно для варианта реакционной смеси с рН-зависимым красителем, обеспечивающим колориметрическую детекцию результата амплификации.
Пример 8
Проведение анализа образца на содержание вируса SARS-CoV-2 (патогенный вирус с РНК-геномом) с применением заявляемой реакционной смеси в составе тест-системы в варианте исполнения с колориметрической детекцией результата амплификации
Для проведения реакции амплификации использовали тест-систему в варианте исполнения с колориметрической детекцией результата амплификации, в которую входит реакционная смесь («РС»), содержащая все компоненты, необходимые для амплификации вирусной РНК, кроме праймеров и матричной НК, и оптимизированная согласно примерам 1-6, и «Праймеры» - смесь праймеров, а также контрольные образцы: положительный и отрицательный контрольные образцы «К+» и «К-», представляющие собой соответственно раствор ПЦР-продукта амплификации специфического участка генома SARS-CoV-2 и воду.
Для проведения анализа использовали твердотельный термостат, позволяющий нагревать образцы до 65°С, и микропробирки объемом от 0,5 до 1,5 мл, подходящие к гнездам термостата.
Компоненты тест-системы размораживали и тщательно перемешивали. Во время работы с реагентами обеспечивали их охлаждение путем помещения их на лед, хладоэлемент (аккумулятор холода) или в охлажденный штатив (например, штатив изотермический Isofreeze®).
Готовили микропробирки в количестве n+3, где n – число образцов, которые нужно исследовать (три пробирки используют в качестве контрольных). Ставили их охлаждаться в изотермический штатив, предварительно охлажденный при -20°С (предпочтительно), или в лед. Ставили в изотермический штатив или лед еще одну пробирку для смешивания «РС» и «Праймеров».
Готовили на холоде (в изотермическом штативе или во льду) смесь «РС» и «Праймеров» из расчета, что на анализ одного образца расходуется 15 мкл «РС» и 2 мкл «Праймеров», с запасом 10 %, необходимым, чтобы нивелировать погрешности пипеток (см. таблицу 2). Размешивали смесь наконечником пипетки, надетым на пипетку. Сразу же использовали полученную смесь.
Таблица 2. Подготовка смеси «РС» и «Праймеров» на 20 образцов, включая контрольные. При необходимости анализа, например, 30 образцов, все объемы из таблицы умножаются на 1,5, и т.д.
Вносили по 17 мкл смеси «РС» и «Праймеров» в каждую микропробирку. Добавляли анализируемые образцы, «К-» и «К+» по таблице 3. После добавления этих компонентов размешивали смесь в каждой пробирке наконечником пипетки, не снимая его с пипетки.
Таблица 3. Схема постановки реакции в тестовых и контрольных микропробирках
контроль
Если в образце отсутствует НК представляющего интерес вируса: розовый.
*Можно подготовить на холоде и сразу же использовать смесь «РС» и «Праймеров» для всех пробирок сразу, как описано выше в тексте.
Микропробирки помещали в твердотельный термостат, предварительно нагретый до 65°С.
Через 25 мин доставали все микропробирки из термостата, включая колориметрический стандарт, давали им остыть до комнатной температуры на столе (в течение 2-3 мин) и визуально оценивали цвет жидкости на белом фоне, сравнивая с колориметрическим стандартом.
Чрезвычайно важно инкубировать микропробирки в термостате не дольше указанного времени! Со временем в пробирках могут накапливаться неспецифические продукты амплификации, что может привести к ложноположительному результату.
Жидкость в пробирке «колориметрический стандарт» остается розового цвета, и с ней сравнивают цвет жидкости в остальных пробирках.
Изменившийся, желтый, цвет жидкости означает положительный результат теста (наличие НК вируса) для исследуемого образца. Розовый цвет жидкости означает отрицательный результат теста (отсутствие НК вируса) для исследуемого образца. Результаты анализа партии образцов являются валидными только в том случае, если жидкость в пробирке, куда вместо физиологического раствора с образцом был добавлен «К+», стала желтой, а жидкость в пробирке, куда вместо физиологического раствора с образцом был добавлен «К-», осталась розовой.
Если жидкость в пробирке, куда вместо физиологического раствора с образцом был добавлен «К+», осталась розовой, это означает, что реакция петлевой изотермической амплификации в данной партии образцов не прошла, что угрожает получением ложноотрицательных результатов, поэтому результаты анализа данной партии образцов считаются недостоверными.
Если жидкость в пробирке, куда вместо физиологического раствора с образцом был добавлен «К-», стала желтой, это означает контаминацию реактивов, расходных материалов или рабочего места нуклеиновыми кислотами с последовательностью нуклеотидов, характерной для определяемого вируса, что угрожает получением ложноположительных результатов, поэтому результаты анализа данной партии образцов считаются недостоверными. Требуется предпринять меры по выявлению и ликвидации источника контаминации и повторить анализ всех образцов данной постановки, для которых получен положительный результат. Образцы данной постановки, анализ которых дал отрицательный результат, можно учитывать как отрицательные.
Пример 9
Проведение анализа образца на содержание вируса, являющегося целевым аналитом, с применением заявляемой реакционной смеси в составе тест-системы в варианте исполнения с флуоресцентной детекцией результата амплификации
Для проведения реакции амплификации использовали тест-систему с флуоресцентной детекцией результата амплификации, в которую входит реакционная смесь («РС»), содержащая все компоненты, необходимые для амплификации, кроме ферментов и матричной НК, и оптимизированная согласно примерам 1-6, и «Фермент» - смесь ферментов, необходимых для амплификации вирусной РНК (обратная транскриптаза и ДНК-полимераза Bst), а также контрольные образцы: положительный и отрицательный контрольные образцы «К+» и «К-», представляющие собой соответственно раствор ПЦР-продукта амплификации специфического участка генома SARS-CoV-2 и воду.
Для проведения анализа использовали амплификаторы, позволяющие нагревать образцы до 65°С и регистрировать флуоресценцию по каналу SYBR (или FAM; λмакс.возб./λмакс.эм. – 497 нм/520 нм) в режиме реального времени, и микропробирки, совместимые с используемыми приборами.
Использовали следующие условия амплификации: 25 минут инкубации, постоянная температура 65°С.
Во время работы с реагентами обеспечивали их охлаждение путем помещения их в охлажденный штатив (например, штатив изотермический Isofreeze®), на хладоэлемент (аккумулятор холода) или в лед.
Компоненты Набора реагентов размораживали и тщательно перемешивали (пипетированием или с помощью 1-2 ударов по стенке пробирки).
Готовили микропробирки в количестве n+2, где n – число образцов, которые нужно исследовать, а 2 пробирки используют в качестве контрольных.
Помещали микропробирки в изотермический штатив, охлажденный при -20°С (предпочтительно), или, при отсутствии такового, в лед. Если в процессе работы нарушается режим охлаждения, с высокой вероятностью образуются неспецифические продукты амплификации.
Готовили смесь «РС» и «Фермента» в отдельной охлажденной пробирке согласно таблице 4, тщательно перемешивали (пипетированием или с помощью 1-2 ударов по стенке пробирки). Немедленно использовали смесь.
Готовили автоматический дозатор, установленный на 8,5 мкл, с надетым наконечником, охлаждали наконечник, опустив его на 5-10 секунд в холодную (стоящую в изотермическом штативе или во льду) смесь «РС» и «Фермента».
Таблица 4. Подготовка смеси «РС» и «Фермента» согласно количеству анализируемых проб*
*Для исследования любого другого числа проб (20, 30, 40…) количество «РС» и «Фермента» для 10 проб нужно умножить на соответствующий коэффициент (2, 3, 4…).
Делили смесь «РС» и «Фермента» между охлажденными микропробирками для ПЦР так, чтобы в каждую микропробирку для ПЦР было внесено 8,5 мкл смеси.
Добавляли в микропробирки реагенты согласно таблице 5.
Перемешивали смесь в каждой пробирке ударом пальца по пробирке.
Таблица 5. Схема постановки реакции в тестовых и контрольных микропробирках
контроль
Незамедлительно помещали микропробирки в амплификатор и запускали программу амплификации.
При этом для проведения анализа готовили амплификатор заранее в соответствии с руководством по эксплуатации амплификатора. Программировали амплификатор согласно следующим принципам:
• температура инкубации постоянная и составляет 65°С;
• суммарное время инкубации образцов в приборе должно составлять 25 минут. В это время включается не только время прохождения циклов в программе амплификатора, но и время между циклами, требующееся для измерения флуоресценции. Т.е. нельзя запрограммировать 75 циклов по 20 секунд, т. к. суммарное время инкубации превысит 25 минут, что может привести к появлению неспецифической амплификации. Время, необходимое для перехода между циклами, и, соответственно, необходимое число циклов будут зависеть от модели амплификатора;
• поэтому при первом запуске анализа замеряли, скольким циклам по 20 секунд (далее это число циклов обозначается как N) будет соответствовать общее время инкубации образцов 25 минут, пользуясь часами или таймером. Для амплификатора CFX96 в случае циклов по 20 секунд такое число циклов N равняется 40 циклам. При этом необходимо остановить выполнение программы амплификатора по прошествии 25 минут;
• при дальнейших запусках анализа программируется необходимое число циклов, N циклов по 20 секунд, которое было определено при первом запуске (см. пункт выше), с измерением флуоресценции на канале SYBR (FAM) каждые 20 секунд.
Обычно после протекания амплификации наблюдают набор кривых разной формы, как на фиг. 7, к которому следует применять следующие критерии интерпретации результата:
Для отрицательного контроля «К-»: значение порогового цикла Ct в канале SYBR (FAM) не должно определяться (на ряде амплификаторов это обозначается как значение порогового цикла Ct 0,00) или должно составлять не менее N циклов (в случае циклов по 20 секунд). Если для «К-» значение Ct менее N циклов, это свидетельствует о наличии контаминации в системе. В этом случае результаты по данной постановке считаются недостоверными. Требуется предпринять меры по выявлению и ликвидации источника контаминации и повторить анализ всех образцов данной постановки, для которых получен положительный результат. Образцы данной постановки, анализ которых дал отрицательный результат, следует учитывать, как отрицательные.
Для положительного контроля «К+»: значение Ct в канале SYBR (FAM) должно быть менее N циклов, иначе вся постановка считается недействительной.
Для каждой микропробирки: значение Ct в канале SYBR (FAM) должно быть более 6 циклов (по 20 секунд). Если в первые 2 минуты реакции (в первые 6 циклов по 20 секунд) выявляется амплификация (иначе говоря, кинетическая кривая флуоресценции пересекает пороговую линию), такая амплификация считается неспецифической и не учитывается при анализе.
Кроме того, не учитываются, т. к. являются неспецифическими, пологие кривые, по форме не напоминающие типичную кривую, получаемую в ПЦР (т. е. кривую с экспоненциальным накоплением продукта амплификации, как на фиг. 8). На фиг. 7 они находятся под пороговой линией, но даже если они пересекают пороговую линию, то также не учитываются. Учитываются только характерные кинетические кривые роста сигнала флуоресценции S-образной (сигмообразной) формы, как на фиг. 8.
Если значение Ct в канале SYBR (FAM) не определяется (на ряде амплификаторов это обозначается как значение порогового цикла Ct 0,00) или составляет не менее N циклов, анализируемый образец считать отрицательным, то есть не содержащим НК представляющего интерес вируса.
Если значение Ct в канале SYBR (FAM) составляет менее N циклов, анализируемый образец считать положительным, то есть содержащим НК представляющего интерес вируса.
Пример 10
Доказательство специфического обнаружения РНК вируса SARS-CoV-2 тест-системой с флуоресцентной детекцией результата амплификации, созданной на основе предлагаемой реакционной смеси
Для определения аналитической специфичности тест-системы проводили анализ, как в примере 9, с образцами возбудителей респираторных инфекций, иных, чем SARS-CoV-2. Результаты анализа отражены в таблице 6.
Наблюдали единственную кривую накопления флуоресцентного продукта амплификации, соответствующую положительному контрольному образцу, входящему в состав тест-системы (фиг. 9).
Таблица 6. Специфическое обнаружение РНК вируса SARS-CoV-2 тест-системой с флуоресцентной детекцией результата амплификации
Для определения диагностической специфичности использовались мазки из носо- и ротоглотки от людей без признаков респираторных заболеваний. Неспецифических реакций выявлено не было.
Пример 11
Доказательство специфического обнаружения РНК вируса SARS-CoV-2 тест-системой с колориметрической детекцией, созданной на основе предлагаемой реакционной смеси
Для определения аналитической специфичности тест-системы проводили анализ, как в примере 8, с образцами возбудителей респираторных инфекций, иных, чем SARS-CoV-2. Результаты анализа отражены в таблице 7.
По окончании реакции наблюдали изменение цвета реакционной смеси только в пробирке, куда был внесен положительный контрольный образец, входящий в состав тест-системы (фиг. 10).
Таблица 7. Специфическое обнаружение РНК вируса SARS-CoV-2 разработанной тест-системой с колориметрической детекцией результата флуоресценции
Пример 12
Сравнение разработанных тест-систем с имеющимися аналогами
Сравнивали специфическую амплификацию РНК коронавируса для разработанных тест-систем и аналогичных имеющихся на рынке продуктов: WarmStart® Colorimetric LAMP 2X Master Mix (DNA & RNA) и Isothermal Amplification Buffer Pack (NewEnglandBiolabs). Реакционную смесь, разработанную для тест-системы с колориметрической детекцией результата амплификации, а также реакционную смесь WarmStart® Colorimetric LAMP 2X Master Mix (DNA & RNA) дополняли флуоресцентным красителем SYBR® GreenI для возможности сравнения с аналогами, использующими принцип флуоресцентной детекции: добавляли такое количество 50Х (50-кратного)SYBR® GreenI, чтобы в реакционной смеси после внесения образца была концентрация 1Х. Проводили реакцию, как описано в примере 9, используя в качестве матрицы тотальную РНК от пациентов, больных COVID-19, выделенную из мазка из ротоглотки методом специфической сорбции на магнитных частицах. Наблюдали кривые накопления флуоресцентных продуктов (фиг. 11), при этом наилучшее (наименьшее) значение порогового цикла наблюдали для разработанной тест-системы с флуоресцентной детекцией результата амплификации, на втором месте по этому показателю находилась разработанная тест-система, предназначенная для колориметрической детекции результата амплификации.
Таким образом, разработанные тест-системы превосходят аналоги производства NewEnglandBiolabs даже в ситуации, когда матрицей в реакции служит выделенная РНК коронавируса (хотя оптимизация разработанных тест-систем проводилась в первую очередь в направлении возможности анализа биологического образца без этапа выделения РНК).
Пример 13
Обнаружение бактерий E. coli (условно патогенный микроорганизм с ДНК-геномом) предлагаемым способом амплификации
Суспензию бактерий E. сoli штамма DH5α подвергали последовательным 10-кратным разведениям вплоть до содержания 103 КОЕ/мл и вносили 1,5 мкл каждого разведения в качестве образца в реакционную смесь, приготовленную, как для тест-системы с флуоресцентной детекцией для выявления вируса SARS-CoV-2, но с праймерами, подобранными к геному E. coli. Наблюдали накопление продукта амплификации (фиг. 12) для разведений 106, 105, 104 КОЕ/мл, но не для 103 КОЕ/мл.
Пример 14
Специфическое обнаружение вирусов гриппа (патогенные вирусы с РНК-геномом) предлагаемым способом амплификации
Подбирали праймеры для LAMP, пригодные соответственно для обнаружения вируса гриппа А штамма H1N1, вируса гриппа А штамма H3N2 либо вируса гриппа B. Готовили реакционную смесь и проводили реакцию, как при использовании тест-системы с флуоресцентной детекцией для выявления вируса SARS-CoV-2, но в каждом из случаев с праймерами для обнаружения одного из этих вирусов. Наблюдали специфическую амплификацию вирусной НК в присутствии подходящих к ней праймеров и отсутствие амплификации при несовпадении праймеров и штамма вируса (фиг. 13-15).
Пример 15
Вакуумная сушка компонентов тест-системы
Подготавливали смесь компонентов, куда входили:
1) разработанная для тест-системы реакционная смесь, видоизмененная так, чтобы полноценная реакционная смесь образовывалась только после объединения с буферным раствором-активатором, а также
2) смесь ферментов «Фермент» (смесь ДНК-полимеразы Bst и обратной транскриптазы из состава той же тест-системы. Подвергали эту смесь компонентов вакуумной сушке в центрифужном испарителе в присутствии лиопротектора (трегалозы), хранили в течение 2 месяцев при комнатной температуре, после чего растворяли высушенные компоненты смеси в буферном растворе-активаторе и проводили полученным реагентом анализ клинических образцов. Положительный контрольный образец высушивали без добавления трегалозы, для применения его растворяли в воде для молекулярной биологии. Не наблюдали ложноположительных и ложноотрицательных результатов анализа (фиг. 16), что доказывает применимость высушенного формата разработанной тест-системы для диагностики.
Все приведенные примеры доказывают выполнение технической задачи, а именно, создание быстрого и надежного способа, способного выявлять целевой аналит, а именно вирусную или микробную НК, с использованием одной реакционной смеси и в одной пробирке.
Промышленная применимость
Все приведенные примеры подтверждают промышленную применимость данного изобретения.
Перечень сокращений
НК – нуклеиновая кислота,
ДНК – дезоксирибонуклеиновая кислота,
ПЦР – полимеразная цепная реакция,
LAMP – петлевая изотермическая амплификация,
РНК – рибонуклеиновая кислота,
ОТ-ПЦР – обратная транскрипция, совмещенная с полимеразной цепной реакцией,
РНКаза – рибонуклеаза,
г – грамм,
л – литр,
SARS-CoV-2 – ассоциированный с тяжёлым острым респираторным синдромом коронавирус 2,
COVID-19 – коронавирусное заболевание 2019,
БСА – бычий сывороточный альбумин,
ЭДТА – этилендиаминтетрауксусная кислота,
SARS-CoV – ассоциированный с тяжёлым острым респираторным синдромом коронавирус,
КОЕ – колониеобразующие единицы.
| название | год | авторы | номер документа |
|---|---|---|---|
| Набор олигонуклеотидных праймеров и флуоресцентно-меченых зондов для идентификации РНК коронавируса человека SARS-CoV-2 методом изотермической ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени | 2021 |
|
RU2778855C1 |
| Тест-система и способ для выявления РНК коронавируса SARS-COV-2, вируса-возбудителя коронавирусного заболевания 2019 COVID-19, методом полимеразной цепной реакции в режиме реального времени (Варианты) | 2020 |
|
RU2731390C1 |
| Олигонуклеотиды для определения мутации S:L452R SARS-CoV-2 | 2022 |
|
RU2795018C1 |
| Способ выявления РНК вируса SARS-CoV2 с помощью мультиплексной изотермической петлевой амплификации с обратной транскрипцией | 2020 |
|
RU2761170C1 |
| Тест-система для выявления SARS-CoV-2, Influenza virus A, Influenza virus B методом одношаговой полимеразной цепной реакции с обратной транскрипцией | 2021 |
|
RU2761481C1 |
| Тест-система для обнаружения РНК вируса SARS-CoV-2 в биоматериале от животных, пищевых продуктах и объектах окружающей среды методом полимеразной цепной реакции в режиме реального времени | 2021 |
|
RU2756474C1 |
| Набор олигодезоксирибонуклетидных праймеров и флуоресцентно-меченого зонда для идентификации РНК коронавирусов человека SARS и 2019-nCoV методом ОТ-ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени | 2020 |
|
RU2733665C1 |
| Набор для выявления вируса SARS-CoV методом ОТ-ПЦР в реальном времени | 2020 |
|
RU2744198C1 |
| НАБОР РЕАГЕНТОВ ДЛЯ ОБНАРУЖЕНИЯ РНК SARS-COV-2 МЕТОДОМ ПЕТЛЕВОЙ ИЗОТЕРМИЧЕСКОЙ АМПЛИФИКАЦИИ В РЕАЛЬНОМ ВРЕМЕНИ (КОВИГЕН-LAMP) | 2022 |
|
RU2779189C1 |
| Олигонуклеотиды для определения мутации S:N501Y SARS-CoV-2 | 2022 |
|
RU2791958C1 |
Изобретение относится к области молекулярной биологии, вирусологии и биотехнологии. Описана тест-система для выявления специфических нуклеотидных последовательностей, характерных для выявляемых микроорганизмов или вирусов, путем амплификации нуклеиновых кислот микробов или вирусов, содержащая ДНК-полимеразу с цепь-вытесняющей активностью, праймеры для петлевой изотермической амплификации, дезоксирибонуклеотиды, соли, а также детергент Triton™ X-100, бычий сывороточный альбумин, дитиотреитол, этилендиаминтетрауксусную кислоту, при этом концентрация веществ в итоговой жидкости для реакции амплификации нуклеиновых кислот составляет: детергент Triton™ X-100 - от 10 до 150 г/л, бычий сывороточный альбумин - от 1 до 20 г/л, дитиотреитол - от 6,25 до 18,75 ммоль/л, этилендиаминтетрауксусная кислота - от 0,5 до 1,5 ммоль/л. Также описана тест-система для выявления специфических нуклеотидных последовательностей, характерных для выявляемых микроорганизмов или вирусов, путем амплификации нуклеиновых кислот микробов или вирусов, путем амплификации нуклеиновых кислот микробов или вирусов, содержащая ДНК-полимеразу с цепь-вытесняющей активностью, обратную транскриптазу, праймеры для петлевой изотермической амплификации, дезоксирибонуклеотиды, соли, а также детергент Triton™ X-100, бычий сывороточный альбумин, дитиотреитол, этилендиаминтетрауксусную кислоту, при этом концентрация веществ в итоговой жидкости для реакции амплификации нуклеиновых кислот составляет: детергент Triton™ X-100 - от 10 до 150 г/л, бычий сывороточный альбумин - от 1 до 20 г/л, дитиотреитол - от 6,25 до 18,75 ммоль/л, этилендиаминтетрауксусная кислота - от 0,5 до 1,5 ммоль/л. Кроме того, представлен способ применения указанных тест-систем для выявления специфических нуклеотидных последовательностей, характерных для выявляемых микроорганизмов или вирусов, путем амплификации нуклеиновых кислот микробов или вирусов, где амплификацию вирусных или микробных нуклеиновых кислот производят способом петлевой изотермической амплификации при температуре от 55 до 69ºС. Изобретение может быть использовано для амплификации нуклеиновых кислот (НК) различного происхождения. 3 н. и 6 з.п. ф-лы, 16 ил., 7 табл., 15 пр.
1. Тест-система для выявления специфических нуклеотидных последовательностей, характерных для выявляемых микроорганизмов или вирусов, путем амплификации нуклеиновых кислот микробов или вирусов, содержащая ДНК-полимеразу с цепь-вытесняющей активностью, праймеры для петлевой изотермической амплификации, дезоксирибонуклеотиды, соли, а также детергент Triton™ X-100, бычий сывороточный альбумин, дитиотреитол, этилендиаминтетрауксусную кислоту, при этом концентрация веществ в итоговой жидкости для реакции амплификации нуклеиновых кислот составляет:
детергент Triton™ X-100 - от 10 до 150 г/л,
бычий сывороточный альбумин - от 1 до 20 г/л,
дитиотреитол - от 6,25 до 18,75 ммоль/л,
этилендиаминтетрауксусная кислота - от 0,5 до 1,5 ммоль/л.
2. Тест-система для выявления специфических нуклеотидных последовательностей, характерных для выявляемых микроорганизмов или вирусов, путем амплификации нуклеиновых кислот микробов или вирусов, содержащая ДНК-полимеразу с цепь-вытесняющей активностью, обратную транскриптазу, праймеры для петлевой изотермической амплификации, дезоксирибонуклеотиды, соли, а также детергент Triton™ X-100, бычий сывороточный альбумин, дитиотреитол, этилендиаминтетрауксусную кислоту, при этом концентрация веществ в итоговой жидкости для реакции амплификации нуклеиновых кислот составляет:
детергент Triton™ X-100 - от 10 до 150 г/л,
бычий сывороточный альбумин - от 1 до 20 г/л,
дитиотреитол - от 6,25 до 18,75 ммоль/л,
этилендиаминтетрауксусная кислота - от 0,5 до 1,5 ммоль/л.
3. Тест-система по п. 1 или 2, котораядополнительно содержит ингибитор РНКаз небелковой природы.
4. Тест-система по п. 3, в которой ингибитором РНКаз является поливинилсульфоновая кислота или ее соль.
5. Тест-система по п. 1 или 2, которая дополнительно содержит краситель.
6. Тест-система по п. 5, в которой краситель представляет собой флуоресцентный краситель.
7. Способ применения тест-системы по пп. 1-6 для выявления специфических нуклеотидных последовательностей, характерных для выявляемых микроорганизмов или вирусов, путем амплификации нуклеиновых кислот микробов или вирусов, где амплификацию вирусных или микробных нуклеиновых кислот производят способом петлевой изотермической амплификации при температуре от 55 до 69ºС.
8. Способ применения тест-системы по п. 7, при котором выявляют коронавирус SARS-CoV-2.
9. Способ применения тест-системы по п. 7, при котором выявляют вирус гриппа.
| WO 2007132589 A1, 22.11.2007 | |||
| Набор олигонуклеотидных праймеров и зондов и способ количественного выявления кокковой микрофлоры методом LAMP | 2018 |
|
RU2699189C1 |
| ОБНАРУЖЕНИЕ МОЛЕКУЛЯРНЫХ КОЛОНИЙ ПОСРЕДСТВОМ ГИБРИДИЗАЦИИ НА МЕМБРАНАХ С ФЛУОРЕСЦЕНТНЫМИ ЗОНДАМИ | 2006 |
|
RU2338787C2 |
| ПАНОВ А., ПТАШНИК О | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Гильванов | |||
Авторы
Даты
2022-04-04—Публикация
2021-05-14—Подача