ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001]
Настоящее изобретение относится к терапевтическому и профилактическому средству против периферических невропатий.
УРОВЕНЬ ТЕХНИКИ
[0002]
Периферическая невропатия индуцируется повреждением нейронов (аксонов или тел клеток) или миелиновых оболочек (шванновские клетки), являющихся компонентами периферических нервов. Гистопатологически наблюдается аксональная дегенерация и дегенерация миелиновых оболочек, и физиологически происходит дисфункция, такая как снижение скорости проведения по нерву.
[0003]
Считается, что повреждение нейронов и миелиновых оболочек периферических нервов индуцирует периферические невропатии, такие как сенсорные невропатии, имеющие такие симптомы, как онемение конечностей (дизестезия), парестезия, гипоестезия, боль, гипоакузия и т.п., моторные невропатии, имеющие такие симптомы, как мышечная слабость или атрофия, периферический паралич или ослабление или потеря глубоких сухожильных рефлексов и т.п., или автономные невропатии, имеющие такие симптомы, как запор, боль в животе, дисгидроз, дизурия, ортостатическая гипотензия и т.п. (непатентный документ 1).
[0004]
Эти симптомы периферических невропатий не являются угрожающими жизни в большинстве случаев, но оказывают значительное влияние на повседневную жизнь пациентов и значительно снижают качество жизни (непатентный документ 1).
[0005]
Периферические невропатии можно ориентировочно классифицировать в зависимости от причин повреждения нерва. Их типичные примеры включают индуцируемые лекарственными средствами периферические невропатии, аутоиммунные периферические невропатии, метаболические периферические невропатии и наследственные периферические невропатии.
[0006]
Примеры лекарственных средств, индуцирующих индуцируемые лекарственным средством периферические невропатии, включают средства против злокачественной опухоли, противовирусные средства, противомикробные средства, противотуберкулезные средства, антиаритмические средства, лекарственные средства, снижающие уровень липидов, иммунодепрессивные лекарственные средства и лекарственные средства против подагры. Симптомы индуцируемых лекарственными средствами периферических невропатий обычно состоят в сенсорных нарушениях, таких как боль, и такие нарушения могут сохраняться после отмены лекарственного средства (непатентный документ 2).
[0007]
В частности, средства против злокачественной опухоли также являются проблематичными, поскольку эти средства вызывают периферические невропатии с высокой частотой, что затрудняет продолжение терапии злокачественной опухоли. Для облегчения симптомов периферических невропатий, индуцируемых средствами против злокачественной опухоли, вводят обезболивающие средства (например, прегабалин, габапентин или кетамин), антиэпилептические средства (например, ламотригин, карбамазепин, фенитоин, вальпроевая кислота или клонезепам), антидепрессанты (например, амитриптилин, имипрамин, клопирамин или дулоксетин), китайские травяные лекарственные средства (например, экстракт Goshajinkigan или экстракт Shakuyakukanzoto), составы витамина B (например, B6 или B12) и т.п. Однако не разработан способ эффективного лечения или предупреждения периферических невропатий, индуцируемых средствами против злокачественной опухоли (непатентный документ 1).
[0008]
Среди описанных выше лекарственных средств дулоксетин отдельно демонстрирует высокие уровни убедительности в клинических испытаниях, и его применение рекомендовано в руководстве по лечению индуцируемой химиотерапией периферической невропатии, которое было разработано American Society of Clinical Oncology (непатентный документ 3). Между тем, среди лекарственных средств, применение которых рекомендовано в руководстве по лечению невропатической боли, разработанном International Association for the Study of Pain и European nerve society, соответственно (непатентный документ 4 и 5), отсутствуют доказательства того, которые явно служат в поддержку того факта, что все из прегабалина, габапентина, нортриптилина и амитриптилина, за исключением дулоксетина, являются эффективными против невропатической боли, индуцируемой средствами против злокачественной опухоли (непатентные документы 6 и 7).
[0009]
Аутоиммунные периферические невропатии представляют собой невропатии, индуцируемые аутоиммунитетом против компонентов периферических нервов, и они представляют собой разнообразные группы заболеваний, включающие синдром Гийена-Барре (GBS), хроническую воспалительную демиелинизирующую полирадикулоневропатию (CIDP), многоочаговую двигательную невропатию (MMN), и парапротеинемическую невропатию (PPN) (непатентный документ 8).
[0010]
Считается, что GBS индуцируется инфекцией патогенными микроорганизмами, такими как вирусы и бактерии, в качестве пускового механизма, и GBS может развиваться после вакцинации для предупреждения инфицирования патогенным микроорганизмом. Основными признаками GBS являются квадриплегия и отсутствие глубокого рефлекса, и часто он сопровождается сенсорными нарушениями, такими как боль и дизестезия. В случае тяжелого GBS пациенты могут погибать вследствие респираторного нарушения или автономной невропатии. GBS имеет множество подтипов, и известна острая воспалительная демиелинизирующая полиневропатия, острая моторная аксональная невропатия, острая моторно-сенсорная аксональная невропатия, синдром Фишера и т.п. (непатентный документ 9). CIDP отличается от GBS и представляет собой хроническую, или рецидивирующую или мелиоративную аутоиммунную периферическую невропатию, ведущую к мышечной слабости и чувствительным нарушениям. MMN и PPN представляют собой заболевания, аналогичные CIDP. MMN характеризуется миопатией, не сопровождающейся чувствительными нарушениями (непатентный документ 10). PPN индуцируется аномальной пролиферацией гомогенного иммуноглобулина и характеризуется медленно прогрессирующей сенсорной невропатией (непатентный документ 11).
[0011]
В качестве способов лечения аутоиммунных периферических невропатий называются эффективными внутривенная терапия иммуноглобулином (терапия IVIg) и простое обменное переливание плазмы (непатентный документ 12). Однако простое обменное переливание плазмы имеет недостатки, состоящие в том, что оно требует специальных помещений и оборудования и не может быть использовано у пожилых людей или пациентов, например, с сосудистой недостаточностью. Между тем, внутривенная терапия иммуноглобулином (терапия IVIg) требует осторожного применения ее для пациентов с шоком и гиперчувствительностью в анамнезе. Как описано выше, в медицинской практике является желательным терапевтическое средство, которое может быть удобным образом использовано и имеет мало побочных эффектов.
[0012]
Метаболические периферические невропатии вызываются различными метаболическими аномалиями. Заболевания, вызывающие метаболические периферические невропатии, широко варьируются, например, диабет, уремия, коллагеновая болезнь, авитаминоз и гипотиреоз.
[0013]
В частности, диабет является наиболее частой причиной периферических невропатий, и прогнозируется, что количество пациентов с диабетом в будущем будет расти. Одним из механизмов, вызывающим начало диабетической периферической невропатии, является гиперактивность каскада многоатомных спиртов, который метаболизирует глюкозу в сорбит. Считается, что чрезмерно накапливаемый сорбит повреждает нейроны (непатентный документ 13). Таким образом, ингибиторы альдозоредуктазы, вовлекающие каскад многоатомных спиртов, считаются эффективными против диабетической периферической невропатии, однако эпалрестат отдельно был одобрен в Японии, он демонстрирует его эффекты только среди пациентов с относительно мягкими патологическими состояниями и часто является неэффективным для тяжело страдающих пациентов или пациентов с большой длительностью заболевания (непатентный документ 14). Более того, прегабалин, дулоксетин и т.п. используют против боли вследствие диабетических периферических невропатий. Однако они не являются лекарственными средствами против периферических невропатий, так что является желательным новое лекарственное средство, демонстрирующее значительные эффекты на диабетическую периферическую невропатию.
[0014]
Примеры наследственных периферических невропатий включают болезнь Шарко-Мари-Тута, семейную амилоидную полиневропатию, наследственную компрессионную нейропатию (HNPP) и наследственную невралгическую амиотрофию. Наиболее типичным их примером является болезнь Шарко-Мари-Тута. Известно по меньшей мере 50 типов генов, которые считаются вовлеченными в болезнь Шарко-Мари-Тута, и они характеризуются тем, что они являются мутантными генами, вовлеченными в миелинизацию, формирование или поддержание нейронов и т.п., и существуют различные гетерогенные формы. Главным образом, в большинстве случаев наследственных периферических невропатий моторные нервы и сенсорные нервы повреждаются и затрудненность двигательной функции является значительной. Для клинического поддержания мышечной силы можно проводить физиотерапию или реабилитационную терапию. Однако в настоящее время отсутствует способ терапии и/или лекарственное средство, эффективные против наследственных периферических невропатий, включающих болезнь Шарко-Мари-Тута (непатентный документ 15).
[0015]
В случае периферических невропатий, индуцированных различными причинами, существуют пациенты, для которых не существует эффективного лекарственного средства, или пациенты, для которых лекарственные средства существуют, но не являются эффективными. Таким образом, ожидается создание нового лекарственного средства против периферических невропатий.
[0016]
Более того, в клинической практике дифференциальный диагноз причин периферических невропатий друг от друга требует детального исследования, и некоторые случаи диагностируются, например, как идиопатические периферические невропатии (непатентный документ 16). Таким образом, лекарственное средство, которое является эффективным против периферических невропатий независимо от причин невропатий, было бы чрезвычайно полезным, однако в настоящее время такого лекарственного средства не существует. Однако, тем не менее, является возможным создание лекарственного средства, которое является эффективным против периферических невропатий в целом. Это является следствием того, что, хотя, как описано выше, периферические невропатии подразделяются на множество типов и их клинические симптомы также варьируются, эти невропатии имеют признак, состоящий в том, что невропатии развиваются посредством повреждения клеток, составляющих периферические нервы, независимо от причин начала. Таким образом, предполагается, что лекарственное средство на основе нейротрофического фактора, который представляет собой молекулу in vivo, вовлеченную, например, в выживаемость, рост или поддержание нейронов, будет широко эффективным против периферических невропатий (непатентный документ 17). Однако даже если создано лекарственное средство на основе нейротрофического фактора, эффективность такого лекарственного средства не была подтверждена в клинических испытаниях на индуцируемых средством против злокачественной опухоли периферических невропатиях или диабетических периферических невропатиях (непатентные документы 18 и 19), что демонстрирует, что создание лекарственного средства, эффективного против периферических невропатий в общем, является чрезвычайно трудным.
[0017]
В патентном документе 1 описано, что производное циклического амина имеет обезболивающим действием, но не описано предположение о наличии у него эффекта на периферические невропатии.
СПИСОК ЛИТЕРАТУРЫ
ПАТЕНТНЫЕ ДОКУМЕНТЫ
[0018]
Патентный документ 1: WO2016/136944
НЕПАТЕНТНЫЙ ДОКУМЕНТ
[0019]
Непатентный документ 1: Shizuoka Cancer Center, "Treatment with Anticancer Agent and Peripheral Neuropathy (3rd printing)", 2016, p. 1-36
Непатентный документ 2: Vilholm et al., Basic & Clinical Pharmacology & Toxicology, 2014, Vol. 115, p. 185-192
Непатентный документ 3: Hershman et al. Journal of Oncology Practice, 2014, Vol. 10, p. e421-e424
Непатентный документ 4: Attal et al. Pain: Clinical Updates, 2010, Vol. 18
Непатентный документ 5: Attal et al. European Journal of Neurology, 2010, Vol. 17, p. 1113-1123
Непатентный документ 6: Shinde et al. Support Care Cancer, 2016, Vol. 24, p. 547-553
Непатентный документ 7: Gewandter et al. Pain, 2017, Vol. 158, p. 30-33
Непатентный документ 8: Kusunoki, Clinical Neurology, 2009, Vol. 49, p. 956-958
Непатентный документ 9: Hughes et al. The Lancet, 2005, Vol. 366, p. 1653-1666
Непатентный документ 10: Kusunoki, Internal Medicine, The Japanese Society of Internal Medicine, 2013, Vol. 102, p. 1965-1970
Непатентный документ 11: Rison et al. BioMed Central Neurology, 2016, Vol. 16, No. 13
Непатентный документ 12: Hughes et al. The Lancet, 1997, Vol. 349, p. 225-230
Непатентный документ 13: Singh et al. Pharmacological Research, 2014, Vol. 80, p. 21-35
Непатентный документ 14: Schemmel et al. Journal of Diabetes and Its Complication, 2010, Vol. 24, p. 354-360
Непатентный документ 15: Saporta et al. Neurologic Clinics, 2013, Vol. 31, p. 597-619
Непатентный документ 16: Azhary et al. American Family Physician, 2010, Vol. 81, p. 887-892
Непатентный документ 17: McMahon et al. Current Opinion in Neurobiology, 1995, Vol. 5, p. 616-624
Непатентный документ 18: Argyriou et al. Critical Reviews in Oncology/Hematology, 2012, Vol. 82, p. 51-77
Непатентный документ 19: Apfel et al. JAMA, 2000, Vol. 284, p. 2215-2221.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
[0020]
Задачей настоящего изобретения является предоставление терапевтического или профилактического средства против периферических невропатий.
РЕШЕНИЕ ПРОБЛЕМЫ
[0021]
В результате тщательных исследований для достижения описанной выше задачи, авторы настоящего изобретения обнаружили, что определенное производное циклического амина или его фармакологически приемлемая соль обладают выраженным эффектом подавления периферических невропатий.
[0022]
В частности, настоящее изобретение относится к терапевтическому средству или профилактическому средству против периферических невропатий, содержащему в качестве активного ингредиента производное циклического амина, соответствующее следующей общей формуле (I), или его фармакологически приемлемую соль:
[химическая формула 1]

где углерод, обозначаемый посредством *, представляет собой асимметричный углерод, и A обозначает группу, соответствующую общим формулам (IIa), (IIb) или (IIc):
[химическая формула 2]

где R1 обозначает метильную группу или этильную группу, необязательно замещенную атомом галогена, R2 обозначает атом водорода или алкилкарбонильную группу, имеющую от 2 до 5 атомов углерода, каждый R3 независимо обозначает метильную группу или этильную группу, и n обозначает 1 или 2].
[0023]
В вышеупомянутом производном циклического амина предпочтительно, чтобы A представлял собой группу, соответствующую общей формуле (IIa), в которой R1 более предпочтительно представляет собой метильную группу или этильную группу, необязательно замещенную атомом фтора; и еще более предпочтительно метильную группу, этильную группу, дифторметильную группу или 2,2,2-трифторэтильную группу.
[0024]
В описанном выше производном циклического амина предпочтительно, чтобы A представлял собой группу, соответствующую общим формулам (IIb) или (IIc), в которой R1 более предпочтительно представляет собой метильную группу или этильную группу, необязательно замещенную атомом фтора, и еще более предпочтительно метильную группу, этильную группу, дифторметильную группу или 2,2,2-трифторэтильную группу.
[0025]
В описанном выше производном циклического амина предпочтительно, чтобы A представлял собой группу, соответствующую общей формуле (IIa) и чтобы стереохимическая конфигурация асимметричного атома углерода, обозначенного * предпочтительно представляла собой S, в которой R1 более предпочтительно представляет собой метильную группу или этильную группу, необязательно замещенную атомом фтора, и еще более предпочтительно метильную группу, этильную группу, дифторметильную группу или 2,2,2-трифторэтильную группу.
[0026]
Также настоящее изобретение относится к фармацевтической композиции для лечения или предупреждения периферической невропатии, содержащей производное циклического амина, соответствующее общей формуле (I), или его фармакологически приемлемую соль, и фармакологически приемлемый эксципиент, и т.п.
[0027]
Также настоящее изобретение относится к производному циклического амина, соответствующему общей формуле (I), или его фармакологически приемлемой соли, для применения для лечения или предупреждения периферических невропатий.
[0028]
Также настоящее изобретение относится к применению производного циклического амина, соответствующего общей формуле (I), или его фармакологически приемлемой соли для лечения или предупреждения периферических невропатий.
[0029]
Также настоящее изобретение относится к применению производного циклического амина, соответствующего общей формуле (I), или его фармакологически приемлемой соли для получения лекарственного средства для лечения или предупреждения периферических невропатий.
[0030]
Также настоящее изобретение относится к способу лечения или предупреждения периферических невропатий, который включает введение терапевтически эффективного количества производного циклического амина, соответствующего общей формуле (I), или его фармакологически приемлемой соли пациенту, нуждающемуся в лечении.
[0031]
В каждом варианте осуществления настоящего изобретения описанные выше периферические невропатии предпочтительно представляют собой индуцируемые лекарственными средствами периферические невропатии, аутоиммунные периферические невропатии, метаболические периферические невропатии, наследственные периферические невропатии, обусловленные васкулитом периферические невропатии, токсические периферические невропатии, инфекционные периферические невропатии или периферические невропатии, ассоциированные со злокачественной опухолью, более предпочтительно индуцируемые лекарственными средствами периферические невропатии, аутоиммунные периферические невропатии, метаболические периферические невропатии или наследственные периферические невропатии, и еще более предпочтительно индуцируемые лекарственными средствами периферические невропатии, аутоиммунные периферические невропатии или метаболические периферические невропатии. Предпочтительно описанные выше индуцируемые лекарственными средствами периферические невропатии представляют собой индуцируемые средствами против злокачественной опухоли периферические невропатии. Предпочтительно описанные выше аутоиммунные периферические невропатии представляет собой по меньшей мере один тип, выбранный из синдрома Гийена-Барре (GBS), хронической воспалительной демиелинизирующей полирадикулоневропатии (CIDP), мультифокальной моторной невропатии (MMN) и парапротеинемической невропатии (PPN). Предпочтительно описанные выше метаболические периферические невропатии представляют собой диабетическую периферическую невропатию. Предпочтительно описанная выше наследственная периферическая невропатия представляет собой болезнь Шарко-Мари-Тута.
ПРЕИМУЩЕСТВЕННЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
[0032]
С использованием производного циклического амина или его фармакологически приемлемой соли по настоящему изобретению можно проводить лечение или предупреждение периферических невропатий. Описанные выше периферические невропатии представляют собой, например, индуцируемые лекарственными средствами невропатии, аутоиммунные периферические невропатии или метаболические периферические невропатии. В частности, описанные выше индуцируемые лекарственными средствами невропатии представляют собой индуцируемые средством против злокачественной опухоли периферические невропатии. Описанные выше аутоиммунные периферические невропатии, в частности, представляют собой по меньшей мере один тип, выбранный из синдрома Гийена-Барре (GBS), хронической демиелинизирующей полирадикулоневропатии (CIDP), мультифокальной моторной невропатии (MMN) и парапротеинемической невропатии (PPN). Описанные выше метаболические периферические невропатии, в частности, представляют собой диабетические периферические невропатии. Описанная выше наследственная периферическая невропатия, в частности, представляет собой болезнь Шарко-Мари-Тута.
[0033]
Настоящее описание включает содержание описания и/или чертежей патентных заявок Японии № 2017-071329 и 2017-071339, которые являются приоритетными документами для настоящей заявки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0034]
[Фигура 1] На фиг. 1 представлен защитный эффект соединения 1 в отношении повреждения клеток в нейрональной клеточной линии, происходящей из ганглия дорсального корешка крыс.
[Фигура 2] На фиг. 2 представлен восстанавливающий эффект соединения 1 в отношении повреждения клеток в нейрональной клеточной линии, происходящей из ганглия дорсального корешка крыс.
[Фигура 3] На фиг. 3 представлен эффект соединения 1 на миелинизацию в сокультуре нейронов ганглия дорсального корешка и шванновских клеток крысы.
[Фигура 4] На фиг. 4 представлен эффект соединения 1 на уровень экспрессии основного белка миелина в сокультуре нейронов ганглия дорсального корешка и шванновских клеток крысы.
[Фигура 5] На фиг. 5 представлен эффект повторяющегося дозирования соединения 1 на холодовую аллодинию в модели индуцируемой оксалиплатином периферической невропатии у крыс.
[Фигура 6] На фиг. 6 представлен эффект повторяющегося дозирования соединения 1 на механическую аллодинию в модели индуцируемой оксалиплатином периферической невропатии у крыс.
[Фигура 7] На фиг. 7 представлен эффект однократного дозирования соединения 1 на механическую аллодинию в модели индуцируемой цисплатином периферической невропатии у крыс.
[Фигура 8] На фиг. 8 представлен эффект однократного дозирования соединения 1 на механическую аллодинию в модели индуцируемой паклитакселом периферической невропатии у крыс.
[Фигура 9] На фиг. 9 представлен эффект однократного дозирования соединения 1 на механическую аллодинию в модели индуцируемой бортезомибом периферической невропатии у крыс
[Фигура 10] На фиг. 10 представлен эффект соединения 1 на клинические показатели в экспериментальной модели аутоиммунного неврита у крыс.
[Фигура 11] Фигура 11 представлен эффект соединения 1 на снижение массы тела в экспериментальной модели аутоиммунного неврита у крыс.
[Фигура 12] Фигура 12 представлен эффект соединения 1 на механическую аллодинию в экспериментальной модели аутоиммунного неврита у крыс.
[Фигура 13] Фигура 13 представлен эффект соединения 1 на снижение скорости проведения по нервам в модели индуцированного стрептозотоцином диабета у крыс.
[Фигура 14] Фигура 14 представлен эффект соединения 1 на механическую аллодинию модели индуцированного стрептозотоцином диабета у крыс.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0035]
Следующие термины, используемые в настоящем описании, определяются следующим образом, если нет иных указаний.
[0036]
Производное циклического амина согласно одному варианту осуществления настоящего изобретения характеризуется тем, что оно соответствует следующей общей формуле (I).
[химическая формула 3]
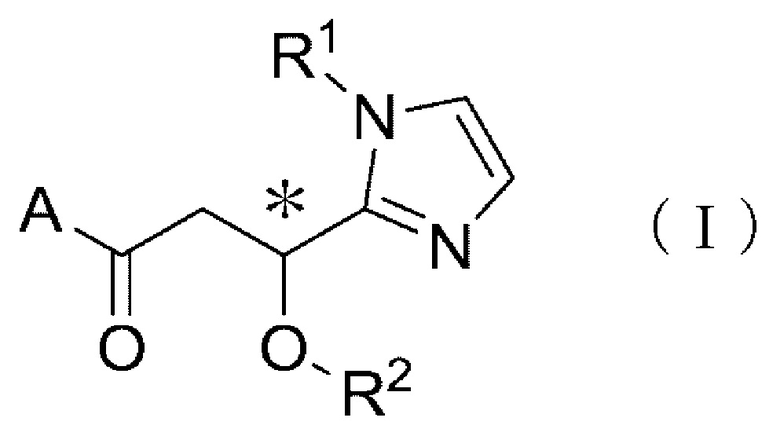
[где
углерод, обозначаемый посредством *, представляет собой асимметричный углерод, и A обозначает группу, соответствующую общим формулам (IIa), (IIb) или (IIc):
[химическая формула 4]

где R1 обозначает метильную группу или этильную группу, необязательно замещенную атомом галогена, R2 обозначает атом водорода или алкилкарбонильную группу, имеющую от 2 до 5 атомов углерода, каждый R3 независимо обозначает метильную группу или этильную группу, и n обозначает 1 или 2].
[0037]
В описанном выше производном циклического амина предпочтительно, чтобы A представлял собой группу, соответствующую общей формуле (IIa), в которой R1 более предпочтительно представляет собой метильную группу или этильную группу, необязательно замещенную атомом фтора; и еще более предпочтительно метильную группу, этильную группу, дифторметильную группу или 2,2,2-трифторэтильную группу.
[0038]
В описанном выше производном циклического амина предпочтительно, чтобы A представлял собой группу, соответствующую общим формулам (IIb) или (IIc), в которой R1 более предпочтительно представляет собой метильную группу или этильную группу, необязательно замещенную атомом фтора, и еще более предпочтительно метильную группу, этильную группу, дифторметильную группу или 2,2,2-трифторэтильную группу.
[0039]
В описанном выше производном циклического амина предпочтительно, чтобы A представлял собой группу, соответствующую общей формуле (IIa) и чтобы стереохимическая конфигурация асимметричного атома углерода, обозначенного * предпочтительно представляла собой S, в которой R1 более предпочтительно представляет собой метильную группу или этильную группу, необязательно замещенную атомом фтора, и еще более предпочтительно метильную группу, этильную группу, дифторметильную группу или 2,2,2-трифторэтильную группу.
[0040]
В одном варианте осуществления описанного выше производного циклического амина A представляет собой группу, соответствующую общей формуле (IIa), в которой R1 представляет собой метильную группу, этильную группу, дифторметильную группу или 2,2,2-трифторэтильную группу, R2 обозначает атом водорода или алкилкарбонильную группу, имеющую от 2 до 5 атомов углерода, и каждый R3 независимо обозначает метильную группу или этильную группу. В этом варианте осуществления предпочтительно, чтобы стереохимическая конфигурация асимметричного углерода, обозначенного *, представляла собой конфигурацию S.
[0041]
В одном варианте осуществления описанного выше производного циклического амина A представляет собой группу, соответствующую общей формуле (IIa), R1 обозначает метильную группу или 2,2,2-трифторэтильную группу, R2 обозначает атом водорода или алкилкарбонильную группу, имеющую 2 атома углерода, и R3 обозначает метильную группу. В этом варианте осуществления предпочтительно, чтобы стереохимическая конфигурация асимметричного углерода, обозначенного *, представляла собой конфигурацию S.
[0042]
В одном варианте осуществления описанного выше производного циклического амина A представляет собой группу, соответствующую общей формуле (IIb), R1 обозначает метильную группу или этильную группу, необязательно замещенную атомом фтора, R2 обозначает атом водорода или алкилкарбонильную группу, имеющую от 2 до 5 атомов углерода, каждый R3 независимо обозначает метильную группу или этильную группу, и n обозначает 1 или 2. В этом варианте осуществления предпочтительно, чтобы стереохимическая конфигурация асимметричного углерода, обозначенного *, представляла собой конфигурацию S.
[0043]
В одном варианте осуществления описанного выше производного циклического амина A представляет собой группу, соответствующую общей формуле (IIb), R1 обозначает метильную группу, этильную группу, дифторметильную группу или 2,2,2-трифторэтильную группу, R2 обозначает атом водорода или алкилкарбонильную группу, имеющую от 2 до 5 атомов углерода, каждый R3 независимо обозначает метильную группу или этильную группу, и n обозначает 1 или 2. В этом варианте осуществления предпочтительно, чтобы стереохимическая конфигурация асимметричного углерода, обозначенного *, представляла собой конфигурацию S.
[0044]
В одном варианте осуществления описанного выше производного циклического амина A представляет собой группу, соответствующую общей формуле (IIb), R1 обозначает метильную группу или 2,2,2–трифторэтильную группу, R2 обозначает атом водорода или алкилкарбонильную группу, имеющую 2 атома углерода, R3 обозначает метильную группу и n обозначает 1 или 2. В этом варианте осуществления предпочтительно, чтобы стереохимическая конфигурация асимметричного углерода, обозначенного *, представляла собой конфигурацию S.
[0045]
В одном варианте осуществления описанного выше производного циклического амина A представляет собой группу, соответствующую общей формуле (IIc), R1 обозначает метильную группу или этильную группу необязательно, замещенную атомом фтора, R2 обозначает атом водорода или алкилкарбонильную группу, имеющую от 2 до 5 атомов углерода, и R3 обозначает метильную группу или этильную группу. В этом варианте осуществления предпочтительно, чтобы стереохимическая конфигурация асимметричного углерода, обозначенного *, представляла собой конфигурацию S.
[0046]
В одном варианте осуществления описанного выше производного циклического амина A представляет собой группу, соответствующую общей формуле (IIc), R1 обозначает метильную группу, этильную группу, дифторметильную группу или 2,2,2-трифторэтильную группу, R2 обозначает атом водорода или алкилкарбонильную группу, имеющую от 2 до 5 атомов углерода, и R3 обозначает метильную группу или этильную группу. В этом варианте осуществления предпочтительно, чтобы стереохимическая конфигурация асимметричного углерода, обозначенного *, представляла собой конфигурацию S.
[0047]
В одном варианте осуществления описанного выше производного циклического амина A представлял собой группу, соответствующую общей формуле (IIc), R1 обозначает метильную группу или 2,2,2-трифторэтильную группу, R2 обозначает атом водорода или алкилкарбонильную группу, имеющую 2 атома углерода, и R3 обозначает метильную группу. В этом варианте осуществления предпочтительно, чтобы стереохимическая конфигурация асимметричного углерода, обозначенного *, представляла собой конфигурацию S.
[0048]
"Атом галогена" относится к атому фтора, атому хлора, атому брома или атому йода.
[0049]
"Метильная группа или этильная группа, необязательно замещенная атомом галогена," относится к метильной группе или этильной группе, в которой каждый из атомов водорода независимо и необязательно замещен атомом галогена, как упоминается выше. Например, может быть упомянута метильная группа, или этильная группа, дифторметильная группа, 2-фторэтильная группа, 2-хлорэтильная группа, 2,2-дифторэтильная группа или 2,2,2-трифторэтильная группа.
[0050]
"Алкилкарбонильная группа, имеющая 2-5 атомов углерода," относится к группе, полученной путем связывания линейной, разветвленной или циклической насыщенной углеводородной группы, имеющей 1-4 атомов углерода, с карбонильной группой. Например, может быть упомянута ацетильная группа, н-пропионильная группа, н-бутирильная группа, изобутирильная группа или валерильная группа.
[0051]
Конкретные примеры предпочтительного соединения в качестве производного циклического амина, соответствующего общей формуле (I) (далее, производное циклического амина (I)) представлены в таблицах 1-1 и 1-2. Однако производные не ограничиваются ими.
[0052]
[Таблица 1-1]
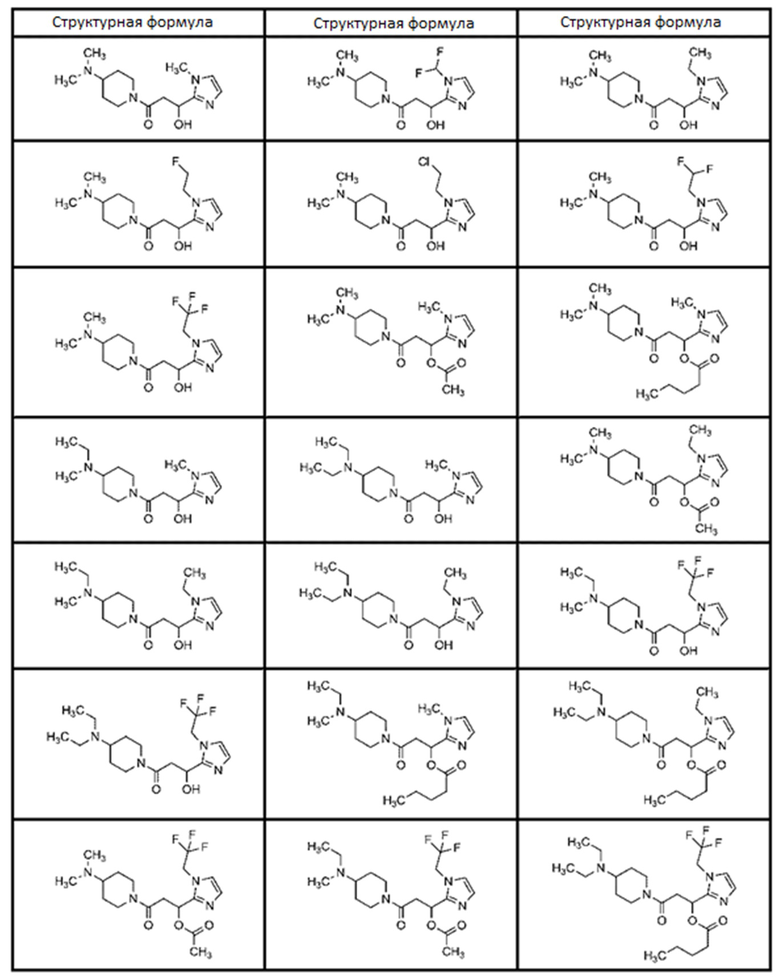
[0053]
[Таблица 1-2]
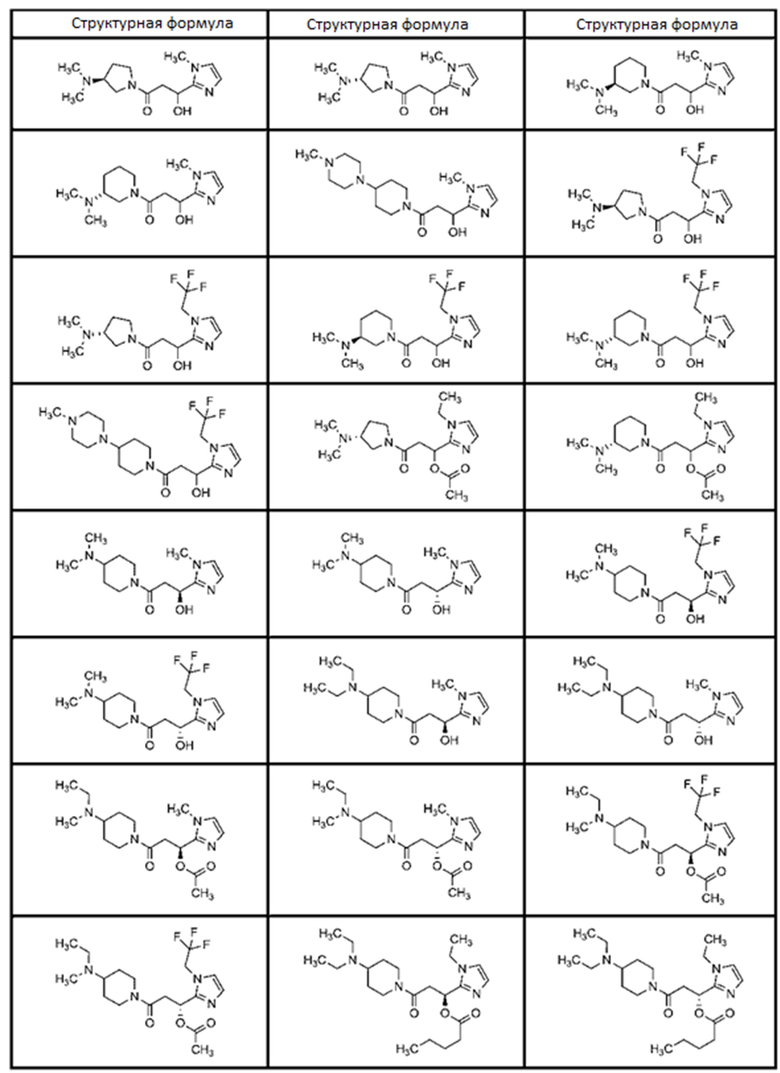
[0054]
Когда производное циклического амина (I) имеет изомеры, такие как энантиомеры и стереоизомеры, производное циклического амина (I) включает любой его изомер и их смеси. Кроме того, когда производное циклического амина (I) содержит изомеры, такие как энантиомеры и стереоизомеры, производное циклического амина (I) также включает любой его изомер и их смеси. Кроме того, когда иногда образуются конформационные изомеры, производное циклического амина (I) также включает такие изомеры и их смеси. Требуемый изомер может быть получен известным способом или способом, сходным с ним. Например, когда присутствуют энантиомеры производного циклического амина (I), энантиомер, отделенный от производного циклического амина (I), также включен в производное циклического амина (I).
[0055]
Требуемый энантиомер может быть получен известными способами (например, используют оптически активное синтетическое промежуточное соединение или рацемическую смесь конечных продуктов подвергают известному способу или способу, сходному с ним (например, оптическое разрешение)).
[0056]
Также включено пролекарство или фармакологически приемлемая соль производного циклического амина (I). Пролекарство производного циклического амина (I) относится к соединению, которое ферментативно или химически конвертируется в производное циклического амина (I) in vivo. Активная форма пролекарства производного циклического амина (I) представляет собой производное циклического амина (I). Однако пролекарство производного циклического амина (I) само по себе может обладать активностью.
[0057]
В качестве пролекарства производного циклического амина (I) может быть упомянуто, например, соединение, полученное алкилированием, фосфорилированием или борированием гидроксигруппы производного циклического амина (I). Каждое из этих соединений можно синтезировать из производного циклического амина (I) в соответствии с известным способом.
[0058]
Пролекарство производного циклического амина (I) может конвертироваться в производное циклического амина (I) в физиологических условиях, как описано в известных источниках литературы ("Development of pharmaceutical product", Hirokawa-Shoten Ltd., 1990, Vol. 7, p. 163-198, и Progress in Medicine, Vol. 5, 1985, p. 2157–2161).
[0059]
Производное циклического амина (I) может быть мечено изотопом. Примеры изотопов для применения для мечения включают 2H, 3H, 13C, 14C, 15N, 15O, 18O и/или 125I.
[0060]
В качестве фармакологически приемлемой соли производного циклического амина (I), например, может быть упомянута неорганическая соль, такая как гидрохлорид, сульфат, фосфат или гидробромид; или органическая соль, такая как оксалат, малонат, цитрат, фумарат, лактат, малат, сукцинат, тартрат, ацетат, трифторацетат, малеат, глюконат, бензоат, салицилат, ксинафоат, памоат, аскорбат, адипат, метансульфонат, п-толуолсульфонат или циннамат. Эти соли могут присутствовать в форме гидрата, сольвата или кристаллического полиморфа.
[0061]
Производное циклического амина (I) или его фармакологически приемлемую соль можно синтезировать в соответствии со способом, например, описанным в известных источниках литературы (международная публикация WO2016/136944).
[0062]
Примеры периферических нервов включают чувствительные нервы, двигательные нервы и автономные нервы.
[0063]
Периферическая невропатия индуцируется повреждением по меньшей мере одного компонента из нейронов и миелиновых оболочек (шванновские клетки), составляющих периферические нервы.
[0064]
Примеры периферических невропатий включают, но не ограничиваются ими, индуцируемые лекарственными средствами невропатии, аутоиммунные периферические невропатии, метаболические периферические невропатии, наследственные периферические невропатии, обусловленные васкулитом периферические невропатии, токсические периферические невропатии, инфекционные периферические невропатии и периферические невропатии, ассоциированные со злокачественной опухолью.
[0065]
Примеры симптомов периферических невропатий включают, но не ограничиваются ими, следующие: когда повреждены чувствительные нервы - онемение конечностей (дизестезия), парестезия, гипоестезия, боль и гипоакузия; когда повреждены двигательные нервы - мышечная слабость или атрофия, периферический паралич или ослабление или потеря глубоких сухожильных рефлексов; и, когда повреждены автономные нервы - запор, боль в животе, дисгидроз, дизурия и ортостатическая гипотензия.
[0066]
Примеры индуцируемых лекарственными средствами периферических невропатий включают индуцируемую средством против злокачественной опухоли периферическую невропатию, индуцируемую противовирусным средством периферическую невропатию, индуцируемую противомикробным средством периферическую невропатию, индуцируемую противотуберкулезным средством периферическую невропатию, индуцируемую антиаритмическим средством периферическую невропатию, индуцируемую снижающим уровень липидов лекарственным средством периферическую невропатию, индуцируемую иммуносупрессивным лекарственным средством периферическую невропатию, индуцируемую терапевтическим средством против подагры периферическую невропатию и периферические невропатии, вызываемые другими лекарственными средствами.
[0067]
Примеры средств против злокачественной опухоли включают ингибиторы метаболизма нуклеиновых кислот, ингибиторы полимеризации и деполимеризации микротрубочек, антагонисты гормонов, ингибиторы внутриклеточной передачи сигнала, специфические молекулярные таргетные лекарственные средства против злокачественной опухоли и неспецифические иммунологические адъюванты.
[0068]
Примеры ингибиторов метаболизма нуклеиновых кислот включают алкилирующие средства, антинеопластические антибиотики, ингибиторы топоизомеразы, лекарственные средства на основе платины, ингибиторы метаболизма пиримидинов, ингибиторы метаболизма пуринов и ингибиторы синтеза фолиевой кислоты.
[0069]
Примеры ингибиторов полимеризации или деполимеризации микротрубочек включают средства против злокачественной опухоли на основе алкалоидов барвинка и средства против злокачественной опухоли на основе таксанов.
[0070]
Примеры антагонистов гормонов включают антиэстрогены и антиандрогены.
[0071]
Примеры ингибиторов внутриклеточной передачи сигнала включают ингибиторы протеасом и ингибиторы на основе цереброна.
[0072]
Примеры специфических молекулярных таргетных лекарственных средств против злокачественной опухоли включают ингибиторы тирозинкиназы, антительные составы и составы на основе мышьяка.
[0073]
Примеры неспецифических иммунологических адъювантов включают составы гемолитических стрептококков и составы полисахарида Coriolus versicolor.
[0074]
Примеры ингибиторов метаболизма нуклеиновых кислот включают, но не ограничиваются ими, следующие специфические средства против злокачественной опухоли: оксалиплатин, цисплатин, карбоплатин, недаплатин, цитарабин, неларабин, этопозид и тенипозид. Примеры ингибиторов полимеризации или деполимеризации микротрубочек включают, но не ограничиваются ими, следующие специфические средства против злокачественной опухоли: паклитаксел, доцетаксел, кабазитаксел, винкристин, винбластин, винорелбин, виндезин, эрибулин, винфлунин, эпотилон и иксабепилон. Примеры ингибиторов внутриклеточной передачи сигнала включают, но не ограничиваются ими, следующие специфические средства против злокачественной опухоли: бортезомиб и карфилзомиб. Примеры специфических молекулярных таргетных лекарственных средств против злокачественной опухоли включают, но не ограничиваются ими, следующие специфические средства против злокачественной опухоли: брентуксимаб ведотин, трастузумаб эмтанзин, талидомид и помалидомид или леналидомид.
[0075]
Примеры противовирусных средств включают, но не ограничиваются ими, эфавиренц, эмтрицитабин, эмтрицитабин и тенофовир дизопроксил фумарат, саквинавир, санилвудин, зальцитабин, диданозин, ставудин, зидовудин, дарунавир, делавирдин мезилат, невирапин, тенофовир дизопроксил фумарат, фоскарнет натрия гидрат, ламивудин, ламивудин и абакавир сульфат, ритонавир, рибавирин, лопинавир и ритонавир, атазанавир и индинавир.
[0076]
Примеры противомикробных средств включают, но не ограничиваются ими, хлорамфеникол, нитрофурантоин, метронидазол, диафенилсульфон, этамбутол и фторхинолон (левофлоксацин, ципрофлоксацин, моксифлоксацин, норфлоксацин, офлоксацин и т.п).
[0077]
Примеры противтуберкулезных средств включают, но не ограничиваются ими, изониазид и этамбутол.
[0078]
Примеры антиаритмических средств включают, но не ограничиваются ими, амиодарон и прокаинамид.
[0079]
Примеры снижающих уровень липидов лекарственных средств включают, но не ограничиваются ими, правастатин, симвастатин, флувастатин, аторвастатин, питавастатин и розувастатин.
[0080]
Примеры иммуносупрессивных лекарственных средств включают, но не ограничиваются ими, такролимус, циклоспорин, микофенолат мофетил, лефлуномид, хлороквин, интерферон α и состав золота.
[0081]
Примеры других лекарственных средств включают, но не ограничиваются ими, терапевтические средства против подагры, такие как колхицин или аллопуринол, антиэпилептические средства, такие как фенитоин, анестетики, такие как оксид азота, витамины, такие как пиридоксин, лекарственные средства против алкоголизма, такие как дисульфирам, и гипотензивные лекарственные средства, такие как гидралазин.
[0082]
Примеры лекарственных средств, которые индуцируют индуцируемые лекарственными средствами периферические невропатии, включают, но не ограничиваются ими, лекарственные средства, которые открыты на сегодняшний день, а также лекарственные средства, которые будут открыты в будущем, исходя из приведенной выше классификации.
[0083]
Примеры аутоиммунных периферических невропатий включают, но не ограничиваются ими, синдром Гийена-Барре, хроническую воспалительную демиелинизирующую полирадикулоневропатию, мультиочаговую моторную невропатию и парапротеинемическую невропатию. Примеры подтипов синдрома Гийена-Барре включают острую воспалительную демиелинизирующую полиневропатию, острую моторную аксональную невропатию, острую моторно-сенсорную аксональную невропатию и синдром Фишера.
[0084]
Примеры метаболических периферических невропатий включают, но не ограничиваются ими, диабетическую периферическую невропатию, уремическую периферическую невропатию, коллагеновую периферическую невропатию, обусловленную дефицитом витаминов периферическую невропатию, и обусловленную гипотиреозом периферическую невропатию.
[0085]
Примеры наследственных периферических невропатий включают, но не ограничиваются ими, болезнь Шарко-Мари-Тута, семейную амилоидную полиневропатию, наследственную наследственную невропатию и наследственную невралгическую амиотрофию.
[0086]
Оценку того, имеет ли производное циклического амина (I) или его фармакологически приемлемая соль эффект подавления повреждения периферических нейронов, можно проводить с использованием нейрональной клеточной линии, происходящей из ганглия дорсального корешка крысы. В частности, нейрональную клеточную линию, происходящую из ганглия дорсального корешка крысы, обрабатывают цитотоксическим веществом для индукции уменьшения клеточной активности, а затем оценивают эффект подавления такого снижения жизнеспособности клеток.
[0087]
Оценку того, имеет ли производное циклического амина (I) или его фармакологически приемлемая соль эффект ускорения миелинизации, можно проводить с использованием сокультуры нейронов ганглия дорсального корешка и шванновских клеток крысы. В частности, нейроны ганглия дорсального корешка и шванновские клетки крысы культивируют совместно, индуцируют миелинизацию посредством обработки аскорбиновой кислотой, а затем оценивают наличие ускорения миелинизации.
[0088]
Описанное выше производное или его фармакологически приемлемая соль, имеющие описанные выше эффекты подавления снижения жизнеспособности клеток и ускорения миелинизации, считаются эффективными для предупреждения и лечения периферических невропатий. Однако этот вариант осуществления не ограничивается данным условием.
[0089]
Оценку того, являются ли производное циклического амина (I) или его фармакологически приемлемая соль эффективными для лечения или предупреждения индуцируемых лекарственными средствами периферических невропатий, и в частности, индуцируемой средством против злокачественной опухоли периферической невропатии, можно проводить с использованием моделей периферических невропатий, индуцируемых различными лекарственными средствами, и, в частности, различными средствами против злокачественной опухоли (Hoeke et al. ILAR Journal, 2014, Vol. 54, p. 273-281).
[0090]
Оценку того, являются ли производное циклического амина (I) или его фармакологически приемлемая соль эффективными для лечения или предупреждения аутоиммунных периферических невропатий, можно проводить с использованием модели экспериментального аутоиммунного неврита (EAN) (Soliven, ILAR Journal, 1994, Vol. 54, p. 282-290).
[0091]
Оценку того, являются ли производное циклического амина (I) или его фармакологически приемлемая соль эффективными для лечения или предупреждения метаболических периферических невропатий и, в частности, диабетической периферической невропатии, можно проводить с использованием модели индуцируемого стрептозотоцином диабета (O’Brien et al. ILAR Journal, 2014, Vol. 54, p. 259-272).
[0092]
Оценку того, являются ли производное циклического амина (I) или его фармакологически приемлемая соль эффективными для лечения или предупреждения наследственных периферических невропатий и, в частности, болезни Шарко-Мари-Тута, можно проводить с использованием мышей PMP22 Trembler-J (Nicks et al. Neurobiology of Disease, 2014, Vol. 70, p. 224-236).
[0093]
Производное циклического амина (I) или его фармакологически приемлемую соль можно использовать в качестве превосходного фармацевтического продукта, пригодного для лечения или предупреждения периферических невропатий у млекопитающих (например, мыши, крысы, хомячка, кролика, кошки, собаки, коровы, овцы, обезьяны или человека), и особенно у человека.
[0094]
Когда производное циклического амина (I) или его фармакологически приемлемую соль используют в качестве лекарственного средства, производное циклического амина (I) или его фармакологически приемлемую соль непосредственно или в комбинации с фармацевтически приемлемым носителем можно вводить перорально или парентерально.
[0095]
В качестве дозированной формы, когда лекарственное средство, содержащее производное циклического амина (I) или его фармакологически приемлемую соль в качестве активного ингредиента, вводят перорально, могут быть упомянуты, например, таблетки (включающие покрытые сахарной оболочкой или покрытые пленкой таблетки), пилюли, гранулы, порошки, капсулы (включая мягкие капсулы и микрокапсулы), сиропы, эмульсии или суспензии. В качестве дозированной формы, когда лекарственное средство, содержащее производное циклического амина (I) или его фармакологически приемлемую соль в качестве активного ингредиента, вводят парентерально, могут быть упомянуты, например, инъекции, инфузии, капли, суппозитории, чрескожные мази или адгезивные пластыри. Кроме того, является эффективным получение состава с замедленным высвобождением с использованием соответствующей основы (например, полимер масляной кислоты, полимер гликолевой кислоты, сополимер масляная кислота-гликолевая кислота, смеси полимера масляной кислоты и полимера гликолевой кислоты, или сложный эфир полиглицерина и жирной кислоты) в комбинации.
[0096]
Составы, имеющие вышеупомянутые дозированные формы, можно получать способами получения, известными в области составления лекарственных средств. В этом случае, если необходимо. получение можно проводить путем добавления эксципиента, связующего вещества, смазывающего вещества, дезинтегрирующего вещества, подсластителя, поверхностно-активного вещества, суспендирующего вещества или эмульгатора, которые обычно используются в области составления лекарственных средств.
[0097]
Таблетки можно получать, например, путем добавления эксципиента, связующего вещества, дезинтегрирующего вещества или смазывающего вещества. Пилюли и гранулы можно получать добавлением, например, эксципиента, связующего вещества или дезинтегрирующего вещества. Порошки и капсулы можно получать путем добавления, например, эксципиента. Сиропы можно получать путем добавления, например, подсластителя. Эмульсии или суспензии можно получать путем добавления, например, поверхностно-активного вещества, суспендирующего вещества или эмульгатора.
[0098]
В качестве эксципиента могут быть упомянуты, например, лактоза, глюкоза, крахмал, сахароза, микрокристаллическая целлюлоза, порошковая солодка, маннит, гидрокарбонат натрия, фосфат кальция или сульфат кальция.
[0099]
В качестве связующего вещества могут быть упомянуты, например, раствор крахмальной пасты, раствор гуммиарабика, раствор желатина, раствор трагаканта, раствор карбоксиметилцеллюлозы, раствор альгината натрия или глицерин.
[0100]
В качестве дезинтегрирующего вещества могут быть упомянуты, например, крахмал или карбонат кальция.
[0101]
В качестве смазывающего вещества могут быть упомянуты, например, стеарат магния, стеариновая кислота, стеарат кальция или очищенный тальк.
[0102]
В качестве подсластителя могут быть упомянуты, например, глюкоза, фруктоза, инвертный сахар, сорбит, ксилит, глицерин или простой сироп.
[0103]
В качестве поверхностно-активного вещества могут быть упомянуты, например, лаурилсульфат натрия, полисорбат 80, сложный моноэфир сорбитана и жирной кислоты или стеариновая кислота полиоксил 40.
[0104]
В качестве суспендирующего вещества могут быть упомянуты, например, гуммиарабик, альгинат натрия, натрий карбоксиметилцеллюлоза, метилцеллюлоза или бентонит.
[0105]
В качестве эмульгатора могут быть упомянуты, например, гуммиарабик, трагакант, желатин или полисорбат 80.
[0106]
Когда лекарственное средство, содержащее производное циклического амина (I) или его фармакологически приемлемую соль в качестве активного ингредиента, получают в виде вышеупомянутых дозированных форм, можно добавлять краситель, консервант, отдушку, вкусовую добавку, стабилизатор или загуститель, обычно используемые в области составления лекарственных средств.
[0107]
Суточная доза лекарственного средства, содержащего производное циклического амина (I) или его фармакологически приемлемую соль в качестве активного ингредиента, варьируется в зависимости, например, от состояния или массы тела пациента или типа соединения или пути его введения. Например, при пероральном введении взрослому (масса: приблизительно 60 кг), количество производного циклического амина (I) или его фармакологически приемлемой соли, служащих в качестве активного ингредиента, находится в диапазоне от 1 до 1000 мг, и введение предпочтительно проводят посредством 1-3 разделенных доз. Например, при парентеральном введении взрослому человеку (масса: приблизительно 60 кг) посредством инъекционного раствора, количество производного циклического амина (I) или его фармакологически приемлемой соли, служащих в качестве активного ингредиента, например, в инъекционном составе, находится в диапазоне от 0,01 до 100 мг на массу тела (1 кг). Предпочтительно вводят внутривенный инъекционный раствор.
[0108]
Производное циклического амина (I) или его фармакологически приемлемую соль можно использовать в комбинации с другими медикаментозными средствами в подходящем соотношении смешения для дополнения или усиления терапевтического или профилактического эффекта или уменьшения дозы. Например, производное циклического амина (I) или его фармакологически приемлемую соль также можно использовать в комбинации с лекарственным средством для облегчения симптомов периферических невропатий.
ПРИМЕРЫ
[0109]
Далее настоящее изобретение описано более конкретно с помощью примеров. Однако настоящее изобретение не ограничивается этими примерами.
[0110]
В качестве тестируемого соединения используют (S)-1-(4-(диметиламино)пиперидин-1-ил)-3-гидрокси-3-(1-метил-1H-имидазол-2-ил)пропан-1-он (далее соединение 1), который соответствует следующей формуле, и его синтезировали в соответствии со способом, описанным в известном источнике литературы (международная публикация WO 2016/136944).
[химическая формула 5]
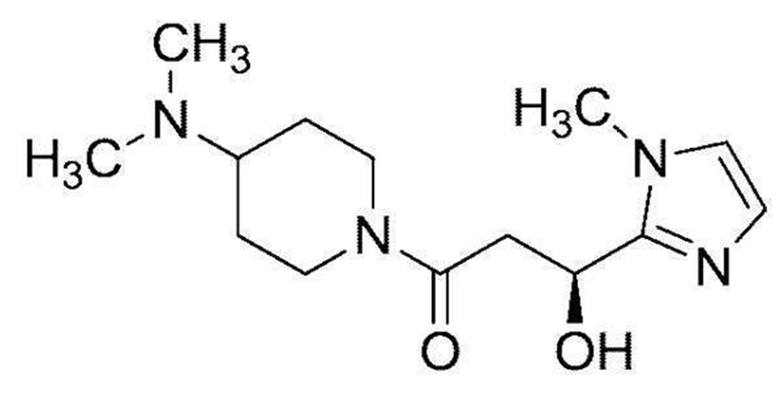
[0111]
(Пример 1) Защитный эффект производного циклического амина (I) или его фармакологически приемлемой соли на повреждение клеток в нейрональной клеточной линии, происходящей из ганглия дорсального корешка крысы
Исследовали защитный эффект производного циклического амина (I) или его фармакологически приемлемой соли в отношении повреждения клеток в нейрональной клеточной линии, происходящей из ганглия дорсального корешка крысы.
[0112]
Нейрональную клеточную линию ND15, происходящую из ганглия дорсального корешка крысы, культивировали в DMEM, содержавшей 10% FBS. На следующие сутки клетки культивировали в DMEM, содержащей 10% FBS, содержащей EC23 (10 мкМ, Reinner) в течение 8 суток для дифференцировки в нейроны.
[0113]
Среду заменяли на среду DMEM/F12, содержавшую цисплатин (конечная концентрация 50 мкМ), а затем культивировали в течение 4 часов, тем самым индуцируя повреждение клеток. Соединение 1 содержалось в среде (конечная концентрация 0,5, 5 или 50 мкМ) для лечения аналогично цисплатину. Группы включали 6 групп: группа без обработки, группа обработки 50 мкМ соединением 1 (группа обработки 50 мкМ соединением 1), группа обработки цисплатином, группа обработки цисплатином и 0,5 мкМ соединением 1 (группа обработки цисплатином и 0,5 мкМ соединением 1), группа обработки цисплатином и 5 мкМ соединением 1, и группа обработки цисплатином и 50 мкМ соединением 1.
[0114]
Для определения жизнеспособности клеток среду заменяли на среду DMEM/F12, содержавшую alamarBlue (Invitrogen), затем культивировали в течение 2 часов, а затем определяли поглощение при длине волны 570 нм и поглощение при длине волны 595 нм. Жизнеспособность клеток вычисляли с использованием отношения поглощения при длине волны 570 нм и поглощения при длине волны 595 нм, и принимая группу без обработки за 100%.
[0115]
Результаты оценки эффектов соединения 1 на жизнеспособность клеток представлены на фиг. 1. На фиг. 1 по вертикальной оси указана жизнеспособность клеток (%) (среднее значение ± стандартная ошибка; n=6 на группу), и по горизонтальной оси указана, слева направо, группа без обработки, группа обработки 50 мкМ соединением 1, группа обработки цисплатином, группа обработки цисплатином и 0,5 мкМ соединением 1, группа обработки цисплатином и 5 мкМ соединением 1, и группа обработки цисплатином и 50 мкМ соединением 1. Обозначение "#" на фиг. 1 указывает на статистически значимое (#: p<0,05, t-критерий Стьюдента) отличие по сравнению с группой без обработки, и обозначение "*" на фиг. 1 указывает на статистически значимое (*: p<0,025, множественное сравнение Вильямса, одностороннее) по сравнению с группой обработки цисплатином.
[0116]
В то время как в результате лечения цисплатином наблюдалось снижение жизнеспособности клеток в нейрональной клеточной линии, происходящей из ганглия дорсального корешка крысы, в результате одновременной обработки с соединением 1 наблюдалось подавление этого снижения. В частности, было обнаружено, что соединение 1 защищает нейрональную клеточную линию, происходящую из ганглия дорсального корешка крысы, от повреждения.
[0117]
(Пример 2) Восстанавливающий эффект производного циклического амина (I) или его фармакологически приемлемой соли на повреждение клеток в нейрональной клеточной линии, происходящей из ганглия дорсального корешка крысы
Проводили исследование восстанавливающего эффекта производного циклического амина (I) или его фармакологически приемлемой соли на повреждение клеток в нейрональной клеточной линии, происходящей из ганглия дорсального корешка крысы.
[0118]
Аналогично примеру 1, повреждение клеток индуцировали в нейрональной клеточной линии, происходящей из ганглия дорсального корешка крысы, ND15 с использованием цисплатина, а затем определяли жизнеспособность клеток. После обработки цисплатином в течение 24 часов, проводили обработку соединением 1 в среде 2 часов (конечная концентрация 0,5, 5 или 50 мкМ). Группы включали 6 групп: группа без обработки, группа обработки 50 мкМ соединением 1, группа обработки цисплатином, группа обработки цисплатином и 0,5 мкМ соединением 1, группа обработки цисплатином и 5 мкМ соединением 1, и группа обработки цисплатином и 50 мкМ соединением 1.
[0119]
Результаты оценки эффектов соединения 1 на жизнеспособность клеток представлены на фиг. 2. На фиг. 2 по вертикальной оси указана жизнеспособность клеток (%) (среднее значение ± стандартная ошибка; n=6 на группу), и по горизонтальной оси указана, слева направо, группа без обработки, группа обработки 50 мкМ соединением 1, группа обработки цисплатином, группа обработки цисплатином и 0,5 мкМ соединением 1, группа обработки цисплатином и 5 мкМ соединением 1, и группа обработки цисплатином и 50 мкМ соединением 1. Обозначение "#" на фиг. 2 указывает на статистически значимое (#: p<0,05, t-критерий Стьюдента) отличие по сравнению с группой без обработки, и обозначение "*" на фиг. 2 указывает на статистически значимое (*: p<0,025, множественное сравнение Вильямса, одностороннее) по сравнению с группой обработки цисплатином.
[0120]
В то время как в результате обработки цисплатином наблюдалось снижение жизнеспособности клеток в нейрональной клеточной линии, происходящей из ганглия дорсального корешка крысы, в результате последующей обработки соединением 1 наблюдалось подавление этого снижения. В частности, было обнаружено, что соединение 1 восстанавливает нейрональную клеточную линию, происходящую из ганглия дорсального корешка крысы, после повреждения.
[0121]
(Пример 3) Эффекты производного циклического амина (I) или его фармакологически приемлемой соли на миелинизацию в сокультуре нейронов ганглиев дорсального корешка и шванновских клеток крысы
Проводили исследование эффекта производного циклического амина (I) или его фармакологически приемлемой соли в отношении ускорения миелинизации в сокультуре нейронов ганглия дорсального корешка и шванновских клеток крысы.
[0122]
Ганглий дорсального корешка извлекали из плода самки крысы SD на 15 сутки беременности, а затем нейроны и клетки-предшественники шванновских клеток культивировали по отдельности (начальный день культивирования клеток обозначался как сутки 1). На 19 сутки после первоначального дня культивирования клеток (19 сутки), клетки-предшественники шванновских клеток добавляли к культуре нейронов для инициации сокультуры. Миелинизацию индуцировали обработкой аскорбиновой кислотой (всего от 4 до 5 раз в зависимости от замены среды от 2 до 3 раз) на сутки от 26-x до 40-x (сутки с 26 по 40) от первого дня культивирования клеток.
[0123]
В комбинации с обработкой аскорбиновой кислотой проводили обработку соединением 1, растворенным в стерильной дистиллированной воде (конечная концентрация 30 мкм) всего от 4 до 5 раз. В качестве контроля проводили лечение стерильной дистиллированной водой вместо раствора соединения 1. Группы включали 2 группы: группа обработки стерильной дистиллированной водой (группа обработки носителем); и группа обработки 30 мкМ соединением 1 (группа обработки соединением 1).
[0124]
Для иммунного окрашивания клетки промывали фосфатно-солевым буфером на сутки с 40-x по 43-е (сутки с 40 по 43) от первого дня культивирования клеток, а затем фиксировали 4% параформальдегидом в фосфатном буфере. После обработки метанолом и блокирования маркерный белок миелиновой оболочки, основной белок миелина (MBP), подвергали иммунофлуоресцентному окрашиванию.
[0125]
Флуоресцентные изображения MBP получали с использованием флуоресцентного микроскопа (DMI4000B, Leica), а затем анализировали количество сегментов миелиновой оболочки (≥25 мкм), исходя из изображений. Следует отметить, что представляющая интерес анализируемая область (ROI) представляла собой часть, где наблюдалось наибольшее количество окрашенных изображений волокнистого MBP среди 4 частей, полученных разделением зоны сокультивирования на четыре.
[0126]
Результаты оценки эффектов соединения 1 на миелинизацию представлены на фиг. 3. На фиг. 3, по вертикальной оси указано количество сегментов миелиновой оболочки на ROI (средняя величина ± стандартная ошибка; n=8-12 на группу), и по горизонтальной оси указано количество суток культивирования клеток.
[0127]
(Пример 4) Эффекты производного циклического амина (I) или его фармакологически приемлемой соли на уровень экспрессии MBP в сокультуре нейронов ганглия дорсального корешка и шванновских клеток крысы
Проводили исследование эффекта производного циклического амина (I) или его фармакологически приемлемой соли на уровень экспрессии MBP в сокультуре нейронов ганглия дорсального корешка и шванновских клеток крысы.
[0128]
Аналогично примеру 3, получали сокультуру нейронов дорсального ганглия крысы и шванновских клеток, индуцировали миелинизацию, а затем проводили обработку соединением 1. Группы включали 2 группы: группа обработки стерильной дистиллированной водой (группа обработки носителем); и группа обработки 30 мкМ соединением 1 (группа обработки соединением 1).
[0129]
Для вестерн-блоттинга на 43 сутки с первых суток культивирования сокультуру лизировали в растворе для лизиса клеток RIPAa затем клеточный лизат подвергали полиакриламидному гель-электрофорезу с додецилсульфатом натрия. Затем белок переносили на PVDF-мембрану, а затем выявляли полосу MBP посредством реакции с антителом. Для количественного определения выявленной таким образом полосы использовали программное обеспечение Image Lab (BIO-RAD).
[0130]
Результаты оценки эффектов соединения 1 на уровень экспрессии MBP представлены на фиг. 4. На фиг. 4 по вертикальной оси указаны относительные уровни экспрессии MBP по сравнению со средней величиной группы носителя, обозначаемой как 1 (средняя величина ± стандартная ошибка; n=4 на группы), и по горизонтальной оси указана слева направо группа обработки носителем и группа обработки соединением 1. Символ "*" на фиг. 4 указывает на статистически значимое (*: p<0,05, t-критерий Стьюдента) отличие по сравнению с группой обработки носителем.
[0131]
В результате обработки соединением 1 наблюдалось увеличенное количество сегментов миелиновой оболочки и увеличение уровней маркерного белка миелиновой оболочки MBP. В частности, было обнаружено, что соединение 1 ускоряет миелинизацию в сокультуре нейронов дорсального ганглия и шванновских клеток крысы.
[0132]
Как показано в примерах 1, 2, 3 и 4, производное циклического амина (I) или его фармакологически приемлемая соль являются эффективными против повреждений нейронов и миелиновых оболочек периферических нервов.
[0133]
(Пример 5) Эффекты повторяющегося дозирования производного циклического амина (I) или его фармакологически приемлемой соли на аллодинию в ответ на холодовые стимулы (холодовая аллодиния) и аллодинию в ответ на тактильные стимулы (механическая аллодиния) в модели индуцированной оксалиплатином периферической невропатии на крысах
Проводили исследование эффекта производного циклического амина (I) или его фармакологически приемлемой соли на холодовую аллодинию и механическую аллодинию, которая развивалась после введения оксалиплатина.
[0134]
Оксалиплатин (4 мг/кг, Elplat, раствор для в/в инфузий, 200 г; Yakult) вводили крысам SD (возраст 7 недель, самцы; CHARLES RIVER LABORATORIES JAPAN, INC.) 1-недельными курсами (внутрибрюшинное введение два раза в течение двух последовательных дней в неделю) в течение 2 или 3 недель, тем самым получая модель индуцируемой оксалиплатином периферической невропатии. В качестве контроля (псевдоиндукция), вводили 5% раствор глюкозы (Otsuka Pharmaceutical Factory, Inc.). Начальный день введения обозначали как сутки 0 после индукции патологических состояний.
[0135]
Раствор, содержавший соединение 1 (3 или 10 мг/кг) или его растворитель (вода для инъекций; Otsuka Pharmaceutical Factory, Inc.), перорально вводили каждые сутки (два раза в сутки) (2-е введение проводили через 8 часов после 1-го введения) крысам, начиная с суток 0 после индукции патологических состояний, в течение 18 суток. На сутки 0 после индукции патологических состояний проводили 1-е введение перед введением оксалиплатина, и в день оценки аллодинии 1-е введение проводили после оценки. Группы включали 4 группы: группа псевдоиндукции и введения растворителя (группа имитации); группа индуцированного патологического состояния и введения растворителя (группа носителя); группа индуцированного патологического состояния и введения соединения 1 (3 мг/кг) (группа соединения 1 (3 мг/кг)); и группа индуцированного патологического состояния и введения соединения 1 (10 мг/кг) (группа соединения 1 (10 мг/кг)).
[0136]
Полезные эффекты на холодовую аллодинию оценивали до индукции патологических состояний и на 12 сутки после индукции патологических состояний (до 1-го введения соединения 1). Полезные эффекты на холодовую аллодинию оценивали посредством испытания с холодной плитой. Для испытания использовали устройство с холодной плитой (Ugo Basile). Животное помещали на плиту, поддерживаемую при заданной температуре (8°C), а затем определяли латентность отдергивания до тех пор, пока не подтверждалось обусловленное болью поведение (подъем задней конечности, встряхивание задней конечности, лизание задней конечности, стояние или прыгание). Следует отметить, что время окончания составляло 180 секунд.
[0137]
Полезные эффекты на механическую аллодинию оценивали до индукции патологических состояний и на 18 сутки после индукции патологических состояний (до 1-го введения соединения 1). Полезные эффекты на механическую аллодинию оценивали с использованием испытания фон Фрея. Следует отметить, что испытание проводили в соответствии со способом, описанным в известном источнике литературы (Chaplan et al. Journal of Neuroscience Methods, 1994, Vol. 53, p. 55-63) с использованием нитей фон Фрея (North Coast Medical), так что вычисляли 50% порог ответа.
[0138]
Результаты оценки эффектов соединения 1 на холодовую аллодинию представлены на фиг. 5. На фиг. 5 по вертикальной оси указана латентность отдергивания в испытании с холодной плитой, и более высокая числовая величина указывает на то, что произошло улучшение холодовой аллодинии (средняя величина ± стандартная ошибка; n=10 на группу). По горизонтальной оси указаны, слева направо, каждая группа до индукции патологических состояний (на фиг. 5, "сутки 0 (до индукции патологических состояний)") и каждая группа на 12 сутки после индукции патологических состояний (на фиг. 5, "сутки 12 (после индукции патологических состояний)"). Символ "#" на фиг. 5 указывает на статистически значимое (#: p<0,05, t-критерий Стьюдента) отличие по сравнению с группой имитации, и символ "*" на фиг. 5 указывает на статистически значимое (*: p<0,025, множественное сравнение Вильямса, одностороннее) по сравнению с группой носителя.
[0139]
На 12 сутки после индукции патологических состояний наблюдали значительное уменьшение латентности отдергивания в группе носителя по сравнению с группой имитации. В частности, подтверждалось развитие холодовой аллодинии, которая представляет собой периферическую невропатию, индуцируемую оксалиплатином.
[0140]
Посредством ежедневного (два раза в сутки) перорального введения соединения 1, наблюдалась значительно более длительная латентность отдергивания в группе соединения 1 (10 мг/кг) на 12 сутки после индукции патологических состояний по сравнению с группой носителя. В частности, было обнаружено, что соединение 1 подавляет холодовую аллодинию в модели индуцируемой оксалиплатином периферической невропатии.
[0141]
Результаты оценки эффектов соединения 1 на механическую аллодинию представлены на фиг. 6. На фиг. 6 по вертикальной оси указан порог 50% ответа в испытании фон Фрея, и более высокая числовая величина указывает на то, что происходит улучшение механической аллодинии (средняя величина ± стандартная ошибка; n=10 на группу). По горизонтальной оси указаны, слева направо, каждая группа до индукции патологических состояний (на фиг. 6, "сутки 0 (до индукции патологических состояний)") и каждая группа на 18 сутки после индукции патологических состояний (на фиг. 6, "сутки 18 (после индукции патологических состояний)"). Символ "#" на фиг. 6 указывает на статистически значимое (#: p<0,05, t-критерий Стьюдента) отличие по сравнению с группой имитации, и символ "*" на фиг. 6 указывает на статистически значимое (*: p<0,025, множественное сравнение Вильямса, одностороннее) по сравнению с группой носителя.
[0142]
На 18 сутки после индукции патологических состояний наблюдали значительное уменьшение порога 50% ответа в группе носителя по сравнению с группой имитации. В частности, подтверждалось развитие механической аллодинии, которая представляет собой периферическую невропатию, индуцируемую оксалиплатином.
[0143]
Посредством ежедневного (два раза в сутки) перорального введения соединения 1 наблюдалась значительное увеличение порога 50% ответа в группе соединения 1 (3 мг/кг) и группе соединения 1 (10 мг/кг) на 18 сутки после индукции патологических состояний по сравнению с группой носителя. В частности, было обнаружено, что соединение 1 подавляет механическую аллодинию в модели индуцируемой оксалиплатином периферической невропатии.
[0144]
Как описано выше, было обнаружено, что производное циклического амина (I) или его фармакологически приемлемая соль демонстрируют значительный супрессивный эффект на периферическую невропатию, индуцируемую оксалиплатином.
[0145]
(Пример 6) Терапевтический эффект однократного дозирования производного циклического амина (I) или его фармакологически приемлемой соли на механическую аллодинию в модели индуцируемой цисплатином периферической невропатии у крыс
Проводили исследование эффектов производного циклического амина (I) или его фармакологически приемлемой соли на механическую аллодинию, развившуюся в результате введения цисплатина.
[0146]
Цисплатин (Wako Pure Chemical Industries, Ltd.) внутрибрюшинно вводили крысам SD (возраст 6 недель, самцы; CHARLES RIVER LABORATORIES JAPAN, INC.) поочередно два раза в неделю (1 или 2 мг/кг) в течение 5 недель, тем самым получая модель индуцируемой цисплатином периферической невропатии. Цисплатин растворяли в физиологическом растворе до концентрации 10 мг/мл, а затем вводили. В качестве контроля (псевдоиндукция) вводили физиологический раствор. Начальный день введения обозначали как 1 сутки после индукции патологических состояний.
[0147]
На 34 сутки после индукции патологических состояний крысам перорально вводили раствор, содержавший соединение 1 (10 мг/кг), или его растворитель (вода для инъекций). Группы включали 3 группы: группа псевдоиндукции и введения растворителя (группа имитация); группа индуцированного патологического состояния и введения растворителя (группа носителя); и группа индуцированного патологического состояния и введения соединения 1 (10 мг/кг) (группа соединения 1 (10 мг/кг)).
[0148]
Полезные эффекты на механическую аллодинию оценивали аналогично примеру 5, и эту оценку проводили до и через 2 часа после введения соединения 1 на 34 сутки после индукции патологических состояний.
[0149]
Результаты оценки эффектов соединения 1 на механическую аллодинию представлены на фиг. 7. На фиг. 7, по вертикальной оси указан порог 50% ответа в испытании фон Фрея, и более высокая числовая величина указывает на то, что происходит улучшение механической аллодинии (средняя величина ± стандартная ошибка; n=4-6 на группу), и по горизонтальной оси указаны, слева направо, каждая группа до введения соединения 1 (на фиг. 7, "сутки 34 (до введения)") и каждая группа через 2 часа после введения соединения (на фиг. 7, "сутки 34 (через 2 часа после введения)"). Символ "#" на фиг. 7 указывает на статистически значимое (#: p<0,05, t-критерий Стьюдента) отличие по сравнению с группой имитации, и символ "*" на фиг. 7 указывает на статистически значимое (*: p<0,05, t-критерий Стьюдента) по сравнению с группой носителя.
[0150]
Через два часа после введения 1 наблюдалось значительное увеличение порога 50% ответа в группе соединения 1 (10 мг/кг) по сравнению с группой носителя. В частности, было обнаружено, что соединение 1 подавляет механическую аллодинию в модели индуцируемой цисплатином периферической невропатии.
[0151]
Как описано выше, было обнаружено, что производное циклического амина (I) или его фармакологически приемлемая соль демонстрируют значительный эффект подавления на периферическую невропатию, индуцируемую цисплатином.
[0152]
(Пример 7) Эффекты однократной дозы производного циклического амина (I) или его фармакологически приемлемой соли на механическую аллодинию в модели индуцируемой паклитакселом периферической невропатии у крыс
Проводили исследование эффектов производного циклического амина (I) или его фармакологически приемлемой соли на механическую аллодинию, развившуюся в результате введения паклитаксела.
[0153]
Паклитаксел (4 мг/кг, ChromaDex) внутрибрюшинно вводили крысам SD (возраст 6 недель, самцы; CHARLES RIVER LABORATORIES JAPAN, INC.) раз в двое суток всего 4 раза, тем самым получая модель индуцируемой паклитакселом периферической невропатии. Паклитаксел растворяли в Cremophor EL (NACALAI TESQUE, INC.) и этаноле (Wako Pure Chemical Industries, Ltd.), смешанных 1:1 до концентрации 6 мг/мл. Таким образом полученный раствор разбавляли физиологическим солевым раствором до концентрации 4 мг/мл, а затем вводили. Первый день введения обозначали как сутки 0 после индукции патологических состояний.
[0154]
На 14 сутки после индукции патологических состояний крысам перорально вводили раствор, содержащий соединение 1 (10 мг/кг), или его растворитель (вода для инъекций). Группы включали 2 группы: группа введения растворителя (группа носителя) и группа введения соединения 1 (10 мг/кг).
[0155]
Полезные эффекты на механическую аллодинию оценивали аналогично примеру 5, и оценку проводили перед индукцией и на 14 сутки после индукции патологических состояний (через 3 часа после введения соединения 1).
[0156]
Результаты оценки эффектов соединения 1 на механическую аллодинию представлены на фиг. 8. На фиг. 8, по вертикальной оси указан порог 50% ответа в испытании фон Фрея, и более высокая числовая величина указывает на то, что происходит улучшение механической аллодинии (средняя величина ± стандартная ошибка; n=8 на группу), и по горизонтальной оси указаны, слева направо, каждая группа до индукции патологических состояний и каждая группа через 3 часа после введения соединения 1 на 14 сутки после индукции патологических состояний (на фиг. 8, "сутки 14 (3 часа после введения)"). Символ "*" на фиг. 8 указывает на статистически значимое (*: p<0,05, t-критерий Стьюдента, двухсторонний) по сравнению с группой носителя.
[0157]
На 14 сутки после индукции патологических состояний (через 3 часа после введения соединения 1), в группе соединения 1 (10 мг/кг) наблюдали значительное снижение порога 50% ответа по сравнению с группой носителя. В частности, было выявлено, что соединение 1 подавляет механическую аллодинию в модели индуцируемой паклитакселом периферической невропатии.
[0158]
Как описано выше, было обнаружено, что производное циклического амина (I) или его фармакологически приемлемая соль демонстрируют значительный эффект подавления на периферическую невропатию, индуцируемую паклитакселом.
[0159]
(Пример 8) Эффекты однократной дозы производного циклического амина (I) или его фармакологически приемлемой соли на механическую аллодинию в модели индуцируемой бортезомибом периферической невропатии у крыс
Проводили исследование эффектов производного циклического амина (I) или его фармакологически приемлемой соли на механическую аллодинию, развившуюся в результате введения бортезомиба.
[0160]
Бортезомиб (0,2 мг/кг, AdooQ BioScience) внутрибрюшинно вводили всего 4 раза крысам SD (возраст 6 недель, самцы; CHARLES RIVER LABORATORIES JAPAN, INC.) на 1, 4, 8 и 11 сутки после индукции патологических состояний, тем самым получая модель индуцируемой бортезомибом периферической невропатии. В данном случае первый день введения обозначали как 1-е сутки (сутки 1) после индукции патологических состояний. Бортезомиб растворяли в диметилсульфоксиде, а затем добавляли Tween80. Затем добавляли воду для инъекций, получая раствор 0,2 мг/мл. Конечная концентрация каждого из диметилсульфоксида и Tween80 составляла 5%.
[0161]
На 15 сутки после индукции патологических состояний крысам перорально вводили раствор, содержащий соединение 1 (20 мг/кг), или его растворитель (вода для инъекций). Группы включали 2 группы: группа введения растворителя (группа носителя) и группа введения соединения 1 (20 мг/кг).
[0162]
Полезные эффекты на механическую аллодинию оценивали аналогично примеру 5, и оценку проводили перед индукцией и на 15 сутки после индукции патологических состояний (через 3 часа после введения соединения 1).
[0163]
Результаты оценки эффектов соединения 1 на механическую аллодинию представлены на фиг. 9. На фиг. 9, по вертикальной оси указан порог 50% ответа в испытании фон Фрея, и более высокая числовая величина указывает на то, что происходит улучшение механической аллодинии (средняя величина ± стандартная ошибка; n=8 на группу). По горизонтальной оси указаны, слева направо, каждая группа до индукции патологических состояний и каждая группа через 3 часа после введения соединения 1 на 15 сутки после индукции патологических состояний (на фиг. 9, "сутки 15 (3 часа после введения)"). Символ "*" на фиг. 9 указывает на статистически значимое (*: p<0,05, t-критерий Стьюдента, двухсторонний) по сравнению с группой носителя.
[0164]
На 15 сутки после индукции патологических состояний (через 3 часа после введения соединения 1), в группе соединения 1 (20 мг/кг) наблюдали значительное снижение порога 50% ответа по сравнению с группой носителя. В частности, было выявлено, что соединение 1 подавляет механическую аллодинию в модели индуцируемой бортезомибом периферической невропатии.
[0165]
Как описано выше, было обнаружено, что производное циклического амина (I) или его фармакологически приемлемая соль демонстрируют значительный эффект подавления на периферическую невропатию, индуцируемую бортезомибом.
[0166]
Таким образом, было выявлено, что производное циклического амина (I) или фармакологически приемлемая соль демонстрируют значительный эффект подавления периферических невропатий, индуцируемых лекарственными средствами и, в частности, средствами против злокачественной опухоли.
[0167]
(Пример 9) Эффекты производного циклического амина (I) или его фармакологически приемлемой соли на модель экспериментального аутоиммунного неврита (EAN) на крысах
Проводили исследование супрессивного эффекта производного циклического амина (I) или его фармакологически приемлемой соли в модели EAN на крысах.
[0168]
Способ получения модельных крыс с EAN является таким, как описано ниже. Пептид 57-81 периферического белка миелина P2 (синтезированный в Toray Research Center, Inc.) растворяли в физиологическом растворе (Otsuka Pharmaceutical Factory, Inc.) с получением раствора 2 мг/мл. Раствор и 2 мг/мл полного адъюванта Фрейнда (Difco Laboratories), содержавший убитые Mycobacterium tuberculosis H37Ra, смешивали в равных количествах, тем самым получая эмульсию, которая представляла собой раствор пептида для введения. Раствор пептида для введения (200 мкл) вводили подкожно в основание хвоста каждой крысы Льюиса (возраст от 6 до 7 недель, самцы; CHARLES RIVER LABORATORIES JAPAN, INC.) под анестезией, тем самым получая модель EAN. День введения пептида обозначали как сутки 0 после индукции патологических состояний.
[0169]
Клинические показатели оценивали следующим образом: 0 = нет симптомов, 1 = вялый хвост или слабость нижних конечностей, 2 = вялый хвост и слабость задних конечностей, 3 = частичный паралич задних конечностей, 4 = полный паралич задних конечностей, 5 = агональное состояние или смерть. Также проводили взвешивание.
[0170]
Соединение 1 (20 мг/кг) растворяли в дистиллированной воде (Otsuka Pharmaceutical Factory, Inc.), а затем раствор перорально вводили в модели EAN два раза в сутки (введение начинали на 10 сутки после индукции патологических состояний). В качестве контроля в модели EAN перорально вводили дистиллированную воду. Группы включали 2 группы: группа введения растворителя (группа носителя); и группа введения соединения 1.
[0171]
Для гистопатологической оценки на 17 сутки после индукции патологических состояний выделяли седалищный нерв и большеберцовый нерв, а затем погружали в нейтральный буферный раствор с 10% формалином. Образцы нарезали, а затем подвергали окрашиванию гематоксилином-эозином, окрашиванию по методу Клювера-Баррера (двойное окрашивание красителем Luxol Fast Blue и красителем Ниссля) и иммунному окрашиванию (Iba1, CD3, NFP и MBP). Образцы наблюдали под оптическим микроскопом, а затем оценивали наличие или отсутствие инфильтрации T-клеток и макрофагов и дегенерацию миелиновых оболочек и аксонов.
[0172]
Результаты оценки эффекта соединения 1 на клинические показатели представлены на фиг. 10. На фиг. 10 по вертикальной оси указаны клинические показатели, и более низкая величина указывает на улучшение симптомов (среднее значение ± стандартная ошибка, n=6-7 на группу). Увеличение клинических показателей подавлялось в группе соединения 1 по сравнению с группой носителя.
[0173]
Результаты оценки эффекта соединения 1 на снижение массы тела представлены на фиг. 11. На фиг. 11 по вертикальной оси указана масса тела крыс (среднее значение ± стандартная ошибка, n=6-7 на группу). В группе носителя индуцировалось снижение массы тела, однако в группе соединения 1 снижение массы тела не индуцировалось.
[0174]
Результаты гистопатологической оценки соединения 1 представлены в таблице 2. В таблице 2 представлено количество животных, демонстрирующих гистологические изменения седалищного нерва и большеберцового нерва (n=3 на группу). В группе носителя, наблюдали инфильтрацию T-клеток и макрофагов, и дегенерацию миелиновых оболочек и аксонов, однако в группе соединения 1 такие изменения практически не наблюдались.
[0175]
[Таблица 2]
[0176]
Как описано выше, было выявлено, что производное циклического амина (I) или его фармакологически приемлемая соль являются эффективными против аутоиммунных периферических невропатий.
[0177]
(Пример 10) Эффекты производного циклического амина (I) или его фармакологически приемлемой соли на механическую аллодинию в модели экспериментального аутоиммунного неврита (EAN) у крыс
Проводили исследование супрессивного эффекта производного циклического амина (I) или его фармакологически приемлемой соли на механическую аллодинию в модели EAN на крысах.
[0178]
Модельных крыс с EAN получали аналогично примеру 9. Кроме того, животных с псевдоиндукцией получали путем введения физиологического раствора (Otsuka Pharmaceutical Factory, Inc.) вместо раствора пептида для введения. День введения раствора пептида для введения или физиологического раствора обозначали как сутки 0 после индукции патологических состояний.
[0179]
На 14 сутки после индукции патологических состояний крысам перорально вводили соединение 1 (5 или 10 мг/кг) или его растворитель (вода для инъекций). Группы включали 4 группы: группа псевдоиндукции и введения растворителя (группа имитации); группа индуцированного патологического состояния и введения растворителя (группа носителя); группа индуцированного патологического состояния и введения соединения 1 (5 мг/кг) (группа соединения 1 (5 мг/кг)); и группа индуцированного патологического состояния и введения соединения 1 (10 мг/кг) (группа введения соединения 1 (10 мг/кг)).
[0180]
Полезные эффекты на механическую аллодинию оценивали аналогично примеру 5, и эту оценку проводили через 3 часа после введения соединения 1 на 14 сутки после индукции патологических состояний.
[0181]
Результаты оценки эффектов соединения 1 на механическую аллодинию представлены на фиг. 12. На фиг. 12 по вертикальной оси указаны пороговые значения 50% ответа в тесте Фон Фрея, и более высокая величина указывает на улучшение механической аллодинии (среднее значение ± стандартная ошибка, n=4-10 на группу). Символ "#" на фиг. 12 указывает на статистически значимое (#: p<0,05, t-критерий Стьюдента) отличие по сравнению с группой имитации и символы "*" на фиг. 12 указывают на статистически значимые (*: p<0,025, множественное сравнение Вильямса, одностороннее) отличия по сравнению с группой носителя.
[0182]
Наблюдалось значительно снижение порогового значения 50% ответа в группе носителя по сравнению с группой имитации. В частности, было подтверждено развитие механической аллодинии в модели EAN.
[0183]
Значительное увеличение порогового значения 50% ответа наблюдалось в группе соединения 1 (5 мг/кг) и соединения 1 (10 мг/кг) по сравнению с группой носителя. В частности, было обнаружено, что соединение 1 подавляет механическую аллодинию в модели EAN.
[0184]
Эти результаты показали, что производное циклического амина (I) или его фармакологически приемлемая соль являются эффективными против механической аллодинии при аутоиммунных периферических невропатиях.
[0185]
(Пример 11) Эффекты производного циклического амина (I) или его фармакологически приемлемой соли на снижение скорости проведения по нервам в модели индуцируемого стрептозотоцина диабета у крыс
Проводили исследование супрессивного эффекта производного циклического амина (I) или его фармакологически приемлемой соли на механическую аллодинию в модели индуцированного стрептозотоцином диабета у крыс.
[0186]
Стрептозотоцин (50 мг/кг, Sigma-Aldrich) вводили внутривенно крысам SD (возраст 6 недель, самцы; CHARLES RIVER LABORATORIES JAPAN, INC.) через хвостовую вену, тем самым получая модель индуцированного стрептозотоцином диабета. Стрептозотоцин растворяли в цитратном буфере с получением раствора 25 мг/мл, а затем вводили. Животное без индуцированного патологического состояния получали, не вводя раствор стрептозотоцина. День первоначального введения был обозначен как сутки 1 после индукции патологических состояний.
[0187]
На 14-28 сутки после индукции патологических состояний крысам перорально вводили раствор, содержавший соединение 1 (3 или 10 мг/кг) или его растворитель (вода для инъекций) два раза в сутки. Группы включали 4 группы: группа без индуцированного патологического состояния и введения растворителя (нормальная группа); группа индуцированного патологического состояния и введения растворителя (группа носителя); группа индуцированного патологического состояния и введения соединения 1 (3 мг/кг) (группа соединения 1 (3 мг/кг)); и группа индуцированного патологического состояния и введения соединения 1 (10 мг/кг) (группа соединения 1 (10 мг/кг)).
[0188]
Скорость проведения по нервам измеряли в пределах 3 суток со дня, следующего после дня последнего введения. Два однополюсных игольчатых электрода (A, B) помещали в бедренную область так, чтобы электроды контактировали с седалищным нервом. Другой однополюсный игольчатый электрод (C) устанавливали в нижний конец икроножной мышцы (ахиллово сухожилие), чтобы установить выводной электрод на подушечке стопы. Стимуляция A-B и стимуляция B-C играла роль дистальной стимуляции и проксимальной стимуляции, соответственно, а затем время распространения стимулирующего сигнала анализировали, исходя из каждой формы колебаний выводного электрода на подушечке стопы. Скорость проведения по нерву вычисляли, исходя из разности во времени распространения между дистальной стимуляцией и проксимальной стимуляцией и расстояния между электродами.
[0189]
Результаты оценки эффектов соединения 1 на сниженную скорость проведения по нервам представлены на фиг. 13. На фиг. 13 по вертикальной оси указана скорость проведения по нервам (среднее значение ± стандартная ошибка, n=5-6 на группу). Символ "#" на фиг. 13 указывает на статистически значимое (#: p<0,05, t-критерий Стьюдента) отличие по сравнению с нормальной группой, и символ "*" на фиг. 13 указывает на статистически значимое (*: p<0,025, множественное сравнение Вильямса, одностороннее) отличие по сравнению с группой носителя.
[0190]
В группе соединения 1 (10 мг/кг) наблюдали значительное повышение скорости проведения по нерву в результате повторяющегося дозирования соединения 1, по сравнению с группой носителя. В частности, было обнаружено, что соединение 1 подавляет снижение скорости проведения по нервам в модели индуцированного стрептозотоцином диабета.
[0191]
(Пример 12) Эффекты производного циклического амина (I) или его фармакологически приемлемой соли на механическую аллодинию в модели индуцируемого стрептозотоцином диабета
Проводили исследование супрессивного эффекта производного циклического амина (I) или его фармакологически приемлемой соли на механическую аллодинию в модели индуцированного стрептозотоцином диабета у крыс.
[0192]
Стрептозотоцин (50 мг/кг, Sigma-Aldrich) вводили внутривенно крысам SD (возраст 6 недель, самцы; CHARLES RIVER LABORATORIES JAPAN, INC.) через хвостовую вену, тем самым получая модель индуцированного стрептозотоцином диабета. Стрептозотоцин растворяли в цитратном буфере с получением раствора 25 мг/мл, а затем вводили. Кроме того, также получали животное с псевдоиндукцией путем введения физиологического раствора вместо введения раствора стрептозотоцина. День первоначального введения был обозначен как сутки 1 после индукции патологических состояний.
[0193]
На 28 сутки после индукции патологических состояний крысам перорально вводили раствор, содержавший соединение 1 (3 или 10 мг/кг) или его растворитель (вода для инъекций). Группы включали 4 группы: группа псевдоиндукции и введения растворителя (группа имитации); группа индуцированного патологического состояния и введения растворителя (группа носителя); группа индуцированного патологического состояния и введения соединения 1 (10 мг/кг) (группа соединения 1 (10 мг/кг)); и группа индуцированного патологического состояния и введения соединения 1 (30 мг/кг) (группа соединения 1 (30 мг/кг)).
[0194]
Полезные эффекты на механическую аллодинию оценивали аналогично примеру 5, и эту оценку проводили через 3 часа после введения соединения 1 на 28 сутки после индукции патологических состояний.
[0195]
Результаты оценки эффектов соединения 1 на механическую аллодинию представлены на фиг. 14. На фиг. 14 по вертикальной оси указаны пороговые значения 50% ответа в тесте Фон Фрея, и более высокая величина указывает на улучшение механической аллодинии (среднее значение ± стандартная ошибка, n=8 на группу). Символы "*" на фиг. 14 указывают на статистически значимые (*: p<0,025, множественное сравнение Шерли-Вильямса, одностороннее) отличия по сравнению с группой носителя.
[0196]
На 28 сутки после индукции патологических состояний (через 3 часа после введения соединения 1) наблюдалось значительное увеличение порогового значения 50% ответа в группе соединения 1 (10 мг/кг) и группе соединения 1 (30 мг/кг) по сравнению с группой носителя. В частности, было обнаружено, что соединение 1 подавляет механическую аллодинию в модели индуцированного стрептозотоцином диабета.
[0197]
Как описано выше, было обнаружено, что производное циклического амина (I) или его фармакологически приемлемая соль являются эффективными против метаболических периферических невропатий и, в частности, против диабетической периферической невропатии.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
[0198]
Производное циклического амина или его фармакологически приемлемая соль по настоящему изобретению обладают эффектами защиты и восстановления периферических нейронов и эффектами ускорения миелинизации и значительно подавляют симптомы и т.п. периферических невропатий и, таким образом, их можно использовать в качестве терапевтического или профилактического средства против периферических невропатий.
[0199]
Все публикации, патенты и патентные заявки, цитированные в настоящем описании, включены в настоящее описание в качестве ссылок в полном объеме.




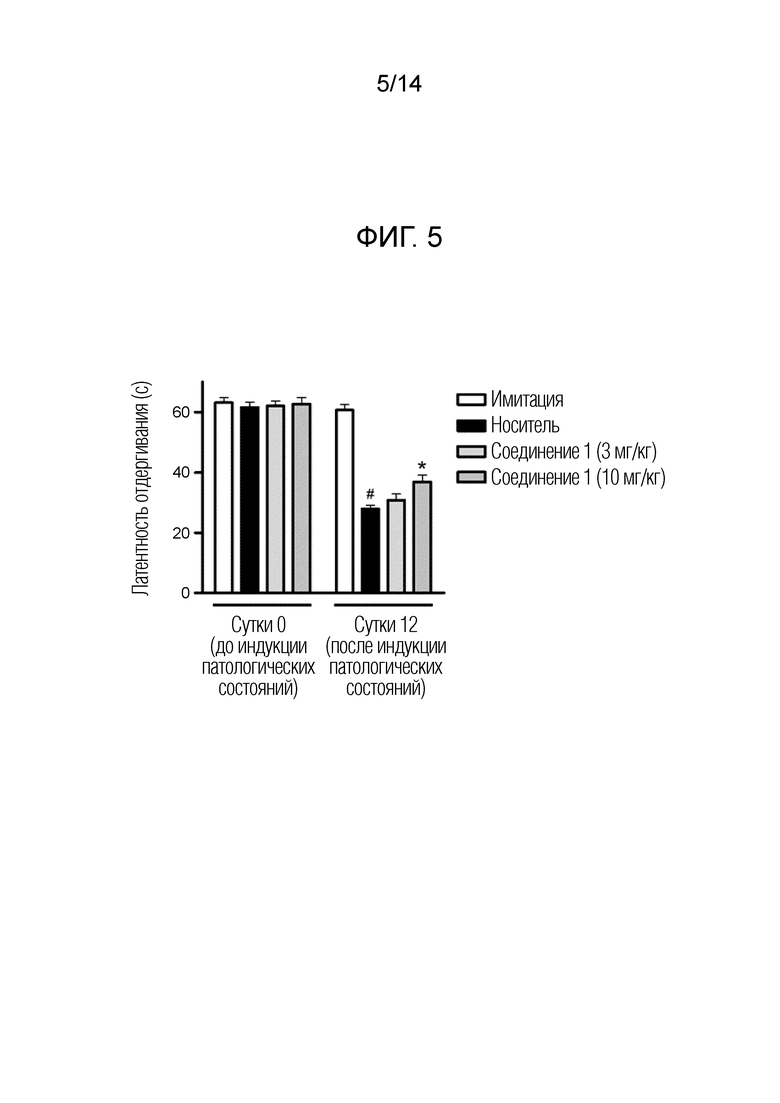

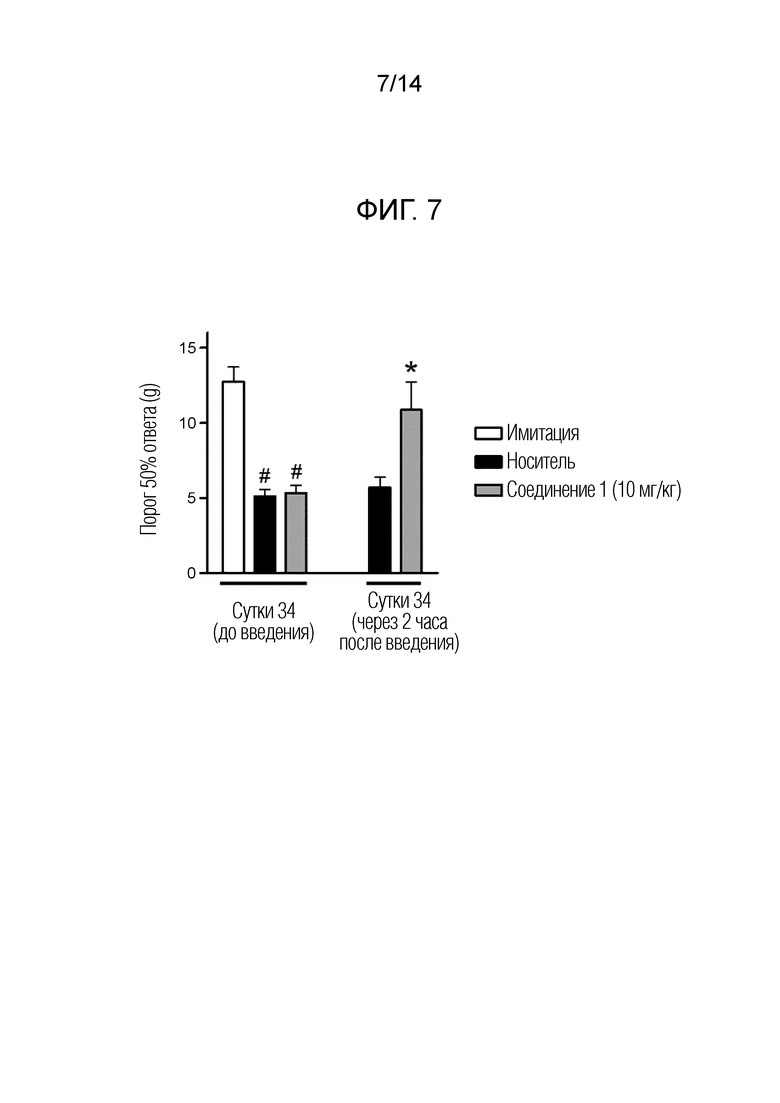
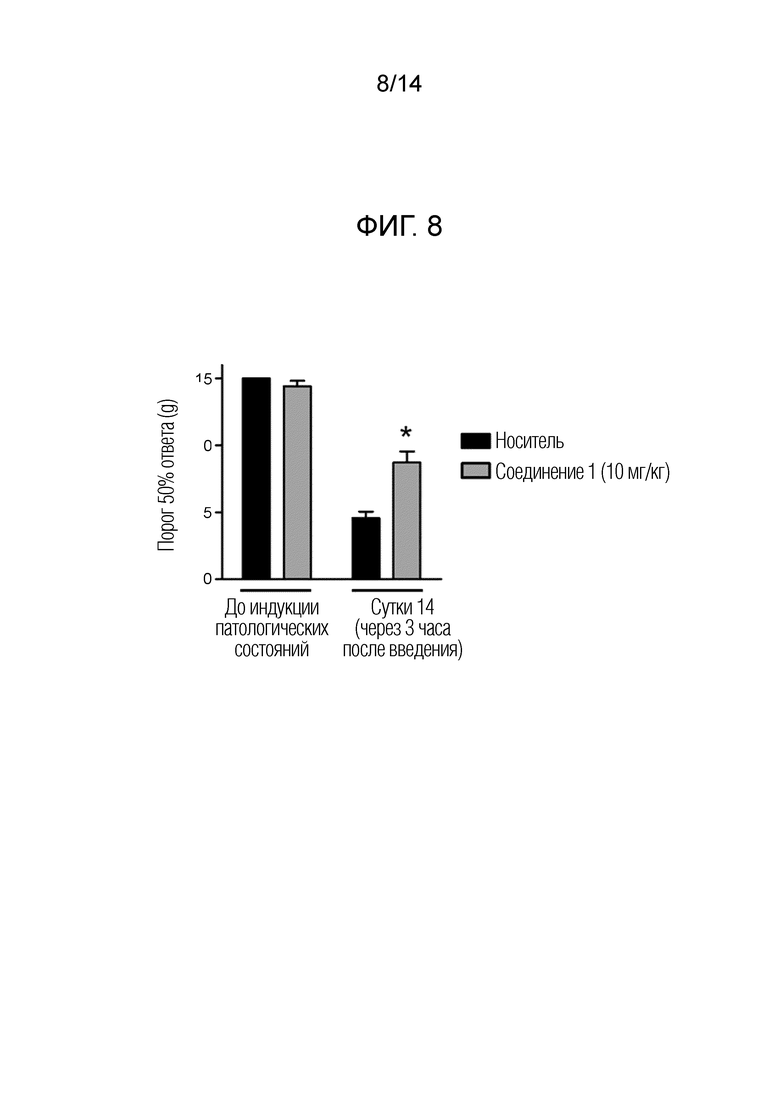
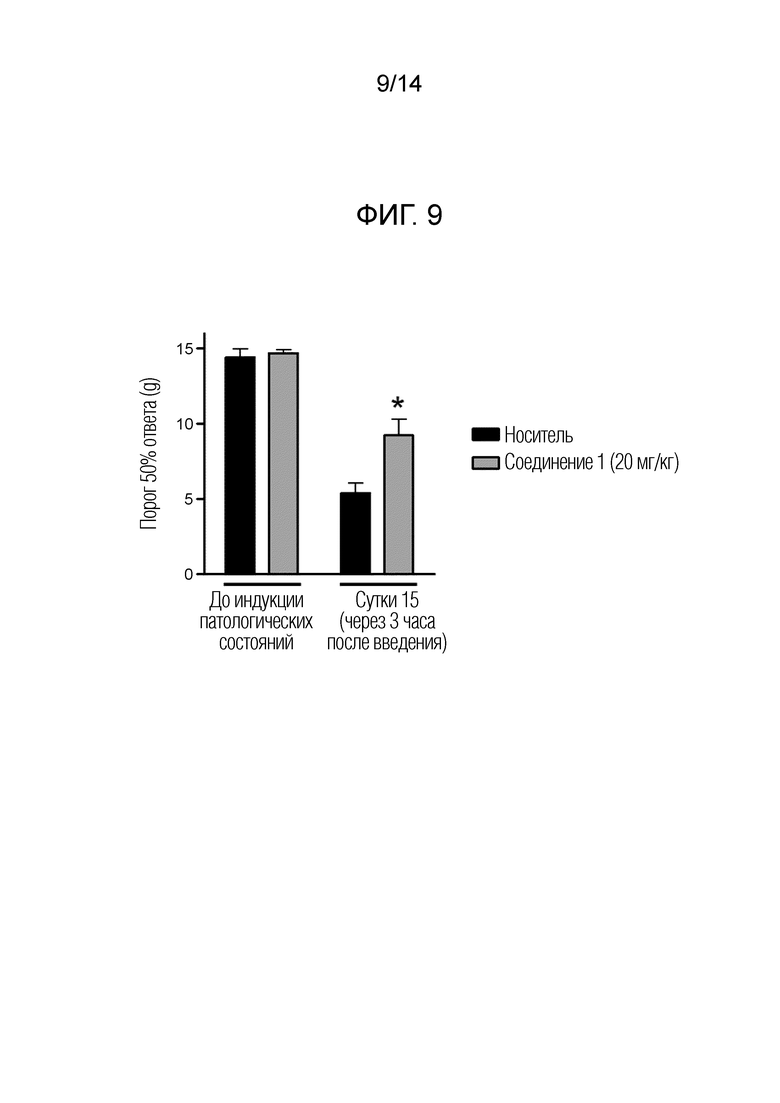





Изобретение относится к области медицины и фармацевтики, а именно к применению производного циклического амина, соответствующего формуле

или его фармакологически приемлемой соли для изготовления лекарственного средства для лечения или предупреждения периферических невропатий. 8 з.п. ф-лы, 14 ил., 3 табл., 12 пр.
1. Применение производного циклического амина, соответствующего общей формуле (I), или его фармакологически приемлемой соли для изготовления лекарственного средства для лечения или предупреждения периферических невропатий,

где атом углерода, обозначаемый посредством *, представляет собой асимметричный атом углерода, и
A обозначает группу, соответствующую общей формуле (IIa):

где R1 обозначает метильную группу,
R2 обозначает атом водорода,
каждый R3 обозначает метильную группу, и
стереохимическая конфигурация асимметричного атома углерода, отмеченного *, представляет собой конфигурацию S.
2. Применение по п.1, где периферические невропатии представляют собой индуцированные лекарственными средствами периферические невропатии.
3. Применение по п.2, где указанные индуцированные лекарственными средствами периферические невропатии представляют собой по меньшей мере один тип, выбранный из индуцированной лекарственным средством против злокачественной опухоли периферической невропатии, индуцированной противовирусным средством периферической невропатии, индуцированной противомикробным средством периферической невропатии, индуцированной противотуберкулезным средством периферической невропатии, индуцированной антиаритмическим средством периферической невропатии, индуцированной снижающим уровень липидов средством периферической невропатии, индуцированной иммуносупрессивным средством периферической невропатии, индуцированной терапевтическим средством против подагры периферической невропатии и периферических невропатий, индуцированных другими лекарственными средствами.
4. Применение по п.1, где периферические невропатии представляют собой аутоиммунные периферические невропатии.
5. Применение по п.4, где указанные аутоиммунные периферические невропатии представляют собой по меньшей мере один тип, выбранный из синдрома Гийена–Барре, хронической воспалительной демиелинизирующей полирадикулоневропатии, мультифокальной моторной невропатии и парапротеинемической невропатии.
6. Применение по п.1, где периферические невропатии представляют собой метаболические периферические невропатии.
7. Применение по п.6, где указанные метаболические периферические невропатии представляют собой по меньшей мере один тип, выбранный из диабетической периферической невропатии, уремической периферической невропатии, коллагеновой периферической невропатии и обусловленной дефицитом витаминов периферической невропатии.
8. Применение по п.1, где периферические невропатии представляют собой наследственные периферические невропатии.
9. Применение по п.8, где указанные наследственные периферические невропатии представляют собой по меньшей мере один тип, выбранный из болезни Шарко–Мари–Тута, семейной амилоидной полиневропатии, наследственной компрессионной невропатии (HNPP) и наследственной невралгической амиотрофии.
| WO 2016136944 A1, 01.09.2016 | |||
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| и доп | |||
| - М.: Новая волна, 2012 | |||
| Приспособление для отсчитывания папирос в укладочных машинах | 1916 |
|
SU1216A1 |
| RU 2013150102 A, 20.05.2012 | |||
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЭКСТРАКТ ТРАВЯНОЙ КОМБИНАЦИИ, ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ЛЕЧЕНИЯ ДИАБЕТИЧЕСКОЙ ПЕРИФЕРИЧЕСКОЙ НЕЙРОПАТИИ | 2011 |
|
RU2566721C2 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИЧЕСКОГО И/ИЛИ ТЕРАПЕВТИЧЕСКОГО ЛЕЧЕНИЯ ПЕРИФЕРИЧЕСКОЙ НЕЙРОПАТИЧЕСКОЙ БОЛИ, ВЫЗЫВАЕМОЙ ПРОТИВОРАКОВЫМ СРЕДСТВОМ | 2013 |
|
RU2595857C2 |
Авторы
Даты
2022-04-15—Публикация
2018-03-30—Подача