Изобретение относится к области биотехнологии, конкретно к разработке технологий производства защитных иммунобиологических лекарственных препаратов, в частности, к разработке способа получения специфического средства экстренной профилактики и лечения инфекционных заболеваний, вызываемых патогенными для человека ортопоксвирусами.
Разработка специфического иммуноглобулина противооспенного из сыворотки крови лошадей жидкого проводилась в период с 1955 по 1965 гг.коллективом авторов под руководством А.Т. Кравченко и А.А. Воробьева. Разрабатываемый препарат предназначался для профилактики и лечения натуральной оспы у людей, а также лечения больных с осложнениями после прививок оспенной вакциной (за исключением детей с осложнениями после прививок оспенной вакциной). На иммуноглобулин противооспенный из сыворотки крови лошадей, полученный методом спиртового осаждения на холоду и методом электродекантации, были разработаны и в 1967 г. утверждены МЗ СССР МРТУ-42 №150-67 для производства препарата.
С прекращением вакцинации против оспы в 1980 г были свернуты работы по созданию новых терапевтических препаратов, вакцин и других средств специфической профилактики натуральной оспы. Прекращение вакцинации против оспы привело к практическому исчезновению популяционного иммунитета к натуральной оспе. В сложившейся ситуации вирус оспы рассматривается многими специалистами в качестве одного из основных поражающих агентов, которые могут быть использованы террористами [1-6]. Активизация терроризма, в частности биотерроризма, делает актуальной проблему защиты населения России от биологических агентов, особенно от натуральной оспы [7, 8]. Существование проблемы возобновления оспопрививания признано также специалистами ВОЗ, Франции, Германии, США и других стран [9, 10]. В ряде стран создаются запасы оспенных вакцин и разрабатываются противооспенные препараты.
В России отсутствуют безопасные средства биологической защиты от натуральной оспы, пригодные для применения в условиях практического отсутствия популяционного иммунитета. Прекращен выпуск метисазона и других химиотерапевтических противооспенных лекарств. Возможное возобновление накожного оспопрививания в современных условиях сопряжено с высоким риском развития большого числа поствакцинальных осложнений [11, 12].
Ранее было показано, что для лечения поствакцинальных осложнений может быть использован специфический донорский иммуноглобулин [13, 14].
В настоящее время серийный выпуск противооспенного гомологичного иммуноглобулина в РФ проблематичен из-за практического отсутствия людей-доноров, имеющих в крови высокий титр противооспенных вируснейтрализующих антител. Поэтому обоснованным является получение гетерологичного противооспенного иммуноглобулина из сыворотки крови лошадей, безопасного в отношении ВИЧ, вирусных гепатитов и прионных инфекций.
Известен способ получения, иммуноглобулина противооспенного из сыворотки крови лошадей жидкого, включающий приготовление антигена из вируса вакцины штаммов Б-51 и Л-ИВП, получение иммунной крови, получение иммунной сыворотки с использованием 30% раствора хлористого кальция, выделение и концентрирование иммуноглобулинов методом осаждения этиловым спиртом на холоду по Кону, стерилизующую фильтрацию. Данный способ является единственным аналогом (прототипом) предлагаемого изобретения.
Способ обеспечивает получение нетоксичного апирогенного стерильного специфического средства экстренной профилактики и лечения инфекционных заболеваний, вызываемых патогенными для человека ортопоксвирусами со специфической активностью, выражающейся титром вируснейтрализующих антител не ниже 1:4096, содержанием гамма-глобулиновой фракции не менее 80%, содержанием примесей посторонних белков не более 20% и остаточным количеством этилового спирта не более 4%.
К недостаткам существующего способа следует отнести то, что в получаемом конечном продукте содержится большое количество посторонних белков сыворотки крови (до 20% альбуминов, α - и β - глобулинов) и остаточного количества (до 4%) этилового спирта, повышающих реактогенность препарата. При анализе методом гельфильтрационной ВЭЖХ в препарате выявляют около 88% мономеров, 6% димеров, 3% полимеров и 3% агрегатов, что свидетельствует о низкой чистоте иммуноглобулиновой фракции. В результате препарат обладает анафилактогенностью, характеризующейся индексом анафилаксии по Вейглу 2,5±0,5.
Целью настоящего изобретения является разработка способа получения иммуноглобулина противооспенного, обеспечивающего получение конечного продукта с более высокой степенью очистки, что позволит значительно снизить анафилактогенность препарата.
Технический результат предлагаемого изобретения, заключается в том, что разработанный способ обеспечивает получение иммуноглобулина противооспенного из сыворотки крови лошадей с высоким содержанием мономерной фракции иммуноглобулина (не менее 95%) и низким содержанием посторонних фракций димеров, полимеров и агрегатов (не более 5%), а также отсутствием остаточного этилового спирта, что снижает анафилактогенность иммуноглобулина (индекс анафилаксии по Вейглу 1,5±0,5) и приводит качество препарата в соответствие с требованиями Европейской Фармакопеи к гетерологичным препаратам [15].
Указанный технический результат достигается за счет того, что предлагаемый способ получения противооспенного иммуноглобулина включает метод осаждения иммуноглобулина сульфатом аммония, а также дополнительные стадии хроматографической очистки и концентрирования, состоящие из трех этапов: гельфильтрационная хроматография на колонке с сорбентом Sephadex G-25 предварительно уравновешенную раствором 20 мМ Трис, со скоростью потока 100 мл/мин. После нанесения раствора разделение проводят в изократическом режиме элюирования, подавая раствор 20 мМ Трис при той же скорости потока; ионообменная хроматография на колонке с сорбентом Q Sepharose FF при температуре 20°С и линейной скорости подачи образца 150 см/ч с последующей градиентной элюцией от 0 до 100% раствором 20 мМ Трис 1 Μ NaCl (рН 8,0) с той же линейной скоростью в течение 80 минут; гельфильтрационная хроматографии на колонке с сорбентом Superdex 200 pg, уравновешенной фосфатно-глициновым буферным раствором (рН 6,9), при линейной скорости потока 50 см/ч в изократическом режиме элюирования при той же скорости; а также концентрированием раствора иммуноглобулина на автоматической системе фильтрации и концентрирования в тангенциальном потоке через кассеты с пределом эксклюзии 50 кДа при скорости потока 500 мл/мин, входном давлении не более 3 бар и выходном давлении не более 2 бар.
Сущность изобретения заключается в том, что в способе получения гетерологичного иммуноглобулина противооспенного выделение методом спиртового осаждения на холоду по Кону заменено на осаждение сульфатом аммония и включены дополнительные стадии очистки и концентрирования препарата с использованием методов ионообменной и гельфильтрационной хроматографии, а также концентрирования раствора иммуноглобулина в тангенциальном потоке через кассеты с пределом эксклюзии 50 кДа. Преимуществом выделения методом осаждения сульфатом аммония является высокая растворимость в нем альбумина и других более легких белков, отсутствие денатурирующего действия на белки, а также необходимости создания специального температурного режима и наличия высокотехнологичного оборудования. Для удаления соли аммония применяли метод гельфильтрационной хроматографии на сорбенте Sephadex G-25. Следующая стадия ионообменной хроматографии на сорбенте Q Sepharose FF позволяет выделить фракции IgG и удалить остатки альбумина, а также фракцию псевдоглобулинов, в которой содержатся α -, β - глобулины и минимальное количество специфических антител. На следующем этапе очистки с помощью гельфильтрационной хроматографии на сорбенте Superdex 200 pg отделяют высокомолекулярные фракции димеров и полимеров, низкомолекулярные фрагментарные фракции, которые снижают качество иммуноглобулинов.
Новизна изобретения заключается в том, что из технологий получения гетерологичных иммуноглобулинов из сыворотки крови лошадей не известно использование комбинации выделения методом осаждения сульфатом аммония и дополнительных операций безаффинной очистки и концентрирования препарата методом ионообменной и гельфильтрационной хроматографии для получения иммуноглобулина противооспенного.
Изобретательский уровень предложенного технического решения заключается в том, что из уровня техники явным образом не следует, что использование метода осаждения сульфатом аммония, дополнительных стадий очистки и концентрирования в технологии получения иммуноглобулина противооспенного с использованием методов ионообменной и гельфильтрационной хроматографии, а также концентрирования раствора иммуноглобулина в тангенциальном потоке через кассеты с пределом эксклюзии 50 кДа обеспечивает получение более безопасного препарата иммуноглобулина.
Промышленная применимость заключается в возможности использования для реализации заявленного способа получения специфического иммуноглобулина типового биотехнологического оборудования и доступных в микробиологической и фармацевтической промышленности РФ материалов.
Предложенное техническое решение может быть использовано для получения более качественного средства экстренной профилактики и лечения инфекционных заболеваний, вызываемых патогенными для человека ортопоксвирусами для нужд Вооруженных сил и населения Российской Федерации.
Пример выполнения
По разработанной технологии приготовлены экспериментально-производственные серии иммуноглобулина противооспенного из сыворотки крови лошадей.
Приготовление включало следующие стадии:
1. Приготовление антигена
Для приготовления антигенов использовали маточные культуры вируса вакцины (штаммы Б-51 и Л-ИВП), представляющие собой 1 мл стерильного лиофилизированного вируссодержащего гомогената ХАО КЭ со стабилизатором (5% пептона), с биологической активностью не менее 1⋅107 ООЕ/мл, хранящиеся под вакуумом в ампулах при температуре не выше минус 18°С.
Антигены для иммунизации животных-продуцентов готовили путем инфицирования трехсуточного монослоя клеток Vero (В) в роллерах из расчета - от 1 до 5 ООЕ на клетку. Зараженные клетки инкубировали в течение 48 часов при скорости вращения 0,125 об/мин в термостатированном помещении при температуре от 35,0 до 36,0°С.
Через двое суток роллер с содержимым помещали в холодильник и замораживали при температуре минус 20°С. Допускается хранение роллера при указанной температуре не более 6 месяцев.
Роллер с содержимым оттаивают, вращательными движениями смывают отслоившийся монослой клеток и повторно замораживают-оттаивают. Вирус-содержащую суспензию центрифугируют при 3500 об/мин в течение 20 минут. Надосадочную жидкость осторожно разливают во флаконы по 100 мл.
Содержимое каждого роллера контролируют на стерильность путем прямого посева в жидкую тиогликолевую среду. Биологическая активность каждого антигена должна составлять не менее 1⋅107 ООЕ/мл. Антигены сохраняют свою активность при температуре от минус 18 до минус 22°С в течение 6 месяцев.
2. Получение иммунной крови и сыворотки крови лошадей Иммунизацию лошадей проводили после выдерживания их в карантине в течение 45 суток в карантинном изолированном помещении. У отобранных на иммунизацию лошадей должна быть нормальная температура тела и общее хорошее состояние. При отсутствии противопоказаний лошадей переводят в производственное помещение для иммунизации, которое строят по принципу изолированных секций и такого же количества выгульных площадок для регулярного моциона животных.
Иммунизация животных проводится в виде циклов, состоящих из однократной инъекции антигена с последующими кровопусканиями:
- первый цикл - подкожное введение 20 мл суспензии вируса вакцины штамм Б-51 стерильным шприцем в область шеи;
- второй и последующие циклы - внутримышечное или подкожное введение суспензии вируса вакцины штамм Л-ИВП в объеме 80-100 мл в область шеи.
Интервал между циклами иммунизации должен быть не менее 1 месяца.
В процессе гипериммунизации у животных ежедневно измеряли температуру. При ее повышении выше нормы дальнейших манипуляций с животными не осуществляли до исчезновения данных симптомов. В процессе иммунизации у лошадей берут небольшие количества крови (объем пробы 20 мл) для наблюдения за динамикой нарастания вируснейтрализующих антител.
Основной объем крови забирают в несколько приемов на 14-35 сутки после последней иммунизации. Кровь берут стерильно из верхней трети яремной вены с помощью монтажа для взятия крови с 10% раствором лимоннокислого натрия из расчета 35 мл раствора на 1 л крови. При первом кровопускании количество забираемой крови составляет 1 л на каждые 50 кг массы животного, при втором - на 30% меньше объема крови, взятой при первом кровопускании.
Иммунную сыворотку получали путем дефибринирования плазмы крови 30% раствором хлористого кальция (1,8 мл раствора на 1 л плазмы) путем энергичного встряхивания в течение 15-30 минут. Дефибринированную плазму оставляли на срок от 18 до 24 часов при комнатной температуре. По истечении указанного срока фибриновые нити и комочки собирались в верхнем, а сыворотка - в нижнем слое жидкости; на дне бутыли оседало небольшое количество эритроцитов. Сыворотку отбирают в стерильные стеклянные бутыли путем декантирования и помещают на хранение при температуре 4°С.
Для фракционирования использовали стерильные свежие сыворотки. Выделение и концентрацию иммуноглобулинов проводили только по окончании контролей специфической активности крови после основного кровопускания.
3. Выделение иммуноглобулина G методом осаждения сульфатом аммония
С целью освобождения от осадка белка, возникающего при хранении, иммунную сыворотку крови лошадей фильтруют через фильтр Sartoplus Р20, подавая раствор белка с помощью перистальтического насоса со скоростью потока не более 100 мл/мин. Объем сыворотки не должен быть менее 500 мл.
Исходную лошадиную сыворотку разбавляли в два раза раствором 20 мМ Трис, рН 8,0. К полученному раствору при постоянном перемешивании по каплям добавляли насыщенный (4,32 М) раствор сульфата аммония в течение 360 минут и до достижения 50% насыщения раствора белка. В этом случае высокомолекулярные фракции иммуноглобулинов выпадают в осадок, а альбумин и другие, более легкие белки остаются в растворе. Осаждение иммуноглобулина проводят центрифугированием при скорости вращения ротора 10000g в течение 20 минут. Полученный осадок растворяли в раствором 20 мМ Трис.
Анализ серий иммуноглобулина противооспенного, выделенного методом осаждения сульфатом аммония, методом высокоэффективной жидкостной хроматографии (ВЭЖХ) показал, что содержание фракции иммуноглобулинов G - не менее 80% и примесей - не более 20%.
4. Хроматографическая очистка иммуноглобулина на сорбенте Sephadex G-25
Полученный после осаждения раствор иммуноглобулинов содержал большое остаточное количество сульфата аммония для удаления, которого применили метод гельфильтрационной хроматографии.
Раствор иммуноглобулина со стадии осаждения подавали на колонку с сорбентом Sephadex G-25 предварительно уравновешенную раствором 20 мМ Трис, со скоростью потока 100 мл/мин. После нанесения раствора разделение проводили в изократическом режиме элюирования, подавая раствор 20 мМ Трис при той же скорости потока. Фракции собирали в полипропиленовые центрифужные пробирки с началом выхода хроматографического пика и до его схода. Для дальнейшей очистки концентрацию общего белка доводили до 1-1,5 мг/мл. Для этого к раствору после стадии гельфильтрации на сорбенте Sephadex G-25 добавляли необходимое количество раствора 20 мМ Трис.
5. Хроматографическая очистка иммуноглобулина на сорбенте О Sepharose FF
Ионообменную хроматографию раствора иммуноглобулинов на колонке с Q-Sepharose FF проводили при температуре 20°С. Для этого рабочий раствор белка с помощью насоса подачи образца перекачивали со скоростью 100 мл/мин на хроматографическую колонку. После нанесения раствора сорбент промывали раствором 20 мМ Трис со скоростью 100 мл/мин. Иммуноглобулин элюировали с колонки раствором 20 мМ Трис 1 Μ NaCl, в условиях градиентной элюции от 0 до 100%. Фракции целевого продукта собирали в бутыли.
6. Концентрирование рабочего раствора иммуноглобулина
Концентрирование раствора иммуноглобулина после стадии ионообменной хроматографии проводили на лабораторной установке для тангенциальной фильтрации.
В держатель кассет помещали две кассеты Sartocon Slice 200 с пределом эксклюзии 50 кДа, затягивали крышку при помощи динамометрического ключа с усилием 18 Нм. Устанавливали такое значение скорости потока, чтобы значения входного и выходного давления составляли 3 Бар и 2 Бар соответственно. Заливали в рабочую емкость 400 мл очищенной воды, открывали линию фильтрата и пермеата и запускали процесс промывки кассет от консерванта этилового спирта, трубки фильтрата и пермеата помещали в пустую емкость. Процедуру повторяли дважды. Одновременно визуально оценивали держатель на предмет герметичности. Далее подсоединяли трубку фильтрата к рабочей емкости, заливали 400 мл раствора 20 мМ Трис и запускали процедуру промывания кассет рабочим буферным раствором. Через 10 минут поток останавливали, прибор был готов к работе.
В рабочую емкость прибора добавляли раствор иммуноглобулина, линию пермеата для сбора фракций ниже 50 кДа помещали в емкость для слива. Запускали поток, контролируя показатели входного, выходного давления, они не должны превышать 3 Бар и 2 Бар - соответственно. При достижении объема концентрата 40 мл через линию подачи образца подавали 20 мл раствор 20 мМ Трис для промывки линии. Собирали сконцентрированный продукт, открыв сливной кран рабочей емкости прибора. Санитизацию прибора проводили 0,5 Μ раствором гидроксида натрия в течение 30 мин по методике, аналогичной промывке от консерванта.
7. Гельфильтрация иммуноглобулина на сорбенте Superdex 200 prep grade
Раствор иммуноглобулина со стадии концентрирования подавали на колонку с сорбентом Superdex 200 pg, предварительно уравновешенную фосфатно-глициновым буферным раствором, со скоростью потока 13 мл/мин. После нанесения раствора разделение проводили в изократическом режиме элюирования, подавая фосфатно-глициновый буферный раствор при той же скорости потока. Фракции по 8 мл собирали в пробирки для сбора фракций с началом выхода хроматографического пика и до схода пика. Фракции, содержащие мономеры иммуноглобулина объединяли, концентрация белка составила 30 мг/мл. Процедуру осаждения, концентрирования и очистки иммуноглобулина проводили не менее трех раз.
8. Стерилизующая фильтрация
Раствор иммуноглобулина стерилизовали в боксирующем устройстве с соблюдением правил асептики. Полученный 3,0% раствор иммуноглобулина стерилизовали в одноразовой системе вакуумной фильтрации с мембранным фильтром с диаметром пор 0,22 мкм.
После стерилизующей фильтрации отбирали пробу иммуноглобулина объемом 35 мл для контроля подлинности, специфической активности, стерильности, содержания белка, молекулярных параметров, величины рН, прозрачности и цветности.
9. Фасовка серии иммуноглобулина во флаконы
Операцию по фасовке препаратов во флаконы проводили в боксе. Иммуноглобулин разливали вручную при помощи диспенсера с соблюдением правил асептики.
На первом этапе фасовали препарат для внутрикожных проб по 8,45 мл, во вторую очередь - основной препарат иммуноглобулина - по 6,35 мл во флаконы вместимостью 10,0 мл.
В процессе розлива флаконов из серии основного препарата и препарата для внутрикожной пробы отбирали по 2 флакона для анализа (по 1 флакону каждого препарата в начале и конце розлива) для контроля на номинальный объем.
Флаконы укупоривали с помощью специального устройства для ручной укупорки алюминиевыми колпачками.
По завершении розлива проводили контроль обоих препаратов на стерильность. Для этого объединяли содержимое 5 флаконов с иммуноглобулином и 5 флаконов с иммуноглобулином для внутрикожных проб.
В таблице 1 представлены характеристики полученных серий препарата.
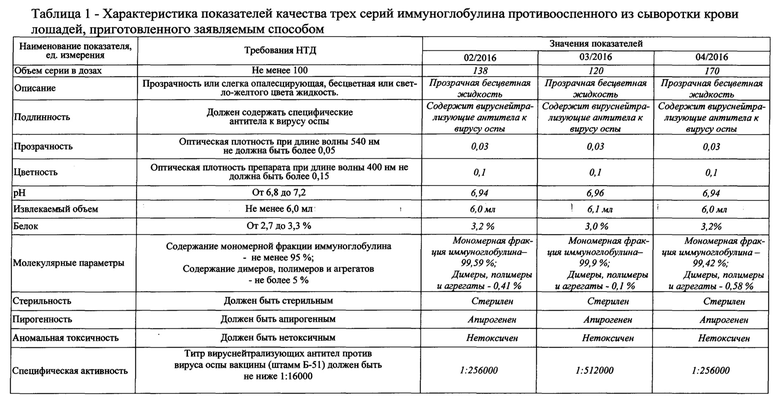
Сравнительные характеристики препаратов иммуноглобулина противооспенного, полученного предлагаемым способом по сравнению с прототипом представлены в таблице 2.

Выводы. Предлагаемый способ позволяет получить экспериментально-производственные серии нетоксичного, апирогенного, стерильного средства профилактики и лечения инфекционных заболеваний, вызываемых патогенными для человека ортопоксвирусами, содержащего большее по сравнению с аналогом количество активной мономерной фракции Ig G, меньшее количество димеров, полимеров и агрегатов, не содержащего этиловый спирт. Препарат обладает защитной эффективностью и меньшей анафилактогенностью, что снижает риск развития анафилактических реакций при введении людям.
Библиографические данные
1. Воробьев А.А. Оценка вероятности использования биоагентов в качестве биологического оружия // Эпидемиология и инфекционные болезни. - 2001. - №6. - С. 54-56.
2. Проблемы биотерроризма в современных условиях /А.А. Воробьев, Б.В. Боев, В.М. Бондаренко, А.Л. Гинцбург // Журн. микробиол. - 2002. - №3. - С. 3-12.
3. Онищенко Г.Г. Особенности организации профилактики управляемых инфекций //Эпидемиология и инфекционные болезни. - 2003. - №4. - С. 4-7.
4. Smallpox as a biological weapon: medical and public health response / D.A. Henderson, T.V. Inglesby, J.G. Bartlett et. al. //JAMA - 1999. - Vol.281. - P. 2127-2137.
5. Modeling potential responses to smallpox as a bioterrorist weapon / M.I. Meltzer, I.W. Leduc, J.D. Millor //Emerg. Infect. Dis. - 2001. - Vol. 7. - P. 959-969.
6. Flow cytometry and T-cell. Response monitoring after smallpox vaccination /F. Poccia, Cr. Giola, C. Montesano et. al. //Emerg. Infect. Dis. - 2003. - Vol.9, №11. - P. 1468-1470.
7. Биотерроризм как национальная и глобальная угроза / Г.Г. Онищенко, Л.С. Сандахчиев, С. В. Щелкунов // Журн. микробиол. - 2000. - №6. - С. 83-85.
8. Инфекционные болезни в конце XX века и санитарно-эпидемиологическое благополучие в России в XXI веке / В.И. Покровский, Г.Г. Онищенко, Б.Л. Черкасский // Журн. микробиол. - 2002. - №3. - С. 16-23.
9. Henderson D.A. Smallpox: clinical and epidemiological features //Emerg. Infect. Dis. - 1999. - Vol. 5, №4. - P. 537-539.
10. Tara'O Toole. Smallpox: an attack scenario // Emerg. Infect. Dis. - 1999. - Vol. 5, №4. - P. 540-546.
11. Непарентеральные методы иммунизации против оспы /А.А. Воробьев, B. Н. Подкуйко, В.В. Михайлов, А.А. Махлай //Журн. микробиол. - 1996. - №5. - C. 117-121.
12. Meltzer M.I. Risks and benefits of preexposure and postexposure smallpox vaccination//Emerg. Infect. Dis. - 2003. - Vol. 9, №11. - 1363-1370.
13. Маренникова C.C., Маневич Г.Р., Свет-Молдавская И.А. Об эффективности γ-глобулина с повышенным содержанием противооспенных антител при лечении поствакцинальных энцефалитов // Вопр. Вирусол. - 1968. - №1. - С. 9-13.
14. Бондарев В.Н., Войтинский Е.Я. Профилактика и лечение поствакцинальных осложнений у детей. - Л.: Медицина, 1972.
15. Европейская Фармакопея 7.0. Том 1, 2010: 1273 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНА ПРОТИВ ЛИХОРАДКИ ЭБОЛА ИЗ СЫВОРОТКИ КРОВИ ЛОШАДЕЙ, ЖИДКОГО | 2017 |
|
RU2673546C1 |
| Способ получения очищенного гетерологического иммуноглобулина против лихорадки Эбола | 2023 |
|
RU2815252C1 |
| ПРЕПАРАТ, СОДЕРЖАЩИЙ ИММУНОГЛОБУЛИН ПРОТИВООСПЕННЫЙ ИЗ СЫВОРОТКИ КРОВИ ЛОШАДЕЙ, РАСТВОР ДЛЯ ВНУТРИМЫШЕЧНОГО ВВЕДЕНИЯ | 2007 |
|
RU2342951C1 |
| Способ получения гомологического иммуноглобулина против COVID-19 | 2022 |
|
RU2792819C1 |
| Живая аттенуированная культуральная вакцина для профилактики натуральной оспы и других ортопоксвирусных инфекций на основе вируса осповакцины и способы ее получения и применения | 2022 |
|
RU2781070C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМБИНИРОВАННОЙ БИВАЛЕНТНОЙ, КУЛЬТУРАЛЬНОЙ, ИНАКТИВИРОВАННОЙ, КОНЦЕНТРИРОВАННОЙ, ОЧИЩЕННОЙ ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКИ С ПОЧЕЧНЫМ СИНДРОМОМ | 2009 |
|
RU2445117C2 |
| СПОСОБ ОЧИСТКИ АЛЬФА-ФЕТОПРОТЕИНА ЧЕЛОВЕКА | 1994 |
|
RU2074193C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА АЛЬФА-ФЕТОПРОТЕИНА | 1998 |
|
RU2123009C1 |
| СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ ТРОФОБЛАСТИЧЕСКОГО БЕТА-1-ГЛИКОПРОТЕИНА | 2007 |
|
RU2325171C1 |
| Способ хроматографического выделения и очистки иммуноглобулинов | 2018 |
|
RU2694620C1 |
Изобретение относится к области биотехнологии, а именно к способу получения иммуноглобулина противооспенного из сыворотки крови лошадей. Способ получения иммуноглобулина противооспенного из сыворотки крови лошадей включает приготовление антигена из вируса вакцины штаммов Б-51 и Л-ИВП, получение иммунной сыворотки с использованием хлористого кальция, выделение иммуноглобулина методом осаждения сульфатом аммония, очистку в три этапа, концентрирование, стерилизующую фильтрацию, фасовку и упаковку при определенных условиях. Вышеописанный способ обеспечивает получение иммуноглобулина противооспенного из сыворотки крови лошадей с высоким содержанием мономерной фракции иммуноглобулина, не менее 95%, и низким содержанием посторонних фракций димеров, полимеров и агрегатов, не более 5%, а также отсутствием остаточного этилового спирта, что снижает анафилактогенность иммуноглобулина и приводит качество препарата в соответствие с требованиями Европейской Фармакопеи к гетерологичным препаратам. 2 табл., 1 пр.
Способ получения иммуноглобулина противооспенного из сыворотки крови лошадей, включающий стадии приготовления антигена из вируса вакцины штаммов Б-51 c активность не менее 1⋅107 ООЕ/мл и Л-ИВП c активность не менее 1⋅107 ООЕ/мл, получения иммунной сыворотки с использованием 30% раствора хлористого кальция, выделения иммуноглобулина, очистку и концентрирование, стерилизующую фильтрацию, фасовку и упаковку, отличающийся тем, что выделение иммуноглобулина противооспенного из сыворотки крови лошадей проводят методом осаждения путем добавления сульфата аммония, очистка иммуноглобулина проводится в три этапа, для первого этапа очистки применяют гельфильтрационную хроматографию на колонке с сорбентом Sephadex G-25, предварительно уравновешенной раствором 20 мМ Трис, со скоростью потока 100 мл/мин, в изократическом режиме элюирования, подавая раствор 20 мМ Трис при той же скорости потока, для второго этапа очистки иммуноглобулина применяется ионообменная хроматография на колонке с сорбентом Q Sepharose FF при температуре 20°С и линейной скорости подачи образца 150 см/ч с последующей градиентной элюцией фракции Ig G от 0 до 100% 20 мМ Трис 1 Μ NaCl с рН 8,0 при той же скорости, для третьего этапа очистки применяется гельфильтрационная хроматография на колонке с сорбентом Superdex 200 pg, уравновешенной фосфатно-глициновым буферным раствором 0,02 Μ фосфат натрия с 2% глицина, рН 6,9 при линейной скорости потока 50 см/ч в изократическом режиме элюирования при той же скорости потока, а для концентрирования раствора иммуноглобулина противооспенного используют автоматическую систему тангенциальной фильтрации с кассетами с пределом эксклюзии 50 кДа при скорости потока 500 мл/мин, входном давлении не более 3 бар и выходном давлении не более 2 бар.
| ПРЕПАРАТ, СОДЕРЖАЩИЙ ИММУНОГЛОБУЛИН ПРОТИВООСПЕННЫЙ ИЗ СЫВОРОТКИ КРОВИ ЛОШАДЕЙ, РАСТВОР ДЛЯ ВНУТРИМЫШЕЧНОГО ВВЕДЕНИЯ | 2007 |
|
RU2342951C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЛОБУЛИНА ПРОТИВ ЛИХОРАДКИ ЭБОЛА ИЗ СЫВОРОТКИ КРОВИ ЛОШАДЕЙ, ЖИДКОГО | 2017 |
|
RU2673546C1 |
| Железнодорожный вагон-платформа | 1929 |
|
SU19653A1 |
Авторы
Даты
2022-04-18—Публикация
2020-06-15—Подача