ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет по предварительной заявке на патент США № 62/437340, поданной 21 декабря 2016 г., содержание которой включено в данный документ посредством ссылки во всей своей полноте.
ВКЛЮЧЕНИЕ ПЕРЕЧНЯ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ПОСРЕДСТВОМ ССЫЛКИ
Перечень последовательностей, представленный в файле под названием NB40835WOPCT_SequenceListing_ST.txt" размером 23 Kб, созданном 14 декабря 2016 г. и поданном вместе с данным документом, включен в данный документ посредством ссылки во всей своей полноте.
ОБЛАСТЬ ТЕХНИКИ
Область техники относится к способам применения термостабильных сериновых протеаз.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Протеазы (также называемые пептидазами или протеиназами) представляют собой ферменты, способные к расщеплению пептидных связей. Протеазы не раз эволюционировали, и различные классы протеаз могут осуществлять одну и ту же реакцию за счет абсолютно разных каталитических механизмов. Протеазы могут быть обнаружены у животных, растений, грибов, бактерий, архей и вирусов.
Протеолиз может обеспечиваться с помощью ферментов, которые в настоящее время разделены на шесть крупных групп: аспартильные протеазы, цистеиновые протеазы, сериновые протеазы, треониновые протеазы, глутаминовые протеазы и металлопротеазы.
Сериновые протеазы представляют собой подгруппу карбонилгидролаз, включающую в себя класс разнообразных ферментов, обладающих широким спектром специфичности и биологических функций. Несмотря на это функциональное разнообразие, к каталитическому механизму сериновых протеаз приблизились по меньшей мере два генетически различных семейства ферментов: 1) субтилизины и 2) сериновые протеазы, связанные с химотрипсином (например, трипсин).
Эти два семейства сериновых протеаз или сериновых эндопептидаз обладают очень сходными каталитическими механизмами. Третичную структуру ферментов из этих двух семейств объединяет консервативная каталитическая триада аминокислот, состоящая из серина, гистидина и аспартата.
Было проведено множество исследований в отношении сериновых протеаз, в основном ввиду их пригодности в путях промышленного применения. Дополнительные исследования были сосредоточены в отношении неблагоприятных условий окружающей среды (например, воздействие окислителей, хелатообразующих средств, экстремальных температур и/или pH), которые могут неблагоприятно влиять на функциональность данных ферментов в различных путях применения.
Таким образом, существует неудовлетворенная потребность в разработке путей применения, при котором протеазы можно использовать в неблагоприятных условиях с сохранением или улучшением активности.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном варианте осуществления раскрыт способ получения термостабильной сериновой протеазы, предусматривающий:
(а) трансформацию продуцирующего хозяина с помощью рекомбинантной конструкции, кодирующей термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80% идентичностью последовательности с SEQ ID NO: 3, 8 или 10; и
(b) культивирование продуцирующего хозяина из стадии (а) при температуре выше 37,5°С c повышением уровня экспрессии термостабильной сериновой протеазы.
Во втором варианте осуществления термостабильную сериновую протеазу можно необязательно извлекать из продуцирующего хозяина.
В третьем варианте осуществления культуральный супернатант, содержащий термостабильную сериновую протеазу, получают с помощью любого из описанных в данном документе способов.
В четвертом варианте осуществления предусмотрены корм, кормовой продукт, композиция, представляющая собой кормовую добавку, премикс, пищевой или зерновой продукт, содержащие термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80% идентичностью последовательности с SEQ ID NO:3, 8 или 10, где указанную термостабильную сериновую протеазу можно применять отдельно или в комбинации с по меньшей мере одним пробиотиком.
В пятом варианте осуществления предусмотрен корм для животных, содержащий термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80% идентичностью последовательности с SEQ ID NO: 3, 8 или 10, где термостабильная сериновая протеаза присутствует в количестве 1-20 г/тонна корма, и дополнительно при этом указанную термостабильную сериновую протеазу можно применять отдельно или в комбинации с по меньшей мере одним пробиотиком.
В шестом варианте осуществления раскрыта композиция, представляющая собой кормовую добавку, описанная в данном документе, дополнительно содержащая по меньшей мере один компонент, выбранный из группы, состоящей из белка, пептида, сахарозы, лактозы, сорбита, глицерина, пропиленгликоля, хлорида натрия, сульфата натрия, ацетата натрия, цитрата натрия, формиата натрия, сорбата натрия, хлорида калия, сульфата калия, ацетата калия, цитрата калия, формиата калия, ацетата калия, сорбата калия, хлорида магния, сульфата магния, ацетата магния, цитрата магния, формиата магния, сорбата магния, метабисульфита натрия, метилпарабена и пропилпарабена.
В седьмом варианте осуществления раскрыта гранулированная композиция, представляющая собой кормовую добавку, для применения в корме для животных, содержащая термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80% идентичностью последовательности с SEQ ID NO: 3, 8 или 10, которую применяют отдельно или в комбинации с по меньшей мере одним пробиотиком, где гранулированная композиция, представляющая собой кормовую добавку, содержит частицы, полученные с помощью способа, выбранного из группы, состоящей из гранулирования с высоким усилием сдвига, барабанного гранулирования, экструзии, сферонизации, агломерации в псевдоожиженном слое, нанесения покрытия распылением в псевдоожиженном слое, распылительной сушки, лиофилизации, приллирования, охлаждения распылением, пульверизации с помощью вращающегося диска, коацервации, таблетирования или любой комбинации вышеуказанных способов.
В восьмом варианте осуществления раскрыта гранулированная композиция, представляющая собой кормовую добавку по пункту 7, где средний диаметр частиц составляет более 50 микрон и менее 2000 микрон. Кроме того, данная заявленная гранулированная композиция, представляющая собой кормовую добавку, может быть в жидкой форме. Более того, данная жидкая форма может быть подходящей для распылительной сушки на грануле корма.
В девятом варианте осуществления раскрыт способ гидролиза крахмалсодержащего материала, предусматривающий:
(а) приведение крахмалсодержащего материала в контакт с жидкостью с образованием затора и
(b) осуществление гидролиза крахмала в заторе с образованием разжиженной фракции путем приведения затора в контакт со смесью ферментов, содержащей термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80% идентичностью последовательности с SEQ ID NO: 3, 8 или 10. Кроме того, смесь ферментов может дополнительно содержать по меньшей мере один фермент, выбранный из группы, состоящей из альфа-амилазы, амилоглюкозидазы, фитазы, пуллуланазы, бета-глюканазы, целлюлазы и ксиланазы.
В десятом варианте осуществления раскрыт способ получения продуктов ферментации из крахмалсодержащего материала, предусматривающий:
(а) разжижение крахмалсодержащего материала с помощью смеси ферментов, содержащей термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80% идентичностью последовательности с SEQ ID NO: 3, 8 или 10;
(b) осахаривание продукта из стадии (а);
(c) ферментацию с помощью подходящего организма и
(d) необязательно извлечение продукта, полученного на стадии (с).
Стадии (b) и (c) можно выполнять последовательно или можно выполнять одновременно.
В случае одновременного выполнения стадий (b) и (c) добавление источника азота (такого как без ограничения мочевина или аммиак) либо исключают, либо уменьшают на по меньшей мере 30%, 40%, 50%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% с помощью применения 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15,16, 17, 18, 19, или 20 г термостабильной сериновой протеазы/метрическая тонна (MT) крахмалсодержащего материала, где применяют указанную термостабильную сериновую протеазу, которая характеризуется по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO:3, 8 или 10.
В случае выполнения стадий (b) и (c) одновременно добавление источника азота (такого как без ограничения мочевина) либо исключают (100% уменьшения), либо уменьшают на по меньшей мере 30%, 40%, 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% с помощью применения по меньшей мере 3, 4, 5 или 6 г термостабильной сериновой протеазы/MT сухого твердого материала, где применяют указанную термостабильную сериновую протеазу, которая характеризуется по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10.
В случае одновременного выполнения стадий (b) и (c) добавление источника азота, такого как без ограничения мочевина, либо исключают (100% уменьшения), либо уменьшают на по меньшей мере 30%, 40%, 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% с помощью применения по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15,16, 17, 18, 19, или 20 г термостабильной сериновой протеазы/MT крахмалсодержащего материала где указанная термостабильная сериновая протеаза характеризуется по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO:3, 8 или 10 и, кроме того, в случае если продукт ферментации представляет собой этанол, на стадии (с) применение кислого протеолитического фермента не требуется.
В одиннадцатом варианте осуществления предусмотрен способ снижения вязкости разжиженного крахмалсодержащего материала который включает приведение взвеси крахмалсодержащего материала в контакт с термостабильной сериновой протеазой, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO:3, 8 или 10. Приведение термостабильной сериновой протеазы, описанной в данном документе, в контакт со взвесью может осуществляться в комбинации с другими ферментами или со взвесью, содержащей ферменты, отличные от термостабильной сериновой протеазы, описанной в данном документе.
В двенадцатом варианте осуществления предусмотрен способ экстрагирования масла из масличной культуры, включающий:
(a) приведение маслосодержащей фракции масличного семени в контакт с водным экстрагирующим средством с образованием экстрагированной фракции масличного семени и
(b) разделение экстрагированной фракции масличного семени на водную фазу, эмульсию масло-в-воде и нерастворимую фазу;
(c) приведение эмульсии масло-в-воде в контакт с по меньшей мере термостабильной сериновой протеазой, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO:3, 8 или 10, либо отдельно, либо в комбинации с фосфолипазой в условиях, обеспечивающих активность фермента в течение периода времени, достаточного для дестабилизации эмульсии; и
(d) разделение дестабилизированной эмульсии из стадии (с) на водную фазу, масляную фазу и нерастворимую фазу с получением масла из масличного семени.
Кроме того, фракцию масличного семени можно получать из сои, семени кукурузы, семени рапса, пальмового ядра, семени подсолнечника, семени сафлора, кокоса, арахиса, семени хлопчатника, семени кунжута, льняного семени, семени мака, миндаля, фундука, грецкого ореха, семени примулы вечерней, виноградной косточки, семени конопли, семени черной смородины, семени красной малины, семени моркови, семени тмина, семени черники, семени клюквы, семени петрушки, семени лука, семени тыквы, абрикосовой косточки, семени горчицы, семени льна, семени льна или семени клещевины.
Более того, фракция масличного семени может содержать белковую фракцию, которая применима как пищевой продукт, пищевой ингредиент, пищевая добавка или биологичеки активная пищевая добавка.
В тринадцатом варианте осуществления раскрыты корм, кормовой продукт, композиция, представляющая собой кормовую добавку, премикс, пищевой или зерновой продукт, содержащие масло, полученное с помощью способа, описанного в настоящем документе.
В четырнадцатом варианте осуществления раскрыт способ получения сусла, предусматривающий:
a) приведение содержащего крахмал материала, который содержит смесь измельченного зерна, в контакт с водой и термостабильной сериновой протеазой, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10, с образованием затора;
b) медленное нагревание затора из стадии (а) с превращением крахмала в сахара и
c) разделение нагретого затора из стадии (b) на остаточное зерно и жидкое сусло,
где термостабильная протеаза присутствует в количестве 1-30 г/тонна измельченного зерна.
Кроме того, на стадии (а) наряду с термостабильной сериновой протеазой можно добавлять альфа-амилазу.
В пятнадцатом варианте осуществления раскрыт способ гидролиза по меньшей мере одного пищевого побочного продукта или побочного продукта животного происхождения, предусматривающий:
(a) приведение пищевого побочного продукта или побочного продукта животного происхождения в контакт с жидкостью и
(b) осуществление гидролиза пищевого побочного продукта или побочного продукта животного происхождения с образованием разжиженной фракции путем приведения в контакт со смесью ферментов, содержащей термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80% идентичностью последовательности с SEQ ID NO:3, 8 или 10.
Кроме того, пищевой побочный продукт представляет собой богатый кератином материал, выбранный из группы, состоящей из перьев, волос и шерсти.
В шестнадцатом варианте осуществления раскрыт способ гидролиза белков в лигноцеллюлозной биомассе, предусматривающий:
(a) приведение биомассы в контакт с жидкостью и
(b) осуществление гидролиза белков в биомассе путем приведения биомассы в контакт со смесью ферментов, содержащей термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO:3, 8 или 10.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ И ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Фигура 1. Физическая карта плазмиды pHYT-Tce01961 для экспрессии протеазы ME-3 в Bacillus subtilis.
Фигура 2. Эффект дозы при гидролизе белка кукурузно-соевого корма при обработке протеазой ME-3 в присутствии пепсина и панкреатина.
Фигура 3. Термостабильность протеазы ME-3, инкубированной при рН 10.
Фигура 4. Влияние рН в отношении ферментативной активности протеазы ME-3 при оценке в диапазоне рН от 3,75 до 7,5.
Фигура 5. Протеаза ME-3 без какого-либо покрытия сохраняла более 70% активности после гранулирования при 90-100°C в течение 60 секунд по сравнению с затором.
Фигура 6. График кумулятивного давления, полученный в результате одновременного осахаривания и ферментации, осуществленных в системе Ankom. Светло-серая линия обозначает состояние при отсутствии FERMGEN™ 2,5x, 240 ppm мочевины, без добавления ME-3; серая со средним оттенком линия представляет состояние 0,178 SAPU/г DS FERMGEN™, 600 ppm мочевины, без добавления ME-3; и черная линия означает состояние при отсутствии FERMGEN™ 2,5x, 240 ppm мочевины плюс протеаза ME-3.
Фигура 7. Содержание FAN (мг/л) в сусле после высокотемпературного затирания с протеазой ME-3 с применением смеси из 50% солода и 50% кукурузы в одном сосуде.
Фигура 8. Множественное выравнивание аминокислотных последовательностей зрелых цепей WP_017594871 с протеазами Thermobifida: ME-3, Tfpa и Thpa, и M. thermotolerans_WP_078763344, A. marina_WP_091675221, A. hymeniacidonis_WP_069846166, N. trehalosi_WP_067965505 и Saccharothrix sp._WP_033441214
Следующие последовательности соответствуют §§ 1.821-1.825 37 C.F.R. ("Требования для патентных заявок, содержащих раскрытия нуклеотидных последовательностей и/или аминокислотных последовательностей - Правила для последовательностей") и согласуются со Стандартом ST.25 (2009) Всемирной организации интеллектуальной собственности (WIPO) и требованиями для перечня последовательностей Европейской патентной конвенции (EPC) и Правилами 5.2 и 49.5 (a-bis) Договора о патентной кооперации (РСТ) и разделом 208 и приложением С Административной инструкции. Символы и формат, применяемые для данных относительно нуклеотидных и аминокислотных последовательностей, соответствуют правилам, изложенным в § 1.822 раздела 37 C.F.R.
SEQ ID NO:1 представляет нуклеотидную последовательность Tce01961n, кодирующую протеазу ME-3.
SEQ ID NO: 2 представляет аминокислотную последовательность препрофермента ME-3, кодируемого Tce01961..
SEQ ID NO: 3 представляет аминокислотную последовательность полностью процессированного зрелого фермента ME-3 (186 аминокислот).
SEQ ID NO:4 представляет последовательность модифицированной последовательности сигнального пептида aprE, слитой с кодон-оптимизированной последовательностью ДНК, кодирующей последовательность, являющуюся предшественником зрелой последовательности протеазы ME-3.
SEQ ID NO:5 представляет терминаторную последовательность, добавленную после гена устойчивости к тетрациклину, с применением участков BstEII и EcoRI для получения вектора pHYT, выделенного из pHY300PLK (Takara Bio Inc.).
SEQ ID NO:6 представляет последовательность линкера, клонированную в участки BamHI и HindIII pHY300PLK.
SEQ ID NO:7 представляет аминокислотную последовательность препрофермента Tfpa Thermobifida fusca.
SEQ ID NO: 8 представляет аминокислотную последовательность полностью процессированного зрелого фермента Tfpa (186 аминокислот).
SEQ ID NO:9 представляет аминокислотную последовательность пептидазы S1, Thpa, Thermobifida halotolerans WP_068687914.
SEQ ID NO:10 представляет аминокислотную последовательность предполагаемого полностью процессированного зрелого фермента пептидазы S1, или Thpa, Thermobifida halotolerans WP_068687914 (186 аминокислот).
SEQ ID NO: 11 представляет аминокислотную последовательность Nocardiopsis potens WP_017594871.
SEQ ID NO: 12 представляет аминокислотную последовательность предполагаемого полностью процессированного зрелого фермента, сериновой протеазы Nocardiopsis potens WP_017594871 (185 аминокислот).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Все цитируемые патенты, заявки на патенты и публикации включены в данный документ посредством ссылки во всей своей полноте.
В данном изобретении применяется ряд терминов и сокращений. Если четко не указано иное, то применяются следующие определения.
Подразумевается, что формы единственного числа элемента или компонента являются неограничивающими в отношении числа примеров (т. е. случаев) элемента или компонента. Поэтому формы единственного числа следует понимать как включающие одно или по меньшей мере одно, а форма единственного числа для обозначения элемента или компонента также включает множественное число, за исключением случаев, когда явно подразумевается единственное число.
Термин "включающий" означает наличие установленных признаков, целых чисел, стадий или компонентов, которые изложены в формуле изобретения, но так, чтобы он не исключал наличие или добавление одного или нескольких признаков, целых чисел, стадий, компонентов или групп из них. Термин "включающий" подразумевают как включающий варианты осуществления, охватываемые терминами "по сути состоящий из" и "состоящий из". Подобным образом, термин "по сути состоящий из" подразумевают как включающий варианты осуществления, охватываемые термином "состоящий из".
Все диапазоны, при наличии таковых, являются включающими и комбинируемыми. Например, при упоминании диапазона "от 1 до 5" упомянутый диапазон следует рассматривать как включающий диапазоны "от 1 до 4", "от 1 до 3", "1-2", "1-2 и 4-5", "1-3 и 5" и т. п.
Используемый в данном документе в отношении числового значения термин "приблизительно" относится к диапазону +/- 0,5 от числового значения, если указанный термин иным образом конкретно не определен в контексте. Например, фраза "значение pH, составляющее приблизительно 6" относится к значениям pH от 5,5 до 6,5, если конкретно не определено иное значение pH.
Подразумевается, что каждая максимальная числовая граница, раскрываемая в настоящем описании, включает каждую нижнюю числовую границу, как если бы такие нижние числовые границы были бы явно приведены в данном документе. Каждая минимальная числовая граница, раскрываемая в настоящем описании, будет включать каждую верхнюю числовую границу, как если бы такие верхние числовые границы были бы явно приведены в данном документе. Каждый числовой диапазон, приведенный в настоящем описании, будет включать каждый более узкий числовой диапазон, который находится в пределах такого более широкого числового диапазона, как если бы такие более узкие числовые диапазоны были явно приведены в данном документе.
Термин "протеаза" означает домен белка или полипептида, полученного из микроорганизма, например, гриба, бактерии, или из растения или животного, и который характеризуется способностью катализировать расщепление пептидных связей в одном или нескольких различных положениях остова белка (например E.C. 3.4). Термины "протеаза", "пептидаза" и "протеиназа" могут использоваться взаимозаменяемо. Протеазы могут быть обнаружены у животных, растений, грибов, бактерий, архей и вирусов. Протеолиз может обеспечиваться с помощью ферментов, которые в настоящее время разделены на шесть крупных групп: аспартильные протеазы, цистеиновые протеазы, сериновые протеазы, треониновые протеазы, глутаминовые протеазы и металлопротеазы.
Термин "термостабильная сериновая протеаза" означает сериновую протеазу, которая является стабильной при нагревании.
Термин "крахмал" относится к любому материалу, состоящему из сложных полисахаридных углеводов растений. Данный термин относится к любому материалу растительного происхождения, включая без ограничения зерновые, травы, клубни и корни и, более конкретно, пшеницу, ячмень, кукурузу, рожь, рис, сорго, отруби, маниоку, просо, картофель, сладкий картофель и тапиоку.
Термин "взвесь" относится к смеси крахмалсодержащего материала (например, измельченной кукурузы) и водного компонента, который может включать в себя воду, деионизованную воду или техническую воду (например, возвратный поток, пар, конденсат) или любую их комбинацию. Термины "взвесь" и "затор" можно применять в данном документе взаимозаменяемо.
Термины "разжиженный", "разжижение", "разжиженная фракция" и их вариации относятся к способу или продукту превращения крахмала в растворимые декстринизированные субстраты (например, полисахариды меньшего размера).
"Разжиженная фракция" может упоминаться как "затор" или может также называться растворимым крахмальным субстратом или разжиженным субстратом. В некоторых случаях это может быть взвесь из цельного молотого зерна, содержащая термостабильную альфа-амилазу, которую подвергли высокотемпературному разжижению с получением в результате растворимого субстрата для осахаривания и ферментации или одновременного осахаривания и ферментации (SSF). Высокая температура представляет собой температуру, превышающую температуру клейстеризации полисахаридов зерна.
Термин "измельченный" используют в данном документе в отношении растительного материала, размер которого был уменьшен, например, путем измельчения, дробления, фракционирования или любых других способов уменьшения размера частиц. Измельчение включает в себя сухое или мокрое измельчение. "Сухое измельчение" относится к измельчению цельного сухого зерна. "Мокрое измельчение" относится к способу, при котором зерно сначала замачивают (погружают) в воде для размягчения зерна.
Термин "гидролиз" относится к химической реакции или способу, при которых химическое соединение разрушается в результате реакции с водой. Ферменты, расщепляющие крахмал, гидролизуют крахмал до меньших единиц, то есть до полисахаридов меньшего размера.
Термин "лигноцеллюлозный" относится к композиции, содержащей как лигнин, так и целлюлозу. Она также может содержать гемицеллюлозу.
Термин "лигноцеллюлозная биомасса" относится к любому лигноцеллюлозному материалу и включает материалы, предусматривающие целлюлозу, гемицеллюлозу, лигнин, крахмал, олигосахариды и/или моносахариды. Биомасса также может предусматривать дополнительные компоненты, такие как белок и/или липид. Биомассу можно получать из одного источника, или биомасса может содержать смесь, полученную из более чем одного источника; 25, например, биомасса может содержать смесь из початков кукурузы и кукурузной соломы или смесь из травы и листьев. Лигноцеллюлозная биомасса включает без ограничения биоэнергетические культуры, сельскохозяйственные остатки, твердые бытовые отходы, твердые промышленные отходы, шлам от получения бумаги, садовые отходы и древесные и лесные отходы. Примеры биомассы включают без ограничения кукурузные початки, растительные остатки 30, такие как кукурузная шелуха, кукурузная солома, травы (в том числе мискантус), пшеничная солома, ячменная солома, сено, рисовая солома, просо прутьевидное, бумажные отходы, жом из сахарного тростника, материал из сорго, соевый растительный материал, компоненты, полученные путем измельчения зерна или использования зерна в производственных процессах (таких как DDGS: виды сухой барды с растворимыми веществами), деревья, ветви, корни, листья, щепа, опилки, кустарники и кусты, овощи, фрукты, цветы, пустая пальмовая фруктовая связка и "энергетический" тростник. Термин "энергетический тростник" относится к сахарному тростнику, который разводят для применения в получении энергии. Его отбирают в отношении более высокого процента клетчатки, а не сахара.
Термин "предварительно обработанная лигноцеллюлозная биомасса" относится к биомассе, которую подвергли физической, термической и/или химической обработке до осахаривания. Термин "лигноцеллюлозная биомасса, предварительно обработанная аммиаком" относится к биомассе, которую подвергли по меньшей мере процессу предварительной обработки с применением аммиака. В одном варианте осуществления предварительная обработка аммиаком представляет собой предварительную обработку с помощью низкой дозы аммиака, при которой биомассу приводят в контакт с водным раствором, содержащим аммиак, с образованием смеси биомассы и водного аммиака, где концентрация аммиака является достаточной для поддержания щелочного уровня рН биомассы в смеси аммиака, но составляет менее приблизительно 12 весовых процентов по отношению к сухому весу биомассы, и где сухой вес биомассы составляет по меньшей мере приблизительно 15 весовых процентов сухих веществ по отношению к весу смеси биомассы и водного аммиака, как раскрыто в патенте США № 7932063, который включен в данный документ посредством ссылки. Термин "гидролизат лигноцеллюлозной биомассы" относится к продукту, полученному в результате осахаривания лигноцеллюлозной биомассы. Биомассу также можно предварительно обрабатывать или предварительно перерабатывать перед осахариванием. Термины "осахаривание" и "сахарообразование" относятся к процессу превращения полисахаридов в мономеры декстрозы с применением ферментов. Осахаривание может относиться к превращению полисахаридов в разжиженную фракцию. Продуктами осахаривания являются, например, глюкоза и другие олигосахариды малого размера (с низким молекулярным весом), такие как дисахариды и трисахариды.
Термин "SSF" относится к одновременному осахариванию и ферментации.
Термин "смесь ферментов" относится к смеси или комбинации по меньшей мере двух разных ферментов, что делает ее более эффективной и действенной для любой каталитической реакции.
Термины "ферментация" или "ферментирование" относятся к процессу превращения сахаров из восстановленного растительного материала с получением продукта ферментации.
Термин "продукт ферментации" означает продукт, полученный с помощью способа, предусматривающего стадию ферментации с применением ферментирующего организма.
Термин "вязкость" означает сопротивление жидкости потоку, то есть внутреннее трение жидкости.
Термин "фосфолипаза" относится к ферменту, который гидролизует фосфолипиды в жирные кислоты и другие липофильные вещества.
Термин "эмульсия" относится к смеси двух или более жидкостей, которые обычно являются несмешиваемыми (не поддающимися перемешиванию или не поддающимися смешиванию). В эмульсии одна жидкость (диспергированная фаза) диспергирована в другой (диспергирующая фаза). Примеры эмульсий включают уксусные заправки, гомогенизированное молоко, майонез и тому подобное.
Термин "солодовая крупка" относится к зерну или некоторому количеству зерна, подлежащему измельчению; измельченному зерну или муке крупного помола, полученным путем измельчения. Термин "сусло" относится к не подвергшейся ферментации жидкости, стекшей после экстракции из солодовой крупки в ходе затирания.
Термин "затор" относится к водной взвеси любого растительного материала, содержащего крахмал и/или сахар, такого как солодовая крупка, например, предусматривающей измельченный ячменный солод, измельченный ячмень и/или другую добавку или их комбинацию, смешанные с водой, в дальнейшем подлежащие разделению на сусло и дробину.
Термин "пиво" следует понимать как включающий любое сброженное сусло, полученное ферментацией/пивоварением растительного крахмалсодержащего материала таким образом, в частности, также пиво, полученное исключительно из солода или добавки или любой комбинации солода и добавки.
Пиво можно получать из ряда растительных материалов, содержащих крахмал и/или сахар, зачастую злакового зерна и/или солода, по сути с помощью того же способа. Полагают, что крахмалы зерна являются гомополимерами глюкозы, в которых остатки глюкозы связаны с помощью либо альфа-1,4-, либо альфа-1,6-связей, причем первые являются преобладающими.
Термин "побочный продукт" относится к вторичному продукту, полученному в процессе производства или химической реакции. Он не является основным производимым продуктом или услугой.
Термины "животное" и "субъект" применяются в данном документе взаимозаменяемо. Животное включает всех нежвачных (включая людей) и жвачных животных. В конкретном варианте осуществления животное представляет собой нежвачное животное, такое как лошадь и животное с однокамерным желудком. Примеры животных с однокамерным желудком включают без ограничения свиней и домашних свиней, таких как поросята, свиньи на доращивании, свиноматки; домашнюю птицу, такую как индейки, утки, куры, бройлерные цыплята, несушки; рыбу, такую как лосось, форель, тилапия, сомы и карпы; и ракообразных, таких как мелкие креветки и крупные креветки. В дополнительном варианте осуществления животное представляет собой жвачное животное, в том числе без ограничения крупный рогатый скот, молодых телят, коз, овец, жирафов, бизонов, лосей, вапити, яков, индийских буйволов, оленей, верблюдов, альпак, лам, антилоп, вилорогов и антилоп-нилгау.
Используемый в данном документе термин "патоген" означает любого возбудителя заболевания. Такие возбудители могут включать без ограничения бактериальные, вирусные, грибковые возбудители и т. п.
"Корм" и "пищевой продукт" соответственно означают любой натуральный или искусственный рацион, еду или подобное или компоненты такой еды, предназначенные или пригодные для употребления в пищу, принятия, переваривания животным, отличным от человека, и человеком соответственно.
Используемый в данном документе термин "пищевой продукт" применяется в широком смысле и охватывает пищевой продукт и продукты питания для людей, а также пищевой продукт для животных, отличных от человека (т. е. корм).
Термин "корм" используется в отношении продуктов, которыми кормят животных при выращивании сельскохозяйственных животных. Термины "корм" и "корм для животных" используются взаимозаменяемо.
Используемый в данном документе термин "пробиотик" ("DFM") представляет собой источник живых (жизнеспособных) встречающихся в природе микроорганизмов. DFM может содержать один или несколько таких встречающихся в природе микроорганизмов, таких как бактериальные штаммы. Категории DFM включают Bacillus, молочнокислые бактерии и дрожжи. Таким образом, термин DFM охватывает одно или несколько из следующих: бактерии-пробиотики, дрожжи-пробиотики, дрожжи-пробиотики и их комбинации.
Бациллы представляют собой уникальные грамположительные палочки, которые образуют споры. Эти споры очень стабильны и могут выдерживать такие условия окружающей среды, как тепло, влагу и определенный диапазон рН. Эти споры прорастают в активные вегетативные клетки при проглатывании животным и могут быть использованы в молотых и гранулированных рационах. Молочнокислые бактерии представляют собой грамположительные кокки, продуцирующие молочную кислоту, которые являются антагонистами патогенных организмов. Поскольку молочнокислые бактерии, по-видимому, до некоторой степени являются чувствительными к нагреванию, их не используют в гранулированных рационах. Типы молочнокислых бактерий включают Bifidobacterium, Lactobacillus и Streptococcus.
Термин "пребиотик" обозначает неперевариваемый ингредиент пищевого продукта, который благоприятно воздействует на хозяина путем избирательного стимулирования роста и/или активности одной или ограниченного числа полезных бактерий.
Используемый в данном документе термин "пробиотическая культура" определяет живые микроорганизмы (в том числе, например, бактерии или дрожжи), которые, например, при приеме внутрь или местном применении в достаточных количествах благоприятно воздействуют на организм-хозяина, т. е. предоставляя одно или несколько очевидных преимуществ для здоровья организма-хозяина. Пробиотики могут улучшать баланс микробиоты на поверхностях одной или нескольких слизистых оболочек. Например, поверхность слизистой оболочки может находиться в кишечнике, мочевыводящих путях, дыхательных путях или на коже. Используемый в данном документе термин "пробиотик" также охватывает живые микроорганизмы, которые могут стимулировать значимые ветви иммунной системы и в то же время уменьшать воспалительные реакции на поверхности слизистой оболочки, например, кишечника. Хотя не существует верхних или нижних пределов для приема пробиотиков, было высказано предположение, что по меньшей мере 106-1012, предпочтительно по меньшей мере 106-1010, предпочтительно 108-109 КОЕ в качестве суточной дозы будет эффективно для достижения благоприятных эффектов для здоровья субъекта.
Используемый в данном документе термин "КОЕ" обозначает "колониеобразующие единицы" и является мерой жизнеспособных клеток, где колония представляет совокупность клеток, полученную из одной клетки-предшественника.
Термин "выделенный" означает вещество в форме или окружении, которые не встречаются в природе. Неограничивающие примеры выделенных веществ включают: (1) любое не встречающееся в природе вещество, (2) любое вещество, включая без ограничения любую клетку-хозяина, фермент, вариант, нуклеиновую кислоту, белок, пептид или кофактор, которое по меньшей мере частично извлечено из одного или нескольких или всех встречающихся в природе компонентов, с которыми оно связано в природе; (3) любое вещество, модифицированное человеком по сравнению с этим веществом, обнаруженным в природе; или (4) любое вещество, модифицированное путем увеличения количества вещества по сравнению с другими компонентами, с которыми оно связано в природе. Термины "выделенная молекула нуклеиновой кислоты", "выделенный полинуклеотид" и "выделенный фрагмент нуклеиновой кислоты" будут использоваться взаимозаменяемо и относятся к полимеру РНК или ДНК, который является одно- или двухнитевым, необязательно содержащим синтетические, неприродные или измененные нуклеотидные основания. Выделенная молекула нуклеиновой кислоты в форме полимера ДНК может состоять из одного или нескольких сегментов cDNA, геномной ДНК или синтетической ДНК.
Термин "очищенный" применительно к нуклеиновым кислотам или полипептидам, как правило, обозначает нуклеиновую кислоту или полипептид, которые по сути не содержат других компонентов, что определено с помощью аналитических методик, хорошо известных из уровня техники (например, очищенный полипептид или полинуклеотид образуют отдельную полосу в электрофоретическом геле, хроматографическом элюате и/или средах, подвергнутых центрифугированию в градиенте плотности). Например, нуклеиновая кислота или полипептид, которые обеспечиваю по сути одну полосу в электрофоретическом геле, являются "очищенными". Чистота очищенных нуклеиновой кислоты или полипептида составляет по меньшей мере приблизительно 50%, обычно по меньшей мере приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99%, приблизительно 99,5%, приблизительно 99,6%, приблизительно 99,7%, приблизительно 99,8% или больше (например, весовых процентов в молях). Иными словами, композиция обогащена молекулой, если имеет место значительное увеличение концентрации молекулы после применения методики очистки или обогащения. Термин "обогащенный" относится к соединению, полипептиду, клетке, нуклеиновой кислоте, аминокислоте или другому определенному материалу или компоненту, который присутствует в композиции в относительной или абсолютной концентрации, которая выше, чем в исходной композиции.
Используемый в данном документе термин "функциональный анализ" относится к анализу, который обеспечивает получение показателя активности белка. В некоторых вариантах осуществления данный термин относится к аналитическим системам, в которых белок анализируется в отношении его способности функционировать в контексте его обычной функциональной активности. Например, в случае протеазы, функциональный анализ предусматривает определение эффективности протеазы при гидролизе белкового субстрата.
Термины "пептиды", "белки" и "полипептиды" используются в данном документе взаимозаменяемо и относятся к полимеру из аминокислот, соединенных вместе пептидными связями. "Белок" или "полипептид" содержит полимерную последовательность аминокислотных остатков. В данном изобретении используется одно- и 3-буквенный код для аминокислот, который определен согласно IUPAC-IUB объединенным комитетом по биохимической номенклатуре (JCBN). Одна буква X относится к любой из двадцати аминокислот. Также понятно, что полипептид может быть закодирован более чем одной нуклеотидной последовательностью вследствие вырожденности генетического кода. Мутации могут быть названы с помощью однобуквенного кода исходной аминокислоты, за которым следует номер положения, а затем однобуквенный код вариантной аминокислоты. Например, мутация с заменой глицина (G) по положению 87 на серин (S) представлена как "G087S" или "G87S". При описании модификаций положение, за которым следуют аминокислоты, перечисленные в скобках, указывает на перечень замен по этому положению любой из перечисленных аминокислот. Например, 6(L,I) означает, что положение 6 может быть замещено лейцином или изолейцином. Также в последовательности используется косая черта (/) для обозначения замен, например, F/V указывает на то, что в конкретном положении может находится фенилаланин или валин.
"Пропоследовательность" или "пропептидная последовательность" относится к аминокислотной последовательности между сигнальной пептидной последовательностью и зрелой последовательностью протеазы, которая необходима для правильного сворачивания и секреции протеазы; их иногда называют внутримолекулярными шаперонами. Отщепление пропоследовательности или пропептидной последовательности дает в результате зрелую активную протеазу. Протеазы часто экспрессируются в виде проферментов.
Термины "сигнальная последовательность" и "сигнальный пептид" относятся к последовательности аминокислотных остатков, которая может участвовать в секреции или управлении транспортом зрелой формы или формы белка-предшественника. Сигнальная последовательность обычно расположена на N-конце по отношению к последовательности белка-предшественника или последовательности зрелого белка. Сигнальная последовательность может быть эндогенной или экзогенной. Сигнальная последовательность в норме отсутствует у зрелого белка. Сигнальная последовательность обычно отщепляется от белка сигнальной пептидазой после осуществления транспорта белка.
Термин "зрелая" форма белка, полипептида или пептида относится к функциональной форме белка, полипептида или фермента без сигнальной пептидной последовательности и пропептидной последовательности.
Термин форма "предшественника" белка или пептида относится к зрелой форме белка с пропоследовательностью, функционально связанной с амино- или карбонильным концом белка. Предшественник может также иметь "сигнальную" последовательность, функционально связанную с аминоконцом пропоследовательности. Предшественник также может иметь дополнительные полипептиды, которые вовлечены в посттрансляционную активность (например, полипептиды, отщепляемые от него с тем, чтобы оставить зрелую форму белка или пептида).
Термин "дикий тип" в отношении аминокислотной последовательности или последовательности нуклеиновой кислоты указывает на то, что аминокислотная последовательность или последовательность нуклеиновой кислоты является нативной или встречающейся в природе последовательностью. Используемый в данном документе термин "встречающийся в природе" относится к любым объектам (например, белкам, аминокислотам или последовательностям нуклеиновых кислот), обнаруживаемым в природе. И наоборот, термин "не встречающийся в природе" относится к объектам, не обнаруживаемым в природе (например, рекомбинантным нуклеиновым кислотам и белковым последовательностям, полученным в лаборатории, или модификациям последовательности дикого типа).
Используемые в данном документе в отношении положений аминокислотных остатков выражения "соответствующий чему-либо", или "соответствует чему-либо", или "соответствует" относятся к аминокислотному остатку в пронумерованном положении в белке или пептиде или аминокислотному остатку, который аналогичен, гомологичен или эквивалентен пронумерованному остатку в белке или пептиде. Используемый в данном документе термин "соответствующая область", как правило, относится к аналогичному положению в родственных белках или эталонном белке.
Термины "происходящий из" и "полученный из" относятся не только к белку, продуцированному или продуцируемому штаммом рассматриваемого организма, но также к белку, кодируемому последовательностью ДНК, выделенной из такого штамма, и продуцируемому в организме-хозяине, содержащем такую последовательность ДНК. Кроме того, данный термин относится к белку, который кодируется последовательностью ДНК синтетического происхождения и/или происходящей от cDNA, и который имеет отличительные характеристики рассматриваемого белка.
Термин "аминокислота" относится к основной химической структурной единице белка или полипептида. В аббревиатурах, используемых в данном документе для идентификации конкретных аминокислот, может применяться трех- или однобуквенный код, известный в данной области, и, кроме того, Xaa или X можно использовать для обозначения любой аминокислоты.
Специалист в данной области техники поймет, что могут быть выполнены модификации аминокислотных последовательностей, раскрытых в данном документе, с сохранением при этом функции, ассоциированной с раскрытыми аминокислотными последовательностями. Например, в данной области техники хорошо известно, что изменения в гене, результатом которых является получение химически эквивалентной аминокислоты в данном сайте без влияния на функциональные свойства кодируемого белка, являются общими. Например, любая конкретная аминокислота в аминокислотной последовательности, раскрытой в данном документе, может быть заменена другой функционально эквивалентной аминокислотой. Для целей настоящего изобретения замены определяются как замещения в пределах одной из следующих пяти групп:
1. малые алифатические, неполярные или в слабой степени полярные остатки: Ala, Ser, Thr (Pro, Gly);
2. полярные, отрицательно заряженные остатки и их амиды: Asp, Asn, Glu, Gln;
3. полярные, положительно заряженные остатки: His, Arg, Lys;
4. крупные алифатические неполярные остатки: Met, Leu, Ile, Val (Cys); и
5. крупные ароматические остатки: Phe, Tyr и Trp.
Таким образом, кодон для аминокислоты аланина, являющейся гидрофобной аминокислотой, можно заменить кодоном, который кодирует другой менее гидрофобный остаток (такой как глицин) или более гидрофобный остаток (такой как валин, лейцин или изолейцин). Аналогично, также можно ожидать, что изменения, которые приводят к замене одного отрицательно заряженного остатка на другой (как, например, термостабильного серина на глутаминовую кислоту) или одного положительно заряженного остатка на другой (как, например, лизин на аргинин), дадут функционально эквивалентный продукт. Во многих случаях ожидается, что изменения нуклеотидов, которые приводят к изменениям N-концевой и C-концевой частей белковой молекулы, также не приведут к изменениям активности белка. Каждая из предложенных модификаций находится в пределах квалификации рядового специалиста в данной области техники, равно как и определение сохранения биологической активности кодируемых продуктов.
Термин "кодон-оптимизированный", относящийся к генам или кодирующим участкам молекул нуклеиновой кислоты для трансформации различных хозяев, относится к изменению кодонов в гене или кодирующих участках молекул нуклеиновой кислоты, чтобы отражать обычное использование кодонов у организма-хозяина без изменения полипептида, который кодируется ДНК.
Термин "ген" относится к молекуле нуклеиновой кислоты, которая экспрессирует конкретный белок, включающей регуляторные последовательности, предшествующие кодирующей последовательности (5'-некодирующие последовательности) и следующие за ней (3'-некодирующие последовательности). Термин "нативный ген" означает ген, обнаруживаемый в природе, со своими собственными регуляторными последовательностями. "Химерный ген" относится к любому гену, который не является нативным геном, содержащему регуляторные и кодирующие последовательности, которые совместно не обнаруживаются в природе. Соответственно, химерный ген может содержать регуляторные последовательности и кодирующие последовательности, которые происходят из различных источников, или регуляторные последовательности и кодирующие последовательности, которые происходят из одного источника, но расположены в порядке, отличающемся от обнаруживаемого в природе. "Эндогенный ген" относится к нативному гену в его естественном расположении в геноме организма. "Чужеродный" ген относится к гену, не обнаруживаемому в норме в организме-хозяине, а который введен в организм-хозяин путем переноса генов. Чужеродные гены могут включать нативные гены, введенные в организм, не являющийся нативным, или химерные гены. "Трансген" представляет собой ген, который ввели в геном с помощью процедуры трансформации.
Термин "кодирующая последовательность" относится к нуклеотидной последовательности, которая кодирует конкретную аминокислотную последовательность. "Подходящие регуляторные последовательности" относятся к нуклеотидным последовательностям, расположенным выше (5'-некодирующие последовательности), в пределах или ниже (3'-некодирующие последовательности) кодирующей последовательности и которые влияют на транскрипцию, процессинг или стабильность РНК или трансляцию ассоциированной кодирующей последовательности. Регуляторные последовательности могут включать промоторы, лидерные последовательности трансляции, сайт процессинга РНК, сайты связывания эффекторов и структуры "стебель-петля".
Термин "функционально связанный" относится к ассоциации последовательностей нуклеиновой кислоты в одной молекуле нуклеиновой кислоты таким образом, что функция одной влияет на другую. Например, промотор функционально связан с кодирующей последовательностью, если он способен влиять на экспрессию такой кодирующей последовательности, т. е. кодирующая последовательность находится под транскрипционный контролем промотора. Кодирующие последовательности могут быть функционально связаны с регуляторными последовательностями в смысловой или антисмысловой ориентации.
Термины "регуляторная последовательность" или "контрольная последовательность" используются в данном документе взаимозаменяемо и относятся к сегменту нуклеотидной последовательности, который способен повышать или понижать экспрессию конкретных генов в организме. Примеры регуляторных последовательностей включают без ограничения промоторы, сигнальную последовательность, операторы и т. п. Как отмечено выше, регуляторные последовательности могут быть функционально связаны в смысловой или антисмысловой ориентации с кодирующей последовательностью/геном, представляющими интерес.
"Промотор" или "промоторные последовательности" относятся к последовательностям ДНК, которые определяют, где начинается транскрипция гена с помощью РНК-полимеразы. Промоторные последовательности обычно располагаются непосредственно выше или на 5'-конце сайта инициации транскрипции. Промоторы можно получить целиком из нативной или встречающейся в природе последовательности или можно составлять из различных элементов, полученных из различных промоторов, обнаруживаемых в природе, или они даже могут содержать сегменты синтетической ДНК. Специалистам в данной области техники будет понятно, что различные промоторы могут управлять экспрессией гена в различных тканях или типах клеток или на различных стадиях развития или в ответ на различные условия окружающей среды или физиологические условия ("индуцируемые промоторы").
Выражение "некодирующие 3'-последовательности" относится к последовательностям ДНК, расположенным ниже кодирующей последовательности, и включает последовательности, кодирующие регуляторные сигналы, способные влиять на процессинг mRNA или экспрессию генов, такие как терминация транскрипции.
Используемый в данном документе термин "трансформация" относится к переносу или введению молекулы нуклеиновой кислоты в организм-хозяин. Молекулу нуклеиновой кислоты можно вводить в виде линейной или кольцевой формы ДНК. Молекула нуклеиновой кислоты может представлять собой плазмиду, которая реплицируется автономно, или она может интегрироваться в геном продуцирующего хозяина. Продуцирующие хозяева, содержащие трансформированную нуклеиновую кислоту, называются "трансформированными", или "рекомбинантными", или "трансгенными" организмами, или "трансформантами".
Используемый в данном документе термин "рекомбинантный" относится к искусственной комбинации двух в ином случае отделенных друг от друга сегментов последовательностей нуклеиновых кислот, например, путем химического синтеза или манипуляции выделенными сегментами нуклеиновых кислот с помощью методик генной инженерии. Например, ДНК, в которую были вставлены один или несколько сегментов или генов естественным образом либо с помощью лабораторной манипуляции из отличающейся молекулы, из другой части той же молекулы или из искусственной последовательности, что привело к введению новой последовательности в ген и, соответственно, в организм. Термины "рекомбинантный", "трансгенный", "трансформированный", "сконструированный" или "модифицированный для экспрессии экзогенного гена" используются в данном документе взаимозаменяемо.
Термины "рекомбинантная конструкция", "экспрессирующая конструкция", "рекомбинантная экспрессирующая конструкция" и "кассета экспрессии" используются в данном документе взаимозаменяемо. Рекомбинантная конструкция содержит искусственную комбинацию фрагментов нуклеиновых кислот, например, регуляторных и кодирующих последовательностей, не все из которых встречаются вместе в природе. Например, конструкция может содержать регуляторные последовательности и кодирующие последовательности, которые происходят из разных источников, или регуляторные последовательности и кодирующие последовательности, которые происходят из одного источника, но расположены в порядке, отличающемся от обнаруживаемого в природе. Такую конструкцию можно использовать саму по себе или можно использовать в сочетании с вектором. Если используют вектор, тогда выбор вектора зависит от способа, который будут применять для трансформации клеток-хозяев, что хорошо известно специалистам в данной области техники. Например, можно использовать плазмидный вектор. Специалисту в данной области техники хорошо известны генетические элементы, которые должны присутствовать в векторе для успешной трансформации, отбора и размножения клеток-хозяев. Специалисту в данной области техники также будет понятно, что у различных независимых трансформантов могут проявляться различные уровни и паттерны экспрессии (Jones et al., (1985) EMBO J 4:2411-2418; De Almeida et al., (1989) Mol Gen Genetics 218:78-86), и, таким образом, для того, чтобы получить линии, характеризующиеся требуемым уровнем и паттерном экспрессии, обычно проводят скрининг множества объектов. Такой скрининг можно осуществлять с помощью стандартных молекулярно-биологических, биохимических и других анализов, в том числе Саузерн-анализа ДНК, нозерн-анализа экспрессии mRNA, ПЦР, количественной ПЦР в реальном времени (qPCR), ПЦР с обратной транскрипцией (RT-PCR), анализа экспрессии белков с помощью иммуноблоттинга, ферментативных анализов или анализов активности и/или фенотипического анализа.
Термины "продуцирующий хозяин", "хозяин" и "клетка-хозяин" используются в данном документе взаимозаменяемо и относятся к любому организму или его клетке, независимо от того, является ли он человеком или отличным от человека, в который может быть стабильно или временно введена рекомбинантная конструкция для экспрессии гена. Этот термин охватывает любое потомство родительской клетки, которое не идентично родительской клетке вследствие мутаций, возникших во время размножения.
Термин "процент идентичности" представляет собой взаимоотношение между двумя или более полипептидными последовательностями или двумя или более полинуклеотидными последовательностями, определенное путем сравнения последовательностей. В данной области техники "идентичность" также означает степень родства последовательностей между полипептидными или полинуклеотидными последовательностями, в зависимости от конкретного случая, определенную по количеству совпадающих нуклеотидов или аминокислот между нитями таких последовательностей. "Идентичность" и "сходство" могут быть легко вычислены с помощью известных способов, в том числе без ограничения тех, которые описаны в Computational Molecular Biology (Lesk, A. M., ed.) Oxford University Press, NY (1988); Biocomputing: Informatics and Genome Projects (Smith, D. W., ed.) Academic Press, NY (1993); Computer Analysis of Sequence Data, Part I (Griffin, A. M., and Griffin, H. G., eds.) Humana Press, NJ (1994); Sequence Analysis in Molecular Biology (von Heinje, G., ed.) Academic Press (1987) и Sequence Analysis Primer (Gribskov, M. and Devereux, J., eds.) Stockton Press, NY (1991). Способы определения идентичности и сходства прописаны в коде общедоступных компьютерных программ.
Используемый в данном документе термин "% идентичности", или "процент идентичности", или "PID" относится к идентичности белковой последовательности. Процент идентичности может быть определен с применением стандартных методик, известных из уровня техники. Применимые алгоритмы включают алгоритмы BLAST (см. Altschul et al., J Mol Biol, 215:403-410, 1990; и Karlin и Altschul, Proc Natl Acad Sci USA, 90:5873-5787, 1993). В программе BLAST используются несколько параметров поиска, большинство из которых выставлены на значения по умолчанию. Алгоритм NCBI BLAST находит наиболее релевантные последовательности с точки зрения биологического сходства, но не рекомендуется для запрашиваемых последовательностей из менее 20 остатков (Altschul et al., Nucleic Acids Res, 25:3389-3402, 1997; и Schaffer et al., Nucleic Acids Res, 29:2994-3005, 2001). Иллюстративные параметры BLAST по умолчанию для поиска последовательностей нуклеиновой кислоты включают: пороговая длина смежного слова=11; отсечка E-значения=10; матрица замен=NUC.3.1 (соответствие=1, несоответствие = -3); открытие гэпа=5 и продление гэпа=2. Иллюстративные параметры BLAST по умолчанию для поиска аминокислотных последовательностей включают: размер слова=3; отсечка E-значения=10; матрица замен=BLOSUM62; открытие гэпа=11 и продление гэпа=1. Значение процента (%) идентичности аминокислотной последовательности определяется по количеству совпадающих идентичных остатков, деленному на общее количество остатков "эталонной" последовательности, включая любые гэпы, созданные программой для оптимального/максимального выравнивания. Алгоритмы BLAST обращаются к "эталонной" последовательности как к "запрашиваемой" последовательности.
Используемые в данном документе термины "гомологичные белки" или "гомологичные протеазы" относятся к белкам, которые имеют отчетливое сходство в первичной, вторичной и/или четвертичной структуре. Гомология белка может относиться к сходству в линейной аминокислотной последовательности при выравнивании белков. Гомологичный поиск белковых последовательностей может быть выполнен с применением BLASTP и PSI-BLAST из NCBI BLAST с порогом (отсечка E-значения) при 0,001. (Altschul SF, Madde TL, Shaffer AA, Zhang J, Zhang Z, Miller W, Lipman DJ. Gapped BLAST and PSI BLAST a new generation of protein database search programs. Nucleic Acids Res 1997 Set 1;25(17):3389-402). Используя эту информацию, можно сгруппировать последовательности белков. Можно построить филогенетическое древо с использованием аминокислотных последовательностей.
Выравнивания последовательностей и расчеты процента идентичности можно произвести с помощью программы Megalign из пакета программ для расчета данных по биоинформатике LASERGENE (DNASTAR Inc., Мэдисон, Висконсин), программы AlignX из Vector NTI, версия 7.0 (Informax, Inc., Бетезда, Мериленд), или пакета открытого программного обеспечения EMBOSS (EMBL-EBI; Rice et al., Trends in Genetics 16, (6):276-277 (2000)). Множественное выравнивание последовательностей можно выполнить с помощью способа выравнивания Clustal (такого как CLUSTALW; например версии 1.83) (Higgins and Sharp, CABIOS, 5:151-153 (1989); Higgins et al., Nucleic Acids Res. 22:4673-4680 (1994); и Chenna et al., Nucleic Acids Res 31 (13):3497-500 (2003)), доступный от Европейской молекулярно-биологической лаборатории через Европейский институт биоинформатики) с параметрами по умолчанию. Подходящие параметры для выравниваний белка в CLUSTALW включают следующие: штраф за наличие гэпа=15, продление гэпа=0,2, матрица=Gonnet (например, Gonnet250), ENDGAP белка = -1, GAPDIST белка=4 и KTUPLE=1. В одном варианте осуществления быстрое или медленное выравнивание применяют с настройками по умолчанию для медленного выравнивания. В качестве альтернативы, параметры, применяемые в способе CLUSTALW (например, версии 1.83), можно модифицировать, чтобы также использовать KTUPLE=1, штраф за введение гэпа=10, продление гэпа=1, матрицу=BLOSUM (например, BLOSUM64), окно=5 и TOP DIAGONALS SAVED=5. Последовательности также можно многократно выровнять, применяя программу MUSCLE от Geneious Software (Biomatters Ltd.) (Robert C. Edgar. MUSCLE: multiple sequence alignment with high accuracy and high throughput Nucl. Acids Res. (2004) 32 (5): 1792-1797).
Различные аминокислотные последовательности полипептидов и полинуклеотидные последовательности раскрыты в данном документе в качестве признаков определенных аспектов. В определенных вариантах осуществления могут применяться варианты этих последовательностей, которые на по меньшей мере приблизительно 70-85%, 85-90% или 90%-95% идентичны последовательностям, раскрытым в данном документе. В качестве альтернативы, вариант полипептидной последовательности или полинуклеотидной последовательности в определенных вариантах осуществления может характеризоваться по меньшей мере 60%, 61%, 62%,63%,64%, 65%, 66%, 67%, 68%,69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью с последовательностью, раскрытой в данном документе. Аминокислотная последовательность или полинуклеотидная последовательность варианта имеет аналогичную раскрытой последовательности функцию или по меньшей мере приблизительно 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% функции раскрытой последовательности.
Термин "вариант" в отношении полипептида относится к полипептиду, который отличается от указанного полипептида дикого типа, исходного или эталонного полипептида тем, что он включает одну или несколько встречающихся в природе или искусственных замен, вставок или делеций аминокислоты. Аналогично, термин "вариант" в отношении полинуклеотида относится к полинуклеотиду, который отличается нуклеотидной последовательностью от указанного полинуклеотида дикого типа, исходного или эталонного полинуклеотида. Идентичность полипептида или полинуклеотида дикого типа, исходного или эталонного полипептида или полинуклеотида будет очевидна из контекста.
Термины "плазмида", "вектор" и "кассета" относятся к внехромосомному элементу, часто несущему гены, которые не являются частью центрального метаболизма клетки, и обычно находящемуся в форме двухнитевой ДНК. Такие элементы могут представлять собой автономно реплицирующиеся последовательности, интегрирующиеся в геном последовательности, фаговые или нуклеотидные последовательности, в линейной или кольцевой форме, одно- или двухнитевой ДНК или РНК, происходящей из любого источника, в которых ряд нуклеотидных последовательностей соединен или подвергнут рекомбинации в уникальную конструкцию, которая способна обеспечивать введение представляющего интерес полинуклеотида в клетку. "Кассета для трансформации" относится к конкретному вектору, содержащему ген и имеющему элементы в дополнение к гену, которые способствуют трансформации конкретной клетки-хозяина. Термины "кассета экспрессии" и "вектор экспрессии" используются в данном документе взаимозаменяемо и относятся к конкретному вектору, содержащему ген и имеющему элементы в дополнение к гену, которые обеспечивают возможность экспрессии этого гена в хозяине.
Используемый в данном документе термин "экспрессия" относится к получению функционального конечного продукта (например, mRNA или белка) в форме белка-предшественника либо в зрелой форме. Экспрессия также может относиться к трансляции mRNA в полипептид.
Экспрессия гена подразумевает транскрипцию гена и трансляцию mRNA в белок-предшественник или зрелый белок. "Зрелый" белок относится к полипептиду, подвергнутому посттрансляционному процессингу; т. е. полипептиду, из которого удалены какие-либо пре- или пропептиды, присутствовавшие в первичном продукте трансляции. "Белок-предшественник" относится к первичному продукту трансляции mRNA; т. е. с еще присутствующими пре- и пропептидами. Пре- и пропептиды могут представлять собой без ограничения сигналы внутриклеточной локализации. "Стабильная трансформация" относится к переносу фрагмента нуклеиновой кислоты в геном организма-хозяина, в том числе геномы как ядра, так и органелл, что приводит к генетически стабильному наследованию. В отличие от этого "временная трансформация" относится к переносу фрагмента нуклеиновой кислоты в ядро или ДНК-содержащую органеллу организма-хозяина, что приводит к экспрессии гена без интеграции или стабильного наследования. Организмы-хозяева, содержащие трансформированные фрагменты нуклеиновой кислоты, называются "трансгенными" организмами.
Вектор экспрессии может быть одним из множества векторов или кассет, пригодных для трансформации подходящих продуцирующих хозяев, известных в данной области техники. Обычно вектор или кассета будет включать последовательности, управляющие транскрипцией и трансляцией соответствующего гена, селектируемый маркер и последовательности, обеспечивающие автономную репликацию или интеграцию в хромосому. Подходящие векторы, как правило, включают 5'-участок гена, который несет элементы, управляющие инициацией транскрипции, и 3'-участок фрагмента ДНК, который управляет терминацией транскрипции. Оба управляющих участка можно получить из генов, гомологичных генам трансформированной продуцирующей клетки-хозяина, и/или генов, нативных для продуцирующего хозяина, хотя такие управляющие участки могут быть получены и не таким способом.
Потенциальные контрольные участки инициации или промоторы, которые могут быть включены в вектор экспрессии, являются многочисленными и известными специалистам в данной области техники. Фактически любой промотор, способный управлять данными генами, является подходящим, в том числе без ограничения промоторы CYC1, HIS3, GAL1, GAL10, ADH1, PGK, PHO5, GAPDH, ADC1, TRP1, URA3, LEU2, ENO, TPI (пригодные для экспрессии в Saccharomyces); AOX1 (пригодный для экспрессии в Pichia); и lac, araB, tet, trp, lPL, lPR, T7, tac и trc (пригодные для экспрессии в Escherichia coli), а также amy, apr, npr и различные фаговые промоторы, подходящие для экспрессии в Bacillus. В некоторых вариантах осуществления промотор представляет собой конститутивный или индуцируемый промотор. "Конститутивный промотор" представляет собой промотор, который является активным в большинстве условий окружающей среды и условий развития. "Индуцируемый" или "репрессируемый" промотор представляет собой промотор, который является активным при регуляции условий окружающей среды и условий развития. В некоторых вариантах осуществления промоторы являются индуцируемыми или репрессируемыми вследствие изменений факторов окружающей среды, в том числе без ограничения доступности углерода, азота или других нутриентов, температуры, показателя pH, осмолярности, наличия тяжелого(тяжелых) металла(металлов), концентрации ингибитора(ингибиторов), стресса или комбинации из вышеуказанных, что известно в данной области техники. В некоторых вариантах осуществления индуцируемые или репрессируемые промоторы индуцируются или репрессируются метаболическими факторами, такими как уровень определенных источников углерода, уровень определенных источников энергии, уровень определенных катаболитов или комбинация из вышеуказанных, что известно в данной области техники. В одном варианте осуществления промотор представляет собой такой промотор, который является нативным в отношении клетки-хозяина. Например, в случае если Trichoderma reesei является хозяином, промотор представляет собой нативный промотор T. reesei, такой как промотор cbh1, который депонирован в GenBank под регистрационным номером D86235.
Подходящие неограничивающие примеры промоторов включают cbh1, cbh2, egl1, egl2, egl3, egl4, egl5, xyn1 и xyn2, репрессируемый промотор гена кислой фосфатазы (phoA) P. chrysogenus (см., например, Graessle et al., (1997) Appl. Environ. Microbiol., 63: 753-756), репрессируемый глюкозой промотор PCK1 (см., например, Leuker et al., (1997), Gene, 192:235-240), индуцируемый мальтозой, репрессируемый глюкозой промотор MET3 (см. Liu et al., (2006), Eukary. Cell, 5:638-649), промотор pKi и промотор cpc1. Другие примеры применимых промоторов включают промоторы генов глюкоамилазы A. awamori и A. niger (см., например, Nunberg et al., (1984) Mol. Cell Biol. 15 4:2306-2315 and Boel et al., (1984) EMBO J. 3:1581-1585). Кроме того, могут применяться промоторы гена xln1 T. reesei (см., например, EPA 137280Al).
Фрагменты ДНК, которые контролируют терминацию транскрипции, также можно получить из разных генов, нативных для предпочтительной клетки-хозяина, являющейся продуцентом. В определенных вариантах осуществления включение участка для контроля терминации является необязательным. В определенных вариантах осуществления вектор экспрессии включает участок контроля терминации, полученный из предпочтительной клетки-хозяина.
Вектор экспрессии может быть включен в продуцирующего хозяина, в частности, в клетки микробных продуцирующих хозяев. Продуцирующие клетки-хозяева могут быть микробными хозяевами, которые обнаруживаются среди семейств грибов или бактерий, и которые растут в широком диапазоне значений температуры, рН и устойчивости к растворителям. Например, предполагается, что любая из бактерий, водорослей и грибов, таких как нитчатые грибы и дрожжи, может соответствующим образом содержать вектор экспрессии.
Включение вектора экспрессии в продуцирующую клетку-хозяина можно применять для экспрессии представляющего интерес белка таким образом, что он может находиться внутриклеточно, внеклеточно или при комбинации как внутри, так и снаружи клетки. Внеклеточная экспрессия обеспечивает более легкое извлечение требуемого белка из продукта ферментации, чем в случае способов извлечения белка, получаемого при внутриклеточной экспрессии.
Определенные варианты осуществления настоящего изобретения относятся к способу получения термостабильной сериновой протеазы, предусматривающему:
(а) трансформацию продуцирующего хозяина с помощью рекомбинантной конструкции, кодирующей термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10; и
(b) культивирование продуцирующего хозяина из стадии (а) при температуре выше 37,5°С c повышением уровня экспрессии термостабильной сериновой протеазы.
В другом аспекте термостабильную сериновую протеазу можно необязательно извлекать из продуцирующего хозяина.
В еще одном аспекте культуральный супернатант, содержащий термостабильную сериновую протеазу, можно получать с помощью любого из способов, описанных в данном документе.
Следует понимать, что экспрессия включает любую стадию, связанную с получением термостабильной сериновой протеазы, в том числе без ограничения транскрипцию, посттранскрипционную модификацию, трансляцию, посттрансляционную модификацию и секрецию.
Методики модификации последовательностей нуклеиновой кислоты с применением способов клонирования хорошо известны в данной области техники.
Можно осуществлять манипуляции в отношении полинуклеотида, кодирующего термостабильную сериновую протеазу, с помощью ряда способов для обеспечения экспрессии полинуклеотида в клетке-хозяине Bacillus. Манипуляции в отношении полинуклеотидной последовательности перед ее вставкой в конструкцию или вектор нуклеиновой кислоты могут быть желательными или необходимыми в зависимости от конструкции нуклеиновой кислоты, или вектора, или клетки-хозяина Bacillus. Методики модификации нуклеотидных последовательностей с применением способов клонирования хорошо известны в данной области техники.
Регуляторные последовательности определены выше. Они включают все компоненты, которые необходимы или полезны для экспрессии термостабильной сериновой протеазы. Каждая контрольная последовательность может быть нативной или чужеродной по отношению к нуклеотидной последовательности, кодирующей термостабильную сериновую протеазу. Такие регуляторные последовательность включают без ограничения лидерную последовательность, последовательность полиаденилирования, пропептидную последовательность, промотор, сигнальную последовательность и терминатор транскрипции. Регуляторные последовательности могут быть снабжены линкерами с целью введения специфических сайтов рестрикции, облегчающих лигирование, или регуляторных последовательностей с кодирующей областью нуклеотидной последовательности, кодирующей термостабильную сериновую протеазу.
Конструкция нуклеиновой кислоты, содержащая полинуклеотид, кодирующий термостабильную сериновую протеазу, может быть функционально связана с одной или несколькими контрольными последовательностями, способными управлять экспрессией кодирующей последовательности в клетке-хозяине Bacillus в условиях, совместимых с контрольными последовательностями.
Каждая контрольная последовательность может быть нативной или чужеродной по отношению полинуклеотида, кодирующего термостабильную сериновую протеазу. Такие контрольные последовательности включают в себя без ограничения лидерную последовательность, промотор, сигнальную последовательность и терминатор транскрипции. Как минимум, контрольные последовательности включают в себя промотор и сигналы остановки транскрипции и трансляции. Контрольные последовательности могут быть снабжены линкерами с целью введения специфических сайтов рестрикции, облегчающих лигирование контрольных последовательностей с кодирующей областью полинуклеотида, кодирующего термостабильную сериновую протеазу.
Контрольная последовательность может представлять собой подходящую промоторную область, нуклеотидную последовательность, которая распознается клеткой-хозяином Bacillus для экспрессии полинуклеотида, кодирующего термостабильную сериновую протеазу. Промоторная область содержит последовательности контроля транскрипции, которые опосредуют экспрессию термостабильной сериновой протеазы. Промоторная область может представлять собой любую нуклеотидную последовательность, которая демонстрирует транскрипционную активность в выбранной клетке-хозяине Bacillus и может быть получена из генов, управляющих синтезом внеклеточных или внутриклеточных полипептидов, обладающих биологической активностью, гомологичной или гетерологичной по отношению к клетке-хозяину Bacillus.
Промоторная область может содержать один промотор или комбинацию промоторов. В случае когда промоторная область содержит комбинацию промоторов, промоторы предпочтительно находятся в тандеме. Промотором из промоторной области может быть любой промотор, который может инициировать транскрипцию полинуклеотида, кодирующего полипептид, обладающий биологической активностью, в представляющей интерес клетке-хозяине Bacillus. Промотор может быть нативным, чужеродным промотором или их комбинацией по отношению к нуклеотидной последовательности, кодирующей полипептид, обладающий биологической активностью. Такой промотор может быть получен из генов, управляющих синтезом внеклеточных или внутриклеточных полипептидов, обладающих биологической активностью, гомологичной или гетерологичной клетке-хозяину Bacillus.
Таким образом, в определенных вариантах осуществления промоторная область содержит промотор, полученный из бактериального источника. В других вариантах осуществления промоторная область содержит промотор, полученный из грамположительной или грамотрицательной бактерии. Грамположительные бактерии включают в себя без ограничения Bacillus, Streptococcus, Streptomyces, Staphylococcus, Enterococcus, Lactobacillus, Lactococcus, Clostridium, Geobacillus и Oceanobacillus. Грамотрицательные бактерии включают в себя без ограничения E. coli, Pseudomonas, Salmonella, Campylobacter, Helicobacter, Flavobacterium, Fusobacterium, Ilyobacter, Neisseria и Ureaplasma.
Промоторная область может содержать промотор, полученный из штамма Bacillus (например, Bacillus agaradherens, Bacillus alkalophilus, Bacillus amyloliquefaciens, Bacillus brevis, Bacillus circulans, Bacillus clausii, Bacillus coagulans, Bacillus firmus, Bacillus lautus, Bacillus lentus, Bacillus licheniformis, Bacillus megaterium, Bacillus pumilus, Bacillus stearothermophilus, Bacillus subtilis или Bacillus thuringiensis; или из штамма Streptomyces (например, Streptomyces lividans или Streptomyces murinus).
Примерами подходящих промоторов для управления транскрипцией полинуклеотида, кодирующего полипептид, обладающий биологической активностью, согласно способам по настоящему изобретению являются промоторы, полученные из оперона E. coli lac, гена агаразы Streptomyces coelicolor (dagA), гена щелочной протеазы Bacillus lentus или Bacillus clausii (aprH), гена щелочной протеазы Bacillus licheniformis (ген Carlsberg субтилизина), гена левансакразы Bacillus subtilis (sacB), гена альфа-амилазы Bacillus subtilis (amyE), гена альфа-амилазы Bacillus licheniformis (amyL), гена мальтогенной амилазы Bacillus stearothermophilus (amyM), гена альфа-амилазы Bacillus amyloliquefaciens (amyQ), гена пенициллиназы Bacillus licheniformis (penP), генов xylA и xylB Bacillus subtilis, гена CryIIIA (cryIIIA) Bacillus thuringiensis подвида tenebfionis или его частей, гена бета-лактамазы прокариот (Villa-Kamaroff et al., 1978, Proceedings of the National Academy of Sciences USA 75:3727-3731) и гена xylA Bacillus megaterium (Rygus и Hillen, 1992, J. Bacteriol. 174: 3049-3055; Kim et al., 1996, Gene 181: 71-76). Другими примерами являются промотор из промотора бактериального фага spo1 и промотора tac (DeBoer et al., 1983, Proceedings of National Academy of Sciences USA, 80: 21-25). Другие промоторы описаны в "Useful proteins from recombinant bacteria" in Scientific American, 1980, 242:74-94; и в Sambrook, Fritsch, and Maniatis, 1989, Molecular Cloning, A Laboratory Manual, 2d edition, Cold Spring Harbor, N.Y.
Промоторная область может содержать промотор, который представляет собой "консенсусный" промотор, имеющий последовательность TTGACA в области "-35" и TATAAT в области "-10". Консенсусный промотор может быть получен из любого промотора, который может функционировать в клетке-хозяине Bacillus. Конструирование "консенсусного" промотора можно осуществлять посредством сайт-направленного мутагенеза с применением способов, хорошо известных в данной области, для создания промотора, который более точно соответствует установленным консенсусным последовательностям в областях "-10" и "-35" вегетативных промоторов типа "сигма А" для Bacillus subtilis (Voskuil et al., 1995, Molecular Microbiology 17: 271-279).
Контрольной последовательностью также может быть подходящая терминаторная последовательность транскрипции, такая как последовательность, распознаваемая клеткой-хозяином Bacillus для терминации транскрипции. Терминаторная последовательность функционально связана с 3'-концом нуклеотидной последовательности, кодирующей термостабильную сериновую протеазу. Можно применять любой терминатор, который является функциональным в клетке-хозяине Bacillus.
Контрольной последовательностью также может быть подходящая лидерная последовательность, нетранслируемая область mRNA, которая является важной для трансляции клеткой-хозяином Bacillus. Лидерная последовательность функционально связана с 5'-концом нуклеотидной последовательности, управляющей синтезом полипептида, обладающего биологической активностью. В настоящем изобретении можно применять любую лидерную последовательность, которая является функциональной в выбранной клетке-хозяине Bacillus.
Контрольной последовательностью также может являться последовательность, стабилизирующая mRNA. Термин "последовательность, стабилизирующая mRNA", определяется в данном документе как последовательность, расположенная ниже промоторной области и выше кодирующей последовательности полинуклеотида, кодирующего термостабильную сериновую протеазу, с которой функционально связана промоторная область, так что все mRNA, синтезированные из промоторной области, могут быть подвергнуты процессингу с получением транскриптов mRNA последовательностью, обеспечивающей стабильность, на 5'-конце транскриптов. Например, присутствие такой стабилизирующей последовательности на 5'-конце транскриптов mRNA увеличивает период их полужизни (Agaisse and Lereclus, 1994, выше, Hue et al., 1995, Journal of Bacteriology 177: 3465-3471). Последовательность, обеспечивающая процессинг/стабилизирующая mRNA, является комплементарной 3'-концу бактериальной 16S рибосомальной РНК. В некоторых вариантах осуществления последовательность, обеспечивающая процессинг/стабилизирующая mRNA, приводит к получению транскриптов по сути одного размера со стабилизирующей последовательностью на 5'-конце транскриптов. Последовательность, обеспечивающая процессинг/стабилизирующая mRNA, предпочтительно представляет собой последовательность, которая комплементарна 3'-концу бактериальной 16S РНК рибосомы. См. патент США № 6255076 и патент США № 5955310.
Конструкцию нуклеиновой кислоты затем можно вводить в клетку-хозяина Bacillus с применением способов, известных в данной области техники, или способов, описанных в данном документе, для введения и экспрессии термостабильной сериновой протеазы.
Конструкция нуклеиновой кислоты, содержащая представляющую интерес ДНК, кодирующую представляющий интерес белок, также может быть сконструирована аналогично тому, что описано выше.
Для получения секреции представляющего интерес белка введенной ДНК контрольная последовательность также может содержать область, кодирующую сигнальный пептид, которая кодирует аминокислотную последовательность, связанную с аминоконцом полипептида, который может направлять экспрессированный полипептид по секреторному пути клетки. Область, кодирующая сигнальный пептид, может быть нативной по отношению к полипептиду или может быть получена из чужеродных источников. 5'-Конец кодирующей последовательности нуклеотидной последовательности может изначально содержать область, кодирующую сигнальный пептид, естественным образом связанную в трансляционной рамке считывания с сегментом кодирующей области, который кодирует секретируемый полипептид. Альтернативно, 5'-конец кодирующей последовательности может содержать область, кодирующую сигнальный пептид, которая является чужеродной по отношению к той части кодирующей последовательности, которая кодирует секретируемый полипептид. Чужеродная область, кодирующая сигнальный пептид, может быть необходима, когда кодирующая последовательность обычно не содержит область, кодирующую сигнальный пептид. Альтернативно, чужеродная область, кодирующая сигнальный пептид, может просто заменять природную область, кодирующую сигнальный пептид, с целью получения повышенной секреции полипептида по сравнению с природной областью, кодирующей сигнальный пептид, обычно связанной с кодирующей последовательностью. Область, кодирующая сигнальный пептид, может быть получена из гена амилазы или протеазы из вида Bacillus. Однако любая область, кодирующая сигнальный пептид, способная направлять экспрессированный полипептид по секреторному пути выбранной клетки-хозяина Bacillus, может применяться в настоящем изобретении.
Эффективной областью, кодирующей сигнальный пептид, для клетки-хозяина Bacillus является область, кодирующая сигнальный пептид, полученная из гена мальтогенной амилазы Bacillus NCIB 11837, гена альфа-амилазы Bacillus stearothermophilus, гена субтилизина Bacillus licheniformis, гена бета-лактамазы Bacillus licheniformis, генов нейтральных протеаз Bacillus stearothermophilus (nprT, nprS, nprM) и гена prsA Bacillus subtilis.
Таким образом, полинуклеотидная конструкция, содержащая нуклеиновую кислоту, кодирующую конструкцию термостабильной сериновой протеазы, содержащую нуклеиновую кислоту, кодирующую представляющий интерес полипептид (POI), может быть сконструирована таким образом, что она экспрессируется клеткой-хозяином. По причине известной вырожденности в генетическом коде различные полинуклеотиды, кодирующие идентичную аминокислотную последовательность, могут быть сконструированы и получены посредством стандартных навыков в данной области. Например, средства оптимизации кодонов могут применяться для оптимизации продуцирования в конкретной клетке-хозяине.
Нуклеиновые кислоты, кодирующие представляющие интерес белки, могут быть включены в вектор, при этом вектор может быть перенесен в клетку-хозяина с применением хорошо известных методик трансформации, таких как описанные в данном документе.
Вектор может представлять собой любой вектор, который можно трансформировать в клетку-хозяина и реплицировать в ней. Например, вектор, содержащий нуклеиновую кислоту, кодирующую POI, можно трансформировать в бактериальную клетку-хозяина и реплицировать в ней в качестве средства размножения и амплификации вектора. Вектор также можно трансформировать в хозяина экспрессии Bacillus по настоящему изобретению, за счет чего белок, кодирующий нуклеиновую кислоту (например, ORF), может экспрессироваться как функциональный белок.
Иллюстративным вектором, который можно модифицировать обычным путем для включения и экспрессии нуклеиновой кислоты, кодирующей POI, является вектор p2JM103BBI.
Полинуклеотид, кодирующий термостабильную сериновую протеазу или POI, может быть функционально связан с подходящим промотором, который обеспечивает транскрипцию в клетке-хозяине. Промотор может представлять собой любую последовательность нуклеиновой кислоты, которая проявляет транскрипционную активность в выбранной клетке-хозяине и может быть получена из генов, кодирующих белки, гомологичные или гетерологичные по отношению к клетке-хозяину. Средства оценки активности/силы промотора являются стандартными для квалифицированного специалиста.
Примеры подходящих промоторов для управления транскрипцией полинуклеотидной последовательности, кодирующей полипептид comS1 или POI по настоящему изобретению, в частности, в бактериальном хозяине, включают промотор lac-оперона E.coli, промоторы dagA или celA гена агаразы Streptomyces coelicolor, промоторы гена альфа-амилазы Bacillus licheniformis (amyL), промоторы гена мальтогенной амилазы Bacillus stearothermophilus (amyM), промоторы альфа-амилазы Bacillus amyloliquefaciens (amyQ), промоторы генов xylA и xylB Bacillus subtilis.
Промотор для управления транскрипцией полинуклеотидной последовательности, кодирующей POI, может представлять собой промотор aprE дикого типа, мутантный промотор aprE или консенсусный промотор aprE, описанные в международной публикации согласно РСТ № WO2001/51643. В некоторых других вариантах осуществления промотор для управления транскрипцией полинуклеотидной последовательности, кодирующей POI, представляет собой промотор spoVG дикого типа, мутантный промотор spoVG или консенсусный промотор spoVG (Frisby and Zuber, 1991).
Промотор для управления транскрипцией полинуклеотидной последовательности, кодирующей термостабильную сериновую протеазу или POI, представляет собой рибосомный промотор, такой как промотор рибосомной РНК или промотор рибосомного белка. Промотор рибосомной РНК может представлять собой промотор rrn, полученный из B. subtilis, более конкретно промотор rrn может представлять собой рибосомный промотор rrnB, rrnI или rrnE B. subtilis. В некоторых вариантах осуществления промотор рибосомальной РНК представляет собой промотор rrnI P2 из B. subtilis, описанный в международной публикации согласно РСТ № WO2013/086219.
Подходящий вектор может дополнительно содержать последовательность нуклеиновой кислоты, обеспечивающую репликацию вектора в клетке-хозяине. Примеры таких последовательностей, обеспечивающих репликацию, включают точки начала репликации плазмид pUC19, pACYC177, pUB110, pE194, pAMB1, pIJ702 и тому подобные.
Подходящий вектор может также содержать селектируемый маркер, например, ген, продукт которого восполняет дефект в выделенной клетке-хозяине, такой как гены dal из B. subtilis или B. licheniformis; или ген, который придает устойчивость к антибиотикам, такую как, например, устойчивость к ампициллину, устойчивость к канамицину, устойчивость к хлорамфениколу, устойчивость к тетрациклину и тому подобное.
Подходящий вектор экспрессии обычно включает компоненты вектора для клонирования, такие как, например, элемент, который обеспечивает автономную репликацию вектора в выбранном организме-хозяине, и один или несколько фенотипически выявляемых маркеров для целей отбора. Векторы экспрессии обычно также содержат контрольные нуклеотидные последовательности, такие как, например, промотор, оператор, сайт для связывания рибосомы, сигнал инициации трансляции и необязательно ген репрессора, одну или несколько последовательностей генов-активаторов или тому подобные.
Кроме того, подходящий вектор экспрессии может дополнительно содержать последовательность, кодирующую аминокислотную последовательность, способную нацеливать белок, представляющий интерес, на органеллу клетки-хозяина, такую как пероксисома, или на конкретный компартмент клетки-хозяина. Такой нацеливающей последовательностью может являться, например, аминокислотная последовательность "SKL". Для экспрессии под управлением контрольных последовательностей последовательность нуклеиновой кислоты представляющего интерес белка может быть функционально связана с контрольными последовательностями подходящим образом, за счет чего осуществляется экспрессия.
Протоколы, такие как описанные в данном документе, применяемые для лигирования конструкции ДНК, кодирующей представляющий интерес белок, промоторы, терминаторы и/или другие элементы, и для вставки их в подходящие векторы, содержащие информацию, необходимую для репликации, хорошо известны специалистам в данной области техники.
Выделенную клетку, содержащую либо полинуклеотидную конструкцию, либо вектор экспрессии применяют преимущественно в качестве клетки-хозяина в рекомбинантном получении POI. Клетку можно трансформировать с помощью конструкции ДНК, кодирующей POI, подходящим образом с помощью интеграции конструкции (в одной или нескольких копиях) в хромосому хозяина. Интеграция, как правило, считается преимущественной, поскольку введенная таким образом последовательность ДНК, скорее всего, будет стабильно поддерживаться в клетке. Интеграция конструкций ДНК в хромосому хозяина может быть осуществлена с применением стандартных способов, например, с помощью гомологичной или гетерологичной рекомбинации. Например, в международной публикации согласно РСТ № WO2002/14490 описаны способы трансформации Bacillus, ее трансформанты и библиотеки на ее основе. Альтернативно, клетку можно трансформировать с помощью вектора экспрессии, как описано выше в связи с другими типами клеток-хозяев.
В других вариантах осуществления преимущественным является удаление генов из хозяев экспрессии, при этом дефицит генов можно устранить с помощью вектора экспрессии. Для получения бактериальной клетки-хозяина, имеющей один или несколько инактивированных генов, можно применять известные в данной области техники способы. Инактивацию генов можно осуществлять путем полной или частичной делеции, путем инсерционной инактивации или путем любых других средств, в результате чего ген прекращает функционировать по своему прямому назначению, за счет чего предотвращается экспрессия геном функционального белка.
Методики трансформации бактерий и культивирования бактерий являются стандартными и хорошо известны в данной области техники. Их можно применять для трансформации улучшенных хозяев по настоящему изобретению для получения представляющих интерес рекомбинантных белков. Введение конструкции ДНК или вектора в клетку-хозяина включает такие методики, как трансформация; электропорация; микроинъекция в ядро; трансдукция; трансфекция (например, опосредованная липофекцией и опосредованная DEAE-декстрином трансфекция); инкубация с осаждением ДНК с помощью фосфата кальция; высокоскоростная бомбардировка микрочастицами, покрытыми ДНК, генная пушка или биолистическая трансформация и слияние протопластов и тому подобное Способы трансформации и экспрессии для бактерий также раскрыты в Brigidi et al. (1990). Общий протокол трансформации и экспрессии штаммов Bacillus с удаленным геном протеазы описан в Ferrari et al. (патент США № 5264366).
Способы трансформации нуклеиновых кислот в нитчатые грибы, такие как Aspergillus spp., например, A. oryzae или A. niger, H. grisea, H. insolens и T. Reesei., хорошо известны в данной области. Подходящая процедура трансформации клеток-хозяев Aspergillus описана, например, в EP238023. Подходящая процедура трансформации клеток-хозяев Trichoderma описана, например, в Steiger et al 2011, Appl. Environ. Microbiol. 77:114-121.
Выбор продуцирующего хозяина может предусматривать любой подходящий микроорганизм, такой как бактерии, грибы и водоросли.
Как правило, выбор будет зависеть от гена, кодирующего термостабильную сериновую протеазу, и его источника.
Введение конструкции ДНК или вектора в клетку-хозяина включает такие методики, как трансформация; электропорация; микроинъекция в ядро; трансдукция; трансфекция, например, (опосредованная липофекцией и опосредованная DEAE-декстрином трансфекция); инкубация с осаждением ДНК с помощью фосфата кальция; высокоскоростная бомбардировка микрочастицами, покрытыми ДНК; и слияние протопластов. Основные пособия, в которых раскрыты общие способы, которые можно применять, включают Sambrook et al., Molecular Cloning, A Laboratory Manual (2nd ed. 1989); Kriegler, Gene Transfer and Expression: A Laboratory Manual (1990); и Ausubel et al., eds., Current Protocols in Molecular Biology (1994)). Способы трансформации по настоящему изобретению могут приводить к стабильной интеграции всего вектора для трансформации или его части в геном клетки-хозяина, такой как клетка-хозяин нитчатого гриба. Однако также рассматривается трансформация, обеспечивающая поддержание самореплицирующегося внехромосомного вектора для трансформации.
Многие стандартные способы трансфекции могут применяться для получения клеточных линий бактерий и нитчатых грибов (например, Aspergillus или Trichoderma), в которых экспрессируются большие количества протеазы. Некоторые из опубликованных способов введения конструкций ДНК в продуцирующие целлюлазу штаммы Trichoderma включают описанные в Lorito, Hayes, DiPietro and Harman, (1993) Curr. Genet. 24: 349-356; Goldman, VanMontagu and Herrera-Estrella, (1990) Curr. Genet. 17:169-174; и Penttila, Nevalainen, Ratto, Salminen и Knowles, (1987) Gene 6: 155-164, также см. патент США № 6022725; патент США № 6268328 и Nevalainen et al., "The Molecular Biology of Trichoderma and its Application to the Expression of Both Homologous and Heterologous Genes" в Molecular Industrial Mycology, Eds, Leong and Berka, Marcel Dekker Inc., NY (1992) pp. 129-148; для Aspergillus включают Yelton, Hamer and Timberlake, (1984) Proc. Natl. Acad. Sci. USA 81: 1470-1474, для Fusarium включают Bajar, Podila and Kolattukudy, (1991) Proc. Natl. Acad. Sci. USA 88: 8202-8212, для Streptomyces включают Hopwood et al., 1985, Genetic Manipulation of Streptomyces: Laboratory Manual, The John Innes Foundation, Norwich, UK, и Fernandez-Abalos et al., Microbiol 149:1623-1632 (2003), и для Bacillus включают Brigidi, DeRossi, Bertarini, Riccardi and Matteuzzi, (1990) FEMS Microbiol. Lett. 55: 135-138).
Тем не менее, можно применять любую из хорошо известных процедур введения чужеродных нуклеотидных последовательностей в клетки-хозяева. Они включают применение трансфекции с фосфатом кальция, полибрена, слияния протопластов, электропорации, биолистики, липосом, микроинъекции, плазматических векторов, вирусных векторов и любых других хорошо известных способов введения клонированной геномной ДНК, cDNA, синтетической ДНК или другого чужеродного генетического материала в клетку-хозяина (см., например, Sambrook et al. выше). Также применим способ трансфекции, опосредованной Agrobacterium, описанный в патенте США № 6255115. Необходимо только, чтобы конкретная применяемая процедура генетической инженерии могла обеспечить успешное введение по меньшей мере одного гена в клетку-хозяина, способную экспрессировать этот ген.
После введения вектора экспрессии в клетки трансфицированные или трансформированные клетки культивируют в условиях, способствующих экспрессии генов под управлением промоторных последовательностей.
Средой, применяемой для культивирования клеток, может быть любая традиционная среда, подходящая для выращивания клетки-хозяина и обеспечения экспрессии полипептида альфа-глюкозидазы. Подходящие среды и компоненты сред доступны от коммерческих поставщиков или могут быть получены в соответствии с опубликованными рецептурами (например, описанными в каталогах Американской коллекции типовых культур).
Термостабильный сериновый полипептид, секретированый из клеток-хозяев, можно применять с минимальной обработкой после получения как препарат, представляющий собой цельный бульон.
В зависимости от применяемой клетки-хозяина могут быть выполнены посттранскрипционные и/или посттрансляционные модификации. Одним из неограничивающих примеров посттранскрипционной и/или посттрансляционной модификации является "обрезание" или "усечение" полипептида. Например, это может привести к переходу термостабильной сериновой протеазы из неактивного или по сути неактивного состояния в активное состояние, как в случае пропептида, подвергающегося дополнительному посттрансляционному процессингу, в зрелый пептид, характеризующийся ферментативной активностью. В другом случае данное обрезание может привести к получению зрелого термостабильного полипептида сериновой протеазы и дальнейшему удалению N- или С-концевых аминокислот с образованием усеченных форм термостабильной сериновой протеазы, которые сохраняют ферментативную активность.
Другие примеры посттранскрипционных или посттрансляционных модификаций включают без ограничения миристоилирование, гликозилирование, усечение, липидизацию и фосфорилирование тирозина, серина или треонина. Специалисту в данной области техники будет понятно, что тип посттранскрипционных или посттрансляционных модификаций, которым может подвергаться белок, может зависеть от организма-хозяина, в котором экспрессируется белок.
В некоторых вариантах осуществления на любой какой-либо стадии процесса ферментации можно добавлять липазу и/или фитазу.
В некоторых вариантах осуществления получения отработанного цельного ферментационного бульона с рекомбинантным микроорганизмом можно достичь с применением любого способа культивирования, известного из уровня техники, приводящего к экспрессии термостабильной сериновой протеазы.
Таким образом, подразумевается, что ферментация включает культивирование во встряхиваемой колбе, мелкомасштабную или крупномасштабную ферментацию (в том числе непрерывный, периодический, периодический с подпиткой или твердофазный типы ферментации) в лабораторных или промышленных ферментерах, выполненную в подходящей среде и в условиях, обеспечивающих возможность экспрессии или выделения альфа-глюкозидазы. Термин "отработанный цельный ферментационный бульон" определен в данном документе как нефракционированное содержимое ферментационного материала, которое включает культуральную среду, внеклеточные белки (например, ферменты) и клеточную биомассу. Следует понимать, что термин "отработанный цельный ферментационный бульон" также охватывает клеточную биомассу, которая была подвергнута лизису или пермеабилизации с применением способов, хорошо известных из уровня техники.
Клетки-хозяева можно культивировать в подходящих условиях, которые обеспечивают возможность экспрессии термостабильной сериновой протеазы. Экспрессия ферментов может быть конститутивной, такой, при которой они продуцируются непрерывно, или индуцируемой, требующей стимуляции для инициирования экспрессии. В случае индуцируемой экспрессии продуцирование белка можно инициировать, когда это необходимо, путем, например, добавления в культуральную среду вещества-стимулятора, например, дексаметазона, или IPTG, или софорозы.
Любой из способов ферментации, хорошо известных в данной области техники, можно подходящим образом применять для ферментации трансформированного или производного грибкового штамма, описанного выше. В некоторых вариантах осуществления грибные клетки выращивают в условиях периодической или непрерывной ферментации.
Классическая периодическая ферментация представляет собой замкнутую систему, в которой композицию среды задают в начале ферментации и эту композицию не изменяют в ходе ферментации. В начале ферментации среду инокулируют требуемым(требуемыми) организмом(организмами). Другими словами, весь процесс ферментации происходит без добавления каких-либо компонентов в систему ферментации в течение всего периода.
В качестве альтернативы, периодическая ферментация определяется как "периодическая" в отношении добавления источника углерода. Кроме того, часто предпринимаются попытки контролировать такие факторы, как рН и концентрация кислорода в процессе ферментации. Обычно композиции метаболитов и биомассы периодической системы постоянно изменяются вплоть до момента прекращения ферментации. В периодических культурах клетки проходят через статическую лаг-фазу в экспоненциальную фазу усиленного роста и, наконец, в стационарную фазу, где скорость роста уменьшается или останавливается. Необработанные клетки в стационарной фазе в конечном итоге погибают. Как правило, клетки в экспоненциальной фазе отвечают за основную часть продуцирования продукта. Подходящим вариантом стандартной периодической системы является система "периодической ферментации с подпиткой". В этом варианте типичной периодической системы субстрат добавляют постепенно, по мере того, как проходит ферментация. Периодические системы с подпиткой пригодны, если известно, что катаболитная репрессия будет подавлять метаболизм клеток, и/или в случае, когда желательно иметь ограниченное количество субстратов в ферментационной среде. Измерение фактической концентрации субстрата в периодических системах с подпиткой затруднено, и поэтому ее оценивают на основании изменений измеряемых факторов, таких как pH, растворенный кислород и парциальное давление отходящих газов, таких как CO2. Периодический и периодический с подпиткой типы ферментации хорошо известны из уровня техники.
Непрерывная ферментация является еще одним известным способом ферментации. Она представляет собой открытую систему, в которой определенную ферментационную среду непрерывно добавляют в биореактор и равное количество кондиционированной среды одновременно удаляют на переработку. При непрерывной ферментации культуры, как правило, поддерживают при постоянной плотности, где клетки преимущественно находятся в экспоненциальной фазе роста. Непрерывная ферментация позволяет модулировать один или несколько факторов, влияющих на рост клеток и/или концентрацию продукта. Например, лимитирующее питательное вещество, такое как источник углерода или источник азота, может поддерживаться на фиксированном уровне, а всем другим параметрам позволяют снижаться. В других системах ряд факторов, влияющих на рост, может изменяться непрерывно, тогда как концентрация клеток, измеряемая по мутности среды, поддерживается постоянной. В непрерывных системах стремятся поддерживать устойчивые условия роста. Таким образом, потеря клеток из-за извлечения среды должна быть пропорциональной скорости роста клеток при ферментации. Способы модуляции питательных веществ и факторов роста для непрерывных способов ферментации, а также методики увеличения до максимума скорости образования продукта хорошо известны в области промышленной микробиологии.
Методики разделения и концентрирования известны из уровня техники, и традиционные способы можно применять для получения концентрированного раствора или бульона, содержащего полипептид термостабильной сериновой протеазы по настоящему изобретению.
После ферментации получают ферментационный бульон, удаляют микробные клетки и различные взвешенные твердые вещества, в том числе остаточные сырьевые материалы для ферментации, с помощью традиционных методик разделения с целью получения раствора, содержащего термостабильную сериновую протеазу. Как правило, применяют фильтрацию, центрифугирование, микрофильтрацию, вакуум-фильтрацию во вращающемся барабане, ультрафильтрацию, центрифугирование с последующей ультрафильтрацией, экстракцией или хроматографией или тому подобное.
Иногда для оптимизации извлечения может быть необходимым концентрирование раствора или бульона, содержащего полипептид, представляющий собой альфа-глюкозидазу. Применение неконцентрированных растворов или бульона обычно увеличивает время инкубации для сбора осадка обогащенного или очищенного фермента.
Раствор, содержащий фермент, можно концентрировать с применением традиционных методик концентрирования до тех пор, пока не будет достигнут требуемый уровень фермента. Концентрирование раствора, содержащего фермент, может быть достигнуто с помощью методик, описанных в данном документе. Примеры способов обогащения и очистки включают без ограничения вакуум-фильтрацию во вращающемся барабане и/или ультрафильтрацию.
Раствор или бульон, содержащий термостабильную сериновую протеазу, можно концентрировать до тех пор, пока активность фермента концентрированного раствора или бульона, содержащего термостабильную сериновую протеазу, не будет на необходимом уровне.
Концентрирование можно осуществлять, например, с помощью осаждающего средства, такого как осаждающее средство на основе галогенидов металлов. Осаждающие средства на основе галогенидов металлов включают без ограничения хлориды щелочных металлов, бромиды щелочных металлов, смеси двух или более из данных галогенидов металлов.
Иллюстративные галогениды металлов включают хлорид натрия, хлорид калия, бромид натрия, бромид калия и смеси двух или более из этих галогенидов металлов. Осаждающее средство на основе галогенидов металлов, хлорид натрия, также можно использовать в качестве консерванта. Для извлечения в промышленном масштабе полипептиды термостабильной сериновой протеазы могут быть обогащены или частично очищены, как в целом описано выше, путем удаления клеток посредством флокуляции с полимерами. Альтернативно, фермент может быть обогащен или очищен с помощью микрофильтрации с последующим концентрированием ультрафильтрацией с применением доступных мембран и оборудования. Однако для некоторых путей применения не требуется обогащение и очистка фермента, при этом цельный культуральный бульон можно подвергнуть лизису и использовать без дополнительной обработки. Фермент можно перерабатывать, например, в гранулы.
Термостабильные сериновые протеазы можно выделять или очищать с помощью различных способов, известных специалистам в данной области техники, в зависимости от того, какие другие компоненты присутствуют в образце. Стандартные способы очистки включают без ограничения хроматографию (например, ионнообменную, аффинную, гидрофобную, хроматофокусирование, иммунологическую и эксклюзионную хроматографию), электрофоретические способы (например, препаративное изоэлектрическое фокусирование), дифференциальную растворимость (например, осаждение сульфатом аммония), экстракционную микрофильтрацию, двухфазное разделение и кристаллизацию. Например, белок, представляющий интерес, может быть очищен с применением стандартной колонки с антителом к белку, представляющему интерес. Также применимы методики ультрафильтрации и диафильтрации в сочетании с концентрированием белка. Что касается общего руководства по подходящим методикам очистки, см. Scopes, Protein Purification (1982). Степень необходимой очистки будет варьироваться в зависимости от применения белка, представляющего интерес. В некоторых случаях очистка не потребуется.
Хорошо известны анализы для выявления и оценки ферментативной активности фермента по настоящему изобретению. Специалистам в данной области также известны различные анализы для выявления и измерения активности протеаз (таких как полипептиды термостабильной сериновой протеазы, описанные в данном документе). В частности, для измерения протеазной активности доступны анализы, которые основаны на высвобождении кислото-растворимых пептидов из казеина или гемоглобина, измеренном как поглощение при 280 нм, или колориметрически с применением метода Фолина и гидролиза меченного красителем азоказеина, измеренного как поглощение при 440-450 нм.
Другие иллюстративные анализы включают солюбилизацию хромогенных субстратов (см., например, Ward, "Proteinases," в Fogarty (ed.)., "Microbial Enzymes and Biotechnology", Applied Science, London, [1983], pp. 251-317). Также можно применять способ анализа выявления протеазы с применением в высокой степени меченого флуоресцеинизотиоцианатом (FITC) казеина в качестве субстрата, модифицированный вариант процедуры, описанный Twining [Twining, S.S., (1984) "Fluorescein Isothiocyanate-Labeled Casein Assay for Proteolytic Enzymes" Anal. Biochem. 143:30-34].
Другие иллюстративные анализы включают без ограничения расщепление казеина на растворимые в трихлоруксусной кислоте пептиды, содержащие остатки тирозина и триптофана, с последующей реакцией с реагентом Фолина-Чокальтеу и колориметрическим выявлением продуктов при 660 нм, расщепление с внутренним гашением посредством FRET (резонансного переноса энергии флуоресценции) пептидных субстратов с последующим выявлением продукта с помощью флуорометра. Резонансный перенос энергии флуоресценции (FRET) представляет собой неизлучающий перенос энергии от возбужденного флуорофора (или донора) на подходящую гасящую (или акцепторную) молекулу. FRET используется во множестве путей применения, в том числе при измерении протеазной активности в отношении субстратов, в которых флуорофор отделен от гасителя короткой пептидной последовательностью, содержащей сайт для расщепления ферментом. Протеолиз пептида вызывает флуоресценцию, когда флуорофор и гаситель отделяются. В ряде дополнительных литературных источников, известных специалистам в данной области техники, представлены подходящие способы (см., например, Wells et al., Nucleic Acids Res. 11:7911-7925 [1983]; Christianson et al., Anal. Biochem. 223:119 -129 [1994]; и Hsia et al., Anal Biochem. 242:221-227 [1999]).
В еще одном аспекте раскрыты корм, кормовой продукт, композиция, представляющая собой кормовую добавку, премикс, пищевой или зерновой продукт, содержащие термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10, либо отдельно, либо в комбинации с по меньшей мере одним пробиотиком.
По меньшей мере один DFM содержит по меньшей мере один жизнеспособный микроорганизм, такой как жизнеспособный бактериальный штамм, или жизнеспособные дрожжи, или жизнеспособные грибы. Предпочтительно DFM содержит по меньшей мере одну жизнеспособную бактерию.
Не исключено, что DFM может представлять собой спорообразующий бактериальный штамм, и, таким образом, термин "DFM" может включать или предусматривать споры, например, бактериальные споры. Таким образом, используемый в данном документе термин "жизнеспособный микроорганизм" может включать споры микроорганизмов, такие как эндоспоры или конидии. В качестве альтернативы, DFM в композиции, представляющей собой кормовую добавку, описанной в данном документе, может не состоять из спор микроорганизмов, например, эндоспор или конидий, или может не содержать их.
Микроорганизм может представлять собой встречающийся в природе микроорганизм, или он может представлять собой трансформированный микроорганизм.
Описанный в данном документе DFM может содержать микроорганизмы из одного или нескольких следующих родов: Lactobacillus, Lactococcus, Streptococcus, Bacillus, Pediococcus, Enterococcus, Leuconostoc, Carnobacterium, Propionibacterium, Bifidobacterium, Clostridium и Megasphaera и их комбинаций.
Предпочтительно DFM содержит один или несколько бактериальных штаммов, выбранных из следующих Bacillus spp: Bacillus subtilis, Bacillus cereus, Bacillus licheniformis, Bacillus pumilis и Bacillus amyloliquefaciens.
Род "Bacillus", используемый в данном документе, включает в себя все виды в пределах рода "Bacillus", известные специалистам в данной области, в том числе без ограничения B. subtilis, B. licheniformis, B. lentus, B. brevis, B. stearothermophilus, B. alkalophilus, B. amyloliquefaciens, B. clausii, B. halodurans, B. megaterium, B. coagulans, B. circulans, B. gibsonii, B. pumilis и B. thuringiensis. Считается, что род Bacillus продолжает претерпевать таксономическую реорганизацию. Таким образом, подразумевается, что этот род включает виды, которые были переклассифицированы, в том числе без ограничения такие организмы, как Bacillus stearothermophilus, который в настоящее время называется "Geobacillus stearothermophilus", или Bacillus polymyxa, который в настоящее время называется "Paenibacillus polymyxa". Образование устойчивых эндоспор в стрессовых условиях окружающей среды считается определяющей чертой рода Bacillus, хотя эта характеристика также присуща недавно названным Alicyclobacillus, Amphibacillus, Aneurinibacillus, Anoxybacillus, Brevibacillus, Filobacillus, Gracilibacillus, Halobacillus, Paenibacillus, Salibacillus, Thermobacillus, Ureibacillus, и Virgibacillus.
В другом аспекте DFM можно дополнительно сочетать со следующими Lactococcus spp: Lactococcus cremoris и Lactococcus lactis, и их комбинациями.
DFM можно дополнительно сочетать со следующими: Lactobacillus spp: Lactobacillus buchneri, Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus kefiri, Lactobacillus bifidus, Lactobacillus brevis, Lactobacillus helveticus, Lactobacillus paracasei, Lactobacillus rhamnosus, Lactobacillus salivarius, Lactobacillus curvatus, Lactobacillus bulgaricus, Lactobacillus sakei, Lactobacillus reuteri, Lactobacillus fermentum, Lactobacillus farciminis, Lactobacillus lactis, Lactobacillus delbreuckii, Lactobacillus plantarum, Lactobacillus paraplantarum, Lactobacillus farciminis, Lactobacillus rhamnosus, Lactobacillus crispatus, Lactobacillus gasseri, Lactobacillus johnsonii и Lactobacillus jensenii, и комбинациями любых из них.
В еще одном аспекте DFM можно дополнительно сочетать со следующими: Bifidobacteria spp: Bifidobacterium lactis, Bifidobacterium bifidium, Bifidobacterium longum, Bifidobacterium animalis, Bifidobacterium breve, Bifidobacterium infantis, Bifidobacterium catenulatum, Bifidobacterium pseudocatenulatum, Bifidobacterium adolescentis, и Bifidobacterium angulatum, и любыми их комбинациями.
Можно упомянуть бактерии следующих видов: Bacillus subtilis, Bacillus licheniformis, Bacillus amyloliquefaciens, Bacillus pumilis, Enterococcus , Enterococcus spp, и Pediococcus spp, Lactobacillus spp, Bifidobacterium spp, Lactobacillus acidophilus, Pediococsus acidilactici, Lactococcus lactis, Bifidobacterium bifidum, Bacillus subtilis, Propionibacterium thoenii, Lactobacillus farciminis, Lactobacillus rhamnosus, Megasphaera elsdenii, Clostridium butyricum, Bifidobacterium animalis ssp. animalis, Lactobacillus reuteri, Bacillus cereus, Lactobacillus salivarius ssp. Salivarius, Propionibacteria sp, и их комбинации.
Пробиотик, описанный в данном документе, содержащий один или несколько бактериальных штаммов, может представлять собой один и тот же тип (род, вид и штамм) или может содержать смесь родов, видов и/или штаммов.
В альтернативном случае DFM можно сочетать с одним или несколькими продуктами или микроорганизмами, содержащимися в данных продуктах, раскрытых в WO2012110778 и обобщенных следующим образом: Bacillus subtilis, штамм 2084, № доступа B-50013 в NRRl; Bacillus subtilis, штамм LSSAO1, № доступа B-50104 в NRRL; и Bacillus subtilis, штамм 15A-P4, № доступа PTA-6507 в ATCC (из Enviva Pro®. (ранее известный как Avicorr®); Bacillus subtilis, штамм C3102 (от Calsporin®); Bacillus subtilis, штамм PB6 (от Clostat®); Bacillus pumilis (8G-134); Enterococcus NCIMB 10415 (SF68) (от Cylactin®); Bacillus subtilis, штамм C3102 (от Gallipro® & GalliproMax®); Bacillus licheniformis (от Gallipro®Tect®); Enterococcus и Pediococcus (от Poultry star®); Lactobacillus, Bifidobacterium и/или Enterococcus от Protexin®); Bacillus subtilis , штамм QST 713 (от Proflora®); Bacillus amyloliquefaciens, CECT-5940 (от Ecobiol® & Ecobiol® Plus); Enterococcus faecium, SF68 (от Fortiflora®); Bacillus subtilis и Bacillus licheniformis (от BioPlus2B®); молочнокислые бактерии 7 Enterococcus faecium (от Lactiferm®); штамм Bacillus (от CSI®); Saccharomyces cerevisiae (от Yea-Sacc®); Enterococcus (от Biomin IMB52®); Pediococcus acidilactici, Enterococcus, Bifidobacterium animalis ssp. animalis, Lactobacillus reuteri, Lactobacillus salivarius ssp. salivarius (от Biomin C5®); Lactobacillus farciminis (от Biacton®); Enterococcus (от Oralin E1707®); Enterococcus (2 штамма), Lactococcus lactis, DSM 1103 (от Probios-pioneer PDFM®); Lactobacillus rhamnosus и Lactobacillus farciminis (от Sorbiflore®); Bacillus subtilis (от Animavit®); Enterococcus (от Bonvital®); Saccharomyces cerevisiae (от Levucell SB 20®); Saccharomyces cerevisiae (от Levucell SC 0 & SC10® ME); Pediococcus acidilacti (от Bactocell); Saccharomyces cerevisiae (от ActiSaf® (ранее BioSaf®)); Saccharomyces cerevisiae, NCYC Sc47 (от Actisaf® SC47); Clostridium butyricum (от Miya-Gold®); Enterococcus (от Fecinor и Fecinor Plus®); Saccharomyces cerevisiae, NCYC R-625 (от InteSwine®); Saccharomyces cerevisia (от BioSprint®); Enterococcus и Lactobacillus rhamnosus (от Provita®); Bacillus subtilis и Aspergillus oryzae (от PepSoyGen-C®); Bacillus cereus (от Toyocerin®); Bacillus cereus var. toyoi, NCIMB 40112/CNCM I-1012 (от TOYOCERIN®), или другие DFM, такие как Bacillus licheniformis и Bacillus subtilis (от BioPlus® YC) и Bacillus subtilis (от GalliPro®).
DFM можно сочетать с Enviva® PRO, который является коммерчески доступным от Danisco A/S. Enviva Pro® представляет собой комбинацию Bacillus , штамм 2084, № доступа B-50013 в NRRl, Bacillus, штамм LSSAO1, № доступа B-50104 в NRRL, и Bacillus, штамм 15A-P4, № доступа PTA-6507 в ATCC (как указано в US 7754469 B, включенном в данный документ посредством ссылки).
Также можно сочетать DFM, описанный в данном документе, с дрожжами рода Saccharomyces spp.
Предпочтительно DFM, описанный в данном документе, содержит микроорганизмы, которые в целом признаны безопасными (GRAS) и предпочтительно имеют подтвержденный статус GRAS.
Специалист в данной области техники располагает информацией о конкретных видах и/или штаммах микроорганизмов из родов, описанных в данном документе, которые применяются в пищевой и/или сельскохозяйственной отраслях промышленности и которые в целом считаются подходящими для потребления животными.
В некоторых вариантах осуществления важно, чтобы DFM был устойчив к нагреванию, т. е. являлся термостойким. Это особенно актуально, если корм сформирован в гранулы. Таким образом, в другом варианте осуществления DFM может представлять собой термостойкий микроорганизм, такой как термостойкие бактерии, в том числе, например, Bacillus spp.
В других аспектах может быть предпочтительно, чтобы DFM содержал спорообразующие бактерии, такие как Bacilli, например, Bacillus spp. Бациллы способны образовывать стабильные эндоспоры, когда условия для роста неблагоприятны, и они являются очень устойчивыми к высоким температурам, pH, влажности и дезинфицирующим средствам.
DFM, описанный в данном документе, может обеспечивать уменьшение патогенных микроорганизмов (таких как Clostridium perfringens и/или E. coli, и/или Salmonella spp, и/или Campylobacter spp.) или предотвращение их установления в кишечнике. Другими словами, DFM может являться антипатогенным. Используемый в данном документе термин "антипатогенный" означает, что DFM компенсирует эффект (отрицательный эффект) патогена.
Как описано выше, DFM может представлять собой любой подходящий DFM. Например, следующий анализ, "анализ DFM" можно применять для определения того, подходит ли микроорганизм для того, чтобы являться DFM. Анализ DFM, используемый в данном документе, более подробно объясняется в US2009/0280090. В целях избежания сомнений DFM, выбранный в качестве подавляющего штамма (или антипатогенного DFM) в соответствии с "анализом DFM", показанным в данном документе, является подходящим DFM для применения в соответствии с настоящим изобретением, т. е. в композиции, представляющей собой кормовую добавку в соответствии с настоящим изобретением.
Каждую пробирку засевали иллюстративным патогеном (например, бактериями) из иллюстративного кластера.
Супернатант из потенциального DFM, выращенного аэробным или анаэробным путем, добавляют в засеянные пробирки (за исключением контроля, к которому не добавляют супернатант) и инкубируют. После инкубации измеряют оптическую плотность (OD) контрольных и обработанных супернатантом пробирок в случае каждого патогена.
Колонии (потенциальные DFM) штаммов, которые обеспечивали пониженное значение OD по сравнению с контролем (который не содержал супернатанта), затем можно классифицировать как подавляющий штамм (или антипатогенный DFM). Таким образом, анализ DFM, применяемый в данном документе, более подробно объясняется в US2009/0280090.
Предпочтительно иллюстративный патоген, применяемый в данном анализе DFM, может представлять собой одно (или несколько) из следующего: Clostridium, такой как Clostridium perfringens и/или Clostridium difficile, и/или E. coli, и/или Salmonella spp, и/или Campylobacter spp. В одном предпочтительном варианте осуществления анализ проводят с одним или несколькими Clostridium perfringens, и/или Clostridium difficile, и/или E. coli, предпочтительно Clostridium perfringens и/или Clostridium difficile, более предпочтительно Clostridium perfringens.
Антипатогенные DFM включают одну или несколько из следующих бактерий и описаны в WO2013029013: штамм 3BP5 Bacillus subtilis, № доступа NRRL B-50510,
штамм 918 Bacillus subtilis, № доступа ATCC NRRL B-50508, и
штамм 1013 Bacillus subtilis, № доступа ATCC NRRL B-50509.
DFM можно получать в виде культуры (культур) и носителя(носителей) (если применимо) и можно вносить в ленточную или лопастную мешалку и смешивать в течение приблизительно 15 минут, однако время можно увеличивать или уменьшать. Компоненты смешивают таким образом, что в результате получают однородную смесь культур и носителей. Конечный продукт предпочтительно представляет собой сухой сыпучий порошок. DFM, содержащие один или несколько бактериальных штаммов, можно затем добавлять в корм для животных или кормовой премикс, добавлять в воду для животных или вводить другими путями, известными из уровня техники (предпочтительно одновременно с ферментами, описанными в данном документе.
Включение отдельных штаммов в смесь DFM можно производить в пропорциях в диапазоне от 1% до 99% и предпочтительно от 25% до 75%.
Подходящие дозировки DFM в корме для животных могут варьироваться от приблизительно 1×103 КОЕ/г корма до приблизительно 1×1010 КОЕ/г корма, подходящим образом от приблизительно 1×104 КОЕ/г корма до приблизительно 1×108 КОЕ/г корма, подходящим образом от приблизительно 7,5×104 КОЕ/г корма до приблизительно 1×107 КОЕ/г корма.
В другом аспекте DFM можно дозировать в кормовом продукте в концентрации более приблизительно 1×103 КОЕ/г корма, подходящим образом более приблизительно 1×104 КОЕ/г корма, подходящим образом более приблизительно 5×104 КОЕ/г корма или подходящим образом более приблизительно 1×105 КОЕ/г корма.
DFM можно дозировать в композиции, представляющей собой кормовую добавку, от приблизительно 1×103 КОЕ/г композиции до приблизительно 1×1013 КОЕ/г композиции, предпочтительно от 1×105 КОЕ/г композиции до приблизительно 1×1013 КОЕ/г композиции, более предпочтительно от приблизительно 1×106 КОЕ/г композиции до приблизительно 1×1012 КОЕ/г композиции и наиболее предпочтительно от приблизительно 3,75×107 КОЕ/г композиции до приблизительно 1×1011 КОЕ/г композиции. В другом аспекте DFM можно дозировать в композиции, представляющей собой кормовую добавку, в концентрации более приблизительно 1×105 КОЕ/г композиции, предпочтительно более приблизительно 1×106 КОЕ/г композиции и наиболее предпочтительно более приблизительно 3,75×107 КОЕ/г композиции. В одном варианте осуществления DFM дозируют в композиции, представляющей собой кормовую добавку, в концентрации более приблизительно 2×105 КОЕ/г композиции, подходящим образом более приблизительно 2×106 КОЕ/г композиции, подходящим образом более приблизительно 3,75×107 КОЕ/г композиции.
композиция, представляющая собой кормовую добавку, для применения в кормах для животных может содержать термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO:3, 8 или 10, применяемую или отдельно или в комбинации с по меньшей мере одним пробиотиком и по меньшей мере одним компонентом, выбранным из группы, состоящей из белка, пептида, сахарозы, лактозы, сорбита, глицерина, пропиленгликоля, хлорида натрия, сульфата натрия, ацетата натрия, цитрата натрия, формиата натрия, сорбата натрия, хлорида калия, сульфата калия, ацетата калия, цитрата калия, формиата калия, ацетат калия, сорбата калия, хлорида магния, сульфата магния, ацетата магния, цитрата магния, формиата магния, сорбата магния, метабисульфита натрия, метилпарабена и пропилпарабена.
В еще одном аспекте раскрыта гранулированная композиция, представляющая собой кормовую добавку, для применения в кормах для животных, содержащая термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10, применяемую либо отдельно, либо в комбинации с по меньшей мере одним пробиотиком, где гранулированная композиция, представляющая собой кормовую добавку, содержит частицы, полученные с помощью способа, выбранного из группы, состоящей из гранулирования с высоким усилием сдвига, барабанного гранулирования, экструзии, сферонизации, агломерации в псевдоожиженном слое, нанесения покрытия распылением в псевдоожиженном слое, распылительной сушки, лиофилизации, приллирования, охлаждения распылением, пульверизации с помощью вращающегося диска, коацервации, таблетирования или любой комбинации вышеуказанных способов.
Кроме того, частицы гранулированной композиции, представляющей собой кормовую добавку, могут иметь средний диаметр более 50 микрон и менее 2000 микрон.
композиция, представляющая собой кормовую добавку, может находиться в жидкой форме, и жидкая форма также может быть подходящей для распылительной сушки в отношении кормовой гранулы.
Корма для животных могут включать растительный материал, такой как кукуруза, пшеница, сорго, соевые бобы, канола, подсолнечник или смеси любого из этих растительных материалов, или источники растительных белков для домашней птицы, свиней, жвачных животных, аквакультуры и домашних животных. Предполагается, что будут улучшены показатели продуктивности животных, такие как рост, потребление корма и эффективность корма, а также улучшена его однородность, снижена концентрация аммиака в помещении для животных и, следовательно, улучшено качество жизни и состояние здоровья животных. Более конкретно, используемое в данном документе выражение "продуктивность животного" может определяться эффективностью корма, и/или приростом массы тела животного, и/или коэффициентом кормоотдачи, и/или перевариваемостью питательных веществ в корме (например, перевариваемостью аминокислот), и/или усваиваемой энергией или метаболической энергией в корме, и/или удержанием азота, и/или способностью животных избегать неблагоприятных воздействий некротического энтерита, и/или иммунным ответом субъекта.
Предпочтительно "продуктивность животного" определяется эффективностью корма, и/или приростом массы тела животного, и/или коэффициентом кормоотдачи.
Под "улучшенной продуктивностью животного" подразумевается, что наблюдается увеличенная эффективность корма, и/или увеличенный прирост массы тела, и/или уменьшенный коэффициент кормоотдачи, и/или улучшенная усвояемость питательных веществ или энергии в корме, и/или улучшенное удержание азота, и/или улучшенная способность избегать отрицательных эффектов некротического энтерита, и/или улучшенный иммунный ответ у субъекта в результате применения композиции, представляющей собой кормовую добавку, по настоящему изобретению в корме по сравнению с кормом, который не содержит указанной композиции, представляющей собой кормовую добавку.
Предпочтительно под "улучшенной продуктивностью животного" подразумевается, что имеет место повышенная эффективность корма, и/или повышенный прирост массы тела, и/или сниженный коэффициент кормоотдачи. Используемый в данном документе термин "эффективность корма" относится к величине прироста массы тела у животного, которая имеет место, когда животное питается ad-libitum или поедает определенное количество пищи в течение определенного периода времени.
Под "увеличенной эффективностью корма" подразумевается, что применение композиции, представляющей собой кормовую добавку, по настоящему изобретению в корме приводит в результате к повышенному приросту массы тела на единицу потребляемого корма по сравнению с животным, питающегося без применения композиции, представляющей собой кормовую добавку.
Используемый в данном документе термин "коэффициент кормоотдачи" означает количество корма, скармливаемого животному для увеличения массы животного на определенную величину.
Улучшенный коэффициент кормоотдачи означает более низкий коэффициент кормоотдачи.
Под "более низким коэффициентом кормоотдачи" или "улучшенным коэффициентом кормоотдачи" подразумевается, что применение композиции, представляющей собой кормовую добавку, в корме приводит в результате к меньшему количеству корма, которое требуется для скармливания животному, чтобы повысить массу животного на определенную величину, по сравнению с количеством корма, необходимым для повышения массы животного на ту же величину, если корм не содержит указанной композиции, представляющей собой кормовую добавку.
Используемый в данном документе термин "усвояемость питательных веществ" означает долю питательных веществ, которая исчезает из желудочно-кишечного тракта или определенного участка желудочно-кишечного тракта, например, тонкого кишечника. Усвояемость питательных веществ можно измерить как разницу между тем, что вводят субъекту, и тем, что выходит с фекалиями субъекта, или между тем, что вводят субъекту, и тем, что остается в содержимом определенного участка желудочно-кишечного тракта, например, в подвздошной кишке.
Усвояемость питательных веществ, используемую в данном документе, можно измерить по разнице между поглощением питательного вещества и выделенным питательным веществом с помощью полного сбора экскрементов в течение определенного периода времени; или с использованием инертного маркера, который не абсорбируется животным и позволяет исследователю рассчитывать количество питательного вещества, которое исчезло во всем желудочно-кишечном тракте или в участке желудочно-кишечного тракта. Такой инертный маркер может представлять собой диоксид титана, оксид хрома или нерастворимую в кислоте золу. Усвояемость можно выразить в виде процентного содержания питательного вещества в корме, или в виде единиц массы усваиваемого питательного вещества на единицы массы питательного вещества в корме.
Усвояемость питательных веществ, применяемая в данном документе, охватывает усвояемость крахмала, усвояемость жиров, усвояемость белка и усвояемость аминокислот.
Усвояемость энергии при использовании в данном документе означает валовую энергию потребляемого корма за вычетом валовой энергии фекалий, или валовую энергию потребляемого корма за вычетом валовой энергии оставшегося содержимого в определенном участке желудочно-кишечного тракта животного, например, в подвздошной кишке. Обменная энергия при использовании в данном документе относится к кажущейся обменной энергии и означает валовую энергию потребляемого корма за вычетом валовой энергии, содержащейся в фекалиях, моче и газообразных продуктах пищеварения. Усвояемость энергии и обменную энергию можно измерить как разницу между потреблением валовой энергии и валовой энергией, выделенной с фекалиями или содержимым, присутствующим в определенном участке желудочно-кишечного тракта, с применением тех же способов, что и для измерения усвояемости питательных веществ, с соответствующими поправками на выведение азота для расчета обменной энергии корма.
В некоторых вариантах осуществления композиции, описанные в данном документе, могут обеспечивать повышение усвояемости или утилизации пищевой гемицеллюлозы или клетчатки у субъекта. В некоторых вариантах осуществления субъект представляет собой свинью.
Удержание азота при использовании в данном документе означает способность субъекта удерживать азот из рациона, что обуславливает прирост массы тела. Отрицательный баланс азота встречается тогда, когда выведение азота превышает суточное потребление, и часто наблюдается при потере мышечной массы. Положительный баланс азота часто ассоциируется с ростом мышц, особенно у растущих животных.
Удержание азота можно измерить как разницу между потреблением азота и выделенным азотом посредством полного сбора экскрементов и мочи в течение определенного периода времени. Понятно, что выделяемый азот включает непереваренный белок корма, эндогенные белковые выделения, микробный белок и азот мочи.
Термин "выживаемость", используемый в данном документе, означает количество особей, оставшихся в живых. Термин "улучшенная выживаемость" может служить вариантом выражения "сокращенная смертность".
Используемый в данном документе термин "выход туши" означает величину туши по отношению к живой массе тела после процесса убоя с коммерческой или экспериментальной целью. Термин "туша" означает тело животного, которое забито для применения в пищу с удалением головы, внутренностей, части конечностей и перьев или кожи. Используемый в данном документе термин "выход мяса" означает количество годного к употреблению в пищу мяса по отношению к живой массе тела или количество определенного мяса, вырезанного по отношению к живому весу тела.
"Повышенный прирост массы" относится к животному с увеличенной массой тела при использовании корма, содержащего композицию, представляющую собой кормовую добавку, по сравнению с животным, которое кормят без использования указанной композиции, представляющей собой кормовую добавку.
Используемый в данном документе термин "животное" включает всех нежвачных и жвачных животных. В конкретном варианте осуществления животное представляет собой нежвачное животное, такое как лошадь и животное с однокамерным желудком. Примеры животных с однокамерным желудком включают без ограничения свиней и домашних свиней, таких как поросята, свиньи на доращивании, свиноматки; домашнюю птицу, такую как индейки, утки, куры, бройлерные цыплята, несушки; рыбу, такую как лосось, форель, тилапия, сомы и карпы; и ракообразных, таких как мелкие креветки и крупные креветки. В дополнительном варианте осуществления животное представляет собой жвачное животное, в том числе без ограничения крупный рогатый скот, молодых телят, коз, овец, жирафов, бизонов, лосей, вапити, яков, индийских буйволов, оленей, верблюдов, альпак, лам, антилоп, вилорогов и антилоп-нилгау.
В настоящем контексте предполагается, что термин "корм для животных" означают корм для домашних животных, таких как без ограничения собаки, кошки, песчанки, хомяки, шиншиллы, необычные крысы, морские свинки; домашние птицы, такие как канарейки, длиннохвостые попугаи и попугаи; домашние рептилии, такие как черепахи, ящерицы и змеи; водные домашние животные, такие как тропические рыбки и лягушки.
Термины "композиция корма для животных", "корм", "кормовой продукт" и "фураж" используются взаимозаменяемо и могут включать один или несколько кормовых материалов, выбранных из группы, включающей a) зерновые культуры, такие как мелкозерные (например, пшеницу, ячмень, рожь, овес и их комбинации) и/или крупнозерновые, такие как маис или сорго; b) побочные продукты от переработки зерновых культур, такие как кукурузная глютеновая мука, сухая барда с растворимыми веществами (DDGS) (в частности сухая барда с растворимыми веществами на основе кукурузы (cDDGS)), пшеничные отруби, пшеничная крупка, пшеничные мелкие отруби, рисовые отруби, рисовая шелуха, овсяная шелуха, ядро кокосового ореха и цитрусовый жом; c) белок, полученный из источников, таких как соя, подсолнечник, арахис, люпин, виды гороха, конские бобы, хлопчатник, канола, рыбная мука, сухой белок плазмы крови, мясо-костная мука, картофельный белок, сыворотка, копра, кунжут; d) масла и жиры, полученные из растительных и животных источников и/или e) минералы и витамины.
Термостабильные сериновые протеазы, описанные в данном документе, или композиции, представляющей собой кормовую добавку, могут быть использованы в качестве корма или при его получении. Термины "композиция, представляющая собой кормовую добавку" и "композиция на основе ферментов" используются в данном документе взаимозаменяемо.
Кормовой продукт может быть в форме раствора или в виде твердого вещества или полутвердого вещества в зависимости от применения, и/или способа применения, и/или способа введения.
В случае применения в качестве корма, такого как функциональный корм, или при его получении композицию на основе ферментов или композицию, представляющую собой кормовую добавку, описанную в данном документе, можно применять в сочетании с одним или несколькими из приемлемого в пищевом отношении носителя, приемлемого в пищевом отношении разбавителя, приемлемого в пищевом отношении наполнителя, приемлемого в пищевом отношении вспомогательного вещества, активного в пищевом отношении ингредиента. Например, упоминается по меньшей мере один компонент, выбранный из группы, состоящей из белка, пептида, сахарозы, лактозы, сорбита, глицерина, пропиленгликоля, хлорида натрия, сульфата натрия, ацетата натрия, цитрата натрия, формиата натрия, сорбата натрия, хлорида калия, сульфата калия, ацетата калия, цитрата калия, формиата калия, сорбата калия, хлорида магния, сульфата магния, ацетата магния, цитрата магния, формиата магния, сорбата магния, метабисульфита натрия, метилпарабена и пропилпарабена.
В предпочтительном варианте осуществления композицию на основе ферментов или композицию, представляющую собой кормовую добавку, по настоящему изобретению смешивают с кормовым компонентом с образованием кормового продукта. Используемый в данном документе термин "кормовой компонент" означает весь кормовой продукт или его часть. Часть кормового продукта может означать один составляющий компонент кормового продукта или более чем один составляющий компонент кормового продукта, например, 2, или 3, или 4, или более. В одном варианте осуществления термин "кормовой компонент" охватывает премикс или составляющие компоненты премикса. Предпочтительно корм может представлять собой фураж или его премикс, комбикорм или его премикс. Композицию, представляющую собой кормовую добавку, можно смешивать с комбикормом, компонентом комбикорма, или премиксом комбикорма, или фуражом, компонентом фуража, или премиксом фуража.
Любой кормовой продукт, описанный в данном документе, может включать один или несколько кормовых материалов, выбранных из группы, содержащей a) злаки, такие как мелкозерные (например, пшеницу, ячмень, рожь, овес, тритикале и их комбинации) и/или крупнозерновые, такие как маис или сорго; b) побочные продукты от переработки зерновых, такие как кукурузная глютеновая мука, влажная барда (в частности, влажная барда на основе кукурузы), сухая барда (DDG) (в частности, сухая барда на основе кукурузы (cDDG)), сухая барда с растворимыми веществами (DDGS) (в частности, сухая барда с растворимыми веществами на основе кукурузы (cDDGS)), пшеничные отруби, пшеничная крупка, пшеничные мелкие отруби, рисовые отруби, рисовая шелуха, овсяная шелуха, ядро кокосового ореха и цитрусовый жом; c) белок, полученный из таких источников, как соя, подсолнечник, арахис, люпин, виды гороха, конские бобы, хлопчатник, канола, рыбная мука, сухой белок плазмы, мясо-костная мука, картофельный белок, сыворотка, копра, кунжут; d) масла и жиры, полученные из растительных и животных источников; e) минералы и витамины.
Термин "фураж", используемый в данном документе, означает любую пищу, которую дают животному (в отличие от пищи, которую животное добывает самостоятельно). Фураж охватывает растения, которые были срезаны. Более того, фураж включает силос, прессованные и гранулированные корма, масла и смешанные рационы, а также проросшие зерновые и бобовые.
Фураж может быть получен из одного или нескольких растений, выбранных из: кукурузы (маиса), люцерны (люцерны посевной), ячменя, ледвенца рогатого, представителей рода капусты, капусты огородной сорта Chau moellier, кормовой капусты, семени рапса (канолы), репы (брюквы), турнепса, клевера, гибридного клевера, красного клевера, подземного клевера, белого клевера, овсяницы, костра, проса, овса, сорго, соевых бобов, деревьев (побегов подстриженных деревьев для древесного сена), пшеницы и бобовых.
Термин "комбикорм" означает промышленный корм в форме муки, гранулы, орешков, жмыха или крошки. Комбикорма можно смешивать с использованием различного сырья и добавок. Эти смеси составляют в соответствии с конкретными требованиями для целевого животного.
Комбикорма могут быть полными кормами, которые обеспечивают все суточно необходимые питательные вещества, концентратами, которые обеспечивают часть рациона (белковую, энергетическую), или добавками, которые обеспечивают только дополнительные питательные микроэлементы, такие как минералы и витамины
Основными ингредиентами, применяемыми в комбикорме, являются кормовые зерновые, которые включают кукурузу, пшеницу, каноловый шрот, рапсовый шрот, люпин, соевые бобы, сорго, овес и ячмень.
В подходящем случае премикс, как обозначается в данном документе, может быть композицией, состоящей из микроингредиентов, таких как витамины, минералы, химические консерванты, антибиотики, продукты ферментации и другие необходимые ингредиенты. Премиксами обычно являются композиции, подходящие для смешивания с промышленными рационами.
В одном варианте осуществления кормовой продукт содержит кукурузу, DDGS (такую как cDDGS), пшеницу, пшеничные отруби или любую их комбинацию, или состоит из них.
В одном варианте осуществления кормовой компонент может представлять собой кукурузу, DDGS (например, cDDGS), пшеницу, пшеничные отруби или их комбинацию. В одном варианте осуществления кормовой продукт содержит кукурузу, DDGS (такую как cDDGS) или их комбинацию, или состоит из них.
Кормовой продукт, описанный в данном документе, может содержать по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50% или по меньшей мере 60% по весу кукурузной и соевой муки или кукурузы и необезжиренной сои, или пшеничной муки, или кормовой муки из жмыха семян подсолнечника.
Например, кормовой продукт может содержать от приблизительно 5 до приблизительно 40% кукурузной DDGS. Для домашней птицы кормовой продукт может содержать в среднем от приблизительно 7 до приблизительно 15% кукурузной DDGS. Для домашних свиней (свиней) кормовой продукт может содержать в среднем 5-40% кукурузной DDGS. Он также может содержать кукурузу в виде цельного зерна, и в этом случае кормовой продукт может содержать от приблизительно 35% до приблизительно 80% кукурузы.
В кормовых продуктах, содержащих зерновую смесь, например, содержащих кукурузу и пшеницу, например, кормовой продукт может содержать по меньшей мере 10% кукурузы.
Дополнительно или в качестве альтернативы кормовой продукт также может содержать по меньшей мере один кормовой материал с высоким содержанием клетчатки и/или по меньшей мере один продукт переработки по меньшей мере одного кормового материала c высоким содержанием клетчатки для получения кормового продукта с высоким содержанием клетчатки. Примеры кормовых материалов с высоким содержанием клетчатки включают пшеницу, ячмень, рожь, овес, побочные продукты от переработки зерновых, такие как кукурузная глютеновая мука, кукурузный глютеновый кормовой продукт, влажная барда, сухая барда (DDG), сухая барда с растворимыми веществами (DDGS), пшеничные отруби, пшеничная крупка, пшеничные мелкие отруби, рисовые отруби, рисовая шелуха, овсяная шелуха, ядро кокосового ореха и цитрусовый жом. Некоторые источники белка также можно рассматривать как источники с высоким содержанием клетчатки: белок, полученный из таких источников, как подсолнечник, люпин, конские бобы и хлопчатник. В одном аспекте кормовой продукт, описанный в данном документе, содержит по меньшей мере один материал с высоким содержанием клетчатки и/или по меньшей мере один побочный продукт от переработки по меньшей мере одного кормового материала c высоким содержанием клетчатки, выбранный из группы, состоящей, например, из сухой барды с растворимыми веществами (DDGS), в частности, cDDGS, влажной барды, сухой барды (DDG), в частности, cDDG, пшеничных отрубей и пшеницы. В одном варианте осуществления изобретения кормовой продукт по настоящему изобретению содержит по меньшей мере один материал с высоким содержанием клетчатки и/или по меньшей мере один побочный продукт от переработки по меньшей мере одного кормового материала c высоким содержанием клетчатки, выбранный из группы, состоящей, например, из сухой барды с растворимыми веществами (DDGS), в частности, cDDGS, пшеничных отрубей и пшеницы.
Корм может представлять собой один или несколько из следующего: комбикорм и премикс, в том числе гранулы, орешки или жмых (для крупного рогатого скота); сельскохозяйственная культура или остатки сельскохозяйственных культур: кукуруза, соевые бобы, сорго, овес, ячмень, копра, солома, мякина, отходы сахарной свеклы; рыбная мука; мясо-костная мука; меласса; масличный жмых и прессованный жмых; олигосахариды; консервированные кормовые растения: силос; водоросли; семена и зерна, цельные или полученные дроблением, измельчением и т. д.; проросшие зерновые и бобовые; экстракт дрожжей.
Используемый в данном документе термин "корм" охватывает в некоторых вариантах осуществления корм для домашних животных. Корм для домашних животных представляет собой материал растительного или животного происхождения, предназначенный для потребления домашними животными, такой как корм для собак или корм для кошек. Корм для домашних животных, такой как корм для собак и кошек, может быть либо в сухой форме, такой как гранулированный корм для собак, либо во влажной консервированной форме. Корм для кошек может содержать аминокислоту таурин.
Корм для животных может также включать корм для рыб. Корм для рыб обычно содержит питательные макроэлементы, микроэлементы и витамины, необходимые для поддержания здоровья рыб, содержащихся в неволе. Корм для рыб может быть в форме хлопьевидной частицы, гранулы или таблетки. Гранулированные формы, некоторые из которых быстро тонут в воде, часто используют для более крупных видов рыб или видов, питающихся на дне. Некоторые корма для рыб также содержат добавки, такие как бета-каротин или половые гормоны для искусственного усиления окраски и узора рыб.
В еще одном аспекте корм для животных охватывает корм для птиц. Корм для птиц включает пищу, которую используют как в кормушках для птиц, так и для кормления комнатных птиц. Обычно корм для птиц содержит разные семена, но также может включать нутряное сало (говяжий или бараний жир).
Используемый в данном документе термин "приведенный в контакт" относится к опосредованному или непосредственному применению фермента, представляющего собой термостабильную сериновую протеазу (или композиции, содержащей термостабильную сериновую протеазу), по отношению к продукту (например, корму). Примеры способов применения, которые можно использовать, включают без ограничения обработку продукта в материале, содержащем композицию, представляющую собой кормовую добавку, непосредственное применение путем смешивания композиции, представляющей собой кормовую добавку, с продуктом, нанесение распылением композиции, представляющей собой кормовую добавку, на поверхность продукта или погружение продукта в препарат на основе композиции, представляющей собой кормовую добавку. В одном варианте осуществления композицию, представляющую собой кормовую добавку, по настоящему изобретению предпочтительно смешивают с продуктом (например, кормовым продуктом). В качестве альтернативы композицию, представляющую собой кормовую добавку, можно включать в эмульсию или сырьевые ингредиенты кормового продукта. Для некоторых путей применения важно, чтобы композиция была доступна на поверхности или для поверхности продукта, подлежащего воздействию/обработке. Это позволяет улучшить характеристики композиции.
В некоторых аспектах описанные термостабильные сериновые протеазы используются для предварительной обработки пищевых продуктов или кормов. Например, корм, характеризующийся 10-300% влажностью, смешивают и инкубируют с протеазами при 5-80°C, предпочтительно при 25-50°C, более предпочтительно при 30-45°C в течение периода от 1 мин. до 72 часов в аэробных условиях или от 1 дня до 2 месяцев в анаэробных условиях. Предварительно обработанный материал можно скармливать непосредственно животным (так называемое жидкое кормление). Предварительно обработанный материл можно также подвергнуть гранулированию паром при повышенным температурах, составляющих 60-120°C. Протеазами могут быть пропитаны кормовой или пищевой материал с помощью вакуумной установки для нанесения покрытий.
Термостабильные сериновые протеазы (или композицию, содержащую термостабильные сериновые протеазы) можно применять для вкрапления, покрытия и/или пропитывания продукта (например, кормового продукта или сырьевых ингредиентов кормового продукта) контролируемым количеством указанного фермента.
Предпочтительно композиция, представляющая собой кормовую добавку, будет термостабильной в отношении термической обработки до приблизительно 70°C; до приблизительно 85°C или до приблизительно 95°C. Термическую обработку можно проводить в течение периода до приблизительно 1 минуты; до приблизительно 5 минут; до приблизительно 10 минут; до приблизительно 30 минут; до приблизительно 60 минут. Термин термостабильный означает, что по меньшей мере приблизительно 75% ферментных компонентов и/или DFM, которые присутствовали/были активны в добавке перед нагреванием до определенной температуры, по-прежнему присутствуют/являются активными после ее охлаждения до комнатной температуры. Предпочтительно по меньшей мере приблизительно 80% протеазного компонента и/или DFM, содержащего один или несколько бактериальных штаммов, которые присутствовали и являлись активными в добавке перед нагреванием до указанной температуры, все еще присутствует и являются активными после охлаждения до комнатной температуры. В особенно предпочтительном варианте осуществления композицию, представляющую собой кормовую добавку, гомогенизируют с получением порошка.
В качестве альтернативы композицию, представляющую собой кормовую добавку, составляют в виде гранул, как описано в WO2007/044968 (называемых гранулами TPT), включенной в данный документ посредством ссылки.
В другом предпочтительном варианте осуществления, когда композицию, представляющую собой кормовую добавку, составляют в виде гранул, эти гранулы содержат гидратированную барьерную соль, покрывающую белковое ядро. Преимуществом такого солевого покрытия является улучшенная термоустойчивость, улучшенная стабильность при хранении и защита от других кормовых добавок, в противном случае неблагоприятно воздействующих на по меньшей мере одну протеазу и/или DFM, содержащий один или несколько бактериальных штаммов. Предпочтительно соль, используемая для солевого покрытия, характеризуется активностью воды, составляющей более 0,25, или постоянной влажностью более 60% при 20°C. Предпочтительно солевое покрытие содержит Na2SO4.
Способ получения композиции, представляющей собой кормовую добавку, также может предусматривать дополнительную стадию гранулирования порошка. Порошок можно смешивать с другими компонентами, известными из уровня техники. Порошок или смесь, содержащую порошок, можно продавливать через форму, а полученные нити разрезать на подходящие гранулы различной длины.
Способ получения термостабильных сериновых протеаз (или композиции, содержащей термостабильные сериновые протеазы) также может предусматривать дополнительную стадию гранулирования порошка. Порошок можно смешивать с другими компонентами, известными из уровня техники. Порошок или смесь, содержащую порошок, можно продавливать через форму, а полученные нити разрезать на подходящие гранулы различной длины.
Необязательно стадия гранулирования может включать обработку паром или стадию кондиционирования перед формированием гранул. Смесь, содержащую порошок, можно поместить в кондиционирующее устройство, например смеситель со впрыском пара. Смесь нагревают в кондиционирующем устройстве до заданной температуры, например, 60-100°C, типичные температуры будут составлять 70°C, 80°C, 85°C, 90°C или 95°C. Время пребывания может варьироваться от секунд до минут и даже часов. Например, 5 секунд, 10 секунд, 15 секунд, 30 секунд, 1 минута, 2 минуты, 5 минут, 10 минут, 15 минут, 30 минут и 1 час. Понятно, что термостабильные сериновые протеазы (или композиции, содержащие термостабильные сериновые протеазы), описанные в данном документе, подходят для добавления в любой подходящий кормовой материал.
Специалисту в данной области техники будет понятно, что разные животные нуждаются в разных кормовых продуктах, и даже одному и тому же животному могут требоваться различные кормовые продукты в зависимости от цели, ради которой выращивают животное.
Необязательно кормовой продукт может также содержать дополнительные минералы, такие как, например, кальций и/или дополнительные витамины. В некоторых вариантах осуществления кормовой продукт представляет собой смесь кукурузной и соевой муки.
Кормовой продукт обычно получают в кормодробилках, в которых сырьевые материалы сначала измельчают до подходящего размера частиц, а затем смешивают с соответствующими добавками. Затем кормовой продукт может быть получен в виде кашицы или гранул; причем в отношении последних, как правило, предусматривается способ, при котором температуру повышают до заданного уровня, а затем корм пропускают через матрицу с получением гранул конкретного размера. Гранулам позволяют остыть. Впоследствии можно добавлять жидкие добавки, такие как жир и фермент. Получение кормового продукта также может включать дополнительную стадию, которая включает экструзию или разбухание перед осуществлением гранулирования, в частности, с помощью подходящих методик, которые могут включать по меньшей мере применение пара.
Кормовой продукт может представлять собой кормовой продукт для животных с однокамерным желудком, таких как домашняя птица (например, бройлер, несушка, несушки бройлерного типа, индейка, утка, гуси, водоплавающая птица) и домашняя свинья (все возрастные категории), жвачных животных, таких как крупный рогатый скот (например, коров или быков (в том числе телят)), лошадей, овец, домашних животных (например, собак, кошек) или рыбы (например, рыбы без желудка, рыбы с желудком, пресноводной рыбы, такой как лосось, треска, форель и карп, например карп кои, морской рыбы, такой как морской окунь, и ракообразных, таких как мелкие креветки, мидии и гребешки). Предпочтительно кормовой продукт предназначен для домашней птицы.
Композицию, представляющую собой кормовую добавку, и/или содержащий ее кормовой продукт можно использовать в любой подходящей форме. Композицию, представляющую собой кормовую добавку, можно применять в форме твердых или жидких препаратов или их альтернативных вариантов. Примеры твердых препаратов включают порошки, пасты, болюсы, капсулы, гранулы, таблетки, присыпки и гранулы, которые могут быть смачиваемыми, высушенными распылительной сушкой или лиофилизированными. Примеры жидких препаратов включают без ограничения водные, органические или водно-органические растворы, суспензии и эмульсии.
В некоторых путях применения композиции, представляющие собой кормовую добавку, можно смешивать с кормом или вводить в питьевую воду.
Композиция, представляющая собой кормовую добавку, предусматривает добавление протеазы, как рассмотрено в данном документе, с приемлемыми в пищевом отношении носителем, разбавителем или наполнителем, и (необязательно) упаковку.
Кормовой продукт и/или композицию, представляющую собой кормовую добавку, можно объединять c по меньшей мере одним минералом и/или по меньшей мере одним витамином. Полученные таким образом композиции могут упоминаться в данном документе как премикс.
В некоторых вариантах термостабильная сериновая протеаза может присутствовать в кормовом продукте в диапазоне от 1 ppb (частей на миллиард) до 10% (вес/вес) в пересчете на чистый белок фермента. В некоторых вариантах осуществления протеаза присутствует в кормовом продукте в диапазоне 1-100 ppm (частей на миллион). Предпочтительная доза может составлять 1-20 г термостабильной сериновой протеазы на тонну кормового продукта или кормовой композиции или конечную дозу 1-20 ppm термостабильной сериновой протеазы в конечном продукте.
Предпочтительно термостабильная сериновая протеаза, присутствующая в кормовом продукте, должна составлять по меньшей мере приблизительно 200 PU/кг или по меньшей мере приблизительно 300 PU/кг корма или по меньшей мере приблизительно 400 PU/кг корма, или по меньшей мере приблизительно 500 PU/кг корма, или по меньшей мере приблизительно 600 PU/кг корма, по меньшей мере приблизительно 700 PU/кг корма, по меньшей мере приблизительно 800 PU/кг корма, по меньшей мере приблизительно 900 PU/кг корма, или по меньшей мере приблизительно 1000 PU/кг корма, или по меньшей мере приблизительно 1500PU/кг корма, или по меньшей мере приблизительно 2000 PU/кг корма, или по меньшей мере приблизительно 2500 PU/кг корма, или по меньшей мере приблизительно 3000 PU/кг корма, или по меньшей мере, приблизительно 3500 PU/кг корма, или по меньшей мере, приблизительно 4000 PU/кг корма, или по меньшей мере приблизительно 4500 PU/кг корма, или по меньшей мере приблизительно 5000 PU/кг корма.
В другом аспекте термостабильная сериновая протеаза может присутствовать в кормовом продукте при содержании менее приблизительно 60000 PU/кг корма, или менее приблизительно 70000PU/кг корма, или менее приблизительно 80000PU/кг корма, или при содержании менее приблизительно 90000PU/кг корма, или при содержании менее приблизительно 100000PU/кг корма, или менее приблизительно 200000PU/кг корма, или менее приблизительно 60000PU/кг корма, или менее приблизительно 70000 PU/кг корма.
Диапазоны могут включать без ограничения любую комбинацию нижних и верхних пределов диапазонов, рассмотренных выше.
Следует понимать, что одна протеазная единица (PU) представляет собой количество фермента, которое высвобождает 2,3 микрограмма фенольного соединения (выраженного в эквивалентах тирозина) из казеинового субстрата в минуту при рН 10,0 при 50°С. Это можно назвать анализом для определения 1 PU.
Составы, содержащие любую из термостабильных сериновых протеаз, и композиции, описанные в данном документе, можно получить любым подходящим способом с гарантией того, что состав будет содержать активные ферменты. Такие составы могут представлять собой жидкость, сухой порошок или гранулу. Предпочтительно композиция, представляющая собой кормовую добавку, находится в жидкой форме, подходящей для высушивания распылением на кормовой грануле.
Сухой порошок или гранулы могут быть получены с помощью способов, известных специалистам в данной области техники, таких как гранулирование с высоким усилием сдвига, барабанное гранулирование, экструзия, сферонизация, агломерация в псевдоожиженном слое, нанесение покрытия распылением в псевдоожиженном слое.
Термостабильные сериновые протеазы и композиции, описанные в данном документе, могут иметь покрытие, например, быть инкапсулированными. В одном варианте осуществления покрытие защищает ферменты от воздействия тепла и может считаться термозащитным средством.
Композиция, представляющая собой кормовую добавку, описанная в данном документе, может быть составлена в виде сухого порошка или гранул, как описано в WO2007/044968 (называемых гранулами TPT), или WO1997/016076, или WO1992/012645 (каждый из которых включен в данный документ посредством ссылки).
В одном варианте осуществления композиция, представляющая собой кормовую добавку, может быть составлена в виде гранулы для кормовых композиций, содержащей ядро, активное средство и по меньшей мере одно покрытие, при этом активное средство в грануле сохраняет по меньшей мере 50% активность, по меньшей мере 60% активность, по меньшей мере 70% активность, по меньшей мере 80% активность после воздействия условий, выбранных из одного или нескольких из: a) процесса гранулирования корма, b) процесса предварительной обработки корма с нагреванием паром, c) хранения, d) хранения в качестве ингредиента в основной смеси и e) хранения в качестве ингредиента в кормовой основной смеси или кормовом премиксе, содержащих по меньшей мере одно соединение, выбранное из микроэлементов, органических кислот, восстанавливающих сахаров, витаминов, холинхлорида и соединений, которые обеспечивают образование кислой или основной кормовой основной смеси или кормового премикса.
Что касается гранулы, то по меньшей мере одно покрытие может содержать увлажняющий гидратирующий материал, который составляет по меньшей мере 55% вес/вес гранулы; и/или по меньшей мере одно покрытие может содержать два покрытия. Эти два покрытия могут представлять собой увлажняющее гидратирующее покрытие и влагоудерживающее покрытие. В некоторых вариантах осуществления увлажняющее гидратирующее покрытие может составлять от 25% до 60% вес/вес гранулы, а влагоудерживающее покрытие может составлять от 2% до 15% вес/вес гранулы. Увлажняющее гидратирующее покрытие может быть выбрано из неорганических солей, сахарозы, крахмала и мальтодекстрина, а влагоудерживающее покрытие может быть выбрано из полимеров, смол, молочной сыворотки и крахмала.
Гранула может быть получена с помощью способа гранулирования корма, и способ предварительной обработки корма можно осуществлять при температуре от 70°C до 95°C в течение нескольких минут, например, при температуре от 85°C до 95°C.
Композиция, представляющая собой кормовую добавку, может быть составлена в виде гранулы для корма для животных, содержащей: ядро; активное средство, при этом активное средство в грануле сохраняет по меньшей мере 80% активность после хранения и после осуществления способа гранулирования с нагреванием паром, где гранула представляет собой ингредиент; влагоудерживающее покрытие и увлажняющее гидратирующее покрытие, которое составляет по меньшей мере 25% вес/вес гранулы, при этом гранула характеризуется активностью воды менее 0,5 перед осуществлением способа гранулирования с нагреванием паром.
Гранула может иметь влагоудерживающее покрытие, выбранное из полимеров и смол, а увлажняющий гидратирующий материал может представлять собой неорганическую соль. Увлажняющее гидратирующее покрытие может составлять от 25% до 45% вес/вес гранулы, а влагоудерживающее покрытие может составлять от 2% до 10% вес/вес гранулы.
Гранула может быть получена с помощью способа гранулирования с нагреванием паром, который можно осуществлять при температуре от 85°C до 95°C в течение периода до нескольких минут.
В качестве альтернативы композиция находится в виде жидкого состава, подходящего для потребления, причем предпочтительно такая потребляемая жидкость содержит одно или несколько из следующего: буфер, соль, сорбит и/или глицерин.
Кроме того, композиция, представляющая собой кормовую добавку, может быть составлена путем нанесения, например распыления, фермента(ферментов) на подложку-носитель, такую как, например, молотая пшеница.
В одном варианте осуществления композиция, представляющая собой кормовую добавку, может быть составлена в виде премикса. Только в качестве примера премикс может содержать один или несколько кормовых компонентов, таких как один или несколько минералов и/или один или несколько витаминов.
В одном варианте осуществления пробиотик ("DFM") и/или термостабильные сериновые протеазы составлены с по меньшей мере одним физиологически приемлемым носителем, выбранным из по меньшей мере одного из мальтодекстрина, известняка (карбоната кальция), циклодекстрина, пшеницы или компонента пшеницы, сахарозы, крахмала, Na2SO4, талька, PVA, сорбита, бензоата, сорбата, глицерина, сахарозы, пропиленгликоля, 1,3-пропандиола, глюкозы, парабенов, хлорида натрия, цитрата, ацетата, фосфата, кальция, метабисульфита, формиата и их смесей.
В другом варианте осуществления раскрыт способ гидролиза крахмалсодержащего материала, предусматривающий:
(а) приведение крахмалсодержащего материала в контакт с жидкостью с образованием затора и
(b) осуществление гидролиза крахмала в заторе с образованием разжиженной фракции путем приведения затора в контакт со смесью ферментов, содержащей термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10.
Кроме того, смесь ферментов может содержать по меньшей мере один фермент, выбранный из группы, состоящей из альфа-амилазы, амилоглюкозидазы, фитазы, пуллуланазы, бета-глюканазы, целлюлазы и ксиланазы.
Любой из этих ферментов можно применять в количестве в диапазоне от 0,5 до 500 микрограмм/г корма или кормового продукта.
Альфа-амилазы (альфа-1,4-глюкан-4-глюканогидролаза, EC 3.2.1.1.) гидролизуют внутренние альфа-1,4-глюкозидные связи в крахмале, в основном случайным образом, с образованием декстранов с более низкой молекулярной массой. Эти полипептиды используются, помимо прочего, в переработке крахмала и производстве спирта. Можно применять любые альфа-амилазы, например, описанные в патентах США №№ 8927250 и 7354752.
Амилоглюкозидаза последовательно катализирует гидролиз 1,4-связанных на конце альфа-
D-глюкозных остатков с отщеплением от невосстанавливающих концов мальтоолиго- и полисахаридов с высвобождением бета-D-глюкозы. Можно применять любую амилоглюкозидазу.
Под фитазой понимают белок или полипептид, который способен катализировать гидролиз фитата до (1) миоинозита и/или (2) моно-, ди-, три-, тетра- и/или пентафосфатов и (3) неорганического фосфата. Например, ферменты, характеризующиеся каталитической активностью, определены под номером EC 3.1.3.8 или номером EC 3.1.3.26 Комиссии по ферментам. Можно применять любую фитазу, такую как описанная в патентах США №№8144046, 8673609 и 8053221.
Пуллуланаза (EC 3.2.1.41) представляет собой определенную разновидность глюканазы, амилолитический экзофермент, который расщепляет пуллан (полисахаридный полимер, состоящий из мальтотриозных структурных единиц, также известный как альфа-1,4-; альфа-1,6-глюкан. Таким образом, она представляет собой пример деветвящего фермента. Пуллуланаза также известна как пуллулан-6-глюкангидролаза. Пуллуланазы, как правило, секретируются видами Bacillus. Например, Bacillus deramificans (патент США № 5817498; 1998), Bacillus acidopullulyticus (Европейский патент № 0063909) и Bacillus naganoensis (патент США № 5055403). Ферменты, обладающие пуллуланазной активностью, коммерчески применяемые, получают, например, из видов Bacillus (торговое название OPITMAX® l-100 от DuPont-Genencor и Promozyme® D2 от Novozymes). Другие примеры деветвящих ферментов включают без ограничения изоамилазу из Sulfolobus solfataricus, Pseudomonas sp. и термостабильную пуллуланазу из Fervidobacterium nodosum (например, WO2010/76113). Изоамилаза из Pseudomonas sp. доступна в качестве очищенного фермента от Megazyme International. Можно применять любую пуллуланазу.
Глюканазы представляют собой ферменты, которые расщепляют глюкан, полисахарид, образованный несколькими субъединицами глюкозы. Поскольку они осуществляют гидролиз глюкозидной связи, то они являются гидролазами.
Ферменты, представляющие собой бета-глюканазы (EC 3.2.1.4), расщепляют клетчатку. Они способствуют расщеплению растительных стенок (целлюлозы).
Целлюлазы представляют собой любой из нескольких ферментов, продуцируемых грибами, бактериями и простейшими, которые катализируют целлюлолиз, разложение целлюлозы и некоторых родственных полисахаридов. Данное название также используется для любой встречающейся в природе смеси или комплекса различных таких ферментов, которые действуют последовательно или синергически с разложением целлюлозного материала. Можно применять любые целлюлазы.
Ксиланаза (EC 3.2.1.8) является названием, данным классу ферментов, которые разрушают линейный полисахарид бета-1,4-ксилан в ксилозу, при этом они расщепляют гемицеллюлозу, один из основных компонентов растительных клеточных стенок. Можно применять любые ксиланазы.
Крахмал или амил представляет собой полимерный углевод, состоящий из большого количества глюкозных единиц, соединенных гликозидными связями. Крахмал может быть гидролизован в более простые углеводы с помощью кислот, различных ферментов или комбинации того и другого.
В промышленности крахмал превращают в сахара, например, путем осолаживания, и ферментируют для получения этанола в производстве пива, виски и биотоплива.
Можно применять любой подходящий крахмалсодержащий материал. Исходный материал обычно выбирают на основании необходимого продукта ферментации. Примеры крахмалсодержащих материалов включают без ограничения цельные зерна, кукурузу, пшеницу, ячмень, рожь, майло, саго, маниоку, тапиоку, сорго, рис, горох, бобы или их смеси, или полученные из них крахмалы, или злаки. Исходный материал может быть сухим твердым веществом, таким как без ограничения сухое твердое вещество корма или кормового продукта, описанных в данном документе. Также рассматриваются восковые и невосковые типы кукурузы и ячменя. Крахмалсодержащие материалы, применяемые для получения этанола, представляют собой кукурузу или пшеницу. Изначально крахмал собирают из зерен растений с применением мокрого измельчения, сухого измельчения или сухого размола.
Субстрат, содержащий растительный материал, восстанавливают или измельчают с помощью способов, известных в данной области техники. Растительный материал может быть получен из пшеницы, кукурузы, ржи, сорго (майло), риса, проса, ячменя, тритикале, маниоки (тапиоки), картофеля, батата, сахарной свеклы, сахарного тростника и бобовых, таких как соя и горох. Предпочтительный растительный материал включает кукурузу, ячмень, пшеницу, рис, майло и их комбинации. Растительный материал может включать гибридные сорта и генетически модифицированные сорта (например, трансгенную кукурузу, ячмень или сою, содержащие гетерологичные гены).
Любая часть растения, содержащая крахмал, может быть использована для получения разжиженной фракции, в том числе без ограничения такие части растения, как листья, стебли, скорлупа, шелуха, клубни, початки, зерна и тому подобное. Предпочтительные цельные зерна включают кукурузу, пшеницу, рожь, ячмень, сорго и их комбинации. В других вариантах осуществления крахмал может быть получен из фракционированных зерен злаков, в том числе клетчатки, эндосперма и/или компонентов зародыша. Способы фракционирования растительного материала, такого как кукуруза и пшеница, известны из области техники. В некоторых вариантах осуществления растительный материал, полученный из разных источников, может быть смешан друг с другом (например, кукуруза и майло или кукуруза и ячмень). Способы измельчения хорошо известны в данной области техники, и приведена ссылка на The Alcohol Textbook: A Reference for the Beverage, Fuel and Industrial Alcohol Industries 3rd ED. K.A. Jacques et al., Eds, (1999) Nottingham University Press. См. главы 2 и 4.
В некоторых вариантах осуществления растительный материал, независимо от того, уменьшен ли размер его частиц посредством измельчения или другого способа, будут объединять с раствором с образованием взвеси, содержащей крахмальный субстрат. В некоторых вариантах осуществления взвесь может включать побочный поток от переработки крахмала, такой как возвратный поток. В некоторых вариантах осуществления взвесь будет содержать 15-55% ds (например, 20-50%, 25-45%, 25-40% и 20-35%). В некоторых вариантах осуществления взвесь может содержать от 10% до 60% возвратного потока. Взвесь, содержащая восстановленный растительный материал, можно подвергнуть способу разжижения, при котором во время стадии разжижения можно добавлять альфа-амилазу. В результате получают разжиженную фракцию. Для получения разжиженной фракции к взвеси можно добавлять однократную или дробную дозу альфа-амилазы. Специалист в данной области может легко определить эффективную дозировку альфа-амилазы для применения в способах разжижения.
Количество альфа-амилазы, применяемой для разжижения, представляет собой количество, эффективное для обеспечения разжижения большей части крахмала. В других вариантах осуществления количество является эффективным для обеспечения разжижения более 40% крахмала, в том числе 50%, 60%, 70%, 80%, 90% и 100%. В некоторых вариантах осуществления диапазон будет составлять от 0,05 до 50 AAU/г ds (единицы альфа-амилазы на грамм сухих твердых веществ (например, корма или кормового продукта, такого как кукуруза), также от 0,1 до 20 AAU/г ds, а также от 1,0 до 10 AAU/г ds. В других вариантах осуществления дозировка альфа-амилазы будет находиться в диапазоне от 0,01 до 10,0 кг/метрическая тонна (МТ)ds; также от 0,05 до 5,0 кг/MT ds; а также от 0,1 до 4,0 кг/MT ds.
Альфа-амилазу можно добавлять при температуре на 0-30°С ниже температуры клейстеризации крахмала гранулированного крахмала из восстановленного растительного материала. Эта температура может составлять от 0 до 25°С, от 0 до 20°С, от 0 до 15°С и от 0 до 10°С ниже температуры клейстеризации крахмала. Это конкретное значение будет варьироваться и зависит от типа зерна, составляющего взвесь. Например, температура клейстеризации крахмала кукурузы обычно выше, чем температура клейстеризации крахмала ржи или пшеницы. В некоторых вариантах осуществления температура будет составлять от 45 до 80°C, также от 50 до 75°C, также от 50 до 72°C, а в некоторых вариантах температура будет ниже 68°C; ниже 65°С, ниже 62°С, ниже 60°С, а также ниже 55°С. В других вариантах осуществления температура будет выше 40°С, выше 45°С, выше 50°С и выше 55°С. В некоторых предпочтительных вариантах температура инкубации будет составлять от 58 до 72°С, а также от 60 до 68°С.
В некоторых вариантах осуществления взвесь будет поддерживаться в диапазоне рН от приблизительно 3,0 до менее 6,5, также в диапазоне рН от 4,0 до менее 6,2, также в диапазоне рН от приблизительно 4,5 до менее 6,0 и предпочтительно при рН в диапазоне приблизительно от 5,0 до 6,0 (например, от приблизительно 5,4 до 5,8), и измельченное зерно во взвеси будет приведено в контакт с композицией на основе ферментов в течение периода времени от 2 минут до 8 часов (например, от 5 мин. до 3 ч.; от 15 мин. до 2,5 ч. и от 30 мин. до 2 ч.). На следующем этапе инкубированный субстрат будет разжижен путем воздействия на инкубированный субстрат повышенной температуры, например, на 0-55°С выше температуры клейстеризации крахмала. (например, от 65°C до 120°C, от 70°C до 110°C, от 70°C до 90°C) в течение периода времени от 2 минут до 8 часов (например, от 2 мин. до 6 ч., от 5 мин. до 4 ч. и предпочтительно от 1 ч. до 2 ч.) при рН от приблизительно 4,0 до 6,5. В некоторых вариантах осуществления температуру можно повысить до температуры приблизительно 85-90°С, и можно применять однократную дозу альфа-амилазы. Если температура повышается выше 90-105°C, вторую дозу альфа-амилазы можно добавлять после того, как температура вернется к нормальной. В дополнительном варианте осуществления температуру можно повышать до приблизительно 105-140°С и можно применять дробную дозу альфа-амилазы, при этом одну часть добавлять до повышения температуры, а другую часть добавлять после снижения температуры до по меньшей мере ниже 105°С, в том числе ниже 104, 103, 102, 101, 100, 99, 98, 97, 96, 95, 94, 93, 92 и 91°С, но предпочтительно ниже 90°С. В некоторых вариантах осуществления полученную разжиженную фракцию охлаждают перед осахариванием.
Полученная, как описано выше, разжиженная фракция, может быть приведена в контакт с глюкоамилазой, кислотоустойчивой альфа-амилазой и кислой грибковой протеазой (такой как FERMGEN™, DuPont или AP1 от CTE Global) в однократной дозе или дробной дозе при условии, что поддерживается необходимое соотношение ферментов. Таким образом, дробная доза означает, что общая доза в необходимом соотношении добавляется более чем одной порцией, в том числе двумя порциями или тремя порциями. В одном варианте осуществления одну порцию общей дозы добавляют в начале, а вторую часть добавляют в указанное время в ходе процесса. В одном варианте осуществления по меньшей мере порцию дозы добавляют в начале осахаривания (или SSF), чтобы начать процесс осахаривания. В одном варианте осуществления каждый фермент в композиции на основе ферментов можно добавлять к разжиженной фракции отдельно, но одновременно или достаточно близко по времени, так что соотношение активности сохраняется. Альтернативно, композицию на основе смеси ферментов, содержащую глюкоамилазу, кислотоустойчивую альфа-амилазу и кислую грибковую протеазу, можно добавлять во время одного из осахаривания и ферментации или и того и другого. Соотношение глюкоамилазы, кислотоустойчивой альфа-амилазы и кислой грибковой протеазы предпочтительно составляет от приблизительно 1:1,5:0,1 до приблизительно 1:8:1 и более предпочтительно от приблизительно 1:2:0,2 до 1:5: 0,6, как измерено с помощью GAU:SSU:SAPU.
Процесс осахаривания или SSF обычно предусматривает добавление мочевины или аммиака, применяемых как источник азота для организма-хозяина (такого как без ограничения дрожжи). В промышленных установках по производству этанола добавление источника азота (такого как мочевина) во время осахаривания или SSF обычно составляет от 200 до 1000 ppm, например, по меньшей мере от 200, 300, 400, 500, 600, 700, 800, 900 до 1000 ppm мочевины. Другим богатым источником азота для установки по производству этанола являются кукурузные белки, присутствующие в зерне кукурузы. Этот источник азота становится доступным для ферментирующего организма, когда он гидролизуется до более мелких фрагментов, таких как небольшие пептиды и аминокислоты.
Как описано в данном документе, неожиданно и непредсказуемо было обнаружено, что когда термостабильная сериновая протеаза, такая как ME3, присутствует на стадии разжижения способа получения продуктов ферментации из материалов, содержащих крахмал, необходимость добавления источника азота во время осахаривания или SSF уменьшается по на меньшей мере 30%, 40%, 50, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% или полностью исключается (100% уменьшения). Это указывает на то, что термостабильная сериновая протеаза, которая характеризуется по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательностей с SEQ ID NO: 3, 8 или 10 (например, без ограничения ME-3, описанная в данном документе), может гидролизовать белки кукурузы до такой степени, что это позволяет ферментирующему организму использовать кукурузные белки как источник азота. Следовательно, на стадии SSF можно добавлять меньшее количество мочевины или вообще не добавлять мочевину. Сильное уменьшение или устранение источника азота обеспечивает работу установки с меньшими затратами.
Кроме того, это указывает на то, что присутствие протеазы, отличной от термостабильной сериновой протеазы, которая характеризуется по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10 (например, без ограничения ME-3, описанная в данном документе) в процессе ферментации может не требоваться.
Процесс осахаривания может длиться от 12 до 120 часов. Однако осахаривание, как правило, проводят от 30 минут до 2 часов, а затем завершают осахаривание во время ферментации. Иногда это упоминается как одновременное осахаривание и ферментация (SSF). Осахаривание обычно осуществляют при температурах от 30 до 65°С и, как правило, при рН от 3,0 до 5,0, в том числе от 4,0 до 5,0. Осахаривание может привести к получению ферментируемых сахаров.
В некоторых вариантах осуществления ферментируемые сахара подвергают ферментации с помощью ферментирующих микроорганизмов. Стадия приведения в контакт и стадия ферментации могут осуществляться одновременно в одном и том же реакционном сосуде или последовательно. В целом способы ферментации описаны в The Alcohol Textbook 3rd ED, A Reference for the Beverage, Fuel and Industrial Alcohol Industries, Eds Jacques et al., (1999) Nottingham University Press, UK.
В некоторых вариантах осуществления способ дополнительно предусматривает применение ферментируемых сахаров (декстрина, например, глюкозы) в качестве исходного сырья для ферментации в видах микробиологической ферментации в подходящих условиях ферментации с получением конечных продуктов, таких как спирт (например, этанол), органические кислоты (например, янтарная кислота, молочная кислота), сахарные спирты (например, глицерин), промежуточные соединения аскорбиновой кислоты (например, глюконат, DKG, KLG), аминокислоты (например, лизин), белки (например, антитела и их фрагменты).
Ферментируемые сахара можно ферментировать с помощью дрожжей при температурах в диапазоне от 15 до 40°С, от 20 до 38°С, а также от 25 до 35°С; в диапазоне рН от 3,0 до 6,5; также рН от 3,0 до 6,0; рН от 3,0 до 5,5, рН от 3,5 до 5,0, а также рН от 3,5 до 4,5 в течение периода времени от 5 ч. до 120 ч., предпочтительно от 12 до 120 и более предпочтительно от 24 до 90 часов с получением спиртового продукта, предпочтительно этанола.
Клетки дрожжей обычно добавляют в количестве от 104 до 1012 и предпочтительно от 107 до 1010 жизнеспособных дрожжевых клеток на мл ферментационного бульона. Ферментация будет включать, помимо ферментирующих микроорганизмов (например, дрожжей), питательные вещества, необязательно кислоту и дополнительные ферменты. В некоторых вариантах осуществления в дополнение к сырьевым материалам, описанным выше, среда для ферментации будет содержать добавки, в том числе без ограничения витамины (например, биотин, фолиевую кислоту, никотиновую кислоту, рибофлавин), кофакторы, а также макро- и микроэлементы и соли (например, (NH4)2SO4; K2HPO4; NaCl; MgSO4; H3BO3; ZnCl2; и CaCl2).
В некоторых предпочтительных вариантах осуществления измельченный растительный материал включает ячмень, майло, кукурузу и их комбинации, а стадии приведения в контакт и ферментации проводят одновременно при рН в диапазоне от 3,5 до 5,5, интервале температур 30-45°С и в течение периода времени от 48 до 90 ч., при этом по меньшей мере 50% крахмала солюбилизировано.
Один конечный продукт процесса ферментации может представлять собой спиртовой продукт, например, этанол. Другие конечные продукты могут представлять собой побочные продукты брожения, такие как сухая барда (DDG) и сухая барда с растворимыми веществами (DDGS), которые можно использовать в качестве корма для животных.
При применении подходящих ферментирующих микроорганизмов, известных из области техники, конечные продукты ферментации могут включать без ограничения глицерин, 1,3-пропандиол, глюконат, 2-кето-D-глюконат, 2,5-дикето-D-глюконат, 2-кето-L-гулоновую кислоту, янтарную кислоту, молочную кислоту, аминокислоты и их производные.
Примерами ферментирующих организмов являются этанологенные микроорганизмы или продуцирующие этанол микроорганизмы, такие как этанологенные бактерии, которые экспрессируют алкогольдегидрогеназу и пируватдегидрогеназу и которые могут быть получены из Zymomonas moblis (см. USP 5000000; USP 5028539, USP 5424202; USP 5514583 и USP 5554520). В дополнительных вариантах осуществления этанологенные микроорганизмы экспрессируют ксилозоредуктазу и ксилитдегидрогеназу, ферменты, которые превращают ксилозу в ксилулозу. В дополнительных вариантах осуществления для превращения ксилозы в ксилулозу применяют ксилозоизомеразу. В особенно предпочтительных вариантах осуществления применяют микроорганизм, способный ферментировать как пентозы, так и гексозы в этанол. Например, в некоторых вариантах осуществления микроорганизм может представлять собой природный или не сконструированный с помощью генной инженерии микроорганизм, или в других вариантах осуществления микроорганизм может представлять собой рекомбинантный микроорганизм.
Ферментирующие микроорганизмы включают в себя без ограничения бактериальные штаммы из Bacillus, Lactobacillus, E. coli, Erwinia, Pantoea (например, P. citrea), Pseudomonas и Klebsiella (например, K. oxytoca). (См., например, USP 5028539, USP 5424202 и WO 95/13362). Bacillus является предпочтительным ферментирующим микроорганизмом. Выбор ферментирующего микроорганизма, применяемого на стадии ферментации, будет зависеть от конечного продукта, который должен быть получен.
Продуцирующий этанол микроорганизм может представлять собой грибковый микроорганизм, такой как Trichoderma, дрожжи и, в частности, Saccharomyces, такой как штаммы S. cerevisiae (USP 4316956). Множество S. cerevisiae являются коммерчески доступными и включают без ограничения FALI (Fleischmann's Yeast), SUPERSTART (Alltech), FERMIOL (DSM Specialties), (Ethanol Red, Fermentis, France), (SYNERXIA® Thrive, Dupont), RED STAR (Lesaffre) и дрожжи Angel alcohol (Angel Yeast Company, Китай).
Например, в случае если необходимым конечным продуктом является молочная кислота, можно использовать Lactobacillus sp. (L. casei); если необходимыми конечными продуктами являются глицерин или 1,3-пропандиол, можно использовать E.coli; и если необходимыми конечными продуктами являются 2-кето-D-глюконат, 2,5-дикето-D-глюконат и 2-кето-L-гулоновая кислота, в качестве ферментирующего микроорганизма можно использовать Pantoea citrea. Приведенный выше список является только иллюстративным, и специалисту в данной области будет известно о ряде ферментирующих микроорганизмов, которые можно соответствующим образом использовать для получения необходимого конечного продукта.
Полученный конечный продукт можно выделять и/или очищать от ферментационной среды. Способы разделения и очистки известны, например, с помощью подвергания сред экстракции, дистилляции и колоночной хроматографии. В некоторых вариантах осуществления конечный продукт идентифицируют непосредственно путем подвергания среды анализу с применением жидкостной хроматографии высокого давления (HPLC).
Затор можно разделять, например, с помощью центрифугирования с получением жидкой фазы и твердой фазы и конечных продуктов, таких как спирт и извлеченные твердые вещества. Спирт можно извлекать с помощью таких способов, как дистилляция и дегидратация с применением молекулярного сита или ультрафильтрация.
В некоторых вариантах осуществления применение смеси ферментов или композиции согласно изобретению в способе получения этанола будет обеспечивать выход этанола более 8%, 10%, 12%, 14%, 16%, 17%, 18%, 19%, 20%, 21%, и 22% (об./об.).
Необязательно после ферментации спирт (например, этанол) можно экстрагировать, например, посредством дистилляции. Этанол можно использовать в качестве топлива, питьевого или промышленного этанола.
В другом варианте осуществления раскрыт способ получения продуктов ферментации из крахмалсодержащего материала, предусматривающий:
(а) разжижение крахмалсодержащего материала с помощью смеси ферментов, содержащей термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO:3, 8 или 10;
(b) осахаривание продукта из стадии (а);
(c) ферментацию с помощью подходящего организма и
(d) необязательно извлечение продукта, полученного на стадии (с).
В еще одном аспекте этот можно осуществлять способ, в котором стадии (b) и (c) выполняют последовательно или одновременно.
Неожиданно было обнаружено, что если термостабильная сериновая протеаза, такая как ME-3, присутствует на стадии разжижения содержащих крахмал материалов для ферментации, необходимость добавления источника азота во время процесса осахаривания или SSF уменьшается на по меньшей мере по меньшей мере 30%, 40%, 50, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% или полностью исключается (100% уменьшения). В случае одновременного выполнения стадий (b) и (c) добавление источника азота (такого как без ограничения) мочевина или аммиак, либо исключают, либо уменьшают на по меньшей мере 30%, 40%, 50, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% с помощью применения 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15,16, 17, 18, 19, или 20 г термостабильной сериновой протеазы/метрическая тонна (MT) крахмалсодержащего материала где применяют указанную термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10. В случае одновременного выполнения стадий (b) и (c) добавление источника азота (такого как без ограничения) мочевина или аммиак, либо исключают, либо уменьшают на по меньшей мере 30%, 40%, 50%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% с помощью применения по меньшей мере 3, 4, 5 или 6 г термостабильной сериновой протеазы/MT сухого твердого материала, где применяют указанную термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO:3, 8 или 10. Считается, что если стадии (b) и (с) выполняют последовательно, можно наблюдать аналогичное уменьшение или исключение применения источника азота на стадии (b).
В случае одновременного выполнения стадий (b) и (c) добавление источника азота (такого как без ограничения) мочевина или аммиак, либо исключают, либо уменьшают на по меньшей мере 30%, 40%, 50%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% с помощью применения 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15,16, 17, 18, 19, или 20 г термостабильной сериновой протеазы/MT крахмалсодержащего материала где применяют указанную термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10, и, кроме того, если продукт ферментации представляет собой этанол, на стадии (с) не требуется кислый протеолитический фермент.
Как описано в данном документе, применение термостабильной сериновой протеазы, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10, в способе получения продуктов ферментации из крахмалсодержащего материала может привести к дополнительным преимуществам, таким как повышенный уровень неочищенного белка, повышенный уровень кислотно-гидролизованного жира, пониженный уровень глицерина (сниженное образование глицерина), более высокая скорость получения этанола и повышенный выход этанола. Повышенный уровень гидролизованного жира свидетельствует о повышенном извлечении масла. Глицерин является малоценным побочным продуктом брожения, при образовании которого используется часть доступного углерода. Снижение уровня глицерина указывает на более эффективное использование углерода, и сниженный уровень глицерина указывает на меньшую нагрузку на дрожжи. Кроме того, любое уменьшение продуцирования глицерина обеспечивает поступление углерода для получения более ценных продуктов, таких как этанол, и может привести к снижению вязкости.
В одном варианте осуществления раскрыт способ получения продуктов ферментации из крахмалсодержащего материала, предусматривающий:
(а) разжижение крахмалсодержащего материала с помощью смеси ферментов, содержащей термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10;
(b) осахаривание продукта из стадии (а);
(c) ферментацию с помощью подходящего организма и
(d) необязательно извлечение продукта, полученного на стадии (с),
где количество гидролизованного кислотой жира из материалов, полученных по завершении ферментации, увеличивается по сравнению с материалами, полученными по завершении контрольной ферментации, не предусматривающей применение указанной термостабильной сериновой протеазы, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10.
В одном варианте осуществления раскрыт способ получения продуктов ферментации из крахмалсодержащего материала, предусматривающий:
(а) разжижение крахмалсодержащего материала с помощью смеси ферментов, содержащей термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10;
(b) осахаривание продукта из стадии (а);
(c) ферментацию с помощью подходящего организма и
(d) необязательно извлечение продукта, полученного на стадии (с),
где продукт ферментации (такой как без ограничения этанол) получают с более высокой скоростью по сравнению с материалами, полученными по завершении контрольной ферментации, не предусматривающей применение указанной термостабильной сериновой протеазы, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10.
В одном варианте осуществления раскрыт способ получения продуктов ферментации из крахмалсодержащего материала, предусматривающий:
(а) разжижение крахмалсодержащего материала с помощью смеси ферментов, содержащей термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10;
(b) осахаривание продукта из стадии (а);
(c) ферментацию с помощью подходящего организма и
(d) необязательно извлечение продукта, полученного на стадии (с),
где выход продукта ферментации (такого как без ограничения этанол) является более высоким по сравнению с выходом продукта ферментации, полученного в контрольной ферментации, не предусматривающей применение указанной термостабильной сериновой протеазы, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10.
В одном варианте осуществления раскрыт способ получения продуктов ферментации из крахмалсодержащего материала, предусматривающий:
(а) разжижение крахмалсодержащего материала с помощью смеси ферментов, содержащей термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10;
(b) осахаривание продукта из стадии (а);
(c) ферментацию с помощью подходящего организма и
(d) необязательно извлечение продукта, полученного на стадии (с),
где уровни глицерина из материалов, полученных по завершении ферментации, понижены по сравнению с материалами, полученными по завершении контрольной ферментации, не предусматривающей применение указанной термостабильной сериновой протеазы, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10.
Продукты ферментации, рассматриваемые ниже, могут включать спирты (например, этанол, метанол, бутанол; полиолы, такие как глицерин, сорбит и инозит); органические кислоты, такие как лимонная кислота, уксусная кислота, итаконовая кислота, молочная кислота, янтарная кислота, глюконовая кислота и т. п.; антибиотики, такие как пенциллин и тетрациклин; ферменты, витамины и гормоны.
В другом варианте осуществления продукт ферментации может представлять собой этанол, например, топливный этанол; питьевой этанол, такой как питьевые нейтральные спирты; или промышленный этанол или продукты, используемые в промышленности потребляемых спиртов, таких как пиво или вино, молочной промышленности (например, кисломолочные продукты), кожевенной промышленности и табачной промышленности. Виды пива могут включать эли, стауты, портеры, лагеры, биттеры, солодовые ликеры, хаппоушу, пиво с высоким содержанием алкоголя, пиво с низким содержанием алкоголя, низкокалорийное пиво или светлое пиво. Если этанол является продуктом ферментации, его можно использовать как топливо, которое обычно смешивают с бензином.
Переработка крахмала в глюкозу обычно состоит из двух стадий, и эти стадии включают разжижение крахмала и осахаривание разжиженного крахмала. Дополнительные стадии могут предусматривать (а) очистку и изомеризацию, если необходимый конечный продукт представляет собой очищенную декстрозу или фруктозу, или (b) ферментацию и дистилляцию, когда необходимый конечный продукт представляет собой, например, спирт (например, этанол).
Целью процесса разжижения крахмала является превращение взвеси полимерных гранул крахмала в раствор декстринов с меньшей длиной цепи с низкой вязкостью. Это является важной стадией для удобного обращения с промышленным оборудованием, используемым в способах превращения крахмала. Обычно крахмал разжижают с помощью применения высокотемпературной и ферментативной биоконверсии. Например, обычный способ ферментативного разжижения предусматривает добавление термостабильной бактериальной альфа-амилазы (например, SPEZYME® PRIME и SPEZYME® FRED, SPEZYME® ETHYL, SPEZYME® RSL, SPEZYME® CL, SPEZYME® HT-WB от Danisco, США), или TERMAMYL SC, TERMAMYL SUPRA или TERMANYL 120L от Novozymes) к взвеси, содержащей субстрат, включающий в себя крахмал, с регуляцией рН до 5,5-6,5 и температуры выше 90°С. SPEZYME® RSL, SPEZYME® CL и SPEZYME® HT-WB могут быть добавлены в соответствующей коммерческой дозе в диапазоне от по меньшей мере 0,05 до 5 кг/метрическая тонна (MT) крахмалсодержащего материала, например, по меньшей мере приблизительно 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0 кг/метрическая тонна (MT) или в любой дозе в данном диапазоне. Крахмал разжижают и затем подвергают воздействию осахаривающих ферментов. Как правило, осахаривание (в случае переработки углеводов) происходит в присутствии ферментов, представляющих собой глюкоамилазу, таких как глюкоамилаза из Aspergillus niger (например, OPTIDEX L-400, DISTILLASE® SSF, DISTILLASE® CS, Spirizyme Fuel, Spirizyme Achieve) при более кислом pH, чем pH на стадии разжижения.
После ферментации или SSF продукт ферментации можно отделять от ферментационной среды. Затор (взвесь) можно подвергать дистилляции для экстракции необходимого продукта ферментации, например, этанола. Альтернативно, необходимый продукт ферментации можно экстрагировать из среды с помощью методик микро- или мембранной фильтрации. Продукт ферментации также можно извлекать посредством отгонки или другого способа, хорошо известного в данной области техники.
Для получения ферментируемых сахаров из лигноцеллюлозной биомассы требуется обработка биомассы для высвобождения сахаров, таких как глюкоза, ксилоза и арабиноза, из полисахаридов биомассы. Лигноцеллюлозную биомассу можно обрабатывать с помощью любого способа, известного специалисту в данной области, с получением ферментируемых сахаров в гидролизате. Биомассу можно предварительно обрабатывать с применением физических, термических или химических способов обработки или их комбинации и осахаривать с помощью ферментов. Способы термохимической предварительной обработки включают обработку паром или способы набухания биомассы для высвобождения сахаров (см., например, WO2010113129; WO2010113130, оба из которых включены посредством ссылки). Также можно применять химическое осахаривание. Для уменьшения размера частиц перед дальнейшей химической обработкой можно также применять виды физической обработки. Виды химической обработки включают основную обработку, такую как обработка сильным основанием (аммиаком или NaOH), 5 или кислотную обработку (US8545633, WO2012103220, включены посредством ссылки).
Например, биомассу можно предварительно обрабатывать аммиаком (US 20080008783, US 7932063, US7781191, US 7998713, US7915017, все из которых включены посредством ссылки). Данные виды обработки обеспечивают высвобождение полимерных сахаров из биомассы. Предварительная обработка может представлять собой предварительную обработку с применением низких уровней аммиака, при которой биомассу приводят в контакт с водным раствором, содержащим аммиак, с образованием смеси водного аммиака и биомассы, где концентрация аммиака является достаточной для поддержания щелочного рН смеси биомассы и водного аммиака, но составляет менее
приблизительно 12 весовых процентов относительно сухого веса биомассы. В вариантах осуществления сухой вес биомассы составляет по меньшей мере приблизительно 15 весовых процентов твердых веществ по отношению к весу смеси биомассы и водного аммиака, как раскрыто в патенте США №7932063, который включен в настоящий документ посредством ссылки.
Осахаривание, которое обеспечивает превращение полимерных сахаров в мономерные сахара, можно осуществлять с помощью ферментативных или химических видов обработки. Предварительно обработанную биомассу 20 приводят в контакт с группой осахаривающих ферментов в подходящих условиях с получением гидролизата лигноцеллюлозной биомассы, который содержит ферментируемые сахара. Перед осахариванием предварительно обработанную биомассу можно привести к необходимому содержанию влаги и обработать для изменения рН, состава или температуры, за счет чего ферменты группы осахаривающих ферментов станут активными.
Уровень pH можно изменять путем добавления кислот в твердой или жидкой форме. Альтернативно, диоксид углерода (CO2), который можно получать в результате ферментации, можно применять для снижения pH. Например, СО2 можно собирать из ферментера и подавать в свободное пространство для предварительной обработки продукта в испарительном резервуаре или барботировать предварительно обработанную биомассу, если присутствует достаточное количество жидкости, при этом 30 обеспечивает контроль рН до достижения необходимого уровня рН. Температуру доводят до температуры, которая совместима с активностью осахаривающих ферментов, как отмечено ниже. Как правило, подходящие условия могут включать температуру от приблизительно 40°С до приблизительно 50°С и рН от приблизительно 4,8 до приблизительно 5,8.
При ферментативном осахаривании целлюлозной или лигноцеллюлозной биомассы обычно применяют композицию на основе ферментов или смесь для расщепления целлюлозы и/или гемицеллюлозы и получения гидролизата, содержащего сахара 5, такие как, например, глюкоза, ксилоза и арабиноза. Осахаривающие ферменты рассмотрены в Lynd, L. R., et al. (Microbiol. Mol. Biol. Rev., 66:506-577, 2002).
Можно применять смесь осахаривающих ферментов, которая включает одну или несколько гликозидаз. Гликозидазы гидролизуют эфирные связи ди-, олиго- и полисахаридов и находятся, согласно классификации ферментов EC 3.2.1.x (Enzyme Nomenclature 1992, Academic Press, San Diego, CA with Supplement 1 (1993), Supplement 2 (1994), Supplement 3 (1995, Supplement 4 (1997) и Supplement 5 [in Eur. J. Biochem., 223:1-5, 1994; Eur. J. Biochem., 232:1-6, 1995; Eur. J. Biochem., 237:1-5, 1996; Eur. J. Biochem., 250:1-6, 1997; и Eur. 15 J. Biochem., 264:610-650 1999 соответственно]), в общей группе "гидролаз"
(EC 3.). Гликозидазы, пригодные для осахаривания, могут быть классифицированы по компонентам биомассы, которые они гидролизуют. Гликозидазы, пригодные для осахаривания, могут включать целлюлозогидролизующие гликозидазы (например, целлюлазы, эндоглюканазы, экзоглюканазы, целлобиогидролазы, b-глюкозидазы), гемицеллюлозогидролизующие гликозидазы (например, ксиланазы, эндоксиланазиназы, экзоксиланозидазы, b-ксилозидазы, арабино-ксиланазы, манназы, галактазы, пектиназы, глюкуронидазы) и крахмалгидролизующие гликозидазы (например, амилазы, а-амилазы, b-амилазы, глюкоамилазы, а-глюкозидазы, изоамилазы). Кроме того, может оказаться полезным добавление к группе осахаривающих ферментов других средств активности, таких как пептидазы (EC 3.4.x.y), липазы (EC3.1.1.x и 3.1.4.x), лигниназы (EC 1.11.1.x) или ферулоилэстеразы (ЕС 3.1.1.73), чтобы способствовать высвобождению полисахаридов из других компонентов биомассы. В данной области техники известно, что микроорганизмы, которые продуцируют гидролизующие полисахариды ферменты, часто проявляют активность, такую как способность разлагать целлюлозу, что катализируется несколькими ферментами или группой ферментов, имеющих различные типы специфичности к субстратам. Таким образом, "целлюлаза" из микроорганизма может предусматривать группу ферментов, один или несколько или все из которых могут участвовать в активности, обеспечивающей разрушение целлюлозы.
Коммерческие или некоммерческие ферментные препараты, такие как целлюлаза, могут включать в себя многочисленные ферменты, в зависимости от схемы очистки, применяемой для получения фермента. Многие ферменты, представляющие собой гликозилгидролазу, и композиции на их основе, которые применимы для осахаривания, раскрыты в WO 2011/038019 или WO 2012/125937, которые включены в настоящий документ посредством ссылки. Дополнительные ферменты для осахаривания включают, например, гликозилгидролазы, которые гидролизуют гликозидную связь между двумя или более углеводами или между углеводным и неуглеводным фрагментом.
Подходящие ферменты могут включать ферменты из семейств гликозидгидролаз, таких как семейства GH3, GH5, GH 6, GH 7, GH10, GH11, GH39, GH43, GH51 и GH 61. GH представляют собой группу ферментов, которые гидролизуют гликозидную связь между двумя или более углеводами или между углеводным и неуглеводным фрагментом. Семейства GH были классифицированы на основе сходства последовательностей и доступны в Базе данных активных в отношении углеводов ферментов (CAZy) (Cantarel et al. (2009) Nucleic Acids Res. 37 (Database issue):D233-238).
Эти ферменты способны воздействовать на ряд субстратов и эффективны в процессе осахаривания. Ферменты семейства гликозидгидролаз 3 ("GH3") обладают рядом известных видов активности: b-глюкозидазной (EC:3.2.1.21); b-ксилозидазной (EC:3.2.1.37); N-ацетил-b-глюкозаминидазной (EC:3.2.1.52); глюкан-b-1,3-глюкозидазной (EC:3.2.1.58); целлодекстриназной (EC:3.2.1.74); экзо-1,3-1,4-глюканазной (EC:3.2.1) и b-галактозидазной (EC 3.2.1.23). Ферменты семейства гликозидгидролаз 39 ("GH39") обладают a-L-идуронидазной (EC:3.2.1.76) или b-ксилозидазной (EC: 3.2.1.37) активностью.
Ферменты семейства гликозидгидролаз 43 ("GH43") обладают следующими активностями: L-25 -арабинофуранозидазной (EC 3.2.1.55); b-ксилозидазной (ЕС 3.2.1.37); эндоарабинаназной (EC 3.2.1.99) и галактан-1,3-b-галактозидазной (EC 3.2.1.145). Ферменты семейства гликозидгидролаз 51 ("GH51") обладают L-a-арабинофуранозидазной (EC 3.2.1.55) или эндоглюканазной (EC 3.2.1.4) активностью. Семейство гликозидгидролаз 10 ("GH10") описано, например, в Schmidt et 30 al.., 1999, Biochemistry 38:2403-2412 и Lo Leggio et al., 2001, FEBS Lett 509: 303-308), и семейство гликозидгидролаз 11 ("GH11") более полно описано в Hakouvainen et al., 1996, Biochemistry 35:9617-24. Подходящие ферменты могут включать ферменты семейства гликозидгидролаз 61 ("GH61"), которые были переклассифицированы в семейство вспомогательной активности 9 (AA9; cazypedia.org) и могут упоминаться в данном документе как ферменты GH61. Как описано в публикации заявки на патент США № US2014/0106408, подходящие ферменты могут включать в себя EG4 (такой как из Trichoderma reesei и его варианты, описанные, например, в WO201517256A1, WO201517255A1, WO201517254A1, включенных посредством ссылки), Fv3A, Fv51A и/или Fv43D (например, из Fusarium verticilloides, описанные, например, в US 2014/016408, включенном посредством ссылки). Подходящие ферменты могут включать, например, ферменты, раскрытые в публикациях заявок согласно PCT №№ WO03/027306, WO200352118_A2, WO200352054_A2, WO200352057_A2, WO200352055_A2, WO200352056_A2, WO200416760_A2, WO9210581_A1, WO200448592_A2, WO200443980_A2, WO200528636_A2, WO200501065_A2, WO2005/001036, WO2005/093050, WO200593073_A1, WO200674005_A2, WO2009/149202, WO2011/038019, WO2010/141779, WO2011/063308, WO2012/125951, WO2012/125925, WO2012125937, WO/2011/153276, WO2014/093275, WO2014/070837, WO2014/070841, WO2014/070844, WO2014/093281, WO2014/093282, WO2014/093287, WO2014/093294, WO2015/084596 или WO2016/069541, включенных в данный документ посредством ссылок.
Осахаривающие ферменты могут быть получены коммерчески. Такие ферменты включают в себя, например, целлюлазу SPEZYME® CP, ксиланазу Multifect®, Accelerase® 1500, Accellerase® DUET, Accellerase® TrioTM, ® CS (от DuPont), DISTILLASE® SSF и Novozyme-188 (Novozymes). DISTILLASE® SSF можно дозировать в коммерческой соответствующей дозе, составляющей от 0,06 до 0,08% веса фермента/вес кукурузы как таковой. Требуемая фактическая доза будет зависеть от условий ферментации: времени, начального значения pH и уровня содержания твердых веществ. Фермент DISTILLASE® CS можно добавлять в коммерчески соответствующей дозе, составляющей от 0,055 до 0,075% вес/вес (крахмал, на основе сухого твердого вещества). Это соответствует уровню от 0,375 до 0,50 кг DISTILLASE® CS/MT зерна "как такового". Можно добавлять дополнительные ферменты, такие как без ограничения трегалаза.
Кроме того, осахаривающие ферменты могут быть предоставлены в виде неочищенных препаратов клеточного экстракта или цельного клеточного бульона. Ферменты могут быть получены с применением рекомбинантных микроорганизмов, которые были сконструированы для экспрессии одного или нескольких осахаривающих ферментов. Например, препарат белка H3A, который можно применять для осахаривания предварительно обработанной лигноцеллюлозной биомассы, представляет собой неочищенный препарат ферментов, полученных из сконструированного с помощью генной инженерии штамма Trichoderma reesei, который включает комбинацию целлюлаз и гемицеллюлаз и описан в WO 2011/038019, включенном в данном документе посредством ссылки.
Будет понятно, что в вариантах осуществления, в которых предварительно обработанный материал лигноцеллюлозной биомассы приводят в контакт с ферментом, представляющим собой ацетамидазу, фермент можно вводить с группой осахаривающих ферментов или отдельно от нее.
Можно применять различные виды обработок для химического осахаривания, и они известны специалисту в данной области, такие как обработка минеральными кислотами, в том числе HCl и H2SO4 (US5580389, WO2011002660, включены посредством ссылки). Сахара 10, такие как глюкоза, ксилоза и арабиноза, высвобождаются путем осахаривания лигноцеллюлозной биомассы, и эти мономерные сахара обеспечивают источник углеводов для биокатализатора, применяемого в способе ферментации. Сахара присутствуют в гидролизате биомассы, который используется в качестве ферментационной среды. Ферментационная среда может состоять исключительно из гидролизата или может включать компоненты, дополнительные по отношению к гидролизату, такие как сорбит или маннит, в конечной концентрации приблизительно 5 мМ, как описано в US 7629156, который включен в настоящий документ посредством ссылки. Гидролизат биомассы может составлять по меньшей мере приблизительно 50% ферментационной среды. В вариантах осуществления приблизительно 10% конечного объема ферментационного бульона составляет инокулят для засева, содержащий ферментационный микроорганизм.
Ферментационная среда, содержащая гидролизат лигноцеллюлозной биомассы, приведенный в контакт с ферментирующим микроорганизмом, ферментируется в ферментационном сосуде, который представляет собой любой сосуд, в котором находится ферментационная среда и по меньшей мере один биокатализатор, и который имеет клапаны, выпускные отверстия и/или впускные отверстия, используемые для управления процессом ферментации. Любой микроорганизм, который продуцирует целевой продукт, утилизируя глюкозу и предпочтительно также ксилозу либо естественным путем, либо посредством генной инженерии, может быть использован для ферментации ферментируемых сахаров в гидролизате лигноцеллюлозной биомассы. Целевые продукты, которые можно получить путем ферментации, включают, например, кислоты, спирты, алканы, алкены, ароматические соединения, альдегиды, кетоны, биополимеры, белки, пептиды, аминокислоты, витамины, антибиотики и фармацевтические препараты. Спирты включают без ограничения метанол, этанол, пропанол, изопропанол, бутанол, этиленгликоль, пропандиол, бутандиол, глицерин, эритрит, ксилит, маннит и сорбит. Кислоты могут включать уксусную кислоту, муравьиную кислоту, молочную кислоту, пропионовую кислоту, 3-гидроксипропионовую кислоту, масляную кислоту, глюконовую кислоту, итаконовую кислоту, лимонную кислоту, янтарную кислоту, 3-гидроксипропионовую кислоту, фумаровую кислоту, малеиновую кислоту и левулиновую 5 кислоту. Аминокислоты могут включать глутаминовую кислоту, аспарагиновую кислоту, метионин, лизин, глицин, аргинин, треонин, фенилаланин и тирозин. Дополнительные целевые продукты включают метан, этилен, ацетон и промышленные ферменты.
Ферментация сахаров в гидролизате лигноцеллюлозной биомассы с получением целевых продуктов может осуществляться одним или несколькими подходящими микроорганизмами, которые способны расти в среде, содержащей гидролизат биомассы, в ходе процессов одностадийной или многостадийной ферментации. Подходящие микроорганизмы могут быть выбраны из бактерий, нитчатых грибов и дрожжей. Подходящими микроорганизмами могут быть микроорганизмы дикого типа или рекомбинантные микроорганизмы, и они могут включать, например, 15 организмов, принадлежащих к родам Escherichia, Zymomonas, Saccharomyces, Candida, Pichia, Streptomyces, Bacillus, Lactobacillus и Clostridiuma. Типичные примеры подходящих микроорганизмов включают рекомбинантные Escherichia coli, Zymomonas mobilis, Bacillus stearothermophilus, Saccharomyces cerevisiae, Clostridia thermocellum, Thermoanaerobacterium saccharolyticum и Pichia stipitis. Для хорошего роста и высокой выработки продукта в ферментационном бульоне на основе гидролизата лигноцеллюлозной биомассы можно выбрать или сконструировать микроорганизм, который будет иметь более высокую устойчивость к ингибиторам, присутствующим в гидролизате биомассы, таким как ацетат. Например, биокатализатор может обеспечивать получение этанола как целевого продукта, например, получение этанола с помощью Zymomonas mobilis или получение этанола с помощью Saccharomyces cerevisiae. Подходящие сконструированные штаммы Zymomonas mobilis и Saccharomyces cerevisiae известны из области техники, например, как описано в US 8247208 и US 8669076, оба включены в данный документ посредством ссылки.
Ферментацию осуществляют в условиях, подходящих для конкретного используемого микроорганизма. Можно осуществлять корректировки в отношении таких условий, как pH, температура, содержание кислорода и перемешивание. Условия ферментации для дрожжей и бактериальных биокатализаторов хорошо известны в данной области. Кроме того, осахаривание и ферментация могут происходить одновременно в одном сосуде, что называется одновременным осахариванием и ферментацией (SSF). Кроме того, до периода одновременного осахаривания и ферментации в способе, называемом HSF (гибридное осахаривание и ферментация) может происходить частичное осахаривание.
Для крупномасштабной ферментации, как правило, сначала выращивают меньшее количество культуры (культуру для засева) ферментационного микроорганизма. Культуру для засева добавляют в ферментационную среду как инокулят, как правило, в диапазоне от приблизительно 2% до приблизительно 20% от конечного объема. Как правило, ферментация с помощью ферментирующего микроорганизма обеспечивает получение ферментационного бульона, содержащего целевой продукт, продуцированный организмом. Например, в способе получения этанола ферментационный бульон может представлять собой пиво, содержащее от примерно 6% до примерно 10% этанола. Кроме целевого продукта ферментационный бульон содержит воду, растворенные вещества, твердые вещества из гидролизатной среды и полученные в результате метаболизма сахаров биокатализатором в гидролизатной среде, а также сам биокатализатор. Целевой продукт можно выделять из ферментационного бульона с получением обедненного бульона, который можно назвать цельной бардой. Например, если продуктом является этанол, бульон дистиллируют, как правило, с использованием бражной колонны, с получением потока этанольного продукта и цельной барды. Для дистилляции можно применять любые условия, известные специалисту в данной области, в том числе атмосферное или пониженное давление. Дистиллированный этанол затем пропускают через ректификационную колонну и молекулярное сито для извлечения этанольного продукта.
Целевой продукт альтернативно можно удалять на более поздней стадии, например, из твердой или жидкой фракции после отделения ферментационного бульона.
Можно добавлять альфа-амилазу во время разжижения вместе с термостабильной сериновой протеазой, описанной в данном документе. Необязательно фермент, участвующий в образовании источника углеводов, такой как глюкоамилазы, и/или необязательно пуллуланазу. Можно применять любую альфа-амилазу.
Альфа-амилазы и пуллуланазы описаны выше.
Биомасса для получения биоэтанола второго поколения требует предварительной обработки, а затем подвергается ферментативному гидролизу с получением ферментируемого сахара. Биомассу обычно предварительно обрабатывают при температурах выше 100°C в кислых или щелочных условиях (DUNSON et al., TREATMENT OF BIOMASS TO OBTAIN FERMENTABLE SUGARS. WO2006110901 (A2) - 2006-10-19).
Термостабильные и термоактивные протеазы, подобные термостабильным сериновым протеазам, описанным в данном документе, можно применять в таких способах для гидролиза любого белка, присутствующего в биомассе, для обеспечения этанологена аминокислотами и пептидными питательными веществами и снижения вязкости суспензии биомассы. Биомасса, предварительно обработанная в щелочных условиях, таких как разбавленный аммоний (WO2006110901), особенно подходит для гидролиза с помощью указанных термостабильных сериновых протеаз по причине их высокого pH.
Таким образом, в еще одном аспекте раскрыт способ гидролиза белков в лигноцеллюлозной биомассе, предусматривающий:
(a) приведение биомассы в контакт с жидкостью и
(b) осуществление гидролиза белков в биомассе путем приведения биомассы в контакт со смесью ферментов, содержащей термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10.
В другом варианте осуществления раскрыт способ снижения вязкости разжиженного крахмалсодержащего материала, который предусматривает приведение взвеси крахмалсодержащего материала в контакт с термостабильной сериновой протеазой, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO:3, 8 или 10.
В другом варианте осуществления раскрыт способ экстрагирования масла из масличной культуры, предусматривающий:
(a) приведение маслосодержащей фракции масличного семени в контакт с водным экстрагирующим средством с образованием экстрагированной фракции масличного семени и
(b) разделение экстрагированной фракции масличного семени на водную фазу, эмульсию масло-в-воде и нерастворимую фазу;
(c) приведение эмульсии масло-в-воде в контакт с по меньшей мере термостабильной сериновой протеазой, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10, либо отдельно, либо в комбинации с фосфолипазой, в условиях, обеспечивающих активность фермента в течение периода времени, достаточного для дестабилизации эмульсии; и
(d) разделение дестабилизированной эмульсии из стадии (с) на водную фазу, масляную фазу и нерастворимую фазу с получением масла из масличного семени.
Кроме того, фракцию масличного семени можно получать из сои, семени кукурузы, семени рапса, пальмового ядра, семени подсолнечника, семени сафлора, кокоса, арахиса, семени хлопчатника, семени кунжута, льняного семени, семени мака, миндаля, фундука, грецкого ореха, семени примулы вечерней, виноградной косточки, семени конопли, семени черной смородины, семени красной малины, семени моркови, семени тмина, семени черники, семени клюквы, семени петрушки, семени лука, семени тыквы, абрикосовой косточки, семени горчицы, семени льна, семени льна или семени клещевины.
Фракция масличного семени может содержать белковую фракцию, которая применима как пищевой продукт, пищевой ингредиент, пищевая добавка или биологичеки активная пищевая добавка.
Очевидно, что масло растительного происхождения можно получать с применением способа, описанного в данном документе.
Кроме того, корм, кормовой продукт, композиция, представляющая собой кормовую добавку, премикс, пищевой или зерновой продукт могут содержать масло, описанное в данном документе.
Липиды растительного происхождения, в частности, масла, являются основным источником липидов для пищевой промышленности и промышленного сырья. В последнее время они представляют интерес и применяются как альтернатива нефтепродуктам для видов топлива. Растительные липиды можно получать из одной или нескольких частей растения, кустарника или дерева. У различных растений источником масла может являться корень, стебель, кора, листья, цветы, семена, плоды или другие части. Такие липиды можно экстрагировать механически, например, посредством приложения внешнего давления, или химически, например, с помощью способов экстракции органическим или водным растворителем или с помощью комбинированных способов.
Масла, полученные из масличных растений, известны благодаря их применению в пище и пищевых продуктах, а также получению мыла, моющих средств, лосьонов, смазывающих средств, инсектицидов, красок, покрытий, чернил и других промышленных или потребительских товаров. Несмотря на то, что подавляющее большинство масел масличного семени экстрагируют с помощью способа экстракции с применением органических растворителей, в настоящее время некоторые экстрагируют с помощью водной экстракции.
В последние годы были разработаны способы водной экстракции масел из масличных семян. См. Freitas et al., Fett/Lipid 99: 333-337, 1997; и Caetano et al., La Rivista Italiana Delle Sostanze Grasse 79: 165-169, 2002. И у Freitas et al., и у Caetano et al. предусмотрена комбинация экструзии и обработки протеазами для экстракции масел в водных способах. Стадии водного способа по своей природе более безопасны, чем стадии экстракции с применением органических растворителей, и, соответственно, инвестиции в основное оборудование для первоначального запуска являются существенно ниже в случае способов водной экстракции.
Используемый в данном документе термин "эмульсия" включает по меньшей мере временно стабильную систему, содержащую физическую смесь по меньшей мере двух материалов, не полностью смешивающихся друг с другом или не растворимых друг в друге. Предпочтительные эмульсии, используемые в данном документе, нелегко разделяются при обеспечении им состояния покоя и могут оставаться смешанными в течение значительных промежутков времени. Предпочтительно они будут оставаться стабильными в течение продолжительных периодов времени, например, более приблизительно 1, 2, 4, 8 12 или 24 часа или даже дольше.
Несмотря на то, что эмульсионные системы могут содержать твердые вещества, жидкости и газы, предпочтительно, чтобы эмульсии для применения по настоящему изобретению содержали по меньшей мере липидную фазу и водную фазу, обе из которых находятся в жидком состоянии. Одна фаза в эмульсии является непрерывной, в то время как другая фаза диспергирована в ней и, таким образом, прерывается посредством другой. Например, эмульсия "масло в воде" имеет прерывную фазу масла, диспергированного в непрерывной водной фазе, тогда как эмульсия "вода в масле" имеет прерывную водную фазу, диспергированную в непрерывной липидной или масляной фазе. На практике прерывная фаза состоит из маленьких капель, диспергированных в другой фазе и содержащихся внутри нее. Таким образом, прерывную фазу также иногда называют "внутренней" фазой и по аналогии непрерывную фазу иногда называют "внешней" фазой. При определенных обстоятельствах эмульсия может инвертироваться, то есть непрерывные и прерывные фазы могут меняться ролями, например, эмульсия масло-в-воде становится эмульсией вода-в-масле или наоборот.
Используемые в данном документе термины "масло в воде" и "вода в масле" являются просто описательными, чтобы помочь понять, какая из фаз является непрерывной, а какая диспергирована в данной эмульсионной системе; эти термины не предназначены для буквального ограничения эмульсии маслом и водой. "Вода" или водная фаза может содержать один или несколько растворенных веществ, таких как соли, и любое количество других растворимых или частично растворимых соединений. Аналогично, "масляная" или липидная фаза может содержать широкий спектр липидов или липидорастворимых соединений.
Используемый в данном документе термин "масло" обозначает любую группу жиров (или липидов), которые остаются жидкими при комнатной температуре. "Растительное масло" при использовании в данном документе обозначает любые такие масла, которые получены из любой ткани растения. Альтернативно, растительные масла также упоминаются в данном документе как "масла растительного происхождения". В некоторых вариантах осуществления растительные масла являются пищевыми, в то время как в других вариантах они не обязательно являются пищевыми. Некоторые масла можно надлежащим и безопасным образом использовать для наружного применения в отношении животного, такого как человек, тогда как другие масла могут быть полностью несъедобными, а также небезопасными для наружного применения в отношении животного. Такие масла, тем не менее, могут быть ценными при применении в промышленных способах как смазывающие средства, чистящие или полирующие продукты или просто как сырье для получения других композиций или продуктов, в которых необходим липид в качестве сырья. Например, некоторые липиды применимы в качестве видов топлива или топливных добавок. В настоящее время существует значительный интерес к биологическим или возобновляемым источникам видов топлива, таким как виды горючего топлива, например липиды для применения в биодизеле.
Используемый в данном документе термин "масличное семя" относится к любому маслосодержащему семени, ореху, ядру или тому подобному, полученным из растения. Все такие растения, а также их семена, орехи или ядра рассматриваются для применения в данном документе. Например, Национальная информационная служба по устойчивому сельскому хозяйству перечисляет следующие источники масла для пищевых, специализированных или промышленных нужд: миндаль, абрикосовые косточки, авокадо, орех бука, черника, черная смородина, огуречник, бразильский орех, календула, семя тмина, орех кешью, семя клещевины, семя цитрусовых, гвоздика, какао, кофе, копра (сушеный кокос), кориандр, семя кукурузы, семя хлопчатника, бузина, примула вечерняя, семя винограда, арахис, фундук, семя конопли, жожоба, льняное семя, орех макадамия, рогоз, семя дыни, семя горчицы, семя нима, семя нуга, мускатный орех, пальмовое ядро, маракуйя, пекан, фисташка, мак, семя тыквы, семя рапса, семя малины, красный перец, шиповник, семя каучука, семя сафлора, облепиха, семя кунжута, соя, молочай, крапива, семя подсолнечника, растение трофо, семя томата или грецкий орех. Также в данном документе применимы различные масличные и родственные им растения, содержание масла в которых представляет интерес для применения в качестве топлива, такого как "экологическое топливо", биодизельное топливо или т. п. Такие растения включают в себя без ограничения ятрофу (например, Jatropha curcas, J. Mahafalensis и их сорта); Elaeis guineensis (например, масличная пальма), Aleurites fordii (тунг китайский или тунг молуккский), Ricinus communis (клещевина обыкновенная), Copaifera langsdorfii (дизельное дерево) и Pongammia pinnata (индийский бук, или понгамия, и его сорта).
Используемые в данном документе термины "маслосодержащая фракция" или "липидсодержащая фракция" относятся к масличному семени или некоторой его порции или части, полученным каким бы то ни было способом. В предпочтительных вариантах осуществления маслосодержащая фракция будет содержать все масло (или содержание жиров или липидов) масличного семени или по меньшей мере его большую часть. В других вариантах осуществления на стадии предварительной обработки можно удалить по меньшей мере часть или даже большую часть масла из масличного семени перед получением фракции. Так, например, в определенных вариантах осуществления при применении сои в качестве источника масличного семени, "фракция" включает соевую муку или соевые хлопья. Предпочтительно полученная мука или хлопья являются "полножирными" в том значении, как этот термин понимается в данной области. Однако это не исключает применения способов, предусмотренных в настоящем документе, например, с использованием частично обезжиренных фракций, таких как соевая мука или соевые хлопья. Экономические факторы могут обеспечивать коммерческую мотивацию для применения фракций, содержащих по меньшей мере большую часть жира, однако не существует никаких известных технических препятствий к применению описанных переработанных фракций, содержащих менее чем большую часть жира цельного масличного семени.
В случае некоторых вариантов осуществления маслосодержащая фракция является основным источником пищевого или промышленного масла. В настоящее время соя, семя кукурузы, семя хлопчатника и рапса, а также семя подсолнечника, сафлора, семя льна и арахис являются предпочтительными источниками пищевого масла.
Используемый в данном документе термин "водный растворитель" предусматривает по меньшей мере воду. Водные растворители обычно содержат другие компоненты, такие как соли, буферные соединения, малые молекулы и многое другое. Дополнительные компоненты могут присутствовать в любом количестве и концентрации при условии, что водный растворитель представляет собой по существу гомогенный раствор или суспензию в воде. Такой водный растворитель с дополнительными компонентами в виде по существу гомогенного раствора или суспензии иногда называют в данном документе "водным экстрагентом" для удобства и для отличия его от растворителя per se, например, воды. Эти два термина являются синонимами, как определено в данном документе. Предпочтительно все присутствующие компоненты находятся в истинном растворе в водном экстрагирующем средстве или водном растворителе. Водный растворитель отличается от органического растворителя тем что, в отличие от воды в качестве растворителя, термин "органический растворитель" относится к большинству других растворителей, которые являются органическими соединениями и содержат атомы углерода. Органические растворители являются более летучими и потенциально взрывоопасными, в отличие от водных растворителей. Обычно экстракция масел с помощью органических растворителей относится к любому способу, применяемому для удаления масла из масличных семян путем непосредственного контакта с органическим растворителем, таким как н-гексан или другие гексаны.
Как отмечено выше, предусмотрены способы или процессы для дестабилизации эмульсии, содержащей масляную фазу и водную фазу. Эмульсию извлекают или получают при экстракции липида с помощью водного растворителя из масличного семени. Эмульсию приводят в контакт с по меньшей мере термостабильной сериновой протеазой, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO:3, 8 или 10, либо отдельно, либо в комбинации с фосфолипазой, в условиях, обеспечивающих активность фермента в течение периода времени, достаточного для дестабилизации эмульсии.
В другом аспекте термостабильную сериновую протеазу можно применять в комбинациях с по меньшей мере фосфолипазой. Несмотря на то, что для применения в настоящем изобретении рассматриваются средства ферментативной активности из любого источника, такого как животное, растение или микроб, ферментативная активность предпочтительно предусматривает средство фосфолипазной активности из поджелудочной железы млекопитающих, Streptomyces violaceoruber, Aspergillus oryzae или Aspergillus niger. В одном варианте осуществления средство фосфолипазной активности происходит из свиной поджелудочной железы.
Водная фаза представляет собой непрерывную фазу, а масляная фаза может представлять собой прерывную фазу, т. е. эмульсия представляет собой эмульсию масло-в-воде.
Способы отделения масла от водных фаз известны в данной области техники. Часто в них применяется гравитация или более предпочтительно силы, превышающие силу гравитации, например, силы, прикладываемые с помощью физических средств, таких как центрифугирование. В одном варианте осуществления эмульсии центрифугируют в способе партиями. В различных вариантах осуществления условия разделения могут включать регулирование эмульсии до предпочтительной температуры, например, с помощью нагревания, после обработки ферментами. В другом варианте осуществления непрерывное центрифугирование является предпочтительным для отделения масла от водной фазы. Непрерывные способы могут быть предпочтительными в случае крупномасштабных операций и хорошо подходят для манипулирования с материалом в заполненном сосуде, например, бункерах, резервуарах, чанах или т. п. или даже в соединенных рядах таких сосудов.
С помощью такого способа можно улучшить выход масла из эмульсии. Специалист в данной области поймет, как контролировать выход на основании различных подходов. Как правило, параметры сравнения выхода получают путем сравнения, например, выхода масла (например, % от теоретического максимального выхода на основании содержания масла в необработанной эмульсии) с применением способов, раскрытых в настоящем документе, с выходом при применении водной экстракции, при которой не применяют стадию приведения эмульсии в контакт со средством ферментативной активности. Можно применять другие подходы для оценки выхода, например, улучшение извлечения масла с применением способов, раскрытых в данном документе, по сравнению с "контрольным" способом.
Эмульсию можно приводить в контакт с по меньшей мере одним средством ферментативной активности, предусматривающим по меньшей мере средство активности, представляющее собой термостабильную сериновую протеазу, описанную в данном документе, либо отдельно, либо в комбинации с фосфолипазой. Несмотря на то, что для применения в настоящем изобретении рассматриваются средства ферментативной активности из любого источника, такого как животное, растение или микроб, ферментативная активность предпочтительно предусматривает средство фосфолипазной активности из поджелудочной железы млекопитающих, Streptomyces violaceoruber, Aspergillus oryzae или Aspergillus niger. В одном варианте осуществления средство фосфолипазной активности происходит из свиной поджелудочной железы.
Показано, что различные средства фосфолипазной активности являются применимыми для дестабилизации эмульсии в соответствии с описанными в данном документе способами. Фосфолипазы для целей в настоящем документе включают без ограничения фосфолипазы А (в том числе А1 и А2), В (также иногда называемые лизофосфолипазой), С и D. Фосфолипазы представляют собой класс ферментов, которые гидролизуют фосфолипиды, такие как фосфатидилхолин или фосфатидилэтаноламин. В пределах фосфолипазного класса ферментов существует пять основных подклассов, фосфолипазы A1, A2, B, C и D.
Фосфолипазы А1 (Е.С. 3.1.1.32) предпочтительно гидролизуют сложноэфирные связи sn1 фосфолипидов, таких как фосфатидилхолин или фосфатидилэтаноламин, с получением 1-лизофосфолипидов плюс карбоновые кислоты. Как правило, фосфолипазам А1 необходим кальций в качестве кофактора. Фосфолипазы А1 обычно проявляют более широкую специфичность, чем фосфолипазы А2.
Фосфолипазы А2 (Е.С. 3.1.1.4) предпочтительно гидролизуют сложноэфирные связи sn2 фосфолипидов, таких как фосфатидилхолин или фосфатидилэтаноламин, с получением 2-лизофосфолипидов плюс карбоновые кислоты. В дополнение к фосфолипидам фосфолипазы А2 проявляют определенную специфичность в отношении гидролиза производных холина и фосфатидов. Как правило, фосфолипазам А2 необходим кальций в качестве кофактора.
Фосфолипазы В (Е.С. 3.1.1.5) также известны как лизофосфолипазы. Они предпочтительно гидролизуют сложноэфирные связи sn1 2-лизофосфолипидов с получением глицерофосфатидов плюс карбоновые кислоты. B-фосфолипазы также будут гидролизовать сложноэфирные связи sn2 1-лизофосфолипидов.
Фосфолипазы С (Е.С. 3.1.4.3) предпочтительно гидролизуют фосфатные связи фосфолипидов, таких как фосфатидилхолин или фосфатидилэтаноламин, с получением соответствующих диацилглицеринов и холинфосфатов. В дополнение к гидролизу фосфолипидов, фосфолипазы С также будут воздействовать в отношении лизофосфолипидов.
Фосфолипазы D (Е.С. 3.1.4.4) предпочтительно гидролизуют фосфатную связь фосфолипидов, таких как фосфатидилхолин или фосфатидилэтаноламин, с получением соответствующих фосфатидных кислот и холина. В дополнение к гидролизу фосфолипидов, фосфолипазы D также будут воздействовать в отношении лизофосфолипидов.
Фосфолипазы можно применять отдельно, или в комбинации, или в смесях с одной или несколькими средствами активности согласно одной и той же или разных классификаций E.C. и из одного и того же или разных источников. Неочищенные или частично очищенные препараты на основе ферментов, содержащие одно или несколько средств фосфолипазной активности, подходят для применения в некоторых вариантах осуществления в данном документе. Коммерческие источники фосфолипаз также подходят для применения в данном документе. Например, Genencor-A Danisco Division (Rochester, NY) предлагает фосфолипазы LysoMax® и G-ZYME® G999 из бактериальных и грибковых источников соответственно. Фосфолипаза C коммерчески доступна, например, от Sigma (Сент-Луис, Миссури).
Фосфолипазы С (Е.С. 3.1.4.3) предпочтительно гидролизуют фосфатные связи фосфолипидов, таких как фосфатидилхолин или фосфатидилэтаноламин, с получением соответствующих диацилглицеринов и холинфосфатов. В дополнение к гидролизу фосфолипидов, фосфолипазы С также будут воздействовать в отношении лизофосфолипидов.
Фосфолипазы D (Е.С. 3.1.4.4) предпочтительно гидролизуют фосфатную связь фосфолипидов, таких как фосфатидилхолин или фосфатидилэтаноламин, с получением соответствующих фосфатидных кислот и холина. В дополнение к гидролизу фосфолипидов, фосфолипазы D также будут воздействовать в отношении лизофосфолипидов.
Маслосодержащая фракция масличного семени содержит клетки, и способ дополнительно предусматривает стадию разрушения клеток перед приведением в контакт фракции масличного семени с водным экстрагентом. В настоящее время предпочтительные способы разрушения клеток включают применение механической силы. Экструзия представляет собой удобный способ разрушения клеток в маслосодержащих семенах. Такое применение экструдеров известно из области техники, например, таким образом, применимыми являются одношнековые или двухшнековые экструдеры. Специалист в данной области техники может легко определить параметры для разрушения клеток в масличных семенах путем измерения извлечения или выхода масла при изменении параметров экструзии, таких как скорость, время прохождения, давление, температура, pH и т. п. Другие способы разрушения клеток включают химическую и/или ферментативную обработку, помимо дополнительных механических способов, таких как прессование, прокатка, истирание, обработка ультразвуком и другие.
Эмульсию масло-в-воде можно приводить в контакт со средством ферментативной активности, предусматривающим по меньшей мере средство активности, представляющее собой термостабильную сериновую протеазу, описанную в данном документе, либо отдельно, либо в комбинации с фосфолипазой.
Этот способ может предусматривать стадию центрифугирования для одной или обеих стадий разделения. Специалисту в данной области техники будет понятно применение центрифугирования для разделения фаз с различной плотностью, таких как масляная и водная фазы, присутствующие в эмульсии согласно предусмотренному способу.
Можно регулировать рН до значения от приблизительно 3,5 до приблизительно 5 перед стадией разделения. Такое регулирование может помочь дестабилизировать эмульсию с помощью различных путей. Не ограничивая способ какой-либо одной теорией действия, регулирование рН может помочь осаждению одного или нескольких белков, причем указанные белки, возможно, участвуют в стабилизации эмульсии. Альтернативно, они могут минимизировать разницу зарядов на группах, которые обеспечивают замедление или предотвращение слипания или агрегации прерывной фазы. Параметры регулирования рН также могут обеспечивать лучшее функционирование ферментов в процессе дестабилизации, например, путем обеспечения более быстрого связывания фермента и субстрата, усиления фактического катализа или помогаю продукту более быстро диффундировать или покидать активный сайт, тем самым обеспечивая стимуляцию превращения субстрата в продукт.
Значение pH эмульсии масло-в-воде можно регулировать до уровня от приблизительно 3,5 до приблизительно 5. Существует множество способов воздействия в отношении регулирования рН, в том числе без ограничения добавление HCl или других кислот, в том числе органических кислот или их солей. Для пищевых путей применения такие кислоты предпочтительно являются пищевыми ингредиентами или в целом признаны безопасными для применения в пищевых продуктах соответствующими регулирующими органами.
В некоторых случаях по меньшей мере одно средство фосфолипазной активности или одно средство протеазной активности в водном экстрагирующем средстве отделяется с эмульсией масло-в-воде на первой стадии разделения. Сохранившийся или совместно отделяющийся фермент (фосфолипаза или протеаза) иногда упоминается в настоящем документе как средство переносимой активности. Средство переносимой активности присутствует в эмульсии масло-в-воде и дестабилизирует эту эмульсию при обеспечении подходящих условий в отношении активности в течение достаточного периода времени. Такой способ первоначального обеспечения достаточного количества фермента, а затем применения подходящих условий способа для обеспечения переносимой активности на более поздней стадии может облегчить извлечение масла посредством обеспечения одностадийного добавления, достаточного для всего способа. Специалист в данной области техники может легко определить, достаточно ли средства переносимой ферментативной активности было перенесено в эмульсию масло-в-воде.
Фракцию масличного семени можно получать из сои, семени кукурузы, семени рапса, пальмового ядра, семени подсолнечника, семени сафлора, кокоса, арахиса, семени хлопчатника, семени кунжута, льняного семени, семени мака, миндаля, фундука, грецкого ореха, семени примулы вечерней, виноградной косточки, семени конопли, семени черной смородины, семени красной малины, семени моркови, семени тмина, семени черники, семени клюквы, семени петрушки, семени лука, семени тыквы, абрикосовой косточки, семени горчицы, семени льна, семени льна или семени клещевины. Как обсуждалось выше, различные виды, которые считаются применимыми или потенциально применимыми для получения биодизельного топлива и сходных путей применения, связанных с топливом, включая, например, ятрофу, масличную пальму, тунг китайский или тунг молуккский, клещевину, дизельное дерево и индийский бук и любые сорта любого из вышеперечисленного, также рассматривают для применения в настоящем документе.
В другом аспекте фракция масличного семени содержит белковую фракцию, которая применима как пищевой продукт, пищевой ингредиент, пищевое вспомогательное вещество или пищевая добавка. Иногда или даже часто имеет место случай, когда белковая фракция масличного семени является более ценной, чем масляная фракция. Одно предполагаемое преимущество способов водной экстракции состоит в том, что в них экстрагированный остаток остается в естественном или более функциональном состоянии, например, белки не денатурируются или сохраняют большую функциональность благодаря контакту с водным растворителем; это является ценным для предприятия пищевой промышленности. Независимо от применения в качестве пищи или корма или для другого применения, способы, предусмотренные в настоящем документе, обеспечивают извлечение белковой фракции, которая не подверглась воздействию потенциально опасных или вредных органических растворителей. Как таковые, белки с меньшей вероятностью денатурируются и могут характеризоваться лучшей потребительской приемлемостью среди определенных групп потребителей.
Также предусмотрены белковые композиции, полученные с помощью способов, описанных в данном документе, а также пищевые продукты, потребительские продукты и промышленное сырье, содержащие белок, полученный с помощью способов или процессов, раскрытых в данном документе.
Фракция масличного семени может содержать соевые хлопья или соевую муку. Предпочтительно, чтобы фракция масличного семени представляла собой "полножирные" хлопья или "полножирную" муку. Специалист в данной области поймет, что "полножирный" является термином в данной области при работе с фракциями масличного семени, такими как соя и кукуруза. Полножирный в каком-то смысле является противоположным обезжиренному, где по сути все липиды удалены, например, из соевых хлопьев, соевой муки или кукурузного зародыша. Специалист в данной области поймет, что способ, представленный в настоящем документе, совместим не только с полножирными фракциями, но также с частично обезжиренными фракциями масличного семени, будь то хлопья, мука, зародыш, мука или т. п.
Может быть возможным улучшить выход масла из масличного семени по сравнению с выходом при экстракции с помощью водного растворителя, при которой не применяют стадию приведения в контакт эмульсии со средством ферментативной активности. В более предпочтительном варианте подходы для извлечения масла, которое получают, представляют собой экстракцию с помощью органических растворителей.
В еще одном аспекте предусмотрены масла растительного происхождения, причем указанные масла получены с помощью любого из способов, описанных в данном документе. В одном варианте осуществления масло по существу не содержит белков, фосфолипидов или водных примесей. Также предусмотрены пищевые продукты, содержащие масло.
В другом варианте осуществления описан способ получения сусла, предусматривающий:
a) приведение крахмалсодержащего материала, который содержит смесь измельченного зерна, в контакт с водой и термостабильной сериновой протеазой, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10, с образованием затора;
b) медленное нагревание затора из стадии (а) с превращением крахмала в сахара и
c) разделение нагретого затора из стадии (b) на остаточное зерно и жидкое сусло,
где термостабильная протеаза присутствует в количестве 1-30 г/тонна измельченного зерна, например, меньшей мере 1, 2, 3, 4, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 г/тонна измельченного зерна
Кроме того, на стадии (а) наряду с термостабильной сериновой протеазой можно добавлять альфа-амилазу.
Производство сусла обычно предполагает приведение смеси измельченного зерна в контакт с водой, и согласно описанному в данном документе способу термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO:3, 8 или 10, добавляют в заторный чан с образованием затора. Термостабильная протеаза присутствует в количестве 1-30 г/т измельченного зерна, например, по меньшей мере 1, 2, 3, 4, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 г/тонна измельченного зерна.
В другом аспекте наряду с термостабильной сериновой протеазой можно добавлять альфа-амилазу.
В ходе затирания присутствующие ферменты превращают крахмалы (углеводы с длинной цепью) в зерне в молекулы меньшего размера или простые сахара (моно-, ди- и трисахариды). Этот процесс превращения называется осахариванием. Результатом процесса затирания является обогащенная сахарами жидкость или "сусло", которое затем пропускают через нижнюю часть заторного чана с помощью процесса, известного как фильтрация сусла, т. е. разделения. Перед разделением температуру затора можно повысить до приблизительно 75-78°С (известно как "нагревание затора") для высвобождения большего количества крахмала и уменьшения вязкости затора. Зерна можно дополнительно орошать водой для экстрагирования дополнительного количества сахаров (процесс, известный как добавление промывной воды).
Протеазы можно добавлять в ходе процесса осахаривания для высвобождения источника азота из белков, присутствующих в сусле. Стандартные анализы контроля качества пивоварения включают тест на свободный аминный азот (FAN). Это позволяет оценить концентрацию отдельных аминокислот и небольших пептидов, которые могут утилизироваться дрожжами во время ферментации пива для роста и пролиферации клеток. Включение несолодовых сырьевых материалов в качестве добавок в способ пивоварения повышает требования в отношении более высокого содержания FAN в сусле для обеспечения правильного процесса ферментации.
Как описано в данном документе, термостабильная сериновая протеаза, характеризующаяся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10 (например, без ограничения ME-3, описанная в настоящем документе), обеспечивала облегчение дозозависимого продуцирования свободного альфа-аминоазота (FAN) в сусло.
В другом варианте осуществления описан способ гидролиза по меньшей мере одного пищевого побочного продукта или побочного продукта животного происхождения, предусматривающий:
(a) приведение пищевого побочного продукта или побочного продукта животного происхождения в контакт с жидкостью и
(b) осуществление гидролиза пищевого побочного продукта или побочного продукта животного происхождения с образованием разжиженной фракции путем приведения в контакт со смесью ферментов, содержащей термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10.
Пищевой побочный продукт может представлять собой богатый кератином материал, выбранный из группы, состоящей из перьев, волос и шерсти.
Белки можно гидролизовать в полипептиды и олигопептиды подходящей длины и свободные аминокислоты либо с помощью химического гидролиза, либо с помощью ферментативного гидролиза. Препараты белкового гидролизата можно применять в питании человека, например, в качестве ингредиентов в энергетических напитках, продуктах для контроля веса и спортивного питания, как источник питания для пожилых пациентов и пациентов с недостаточным весом, а также в производстве ароматизирующих веществ. Белок можно получать из растений или животных.
На многих предприятиях побочные продукты получают параллельно с переработкой пищи. Побочные продукты могут быть достаточно дорогостоящими в отношении утилизации и представляют собой потенциальный канал поступления доходов.
Примеры побочных продуктов производства пищи для человека, которые можно использовать в качестве корма для животных, включают зерновые продукты (шелуха, отруби, зародыши, глютеновая мука, крупа и шрот); пшеничную крупку, образующуюся при переработке пшеницы на муку; шелуху, кожуру, жмых, мякоть, обрезки или другой подобный материал, полученный при переработке фруктов или овощей для потребления человеком; пищу для человека, такую как картофельные чипсы, печенье, хлеб, кондитерские изделия и макаронные изделия, которые не являются фальсифицированными и считаются безопасными для применения в качестве корма для животных, но не являются приемлемыми в качестве еды для людей по соображениям их качества, таким как неправильный размер, форма, цвет или текстура.
Побочными продуктами животного происхождения являются туши и части туш из скотобоен, приютов для животных, зоопарков и ветеринарных клиник, а также продукты животного происхождения, не предназначенные для потребления человеком, в том числе пищевые отходы (все пищевые отходы из ресторанов, предприятий общественного питания, центральных кухонь, скотобоен и домашних кухонь). Примеры побочных продуктов животного происхождения включают без ограничения кровяную муку (от работ на скотобойне), муку из побочных продуктов от домашней птицы, коллаген и желатин (из вареной кожи и других частей забитого домашнего скота), перья (от переработки домашней птицы), перьевую муку (от переработки домашней птицы), ланолин (от чистки шерсти), кожу, навоз, мясокостную муку (от переработки костей животных и субпродуктов) и т. п.
Термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10, описанную в настоящем документе, можно применять для удаления белков их животных и их последующего разрушения или утилизации, таких как, например, перья, кожа, волосы, шкура. В некоторых случаях погружение туши животного в раствор, содержащий термостабильную сериновую протеазу, описанную в настоящем документе, может действовать в качестве защиты кожи от повреждения по сравнению с традиционным погружением в воду для обваривания или способом удаления перьев. В одном варианте осуществления перья можно опрыскивать термостабильной сериновой протеазой, описанной в настоящем документе, при условиях, подходящих для расщепления или инициации процесса разрушения оперения. В некоторых вариантах осуществления вариант можно применять в комбинации с окисляющим средством.
В некоторых вариантах осуществления удаление масла или жира, связанного с необработанными перьями, можно облегчать с помощью термостабильной сериновой протеазы, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99%идентичностью последовательности с SEQ ID NO: 3, 8 или 10, описанной в данном документе. В некоторых вариантах осуществления один или несколько гомологов и/или вариантов ME-3 (термостабильной сериновой протеазы), описанной в данном документе, применяют в композициях для очистки перьев, а также для дезинфекции и частичного обезвоживания волокон. Еще в одном варианте осуществления термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10, описанную в данном документе, применяют при извлечении белка из оперения.
Неограничивающие примеры композиций и способов, раскрытых в данном документе, включают следующие.
1. Способ получения термостабильной сериновой протеазы, предусматривающий:
(а) трансформацию продуцирующего хозяина с помощью рекомбинантной конструкции, кодирующей термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10; и
(b) культивирование продуцирующего хозяина из стадии (а) при температуре выше 37,5°С c повышением уровня экспрессии термостабильной сериновой протеазы.
2. Способ согласно варианту осуществления 1, где термостабильную сериновую протеазу необязательно извлекают из продуцирующего хозяина.
3. Культуральный супернатант, содержащий термостабильную сериновую протеазу, полученный с помощью способа согласно вариантам осуществления 1 или 2.
4. Корм, кормовой продукт, композиция, представляющая собой кормовую добавку, премикс, пищевой или зерновой продукт, содержащие термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10, где указанную термостабильную сериновую протеазу можно применять отдельно или в комбинации с по меньшей мере одним пробиотиком.
5. Корм для животных, содержащий термостабильную сериновую протеазу, характеризующаяся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10, где термостабильная сериновая протеаза присутствует в количестве 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15,16, 17, 18, 19, или 20 г/тонна корма, и дополнительно при этом указанную термостабильную сериновую протеазу можно применять отдельно или в комбинации с по меньшей мере одним пробиотиком.
6. Композиция, представляющая собой кормовую добавку, согласно варианту осуществления 4 для применения в корме для животных, дополнительно содержащая 10 и по меньшей мере один компонент, выбранный из группы, состоящей из белка, пептида, сахарозы, лактозы, сорбита, глицерина, пропиленгликоля, хлорида натрия, сульфата натрия, ацетата натрия, цитрата натрия, формиата натрия, сорбата натрия, хлорида калия, сульфата калия, ацетата калия, цитрата калия, формиата калия, ацетата калия, сорбата калия, хлорида магния, сульфата магния, ацетата магния, цитрата магния, формиата магния, сорбата магния, метабисульфита натрия, метилпарабена и пропилпарабена.
7. Гранулированная композиция, представляющая собой кормовую добавку, для применения в корме для животных, содержащая термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10, применяемую либо отдельно, либо в комбинации с по меньшей мере одним пробиотиком, где гранулированная композиция, представляющая собой кормовую добавку, содержит частицы, полученные с помощью способа, выбранного из группы, состоящей из гранулирования с высоким усилием сдвига, барабанного гранулирования, экструзии, сферонизации, агломерации в псевдоожиженном слое, нанесения покрытия распылением в псевдоожиженном слое, распылительной сушки, лиофилизации, приллирования, охлаждения распылением, пульверизации с помощью вращающегося диска, коацервации, таблетирования или любой комбинации вышеуказанных способов.
8. Гранулированная композиция, представляющая собой кормовую добавку, согласно варианту осуществления 7, где средний диаметр частиц составляет более 50 микрон и менее 2000 микрон.
9. Композиция, представляющая собой кормовую добавку, согласно варианту осуществления 7, где указанная композиция представлена в жидкой форме.
10. Композиция, представляющая собой кормовую добавку согласно варианту осуществления 9, где указанная композиция представлена в жидкой форме, подходящей для распылительной сушки с нанесением на кормовую гранулу.
11. Способ гидролиза крахмалсодержащего материала, предусматривающий:
(а) приведение крахмалсодержащего материала в контакт с жидкостью с образованием затора и
(b) осуществление гидролиза крахмала в заторе с образованием разжиженной фракции путем приведения затора в контакт со смесью ферментов, содержащей термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10.
12. Способ по варианту осущствления 11, где смесь ферментов дополнительно содержит по меньшей мере один фермент, выбранный из группы, состоящей из альфа-амилазы, амилоглюкозидазы, фитазы, пуллуланазы, бета-глюканазы, целлюлазы и ксиланазы.
13. Способ получения продуктов ферментации из крахмалсодержащего материала, предусматривающий:
(а) разжижение крахмалсодержащего материала с помощью смеси ферментов, содержащей термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10;
(b) осахаривание продукта из стадии (а);
(c) ферментацию с помощью подходящего организма и
(d) необязательно извлечение продукта, полученного на стадии (с).
13b. Способ согласно варианту осуществления 13, где стадии (b) и (c) выполняют последовательно.
14. Способ согласно варианту осуществления 13, где стадии (b) и (c) выполняют одновременно.
15. Способ согласно варианту осуществления 13 или варианту осуществления 14, где добавление источника азота (такого как без ограничения мочевина или аммиак) исключают или уменьшают на по меньшей мере 30%, 40%, 50%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% с помощью применения 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15,16, 17, 18, 19, или 20 г термостабильной сериновой протеазы/MT крахмалсодержащего материала, характеризующейся по меньшей мере 80% идентичностью последовательности с SEQ ID NO: 3, 8 или 10.
15b. Способ согласно варианту осуществления 13 или варианту осуществления 14, где добавление источника азота исключают или уменьшают на по меньшей мере 30%, 40%, 50%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% с помощью применения по меньшей мере 3, 4, 5 или 6 г термостабильной сериновой протеазы/MT сухого твердого вещества, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10.
15c Способ согласно варианту осуществления 1b5, где источник азота выбран из группы, состоящей из мочевины и аммиака.
15d. Способ согласно варианту осуществления 13 или варианту осуществления 14, где уровни гидролизованного кислотой жира из материалов, полученных по завершении ферментации, повышаются по сравнению с материалами, полученными по завершении контрольной ферментации, не предусматривающей применение указанной термостабильной сериновой протеазы, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10.
15e. Способ согласно варианту осуществления 13 или варианту осуществления 14, где продукт ферментации (такой как без ограничения этанол) получают с более высокой скоростью по сравнению с контрольной ферментацией, не предусматривающей применение указанной термостабильной сериновой протеазы, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10.
15f. Способ согласно варианту осуществления 13 или варианту осуществления 14, где выход продукта ферментации (такого как без ограничения этанол) является более высоким по сравнению с выходом продукта ферментации, полученного в контрольной ферментации, не предусматривающей применение указанной термостабильной сериновой протеазы, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10.
15h. Способ согласно варианту осуществления 13 или варианту осуществления 14, где уровни глицерина из материалов, полученных по завершении ферментации, понижаются по сравнению с материалами, полученными по завершении контрольной ферментации, не предусматривающей применение указанной термостабильной сериновой протеазы, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10.
16. Способ согласно варианту осуществления 15, где, в случае если продукт ферментации представляет собой этанол, на стадии (с) не требуется кислый протеолитический фермент при применении по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15,16, 17, 18, 19, или 20 г термостабильной сериновой протеазы/МТ крахмалсодержащего материала, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10.
17. Способ уменьшения вязкости разжиженного крахмалсодержащего материала, который предусматривает приведение взвеси из крахмалсодержащего материала в контакт с термостабильной сериновой протеазой, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99%идентичностью последовательности с SEQ ID NO: 3, 8 или 10.
18. Способ экстрагирования масла из масличной культуры, предусматривающий:
(a) приведение маслосодержащей фракции масличного семени в контакт с водным экстрагирующим средством с образованием экстрагированной фракции масличного семени и
(b) разделение экстрагированной фракции масличного семени на водную фазу, эмульсию масло-в-воде и нерастворимую фазу;
(c) приведение эмульсии масло-в-воде в контакт с по меньшей мере термостабильной сериновой протеазой, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10, либо отдельно, либо в комбинации с по меньшей мере фосфолипазой, в условиях, обеспечивающих активность фермента в течение периода времени, достаточного для дестабилизации эмульсии; и
(d) разделение дестабилизированной эмульсии из стадии (с) на водную фазу, масляную фазу и нерастворимую фазу с получением масла из масличного семени.
19. Способ согласно варианту осуществления 19, где фракция масличной культуры получена из сои, семени кукурузы, семени рапса, пальмового ядра, семени подсолнечника, семени сафлора, кокоса, арахиса, семени хлопчатника, семени кунжута, льняного семени, семени мака, миндаля, фундука, грецкого ореха, семени примулы вечерней, виноградной косточки, семени конопли, семени черной смородины, семени красной малины, семени моркови, семени тмина, семени черники, семени клюквы, семени петрушки, семени лука, семени тыквы, абрикосовой косточки, семени горчицы, семени льна, семени клещевины или ятрофы.
20. Способ согласно варианту осуществления 18, где фракция масличного семени содержит белковую фракцию, которая применима как пищевой продукт, пищевой ингредиент, пищевая добавка или биологически активная пищевая добавка.
21. Масло растительного происхождения, полученное с помощью способа согласно варианту осуществления 18.
22. Корм, кормовой продукт, композиция, представляющая собой кормовую добавку, премикс, пищевой или зерновой продукт, содержащие масло согласно варианту осуществления 21.
23. Способ получения сусла, предусматривающий:
a) приведение крахмалсодержащего материала, который содержит смесь измельченного зерна, в контакт с водой и термостабильной сериновой протеазой, характеризующейся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10, с образованием затора;
b) медленное нагревание затора из стадии (а) с превращением крахмала в сахара и
c) разделение нагретого затора из стадии (b) на остаточное зерно и жидкое сусло,
где термостабильная протеаза присутствует в количестве 1-30 г/тонна измельченного зерна.
24. Способ согласно варианту осуществления 23, где по меньшей мере одну альфа-амилазу добавляют на стадии (а) вместе с термостабильной сериновой протеазой.
25. Способ гидролиза по меньшей мере одного пищевого побочного продукта или побочного продукта животного происхождения, предусматривающий:
(a) приведение пищевого побочного продукта или побочного продукта животного происхождения в контакт с жидкостью и
(b) осуществление гидролиза пищевого побочного продукта или побочного продукта животного происхождения в заторе с образованием разжиженной фракции путем приведения в контакт со смесью ферментов, содержащей термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10.
26. Способ согласно варианту осуществления 25, где пищевой побочный продукт представляет собой богатый кератином материал, выбранный из группы, состоящей из перьев, волос и шерсти.
27. Способ гидролиза белков в лигноцеллюлозной биомассе, предусматривающий:
(a) приведение биомассы в контакт с жидкостью и
(b) осуществление гидролиза белков в биомассе путем приведения биомассы в контакт со смесью ферментов, содержащей термостабильную сериновую протеазу, характеризующуюся по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с SEQ ID NO: 3, 8 или 10.
ПРИМЕРЫ
Если в данном документе не определено иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понимает специалист в данной области техники, к которой принадлежит настоящее изобретение. Singleton, et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY, 2D ED., John Wiley and Sons, New York (1994) и Hale & Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGY, Harper Perennial, N.Y. (1991) предоставляют для специалиста общий словарь для многих терминов, используемых в данном изобретении.
Настоящее изобретение дополнительно определено в следующих примерах. Следует понимать, что примеры, хотя и показывают определенные варианты осуществления, приводятся исключительно в целях иллюстрации. Из приведенного выше обсуждения и примеров специалист в данной области техники сможет установить существенные характеристики настоящего изобретения, и не отклоняясь от его идеи и объема, сможет осуществить различные изменения и модификации для его адаптации к различным областям применения и условиям.
ПРИМЕР 1
Сериновая протеаза ME-3 из Thermobifida cellulosilytica DSM 44535
Thermobifida cellulosilytica DSM 44535, бактериальный штамм, полученный из Немецкой коллекции микроорганизмов и клеточных культур DSMZ Института Лейбница (Брауншвейг, Германия), выбрали как потенциальный источник ферментов, пригодных в различных областях промышленного применения. Весь геном этого штамма секвенировали с применением секвенирования ILLUMINA® посредством технологии синтеза. Секвенирование генома и сбор данных о последовательностях выполняли посредством BaseClear (Лейден, Нидерланды). Контиги снабжали примечаниями с помощью BioXpr (Намюр, Бельгия).
Один из генов, идентифицированных таким образом в Thermobifida cellulosilytica DSM 44535, Tce01961n (SEQ ID NO:1), кодирует протеазу, обозначенную ME-3, которая показала гомологию с сериновыми протеазами других бактерий. Нуклеотидная последовательность Tce01961n, кодирующая протеазу ME-3, изложена под SEQ ID NO:1. Аминокислотная последовательность препрофермента ME-3, кодируемого Tce01961n, изложена под SEQ ID NO:2. На N-конце препрофермент ME-3 имеет сигнальный пептид с предполагаемой длиной 27 остатков (аминокислоты 1-27 в SEQ ID NO:2), как определено с применением SignalP (Emanuelsson et al. (2007) Nature Protocols, 2: 953-971). Наличие последовательности сигнального пептида указывает на то, что такая сериновая протеаза является секретируемым ферментом. Как и другие сериновые протеазы, фермент имеет пропоследовательность с предполагаемой длиной 162 остатка (аминокислоты 28-189 в SEQ ID NO:2). Прогнозирование пропоследовательности основывалось на данных о соединении в состоянии, предшествующем зрелому, у гомологичных протеаз, таких как Cellulomonadin (Shaw et al., (2007) Acta Crystallogr Sect F Struct Biol Cryst Commun 63: 266-269) и протеаза A Thermobifida fusca (Kelch BA & Agard DA (2007) J Mol Biol. 370:784-795).
Аминокислотная последовательность полностью процессированного зрелого фермента ME-3 (186 аминокислот) изображена под SEQ ID NO:3.
ПРИМЕР 2
Гетерологичная экспрессия протеазы ME-3
Протеазу ME-3 получали в Bacillus subtilis с применением кассеты экспрессии, состоящей из промотора aprE B. subtilis, модифицированной последовательности сигнального пептида aprE B. subtilis, кодон-оптимизированной последовательности, кодирующей зрелую последовательность протеазы ME-3, и терминатора BPN'.
Последовательность модифицированной последовательности сигнального пептида aprE, слитая с кодон-оптимизированной последовательностью ДНК, кодирующей зрелую последовательность протеазы ME-3, изображена под SEQ ID NO: 4. Кассету экспресии ME-3 клонировали в реплицирующийся челночный вектор pHYT и трансформировали в подходящий штамм B. subtilis.
Вектор pHYT получали из pHY300PLK (Takara Bio Inc.) путем добавления терминатора после гена устойчивости к тетрациклину с использованием сайтов BstEII и EcoRI (терминаторная последовательность изложена под SEQ ID NO:5). Сайт HindIII в pHY300PLK также удаляли с применением линкера, клонированного по сайтам BamHI и HindIII (линкерная последовательность изложена под SEQ ID NO:6). Карта вектора pHYT для экспрессии протеазы ME-3 (pHYT-Tce01961) показана на фигуре 1.
Для получения протеазы ME-3 96-луночный лоток, содержащий 150 мкл триптон-соевого бульона (TBS) + 15 ppm тетрациклина в каждой лунке, инокулировали трансформантом B. subtilis, содержащим pHYT-Tce01961. Инкубировали 96-луночный лоток в течение ночи при 37°С, 200 об./мин., во встряхиваемом инкубаторе. 30 мкл данной ночной (предварительной) культуры добавляли в лунку в 24-луночный лоток, содержащий 3 мл обогащенной полуопределяемой среды (на основе буфера MOP с мочевиной в качестве основного источника азота, глюкозой в качестве основного источника углерода и дополненной 1% сойтона), дополненной 5 мМ CaCl2 и 25 ppm тетрациклина. 24-луночный лоток инкубировали при 32°С, 200 об./мин. в течение 48 часов.
Культуру собирали посредством центрифугирования при 4500 об./мин. в течение 20 минут. Полученный супернатант фильтровали через фильтр 0,22 мкм с получением бесклеточного супернатанта. Супернатант содержал протеазу ME-3 (подтверждено с помощью SDS-PAGE), и эту фракцию затем использовали для анализов, а в некоторых случаях дополнительно очищали, как описано ниже.
Протеазу ME-3 очищали с поомщью инкубирования бесклеточного супернатанта в течение 1 часа при 70°C в партии воды.
Инкубированный супернатант центрифугировали при 5100g в течение 10 минут и затем фильтровали через фильтр 0,22 мкм. Добавляли 0,02% азида и образец заменяли буфером, используя ультрафильтрационные пробирки Viva spin 20 мл с 10000 MWCO (Sartorius). Центрифугирование проводили до достижения 5-10% от первоначального объема и добавляли 25 мМ буфера HEPES, рН 7,0, 1 мМ CaCl2, 0,02% азида до конечного объема 20 мл. Эту стадию повторяли 3 раза и наконец образец извлекали из ультрафильтрационной пробирки и добавляли 25 мМ буфера HEPES pH 7,0, 1 мМ CaCl2, 0,02% азида для получения небходимого конечного объема.
Оценивали влияние температуры в отношении экспрессии протеазы ME-3. Штамм B. subtilis, содержащий кассету экспрессии ME-3, культивировали в 2 мл бульона LB при 37°C в течение 8 часов при отборе с помощью антибиотиков. Аликвоту 100 мкл данной предварительной культуры добавляли в колбу с перегородками объемом 125 мл, содержащую 10 мл обогащенной полуопределяемой среды (на основе буфера MOP, с мочевиной в качестве основного источника азота, глюкозой в качестве основного источника углерода и дополненной 1% сойтона), дополненной антибиотиками. Колбы инкубировали в течение 2 дней при 37°С или 42°С с постоянным вращательным перемешиванием при 250 об./мин. Культуральный супернатант извлекали посредством центрифугирования (20000 g в течение 1 мин.) и использовали для количественного определения протеазы ME-3 с применением субстрата Suc-AAPF-pNA, как описано в примере 3 ниже.
Концентрацию протеазы ME-3 рассчитывали с использованием стандартной кривой, полученной при применении очищенного фермента. Средний выход протеазы ME-3 (3 повторности) из культур, выращенных при 37°C и 42°C, представлен в таблице 1 ниже. Как показано, увеличение на примерно 50% выхода протеазы ME-3 было получено, когда клетки выращивали при 42°C, по сравнению с 37°C.
ПРИМЕР 3
Протеазная активность ME-3 in vitro
Влияние ME-3 в отношении кукурузно-соевого корма в присутствии пепсина и панкреатина
1. Ферментная обработка кукурузно-соевого корма
Кукурузно-соевую кормовую муку (состав, показанный в таблице 2) просеивали до достижения размера частиц менее 212 мкм и суспендировали в воде до 10% (вес/вес) взвеси, а рН регулировали до рН 3. 138 мкл этой взвеси добавляли в каждую лунку 96-луночного планшета МТР. Добавляли 20 мкл образца протеазы ME-3, полученной в 50 мМ ацетате, рН 3, затем добавляли 10 мкл свиного пепсина (Sigma, P7000, приготовленного при 800 Ед/мл в воде). Планшет инкубировали при 40°С в течение 45 мин. в инкубаторе для встряхивания микропланшетов iEMS (iEMS) при 1150 об./мин. Затем добавляли 34 мкл свиного панкреатина (Sigma P7545, полученного при 0,463 мг/мл в 1 М Na-бикарбонате), а планшет инкубировали при 40°C в течение 60 минут в iEMS при 1150 об./мин. После этого планшет центрифугировали при 5°C, 4000 об./мин., в течение 15 мин., супернатант объемом 20 мкл переносили на новые планшеты (планшет Corning № 3641 с несвязывающей поверхностью), содержащие 180 мкл воды в каждой лунке, до 10x разведения.
2. Измерение степени гидролиза белка
Определение степени гидролиза (DH) белка основано на реакции первичных аминогрупп с ортофталевым диальдегидом (анализ OPA), как описано P.M. Nielsen, D. Petersen и C. Dambmann. Improved Method for Determining Food Protein Degree of Hydrolysis. Journal of Food Science. 66 (2001) 642-646. Данный анализ OPA применяли для определения степени гидролиза.
3. Измерение каталитической активности с применением субстрата AAPF в растворе
Для измерения каталитической активности протеазы применяли субстрат Suc-AAPF-pNA (Sigma, S-7388). Активность измеряли следующим образом: 5 мкл супернатанта, содержащего фермент, 50 мкл 0,2 М Mes-NaOH (pH 6,0), 50 мкл воды или 55 мкл воды (холостой контроль), 5 мкл Suc-AAPF-pNA (20 мг/мл) добавляли до половины нижней части 96-луночного микропланшета (Costar 3695, Corning Inc., Нью-Йорк, США). Степень гидролиза отслеживали при 410 нм в течение периода до 20 мин.
4. Измерения каталитической активности в отношении кормовых экстрактов
Для анализа извлечения ME-3 в способе гранулирования корма перед анализом образцы корма измельчали с применением лабораторной мельницы Perten с размером частиц <0,75 мкм. Растворяли 5 граммов измельченного корма в 50 мл 0,1 М раствора Tris, рН 10, содержащего 1% (вес/об.) SDS, и центрифугировали. Супернатант фильтровали и использовали для определения протеазной активности с применением субстрата AAPF-pNA и способа, описанного выше. Композицию кукурузно-соевого корма, представленную в таблице 2, получали на основании следующего литературного источника: Interactions of phytate and myo-inositol phosphate esters (IP1-5) including IP5 isomers with dietary protein and iron and inhibition of pepsin. S. Yu, A. Cowieson, C. Gilbert, P. Plumstead and S. Dalsgaard. J. Anim. Sci. 90 (2012) 1824-1832, Supplementary Information.
Результаты обработки кукурузно-соевого корма протеазой ME-3 в различных концентрациях (500, 1000, 1500 ppm) в присутствии ферментов пепсина и панкреатина представлены ниже на фигуре 2.
ПРИМЕР 4
Термостабильность протеазы ME-3 при различных значениях pH
Аликвоты протеазы ME-3 инкубировали в течение 60 секунд в 0,1 М Tris pH10, содержащем 5 мМ CaCl2 и 0,005% Triton Х-100, в 96-луночном планшете MTP при температурах в диапазоне от 72°C до 95°C. Планшет охлаждали до 4°C и измеряли каталитическую активность при 37°C с применением субстрата AAPF-pNA с помощью способа, описанного в примере 3. Результаты представлены на фигуре 3. Как видно на фигуре 3, ME-3 сохраняет приблизительно 80% активность при 90°C при pH 10. В других экспериментах эффекта EDTA обнаружено не было (данные не представлены). Термостабильность ME-3 также измеряли при pH 4,5 и pH 5,5 с применением 0,1 М ацетата. Было обнаружено, что после инкубирования при 85,5°C в течение 10 мин. фермент ME-3 сохраняет приблизительно 85% активность при pH 4,5 и 5,5, в то время как во время инкубирования при 100°C в течение 5 мин., остаточная активность при рН 5,5 составляет приблизительно 65%.
ПРИМЕР 5
Профиль pH-протеазы ME-3
Влияние рН в отношении активности протеазы ME-3 оценивали в диапазоне рН от 3,75 до 7,5. Два исходных буфера применяли для получения указанного диапазона рН: 0,1 М цитратный буфер и 0,2 М фосфатный буфер, оба из которых содержали 0,05% (вес/об.) Tween-80. Каталитическую активность фермента измеряли при 40°C с применением анализа субстрата AAPF-pNA, описанного в примере 3, и результаты представлены на фигуре 4. Также изучали стабильность протеазы ME-3 при низких значениях pH. Было обнаружено, что после 30 мин. инкубирования при рН 2,5 фермент сохранял 90% активность относительно активности, измеренной при рН 5,0 (данные не показаны).
ПРИМЕР 6
Стабильность протеазы ME-3, непосредственно распыляемой на корм, во время гранулирования
Стабильность протеазы ME-3 во время гранулирования корма для животных оценивали как результат восстановления активности фермента в процентах после процедуры. Гранулирование корма проводили при различных температурах в Датском технологическом институте (Колдинг, Дания) в соответствии со стандартными рабочими процедурами. Фермент ME-3 без покрытия разводили в 600 мл воды и затем распыляли непосредственно на 120 кг корма. Данный образец корма с нанесенной на него распылением ME-3 гранулировали при 90, 95 или 100°C в течение 60 секунд. Для определения стабильности протеазы после данной процедуры гранулы измельчали с помощью лабораторной мельницы Perten и экстрагировали в 50 мл 0,1 М раствора Tris, рН 10, содержащего 1% (вес/об.) SDS, при 22°C в течение 20 мин. Экстракт центрифугировали и фильтровали через фильтровальную бумагу. Затем фильтрат использовали для определения каталитической активности ME-3 с применением анализа субстрата AAPF-pNA, описанного в примере 3. Как показано на фигуре 5, фермент ME-3 без какого-либо покрытия сохраняет более чем 70% активность после гранулирования при 90-100°C в течение 60 секунд.
ПРИМЕР 7
Оценка протеазы ME-3 при разжижении крахмала и одновременном осахаривании и ферментации
Исследовали влияние протеазы ME-3 в лабораторных условиях с применением протоколов по разжижению и одновременному осахариванию и ферментации (SSF) с использованием кукурузы, как описано ниже. Кукурузные зерна (Arie Blok Animal Nutrition, NL-3440 AA Woerden, Artnr: 3777) измельчали с помощью размольной установки Retsch ZM200 с настройками: 3 мм сито, 10 тыс. об./мин. Измельченную кукурузную муку использовали для получения 2 кг взвеси при 32,0% сухих твердых веществ путем добавления к муке смеси 1:1 водопроводной воды/деминерализованной воды. Значение pH регулировали до 5,5 с помощью H2SO4 и затем дозировали SPEZYME® RSL (коммерческий продукт DuPont, содержащий бактериальную альфа-амилазу) в соответствующей коммерческой дозе. Затем добавляли протеазу ME-3 до конечной концентрации 5 мкг/г DS и 2 кг смеси инкубировали при 85°C в течение двух часов при постоянном перемешивании с использованием вертикальной мешалки. Контрольный образец получали без добавления протеазы в смесь для разжижения. После инкубирования обработанный образец кукурузы (разжиженную фракцию) собирали и использовали в последующих экспериментах по одновременному осахариванию и ферментации (SSF), и аликвоты также анализировали с помощью метода эксклюзионной HPLC для определения степени разжижения кукурузного образца.
Анализ вязкости в ходе разжижения кукурузного образца. Кукурузные зерна (Arie Blok Animal Nutrition, NL-3440 AA Woerden, Artnr: 3777) измельчали с помощью размольной установки Retsch ZM200 с настройками: 3 мм сито, 10 тыс. об./мин. Измельченную кукурузную муку использовали для получения 25 г кукурузной взвеси с содержанием сухих твердых веществ 32% путем добавления к муке смеси 1:1 водопроводной воды/деминерализованной воды. Значение рН доводили до 5,5 с помощью серной кислоты, а затем добавляли SPEZYME® CL (коммерческий продукт DuPont, содержащий бактериальную альфа-амилазу) в соответствующей коммерческой дозе. К этой взвеси добавляли протеазу ME-3 до достижения конечной концентрации 10 мкг/г сухого твердого вещества (мкг/г DS). В случае контрольного образца протеазу не добавляли. Образцы инкубировали в быстром анализаторе вязкости (Perten Instruments, RVA4500, настройки: 160 об./мин.) в течение 1 часа при 85°C, а затем температуру понижали до 32°C. Через 15 минут при 32°C получали средние конечные уровни вязкости за последнюю минуту инкубирования, и результат показан в таблице 3.
Одновременное осахаривание и ферментация (SSF)
Значение pH разжиженных образцов (с добавлением и без добавления протеазы в разжижаемую реакционную смесь) доводили до 4,8 и добавляли DISTILLASE® SSF (коммерческий продукт DuPont, содержащий грибковую альфа-амилазу, грибковую глюкоамилазу и кислую грибковую протеазу) в соответствующей коммерческой дозе. Затем добавляли 0,1% вес/вес активных сухих дрожжей (Ethanol Red, Fermentis, Франция). Отбирали аликвоту образца этой смеси 50 граммов в сосуды для SSF. Добавляли ноль или 0,178 SAPU/г DS FERMGEN™ 2,5x (коммерческий продукт DuPont, содержащий кислую грибковую протеазу) и различные количества мочевины (0, 200 и 600 ppm). Все эксперименты проводили в двух повторностях. Процедуры ферментативного инкубирования проводили с применением двух разных способов, описанных ниже.
Способ SSF 1. Сосуды для ферментации инкубировали при 32°C на водяной бане с магнитным перемешиванием при 300 об./мин. Образцы собирали в четырех различных временных точках (5, 22, 29 и 46 часов). Эти образцы анализировали в отношении концентрации этанола с применением разделения посредством HPLC и количественного анализа, как описано ниже.
Условия проведения HPLC (Agilent Technologies серии 1200) были следующими: колонка Phenomenex Rezex™ RFQ-Fast Acid H+, поддержание при 80°C, прогонка при изократическом потоке 1,0 мл/мин. растворителя 0,01 н H2SO4, объем впрыска 10 мкл и время элюирования 5,3 мин. Определение показателя преломления применяли для количественного определения этанола, и результаты показаны в таблице 4.
В таблице 4 показано, что при уменьшении дозы мочевины с 600 до 200 ppm (что эквивалентно уменьшению дозы мочевины на 67%) скорость образования этанола при разжижении ферментами, такими как SPEZYME RSL, снижается. Когда в смесь для разжижения, в том числе SPEZYME RSL, добавляли протеазу ME-3, скорость ферментации была сравнима с той, которая была получена при включении 600 ppm мочевины. Кроме того, добавление ME-3 к смеси для разжижения, в том числе SPEZYME RSL, давало такой же выход этанола, как если бы вместо этого использовали либо ноль, либо только 200 ppm мочевины. Следовательно, добавление ME-3 в ходе разжижения позволяет значительно уменьшить или исключить потребность в мочевине.
Способ SSF 2. Сосуды для ферментации инкубировали при 32°C на водяной бане и с магнитным перемешиванием при 300 об./мин. Кумулятивное давление регистрировали во времени с применением системы выработки газа ANKOM RF (ANKOM Technology, Македон, Нью-Йорк, США), которая обеспечивает простой в применении способ для мониторинга и измерения выработки газа. Выработка газа (CO2) является мерой выработки этанола. Скорости выработки газа показаны на фигуре 6. На фигуре 6 показаны графики кумулятивного давления в результате одновременного осахаривания и ферментации, проводимых в системе Ankom. Контрольные условия показаны серой линией среднего оттенка, при которых добавляли 600 ppm мочевины и 0,178 SAPU/г DS FERMGEN™ 2,5x к ферментационной смеси и не применяли ME-3 в ходе разжижения. Светло-серой линией показаны показатели выхода этанола при применении 240 ppm мочевины, при этом к ферментационной смеси не добавляли FERMGEN™ 2,5x и не применяли ME-3 в ходе разжижения. Черной линией показаны показатели выхода этанола при добавлении протеазы ME-3 в смесь для разжижения, и ферментацию осуществляли с 240 ppm мочевины и без добавления FERMGEN™ 2,5x. Как можно видеть, даже при дозе мочевины ниже на 60% и без добавления FERMGEN™ к ферментационной смеси, при добавлении протеазы ME-3 в смесь для разжижения выход этанола улучшался по сравнению с контрольными условиями.
Обнаружение гидролиза белка кукурузной муки с помощью анализа HPLC кукурузных образцов для разжижения
Для оценки гидролиза кукурузного белка протеазой ME-3 применяли эксклюзионную HPLC для количественного определения солюбилизации кукурузного белка. Образцы по окончании разжижения центрифугировали при 13000 об./мин. в течение 5 минут и 200 мкл супернатанта фильтровали через фильтр 0,22 мкм. Аликвоту 5 мкл этого фильтрата впрыскивали для HPLC(Agilent Technologies серия 1200) на колонке Waters  1,7 мкм/300 мм; и прогоняли при 0,4 мл/мин. Подвижный буфер: 25 мМ NaPO4, рН 6,8, 0,1 М NaCl. Общую площадь от времени удерживания 7 мин. до 10 мин. интегрировали, обнаружение: OD220 нм.
1,7 мкм/300 мм; и прогоняли при 0,4 мл/мин. Подвижный буфер: 25 мМ NaPO4, рН 6,8, 0,1 М NaCl. Общую площадь от времени удерживания 7 мин. до 10 мин. интегрировали, обнаружение: OD220 нм.
Результаты обнаружения посредством HPLC пептидов в образцах для разжижения показаны в таблице 5 в виде интегрированной области под кривой со временем удерживания 7-10 минут для образцов, обработанных протеазой ME-3, и без ее применения. Результаты гидролиза белка, показанные в таблице 5, демонстрируют, что при добавлении ME-3 в смесь для разжижения наблюдалось повышение уровней растворимых пептидов.
ПРИМЕР 8
Применение протеазы ME-3 для выработки свободного аминного азота при затирании при высоких температурах
Стандартные анализы контроля качества пивоварения включают тест на свободный аминный азот (FAN). Это позволяет оценить концентрацию отдельных аминокислот и небольших пептидов, которые могут утилизироваться дрожжами во время ферментации пива для роста и пролиферации клеток. Включение несолодовых сырьевых материалов в качестве добавок в способ пивоварения повышает требования в отношении более высокого содержания FAN в сусле для обеспечения правильного процесса ферментации. Протеазу ME-3 исследовали в процессе затирания с 50% солода Pilsner (солод Pilsner; Fuglsang Denmark, партия 13.01.2016) и 50% кукурузной крупки (Benntag Nordic; Nordgetreide GmBH  Германия, партия: 02.05.2016.) с применением соотношения воды и зерна 4,0:1. Солод Pilsner измельчали на солодовой мельнице Buhler Miag (установка при 0,5 мм).
Германия, партия: 02.05.2016.) с применением соотношения воды и зерна 4,0:1. Солод Pilsner измельчали на солодовой мельнице Buhler Miag (установка при 0,5 мм).
Маисовую крупку (1,5 г), солод (измельченный солод Pilsner, 1,5 г) и водопроводную воду (12,0 г) смешивали в чашах Уитона (стеклянные контейнеры Уитон с крышкой), предварительно инкубированных с 12,0 г водопроводной воды, рН регулировали до 5,4 с помощью 2,5 М серной кислоты и нагревали до 70°С. Протеазу ME-3 добавляли на основании ppm активного белка (всего 0,5 мл) и воды в качестве контроля без фермента. Коммерчески соответствующую дозу альфа-амилазы (Amylex® 5T, коммерческий продукт DuPont) применяли в отношении всех образцов для облегчения разжижения. Чашки Уитона помещали на сухую баню (станция Thermo Scientific Stem) с магнитным перемешиванием и применяли следующую программу затирания; выдерживали при 70°С в течение 30 минут; нагревали до 95°С в течение 12,5 минуты с повышением температуры на 2°С/минута; выдерживали при 95°С в течение 17,5 минуты; охлаждали до 70°С в течение 15 минут и выдерживали при 70°С в течение 30 минут и наконец нагревали до 79°С в течение 15 минут и затирали. Образец 10 мл переносили в пробирки Falcon и кипятили при 100°C в течение 20 минут для обеспечения полной инактивации фермента. Отработанные зерна отделяли от сусла с помощью центрифугирования в центрифуге Multifuge X3R (Heraeus) при 4500 об./мин. в течение 30 минут при 10°С.
Супернатант собирали для анализа свободного альфа-аминного азота (FAN). Содержание FAN (мг/литр) измеряли в сусле с помощью международного способа EBC 8.10 для определения содержания свободного аминного азота в сусле с помощью колориметрии (с применением спектрофотометра Genesys 10S UV-Vis) с поомщью нингидрина. Как показано на фигуре 7, протеаза ME-3 способствовала дозозависимой выработке свободного альфа-аминного азота (FAN) в сусле.
ПРИМЕР 9
Экстракция масла из масличного семени с помощью протеазы ME-3
Плющеные, очищенные от кожуры и измельченные семена арахиса (Arachis hypogaea) суспендировали в 2 мл 0,1 М Tris-HCl, содержащего 5 мМ CaCl2 (рН 8,0), и инкубировали при 60°C со встряхиванием при 1180 ppm в течение 3 ч., чтобы сымитировать процесс экстрагирования масла. В конце экстракции масляно-водный супернатант собирали с помощью центрифугирования при 4000 об./мин. в течение 15 мин. с применением настольной центрифуги. Собранный супернатант обрабатывали протеазой ME-3 с гидролизом белков, распределенных в масляно-водной эмульсии. Вкратце, аликвоту 120 мкл супернатанта смешивали с увеличивающимися количествами протеазы ME-3 (3,7 мкг белка/мкл исходного раствора): 0, 1, 3, 5 и 10 мкл и инкубировали со встряхиванием при 60°C и 1180 об./мин. в течение 1 ч. (n=2). В конце периода инкубирования реакционную смесь охлаждали до 0°C и отбирали 20 мкл каждого образца для измерения мутности при 600 нм. Результаты представлены в таблице 6, и они демонстрируют, что добавление протеазы ME-3 обеспечивало уменьшение мутности образца.
Такое снижение мутности реакционной смеси объясняется гидролизом белков в масляно-белковой эмульсии. Хорошо известно, что растительное масло можно экстрагировать органическими растворителями, такими как гексан, но является высоким риск возникновения пожара и взрыва. Экстракция растительного масла с помощью водного раствора при пониженной температуре может обеспечивать избегание этих рисков, но образование водно-масляной эмульсии является проблемой, поскольку сложно отделить свободное масло от водной фазы. Использование протеаз для гидролиза растительного материала или клеточной стенки семян растений для высвобождения большего количества захваченного масла, а также белковых частей в водно-масляной эмульсии увеличивает выход масла (как описано в патентной заявке US2010227042).
Применение термостабильной протеазы, такой как ME-3, более совместимо с высокотемпературным способом экстракции масла из растения и водоросли, чем протеаз, раскрытых в патенте US2010227042, которые менее термостабильны. Липазы, в том числе фосфолипазы, также можно применять в способе, но преимущество применения термостабильной протеазы состоит в том, что она гидролизует растительные белки, в том числе те, которые могут обуславливать аллергенность, и белковые ингибиторы, которые негативным образом влияют на пищеварение, с получением за счет этого более желательного продукта.
ПРИМЕР 10
Гидролиз кератина с помощью протеазы ME-3
Оценку гидролиза кератина с помощью протеазы ME-3 проводили, как описано ниже. Протеазу ME-3 (3,7 мг белка/мл), дозированную при 0, 5 мкл, 10 мкл и 20 мкл, добавляли к 2 мл суспензии 1% (вес/вес) кератина шерсти (K0044, Tokyo Chemical Industry Co. Ltd), суспендированного в 0,1 М Tris-HCl, содержащем 5 мМ CaCl2 (рН 8,0) и 0,1 мл цистеина (0,1 М). Реакции проводили при 60°C со встряхиванием при 1180 об./мин. в течение 3 ч. (n=3). В конце периода инкубирования реакционные смеси центрифугировали при 10000 об./мин. в течение 20 мин. Супернатант удаляли, а осадок высушивали и взвешивали для определения количества гидролизованной шерсти. Результаты приведены в таблице 7, и они показывают, что увеличивающиеся количества протеазы ME-3 эффективно гидролизуют кератин шерсти.
Богатые кератином материалы, в том числе перья птицы, волосы млекопитающих и шерсть, представляют собой белки с высокой степенью сшивки, которые, как известно, трудно гидролизуются ферментами. Некоторые протеазы могут в определенной степени гидролизовать некоторые из этих кератиновых материалов, таких как перья (Pedersen et al., Comparison of four feed proteases for improvement of nutritive value of poultry feather meal. J. Anim. Sci. 2012, Vol. 90 No. Supplement_4, p. 350-352). Однако ни одна из ранее оцениваемых протеаз не является эффективной, и ни одна из них не может гидролизовать кератин шерсти ввиду своей нестабильности при повышенных температурах.
Эффективность, наблюдаемая для протеазы ME-3 при гидролизе материала на основе кератина шерсти, может быть обусловлена ее устойчивостью к высоким температурам, поскольку кератиновые белки разворачиваются легче при более высокой температуре. Кроме того, современный способ получения перьевой муки для корма для животных и корма для домашних животных обычно включает обработку перьев (с высоким содержанием кератина) при высокой температуре для уничтожения возможных патогенов и денатурации белков перьев. Протеазу ME-3 можно применять или отдельно, или в комбинации с высокотемпературной обработкой перьев (как описано в патенте №US2015197783).
ПРИМЕР 11
Применение протеазы ME-3 для гидролиза белков в биомассе
Биомассе для получения биоэтанола второго поколения или для других целей необходима предварительная обработка перед подверганием ферментативному гидролизу с получением ферментируемых сахаров. Биомассу, как правило, предварительно обрабатывают при повышенных температурах, как правило, выше 100°C, либо в кислых, либо в щелочных условиях (как описано в заявках на патент WO2006110901, WO2014202716).
Термостабильную протеазу, такую как ME-3, можно применять в таком способе для гидролиза белков, присутствующих в биомассе, с целью обеспечения ферментирующих организмов, таких как этанологен, дополнительными аминокислотами и пептидными питательными веществами, а также для уменьшения вязкости взвеси биомассы для увеличения ее текучести. Предварительно обработанная щелочью биомасса, например, с помощью предварительной обработки разбавленным аммиаком (как описано в патенте WO2006110901), была бы особенно подходящей для обработки ME-3 для получения таких питательных веществ вследствие более высокого оптимума рН для ME-3. Чтобы оценить влияние ME-3 в данных условиях, использовали кукурузную солому (63% твердых веществ), предварительно обработанную разбавленным аммиаком и суспендированную в деионизованной воде при 10% (вес/об.). Значение pH данной взвеси составляло 8,25. Взвесь распределяли в 12 пробирок, каждая из которых содержала 4 мл взвеси. Протеазу ME-3 (3,7 мг/мл) дозировали при 0, 1, 5, 10, 15 и 25 мкл (n=2). Образцы перемешивали и осуществляли реакцию при 60°C в течение 4 ч. Затем образцы центрифугировали и собранный супернатант фильтровали через фильтр 0,45 мкм и разбавляли в 10 раз водой. Образцы применяли для измерения свободных аминогрупп белков и аминокислот с помощью взаимодействия 20 мкл разбавленного образца с реагентом ОРА, как описано в примере 3. Степень гидролиза белка в результате обработки биомассы с помощью ME-3 показана в таблице 8. Из таблицы 8 видно, что количество свободных аминогрупп, как видно по значению ОРА, увеличивалось при добавлении ME-3.
ПРИМЕР 12
Гомологи протеазы ME-3
Поиск BlastP в отношении протеазы ME-3 (SEQ ID NO: 3) по базам данных nr и pat в NCBI выявил гомологи протеазы ME-3 у двух других видов Thermobifida: Thermobifida fusca и Thermobifida halotolerans.
Гомолог, присутствующий в Thermobifida fusca, Tfpa, был впервые описан Kelch,B.A. и Agard,D.A. (2007) J. Mol. Biol. 370: 784-795. Номера доступа Tfpa в NCBI (PDB ID) - 2PFE. Номера доступа WP_011290931, WP_016188200 и SCV75185 являются идентичными белками (зрелые цепи). Номером доступа в NCBI белка гомолога протеазы ME-3 у Thermobifida halotolerans (Thpa) является WP_068687914. Аминокислотная последовательность препрофермента Tfpa Thermobifida fusca изложена под SEQ ID NO:7. На N-конце препрофермент Tfpa имеет сигнальный пептид с предполагаемой длиной 31 остаток (аминокислоты 1-31 в SEQ ID NO:7). Пропоследовательность Tfpa имеет длину 151 остаток (аминокислоты 32-182 в SEQ ID NO:7), а аминокислотная последовательность полностью процессированного зрелого фермента Tfpa (186 аминокислот) отображена в SEQ ID NO:8.
Аминокислотная последовательность пептидазы S1 Thermobifida halotolerans WP_068687914, Thpa, изложена под SEQ ID NO:9. На основании выравниваний с протеазой ME-3 и препроферментом Tfpa в последовательности WP_068687914, по-видимому, отсутствует часть N-концевого сигнального пептида. Предполагаемый неполный сигнальный пептид соответствует 15 остаткам (аминокислоты 1-15 в SEQ ID NO: 9). Предполагаемая пропоследовательность Thermobifida halotolerans WP_068687914 имеет длину 152 остатка (аминокислоты 16-167 в SEQ ID NO:9). Аминокислотная последовательность предполагаемого полностью процессированного зрелого фермента Thermobifida halotolerans WP_068687914, Thpa (186 аминокислот), представлена в SEQ ID NO:10.
Дополнительные гомологи протеазы ME-3, которые находятся за пределами рода Thermobifida, были обнаружены с помощью поиска BLAST P в базе данных NCBI и включают в себя следующие протеазы S1: протеаза Nocardiopsis potens (WP_017594871), Marinactinospora thermotolerans (WP_078763344.1), Amycolatopsis marina (WP_091675221.1), Actinoalloteichus hymeniacidonis (WP_069846166.1), Nocardiopsis trehalosi (WP_067965505.1), Saccharothrix sp. NRRL B-16314 (WP_033441214.1). Процент идентичности последовательностей по всем последовательностям зрелого фермента рассчитан и показан в таблице 9.
Аминокислотная последовательность Nocardiopsis potens WP_017594871 изложена под SEQ ID NO:11. Предполагаемый сигнальный пептид имеет длину 29 аминокислот. Предполагаемая пропоследовательность протеазы Nocardiopsis potens WP_017594871 имеет длину 161 аминокислоту, а аминокислотная последовательность предполагаемого полностью процессированного зрелого фермента сериновой протеазы Nocardiopsis potens WP_017594871 (185 аминокислот) отображена в SEQ ID NO:12.
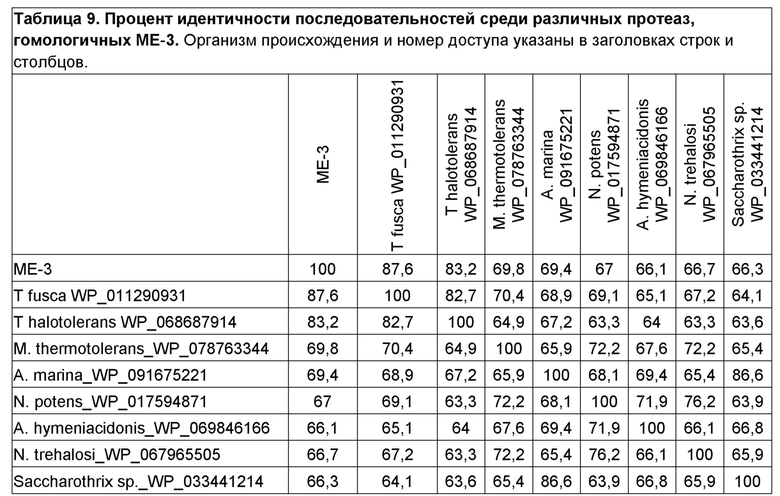
Многократное выравнивание последовательностей зрелых аминокислотных последовательностей для ME-3 (SEQ ID NO:3), Tfpa (SEQ ID NO:8), Thpa (SEQ ID NO:10), N. potens_WP_017594871 (SEQ ID NO:12), Marinactinospora thermotolerans WP_078763344 (аминокислоты 197-381); Amycolatopsis marina WP_091675221 (аминокислоты 193-435); Actinoalloteichus hymeniacidonis WP_069846166 (аминокислоты 201-385); Nocardiopsis trehalosi WP_067965505 (аминокислоты 191-375); и Saccharothrix sp. NRRL B-16314 WP_033441214 (аминокислоты 191-437) показаны на фигуре 8. Последовательности были приведены в соответствие с параметрами по умолчанию с использованием программы MUSCLE от Geneious software (Biomatters Ltd.) (Robert C. Edgar. MUSCLE: multiple sequence alignment with high accuracy and high throughput Nucl. Acids Res. (2004) 32 (5): 1792-1797).
ПРИМЕР 13
Влияние протеазы ME-3 в отношении усвояемости сухого вещества кукурузы и выработку газа при ферментации в рубце in vitro
Параметры влияния протеазы ME-3 оценивали в отношении усвояемости сухого вещества (DMD), выработки газа, усвояемости крахмала и pH в системе периодической ферментации in vitro с использованием в качестве субстрата зубовидной кукурузы (помол 4 мм). Эффективность фермента оценивали в трех дозах (0,25, 0,5 и 0,75 мг/г кормового субстрата) в трех отдельных опытах с четырьмя повторностями на дозу фермента в каждом опыте. Эффективность ME-3 определяли в отношении характера ферментации в рубце после инкубации забуференного содержимого рубца с субстратом и ферментом в 160 мл флаконах с сывороткой в течение 7 ч. при 39°C.
Эксперименты были основаны на протоколе, установленном и опубликованном ранее (Adesogan, A.T., Krueger, N.A., и Kim, S.C. 2005. Anim. Feed Sci. Technol. 123: 211-223). Зубовидная кукуруза, применяемая в данной системе периодической ферментации in vitro, содержала 88,8% сухого вещества (DM), 9,3% неочищенного белка (CP), 3,2% кислотно-детергентного волокна (ADF), 8,3% нейтрально-детергентного волокна, обработанного амилазой (aNDF), 76,9% неволокнистых углеводов (NFC), 88,0% общего количества перевариваемых питательных веществ (TDN). Измельченную зубовидную кукурузу (4 мм) взвешивали в 6 повторностях на серию в фильтровальных мешках F57 (ANKOM Technology, Македон, Нью-Йорк).
Перед помещением во флаконы образец фермента разбавляли в 0,1 М цитратно-фосфатном буфере (pH 6,0) и добавляли к 0,5 г измельченной зубовидной кукурузы в мешках F57 (Krueger, N. A., and A. T. Adesogan. 2008. Anim. Feed Sci. Tech. 145: 84-94; Goering, H. K. and P. J. Van Soest. 1970. Agric. Handbook No. 379. ARS USDA, Washington, DC, pp. 20). Фильтровальные мешки F57 герметично закрывали с помощью настольного устройства для запаивания полиэтиленовых пакетов от Uline (Impulse® типа AIE-200), затем немедленно помещали в сосуды для ферментации (флаконы объемом 160 мл с резиновой пробкой). Также предусматривали пустые флаконы, содержащие только фильтровальный мешок, а также контрольные образцы, содержащие только молотую зубовидную кукурузу без фермента. Рубцовый сок репрезентативным образом отбирали от трех лактирующих молочных коров Holstein с канюлированием рубца через 2-3 ч. после употребления полнорационной кормосмеси (TMR). Ингредиентный состав TMR, даваемой в пищу молочным коровам с наложенной фистулой, основывался на сухом веществе, состоящем из 38,2% кукурузного силоса, 27,3% молотой обмолоченной кукурузы, 14,5% соевой муки с 44% неочищенного белка, 9,1% цитрусового жома, 4,5% премикса для кормления на открытых кормовых площадках, 4,0% сена из люцерны в середине цветения, 1,8% энергетической усиливающей добавки (MS Specialty Nutrition, Данди, Иллинойс), 0,5% Novasil (BASF, Германия), составляя в сумме 100%.
Собранный рубцовый сок фильтровали через четыре слоя марли перед смешиванием с предварительно подогретой искусственной слюной (39°C). Состав искусственной слюны включал микроминеральный раствор CaCl2⋅2H2O, MnCl2⋅4H2O, CoCl2⋅6H2O, FeCl2⋅6H2O; макроминеральный раствор Na2HPO4⋅12H2O, KH2PO4, MgSO4⋅7H2O; буферный раствор (NH4)2HCO3 и NaHCO3; триптиказо-пептонный раствор (триптон, Sigma-Aldrich, Сент-Луис, Миссури, США); окислительно-восстановительный индикатор резазурин и восстанавливающий раствор, содержащий цистеин-HCl, 1 М NaOH, Na2S⋅9H2O, и дистиллированную воду. Объемное соотношение между рубцовым соком и искусственной слюной составляло 1:2. Забуференный рубцовый сок (52 мл) добавляли во флаконы объемом 160 мл с резиновой пробкой, содержащие фильтровальные мешки, и флаконы закрывали с помощью резиновых пробок и закупоривали с помощью алюминиевых пломб. Флаконы инкубировали в течение 7 ч. при 39°C в инкубаторе с принудительной вентиляцией. В конце инкубирования фильтровальные мешки, содержащие остатки, сушили в печи при 60°C в течение 48 ч. и взвешивали с целью количественного определения DMD. Давление газа внутри флаконов измеряли с помощью преобразователя давления и апостериорно преобразовывали в объем газа при 7 ч. инкубации. Следующую формулу применяли для преобразования давления газа в объем газа:
объем газа (мл) = (давление газа (фунтов/кв. дюйм) * 4,8843) + 3,1296.
Уравнение составляли на основе экспериментальных условий с применением флаконов объемом 160 мл с резиновой пробкой и применяли для всех экспериментов из таблиц 10 и 11.
Статистический анализ. Для всех экспериментов из данного примера собранные данные анализировали с применением процедуры GLIMMIX SAS (версия 9.1; SAS Institute, Кэри, Северная Каролина). Эксперименты разрабатывали в виде полностью рандомизированной блочной схемы, где каждая серия рассматривалась как блок. Дозу применяли в качестве фиксированного эффекта в модели при исследовании фермента в различных дозах. Переменная отклика включала DMD и выработку газа in-vitro. Серию рассматривали как случайный фактор. Фиксированные эффекты модели включали время отбора проб в отношении параметров ферментации, измеряемых в разные часы после инкубирования. Процедуру UNIVARIATE SAS применяли для тестирования остатков на выпадающие значения и нормальность, перед тем как проводили окончательные анализы. Эффекты обработок считали статистически значимыми при P < 0,05, тогда как любые тренды определяли при 0,05≤P≤0,10.
Результаты, представленные в таблице 10 ниже, показывают, что в условиях ферментации в рубце in vitro протеаза ME-3 способна стимулировать DMD и выработку газа в зависимости от дозы.
a-c Средние значения в строке с различными верхними индексами отличаются (P < 0,05)
ПРИМЕР 14
Дальнейшая оценка протеазы ME-3 в качестве протеазы для разжижения
Проводили исследования разжижения-SSF, в которых термостабильную сериновую протеазу ME-3 дополнительно исследовали в лабораторных условиях разжижения и одновременного осахаривания и ферментации (SSF) кукурузных образцов. Измельченную кукурузную муку из промышленной установки по производству этанола использовали для получения взвеси с 33% сухих твердых веществ путем добавления к муке 6:4 вес/вес смеси водопроводной воды:возвратного потока из промышленной установки по производству этанола. Значение pH регулировали до 5,1 с помощью H2SO4 и затем дозировали SPEZYME® HT-WB (коммерческий продукт DuPont, содержащий бактериальную альфа-амилазу) в соответствующей коммерческой дозе. Смесь инкубировали при 85°C в течение 20 минут. После этого взвесь кипятили в течение 10 минут при 100°C и затем охлаждали в течение 10 минут при 85°C. Добавляли еще одну дозу SPEZYME® HT-WB, и, кроме того, добавляли протеазу ME-3 до конечной концентрации 3, 4, 5 или 6 мкг/г DS. Разжижение продолжали в течение еще 2 часов при постоянном перемешивании с использованием вертикальной мешалки. Контрольный образец получали без добавления протеазы в смесь для разжижения. После инкубирования обработанный образец кукурузы (разжиженную фракцию) собирали и использовали в последующем эксперименте с SSF.
рН образцов для разжижения (с добавлением протеазы ME-3 и без нее к реакции разжижения) доводили до 4,8 и добавляли грибковую альфа-амилазу, грибковую глюкоамилазу и грибковую трегалазу в соответствующей дозе в каждый сосуд для SSF, содержащий 98 граммов разжиженной фракции. После этого добавляли 2 мл размноженной дрожжевой культуры (SYNERXIA® Thrive, Dupont) и затем добавляли мочевину и FERMGEN™ 2,5x (коммерческий продукт DuPont, содержащий кислую грибковую протеазу) в различных концентрациях, как указано в таблице 11. Эксперименты проводили в четырех повторностях.
Сосуды для ферментации инкубировали при 32°C в инкубаторе с принудительной подачей воздуха при 150 об./мин. Образцы собирали в пяти различных временных точках (16 ч., 24 ч., 40 ч., 48 ч. и 54 часа). Эти образцы анализировали в отношении концентрации этанола, концентрации глицерина, гидролизованного кислотой жира и проводили анализ сырого белка, как описано ниже.
Для определения концентрации этанола и глицерина образцы для ферментации центрифугировали в течение 3 минут при 12000 g. Добавляли 50 мкл 1 н. H2SO4 к 500 мкл супернатанта и оставляли при комнатной температуре на 5 минут. Образец разбавляли в 11x в дистиллированной воде и фильтровали через фильтр 0,2 мкм перед анализом HPLC. Условия проведения HPLC (Thermo Scientific UltiMate 3000) были следующими: колонка Phenomenex® Rezex™ Organic Acid (ROA), 300×7,80 мм, поддержание при 65°C, прогонкна при изократическом потоке 0,7 мл/мин., 0,01 н. растворитель H2SO4, объем впрыска 20 мкл и время элюирования 23 мин. Определение показателя преломления использовали для количественного определения этанола и глицерина. Результаты приведены в таблице 11 (глицерин) и таблице 12 (этанол).
Материалы для конечной ферментации также анализировали в Midwest Laboratories (13611 B Street Omaha, Nebraska 68144) в отношении содержания гидролизованного жира (способ AOAC 954.02 применяли со следующими исключениями: 15 мл пробирки из PET-эфира и этилового эфира вместо сосудов объемом 25 мл и дигитальные пробирки вместо пробирок Можонье) и анализ неочищенного белка (протокол AOAC 990.03). Результаты представлены в таблице 11.
Анализ материала, полученного в конце ферментации, показал, что обработка ME-3 приводила к более высоким уровням неочищенного белка и гидролизованного кислотой жира, что свидетельствует о потенциально более высоком выходе кукурузного масла на установке по производству этанола. Кроме того, было обнаружено, что уровни глицерина являются ниже в случае обработанных с помощью ME-3 разжиженных фракций, что считается положительным для промышленности в комбинации с более высоким выходом этанола.
В таблице 11 показаны результаты измерения уровней гидролизованного кислотой жира, неочищенного белка и глицерина в конце ферментации (54 часа), полученные с использованием различных доз ME-3. ND означает "не определено".
(ppm)
(% сухого веса)
Также определяли выход этанола (как описано в примере 7), и результаты показывают, что при добавлении ME-3 в различных концентрациях во время разжижения и последующего SSF наблюдался четкий эффект реакции на дозу и более высокая скорость выработки этанола, как описано в таблице 12. Кроме того, было обнаружено, что уровни этанола в конце ферментации (54 часа, таблица 12) были немного выше в случае обработанных с помощью ME-3 разжиженных фракций.
В другом исследовании дозу ME-3 удваивали в ходе разжижения. Было обнаружено, что последующее SSF можно осуществлять с применением протеазы для SSF на нормальном уровне без необходимости в каком-либо количестве мочевины. Таким образом, было обнаружено, что не только можно заменить всю мочевину, но и повысить скорость выработки этанола, а также конечный выход этанола (измеренный через 53 часа) по сравнению с контролем, как показано в таблице 13.
В данном исследовании кукурузные зерна (Arie Blok Animal Nutrition, NL-3440 AA Woerden, Artnr: 3777) измельчали с помощью размольной установки Retsch ZM200 с настройками: 3 мм сито, 10k об./мин. Измельченную кукурузную муку использовали для получения взвеси с 32,64% сухих твердых веществ путем добавления к муке смеси 1:1 водопроводной воды/возвратного потока из промышленной установки по производству этанола. Значение pH регулировали до 5,5 с помощью H2SO4 и затем дозировали SPEZYME® RSL (коммерческий продукт DuPont, содержащий бактериальную альфа-амилазу) в соответствующей коммерческой дозе. Затем добавляли протеазу ME-3 до конечной концентрации 0, 3 или 6 мкг/г DS и смесь инкубировали при 85°C в течение двух часов при постоянном перемешивании с использованием вертикальной мешалки. Контрольный образец получали без добавления протеазы в смесь для разжижения. После инкубирования обработанный образец кукурузы (разжиженную фракцию) собирали и использовали в последующем эксперименте с SSF.
рН образцов для разжижения (с добавлением протеазы ME-3 и без нее к реакции разжижения) доводили до 4,8 и добавляли грибковую альфа-амилазу, грибковую глюкоамилазу и грибковую трегалазу в соответствующей дозе в каждый сосуд для SSF, содержащий 98 граммов разжиженной фракции. После этого добавляли 2 мл размноженной дрожжевой культуры (SYNERXIA® Thrive, Dupont) и затем добавляли мочевину и FERMGEN™ 2,5x (коммерческий продукт DuPont, содержащий кислую грибковую протеазу) в различных концентрациях, как указано в таблице 13. Все эксперименты проводили в двух повторностях.
Сосуды для ферментации инкубировали при 32°C в инкубаторе с принудительной подачей воздуха при 150 об./мин. Образцы собирали в четырех разных временных точках (24 ч., 30 ч., 47 ч. и 53 часа). Эти образцы анализировали в отношении концентрации этанола с применением разделения посредством HPLC и количественного анализа, как описано ниже.
Образцы для ферментации центрифугировали в течение 7 минут при 15000g. Супернатант разбавляли в 11 раз с помощью 0,01 н. H2SO4 и фильтровали через фильтр 0,22 мкм перед анализом HPLC. Условия проведения HPLC (Agilent Technologies серии 1200) были следующими: колонка Phenomenex Rezex™ RFQ-Fast Acid H+, поддержание при 80°C, прогонка при изократическом потоке 1,0 мл/мин. растворителя 0,01 н H2SO4, объем впрыска 10 мкл и время элюирования 5,3 мин. Определение показателя преломления применяли для количественного определения этанола, и результаты показаны в таблице 13.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> DuPont Nutrition Biosciences APS
<120> Способы применения термостабильных протеаз
<130> NB40835-US-PSP
<160> 12
<170> PatentIn версия 3.5
<210> 1
<211> 1122
<212> ДНК
<213> Thermobifida cellulosilytica
<400> 1
gtgaaccgac cctccacccg cagaaccgtc cgcgccctgc tcaccgcggc cctggcggcc 60
accgcactga ccgccccggc cgctccctcc ctcgcccagg aggcctccca ggaggccgcc 120
ctcacccgcg acctcgacct gaccggaacc gaggtcgcgc tgctgcgcgc cgccgagtcc 180
gaggcgatgg accgcgagga ggagctgagc gccgtcctcg gctccgactt cggcggcgtc 240
tacctggctc cggagaccgg agaggtcacc gtcgcggtca ccgaccccgc agccgtgccc 300
gtcgtcgagc agtcgggggc caccgcccag gtcgtcacct tcggcgagac cgcgctcaac 360
gacttcgtgg actccctcaa cgccgtcgcc gaccgggccg acgagcagat caccggctgg 420
tacaccgacc tcgccgccga cacggtggtc atcaccgcct tcccgggcgg ctccgctgcc 480
gccgaggagc tggcggccct ggcgggcgtc gacgaacggg cggtgcgggt caccgagagc 540
gccgcgcgac cgcaactgtt cgccgacgtc atcggcggca acccctacta cttcgggggg 600
taccgctgct ccatcggctt ctcggtgcgc aagggctcgg acaccggctt cgccaccgcc 660
ggccactgcg gcgagacggg caccctcacc cgctcccccg agggcgtggt cgccggatcg 720
tacttccccg gacgcgacat gggctgggtg cgcctcaccg gcgccgacac cgtcacccct 780
ctcgtcaacc gctacgacgg ggggaccgtg accgtcaccg gttcgcagga ggccgtcacc 840
ggctcctccg tctgccgctc cggctccacc accggctggc gctgcggcat catccagtcg 900
aagaaccaga ccgtccgcta cgccgagggc accgtcaccg gtctgacccg caccaccgcc 960
tgcgccgagg ccggcgactc cggcggcccc tggctcaccg gctcccaggc ccagggggtc 1020
acctcgggcg gcagcggcaa ctgccggacc ggcggcatca cctacttcca gcccatcaac 1080
ccgctgctgt cctacttcgg cctggaactg gtcaccggct ga 1122
<210> 2
<211> 373
<212> БЕЛОК
<213> Thermobifida cellulosilytica
<400> 2
Met Asn Arg Pro Ser Thr Arg Arg Thr Val Arg Ala Leu Leu Thr Ala
1. 5 10 15
Ala Leu Ala Ala Thr Ala Leu Thr Ala Pro Ala Ala Pro Ser Leu Ala
20 25 30
Gln Glu Ala Ser Gln Glu Ala Ala Leu Thr Arg Asp Leu Asp Leu Thr
35 40 45
Gly Thr Glu Val Ala Leu Leu Arg Ala Ala Glu Ser Glu Ala Met Asp
50 55 60
Arg Glu Glu Glu Leu Ser Ala Val Leu Gly Ser Asp Phe Gly Gly Val
65 70 75 80
Tyr Leu Ala Pro Glu Thr Gly Glu Val Thr Val Ala Val Thr Asp Pro
85 90 95
Ala Ala Val Pro Val Val Glu Gln Ser Gly Ala Thr Ala Gln Val Val
100 105 110
Thr Phe Gly Glu Thr Ala Leu Asn Asp Phe Val Asp Ser Leu Asn Ala
115 120 125
Val Ala Asp Arg Ala Asp Glu Gln Ile Thr Gly Trp Tyr Thr Asp Leu
130 135 140
Ala Ala Asp Thr Val Val Ile Thr Ala Phe Pro Gly Gly Ser Ala Ala
145 150 155 160
Ala Glu Glu Leu Ala Ala Leu Ala Gly Val Asp Glu Arg Ala Val Arg
165 170 175
Val Thr Glu Ser Ala Ala Arg Pro Gln Leu Phe Ala Asp Val Ile Gly
180 185 190
Gly Asn Pro Tyr Tyr Phe Gly Gly Tyr Arg Cys Ser Ile Gly Phe Ser
195 200 205
Val Arg Lys Gly Ser Asp Thr Gly Phe Ala Thr Ala Gly His Cys Gly
210 215 220
Glu Thr Gly Thr Leu Thr Arg Ser Pro Glu Gly Val Val Ala Gly Ser
225 230 235 240
Tyr Phe Pro Gly Arg Asp Met Gly Trp Val Arg Leu Thr Gly Ala Asp
245 250 255
Thr Val Thr Pro Leu Val Asn Arg Tyr Asp Gly Gly Thr Val Thr Val
260 265 270
Thr Gly Ser Gln Glu Ala Val Thr Gly Ser Ser Val Cys Arg Ser Gly
275 280 285
Ser Thr Thr Gly Trp Arg Cys Gly Ile Ile Gln Ser Lys Asn Gln Thr
290 295 300
Val Arg Tyr Ala Glu Gly Thr Val Thr Gly Leu Thr Arg Thr Thr Ala
305 310 315 320
Cys Ala Glu Ala Gly Asp Ser Gly Gly Pro Trp Leu Thr Gly Ser Gln
325 330 335
Ala Gln Gly Val Thr Ser Gly Gly Ser Gly Asn Cys Arg Thr Gly Gly
340 345 350
Ile Thr Tyr Phe Gln Pro Ile Asn Pro Leu Leu Ser Tyr Phe Gly Leu
355 360 365
Glu Leu Val Thr Gly
370
<210> 3
<211> 186
<212> БЕЛОК
<213> Thermobifida cellulosilytica
<400> 3
Ala Asp Val Ile Gly Gly Asn Pro Tyr Tyr Phe Gly Gly Tyr Arg Cys
1. 5 10 15
Ser Ile Gly Phe Ser Val Arg Lys Gly Ser Asp Thr Gly Phe Ala Thr
20 25 30
Ala Gly His Cys Gly Glu Thr Gly Thr Leu Thr Arg Ser Pro Glu Gly
35 40 45
Val Val Ala Gly Ser Tyr Phe Pro Gly Arg Asp Met Gly Trp Val Arg
50 55 60
Leu Thr Gly Ala Asp Thr Val Thr Pro Leu Val Asn Arg Tyr Asp Gly
65 70 75 80
Gly Thr Val Thr Val Thr Gly Ser Gln Glu Ala Val Thr Gly Ser Ser
85 90 95
Val Cys Arg Ser Gly Ser Thr Thr Gly Trp Arg Cys Gly Ile Ile Gln
100 105 110
Ser Lys Asn Gln Thr Val Arg Tyr Ala Glu Gly Thr Val Thr Gly Leu
115 120 125
Thr Arg Thr Thr Ala Cys Ala Glu Ala Gly Asp Ser Gly Gly Pro Trp
130 135 140
Leu Thr Gly Ser Gln Ala Gln Gly Val Thr Ser Gly Gly Ser Gly Asn
145 150 155 160
Cys Arg Thr Gly Gly Ile Thr Tyr Phe Gln Pro Ile Asn Pro Leu Leu
165 170 175
Ser Tyr Phe Gly Leu Glu Leu Val Thr Gly
180 185
<210> 4
<211> 1128
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Кодон-оптимизированная последовательность ДНК, кодирующая
последовательность, являющуюся предшественником зрелой последовательности ME-3
<400> 4
gtgagaagca aaaaattgtg gatcagcttg ttgtttgcgt taacgttaat ctttacgatg 60
gcgttcagca acatgtctgc tagcgcagca ccgtcactgg cacaagaagc atcacaagaa 120
gcagcactga caagagatct ggatctgaca ggcacagaag ttgcactgct gagagcagca 180
gaatcagaag caatggatag agaagaagaa ctgtcagcag ttctgggctc agattttggc 240
ggagtttatc tggcaccgga aacaggcgaa gttacagttg cagttacaga tccggcagca 300
gttccggttg ttgaacaatc aggcgcaaca gcacaagttg ttacatttgg cgaaacagcg 360
ctgaatgatt ttgttgattc actgaatgca gttgcggata gagcagatga acaaattaca 420
ggctggtata cagatcttgc agcagataca gttgtcatta cagcatttcc gggtggctca 480
gcagcagcag aagaacttgc agcactggca ggcgttgatg aaagagcagt tagagttaca 540
gaatcagcag caagaccgca actgtttgca gatgttattg gcggaaatcc gtattacttt 600
ggcggatata gatgctcaat tggcttttca gttagaaaag gctcagatac aggctttgca 660
acagcaggcc attgcggaga aacaggcaca ctgacaagat caccggaagg cgttgttgca 720
ggctcatatt ttccgggaag agatatgggc tgggttagac tgacaggcgc agatacagtc 780
acaccgctgg ttaatagata cgatggcgga acagttacag tcacaggcag ccaagaagca 840
gttacaggct catcagtttg cagatcaggc tcaacaacag gctggcgctg cggcattatt 900
caatcaaaaa atcagacagt tcgctatgca gaaggcacag ttacaggcct gacaagaaca 960
acagcatgcg cagaagcagg cgattcaggc ggaccgtggc tgacaggctc acaagcacaa 1020
ggcgttacat caggcggatc aggcaattgc agaacaggcg gaattacata ttttcagccg 1080
attaatccgc tgctgtcata ttttggcctg gaactggtta caggctaa 1128
<210> 5
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Терминатор
<400> 5
ggttaccttg aatgtatata aacattctca aagggatttc taataaaaaa cgctcggttg 60
ccgccgggcg ttttttatgc atcgatggaa ttc 93
<210> 6
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> линкер
<400> 6
ggatcctgac tgcctgagct t 21
<210> 7
<211> 368
<212> БЕЛОК
<213> Thermobifida fusca
<400> 7
Met Asn His Ser Ser Arg Arg Thr Thr Ser Leu Leu Phe Thr Ala Ala
1. 5 10 15
Leu Ala Ala Thr Ala Leu Val Ala Ala Thr Thr Pro Ala Ser Ala Gln
20 25 30
Glu Leu Ala Leu Lys Arg Asp Leu Gly Leu Ser Asp Ala Glu Val Ala
35 40 45
Glu Leu Arg Ala Ala Lys Ala Glu Ala Val Glu Leu Glu Glu Glu Leu
50 55 60
Arg Asp Ser Leu Gly Ser Asp Phe Gly Gly Val Tyr Leu Asp Ala Asp
65 70 75 80
Thr Thr Glu Ile Thr Val Ala Val Thr Asp Pro Ala Ala Val Ser Arg
85 90 95
Val Asp Ala Asp Asp Val Thr Val Asp Val Val Asp Phe Gly Glu Thr
100 105 110
Ala Leu Asn Asp Phe Val Ala Ser Leu Asn Ala Ile Ala Asp Thr Ala
115 120 125
Asp Pro Lys Val Thr Gly Trp Tyr Thr Asp Leu Glu Ser Asp Ala Val
130 135 140
Val Ile Thr Thr Leu Arg Gly Gly Thr Pro Ala Ala Glu Glu Leu Ala
145 150 155 160
Glu Arg Ala Gly Leu Asp Glu Arg Ala Val Arg Ile Val Glu Glu Asp
165 170 175
Glu Glu Pro Gln Ser Leu Ala Ala Ile Ile Gly Gly Asn Pro Tyr Tyr
180 185 190
Phe Gly Asn Tyr Arg Cys Ser Ile Gly Phe Ser Val Arg Gln Gly Ser
195 200 205
Gln Thr Gly Phe Ala Thr Ala Gly His Cys Gly Ser Thr Gly Thr Arg
210 215 220
Val Ser Ser Pro Ser Gly Thr Val Ala Gly Ser Tyr Phe Pro Gly Arg
225 230 235 240
Asp Met Gly Trp Val Arg Ile Thr Ser Ala Asp Thr Val Thr Pro Leu
245 250 255
Val Asn Arg Tyr Asn Gly Gly Thr Val Thr Val Thr Gly Ser Gln Glu
260 265 270
Ala Ala Thr Gly Ser Ser Val Cys Arg Ser Gly Ala Thr Thr Gly Trp
275 280 285
Arg Cys Gly Thr Ile Gln Ser Lys Asn Gln Thr Val Arg Tyr Ala Glu
290 295 300
Gly Thr Val Thr Gly Leu Thr Arg Thr Thr Ala Cys Ala Glu Gly Gly
305 310 315 320
Asp Ser Gly Gly Pro Trp Leu Thr Gly Ser Gln Ala Gln Gly Val Thr
325 330 335
Ser Gly Gly Thr Gly Asp Cys Arg Ser Gly Gly Ile Thr Phe Phe Gln
340 345 350
Pro Ile Asn Pro Leu Leu Ser Tyr Phe Gly Leu Gln Leu Val Thr Gly
355 360 365
<210> 8
<211> 186
<212> БЕЛОК
<213> Thermobifida fusca
<400> 8
Ala Ala Ile Ile Gly Gly Asn Pro Tyr Tyr Phe Gly Asn Tyr Arg Cys
1. 5 10 15
Ser Ile Gly Phe Ser Val Arg Gln Gly Ser Gln Thr Gly Phe Ala Thr
20 25 30
Ala Gly His Cys Gly Ser Thr Gly Thr Arg Val Ser Ser Pro Ser Gly
35 40 45
Thr Val Ala Gly Ser Tyr Phe Pro Gly Arg Asp Met Gly Trp Val Arg
50 55 60
Ile Thr Ser Ala Asp Thr Val Thr Pro Leu Val Asn Arg Tyr Asn Gly
65 70 75 80
Gly Thr Val Thr Val Thr Gly Ser Gln Glu Ala Ala Thr Gly Ser Ser
85 90 95
Val Cys Arg Ser Gly Ala Thr Thr Gly Trp Arg Cys Gly Thr Ile Gln
100 105 110
Ser Lys Asn Gln Thr Val Arg Tyr Ala Glu Gly Thr Val Thr Gly Leu
115 120 125
Thr Arg Thr Thr Ala Cys Ala Glu Gly Gly Asp Ser Gly Gly Pro Trp
130 135 140
Leu Thr Gly Ser Gln Ala Gln Gly Val Thr Ser Gly Gly Thr Gly Asp
145 150 155 160
Cys Arg Ser Gly Gly Ile Thr Phe Phe Gln Pro Ile Asn Pro Leu Leu
165 170 175
Ser Tyr Phe Gly Leu Gln Leu Val Thr Gly
180 185
<210> 9
<211> 353
<212> БЕЛОК
<213> Thermobifida halotolerans
<400> 9
Met Val Ala Thr Ala Leu Thr Ala Ser Ala Thr Pro Ala Ser Ala Asp
1. 5 10 15
Arg His Asp Ala Leu Lys Arg Asp Leu Gly Leu Thr Asp Ser Glu Val
20 25 30
Ala Arg Leu Arg Thr Ala Glu Thr Glu Ala Met Asp Arg Glu Ala Glu
35 40 45
Leu Arg Asp Thr Leu Gly Ser Asp Phe Gly Gly Val His Leu Asp Ala
50 55 60
Ala Ser Gly Glu Leu Thr Ile Ala Val Thr Asp Pro Glu Ala Val Pro
65 70 75 80
Thr Val Glu Arg Ala Gly Ala Asn Ala Glu Val Val Thr Phe Gly Glu
85 90 95
Ser Ala Leu Asn Gly Phe Val Asp Ser Leu Asn Ser Val Ala Asp Gln
100 105 110
Ala Asp Glu Gln Val Thr Gly Trp Tyr Ala Asp Ile Ala Asp Asp Ser
115 120 125
Val Val Ile Thr Val Arg Glu Gly Gly Thr Ala Ala Ala Glu Ala Leu
130 135 140
Val Ala Arg Ala Gly Val Asp Glu Arg Ala Val Arg Val Thr Lys Ser
145 150 155 160
Asp Glu Arg Pro Gln Leu Phe Thr Asp Ile Ile Gly Gly Asn Pro Tyr
165 170 175
Tyr Phe Asp Gly Tyr Arg Cys Ser Ile Gly Phe Ser Val Arg Arg Gly
180 185 190
Ser Glu Ser Gly Phe Ala Thr Ala Gly His Cys Gly Glu Glu Gly Thr
195 200 205
Glu Thr Ser Asp Pro Glu Gly Thr Val Ala Gly Ala Tyr Phe Pro Gly
210 215 220
Arg Asp Met Gly Trp Val Arg Ile Thr Asp Ala Asp Thr Val Thr Pro
225 230 235 240
Leu Val Asn Arg Tyr Asn Gly Glu Asn Val Thr Val Ala Gly Ser Arg
245 250 255
Glu Ala Ala Thr Gly Ser Ser Val Cys Arg Ser Gly Ser Thr Thr Gly
260 265 270
Trp Arg Cys Gly Thr Ile Arg Ser Lys Asn Gln Thr Val Arg Tyr Ile
275 280 285
Glu Gly Thr Val Thr Gly Leu Thr Arg Thr Thr Ala Cys Ala Glu Gly
290 295 300
Gly Asp Ser Gly Gly Pro Trp Leu Thr Gly Ser Gln Gly Gln Gly Val
305 310 315 320
Thr Ser Gly Gly Ser Gly Asn Cys Thr Leu Gly Gly Val Thr Tyr Phe
325 330 335
Gln Pro Leu Asn Pro Leu Leu Ser His Phe Asp Leu Asp Leu Val Thr
340 345 350
Gly
<210> 10
<211> 186
<212> БЕЛОК
<213> Thermobifida halotolerans
<400> 10
Thr Asp Ile Ile Gly Gly Asn Pro Tyr Tyr Phe Asp Gly Tyr Arg Cys
1. 5 10 15
Ser Ile Gly Phe Ser Val Arg Arg Gly Ser Glu Ser Gly Phe Ala Thr
20 25 30
Ala Gly His Cys Gly Glu Glu Gly Thr Glu Thr Ser Asp Pro Glu Gly
35 40 45
Thr Val Ala Gly Ala Tyr Phe Pro Gly Arg Asp Met Gly Trp Val Arg
50 55 60
Ile Thr Asp Ala Asp Thr Val Thr Pro Leu Val Asn Arg Tyr Asn Gly
65 70 75 80
Glu Asn Val Thr Val Ala Gly Ser Arg Glu Ala Ala Thr Gly Ser Ser
85 90 95
Val Cys Arg Ser Gly Ser Thr Thr Gly Trp Arg Cys Gly Thr Ile Arg
100 105 110
Ser Lys Asn Gln Thr Val Arg Tyr Ile Glu Gly Thr Val Thr Gly Leu
115 120 125
Thr Arg Thr Thr Ala Cys Ala Glu Gly Gly Asp Ser Gly Gly Pro Trp
130 135 140
Leu Thr Gly Ser Gln Gly Gln Gly Val Thr Ser Gly Gly Ser Gly Asn
145 150 155 160
Cys Thr Leu Gly Gly Val Thr Tyr Phe Gln Pro Leu Asn Pro Leu Leu
165 170 175
Ser His Phe Asp Leu Asp Leu Val Thr Gly
180 185
<210> 11
<211> 375
<212> БЕЛОК
<213> Nocardiopsis potens
<400> 11
Met Arg Lys Ser Pro Tyr Ile Ser Phe Leu Gly Ala Ser Ala Leu Ala
1. 5 10 15
Leu Gly Met Ile Ala Ala Ser Pro Ala Ala Ala Ser Ala Asp Glu Ala
20 25 30
Ala Asp Thr Ser Pro Ala Glu Ala Leu Ala Ser Gly Leu Asp Met Ser
35 40 45
Ala Ser Gln Ala Ala Asp Leu Leu Asp Ala Glu Ala Glu Ala Arg Gly
50 55 60
Thr Glu Ala Glu Ala Arg Glu Ala Ala Gly Gly Ser Phe Ala Gly Ala
65 70 75 80
Val Phe Asp Ala Glu Ser Gln Val Leu Thr Val Ser Val Thr Asp Ala
85 90 95
Ala Ala Ala Glu Ala Val Glu Ala Thr Gly Ala Glu Thr Arg Val Val
100 105 110
Glu Ala Ser Glu Asp Glu Leu Asp Ser Ala Val Ser Asp Leu Asn Ala
115 120 125
Glu Glu Ser Ser Leu Gly Ser Ala Ile Glu Gly Val Thr Gly Trp Tyr
130 135 140
Val Asp Pro Ala Ala Asn Glu Val Val Val Thr Val Leu Asp Gly Glu
145 150 155 160
Thr Ala Ala Ala Glu Thr Leu Leu Asp Glu Ala Gly Val Asp Gly Val
165 170 175
Pro Val Arg Ile Asp Glu Gly Ala Glu Gln Pro Glu Thr Phe Gly Asp
180 185 190
Ile Val Gly Gly Asn Ala Tyr Tyr Pro Gly Gly Ser Arg Cys Ser Ile
195 200 205
Gly Phe Ser Val Gln Gly Gly Phe Ala Thr Ala Gly His Cys Gly Ser
210 215 220
Gln Gly Thr Arg Val Thr Gly Gly Ala Gly Glu Ser Gly Thr Val Ala
225 230 235 240
Gly Ser Ile Phe Pro Gly Arg Asp Met Gly Trp Val Arg Val Asn Ser
245 250 255
Gly Trp Asn Pro Ser Pro Tyr Val Asn Asn Tyr Ser Gly Gly Arg Val
260 265 270
Leu Val Thr Gly Ser Gln Glu Ala Ser Val Gly Ala Ser Ile Cys Arg
275 280 285
Ser Gly Ser Thr Thr Gly Trp His Cys Gly Thr Ile Gln Ala Lys Asn
290 295 300
Gln Thr Val Arg Tyr Pro Gln Gly Thr Val Asn Gly Leu Thr Arg Thr
305 310 315 320
Asn Val Cys Ala Glu Pro Gly Asp Ser Gly Gly Ser Trp Ile Ser Gly
325 330 335
Ser Gln Ala Gln Gly Val Thr Ser Gly Gly Ser Gly Asn Cys Ser Thr
340 345 350
Gly Gly Thr Thr Phe Tyr Gln Pro Ile Asn Pro Ile Leu Ser Gln Trp
355 360 365
Gly Leu Thr Leu Thr Thr Gly
370 375
<210> 12
<211> 185
<212> БЕЛОК
<213> Nocardiopsis potens
<400> 12
Gly Asp Ile Val Gly Gly Asn Ala Tyr Tyr Pro Gly Gly Ser Arg Cys
1. 5 10 15
Ser Ile Gly Phe Ser Val Gln Gly Gly Phe Ala Thr Ala Gly His Cys
20 25 30
Gly Ser Gln Gly Thr Arg Val Thr Gly Gly Ala Gly Glu Ser Gly Thr
35 40 45
Val Ala Gly Ser Ile Phe Pro Gly Arg Asp Met Gly Trp Val Arg Val
50 55 60
Asn Ser Gly Trp Asn Pro Ser Pro Tyr Val Asn Asn Tyr Ser Gly Gly
65 70 75 80
Arg Val Leu Val Thr Gly Ser Gln Glu Ala Ser Val Gly Ala Ser Ile
85 90 95
Cys Arg Ser Gly Ser Thr Thr Gly Trp His Cys Gly Thr Ile Gln Ala
100 105 110
Lys Asn Gln Thr Val Arg Tyr Pro Gln Gly Thr Val Asn Gly Leu Thr
115 120 125
Arg Thr Asn Val Cys Ala Glu Pro Gly Asp Ser Gly Gly Ser Trp Ile
130 135 140
Ser Gly Ser Gln Ala Gln Gly Val Thr Ser Gly Gly Ser Gly Asn Cys
145 150 155 160
Ser Thr Gly Gly Thr Thr Phe Tyr Gln Pro Ile Asn Pro Ile Leu Ser
165 170 175
Gln Trp Gly Leu Thr Leu Thr Thr Gly
180 185
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЛЮКОАМИЛАЗЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2802790C2 |
| ВАРИАНТЫ КСИЛАНАЗЫ И КОДИРУЮЩИЕ ИХ ПОЛИНУКЛЕОТИДЫ | 2017 |
|
RU2752204C2 |
| ВАРИАНТЫ ПРОТЕАЗЫ КЛАДЫ APRL И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2733987C2 |
| НОВЫЕ ТЕРМОСТАБИЛЬНЫЕ ФИТАЗЫ С ВЫСОКОЙ КАТАЛИТИЧЕСКОЙ ЭФФЕКТИВНОСТЬЮ | 2018 |
|
RU2758271C2 |
| ГИБРИДНЫЕ БЕЛКИ И СПОСОБЫ СТИМУЛЯЦИИ РОСТА РАСТЕНИЙ, ЗАЩИТЫ РАСТЕНИЙ И ИММОБИЛИЗАЦИИ СПОР BACILLUS НА РАСТЕНИЯХ | 2014 |
|
RU2815587C2 |
| СПОСОБЫ УЛУЧШЕНИЯ ЗДОРОВЬЯ РАСТЕНИЯ С ПРИМЕНЕНИЕМ СВОБОДНЫХ ФЕРМЕНТОВ И МИКРООРГАНИЗМОВ, ЭКСПРЕССИРУЮЩИХ ФЕРМЕНТЫ НА ПОВЫШЕННОМ УРОВНЕ | 2017 |
|
RU2802848C2 |
| ВАРИАНТЫ ПРОТЕАЗ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2790443C2 |
| ИНСЕКТИЦИДНЫЕ ПОЛИПЕПТИДЫ С ШИРОКИМ СПЕКТРОМ АКТИВНОСТИ И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2750459C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ РЕКОМБИНАНТНЫЕ КЛЕТКИ BACILLUS И ДРУГОЙ АГЕНТ БИОЛОГИЧЕСКОЙ БОРЬБЫ | 2015 |
|
RU2736827C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ РЕКОМБИНАНТНЫЕ КЛЕТКИ BACILLUS И ИНСЕКТИЦИД | 2015 |
|
RU2736562C2 |
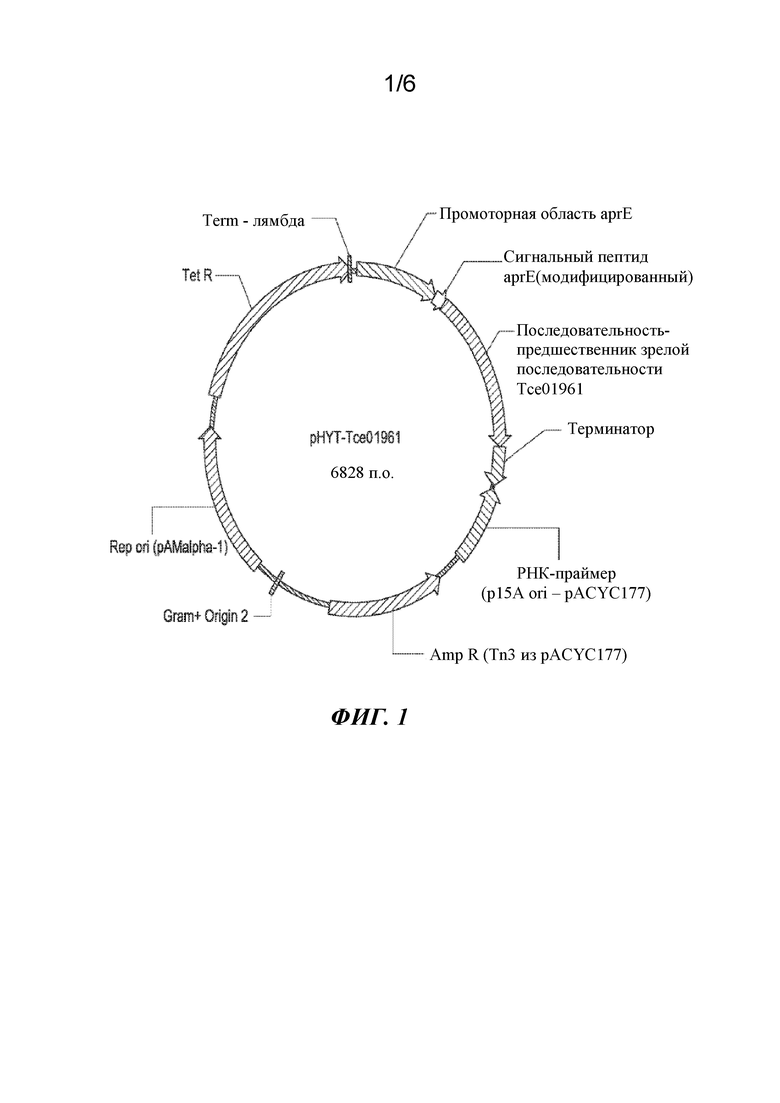
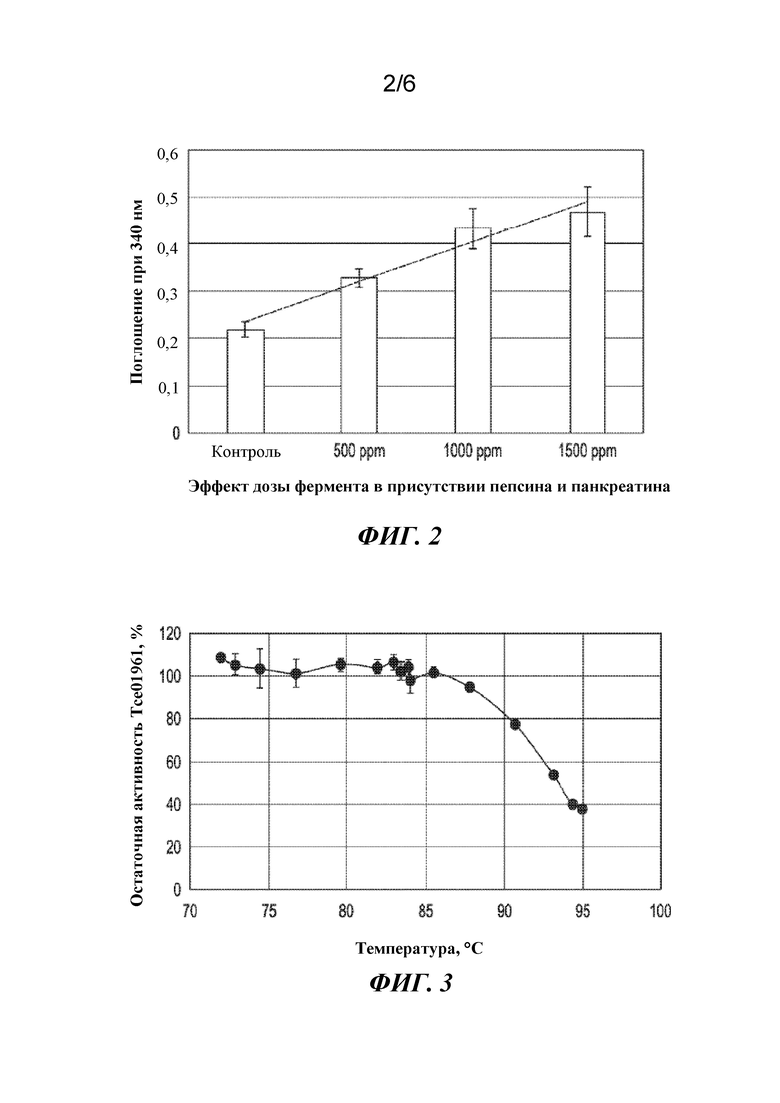
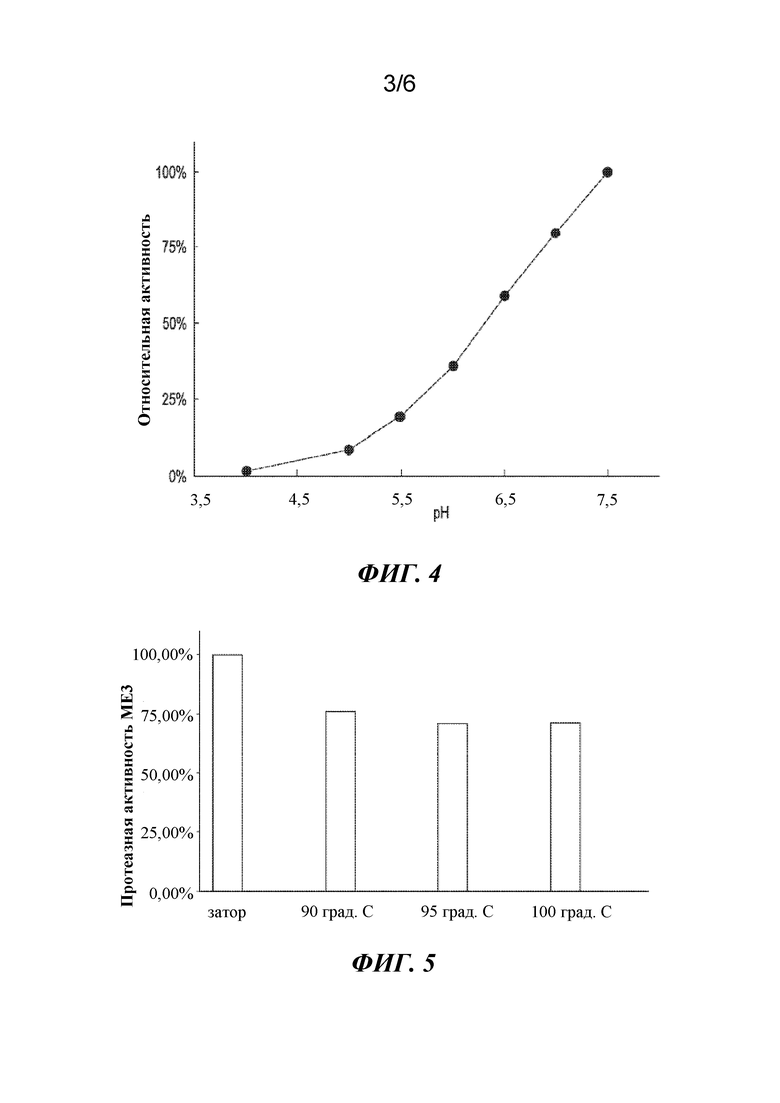
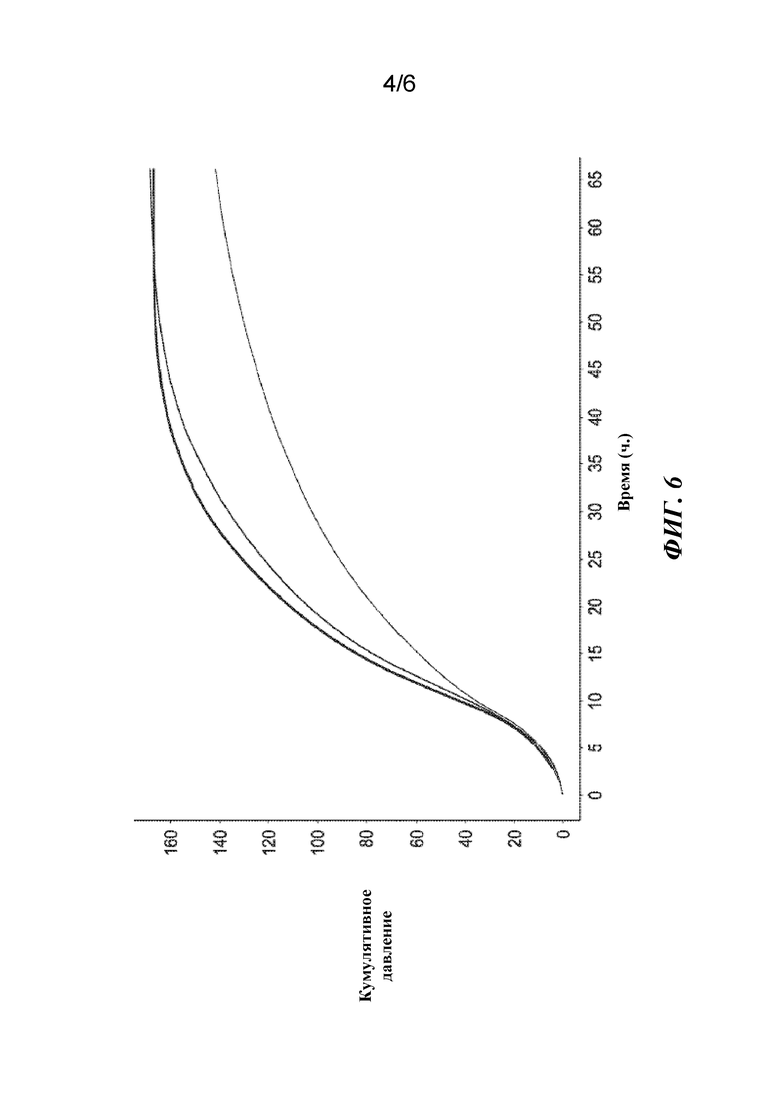
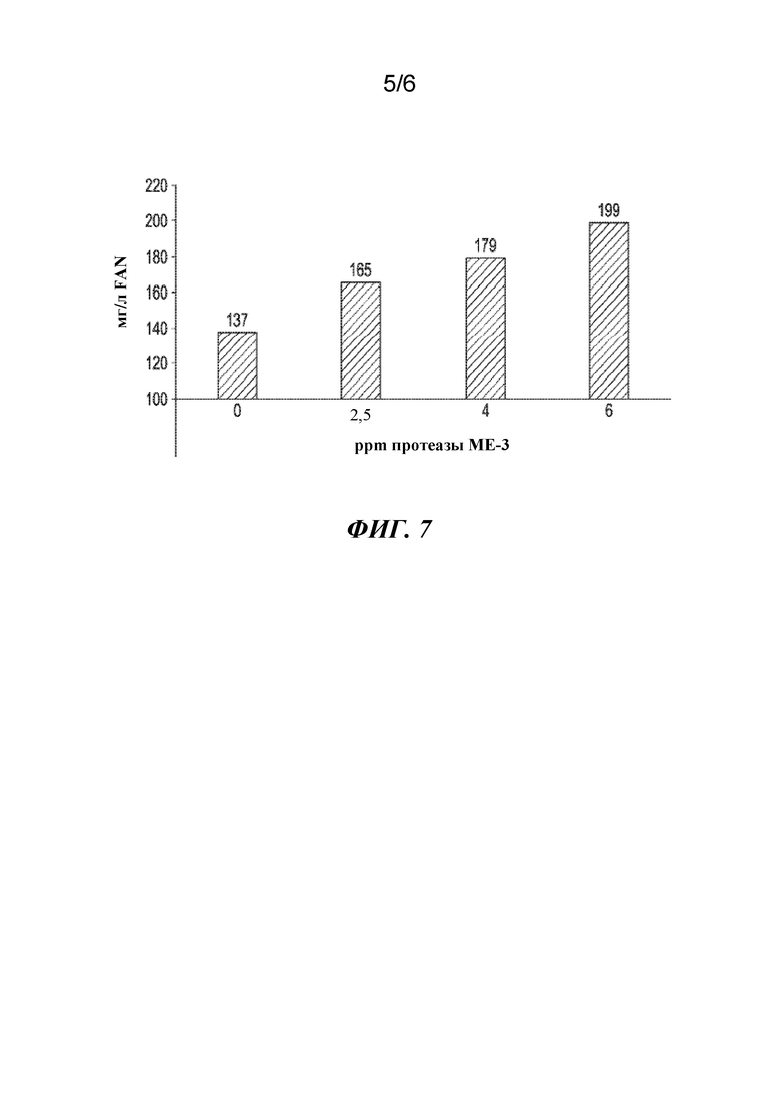

Изобретение относится к биотехнологии. Способ получения продуктов ферментации из крахмалсодержащего материала, предусматривающий: (а) разжижение крахмалсодержащего материала с помощью смеси ферментов, содержащей 1-20 г термостабильной сериновой протеазы/метрическая тонна (MT) крахмалсодержащего материала, характеризующейся по меньшей мере 80% идентичностью последовательности с SEQ ID NO: 3; (b) осахаривание продукта из стадии (а); (c) ферментацию с помощью подходящего организма и (d) необязательно извлечение продукта, полученного на стадии (с). Изобретение позволяет использовать протеазу в неблагоприятных условиях с сохранением или улучшением ее активности. 3 з.п. ф-лы, 8 ил., 13 табл., 14 пр.
1. Способ получения продуктов ферментации из крахмалсодержащего материала, предусматривающий:
(а) разжижение крахмалсодержащего материала с помощью смеси ферментов, содержащей 1-20 г термостабильной сериновой протеазы/метрическая тонна (MT) крахмалсодержащего материала, характеризующейся по меньшей мере 80% идентичностью последовательности с SEQ ID NO: 3;
(b) осахаривание продукта из стадии (а);
(c) ферментацию с помощью подходящего организма и
(d) необязательно извлечение продукта, полученного на стадии (с).
2. Способ по п. 1, где стадии (b) и (c) выполняют одновременно.
3. Способ по п. 1 или 2, где добавление источника азота исключают или уменьшают на по меньшей мере 60% с помощью применения 1–20 г термостабильной сериновой протеазы/MT крахмалсодержащего материала, которая характеризуется по меньшей мере 80% идентичностью последовательности с SEQ ID NO: 3.
4. Способ по п. 3, где, в случае если продукт ферментации представляет собой этанол, на стадии (с) не требуется кислый протеолитический фермент при применении 1–20 г термостабильной сериновой протеазы/МТ крахмалсодержащего материала, которая характеризуется по меньшей мере 80% идентичностью последовательности с SEQ ID NO: 3.
| WO 2014209789 A1, 31.12.2014 | |||
| WO 2016087427 A1, 09.06.2016 | |||
| WO 2016069552 A2, 06.05.2016 | |||
| ВАРИАНТЫ СЕРИНОВОЙ ПРОТЕАЗЫ С МНОЖЕСТВЕННЫМИ МУТАЦИЯМИ | 2007 |
|
RU2558261C2 |
| НОВАЯ ПРОТЕАЗА ГРИБОВ И ЕЕ ПРИМЕНЕНИЕ | 2010 |
|
RU2566549C2 |
Авторы
Даты
2022-04-29—Публикация
2017-12-18—Подача