Изобретение относится к области медицинской биотехнологии и может быть использовано в клинической медицине и в ветеринарии для лечения злокачественных опухолей человека и животных.
Онкологические заболевания представляют собой угрозу человечеству. Несмотря на внедрение новых методов диагностики, в том числе методов ранней диагностики рака, своевременное применение хирургических методов лечения, радио- и химиотерапии, противораковых моноклональных антител и их конъюгатов с цитостатиками, достигнуть полной элиминации злокачественной опухоли удается далеко не всегда, в подавляющем большинстве случаев достигается лишь частичное излечение (ремиссия), т.е. продление жизни больного вследствие удаления либо уничтожения значительной части опухолевых клеток и подавления их пролиферации. Через некоторое время наблюдается последующий рост опухоли или ее метастазов, что требует повторного лечения. Поиск более эффективных противораковых веществ и новых способов лечения онкологических заболеваний активно продолжается во всех развитых странах мира.
Пептиды системы врожденного иммунитета человека и животных являются перспективными кандидатами для разработки противораковых лекарственных средств. Их противоопухолевое действие основано на способности разрушать цитоплазматические и митохондриальные мембраны опухолевых клеток [Gaspar D, Veiga AS, Castanho MA. From antimicrobial to anticancer peptides. A review. Front Microbiol. 2013; 4:294. doi:10.3389/fmicb.2013.00294.].
Известно, что мембраны опухолевых клеток отличаются от мембран обычных (нормальных) клеток повышенным содержанием фосфатидилсерина, гликопротеинов, гликолипидов с повышенным содержанием сиаловых кислот, а также протеогликанов, обогащенных сульфатом гепарина [Hoskin DW, Ramamoorthy A. Studies on anticancer activities of antimicrobial peptides. Biochim Biophys Acta. 2008; 1778(2):357-75. doi:10.1016/j.bbamem.2007.11.008.]. Вследствие таких различий мембраны опухолевых клеток имеют выраженный отрицательный заряд.
Известен также противоопухолевый пептид в ацетил-амидной форме Ac-TGENHR-NH2, активный против опухолей мыши: лимфолейкоза Р388, миеломы SP2/0, саркомы S37, однако оптимальные концентрации, в которых данный пептид осуществляет свою противоопухолевую активность in vivo, велики и находится в диапазоне от 25 мг/кг до 120 мг/кг, [RU2682039], что многократно превышает противоопухолевые концентрации пептида по настоящему изобретению (от 1 до 100 мкг/мышь), составляющие, при среднем весе мыши 25 г, от 40 мкг/кг до 4 мг/кг веса тела животного.
Многие природные и синтетические пептиды, в частности, богатые пролином (т.е. содержащие 20%-50% остатков пролина в своих последовательностях), способны разрушать мембраны опухолевых клеток, в меньшей степени разрушая мембраны здоровых клеток. В результате разрушения клеточных мембран наступает лизис клеток либо их апоптотическая или некротическая гибель [Tornesello AL, Borrelli А, Buonaguro L, Buonaguro FM, Tornesello ML. Antimicrobial Peptides as Anticancer Agents: Functional Properties and Biological Activities. Molecules. 2020; 25(12):2850. doi:10.3390/molecules25122850.].
Кроме того, проникая внутрь клеток, некоторые богатые пролином пептиды связываются с внутриклеточными мишенями, например, с шапероном DnaK, вызывая нарушения фолдирования белков [Tornesello AL, Borrelli A, Buonaguro L, Buonaguro FM, Tornesello ML. Antimicrobial Peptides as Anticancer Agents: Functional Properties and Biological Activities. Molecules. 2020; 25(12):2850. doi:10.3390/molecules25122850.], а также с рибосомами, подавляя процесс трансляции [Roy RN, Lomakin IB, Gagnon MG, Steitz ТА. The mechanism of inhibition of protein synthesis by the proline-rich peptide oncocin. Nat Struct Mol Biol. 2015; 22(6):466-469. doi:10.1038/nsmb.3031.].
Несмотря на то, что в настоящее время известно более 3000 пептидов, обладающих противораковой активностью [Tyagi A, Tuknait A, Anand Ρ, Gupta S, Sharma Μ, Mathur D, Joshi A, Singh S, Gautam A, Raghava GP. Cancer PPD: a database of anticancer peptides and proteins. Nucleic Acids Res. 2015; 43 (Database issue):D837-843. doi:10.1093/nar/gku892.], ни один из них не используется в лечебной практике. Для внедрения противораковых пептидов в практику здравоохранения необходимо повысить избирательность их действия, т.е. получить пептиды, обладающие высоким токсическим действием по отношению к раковым клеткам и низким - по отношению к нормальным (неопухолевым) клеткам.
Наиболее близким к настоящему изобретению пептидом является природный богатый пролином пептид - бактенецин ChBac3.4, выделенный из лейкоцитов домашней козы Capra hircus [Shamova О., Orlov D., Stegemann С., Czihal P., Hoffmann R., Brogden K., et al. ChBac3.4: A novel proline-rich antimicrobial peptide from goat leukocytes. Int. J. Pept. Res. Therap.2009, 15:1, 31-42. doi:10.1007/s10989-009-9170-7], обладающий бактерицидным и цитолитическим действием против нормальных и опухолевых клеток. Молекула бактенецина ChBac3.4, состоящая из 26 аминокислот и амидированная с С-конца, представлена на фиг.1.
Задачей изобретения является расширение спектра богатых пролином пептидов, обладающих селективным противоопухолевым действием.
Задача решается путем преобразования пептида ChBac3.4 за счет вставки четырех аминокислотных остатков - изолейцина, гистидина, пролина и фенилаланина (I,H,P,F), удаления трех аминокислотных остатков - двух остатков пролина и фенилаланина (P,P,F), замены изолейцина (I) на валин (V) и удалением аминогруппы с С-конца молекулы. Дизайн молекулы созданного пептида представлен на фиг.2, где показано расположение вставок, удалений и замены, в результате которых получен пептид, характеризующийся аминокислотной последовательностью SEQ ID No1 и проявляющий противоопухолевую активность. Созданному таким образом новому пептиду присвоено наименование ChBac3.4-1-COOH.
Автоматизированный химический синтез пептидов ChBac3.4 и ChBac3.4-1-COOH осуществляли следующим образом
Пептиды синтезировали из Fmoc-аминокислот методом твердофазного автоматизированного синтеза на пептидном синтезаторе SymphonyX (Protein Technologies Inc., США) с использованием стандартных протоколов синтеза. После завершения сборки линейный незащищенный пептид отщепляли от полимера с помощью четырехкомпонентной смеси, состоящей из TFA, триизопропилсилана, воды и этандитиола в соотношении (94:1 : 2,5 : 2,5) и очищали методом обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ ВЭЖХ - RP-HPLC) на установке GoldSystem фирмы Beckman, США. Разделение проводили на колонках Vydac С-18 (4.6×250 мм; 10×250 мм; диаметр частиц сорбента 5 мкм), элюируя пептиды с колонки в градиенте концентраций вода - ацетонитрил с использованием различных противоионов (0,1% трифторуксусная кислота, 0.13% гептафтормасляная кислота, 5 мМ тетрабутил аммония). После проведения ОФ ВЭЖХ фракции высушивали под вакуумом на установке SpeedVac фирмы Savant (США).
Пример 1. Изучение гемолитического действия пептидов ChBac3.4 и ChBac3.4-1-COOH
Эритроциты человека приготавливали из крови, взятой у здоровых доноров в ЭДТА-содержащие вакутейнеры, путем трехкратного низкоскоростного осаждения при температуре +4°С и ресуспендирования в физиологическом растворе. Пробы состояли из 27 мкл 2,8%-ной суспензии эритроцитов и 3 мкл раствора анализируемого пептида. После добавления пептидов получали 2,5%-ные суспензии эритроцитов. Конечная концентрация пептидов в инкубируемых пробах составляла от 1,25 до 40 мкМ. Серийные разведения анализируемых пептидов делали в 0,01% растворе уксусной кислоты.
Для получения положительного контроля (100% лизис эритроцитов) к 27 мкл раствора эритроцитов добавляли 3 мкл детергента (Triton Х-100, разбавленный в 10 раз в водном растворе 0,01% уксусной кислоты. Для получения негативного контроля (0% лизис эритроцитов) к 27 мкл раствора эритроцитов добавляли 3 мкл 0,01% уксусной кислоты. Анализируемые растворы (по 3 параллели для каждой из исследуемых проб) инкубировали при 37°С в течение 30 мин. После инкубации реакцию останавливали добавлением 75 мкл охлажденного физиологического раствора, пробы центрифугировали при 5000 g при 4°С в течение 4 мин. Супернатант отбирали и вносили в ячейки 96-луночного планшета (Costar, Corning Inc.).
Измерение оптической плотности проб при длине волны 540 нм производили на фотометре SpectraMax 250 фирмы MolecularDevices (США). Процент гемолиза эритроцитов подсчитывали по формуле:
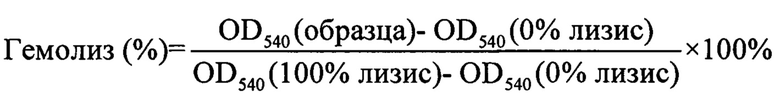
Оба пептида показали практически идентичную крайне низкую гемолитическую активность при концентрациях от 1 до 60 мкМ, не превышающую 5% за 30 мин инкубации.
Пример 2. Изучение цитотоксического действия пептидов ChBac3.4 и ChBac3.4-1-COOH по отношению к нормальным и раковым клеткам человека in vitro
Влияние пептидов на жизнеспособность клеток исследовали с помощью МТТ-теста, позволяющего оценивать суммарную активность дыхательных ферментов митохондрий по восстановлению неокрашенного предшественника до формазана, имеющего голубую окраску [Mosmann Т. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods. 1983; 65(1-2):55-63. doi:10.1016/0022-1759(83)90303-4].
В качестве нормальных клеток использовали мононуклеарные клетки крови человека, выделенные из крови здоровых доноров. Цельную гепаринизированную кровь, разбавленную в три раза стерильным фосфатно-солевым раствором (PBS), осторожно наслаивали на 5 мл стерильного раствора фиколл-400 (Pharmacia, Швеция) плотностью 1,077 г/мл. Пробирку центрифугировали при 600-х G и 4°С в течение 40 минут. Фракцию клеток, расположенную над слоем фиколла, отбирали, дважды промывали холодным раствором PBS, ресуспендировали в среде RPMI1640 и немедленно использовали для постановки теста. В качестве раковых клеток использовали клетки двух суспензионных клеточных линий: эритромиелоидной лейкемии человека К-562 и клетки гистиоцитарной лимфомы человека U-937, находящиеся в логарифмической фазе роста.
Клетки (20000 клеток в 90 мкл/лунку) вносили в лунки 96-луночных планшетов ("Orange Scientific", Бельгия) в среде RPMI-1640, содержавшей 10% эмбриональную сыворотку, после чего к клеточной суспензии добавляли по 10 мкл раствора пептида (в среде RPMI 1640) различной концентрации в четырех параллелях.
В контрольные лунки добавляли по 10 мкл среды. Планшеты далее помещали в CO2 инкубатор на 20 часов. За три часа до окончания срока инкубации в лунки планшетов добавляли по 10 мкл раствора МТТ (5 мг/мл в забуференном физиологическом растворе). По окончании инкубации в лунки вносили по 100 мкл изопропанола с 0.04 Μ HCl, перемешивали и проводили измерение оптической плотности раствора в лунках планшета при длине волны 540 нм (вычитая величину оптической плотности при 690 нм, как фоновую) на спектрофотометре SpectraMax-250 (США).
Для расчета медианной ингибирующей концентрации пептидов (ИК50) использовали программу SigmaPlot 9. Полученные величины ИК50 использовали для подсчета индекса селективности SI(n/t) по формуле:

Результаты представлены в таблице 1.

Из таблицы 1 видно, что индекс селективности SI(n/t) пептида ChBac3.4-1-COOH превосходит аналогичный показатель пептида ChBac3.4 в 1,6 раза.
Пример 3. Изучение противоопухолевой активности пептидов ChBac3.4 и ChBac3.4-1-COOH in vivo
Для изучения противоопухолевой активности пептидов гибридным мышам (C57BL/J6 хСВА) весом 28+/-2 г подкожно в верхнюю часть спины вводили суспензию клеток асцитной карциномы Эрлиха в физиологическом растворе в дозе 2×105 клеток/мышь.
Пептид ChBac3.4-1-COOH в дозах 1 мкг/мышь и 100 мкг/мышь вводили мышам (n=8 для каждой дозы пептида) интраперитонеально в 0,1 мл физиологического раствора хлорида натрия еженедельно, начиная с первого для эксперимента.
Анализ кривых выживаемости животных по Мейеру-Каплану показывает, что данный пептид как в низкой, так и в высокой дозе статистически достоверно повышал время жизни животных: среднее время жизни животных, получавших пептид в дозе 1 мкг/мышь составило 27,9+/-4,8 дней, в дозе 100 мкг/мышь - 26,5+/-2,9 дней при данном показателе у контрольных животных, равном 23,2+/-1,5 дней (U-тест Манна-Уитни р<0,05).
Таким образом, созданный пептид ChBac3.4-1-COOH, который является модифицированным аналогом природного биологически активного пептида ChBac3.4, получаемого из лейкоцитов козы, проявляя низкую гемолитическую и избирательную цитотоксическую активность, по индексу селективности SI(n/t) превосходит в 1,6 раза аналогичный показатель пептида ChBac3.4 и достоверно повышает время жизни модельных животных с карциномой Эрлиха.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ФГБНУ “ИЭМ” (FSBSI “IEM”)
<120> Пептид, обладающий противоопухолевой активностью
<140>
<141>
<150>
<151>
<160> 1
<170>
<210> SEQ ID No: 1
<211> 27
<212> Аминокислотная последовательность
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность пептида ChBac3.4-1-COOH
<400> 1
Arg Phe Arg Leu Pro Phe Arg Arg Ile His Pro Pro Pro Phe Val Arg
1 5 10 15
Ile His Pro Pro Pro Phe Tyr Arg Arg Phe Leu
20 25
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИД, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2658781C1 |
| Искусственный пептид для лечения черепно-мозговой травмы | 2023 |
|
RU2816919C1 |
| Пептид, обладающий антибактериальной активностью в отношении микроорганизмов с множественной лекарственной устойчивостью | 2021 |
|
RU2771493C1 |
| БИОЦИДНЫЙ ПЕПТИД И ПРЕПАРАТ НА ЕГО ОСНОВЕ | 2017 |
|
RU2678985C2 |
| Бета-шпилечный пептид, обладающий антимикробной активностью в отношении бактерий с множественной лекарственной устойчивостью | 2023 |
|
RU2812977C1 |
| АНТИМИКРОБНОЕ ВЕЩЕСТВО | 2010 |
|
RU2447896C1 |
| Катионный пептид, проявляющий антибактериальные свойства | 2021 |
|
RU2778856C1 |
| Пептид, проявляющий антибактериальные и противоопухолевые свойства | 2019 |
|
RU2702661C1 |
| ЦИКЛИЧЕСКИЕ ПЕПТИДЫ С АНТИНЕОПЛАСТИЧЕСКОЙ И АНТИАНГИОНЕННОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2603286C2 |
| АНТИТЕЛО, НАЦЕЛЕННОЕ НА CD47, И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2832773C1 |

Изобретение относится к области медицинской биотехнологии и может быть использовано в клинической медицине и в ветеринарии для лечения злокачественных опухолей человека и животных. Разработан новый пептид ChBac3.4-1-COOH, который является модифицированным аналогом природного биологически активного пептида ChBac3.4, получаемого из лейкоцитов козы. Пептид обладает выраженной противоопухолевой активностью, при этом проявляет низкую гемолитическую и избирательную цитотоксическую активность, по индексу селективности SI(n/t) превосходит в 1,6 раза аналогичный показатель пептида ChBac3.4 и достоверно повышает время жизни модельных животных с карциномой Эрлиха. 2 ил., 1 табл., 3 пр.
Пептид формулы RFRLPFRRIHPPPFVRIHPPPFYRRFL-COOH, обладающий противоопухолевой активностью и характеризующийся аминокислотной последовательностью SEQ ID No: 1.
| ПЕПТИД, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2658781C1 |
| Шамова О.В., "Действие антимикробных пептидов из нейтрофильных гранулоцитов на опухолевые и нормальные клетки в культуре", Цитология, 2007, т.49, No 12, стр.1000-1010 | |||
| Ямщикова Елена Владимировна, "Биологическая активность обогащенных пролином пептидов системы врожденного иммунитета", Автореферат, Санкт-Петербург, 2012, | |||
Авторы
Даты
2022-05-05—Публикация
2021-04-15—Подача