Область техники, к которой относится изобретение
[1] Настоящее изобретение относится к соединениям пирролопиримидина и их применению для профилактики и/или лечения боли, воспалительных состояний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, неврологических заболеваний, осложнений диабета, рака и/или фиброзных заболеваний. В конкретном аспекте настоящие соединения представляют собой ингибиторы ASK, в частности ингибиторы ASK1. Настоящее изобретение также относится к способам получения соединения по изобретению, фармацевтические композиции, содержащие соединение по изобретению, применение соединений для профилактики и/или лечения боли, воспалительных состояний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, неврологических заболеваний, осложнений диабета, рака и/или фиброзных заболеваний.
Уровень техники
[2] Регулирующая апоптотические сигналы киназа (ASK1) представляет собой повсеместно экспрессируемую Ser/Thr киназу на сигнальном пути митоген-активируемой протеинкиназы (MAPK), индуцирующую ответ на стрессовые стимулы, в том числе провоспалительные молекулы, такие как фактор некроза опухоли-α (ФНО-α) и липополисахарид (LPS), стресс эндоплазматического ретикулума, оксидативный стресс, генотоксичный стресс, свободные радикалы, лиганд Fas и перегрузка кальцием (Takeda K et al., (2008) Annu Rev Pharacol Toxicol 248 pp.199-225; Nagai H et al., (2007) J Biochem Mol Biol 40 pp1-6).
[3] ASK1 является одной из ряда MAP-киназ киназа киназы (MAP3K), которая передают сигналы через MAP-киназу киназы (MKK). В случае передачи сигнала ASK1, MKK3 и MKK6 активирует путь p38 и MKK4 и MKK7 активирует путь JNK (Davis RJ (2000) Cell 103 pp. 239-252; Ichijo H et al., (1997) Science 275 pp. 90-94). Поэтому ингибиторы ASK1 могут супрессировать сигнальные пути как через p38, так и JNK.
[4] Применение растворимого рецептора ФНО: Было показано, что слитый белок Enbrel, содержащий Fc, (этанерцепт) является эффективным в клинике для лечения боли, а также на доклинических моделях нейропатической боли (Hao S et al. (2007) Gene Therapy 14 pp 1010-1016), подразумевая, что ФНО-α является ключевым медиатором реакции на боль. ИЛ-6 является ключевым медиатор передачи сигнала ФНО-α ниже в потоке и имеются клинические данные, подтверждающие, что анти-ИЛ-6 терапия является эффективным терапевтическим подходом при ревматоидном артрите (Roche опубликовала положительные результаты III фазы для актемры/тоцилизумаба в мае 2008 г.).
[5] Ряд клеток, которые не имеют функционального ASK1 (выделенного у нокаутированных по ASK1 мышей или после сайленсинга гена), являются устойчивыми к ФНО-α индуцированному апоптозу (Tobiume K, et al., (2001) EMBO Rep 2 pp. 222-228). Следовательно, ASK1 играет ключевую роль в пути ФНО-α и поддерживает гипотезу о том, что нарушение сигнального пути ФНО-α посредством ингибирования ASK1 может привести к полезным побочным эффектам, таким как облегчение боли. Существуют убедительные доказательства связи активации р38 и/или JNK с получением провоспалительных медиаторов и последующей болевой реакции (Ji R-R and Suter MR (2007) Molecular Pain 3 pp. 33-41; Cheng HT et al., (2008) Neuroscience 155 pp. 948-958; Ji R-R and Gao Y-J (2008) Neurosci Lett 437 pp. 180-183). Активация ASK1 может привести к активации как p38, так и JNK, ингибирование ASK1 имеет потенциал быть более мощным, чем в случае ингибиторов p38 отдельно и, поскольку он выше в каскаде передачи сигнала, может ограничивать вероятность нежелательных потенциалов.
[6] Фиброз представляет собой процесс заживления ран, в котором происходит избыточное отложение внеклеточного матрикса (ВКМ). ВКМ состоит из коллагенов, неколлагеновых гликопротеинов, связанных с матриксом факторов роста, гликозаминогликанов, протеогликанов и матрицеллюлярных белков, которые обеспечивают поддержку как нормальной, так и фиброзной ткани.
[7] Неалкогольная жировая болезнь печени (NAFLD - Non-alcoholic fatty liver disease) является наиболее распространенной причиной хронической болезни печени в развитых странах (Younossi ZM, et al., Clin Gastroenterol Hepatol 2011; 9: 524-30 и Cohen JC, et al., Science, 2011; 332: 1519-23). Это может быть в общих чертах классифицированы на две категории: неалкогольную жировую дистрофию печени (или простой стеатоз) и неалкогольный стеатогепатит (NASH - non-alcoholic steatohepatitis). Хотя ранее считалось, что стеатоз в значительной степени не прогрессирует, в то время как NASH является прогрессирующей формой NAFLD, недавние данные исследований серийной биопсии показывают, что пациенты со стеатозом или NASH имеют повышенный риск последующего прогрессирования болезни до выраженного фиброза и цирроза (Singh S, et al., Clin Gastroenterol Hepatol 2015; 13: 643-54 и McPherson S, et al., J Hepatol 2015; 62: 1148-55).
[8] Известно, что оксидативный стресс играет основную роль в активации звездчатых клеток печени (HSC) при NASH (Bian Z, & Ma X. Front Physiol 2012; 3: 248 и Koek GH, et al., Clin Chim Acta 2011; 412: 1297-305) и антиоксиданты не только оказывают профилактическое действие на повреждение гепатоцитов, но и могут непосредственно способствовать снижению фиброгенеза (Serviddio G et al., Free Radic Biol Med 2013; 65: 952-68), эффект, подтвержденный исследованиями по ассоциации генов, в которых варианты, влияющие на эффективность защитных функций клеточного антиоксиданта, влияют на риск фиброза NAFLD (Al-Serri A, et al., J Hepatol 2012; 56: 448-54).
[9] Регулирующая апоптотические сигналы киназа 1 (ASK1) представляет собой киназу, которая активируется различными стимулами, в том числе гипергликемией, ТФР-β и ROS (Karnik S, Charlton MR, Li L, et al., The Liver Meeting 2015, San Francisco, CA, November 13-17, American Association for the Study of Liver Diseases, 2015). ASK1 индуцирует апоптоз, фиброз и нарушение обмена веществ путем активации путей p38 и JNK1. Показано, что путь ASK1 активируется при биопсии печени NASH человека (Karnik S, The Liver Meeting 2014, Boston, Massachusetts, November 7-11, American Association for the Study of Liver Diseases, 2014). Кроме того, в шестимесячном клиническом исследовании NASH с участием людей было показано, что ингибитор ASK1 селонсертиб приводит к снижению стадии фиброза печени, прогрессированию до цирроза печени, ригидности и содержанию жира в печени (Loomba et al. The liver meeting 2016, Boston, Massachusetts, November 11-15, American Association for the Study of Liver Diseases, 2016).
[10] WO 2008/016131 описывает слитые гетероциклические ингибиторы ASK1 для применения при лечении диабета и воспалительного заболевания. В WO 2004/048565 описан впервые полученный пептид, который имеет активность ASK1, который может быть применимым при лечении рака и дегенеративных заболеваний. В WO 2009/123986 и WO 2009/027283 описаны ингибиторы ASK1. В WO 2008/075172 описаны производные никотинамида в качестве ингибиторов h-PGDS и их применение для лечения опосредованных простагландином D2 болезней. В WO 2001/39777 описаны соединения, специфичные к рецепторам аденозина A1 A2a и A3. EP 2058309 описывает слитые гетероциклические соединения.
[11] Настоящее изобретение описывает серии производных пирролопиримидина, которые являются ингибиторами киназы ASK1 и которые могут быть применимыми для профилактики и/или лечения боли, воспалительных состояний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, неврологических заболеваний, осложнений диабета, рака и/или фиброзных заболеваний.
Сущность изобретения
[12] Настоящее изобретение основано на определении впервые полученных соединений пирролопиримидина и пирролопиридина, которые могут быть применимыми для профилактики и/или лечения боли и/или фиброзных заболеваний. В конкретном аспекте настоящие соединения представляют собой ингибиторы ASK, в частности ингибиторы ASK1. Настоящее изобретение также относится к способам получения этих соединения, фармацевтические композиции, содержащие эти соединения, и применения соединений для профилактики и/или лечения боли, воспалительных состояний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, неврологических заболеваний, осложнений диабета, рака и/или фиброзных заболеваний.
[13] Соответственно, в первом аспекте изобретения соединения по изобретению представляют собой те, которые имеют формулу I:
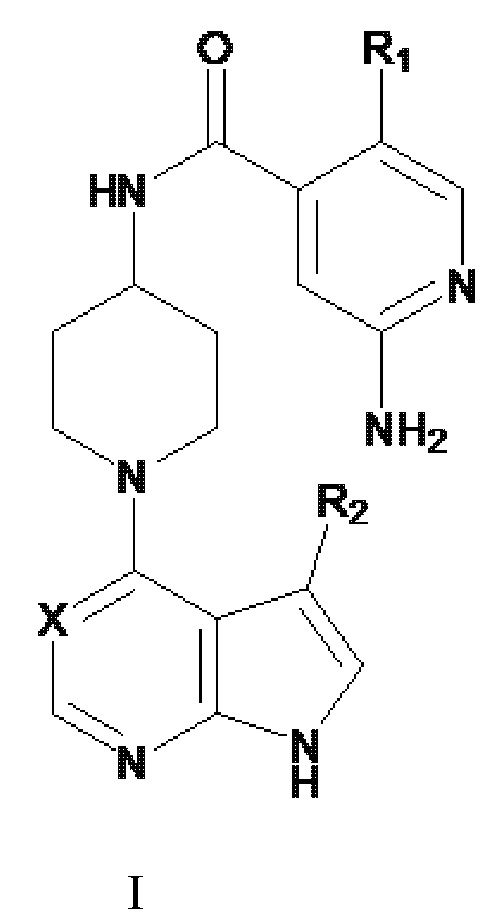
где
R1 представляет собой Н, CH3, F или Cl;
Х представляет собой N, CH или С-CN; и
R2 представляет собой CH3 или галоген.
[14] В конкретном аспекте соединения по изобретению могут проявлять селективность по отношению к семейству киназ ASK, в частности по отношению к ASK1. В дополнительном конкретном аспекте соединения по изобретению могут демонстрировать низкую активность в отношении других ферментов киназ, в частности JAK2. Подобная селективность может приводить к повышенной безвредности лекарственного средства и/или снижению побочных сопутствующих рисков.
[15] В дополнительном аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим соединение по изобретению и фармацевтический носитель, вспомогательное вещество или разбавитель. В конкретном аспекте фармацевтическая композиция может дополнительно содержать дополнительные терапевтически активные ингредиенты, подходящие для применения в комбинации с соединениями по изобретению. В более конкретном аспекте дополнительный терапевтически активный ингредиент представляет собой средство для профилактики и/или лечения боли и/или фиброзных заболеваний.
[16] Кроме того, соединения по изобретению, применимые в фармацевтических композициях и способах лечения, описанных в настоящем документе, являются фармацевтически приемлемыми в том виде, в котором они получены и используются.
[17] В дополнительном аспекте изобретения данное изобретение относится к способу лечения млекопитающего, в частности людей, страдающих от патологического состояния, выбранного из числа перечисленных в настоящем документе, и в частности боли и/или фиброзных заболеваний, который включает введение эффективного количества фармацевтической композиции или соединений по изобретению, как описано в настоящем документе.
[18] Настоящее изобретение также относится к фармацевтическим композициям, содержащим соединение по изобретению и подходящий фармацевтический носитель, вспомогательное вещество или разбавитель для применения в медицине. В конкретном аспекте фармацевтическая композиция предназначена для применения в профилактике и/или лечении боли и/или фиброзных заболеваний.
[19] В конкретном аспекте соединения по изобретению предназначены для применения в профилактике и/или лечении боли.
[20] В дополнительном аспекте данное изобретение относится к способам синтезирования соединений по изобретению, с типовыми протоколами и путями синтеза, описанными в настоящем документе.
[21] Другие цели и преимущества станут очевидными для специалистов в данной области техники из рассмотрения следующего далее подробного описания.
[22] Следует принять во внимание, что соединения по изобретению могут быть метаболизированы с образованием биологически активных метаболитов.
Подробное описание изобретения
Определения
[23] Следующие термины имеют значения, представленные ниже, и применимы для понимания описания и предполагаемого объема настоящего изобретения.
[24] При описании изобретения, которое может включать соединения, фармацевтические композиции, содержащие подобные соединения, и способы применения подобных соединений и композиций, следующие термины, если они присутствуют, имеют следующие значения, если не указано иное. Следует также понимать, что при описании в настоящем документе любой из фрагментов, определенных ниже, может быть замещен множеством заместителей, и что соответствующие определения предназначены для включения таких замещенных фрагментов в их объем, как изложено ниже. Если не указано иное, термин «замещенный» должен быть определен таким образом, как изложено ниже. Следует также понимать, что термины «группы» и «радикалы» при использовании в настоящем документе могут рассматриваться как взаимозаменяемые.
[25] Как применяют в данном документе, единственное число относится к одному или более чем одному (т.е. к по меньшей мере одному) грамматическому объекту предмета. В качестве примера, «аналог» означает один аналог или более чем один аналог.
[26] «Амино» соответствует радикалу -NH2.
[27] «Галогено» или «галоген» соответствует фтору (F), хлору (Cl), брому (Br) и йоду (I). В конкретном случае, галогенные группы представляют собой либо фтор, либо хлор.
[28] «Фармацевтически приемлемый» означает одобренный или заслуживающий одобрения регулирующим органом Федерального правительства или правительства штата или соответствующим органом в других странах, помимо США, или указанный в Фармакопее США или другой общепризнанной фармакопее для применения на животных и, в частности, на людях.
[29] «Фармацевтически приемлемая соль» соответствует соли соединения по изобретению, которая является фармацевтически приемлемой и которая обладает желаемой фармакологической активностью исходного вещества В частности, подобные нетоксичные соли могут представлять собой соли присоединения неорганических или органических кислот и соли присоединения оснований. Конкретно, подобные соли включают: (1) соли присоединения кислот, образованные с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобными; или образованные с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексановая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, 4-метилбицикло[2.2.2]-окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 3фенилпропионовая кислота, триметилуксусная кислота, третичная бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и подобными; или (2) соли, образованные при условии, что кислый протон, присутствующий в исходном соединении, либо замещается ионом металла, например, ионом щелочного металла, ионом щелочноземельного металла или ион алюминия; или координируется с таким органическим основанием, как этаноламин, диэтаноламин, триэтаноламин, N-метилглюкамин и подобное. Соли дополнительно включают, исключительно в качестве примера, соли натрия, калия, кальция, магния, аммония, тетраалкиламмония и подобные; и при условии, что соединение имеет основную функциональность, соли нетоксичных органических или неорганических кислот, таких как гидрохлорид, гидробромид, тартрат, мезилат, ацетат, малеат, оксалат и тому подобное. Термин «фармацевтически приемлемый катион» относится к приемлемому катионному противоиону кислотной функциональной группы. Подобные катионы представлены катионами натрия, калия, кальция, магния, аммония, тетраалкиламмония и подобными.
[30] «Фармацевтически приемлемое наполнитель» соответствует разбавителю, адъюванту, вспомогательному веществу или носителю, с которым вводят соединение по изобретению.
[31] «Пролекарства» соответствуют соединениям, в том числе производным соединений по изобретению, которые имеют расщепляемые группы и превращаются путем сольволиза или в физиологических условиях в соединения по изобретению, которые являются фармацевтически активными in vivo. Подобные примеры включают, но без ограничения этим, производные сложного эфира холина и подобное, сложные эфиры N-алкилморфолина и подобное.
[32] «Сольват» соответствует формам соединений, которые связаны с растворителем, обычно путем реакции сольволиза. Эта физическая связь включает водородную связь. Повсеместно принятые растворители включают воду, EtOH, уксусную кислоту и подобное. Соединения по изобретению могут быть получены, например, в кристаллической форме и могут быть сольватированными или гидратированными. Подходящие сольваты включают фармацевтически приемлемые сольваты, такие как гидраты, и дополнительно включают как стехиометрические сольваты, так и нестехиометрические сольваты. В некоторых случаях сольват может быть выделен, например, при условии, что одна или более молекул растворителя включены в кристаллическую решетку кристаллического твердого вещества. «Сольват» охватывает как растворенную фазу, так и выделяемые сольваты. Репрезентативные сольваты включают гидраты, этаноляты и метаноляты.
[33] «Субъект» включает людей. Термины «человек», «пациент» и «субъект» применяют в данном документе взаимозаменяемо.
[34] «Эффективное количество» означает количество соединения по изобретению, которое, при введении субъекту для лечения заболевания, является достаточным для осуществления подобной терапии в случае заболевания. «Эффективное количество» может меняться в зависимости от соединения, заболевания и его тяжести и возраста, массы и т.д. субъекта, которого лечат.
[35] «Предотвращение» или «предупреждение» относится к снижению риска приобретения заболевания или расстройства (т.е. то, в результате чего не развивается по меньшей мере один из клинических симптомов заболевания у пациента, который может подвергаться воздействию возбудителя заболевания или быть предрасположенным к заболеванию до начала заболевания).
[36] Термин «профилактика» связан с «предупреждением» и соответствует мере или процедуре, целью которой является предотвращение, а не лечение или излечение заболевания. Неограничивающие примеры профилактических мер могут включать введение вакцин; введение низкомолекулярного гепарина больным пациентам с риском тромбоза, например, из-за иммобилизации; и введение противомалярийного средства, такого как хлорохин, перед посещением географического региона, где малярия является эндемической или риск заражения малярией высок.
[37] «Лечение» или «терапия» какого-либо заболевания или расстройства соответствует, в одном варианте осуществления, уменьшению интенсивности симптомов или предотвращению болезни или расстройства (т.e. устранению болезни или снижению проявления, степени или тяжести по меньшей мере одного из ее клинических симптомов). В другом варианте осуществления «лечение» или «терапия» соответствует уменьшению интенсивности по меньшей мере одного физического параметра, который не может быть различим субъектом. В еще одном варианте осуществления «лечение» или «терапия» соответствует модулированию болезни или расстройства, либо физически (например, стабилизации заметного симптома), либо физиологически (например, стабилизации физического параметра), либо и физически, и физиологически. В дополнительном варианте осуществления «лечение» или «терапия» относится к замедлению прогрессирования болезни.
[38] В контексте данного документа термин «боль» соответствует воспалительной боли, в частности хронической суставной боли (например, ревматоидному артриту, остеоартриту, ревматоидному спондилиту, подагрическому артриту (подагре) и ювенильному артриту), включая свойство модифицирования течение болезни и сохранения структуры суставов; скелетно-мышечной боли; боли в пояснице и шее; растяжениям и вывихам; невропатической боли; симпатически поддерживаемой боли; миозиту; связанной с раком и фибромиалгией боли; связанной с мигренью боли; боли, связанной с гриппом или другими вирусными инфекциями, такими как простуда; ревматической лихорадке; боли, связанной с функциональными расстройствами кишечника, такими как неязвенная диспепсия, боль в груди некардиального происхождения и синдром раздраженного кишечника; связанной с ишемией миокарда боли; послеоперационной боли; головной боли; зубной боли; и дисменореи. Более конкретно, термин соответствует хронической суставной боли. Более конкретно, термин соответствует ревматоидному артриту, остеоартриту и подагрическому артриту (подагре).
[39] В контексте данного документа термин «сердечно-сосудистое(ые) заболевание(я)» соответствует болезням влияет на сердце или кровеносные сосуды, или и на сердце, и на кровеносные сосуды. В частности, сердечно-сосудистое заболевание включает аритмию (предсердную, или желудочковую, или обе); атеросклероз и его последствия; стенокардию; нарушения сердечного ритма; ишемию миокарда; инфаркт миокарда; аневризму сердца или сосудов; васкулит, инсульт; периферическую обструктивную артериопатию конечности, органа или ткани; реперфузионное повреждение после ишемии головного мозга, сердца, почки или другого органа или ткани; шоковые состояния, связанные с заметным падением артериального давления (например, эндотоксический, хирургический, травматический шок или септический шок); легочную артериальную гипертензию (PAH), гипертонию, порок клапана сердца, сердечную недостаточность, аномальное артериальное давление; шок; вазоконстрикцию (в том числе связанную с мигренью); сосудистые нарушения, варикозную терапию, недостаточность, ограниченную одним органом или тканью, функциональную или органическую венозную недостаточность; гипертрофию сердца, фиброз желудочков и ремоделирование миокарда. Более конкретно, соответствует атеросклерозу, легочной артериальной гипертонии, сердечной недостаточности, острому коронарному синдрому, гипертрофии сердца, фиброзу желудочков и ремоделированию миокарда.
[40] В контексте данного документа термины «невропатическая боль» или «синдромы, включающие невропатическую боль» включают и центральную невропатическую боль и периферическую невропатическую боль, если контекст не определяет иного, включают: диабетическую невропатию; воспаление седалищного нерва; неспецифическую боль в пояснице; боль при рассеянном склерозе; фибромиалгию; ВИЧ-обусловленную невропатию; постгерпетическую невралгию; тригеминальную невралгию; и боль в результате физической травмы, ампутации, рака, токсинов, невропатии, вызванной химиотерапией, или хронических воспалительных состояний. Симптомы невропатической боли включают спонтанную колющую боль и режущую боль или постоянную жгучую боль. Кроме того, включают боль, связанную с обычно безболезненными ощущениями, такими как «ощущения покалывания» (парестезии и дизестезии), повышенную чувствительность к прикосновению (гиперестезию), болезненные ощущения после безвредной стимуляции (динамическую, статическую или термическую аллодинию), повышенную чувствительность к болевым раздражителям (термическую, холодную или механическую гипералгезию), продолжающееся болевое ощущение после снятия стимуляции (гиперпатию) или отсутствие или дефицит избирательных сенсорных проводящих путей (гипоальгезию).
[41] В контексте данного документа термин «воспалительное(ые) состояние(я)» соответствует(ют) группе патологических состояний, которая включает ревматоидный артрит, остеоартрит, ювенильный идиопатический артрит, псориатический артрит, анкилозирующий спондилоартрит, кожные патологии (например, загар, ожоги, экзема, дерматит, псориаз), офтальмологические заболевания (например, глаукома, ретинит, ретинопатии, увеиты и острое повреждение ткани глаза (например, конъюктивит)), заболевания легких (например, аллергическое заболевание дыхательных путей (например, астма, ринит), хроническую обструктивную болезнь легких (ХОБЛ), бронхит, эмфизему, респираторный дистресс-синдром, болезнь любителей птиц и аллергический альвеолит у сельскохозяйственных рабочих), расстройства желудочно-кишечного тракта (например, воспалительные заболевания кишечника, такие как болезнь Крона или язвенный колит, афтозная язва, атопический гастрит, вариоформный гастрит, целиакия, регионарный илеит, синдром раздраженного кишечника, желудочно-кишечная рефлюксная болезнь, диарея и/или констипация), вызванные эндотоксином болезненные состояния (например, осложнения после шунтирования или хронические эндотоксиновые состояния, способствующие, например, хронической сердечной недостаточности), трансплантацию органов и другие состояния с воспалительным компонентом, такие как сосудистые заболевания, стеатогепатит, мигрень, узловой периартериит, тиреоидит, апластическую анемию, болезнь Ходжкина, склеродому, миастению, рассеянный склероз, соркоидоз, нефротический синдром, болезнь Бехчета, полимиозит, гингивит, ишемию миокарда, пирексию, системную красную волчанку, полимиозит, тендинит, бурсит и синдром Шегрена. В частности термин соответствует ревматоидному артриту, остеоартриту, аллергическому заболеванию дыхательных путей (например, астме), хронической обструктивной болезни легких (ХОБЛ) и воспалительному заболеванию кишечника. Более конкретно термин соответствует ревматоидному артриту, остеоартриту, хронической обструктивной болезни легких (ХОБЛ) и воспалительном заболеванию кишечника.
[42] В контексте данного документа термин «астма» соответствует любому заболеванию легких, характеризующемуся изменениями легочного газового потока, связанными с сужением дыхательных путей по любой причине (внутренней, внешней или обеих; аллергической или неаллергической). Термин астма может использоваться с одним или несколькими прилагательными для указания причины.
[43] В контексте данного документа термин «нейродегенеративные заболевания» соответствует патологическим состояниям, возникающим в результате или включающим нейродегенерацию, в том числе деменции, в частности дегенеративной деменции (в том числе сенильной деменции, болезни Альцгеймера, болезни Пика, болезни Хантингтона, болезни Паркинсона и болезни Крейтцфельда-Якоба, ALS и болезни моторных нейронов); сосудистой деменции (в том числе мультиинфарктной деменции); а также деменции, связанной с интракраниальными объемными образованиями; травме; инфекциям и связанным с ними состояниям (в том числе инфекции ВИЧ); периферическим нейропатиям, рассеянному склерозу, ретинопатиям, глаукоме, макулярной дегенерации, ишемии головного мозга, и травматическому повреждению мозга, и легким когнитивным нарушениям, связанным со старением, в частности возрастному нарушению памяти.
[44] В контексте данного документа термин «осложнения диабета» соответствует патологическим состояниям, которые связаны с диабетом I типа или II типа, эти патологические состояния включают патологические состояния, связанные с сосудистыми или микрососудистыми изменениями, например, диабетическую ретинопатию, диабетическую микроангиопатию, диабетическую нефропатию (также называемую диабетической болезнью почек (ДБП)), макулярную дегенерацию, глаукому, нефротический синдром, диабетическую кардиомиопатию, апластическую анемию, увеиты, болезнь Кавасаки и саркоидоз; а также расстройства жирового обмена, которые могут быть связаны с диабетом или ожирением, например, стеатоз печени. Более конкретно термин соответствует диабетической ретинопатии, диабетической микроангиопатии, диабетической нефропатии и стеатозу печени.
[45] В контексте данного документа, термин «рак» относится к злокачественному или доброкачественному росту клеток в коже или органах тела, например, но без ограничения этим, груди, простаты, легких, почек, поджелудочной железы, желудка или кишечника. Рак имеет тенденцию проникать в соседние ткани и распространяться (метастазировать) в отдаленные органы, например, в кости, печень, легкие или мозг. В контексте данного документа термин рак включает как метастатические опухолевые типы клеток (такие как, но без ограничения этим, меланому, лимфому, лейкемию, фибросаркому, рабдомиосаркому и мастоцитому), так и типы тканевого ракового новообразования (такие как, но без ограничения этим, колоректальный рак, рак простаты, мелкоклеточный рак легких и немелкоклеточный рак легких, рак груди, рак поджелудочной железы, рак мочевого пузыря, рак почки, рак желудочно-кишечного тракта, глиобластома, первичный рак печени, рак яичников, рак простаты и лейомиосаркома матки). В частности, термин «рак» соответствует такому, как острый лимфобластный лейкоз, острый миелоидный лейкоз, адренокортикальная карцинома, рак анального канала, рак аппендикса, астроцитомы, атипичная тератоидная/рабдоидная опухоль, базально-клеточная карцинома, рак желчного протока, рак мочевого пузыря, рак кости (остеосаркома и злокачественная фиброзная гистиоцитома), глиома ствола мозга, опухоли головного мозга, опухоли головного и спинного мозга, рак груди, бронхиальные опухоли, лимфома Беркитта, рак шейки матки, хронический лимфоцитарный лейкоз, хроническая гранулоцитная лейкемия, рак толстой кишки, колоректальный рак, краниофарингиома, кожная Т-клеточная лимфома, эмбриональные опухоли, рак эндометрия, эпендимобластома, эпендимома, рак пищевода, опухоли семейства саркомы Юинга, рак глаза, ретинобластома, рак желчного пузыря, рак желудочно-кишечного тракта (желудка), желудочно-кишечная карциноидная опухоль, гастроинтестинальная стромальная опухоль (GIST), желудочно-кишечная стромально-клеточная опухоль, эмбрионально-клеточная опухоль, глиома, лейкоз ворсистых клеток, рак головы и шеи, гепатоцеллюлярный рак (печени), ходжкинская лимфома, гипофарингеальный рак, интраокулярная меланома, опухоли островковых клеток (эндокринной поджелудочной железы), саркома Капоши, рак почек, гистиоцитоз из клеток Лангерганса, рак гортани, лейкемия, острый лимфобластный лейкоз, острая миелоидная лейкемия, хронический лимфоцитарный лейкоз, хроническая гранулоцитная лейкемия, лейкоз ворсистых клеток, рак печени, немелкоклеточный рак легкого, мелкоклеточный рак легкого, лимфома Беркитта, кожная Т-клеточная лимфома, ходжкинская лимфома, неходжкинская лимфома, лимфома, макроглобулинемия Вальденстрема, медуллобластома, медуллоэпителиома, меланома, мезотелиома, рак ротовой полости, хроническая гранулоцитная лейкемия, миелоидный лейкоз, множественная миелома, рак носоглотки, нейробластома, неходжкинская лимфома, немелкоклеточный рак легкого, рак ротовой полости, рак ротоглотки, остеосаркома, злокачественная фиброзная гистиоцитома кости, рак яичников, эпителиальный рак яичников, эмбрионально-клеточная опухоль яичников, пограничная опухоль яичника, рак поджелудочной железы, папилломатоз, рак паращитовидных желез, рак полового члена, фарингеальный рак, опухоли паренхимы шишковидной железы промежуточной дифференцировки, пинеобластома и супратенториальные примитивные нейроэктодермальные опухоли, опухоль гипофиза, плазмоклеточная опухоль/множественная миелома, плевролегочная бластома, первичная лимфома головного мозга, рак простаты, рак прямой кишки, рак почечного эпителия (почек), ретинобластома, рабдомиосаркома, рак слюнных желез, саркома, опухоли семейства саркомы Юинга, саркома, Капоши, синдром Сезари, рак кожи, мелкоклеточный рак легкого, рак тонкой кишки, саркома мягких тканей, плоскоклеточная карцинома, рак желудка (желудочно-кишечного тракта), супратенториальные примитивные нейроэктодермальные опухоли, рак яичка, рак горла, тимома и рак вилочковой железы, рак щитовидной железы, рак уретры, рак матки, саркома матки, рак влагалища, рак наружных половых органов, макроглобулинемия Вальденстрема и опухоль Вильмса. В другом конкретном варианте осуществления термин рак соответствует раку поджелудочной железы, раку печени, гепатоцеллюлярной карциноме (HCC - hepatocellular carcinoma), раку груди, или раку толстой кишки. В частности, это соответствует гепатоцеллюлярной карциноме, меланоме, раку желудочно-кишечного тракта, липосаркоме и типам рака, вызванным оксидативными стрессами, например, спондилотической цервикальной миелопатии.
[46] В контексте данного документа термин «фиброзные заболевания» соответствует болезням, характеризующимся чрезмерным рубцеванием вследствие чрезмерного образования, отложения и сокращения внеклеточного матрикса, и тем, которые связаны с абнормальным накоплением клеток, и/или фибронектина, и/или коллагена, и/или увеличением набора фибробластов, и включает, но не ограничиваясь этим, фиброз отдельных органов или таких тканей, как сердце, почки, печень, суставы, легкие, ткань плевры, ткань брюшины, кожу, роговую оболочку глаза, сетчатку, опорно-двигательный аппарат и желудочно-кишечный тракт. В частности, термин фиброзных заболеваний относится к такому, как идиопатический фиброз легких (ИФЛ); муковисцидоз, другие диффузные паренхиматозные заболевания легких различных этиологий, в том числе ятрогенный индуцированный лекарственным средством фиброз, профессиональный и/или вызванный окружающей средой фиброз, гранулематозные болезни (саркоидоз, гиперсенситивный пневмонит), диффузное поражение соединительной ткани, альвеолярный протеиноз, гранулематоз из клеток Лангерганса, лимфангиолейомиоматоз, наследственные болезни (синдром Германского-Пудлака, туберозный склероз, нейрофиброматоз, метаболическая болезнь накопления, семейная интерстициальная болезнь легких); индуцированный облучением фиброз; хроническая обструктивная болезнь легких (ХОБЛ); склеродермия; индуцированный блеомицином фиброз легких; хроническая астма; силикоз; индуцированный асбестом фиброз легких; синдром острой дыхательной недостаточности (ARDS - acute respiratory distress syndrome); фиброз почек; тубулоинтерстициальный фиброз; гломерулярный нефрит; фокально-сегментарный гломерулосклероз; Ig A-нефропатия; гипертензия; синдром Альпорта; фиброз желудочно-кишечного тракта; фиброз печени; цирроз; индуцированный алкоголем фиброз печени; индуцированный лекарственным/токсичным средством фиброз печени; гемохроматоз; неалкогольный стеатогепатит (NASH); повреждение желчных протоков; первичный биллиарный цирроз; индуцированный инфекцией фиброз печени; индуцированный вирусом фиброз печени; и аутоиммунный гепатит; рубцевание роговой оболочки глаза; гипертрофированное рубцевание; болезнь Дюпюитрена, келоидные рубцы, фиброз кожи; склеродермия кожи; системный склероз, поражение/фиброз опорно-двигательного аппарата; миелофиброз; сосудистый рестеноз; атеросклероз; артериосклероз; грануломатоз Вегенера; болезнь Пейрони или хроническая лимфоцитарная. В конкретном варианте осуществления фиброзное заболевание представляет собой заболевание отдельного органа или ткани, например, фиброз печени, фиброз легких или фиброз почек. В конкретном варианте осуществления фиброзное заболевание выбирают из идиопатического фиброза легких (ИФЛ), диабетической болезни почек (ДБП) и неалкогольного стеатогепатита (NASH).
[47] «Соединение(я) по изобретению» и эквивалентные выражения предназначены для охвата соединений по формуле(ам), как описывается в настоящем документе, причем это выражение включает фармацевтически приемлемые соли и сольваты, например, гидраты, и сольваты фармацевтически приемлемых солей, где контекст позволяет подобное. Аналогичным образом, ссылка на промежуточные соединения, независимо от того, заявлены они сами по себе или нет, предназначена для охвата их солей и сольватов, где это позволяет контекст.
[48] Когда в настоящем документе упоминаются диапазоны, например, но без ограничения этим, C1-8 алкил, перечисление диапазона должно рассматриваться как представление каждого члена указанного диапазона.
[49] Другие производные соединений по данному изобретению обладают активностью как в кислой форме, так и в форме кислого производного, но в чувствительной к кислоте форме часто предлагают преимущества растворимости, совместимости с тканями или отсроченного высвобождения в организме млекопитающих.
[50] В контексте данного документа термин «изотопный вариант» соответствует соединению, которое содержит неестественные пропорции изотопов одного или более атомов, которые составляют такое соединение. Например, «изотопный вариант» соединения может содержать один или более нерадиоактивных изотопов, такие как, например, дейтерий (2H или D), углерод13 (13C), азот (15N) или подобный. Следует понимать, что в соединении, в котором производится такая изотопная замена, следующие атомы, если они присутствуют, могут варьироваться таким образом, что например, любой водород может представлять собой 2H/D, любой углерод может представлять собой 13C или любой азот может представлять собой 15N и что наличие и месторасположение таких атомов может быть определено специалистом в данной области техники. Аналогичным образом, изобретение может включать получение изотопных вариантов с радиоизотопами, в случае, например, тех, в которых получаемые соединения могут быть применимы для исследований распределения лекарственного средства и/или субстрата в ткани. Радиоактивный изотоп тритий, т.е. 3H, и углерод-14, т. е. 14C, являются особенно применимыми для этой цели ввиду легкости их введения и готовых способов обнаружения. Дополнительно, могут быть получены соединения, которые замещены позитронно-активными изотопами, такими как 11C, 18F, 15O и 13N, и будут применены в исследованиях с помощью позитронно-эмиссионной томографии (ПЭТ) для изучения степени занятости рецептора субстратом.
[51] Если не указано иное, описание или наименование конкретного соединения в спецификации и формуле изобретения предназначено для включения как отдельных энантиомеров, так и их смесей, рацемических или иных. Способы для определения стереохимии и разделения стереоизомеров хорошо известны в данной области техники.
[52] Следует принять во внимание, что соединения по изобретению могут быть метаболизированы с образованием биологически активных метаболитов.
ФИГУРЫ
[53] Фигура 1 демонстрирует влияние Соединения 1 в двух различных дозах, получаемых п/о, на CFA-индуцированную гипералгезию на крысиной модели из Примера 3.1.
[54] Фигура 2 демонстрирует влияние Соединения 1 при 10 мг/кг, получаемых п/о, на MIA-индуцированную гипералгезию на крысиной модели из Примера 3.2.
[55] Фигура 3 демонстрирует влияние Соединения 1 при 5 мг/кг/1 р. в сутки, 15 мг/кг/1 р. в сутки и 15 мг/кг/2 р. в сутки на уровни экспрессии панели генов, связанных с фиброзом, в образцах печени мыши из CFAHFD модели фиброза (Пример 3.10). Фигура 3A: PAI1, Фигура 3B: TIMP1, Фигура 3C:COL1A1, Фигура 3D: CTGF, Фигура 3E: ACTA2 и Фигура 3F: Данные ТФР-β получены на 73-й день и представлены как среднее ± СПС, * p<0,05, ** p<0,01, ***p<0,001, ****P<0,0001 по сравнению с диетой CDAHFD+наполнитель, критерий Манна-Уитни.
[56] Фигура 4 демонстрирует влияние Соединения 1 при 5 мг/кг/1 р. в сутки, 15 мг/кг/1 р. в сутки и 15 мг/кг/2 р. в сутки на уровни экспрессии панели генов, связанных с воспалением, в образцах печени мыши из CFAHFD модели фиброза (Пример 3.10). Фигура 4A: ФНО-α, Фигура 4B: ИЛ-10 и Фигура 4C: CCL2. Данные получены на 73-й день и представлены как среднее ± СПС, * p<0,05, ** p<0,01, ***p<0,001, ****P<0,0001 по сравнению с диетой CDAHFD+наполнитель, критерий Манна-Уитни.
[57] Фигура 5 демонстрирует влияние Соединения 1 при 5 мг/кг/1 р. в сутки, 15 мг/кг/1 р. в сутки и 15 мг/кг/2 р. в сутки на уровни гидроксипролина в ткани печени мыши из CFAHFD модели фиброза (Пример 3.10). Данные получены на 73-й день и представлены как среднее ± СПС, * p<0,05, ** p<0,01, ***p<0,001, ****P<0,0001 по сравнению с диетой CDAHFD+наполнитель, критерий Манна-Уитни.
[58] Фигура 6 демонстрирует влияние Соединения 1 при 5 мг/кг/1 р. в сутки, 15 мг/кг/1 р. в сутки и 15 мг/кг/2 р. в сутки с применением количественной оценки фиброза с помощью красителя Sirius red из CFAHFD модели фиброза (Пример 3.10). Данные получены на 73-й день и представлены как среднее ± СПС, * p<0,05, ** p<0,01, ***p<0,001, ****P<0,0001 по сравнению с диетой CDAHFD+наполнитель, критерий Манна-Уитни.
[59] Фигура 7 демонстрирует влияние Соединения 1 при 5 мг/кг/1 р. в сутки, 15 мг/кг/1 р. в сутки и 15 мг/кг/2 р. в сутки на количественную оценку F4/80 из CFAHFD модели фиброза (Пример 3,10). Данные получены на 73-й день и представлены как среднее ± СПС, * p<0,05, ** p<0,01, ***p<0,001, ****P<0,0001 по сравнению с диетой CDAHFD+наполнитель, критерий Манна-Уитни.
Изобретение
[60] Настоящее изобретение основано на определении впервые полученных соединений пирролопиримидина и пирролопиридина, которые могут быть применимыми для профилактики и/или лечения боли, воспалительных состояний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, неврологических заболеваний, осложнений диабета, рака и/или фиброзных заболеваний. В конкретном аспекте настоящие соединения представляют собой ингибиторы ASK, в частности ингибиторы ASK1.
[61] Настоящее изобретение также относится к способам получения этих соединения, фармацевтические композиции, содержащие эти соединения, и способы для лечения боли, воспалительных состояний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, неврологических заболеваний, осложнений диабета, рака и/или фиброзных заболеваний путем введения соединений по изобретению.
[62] Соответственно, в первом аспекте изобретения соединения по изобретению представляют собой те, которые имеют формулу I:

где
R1 представляет собой Н, CH3, F или Cl;
Х представляет собой N, CH или С-CN; и
R2 представляет собой CH3 или галоген.
[63] В одном варианте осуществления R1 представляет собой F.
[64] В одном варианте осуществления R1 представляет собой F и R2 представляет собой CH3.
[65] В одном варианте осуществления Х представляют собой CH. В альтернативном варианте осуществления Х представляют собой C-CN. В альтернативном варианте осуществления Х представляют собой N.
[66] В одном варианте осуществления Х представляют собой N и R1 представляет собой F. В конкретном варианте осуществления Х представляет собой N, R1 представляет собой F и R2 представляет собой CH3. В дополнительном варианте осуществления R2 представляет собой CH3 или Cl. В еще одном дополнительном варианте осуществления R2 представляет собой CH3.
[67] В одном варианте осуществления соединение по изобретению выбирают из:
2-амино-5-фтор-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]пиридин-4-карбоксамида (Соединение 1),
2-амино-5-метил-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]пиридин-4-карбоксамида (Соединение 2),
2-амино-5-хлор-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]-пиридин-4-карбоксамида (Соединение 3),
2-амино-N-[1-(5-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]пиридин-4-карбоксамида (Соединение 4),
2-амино-N-[1-(5-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]-5-фтор-пиридин-4-карбоксамида (Соединение 5),
2-амино-N-[1-(5-циано-3-метил-1H-пирроло[2,3-b]пиридин-4-ил)-4-пиперидил]-5-фтор-пиридин-4-карбоксамида (Соединение 6) и
2-амино-N-[1-(3-хлор-1H-пирроло[2,3-b]пиридин-4-ил)-4-пиперидил]-5-фтор-пиридин-4-карбоксамида (Соединение 7).
[68] В одном варианте осуществления соединение по изобретению не является изотопным вариантом.
[69] В одном аспекте соединение по изобретению по любому из описанных в настоящем документе вариантов осуществления присутствует в виде свободного основания.
[70] В одном аспекте соединение по изобретению по любому из описанных в настоящем документе вариантов осуществления представляет собой фармацевтически приемлемую соль.
[71] В одном аспекте соединение по изобретению по любому из описанных в настоящем документе вариантов осуществления представляет собой сольват соединения.
[72] В одном аспекте соединение по изобретению по любому из описанных в настоящем документе вариантов осуществления представляет собой сольват фармацевтически приемлемой соли соединения.
[73] В конкретном варианте осуществления соединение по изобретению по любому из описанных в настоящем документе вариантов осуществления проявляет улучшенную активность в in vitro оценке состояния клеток на активность ASK1 по сравнению со структурно схожими соединениями. В конкретном варианте осуществления соединение по изобретению проявляет улучшенную активность в оценке состояния клеток на активность ASK1 в мононуклеарных клетках периферической крови (PBMC), как описано в настоящем документе в качестве Примера 2.3.
[74] В альтернативном варианте осуществления соединение по изобретению по любому из описанных в настоящем документе вариантов осуществления может демонстрировать сниженную индукцию активности Cyp. В частности, соединение по изобретению могут демонстрировать сниженную индукцию активности Cyp3A4 по сравнению со структурно схожими соединениями.
[75] В альтернативном варианте осуществления соединение по изобретению по любому из описанных в настоящем документе вариантов осуществления может демонстрировать повышенное ингибирование активности Cyp. В частности, соединение по изобретению могут демонстрировать повышенное в сравнении со структурно схожими соединениями ингибирование активности Cyp3A4. Более конкретно, соединение по изобретению может демонстрировать IC50 для ингибирования Cyp > 10 мкМ.
[76] Хотя указанные для каждого варианта осуществления группы, как правило, приведенные выше отдельно, соединение по изобретению включает одну, в которой несколько или каждый вариант осуществления в приведенной выше формуле, а также другие формулы, представленные в настоящем документе, выбирают из один или более конкретных членов или групп, обозначенных соответственным образом для каждой переменной. Следовательно, данное изобретение предназначено для включения в его объем всех комбинаций таких вариантов осуществления.
[77] Хотя указанные для каждого варианта осуществления группы, как правило, приведены выше отдельно, соединение по изобретению может быть одним из тех, для которого одну или более переменных (например, групп R) выбирают из одного или более вариантов осуществления в соответствии с любой из формул, приведенных выше. Следовательно, настоящее изобретение предназначено для включения в его объем всех комбинаций переменных из любого из раскрытых вариантов осуществления в пределах его объема.
[78] В качестве альтернативы настоящее изобретение предполагает исключение одной или более из указанных переменных из группы или варианта осуществления, или их комбинаций.
[79] В некоторых аспектах, настоящее изобретение относится к пролекарствам и производным соединений в соответствии с формулами выше. Пролекарства представляют собой производные соединений по изобретению, которые имеют метаболически расщепляемые группы и превращаются путем сольволиза или в физиологических условиях в соединения по изобретению, которые являются фармацевтически активными, in vivo. Подобные примеры включают, но без ограничения этим, производные сложного эфира холина и подобное, сложные эфиры N-алкилморфолина и подобное.
[80] Другие производные соединений по данному изобретению обладают активностью как в кислой форме, так и в форме кислого производного, но в чувствительной к кислоте форме часто предлагают преимущества растворимости, совместимости с тканями или отсроченного высвобождения в организме млекопитающих (Bundgaard, 1985). Пролекарства включают кислые производные, хорошо известные специалистам в данной области техники, такие как, например, сложные эфиры, получаемые путем реакции исходной кислоты с подходящим спиртом или амидами, получаемыми путем реакции исходной кислоты соединение с замещенным или незамещенным амином, или ангидридами кислот, или смешанными ангидридами. Простые алифатические или ароматические сложные эфиры, амиды и ангидриды, полученные из кислотных групп, которые могут быть включены в соединения по данному изобретению, являются предпочтительными пролекарствами. В некоторых случаях является желательным получить пролекарства типа двойные сложные эфиры, такие как (ацилокси)алкиловые сложные эфиры или ((алкоксикарбонил)окси)алкиловые сложные эфиры. В частности, применимыми являются C1-C8 алкиловые, C2-C8 алкениловые, ариловые, C7-C12 замещенные ариловые и C7-C12 арилалкиловые сложные эфиры соединений по изобретению.
Фармацевтические композиции
[81] При применении в качестве фармацевтических средств, соединение по изобретению обычно вводят в форме фармацевтической композиции. Подобные композиции могут быть получены хорошо известным в фармацевтике способом и содержат по меньшей мере одно активное соединение по изобретению в соответствии с Формулой I. Обычно, соединение по изобретению вводят в фармацевтически эффективном количестве. Количество фактически вводимого соединения по изобретению, как правило, определяется врачом с учетом соответствующих обстоятельств, в том числе подлежащего лечению патологического состояния, выбранного пути введения, конкретного вводимого соединения по изобретению, возраста, массы и реакции индивидуального пациента, тяжести симптомов у пациента и подобное.
[82] Фармацевтические композиции по данному изобретению могут быть введены множеством путей, в том числе пероральным, ректальным, трансдермальным, подкожным, внутрисуставным, внутривенным, внутримышечным и интраназальным. В зависимости от предполагаемого пути доставки, соединение по изобретению предпочтительно составляют в виде либо инъекционных, либо пероральных композиций, либо в виде мазей, в виде лосьонов или пластырей для трансдермального введения.
[83] Композиции для перорального введения может принимать форму нерасфасованных жидких растворов или суспензий или нерасфасованных порошков. Чаще, однако, композиции присутствуют в стандартных лекарственных формах с целью облегчения точного дозирования. Термин «стандартные лекарственные формы» соответствует физически дискретным единицам, пригодным в качестве единичных дозировок для человека и других млекопитающих, причем каждая стандартная лекарственная форма содержит заранее определенное количество активного материала, рассчитанное на получение желаемого терапевтического эффекта, в сочетании с подходящим фармацевтическим вспомогательным средством, наполнителем или носителем. Обычно стандартные лекарственные формы включают предварительно заполненные, предварительно отмеренные ампулы или шприцы жидких композиций или пилюли, таблетки, капсулы или подобное в случае твердых композиций. В подобных композициях, соединение по изобретению в соответствии с Формулой I является обычно микрокомпонентом (от около 0,1 до около 50% по массе или предпочтительно от около 1 до около 40% по массе) с остатком, которые представляет собой различные наполнители или носители, и вспомогательные вещества, используемые в производственном процессе, полезные для образования желаемой формы дозирования.
[84] Подходящие для перорального введения жидкие формы могут включать подходящий водный или неводный наполнитель с буферами, суспендирующее и диспергирующее средства, красители, вкусоароматические добавки и подобное. Твердые формы могут включать, например, любой из следующих ингредиентов или соединение по изобретениям аналогичной природы: связующее вещество, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; вспомогательное вещество, такое как крахмал или лактоза, средство для улучшения распадаемости таблеток, такое как альгиновая кислота, Primogel или кукурузный крахмал; смазывающее вещество, такое как стеарат магния; способствующее скольжению вещество, такое как коллоидный диоксид кремния; подслащивающее средство, такое как сахароза или сахарин; или вкусоароматическое средство, такое как мятный или апельсиновый ароматизатор.
[85] Инъецируемые композиции обычно основаны на инъецируемом стерильном физиологическом растворе или фосфатно-солевом буфере или других инъецируемых носителях, известных в данной области техники. По-прежнему, активное соединение по изобретению в соответствии с Формулой I в подобных композициях обычно представляет собой микрокомпонент, часто составляющий от около 0,05 до 10% по массе с остатком, который представляет собой инъецируемый носитель и подобное.
[86] Трансдермальные композиции обычно составляют в виде мазь местного применения или крем, содержащие активный(е) ингредиент(ы), как правило, в количестве в диапазоне от около 0,01 до около 20% по массе, предпочтительно, от около 0,1 до около 20% по массе, предпочтительно от около 0,1 до около 10% по массе и, более предпочтительно, от около 0,5 до около 15% по массе. При изготовлении в виде мази активные ингредиенты будут как правило объединять с либо парафиновой или смешивающейся с водой основой для мази. В качестве альтернативы, активные ингредиенты могут быть составлены в виде крема с, например, основой для крема типа «масло в воде». Подобные трансдермальные составы хорошо известны в данной области техники и, как правило, содержат дополнительные ингредиенты для усиления проникновения через кожу стабильности активных ингредиентов или состава. Все подобные известные трансдермальные составы и ингредиенты включены в объем данного изобретения.
[87] Соединение по изобретению также можно вводить с помощью устройства трансдермальной доставки. Соответственно, трансдермальное введение может быть выполнено с использованием пластыря, либо мембраны накопительного типа, либо пористой мембраны, либо разновидности с твердой матрицей.
[88] Описанные выше компоненты для перорально вводимых, инъецируемых или вводимых местно композиций являются исключительно репрезентативными. Другие материалы, а также способы обработки и тому подобное изложены в Part 8 в Remington’s Pharmaceutical Sciences, 17th edition, 1985, Mack Publishing Company, Easton, Pennsylvania, которая включена в настоящий документ посредством ссылки.
[89] Соединение по изобретению также может быть введено в формах с пролонгированным высвобождением или в системах доставки лекарственного средства с пролонгированным высвобождением. Описание репрезентативных материалов с пролонгированным высвобождением возможно найти в Remington’s Pharmaceutical Sciences.
[90] Приведенные далее примеры составов иллюстрируют репрезентативные фармацевтические композиции, которые могут быть получены в соответствии с данным изобретением. Настоящее изобретение, при этом, не ограничивается приведенными далее фармацевтическими композициями.
Состав 1 - таблетки
[91] Соединение по изобретению в соответствии с Формулой I может быть смешано в виде сухого порошка с сухим связующим веществом на основе желатина в соотношении приблизительно 1:2 по массе. Незначительное количество стеарата магния может быть добавлено в качестве смазывающего вещества. Смесь может быть отформована в 240-270 мг таблетки (80-90 мг активного соединения по изобретению в соответствии с Формулой I на таблетку) в таблетировочном прессе.
Состав 2 - Капсулы
[92] Соединение по изобретению в соответствии с Формулой I может быть смешано в виде сухого порошка с разбавителем на основе крахмала в соотношении приблизительно 1:1 по массе. Смесь может быть помещена в 250 мг капсулы (125 мг активного соединения по изобретению в соответствии с Формулой I на капсулу).
Состав 3 - Жидкость
[93] Соединение по изобретению в соответствии с Формулой I (125 мг) может быть примешано к сахарозе (1,75 г) и ксантановой камеди (4 мг), а получаемая смесь может быть перемешана, пропущена сквозь сито № 10 меш и затем смешана с полученным ранее раствором микрокристаллической целлюлозы и карбоксиметилцеллюлозы натрия (11:89, 50 мг) в воде. Бензоат натрия (10 мг), вкусоароматическая добавка и краситель могут быть разбавлены водой и добавлены при перемешивании. Затем при перемешивании может быть добавлено достаточное количество воды. Затем может быть добавлено достаточное количество воды, чтобы получить общий объем 5 мл.
Состав 4 - таблетки
[94] Соединение по изобретению в соответствии с Формулой I может быть смешано в виде сухого порошка с сухим связующим веществом на основе желатина в соотношении приблизительно 1:2 по массе. Незначительное количество стеарата магния может быть добавлено в качестве смазывающего вещества. Смесь может быть отформована в 450-900 мг таблетки (150-300 мг активного соединения по изобретению в соответствии с Формулой I) в таблетировочном прессе.
Состав 5 - Инъекция
[95] Соединение по изобретению в соответствии с Формулой I может быть растворено или суспендировано в забуференной стерильным физиологическим раствором инъецируемой водной среде до концентрации приблизительно 5 мг/мл.
Состав 6 - Препарат для местного применения
[96] Стеариловый спирт (250 г) и медицинский вазелин (250 г) могут быть расплавлены при температуре около 75°C и после этого могут быть добавлены смесь соединения по изобретению в соответствии с Формулой I (50 г), метилпарабен (0,25 г), пропилпарабен (0,15 г), лаурилсульфат натрия (10 г) и пропиленгликоль (120 г), растворенные в воде (около 370 г), а полученную смесь могут перемешивать до тех пор, пока она не застынет.
Способы лечения
[97] В одном варианте осуществления настоящее изобретение относится к соединению по изобретению или фармацевтическим композициям, содержащим соединение по изобретению, для применения в медицине. В конкретном варианте осуществления настоящее изобретение относится к соединению по изобретению или фармацевтическим композициям, содержащим соединение по изобретению, для применения с целью профилактики и/или лечения боли, воспалительных состояний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, неврологических заболеваний, осложнений диабета, рака и/или фиброзных заболеваний.
[98] В другом варианте осуществления настоящее изобретение относится к соединению по изобретению или фармацевтическим композициям, содержащим соединение по изобретению для использования в производстве лекарственного препарата для применения с целью профилактики и/или лечения боли, воспалительных состояний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, неврологических заболеваний, осложнений диабета, рака и/или фиброзных заболеваний.
[99] В одном варианте осуществления настоящее изобретение относится к фармацевтическим композициям, содержащим соединение по изобретению и другое терапевтическое средство. В конкретном варианте осуществления другое терапевтическое средство представляет собой средство для профилактики и/или лечения боли, воспалительных состояний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, неврологических заболеваний, осложнений диабета, рака и/или фиброзных заболеваний.
[100] В дополнительных аспектах способа лечения, данное изобретение относится к способам профилактики и/или лечения боли, воспалительных состояний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, неврологических заболеваний, осложнений диабета, рака и/или фиброзных заболеваний, которые могут включать этап введения эффективного количества соединения по изобретению или одной или более фармацевтических композиций, описанных в настоящем документе, для лечения или профилактики вышеуказанного состояния.
[101] В дополнительных аспектах способа лечения, данное изобретение относится к способам профилактики и/или лечения млекопитающего, страдающего от боли, воспалительных состояний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, неврологических заболеваний, осложнений диабета, рака и/или фиброзных заболеваний, которые могут включать этап введения эффективного количества соединения по изобретению или одной или более фармацевтических композиций, описанных в настоящем документе, для лечения или профилактики вышеуказанного состояния.
[102] В одном варианте осуществления настоящее изобретение относится к соединению по изобретению или фармацевтическим композициям, содержащим соединение по изобретению, для применения с целью профилактики и/или лечения боли. В конкретном варианте осуществления боль выбрана из хронической суставной боли. В конкретном варианте осуществления хроническая суставная боль представляет собой боль при остеоартрите, ревматоидном артрите, ревматоидном спондилите, подагрическом артрите (подагре) и/или ювенильном артрите.
[103] В другом варианте осуществления настоящее изобретение относится к соединению по изобретению или фармацевтическим композициям, содержащим соединение по изобретению для использования в производстве лекарственного препарата для применения с целью профилактики и/или лечения боли. В конкретном варианте осуществления боль выбрана из хронической суставной боли. В конкретном варианте осуществления хроническая суставная боль представляет собой боль при остеоартрите, ревматоидном артрите, ревматоидном спондилите, подагрическом артрите (подагре) и/или ювенильном артрите.
[104] В дополнительных аспектах способа лечения, данное изобретение относится к способам профилактики и/или лечения млекопитающего, страдающего от боли, которые могут включать этап введения эффективного количества соединения по изобретению или одной или более фармацевтических композиций, описанных в настоящем документе, для лечения или профилактики вышеуказанного патологического состояния. В конкретном варианте осуществления боль выбрана из хронической суставной боли. В конкретном варианте осуществления хроническая суставная боль представляет собой боль при остеоартрите, ревматоидном артрите, ревматоидном спондилите, подагрическом артрите (подагре) и/или ювенильном артрите.
[105] В одном варианте осуществления настоящее изобретение относится к соединению по изобретению или фармацевтическим композициям, содержащим соединение по изобретению, для применения с целью профилактики и/или лечения воспалительных состояний. В конкретном варианте осуществления воспалительное состояние выбирают из ревматоидного артрита, остеоартрита, хронической обструктивной болезни легких (ХОБЛ) и воспалительных заболеваний кишечника. Более конкретно, воспалительное состояние представляет собой остеоартрит.
[106] В другом варианте осуществления настоящее изобретение относится к соединению по изобретению или фармацевтическим композициям, содержащим соединение по изобретению для использования в производстве лекарственного препарата для применения с целью профилактики и/или лечения воспалительных состояний. В конкретном варианте осуществления воспалительное состояние выбирают из ревматоидного артрита, остеоартрита, хронической обструктивной болезни легких (ХОБЛ) и воспалительных заболеваний кишечника. Более конкретно, воспалительное состояние представляет собой остеоартрит.
В дополнительных аспектах способа лечения, данное изобретение относится к способам профилактики и/или лечения млекопитающего, страдающего от воспалительных состояний, которые могут включать этап введения эффективного количества соединения по изобретению или одной или более фармацевтических композиций, описанных в настоящем документе, для лечения или профилактики вышеуказанного патологического состояния. В конкретном варианте осуществления воспалительное состояние выбирают из ревматоидного артрита, остеоартрита, хронической обструктивной болезни легких (ХОБЛ) и воспалительных заболеваний кишечника. Более конкретно, воспалительное состояние представляет собой остеоартрит.
[107] В одном варианте осуществления настоящее изобретение относится к соединению по изобретению или фармацевтическим композициям, содержащим соединение по изобретению, для применения с целью профилактики и/или лечения сердечно-сосудистых заболеваний. В конкретном варианте осуществления сердечно-сосудистое заболевание выбирают из атеросклероза, легочной артериальной гипертонии, сердечной недостаточности, острого коронарного синдрома, гипертрофии сердца, фиброза желудочков и ремоделирования миокарда.
[108] В другом варианте осуществления настоящее изобретение относится к соединению по изобретению или фармацевтическим композициям, содержащим соединение по изобретению, для использования в производстве лекарственного препарата для применения с целью профилактики и/или лечения сердечно-сосудистых заболеваний. В конкретном варианте осуществления сердечно-сосудистое заболевание выбирают из атеросклероза, легочной артериальной гипертонии, сердечной недостаточности, острого коронарного синдрома, гипертрофии сердца, фиброза желудочков и ремоделирования миокарда.
[109] В дополнительных аспектах способа лечения, данное изобретение относится к способам профилактики и/или лечения млекопитающего, страдающего от сердечно-сосудистого заболевания, которые могут включать этап введения эффективного количества соединения по изобретению или одной или более фармацевтических композиций, описанных в настоящем документе, для лечения или профилактики указанного заболевания. В конкретном варианте осуществления сердечно-сосудистое заболевание выбирают из атеросклероза, легочной артериальной гипертонии, сердечной недостаточности, острого коронарного синдрома, гипертрофии сердца, фиброза желудочков и ремоделирования миокарда.
[110] В одном варианте осуществления настоящее изобретение относится к соединению по изобретению или фармацевтическим композициям, содержащим соединение по изобретению, для применения с целью профилактики и/или лечения нейродегенеративных заболеваний. В конкретном варианте осуществления нейродегенеративное заболевание выбирают из дегенеративной деменции, болезни Альцгеймера, рассеянного склероза и ретинопатий.
[111] В другом варианте осуществления настоящее изобретение относится к соединению по изобретению или фармацевтическим композициям, содержащим соединение по изобретению для использования в производстве лекарственного препарата для применения с целью профилактики и/или лечения нейродегенеративных заболеваний. В конкретном варианте осуществления нейродегенеративное заболевание выбирают из дегенеративной деменции, болезни Альцгеймера, рассеянного склероза и ретинопатий.
[112] В дополнительных аспектах способа лечения, данное изобретение относится к способам профилактики и/или лечения млекопитающего, страдающего от нейродегенеративного заболевания, которые могут включать этап введения эффективного количества соединения по изобретению, или одной, или более фармацевтических композиций, описанных в настоящем документе, для лечения или профилактики указанного заболевания. В конкретном варианте осуществления нейродегенеративное заболевание выбирают из дегенеративной деменции, болезни Альцгеймера, рассеянного склероза и ретинопатий.
[113] В одном варианте осуществления настоящее изобретение относится к соединению по изобретению или фармацевтическим композициям, содержащим соединение по изобретению, для применения с целью профилактики и/или лечения неврологических заболеваний. В конкретном варианте осуществления неврологическое заболевание выбирают из невропатической боли, деменции, рассеянного склероза и ретинопатий.
[114] В другом варианте осуществления настоящее изобретение относится к соединению по изобретению или фармацевтическим композициям, содержащим соединение по изобретению для использования в производстве лекарственного препарата для применения с целью профилактики и/или лечения неврологических заболеваний. В конкретном варианте осуществления неврологическое заболевание выбирают из невропатической боли, деменции, рассеянного склероза и ретинопатий.
[115] В дополнительных аспектах способа лечения, данное изобретение относится к способам профилактики и/или лечения млекопитающего, страдающего от неврологического заболевания, которые могут включать этап введения эффективного количества соединения по изобретению или одной или более фармацевтических композиций, описанных в настоящем документе, для лечения или профилактики указанного заболевания. В конкретном варианте осуществления неврологическое заболевание выбирают из невропатической боли, деменции, рассеянного склероза и ретинопатий.
[116] В одном варианте осуществления настоящее изобретение относится к соединению по изобретению или фармацевтическим композициям, содержащим соединение по изобретению, для применения с целью профилактики и/или лечения осложнений диабета. В конкретном варианте осуществления осложнение выбирают из диабетической ретинопатии, диабетической микроангиопатии, диабетической нефропатии и стеатоза печени.
[117] В другом варианте осуществления настоящее изобретение относится к соединению по изобретению или фармацевтическим композициям, содержащим соединение по изобретению для использования в производстве лекарственного препарата для применения с целью профилактики и/или лечения осложнений диабета. В конкретном варианте осуществления осложнение выбирают из диабетической ретинопатии, диабетической микроангиопатии, диабетической нефропатии и стеатоза печени.
[118] В дополнительных аспектах способа лечения, данное изобретение относится к способам профилактики и/или лечения млекопитающего, страдающего от осложнения диабета, которые могут включать этап введения эффективного количества соединения по изобретению или одной или более фармацевтических композиций, описанных в настоящем документе, для лечения или профилактики указанного осложнения. В конкретном варианте осуществления осложнение выбирают из диабетической ретинопатии, диабетической микроангиопатии, диабетической нефропатии и стеатоза печени.
[119] В одном варианте осуществления настоящее изобретение относится к соединению по изобретению или фармацевтическим композициям, содержащим соединение по изобретению, для применения с целью профилактики и/или лечения рака.
[120] В другом варианте осуществления настоящее изобретение относится к соединению по изобретению или фармацевтическим композициям, содержащим соединение по изобретению для использования в производстве лекарственного препарата для применения с целью профилактики и/или лечения рака.
[121] В дополнительных аспектах способа лечения, данное изобретение относится к способам профилактики и/или лечения млекопитающего, страдающего от рака, которые могут включать этап введения эффективного количества соединения по изобретению или одной или более фармацевтических композиций, описанных в настоящем документе, для лечения или профилактики указанного рака.
[122] В одном варианте осуществления настоящее изобретение относится к соединению по изобретению или фармацевтическим композициям, содержащим соединение по изобретению, для применения с целью профилактики и/или лечения фиброзных заболеваний. В конкретном варианте осуществления фиброзное заболевание представляет собой заболевание отдельного органа или ткани, например, фиброз печени, фиброз легких или фиброз почек. В конкретном варианте осуществления фиброзное заболевание выбирают из идиопатического фиброза легких (ИФЛ), диабетической болезни почек (ДБП) и неалкогольного стеатогепатита (NASH).
[123] В другом варианте осуществления настоящее изобретение относится к соединению по изобретению или фармацевтическим композициям, содержащим соединение по изобретению, для использования в производстве лекарственного препарата для применения с целью профилактики и/или лечения фиброзных заболеваний. В конкретном варианте осуществления фиброзное заболевание представляет собой заболевание отдельного органа или ткани, например, фиброз печени, фиброз легких или фиброз почек. В конкретном варианте осуществления фиброзное заболевание выбирают из идиопатического фиброза легких (ИФЛ), диабетической болезни почек (ДБП) и неалкогольного стеатогепатита (NASH).
[124] В дополнительных аспектах способа лечения, данное изобретение относится к способам профилактики и/или лечения млекопитающего, страдающего от фиброзных заболеваний, которые могут включать этап введения эффективного количества соединения по изобретению или одной или более фармацевтических композиций, описанных в настоящем документе, для лечения или профилактики указанного заболевания. В конкретном варианте осуществления фиброзное заболевание представляет собой заболевание отдельного органа или ткани, например, фиброз печени, фиброз легких или фиброз почек. В конкретном варианте осуществления фиброзное заболевание выбирают из идиопатического фиброза легких (ИФЛ), диабетической болезни почек (ДБП) и неалкогольного стеатогепатита (NASH).
[125] Диапазон уровней дозы для инъекций составляет от около 0,1 мг/кг/ч до по меньшей мере 10 мг/кг/ч или от около 1 до около 120 ч и особенно от 24 до 96 ч. Для достижения адекватных плато концентрации также может быть введен болюс предварительной нагрузки от около 0,1 мг/кг до около 10 мг/кг или более. Максимальная общая доза не должна превышать около 1 г/день для пациента-человека с массой 40-80 кг.
[126] Для профилактики и/или лечения продолжительных состояний, таких как дегенеративные состояния, обычно растягивается на многие месяцы или годы, поэтому дозирование перорально предпочтительнее для удобства и переносимости пациентом. При пероральном введении, от одной до четырех (1-4) регулярных доз ежедневно, конкретно, от одной до трех (1-3) регулярных доз ежедневно, обычно, от одной до двух (1-2) регулярных доз ежедневно и, наиболее характерно, одна (1) регулярная доза ежедневно являются репрезентативными режимами. В качестве альтернативы, в случае лекарственных средств с устойчивым эффекта, при пероральном введении, режимы раз в две недели, раз в неделю и раз в день являются репрезентативными. В частности, режим дозировки могут представлять каждые 1-14 дней, более конкретно, 1-10 дней, еще более конкретно, 1-7 дней, и, наиболее конкретно, 1-3 дней.
[127] С применением этих паттернов дозирования, каждая доза обеспечивает от около 1 до около 1000 мг соединения по изобретению, причем конкретные дозы обеспечивают от около 10 до около 500 мг и особенно от около 30 до около 250 мг.
[128] Трансдермальные дозы, как правило, выбирают с целью обеспечения аналогичных или более низких уровней в крови, которые достигают с применением доз для инъекций.
[129] При использовании для предотвращения возникновения состояния соединение по изобретению будут вводиться пациенту с риском развития заболевания, обычно по рекомендации и под наблюдением врача, при уровнях дозировки, описанных выше. Пациенты, подверженные риску развития конкретного патологического состояния, как правило, включают тех, которые имеют семейную историю состояния, либо тех, которые, как было определено с помощью генетического анализа или скрининга, являются особенно восприимчивыми к развитию патологического состояния.
[130] Соединение по изобретению может быть введено в качестве единоличного активного средства или может быть введено в комбинации с другими терапевтическими средствами, в том числе другими соединениями по изобретению, которые демонстрируют схожую или аналогичную терапевтическая активность, и которые определяют как безопасные и эффективные для такого комбинированного введения. В конкретном варианте осуществления совместное введение двух (или более) средств позволяет значительно снизить дозу каждого из них, тем самым уменьшая видимые побочные эффекты.
[131] В одном варианте осуществления соединение по изобретению или фармацевтическую композицию, которая включает соединение по изобретению, вводят в качестве лекарственного препарата. В конкретном варианте осуществления указанная фармацевтическая композиция дополнительно содержит дополнительный активный ингредиент.
[132] В одном варианте осуществления соединение по изобретению совместно вводят с другим терапевтическим средством для лечения и/или профилактики воспалительного состояния, конкретные средства включают, но без ограничения этим, иммунорегуляторные средства, например, азатиоприн, кортикостероиды (например, преднизолон или дексаметазон), циклофосфамид, циклоспорин A, такролимус, микофенолат, мофетил, муромонаб-CD3 (OKT3, например, Orthocolone®), ATG, аспирин, ацетаминофен, ибупрофен, напроксен и пироксикам.
[133] В одном варианте осуществления соединение по изобретению совместно вводят с другим терапевтическим средством для лечения и/или профилактики артрита (например, ревматоидного артрита), конкретные средства включают, но без ограничения этим, аналгезирующие средства, нестероидные противовоспалительные лекарственные средства (NSAIDS), стероиды, синтетические модифицирующие течение болезни антиревматические лекарственные средства (DMARDS), (например, но без ограничения этим, метотрексат, лефлуномид, сульфасалазин, ауранофин, ауротиомалат натрия, пеницилламин, хлорохин, гидроксихлорохин, азатиоприн, тофаситиниб, барицитиниб, фосфаматиниб и циклоспорин) и биологические DMARDS (например, но без ограничения этим, инфликсимаб, этанерцепт, адалимумаб, ритуксимаб и абатацепт).
[134] Под совместным введением подразумевают любые способы доставки двух или более терапевтических средств пациенту в качестве части подобного режима лечения, что будет очевидно специалисту в данной области техники. Хотя два или более средств могут быть введены одновременно в одном составе, например, в качестве одной фармацевтической композиции, это не является существенным. Средства могут быть введены в различных составах и в разное время.
Методы химического синтеза
Общая информация
[135] В соответствии с дополнительным аспектом настоящего изобретения предложен способ получения соединений формулы I. Схемы в настоящем документе представляют собой примеры схем синтеза, которые могут быть применены для синтезирования соединений по изобретению. В схемах в настоящем документе реакционно-способные группы могут быть защищены с помощью защитных групп и снимают защиту в соответствии с хорошо известными способами.
[136] В соответствии с дополнительным аспектом по изобретению предлагают способ получения соединения формулы I, как определено в настоящем документе, который включает:
(a) приведение в контакт соединения формулы II:
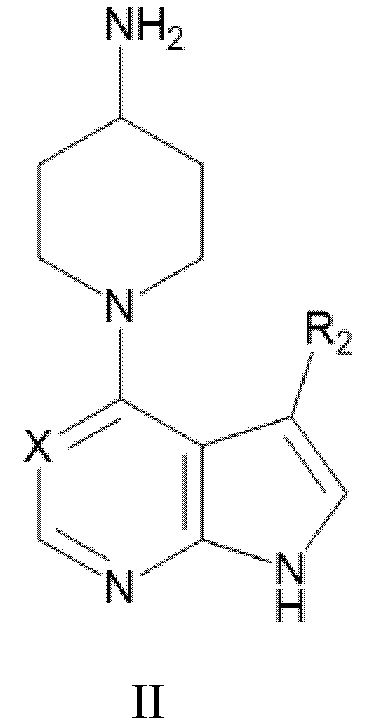
где Х и R2 являются такими, как определено в настоящем документе, с соединением формулы III:
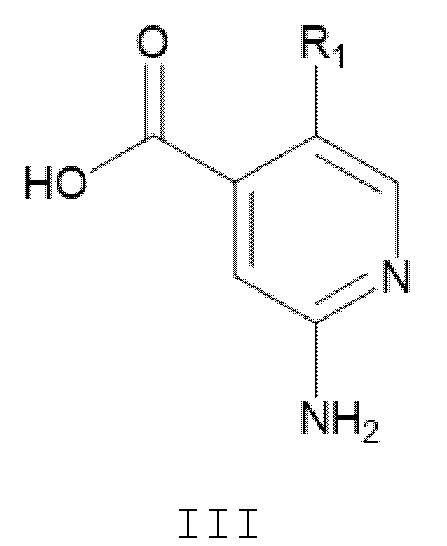
или его производное с защитной группой, где R1 является таким, как определено в настоящем документе;
(b) снятие защиты с производного с защитной группой соединения формулы I;
(c) взаимопревращение соединения формулы I или его производного с защитной группой с другим соединением формулы I или его производным с защитной группой; и
(d) необязательное образование фармацевтически приемлемой соли соединения формулы I.
[137] Соединения формул II и III могут быть получены в соответствии с процедурами, описанными в настоящем документе в Схемах 1A, 1B, 1C, и процедурами получения соединений 1-7.
[138] Соединение по изобретению могут быть получены из легкодоступных исходных материалов с применением следующих общих способов и процедур. Понятно, что если даны типичные или предпочтительные условия процесса (например, температура реакции, время, мольные соотношения реагентов, растворители, давление и т.д.), также могут использоваться другие условия процесса, если не указано иное. Оптимальные условия реакции могут варьироваться в зависимости от конкретных используемых реагентов или растворителя, но специалист в данной области техники может определить такое состояние с помощью рутинных процедур оптимизации.
[139] Дополнительно, что будет очевидно для специалистов в данной области техники, обычные защитные группы могут быть необходимыми для предотвращения нежелательных реакций определенных функциональных групп. Выбор подходящей защитной группы для конкретной функциональной группы, а также подходящих условий для защиты и снятия защиты хорошо известны в данной области техники.
[140] Следующие способы представлены с подробностями относительно получения соединения по изобретению, как определено выше, и сравнительных примеров. Соединение по изобретению могут быть получены из известных или коммерчески доступных исходных материалов и реагентов специалистом в области органического синтеза.
[141] Все реагенты являются реагентами промышленного назначения и используются в том виде, в каком они были получены, без дополнительной очистки, если не указано иное. Для реакций, проводимых в инертной атмосфере применяют коммерчески доступные безводные растворители. Во всех других случаях применяют чистые для анализа растворители, если не указано иное. Колоночную хроматографию осуществляют на силикагеле 60 (35-70 мкм). Тонкослойную хроматографию проводят с использованием предварительно покрытых силикагелем пластин 60F-254 (толщина 0,25 мм). Спектр ЯМР записывают на спектрометре Bruker DPX 300 МГц, оборудованном 5 мм зондом BBI, Bruker AV400 МГц, оборудованном 5 мм зондом PABBO, Bruker DRX 500 МГц, оборудованном 5 мм зондом PABBI, и Bruker Avance III 600, оборудованном 5 мм зондом RT BBI. Образцы регистрируют при температуре 25°C с применением ДМСО-d6 или CDCl3 в качестве растворителя, если не указано иное. Химические сдвиги (δ) для спектров ЯМР 1H представлены в частях на миллион (м.д.) относительно тетраметилсилана (δ 0,00) в качестве внутреннего стандарта.
[142] Спектры МС с электрораспылением получают на Waters Acquity UPLC с детектором с фотодиодной матрицей Waters Acquity и масс-спектрометром SQD. Используемые колонки: Предколонка СВЭЖХ BEH C18 1,7 мкм, 2,1×5 мм VanGuard с BEH колонкой С18 Acquity UPLC C18 1,7 мкм, 2,1×50 мм или CSH колонкой Acquity UPLC C18 1,7 мкм, 2,1×50 мм. Во всех способах используются градиенты MeCN/H2O. MeCN и H2O содержат либо 0,1% муравьиной кислоты, либо 10 мМ NH4HCO3.
[143] Для препаративной очистки применяют HPLC Waters Mass Directed Autopurification System. Система состоит из Waters Sample Manager 2767, Waters System Fluid Organizer, Waters Binary Gradient Module 2545, Waters 515 HPLC Pump, Waters Photodiode Array Detector 2998 и МС-детектора Waters Micromass ZQ MS. Используемое программное обеспечение: FractionLynx и MassLynx v4.1. Общие параметры метода ВЭЖХ: градиент подвижной фазы 0,1% муравьиной кислоты в H2O и MeCN или 10 мМ NH4HCO3 pH=10 и MeCN. Колонка XBridge 30×150 мм, 5 мкм. Настройки детектора с фотодиодной матрицей: длина волны: 210-400 нм, разрешение: 1,2 нм, частота ввода проб: 1,0 точек/сек., характеристика фильтра: 1. Микроволновое нагревание осуществляют с помощью Biotage Initiator.
Список применяемых в экспериментальном разделе аббревиатур
Масс-направленная автоматизированная ВЭЖХ
[144] Где это применимо, очистка с помощью масс-направленной автоматизированной ВЭЖХ проводилась с использованием следующих аппаратов и условий:
Оборудование:
Waters 2525 Binary Gradient Module
Waters 515 Makeup Pump
Waters Pump Control Module
Waters 2767 Inject Collect
Waters Column Fluidics Manager
Waters 2996 Photodiode Array Detector
Waters ZQ Mass Spectrometer
Сборник фракций Gilson 202
Сборник сливов Gilson Aspec
Программное обеспечение: Waters MassLynx версии 4 SP2
Колонка: использовались колонки Waters Atlantis, размеры которых составляли 19 мм × 100 мм (малого размера) и 30 мм × 100 мм (большого размера). Размер частиц неподвижной фазы 5μм.
Способ на основе кислоты:
Растворители:
A: Водный растворитель=Вода+0,1% муравьиной кислоты
B: Органический растворитель=Ацетонитрил+0,1% муравьиной кислоты
Вспомогательный растворитель=Метанол : Вода 80:20
Растворитель для промывания иглы=Метанол
Способы
[145] Были использованы пять способов в зависимости от аналитического времени удержания представляющих интерес соединений. Каждый имел время выполнения 13,5 минут, что включает 10-минутный градиент, за которым следовали 3,5-минутная очистка колонки и этап повторного уравновешивания.
Большой/малый масштаб 1,0-1,5 (ВЭЖХ), 0,4-0,6 (СВЭЖХ) = 5-30% B
Большой/малый масштаб 1,5-2,2 (ВЭЖХ), 0,6-0,9 (СВЭЖХ) = 15-55% B
Большой/малый масштаб 2,2-2,9 (ВЭЖХ), 0,9-1,2 (СВЭЖХ) = 30-85% B
Большой/малый масштаб 2,9-3,6 (ВЭЖХ), 1,2-1,4 (СВЭЖХ) = 50-99% B
Большой/малый масштаб 3,6-5,0 (ВЭЖХ), 1,4-2,0 (СВЭЖХ) = 80-99% B (в течение 6 минут с последующим промыванием в течение 7,5 минут и повторным уравновешиванием)
Скорость потока: все вышеперечисленные способы имеют скорость потока либо 20 мл/мин (малый размер) или 40 мл/мин (большой размер).
Способы с высоким pH:
Колонка: анализ ВЭЖХ проводят на колонке XBridge C18 (100 нм × 19нм вн.д диаметр заполнения 5μм) при температуре окружающей среды
Растворители:
A: 10 мМ бикарбонат аммония в воде, доведенный до pH 10 с помощью раствора аммония.
B: Ацетонитрил.
Способы:
[146] Были использованы пять способов в зависимости от аналитического времени удержания представляющих интерес соединений. Они имеют время выполнения 15 минут, что включает 10-минутный градиент, за которым следовали 5-минутная очистка колонки и этап повторного уравновешивания.
Большой/малый масштаб 1,0-1,5 (ВЭЖХ), 0,4-0,6 (СВЭЖХ) = 1-30% B
Большой/малый масштаб 1,5-2,2 (ВЭЖХ), 0,6-0,9 (СВЭЖХ) = 15-55% B
Большой/малый масштаб 2,2-2,9 (ВЭЖХ), 0,9-1,2 (СВЭЖХ) = 30-85% B
Большой/малый масштаб 2,9-3,6 (ВЭЖХ), 1,2-1,4 (СВЭЖХ) = 50-99% B
Большой/малый масштаб 3,6-5,0 (ВЭЖХ), 1,4-2,0 (СВЭЖХ) = 80-99% B (в течение 6 минут с последующим промыванием в течение 7,5 минут и повторным уравновешиванием)
Скорость потока: все вышеперечисленные способы имеют скорость потока либо 20 мл/мин (малый размер) или 40 мл/мин (большой размер).
Жидкостная хроматография/Масс-спектрометрия
[147] Анализ вышеприведенных примеров с помощью жидкостной хроматографии/масс-спектрометрии (ЖХ/МС) проводили с использованием устройства и состояний, указанных в способах, показанных ниже.
Жидкостная хроматография:
Описание способа: Способ 2-минутной общей аналитической СВЭЖХ на основе муравьиной кислоты с ЖХ/МС с открытым доступом
Система для ЖХ/МС: Acquity UPLC в сочетании с масс-спектрометром SQD
Условия ЖХ
Колонка: C18 Acquity UPLC BEH (50 мм × 2,1 мм вн.д., диаметр заполнения 1,7 мкм
Температура колонки: 40°C
Растворители: A=0,1% об./об. раствор муравьиной кислоты в воде
B=0,1% об./об. раствор муравьиной кислоты в ацетонитриле
Объем инъекции: 2 мкл
Таблица градиентов:
Время остановки: 2 мин
Условия УФ
Диапазон фотодиодной матрицы: 210 нм-350 нм
[148] УФ-детектирование представляло собой суммарный сигнал от длины волны от 210 нм до 350 нм
Скорость сбора данных: 40 Гц
Условия МС
Режим ионизации: Альтернативный - сканирование на основе положительной и отрицательной ионизации электрораспылением (ES+/ES-)
Скорость сканирования: От 100 до 1000 АМЕ
Время сканирования: 0,15
Задержки между сканирования:
Между МС сканированиями: 0,02 секунды
Переключение полярности/режимов между сканированиями: 0,02 секунды
Описание способа: Способ 2 - минутной общей аналитической СВЭЖХ на основе бикарбоната аммония с ЖХ/МС с открытым доступом
Система для ЖХ/МС: Acquity UPLC в сочетании с масс-спектрометром SQD
Условия ЖХ
Колонка: C18 Acquity UPLC BEH (50 мм × 2,1 мм вн.д., диаметр заполнения 1,7 мкм
Температура колонки: 40°C
Растворители: A=10 мМ водный раствор NH4HCO3 (доведенный до pH 10 с помощью аммония)
B = Ацетонитрил
Объем инъекции: 1 мкл
Таблица градиентов:
Время остановки: 2 мин
Условия УФ
Диапазон фотодиодной матрицы: 210 нм - 350 нм
УФ-детектирование представляло собой суммарный сигнал от длины волны от 210 нм до 350 нм
Скорость сбора данных: 40 Гц
Условия МС
Режим ионизации: Альтернативный - сканирование на основе положительной и отрицательной ионизации электрораспылением (ES+/ES-)
Скорость сканирования: От 100 до 1000 АМЕ
Время сканирования: 0,15
Задержки между сканирования:
Между МС сканированиями: 0,02 секунды
Переключение полярности/режимов между сканированиями: 0,02 секунды
Получение соединений по изобретению с помощью синтезирования
Схема 1A Синтез промежуточного соединения A
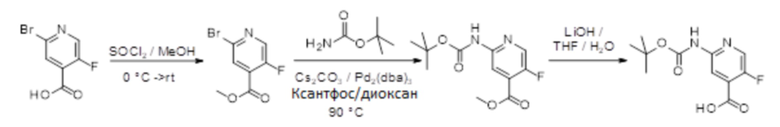 Схема 1B Синтез промежуточного соединения B
Схема 1B Синтез промежуточного соединения B
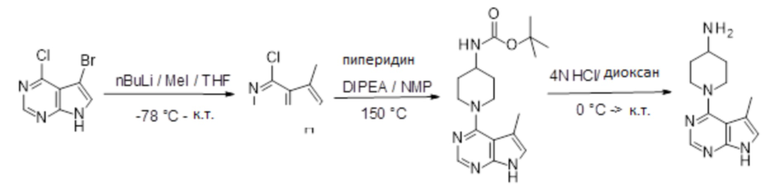
Схема 1C Синтез соединения 1
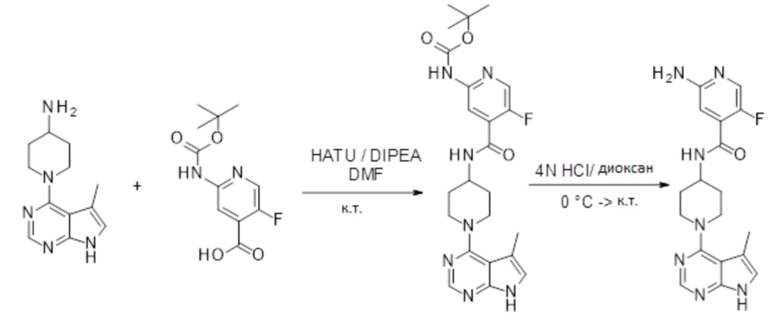
1.1 Соединение 1: 2-амино-5-фтор-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]пиридин-4-карбоксамид
1.1.1 Этап 1: Синтез метил-2-бром-5-фтор-пиридин-4-карбоксилата

[149] К раствору 2-бром-5-фтор-пиридин-4-карбоновой кислоты (10,0 г, 45,5 ммоль) в метаноле (300 мл), охлажденном до температуры 0°C, добавляли тионилхлорид (16,5 мл, 227,3 ммоль) по каплям в течение 30 минут. Реакционную смесь перемешивали при температуре окружающей среды в течение 24 часов. К реакционной смеси добавляли толуол (40 мл). После испарения метанола, отгоняли тионилхлорид. Оставшийся толуол упаривали на роторном испарителе с получением неочищенного продукта, который растворяли в дихлорметане (30 мл), выпаривали при пониженном давлении с получением метил-2-бром-5-фтор-пиридин-4-карбоксилата (10,3 г). ЖХМС: Мол. масса (рассч.): 232,9; МС (ES+, м/з): 234, 236 (M+H)+.
1.1.2 Альтернативный метод синтеза:
[150] К раствору 2-бром-5-фтор-пиридин-4-карбоновой кислоты (10,0 г, 45,5 ммоль) в метаноле (35 мл) и толуоле (65 мл), охлажденном до температуры 0°C, добавляли (триметилсилил)диазометан (2,0 M раствор в диэтиловом эфире; 45,5 мл, 90,9 ммоль) по каплям в течение 30 минут. Реакционную смесь перемешивали при температуре окружающей среды. Спустя 2 ч, реакционную смесь упаривали при пониженном давлении с получением неочищенного продукта, который растворяли в этилацетате (50 мл), промывали водой (100 мл) и насыщенным раствором соли (50 мл), соответственно, отфильтровывали через фильтр для фазового разделителя и выпаривали при пониженном давлении с получением метил-2-бром-5-фтор-пиридин-4-карбоксилата (10,46 г). ЖХМС: Мол. масса (рассч.): 232,9; МС (ES+, м/з): 234, 236 (M+H)+.
1.1.3 Этап 2: Синтез метил-2-(трет-бутоксикарбониламино)-5-фтор-пиридин-4-карбоксилата
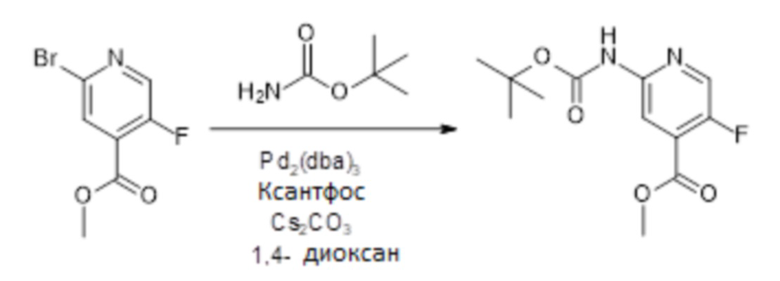
[151] К раствору метил-2-бром-5-фтор-пиридин-4-карбоксилата (10,3 г, 44,0 ммоль) в 1,4-диоксане (150 мл) добавляли трет-бутилкарбамат (6,18 г, 52,8 ммоль), трис(дибензилиденацетон)дипалладий(0) (0,86 г, 0,88 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (1,02 г, 1,76 ммоль) и карбонат цезия (20,08 г, 61,6 ммоль). Реакционную смесь продували аргоном, обрабатывали ультразвуком, закрывали крышкой и оставляли перемешиваться при температуре 90°C в течение 24 ч. Реакционную смесь охлаждали, отфильтровывали через слой целита и промывали этилацетатом. Маточный раствор промывали водой (2×100 мл) и насыщенным раствором соли (100 мл) и выпаривали при пониженном давлении с получением неочищенного продукта, который растирали с этилацетатом с получением метил-2-(трет-бутоксикарбониламино)-5-фтор-пиридин-4-карбоксилата (8,43 г). ЖХМС: Мол. масса (рассч.): 270,1; МС (ES+, м/з): 215,41 (M+H-56)+.
1.1.4 Альтернативный метод синтеза (промежуточное соединение метил-2-((дифенилметилен)амино)-5-фторизоникотинат):

[152] К дегазированной и очищенной аргоном суспензии метил-2-бром-5-фтор-пиридин-4-карбоксилата (308 мг, 1,32 ммоль) в 1,4-диоксане (6 мл) добавляли бензофенонимин (0,266 мл, 1,58 ммоль), трис(дибензилиденацетон)дипалладий(0) (24,1 мг, 0,026 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (30,5 мг, 0,053 ммоль) и карбонат цезия (602,0 мг, 0,053 ммоль). Реакционную смесь промывали аргоном, обрабатывали ультразвуком, закрывали крышкой и оставляли перемешиваться при температуре 100°C в течение 16 ч. Реакционную смесь охлаждали, разбавляли этилацетатом (15 мл), промывали водой (15 мл), насыщенным раствором соли (15 мл) и выпаривали при пониженном давлении с получением метил-2-((дифенилметилен)амино)-5-фторизоникотината (230 мг). ЖХМС: Мол. масса (рассч.): 334,1; МС (ES+, м/з): 335,34 (M+H)+.
1.1.5 Этап 3: Синтез 2-(трет-бутоксикарбониламино)-5-фтор-пиридин-4-карбоновой кислоты
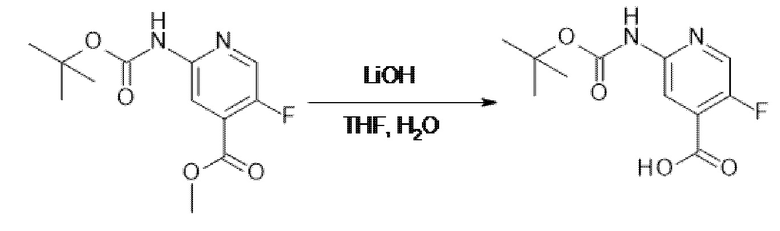
[153] К суспензии метил-2-(трет-бутоксикарбониламино)-5-фтор-пиридин-4-карбоксилата (8,43 г, 31,19 ммоль) в тетрагидрофуране (100 мл) добавляли гидроксид лития (2,98 г, 124,76 ммоль) и воду (50 мл). Реакционную смесь оставляли перемешиваться в течение ночи при температуре окружающей среды. На следующий день тетрагидрофуран упаривали при пониженном давлении, pH водного слоя доводили до 4. Образующийся осадок отфильтровывали и выпаривали вместе с толуолом (4×20 мл) и высушивали в вакуумной печи при температуре 40°C в течение 5 ч с получением 2-(трет-бутоксикарбониламино)-5-фтор-пиридин-4-карбоновой кислоты (7,79 г). ЖХМС: Мол. масса (рассч.): 256,08; МС (ES+, м/з): 201,4 (M+H-56)+.
1.1.6 Этап 4: Синтез 4-хлор-5-метил-7H-пирроло[2,3-d]пиримидина

[154] 5-Бром-4-хлор-7H-пирроло[2,3-d]пиримидин (10,0 г, 43,0 ммоль) растворяли в сухом ТГФ (350 мл) и охлажденном до температуры -78°C под атмосферой аргона. н-BuLi (2,5 M в гексане, 38 мл, 94,6 ммоль) добавляли по каплям за один час. После завершения добавления, раствор перемешивали в течение 40 мин и добавляли йодметан (4,3 мл, 68,8 ммоль). Раствору позволяли медленно нагреваться до комнатной температуры. Добавляли воду (20 мл) и удаляли растворитель под вакуумом с получением коричневой суспензии, которую растворяли в воде (200 мл) и экстрагировали этилацетатом (3×100 мл). Объединенные органические фазы промывали насыщенным раствором соли (150 мл), высушивали над безводным Na2SO4, отфильтровывали и концентрировали для получения неочищенного соединения, которое растирали с этилацетатом с получением 4-хлор-5-метил-7H-пирроло[2,3-d] (5,32 г). ЖХМС: Мол. масса (рассч.): 167,03; МС (ES+, м/з): 168,37 (M+H)+.
1.1.7 Этап 5: Синтез трет-бутил-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]-карбамата
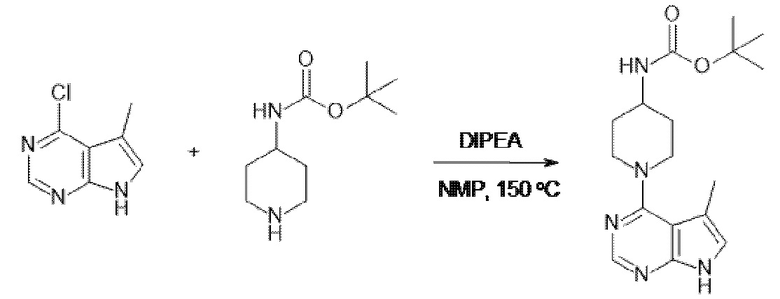
[155] К раствору 4-хлор-5-метил-7H-пирроло[2,3-d]пиримидина (10,0 г, 59,7 ммоль) в 1-метил-2-пирролидинон (40 мл) добавляли трет-бутил-N-(4-пиперидил)карбамат (17,95 г, 89,6 ммоль) и N,N-диизопропилэтиламин (25,2 мл, 149,3 ммоль). Реакционную смесь оставляли перемешиваться при температуре 150°C в течение 3 ч. Реакционную смесь охлаждали и затем выливали в холодную воду (300 мл). К смеси добавляли этилацетат (40 мл) и оставляли перемешиваться в течение 30 мин при температуре окружающей среды. Образующийся осадок отфильтровывали, промывали водой и диэтиловым эфиром и оставляли сохнуть в вакуумной печи при температуре 40°C в течение ночи. Высушивание дает трет-бутил-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]-карбамат (19,91 г). ЖХМС: Мол. масса (рассч.): 331,2; МС (ES+, м/з): 332,7 (M+H)+.
1.1.8 Этап 6: Синтез 1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-амин
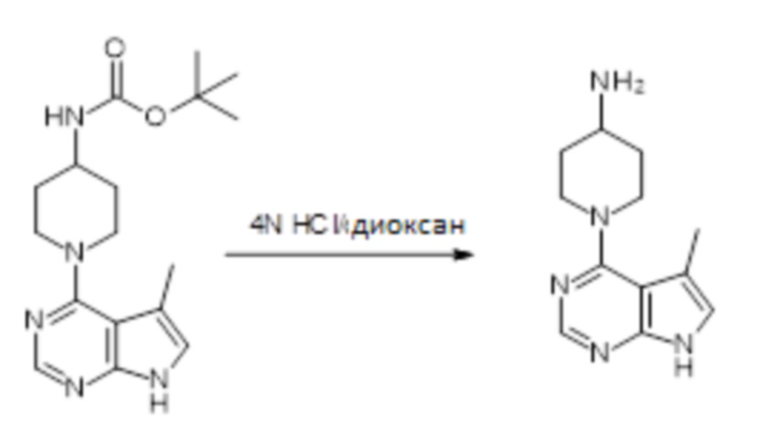
[156] К суспензии трет-бутил-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]карбамата (38,9 г, 117,3 ммоль) в 1,4-диоксане (200 мл), охлажденном до температуры 0°C, добавляли HCl (4M раствор в диоксане) (290 мл). Реакционную смесь перемешивали при температуре окружающей среды. Спустя 23 ч реакционную смесь упаривали при пониженном давлении, выпаривали совместно с толуолом (200 мл) и высушивали в вакуумной печи при температуре 40°C в течение ночи. Высушивание дает 1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-амин (47,68 г) в виде соли HCl. ЖХМС: Мол. масса (рассч.): 231,15; МС (ES+, м/з): 232,6 (M+H)+.
1.1.9 Этап 7: Синтез трет-бутил-N-[5-фтор-4-[[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]карбамоил]-2-пиридил]карбамата
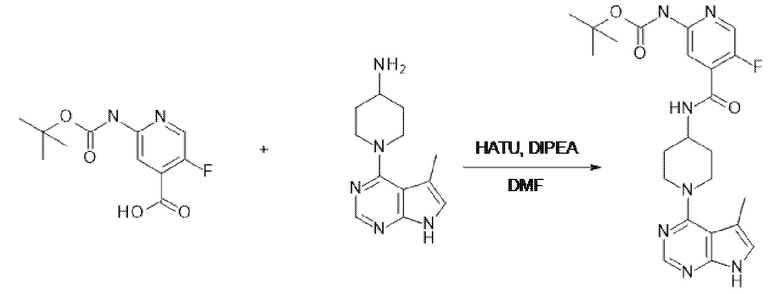
[157] К суспензии 2-(трет-бутоксикарбониламино)-5-фтор-пиридин-4-карбоновой кислоты (14,25 г, 55,6 ммоль) в N, N-диметилформамиде (130 мл) добавляли HATU (19,03 г, 50,1 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 20 мин, после чего добавляли 1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-амин×2HCl (16,92 г, 55,6 ммоль) и N, N-диизопропилэтиламин (47,56 мл, 278,1 ммоль). Реакционную смесь перемешивали при температуре окружающей среды. Через 3 часа реакция завершалась. Реакционную смесь выливали в ледяную воду (1,2 л). Образующийся осадок отфильтровывали, после чего промывали ацетонитрилом и высушивали в вакуумной печи при температуре 40°C в течение 4 ч с получением трет-бутил-N-[5-фтор-4-[[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]карбамоил]-2-пиридил]карбамата (19,26 г). ЖХМС: Мол. масса (рассч.): 469,22; МС (ES+, м/з): 470,7 (M+H)+.
1.1.10 Этап 8: Синтез 2-амино-5-фтор-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил] пиридин-4-карбоксамида
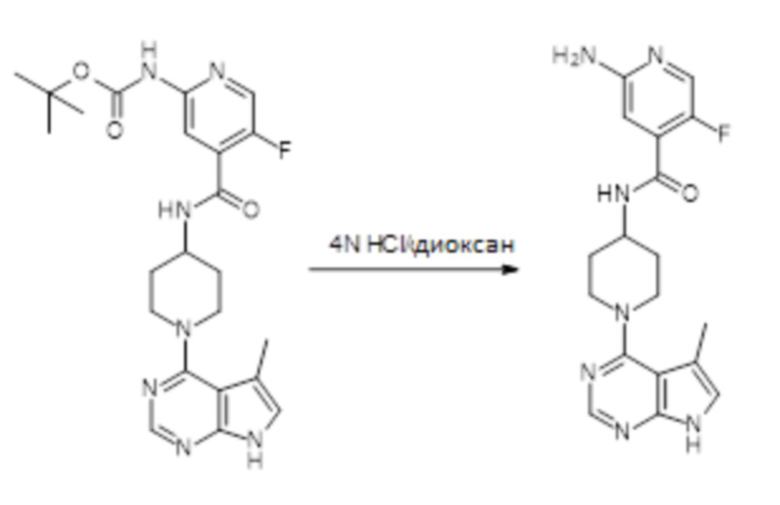
[158] К суспензии трет-бутил-N-[5-фтор-4-[[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]карбамоил]-2-пиридил]карбамата (25,76 г, 54,9 ммоль) в дихлорметане (300 мл), охлажденном до температуры 0°C, добавляли HCl (4M раствор в диоксане) (130 мл) по каплям. Через несколько минут образовывался липкий остаток. К реакционной смеси добавляли дополнительное количество дихлорметана (200 мл). Смолистый остаток измельчали с помощью обработки ультразвуком (спустя 45 мин). Реакционную смесь перемешивали в течение ночи при температуре окружающей среды. На следующий день осадок отфильтровывали и промывали водой, ацетонитрилом и метанолом и высушивали в вакуумной печи при температуре 40°C в течение 5 ч и затем в течение ночи при температуре окружающей среды. Высушивание дает 2-амино-5-фтор-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]пиридин-4-карбоксамид (13,65 г). ЖХМС: Мол. масса (рассч.): 369,17; МС (ES+, м/з): 370,77 (M+H)+.
1H ЯМР (600 МГц, ДМСО-d6): δ=1,59-1,70 (м, J=12,3, 3,7 Гц, 2 H), 1,93 (дд, J=12,6, 2,7 Гц, 2 H), 2,34 (с, 3H), 3,06 (т, J=11,4 Гц, 2 H), 3,94 (д, J=13,2 Гц, 2 H), 3,95-4,03 (м, J=11,2, 11,2, 7,5, 4,2, 4,2 Гц, 1 H), 6,02 (с, 2 H), 6,51 (д, J=4,8 Гц, 1 H), 7,05 (с, 1 H), 7,91 (д, J=1,5 Гц, 1 H), 8,19 (с, 1 H), 8,46 (д, J=7,7 Гц, 1 H), 11,51 (уш. с., 1 H) м.д.
1.2 Соединение 2: (2-амино-5-метил-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]пиридин-4-карбоксамид)
1.2.1 Этап 1: Синтез метил-2-амино-5-метил-пиридин-4-карбоксилата

[159] Метил-2-амино-5-бром-пиридин-4-карбоксилат (200 мг, 0,87 ммоль), S-Phos (4,6 мг, 3,2 ммоль), трикалийфосфат (369,3 мг, 1,74 ммоль) и диацетоксипалладий (19,5 г, 0,011 ммоль) объединяли, дегазировали и заново заполняли N2 и после этого растворяли в ДМСО (4 мл) и триметилбороксине (467,5 мкл, 3,2 ммоль) при комнатной температуре. Смесь после этого нагревали до температуры 80°C и перемешивали в течение ночи. Спустя 16 часов смесь разбавляли с помощью EtOAc и промывали с помощью H2O. Органическую фазу высушивали над Na2SO4, отфильтровывали, абсорбировали на целите и концентрировали in vacuo для получения неочищенного продукта, который очищали посредством очистного устройства Biotage на 4 г KP-Sil колонке Interchim со скоростью потока 9 мл/мин., ДХМ в качестве растворителя A и ДХМ:MeOH=20:1 в качестве растворителя B. Чтобы получить метил-2-амино-5-метил-пиридин-4-карбоксилат (167,03 мг) собирали соответствующие фракции. ЖХМС: Мол. масса (рассч.): 166,07; МС (ES+, м/з): 167,03 (M+H)+.
1.2.2 Этап 2: Синтез 2-амино-5-метил-пиридин-4-карбоновой кислоты
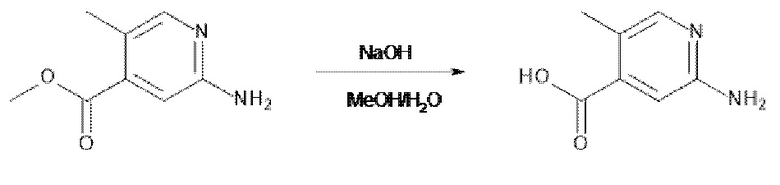
[160] Метил-2-амино-5-метил-пиридин-4-карбоксилат (125 мг, 0,75 ммоль) растворяли в MeOH/H2O (2/2) и добавляли NaOH (1M раствор, 0,75 мкл). Смесь после этого нагревали до температуры 60°C и оставляли перемешиваться в течение 1 ч. Спустя 1 ч MeOH упаривали и экстрагировали разжиженный остаток с помощью EtOAc. Желаемый продукт оставался в водном слое, который лиофилизировали в течение ночи.
После лиофилизации, смесь растворяли в ацетоне, отфильтровывали и упаривали маточный раствор для получения 2-амино-5-метил-пиридин-4-карбоновой кислоты (55 мг). ЖХМС: Мол. масса (рассч.): 152,06; МС (ES+, м/з): 153,02 (M+H)+.
1.2.3 Этап 3: Синтез 2-амино-5-метил-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]пиридин-4-карбоксамида
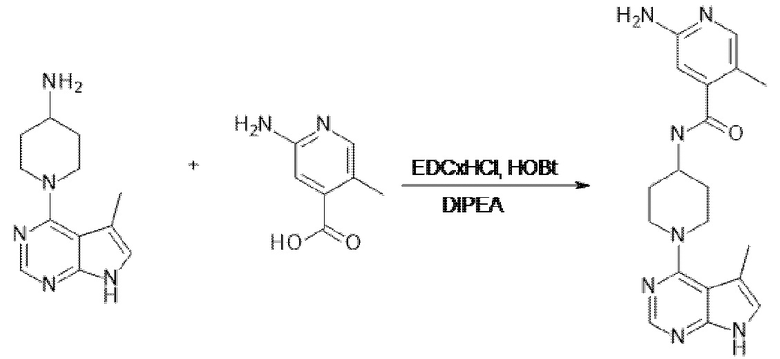
[161] К раствору 2-амино-5-метил-пиридин-4-карбоновой кислоты (33 мг, 0,22 ммоль) в ДМФА (1 мл) при температуре 0°C добавляли EDC×HCl (54,8 мг, 0,29 ммоль) и ДИПЭА (111,1 мкл, 0,64 ммоль) и оставляли перемешиваться в течение 30 минут. Затем добавляли HOBtxH2O (35,6 мг, 0,26 ммоль) и 1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-амин (50,2 мг, 0,22 ммоль). Реакционную смесь оставляли перемешивали в течение ночи при комнатной температуре. На следующий день реакционную смесь разбавляли водой (5 мл) и экстрагировали с помощью EtOAc (3×5 мл). Объединенные органические слои промывали насыщенным раствором соли (10 мл), высушивали над Na2SO4, отфильтровывали и концентрировали in vacuo для получения неочищенного продукта, который очищали посредством очистного устройства Biotage на 4 г колонке KP-Sil Interchim со скоростью 9 мл/мин, ДХМ в качестве слабого растворителя и ДХМ:MeOH:NH4OH=90:1,5:0,15 в качестве сильного растворителя. Чтобы получить 2-амино-5-метил-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]пиридин-4-карбоксамид (8 мг), собирали соответствующие фракции. ЖХМС: Мол. масса (рассч.): 365,20; МС (ES+, м/з): 366,23 (M+H)+. 1H ЯМР (300 МГц, ДМСО-d6) δ 11,51 (уш. с., 1H), 8,35 (д, J=8,01 Гц, 1H), 8,17 (с, 1H), 7,75 (с, 1H), 7,05 (с, 1H), 6,35 (с, 1H), 5,81 (с, 2H), 3,95 (м, 3H), 3,05 (т, J=11,41 Гц, 2H), 2,34 (с, 3H), 2,06 (с, 3H), 1,92 (д, J=9,58 Гц, 2H), 1,56-1,70 (м, 2H) ч./млн.
1.3: Соединение 3: 2-амино-5-хлор-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]-пиридин-4-карбоксамид
1.3.1 Этап 1: Синтез 3-хлор-1-оксо-пиридин-4-карбоновой кислоты
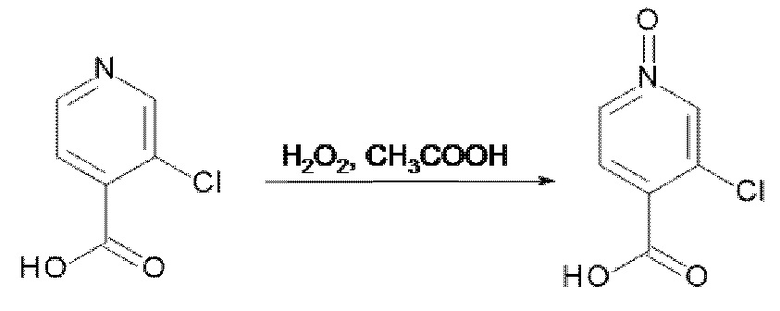
[162] 3-Хлорпиридин-4-карбоновую кислоту (620 мг, 3,94 ммоль) растворяли в уксусной кислоте (2 мл) и добавляли 30% водн. H2O2 (6 мл). Реакционную смесь нагревали в течение 38 ч при температуре 80°C. После завершения ее концентрировали до половины ее объема. Образовавшиеся кристаллы отфильтровывали и высушивали в вакуумной сушилке для получения 3-хлор-1-оксо-пиридин-4-карбоновой кислоты (420 мг). ЖХМС: Мол. масса (рассч.): 172,99; МС (ES+, м/з): 174,33 (M+H)+.
1.3.2 Этап 2: Синтез 3-хлор-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]-1-оксо-пиридин-4-карбоксамида

[163] К раствору 3-хлор-1-оксо-пиридин-4-карбоновой кислоты (52 мг, 0,30 ммоль) в ДМФА (1 мл) при температуре 0°C добавляли EDC×HCl (74,8 мг, 0,39 ммоль) и ДИПЭА (161 мкл, 0,87 ммоль) и оставляли перемешиваться в течение 30 минут. После этого добавляли HOBt×H2O (55,1 мг, 0,36 ммоль) и 1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-амин (69,4 мг, 0,30 ммоль). Реакционную смесь оставляли перемешивали в течение ночи при комнатной температуре. На следующий день реакционную смесь упаривали досуха. Маслянистый остаток очищали с помощью колоночной хроматографии на силикагеле (слабый элюент: ДХМ, сильный элюент: ДХМ:MeOH:NH4OH=90:5:0,1) для получения 3-хлор-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]-1-оксо-пиридин-4-карбоксамида (87 мг). ЖХМС: Мол. масса (рассч.): 386,13; МС (ES+, м/з): 387,49 (M+H)+.
1.3.3 Этап 3: Синтез 2-амино-5-хлор-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]пиридин-4-карбоксамида
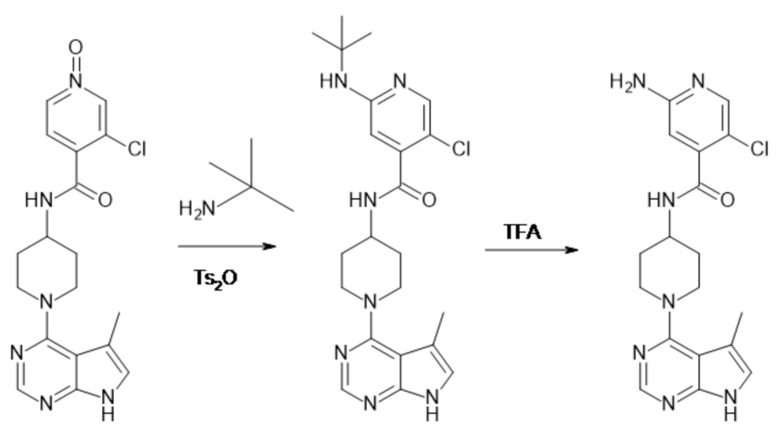
[164] К раствору 3-хлор-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]-1-оксо-пиридин-4-карбоксамида (87 мг, 0,23 ммоль) и трет-бутиламина (0,160 мл, 1,53 ммоль) в смеси хлороформа (10 мл) и бензотрифторид (1 мл) при температуре 0°C добавляли п-толуолсульфоновый ангидрид (260 мг, 0,57 ммоль) по частям, поддерживая температуру на уровне 5°C. Реакция завершалась спустя 10 минут. Раствор трифторуксусной кислоты (5 мл) и реакционную смесь перемешивали в течение 3 ч при температуре 80°C. Растворители восстанавливали в вакууме и разбавляли остаток дихлорметаном и гасили с помощью 40% NaOH до pH 9-10. Водный слой экстрагировали с помощью дихлорметана (4×15 мл). Объединенные органические фазы высушивали над Na2SO4, концентрировали и очищали с помощью колоночной хроматографии на силикагеле (слабый элюент: ДХМ, сильный элюент: ДХМ:MeOH:NH4OH=90:9:0,5), чтобы получить 2-амино-5-хлор-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]пиридин-4-карбоксамид (9,05 мг). ЖХМС: Мол. масса (рассч.): 385,14; МС (ES+, м/з): 386,54 (M+H)+. 1H ЯМР (500 МГц, ДМСО-d6) δ 11,52 (уш. с., 1H), 8,52 (д, J=7,63 Гц, 1H), 8,20 (с, 1H), 7,91 (д, J=4,88 Гц, 1H), 7,06 (с, 1H), 6,52 (д, J=4,88 Гц, 1H), 6,42 (с, 2H), 3,94 (м, 3H), 3,08 (т, J=11,44 Гц, 2H), 2,34 (с, 3H), 1,95 (д, J=9,77 Гц, 2H), 1,57-1,71 (м, 2H) м.д.
1.4: Соединение 4: 2-амино-N-[1-(5-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]пиридин-4-карбоксамид
1.4.1 Этап 1: Синтез 4,5-дихлор-7H-пирроло[2,3-d]пиримидина
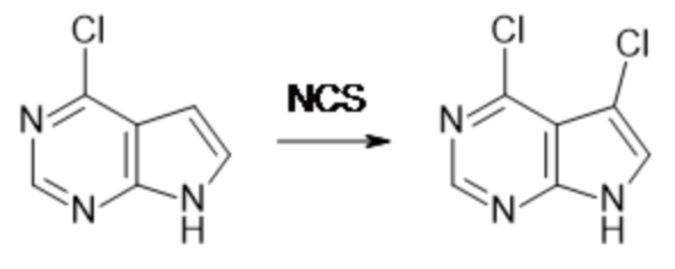
[165] К раствору 4-хлор-7H-пирроло[2,3-d]пиримидина (2,0 г, 13,04 ммоль) в ДХМ (80 мл) добавляли N-хлорсукцинимид (1,7 г, 13,04 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 3 дней. Реакционную смесь растворяли в воде и экстрагировали с помощью EtOAc (3×50 мл). Объединенные органические слои высушивали над MgSO4, отфильтровывали и упаривали для получения 4,5-дихлор-7H-пирроло[2,3-d]пиримидина (1,08 г). ЖХМС: Мол. масса (рассч.): 186,97; МС (ES+, м/з): 187,98 (M+H)+.
1.4.2 Этап 2: Синтез трет-бутил-N-(5-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)карбамата
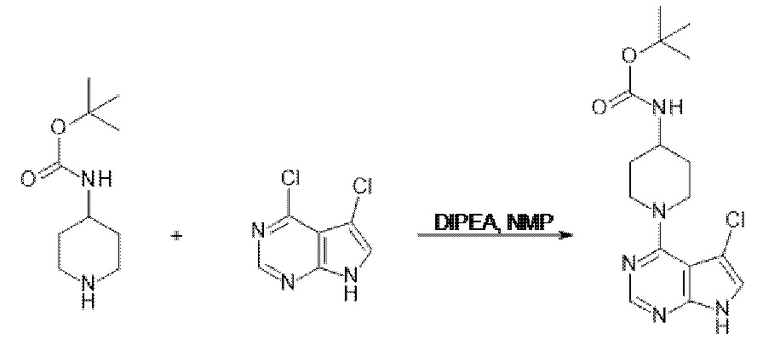
[166] трет-Бутил-N-(4-пиперидил)карбамат (895,3 мг, 4,47 ммоль) и 4,5-дихлор-7H-пирроло[2,3-d]пиримидин (1080 мг, 5,36 ммоль) растворяли в NMP (8 мл) и добавляли DIPEA (2,33 мл, 13,4 ммоль) по каплям. Реакционную смесь перемешивали при комнатной температуре в течение 3 дней. Смесь растворяли в воде и экстрагировали с помощью EtOAc (3×15 мл). Объединенные органические слои высушивали и концентрировали для получения неочищенного продукта, который перекристаллизовывали с помощью ацетонитрила для получения трет-бутил-N-(5-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)карбамата
(1,42 г). ЖХМС: Мол. масса (рассч.): 351,15; МС (ES+, м/з): 352,22 (M+H)+.
1.4.3 Этап 3. Синтез 1-(5-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-амина
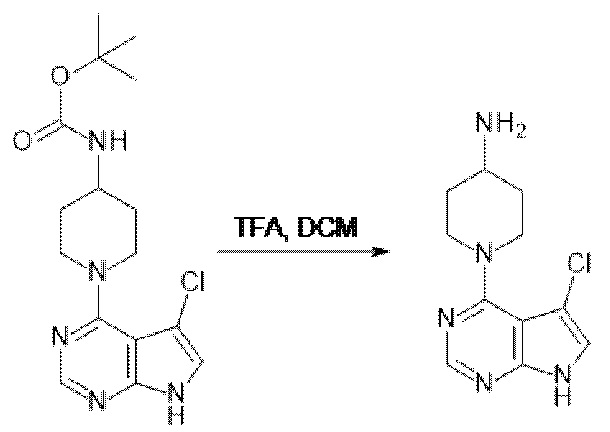
[167] К раствору трет-бутил-N-[1-(5-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]карбамата (2,0 г, 5,69 ммоль) в ДХМ (10 мл) добавляли трифторуксусную кислоту (3,3 мл) и перемешивали получаемый раствор при комнатной температуре в течение 2 ч. По завершении растворитель выпаривали и помещали неочищенный продукт в предварительно кондиционированную (40 мл MeOH) колонку SCX (20 г). Колонку промывали с помощью MeOH (2×40 мл), а затем 7 N NH3/MeOH (100 мл). Растворитель упаривали для получения 1-(5-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-амина (1,3 г). ЖХМС: Мол. масса (рассч.): 251,09; МС (ES+, м/з): 252,10 (M+H)+.
1.4.4 Этап 4. Синтез 2-амино-N-[1-(5-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]-пиридин-4-карбоксамида
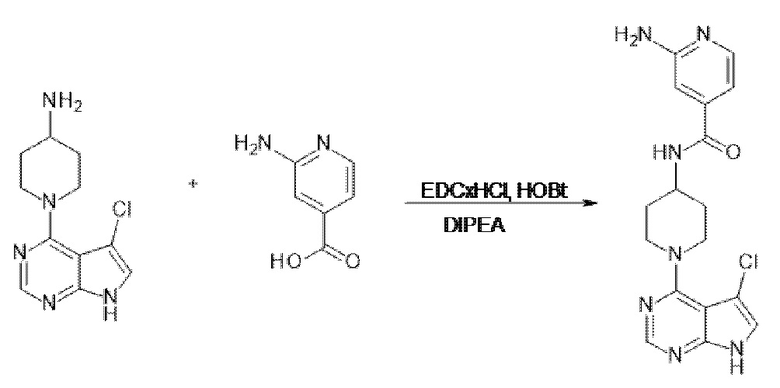
[168] К раствору 2-аминопиридин-4-карбоновой кислоты (200 мг, 1,45 ммоль) в ДМФА (4 мл) при температуре 0°C добавляли EDC×HCl (362,3 мг, 1,89 ммоль) и ДИПЭА (732 мкл, 4,21 ммоль) и оставляли перемешиваться в течение 30 минут. После этого добавляли HOBt×H2O (266,4 мг, 1,74 ммоль) и 1-(5-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-амин (546,23 мг, 2,17 ммоль). Реакционную смесь оставляли перемешиваться в течение ночи при комнатной температуре, разбавляли водой (10 мл) и экстрагировали с помощью EtOAc (3×10 мл). Объединенные органические слои промывали насыщенным раствором соли (20 мл), высушивали над Na2SO4, отфильтровывали и концентрировали in vacuo. Неочищенный продукт очищали посредством очистного устройства Biotage на 12 г колонке KP-Sil Interchim: ДХМ в качестве слабого растворителя и ДХМ:MeOH:NH4OH=90:1,5:0,15 в качестве сильного растворителя. Чтобы получить продукт, который растирали с ацетонитрилом для получения 2-амино-N-[1-(5-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]-пиридин-4-карбоксамида (162,1 мг), собирали соответствующие фракции. ЖХМС: Мол. масса (рассч.): 371,13; МС (ES+, м/з): 372,18 (M+H)+. 1H ЯМР (500 МГц, ДМСО-d6) δ 12,15 (уш. с., 1H), 8,39 (д, J=7,32 Гц, 1H), 8,27 (с, 1H), 7,97 (д, J=4,88 Гц, 1H), 7,49 (с, 1H), 6,77-6,87 (м, 2H), 6,09 (уш. с., 2H), 4,21 (д, J=12,21 Гц, 2H), 4,05 (д, J=7,32 Гц, 1H), 3,10 (т, J=12,36 Гц, 2H), 1,91 (д, J=10,68 Гц, 2H), 1,74 (м, 2H) м.д.
1.5 Соединение 5: Синтез 2-амино-N-[1-(5-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]-5-фтор-пиридин-4-карбоксамида
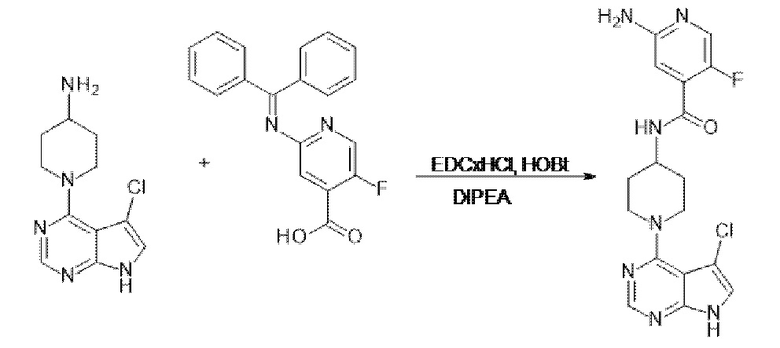
[169] К раствору 2-(бензгидрилиденамино)-5-фтор-пиридин-4-карбоновой кислоты (43,0 мг, 0,13 ммоль) в ДМФА (5 мл) при температуре 0°C добавляли EDCxHCl (32,6 мг, 0,17 ммоль) и ДИПЭА (66,1 мкл, 0,38 ммоль) и оставляли перемешиваться в течение 30 минут. После этого добавляли HOBt×H2O (24,5 мг, 0,16 ммоль) и 1-(5-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)пиперидин-4-амин (50,3 мг, 0,20 ммоль). Реакционную смесь оставляли, перемешивали в течение ночи при комнатной температуре. Растворитель упаривали досуха. Неочищенный продукт очищали посредством препаративной ЖХ-МС. Соответствующие фракции собирали и лиофилизировали в течение ночи для получения 2-амино-N-[1-(5-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]-5-фтор-пиридин-4-карбоксамида (17 мг). ЖХМС: Мол. масса (рассч.): 389,12; МС (ES+, м/з): 390,39 (M+H)+. 1H ЯМР (600 МГц, ДМСО-d6) δ 12,15 (уш. с., 1H), 8,47 (д, J=7,70 Гц, 1H), 8,25 (с, 1H), 7,91 (с, 1H), 7,47 (с, 1H), 6,51 (д, J=4,40 Гц, 1H), 6,02 (с, 2H), 4,14 (д, J=12,65 Гц, 2H), 4,02 (м, 1H), 3,13 (т, J=11,83 Гц, 2H), 1,93 (д, J=10,82 Гц, 2H), 1,67 (м, 2H) м.д.
1.6 Соединение 6: Синтез 2-амино-N-[1-(5-циано-3-метил-1H-пирроло[2,3-b]пиридин-4-ил)-4-пиперидил]-5-фтор-пиридин-4-карбоксамида
1.6.1. Синтез 3-бром-4-хлор-1H-пирроло[2,3-b]пиридин-5-карбонитрила
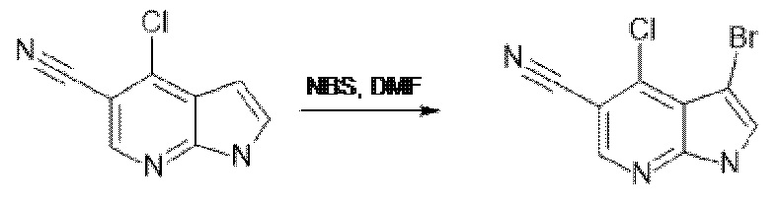
[170] К перемешиваемому раствору 4-хлор-1H-пирроло(3,2-b)пиридин-5-карбонитрила (3 г, 16,89 ммоль) в ДМФА (20 мл) добавляли N-бромсукцинимид (3,3 г, 18,582 ммоль). Получаемый раствор перемешивали при комнатной температуре в течение 20 мин. Реакционную смесь разбавляли водой (50 мл) и экстрагировали этилацетатом (2×25 мл). Объединенные органические слои промывали насыщенным раствором соли, высушивали над сульфатом магния и концентрировали in vacuo. Получаемый порошок растирали с EtOAc и высушивали для получения 3-бром-4-хлор-1H-пирроло[2,3-b]пиридин-5-карбонитрила (1,5 г). ЖХМС: Мол. масса (рассч.): 256,49; МС (ES+, м/з): 257,93 (M+H)+.
1.6.2. Синтез 4-хлор-3-метил-1H-пирроло[2,3-b]пиридин-5-карбонитрила

[171] К раствору 3-бром-4-хлор-1H-пирроло[2,3-b]пиридин-5-карбонитрила (1,5 г, 5,85 ммоль) в ТГФ (48 мл) при температуре -78°C под аргоном добавляли раствор бутиллития (5,2 мл, 12,87 ммоль) и перемешивали реакционную смесь в течение 20 мин. Затем по каплям добавляли йодметан (590 мкл, 9,36 ммоль) и давали реакционной смеси нагреваться до комнатной температуры в холодной бане. Реакционную смесь гасили водой (30 мл) и доводили pH до 7. ТГФ упаривали и добавляли воду. Полученное твердое вещество отфильтровывали, промывали водой и растирали с EtOAc для получения 4-хлор-3-метил-1H-пирроло[2,3-b]пиридин-5-карбонитрила (813 мг). ЖХМС: Мол. масса (рассч.): 191,6; МС (ES+, м/з): 192,05 (M+H)+.
1.6.3. Синтез трет-бутил-N-[1-(5-циано-3-метил-1H-пирроло[2,3-b]пиридин-4-ил)-4-пиперидил]карбамата
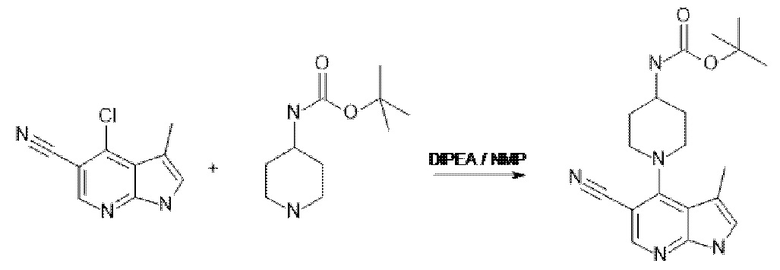
[172] Смесь 4-хлор-3-метил-1H-пирроло[2,3-b]пиридин-5-карбонитрила (813 мг, 4,24 ммоль), 4-boc-аминопиперидина (1,27 г, 6,36 ммоль) и ДИПЭА (1,85 мл, 10,61 ммоль) в NMP (5 мл) перемешивали при температуре 150°C в течение 3 ч и продолжали перемешивать при комнатной температуре в течение выходных дней. Реакционную смесь разбавляли водой (110 мл) и диэтиловым эфиром. Полученное твердое вещество отфильтровывали, промывали водой и диэтиловым эфиром и высушивали для получения трет-бутил-N-[1-(5-циано-3-метил-1H-пирроло[2,3-b]пиридин-4-ил)-4-пиперидил]карбамата (1,28 г). ЖХМС: Мол. масса (рассч.): 355,43; МС (ES+, м/з): 356,30 (M+H)+.
1.6.4. Синтез 4-(4-амино-1-пиперидил)-3-метил-1H-пирроло[2,3-b]пиридин-5-карбонитрила
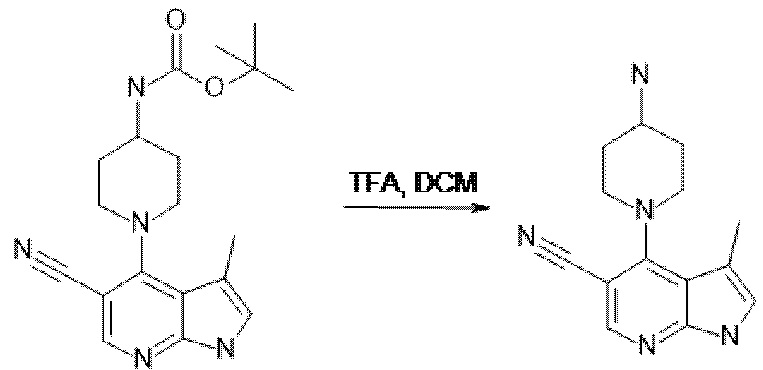
[173] К раствору трет-бутил-N-[1-(5-циано-3-метил-1H-пирроло[2,3-b]пиридин-4-ил)-4-пиперидил]карбамата (1,28 г, 3,6 ммоль) в ДХМ (40 мл) добавляли трифторуксусную кислоту (5,5 мл, 72,03 ммоль). Получаемый раствор перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь загружали на SCX колонку (20 г, предварительно кондиционированную с помощью 100 мл MeOH). MeOH (200 мл) пропускали сквозь колонку и элюировали соединение с помощью 7N NH3 в MeOH:MeOH=1:4 (300 мл). Фильтрат концентрировали in vacuo для получения 4-(4-амино-1-пиперидил)-3-метил-1H-пирроло[2,3-b]пиридин-5-карбонитрила (1,06 г). ЖХМС: Мол. масса (рассч.): 255,32; МС (ES+, м/з): 256,21 (M+H)+.
1.6.5. Синтез 2-амино-N-[1-(5-циано-3-метил-1H-пирроло[2,3-b]пиридин-4-ил)-4-пиперидил]-5-фтор-пиридин-4-карбоксамида

[174] К раствору 2-амино-5-фтор-пиридин-4-карбоновой кислоты (66,0 мг, 0,30 ммоль) в ДМФА (1 мл) при температуре 0°C добавляли EDC×HCl (50,0 мг, 0,26 ммоль) и ДИПЭА (101 мкл, 0,58 ммоль) и оставляли перемешиваться в течение 30 минут. После этого добавляли HOBt×H2O (37,0 мг, 0,24 ммоль) и 4-(4-амино-1-пиперидил)-3-метил-1H-пирроло[2,3-b]пиридин-5-карбонитрил (108,0 мг, 0,30 ммоль). Реакционную смесь оставляли перемешивали в течение ночи при комнатной температуре. Растворитель упаривали досуха. Неочищенный продукт очищали посредством очистного устройства Biotage на 4 г колонке KP-Sil Interchim: ДХМ в качестве слабого растворителя и ДХМ:MeOH=10:1 в качестве сильного растворителя. Чтобы получить 2-амино-N-[1-(5-циано-3-метил-1H-пирроло[2,3-b]пиридин-4-ил)-4-пиперидил]-5-фтор-пиридин-4-карбоксамид (1,27 мг), собирали соответствующие фракции. ЖХМС: Мол. масса (рассч.): 393,42; МС (ES+, м/з): 394,53 (M+H)+. 1H ЯМР (500 МГц, ДМСО-d6) δ 11,82 (уш. с., 1H), 8,55 (д, J=7,32 Гц, 1H), 8,23 (с, 1H), 7,93 (с, 1H), 7,24 (с, 1H), 6,54 (д, J=4,27 Гц, 1H), 6,04 (уш. с., 2H), 3,97 (уш. с., 1H), 3,62 (д, J=12,21 Гц, 2H), 3,40 (м, 2H), 2,41 (с, 3H), 1,97 (д, J=11,29 Гц, 2H), 1,72-1,83 (м, 2H) м.д.
Соединение 7: Синтез 2-амино-N-[1-(3-хлор-1H-пирроло[2,3-b]пиридин-4-ил)-4-пиперидил]-5-фтор-пиридин-4-карбоксамида
1.7.1. Синтез трет-бутил-N-[1-(1H-пирроло[2,3-b]пиридин-4-ил)-4-пиперидил]карбамата
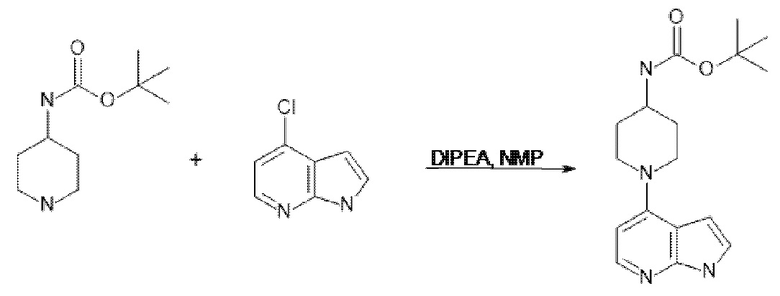
[175] Смесь 4-хлор-1H-пирроло[2,3-b]пиридина (4,0 г, 26,20 ммоль), трет-бутил-N-(4-пиперидил)карбамата (7,8 г, 39,30 ммоль) и ДИПЭА (11,4 мл, 65,50 ммоль) в NMP (28 мл) перемешивали при температуре 150°C в течение 72 ч. Реакционную смесь разбавляли водой и экстрагировали с помощью EtOAc (4x). Объединенные органические слои высушивали и концентрировали для получения неочищенного продукта, который перекристаллизовывали с помощью ацетонитрила для получения трет-бутил-N-[1-(1H-пирроло[2,3-b]пиридин-4-ил)-4-пиперидил]карбамата (1,88 г). ЖХМС: Мол. масса (рассч.): 316,41; МС (ES+, м/з): 317,22 (M+H)+.
1.7.2. Синтез трет-бутил-N-[1-(3-хлор-1H-пирроло[2,3-b]пиридин-4-ил)-4-пиперидил]карбамата
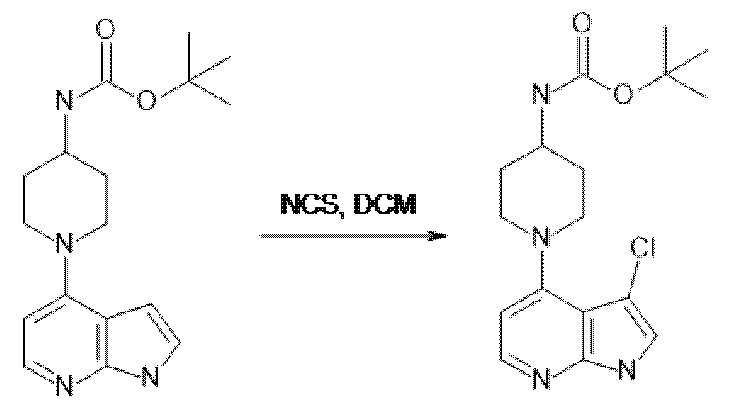
[176] трет-бутил-N-[1-(1H-пирроло[2,3-b]пиридин-4-ил)-4-пиперидил]карбамат (316 мг, 1 ммоль) растворяли в сухом ДХМ (10 мл) и добавляли N-хлорсукцинимид (147 мг, 1,1 ммоль). Реакционную смесь оставляли перемешиваться при температуре 40°C. Спустя 16 ч к реакционной смеси добавляли воду и экстрагировали с помощью ДХМ (3x). Объединенные органические слои высушивали над безводным Na2SO4, отфильтровывали через фазовый разделитель и упаривали для получения неочищенного соединения, который очищали посредством очистного устройства Biotage на 4 г колонке KP-Sil Interchim со скоростью потока 10 мл/мин, ДХМ в качестве растворителя A и ДХМ : MeOH=7:3 в качестве растворителя B. Метод: 0-5%B 4 CV; 20% 4 CV; 20-40%B 5 CV; 40%B 5 CV; 40-60%B 4 CV; 60%B 4 CV. Для получения трет-бутил-N-[1-(3-хлор-1H-пирроло[2,3-b]пиридин-4-ил)-4-пиперидил]карбамата (150 мг), собирали соответствующие фракции. ЖХМС: Мол. масса (рассч.): 350,85; МС (ES+, м/з): 351,43 (M+H)+.
1.7.3. Синтез 1-(3-хлор-1H-пирроло[2,3-b]пиридин-4-ил)пиперидин-4-амина

[177] К смеси трет-бутил-N-[1-(3-хлор-1H-пирроло[2,3-b]пиридин-4-ил)-4-пиперидил] карбамата (320 мг, 1,8 ммоль) в ДХМ (10 мл) при температуре 0°C добавляли TFA (1,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. После завершения растворитель упаривали и помещали неочищенный продукт в предварительно кондиционированную (с помощью MeOH) колонку SCX (5 г). Колонку промывали с помощью MeOH (2×5 мл) и после этого с помощью 7 N NH3/MeOH (10 мл) для получения 1-(3-хлор-1H-пирроло[2,3-b]пиридин-4-ил)пиперидин-4-амина
[178] (108 мг). ЖХМС: Мол. масса (рассч.): 250,73; МС (ES+, м/з): 251,38 (M+H)+.
1.7.4. Синтез 2-амино-N-[1-(3-хлор-1H-пирроло[2,3-b]пиридин-4-ил)-4-пиперидил]-5-фтор-пиридин-4-карбоксамида
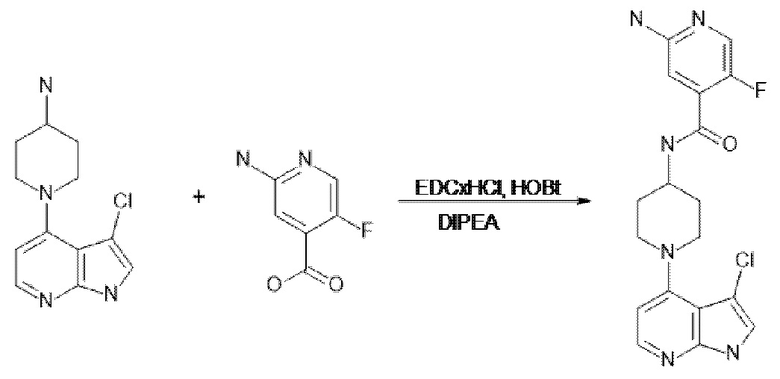
[179] К раствору 2-амино-5-фтор-пиридин-4-карбоновой кислоты (66,0 мг, 0,43 ммоль) в ДМФА (1 мл) при температуре 0°C добавляли EDC×HCl (70,0 мг, 0,36 ммоль) и ДИПЭА (141 мкл, 0,81 ммоль) и оставляли перемешиваться в течение 30 минут. После этого добавляли HOBtxH2O (52,0 мг, 0,34 ммоль) и 1-(3-хлор-1H-пирроло[2,3-b]пиридин-4-ил)пиперидин-4-амин (108,0 мг, 0,43 ммоль). Реакционную смесь оставляли перемешивали в течение ночи при комнатной температуре. Реакционную смесь разбавляли водой (10 мл) и продукт выпал в осадок. Кристаллы отфильтровывали и высушивали в вакуумной сушилке при температуре 65°C в течение 3 ч. Фильтрат экстрагировали с помощью EtOAc (4×5 мл). Объединенные органические слои высушивали над Na2SO4, отфильтровывали и концентрировали in vacuo для получения неочищенного продукта. Неочищенный продукт очищали посредством очистного устройства Biotage на 4 г колонке KP-Sil Interchim: ДХМ в качестве слабого растворителя и E1 в качестве сильного растворителя. Чтобы получить 2-амино-N-[1-(3-хлор-1H-пирроло[2,3-b]пиридин-4-ил)-4-пиперидил]-5-фтор-пиридин-4-карбоксамид (7,77 мг), собирали соответствующие фракции. ЖХМС: Мол. масса (рассч.): 388,8; МС (ES+, м/з): 389,47 (M+H)+. 1H ЯМР (500 МГц, ДМСО-d6) δ 11,81 (уш. с., 1H), 8,51 (д, J=7,63 Гц, 1H), 8,06 (д, J=5,19 Гц, 1H), 7,92 (с, 1H), 7,45 (с, 1H), 6,47-6,64 (м, 2H), 6,03 (с, 2H), 3,94 (м, 1H), 3,50-3,64 (м, 2H), 2,87 (т, J=11,44 Гц, 2H), 1,96 (д, J=10,38 Гц, 2H), 1,72-1,87 (м, 2H) ч./млн.
Биологические примеры
2. In vitro анализы
2.1 Биохимические анализы ASK1/2 (технология IMAP)
[180] Технология IMAP® относится к гомогенному тесту, применимому к широкому спектру киназ, фосфатаз и фосфодиэстераз без учета пептидной последовательности субстрата. Анализ представляет собой простую процедуру смешивания и считывания, позволяющую точно определить ферментативную активность. Основанный на специфическом высокоаффинном взаимодействии фосфогрупп с трехвалентными металлсодержащими наночастицами (гранулами), IMAP является общей платформой, не основанной на антителах, для оценки киназной, фосфатазной и фосфодиэстеразной активности. Ферментативную реакцию проводят с использованием флуоресцентно меченного субстрата. Добавление IMAP Binding System останавливает ферментативную реакцию и инициирует связывание гранул с фосфорилированными субстратами. Связывание субстрата с гранулами, которое коррелирует с ферментативной активностью, может быть обнаружено с использованием FP или TR-FRET в качестве показаний.
[181] Регулирующая апоптотические сигналы киназа (ASK1), также известная как MAP3K5, является членом семейства киназ митоген-активируемой протеинкиназы киназы киназы (MAP3K). Это активирует пути Jnk и p38 через MAP2K MKK4/7 и MKK3/6 (соответственно). Этот ASK1 IMAP анализ использует следующий IMAP пептид: RP7140-T2 (5TAMRA-GTFRAAIRRLAARRR-OH, SEQ ID NO: 1). Анализ был сконфигурирован для запуска при Km для АТФ (150 мМ), так что он будет чувствителен к АТФ-конкурентным ингибиторам. Итоговые условия анализа представляют собой 150 мМ АТФ, 1 мМ DTT, 200 нМ пептид и 6 нМ ASK1 (общий белок). Связывающий реагент готовят в 100% A в конечном разведении 1:200.
Растворы:
[182] KIT IMAP FP, кат. № R8127; рабочий буферный раствор-Tween (5x конц.), Molecular Devices, кат. № R7436; разбавленный 1:5 с помощью H2O и содержащий DTT (1 мМ из 1M исходного раствора); прогрессивный буфер для связывания (PBB) A (5x конц.), Molecular Devices, Кат. № R7282; реагент для прогрессивного связывания (реагент для п.с.), Molecular Devices, кат. № R7284; раствор фермента (содержащий 2x Ask1 в реакционном буфере); раствор субстрата (содержащий 2x пептидный субстрат в реакционном буфере и 2x 150 мкМ АТФ в рабочем буферном растворе); буфер для связывания на частицах (буфер для прогрессивного связывания A, разбавленный 1:5 с помощью H2O); раствор для связывания на частицах (буфер для связывания на частицах, содержащий 1:200 реагент для прогрессивного связывания (2x))
Экспериментальная часть
[183] 100 нл тестируемого соединения в 100% ДМСО добавляли в 384-луночные планшеты. Для эксперимента зависимости доза-ответ использовали разведение соединения 1:4 (максимальная конечная концентрация 25 мкМ). 3 мкл hASK1 (6 нМ), hASK2 (25 нМ) или rASK1 (15 нМ) добавляли в каждую лунку, за исключением контрольной лунки, в которую добавляли 3 мкл буфера. В каждую лунку добавляли 3 мкл раствора субстрата и инкубировали планшеты в течение 4 ч при комнатной температуре. По истечении этого времени в каждую лунку добавляли 6 мкл раствор для связывания на частицах IMAP™ (буфер для прогрессивного связывания A+реагент для п.с.; конечное разведение 1:100) и центрифугировали в течение 1 минуты при 1000 об/мин. Планшеты после этого инкубировали в течение 2 ч при комнатной температуре по истечении этого времени планшеты считывали на микропланшет-ридере Perkin Elmer EnVision.
Анализ данных
[184] Расчет данных IC50, графики и анализ контроля качества делали с помощью применения инструментов Excel и программного обеспечения GraphPadPrism, v. 5.03. Вкратце, индивидуальные кривые «концентрация-эффект» генерировали путем построения логарифма исследуемой концентрации исследуемых соединений (X) по сравнению с соответствующими процентными величинами (Y) ингибирования с использованием метода наименьших квадратов (обычного). Допускается исключение до ¼ точек из максимальных/минимальных значений контроля, но только если значения составляют >Ср.±1*ст. откл. Эмпирическое уравнение, применяемое для расчета IC50=log(ингибитор) по сравнению с ответ - переменный угловой коэффициент (четыре параметра). Рассчитанные результаты: Рассч 1: величина mP для измерения FP=1000 * (S - G * P) / (S+G * P), где S = <детектор 2 или FP-BodipyTAMRA_Ex531-Em579-оптимизированный(1) канал 2> P = <детектор 1 или FP-BodipyTAMRA_Ex531-Em579-оптимизированный(1) канал 1> G=G-фактор. Повышение=100. Верхнее ограничение используется только в том случае, если верхние значения рассчитаны неправильно.
[185] Минимальное ограничение, если менее -30%I или более 30%I. Максимальное ограничение, если менее 70%I или более 130%I. Цель Z'-фактора ≥ 0,4. Диапазон углового коэффициента Хилла от 0,5 до 5.
[186] Иллюстративные соединения по изобретению исследуют в соответствии со способом из Примера 2.1. Результаты приведены ниже:
2.2 Биохимические анализы ASK1/2 (технология AlphaScreen)
Описание технологии AlphaScreen
[187] Биохимические активности ASK1 и ASK2 также определяли с использованием технологии AlphaScreen, которая измеряет степень фосфорилирования белкового субстрата (MKK7). Технология AlphaScreen основана на связывании субстрата с двумя типами гранул, акцептор и донор. Связывание с одной гранулой происходит через маркер субстратного белка. Связывание со второй гранулой происходит через фосфоспецифическое связывание антитела с фосфозитом субстрата. Это формирует сендвич-структуру, с акцепторной и донорной гранулами в непосредственной близости. Когда донорные гранулы возбуждаются светом в диапазоне 680 нм, высвобождается атомарный кислород и вызывает испускание света из акцептора в диапазоне 620 нм, который может быть обнаружен с помощью подходящего планшет-ридера.
Описание анализа AlphaScreen ASK1/2
[188] Анализы AlphaScreen ASK1/2 были включены путем связывания неактивного полноразмерного белка MKK7 с глутатион-донорными гранулами с помощью применения GST-маркера. Сайт фосфорилирования на MKK7 (Ser271/Thr275) затем распознается фосфоспецифическим антителом. Фосфоспецифическое антитело связывается с акцепторными гранулами AlphaScreen через взаимодействие белка-А. Фосфорилирование MKK7 с помощью ASK1 или ASK2 впоследствии облегчает the сближение донорных и акцепторных гранул в непосредственную близость, после чего передача атомарного кислорода приводит к генерации сигнала AlphaScreen.
Реагенты, состояния и протокол AlphaScreen ASK1/2
Полноразмерный белок ASK1 человека с N-концевым маркером 6His-Avi.
Гетеродимер полноразмерного белка ASK1 с N-концевым маркером 6His-Avi (неактивный фермент, где лизин 709 замещен на метионин) и полноразмерного белка ASK2 с маркером 6His-FLAG.
Неактивный MKK7 человека (Carna Bioscience, кат. № 07-147-10).
Фосфо-MKK7 (Ser171/Thr275) антитело (Cell Signalling Technologies кат. № 4171).
Акцепторные гранулы белка A (Perkin Elmer, кат. № 6760137).
Донорные гранулы глутатиона (Perkin Elmer, кат. № 6765301).
Аденозинтрифосфат, АТФ (Promega, кат. № V915B).
Рабочий буферный раствор: 50 мМ Hepes, 150 мМ NaCl, 10 мМ MgCl2, 1 мМ CHAPS, pH 7,2.
Останавливающий буфер: 50 мМ Hepes, 150 мМ NaCl, 60 мМ ЭДТА, 1 мМ CHAPS, pH 7,2.
[189] Анализ был настроен для проведения с использованием следующих условий (конечные концентрации): 150 мкМ АТФ; 400 нМ MKK7; 0,8 нМ ASK1 и 2 нМ ASK2.
Экспериментальная часть
[190] 100 нл тестируемого соединения (выходная концентрация 6 мкМ, 11 концентрации с 3-кратными серийными разведениями) в 100% ДМСО добавляли в малообъемные 384-луночные планшеты. 2,5 мкл ASK1 или ASK2 добавляли в каждую лунку, за исключением контрольных лунок, в которые добавляли 2,5 мкл буфера. Во все лунки добавляли 2,5 мкл раствора MKK7. Планшет инкубировали в течение 60 минут при комнатной температуре. Акцепторные гранулы белка-A и фосфоспецифичное антитело инкубировали в течение 30 минут и после этого в каждую лунку добавляли 2,5 мкл смеси акцепторных гранул белка-A/фосфоспецифичного антитела (конечная концентрация акцепторных гранул 2,5 мкг/мл и конечное разведение антитела 1/800). Планшет инкубировали в течение 30 минут при комнатной температуре и после этого в каждую лунку добавляли 2,5 мкл донорных гранул GSH (конечная концентрация акцепторных гранул 10 мкг/мл). Планшет инкубировали в течение дополнительных 60 минут при комнатной температуре, после чего читали планшет на планшет-ридере Perkin Elmer Enspire.
Анализ данных
[191] Расчет данных IC50, графики и анализ контроля качества делали с помощью применения инструментов Excel и программного обеспечения GraphPadPrism, v.5.03. Вкратце, индивидуальные кривые «концентрация-эффект» генерировали путем построения логарифма исследуемой концентрации исследуемых соединений (X) по сравнению с соответствующими процентными величинами (Y) ингибирования с использованием метода наименьших квадратов (обычного). Эмпирическое уравнение, применяемое для расчета IC50=log(ингибитор) по сравнению с ответ - переменный угловой коэффициент (четыре параметра).
[192] Иллюстративные соединения по изобретению исследуют в соответствии со способом из Примера 2.2. Результаты приведены ниже:
2.3 Анализ клеток ASK1/2
[193] Активность ASK1/2 in vitro анализировали путем определения количества фосфо-MKK3 белка в H2O2-стимулированном PBMC, используя метод вестерн-блоттинга. Было показано, что MKK3 является прямым субстратом катализируемого ASK1/2 фосфорилирования в пути активации p38.
2.3.1 Материалы и условия анализа
Lymphoprep (Axis-Shield, кат. № 1114545)
Лизатный буфер на основе хлорида аммония с pH 7,4 (10x концентрированный):
NH4Cl - итоговая конц. 1,5 M (Kemika, кат. № 0137407)
NaHCO3 - итоговая конц. 100 мМ (Kemika, кат. № 1411007)
Na2ЭДТА - итоговая конц. 10 мМ (Sigma Aldrich; кат. № E-4884)
RPMI 1640 (Lonza кат. № BE12-115F/U1)
FBS (Sigma кат. № F7524, инактивированный нагревом 30’ / 56°C)
Диметил сульфоксид (ДМСО) (Sigma, кат. № D2650)
Буфер для лизиса клеток (pH 7,4): PBS+1% тритона X-100 (Sigma Aldrich; кат. № X100) - 10 мл
Phospho-Stop - 1 таблетка (Sigma, кат. № 4693124001) Ингибитор протеазы - 1 таблетка (Sigma, кат. № 4906837001)
Раствор пероксида водорода 3% мас./мас. (Sigma Aldrich, кат. № H-6520)
PBS (Sigma Aldrich, кат. № P4417-100TAB)
Микропланшет, 96 луночный, пп, V-образное дно, чистый (Greiner bio-one; кат. № 651201)
Планшет для культивирования тканей, 6 лунок, плоское дно с крышкой для низкого испарения (Falcon, кат. № 353224)
50 мл пробирка фирмы Falcon (TPP, кат. № 91050)
Набор для анализа белка Pierce BCA (Thermo Scientific, кат. № 23225)
96-Луночный планшет 1B Microtiter™ Immulon® (Thermo Scientific, кат. № 3355)
Набор Wes 12-230 kDa Master Kit (Protein Simple, кат. № PS-MK14)
Кроличье антитело MKK3 (D4C3) (Cell Signaling, кат. № 8535)
Фосфо-MKK3 кроличье антитело (Ser189)/MKK6 (Ser207) (D8E9) (Cell Signaling, кат. № 12280)
[194] Анализ был настроен для проведения с использованием следующих условий Диапазон концентраций исследуемых соединений: 1-0,0014 мкМ (7 серийных разведений в три раза); концентрация H2O2: 3 мМ
2.3.2 Экспериментальная часть
[195] Чтобы выделить PBMC из лейкоцитной пленки, лейкоцитную пленку разбавляли 1:1 в PBS, после чего разведенную лейкоцитную пленку (25 мл) аккуратно пипетировали на поверхность 20 мл Lymphoprep в пробирке фирмы Falcon. Пробирки после этого центрифугировали в течение 35 мин при 400×g. Затем верхний слой плазмы осторожно удаляли, оставляя слой, содержащий MNC. Слой, содержащий MNC, затем переносили в новую пробирку, добавляли PBS до общего объема 50 мл и после этого центрифугировали пробирку в течение 10 минут (200×g, 25°C). Получаемый осадок в пробирке после центрифугирования затем ресуспендировали в 2 мл PBS, этап промывания повторяли. Итоговые осадки в пробирке после центрифугирования ресуспендировали в лизатном буфере на основе хлорида аммония до 50 мл, аккуратно перемешивали и центрифугировали в течение 10 минут (200×g, 25°C), ресуспендировали в 2-3 мл клеточной среды и разбавляли до 50 мл в клеточной среде. Плотность клеток разбавления 1/20 в клеточной среде определяли с применением автоматического счетчика клеток.
[196] На лунку 10×106 PBMC высевали в 1 мл клеточной среды RPMI 1640, с добавлением 10% FBS в 6-луночных планшетах. Готовили семь наборов трехкратных серийных разбавлений соединений в ДМСО, начиная с 1 мМ в 96-луночном планшете с V-образным дном. Растворы соединений в ДМСО разбавляли 100x в клеточной среде. 200 мкл раствора соединения разбавляли 100x добавляли в лунку, контрольные лунки содержали 200 мкл 1% ДМСО, приготовленного в клеточной среде. Получали 7,5 мМ H2O2 в клеточной среде и добавляли 800 мкл в каждую лунку, за исключением лунки отрицательного контроля, в которую добавляли 800 мкл клеточной среды. Клетки инкубировали в течение 30 мин. при температуре 37°C, 5% CO2, 95% влажности. Клетки переносили в 2 мл пробирки Эппендорфа и центрифугировали в течение 10 минут при 300 x g при температуре 4°C, которые после этого промывали с помощью 1 мл PBS, клеточный осадок в пробирке после центрифугирования ресуспендировали in 100 мкл буфера для лизиса клеток и инкубировали на льду в течение 30 минут. По истечении этого времени клеточные лизаты центрифугировали в течение 5 минут при 10000×g при температуре 4°C и после этого супернатанты хранили при температуре -20°C.
[197] Образцы разбавляли 5x в буфере для лизиса клеток и определяли общую концентрацию белка в 96-луночном планшете Immulon 1B с применением набора для анализа белка BCA, следуя инструкциям производителя.
[198] Вестерн-блот-анализ осуществляли с применением набора Protein Simple Wes Master Kit и устройства, следуя инструкциям производителя. 0,5 мг/мл общих белков загружали в образец; фосфо-MKK3 и MKK3 антитела разбавляли 300x.
[199] Результаты вестерн-блот-анализа анализировали с применением программного обеспечения Compass 2.7.1 и количество фосфо-MKK3 делили на количество MKK3 для каждого образца. Процент ингибирования рассчитывали путем нормализации данных для контролей с использованием следующего уравнения:
[(Образец - минимальное значение контроля)/(максимальное значение контроля - минимальное значение контроля)]*100
[200] Величины IC50 соединений определяли путем построения графика зависимости процентных соотношений ингибирования от логарифма концентраций соединения с применением программного обеспечения GraphPad Prism, нелинейной регрессии (построение кривой), log (ингибитор) по отношению к ответу - переменный угловой коэффициент (четыре параметра).
[201] Иллюстративные соединения по изобретению исследуют в соответствии со способом из Примера 2.3. Результаты приведены ниже:
2.4. Анализ ASK1/2 в цельной крови человека
[202] Активность ASK1/2 in vitro анализировали путем определения количества цитокина CCL2, продуцированного в цельной крови человека, стимулированный с помощью LPS, с применением ELISA. В литературе было описано, что получение CCL2 было снижено в сыворотке от нокаутированных по ASK1 мышей в нестимулированном и LPS-стимулированном патологических состояниях.
2.4.1 Материалы и условия анализа
RPMI 1640 (Lonza кат. № BE12-115F/U1)
Диметил сульфоксид (ДМСО) (Sigma, кат. № D2650)
Липополисахарид из E.coli (LPS) (Sigma, кат. № L4391)
Микропланшет, 96 луночный, пп, V-образное дно, чистый (Greiner; кат. № 651201)
96-луночный мастер-блок, 2 мл (Greiner, кат. № 780271)
Микропланшет, 96-луночный, пс, u-образное дно, чистый, с крышкой (Greiner, кат. № 650180)
50 мл пробирка фирмы Falcon (TPP, кат. № 91050)
96-луночный планшет Immulon 2HB (Thermo Fisher Scientific, кат. № 3455)
Сахароза (Kemika, кат. № 1800408)
Стрептавидин-HRP (Calbiochem, кат. № OR03L)
Серная кислота (Kemika, кат. № 1816501)
Антитело против hCCL2 (R&D Systems, кат. № MAB679), растворенное в 1 мл PBS
Детекторное антитело против hCCL2 (R&D Systems, кат. № BAF279), растворенное в 1 мл PBS
Рекомбинантный hCCL2 (стандарт, R&D Systems, кат. № 366-6C)
Промывочный буфер (PBS+0,05% Tween-20)
PBS (Sigma, кат. № P4417)
Tween-20 (Sigma, кат. № P2287)
Субстрат для 20 мл: 18 мл H2O+2 мл 1 M ацетата натрия+200 мкл смеси TMB+2,5 мкл 30% H2O2
Ацетат натрия (Kemika, кат. № 1441908)
Смесь TMB (Sigma, кат. № T2885)
Пероксид водорода (Merck, кат. № 1.08597)
Покрывающий буфер (15 мМ Na2CO3 (xH2O) + 35 мМ NaHCO3 )
Карбонат натрия (Sigma, кат. № S-2127)
Бикарбонат натрия (Kemika, кат. № 1411007)
Аналитический буфер (PBS+0,05% Tween-20+1% BSA)
Бычий сывороточный альбумин (BSA) (Sigma, кат. № A2153).
2.4.2 Экспериментальная часть
[203] Цельную кровь собирали с помощью цитратного антикоагулянта. 100 мкл применяли для определения количества клеток с использованием автоматического счетчика клеток.
[204] В 2 мл мастер-блок 96-луночный планшет добавляли 300 мкл цельной крови. Готовили шесть трехкратных серийных разбавлений соединений в ДМСО, начиная с 10 мМ в 96-луночном планшете с V-образным дном. 0,6 мкл полученных соединений или 0,6 мкл ДМСО (лунки положительного и отрицательного контроля) из планшет с v-образным дном добавляли в планшет мастер-блока с кровью. Получали 2 нг/мл LPS в культурной среде без сыворотки и добавляли 300 мкл в лунку в планшет мастер-блока с кровью для тестовых лунок. 300 мкл культурной среды добавляли в лунки отрицательного контроля. Планшет инкубировали с цельной кровью в течение ночи в CO2 инкубаторе (37°C, 5% CO2, 95% влажности). Планшет затем центрифугировали в течение 7 минут при 1500 x g и переносили супернатанты в 96-луночный планшет с u-образным дном для определения цитокина CCL2 или хранили супернатанты при температуре -20°C для дальнейших исследований.
[205] За день до проведения ELISA, планшет Immulon 2HB покрывали с помощью 100 мкл на лунку разбавленного 250x антитела против hCCL2 в покрывающем буфере. Планшет после этого инкубировали при температуре 4°C в течение ночи. Планшет промывали три раза с помощью 300 мкл на лунку промывочного буфера и повторяли это после каждого этапа. Добавляли 200 мкл блокирующего буфера (аналитический буфер+5% сахароза) в каждую лунку и инкубировали в течение 60 минут при температуре 37°C. Готовили семь наборов двукратных серийных разбавлений стандарта hCCL2 в аналитическом буфере, начиная с 2000 пг/мл, в двух экземплярах. Получали лунки с холостым раствором, содержащим только аналитический буфер. Тестируемые образцы (супернатанты) добавляли в планшет для разведения в 10 раз в буфере для анализа. Все конечные объемы в планшете составляли 100 мкл. Планшет инкубировали в течение 60 минут при температуре 37°C. Добавляли 100 мкл на лунку разбавленного 500x детекторного антитела против hCCL2 в аналитическом буфере и инкубировали планшет в течение 45 минут при температуре 37°C. Добавляли 100 мкл на лунку 50 нг/мл стрептавидина-HRP в аналитическом буфере и инкубировали планшет в течение 30 минут при температуре 37°C. Добавляли по 100 мкл на лунку полученного раствора субстрата и инкубировали планшет при комнатной температуре, защищенный от света до появления синего цвета в лунках. Чтобы остановить развитие цвета в лунку добавляли 100 мкл 1 M серной кислоты. Абсорбцию планшета читали при 450 нм на планшет-ридере.
2.4.3 Анализ данных
[206] Результаты ELISA (абсорбцию при 450 нМ) анализировали с применением программного обеспечения Microsoft Excel. Среднее значение холостого раствора вычитали из всех значений. Стандартную кривую строили с серийными разведениями стандартов (пг/мл) на оси х в зависимости от соответствующих значений поглощения на оси у. Количество цитокина в образцах (пг/мл) рассчитывали по стандартной кривой. Процент ингибирования рассчитывали путем нормализации данных для контролей с использованием следующего уравнения:
[(Образец - минимальное значение контроля)/(максимальное значение контроля - минимальное значение контроля)]*100
[207] Величины IC50 соединений определяли путем построения графика зависимости процентных соотношений ингибирования от логарифма концентраций соединения с применением программного обеспечения GraphPad Prism, нелинейной регрессии (построение кривой), log (ингибитор) по отношению к ответу - переменный угловой коэффициент (четыре параметра).
3. In vivo анализы
3.1 CFA (полный адъювант Фрейнда) индуцированный гиперчувствительностью у крыс, анализируемый с использованием метода весовой нагрузки
[208] Внутриподошвенная инъекция полного адъюванта Фрейнда (CFA) вызывает воспалительную реакцию, которая вызывает гиперчувствительность и отек, и имитирует некоторые аспекты клинической воспалительной боли. Эти эффекты могут быть исследованы с использованием оборудования для измерения весовой нагрузки и плетизмометра.
3.1.1 Весовая нагрузка
[209] Наивные крысы равномерно распределяют массу тела между двумя задними лапами. Однако, когда (левая) задняя лапа, в которую осуществляли инъекцию, воспаляется и/или становится болезненной, масса перераспределяется так, что на пораженную лапу нагружают меньшую массу (уменьшение весовой нагрузки на поврежденную лапу). Вес, который несет каждая задняя конечность, измеряли с помощью тестера на недееспособность крыс (Linton Instruments, UK).
[210] Крыс помещали в тестер на неспособность с задними лапами на отдельных датчиках, и среднее усилие, прикладываемое обеими задними конечностями, регистрировали в течение 4 секунд.
[211] Были взяты базовые данные по весовой нагрузке и объему лапы, а гиперчувствительность индуцирована инъекцией CFA (базовые данные по весовой нагрузке и объему лапы были сделаны до индукции инсульта. Воспалительная гиперчувствительность была индуцирована с помощью внутриподошвенной инъекции CFA (100 мкл 1 мг/мл раствора) внутриподошвенно крысам в левую заднюю лапу.
[212] Животные (самцы крыс Спрага-Доули (Charles River, Великобритания), 212-260 г) ранжировали и рандомизировали по группам лечения в соответствии с окном весовой нагрузки CFA в схеме латинского квадрата. Животные получали лечение с либо наполнителем, соединением 1 10 мг/кг, либо индометацином 10 мг/кг (объем дозы 10 мкл/кг) спустя 24 часа после CFA. Весовую нагрузку измеряли спустя 1, 2 и 4 часа после лечение. Данные весовой нагрузки (г) брали как для правой, так и для левой задней лапы, а также рассчитывали разницу. Данные выражены в % купирования гиперчувствительности к боли (среднее ± СПС). Данные объема лапы (млл) брали для левых задних лап. Данные были выражены как % купирования отека (среднее ± СПС). Статистический анализ: осуществляли с повторяющимися измерениями ANOVA с последующим плановым сравнительным тестом с использованием InVivoStat (invivostat.co.uk, Clark et al., 2012), p<0,05 считается значительным.
[213] Соединение 1 и индометацин (10мг/кг) значительно ингибировали реакцию гиперчувствительности во всех временных точках, исследуемых после введения.
3.2 MIA-индуцированная гипералгезия у крыс - in vivo модель хронической боли
[214] Внутрисуставное введение однозамещенного йодацетата натрия (MIA) в ипсилатеральное колено у крыс Спрег-Доули приводит к развитию устойчивой и длительной гипералгезии и аллодинии, первоначально связанной с воспалительной реакцией. Считается, что развитие этих признаков в этой животной модели является клинически значимым; отражая симптомы, проявляющиеся у пациентов с хронической воспалительной болью, связанной с основным патологическим состоянием, таким как остеоартрит (OA) или ревматоидный артрит (Bove SE et al., Osteoarthritis Cartilage 2003; 11 (11): 821-30; Fernihough J, et al., боль 2004; 112 (1-2): 83-93; Kalbhen DA. J Rheumatol 1987; 14 Spec No: 130-1).
Весовая нагрузка
[215] Наивные крысы равномерно распределяют массу тела между двумя задними лапами. Однако, когда (левое) заднее колено, в которую осуществляли инъекцию, воспаляется и/или становится болезненным, масса перераспределяется так, что на пораженную конечность нагружают меньшую массу (уменьшение весовой нагрузки на поврежденную конечность). Вес, который несет каждая задняя конечность, измеряли с помощью тестера на недееспособность крыс (Linton Instruments, UK).
[216] Остеоартрит (OA) у крыс ((Спрег-Доули, самцы, группы из 10) индуцировали посредством инъекции раствора MIA (Sigma, I2512), 25 мкл 80 мг/мл, (2 мг) в коленный сустав левой задней ноги. Весовую нагрузку оценивали в дни 3, 5, 7, 9, 12 и 16, после инъекции MIA, для развития хронической боли. В день 3 весовой нагрузки измерения брали и ранжировали животных и рандомизировали по группам лечения в соответствии с окном MIA в схеме латинского квадрата.
[217] Животные получали лечение с соединением 1 10 мг/кг в 0,5% метилцеллюлозе или наполнителе (0,5% метилцеллюлозы) 10 мл/кг п/о в день 3 и затем ежедневно до дня 16. Измерения весовой нагрузки выполняли спустя 1, 2 и 4 часа после дозирования в день 3 и спустя 2 часа после дозирования в дни 5, 7, 9, 12 и 16.
[218] Данные весовой нагрузки (г) брали как для правой, так и для левой задней лапы, а также рассчитывали разницу. Данные выражают в виде % соотношения ипсилатеральных/контралатеральных ((ВН слева/ВН справа)*100) (среднее ± СПС)
[219] Расчет: Ипсилатеральные данные/контралатеральные данные x 100. Наивная разность ВН - разность ВН до введения дозы определяли в виде окна MIA.
[220] Статистический анализ: Повторяющиеся измерения ANOVA с последующим плановым сравнительным тестом с использованием InVivoStat (invivostat.co.uk), (p<0,05 считается значительным). Данные анализировали путем сравнения групп, получавших лечение, с контрольными группами, получавшими наполнитель в каждый момент времени.
[221] Значительное и выраженное купирование гиперчувствительности наблюдалось с соединением 1 при дозе 10 мг/кг с 1 часа после получения дозы до дня 12 (9 дней после получения дозы). Соединение 1, вводимое при 10 мг/кг, показало значительное купирование при сравнении с наполнителем в любой момент времени, сравнимое с положительным контролем целекоксибом.
3.3 CCl4 модель фиброза печени - протокол 1
[222] Целью данного исследования было оценить модель фиброза печени с помощью интоксикации CCl4. Начало болезни и влияние потенциальных положительных ссылок определяют путем оценки фиброза печени путем изучения гистологии, биохимии, визуализации и экспрессии генов в разные моменты времени. Starkel P., Animal models for the study of hepatic fibrosis, Best practice & Research Clinical Gastroenterology 25: 319-333, 2011
3.3.1 Группы исследования:
[223] Исследование осуществляют с использованием 5-недельных самцов мышей BalbC J (Janvier Lab).
и/п 2 р./неделя
и/п 2 р./неделя
2 р./неделя
30 мг/кг, два раза в день, п/о
+ вальпроевая кислота
ad libitum в питьевой воде 0,4%
3.3.2 Материалы:
CCl4 : Тетрахлорид углерода ACROS 99,8% CAS= 56-23-5 Партия A0293900
Оливковое масло, SIGMA O1514-500 мл Партия № BCBQ4885V
colF (ImmunoChemistry Technologies), сер. 6346 Партия 13Y39 Ср. годн. 05/2017
Исходный раствор разбавляли в 100 мкл ДМСО (6,8 мМ) и хранили при температуре 4°C
инъекция разбавления 1:170 в ppi воде животному за 15 минут до визуализации (100 мкл, синус в/в)
CCl4 разбавляли до 1/2 в оливковом масле и вводили и/п дважды в неделю при температуре 0,6 мл/кг.
3.3.2 Образцы и результаты
[224] Кровь собирают в пробирки с сывороткой и центрифугировали образцы при 3000t/мин. в течение 5 мин. и замораживали при температуре -20°C для оценки AST, ALT, ALP и общего билирубина. Также отбирали образец правой срединной доли печени и быстро помещали в пробирки Эппендорфа (2 мл с круглым дном) с 1 мл RNAlater (закрывающиеся пробирки), хранимого при температуре 4°C.
[225] Печень собирали и взвешивали. Ex vivo визуализацию связывания colF в печени осуществляли немедленно (Bruker Xtreme). Образцы печени помещают в формальдегид (флакон 25 мл - 60 куб.см) для гистологической оценки для количественной оценки aSMA и col I IHC.
[226] Для следующих анализов взвешивали образцы селезенки.
[227] Для анализа экспрессии генов использовали панель из 9 генов фиброзов.
3.4 CCl4 модель фиброза печени - протокол 2
[228] Целью данного исследования было оценить модель фиброза печени с помощью интоксикации CCl4. Начало болезни и влияние потенциальных положительных ссылок определяют путем оценки фиброза печени путем изучения гистологии, биохимии, визуализации и экспрессии генов в разные моменты времени. Starkel P., Animal models for the study of hepatic fibrosis, Best practice & Research Clinical Gastroenterology 25: 319-333, 2011
3.4.1 Группы исследования:
[229] Исследование осуществляют, используя 8-недельных самцов мышей BALB/c (Charles River, Италия)
тель
(0,6 мл/кг)
2 x неделя
D0 - D38
тель
5 мг/кг
1 р. в сутки
15 мг/кг
1 р. в сутки
15 мг/кг
3.4.2 Материалы:
CCl4 (жидкость) будут добавлять к оливковому маслу при концентрации 0,06 мл/мл. Раствор будет вводиться и/п в дозе 0,6 мл/кг. Объем применения будет составлять 10 мл/кг.
Тестируемое соединение будет растворяться/суспендировано в метилцеллюлозе (MC 0,5%).
3.4.3 Образцы и результаты
[230] Для отбора проб ФК в равновесной состоянии кровь будет собираться в пробирки с He-Lithium с целью генерирования плазмы. Все образцы крови будут обработаны для получения плазмы с помощью центрифугирования (5000 об/мин в течение 10 минут при температуре 4°C) в течение 30 минут после сбора. Образцы вплоть до анализа после этого хранили при температуре -80°C.
[231] Конечные образцы крови будут собирать в микропробирки с K2ЭДТА путем разрезания v. jugularis. Все образцы крови будут обработаны для получения плазмы с помощью центрифугирования (3500 об/мин в течение 10 минут при температуре 4°C) в течение 30 минут после сбора. Плазму из каждого образца крови хранили при температуре -80°C вплоть до анализа.
[232] Собирали образец печени и хранили части левой боковой доли для анализа экспрессии гена РНК, делали срезы для измерения пролина ОН, а остальные помещали в 10% формалин для гистопатологической оценки.
[233] Для анализа экспрессии генов (Col1, Timp1, Pai1, Snail1, Acta2) использовали панель из 5 генов фиброзов.
3.5 Метионин- и холин-дефицитные модели стеатогепатита и фиброза
[234] MCD представляет собой новую мышиную модель стеатогепатита и фиброза, индуцированных диетой: Метионин- и холин-дефицитной (MCD). (Wehr et al., 2013, J immunol, 190(10):5226-36; Baeck et al., 2014 Hepatology, 59(3):1060-72; Gautheron et al., 2014 EMBO, 6(8):1062-74).
3.5.1 Группы исследования и режим дозирования:
[235] C57BL/6 мышей от (Janvier Labs (Франция)) разделяли на группы как изложено ниже, в начале фазы индуцирования мыши являются 8-недельными (>20 г)
группы
+ 1 экв. HCl
+ 1 экв. HCl
3.5.2 Материалы и соединения
MCD диета без холин и метионин Ref EFTD.90262 MCD мод. партия 8206423, Ssniff, Soest, Германия -
Метилцеллюлоза 0,5%, VWR,
PEG 400: P3265, Sigma
Cryomold® Standard 25×20×5 мм (Sakura Finetec, 4557)
O.C.T.™ Compound cryomold (Sakura Finetec, 4583)
Формалин для консервации образца - 4% забуференный с MetOH
3.5.3 Получение соединение:
[236] Соединения растворяли/суспендировали в соответствующем наполнителе (смотри таблицу выше), при перемешивании. После получения, растворы/суспензии выдерживали при комнатной температуре в темноте при постоянном магнитном перемешивании. При дозировании применяли объем 10 мл/кг и доводили концентрацию раствора в соответствии с массой животного.
3.5.4 Протокол:
[237] Фаза индуцирования составляла 3 недели. Глюкозу натощак не давали. Мышам обеспечивали либо MCD контрольный рацион, либо MCD диету.
[238] Во время фазы лечения мышей поддерживали на MCD контрольном рационе или MCD диете, как и на фазе индуцирования. Мышей в группу лечения распределяли случайным образом в соответствии с их массой тела для обеспечения гомогенного распределения. Мышам во время фазы оценки тестируемое соединение вводили ежедневно один или два раза
3.6 Профилактическая модель индуцированного блеомицином фиброза легких у 14-дневных мышей
[239] Целью исследования является исследование эффективности тестируемого соединения при трех различных дозах на модели индуцированного блеомицином фиброза легких у 14-дневных мышей.
3.6.1 Животные
[240] Это исследование проводили на самцах C5²7BL/6N мышей, предоставленных Charles River, Италия, которые акклиматизировались в течение 5 дней в среде, поддерживаемой при 22°C, при 55% относительной влажности, с 15-20 сменами воздуха в час при циклах освещения в 12 ч. Мышам обеспечивали гранулированную еду и воду ad libitum.
[241] По меньшей мере за один день до начала эксперимента всех животных распределяли случайным образом на группы таким образом, как указано в таблице ниже.
[242] Все связанные с животными исследования проводили в соответствии с 2010/63/EU и Национальным законодательством, регулирующим использование лабораторных животных в научных исследованиях и для других целей (Official Gazette 55/13).
3.6.2 Группы исследования
тель
PBS+
наполнитель
BLM+
наполнитель
(2 р. в сутки)
BLM+ пирфенидон
BLM+ тестируемое соединение
BLM+ тестируемое соединение
BLM+ тестируемое соединение
BLM+ тестируемое соединение-спутник для ФК
3.6.3 Материалы
[243] Растворитель для тестируемых растворов получали путем добавления 0,5 г гидроксиэтилцеллюлозы (Natrosol) в 500 мл дистилята воды (0,1%) при постоянном перемешивании без нагревания в течение 5 ч на магнитной мешалке.
[244] Анестезирующий раствор получали путем добавления 1 мл Narketan (Narketan 10, Vetoquinol, Берн, Швейцария, 03605877535982) и 0,5 мл Rompun (Rompun, 2%: Bayer, Леверкузен, Германия) в 9 мл физиологического раствора. Получаемый раствор вводят при 10 мл/кг.
[245] Для получения раствора для интраназальной (и/н) провокации, размораживали 0,8 мг/мл исходные растворы блеомицина (Bleomycin sulphate, Enzo Life Sciences, Inc., США; CAS № 9041-93-4; кат. № BML-AP302-0010) и разбавляли в 330 мкл физиологического раствора.
[246] Перед и/н введением, мышей анестезировали и/п с анестезирующим раствором, описанным выше.
[247] Свежий состав пирфенидона готовили ежедневно в 0,1% составах Natrosol до конечной концентрации 5 мг/мл. Перед дозированием животных взвешивали и вводимое количество пирфенидона доводили в соответствии с индивидуальными массами, соответствующими 10 мл/кг массы тела, дважды в день п/о, с интервалом 7,5 ч между двумя введениями.
[248] В итоге, растворы тестируемых соединений получали путем растворения подходящего количества указанного тестируемого соединения в PEG 400 (20% конечного объема), после чего MC 0,5% (80% конечного объема) для достижения конечных концентраций 1 мг/мл, 0,3 мг/мл и 0,1 мг/мл, таким образом получая соединение в дозах 10 мг/кг, 3 мг/кг и 1 мг/кг. Перед дозированием животных взвешивали и вводили количество, доведенное в соответствии с индивидуальными массами.
[249] Объем применения тестируемых доз соответствует 10 мл/кг массы тела и тестируемые соединения вводили п/о дважды в день, с интервалом 7,5 ч между двумя введениями.
3.6.4 Исследование
[250] Животных клинически осматривали два раза в день. Список клинических признаков и параметров указан в таблице конечных точек человека. Животных взвешивают ежедневно, начиная с D0.
[251] В день 14, спустя два часа после дозирования с пирфенидоном или тестируемым соединением, мышей умерщвляли с помощью передозировки обезболивающих.
[252] Легкие иссекали и взвешивали индивидуально. Для всех групп: всю верхнюю правую долю легкого помещали в пробирку Precellys, содержащую кварцевые гранулы, и немедленно замораживали в жидком азоте и подвергали анализу экспрессии генов.
[253] Все оставшиеся легкие помещали в маркированные флаконы, содержащие 10% забуференного формалина, для дальнейшей гистопатологической оценки.
3.6.5 Анализ образца, обработка данных и статистическая оценка
[254] Данные массы тела и данные массы легких обрабатывали с применением MS Excel. Статистический анализ и графическое представление осуществляли с применением программного обеспечения GraphPad Prism (версия 5.04).
[255] Однофакторный дисперсионный анализ или критерий Манна-Уитни использовали для масс легких.
[256] Двухфакторный дисперсионный анализ использовали для изменений массы тела.
[257] Различия между группами будут считаться статистически значимыми при р <0,05.
[258] Для гистопатологической оценки целые легкие (за исключением пробы верхнего правого легкого) помещали в парафин и окрашивали трихромом Мэллори.
[259] Легочные гистологические изменения оценивали с использованием модификации Мацусе по шкале Ашкрофта (Ashcroft et al., 1988; Matsuse et al., 1999). Статистический анализ и графическое представление осуществляли с применением программного обеспечения GraphPad Prism (версия 5.04). Применяли критерий Манна-Уитни.
[260] Различия между группами будут считаться статистически значимыми при р <0,05.
3.6.6 ФК Анализ - группа 7
3.6.6.1 Протокол
[261] Животных в группе 7 (n=10) включали только для изучения ФК и они не подлежали оцениванию клинических признаков
[262] У этих животных индуцировали болезнь в начале лечения в день 0 и последовательно умерщвляли в день 7 спустя 1 ч, 3 ч, 6 ч, 8 ч, 24 ч после первого введения тестируемого соединения.
[263] Образец крови (50 мкл) собирали из хвостовой вены в пробирки с антикоагулянтом на основе Li-гепарин в каждом моменте времени и держали на льду до разделения. В течение максимум 30 минут после сбора, образцы крови центрифугировали при 2000g в течение 10 мин. при температуре 4°C и разделяли получаемые образцы плазмы на аликвоты в пробирки из полипропилена (1×25 мкл). Образцы хранили замороженными при температуре -20°C вплоть до анализа.
[264] Ткань легких собирали при умерщвлении после забора крови для каждого животного, после чего взвешивали и помещали в пробирки из полипропилена перед замораживанием. Образцы хранили замороженными при температуре -80°C вплоть до анализа.
3.6.6.2 Концентрация в плазме и фармакокинетический анализ
[265] Концентрации в плазме и легких измеряли посредством ЖХ-МС/MS. Образцы готовили для анализа ЖХ-МС/MS посредством преципитации белка. Концентрации в плазме, измеренные ниже нижнего предела количественного обнаружения (LLOQ), сообщаются как ниже предела количественного определения (BLQ).
[266] Концентрации тестируемого соединения в плазме выражают в нг/мл.
[267] Рассчитывали средние концентрации в плазме. Для расчета среднего значения концентрации ниже LLOQ устанавливаются равными ноль. Следовательно, средние величины может быть BLQ. Стандартное отклонение (ст. откл.), стандартная ошибка среднего (СОС) и коэффициент вариаций (CV, %) сводили в таблицу, когда, по крайней мере, три значения концентрации в плазме выше LLOQ.
[268] Некомпартментный анализ отдельных концентраций в плазме осуществляют с применением PhoenixTM WinNonlin® 6,3 (Pharsight Corporation) для определения, по меньшей мере, следующих фармакокинетических параметров:
[269] Максимальная концентрация в плазме, Cmax (мкг/мл) с соответствующим временем, tmax (h),
[270] Площадь под кривой зависимости концентрации в плазме от времени до последней измеряемой концентрации AUC0-t или до 24 ч. AUC0-24h (мкг.ч/мл) (если соединение поддается количественной оценке до 24 ч после введения дозы) и/или до бесконечности для AUC0-∞, (мкг.ч/мл) рассчитывали в соответствии с линейно-логарифмическим методом трапеций. Если это будет сочтено необходимым, может быть рассчитана частичная AUC. Концентрации ниже предела количественного определения (BLQ) устанавливаются равными ноль. AUC не рассчитывали, если существует менее трех количественных точек времени. AUC0-∞ считается, если %AUCextra < 20%.
[271] Кажущийся конечный период полувыведения, t1/2 (ч) сообщается только в том случае, если для линейной регрессии используются три или более временных точек, за исключением tmaX, и если скорректированное R² > 0,80.
[272] Нормализованная AUC и Cmax дозы.
[273] Рассчитывали средние фармакокинетические параметры. Стандартное отклонение (ст. откл.) и коэффициент вариаций (CV, %) сводили в таблицу, если доступны по крайней мере три значения.
3.7 Модель CIA
3.7.1 Материалы
[274] Полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA) приобретали у Difco. Бычий коллаген типа II (CII), липополисахарид (LPS) и Enbrel получали от Chondrex (L’Isle-d’Abeau, Франция), Sigma (P4252, L’Isle-d’Abeau, Франция), Wyeth (25 мг инъекционный шприц, Франция) Acros Organics (Palo Alto, Калифорния), соответственно. Все остальные используемые реагенты являются чистыми для анализа, а все растворители имеют аналитическую степень чистоты.
3.7.2 Животные
[275] Крыс расцветки темный агути (самец, возраст 7-8 недель) получали из Harlan Laboratories (Maison-Alfort, Франция). Крыс выдерживали в 12 ч цикле день/ночь (0700-1900). Температуру поддерживали на 22°C, а пищу и воду обеспечивали ad libitum.
3.7.3 Коллаген-индуцированный артрит(CIA)
[276] За день до эксперимента, раствор CII (2 мг/мл) готовили с 0,05 M уксусной кислотой и хранили при температуре 4°C. Непосредственно перед иммунизацией равные объемы адъюванта (IFA) и CII перемешивали с помощью гомогенизатора в предварительно охлажденной стеклянной бутылке на бане с ледяной водой. Если эмульсия не образуется, может потребоваться дополнительная адъювантная и длительная гомогенизация. 0,2 мл эмульсии инъецировали внутрикожно у основания хвоста каждой крысе в день 1, вторую бустерную внутрикожную инъекцию (раствор CII при 2 мг/мл в CFA 0,1 мл физиологического раствора) осуществляли в день 9. Этот метод иммунизации модифицирован из опубликованных способов (Jou et al., 2005; Sims et al., 2004).
3.7.4 План исследования
[277] Терапевтические эффекты соединений исследовали на крысиной модели CIA. Крыс случайным образом разделяли на равные группы и каждая группа включала 10 крыс. Всех крыс прививали в день 1 и стимулировали в день 9. Терапевтическое дозирование продолжали с 16 по 30 день. Группу отрицательного контроля лечили с наполнителем, а группа положительного контроля с помощью Enbrel (10 мг/кг, 3x/неделя, п/к). Представляющее интерес соединение обычно тестировали в 4 дозах, например, 0,3, 1, 3 и 10 мг/кг, п/о.
3.7.5 Шкала клинической оценки артрита
[278] Артрит оценивается по методике, описанной в литературе (Khachigian 2006 Nat Protoc. 2006; 1(5):2512-6; Lin et al., 2007, Br J Pharmacol, 150, pp. 862-872; Nishida et al., 2004, Arthritis и Rheumatism, 50(10), pp. 3365-3376). Распухание каждой из четырех лап оценивали с помощью оценки артрита следующим образом: 0 - отсутствие симптомов; 1 - слабое, но определенное покраснение и распухание одного типа сустава, такого как лодыжка или запястье, или явное покраснение и распухание, ограниченное отдельными цифрами, независимо от количества пораженных пальцев; 2 - умеренное покраснение и припухлость двух или более типов суставов; 3 - сильное покраснение и отек всей лапы, в том числе пальцев; 4 - максимально воспаленная конечность с вовлечением нескольких суставов (максимальная суммарная клиническая оценка артрита на животное 16) (Nishida et al., 2004).
[279] Чтобы разрешить метаанализ множественных исследований, значения клинической оценки могут быть нормированы следующим образом:
[280] AUC клинической оценки (оценка AUC): Площадь под кривой (AUC) с 1 по 14 день рассчитывали для каждой отдельной крысы. AUC каждого животного делили на среднее значение AUC, полученное для наполнителя в исследовании, из которого получены данные об этом животном, и умножали на 100 (например, AUC выражали в процентах от среднего значения AUC средства доставки за исследование).
[281] Увеличение клинической оценки с 1 по 14 день (конечная оценка): Клиническую оценку каждого животного делили на среднюю разницу значения клинической оценки, полученной для наполнителя в исследовании, из которого получены данные об этом животном, и умножали на 100 (например, разницу выражали в процентах от среднего разницу значения клинической оценки для средства доставки за исследование).
3.7.6 Изменение массы тела (%) после начала артрита
[282] Клинически, потеря массы тела связана с артритом (Rall & Roubenoff 2004 Rheumatology (Oxford); 43(10):1219-23; Shelton et al., 2005, Pain; 116(1-2):8-16; Walsmith et al., 2004, J Rheumatol.; 31(1):23-9). Следовательно, изменения массы тела после начала артрита можно использовать как неспецифическую конечную точку для оценки эффекта терапевтической терапии на крысиной модели. Изменение массы тела (%) после начала артрита рассчитывали следующим образом:
Мыши: 
Крысы: 
3.7.7 Радиология
[283] Для задних лап каждого отдельного животного делали рентгеновские снимки делали. Каждому из снимков присваивали случайный слепой идентификационный номер, а тяжесть эрозии кости оценивали двумя независимыми оценщиками с помощью радиологической системы оценок Ларсена следующим образом: 0 - нормальный с неповрежденными контурами костей и нормальной суставной щелью; 1 - небольшая аномалия с любой одной или двумя наружными плюсневыми костями, демонстрирующими небольшую эрозию кости; 2 - определенная ранняя аномалия с любыми тремя-пятью наружными плюсневыми костями, демонстрирующими эрозию кости; 3 - средняя деструктивная аномалия со всеми наружными плюсневыми костями, а также с любой одной или двумя внутренними плюсневыми костями, демонстрирующими определенные эрозии кости; 4-серьезная деструктивная аномалия со всеми плюсневыми костями, демонстрирующими определенную эрозию кости и по меньшей мере один из внутренних плюсневых суставов полностью разрушен, оставляя некоторые контуры костного сустава частично сохраненными; 5-калечащие нарушения без контуров костей. Эта система оценивания является модификацией протоколов, известных в литературе (Bush et al., 2002, Arthritis и Rheumatism, 46(3), 802-805; Jou et al., 2005, Arthritis Rheum, 52(1), 339-44; Salvemini et al., 2001, Arthritis Rheum, 44(12), 2909-21; Sims et al., 2004, Arthritis Rheum, 50(7), 2338-46).
3.7.8 Гистология
[284] После рентгенологического исследования для точной гистологии задние лапы мышей фиксировали в 10% фосфатно-буферном формалине (рН 7,4), декальцинировали с помощью быстрого декальцификатора костей (EUROBIO, Les Ulis, Франция) и помещали в парафин. Чтобы обеспечить обширную оценку артритических суставов, осуществляли по меньшей мере четыре последовательных среза (толщиной 5 мкм), а каждая серия срезов находится на расстоянии 100 мкм. Срезы окрашивали гематоксилином и эозином (H&E). Гистологические исследования на синовиальное воспаление и повреждение костей и хрящей осуществляли двойным слепым методом. Для каждой лапы оценивали четыре параметра по четырехбалльной шкале. Параметры представляют собой инфильтрацию клеток, тяжесть паннуса, эрозию хряща и эрозию кости. Оценивание осуществляли следующим образом: 1 - нормальный, 2 - мягкий, 3 - средний, 4 - заметный. Четыре оценки суммировали вместе и представляли в виде дополнительной оценки, а именно «Общий балл РА».
3.7.9 Анализ пяточной кости (пятки) с помощью микрокомпьютерной томографии (мкКТ)
[285] Наблюдаемая при РА деградация кости происходит конкретно в кортикальной кости и может быть выявлена с помощью анализа микротомографии (Oste et al., 2007; Sims et al., 2004). После сканирования и трехмерной реконструкции объема пяточной кости, деградацию кости измеряли в качестве количества дискретных объектов, присутствующих на слайде, выделенных in silico перпендикулярно продольной оси кости. Чем больше разрушается кость, тем больше дискретных объектов измеряют. Анализировали тысяча срезов, равномерно распределенных по пяточной кости (с интервалом около 10,8 мкм).
3.7.10 ФК в равновесной концентрации
[286] В день 7 или позже образцы крови собирали в ретроорбитальном синусе с гепарином лития в качестве антикоагулянта в следующие моменты времени: перед введением дозы, спустя 1, 3 и 6 часов. Образцы цельной крови подвергали центрифугированию, а образцы плазмы в ожидании анализа хранили при температуре -20°C. Концентрации в плазме каждого тестируемого соединения определяли с помощью метода ЖХ-МС/MS, в котором масс-спектрометр работает в режиме положительного электрораспыления. Фармакокинетические параметры рассчитывали с применением WinNonlin® (Pharsight®, United States) и предполагается, что уровни в плазме перед введением дозы равны уровням в плазме в момент времени 24 ч.
3.8 Модель МАВ
[287] Модель MAB позволяет быстро оценить модуляцию РА-подобного воспалительного ответа терапевтами Khachigian, 2006. Мышам DBA/J инъецировали в/в коктейль из мкАт, направленных против коллагена II. Через день начинали комплексное лечение. Через три дня мыши получали и/п инъекцию LPS (50 мкг/мышь), что приводит к быстрому началу воспаления. Комплексное лечение продолжали вплоть до 10 дней после инъекции мкАт. Воспаление читали путем измерения распухания лапы и фиксации клинической оценки каждой лапы. Суммарная клиническая оценка артрита четырех конечностей представлена, чтобы показать тяжесть воспаления. Систему оценивания применяли к каждой конечности с применением шкалы от 0 до 4, причем 4 соответствует наиболее сильному воспалению.
0 Без симптомов
1 Легкое, но определенное покраснение и припухлость одного типа сустава, такого как лодыжка или запястье, или явное покраснение и припухлость, ограниченные отдельными пальцами, независимо от количества пораженных пальцев
2 Умеренное покраснение и припухлость двух или более типов суставов
3 Сильное покраснение и распухание всей лапы, в том числе пальцев
4 Максимально воспаленная конечность с вовлечением нескольких суставов.
3.9 Крысиная in vivo модель с менисэктомией (MNX)
3.9.1 In vivo эффективность на крысиной MNX модели
[288] In vivo эффективность изучали на самках модели крыс Льюиса с менисэктомией (MNX). Крысиная модель MNX является хорошо подтвержденной моделью заболевания остеоартрита (Bendele, 2001, J Musculoskel Neuron Interact, 1(4), 377-85; Janusz et al., 2002, Osteoarthr Cartilage, 10, 785-91; Pritzker et al., 2006, Osteoarthr Cartilage, 14, 13-29).
3.9.2 Хирургическое вмешательство и дозирование
[289] Остеоартрит индуцировали с помощью менискэктомии в день 0 (D0) в правой ноге каждой крысе путем разреза медиальной коллатеральной связки и удаляли 4 мм связки. Внутреннюю часть мениска иссекали по вертикали на два лоскута, которые выдвигают к передней и задней части синовиальной полости. Подвергнутых ложной тимэктомии животных подвергали только анестезии, разрезу кожи и мышц, а затем сшиванию. В день 1, мышей в группу лечения (n=20 на группу) распределяли случайным образом в соответствии с их массой тела для обеспечения гомогенного распределения. С C2 по D21, крысам вводили per os (п/о) один раз ежедневно (1 р./сут.) или два раза в день (2 р./сут) с соединениями, составленными в метилцеллюлозе (MC) 0,5% или в HPβCD 10% pH 3,0.
3.9.3 Определение ФК в равновесной концентрации (ssPK)
[290] Спустя по меньшей мере 7 дней лечения, кровь забирали в 4 временных точках после введения: 0, 1, 3 и 6 ч (и при условии, что 24 ч равняется пробе перед получением дозы) для определения воздействия в равновесной концентрации в плазме.
3.9.4 Гистология
[291] При умерщвлении, для гистологического анализа собирали и обрабатывали правую голень каждой крысы. Спустя 48 часов фиксации в 4% формальдегиде большеберцовые кости декальцинировали в Osteosoft в течение 7 дней и разрезали на 2 половины перед погружением в парафин друг напротив друга. Пять серий срезов прорезали с интервалами 200 мкм, покрывая около 1,5 мм средней части кости. Одна серия слайдов окрашивали с помощью Safranin O и светло-зеленым для морфологической оценки и оценивания по OARSI. Другие серии слайдов оснащены DAPI для измерения плотности хондроцитов.
[292] Степень повреждения хряща, отражающая остеоартрит в большеберцовом плато, определяли и оценивали с использованием метода OARSI, основанного на классификации и стадийности поражения хряща. (Pritzker et al., 2006). Оценивание по OARSI проводили анонимно двумя разными ридерами. Для каждой голени присваивали один балл в качестве медианы оценки OARSI из 5 разделов.
[293] Для статистического анализа медианы групп сравнивали с помощью стратифицированного критерия Крускала-Уоллиса с последующим многократным сравнительным тестом Даннетта post hoc.
[294] Уровни значимости: нс: не является статистически значимым; *p<0,05; **p<0,01; ***p<0,001 по сравнению с MNX-наполнитель. Статистический анализ осуществляли по всем группам исследований.
3.10 - Индуцированная диетой мышиная модель неалкогольного стеатогепатита (NASH)
[295] Эта модель использует диету с высоким содержанием жиров (CDAHFD) с дефицитом холина и L-аминокислот, состоящую из 60 ккал % жира и 0,1% метионина, чтобы вызвать NASH.
3.10.1 Группы исследования и режим дозирования:
[296] C57/BL6 мышей (Charles River) разделяли на группы, как изложено ниже, в начале фазы индуцирования мыши являются 8-недельными (>20 г)
тель
3.10.2 Материалы и соединения
CDAHFD; Research Diets Inc., Ref. № A06071302
Контрольный рацион: нормальная диета (VRF 1, P), Special Diets Services
3.10.3 Протокол лечения:
Фаза индуцирования: в течение 4 недель.
[297] Для того, чтобы вызвать неалкогольный стеатогепатит (NASH), животные будут получать диету (CDAHFD) с высоким содержанием жиров с дефицитом холина и L-аминокислот.
Фаза лечения: в течение 6 недель
[298] Мышей случайным образом распределяли по группам лечения и лечили в соответствии с графиком, представленным в таблице выше, вплоть до фазы оценки.
3.10.4 - Отбор проб
[299] Отбор проб ФК в равновесном состоянии - Кровь будут собирать в микропробирки с K2-ЭДТА для получения плазмы. Все образцы крови будут обработаны для получения плазмы с помощью центрифугирования (5000 об/мин в течение 10 минут при температуре 4°C) в течение 30 минут после сбора. Плазму из каждого образца крови будут быстро замораживать в жидком азоте и хранить в морозильной камере, поддерживаемой при -80°С вплоть до анализа.
[300] Конечные образцы крови - Кровь будут собирать в пробирки для получения сыворотки, содержащей ингибитор протеазы. Все образцы крови будут обработаны с помощью центрифугирования (3500 об/мин в течение 15 минут при температуре 4°C). Аликвоты полученных образцов сыворотки будут хранить замороженными при температуре -80°C вплоть до дополнительного анализа.
[301] Образцы ткани: Собирали образец печени и хранили части левой боковой доли для анализа экспрессии гена РНК, для анализа триглицеридов, делали срезы для измерения пролина ОН, а остальные помещали в 10% формалин для гистопатологической оценки. Гистопатологическая оценка включает срезы, окрашенные красителем Sirius red, для оценки степени фиброза, и срезы, окрашенные F4/80, для оценки накопления макрофагов.
[302] Для анализа экспрессии генов использовали панель 6 генов фиброза (Col1A1, Timp1, Pai1, CTGF, ТФР-β и Acta2), гены воспаления (ФНО-α, ИЛ-10 и CCL2) и 2 конститутивных гена.
3.10.5 Результаты
[303] Соединение 1 при испытании на этой модели показало значительное влияние по меньшей мере на самые высокие испытанные дозы на уровни экспрессии Pai1, TIMP1, CTGF и ТФР-β на панели генов фиброзов (Фигура 3) и на все три гена на панели воспаления (Фигура 4). Кроме того, оно показало значительное влияние на уровни гидроксипролина при 15 мг/кг/1 р. в сутки и 15 мг/кг/2 р. в сутки (Фигура 5), значительное влияние на количественную оценку фиброза с помощью красителя Sirius red при 15 мг/кг/1 р. в сутки и 15 мг/кг/2 р. в сутки (Фигура 6) и значительное влияние на количественную оценку F4/80 при 15 мг/кг/2 р. в сутки (Фигура 7).
4 Ингибирование CYP
[304] Ингибирующий потенциал тестируемого соединения для изоферментов цитохрома P450 человека (CYP1A2, 2C9, 2C19, 2D6 и 3A4) оценивали с применением кДНК-экспрессируемых изоферментов цитохрома P450 человека и нефлуоресцентных субстратов, которые метаболизируются до флуоресцентных метаболитов.
[305] Соединения исследовали при 3,3 и 10 мкМ, конечной концентрацией ДМСО 0,3%. Соединения инкубировали в течение 15 мин с ферментом перед добавлением смеси кофакторсубстрат. Конечные концентрации реакций в смеси кофакторов для анализов CYP3A4 (BD Biosciences, 456202), CYP2C9 (BD Biosciences, 456258), CYP2C19 (BD Biosciences, 456259) и CYP1A2 (BD Biosciences, 456203) представляют собой: 0,4 ед./мл глюкозо6фосфатдегидрогеназы (G6PDH, Roche, 10165875001), 3,3 мМ MgCl2 (Sigma, M2670), 3,3 мМ D-глюкоза 6 фосфаты (Sigma, G7879) и 1,3 мМ NADP+ (Sigma, N0505). Для CYP2D6 (BD Biosciences, 456217), конечная концентрация в реакционной смеси в анализе составляет 0,4 ед./мл G6PDH, 0,41 мМ MgCl2, 0,41 мМ D-глюкоза 6 фосфат и 8,2 мкМ NADP+. Концентрации фермента и субстрата сообщали в 0. После инкубационного периода реакцию останавливали путем добавления останавливающего раствора. Для экспериментов с ДБФ в качестве субстрата используют 2 N NaOH останавливающий раствор, в то время как для всех других субстратов останавливающий раствор представляет собой 80% MeCN/20% 0,5 M трис-основание.
[306] Флуоресценцию считывали либо сразу (для CEC, AMMC, BFC), либо спустя 20 мин (для CYP2C9 и CYP3A4 с применением DBF в качестве субстрата) на ридере PerkinElmer EnVision® при соответствующей длине волны возбуждения и излучения (cf. 0).
[307] Затем путем нормализации данных для холостых проб рассчитывали процент ингибирования CYP с помощью тестируемого соединения: 100% ингибирование представляет собой холостую пробу, остановленную перед добавлением смеси фермента/субстрата, а 0% ингибирование представляет собой холостую пробу, остановленную после прохождения ферментативной реакции (50 мин).
Условия анализа ингибирования, используемые для каждого изученного изофермента CYP450
DBF
CEC
AMMC
BFC
AMMC: аминоэтил7метокси4метилкумарин
BFC: 7бензилокси4трифторметилкумарин
CEC: 3циано7этоксикумарин
DBF: дибензил флуоресцеин.
5 Зависимое от времени ингибирование CYP3A4
[0308] Зависимое от времени ингибирование CYP3A4 с помощью соединений, оцениваемых в объединенном HLM, определяли посредством определения IC50 в соответствии с Grimm et al., Drug Metabolism and Disposition 2009, 37, 1355-1370 and the draft FDA Guidance for Industry (Drug Interaction Studies - Study Design, Data Analysis, Implications for Dosing, and Labeling Recommendations), 2006, http://www.fda.gov/cder/guidance/index.htm. Применяли тестостерон в качестве маркерного субстрата, а в качестве положительного контроля применяли тролеандомицин.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Galapagos NV
Calchan Limited
<120> ПРОИЗВОДНЫЕ ПИРРОЛОПИРИМИДИНА И ПИРРОЛОПИРИДИНА
<130> GAL-C-P2188PCT (CALCH-232-WO-PCT)
<150> GB1711234.3
<151> 12.07.2017
<160> 1
<170> PatentIn версия 3.5
<210> 1
<211> 15
<212> БЕЛОК
<213> Искусственный
<220>
<223> Синтетический пептид
<400> 1
Gly Thr Phe Arg Ala Ala Ile Arg Arg Leu Ala Ala Arg Arg Arg
1. 5 10 15
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИРРОЛОПИРИМИДИНА, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ JAK-КИНАЗЫ | 2012 |
|
RU2618673C2 |
| ПИРРОЛОПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2563644C2 |
| ПРОИЗВОДНЫЕ 4-АМИНО-6-ФЕНИЛПИРРОЛО[2,3] ПИРИМИДИНА, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩИМ ДЕЙСТВИЕМ В ОТНОШЕНИИ ДЕЙСТВИЯ ТИРОЗИНКИНАЗЫ, ИХ ПРИМЕНЕНИЕ И СПОСОБЫ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 2002 |
|
RU2318826C2 |
| ЗАМЕЩЕННЫЕ ПОЛИЦИКЛИЧЕСКИЕ ПИРАЗОЛЬНЫЕ ИНГИБИТОРЫ КИНАЗНОЙ АКТИВНОСТИ И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2655921C2 |
| C26-СВЯЗАННЫЕ АНАЛОГИ РАПАМИЦИНА В КАЧЕСТВЕ ИНГИБИТОРОВ mTOR | 2019 |
|
RU2826559C2 |
| ИНГИБИТОРЫ HPK1 И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2839132C2 |
| БИЦИКЛИЧЕСКИЕ АМИНЫ В КАЧЕСТВЕ НОВЫХ ИНГИБИТОРОВ JAK-КИНАЗЫ | 2018 |
|
RU2764980C2 |
| АЗАИНДОЛИЛПИРИДОНЫ И ДИАЗАИНДОЛИЛПИРИДОНЫ | 2018 |
|
RU2788659C2 |
| С40-, С28- И С-32-СВЯЗАННЫЕ АНАЛОГИ РАПАМИЦИНА В КАЧЕСТВЕ ИНГИБИТОРОВ MTOR | 2019 |
|
RU2805211C2 |
| СКОНДЕНСИРОВАННЫЕ С ГЕТЕРОЦИКЛИЧЕСКИМ КОЛЬЦОМ ПРОИЗВОДНЫЕ ПИРИМИДИНА | 1996 |
|
RU2136683C1 |

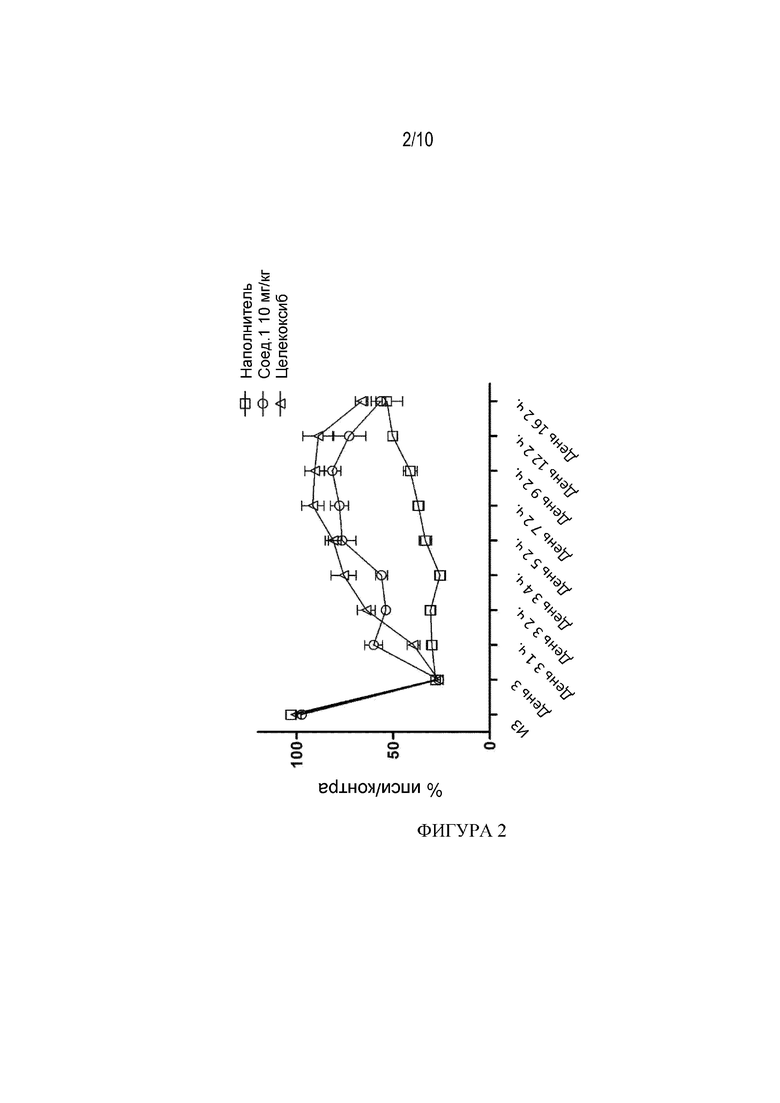
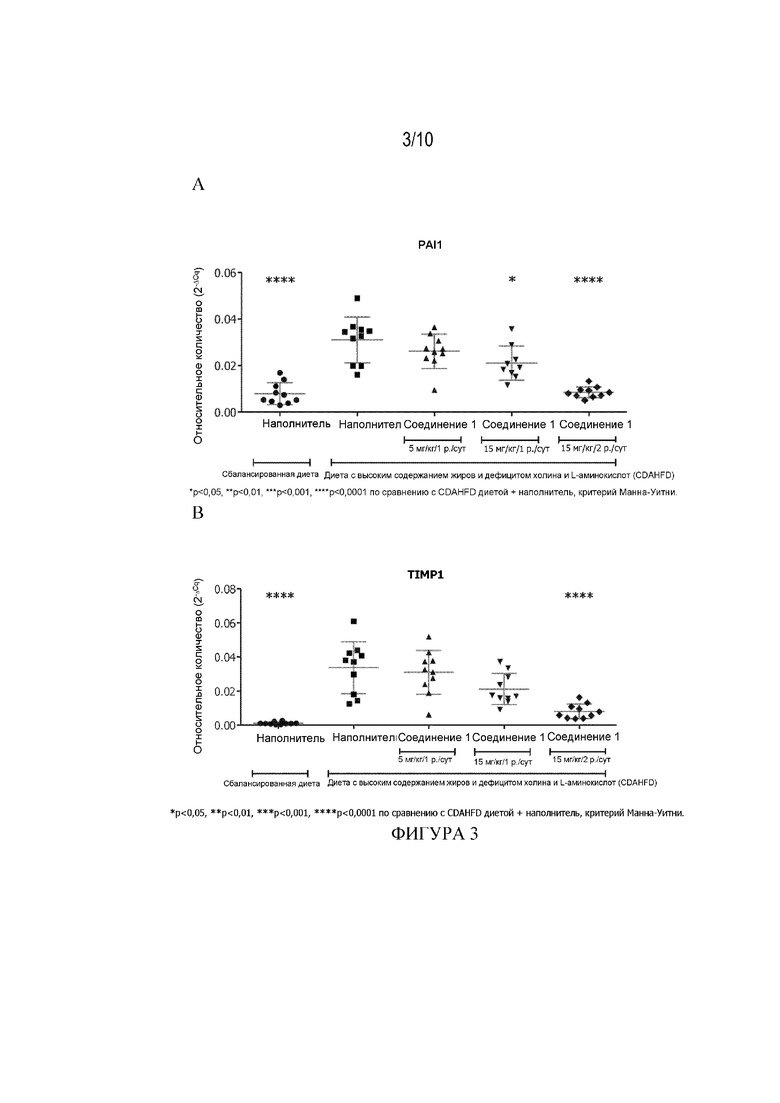
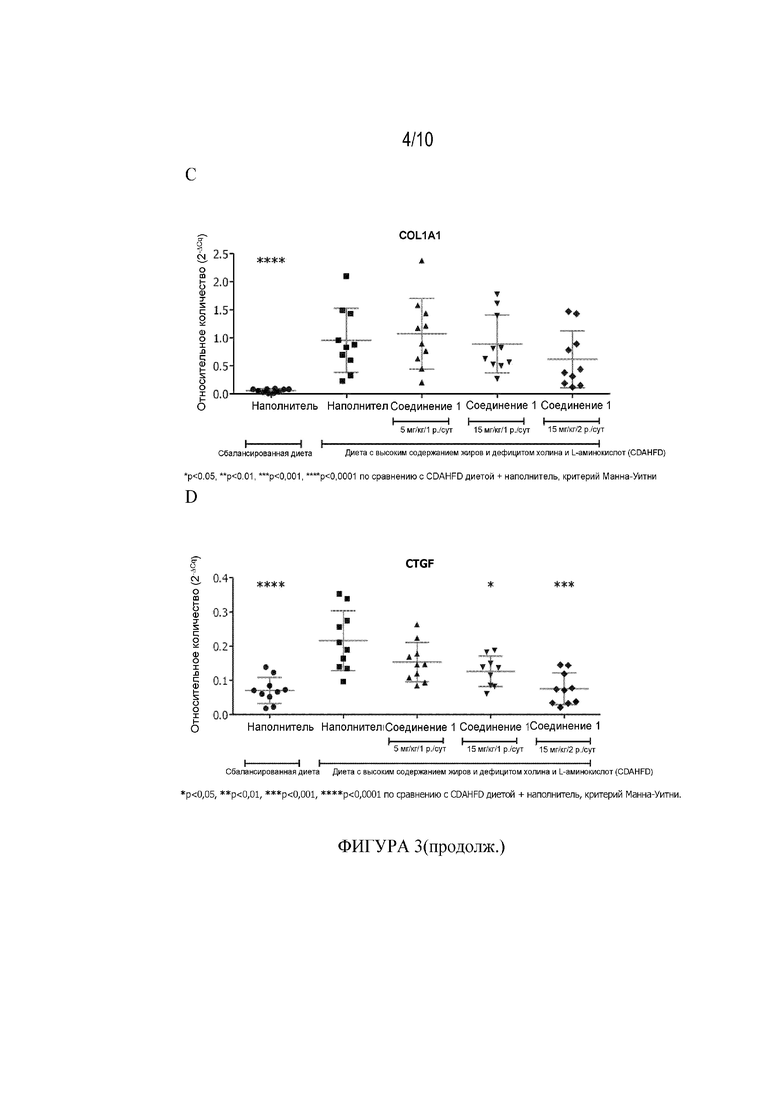
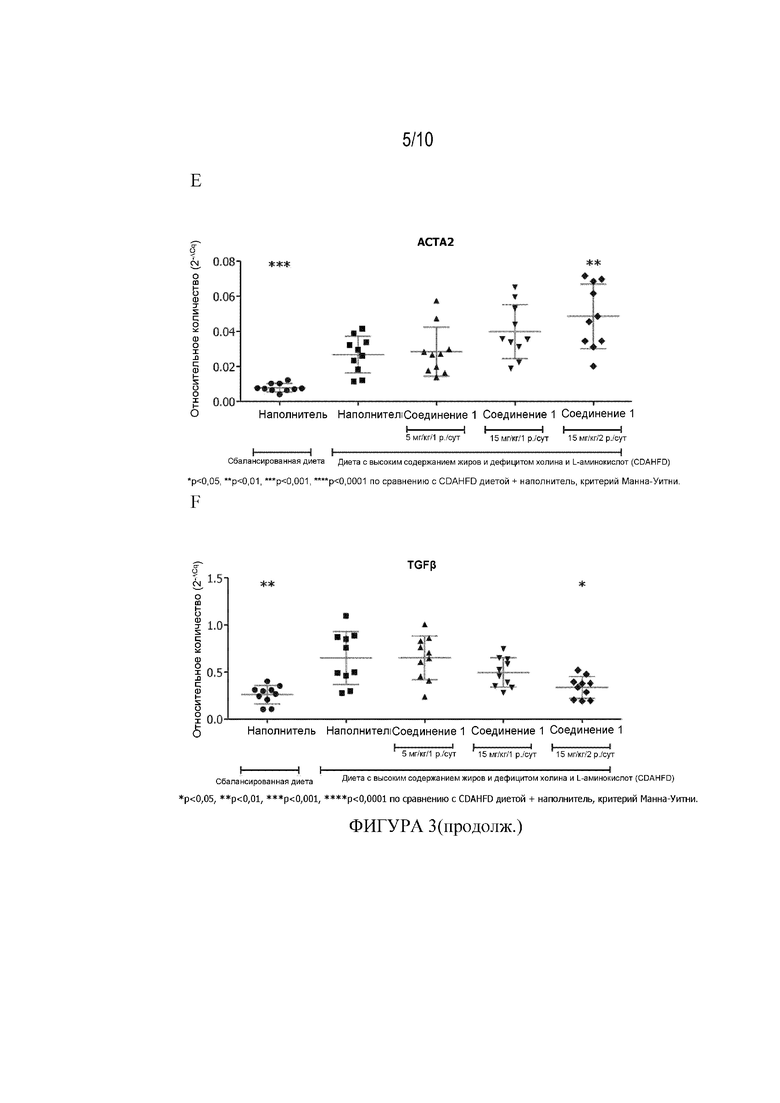
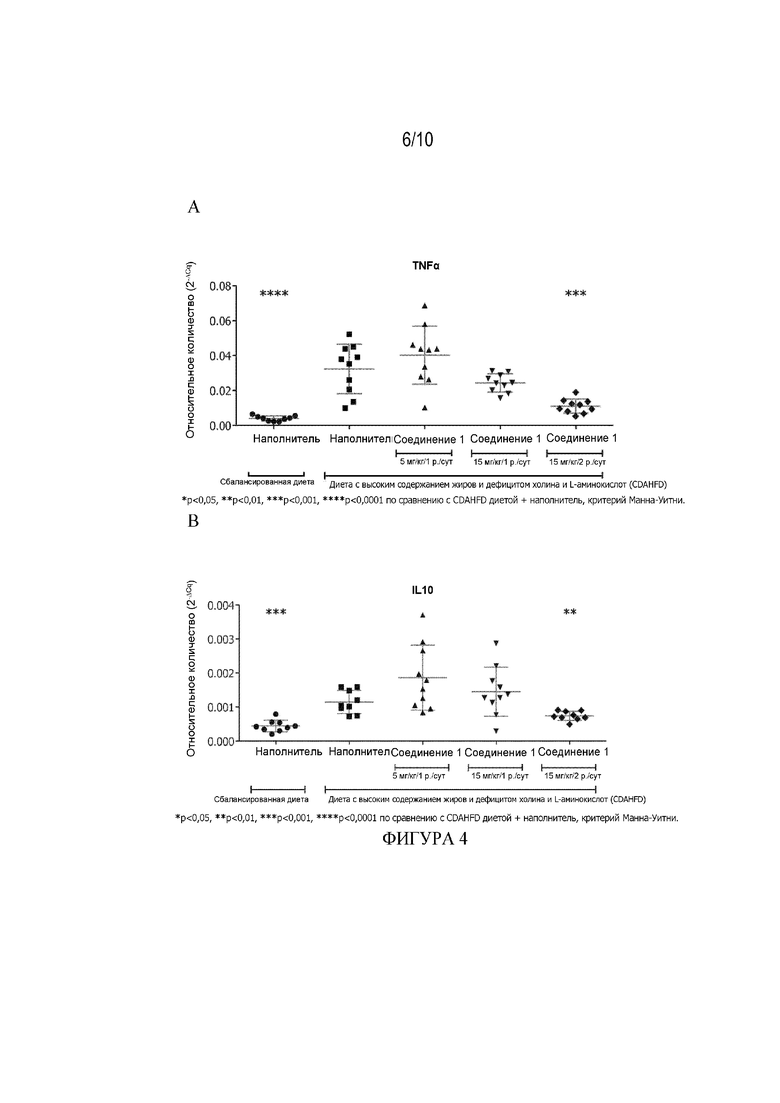




Изобретение относится к соединениям пирролопиримидина в соответствии с Формулой I, которые представляют собой ингибиторы ASK, в частности ингибиторы ASK1. Настоящее изобретение также относится к способам получения соединения по изобретению, фармацевтическим композициям, содержащим соединение по изобретению, для профилактики и/или лечения боли, воспалительных состояний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, неврологических заболеваний, осложнений диабета типа I, рака и/или фиброзных заболеваний. 3 н. и 8 з.п. ф-лы, 7 ил., 12 табл.
1. Соединение в соответствии с Формулой I:

где
R1 представляет собой Н, CH3, F или Cl;
Х представляет собой N, CH или С-CN; и
R2 представляет собой CH3 или галоген.
2. Соединение по п. 1, где R1 представляет собой F.
3. Соединение по п. 1 или 2, где R2 представляет собой CH3.
4. Соединение по пп. 1, 2 или 3, где Х представляют собой CH.
5. Соединение по пп. 1, 2 или 3, где Х представляют собой C-CN.
6. Соединение по пп. 1, 2 или 3, где Х представляют собой N.
7. Соединение по п. 1, где соединение выбирают из:
2-амино-5-фтор-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]пиридин-4-карбоксамида,
2-амино-5-метил-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]пиридин-4-карбоксамида,
2-амино-5-хлор-N-[1-(5-метил-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]-пиридин-4-карбоксамида,
2-амино-N-[1-(5-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]пиридин-4-карбоксамида,
2-амино-N-[1-(5-хлор-7H-пирроло[2,3-d]пиримидин-4-ил)-4-пиперидил]-5-фтор-пиридин-4-карбоксамида,
2-амино-N-[1-(5-циано-3-метил-1H-пирроло[2,3-b]пиридин-4-ил)-4-пиперидил]-5-фтор-пиридин-4-карбоксамида и
2-амино-N-[1-(3-хлор-1H-пирроло[2,3-b]пиридин-4-ил)-4-пиперидил]-5-фтор-пиридин-4-карбоксамида.
8. Фармацевтическая композиция для ингибирования ASK1, содержащая терапевтически эффективное количество соединения по любому из пп. 1-7 и фармацевтически приемлемый носитель.
9. Соединение по любому из пп. 1-7 или фармацевтическая композиция по п. 8 для применения в медицине.
10. Соединение по любому из пп. 1-7, или фармацевтическая композиция по п. 8 для применения с целью профилактики и/или лечения боли, воспалительных состояний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, неврологических заболеваний, осложнений диабета, рака и/или фиброзных заболеваний.
11. Способ получения соединения формулы I по п. 1, который включает:
(a) приведение в контакт соединения формулы II:
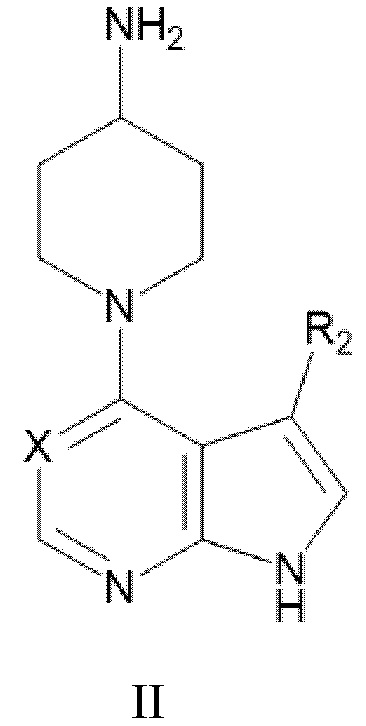
где X и R2 являются такими, как определено в п. 1, с соединением формулы III:
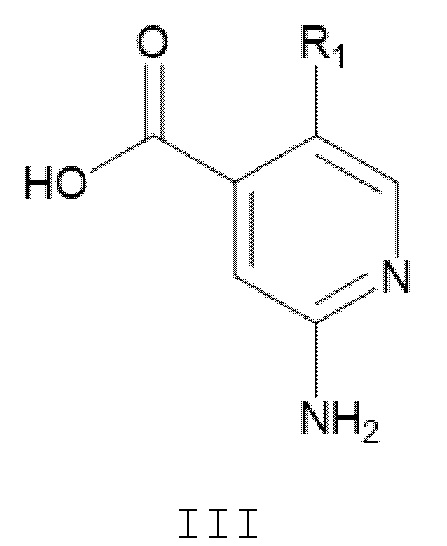
или его производным с защитной группой, где R1 является таким, как определено в п. 1;
(b) снятие защиты с производного с защитной группой соединения формулы I;
(c) взаимопревращение соединения формулы I или его производного с защитной группой с другим соединением формулы I или его производным с защитной группой.
| WO 2012080735 A1, 21.06.2012 | |||
| EA 201591018 A1, 29.01.2016 | |||
| WO 2015187499 A1, 10.12.2015 | |||
| Berge S | |||
| M | |||
| et al | |||
| "Pharmaceutical Salts", Journal of Pharmaceutical Sciences, 1977, Vol | |||
| Приспособление для соединения пучка кисти с трубкою или втулкою, служащей для прикрепления ручки | 1915 |
|
SU66A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Janos Berdy "Bioactive Microbial Metabolites", The Journal of Antibiotics, 2005, Vol | |||
| Способ окисления боковых цепей ароматических углеводородов и их производных в кислоты и альдегиды | 1921 |
|
SU58A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| интернет-источник | |||
Авторы
Даты
2022-05-19—Публикация
2018-07-12—Подача