ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В этой заявке заявлен приоритет к предварительной заявке на патент США № 62/665,426, поданной 1 мая 2018 и предварительной заявке на патент США № 62/752,881, поданной 30 октября 2018 и предварительной заявке на патент США № 62/836,040, поданной 18 апреля 2019, содержание которых включено сюда в качестве ссылки полностью.
ССЫЛКА НА СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Список последовательностей, связанный с этой заявкой, представлен в текстовом формате вместо бумажной копии, и поэтому включен в спецификацию в качестве ссылки. Наименование текстового файла, содержащего список последовательностей: REME_009_01WO_SeqList_ST25.txt. Текстовый файл составляет около 43 килобайта, создан 26 апреля 2019, и отправляется в электронном виде через EFS-Web.
ОБЛАСТЬ ТЕХНИКИ
Данное раскрытие относится к ингибиторам mTOR. Конкретно, варианты осуществления связаны с соединениями и композициями, ингибирующими mTOR, способами лечения заболеваний, медиированных mTOR и способами синтеза этих соединений.
УРОВЕНЬ ТЕХНИКИ
Мишенью рапамицина (mTOR) у млекопитающих является серин-треонинкиназа, родственная липидным киназам семейства фосфоинозитид-3-киназ (PI3K). mTOR существует в двух комплексах, mTORC1 и mTORC2, которые регулируются по-разному, обладают различной специфичностью к субстратам и по-разному чувствительны к рапамицину. mTORC1 интегрирует сигналы от рецепторов фактора роста с клеточным пищевым статусом и контролирует уровень кэп-зависимой трансляции мРНК, модулируя активность ключевых компонентов трансляции, таких как кэп-связывающий белок и онкоген eIF4E.
Сигнализация mTOR расшифровывается все более подробно. Различная фармакология ингибиторов mTOR была особенно информативной. Первый описанный ингибитор mTOR, рапамицин, теперь считается неполным ингибитором mTORC1. Рапамицин является селективным ингибитором mTORC1 через связывание с доменом связывания рапамицина FK506 (FRB) mTOR киназы с помощью FK506 связывающего белка 12 (FKBP12). FRB домен mTOR доступен в комплексе mTORC1, но менее доступен в комплексе mTORC2. Интересно, что эффективность ингибирующей активности против последующих субстратов mTORC1 при лечении рапамицином, как известно, различается среди субстратов mTORC1. Например, рапамицин сильно ингибирует фосфорилирование mTORC1 субстрата S6K и, косвенно, фосфорилирование последующего рибосомного белка S6, который контролирует рибосомный биогенез. С другой стороны, рапамицин проявляет лишь частичную ингибирующую активность в отношении фосфорилирования 4E-BP1, основного регулятора eIF4E, который контролирует инициацию кэп-зависимой трансляции. В результате представляют интерес более полные ингибиторы передачи сигналов mTORC1.
Был описан второй класс ингибиторов «АТФ-сайта» mTOR киназы. Этот класс ингибиторов mTOR будет называться TORi (ингибитор АТФ сайта TOR). Молекулы конкурируют с АТФ, субстратом киназной реакции, в активном сайте mTOR киназы (и поэтому также являются ингибиторами активного сайта mTOR). В результате эти молекулы ингибируют последующее фосфорилирование более широкого диапазона субстратов.
Хотя ингибирование mTOR может иметь эффект блокирования фосфорилирования 4E-BP1, эти агенты могут также ингибировать mTORC2, что приводит к блокированию активации Akt из-за ингибирования фосфорилирования Akt S473.
В настоящем документе, среди прочего, описаны ингибиторы mTOR. В некоторых вариантах реализации, соединения, раскрытые в данном документе, являются более селективными ингибиторами mTORC1 по сравнению с mTORC2. В некоторых вариантах реализации, соединения, раскрытые в данном документе, являются более селективными ингибиторами mTORC2 по сравнению с mTORC1. В некоторых вариантах реализации, соединения, раскрытые в настоящем документе, не проявляют разницы в селективности между mTORC1 и mTORC2.
СУЩНОСТЬ РАСКРЫТИЯ
Данное раскрытие относится к соединениям, способным ингибировать активность mTOR. Данное раскрытие дополнительно представляет способ получения соединений данного раскрытия, фармацевтические препараты, содержащие такие соединения, и способы применения таких соединений и композиций в управлении заболеваниями или расстройствами, медиированным mTOR.
В данном раскрытии представлены соединения формулы Iа:
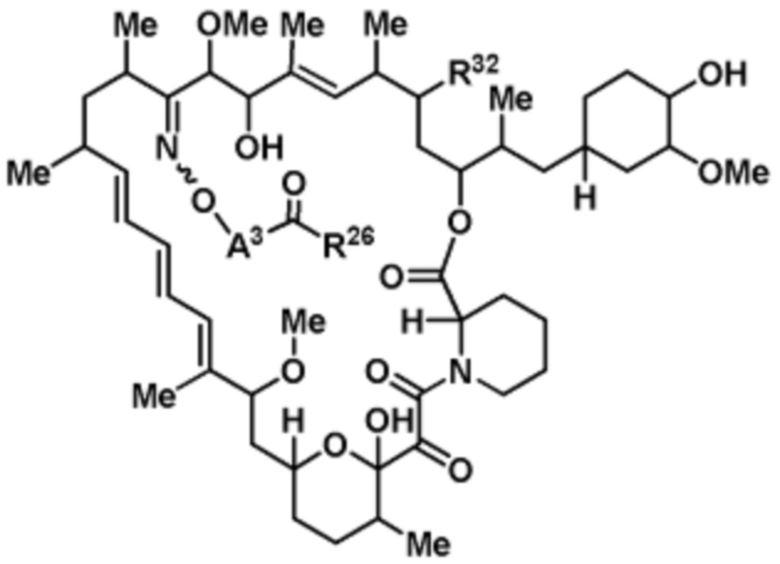 (Iа)
(Iа)
или его фармацевтически приемлемая соль или таутомер, где:
R32 является -Н, =O, -OR3 или -N3;
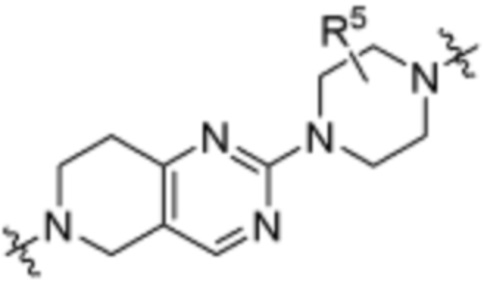
A3 является -[C(R3)2]n-, (C6-C10)ариленом, циклоалкиленом, гетероариленом или гетероциклиленом;
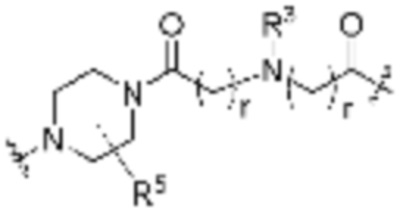
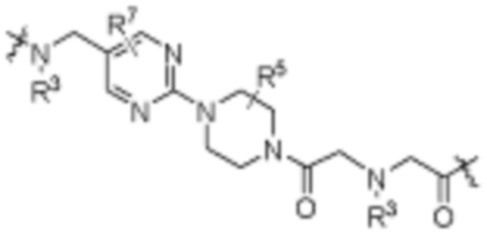
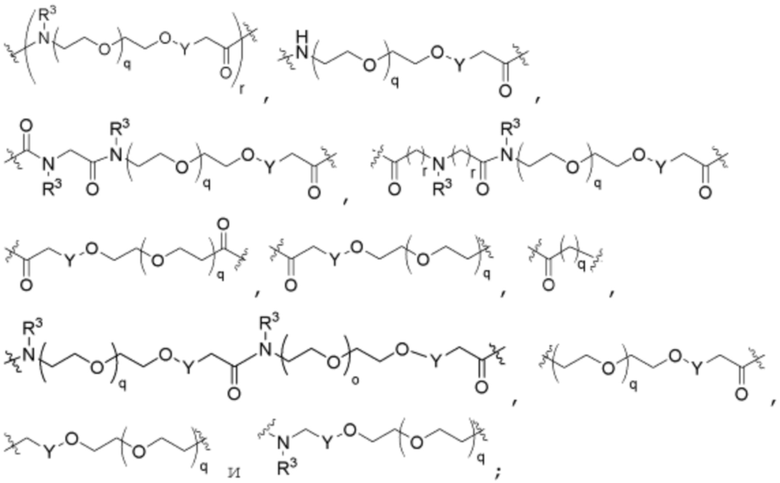
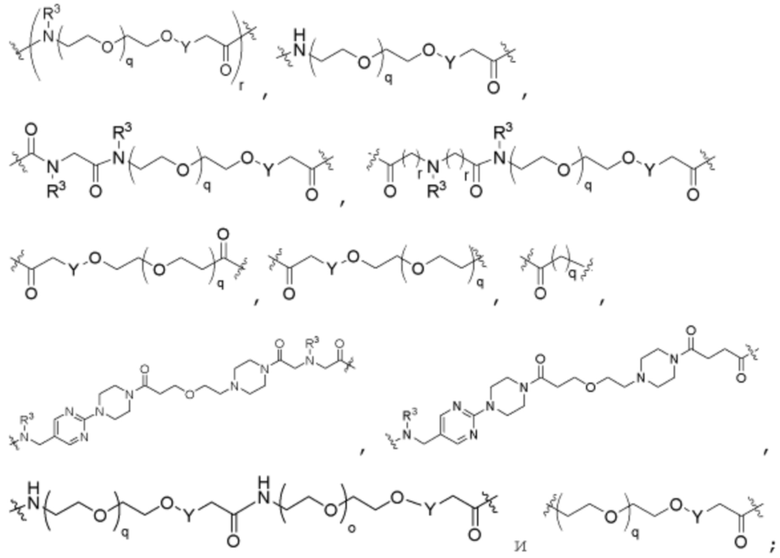
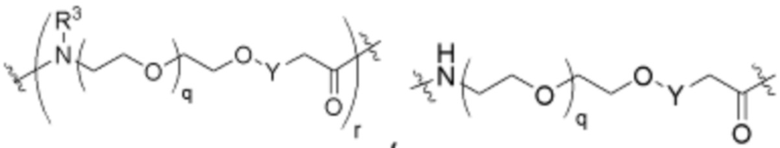
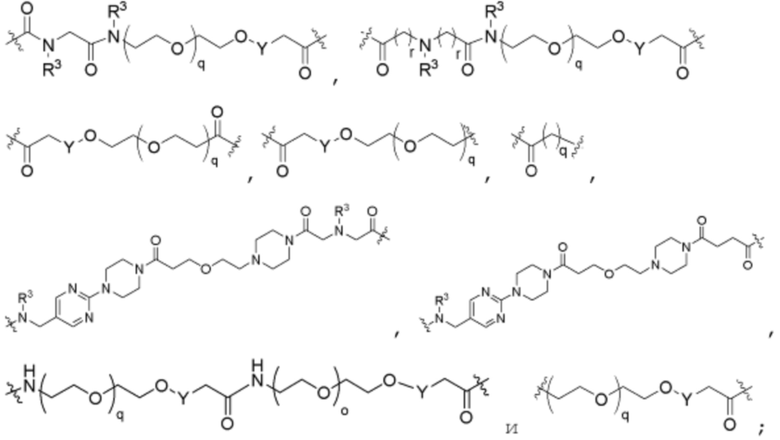
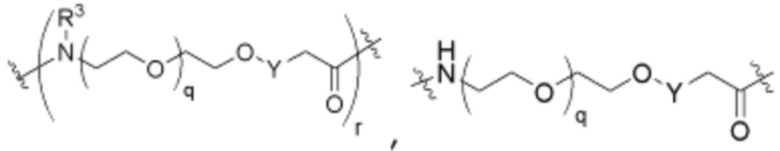
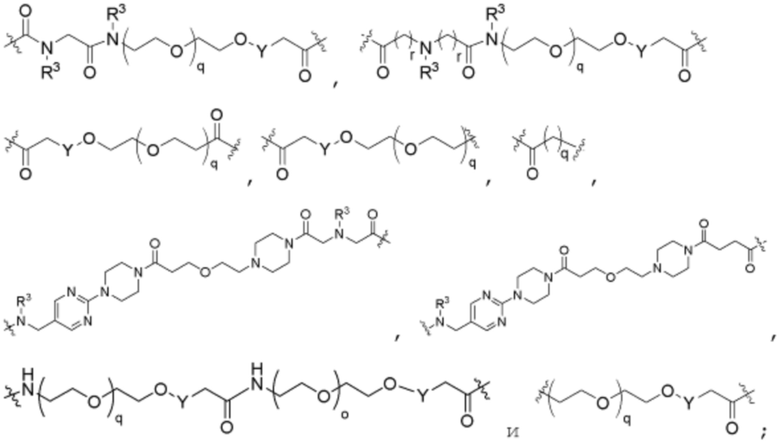
R26 является -A1-L1-A2-B; -A1-A2-B; -L2-A1-L1-A2-L3-B; или -ОН;
A1 и A2 независимо отсутствуют или независимо выбраны из
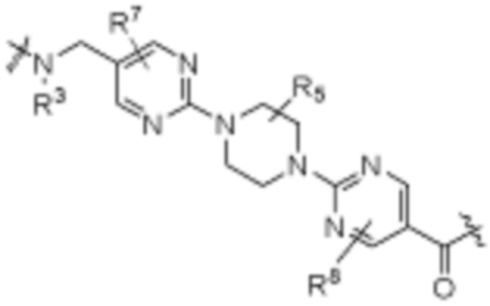 ,
,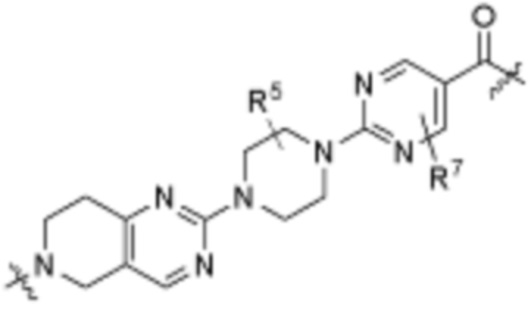 ,
,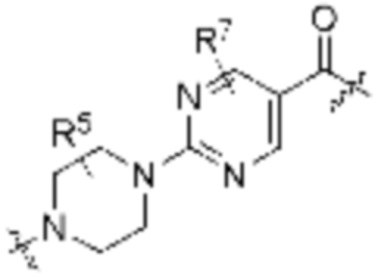 ,
,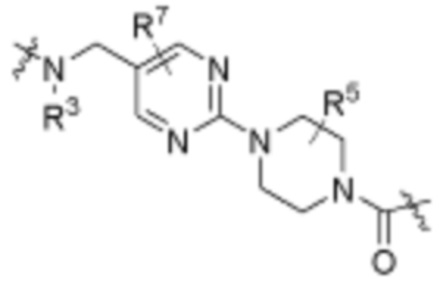 ,
,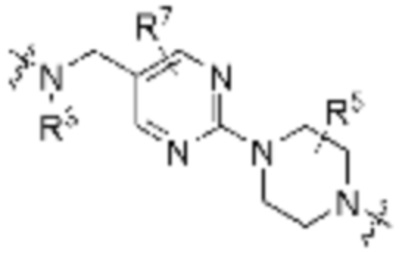 ,
,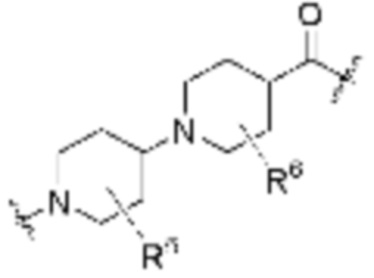 ,
,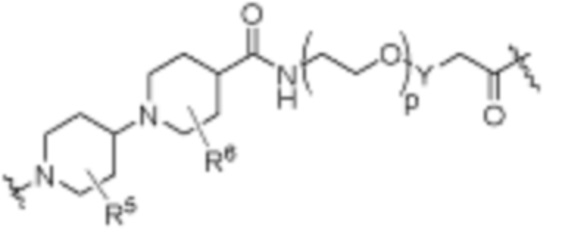 ,
, ,
,  ,
,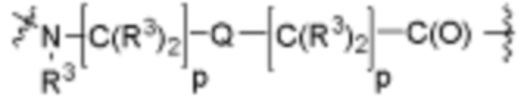 ,
,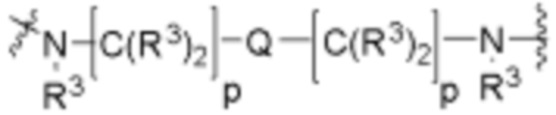 ,
,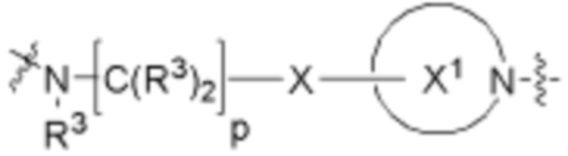 ,
,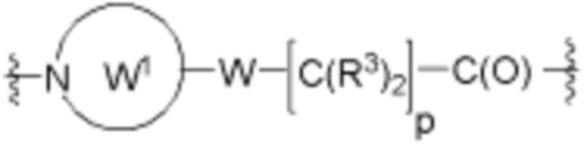 ,
,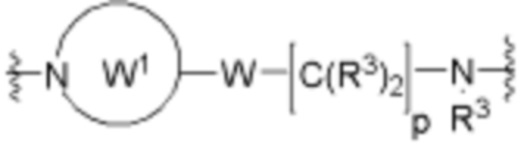 ,
, ,
,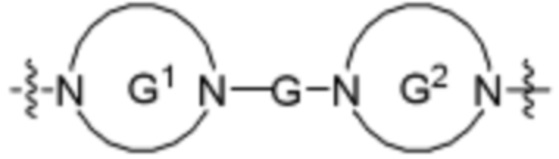 ,
, ,
, ,
, и
и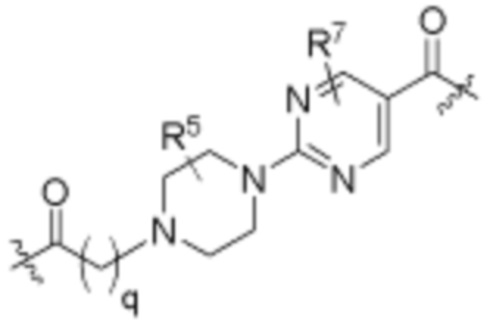 ;
;
где связь на левой стороне A1, как изображено, связана с -C(=O)- или L2; и где связь на правой стороне группы A2, как изображено, связана с B или L3;
каждый Q независимо является 1-3 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый X независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый X1 независимо является гетероариленовым или гетероциклиленовым кольцом;
каждый W независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый W1 независимо является гетероариленовым или гетероциклиленовым кольцом;
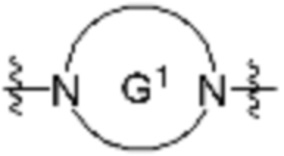
каждый G независимо отсутствует или является кольцом, выбранным из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый G1 и G2 независимо является гетероариленовым или гетероциклиленовым кольцом;
каждый L1 независимо выбирают из
L2 и L3 независимо отсутствуют или независимо выбраны из
каждый B независимо выбирают из
 ,
,
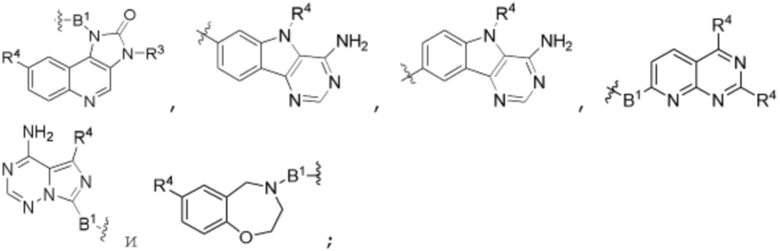
каждый B1 независимо выбирают из  NR3-(C(R3)2)n-,
NR3-(C(R3)2)n-,  NR3-(C(R3)2)n-(C6-C10)арилен-(C(R3)2)n-,
NR3-(C(R3)2)n-(C6-C10)арилен-(C(R3)2)n-,  NR3-(C(R3)2)n-гетероарилена-,
NR3-(C(R3)2)n-гетероарилена-,  (C6-C10)арилена-,
(C6-C10)арилена-,  NR3-(C(R3)2)n-NR3C(O)-,
NR3-(C(R3)2)n-NR3C(O)-,  NR3-(C(R3)2)n-гетероариленгетероциклилен-(C6-C10)арилена-,
NR3-(C(R3)2)n-гетероариленгетероциклилен-(C6-C10)арилена-,  гетероариленгетероциклилен-(C6-C10)арилена-,
гетероариленгетероциклилен-(C6-C10)арилена-, 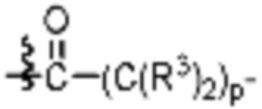 ,
, 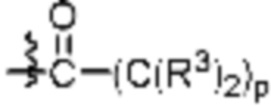 -гетероарилена,
-гетероарилена,  ,
, 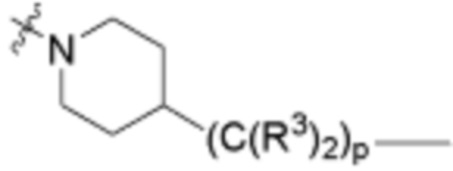 ,
, 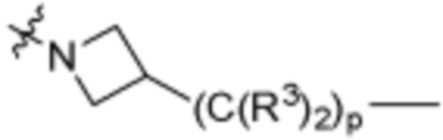 ,
, 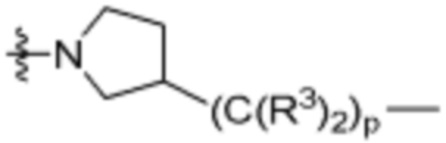 ,
,  (С6-С10)арилена,
(С6-С10)арилена, 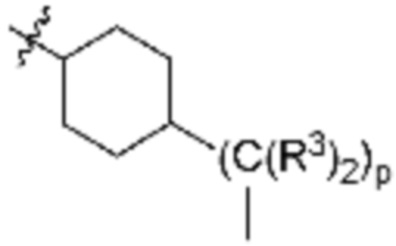 ,
,  гетероарилена-,
гетероарилена-,  гетероциклиленарилена- и
гетероциклиленарилена- и  NR3-(C(R3)2)n-S(O)2-арилен-C(O)-, где
NR3-(C(R3)2)n-S(O)2-арилен-C(O)-, где  связь на левой стороне B1, как изображено, связана с A2 или L1; и где гетероарилен, гетероциклилен и арилен каждый независимо необязательно замещен алкилом, гидроксиалкилом, галоалкилом, алкокси, галогеном или гидроксилом;
связь на левой стороне B1, как изображено, связана с A2 или L1; и где гетероарилен, гетероциклилен и арилен каждый независимо необязательно замещен алкилом, гидроксиалкилом, галоалкилом, алкокси, галогеном или гидроксилом;
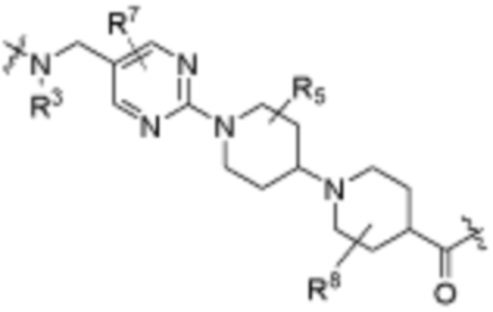
каждый R3 независимо является H или (C1-C6)алкилом;
каждый R4 независимо является H, (C1-C6)алкилом, галогеном, 5-12-членным гетероарилом, 5-12-членным гетероциклилом, (C6-C10)арилом, где гетероарил, гетероциклил и арил каждый независимо необязательно замещен -N(R3)2, -OR3, галогеном, (C1-C6)алкилом, -(C1-C6)алкиленгетероарилом, -(C1-C6)алкилен-CN, -C(O)NR3-гетероарилом или -C(O)NR3-гетероциклилом;
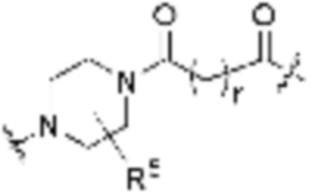
каждый R5 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил из (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый R6 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый R7 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый R8 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый Y независимо является -C(R3)2 или связью;
каждый n независимо является целым числом от одного до 12;
каждый o независимо является целым числом от нуля до 30;
каждый p независимо является целым числом от нуля до 12;
каждый q независимо является целым числом от нуля до 30; и
каждый r независимо является целым числом от одного до 6.
В данном раскрытии представлены соединения формулы I:
 (I)
(I)
или его фармацевтически приемлемая соль или таутомер, где:
R32 является -Н, =O или -OR3;
A3 является -[C(R3)2]n-, (C6-C10)ариленом, циклоалкиленом, гетероариленом или гетероциклиленом;
R26 является -A1-L1-A2-B; -A1-A2-B; -L2-A1-L1-A2-L3-B; или -ОН;
A1 и A2 независимо отсутствуют или независимо выбраны из
 ,
, ,
, ,
, ,
, ,
, ,
, ,
, ,
,  ,
, ,
, ;
;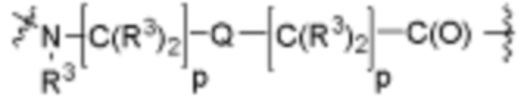 ,
,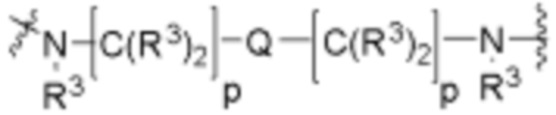 ,
,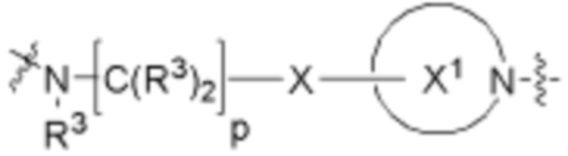 ,
,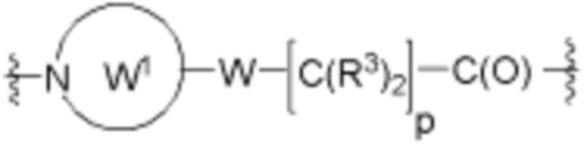 ,
,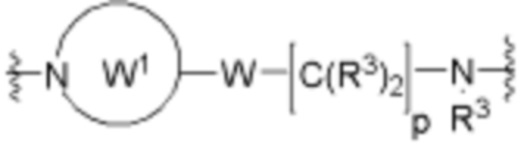 ,
, ,
,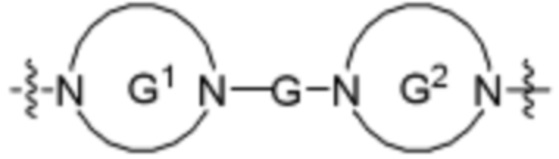 и,
и, ,
,
где связь на левой стороне A1, как изображено, связана с -C(=O)- или L2; и где связь на правой стороне группы A2, как изображено, связана с B или L3;
каждый Q независимо является 1-3 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый X независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый X1 является гетероариленовым или гетероциклиленовым кольцом;
каждый W независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый W1 является гетероариленовым или гетероциклиленовым кольцом;
каждый G независимо отсутствует или является кольцом, выбранным из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый G1 и G2 независимо является гетероариленовым или гетероциклиленовым кольцом;
каждый L1 независимо выбирают из
L2 и L3 независимо отсутствуют или независимо выбраны из
 ,
,
каждый B независимо выбирают из
каждый B1 независимо выбирают из  NR3-(C(R3)2)n-,
NR3-(C(R3)2)n-,  NR3-(C(R3)2)n-(C6-C10)арилен-(C(R3)2)n-,
NR3-(C(R3)2)n-(C6-C10)арилен-(C(R3)2)n-,  NR3-(C(R3)2)n-гетероарилена-,
NR3-(C(R3)2)n-гетероарилена-,  (C6-C10)арилена-,
(C6-C10)арилена-,  NR3-(C(R3)2)n-NR3C(O)-,
NR3-(C(R3)2)n-NR3C(O)-,  NR3-(C(R3)2)n-гетероариленгетероциклилен-(C6-C10)арилена-,
NR3-(C(R3)2)n-гетероариленгетероциклилен-(C6-C10)арилена-,  гетероариленгетероциклилен-(C6-C10)арилена-,
гетероариленгетероциклилен-(C6-C10)арилена-, 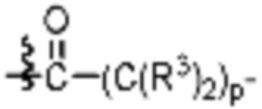 ,
, 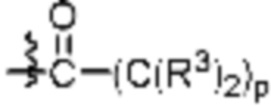 -гетероарилена,
-гетероарилена,  ,
,  ,
,  ,
,  ,
,  (С6-С10)арилена,
(С6-С10)арилена,  ,
,  гетероарилена-,
гетероарилена-,  гетероциклиленарилена- и
гетероциклиленарилена- и  NR3-(C(R3)2)n-S(O)2-арилен-C(O)-, где
NR3-(C(R3)2)n-S(O)2-арилен-C(O)-, где  связь на левой стороне B1, как изображено, связана с A2, L3 или L1; и где гетероарилен, гетероциклилен и арилен каждый независимо необязательно замещен алкилом, гидроксиалкилом, галоалкилом, алкокси, галогеном или гидроксилом;
связь на левой стороне B1, как изображено, связана с A2, L3 или L1; и где гетероарилен, гетероциклилен и арилен каждый независимо необязательно замещен алкилом, гидроксиалкилом, галоалкилом, алкокси, галогеном или гидроксилом;
каждый R3 независимо является H или (C1-C6)алкилом;
каждый R4 независимо является H, (C1-C6)алкилом, галогеном, 5-12-членным гетероарилом, 5-12-членным гетероциклилом, (C6-C10)арилом, где гетероарил, гетероциклил и арил каждый независимо необязательно замещен -N(R3)2, -OR3, галогеном, (C1-C6)алкилом, -(C1-C6)алкиленгетероарилом, -(C1-C6)алкилен-CN, -C(O)NR3-гетероарилом или -C(O)NR3-гетероциклилом;
каждый R5 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил из (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый R6 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил из (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый R7 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил из (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый R8 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил из (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый Y независимо является -C(R3)2 или связью;
каждый n независимо является целым числом от одного до 12;
каждый o независимо является целым числом от нуля до 30;
каждый p независимо является целым числом от нуля до 12;
каждый q независимо является целым числом от нуля до 30; и
каждый r независимо является целым числом от одного до 6.
В настоящем описании представлен способ лечения заболевания или расстройства, медиированного mTOR, включающий введение субъекту, страдающему или подверженному развитию заболевания или расстройства, медиированного mTOR, терапевтически эффективного количества одного или нескольких раскрытых соединений. В настоящем описании представлен способ профилактики заболевания или расстройства, медиированного mTOR, включающий введение субъекту, страдающему или подверженному развитию заболевания или расстройства, медиированного mTOR, терапевтически эффективного количества одного или нескольких описанных соединений. В настоящем описании представлен способ снижения риска заболевания или расстройства, медиированного mTOR, включающий введение субъекту, страдающему или подверженному развитию заболевания или расстройства, медиированного mTOR, терапевтически эффективного количества одного или более раскрытых соединений.
Другой аспект данного раскрытия относится к фармацевтической композиции, содержащей соединение формулы I, Ia или Ib, или фармацевтически приемлемую соль или таутомер любого из вышеперечисленных, и фармацевтически приемлемый носитель. Фармацевтически приемлемый носитель может дополнительно включать эксципиент, разбавитель или поверхностно-активное вещество. Фармацевтическая композиция может быть эффективной для лечения, профилактики или снижения риска заболевания или расстройства, медиированного mTOR, заболевания, медиированного mTOR, у субъекта, нуждающегося в этом.
Другой аспект данного раскрытия относится к соединению Формулы I, Ia или Ib, или фармацевтически приемлемой соли или таутомеру любого из вышеперечисленных для применения в лечении, профилактике или снижении риска заболевания или расстройства, медиированного mTOR, у субъекта, нуждающегося в этом.
Другой аспект данного раскрытия относится к применению соединения формулы I, Ia или Ib, или фармацевтически приемлемой соли или таутомера любого из вышеперечисленных в производстве лекарственного средства для лечения, профилактики или уменьшения риска заболевания или расстройства, медиированного mTOR, у субъекта, нуждающегося в этом.
В настоящем раскрытии также представлены соединения, которые можно использовать для ингибирования mTOR.
ПОДРОБНОЕ ОПИСАНИЕ РАСКРЫТИЯ
Настоящее раскрытие относится к ингибиторам mTOR. В частности, варианты осуществления относятся к соединениям и композициям, ингибирующим mTOR, способам лечения заболеваний, медиированных mTOR, и способам синтеза этих соединений.
Подробности раскрытия изложены в приложенном описании ниже. Хотя способы и материалы, подобные или эквивалентные описанным здесь, могут быть использованы на практике или при тестировании данного раскрытия, далее описаны иллюстративные способы и материалы. Другие особенности, цели и преимущества раскрытия будут очевидны из описания и формулы изобретения. В описании и прилагаемой формуле изобретения формы единственного числа также могут включать множественное число, если контекст явно не диктует иное. Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понимается специалистом в области, к которой принадлежит это раскрытие. Все патенты и публикации, цитируемые в этом описании, полностью включены в настоящий документ в качестве ссылки.
Термины
Артикли «а» и «an» используются в этом раскрытии и относятся к одному или более чем одному (т. е., по меньшей мере, одному) грамматическому объекту описания, если не указано иное. В качестве примера «элемент» может означать один элемент или более одного элемента, если не указано иное.
Термин «или» означает «и/или», если не указано иное. Термин «и/или» означает либо «и», либо «или», либо оба, если не указано иное.
Термин «необязательно замещенный», если не указано иное, означает, что группа может быть не замещена или замещена одним или более (например, 0, 1, 2, 3, 4 или 5 или более или любым диапазоном, производным от нее) заместителями, перечисленными для этой группы, в которой указанные заместители могут быть одинаковыми или разными. В одном варианте осуществления, необязательно замещенная группа имеет 1 заместитель. В другом варианте осуществления, необязательно замещенная группа имеет 2 заместителя. В другом варианте осуществления, необязательно замещенная группа имеет 3 заместителя. В другом варианте осуществления, необязательно замещенная группа имеет 4 заместителя. В другом варианте осуществления, необязательно замещенная группа имеет 5 заместителей.
Термин «алкил» сам по себе или как часть другого заместителя означает, если не указано иное, прямую (т.е. неразветвленную) или разветвленную не циклическую углеродную цепь (или углерод) или их сочетание, которая может быть полностью насыщенной, моно - или полиненасыщенной и может включать двух- и многовалентные радикалы, имеющие указанное число атомов углерода (т.е. C1-C10 означает от одного до десяти атомов углерода). Примеры насыщенных углеводородных радикалов включают, но не ограничены ими, такие группы, как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, (циклогексил) метил, гомологи и изомеры, например, н-пентил, н-гексил, н-гептил, н-октил и подобные. Ненасыщенной алкильной группой является группа, имеющая одну или несколько двойных или тройных связей. Примеры ненасыщенных алкильных групп включают, но не ограничены ими, винил, 2-пропенил, кротил, 2-изопентенил, 2-(бутадиенил), 2,4-пентадиенил, 3-(1,4-пентадиенил), этинил, 1- и 3-пропинил, 3-бутинил и высшие гомологи и изомеры.
Термин «алкилен» сам по себе или как часть другого заместителя означает, если не указано иное, двухвалентный радикал, производный от алкила. Обычно алкильная (или алкиленовая) группа имеет от 1 до 24 атомов углерода, например как группы, имеющие 10 или меньше атомов углерода.
Термин «алкенил» означает алифатическую углеводородную группу, содержащую двойную связь углерод-углерод и которая может быть прямой или разветвленной, содержит от 2 до 6 атомов углерода в цепи. Некоторые алкенильные группы содержат от 2 до 4 атомов углерода в цепи. Разветвленный может означать, что одна или несколько низших алкильных групп, таких как метил, этил или пропил, присоединены к линейной алкенильной цепи. Примеры алкенильных групп включают этенил, пропенил, н-бутенил и изобутенил. C2-C6 алкенильной группой является алкенильная группа, содержащая от 2 до 6 атомов углерода.
Термин «алкенилен» сам по себе или как часть другого заместителя означает, если не указано иное, двухвалентный радикал, производный от алкена.
Термин «алкинил» означает алифатическую углеводородную группу, содержащую тройную связь углерод-углерод, которая может быть прямой или разветвленной, содержит от 2 до 6 атомов углерода в цепи. Некоторые алкинильные группы содержат от 2 до 4 атомов углерода в цепи. Разветвленный может означать, что одна или несколько низших алкильных групп, таких как метил, этил или пропил, присоединены к линейной алкинильной цепи. Примеры алкинильных групп включают этинил, пропинил, н-бутинил, 2-бутинил, 3-метилбутинил и н-пентинил. C2-C6 алкинильной группой является алкинильная группа, содержащая от 2 до 6 атомов углерода.
Термин «алкинилен» сам по себе или как часть другого заместителя означает, если не указано иное, двухвалентный радикал, производный от алкина.
Термин «циклоалкил» означает моноциклическое или полициклическое насыщенное или частично ненасыщенное углеродное кольцо, содержащее 3-18 атомов углерода. Примеры циклоалкильных групп включают, без ограничения, циклопропил, циклобутил, циклопентил, циклогексил, циклогептанил, циклооктанил, норборанил, норборенил, бицикло[2.2.2]октанил или бицикло[2.2.2]октенил. C3-C8 циклоалкилом является группа, содержащая от 3 до 8 атомов углерода. Циклоалкильная группа может быть конденсированной (например, декалин) или мостиковой (например, норборнан).
«Циклоалкилен» сам по себе или как часть другого заместителя означает двухвалентный радикал, производный от циклоалкила.
Термины «гетероциклил» или «гетероциклоалкил» или «гетероцикл» относятся к моноциклическому или полициклическому 3-24-членному кольцу, содержащему углерод и, по меньшей мере, один гетероатом, выбранный из кислорода, фосфора, азота и серы, и где нет делокализованных π-электронов (ароматичности), общих для углерода кольца или гетероатома(ов). Гетероциклильные кольца включают, но не ограничены ими, оксетанил, азетадинил, тетрагидрофуранил, пирролидинил, оксазолинил, оксазолидинил, тиазолинил, тиазолидинил, тиазолидинил, пиранил, тиопиранил, тетрагидропиранил, диоксалинил, пиперидинил, морфолинил, тиоморфолинил, тиоморфолинил S-оксид, тиоморфолинил S-диоксид, пиперазинил, азепинил, оксепинил, диазепинил, тропанил и гомотропанил. Гетероциклильное или гетероциклоалкильное кольцо также может быть конденсированным или мостиковым, например, может быть бициклическим кольцом.
«Гетероциклилен» или «гетероциклоалкилен» сам по себе или как часть другого заместителя означает двухвалентный радикал, производный от «гетероциклила», «гетероциклоалкила» или «гетероцикла».
Термин «арил» означает, если не указано иное, полиненасыщенный, ароматический углеводородный заместитель, который может быть одним кольцом или несколькими кольцами (предпочтительно от 1 до 3 колец), которые конденсированы вместе (т.е. конденсированное арильное кольцо) или связаны ковалентно. Конденсированное арильное кольцо может относиться к нескольким кольцам, конденсированным вместе, где, по меньшей мере, одно из конденсированных колец является арильным кольцом.
«Арилен» сам по себе или как часть другого заместителя означает двухвалентный радикал, производный от арила.
Термин «гетероарил» относится к арильной группе (или кольцам), которая содержит, по меньшей мере, один гетероатом, такой как N, O или S, где атом(ы) азота и серы необязательно окислены, а атом(ы) азота необязательно кватернизованы. Таким образом, термин «гетероарил» включает конденсированные кольцевые гетероарильные группы (т.е. несколько колец, конденсированных вместе, где, по меньшей мере, одним из конденсированных колец является гетероароматическое кольцо). 5,6-конденсированный кольцевой гетероарилен относится к двум кольцам, конденсированным вместе, где одно кольцо имеет 5 членов, и другое кольцо имеет 6 членов, и где, по меньшей мере, одно кольцо является гетероарильным кольцом. Также, 6,6-конденсированный кольцевой гетероарилен относится к двум кольцам, конденсированным вместе, где одно кольцо имеет 6 членов, и другое кольцо имеет 6 членов, и где, по меньшей мере, одно кольцо является гетероарильным кольцом. И 6,5-конденсированный кольцевой гетероарилен относится к двум кольцам, конденсированным вместе, где одно кольцо имеет 6 членов, и другое кольцо имеет 5 членов, и где, по меньшей мере, одно кольцо является гетероарильным кольцом. Гетероарильная группа может быть присоединена к остальной части молекулы через углерод или гетероатом. Неограничивающие примеры арильных и гетероарильных групп включают фенил, 1-нафтил, 2-нафтил, 4-бифенил, 1-пирролил, 2-пирролил, 3-пирролил, 3-пиразолил, 2-имидазолил, 4-имидазолил, пиразинил, 2-оксазолил, 4-оксазолил, 2-фенил-4-оксазолил, 5-оксазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3-фурил, 2-тиенил, 3-тиенил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 5-бензотиазолил, пуринил, 2-бензимидазолил, 5-индолил, 1-изохинолил, 5-изохинолил, 2-хиноксалинил, 5-хиноксалинил, 3-хинолил и 6-хинолил. Заместители для каждой из вышеупомянутых арильных и гетероарильных кольцевых систем выбирают из группы приемлемых заместителей, описанных в данном документе.
Термин «гетероарил» может также включать множественные конденсированные кольцевые системы, которые имеют, по меньшей мере, одно такое ароматическое кольцо, и эти множественные конденсированные кольцевые системы дополнительно описаны ниже. Термин может также включать множественные конденсированные кольцевые системы (например, кольцевые системы, содержащие 2, 3 или 4 кольца), где гетероарильная группа, как определено выше, может быть конденсирована с одним или несколькими кольцами, выбранными из гетероарилов (с образованием, например, нафтиридинила, такого как 1,8-нафтиридинил), гетероциклов (с образованием, например, 1,2,3,4-тетрагидронафтиридинила, такого как 1,2,3,4-тетрагидро-1,8-нафтиридинил), карбоциклов (с образованием, например, 5,6,7,8-тетрагидрохинолила) и арилов (с образованием, например, индазолила) с образованием множественных конденсированных кольцевых систем. Кольца множественных конденсированных кольцевых систем могут быть соединены друг с другом с помощью конденсированных, спиро- и мостиковых связей, если это разрешено требованиями валентности. Следует понимать, что отдельные кольца множественных конденсированных кольцевых систем могут быть соединены в любом порядке относительно друг друга. Также следует понимать, что точка присоединения множественной конденсированной кольцевой системы (как определено выше для гетероарила) может находиться в любом положении множественной конденсированной кольцевой системы, включая гетероарильную, гетероцикловую, арильную или карбоциклическую часть множественной конденсированной кольцевой системы, и на любом подходящем атоме множественной конденсированной кольцевой системы, включая атом углерода и гетероатом (например, азот).
«Гетероарилен» сам по себе или как часть другого заместителя означает двухвалентный радикал, производный от гетероарила.
Не ограничивающие примеры арильных и гетероарильных групп включают пиридинил, пиримидинил, тиофенил, тиенил, фуранил, индолил, бензоксадиазолил, бензодиоксолил, бензодиоксанил, тианафтанил, пирролопиридинил, индазолил, хинолинил, хиноксалинил, пиридопиразинил, хиназолинонил, бензоизоксазолил, имидазопиридинил, бензофуранил, бензотиенил, бензотиофенил, фенил, нафтил, бифенил, пирролил, пиразолил, имидазолил, пиразинил, оксазолил, изоксазолил, тиазолил, фурилтиенил, пиридил, пиримидил, бензотиазолил, пуринил, бензимидазолил, изохинолил, тиадиазолил, оксадиазолил, пирролил, диазолил, триазолил, тетразолил, бензотиадиазолил, изотиазолил, пиразолопиримидинил, пирролопиримидинил, бензотриазолил, бензоксазолил или хинолил. Приведенные выше примеры могут быть замещенными или незамещенными, и двухвалентные радикалы каждого примера гетероарила, приведенного выше, являются не ограничивающими примерами гетероарилена. Гетероарильная группа может включать один кольцевой гетероатом (например, O, N или S). Гетероарильная группа может включать два необязательно разных кольцевых гетероатома (например, O, N или S). Гетероарильная группа может включать три необязательно разных кольцевых гетероатома (например, O, N или S). Гетероарильная группа может включать четыре необязательно разных кольцевых гетероатома (например, O, N или S). Гетероарильная группа может включать пять необязательно разных кольцевых гетероатомов (например, O, N или S). Арильная группа может иметь одно кольцо. Арильная группа может иметь два необязательно разных кольца. Арильная группа может иметь три необязательно разных кольца. Арильная группа может иметь четыре необязательно разных кольца. Гетероарильная группа может иметь одно кольцо. Гетероарильная группа может иметь два необязательно разных кольца. Гетероарильная группа может иметь три необязательно разных кольца. Гетероарильная группа может иметь четыре необязательно разных кольца. Гетероарильная группа может иметь пять необязательно разных колец.
Термины «гало» или «галоген» сами по себе или как часть другого заместителя означают, если не указано иное, атом фтора, хлора, брома или йода. Кроме того, такие термины, как «галоалкил», могут включать моногалоалкил и полигалоалкил. Например, термин «гало(C1-C4)алкил» может включать, но не ограничивается ими, фторметил, дифторметил, трифторметил, 2,2,2-трифторэтил, 4-хлорбутил, 3-бромпропил, 1-фтор-2-бромэтил и подобные.
Используемый здесь термин «гидроксил» означает -ОН.
Используемый здесь термин «гидроксиалкил» означает алкильную группу, как определено в данном описании, замещенную одной или несколькими, такими как одна, две или три, гидроксигруппами. В некоторых случаях один и тот же атом углерода не несет более одной гидроксигруппы. Типичные примеры включают, но не ограничиваются ими, гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 1-(гидроксиметил)-2-метилпропил, 2-гидроксибутил, 3-гидроксибутил, 4-гидроксибутил, 2,3-дигидроксипропил, 2-гидрокси-1-гидроксиметилэтил, 2,3-дигидроксибутил, 3,4-дигидроксибутил и 2-(гидроксиметил)-3-гидроксипропил.
Используемый здесь термин «оксо» означает кислород, который связан двойной связью с атомом углерода.
Используемой здесь замещающей группой может быть группа, выбранная из следующих групп:
(A) оксо, галоген, -CF3, -CN, -OH, -OCH3, -NH2, -COOH, -CONH2, -NO2, -SH, -SO3H, -SO4H, -SO2NH2, -NHNH2, -ONH2, -NHC=(O)NHNH2, -NHC=(O)NH2, -NHSO2H, -NHC=(O)H,-NHC(O)-OH, -NHOH, -OCF3, -OCHF2, -OCH2F, незамещенный алкил, незамещенный циклоалкил, незамещенный гетероциклоалкил, незамещенный арил, незамещенный гетероарил, и
(B) алкил, циклоалкил, гетероциклил, арил, гетероарил, замещенный, по меньшей мере, одним заместителем, выбранным из:
(i) оксо, галогена, -CF3, -CN, -OH, -OCH3, -NH2, -COOH, -CONH2, -NO2, -SH, -SO3H, -SO4H, -SO2NH2, -NHNH2, -ONH2, -NHC=(O)NHNH2, -NHC=(O)NH2, -NHSO2H, -NHC=(O)H, -NHC(O)-OH, -NHOH, -OCF3, -OCHF2, -OCH2F, незамещенного алкила, незамещенного гетероалкила, незамещенного циклоалкила, незамещенного гетероциклоалкила, незамещенного арила, незамещенного гетероарила и
(ii) алкила, гетероалкила, циклоалкила, гетероциклоалкила, арила, гетероарила, замещенного, по меньшей мере, одним заместителем, выбранным из:
(a) оксо, галогена, -CF3, -CN, -OH, -OCH3, -NH2, -COOH, -CONH2, -NO2, -SH, -SO3H, -SO4H, -SO2NH2, -NHNH2, -ONH2, -NHC=(O)NHNH2, -NHC=(O)NH2, -NHSO2H, -NHC=(O)H, -NHC(O)-OH, -NHOH, -OCF3, -OCHF2, -OCH2F, незамещенного алкила, незамещенного гетероалкила, незамещенного циклоалкила, незамещенного гетероциклоалкила, незамещенного арила, незамещенного гетероарила и
(b) алкила, гетероалкила, циклоалкила, гетероциклоалкила, арила, гетероарила, замещенного, по меньшей мере, одним заместителем, выбранным из: оксо, галогена, -CF3, -CN, -OH, -NH2, -COOH, -CONH2, -NO2, -SH, -SO3H, -SO4H, -SO2NH2, -NHNH2, -ONH2, -NHC=(O)NHNH2, -NHC=(O)NH2, -NHSO2H, -NHC=(O)H, -NHC(O)-OH, -NHOH, -OCF3, -OCHF2, незамещенного алкила, незамещенного гетероалкила, незамещенного циклоалкила, незамещенного гетероциклоалкила, незамещенного арила, незамещенного гетероарила.
«Эффективное количество» при использовании в сочетании с соединением представляет собой количество, эффективное для лечения или профилактики заболевания у субъекта, как описано в данном документе.
Термин «носитель», используемый в этом раскрытии, охватывает носители, эксципиенты и разбавители и может означать материал, композицию или носитель, такой как жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или инкапсулирующий материал, участвующие в переносе или транспортировке фармацевтического агента из одного органа или части тела в другой орган или часть тела субъекта.
Термин «лечение» по отношению к субъекту относится к уменьшению, по меньшей мере, одного из симптомов расстройства субъекта. Лечение может включать в себя излечение, улучшение или, по меньшей мере, частичное облегчение состояния.
Термин «предотвращать» или «профилактика» в отношении субъекта относится к профилактике поражения субъекта заболеванием или расстройством. Профилактика может включать профилактическое лечение. Например, профилактика может включать введение субъекту соединения, описанного в данном документе, до того, как субъект будет поражен заболеванием, и введение будет предохранять субъекта от поражения этим заболеванием.
Термин «расстройство» используется в этом раскрытии и означает и используется взаимозаменяемо с терминами заболевание, состояние или болезнь, если не указано иное.
Термин «вводить», «вводимый» или «введение», используемый в данном раскрытии, относится либо к прямому введению раскрытого соединения или фармацевтически приемлемой соли или таутомера раскрытого соединения или композиции субъекту, либо к введению производного пролекарства или аналога соединения или фармацевтически приемлемой соли или таутомера соединения или композиции субъекту, которые могут образовывать эквивалентное количество активного соединения в организме субъекта.
«Пациентом» или «субъектом» является млекопитающее, например, человек, мышь, крыса, морская свинка, собака, кошка, лошадь, корова, свинья или нечеловеческий примат, такой как обезьяна, шимпанзе, бабуин или резус.
Соединения
В данном раскрытии представлено соединение, имеющее структуру формулы (Iа)
 (Iа)
(Iа)
или его фармацевтически приемлемая соль или таутомер, где R32, A3 и R26 такие, как описаны выше.
В данном раскрытии представлено соединение, имеющее структуру формулы I
 (I)
(I)
или его фармацевтически приемлемая соль или таутомер, где R32, A3 и R26 такие, как описаны выше.
В данном раскрытии представлено соединение, имеющее структуру формулы Ib
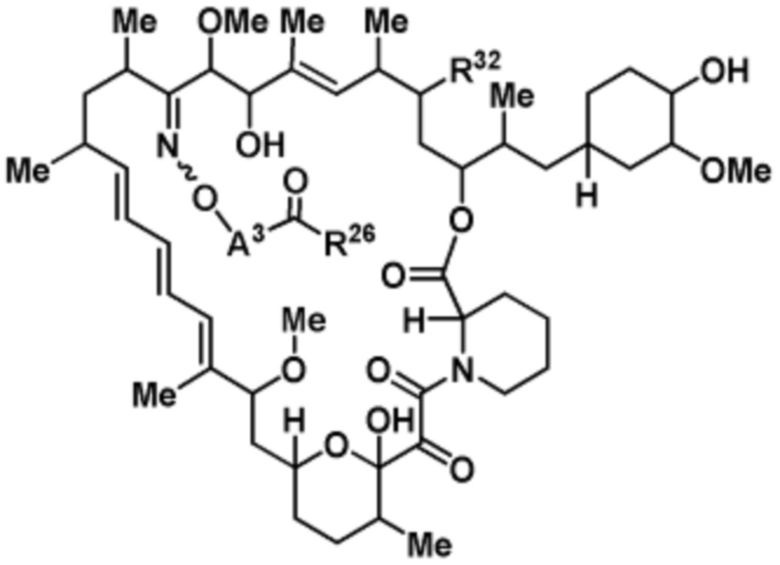 (Ib)
(Ib)
или его фармацевтически приемлемая соль или таутомер, где R32, A3 и R26 такие, как описаны выше.
В определенных вариантах осуществления, соединение имеет следующую формулу:
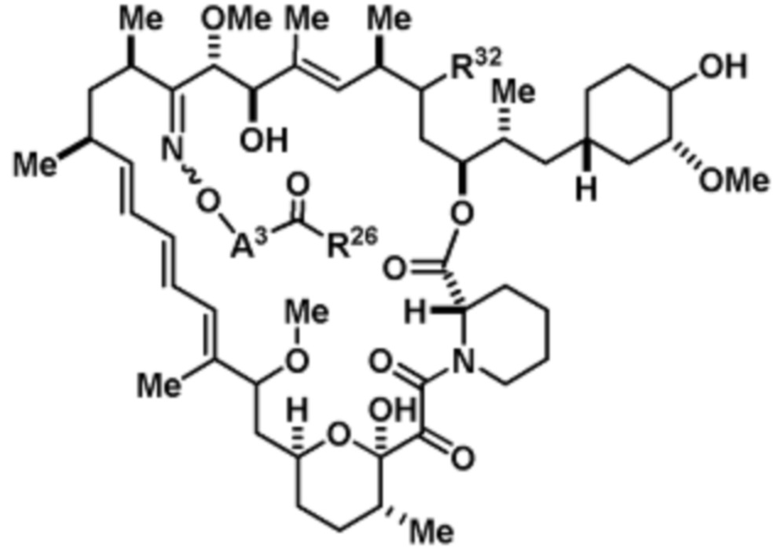
или его фармацевтически приемлемая соль или таутомер.
В определенных вариантах осуществления, R32 является =O. В определенных вариантах осуществления, R32 является -OR3. В определенных вариантах осуществления, R32 является H. В определенных вариантах осуществления, R32 является -N3.
В определенных вариантах осуществления, A3 является -[C(R3)2]n-. В определенных вариантах осуществления, A3 является CH2. В определенных вариантах осуществления, A3 является (C6-C10)ариленом. В определенных вариантах осуществления, A3 является циклоалкиленом. В определенных вариантах осуществления, A3 является гетероариленом. В определенных вариантах осуществления, A3 является гетероциклиленом.
В определенных вариантах осуществления, R26 является -OH.
В определенных вариантах осуществления, R26 является -A1-L1-A2-B. В определенных вариантах осуществления, R26 является -A1-A2-B. В определенных вариантах осуществления, R26 является -L2-A1-L1-A2-L3-B.
В определенных вариантах осуществления, R26 является -A1-L1-A2-B. В определенных вариантах осуществления, R26 является -A1-L1-A2-B, где A1 и A2 отсутствуют. В определенных вариантах осуществления, R26 является -A1-L1-A2-B, где A2 отсутствует. В определенных вариантах осуществления, R26 является -A1-L1-A2-B, где A1 отсутствует.
В определенных вариантах осуществления, R26 является -A1-A2-B. В определенных вариантах осуществления, R26 является -L2-A1-L1-A2-L3-B, где L2 и A1 отсутствуют. В определенных вариантах осуществления, R26 является -L2-A1-L1-A2-L3-B, где L2 отсутствует. В определенных вариантах осуществления, R26 является -L2-A1-L1-A2-L3-B, где L3 отсутствует.
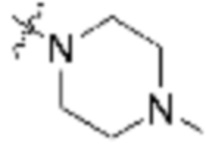
Как описано выше, каждый L1 независимо выбирают из

Как описано выше для формулы Ia, каждый L1 независимо выбирают из

В определенных вариантах осуществления, L1 является 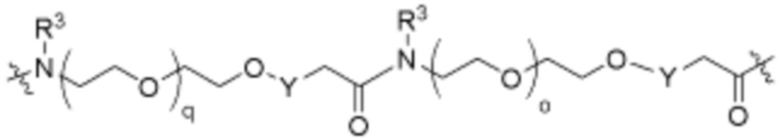 .
.
В определенных вариантах осуществления, L1 является 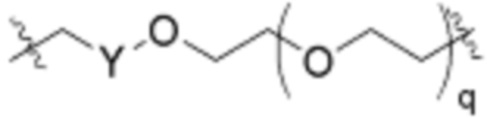 .
.
В определенных вариантах осуществления, L1 является 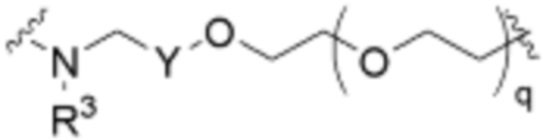 .
.
В определенных вариантах осуществления, является 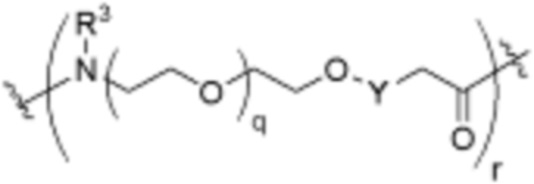 .
.
В определенных вариантах осуществления, L1 является 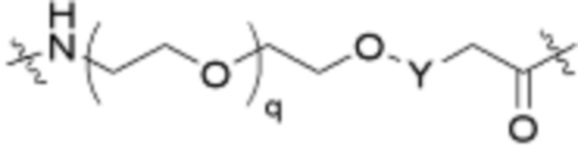 .
.
В определенных вариантах осуществления, L1 является 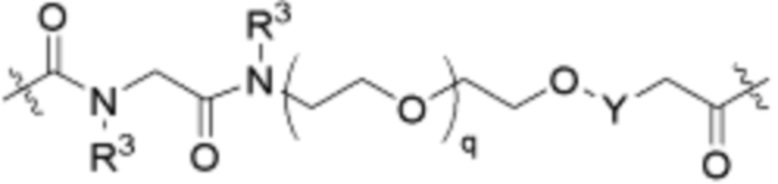 .
.
В определенных вариантах осуществления, L1 является 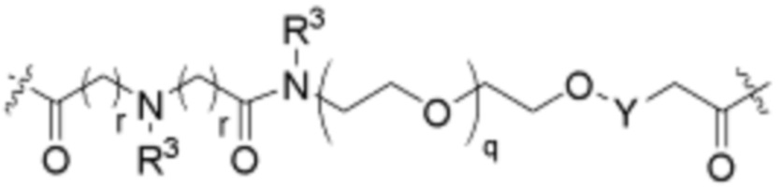 .
.
В определенных вариантах осуществления, L1 является 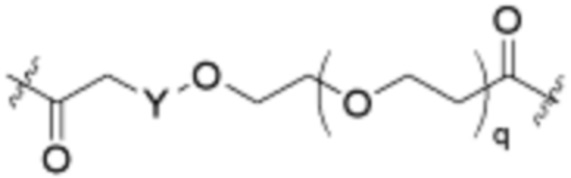 .
.
В определенных вариантах осуществления, L1 является 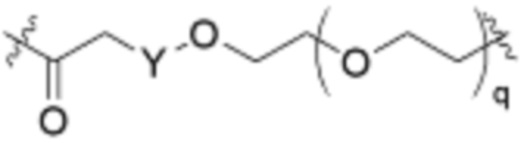 .
.
В определенных вариантах осуществления, L1 является 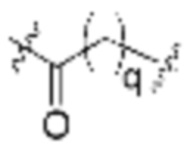 .
.
В определенных вариантах осуществления, L1 является  .
.
В определенных вариантах осуществления, L1 является  .
.
В определенных вариантах осуществления, L1 является 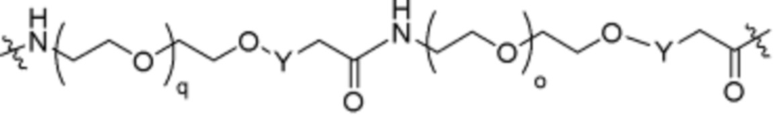 или
или 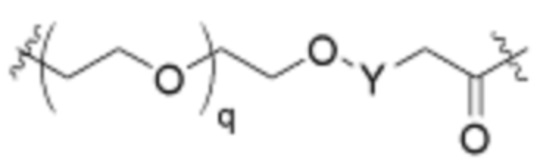 .
.
Как описано выше, L2 и L3 независимо отсутствуют, или независимо выбраны из
 ,
,
Как описано выше для формулы Ia, L2 и L3 независимо отсутствуют, или независимо выбраны из
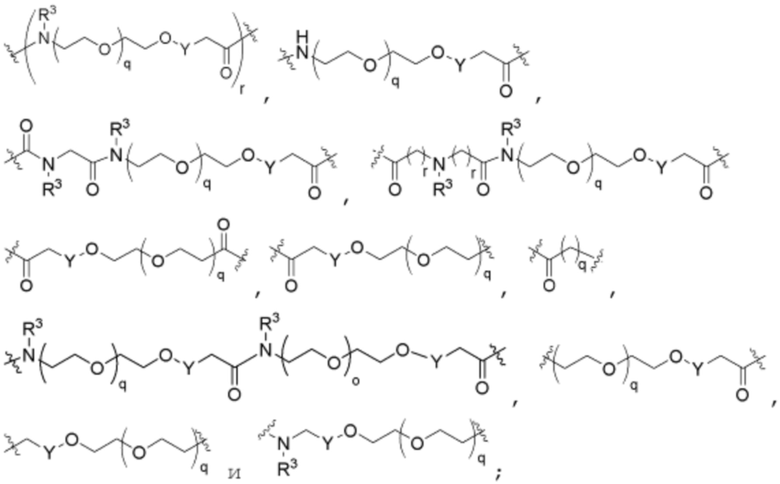
В определенных вариантах осуществления, L2 отсутствует.
В определенных вариантах осуществления, L2 является 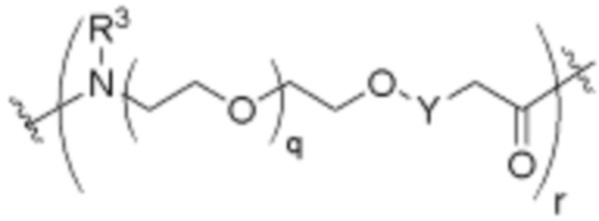 .
.
В определенных вариантах осуществления, L2 является 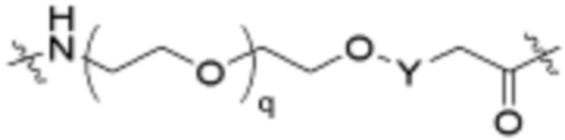 .
.
В определенных вариантах осуществления, L2 является 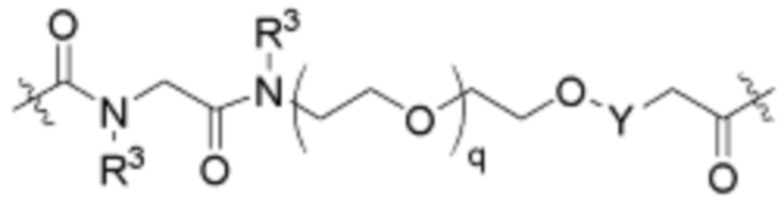 .
.
В определенных вариантах осуществления, L2 является 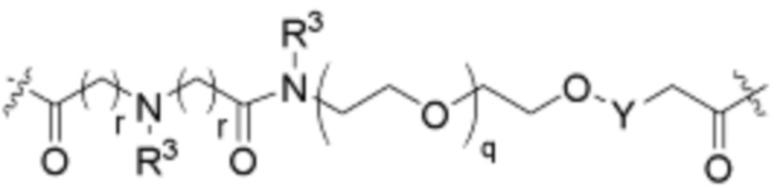 .
.
В определенных вариантах осуществления, L2 является 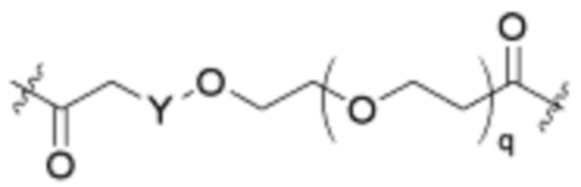 .
.
В определенных вариантах осуществления, L2 является 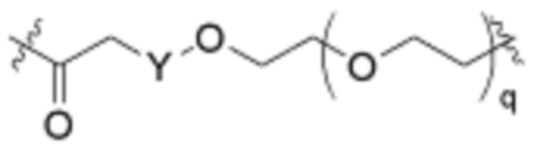 .
.
В определенных вариантах осуществления, L2 является  .
.
В определенных вариантах осуществления, L2 является  .
.
В определенных вариантах осуществления, L2 является  .
.
В определенных вариантах осуществления, L2 является  или
или  .
.
В определенных вариантах осуществления, L2 является 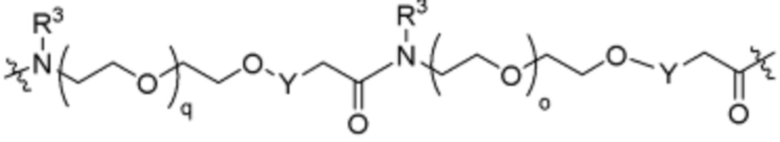 .
.
В определенных вариантах осуществления, L2 является 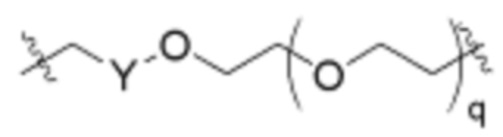 .
.
В определенных вариантах осуществления, L2 является 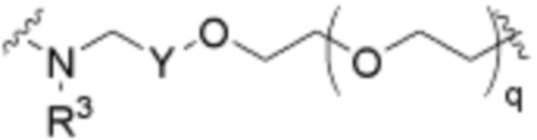 .
.
В определенных вариантах осуществления, L3 отсутствует.
В определенных вариантах осуществления, L3 является 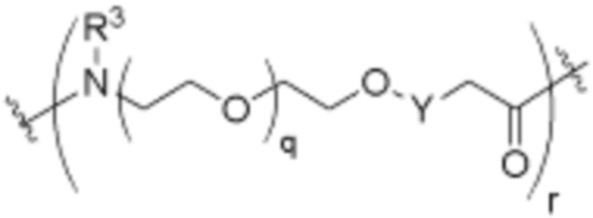 .
.
В определенных вариантах осуществления, L3 является 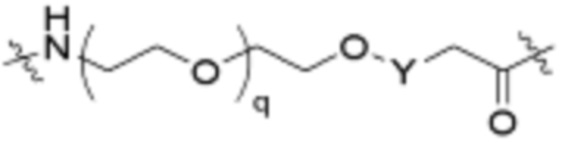 .
.
В определенных вариантах осуществления, L2 является  .
.
В определенных вариантах осуществления, L2 является  .
.
В определенных вариантах осуществления, L2 является  .
.
В определенных вариантах осуществления, L2 является  .
.
В определенных вариантах осуществления, L2 является  .
.
В определенных вариантах осуществления, L2 является  .
.
В определенных вариантах осуществления, L2 является  .
.
В определенных вариантах осуществления, L2 является  или
или  .
.
В определенных вариантах осуществления, L2 является  .
.
В определенных вариантах осуществления, L2 является  .
.
В определенных вариантах осуществления, L2 является  .
.
Как описано выше, A1 и A2 независимо отсутствуют, или независимо выбраны из
 ,
, ,
, ,
, ,
, ,
, ,
, ,
, ,
,  ,
, ,
, ;
;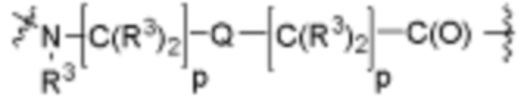 ,
,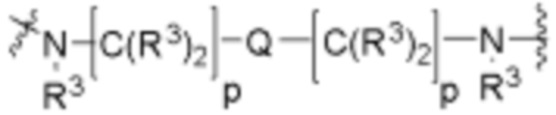 ,
,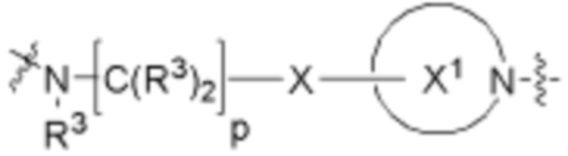 ,
,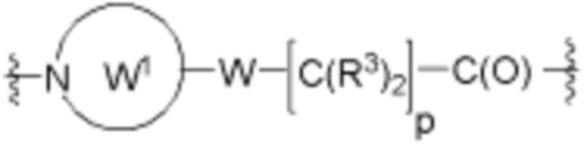 ,
,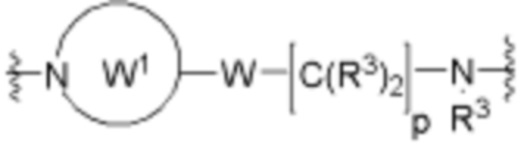 ,
, ,
,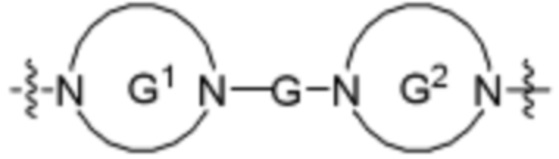 и,
и, ,
,
где связь на левой стороне A1, как изображено, связана с -C(=O)- или L2; и где связь на правой стороне группы A2, как изображено, связана с B или L3;
каждый Q независимо является 1-3 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый X независимо отсутствует, или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый X1 независимо является гетероариленовым или гетероциклиленовым кольцом;
каждый W независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый W1 независимо является гетероариленовым или гетероциклиленовым кольцом;
каждый G независимо отсутствует или является кольцом, выбранным из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый G1 и G2 независимо является гетероариленовым или гетероциклиленовым кольцом.
Как описано выше для формулы Ia, A1 и A2 независимо отсутствуют, или независимо выбраны из
 ,
, ,
, ,
, ,
, ,
, ,
, ,
, ,
,  ,
,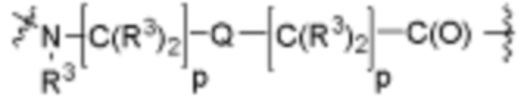 ,
,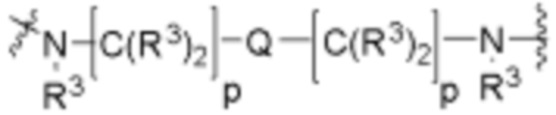 ,
,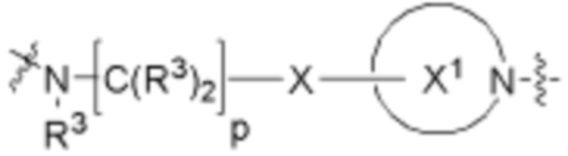 ,
,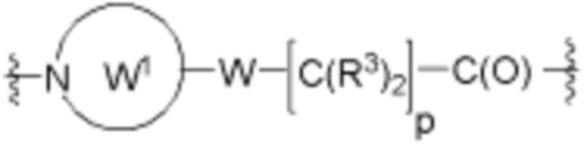 ,
,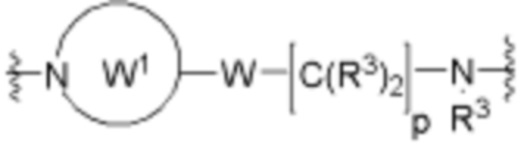 ,
, ,
,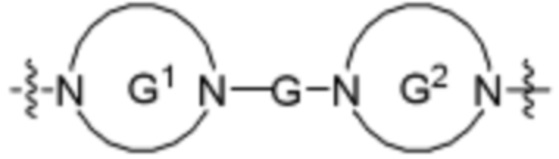 ,
, ,
, ,
, и
и ;
;
где связь на левой стороне A1, как изображено, связана с -C(=O)- или L2; и где связь на правой стороне группы A2, как изображено, связана с B или L3;
каждый Q независимо является 1-3 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый X независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый X1 независимо является гетероариленовым или гетероциклиленовым кольцом;
каждый W независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый W1 независимо является гетероариленовым или гетероциклиленовым кольцом;
каждый G независимо отсутствует или является кольцом, выбранным из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый G1 и G2 независимо является гетероариленовым или гетероциклиленовым кольцом.
В определенных вариантах осуществления, A1 отсутствует. В определенных вариантах осуществления, A1 является 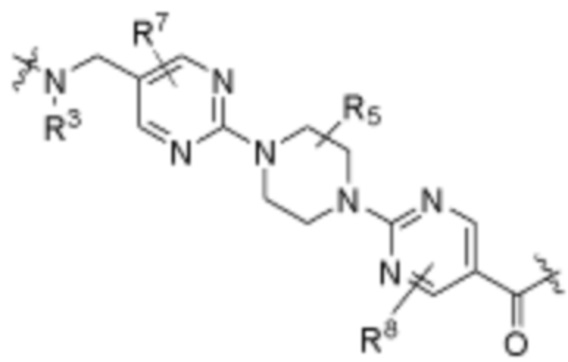 . В определенных вариантах осуществления, A1 является
. В определенных вариантах осуществления, A1 является  . В определенных вариантах осуществления, A1 является
. В определенных вариантах осуществления, A1 является  . В определенных вариантах осуществления, A1 является
. В определенных вариантах осуществления, A1 является  .
.
В определенных вариантах осуществления, A1 является  . В определенных вариантах осуществления, A1 является
. В определенных вариантах осуществления, A1 является  . В определенных вариантах осуществления, A1 является
. В определенных вариантах осуществления, A1 является  . В определенных вариантах осуществления, A1 является
. В определенных вариантах осуществления, A1 является 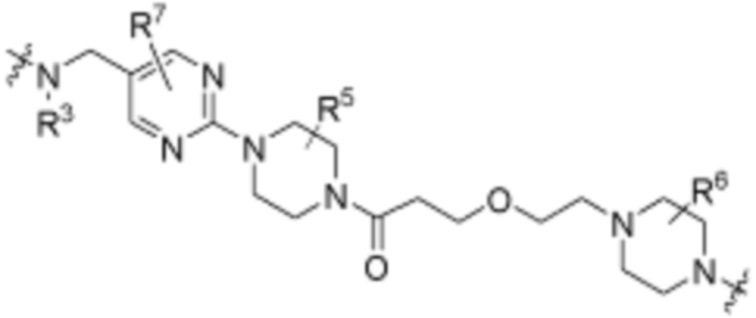 . В определенных вариантах осуществления, A1 является
. В определенных вариантах осуществления, A1 является 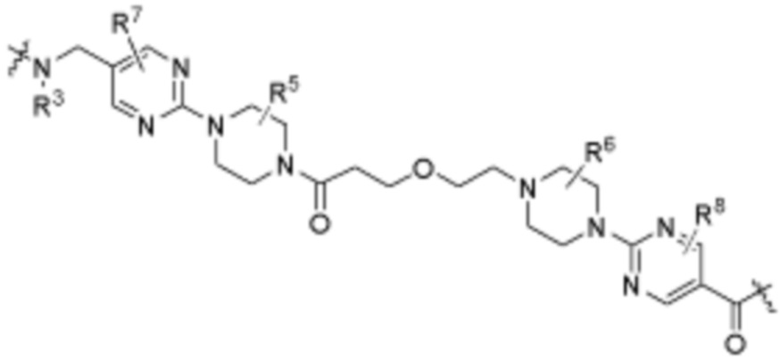 . В определенных вариантах осуществления, A1 является
. В определенных вариантах осуществления, A1 является 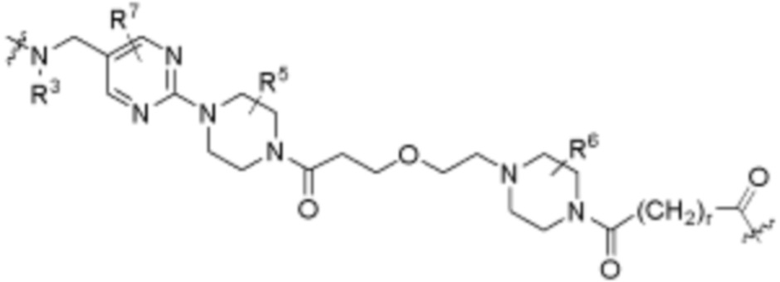 . В определенных вариантах осуществления, A1 является
. В определенных вариантах осуществления, A1 является 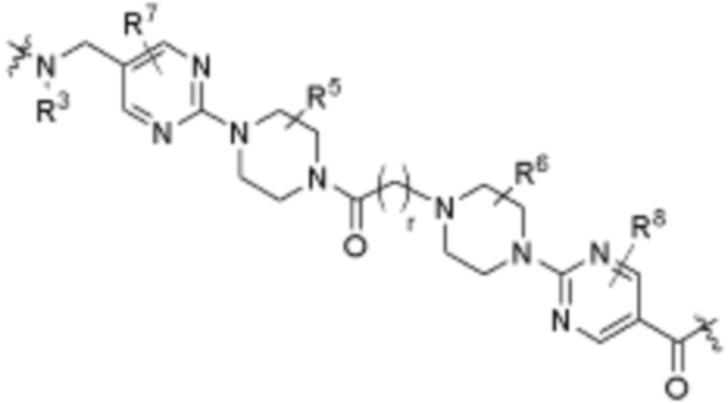 . В определенных вариантах осуществления, A1 является
. В определенных вариантах осуществления, A1 является 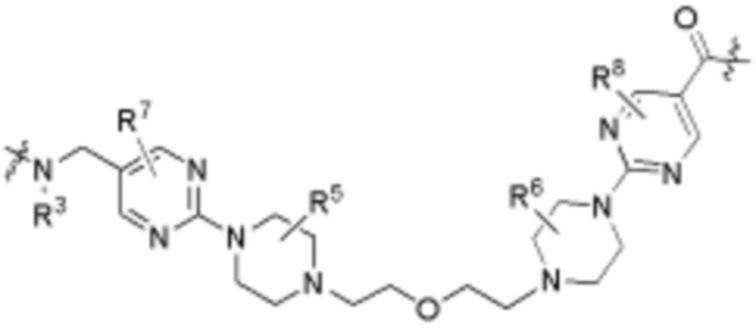 . В определенных вариантах осуществления, A1 является
. В определенных вариантах осуществления, A1 является 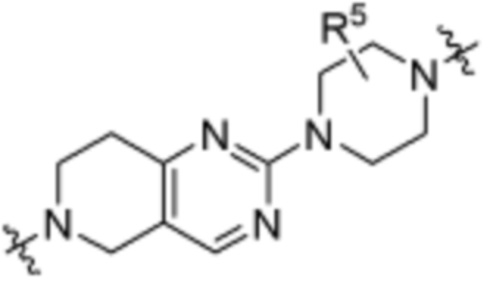 .
.
В определенных вариантах осуществления, A1 является 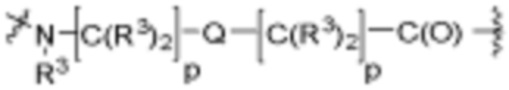 , где каждый Q независимо является 1-3 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена.
, где каждый Q независимо является 1-3 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена.
В определенных вариантах осуществления, A1 является 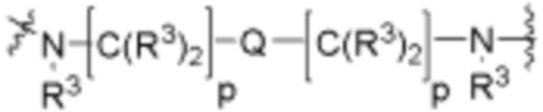 , где каждый Q независимо является 1-3 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена.
, где каждый Q независимо является 1-3 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена.
В определенных вариантах осуществления, A1 является 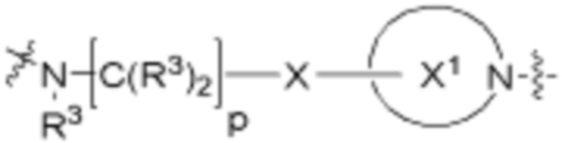 , где каждый X независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена; и каждый X1 является гетероариленовым или гетероциклиленовым кольцом.
, где каждый X независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена; и каждый X1 является гетероариленовым или гетероциклиленовым кольцом.
В определенных вариантах осуществления, A1 является 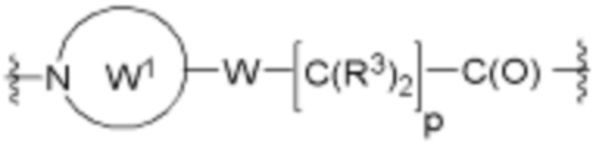 , где каждый W независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена; и каждый W1 является гетероариленовым или гетероциклиленовым кольцом.
, где каждый W независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена; и каждый W1 является гетероариленовым или гетероциклиленовым кольцом.
В определенных вариантах осуществления, A1 является 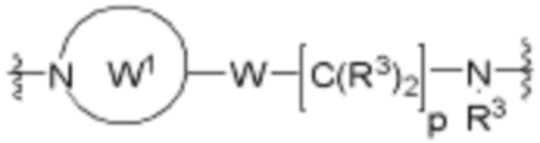 , где каждый W независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена; и каждый W1 является гетероариленовым или гетероциклиленовым кольцом.
, где каждый W независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена; и каждый W1 является гетероариленовым или гетероциклиленовым кольцом.
В определенных вариантах осуществления, A1 является  , где каждый G независимо отсутствует или является кольцом, выбранным из арилена, циклоалкилена, гетероарилена и гетероциклилена.
, где каждый G независимо отсутствует или является кольцом, выбранным из арилена, циклоалкилена, гетероарилена и гетероциклилена.
В определенных вариантах осуществления, A1 является 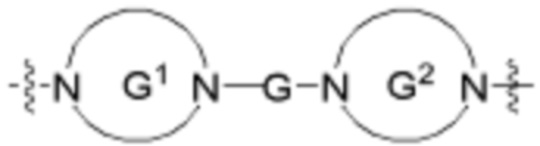 , где каждый G независимо отсутствует или является кольцом, выбранным из арилена, циклоалкилена, гетероарилена и гетероциклилена; и каждый G1 и G2 независимо является гетероариленовым или гетероциклиленовым кольцом.
, где каждый G независимо отсутствует или является кольцом, выбранным из арилена, циклоалкилена, гетероарилена и гетероциклилена; и каждый G1 и G2 независимо является гетероариленовым или гетероциклиленовым кольцом.
В определенных вариантах осуществления, A1 является  . В определенных вариантах осуществления, A1 является
. В определенных вариантах осуществления, A1 является  . В определенных вариантах осуществления, A1 является
. В определенных вариантах осуществления, A1 является  .
.
В определенных вариантах осуществления, A2 отсутствует. В определенных вариантах осуществления, A2 является 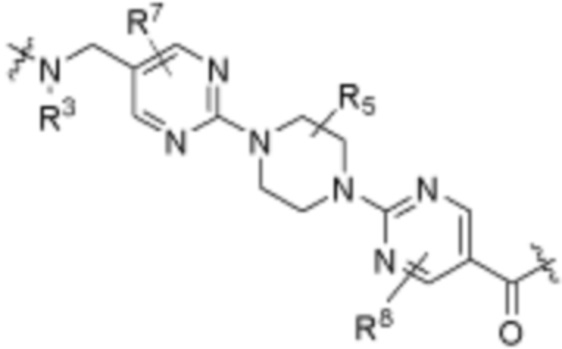 . В определенных вариантах осуществления, A2 является
. В определенных вариантах осуществления, A2 является  . В определенных вариантах осуществления, A2 является
. В определенных вариантах осуществления, A2 является  . В определенных вариантах осуществления, A2 является
. В определенных вариантах осуществления, A2 является  . В определенных вариантах осуществления, A2 является
. В определенных вариантах осуществления, A2 является  . В определенных вариантах осуществления, A2 является
. В определенных вариантах осуществления, A2 является  . В определенных вариантах осуществления, A2 является
. В определенных вариантах осуществления, A2 является  . В определенных вариантах осуществления, A2 является
. В определенных вариантах осуществления, A2 является  . В определенных вариантах осуществления, A2 является
. В определенных вариантах осуществления, A2 является  . В определенных вариантах осуществления, A2 является
. В определенных вариантах осуществления, A2 является  . В определенных вариантах осуществления, A2 является
. В определенных вариантах осуществления, A2 является  . В определенных вариантах осуществления, A2 является
. В определенных вариантах осуществления, A2 является  . В определенных вариантах осуществления, A2 является
. В определенных вариантах осуществления, A2 является  .
.
В определенных вариантах осуществления, A2 является 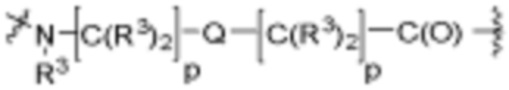 , где каждый Q независимо является 1-3 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена.
, где каждый Q независимо является 1-3 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена.
В определенных вариантах осуществления, A2 является 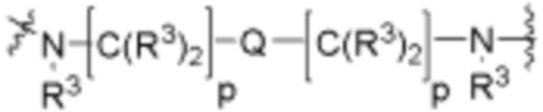 , где каждый Q независимо является 1-3 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена.
, где каждый Q независимо является 1-3 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена.
В определенных вариантах осуществления, A2 является 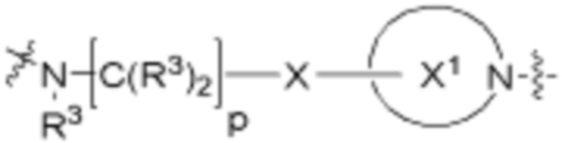 , где каждый X независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена; и каждый X1 является гетероариленовым или гетероциклиленовым кольцом.
, где каждый X независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена; и каждый X1 является гетероариленовым или гетероциклиленовым кольцом.
В определенных вариантах осуществления, A2 является 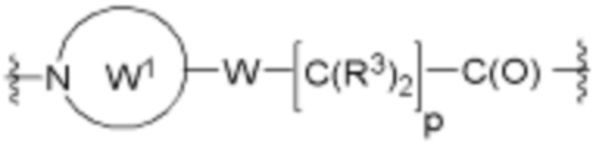 , где каждый W независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена; и каждый W1 является гетероариленовым или гетероциклиленовым кольцом.
, где каждый W независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена; и каждый W1 является гетероариленовым или гетероциклиленовым кольцом.
В определенных вариантах осуществления, A2 является 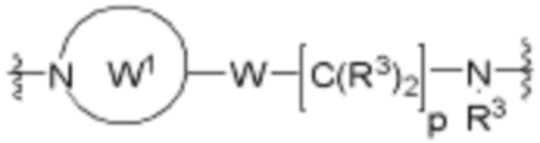 , где каждый W независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена; и каждый W1 является гетероариленовым или гетероциклиленовым кольцом.
, где каждый W независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена; и каждый W1 является гетероариленовым или гетероциклиленовым кольцом.
В определенных вариантах осуществления, A2 является  , где каждый G независимо отсутствует или является кольцом, выбранным из арилена, циклоалкилена, гетероарилена и гетероциклилена.
, где каждый G независимо отсутствует или является кольцом, выбранным из арилена, циклоалкилена, гетероарилена и гетероциклилена.
В определенных вариантах осуществления, A2 является 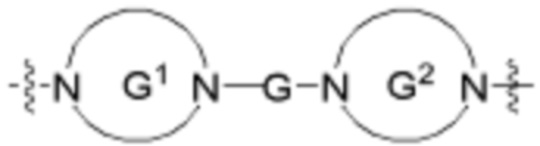 , где каждый G независимо отсутствует или является кольцом, выбранным из арилена, циклоалкилена, гетероарилена и гетероциклилена; и каждый G1 и G2 независимо является гетероариленовым или гетероциклиленовым кольцом.
, где каждый G независимо отсутствует или является кольцом, выбранным из арилена, циклоалкилена, гетероарилена и гетероциклилена; и каждый G1 и G2 независимо является гетероариленовым или гетероциклиленовым кольцом.
В определенных вариантах осуществления, A2 является  . В определенных вариантах осуществления, A2 является
. В определенных вариантах осуществления, A2 является  . В определенных вариантах осуществления, A2 является
. В определенных вариантах осуществления, A2 является  .
.
Как описано выше, каждый B независимо выбирают из
 ,
,
 .
.
В определенных вариантах осуществления, B является  .
.
В определенных вариантах осуществления, B является 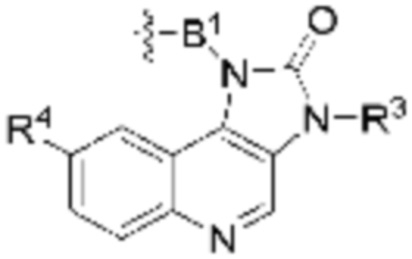 .
.
В определенных вариантах осуществления, B является 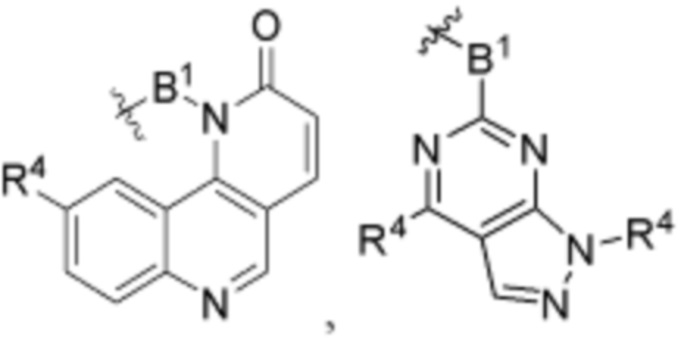 ,
, 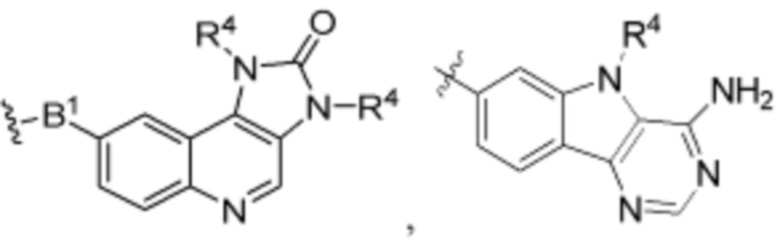 ,
, 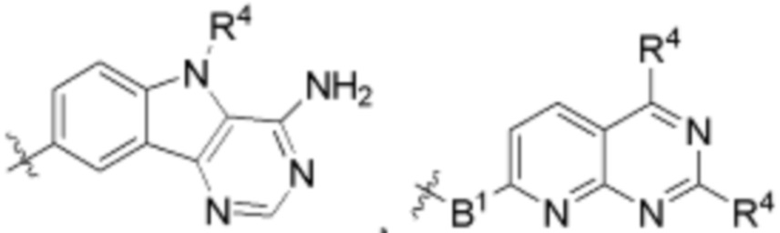 или
или 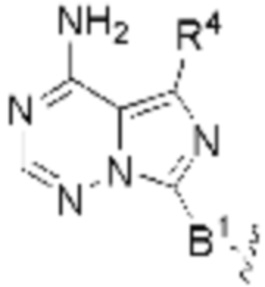 . В определенных вариантах осуществления, B является
. В определенных вариантах осуществления, B является 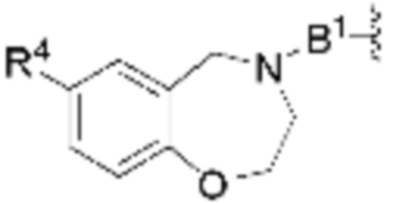 .
.
Как описано выше, каждый B1 независимо выбирают из  NR3-(C(R3)2)n-,
NR3-(C(R3)2)n-,  NR3-(C(R3)2)n-(C6-C10)арилен-(C(R3)2)n-,
NR3-(C(R3)2)n-(C6-C10)арилен-(C(R3)2)n-,  NR3-(C(R3)2)n-гетероарилена-,
NR3-(C(R3)2)n-гетероарилена-,  (C6-C10)арилена-,
(C6-C10)арилена-,  NR3-(C(R3)2)n-NR3C(O)-,
NR3-(C(R3)2)n-NR3C(O)-,  NR3-(C(R3)2)n-гетероариленгетероциклилен-(C6-C10)арилена-,
NR3-(C(R3)2)n-гетероариленгетероциклилен-(C6-C10)арилена-,  гетероариленгетероциклилен-(C6-C10)арилена-,
гетероариленгетероциклилен-(C6-C10)арилена-, 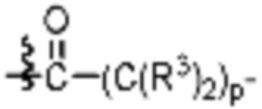 ,
, 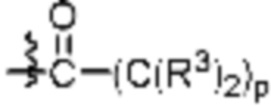 -гетероарилена,
-гетероарилена,  ,
,  ,
,  ,
,  ,
,  (С6-С10)арилена,
(С6-С10)арилена,  ,
,  гетероарилена-,
гетероарилена-,  гетероциклиленарилена- и
гетероциклиленарилена- и  NR3-(C(R3)2)n-S(O)2-арилен-C(O)-, где
NR3-(C(R3)2)n-S(O)2-арилен-C(O)-, где  связь на левой стороне B1, как изображено, связана с A2 или L1; и где гетероарилен, гетероциклилен и арилен каждый независимо необязательно замещен алкилом, гидроксиалкилом, галоалкилом, алкокси, галогеном или гидроксилом.
связь на левой стороне B1, как изображено, связана с A2 или L1; и где гетероарилен, гетероциклилен и арилен каждый независимо необязательно замещен алкилом, гидроксиалкилом, галоалкилом, алкокси, галогеном или гидроксилом.
В определенных вариантах осуществления, B1 является 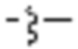 NR3-(C(R3)2)n-.
NR3-(C(R3)2)n-.
В определенных вариантах осуществления, B1 является  (С6-С10)ариленом. В определенных вариантах осуществления, B1 является
(С6-С10)ариленом. В определенных вариантах осуществления, B1 является  (С6-С10)ариленом, где арилен необязательно замещен галоалкилом.
(С6-С10)ариленом, где арилен необязательно замещен галоалкилом.
В определенных вариантах осуществления, B1 является 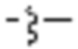 NR3-(C(R3)2)n-,
NR3-(C(R3)2)n-, 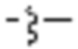 NR3-(C(R3)2)n-(C6-C10)арилен-(C(R3)2)n-,
NR3-(C(R3)2)n-(C6-C10)арилен-(C(R3)2)n-, 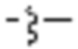 NR3-(C(R3)2)n-гетероариленом-,
NR3-(C(R3)2)n-гетероариленом-, 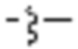 (C6-C10)ариленом-,
(C6-C10)ариленом-, 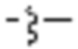 NR3-(C(R3)2)n-NR3C(O)-,
NR3-(C(R3)2)n-NR3C(O)-, 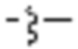 NR3-(C(R3)2)n-гетероариленгетероциклилен-(C6-C10)ариленом- или
NR3-(C(R3)2)n-гетероариленгетероциклилен-(C6-C10)ариленом- или 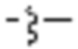 гетероариленгетероциклилен-(C6-C10)ариленом-. В определенных вариантах осуществления, B1 является
гетероариленгетероциклилен-(C6-C10)ариленом-. В определенных вариантах осуществления, B1 является 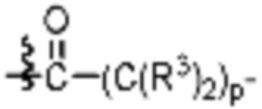 или
или 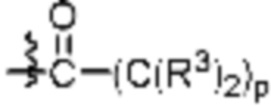 -гетероариленом.
-гетероариленом.
В определенных вариантах осуществления, B1 является  гетероариленом-. В определенных вариантах осуществления, B1 является
гетероариленом-. В определенных вариантах осуществления, B1 является  гетероциклиленариленом-. В определенных вариантах осуществления, B1 является
гетероциклиленариленом-. В определенных вариантах осуществления, B1 является  NR3-(C(R3)2)n-S(O)2-арилен-C(O)-.
NR3-(C(R3)2)n-S(O)2-арилен-C(O)-.
В определенных вариантах осуществления, в B1, гетероарил, гетероциклил и арилен необязательно замещены алкилом, гидроксиалкилом, галоалкилом, алкокси, галогеном или гидроксилом.
В определенных вариантах осуществления, R3 является H. В определенных вариантах осуществления, R3 является (C1-C6)алкилом.
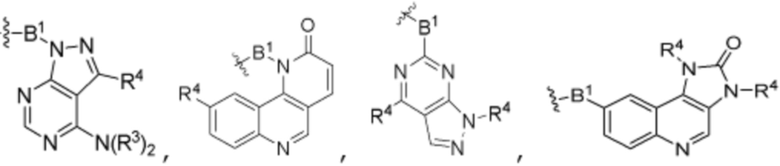
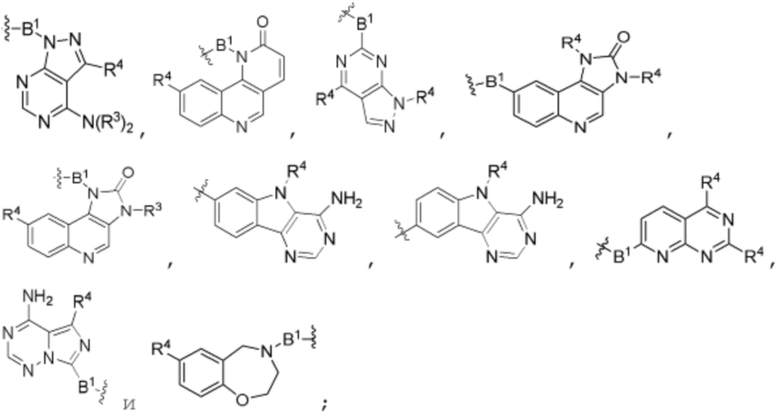
В определенных вариантах осуществления, R4 является H. В определенных вариантах осуществления, R4 является (C1-C6)алкилом. В определенных вариантах осуществления, R4 является галогеном. В определенных вариантах осуществления, R4 является 5-12-членным гетероарилом, 5-12-членным гетероциклилом или (C6-C10)арилом, где гетероарил, гетероциклил и арил необязательно замещены -N(R3)2, -OR3, галогеном, (C1-C6)алкилом, -(C1-C6)алкиленгетероарилом, -(C1-C6)алкилен-CN или -C(O)NR3-гетероарилом. В определенных вариантах осуществления, R4 является -C(O)NR3-гетероциклилом. В определенных вариантах осуществления, R4 является 5-12-членным гетероарилом, необязательно замещенным -N(R3)2 или -OR3.
Как описано выше, каждый R5 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил из (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3. В определенных вариантах осуществления, R5 является H. В определенных вариантах осуществления, R5 является (C1-C6)алкилом, где алкил необязательно замещен -N(R3)2 или -OR3. В определенных вариантах осуществления, R5 является -C(O)OR3. В определенных вариантах осуществления, R5 является -N(R3)2.
Как описано выше, каждый R6 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил из (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3. В определенных вариантах осуществления, R6 является H. В определенных вариантах осуществления, R6 является (C1-C6)алкилом, где алкил необязательно замещен -N(R3)2 или -OR3. В определенных вариантах осуществления, R6 является -C(O)OR3. В определенных вариантах осуществления, R6 является -N(R3)2.
Как описано выше, каждый R7 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил из (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3. В определенных вариантах осуществления, R7 является H. В определенных вариантах осуществления, R7 является (C1-C6)алкилом, где алкил необязательно замещен -N(R3)2 или -OR3. В определенных вариантах осуществления, R7 является -C(O)OR3. В определенных вариантах осуществления, R7 является -N(R3)2.
Как описано выше, каждый R8 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил из (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3. В определенных вариантах осуществления, R8 является H. В определенных вариантах осуществления, R8 является (C1-C6)алкилом, где алкил необязательно замещен -N(R3)2 или -OR3. В определенных вариантах осуществления, R8 является -C(O)OR3. В определенных вариантах осуществления, R8 является -N(R3)2.
Как описано выше, каждый Y независимо является C(R3)2 или связью. В определенных вариантах осуществления, Y является C(R3)2. В определенных вариантах осуществления, Y является CH2. В определенных вариантах осуществления, Y является связью.
В определенных вариантах осуществления, n равно 1, 2, 3, 4, 5, 6, 7 или 8 или любому диапазону, выводимому здесь. В определенных вариантах осуществления, n равно 1, 2, 3 или 4. В определенных вариантах осуществления, n равно 5, 6, 7 или 8. В определенных вариантах осуществления, n равно 9, 10, 11 или 12.
В определенных вариантах осуществления, o равно целому числу от нуля до 10 или любому диапазону, выводимому здесь. В определенных вариантах осуществления, o равно 0, 1, 2, 3, 4 или 5. В определенных вариантах осуществления, o равно 6, 7, 8, 9 или 10. В определенных вариантах осуществления, o равно от одного до 7. В определенных вариантах осуществления, o равно от одного до 8. В определенных вариантах осуществления, o равно от одного до 9. В определенных вариантах осуществления, o равно от 3 до 8.
В определенных вариантах осуществления, o равно целому числу от нуля до 30 или любому диапазону, выводимому здесь. В определенных вариантах осуществления, o равно целому числу от нуля до 30, 29, 28, 27 или 26. В определенных вариантах осуществления, o равно целому числу от нуля до 25, 24, 23, 22 или 21. В определенных вариантах осуществления, o равно целому числу от нуля до 20, 19, 18, 17 или 16. В определенных вариантах осуществления, o равно целому числу от нуля до 15, 14, 13, 12 или 11.
В определенных вариантах осуществления, p равно 0, 1, 2, 3, 4, 5 или 6 или любому диапазону, выводимому здесь. В определенных вариантах осуществления, p равно 7, 8, 9, 10, 11 или 12. В определенных вариантах осуществления, p равно 0, 1, 2 или 3. В определенных вариантах осуществления, p равно 4, 5 или 6.
В определенных вариантах осуществления, q равно целому числу от нуля до 10 или любому диапазону, выводимому здесь. В определенных вариантах осуществления, q равно 0, 1, 2, 3, 4 или 5. В определенных вариантах осуществления, q равно 6, 7, 8, 9 или 10. В определенных вариантах осуществления, q равно от одного до 7. В определенных вариантах осуществления, q равно от одного до 8. В определенных вариантах осуществления, q равно от одного до 9. В определенных вариантах осуществления, q равно от 3 до 8.
В определенных вариантах осуществления, q равно целому числу от нуля до 30 или любому диапазону, выводимому здесь. В определенных вариантах осуществления, q равно целому числу от нуля до 30, 29, 28, 27 или 26. В определенных вариантах осуществления, q равно целому числу от нуля до 25, 24, 23, 22 или 21. В определенных вариантах осуществления, q равно целому числу от нуля до 20, 19, 18, 17 или 16. В определенных вариантах осуществления, q равно целому числу от нуля до 15, 14, 13, 12 или 11.
Как описано выше, r равно целому числу от одного до 6. В определенных вариантах осуществления, r равно единице. В определенных вариантах осуществления, r равно 2. В определенных вариантах осуществления, r равно 3. В определенных вариантах осуществления, r равно 4. В определенных вариантах осуществления, r равно 5. В определенных вариантах осуществления, r равно 6.
В данном раскрытии представлено соединение формулы (I) или (Ia)
 (I)
(I) 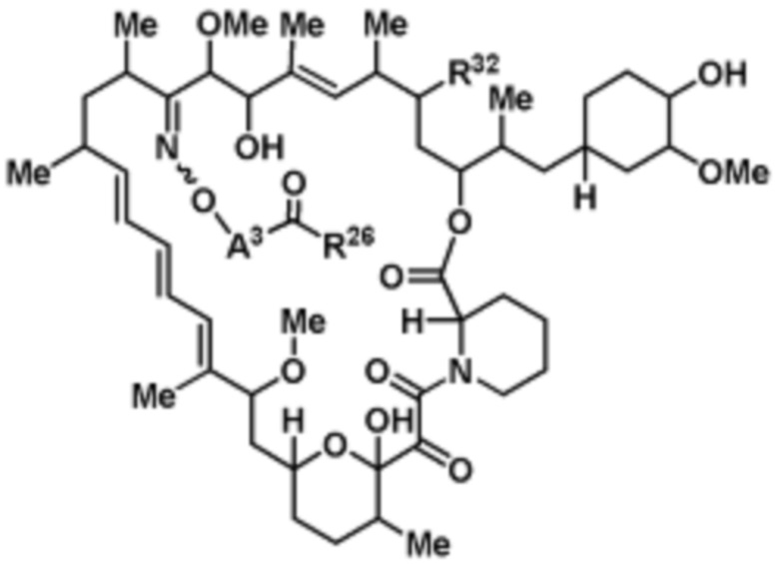 (Ia)
(Ia)
или его фармацевтически приемлемая соль или таутомер, имеющее одну, две, три или четыре из следующих характеристик:
a) A3 является -[C(R3)2]n-, таким как CH2;
b) R26 является -A1-L1-A2-B;
c) L1 является 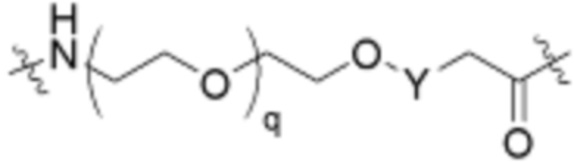 ;
;
d) A2 является  ;
;
e) B является  ;
;
f) B1 является  NR3-(C(R3)2)n- или
NR3-(C(R3)2)n- или 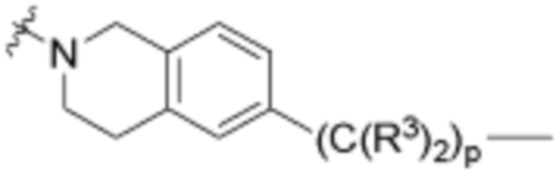 ;
;
g) R4 является 5-12-членным гетероарилом, необязательно замещенным -N(R3)2 или -OR3, и
h) R32 является -ОН.
В данном раскрытии представлено соединение формулы (I) или (Ia)
 (I)
(I)  (Ia)
(Ia)
или его фармацевтически приемлемая соль или таутомер, имеющее одну, две, три или четыре из следующих характеристик:
a) A3 является -[C(R3)2]n-, таким как CH2;
b) R26 является -A1-L1-A2-B;
c) А1 отсутствует;
d) А2 отсутствует;
е) L1 является  ;
;
f) B является  ;
;
f) B1 является  NR3-(C(R3)2)n- или
NR3-(C(R3)2)n- или  ;
;
g) R4 является 5-12-членным гетероарилом, необязательно замещенным -N(R3)2 или -OR3, и
h) R32 является -ОН.
В данном раскрытии представлено соединение формулы (Ia)
 (Ia)
(Ia)
или его фармацевтически приемлемая соль или таутомер, имеющее одну, две, три или четыре из следующих характеристик:
a) A3 является -[C(R3)2]n-, таким как CH2;
b) R26 является -A1-L1-A2-B;
c) А1 является  ;
;
d) A2 является  ;
;
е) L1 является 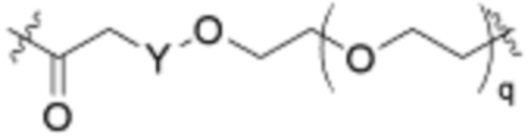 ;
;
e) B является  ;
;
f) B1 является  NR3-(C(R3)2)n- или
NR3-(C(R3)2)n- или  ;
;
g) R4 является 5-12-членным гетероарилом, необязательно замещенным -N(R3)2 или -OR3, и
h) R32 является -ОН.
В определенных вариантах осуществления, в данном раскрытии представлено соединение, выбранное из списка ниже, или его фармацевтически приемлемая соль или таутомер

Пример 1
Пример 2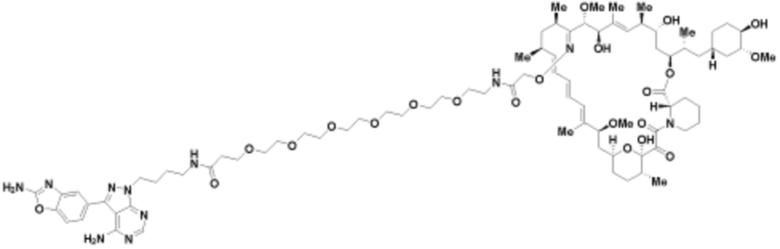
Пример 3
Пример 4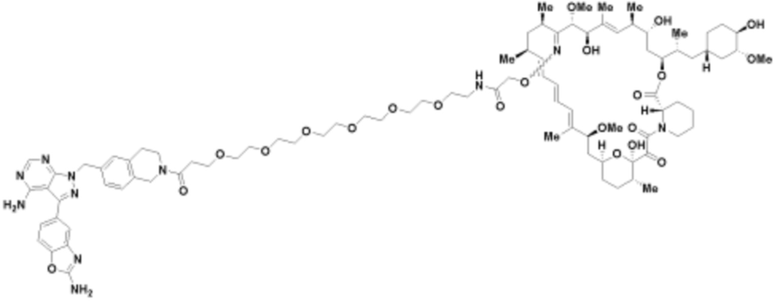
Пример 5
Пример 6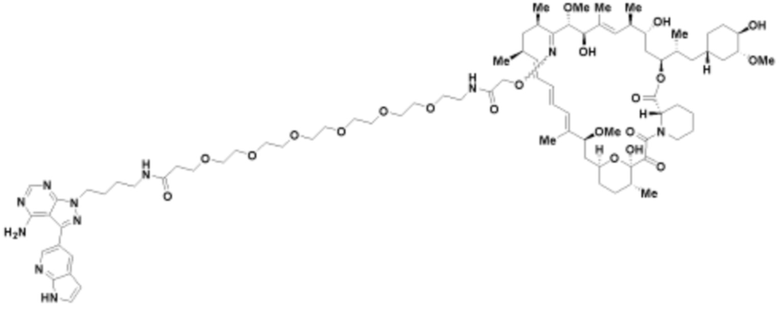
Пример 7
Пример 8
Пример 9
Пример 10
Пример 11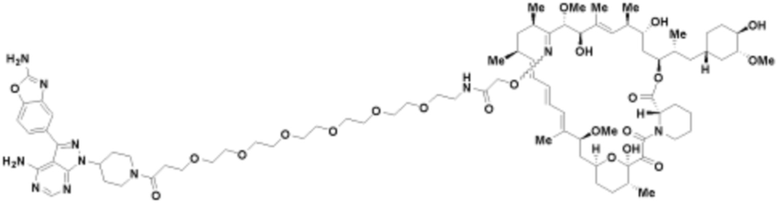
Пример 12
Пример 13
Пример 14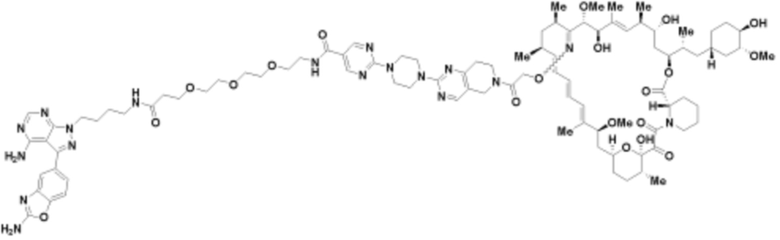
Пример 15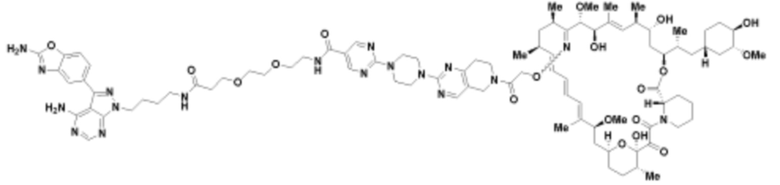
Пример 16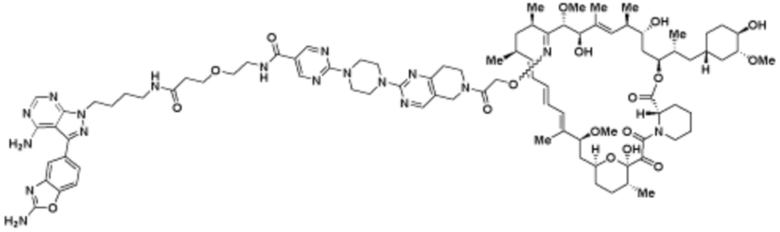
Пример 17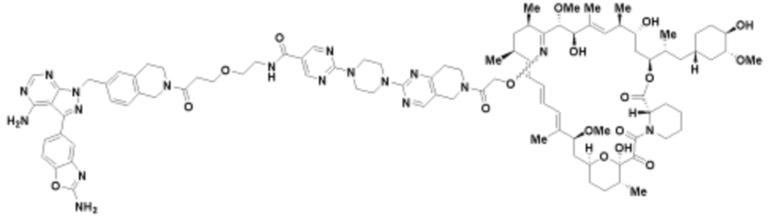
Пример 18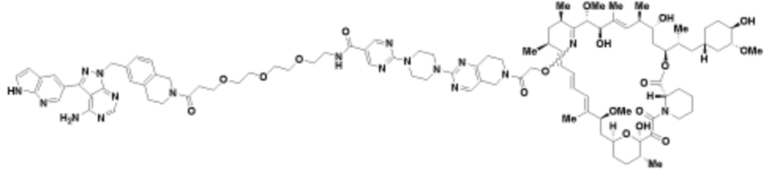
Пример 19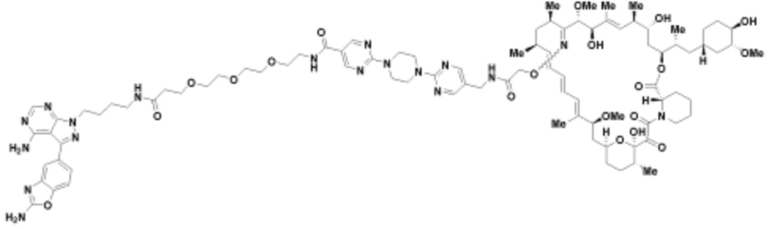
Пример 20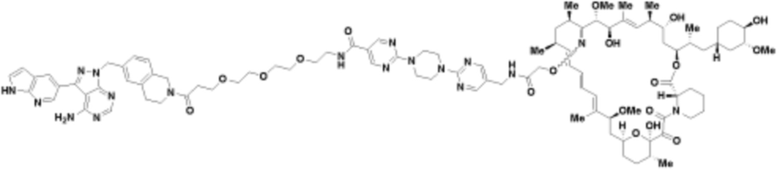
Пример 21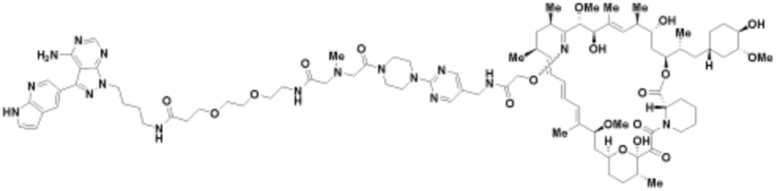
Пример 22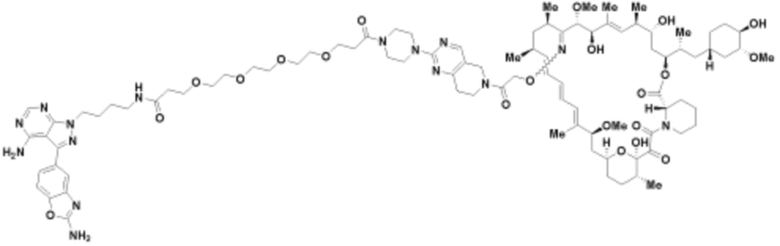
Пример 23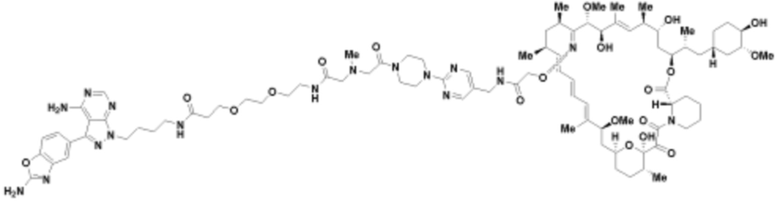
Пример 24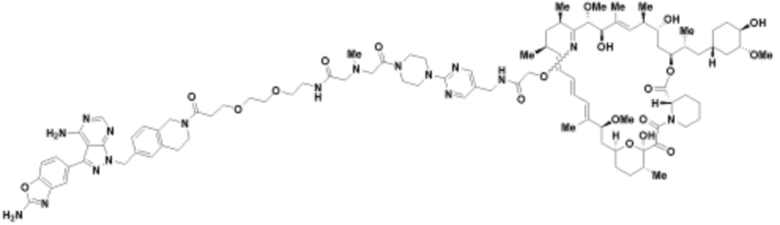
Пример 25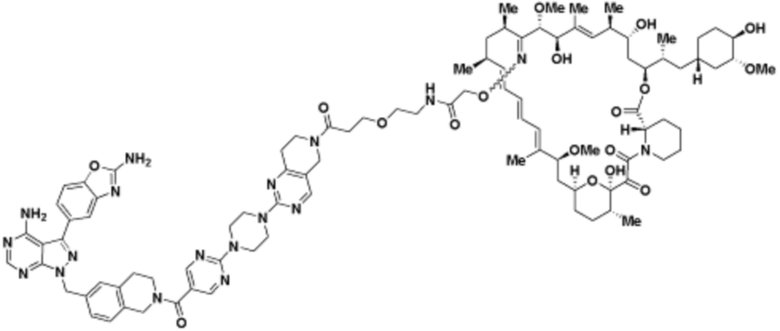
Пример 26
Пример 27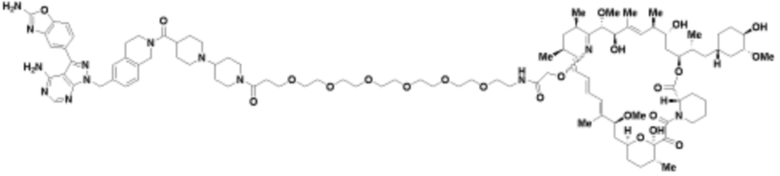
Пример 28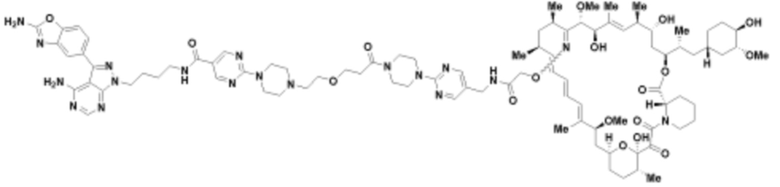
Пример 29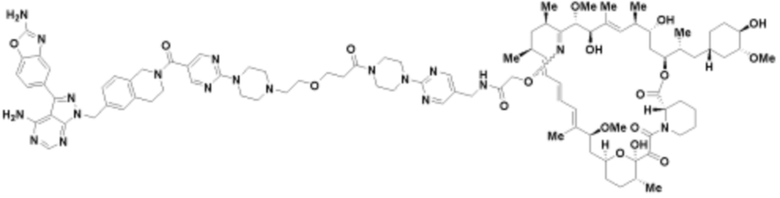
Пример 30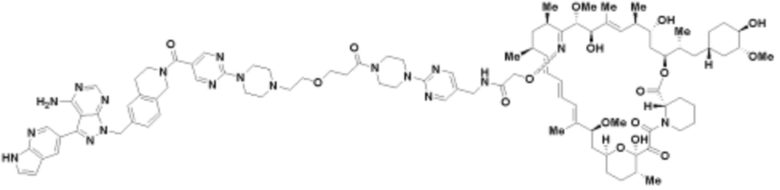
Пример 31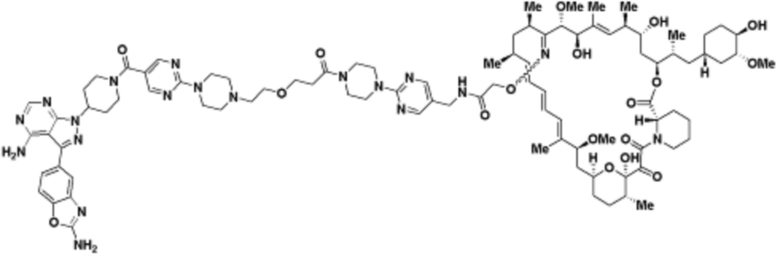
Пример 32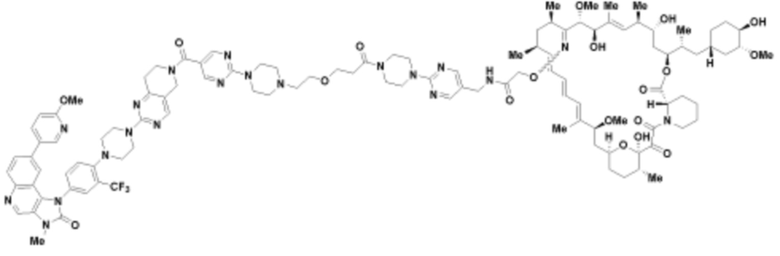
Пример 33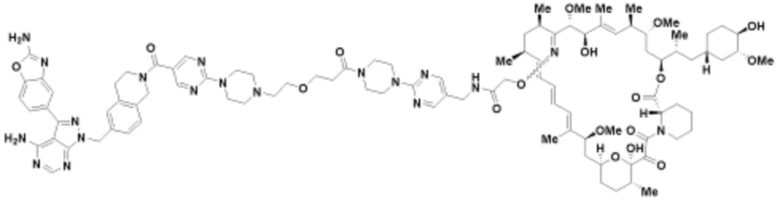
Пример 34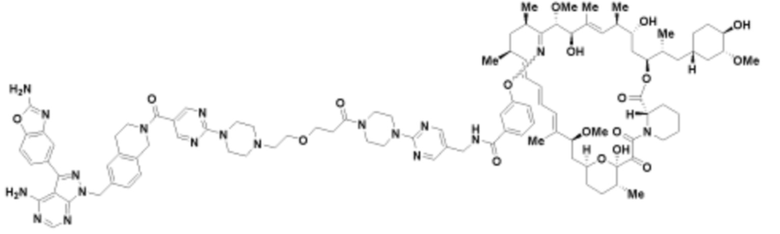
Пример 35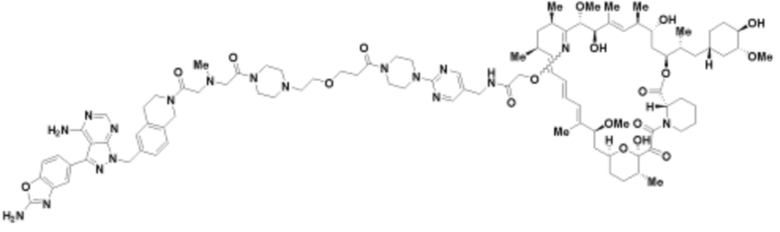
Пример 36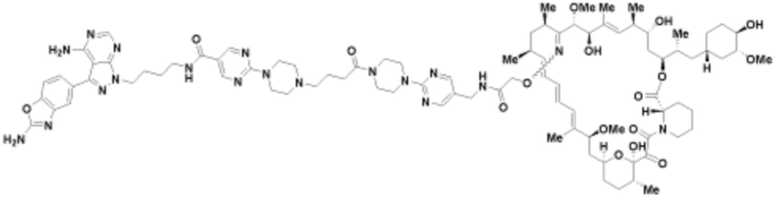
Пример 37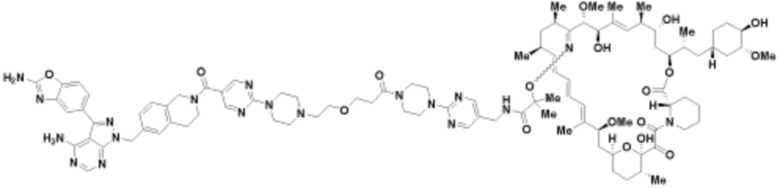
Пример 38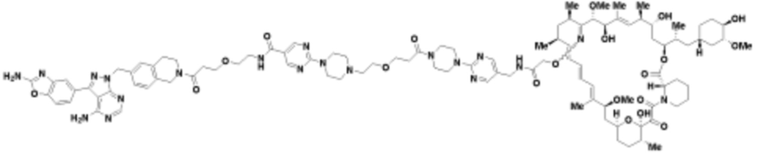
Пример 39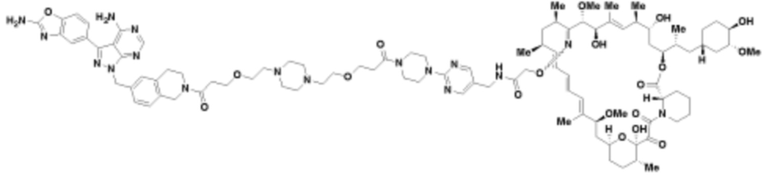
Пример 40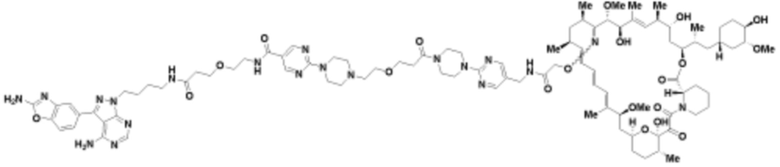
Пример 41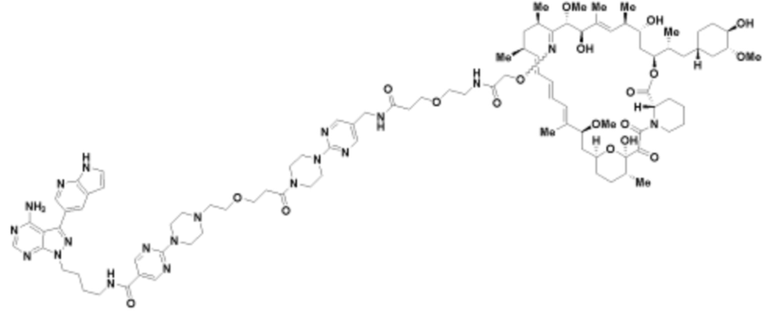
Пример 42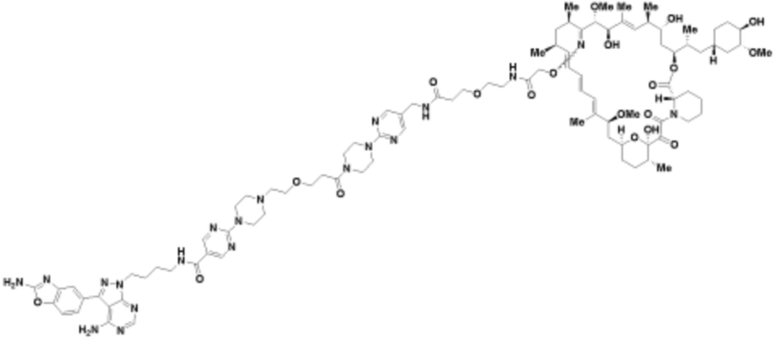
Пример 43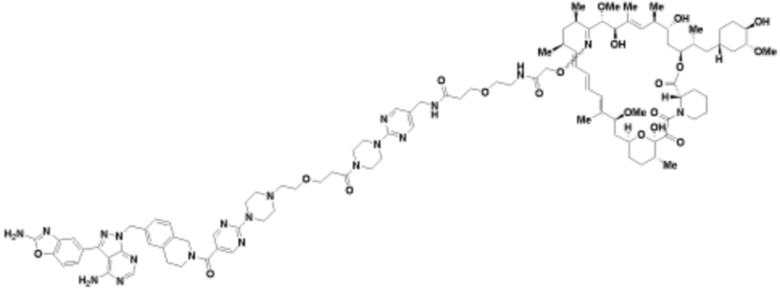
Пример 44
В определенных вариантах осуществления, данное раскрытие представлено для соединения, выбранного из списка ниже или его фармацевтически приемлемой соли или таутомера

Пример 45
Пример 46
Пример 47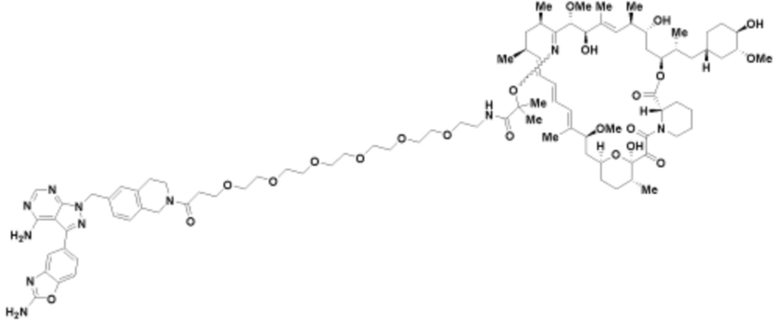
Пример 48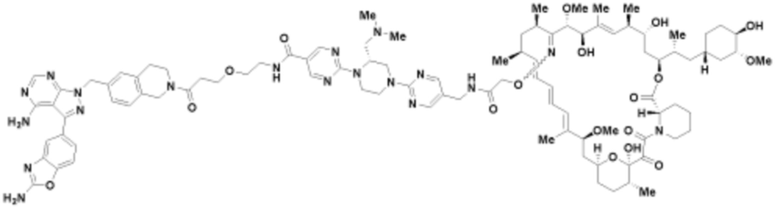
Пример 49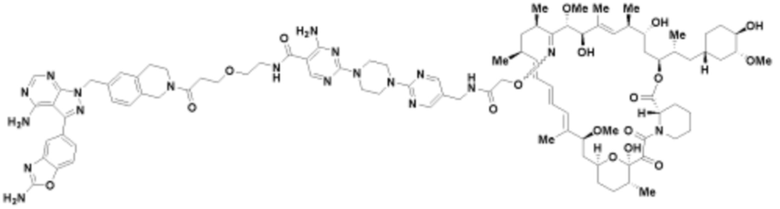
Пример 50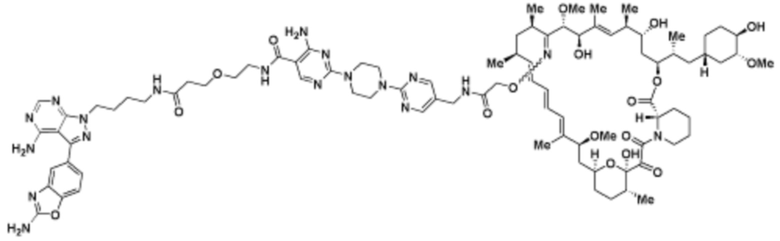
Пример 51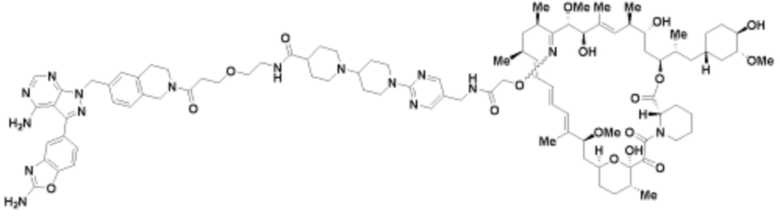
Пример 52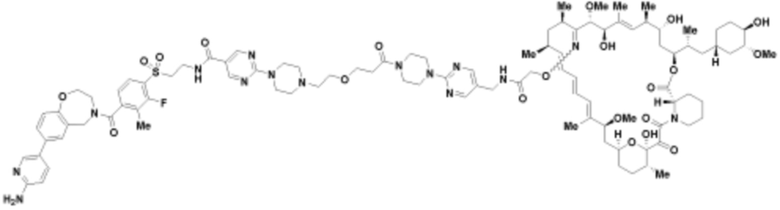
Пример 53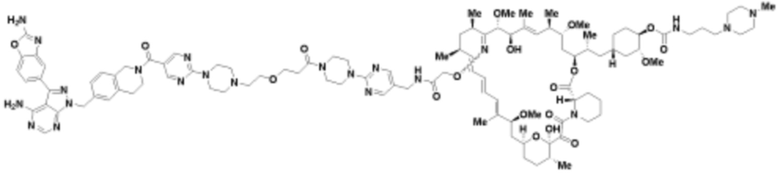
Пример 54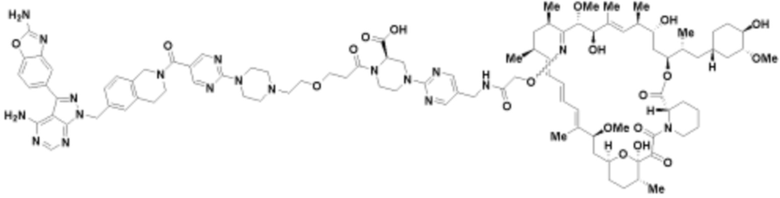
Пример 55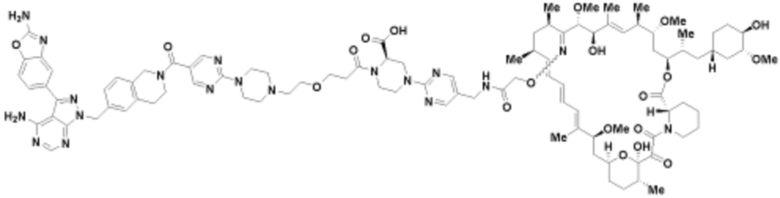
Пример 56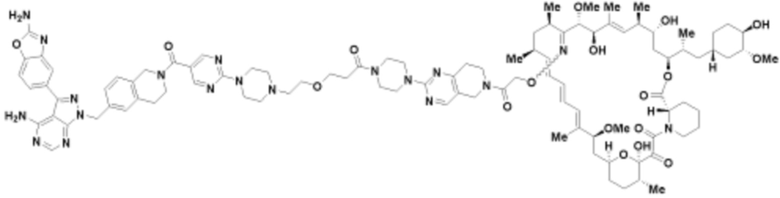
Пример 57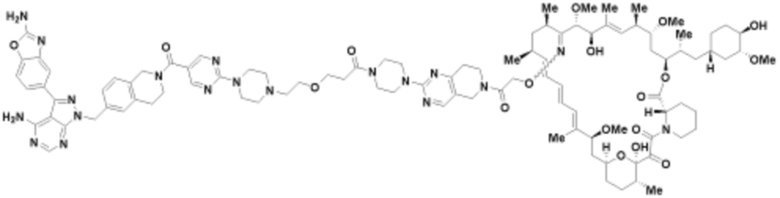
Пример 58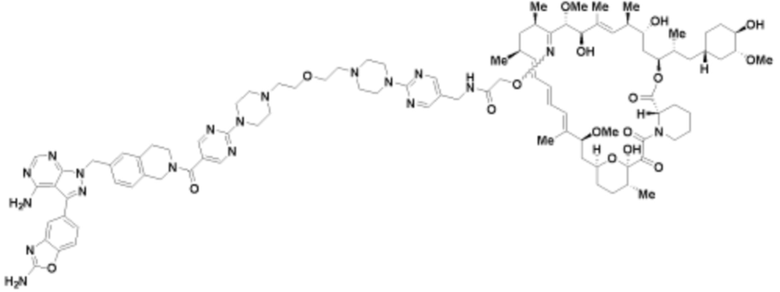
Пример 59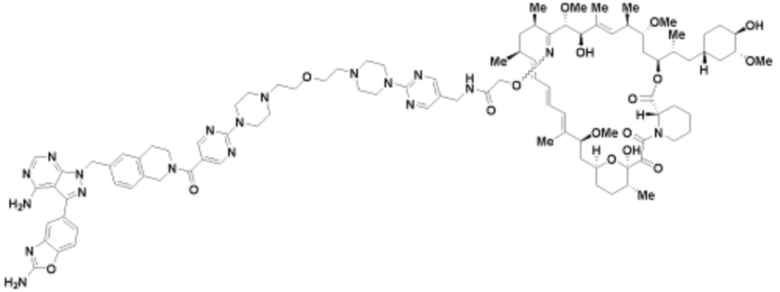
Пример 60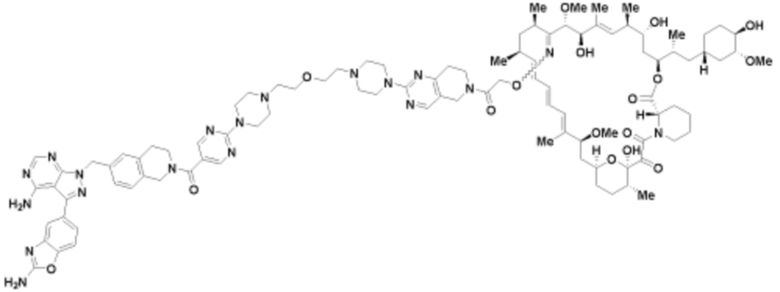
Пример 61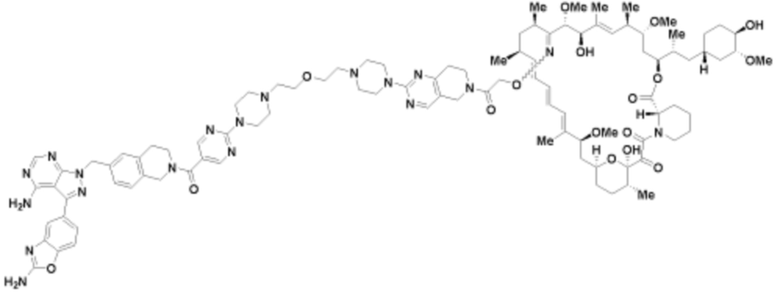
Пример 62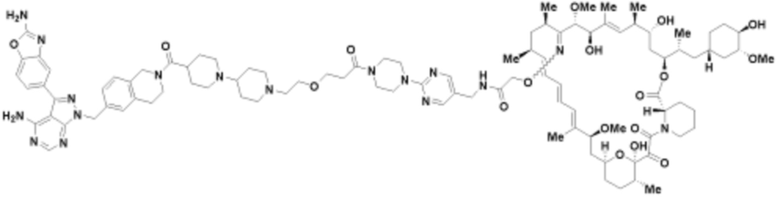
Пример 63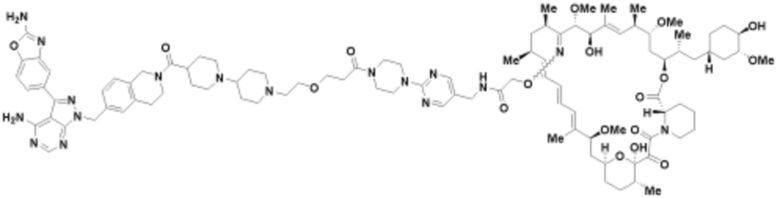
Пример 64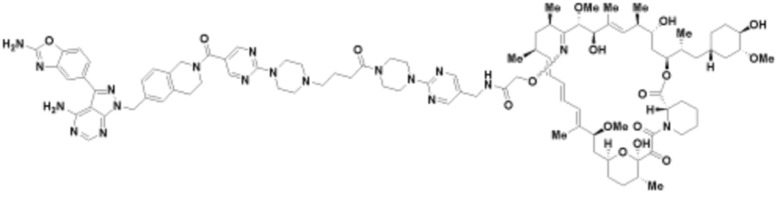
Пример 65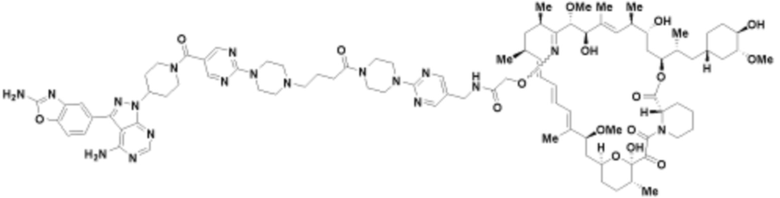
Пример 66
В определенных вариантах осуществления, данное раскрытие представлено для соединения, выбранного из списка ниже или его фармацевтически приемлемой соли или таутомера

Пример 67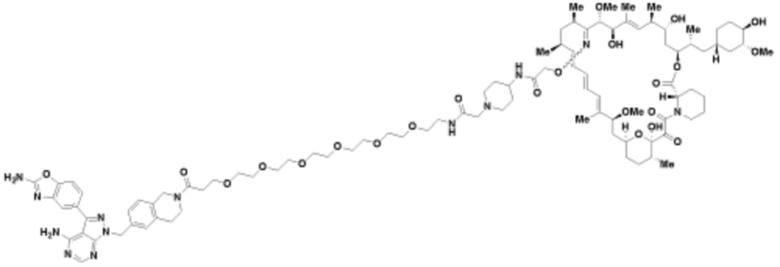
Пример 68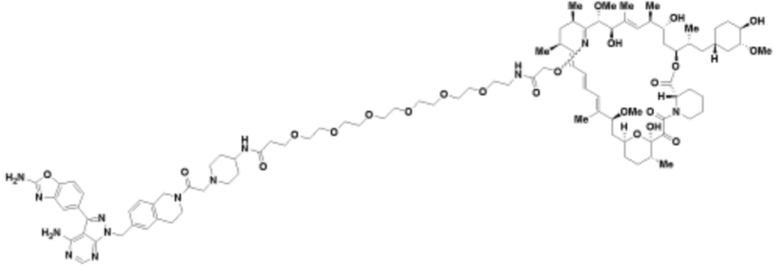
Пример 69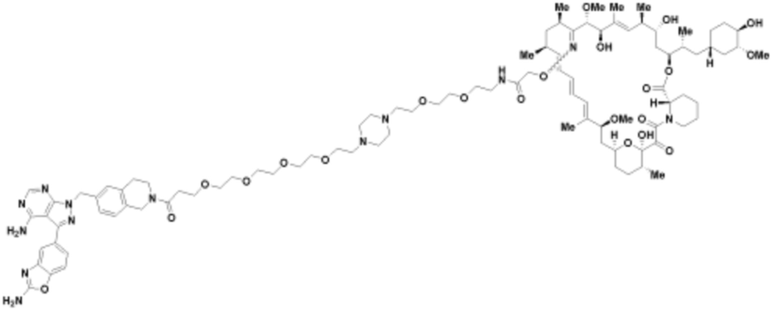
Пример 70
Соединения настоящего раскрытия могут включать фармацевтически приемлемые соли раскрытых здесь соединений. Типичные «фармацевтически приемлемые соли» могут включать, например, водорастворимые и неводорастворимые соли, такие как ацетат, амсонат (4,4-диаминостильбен-2,2-дисульфонат), бензолсульфонат, бензонат, бикарбонат, бисульфат, битартрат, борат, бромид, бутират, кальций, эдетат кальция, камсилат, карбонат, хлорид, цитрат, клавулариат, дигидрохлорид, эдетат, эдисилат, эстолат, эзилат, fiunarate (фиунарат?), глюцепат, глюконат, глутамат, гликоллиларсанилат, гексафторфосфат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, йодид, sethionate (изетионат?), лактат, лактобионат, лаурат, магний, малат, малеат, миндалят, мезилат, метилбромид, метилнитрат, метилсульфат, мукат, напсилат, нитрат, аммониевая соль N-метилглюкамина, 3-гидрокси-2-нафтоат, олеат, оксалат, пальмитат, памоат, 1,1-метенбис-2-гидрокси-3-нафтоат, эйнбонат, пантотенат, фосфат/дифосфат, пикрат, полигалактуронат, пропионат, п-толуолсульфонат, салицилат, стеарат, субацетат, сукцинат, сульфат, сульфосалицилат, сурамат, таннат, тартрат, теоклат, тозилат, триэтиодид и валерат.
«Фармацевтически приемлемая соль» может также включать кислотно- и основно-аддитивные соли. «Фармацевтически приемлемая кислотно-аддитивная соль» может относиться к тем солям, которые сохраняют биологическую эффективность и свойства свободных оснований, которые не являются биологически или иным образом нежелательными и которые могут быть образованы с неорганическими кислотами, такими как, но не ограничиваясь ими, хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобные, и органическими кислотами, такими как, но не ограничиваясь ими, уксусная кислота, 2,2-дихлоруксусная кислота, адипиновая кислота, альгиновая кислота, аскорбиновая кислота, аспарагиновая кислота, бензолсульфоновая кислота, бензойная кислота, 4-ацетамидобензойная кислота, камфорная кислота, камфор-10- сульфоновая кислота, каприновая кислота, капроновая кислота, каприловая кислота, угольная кислота, коричная кислота, лимонная кислота, цикламиновая кислота, додецилсерная кислота, этан-1,2-дисульфоновая кислота, этансульфоновая кислота, 2-гидроксиэтансульфоновая кислота, муравьиная кислота, фумаровая кислота, галактаровая кислота, гентизиновая кислота, глюкогептоновая кислота, глюконовая кислота, глюкуроновая кислота, глутаминовая кислота, глутаровая кислота, 2-оксоглутаровая кислота, глицерофосфорная кислота, гликолевая кислота, гиппуровая кислота, изомасляная кислота, молочная кислота, лактобионовая кислота, лауриновая кислота, малеиновая кислота, яблочная кислота, малоновая кислота, миндальная кислота, метансульфоновая кислота, слизевая кислота, нафталин-1,5-дисульфоновая кислота, нафталин-2-сульфоновая кислота, 1-гидрокси-2-нафтойная кислота, никотиновая кислота, олеиновая кислота, оротовая кислота, щавелевая кислота, пальмитиновая кислота, памовая кислота, пропионовая кислота, пироглутаминовая кислота, пировиноградная кислота, салициловая кислота, 4-аминосалициловая кислота, себациновая кислота, стеариновая кислота, янтарная кислота, винная кислота, тиоциановая кислота, п-толуолсульфоновая кислота, трифторуксусная кислота, ундециленовая кислота и подобные.
«Фармацевтически приемлемая основно-аддитивная соль» может относиться к тем солям, которые сохраняют биологическую эффективность и свойства свободных кислот, которые не являются нежелательными с биологической или иной точки зрения. Эти соли могут быть получены добавлением неорганического основания или органического основания к свободной кислоте. Соли, полученные из неорганических оснований, могут включать, но не ограничиваются ими, соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и подобных. Например, неорганические соли могут включать, но не ограничиваются ими, соли аммония, натрия, калия, кальция и магния. Соли, полученные из органических оснований, могут включать, но не ограничиваются ими, соли первичных, вторичных и третичных аминов, замещенных аминов, включая встречающиеся в природе замещенные амины, циклических аминов и основных ионообменных смол, таких как аммиак, изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, диэтаноламин, этаноламин, деанол, 2-диметиламиноэтанол, 2-диэтиламиноэтанол, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, бенетамин, бензатин, этилендиамин, глюкозамин, метилглюкамин, теобромин, триэтаноламин, трометамин, пурины, пиперазин, пиперидин, N-этилпиперидин, полиаминовые смолы и подобные.
Если не указано иное, изображенные здесь структуры также могут включать соединения, которые отличаются только присутствием одного или нескольких изотопно обогащенных атомов. Например, соединения, имеющие настоящую структуру, за исключением замены атома водорода дейтерием или тритием или замены атома углерода на 13C или 14C, или замены атома азота на 15N или замены атома кислорода на 17O или 18O, включены в объем раскрытия. Такие меченые изотопами соединения полезны в качестве инструментов исследования или диагностики.
В некоторых вариантах осуществления, один или несколько атомов дейтерия могут быть введены в группу ПЭГ любого соединения по настоящему изобретению. Механизмы таких модификаций известны в данной области, начиная с коммерчески доступных исходных материалов, таких как изотопно обогащенные гидроксиламиновые строительные блоки. В некоторых вариантах осуществления, тритий или дейтерий могут быть введены в положение C32 соединений по настоящему изобретению с использованием, например, коммерчески доступного изотопно чистого восстанавливающего агента и способов, известных специалистам в данной области. В некоторых вариантах осуществления изотоп, такой как дейтерий или тритий, можно ввести в заместитель R26 соединения формулы I, Ia или Ib, используя коммерчески доступные исходные материалы и методы, известные специалистам в данной области.
Способы синтеза описанных соединений
Соединения данного раскрытия могут быть получены различными способами, включая стандартные химические методы. Подходящие пути синтеза изображены на схемах, приведенных ниже.
Соединения любой из формул, описанных здесь, могут быть получены способами, известными в области органического синтеза, которые частично изложены следующими схемами синтеза и примерами. В схемах, описанных ниже, хорошо понятно, что защитные группы для чувствительных или реакционноспособных групп используются там, где это необходимо, в соответствии с общими принципами или химией. С защитными группами работают согласно стандартным методам органического синтеза (T. W. Greene и P. G. M. Wuts, "Protective Groups in Organic Synthesis", Third edition, Wiley, New York 1999). Эти группы удаляют на удобной стадии синтеза соединения с использованием способов, которые очевидны для специалистов в данной области. Процессы выбора, а также условия реакции и порядок их выполнения, должны соответствовать получению соединений формулы I или IIb или фармацевтически приемлемой соли или таутомера любого из вышеперечисленных.
Соединения любой из формул, описанных в данном документе, могут быть получены способами, исключающими использование медиированных металлами реакций циклоприсоединения, которые требуют использования азидсодержащих соединений. Азидсодержащие соединения представляют потенциальную угрозу безопасности, связанную с их получением и хранением (например, взрываются из-за разложения с высокой энергией). Кроме того, приведенные здесь схемы реакций позволяют избежать использования металлической меди или рутения на предпоследних или последних стадиях синтеза, что может быть выгодным. Отказ от использования металлической меди или рутения на предпоследних или последних стадиях синтеза снижает вероятность загрязнения конечных соединений нежелательными металлическими примесями.
Специалисты в данной области поймут, существует ли стереоцентр в любом из соединений данного раскрытия. Соответственно, настоящее раскрытие может включать оба возможных стереоизомера (если не указано в синтезе), так и может включать не только рацемические соединения, и может включать не только рацемические соединения, но и отдельные энантиомеры и/или диастереомеры. Когда соединение желательно в виде единственного энантиомера или диастереомера, оно может быть получено стереоспецифическим синтезом или разделением конечного продукта или любого удобного промежуточного соединения. Разделение конечного продукта, промежуточного соединения или исходного материала может осуществляться любым подходящим способом, известным в данной области. См., например, "Stereochemistry of Organic Compounds" by E. L. Eliel, S. H. Wilen и L. N. Mander (Wiley-lnterscience, 1994).
Получение соединений
Описанные здесь соединения могут быть получены из коммерчески доступных исходных материалов или синтезированы с использованием известных органических, неорганических и/или ферментативных процессов.
Соединения данного раскрытия могут быть получены множеством способов, хорошо известных специалистам в области органического синтеза. В качестве примера, соединения по настоящему раскрытию могут быть синтезированы с использованием способов, описанных ниже, вместе с синтетическими методами, известными в области синтетической органической химии, или их вариациями, как это понятно специалистам в данной области. Эти способы могут включать, но не ограничиваются ими, способы, описанные ниже.
Термин «таутомеры» может относиться к ряду соединений, которые имеют одинаковое количество и тип атомов, но различаются связностью и находятся в равновесии друг с другом. «Таутомер» является единственным членом этого ряда соединений. Обычно рисуется единственный таутомер, но можно понять, что эта единственная структура может представлять все возможные таутомеры, которые могут существовать. Примеры могут включать енол-кетоноую таутомерию. Когда извлекается кетон, можно понять, что как енольная, так и кетоновая формы являются частью описания.
В дополнение к таутомерам, которые могут существовать во всех амидных, карбонильных и оксимных группах в соединениях формулы I, Ia или Ib, соединения этого семейства легко взаимно превращаются через соединения с открытым кольцом между двумя основными изомерными формами, известными как пирановые и оксепановые изомеры (показаны ниже). Этому взаимному превращению могут способствовать ионы магния, слабокислые условия или соли алкиламина, как описано в следующих ссылках: i) Hughes, P. F.; Musser, J.; Conklin, M.; Russo, R. 1992. Tetrahedron Lett. 33(33): 4739-32. ii) Zhu, T. 2007. Патент США № 7,241,771; Wyeth. iii) Hughes, P.F. 1994. Патент США № 5,344,833; American Home Products Corp. Схема ниже показывает взаимопревращение между пирановым и оксепановым изомерами в соединениях формулы I, Ia или Ib.
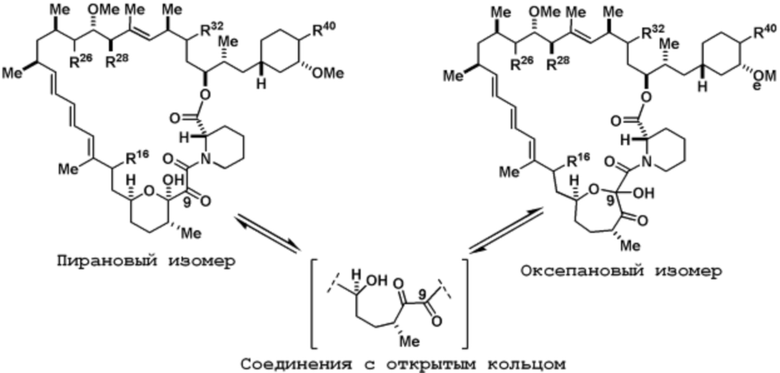
Поскольку это взаимное превращение происходит в мягких условиях, и положение термодинамического равновесия может варьироваться между различными членами соединений формулы I, Ia или Ib, оба изомера рассматриваются для соединений формулы I, Ia или Ib. Для краткости показана пирановая изомерная форма всех промежуточных соединений и соединений формул I, Ia или Ib.
Общие подходы к сборке для бифункциональных рапалогов
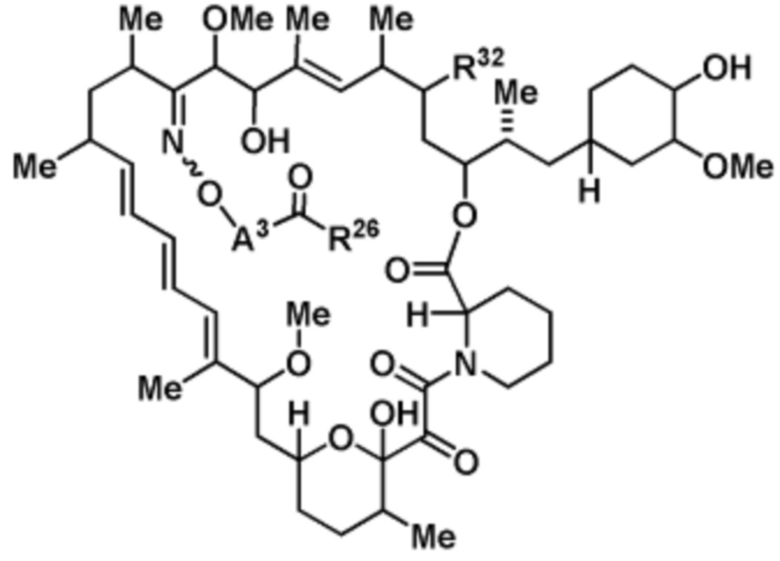
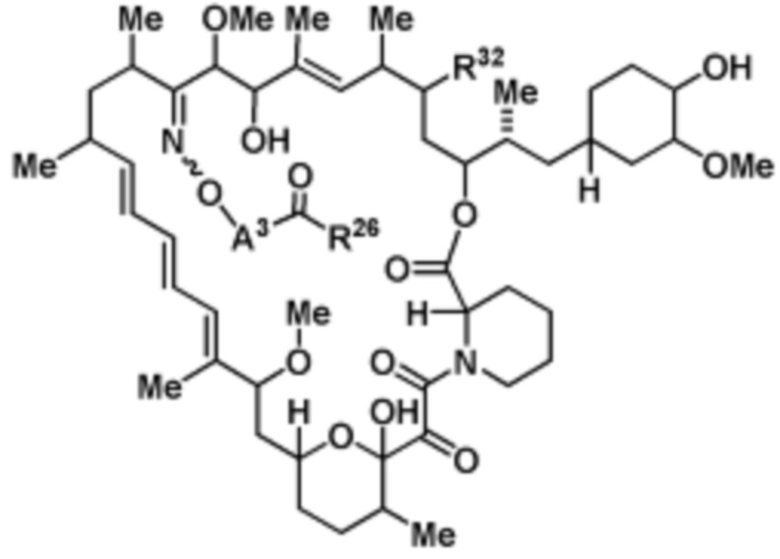
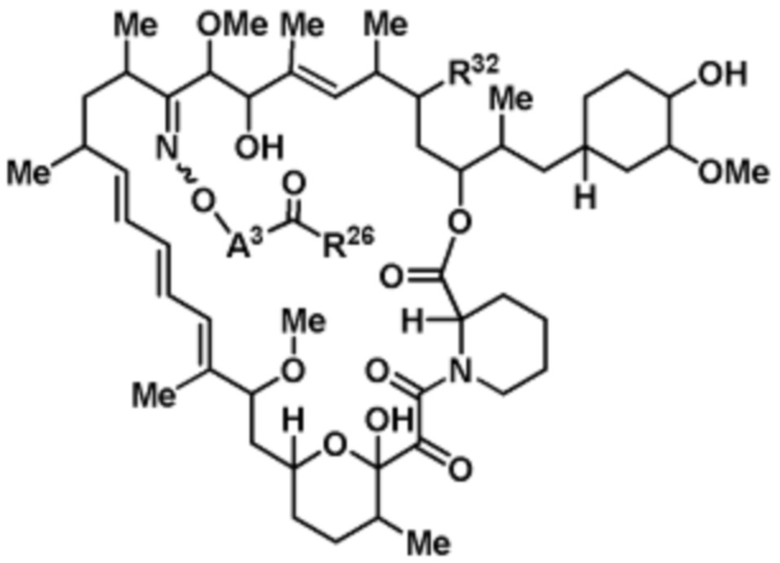
Со ссылкой на схемы ниже, рапамицин имеет формулу RAP,
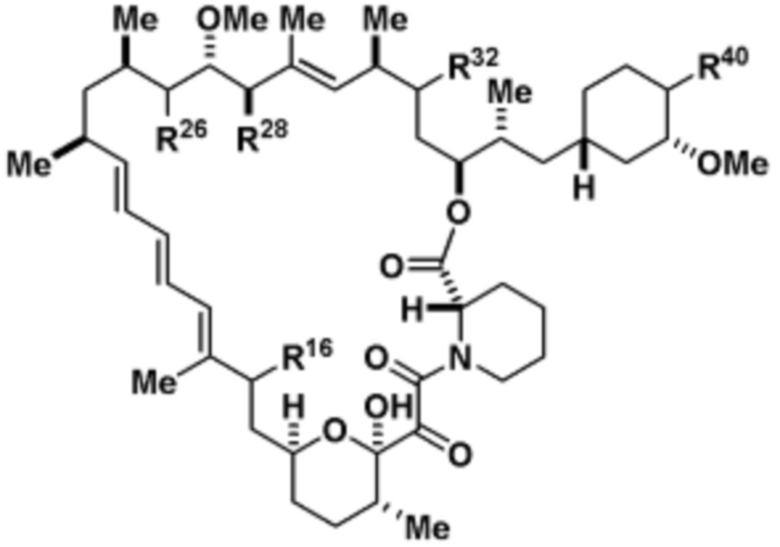 (RAP)
(RAP)
где R16 является -OCH3; R26 является =O; R28 является -OH; R32 является =O; и R40 является -OH. “Рапалог” относится к аналогу или производному рапамицина. Например, со ссылкой на схемы ниже, рапалогом может быть рапамицин, который замещен в любом положении, таком как R16, R26, R28, R32 или R40. Ингибитором активного сайта (ингибитором АС) является ингибитор mTOR активного сайта. В определенных вариантах осуществления, Ингибитор АС изображен посредством B в формуле I, Ia или Ib.
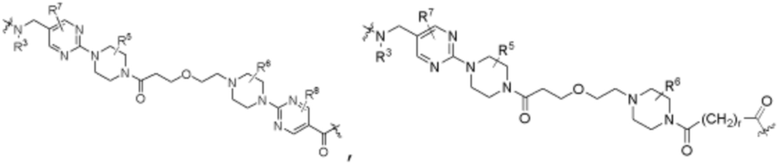
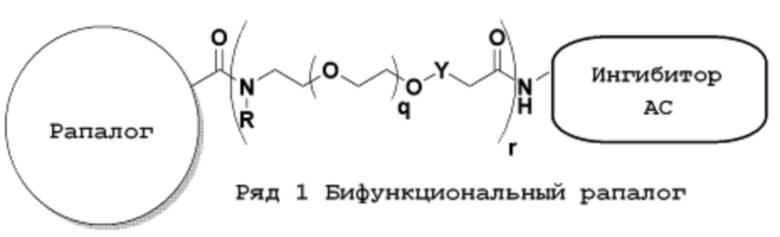
Ряд 1 бифункциональных рапалогов
Общая структура Ряда 1 бифункциональных рапалогов показана на схеме 1 ниже. Схема 1. Для этих типов бифункциональных рапалогов, линкер может включать варианты, где q=0-30, например, q=1-7 и r=1-6. Линкерный амин может включать замещения, такие как R=H и C1-C6 алкильные группы. Амидная группа может быть присоединена к рапалогу на R26 (формула I, Ia или Ib) через фрагмент оксимной связи, включая варианты, найденные в таблице 1 в разделе примеров. Ингибитор mTOR активного сайта может присоединяться к линкеру через первичный или вторичный амин, и может включать варианты, найденные в таблице 2 в разделе примеров.
Схема 1. Ряд 1 бифункциональных рапалогов.
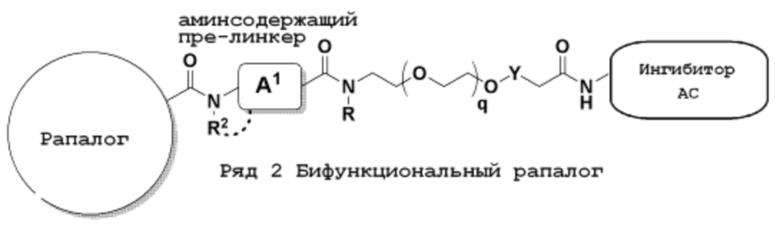
Ряд 2 бифункциональных рапалогов
Общая структура Ряда 2 бифункциональных рапалогов показана на схеме 2 ниже. Для этих типов бифункциональных рапалогов, линкер может включать варианты, где q=0-30, например, q=1-7. Линкерный амин может включать замещения, такие как R=H и C1-C6 алкильные группы. Пре-линкерный амин может включать замещения, такие как R2=H, C1-C6 алкильные группы и циклоалкил, включая 4-8-членные кольца. Амидная группа может быть присоединена к рапалогу на R26 (формула I, Ia или Ib) через фрагмент оксимной связи, включая варианты, найденные в таблице 1 в разделе примеров. Ингибитор mTOR активного сайта может присоединяться к линкеру через первичный или вторичный амин и может включать варианты, найденные в таблице 2 в разделе примеров.
Схема 2. Ряд 2 бифункциональных рапалогов.
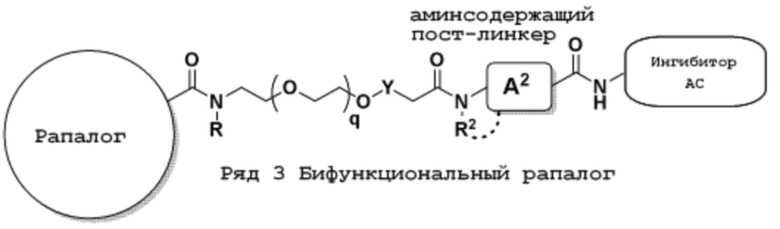
Ряд 3 бифункциональных рапалогов
Общая структура Ряда 3 бифункциональных рапалогов показана на схеме 3 ниже. Для этих типов бифункциональных рапалогов, линкер может включать варианты, где q=0-30, например, q=1-7. Линкерный амин может включать замещения, такие как R=H и C1-C6 алкильные группы. Пост-линкерный амин может включать замещения, такие как R2=H, C1-C6 алкильные группы и циклоалкил, включая 4-8-членные кольца. Амидная группа может быть присоединена к рапалогу на R26 (формулы I, Ia или Ib) через фрагмент оксимной связи, включая варианты, найденные в таблице 1 в разделе примеров. Ингибитор mTOR активного сайта может присоединяться к линкеру через первичный или вторичный амин и может включать варианты, найденные в таблице 2 в разделе примеров.
Схема 3. Ряд 3 бифункциональных рапалогов
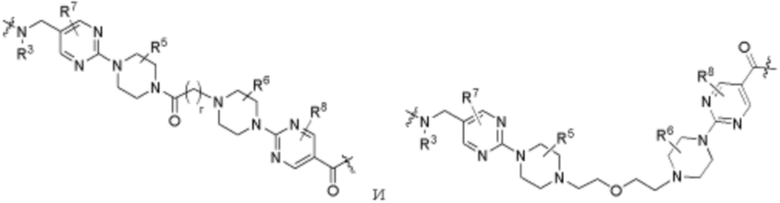
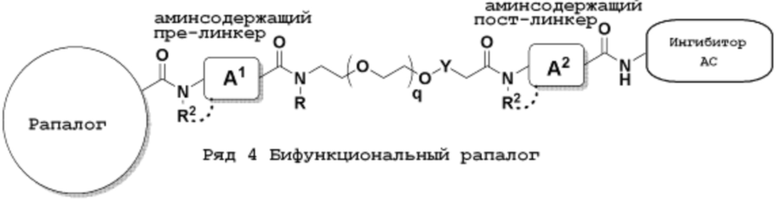
Ряд 4 бифункциональные рапалоги
Общая структура Ряда 4 бифункциональных рапалогов показана на схеме 4 ниже. Для этих типов бифункциональных рапалогов, линкер может включать варианты, где q=0-30, например, q=1-7. Линкерный амин может включать замещения, такие как R=H и C1-C6 алкильные группы. Каждый из пре- и пост-линкерных аминов может содержать замещения, такие как R2=H, C1-C6 алкильные группы и циклоалкил, включая 4-8-членные кольца. Амидная группа может быть присоединена к рапалогу на R26 (формула I, Ia или Ib) через фрагмент оксимной связи, включая варианты, найденные в таблице 1 в разделе примеров. Ингибитор mTOR активного сайта может присоединяться к линкеру через первичный или вторичный амин и может включать варианты, найденные в таблице 2 в разделе примеров.
Схема 4. Ряд 4 бифункциональные рапалоги
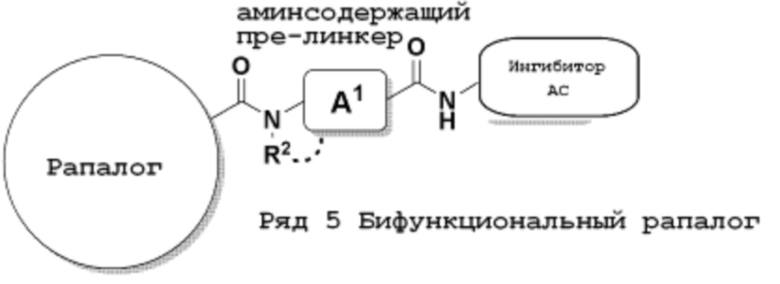
Ряд 5 бифункциональные рапалоги
Общая структура Ряда 5 бифункциональных рапалогов показана на схеме 5 ниже. Для этих типов бифункциональных рапалогов, пре-линкерный амин может включать замещения, такие как R2=H, C1-C6 алкильные группы и циклоалкил, включая 4-8-членные кольца. Амидная группа может быть присоединена к рапалогу на R26 (формула I, Ia или Ib) через фрагмент оксимной связи, включая варианты, найденные в таблице 1 в разделе примеров. Ингибитор mTOR активного сайта может присоединяться к линкеру через первичный или вторичный амин и может включать варианты, найденные в таблице 2 в разделе примеров.
Схема 5. Ряд 5 бифункциональные рапалоги
Ряд 6 бифункциональных рапалогов
Общая структура Ряда 6 бифункциональных рапалогов показана на схеме 6 ниже. Для этих типов бифункциональных рапалогов, линкер может включать варианты, где q=0-30, например, q=1-7. Линкерные амины могут включать замещения, такие как R=H и C1-C6 алкильные группы. Пост-линкерный амин может включать замещения, такие как R2=H, C1-C6 алкильные группы и циклоалкил, включая 4-8-членные кольца. Амидная группа может быть присоединена к рапалогу на R26 (формула I, Ia или Ib) через франгмент оксимной связи, включая варианты, найденные в таблице 1 в разделе примеров. Ингибитор mTOR активного сайта может присоединяться к линкеру через первичный или вторичный амин и может включать варианты, найденные в таблице 2 в разделе примеров.
Схема 6. Ряд 6 бифункциональные рапалоги.
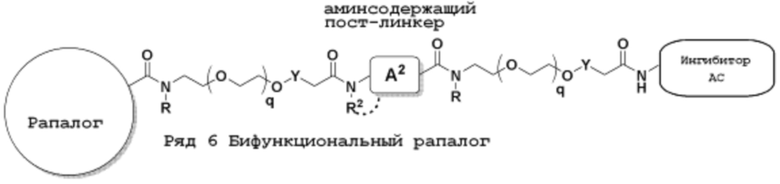
Ряд 7 бифункциональных рапалогов
Общая структура Ряда 7 бифункциональных рапалогов показана на схеме 7 ниже. Для этих типов бифункциональных рапалогов, линкер может включать варианты, где q=0-30, например, q=1-7. Линкерный амин может включать замещения, такие как R=H и C1-C6 алкильные группы. Каждый из пре- и пост-линкерных аминов включает замещения, такие как R2=H, C1-C6 алкильные группы и циклоалкил, включая 4-8-членные кольца. Амидная группа может быть присоединена к рапалогу на R26 (формула I, Ia или Ib) через фрагмент оксимной связи, включая варианты, найденные в таблице 1 в разделе примеров. Ингибитор mTOR активного сайта может присоединяться к линкеру через первичный или вторичный амин и может включать варианты, найденные в таблице 2 в разделе примеров.
Схема 7. Ряд 7 бифункциональные рапалоги
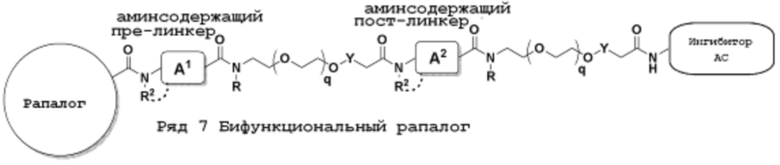
Ряд 8 бифункциональных рапалогов
Общая структура Ряда 8 бифункциональных рапалогов показана на схеме 8ниже. Для этих типов бифункциональных рапалогов, линкер может включать варианты, где q=0-10, например, q=1-7. Линкерный амин может включать замещения, такие как R=H и C1-C6 алкильные группы. Пост-линкерный амин может включать замещения, такие как R2=H, C1-C6 алкильные группы и циклоалкил, включая 4-8-членные кольца. Амидная группа может быть присоединена к рапалогу на R26 (формула I, Ia или Ib) через фрагмент оксимной связи, включая варианты, найденные в таблице 1 в разделе примеров. Ингибитор mTOR активного сайта может присоединяться к линкеру через первичный или вторичный амин и может включать варианты, найденные в таблице 2 в разделе примеров.
Схема 8. Ряд 8 бифункциональные рапалоги
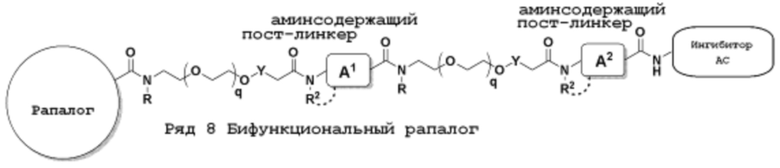
Фармацевтические композиции
Другой аспект относится к фармацевтической композиции, включающей фармацевтически приемлемый эксципиент и соединение или его фармацевтически приемлемую соль или таутомер.
В вариантах осуществления фармацевтических композиций соединение по настоящему изобретению или его фармацевтически приемлемая соль или таутомер могут быть включены в терапевтически эффективном количестве.
Введение раскрытых соединений или композиций может осуществляться любым способом введения терапевтических агентов. Эти способы могут включать системное или местное введение, такое как пероральный, назальный, парентеральный, чрезкожный, подкожный, вагинальный, буккальный, ректальный, местный, интратекальный или внутричерепной режимы введения.
В некоторых вариантах осуществления, введение может включать пероральное введение, введение в виде суппозитория, местный контакт, внутривенное, парентеральное, внутрибрюшинное, внутримышечное, внутриочаговое, интратекальное, внутричерепное, интраназальное или подкожное введение или имплантацию устройства с медленным высвобождением, например, мини-осмотического насоса, субъекту. Введение может осуществляться любым путем, включая парентеральный и чрезслизистый (например, буккальный, сублингвальный, небный, десневой, назальный, вагинальный, ректальный или чрежкожный). Парентеральное введение включает, например, внутривенное, внутримышечное, внутриартериольное, внутрикожное, подкожное, внутрибрюшинное, внутрижелудочковое и внутричерепное. Другие способы доставки включают, но не ограничиваются ими, использование липосомальных составов, внутривенную инфузию, чрезкожные пластыри и т.д. Композиции данного раскрытия могут доставляться чрезкожно, местным путем, составленные в виде аппликаторов, растворов, суспензий, эмульсий, гелей, кремов, мазей, паст, желе, красок, порошков и аэрозолей. Пероральные препараты включают таблетки, пилюли, порошок, драже, капсулы, жидкости, лепешки, облатки, гели, сиропы, кашицы, суспензии и т.д., подходящие для приема внутрь пациентом. Препараты в твердой форме включают порошки, таблетки, пилюли, капсулы, облатки, суппозитории и диспергируемые гранулы. Препараты в жидкой форме включают растворы, суспензии и эмульсии, например, растворы в воде или воде/пропиленгликоле. Композиции данного раскрытия могут дополнительно включать компоненты для обеспечения замедленного высвобождения и/или комфорта. Такие компоненты включают высокомолекулярные, анионные мукомиметические полимеры, гелеобразующие полисахариды и тонкоизмельченные субстраты-носители лекарственного средства. Эти компоненты более подробно обсуждаются в патентах США №№ 4,911,920; 5,403,841; 5,212,162; и 4,861,760. Все содержание этих патентов полностью включено в настоящий документ посредством ссылки для всех целей. Композиции данного раскрытия также могут доставляться в виде микросфер для медленного высвобождения в организме. Например, микросферы могут вводиться посредством внутрикожной инъекции содержащих лекарственное средство микросфер, которые медленно высвобождаются подкожно (см. Rao, J. Biomater Set Polym. Ed. 7:623-645, 1995); в виде биоразлагаемых и вводимых инъекцией гелевых составов (см., например, Gao Pharm. Res. 12:857-863, 1995); или в виде микросфер для перорального введения (см., например, Eyles, J. Pharm. Pharmacol. 49:669-674, 1997). В другом варианте осуществления, композиции данного раскрытия могут быть доставлены с использованием липосом, которые сливаются с клеточной мембраной или подвергаются эндоцитозу, т.е. с использованием лигандов рецепторов, прикрепленных к липосомам, которые связываются с рецепторами белков поверхностных мембран клетки, приводя к эндоцитозу. При использовании липосом, особенно в тех случаях, когда поверхность липосом несет лиганды рецепторов, специфичные для клеток-мишеней или другим образом предпочтительно направленные на конкретный орган, можно сфокусировать доставку композиций по настоящему изобретению в клетки-мишени in vivo. (См., например, Al-Muhammed, J. Microencapsul. 13:293-306, 1996; Chonn, Curr. Opin. Biotechnol. 6:698-708, 1995; Ostro, Am. J. Hosp. Pharm. 46: 1576-1587, 1989). Композиции данного раскрытия также могут доставляться в виде наночастиц.
В зависимости от предполагаемого способа введения, раскрытые соединения или фармацевтические композиции могут быть в твердой, полутвердой или жидкой дозированной форме, такой как, например, инъекции, таблетки, суппозитории, пилюли, капсулы с замедленным высвобождением, эликсиры, настойки, эмульсии, сиропы, порошки, жидкости, суспензии или подобные, иногда в стандартных дозах и в соответствии с общепринятой фармацевтической практикой. Аналогичным образом, их можно также вводить во внутривенной (болюсом и инфузией), внутрибрюшинной, интратекальной, подкожной или внутримышечной форме, и все применяемые формы хорошо известны специалистам в области фармацевтики.
Иллюстративными фармацевтическими композициями являются таблетки и желатиновые капсулы, содержащие соединение по раскрытию и фармацевтически приемлемый носитель, такой как а) разбавитель, например очищенную воду, триглицеридные масла, такие как гидрогенизированное или частично гидрогенизированное растительное масло или их смеси, кукурузное масло, оливковое масло, подсолнечное масло, сафлоровое масло, рыбий жир, такой как EPA или DHA, или их сложные эфиры, триглицериды или их смеси, омега-3 жирные кислоты или их производные, лактозу, декстрозу, сахарозу, маннит, сорбит, целлюлозу, натрий, сахарин, глюкозу и/или глицин; b) смазывающий агент, например диоксид кремния, тальк, стеариновую кислоту, ее магниевую или кальциевую соль, олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и/или полиэтиленгликоль; также для таблеток; c) связующий агент, например алюмосиликат магния, крахмальную пасту, желатин, трагакант, метилцеллюлозу, карбоксиметилцеллюлозу натрия, карбонат магния, натуральные сахара, такие как глюкоза или бета-лактоза, кукурузные подсластители, натуральные и синтетические камеди, такие как аравийская камедь, трагакант или альгинат натрия, воски и/или поливинилпирролидон, если желательно; d) разрыхлитель, например крахмалы, агар, метилцеллюлозу, бентонит, ксантановую камедь, альгиновую кислоту или ее натриевую соль или шипучие смеси; e) абсорбент, краситель, ароматизатор и подсластитель; f) эмульгатор или диспергирующий агент, такой как Tween 80, Labrasol, HPMC, DOSS, капроил 909, лабрафак, лабрафил, пецеол, транскутол, капмул MCM, капмул PG-12, каптекс 355, геликур, витамин E TGPS или другой приемлемый эмульгатор; и/или g) агент, усиливающий абсорбцию соединения, такой как циклодекстрин, гидроксипропилциклодекстрин, ПЭГ400, ПЭГ200.
Жидкие, в частности, инъекционные композиции могут, например, быть приготовлены путем растворения, диспергирования и т.д. Например, раскрытое соединение растворяют или смешивают с фармацевтически приемлемым растворителем, таким как, например, вода, физиологический раствор, водная декстроза, глицерин, этанол и подобные, чтобы таким образом образовать изотонический раствор или суспензию для инъекций. Белки, такие как альбумин, хиломикронные частицы или белки сыворотки, могут быть использованы для солюбилизации раскрытых соединений.
Раскрытые соединения также могут быть составлены в виде суппозиториев, которые могут быть приготовлены из жировых эмульсий или суспензий; с использованием полиалкиленгликолей, таких как пропиленгликоль, в качестве носителя.
Раскрытые соединения также могут быть введены в форме липосомных систем доставки, таких как небольшие однослойные везикулы, большие однослойные везикулы и многослойные везикулы. Липосомы могут быть образованы из множества фосфолипидов, содержащих холестерин, стеариламин или фосфатидилхолины. В некоторых вариантах осуществления, пленку из липидных компонентов гидрируют водным раствором лекарственного средства с образованием липидного слоя, инкапсулирующего лекарственное средство, как описано, например, в патенте США № 5,262,564, содержание которого включено сюда в качестве ссылки.
Раскрытые соединения также могут быть доставлены с использованием моноклональных антител в качестве индивидуальных носителей, с которыми сопряжены раскрытые соединения. Раскрытые соединения также могут быть связаны с растворимыми полимерами в качестве нацеленных носителей лекарственных средств. Такие полимеры могут включать поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламидфенол, полигидроксиэтиласпанамидфенол или замещенные полиэтиленоксидполилизином пальмитоиловые остатки. Кроме того, раскрытые соединения могут быть сопряжены с классом биоразлагаемых полимеров, используемых для достижения контролируемого высвобождения лекарственного средства, например, полимолочной кислотой, полипсилонкапролактоном, полигидроксимасляной кислотой, сложными полиортоэфирами, полиацеталями, полидигидропиранами, полицианоакрилатами и поперечно-сшитыми или амфипатическими блок-сополимерами гидрогелей. В одном варианте осуществления, раскрытые соединения не связаны ковалентно с полимером, например, полимером поликарбоновой кислоты или полиакрилатом.
Введение парентеральной инъекцией обычно используется для подкожных, внутримышечных или внутривенных инъекций и инфузий. Инъекционные препараты могут быть приготовлены в обычных формах либо в виде жидких растворов, либо суспензий, либо твердых форм, подходящих для растворения в жидкости перед инъекцией.
Другой аспект раскрытия относится к фармацевтической композиции, содержащей соединение или его фармацевтически приемлемую соль или таутомер данного раскрытия и фармацевтически приемлемый носитель. Фармацевтически приемлемый носитель может дополнительно включать эксципиент, разбавитель или поверхностно-активное вещество.
Композиции могут быть приготовлены согласно обычным методам смешивания, гранулирования или нанесения покрытия, соответственно, и настоящие фармацевтические композиции могут содержать от около 0,1% до около 99%, от около 5% до около 90% или от около 1% до около 20% раскрытого соединения по массе или объему.
Описанные здесь соединения можно использовать в сочетании друг с другом, с другими активными агентами, известными как полезные при лечении рака, аутоиммунного заболевания, воспалительного заболевания, метаболического заболевания, нейродегенеративного заболевания, грибковой инфекции или отторжения трансплантата, или со вспомогательными агентами, которые могут быть не эффективны сами по себе, но могут способствовать повышению эффективности активного агента. Описанные здесь соединения могут использоваться в сочетании с другими активными агентами, известными как агенты продления жизни или агенты против старения.
В вариантах осуществления фармацевтических композиций, фармацевтическая композиция может включать второй агент (например, терапевтический агент). В вариантах осуществления фармацевтических композиций, фармацевтическая композиция может включать второй агент (например, терапевтический агент) в терапевтически эффективном количестве. В вариантах осуществления, вторым агентом является противораковый агент. В вариантах осуществления, вторым агентом является иммунотерапевтический агент. В вариантах осуществления, вторым агентом является иммуно-онкологический агент. В вариантах осуществления, вторым агентом является анти-аутоиммунный агент. В вариантах осуществления, вторым агентом является противовоспалительный агент. В вариантах осуществления, вторым агентом является анти-нейродегенеративный агент. В вариантах осуществления, вторым агентом является анти-метаболический агент. В вариантах осуществления, вторым агентом является анти-сердечнососудистый агент. В вариантах, вторым агентом является агент против старения. В вариантах осуществления, вторым агентом является агент для продления жизни. В вариантах осуществления, вторым агентом является агент для лечения или профилактики отторжения трансплантата. В вариантах осуществления, вторым агентом является агент для лечения или профилактики грибковой инфекции. В вариантах осуществления, вторым агентом является репрессор иммунной системы. В вариантах осуществления, вторым агентом является модулятор mTOR. В вариантах осуществления, вторым агентом является ингибитор mTOR. В вариантах осуществления, вторым агентом является ингибитор активного сайта mTOR. В вариантах осуществления, вторым агентом является рапамицин. В вариантах осуществления, вторым агентом является аналог рапамицина. В вариантах осуществления, вторым агентом является ингибитор пути mTOR. В определенных вариантах осуществления, вторым агентом является ингибитор CDK4/6; анти-PD1/PD-L1, ингибитор PI3K; или ингибитор АС.
«Противораковый агент» или «противораковое лекарственное средство» используется в соответствии с его простым обычным значением и относится к композиции (например, соединению, лекарственному средству, антагонисту, ингибитору, модулятору), имеющей противоопухолевые свойства или способность подавлять рост или пролиферацию клеток. В некоторых вариантах осуществления, противораковый агент является химиотерапевтическим. В некоторых вариантах осуществления, противораковый агент является агентом, одобренным FDA или аналогичным регулирующим агентством страны, отличной от США, для лечения рака. Примеры противораковых агентов включают, но не ограничиваются ими, рапамицин, аналог рапамицина, бевацизумаб, PP242, ГN 128, MLN0128, антиандрогены (например, Каходекс, Флутамид, MDV3100 или ARN-509), ингибиторы MEK (например, MEKl, MEK2 или MEKl и MEK2) (например, XL518, CI-1040, PD035901, селуметиниб/AZD6244, GSK1 120212/траметиниб, GDC-0973, ARRY-162, ARRY-300, AZD8330, PD0325901, U0126, PD98059, TAK-733, PD318088, AS703026, BAY 869766), алкилирующие агенты (например, циклофосфамид, ифосфамид, хлорамбуцил, бусульфан, мелфалан, мехлоретамин, урамустин, тиотепа, нитрозомочевины, хлорметины (например, мехлорэтамин, циклофосфамид, хлорамбуцил, мелфалан), этиленимин и метилмеламины (например, гексаметилмеламин, тиотепа), алкилсульфонаты (например, бусульфан), нитрозомочевины (например, кармустин, ломуситн, семустин, стрептозоцин, триазены (декарбазин)), антиметаболиты (например, 5-азатиоприн, лейковорин, капецитабин, флударабин, гемцитабин, пеметрексед, ралтитрексед, аналог фолиевой кислоты (например, метотрексат), аналоги пиримидина (например, фторурацил, флоксуридин, цитарабин), аналоги пурина (например, меркаптопурин, тиогуанин, пентостатин) и т.д.), растительные алкалоиды (например, винкристин, винбластин, винорелбин, виндезин, подофиллотоксин, паклитаксел, доцетаксел и т.д.), ингибиторы топоизомеразы (например, иринотекан, топотекан, амсакрин, этопозид (VP 16), этопозид фосфат, тенипозид и т.д.), противоопухолевые антибиотики (например, доксорубицин, адриамицин, даунорубицин, эпирубицин, актиномицин, блеомицин, митомицин, митоксантрон, пликамицин и т.д.), соединения на основе платины (например, цисплатин, оксалиплатин, карбоплатин), антрацендион (например, митоксантрон), замещенную мочевину (например, гидроксимочевина), производное метилгидразина (например, прокарбазин), адренокортикальный супрессор (например, митотан, аминоглутетимид), эпиподофиллотоксины (например, этопозид), антибиотики (например, даунорубицин, доксорубицин, блеомицин), ферменты (например, L-аспарагиназа), ингибиторы азот-активированной подачи сигналов протеинкиназы (например, U0126, PD98059, PD184352, PD0325901, ARRY-142886, SB239063, SP600125, BAY 43-9006, вортманнин или LY294002), ингибиторы mTOR, антитела (например, ритуксан), 5-аза-2'-деоксицитидин, доксорубицин, винкристин, этопозид, гемцитабин, иматиниб (Gleevec.RTM.), шелданамицин, 17-N-аллиламино-17-деметоксигелданамицин (17-AAG), бортезомиб, трастузумаб, анастрозол; ингибиторы ангиогенеза; антиандрогены, антиэстрогены; антисмысловые олигонуклеотиды; модуляторы генов апоптоза; регуляторы апоптоза; аргининдезаминазу; антагонисты BCR/ABL; производные бета-лактама; ингибитор bFGF; бикалутамид; производные камптотецина; ингибиторы казеинкиназы (ICOS); аналоги кломифена; цитарабин дакликсимаб; дексаметазон; агонисты эстрогена; антагонисты эстрогена; этанидазол; этопозид фосфат; экземестан; фадрозол; финастерид; флударабин; фтородауноруницина гидрохлорид; гадолиний тексафирин; нитрат галлия; ингибиторы желатиназы; гемцитабин; ингибиторы глутатиона; гепсульфам; иммуностимулирующие пептиды; ингибитор рецептора инсулиноподобного фактора роста-1; агонисты интерферона; интерфероны; интерлейкины; летрозол; фактор ингибирования лейкоза; лейкоцитарный альфа-интерферон; лейпролид+эстроген+ прогестерон; лейпрорелин; ингибиторы матрилизина; ингибиторы матричной металлопротеиназы; ингибитор MIF; мифепристон; несовпадающую двухцепочечную РНК; моноклональное антитело; экстракт микобактериальной клеточной стенки; модуляторы оксида азота; оксалиплатин; паномифен; пентрозол; ингибиторы фосфатазы; ингибитор активатора плазминогена; платиновый комплекс; соединения платины; преднизон; ингибиторы протеасомы; иммуномодулятор на основе протеина А; ингибитор протеинкиназы C; ингибиторы протеинтирозинфосфатазы; ингибиторы пуриновой нуклеозидфосфорилазы; ингибиторы ras фарнезилпротеинтрансферазы; ингибитор ras; ингибитор ras-GAP; рибозимы; ингибиторы сигнальной трансдукции; модуляторы трансдукции сигналов; одноцепочечный антигенсвязывающий белок; ингибитор стволовых клеток; ингибиторы деления стволовых клеток; ингибиторы стромелизина; синтетические гликозаминогликаны; тамоксифен метиодид; ингибиторы теломеразы; тиреотропный гормон; ингибиторы трансляции; ингибиторы тирозинкиназы; антагонисты рецепторов урокиназы; стероиды (например, дексаметазон), финастерид, ингибиторы ароматазы, агонисты гонадотропин-рилизинг-гормона (GnRH), такие как гозерелин или лейпролид, адренокортикостероиды (например, преднизон), прогестины (например, гидроксипрогестерона капроат, мегестрола ацетат, медроксипрогестерона ацетат), эстрогены (например, диэтилстилбестрол, этинилэстрадиол), антиэстроген (например, тамоксифен), андрогены (например, пропионат тестостерона, например, флуоксиместерон), антиандроген (например, флутамид), иммуностимуляторы (например, Bacillus Calmette-Guerin (BCG), левамизол, интерлейкин-2, альфа-интерферон и т.д.), моноклональные антитела (например, анти-CD20, анти-HER2, анти-CD52, анти-HLA-DR и анти-VEGF моноклональные антитела), иммунотоксины (например, конъюгат анти-CD33 моноклонального антитела и калихеамицина, конъюгат анти-CD22 моноклонального антитела и экзотоксина pseudomonas и т.д.), радиоиммунотерапия (например, анти-CD20 моноклональное антитело, конъюгированное с U 1ln, 90Y или 131I, и т.д.), триптолид, гомохаррингтонин, дактиномицин, доксорубицин, эпирубицин, топотекан, итраконазол, виндезин, церивастатин, винкристин, дезоксиаденозин, сертралин, питавастатин, иринотекан, клофазимин, 5-нонилокситриптамин, вемурафениб, дабрафениб, эрлотиниб, гефитиниб, ингибиторы EGFR, таргетная терапия или терапевтическое средство для рецептора эпидермального фактора роста (EGFR) или (например, гефитиниб (Iressa™), эрлотиниб (Tarceva™), цетуксимаб (Erbitux™), лапатиниб (Tykerb™), панитумумаб (Vectibix™), вандетаниб (Caprelsa™), афатиниб/BIBW2992, CI-1033/канертиниб, нератиниб/HKI-272, CP-724714, TAK-285, AST-1306, ARRY334543, ARRY-380, AG-1478, дакомитиниб/PF299804, OSI-420/десметил эрлотиниб, AZD8931, AEE788, пелитиниб/EKB-569, CUDC-101, WZ8040, WZ4002, WZ3146, AG-490, XL647, PD153035, BMS-599626), сорафениб, иматиниб, сунитиниб, дасатиниб, пирролобензодиазепины (например, томаимицин), карбоплатин, CC-1065 и CC-1065 аналоги, включая амино-CBI, хлорметины (такие как хлорамбуцил и мелфалан), доластатин и аналоги доластатина (включая ауристатины: например, монометил ауристатин E), антрациклиновые антибиотики (такие как доксорубицин, даунорубицин и т.д.), дуокармицины и аналоги дуокармицина, энедиины (такие как неокарзиностатин и калихеамицины), производные лептомицина, майтанзиноиды и аналоги майтанзиноидов (например, мертансин), метотрексат, митомицин С, таксоиды, алкалоиды барвинка (такие как винбластин и винкристин), эпотилоны, (например, эпотилон B), камптотецин и его клинические аналоги топотекан и иринотекан, ΓΝΚ128, PP242, PP121, MLN0128, AZD8055, AZD2014, VP-BEZ235, BGT226, SFl 126, Торин 1, Торин 2, WYE 687, соль WYE 687 (например, гидрохлорид), PF04691502, PI-103, CC-223, OSI-027, XL388, KU-0063794, GDC-0349, PKI-587, рапамицин, дефоролимус (AP23573, MK-8669, ридафоролимус), темсиролимус (CCI-779), ABT478, эверолимус (RAD001) или подобные.
mTOR и способы лечения
Термин «mTOR» относится к белку «механистическая мишень рапамицина (серин/треонинкиназы)» или «мишень рапамицина млекопитающих». Термин «mTOR» может относиться к нуклеотидной последовательности или белковой последовательности mTOR человека (например, Entrez 2475, Uniprot P42345, RefSeq NM_004958 или RefSeq NP_004949) (SEQ ID NO: 1). Термин “mTOR” может включать и дикий тип нуклеотидных последовательностей или белков, и также их мутанты. В некоторых вариантах осуществления, “mTOR” является mTOR дикого типа. В некоторых вариантах осуществления, “mTOR” является одной или более мутантных форм. Термин “mTOR” XYZ может относиться к нуклеотидной последовательности или белку мутантного mTOR, где аминокислота с номером Y mTOR, которая обычно имеет аминокислоту X в диком типе, вместо этого имеет аминокислоту Z в мутанте. В вариантах осуществления, mTOR является человеческим mTOR. В вариантах осуществления, mTOR имеет нуклеотидную последовательность, соответствующую ссылочному номеру GL206725550 (SEQ ID NO: 2). В вариантах осуществления, mTOR имеет нуклеотидную последовательность, соответствующую RefSeq NM_004958.3 (SEQ ID NO:2). В вариантах осуществления, mTOR имеет белковую последовательность, соответствующую ссылочному номеру GL4826730 (SEQ ID NO: 1). В вариантах осуществления, mTOR имеет белковую последовательность, соответствующую RefSeq NP_004949.1 (SEQ ID NO: 1). В вариантах осуществления, mTOR имеет следующую аминокислотную последовательность:
MLGTGPAAATTAATTSSNVSVLQQFASGLKSRNEETRAKAAKELQHYVTMELREMSQEESTRFYDQLNHHIFELVSSSDANERKGGILAIASLIGVEGGNATRIGRFANYLRNLLPSNDPWMEMASKAIGRLAMAGDTFTAEYVEFEVKRALEWLGADRNEGRRHAAVLVLRELAISVPTFFFQQVQPFFDNIFVAVWDPKQAIREGAVAALRACLILTTQREPKEMQKPQWYRHTFEEAEKGFDETLAKEKGMNRDDRIHGALLILNELVRISSMEGERLREEMEEITQQQLVHDKYCKDLMGFGTKPRHITPFTSFQAVQPQQSNALVGLLGYSSHQGLMGFGTSPSPAKSTLVESRCCRDLMEEKFDQVCQWVLKCRNSKNSLIQMTILNLLPRLAAFRPSAFTDTQYLQDTMNHVLSCVKKEKERTAAFQALGLLSVAVRSEFKVYLPRVLDIIRAALPPKDFAHKRQKAMQVDATVFTCISMLARAMGPGIQQDIKELLEPMLAVGLSPALTAVLYDLSRQIPQLKKDIQDGLLKMLSLVLMHKPLRHPGMPKGLAHQLASPGLTTLPEASDVGSITLALRTLGSFEFEGHSLTQFVRHCADHFLNSEHKEIRMEAARTCSRLLTPSIHLISGHAHVVSQTAVQVVADVLSKLLWGITDPDPDIRYCVLASLDERFDAHLAQAENLQALFVAL NDQVFEIRELAICTVGRLSSMNPAFVMPFLRKMLIQILTELEHSGIGRIKEQSARMLGHLVSNAPRLIRPYMEPILKALILKLKDPDPDPNPGVINNVLATIGELAQVSGLEMRKWVDELFIIIMDMLQDSSLLAKRQVALWTLGQLVASTGYVVEPYRKYPTLLEVLLNFLKTEQNQGTRREAIRVLGLLGALDPYKHKVNIGMIDQSRDASAVSLSESKSSQDSSDYSTSEMLVNMGNLPLDEFYPAVSMVALMRIFRDQSLSHHHTMVVQAITFIFKSLGLKCVQFLPQVMPTFLNVIRVCDGAIREFLFQQLGMLVSFVKSHIRPYMDEIVTLMREFWVMNTSIQSTIILLIEQIVVALGGEFKLYLPQLIPHMLRVFMHDNSPGRIVSIKLLAAIQLFGANLDDYLHLLLPPIVKLFDAPEAPLPSRKAALETVDRLTESLDFTDYASRIIHPIVRTLDQSPELRSTAMDTLSSLVFQLGKKYQIFIPMVNKVLVRHRINHQRYDVLICRIVKGYTLADEEEDPLIYQHRMLRSGQGDALASGPVETGPMKKLHVSTINLQKAWGAARRVSKDDWLEWLRRLSLELLKDSSSPSLRSCWALAQAYNPMARDLFNAAFVSCWSELNEDQQDELIRSIELALTSQDIAEVTQTLLNLAEFMEHSDKGPLPLRDDNGIVLLGERAAKCRAYAKALHYKELEFQKGPTPAILESLISINNKLQQPEAAAGVLEYAMKHFGELEIQATWYEKLHEWEDALVAYDKKMDTNKDDPELMLGRMRCLEALGEWGQLHQQCCEKWTLVNDETQAKMARMAAAAAWGLGQWDSMEEYTCMIPRDTHDGAFYRAVLALHQDLFSLAQQCIDKARDLLDAELTAMAGESYSRAYGAMVSCHMLSELEEVIQYKLVPERREIIRQIWWERLQGCQRIVEDWQKILMVRSLVVSPHEDMRTWLKYASLCGKSGRLALAHKTLVLLLGVDPSRQLDHPLPTVHPQVTYAYMKNMWKSARKIDAFQHMQHFVQTMQQQAQHAIATEDQQHKQELHKLMARCFLKLGEWQLNLQGINESTIPKVLQYYSAATEHDRSWYKAWHAWAVMNFEAVLHYKHQNQARDEKKKLRHASGANITNATTAATTAATATTTASTEGSNSESEAESTENSPTPSPLQKKVTEDLSKTLLMYTVPAVQGFFRSISLSRGNNLQDTLRVLTLWFDYGHWPDVNEALVEGVKAIQIDTWLQVIPQLIARIDTPRPLVGRLIHQLLTDIGRYHPQALIYPLTVASKSTTTARHNAANKILKNMCEHSNTLVQQAMMVSEELIRVAILWHEMWHEGLEEASRLYFGERNVKGMFEVLEPLHAMMERGPQTLKETSFNQAYGRDLMEAQEWCRKYMKSGNVKDLTQAWDLYYHVFRRISKQLPQLTSLELQYVSPKLLMCRDLELAVPGTYDPNQPIIRIQSIAPSLQVITSKQRPRKLTLMGSNGHEFVFLLKGHEDLRQDERVMQLFGLVNTLLANDPTSLRKNLSIQRYAVIPLSTNSGLIGWVPHCDTLHALIRDYREKKKILLNIEHRIMLRMAPDYDHLTLMQKVEVFEHAVNNTAGDDLAKLLWLKSPSSEVWFDRRTNYTRSLAVMSMVGYILGLGDRHPSNLMLDRLSGKILHIDFGDCFEVAMTREKFPEKIPFRLTRMLTNAMEVTGLDGNYRITCHTVMEVLREHKDSVMAVLEAFVYDPLLNWRLMDTNTKGNKRSRTRTDSYSAGQSVEILDGVELGEPAHKKTGTTVPESIHSFIGDGLVKPEALNKKAIQIINRVRDKLTGRDFSHDDTLDVPTQVELLIKQATSHENLCQCYIGWCPFW
(SEQ ID NO: 1)
В вариантах осуществления, mTOR является мутантным mTOR. В вариантах осуществления, мутантный mTOR связан с заболеванием, которое не связано с диким типом mTOR. В вариантах осуществления, mTOR может включать, по меньшей мере, одну аминокислотную мутацию (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 мутаций или любой диапазон, выводимый здесь) по сравнению с последовательностью выше.
Термин “mTORC1” относится к белковому комплексу, включающему mTOR и Raptor (регуляторно-ассоциированный белок mTOR). mTORC1 может также включать MLST8 (млекопитающий летальный с SEC 13 белок 8), PRAS40 и/или DEPTOR. mTORC1 может функционировать в качестве датчика питательных средств/энергии/редокса и регулятора синтеза белка. Термин “путь mTORC1” или “путь трансдукции сигнала mTORC1” может относиться к клеточному пути, включающему mTORC1. Путь mTORC1 включает компоненты пути выше и ниже mTORC1. Путь mTORC1 является сигнальным путем, который модулируется через модуляцию активности mTORC1. В вариантах осуществления, путь mTORC1 является сигнальным путем, который модулируется через модулирование активности mTORC1, но не через модулирование активности mTORC2. В вариантах осуществления, путь mTORC1 является сигнальным путем, который модулируется в значительной степени через модулирование активности mTORC1, чем через модулирование активности mTORC2.
Термин “mTORC2” относится к белковому комплексу, включающему mTOR и RICTOR (рапамицин-интенсивный компаньон mTOR). mTORC2 также может включать GβL, mSIN1 (активированный стрессом взаимодействующий белок протеинкиназы 1 млекопитающих), Protor 1/2, DEPTOR, TTI1 и/или TEL2. mTORC2 может регулировать клеточный метаболизм и цитоскелет. Термин “путь mTORC2” или “путь трансдукции сигнала mTORC2” может относиться к клеточному пути, включающему mTORC2. Путь mTORC2 включает компоненты выше и ниже mTORC2. Путь mTORC2 является сигнальным путем, который модулируется через модуляцию активности mTORC2. В вариантах осуществления, путь mTORC2 является сигнальным путем, который модулируется через модулирование активности mTORC2, но не через модулирование активности mTORC1. В вариантах осуществления, путь mTORC2 является сигнальным путем, который модулируется в значительной степени через модулирование активности mTORC2, чем через модулирование активности mTORC1.
Термин “рапамицин” или “сиролимус” относится к макролиду, произведенному бактерией Streptomyces hygroscopicus. Рапамицин может предотвращать активацию T клеток и B клеток. Рапамицин имеет наименование IUPAC (3S,6R,7E,9R, 10R, 12R, 14S, 15E, 17E, 19E,21S,23S,26R,27R,34aS)-9,10,12,13,14,21,22,23,24,25,26,27,32,33,34,34a-гексадекагидро-9,27-дигидрокси-3-[(lR)-2-[(1S,3R,4R)-4-гидрокси-3-метоксициклогексил]-1-метилэтил]-10,21-диметокси-6,8,12,14,20,26-гексаметил-23,27-эпокси-3H-пиридо[2,1-c][1,4]-оксоазациклогентриаконтин-1,5,11,28,29(4H,6H,31H)-пентон. Рапамицин имеет номер CAS 53123-88-9. Рапамицин может быть получен синтетически (например, химическим синтезом) или через применение способа получения, который не включает применение Streptomyces hygroscopicus.
«Аналог» используется в соответствии с его обычным значением в химии и биологии и относится к химическому соединению, которое структурно похоже на другое соединение (т.е. так называемое «эталонное» соединение), но отличается по составу, например, заменой одного атома на атом другого элемента или присутствием конкретной функциональной группы или заменой одной функциональной группы другой функциональной группой или абсолютной стереохимией одного или нескольких хиральных центров ссылочного соединения, включая его изомеры.
Термин “аналог рапамицина” или “рапалог” относится к аналогу или производному (например, пролекарству) рапамицина.
Термины “ингибитор активного сайта mTOR” и “АТФ миметик” относится к соединению, которое ингибирует активность mTOR (например, киназную активность) и связывается с активным сайтом mTOR (например, сайтом связывания АТФ, накладываясь на сайт связывания АТФ, блокируя доступ АТФ к сайту связывания АТФ mTOR). Примеры ингибиторов активного сайта mTOR включают, но не ограничены ими, ΓΝΚ128, PP242, PP121, MLN0128, AZD8055, AZD2014, NVP-BEZ235, BGT226, SF1126, Torin 1, Torin 2, WYE 687, соль WYE 687 (например, гидрохлорид), PF04691502, PI-103, CC-223, OSI-027, XL388, KU-0063794, GDC-0349 и PKI-587. В вариантах осуществления, ингибитором активного сайта mTOR является asTORi. В некоторых вариантах осуществления, “ингибитор активного сайта” может относиться к “ингибитору активного сайта mTOR”.
Термин “FKBP” относится к белку Пептидил-пролил цис-транс изомеразе. Не ограничивающие примеры FKBP представлены в Cell Mol Life Sci. 2013 Sep; 70(18): 3243-75. В вариантах осуществления, “FKBP” может относиться к “FKBP-12” или “FKBP 12” или “FKBP 1A.” В вариантах осуществления, “FKBP” может относиться к человеческому белку. В термин “FKBP” включен дикий тип и мутантные формы белка. В вариантах осуществления, “FKBP” может относиться к дикому типу человеческого белка. В вариантах осуществления, “FKBP” может относиться к дикому типу человеческой нуклеиновой кислоты. В вариантах осуществления, FKBP является мутантный FKBP. В вариантах осуществления, мутантный FKBP связан с заболеванием, которое не связано с диким типом FKBP. В вариантах осуществления, FKBP включает, по меньшей мере, одну аминокислотную мутацию (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 мутации или любой диапазон, выводимый здесь) по сравнению с диким типом FKBP.
Термин “FKBP-12” или “FKBP 12” или “FKBP 1A” может относиться к белку “Пептидил-пролил цис-транс изомеразе FKBP 1A.” В вариантах осуществления, “FKBP-12” или “FKBP 12” или “FKBP 1A” может относиться к человеческому белку. Включенные в термин, “FKBP-12” или “FKBP 12” или “FKBP 1A” являются диким типом и мутантными формами белка. В вариантах осуществления, “FKBP-12” или “FKBP 12” или “FKBP 1A” может относиться к белку, связанному с Entrez Gene 2280, OMIM 186945, UniProt P62942 и/или RefSeq (белок) NP_000792 (SEQ ID NO:3). В вариантах осуществления, ссылочные номера непосредственно выше могут относиться к белку и ассоциированным нуклеиновым кислотам, известным на дату подачи этой заявки. В вариантах осуществления, “FKBP-12” или “FKBP 12” или “FKBP 1A” может относиться к дикому типу человеческого белка. В вариантах осуществления, “FKBP-12” или “FKBP 12” или “FKBP 1A” может относиться к дикому типу человеческой нуклеиновой кислоты. В вариантах осуществления, FKBP-12 является мутантным FKBP-12. В вариантах осуществления, мутантный FKBP-12 связан с заболеванием, которое не связано с диким типом FKBP-12. В вариантах осуществления, FKBP-12 может включать, по меньшей мере, одну аминокислотную мутацию (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 мутаций или любой диапазон, выводимый здесь) по сравнению с дикими типом FKBP-12. В вариантах осуществления, FKBP-12 имеет белковую последовательность, соответствующую ссылочному номеру GI:206725550. В вариантах осуществления, FKBP-12 имеет белковую последовательность, соответствующую RefSeq NP_000792.1 (SEQ ID NO:3).
Термин “4E-BP1” или “4EBP1” или “EIF4EBP1” относится к белку “связывающий эукариотный фактор инициации трансляции 4E белок 1.” В вариантах осуществления, “4E-BP1” или “4EBP1” или “EIF4EBP1” может относиться к человеческому белку. Включенные в термин, “4E-BP1” или “4EBP1” или “EIF4EBP1” являются диким типом и мутантными формами белка. В вариантах осуществления, “4E-BP1” или “4EBP1” или “EIF4EBP1” может относиться к белку, связанному с Entrez Gene 1978, OMIM 602223, UniProt Q13541 и/или RefSeq (белок) NP_004086 (SEQ ID NO:4). В вариантах осуществления, ссылочные номера непосредственно выше могут относиться к белку и ассоциированным нуклеиновым кислотам, известным на дату подачи этой заявки. В вариантах осуществления, “4E-BP1” или “4EBP1” или “EIF4EBP1” может относиться к дикому типу человеческого белка. В вариантах осуществления, “4E-BP1” или “4EBP1” или “EIF4EBP1” может относиться к дикому типу человеческой нуклеиновой кислоты. В вариантах осуществления, 4EBP1 является мутантным 4EBP1. В вариантах осуществления, мутантный 4EBP1 связан с заболеванием, которое не связано с диким типом 4EBP1. В вариантах осуществления, 4EBP1 может включать, по меньшей мере, одну аминокислотную мутацию (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 мутаций или любой диапазон, выводимый здесь) по сравнению с дикими типом 4EBP1. В вариантах осуществления, 4EBP1 имеет белковую последовательность, соответствующую ссылочному номеру GL4758258. В вариантах осуществления, 4EBP1 имеет белковую последовательность, соответствующую RefSeq NP_004086.1 (SEQ ID NO:4).
Термин “Akt” относится к серин/треонин специфической протеинкиназе, вовлеченной в клеточные процессы, такие как метаболизм глюкозы, апоптоз, пролиферация и другие функции, также известной как “протеинкиназа B” (PKB) или “Akt1.” В вариантах осуществления, “Akt” или “AM” или “PKB” может относиться к человеческому белку. Включенные в термин, “Akt” или “Akt1” или “PKB” являются диким типом и мутантными формами белка. В вариантах осуществления, “Akt” или “Akt1” или “PKB” может относиться к белку, связанному с Entrez Gene 207, OMIM 164730, UniProt P31749 и/или RefSeq (белок) NP_005154 (SEQ ID NO:5). В вариантах осуществления, ссылочные номера непосредственно выше могут относиться к белку и ассоциированным нуклеиновым кислотам, известным на дату подачи этой заявки. В вариантах осуществления, “Akt” или “Akt1” или “PKB” может относиться к дикому типу человеческого белка. В вариантах осуществления, “Akt” или “Akt1” или “PKB” может относиться к дикому типу человеческой нуклеиновой кислоты. В вариантах осуществления, Akt является мутантной Akt. В вариантах осуществления, мутантная Akt связана с заболеванием, которое не связано с диким типом Akt. В вариантах осуществления, Akt может включать, по меньшей мере, одну аминокислотную мутацию (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 мутаций или любой диапазон, выводимый здесь) по сравнению с дикими типом Akt. В вариантах осуществления, Akt имеет белковую последовательность, соответствующую ссылочному номеру GI: 62241011. В вариантах осуществления, Akt имеет белковую последовательность, соответствующую RefSeq NP_005154.2 (SEQ ID NO:5).
В настоящем раскрытии предложен способ лечения заболевания или расстройства, медиированного mTOR, включающий введение субъекту, страдающему или подверженному развитию заболевания или расстройства, медиированного mTOR, терапевтически эффективного количества одной или нескольких описанных композиций или соединений. В настоящем описании предложен способ профилактики заболевания или расстройства, медиированного mTOR, включающий введение субъекту, страдающему или подверженному развитию заболевания или расстройства, медиированного mTOR, терапевтически эффективного количества одной или нескольких описанных композиций или соединений. В настоящем раскрытии предложен способ снижения риска заболевания или расстройства, медиированного mTOR, включающий введение субъекту, страдающему или подверженному развитию заболевания или расстройства, медиированного mTOR, терапевтически эффективного количества одной или нескольких описанных композиций или соединений.
В некоторых вариантах осуществления, заболеванием является рак или иммуноопосредованное заболевание. В некоторых вариантах осуществления, рак выбирают из рака мозга и сосудисто-нервной системы, рака головы и шеи, рака груди, рака легких, мезотелиомы, лимфоидного рака, рака желудка, рака почки, карциномы почек, рака печени, рака яичников, эндометриоза яичников, рака яичек, рака желудочно-кишечного тракта, рака простаты, глиобластомы, рака кожи, меланомы, нервных раков, рака селезенки, рака поджелудочной железы, пролиферативных нарушений крови, лимфомы, лейкоза, рака эндометрия, рака шейки матки, рака вульвы, рака простаты, рака полового члена, рака костей, рака мышц, раков мягких тканей, рака кишечника или прямой кишки, рака анального канала, рака мочевого пузыря, рака желчных протоков, рака глаза, стромальных опухолей желудочно-кишечного тракта и нейроэндокринных опухолей. В некоторых вариантах осуществления, расстройством является цирроз печени. В некоторых вариантах осуществления, иммуноопосредованное заболевание выбирают из резистентности при трансплантации сердца, почек, печени, костного мозга, кожи, роговицы, легкого, поджелудочной железы, тонкого кишечника, конечностей, мышц, нервов, двенадцатиперстной кишки, тонкой кишки или островковых клеток поджелудочной железы; болезни «трансплантат против хозяина», вызванной трансплантацией костного мозга; ревматоидного артрита, системной красной волчанки, тиреоидита Хашимото, рассеянного склероза, миастении гравис, диабета I типа, увеита, аллергического энцефаломиелита и гломерулонефрита. В определенных вариантах осуществления, заболеванием является комплекс туберозного склероза (КТС). В определенных вариантах осуществления, заболеванием является нейроэндокринная опухоль поджелудочной железы (НОПЖ), мантийноклеточная лимфома (МКЛ), рак прямой и ободочной кишки или рак толстой кишки (РПОК), рак матки, рак яичников, рак мочевого пузыря, рак мочеполового тракта или почечно-клеточная карцинома (ПКК).
В настоящем раскрытии предложен способ лечения рака, включающий введение субъекту терапевтически эффективного количества одной или нескольких описанных композиций или соединений. В некоторых вариантах осуществления, рак выбирают из опухолей головного мозга и сосудисто-нервной системы, рака головы и шеи, рака груди, рака легких, мезотелиомы, лимфоидного рака, рака желудка, рака почки, карциномы почек, рака печени, рака яичников, эндометриоза яичников, рака яичек, рака желудочно-кишечного тракта, рака простаты, глиобластомы, рака кожи, меланомы, нервных раков, рака селезенки, рака поджелудочной железы, нарушений пролиферации крови, лимфомы, лейкоза, рака эндометрия, рака шейки матки, рака вульвы, рака простаты, рака полового члена, рака костей, рака мышц, рака мягких тканей, рака кишечника или прямой кишки, рака анального канала, рака мочевого пузыря, рака желчных протоков, рака глаза, стромальных опухолей желудочно-кишечного тракта и нейроэндокринных опухолей. В некоторых вариантах осуществления, заболеванием является цирроз печени. В некоторых вариантах осуществления, заболеванием является комплекс туберозного склероза (КТС). В определенных вариантах осуществления, заболеванием является нейроэндокринные опухоли поджелудочной железы (НОПЖ), мантийно-клеточная лимфома (МКЛ), рак прямой и ободочной кишки или толстой кишки (РПОК), рак матки, рак яичников, рак мочевого пузыря, рак мочеполового тракта или почечно-клеточная карцинома (ПКК).
В определенных вариантах осуществления, рак включает человеческие раки и карциномы, саркомы, аденокарциномы, лимфомы, лейкозы и т.д., включая солидные и лимфоидные раки, рак почек, груди, легких, мочевого пузыря, толстой кишки, яичников, простаты, поджелудочной железы, желудка, мозга, головы и шеи, кожи, матки, яичек, глиому, рак пищевода и печени, включая гепатокарциному, лимфому, включая B-острую лимфобластную лимфому, неходжкинские лимфомы (например, лимфомы Буркитта, мелкоклеточную и крупноклеточную), лимфому Ходжкина, лейкоз (включая ОМЛ, ОЛЛ и ХМЛ) или множественную миелому. В определенных вариантах осуществления, заболеванием является множественная миелома. В определенных вариантах осуществления, заболеванием является рак груди. В определенных вариантах осуществления, заболеванием является трижды негативный рак молочной железы.
В определенных вариантах осуществления, рак включает рак, новообразование или злокачественные опухоли, найденные у млекопитающих (например, человека), включая лейкоз, карциномы и саркомы. Типовые раки, которые могут быть лечены соединением или способом, представленным здесь, включают рак простаты, щитовидной железы, эндокринной системы, мозга, груди, шейки матки, толстой кишки, головы и шеи, печени, почек, легкого, немелкоклеточный рак легкого, меланому, мезотелиому, яичников, саркому, желудка, матки, медуллобластому, рак прямой и ободочной кишки, рак поджелудочной железы. Дополнительные примеры могут включать болезнь Ходжкина, неходжкинскую лимфому, множественную миелому, нейробластому, глиому, мультиформную глиобластому, рак яичников, рабдомиосаркому, первичный тромбоцитоз, первичную макроглобулинемию, первичные опухоли мозга, злокачественную инсулиному поджелудочной железы, злокачественную нейроэндокринную опухоль, рак мочевого пузыря, предраковые повреждения кожи, рак яичек, лимфомы, рак щитовидной железы, нейробластому, рак пищевода, рак мочеполового тракта, злокачественную гиперкальциемию, рак эндометрия, рак коры надпочечников, новообразования эндокринной или экзокринной части поджелудочной железы, медуллярный рак щитовидной железы, медуллярная карцинома поджелудочной железы, меланому, рак прямой и ободочной кишки, папиллярный рак щитовидной железы, печеночно-клеточную карциному или рак простаты.
В определенных вариантах осуществления, заболеванием является лейкоз. Термин “лейкоз” в широком смысле относится к прогрессирующим злокачественным заболеваниям кроветворных органов и обычно характеризуется нарушенной пролиферацией и развитием лейкоцитов и их предшественников в крови и костном мозге. Лейкоз обычно клинически классифицируют на основании (1) продолжительности и характера заболевания - острого или хронического; (2) типа задействованной клетки; миелоидный (миелогенный), лимфоидный (лимфогенный) или моноцитарный; и (3) увеличения или отсутствия увеличения количества аберрантных клеток в крови - лейкозный или алейкозный (сублейкозный). Примеры лейкозов, которые можно лечить с помощью соединения или способа, представленных в настоящем документе, включают, например, острый нелимфоцитарный лейкоз, хронический лимфоцитарный лейкоз, острый гранулоцитарный лейкоз, хронический гранулоцитарный лейкоз, острый промиелоцитарный лейкоз, Т-клеточный лейкоз взрослых, алейкозный лейкоз, лейкоцитемический лейкоз, базофильный лейкоз, недифференцируемый лейкоз, коровий лейкоз, хронический миелоцитарный лейкоз, гемодермию, эмбриональный лейкоз, эозинофильный лейкоз, лейкоз Гросса, волосатоклеточный лейкоз, гемобластный лейкоз, гемоцитобластный лейкоз, гистиоцитарный лейкоз, лейкоз стволовых клеток, острый моноцитарный лейкоз, лейкопенический лейкоз, лимфолейкоз, лимфобластный лейкоз, лимфоцитарный лейкоз, лимфогенный лейкоз, лимфоидный лейкоз, тучноклеточный лейкоз, мегакариоцитарный лейкоз, микромиелобластный лейкоз, моноцитарный лейкоз, миелобластный лейкоз, лимфосаркому, базофильный лейкоз, мегакариоцитарный лейкоз, микромиелобластный лейкоз, моноцитарный лейкоз, миелобластный лейкоз, миелоцитарный лейкоз, миелоидный гранулоцитарный лейкоз, миеломоноцитарный лейкоз, лейкоз Негели, плазмоклеточный лейкоз, множественную миелому, плазмацитарный лейкоз, промиелоцитарный лейкоз, лейкоз клеток Ридера, лейкоз Шиллинга, лейкоз стволовых клеток, сублейкозный лейкоз или недифференцированный клеточный лейкоз.
В определенных вариантах осуществления, заболеванием является саркома. Термин “саркома” в общем относится к опухоли, которая состоит из вещества, подобного эмбриональной соединительной ткани, и обычно состоит из плотно упакованных клеток, заключенных в фибриллярное или гомогенное вещество. Саркомы, которые можно лечить с помощью соединения или способа, представленных в настоящем документе, включают хондросаркому, фибросаркому, лимфосаркому, меланосаркому, миксосаркому, остеосаркому, саркому Абемети, саркому жировой ткани, липосаркому, альвеолярную мягкотканую саркому, амелобластную саркому, ботриоидную саркому, гранулоцитарную саркому, хориокарциному, эмбриональную саркому, опухоль Вильмса, эндометриальную саркому, стромальную саркому, саркому Юинга, фасциальную саркому, фибробластную саркому, гигантоклеточную саркому, гранулоцитарную саркому, саркому Ходжкина, идиопатическую множественную пигментную геморрагическую саркому, иммунобластную В-клеточную саркому, лимфому, иммунобластную Т-клеточную саркому, саркому Дженсена, саркому Капоши, саркому купферовых клеток, ангиосаркому, лейкосаркому, злокачественную мезенхимому, паростальную саркому, ретикулоцитарную саркому, саркому Рауса, листовидную цистосаркому, синовиальную саркому или телеангиэктатическую саркому.
В определенных вариантах осуществления, заболеванием является меланома. Термин “меланома” понимают опухоль, состоящую из меланоцитарной системы кожи и других органов. Меланомы, которые можно лечить с помощью соединения или способа, представленных в настоящем документе, включают, например, акральную лентигинозную меланому, амеланотическую меланому, доброкачественную ювенильную меланому, меланому Клаудмана, меланому S91, меланому Хардинга-Пасси, ювенильную меланому, лентиго-меланому, злокачественную меланому, узловую меланому, подногтевую меланому или поверхностную распространяющуюся меланому.
В определенных вариантах осуществления, заболеванием является карцинома. Термин «карцинома» относится к злокачественному новообразованию, состоящему из эпителиальных клеток, которые имеют тенденцию проникать в окружающие ткани и вызывать метастазы. Примеры карцином, которые можно лечить с помощью соединения или способа, представленных в настоящем документе, включают, например, медуллярную карциному щитовидной железы, семейную медуллярную карциному щитовидной железы, ацинарную карциному, ацинозную карциному, аденокистозную карциному, железисто-кистозную карциному, аденоматозную карциному, карциному коры надпочечников, альвеолярную карциному, альвеолярно-клеточную карциному, базально-клеточную карциному, базоцеллюлярную карциному, базалоидную карциному, базоспиноцеллюлярнцю карциному, бронхоальвеолярную карциному, бронхиолярную карциному, бронхогенную карциному, мозговидную карциному, холангиоцеллюлярную карциному, хорионическую карциному, коллоидную карциному, карциному комедонного типа, корпусную карциному, крибриформную карциному, карциному en cuirasse, карциному кожи, цилиндрическую карциному, карциному цилиндрического типа, протоковую карциному, твердую карциному, эмбриональную карциному, энцефалоидную карциному, эпидермоидную карциному, карциному эпителия аденоидов, экзофитную карциному, карциному ex ulcere, карциному fibrosum, карциному gelatiniforni, слизеобразующую карциному, гигантоклеточную карциному, аденокарциному, фоллмкулому, базально-клеточную карциному, гематоидную карциному, печеночно-клеточную карциному, онкоцитарную карциному, гиалиновую карциному, гипернефроидную карциному, детскую эмбриональную карциному, карциному in situ, интраэпидрмальную карнциному, интраэпителиальную карциному, карциному Кромпехера, карциному клеток Кульчицки, крупноклеточную карциному, хрусталиковую карциному, карциному lenticulare, липоматозную карциному, лимфоэпителиальную карциному, карциному medullare, медуллярную карциному, меланотическую карциному, карциному molle, слизеобразующую карциному, карциному muciparum, карциному mucocellulare, мукоэпидермоидную карциному, карциному mucosum, слизистую карциному, карциному myxomatodes, носоглоточную карциному, овсяно-клеточную карциному, карциному ossificans, остеоидную карциному, папиллярную карциному, перипортальную карциному, прелинвазивную карциному, карциному щипцовых клеток, размягченную карциному, почечно-клеточную карциному почек, карциному резервных клеток, карциному sarcomatodes, карциному Шнейдера, скиррозную карциному, карциному scroti, перстневидно-клеточную карциному, недифференцированную карциному, мелкоклеточную карциному, соланоидную карциному, карциному из сферических клеток, карциносаркому, карциному spongiosum, плоскоклеточную карциному, струнную карциному, карциному telangiectaticum, карциному telangiectodes, переходноклеточную карциному, карциному tuberosum, туберозную карциному, веррукозную карциному или карциному villosum.
В настоящем раскрытии предлагается способ лечения иммуноопосредованного заболевания, включающий введение субъекту терапевтически эффективного количества одной или нескольких описанных композиций или соединений. В некоторых вариантах осуществления, иммуноопосредованное заболевание выбирают из резистентности при трансплантации сердца, почки, печени, костного мозга, кожи, роговицы, легкого, поджелудочной железы, тонкого кишечника, конечности, мышцы, нервов, двенадцатиперстной кишки, тонкой кишки или клеток панкреатических островков; болезней «трансплантат против хозяина», вызванных трансплантацией костного мозга; ревматоидного артрита, системной красной волчанки, тиреоидита Хашимото, рассеянного склероза, миастении гравис, диабета I типа, увеита, аллергического энцефаломиелита и гломерулонефрита.
В определенных вариантах осуществления, заболеванием является аутоиммунное заболевание. В данном документе, термин “аутоиммунное заболевание” относится к заболеванию или состоянию, при котором иммунная система субъекта имеет аберрантный иммунный ответ против вещества, которое обычно не вызывает иммунный ответ у здорового субъекта. Примеры аутоиммунных заболеваний, которые могут быть лечены соединением, фармацевтической композицией или способом, описанным здесь, включают острый рассеянный энцефаломиелит (ОРЭ), острый некротизирующий геморрагический лейкоэнцефалит, болезнь Аддисонв, агаммаглобулинемию, гнездную алопецию, амилоидоз, анкилозирующий спондилит, анти-GBM/анти-TBM нефрит, антифосфолипидный синдром (АФС), аутоиммунный антигневротический отек, аутоиммунную апластическую анемию, аутоиммунную вегетативную дистонию, аутоиммунный гепатит, аутоиммунную гиперлипидемию, аутоиммунный иммунодефицит, аутоиммунное заболевание внутреннего уха (АЗВУ), аутоиммунный миокардит, аутоиммунный оофорит, аутоиммунный панкреатит, аутоиммунную ретинопатию, аутоиммунную тромбоцитопеническую пурпуру (АТП), аутоиммунную болезнь щитовидной железы, аутоиммунную крапивницу, аксональные или нейронные невропатии, болезнь Бало, болезнь Бехчета, буллезный пемфигоид, кардиомиопатию, болезнь Кастлемена, целиакию, болезнь Чагаса, синдром хронической усталости, хроническую воспалительную демиелинирующую полинейропатию (ХВДП), хронический рецидивирующий множественный остеомиелит (ХРМО), синдром Черджа-Строса, рубцующийся пемфигоид/доброкачественный слизистый пемфигоид, болезнь Крона, синдром Коганса, болезнь холодовых агглютининов, врожденную блокаду сердца, миокардит Коксаки, болезнь CREST, первичную криоглобулинемию смешанного типа, демиелинирующие нейропатии, герпетиформный дерматит, дерматомиозит, болезнь Девика (оптикомиелит), дискоидную волчанку, синдром Дрессьера, эндометриоз, эозинофильный эзофагит, эозинофильный фасциит, нодозную эритему, экспериментальный аллергический энцефаломиелит, синдром Эванса, фибромиалгию, фиброзирующий альвеолиит, гигантоклеточный артериит (височный артериит), гигантоклеточный миокардит, гломерулонефрит, синдром Гудпасчера, гранулематоз с полиангиитом (ГПА) (ранее называемый гранулематоз Вегенера), болезнь Грейвса, синдром Гийена-Барре, энцефалит Хашимото, тироидит Хашимото, гемолитическую анемию, пурпуру Шенлейна-Геноха, герпес беременных, гипогаммаглобулинемию, идиопатическую тромбоцитопеническую пурпуру (ИТП), IgA нефропатию, IgG4-родственную склерозирующую болезнь, иммунорегулирующие липопротеины, миозит с включенными тельцами, интерстициальный цистит, ювенильный диабет (диабет 1 типа), ювенильный миозит, синдром Кавасаки, синдром Ламберта-Итона, лейкоцитокластический васкулит, красный плоский лишай, каплевидную склеродермию, деревянистый конъюнктивит, линейную IgA болезнь (ЛАБ), волчанку (СКВ), болезнь Лайма, хроническую, болезнь Меньера, микроскопический полиангиит, смешанное поражение соединительной ткани (СПСТ), язву Мурена, болезнь Мухи-Габерманна, рассеянный склероз, миастению гравис, миозит, нарколепсию, оптикомиелит (Девика), нейтропению, рубцующийся пемфигоид глаз, неврит зрительного нерва, мигрирующий артрит, PANDAS (педиатрические аутоиммунные психоневрологические расстройства, связанные со стрептококком), паранеопластическую мозжечковую дегенерацию, ночную пароксизмальную гемоглобинурию (НПГ), синдром Парри-Ромберга, синдром Персонейджа-Тернера, парспланит (периферический увеит), пузырчатку, периферическую нейропатию, околовенозный энцефаломиелит, пернициозную анемию, синдром POEMS, нодозный полиартериит, аутоиммунные полигландулярные синдромы I, II и III типа, ревматическую полимиалгию, полимиозит, постинфарктный синдром, посткардиотомный синдром, прогестероновый дерматит, первичный билиарный цирроз, первичный склерозирующий холангит, псориаз, псориазный артрит, идиопатический фиброз легких, гангренозную пиодермию, истинную эритроцитарную аплазию, феномен Рейно, реактивный артрит, рефлекторную симпатическую дистрофию, синдром Рейтера, рецидивирующий полихондрит, синдром беспокойных ног, ретроперитонеальный фиброз, ревматическую лихорадку, ревматоидный артрит, саркоидоз, синдром Шмидта, склерит, склеродермию, синдром Шегрена, аутоиммунность спермы и яичек, синдром мышечной скованности, подострый бактериальный эндокардит (ПБЭ), синдром Сусака, метастатическую офтальмию, артериит Такаяши, височный артериит/гигантоклеточный артериит, тромбоцитопеническую пурпуру (ТТП), синдром Толоса-Ханта, поперечный миелит, диабет 1 типа, язвенный колит, недифференцированное заболевание соединительной ткани (НЗСТ), увеит, васкулит, везиколубуллезный дерматоз, витилиго или гранулематоз Вегенера (т.е. гранулематоз с полиангиитом (ГПА)).
В настоящем раскрытии предлагается способ лечения возрастного состояния, включающий введение субъекту терапевтически эффективного количества одной или нескольких описанных композиций или соединений. В определенных вариантах осуществления, возрастное состояние выбирается из саркопении, атрофии кожи, мышечной атрофии, атрофии головного мозга, атеросклероза, артериосклероза, эмфиземы легких, остеопороза, остеоартрита, высокого кровяного давления, эректильной дисфункции, деменции, болезни Хантингтона, болезни Альцгеймера, катаракты, возрастной дегенерации желтого пятна, рака простаты, инсульта, сокращения продолжительности жизни, нарушения функции почек и возрастной потери слуха, инвалидности, связанной со старением (например, слабости), снижения когнитивных функций, возрастной деменции, нарушения памяти, жесткости сухожилий, сердечной дисфункции, такой как гипертрофия сердца и систолическая и диастолическая дисфункция, иммунного старения, рака, ожирения и диабета.
В определенных вариантах осуществления, раскрытые композиции или соединения могут применяться в отношении старения иммунной системы. Старение иммунной системы может относиться к снижению иммунной функции, что приводит к нарушению иммунного ответа, например, к раку, вакцинации, инфекционным патогенам, среди прочего. Он включает в себя как способность хозяина отвечать на инфекции, так и развитие долговременной иммунной памяти, особенно путем вакцинации. Этот иммунодефицит встречается повсеместно и обнаруживается как у долгоживущих, так и у короткоживущих видов скорее в зависимости от их возраста относительно продолжительности жизни, а не хронологического времени. Это считается основным фактором, способствующим увеличению частоты заболеваемости и смертности среди пожилых людей. Старение иммунной системы не является случайным ухудшающим явлением, скорее, оно, по-видимому, в обратном порядке повторяет эволюционную схему, и большинство параметров, на которые влияет старение иммунной системы, по-видимому, находятся под генетическим контролем. Иногда можно предвидеть старение иммунной системы как результат постоянного испытания неизбежным воздействием различных антигенов, таких как вирусы и бактерии. Старение иммунной системы является многофакторным состоянием, приводящим ко многим патологически значимым проблемам со здоровьем, например, у пожилого населения. Возрастные биологические изменения, такие как истощение гемопоэтических стволовых клеток, увеличение PD1+ лимфоцитов, снижение общего количества фагоцитов и NK-клеток и снижение гуморального иммунитета, способствуют наступлению старения иммунной системы. В одном аспекте, старение иммунной системы можно измерить у индивида путем измерения длины теломер в иммунных клетках (см., например, патент США № 5,741,677). Старение иммунной системы также может быть определено регистрацией у человека более низкого, чем обычно, количества наивных CD4 и/или CD8 Т клеток, Т клеточного репертуара, количества Т-клеток, экспрессирующих PD1, например, более низкое, чем обычно, количество PD-1 отрицательных Т-клеток, или ответа на вакцинацию у субъекта 65 лет или старше. В определенных вариантах осуществления, селективная модуляция mTOR определенных популяций Т-клеток может улучшить эффективность вакцины в стареющей популяции и повысить эффективность иммунотерапии рака. В настоящем описании представлен способ лечения старения иммунной системы, включающий введение субъекту терапевтически эффективного количества одной или нескольких раскрытых композиций или соединений.
В определенных вариантах осуществления, заболевание, которое можно лечить с помощью соединения, фармацевтической композиции или способа, описанных в настоящем документе, представляет собой отторжение трансплантата органа или ткани (например, трансплантатов сердца, легких, комбинированных трансплантатов сердце-легкое, печени, почки, поджелудочной железы, кожи или роговицы; болезнь трансплантат против хозяина), рестеноз, синдромы гамартомы (например, туберозный склероз или болезнь Каудена), лимфангиолейомиоматоз, пигментный ретинит, энцефаломиелит, инсулинозависимый сахарный диабет, волчанку, дерматомиозит, артрит, ревматические заболевания, стероид-резистентный острый лимфобластный лейкоз, фиброз, склеродермию, легочный фиброз, почечный фиброз, муковисцидоз, синдром легочной гипертензии, рассеянный склероз, синдром VHL, синдром Карни, семейный аденоматозный полипоз, синдром юношеского полипоза, синдром Бирта-Хогга-Дьюка, семейную гипертрофическую кардиомиопатию, синдром Вольфа-Паркинсона-Уайта, болезнь Паркинсона, болезнь Хантингтона, болезнь Альцгеймера, деменции, вызванные тау мутациями, спинально-церебеллярную атаксию 3 типа, заболевание двигательных нейронов, вызванное мутациями SOD1, нейронный восковидный липофусциноз/болезнь Баттена (детскую нейродегенерацию), влажную макулодистрофию, сухую макулодистрофию, истощение мышц (атрофию, кахексию), миопатии (например, болезнь Данона), бактериальную инфекцию, вирусную инфекцию, M. tuberculosis, стрептококк группы A, HSV I типа, ВИЧ-инфекцию, нейрофиброматоз (например, нейрофиброматоз 1 типа) или синдром Пейтца-Егерса.
В определенных вариантах осуществления, заболеванием является нейродегенеративное заболевание. Используемый здесь термин «нейродегенеративное заболевание» относится к заболеванию или состоянию, при котором функция нервной системы субъекта нарушается. Примеры нейродегенеративных заболеваний, которые можно лечить с помощью соединения, фармацевтической композиции или способа, описанных в данном документе, включают болезнь Александера, болезнь Альпера, болезнь Альцгеймера, боковой амиотрофический склероз, атаксию-телеангиэктазию, болезнь Баттена (также известную как болезнь Шпильмейера-Фогта-Шегрена-Баттена), синдром коровьего бешенства (СКБ), болезнь Канавана, синдром Кокейна, кортикобазальную дегенерацию, болезнь Крейтцфельда-Якоба, лобно-височную деменцию, синдром Герстмана-Штрауслера-Шейнкера, болезнь Хантингтона, ВИЧ-ассоциированную деменцию, болезнь Кеннеди, болезнь Краббе, куру, деменцию с тельцами Леви, болезнь Мачадо-Джозефа (спинально-церебеллярную атаксию 3 типа), рассеянный склероз, множественную системную атрофию, нарколепсию, нейроборрелиоз, болезнь Паркинсона, болезнь Пелицея-Мерцбахера, болезнь Пика, первичный боковой склероз, прионные болезни, болезнь Рефсума, болезнь Сандхоффа, болезнь Шильдера, подострую комбинированную дегенерацию спинного мозга, вторичную к злокачественной анемии, шизофрению, спинально-церебеллярную атаксию (множественные типы с варьирующимися характеристиками), спинальную мышечную атрофию, болезнь Стила-Ричардсона-Ольшевского или сухотку спинного мозга.
В некоторых вариантах осуществления, заболеванием является метаболическое заболевание. Используемый здесь термин «метаболическое заболевание» относится к заболеванию или состоянию, при котором метаболизм или метаболическая система субъекта (например, функция накопления или использования энергии) нарушаются. Примеры метаболических заболеваний, которые можно лечить описанными здесь соединением, фармацевтической композицией или способом, включают диабет (например, I типа или II типа), ожирение, метаболический синдром или митохондриальное заболевание (например, дисфункцию митохондрий или аберрантную функцию митохондрий).
В определенных вариантах осуществления, заболеванием является грибковое заболевание. Используемый здесь термин «грибковое заболевание» относится к заболеванию или состоянию, связанному с грибковой инфекцией субъекта. Примеры грибковых заболеваний, которые можно лечить описанными здесь соединением, фармацевтической композицией или способом, включают заражение Mucor circinelloides, зигомицетами, Cryptococcus neoformans, Candida albicans, дрожжами и Saccharomyces cerevisiae, среди прочих.
В определенных вариантах осуществления, заболеванием является воспалительное заболевание. Используемый здесь термин «воспалительное заболевание» относится к заболеванию или состоянию, характеризующемуся аберрантным воспалением (например, повышенным уровнем воспаления по сравнению с контролем, таким как здоровый человек, не страдающий заболеванием). Примеры воспалительных заболеваний включают черепно-мозговую травму, артрит, ревматоидный артрит, псориазный артрит, ювенильный идиопатический артрит, рассеянный склероз, системную красную волчанку (СКВ), миастению гравис, ювенильный диабет, сахарный диабет 1 типа, синдром Гийена-Барре, энцефалит Хашимото, тиреоидит Хашимото, анкилозирующий спондилит, псориаз, синдром Шегрена, васкулит, гломерулонефрит, аутоиммунный тиреоидит, болезнь Бехчета, болезнь Крона, язвенный колит, буллезный пемфигоид, саркоидоз, ихтиоз, офтальмопатию Грейвса, воспалительную болезнь кишечника, болезнь Аддисона, витилиго, астму, аллергическую астму, обыкновенные угри, целиакию, хронический простатит, воспалительное заболевание кишечника, воспалительные заболевания органов малого таза, реперфузионное повреждение, саркоидоз, отторжение трансплантата, интерстициальный цистит, атеросклероз и атопический дерматит.
В определенных вариантах осуществления, заболеванием является сердечнососудистое заболевание. Используемый здесь термин «сердечнососудистое заболевание» относится к заболеванию или состоянию, при котором функция сердечнососудистой системы субъекта нарушается. Примеры сердечнососудистых заболеваний, которые можно лечить описанными здесь соединением, фармацевтической композицией или способом, включают застойную сердечную недостаточность; аритмогенные синдромы (например, пароксисомную тахикардию, отсроченную после деполяризации, желудочковую тахикардию, внезапную тахикардию, аритмии, вызванные физической нагрузкой, синдромы удлиненного интервала QT или двунаправленную тахикардию); тромбоэмболические расстройства (например, артериальные сердечнососудистые тромбоэмболические расстройства, венозные сердечнососудистые тромбоэмболические расстройства или тромбоэмболические расстройства в камерах сердца); атеросклероз; рестеноз; заболевание периферических артерий; операцию по аортокоронарному шунтированию; заболевание сонной артерии; артериит; миокардит; сердечнососудистое воспаление; сосудистое воспаление; ишемическую болезнь сердца (ИБС); нестабильную стенокардия (НС); нестабильную рефрактерную стенокардию; стабильную стенокардию (СС); хроническую стабильную стенокардия; острый коронарный синдром (ОКС); инфаркт миокарда (первичный или повторный); острый инфаркт миокарда (ОИМ); инфаркт миокарда; инфаркт миокарда без зубца Q; инфаркт миокарда без ST; атеросклеротическую болезнь сердца; ишемическую болезнь сердца; сердечную ишемию; ишемию; внезапную ишемическую смерть; преходящую ишемическую атаку; инсульт; окклюзионную болезнь периферических артерий; венозный тромбоз; тромбоз глубоких вен; тромбофлебит; артериальную эмболию; тромбоз коронарных артерий; церебральный артериальный тромбоз, церебральную эмболию; эмболию почек; легочную эмболию; тромбоз (например, связанный с протезами клапанов или другими имплантатами, постоянными катетерами, стентами, искусственным кровообращением, гемодиализом); тромбоз (например, связанный с атеросклерозом, хирургическим вмешательством, длительной иммобилизацией, фибрилляцией артерий, врожденной тромбофилией, раком, диабетом, гормонами или беременностью); или сердечные аритмии (например, суправентрикулярные аритмии, предсердные аритмии, трепетание предсердий или фибрилляцию предсердий).
В одном аспекте представлен способ лечения заболевания, связанного с аберрантным уровнем активности mTOR у субъекта, нуждающегося в таком лечении. Заболевание может быть вызвано повышением активности mTOR. Способ может включать введение субъекту одной или нескольких композиций или соединений, описанных в данном документе. Способ может включать введение субъекту терапевтически эффективного количества одной или нескольких композиций или соединений, описанных в данном документе (например, модулятора mTOR (например, ингибитора), как описано выше).
В одном аспекте представлена одна или несколько композиций или соединений, описанных в данном документе, для использования в качестве лекарственного средства. В вариантах осуществления, лекарственное средство полезно для лечения заболевания, вызванного повышающей регуляцией mTOR. Применение может включать введение субъекту одной или нескольких композиций или соединений, описанных в данном документе. Применение может включать введение субъекту терапевтически эффективного количества одной или нескольких композиций или соединений, описанных в настоящем документе (например, модулятора mTOR (например, ингибитора), как описано выше).
В одном аспекте представлена одна или несколько композиций или соединений, как описано в данном документе, для применения при лечении заболевания, вызванного аберрантными уровнями активности mTORC1 у субъекта, нуждающегося в таком лечении. Заболевание может быть вызвано активацией mTORC1. Применение может включать введение субъекту одной или нескольких композиций или соединений, описанных в данном документе. Использование может включать введение субъекту терапевтически эффективного количества одной или нескольких композиций или соединений, описанных в данном документе (например, модулятора mTORC1 (например, ингибитора), как описано выше).
Повышающая регуляция mTOR может привести к увеличению активности mTOR по сравнению с нормальными уровнями активности mTOR у конкретного субъекта или группы здоровых субъектов. Повышенное количество активности mTOR может привести, например, к чрезмерной пролиферации клеток, вызывая тем самым болезненное состояние.
Субъектом лечения заболевания обычно является млекопитающее. Млекопитающее, лечимое соединением (например, описанным здесь соединением, модулятором mTOR (например, ингибитором)), может быть человеком, нечеловеческим приматом и/или нечеловеческим млекопитающим (например, грызуном, собакой).
В другом аспекте представлен способ лечения заболевания, связанного с активностью mTOR, у субъекта, нуждающегося в таком лечении, где способ включает введение одной или нескольких композиций или соединений, как описано в данном документе, включая варианты осуществления (например, пункт формулы изобретения, вариант осуществления, пример, таблицу, рисунок или пункт формулы изобретения) субъекту.
В другом аспекте представлена одна или несколько композиций или соединений, как описано в данном документе, для использования в качестве лекарственного средства. В вариантах осуществления, лекарственное средство может быть полезно для лечения заболевания, связанного с активностью mTORC1, у субъекта, нуждающегося в таком лечении. В вариантах осуществления, использование может включать введение субъекту одной или нескольких композиций или соединений, как описано в данном документе, включая варианты осуществления (например, аспект, вариант осуществления, пример, таблицу, фигуру или пункт формулы изобретения).
В другом аспекте представлена одна или несколько композиций или соединений для применения при лечении заболевания, связанного с активностью mTOR, у субъекта, нуждающегося в таком лечении. В вариантах осуществления использование может включать введение субъекту одной или нескольких композиций или соединений, как описано в данном документе, включая варианты осуществления (например, аспект, вариант осуществления, пример, таблицу, фигуру или пункт формулы изобретения).
В вариантах осуществления заболеванием, связанным с активностью mTOR, или заболеванием, связанным с аберрантными уровнями активности mTOR, является рак. В вариантах осуществления, заболеванием, связанным с активностью mTOR, или заболеванием, связанным с аберрантными уровнями активности mTOR, является аутоиммунное заболевание. В вариантах осуществления заболеванием, связанным с активностью mTOR, или заболеванием, связанным с аберрантными уровнями активности mTOR, является воспалительное заболевание. В вариантах осуществления, заболеванием, связанным с активностью mTOR, или заболеванием, связанным с аберрантными уровнями активности mTOR, является нейродегенеративное заболевание. В вариантах осуществления, заболеванием, связанным с активностью mTOR, или заболеванием, связанным с аберрантными уровнями активности mTOR, является метаболическое заболевание. В вариантах осуществления, заболеванием, связанным с активностью mTOR, или заболеванием, связанным с аберрантными уровнями активности mTOR, является отторжение трансплантата. В вариантах осуществления, заболеванием, связанным с активностью mTOR, или заболеванием, связанным с аберрантными уровнями активности mTOR, является грибковая инфекция. В вариантах осуществления, заболеванием, связанным с активностью mTOR, или заболеванием, связанным с аберрантными уровнями активности mTOR, является сердечнососудистое заболевание.
В вариантах осуществления, заболеванием, связанным с активностью mTOR, или заболеванием, связанным с аберрантными уровнями активности mTOR, является старение. В вариантах осуществления, заболеванием, связанным с активностью mTOR, или заболеванием, связанным с аберрантными уровнями активности mTOR, является смерть от возрастной болезни. В вариантах осуществления, заболеванием, связанным с активностью mTOR, или заболеванием, связанным с аберрантными уровнями активности mTOR, является возрастное состояние. В определенных вариантах осуществления, возрастное состояние выбрано из группы, состоящей из саркопении, атрофии кожи, истощения мышц, атрофии мозга, атеросклероза, артериосклероза, эмфиземы легких, остеопороза, остеоартрита, высокого кровяного давления, эректильной дисфункции, деменции, болезни Хантингтона, болезни Альцгеймера, катаракты, возрастной дегенерации желтого пятна, рака простаты, инсульта, снижения продолжительности жизни, нарушения функции почек и возрастной потери слуха, инвалидности, связанной со старением (например, слабости), снижения когнитивных функций, возрастной деменции, нарушения памяти, жесткости сухожилий, сердечной дисфункции, такой как гипертрофия сердца, систолическая и диастолическая дисфункция, старения иммунной системы, рака, ожирения и диабета. В определенных вариантах осуществления, селективная модуляция mTOR определенных популяций Т-клеток может улучшить эффективность вакцины в стареющей популяции и повысить эффективность иммунотерапии рака. В настоящем раскрытии предложен способ лечения старения иммунной системы, включающий введение субъекту терапевтически эффективного количества одного или нескольких раскрытых соединений.
В вариантах осуществления, заболеванием, связанным с активностью mTOR, или заболеванием, связанным с аберрантными уровнями активности mTOR, является рак (например, карциномы, саркомы, аденокарциномы, лимфомы, лейкозы, солидные раки, лимфоидные раки; рак почки, груди, легких, мочевого пузыря, толстой кишки, желудочно-кишечного тракта, яичников, простаты, поджелудочной железы, желудка, головного мозга, головы и шеи, кожи, матки, пищевода, печени; рак яичек, глиома, гепатокарцинома, лимфома, включая B-острую лимфобластную лимфому, неходжкинские лимфомы (например, Беркитта, мелкоклеточные и крупноклеточные лимфомы), лимфома Ходжкина, лейкоз (включая ОМЛ, ОЛЛ и ХМЛ), множественная миелома и рак груди (например, трижды негативный рак груди)).
В вариантах осуществления, заболеванием, связанным с активностью mTOR, или заболеванием, связанным с аберрантными уровнями активности mTOR, является острый диссеминированный энцефаломиелит (ОДЭМ), острый некротический геморрагический лейкоэнцефалит, болезнь Аддисона, агаммаглобулинемия, очаговая алопеция, амилоидоз, анкилозирующий спондилит, анти-GBM/анти-TBM нефрит, антифосфолипидный синдром (АФС), аутоиммунный ангионевротический отек, аутоиммунная апластическая анемия, аутоиммунная вегетативная дистония, аутоиммунный гепатит, аутоиммунная гиперлипидемия, аутоиммунный иммунодефицит, аутоиммунное внутреннее заболевание уха (АВЗУ), аутоиммунный миокардит, аутоиммунный оофорит, аутоиммунный панкреатит, аутоиммунная ретинопатия, аутоиммунная тромбоцитопеническая пурпура (АТП), аутоиммунное заболевание щитовидной железы, аутоиммунная крапивница, аксональные или нейрональные невропатии, болезнь Бало, болезнь Бехчета, буллезный пемфигоид, кардиомиопатия, болезнь Кастлемана, целиакия, болезнь Шагаса, синдром хронической усталости, хроническая воспалительная демиелинизирующая полинейропатия (ХВДП), хронический рецидивирующий мультифокальный остомиелит (ХРМО), синдром Чарджа-Стросса, рубцовый пемфигоид/доброкачественный пемфигоид слизистой оболочки, болезнь Крона, синдром Коганса, болезнь холодовых агглютининов, врожденная блокада сердца, миокардит Коксаки, болезнь CREST, эссенциальная смешанная криоглобулинемия, демиелинизирующие невропатии, герпетиформный дерматит, дерматомиозит, болезнь Девика (оптический нейромиелит), дискоидная волчанка, синдром Дрессьера, эндометриоз, эозинофильный эзофагит, эозинофильный фасциит, узловатая эритема, экспериментальный аллергический энцефаломиелит, синдром Эванса, фибромиалгия, фиброзирующий альвеолит, гигантоклеточный артериит (височный артериит), гигантоклеточный миокардит, гломерулонефрит, синдром Гудпасчера, гранулематоз с полиангиитом (ГПА) (ранее назывался гранулематоз Вегенера), болезнь Грейвса, синдром Гийена-Барре, энцефалит Хашимото, тиреоидит Хашимото, гемолитическая анемия, пурпура Геноха-Шонлейна, герпес беременных, гипогаммаглобулинемия, идиопатическая тромбоцитопеническая пурпура (ИТП), нефропатия IgA, склерозирующая болезнь, связанная с IgG4, иммунорегуляторные липопротеины, миозит с включенными тельцами, интерстициальный цистит, ювенильный артрит, ювенильный диабет (диабет 1 типа), ювенильный миозит, синдром Кавасаки, синдром Ламберта-Итона, лейкоцитокластический васкулит, красный плоский лишай, каплевидная склеродермия, деревянистый конъюнктивит, линейная IgA болезнь (ЛАБ), волчанка (СКВ), болезнь Лайма, хроническая, болезнь Меньера, микроскопический полиангиит, смешанное заболевание соединительной ткани (СЗСТ), язва Мурена, болезнь Мухи-Хабермана, рассеянный склероз, миастения гравис, миозит, нарколепсия, оптический нейромиелит (Девика), нейтропения, глазной рубцовый пемфигоид, неврит зрительного нерва, палиндромный ревматизм, PANDAS (педиатрические аутоиммунные нейропсихиатрические расстройства, связанные со стрептококком), паранеопластическая дегенерация мозжечка, пароксизмальная ночная гемоглобинурия (ПНГ), синдром Парри-Ромберга, синдром Парсонажа-Тернера, планит Парса (периферический увеит), пузырчатка, периферическая невропатия, перивенозный энцефаломиелит, пернициозная анемия, синдром POEMS, узелковый полиартериит, аутоиммунные полигландулярные синдромы I, II и III типов, ревматическая полимиалгия, полимиозит, синдром постмиокардиального инфаркта, постперикардиотомный синдром, прогестероновый дерматит, первичный билиарный цирроз, первичный склерозирующий холангит, псориаз, псориатический артрит, идиопатический легочный фиброз, гангренозная пиодермия, истинная эритроцитарная аплазия, феномен Рейно, реактивный артрит, рефлекторная симпатическая дистрофия, синдром Рейтера, рецидивирующий полихондрит, синдром беспокойных ног, забрюшинный фиброз, ревматическая лихорадка, ревматоидный артрит, саркоидоз, синдром Шмидта, склерит, склеродермия, синдром Шегрена, аутоиммунитет сперматозоидов и яичек, синдром скованного человека, подострый бактериальный эндокардит (ПБЭ), синдром Сусака, симпатическая офтальмия, артериит Такаясу, височный артериит/гигантоклеточный артериит, тромбоцитопеническая пурпура (ТТП), синдром Толосы-Ханта, поперечный миелит, диабет 1 типа, язвенный колит, недифференцированное заболевание соединительной ткани (НЗСТ), увеит, васкулит, везикулобуллезный дерматоз, витилиго, гранулематоз Вегенера (т. е. гранулематоз с полиангиитом (ГПА), черепно-мозговая травма, артрит, ревматоидный артрит, псориазный артрит, ювенильный идиопатический артрит, рассеянный склероз, системная красная волчанка (СКВ), миастения гравис, ювенильный диабет, сахарный диабет 1 типа, синдром Гийена-Барре, энцефалит Хашимото, тип 1, тиреоидит Хашимото, анкилозирующий спондилит, псориаз, синдром Шегрена, васкулит, гломерулонефрит, аутоиммунный тиреоидит, болезнь Бехчета, болезнь Крона, язвенный колит, буллезный пемфигоид, саркоидоз, ихтиоз, офтальмопатия Грейвса, воспалительная болезнь кишечника, болезнь Аддисона, витилиго, астма, аллергическая астма, обыкновенные угри, целиакия, хронический простатит, воспалительное заболевание кишечника, воспалительные заболевания органов малого таза, реперфузионное повреждение, саркоидоз, отторжение трансплантата, интерстициальный цистит, атеросклероз, атопический дерматит, болезнь Александера, болезнь Альпера, болезнь Альцгеймера, боковой амиотрофический склероз, атаксия-телеангиэктазия, болезнь Баттена (также известная как болезнь Шпильмейера-Фогта-Шегрена-Баттена), синдром коровьего бешенства (СКБ), болезнь Канавана, синдром Кокейна, кортикобазальная дегенерация, болезнь Крейтцфельда-Якоба, лобно-височная деменция, синдром Герстмана-Штрауслера-Шейнкера, болезнь Хантингтона, ВИЧ-ассоциированная деменция, болезнь Кеннеди, болезнь Краббе, куру, деменция с тельцами Леви, болезнь Мачадо-Джозефа (спиноцеребеллярная атаксия 3 типа), рассеянный склероз, множественная системная атрофия, нарколепсия, нейроборрелиоз, болезнь Паркинсона, болезнь Пелизея-Мерцбахера, болезнь Пика, первичный боковой склероз, прионные болезни, болезнь Рефсума, болезнь Сандхоффа, болезнь Шильдера, подострая комбинированная дегенерация спинного мозга, вторичная к злокачественной анемии, шизофрения, спинально-церебеллярная атаксия (несколько типов с различными характеристиками), спинальная мышечная атрофия, болезнь Стила-Ричардсона-Ольшевского, сухотка спинного мозга, диабет (например, I типа или II типа), ожирение, метаболический синдром, митохондриальное заболевание (например, дисфункция митохондрий или аберрантная функция митохондрий), грибковая инфекция, отторжение трансплантата или сердечнососудистое заболевание (например, застойная сердечная недостаточность; аритмогенные синдромы (например, пароксисомная тахикардия, отсроченная после деполяризации, желудочковая тахикардия, внезапная тахикардия, аритмии, вызванные физической нагрузкой, синдромы удлиненного интервала QT или двунаправленная тахикардия); тромбоэмболические расстройства (например, артериальные сердечнососудистые тромбоэмболические расстройства, венозные сердечнососудистые тромбоэмболические расстройства или тромбоэмболические расстройства в камерах сердца); атеросклероз; рестеноз; заболевание периферических артерий; операция по аортокоронарному шунтированию; заболевание сонной артерии; артериит; миокардит; сердечнососудистое воспаление; сосудистое воспаление; ишемическая болезнь сердца (ИБС); нестабильная стенокардия (НС); нестабильная рефрактерная стенокардия; стабильная стенокардия (СС); хроническая стабильная стенокардия; острый коронарный синдром (ОКС); инфаркт миокарда (первый или повторный); острый инфаркт миокарда (ОИМ); инфаркт миокарда; инфаркт миокарда без зубца Q; инфаркт миокарда без ST; атеросклеротическая болезнь сердца; ишемическая болезнь сердца; сердечная ишемия; ишемия; внезапная ишемическая смерть; преходящая ишемическая атака; инсульт; окклюзионная болезнь периферических артерий; венозный тромбоз; тромбоз глубоких вен; тромбофлебит; артериальная эмболия; тромбоз коронарных артерий; церебральный артериальный тромбоз, церебральная эмболия; эмболия почек; легочная эмболия; тромбоз (например, связанный с протезами клапанов или другими имплантатами, постоянными катетерами, стентами, искусственным кровообращением, гемодиализом); тромбоз (например, связанный с атеросклерозом, хирургическим вмешательством, длительной иммобилизацией, фибрилляцией артерий, врожденной тромбофилией, раком, диабетом, гормонами или беременностью); или сердечные аритмии (например, суправентрикулярные аритмии, предсердные аритмии, трепетание предсердий или фибрилляция предсердий).
В одном аспекте представлен способ лечения заболевания, включающий введение эффективного количества одной или нескольких композиций или соединений, как описано в данном документе. В одном аспекте представлена одна или несколько композиций или соединений, как описано в данном документе, для применения в качестве лекарственного средства (например, для лечения заболевания). В одном аспекте представлена одна или несколько композиций или соединений, как описано в данном документе, для применения при лечении заболевания (например, включая введение эффективного количества одной или нескольких композиций или соединений, как описано в данном документе). В вариантах осуществления, заболеванием является рак. В вариантах осуществления, заболеванием является аутоиммунное заболевание. В вариантах осуществления, заболеванием является воспалительное заболевание. В вариантах осуществления, заболеванием является нейродегенеративное заболевание. В вариантах осуществления, заболеванием является метаболическое заболевание. В вариантах осуществления, заболеванием является грибковая инфекция. В вариантах осуществления, заболеванием является отторжение трансплантата. В вариантах осуществления, заболеванием является сердечнососудистое заболевание.
В вариантах осуществления, заболеванием является рак (например, карциномы, саркомы, аденокарциномы, лимфомы, лейкозы, солидные раки, лимфоидные раки; рак почки, груди, легких, мочевого пузыря, толстой кишки, желудочно-кишечного тракта, яичников, простаты, поджелудочной железы, желудка, головного мозга, головы и шеи, кожи, матки, пищевода, печени; рак яичек, глиома, гепатокарцинома, лимфома, включая B-острую лимфобластную лимфому, неходжкинские лимфомы (например, Беркитта, мелкоклеточные и крупноклеточные лимфомы), лимфома Ходжкина, лейкоз (включая ОМЛ, ОЛЛ и ХМЛ), множественная миелома и рак груди (например, трижды негативный рак груди)).
В вариантах осуществления, заболеванием является острый диссеминированный энцефаломиелит (ОДЭМ), острый некротический геморрагический лейкоэнцефалит, болезнь Аддисона, агаммаглобулинемия, очаговая алопеция, амилоидоз, анкилозирующий спондилит, анти-GBM/анти-TBM нефрит, антифосфолипидный синдром (АФС), аутоиммунный ангионевротический отек, аутоиммунная апластическая анемия, аутоиммунная вегетативная дистония, аутоиммунный гепатит, аутоиммунная гиперлипидемия, аутоиммунный иммунодефицит, аутоиммунное внутреннее заболевание уха (АВЗУ), аутоиммунный миокардит, аутоиммунный оофорит, аутоиммунный панкреатит, аутоиммунная ретинопатия, аутоиммунная тромбоцитопеническая пурпура (АТП), аутоиммунное заболевание щитовидной железы, аутоиммунная крапивница, аксональные или нейрональные невропатии, болезнь Бало, болезнь Бехчета, буллезный пемфигоид, кардиомиопатия, болезнь Кастлемана, целиакия, болезнь Шагаса, синдром хронической усталости, хроническая воспалительная демиелинизирующая полинейропатия (ХВДП), хронический рецидивирующий мультифокальный остомиелит (ХРМО), синдром Чарджа-Стросса, рубцовый пемфигоид/доброкачественный пемфигоид слизистой оболочки, болезнь Крона, синдром Коганса, болезнь холодовых агглютининов, врожденная блокада сердца, миокардит Коксаки, болезнь CREST, эссенциальная смешанная криоглобулинемия, демиелинизирующие невропатии, герпетиформный дерматит, дерматомиозит, болезнь Девика (оптический нейромиелит), дискоидная волчанка, синдром Дрессьера, эндометриоз, эозинофильный эзофагит, эозинофильный фасциит, узловатая эритема, экспериментальный аллергический энцефаломиелит, синдром Эванса, фибромиалгия, фиброзирующий альвеолит, гигантоклеточный артериит (височный артериит), гигантоклеточный миокардит, гломерулонефрит, синдром Гудпасчера, гранулематоз с полиангиитом (ГПА) (ранее назывался гранулематоз Вегенера), болезнь Грейвса, синдром Гийена-Барре, энцефалит Хашимото, тиреоидит Хашимото, гемолитическая анемия, пурпура Геноха-Шонлейна, герпес беременных, гипогаммаглобулинемия, идиопатическая тромбоцитопеническая пурпура (ИТП), нефропатия IgA, склерозирующая болезнь, связанная с IgG4, иммунорегуляторные липопротеины, миозит с включенными тельцами, интерстициальный цистит, ювенильный артрит, ювенильный диабет (диабет 1 типа), ювенильный миозит, синдром Кавасаки, синдром Ламберта-Итона, лейкоцитокластический васкулит, красный плоский лишай, каплевидная склеродермия, деревянистый конъюнктивит, линейная IgA болезнь (ЛАБ), волчанка (СКВ), болезнь Лайма, хроническая, болезнь Меньера, микроскопический полиангиит, смешанное заболевание соединительной ткани (СЗСТ), язва Мурена, болезнь Мухи-Хабермана, рассеянный склероз, миастения гравис, миозит, нарколепсия, оптический нейромиелит (Девика), нейтропения, глазной рубцовый пемфигоид, неврит зрительного нерва, палиндромный ревматизм, PANDAS (педиатрические аутоиммунные нейропсихиатрические расстройства, связанные со стрептококком), паранеопластическая дегенерация мозжечка, пароксизмальная ночная гемоглобинурия (ПНГ), синдром Парри-Ромберга, синдром Парсонажа-Тернера, планит Парса (периферический увеит), пузырчатка, периферическая невропатия, перивенозный энцефаломиелит, пернициозная анемия, синдром POEMS, узелковый полиартериит, аутоиммунные полигландулярные синдромы I, II и III типов, ревматическая полимиалгия, полимиозит, синдром постмиокардиального инфаркта, постперикардиотомный синдром, прогестероновый дерматит, первичный билиарный цирроз, первичный склерозирующий холангит, псориаз, псориатический артрит, идиопатический легочный фиброз, гангренозная пиодермия, истинная эритроцитарная аплазия, феномен Рейно, реактивный артрит, рефлекторная симпатическая дистрофия, синдром Рейтера, рецидивирующий полихондрит, синдром беспокойных ног, забрюшинный фиброз, ревматическая лихорадка, ревматоидный артрит, саркоидоз, синдром Шмидта, склерит, склеродермия, синдром Шегрена, аутоиммунитет сперматозоидов и яичек, синдром скованного человека, подострый бактериальный эндокардит (ПБЭ), синдром Сусака, симпатическая офтальмия, артериит Такаясу, височный артериит/гигантоклеточный артериит, тромбоцитопеническая пурпура (ТТП), синдром Толосы-Ханта, поперечный миелит, диабет 1 типа, язвенный колит, недифференцированное заболевание соединительной ткани (НЗСТ), увеит, васкулит, везикулобуллезный дерматоз, витилиго, гранулематоз Вегенера (т. е. гранулематоз с полиангиитом (ГПА), черепно-мозговая травма, артрит, ревматоидный артрит, псориазный артрит, ювенильный идиопатический артрит, рассеянный склероз, системная красная волчанка (СКВ), миастения гравис, ювенильный диабет, сахарный диабет 1 типа, синдром Гийена-Барре, энцефалит Хашимото, тип 1, тиреоидит Хашимото, анкилозирующий спондилит, псориаз, синдром Шегрена, васкулит, гломерулонефрит, аутоиммунный тиреоидит, болезнь Бехчета, болезнь Крона, язвенный колит, буллезный пемфигоид, саркоидоз, ихтиоз, офтальмопатия Грейвса, воспалительная болезнь кишечника, болезнь Аддисона, витилиго, астма, аллергическая астма, обыкновенные угри, целиакия, хронический простатит, воспалительное заболевание кишечника, воспалительные заболевания органов малого таза, реперфузионное повреждение, саркоидоз, отторжение трансплантата, интерстициальный цистит, атеросклероз, атопический дерматит, болезнь Александера, болезнь Альпера, болезнь Альцгеймера, боковой амиотрофический склероз, атаксия-телеангиэктазия, болезнь Баттена (также известная как болезнь Шпильмейера-Фогта-Шегрена-Баттена), синдром коровьего бешенства (СКБ), болезнь Канавана, синдром Кокейна, кортикобазальная дегенерация, болезнь Крейтцфельда-Якоба, лобно-височная деменция, синдром Герстмана-Штрауслера-Шейнкера, болезнь Хантингтона, ВИЧ-ассоциированная деменция, болезнь Кеннеди, болезнь Краббе, куру, деменция с тельцами Леви, болезнь Мачадо-Джозефа (спиноцеребеллярная атаксия 3 типа), рассеянный склероз, множественная системная атрофия, нарколепсия, нейроборрелиоз, болезнь Паркинсона, болезнь Пелизея-Мерцбахера, болезнь Пика, первичный боковой склероз, прионные болезни, болезнь Рефсума, болезнь Сандхоффа, болезнь Шильдера, подострая комбинированная дегенерация спинного мозга, вторичная к злокачественной анемии, шизофрения, спинально-церебеллярная атаксия (несколько типов с различными характеристиками), спинальная мышечная атрофия, болезнь Стила-Ричардсона-Ольшевского, сухотка спинного мозга, диабет (например, I типа или II типа), ожирение, метаболический синдром, митохондриальное заболевание (например, дисфункция митохондрий или аберрантная функция митохондрий), грибковая инфекция, отторжение трансплантата или сердечнососудистое заболевание (например, застойная сердечная недостаточность; аритмогенные синдромы (например, пароксисомная тахикардия, отсроченная после деполяризации, желудочковая тахикардия, внезапная тахикардия, аритмии, вызванные физической нагрузкой, синдромы удлиненного интервала QT или двунаправленная тахикардия); тромбоэмболические расстройства (например, артериальные сердечнососудистые тромбоэмболические расстройства, венозные сердечнососудистые тромбоэмболические расстройства или тромбоэмболические расстройства в камерах сердца); атеросклероз; рестеноз; заболевание периферических артерий; операция по аортокоронарному шунтированию; заболевание сонной артерии; артериит; миокардит; сердечнососудистое воспаление; сосудистое воспаление; ишемическая болезнь сердца (ИБС); нестабильная стенокардия (НС); нестабильная рефрактерная стенокардия; стабильная стенокардия (СС); хроническая стабильная стенокардия; острый коронарный синдром (ОКС); инфаркт миокарда (первый или повторный); острый инфаркт миокарда (ОИМ); инфаркт миокарда; инфаркт миокарда без зубца Q; инфаркт миокарда без ST; атеросклеротическая болезнь сердца; ишемическая болезнь сердца; сердечная ишемия; ишемия; внезапная ишемическая смерть; преходящая ишемическая атака; инсульт; окклюзионная болезнь периферических артерий; венозный тромбоз; тромбоз глубоких вен; тромбофлебит; артериальная эмболия; тромбоз коронарных артерий; церебральный артериальный тромбоз, церебральная эмболия; эмболия почек; легочная эмболия; тромбоз (например, связанный с протезами клапанов или другими имплантатами, постоянными катетерами, стентами, искусственным кровообращением, гемодиализом); тромбоз (например, связанный с атеросклерозом, хирургическим вмешательством, длительной иммобилизацией, фибрилляцией артерий, врожденной тромбофилией, раком, диабетом, гормонами или беременностью); или сердечные аритмии (например, суправентрикулярные аритмии, предсердные аритмии, трепетание предсердий или фибрилляция предсердий). В вариантах осуществления, заболеванием является поликистозная болезнь. В вариантах осуществления, заболеванием является поликистоз почек. В вариантах осуществления, заболеванием является стеноз. В вариантах осуществления, заболеванием является рестеноз. В вариантах осуществления, заболеванием является пролиферация неоинтимы. В вариантах осуществления, заболеванием является гиперплазия неоинтимы.
В другом аспекте представлен способ лечения старения у субъекта, нуждающегося в таком лечении, где способ включает введение одной или нескольких композиций или соединений, как описано в данном документе, включая варианты осуществления (например, пункт формулы изобретения, вариант осуществления, пример, таблицу, рисунок или пункт формулы изобретения) субъекту. В настоящем описании представлен способ лечения старения иммунной системы, включающий введение субъекту терапевтически эффективного количества одного или нескольких описанных соединений или композиций.
В другом аспекте представлена одна или несколько композиций или соединений, как описано в данном документе, для использования в качестве лекарственного средства. В вариантах осуществления лекарственное средство может быть полезно для лечения старения у субъекта, нуждающегося в таком лечении. В вариантах осуществления использование может включать введение субъекту одной или нескольких композиций или соединений, как описано в данном документе, включая варианты осуществления (например, аспект, вариант осуществления, пример, таблицу, фигуру или пункт формулы изобретения).
В другом аспекте представлена одна или несколько композиций или соединений, раскрытых в данном документе, для применения при лечении старения у субъекта, нуждающегося в таком лечении. В вариантах осуществления использование может включать введение субъекту одной или нескольких композиций или соединений, как описано в данном документе, включая варианты осуществления (например, аспект, вариант осуществления, пример, таблицу, фигуру или пункт формулы изобретения).
В другом аспекте представлен способ увеличения продолжительности жизни или вызова долголетия у субъекта, нуждающегося в таком лечении, где способ включает введение одной или нескольких композиций или соединений, как описано в данном документе, включая варианты осуществления (например, пункт формулы, вариант осуществления, пример, таблицу, фигуру или пункт формулы изобретения) субъекту.
В другом аспекте представлена одна или несколько композиций или соединений, как описано в данном документе, для использования в качестве лекарственного средства. В вариантах осуществления, лекарственное средство может быть использовано для увеличения продолжительности жизни или вызова долголетия у субъекта, нуждающегося в таком лечении. В вариантах осуществления использование может включать введение субъекту одной или нескольких композиций или соединений, как описано в данном документе, включая варианты осуществления (например, аспект, вариант осуществления, пример, таблицу, фигуру или пункт формулы изобретения).
В другом аспекте представлена одна или несколько композиций или соединений для использования для увеличения продолжительности жизни или вызова долголетия у субъекта, нуждающегося в таком лечении. В вариантах осуществления использование может включать введение субъекту одной или нескольких композиций или соединений, как описано в данном документе, включая варианты осуществления (например, аспект, вариант осуществления, пример, таблицу, фигуру или пункт формулы).
В одном аспекте представлен способ лечения поликистоза у субъекта, нуждающегося в таком лечении. Поликистоз может быть поликистозом почек. Способ может включать введение субъекту одной или нескольких композиций или соединений, описанных в данном документе. Способ может включать введение субъекту терапевтически эффективного количества одной или нескольких композиций или соединений, описанных в данном документе (например, модулятора mTOR (например, ингибитора), как описано выше).
В одном аспекте представлена одна или несколько композиций или соединений, как описано в данном документе, для использования в качестве лекарственного средства. В вариантах осуществления лекарственное средство полезно для лечения поликистоза. Поликистоз может быть поликистозом почек. Применение может включать введение субъекту одной или нескольких композиций или соединений, описанных в данном документе. Применение может включать введение субъекту терапевтически эффективного количества одной или нескольких композиций или соединений, описанных в настоящем документе (например, модулятора mTOR (например, ингибитора), как описано выше).
В одном аспекте представлена одна или несколько композиций или соединений, как описано в данном документе, для применения при лечении поликистозного заболевания у субъекта, нуждающегося в таком лечении. Поликистоз может быть поликистозом почек. Применение может включать введение субъекту одной или нескольких композиций или соединений, описанных в данном документе. Применение может включать введение субъекту терапевтически эффективного количества одной или нескольких композиций или соединений, описанных в настоящем документе (например, модулятора mTOR (например, ингибитора), как описано выше).
В одном аспекте представлен способ лечения стеноза у субъекта, нуждающегося в таком лечении. Стеноз может быть рестенозом. Способ может включать введение субъекту одной или нескольких композиций или соединений, описанных в данном документе. В вариантах осуществления одна или несколько композиций или соединений вводятся в стенте, выделяющем лекарственное средство. Способ может включать введение субъекту терапевтически эффективного количества одной или нескольких композиций или соединений, описанных в данном документе (например, модулятора mTOR (например, ингибитора), как описано выше).
В одном аспекте представлена одна или несколько композиций или соединений, как описано в данном документе, для использования в качестве лекарственного средства. В вариантах осуществления лекарственное средство полезно для лечения стеноза. Стеноз может быть рестенозом. Применение может включать введение субъекту одной или нескольких композиций или соединений, описанных в данном документе. В вариантах осуществления соединение вводят в стенте, выделяющем лекарственное средство. Применение может включать введение субъекту терапевтически эффективного количества одной или нескольких композиций или соединений, описанных в настоящем документе (например, модулятора mTOR (например, ингибитора), как описано выше).
В одном аспекте представлена одна или несколько композиций или соединений, как описано в данном документе, для применения при лечении стеноза у субъекта, нуждающегося в таком лечении. Стеноз может быть рестенозом. Применение может включать введение субъекту одной или нескольких композиций или соединений, описанных в данном документе. В вариантах осуществления одна или несколько композиций или соединений вводятся в стенте, выделяющем лекарственное средство. Применение может включать введение субъекту терапевтически эффективного количества одной или нескольких композиций или соединений, описанных в настоящем документе (например, модулятора mTOR (например, ингибитора), как описано выше).
В вариантах осуществления, заболевание представляет собой заболевание, описанное в данном документе, и соединение представляет собой соединение, описанное в данном документе, и композиция представляет собой композицию, описанную в данном документе.
Способы модулирования mTOR
В некоторых вариантах осуществления, раскрытые в данном документе соединения являются более селективными ингибиторами mTORC1 по сравнению с mTORC2. В некоторых вариантах осуществления, раскрытые в данном документе соединения являются более селективными ингибиторами mTORC2 по сравнению с mTORC1. В некоторых вариантах осуществления соединения, раскрытые в данном документе, не проявляют разницы в селективности между mTORC1 и mTORC2.
В другом аспекте представлен способ модулирования активности mTORC1 у субъекта, нуждающегося в этом, включая введение субъекту эффективного количества соединения, как описано в данном документе, или его фармацевтически приемлемой соли. В вариантах осуществления способ включает ингибирование активности mTORC1. В вариантах осуществления способ включает ингибирование активности mTORC1, но не ингибирование активности mTORC2.
В вариантах осуществления, способ включает ингибирование активности mTORC1 в большей степени, чем ингибирование активности mTORC2. В вариантах осуществления, способ включает ингибирование активности mTORC1 в, по меньшей мере, 1,1 раза больше, чем ингибирование активности mTORC2 (например, в, по меньшей мере, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 10000, 20000, 30000, 40000, 50000, 60000, 70000, 80000,90000, 100000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000 или 1000000 раз).
В другом аспекте представлен способ модулирования активности mTORC2 у субъекта, нуждающегося в этом, включая введение субъекту эффективного количества соединения, как описано в данном документе, или его фармацевтически приемлемой соли. В вариантах осуществления способ включает ингибирование активности mTORC2. В вариантах осуществления способ включает ингибирование активности mTORC2, но не ингибирование активности mTORC1.
В вариантах осуществления, способ включает ингибирование активности mTORC2 в большей степени, чем ингибирование активности mTORC1. В вариантах осуществления, способ включает ингибирование активности mTORC2 в, по меньшей мере, 1,1 раза больше, чем ингибирование активности mTORC1 (например, в, по меньшей мере, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 10000, 20000, 30000, 40000, 50000, 60000, 70000, 80000,90000, 100000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000 или 1000000 раз).
В некоторых вариантах осуществления, mTOR находится в клетке. В некоторых вариантах осуществления, клетка представляет собой клетку млекопитающего, такую как клетка человека. Клетка может быть выделена in vitro, образовывать часть ткани in vitro или может составлять часть организма.
Типовые варианты осуществления
Некоторые варианты осуществления данного раскрытия являются Вариантом осуществления I, следующим образом:
Вариант осуществления I-1. Соединение формулы I:
 (I)
(I)
или его фармацевтически приемлемая соль или таутомер, где:
R32 является -Н, =O или -OR3;
A3 является -[C(R3)2]n-, (C6-C10)ариленом, циклоалкиленом, гетероариленом или гетероциклиленом;
R26 является -A1-L1-A2-B; -A1-A2-B; -L2-A1-L1-A2-L3-B; или -ОН;
A1 и A2 независимо отсутствуют или независимо выбраны из
 ,
, ,
, ,
, ,
, ,
, ,
, ,
, ,
,  ,
, ,
, ;
;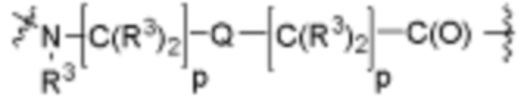 ,
,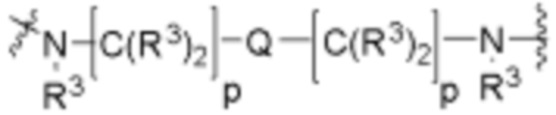 ,
,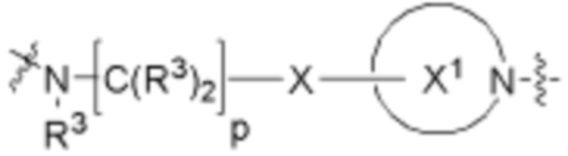 ,
,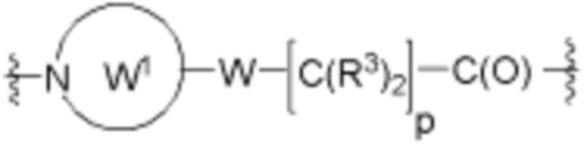 ,
,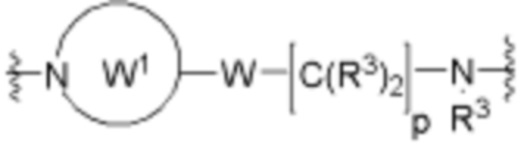 ,
, ,
,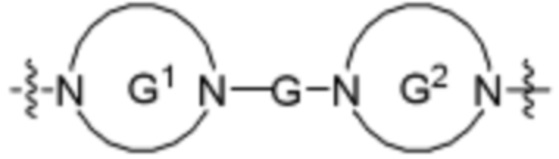 и,
и, ,
,
где связь на левой стороне A1, как изображено, связана с -C(=O)- или L2; и где связь на правой стороне группы A2, как изображено, связана с B или L3;
каждый Q независимо является 1-3 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый X независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый X1 является гетероариленовым или гетероциклиленовым кольцом;
каждый W независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый W1 является гетероариленовым или гетероциклиленовым кольцом;
каждый G независимо отсутствует или является кольцом, выбранным из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый G1 и G2 независимо является гетероариленовым или гетероциклиленовым кольцом;
каждый L1 независимо выбирают из

L2 и L3 независимо отсутствуют или независимо выбраны из
 ,
,

каждый B независимо выбирают из

каждый B1 независимо выбирают из  NR3-(C(R3)2)n-,
NR3-(C(R3)2)n-,  NR3-(C(R3)2)n-(C6-C10)арилен-(C(R3)2)n-,
NR3-(C(R3)2)n-(C6-C10)арилен-(C(R3)2)n-,  NR3-(C(R3)2)n-гетероарилена-,
NR3-(C(R3)2)n-гетероарилена-,  (C6-C10)арилена-,
(C6-C10)арилена-,  NR3-(C(R3)2)n-NR3C(O)-,
NR3-(C(R3)2)n-NR3C(O)-,  NR3-(C(R3)2)n-гетероариленгетероциклилен-(C6-C10)арилена-,
NR3-(C(R3)2)n-гетероариленгетероциклилен-(C6-C10)арилена-,  гетероариленгетероциклилен-(C6-C10)арилена-,
гетероариленгетероциклилен-(C6-C10)арилена-, 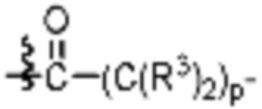 ,
, 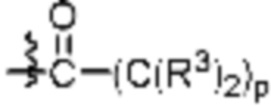 -гетероарилена,
-гетероарилена,  ,
,  ,
,  ,
,  ,
,  (С6-С10)арилена,
(С6-С10)арилена,  ,
,  гетероарилена-,
гетероарилена-,  гетероциклиленарилена- и
гетероциклиленарилена- и  NR3-(C(R3)2)n-S(O)2-арилен-C(O)-, где
NR3-(C(R3)2)n-S(O)2-арилен-C(O)-, где  связь на левой стороне B1, как изображено, связана с A2, L3 или L1; и где гетероарилен, гетероциклилен и арилен каждый независимо необязательно замещен алкилом, гидроксиалкилом, галоалкилом, алкокси, галогеном или гидроксилом;
связь на левой стороне B1, как изображено, связана с A2, L3 или L1; и где гетероарилен, гетероциклилен и арилен каждый независимо необязательно замещен алкилом, гидроксиалкилом, галоалкилом, алкокси, галогеном или гидроксилом;
каждый R3 независимо является H или (C1-C6)алкилом;
каждый R4 независимо является H, (C1-C6)алкилом, галогеном, 5-12-членным гетероарилом, 5-12-членным гетероциклилом, (C6-C10)арилом, где гетероарил, гетероциклил и арил каждый независимо необязательно замещен -N(R3)2, -OR3, галогеном, (C1-C6)алкилом, -(C1-C6)алкиленгетероарилом, -(C1-C6)алкилен-CN, -C(O)NR3-гетероарилом или -C(O)NR3-гетероциклилом;
каждый R5 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил из (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый R6 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил из (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый R7 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил из (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый R8 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил из (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый Y независимо является -C(R3)2 или связью;
каждый n независимо является целым числом от одного до 12;
каждый o независимо является целым числом от нуля до 30;
каждый p независимо является целым числом от нуля до 12;
каждый q независимо является целым числом от нуля до 30; и
каждый r независимо является целым числом от одного до 6.
Вариант осуществления I-2. Соединение по варианту осуществления I-1, где R32 является =O.
Вариант осуществления I-3. Соединение по варианту осуществления I-1, где R32 является -OR3.
Вариант осуществления I-4. Соединение по любому из вариантов осуществления I-1 - I-3, где A3 является -[C(R3)2]n-.
Вариант осуществления I-5. Соединение по любому из вариантов осуществления I-1 - I-3, где A3 является (C6-C10)ариленом.
Вариант осуществления I-6. Соединение по любому из вариантов осуществления I-1 - I-5, где R26 является -A1-L1-A2-B, где A1 и A2 отсутствуют.
Вариант осуществления I-7. Соединение по любому из вариантов осуществления I-1 - I-5, где R26 является -A1-L1-A2-B, где A2 отсутствует.
Вариант осуществления I-8. Соединение по любому из вариантов осуществления I-1 - I-5, где R26 является -A1-L1-A2-B, где A1 отсутствует.
Вариант осуществления I-9. Соединение по любому из вариантов осуществления I-1 - I-5, где R26 является -A1-L1-A2-B.
Вариант осуществления I-10. Соединение по любому из вариантов осуществления I-1 - I-5, где R26 является -A1-A2-B.
Вариант осуществления I-11. Соединение по любому из вариантов осуществления I-1 - I-5, где R26 является --L2-A1-L1-A2-L3-B.
Вариант осуществления I-12. Соединение по любому из вариантов осуществления I-1 - I-5, где R26 является -OH.
Вариант осуществления I-13. Соединение по любому из вариантов осуществления I-1 - I-11, где L1 является 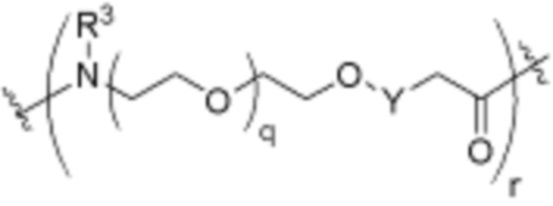 .
.
Вариант осуществления I-14. Соединение по любому из вариантов осуществления I-1 - I-11, где L1 является 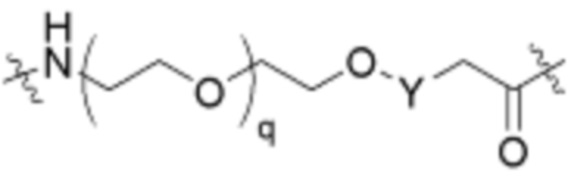 .
.
Вариант осуществления I-15. Соединение по любому из вариантов осуществления I-1 - I-11, где L1 является 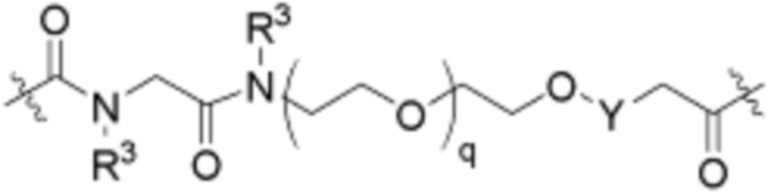 или
или 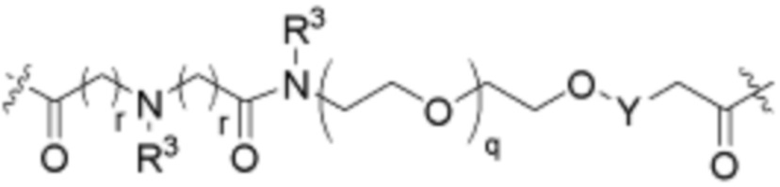 .
.
Вариант осуществления I-16. Соединение по любому из вариантов осуществления I-1 - I-11, где L1 является 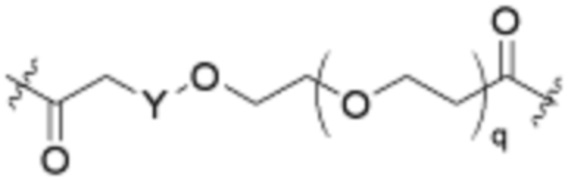 .
.
Вариант осуществления I-17. Соединение по любому из вариантов осуществления I-1 - I-11, где L1 является 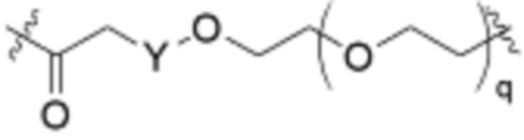 .
.
Вариант осуществления I-18. Соединение по любому из вариантов осуществления I-1 - I-11, где L1 является 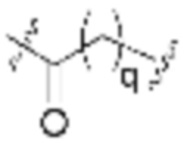 .
.
Вариант осуществления I-19. Соединение по любому из вариантов осуществления I-1 - I-11, где L1 является 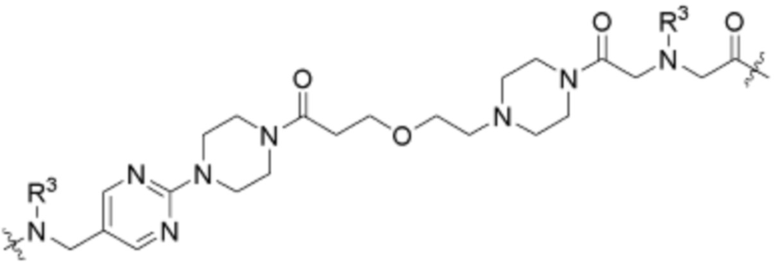 .
.
Вариант осуществления I-20. Соединение по любому из вариантов осуществления I-1 - I-11, где L1 является 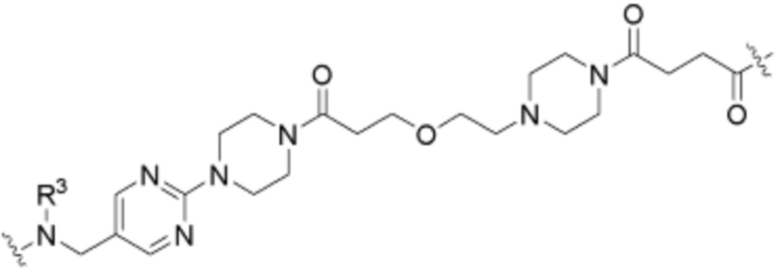 .
.
Вариант осуществления I-21. Соединение по любому из вариантов осуществления I-1 - I-11 и I-13 - I-20, где A1 отсутствует.
Вариант осуществления I-22. Соединение по любому из вариантов осуществления I-1 - I-5, I-7, I-9 - I-11 и I-13 - I-20, где A1 является 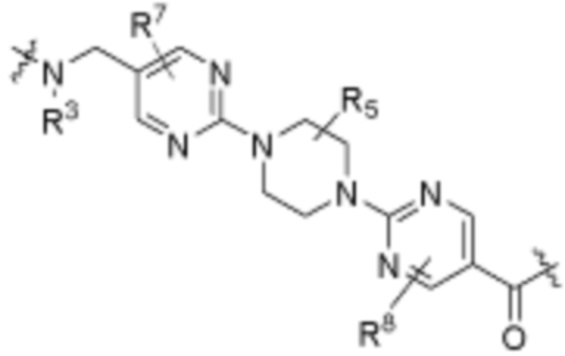 .
.
Вариант осуществления I-23. Соединение по любому из вариантов осуществления I-1 - I-5, I-7, I-9 - I-11 и I-13 - I-20, где A1 является 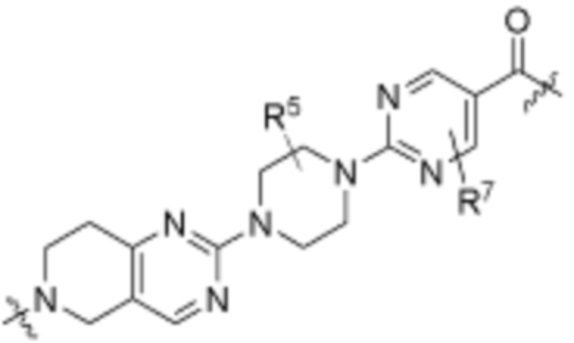
Вариант осуществления I-24. Соединение по любому из вариантов осуществления I-1 - I-5, I-7, I-9 - I-11 и I-13 - I-20, где A1 является 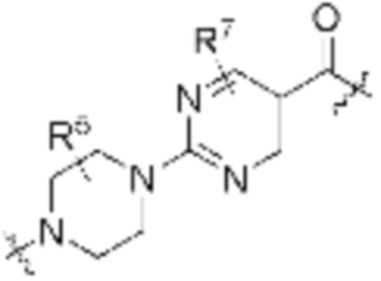 .
.
Вариант осуществления I-25. Соединение по любому из вариантов осуществления I-1 - I-5, I-7, I-9 - I-11 и I-13 - I-20, где A1 является 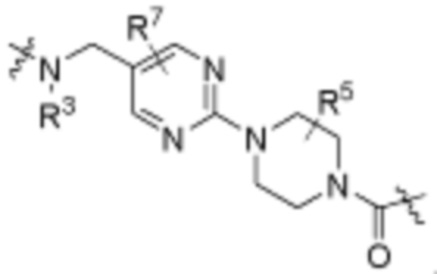 .
.
Вариант осуществления I-26. Соединение по любому из вариантов осуществления I-1 to- I-5, I-7, I-9 - I-11 и I-13 - I-20, где A1 является 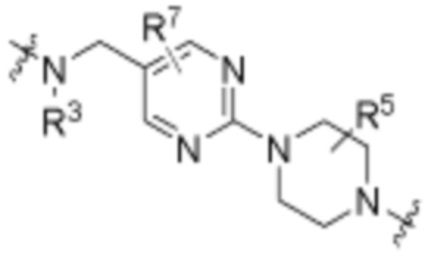 .
.
Вариант осуществления I-27. Соединение по любому из вариантов осуществления I-1 - I-11 и I-13 - I-24, где A2 отсутствует.
Вариант осуществления I-28. Соединение по любому из вариантов осуществления I-1 - I-5, I-8 - I-11 и I-13 - I-24, где A2 является 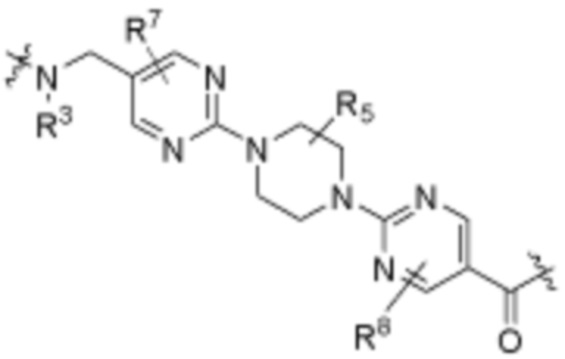 .
.
Вариант осуществления I-29. Соединение по любому из вариантов осуществления I-1 - I-5, I-8 - I-11 и I-13 - I-24, где A2 является 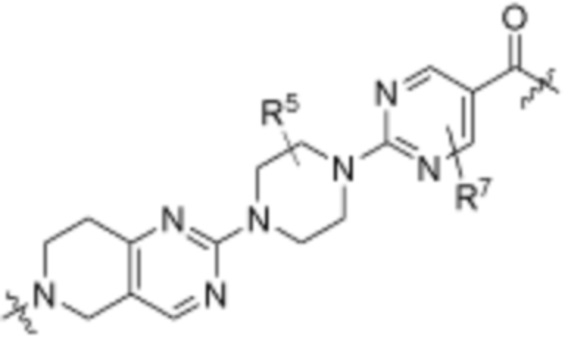 .
.
Вариант осуществления I-30. Соединение по любому из вариантов осуществления I-1 - I-5, I-8 - I-11 и I-13 - I-24, где A2 является 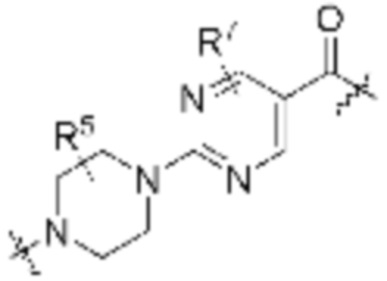 .
.
Вариант осуществления I-31. Соединение по любому из вариантов осуществления I-1 - I-5, I-8 - I-11 и I-13 - I-24, где A2 является 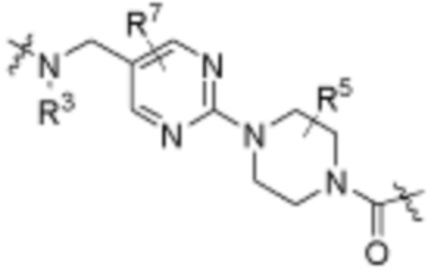 .
.
Вариант осуществления I-32. Соединение по любому из вариантов осуществления I-1 - I-5, I-8 - I-11 и I-13 - I-24, где A2 является 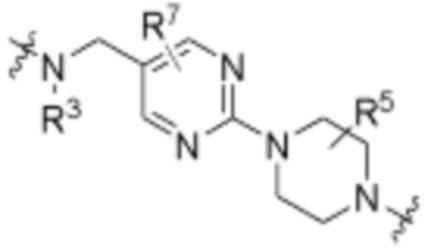 .
.
Вариант осуществления I-33. Соединение по любому из вариантов осуществления I-1 - I-11 и I-13 - I-30, где B является  .
.
Вариант осуществления I-34. Соединение по любому из вариантов осуществления I-1 - I-11 и I-13 - I-30, где B является  .
.
Вариант осуществления I-35. Соединение по любому из вариантов осуществления I-1 - I-11 и I-13 - I-34, где B1 является 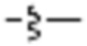 NR3-(C(R3)2)n-.
NR3-(C(R3)2)n-.
Вариант осуществления I-36. Соединение по любому из вариантов осуществления I-1 - I-11 и I-13 - I-34, где B1 является 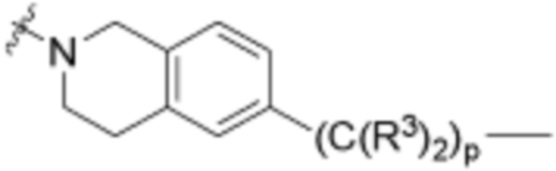 .
.
Вариант осуществления I-37. Соединение по любому из вариантов осуществления I-1 - I-11 и I-13 - I-36, где R4 является 5-12-членным гетероарилом, необязательно замещенным -N(R3)2, -OR3, галогеном, (C1-C6)алкилом, -(C1-C6)алкиленгетероарилом, -(C1-C6)алкилен-CN или -C(O)NR3-гетероарилом.
Вариант осуществления I-38. Соединение по любому из вариантов осуществления I-1 - I-37, или его фармацевтически приемлемая соль или таутомер, где соединение имеет следующую формулу:
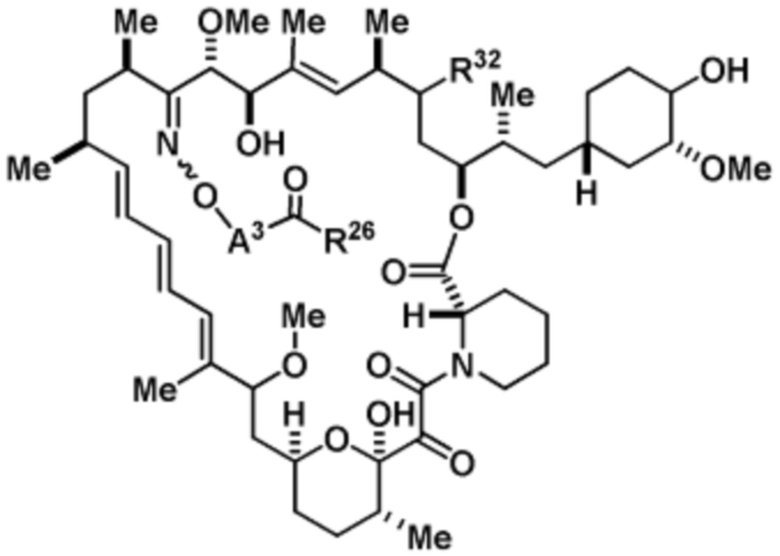 .
.
Вариант осуществления I-39. Соединение, выбранное из группы, состоящей из:

Пример 1
Пример 2
Пример 3
Пример 4
Пример 5
Пример 6
Пример 7
Пример 8
Пример 9
Пример 10
Пример 11
Пример 12
Пример 13
Пример 14
Пример 15
Пример 16
Пример 17
Пример 18
Пример 19
Пример 20
Пример 21
Пример 22
Пример 23
Пример 24
Пример 25
Пример 26
Пример 27
Пример 28
Пример 29
Пример 30
Пример 31
Пример 32
Пример 33
Пример 34
Пример 35
Пример 36
Пример 37
Пример 38
Пример 39
Пример 40
Пример 41
Пример 42
или его фармацевтически приемлемая соль или изомер.
Вариант осуществления I-40. Фармацевтическая композиция, содержащая соединение по любому из вариантов осуществления I-1 - I-39 или его фармацевтически приемлемую соль и, по меньшей мере, один из фармацевтически приемлемых носителя, разбавителя или эксципиента.
Вариант осуществления I-41. Способ лечения заболевания или расстройства, медиированного mTOR, включающий введение субъекту, страдающему или подверженному риску развития заболевания или расстройства, медиированного mTOR, терапевтически эффективного количества одного или более соединений по любому из вариантов осуществления I-1 - I-39 или его фармацевтически приемлемой соли.
Вариант осуществления I-42. Способ профилактики заболевания или расстройства, медиированного mTOR, включающий введение субъекту, страдающему от или подверженному риску развития заболевания или расстройства, медиированного mTOR, терапевтически эффективного количества одного или более соединений по любому из вариантов осуществления I-1 - I-39 или его фармацевтически приемлемой соли.
Вариант осуществления I-43. Способ снижения риска заболевания или расстройства, медиированного mTOR, включающий введение субъекту, страдающему от или подверженному риску развития заболевания или расстройства, медиированного mTOR терапевтически эффективного количества одного или более соединений по любому из вариантов осуществления I-1 - I-39 или его фармацевтически приемлемой соли.
Вариант осуществления I-44. Способ по любому из вариантов осуществления I-41 - I-44, где заболеванием является рак или иммуноопосредованное заболевание.
Вариант осуществления I-45. Способ по варианту осуществления I-44, где рак выбирают из опухолей головного мозга и сосудисто-нервной системы, рака головы и шеи, рака груди, рака легких, мезотелиомы, лимфоидного рака, рака желудка, рака почки, карциномы почек, рака печени, рака яичников, эндометриоза яичников, рака яичек, рака желудочно-кишечного тракта, рака простаты, глиобластомы, рака кожи, меланомы, нервного рака, рака селезенки, рака поджелудочной железы, нарушений пролиферации крови, лимфомы, лейкоза, рака эндометрия, рака шейки матки, рака вульвы, рака простаты, рака полового члена, рака костей, рака мышц, рака мягких тканей, рака кишечника или прямой кишки, рака анального канала, рака мочевого пузыря, рака желчных протоков, рака глаза, стромальных опухолей желудочно-кишечного тракта и нейроэндокринных опухолей.
Вариант осуществления I-46. Способ по варианту осуществления I-44, где иммуноопосредованное заболевание выбирают из резистентности при трансплантации сердца, почек, печени, костного мозга, кожи, роговицы, легкого, поджелудочной железы, тонкого кишечника, конечностей, мышц, нервов, двенадцатиперстной кишки, тонкой кишки или островковых клеток поджелудочной железы; болезней «трансплантат против хозяина», вызванных трансплантацией костного мозга; ревматоидного артрита, системной красной волчанки, тиреоидита Хашимото, рассеянного склероза, миастении гравис, диабета I типа, увеита, аллергического энцефаломиелита и гломерулонефрита.
Вариант осуществления I-47. Способ лечения рака, включающий введение субъекту терапевтически эффективного количества одного или более соединений по любому из вариантов осуществления I-1 - I-39 или его фармацевтически приемлемой соли.
Вариант осуществления I-48. Способ по варианту осуществления I-47, где рак выбирают из опухолей головного мозга и сосудисто-нервной системы, рака головы и шеи, рака груди, рака легких, мезотелиомы, лимфоидного рака, рака желудка, рака почки, карциномы почек, рака печени, рака яичников, эндометриоза яичников, рака яичек, рака желудочно-кишечного тракта, рака простаты, глиобластомы, рака кожи, меланомы, нервного рака, рака селезенки, рака поджелудочной железы, нарушений пролиферации крови, лимфомы, лейкоза, рака эндометрия, рака шейки матки, рака вульвы, рака простаты, рака полового члена, рака костей, рака мышц, рака мягких тканей, рака кишечника или прямой кишки, рака анального канала, рака мочевого пузыря, рака желчных протоков, рака глаза, стромальных опухолей желудочно-кишечного тракта и нейроэндокринных опухолей.
Вариант осуществления I-49. Способ лечения иммуноопосредованного заболевания, включающий введение субъекту терапевтически эффективного количества одного или более соединений по любому из вариантов осуществления I-1 - I-39 или его фармацевтически приемлемой соли.
Вариант осуществления I-50. Способ по варианту осуществления I-49, где иммуноопосредованное заболевание выбирают из резистентности при трансплантации сердца, почек, печени, костного мозга, кожи, роговицы, легкого, поджелудочной железы, тонкого кишечника, конечностей, мышц, нервов, двенадцатиперстной кишки, тонкой кишки или островковых клеток поджелудочной железы; болезней «трансплантат против хозяина», вызванных трансплантацией костного мозга; ревматоидного артрита, системной красной волчанки, тиреоидита Хашимото, рассеянного склероза, миастении гравис, диабета I типа, увеита, аллергического энцефаломиелита и гломерулонефрита.
Вариант осуществления I-51. Способ лечения возрастного состояния, включающий введение субъекту терапевтически эффективного количества одного или более соединений по любому из вариантов осуществления I-1 - I-39 или его фармацевтически приемлемой соли.
Вариант осуществления I-52. Способ по варианту осуществления I-51, где возрастное состояние выбирают из саркопении, атрофии кожи, мышечной атрофии, атрофии головного мозга, атеросклероза, артериосклероза, эмфиземы легких, остеопороза, остеоартрита, высокого кровяного давления, эректильной дисфункции, деменции, болезни Хантингтона, болезни Альцгеймера, катаракты, возрастной дегенерации желтого пятна, рака простаты, инсульта, сокращения продолжительности жизни, нарушения функции почек и возрастной потери слуха, инвалидности, связанной со старением (например, слабости), снижения когнитивных функций, возрастной деменции, нарушения памяти, жесткости сухожилий, сердечной дисфункции, такой как гипертрофия сердца и систолическая и диастолическая дисфункция, иммунного старения, рака, ожирения и диабета.
Вариант осуществления I-53. Соединение по любому из вариантов осуществления I-1 - I-39 или его фармацевтически приемлемая соль, для применения в лечении, профилактике или снижении риска заболевания или состояния, медиированного mTOR.
Вариант осуществления I-54. Применение соединения по любому из вариантов осуществления I-1 - I-39 или его фармацевтически приемлемой соли в производстве лекарственного средства для лечения, профилактики или снижении риска заболевания или состояния, медиированного mTOR.
Вариант осуществления I-55. Соединение по любому из вариантов осуществления I-1 - I-39 или его фармацевтически приемлемая соль, для применения в лечении рака.
Вариант осуществления I-56. Применение соединения по любому из вариантов осуществления I-1 - I-39 или его фармацевтически приемлемой соли в производстве лекарственного средства для лечения рака.
Вариант осуществления I-57. Соединение по любому из вариантов осуществления I-1 - I-39 или его фармацевтически приемлемая соль, для применения в лечении иммуноопосредованного заболевания.
Вариант осуществления I-58. Применение соединения по любому из вариантов осуществления I-1 - I-39 или его фармацевтически приемлемой соли в производстве лекарственного средства для лечения иммуноопосредованного заболевания.
Вариант осуществления I-59. Соединение по любому из вариантов осуществления I-1 - I-39 или его фармацевтически приемлемая соль, для применения в лечении возрастного состояния.
Вариант осуществления I-60. Применение соединения по любому из вариантов осуществления I-1 - I-39 или его фармацевтически приемлемой соли в производстве лекарственного средства для лечения возрастного состояния.
Некоторые варианты осуществления этого раскрытия являются Вариантом осуществления II, представленным ниже:
Вариант осуществления II-1. Соединение формулы Iа:
 (Iа)
(Iа)
или его фармацевтически приемлемая соль или таутомер, где:
R32 является -Н, =O, -OR3 или -N3;
A3 является -[C(R3)2]n-, (C6-C10)ариленом, циклоалкиленом, гетероариленом или гетероциклиленом;
R26 является -A1-L1-A2-B; -A1-A2-B; -L2-A1-L1-A2-L3-B; или -ОН;
A1 и A2 независимо отсутствуют или независимо выбраны из
 ,
, ,
, ,
, ,
, ,
, ,
, ,
, ,
,  ,
,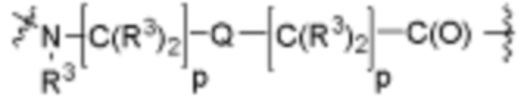 ,
,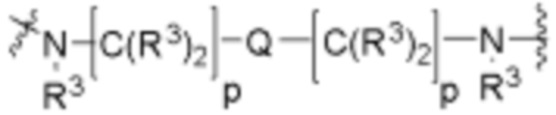 ,
,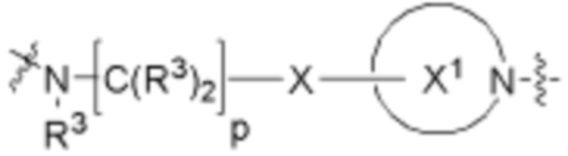 ,
,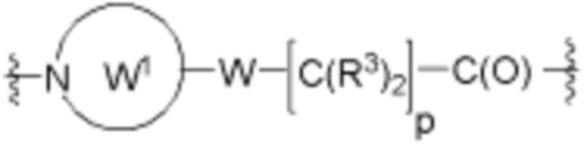 ,
,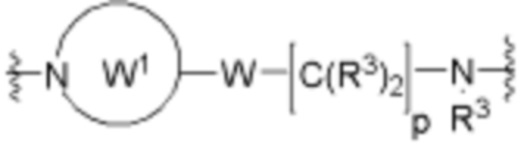 ,
, ,
,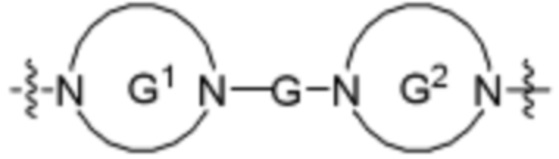 ,
, ,
, ,
, и
и ;
;
где связь на левой стороне A1, как изображено, связана с -C(=O)- или L2; и где связь на правой стороне группы A2, как изображено, связана с B или L3;
каждый Q независимо является 1-3 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый X независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый X1 независимо является гетероариленовым или гетероциклиленовым кольцом;
каждый W независимо отсутствует или является 1-2 кольцами, выбранными из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый W1 независимо является гетероариленовым или гетероциклиленовым кольцом;
каждый G независимо отсутствует или является кольцом, выбранным из арилена, циклоалкилена, гетероарилена и гетероциклилена;
каждый G1 и G2 независимо является гетероариленовым или гетероциклиленовым кольцом;
каждый L1 независимо выбирают из

L2 и L3 независимо отсутствуют или независимо выбраны из

каждый B независимо выбирают из
 ,
,

каждый B1 независимо выбирают из  NR3-(C(R3)2)n-,
NR3-(C(R3)2)n-,  NR3-(C(R3)2)n-(C6-C10)арилен-(C(R3)2)n-,
NR3-(C(R3)2)n-(C6-C10)арилен-(C(R3)2)n-,  NR3-(C(R3)2)n-гетероарилена-,
NR3-(C(R3)2)n-гетероарилена-,  (C6-C10)арилена-,
(C6-C10)арилена-,  NR3-(C(R3)2)n-NR3C(O)-,
NR3-(C(R3)2)n-NR3C(O)-,  NR3-(C(R3)2)n-гетероариленгетероциклилен-(C6-C10)арилена-,
NR3-(C(R3)2)n-гетероариленгетероциклилен-(C6-C10)арилена-,  гетероариленгетероциклилен-(C6-C10)арилена-,
гетероариленгетероциклилен-(C6-C10)арилена-, 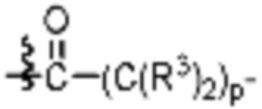 ,
, 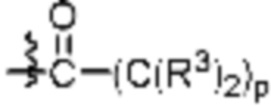 -гетероарилена,
-гетероарилена,  ,
,  ,
,  ,
,  ,
,  (С6-С10)арилена,
(С6-С10)арилена,  ,
,  гетероарилена-,
гетероарилена-,  гетероциклиленарилена- и
гетероциклиленарилена- и  NR3-(C(R3)2)n-S(O)2-арилен-C(O)-, где
NR3-(C(R3)2)n-S(O)2-арилен-C(O)-, где  связь на левой стороне B1, как изображено, связана с A2 или L1; и где гетероарилен, гетероциклилен и арилен каждый независимо необязательно замещен алкилом, гидроксиалкилом, галоалкилом, алкокси, галогеном или гидроксилом;
связь на левой стороне B1, как изображено, связана с A2 или L1; и где гетероарилен, гетероциклилен и арилен каждый независимо необязательно замещен алкилом, гидроксиалкилом, галоалкилом, алкокси, галогеном или гидроксилом;
каждый R3 независимо является H или (C1-C6)алкилом;
каждый R4 независимо является H, (C1-C6)алкилом, галогеном, 5-12-членным гетероарилом, 5-12-членным гетероциклилом, (C6-C10)арилом, где гетероарил, гетероциклил и арил каждый независимо необязательно замещен -N(R3)2, -OR3, галогеном, (C1-C6)алкилом, -(C1-C6)алкиленгетероарилом, -(C1-C6)алкилен-CN, -C(O)NR3-гетероарилом или -C(O)NR3-гетероциклилом;
каждый R5 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил из (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый R6 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый R7 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый R8 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый Y независимо является -C(R3)2 или связью;
каждый n независимо является целым числом от одного до 12;
каждый o независимо является целым числом от нуля до 30;
каждый p независимо является целым числом от нуля до 12;
каждый q независимо является целым числом от нуля до 30; и
каждый r независимо является целым числом от одного до 6.
Вариант осуществления II-2. Соединение по варианту осуществления II-1, где R32 является =O.
Вариант осуществления II-3. Соединение по варианту осуществления II-1, где R32 является -OR3.
Вариант осуществления II-4. Соединение по любому из вариантов осуществления II-1 - II-3, где A3 является -[C(R3)2]n-.
Вариант осуществления II-5. Соединение по любому из вариантов осуществления II-1 - II-3, где A3 является -(C6-C10)ариленом-.
Вариант осуществления II-6. Соединение по любому из вариантов осуществления II-1 - II-5, где R26 является -A1-L1-A2-B, где A1 и A2 отсутствуют.
Вариант осуществления II-7. Соединение по любому из вариантов осуществления II-1 - II-5, где R26 является -A1-L1-A2-B, где A2 отсутствует.
Вариант осуществления II-8. Соединение по любому из вариантов осуществления II-1 - II-5, где R26 является -A1-L1-A2-B, где A1 отсутствует.
Вариант осуществления II-9. Соединение по любому из вариантов осуществления II-1 - II-5, где R26 является -A1-L1-A2-B.
Вариант осуществления II-10. Соединение по любому из вариантов осуществления II-1 - II-5, где R26 является -A1-A2-B.
Вариант осуществления II-11. Соединение по любому из вариантов осуществления II-1 - II-5, где R26 является -L2-A1-L1-A2-L3-B.
Вариант осуществления II-12. Соединение по любому из вариантов осуществления II-1 - II-5, где R26является -OH.
Вариант осуществления II-13. Соединение по любому из вариантов осуществления II-1 - II-11, где L1 является 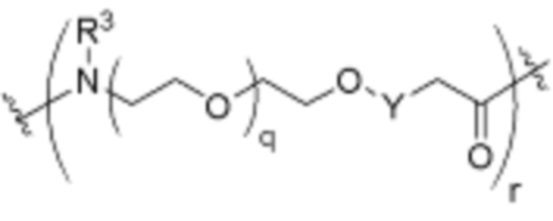 .
.
Вариант осуществления II-14. Соединение по любому из вариантов осуществления II-1 - II-11, где L1 является 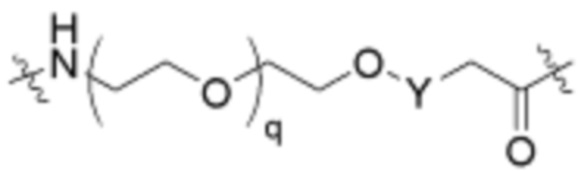 .
.
Вариант осуществления II-15. Соединение по любому из вариантов осуществления II-1 - II-11, где L1 является 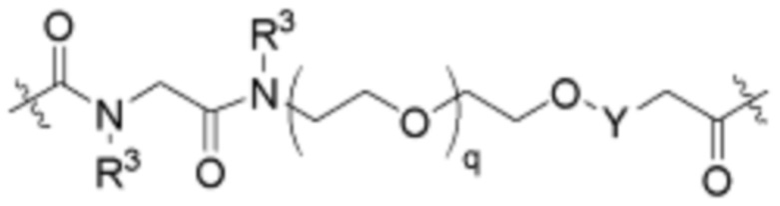 или
или 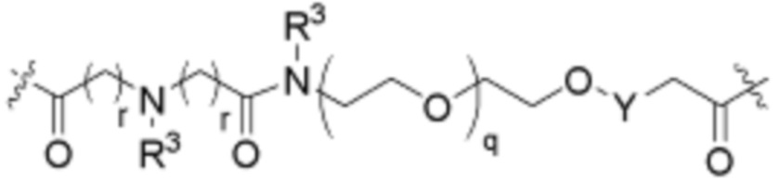 .
.
Вариант осуществления II-16. Соединение по любому из вариантов осуществления II-1 - II-11, где L1 является 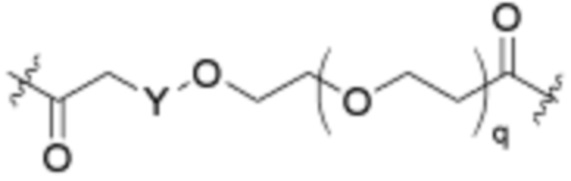 .
.
Вариант осуществления II-17. Соединение по любому из вариантов осуществления II-1 - II-11, где L1 является 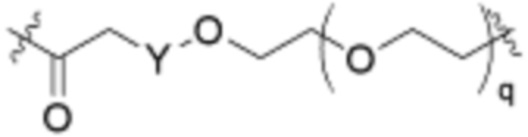 .
.
Вариант осуществления II-18. Соединение по любому из вариантов осуществления II-1 - II-11, где L1 является 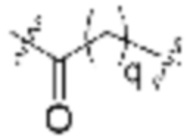 .
.
Вариант осуществления II-19. Соединение по любому из вариантов осуществления II-1 - II-11, где L1 является 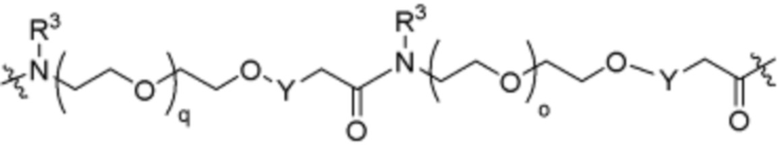 .
.
Вариант осуществления II-20. Соединение по любому из вариантов осуществления II-1 - II-11, где L1 является 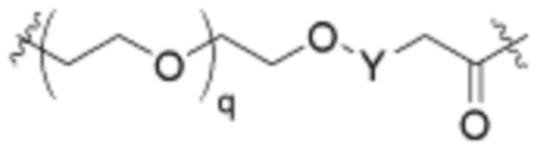 .
.
Вариант осуществления II-21. Соединение по любому из вариантов осуществления II-1 - II-11, где L1 является 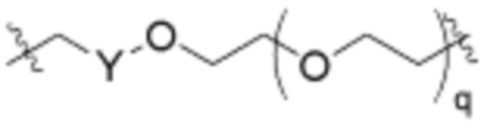 .
.
Вариант осуществления II-22. Соединение по любому из вариантов осуществления II-1 - II-11 и II-13 - II-21, где A1 отсутствует.
Вариант осуществления II-23. Соединение по любому из вариантов осуществления II-1 - II-5, II-7, II-9 - II-11 и II-13 - II-21, где A1 является 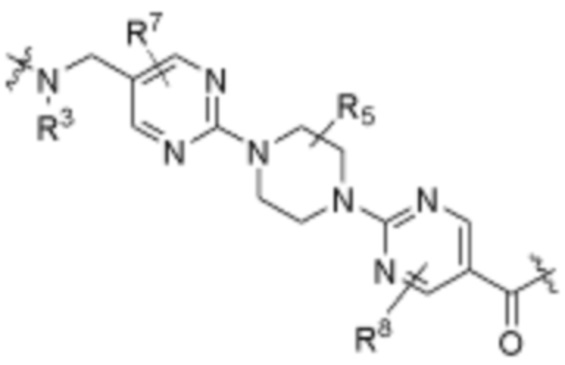 .
.
Вариант осуществления II-24. Соединение по любому из вариантов осуществления II-1 - II-5, II-7, II-9 - II-11 и II-13 - II-21, где A1 является 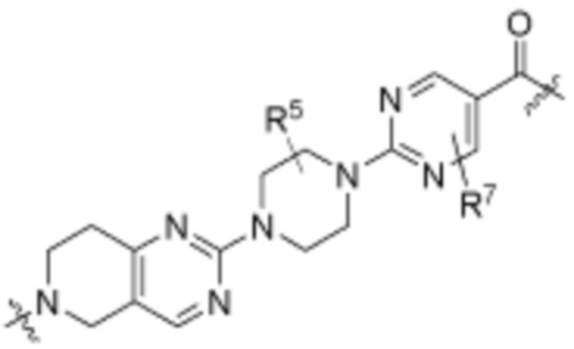
Вариант осуществления II-25. Соединение по любому из вариантов осуществления II-1 - II-5, II-7, II-9 - II-11 и II-13 - II-21, где A1 является 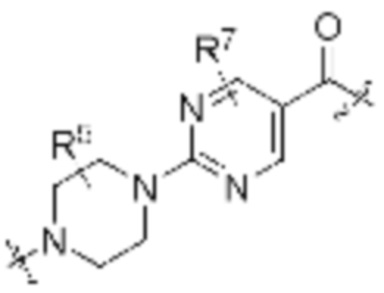 .
.
Вариант осуществления II-26. Соединение по любому из вариантов осуществления II-1 - II-5, II-7, II-9 - II-11 и II-13 - II-21, где A1 является 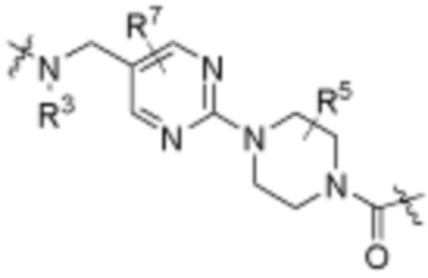 .
.
Вариант осуществления II-27. Соединение по любому из вариантов осуществления II-1 - II-5, II-7, II-9 - II-11 и II-13 - II-21, где A1 является 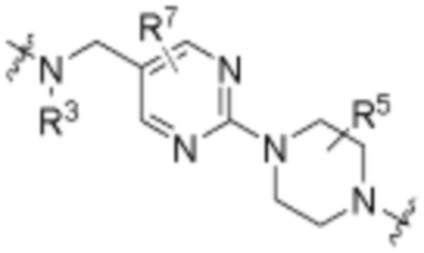 .
.
Вариант осуществления II-28. Соединение по любому из вариантов осуществления II-1 - II-5, II-7, II-9 - II-11 и II-13 - II-21, где A1 является 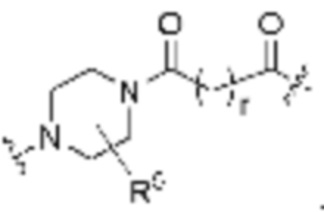 .
.
Вариант осуществления II-29. Соединение по любому из вариантов осуществления II-1 - II-5, II-7, II-9 - II-11 и II-13 - II-21, где A1 является 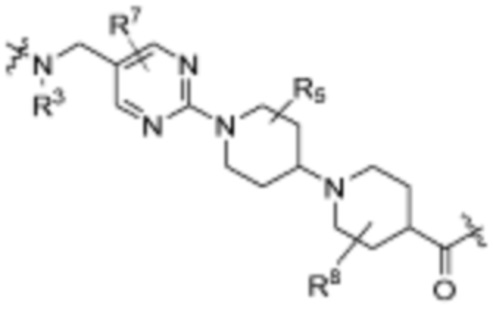 .
.
Вариант осуществления II-30. Соединение по любому из вариантов осуществления II-1 - II-11 и II-13 - II-29, где A2 отсутствует.
Вариант осуществления II-31. Соединение по любому из вариантов осуществления II-1 - II-5, II-8 - II-11 и II-13 - II-29, где A2 является 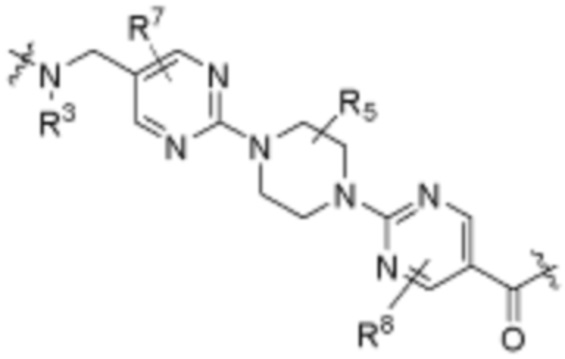 .
.
Вариант осуществления II-32. Соединение по любому из вариантов осуществления II-1 - II-5, II-8 - II-11 и II-13 - II-29, где A2 является 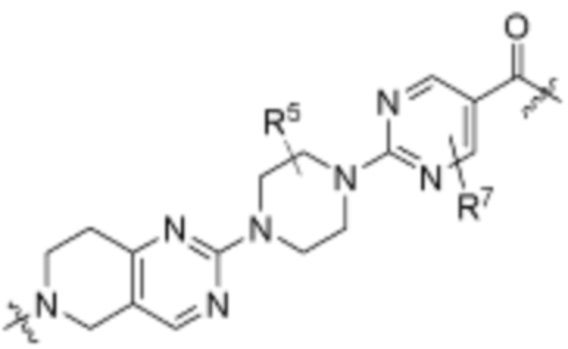 .
.
Вариант осуществления II-33. Соединение по любому из вариантов осуществления II-1 - II-5, II-8 - II-11 и II-13 - II-29, где A2 является 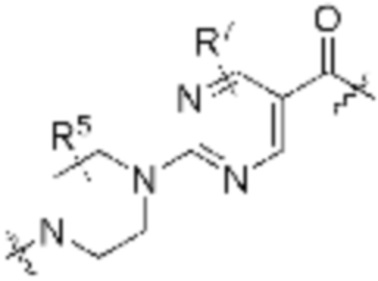 .
.
Вариант осуществления II-34. Соединение по любому из вариантов осуществления II-1 - II-5, II-8 - II-11 и II-13 - II-29, где A2 является 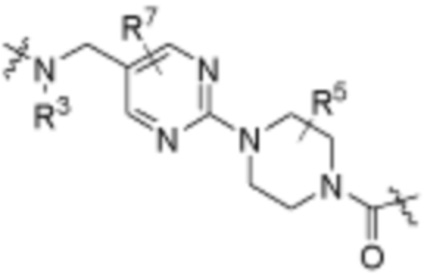 .
.
Вариант осуществления II-35. Соединение по любому из вариантов осуществления II-1 - II-5, II-8 - II-11 и II-13 - II-29, где A2 является 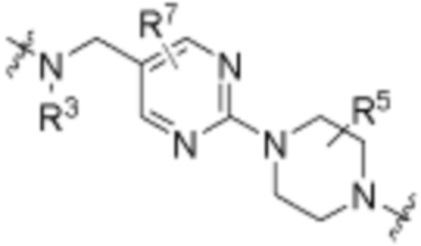 .
.
Вариант осуществления II-36. Соединение по любому из вариантов осуществления II-1 - II-5, II-8 - II-11 и II-13 - II-29, где A2 является 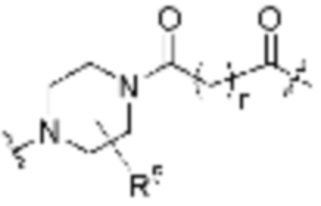 .
.
Вариант осуществления II-37. Соединение по любому из вариантов осуществления II-1 - II-5, II-8 - II-11 и II-13 - II-29, где A2 является 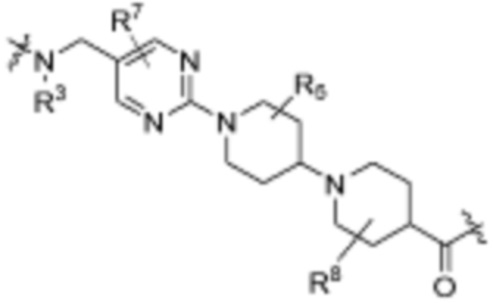 .
.
Вариант осуществления II-38. Соединение по любому из вариантов осуществления II-1 - II-11 и II-13 - II-37, где B является 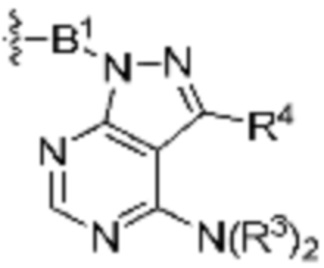 .
.
Вариант осуществления II-39. Соединение по любому из вариантов осуществления II-1 - II-11 и II-13 - II-37, где B является 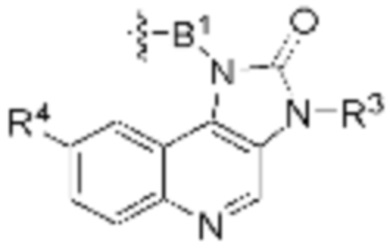 .
.
Вариант осуществления II-40. Соединение по любому из вариантов осуществления II-1 - II-11 и II-13 - II-39, где B1 является  NR3-(C(R3)2)n-.
NR3-(C(R3)2)n-.
Вариант осуществления II-41. Соединение по любому из вариантов осуществления II-1 - II-11 и II-13 - II-39, где B1 является  .
.
Вариант осуществления II-42. Соединение по любому из вариантов осуществления II-1 - II-11 и II-13 - II-41, где R4 является 5-12-членным гетероарилом, необязательно замещенным-N(R3)2, -OR3, галогеном, (C1-C6)алкилом, -(C1-C6)алкиленгетероарилом, -(C1-C6)алкилен-CN или -C(O)NR3-гетероарилом.
Вариант осуществления II-43. Соединение по любому из вариантов осуществления II-1 - II-42 или его фармацевтически приемлемая соль или тау-мер, где соединение имеет следующую формулу:
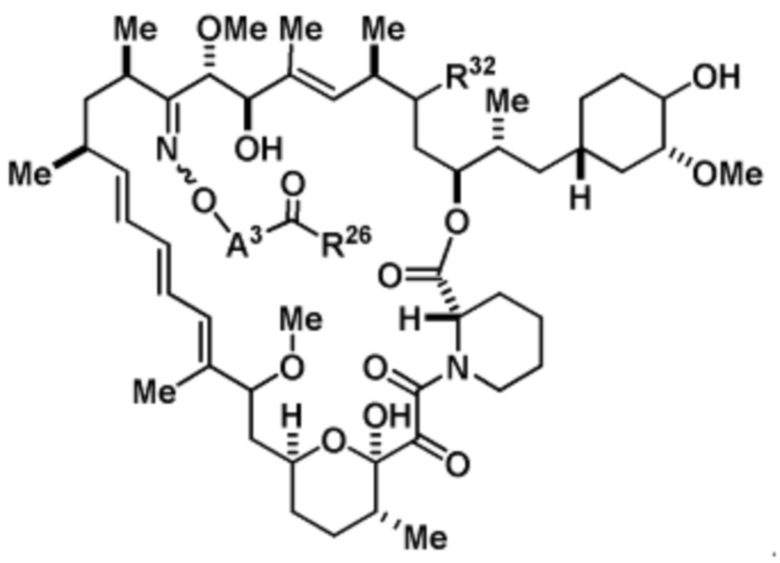
Вариант осуществления II-44. Соединение, выбранное из группы, состоящей из:

Пример 1
Пример 2
Пример 3
Пример 4
Пример 5
Пример 6
Пример 7
Пример 8
Пример 9
Пример 10
Пример 11
Пример 12
Пример 13
Пример 14
Пример 15
Пример 16
Пример 17
Пример 18
Пример 19
Пример 20
Пример 21
Пример 22
Пример 23
Пример 24
Пример 25
Пример 26
Пример 27
Пример 28
Пример 29
Пример 30
Пример 31
Пример 32
Пример 33
Пример 34
Пример 35
Пример 36
Пример 37
Пример 38
Пример 39
Пример 40
Пример 41
Пример 42
Пример 43
Пример 44
или его фармацевтически приемлемая соль или таутомер.
Вариант осуществления II-45. Соединение, выбранное из группы, состоящей из:

Пример 45
Пример 46
Пример 47
Пример 48
Пример 49
Пример 50
Пример 51
Пример 52
Пример 53
Пример 54
Пример 55
Пример 56
Пример 57
Пример 58
Пример 59
Пример 60
Пример 61
Пример 62
Пример 63
Пример 64
Пример 65
Пример 66
или его фармацевтически приемлемая соль или таутомер.
Вариант осуществления II-46. Соединение, выбранное из группы, состоящей из:

Пример 67
Пример 68
Пример 69
Пример 70
или его фармацевтически приемлемая соль или таутомер.
Вариант осуществления II-47. Фармацевтическая композиция, содержащая соединение по любому из вариантов осуществления II-1 - II-46 или его фармацевтически приемлемую соль и, по меньшей мере, один из фармацевтически приемлемого носителя, разбавителя или эксципиента.
Вариант осуществления II-48. Способ лечения заболевания или расстройства, медиированного mTOR, включающий введение субъекту, страдающему от или подверженному риску развития заболевания или расстройства, медиированного mTOR терапевтически эффективного количества одного или более соединений по любому из вариантов осуществления II-1 - II-46 или его фармацевтически приемлемой соли.
Вариант осуществления II-49. Способ профилактики заболевания или расстройства, медиированного mTOR, включающий введение субъекту, страдающему от или подверженному риску развития заболевания или расстройства, медиированного mTOR, терапевтически эффективного количества одного или более соединений по любому из вариантов осуществления II-1 - II-46 или его фармацевтически приемлемой соли.
Вариант осуществления II-50. Способ снижения риска заболевания или расстройства, медиированного mTOR, включающий введение субъекту, страдающему от или подверженному риску развития заболевания или расстройства, медиированного mTOR, терапевтически эффективного количества одного или более соединений по любому из вариантов осуществления II-1 - II-46 или его фармацевтически приемлемой соли.
Вариант осуществления II-51. Способ по любому из вариантов осуществления II-47 - II-49, где заболеванием является рак или иммуноопосредованное заболевание.
Вариант осуществления II-52. Способ по варианту осуществления II-51, где рак выбирают из опухолей головного мозга и сосудисто-нервной системы, рака головы и шеи, рака груди, рака легких, мезотелиомы, лимфоидного рака, рака желудка, рака почки, карциномы почек, рака печени, рака яичников, эндометриоза яичников, рака яичек, рака желудочно-кишечного тракта, рака простаты, глиобластомы, рака кожи, меланомы, нервного рака, рака селезенки, рака поджелудочной железы, нарушений пролиферации крови, лимфомы, лейкоза, рака эндометрия, рака шейки матки, рака вульвы, рака простаты, рака полового члена, рака костей, рака мышц, рака мягких тканей, рака кишечника или прямой кишки, рака анального канала, рака мочевого пузыря, рака желчных протоков, рака глаза, стромальных опухолей желудочно-кишечного тракта и нейроэндокринных опухолей.
Вариант осуществления II-53. Способ по варианту осуществления II-51, где иммуноопосредованное заболевание выбирают из резистентности при трансплантации сердца, почек, печени, костного мозга, кожи, роговицы, легкого, поджелудочной железы, тонкого кишечника, конечностей, мышц, нервов, двенадцатиперстной кишки, тонкой кишки или островковых клеток поджелудочной железы; болезней «трансплантат против хозяина», вызванных трансплантацией костного мозга; ревматоидного артрита, системной красной волчанки, тиреоидита Хашимото, рассеянного склероза, миастении гравис, диабета I типа, увеита, аллергического энцефаломиелита и гломерулонефрита.
Вариант осуществления II-54. Способ лечения рака, включающий введение субъекту терапевтически эффективного количества одного или более соединений по любому из вариантов осуществления II-1 - II-46 или его фармацевтически приемлемой соли.
Вариант осуществления II-55. Способ по варианту осуществления II-54, где рак выбирают из опухолей головного мозга и сосудисто-нервной системы, рака головы и шеи, рака груди, рака легких, мезотелиомы, лимфоидного рака, рака желудка, рака почки, карциномы почек, рака печени, рака яичников, эндометриоза яичников, рака яичек, рака желудочно-кишечного тракта, рака простаты, глиобластомы, рака кожи, меланомы, нервного рака, рака селезенки, рака поджелудочной железы, нарушений пролиферации крови, лимфомы, лейкоза, рака эндометрия, рака шейки матки, рака вульвы, рака простаты, рака полового члена, рака костей, рака мышц, рака мягких тканей, рака кишечника или прямой кишки, рака анального канала, рака мочевого пузыря, рака желчных протоков, рака глаза, стромальных опухолей желудочно-кишечного тракта и нейроэндокринных опухолей.
Вариант осуществления II-56. Способ лечения иммуноопосредованного заболевания, включающий введение субъекту терапевтически эффективного количества одного или более соединений по любому из вариантов осуществления II-1 - II-46 или его фармацевтически приемлемой соли.
Вариант осуществления II-57. Способ по варианту осуществления II-56, где иммуноопосредованное заболевание выбирают из резистентности при трансплантации сердца, почек, печени, костного мозга, кожи, роговицы, легкого, поджелудочной железы, тонкого кишечника, конечностей, мышц, нервов, двенадцатиперстной кишки, тонкой кишки или островковых клеток поджелудочной железы; болезней «трансплантат против хозяина», вызванных трансплантацией костного мозга; ревматоидного артрита, системной красной волчанки, тиреоидита Хашимото, рассеянного склероза, миастении гравис, диабета I типа, увеита, аллергического энцефаломиелита и гломерулонефрита.
Вариант осуществления II-58. Способ лечения возрастного состояния, включающий введение субъекту терапевтически эффективного количества одного или более соединений по любому из вариантов осуществления II-1 - II-46 или его фармацевтически приемлемой соли.
Вариант осуществления II-59. Способ по варианту осуществления II-58, где возрастное состояние выбирают из саркопении, атрофии кожи, мышечной атрофии, атрофии головного мозга, атеросклероза, артериосклероза, эмфиземы легких, остеопороза, остеоартрита, высокого кровяного давления, эректильной дисфункции, деменции, болезни Хантингтона, болезни Альцгеймера, катаракты, возрастной дегенерации желтого пятна, рака простаты, инсульта, сокращения продолжительности жизни, нарушения функции почек и возрастной потери слуха, инвалидности, связанной со старением (например, слабости), снижения когнитивных функций, возрастной деменции, нарушения памяти, жесткости сухожилий, сердечной дисфункции, такой как гипертрофия сердца и систолическая и диастолическая дисфункция, иммунного старения, рака, ожирения и диабета.
Вариант осуществления II-60. Соединение по любому из вариантов осуществления II-1 - II-46 или его фармацевтически приемлемая соль, для применения в лечении, профилактике или снижении риска заболевания или состояния, медиированного mTOR.
Вариант осуществления II-61. Применение соединения по любому из вариантов осуществления II-1 - II-46 или его фармацевтически приемлемой соли в производстве лекарственного средства для лечения, профилактики или снижения риска заболевания или расстройства, медиированного mTOR.
Вариант осуществления II-62. Соединение по любому из вариантов осуществления II-1 - II-46 или его фармацевтически приемлемая соль для применения в лечении рака.
Вариант осуществления II-63. Применение соединения по любому из вариантов осуществления II-1 - II-46 или его фармацевтически приемлемой соли в производстве лекарственного средства для лечения рака.
Вариант осуществления II-64. Соединение по любому из вариантов осуществления II-1 - II-46 или его фармацевтически приемлемая соль для применения в лечении иммуноопосредованного заболевания.
Вариант осуществления II-65. Применение соединения по любому из вариантов осуществления II-1 - II-46 или его фармацевтически приемлемой соли в производстве лекарственного средства для лечения иммуноопосредованного заболевания.
Вариант осуществления II-66. Соединение по любому из вариантов осуществления II-1 - II-46 или его фармацевтически приемлемая соль для применения в лечении возрастного состояния.
Вариант осуществления II-67. Применение соединения по любому из вариантов осуществления II-1 - II-46 или его фармацевтически приемлемой соли в производстве лекарственного средства для лечения возрастного состояния.
Примеры
Раскрытие дополнительно проиллюстрировано следующими примерами и примерами синтеза, которые не должны толковаться как ограничивающие это раскрытие по объему или сути конкретными описанными здесь методиками. Следует понимать, что в представленных примерах проиллюстрированы определенные варианты осуществления, и что они не предполагают ограничение объема раскрытия. Кроме того, следует понимать, что можно прибегнуть к различным другим вариантам осуществления, модификациям и их эквивалентам, которые могут быть предложены специалистами в данной области без отступления от сути данного раскрытия и/или объема прилагаемой формулы изобретения.
Определения, используемые в следующих примерах и в других местах настоящего документа:
ДМА
Диметилацетамид
Ряд 1 бифункциональных рапалогов
Общая структура Ряда 1 бифункциональных рапалогов показана на схеме 1 ниже. Схема 1. Для этих типов бифункциональных рапалогов, линкер может включать варианты, где q=0-30, например, q=1-7 и r=1-6. Линкерный амин может включать замещения, такие как R=H и C1-C6 алкильные группы. Амидная группа может быть присоединена к рапалогу на R26 (формула I) через фрагмент оксимной связи, включая варианты, найденные в таблице 1 в разделе примеров. Ингибитор mTOR активного сайта может присоединяться к линкеру через первичный или вторичный амин, и может включать варианты, найденные в таблице 2 в разделе примеров.
Схема 1. Ряд 1 бифункциональных рапалогов.

Ряд 2 бифункциональных рапалогов
Общая структура Ряда 2 бифункциональных рапалогов показана на схеме 2 ниже. Для этих типов бифункциональных рапалогов, линкер может включать варианты, где q=0-30, например, q=1-7. Линкерный амин может включать замещения, такие как R=H и C1-C6 алкильные группы. Пре-линкерный амин может включать замещения, такие как R2=H, C1-C6 алкильные группы и циклоалкил, включая 4-8-членные кольца. Амидная группа может быть присоединена к рапалогу на R26 (формула I) через фрагмент оксимной связи, включая варианты, найденные в таблице 1 в разделе примеров. Ингибитор mTOR активного сайта может присоединяться к линкеру через первичный или вторичный амин и может включать варианты, найденные в таблице 2 в разделе примеров.
Схема 2. Ряд 2 бифункциональных рапалогов.

Ряд 3 бифункциональных рапалогов
Общая структура Ряда 3 бифункциональных рапалогов показана на схеме 3 ниже. Для этих типов бифункциональных рапалогов, линкер может включать варианты, где q=0-30, например, q=1-7. Линкерный амин может включать замещения, такие как R=H и C1-C6 алкильные группы. Пост-линкерный амин может включать замещения, такие как R2=H, C1-C6 алкильные группы и циклоалкил, включая 4-8-членные кольца. Амидная группа может быть присоединена к рапалогу на R26 (формулы I) через фрагмент оксимной связи, включая варианты, найденные в таблице 1 в разделе примеров. Ингибитор mTOR активного сайта может присоединяться к линкеру через первичный или вторичный амин и может включать варианты, найденные в таблице 2 в разделе примеров.
Схема 3. Ряд 3 бифункциональных рапалогов

Ряд 4 бифункциональные рапалоги
Общая структура Ряда 4 бифункциональных рапалогов показана на схеме 4 ниже. Для этих типов бифункциональных рапалогов, линкер может включать варианты, где q=0-30, например, q=1-7. Линкерный амин может включать замещения, такие как R=H и C1-C6 алкильные группы. Каждый из пре- и пост-линкерных аминов может содержать замещения, такие как R2=H, C1-C6 алкильные группы и циклоалкил, включая 4-8-членные кольца. Амидная группа может быть присоединена к рапалогу на R26 (формула I) через фрагмент оксимной связи, включая варианты, найденные в таблице 1 в разделе примеров. Ингибитор mTOR активного сайта может присоединяться к линкеру через первичный или вторичный амин и может включать варианты, найденные в таблице 2 в разделе примеров.
Схема 4. Ряд 4 бифункциональные рапалоги

Ряд 5 бифункциональные рапалоги
Общая структура Ряда 5 бифункциональных рапалогов показана на схеме 5 ниже. Для этих типов бифункциональных рапалогов, пре-линкерный амин может включать замещения, такие как R2=H, C1-C6 алкильные группы и циклоалкил, включая 4-8-членные кольца. Амидная группа может быть присоединена к рапалогу на R26 (формула I) через фрагмент оксимной связи, включая варианты, найденные в таблице 1 в разделе примеров. Ингибитор mTOR активного сайта может присоединяться к линкеру через первичный или вторичный амин и может включать варианты, найденные в таблице 2 в разделе примеров.
Схема 5. Ряд 5 бифункциональные рапалоги

Ряд 6 бифункциональных рапалогов
Общая структура Ряда 6 бифункциональных рапалогов показана на схеме 6 ниже. Для этих типов бифункциональных рапалогов, линкер может включать варианты, где q=0-30, например, q=1-7. Линкерные амины могут включать замещения, такие как R=H и C1-C6 алкильные группы. Пост-линкерный амин может включать замещения, такие как R2=H, C1-C6 алкильные группы и циклоалкил, включая 4-8-членные кольца. Амидная группа может быть присоединена к рапалогу на R26 (формула I) через франгмент оксимной связи, включая варианты, найденные в таблице 1 в разделе примеров. Ингибитор mTOR активного сайта может присоединяться к линкеру через первичный или вторичный амин и может включать варианты, найденные в таблице 2 в разделе примеров.
Схема 6. Ряд 6 бифункциональные рапалоги.

Ряд 7 бифункциональных рапалогов
Общая структура Ряда 7 бифункциональных рапалогов показана на схеме 7 ниже. Для этих типов бифункциональных рапалогов, линкер может включать варианты, где q=0-30, например, q=1-7. Линкерный амин может включать замещения, такие как R=H и C1-C6 алкильные группы. Каждый из пре- и пост-линкерных аминов включает замещения, такие как R2=H, C1-C6 алкильные группы и циклоалкил, включая 4-8-членные кольца. Амидная группа может быть присоединена к рапалогу на R26 (формула I) через фрагмент оксимной связи, включая варианты, найденные в таблице 1 в разделе примеров. Ингибитор mTOR активного сайта может присоединяться к линкеру через первичный или вторичный амин и может включать варианты, найденные в таблице 2 в разделе примеров.
Схема 7. Ряд 7 бифункциональные рапалоги

Ряд 8 бифункциональных рапалогов
Общая структура Ряда 8 бифункциональных рапалогов показана на схеме 8ниже. Для этих типов бифункциональных рапалогов, линкер может включать варианты, где q=0-10, например, q=1-7. Линкерный амин может включать замещения, такие как R=H и C1-C6 алкильные группы. Пост-линкерный амин может включать замещения, такие как R2=H, C1-C6 алкильные группы и циклоалкил, включая 4-8-членные кольца. Амидная группа может быть присоединена к рапалогу на R26 (формула I) через фрагмент оксимной связи, включая варианты, найденные в таблице 1 в разделе примеров. Ингибитор mTOR активного сайта может присоединяться к линкеру через первичный или вторичный амин и может включать варианты, найденные в таблице 2 в разделе примеров.
Схема 8. Ряд 8 бифункциональные рапалоги

Таблица 1. Карбонат- и тиокарбонатсодержащие мономеры рапалога.
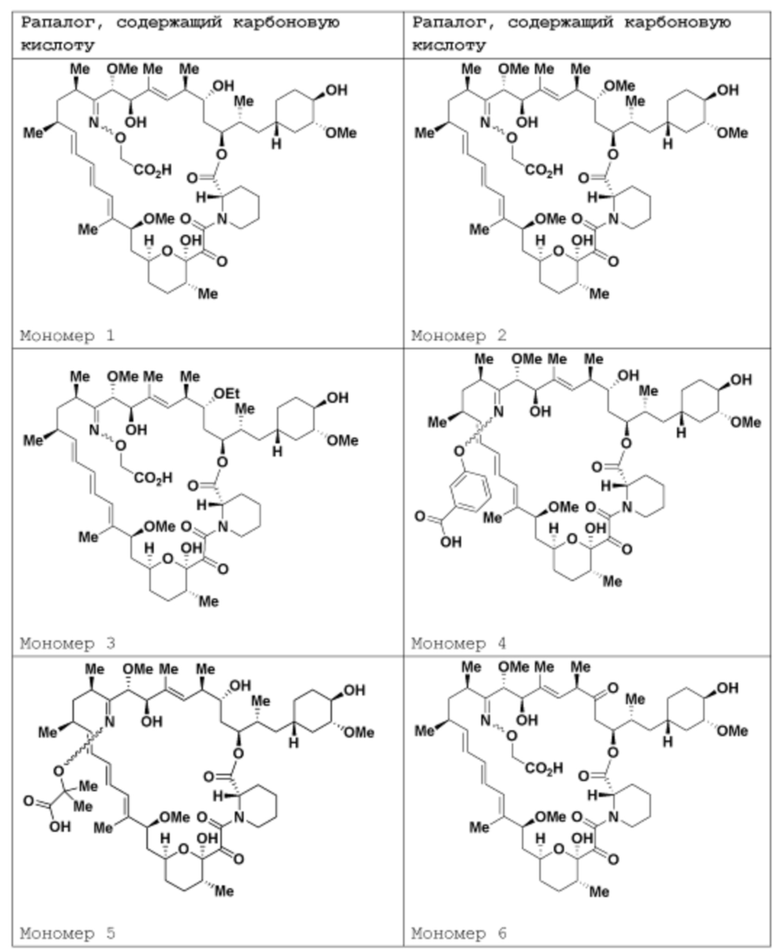
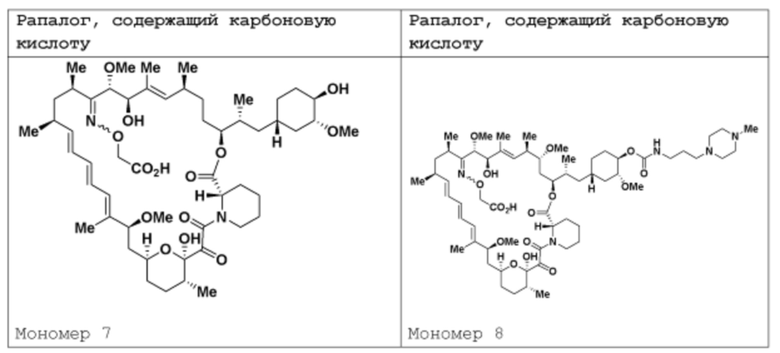
Таблица 2. Мономеры ингибитора активного сайта.
Мономер A
Мономер B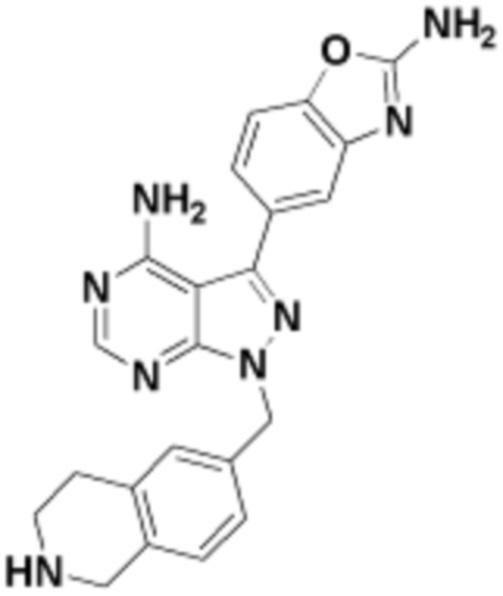
Мономер C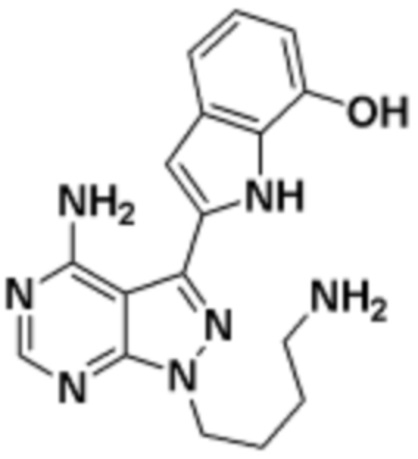
Мономер D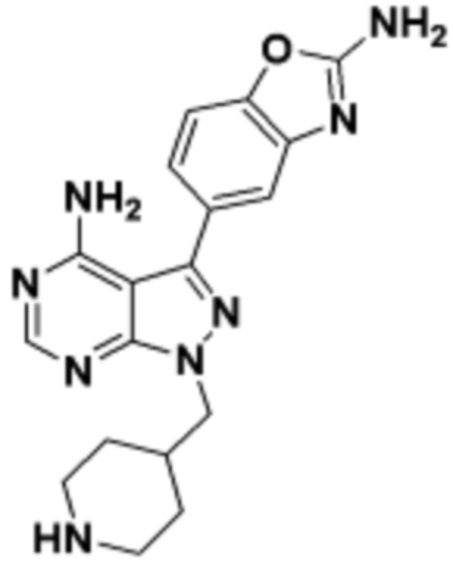
Мономер E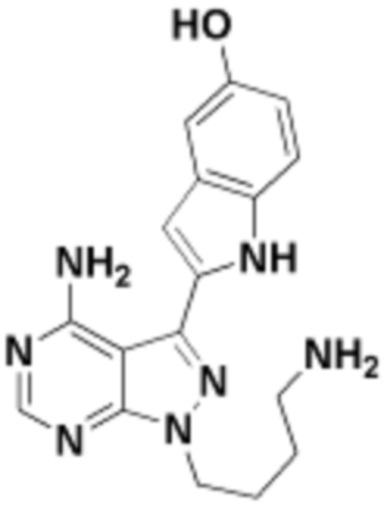
Мономер F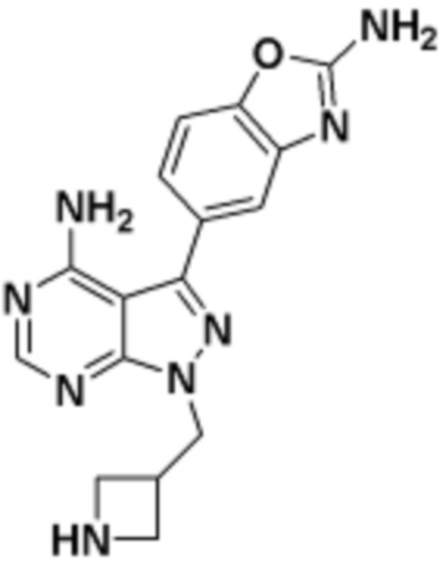
Мономер G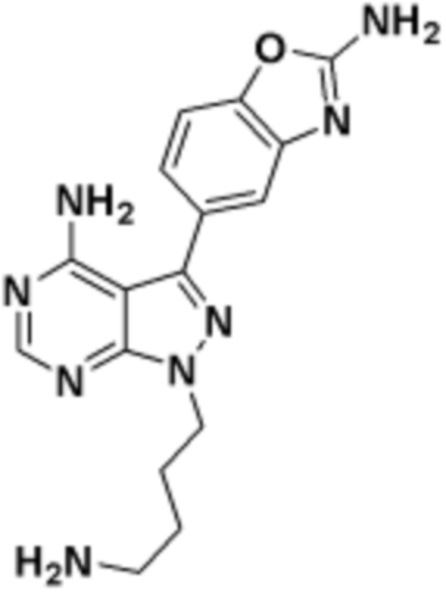
Мономер H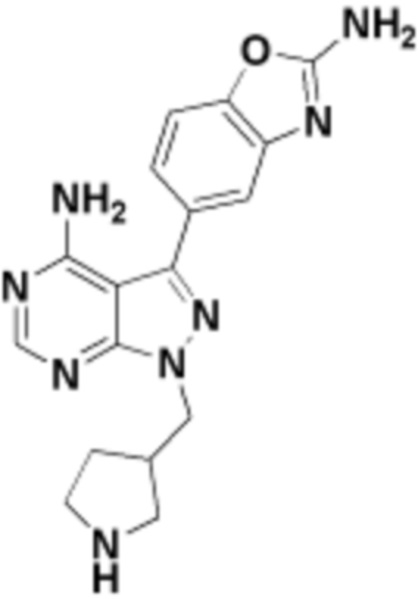
Мономер I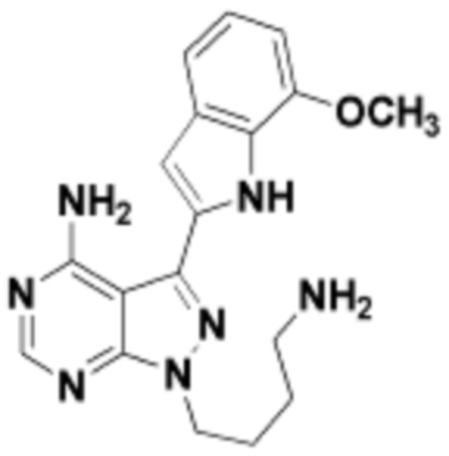
Мономер J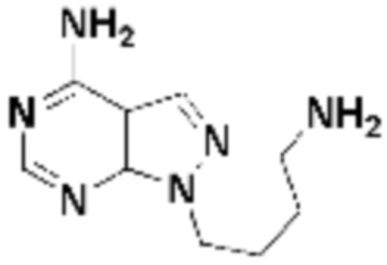
Мономер K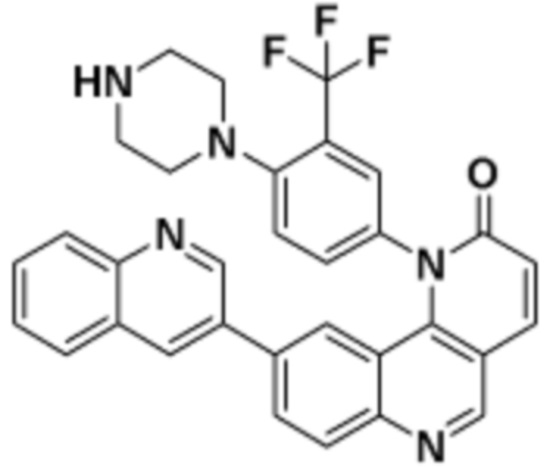
Мономер L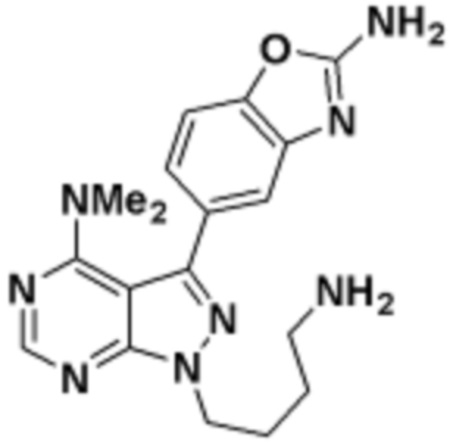
Мономер M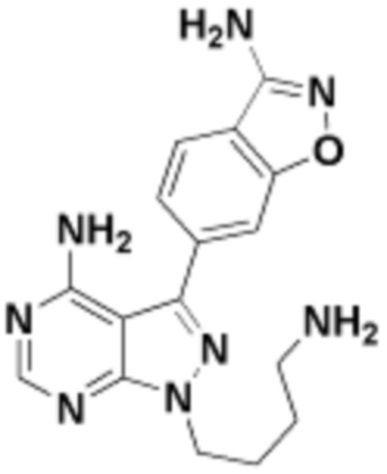
Мономер N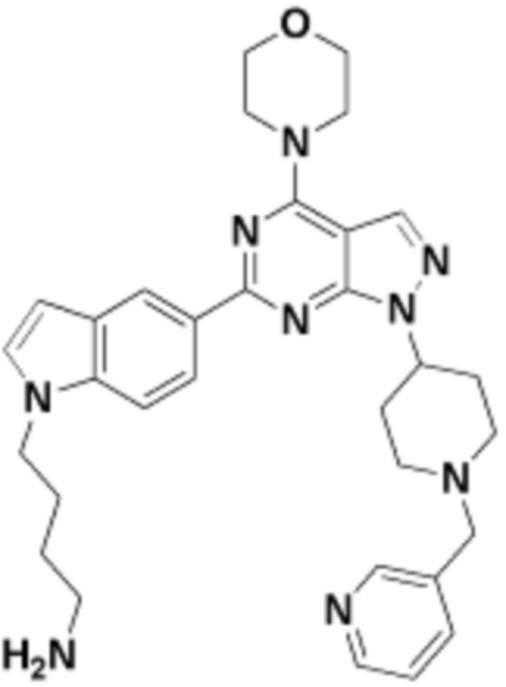
Мономер O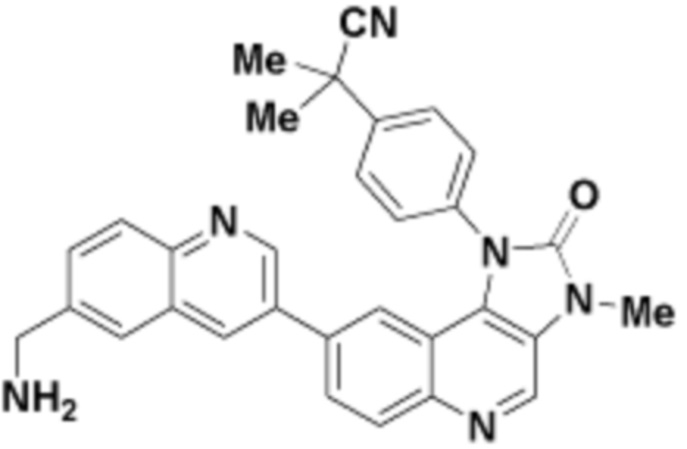
Мономер P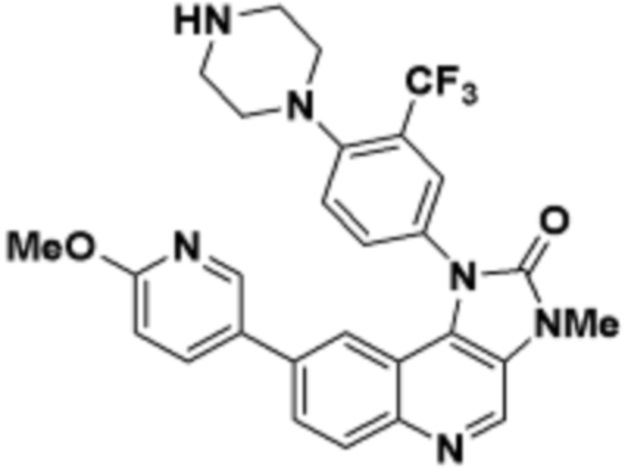
Мономер Q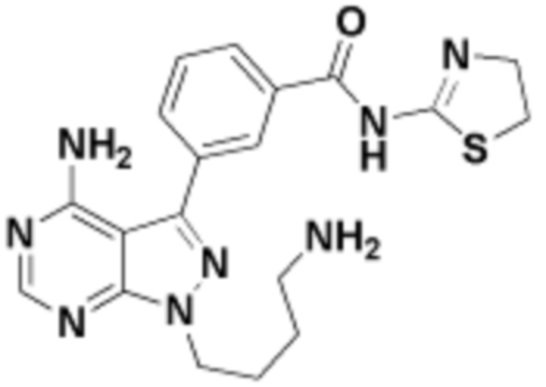
Мономер R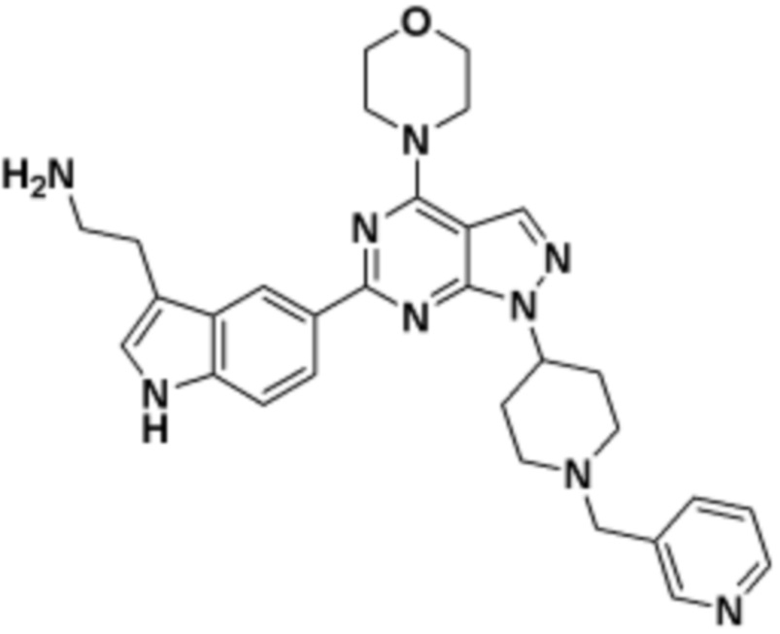
Мономер S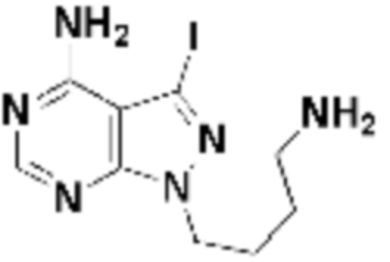
Мономер T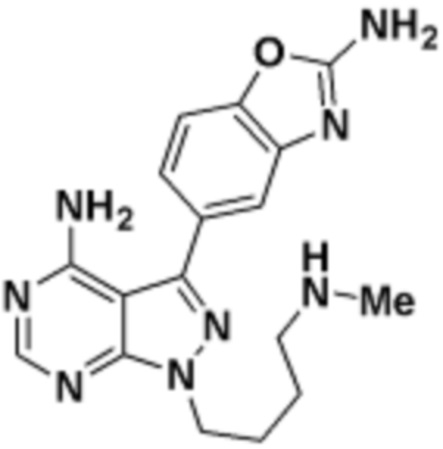
Мономер U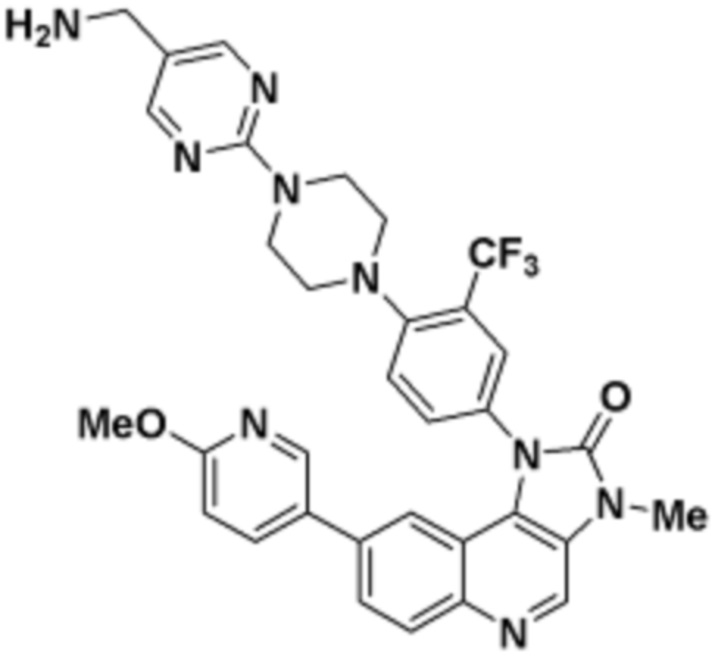
Мономер V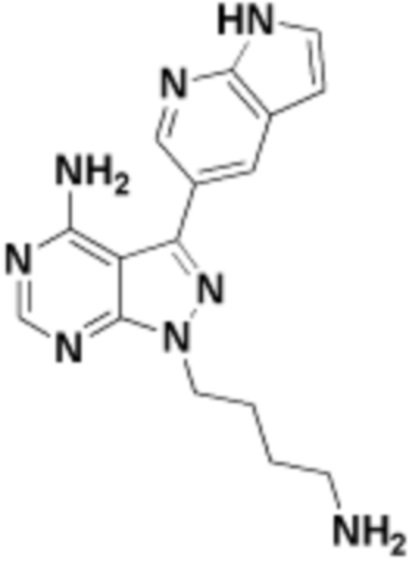
Мономер W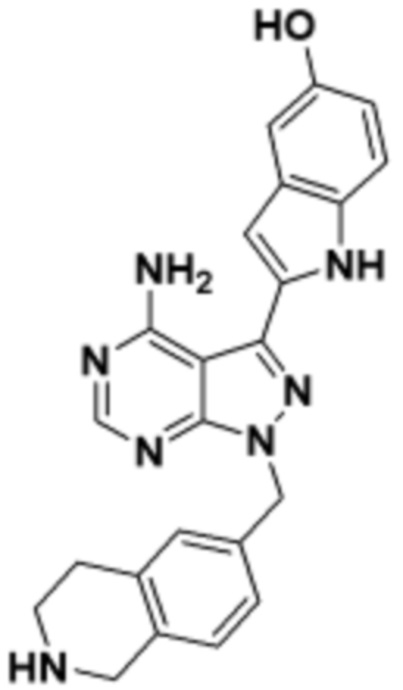
Мономер X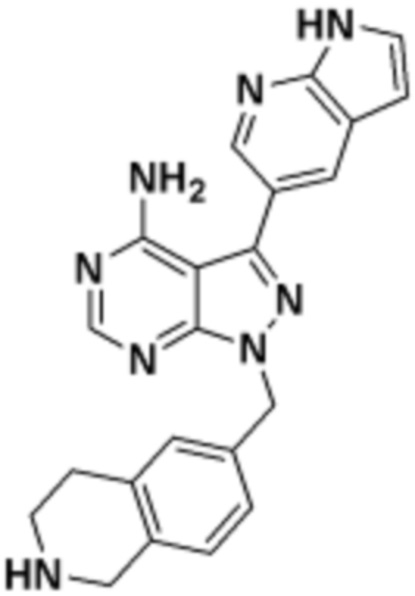
Мономер Y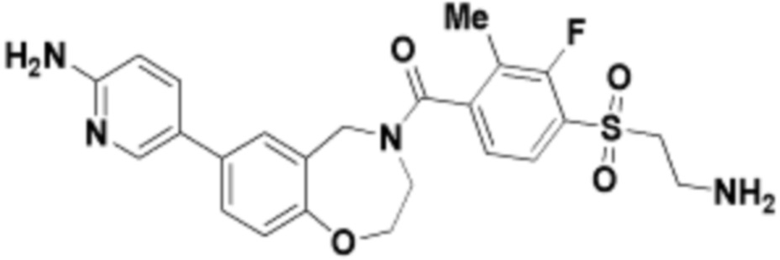
Мономер Z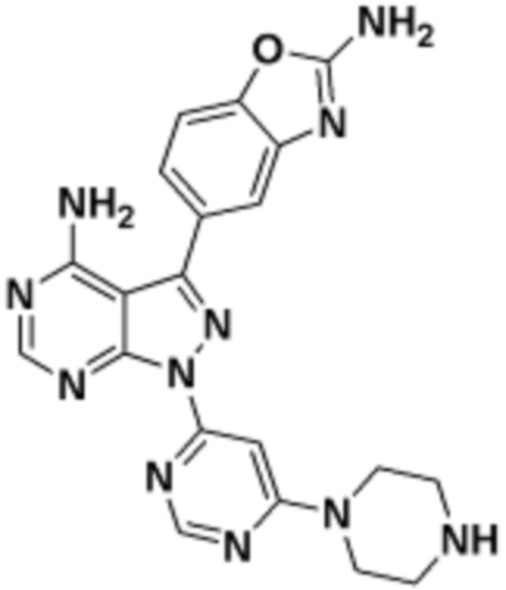
Мономер AA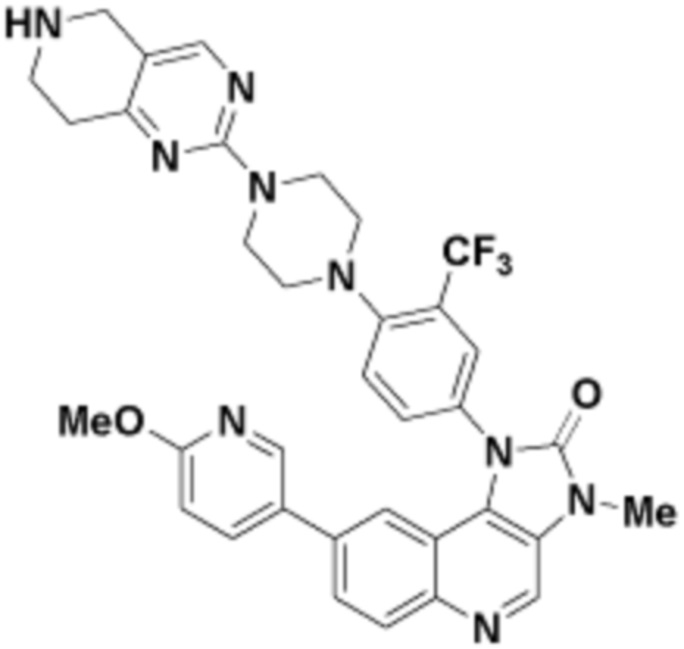
Мономер AB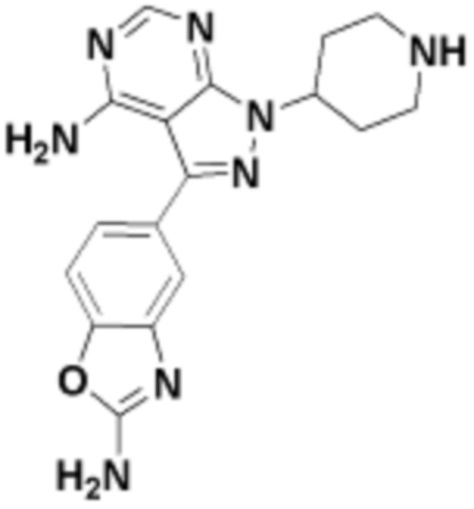
Мономер AC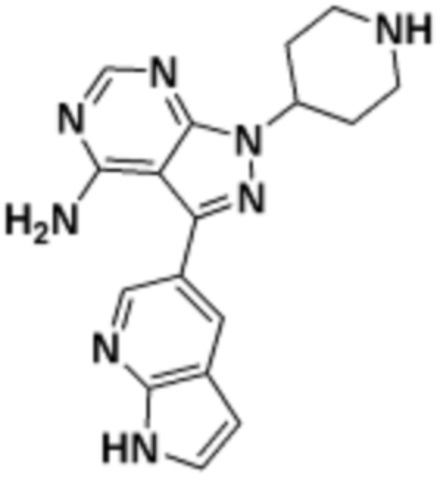
Мономер AD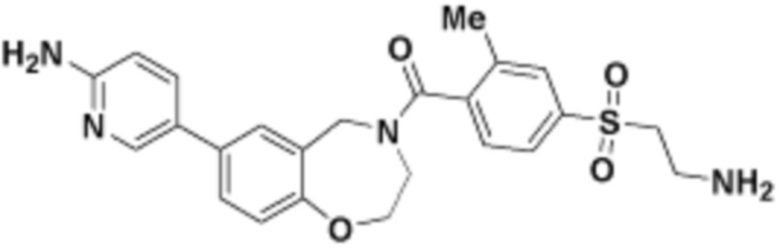
Мономер AE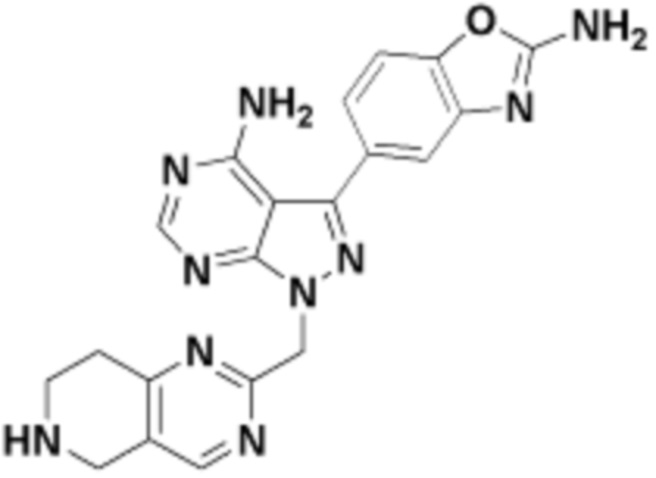
Мономер AF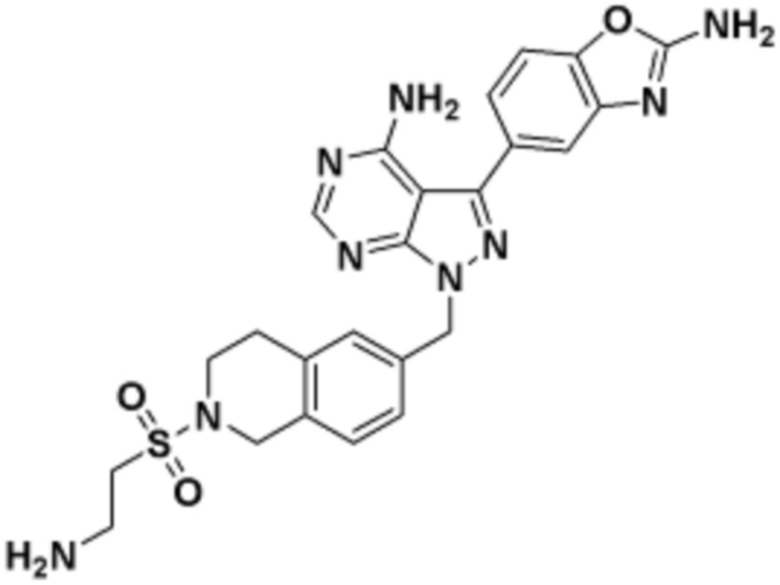
Мономер AG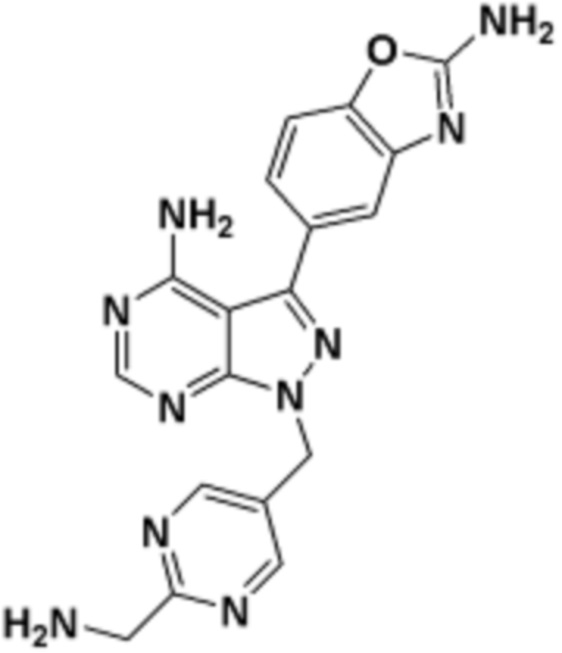
Мономер AH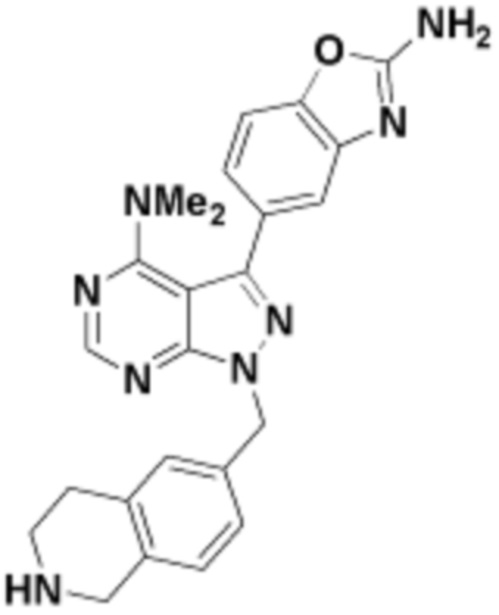
Мономер AI
Таблица 3.Мономеры ингибитора активного сайта
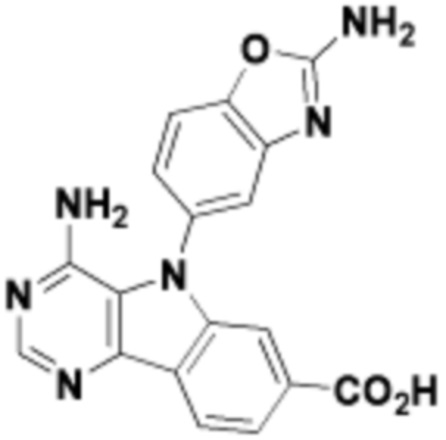
Мономер AJ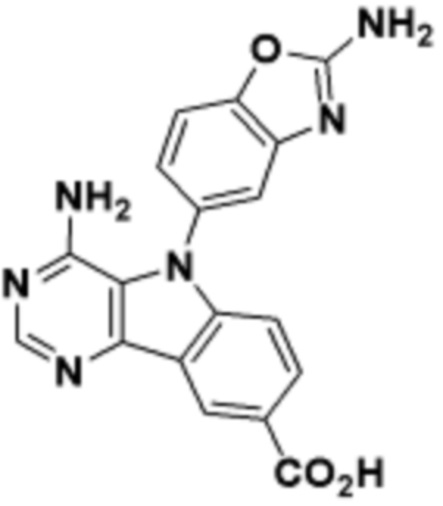
Мономер AK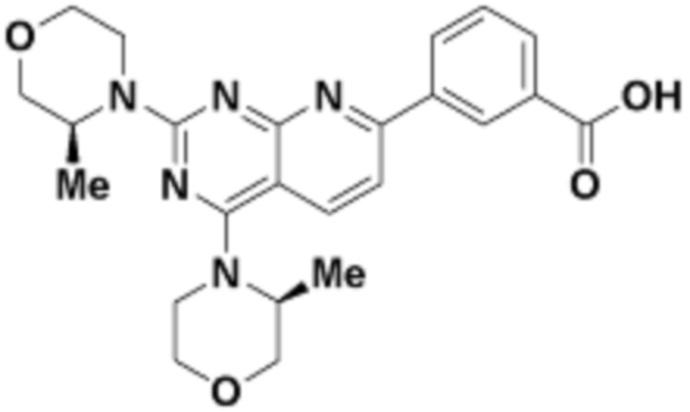
Мономер AL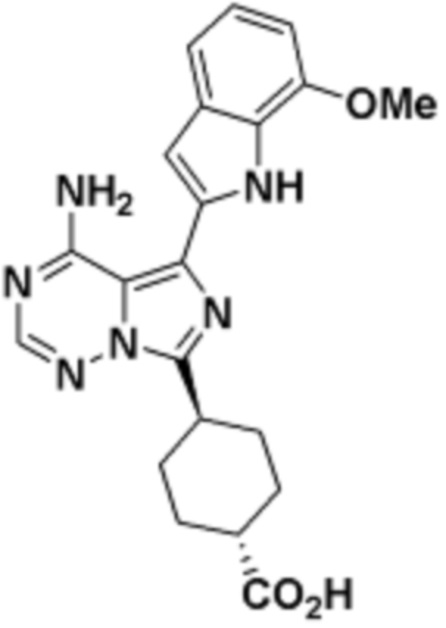
Мономер AM
Мономер AN
Мономер AO
Таблица 4. Аминсодержащие пре- и постлинкеры
Строительный блок A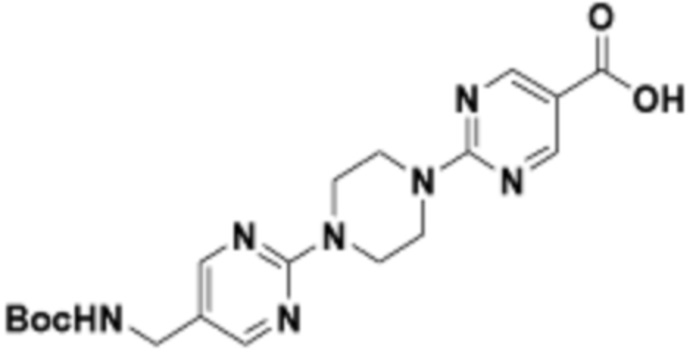
Строительный блок B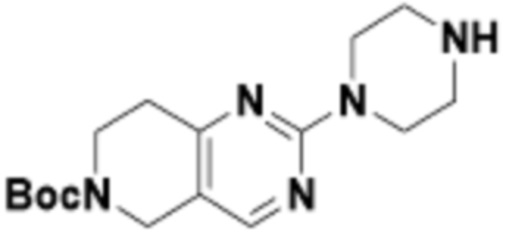
Строительный блок C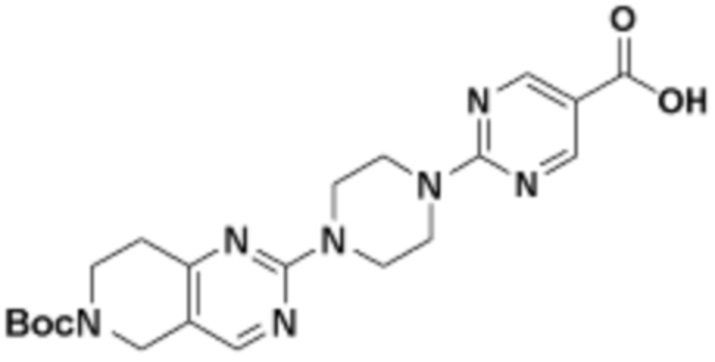
Строительный блок D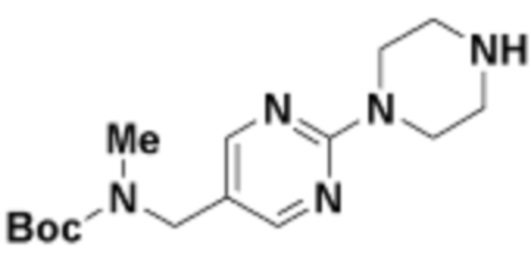
Строительный блок E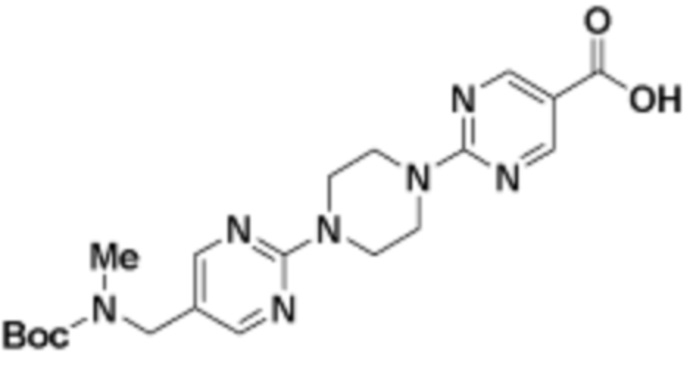
Строительный блок F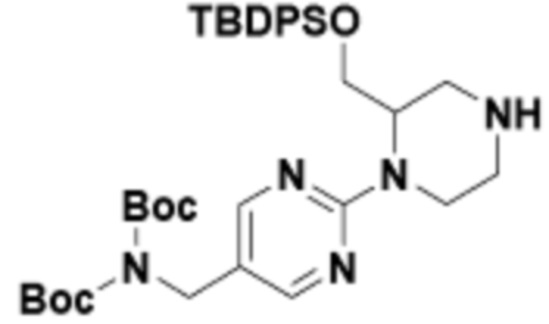
Строительный блок G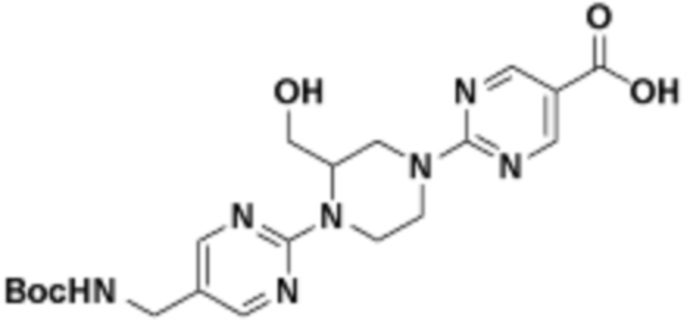
Строительный блок H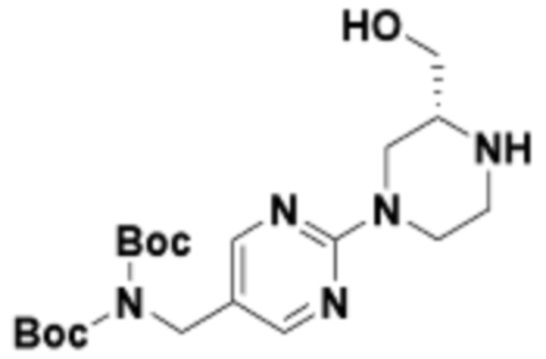
Строительный блок I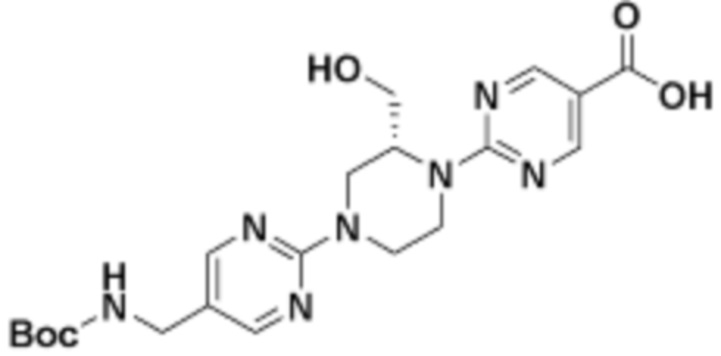
Строительный блок J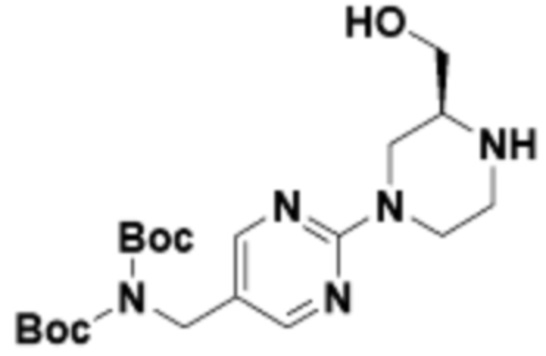
Строительный блок K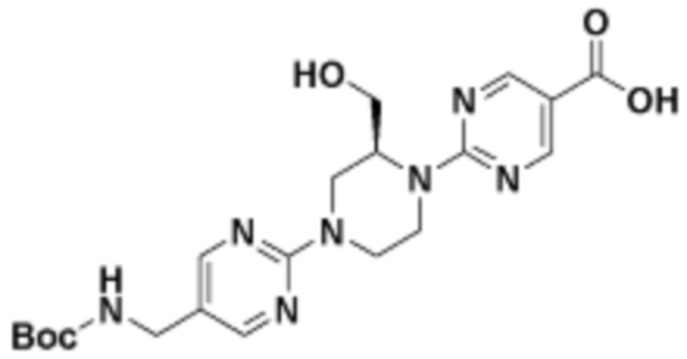
Строительный блок L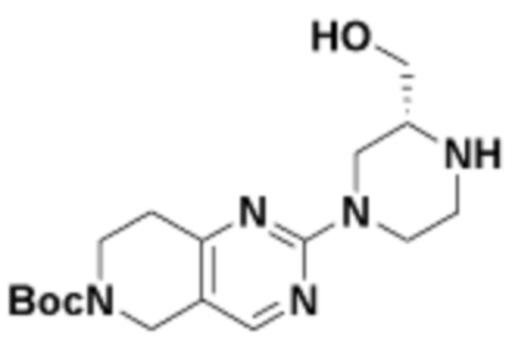
Строительный блок M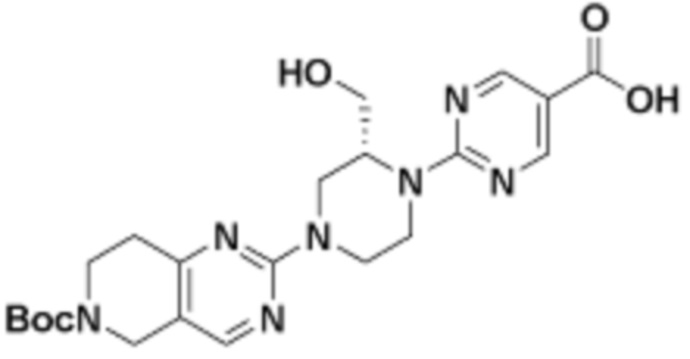
Строительный блок N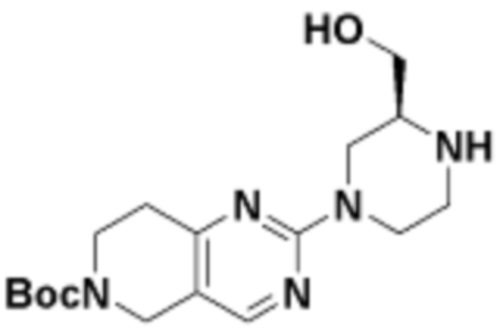
Строительный блок O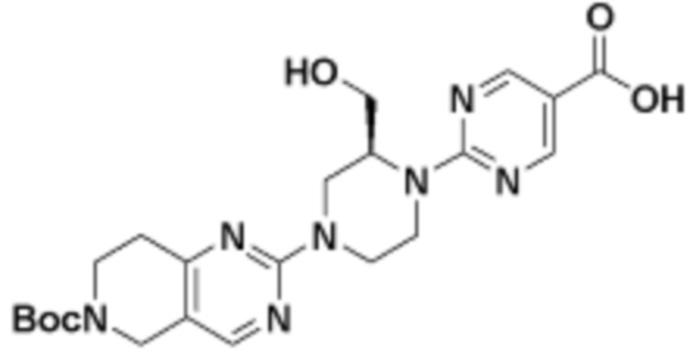
Строительный блок P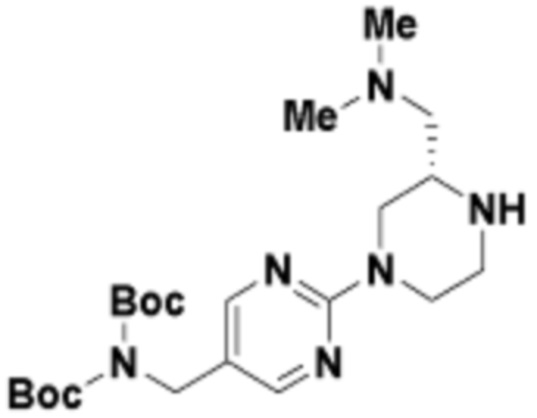
Строительный блок Q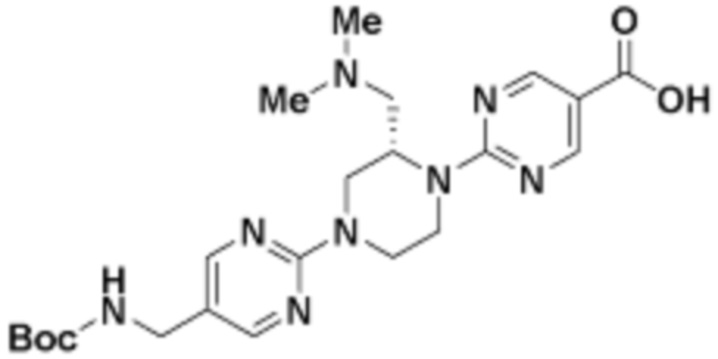
Строительный блок R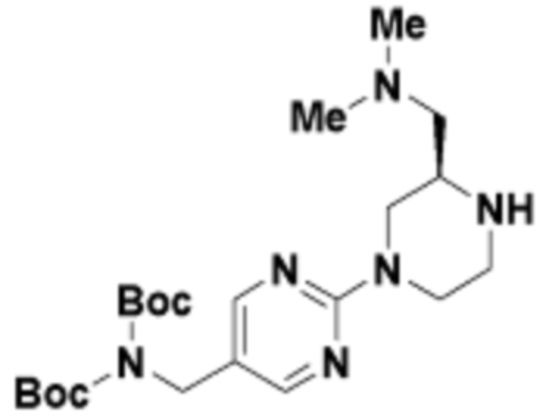
Строительный блок S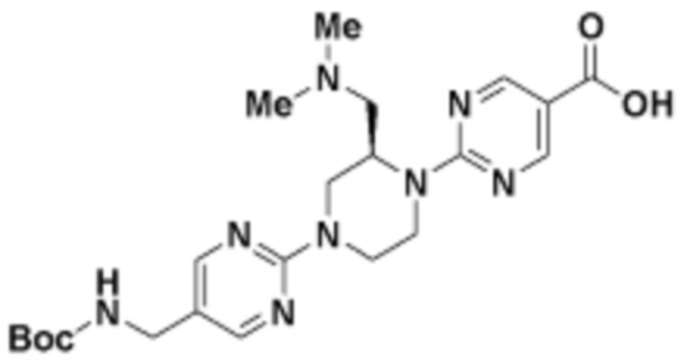
Строительный блок T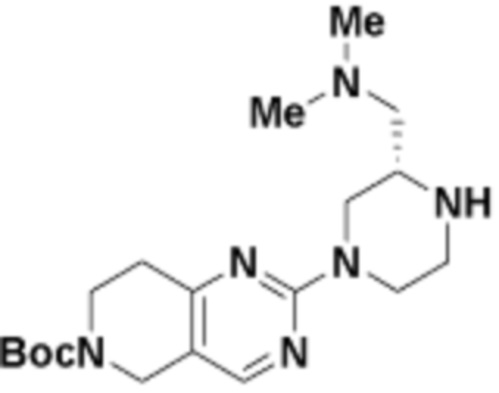
Строительный блок U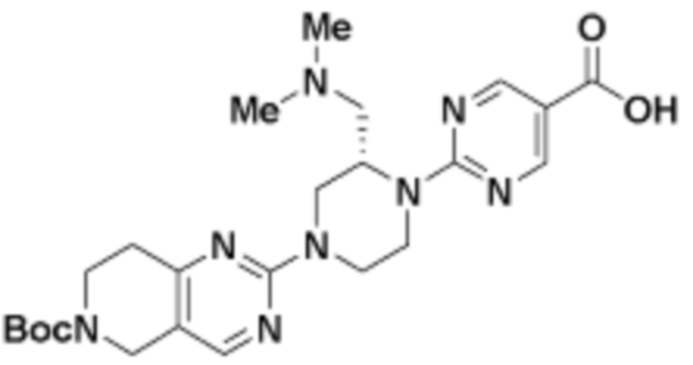
Строительный блок V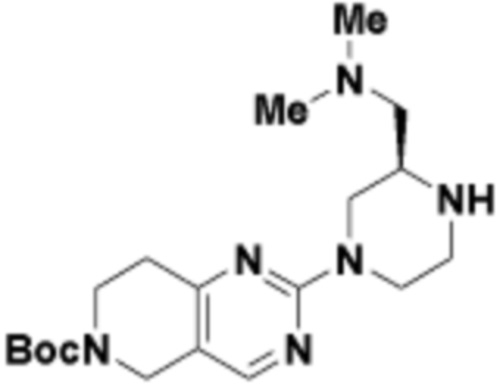
Строительный блок W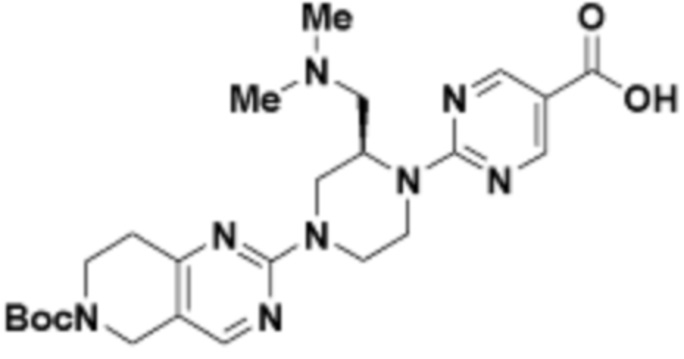
Строительный блок X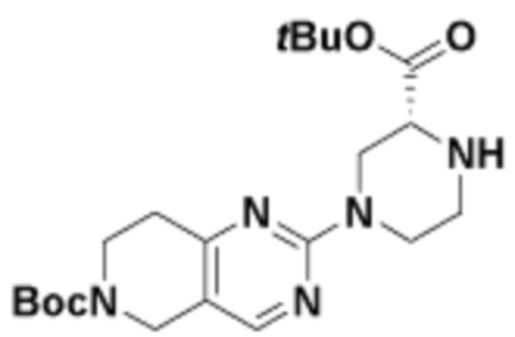
Строительный блок Y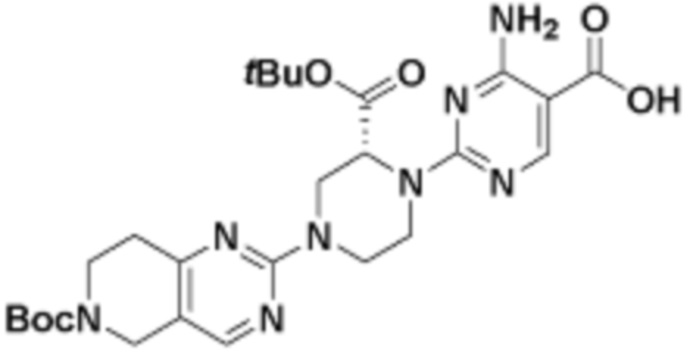
Строительный блок Z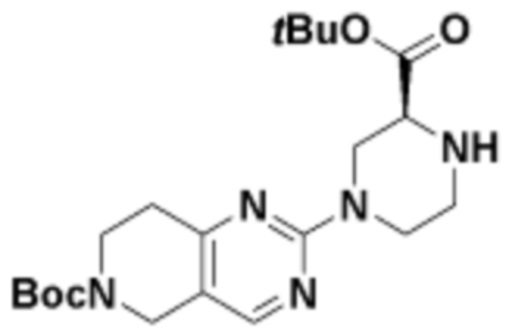
Строительный блок AA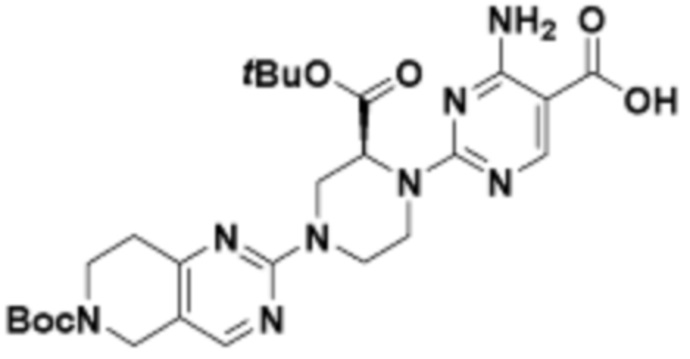
Строительный блок AB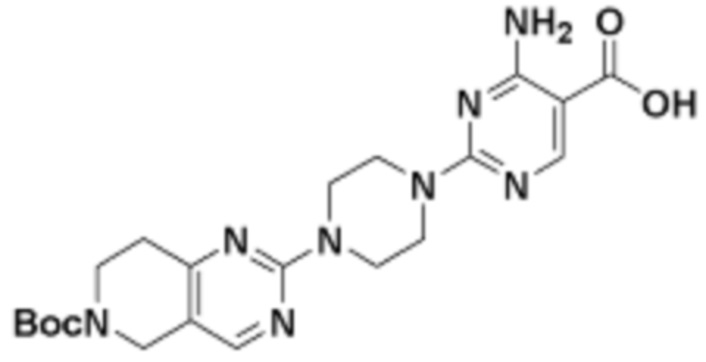
Строительный блок AC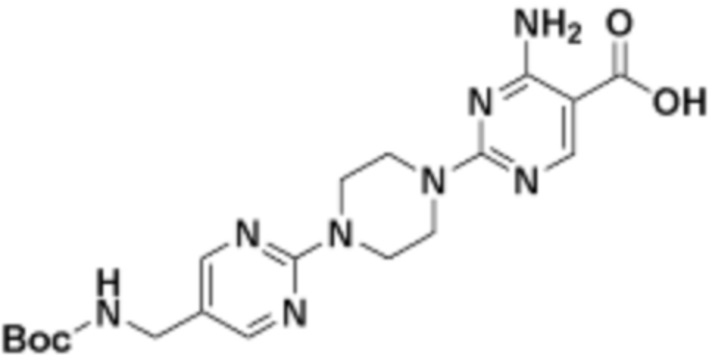
Строительный блок AD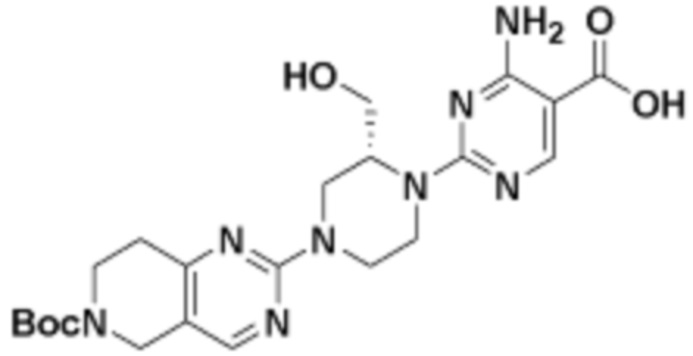
Строительный блок AE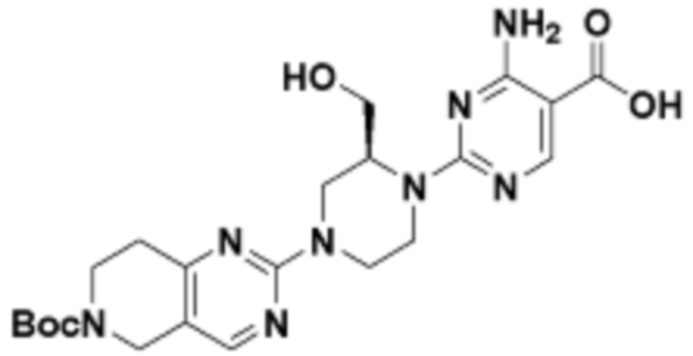
Строительный блок AF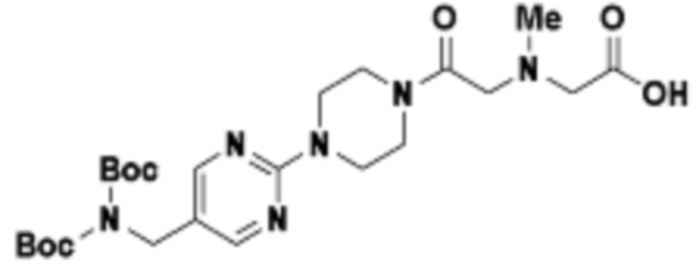
Строительный блок AG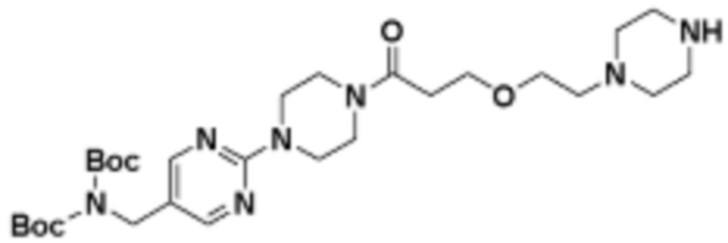
Строительный блок AH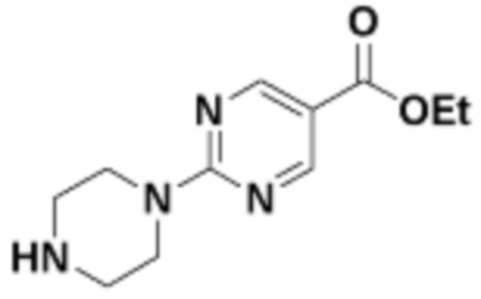
Строительный блок AI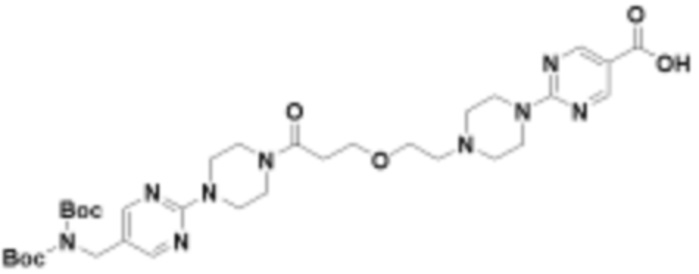
Строительный блок AJ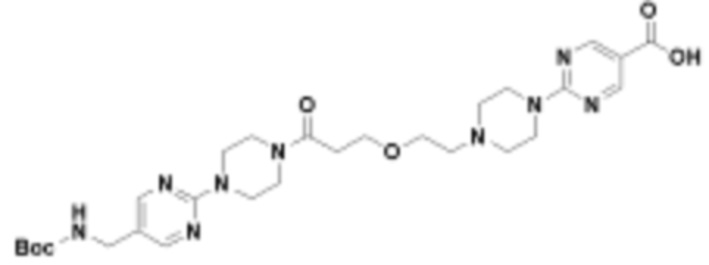
Строительный блок AK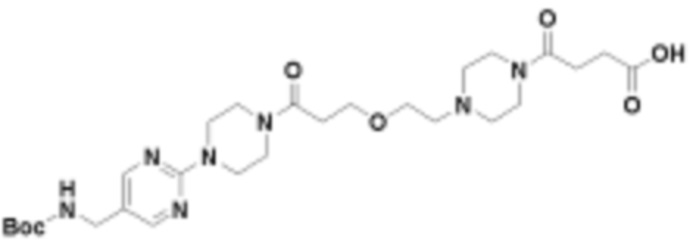
Строительный блок AL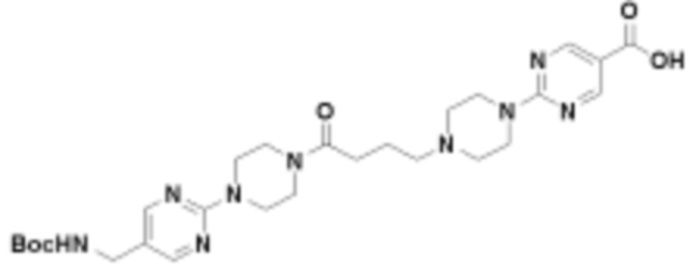
Строительный блок AM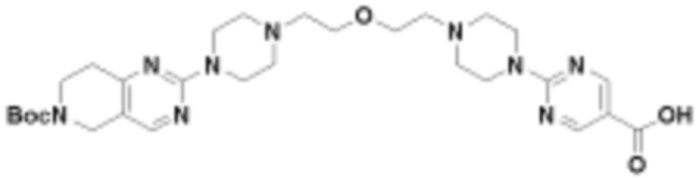
Строительный блок AN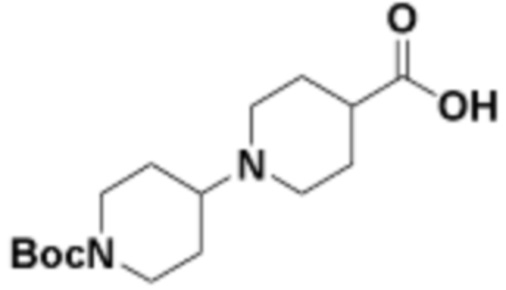
Строительный блок AO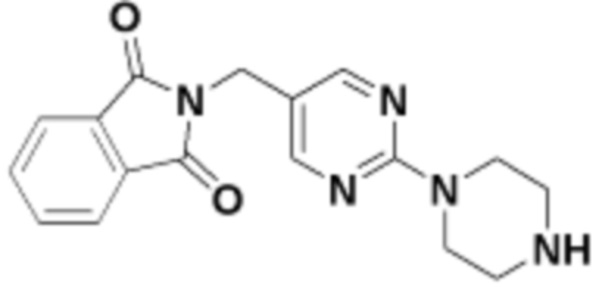
Строительный блок AP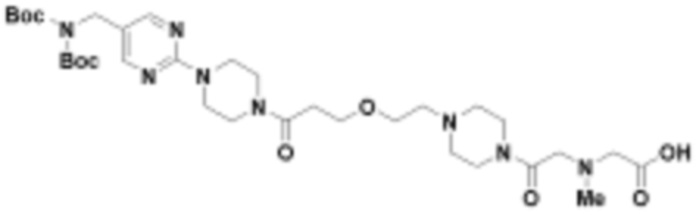
Строительный блок AQ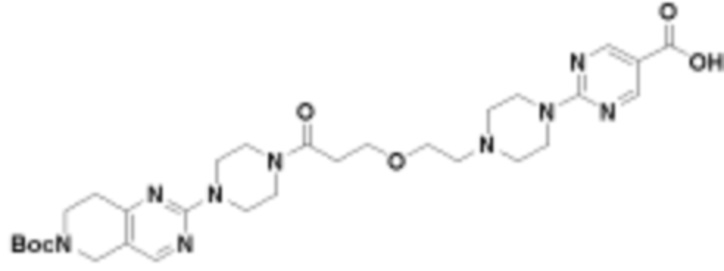
Строительный блок AR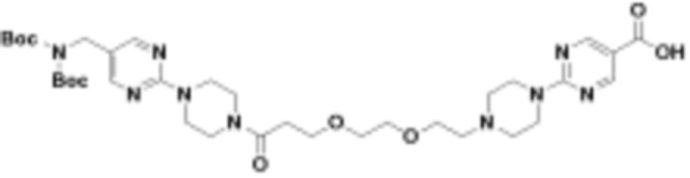
Строительный блок AS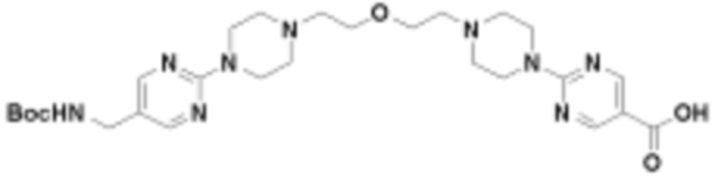
Строительный блок AT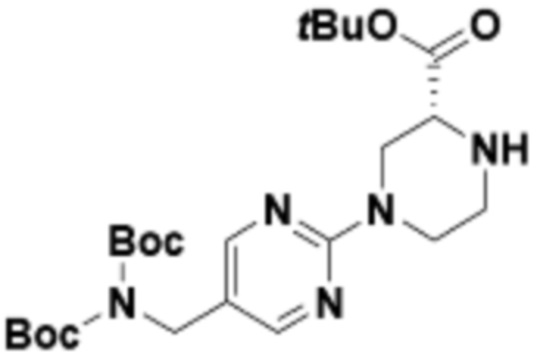
Строительный блок AU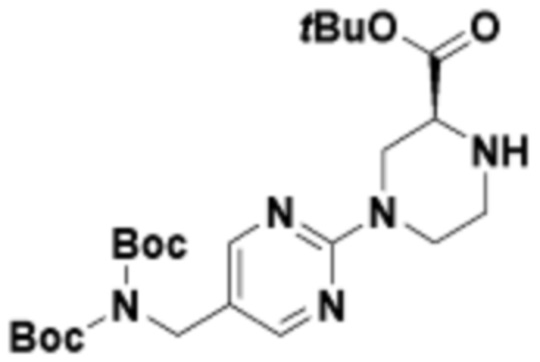
Строительный блок AV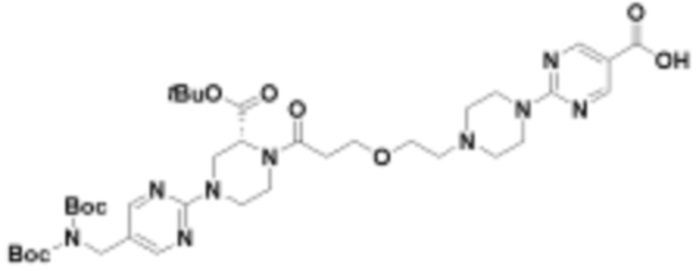
Строительный блок AW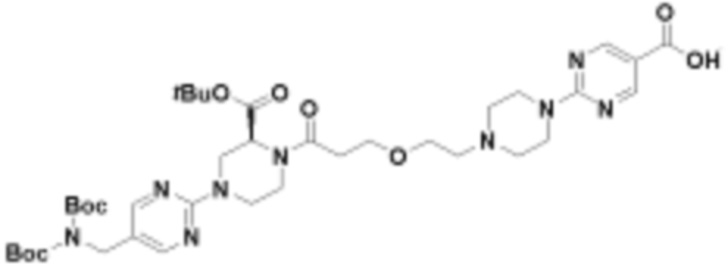
Строительный блок AX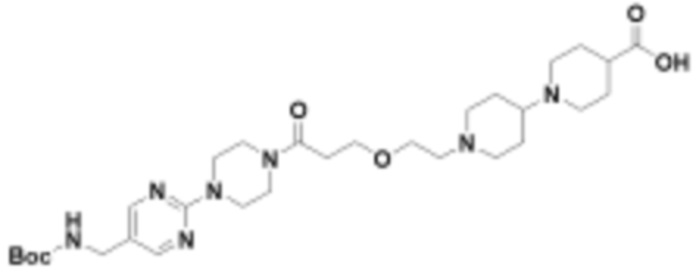
Строительный блок AY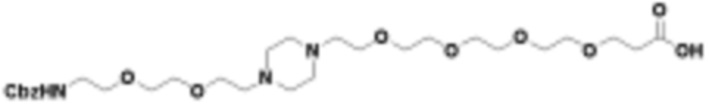
Строительный блок AZ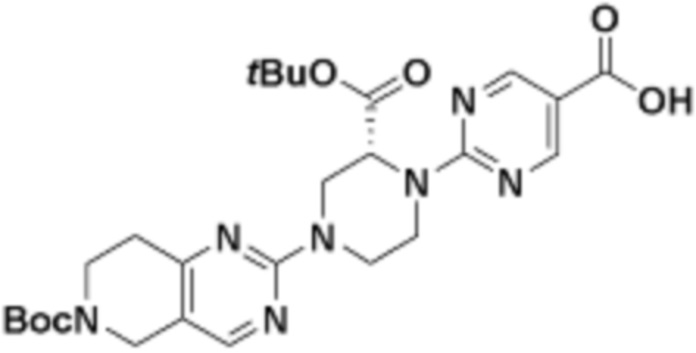
Строительный блок BA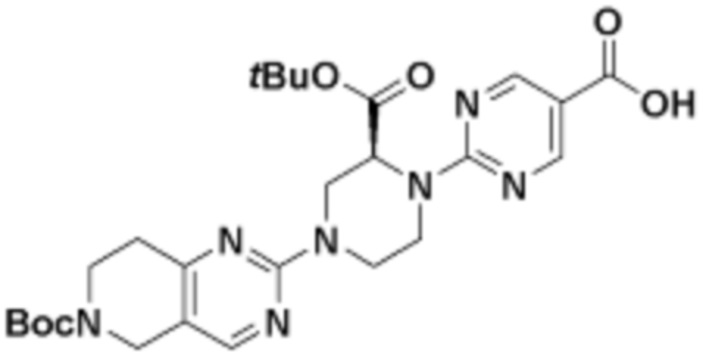
Строительный блок BB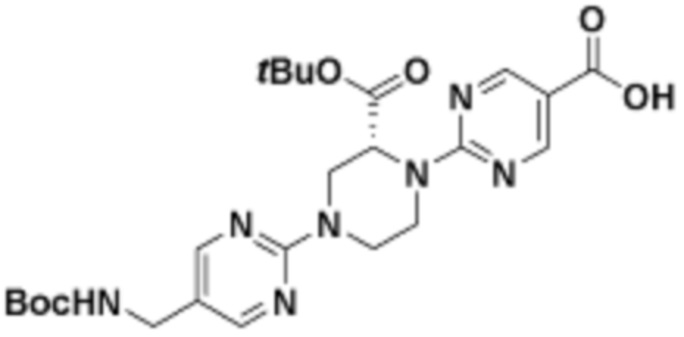
Строительный блок BC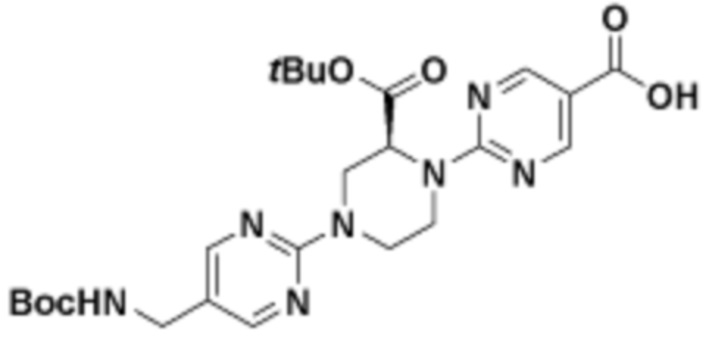
Строительный блок BD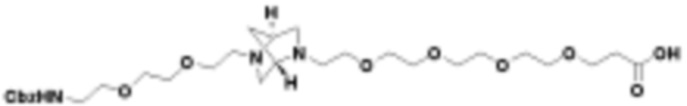
Строительный блок BE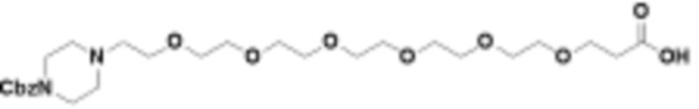
Строительный блок BF
Получение мономеров ингибитора активного сайта
Мономер A. 5-(4-амино-1-(4-(аминометил)бензил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амин соль трифторуксусной кислоты.
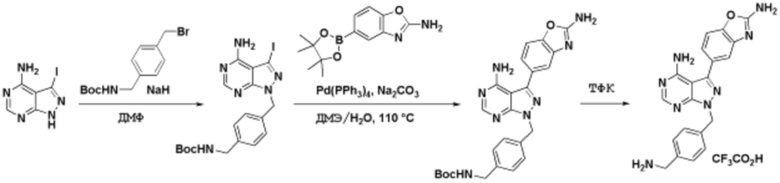
Стадия 1: Синтез трет-бутил 4-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)бензилкарбамат
К раствору 3-йод-1H-пиразоло[3,4-d]пиримидин-4-амина (3,8 g, 14,56 ммоль, 1,0 эквив.) в ДМФ (20 мл) добавляют NaH (582,27 мг, 14,56 ммоль, 60% масс., 1,0 эквив.) при 0°C и реакционный раствор перемешивают при этой температуре в течение 30 мин, затем трет-бутил 4-(бромметил)бензилкарбамат (4,59 г, 15,29 ммоль, 1,05 эквив.) добавляют к реакционной смеси при 0°C, и реакционный раствор перемешивают при комнатной температуре в течение 2 ч. Раствор выливают в H2O (80 мл) и выпавшее в осадок твердое вещество фильтруют. Твердую лепешку промывают H2O (2×10 мл) и затем сушат при пониженном давлении с получением трет-бутил 4-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)бензилкарбамата (5 г, 53% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+Na] рассч. для C18H21IN6O2: 503,07; найдено 503,2.
Стадия 2: Синтез трет-бутил 4-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)бензилкарбамата
К двухфазной суспензии трет-бутил 4-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)бензилкарбамата (5 г, 7,68 ммоль, 1,0 эквив.), 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол-2-амина (2,40 г, 9,22 ммоль, 1,2 эквив.) и Pd(PPh3)4 (887,66 мг, 768,16 мкмоль, 0,1 эквив.) в ДМЭ (100 мл) и H2O (50 мл) добавляют Na2CO3 (1,91 г, 23,04 ммоль, 3,0 эквив.) при комнатной температуре под N2. Смесь перемешивают при 110°C в течение 3 ч. Реакционную смесь охлаждают при комнатной температуре и фильтруют, фильтрат экстрагируют E-Ac (3×50 мл). Органические фазы объединяют и промывают насыщенным раствором соли (10 мл), сушат над Na2SO4, фильтруют и фильтрат концентрируют при пониженном давлении с получением остатка. Остаток очищают хроматографией на силикагеле (0→20% MeOH/E-Ac) с получением трет-бутил 4-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)бензилкарбамата (4,5 г, 82% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C25H26N8O3: 487,22; найдено 487,2.
Стадия 3: Синтез 5-(4-амино-1-(4-(аминометил)бензил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амина
К раствору трет-бутил 4-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)бензилкарбамата (4,5 г, 6,29 ммоль, 1,0 эквив.) в ДХМ (50 мл) добавляют ТФК (30,80 г, 270,12 ммоль, 20 мл, 42,95 эквив.) при 0°C. Реакционный раствор перемешивают при комнатной температуре в течение 2 ч. Реакционный раствор концентрируют при пониженном давлении с получением остатка, который растворяют в 10 мл MeCN, затем выливают в МТБЭ (100 мл). Выпавшее в осадок твердое вещество затем фильтруют, и твердую лепешку сушат при пониженном давлении с получением 5-[4-амино-1-[[4-(аминометил)фенил]метил]пиразоло[3,4-d]пиримидин-3-ил]-1,3-бензоксазол-2-амин (2,22 г, 71% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C20H18N8O: 387,16; найдено 387,1.
Мономер B. 2-(4-амино-1-(4-аминобутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)-1H-индол-6-ол соль трифторуксусной кислоты.
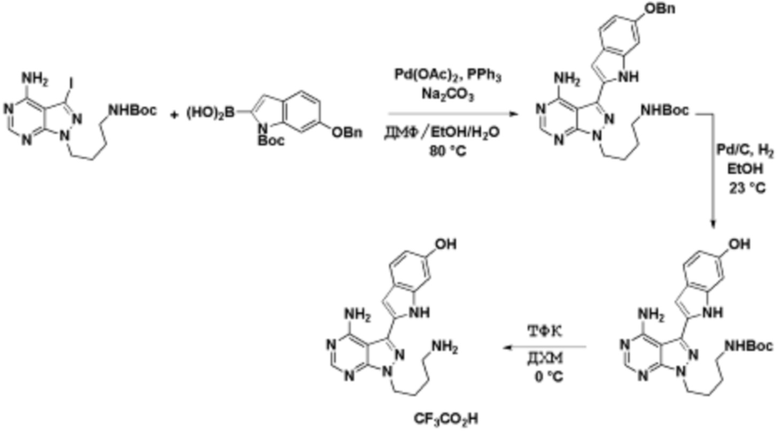
Стадия 1: Синтез tert-бутил N-(4-{4-амино-3-[6-(бензилокси)-1H-индол-2-ил]-1H-пиразоло[3,4-d]пиримидин1-ил}бутил)карбамата
К смеси трет-бутил (4-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата (300 мг, 694 мкмоль, 1,0 эквив.) и (6-(бензилокси)-1-(трет-бутоксикарбонил)-1H-индол-2-ил)бороновой кислоты (763 мг, 2,08 ммоль, 3,0 эквив.) в ДМФ (2,6 мл), E-H (525 мкл) и H2O(350 мкл) добавляют Pd(OAc)2 (15,5 мг, 69 мкмоль, 0,1 эквив.), трифенилфосфин (36,1 мг, 138 мкмоль, 0,2 эквив.) и карбонат натрия (440 мг, 4,16 ммоль, 6,0 эквив.). Реакционную смесь нагревают при 80°C в течение 20 ч, охлаждают при комнатной температуре и гасят H2O (10 мл) и E-Ac (10 мл). Смесь переносят в делительную воронку и водную фазу экстрагируют E-Ac (3×20 мл). Объединенную органическую фазу промывают насыщ. водн. NaCl (1×20 мл), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Неочищенный продукт очищают хроматографией на силикагеле (20→85% E-Ac/гептан) с получением продукта (201 мг, 46% выход) в виде оранжевого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C29H33N7O3: 528,27; найдено 528,2.
Стадия 2: Синтез трет-бутил (4-(4-амино-3-(6-гидрокси-1H-индол-2-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата
К раствору трет-бутил N-(4-{4-амино-3-[6-(бензилокси)-1H-индол-2-ил]-1H‐пиразоло[3,4-d]пиримидин‐1-ил}бутил)карбамата (1,0 эквив.) в E-H добавляют Pd/C (10% моль.). Реакционную смесь продувают H2 и реакционную смесь перемешивают в атмосфере H2 до потребления исходного материала, по данным ЖХМС. Реакционную смесь затем разбавляют E-Ac, фильтруют над Целитом и концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на силикагеле с получением желаемого продукта.
Стадия 3: Синтез 2-(4-амино-1-(4-аминобутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)-1H-индол-6-ола
К раствору трет-бутил (4-(4-амино-3-(6-гидрокси-1H-индол-2-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата (1,0 эквив.) в безводном ДХМ добавляют ТФК (50 эквив.) по каплям при 0°C. Реакционную смесь перемешивают при 0°C и нагревают до комнатной температуры. После завершения реакции, по данным ЖХМС, реакционную смесь концентрируют при пониженном давлении. Остаток растирают с MeCN, затем капают в МТБЭ более 10 мин. Надосадочную жидкость удаляют, и осадок собирают фильтрацией под N2 с получением 2-(4-амино-1-(4-аминобутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)-1H-индол-6-ола.
Мономер C. 5-(4-амино-1-((1,2,3,4-тетрагидроизохинолин-6-ил)метил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амин соль трифторуксусной кислоты.
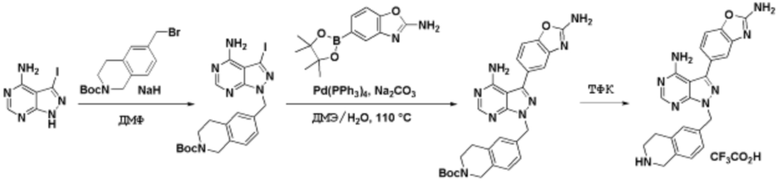
Стадия 1: Синтез трет-бутил 6-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилат
К суспензии 3-йод-1H-пиразоло[3,4-d]пиримидин-4-амина (5 г, 19,16 ммоль, 1,0 эквив.) в ДМФ (50,0 мл) добавляют NaH (766,22 мг, 19,16 ммоль, 60% масс., 1,0 эквив.) при 4°C. Смесь перемешивают при 4°C в течение 30 мин. К реакционной смеси добавляют трет-бутил 6-(бромметил)-3,4-дигидроизохинолин-2(1H)-карбоксилат (6,87 г, 21,07 ммоль, 1,1 эквив.) в ДМФ (30 мл) при 4°C. Смесь перемешивают при комнатной температуре в течение 2 ч. Смесь затем охлаждают до 4°C и добавляют H2O (400 мл), и смесь перемешивают в течение 30 мин. Полученный осадок собирают фильтрацией с получением неочищенного трет-бутил 6-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата (9,7 г, 76% выход) в виде светло-желтого твердого вещества. Неочищенный продукт применяют непосредственно на следующей стадии.
Стадия 2: Синтез трет-бутил 6-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата
К двухфазной суспензии трет-бутил 6-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата (9,7 г, 14,63 ммоль, 1,0 эквив.), 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол-2-амина (4,57 г, 17,55 ммоль, 1,2 эквив.) и Na2CO3 (7,75 г, 73,14 ммоль, 5,0 эквив.) в ДМЭ (120,0 мл) и H2O (60 мл) добавляют Pd(PPh3)4 (1,69 г, 1,46 ммоль, 0,1 эквив.) при комнатной температуре под N2. Смесь перемешивают при 110°C в течение 3 ч. Реакционную смесь затем охлаждают при комнатной температуре и разделяют между E-Ac (100 мл) и H2O (100 мл). Водный слой отделяют и экстрагируют E-Ac (2×60 мл). Органические слои объединяют, промывают насыщенным раствором соли (80 мл) и сушат над безводным Na2SO4, фильтруют, и фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (1→100% E-Ac/петролейный эфир, затем 20→50% MeOH/E-Ac) с получением трет-бутил 6-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата (4,5 г, 58% выход) в виде светло-желтого твердого вещества.
Стадия 3: Синтез 5-(4-амино-1-((1,2,3,4-тетрагидроизохинолин-6-ил)метил)-1H-пиразоло[3,4-d]пирамидин-3-ил)бензо[d]оксазол-2-амина
К чистой ТФК (32,5 мл, 438,97 ммоль, 50,0 эквив.) добавляют трет-бутил 6-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилат (4,5 г, 8,78 ммоль, 1,0 эквив.) при комнатной температуре. Смесь перемешивают в течение 30 мин и затем концентрируют при пониженном давлении. Маслянистый остаток растирают с MeCN (8 мл), затем капают в МТБЭ (350 мл) более 10 мин. Надосадочную жидкость удаляют и затем осадок собирают фильтрацией под N2 с получением 5-(4-амино-1-((1,2,3,4-тетрагидроизохинолин-6-ил)метил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амина (5,72 г, более 100% выход) в виде светло-розового твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C22H20N8O: 413,18; найдено 413,2.
Мономер D. 2-(4-амино-1-(4-аминобутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)-1H-индол-7-ол соль трифторуксусной кислоты.
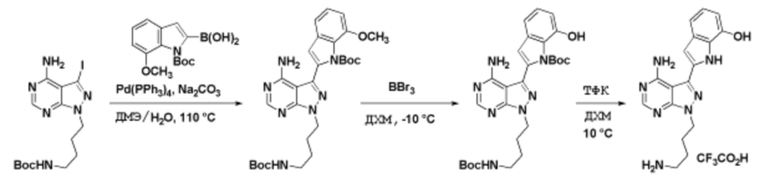
Стадия 1: Синтез трет-бутил 2-(4-амино-1-(4-((трет-бутоксикарбонил)амино)бутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)-7-метокси-1H-индол-1-карбоксилат
К смеси трет-бутил (4-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата (1,0 эквив.) и (1-(трет-бутоксикарбонил)-7-метокси-1H-индол-2-ил)бороновой кислоты (3,0 эквив.) в ДМЭ и H2O добавляют Pd(PPh3)4 (0,1 эквив.) и карбонат натрия (6,0 эквив.). Реакционную смесь нагревают при 80°C до завершения, по данным ЖХМС и ТСХ анализа. Реакционную смесь затем гасят H2O и E-Ac. Смесь переносят в делительную воронку и водную фазу экстрагируют E-Ac. Органическую фазу промывают насыщ. водн. NaCl, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Желаемый продукт выделяют после хроматографии на силикагеле.
Стадия 2: Синтез трет-бутил 2-(4-амино-1-(4-((трет-бутоксикарбонил)амино)бутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)-7-гидрокси-1H-индол-1-карбоксилата
К раствору трет-бутил 2-(4-амино-1-(4-((трет-бутоксикарбонил)амино)бутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)-7-метокси-1H-индол-1-карбоксилата (1,0 эквив.) в ДХМ при -10°C добавляют BBr3 (2,0 эквив.). Реакционную смесь перемешивают до потребления исходного материала, по данным ЖХМС. Реакционную смесь гасят медленным добавлением насыщ. водн. NaHCO3, переносят в делительную воронку и смесь экстрагируют ДХМ. Органическую фазу промывают насыщ. водн. NaCl, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Желаемый продукт выделяют после хроматографии на силикагеле.
Стадия 3: Синтез 2-(4-амино-1-(4-аминобутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)-1H-индол-7-ола
К раствору трет-бутил 2-(4-амино-1-(4-((трет-бутоксикарбонил)амино)бутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)-7-гидрокси-1H-индол-1-карбоксилата (1,0 эквив.) в ДХМ при 0°C добавляют ТФК по каплям. Реакционную смесь перемешивают при 0°C и нагревают до комнатной температуры. После завершения реакции, по данным ЖХМС, реакционную смесь концентрируют при пониженном давлении. Остаток растирают с MeCN, затем капают в МТБЭ более 10 мин. Надосадочную жидкость удаляют и осадок собирают фильтрацией под N2 с получением 2-(4-амино-1-(4-аминобутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)-1H-индол-7-ола.
Мономер E. 5-(4-амино-1-(пиперидин-4-илметил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амин соль трифторуксусной кислоты.
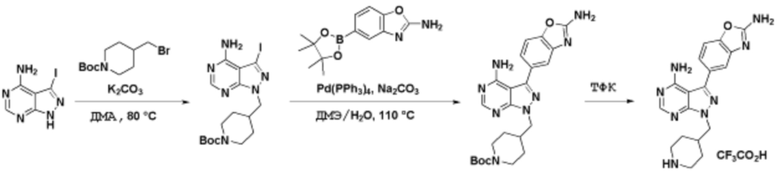
Стадия 1: Синтез трет-бутил 4-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)пиперидин-1-карбоксилата
К раствору 3-йод-1H-пиразоло[3,4-d]пиримидин-4-амина (3 г, 11,49 ммоль, 1,0 эквив.) в ДМА (30 мл) добавляют трет-бутил 4-(бромметил)пиперидин-1-карбоксилат (3,36 г, 12,07 ммоль, 1,05 эквив.) и K2CO3 (4,77 г, 34,48 ммоль, 3,0 эквив.), затем реакционную смесь перемешивают при 80°C в течение 3 ч. Реакционную смесь фильтруют для удаления K2CO3, и фильтрат выливают в H2O (200 мл). Выпавшее в осадок твердое вещество затем фильтруют с получением трет-бутил 4-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)пиперидин-1-карбоксилата (3 г, 57% выход) в виде светло-желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C16H23IN6O2: 459,10; найдено 459,1.
Стадия 2: Синтез трет-бутил 4-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)пиперидин-1-карбоксилата
К двухфазной суспензии трет-бутил 4-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)пиперидин-1-карбоксилата (3 г, 6,55 ммоль, 1,0 эквив.) и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол-2-амина (2,04 г, 7,86 ммоль, 1,2 эквив.) и Na2CO3 (3,47 г, 32,73 ммоль, 5,0 эквив.) в ДМЭ (60 мл) и H2O (30 мл) добавляют Pd(PPh3)4 (756,43 мг, 654,60 мкмоль, 0,1 эквив.) при комнатной температуре под N2. Смесь перемешивают при 110°C в течение 3 ч. Две партии объединяют вместе. Реакционную смесь охлаждают и разделяют между E-Ac (500 мл) и H2O (500 мл). Водный слой отделяют и экстрагируют E-Ac (3×300 мл). Все органические слои объединяют, промывают насыщенным раствором соли (20 мл), сушат над безводным Na2SO4, фильтруют и фильтрат концентрируют при пониженном давлении с получением трет-бутил 4-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)пиперидин-1-карбоксилата (4,5 г, 74% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C23H28N8O3: 465,24; найдено 465,2.
Стадия 3: Синтез 5-(4-амино-1-(пиперидин-4-илметил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амина
Раствор трет-бутил 4-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)пиперидин-1-карбоксилата (2,5 г, 5,38 ммоль, 1,0 эквив.) в ТФК (25 мл) перемешивают при комнатной температуре в течение 30 мин. Реакционный раствор концентрируют при пониженном давлении для удаления ТФК. Остаток добавляют к МТБЭ (400 мл) и выпадает твердый осадок, который затем фильтруют с получением 5-(4-амино-1-(пиперидин-4-илметил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амина (2,7 г, более 100% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C18H20N8O: 365,18; найдено 365,1.
Мономер F. 2-(4-амино-1-(4-аминобутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)-1H-индол-5-ол соль трифторуксусной кислоты.
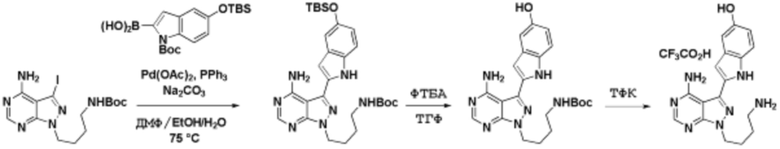
Стадия 1: Синтез трет-бутил (4-(4-амино-3-(5-((трет-бутилдиметилсилил)окси)-1H-индол-2-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамат
К раствору трет-бутил (4-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата (1,0 г, 2,31 ммоль, 1,0 эквив.) в диоксане (10,5 мл) и H2O (3,5 мл) добавляют (1-(трет-бутоксикарбонил)-5-((трет-бутилдиметилсилил)окси)-1H-индол-2-ил)бороновую кислоту (1,54 г, 2,78 ммоль, 1,2 эквив.), K3PO4 (1,47 г, 6,94 ммоль, 3,0 эквив.), Pd2(dba)3 (211,84 мг, 231,34 мкмоль, 0,1 эквив.) и SPhos (189,95 мг, 462,69 мкмоль, 0,2 эквив.) при комнатной температуре под N2. Герметично закрытую пробирку нагревают при 150°C в течение 20 мин в микроволновой печи. Это повторяют 9 дополнительных партий. 10 партий объединяют, и реакционную смесь охлаждают и разделяют между E-Ac (60 мл) и H2O (80 мл). Водный слой отделяют и экстрагируют E-Ac (2×50 мл). Органические слои объединяют, промывают насыщенным раствором соли (60 мл) и сушат над безводным Na2SO4. Суспензию фильтруют, и фильтрат концентрируют при пониженном давлении. Неочищенный продукт очищают хроматографией на силикагеле (1→75% E-Ac/петролейный эфир). Желаемые фракции объединяют и выпаривают при пониженном давлении с получением трет-бутил (4-(4-амино-3-(5-((трет-бутилдиметилсилил)окси)-1H-индол-2-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата (10 г, 60% выход) в виде светло-желтого твердого вещества.
Стадия 2: Синтез трет-бутил (4-(4-амино-3-(5-гидрокси-1H-индол-2-ил)-1H-пиразоло[3,4-d] пиримидин-1-ил)бутил)карбамата
К смеси трет-бутил (4-(4-амино-3-(5-((трет-бутилдиметилсилил)окси)-1H-индол-2-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата (10 г, 18,12 ммоль, 1,0 эквив.) в ТГФ (100 мл) добавляют ФТБА•3H2O (1 M, 54,37 мл, 3,0 эквив.) одной порцией при комнатной температуре под N2. Смесь перемешивают в течение 1 ч и затем H2O (100 мл) добавляют к реакционной смеси. Слои разделяют, и водную фазу экстрагируют E-Ac (2×80 мл). Объединенную органическую фазу промывают насыщенным раствором соли (100 мл), сушат с безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (1→67% E-Ac/петролейный эфир) с получением трет-бутил (4-(4-амино-3-(5-гидрокси-1H-индол-2-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата (7 г, 87% выход) в виде светло-розового твердого вещества.
Стадия 3: Синтез 2-[4-амино-1-(4-аминобутил)пиразоло[3,4-d]пиримидин-3-ил]-1H-индол-5-ола
К ТФК (50,0 мл, 675,26 ммоль, 38,9 эквив.) добавляют трет-бутил (4-(4-амино-3-(5-гидрокси-1H-индол-2-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамат (7,6 г, 17,37 ммоль, 1,0 эквив.) при комнатной температуре. Смесь перемешивают в течение 40 мин и затем концентрируют при пониженном давлении. Маслянистый остаток растирают с MeCN (20 мл), затем добавляют по каплям в МТБЭ (300 мл) в течение 10 мин. Надосадочную жидкость удаляют и затем осадок собирают фильтрацией под N2 с получением 2-[4-амино-1-(4-аминобутил)пиразоло[3,4-d]пиримидин-3-ил]-1H-индол-5-ола (7,79 г, 91% выход) в виде светло-желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C17H19N7O: 338,17; найдено 338,2.
Мономер G. 5-(4-амино-1-(азетидин-3-илметил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амин соль трифторуксусной кислоты.
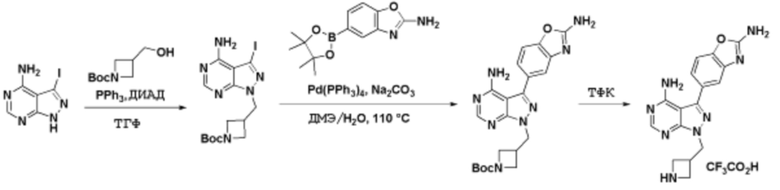
Стадия 1: Синтез трет-бутил 3-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)азетидин-1-карбоксилата
К раствору 3-йод-1H-пиразоло[3,4-d]пиримидин-4-амина (4 г, 15,32 ммоль, 1,0 эквив.), трет-бутил 3-(гидроксиметил)азетидин-1-карбоксилата (3,01 г, 16,09 ммоль, 1,05 эквив.) и PPh3 (6,03 г, 22,99 ммоль, 1,5 эквив.) в ТГФ (80 мл) охлаждают до 0°C, добавляют ДИАД (4,47 мл, 22,99 ммоль, 1,5 эквив.) по каплям. После завершения добавления, реакционную смесь перемешивают при комнатной температуре в течение 14 ч. Реакционную смесь выливают в H2O (200 мл) и затем экстрагируют E-Ac (3×50 мл). Органические слои объединяют и промывают насыщенным раствором соли (2×50 мл). Органическую фазу сушат над Na2SO4, фильтруют, фильтрат концентрируют при пониженном давлении с получением остатка. Остаток очищают хроматографией на силикагеле (0→100% E-Ac/петролейный эфир) с получением трет-бутил 3-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)азетидин-1-карбоксилата (4,2 г, 64% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C14H19IN6O2: 431,07; найдено 431,0.
Стадия 2: Синтез трет-бутил 3-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)азетидин-1-карбоксилата
К двухфазной суспензии трет-бутил 3-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)азетидин-1-карбоксилата (4 г, 9,30 ммоль, 1,0 эквив.), 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол-2-амина (2,90 г, 11,16 ммоль, 1,2 эквив.) и Na2CO3 (4,93 г, 46,49 ммоль, 5,0 эквив.) в ДМЭ (100 мл) и H2O (50 мл) добавляют Pd(PPh3)4 (1,07 г, 929,71 мкмоль, 0,1 эквив.) при комнатной температуре под N2. Смесь перемешивают при 110°C в течение 3 ч. Реакционную смесь затем охлаждают при комнатной температуре и фильтруют и фильтрат экстрагируют E-Ac (3×50 мл). Органические слои объединяют и промывают насыщенным раствором соли (10 мл), сушат над Na2SO4, фильтруют и фильтрат концентрируют при пониженном давлении с получением остатка. Остаток очищают хроматографией на силикагеле (0→20% MeOH/E-Ac) с получением трет-бутил 3-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)азетидин-1-карбоксилата (3,5 г, 80% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C21H24N8O3: 437,20; найдено 437,2.
Стадия 3: Синтез 5-(4-амино-1-(азетидин-3-илметил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амина
К раствору трет-бутил 3-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)азетидин-1-карбоксилата (3,29 г, 6,87 ммоль, 1,0 эквив.) в ДХМ (20 мл) добавляют ТФК (7,50 мл, 101,30 ммоль, 14,7 эквив.) при 0°C. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 2 ч. Реакционный раствор концентрируют при пониженном давлении с получением остатка. Остаток растворяют в MeCN (6 мл) и затем выливают в МТБЭ (80 мл). Выпадает твердый осадок, который фильтруют, и твердую лепешку сушат при пониженном давлении с получением 5-[4-амино-1-(азетидин-3-илметил)пиразоло[3,4-d]пиримидин-3-ил]-1,3-бензоксазол-2-амина (4,34 г, более 100% выход, ТФК) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C16H16N8O: 337,15; найдено 337,1.
Мономер H. 5-(4-амино-1-(4-аминобутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]-оксазол-2-амин соль трифторуксусной кислоты.
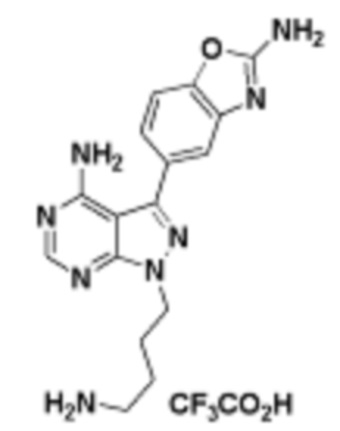
Этот мономер синтезируют по методике, описанной в Nature 2015, 534, 272-276, который включен сюда в качестве ссылки полностью.
Мономер I. 5-(4-амино-1-(пирролидин-3-илметил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амин соль трифторуксусной кислоты.
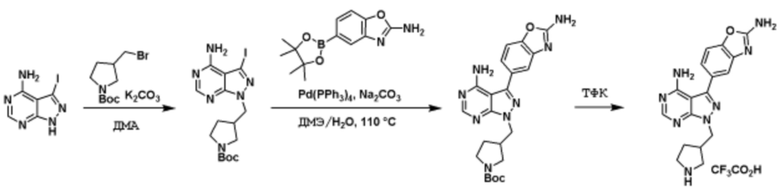
Стадия 1: Синтез трет-бутил 3-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)пирролидин-1-карбоксилата
Суспензию 3-йод-1H-пиразоло[3,4-d]пиримидин-4-амина (4,5 г, 17,24 ммоль, 1,0 эквив.), трет-бутил 3-(бромметил)пирролидин-1-карбоксилата (4,78 г, 18,10 ммоль, 1,05 эквив.) и K2CO3 (7,15 г, 51,72 ммоль, 3,0 эквив.) в ДМА (40 мл) нагревают до 85°C. Реакционную смесь перемешивают при 85°C в течение 3 ч, в этот момент раствор охлаждают при комнатной температуре. Затем, H2O (80 мл) добавляют к реакционной смеси, и выпадает твердый осадок. Смесь фильтруют, и твердую лепешку промывают H2O (2×40 мл) и затем сушат при пониженном давлении с получением трет-бутил 3-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил) метил)пирролидин-1-карбоксилата (6 г, 78% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C15H21IN6O2: 445,08; найдено 445,1.
Стадия 2: Синтез трет-бутил3-[[4-амино-3-(2-амино-1,3-бензоксазол-5-ил)пиразоло[3,4-d]пиримидин-1-ил]метил]пирролидин-1-карбоксилата
К двухфазной суспензии трет-бутил 3-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)пирролидин-1-карбоксилата (4 г, 9,00 ммоль, 1,0 эквив.), 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол-2-амина (2,81 г, 10,80 ммоль, 1,2 эквив.) и Na2CO3 (4,77 г, 45,02 ммоль, 5,0 эквив.) в ДМЭ (120 мл) и H2O (60 мл) добавляют Pd(PPh3)4 (1,04 г, 900,35 мкмоль, 0,1 эквив.) при комнатной температуре под N2. Смесь перемешивают при 110°C в течение 3 ч. Реакционную смесь охлаждают при комнатной температуре и фильтруют, и фильтрат экстрагируют E-Ac (3×50 мл). Органические фазы объединяют и промывают насыщенным раствором соли (50 мл), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением остатка. Остаток очищают хроматографией на силикагеле (0→20% MeOH/E-Ac) с получением трет-бутил 3-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)пирролидин-1-карбоксилата (3 г, 64% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C22H26N8O3: 451,21, найдено 451,2.
Стадия 3: Синтез 5-(4-амино-1-(пирролидин-3-илметил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амина
К раствору трет-бутил 3-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)пирролидин-1-карбоксилата (3 г, 6,66 ммоль, 1,0 эквив.) в ДХМ (40 мл) добавляют ТФК (20 мл) при 0°C, по каплям. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 2 ч. Реакционный раствор затем концентрируют при пониженном давлении с получением остатка. Остаток растворяют в MeCN (4 мл), затем выливают в МТБЭ (100 мл) и выпадает твердый осадок. Твердое вещество фильтруют, и лепешку сушат при пониженном давлении с получением 5-(4-амино-1-(пирролидин-3-илметил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амин (4,00 г, более 100% выход, ТФК) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C17H18N8O: 351,17; найдено 351,2.
Мономер J. 1-(4-аминобутил)-3-(7-метокси-1H-индол-2-ил)-1H-пиразоло[3,4-d]пиримидин-4-амин соль трифторуксусной кислоты.
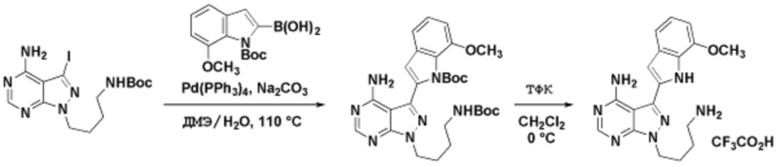
Стадия 1: Синтез трет-бутил 2-(4-амино-1-(4-((трет-бутоксикарбонил)амино)бутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)-7-метокси-1H-индол-1-карбоксилата
К смеси трет-бутил (4-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата (1,0 эквив.) и (1-(трет-бутоксикарбонил)-7-метокси-1H-индол-2-ил)бороновой кислоты (3,0 эквив.) в ДМЭ и H2O добавляют Pd(PPh3)4 (0,1 эквив.) и карбонат натрия (6,0 эквив.). Реакционную смесь нагревают при 80°C до завершения, по данным ЖХМС и ТСХ анализа. Реакционную смесь затем гасят H2O и E-Ac. Смесь переносят в делительную воронку и водную фазу экстрагируют E-Ac. Органическую фазу промывают насыщ. водн. NaCl, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Желаемый продукт выделяют после хроматографии на силикагеле.
Стадия 2: Синтез 1-(4-аминобутил)-3-(7-метокси-1H-индол-2-ил)-1H-пиразоло[3,4-d]пиримидин-4-амина
К раствору трет-бутил 2-(4-амино-1-(4-((трет-бутоксикарбонил)амино)бутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)-7-гидрокси-1H-индол-1-карбоксилата (1,0 эквив.) в ДХМ при 0°C добавляют ТФК по каплям. Реакционную смесь перемешивают при 0°C и нагревают до комнатной температуры. После завершения реакции, по данным ЖХМС, реакционную смесь концентрируют при пониженном давлении. Остаток растирают с MeCN, затем капают в МТБЭ более 10 мин. Надосадочную жидкость удаляют, и осадок собирают фильтрацией под N2 с получением 1-(4-аминобутил)-3-(7-метокси-1H-индол-2-ил)-1H-пиразоло[3,4-d]пиримидин-4-амина.
Мономер K. Синтез 1-(4-аминобутил)-1H-пиразоло[3,4-d]пиримидин-4-амин соль трифторуксусной кислоты.
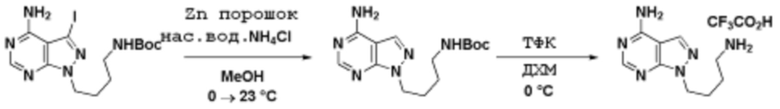
Стадия 1: Синтез трет-бутил (4-(4-амино-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата
К смеси трет-бутил (4-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата (300 мг, 694 мкмоль, 1,0 эквив.) в MeOH (14 мл) при 0°C добавляют цинковый порошок (226 мг, 3,46 ммоль, 5,0 эквив.). Насыщ. водн. NH4Cl (14 мл) добавляют к реакционной смеси, и реакционную смесь нагревают до комнатной температуры и перемешивают в течение 18 ч. Реакционную смесь гасят E-Ac (40 мл) и H2O (10 мл), и смесь переносят в делительную воронку. Водную фазу экстрагируют E-Ac (3×20 мл) и объединенные органические фазы промывают насыщ. водн. NaHCO3 (15 мл), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением продукта (210 мг, 99% выход) в виде светло-желтого твердого вещества, которое применяют без дальнейшей очистки. ЖХМС (ИЭР) m/z: [M+H] рассч. для C14H22N6O2: 307,19; найдено 307,1.
Стадия 2: Синтез 1-(4-аминобутил)-1H-пиразоло[3,4-d]пиримидин-4-амина
К раствору трет-бутил (4-(4-амино-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата (210 мг, 691 мкмоль) в ДХМ (3,5 мл) при 0°C добавляют ТФК (3,5 мл), по каплям. Через 3 ч, реакционную смесь нагревают до комнатной температуры и концентрируют при пониженном давлении с получением трифторацетата продукта (220 мг, 99% выход) в виде коричневого масла, которое применяют без дальнейшей очистки. ЖХМС (ИЭР) m/z: [M+H] рассч. для C9H14N6: 207,13; найдено 207,1.
Мономер L. 1-[4-(пиперазин-1-ил)-3-(трифторметил)фенил]-9-(хинолин-3-ил)-1H,2H-бензо[h]1,6-нафтиридин-2-он
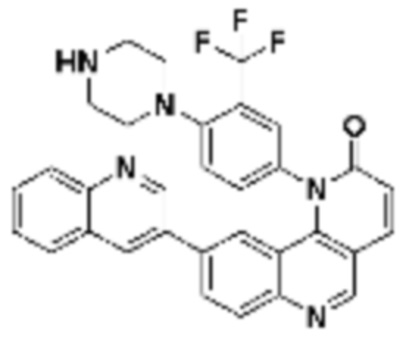
Получение этого мономера было ранее описано в литературе. Смотрите следующие ссылки: i) Liu, Qingsong; Chang, Jae Won; Wang, Jinhua; Kang, Seong A.; Thoreen, Carson C.; Markhard, Andrew; Hur, Wooyoung; Zhang, Jianming; Sim, Taebo; Sabatini, David M.; et al From Journal of Medicinal Chem является try (2010), 53(19), 7146-7155. ii) Gray, Nathanael; Chang, Jae Won; Zhang, Jianming; Thoreen, Carson C.; Kang, Seong Woo Anthony; Sabatini, David M.; Liu, Qingsong из межд. заявки PCT (2010), WO 2010044885A2, которые включены сюда в качестве ссылки полностью.
Мономер M. 5-(1-(4-аминобутил)-4-(диметиламино)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амин соль трифторуксусной кислоты.
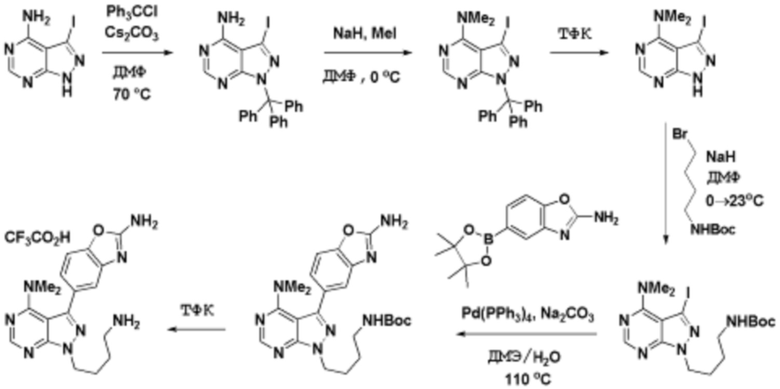
Стадия 1: Синтез 3-йод-1-тритил-1H-пиразоло[3,4-d]пиримидин-4-амина
Суспензию 3-йод-1H-пиразоло[3,4-d]пиримидин-4-амина (10,5 г, 40,23 ммоль, 1,0 эквив.) в ДМФ (170,0 мл) обрабатывают Cs2CO3 (19,7 г, 60,34 ммоль, 1,5 эквив.) и [хлор(дифенил)метил]бензолом (13,5 г, 48,27 ммоль, 1,2 эквив.) при комнатной температуре. Реакционную смесь перемешивают при 70°C в течение 4 ч в атмосфере азота. Реакционную смесь добавляют к H2O (1200 мл). Осадок фильтруют и промывают H2O. Остаток очищают хроматографией на силикагеле (0→60% E-Ac/петролейный эфир) с получением 3-йод-1-тритил-1H-пиразоло[3,4-d]пиримидин-4-амина (15,40 г, 73,5% выход) в виде белого твердого вещества.
Стадия 2: Синтез 3-йод-N, N-диметил-1-тритил-1H-пиразоло[3,4-d]пиримидин-4-амина
К суспензии NaH (2,98 г, 74,50 ммоль, 60% масс.,2,5 эквив.) в ДМФ (150 мл) добавляют раствор 3-йод-1-тритил-1H-пиразоло[3,4-d]пиримидин-4-амина (15,0 г, 29,80 ммоль, 1,0 эквив.) в ДМФ (50 мл) при 0°C. Смесь перемешивают при 0°C в течение 10 мин. К реакционной смеси затем добавляют йодметан (16,92 г, 119,20 ммоль, 7,42 мл, 4,0 эквив.) при 0°C. Смесь перемешивают при комнатной температуре в течение 2 ч, в этот момент добавляют H2O (1400 мл) при 0°C. Смесь перемешивают в течение еще 10 мин при 0°C. Полученный осадок собирают фильтрацией с получением неочищенного продукта, который очищают хроматографией на силикагеле (1%→25% E-Ac/петролейный эфир) дважды с получением 3-йод-N, N-диметил-1-тритил-1H-пиразоло[3,4-d]пиримидин-4-амина (9,0 г, 89% выход) в виде белого твердого вещества.
Стадия 3: Синтез 3-йод-N, N-диметил-1H-пиразоло[3,4-d]пиримидин-4-амина
К охлаждаемому раствору ТФК (19,1 мл, 258,1 ммоль, 15,0 эквив.) в ДХМ (100,0 мл) добавляют 3-йод-N, N-диметил-1-тритил-1H-пиразоло[3,4-d]пиримидин-4-амин (9,10 г, 17,12 ммоль, 1,0 эквив.) при 4°C. Смесь перемешивают при комнатной температуре в течение 1 ч. Остаток выливают в H2O (100 мл), и водную фазу экстрагируют ДХМ (2×50 мл). К водной фазе затем добавляют насыщенный водный раствор NaHCO3 до тех пор, пока раствор не примет pH 8. Полученный осадок собирают фильтрацией с получением 3-йод-N, N-диметил-1H-пиразоло[3,4-d]пиримидин-4-амина (3,40 г, 68,7% выход) в виде белого твердого вещества.
Стадия 4: Синтез трет-бутил (4-(4-(диметиламино)-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата
К суспензии 3-йод-N, N-диметил-1H-пиразоло[3,4-d]пиримидин-4-амина (1,7 г, 5,88 ммоль, 1,0 эквив.) в ДМФ (20 мл) добавляют NaH (247 мг, 6,17 ммоль, 60% масс.,1,05 эквив.) при 4°C. Смесь перемешивают при 4°C в течение 30 мин. К реакционной смеси затем добавляют трет-бутил N-(4-бромбутил)карбамат (2,22 г, 8,82 ммоль, 1,81 мл, 1,5 эквив.) в ДМФ (10 мл) при 4°C. Смесь перемешивают при комнатной температуре в течение 2 ч. К смеси затем добавляют H2O (100 мл) при 4°C. Смесь перемешивают в течение дополнительных 30 мин при 4°C, и полученный осадок собирают фильтрацией с получением неочищенного продукта. Остаток очищают хроматографией на силикагеле (0→75% E-Ac/петролейный эфир) с получением трет-бутил(4-(4-(диметиламино)-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата (2,0 г, 56% выход) в виде белого твердого вещества.
Стадия 5: Синтез трет-бутил (4-(3-(2-аминобензо[d]оксазол-5-ил)-4-(диметиламино)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата
К двухфазной суспензии трет-бутил (4-(4-(диметиламино)-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата (4,0 г, 8,69 ммоль, 1,0 эквив.), 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол-2-амина (3,4 г, 13,03 ммоль, 1,5 эквив.) и Na2CO3 (4,6 г, 43,45 ммоль, 5,0 эквив.) в ДМЭ (80,0 мл) и H2O (40,0 мл) добавляют Pd(PPh3)4 (1,0 г, 868,98 мкмоль, 0,1 эквив.) при комнатной температуре под N2. Смесь перемешивают при 110°C в течение 3 ч. Реакционную смесь затем охлаждают и разделяют между E-Ac (300 мл) и H2O (600 мл). Водный слой отделяют и экстрагируют E-Ac (2×100 мл). Органические слои объединяют, промывают насыщенным раствором соли (2×60 мл) и сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Неочищенный продукт очищают хроматографией на колонке с силикагелем (50% E-Ac/гексан, затем 20% MeOH/E-Ac). Желаемые фракции объединяют и концентрируют при пониженном давлении с получением трет-бутил (4-(3-(2-аминобензо[d]оксазол-5-ил)-4-(диметиламино)-1H-пиразоло[3,4-d]пирамидин-1-ил)бутил)карбамата (3,2 г, 78,9% выход) в виде светло-коричневого твердого вещества.
Стадия 6: Синтез 5-(1-(4-аминобутил)-4-(диметиламино)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амина
К ТФК (20,82 мл, 281,27 ммоль, 36,5 эквив.) добавляют трет-бутил (4-(3-(2-аминобензо[d]оксазол-5-ил)-4-(диметиламино)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамат (3,6 г, 7,72 ммоль, 1,0 эквив.) при комнатной температуре. Смесь перемешивают в течение 30 мин, в этот момент смесь концентрируют при пониженном давлении. Маслянистый остаток растирают с MeCN (8 мл) и МТБЭ (60 мл) в течение 10 мин. Надосадочную жидкость удаляют, и затем осадок собирают фильтрацией под N2 с получением 5-(1-(4-аминобутил)-4-(диметиламино)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амина (4,0 г, неочищенный, ТФК) в виде светло-коричневого твердого вещества.
К 1M NaOH (107,2 мл, 14,7 эквив.) добавляют 5-(1-(4-аминобутил)-4-(диметиламино)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амина (3,5 г, неочищенный, ТФК) при комнатной температуре. Смесь перемешивают в течение 10 мин, и затем водную фазу экстрагируют ДХМ (3×50 мл). Объединенную органическую фазу промывают насыщенным раствором соли (50 мл), сушат с безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. ТФК (539,37 мкл, 7,28 ммоль, 1,0 эквив.) добавляют и концентрируют при пониженном давлении. Затем добавляют MeCN (10 мл), затем МТБЭ (150 мл). Полученный осадок собирают фильтрацией с получением 5-(1-(4-аминобутил)-4-(диметиламино)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амина (1,3 г, 36,6% выход, ТФК) в виде светло-коричневого продукта. ЖХМС (ИЭР) m/z: [M+H] рассч. для C18H22N8O: 367,19; найдено 367,1.
Мономер N. 6-(4-амино-1-(4-аминобутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо-[d]изоксазол-3-амин соль трифторуксусной кислоты.
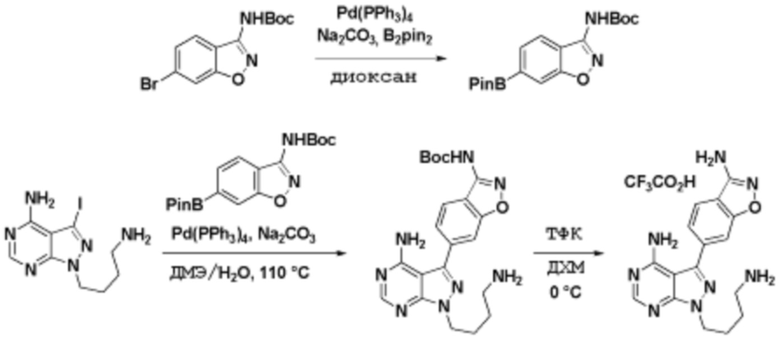
Стадия 1: Синтез трет-бутил (6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]изоксазол-3-ил)карбамата
К раствору трет-бутил (6-бромбензо[d]изоксазол-3-ил)карбамата (1,0 эквив.) в диоксане добавляют Pd(PPh3)4 (0,1 эквив.), карбонат натрия (6,0 эквив.) и бис(пинаколато)диборон (3,0 эквив.). Реакционную смесь перемешивают и нагревают до завершения, по данным ЖХМС и ТСХ анализа. Реакционную смесь охлаждают при комнатной температуре, гасят насыщ. водн. NaHCO3 и смесь переносят в делительную воронку. Водную фазу экстрагируют E-Ac и органическую фазу промывают насыщ. водн. NaCl, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Желаемый продукт выделяют после очистки хроматографией на силикагеле.
Стадия 2: Синтез трет-бутил (4-(4-амино-3-(3-((трет-бутоксикарбонил)амино)бензо[d]изоксазол-6-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата
К смеси трет-бутил (4-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата (1,0 эквив.) и трет-бутил (6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]изоксазол-3-ил)карбамата (3,0 эквив.) в ДМЭ и H2O добавляют Pd(PPh3)4 (0,1 эквив.) и карбонат натрия (6,0 эквив.). Реакционную смесь нагревают при 80°C до завершения, по данным ЖХМС и ТСХ анализа. Реакционную смесь затем гасят H2O и E-Ac. Смесь переносят в делительную воронку, и водную фазу экстрагируют E-Ac. Органическую фазу промывают насыщ. водн. NaCl, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Желаемый продукт выделяют после хроматографии на силикагеле.
Стадия 3: Синтез 6-(4-амино-1-(4-аминобутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо-[d]изоксазол-3-амина
К раствору трет-бутил (4-(4-амино-3-(3-((трет-бутоксикарбонил)амино)бензо[d]изоксазол-6-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата (1,0 эквив.) в ДХМ при 0°C добавляют ТФК, по каплям. Реакционную смесь перемешивают при 0°C и нагревают до комнатной температуры. После завершения реакции, по данным ЖХМС, реакционную смесь концентрируют при пониженном давлении. Остаток растирают с MeCN, затем добавляют по каплям в МТБЭ более 10 мин. Надосадочную жидкость удаляют, и осадок собирают фильтрацией под N2 с получением 6-(4-амино-1-(4-аминобутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо-[d]изоксазол-3-амина.
Мономер O. 4-(5-(4-морфолино-1-(1-(пиридин-3-илметил)пиперидин-4-ил)-1H-пиразоло[3,4-d]пиримидин-6-ил)-1H-индол-1-ил)бутан-1-амин соль трифторуксусной кислоты.
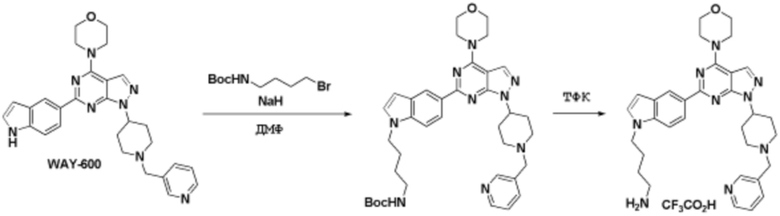
Синтез этого мономера проходит через алкилирование WAY-600 (CAS# 1062159-35-6) с трет-бутил (4-бромбутил)карбаматом в основных условиях, затем снятие защиты Boc с применением ТФК с получением соли ТФК.
Ссылки на получение WAY-600: Discovery of Potent и Selective Inhibi-rs of the Mammalian Target of Rapamycin (mTOR) Kinase: Nowak, P.; Cole, D.C.; Brooijmans, N.; Bursavich, M.G.; Curran, K.J.; Ellingboe, J.W.; Gibbons, J.J.; Hollander, I.; Hu, Y.; Kaplan, J.; Malwitz, D.J.; -ral-Barza, L.; Verheijen, J.C.; Zask, A.; Zhang, W.-G.; Yu, K. 2009; Journal of Medicinal Chemistry Volume 52, Issue 22, 7081-89, который включен сюда в качестве ссылки полностью.
Мономер P. 2-(4-(8-(6-(аминометил)хинолин-3-ил)-3-метил-2-оксо-2,3-дигидро-1H-имидазо[4,5-c]хинолин-1-ил)фенил)-2-метилпропаннитрил соль трифторуксусной кислоты.
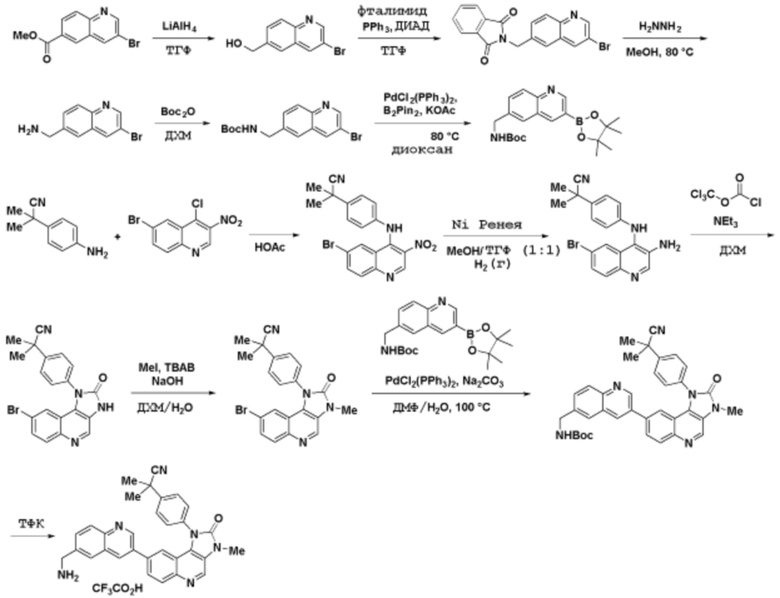
Синтез этого мономера проходит сначала через синтез агента сочетания реакции Сузуки (3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан)хинолин-6-ил)-N-boc-метанамина, начиная с метил 3-бромхинолин-6-карбоксилата. Восстановление метилового эфира алюмогидридом лития с последующей реакцией Мицунобу с фталимидом и гидразиновым расщеплением дает бензильный амин. Защита бензильного амина ди-трет-бутилдикарбонатом с последующей реакцией борилирования Мияуры дает (3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан)хинолин-6-ил)-N-boc-метанамин.
SNAr реакция 2-(4-аминофенил)-2-метилпропаннитрила с 6-бром-4-хлор-3-нитрохинолином дает замещенный аминонитропиридин. Восстановление нитрогруппы Ni Ренея в атмосфере водорода с последующей циклизацией с трихлорметил хлорформиатом дает арилзамещенную мочевину. Замещение свободного N-H мочевины метилйодидом, медиированное бромидом тетрабутиламмония и гидроксидом натрия с последующим сочетанием Сузуки (3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан)хинолин-6-ил)-N-boc-метанамина и затем снятием защиты Boc с применением ТФК дает соль ТФК.
Ссылка на получение 2-[4-(8-бром-3-метил-2-оксо-2,3-дигидроимидазо[4,5-c]хинолин-1-ил)фенил]-2-метилпропионитрил: Vannucchi, A.M.; Bogani, C.; Bartalucci, N. 2016. JAK PI3K/mTOR combination therapy. US9358229. Novartis Pharma AG, Incyte Corporation, который включен сюда в качестве ссылки полностью.
Мономер Q. 8-(6-метоксипиридин-3-ил)-3-метил-1-[4-(пиперазин-1-ил)-3-(трифторметил)фенил]-1H,2H,3H-имидазо[4,5-c]хинолин-2-она
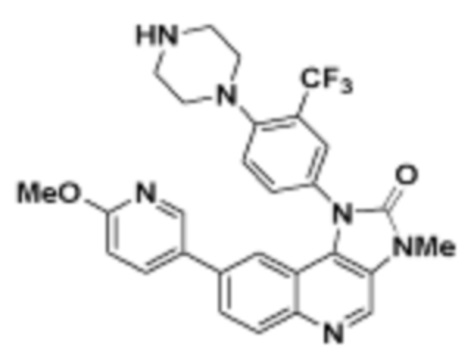
Этот мономер является коммерчески доступным соединением, известным как BGT226(CAS# 1245537-68-1). Во время подготовки этой заявки, он был доступен для покупки от нескольких поставщиков в виде свободного амина.
Мономер R. 3-(4-амино-1-(4-аминобутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)-N-(4,5-дигидротиазол-2-ил)бензамид соль трифторуксусной кислоты.
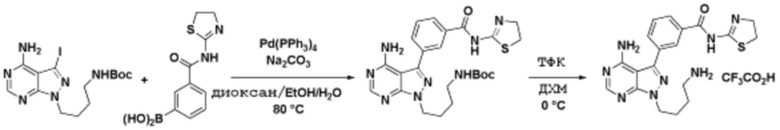
Стадия 1: Синтез трет-бутил (4-(4-амино-3-(3-((4,5-дигидротиазол-2-ил)карбамоил)фенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамат
К раствору (3-((4,5-дигидротиазол-2-ил)карбамоил)фенил)бороновой кислоты (500 мг, 1,15 ммоль, 1,0 эквив.) и трет-бутил (4-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата (575 мг, 2,30 ммоль, 2,0 эквив.) в диоксане (19,1 мл), E-H (3,8 мл) и H2O (2,3 мл) добавляют Pd(PPh3)4 (265 мг, 230 мкмоль, 0,2 эквив.) и карбонат натрия (730 мг, 6,89 ммоль, 6,0 эквив.). Реакционную смесь обрабатывают ультразвуком до образования прозрачного желтого раствора, который затем нагревают при 80°C в течение 14 ч. Реакционную смесь затем разбавляют насыщ. водн. NaCl (30 мл), и смесь переносят в делительную воронку. Водную фазу экстрагируют ДХМ (3×25 мл). Объединенные органические фазы сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Желаемый продукт выделяют в виде желтого твердого вещества (324 мг, 53% выход) после хроматографии на силикагеле (0→15% MeOH/ДХМ). ЖХМС (ИЭР) m/z: [M+H] рассч. для C24H30N8O3S: 511,22; найдено 511,2.
Стадия 2: Синтез 3-(4-амино-1-(4-аминобутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)-N-(4,5-дигидротиазол-2-ил)бензамида
К раствору трет-бутил (4-(4-амино-3-(3-((4,5-дигидротиазол-2-ил)карбамоил)фенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата (324 мг, 614 мкмоль) в ДХМ (4,1 мл) при 0°C добавляют ТФК (1,5 мл), по каплям. Через 1 ч, реакционную смесь нагревают до комнатной температуры и концентрируют при пониженном давлении с получением трифторацетата продукта в виде желтого твердого вещества (320 мг, 99%). Применяется без дальнейшей очистки. ЖХМС (ИЭР) m/z: [M+H] рассч. для C19H22N8OS: 411,16; найдено 411,1
Мономер S. 2-(5-(4-морфолино-1-(1-(пиридин-3-илметил)пиперидин-4-ил)-1H-пиразоло[3,4-d]пиримидин-6-ил)-1H-индол-3-ил)этан-1-амин.
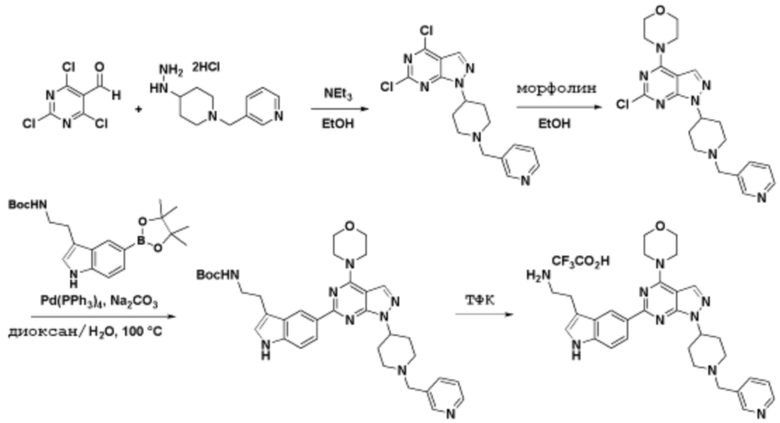
Синтез этого мономера проводят через конденсацию 2,4,6-трихлорпиримидин-5-карбальдегида с гидрохлоридом 3-((4-гидразинеилпиперидин-1-ил)метил)пиридина. Реакция продукта с морфолином с последующей реакцией Сузуки с бороновым эфиром дает Boc-защищенный амин. Конечное снятие защиты с ТФК дает мономер. Этот способ синтеза практически в точности следует описанному получению высоко родственных структур в следующих ссылках: i) Nowak, Pawel; Cole, Derek C.; Brooijmans, Natasja; Curran, Kevin J.; Ellingboe, John W.; Gibbons, James J.; Hollander, Irwin; Hu, Yong Bo; Kaplan, Joshua; Malwitz, David J.; et al From Journal of Medicinal Chemistry (2009), 52(22),7081-7089. ii) Zask, Arie; Nowak, Pawel Wojciech; Verheijen, Jeroen; Curran, Kevin J.; Kaplan, Joshua; Malwitz, David; Bursavich, Matthew Gregory; Cole, Derek Cecil; Ayral-Kaloustian, Semiramis; Yu, Ker; et al. From PCT Int. Appl.(2008),WO2008115974A220080925, которые включены сюда в качестве ссылки.
Мономер T. 1-(4-аминобутил)-3-йод-1H-пиразоло[3,4-d]пиримидин-4-амин соль трифторуксусной кислоты.
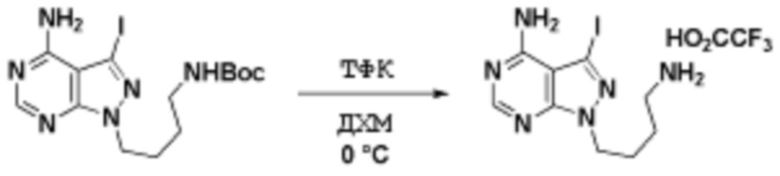
К смеси трет-бутил (4-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)карбамата (496 мг, 1,14 ммоль, 1,0 эквив.) в ДХМ (5,7 мл) при 0°C добавляют ТФК (1,5 мл) по каплям. Реакционную смесь перемешивают при 0°C в течение 1 ч, в это время реакционную смесь концентрируют при пониженном давлении с получением желтого твердого вещества (505 мг, 99% выход), которое берут без дальнейшей очистки. ЖХМС (ИЭР) m/z: [M+H] рассч. для C9H13IN6: 333,02; найдено 332,9.
Мономер U. 5-(4-амино-1-(4-(метиламино)бутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амин соль трифторуксусной кислоты.
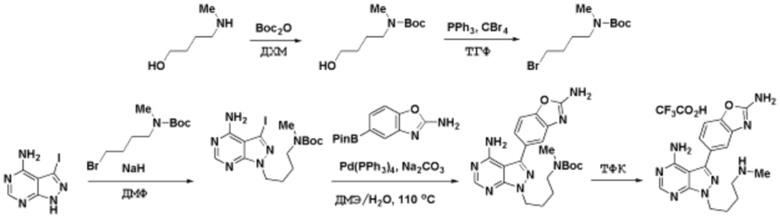
Стадия 1: Синтез трет-бутил (4-гидроксибутил)(метил)карбамата
К раствору 4-(метиламино)бутан-1-ола (0,5 г, 4,85 ммоль, 104,2 мл, 1,0 эквив.) в ДХМ (10 мл) при комнатной температуре добавляют Boc2O (1,06 г, 4,85 ммоль, 1,11 мл, 1,0 эквив.). Смесь перемешивают в течение 3 ч при комнатной температуре, и затем смесь концентрируют при пониженном давлении при 30°C. Остаток очищают хроматографией на силикагеле (100/1-3/1 петролейный эфир/E-Ac) с получением трет-бутил (4-гидроксибутил)(метил)карбамата (0,9 г, 91,4% выход) в виде бесцветного масла.
Стадия 2: Синтез трет-бутил (4-бромбутил)(метил)карбамата
К раствору трет-бутил (4-гидроксибутил)(метил)карбамата (0,9 г, 4,43 ммоль, 1,0 эквив.) в ТГФ (20 мл) при комнатной температуре добавляют PPh3 (2,21 г, 8,41 ммоль, 1,9 эквив.) и CBr4 (2,79 г, 8,41 ммоль, 1,9 эквив.). Смесь перемешивают в течение 1 ч, и затем реакционную смесь фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (1/0-4/1 петролейный эфир/E-Ac) с получением трет-бутил (4-бромбутил)(метил)карбамата (1,1 г, 93,3% выход) в виде бесцветного масла.
Стадия 3: Синтез трет-бутил (4-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)(метил)карбамата
К суспензии 3-йод-1H-пиразоло[3,4-d]пиримидин-4-амина (0,9 г, 3,45 ммоль, 1,0 эквив.) в ДМФ (10 мл) при 4°C добавляют NaH (137,92 мг, 3,45 ммоль, 60% масс.,1,0 эквив.). Смесь перемешивают при 4°C в течение 30 мин и затем добавляют раствор трет-бутил (4-бромбутил)(метил)карбамата (1,01 г, 3,79 ммоль, 25,92 мл, 1,1 эквив.) в ДМФ (3 мл). Смесь перемешивают при комнатной температуре в течение 3 ч, в этот момент добавляют H2O (100 мл). Водную фазу экстрагируют E-Ac (3×30 мл), и объединенные органические фазы промывают насыщенным раствором соли (20 мл), сушат с безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (1/0-0/1 петролейный эфир/E-Ac) с получением трет-бутил (4-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)(метил)карбамата (1,2 г, 78% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C15H23IN6O2: 447,10; найдено 447,1.
Стадия 4: Синтез трет-бутил (4-(4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)(метил)карбамата
К двухфазной суспензии трет-бутил (4-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)(метил)карбамата (1,2 г, 2,69 ммоль, 1,0 эквив.), 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол-2-амина (1,19 г, 3,23 ммоль, 1,2 эквив.) и Na2CO3 (1,42 г, 13,44 ммоль, 5,0 эквив.) в ДМЭ (20 мл) и H2O (10 мл) при комнатной температуре добавляют Pd(PPh3)4 (310,71 мг, 268,89 мкмоль, 0,1 эквив.) под N2. Смесь перемешивают при 110°C в течение 3 ч, и затем реакционную смесь охлаждают и разделяют между E-Ac (20 мл) и H2O (15 мл). Водный слой отделяют и экстрагируют E-Ac (3×20 мл). Объединенные органические слои промывают насыщенным раствором соли (2×20 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Неочищенный продукт очищают хроматографией на силикагеле (1/0-4/1 E-Ac/MeOH) с получением трет-бутил (4-(4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)(метил)карбамата (0,78 г, 62,5% выход) в виде оранжевого твердого вещества.
Стадия 5: Синтез 5-(4-амино-1-(4-(метиламино)бутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амина
Раствор трет-бутил(4-(4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)(метил)карбамата (0,78 г,1,72 ммоль, 1,0 эквив.) в ТФК (5 мл) при комнатной температуре перемешивают в течение 30 мин. Раствор концентрируют при пониженном давлении, и маслянистый остаток растирают с MeCN (1 мл) и затем добавляют к МТБЭ (100 мл). Надосадочную жидкость удаляют, и затем осадок собирают фильтрацией под N2 с получением бис-трифторсульфоната 5-(4-амино-1-(4-(метиламино)бутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амина (0,959 г, 93% выход) в виде оранжевого твердого вещества. ЖХМС (ИЭР) m/z: [M +H] рассч. для C17H20N8O: 353,18; найдено 353,1.
Мономер V. 1-(4-(4-(5-(аминометил)пиримидин-2-ил)пиперазин-1-ил)-3-(трифторметил)фенил)-8-(6-метоксипиридин-3-ил)-3-метил-1,3-дигидро-2H-имидазо[4,5-c]хинолин-2-он.
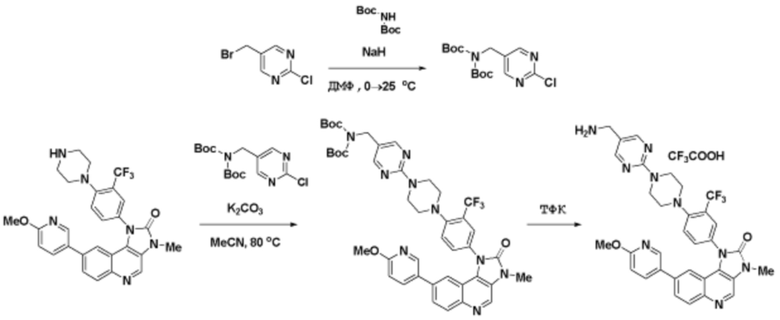
Стадия 1: Синтез трет-бутил N-трет-бутоксикарбонил-N-[(2-хлорпиримидин-5-ил)метил]карбамата
К раствору трет-бутил N-трет-бутоксикарбонилкарбамата (7,33 г, 33,74 ммоль, 1,0 эквив.) в ДМФ (80 мл) добавляют NaH (1,62 г, 40,49 ммоль, 60% масс., 1,2 эквив.) при 0°C. Смесь перемешивают при 0°C в течение 30 мин и затем добавляют 5-(бромметил)-2-хлор-пиримидин (7 г, 33,74 ммоль, 1 эквив.). Реакционную смесь перемешивают при комнатной температуре в течение 1,5 ч, и затем смесь выливают в насыщ. NH4Cl (300 мл) и перемешивают в течение 5 мин. Водную фазу экстрагируют E-Ac (3×80 мл) и объединенные органические фазы промывают насыщенным раствором соли (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (20:1-1:1 петролейный эфир/E-Ac) с получением трет-бутил N-трет-бутоксикарбонил-N-[(2-хлорпиримидин-5-ил)метил]карбамата (7,0 г, 60,3% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C15H22ClN3O4: 344,14; найдено 344,2.
Стадия 2: Синтез трет-бутил N-трет-бутоксикарбонил-N-[[2-[4-[4-[8-(6-метокси-3-пиридил)-3-метил-2-оксо-имидазо[4,5-c]хинолин-1-ил]-2-(трифторметил)фенил]пиперазин-1-ил]пиримидин-5-ил]метил]карбамата
К раствору 8-(6-метокси-3-пиридил)-3-метил-1-[4-пиперазин-1-ил-3-(трифторметил)фенил]имидазо[4,5-c]хинолин-2-она (0,4 г, 748,32 мкмоль, 1,0 эквив.) в MeCN (7 мл) добавляют трет-бутил N-трет-бутоксикарбонил-N-[(2-хлорпиримидин-5-ил)метил]карбамат (514,55 мг, 1,50 ммоль, 2,0 эквив.) и K2CO3 (413,69 мг, 2,99 ммоль, 4 эквив.) при комнатной температуре. Реакционную смесь перемешивают при 80°C в течение 14 ч, и затем смесь охлаждают при комнатной температуре, фильтруют и концентрируют при пониженном давлении. Остаток очищают промыванием с МТБЭ (5 мл) с получением трет-бутил N-трет-бутоксикарбонил-N-[[2-[4-[4-[8-(6-метокси-3-пиридил)-3-метил-2-оксо-имидазо[4,5-c]хинолин-1-ил]-2-(трифторметил)фенил]пиперазин-1-ил]пиримидин-5-ил]метил]карбамата (0,57 г, 90,5% выход) в виде светло-желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C43H46F3N9O6: 842,36; найдено 842,7
Стадия 3: Синтез 1-[4-[4-[5-(аминометил)пиримидин-2-ил]пиперазин-1-ил]-3-(трифторметил)фенил]-8-(6-метокси-3-пиридил)-3-метилимидазо[4,5-c]хинолин-2-она
Раствор трет-бутил N-трет-бутоксикарбонил-N-[[2-[4-[4-[8-(6-метокси-3-пиридил)-3-метил-2-оксоимидазо[4,5-c]хинолин-1-ил]-2-(трифторметил)фенил]пиперазин-1-ил]пиримидин-5-ил]метил]карбамата (0,95 г, 1,13 ммоль, 1 эквив.) в ТФК (10 мл) перемешивают при комнатной температуре в течение 1 ч, в этот момент растворитель концентрируют при пониженном давлении. Остаток растворяют в MeCN (10 мл) и затем раствор добавляют к МТБЭ (150 мл), по каплям. Осадок собирают с получением трифторметансульфоната 1-[4-[4-[5-(аминометил)пиримидин-2-ил]пиперазин-1-ил]-3-(трифторметил)фенил]-8-(6-метокси-3-пиридил)-3-метилимидазо[4,5-c]хинолин-2-она (0,778 г, 84,8% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C33H30F3N9O2: 642,26; найдено 642,4
Мономер W. 1-(4-аминобутил)-3-(1H-пирроло[2,3-b]пиридин-5-ил)пиразоло[3,4-d]пиримидин-4-амин.
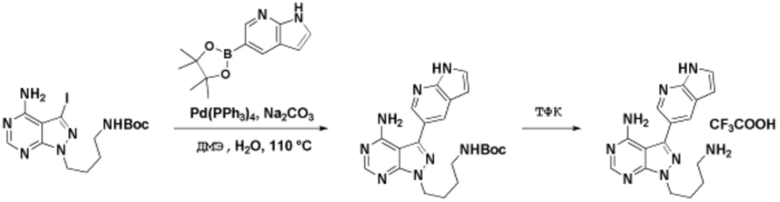
Стадия 1: Синтез трет-бутил N-[4-[4-амино-3-(1H-индол-5-ил)пиразоло[3,4-d]пиримидин-1-ил]бутил]карбамата
К двухфазной суспензии трет-бутил N-[4-(4-амино-3-йодпиразоло[3,4-d]пиримидин-1-ил)бутил]карбамата (8 г, 18,51 ммоль, 1 эквив.), 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридина (5,42 г, 22,21 ммоль, 1,2 эквив.) и Na2CO3 (9,81 г, 92,54 ммоль, 5 эквив.) в диглиме (160 мл) и H2O (80 мл) добавляют Pd(PPh3)4 (2,14 г, 1,85 ммоль, 0,1 эквив.) при комнатной температуре под N2. Смесь перемешивают при 110°C в течение 3 ч. Реакционную смесь охлаждают при комнатной температуре, фильтруют, и фильтрат разделяют между E-Ac (500 мл) и H2O (500 мл). Водный слой отделяют и экстрагируют E-Ac (3×300 мл). Органические слои объединяют, промывают насыщенным раствором соли (20 мл) и сушат над безводным Na2SO4, затем фильтруют, и фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (1/0-0/1 петролейный эфир/E-Ac, затем 4/1 E-Ac/MeOH) с получением трет-бутил N-[4-[4-амино-3-(1H-индол-5-ил)пиразоло[3,4-d]пиримидин-1-ил]бутил]карбамата (6,6 г, 84,6% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C22H27N7O2: 422,22; найдено 423,3.
Стадия 2: Синтез 1-(4-аминобутил)-3-(1H-пирроло[2,3-b]пиридин-5-ил)пиразоло[3,4-d]пиримидин-4-амина
К трет-бутил N-[4-[4-амино-3-(1H-индол-5-ил)пиразоло[3,4-d]пиримидин-1-ил]бутил]карбамату (6,6 г, 15,66 ммоль, 1 эквив.) добавляют ТФК (66 мл), который затем перемешивают при комнатной температуре в течение 30 мин. Реакционный раствор концентрируют при пониженном давлении для удаления ТФК, и затем МТБЭ (400 мл) добавляют к остатку. Суспензию перемешивают в течение 15 мин, в этот момент желтое твердое вещество фильтруют, и твердую лепешку сушат при пониженном давлении с получением 1-(4-аминобутил)-3-(1H-пирроло[2,3-b]пиридин-5-ил)пиразоло[3,4-d]пиримидин-4-амина (10,2 г, 97,1% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C16H18N8: 323,17; найдено 323,1.
Мономер X. 2-(4-амино-1-((1,2,3,4-тетрагидроизохинолин-6-ил)метил)-1H-пиразоло[3,4-d]пиримидин-3-ил)-1H-индол-5-ол 2,2,2-трифторацетат.
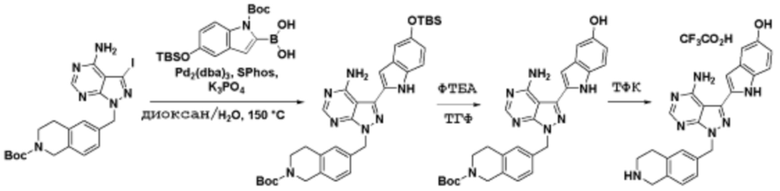
Стадия 1: Синтез трет-бутил 6-((4-амино-3-(5-((трет-бутилдиметилсилил)окси)-1H-индол-2-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата
К раствору трет-бутил 6-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата (1 г, 1,97 ммоль, 1,0 эквив.) в диоксане (10,5 мл) и H2O (3,5 мл) добавляют (1-(трет-бутоксикарбонил)-5-((трет-бутилдиметилсилил)окси)-1H-индол-2-ил)бороновую кислоту (1,16 г, 2,96 ммоль, 1,5 эквив.), K3PO4 (1,26 г, 5,92 ммоль, 3,0 эквив.), Pd2(dba)3 (180,85 мг, 197,50 мкмоль, 0,1 эквив.) и SPhos (162,16 мг, 394,99 мкмоль, 0,2 эквив.) при комнатной температуре под N2. Герметично закрытую пробирку нагревают при 150°C в течение 20 мин под микроволнами. Реакционную смесь затем охлаждают, и 6 отдельных партий объединяют вместе. Реакционную смесь разделяют между E-Ac (100 мл) и H2O(100 мл). Водный слой отделяют и экстрагируют E-Ac (3×80 мл). Органические слои объединяют, промывают насыщенным раствором соли (100 мл) и сушат над безводным Na2SO4. Раствор фильтруют, и фильтрат концентрируют при пониженном давлении. Неочищенный продукт очищают хроматографией на колонке с силикагелем (100/1-1/4 петролейный эфир/E-Ac) с получением трет-бутил 6-((4-амино-3-(5-((трет-бутилдиметилсилил)окси)-1H-индол-2-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата (6,17 г, 82,9% выход) в виде светло-желтого твердого вещества.
Стадия 2: Синтез трет-бутил 6-((4-амино-3-(5-гидрокси-1H-индол-2-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата
К смеси трет-бутил 6-((4-амино-3-(5-((трет-бутилдиметилсилил)окси)-1H-индол-2-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата (6,17 г, 9,86 ммоль, 1,0 эквив.) в ТГФ (100 мл) добавляют тригидрат фторида тетрабутиламмония (1 M, 10,84 мл, 1,1 эквив.) одной порцией при 0°C под N2. Смесь перемешивают при 0°C в течение 1 h и затем добавляют к H2O (100 мл). Водную фазу экстрагируют E-Ac (3×80 мл), и объединенную органическую фазу промывают насыщенным раствором соли (2×80 мл), сушат с безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (1/1-0/1 петролейный эфир/E-Ac) с получением трет-бутил 6-((4-амино-3-(5-гидрокси-1H-индол-2-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата (4 г, 79,3% выход) в виде светло-розового твердого вещества. ЖХМС (ИЭР)m/z: [M+H] рассч. для C28H29N7O3: 512,24; найдено 512,3.
Стадия 3: Синтез 2,2,2-трифторацетата 2-(4-амино-1-((1,2,3,4-тетрагидроизохинолин-6-ил)метил)-1H-пиразоло[3,4-d]пиримидин-3-ил)-1H-индол-5-ола
К раствору трет-бутил 6-((4-амино-3-(5-гидрокси-1H-индол-2-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата (4,5 г, 8,80 ммоль, 1,0 эквив.) в MeOH (50 мл) добавляют HCl в MeOH (4 M, 50 мл, 22,7 эквив.) при комнатной температуре. Смесь перемешивают при комнатной температуре в течение ночи и затем концентрируют при пониженном давлении. К неочищенному продукту добавляют E-Ac (100 мл), и полученный осадок собирают фильтрацией под N2 с получением 2,2,2-трифторацетата 2-(4-амино-1-((1,2,3,4-тетрагидроизохинолин-6-ил)метил)-1H-пиразоло[3,4-d]пиримидин-3-ил)-1H-индол-5-ола (4,1 г, 85,0% выход, 3HCl) в виде светло-желтого твердого вещества. ЖХМС (ИЭР)m/z: [M+H] рассч. для C23H21N7O: 412,19; найдено 412,1.
Мономер Y. 2,2,2-трифторацетата 3-(1H-пирроло[2,3-b]пиридин-5-ил)-1-((1,2,3,4-тетрагидроизохинолин-6-ил)метил)-1H-пиразоло[3,4-d]пиримидин-4-амина.
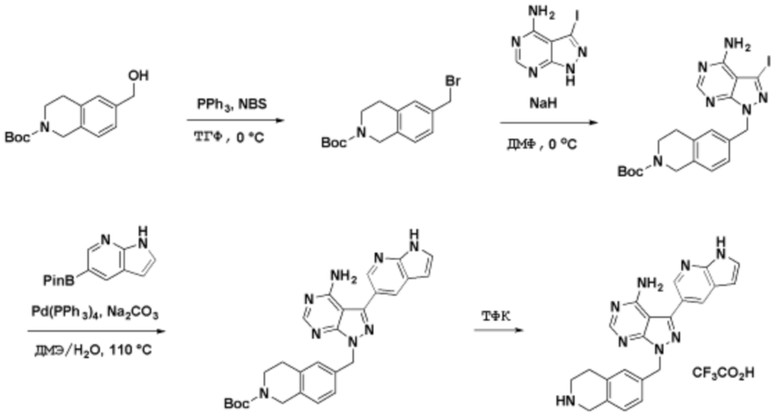
Стадия 1: Синтез трет-бутил 6-(бромметил)-3,4-дигидроизохинолин-2(1H)-карбоксилата
Раствор NBS (34,07 г, 191,39 ммоль, 4 эквив.) в ТГФ (200 мл) добавляют порциями к раствору трет-бутил 6-(гидроксиметил)-3,4-дигидроизохинолин-2(1H)-карбоксилата (12,6 г, 47,85 ммоль, 1,0 эквив.) и трифенилфосфина (37,65 г, 143,55 ммоль, 3,0 эквив.) в ТГФ (200 мл) при 0°C. После завершения добавления, смесь перемешивают в течение 1 ч при комнатной температуре. Добавляют E-Ac (150 мл), и смесь промывают H2O (200 мл) и насыщенным раствором соли (150 мл), сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (100/1-10/1 петролейный эфир/E-Ac) с получением трет-бутил 6-(бромметил)-3,4-дигидроизохинолин-2(1H)-карбоксилата (8,56 г, 54,8% выход) в виде светло-желтого твердого вещества.
Стадия 2: Синтез трет-бутил 6-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата
К суспензии 3-йод-1H-пиразоло[3,4-d]пиримидин-4-амина (9,5 г, 36,40 ммоль, 1,0 эквив.) в ДМФ (110 мл) добавляют NaH (1,46 г, 36,40 ммоль, 60% масс., 1,0 эквив.) при 0°C. Смесь перемешивают при 0°C в течение 30 мин, в этот момент раствор трет-бутил 6-(бромметил)-3,4-дигидроизохинолин-2(1H)-карбоксилата (12,47 г, 38,22 ммоль, 1,05 эквив.) в ДМФ (40 мл) добавляют при 0°C. Смесь перемешивают при комнатной температуре в течение 1 ч и затем добавляют H2O (1000 мл) при 0°C. Смесь перемешивают при 0°C в течение 30 мин, и затем полученный осадок собирают фильтрацией с получением трет-бутил 6-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата (17,8 г, 76,3% выход) в виде светло-желтого твердого вещества, которое применяют сразу на следующей стадии. ЖХМС (ИЭР) m/z: [M+H] рассч. для C20H23IN6O2: 507,10; найдено 507,1.
Стадия 3: Синтез трет-бутил 6-((4-амино-3-(1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата
К двухфазной суспензии трет-бутил 6-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата (6,5 г, 10,14 ммоль, 1,0 эквив.), 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридина (2,97 г, 12,16 ммоль, 1,2 эквив.) и Na2CO3 (5,37 г, 50,68 ммоль, 5,0 эквив.) в диглиме (100 мл) и H2O (50 мл) добавляют Pd(PPh3)4 (1,17 г, 1,01 ммоль, 0,1 эквив.) при комнатной температуре под N2. Смесь перемешивают при 110°C в течение 3 ч. Реакционную смесь затем охлаждают и разделяют между E-Ac (100 мл) и H2O (100 мл). Водный слой отделяют и экстрагируют E- (2×100 мл). Объединенную органическую фазу промывают насыщенным раствором соли (100 мл), сушат с безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (0/1-1/4 MeOH/E-Ac) с получением трет-бутил 6-((4-амино-3-(1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиразоло[3,4-d]пирамидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата (3,77 г, 72,1% выход) в виде светло-желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C27H28N8O2: 497,24; найдено 497,3.
Стадия 4: Синтез 2,2,2-трифторацетата 3-(1H-пирроло[2,3-b]пиридин-5-ил)-1-((1,2,3,4-тетрагидроизохинолин-6-ил)метил)-1H-пиразоло[3,4-d]пиримидин-4-амина
трет-Бутил 6-((4-амино-3-(1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилат (3,77 г, 7,59 ммоль, 1,0 эквив.) добавляют к ТФК (85,36 мл, 1,15 моль, 151,8 эквив.) при комнатной температуре. Реакционную смесь перемешивают в течение 1 ч. Затем ее концентрируют при пониженном давлении, и маслянистый остаток растирают с MeCN (3 мл), затем капают в МТБЭ (200 мл) в течение 5 мин. Надосадочную жидкость удаляют, и затем осадок собирают фильтрацией под N2 с получением продукта, который растворяют в MeCN (20 мл) и, наконец, концентрируют при пониженном давлении с получением 2,2,2-трифторацетата 3-(1H-пирроло[2,3-b]пиридин-5-ил)-1-((1,2,3,4-тетрагидроизохинолин-6-ил)метил)-1H-пиразоло[3,4-d]пиримидин-4-амина (4,84 г, 85,0% выход, 3ТФК) в виде светло-желтого твердого вещества. ЖХМС (ИЭР)m/z: [M+H] рассч. для C22H20N8: 397,19; найдено 397,2.
Мономер Z. 2,2,2-трифторацетата (4-((2-аминоэтил)сульфонил)-3-фтор-2-метилфенил)(7-(6-аминопиридин-3-ил)-2,3-дигидробензо[f][1,4]оксазепин-4(5H)-ил)метанона.
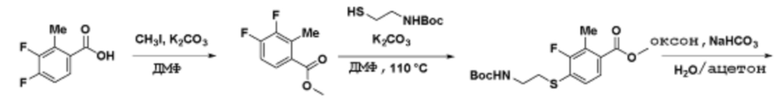
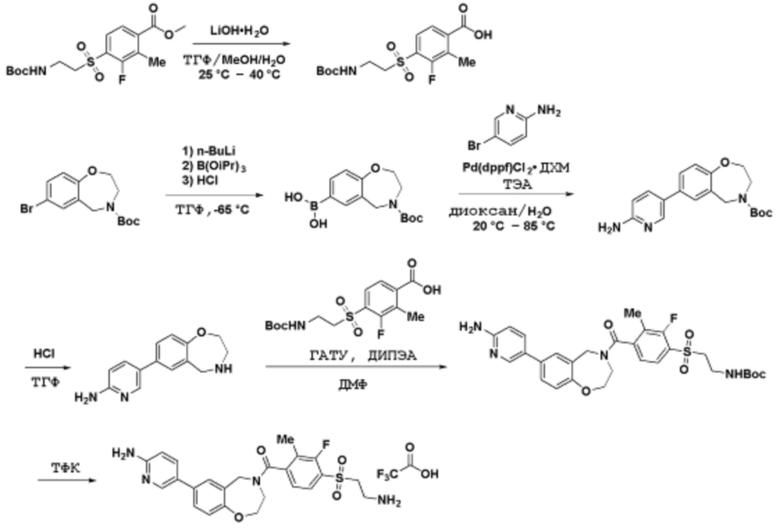
Стадия 1: Синтез метил 3,4-дифтор-2-метилбензоата
К раствору 3,4-дифтор-2-метилбензойной кислоты (2 г, 11,62 ммоль, 1,0 эквив.) в ДМФ (20 мл) добавляют K2CO3 (4,82 г, 34,86 ммоль, 3,0 эквив.) и йодметан (3,26 мл, 52,29 ммоль, 4,5 эквив.) при комнатной температуре. Смесь перемешивают при комнатной температуре в течение 3 ч. Раствор метил 3,4-дифтор-2-метилбензоата в ДМФ (20 мл) используют сразу на следующей стадии.
Стадия 2: Синтез метил 4-((2-((трет-бутоксикарбонил)амино)этил)тио)-3-фтор-2-метилбензоата
К раствору метил 3,4-дифтор-2-метилбензоата (2,16 г, 11,28 ммоль, 1,0 эквив.) в ДМФ (20 мл) добавляют трет-бутил (2-меркаптоэтил)карбамат (2,0 г, 11,28 ммоль, 1 эквив.) и K2CO3 (3,12 г, 22,56 ммоль, 2,0 эквив.) при комнатной температуре. Реакционную смесь перемешивают при 110°C в течение 12 ч, в этот момент смесь добавляют к H2O (50 мл). Водный раствор затем экстрагируют E-Ac (3×30 мл) и органическую фазу объединяют и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (1/0-3/1 петролейный эфир/E-Ac) с получением метил 4-((2-((трет-бутоксикарбонил)амино)этил)тио)-3-фтор-2-метилбензоата (3 г, 76,0% выход) в виде светло-желтого твердого вещества.
Стадия 3: Синтез метил 4-((2-((трет-бутоксикарбонил)амино)этил)сульфонил)-3-фтор-2-метилбензоата
К раствору метил 4-((2-((трет-бутоксикарбонил)амино)этил)тио)-3-фтор-2-метилбензоата (3,3 г, 9,61 ммоль, 1,0 эквив.), NaOH (2 M, 4,80 мл, 1,0 эквив.) и NaHCO3 (2,42 г, 28,83 ммоль, 3,0 эквив.) в ацетоне (30 мл) добавляют пероксимоносульфат калия (12,35 г, 20,08 ммоль, 2,1 эквив.). Смесь перемешивают в течение 12 ч при комнатной температуре, и затем смесь подкисляют до pH 5 добавлением 1N HCl. Водный слой экстрагируют E-Ac (3×30 мл), и объединенную органическую фазу промывают насыщенным раствором соли (20 мл), сушат с безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (1/0-3/1 петролейный эфир/E-Ac) с получением метил 4-((2-((трет-бутоксикарбонил)амино)этил)сульфонил)-3-фтор-2-метилбензоата (2,1 г, 58,2% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M-56 +H] рассч. для C16H22FNO6S: 320,12; найдено 320,1
Стадия 4: Синтез 4-((2-((трет-бутоксикарбонил)амино)этил)сульфонил)-3-фтор-2-метилбензойной кислоты
К раствору метил 4-((2-((трет-бутоксикарбонил)амино)этил)сульфонил)-3-фтор-2-метилбензоата (2,1 г, 5,59 ммоль, 1,0 эквив.) в ТГФ (20 мл), MeOH (10 мл) и H2O (10 мл) добавляют LiOH•H2O (704,16 мг, 16,78 ммоль, 3,0 эквив.) при комнатной температуре. Реакционную смесь перемешивают при 40°C в течение 4 ч. Смесь затем концентрируют при пониженном давлении для удаления ТГФ и MeOH. Водную фазу нейтрализуют 0,5N HCl и затем экстрагируют E-Ac (5×20 мл). Объединенную органическую фазу промывают насыщенным раствором соли (2×20 мл), сушат с безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением 4-((2-((трет-бутоксикарбонил)амино)этил)сульфонил)-3-фтор-2-метилбензойной кислоты (2,01 г, 97,1% выход) в виде белого твердого вещества. ЖХМС (ИЭР)m/z: [M-100+H] рассч. для C15H20FNO6S: 262,11; найдено 262,1.
Стадия 5: Синтез (4-(трет-бутоксикарбонил)-2,3,4,5-тетрагидробензо[f][1,4]оксазепин-7-ил)бороновой кислоты
К раствору трет-бутил 7-бром-2,3-дигидробензо[f][1,4]оксазепин-4(5H)-карбоксилата (4 г, 12,19 ммоль, 1,0 эквив.) в ТГФ (80 мл) при -60°C добавляют B(OiPr)3 (4,58 г, 24,38 ммоль, 5,60 мл, 2,0 эквив.), затем по каплям добавляют n-BuLi (2,5 M, 12,19 мл, 2,5 эквив.) в n-гексане. Реакционную смесь перемешивают при -65°C в течение 1 ч. Реакционную смесь гасят 1N HCl (12,25 мл) и нагревают до комнатной температуры. Реакционную смесь экстрагируют E-Ac (3×30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением (4-(трет-бутоксикарбонил)-2,3,4,5-тетрагидробензо[f][1,4]оксазепин-7-ил)бороновой кислоты (3,5 г, неочищенный) в виде светло-желтого масла, которое применяют сразу на следующей стадии. ЖХМС (ИЭР) m/z: [M-100+H] рассч. для C14H20BNO5: 194,15; найдено 194,2.
Стадия 6: Синтез трет-бутил 7-(6-аминопиридин-3-ил)-2,3-дигидробензо[f][1,4]оксазепин-4(5H)-карбоксилата
К раствору (4-(трет-бутоксикарбонил)-2,3,4,5-тетрагидробензо[f][1,4]оксазепин-7-ил)бороновой кислоты (4,2 г, 14,33 ммоль, 1,0 эквив.) в H2O (20 мл) и диоксане (60 мл) добавляют 5-бромпиридин-2-амин (2,48 г, 14,33 ммоль, 1,0 эквив.), Pd(dppf)Cl2•ДХМ (1,17 г, 1,43 ммоль, 0,1 эквив.) и Et3N (4,35 г, 42,99 ммоль, 5,98 мл, 3,0 эквив.) при комнатной температуре. Смесь перемешивают при 85°C в течение 12 ч. Смесь затем охлаждают при комнатной температуре, и остаток выливают в H2O (15 мл). Водную фазу экстрагируют E-Ac (3×40 мл) и объединенную органическую фазу промывают насыщенным раствором соли (2×40 мл), сушат с безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (1/0-1/8 петролейный эфир/E-Ac) с получением трет-бутил 7-(6-аминопиридин-3-ил)-2,3-дигидробензо[f][1,4]оксазепин-4(5H)-карбоксилата (3,3 г, 65,0% выход) в виде светло-желтого твердого вещества. ЖХМС (ИЭР)m/z: [M+H] рассч. для C19H23N3O3: 342,18; найдено 342,2.
Стадия 7: Синтез 5-(2,3,4,5-тетрагидробензо[f][1,4]оксазепин-7-ил)пиридин-2-амина
К раствору трет-бутил 7-(6-аминопиридин-3-ил)-2,3-дигидробензо[f][1,4]оксазепин-4(5H)-карбоксилата (3,3 г, 9,67 ммоль, 1,0 эквив.) в ТГФ (40 мл) добавляют HCl в E-Ac (4 M, 100 мл, 41,38 эквив.) при комнатной температуре. Смесь перемешивают в течение 3 ч. Реакционную смесь фильтруют и фильтровальную лепешку промывают E-Ac (3×15 мл) и затем сушат при пониженном давлении с получением 5-(2,3,4,5-тетрагидробензо[f][1,4]оксазепин-7-ил)пиридин-2-амина (3 г, 95,1% выход, 2HCl) в виде светло-желтого твердого вещества.
Стадия 8: Синтез трет-бутил (2-((4-(7-(6-аминопиридин-3-ил)-2,3,4,5-тетрагидробензо[f][1,4]оксазепин-4-карбонил)-2-фтор-3-метилфенил)сульфонил)этил)карбамата
К раствору 4-((2-((трет-бутоксикарбонил)амино)этил)сульфонил)-3-фтор-2-метилбензойной кислоты (690,08 мг, 1,91 ммоль, 1,0 эквив.) в ДМФ (10 мл) добавляют ГАТУ (1,09 г, 2,86 ммоль, 1,5 эквив.) и ДИПЭА (1,66 мл, 9,55 ммоль, 5 эквив.). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин, и добавляют затем 5-(2,3,4,5-тетрагидробензо[f][1,4]оксазепин-7-ил)пиридин-2-амин (0,6 г, 1,91 ммоль, 1,0 эквив., 2 HCl). Смесь перемешивают в течение 2 ч, в этот момент добавляют H2O (40 мл). Смесь перемешивают в течение 5 мин, и полученный осадок собирают фильтрацией с получением неочищенного продукта. Остаток очищают хроматографией на силикагеле (1/0-10/1 E-Ac/MeOH) с получением трет-бутил (2-((4-(7-(6-аминопиридин-3-ил)-2,3,4,5-тетрагидробензо[f][1,4]оксазепин-4-карбонил)-2-фтор-3-метилфенил)сульфонил)этил)карбамата (0,538 г, 47,4% выход) в виде светло-желтого твердого вещества. ЖХМС (ИЭР)m/z: [M+H] рассч. для C29H33FN4O6S: 585,22; найдено 585,3.
Стадия 9: Синтез 2,2,2-трифторацетата (4-((2-аминоэтил)сульфонил)-3-фтор-2-метилфенил)(7-(6-аминопиридин-3-ил)-2,3-дигидробензо[f][1,4]оксазепин-4(5H)-ил)метанона
Раствор трет-бутил (2-((4-(7-(6-аминопиридин-3-ил)-2,3,4,5-тетрагидробензо[f][1,4]оксазепин-4-карбонил)-2-фтор-3-метилфенил)сульфонил)этил)карбамата (0,538 г, 920,20 мкмоль, 1,0 эквив.) в ТФК (10,35 мл, 139,74 ммоль, 151,85 эквив.) перемешивают при комнатной температуре в течение 2 ч. Раствор затем концентрируют при пониженном давлении. Маслянистый остаток растирают с MeCN (1 мл) и затем капают в МТБЭ (30 мл) в течение 10 мин. Надосадочную жидкость удаляют, и затем осадок собирают фильтрацией под N2 с получением 2,2,2-трифторацетата (4-((2-аминоэтил)сульфонил)-3-фтор-2-метилфенил)(7-(6-аминопиридин-3-ил)-2,3-дигидробензо[f][1,4]оксазепин-4(5H)-ил)метанона (0,50 г, 87,4% выход) в виде светло-коричневого твердого вещества. ЖХМС (ИЭР)m/z: [M+H] рассч. для C24H25FN4O4S: 485,17; найдено 485,1.
Мономер AA. 5-(4-амино-1-(6-(пиперазин-1-ил)пиримидин-4-ил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амин соль трифторуксусной кислоты.
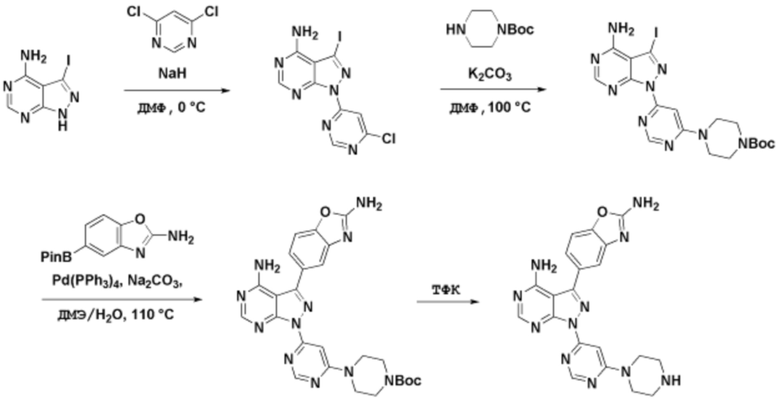
Стадия 1: Синтез 1-(6-хлорпиримидин-4-ил)-3-йод-1H-пиразоло[3,4-d]пиримидин-4-амина
К суспензии 3-йод-1H-пиразоло[3,4-d]пиримидин-4-амина (5 г, 19,16 ммоль, 1,0 эквив.) в ДМФ (60 мл) добавляют NaH (804,53 мг, 20,11 ммоль, 60% масс., 1,05 эквив.) при 0°C. Смесь перемешивают при 0°C в течение 30 мин. К реакционной смеси затем добавляют 4,6-дихлорпиримидин (3,42 г, 22,99 ммоль, 1,2 эквив.) при 0°C. Смесь перемешивают при комнатной температуре в течение 2,5 ч, в этот момент реакционную смесь добавляют к H2O (600 мл). Суспензию затем фильтруют с получением продукта (7,1 г, 99,2% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C9H5ClIN7: 373,94; найдено 373,9.
Стадия 2: Синтез трет-бутил 4-(6-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)пиримидин-4-ил)пиперазин-1-карбоксилата
К раствору 1-(6-хлорпиримидин-4-ил)-3-йод-1H-пиразоло[3,4-d]пиримидин-4-амина (5 г, 13,39 ммоль, 1,0 эквив.) и трет-бутил пиперазин-1-карбоксилата (2,99 г, 16,06 ммоль, 1,2 эквив.) в ДМФ (50 мл) добавляют K2CO3 (3,70 г, 26,77 ммоль, 2,0 эквив.). Реакционную смесь перемешивают при 100°C в течение 4 ч, в этот момент ее добавляют к H2O (500 мл). Суспензию затем фильтруют с получением продукта (6,2 г, 88,5% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C18H22IN9O2: 524,09; найдено 524,2.
Стадия 3: Синтез трет-бутил 4-(6-(4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиримидин-4-ил)пиперазин-1-карбоксилата
К двухфазной суспензии 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол-2-амина (3,08 г, 11,85 ммоль, 1,0 эквив.), трет-бутил 4-(6-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)пиримидин-4-ил)пиперазин-1-карбоксилата (6,2 г, 11,85 ммоль, 1,0 эквив.) и Na2CO3 (6,28 г, 59,24 ммоль, 5,0 эквив.) в H2O (100 мл) и ДМЭ (200 мл) добавляют Pd(PPh3)4 (1,37 г, 1,18 ммоль, 0,1 эквив.) при комнатной температуре под N2. Смесь перемешивают при 110°C в течение 24 ч, и затем смесь фильтруют с получением твердой лепешки. Твердое вещество добавляют к диоксану (20 мл) и перемешивают при 110°C в течение 60 мин, затем фильтруют с получением продукта (3,5 г, 55,8% выход) в виде коричневого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C25H27N11O3: 530,24; найдено 530,3.
Стадия 4: Синтез 5-(4-амино-1-(6-(пиперазин-1-ил)пиримидин-4-ил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амина соли трифторуксусной кислоты
Раствор трет-бутил 4-(6-(4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиримидин-4-ил)пиперазин-1-карбоксилата (3,5 г, 6,61 ммоль, 1,0 эквив.) в ТФК (35 мл) перемешивают при комнатной температуре в течение 1 ч. Реакционный раствор концентрируют при пониженном давлении и полученный неочищенный продукт растворяют в MeCN (20 мл) и добавляют по каплям к МТБЭ (500 мл). Полученное твердое вещество затем фильтруют с получением продукта (5,5 г, 91,9% выход) в виде коричневого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C20H19N11O: 430,19; найдено 430,1.
Мономер AB. 8-(6-метоксипиридин-3-ил)-3-метил-1-(4-(4-(5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-ил)пиперазин-1-ил)-3-(трифторметил)фенил)-1H-имидазо[4,5-c]хинолин-2(3H)-он соль трифторуксусной кислоты.
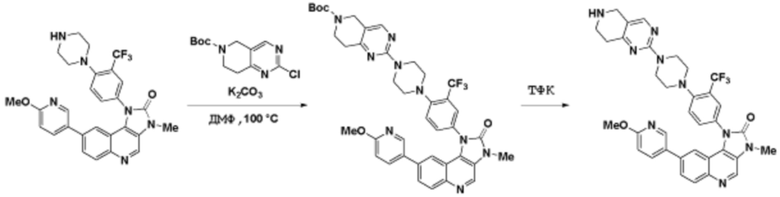
Стадия 1: Синтез трет-бутил 2-(4-(4-(8-(6-метоксипиридин-3-ил)-3-метил-2-оксо-2,3-дигидро-1H-имидазо[4,5-c]хинолин-1-ил)-2-(трифторметил)фенил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата
К смеси 8-(6-метоксипиридин-3-ил)-3-метил-1-(4-(пиперазин-1-ил)-3-(трифторметил)фенил)-1H-имидазо[4,5-c]хинолин-2(3H)-она (0,3 г, 561,24 мкмоль, 1,0 эквив.) и трет-бутил 2-хлор-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (151,38 мг, 561,24 мкмоль, 1,0 эквив.) в ДМФ (5 мл) добавляют K2CO3 (193,92 мг, 1,40 ммоль, 2,5 эквив.). Смесь перемешивают при 100°C в течение 14 ч, в этот момент добавляют H2O (20 мл). Водный слой экстрагируют E-Ac (3×40 мл), и объединенные органические слои концентрируют при пониженном давлении. Неочищенный продукт очищают хроматографией на колонке (30/1-15/1 ДХМ/MeOH) с получением продукта (0,30 г, 69,6% выход) в виде светло-желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C40H40F3N9O4: 768,33; найдено 768,5.
Стадия 2: Синтез 8-(6-метоксипиридин-3-ил)-3-метил-1-(4-(4-(5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-ил)пиперазин-1-ил)-3-(трифторметил)фенил)-1H-имидазо[4,5-c]хинолин-2(3H)-она
Раствор трет-бутил 2-(4-(4-(8-(6-метоксипиридин-3-ил)-3-метил-2-оксо-2,3-дигидро-1H-имидазо[4,5-c]хинолин-1-ил)-2-(трифторметил)фенил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (0,8 г, 1,04 ммоль, 1,0 эквив.) в ТФК (8 мл) перемешивают при комнатной температуре в течение 2 ч. Растворитель концентрируют при пониженном давлении, и остаток растворяют в MeCN (5 мл), затем раствор добавляют по каплям к МТБЭ (150 мл). Осадок фильтруют и твердое вещество сушат при пониженном давлении с получением продукт (600 мг, 70,6% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C35H32F3N9O2: 668,27; найдено 668,3.
Мономер AC. 5-(4-амино-1-(пиперидин-4-илметил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амин соль трифторуксусной кислоты.
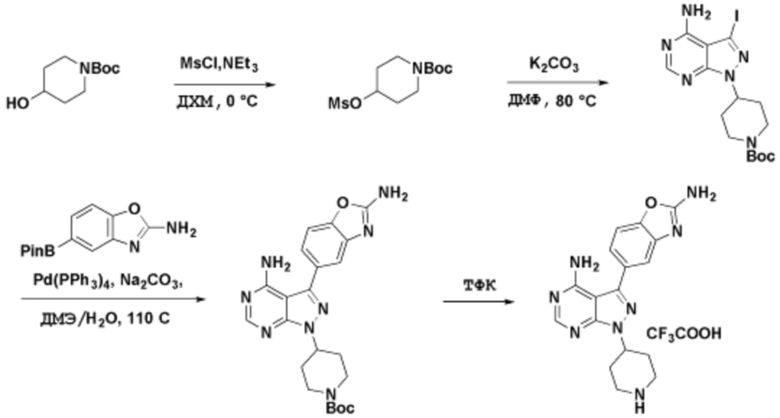
Стадия 1: Синтез трет-бутил 4-((метилсульфонил)окси)пиперидин-1-карбоксилата
К раствору трет-бутил 4-гидроксипиперидин-1-карбоксилата (4 г, 19,87 ммоль, 1,0 эквив.) и Et3N (3,87 мл, 27,82 ммоль, 1,4 эквив.) в ДХМ (40 мл) добавляют MsCl (2,15 мл, 27,82 ммоль, 1,4 эквив.) при 0°C. Затем реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Добавляют H2O (50 мл), и водную фазу экстрагируют ДХМ (3×50 мл). Объединенную органическую фазу промывают насыщенным раствором соли, сушат с безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением продукта (5,62 г, 101% неочищенный выход) в виде желтого твердого вещества, которое используют сразу на следующей стадии.
Стадия 2: Синтез трет-бутил 4-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилата
К суспензии 3-йод-1H-пиразоло[3,4-d]пиримидин-4-амин (5 г, 19,16 ммоль, 1,0 эквив.) и трет-бутил 4-((метилсульфонил)окси)пиперидин-1-карбоксилата (5,62 г, 20,11 ммоль, 1,05 эквив.) в ДМФ (100 мл) добавляют K2CO3 (5,29 г, 38,31 ммоль, 2,0 эквив.). Смесь перемешивают при 80°C в течение 12 ч. Реакционную смесь затем добавляют к H2O (400 мл) при 0°C. Полученный осадок фильтруют с получением продукта (5,0 г, 58,8% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C15H21IN6O2: 445,09; найдено 445,1.
Стадия 3: Синтез трет-бутил 4-(4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилата
К суспензии трет-бутил 4-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилата (5 г, 11,25 ммоль, 1,0 эквив.), 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол-2-амина (3,51 г, 13,51 ммоль, 1,2 эквив.) и Na2CO3 (5,96 г, 56,27 ммоль, 5,0 эквив.) в H2O (50 мл) и ДМЭ (100 мл) добавляют Pd(PPh3)4 (1,30 г, 1,13 ммоль, 0,1 эквив.) при комнатной температуре под N2. Смесь перемешивают при 110°C в течение 3 ч. Реакционную смесь затем охлаждают при комнатной температуре и фильтруют. Фильтрат разделяют между E-Ac (100 мл) и H2O (100 мл), и затем водный слой отделяют и экстрагируют E-Ac (3×100 мл). Объединенный органический слой промывают насыщенным раствором соли (20 мл) и сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток растирают с E-Ac(30 мл) и фильтруют с получением продукта (3,6 г, 71,0% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C22H26N8O3: 451,22; найдено 451,3.
Стадия 4: Синтез 5-(4-амино-1-(пиперидин-4-ил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амина соли трифторуксусной кислоты
Раствор трет-бутил 4-(4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилата (1,4 г, 3,11 ммоль, 1,0 эквив.) в ТФК (10 мл) перемешивают при комнатной температуре в течение 30 мин. Реакционный раствор концентрируют при пониженном давлении, и неочищенное твердое вещество растворяют в MeCN (20 мл). Раствор добавляют по каплям к МТБЭ (100 мл) и полученное твердое вещество фильтруют с получением продукта (1,6 г, 85,8% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C17H18N8O3: 351,17; найдено 351,1.
Мономер AD. 1-(пиперидин-4-ил)-3-(1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиразоло[3,4-d]пиримидин-4-амин соль трифторуксусной кислоты.
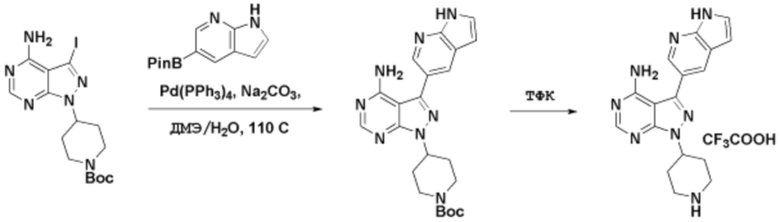
Стадия 1: Синтез трет-бутил 4-(4-амино-3-(1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилата
К суспензии 5-(4,4,5-триметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридина (857,12 мг, 3,51 ммоль, 1,2 эквив.), трет-бутил 4-(4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилата (1,3 г, 2,93 ммоль, 1,0 эквив.) и Na2CO3 (1,55 г, 14,63 ммоль, 5,0 эквив.) в ДМЭ (20 мл) и H2O (10 мл) добавляют Pd(PPh3)4 (338,13 мг, 292,62 мкмоль, 0,1 эквив.) при комнатной температуре под N2. Смесь перемешивают при 110°C в течение 3 ч. Реакционную смесь затем охлаждают при комнатной температуре и фильтруют. Фильтрат разделяют между E-Ac (50 мл) и H2O (50 мл), и водный слой отделяют и экстрагируют E-Ac (3×50 мл). Объединенный органический слой промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток растирают с E-Ac (10 мл), фильтруют, твердую лепешку сушат при пониженном давлении с получением продукта (1,0 г, 78,7% выход) в виде желтого твердого вещества.
Стадия 2: Синтез 1-(пиперидин-4-ил)-3-(1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиразоло[3,4-d]пиримидин-4-амин соль трифторуксусной кислоты
Раствор трет-бутил 4-(4-амино-3-(1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)пиперидин-1-карбоксилата (1,5 г, 3,45 ммоль, 1,0 эквив.) в ТФК (10 мл) перемешивают при комнатной температуре в течение 30 мин. Реакционный раствор концентрируют при пониженном давлении и неочищенный остаток растворяют в MeCN (20 мл). Раствор добавляют по каплям к МТБЭ (100 мл), и полученное твердое вещество фильтруют с получением продукта (1,19 г, 74,2% выход) в виде светло-желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C17H18N8: 335,18; найдено 335,1.
Мономер AE. (4-((2-аминоэтил)сульфонил)-2-метилфенил)(7-(6-аминопиридин-3-ил)-2,3-дигидробензо[f][1,4]оксазепин-4(5H)-ил)метанон.
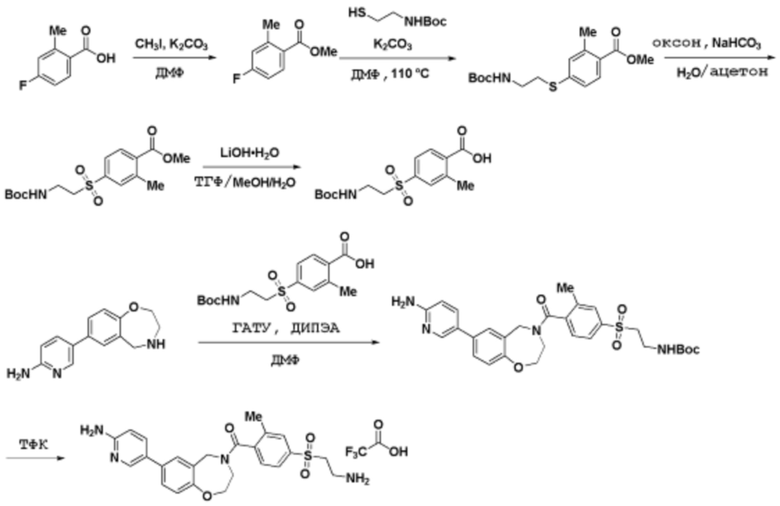
Стадия 1: Синтез метил 4-фтор-2-метилбензоата
К раствору 4-фтор-2-метилбензоной кислоты (86 г, 557,94 ммоль, 1,0 эквив.) в ДМФ (900 мл) добавляют K2CO3 (231,33 г, 1,67 моль, 3,0 эквив.) и йодметан (79,19 г, 557,94 ммоль, 34,73 мл, 1,0 эквив.). Смесь перемешивают при комнатной температуре в течение 1 ч. Раствор метил 4-фтор-2-метилбензоата в ДМФ (900 мл) используют сразу на следующей стадии.
Стадия 2: Синтез метил 4-((2-((трет-бутоксикарбонил)амино)этил)тио)-2-метилбензоата
К раствору метил 4-фтор-2-метилбензоата (93,8 г, 557,94 ммоль, 1,0 эквив.) в ДМФ (900 мл) добавляют трет-бутил (2-меркаптоэтил)карбамат (98,91 г, 557,97 ммоль, 1,0 эквив.) и K2CO3 (154,23 г, 1,12 моль, 2,0 эквив.). Реакционную смесь перемешивают при 110°C в течение 12 ч, в этот момент смесь охлаждают при комнатной температуре и добавляют к H2O (1000 мл). Водный слой затем экстрагируют E-Ac (3×600 мл), и объединенные органические слои промывают насыщенным раствором соли, сушат и концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→25% E-Ac/петролейный эфир) дает желаемый продукт в виде бесцветного масла (144 г, 79% выход).
Стадия 3: Синтез метил 4-((2-((трет-бутоксикарбонил)амино)этил)сульфонил)-2-метилбензоата
К двум раздельным партиям, содержащим раствор метил 4-((2-((трет-бутоксикарбонил)амино)этил)тио)-2-метилбензоата (72 г, 221,25 ммоль, 1,0 эквив.), NaOH (2 M, 110,6 мл, 1,0 эквив.) и NaHCO3 (55,76 г, 663,75 ммоль, 3,0 эквив.) в ацетоне (750 мл) добавляют пероксимоносульфат калия (284,28 г, 462,41 ммоль, 2,1 эквив.). Смесь перемешивают в течение 12 ч при комнатной температуре, в этот момент две партии объединяют и затем смесь подкисляют до pH 5 добавлением 1N HCl. Водный слой экстрагируют E-Ac (3×1500 мл), и объединенные органические фазы промывают насыщенным раствором соли (2×500 мл), сушат и концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→25% E-Ac/петролейный эфир) дает желаемый продукт в виде белого твердого вещества (120 г, 76% выход).
Стадия 4: Синтез 4-((2-((трет-бутоксикарбонил)амино)этил)сульфонил)-2-метилбензойной кислоты
К раствору метил 4-((2-((трет-бутоксикарбонил)амино)этил)сульфонил)-2-метилбензоата (35 г, 97,92 ммоль, 1,0 эквив.) в ТГФ (200 мл), MeOH (100 мл) и H2O (100 мл) добавляют LiOH•H2O (12,33 г, 293,77 ммоль, 3,0 эквив.) при комнатной температуре. Реакционную смесь перемешивают при 40°C в течение 1 ч. Смесь затем концентрируют при пониженном давлении для удаления ТГФ и MeOH. Водную фазу нейтрализуют 0,5N HCl, и полученный осадок выделяют фильтрацией. Твердую лепешку промывают H2O (3×20 мл) с получением желаемого продукта в виде белого твердого вещества (25 г, 74% выход).
Стадия 5: Синтез трет-бутил (2-((4-(7-(6-аминопиридин-3-ил)-2,3,4,5-тетрагидробензо[f][1,4]оксазепин-4-карбонил)-3-метилфенил)сульфонил)этил)карбамата
К раствору 4-((2-((трет-бутоксикарбонил)амино)этил)сульфонил)-2-метилбензойной кислоты (9,7 г, 28,25 ммоль, 1,0 эквив.) и 5-(2,3,4,5-тетрагидробензо[f][1,4]оксазепин-7-ил)пиридин-2-амина (8,88 г, 28,25 ммоль, 1,0 эквив., 2HCl) в ДМФ (120 мл) добавляют ГАТУ (16,11 г, 42,37 ммоль, 1,5 эквив.) и ДИПЭА (18,25 г, 141,24 ммоль, 24,60 мл, 5,0 эквив.). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч, в этот момент реакционную смесь выливают в H2O (1000 мл). Смесь перемешивают в течение 5 мин, и полученный осадок собирают фильтрацией с получением неочищенного продукта. Неочищенный продукт растирают с E-Ac (100 мл), фильтруют и твердую лепешку сушат при пониженном давлении с получением желаемого продукта в виде белого твердого вещества (14 г, 87% выход).
Стадия 6: Синтез (4-((2-аминоэтил)сульфонил)-2-метилфенил)(7-(6-аминопиридин-3-ил)-2,3-дигидробензо[f][1,4]оксазепин-4(5H)-ил)метанона
Раствор трет-бутил (2-((4-(7-(6-аминопиридин-3-ил)-2,3,4,5-тетрагидробензо[f][1,4]оксазепин-4-карбонил)-3-метилфенил)сульфонил)этил)карбамата (19 г, 33,53 ммоль, 1,0 эквив.) в ТФК (100 мл) перемешивают при комнатной температуре в течение 30 мин. Раствор затем концентрируют при пониженном давлении. Остаток растирают с MeCN (30 мл) и затем капают в МТБЭ (600 мл) и перемешивают в течение 20 мин. Суспензию фильтруют, и полученное твердое вещество растворяют в MeCN (30 мл) и концентрируют при пониженном давлении с получением желаемого продукта в виде светло-желтого твердого вещества (24 г, соль ТФК). ЖХМС (ИЭР)m/z: [M+H] рассч. для C24H26N4O4S:467,18; найдено 467,1.
Мономер AF. 5-(4-амино-1-((5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-ил)метил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амин.
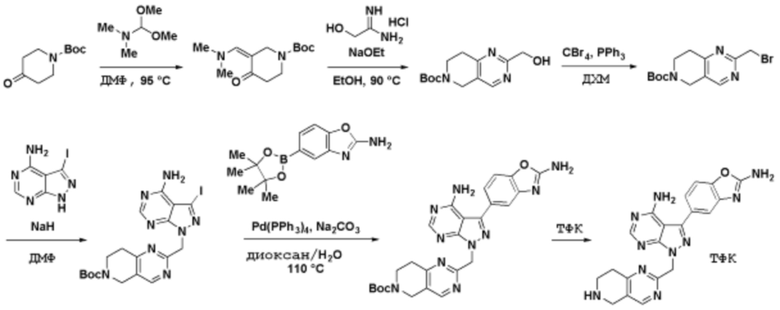
Стадия 1: Синтез (Z)-трет-бутил 3-((диметиламино)метилен)-4-оксопиперидин-1-карбоксилата
Раствор трет-бутил 4-оксопиперидин-1-карбоксилата (15 г, 75,28 ммоль, 1,0 эквив.) и 1,1-диметокси-N, N-диметилметанамина (11,00 мл, 82,81 ммоль, 1,1 эквив.) в ДМФ (105 мл) перемешивают при 95°C в течение 12 ч. Реакционную смесь затем концентрируют при пониженном давлении, и полученный остаток растворяют вE-Ac (30 мл) и промывают насыщенным раствором соли (3×30 мл). Водную фазу экстрагируют E-Ac (50 мл), и объединенные органические фазы сушат и концентрируют при пониженном давлении с получением желаемого продукта в виде желтого твердого вещества (10,1 г, 53% выход).
Стадия 2: Синтез трет-бутил 2-(гидроксиметил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата
К раствору NaOEt (1,98 г, 29,10 ммоль, 1,0 эквив.) в E-H (70 мл) добавляют (Z)-трет-бутил 3-((диметиламино)метилен)-4-оксопиперидин-1-карбоксилат (7,4 г, 29,10 ммоль, 1,0 эквив.) и гидрохлорид 2-гидроксиацетимидамида (3,54 г, 32,01 ммоль, 1,1 эквив.). Реакционную смесь нагревают до 90°C в течение 12 ч, в этот момент смесь охлаждают при комнатной температуре и концентрируют при пониженном давлении. Остаток разделяют с E-Ac (40 мл) и промывают насыщ. NaHCO3 (40 мл). Водную фазу экстрагируют E-Ac (3×20 мл), и объединенные органические фазы промывают насыщенным раствором соли (2×50 мл), сушат и концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (25% E-Ac/петролейный эфир) дает желаемый продукт в виде желтого твердого вещества (7,24 г, 94% выход).
Стадия 3: Синтез трет-бутил 2-(бромметил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата
К раствору трет-бутил 2-(гидроксиметил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (6,24 г, 23,52 ммоль, 1,0 эквив.) и PPh3 (12,34 г, 47,04 ммоль, 2,0 эквив.) в ДХМ (140 мл) добавляют CBr4 (14,82 г, 44,69 ммоль, 1,9 эквив.). Смесь перемешивают при комнатной температуре в течение 3 ч, в этот момент смесь концентрируют при пониженном давлении. Остаток разделяют между E-Ac (20 мл) и H2O(20 мл), водную фазу экстрагируют E-Ac (3×20 мл). Объединенные органические фазы промывают насыщенным раствором соли (2×50 мл), сушат и концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (14% E-Ac/петролейный эфир) дает желаемый продукт в виде желтого твердого вещества (3,6 г, 47% выход).
Стадия 4: Синтез трет-бутил 2-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата
К раствору 3-йод-1H-пиразоло[3,4-d]пиримидин-4-амина (1,59 г, 6,09 ммоль, 1,0 эквив.) в ДМФ (15 мл) добавляют NaH (243,73 мг, 6,09 ммоль, 60% масс., 1,0 эквив.) при 0°C. Суспензию перемешивают в течение 30 мин, и затем добавляют трет-бутил 2-(бромметил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилат (2,2 г, 6,70 ммоль, 1,1 эквив.). Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 3 ч. Смесь выливают в H2O при 0°C, и осадок собирают фильтрацией с получением желаемого продукта в виде коричневого твердого вещества (2,5 г, 66% выход).
Стадия 5: Синтез трет-бутил 2-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилат
К раствору трет-бутил 2-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (4,55 г, 8,95 ммоль, 1,0 эквив.), 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол-2-амина (2,79 г, 10,74 ммоль, 1,2 эквив.) и Na2CO3 (4,74 г, 44,76 ммоль, 5,0 эквив.) в диоксане (70 мл) и H2O (35 мл) добавляют Pd(PPh3)4 (1,03 г, 895,11 мкмоль, 0,1 эквив.). Реакционную смесь нагревают до 110°C в течение 3 ч, в этот момент смесь охлаждают при комнатной температуре и выливают в H2O при 0°C. Осадок фильтруют, и твердую лепешку сушат при пониженном давлении. Неочищенный продукт промывают E-Ac (50 мл) с получением желаемого продукта в виде светло-желтого твердого вещества (3,14 г, 68% выход).
Стадия 6: Синтез 5-(4-амино-1-((5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-ил)метил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амина
Раствор трет-бутил 2-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (3,14 г, 6,10 ммоль, 1,0 эквив.) в ТФК (20 мл) перемешивают при комнатной температуре в течение 30 мин. Смесь концентрируют при пониженном давлении, и полученный остаток добавляют растворяют в MeCN (7 мл) и добавляют к МТБЭ (700 мл). Осадок собирают фильтрацией с получением желаемого продукта в виде коричневого твердого вещества (4,25 г, 92% выход, 3 ТФК). ЖХМС (ИЭР)m/z: [M +H] рассч. для C20H18N10O: 415,18; найдено 415,1.
Мономер AG. 5-(4-амино-1-((2-((2-аминоэтил)сульфонил)-1,2,3,4-тетрагидроизохинолин-6-ил)метил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амин.

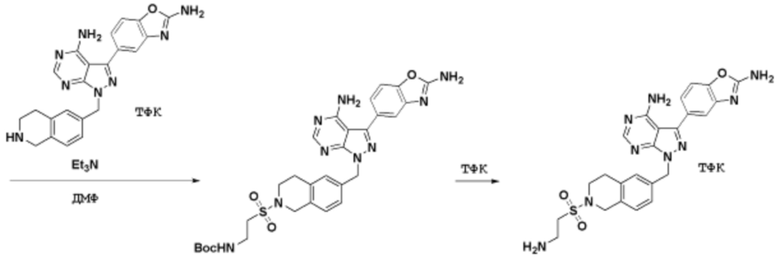
Стадия 1: Синтез N-Boc таурина соли тетрабутиламмония
К раствору 2-аминоэтанeсульфоновой кислоты (10,00 мл, 79,91 ммоль, 1,0 эквив.) в ТГФ (60 мл) и водном NaOH (2 M, 40 мл, 1,0 эквив.) добавляют Boc2O (18,31 г, 83,90 ммоль, 1,05 эквив.). Смесь перемешивают при комнатной температуре в течение 15 ч, в этот момент смесь экстрагируют E-Ac (10 мл). Водную фазу разбавляют H2O (450 мл), обрабатывают LiOH•H2O (3,35 г, 79,83 ммоль, 1,0 эквив.) и nBu4NHSO4 (27,13 г, 79,90 ммоль, 1,0 эквив.) и перемешивают в течение 30 мин. Эту смесь экстрагируют ДХМ (3×80 мл) и объединенные органические фазы сушат и концентрируют при пониженном давлении с получением желаемого продукта в виде бесцветного масла (34,26 г, 91% выход).
Стадия 2: Синтез трет-бутил (2-(хлорсульфонил)этил)карбамата
К раствору N-Boc таурина соли тетрабутиламмония (4,7 г, 10,05 ммоль, 1,0 эквив.) в ДХМ (42 мл) добавляют ДМФ (77,32 мкл, 1,00 ммоль, 0,1 эквив.), затем раствор трифосгена (0,5 M, 8,04 мл, 0,4 эквив.) в ДХМ при 0°C. Смесь нагревают до комнатной температуры и перемешивают в течение 30 мин. Раствор трет-бутил (2-(хлорсульфонил)этил)карбамата (2,45 г, неочищенный) в ДХМ используют сразу на следующей стадии.
Стадия 3: Синтез трет-бутил (2-((6-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-ил)сульфонил)этил)карбамата
К раствору 5-(4-амино-1-((1,2,3,4-тетрагидроизохинолин-6-ил)метил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амина (6,04 г, 9,44 ммоль, 1,0 эквив., 2ТФК) в ДМФ (40 мл) добавляют Et3N (7,88 мл, 56,63 ммоль, 6,0 эквив.). Добавляют раствор трет-бутил (2-(хлорсульфонил)этил)карбамата в ДХМ (42 мл) при 0°C. Смесь нагревают до комнатной температуры и перемешивают 16 ч. Реакционную смесь концентрируют при пониженном давлении для удаления ДХМ, и полученный раствор очищают хроматографией с обращенной фазой (15→45% MeCN/H2O) с получением желаемого продукта в виде белого твердого вещества (5,8 г, 83% выход, ТФК). ЖХМС (ИЭР) m/z: [M+H] рассч. для C29H33N9O5S: 620,24; найдено 620,3.
Стадия 4: Синтез 5-(4-амино-1-((2-((2-аминоэтил)сульфонил)-1,2,3,4-тетрагидроизохинолин-6-ил)метил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амина
Раствор трет-бутил (2-((6-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-ил)сульфонил)этил)карбамата (5,8 г, 9,36 ммоль, 1,0 эквив.) в ТФК (48 мл) перемешивают при комнатной температуре в течение 0,5 ч, в этот момент реакционную смесь концентрируют при пониженном давлении. Неочищенный продукт растворяют в MeCN (30 мл) и добавляют по каплям в МТБЭ (200 мл). Смесь перемешивают в течение 5 мин и фильтруют, фильтровальную лепешку сушат при пониженном давлении с получением желаемого продукта в виде желтого твердого вещества (3,6 г, 62% выход, 2,2ТФК). ЖХМС (ИЭР) m/z: [M+H] рассч. для C24H25N9O3S: 520,19; найдено 520,1.
Мономер AH. трет-бутил ((5-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)пиримидин-2-ил)метил)карбамат.
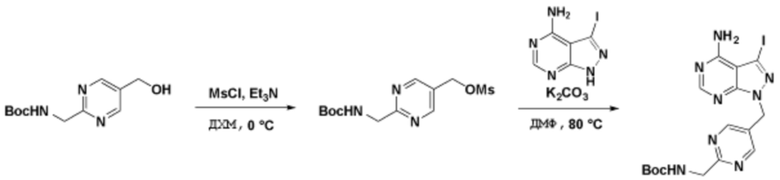
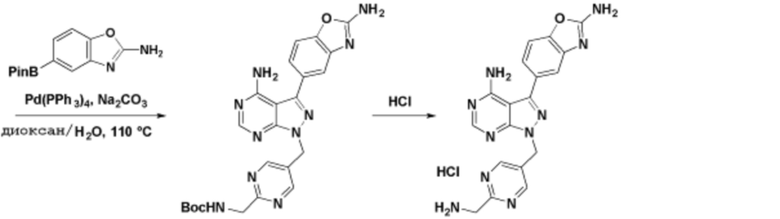
Стадия 1: Синтез (2-(((трет-бутоксикарбонил)амино)метил)пиримидин-5-ил)метил метансульфоната
К раствору трет-бутил ((5-(гидроксиметил)пиримидин-2-ил)метил)карбамата (4,2 г, 17,55 ммоль, 1,0 эквив.) в ДХМ (42 мл) при 0°C добавляют Et3N (7,33 мл, 52,66 ммоль, 3,0 эквив.), затем MsCl (2,41 г, 21,06 ммоль, 1,63 мл, 1,2 эквив.). Смесь перемешивают при 0°C в течение 10 мин и затем добавляют H2O (15 мл). Реакционную смесь экстрагируют ДХМ (5×10 мл), и объединенные органические фазы промывают насыщенным раствором соли (5 мл), сушат, фильтруют и концентрируют при пониженном давлении с получением желаемого продукта (5,5 г, 98,7% выход) в виде бесцветного твердого вещества.
Стадия 2: Синтез трет-бутил ((5-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)пиримидин-2-ил)метил)карбамата
К раствору (2-(((трет-бутоксикарбонил)амино)метил)пиримидин-5-ил)метилметансульфоната (5,47 г, 17,24 ммоль, 1,2 эквив.) и 3-йод-1H-пиразоло[3,4-d]пиримидин-4-амина (3,75 г, 14,37 ммоль, 1,0 эквив.) в ДМФ (55 мл) при комнатной температуре добавляют K2CO3 (5,96 г, 43,10 ммоль, 3 эквив.). Смесь перемешивают при 80°C в течение 5 ч, в этот момент H2O (100 мл) и насыщенный раствор соли (20 мл) выливают в реакционную смесь. Раствор экстрагируют E-Ac (10×30 мл), и объединенные органические фазы сушат, фильтруют и концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→30% E-Ac/MeOH) дает желаемый продукт (2 г, 28,9% выход) в виде желтого твердого вещества.
Стадия 3: Синтез трет-бутил ((5-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)пиримидин-2-ил)метил)карбамата
К раствору трет-бутил ((5-((4-амино-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)пиримидин-2-ил)метил)карбамата (2 г, 4,15 ммоль, 1,0 эквив.), 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3-бензоксазол-2-амина (1,13 г, 4,35 ммоль, 1,05 эквив.) и Na2CO3 (688,39 мг, 8,29 ммоль, 2,0 эквив.) в диоксане (20 мл) и H2O (10 мл) добавляют Pd(PPh3)4 (479,21 мг, 414,70 мкмоль, 0,1 эквив.). Смесь перемешивают при 110°C в течение 1 ч, в это время смесь охлаждают при комнатной температуре, фильтруют и твердую лепешку промывают MeOH (3×10 мл). Фильтрат концентрируют при пониженном давлении для удаления MeOH и затем добавляют по каплям в H2O (50 мл). Полученную суспензию фильтруют, и фильтровальную лепешку промывают H2O (3×10 мл). Твердую лепешку перемешивают в MeOH (20 мл) в течение 30 мин. Полученную суспензию фильтруют и фильтровальную лепешку промывают MeOH (3×8 мл). Фильтровальную лепешку сушат при пониженном давлении с получением желаемого продукта (1,03 г, 48,9% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+ H] рассч. для C23H24N10O3:489,21; найдено489,2.
Стадия 4: Синтез 5-(4-амино-1-{[2-(аминометил)пиримидин-5-ил]метил}-1H-пиразоло[3,4-d]пиримидин-3-ил)-1,3-бензоксазол-2-амина
К трет-бутил ((5-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)пиримидин-2-ил)метил)карбамату (100 мг, 0,205 ммоль, 1,0 эквив.) добавляют конц. HCl (850 мкл, 10,2 ммоль, 50 эквив.). Реакционную смесь перемешивают в течение 1 ч и затем выливают в ацетон (3 мл). Полученный осадок фильтруют, промывают ацетоном и сушат при пониженном давлении с получением желаемого продукта (80 мг, 92% выход) в виде коричневого твердого вещества. ЖХМС (ИЭР) m/z: [M+ H] рассч. для C18H16N10O:389,16; найдено 389,0.
Мономер AI. 5-(4-(диметиламино)-1-((1,2,3,4-тетрагидроизохинолин-6-ил)метил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амин соль трифторуксусной кислоты.
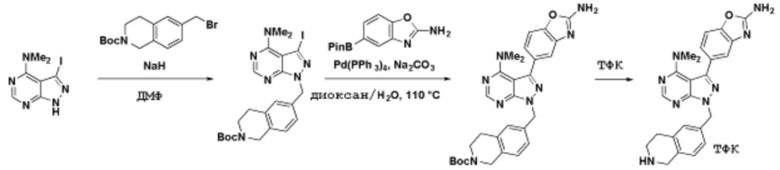
Стадия 1: Синтез трет-бутил 6-((4-(диметиламино)-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата
К раствору 3-йод-N, N-диметил-1H-пиразоло[3,4-d]пиримидин-4-амина (3,6 г, 12,45 ммоль, 1,0 эквив.) в ДМФ (36 мл) при 0°C добавляют NaH (523,00 мг, 13,08 ммоль, 60% масс., 1,05 эквив.). Смесь перемешивают при 0°C в течение 30 мин. К реакционной смеси затем добавляют раствор трет-бутил 6-(бромметил)-3,4-дигидроизохинолин-2(1H)-карбоксилата (4,47 г, 13,70 ммоль, 1,1 эквив.) в ДМФ (18 мл) при 0°C. Смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь затем добавляют к холодной H2O (200 мл) и перемешивают в течение 30 мин. Полученный осадок собирают фильтрацией с получением желаемого продукта (6 г, 71,9% выход) в виде белого твердого вещества.
Стадия 2: Синтез трет-бутил 6-((3-(2-аминобензо[d]оксазол-5-ил)-4-(диметиламино)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата
К раствору трет-бутил 6-((4-(диметиламино)-3-йод-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата (2 г, 2,96 ммоль, 1,0 эквив.) и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензо[d]оксазол-2-амина (922,81 мг, 3,55 ммоль, 1,2 эквив.) в диоксане (24 мл) и H2O (12 мл) добавляют Na2CO3 (1,57 г, 14,78 ммоль, 5,0 эквив.) и Pd(PPh3)4 (341,66 мг, 295,66 мкмоль, 0,1 эквив.). Смесь перемешивают при 110°C в течение 12 ч. Реакционную смесь затем выливают в холодную H2O (200 мл) и перемешивают в течение 30 мин. Полученный осадок собирают фильтрацией. Очистка хроматографией на силикагеле (5→100% петролейный эфир/E-Ac) дает желаемый продукт (1,2 г, 72,3% выход) в виде желтого твердого вещества.
Стадия 3: Синтез 5-(4-(диметиламино)-1-((1,2,3,4-тетрагидроизохинолин-6-ил)метил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амина
Раствор трет-бутил 6-((3-(2-аминобензо[d]оксазол-5-ил)-4-(диметиламино)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-карбоксилата (1,7 г, 3,14 ммоль, 1,0 эквив.) в ТФК (10 мл) перемешивают при комнатной температуре в течение 30 мин. Реакционную смесь затем концентрируют при пониженном давлении. Остаток добавляют к MeCN (10 мл), и раствор добавляют по каплям в МТБЭ (200 мл). Полученное твердое вещество растворяют в MeCN (30 мл) и раствор концентрируют при пониженном давлении с получением желаемого продукта (1,67 г, 92,9% выход,) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C24H24N8O:441,22; найдено441,2.
Мономер AJ. 4-амино-5-(2-аминобензо[d]оксазол-5-ил)-5H-пиримидо[5,4-b]индол-7-карбоновая кислота.
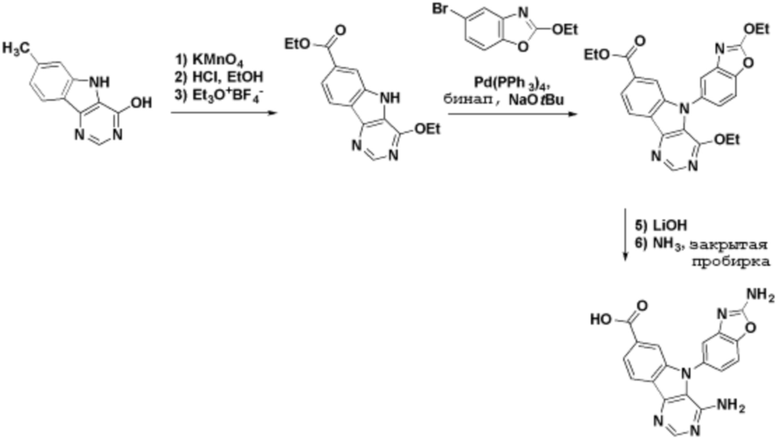
Этот мономер может быть получен из 7-метил-5H-пиримидо[5,4-b]индол-4-ола бензильным окислением до карбоновой кислоты, превращением в этиловый эфир, затем O-этилированием с тетрафторборатом триэтилоксония. Медиированное палладием арилирование с последующим гидролизом сложного эфира и конечным аммониолизом дает мономер.
Мономер AK. 4-амино-5-(2-аминобензо[d]оксазо-5-ил)-5H-пиримидо[5,4-b]индол-8-карбоновая кислота.
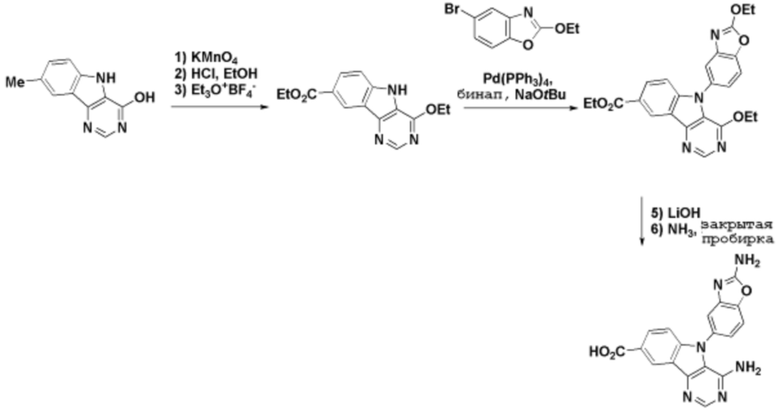
Этот мономер может быть получен по методике получения предыдущего мономера, но с применением изомерного исходного материала из 8-метил-5H-пиримидо[5,4-b]индол-4-ола. Бензильное окисление до карбоновой кислоты, превращение в этиловый эфир, затем O-этилирование с тетрафторборатом триэтилоксония и медиированное палладием арилирование с последующим гидролизом сложного эфира и конечным аммониолизом дает мономер.
Мономер AL. 3-(2,4-бис((S)-3-метилморфолино)-4a,8a-дигидропиридо[2,3-d]пиримидин-7-ил)бензойная кислота.
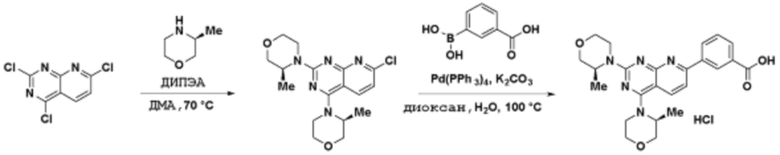
Стадия 1: Синтез (3S)-4-[7-хлор-2-[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d] пиримидин-4-ил] 3-метил-морфолина
К раствору 2,4,7-трихлорпиридо[2,3-d]пиримидина (4,0 г, 17,06 ммоль, 1,0 эквив.) в ДМА (10 мл) добавляют (3S)-3-метилморфолин (4,31 г, 42,65 ммоль, 2,5 эквив.) и ДИПЭА (5,51 г, 42,65 ммоль, 7,43 мл, 2,5 эквив.). Реакционный раствор нагревают до 70°C в течение 48 ч. Реакционную суспензию охлаждают при комнатной температуре, выливают в холодную H2O (50 мл) до осаждения твердого вещества. Твердое вещество фильтруют и фильтровальную лепешку промывают H2O и сушат при пониженном давлении с получением неочищенного продукта, который очищают хроматографией на колонке с силикагелем (0→100% петролейный эфир/E-Ac) с получением (3S)-4-[7-хлор-2-[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-4-ил]3-метилморфолина (3,5 г, 56,4% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M +H] рассч. для C17H22ClN5O2: 364,15; найдено 364,2.
Стадия 2: Синтез 3-[2,4-бис[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-7-ил]бензойной кислоты
К раствору (3S)-4-[7-хлор-2-[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-4-ил]-3-метилморфолина (2 г, 5,50 ммоль, 1,0 эквив.) и 3-боронобензойной кислоты (1,09 г, 6,60 ммоль, 1,2 эквив.) в 1,4-диоксане (40 мл) добавляют раствор K2CO3 (911,65 мг, 6,60 ммоль, 1,2 эквив.) в H2O (4 мл), затем Pd(PPh3)4 (317,60 мг, 274,85 мкмоль, 0,05 эквив.). Раствор дегазируют в течение 10 мин и повторно заполняют N2, затем реакционную смесь нагревают до 100°C под N2 в течение 5 ч. Реакционную смесь охлаждают при комнатной температуре и фильтруют. Фильтрат подкисляют HCl (2N) до pH 3, и водный слой промывают E-Ac (3×20 мл). Затем водную фазу концентрируют при пониженном давлении с получением остатка, который очищают хроматографией на колонке с силикагелем (50%→100% петролейный эфир/E-Ac) с получением гидрохлорида 3-[2,4-бис[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-7-ил]бензойной кислоты (2,5 г, 89,9% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C24H27N5O4: 450,21; найдено 450,2.
Ссылка на получение этого мономера: Menear, K.; Smith, G.C.M.; Malagu, K.; Duggan, H.M.E.; Martin, N.M.B.; Leroux, F.G.M. 2012. Pyrido-, pyrazo- and pyrimido-pyrimidine derivatives as mTOR inhibi-rs. US8101602. Kudos Pharmaceuticals, Ltd, который включен сюда в качестве ссылки. полностью.
Мономер AM. (1r,4r)-4-[4-амино-5-(7-метокси-1H-индол-2-ил)имидазо[4,3-f][1,2,4]триазин-7-ил]циклогексан-1-карбоновая кислота
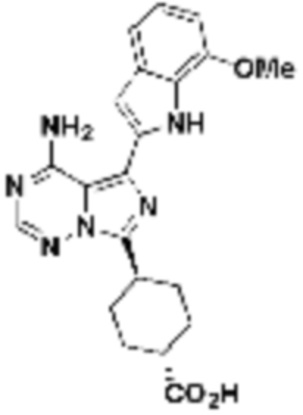
Этот мономер, также известный как OSI-027 (CAS# = 936890-98-1), является коммерчески доступным соединением. На момент подготовки этой заявки, он был доступен для покупки от нескольких поставщиков.
Мономер AN. 2-(4-(4-(8-(6-метоксипиридин-3-ил)-3-метил-2-оксо-2,3-дигидро-1H-имидазо[4,5-c]хинолин-1-ил)-2-(трифторметил)фенил)пиперазин-1-ил)пиримидин-5-карбоновая кислота.
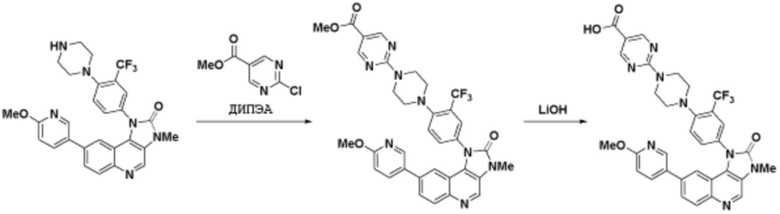
Получение этого мономера осуществляют реакцией BGT226 с метил 2-хлорпиримидин-5-карбоксилатом с последующим гидролизом сложного эфира, с получением указанного в заголовке мономера.
Мономер AO. 4-амино-5-{1H-пирроло[2,3-b]пиридин-5-ил}-5H-пиримидо[5,4-b]индол-8-карбоновая кислота.
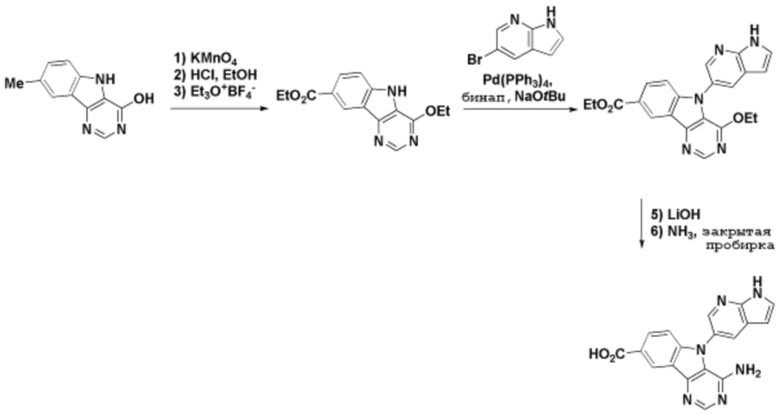
Этот мономер может быть получен из 7-метил-5H-пиримидо[5,4-b]индол-4-ола бензильным окислением до карбоновой кислоты, превращением в этиловый эфир, затем O-этилированием с тетрафторборатом триэтилоксония. Медиированное палладием арилирование, затем гидролиз сложного эфира и конечный аммониолиз дает мономер.
Получение пре- и пост-линкеров
Строительный блок A. трет-бутил N-[(трет-бутокси)карбонил]-N-{[2-(пиперазин-1-ил)пиримидин-5-ил]метил}карбамат.
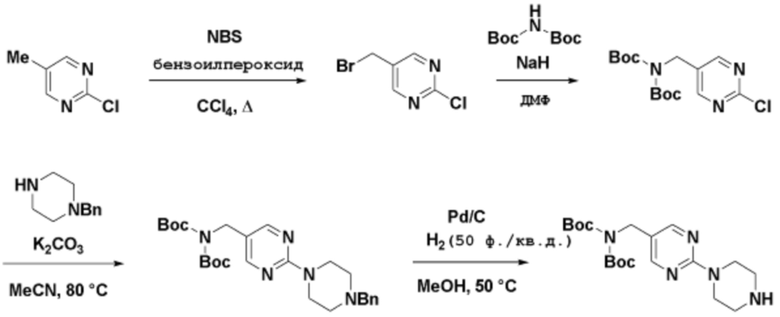
Стадия 1: Синтез 5-(бромметил)-2-хлорпиримидина
К раствору 2-хлор-5-метилпиримидина (92 г, 715,62 ммоль, 1,0 эквив.) в CCl4 (1000 мл) добавляют NBS (178,31 г, 1,00 моль, 1,4 эквив.) и бензоилпероксид (3,47 г, 14,31 ммоль, 0,02 эквив.). Смесь перемешивают при 76°C в течение 18 ч. Реакционную смесь затем охлаждают при комнатной температуре и концентрируют при пониженном давлении. Реакционную смесь фильтруют, и твердую лепешку промывают ДХМ (150 мл). Полученный раствор концентрируют при пониженном давлении с получением неочищенного продукта. Остаток очищают хроматографией на силикагеле (1/0-0/1 петролейный эфир/E-Ac) с получением продукта (70,8 г, 47,7% неочищенный выход) в виде желтого масла, которое применяют сразу на следующей стадии. ЖХМС (ИЭР)m/z: [M+H] рассч. для C5H4BrClN2: 206,93; найдено 206,9.
Стадия 2: Синтез трет-бутил N-трет-бутоксикарбонил-N-((2-пиперазин-1-илпиримидин-5-ил)метил)карбамата
К раствору трет-бутил N-трет-бутоксикарбонилкарбамата (36,89 г, 169,79 ммоль, 0,74 эквив.) в ДМФ (750 мл) добавляют NaH (6,88 г, 172,09 ммоль, 60% масс.,0,75 эквив.) при 0°C. Смесь перемешивают при 0°C в течение 30 мин. Затем, 5-(бромметил)-2-хлорпиримидин (47,6 г, 229,45 ммоль, 1,0 эквив.) добавляют при 0°C. Реакционную смесь перемешивают при комнатной температуре в течение 15,5 ч. Смесь затем выливают в H2O (1600 мл) и водную фазу экстрагируют E-Ac (3×300 мл). Объединенную органическую фазу промывают насыщенным раствором соли (2×200 мл), сушат с безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (1/0-0/1 петролейный эфир/E-Ac) с получением продукта (70 г, неочищенный) в виде желтого твердого вещества, которое применяют сразу на следующей стадии.
Стадия 3: Синтез трет-бутил N-трет-бутоксикарбонил-N-[(2-пиперазин-1-илпиримидин-5-ил)метил]карбамата
К раствору 1-бензилпиперазина (30,44 г, 122,16 ммоль, 1,0 эквив., 2HCl) в MeCN (550 мл) добавляют трет-бутил N-трет-бутоксикарбонил-N-((2-хлорпиримидин-5-ил)метил)карбамат (42 г, 122,16 ммоль, 1,0 эквив.) и K2CO3 (84,42 г, 610,81 ммоль, 5,0 эквив.). Смесь перемешивают при 80°C в течение 61 ч. Реакционную смесь затем разбавляют E-Ac (150 мл) и смесь фильтруют. Полученный раствор концентрируют при пониженном давлении с получением неочищенного продукта. Остаток очищают хроматографией на силикагеле (1/0-0/1 петролейный эфир/E-Ac) с получением продукта (45 г, 74% выход) в виде белого твердого вещества.
Стадия 4: Синтез трет-бутил N-трет-бутоксикарбонил-N-[(2-пиперазин-1-илпиримидин-5-ил)метил]карбамата
К раствору трет-бутил N-[[2-(4-бензилпиперазин-1-ил)пиримидин-5-ил]метил]-N-трет-бутоксикарбонилкарбамата (24 г, 49,63 ммоль, 1,0 эквив.) в MeOH (600 мл) добавляют Pd/C (24 г, 47,56 ммоль, 10% масс., 1,0 эквив.) под аргоном. Смесь дегазируют при пониженном давлении и продувают H2 три раза. Смесь перемешивают под H2 (50 ф./кв.д.) при 50°C в течение 19 ч. Реакционную смесь охлаждают при комнатной температуре, фильтруют и фильтровальную лепешку промывают MeOH (500 мл). Полученный раствор концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (1/0-0/1 E-Ac/MeOH) с получением продукта (25,5 г, 68% выход) в виде белого твердого вещества.
Строительный блок B. 2-(4-(5-(((трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)пиримидин-5-карбоновая кислота.
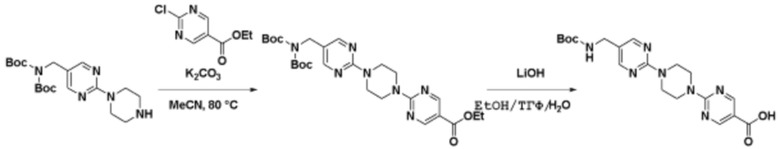
Стадия 1: Синтез этил 2-(4-(5-((бис(трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)пиримидин-5-карбоксилата
К раствору этил 2-хлорпиримидин-5-карбоксилата (2,37 г, 12,71 ммоль, 1,0 эквив.) и трет-бутил N-трет-бутоксикарбонил-N-((2-пиперазин-1-илпиримидин-5-ил)метил)карбамата (5 г, 12,71 ммоль, 1,0 эквив.) в MeCN (80 мл) добавляют K2CO3 (5,27 г, 38,12 ммоль, 3,0 эквив.). Смесь перемешивают при 80°C в течение 16 ч. Реакционную смесь затем выливают в H2O (200 мл) и суспензию фильтруют. Фильтрат промывают H2O (80 мл) и сушат при пониженном давлении с получением продукта (6,1 г, 87% выход) в виде белого твердого вещества.
Стадия 2: Синтез 2-(4-(5-(((трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору этил 2-(4-(5-((бис(трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)пиримидин-5-карбоксилата (5 г, 9,20 ммоль, 1,0 эквив.) в H2O (50 мл), E-H (15 мл) и ТГФ (50 мл) добавляют LiOH•H2O (1,54 г, 36,79 ммоль, 4,0 эквив.). Реакционную смесь перемешивают при 55°C в течение 16 ч. Смесь затем концентрируют для удаления ТГФ и E-H, и затем смесь разбавляют H2O (55 мл) и подкисляют (pH=3) водной HCl (1N). Смесь фильтруют, и фильтровальную лепешку промывают H2O (36 мл).Фильтровальную лепешку сушат при пониженном давлении с получением продукта (2,7 г, 69,3%) в виде белого твердого вещества. ЖХМС (ИЭР)m/z: [M+H] рассч. для C19H25N7O4: 416,21; найдено 416,1.
Строительный блок C. трет-бутил 2-(пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилат.

Стадия 1: Синтез трет-бутил 2-(4-бензилпиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата
К раствору трет-бутил 2-хлор-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (15 г, 55,61 ммоль, 1,0 эквив.) в MeCN (150 мл) добавляют 1-бензилпиперазин (11,76 г, 66,73 ммоль, 1,2 эквив.) и K2CO3 (46,12 г, 333,67 ммоль, 6,0 эквив.). Смесь перемешивают при 80°C в течение 27 ч. Реакционную смесь разбавляют E-Ac (200 мл), фильтруют и концентрируют при пониженном давлении. Неочищенный продукт очищают хроматографией на силикагеле (1/0-0/1 петролейный эфир/E-Ac)с получением продукта (20,2 г, 80% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C23H31N5O2: 410,26; найдено 410,1.
Стадия 2: Синтез трет-бутил2-(пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата
К раствору трет-бутил 2-(4-бензилпиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (8 г, 19,53 ммоль, 1,0 эквив.) в MeOH (200 мл) добавляют Pd/C (8 г, 19,53 ммоль, 10% масс., 1,0 эквив.) под аргоном. Смесь дегазируют и продувают H2 три раза. Смесь перемешивают под H2 (50 ф./кв.д.) при 50°C в течение 19 ч. Реакционную смесь охлаждают при комнатной температуре, фильтруют через слой Целита и фильтровальную лепешку промывают MeOH (150 мл). Полученный раствор концентрируют при пониженном давлении и неочищенный продукт промывают петролейным эфиром (60 мл) с получением продукта (9,25 г, 72% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C16H25N5O2: 320,21; найдено 320,2.
Строительный блок D. 2-(4-(6-(трет-бутоксикарбонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-ил)пиперазин-1-ил)пиримидин-5-карбоновая кислота.
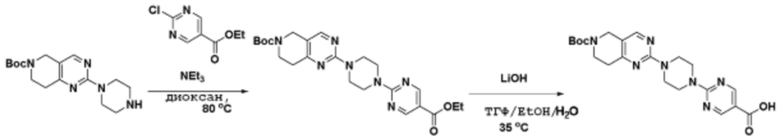
Стадия 1: Синтез трет-бутил 2-(4-(5-(этоксикарбонил)пиримидин-2-ил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата
К раствору этил 2-хлорпиримидин-5-карбоксилата (4,09 г, 21,92 ммоль, 1,0 эквив.) в диоксане (80 мл) добавляют трет-бутил 2-(пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилат (7 г, 21,92 ммоль, 1,0 эквив.) и Et3N (9,15 мл, 65,75 ммоль, 3,0 эквив.). Смесь перемешивают при 90°C в течение 64 ч. Раствор выливают в H2O (200 мл), и затем смесь фильтруют и фильтровальную лепешку промывают H2O (100 мл), затем петролейным эфиром (60 мл). Фильтровальную лепешку сушат при пониженном давлении получением продукта (10,1 г, 92% выход) в виде коричневого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C23H31N7O4: 470,25; найдено 470,4.
Стадия 2: Синтез 2-(4-(6-(трет-бутоксикарбонил)-5,6,7,8-тетрагидропиридо[4,3- d]пиримидин-2-ил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору трет-бутил 2-(4-(5-(этоксикарбонил)пиримидин-2-ил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (6,0 г, 12,78 ммоль, 1,0 эквив.) в ТГФ (40 мл), E-H (20 мл) и H2O (40 мл) добавляют LiOH•H2O (1,07 г, 25,56 ммоль, 2,0 эквив.). Реакционную смесь перемешивают при 35°C в течение 15 ч. Смесь затем концентрируют при пониженном давлении для удаления ТГФ и E-H. Смесь затем разбавляют H2O (500 мл) и доводят до pH 3 водной HCl (1N). Смесь фильтруют, и фильтровальную лепешку промывают H2O (80 мл), затем петролейным эфиром (80 мл). Фильтровальную лепешку сушат при пониженном давлении с получением продукта (3,8 г, 65% выход) в виде белого твердого вещества. ЖХМС (ИЭР)m/z: [M+H] рассч. для C21H27N7O4: 442,22; найдено 442,3.
Строительный блок E. трет-бутил метил((2-(пиперазин-1-ил)пиримидин-5-ил)метил)карбамат.
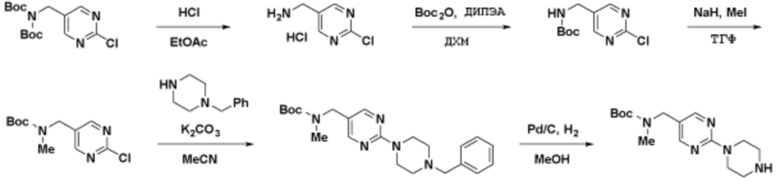
Стадия 1: Синтез (2-хлорпиримидин-5-ил)метанамина
К раствору трет-бутил N-трет-бутоксикарбонил-N-((2-хлорпиримидин-5-ил)метил)карбамата (28 г, 81,44 ммоль, 1,0 эквив.) в E-Ac (30 мл) добавляют HCl в E-Ac (260 мл). Реакционную смесь перемешивают при комнатной температуре в течение 5 ч. Реакционную смесь фильтруют, и фильтровальную лепешку промывают E-Ac (100 мл). Твердую лепешку сушат при пониженном давлении с получением продукта (14,3 г, 96,6% выход) в виде белого твердого вещества.
Стадия 2: Синтез трет-бутил((2-хлорпиримидин-5-ил)метил)карбамата
К раствору (2-хлорпиримидин-5-ил)метанамина (13 г, 72,21 ммоль, 1,0 эквив., HCl) в ДХМ (130 мл) добавляют ДИПЭА (20,41 мл, 144,42 ммоль, 1,8 эквив.) и Boc2O (16,59 мл, 72,21 ммоль, 1,0 эквив.), затем смесь перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь добавляют к H2O (100 мл) и затем водный слой разделяют и экстрагируют ДХМ (2×100мл). Затем объединенную органическую фазу промывают насыщ. NH4Cl (2×200 мл) и насыщенным раствором соли (2×200 мл), сушат с безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (1/0-1/1 петролейный эфир/E-Ac) с получением продукта (12 г, 68,2% выход) в виде белого твердого вещества.
Стадия 3: Синтез трет-бутил((2-хлорпиримидин-5-ил)метил)(метил)карбамата
К раствору трет-бутил((2-хлорпиримидин-5-ил)метил)карбамата (11 г, 45,14 ммоль, 1,0 эквив.) и MeI (14,05 мл, 225,70 ммоль, 5,0 эквив.) в ТГФ (150 мл) добавляют NaH (1,99 г, 49,65 ммоль, 60% масс., 1,1 эквив.) при 0°C. Смесь перемешивают при 0°C в течение 3 ч, и затем реакционную смесь гасят H2O (100 мл). Водную фазу экстрагируют E-Ac (3×150 мл), и объединенную органическую фазу промывают насыщенным раствором соли (50 мл), сушат с безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (1/0-3/1 петролейный эфир/E-Ac) с получением продукта (9 г, 77,4% выход) в виде белого твердого вещества.
Стадия 4: Синтез трет-бутил((2-(4-бензилпиперазин-1-ил)пиримидин-5-ил)метил)(метил)карбамата
К раствору трет-бутил((2-хлорпиримидин-5-ил)метил)(метил)карбамата (9 г, 34,92 ммоль, 1,0 эквив.) в MeCN (90 мл) добавляют 1-бензилпиперазин (8,70 г, 34,92 ммоль, 1,0 эквив., 2HCl) и K2CO3 (24,13 г, 174,61 ммоль, 5,0 эквив.). Реакционную смесь перемешивают при 80°C в течение 20 ч. Смесь затем фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (1/0-1/1 петролейный эфир/E-Ac) с получением продукта (12 г, 86,4% выход) в виде желтого масла.
Стадия 5: Синтез трет-бутилметил((2-(пиперазин-1-ил)пиримидин-5-ил)метил)карбамата
К раствору трет-бутил((2-(4-бензилпиперазин-1-ил)пиримидин-5-ил)метил)(метил)карбамата (12 г, 30,19 ммоль, 1,0 эквив.) в MeOH (120 мл) добавляют Pd/C (2 г, 10% масс.). Суспензию дегазируют и продувают H2 и затем смесь перемешивают под H2 (15 ф./кв.д.) при комнатной температуре в течение 3 ч. Реакционную смесь фильтруют через Целит, и фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (1/0-1/1 петролейный эфир/E-Ac) с получением получистого продукта (9 г) в виде желтого масла. Петролейный эфир добавляют к остатку, и раствор перемешивают при -60°C до появления твердого вещества. Суспензию фильтруют, и фильтраты концентрируют при пониженном давлении с получением продукта (4,07 г, 55,6% выход) в виде желтого масла. ЖХМС(ИЭР) m/z: [M+H] рассч. для C15H25N5O2: 308,21; найдено 308,1.
Строительный блок F. 2-(4-(5-(((трет-бутоксикарбонил)(метил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)пиримидин-5-карбоновая кислота.
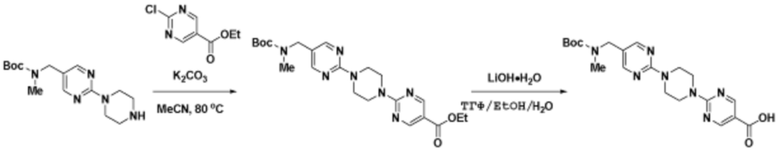
Стадия 1: Синтез этил 2-(4-(5-(((трет-бутоксикарбонил)(метил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)пиримидин-5-карбоксилата
К смеси трет-бутилметил ((2-(пиперазин-1-ил)пиримидин-5-ил)метил)карбамата (4,3 г, 13,99 ммоль, 1,0 эквив.) и этил 2-хлорпиримидин-5-карбоксилата (2,87 г, 15,39 ммоль, 1,1 эквив.) в MeCN (20 мл) добавляют K2CO3 (3,87 г, 27,98 ммоль, 2,0 эквив.). Смесь перемешивают при 80°C в течение 12 ч. Реакционную смесь затем охлаждают при комнатной температуре и фильтруют. Фильтрат концентрируют при пониженном давлении и неочищенный продукт очищают хроматографией на силикагеле (1/0-1/1 петролейный эфир/E-Ac) с получением продукта (4,7 г, 71,3% выход) в виде белого твердого вещества.
Стадия 2: Синтез 2-(4-(5-(((трет-бутоксикарбонил)(метил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору этил 2-(4-(5-(((трет-бутоксикарбонил)(метил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)пиримидин-5-карбоксилата (6 г, 13,11 ммоль, 1,0 эквив.)в ТГФ (100 мл), E-H (30 мл) и H2O (30 мл) добавляют LiOH•H2O (1,10 г, 26,23 ммоль, 2,0 эквив.). Смесь перемешивают при комнатной температуре в течение 16 ч. Смесь затем концентрируют при пониженном давлении для удаления ТГФ и E-H и затем нейтрализуют добавлением 1N HCl. Полученный осадок собирают фильтрацией с получением продукта (5,11 г, 90,1% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C20H27N7O4: 430,22; найдено 430,2.
Строительный блок G. трет-бутил N-трет-бутоксикарбонил-N-((2-(2-((трет-бутил(дифенил)силил)оксиметил)пиперазин-1-ил)пиримидин-5-ил)метил)карбамат.
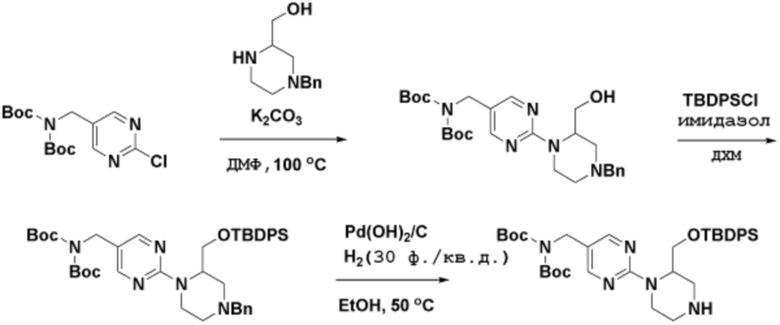
Стадия 1: Синтез трет-бутил N-((2-(4-бензил-2-(гидроксиметил)пиперазин-1-ил)пиримидин-5-ил)метил)-N-трет-бутоксикарбонилкарбамата
К раствору трет-бутил N-трет-бутоксикарбонил-N-((2-хлорпиримидин-5-ил)метил)карбамата (18,33 г, 53,32 ммоль, 1,1 эквив.) и (4-бензилпиперазин-2-ил)метанола (10 г, 48,48 ммоль, 1,0 эквив.) в ДМФ (100 мл) добавляют K2CO3 (13,40 г, 96,95 ммоль, 2,0 эквив.). Смесь перемешивают при 100°C в течение 12 ч. Реакционную смесь затем охлаждают при комнатной температуре и добавляют H2O (100 мл). Водный слой экстрагируют E-Ac(2×150 мл) и объединенный органический слой промывают насыщенным раствором соли (20 мл), сушат с Na2SO4, фильтруют и фильтрат концентрируют при пониженном давлении с получением продукта (7,3 г, 29,3% выход) в виде желтого масла. ЖХМС (ИЭР) m/z: [M+H] рассч. для C27H39N5O5: 514,31; найдено 514,5
Стадия 2: Синтез трет-бутил N-((2-(4-бензил-2-((трет-бутил(дифенил)силил)оксиметил)пиперазин-1-ил)пиримидин-5-ил)метил)-N-трет-бутоксикарбонилкарбамата
К раствору трет-бутил N-((2-(4-бензил-2-(гидроксиметил)пиперазин-1-ил)пиримидин-5-ил)метил)-N-трет-бутоксикарбонилкарбамата (2,3 г, 4,48 ммоль, 1,0 эквив.) в ДХМ (30 мл) добавляют имидазол (609,69 мг, 8,96 ммоль, 2,0 эквив.) и TBDPSCl (1,73 мл, 6,72 ммоль, 1,5 эквив.). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Смесь затем промывают H2O (100 мл) и водную фазу экстрагируют E-Ac (2×60 мл). Объединенную органическую фазу промывают насыщенным раствором соли (20 мл), сушат с Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (20/1-3/1 петролейный эфир/E-Ac) с получением продукта (4 г, 59,4% выход) в виде желтого масла. ЖХМС (ИЭР) m/z: [M+H] рассч. для C43H57N5O5Si: 752,42; найдено 752,4.
Стадия 3: Синтез трет-бутил N-трет-бутоксикарбонил-N-((2-(2-((трет-бутил(дифенил)силил)оксиметил)пиперазин-1-ил)пиримидин-5-ил)метил)карбамата
К раствору трет-бутил-N-((2-(4-бензил-2-((трет-бутил(дифенил)силил)оксиметил)пиперазин-1-ил)пиримидин-5-ил)метил)-N-трет-бутоксикарбонилкарбамата (3,3 г, 4,39 ммоль, 1,0 эквив.) в E-H (10 мл) добавляют Pd(OH)2/C (1 г, 10% масс.). Смесь нагревают до 50°C под H2 (30 ф./кв.д.) в течение 30 ч. Смесь затем охлаждают при комнатной температуре, фильтруют через Целит и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (20/1-3/1 E-Ac/E-H) с получением продукта (1,44 г, 45,6% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C36H51N5O5Si: 662,38; найдено 662,3.
Строительный блок H. 2-(4-(5-(((трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)-3-(гидроксиметил)пиперазин-1-ил)пиримидин-5-карбоновая кислота.
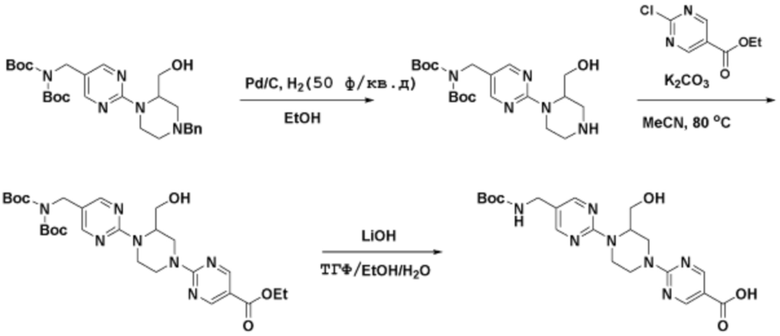
Стадия 1: Синтез трет-бутил N-трет-бутоксикарбонил-N-((2-(2-(гидроксиметил)пиперазин-1-ил)пиримидин-5-ил)метил)карбамата
К раствору трет-бутил N-((2-(4-бензил-2-(гидроксиметил)пиперазин-1-ил)пиримидин-5-ил)метил)-N-трет-бутоксикарбонилкарбамата (3 г, 5,84 ммоль, 1,0 эквив.) в E-H (40 мл) добавляют Pd/C (2 г, 10% масс.). Суспензию дегазируют и продувают H2, затем перемешивают под H2 (50 ф./кв.д.) при 30°C в течение 16 ч. Реакционную смесь охлаждают при комнатной температуре и фильтруют через Целит и затем концентрируют при пониженном давлении с получением продукта (1,6 г, неочищенный) в виде желтого масла. ЖХМС (ИЭР) m/z: [M+H] рассч. для C20H33N5O5: 424,26; найдено 424,3.
Стадия 2: Синтез этил 2-(4-(5-((бис(трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)-3-(гидроксиметил)пиперазин-1-ил)пиримидин-5-карбоксилата
К раствору трет-бутил N-трет-бутоксикарбонил-N-((2-(2-(гидроксиметил)пиперазин-1-ил)пиримидин-5-ил)метил)карбамата (1,4 г, 3,31 ммоль, 1,0 эквив.) в MeCN (20 мл) добавляют K2CO3 (2,28 г, 16,53 ммоль, 5,0 эквив.) и этил 2-хлорпиримидин-5-карбоксилат (616,84 мг, 3,31 ммоль, 1,0 эквив.). Раствор перемешивают при 80°C в течение 4 ч. Смесь охлаждают при комнатной температуре и выливают в H2O (30 мл). Водный слой экстрагируют E-Ac (2×30 мл) и объединенный органический слой промывают насыщенным раствором соли (20 мл), сушат с Na2SO4, фильтруют и концентрируют при пониженном давлении. Смесь очищают хроматографией на силикагеле (20/1-3/1 петролейный эфир/E-Ac) с получением продукта (1,6 г, 66,7% выход) в виде светло-желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C27H39N7O7: 574,30; найдено 574,4.
Стадия 3: Синтез 2-(4-(5-(((трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)-3-(гидроксиметил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору этил 2-(4-(5-((бис(трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)-3-(гидроксиметил)пиперазин-1-ил)пиримидин-5-карбоксилата (1,4 г, 2,44 ммоль, 1,0 эквив.) в ТГФ (6 мл) и E-H (6 мл) при 0°C добавляют раствор LiOH•H2O (512,07 мг, 12,20 ммоль, 5,0 эквив.) в H2O (3 мл). Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 2 ч. Смесь затем концентрируют при пониженном давлении для удаления ТГФ и E-H. Водную фазу доводят до pH 3 с 0,1M HCl и полученную суспензию фильтруют. Твердую лепешку сушат при пониженном давлении с получением продукта (613,14 мг, 55,6% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C20H27N7O5: 446,22; найдено 446,2.
Строительный блок I. трет-бутил N-[(трет-бутокси)карбонил]-N-({2-[(3R)-3-(гидроксиметил)пиперазин-1-ил]пиримидин-5-ил}метил)карбамат.
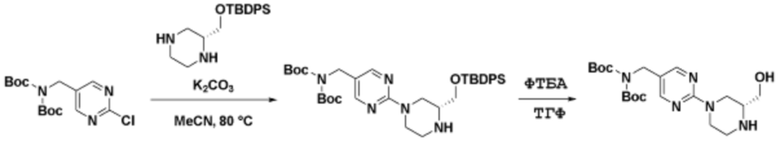
Стадия 1: Синтез (R)-трет-бутил-N-трет-бутоксикарбонил-((2-(3-(((трет-бутилдифенилсилил)окси)метил)пиперазин-1-ил)пиримидин-5-ил)метил)карбамата
К раствору трет-бутил-N-трет-бутоксикарбонил-((2-хлорпиримидин-5-ил)метил)карбамата (24,24 г, 70,51 ммоль, 1,0 эквив.) в MeCN (300 мл) добавляют (R)-2-(((трет-бутилдифенилсилил)окси)метил)пиперазин (25 г, 70,51 ммоль, 1,0 эквив.) и K2CO3 (29,24 г, 211,53 ммоль, 3,0 эквив.). Смесь перемешивают при 80°C в течение 16 ч. Реакционную смесь затем охлаждают при комнатной температуре, разбавляют E-Ac (200 мл), фильтруют и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→100% E-Ac/петролейный эфир) дает желаемый продукт (46,5 г, 94% выход) в виде белого твердого вещества.
Стадия 2: Синтез трет-бутил N-[(трет-бутокси)карбонил]-N-({2-[(3R)-3-(гидроксиметил)пиперазин-1-ил]пиримидин-5-ил}метил)карбамата
К раствору (R)-трет-бутил-N-трет-бутоксикарбонил-((2-(3-(((трет-бутилдифенилсилил)окси)метил)пиперазин-1-ил)пиримидин-5-ил)метил)карбамата (12 г, 18,13 ммоль, 1,0 эквив.) в ТГФ (120 мл) добавляют ФТБА (1 M, 23,93 мл, 1,3 эквив.). Смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь затем выливают в H2O (300 мл), и водную фазу экстрагируют E-Ac (3×80 мл). Объединенные органические фазы объединяют, промывают насыщенным раствором соли (80 мл), сушат, фильтруют и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→20% MeOH/ДХМ) дает желаемый продукт (5 г, 64% выход) в виде желтого твердого вещества.
Строительный блок J. 2-{4-[5-({[(трет-бутокси)карбонил]амино}метил)пиримидин-2-ил]пиперазин-1-ил}пиримидин-5-карбоновая кислота.
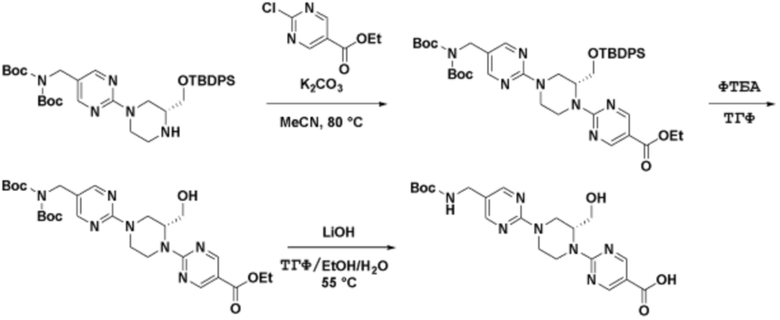
Стадия 1: Синтез (R)-этил 2-(4-(5-(((ди-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)-2-(((трет-бутилдифенилсилил)окси)метил)пиперазин-1-ил)пиримидин-5-карбоксилата
К раствору (R)-трет-бутил-N-трет-бутоксикарбонил-N-((2-(3-(((трет-бутилдифенилсилил)окси)метил)пиперазин-1-ил)пиримидин-5-ил)метил)карбамата (31,5 г, 45,21 ммоль, 1,0 эквив.) в MeCN (350 мл) добавляют этил 2-хлорпиримидин-5-карбоксилат (8,44 г, 45,21 ммоль, 1,0 эквив.) и K2CO3 (18,75 г, 135,63 ммоль, 3,0 эквив.). Смесь перемешивают при 80°C в течение 16 ч. Реакционную смесь затем охлаждают при комнатной температуре, разбавляют E-Ac (150 мл) и фильтруют для удаления неорганических солей. Фильтрат затем концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→100% E-Ac/петролейный эфир) дает желаемый продукт (33,5 г, 89% выход).
Стадия 2: Синтез (R)-этил 2-(4-(5-(((ди-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)-2-(гидроксиметил)пиперазин-1-ил)пиримидин-5-карбоксилата
К раствору (R)-этил 2-(4-(5-(((ди-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)-2-(((трет-бутилдифенилсилил)окси)метил)пиперазин-1-ил)пиримидин-5-карбоксилата (36,5 г, 44,95 ммоль, 1,0 эквив.) в ТГФ (300 мл) добавляют ФТБА (1 M, 59,33 мл, 1,32 эквив.). Смесь перемешивают при комнатной температуре в течение 6 ч, в этот момент реакционную смесь выливают в H2O (500 мл). Водную фазу отделяют и экстрагируют E-Ac (3×150 мл) и объединенные органические слои промывают насыщенным раствором соли (150 мл), сушат, фильтруют и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→100% E-Ac/петролейный эфир) дает желаемый продукт (17 г, 64% выход) в виде желтого масла.
Стадия 3: Синтез (R)-2-(4-(5-(((трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)-2-(гидроксиметил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору (R)-этил 2-(4-(5-(((ди-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)-2-(гидроксиметил)пиперазин-1-ил)пиримидин-5-карбоксилата (17 г, 29,64 ммоль, 1,0 эквив.) в H2O (160 мл), E-H (80 мл) и ТГФ (160 мл) добавляют LiOH•H2O (4,97 г, 118,54 ммоль, 4,0 эквив.). Реакционную смесь перемешивают при 55°C в течение 16 ч. К смеси затем добавляют LiOH•H2O (1,01 г, 24,00 ммоль, 0,81 эквив.), и реакционную смесь перемешивают при 55°C в течение еще 19 ч. Смесь охлаждают при комнатной температуре, разбавляют H2O (150 мл) и концентрируют при пониженном давлении для удаления ТГФ и E-H. Смесь подкисляют (pH=5) 1 N HCl, фильтруют и фильтровальную лепешку промывают H2O (2×30 мл). Фильтровальную лепешку сушат при пониженном давлении с получением желаемого продукта (9,2 г, 67% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C20H27N7O5: 446,22; найдено 446,1.
Строительный блок K. трет-бутил N-[(трет-бутокси)карбонил]-N-({2-[(3S)-3-(гидроксиметил)пиперазин-1-ил]пиримидин-5-ил}метил)карбамат.
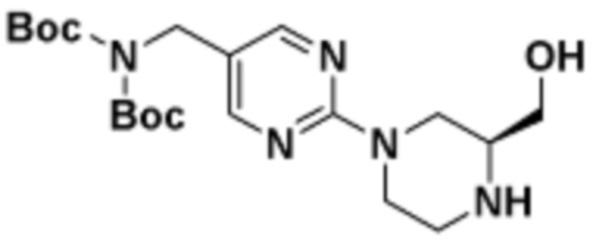
Этот строительный блок получают по методике, аналогичной методике получения Строительного блока I с применением [(2S)-пиперазин-2-ил]метанола.
Строительный блок L. 2-[(2S)-4-[5-({[(трет-бутокси)карбонил]амино}метил)пиримидин-2-ил]-2-(гидроксиметил)пиперазин-1-ил]пиримидин-5-карбоновая кислота.
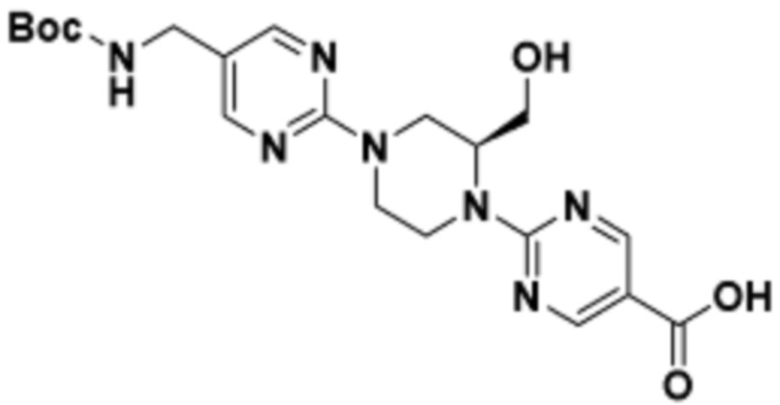
Этот строительный блок получают из Строительного блока K по методике, аналогичной методике получения Строительного блока J.
Строительный блок M. трет-бутил 2-[(3R)-3-(гидроксиметил)пиперазин-1-ил]-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-6-карбоксилат.
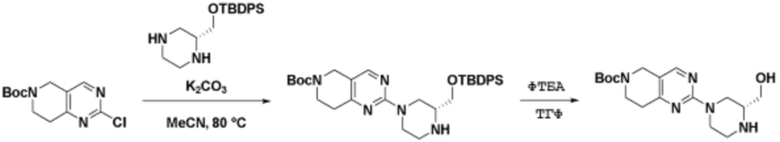
Стадия 1: Синтез (R)-трет-бутил 2-(3-(((трет-бутилдифенилсилил)окси)метил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата
К раствору (R)-2-(((трет-бутилдифенилсилил)окси)метил)пиперазина (25 г, 70,51 ммоль, 1,0 эквив.) в MeCN (250 мл) добавляют K2CO3 (29,24 г, 211,53 ммоль, 3,0 эквив.) и трет-бутил 2-хлор-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (17,12 г, 63,46 ммоль, 0,9 эквив.). Смесь перемешивают при 80°C в течение 17 ч. Реакционную смесь затем охлаждают при комнатной температуре, фильтруют и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→100% E-Ac/петролейный эфир) дает желаемый продукт (31 г, 73,5% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C33H45N5O3Si: 588,34; найдено 588,2.
Стадия 2: Синтез (R)-трет-бутил 2-(3-(гидроксиметил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата
К смеси (R)-трет-бутил 2-(3-(((трет-бутилдифенилсилил)окси)метил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (12 г, 20,41 ммоль, 1,0 эквив.) в ТГФ (120 мл) добавляют ФТБА (1,0 M, 24,50 мл, 1,2 эквив.). Смесь перемешивают при комнатной температуре в течение 5 ч. Смесь выливают в H2O (100 мл), и водную фазу экстрагируют E-Ac (2×100 мл). Объединенные органические фазы промывают насыщенным раствором соли (100 мл), сушат, фильтруют и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→10% MeOH/ДХМ) дает желаемый продукт (6 г, 84,1% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C17H27N5O3: 350,22; найдено 350,2.
Строительный блок N. 2-[(2R)-4-{6-[(трет-бутокси)карбонил]-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-2-ил}-2-(гидроксиметил)пиперазин-1-ил]пиримидин-5-карбоновая кислота.
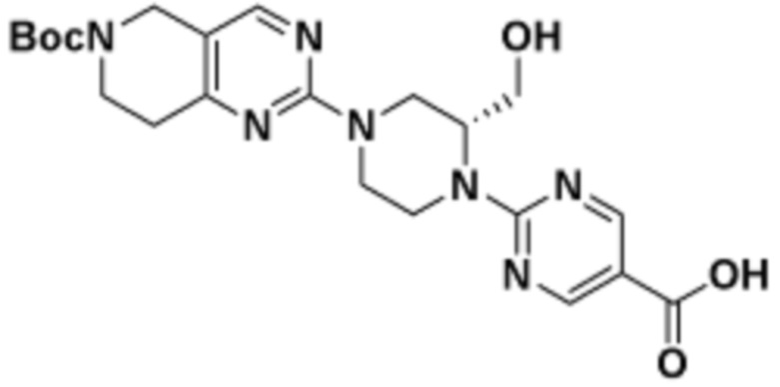
Этот строительный блок получают из Строительного блока M по методике, аналогичной методике получения Строительного блока J.
Строительный блок O. трет-бутил 2-[(3S)-3-(гидроксиметил)пиперазин-1-ил]-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-6-карбоксилат.
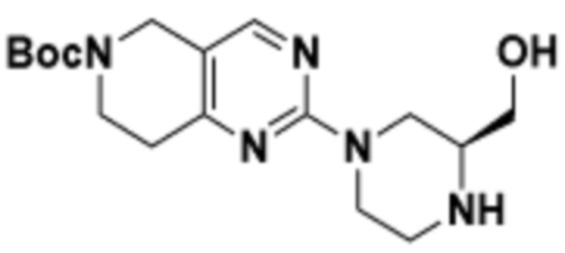
Этот строительный блок получают по методике, аналогичной методике получения Строительного блока Iс применением трет-бутил 2-хлор-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата и [(2S)-пиперазин-2-ил]метанола.
Строительный блок P. 2-[(2S)-4-{6-[(трет-бутокси)карбонил]-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-2-ил}-2-(гидроксиметил)пиперазин-1-ил]пиримидин-5-карбоновая кислота.
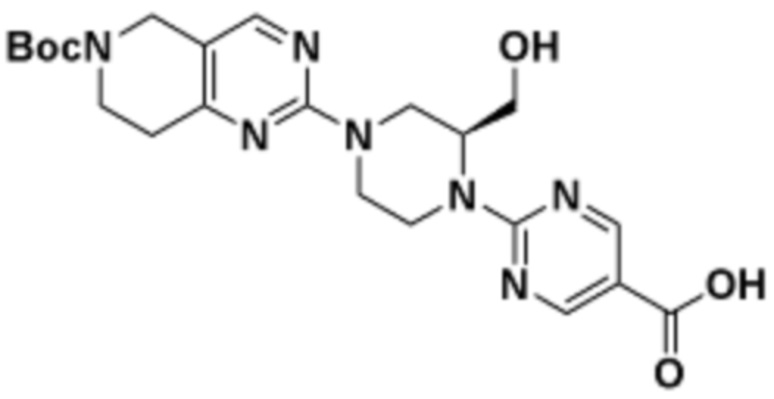
Этот строительный блок получают из Строительного блока O по методике, аналогичной методике получения Строительного блока J.
Строительный блок Q. трет-бутил N-[(трет-бутокси)карбонил]-N-({2-[(3S)-3-[(диметиламино)метил]пиперазин-1-ил]пиримидин-5-ил}метил)карбамат.
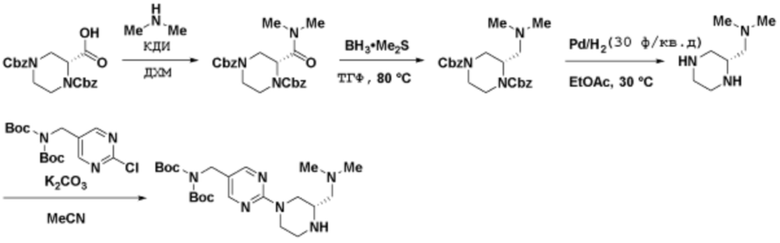
Стадия 1: Синтез (R)-дибензил 2-(диметилкарбамоил)пиперазин-1,4-дикарбоксилата
К раствору КДИ (12,21 г, 75,30 ммоль, 1,2 эквив.) в ДХМ (300 мл) при 0°C добавляют (R)-1,4-бис((бензилокси)карбонил)пиперазин-2-карбоновую кислоту (25 г, 62,75 ммоль, 1,0 эквив.). Смесь перемешивают при 0°C в течение 0,5 ч, в это время добавляют диметиламин (8,51 мл, 92,87 ммоль, 1,5 эквив., HCl). Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 12 ч. Реакционную смесь затем добавляют к H2O (200 мл), и водный слой отделяют и экстрагируют ДХМ (2×200 мл). Объединенные органические фазы промывают насыщенным раствором соли (2×50 мл), сушат, фильтруют и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (50→100% E-Ac/петролейный эфир) дает желаемый продукт (23,5 г, 88,0% выход) в виде желтого масла.
Стадия 2: Синтез (S)-дибензил 2-((диметиламино)метил)пиперазинe-1,4-дикарбоксилата
К раствору (R)-дибензил 2-(диметилкарбамоил)пиперазин-1,4-дикарбоксилата (28 г, 65,81 ммоль, 1,0 эквив.) в ТГФ (300 мл) при 0°C добавляют BH3●Me2S (10 M, 13,16 мл, 2,0 эквив.). Реакционную смесь затем перемешивают при 80°C в течение 3 ч. Реакционную смесь охлаждают при комнатной температуре и затем добавляют MeOH (50 мл). После перемешивания в течение еще 1 ч, смесь концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (50→100% E-Ac/петролейный эфир) дает желаемый продукт (18 г, 66,5% выход) в виде желтого масла.
Стадия 3: Синтез (R)-N, N-диметил-1-(пиперазин-2-ил)метанамина
К раствору (S)-дибензил 2-((диметиламино)метил)пиперазин-1,4-дикарбоксилата (18 г, 43,74 ммоль, 1,0 эквив.) в E-Ac (200 мл) добавляют Pd/C (1,5 г, 10% масс.). Суспензию дегазируют при пониженном давлении и продувают H2 три раза. Суспензию перемешивают под H2 (30 ф./кв.д.) при 30°C в течение 5 ч. Реакционную смесь затем фильтруют через Целит, и фильтрат концентрируют при пониженном давлении с получением желаемого продукта (6 г, 95,8% выход) в виде желтого твердого вещества.
Стадия 4: Синтез трет-бутил N-трет-бутоксикарбонил-N-((2-((3S)-3-((диметиламино)метил)пиперазин-1-ил)пиримидин-5-ил)метил)карбамата
К раствору (R)-N, N-диметил-1-(пиперазин-2-ил)метанамина (2,8 г, 19,55 ммоль, 1,0 эквив.) в MeCN (40 мл) добавляют трет-бутил N-трет-бутоксикарбонил-N-((2-хлорпиримидин-5-ил)метил)карбамат (6,72 г, 19,55 ммоль, 1,0 эквив.) и K2CO3 (5,40 г, 39,10 ммоль, 2,0 эквив.). Смесь перемешивают при 80°C в течение 24 ч. Смесь затем охлаждают при комнатной температуре, фильтруют и фильтровальную лепешку промывают E-Ac(3×10 мл). Фильтрат затем концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→100% MeOH/E-Ac) дает желаемый продукт (5,3 г, 57,8% выход) в виде желтого масла. ЖХМС (ИЭР) m/z: [M+H] рассч. для C22H38N6O4: 451,31; найдено 451,2.
Строительный блок R. 2-[(2S)-4-[5-({[(трет-бутокси)карбонил]амино}метил)пиримидин-2-ил]-2-[(диметиламино)метил]пиперазин-1-ил]пиримидин-5-карбоновая кислота.
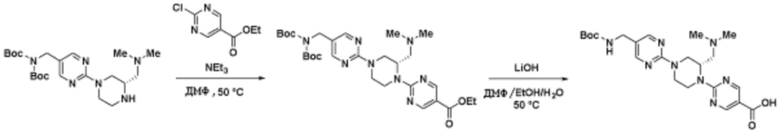
Стадия 1: Синтез (S)-этил 2-(4-(5-(((би-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)-2-((диметиламино)метил)пиперазин-1-ил)пиримидин-5-карбоксилата
К раствору (S)-трет-бутил-N-трет-бутоксикарбонил ((2-(3-((диметиламино)метил)пиперазин-1-ил)пиримидин-5-ил)метил)карбамата (3,26 г, 7,24 ммоль, 1,0 эквив.) в ДМФ (30 мл) добавляют Et3N (3,02 мл, 21,71 ммоль, 3,0 эквив.) и этил 2-хлорпиримидин-5-карбоксилат (1,47 г, 7,86 ммоль, 1,1 эквив.). Смесь перемешивают при 50°C в течение 3 ч, и затем концентрируют при пониженном давлении с получением желаемого продукта (4,35 г, неочищенный) в виде раствора в ДМФ (30 мл), который используют сразу на следующей стадии. ЖХМС (ИЭР) m/z: [M+H] рассч. для C29H44N8O6: 601,35; найдено 601,5.
Стадия 2: Синтез (S)-2-(4-(5-(((трет-бутоксикарбонил)амино)метил)-пиримидин-2-ил)-2-((диметиламино)метил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору (S)-этил 2-(4-(5-(((би-трет-бутоксикарбонил)амино)метил)-пиримидин-2-ил)-2-((диметиламино)метил)пиперазин-1-ил)пиримидин-5-карбоксилата (4,35 г, 7,24 ммоль, 1,0 эквив.) в ДМФ (30 мл) добавляют ДМФ (50 мл), E-H (30 мл) и H2O (30 мл). К раствору затем добавляют LiOH•H2O (3 г, 71,50 ммоль, 9,9 эквив.) при 50°C. Реакционную смесь перемешивают при 50°C в течение 36 ч. Смесь затем охлаждают при комнатной температуре, нейтрализуют 0,5 N HCl и концентрируют при пониженном давлении. Очистка хроматографией с обращенной фазой (2→30% MeCN/H2O) дает желаемый продукт (1,15 г, 34% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C22H32N8O4: 473,26; найдено 473,3.
Строительный блок S. трет-бутил N-[(трет-бутокси)карбонил]-N-({2-[(3R)-3-[(диметиламино)метил]пиперазин-1-ил]пиримидин-5-ил}метил)карбамат.
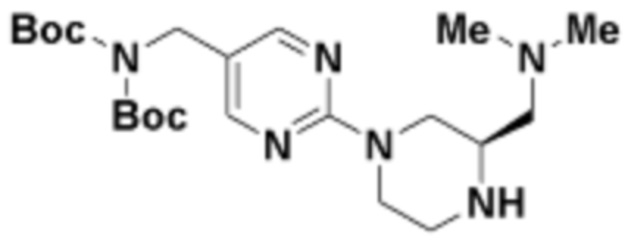
Этот строительный блок получают по методике, аналогичной методике получения Строительного блока Iс применением диметил({[(2S)-пиперазин-2-ил]метил})амина.
Строительный блок T. 2-[(2R)-4-[5-({[(трет-бутокси)карбонил]амино}метил)пиримидин-2-ил]-2-[(диметиламино)метил]пиперазин-1-ил]пиримидин-5-карбоновая кислота.
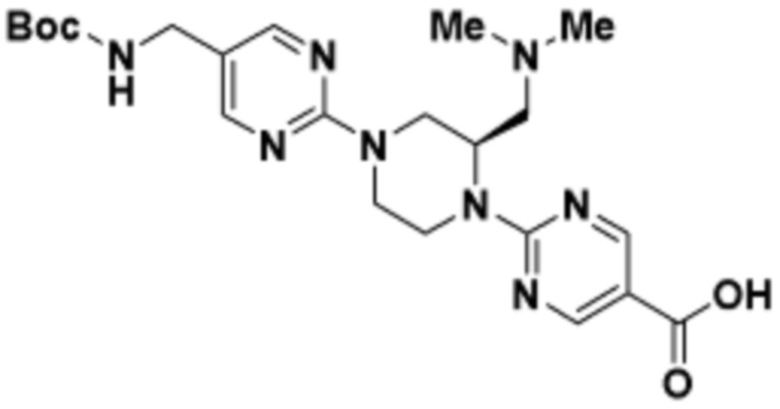
Этот строительный блок получают из Строительного блока S по методике, аналогичной методике получения Строительного блока J.
Строительный блок U. трет-бутил 2-[(3S)-3-[(диметиламино)метил]пиперазин-1-ил]-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-6-карбоксилат.
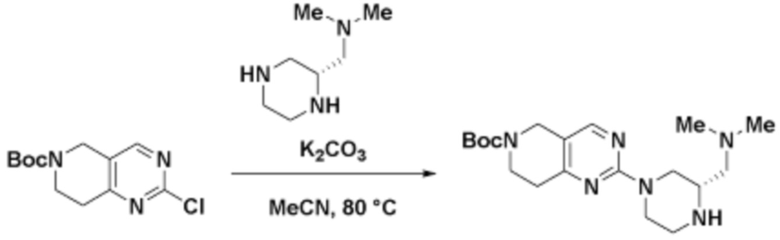
К раствору трет-бутил 2-хлор-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (4,80 г, 17,80 ммоль, 1,4 эквив.) в MeCN (45 мл) добавляют K2CO3 (10,42 г, 75,40 ммоль, 3,0 эквив.) и (R)-N, N-диметил-1-(пиперазин-2-ил)метанамин (3,6 г, 25,13 ммоль, 1,0 эквив.). Смесь перемешивают при 80°C в течение 8 ч. Смесь затем охлаждают при комнатной температуре, фильтруют и фильтровальную лепешку промывают E-Ac (50 мл). К органической фазе добавляют H2O (50 мл), и водную фазу экстрагируют E-Ac (3×50 мл). Объединенные органические фазы промывают насыщенным раствором соли (5 мл), сушат, фильтруют и концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (8→67% E-Ac/петролейный эфир) дает желаемый продукт (6,5 г, 63,5% выход) в виде желтого масла.
Строительный блок V. 2-[(2S)-4-{6-[(трет-бутокси)карбонил]-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-2-ил}-2-[(диметиламино)метил]пиперазин-1-ил]пиримидин-5-карбоновая кислота.
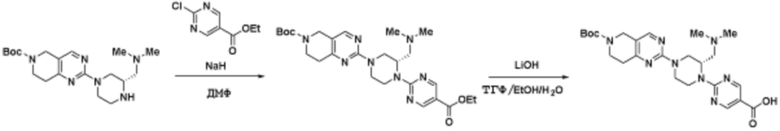
Стадия 1: Синтез (S)-трет-бутил 2-(3-((диметиламино)метил)-4-(5-(этоксикарбонил)пиримидин-2-ил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата
К раствору (S)-трет-бутил 2-(3-((диметиламино)метил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (3 г, 7,97 ммоль, 1,0 эквив.) в ДМФ (70 мл) при 0°C добавляют NaH (382,44 мг, 9,56 ммоль, 60% масс., 1,2 эквив.). Суспензию перемешивают при 0°C в течение 0,5 ч, затем этил 2-хлорпиримидин-5-карбоксилат (1,49 г, 7,97 ммоль, 1 эквив.) в ДМФ (50 мл) добавляют по каплям. Смесь нагревают до комнатной температуры и перемешивают в течение 5 ч. Смесь затем охлаждают до 0°C и выливают в H2O (360 мл). Суспензию фильтруют, и фильтровальную лепешку промывают H2O (30 мл) и сушат при пониженном давлении. Очистка хроматографией на силикагеле (6%→33% E-Ac/петролейный эфир) дает желаемый продукт (1,8 г,39,6% выход)в виде коричневого масла.
Стадия 2: Синтез (S)-2-(4-(6-(трет-бутоксикарбонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-ил)-2-((диметиламино)метил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору (S)-трет-бутил 2-(3-((диметиламино)метил)-4-(5-(этоксикарбонил)пиримидин-2-ил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (1,1 г, 2,09 ммоль, 1,0 эквив.) в ТГФ (5 мл), E-H (2,5 мл) и H2O (2,5 мл) добавляют LiOH•H2O (175,30 мг, 4,18 ммоль, 2,0 эквив.). Смесь перемешивают при комнатной температуре в течение 2 ч, в этот момент pH доводят до 7 добавлением 1 N HCl при 0°C. Смесь концентрируют при пониженном давлении для удаления ТГФ и MeOH. Полученную суспензию фильтруют, и фильтровальную лепешку промывают H2O (5 мл) и сушат при пониженном давлении с получением желаемого продукта (680 мг, 65,3% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C24H34N8O4: 499,28; найдено 499,2.
Строительный блок W. трет-бутил 2-[(3R)-3-[(диметиламино)метил]пиперазин-1-ил]-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-6-карбоксилат.
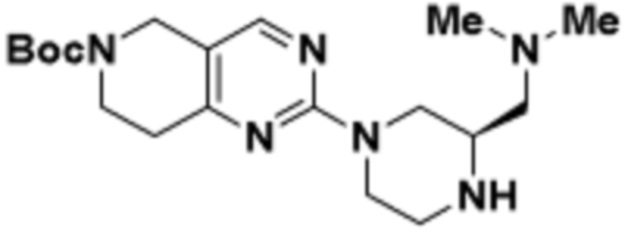
Этот строительный блок получают по методике, аналогичной методике получения Строительного блока Iс применением трет-бутил 2-хлор-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата и диметил({[(2S)-пиперазин-2-ил]метил})амина.
Строительный блок X. 2-[(2R)-4-{6-[(трет-бутокси)карбонил]-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-2-ил}-2-[(диметиламино)метил]пиперазин-1-ил]пиримидин-5-карбоновая кислота.
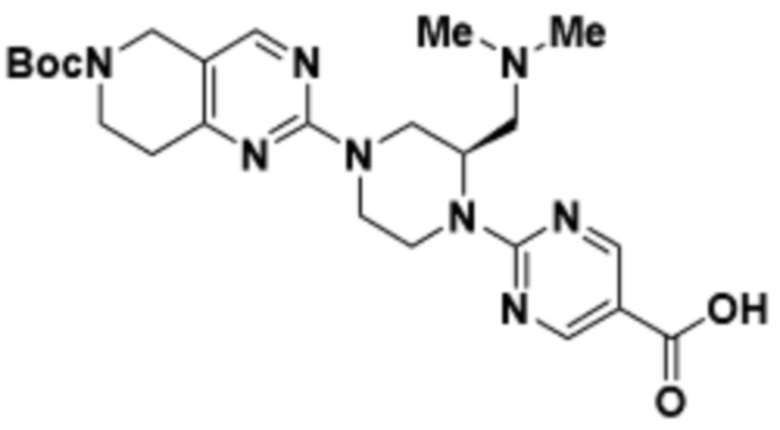
Этот строительный блок получают из Строительного блока W по методике, аналогичной методике получения Строительного блока J.
Строительный блок Y. трет-бутил (2R)-4-{6-[(трет-бутокси)карбонил]-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-2-ил}пиперазинe-2-карбоксилат.
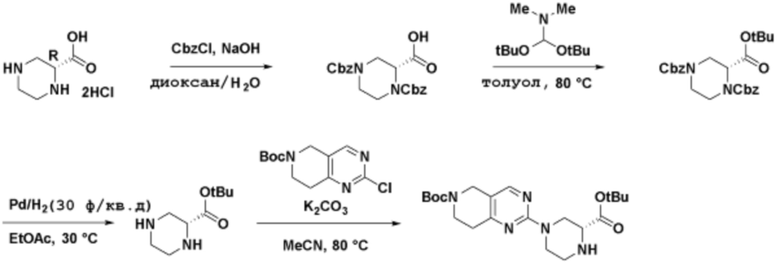
Стадия 1: Синтез (R)-1,4-бис((бензилокси)карбонил)пиперазинe-2-карбоновой кислоты
К раствору (R)-пиперазин-2-карбоновой кислоты (70 г, 344,71 ммоль, 1,0 эквив., 2HCl) в диоксане (1120 мл) и H2O (700 мл) добавляют 50% водн. NaOH до тех пор, пока рН раствора не станет pH=11. Добавляют бензилхлорформиат (156,82 мл, 1,10 моль, 3,2 эквив.) и реакционную смесь перемешивают при комнатной температуре в течение 12 ч. К раствору затем добавляют H2O (1200 мл), и водный слой промывают МТБЭ (3×800 мл). Водный слой доводят до pH=2 с концентрированной HCl (12N) и экстрагируют E-Ac (2×1000 мл). Объединенные органические экстракты сушат, фильтруют и фильтрат концентрируют при пониженном давлении с получением желаемого продукта (137 г, 99,8% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C21H22N2O6:399,16; найдено 399,2.
Стадия 2: Синтез (R)-1,4-дибензил 2-трет-бутил пиперазин-1,2,4-трикарбоксилата
К раствору (R)-1,4-бис((бензилокси)карбонил)пиперазин-2-карбоновой кислоты (50 г, 125,50 ммоль, 1,0 эквив.) в толуоле (500 мл) при 80°C добавляют 1,1-ди-трет-бутокси-N, N-диметилметанамин (57,17 мл, 238,45 ммоль, 1,9 эквив.). Раствор перемешивают при 80°C в течение 2 ч, в этот момент реакционную смесь охлаждают при комнатной температуре и разделяют между E-Ac (300 мл) и H2O (500 мл).Водный слой экстрагируют E-Ac (2×500 мл) и объединенные органические слои сушат, фильтруют и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0%→25% E-Ac/петролейный эфир) дает желаемый продукт (35 г, 61,2% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+Na] рассч. для C25H30N2O6: 477,20; найдено 477,1.
Стадия 3: Синтез (R)-трет-бутил пиперазин-2-карбоксилата
К раствору(R)-1,4-дибензил 2-трет-бутил пиперазин-1,2,4-трикарбоксилата (35 г, 77,01 ммоль, 1,0 эквив.) в E-Ac (350 мл) добавляют Pd/C (10 г, 10% масс.). Суспензию дегазируют при пониженном давлении и продувают H2 три раза. Смесь перемешивают под H2 (30 ф./кв.д.) при 30°C в течение 4 ч. Реакционную смесь затем фильтруют через Целит, остаток промывают MeOH (5×200 мл) и фильтрат концентрируют при пониженном давлении с получением желаемого продукта (14 г, 79,6% выход) в виде желтого масла. ЖХМС (ИЭР) m/z: [M+H] рассч. для C9H18N2O2:187,15; найдено 187,1.
Стадия 4: Синтез (R)-трет-бутил 2-(3-(трет-бутоксикарбонил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата
К раствору трет-бутил (2R)-пиперазин-2-карбоксилата (12 г, 64,43 ммоль, 1,0 эквив.) в MeCN (200 мл) добавляют K2CO3 (17,81 г, 128,86 ммоль, 2,0 эквив.) и трет-бутил 2-хлор-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилат (17,38 г, 64,43 ммоль, 1,0 эквив.). Реакционную смесь нагревают до 80°C и перемешивают в течение 12 ч. Реакционную смесь затем охлаждают при комнатной температуре и фильтруют, остаток промывают E-Ac (3×150 мл) и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0%→100% E-Ac/петролейный эфир) дает желаемый продукт (19 г, 69,2% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C21H33N5O4: 420,26; найдено 420,2.
Строительный блок Z. 4-амино-2-[(2R)-2-[(трет-бутокси)карбонил]-4-{6-[(трет-бутокси)карбонил]-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-2-ил}пиперазин-1-ил]пиримидин-5-карбоновая кислота.
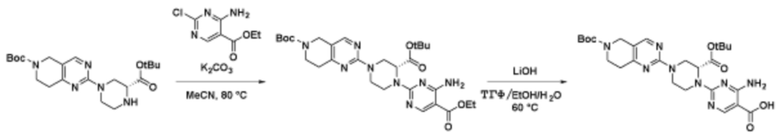
Стадия 1: Синтез (R)-трет-бутил 2-(4-(4-амино-5-(этоксикарбонил)пиримидин-2-ил)-3-(трет-бутоксикарбонил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата
К перемешиваемому раствору (R)-трет-бутил 2-(3-(трет-бутоксикарбонил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (12 г, 28,60 ммоль, 1,0 эквив.) в MeCN (150 мл) добавляют K2CO3 (7,91 г, 57,20 ммоль, 2,0 эквив.) и этил 4-амино-2-хлорпиримидин-5-карбоксилат (6,92 г, 34,32 ммоль, 1,2 эквив.). Реакционную смесь перемешивают при 80°C в течение 12 ч, в этот момент реакционную смесь фильтруют и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0%→17% E-Ac/петролейный эфир) дает желаемый продукт (16 г, 91,6% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C28H40N8O6: 585,32; найдено 585,1.
Стадия 2: Синтез (R)-4-амино-2-(2-(трет-бутоксикарбонил)-4-(6-(трет-бутоксикарбонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-ил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К двум раздельным партиям, полученным параллельно, где каждая содержит раствор (R)-трет-бутил 2-(4-(4-амино-5-(этоксикарбонил)пиримидин-2-ил)-3-(трет-бутоксикарбонил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (7 г, 11,97 ммоль, 1,0 эквив.) в ТГФ (70 мл), E-H (35 мл) и H2O (35 мл) добавляют LiOH•H2O (2,01 г, 47,89 ммоль, 4,0 эквив.). Смеси перемешивают при 60°C в течение 3 ч, в этот момент две реакционные смеси объединяют и доводят до pH=7 с 1 N HCl. Смесь концентрируют при пониженном давлении для удаления ТГФ и E-H, фильтруют, и остаток сушат при пониженном давлении. Остаток перемешивают в МТБЭ (100 мл) в течение 10 мин, фильтруют, и остаток сушат при пониженном давлении с получением желаемого продукта (8,02 г, 55,1% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C26H36N8O6:557,29; найдено 557,3.
Строительный блок AA. трет-бутил (2S)-4-{6-[(трет-бутокси)карбонил]-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-2-ил}пиперазинe-2-карбоксилат.
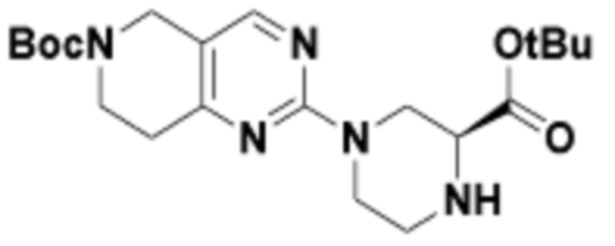
Этот строительный блок получают по методике, аналогичной методике получения Строительного блока Iс применением трет-бутил 2-хлор-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата и трет-бутил (2S)-пиперазин-2-карбоксилата.
Строительный блок AB. 4-амино-2-[(2S)-2-[(трет-бутокси)карбонил]-4-{6-[(трет-бутокси)карбонил]-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-2-ил}пиперазин-1-ил]пиримидин-5-карбоновая кислота.
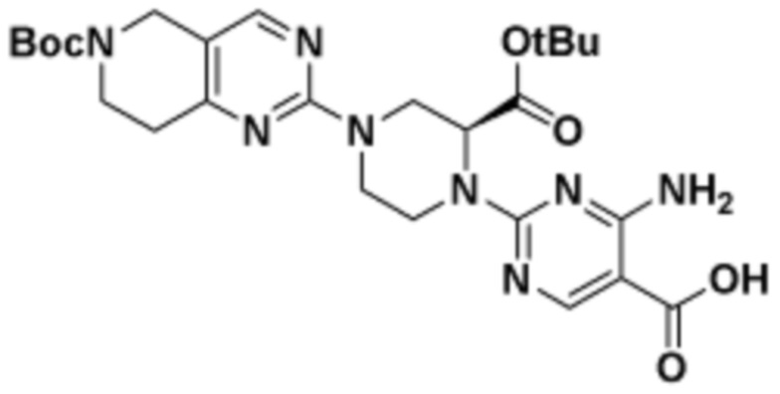
Этот строительный блок получают из Строительного блока AA по методике, аналогичной методике получения Строительного блока J с применением этил 4-амино-2-хлорпиримидин-5-карбоксилата.
Строительный блок AC. 4-амино-2-(4-{6-[(трет-бутокси)карбонил]-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-2-ил}пиперазин-1-ил)пиримидин-5-карбоновая кислота.
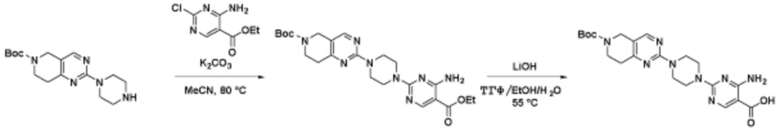
Стадия 1: Синтез трет-бутил 2-(4-(4-амино-5-(этоксикарбонил)пиримидин-2-ил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата
К раствору трет-бутил 2-(пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (8,3 г, 25,99 ммоль, 1,0 эквив.) и этил 4-амино-2-хлорпиримидин-5-карбоксилата (5,24 г, 25,99 ммоль, 1,0 эквив.) в MeCN (100 мл) добавляют к K2CO3 (7,18 г, 51,97 ммоль, 2,0 эквив.). Реакционную смесь перемешивают при 80°C в течение 12 ч. Реакционную смесь затем охлаждают при комнатной температуре, добавляют ДХМ (100 мл) и реакционную смесь перемешивают в течение 30 мин. Суспензию фильтруют, и фильтровальную лепешку промывают ДХМ (6×100 мл). Фильтрат концентрируют при пониженном давлении, и остаток растирают с E-Ac (30 мл), фильтруют и затем фильтровальную лепешку сушат при пониженном давлении с получением желаемого продукта (8,7 г, 65,9% выход) в виде светло-желтого твердого вещества.
Стадия 2: Синтез 4-амино-2-(4-(6-(трет-бутоксикарбонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-ил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору трет-бутил 2-(4-(4-амино-5-(этоксикарбонил)пиримидин-2-ил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (8,7 г, 17,95 ммоль, 1,0 эквив.) в ТГФ (120 мл), E-H (60 мл) и H2O (60 мл) добавляют LiOH•H2O (1,51 г, 35,91 ммоль, 2,0 эквив.). Смесь перемешивают при 55°C в течение 12 ч. Реакционную смесь затем концентрируют при пониженном давлении для удаления E-H и ТГФ, и реакционную смесь доводят до pH=6 добавлением 1N HCl. Осадок фильтруют, и фильтровальную лепешку промывают H2O (3×50 мл) и затем сушат при пониженном давлении с получением желаемого продукта (7,3 г, 89,1% выход) в виде светло-желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C21H28N8O4: 457,23; найдено 457,2.
Строительный блок AD. 4-амино-2-{4-[5-({[(трет-бутокси)карбонил]амино}метил)пиримидин-2-ил]пиперазин-1-ил}пиримидин-5-карбоновая кислота.
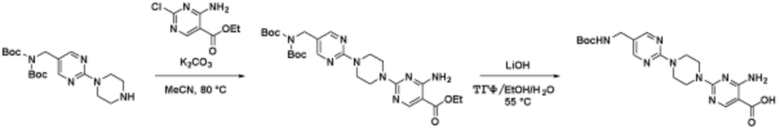
Стадия 1: Синтез этил 4-амино-2-(4-(5-(((ди-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)пиримидин-5-карбоксилата
К раствору трет-бутил-N-трет-бутоксикарбонил-N-((2-(пиперазин-1-ил)пиримидин-5-ил)метил)карбамата (8,3 г, 21,09 ммоль, 1,0 эквив.) в MeCN (100 мл) добавляют этил 4-амино-2-хлорпиримидин-5-карбоксилат (4,04 г, 20,04 ммоль, 0,95 эквив.) и K2CO3 (8,75 г, 63,28 ммоль, 3,0 эквив.). Смесь перемешивают при 80°C в течение 3 ч. Реакционную смесь затем охлаждают при комнатной температуре, добавляют ДХМ (150 мл) и реакционную смесь перемешивают в течение 30 мин. Суспензию фильтруют, фильтровальную лепешку промывают ДХМ (3×100 мл) и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0%→100% E-Ac/петролейный эфир) дает желаемый продукт (8,35 г, 67% выход) в виде белого твердого вещества.
Стадия 2: Синтез 4-амино-2-(4-(5-(((трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору этил 4-амино-2-(4-(5-(((ди-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)пиримидин-5-карбоксилата (8,3 г, 14,86 ммоль, 1,0 эквив.) в H2O (70 мл), E-H (36 мл) и ТГФ (80 мл) добавляют LiOH•H2O (2,49 г, 59,43 ммоль, 4,0 эквив.). Реакционную смесь перемешивают при 55°C в течение 16 ч. Смесь затем концентрируют при пониженном давлении для удаления ТГФ и E-H. Смесь разбавляют H2O (55 мл) и доводят до pH=6 добавлением 1N HCl. Смесь фильтруют, и фильтровальную лепешку промывают H2O (2×20 мл). Твердую лепешку сушат при пониженном давлении с получением желаемого продукта (5,5 г, 84% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C19H26N8O4: 431,22; найдено 431,4.
Строительный блок AE. 4-амино-2-[(2R)-4-{6-[(трет-бутокси)карбонил]-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-2-ил}-2-(гидроксиметил)пиперазин-1-ил]пиримидин-5-карбоновая кислота.
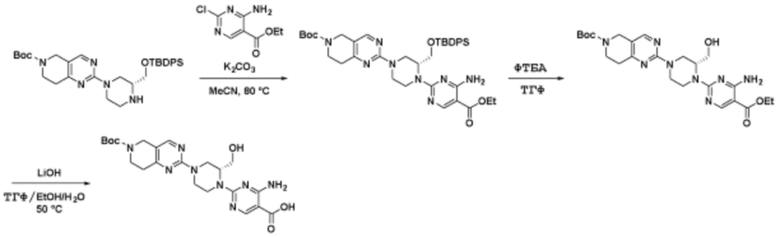
Стадия 1: Синтез (R)-трет-бутил 2-(4-(4-амино-5-(этоксикарбонил)пиримидин-2-ил)-3-(((трет-бутилдифенилсилил)окси)метил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата
К раствору (R)-трет-бутил 2-(3-(((трет-бутилдифенилсилил)окси)метил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (17,2 г, 29,26 ммоль, 1,0 эквив.) в MeCN (200 мл) добавляют K2CO3 (12,13 г, 87,78 ммоль, 3,0 эквив.) и этил 4-амино-2-хлорпиримидин-5-карбоксилат (6,37 г, 31,60 ммоль, 1,08 эквив.). Смесь перемешивают при 80°C в течение 18 ч. Реакционную смесь затем охлаждают при комнатной температуре, фильтруют и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0%→33% E-Ac/петролейный эфир) дает желаемый продукт (20,3 г, 90,6% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C40H52N8O5Si: 753,39; найдено 753,4.
Стадия 2: Синтез (R)-4-амино-2-(4-(6-(трет-бутоксикарбонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-ил)-2-(гидроксиметил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору (R)-трет-бутил 2-(4-(4-амино-5-(этоксикарбонил)пиримидин-2-ил)-3-(((трет-бутилдифенилсилил)окси)метил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (20,3 г, 26,96 ммоль, 1,0 эквив.) в ТГФ (200 мл) добавляют ФТБА (1,0 M, 50,75 мл, 1,9 эквив.). Реакционную смесь перемешивают при комнатной температуре в течение 5 ч. Смесь затем выливают в H2O (200 мл) и водную фазу экстрагируют E-Ac (2×150 мл). Объединенные органические фазы промывают насыщенным раствором соли (2×100 мл), сушат, фильтруют и концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0%→20% E-Ac/петролейный эфир) дает желаемый продукт (12 г, 85,7% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C24H34N8O5: 515,28; найдено 515,4.
Стадия 3: Синтез (R)-4-амино-2-(4-(6-(трет-бутоксикарбонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-ил)-2-(гидроксиметил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору (R)-4-амино-2-(4-(6-(трет-бутоксикарбонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-ил)-2-(гидроксиметил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты (12 г, 23,32 ммоль, 1,0 эквив.) в ТГФ (100 мл), E-H (30 мл) и H2O (30 мл) добавляют LiOH•H2O (5,87 г, 139,92 ммоль, 6,0 эквив.). Смесь перемешивают при 50°C в течение 22 ч. Смесь затем концентрируют при пониженном давлении для удаления ТГФ и E-H. Водную фазу нейтрализуют 1 N HCl и полученный осадок фильтруют. Фильтровальную лепешку промывают H2O (50 мл) и сушат при пониженном давлении. Фильтрат экстрагируют ДХМ (8×60 мл) и объединенные органические фазы промывают насыщенным раствором соли (2×50 мл), сушат, фильтруют и концентрируют при пониженном давлении. Полученный остаток объединяют с исходной фильтровальной лепешкой, и твердое вещество растворяют в ДХМ (150 мл) и концентрируют при пониженном давлении с получением желаемого продукта (9,76 г, 85,2% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C22H30N8O5: 487,24; найдено 487,2.
Строительный блок AF. 4-амино-2-[(2S)-4-{6-[(трет-бутокси)карбонил]-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-2-ил}-2-(гидроксиметил)пиперазин-1-ил]пиримидин-5-карбоновая кислота
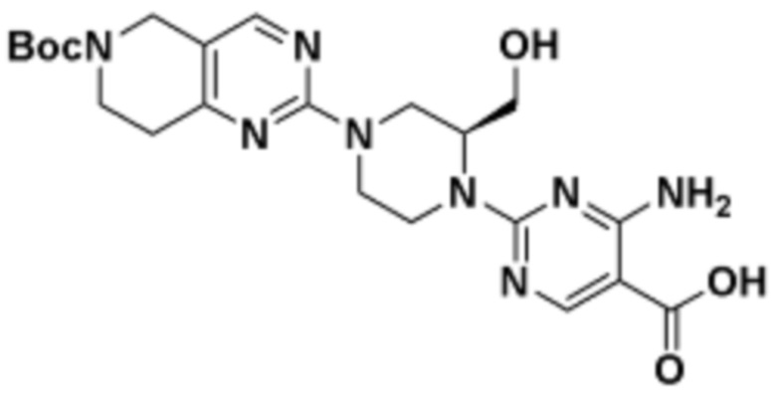
Этот строительный блок получают из Строительного блока O по методике, аналогичной методике получения Строительного блока J с применением этил 4-амино-2-хлорпиримидин-5-карбоксилата.
Строительный блок AG. 2-((2-(4-(5-((ди-(трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-2-оксоэтил)(метил)амино)уксусная кислота.
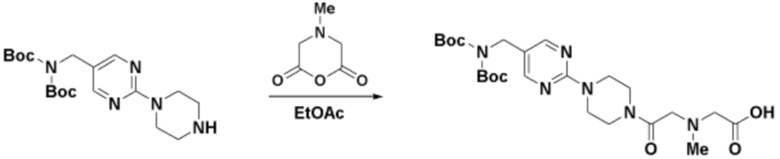
К раствору трет-бутил N-трет-бутоксикарбонил-N-((2-пиперазин-1-илпиримидин-5-ил)метил)карбамата (4,88 г, 12,39 ммоль, 1,0 эквив.) в E-Ac (40 мл) добавляют 4-метилморфолин-2,6-дион (1,6 г, 12,39 ммоль, 1,0 эквив.). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч, затем реакционную смесь концентрируют при пониженном давлении с получением неочищенного продукта. Остаток растирают с E-Ac (15 мл) и фильтруют с получением продукт (5,65 г, 87,2% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C24H39N6O7: 523,28; найдено 523,3.
Строительный блок AH. трет-бутил N-трет-бутоксикарбонил-N-((2-(4-(3-(2-пиперазин-1-илэтокси)пропаноил)пиперазин-1-ил)пиримидин-5-ил)метил)карбамат.
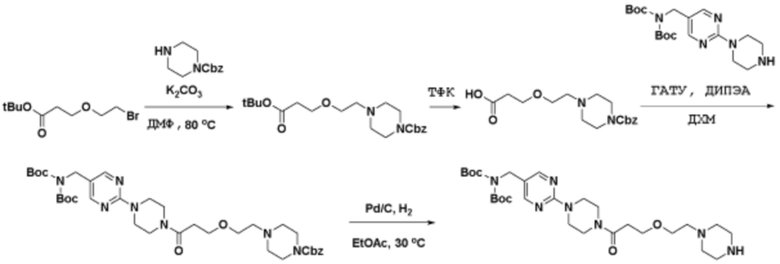
Стадия 1: Синтез бензил 4-(2-(3-(трет-бутокси)-3-оксопропокси)этил)пиперазин-1-карбоксилата
К раствору трет-бутил 3-(2-бромэтокси)пропаноата (35 г, 138,27 ммоль, 1,0 эквив.) и бензилпиперазин-1-карбоксилата (31,14 мл, 138,27 ммоль, 1,0 эквив., HCl) в MeCN (420 мл) добавляют K2CO3 (57,33 г, 414,80 ммоль, 3,0 эквив.). Реакционную смесь перемешивают при 80°C в течение 20 ч. Реакционную смесь охлаждают при комнатной температуре, и суспензию фильтруют. Фильтровальную лепешку промывают E-Ac (3×50 мл) и объединенные фильтраты концентрируют при пониженном давлении с получением неочищенного продукта. Остаток очищают хроматографией на силикагеле (5/1-0/1 петролейный эфир/E-Ac) с получением продукт (46 г, 84,8% выход) в виде желтого масла.
Стадия 2: Синтез 3-(2-(4-((бензилокси)карбонил)пиперазин-1-ил)этокси)пропановой кислоты
Раствор бензил 4-(2-(3-(трет-бутокси)-3-оксопрoпокси)этил)пиперазинe-1-карбоксилата (21 г, 53,50 ммоль, 1,0 эквив.) в ТФК (160 мл) перемешивают при комнатной температуре в течение 2 ч и затем концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (1/0-4/1 E-Ac/MeOH) с получением продукта (20,4 г, 84,7% выход, ТФК) в виде желтого масла. ЖХМС (ИЭР) m/z: [M+H] рассч. для C17H24N2O5: 337,18; найдено 337,1.
Стадия 3: Синтез бензил 4-(2-(3-(4-(5-(((ди-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этил)пиперазин-1-карбоксилата
К раствору 3-(2-(4-((бензилокси)карбонил)пиперазин-1-ил)этокси)пропановой кислоты (20,2 г, 44,85 ммоль, 1,0 эквив., ТФК) в ДХМ (500 мл) добавляют ГАТУ (25,58 г, 67,27 ммоль, 1,5 эквив.) и ДИПЭА (17,39 г, 134,55 ммоль, 23,44 мл, 3,0 эквив.). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и затем добавляют трет-бутил N-трет-бутоксикарбонил-N-((2-пиперазин-1-илпиримидин-5-ил)метил)карбамат (14,12 г, 35,88 ммоль, 0,8 эквив.). Реакционную смесь перемешивают при в течение 2 ч и затем гасят насыщ. NH4Cl (500 мл). Водную фазу экстрагируют ДХМ (3×300 мл) и объединенную органическую фазу промывают насыщенным раствором соли (30 мл), сушат с безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением неочищенного продукта. Остаток очищают хроматографией на силикагеле (0/1 петролейный эфир/E-Ac до 10/1 ДХМ/MeOH) с получением продукта (29 г, 90,8% выход) в виде желтого масла. ЖХМС (ИЭР) m/z: [M+H] рассч. для C36H53N7O8: 712,41; найдено 712,4.
Стадия 4: Синтез трет-бутил N-трет-бутоксикарбонил-N-((2-(4-(3-(2-пиперазин-1-илэтокси)пропаноил)пиперазин-1-ил)пиримидин-5-ил)метил)карбамата
К раствору 4-(2-(3-(4-(5-(((ди-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этил)пиперазин-1-карбоксилата (5 г, 7,02 ммоль, 1,0 эквив.) в E-Ac (150 мл) добавляют Pd/C (2 г, 10% масс.). Суспензию дегазируют и продувают H2 и затем перемешивают под H2 (30 ф./кв.д.) при 30°C в течение 3 ч. Суспензию затем охлаждают при комнатной температуре и фильтруют через Целит. Фильтровальную лепешку промывают MeOH (15×100 мл), и объединенные фильтраты концентрируют при пониженном давлении с получением продукта (12 г, 89,9% выход) в виде светло-желтого масла. ЖХМС (ИЭР) m/z: [M+H] рассч. для C28H47N7O6: 578,37;найдено 578,5.
Строительный блок AI. этил 2-(пиперазин-1-ил)пиримидин-5-карбоксилат.
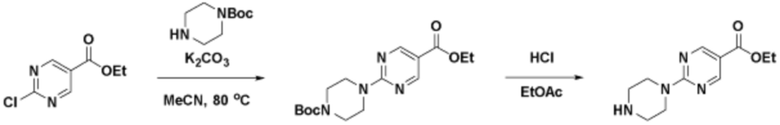
Стадия 1: Синтез этил 2-(4-(трет-бутоксикарбонил)пиперазин-1-ил)пиримидин-5-карбоксилата
К раствору трет-бутил пиперазин-1-карбоксилата (11,94 г, 53,59 ммоль, 1,0 эквив., HCl) и этил 2-хлорпиримидин-5-карбоксилата (10 г, 53,59 ммоль, 1,0 эквив.) в MeCN (100 мл) добавляют K2CO3 (7,41 г, 53,59 ммоль, 1,0 эквив.). Смесь перемешивают при 80°C в течение 17 ч и затем выливают в H2O (200 мл). Смесь фильтруют, и фильтровальную лепешку промывают H2O (80 мл) и сушат при пониженном давлении с получением продукта (15,76 г, 82% выход) в виде белого твердого вещества.
Стадия 2: Синтез этил 2-(пиперазин-1-ил)пиримидин-5-карбоксилата
К раствору этил 2-(4-(трет-бутоксикарбонил)пиперазин-1-ил)пиримидин-5-карбоксилата (15,7 г, 46,67 ммоль, 1,0 эквив.) в E-Ac (150 мл) добавляют HCl/E-Ac (150 мл) при 0°C. Полученную смесь перемешивают при комнатной температуре в течение 9 ч. Реакционную смесь фильтруют, и фильтровальную лепешку промывают E-Ac (100 мл). Твердое вещество сушат при пониженном давлении с получением продукта (12,55 г, 96% выход, HCl) в виде белого твердого вещества. ЖХМС (ИЭР)m/z: [M+H] рассч. для C11H16N4O2: 237,14; найдено 237,3.
Строительный блок AJ. 2-(4-(2-(3-(4-(5-(((ди-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этил)пиперазин-1-ил)пиримидин-5-карбоновая кислота.
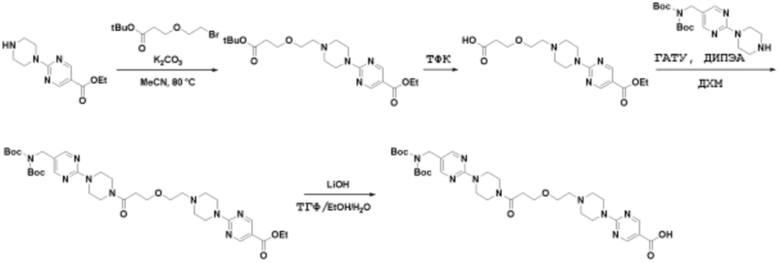
Стадия 1: Синтез этил 2-(4-(2-(3-(трет-бутокси)-3-оксопропокси)этил)пиперазин-1-ил)пиримидин-5-карбоксилата
К раствору этил 2-пиперазин-1-илпиримидин-5-карбоксилата (17,92 г, 75,85 ммоль, 1,2 эквив.) и трет-бутил 3-(2-бромэтокси)пропаноата (16 г, 63,21 ммоль, 1,0 эквив.) в MeCN (200 мл) добавляют K2CO3 (17,47 г, 126,42 ммоль, 2,0 эквив.). Реакционную смесь перемешивают при 80°C в течение 12 ч, и затем реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении. Неочищенный продукт суспендируют в петролейном эфире (200 мл) и перемешивают в течение 20 мин при 0°C и затем фильтруют. Твердое вещество сушат при пониженном давлении с получением продукта (19,4 г, 75,1% выход) в виде желтого твердого вещества.
Стадия 2: Синтез 3-(2-(4-(5-(этоксикарбонил)пиримидин-2-ил)пиперазин-1-ил)этокси)пропановой кислоты
Раствор этил 2-(4-(2-(3-(трет-бутокси)-3-оксопропокси)этил)пиперазин-1-ил)пиримидин-5-карбоксилата (19,4 г, 47,49 ммоль, 1,0 эквив.) в ТФК (200 мл) перемешивают при комнатной температуре в течение 30 мин. Реакционную смесь затем концентрируют при пониженном давлении и остаток очищают хроматографией на силикагеле (50/1-1/1 E-Ac/MeOH) с получением продукта (18 г, 81,3% выход) в виде желтого масла.
Стадия 3: Синтез этил 2-(4-(2-(3-(4-(5-(((ди-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этил)пиперазин-1-ил)пиримидин-5-карбоксилата
К раствору 3-(2-(4-(5-(этоксикарбонил)пиримидин-2-ил)пиперазин-1-ил)этокси)пропановой кислоты (13 г, 27,87 ммоль, 1,0 эквив.) в ДХМ (200 мл) добавляют ГАТУ (15,90 г, 41,81 ммоль, 1,5 эквив.) и ДИПЭА (19,42 мл, 111,49 ммоль, 4,0 эквив.). Реакционную смесь затем перемешивают при комнатной температуре в течение 30 мин и затем добавляют трет-бутил N-трет-бутоксикарбонил-N-[(2-пиперазин-1-илпиримидин-5-ил)метил]карбамат (10,97 г, 27,87 ммоль, 1,0 эквив.). Смесь перемешивают в течение 2 ч и затем выливают в насыщ. раствор NH4Cl (200 мл). Водную фазу экстрагируют ДХМ (2×200 мл), и объединенную органическую фазу промывают насыщенным раствором соли (2×20 мл), сушат с безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (100/1-9/1 E-Ac/MeOH) с получением продукта (17 г, 79% выход) в виде желтого масла.
Стадия 4: Синтез 2-(4-(2-(3-(4-(5-(((ди-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору этил 2-(4-(2-(3-(4-(5-(((ди-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этил)пиперазин-1-ил)пиримидин-5-карбоксилата (11 г, 15,11 ммоль, 1,0 эквив.) в ТГФ (40 мл), E-H (10 мл) и H2O (20 мл) добавляют LiOH•H2O (1,27 г, 30,23 ммоль, 2,0 эквив.). Смесь затем перемешивают при 35°C в течение 1,5 ч. Реакционную смесь экстрагируют E-Ac (30 мл) и водную фазу доводят до pH=7 добавлением HCl (1 N). Смесь затем концентрируют при пониженном давлении. Неочищенный продукт очищают хроматографией с обращенной фазой (20/1-3/1 H2O/MeCN) с получением продукта (6,1 г, 67,3% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C33H49N9O8: 700,38; найдено 700,4.
Строительный блок AK. 2-(4-(2-(3-(4-(5-(((трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этил)пиперазин-1-ил)пиримидин-5-карбоновая кислота.
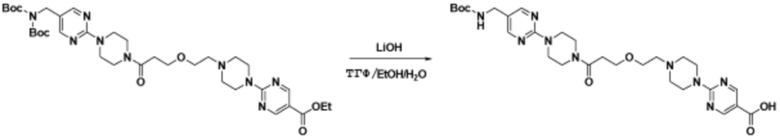
Раствор этил 2-(4-(2-(3-(4-(5-(((ди-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этил)пиперазин-1-ил)пиримидин-5-карбоксилата (5,4 г, 7,42 ммоль, 1,0 эквив.) в ТГФ (40 мл), E-H (10 мл) и H2O (10 мл) добавляют LiOH•H2O (933,92 мг, 22,26 ммоль, 3,0 эквив.). Смесь затем перемешивают при 30°C в течение 12 ч. Реакционную смесь затем экстрагируют E-Ac (2×50 мл), и водную фазу доводят до pH=7 добавлением HCl (1N). Раствор затем концентрируют при пониженном давлении. Неочищенный продукт очищают хроматографией с обращенной фазой (20/1-3/1 H2O/MeCN) с получением продукта (1,01 г, 22,5% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C28H41N9O6: 600,33; найдено 600,2.
Строительный блок AL. 4-{4-[2-(3-{4-[5-({[(трет-бутокси)карбонил]амино}метил)пиримидин-2-ил]пиперазин-1-ил}-3-оксопропокси)этил]пиперазин-1-ил}-4-оксобутановая кислота.
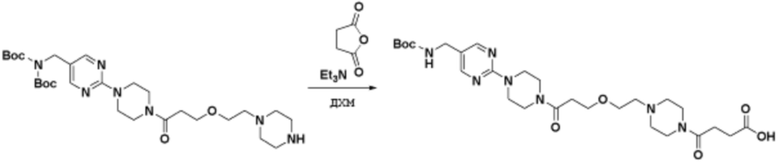
К раствору трет-бутил N-трет-бутоксикарбонил-N-((2-(4-(3-(2-пиперазин-1-илэтокси)пропаноил)пиперазин-1-ил)пиримидин-5-ил)метил)карбамата (1,0 эквив.) в ДХМ добавляют янтарный ангидрид (1,2 эквив.) и Et3N (2,0 эквив.). Реакционную смесь перемешивают при комнатной температуре до потребления исходного материала, по данным ЖХМС анализа. Реакционную смесь затем концентрируют при пониженном давлении с получением неочищенного продукта. Остаток очищают хроматографией на силикагеле с получением продукта.
Строительный блок AM. 2-(4-(4-(4-(5-(((трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-4-оксобутил)пиперазин-1-ил)пиримидин-5-карбоновая кислота.
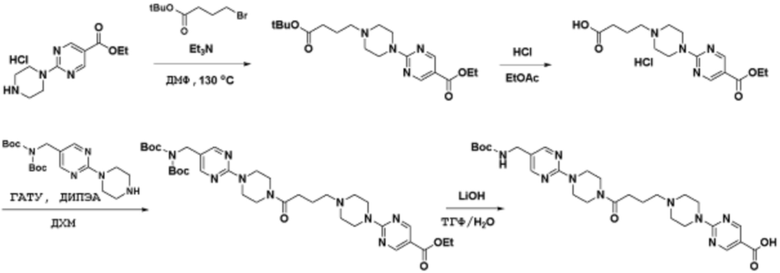
Стадия 1: Синтез этил 2-(4-(4-(трет-бутокси)-4-оксобутил)пиперазин-1-ил)пиримидин-5-карбоксилата
К раствору гидрохлорида этил 2-(пиперазин-1-ил)пиримидин-5-карбоксилата (10 г, 36,67 ммоль, 1,0 эквив., HCl) и трет-бутил 4-бромбутанoата (8,18 г, 36,67 ммоль, 1,0 эквив.) в ДМФ (100 мл) добавляют Et3N (15,31 мл, 110,00 ммоль, 3,0 эквив.). Смесь перемешивают при 130°C в течение 14 ч. Смесь затем выливают в H2O (400 мл) и раствор экстрагируют с E-Ac (3×150 мл). Объединенный органический слой промывают насыщенным раствором соли (200 мл), сушат над Na2SO4 и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (5/1-1/1 петролейный эфир/E-Ac) с получением продукта (9,5 г, 68,5% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C19H30N4O4: 379,24; найдено 379,2, 380,2.
Стадия 2: Синтез гидрохлорида 4-(4-(5-(этоксикарбонил)пиримидин-2-ил)пиперазин-1-ил)бутановой кислоты
К раствору этил 2-(4-(4-(трет-бутокси)-4-оксобутил)пиперазин-1-ил)пиримидин-5-карбоксилата (9,5 г, 25,10 ммоль, 1,0 эквив.) в E-Ac (100 мл) добавляют HCl/E-Ac (500 мл). Смесь перемешивают при комнатной температуре в течение 10 ч, и затем раствор концентрируют при пониженном давлении с получением продукта (9,6 г, 96,8% выход, 2HCl) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C15H22N4O4: 323,17; найдено 323,2.
Стадия 3: Синтез этил 2-(4-(4-(4-(5-(((ди-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-4-оксобутил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору гидрохлорида 4-(4-(5-(этоксикарбонил)пиримидин-2-ил)пиперазин-1-ил)бутановой кислоты (5 г, 15,51 ммоль, 1,0 эквив.) и трет-бутил N-трет-бутоксикарбонил-N-((2-пиперазин-1-илпиримидин-5-ил)метил)карбамата (6,10 г, 15,51 ммоль, 1,0 эквив.) в ДМФ (150 мл) добавляют ДИПЭА (8,11 мл, 46,53 ммоль, 3,0 эквив.) и ГАТУ (7,08 г, 18,61 ммоль, 1,2эквив.). Смесь перемешивают при комнатной температуре в течение 3 ч и затем раствор выливают в H2O (600 мл). Водный слой экстрагируют с E-Ac (3×200 мл) и затем объединенный органический слой промывают насыщенным раствором соли (100 мл), сушат с Na2SO4 и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (50/1-15/1 ДХМ/MeOH) с получением продукта (6,3 г, 58,2% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C34H51N9O7: 698,40; найдено 698,6.
Стадия 4: Синтез 2-(4-(4-(4-(5-(((трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-4-оксобутил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору этил 2-(4-(4-(4-(5-((бис(трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-4-оксобутил)пиперазин-1-ил)пиримидин-5-карбоксилата (4,5 г, 6,45 ммоль, 1,0 эквив.) в E-H (7 мл) и ТГФ (28 мл) добавляют раствор LiOH•H2O (541,17 мг, 12,90 ммоль, 2,0 эквив.) в H2O (7 мл). Смесь перемешивают при 30°C в течение 8 ч, затем добавляют еще LiOH•H2O (541 мг, 12,90 ммоль, 2,0 эквив.). После перемешивания в течение еще 8 ч при 30°C, раствор концентрируют при пониженном давлении. Добавляют H2O (20 мл) и раствор доводят до pH 3 с 1N HCl. Суспензию фильтруют, и твердое вещество сушат при пониженном давлении с получением продукта (3,2 г, 79,1% выход) в виде белого твердого вещества. ЖХМС(ИЭР) m/z: [M+H] рассч. для C27H39N9O5: 570,32; найдено 570,3.
Строительный блок AN. 2-(4-(2-(2-(4-(6-(трет-бутоксикарбонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-ил)пиперазин-1-ил)этокси)этил)пиперазин-1-ил)пиримидин-5-карбоновая кислота.
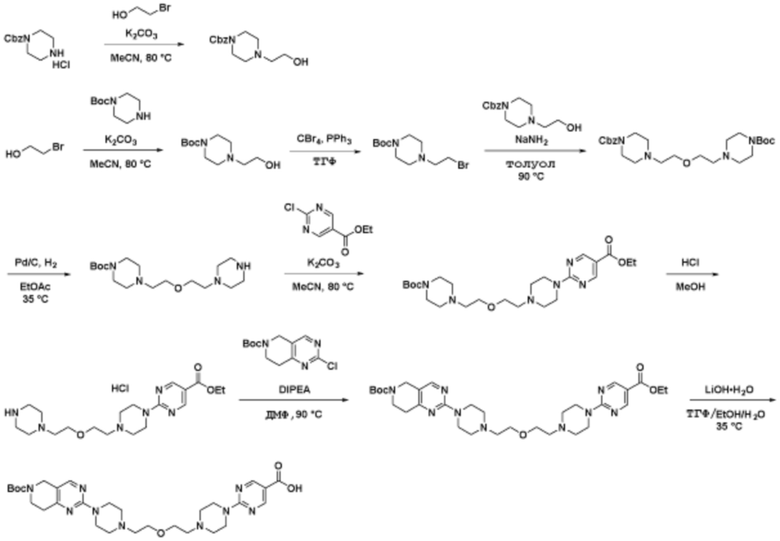
Стадия 1: Синтез бензил 4-(2-гидроксиэтил)пиперазин-1-карбоксилата
К раствору гидрохлорида бензилпиперазин-1-карбоксилата (41,09 г, 160,04 ммоль, 1,0 эквив., HCl) в MeCN (200 мл) добавляют K2CO3 (66,36 г, 480,13 ммоль, 3,0 эквив.) и 2-бромэтанол (20 г, 160,04 ммоль, 1,0 эквив.). Реакционную смесь перемешивают при 80°C в течение 16 ч, в этот момент ее охлаждают при комнатной температуре и фильтруют. Фильтровальную лепешку промывают E-Ac (100 мл) и фильтрат затем промывают H2O (100 мл). Водную фазу экстрагируют E-Ac (3×50 мл) и объединенные органические фазы промывают насыщенным раствором соли (50 мл), сушат и концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (5→25% MeOH/E-Ac) дает желаемый продукт в виде желтого твердого вещества (20 г, 47% выход). ЖХМС (ИЭР) m/z: [M+H] рассч. для C14H20N2O3: 265,16; найдено 264,9.
Стадия 2: Синтез трет-бутил 4-(2-гидроксиэтил)пиперазин-1-карбоксилата
К раствору трет-бутил пиперазин-1-карбоксилата (198,72 г, 1,07 моль, 1,0эквив.) в MeCN (1500 мл) добавляют 2-бромэтанол (240 г, 1,92 моль, 1,8 эквив.) и K2CO3 (221,19 г, 1,60 моль, 1,5 эквив.). Реакционную смесь перемешивают при 80°C в течение 16 ч, в этот момент смесь охлаждают при комнатной температуре, фильтруют и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→14% MeOH/E-Ac) дает желаемый продукт в виде белого твердого вещества (146 г, 59% выход).
Стадия 3: Синтез трет-бутил 4-(2-бромэтил)пиперазин-1-карбоксилата
К раствору трет-бутил 4-(2-гидроксиэтил)пиперазин-1-карбоксилата (45 г, 195,39 ммоль, 1,0 эквив.) в ТГФ (600 мл) добавляют трифенилфосфин (97,38 г, 371,25 ммоль, 1,9 эквив.) и CBr4 (116,64 г, 351,71 ммоль, 1,8 эквив.). Смесь перемешивают при комнатной температуре в течение 3 ч. Две раздельных партии объединяют, и реакционную смесь фильтруют и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (1→25% E-Ac/петролейный эфир) дает желаемый продукт в виде светло-желтого твердого вещества (31 г, 27% выход).
Стадия 4: Синтез бензил 4-(2-(2-(4-(трет-бутоксикарбонил)пиперазин-1-ил)этокси)этил)пиперазин-1-карбоксилата
К раствору бензил 4-(2-гидроксиэтил)пиперазин-1-карбоксилата (18 г, 68,10 ммоль, 1,0 эквив.) в толуоле (200 мл) добавляют NaNH2 (26,57 г, 680,99 ммоль, 10,0 эквив.). трет-Бутил 4-(2-бромэтил)пиперазин-1-карбоксилат (25 г, 85,27 ммоль, 1,25 эквив.) добавляют, и смесь нагревают до 90°C в течение 18 ч. Смесь охлаждают при комнатной температуре и выливают в H2O (700 мл) при 0°C. Водную фазу экстрагируют E-Ac (3×240 мл) и объединенные органические фазы последовательно промывают H2O (350 мл) и насыщенным раствором соли (2×200 мл), сушат, фильтруют и концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→12% MeOH/E-Ac) дает желаемый продукт в виде светло-желтого масла (20 г, 62% выход).
Стадия 5: Синтез трет-бутил 4-(2-(2-(пиперазин-1-ил)этокси)этил)пиперазинe-1-карбоксилата
К раствору бензил 4-(2-(2-(4-(трет-бутоксикарбонил)пиперазин-1-ил)этокси)этил)пиперазин-1-карбоксилата (20 г, 41,96 ммоль, 1,0 эквив.) в E-Ac (180 мл) добавляют Pd/C (8 г, 10% масс.). Суспензию дегазируют при пониженном давлении и продувают H2 три раза. Смесь перемешивают под H2 (30 ф./кв.д.) при 35°C в течение 12 ч. Реакционную смесь затем фильтруют, и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→100% MeOH/E-Ac) дает желаемый продукт в виде бесцветного масла (10,8 г,75% выход).
Стадия 6: Синтез этил 2-(4-(2-(2-(4-(трет-бутоксикарбонил)пиперазин-1-ил)этокси)-этил)пиперазин-1-ил)пиримидин-5-карбоксилата
К раствору трет-бутил 4-(2-(2-(пиперазин-1-ил)этокси)этил)пиперазин-1-карбоксилата (10,8 г, 31,54 ммоль, 1,0 эквив.) в MeCN (100 мл) добавляют K2CO3 (13,08 г, 94,61 ммоль, 3,0 эквив.) и этил 2-хлорпиримидин-5-карбоксилат (5,88 г, 31,54 ммоль, 1,0 эквив.). Смесь перемешивают при 80°C в течение 12 ч, в этот момент реакционную смесь охлаждают при комнатной температуре, фильтруют и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→9% MeOH/ДХМ) дает желаемый продукт в виде белого твердого вещества(13,6 г, 85% выход).
Стадия 7: Синтез 2-(4-(2-(2-(4-(6-(трет-бутоксикарбонил)-5,6,7,8-тетрагидропиридо-[4,3-d]пиримидин-2-ил)пиперазин-1-ил)этокси)этил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору этил 2-(4-(2-(2-(4-(трет-бутоксикарбонил)пиперазин-1-ил)этокси)этил)пиперазин-1-ил)пиримидин-5-карбоксилата (13,6 г, 27,61 ммоль, 1,0 эквив.) в MeOH (50 мл) добавляют раствор HCl в MeOH (4 M, 150 мл, 21,7 эквив.). Реакционную смесь перемешивают при комнатной температуре в течение 4 ч, в этот момент смесь концентрируют при пониженном давлении с получением неочищенного желаемого продукта в виде белого твердого вещества (13,8 г, 4 HCl), который берут сразу на следующей стадии. ЖХМС (ИЭР) m/z: [M+H] рассч. для C19H32N6O3: 393,26; найдено 393,3.
Стадия 8: Синтез трет-бутил 2-(4-(2-(2-(4-(5-(этоксикарбонил)пиримидин-2-ил)-пиперазин-1-ил)этокси)этил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата
К перемешиваемому раствору 2-(4-(2-(2-(4-(6-(трет-бутоксикарбонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-ил)пиперазин-1-ил)этокси)этил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты (10,2 г, 18,95 ммоль, 1,0 эквив., 4 HCl) и ДИПЭА (16,50 мл, 94,74 ммоль, 5,0 эквив.) в ДМФ (100 мл) добавляют трет-бутил 2-хлор-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилат (5,11 г, 18,95 ммоль, 1,0 эквив.). Реакционную смесь перемешивают при 90°C в течение 12 ч. Реакционную смесь затем охлаждают при комнатной температуре и добавляют к E-Ac (200 мл) и H2O (400 мл). Водную фазу экстрагируют E-Ac (2×100 мл) и объединенные органические фазы промывают водным NH4Cl (4×100 мл), насыщенным раствором соли (2×100 мл), сушат, фильтруют и концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→9% MeOH/ДХМ) дает желаемый продукт в виде белого твердого вещества (5,4 г,45% выход). ЖХМС (ИЭР) m/z: [M+H] рассч. для C31H47N9O5: 626,38; найдено 626,3.
Стадия 9: Синтез 2-(4-(2-(2-(4-(6-(трет-бутоксикарбонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-ил)пиперазин-1-ил)этокси)этил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору трет-бутил 2-(4-(2-(2-(4-(5-(этоксикарбонил)пиримидин-2-ил)пиперазин-1-ил)этокси)этил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (5,4 г, 8,63 ммоль, 1,0 эквив.) в ТГФ (50 мл), E-H (20 мл) и H2O(20 мл) добавляют LiOH•H2O (1,09 г, 25,89 ммоль, 3,0 эквив.). Реакционную смесь перемешивают при 35°C в течение 12 ч, в этот момент смесь концентрируют при пониженном давлении для удаления ТГФ и E-H. Водную фазу нейтрализуют до pH=7 с 0,5 N HCl и концентрируют при пониженном давлении. Очистка хроматографией с обращенной фазой дает желаемый продукт в виде белого твердого вещества (4,72 г,92% выход). ЖХМС (ИЭР) m/z: [M+H] рассч. для C29H43N9O5: 598,35; найдено 598,3.
Строительный блок AO. 1'-[(трет-бутокси)карбонил]-[1,4'-бипиперидин]-4-карбоновая кислота.
Во время подготовки этой заявки этот строительный блок был коммерчески доступен (CAS # 201810-59-5).
Строительный блок AP. гидрохлорид 2-((2-(пиперазин-1-ил)пиримидин-5-ил)метил)изоиндолин-1,3-дион.
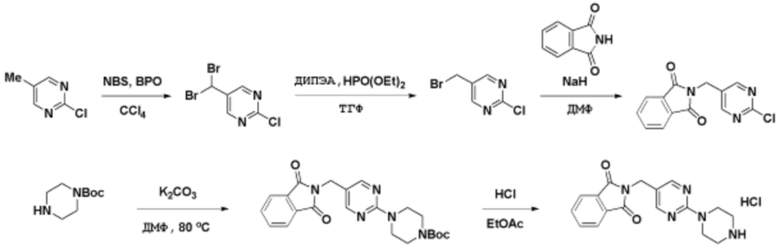
Стадия 1: Синтез 2-хлор-5-(дибромметил)пиримидина
К раствору 2-хлор-5-метилпиримидина (100 г, 777,85 ммоль, 1,0 эквив.) в CCl4 (1200 мл) добавляют NBS (304,58 г, 1,71 моль, 2,2 эквив.) и AIBN (51,09 г, 311,14 ммоль, 0,4 эквив.). Смесь перемешивают при 80°C в течение 16 ч. Реакционный раствор затем охлаждают при комнатной температуре, фильтруют и фильтрат выливают в H2O (1500 мл). Раствор разбавляют ДХМ (3×250 мл) и органический слой промывают насыщенным раствором соли (300 мл), сушат с безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением неочищенного продукта в виде коричневого масла, которое используют сразу на следующей стадии.
Стадия 2: Синтез 5-(бромметил)-2-хлорпиримидина
К раствору 2-хлор-5-(дибромметил)пиримидина (229 г, 799,72 ммоль, 1,0 эквив.) в ТГФ (600 мл) добавляют ДИПЭА (111,44 мл, 639,77 ммоль, 0,8 эквив.) и 1-этоксифосфоноилоксиэтан (82,57 мл, 639,77 ммоль, 0,8эквив.). Смесь перемешивают при комнатной температуре в течение 19 ч. Смесь затем выливают в H2O (1200 мл) и водную фазу экстрагируют с E-Ac (3×300 мл). Объединенную органическую фазу промывают насыщенным раствором соли (300 мл), сушат с безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (1/0-0/1 петролейный эфир/E-Ac) с получением продукта в виде коричневого масла, которое используют сразу на следующей стадии.
Стадия 3: Синтез 2-((2-хлорпиримидин-5-ил)метил)изоиндолин-1,3-диона
К смеси изоиндолин-1,3-диона (15 г, 101,95 ммоль, 1,0 эквив.) в ДМФ (126 мл) добавляют NaH (4,89 г, 122,34 ммоль, 60% масс., 1,2 эквив.) при 0°C. Смесь перемешивают при 0°C в течение 30 мин, затем раствор 5-(бромметил)-2-хлорпиримидина (30,21 г, 101,95 ммоль, 1,0 эквив.) в ДМФ (24 мл) добавляют по каплям к вышеуказанной смеси при комнатной температуре. Смесь перемешивают при комнатной температуре в течение 2 ч и затем охлаждают до 0°C и гасят насыщ. NH4Cl (600 мл). Суспензию фильтруют, и твердое вещество сушат при пониженном давлении с получением неочищенного продукта (27,4 г, 98,2% выход) в виде серого твердого вещества, которое используют сразу на следующей стадии. ЖХМС(ИЭР) m/z: [M+H]рассч. для C13H8ClN3O2: 274,04; найдено 274,0.
Стадия 4: Синтез трет-бутил4-(5-((1,3-диоксоизоиндолин-2-ил)метил)пиримидин-2-ил)пиперазин-1-карбоксилата
К раствору 2-((2-хлорпиримидин-5-ил)метил)изоиндолин-1,3-диона (27 г, 98,66 ммоль, 1,0 эквив.) и трет-бутилпиперазин-1-карбоксилата (20,21 г, 108,52 ммоль, 1,1 эквив.) в ДМФ (270 мл) добавляют K2CO3 (34,09 г, 246,64 ммоль, 2,5 эквив.). Смесь перемешивают при 80°C в течение 3 ч и затем реакционную смесь охлаждают при комнатной температуре и выливают в H2O (1200 мл). Суспензию фильтруют, и твердое вещество сушат при пониженном давлении с получением неочищенного продукта (35,58 г, 85,2% выход) в виде белого твердого вещества, которое используют сразу на следующей стадии.
Стадия 5: Синтез 2-((2-(пиперазин-1-ил)пиримидин-5-ил)метил)изоиндолин-1,3-диона
Раствор трет-бутил 4-(5-((1,3-диоксоизоиндолин-2-ил)метил)пиримидин-2-ил)пиперазин-1-карбоксилата (15 г, 35,42 ммоль, 1 эквив.) в HCl/E-Ac (150 мл) перемешивают при комнатной температуре в течение 2 ч. Смесь фильтруют, и затем фильтровальную лепешку промывают E-Ac (20 мл) и сушат при пониженном давлении с получением продукта (42,53 г, 92,5% выход) в виде белого твердого вещества.
Строительный блок AQ. 2-[(2-{4-[2-(3-{4-[5-({бис[(трет-бутокси)карбонил]амино}метил)пиримидин-2-ил]пиперазин-1-ил}-3-оксопропокси)этил]пиперазин-1-ил}-2-оксоэтил)(метил)амино]уксусная кислота.
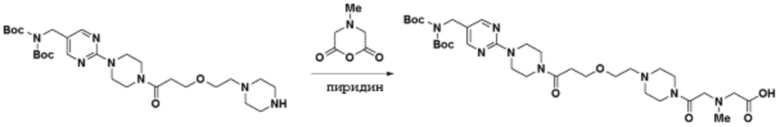
К раствору трет-бутил N-[(трет-бутокси)карбонил]-N-{[2-(4-{3-[2-(пиперазин-1-ил)этокси]пропаноил}пиперазин-1-ил)пиримидин-5-ил]метил}карбамата (300 мг, 519 мкмоль, 1,0 эквив.) в пиридине (8 мл) при 0°C добавляют 4-метилморфолин-2,6-дион (80,3 мг, 622 мкмоль, 1,2 эквив.). Реакционную смесь перемешивают при 0°C в течение 1 ч и затем нагревают до комнатной температуры и перемешивают в течение еще 12 ч. Растворитель концентрируют при пониженном давлении, и твердое вещество разделяют между ДХМ и H2O. Органический слой отделяют, сушат над MgSO4 и растворитель концентрируют при пониженном давлении с получением продукта (23,0 мг, 6,28% выход). ЖХМС (ИЭР) m/z: [M+H] рассч. для C33H54N8O9: 707,41; найдено 707,4.
Строительный блок AR. 2-(4-(2-(3-(4-(6-(трет-бутоксикарбонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этил)пиперазин-1-ил)пиримидин-5-карбоновая кислота.
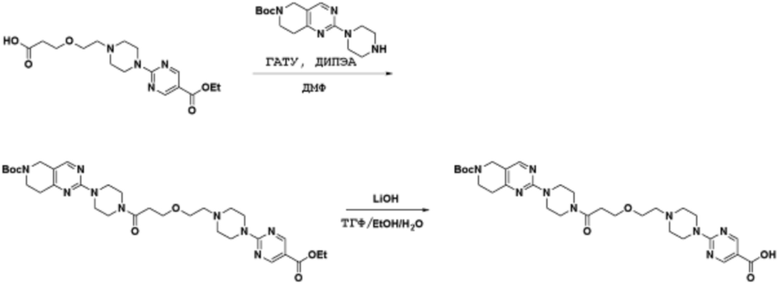
Стадия 1: Синтез трет-бутил 2-(4-(3-(2-(4-(5-(этоксикарбонил)пиримидин-2-ил)пиперазин-1-ил)этокси)пропаноил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата
К раствору 3-(2-(4-(5-(этоксикарбонил)пиримидин-2-ил)пиперазин-1-ил)этокси)пропановой кислоты (6 г, 12,86 ммоль, 1,0 эквив., ТФК) в ДМФ (55 мл) добавляют ГАТУ (6,36 г, 16,72 ммоль, 1,3 эквив.) и ДИПЭА (11,20 мл, 64,32 ммоль, 5,0 эквив.). Через 0,5 ч добавляют трет-бутил 2-(пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилат (4,11 г, 12,86 ммоль, 1,0 эквив.). Смесь перемешивают в течение 3 ч, в этот момент ее фильтруют и твердую лепешку сушат при пониженном давлении с получением желаемого продукта в виде белого твердого вещества (7,5 г, 89% выход). ЖХМС(ИЭР) m/z: [M+ H] рассч. для C32H47N9O6: 654,37; найдено 654,4.
Стадия 2: Синтез 2-(4-(2-(3-(4-(6-(трет-бутоксикарбонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору трет-бутил 2-(4-(3-(2-(4-(5-(этоксикарбонил)пиримидин-2-ил)пиперазин-1-ил)этокси)пропаноил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (7,2 г, 11,01 ммоль, 1,0 эквив.) в ТГФ (72 мл), E-H (36 мл) и H2O (36 мл) добавляют LiOH•H2O (1,85 г, 44,05 ммоль, 4,0 эквив.). Реакционную смесь перемешивают при комнатной температуре в течение 2,5 ч, в этот момент смесь фильтруют и фильтрат концентрируют при пониженном давлении для удаления ТГФ и E-H. Водную фазу нейтрализуют до pH=7 с 1N HCl и затем концентрируют при пониженном давлении. Очистка хроматографией с обращенной фазой (30% MeCN/H2O) дает желаемый продукт в виде белого твердого вещества (3,85 г, 54% выход). ЖХМС (ИЭР) m/z: [M+H] рассч. для C30H43N9O6: 626,34; найдено 626,3.
Строительный блок AS. 2-(4-(2-(2-(3-(4-(5-((ди-трет-бутоксикарбониламино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этокси)этил)пиперазин-1-ил)пиримидин-5-карбоновая кислота.
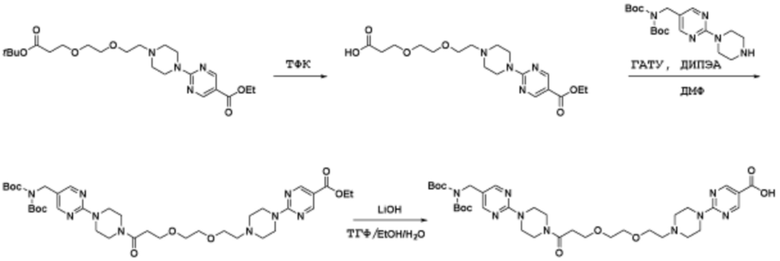
Стадия 1: Синтез 3-(2-(2-(4-(5-(этоксикарбонил)пиримидин-2-ил)пиперазин-1-ил)этокси)этокси)пропановой кислоты
Раствор этил 2-(4-(2-(2-(3-(трет-бутокси)-3-оксопропокси)этокси)этил)пиперазин-1-ил)пиримидин-5-карбоксилата (4 г, 8,84 ммоль, 1,0 эквив.) в ТФК (12,29 мл, 166,00 ммоль,18,8 эквив.) перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→20% MeOH/E-Ac) дает желаемый продукт в виде коричневого масла (4,35 г,95% выход, соль ТФК).
Стадия 2: Синтез этил 2-(4-(2-(2-(3-(4-(5-((бис(трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этокси)этил)пиперазин-1-ил)пиримидин-5-карбоксилата
К раствору 3-(2-(2-(4-(5-этоксикарбонилпиримидин-2-ил)пиперазин-1-ил)этокси)этокси)пропановой кислоты (3,8 г, 7,44 ммоль, 1,0 эквив., ТФК) в ДХМ (30 мл) добавляют ГАТУ (4,25 г, 11,17 ммоль, 1,5 эквив.) и ДИПЭА (6,48 мл, 37,22 ммоль, 5,0 эквив.). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин, и затем добавляют трет-бутил N-трет-бутоксикарбонил-N-((2-пиперазин-1-илпиримидин-5-ил)метил)карбамат (2,93 г, 7,44 ммоль, 1,0 эквив.). Смесь перемешивают при комнатной температуре в течение 3,5 ч, в этот момент реакционную смесь концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→20% MeOH/E-Ac) дает желаемый продукт в виде коричневого масла (4,14 г, 70% выход).
Стадия 3: Синтез 2-(4-(2-(2-(3-(4-(5-((ди-трет-бутоксикарбониламино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этокси)этил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору этил 2-(4-(2-(2-(3-(4-(5-((бис(трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этокси)этил)пиперазин-1-ил)пиримидин-5-карбоксилата (1,4 г, 1,81 ммоль, 1,0 эквив.) в ТГФ (28 мл), E-H (14 мл) и H2O (14 мл) добавляют LiOH•H2O (304,44 мг, 7,25 ммоль, 4,0 эквив.). Смесь перемешивают при 40°C в течение 30 мин, в этот момент реакционную смесь концентрируют при пониженном давлении. Очистка хроматографией с обращенной фазой (10→40% MeCN/H2O) дает желаемый продукт в виде желтого твердого вещества (500 мг, 43% выход).
Строительный блок AT. 2-{4-[2-(2-{4-[5-({[(трет-бутокси)карбонил]амино}метил)пиримидин-2-ил]пиперазин-1-ил}этокси)этил]пиперазин-1-ил}пиримидин-5-карбоновая кислота.
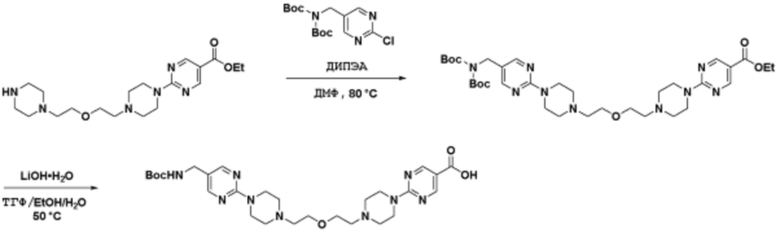
Стадия 1: Синтез этил 2-(4-(2-(2-(4-(5-(((ди-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)этокси)этил)пиперазин-1-ил)пиримидин-5-карбоксилата
К раствору этил гидрохлорида 2-(4-(2-(2-(пиперазин-1-ил)этокси)этил)пиперазин-1-ил)пиримидин-5-карбоксилата (7,3 г, 13,56 ммоль, 1,0 эквив., 4 HCl) в ДМФ (75 мл) добавляют ДИПЭА (14,17 мл, 81,36 ммоль, 6,0 эквив.) и трет-бутил-N-трет-бутоксикарбонил-N-[(2-хлорпиримидин-5-ил)метил]карбамат (5,59 г, 16,27 ммоль, 1,2 эквив.). Смесь перемешивают при 80°C в течение 12 ч. Смесь затем охлаждают при комнатной температуре и выливают в H2O (300 мл). Водную фазу экстрагируют E-Ac (3×80 мл). Объединенные органические фазы промывают насыщ. NH4Cl (4×80 мл) и насыщенным раствором соли (150 мл), сушат, фильтруют и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0%→17% MeOH/E-Ac) дает желаемый продукт (7,7 г, 81,1% выход) в виде светло-желтого масла. ЖХМС (ИЭР) m/z: [M+Na] рассч. для C34H53N9O7: 722,40; найдено 722,4.
Стадия 2: Синтез 2-(4-(2-(2-(4-(5-(((трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)этокси)этил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору этил 2-(4-(2-(2-(4-(5-(((ди-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)этокси)этил)пиперазин-1-ил)пиримидин-5-карбоксилата (7,7 г, 11,00 ммоль, 1,0 эквив.) в ТГФ (80 мл), E-H (20 мл) и H2O (40 мл) добавляют LiOH•H2O (2,31 г, 55,01 ммоль, 5,0 эквив.). Смесь перемешивают при 50°C в течение 26 ч. Смесь затем концентрируют при пониженном давлении для удаления ТГФ и E-H. Водную фазу нейтрализуют 0,5 N HCl и концентрируют при пониженном давлении. Очистка хроматографией с обращенной фазой дает желаемый продукт (4,67 г, 74,3% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M-H] рассч. для C27H41N9O5: 570,31; найдено 570,3.
Строительный блок AU. (R)-трет-бутил 4-(5-(((трет-бутоксикарбонил-N-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-2-карбоксилат.
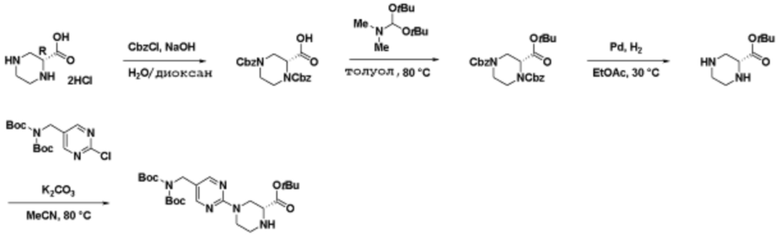
Стадия 1: Синтез (R)-1,4-бис((бензилокси)карбонил)пиперазинe-2-карбоновой кислоты
К двум раздельным партиям, содержащим раствор (2R)-пиперазин-2-карбоновой кислоты (70 г, 344,71 ммоль, 1 эквив., 2 HCl) в H2O (700 мл) и диоксане (1120 мл) добавляют 50% водн. NaOH до pH=11. Добавляют бензилхлорформиат (156,82 мл, 1,10 моль, 3,2 эквив.) и реакционную смесь перемешивают при комнатной температуре в течение 12 ч. Две реакционные смеси объединяют и добавляют H2O (1200 мл). Водный слой экстрагируют МТБЭ (3×1000 мл), доводят до pH=2 с конц. HCl и затем экстрагируют E-Ac (2×1000 мл). Объединенные органические фазы сушат, фильтруют и концентрируют при пониженном давлении с получением желаемого продукта (280 г, 86% выход). ЖХМС (ИЭР) m/z: [M+H] рассч. для C21H22N2O6: 399,16; найдено 399,0.
Стадия 2: Синтез (R)-1,4-дибензил 2-трет-бутилпиперазин-1,2,4-трикарбоксилата
К раствору (R)-1,4-бис((бензилокси)карбонил)пиперазин-2-карбоновой кислоты (70 г, 175,70 ммоль, 1,0 эквив.) в толуоле (700 мл) при 80°C добавляют 1,1-ди-трет-бутокси-N, N-диметилметанамин (80,04 мл, 333,83 ммоль, 1,9 эквив.). Реакционную смесь перемешивают при 80°C в течение 2 ч, в этот момент ее охлаждают при комнатной температуре и разделяют между E-Ac (300 мл) и H2O (500 мл). Водный слой экстрагируют E-Ac (2×500 мл) и объединенные органические слои сушат, фильтруют и концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→25 E-Ac/петролейный эфир)дает желаемый продукт в виде белого твердого вещества (50 г, 57% выход).ЖХМС (ИЭР) m/z: [M+Na] рассч. для C25H30N2O6: 477,20; найдено 476,9.
Стадия 3: Синтез (R)-трет-бутилпиперазин-2-карбоксилата
К раствору(R)-1,4-дибензил 2-трет-бутилпиперазин-1,2,4-трикарбоксилата (50 г, 110,01 ммоль, 1 эквив.) в E-Ac (20 мл) добавляют Pd/C (15 г, 10% масс.). Суспензию дегазируют при пониженном давлении и продувают H2 три раза. Суспензию перемешивают под H2 (30 ф./кв.д.) при 30°C в течение 4 ч. Реакционную смесь затем фильтруют, остаток промывают MeOH (5×200 мл) и фильтрат концентрируют при пониженном давлении с получением желаемого продукта в виде желтого масла (17 г, 81% выход). ЖХМС (ИЭР) m/z: [M+H] рассч. для C9H18N2O2: 187,15; найдено 187,1.
Стадия 4: Синтез (R)-трет-бутил 4-(5-(((трет-бутоксикарбонил-N-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-2-карбоксилата
К суспензии(R)-трет-бутилпиперазин-2-карбоксилата (8 г, 23,27 ммоль, 1,0 эквив.) и трет-бутил-N-трет-бутоксикарбонил ((2-хлорпиримидин-5-ил)метил)карбамата (5,20 г, 27,92 ммоль, 1,2 эквив.) в MeCN (100 мл) добавляют K2CO3 (6,43 г, 46,54 ммоль, 2,0 эквив.). Реакционную смесь нагревают до 80°C в течение 12 ч, в этот момент ее охлаждают при комнатной температуре, фильтруют и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→100% E-Ac/петролейный эфир) дает желаемый продукт в виде желтого твердого вещества (9,2 г, 73% выход). ЖХМС (ИЭР) m/z: [M+H] рассч. для C24H39N5O6: 494,30; найдено 494,1.
Строительный блок AV. (S)-трет-бутил 4-(5-(((трет-бутоксикарбонил-N-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-2-карбоксилат.
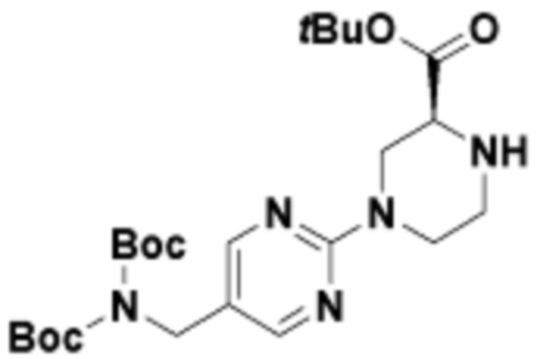
Этот строительный блок получают по методике, аналогичной методике получения Строительного блока AU с применением (2S)-пиперазин-2-карбоновой кислоты.
Строительный блок AW. (R)-2-(4-(2-(3-(2-(трет-бутоксикарбонил)-4-(5-(((трет-бутоксикарбонил-N-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этил)пиперазин-1-ил)пиримидин-5-карбоновая кислота.
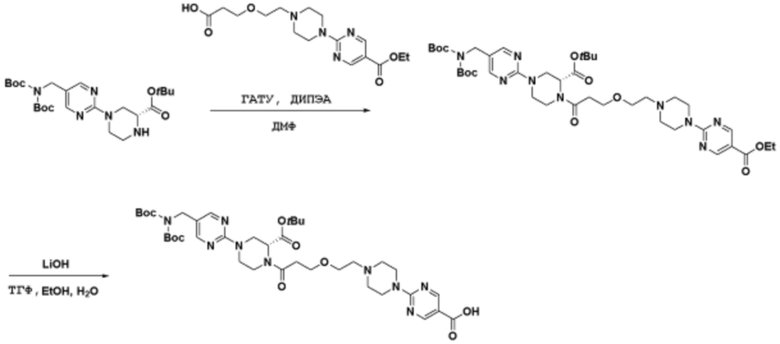
Стадия 1: Синтез (R)-этил 2-(4-(2-(3-(2-(трет-бутоксикарбонил)-4-(5-(((трет-бутоксикарбонил-N-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этил)пиперазин-1-ил)пиримидин-5-карбоксилата
К раствору (R)-трет-бутил 4-(5-(((трет-бутоксикарбонил-N-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-2-карбоксилата (5,3 г, 11,36 ммоль, 1,0 эквив., ТФК) в ДХМ (80 мл) добавляют ГАТУ (6,48 г, 17,05 ммоль, 1,5 эквив.) и ДИПЭА (7,92 мл, 45,45 ммоль, 4,0 эквив.). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и затем добавляют трет-бутил (2R)-4-(5-((бис(трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-2-карбоксилат (5,61 г, 11,36 ммоль, 1,0 эквив.). Смесь перемешивают в течение 1 ч, в этот момент насыщ. NH4Cl (80 мл). Органическую фазу промывают насыщ. NH4Cl (5×80 мл), сушат, фильтруют и концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→9% MeOH/E-Ac) дает желаемый продукт в виде желтого твердого вещества (8,4 г, 85% выход).
Стадия 2: Синтез(R)-2-(4-(2-(3-(2-(трет-бутоксикарбонил)-4-(5-(((трет-бутоксикарбонил-N-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К двум раздельным партиям, содержащим раствор (R)-этил 2-(4-(2-(3-(2-(трет-бутоксикарбонил)-4-(5-(((трет-бутоксикарбонил-N-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этил)пиперазин-1-ил)пиримидин-5-карбоксилата (3,4 г, 4,11 ммоль, 1,0 эквив.) в ТГФ (16 мл), E-H (8 мл) и H2O (8 мл) добавляют LiOH•H2O (344,61 мг, 8,21 ммоль, 2,0 эквив.). Смесь перемешивают при комнатной температуре в течение 2 ч. Две реакционных смеси затем объединяют и доводят до pH=7 с 1N HCl. Раствор концентрируют при пониженном давлении для удаления ТГФ и E-H. Раствор затем фильтруют, и полученное твердое вещество очищают хроматографией с обращенной фазой с получением желаемого продукта в виде белого твердого вещества (4 г, 59% выход). ЖХМС (ИЭР) m/z: [M+H] рассч. для C38H57N9O10: 800,43; найдено 800,3.
Строительный блок AX. (S)-2-(4-(2-(3-(2-(трет-бутоксикарбонил)-4-(5-(((трет-бутоксикарбонил-N-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этил)пиперазин-1-ил)пиримидин-5-карбоновая кислота.
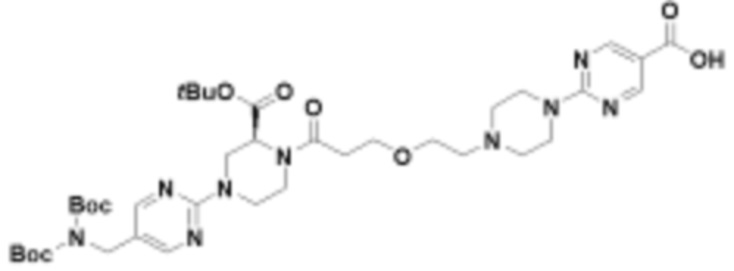
Этот строительный блок получают из Строительного блока AV по методике, аналогичной методике получения Строительного блока AW.
Строительный блок AY. 1'-(2-(3-(4-(5-(((трет-бутоксикарбонил)амино)метил)пиримидин-2-ил) пиперазин-1-ил)-3-оксопропокси)этил)-[1,4'-бипиперидин]-4-карбоновая кислота.
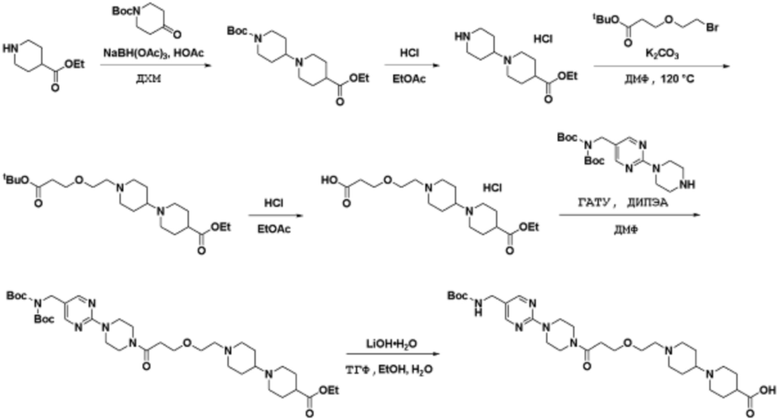
Стадия 1: Синтез 1'-трет-бутил 4-этил [1,4'-бипиперидин]-1',4-дикарбоксилата
К раствору этилпиперидин-4-карбоксилата (30 г, 150,57 ммоль, 1,0 эквив.) и трет-бутил 4-оксопиперидин-1-карбоксилата (23,67 г, 150,57 ммоль, 1,0 эквив.) в ДХМ (300 мл) добавляют HOAc (6,00 мл, 104,95 ммоль, 0,7 эквив.). Смесь перемешивают при комнатной температуре в течение 30 мин, затем добавляют NaBH(OAc)3 (63,82 г, 301,13 ммоль, 2,0 эквив.). Смесь перемешивают в течение 16 ч, в этот момент добавляют H2O (50 мл). Водную фазу экстрагируют ДХМ (3×15 мл), и объединенные органические фазы промывают насыщенным раствором соли (10 мл), сушат, фильтруют и концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (8→100 MeOH/E-Ac) дает желаемый продукт в виде желтого масла (30 г, 59% выход).
Стадия 2: Синтез этил [1,4'-бипиперидин]-4-карбоксилат
К раствору HCl в E-Ac (200 мл) добавляют 1'-трет-бутил 4-этил[1,4'-бипиперидин]-1',4-дикарбоксилат (20 г, 58,74 ммоль, 1,0 эквив.). Смесь перемешивают при комнатной температуре в течение 3 ч. Смесь затем концентрируют при пониженном давлении с получением желаемого неочищенного продукта в виде белого твердого вещества (15 г, соль HCl).
Стадия 3: Синтез этил 1'-(2-(3-(трет-бутокси)-3-оксопропокси)этил)-[1,4'-бипиперидин]-4-карбоксилата
К раствору трет-бутил 3-(2-бромэтокси)пропаноата (6,46 г, 25,54 ммоль, 1,0 эквив.) в ДМФ (240 мл) добавляют K2CO3 (10,59 г, 76,61 ммоль, 3,0 эквив.) и этил [1,4'-бипиперидин]-4-карбоксилат (8 г, 25,54 ммоль, 1,0 эквив., 2 HCl). Смесь перемешивают при 120°C в течение 12 ч, в этот момент реакционную смесь охлаждают при комнатной температуре, фильтруют, фильтровальную лепешку промывают H2O (20 мл) и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→11% MeOH/E-Ac) дает желаемый продукт в виде желтого масла (6,6 г, 63% выход).
Стадия 4: Синтез 3-(2-(4-(этоксикарбонил)-[1,4'-бипиперидин]-1'-ил)этокси)пропановой кислоты
К раствору HCl в E-Ac (70 мл) добавляют этил 1'-(2-(3-(трет-бутокси)-3-оксопропокси)этил)-[1,4'-бипиперидин]-4-карбоксилат (6,6 г, 16,00 ммоль, 1,0 эквив.). Смесь перемешивают при комнатной температуре в течение 3 ч, в этот момент реакционную смесь концентрируют при пониженном давлении с получением желаемого продукта в виде белого твердого вещества (6,5 г, 95% выход, 2 HCl).
Стадия 5: Синтез этил 1'-(2-(3-(4-(5-(((N, N-ди-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этил)-[1,4'-бипиперидин]-4-карбоксилата
К раствору трет-бутил-трет-бутоксикарбонил((2-(пиперазин-1-ил)пиримидин-5-ил)метил)карбамата (2,49 г, 6,33 ммоль, 1,5 эквив.) в ДМФ (40 мл) добавляют ДИПЭА (9,74 мл, 55,89 ммоль, 6,0 эквив.) и ГАТУ (5,31 г, 13,97 ммоль, 1,5 эквив.). Смесь перемешивают при комнатной температуре в течение 30 мин и затем добавляют 3-(2-(4-(этоксикарбонил)-[1,4'-бипиперидин]-1'-ил)этокси)пропановую кислоту (4 г, 9,32 ммоль, 1,0 эквив., 2 HCl). Смесь перемешивают в течение 1,5 ч, в этот момент добавляют H2O (5 мл) и E-Ac (20 мл). Водную фазу экстрагируют E-Ac (3×10 мл), и объединенные органические фазы промывают насыщенным раствором соли (5 мл), сушат, фильтруют и концентрируют при пониженном давлении. Очистка хроматографией с обращенной фазой дает желаемый продукт в виде коричневого масла (1,6 г, 23% выход). ЖХМС (ИЭР) m/z: [M+H] рассч. для C37H61N7O8: 732,47; найдено 732,6.
Стадия 6: Синтез 1'-(2-(3-(4-(5-(((трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этил)-[1,4'-бипиперидин]-4-карбоновой кислоты
К раствору этил 1'-(2-(3-(4-(5-(((N, N-ди-трет-бутоксикарбонил)амино)метил)пиримидин-2-ил)пиперазин-1-ил)-3-оксопропокси)этил)-[1,4'-бипиперидин]-4-карбоксилата (1,4 г, 1,91 ммоль, 1,0 эквив.) в ТГФ (7,5 мл), E-H (3,8 мл) и H2O (3,8 мл) добавляют LiOH•H2O (321,07 мг, 7,65 ммоль, 4,0 эквив.). Смесь перемешивают при комнатной температуре в течение 2 ч, в этот момент смесь концентрируют при пониженном давлении. Очистка хроматографией с обращенной фазой (5→38% MeCN/H2O) дает желаемый продукт в виде желтого твердого вещества (325 мг, 22% выход). ЖХМС (ИЭР) m/z: [M+H] рассч. для C30H49N7O6: 604,38; найдено 604,3.
Строительный блок AZ. 1-(4-{2-[2-(2-{[(бензилокси)карбонил]амино}этокси)этокси]этил}пиперазин-1-ил)-3,6,9,12-тетраоксапентадекан-15-овая кислота.
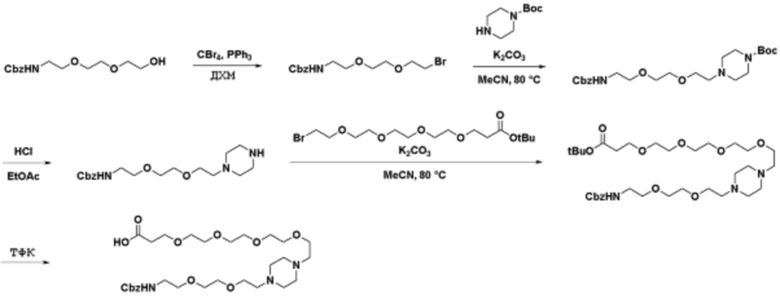
Стадия 1: Синтез бензил (2-(2-(2-бромэтокси)этокси)этил)карбамата
К раствору бензил (2-(2-(2-гидроксиэтокси)этокси)этил)карбамата (10 г, 35,30 ммоль, 1,0 эквив.) в ДХМ (300 мл) при 0°C добавляют PPh3 (13,79 г, 52,59 ммоль, 1,49 эквив.) и CBr4 (17,44 г, 52,59 ммоль, 1,49 эквив.). Затем смесь нагревают до комнатной температуры и перемешивают в течение 12 ч. Реакционную смесь затем фильтруют, и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (1%→25% E-Ac/петролейный эфир) дает желаемый продукт (10,8 г, 88,4% выход) в виде желтого масла.
Стадия 2: Синтез трет-бутил 4-(3-оксо-1-фенил-2,7,10-триокса-4-азадодекан-12-ил)пиперазин-1-карбоксилат
К раствору бензил (2-(2-(2-бромэтокси)этокси)этил)карбамата (10,8 г, 31,19 ммоль, 1,0 эквив.) и трет-бутил пиперазин-1-карбоксилата (5,81 г, 31,19 ммоль, 1,0 эквив.) в MeCN (100 мл) добавляют K2CO3 (4,31 г, 31,19 ммоль, 1,0 эквив.). Смесь перемешивают при 80°C в течение 1 ч. Реакционную смесь затем фильтруют, и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0%→50% MeOH/E-Ac) дает желаемый продукт (13,1 г, 93,0% выход) в виде желтого масла.
Стадия 3: Синтез бензил (2-(2-(2-(пиперазин-1-ил)этокси)этокси)этил)карбамата
Раствор трет-бутил 4-(3-оксо-1-фенил-2,7,10-триокса-4-азадодекан-12-ил)пиперазин-1-карбоксилата (5,64 г, 12,49 ммоль, 1,0 эквив.) в HCl/E-Ac (50 мл, 4 M) перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь затем концентрируют при пониженном давлении с получением желаемого продукта (5,23 г, неочищенный, соль HCl) в виде желтого масла.
Стадия 4: Синтез трет-бутил 1-(4-(3-оксо-1-фенил-2,7,10-триокса-4-азадодекан-12-ил)пиперазин-1-ил)-3,6,9,12-тетраоксапентадекан-15-оата
Раствор бензил (2-(2-(2-(пиперазин-1-ил)этокси)этокси)этил)карбамата (13,3 г, 31,34 ммоль, 1,0 эквив., 2 HCl) и трет-бутил 1-бром-3,6,9,12-тетраоксапентадекан-15-оата в MeCN (150 мл) добавляют K2CO3 (21,66 г, 156,71 ммоль, 5,0 эквив.). Смесь перемешивают при 80°C в течение 12 ч. Реакционную смесь затем фильтруют, и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (1%→17% MeOH/ДХМ) дает желаемый продукт (5,4 г, 26,3% выход) в виде желтого масла.
Стадия 5: Синтез 1-(4-(3-оксо-1-фенил-2,7,10-триокса-4-азадодекан-12-ил)пиперазин-1-ил)-3,6,9,12-тетраоксапентадекан-15-овой кислоты
Раствор трет-бутил 1-(4-(3-оксо-1-фенил-2,7,10-триокса-4-азадодекан-12-ил)пиперазин-1-ил)-3,6,9,12-тетраоксапентадекан-15-оата (2,4 г, 3,66 ммоль, 1,0 эквив.) в ТФК (20 мл) перемешивают при комнатной температуре в течение 30 мин. Реакционную смесь затем концентрируют при пониженном давлении с получением желаемого продукта (3,03 г, соль ТФК) в виде желтого масла.
Строительный блок BA. (R)-2-(2-(трет-бутоксикарбонил)-4-(6-(трет-бутоксикарбонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-ил)пиперазин-1-ил)пиримидин-5-карбоновая кислота.
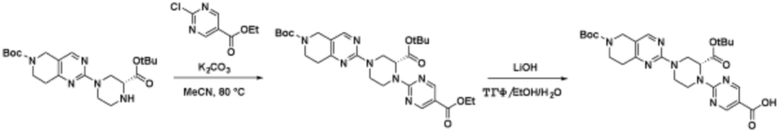
Стадия 1: Синтез (R)-трет-бутил 2-(3-(трет-бутоксикарбонил)-4-(5-(этоксикарбонил)пиримидин-2-ил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата
К двум разным партиям, полученным параллельно, каждая из которых содержит раствор (R)-трет-бутил 2-(3-(трет-бутоксикарбонил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (6 г, 14,30 ммоль, 1,0 эквив.) и K2CO3 (3,95 г, 28,60 ммоль, 2,0 эквив.) в MeCN (80 мл) добавляют этил 2-хлорпиримидин-5-карбоксилат (3,20 г, 17,16 ммоль, 1,2 эквив.). Реакционные смеси перемешивают при 80°C в течение 12 ч. Две реакционные смеси объединяют и фильтруют, остаток промывают E-Ac (3×50 мл) и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0%→17% MeOH/E-Ac) дает желаемый продукт (15 г, 91,5% выход) в виде желтого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C28H39N7O6:570,31; найдено 570,1.
Стадия 2: Синтез (R)-2-(2-(трет-бутоксикарбонил)-4-(6-(трет-бутоксикарбонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-ил)пиперазин-1-ил)пиримидин-5-карбоновой кислоты
К раствору (R)-трет-бутил 2-(3-(трет-бутоксикарбонил)-4-(5-(этоксикарбонил)пиримидин-2-ил)пиперазин-1-ил)-7,8-дигидропиридо[4,3-d]пиримидин-6(5H)-карбоксилата (15 г, 26,33 ммоль, 1,0 эквив.) в ТГФ (80 мл), E-H (40 мл) и H2O (40 мл) добавляют LiOH●H2O (2,21 г, 52,66 ммоль, 2,0 эквив.). Смесь перемешивают при комнатной температуре в течение 6 ч. Реакционную смесь затем доводят до pH=6 с 1 N HCl. Полученную суспензию фильтруют, и твердую лепешку сушат при пониженном давлении с получением желаемого продукта (10,87 г, 75,9% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C26H35N7O6: 542,27; найдено 542,1.
Строительный блок BB. (S)-2-(2-(трет-бутоксикарбонил)-4-(6-(трет-бутоксикарбонил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-2-ил)пиперазин-1-ил)пиримидин-5-карбоновая кислота.
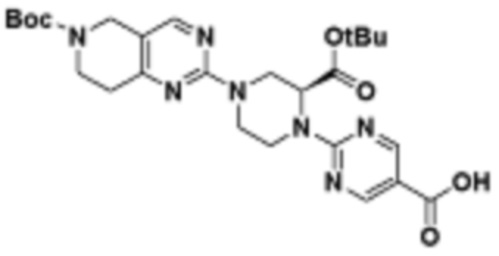
Этот строительный блок получают из Строительного блока AA по методике, аналогичной методике получения Строительного блока BA.
Строительный блок BC. 2-[(2R)-2-[(трет-бутокси)карбонил]-4-[5-({[(трет-бутокси)карбонил]амино}метил)пиримидин-2-ил]пиперазин-1-ил]пиримидин-5-карбоновая кислота.
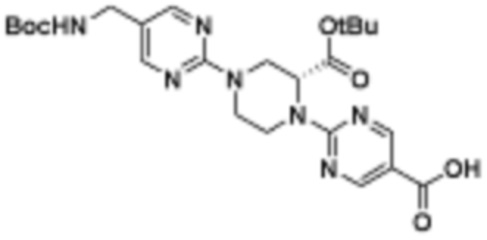
Этот строительный блок получают из Строительного блока AU по методике, аналогичной методике получения Строительного блока BA.
Строительный блок BD. 2-[(2S)-2-[(трет-бутокси)карбонил]-4-[5-({[(трет-бутокси)карбонил]амино}метил)пиримидин-2-ил]пиперазин-1-ил]пиримидин-5-карбоновая кислота.
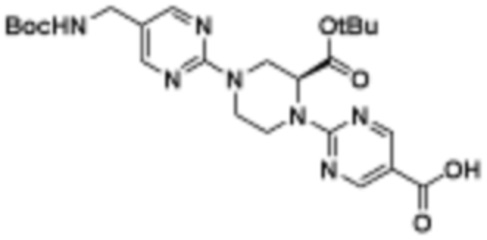
Этот строительный блок получают из Строительного блока AV по методике, аналогичной методике получения Строительного блока BA.
Строительный блок BE. 15-(6-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-ил)-1-((1S,4S)-5-(2-(2-(2-аминоэтокси)этокси)этил)-2,5-диазабицикло[2,2,1]гептан-2-ил)-3,6,9,12-тетраоксапентадекан-15-он.
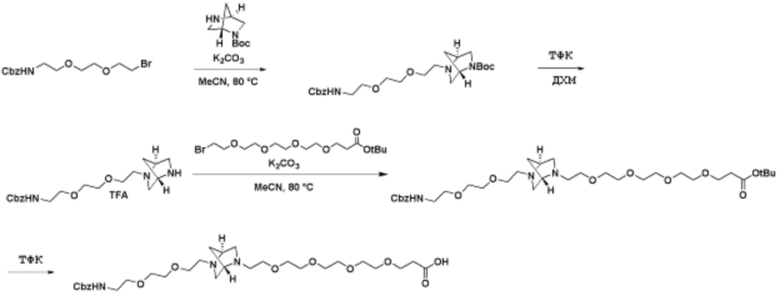
Стадия 1: Синтез (1S,4S)-трет-бутил 5-(3-оксо-1-фенил-2,7,10-триокса-4-азадодекан-12-ил)-2,5-диазабицикло[2,2,1]гептан-2-карбоксилата
К раствору (1S,4S)-трет-бутил 2,5-диазабицикло[2,2,1]гептан-2-карбоксилата (2,85 г, 14,37 ммоль, 1,0 эквив.) в MeCN (50 мл) добавляют K2CO3 (3,97 г, 28,75 ммоль, 2,0 эквив.) и бензил (2-(2-(2-бромэтокси)этокси)этил)карбамат (4,98 г, 14,37 ммоль, 1,0 эквив.). Смесь перемешивают при 80°C в течение 24 ч. Реакционную смесь затем фильтруют, и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→10% MeOH/E-Ac) дает желаемый продукт (6,2 г, 93,0% выход) в виде бесцветного масла. ЖХМС (ИЭР) m/z: [M+H] рассч. для C24H37N3O6: 464,27; найдено 464,2.
Стадия 2: Синтез бензил (2-(2-(2-((1S,4S)-2,5-диазабицикло[2,2,1]гептан-2-ил)этокси)этокси)этил)карбамата
К раствору (1S,4S)-трет-бутил 5-(3-оксо-1-фенил-2,7,10-триокса-4-азадодекан-12-ил)-2,5-диазабицикло[2,2,1]гептан-2-карбоксилата (6,2 г, 13,37 ммоль, 1,0 эквив.) в ДХМ (60 мл) добавляют ТФК (20,7 мл, 279,12 ммоль, 20,9 эквив.). Реакционную смесь перемешивают в течение 2 ч, в этот момент смесь концентрируют при пониженном давлении при 45°C с получением желаемого неочищенного продукта (10,5 г,4 ТФК) в виде светло-коричневого масла, которое применяют сразу на следующей стадии. ЖХМС (ИЭР) m/z: [M+H] рассч. для C19H29N3O4: 364,22; найдено 364,2.
Стадия 3: Синтез трет-бутил 1-((1S,4S)-5-(3-оксо-1-фенил-2,7,10-триокса-4-азадодекан-12-ил)-2,5-диазабицикло[2,2,1]гептан-2-ил)-3,6,9,12-тетраоксапентадекан-15-оата
К раствору бензил (2-(2-(2-((1S,4S)-2,5-диазабицикло[2,2,1]гептан-2-ил)этокси)этокси)этил)карбамата (5 г, 6,10 ммоль, 1,0 эквив., 4 ТФК) в MeCN (80 мл) добавляют K2CO3 (5,06 г, 36,61 ммоль, 6,0 эквив.) и трет-бутил 1-бром-3,6,9,12-тетраоксапентадекан-15-оат (2,35 г, 6,10 ммоль, 1,0 эквив.). Реакционную смесь перемешивают при 80°C в течение 12 ч. Реакционную смесь затем фильтруют, и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→15% MeOH/E-Ac) дает желаемый продукт (5,2 г, 92,8% выход) в виде светло-желтого масла. ЖХМС (ИЭР) m/z: [M+H] рассч. для C34H57N3O10: 668,4; найдено 668,4.
Стадия 4: Синтез 1-((1S,4S)-5-(3-оксо-1-фенил-2,7,10-триокса-4-азадодекан-12-ил)-2,5-диазабицикло[2,2,1]гептан-2-ил)-3,6,9,12-тетраоксапентадекан-15-овой кислоты
Раствор трет-бутил 1-((1S,4S)-5-(3-оксо-1-фенил-2,7,10-триокса-4-азадодекан-12-ил)-2,5-диазабицикло[2,2,1]гептан-2-ил)-3,6,9,12-тетраоксапентадекан-15-оата (5,2 г, 5,66 ммоль, 1,0 эквив.) в ТФК (47,3 мл, 638,27 ммоль, 112,75 эквив.) перемешивают при комнатной температуре в течение 30 мин. Смесь затем концентрируют при пониженном давлении при 45°C. Очистка хроматографией с обращенной фазой (2→35% MeCN/H2O (0,05% NH4OH)) дает желаемый продукт (1,88 г, 54,3% выход) в виде светло-коричневого масла. ЖХМС (ИЭР) m/z: [M+H] рассч. для C30H49N3O10: 612,34; найдено 612,3.
Строительный блок BF. 21-(6-((4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3,4-дигидроизохинолин-2(1H)-ил)-1-(пиперазин-1-ил)-3,6,9,12,15,18-гексаоксагеникосан-21-он.
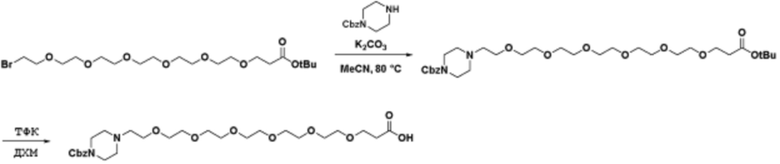
Стадия 1: Синтез бензил 4-(23,23-диметил-21-оксо-3,6,9,12,15,18,22-гексаоксатетракосил)пиперазин-1-карбоксилата
К раствору трет-бутил 1-бром-3,6,9,12,15,18-гексаоксагеникосан-21-оата (5 г, 10,56 ммоль, 1,0 эквив.) и бензилпиперазин-1-карбоксилата (2,62 мл, 11,62 ммоль, 1,1 эквив., HCl) в MeCN (50 мл) добавляют K2CO3 (4,38 г, 31,69 ммоль, 3,0 эквив.). Реакционную смесь перемешивают при 80°C в течение 10 ч. Смесь затем фильтруют, твердую лепешку промывают E-Ac (3×3 мл) и фильтрат концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (0→10% MeOH/E-Ac) дает желаемый продукт (4 г, 61,8% выход) в виде красной жидкости.
Стадия 2: Синтез 1-(4-((бензилокси)карбонил)пиперазин-1-ил)-3,6,9,12,15,18-гексаоксагеникосан-1-овой кислотой
К раствору бензил 4-(23,23-диметил-21-оксо-3,6,9,12,15,18,22-гексаоксатетракосил)пиперазин-1-карбоксилата (1,8 г, 2,94 ммоль, 1,0 эквив.) в ДХМ (10 мл) добавляют ТФК (10 мл). Раствор перемешивают в течение 0,5 ч. Раствор затем концентрируют при пониженном давлении. К остатку добавляют ДХМ (30 мл) и затем раствор концентрируют при пониженном давлении с получением желаемого продукта (1,6 г, 2,87 ммоль, ТФК) в виде красной жидкости.
Получение мономеров рапамицина.
Мономер 1. 32(R)-гидрокси 26-аминооксиуксусная кислота рапамицин.
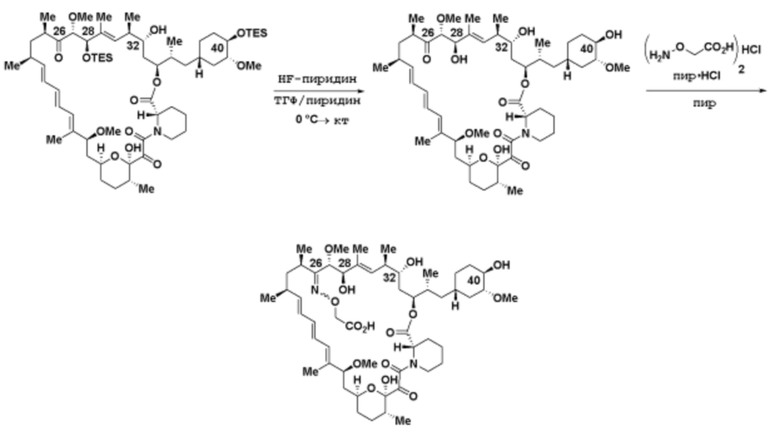
Стадия 1: Синтез 32(R)-гидрокси рапамицин
Раствор 32(R)-гидрокси-28,40-бистриэтилсилил рапамицина (3,64 г, 3,18 ммоль, 1 эквив.) в ТГФ (41,8 мл) обрабатывают пиридином (20,8 мл, 258 ммоль, 81 эквив.) и реакционную смесь охлаждают до 0°C. Раствор обрабатывают по каплям 70% HF-пиридином (4,60 мл, 159 ммоль, 50 эквив.) и реакционную смесь перемешивают при 0°C в течение 20 мин, затем нагревают до комнатной температуры. Через 5 ч, реакционную смесь охлаждают обратно до 0°C и осторожно добавляют - ледяной насыщ. раствор NaHCO3 (400 мл). Смесь экстрагируют E-Ac (2×100 мл) и органическую фазу промывают 75 мл порциями H2O, насыщ. раствором NaHCO3 и насыщенным раствором соли. Органический раствор сушат над Na2SO4, фильтруют и концентрируют с получением светло-желтого масла, которое дает жесткую пену при пониженном давлении. Неочищенный продукт очищают хроматографией на силикагеле (20→40% ацетон/гекс) с получением желаемого продукта в виде белого аморфного твердого вещества (1,66 г, 57% выход). ЖХМС (ИЭР) m/z: [M+Na] рассч. для C51H81NO13: 938,56; найдено 938,7; m/z: [M-H] рассч. для C51H81NO13: 914,56; найдено 914,7.
Стадия 2: Синтез 32(R)-гидрокси 26-аминоуксусной кислоты рапамицина
В сухую реакционную колбу добавляют 32(R)-гидрокси рапамицин (3,39 г, 3,70 ммоль, 1.0 эквив.) и полугидрохлорид карбоксиметоксиламина (1,62 г, 7,40 ммоль, 2,0 эквив.), затем пиридин (18 мл) при комнатной температуре. Добавляют гидрохлорид пиридина (2,99 г, 25,9 ммоль, 7,0 эквив.) и затем реакционную смесь нагревают до 50°C. Через 1,5 дня, растворитель удаляют при пониженном давлении и полутвердый продукт очищают хроматографией с обращенной фазой (15→90% MeCN/H2O, без ТФК) с получением продукта, смеси E/Z оксимных изомеров, в виде белого порошка (1,51 г, 41% выход). ЖХМС (ИЭР) m/z:[M+Na] рассч. для C53H84N2O15: 1011,58; найдено 1011,6.
Мономер 2. 32(R)-метокси 26-аминоуксусная кислота рапамицин.
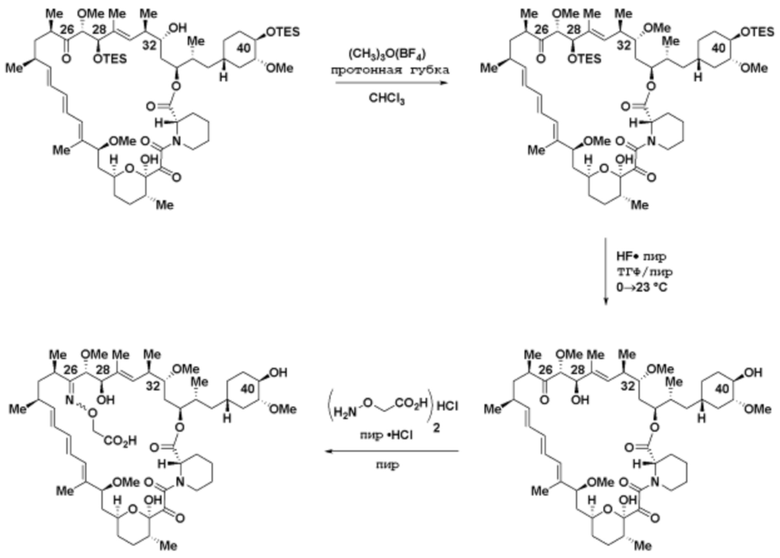
Стадия 1: Синтез 32(R)-метокси-28,40-бистриэтилсилил рапамицина
К перемешиваемому раствору 32(R)-гидрокси-28,40-бистриэтилсилил рапамицина (3,83 г, 3,34 ммоль, 1,0 эквив.) в хлороформе (95,8 мл) добавляют Pro-n Sponge® (7,17 г, 33,5 ммоль, 10,0 эквив.) вместе со свежевысушенными 4 Å молекулярными ситами (4 г). Раствор перемешивают в течение 1 ч, затем добавляют тетрафторборат триметиоксония (4,95 г, 33,5 ммоль, 10,0 эквив., сушат нагреванием при пониженном давлении при 50°C в течение 1 ч перед применением) при комнатной температуре. Реакционную смесь перемешивают в течение 18 ч и затем реакционную смесь разбавляют ДХМ и фильтруют через Целит. Фильтрат промывают последовательно водным 1 M HCl (2x), насыщ. водным раствором NaHCO3, затем сушат и концентрируют при пониженном давлении. Очистка хроматографией на силикагеле (10→20% E-Ac/гексан) дает желаемый продукт в виде желтого масла с примесью 3% масс. протонную губку. Остаток берут в МТБЭ и промывают водной 1 M HCl, насыщ. водным раствором NaHCO3, сушат и затем концентрируют при пониженном давлении с получением желтой пены (3,15 г, 81,2% выход). ЖХМС (ИЭР) m/z: [M-TES+H2O] рассч. для C64H111NO13Si2: 1061,68; найдено 1061,9.
Стадия 2: Синтез 32(R)-метокси рапамицина
К перемешиваемому раствору 32(R)-метокси-28,40-бистриэтилсилил рапамицина (1,11 г, 0,958 ммоль, 1,0 эквив.) в ТГФ (12,6 мл) и пиридине (6,30 мл) в пластиковом флаконе добавляют 70% HF-пиридин (2,22 мл, 76,6 ммоль, 80,0 эквив.) по каплям при 0°C. Реакционную смесь перемешивают при 0°C в течение 20 мин, затем нагревают до комнатной температуры в течение 3 ч. Реакционную смесь охлаждают до 0°C и медленно выливают в ледяной насыщ. водный раствор NaHCO3 (50 мл). Водный слой экстрагируют E-Ac (3x) и объединенные органические слои промывают насыщ. водным раствором NaHCO3, насыщенным раствором соли, сушат и концентрируют при пониженном давлении. Желтый остаток растворяют в MeOH (5 мл) и добавляют по каплям к H2O (50 мл) с получением белого осадка. После перемешивания в течение 15 мин суспензию фильтруют на воронке со средней пористостью, и лепешку промывают H2O (2x). Твердые вещества затем растворяют в MeCN (50 мл) и лиофилизируют в течение ночи с получением продукта в виде белого твердого вещества (780 мг, 87% выход). ЖХМС (ИЭР) m/z: [M+Na] рассч. для C52H83NO13: 952,58; найдено 952,4.
Стадия 3:Синтез 32(R)-метокси 26-аминоуксусной кислоты рапамицина
В сухую реакционную колбу добавляют 32(R)-метокси рапамицин (118 мг, 0,127 ммоль, 1,.0 эквив.) и полугидрохлорид карбоксиметоксиламина (137 мг, 0,634 ммоль, 5,0 эквив.), затем пиридин (0,59 мл) при комнатной температуре. Добавляют гидрохлорид пиридина (0,103 г, 0,888 ммоль, 7,0 эквив.) и затем реакционную смесь нагревают до 50°C. Через 1,5 дней реакционную смесь охлаждают до комнатной температуры и по каплям добавляют в H2O (25 мл), затем смесь охлаждают до 0°C. Выпавшее в осадок твердое вещество фильтруют, промывают H2O дважды и сушат с получением продукта, смеси E/Z оксимовых изомероа, в виде белого порошка (99 мг, 77% выход). ЖХМС (ИЭР) m/z: [M-H] рассч. для C54H86N2O15: 1001,59; найдено 1001,7.
Мономеры 3. 32(R)-этокси 26-аминоуксусная кислота рапамицин.
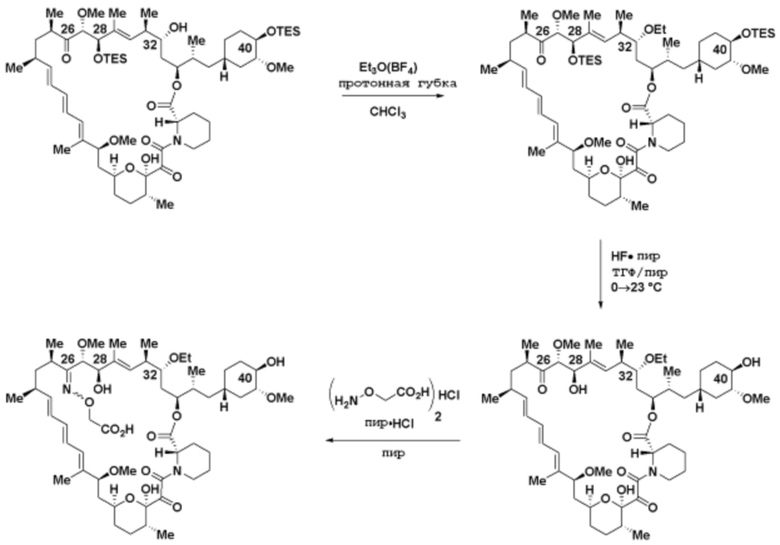
Стадия 1: Синтез 32(R)-этокси-28,40-бистриэтилсилил рапамицина
Раствор 32(R)-гидроксигидрокси-28,40-бистриэтилсилил рапамицина (773 мг, 0,675 ммоль, 1,0 эквив.) в хлороформе (19 мл) обрабатывают N, N,N',N'-тетраметил-1,8-нафталиндиамин (1,85 г, 8,63 ммоль, 12,8 эквив.) вместе со свежевысушенными 4Å молекулярными ситами. Смесь перемешивают в течение 1 ч при комнатной температуре и обрабатывают тетрафторборатом триэтилоксония (1,51 г, 7,95 ммоль, 11,8 эквив.) одной порцией при комнатной температуре. Реакционную смесь перемешивают в течение 3 ч, в этот момент реакционную смесь разбавляют ДХМ и фильтруют через Целит, промывая фильтровальный слой дополнительным ДХМ. Объединенные фильтраты дважды промывают 1M HCl, одиножды насыщенным раствором NaHCO3 и сушат над Na2SO4. Раствор фильтруют и концентрируют до остатка. Неочищенный остаток обрабатывают МТБЭ и фильтруют для удаления полярного нерастворимого продукта. Фильтрат концентрируют и очищают хроматографией на силикагеле (5→25% E-Ac/гекс) с получением продукта в виде пены (516 мг, 65% выход). ЖХМС (ИЭР) m/z: [M+Na] рассч. для C65H113NO13Si2 1194,77; найдено 1194,6.
Стадия 2: Синтез 32(R)-этокси рапамицина
К раствору 32(R)-этокси-28,40-бистриэтилсилил рапамицина (131 мг, 0,112 ммоль, 1,0 эквив.) в ТГФ (1,3 мл) при 0°C добавляют пиридин (271 мкл, 3,35 ммоль, 3,4 эквив.), затем 70% HF-пиридин (51 мкл, 1,8 ммоль, 1,8 эквив.). Реакционную колбу закрывают крышкой и хранят в холодильнике в течение 3 дней, в этот момент реакционную смесь выливают в холодный насыщенный NaHCO3 (20 мл). Водный слой экстрагируют E-Ac (3×20 мл), и объединенные органические слои промывают 1M HCl (2×20 мл), насыщенным раствором NaHCO3 (20 мл) и насыщенным раствором соли. Раствор сушат над Na2SO4, фильтруют и концентрируют. Остаток берут в MeOH (1,5 мл) и добавляют по каплям к H2O (20 мл). Твердые вещества фильтруют и промывают дополнительной H2O с получением продукта (53 мг, 51% выход) в виде белого порошка. ЖХМС (ИЭР) m/z: [M+Na] рассч. для C53H85NO13: 966,59; найдено 966,5.
Стадия 3:Синтез 32(R)-этокси 26-аминоуксусной кислоты рапамицина
В сухую реакционную колбу добавляют 32(R)-этокси рапамицин (1,0 эквив.) и полугидрохлорид карбоксиметоксиламина (5,0 эквив.), затем пиридин при комнатной температуре. Добавляют гидрохлорид пиридина (7,0 эквив.) и затем реакционную смесь нагревают до 50°C. Через 1,5 дня реакционную смесь охлаждают до комнатной температуры и по каплям добавляют в H2O, затем смесь охлаждают до 0°C. Выпавшее в осадок твердое вещество фильтруют, промывают H2O дважды и сушат с получением продукта, смеси E/Z оксимовых изомеров.
Мономер 4. 32(R)-гидрокси 26-(3-аминооксибензойная кислота) рапамицин.
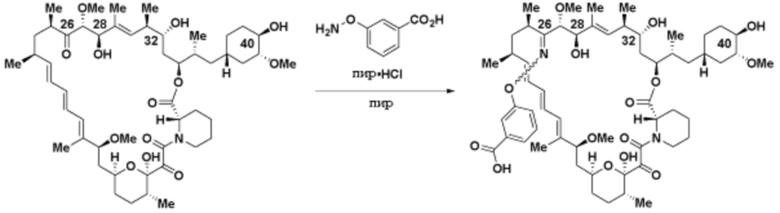
К раствору 32(R)-гидрокси рапамицина (0,500 г, 0,546 ммоль, 1,0 эквив.) и 3-(аминоокси)бензойной кислоты (0,207 г, 1,35 ммоль, 2,5 эквив.) в пиридине (2,6 мл) добавляют гидрохлорид пиридина (0,442 г, 3,82 ммоль, 7,0 эквив.). Реакционную смесь нагревают до 50°C. Через 43 ч, добавляют дополнительную 3-(аминоокси)бензойную кислоту (0,103 г, 0,67 ммоль, 1,2 эквив.) и 4M HCl в диоксане (0,136 мл, 0,54 ммоль, 1,0 эквив.). Через 24 ч, реакционную смесь охлаждают до комнатной температуры, и раствор разделяют между EtOAc и 1M HCl. Водный слой экстрагируют EtOAc, и объединенные органические слои промывают 2M HCl, H2O, и насыщенным раствором соли, сушат с Na2SO4 и концентрируют при пониженном давлении. Неочищенный продукт очищают хроматографией на силикагеле (15→50% ацетон/ДХМ, затем 5% MeOH/ДХМ) с получением получистого продукта. Очистка препаративной хроматографией на тарелке с силикагелем (50% ацетон/ДХМ) дает продукт (0,089 г, 16% выход) в виде белой пены. ЖХМС (ИЭР) m/z: [M+Na] рассч. для C58H86N2O15: 1073,59; найдено 1073,5.
Мономер 5. 32(R)-гидрокси 26-(2-аминоокси-2-метилпропановая кислота) рапамицин.
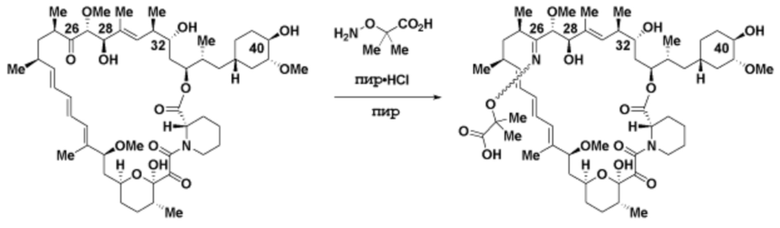
К раствору 32(R)-гидрокси рапамицина (0,500 г, 0,546 ммоль, 1,0 эквив.) и гидрохлорида 2-(аминоокси)-2-метилпропановой кислоты (0,340 г, 2,18 ммоль, 4,0 эквив.) в пиридине (2,6 мл) добавляют гидрохлорид пиридина (0,504 г, 4,36 ммоль, 8,0 эквив.). Реакционную смесь нагревают до 50°C в течение 64 ч. Реакционную смесь затем охлаждают до комнатной температуры и разделяют между EtOAc и 2N HCl. Водный слой экстрагируют EtOAc и затем объединенные органические слои промывают 2N HCl, H2O и насыщенным раствором соли, сушат с Na2SO4 и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (20→50% ацетон/ДХМ) с получением получистого продукта (0,275 г). Растирание м 50% Et2O/гексаном (4 мл) дает очищенный продукт (0,127 г, 23% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+Na] рассч. для C55H88N2O15: 1039,61; найдено 1039,6.
Мономер 6. 26-аминоуксусная кислота рапамицин.
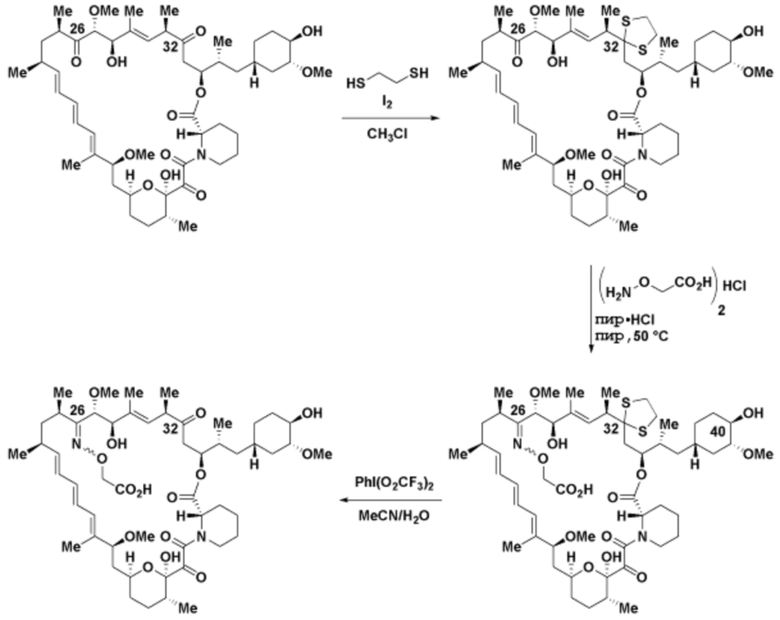
Стадия 1: Синтез 32-(1,3-дитиолан) рапамицина
К раствору рапамицина (1,0 эквив.) в хлороформе добавляют 1,2-этандитиол (1,1 эквив.), затем йод (0,1 эквив.). Раствор перемешивают при комнатной температуре до потребления рапамицина, по данным ЖХМС анализа. После водной обработки, неочищенный продукт очищают хроматографией на силикагеле с получением продукта.
Стадия 2: Синтез 32-(1,3-дитиолан)26-аминоуксусной кислоты рапамицина
В сухую реакционную колбу добавляют 32-(1,3-дитиолан) рапамицин (1,0 эквив.) и полугидрохлорид карбоксиметоксиламина (5,0 эквив.), затем пиридин при комнатной температуре. Гидрохлорид пиридина (7,0 эквив.) добавляют, и затем реакционную смесь нагревают до 50°C. Через 1,5 дня реакционную смесь охлаждают до комнатной температуры и по каплям добавляют в H2O, затем смесь охлаждают до 0°C. Выпавшее в осадок твердое вещество фильтруют, промывают H2O дважды и сушат с получением продукта, смеси E/Z оксимовых изомеров.
Стадия 3: Синтез 26-аминоуксусной кислоты рапамицина
К раствору 32-(1,3-дитиолан)26-аминоуксусной кислоты рапамицина в MeCN и H2O при комнатной температуре добавляют [бис(трифторацетокси)йод]бензол. Раствор перемешивают при комнатной температуре до потребления исходного продукта, по данным ЖХМС анализа. После водной обработки неочищенный продукт очищают хроматошрафией на силикагеле с получением продукта.
Мономер 7. 32-деокси 26-аминоуксусная кислота рапамицин.
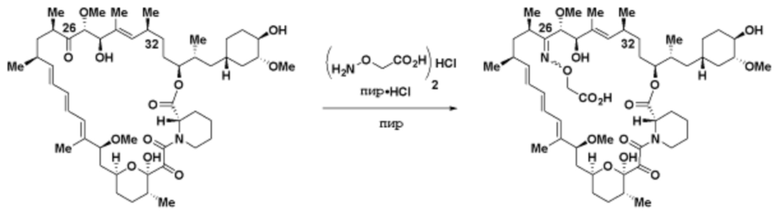
К раствору 32-деокси рапамицина (880 мг, 0,978 ммоль, 1,0 эквив.) и полугидрохлорида карбоксиметоксиламина (430 мг, 2,0 ммоль) в пиридине (10,4 мл) добавляют гидрохлорид пиридина (791,7 мг, 6,851 ммоль, 7,0 эквив.) и затем реакционную смесь нагревают до 50°C. Через 67 ч реакционную смесь охлаждают до комнатной температуры и добавляют в H2O (100 мл). Водный слой экстрагируют EtOAc (2×100 мл), и объединенные органические слои промывают H2O (50 мл), сушат, фильтруют и концентрируют при пониженном давлении. Очистка хроматографией с обращенной фазой (15→100% MeCN/H2O) дает желаемый продукт (190 мг, 20%) в виде бесцветного рыхлого твердого вещества. ЖХМС (ИЭР) m/z: [M+Na] рассч. для C53H84N2O14: 995,58; найдено 995,7; [M-H] рассч. для C53H84N2O14: 971,58; найдено 972,0.
Мономер 8. 32(R)-метокси 26-аминооксиуксусная кислота 40(R)-[[(3-(4-метил-1-пиперазинил)пропил]карбамат]рапамицин.
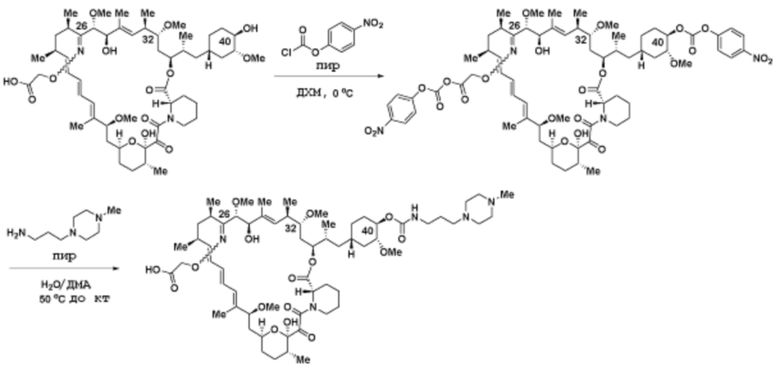
Стадия 1: Синтез 32(R)-метокси 26-(2-{[(4-нитрофенокси)карбонил]окси}-2-оксоэтокси)имино 40(R)-(4-нитрофенил)карбонатрапамицина
К раствору 32(R)-метокси 26-аминоуксусной кислоты рапамицина (300 мг, 0,299 ммоль, 1,0 эквив.) в ДХМ (10,6 мл) добавляют 4Å молекулярные сита (300 мг). Суспензию перемешивают в течение 1 ч и затем добавляют пиридин (239 мкл, 2,98 ммоль, 10,0 эквив.). Реакционную смесь охлаждают до 0°C и затем добавляют O-(4-нитрофенил)хлорформиат (153 мг, 0,897 ммоль, 3,0 эквив.). Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 2 ч, в этот момент растворитель удаляют при пониженном давлении с получением неочищенного белого твердого вещества, которое берут сразу на следующую стадию. ЖХМС (ИЭР) m/z: [M+H] рассч. для C68H92N4O23: 1333,63; найдено 1333,6.
Стадия 2: Синтез 32(R)-метокси 26-аминооксиуксусной кислоты 40(R)-[[(3-(4-метил-1-пиперазинил)пропил]карбамата] рапамицина
К раствору 32(R)-метокси 26-(2-{[(4-нитрофенокси)карбонил]окси}-2-оксоэтокси)имино 40(R)-(4-нитрофенил)карбонатрапамицина (0,270 г, 0,2024 ммоль, 1,0 эквив.) в ДМА (1,0 мл) добавляют пиридин (161 мкл, 2,02 ммоль, 10,0 эквив.) и H2O (1,09 мл, 60,7 ммоль, 300 эквив.). Реакционную смесь перемешивают при 50°C в течение 8 ч, в этот момент реакционную смесь охлаждают до комнатной температуры и перемешивают в течение еще 12 ч. К реакционной смеси затем добавляют 3-(4-метилпиперазин-1-ил)пропан-1-амин (63,6 мг, 0,4048 ммоль, 2,0 эквив.), и реакционную смесь перемешивают в течение 1 ч, в этот момент смесь очищают хроматографией с обращенной фазой (10→100% MeCN/H2O) с получением желаемого продукта в виде белого твердого вещества (17,0 мг, 7% выход). ЖХМС (ИЭР) m/z: [M+H] рассч. для C63H103N5O16: 1186,75; найдено 1186,8.
Общие методики и конкретные примеры
Общая методика 1: Сочетание карбоновой кислоты и амина, затем снятие защиты N-Boc.

Стадия 1:
К 0,1M раствору карбоновой кислоты (1,0 эквив.) в ДМА добавляют амин (1,2 эквив.), ДИПЭА (4,0 эквив.) и PyBOP (1,3 эквив.). Реакционную смесь перемешивают до потребления карбоновой кислоты, по данным ЖХМС. Реакционную смесь затем очищают хроматографией на силикагеле с получением продукта.
Стадия 2:
К 0,03M раствору N-Boc защищенного амина (1,0 эквив.) в диоксане добавляют HCl (4M в диоксане, 10 эквив.). Реакционную смесь перемешивают до потребления N-Boc защищенного амина, по данным ЖХМС. Затем реакционную смесь концентрируют при пониженном давлении, и полученное масло подвергают азеотропной перегонке с ДХМ с получением продукта.
Промежуточное соединение A1-1. гидрохлорид 1-амино-N-{4-[4-амино-3-(2-амино-1,3-бензоксазол-5-ил)-1H-2λ⁴-пиразоло[3,4-d]пиримидин-2-ил]бутил}-3,6,9,12,15,18,21,24-октаоксагептакозан-27-амида
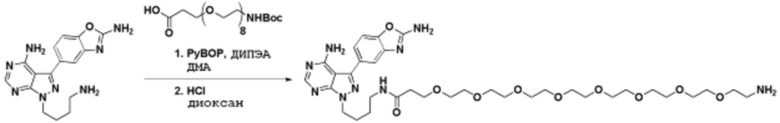
Стадия 1: Синтез трет-бутил N-[26-({4-[4-амино-3-(2-амино-1,3-бензоксазол-5-ил)-1H-2λ⁴-пиразоло[3,4-d]пиримидин-2-ил]бутил}карбамоил)-3,6,9,12,15,18,21,24-октаоксагексакозан-1-ил]карбамата
К раствору 1-{[(трет-бутокси)карбонил]амино}-3,6,9,12,15,18,21,24-октаоксагептакозан-27-овой кислоты (250 мг, 0,4615 ммоль, 1,0 эквив.) и 5-(4-амино-1-(4-аминобутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амина, соли трифторуксусной кислоты (375 мг, 0,8307 ммоль, 1,8 эквив.) в ДМА (4,61 мл) добавляют ДИПЭА (239 мкл, 1,38 ммоль, 3,0 эквив.), затем PyBOP (312 мг, 0,599 ммоль, 1,3 эквив.). Гомогенную реакционную смесь перемешивают при комнатной температуре. Через 3 ч неочищенный реакционный раствор очищают препаративной ВЭЖХ (10→99% MeCN/H2O) с получением продукта (127 мг, 31% выход) в виде розового твердого вещества. ЖХМС (ИЭР) m/z: [M+H] рассч. для C40H63N9O12: 862,47; найдено 862,3.
Стадия 2: Синтез гидрохлорида 1-амино-N-{4-[4-амино-3-(2-амино-1,3-бензоксазол-5-ил)-1H-2λ⁴-пиразоло[3,4-d]пиримидин-2-ил]бутил}-3,6,9,12,15,18,21,24-октаоксагептакозан-27-амида
К раствору трет-бутил N-[26-({4-[4-амино-3-(2-амино-1,3-бензоксазол-5-ил)-1H-2λ⁴-пиразоло[3,4-d]пиримидин-2-ил]бутил}карбамоил)-3,6,9,12,15,18,21,24-октагексакозан-1-ил]карбамата (124 мг, 0,1436 ммоль, 1,0 эквив.) в диоксане (2 мл) добавляют 4N HCl в диоксане (2 мл). Гетерогенный раствор энергично перемешивают в течение 2 ч, в этот момент реакционную смесь концентрируют при пониженном давлении. Продукт растворяют в H2O и лиофилизируют с получением продукта (132 мг, 115%) в виде светло-розовой камеди. ЖХМС (ИЭР) m/z: [M+H] рассч. для C35H55N9O10: 762,42; найдено 762,3.
Используя общую методику 1, но с применением подходящего аминсодержащего ингибитора активного сайта в таблице 2 и ПЭГ карбоновой кислоты, получают промежуточные соединения A1 в таблице 5:
Таблица 5. Дополнительные полученные амины
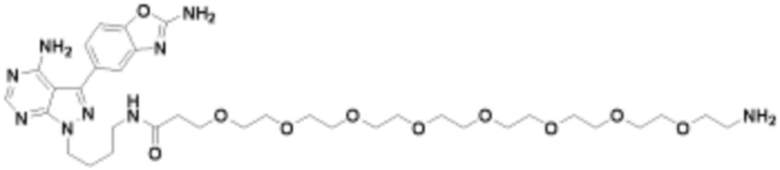
Промежуточное соединение A1-1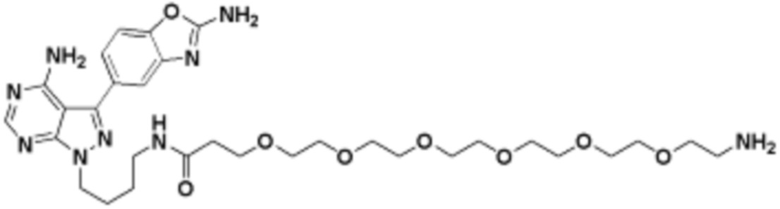
Промежуточное соединение A1-2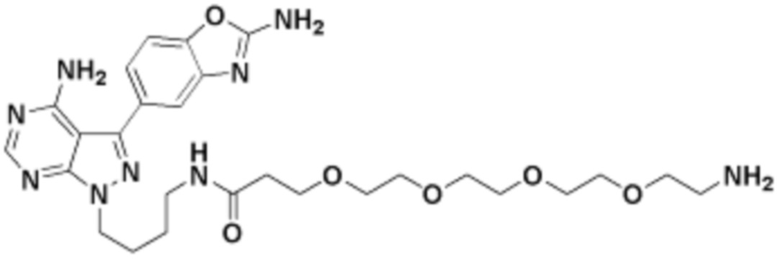
Промежуточное соединение A1-3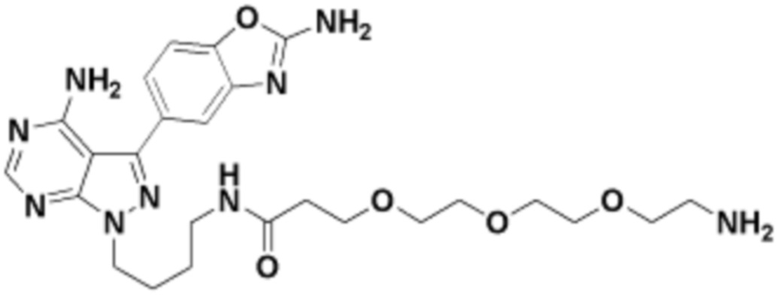
Промежуточное соединение A1-4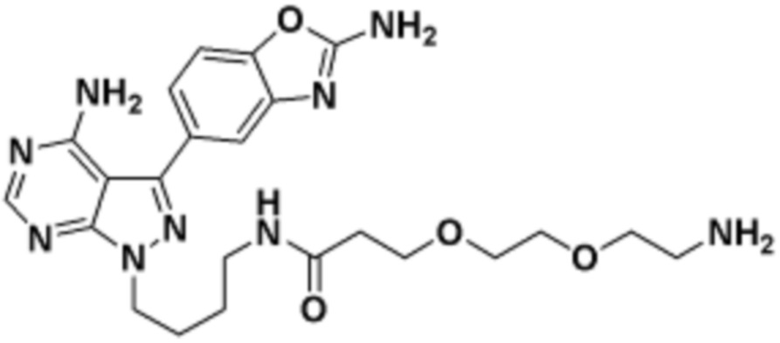
Промежуточное соединение A1-5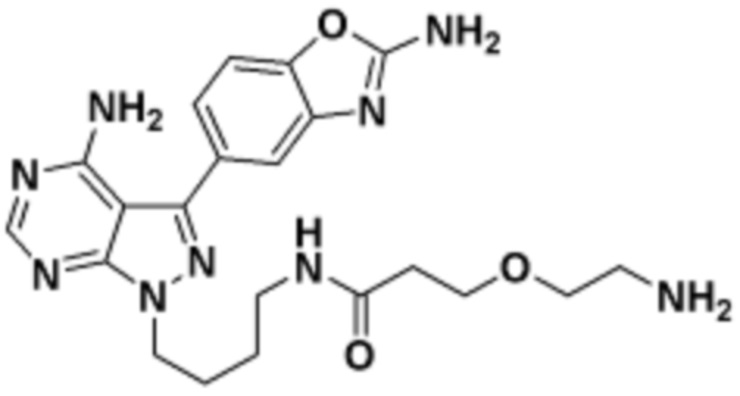
Промежуточное соединение A1-6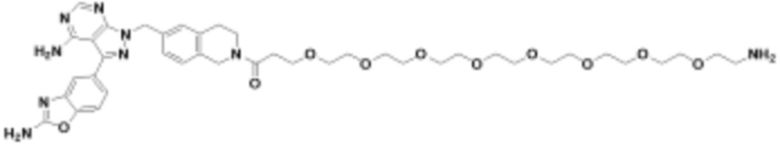
Промежуточное соединение A1-7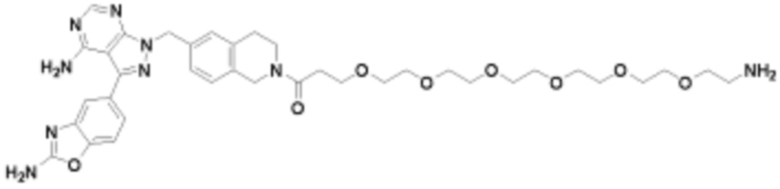
Промежуточное соединение A1-8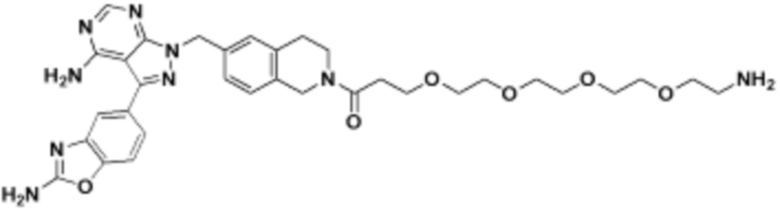
Промежуточное соединение A1-9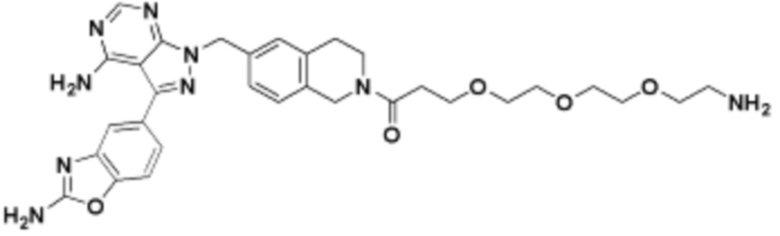
Промежуточное соединение A1-10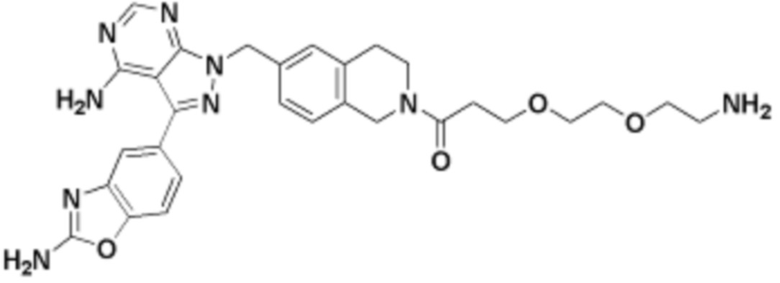
Промежуточное соединение A1-11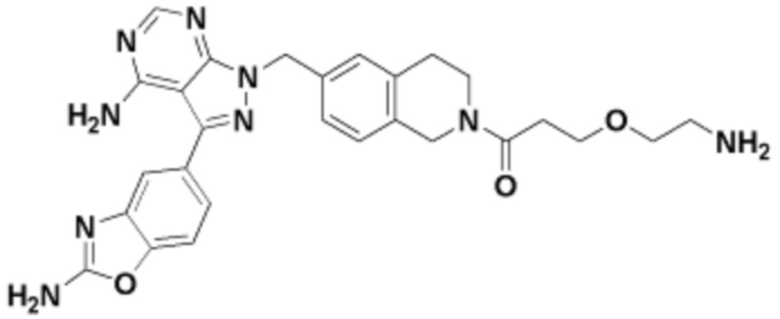
Промежуточное соединение A1-12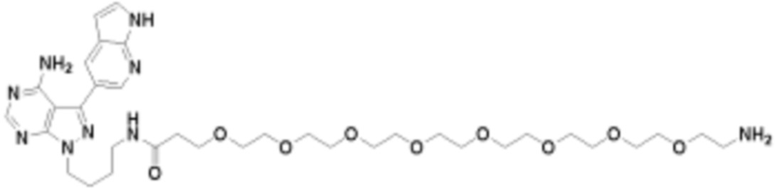
Промежуточное соединение A1-13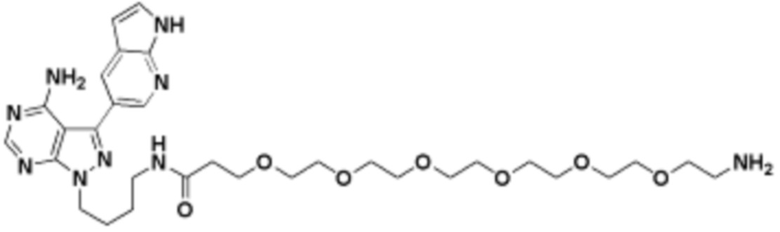
Промежуточное соединение A1-14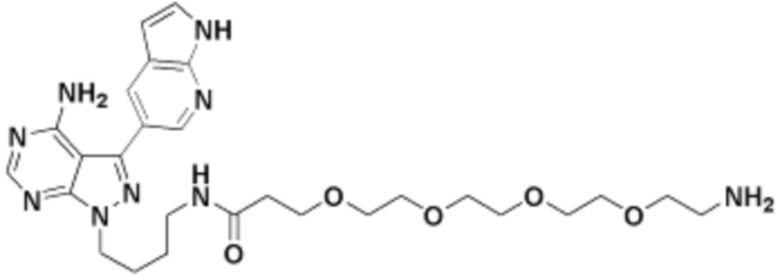
Промежуточное соединение A1-15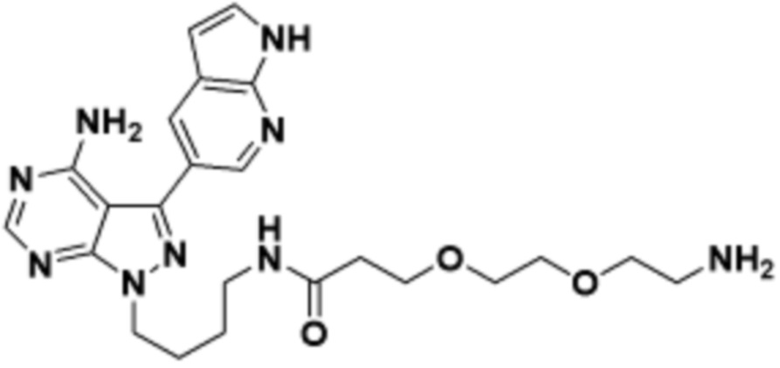
Промежуточное соединение A1-16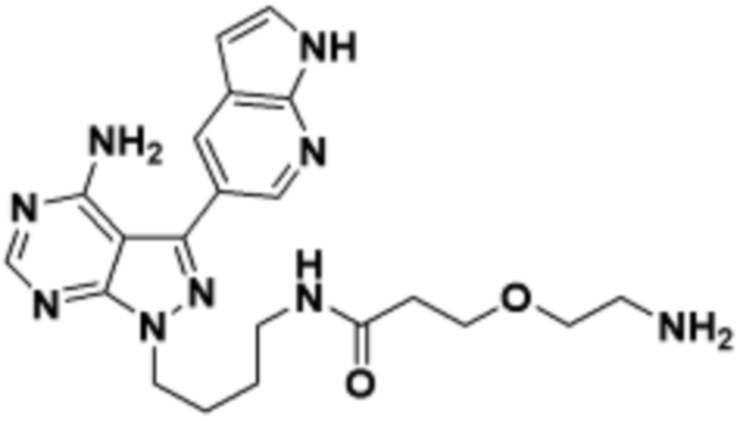
Промежуточное соединение A1-17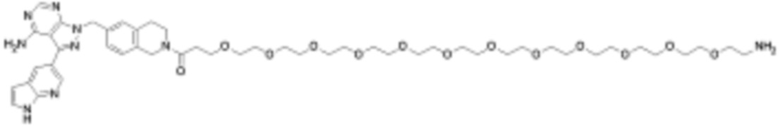
Промежуточное соединение A1-18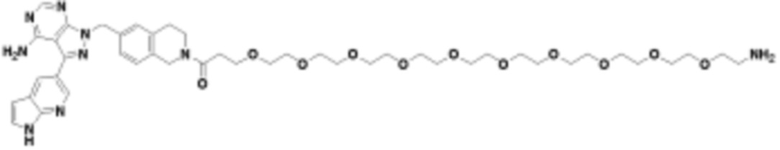
Промежуточное соединение A1-19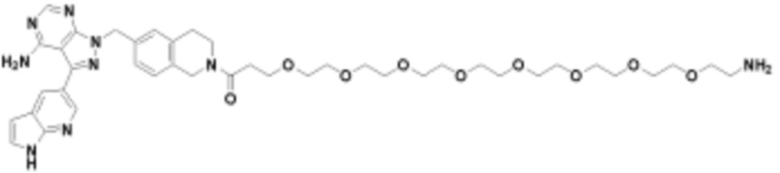
Промежуточное соединение A1-20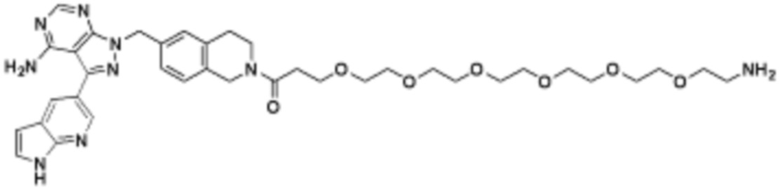
Промежуточное соединение A1-21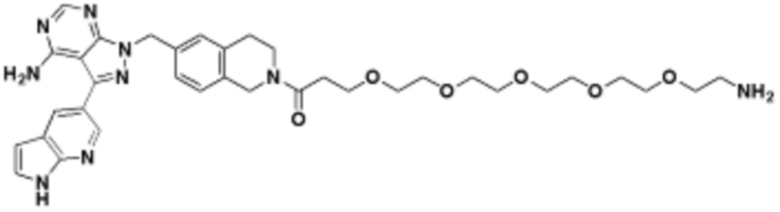
Промежуточное соединение A1-22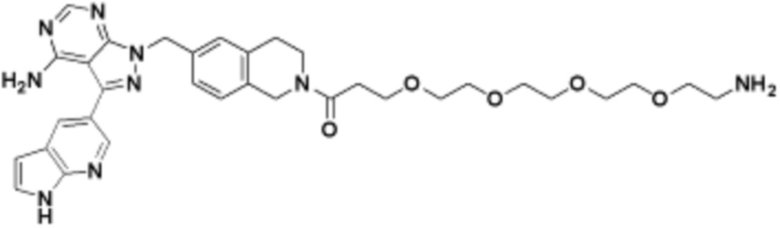
Промежуточное соединение A1-23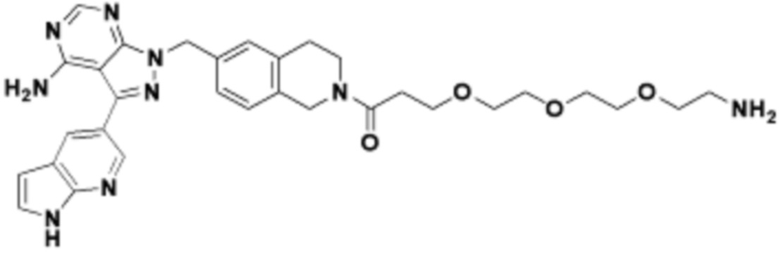
Промежуточное соединение A1-24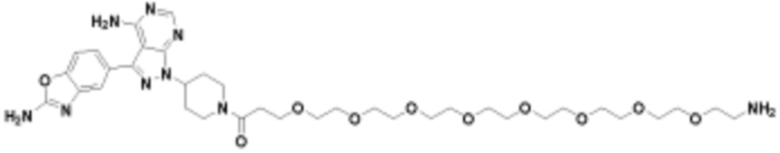
Промежуточное соединение A1-25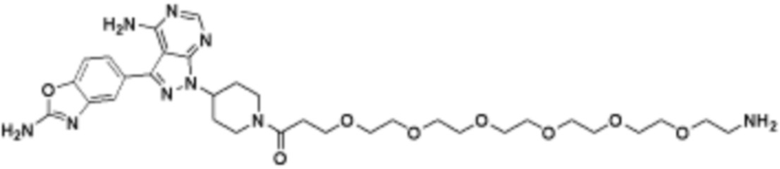
Промежуточное соединение A1-26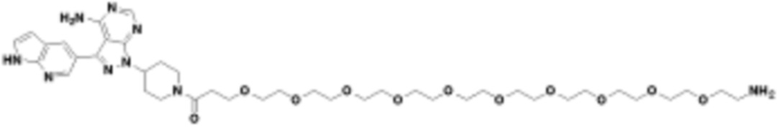
Промежуточное соединение A1-27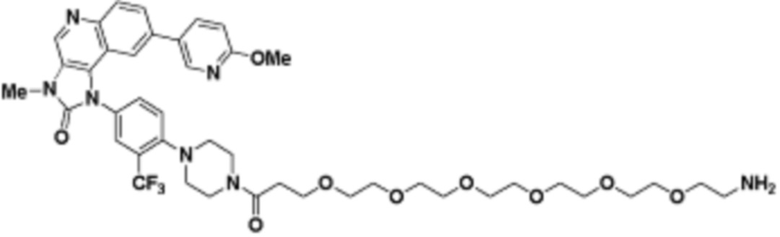
Промежуточное соединение A1-28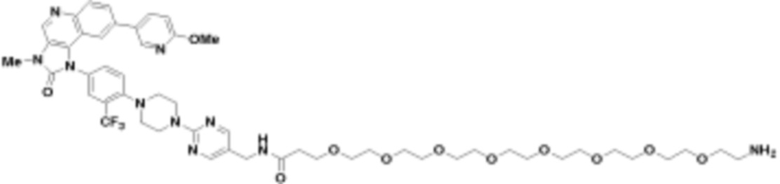
Промежуточное соединение A1-29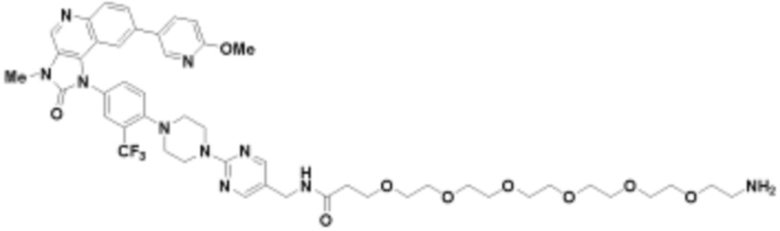
Промежуточное соединение A1-30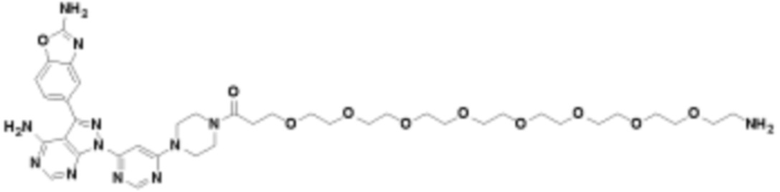
Промежуточное соединение A1-31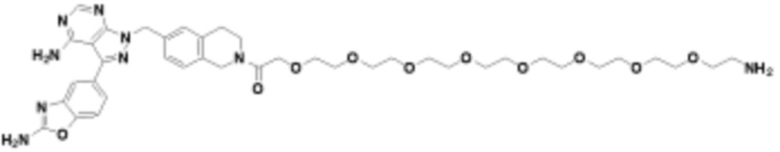
Промежуточное соединение A1-32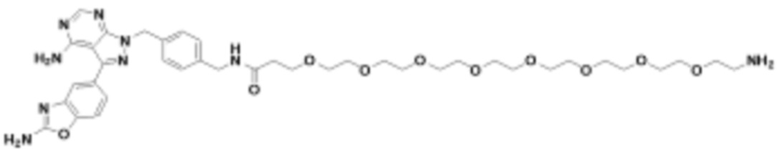
Промежуточное соединение A1-33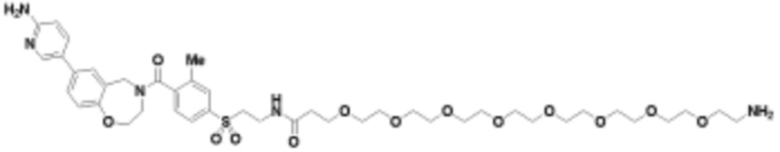
Промежуточное соединение A1-34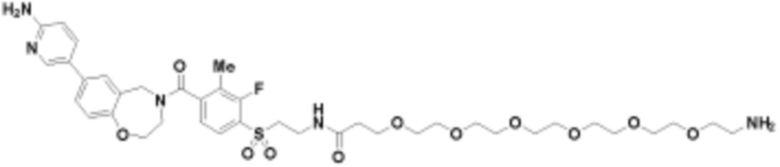
Промежуточное соединение A1-35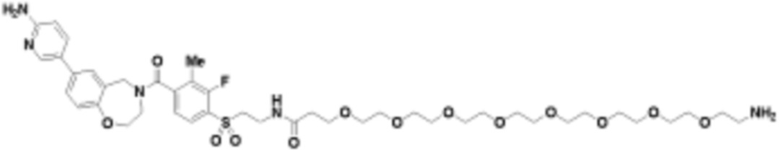
Промежуточное соединение A1-36
Промежуточное соединение A1-37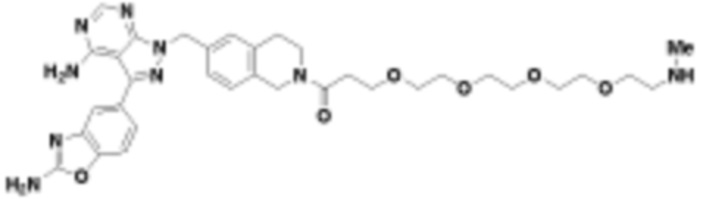
Промежуточное соединение A1-38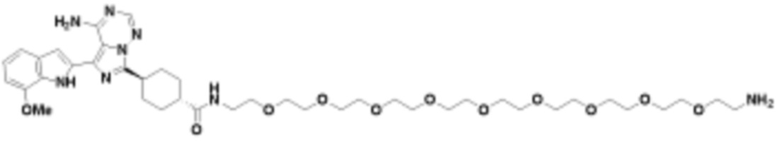
Промежуточное соединение A1-39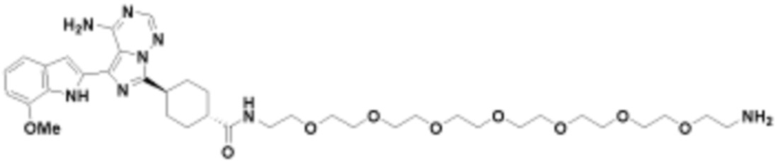
Промежуточное соединение A1-40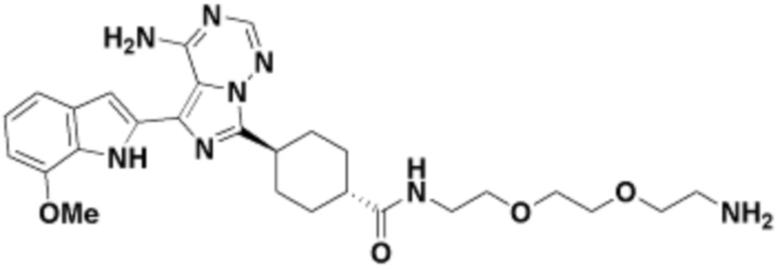
Промежуточное соединение A1-41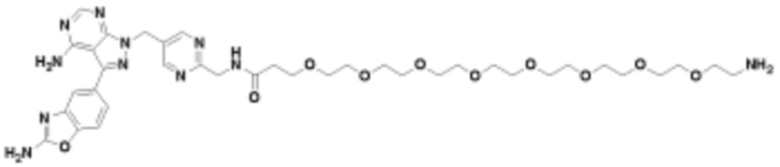
Промежуточное соединение A1-42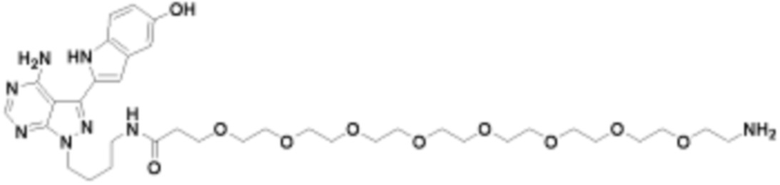
Промежуточное соединение A1-43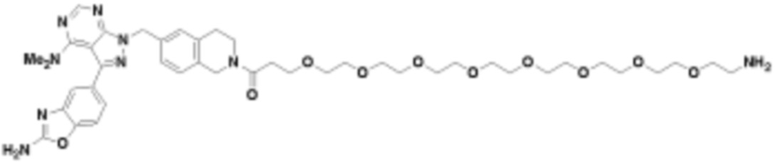
Промежуточное соединение A1-44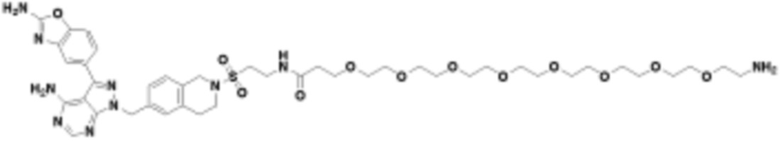
Промежуточное соединение A1-45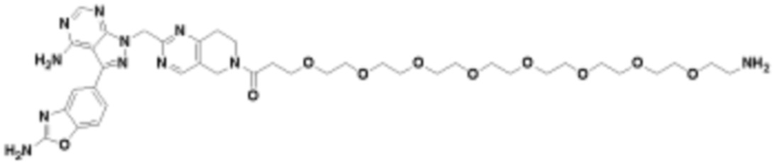
Промежуточное соединение A1-46
Согласно общей методике 1, но заменяя подходящее Промежуточное соединение A1 в таблице 5 и ПЭГ карбоновую кислоту, получают Промежуточные соединения A2 в таблице 6:
Таблица 6. Дополнительные полученные амины
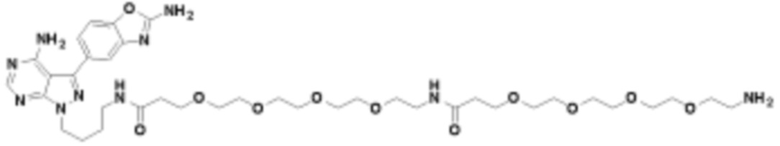
Промежуточное соединение A2-1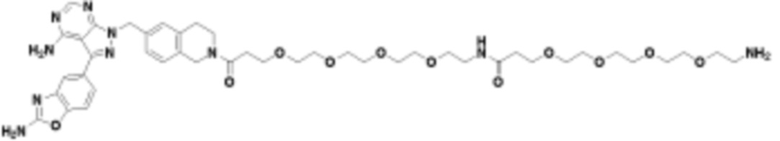
Промежуточное соединение A2-2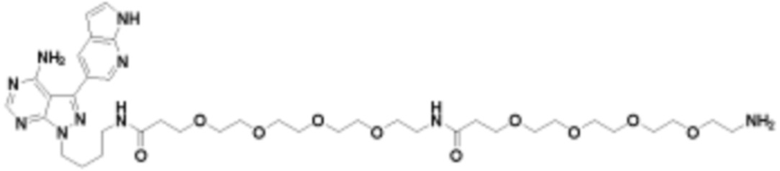
Промежуточное соединение A2-3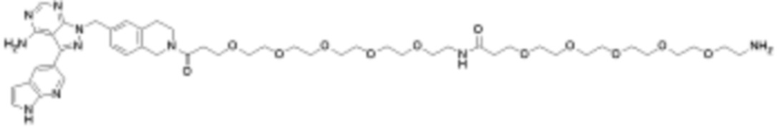
Промежуточное соединение A2-4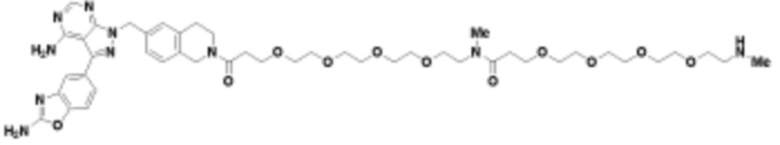
Промежуточное соединение A2-5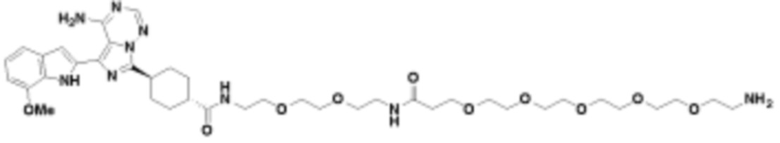
Промежуточное соединение A2-6
Общая методика 2: Сочетание содержащего мономер карбоновой кислоты рапамицина и ингибитора активного сайта, содержащего промежуточное соединение, имеющее первичный или вторичный амин.
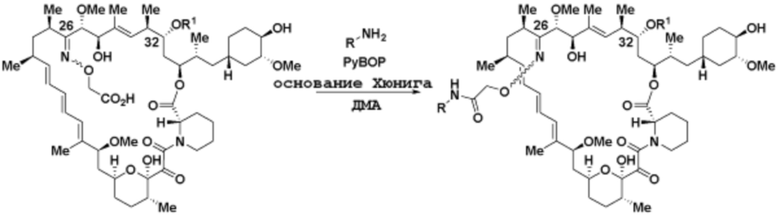
К 0,05M раствору содержащего мономер карбоновой кислоты рапамицина (1,0 эквив.) и ингибитора активного сайта, содержащего промежуточное соединение (1,5 эквив.) в ДМА добавляют ДИПЭА (5,0 эквив.). Полученный раствор перемешивают при комнатной температуре под азотом. После завершения по данным ЖХМС анализа, неочищенную реакционную смесь очищают препаративной ВЭЖХ с получением продукта.
Пример 1: Синтез ряда 1 двухвалентного соединения рапамицина.
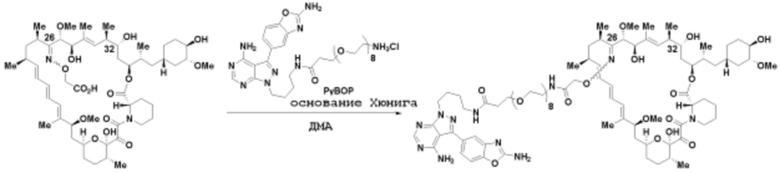
К раствору 32(R)-гидрокси 26-аминооксиуксусной кислоты рапамицина (28 мг, 28,30 мкмоль, 1,0 эквив.) и гидрохлорида 1-амино-N-{4-[4-амино-3-(2-амино-1,3-бензоксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил]бутил}-3,6,9,12,15,18,21,24-октаоксагептакозан-27-амида (33,8 мг, 42,33 мкмоль, 1,5 эквив.) в ДМА (566 мкл) добавляют ДИПЭА (24,5 мкл, 141,5 мкмоль, 5,0 эквив.), затем PyBOP (26,5 мг, 50,94 мкмоль, 1,8 эквив.). Полученный гомогенный раствор перемешивают при комнатной температуре. Через 5 ч неочищенную реакционную смесь очищают препаративной ВЭЖХ (40→99% MeCN/H2O) с получением продукта (21 мг, 42% выход) в виде рыхлого белого твердого вещества. ЖХМС (ИЭР) )m/z: [M+H] рассч. для C88H137N11O24: 1732,99; найдено 1732,9.
Следуя общей методике 2, но с применением подходящего содержащего карбоновую кислоту мономера рапамицина в таблице 1 и Промежуточных соединений A1 и A2 из таблиц 5 и 6, Ряд 1 двухвалентных аналогов в таблице 7 синтезируют:
Таблица 7. Ряд 1 двухвалентных соединения:

Пример 1
Пример 2
Пример 3
Пример 4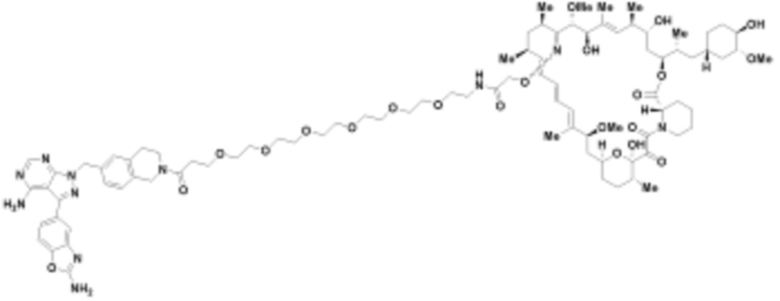
Пример 5 Пример 6
Пример 6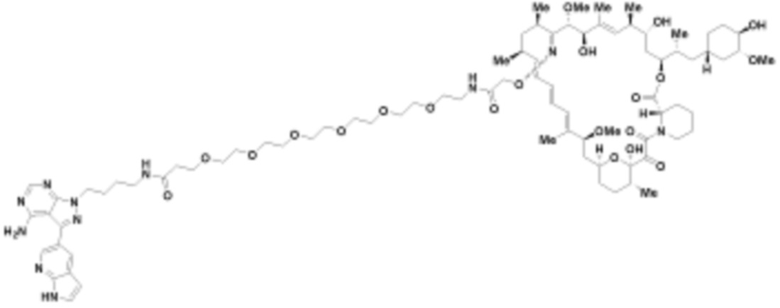
Пример 7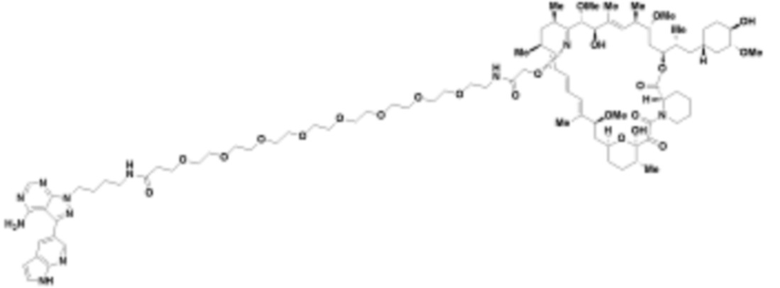 Пример 8
Пример 8
Пример 9
Пример 10
Пример 11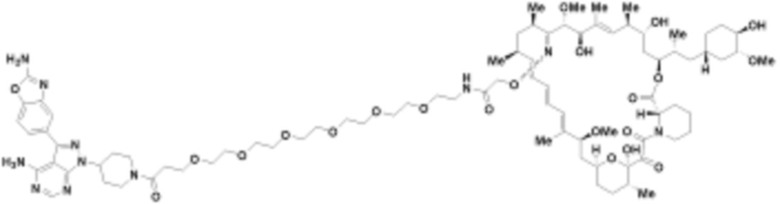
Пример 12
Пример 13
Пример 14
Пример 45
Пример 46
Пример 47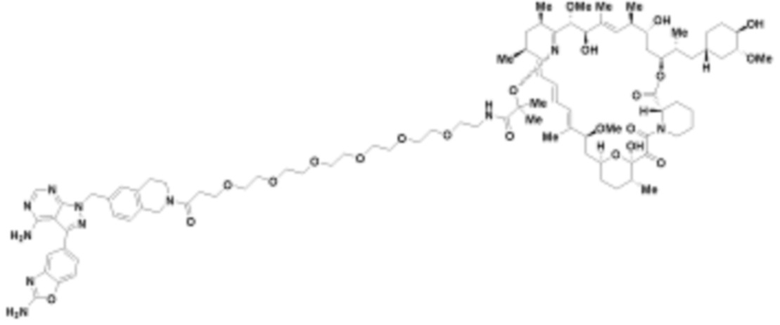
Пример 48
Пример 67
Общая методика 3: Сочетание сложного эфира ПЭГ, содержащего галогенид, и аминсодержащего пре-линкера с последующим снятием защиты со сложного эфира
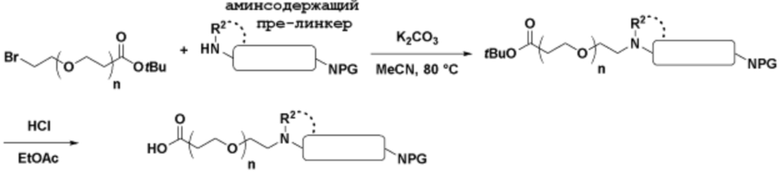
Стадия 1:
К 0,1M раствору аминсодержащего пре-линкера (1,0 эквив.) в MeCN добавляют K2CO3 (2,0 эквив.), затем сложный эфир ПЭГ, содержащий галогенид (1,0 эквив.). Реакционную смесь перемешивают при 80°C до потребления аминсодержащего пре-линкера, по данным ЖХМС анализа. Реакционную смесь затем очищают хроматографией на силикагеле с получением продукта.
Стадия 2:
К 0,1M раствору трет-бутилового эфира ПЭГ (1,0 эквив.) в E-Ac добавляют раствор HCl в E-Ac. Полученную суспензию перемешивают при комнатной температуре до потребления сложного эфира ПЭГ, по данным ЖХМС анализа. Реакционную смесь затем концентрируют при пониженном давлении с получением продукта.
Промежуточное соединение B1-1. 1-(4-(5-((1,3-диоксоизоиндолин-2-ил)метил)пиримидин-2-ил)пиперазин-1-ил)-3,6,9,12-тетраоксапентадекан-15-овая кислота
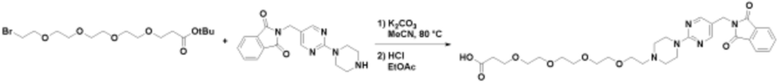
Стадия 1: Синтез трет-бутил 1-(4-(5-((1,3-диоксоизоиндолин-2-ил)метил)пиримидин-2-ил)пиперазин-1-ил)-3,6,9,12-тетраоксапентадекан-15-оата
К смеси 2-((2-(пиперазин-1-ил)пиримидин-5-ил)метил)изоиндолин-1,3-диона (7,97 г, 24,66 ммоль, 1,0 эквив.) в MeCN (200 мл) добавляют K2CO3 (6,82 г, 49,31 ммоль, 2,0 эквив.) затем трет-бутил 1-бром-3,6,9,12-тетраоксапентадекан-15-оат (9,5 г, 24,66 ммоль, 1,0 эквив.). Реакционную смесь нагревают до 85°C и перемешивают в течение 15 ч. Смесь затем охлаждают при комнатной температуре и фильтруют. Фильтрат концентрируют при пониженном давлении, и остаток очищают хроматографией на силикагеле (0→20% E-Ac/MeOH) с получением продукта (11,5 г, 74,3% выход) в виде светло-желтой жидкости.
Стадия 2: Синтез 1-(4-(5-((1,3-диоксоизоиндолин-2-ил)метил)пиримидин-2-ил)пиперазин-1-ил)-3,6,9,12-тетраоксапентадекан-15-овой кислоты
К раствору трет-бутил 1-(4-(5-((1,3-диоксоизоиндолин-2-ил)метил)пиримидин-2-ил)пиперазин-1-ил)-3,6,9,12-тетраоксапентадекан-15-оата (3,5 г, 5,58 ммоль, 1,0 эквив.) в E-Ac (50 мл) добавляют раствор HCl в E-Ac (500 мл). Смесь перемешивают при комнатной температуре в течение 3 ч. Смесь затем концентрируют при пониженном давлении с получением продукта (5,3 г, 78,2% выход, HCl) в виде белого твердого вещества. ЖХМС(ИЭР) m/z: [M+H] рассч. для C28H37N5O8: 572,27; найдено 572,4.
Следуя общей методике 3, но с применением подходящего галогенида, содержащего ПЭГ и аминсодержащих пре-линкеров в таблице 4, получают Промежуточные соединения B1 в таблице 8:
Таблица 8. Полученные дополнительные защищенные амины.
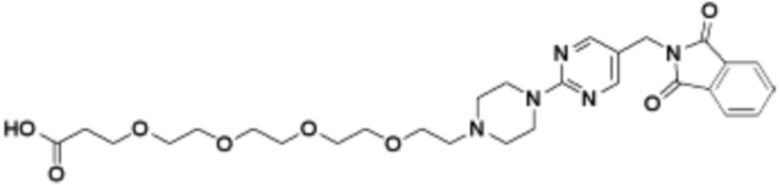
Промежуточное соединение B1-1
Общая методика 4: Сочетание ПЭГ карбоновой кислоты и аминсодержащего ингибитора активного сайта, затем снятие защиты амина.
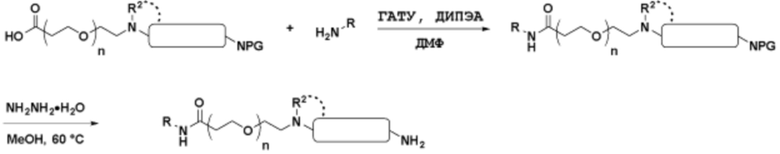
Стадия 1:
К 0,15M раствору ПЭГ карбоновой кислоты (1,0 эквив.) в ДМФ добавляют ГАТУ (1,3 эквив.) и ДИПЭА (5,0 эквив.). После перемешивания в течение 30 мин, добавляют аминсодержащий ингибитор активного сайта (1,2 эквив.). Реакционную смесь перемешивают при комнатной температуре до потребления ПЭГ карбоновой кислоты, по данным ЖХМС. Реакционную смесь затем очищают хроматографией с обращенной фазой с получением продукта.
Стадия 2:
К 0,1M раствору защищенного фталимидом амина (1,0 эквив.) в MeOH при 0°C добавляют NH2NH2•H2O (4,0 эквив.). Полученную смесь перемешивают при 60°C до потребления защищенного фталимидом амина, по данным ЖХМС анализа. Реакционную смесь затем очищают хроматографией с обращенной фазой с получением продукта.
Промежуточное соединение B2-1. N-(4-(4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)-1-(4-(5-(аминометил)пиримидин-2-ил)пиперазин-1-ил)-3,6,9,12-тетраоксапентадекан-15-амида
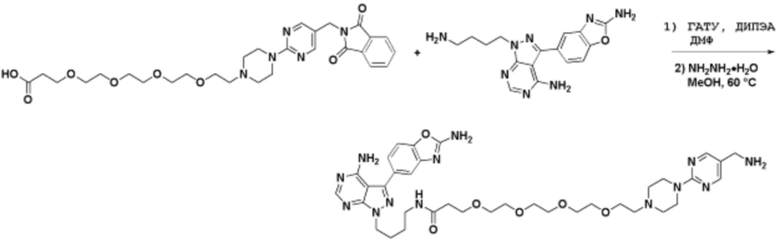
Стадия 1: Синтез N-(4-(4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)-1-(4-(5-((1,3-диоксоизоиндолин-2-ил)метил)пиримидин-2-ил)пиперазин-1-ил)-3,6,9,12-тетраоксапентадекан-15-амида
К смеси 1-(4-(5-((1,3-диоксоизоиндолин-2-ил)метил)пиримидин-2-ил)пиперазин-1-ил)-3,6,9,12-тетраоксапентадекан-15-овой кислоты (3 г, 4,93 ммоль, 1,0 эквив., HCl) в ДМФ (30 мл) добавляют ГАТУ (12,11 мкл, 6,41 ммоль, 1,3 эквив.) и ДИПЭА (4,30 мл, 24,67 ммоль, 5,0 эквив.). Через 30 мин добавляют 5-(4-амино-1-(4-аминобутил)-1H-пиразоло[3,4-d]пиримидин-3-ил)бензо[d]оксазол-2-амин (4,03 г, 5,92 ммоль, 1,2 эквив., 3 ТФК). Смесь перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь затем очищают преп-ВЭЖХ (MeCN/H2O) с получением продукта (5,4 г, 81,2% выход) в виде светло-красного твердого вещества. ЖХМС (ИЭР) m/z: [M+2H]/2 рассч. для C44H53N13O8: 446,71; найдено 447,0.
Стадия 2: Синтез N-(4-(4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)-1-(4-(5-(аминометил)пиримидин-2-ил)пиперазин-1-ил)-3,6,9,12-тетраоксапентадекан-15-амида
К смеси N-(4-(4-амино-3-(2-аминобензо[d]оксазол-5-ил)-1H-пиразоло[3,4-d]пиримидин-1-ил)бутил)-1-(4-(5-((1,3-диоксоизоиндолин-2-ил)метил)пиримидин-2-ил)пиперазин-1-ил)-3,6,9,12-тетраоксапентадекан-15-амида (4 г, 2,97 ммоль, 1,0 эквив., 4 ТФК) в MeOH (25 мл) при 0°C добавляют NH2NH2•H2O (588,63 мкл, 11,87 ммоль, 4,0 эквив.). Смесь перемешивают при 60°C в течение 2 ч. Смесь затем охлаждают при комнатной температуре и фильтруют, и фильтровальную лепешку промывают MeOH (5 мл). Фильтрат концентрируют при пониженном давлении, и остаток очищают преп-ВЭЖХ (MeCN/H2O) с получением продукта (700 мг, 24,5% выход) в виде белого твердого вещества. ЖХМС (ИЭР) m/z: [M+2H]/2 рассч. для C36H51N13O6: 381,71; найдено 381,8.
Следуя общей методике 4, но с применением подходящего Промежуточного соединения B1 в таблице 8 и аминсодержащих ингибиторов активного сайта в таблице 2, получают промежуточные соединения B2 в таблице 9:
Таблица 9. Полученные дополнительные амины
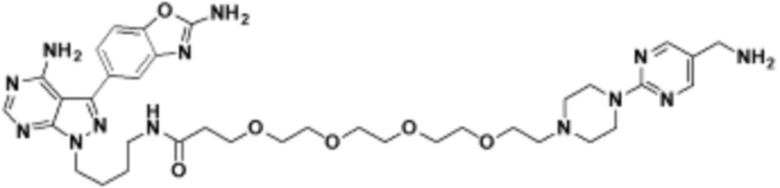
Промежуточное соединение B2-1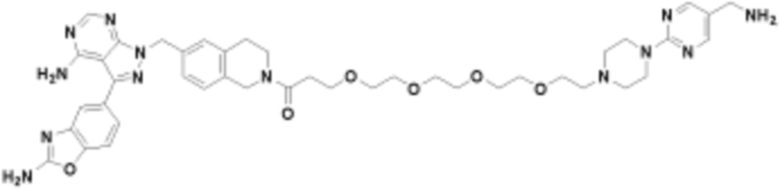
Промежуточное соединение B2-2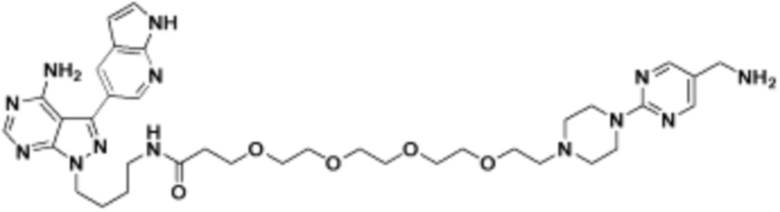
Промежуточное соединение B2-3
Общая методика 5: Сочетание содержащей галогенид ПЭГ карбоновой кислоты и аминсодержащего ингибитора активного сайта.

К 0,1M раствору аминсодержащего ингибитора активного сайта (1,0 эквив.) и карбоновой кислоты, содержащей ПЭГ (1,2 эквив.) в ДМА добавляют ДИПЭА (4,0 эквив.) затем PyBOP (1,3 эквив.). Реакционную смесь перемешивают до потребления аминсодержащего ингибитора активного сайта, по данным ЖХМС. Реакционную смесь затем очищают ВЭЖХ с обращенной фазой с получением продукта.
Промежуточное соединение B3-1. 18-{6-[(4-амино-3-{1H-пирроло[2,3-b]пиридин-5-ил}-1H-пиразоло[3,4-d]пиримидин-1-ил)метил]-1,2,3,4-тетрагидроизохинолин-2-ил}-1-бром-3,6,9,12,15-пентаоксаоктадекан-18-он
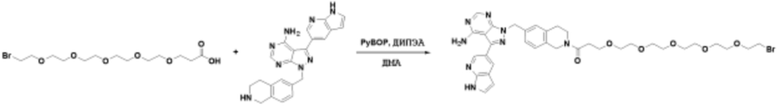
К раствору 1-бром-3,6,9,12,15-пентаоксаоктадекан-18-овой кислоты (105 мг, 282 мкмоль, 1,2 эквив.) и 3-{1H-пирроло[2,3-b]пиридин-5-ил}-1-[(1,2,3,4-тетрагидроизохинолин-6-ил)метил]-1H-пиразоло[3,4-d]пиримидин-4-амина (120 мг, 235 мкмоль, 1,0 эквив.) в ДМА (2,34 мл) добавляют ДИПЭА (163 мкл, 940 мкмоль, 4,0 эквив.), затем PyBOP (158 мг, 305 мкмоль, 1,3 эквив.). Полученный раствор перемешивают при комнатной температуре в течение 3 ч, затем очищают ВЭЖХ с обращенной фазой (10→98% MeCN+0,1% муравьиная кислота/H2O+0,1% муравьиная кислота) с получением продукта (82,7 мг, 47% выход). ЖХМС (ИЭР) m/z: [M+H] рассч. для C35H43BrN8O6: 751,26; найдено 751,2.
Следуя общей методике 5, но с применением подходящей содержащей галогенид ПЭГ карбоновой кислоты и аминсодержащих ингибиторов активного сайта в таблице 2, получают промежуточные соединения B3 в таблице 10:
Таблица 10. Дополнительные полученные ПЭГ галогениды
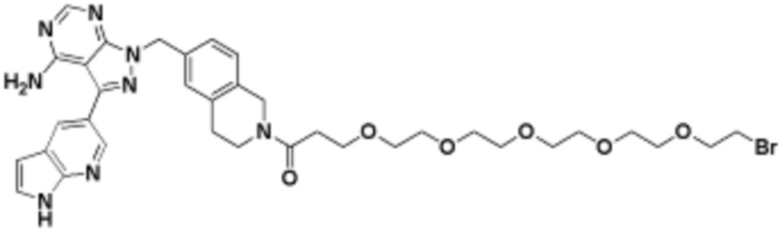
Промежуточное соединение B3-1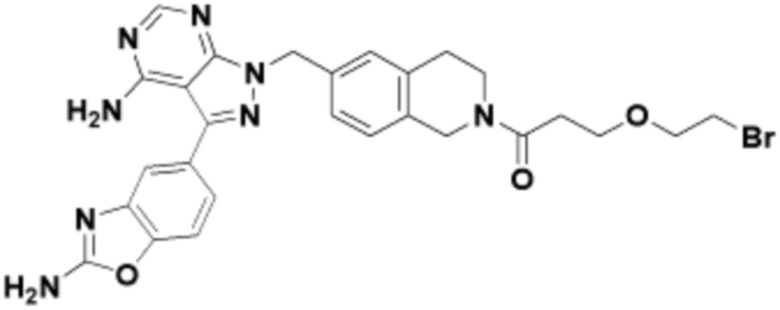
Промежуточное соединение B3-2
Общая методика 6: Замещение ПЭГ галогенида аминсодержащим пост-линкером и снятие защиты амина.
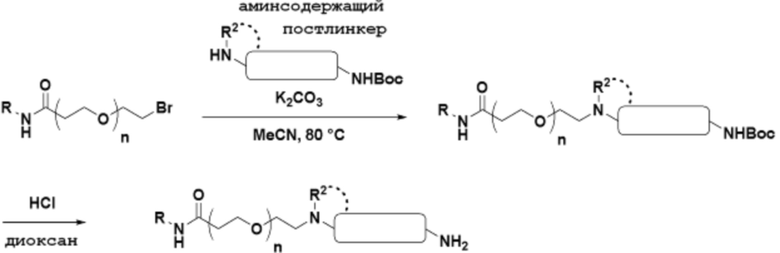
Стадия 1:
К 0,1M раствору галогенида, содержащего ПЭГ (1,0 эквив.) в MeCN добавляют K2CO3 (3,0 эквив.), затем аминсодержащий пост-линкер (1,2 эквив.). Полученную суспензию нагревают до 80°C и перемешивают до потребления ПЭГ галогенида, по данным ЖХМС анализа. Реакционную смесь охлаждают при комнатной температуре и затем очищают хроматографией на силикагеле с получением продукта.
Стадия 2:
К 0,07M раствору N-Boc замещенного амина (1,0 эквив.) в диоксане добавляют HCl (4M в диоксане, 10,0 эквив.). Реакционную смесь перемешивают до потребления N-Boc защищенного амина, по данным ЖХМС анализа. Реакционную смесь затем концентрируют при пониженном давлении с получением продукта.
Промежуточное соединение B2-4. 18-{6-[(4-амино-3-{1H-пирроло[2,3-b]пиридин-5-ил}-1H-пиразоло[3,4-d]пиримидин-1-ил)метил]-1,2,3,4-тетрагидроизохинолин-2-ил}-1-(4-{5H,6H,7H,8H-пиридо[4,3-d]пиримидин-2-ил}пиперазин-1-ил)-3,6,9,12,15-пентаоксаоктадекан-18-она
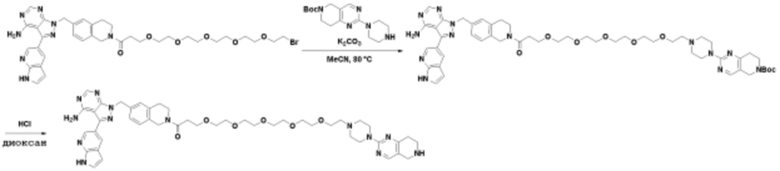
Стадия 1: Синтез трет-бутил 2-[4-(18-{6-[(4-амино-3-{1H-пирроло[2,3-b]пиридин-5-ил}-1H-пиразоло[3,4-d]пиримидин-1-ил)метил]-1,2,3,4-тетрагидроизохинолин-2-ил}-18-оксо-3,6,9,12,15-пентаоксаоктадекан-1-ил)пиперазин-1-ил]-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-6-карбоксилата
К суспензии 18-{6-[(4-амино-3-{1H-пирроло[2,3-b]пиридин-5-ил}-1H-пиразоло[3,4-d]пиримидин-1-ил)метил]-1,2,3,4-тетрагидроизохинолин-2-ил}-1-бром-3,6,9,12,15-пентаоксаоктадекан-18-она (82,7 мг, 110 мкмоль, 1,0 эквив.) в MeCN (1,09 мл) добавляют K2CO3 (45,6 мг, 330 мкмоль, 3,0 эквив.), затем трет-бутил 2-(пиперазин-1-ил)-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-6-карбоксилат (42,1 мг, 132 мкмоль, 1,2 эквив.). Полученную суспензию нагревают до 80°C в течение 8 ч, затем очищают хроматографией на силикагеле (0→20% MeOH/ДХМ) с получением продукта (75,1 мг, 70% выход). ЖХМС (ИЭР) m/z: [M+H] рассч. для C51H67N13O8: 990,53; найдено 990,5.
Стадия 2: Синтез 18-{6-[(4-амино-3-{1H-пирроло[2,3-b]пиридин-5-ил}-1H-пиразоло[3,4-d]пиримидин-1-ил)метил]-1,2,3,4-тетрагидроизохинолин-2-ил}-1-(4-{5H,6H,7H,8H-пиридо[4,3-d]пиримидин-2-ил}пиперазин-1-ил)-3,6,9,12,15-пентаоксаоктадекан-18-она
К раствору трет-бутил 2-[4-(18-{6-[(4-амино-3-{1H-пирроло[2,3-b]пиридин-5-ил}-1H-пиразоло[3,4-d]пиримидин-1-ил)метил]-1,2,3,4-тетрагидроизохинолин-2-ил}-18-оксо-3,6,9,12,15-пентаоксаоктадекан-1-ил)пиперазин-1-ил]-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-6-карбоксилата (75,1 мг, 75,8 мкмоль, 1,0 эквив.) в диоксане (1 мл) добавляют HCl (4M в диоксане, 472 мкл, 1,89 ммоль, 10,0 эквив.). Раствор перемешивают при комнатной температуре в течение 45 мин, затем концентрируют при пониженном давлении с получением продукта. ЖХМС (ИЭР) m/z: [M+Na] рассч. для C46H59N13O6: 912,46; найдено 912,5.
Следуя общей методике 6, но с применением подходящей ПЭГ карбоновой кислоты и аминсодержащих ингибиторов активного сайта в таблице 2, получают промежуточные соединения B2 в таблице 11:
Таблица 11. Дополнительные полученные амины
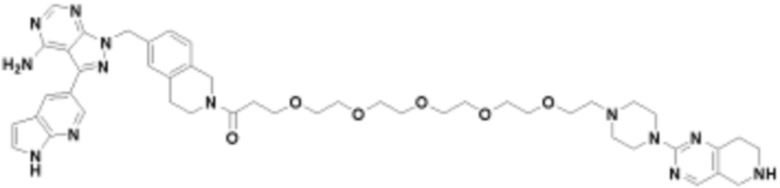
Промежуточное соединение B2-4
Следуя общей методике 1, но с применением подходящего трет-бутилового эфира ПЭГ карбоновой кислоты и аминсодержащих ингибиторов активного сайта в таблице 2, получают Промежуточные соединения B4 в таблице 12:
Таблица 12. Дополнительные полученные амины
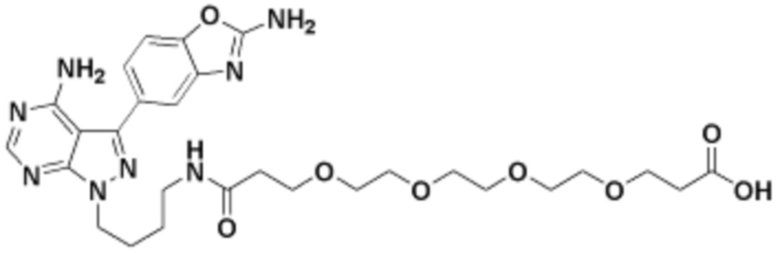
Промежуточное соединение B4-1
Следуя общей методике 1, но с применением подходящих Промежуточных соединений B4 в таблице 12 и аминсодержащих пре-линкеров в таблице 4, получают Промежуточные соединения B2 в таблице 13:
Таблица 13. Дополнительные полученные амины
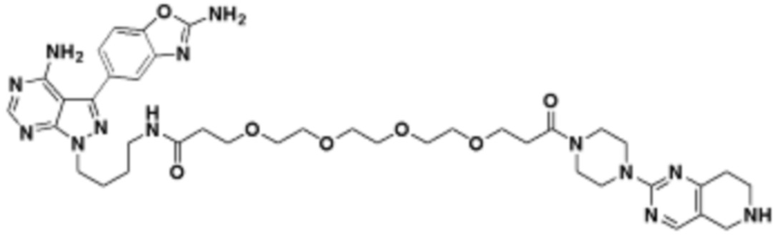
Промежуточное соединение B2-5
Следуя общей методике 1, но с применением подходящих Промежуточных соединений A1 и аминсодержащих пре-линкеров в таблице 4, получают Промежуточные соединения B2 в таблице 14:
Таблица 14. Дополнительные полученные амины
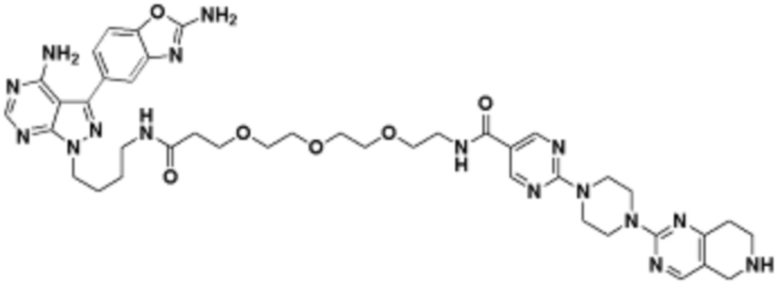
Промежуточное соединение B2-6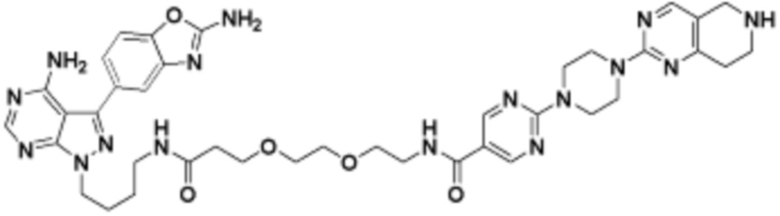
Промежуточное соединение B2-7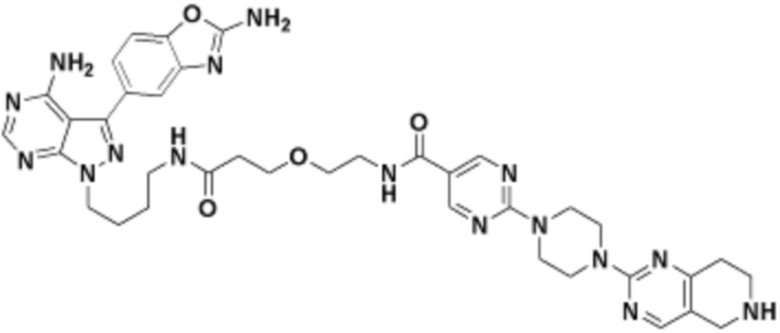
Промежуточное соединение B2-8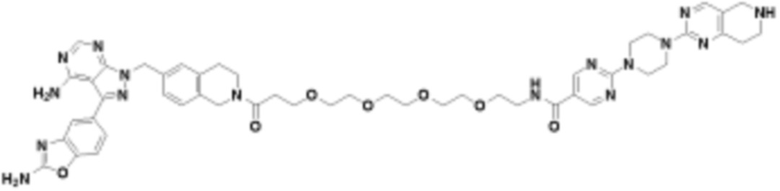
Промежуточное соединение B2-9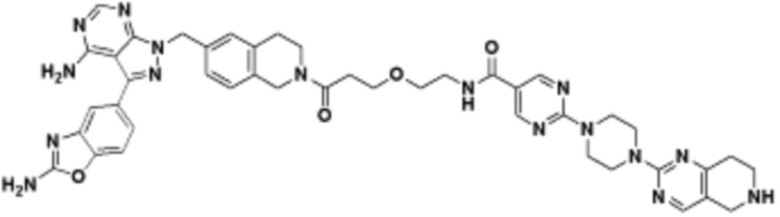
Промежуточное соединение B2-10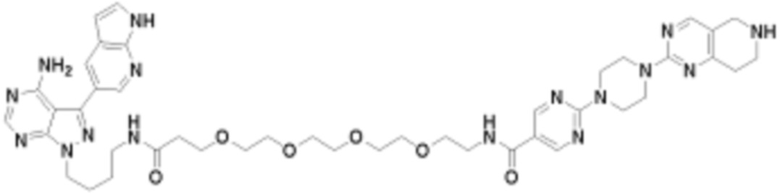
Промежуточное соединение B2-11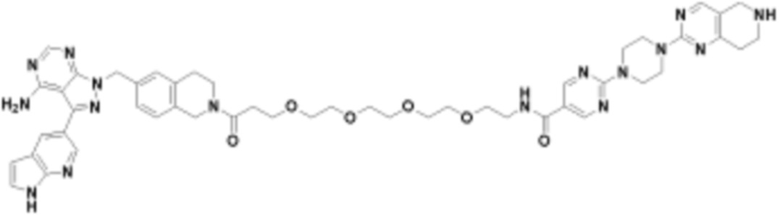
Промежуточное соединение B2-12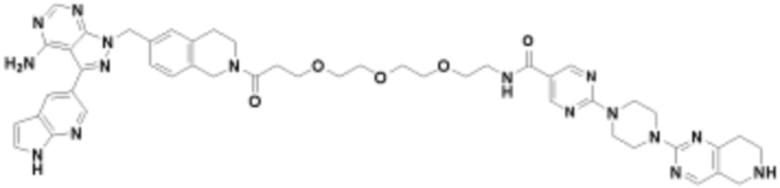
Промежуточное соединение B2-13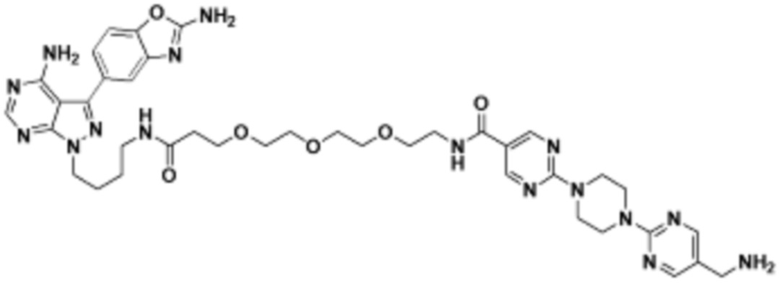
Промежуточное соединение B2-14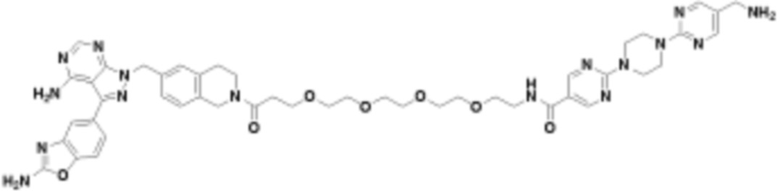
Промежуточное соединение B2-15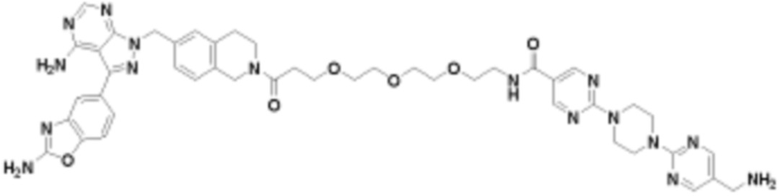
Промежуточное соединение B2-16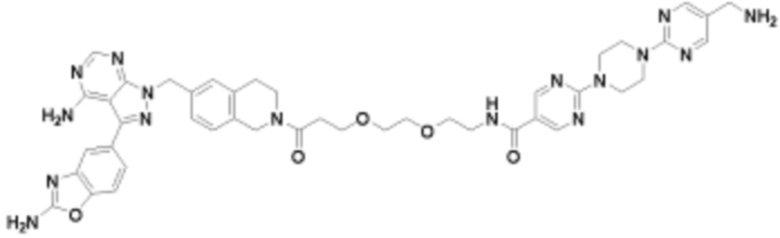
Промежуточное соединение B2-17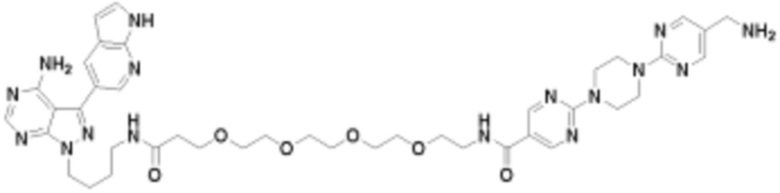
Промежуточное соединение B2-18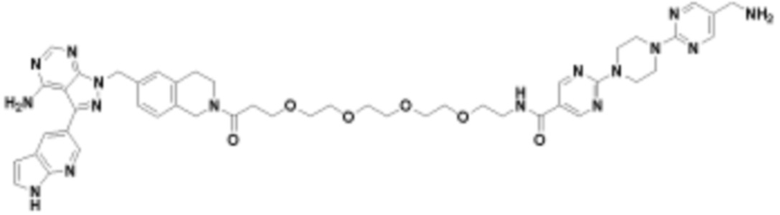
Промежуточное соединение B2-19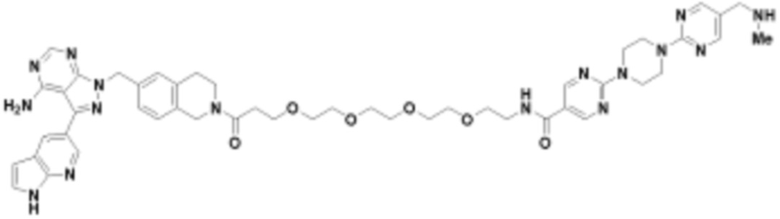
Промежуточное соединение B2-20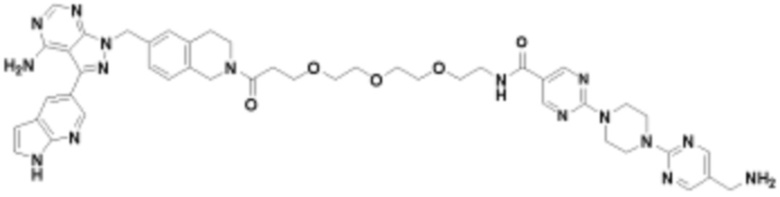
Промежуточное соединение B2-21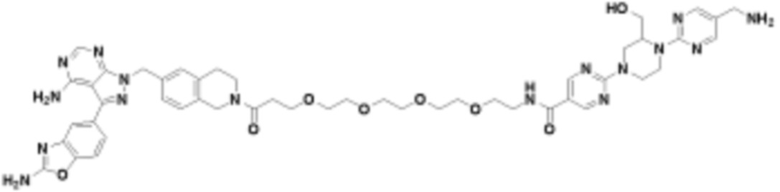
Промежуточное соединение B2-22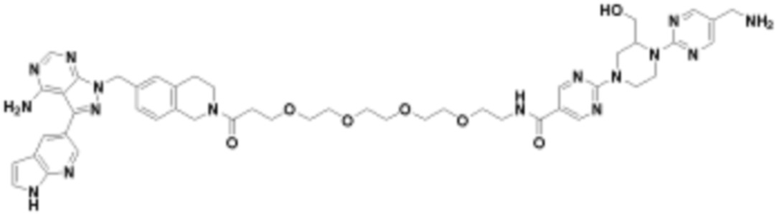
Промежуточное соединение B2-23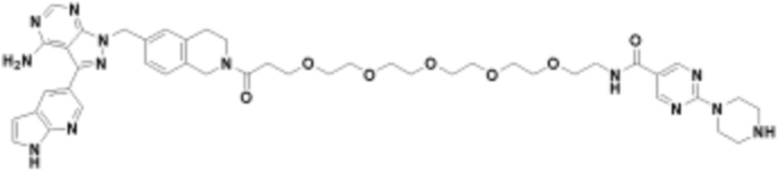
Промежуточное соединение B2-24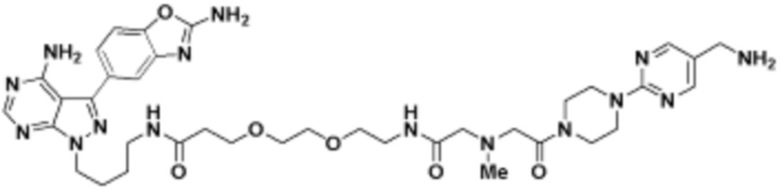
Промежуточное соединение B2-25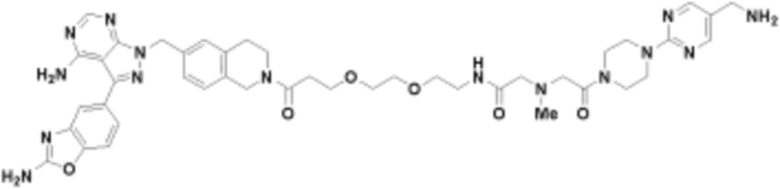
Промежуточное соединение B2-26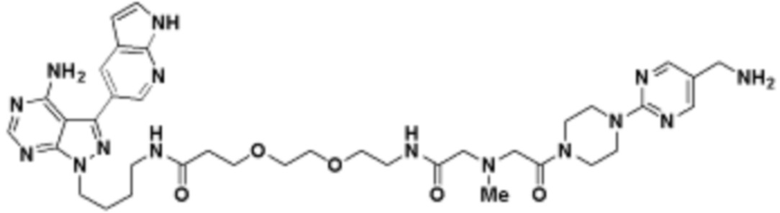
Промежуточное соединение B2-27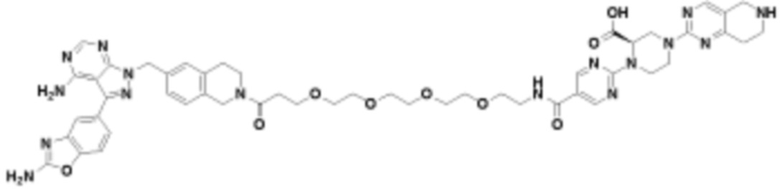
Промежуточное соединение B2-28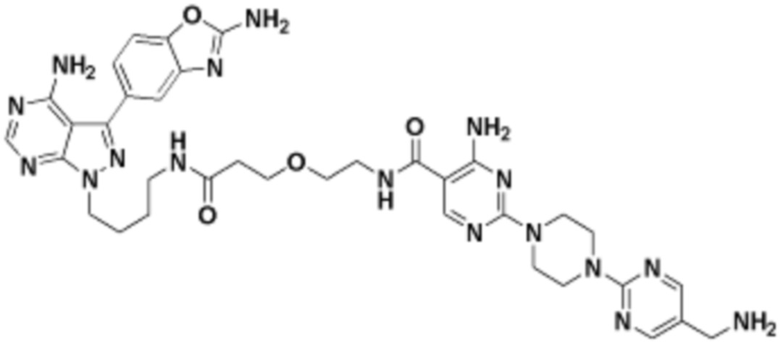
Промежуточное соединение B2-29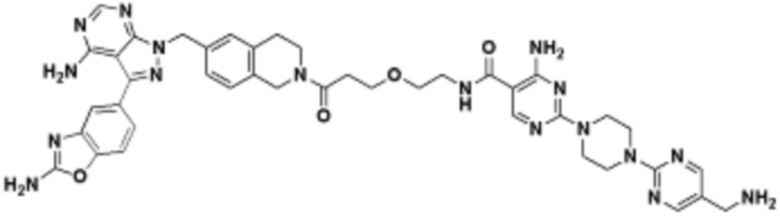
Промежуточное соединение B2-30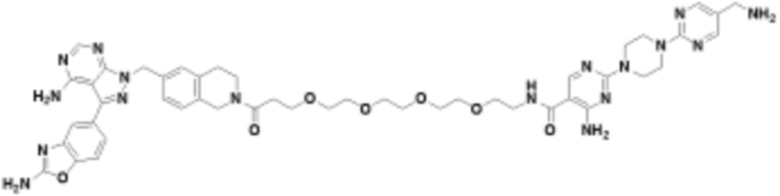
Промежуточное соединение B2-31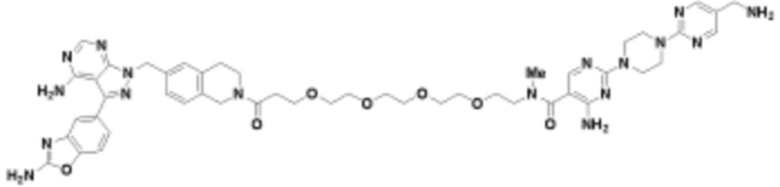
Промежуточное соединение B2-32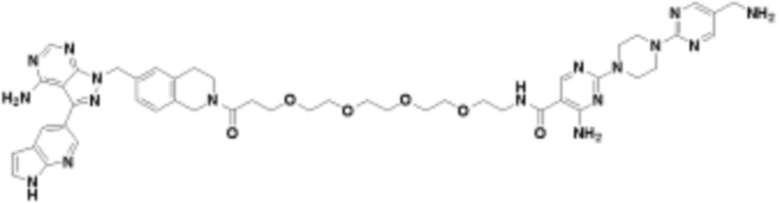
Промежуточное соединение B2-33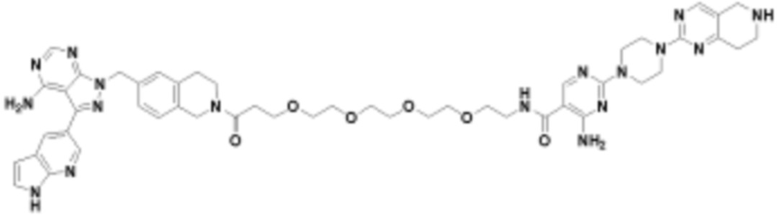
Промежуточное соединение B2-34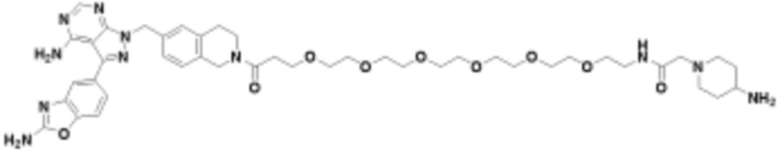
Промежуточное соединение B2-35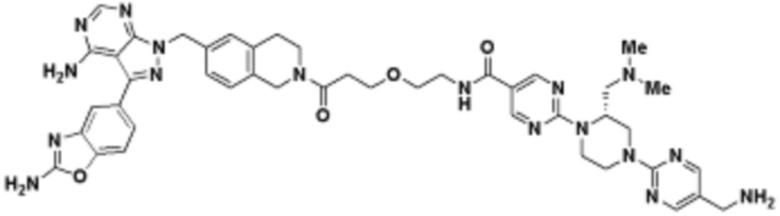
Промежуточное соединение B2-36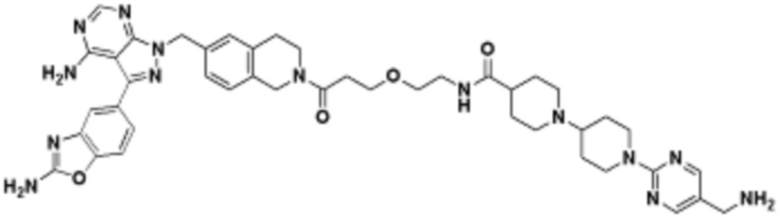
Промежуточное соединение B2-37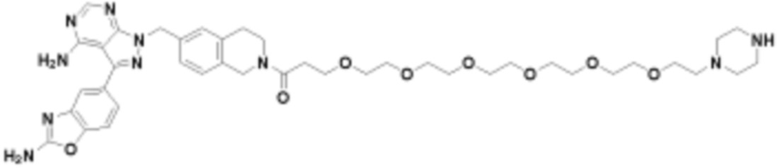
Промежуточное соединение B2-38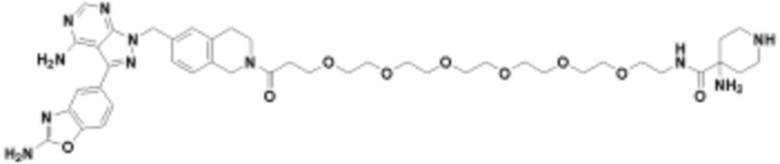
Промежуточное соединение B2-39
Следуя общей методике 2, но с применением подходящих рапамициновых мономеров, содержащих карбоновую кислоту, в таблице 1 и Промежуточных соединений B2 из таблиц 9, 11 и 13 и 14, синтезируют Ряд 2 двухвалентных аналогов в таблице 15:
Таблица 15. Ряд 2 двухвалентных соединений:
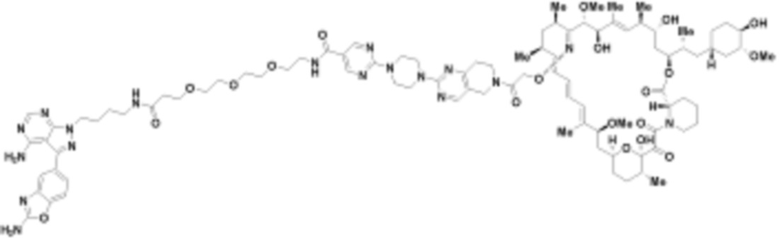
Пример 15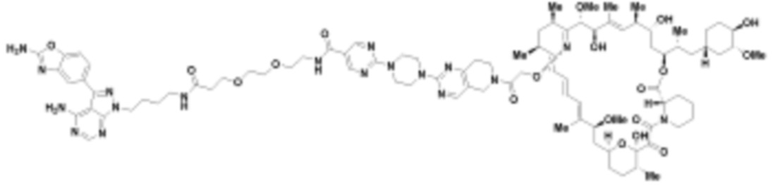
Пример 16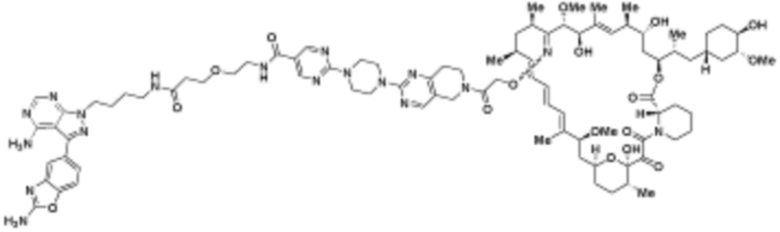 Пример 17
Пример 17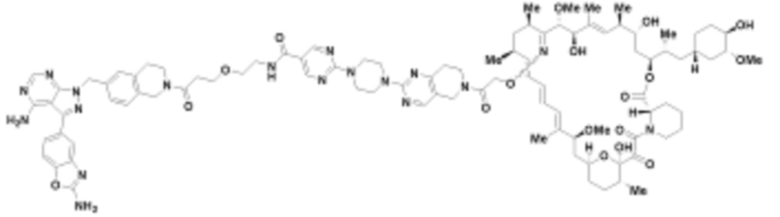 Пример 18
Пример 18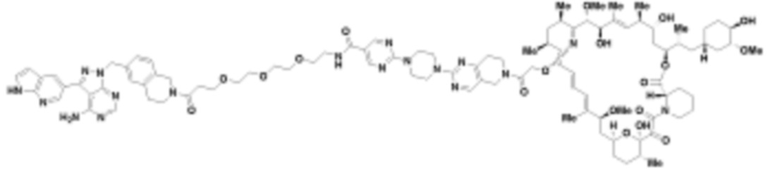
Пример 19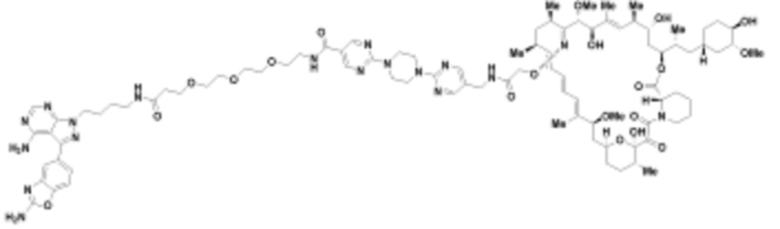
Пример 20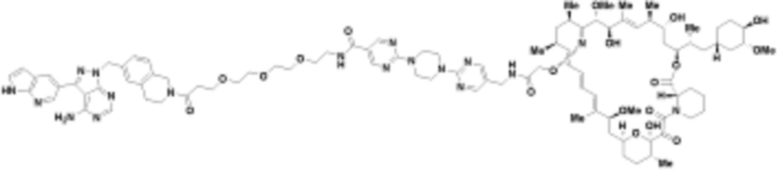
Пример 21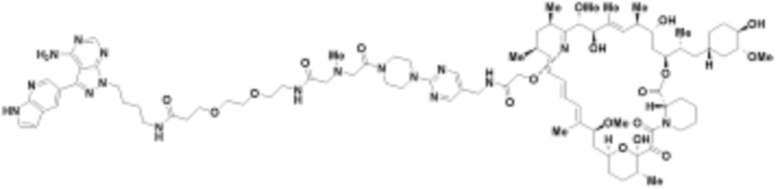
Пример 22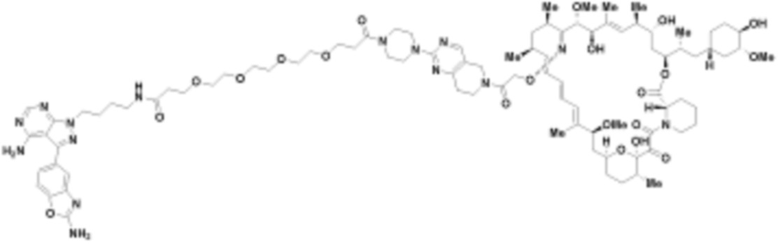
Пример 23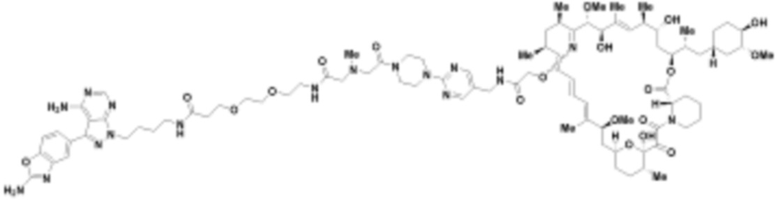
Пример 24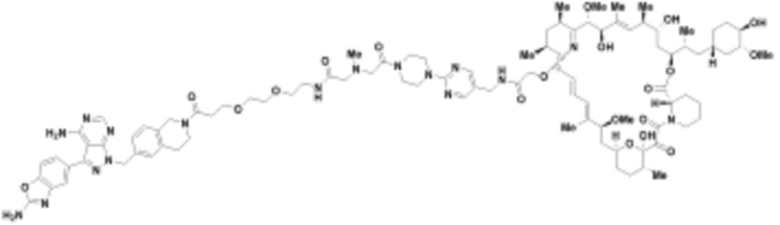
Пример 25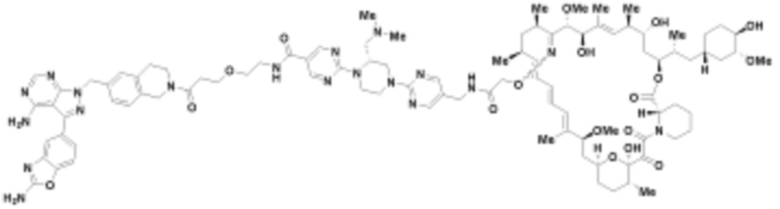
Пример 49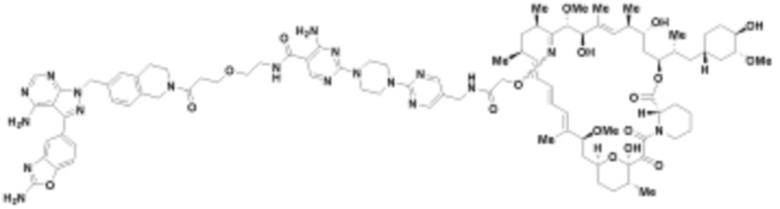
Пример 50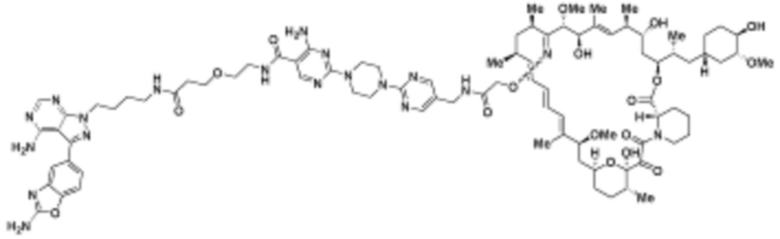
Пример 51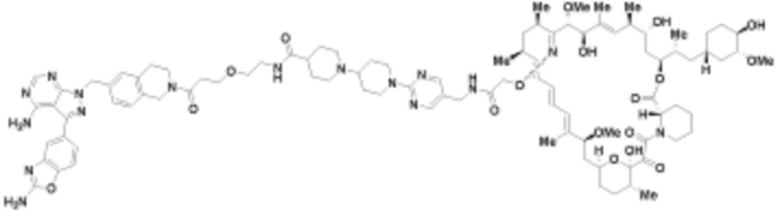
Пример 52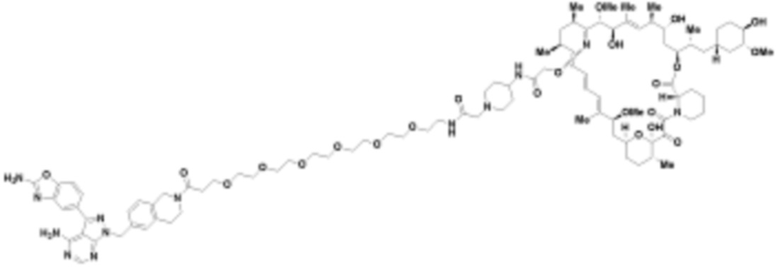
Пример 68
Следуя общей методике 1, но с применением подходящих аминсодержащих ингибиторов активного сайта в таблице 2 и аминсодержащих пре-линкеров в таблице 4, получают Промежуточные соединения C1 в таблице 16:
Таблица 16. Дополнительные полученные амины
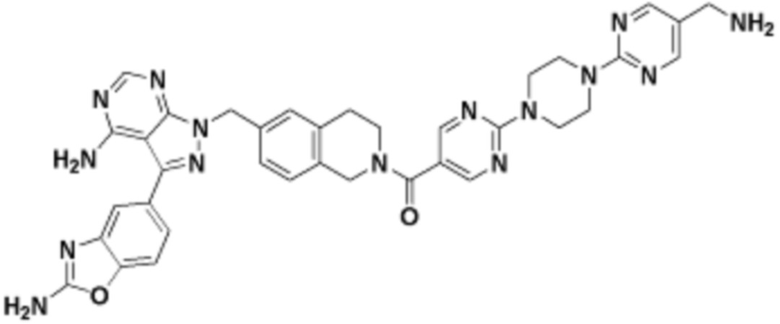
Промежуточное соединение C1-1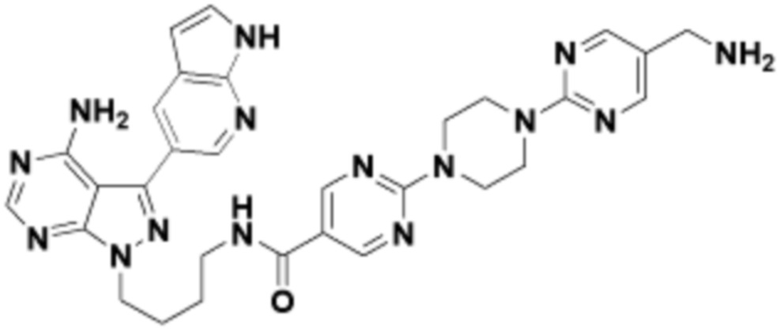
Промежуточное соединение C1-2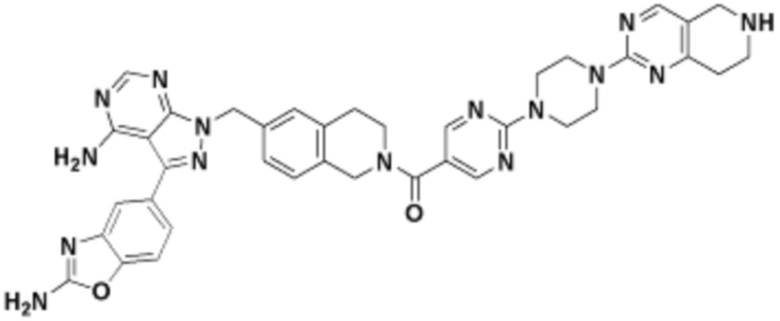
Промежуточное соединение C1-3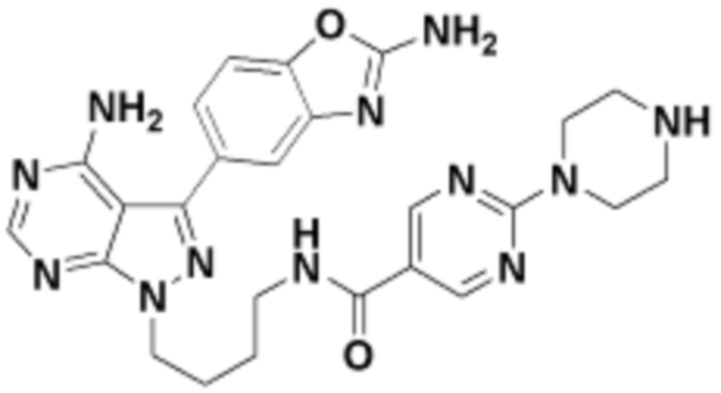
Промежуточное соединение C1-4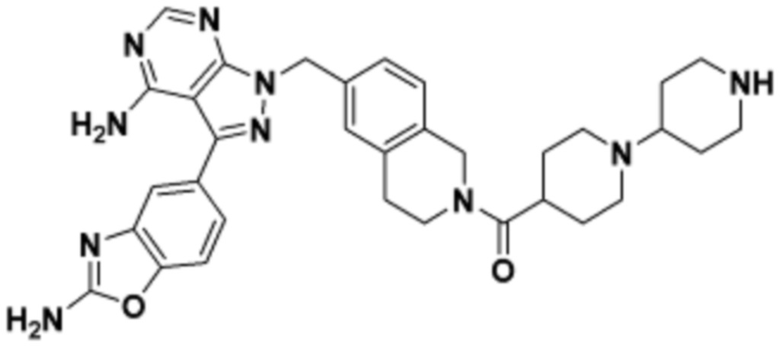
Промежуточное соединение C1-5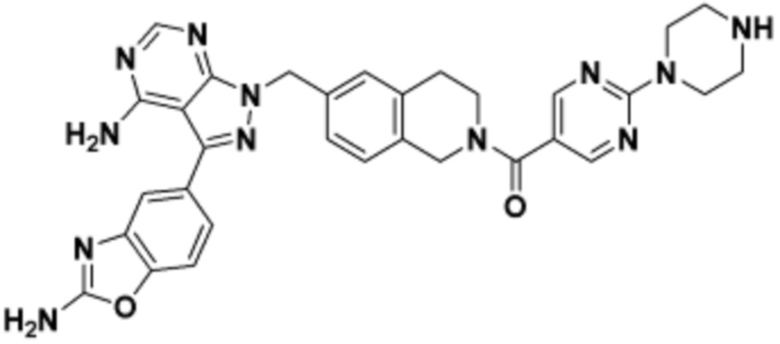
Промежуточное соединение C1-6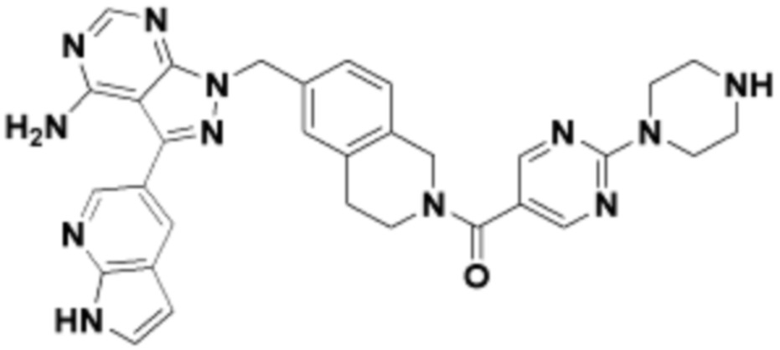
Промежуточное соединение C1-7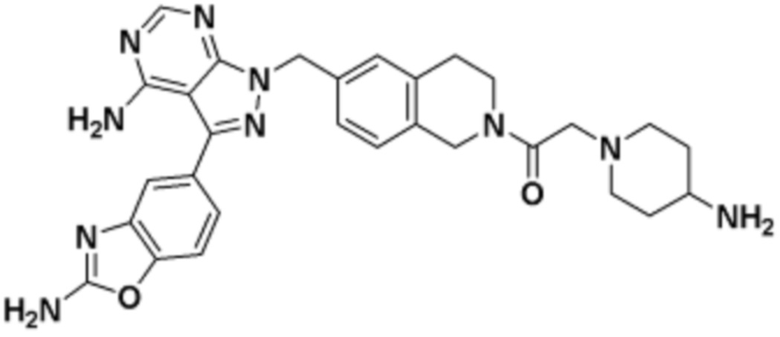
Промежуточное соединение C1-8
Следуя общей методике 1, но с применение ПЭГ карбоновых кислот и Промежуточных соединений C1 в таблице 16, получают Промежуточные соединения C2 в таблице 17:
Таблица 17. Дополнительные полученные амины
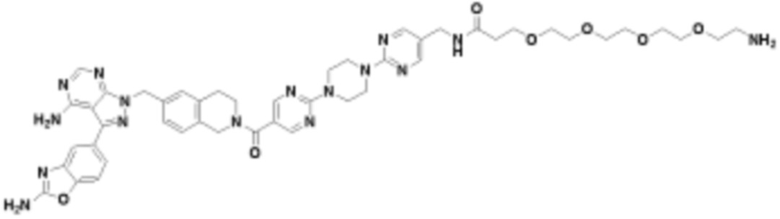
Промежуточное соединение C2-1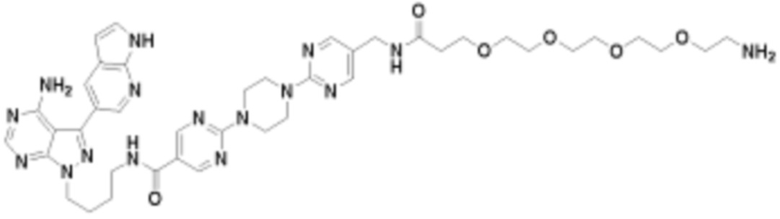
Промежуточное соединение C2-2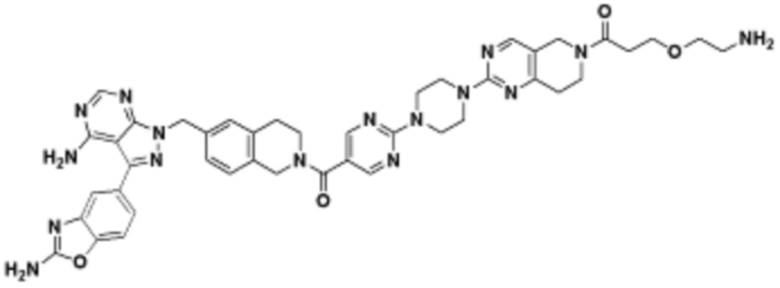
Промежуточное соединение C2-3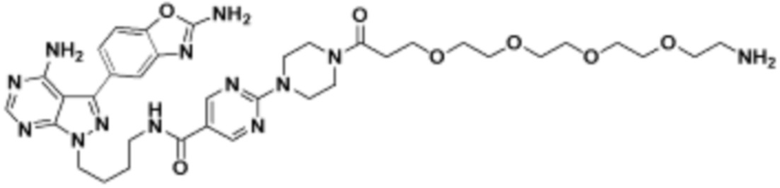
Промежуточное соединение C2-4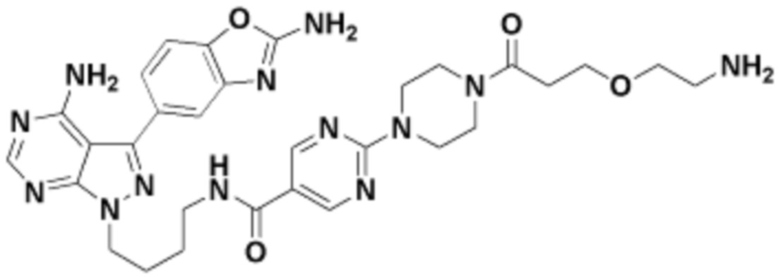
Промежуточное соединение C2-5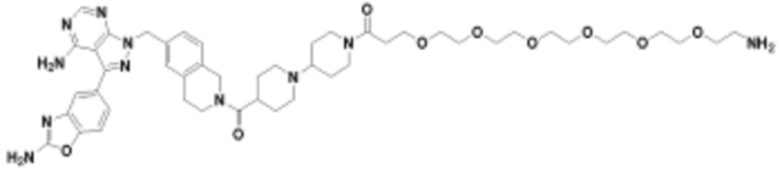
Промежуточное соединение C2-6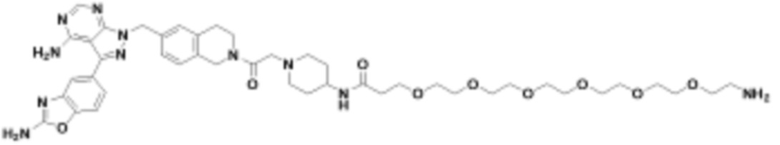
Промежуточное соединение C2-7
Следуя общей методике 2, но с применением подходящего мономера рапамицина, содержащего карбоновую кислоту, в таблице 1 и Промежуточных соединений C2 из Таблицы 17, синтезируют Ряд 3 двухвалентных аналогов в таблице 18:
Таблица 18. Ряд 3 двухвалентных соединений
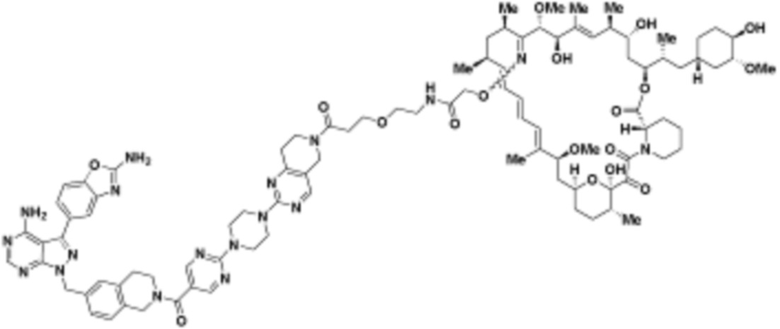
Пример 26
Пример 27
Пример 28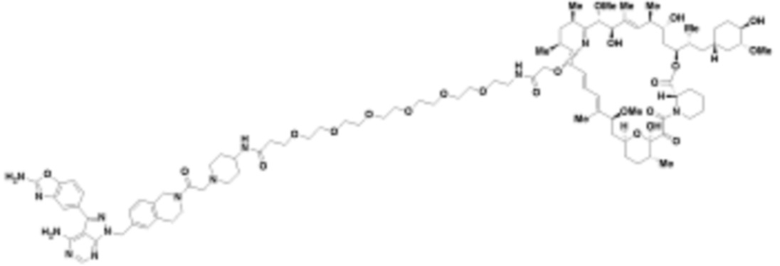
Пример 69
Следуя общей методике 1, но с применением подходящих Промежуточных соединений C2 в таблице 17 и аминсодержащих пре-линкеров в таблице 4, получают Промежуточные соединения D1 в таблице 19:
Таблица 19. Дополнительные полученные амины
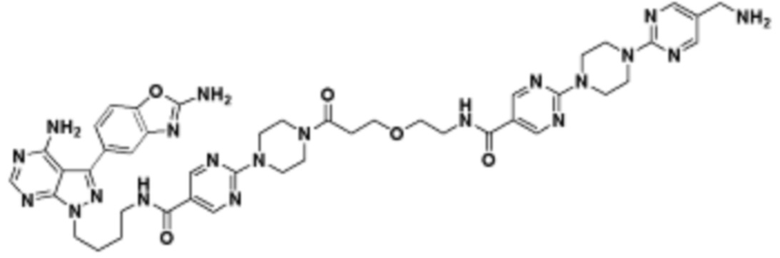
Промежуточное соединение D1-1
Следуя общей методике 1, но с применением подходящих аминсодержащих ингибиторов активного сайта в таблице 2 и аминсодержащих пре-линкеров в таблице 4, получают Промежуточные соединения D1 в таблице 20:
Таблица 20. Дополнительные полученные амины
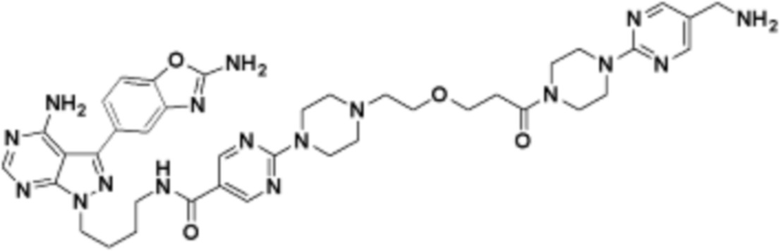
Промежуточное соединение D1-2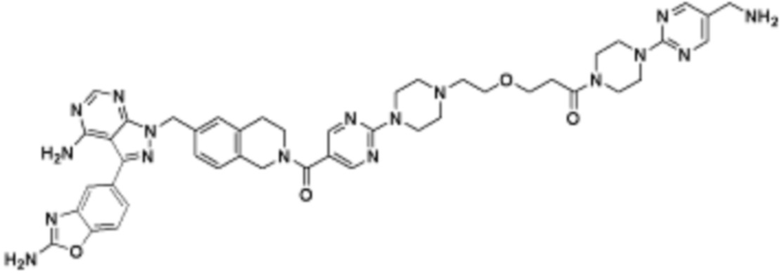
Промежуточное соединение D1-3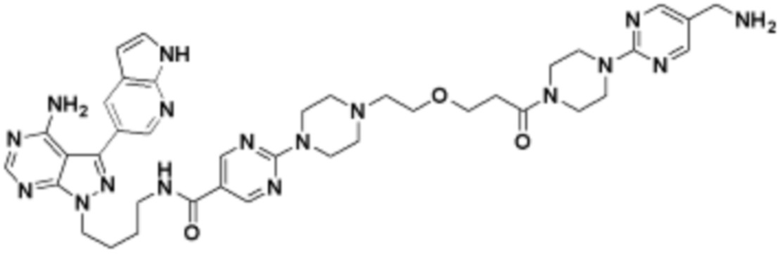
Промежуточное соединение D1-4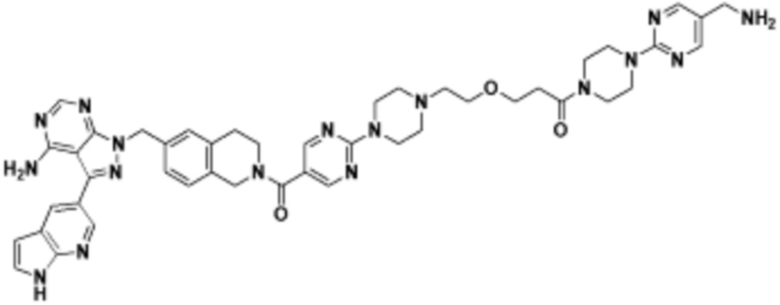
Промежуточное соединение D1-5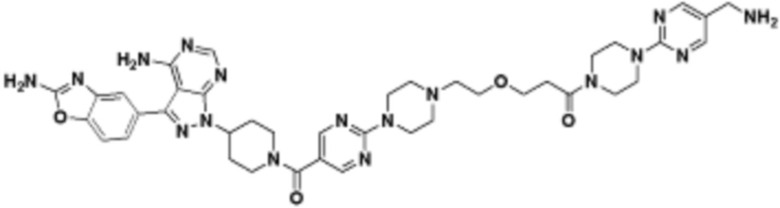
Промежуточное соединение D1-6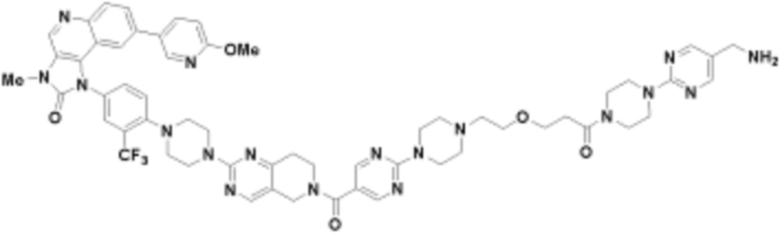
Промежуточное соединение D1-7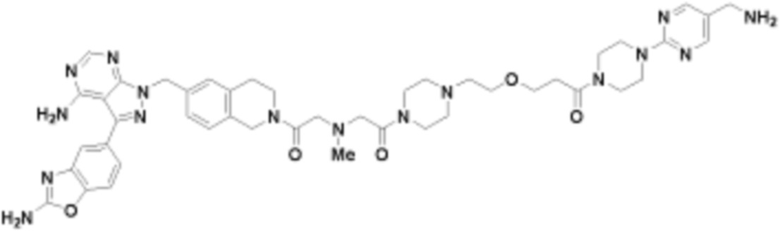
Промежуточное соединение D1-8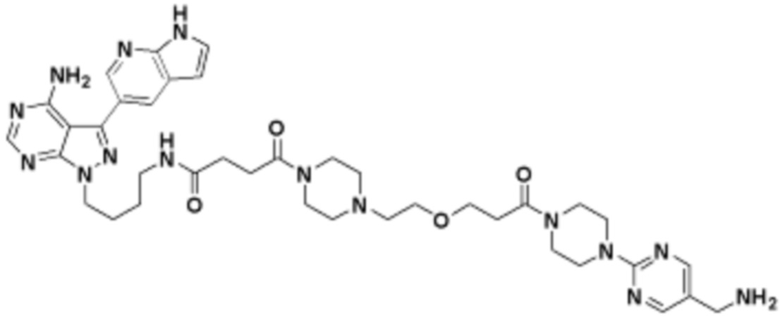
Промежуточное соединение D1-9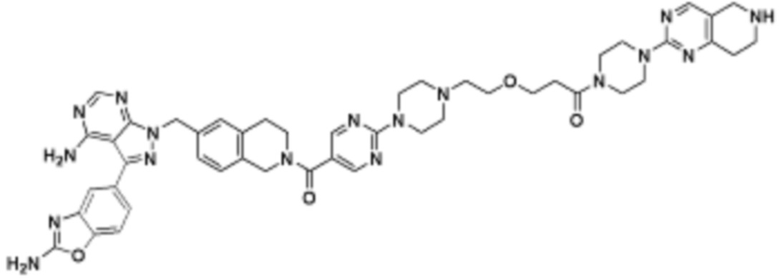
Промежуточное соединение D1-10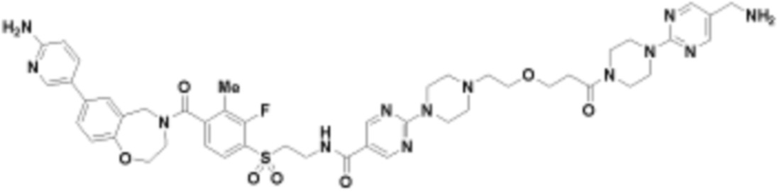
Промежуточное соединение D1-11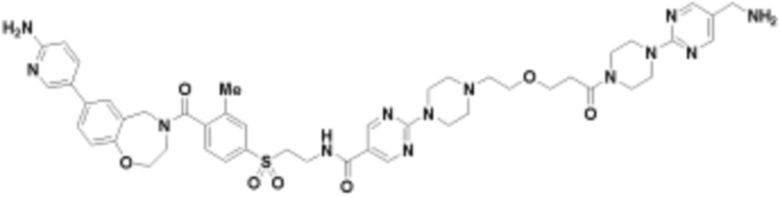
Промежуточное соединение D1-12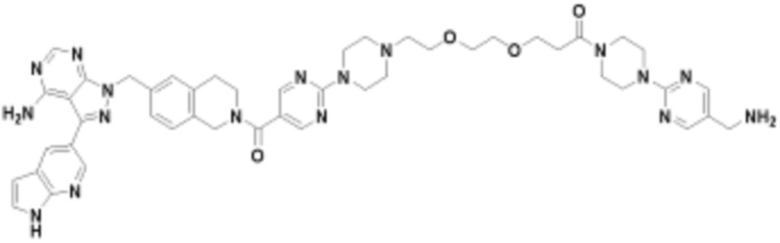
Промежуточное соединение D1-13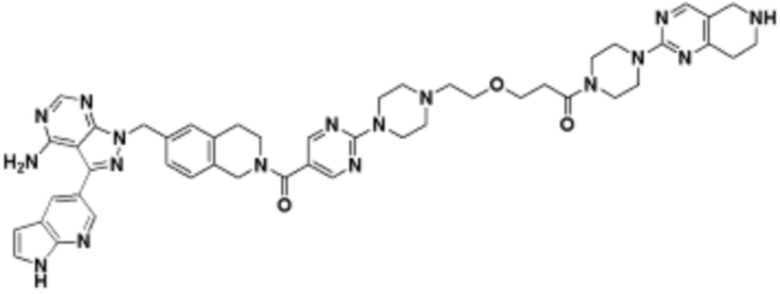
Промежуточное соединение D1-14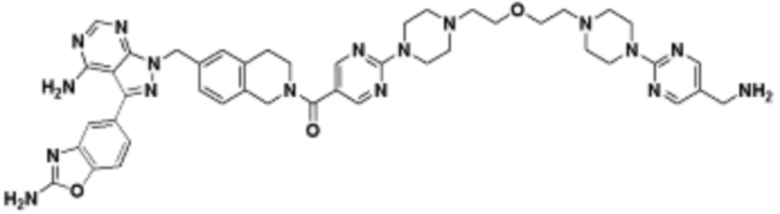
Промежуточное соединение D1-15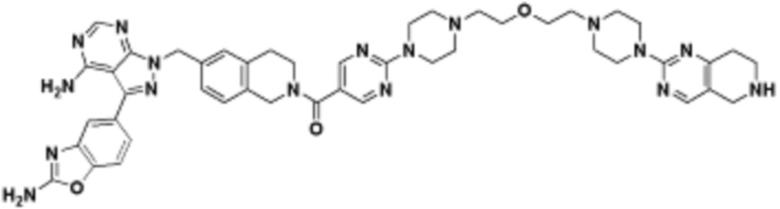
Промежуточное соединение D1-16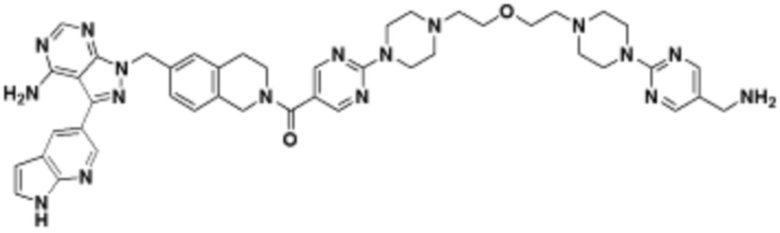
Промежуточное соединение D1-17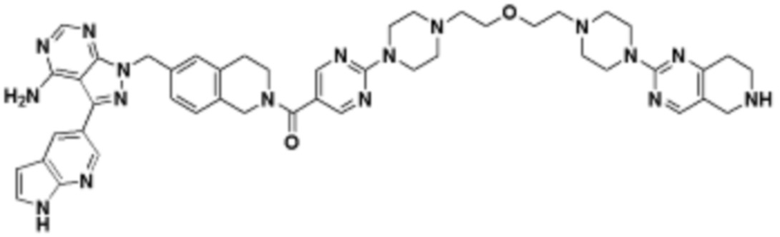
Промежуточное соединение D1-18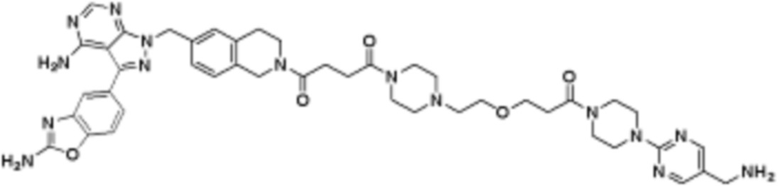
Промежуточное соединение D1-19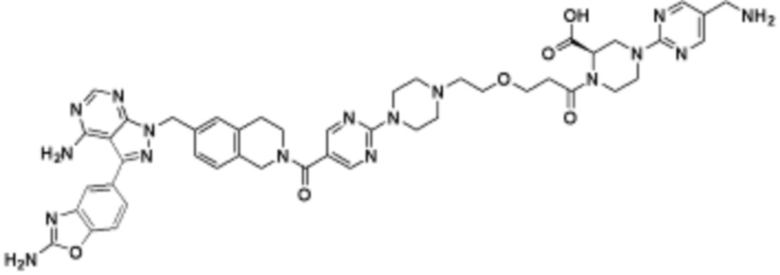
Промежуточное соединение D1-20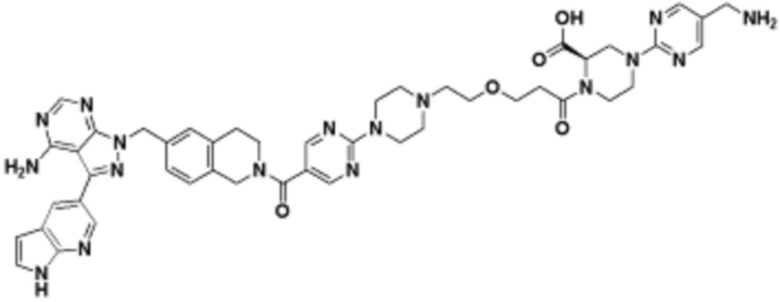
Промежуточное соединение D1-21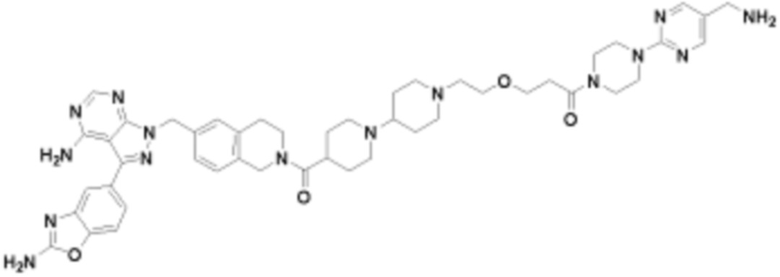
Промежуточное соединение D1-22
Следуя общей методике 2, но с применением подходящего мономера рапамицина, содержащего карбоновую кислоту, в таблице 1 и Промежуточных соединений D1 из таблиц 19 и 20, синтезируют Ряд 4 двухвалентных аналогов в таблице 21:
Таблица 21. Ряд 4 двухвалентных соединений
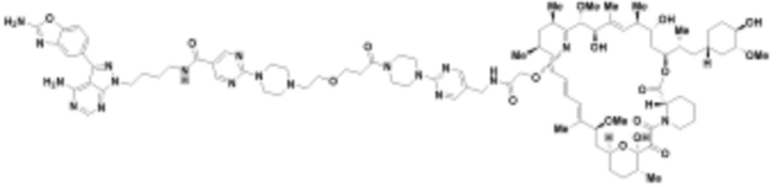
Пример 29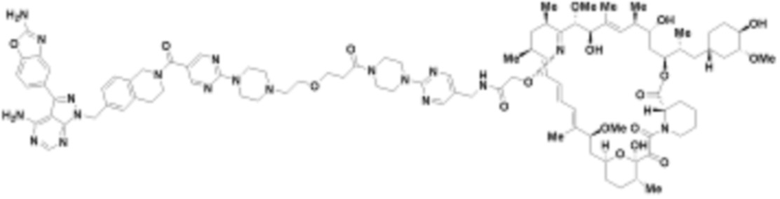
Пример 30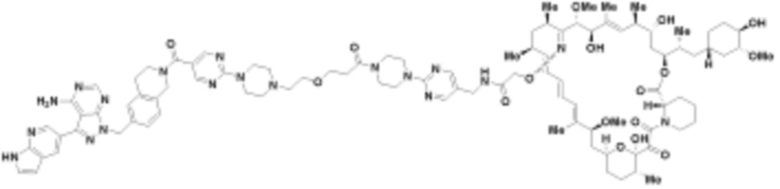
Пример 31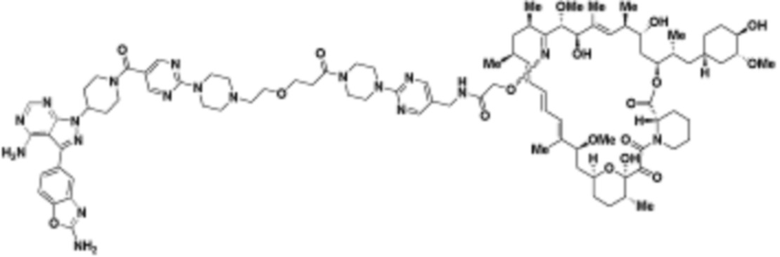
Пример 32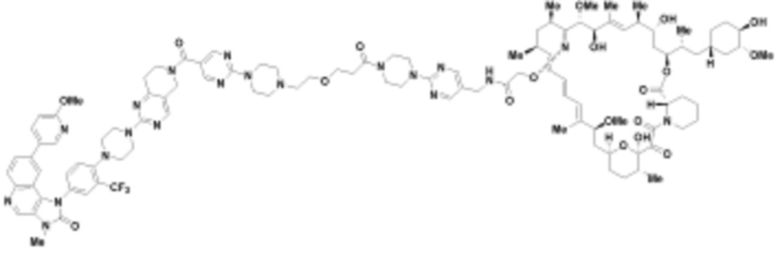
Пример 33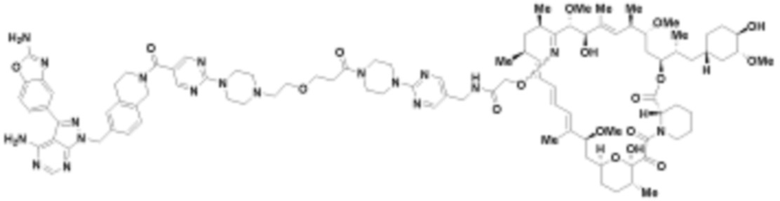
Пример 34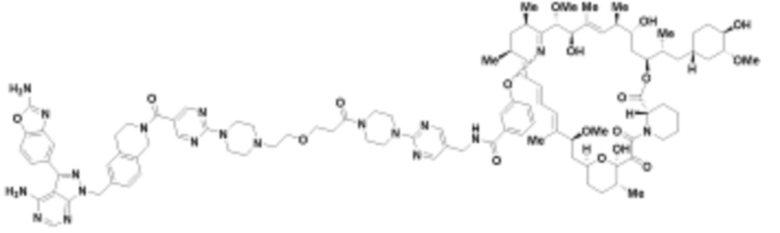
Пример 35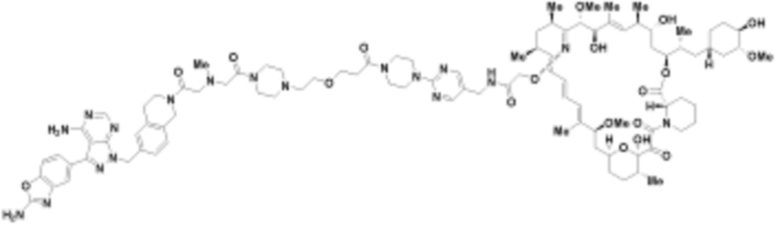
Пример 36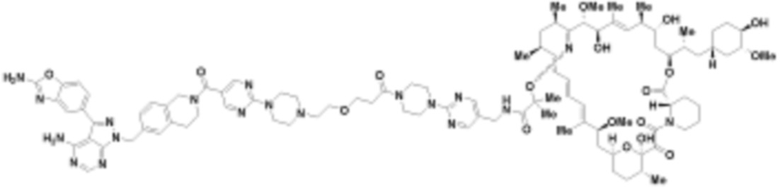
Пример 38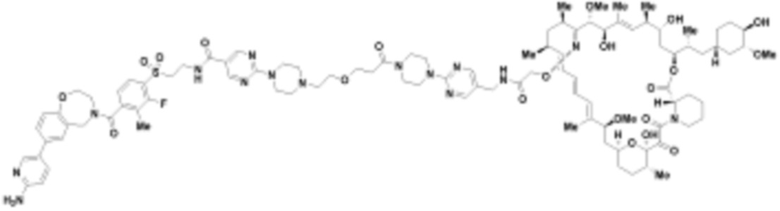
Пример 53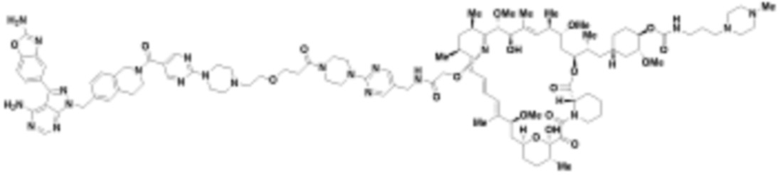
Пример 54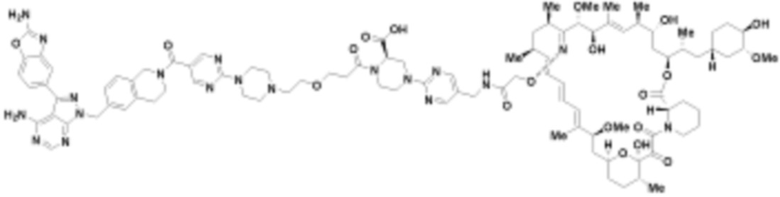
Пример 55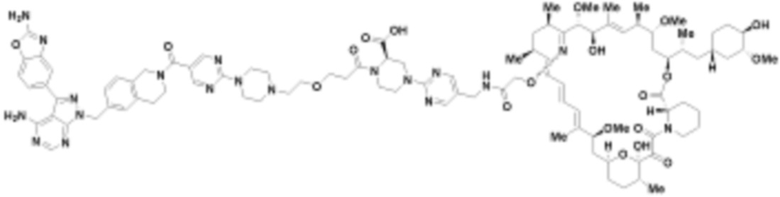
Пример 56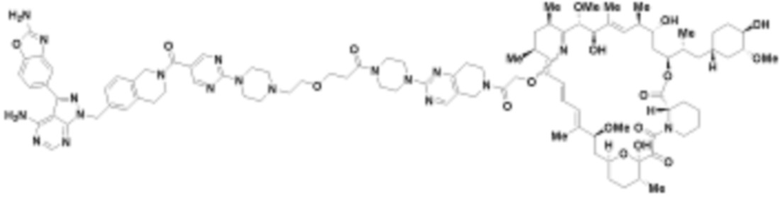
Пример 57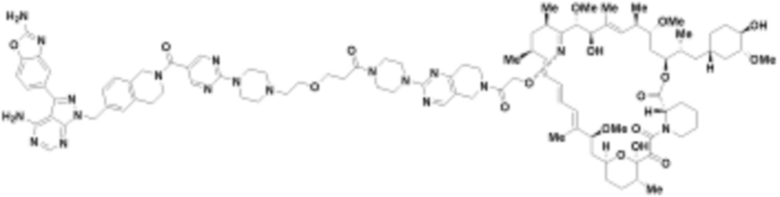
Пример 58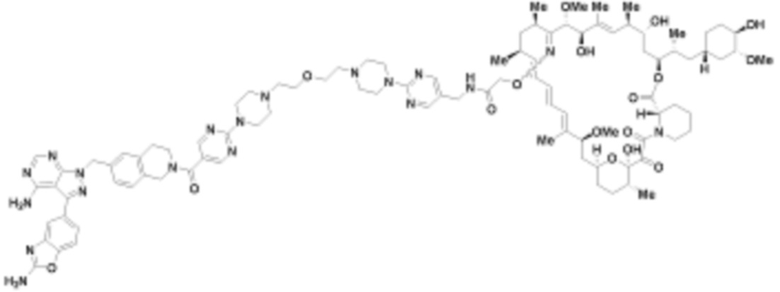
Пример 59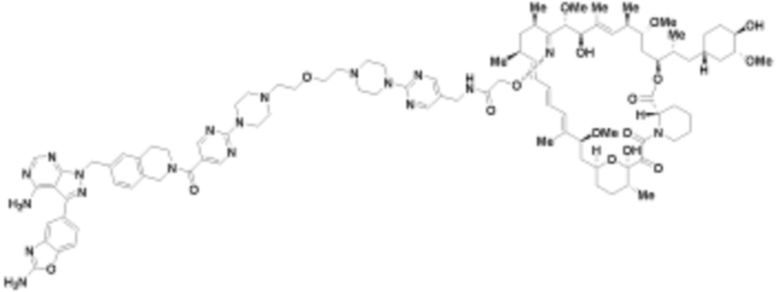
Пример 60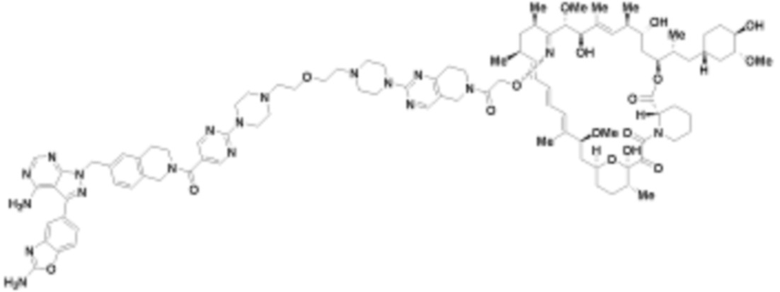
Пример 61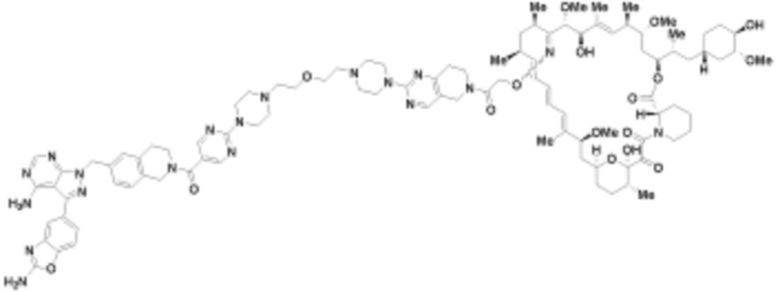
Пример 62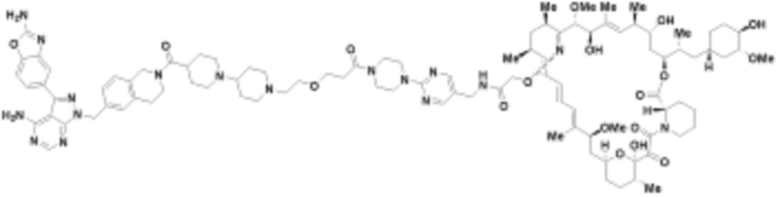
Пример 63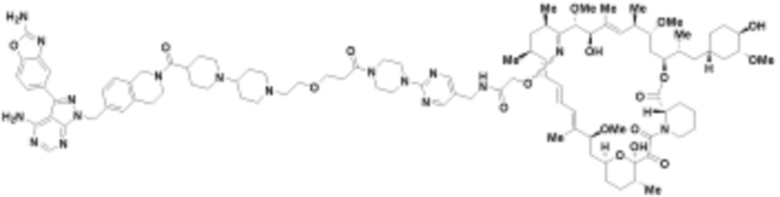
Пример 64
Следуя общей методике 1, но с применением подходящих Промежуточных соединений C1 в таблице 16 и аминсодержащих пре-линкеров в таблице 4, получают Промежуточные соединения E1 в таблице 22:
Таблица 22. Дополнительные полученные амины
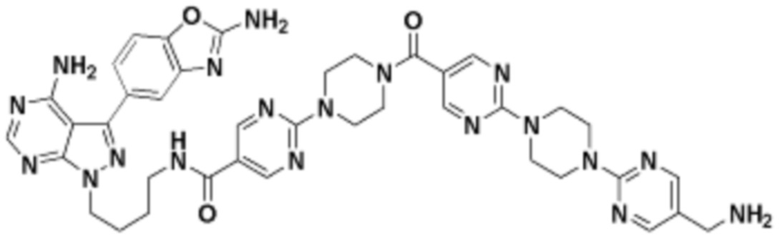
Промежуточное соединение E1-1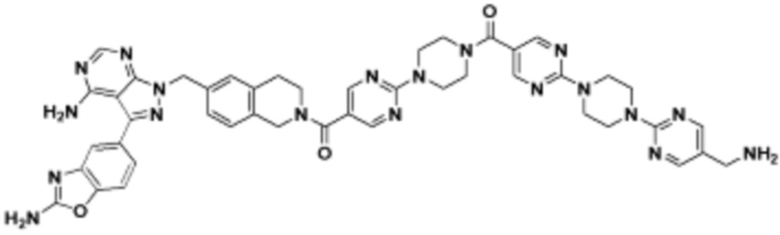
Промежуточное соединение E1-2
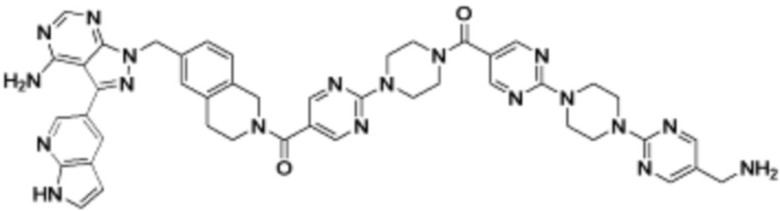
Промежуточное соединение E1-3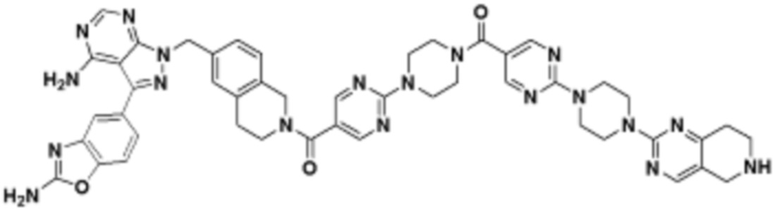
Промежуточное соединение E1-4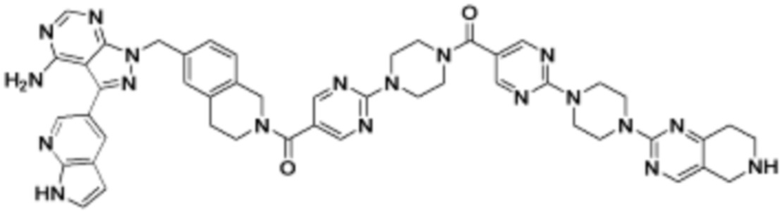
Промежуточное соединение E1-5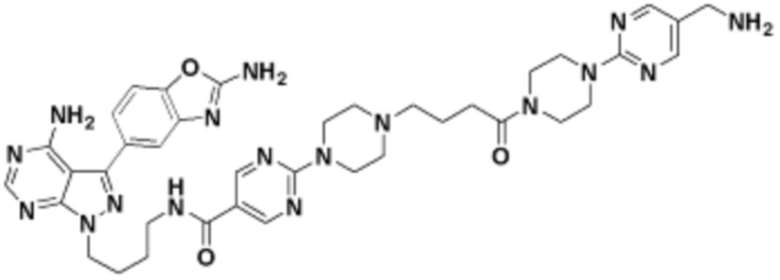
Промежуточное соединение E1-6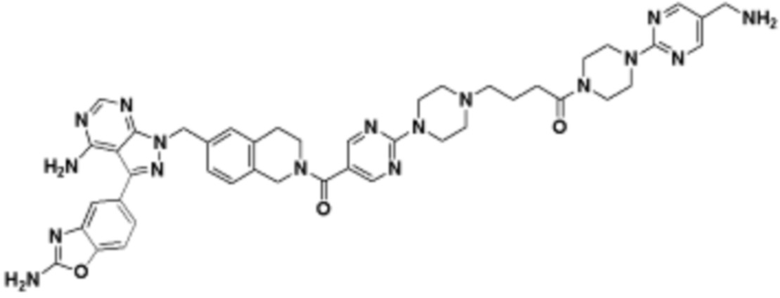
Промежуточное соединение E1-7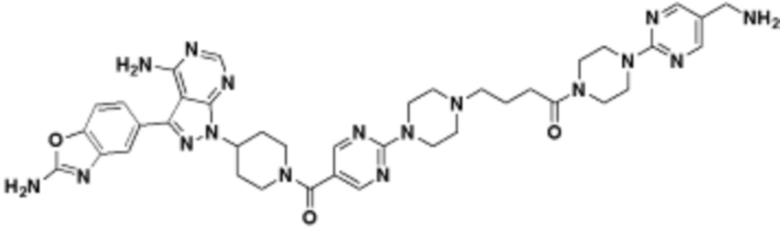
Промежуточное соединение E1-8
Следуя общей методике 2, но с применением подходящих мономеров рапамицина, содержащих карбоновую кислоту, в таблице 1 и Промежуточных соединений E1 из Таблицы 22, синтезируют Ряд 5 двухвалентных аналогов в таблице 23:
Таблица 23. Ряд 5 двухвалентных соединений
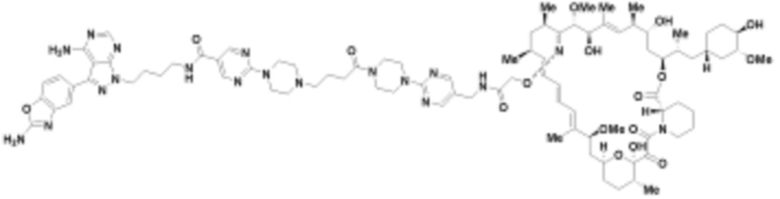
Пример 37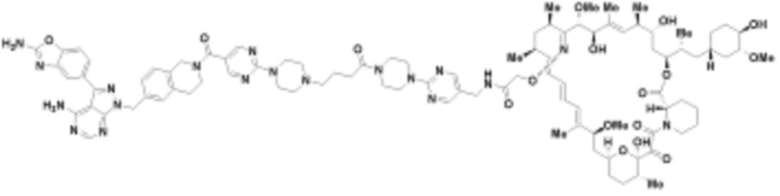
Пример 65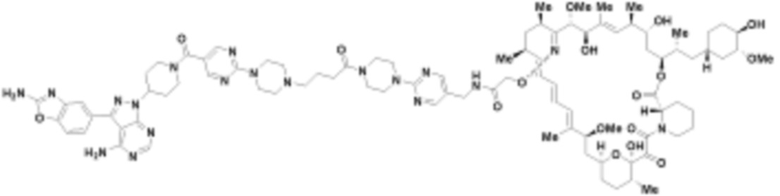
Пример 66
Таблица 24. Дополнительные полученные амины
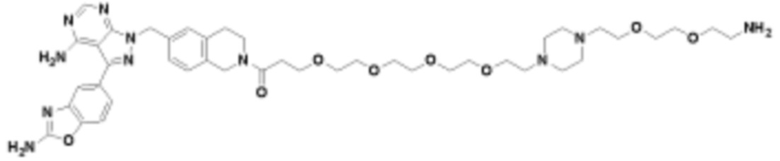
Промежуточное соединение F1-1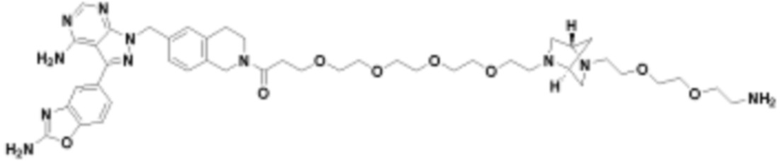
Промежуточное соединение F1-2
Следуя общей методике 2, но с применением подходящих мономеров рапамицина, содержащих карбоновую кислоту, в таблице 1 и Промежуточных соединений F1 из Таблицы 24, синтезируют Ряд 6 двухвалентных аналогов в таблице 25:
Таблица 25. Ряд 6 двухвалентных соединений
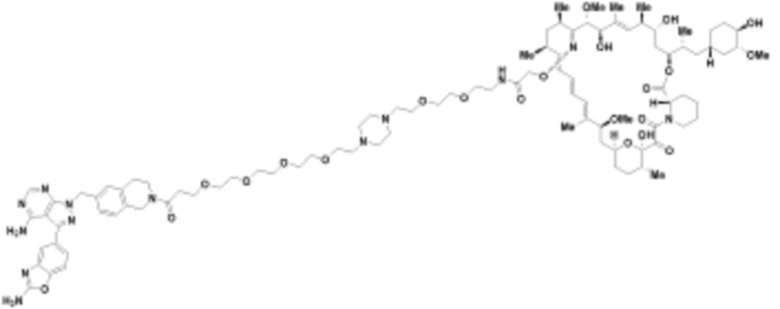
Пример 70
Следуя общей методике 1, но с применением подходящих Промежуточных соединений A1 в таблице 5 и аминсодержащих пре-линкеров в таблице 4, получают Промежуточные соединения G1 в таблице 26:
Таблица 26. Дополнительные полученные амины
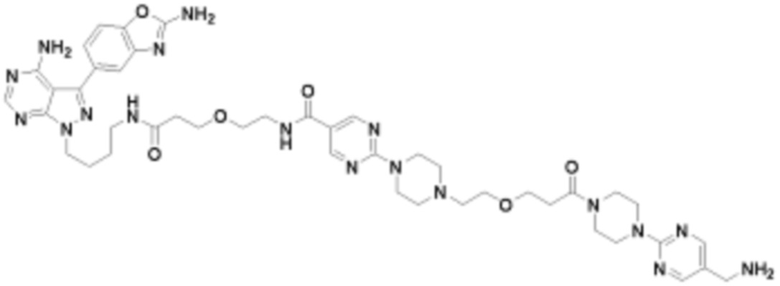
Промежуточное соединение G1-1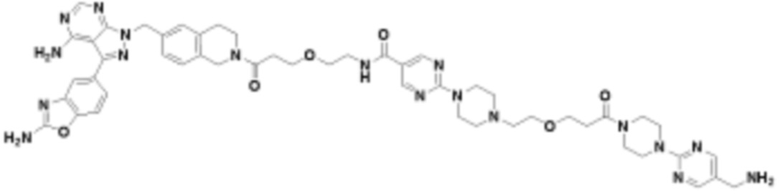
Промежуточное соединение G1-2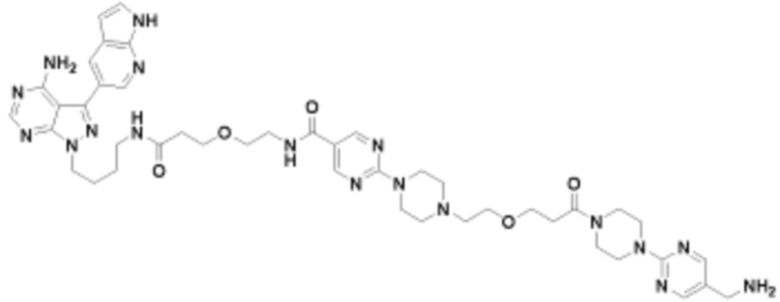
Промежуточное соединение G1-3
Следуя общей методике 6, но с применением подходящих Промежуточных соединений B3 в таблице 10 и аминсодержащих пре-линкеров в таблице 4, получают Промежуточные соединения G1 в таблице 27:
Таблица 27. Дополнительные полученные амины
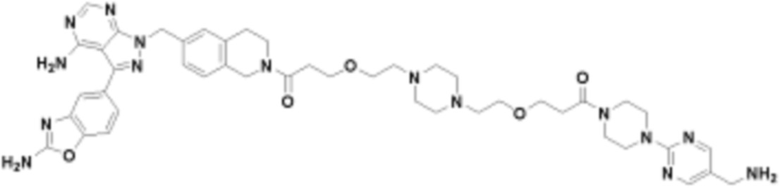
Промежуточное соединение G1-4
Следуя общей методике 2, но с применением подходящего мономера рапамицина, содержащего карбоновую кислоту, в таблице 1 и Промежуточных соединений G1 из таблиц 26 и 27, синтезируют Ряд 7 двухвалентных аналогов в таблице 28:
Таблица 28. Ряд 7 двухвалентных соединений
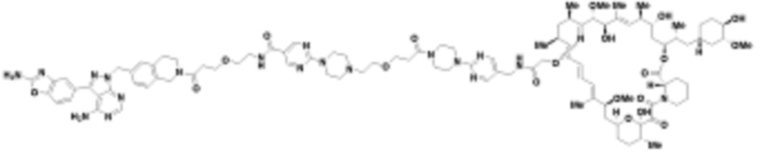
Пример 39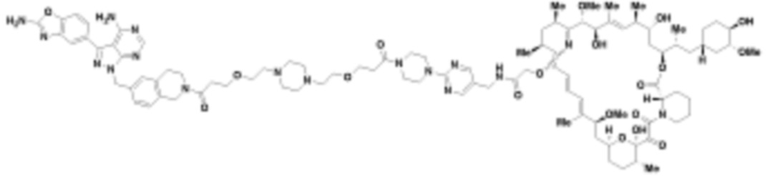
Пример 40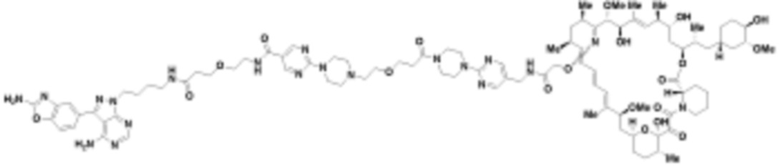
Пример 41
Следуя общей методике 1, но с применением подходящих Промежуточных соединений D1 в таблицах 19 и 20 и ПЭГ карбоновых кислот, получают Промежуточные соединения H1 в таблице 29:
Таблица 29. Дополнительные полученные амины
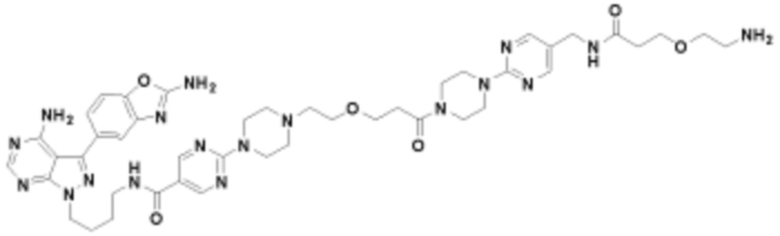
Промежуточное соединение H1-1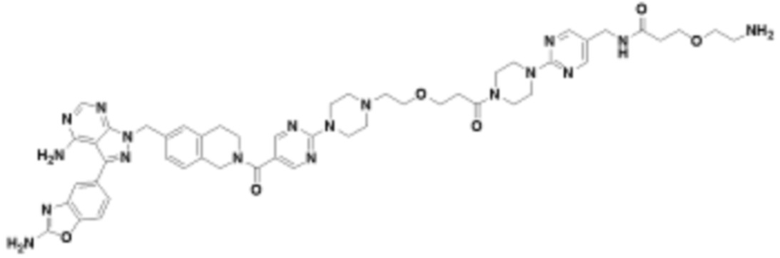
Промежуточное соединение H1-2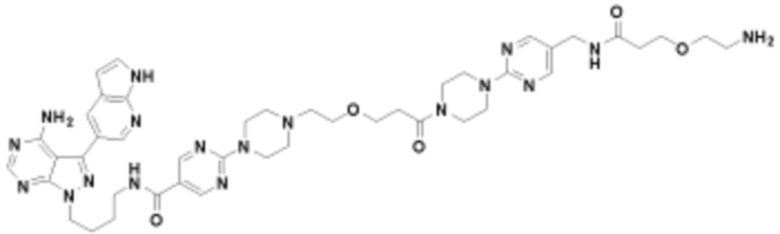
Промежуточное соединение H1-3
Следуя общей методике 2, но с применением подходящего мономера рапамицина, содержащего карбоновую кислоту, в таблице 1 и Промежуточных соединений H1 из Таблицы 29, синтезируют Ряд 8 двухвалентных аналогов в таблице 30:
Таблица 30. Ряд 8 двухвалентных соединений:
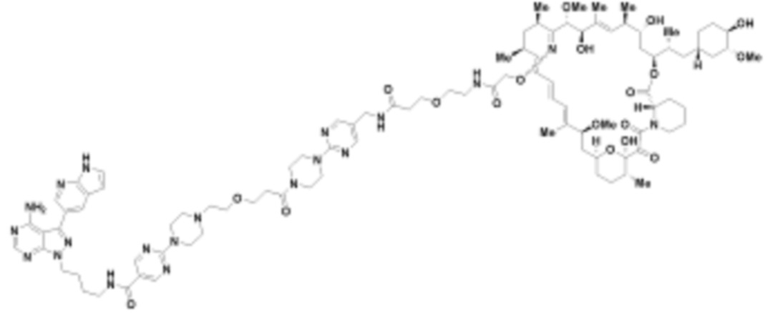
Пример 42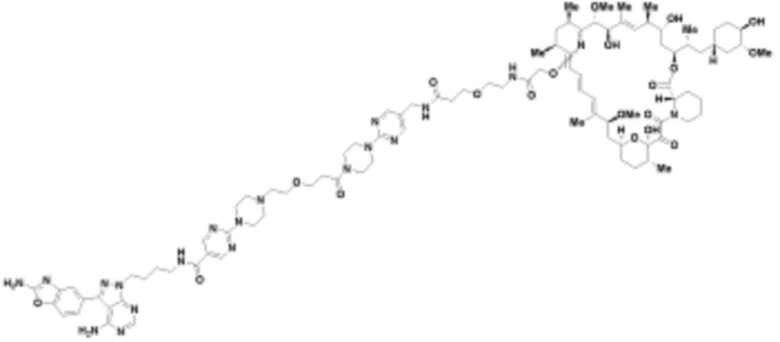
Пример 43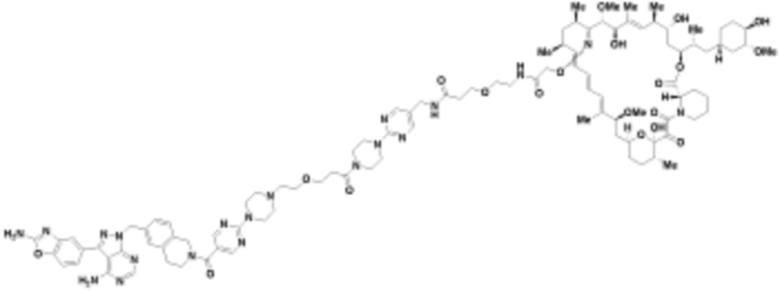
Пример 44
Биологические примеры
Клеточные AlphaLISA анализы для определения IC50 для ингибирования P-Akt (S473), P-4E-BP1 (T37/46) и P-P70S6K (T389) в клетках MDA-MB-468
Клеточные анализ mTOR киназы
Для измерения функциональной активности mTORC1 и mTORC2 в клетках, фосфорилирование 4EBP1 (Thr37/46) и P70S6K (Thr389) и AKT1/2/3 (Ser473) проводят с применением наборов Alphalisa SureFire Ultra Kits (Perkin Elmer). Клетки MDA-MB-468 (ATCC® HTB-132) культивируют в 96-луночных планшетах для тканевых культур и обрабатывают соединениями по раскрытию в концентрациях 0,017-1,000 нМ в течение двух часов при 37°C. Инкубирование прекращают удалением аналитического буфера и добавлением лизисного буфера, поставляемого с набором для анализа. Образцы обрабатывают согласно инструкциям производителя. Альфа сигнал от соответствующих фосфобелков измеряют дважды и применением микропланшетного ридера (Envision, Perkin-Elmer или Spectramax M5, Molecular Devices). Кривые ответа на концентрацию ингибитора анализируют с применением нормализованной кривой регрессии IC50, согласуя с нормализацией на основе контроля.
В качестве примера, измеренные значения IC50 для выбранных соединений представлены ниже:
Примечание:
Эквиваленты
Хотя настоящее раскрытие было описано в связи с конкретными вариантами осуществления, изложенными выше, многие их альтернативы, модификации и другие вариации будут очевидны специалистам в данной области техники. Все такие альтернативы, модификации и вариации соответствуют сути и объему данного раскрытия.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Revolution Medicines, Inc.
<120> C26-СВЯЗАННЫЕ АНАЛОГИ РАПАМИЦИНА В КАЧЕСТВЕ ИНГИБИТОРОВ MTOR
<130> REME-009/01WO 323913-2133
<150> US 62/836,040
<151> 2019-04-18
<150> US 62/752,881
<151> 2018-10-30
<150> US 62/665,426
<151> 2018-05-01
<160> 5
<170> PatentIn version 3.5
<210> 1
<211> 2549
<212> PRT
<213> Homo sapiens
<400> 1
Met Leu Gly Thr Gly Pro Ala Ala Ala Thr Thr Ala Ala Thr Thr Ser
1 5 10 15
Ser Asn Val Ser Val Leu Gln Gln Phe Ala Ser Gly Leu Lys Ser Arg
20 25 30
Asn Glu Glu Thr Arg Ala Lys Ala Ala Lys Glu Leu Gln His Tyr Val
35 40 45
Thr Met Glu Leu Arg Glu Met Ser Gln Glu Glu Ser Thr Arg Phe Tyr
50 55 60
Asp Gln Leu Asn His His Ile Phe Glu Leu Val Ser Ser Ser Asp Ala
65 70 75 80
Asn Glu Arg Lys Gly Gly Ile Leu Ala Ile Ala Ser Leu Ile Gly Val
85 90 95
Glu Gly Gly Asn Ala Thr Arg Ile Gly Arg Phe Ala Asn Tyr Leu Arg
100 105 110
Asn Leu Leu Pro Ser Asn Asp Pro Val Val Met Glu Met Ala Ser Lys
115 120 125
Ala Ile Gly Arg Leu Ala Met Ala Gly Asp Thr Phe Thr Ala Glu Tyr
130 135 140
Val Glu Phe Glu Val Lys Arg Ala Leu Glu Trp Leu Gly Ala Asp Arg
145 150 155 160
Asn Glu Gly Arg Arg His Ala Ala Val Leu Val Leu Arg Glu Leu Ala
165 170 175
Ile Ser Val Pro Thr Phe Phe Phe Gln Gln Val Gln Pro Phe Phe Asp
180 185 190
Asn Ile Phe Val Ala Val Trp Asp Pro Lys Gln Ala Ile Arg Glu Gly
195 200 205
Ala Val Ala Ala Leu Arg Ala Cys Leu Ile Leu Thr Thr Gln Arg Glu
210 215 220
Pro Lys Glu Met Gln Lys Pro Gln Trp Tyr Arg His Thr Phe Glu Glu
225 230 235 240
Ala Glu Lys Gly Phe Asp Glu Thr Leu Ala Lys Glu Lys Gly Met Asn
245 250 255
Arg Asp Asp Arg Ile His Gly Ala Leu Leu Ile Leu Asn Glu Leu Val
260 265 270
Arg Ile Ser Ser Met Glu Gly Glu Arg Leu Arg Glu Glu Met Glu Glu
275 280 285
Ile Thr Gln Gln Gln Leu Val His Asp Lys Tyr Cys Lys Asp Leu Met
290 295 300
Gly Phe Gly Thr Lys Pro Arg His Ile Thr Pro Phe Thr Ser Phe Gln
305 310 315 320
Ala Val Gln Pro Gln Gln Ser Asn Ala Leu Val Gly Leu Leu Gly Tyr
325 330 335
Ser Ser His Gln Gly Leu Met Gly Phe Gly Thr Ser Pro Ser Pro Ala
340 345 350
Lys Ser Thr Leu Val Glu Ser Arg Cys Cys Arg Asp Leu Met Glu Glu
355 360 365
Lys Phe Asp Gln Val Cys Gln Trp Val Leu Lys Cys Arg Asn Ser Lys
370 375 380
Asn Ser Leu Ile Gln Met Thr Ile Leu Asn Leu Leu Pro Arg Leu Ala
385 390 395 400
Ala Phe Arg Pro Ser Ala Phe Thr Asp Thr Gln Tyr Leu Gln Asp Thr
405 410 415
Met Asn His Val Leu Ser Cys Val Lys Lys Glu Lys Glu Arg Thr Ala
420 425 430
Ala Phe Gln Ala Leu Gly Leu Leu Ser Val Ala Val Arg Ser Glu Phe
435 440 445
Lys Val Tyr Leu Pro Arg Val Leu Asp Ile Ile Arg Ala Ala Leu Pro
450 455 460
Pro Lys Asp Phe Ala His Lys Arg Gln Lys Ala Met Gln Val Asp Ala
465 470 475 480
Thr Val Phe Thr Cys Ile Ser Met Leu Ala Arg Ala Met Gly Pro Gly
485 490 495
Ile Gln Gln Asp Ile Lys Glu Leu Leu Glu Pro Met Leu Ala Val Gly
500 505 510
Leu Ser Pro Ala Leu Thr Ala Val Leu Tyr Asp Leu Ser Arg Gln Ile
515 520 525
Pro Gln Leu Lys Lys Asp Ile Gln Asp Gly Leu Leu Lys Met Leu Ser
530 535 540
Leu Val Leu Met His Lys Pro Leu Arg His Pro Gly Met Pro Lys Gly
545 550 555 560
Leu Ala His Gln Leu Ala Ser Pro Gly Leu Thr Thr Leu Pro Glu Ala
565 570 575
Ser Asp Val Gly Ser Ile Thr Leu Ala Leu Arg Thr Leu Gly Ser Phe
580 585 590
Glu Phe Glu Gly His Ser Leu Thr Gln Phe Val Arg His Cys Ala Asp
595 600 605
His Phe Leu Asn Ser Glu His Lys Glu Ile Arg Met Glu Ala Ala Arg
610 615 620
Thr Cys Ser Arg Leu Leu Thr Pro Ser Ile His Leu Ile Ser Gly His
625 630 635 640
Ala His Val Val Ser Gln Thr Ala Val Gln Val Val Ala Asp Val Leu
645 650 655
Ser Lys Leu Leu Val Val Gly Ile Thr Asp Pro Asp Pro Asp Ile Arg
660 665 670
Tyr Cys Val Leu Ala Ser Leu Asp Glu Arg Phe Asp Ala His Leu Ala
675 680 685
Gln Ala Glu Asn Leu Gln Ala Leu Phe Val Ala Leu Asn Asp Gln Val
690 695 700
Phe Glu Ile Arg Glu Leu Ala Ile Cys Thr Val Gly Arg Leu Ser Ser
705 710 715 720
Met Asn Pro Ala Phe Val Met Pro Phe Leu Arg Lys Met Leu Ile Gln
725 730 735
Ile Leu Thr Glu Leu Glu His Ser Gly Ile Gly Arg Ile Lys Glu Gln
740 745 750
Ser Ala Arg Met Leu Gly His Leu Val Ser Asn Ala Pro Arg Leu Ile
755 760 765
Arg Pro Tyr Met Glu Pro Ile Leu Lys Ala Leu Ile Leu Lys Leu Lys
770 775 780
Asp Pro Asp Pro Asp Pro Asn Pro Gly Val Ile Asn Asn Val Leu Ala
785 790 795 800
Thr Ile Gly Glu Leu Ala Gln Val Ser Gly Leu Glu Met Arg Lys Trp
805 810 815
Val Asp Glu Leu Phe Ile Ile Ile Met Asp Met Leu Gln Asp Ser Ser
820 825 830
Leu Leu Ala Lys Arg Gln Val Ala Leu Trp Thr Leu Gly Gln Leu Val
835 840 845
Ala Ser Thr Gly Tyr Val Val Glu Pro Tyr Arg Lys Tyr Pro Thr Leu
850 855 860
Leu Glu Val Leu Leu Asn Phe Leu Lys Thr Glu Gln Asn Gln Gly Thr
865 870 875 880
Arg Arg Glu Ala Ile Arg Val Leu Gly Leu Leu Gly Ala Leu Asp Pro
885 890 895
Tyr Lys His Lys Val Asn Ile Gly Met Ile Asp Gln Ser Arg Asp Ala
900 905 910
Ser Ala Val Ser Leu Ser Glu Ser Lys Ser Ser Gln Asp Ser Ser Asp
915 920 925
Tyr Ser Thr Ser Glu Met Leu Val Asn Met Gly Asn Leu Pro Leu Asp
930 935 940
Glu Phe Tyr Pro Ala Val Ser Met Val Ala Leu Met Arg Ile Phe Arg
945 950 955 960
Asp Gln Ser Leu Ser His His His Thr Met Val Val Gln Ala Ile Thr
965 970 975
Phe Ile Phe Lys Ser Leu Gly Leu Lys Cys Val Gln Phe Leu Pro Gln
980 985 990
Val Met Pro Thr Phe Leu Asn Val Ile Arg Val Cys Asp Gly Ala Ile
995 1000 1005
Arg Glu Phe Leu Phe Gln Gln Leu Gly Met Leu Val Ser Phe Val
1010 1015 1020
Lys Ser His Ile Arg Pro Tyr Met Asp Glu Ile Val Thr Leu Met
1025 1030 1035
Arg Glu Phe Trp Val Met Asn Thr Ser Ile Gln Ser Thr Ile Ile
1040 1045 1050
Leu Leu Ile Glu Gln Ile Val Val Ala Leu Gly Gly Glu Phe Lys
1055 1060 1065
Leu Tyr Leu Pro Gln Leu Ile Pro His Met Leu Arg Val Phe Met
1070 1075 1080
His Asp Asn Ser Pro Gly Arg Ile Val Ser Ile Lys Leu Leu Ala
1085 1090 1095
Ala Ile Gln Leu Phe Gly Ala Asn Leu Asp Asp Tyr Leu His Leu
1100 1105 1110
Leu Leu Pro Pro Ile Val Lys Leu Phe Asp Ala Pro Glu Ala Pro
1115 1120 1125
Leu Pro Ser Arg Lys Ala Ala Leu Glu Thr Val Asp Arg Leu Thr
1130 1135 1140
Glu Ser Leu Asp Phe Thr Asp Tyr Ala Ser Arg Ile Ile His Pro
1145 1150 1155
Ile Val Arg Thr Leu Asp Gln Ser Pro Glu Leu Arg Ser Thr Ala
1160 1165 1170
Met Asp Thr Leu Ser Ser Leu Val Phe Gln Leu Gly Lys Lys Tyr
1175 1180 1185
Gln Ile Phe Ile Pro Met Val Asn Lys Val Leu Val Arg His Arg
1190 1195 1200
Ile Asn His Gln Arg Tyr Asp Val Leu Ile Cys Arg Ile Val Lys
1205 1210 1215
Gly Tyr Thr Leu Ala Asp Glu Glu Glu Asp Pro Leu Ile Tyr Gln
1220 1225 1230
His Arg Met Leu Arg Ser Gly Gln Gly Asp Ala Leu Ala Ser Gly
1235 1240 1245
Pro Val Glu Thr Gly Pro Met Lys Lys Leu His Val Ser Thr Ile
1250 1255 1260
Asn Leu Gln Lys Ala Trp Gly Ala Ala Arg Arg Val Ser Lys Asp
1265 1270 1275
Asp Trp Leu Glu Trp Leu Arg Arg Leu Ser Leu Glu Leu Leu Lys
1280 1285 1290
Asp Ser Ser Ser Pro Ser Leu Arg Ser Cys Trp Ala Leu Ala Gln
1295 1300 1305
Ala Tyr Asn Pro Met Ala Arg Asp Leu Phe Asn Ala Ala Phe Val
1310 1315 1320
Ser Cys Trp Ser Glu Leu Asn Glu Asp Gln Gln Asp Glu Leu Ile
1325 1330 1335
Arg Ser Ile Glu Leu Ala Leu Thr Ser Gln Asp Ile Ala Glu Val
1340 1345 1350
Thr Gln Thr Leu Leu Asn Leu Ala Glu Phe Met Glu His Ser Asp
1355 1360 1365
Lys Gly Pro Leu Pro Leu Arg Asp Asp Asn Gly Ile Val Leu Leu
1370 1375 1380
Gly Glu Arg Ala Ala Lys Cys Arg Ala Tyr Ala Lys Ala Leu His
1385 1390 1395
Tyr Lys Glu Leu Glu Phe Gln Lys Gly Pro Thr Pro Ala Ile Leu
1400 1405 1410
Glu Ser Leu Ile Ser Ile Asn Asn Lys Leu Gln Gln Pro Glu Ala
1415 1420 1425
Ala Ala Gly Val Leu Glu Tyr Ala Met Lys His Phe Gly Glu Leu
1430 1435 1440
Glu Ile Gln Ala Thr Trp Tyr Glu Lys Leu His Glu Trp Glu Asp
1445 1450 1455
Ala Leu Val Ala Tyr Asp Lys Lys Met Asp Thr Asn Lys Asp Asp
1460 1465 1470
Pro Glu Leu Met Leu Gly Arg Met Arg Cys Leu Glu Ala Leu Gly
1475 1480 1485
Glu Trp Gly Gln Leu His Gln Gln Cys Cys Glu Lys Trp Thr Leu
1490 1495 1500
Val Asn Asp Glu Thr Gln Ala Lys Met Ala Arg Met Ala Ala Ala
1505 1510 1515
Ala Ala Trp Gly Leu Gly Gln Trp Asp Ser Met Glu Glu Tyr Thr
1520 1525 1530
Cys Met Ile Pro Arg Asp Thr His Asp Gly Ala Phe Tyr Arg Ala
1535 1540 1545
Val Leu Ala Leu His Gln Asp Leu Phe Ser Leu Ala Gln Gln Cys
1550 1555 1560
Ile Asp Lys Ala Arg Asp Leu Leu Asp Ala Glu Leu Thr Ala Met
1565 1570 1575
Ala Gly Glu Ser Tyr Ser Arg Ala Tyr Gly Ala Met Val Ser Cys
1580 1585 1590
His Met Leu Ser Glu Leu Glu Glu Val Ile Gln Tyr Lys Leu Val
1595 1600 1605
Pro Glu Arg Arg Glu Ile Ile Arg Gln Ile Trp Trp Glu Arg Leu
1610 1615 1620
Gln Gly Cys Gln Arg Ile Val Glu Asp Trp Gln Lys Ile Leu Met
1625 1630 1635
Val Arg Ser Leu Val Val Ser Pro His Glu Asp Met Arg Thr Trp
1640 1645 1650
Leu Lys Tyr Ala Ser Leu Cys Gly Lys Ser Gly Arg Leu Ala Leu
1655 1660 1665
Ala His Lys Thr Leu Val Leu Leu Leu Gly Val Asp Pro Ser Arg
1670 1675 1680
Gln Leu Asp His Pro Leu Pro Thr Val His Pro Gln Val Thr Tyr
1685 1690 1695
Ala Tyr Met Lys Asn Met Trp Lys Ser Ala Arg Lys Ile Asp Ala
1700 1705 1710
Phe Gln His Met Gln His Phe Val Gln Thr Met Gln Gln Gln Ala
1715 1720 1725
Gln His Ala Ile Ala Thr Glu Asp Gln Gln His Lys Gln Glu Leu
1730 1735 1740
His Lys Leu Met Ala Arg Cys Phe Leu Lys Leu Gly Glu Trp Gln
1745 1750 1755
Leu Asn Leu Gln Gly Ile Asn Glu Ser Thr Ile Pro Lys Val Leu
1760 1765 1770
Gln Tyr Tyr Ser Ala Ala Thr Glu His Asp Arg Ser Trp Tyr Lys
1775 1780 1785
Ala Trp His Ala Trp Ala Val Met Asn Phe Glu Ala Val Leu His
1790 1795 1800
Tyr Lys His Gln Asn Gln Ala Arg Asp Glu Lys Lys Lys Leu Arg
1805 1810 1815
His Ala Ser Gly Ala Asn Ile Thr Asn Ala Thr Thr Ala Ala Thr
1820 1825 1830
Thr Ala Ala Thr Ala Thr Thr Thr Ala Ser Thr Glu Gly Ser Asn
1835 1840 1845
Ser Glu Ser Glu Ala Glu Ser Thr Glu Asn Ser Pro Thr Pro Ser
1850 1855 1860
Pro Leu Gln Lys Lys Val Thr Glu Asp Leu Ser Lys Thr Leu Leu
1865 1870 1875
Met Tyr Thr Val Pro Ala Val Gln Gly Phe Phe Arg Ser Ile Ser
1880 1885 1890
Leu Ser Arg Gly Asn Asn Leu Gln Asp Thr Leu Arg Val Leu Thr
1895 1900 1905
Leu Trp Phe Asp Tyr Gly His Trp Pro Asp Val Asn Glu Ala Leu
1910 1915 1920
Val Glu Gly Val Lys Ala Ile Gln Ile Asp Thr Trp Leu Gln Val
1925 1930 1935
Ile Pro Gln Leu Ile Ala Arg Ile Asp Thr Pro Arg Pro Leu Val
1940 1945 1950
Gly Arg Leu Ile His Gln Leu Leu Thr Asp Ile Gly Arg Tyr His
1955 1960 1965
Pro Gln Ala Leu Ile Tyr Pro Leu Thr Val Ala Ser Lys Ser Thr
1970 1975 1980
Thr Thr Ala Arg His Asn Ala Ala Asn Lys Ile Leu Lys Asn Met
1985 1990 1995
Cys Glu His Ser Asn Thr Leu Val Gln Gln Ala Met Met Val Ser
2000 2005 2010
Glu Glu Leu Ile Arg Val Ala Ile Leu Trp His Glu Met Trp His
2015 2020 2025
Glu Gly Leu Glu Glu Ala Ser Arg Leu Tyr Phe Gly Glu Arg Asn
2030 2035 2040
Val Lys Gly Met Phe Glu Val Leu Glu Pro Leu His Ala Met Met
2045 2050 2055
Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr Ser Phe Asn Gln Ala
2060 2065 2070
Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp Cys Arg Lys Tyr
2075 2080 2085
Met Lys Ser Gly Asn Val Lys Asp Leu Thr Gln Ala Trp Asp Leu
2090 2095 2100
Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Gln Leu Pro Gln Leu
2105 2110 2115
Thr Ser Leu Glu Leu Gln Tyr Val Ser Pro Lys Leu Leu Met Cys
2120 2125 2130
Arg Asp Leu Glu Leu Ala Val Pro Gly Thr Tyr Asp Pro Asn Gln
2135 2140 2145
Pro Ile Ile Arg Ile Gln Ser Ile Ala Pro Ser Leu Gln Val Ile
2150 2155 2160
Thr Ser Lys Gln Arg Pro Arg Lys Leu Thr Leu Met Gly Ser Asn
2165 2170 2175
Gly His Glu Phe Val Phe Leu Leu Lys Gly His Glu Asp Leu Arg
2180 2185 2190
Gln Asp Glu Arg Val Met Gln Leu Phe Gly Leu Val Asn Thr Leu
2195 2200 2205
Leu Ala Asn Asp Pro Thr Ser Leu Arg Lys Asn Leu Ser Ile Gln
2210 2215 2220
Arg Tyr Ala Val Ile Pro Leu Ser Thr Asn Ser Gly Leu Ile Gly
2225 2230 2235
Trp Val Pro His Cys Asp Thr Leu His Ala Leu Ile Arg Asp Tyr
2240 2245 2250
Arg Glu Lys Lys Lys Ile Leu Leu Asn Ile Glu His Arg Ile Met
2255 2260 2265
Leu Arg Met Ala Pro Asp Tyr Asp His Leu Thr Leu Met Gln Lys
2270 2275 2280
Val Glu Val Phe Glu His Ala Val Asn Asn Thr Ala Gly Asp Asp
2285 2290 2295
Leu Ala Lys Leu Leu Trp Leu Lys Ser Pro Ser Ser Glu Val Trp
2300 2305 2310
Phe Asp Arg Arg Thr Asn Tyr Thr Arg Ser Leu Ala Val Met Ser
2315 2320 2325
Met Val Gly Tyr Ile Leu Gly Leu Gly Asp Arg His Pro Ser Asn
2330 2335 2340
Leu Met Leu Asp Arg Leu Ser Gly Lys Ile Leu His Ile Asp Phe
2345 2350 2355
Gly Asp Cys Phe Glu Val Ala Met Thr Arg Glu Lys Phe Pro Glu
2360 2365 2370
Lys Ile Pro Phe Arg Leu Thr Arg Met Leu Thr Asn Ala Met Glu
2375 2380 2385
Val Thr Gly Leu Asp Gly Asn Tyr Arg Ile Thr Cys His Thr Val
2390 2395 2400
Met Glu Val Leu Arg Glu His Lys Asp Ser Val Met Ala Val Leu
2405 2410 2415
Glu Ala Phe Val Tyr Asp Pro Leu Leu Asn Trp Arg Leu Met Asp
2420 2425 2430
Thr Asn Thr Lys Gly Asn Lys Arg Ser Arg Thr Arg Thr Asp Ser
2435 2440 2445
Tyr Ser Ala Gly Gln Ser Val Glu Ile Leu Asp Gly Val Glu Leu
2450 2455 2460
Gly Glu Pro Ala His Lys Lys Thr Gly Thr Thr Val Pro Glu Ser
2465 2470 2475
Ile His Ser Phe Ile Gly Asp Gly Leu Val Lys Pro Glu Ala Leu
2480 2485 2490
Asn Lys Lys Ala Ile Gln Ile Ile Asn Arg Val Arg Asp Lys Leu
2495 2500 2505
Thr Gly Arg Asp Phe Ser His Asp Asp Thr Leu Asp Val Pro Thr
2510 2515 2520
Gln Val Glu Leu Leu Ile Lys Gln Ala Thr Ser His Glu Asn Leu
2525 2530 2535
Cys Gln Cys Tyr Ile Gly Trp Cys Pro Phe Trp
2540 2545
<210> 2
<211> 8733
<212> ДНК
<213> Homo sapiens
<400> 2
gctcccggct tagaggacag cggggaaggc gggcggtggg gcagggggcc tgaagcggcg 60
gtaccggtgc tggcggcggc agctgaggcc ttggccgaag ccgcgcgaac ctcagggcaa 120
gatgcttgga accggacctg ccgccgccac caccgctgcc accacatcta gcaatgtgag 180
cgtcctgcag cagtttgcca gtggcctaaa gagccggaat gaggaaacca gggccaaagc 240
cgccaaggag ctccagcact atgtcaccat ggaactccga gagatgagtc aagaggagtc 300
tactcgcttc tatgaccaac tgaaccatca catttttgaa ttggtttcca gctcagatgc 360
caatgagagg aaaggtggca tcttggccat agctagcctc ataggagtgg aaggtgggaa 420
tgccacccga attggcagat ttgccaacta tcttcggaac ctcctcccct ccaatgaccc 480
agttgtcatg gaaatggcat ccaaggccat tggccgtctt gccatggcag gggacacttt 540
taccgctgag tacgtggaat ttgaggtgaa gcgagccctg gaatggctgg gtgctgaccg 600
caatgagggc cggagacatg cagctgtcct ggttctccgt gagctggcca tcagcgtccc 660
taccttcttc ttccagcaag tgcaaccctt ctttgacaac atttttgtgg ccgtgtggga 720
ccccaaacag gccatccgtg agggagctgt agccgccctt cgtgcctgtc tgattctcac 780
aacccagcgt gagccgaagg agatgcagaa gcctcagtgg tacaggcaca catttgaaga 840
agcagagaag ggatttgatg agaccttggc caaagagaag ggcatgaatc gggatgatcg 900
gatccatgga gccttgttga tccttaacga gctggtccga atcagcagca tggagggaga 960
gcgtctgaga gaagaaatgg aagaaatcac acagcagcag ctggtacacg acaagtactg 1020
caaagatctc atgggcttcg gaacaaaacc tcgtcacatt acccccttca ccagtttcca 1080
ggctgtacag ccccagcagt caaatgcctt ggtggggctg ctggggtaca gctctcacca 1140
aggcctcatg ggatttggga cctcccccag tccagctaag tccaccctgg tggagagccg 1200
gtgttgcaga gacttgatgg aggagaaatt tgatcaggtg tgccagtggg tgctgaaatg 1260
caggaatagc aagaactcgc tgatccaaat gacaatcctt aatttgttgc cccgcttggc 1320
tgcattccga ccttctgcct tcacagatac ccagtatctc caagatacca tgaaccatgt 1380
cctaagctgt gtcaagaagg agaaggaacg tacagcggcc ttccaagccc tggggctact 1440
ttctgtggct gtgaggtctg agtttaaggt ctatttgcct cgcgtgctgg acatcatccg 1500
agcggccctg cccccaaagg acttcgccca taagaggcag aaggcaatgc aggtggatgc 1560
cacagtcttc acttgcatca gcatgctggc tcgagcaatg gggccaggca tccagcagga 1620
tatcaaggag ctgctggagc ccatgctggc agtgggacta agccctgccc tcactgcagt 1680
gctctacgac ctgagccgtc agattccaca gctaaagaag gacattcaag atgggctact 1740
gaaaatgctg tccctggtcc ttatgcacaa accccttcgc cacccaggca tgcccaaggg 1800
cctggcccat cagctggcct ctcctggcct cacgaccctc cctgaggcca gcgatgtggg 1860
cagcatcact cttgccctcc gaacgcttgg cagctttgaa tttgaaggcc actctctgac 1920
ccaatttgtt cgccactgtg cggatcattt cctgaacagt gagcacaagg agatccgcat 1980
ggaggctgcc cgcacctgct cccgcctgct cacaccctcc atccacctca tcagtggcca 2040
tgctcatgtg gttagccaga ccgcagtgca agtggtggca gatgtgctta gcaaactgct 2100
cgtagttggg ataacagatc ctgaccctga cattcgctac tgtgtcttgg cgtccctgga 2160
cgagcgcttt gatgcacacc tggcccaggc ggagaacttg caggccttgt ttgtggctct 2220
gaatgaccag gtgtttgaga tccgggagct ggccatctgc actgtgggcc gactcagtag 2280
catgaaccct gcctttgtca tgcctttcct gcgcaagatg ctcatccaga ttttgacaga 2340
gttggagcac agtgggattg gaagaatcaa agagcagagt gcccgcatgc tggggcacct 2400
ggtctccaat gccccccgac tcatccgccc ctacatggag cctattctga aggcattaat 2460
tttgaaactg aaagatccag accctgatcc aaacccaggt gtgatcaata atgtcctggc 2520
aacaatagga gaattggcac aggttagtgg cctggaaatg aggaaatggg ttgatgaact 2580
ttttattatc atcatggaca tgctccagga ttcctctttg ttggccaaaa ggcaggtggc 2640
tctgtggacc ctgggacagt tggtggccag cactggctat gtagtagagc cctacaggaa 2700
gtaccctact ttgcttgagg tgctactgaa ttttctgaag actgagcaga accagggtac 2760
acgcagagag gccatccgtg tgttagggct tttaggggct ttggatcctt acaagcacaa 2820
agtgaacatt ggcatgatag accagtcccg ggatgcctct gctgtcagcc tgtcagaatc 2880
caagtcaagt caggattcct ctgactatag cactagtgaa atgctggtca acatgggaaa 2940
cttgcctctg gatgagttct acccagctgt gtccatggtg gccctgatgc ggatcttccg 3000
agaccagtca ctctctcatc atcacaccat ggttgtccag gccatcacct tcatcttcaa 3060
gtccctggga ctcaaatgtg tgcagttcct gccccaggtc atgcccacgt tccttaacgt 3120
cattcgagtc tgtgatgggg ccatccggga atttttgttc cagcagctgg gaatgttggt 3180
gtcctttgtg aagagccaca tcagacctta tatggatgaa atagtcaccc tcatgagaga 3240
attctgggtc atgaacacct caattcagag cacgatcatt cttctcattg agcaaattgt 3300
ggtagctctt gggggtgaat ttaagctcta cctgccccag ctgatcccac acatgctgcg 3360
tgtcttcatg catgacaaca gcccaggccg cattgtctct atcaagttac tggctgcaat 3420
ccagctgttt ggcgccaacc tggatgacta cctgcattta ctgctgcctc ctattgttaa 3480
gttgtttgat gcccctgaag ctccactgcc atctcgaaag gcagcgctag agactgtgga 3540
ccgcctgacg gagtccctgg atttcactga ctatgcctcc cggatcattc accctattgt 3600
tcgaacactg gaccagagcc cagaactgcg ctccacagcc atggacacgc tgtcttcact 3660
tgtttttcag ctggggaaga agtaccaaat tttcattcca atggtgaata aagttctggt 3720
gcgacaccga atcaatcatc agcgctatga tgtgctcatc tgcagaattg tcaagggata 3780
cacacttgct gatgaagagg aggatccttt gatttaccag catcggatgc ttaggagtgg 3840
ccaaggggat gcattggcta gtggaccagt ggaaacagga cccatgaaga aactgcacgt 3900
cagcaccatc aacctccaaa aggcctgggg cgctgccagg agggtctcca aagatgactg 3960
gctggaatgg ctgagacggc tgagcctgga gctgctgaag gactcatcat cgccctccct 4020
gcgctcctgc tgggccctgg cacaggccta caacccgatg gccagggatc tcttcaatgc 4080
tgcatttgtg tcctgctggt ctgaactgaa tgaagatcaa caggatgagc tcatcagaag 4140
catcgagttg gccctcacct cacaagacat cgctgaagtc acacagaccc tcttaaactt 4200
ggctgaattc atggaacaca gtgacaaggg ccccctgcca ctgagagatg acaatggcat 4260
tgttctgctg ggtgagagag ctgccaagtg ccgagcatat gccaaagcac tacactacaa 4320
agaactggag ttccagaaag gccccacccc tgccattcta gaatctctca tcagcattaa 4380
taataagcta cagcagccgg aggcagcggc cggagtgtta gaatatgcca tgaaacactt 4440
tggagagctg gagatccagg ctacctggta tgagaaactg cacgagtggg aggatgccct 4500
tgtggcctat gacaagaaaa tggacaccaa caaggacgac ccagagctga tgctgggccg 4560
catgcgctgc ctcgaggcct tgggggaatg gggtcaactc caccagcagt gctgtgaaaa 4620
gtggaccctg gttaatgatg agacccaagc caagatggcc cggatggctg ctgcagctgc 4680
atggggttta ggtcagtggg acagcatgga agaatacacc tgtatgatcc ctcgggacac 4740
ccatgatggg gcattttata gagctgtgct ggcactgcat caggacctct tctccttggc 4800
acaacagtgc attgacaagg ccagggacct gctggatgct gaattaactg cgatggcagg 4860
agagagttac agtcgggcat atggggccat ggtttcttgc cacatgctgt ccgagctgga 4920
ggaggttatc cagtacaaac ttgtccccga gcgacgagag atcatccgcc agatctggtg 4980
ggagagactg cagggctgcc agcgtatcgt agaggactgg cagaaaatcc ttatggtgcg 5040
gtcccttgtg gtcagccctc atgaagacat gagaacctgg ctcaagtatg caagcctgtg 5100
cggcaagagt ggcaggctgg ctcttgctca taaaacttta gtgttgctcc tgggagttga 5160
tccgtctcgg caacttgacc atcctctgcc aacagttcac cctcaggtga cctatgccta 5220
catgaaaaac atgtggaaga gtgcccgcaa gatcgatgcc ttccagcaca tgcagcattt 5280
tgtccagacc atgcagcaac aggcccagca tgccatcgct actgaggacc agcagcataa 5340
gcaggaactg cacaagctca tggcccgatg cttcctgaaa cttggagagt ggcagctgaa 5400
tctacagggc atcaatgaga gcacaatccc caaagtgctg cagtactaca gcgccgccac 5460
agagcacgac cgcagctggt acaaggcctg gcatgcgtgg gcagtgatga acttcgaagc 5520
tgtgctacac tacaaacatc agaaccaagc ccgcgatgag aagaagaaac tgcgtcatgc 5580
cagcggggcc aacatcacca acgccaccac tgccgccacc acggccgcca ctgccaccac 5640
cactgccagc accgagggca gcaacagtga gagcgaggcc gagagcaccg agaacagccc 5700
caccccatcg ccgctgcaga agaaggtcac tgaggatctg tccaaaaccc tcctgatgta 5760
cacggtgcct gccgtccagg gcttcttccg ttccatctcc ttgtcacgag gcaacaacct 5820
ccaggataca ctcagagttc tcaccttatg gtttgattat ggtcactggc cagatgtcaa 5880
tgaggcctta gtggaggggg tgaaagccat ccagattgat acctggctac aggttatacc 5940
tcagctcatt gcaagaattg atacgcccag acccttggtg ggacgtctca ttcaccagct 6000
tctcacagac attggtcggt accaccccca ggccctcatc tacccactga cagtggcttc 6060
taagtctacc acgacagccc ggcacaatgc agccaacaag attctgaaga acatgtgtga 6120
gcacagcaac accctggtcc agcaggccat gatggtgagc gaggagctga tccgagtggc 6180
catcctctgg catgagatgt ggcatgaagg cctggaagag gcatctcgtt tgtactttgg 6240
ggaaaggaac gtgaaaggca tgtttgaggt gctggagccc ttgcatgcta tgatggaacg 6300
gggcccccag actctgaagg aaacatcctt taatcaggcc tatggtcgag atttaatgga 6360
ggcccaagag tggtgcagga agtacatgaa atcagggaat gtcaaggacc tcacccaagc 6420
ctgggacctc tattatcatg tgttccgacg aatctcaaag cagctgcctc agctcacatc 6480
cttagagctg caatatgttt ccccaaaact tctgatgtgc cgggaccttg aattggctgt 6540
gccaggaaca tatgacccca accagccaat cattcgcatt cagtccatag caccgtcttt 6600
gcaagtcatc acatccaagc agaggccccg gaaattgaca cttatgggca gcaacggaca 6660
tgagtttgtt ttccttctaa aaggccatga agatctgcgc caggatgagc gtgtgatgca 6720
gctcttcggc ctggttaaca cccttctggc caatgaccca acatctcttc ggaaaaacct 6780
cagcatccag agatacgctg tcatcccttt atcgaccaac tcgggcctca ttggctgggt 6840
tccccactgt gacacactgc acgccctcat ccgggactac agggagaaga agaagatcct 6900
tctcaacatc gagcatcgca tcatgttgcg gatggctccg gactatgacc acttgactct 6960
gatgcagaag gtggaggtgt ttgagcatgc cgtcaataat acagctgggg acgacctggc 7020
caagctgctg tggctgaaaa gccccagctc cgaggtgtgg tttgaccgaa gaaccaatta 7080
tacccgttct ttagcggtca tgtcaatggt tgggtatatt ttaggcctgg gagatagaca 7140
cccatccaac ctgatgctgg accgtctgag tgggaagatc ctgcacattg actttgggga 7200
ctgctttgag gttgctatga cccgagagaa gtttccagag aagattccat ttagactaac 7260
aagaatgttg accaatgcta tggaggttac aggcctggat ggcaactaca gaatcacatg 7320
ccacacagtg atggaggtgc tgcgagagca caaggacagt gtcatggccg tgctggaagc 7380
ctttgtctat gaccccttgc tgaactggag gctgatggac acaaatacca aaggcaacaa 7440
gcgatcccga acgaggacgg attcctactc tgctggccag tcagtcgaaa ttttggacgg 7500
tgtggaactt ggagagccag cccataagaa aacggggacc acagtgccag aatctattca 7560
ttctttcatt ggagacggtt tggtgaaacc agaggcccta aataagaaag ctatccagat 7620
tattaacagg gttcgagata agctcactgg tcgggacttc tctcatgatg acactttgga 7680
tgttccaacg caagttgagc tgctcatcaa acaagcgaca tcccatgaaa acctctgcca 7740
gtgctatatt ggctggtgcc ctttctggta actggaggcc cagatgtgcc catcacgttt 7800
tttctgaggc ttttgtactt tagtaaatgc ttccactaaa ctgaaaccat ggtgagaaag 7860
tttgactttg ttaaatattt tgaaatgtaa atgaaaagaa ctactgtata ttaaaagttg 7920
gtttgaacca actttctagc tgctgttgaa gaatatattg tcagaaacac aaggcttgat 7980
ttggttccca ggacagtgaa acatagtaat accacgtaaa tcaagccatt cattttgggg 8040
aacagaagat ccataacttt agaaatacgg gttttgactt aactcacaag agaactcatc 8100
ataagtactt gctgatggaa gaatgaccta gttgctcctc tcaacatggg tacagcaaac 8160
tcagcacagc caagaagcct caggtcgtgg agaacatgga ttaggatcct agactgtaaa 8220
gacacagaag atgctgacct cacccctgcc acctatccca agacctcact ggtctgtgga 8280
cagcagcaga aatgtttgca agataggcca aaatgagtac aaaaggtctg tcttccatca 8340
gacccagtga tgctgcgact cacacgcttc aattcaagac ctgaccgcta gtagggaggt 8400
ttattcagat cgctggcagc ctcggctgag cagatgcaca gaggggatca ctgtgcagtg 8460
ggaccaccct cactggcctt ctgcagcagg gttctgggat gttttcagtg gtcaaaatac 8520
tctgtttaga gcaagggctc agaaaacaga aatactgtca tggaggtgct gaacacaggg 8580
aaggtctggt acatattgga aattatgagc agaacaaata ctcaactaaa tgcacaaagt 8640
ataaagtgta gccatgtcta gacaccatgt tgtatcagaa taatttttgt gccaataaat 8700
gacatcagaa ttttaaacat atgtaaaaaa aaa 8733
<210> 3
<211> 108
<212> PRT
<213> Homo sapiens
<400> 3
Met Gly Val Gln Val Glu Thr Ile Ser Pro Gly Asp Gly Arg Thr Phe
1 5 10 15
Pro Lys Arg Gly Gln Thr Cys Val Val His Tyr Thr Gly Met Leu Glu
20 25 30
Asp Gly Lys Lys Phe Asp Ser Ser Arg Asp Arg Asn Lys Pro Phe Lys
35 40 45
Phe Met Leu Gly Lys Gln Glu Val Ile Arg Gly Trp Glu Glu Gly Val
50 55 60
Ala Gln Met Ser Val Gly Gln Arg Ala Lys Leu Thr Ile Ser Pro Asp
65 70 75 80
Tyr Ala Tyr Gly Ala Thr Gly His Pro Gly Ile Ile Pro Pro His Ala
85 90 95
Thr Leu Val Phe Asp Val Glu Leu Leu Lys Leu Glu
100 105
<210> 4
<211> 118
<212> PRT
<213> Homo sapiens
<400> 4
Met Ser Gly Gly Ser Ser Cys Ser Gln Thr Pro Ser Arg Ala Ile Pro
1 5 10 15
Ala Thr Arg Arg Val Val Leu Gly Asp Gly Val Gln Leu Pro Pro Gly
20 25 30
Asp Tyr Ser Thr Thr Pro Gly Gly Thr Leu Phe Ser Thr Thr Pro Gly
35 40 45
Gly Thr Arg Ile Ile Tyr Asp Arg Lys Phe Leu Met Glu Cys Arg Asn
50 55 60
Ser Pro Val Thr Lys Thr Pro Pro Arg Asp Leu Pro Thr Ile Pro Gly
65 70 75 80
Val Thr Ser Pro Ser Ser Asp Glu Pro Pro Met Glu Ala Ser Gln Ser
85 90 95
His Leu Arg Asn Ser Pro Glu Asp Lys Arg Ala Gly Gly Glu Glu Ser
100 105 110
Gln Phe Glu Met Asp Ile
115
<210> 5
<211> 480
<212> PRT
<213> Homo sapiens
<400> 5
Met Ser Asp Val Ala Ile Val Lys Glu Gly Trp Leu His Lys Arg Gly
1 5 10 15
Glu Tyr Ile Lys Thr Trp Arg Pro Arg Tyr Phe Leu Leu Lys Asn Asp
20 25 30
Gly Thr Phe Ile Gly Tyr Lys Glu Arg Pro Gln Asp Val Asp Gln Arg
35 40 45
Glu Ala Pro Leu Asn Asn Phe Ser Val Ala Gln Cys Gln Leu Met Lys
50 55 60
Thr Glu Arg Pro Arg Pro Asn Thr Phe Ile Ile Arg Cys Leu Gln Trp
65 70 75 80
Thr Thr Val Ile Glu Arg Thr Phe His Val Glu Thr Pro Glu Glu Arg
85 90 95
Glu Glu Trp Thr Thr Ala Ile Gln Thr Val Ala Asp Gly Leu Lys Lys
100 105 110
Gln Glu Glu Glu Glu Met Asp Phe Arg Ser Gly Ser Pro Ser Asp Asn
115 120 125
Ser Gly Ala Glu Glu Met Glu Val Ser Leu Ala Lys Pro Lys His Arg
130 135 140
Val Thr Met Asn Glu Phe Glu Tyr Leu Lys Leu Leu Gly Lys Gly Thr
145 150 155 160
Phe Gly Lys Val Ile Leu Val Lys Glu Lys Ala Thr Gly Arg Tyr Tyr
165 170 175
Ala Met Lys Ile Leu Lys Lys Glu Val Ile Val Ala Lys Asp Glu Val
180 185 190
Ala His Thr Leu Thr Glu Asn Arg Val Leu Gln Asn Ser Arg His Pro
195 200 205
Phe Leu Thr Ala Leu Lys Tyr Ser Phe Gln Thr His Asp Arg Leu Cys
210 215 220
Phe Val Met Glu Tyr Ala Asn Gly Gly Glu Leu Phe Phe His Leu Ser
225 230 235 240
Arg Glu Arg Val Phe Ser Glu Asp Arg Ala Arg Phe Tyr Gly Ala Glu
245 250 255
Ile Val Ser Ala Leu Asp Tyr Leu His Ser Glu Lys Asn Val Val Tyr
260 265 270
Arg Asp Leu Lys Leu Glu Asn Leu Met Leu Asp Lys Asp Gly His Ile
275 280 285
Lys Ile Thr Asp Phe Gly Leu Cys Lys Glu Gly Ile Lys Asp Gly Ala
290 295 300
Thr Met Lys Thr Phe Cys Gly Thr Pro Glu Tyr Leu Ala Pro Glu Val
305 310 315 320
Leu Glu Asp Asn Asp Tyr Gly Arg Ala Val Asp Trp Trp Gly Leu Gly
325 330 335
Val Val Met Tyr Glu Met Met Cys Gly Arg Leu Pro Phe Tyr Asn Gln
340 345 350
Asp His Glu Lys Leu Phe Glu Leu Ile Leu Met Glu Glu Ile Arg Phe
355 360 365
Pro Arg Thr Leu Gly Pro Glu Ala Lys Ser Leu Leu Ser Gly Leu Leu
370 375 380
Lys Lys Asp Pro Lys Gln Arg Leu Gly Gly Gly Ser Glu Asp Ala Lys
385 390 395 400
Glu Ile Met Gln His Arg Phe Phe Ala Gly Ile Val Trp Gln His Val
405 410 415
Tyr Glu Lys Lys Leu Ser Pro Pro Phe Lys Pro Gln Val Thr Ser Glu
420 425 430
Thr Asp Thr Arg Tyr Phe Asp Glu Glu Phe Thr Ala Gln Met Ile Thr
435 440 445
Ile Thr Pro Pro Asp Gln Asp Asp Ser Met Glu Cys Val Asp Ser Glu
450 455 460
Arg Arg Pro His Phe Pro Gln Phe Ser Tyr Ser Ala Ser Gly Thr Ala
465 470 475 480
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| С40-, С28- И С-32-СВЯЗАННЫЕ АНАЛОГИ РАПАМИЦИНА В КАЧЕСТВЕ ИНГИБИТОРОВ MTOR | 2019 |
|
RU2805211C2 |
| АНАЛОГИ РАПАМИЦИНА КАК ИНГИБИТОРЫ mTOR | 2018 |
|
RU2828109C2 |
| ПРОИЗВОДНЫЕ БЕНЗИЗОКСАЗОЛСУЛЬФОНАМИДА | 2020 |
|
RU2813356C2 |
| ИНГИБИТОРЫ МУТАЦИИ HER2 | 2022 |
|
RU2834124C2 |
| ПИРАЗОЛОПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ-ИНГИБИТОРЫ JAK И СПОСОБЫ | 2009 |
|
RU2539568C2 |
| СОЕДИНЕНИЯ | 2016 |
|
RU2725616C2 |
| ПРОИЗВОДНЫЕ 3-(5-ГИДРОКСИ-1-ОКСОИЗОИНДОЛИН-2-ИЛ) ПИПЕРИДИН-2,6-ДИОНА И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С БЕЛКОМ С "ЦИНКОВЫМИ ПАЛЬЦАМИ" 2 (IKZF2) СЕМЕЙСТВА IKAROS | 2019 |
|
RU2797559C2 |
| ПИРРОЛОБЕНЗОДИАЗЕПИНОВЫЕ КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2736725C1 |
| N1/N2-ЛАКТАМНЫЕ ИНГИБИТОРЫ АЦЕТИЛ-КоА-КАРБОКСИЛАЗ | 2011 |
|
RU2540337C2 |
| АНТИТЕЛА К В7-Н3 И КОНЪЮГАТЫ АНТИТЕЛА И ЛЕКАРСТВЕННОГО СРЕДСТВА | 2017 |
|
RU2764651C2 |
Изобретение относится к соединениям формулы Iа, а также к Фармацевтической композиция для ингибирования активности mTOR и способам лечения заболеваний или расстройств, опосредованных mTOR. Технический результат: получены новые соединения, обладающие активностью в отношении mTOR, которые могут быть применены в лечении опосредованных указанной активностью заболеваний, таких как рак или иммуноопосредованное заболевание. 15 н. и 47 з.п. ф-лы, 70 пр., 30 табл.
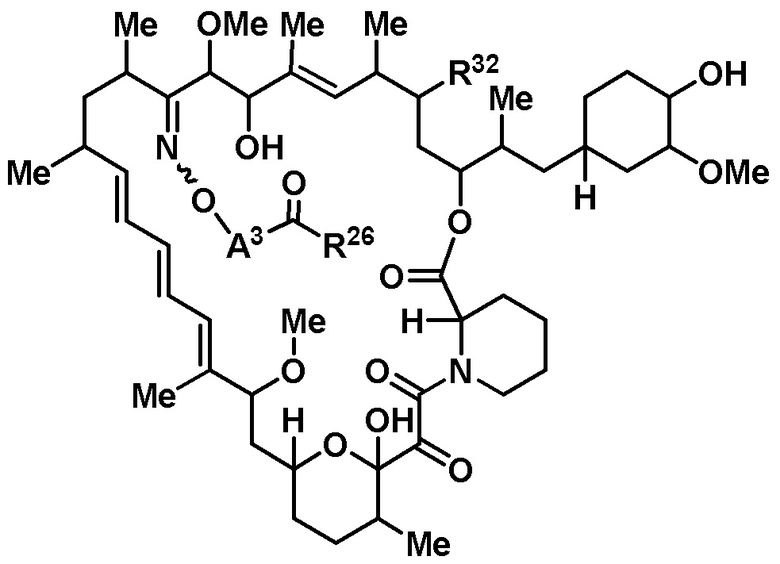 (Iа)
(Iа)
1. Соединение формулы Iа:
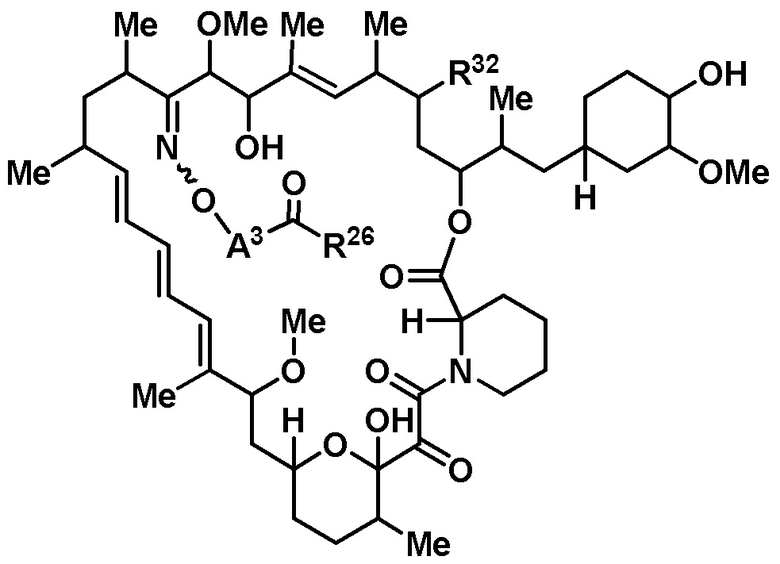 (Iа)
(Iа)
или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где:
R32 является -Н или -OR3;
A3 является -[C(R3)2]n- или C6ариленом;
R26 является -A1-L1-A2-B; -A1-A2-B; -L2-A1-L1-A2-L3-B;
A1 и A2 независимо отсутствуют или независимо выбраны из
 ,
,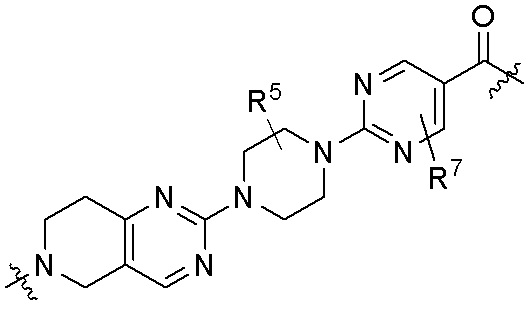 ,
,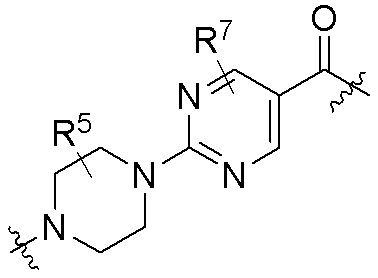 ,
,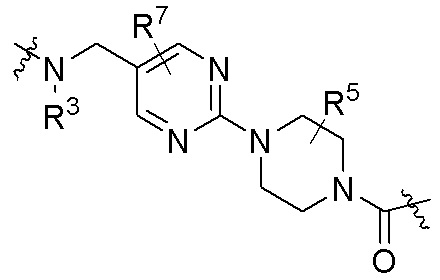 ,
,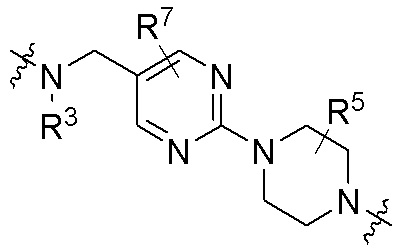 ,
,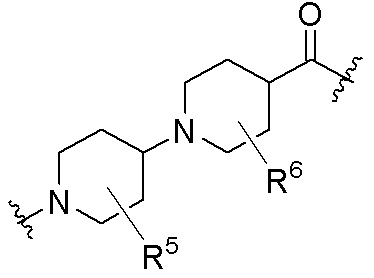 ,
,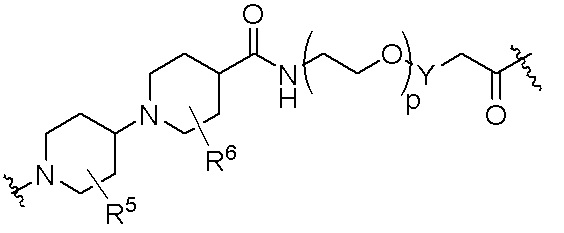 ,
,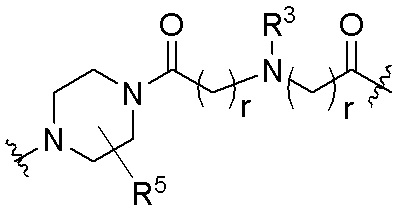 ,
, 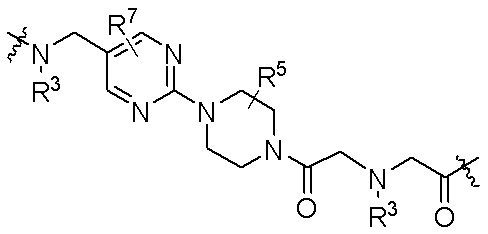 ,
,
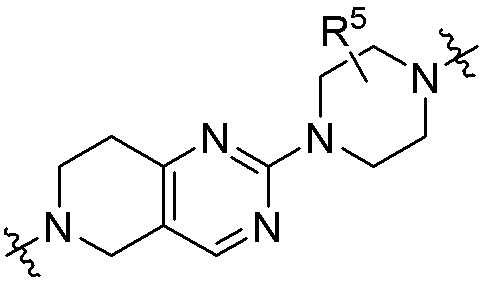 ,
,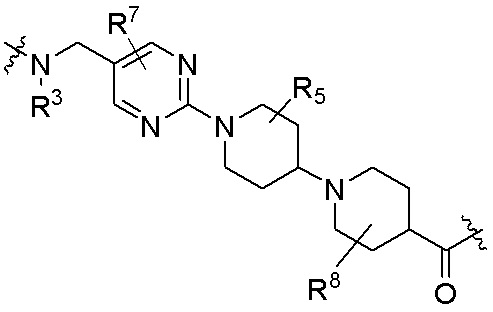 ,
,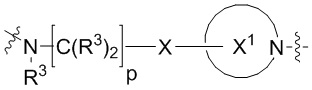
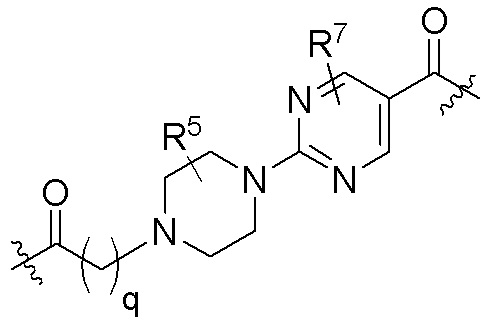 ;
;
каждый G1 представляет собой 6-членное гетероциклиленовое кольцо;
каждый X независимо отсутствует или имеет от 1 до 2 колец, выбранных из 10-членного арилена и 6-членного гетероциклилена, содержащего 1-2 атома азота;
каждый X1 представляет собой 6-членное гетероциклиленовое кольцо;
где связь на левой стороне A1, как изображено, связана с -C(=O)- или L2; и где связь на правой стороне группы A2, как изображено, связана с B или L3;
каждый L1 независимо выбирают из
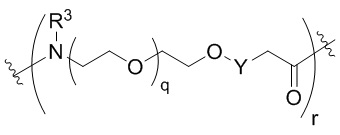 ,
, 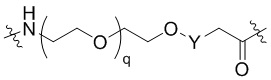 ,
, 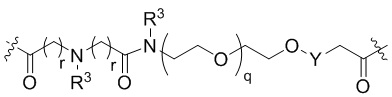
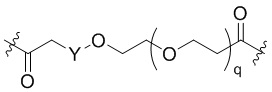 ,
,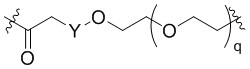 ,
, 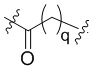 ,
, 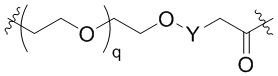 ,
, 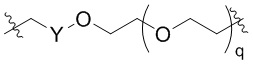 , и
, и 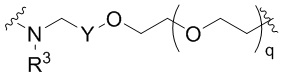 ;
;
L2 и L3 независимо отсутствуют или независимо выбраны из
 ,
,  ,
, 
 ,
, ,
,  ,
,  ,
,  , и
, и  ;
;
каждый B независимо выбирают из
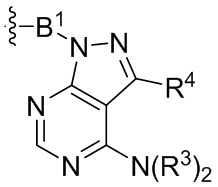 ,
, 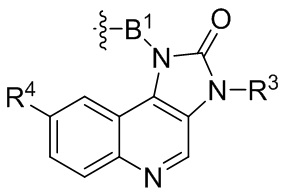 , и
, и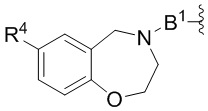 ;
;
каждый B1 независимо выбирают из  NR3-(C(R3)2)n-,
NR3-(C(R3)2)n-,  NR3-(C(R3)2)n-гетероариленгетероциклилен-(C6-C10)арилена-,
NR3-(C(R3)2)n-гетероариленгетероциклилен-(C6-C10)арилена-, 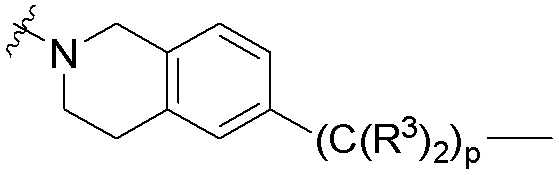 ,
, 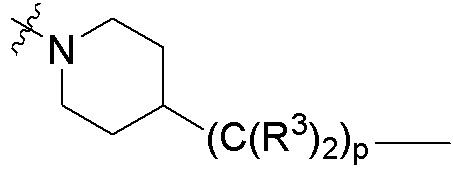 ,
,  (С6-С10)арилена,
(С6-С10)арилена,  гетероциклиленарилена- и
гетероциклиленарилена- и  NR3-(C(R3)2)n-S(O)2-арилен-C(O)-, где
NR3-(C(R3)2)n-S(O)2-арилен-C(O)-, где 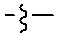 связь на левой стороне B1, как изображено, связана с A2 или L1; и где гетероарилен, гетероциклилен и арилен каждый независимо необязательно замещен алкилом, гидроксиалкилом, галоалкилом, алкокси, галогеном или гидроксилом;
связь на левой стороне B1, как изображено, связана с A2 или L1; и где гетероарилен, гетероциклилен и арилен каждый независимо необязательно замещен алкилом, гидроксиалкилом, галоалкилом, алкокси, галогеном или гидроксилом;
каждый R3 независимо является H или (C1-C6)алкилом;
каждый R4 независимо является H, (C1-C6)алкилом, галогеном, 5-12-членным гетероарилом, 5-12-членным гетероциклилом, (C6-C10)арилом, где гетероарил, гетероциклил и арил каждый независимо необязательно замещен -N(R3)2, -OR3, галогеном, (C1-C6)алкилом, -(C1-C6)алкиленгетероарилом, -(C1-C6)алкилен-CN, -C(O)NR3-гетероарилом или -C(O)NR3-гетероциклилом;
каждый R5 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил из (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый R6 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил из (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый R7 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый R8 независимо является H, (C1-C6)алкилом, -C(O)OR3 или -N(R3)2, где алкил (C1-C6)алкила необязательно замещен -N(R3)2 или -OR3;
каждый Y независимо является -C(R3)2 или связью;
каждый n независимо является целым числом от одного до 12;
каждый p независимо является целым числом от нуля до 12;
каждый q независимо является целым числом от нуля до 30; и
каждый r независимо является целым числом от одного до 6;
где каждый из гетероарилена или гетероарила представляет собой 6-членный гетероарилен или гетероарил, содержащий 1-2 атома азота;
каждый из арилена или арила представляет собой 6-членный арилен или арил;
каждый из гетероциклилена или гетероциклила представляет собой 6-членный гетероциклилен или гетероциклил, содержащий 1-2 атома азота;
каждый алкил представляет собой (C1-C6)алкил;
каждый алкокси представляет собой (C1-C6)алкокси.
2. Соединение по п. 1 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где R32 является -OR3.
3. Соединение по п. 1 или 2 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где A3 является -[C(R3)2]n-.
4. Соединение по п. 1 или 2 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где A3 является -(C6-C10)ариленом-.
5. Соединение по любому из пп. 1-4 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где R26 является -A1-L1-A2-B, где A1 и A2 отсутствуют.
6. Соединение по любому из пп. 1-4 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где R26 является -A1-L1-A2-B, где A2 отсутствует.
7. Соединение по любому из пп. 1-4 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где R26 является -A1-L1-A2-B, где A1 отсутствует.
8. Соединение по любому из пп. 1-4 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где R26 является -A1-L1-A2-B.
9. Соединение по любому из пп. 1-4 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где R26 является -A1-A2-B.
10. Соединение по любому из пп. 1-4 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где R26 является -L2-A1-L1-A2-L3-B.
11. Соединение по любому из пп. 1-10 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где L1 является 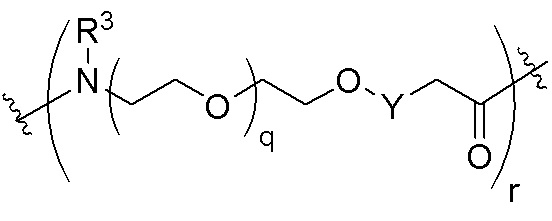 .
.
12. Соединение по любому из пп. 1-10 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где L1 является 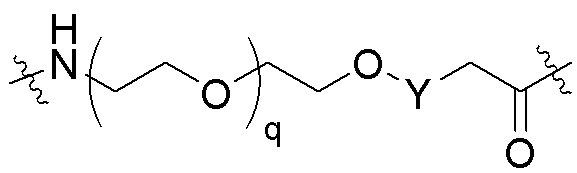 .
.
13. Соединение по любому из пп. 1-10 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где L1 является 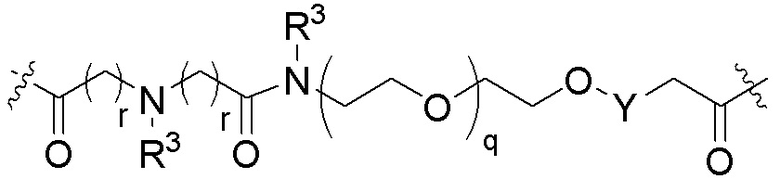 .
.
14. Соединение по любому из пп. 1-10 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где L1 является 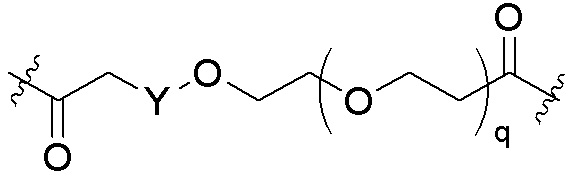 .
.
15. Соединение по любому из пп. 1-10 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где L1 является 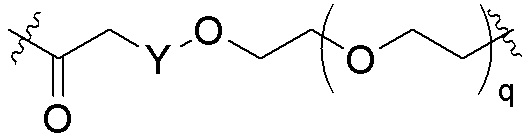 .
.
16. Соединение по любому из пп. 1-10 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где L1 является  .
.
17. Соединение по любому из пп. 1-10 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где L1 является 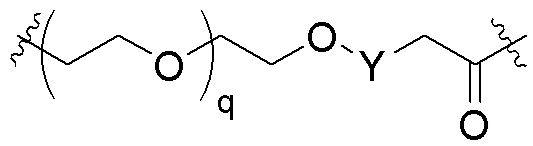 .
.
18. Соединение по любому из пп. 1-10 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где L1 является 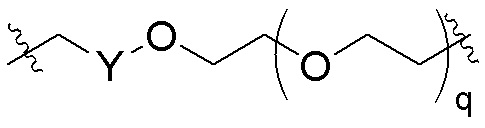 .
.
19. Соединение по любому из пп. 1-10 и 11-18 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где A1 отсутствует.
20. Соединение по любому из пп. 1-4, 6, 8-10 и 11-18 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где A1 является 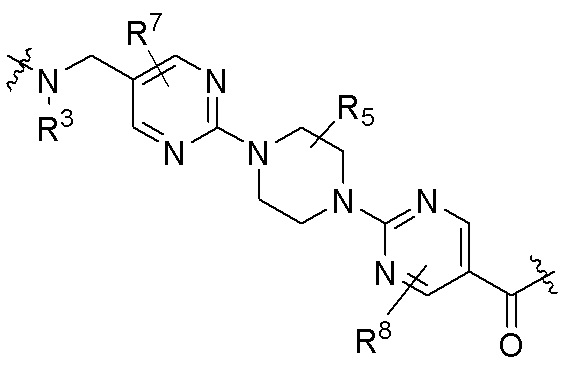 .
.
21. Соединение по любому из пп. 1-4, 6, 8-10 и 11-18 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где A1 является 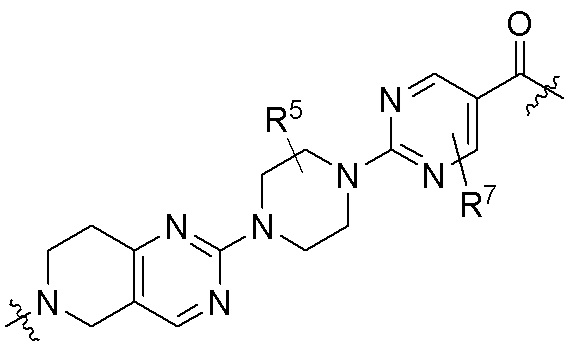 .
.
22. Соединение по любому из пп. 1-4, 6, 8-10 и 11-18 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где A1 является 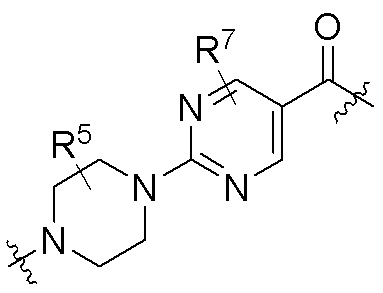 .
.
23. Соединение по любому из пп. 1-4, 6, 8-10 и 11-18 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где A1 является 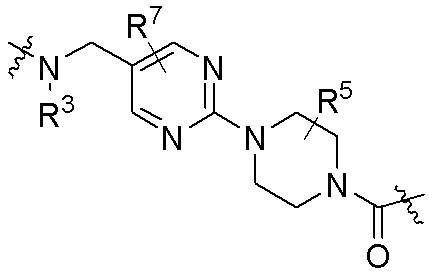 .
.
24. Соединение по любому из пп. 1-4, 6, 8-10 и 11-18 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где A1 является 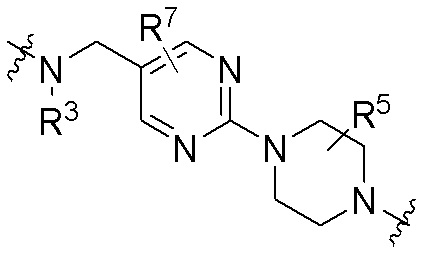 .
.
25. Соединение по любому из пп. 1-4, 6, 8-10 и 11-18 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где A1 является 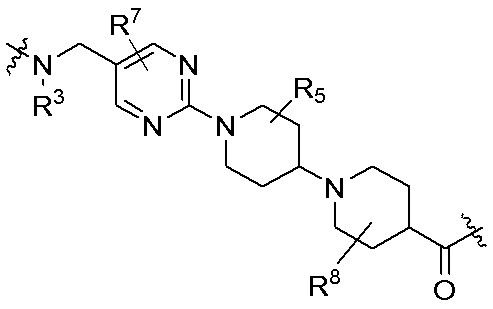 .
.
26. Соединение по любому из пп. 1-10 и 11-25 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где A2 отсутствует.
27. Соединение по любому из пп. 1-4, 7-10 и 11-25 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где A2 является 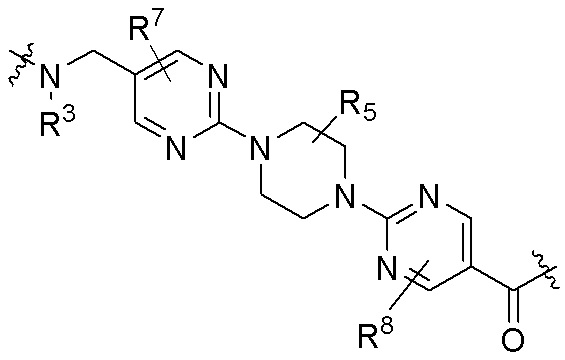 .
.
28. Соединение по любому из пп. 1-4, 7-10 и 11-25 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где A2 является 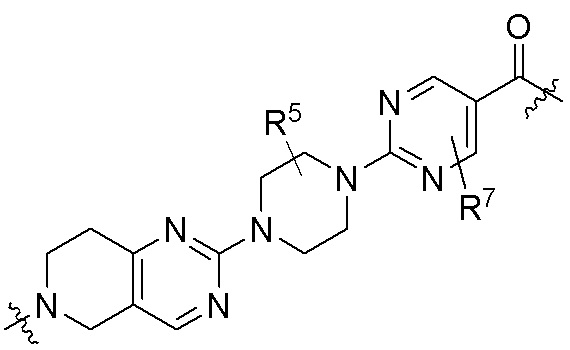 .
.
29. Соединение по любому из пп. 1-4, 7-10 и 11-25 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где A2 является 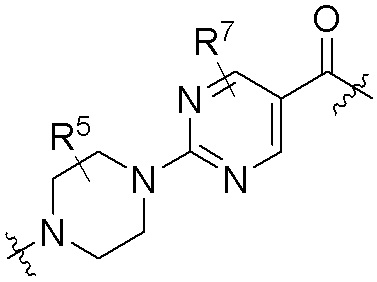 .
.
30. Соединение по любому из пп. 1-4, 7-10 и 11-25 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где A2 является 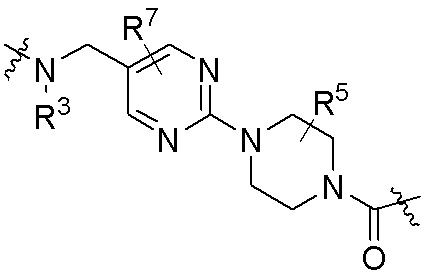 .
.
31. Соединение по любому из пп. 1-4, 7-10 и 11-25 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где A2 является 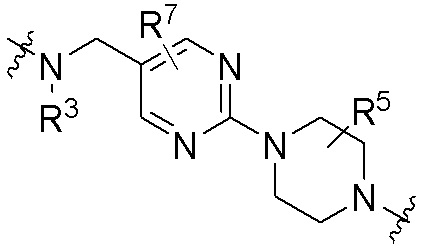 .
.
32. Соединение по любому из пп. 1-4, 7-10 и 11-25 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где A2 является 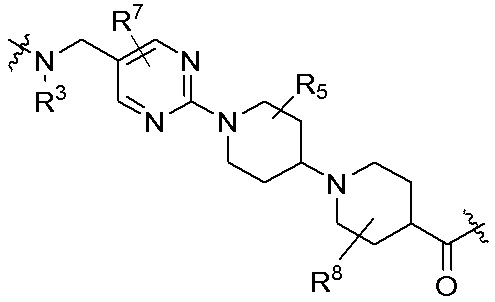 .
.
33. Соединение по любому из пп. 1-10 и 11-32 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где B является 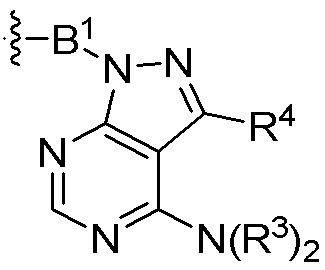 .
.
34. Соединение по любому из пп. 1-10 и 11-32 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где B является 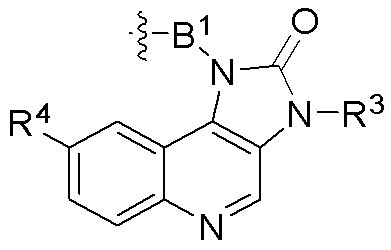 .
.
35. Соединение по любому из пп. 1-10 и 11-34 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где B1 является  NR3-(C(R3)2)n-.
NR3-(C(R3)2)n-.
36. Соединение по любому из пп. 1-10 и 11-34 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где B1 является 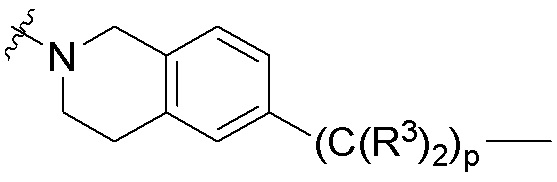 .
.
37. Соединение по любому из пп. 1-10 и 11-36 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где R4 является 5-12-членным гетероарилом, необязательно замещенным-N(R3)2, -OR3, галогеном, (C1-C6)алкилом, -(C1-C6)алкиленгетероарилом, -(C1-C6)алкилен-CN или -C(O)NR3-гетероарилом.
38. Соединение по любому из пп. 1-37 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, где соединение имеет следующую формулу:
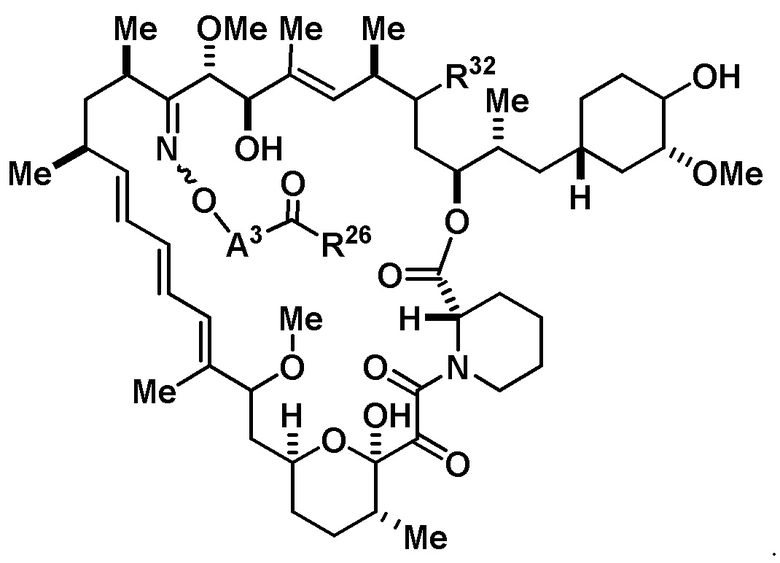
39. Соединение, выбранное из группы, состоящей из:
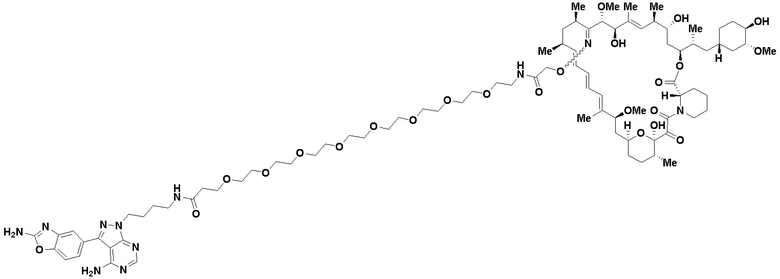
Пример 1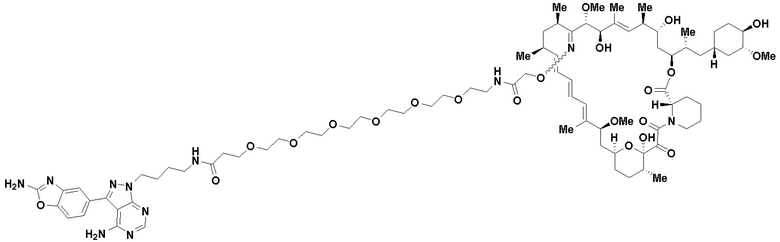
Пример 2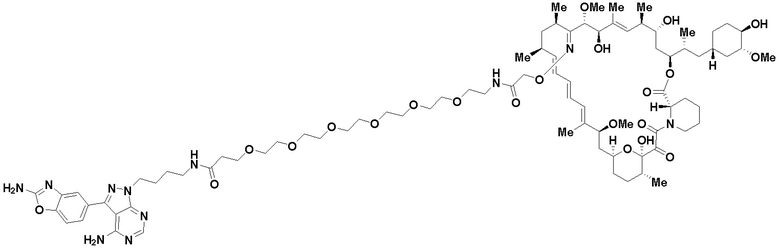
Пример 3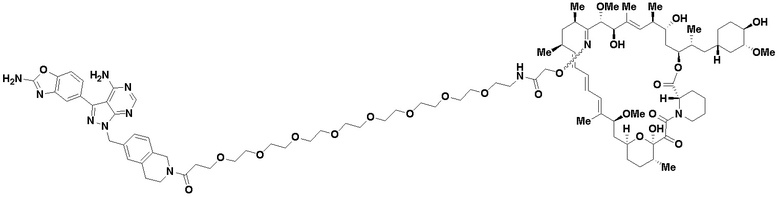
Пример 4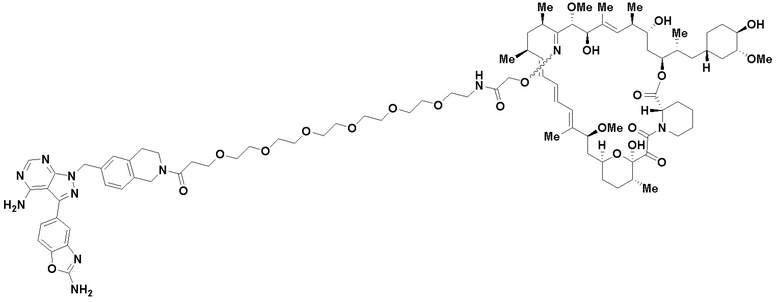
Пример 5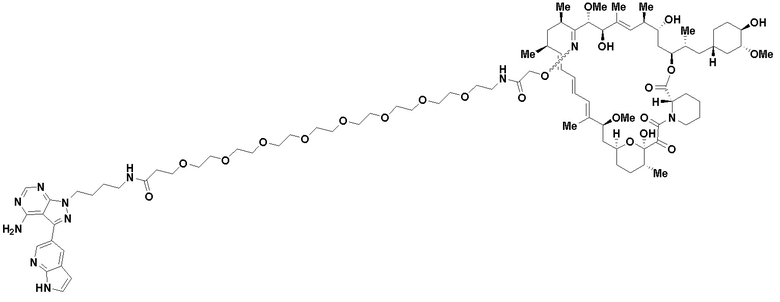
Пример 6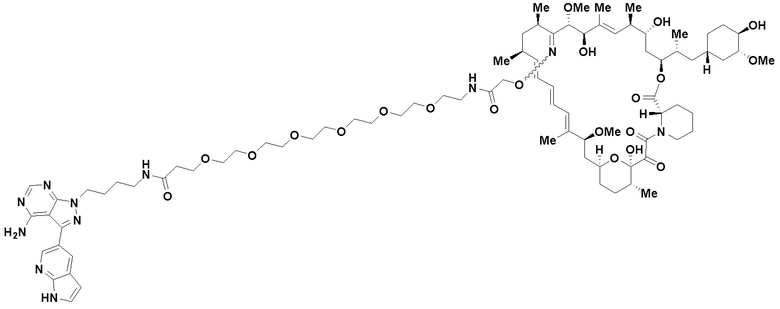
Пример 7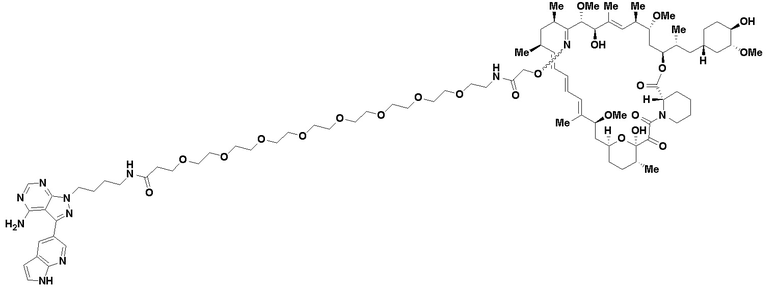
Пример 8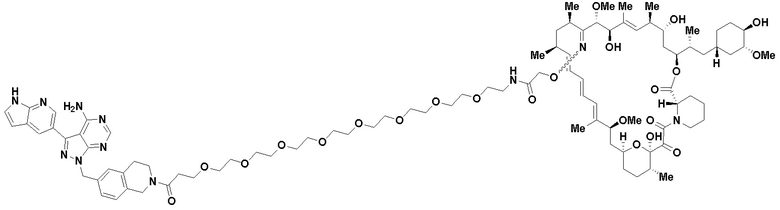
Пример 9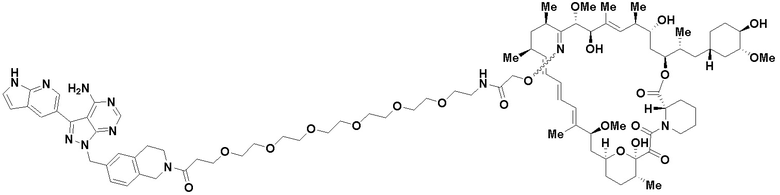
Пример 10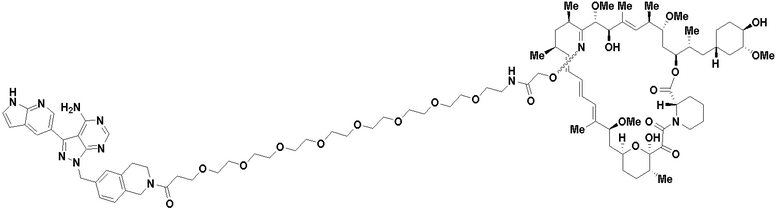
Пример 11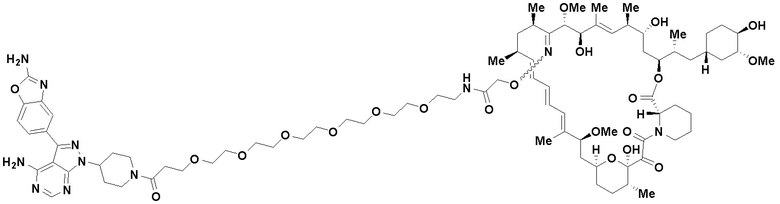
Пример 12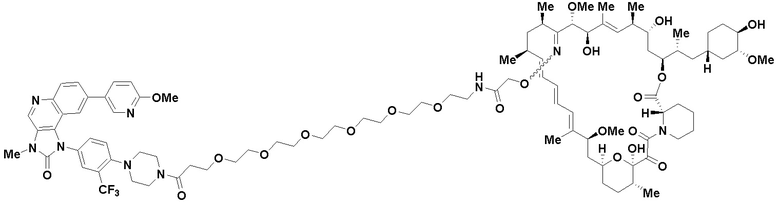
Пример 13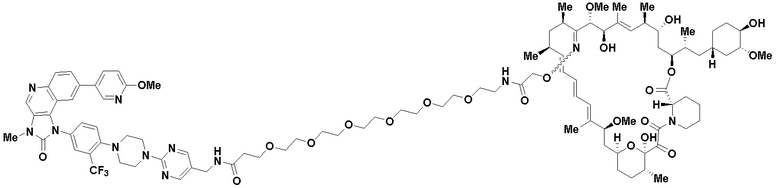
Пример 14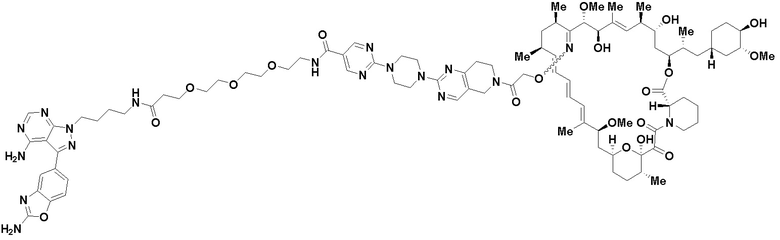
Пример 15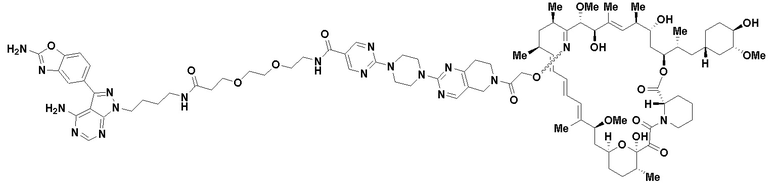
Пример 16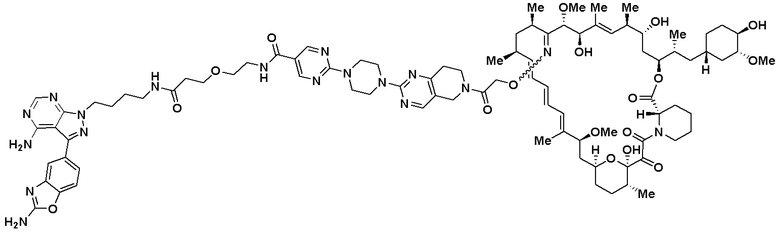
Пример 17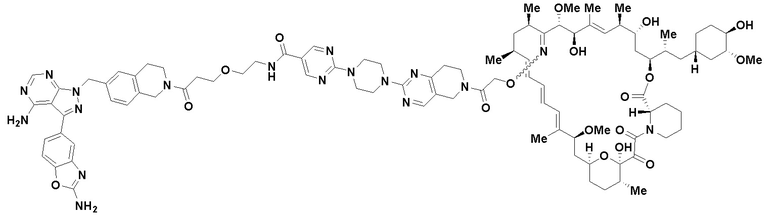
Пример 18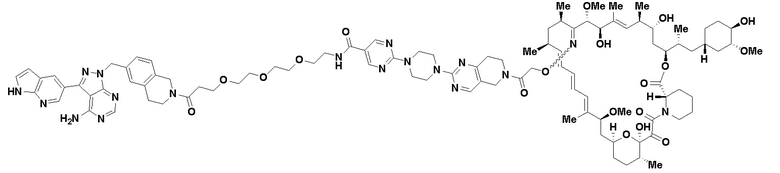
Пример 19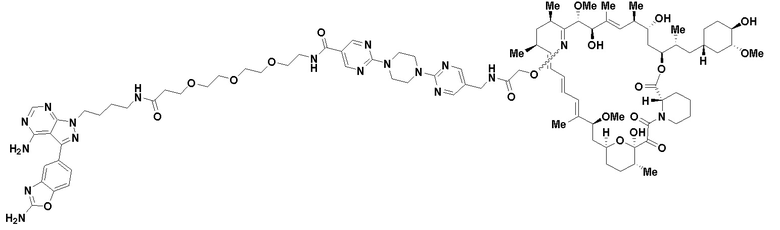
Пример 20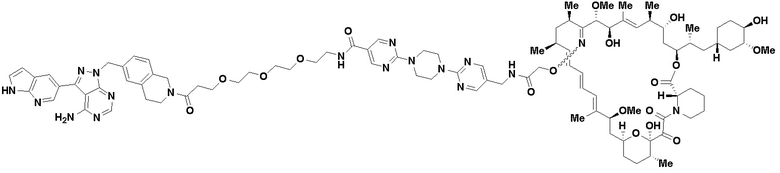
Пример 21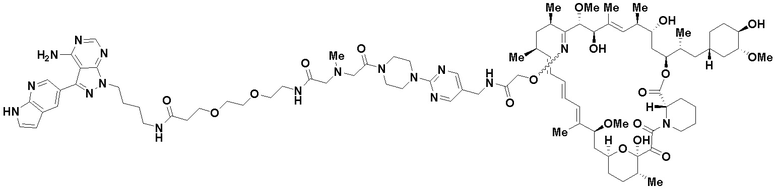
Пример 22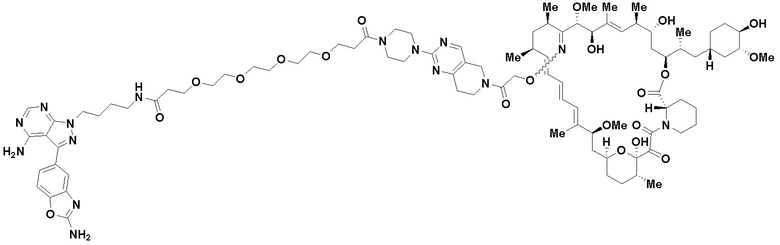
Пример 23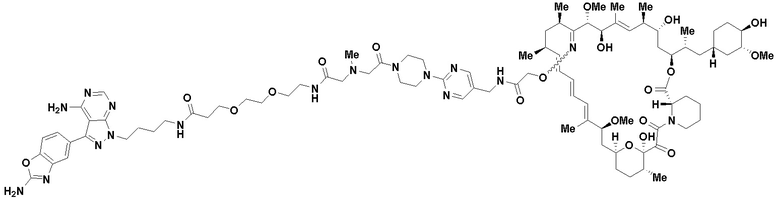
Пример 24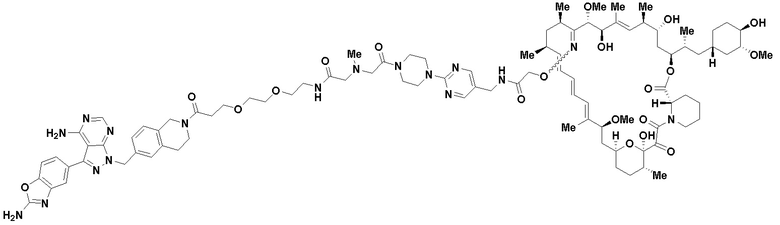
Пример 25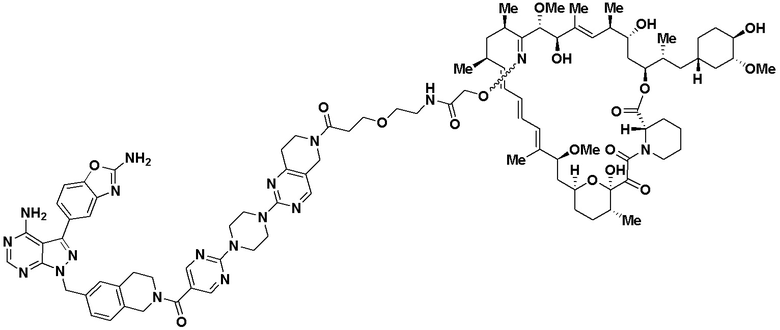
Пример 26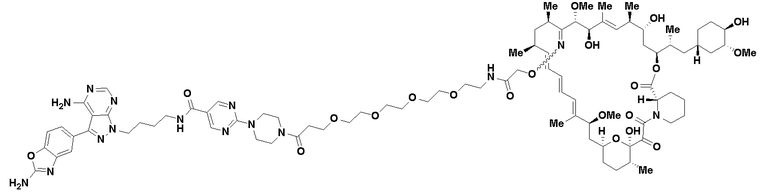
Пример 27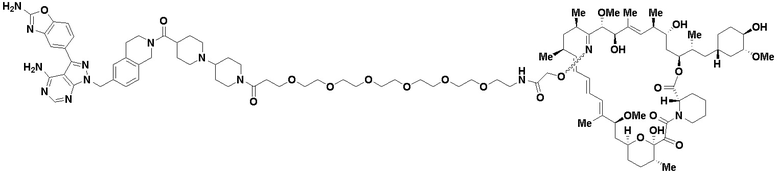
Пример 28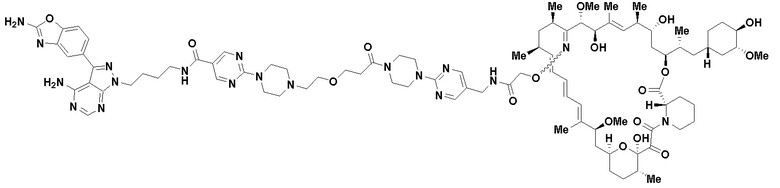
Пример 29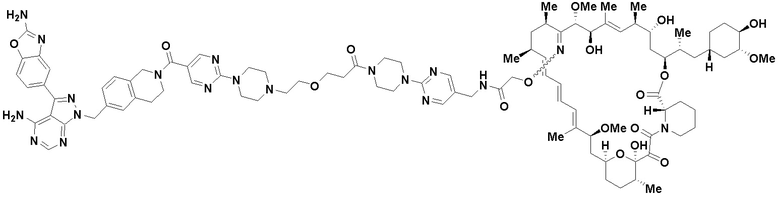
Пример 30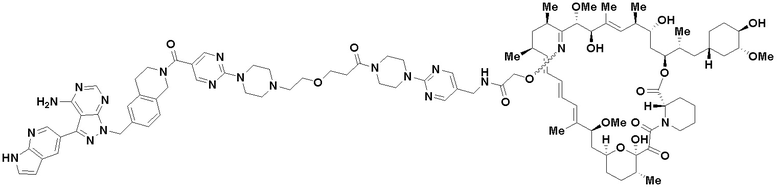
Пример 31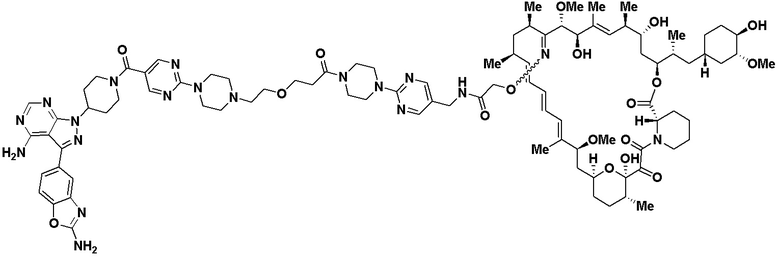
Пример 32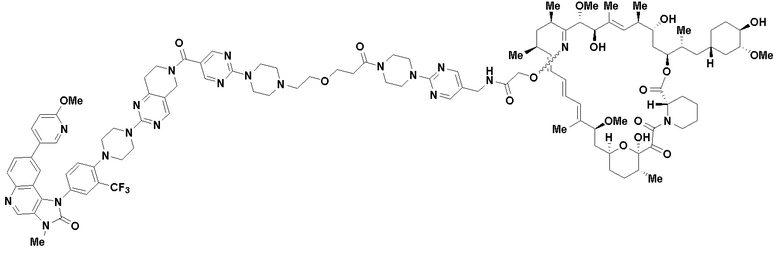
Пример 33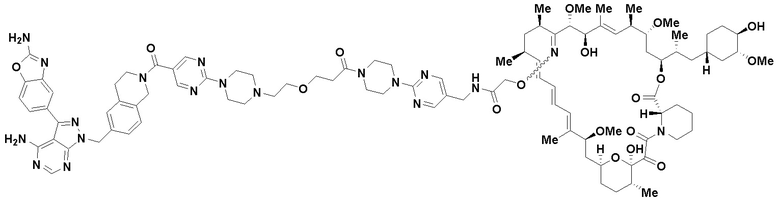
Пример 34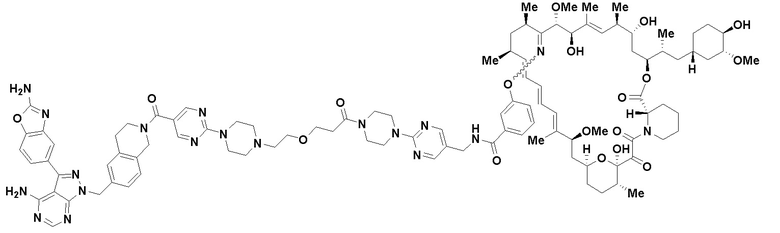
Пример 35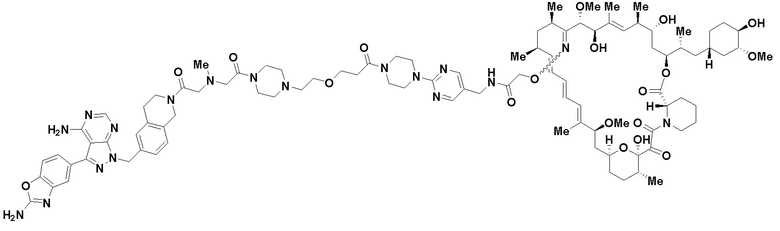
Пример 36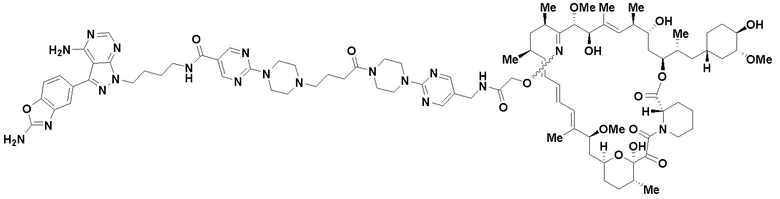
Пример 37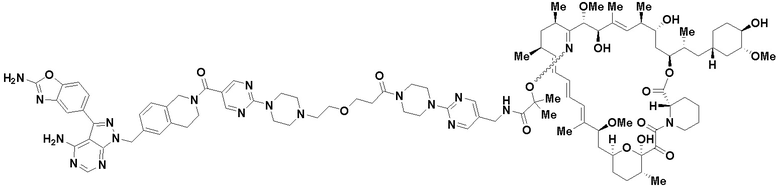
Пример 38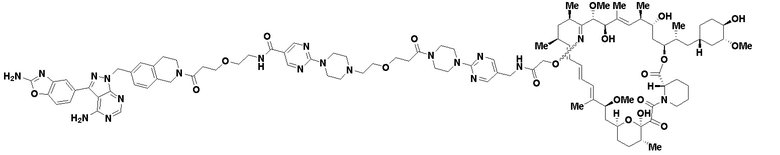
Пример 39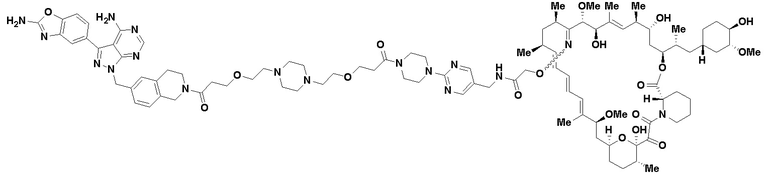
Пример 40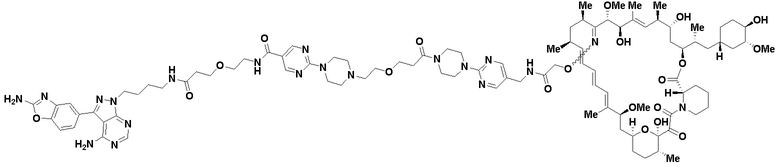
Пример 41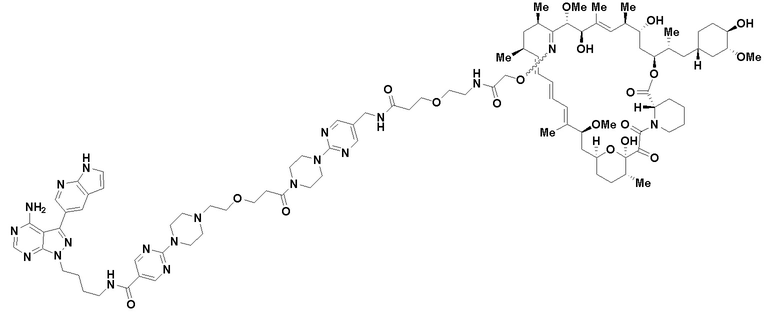
Пример 42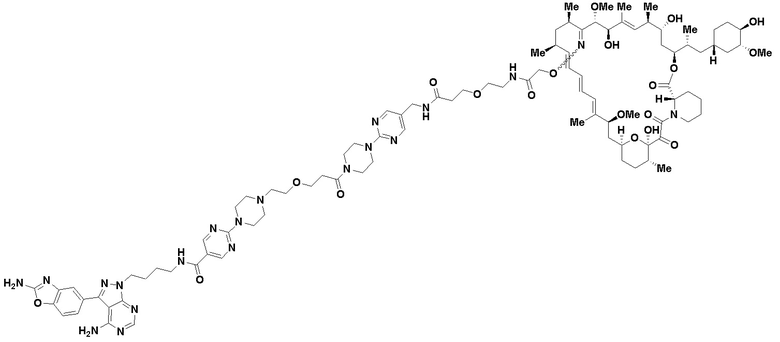
Пример 43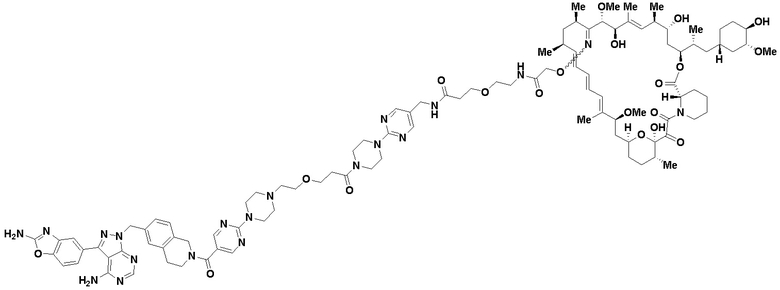
Пример 44
или его фармацевтически приемлемая соль, оксепановый изомер или таутомер.
40. Соединение, выбранное из группы, состоящей из:

Пример 45
Пример 46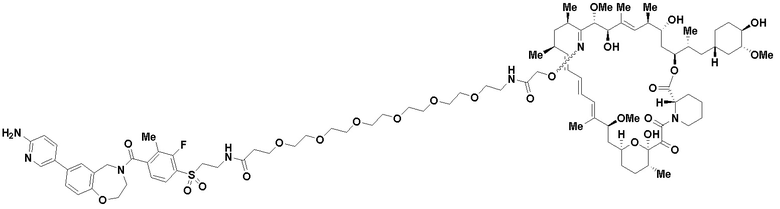
Пример 47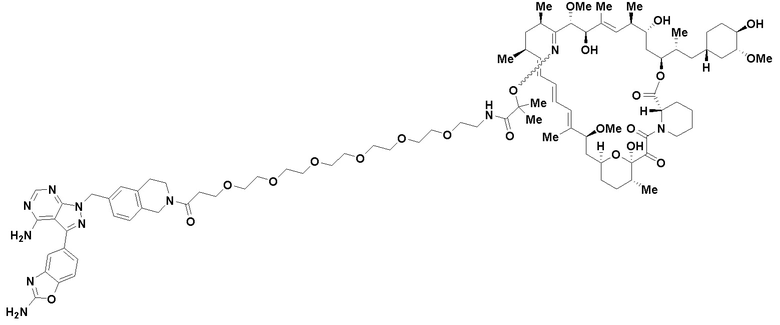
Пример 48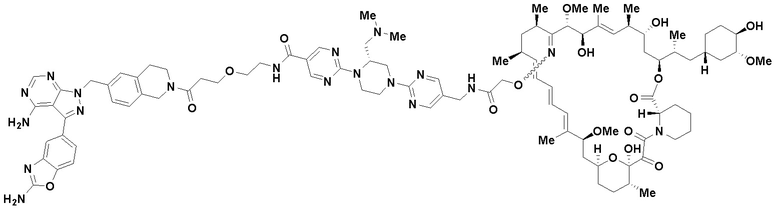
Пример 49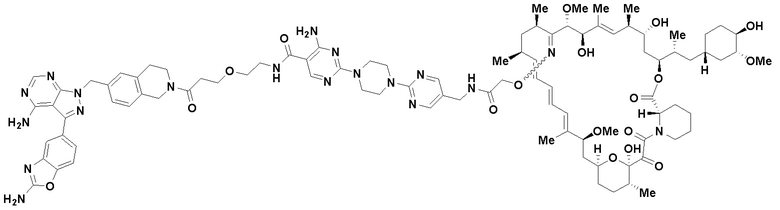
Пример 50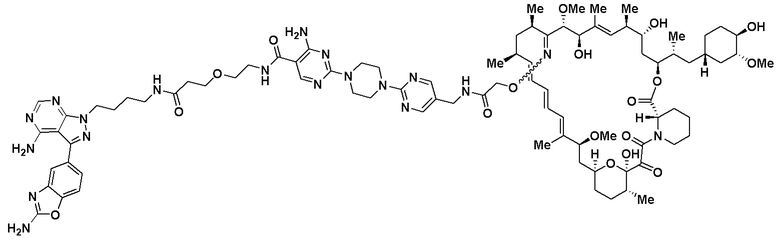
Пример 51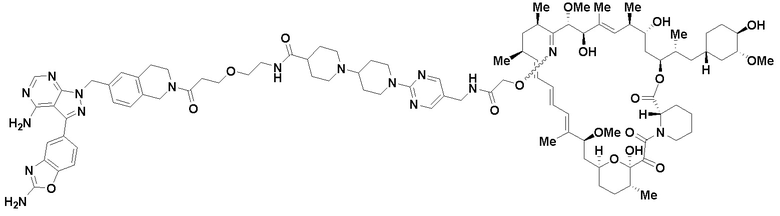
Пример 52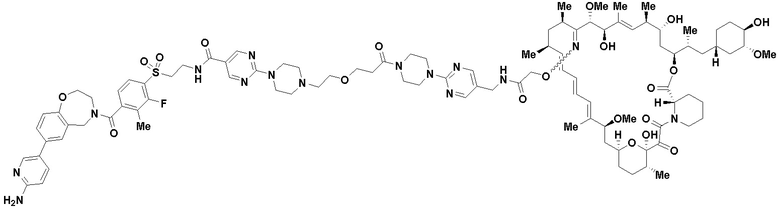
Пример 53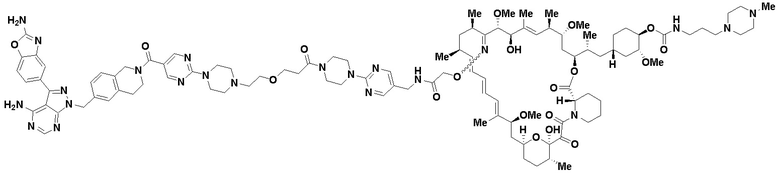
Пример 54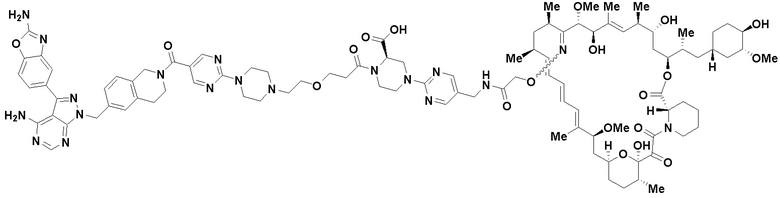
Пример 55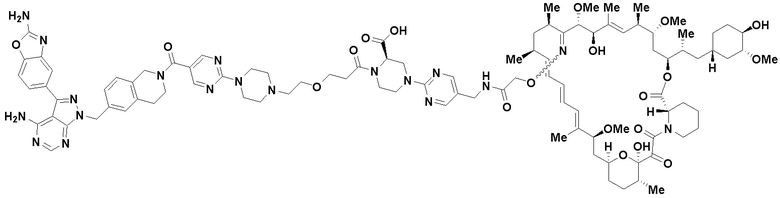
Пример 56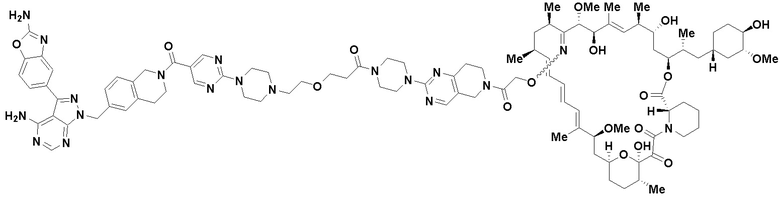
Пример 57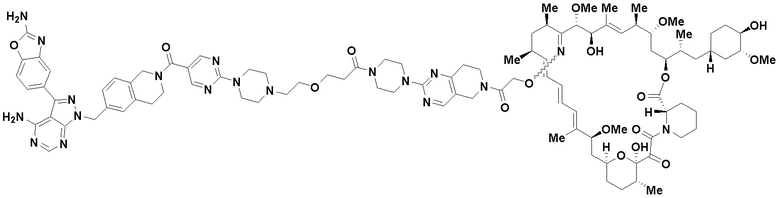
Пример 58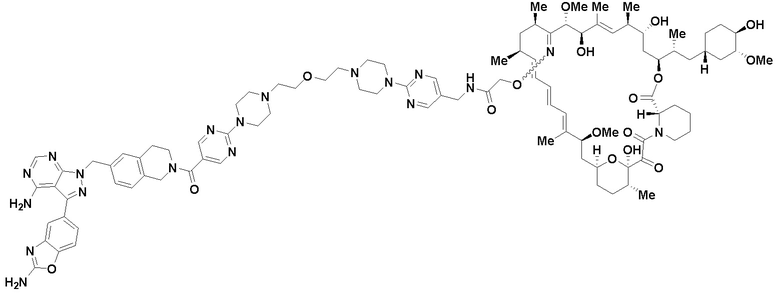
Пример 59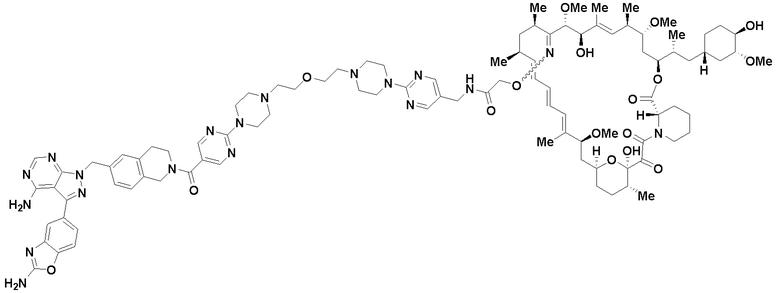
Пример 60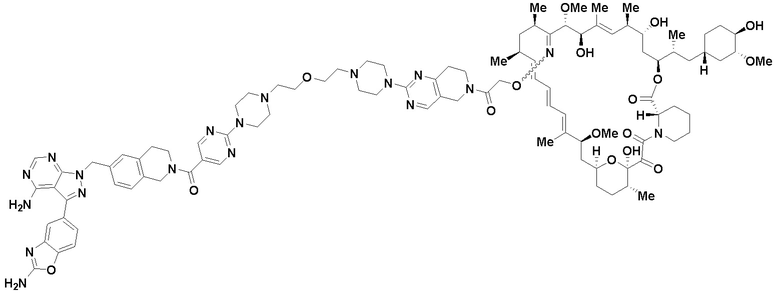
Пример 61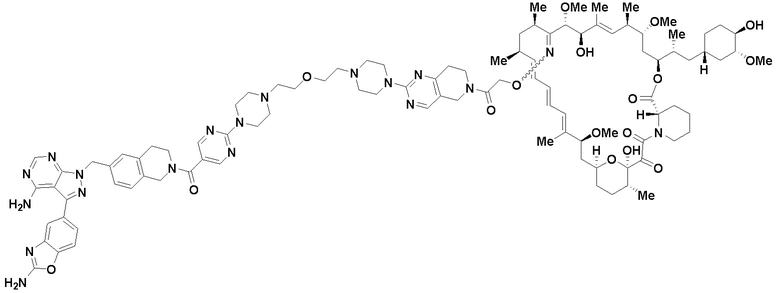
Пример 62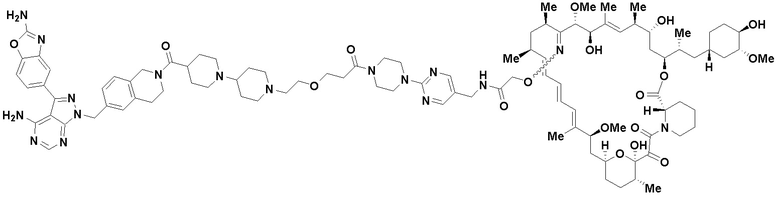
Пример 63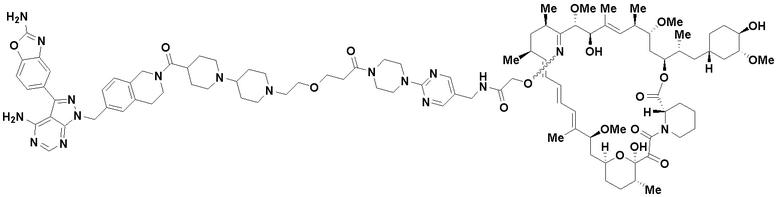
Пример 64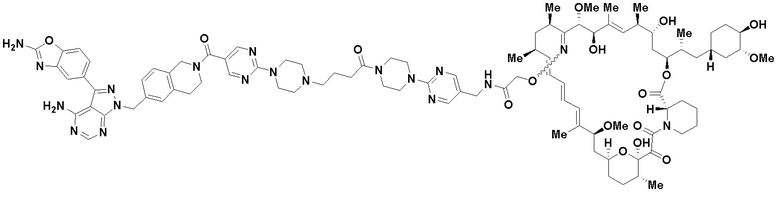
Пример 65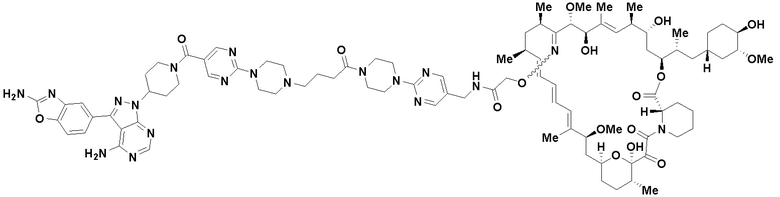
Пример 66
или его фармацевтически приемлемая соль, оксепановый изомер или таутомер.
41. Соединение, выбранное из группы, состоящей из:

Пример 67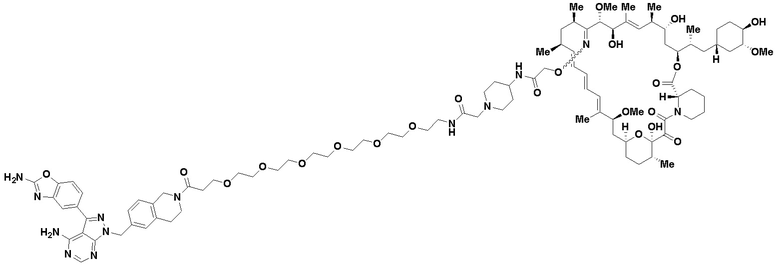
Пример 68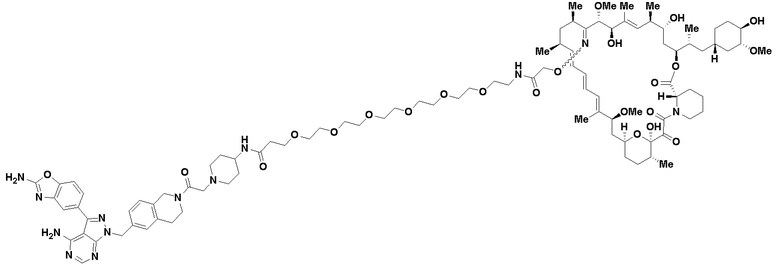
Пример 69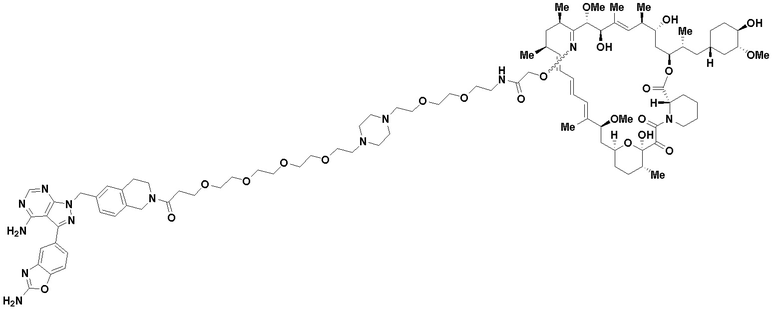
Пример 70
или его фармацевтически приемлемая соль, оксепановый изомер или таутомер.
42. Фармацевтическая композиция для ингибирования активности mTOR, содержащая эффективное количество соединения по любому из пп. 1-41 или его фармацевтически приемлемой соли, оксепанового изомера или таутомера и, по меньшей мере, один из фармацевтически приемлемого носителя, разбавителя или эксципиента.
43. Способ лечения заболевания или расстройства, опосредованного mTOR, включающий введение субъекту, страдающему от или подверженному риску развития заболевания или расстройства, опосредованного mTOR, одного или более соединений по любому из пп. 1-41 или его фармацевтически приемлемой соли, оксепанового изомера или таутомера.
44. Способ профилактики заболевания или расстройства, опосредованного mTOR, включающий введение субъекту, страдающему от или подверженному риску развития заболевания или расстройства, опосредованного mTOR, одного или более соединений по любому из пп. 1-41 или его фармацевтически приемлемой соли, оксепанового изомера или таутомера.
45. Способ снижения риска заболевания или расстройства, опосредованного mTOR, включающий введение субъекту, страдающему от или подверженному риску развития заболевания или расстройства, опосредованного mTOR, одного или более соединений по любому из пп. 1-41 или его фармацевтически приемлемой соли, оксепанового изомера или таутомера.
46. Способ по любому из пп. 42-44, где заболеванием является рак или иммуноопосредованное заболевание.
47. Способ по п. 46, где рак выбирают из опухолей головного мозга и сосудисто-нервной системы, рака головы и шеи, рака груди, рака легких, мезотелиомы, лимфоидного рака, рака желудка, рака почки, карциномы почек, рака печени, рака яичников, эндометриоза яичников, рака яичек, рака желудочно-кишечного тракта, рака простаты, глиобластомы, рака кожи, меланомы, нервного рака, рака селезенки, рака поджелудочной железы, нарушений пролиферации крови, лимфомы, лейкоза, рака эндометрия, рака шейки матки, рака вульвы, рака простаты, рака полового члена, рака костей, рака мышц, рака мягких тканей, рака кишечника или прямой кишки, рака анального канала, рака мочевого пузыря, рака желчных протоков, рака глаза, стромальных опухолей желудочно-кишечного тракта и нейроэндокринных опухолей.
48. Способ по п. 46, где иммуноопосредованное заболевание выбирают из резистентности при трансплантации сердца, почек, печени, костного мозга, кожи, роговицы, легкого, поджелудочной железы, тонкого кишечника, конечностей, мышц, нервов, двенадцатиперстной кишки, тонкой кишки или островковых клеток поджелудочной железы; болезней «трансплантат против хозяина», вызванных трансплантацией костного мозга; ревматоидного артрита, системной красной волчанки, тиреоидита Хашимото, рассеянного склероза, миастении гравис, диабета I типа, увеита, аллергического энцефаломиелита и гломерулонефрита.
49. Способ лечения рака, опосредованного mTOR, включающий введение субъекту одного или более соединений по любому из пп. 1-41 или его фармацевтически приемлемой соли, оксепанового изомера или таутомера.
50. Способ по п. 49, где рак выбирают из опухолей головного мозга и сосудисто-нервной системы, рака головы и шеи, рака груди, рака легких, мезотелиомы, лимфоидного рака, рака желудка, рака почки, карциномы почек, рака печени, рака яичников, эндометриоза яичников, рака яичек, рака желудочно-кишечного тракта, рака простаты, глиобластомы, рака кожи, меланомы, нервного рака, рака селезенки, рака поджелудочной железы, нарушений пролиферации крови, лимфомы, лейкоза, рака эндометрия, рака шейки матки, рака вульвы, рака простаты, рака полового члена, рака костей, рака мышц, рака мягких тканей, рака кишечника или прямой кишки, рака анального канала, рака мочевого пузыря, рака желчных протоков, рака глаза, стромальных опухолей желудочно-кишечного тракта и нейроэндокринных опухолей.
51. Способ лечения иммуноопосредованного заболевания, опосредованного mTOR, включающий введение субъекту одного или более соединений по любому из пп. 1-41 или его фармацевтически приемлемой соли, оксепанового изомера или таутомера.
52. Способ по п. 51, где иммуноопосредованное заболевание выбирают из резистентности при трансплантации сердца, почек, печени, костного мозга, кожи, роговицы, легкого, поджелудочной железы, тонкого кишечника, конечностей, мышц, нервов, двенадцатиперстной кишки, тонкой кишки или островковых клеток поджелудочной железы; болезней «трансплантат против хозяина», вызванных трансплантацией костного мозга; ревматоидного артрита, системной красной волчанки, тиреоидита Хашимото, рассеянного склероза, миастении гравис, диабета I типа, увеита, аллергического энцефаломиелита и гломерулонефрита.
53. Способ лечения возрастного состояния, опосредованного mTOR, включающий введение субъекту одного или более соединений по любому из пп. 1-41 или его фармацевтически приемлемой соли, оксепанового изомера или таутомера.
54. Способ по п. 53, где возрастное состояние выбирают из саркопении, атрофии кожи, мышечной атрофии, атрофии головного мозга, атеросклероза, артериосклероза, эмфиземы легких, остеопороза, остеоартрита, высокого кровяного давления, эректильной дисфункции, деменции, болезни Хантингтона, болезни Альцгеймера, катаракты, возрастной дегенерации желтого пятна, рака простаты, инсульта, сокращения продолжительности жизни, нарушения функции почек и возрастной потери слуха, инвалидности, связанной со старением (например, слабости), снижения когнитивных функций, возрастной деменции, нарушения памяти, жесткости сухожилий, сердечной дисфункции, такой как гипертрофия сердца и систолическая и диастолическая дисфункция, иммунного старения, рака, ожирения и диабета.
55. Соединение по любому из пп. 1-41 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, для применения в лечении, профилактике или снижении риска заболевания или состояния, опосредованного mTOR.
56. Применение соединения по любому из пп. 1-41 или его фармацевтически приемлемой соли, оксепанового изомера или таутомера, в производстве лекарственного средства для лечения, профилактики или снижения риска заболевания или состояния, опосредованного mTOR.
57. Соединение по любому из пп. 1-41 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, для применения в лечении рака.
58. Применение соединения по любому из пп. 1-41 или его фармацевтически приемлемой соли, оксепанового изомера или таутомера, в производстве лекарственного средства для лечения рака, опосредованного mTOR.
59. Соединение по любому из пп. 1-41 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, для применения в лечении иммуноопосредованного заболевания.
60. Применение соединения по любому из пп. 1-41 или его фармацевтически приемлемой соли, оксепанового изомера или таутомера, в производстве лекарственного средства для лечения иммуноопосредованного заболевания, опосредованного mTOR.
61. Соединение по любому из пп. 1-41 или его фармацевтически приемлемая соль, оксепановый изомер или таутомер, для применения в лечении возрастного состояния.
62. Применение соединения по любому из пп. 1-46 или его фармацевтически приемлемой соли, оксепанового изомера или таутомера, в производстве лекарственного средства для лечения возрастного состояния, опосредованного mTOR.
| WO 2016100116 A1, 23.06.2016 | |||
| WO 2006116727 A2, 02.11.2006 | |||
| WO 2009089262 A1, 16.07.2009 | |||
| ЛЕЧЕНИЕ НЕЙРОЭНДОКРИННЫХ ОПУХОЛЕЙ | 2006 |
|
RU2487711C2 |
Авторы
Даты
2024-09-12—Публикация
2019-04-29—Подача