Область техники, к которой относится настоящее изобретение
[1] Настоящее изобретение относится к способам применения ингибитора глюкагона (GCG) или антагониста глюкагонового рецептора (GCGR) для лечения или замедления прогрессирования тяжелой инсулинорезистентности и/или снижения терапевтической дозы инсулина у нуждающегося в этом пациента.
Перечень последовательностей
[2] Официальная копия перечня последовательностей подана одновременно с описанием изобретения в электронном виде посредством EFS-Web в виде перечня последовательностей в формате, соответствующем ASCII (Американский стандартный код обмена информацией), с именем файла 10282WO01_SEQ_LIST_ST25, датой создания 25 августа 2017 г. и размером, составляющим приблизительно 116 KB. Перечень последовательностей, содержащийся в этом отформатированном согласно ASCII документе, является частью настоящего описания изобретения, и тем самым полностью включен в настоящий документ посредством ссылки.
Предшествующий уровень техники настоящего изобретения
[3] Глюкагон представляет собой полипептидный гормон из 29 остатков, который совместно с инсулином опосредует гомеостатическую регуляцию количества глюкозы в крови. Глюкагон действует в первую очередь за счет того, что он стимулирует определенные клетки, например, клетки печени, высвобождать глюкозу, когда содержания глюкозы в крови падают, для поддержания нормальных содержаний глюкозы в крови. Действие глюкагона противоположно действию инсулина, который стимулирует клетки поглощать и накапливать глюкозу при повышении содержаний глюкозы в крови. Глюкагон производится в альфа-клетках поджелудочной железы, тогда как инсулин секретируется из соседних бета-клеток.
[4] Дисбаланс глюкагона и инсулина может играть важную роль при некоторых заболеваниях, таких как сахарный диабет и диабетический кетоацидоз. В частности, исследования показали, что повышенные базальные уровни глюкагона и отсутствие подавления секреции глюкагона после приема пищи способствуют развитию диабетических состояний у людей (Muller et al. (1970), N Eng J Med, 283: 109-115).
[5] Считается, что эффекты глюкагона на повышение содержаний глюкозы в крови частично опосредованы активацией определенных клеточных каскадов после связывания глюкагона (GCG) с его рецептором (обозначенным как GCGR). GCGR является представителем подсемейства секретина (семейство B) рецепторов, связанных с G-белком, и экспрессируется преимущественно в печени. Связывание глюкагона с его рецептором запускает каскад передачи сигнала G-белка, активируя внутриклеточный циклический AMP и приводя к увеличению выхода глюкозы посредством синтеза de novo (глюконеогенез) и расщепления гликогена (гликогенолиз) (Wakelam et al., (1986) Nature, 323:68-71; Unson et al., (1989) Peptides, 10:1171-1177; и Pittner and Fain, (1991) Biochem. J., 277:371-378).
[6] Действие глюкагона может быть подавлено действием антагониста, такого как низкомолекулярный ингибитор, антитело к GCG или антитело к GCGR, как описано в настоящем документе. Антитела к GCG упомянуты, например, в патентах США №№ 4206199; 4221777; 4423034; 4272433; 4407965; 5712105; и в публикациях согласно PCT №№ WO2007/124463 и WO2013/081993. Антитела к GCGR описаны в патентах США №№ 5770445, 7947809 и 8545847; заявке на выдачу европейского патента № EP2074149A2; европейском патенте EP0658200B1; патентных публикациях США №№ 2009/0041784; 2009/0252727 и 2011/0223160; и публикации согласно PCT № WO2008/036341. Низкомолекулярные ингибиторы GCG или GCGR упомянуты, например, в международных патентных публикациях №№ WO 07/47676; WO 06/86488; WO 05/123688; WO 05/121097; WO 06/14618; WO 08/42223; WO 08/98244; WO 2010/98948; патентной публикации США № US 20110306624; международных патентных публикациях №№ WO 2010/98994; WO 2010/88061; WO 2010/71750; WO 2010/30722; WO 06/104826; WO 05/65680; WO 06/102067; WO 06/17055; WO 2011/07722 или WO 09/140342.
[7] Синдромы тяжелой инсулинорезистентности представляют собой редкие метаболические нарушения, при которых пациенты не реагируют должным образом на инсулин. Современные способы лечения, доступные для синдромов тяжелой инсулинорезистентности включают в себя приемы пищи по часам и очень высокие дозы инсулина в попытке обеспечить адекватный гликемический контроль. Введение IGF-I, хотя и было эффективным в краткосрочной перспективе, не обеспечивало долгосрочного гликемического контроля у пациентов с тяжелой инсулинорезистентностью. Vestergaard et al., (1997) European Journal of Endocrinology, 136:475-482. Введение рекомбинантного лептина показало определенный успех у пациентов с синдромом Рабсона-Менденхолла (RMS) за счет снижения содержаний глюкозы в крови в течение нескольких месяцев. Cochran et al., (2004) Journal of Clinical Endocrinology and Metabolism, 89:1548-1554.
[8] Учитывая отсутствие эффективных видов терапии для лечения или замедления прогрессирования заболевания тяжелой инсулинорезистентности, т.е. чтобы продлить жизнь и/или улучшить качество жизни пациента с тяжелой инсулинорезистентностью, существует потребность в идентификации и исследовании применения других средств для лечения указанных заболеваний, таких как ингибиторы и антагонисты сигнального пути GCG/GCGR, как описано в настоящем документе.
Краткое раскрытие настоящего изобретения
[9] В настоящем документе предусмотрены способы лечения пациента с состоянием или заболеванием, характеризующимся тяжелой инсулинорезистентностью, путем введения ингибитора GCG или антагониста GCGR, например, фармацевтической композиции, содержащей ингибитор GCG или GCGR. Ингибитор GCG или антагонист GCGR представляет собой соединение, способное блокировать или ингибировать сигнальный путь глюкагонового рецептора. Антагонист может принимать форму низкомолекулярного ингибитора, пептидного ингибитора, технологии CRISPR (короткие палиндромные повторы, регулярно расположенные группами; технология CRISPR может создавать нокдаун GCGR или делецию регуляторных последовательностей, влияющих на активность GCGR), антисмысловой ингибитор, DARPin (сконструированный белок с анкириновым повтором), и нейтрализующее GCG или GCGR моноклональное антитело. Ингибитор GCG или антагонист GCGR можно вводить отдельно, в фармацевтической композиции или в сочетании с одним или несколькими терапевтическими средствами, применимыми в лечении состояния или заболевания, ассоциированного с тяжелой инсулинорезистентностью, или в лечении одного или нескольких симптомов, ассоциированных с состоянием или заболеванием, или в снижении содержания глюкозы в крови и/или кетонов у пациента, характеризующегося наличием состояния или заболевания, ассоциированного с тяжелой инсулинорезистентностью.
[10] Согласно некоторым вариантам осуществления предусмотрены способы снижения содержаний глюкозы в крови и/или содержаний бета-гидроксибутирата, или уменьшения кетонемии и/или кетоацидоза, или лечения состояния или заболевания, ассоциированного или частично характеризующегося высоким содержанием глюкозы в крови и/или кетонемией и/или кетоацидозом, или по меньшей мере одного симптома или осложнения, ассоциированного с состоянием или заболеванием. Согласно некоторым аспектам способ предусматривает введение пациенту с тяжелой инсулинорезистентностью терапевтически эффективного количества композиции, содержащей ингибитор передачи сигнала GCG/GCGR, так что содержания глюкозы в крови или бета-гидроксибутирата снижаются, или состояние или заболевание облегчается, или по меньшей мере один симптом или осложнение, ассоциированное с состоянием или заболеванием, облегчается или его тяжесть снижается. Согласно некоторым вариантам осуществления ингибитор передачи сигнала GCGR представляет собой антагонист GCGR, такой как антитело к GCGR. Согласно некоторым вариантам осуществления антитело к GCGR содержит пару последовательностей HCVR/LCVR согласно SEQ ID NO: 86/88. Согласно некоторым вариантам осуществления ингибитор передачи сигнала GCGR представляет собой ингибитор GCG, такой как антитело к GCG. Согласно некоторым вариантам осуществления антитело к GCG содержит пару последовательностей HCVR/LCVR согласно SEQ ID NO: 182/190. Согласно некоторым вариантам осуществления антитело к GCG содержит пару последовательностей HCVR/LCVR согласно SEQ ID NO: 166/174.
[11] Согласно некоторым аспектам предусмотрены способы лечения пациента с тяжелой инсулинорезистентностью, при которых пациент проявляет повышенные содержания глюкозы в крови. Способ предусматривает введение пациенту терапевтически эффективного количества композиции, содержащей ингибитор GCG или антагонист GCGR.
[12] Согласно некоторым аспектам предусмотрены способы лечения пациента с тяжелой инсулинорезистентностью, при которых пациент не проявляет повышенные содержания глюкозы в крови. Способ предусматривает введение пациенту терапевтически эффективного количества композиции, содержащей ингибитор GCG или антагонист GCGR.
[13] Согласно некоторым вариантам осуществления предусмотрены способы снижения количества и/или дозировки инсулина, необходимого для лечения пациента с тяжелой инсулинорезистентностью, при которых пациент проявляет тяжелую инсулинорезистентность и/или повышенные содержания глюкозы в крови. Согласно некоторым аспектам способ предусматривает введение пациенту терапевтически эффективного количества композиции, содержащей ингибитор GCG или антагонист GCGR. Согласно некоторым аспектам ингибитор GCG или антагонист GCGR вводят одновременно с инсулином. Количество и/или дозировку инсулин можно снизить на приблизительно 30% - приблизительно 95% или приблизительно на 90%, при введении одновременно с выделенным моноклональным антителом человека, которое специфически связывается с GCGR.
[14] Согласно некоторым аспектам антагонист GCGR может представлять собой антитело к GCGR. Антитело к GCGR может ингибировать или оказывать антагонистическое действие на GCGR. Антитело к GCGR может ингибировать или блокировать сигнальный путь GCGR. Согласно некоторым аспектам ингибитор GCG может представлять собой антитело к GCG. Антитело к GCG может ингибировать связывание GCG с GCGR.
[15] Согласно определенным вариантам осуществления антитело или антигенсвязывающий фрагмент специфически связываются с hGCGR и содержит домены CDR тяжелой и легкой цепей, содержащиеся в пределах пар последовательностей тяжелой и легкой цепей, выбранных из группы, состоящей из SEQ ID NO: 2/10, 18/26, 34/42, 50/58, 66/68, 70/78, 86/88, 90/98, 106/108, 110/118, 126/128, 130/138 и 146/148.
[16] Согласно определенным вариантам осуществления антитело или антигенсвязывающий фрагмент содержат домены CDR тяжелой и легкой цепей, содержащиеся в пределах пары аминокислотных последовательностей HCVR/LCVR согласно SEQ ID NO: 86/88.
[17] Согласно определенным вариантам осуществления антитело или антигенсвязывающий фрагмент содержат пару аминокислотных последовательностей HCVR/LCVR согласно SEQ ID NO: 86/88.
[18] Согласно одному варианту осуществления антитело человека или антигенсвязывающий фрагмент антитела человека, которые связываются с hGCGR, содержат вариабельную область тяжелой цепи (HCVR), характеризующуюся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2, 18, 34, 50, 66, 70, 86, 90, 106, 110, 126, 130 и 146, или по существу сходной с ней последовательностью, которая характеризуется по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательностей.
[19] Согласно одному варианту осуществления антитело человека или антигенсвязывающий фрагмент антитела человека, которые связываются с hGCGR, содержат вариабельную область легкой цепи (LCVR), характеризующуюся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 10, 26, 42, 58, 68, 78, 88, 98, 108, 118, 128, 138 и 148, или по существу сходной с ней последовательностью, которая характеризуется по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательностей.
[20] Согласно определенным вариантам осуществления антитело человека или его фрагмент, которые связываются с hGCGR, содержат пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 2/10, 18/26, 34/42, 50/58, 66/68, 70/78, 86/88, 90/98, 106/108, 110/118, 126/128, 130/138 и 146/148. Согласно определенным вариантам осуществления пара аминокислотных последовательностей HCVR/LCVR выбрана из группы, состоящей из SEQ ID NO: 34/42, 70/78, 86/88, 110/118 и 126/128.
[21] Согласно определенным вариантам осуществления выделенное антитело человека или его антигенсвязывающий фрагмент, которые специфически связываются с hGCGR, содержат HCVR, содержащую три CDR тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащиеся в пределах последовательности HCVR, выбранной из группы, состоящей из SEQ ID NO: 2, 18, 34, 50, 66, 70, 86, 90, 106, 110, 126, 130 и 146; и/или LCVR, содержащую три легкой CDR цепи (LCDR1, LCDR2 и LCDR3), содержащиеся в пределах последовательностей LCVR, выбранных из группы, состоящей из SEQ ID NO: 10, 26, 42, 58, 68, 78, 88, 98, 108, 118, 128, 138 и 148.
[22] Согласно определенным вариантам осуществления способы, предусмотренные в настоящем документе, предусматривают применение выделенного антитела человека или его антигенсвязывающего фрагмента, которые связываются с hGCGR, содержащих домен HCDR3, характеризующийся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 8, 24, 40, 56, 76, 96, 116 и 136, или по существу сходной с ней последовательностью, которая характеризуется по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательностей; и/или домен LCDR3, характеризующийся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 16, 32, 48, 64, 84, 104, 124 и 144, или по существу сходной с ней последовательностью, которая характеризуется по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательностей.
[23] Согласно одному варианту осуществления способы, предусмотренные в настоящем документе, предусматривают применение антитела или его фрагмента, которые дополнительно содержат домен HCDR1, характеризующийся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 4, 20, 36, 52, 72, 92, 112 и 132, или по существу сходной с ней последовательностью, которая характеризуется по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательностей; домен HCDR2, характеризующийся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 6, 22, 38, 54, 74, 94, 114 и 134, или по существу сходной с ней последовательностью, которая характеризуется по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательностей; домен LCDR1, характеризующийся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 12, 28, 44, 60, 80, 100, 120 и 140, или по существу сходной с ней последовательностью, которая характеризуется по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательностей; и домен LCDR2, характеризующийся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 14, 30, 46, 62, 82, 102, 122 и 142, или по существу сходной с ней последовательностью, которая характеризуется по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательностей.
[24] Согласно одному варианту осуществления антитело или антигенсвязывающий фрагмент антитела содержат:
(a) домен HCDR3, характеризующийся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 8, 24, 40, 56, 76, 96, 116 и 136; и
(b) домен LCDR3, характеризующийся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 16, 32, 48, 64, 84, 104, 124 и 144.
[25] Согласно родственному варианту осуществления антитело или антигенсвязывающий фрагмент антитела дополнительно содержат:
(c) домен HCDR1, характеризующийся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 4, 20, 36, 52, 72, 92, 112 и 132;
(d) домен HCDR2, характеризующийся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 6, 22, 38, 54, 74, 94, 114 и 134;
(e) домен LCDR1, характеризующийся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 12, 28, 44, 60, 80, 100, 120 и 140; и
(f) домен LCDR2, характеризующийся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 14, 30, 46, 62, 82, 102, 122 и 142.
[26] Согласно одному варианту осуществления антитело или его антигенсвязывающий фрагмент содержат HCVR, содержащую домен HCDR1, характеризующийся аминокислотной последовательностью, выбранной из одной из SEQ ID NO: 4, 20, 36, 52, 72, 92, 112 и 132; домен HCDR2, характеризующийся аминокислотной последовательностью, выбранной из одной из SEQ ID NO: 6, 22, 38, 54, 74, 94, 114 и 134; домен HCDR3, характеризующийся аминокислотной последовательностью, выбранной из одной из SEQ ID NO: 8, 24, 40, 56, 76, 96, 116 и 136; и LCVR, содержащую домен LCDR1, характеризующийся аминокислотной последовательностью, выбранной из одной из SEQ ID NO: 12, 28, 44, 60, 80, 100, 120 и 140; домен LCDR2, характеризующийся аминокислотной последовательностью, выбранной из одной из SEQ ID NO: 14, 30, 46, 62, 82, 102, 122 и 142; и домен LCDR3, характеризующийся аминокислотной последовательностью, выбранной из одной из SEQ ID NO: 16, 32, 48, 64, 84, 104, 124 и 144.
[27] Согласно определенным вариантам осуществления антитело человека или антигенсвязывающий фрагмент антитела человека, которые связываются с GCGR человека, содержат пару аминокислотных последовательностей HCDR3/LCDR3, выбранную из группы, состоящей из SEQ ID NO: 8/16, 24/32, 40/48, 56/64, 76/84, 86/88, 96/104, 116/124 и 136/144. Неограничивающие примеры антител к GCGR, характеризующихся указанными парами HCDR3/LCDR3, представляют собой антитела, обозначенные H4H1345N, H4H1617N, H4H1765N, H4H1321B и H4H1321P, H4H1327B и H4H1327P, H4H1328B и H4H1328P, H4H1331B и H4H1331P, H4H1339B и H4H1339P, соответственно.
[28] Согласно одному варианту осуществления выделенное антитело или его антигенсвязывающий фрагмент, применимые согласно способам, предусмотренным в настоящем документе, которые специфически связываются с GCG и нейтрализуют по меньшей мере одну активность, ассоциированную с GCG, содержат следующее: (a) три определяющие комплементарность области тяжелой цепи (HCDR1, HCDR2 и HCDR3), содержащиеся в пределах аминокислотной последовательности вариабельной области тяжелой цепи (HCVR), выбранной из группы, состоящей из SEQ ID NO: 150, 166, 182, 198, 214, 230, 246, 262, 278 и 294; и (b) три CDR легкой цепи (LCDR1, LCDR2 и LCDR3), содержащиеся в пределах аминокислотной последовательности вариабельной области легкой цепи (LCVR), выбранной из группы, состоящей из SEQ ID NO: 158, 174, 190, 206, 222, 238, 254, 270, 286 и 302.
[29] Согласно некоторым вариантам осуществления выделенное антитело или его антигенсвязывающий фрагмент, которые специфически связываются с GCG и нейтрализуют по меньшей мере одну активность, ассоциированную с GCG, содержат HCVR, характеризующуюся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 150, 166, 182, 198, 214, 230, 246, 262, 278 и 294, и LCVR, характеризующуюся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 158, 174, 190, 206, 222, 238, 254, 270, 286 и 302.
[30] Согласно некоторым вариантам осуществления выделенное антитело или его антигенсвязывающий фрагмент, которые специфически связываются с GCG и нейтрализуют по меньшей мере одну активность, ассоциированную с GCG, содержат пару аминокислотных последовательностей HCVR/LCVR, выбранную из группы, состоящей из SEQ ID NO: 150/158; 166/174; 182/190; 198/206; 214/222; 230/238; 246/254; 262/270; 278/286 и 294/302.
[31] Согласно некоторым вариантам осуществления пара аминокислотных последовательностей HCVR/LCVR содержит SEQ ID NO: 166/174.
[32] Согласно некоторым вариантам осуществления пара аминокислотных последовательностей HCVR/LCVR содержит SEQ ID NO: 182/190.
[33] Согласно одному варианту осуществления выделенное антитело или его антигенсвязывающий фрагмент, применимые согласно способам, предусмотренным в настоящем документе, содержат:
(a) домен HCDR1, характеризующийся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 152, 168, 184, 200, 216, 232, 248, 264, 280, и 296;
(b) домен HCDR2, характеризующийся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 154, 170, 186, 202, 218, 234, 250, 266, 282, и 298;
(c) домен HCDR3, характеризующийся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 156, 172, 188, 204, 220, 236, 252, 268, 284, и 300;
(d) домен LCDR1, характеризующийся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 160, 176, 192, 208, 224, 240, 256, 272, 288, и 304;
(e) домен LCDR2, характеризующийся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 162, 178, 194, 210, 226, 242, 258, 274, 290, и 306; и
(f) домен LCDR3, характеризующийся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 164, 180, 196, 212, 228, 244, 260, 276, 292, и 308.
[34] Согласно одному варианту осуществления выделенное антитело или его антигенсвязывающий фрагмент, применимые согласно способам, предусмотренным в настоящем документе, содержат:
(a) домен HCDR1, содержащий аминокислотную последовательность согласно SEQ ID NO: 168;
(b) домен HCDR2, содержащий аминокислотную последовательность согласно SEQ ID NO: 170;
(c) домен HCDR3, содержащий аминокислотную последовательность согласно SEQ ID NO: 172;
(d) домен LCDR1, содержащий аминокислотную последовательность согласно SEQ ID NO: 176;
(e) домен LCDR2, содержащий аминокислотную последовательность согласно SEQ ID NO: 178; и
(f) домен LCDR3, содержащий аминокислотную последовательность согласно SEQ ID NO: 180.
[35] Согласно одному варианту осуществления выделенное антитело или его антигенсвязывающий фрагмент, применимые согласно способам, предусмотренным в настоящем документе, содержат:
(a) домен HCDR1, содержащий аминокислотную последовательность согласно SEQ ID NO: 184;
(b) домен HCDR2, содержащий аминокислотную последовательность согласно SEQ ID NO: 186;
(c) домен HCDR3, содержащий аминокислотную последовательность согласно SEQ ID NO: 188;
(d) домен LCDR1, содержащий аминокислотную последовательность согласно SEQ ID NO: 192;
(e) домен LCDR2, содержащий аминокислотную последовательность согласно SEQ ID NO: 194; и
(f) домен LCDR3, содержащий аминокислотную последовательность согласно SEQ ID NO: 196.
[36] Кроме того, применимыми согласно способам, предусмотренным в настоящем документе, являются антитела или их антигенсвязывающие фрагменты, которые специфически связываются с GCG, содержащие CDR1 тяжелой цепи (HCDR1), содержащую аминокислотную последовательность, выбранную из любой из аминокислотных последовательностей HCDR1, предусмотренных в настоящем документе или по существу сходной с ними последовательности, которая характеризуется по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательностей.
[37] Кроме того, применимыми согласно способам, предусмотренным в настоящем документе, являются антитела или их антигенсвязывающие фрагменты, которые специфически связываются с GCG, содержащие CDR2 тяжелой цепи (HCDR2), содержащую аминокислотную последовательность, выбранную из любой из аминокислотных последовательностей HCDR2, предусмотренных в настоящем документе или по существу сходной с ними последовательности, которая характеризуется по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательностей.
[38] Кроме того, применимыми согласно способам, предусмотренным в настоящем документе, являются антитела или их антигенсвязывающие фрагменты, которые специфически связываются с GCG, содержащие CDR3 тяжелой цепи (HCDR3), содержащую аминокислотную последовательность, выбранную из любой из аминокислотных последовательностей HCDR3, предусмотренных в настоящем документе или по существу сходной с ними последовательности, которая характеризуется по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательностей.
[39] Кроме того, применимыми согласно способам, предусмотренным в настоящем документе, являются антитела или их антигенсвязывающие фрагменты, которые специфически связываются с GCG, содержащие CDR1 легкой цепи (LCDR1), содержащую аминокислотную последовательность, выбранную из любой из аминокислотных последовательностей LCDR1, предусмотренных в настоящем документе или по существу сходной с ними последовательности, которая характеризуется по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательностей.
[40] Кроме того, применимыми согласно способам, предусмотренным в настоящем документе, являются антитела или их антигенсвязывающие фрагменты, которые специфически связываются с GCG, содержащие CDR2 легкой цепи (LCDR2), содержащую аминокислотную последовательность, выбранную из любой из аминокислотных последовательностей LCDR2, предусмотренных в настоящем документе или по существу сходной с ними последовательности, которая характеризуется по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательностей.
[41] Кроме того, применимыми согласно способам, предусмотренным в настоящем документе, являются антитела или их антигенсвязывающие фрагменты, которые специфически связываются с GCG, содержащие CDR3 легкой цепи (LCDR3), содержащую аминокислотную последовательность, выбранную из любой из аминокислотных последовательностей LCDR3, предусмотренных в настоящем документе или по существу сходной с ними последовательности, которая характеризуется по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательностей.
[42] Кроме того, применимыми согласно способам, предусмотренным в настоящем документе, являются антитела или их антигенсвязывающие фрагменты, которые специфически связываются с GCG, содержащие пару аминокислотных последовательностей HCDR3 и LCDR3 (HCDR3/LCDR3), содержащую любую из аминокислотных последовательностей HCDR3, предусмотренных в настоящем документе, спаренную с любой из аминокислотных последовательностей LCDR3, предусмотренных в настоящем документе. Согласно определенным вариантам осуществления антитела или их антигенсвязывающие фрагменты содержат пару аминокислотных последовательностей HCDR3/LCDR3, содержащуюся в пределах любого из иллюстративных антител к GCG, предусмотренных в настоящем документе. Согласно определенным вариантам осуществления пара аминокислотных последовательностей HCDR3/LCDR3 содержит SEQ ID NO: 172/180.
[43] Кроме того, применимыми согласно способам, предусмотренным в настоящем документе, являются антитела или их антигенсвязывающие фрагменты, которые специфически связываются с GCG, содержащие набор из шести CDR (т.е. HCDR1-HCDR2-HCDR3-LCDR1-LCDR2-LCDR3), содержащийся в пределах любого из иллюстративных антител к GCG, предусмотренных в настоящем документе. Согласно определенным вариантам осуществления набор аминокислотных последовательностей HCDR1/HCDR2/HCDR3/LCDR1/LCDR2/LCDR3 содержит SEQ ID NO: 168/170/172/176/178/180. Согласно определенным вариантам осуществления набор аминокислотных последовательностей HCDR1/HCDR2/HCDR3/LCDR1/LCDR2/LCDR3 содержит SEQ ID NO: 184/186/188/192/194/196.
[44] Согласно родственному варианту осуществления антитела или их антигенсвязывающие фрагменты, которые специфически связываются с GCG, содержат набор из шести CDR (т.е. HCDR1/HCDR2/HCDR3/LCDR1/LCDR2/LCDR3), содержащийся в пределах пары аминокислотных последовательностей HCVR/LCVR, как определено любым из иллюстративных антител к GCG, предусмотренных в настоящем документе. Например, антитела или их антигенсвязывающие фрагменты, которые специфически связываются с GCG, содержат набор аминокислотных последовательностей HCDR1/HCDR2/HCDR3/LCDR1/LCDR2/LCDR3, содержащийся в пределах пары аминокислотных последовательностей HCVR/LCVR, выбранной из группы, состоящей из: 166/174; 182/190; 198/206; 214/222; 230/238; 246/254; 262/270; 278/286 и 294/302.
[45] Неограничивающие примеры антител, которые специфически связываются с GCG и содержат последовательности CDR, представленные выше, включают в себя HIH059P, H4H10223P, H4H10231P, H4H10232P, H4H10236P, H4H10237P, H4H10238P, H4H10250P, H4H10256P и H4H10270P.
[46] Способы и техники для идентификации CDR в пределах аминокислотных последовательностей HCVR и LCVR хорошо известны в настоящей области техники и их можно использовать для идентификации CDR в пределах указанных аминокислотных последовательностей HCVR и/или LCVR, раскрытых в настоящем документе. Иллюстративные соглашения, которые можно использовать для идентификации границ CDR, включают в себя, например, определение согласно Kabat, определение согласно Chothia и определение AbM. В общих чертах, определение согласно Kabat основано на изменчивости последовательности, определение согласно Chothia основано на расположении областей структурной петли, а определение AbM является компромиссом между подходами Kabat и Chothia. См., например, Kabat, (1991) "Sequences of Proteins of Immunological Interest," National Institutes of Health, Bethesda, Md.; Al-Lazikani et al., (1997) J. Mol. Biol. 273:927-948; и Martin et al., (1989) Proc. Natl. Acad. Sci. USA 86:9268-9272. Общедоступные базы данных также доступны для идентификации последовательностей CDR в пределах антитела.
[47] Согласно некоторым вариантам осуществления пациент с тяжелой инсулинорезистентностью может страдать от одного из состояний или заболеваний, выбранных из следующего: синдром Донохью, синдром Рабсона-Менденхолла, инсулинорезистентность типа А, инсулинорезистентность типа В, синдром HAIR-AN (гиперандрогения, инсулинорезистентность и акантокератодермия), псевдоакромегалия, синдром Альстрема, миотоническая дистрофия, синдром Вернера, липодистрофия, цирроз печени, моногенное морбидное ожирение, гиперпроинсулинемия, недостаточность карбоксипептидазы E, нарушенный метаболизм аргинина, синдром Барде-Бидля и состояние или заболевание, ассоциированное с наличием одного или нескольких генных вариантов, которые, как сообщалось, вызывают тяжелую инсулинорезистентность. Согласно некоторым вариантам осуществления активность расщепляющей инсулин протеазы обнаруживают в сыворотке пациентов. Согласно некоторым вариантам осуществления нейтрализующие антитела к инсулину или антитела к рецептору инсулина обнаруживают в сыворотке пациентов. У некоторых пациентов тяжелая инсулинорезистентность возникает в контексте аутоиммунного разрушения адипоцитов, приводящего к липодистрофии.
[48] Согласно некоторым аспектам генный вариант, ассоциированный с тяжелой инсулинорезистентностью, выбран из следующего: INSR, PSMD6, ADRA2A, AGPAT2 (ассоциированы с липодистрофией и инсулинорезистентностью), AKT2, APPL1, BBS1 (ассоциированы с синдромом Барде-Бидля 1), BSCL2, CIDEC, GRB10, IRS2, KLF14, LEP, LEPR, LMNA (ассоциированы с липодистрофией), MC4R, PCNT, PIK2CA, POLD1 (ассоциированы с липодистрофией), PPARG, PTPRD, PTRF (ассоциированы с липодистрофией), RASGRP1, TBC1D4 и TCF7L2.
[49] Согласно некоторым аспектам композицию, содержащую антагонист глюкагона/GCGR, вводят пациенту в комбинации по меньшей мере с одним дополнительным терапевтическим средством. Дополнительное терапевтическое средство может представлять собой любое средство, которое частично снимает или снижает симптомы и признаки, ассоциированные с тяжелой инсулинорезистентностью. Согласно некоторым вариантам осуществления по меньшей мере одно дополнительное терапевтическое средство выбрано из следующего: инсулин, бигуанид, hIGF1, лептин, метралептин, пиоглитазон, вилдаглиптин, акарбоза, ингибиторы альфа-гликозидазы, L-аргинин, ингибиторы дипептидил-пептидазы-4, секретогены инсулина, агонисты рецептора амилина, сенсибилизаторы инсулина, FGF21, ингибиторы SGLT2, ингибиторы SGLT1, агонисты рецептора GLP-1, активаторы рецептора GLP-1, второй ингибитор GCG и второй антагонист GCGR. Согласно некоторым аспектам секретоген инсулина выбран из сульфонилмочевин, антагонистов чувствительных к AТФ калиевых каналов и меглитинидов. Согласно некоторым аспектам сенсибилизатор инсулина выбран из тиазолидиндиона и росиглитазона. Согласно некоторым аспектам дополнительное терапевтическое средство может представлять собой средство, которое увеличивает расход энергии и/или активность бурого жира, такое как, например, β3 адренергические агонисты (такие как миглитол), агонисты NPR1, антагонисты NPR3, трийодтиронин, тиазолидиндионы, VEGF, ирисин, метеорин-подобный белок, натрийуретические пептиды, орексин, норэпинефрин, T4, желчные кислоты, FGF-21, ментол, slit2-C BMP7, BMP8β и остовы, подобные домену FnIII/Tn3 (связывающие молекулы на основе третьего домена фибронектина III типа тенасцина C человека).
[50] Другие цели и преимущества станут очевидными из обзора последующего подробного описания.
Краткое описание фигур
[51] На фигурах 1A-1E показаны содержания глюкозы в крови, содержания инсулина, содержания глюкагона и содержания β-гидроксибутирата, а также массы тела в модели тяжелой инсулинорезистентности на мышах. На фиг. 1A мыши, получившие лечение с помощью антагониста инсулинового рецептора, S961, и антитела к GCGR, H4H1327P, (незаштрихованные треугольники), проявляли повышение содержаний глюкозы в крови по отношению к содержаниям глюкозы в крови у мышей, получивших лечение с помощью антагониста инсулинового рецептора и изотипического контрольного антитела (заштрихованные квадраты). На фиг. 1B лечение мышей с помощью S961 продемонстрировало увеличение содержаний инсулина с течением времени (заштрихованные квадраты), даже в присутствии H4H1327P (незаштрихованные треугольники). На фиг. 1C мыши, получившие лечение с помощью H4H1327P, при отсутствии (незаштрихованные кружки) или в присутствии S961 (незаштрихованные треугольники), проявляли более высокие содержания глюкагона, чем получившие лечение с помощью изотипического контроля (заштрихованные кружки) или с помощью S961 (заштрихованные квадраты) мыши. На фиг. 1D мыши, получившие лечение с помощью S961 и H4H1327P (незаштрихованные треугольники) поддерживали содержания бета-гидроксибутирата, аналогичные тем, которые наблюдали у получивших лечение с помощью изотипического контроля (заштрихованные кружки) и с помощью контроля, получившего лечение с помощью антитела отдельно (незаштрихованные кружки). Мыши, получившие лечение с помощью антагониста инсулинового рецептора при отсутствии антитела к GCGR, проявляли повышенные содержания бета-гидроксибутирата (заштрихованные квадраты) по сравнению с другими группами лечения. Массы тела во всех четырех группах лечения оставались неизменными. См. фиг. 1E.
[52] На фигурах 2A-2F показаны содержания глюкозы в крови, содержания инсулина, содержания глюкагона, содержания B-гидроксибутирата и содержания аминокислот, а также массы тела, в модели тяжелой инсулинорезистентности на мышах. Лечение с помощью антагониста инсулинового рецептора (S961) предшествовало лечению с помощью антитела, H4H1327P, вызывая повышенные содержания глюкозы в крови, и способность антитела уменьшать содержания глюкозы в крови было продемонстрировано в течение нескольких дней после начала лечения с помощью антитела (незаштрихованные треугольники). См. фиг. 2A. На фиг. 2B лечение с помощью S961 вызывало повышение содержаний инсулина (заштрихованные квадраты), и последующее лечение с помощью антитела GCGR, H4H1327P, не снижало содержания инсулина (незаштрихованные треугольники). Как показано на фиг. 2C, содержания глюкагона являлись повышенными у мышей, получивших лечение с помощью H4H1327P (незаштрихованные кружки), и все еще повышенными у мышей, получивших лечение с помощью как антитела, так и S961 (незаштрихованные треугольники). На фиг. 2D показано, что содержания бета-гидроксибутирата в плазме повышались в ответ на лечение с помощью S961 (заштрихованные квадраты), но в течение нескольких дней после лечения с помощью H4H1327P содержания падали до уровня не получившего лечения контроля и контроля, получившего лечение с помощью антитела отдельно (незаштрихованные треугольники). На фиг. 2E показано, что содержания аминокислот являлись повышенными у мышей, получивших лечение с помощью H4H1327P (незаштрихованные кружки), и все еще повышенными у мышей, получивших лечение с помощью как антитела, так и S961 (незаштрихованные треугольники). Никаких изменений массы тела не наблюдали. См. фиг. 2F.
[53] На фигурах 3A и 3B представлены результаты анализа вестерн-блоттинг на образцах печени мышей, полученных от мышей, получивших лечение с помощью одного или как S961, так и H4H1327P. Лечение с помощью H4H1327P снижало фосфоенолпируват-карбоксикиназу (Pepck) в печени мышей на 70% по отношению к получившей лечение с помощью изотипического антитела контрольной группе, и лечение с помощью S961 вызывало 2,3-кратное увеличение содержаний Pepck. Лечение с помощью H4H1327P снижало повышенные содержания, вызванные S961, до 30% ниже исходного уровня. См. фигуры 3A и 3B.
[54] На фигурах 4A-4D показаны эффекты четырех видов лечения на ткани поджелудочной железы: масса поджелудочной железы, фиг. 4A; масса α-клеток поджелудочной железы, фиг. 4B; масса β-клеток поджелудочной железы, фиг. 4C; и количество островков относительно общей площади поджелудочной железы, фиг. 4D. масса β-клеток удваивалась в присутствии S961 и H4H1327P по сравнению с S961 отдельно и увеличивалась в 5,8 раз по сравнению с контрольными мышами. См. фиг. 4C.
Подробное раскрытие настоящего изобретения
[55] Прежде чем будут описаны настоящие способы, следует понимать, что настоящее изобретение не ограничивается конкретными способами и описанными экспериментальными условиями, поскольку такие способы и условия могут варьироваться. Также следует понимать, что используемая в настоящем документе терминология предназначена только для описания конкретных вариантов осуществления и не предназначена для ограничения, поскольку объем настоящего изобретения будет ограничен только прилагаемой формулой изобретения.
[56] Используемые в настоящем описании и прилагаемой формуле изобретения формы единственного числа включают в себя ссылки на формы множественного числа, если контекстом явно не предписано иное. Таким образом, например, ссылка на "способ" включает в себя один или несколько способов и/или стадий описанного в настоящем документе типа и/или типа, который станет очевидным для специалистов в настоящей области техники после прочтения настоящего раскрытия и так далее.
[57] Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют то же значение, которое обычно подразумевается специалистом в настоящей области техники, к которой относится настоящее изобретение. Хотя любые способы и материалы, подобные или эквивалентные тем, которые описаны в настоящем документе, можно использовать при практическом применении или испытании настоящего изобретения, ниже описаны предпочтительные способы и материалы. Все упомянутые в настоящем описании патенты, заявки и непатентные публикации полностью включены в настоящий документ посредством ссылки.
Общее описание
[58] Тяжелая инсулинорезистентность возникает в связи с различными физиологическими и патофизиологическими состояниями. Клинические проявления включают в себя гиперинсулинемию, акантокератодермию, яичниковую гиперандрогению, поликистозные яичники и возможную гипергликемию, и в редких случаях у пациентов может развиться кетоацидоз. Хотя не существует единого определения для тяжелой инсулинорезистентности, чтобы отличить ее от более распространенной инсулинорезистентности, синдромную инсулинорезистентность классифицировали либо как первичные дефекты передачи сигнала инсулина (инсулиновые рецепторопатии или частичное нарушение сигнального пути инсулина), либо инсулинорезистентность, вторичную по отношению к аномалиям жировой ткани (тяжелого ожирения или липодистрофии). См. Semple et al., (2011), Genetic Syndromes of Severe Insulin Resistance, Endocrine Reviews, 32(4):498-514.
[59] Проявления тяжелой инсулинорезистентности наблюдают у пациентов, которые нуждаются в экзогенном инсулине в дозах более 100-200 единиц в день, или у пациентов с хронически повышенными содержаниями эндогенного инсулина в крови. Moller and Flier, (1991) New England Journal of Medicine, 325:938-948. Содержания инсулина натощак выше 50-70 мкЕд/мл или пиковые (после пробы на толерантность к глюкозе при пероральном введении) содержания инсулина выше 350 мкЕд/мл указывают на тяжелую инсулинорезистентность. Значения индекса чувствительности к инсулину ниже 2×104 мкЕд/мл⋅мин, как правило, встречаются при наличии тяжелой инсулинорезистентности. Пациенты с тяжелой инсулинорезистентностью также демонстрируют скорость утилизации глюкозы ниже 2 мг/кг⋅мин. См. Tritos and Mantzoros, (1998) Journal of Clinical Endocrinology and Metabolism, 83:3025-3030.
[60] Инсулин взаимодействует с рецепторами инсулина на плазматической мембране клеток-мишеней. Рецептор инсулина представляет собой трансмембранный тирозинкиназный рецептор, он функционирует для регуляции гомеостаза глюкозы. Рецептор инсулина состоит из двух α-субъединиц, содержащих сайт связывания инсулина, и двух β-субъединиц, содержащих тирозинкиназный домен; субъединицы связаны дисульфидными мостиками с образованием β-α-α-β-тетрамера с молекулярной массой 350 кДа. Существуют две изоформы рецептора: изоформа с экзоном 11 (IR-B) и изоформа без экзона 11 (IR-A), и уровни изоформ экспрессированы по-разному в разных тканях. Изоформа IR-B проявляет более высокую и более эффективную сигнальную активность, чем изоформа IR-A, а также изоформа IR-B экспрессируется преимущественно в печени, жировой ткани и мышечной ткани. Изоформа IR-A экспрессируется в клетках ЦНС и кроветворных клетках и имеет немного более высокую аффинность связывания с инсулином.
[61] Тирозинкиназная активность активированного рецептора инсулина ответственна за трансмембранную передачу сигнала транспорта глюкозы и регуляцию гомеостаза глюкозы.
[62] Тяжелая инсулинорезистентность, как правило, ассоциирована с мутациями рецептора инсулина, что приводит к снижению экспрессии на поверхности клетки или к способности рецептора к передаче сигнала. Другие мутации включают в себя дефекты в аффинности связывания с рецептором или мутации в белках, вовлеченных в путь передачи сигнала инсулина, например, консервативные области тирозинкиназного домена инсулинового рецептора.
[63] Пациенты с тяжелой инсулинорезистентностью могут страдать от состояния или заболевания, выбранного из следующего: синдром Донохью, синдром Рабсона-Менденхолла, инсулинорезистентность типа А, инсулинорезистентность типа В, синдром HAIR-AN (гиперандрогения, инсулинорезистентность, и акантокератодермия), псевдоакромегалия, синдром Альстрома, миотоническая дистрофия, синдром Вернера, липодистрофия, цирроз печени, моногенное морбидное ожирение, гиперпроинсулинемия, недостаточность карбоксипептидазы Е, нарушенный метаболизм аргинина или синдром Барде-Бидля.
[64] Генетические и приобретенные состояния тяжелой инсулинорезистентности представляют собой редкие нарушения, при которых ткани и органы организма не реагируют должным образом на инсулин. Клинические проявления, ассоциированные с тяжелой инсулинорезистентностью, включают в себя задержку роста, органомегалию, нарушенное развитие скелетной и жировой ткани, разрастание мягких тканей, сахарный диабет, стеатоз печени, акантокератодермию, яичниковую гиперандрогению и гирсутизм. Лабораторные показатели включают в себя гиперинсулинемию, сниженный клиренс инсулина, гипергликемию, дислипидемию и повышенные содержания андрогенов. Каждый из различных синдромов, ассоциированных с тяжелой инсулинорезистентностью, характеризуется уникальными признаками, в дополнение к некоторым или всем общим клиническим и лабораторным признакам.
[65] Синдром Донохью (DS, также называемый лепречаунизмом) и синдром Рабсона-Менденхолла (RMS) представляют собой редкие аутосомно-рецессивные состояния, при которых оба аллеля рецептора инсулина являются аномальными, и пациенты не реагируют на эндогенный и экзогенный инсулин. Люди с DS и RMS являются недоразвитыми до рождения, а затем не могут благополучно развиваться, будучи младенцами. У пациентов присутствуют чрезвычайно высокие содержания инсулина в крови, вплоть до 1000 раз превышающие нормальное содержание. Первичным метаболическим последствием DS является гипогликемия натощак и, во-вторых, постпрандиальная гипергликемия. Люди с диагнозом DS, как правило, умирают в возрасте до одного года, и у них не развивается диабетический кетоацидоз. Люди с RMS также испытывают гипогликемию натощак и, как правило, выживают в младенческом возрасте, но со временем у них развивается тяжелый и трудноизлечимый диабетический кетоацидоз и снижение содержания инсулина.
[66] Кетонемия возникает, когда в результате расщепления жирных кислот и дезаминирования аминокислот образуются кетоновые тела и накапливаются в крови. Если ее не лечить, пациенты могут перейти к диабетическому кетоацидозу. Бета-гидроксибутират и ацетоуксусная кислота являются двумя наиболее распространенными кетонами, и повышенные содержания можно использовать для определения степени кетонемии и в качестве показателя кетоацидоза.
[67] Синдром инсулинорезистентности типа А представляет собой еще одно редкое заболевание, характеризующееся тяжелой инсулинорезистентностью, и симптомы, как правило, присутствуют в подростковом возрасте у женщин или в зрелом возрасте у мужчин. У женщин наблюдается первичная аменорея или олигоменорея, кисты яичников, гирсутизм и акантокератодермия, но, как правило, они не характеризуются избыточной массой тела. У мужчин заболевание проявляется, когда у них развивается сахарный диабет. Как и в случае DS и RMS, мутации гена рецептора инсулина ответственны за синдром инсулинорезистентности типа А.
[68] Липодистрофия относится к группе нарушений, характеризующихся аномальным распределением, использованием и метаболизмом жировой ткани из-за дефектов в самом рецепторе инсулина или нижележащих компонентах сигнального каскада инсулина. У пациентов с липодистрофией обнаруживают общее или частичное отсутствие жировой ткани, инсулинорезистентность (с диабетом или без него), значительную дислипидемию и ожирение печени. Некоторые синдромы липодистрофии, такие как синдром Берардинелли-Сейпа, передаются по наследству, в то время как другие, включая в себя синдром Лоренса, являются приобретенными, иногда после инфекционного продромального периода. Дополнительные синдромы липодистрофии включают в себя синдром Кобберлинга-Даннигана, липодистрофию с другими дисморфическими признаками и цефалоторакальную липодистрофию.
[69] Синдром инсулинорезистентности типа B отличается от DS, RMS и синдрома инсулинорезистентности типа A тем, что первый ассоциирован с наличием в сыворотке аутоантител к рецептору инсулина и может возникать в контексте аутоиммунного заболевания. Симптомы аналогичны другим синдромам инсулинорезистентности и включают в себя некетотический и тяжелый инсулинорезистентный сахарный диабет, акантокератодермию и гирсутизм в дополнение к эпизодической парадоксальной гипогликемии.
[70] Синдром HAIR-AN (гиперандрогения, инсулинорезистентность и акантокератодермия) встречается у молодых женщин, как правило, страдающих ожирением, с инсулинорезистентностью, принимающей различные формы; некоторые индивидуумы характеризуются высокими концентрациями инсулина, но нормальными содержаниями глюкозы, в то время как у других обнаруживают симптомы сахарного диабета. В отличие от малой распространенности других синдромов тяжелой инсулинорезистентности, синдром HAIR-AN поражает приблизительно 5% девочек-подростков во всем мире. Синдром ассоциирован с мутациями тирозинкиназного домена гена инсулинового рецептора.
[71] Псевдоакромегалия характеризуется тяжелой инсулинорезистентностью в сочетании с акромегалоидизмом и, возможно, вызвана дефектом в сигнальном пути инсулина или высокими содержаниями инсулина, передающими сигнал посредством рецептора IGF-1.
[72] Другие тяжелые синдромы инсулинорезистентности включают в себя синдром Альстрема, миотоническую дистрофию и синдром Вернера, если назвать несколько из них.
[73] У некоторых пациентов состояние или заболевание ассоциировано с наличием генного варианта, который, как сообщалось, вызывает тяжелую инсулинорезистентность. Иллюстративные генные варианты включают в себя INSR, PSMD6, ADRA2A, AGPAT2 (ассоциированы с липодистрофией и инсулинорезистентностью), AKT2, APPL1, BBS1 (ассоциированы с синдромом Барде-Бидля 1), BSCL2, CIDEC, GRB10, IRS2, KLF14, LEP, LEPR, LMNA (ассоциированы с липодистрофией), MC4R, PCNT, PIK2CA, POLD1 (ассоциированы с липодистрофией), PPARG, PTPRD, PTRF (ассоциированы с липодистрофией), RASGRP1, TBC1D4 и TCF7L2.
[74] У некоторых пациентов активность расщепляющей инсулин протеазы обнаруживают в сыворотке пациентов. У некоторых пациентов нейтрализующие антитела к инсулину или антитела к инсулиновому рецептору обнаруживают в сыворотке пациентов. У некоторых пациентов тяжелая инсулинорезистентность возникает в контексте аутоиммунного разрушения адипоцитов, приводящего к липодистрофии.
[75] У пациентов с тяжелой инсулинорезистентностью в конечном итоге развивается гипергликемия и, при некоторых синдромах, кетоацидоз. Например, у пациентов с RMS содержания инсулина начинаются с очень высоких в начале жизни, даже в периоды парадоксальной гипогликемии натощак. По мере прогрессирования заболевания содержания инсулина, хотя и остаются повышенными, падают. Кроме того, содержания частично окисленных жирных кислот увеличиваются, что указывает на то, что инсулин не способен подавлять высвобождение жирных кислот из адипоцитов, что в конечном итоге приводит к постоянному кетоацидозу. Аналогично, постоянная гипергликемия приводит к тому, что содержания инсулина больше не способны подавлять продукцию глюкозы в печени и ее высвобождение. Тем не менее, непрерывная инфузия чрезвычайно высоких концентраций инсулина (9,5 Ед/кг⋅ч) может вызвать обратное развитие повышенного окисления жирных кислот и блокировать кетонурию. Longo et al., (1991) Journal of Clinical Endocrinology & Metabolism, 84:2623-2629. Кроме того, гипертриглицеридемия и низкие содержания холестерина липопротеинов высокой плотности ассоциированы с тяжелой инсулинорезистентностью.
[76] Пациенты с синдромами тяжелой инсулинорезистентности характеризуются нормальными или даже слегка повышенными содержаниями глюкагона в плазме, несмотря на гипергликемию. West et al., (1975) Arch. Dis. Child., 50 (9): 703-708; Desbois-Mouthon et al., (1997) Pediatr. Res., 42 (1): 72-77. Гипергликемия возникает в результате усиленной продукции глюкозы в печени из-за отсутствия подавления инсулином и аномально высокого уровня передачи сигнала глюкагона.
[77] До настоящего времени не проводили исследования, изучающие эффекты антагонистического действия на сигнальный путь GCG/GCGR на состояния или заболевания тяжелой инсулинорезистентности. В исследованиях, описанных в примерах, используют антагонист GCGR, в качестве иллюстративного ингибитора сигнального пути GCG/GCGR, в модели тяжелой инсулинорезистентности на мышах, чтобы продемонстрировать эффекты на содержания глюкозы в крови и кетонемию, измеренные с помощью содержаний бета-гидроксибутирата в плазме, в течение нескольких недель лечения.
Определения
[78] "Глюкагоновый рецептор", также называемый в настоящем документе "GCGR", принадлежит к семейству рецепторов, связанных с G-белком класса 2 и состоит из длинного аминоконцевого внеклеточного домена, семи трансмембранных сегментов и внутриклеточного C-концевого домена. Глюкагоновые рецепторы в значительной мере экспрессируются на поверхности гепатоцитов, где они связываются с глюкагоном и передают сигнал, передаваемый таким образом, в клетку. Соответственно, термин "глюкагоновый рецептор" также относится к одному или нескольким рецепторам, которые специфически взаимодействуют с глюкагоном для получения биологического сигнала. Последовательности ДНК, кодирующие глюкагоновые рецепторы крысиного и человеческого происхождения, были выделены и раскрыты в настоящей области техники (EP0658200B1). Гомологи мыши и яванского макака также были выделены и секвенированы (Burcelin, et al., (1995) Gene 164:305-310); McNally et al., (2004) Peptides 25:1171-1178). Используемые в настоящем документе термины "глюкагоновый рецептор" и "GCGR" используют взаимозаменяемо. Используемое в настоящем документе выражение "GCGR", "hGCGR" или их фрагменты относится к белку GCGR человека или его фрагменту, если не указано, что он происходит из вида, не относящегося к человеку, например, "GCGR мыши", "GCGR крысы" или "GCGR обезьяны".
[79] Фраза "антагонист GCGR" относится к ингибитору, антагонисту или обратному агонисту сигнального пути GCGR. “Ингибитор GCG” может предотвращать связывание глюкагона с рецептором. Ингибитор GCGR также может предотвращать связывание глюкагона с рецептором. Тем не менее, оба они эффективно блокируют или ослабляют активацию рецептора или могут препятствовать сигнальному каскаду после активации GCGR.
[80] Антагонист GCGR способен связываться с глюкагоновым рецептором и тем самым оказывать антагонистическое действие на активность GCG, опосредованную GCGR. Ингибирование активности GCG путем антагонизма связывания и активности GCG на GCGR снижает скорость глюконеогенеза и гликогенолиза, а также концентрацию глюкозы в плазме. Способы, с помощью которых можно определить связывание предполагаемого антагониста с рецептором глюкагона, известны в настоящей области техники, и средства, с помощью которых можно определить наличие препятствия активности глюкагона на глюкагоновом рецепторе, являются общедоступными; см., например, S. E. de Laszlo et al., (1999) Bioorg. Med. Chem. Lett. 9: 641-646. Как применимые в настоящем документе предусмотрены антагонисты GCGR или ингибиторы GCG, содержащие в качестве функционального компонента низкомолекулярное соединение или, другими словами, низкомолекулярное органическое соединение. Малая молекула, как правило, характеризуется массой менее 800 Дальтон. Кроме того, технологию CRISPR можно использовать для нокдауна экспрессии GCG или GCGR.
[81] Термины "ингибитор" или "антагонист" включают в себя вещество, которое замедляет или предотвращает химическую или физиологическую реакцию или ответ. Общепринятые ингибиторы или антагонисты включают в себя без ограничения антисмысловые молекулы, антитела, низкомолекулярные ингибиторы, пептидные ингибиторы, DARPin, шпигельмеры (Spiegelmer), аптамеры, сконструированные домены Fn типа III и их производные.
[82] Пример ингибитора GCG или антагониста сигнального пути GCGR включает в себя без ограничения антитело (человеческое или гуманизированное), или его антигенсвязывающую часть, к GCG или GCGR, которые блокируют связывание или ингибируют активность сигнального пути GCGR. Иллюстративные антагонисты GCGR, которые можно использовать в способах, описанных в настоящем документе, включают в себя выделенное моноклональное антитело человека или его антигенсвязывающий фрагмент, содержащие следующее: (a) HCVR, характеризующаяся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2, 18, 34, 50, 66, 70, 86, 90, 106, 110, 126, 130 и 146; и/или (b) LCVR, характеризующаяся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 10, 26, 42, 58, 68, 78, 88, 98, 108, 118, 128, 138 и 148. Иллюстративные ингибиторы GCG, которые можно использовать в способах, описанных в настоящем документе, включают в себя выделенное моноклональное антитело человека или его антигенсвязывающий фрагмент, содержащие следующее: (a) HCVR, характеризующаяся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 150, 166, 182, 198, 214, 230, 246, 262, 278 и 294; и/или (b) LCVR, характеризующаяся аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 158, 174, 190, 206, 222, 238, 254, 270, 286 и 302.
[83] "Терапевтически эффективная доза" представляет собой дозу, которая производит требуемый эффект, для которого ее вводят. Точная доза будет зависеть от цели лечения и может быть установлена специалистом в настоящей области техники с использованием известных техник (см., например, Lloyd (1999) The Art, Science and Technology of Pharmaceutical Compounding).
[84] Фраза "по существу идентичная" означает последовательность белка, характеризующуюся по меньшей мере 95% идентичности по отношению к HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2, 18, 34, 50, 66, 70, 86, 90, 106, 110, 126, 130 и 146; и/или (b) LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 10, 26, 42, 58, 68, 78, 88, 98, 108, 118, 128, 138 и 148, и способную связываться с GCGR и ингибировать биологическую активность GCGR. Фраза “по существу идентичная” также означает последовательность белка, характеризующуюся по меньшей мере 95% идентичности по отношению к HCVR с аминокислотной последовательностью, выбранной из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 150, 166, 182, 198, 214, 230, 246, 262, 278 и 294; и/или (b) LCVR с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 158, 174, 190, 206, 222, 238, 254, 270, 286 и 302, и способную связываться с GCG и ингибировать биологическую активность GCG.
[85] Термины "идентичность" или "гомология" понимают как означающие процент аминокислотных остатков в последовательности-кандидате, которые идентичны остатку соответствующей последовательности, с которой ее сравнивают, после выравнивания последовательностей и введения пропусков, при необходимости, для достижения максимальной идентичности в процентах для всей последовательности и не рассматривая какие-либо консервативные замены как часть идентичности последовательностей. Ни N- или C-концевые удлинения, ни вставки не будут истолкованы как снижение идентичности или гомологии. Способы и компьютерные программы для выравнивания хорошо известны в настоящей области техники. Идентичность последовательностей можно измерить с использованием программного обеспечения для анализа последовательности (например, пакета программного обеспечения для анализа последовательностей, Genetics Computer Group, Биотехнологический центр Университета Висконсина, 1710 University Ave., Madison, Wis. 53705). Это программное обеспечение сопоставляет сходные последовательности, присваивая степени гомологии различным заменам, делециям и другим модификациям.
[86] Термин "осуществление лечения" (или "лечить" или "лечение") относится к процессам, включающим в себя замедление, прерывание, ингибирование, прекращение, регулирование, остановку, снижение, уменьшение интенсивности или обратное развитие прогрессирования, продолжительности или тяжести существующего симптома, нарушения, состояние или заболевание, но необязательно включает в себя полное устранение всех связанных с заболеванием симптомов, состояний или нарушений путем применения ингибитора GCG или антагониста GCGR, как описано в настоящем документе. Кроме того, термин "осуществление лечения", "лечение" или "лечить" относится к подходу для получения благоприятных или желательных результатов, включая в себя клинические результаты, которые включают в себя без ограничения одно или несколько из следующего: ингибирование, задержка или предотвращение прогрессирования тяжелой инсулинорезистентности; ингибирование, задержка или предотвращение прогрессирования заболевания, ассоциированного с тяжелой инсулинорезистентностью или характеризующегося повышенными содержаниями инсулина в плазме, повышенными содержаниями глюкозы в крови и/или кетонемией или кетоацидозом (что измеряют по повышенным содержаниям бета-гидроксибутирата), например, при синдроме Донохью, синдроме Рабсона-Менденхолла, инсулинорезистентности типа А, инсулинорезистентности типа В, синдроме HAIR-AN (гиперандрогения, инсулинорезистентность и акантокератодермия), псевдоакромегалии, синдроме Альстрема, миотонической дистрофии, синдроме Вернера, липодистрофии, циррозе печени, моногенном морбидном ожирении, гиперпроинсулинемии, недостаточности карбоксипептидазы E, нарушенном метаболизме аргинина, синдроме Барде-Бидля или состоянии или заболевании, ассоциированном с наличием генного варианта, который, как сообщалось, вызывает тяжелую инсулинорезистентность; или ингибирование, предотвращение или уменьшение интенсивности по меньшей мере одного симптома, ассоциированного с заболеванием, ассоциированным с тяжелой инсулинорезистентностью; или снижение содержаний глюкозы в крови и/или содержаний бета-гидроксибутирата (как показателя кетоацидоза), так что состояние или заболевание, ассоциированное с высокими содержаниями глюкозы в крови и кетонемией, облегчается, или по меньшей мере один симптом или осложнение, ассоциированное с состоянием или заболеванием, облегчается или его тяжесть снижается. Используемые в настоящем документе термины "лечение" или "осуществление лечения" также относятся к повышению качества жизни индивидуумов, страдающих от заболевания, снижению дозы других лекарственных средств, необходимых для лечения заболевания и/или продлению выживаемости пациентов. Например, термины "лечение" или "осуществление лечения" могут включают в себя снижение количества и/или дозировки инсулина, необходимого для лечения пациента с тяжелой инсулинорезистентностью.
[87] Фраза "инсулинорезистентность" представляет собой состояние, при котором требуется большее, чем обычно, количество инсулина, чтобы вызвать количественно нормальный ответ. Фраза "тяжелая инсулинорезистентность", в общем, относится к нозологической единице, которая, как правило, характеризуется почти нормальными или повышенными содержаниями глюкозы в крови, несмотря на заметные повышения секреции эндогенного инсулина и/или содержаний инсулина в плазме. Проявления тяжелой инсулинорезистентности наблюдаются у пациентов, которым требуется экзогенный инсулин в дозах, составляющих более 100-200 единиц в день, или у пациентов с хронически повышенными содержаниями эндогенного инсулина в крови. Moller and Flier, (1991) New England Journal of Medicine, 325:938-948. Содержания инсулина натощак выше 50-70 мкЕд/мл или пиковые (после пробы на толерантность к глюкозе при пероральном введении) содержания инсулина выше 350 мкЕд/мл указывают на тяжелую инсулинорезистентность. Значения индекса чувствительности к инсулину ниже 2×104 мкЕд/мл⋅мин, как правило, встречаются при наличии тяжелой инсулинорезистентности. Пациенты с тяжелой инсулинорезистентностью также демонстрируют скорость утилизации глюкозы, составляющую ниже 2 мг/кг⋅мин. См. Tritos and Mantzoros, (1998) Journal of Clinical Endocrinology and Metabolism, 83:3025-3030.
Ингибиторы сигнального пути GCG/GCGR
[88] В настоящем документе предусмотрены ингибиторы GCG и антагонисты GCGR для лечения состояний или заболеваний, характеризующихся тяжелой инсулинорезистентностью. Согласно некоторым вариантам осуществления антагонист представляет собой ингибитор глюкагона. Согласно некоторым вариантам осуществления антагонист представляет собой ингибитор GCGR. Согласно некоторым вариантам осуществления антагонист GCGR представляет собой MK-0893, PF-06291874, LGD-6972 или LY2409021.
[89] Согласно некоторым вариантам осуществления антагонист содержит антитело, способное связываться с GCG или GCGR, или его фрагмент. Согласно некоторым вариантам осуществления сигнальный путь ингибируют путем прерывания экспрессии GCG или GCGR, например, с использованием технологии CRISPR или антисмысловой последовательности.
[90] Согласно некоторым вариантам осуществления ингибитор GCG или антагонист GCGR представляет собой антисмысловую молекулу, антитело, низкомолекулярный ингибитор, пептидный ингибитор, DARPin, шпигельмер, аптамер, сконструированные домены Fn III типа или их производное.
Антитела к GCGR, антитела к GCG и фрагменты антител
[91] Согласно некоторым вариантам осуществления антагонист GCGR представляет собой антитело или фрагмент антитела, как раскрыто в патенте США № 8545847, полностью включенном в настоящий документ посредством ссылки. Раскрытые в нем антитела представлены в таблице 1.
Таблица 1
[92] Дополнительные антитела GCGR или фрагменты антител, рассматриваемые как применимые в настоящем документе, включают в себя те, которые раскрыты в патентах США №№ 5770445 и 7947809; заявке на выдачу европейского патента EP2074149A2; европейском патенте EP0658200B1; патентных публикациях США №№ 2009/0041784; 2009/0252727 и 2011/0223160 и публикации согласно PCT № WO2008/036341. Патенты и публикации полностью включены в настоящий документ посредством ссылки.
[93] Согласно некоторым вариантам осуществления ингибитор GCG представляет собой антитело или его фрагмент, как раскрыто в патентной публикации США № 2016/0075778, полностью включенной в настоящий документ посредством ссылки. Раскрытые в нем антитела представлены в таблице 2.
Таблица 2
[94] Дополнительные антитела GCG или фрагменты антител, рассматриваемые как применимые в настоящем документе, включают в себя те, которые раскрыты в патентах США №№ 4206199; 4221777; 4423034; 4272433; 4407965; 5712105 и публикациях согласно PCT №№ WO2007/124463 и WO2013/081993.
[95] Фрагменты антител включают в себя любой фрагмент, характеризующийся требуемой специфичностью в отношении мишени, например, фрагменты антител, полученные либо путем модификации целых антител (например, путем ферментативного расщепления), либо синтезированные de novo с использованием методик рекомбинантной ДНК (scFv, однодоменные антитела, DVD (иммуноглобулины с двумя вариабельными доменами) или dAb (антитела с одним вариабельным доменом)), либо идентифицированные с использованием библиотек фагового или дрожжевого дисплея человека (см., например, McCafferty et al. (1990) Nature 348: 552-554). Альтернативно антитела можно выделить из мышей, продуцирующих человеческие, человеческие/мышиные, человеческие/крысиные и человеческие/кроличьи химерные антитела, с использованием стандартных способов иммунизации и выделения антител, включая в себя без ограничения создание гибридом или использование технологий скрининга В-клеток, таких как SLAM. Связывающие иммуноглобулин домены также включают в себя без ограничения вариабельные области тяжелой (VH) или легкой (VL) цепей иммуноглобулинов. Или путем иммунизации людей и выделения антиген-положительных В-клеток и клонирования кДНК, кодирующих тяжелую и легкую цепь, и их совместной экспрессии в клетке, такой как СНО.
[96] Используемый в настоящем документе термин "антитело" относится к полипептиду, содержащему каркасную область из гена иммуноглобулина или его фрагментов, которая специфически связывает и распознает антиген. Распознанные гены иммуноглобулина включают в себя константные области каппа, лямбда, альфа, гамма, дельта, эпсилон и мю, а также множество генов вариабельной области иммуноглобулина. Легкие цепи классифицируют как каппа или лямбда. Тяжелые цепи классифицируют как гамма, мю, альфа, дельта или эпсилон, которые, в свою очередь, определяют классы иммуноглобулинов, IgG, IgM, IgA, IgD и IgE соответственно. В пределах каждого класса IgG существуют разные изотипы (например, IgG1, IgG2, IgG3, IgG4). Как правило, антигенсвязывающая область антитела будет наиболее важной при определении специфичности и аффинности связывания.
[97] Иллюстративная структурная единица иммуноглобулина (антитела) содержит тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, каждая пара содержит одну легкую цепь (приблизительно 25 кДа) и одну тяжелую цепь (приблизительно 50-70 кДа). N-конец каждой цепи определяет вариабельную область из приблизительно 100-110 или более аминокислот, в первую очередь ответственную за распознавание антигена. Термины "вариабельная легкая цепь" (VL) и "вариабельная тяжелая цепь" (VH) относятся к этим легким и тяжелым цепям соответственно.
[98] Антитела существуют в виде интактных иммуноглобулинов или в виде ряда хорошо охарактеризованных фрагментов, полученных путем расщепления различными пептидазами. Например, пепсин расщепляет антитело ниже дисульфидных связей в шарнирной области с образованием F(ab)'2, димера Fab, который сам представляет собой легкую цепь, соединенную с VH -CH1 дисульфидной связью. F(ab)'2 можно восстановить в мягких условиях, чтобы разорвать дисульфидную связь в шарнирной области, превращая тем самым димер F(ab)'2 в мономер Fab'. Мономер Fab' по существу представляет собой Fab с частью шарнирной области. Хотя различные фрагменты антител определены с точки зрения расщепления интактного антитела, специалисту в настоящей области техники будет понятно, что такие фрагменты можно синтезировать de novo либо химически, либо с использованием методики рекомбинантной ДНК.
[99] Способы получения антител, применимых в соответствии с описанными в настоящем документе способами, известны в настоящей области техники. См., например, Kohler & Milstein (1975) Nature 256:495-497; Harlow & Lane (1988) Antibodies: a Laboratory Manual, Cold Spring Harbor Lab., Cold Spring Harbor, N.Y.). Гены, кодирующие тяжелые и легкие цепи представляющего интерес антитела, можно клонировать из клетки, например, гены, кодирующие моноклональное антитело, можно клонировать из гибридомы и использовать для получения рекомбинантного моноклонального антитела. Моноклональные антитела можно гуманизировать с использованием стандартного клонирования областей CDR в полученный от человека остов. Генные библиотеки, кодирующие человеческие тяжелые и легкие цепи моноклональных антител, также можно получить из клеток гибридомы или плазматических клеток. Случайные комбинации продуктов генов тяжелой и легкой цепей создают большой пул антител с различной антигенной специфичностью. Техники для получения одноцепочечных антител или рекомбинантных антител (патент США № 4946778; патент США № 4816567) можно адаптировать для получения антител, используемых в раскрытых в настоящем документе способах. Кроме того, трансгенные мыши или другие организмы, такие как другие млекопитающие, могут быть использованы для экспрессии человеческих, человеческих/мышиных, человеческих/крысиных, человеческих/кроличьих химерных или гуманизированных антител. Альтернативно технологию фагового дисплея или дрожжевого дисплея можно использовать для идентификации человеческих антител и гетеромерных фрагментов Fab, которые специфически связываются с выбранными антигенами.
Иммуноконъюгаты
[100] Согласно настоящему раскрытию предусмотрено лечение тяжелой инсулинорезистентности с помощью моноклонального антитела к GCGR человека, конъюгированного с терапевтическим фрагментом ("иммуноконъюгат"), таким как средство, которое способно снижать содержания глюкозы в крови или устранять другой симптом тяжелой инсулинорезистентности. Тип терапевтического фрагмента, который можно конъюгировать с антителом к GCGR, будет учитывать подлежащее лечению состояние и требуемый терапевтический эффект, который должен быть достигнут. Например, в целях снижения содержания глюкозы в крови и/или поддержания нормальных содержаний глюкозы в крови, такое средство, как бигуанид (например, метформин), сульфонилмочевина (например, глибурид, глипизид), агонист PPAR-гамма (например, пиоглитазон, росиглитазон); ингибитор альфа-глюкозидазы (например, акарбоза, воглибоза), ингибитор образования конечных продуктов гликирования (например, аминогуанидин) или второй ингибитор GCGR или ингибитор GCG, можно конъюгировать с антителом GCGR. Альтернативно, если требуемый терапевтический эффект заключается в лечении кетонемии или любых других симптомов или состояний, ассоциированных с тяжелой инсулинорезистентностью, может быть целесообразно конъюгировать подходящее средство с антителом к GCGR. Примеры подходящих средств для образования иммуноконъюгатов известны в настоящей области техники, см., например, международную патентную публикацию WO 05/103081.
Мультиспецифические антитела
[101] Антитела, применимые согласно способам, предусмотренным в настоящем документе, могут являться моноспецифическими, биспецифическими или мультиспецифическими. Мультиспецифические антитела могут являться специфическими в отношении разных эпитопов одного целевого полипептида или могут содержать антигенсвязывающие домены, специфические в отношении более чем одного целевого полипептида. См, например, Tutt et al., (1991) J. Immunol. 147:60-69; Kufer et al., (2004) Trends Biotechnol. 22:238-244. Антитела к GCGR могут быть связаны или коэкспрессированы с другой функциональной молекулой, например, другим пептидом или белком. Например, антитело или его фрагмент могут являться функционально связанными (например, путем химического связывания, генетического слияния, нековалентной ассоциации или иным образом) с одним или несколькими другими молекулярными субстанциями, такими как другое антитело или фрагмент антитела, для получения биспецифического или мультиспецифического антитела со второй специфичностью связывания. Например, предусмотрены биспецифические антитела, в которых одно плечо иммуноглобулина является специфическим в отношении GCGR человека или его фрагмента, а другое плечо иммуноглобулина является специфическим в отношении второй терапевтической мишени или конъюгировано с терапевтическим фрагментом. Согласно определенным вариантам осуществления одно плечо иммуноглобулина является специфическим в отношении эпитопа на N-концевом домене hGCGR или его фрагмента, а другое плечо иммуноглобулина является специфическим в отношении эпитопа на одной из петель EC hGCGR или его фрагмента. Согласно определенным вариантам осуществления одно плечо иммуноглобулина является специфическим в отношении одной петли ЕС или ее фрагмента, а второе плечо является специфическим в отношении второй петли ЕС или ее фрагмента. Согласно определенным вариантам осуществления одно плечо иммуноглобулина является специфическим в отношении одного эпитопа на одной петле EC hGCGR, а другое плечо является специфическим в отношении второго эпитопа на той же петле EC hGCGR.
[102] Иллюстративный формат биспецифических антител, который можно использовать в соответствии со способами, описанными в настоящем документе, включает в себя использование первого домена CH3 иммуноглобулина (Ig) и второго домена CH3 Ig, причем первый и второй домены CH3 Ig отличаются друг от друга по меньшей мере на одну аминокислоту, и где по меньшей мере одно различие аминокислот снижает связывание биспецифического антитела с белком А по сравнению с биспецифическим антителом, в котором отсутствует различие по аминокислотам. Согласно одному варианту осуществления первый домен Ig CH3 связывает белок A, а второй домен Ig CH3 содержит мутацию, которая снижает или устраняет связывание белка A, такую как модификация H95R (согласно нумерации экзонов IMGT; H435R согласно нумерации EU). Второй CH3 может дополнительно содержать модификацию Y96F (согласно IMGT; Y436F согласно нумерации EU). Дополнительные модификации, которые можно обнаружить в пределах второго CH3, включают в себя: D16E, L18M, N44S, K52N, V57M и V82I (согласно IMGT; D356E, L358M, N384S, K392N, V397M и V422I согласно EU) в случае антител IgG1; N44S, K52N и V821 (согласно IMGT; N384S, K392N и V422I согласно EU) в случае антител IgG2; и Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (согласно IMGT; Q355R, N384S, K392N, V397M, R409K, E419Q и V422I согласно EU) в случае антител IgG4. Вариации формата биспецифических антител, описанного выше, предусмотрены в объеме настоящего раскрытия.
Скрининг и отбор антител
[103] Скрининг и отбор предпочтительных антител, применимых согласно способам, предусмотренным в настоящем документе, можно провести с помощью различных способов, известных в настоящей области техники. Первоначальный скрининг на наличие моноклональных антител, специфических в отношении целевого антигена, можно проводить, например, с использованием способов на основе ELISA. Вторичный скрининг предпочтительно проводят для идентификации и отбора требуемого моноклонального антитела для использования в конструировании конъюгатов антитела с лекарственным средством. Вторичный скрининг можно проводить любым подходящим способом, известным в настоящей области техники. Один предпочтительный способ, названный "Определение профиля с помощью модификации биосенсора" ("Biosensor Modification-Assisted Profiling", "BiaMAP"), описан в патентной публикации США № 2004/0101920, которая специально полностью включена посредством ссылки в настоящий документ. BiaMAP позволяет быстро идентифицировать клоны гибридомы, производящие моноклональные антитела с требуемыми характеристиками. Более конкретно, моноклональные антитела сортируют в отдельные связанные с эпитопом группы на основе оценки взаимодействий антитело: антиген. Антитела, способные блокировать либо лиганд, либо рецептор, можно идентифицировать с помощью клеточного анализа, такого как люциферазный анализ с использованием гена люциферазы под контролем промотора, управляемого NFκB, или промотора, управляемого реакцией cAMP. Стимуляция GCGR глюкагоном приводит к сигналу через NFκB/cAMP/CREB, таким образом увеличивая содержания люциферазы в клетке. Блокирующие антитела идентифицируют как антитела, которые блокировали индукцию глюкагоном люциферазной активности.
Популяция для проведения лечения
[104] Предусмотренные в настоящем документе терапевтические способы являются применимыми для лечения индивидуумов с тяжелой инсулинорезистентностью или состоянием или заболеванием, ассоциированным с тяжелой инсулинорезистентностью. Иллюстративные состояния или заболевания включают в себя следующее: синдром Донохью, синдром Рабсона-Менденхолла, инсулинорезистентность типа А, инсулинорезистентность типа В, синдром HAIR-AN (гиперандрогения, инсулинорезистентность и акантокератодермия), псевдоакромегалия, синдром Альстрема, миотоническая дистрофия, синдром Вернера, липодистрофия, цирроз печени, моногенное морбидное ожирение, гиперпроинсулинемия, недостаточность карбоксипептидазы E, нарушенный метаболизм аргинина, синдром Барде-Бидля и состояние или заболевание, ассоциированное с присутствием генного варианта, который, как сообщалось, вызывает тяжелую инсулинорезистентность. Согласно некоторым вариантам осуществления активность расщепляющей инсулин протеазы обнаруживают в сыворотке пациентов. Согласно некоторым вариантам осуществления нейтрализующие антитела к инсулину обнаруживают в сыворотке пациентов. У некоторых пациентов тяжелая инсулинорезистентность возникает в контексте аутоиммунного разрушения адипоцитов, приводящего к липодистрофии.
Терапевтическое введение и составы
[105] Согласно способам, предусмотренным в настоящем документе, применимыми являются терапевтические композиции, содержащие антагонист глюкагона/GCGR, такой как, например, антитело к GCGR. Введение терапевтических композиций в соответствии со способами, описанными в настоящем документе, будут осуществлять подходящим путем, включая в себя без ограничения следующее: внутривенно, подкожно, внутримышечно, интратекально, интрацеребрально, интравентрикулярно, интраназально или перорально, с подходящими носителями, вспомогательными веществами и другими средствами, которые включены в составы для обеспечения улучшенного переноса, доставки, переносимости и тому подобного. Множество подходящих составов можно найти в фармакологическом справочнике, известном всем химикам-фармацевтам: Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, PA. Эти составы включают в себя, например, порошки, пасты, мази, желе, воски, масла, липиды, содержащие липиды (катионные или анионные) везикулы (такие как LIPOFECTIN™), конъюгаты ДНК, безводные абсорбирующие пасты, эмульсии масло-в-воде и вода-в-масле, эмульсии карбовакс (полиэтиленгликоли различной молекулярной массы), полутвердые гели и полутвердые смеси, содержащие карбовакс. См. также Powell et al. "Compendium of excipients for parenteral formulations" PDA (1998) J Pharm Sci Technol 52:238-311.
[106] Доза антитела может варьироваться в зависимости от возраста и размера субъекта, подлежащего введению, целевого заболевания, состояний, пути введения и тому подобного. Когда антитело используют для снижения содержаний глюкозы в крови и/или уменьшения кетонемии (что измеряют, например, по содержаниям бета-гидроксибутирата), ассоциированной с тяжелой инсулинорезистентностью при различных состояниях и заболеваниях, таких как синдром инсулинорезистентности типа A, RMS или DS, у пациента, целесообразно внутривенно вводить антитело, как правило, в дозе, составляющей приблизительно 0,01 - приблизительно 30 мг/кг массы тела, более предпочтительно приблизительно 0,02 - приблизительно 7, приблизительно 0,03 - приблизительно 5 или приблизительно 0,05 - приблизительно 3 мг/кг массы тела. В зависимости от тяжести состояния и ответа на лечение частоту и продолжительность лечения можно регулировать. Согласно определенным вариантам осуществления антитело или его антигенсвязывающий фрагмент можно вводить в виде начальной дозы, составляющей по меньшей мере приблизительно 0,1 мг - приблизительно 800 мг, приблизительно 1 - приблизительно 500 мг, приблизительно 5 - приблизительно 300 мг или приблизительно 10 - приблизительно 200 мг, до приблизительно 100 мг или до приблизительно 50 мг.
[107] Согласно определенным вариантам осуществления за начальной дозой может следовать введение второй или множества последующих доз антитела или его антигенсвязывающего фрагмента в количестве, которое может быть приблизительно таким же или меньше, чем количество начальной дозы, причем последующие дозы разделены интервалом, составляющим по меньшей мере 1 день - 3 дня; по меньшей мере одну неделю, по меньшей мере 2 недели; по меньшей мере 3 недели; по меньшей мере 4 недели; по меньшей мере 5 недель; по меньшей мере 6 недель; по меньшей мере 7 недель; по меньшей мере 8 недель; по меньшей мере 9 недель; по меньшей мере 10 недель; по меньшей мере 12 недель; или по меньшей мере 14 недель.
[108] Известны различные системы доставки, которые можно использовать для введения фармацевтической композиции, содержащей антитело, например, инкапсулирование в липосомы, микрочастицы, микрокапсулы, рекомбинантные клетки, способные экспрессировать мутантные вирусы, опосредованный рецептором эндоцитоз (см., например, Wu et al. (1987) J. Biol. Chem. 262:4429-4432). Способы введения включают в себя без ограничения составы-депо, аэрозольные, интрадермальные, трансдермальные, внутримышечные, интраперитонеальные, внутривенные, подкожные, интраназальные, эпидуральные, интратекальные, внутрижелудочковые и пероральные пути. Композицию можно вводить любым удобным путем, например, путем инфузии или болюсной инъекции, путем абсорбции через эпителиальные или слизистые оболочки (например, слизистую оболочку полости рта, слизистую оболочку прямой кишки и кишечника и т.д.) и можно вводить вместе с другими биологически активными средствами. Введение может являться системным или локальным.
[109] Фармацевтическую композицию можно доставлять в везикуле, в частности липосоме (см., например, Langer (1990) Science 249:1527-1533).
[110] В определенных ситуациях фармацевтическую композицию можно доставлять в системе контролируемого высвобождения. Согласно одному варианту осуществления можно использовать насос. Согласно другому варианту осуществления можно использовать полимерные материалы. Согласно еще одному варианту осуществления систему контролируемого высвобождения можно поместить в непосредственной близости от мишени композиции, таким образом, понадобится лишь доля системной дозы.
[111] Инъекционные препараты могут включать в себя лекарственные формы для внутривенных, подкожных, внутрикожных и внутримышечных инъекций, капельных инфузий и т.д. Эти инъекционные препараты можно получить общеизвестными способами. Например, инъекционные препараты можно получить, например, путем растворения, суспендирования или эмульгирования описанного выше антитела или его соли в стерильной водной среде или масляной среде, обычно используемых для инъекций. В качестве водной среды для инъекций существует, например, физиологический солевой раствор, изотонический раствор, содержащий глюкозу и другие вспомогательные средства и т.д., которые можно использовать в комбинации с подходящим солюбилизирующим средством, таким как спирт (например, этанол), многоатомный спирт (например, пропиленгликоль, полиэтиленгликоль), неионогенное поверхностно-активное вещество [например, полисорбат 80, HCO-50 (полиоксиэтиленовый (50 моль) аддукт гидрогенизированного касторового масла)] и т.д. В качестве масляной среды используют, например, кунжутное масло, соевое масло и т.д., которые можно использовать в комбинации с солюбилизирующим средством, таким как бензилбензоат, бензиловый спирт и т.д. Полученной таким образом инъекцией предпочтительно наполняют соответствующую ампулу.
[112] Фармацевтическую композицию, применимую в настоящем документе, можно доставлять подкожно или внутривенно с помощью стандартной иглы и шприца. Кроме того, в отношении подкожной доставки, устройство доставки шприц-ручка легко находит применение при доставке фармацевтической композиции, применимой в способах, описанных в настоящем документе. Такое устройство доставки шприц-ручка может являться многоразовым или одноразовым. Многоразовое устройство доставки шприц-ручка обычно использует сменный картридж, который содержит фармацевтическую композицию. Как только вся фармацевтическая композиция в картридже введена и картридж пуст, пустой картридж можно легко выбросить и заменить новым картриджем, который содержит фармацевтическую композицию. После этого устройство доставки шприц-ручку можно повторно использовать. В одноразовом устройстве доставки шприце-ручке нет сменного картриджа. Напротив, одноразовое устройство доставки шприц-ручка поставляется предварительно заполненным фармацевтической композицией, содержащейся в резервуаре внутри устройства. Как только резервуар опорожняется от фармацевтической композиции, все устройство выбрасывают.
[113] Многочисленные многоразовые устройства доставки шприцы-ручки и автоинъекторы находят применение в подкожной доставке фармацевтической композиции, применимой согласно способам, описанным в настоящем документе. Примеры включают в себя без ограничения следующее: AUTOPEN™ (Owen Mumford, Inc., Woodstock, UK), шприц-ручка DISETRONIC™ (Disetronic Medical Systems, Burghdorf, Switzerland), шприц-ручка HUMALOG MIX 75/25™, шприц-ручка HUMALOG™, шприц-ручка HUMALIN 70/30™ (Eli Lilly and Co., Indianapolis, Inn.), NOVOPEN™ I, II и III (Novo Nordisk, Copenhagen, Denmark), NOVOPEN JUNIOR™ (Novo Nordisk, Copenhagen, Denmark), шприц-ручка BD™ (Becton Dickinson, Franklin Lakes, N.J.), OPTIPEN™, OPTIPEN PRO™, OPTIPEN STARLET™ и OPTICLIK™ (Sanofi-Aventis, Frankfurt, Germany), называя лишь несколько из них. Примеры одноразовых устройств доставки шприц-ручка, находящих свое применение в подкожной доставке фармацевтической композиции, применимой согласно способам, описанным в настоящем документе, включают в себя без ограничения следующее: шприц-ручка SOLOSTAR™ (sanofi-aventis), FLEXPEN™ (Novo Nordisk) и KWIKPEN™ (Eli Lilly), автоинъектор SURECLICK™ (Amgen, Thousand Oaks, Calif.), PENLET™ (Haselmeier, Stuttgart, Germany), EPIPEN (Dey, L.P.) и шприц-ручка HUMIRA™ (Abbott Labs, Abbott Park, Ill.), называя лишь несколько из них.
[114] Фармацевтические композиции для перорального или парентерального применения, описанные выше, преимущественно получают в виде лекарственных форм в стандартной дозе, которая соответствует дозе активного ингредиента. Такие лекарственные формы в стандартной дозе включают в себя, например, таблетки, пилюли, капсулы, инъекции (ампулы), суппозитории и т.д. Количество содержащегося вышеупомянутого антитела, как правило, составляет от приблизительно 5 до приблизительно 750 мг на лекарственную форму в стандартной дозе; особенно в форме инъекций предпочтительно, чтобы указанное антитело содержалось в количестве, составляющем от приблизительно 5 до приблизительно 100 мг и от приблизительно 10 до приблизительно 250 мг для других лекарственных форм.
Виды комбинированной терапии
[115] Согласно многим вариантам осуществления ингибиторы GCG или антагонисты GCGR, применимые в настоящем документе, можно вводить в комбинации с одним или несколькими дополнительными соединениями или видами терапии. Комбинированная терапия может являться одновременной или последовательной.
[116] Согласно некоторым вариантам осуществления ингибитор GCG или антагонист GCGR вводят по меньшей мере с одним дополнительным терапевтическим средством, выбранным из следующего: инсулин, бигуанид, hIGF1, лептин, пиоглитазон, вилдаглиптин, акарбоза, ингибиторы альфа-гликозидазы, L-аргинин, ингибиторы дипептидил-пептидазы-4, секретогены инсулина, агонисты рецептора амилина, сенсибилизаторы инсулина, ингибиторы SGLT2, ингибиторы SGLT1, аналоги GLP-1, активаторы рецептора GLP-1, второй ингибитор GCG и второй антагонист GCGR. Согласно некоторым вариантам осуществления ингибитор GCG или антагонист GCGR вводят по меньшей мере с одним дополнительным терапевтическим средством, выбранным из следующего: ванадат или соли ванадия, фенитоин, бензафибрат. Согласно некоторым вариантам осуществления ингибитор GCG или антагонист GCGR вводят с диетической добавкой, такой как богатый ω-3 жирными кислотами рыбий жир.
[117] Согласно некоторым вариантам осуществления сенсибилизатор инсулина представляет собой тиазолидиндион, такой как троглитазон. Согласно некоторым вариантам осуществления сенсибилизатор инсулина представляет собой росиглитазон.
[118] Согласно некоторым вариантам осуществления секретоген инсулина представляет собой сульфонилмочевину, антагонисты чувствительных к АТФ калиевых каналов или меглитинид.
[119] Дополнительный(е) терапевтически активный(е) компонент(ы) можно вводить до, одновременно или после введения ингибитора GCG или антагониста GCGR. Для целей настоящего раскрытия такие схемы введения считаются введением ингибитора GCG или антагониста GCGR "в комбинации со" вторым терапевтически активным компонентом.
Схемы введения
[120] Согласно определенным вариантам осуществления, описанным в настоящем документе, множественные дозы антагониста глюкагона/GCGR можно вводить субъекту в течение определенного периода времени. Способы предусматривают последовательное введение субъекту множественных доз антагониста глюкагона/GCGR. Используемый в настоящем документе термин "последовательное введение" означает, что каждую дозу антагониста вводят субъекту в разные моменты времени, например, в разные дни, разделенные заданным интервалом (например, часами, днями, неделями или месяцами). Способы, описанные в настоящем документе, предусматривают последовательное введение пациенту одной начальной дозы антагониста глюкагона/GCGR с последующей одной или несколькими вторичными дозами антагониста глюкагона/GCGR и необязательно с последующей одной или несколькими третичными дозами антагониста глюкагона/GCGR.
[121] Термины "начальная доза", "вторичные дозы" и "третичные дозы" относятся к временной последовательности введения антагониста глюкагона/GCGR, применимого в настоящем документе. Таким образом, "начальная доза" представляет собой дозу, которую вводят в начале схемы лечения (ее также называют "исходной дозой"); "вторичные дозы" представляют собой дозы, которые вводят после начальной дозы; и "третичные дозы" представляют собой дозы, которые вводят после вторичных доз. Начальная, вторичная и третичная дозы могут содержать одинаковое количество антагониста глюкагона/GCGR, но, как правило, могут отличаться друг от друга с точки зрения частоты введения. Тем не менее, согласно определенным вариантам осуществления количество антагонистов глюкагона/GCGR, содержащихся в начальной, вторичной и/или третичной дозах, варьируется относительно друг друга (например, его корректируют выше или ниже в зависимости от ситуации) в течение курса лечения. Согласно определенным вариантам осуществления две или больше (например, 2, 3, 4 или 5) дозы вводят в начале схемы лечения в виде "нагрузочных доз", за которыми вводят последующие дозы, которые вводят реже (например, "поддерживающие дозы").
Фармацевтические композиции
[122] Раскрытые в настоящем документе способы предусматривают использование фармацевтических композиций, содержащих по меньшей мере терапевтически эффективное количество активного средства, применимого для лечения тяжелой инсулинорезистентности, такого как антагонист глюкагона/GCGR, и фармацевтически приемлемый носитель. Термин "фармацевтически приемлемый" означает одобренный регулирующим органом Федерального правительства или правительства штата или указанный в Фармакопее США или другой общепризнанной фармакопее для применения для животных и, в частности, для людей. Термин "носитель" относится к разбавителю, адъюванту, вспомогательному веществу или несущей среде, с которыми вводят терапевтическое средство. Такими фармацевтическими носителями могут являться стерильные жидкости, такие как вода и масла, включая в себя масла минерального, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное. Подходящие фармацевтические вспомогательные вещества включают в себя крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропилен, гликоль, воду, этанол и тому подобное. Композиция при необходимости также может содержать незначительные количества смачивающих или эмульгирующих средств или буферных средств для поддержания рН. Эти композиции могут принимать форму растворов, суспензий, эмульсий, таблеток, пилюль, капсул, порошков, составов с замедленным высвобождением и тому подобного. Композицию можно составить в виде суппозитория с общепринятыми связующими веществами и носителями, такими как триглицериды. Пероральные составы могут включать в себя стандартные носители, такие как маннит, лактозу, крахмал, стеарат магния, сахарин натрия, целлюлоза, карбонат магния фармацевтической степени чистоты и т.д. Примеры подходящих фармацевтических носителей описаны в "Remington's Pharmaceutical Sciences", E.W. Martin.
[123] Согласно одному варианту осуществления композиция составлена в соответствии с обычными процедурами в виде фармацевтической композиции, адаптированной для внутривенного введения людям. При необходимости композиция также может включать в себя солюбилизирующее средство и местный анестетик, такой как лидокаин, для облегчения боли в месте инъекции. Если композицию следует вводить с помощью инфузии, ее могут отпускать с флаконом для инфузии, содержащим стерильную воду или физиологический раствор фармацевтической степени чистоты. Если композицию вводят с помощью инъекции, может быть предоставлена ампула со стерильной водой для инъекций или физиологическим раствором, так чтобы ингредиенты можно было смешать перед введением.
[124] Активные средства, применимые в соответствии со способами, описанными в настоящем документе, можно составить в виде нейтральных или солевых форм. Фармацевтически приемлемые соли включают в себя соли, образованные со свободными аминогруппами, такие как соли, полученные из соляной, фосфорной, уксусной, щавелевой, винной кислот и т.д., и соли, образованные со свободными карбоксильными группами, такие как соли натрия, калия, аммония, кальция, гидроксидов трехвалентного железа, изопропиламина, триэтиламина, 2-этиламиноэтанола, гистидина, прокаина и т.п.
[125] Количество активного средства, которое будет эффективным при лечении тяжелой инсулинорезистентности, можно определить с помощью стандартных клинических техник на основе настоящего описания. Кроме того, анализы in vitro можно необязательно использовать, чтобы помочь идентифицировать оптимальные диапазоны доз. Точная доза, которую будут использовать в составе, будет также зависеть от пути введения и серьезности состояния, и ее следует определять в соответствии с решением лечащего врача и обстоятельствами каждого субъекта. Тем не менее, подходящие диапазоны доз для внутривенного введения, как правило, составляют приблизительно от 20 мкг до 2 г активного соединения на килограмм массы тела. Подходящие диапазоны доз для интраназального введения, как правило, составляют приблизительно от 0,01 пг/кг массы тела до 1 мг/кг массы тела. Эффективные дозы можно экстраполировать из кривых зависимости ответа от дозы, полученных из тест-систем in vitro или на моделях с использованием животных.
[126] Для системного введения терапевтически эффективную дозу можно первоначально оценить из анализов in vitro. Например, дозу можно составить на моделях с использованием животных для достижения диапазона циркулирующих концентраций, который включает в себя IC50, как определено в культуре клеток. Такую информацию можно использовать для более точного определения применимых у людей доз. Начальные дозировки также можно оценить по данным in vivo, например, на моделях с использованием животных, с использованием техник, хорошо известных в настоящей области техники. Специалист в настоящей области техники может легко оптимизировать введение людям на основе данных, полученных на животных.
[127] Количество и интервал дозировки можно регулировать индивидуально, чтобы обеспечить содержания соединений в плазме, которые являются достаточными для поддержания терапевтического эффекта. В случаях местного введения или селективного поглощения эффективная локальная концентрация соединений может быть не связана с концентрацией в плазме. Специалист в настоящей области техники сможет оптимизировать терапевтически эффективные местные дозировки без чрезмерных экспериментов.
[128] Количество вводимого соединения, конечно, будет зависеть от субъекта, которого лечат, от массы субъекта, тяжести поражения, способа введения и решения лечащего врача. Терапию можно повторять периодически, пока обнаруживаются симптомы или даже когда они не обнаруживаются. Терапию можно проводить отдельно или в комбинации с другими лекарственными средствами.
Наборы
[129] В настоящем документе также предусмотрено готовое изделие, содержащее упаковочный материал и фармацевтическое средство, содержащееся в упаковочном материале, причем фармацевтическое средство содержит по меньшей мере один антагонист GCG/GCGR, применимый в соответствии со способами, раскрытыми в настоящем документе, и при этом упаковочный материал содержит этикетку или вкладыш в упаковку, на которых указано, что антагонист GCG/GCGR можно использовать для лечения состояния или заболевания, характеризующегося тяжелой инсулинорезистентностью.
[130] Несмотря на то, что настоящее изобретение было конкретно показано и описано со ссылкой на ряд вариантов осуществления, специалистам в настоящей области техники понятно, что изменения в форме и деталях можно внести в различные варианты осуществления, раскрытые в настоящем документе, не отклоняясь от сущности и объема настоящего изобретения, и то, что различные варианты осуществления, раскрытые в настоящем документе, не предназначены в качестве ограничений объема настоящей формулы изобретения.
ПРИМЕРЫ
[131] Следующие примеры предоставлены таким образом, чтобы специалисты в настоящей области техники имели полное раскрытие и описание того, как реализовать способы, раскрытые в настоящем документе. Были предприняты усилия для обеспечения точности по отношению к используемым числам (например, количествам, температуре и т.д.), но следует учитывать некоторые экспериментальные ошибки и отклонения. Если не указано иное, части даны по массе, молекулярная масса представляет собой среднюю молекулярную массу, температура представлена в градусах Цельсия, а давление равно атмосферному или близко к нему.
Пример 1. Оценка антагониста GCGR в профилактике гипергликемии в модели крайней инсулинорезистентности на мышах
[132] Введение S961, антагониста инсулинового рецептора, с помощью осмотических мининасосов у мышей вызывает тяжелую инсулинорезистентность и гипергликемию (Gusarova V et al., (2014) Cell, 159:691-696; Yi P et al., (2013) Cell, 153:747-758; Schaffer L., (2008) Biochem. Biophys. Res. Commun., 376:380-383). Эту модель тяжелой инсулинорезистентности использовали для определения эффекта антитела к GCGR в профилактике гипергликемии, а также эффектов на содержания глюкозы в крови и содержания бета-гидроксибутирата в плазме (как меру кетонемии), являющихся результатом тяжелой инсулинорезистентности.
Материалы:
изотипический контроль hIgG4
H4H1327P, hIgG4 к hGCGR
S961, антагонист инсулинового рецептора (синтезированный Celtek Peptides на заказ с использованием опубликованной последовательности (Schaffer L., (2008) Biochem. Biophys. Res. Commun., 376:380-383))
Животные и инъекции:
[133] 29 мышей разделили на четыре группы по шесть - восемь мышей. Первой группе подкожно вводили с помощью инъекции 10 мг/кг изотипического контроля hIgG4 в день 0, 6 и 14 и подкожно вводили PBS с помощью инфузии с помощью осмотических мининасосов (Alzet 2002), начиная с дня 7. Второй группе подкожно вводили с помощью инъекции 10 мг/кг H4H1327P в день 0, 6 и 14 и подкожно вводили PBS с помощью инфузии с помощью осмотических мининасосов (Alzet 2002), начиная с дня 7. Третьей группе подкожно вводили с помощью инъекции 10 мг/кг изотипического контроля hIgG4 в день 0, 6 и 14 и подкожно с помощью инфузии вводили S961 в дозе, составляющей 20 нмоль/неделя с помощью осмотических мининасосов (Alzet 2002), начиная с дня 7. Четвертой группе подкожно вводили с помощью инъекции 10 мг/кг H4H1327P в день 0, 6 и 14 и подкожно с помощью инфузии вводили S961 в дозе, составляющей 20 нмоль/неделя с помощью осмотических мининасосов (Alzet 2002), начиная с дня 7. У мышей проводили забор крови в дни 0, 3, 6, 10, 14, 17 и 21 для измерений содержания глюкозы в крови. Среднее ± SEM (среднеквадратическое отклонение) содержаний глюкозы в крови в каждый момент времени рассчитывали для каждой группы, эти значения показаны в таблице 3. Плазму собирали на исходном уровне и в дни 6, 14 и 21 для определения содержаний инсулина и бета-гидроксибутирата. Среднее ± SEM содержаний бета-гидроксибутирата и инсулина в плазме в каждый момент времени рассчитывали для каждой группы, эти значения показаны в таблицах 4 и 5.
Таблица 3. Содержания глюкозы в крови
Таблица 4. Содержания бета-гидроксибутирата в плазме
Таблица 5. Содержания инсулина в плазме
Результаты
[134] Статистический анализ проводили с помощью программного обеспечения Prism (версия 6). Для оценки значимости по отношению к контрольной группе (группе 1), использовали двухфакторный дисперсионный анализ с критерием множественного сравнения Бонферрони. a: p <0,05, b: p <0,01, c: p <0,001, d: p <0,0001.
[135] Животные, которые получили лечение с помощью H4H1327P и которым вводили PBS с помощью инфузии (группа 2), показали снижения содержания глюкозы в крови по сравнению с животными, которым вводили изотипический контроль и вводили PBS с помощью инфузии (группа 1) после введения H4H1327P (между днями 3 и 21), подтверждая эффективность H4H1327P в снижении глюкозы. Животные, которым вводили изотипический контроль и вводили S961 с помощью инфузии (группа 3), показали увеличения содержания глюкозы в крови по сравнению животными, которым вводили изотипический контроль и вводили PBS с помощью инфузии (группа 1) после инфузии S961 (между днями 10 и 21), подтверждая гипергликемический эффект S961. У животных, которые получили лечение с помощью H4H1327P и которым вводили S961 с помощью инфузии (группа 4), содержания глюкозы в крови являлись сопоставимыми с содержания глюкозы у мышей группы 1 между 10 и 21 днями после инфузии S961. См. фигуру 1A.
[136] Содержания инсулина в плазме являлись повышенными у животных, которым вводили изотипический контроль и которым вводили S961 с помощью инфузии (группа 3), по сравнению животными, которым вводили изотипический контроль и вводили PBS с помощью инфузии (группа 1) в дни 14 и 21, подтверждая действие S961 в ингибировании инсулинового рецептора в течение всего периода исследования. Содержания инсулина были увеличены в равной степени у животных, которые получили лечение с помощью H4H1327P и которым вводили S961 с помощью инфузии (группа 4), по сравнению животными, которым вводили изотипический контроль и вводили S961 с помощью инфузии (группа 3). См. фигуру 1B.
[137] В соответствии с предыдущими исследованиями (Okamoto et al., (2015) Endocrinology, 156(8): 2781-2794), H4H1327P продемонстрировало повышенные содержания глюкагона в плазме, эффект, который являлся независимым от введения S961 (см. фигуру 1C).
[138] Содержания бета-гидроксибутирата в плазме повышались у животных, которым вводили изотипический контроль и которым вводили S961 с помощью инфузии (группа 3), по сравнению животными, которым вводили изотипический контроль и вводили с помощью инфузии PBS (группа 1) в день 14 и 21, тогда как они не изменялись у животных, которые получили лечение с помощью H4H1327P и которым вводили S961 с помощью инфузии (группа 4). См. фигуру 1D. Кроме того, отсутствовали различия в массе тела между группами лечения (см. фигуру 1E).
139] Эти данные указывают на то, что H4H1327P предотвращает индуцированную антагонистом инсулинового рецептора гипергликемию и кетонемию и снижает содержание глюкозы в крови даже при наличии тяжелой гиперинсулинемии.
Пример 2. Оценка антагониста GCGR в обратном развитии гипергликемии в модели крайней инсулинорезистентности на мышах
[140] Эффект антитела к GCGR в обратном развитии установившейся гипергликемии, вызванной тяжелой инсулинорезистентностью, определяли с использованием той же модели на животных и тех же материалов, которые указаны в примере 1, за исключением того, что антагонист инсулинового рецептора вводили за 4 дня до инъекции антитела к GCGR. Также определяли эффекты на содержания глюкозы в крови и бета-гидроксибутирата в плазме.
Животные и инъекции:
[141] 32 мыши разделили на четыре группы по восемь мышей. Первой группе подкожно вводили PBS с помощью инфузии с помощью осмотических мининасосов (Alzet 2002), начиная с дня 0, и подкожно вводили с помощью инъекции 10 мг/кг изотипического контроля hIgG4 в день 4, 11 и 18. Второй группе подкожно вводили PBS с помощью инфузии, начиная с дня 0, и подкожно вводили с помощью инъекции 10 мг/кг H4H1327P в день 4, 11 и 18. Третьей группе подкожно вводили с помощью инфузии S961 в дозе, составляющей 20 нмоль/неделя, начиная с дня 0, и подкожно вводили с помощью инъекции 10 мг/кг изотипического контроля hIgG4 в день 4, 11 и 18. Четвертой группе подкожно вводили с помощью инфузии S961 в дозе, составляющей 20 нмоль/неделя, начиная с дня 0, и подкожно вводили с помощью инъекции 10 мг/кг H4H1327P в день 4, 11 и 18. Забор крови у мышей осуществляли в дни 0, 4, 7, 11, 14, 18 и 21 для измерений содержания глюкозы в крови. Среднее ± SEM содержаний глюкозы в крови в каждый момент времени рассчитывали для каждой группы, и результаты показаны в таблице 6. Плазму собирали на исходном уровне и в дни 4, 11 и 21 для определения содержаний инсулина и бета-гидроксибутирата. Среднее ± SEM содержаний бета-гидроксибутирата и инсулина в плазме в каждый момент времени рассчитывали для каждой группы, и результаты показаны в таблицах 7 и 8.
Таблица 6. Содержания глюкозы в крови (мг/дл)
изотипический контроль
Таблица 7. Содержания бета-гидроксибутирата в плазме (ммоль/л)
изотипический контроль
Таблица 8. Содержания инсулина в плазме (нг/мл)
изотипический контроль
Результаты
[142] Статистический анализ проводили с помощью программного обеспечения Prism (версия 6). Для оценки значимости по отношению к контрольной группе (групп 1) использовали двухфакторный дисперсионный анализ с критерием множественного сравнения Бонферрони. a: p <0,05, b: p <0,01, c: p <0,001, d: p <0,0001.
[143] Животные, которым вводили S961 с помощью инфузии и которым вводили изотипический контроль (группа 3), показали увеличения содержания глюкозы в крови по сравнению с животным, которым вводили PBS с помощью инфузии и которым вводили изотипический контроль (группа 1) после инфузии S961 (между днями 4 и 21), подтверждая гипергликемический эффект S961. Животные, которым вводили S961 с помощью инфузии и которые получали лечение с помощью H4H1327P (группа 4), показали содержания глюкозы в крови, которые являлись почти идентичными содержаниям у животных, которым вводили PBS с помощью инфузии и которым вводили изотипический контроль (группа 1) после введения H4H1327P. Животные, которым вводили PBS с помощью инфузии и которые получили лечение с помощью H4H1327P (группа 2), поддерживали сниженные содержания глюкозы в крови по сравнению животными, которым вводили изотипический контроль и вводили PBS с помощью инфузии (группа 1) после введения H4H1327P (между днями 4 и 21), подтверждая эффективность H4H1327P в снижении глюкозы. См. фигуру 2A.
[144] Содержания инсулина в плазме повышались у животных, которым вводили S961 с помощью инфузии и которым вводили изотипический контроль (группа 3), по сравнению с животными, которым вводили PBS с помощью инфузии и которым вводили изотипический контроль (группа 1) в дни 4, 11 и 21, подтверждая действие S961 в ингибировании инсулинового рецептора в течение всего периода исследования. См. фигуру 2B. Гиперинсулинемия (таблица 8 и фигура 2B) и гиперглюкагонемия (см. фигуру 2C) являлись более выраженными у мышей, которые получили антагонисты обоих рецепторов.
[145] Содержания бета-гидроксибутират в плазме повышались у животных, которым вводили S961 с помощью инфузии и которым вводили изотипический контроль (группа 3), по сравнению с животными, которым вводили PBS с помощью инфузии и которым вводили изотипический контроль (группа 1) в дни 11 и 21, тогда как они не изменялись у животных, которым вводили S961 с помощью инфузии и которые получали лечение с помощью H4H1327P (группа 4) в те же самые моменты времени, что и у животных группы 1. См. фигуру 2D.
[146] В соответствии с предыдущими данными (Okamoto et al., 2015), H4H1327P увеличивало содержания аминокислот в кровотоке, как это делал S961, но в меньшей степени, чем это делало антитело (см. фигуру 2E). Ингибирование как инсулиновых, так и глюкагоновых рецепторов вызывало аддитивное увеличение содержаний аминокислот в плазме (см. фигуру 2E). Изменений массы тела не наблюдали (см. фигуру 2F).
[147] Эти данные указывают на то, что H4H1327P вызывает обратное развитие вызванной антагонистом инсулинового рецептора гипергликемии и кетонемии и снижает содержание глюкозы в крови даже при наличии тяжелой гиперинсулинемии.
Пример 3: Оценка антагониста GCGR в обратном развитии вызванной антагонистом инсулинового рецептора экспрессии Pepck в печени
[148] Образцы печени, полученные от мышей, получивших лечение в соответствии с каждой из четырех групп из примера 1, лизировали охлажденным на льду буфером RIPA (50 мМ Трис, 150 мМ NaCl, 1 мМ EDTA, 50 мМ NaF, 10 мМ β-глицерофосфата, 5 мМ пирофосфата натрия двухосновного и 1% NP-40) в присутствии коктейлей ингибиторов протеаз и фосфатаз (Thermo-Fisher), 1 мМ DTT и 2 мМ Na3VO4. Общие лизаты образцов смешивали с 6-кратным загрузочным буфером SDS (Alfa-Aesar) и кипятили в течение 5 минут. Образцы белка (10-100 мкг) загружали и разделяли на 4-20% градиентных гелях SDS-PAGE (Bio-Rad) и переносили на поливинилидендифторидные мембраны. Мембраны блокировали в течение 1 часа 5% бычьим сывороточным альбумином в 1×TBS с добавлением 0,1% Tween-20 (Bio-Rad) и инкубировали с антителом к фосфоенолпируваткарбоксикиназе (PEPCK) (1: 250; Abcam). Связанные антитела обнаруживали с использованием конъюгированных с пероксидазой хрена вторичных антител к антителам кролика или мыши (1: 10000; Jackson ImmunoResearch) и усиленного хемилюминесцентного реагента (Thermo-Fisher). Интенсивности полос количественно определяли в программном обеспечении Image J.
[149] Анализ вестерн-блоттинг показал, что содержания ограничивающего скорость глюконеогенного фермента фосфоенолпируваткарбоксикиназы (Pepck) снижались на 70% в печени мышей, получавших лечение с помощью H4H1327P (см. фиг. 3A и B). Напротив, содержания Pepck увеличились в 2,3 раза в печени мышей, которым вводили S961 с помощью инфузии, причем этот эффект изменялся на снижение на 30% ниже исходного уровня с помощью H4H1327P. Таким образом, относительные содержания передачи сигнала глюкагона и инсулина регулируют экспрессию Pepck, как продемонстрировано ранее (Lynedjian et al., (1995); Rucktäschel et al., (2000); Chakravarty et al., (2005)). Эти данные показывают, что блокада GCGR с помощью H4H1327P предотвращает индуцированную тяжелой инсулинорезистентностью гипергликемию у мышей путем подавления продукции глюкозы в печени.
Пример 4. Оценка антагонизма GCGR и инсулинового рецептора на массы α- и β-клеток
[150] Поджелудочную железу, полученную от мышей, получавших лечение в соответствии с каждой из четырех групп из примера 2, фиксировали в 10% нейтральном забуференном растворе формалина в течение 48 часов, помещали в парафин и разрезали на микропрепараты. Ткань и клетки поджелудочной железы пермеабилизировали и гибридизировали с помощью комбинаций зондов иРНК для мышиного Gcg и Ins2 в соответствии с инструкциями производителя (Advanced Cell Diagnostics). Хромогенный набор использовали для амплификации сигнала иРНК (Advanced Cell Diagnostics). Области положительных в отношении глюкагона и инсулина клеток измеряли с использованием программного обеспечения для анализа цифровых изображений Halo (Indica Labs). Рассчитывали процентное отношение положительных в отношении глюкагона и инсулина областей пропорционально всей площади поджелудочной железы. Массу α- и β-клеток рассчитывали путем умножения площади α- и β-клеток для каждого животного на его соответствующую массу поджелудочной железы. Количество островков измеряли путем подсчета количества положительных в отношении инсулина островков на срезе с использованием программного обеспечения для анализа цифровых изображений Halo и нормировали ко всей области поджелудочной железы среза.
[151] H4H1327P увеличивало массу поджелудочной железы на 19%, причем этот эффект был больше (33%) в присутствии как H4H1327P, так и S961 (см. фигуру 4A). Гибридизацию РНК in situ (РНК ISH) с использованием зондов для Gcg и Ins2 использовали для морфометрического анализа срезов поджелудочной железы. H4H1327P увеличило массу α-клеток в 5,7 раза (см. фигуру 4B), а введение S961 увеличило массу β-клеток в 3 раза (см. фигуру 4C). H4H1327P отдельно не влияло на массу β-клеток, но неожиданно, масса β-клеток удваивалась при одновременном присутствии S961 и H4H1327P по сравнению с S961 отдельно и увеличивалась в 5,8 раза по сравнению с контрольными мышами (см. фигуру 4C). Важно отметить, что дальнейшее увеличение массы β-клеток имело место в условиях нормальных содержаний глюкозы в крови (таблица 3). Масса α-клеток немного увеличивалась при лечении с помощью S961 (в 1,6 раза) и при одновременном присутствии H4H1327P (в 1,4 раза по сравнению с H4H1327P отдельно) (см. фигуру 4B). S961 увеличил количество островков на общую площадь поджелудочной железы на 49%, тогда как комбинированное лечение с помощью S961 и H4H1327P увеличило количество островков на площадь на 82% (см. фигуру 4D). Таким образом, компенсаторное увеличение массы α- и β-клеток происходило, когда происходило ингибирование передачи сигнала глюкагона и инсулина. Новые данные заключаются в том, что масса β-клеток удвоилась у инсулинорезистентных мышей, когда передача сигнала глюкагона была блокирована, и что этот эффект имел место при нормальных содержаниях глюкозы в крови.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> РЕГЕНЕРОН ФАРМАСЬЮТИКАЛЗ, ИНК.
ГРОМАДА, Джеспер
ОКАМОТО, Харука
ДЖАСПЕРС, Стивен
ХАРП, Джойс
<120> Способы лечения тяжелой инсулинорезистентности путем прерывания
передачи
сигнала глюкагонового рецептора
<130> 10282WO01
<140> TBD
<141> 2017-08-25
<150> 62/381263
<151> 2016-08-30
<150> 62/411032
<151> 2016-10-21
<160> 308
<170> PatentIn версия 3.5
<210> 1
<211> 375
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 1
caggtccagt tggtacagtc tggggctgac gtgaagaagc ctggggcctc agtgaaggtc
60
tcctgcaagg tttccggaca tatcctcact gatttatcca tgcactgggt gcgacagcct
120
cctggaaaag gacttgagtg gatggcaggt tttgatcctg aagaaggtaa aataatctac
180
gcacagaagt tccagggcag agtcaccatg accgaggaca catctacaga cacagcctac
240
atggagctga gcagcctgag atctggggac acggccgttt attactgtgc aacaagcgat
300
attttgactg ggtattatag agactactac ggtttggacg tctggggcca agggaccacg
360
ctcaccgtct cctca
375
<210> 2
<211> 125
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 2
Gln Val Gln Leu Val Gln Ser Gly Ala Asp Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Val Ser Gly His Ile Leu Thr Asp Leu
20 25 30
Ser Met His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Ala Gly Phe Asp Pro Glu Glu Gly Lys Ile Ile Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Glu Asp Thr Ser Thr Asp Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Gly Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Ser Asp Ile Leu Thr Gly Tyr Tyr Arg Asp Tyr Tyr Gly Leu
100 105 110
Asp Val Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser
115 120 125
<210> 3
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 3
ggacatatcc tcactgattt atcc
24
<210> 4
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 4
Gly His Ile Leu Thr Asp Leu Ser
1 5
<210> 5
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 5
tttgatcctg aagaaggtaa aata
24
<210> 6
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 6
Phe Asp Pro Glu Glu Gly Lys Ile
1 5
<210> 7
<211> 54
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 7
gcaacaagcg atattttgac tgggtattat agagactact acggtttgga cgtc
54
<210> 8
<211> 18
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 8
Ala Thr Ser Asp Ile Leu Thr Gly Tyr Tyr Arg Asp Tyr Tyr Gly Leu
1 5 10 15
Asp Val
<210> 9
<211> 336
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 9
gatattgtga tgactcagtc tccactcttc ctgcccgtca cccctggaga gccggcctcc
60
atctcctgca ggtctagtca gagcctcctg catagtaaag gatacaacta tttggattgg
120
tacctgcaga agccagggca gtctccacaa ctcctgatct atttgggttc taatcgggcc
180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc
240
agcagagtgg aggctgaaga tgttggggtt tattactgca tgcaaactct acaaactcct
300
cggacgttcg gccaagggac caaggtggaa atcaaa
336
<210> 10
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 10
Asp Ile Val Met Thr Gln Ser Pro Leu Phe Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Lys Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Thr
85 90 95
Leu Gln Thr Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 11
<211> 33
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 11
cagagcctcc tgcatagtaa aggatacaac tat
33
<210> 12
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 12
Gln Ser Leu Leu His Ser Lys Gly Tyr Asn Tyr
1 5 10
<210> 13
<211> 9
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 13
ttgggttct
9
<210> 14
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 14
Leu Gly Ser
1
<210> 15
<211> 27
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 15
atgcaaactc tacaaactcc tcggacg
27
<210> 16
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 16
Met Gln Thr Leu Gln Thr Pro Arg Thr
1 5
<210> 17
<211> 375
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 17
caggtccagt tggtacagtc tggggctgac gtgaagaagc ctggggcctc agtgaaggtc
60
tcctgcaagg tttccggaca tatcctcact gatttatcca tgcactgggt gcgacaggct
120
cctggaaaag ggcttgagtg gatgggaggt tttgatcctg aagaaggtga aataatctac
180
gcacagaagt tccagggcag agtcaccatg accgaggaca catctacaga cacagcctac
240
atggagctga gcagcctgag atctggggac acggccgttt attactgtgc aacaagcgat
300
attttgactg gttattatag agactactac ggtttggacg tctggggcca agggaccacg
360
ctcaccgtct cctca
375
<210> 18
<211> 125
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 18
Gln Val Gln Leu Val Gln Ser Gly Ala Asp Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Val Ser Gly His Ile Leu Thr Asp Leu
20 25 30
Ser Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Gly Phe Asp Pro Glu Glu Gly Glu Ile Ile Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Glu Asp Thr Ser Thr Asp Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Gly Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Ser Asp Ile Leu Thr Gly Tyr Tyr Arg Asp Tyr Tyr Gly Leu
100 105 110
Asp Val Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser
115 120 125
<210> 19
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 19
ggacatatcc tcactgattt atcc
24
<210> 20
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 20
Gly His Ile Leu Thr Asp Leu Ser
1 5
<210> 21
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 21
tttgatcctg aagaaggtga aata
24
<210> 22
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 22
Phe Asp Pro Glu Glu Gly Glu Ile
1 5
<210> 23
<211> 54
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 23
gcaacaagcg atattttgac tggttattat agagactact acggtttgga cgtc
54
<210> 24
<211> 18
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 24
Ala Thr Ser Asp Ile Leu Thr Gly Tyr Tyr Arg Asp Tyr Tyr Gly Leu
1 5 10 15
Asp Val
<210> 25
<211> 336
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 25
gatattgtga tgactcagtc tccactcttc ctgcccgtca cccctggaga gccggcctcc
60
atctcctgca ggtctagtca gagcctcctg catagtaaag gatacaacta tttggattgg
120
tacctgcaga agccagggca gtctccacaa ctcctgatct atttgggttc taatcgggcc
180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttac actgaaaatc
240
agcagagtgg aggctgaaga tgttggggtt tattactgca tgcaaactct acaaactcct
300
cggacgttcg gccaagggac caaggtggaa atcaaa
336
<210> 26
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 26
Asp Ile Val Met Thr Gln Ser Pro Leu Phe Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Lys Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Thr
85 90 95
Leu Gln Thr Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 27
<211> 33
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 27
cagagcctcc tgcatagtaa aggatacaac tat
33
<210> 28
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 28
Gln Ser Leu Leu His Ser Lys Gly Tyr Asn Tyr
1 5 10
<210> 29
<211> 9
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 29
ttgggttct
9
<210> 30
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 30
Leu Gly Ser
1
<210> 31
<211> 27
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 31
atgcaaactc tacaaactcc tcggacg
27
<210> 32
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 32
Met Gln Thr Leu Gln Thr Pro Arg Thr
1 5
<210> 33
<211> 372
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 33
gaggagcaac tggtggagtc tgggggagac ttggtacagc ctggagggtc cctaagactc
60
tcctgtgcag cctctggatt cactctcagt agttatgaaa tgaactgggt ccgccaggct
120
ccagggaagg ggctggagtg ggtttcatac attagtagag gtggtagtct gatacactac
180
acagactctg tgaagggccg attcaccatc tccagagaca acgccaagaa ttcactgtat
240
ctgcaaatga acagcctgag agccgaggac acggctgttt attactgtgt gagagaccca
300
gcagctcgtt atcattatta ttatcacggt atggacgtct ggggccaagg gaccacggtc
360
accgtctcct ca
372
<210> 34
<211> 124
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 34
Glu Glu Gln Leu Val Glu Ser Gly Gly Asp Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Ser Ser Tyr
20 25 30
Glu Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Arg Gly Gly Ser Leu Ile His Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Pro Ala Ala Arg Tyr His Tyr Tyr Tyr His Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 35
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 35
ggattcactc tcagtagtta tgaa
24
<210> 36
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 36
Gly Phe Thr Leu Ser Ser Tyr Glu
1 5
<210> 37
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 37
attagtagag gtggtagtct gata
24
<210> 38
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 38
Ile Ser Arg Gly Gly Ser Leu Ile
1 5
<210> 39
<211> 51
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 39
gtgagagacc cagcagctcg ttatcattat tattatcacg gtatggacgt c
51
<210> 40
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 40
Val Arg Asp Pro Ala Ala Arg Tyr His Tyr Tyr Tyr His Gly Met Asp
1 5 10 15
Val
<210> 41
<211> 336
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 41
gatattgtga tgactcagtc tccactctcc ctgcccgtca cccctggaga gccggcctcc
60
atctcctgca ggtctagtca gagcctcctg cacaataatg gatataacta tttggattgg
120
tatctgcaga agccagggca gtctccacag ctcctgatct atttgggttc tagtcgggcc
180
tccggggtcc ctgacaggtt cagtggcagt ggatcaggca cagattttat actgaaaatc
240
agcagagtgg aggctgaaga tgttggggtt tattactgca tgcaagctct acaaactccg
300
tggacgttcg gccgagggac caaggtggaa atcaaa
336
<210> 42
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 42
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Asn
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Ser Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Ile Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Trp Thr Phe Gly Arg Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 43
<211> 33
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 43
cagagcctcc tgcacaataa tggatataac tat
33
<210> 44
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 44
Gln Ser Leu Leu His Asn Asn Gly Tyr Asn Tyr
1 5 10
<210> 45
<211> 9
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 45
ttgggttct
9
<210> 46
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 46
Leu Gly Ser
1
<210> 47
<211> 27
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 47
atgcaagctc tacaaactcc gtggacg
27
<210> 48
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 48
Met Gln Ala Leu Gln Thr Pro Trp Thr
1 5
<210> 49
<211> 384
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 49
gaggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc
60
tcctgtgcag cctctggatt caccttcagt agttatgaca tgcactgggt ccgccaggct
120
ccaggcaagg ggctggagtg ggtggcagtt atatcatctg atggacgtga taaatactat
180
gtagactccg tgaagggccg attcaccatc tccagagaca actccaagaa cacgctttat
240
ctgcaaatga acagcctgag agctgaggac acggctgttt attactgtgc gaaagagatg
300
gtgtattacg atattttgac tggttatcat aactactacg gtatggacgt ctggggccaa
360
gggaccacgg tcaccgtctc ctca
384
<210> 50
<211> 128
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 50
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Ser Asp Gly Arg Asp Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Met Val Tyr Tyr Asp Ile Leu Thr Gly Tyr His Asn Tyr
100 105 110
Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 51
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 51
ggattcacct tcagtagtta tgac
24
<210> 52
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 52
Gly Phe Thr Phe Ser Ser Tyr Asp
1 5
<210> 53
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 53
atatcatctg atggacgtga taaa
24
<210> 54
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 54
Ile Ser Ser Asp Gly Arg Asp Lys
1 5
<210> 55
<211> 63
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 55
gcgaaagaga tggtgtatta cgatattttg actggttatc ataactacta cggtatggac
60
gtc
63
<210> 56
<211> 21
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 56
Ala Lys Glu Met Val Tyr Tyr Asp Ile Leu Thr Gly Tyr His Asn Tyr
1 5 10 15
Tyr Gly Met Asp Val
20
<210> 57
<211> 324
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 57
gacatcgtga tgacccagtc tccatcctca ctgtctgcat ctgtaggaga cagagtcacc
60
atcacttgtc gggcgagtca gggcattaac aattatttag cctggtttca gcagaaacca
120
gggaaagccc ctaagtccct gatccatact gcatccagtt tgcaaagtgg ggtcccatca
180
aagttcagcg gcagtggatc tgggacagat ttcactctca ccatcagcag cctgcagcct
240
gaagattttg caacttatta ctgccaacag tataatactt accctctcac tttcggcgga
300
gggaccaaag tggagatcaa acga
324
<210> 58
<211> 108
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 58
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Asn Asn Tyr
20 25 30
Leu Ala Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Ser Leu Ile
35 40 45
His Thr Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Lys Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Thr Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 59
<211> 18
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 59
cagggcatta acaattat
18
<210> 60
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 60
Gln Gly Ile Asn Asn Tyr
1 5
<210> 61
<211> 9
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 61
actgcatcc
9
<210> 62
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 62
Thr Ala Ser
1
<210> 63
<211> 27
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 63
caacagtata atacttaccc tctcact
27
<210> 64
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 64
Gln Gln Tyr Asn Thr Tyr Pro Leu Thr
1 5
<210> 65
<211> 381
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 65
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc
60
tcctgtgcag cctctggatt caccttcagt agttatgaca tgcactgggt ccgccaggct
120
ccaggcaagg ggctggagtg ggtggcagtt atatcatctg atggacgtga taaatactat
180
gtagactccg tgaagggccg attcaccatc tccagagaca actccaagaa cacgctttat
240
ctgcaaatga acagcctgag agctgaggac acggctgttt attactgtgc gaaagagatg
300
gtgtattacg atattttgac tggttatcat aactactacg gtatggacgt ctggggccaa
360
gggaccacgg tcaccgtctc c
381
<210> 66
<211> 127
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 66
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Ser Asp Gly Arg Asp Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Met Val Tyr Tyr Asp Ile Leu Thr Gly Tyr His Asn Tyr
100 105 110
Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser
115 120 125
<210> 67
<211> 321
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 67
gacatccaga tgacccagtc tccatcctca ctgtctgcat ctgtaggaga cagagtcacc
60
atcacttgtc gggcgagtca gggcattaac aattatttag cctggtttca gcagaaacca
120
gggaaagccc ctaagtccct gatccatact gcatccagtt tgcaaagtgg ggtcccatca
180
aagttcagcg gcagtggatc tgggacagat ttcactctca ccatcagcag cctgcagcct
240
gaagattttg caacttatta ctgccaacag tataatactt accctctcac tttcggcgga
300
gggaccaagg tggagatcaa a
321
<210> 68
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 68
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Asn Asn Tyr
20 25 30
Leu Ala Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Ser Leu Ile
35 40 45
His Thr Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Lys Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Thr Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 69
<211> 384
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 69
caggtgcagc tggtgcagtc tgggggaggc ttggtccagc ctggggggtc cctgagactc
60
tcctgtgcag cctccggatt cacctttagt aactatttga tgaactgggt ccgccaggct
120
ccagggaagg ggctggagtg gctggccaac atacaggaag atggaattga gaaatactat
180
gtggactctg tgaagggccg attcaccatc tccagagaca acgccaagaa ctcactgtat
240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagagagccc
300
tcccattacg atattttgac tggttatgac tactattacg gtatggacgt ctggggccaa
360
gggaccacgg tcaccgtctc ctca
384
<210> 70
<211> 128
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 70
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Leu Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Asn Ile Gln Glu Asp Gly Ile Glu Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Pro Ser His Tyr Asp Ile Leu Thr Gly Tyr Asp Tyr Tyr
100 105 110
Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 71
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 71
ggattcacct ttagtaacta tttg
24
<210> 72
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 72
Gly Phe Thr Phe Ser Asn Tyr Leu
1 5
<210> 73
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 73
atacaggaag atggaattga gaaa
24
<210> 74
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 74
Ile Gln Glu Asp Gly Ile Glu Lys
1 5
<210> 75
<211> 63
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 75
gcgagagagc cctcccatta cgatattttg actggttatg actactatta cggtatggac
60
gtc
63
<210> 76
<211> 21
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 76
Ala Arg Glu Pro Ser His Tyr Asp Ile Leu Thr Gly Tyr Asp Tyr Tyr
1 5 10 15
Tyr Gly Met Asp Val
20
<210> 77
<211> 324
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 77
gacatccagt tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc
60
atcacttgcc gggcaagtca gggcattaga aatgatttag gctggtatca gcagaaacca
120
gggaaagccc ctaagcgcct gatctatgct gcatccagtt tgcaaagtgg ggtcccatca
180
aggttcagcg gcagtggatc tgggacagaa ttcattctca cagtcagcag cctgcagcct
240
gaagactttg caacttatta ctgtctacag tataatagta acccattcac tttcggccct
300
gggaccaagg tggagatcaa acga
324
<210> 78
<211> 108
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 78
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ile Leu Thr Val Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Tyr Asn Ser Asn Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 79
<211> 18
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 79
cagggcatta gaaatgat
18
<210> 80
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 80
Gln Gly Ile Arg Asn Asp
1 5
<210> 81
<211> 9
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 81
gctgcatcc
9
<210> 82
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 82
Ala Ala Ser
1
<210> 83
<211> 27
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 83
ctacagtata atagtaaccc attcact
27
<210> 84
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 84
Leu Gln Tyr Asn Ser Asn Pro Phe Thr
1 5
<210> 85
<211> 381
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 85
gaggtgcagc tggtggagtc tgggggaggc ttggtccagc ctggggggtc cctgagactc
60
tcctgtgcag cctccggatt cacctttagt aactatttga tgaactgggt ccgccaggct
120
ccagggaagg ggctggagtg gctggccaac atacaggaag atggaattga gaaatactat
180
gtggactctg tgaagggccg attcaccatc tccagagaca acgccaagaa ctcactgtat
240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagagagccc
300
tcccattacg atattttgac tggttatgac tactattacg gtatggacgt ctggggccaa
360
gggaccacgg tcaccgtctc c
381
<210> 86
<211> 127
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 86
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Leu Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Asn Ile Gln Glu Asp Gly Ile Glu Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Pro Ser His Tyr Asp Ile Leu Thr Gly Tyr Asp Tyr Tyr
100 105 110
Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser
115 120 125
<210> 87
<211> 321
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 87
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc
60
atcacttgcc gggcaagtca gggcattaga aatgatttag gctggtatca gcagaaacca
120
gggaaagccc ctaagcgcct gatctatgct gcatccagtt tgcaaagtgg ggtcccatca
180
aggttcagcg gcagtggatc tgggacagaa ttcattctca cagtcagcag cctgcagcct
240
gaagactttg caacttatta ctgtctacag tataatagta acccattcac tttcggccct
300
gggaccaaag tggatatcaa a
321
<210> 88
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 88
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Ile Leu Thr Val Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Tyr Asn Ser Asn Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 89
<211> 381
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 89
gaggtgcagc tggtgcagtc tgggggagcc ttggtacagc ctggggggtc cctgagactc
60
tcctgtacag cctctggttt caccttcagt aactacgaca tgcactgggt ccgccaaact
120
acaggaaaag gtctggagtg gatctcagct attgatactg ctggtgacac atactatcca
180
ggctccgtga agggccgatt caccgtctcc agagaaaatg ccaagaactc cttttatctt
240
caaatgaaca gcctgagagc cggggacacg gctgtgtatt actgtgcaag ggaggggaag
300
tattacgata ttttgactgg tgactaccac tactacggta tggacgtctg gggccaaggg
360
accacggtca ccgtctcctc a
381
<210> 90
<211> 127
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 90
Glu Val Gln Leu Val Gln Ser Gly Gly Ala Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Asp Met His Trp Val Arg Gln Thr Thr Gly Lys Gly Leu Glu Trp Ile
35 40 45
Ser Ala Ile Asp Thr Ala Gly Asp Thr Tyr Tyr Pro Gly Ser Val Lys
50 55 60
Gly Arg Phe Thr Val Ser Arg Glu Asn Ala Lys Asn Ser Phe Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Gly Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Gly Lys Tyr Tyr Asp Ile Leu Thr Gly Asp Tyr His Tyr Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 91
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 91
ggtttcacct tcagtaacta cgac
24
<210> 92
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 92
Gly Phe Thr Phe Ser Asn Tyr Asp
1 5
<210> 93
<211> 21
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 93
attgatactg ctggtgacac a
21
<210> 94
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 94
Ile Asp Thr Ala Gly Asp Thr
1 5
<210> 95
<211> 63
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 95
gcaagggagg ggaagtatta cgatattttg actggtgact accactacta cggtatggac
60
gtc
63
<210> 96
<211> 21
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 96
Ala Arg Glu Gly Lys Tyr Tyr Asp Ile Leu Thr Gly Asp Tyr His Tyr
1 5 10 15
Tyr Gly Met Asp Val
20
<210> 97
<211> 324
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 97
gccatccgga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc
60
atcacttgtc gggcaagtca gggcattaga aatgatttag gctggtatca gcagaaacca
120
gggaaagccc ctaagcgact gatctatgct acatccagtt tgcaaagtgg ggtcccatca
180
aggttcagcg gcagtggatc tgggacagaa ttcactctca caatcagcag cctgcagcct
240
gaagattttg caacttatta ctgtctacag cataatagtt acccgctcac tttcggcgga
300
gggaccaagg tggaaatcaa acga
324
<210> 98
<211> 108
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 98
Ala Ile Arg Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Leu Ile
35 40 45
Tyr Ala Thr Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln His Asn Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 99
<211> 18
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 99
cagggcatta gaaatgat
18
<210> 100
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 100
Gln Gly Ile Arg Asn Asp
1 5
<210> 101
<211> 9
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 101
gctacatcc
9
<210> 102
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 102
Ala Thr Ser
1
<210> 103
<211> 27
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 103
ctacagcata atagttaccc gctcact
27
<210> 104
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 104
Leu Gln His Asn Ser Tyr Pro Leu Thr
1 5
<210> 105
<211> 378
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 105
gaggtgcagc tggtggagtc tgggggagcc ttggtacagc ctggggggtc cctgagactc
60
tcctgtacag cctctggttt caccttcagt aactacgaca tgcactgggt ccgccaaact
120
acaggaaaag gtctggagtg gatctcagct attgatactg ctggtgacac atactatcca
180
ggctccgtga agggccgatt caccgtctcc agagaaaatg ccaagaactc cttttatctt
240
caaatgaaca gcctgagagc cggggacacg gctgtgtatt actgtgcaag ggaggggaag
300
tattacgata ttttgactgg tgactaccac tactacggta tggacgtctg gggccaaggg
360
accacggtca ccgtctcc
378
<210> 106
<211> 126
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 106
Glu Val Gln Leu Val Glu Ser Gly Gly Ala Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Asp Met His Trp Val Arg Gln Thr Thr Gly Lys Gly Leu Glu Trp Ile
35 40 45
Ser Ala Ile Asp Thr Ala Gly Asp Thr Tyr Tyr Pro Gly Ser Val Lys
50 55 60
Gly Arg Phe Thr Val Ser Arg Glu Asn Ala Lys Asn Ser Phe Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Gly Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Gly Lys Tyr Tyr Asp Ile Leu Thr Gly Asp Tyr His Tyr Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser
115 120 125
<210> 107
<211> 321
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 107
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc
60
atcacttgtc gggcaagtca gggcattaga aatgatttag gctggtatca gcagaaacca
120
gggaaagccc ctaagcgact gatctatgct acatccagtt tgcaaagtgg ggtcccatca
180
aggttcagcg gcagtggatc tgggacagaa ttcactctca caatcagcag cctgcagcct
240
gaagattttg caacttatta ctgtctacag cataatagtt acccgctcac tttcggcgga
300
gggaccaagc tggagatcaa a
321
<210> 108
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 108
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Leu Ile
35 40 45
Tyr Ala Thr Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln His Asn Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 109
<211> 372
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 109
caggtgcagc tggtgcagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc
60
tcctgtgcag cgtctgggtt cacctttagt aactttggca tgcactgggt ccgccaggct
120
ccaggcaagg ggctggagtg ggtggcagtt atatggtttg atgaaattga taaatactat
180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat
240
ccgcaaatga acagcctgag agccgaagac acggctgtgt attactgtgc gcgagaagat
300
tacgatattt tgactggtta ctattacgct atggacgtct ggggccaagg gaccacggtc
360
accgtctcct ca
372
<210> 110
<211> 124
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 110
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Phe Asp Glu Ile Asp Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Pro Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Tyr Asp Ile Leu Thr Gly Tyr Tyr Tyr Ala Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 111
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 111
gggttcacct ttagtaactt tggc
24
<210> 112
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 112
Gly Phe Thr Phe Ser Asn Phe Gly
1 5
<210> 113
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 113
atatggtttg atgaaattga taaa
24
<210> 114
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 114
Ile Trp Phe Asp Glu Ile Asp Lys
1 5
<210> 115
<211> 51
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 115
gcgcgagaag attacgatat tttgactggt tactattacg ctatggacgt c
51
<210> 116
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 116
Ala Arg Glu Asp Tyr Asp Ile Leu Thr Gly Tyr Tyr Tyr Ala Met Asp
1 5 10 15
Val
<210> 117
<211> 321
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 117
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc
60
atcacttgcc gggcaagtca gggcattaga aatgatttag gctggtatca gcagaaacca
120
gggaaagccc ctaagcgcct aatctatgct gcatcccgtt tgcaaagtgg ggtcccatcg
180
aggttcagcg gcagtggatc tgggacagaa ttcactctca caatcagcag cctgcagcct
240
gaagattttg gaacttatta ctgtctacag cataatagtc accccacctt cggccaaggg
300
accaaggtgg agatcaaacg a
321
<210> 118
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 118
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Leu Ile
35 40 45
Tyr Ala Ala Ser Arg Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Gly Thr Tyr Tyr Cys Leu Gln His Asn Ser His Pro Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 119
<211> 18
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 119
cagggcatta gaaatgat
18
<210> 120
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 120
Gln Gly Ile Arg Asn Asp
1 5
<210> 121
<211> 9
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 121
gctgcatcc
9
<210> 122
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 122
Ala Ala Ser
1
<210> 123
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 123
ctacagcata atagtcaccc cacc
24
<210> 124
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 124
Leu Gln His Asn Ser His Pro Thr
1 5
<210> 125
<211> 369
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 125
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc
60
tcctgtgcag cgtctgggtt cacctttagt aactttggca tgcactgggt ccgccaggct
120
ccaggcaagg ggctggagtg ggtggcagtt atatggtttg atgaaattga taaatactat
180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat
240
ccgcaaatga acagcctgag agccgaagac acggctgtgt attactgtgc gcgagaagat
300
tacgatattt tgactggtta ctattacgct atggacgtct ggggccaagg gaccacggtc
360
accgtctcc
369
<210> 126
<211> 123
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 126
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Phe Asp Glu Ile Asp Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Pro Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Tyr Asp Ile Leu Thr Gly Tyr Tyr Tyr Ala Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser
115 120
<210> 127
<211> 318
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 127
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc
60
atcacttgcc gggcaagtca gggcattaga aatgatttag gctggtatca gcagaaacca
120
gggaaagccc ctaagcgcct aatctatgct gcatcccgtt tgcaaagtgg ggtcccatcg
180
aggttcagcg gcagtggatc tgggacagaa ttcactctca caatcagcag cctgcagcct
240
gaagattttg gaacttatta ctgtctacag cataatagtc accccacctt cggccaaggg
300
accaaggtgg agatcaaa
318
<210> 128
<211> 106
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 128
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Lys Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Leu Ile
35 40 45
Tyr Ala Ala Ser Arg Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Gly Thr Tyr Tyr Cys Leu Gln His Asn Ser His Pro Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 129
<211> 381
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 129
gaggtgcagc tggtggagtc ggggggaggc atggtacagc ctggggggtc cctgagactc
60
tcctgtgcag cctctggatt cacctccagt aactacgaca tgcactgggt ccgccaagct
120
acaggaaaag gtctggagtg ggtctcaagt attgatactg ctggggacac ttactatcca
180
gactccgtga agggccgctt tatcatctcc agagaaaatg ccaaaaactc cctgtatctt
240
caaatgaata gcctgagagc cggggacacg gctgtgtatt actgtacaag ggagccccga
300
aattacgaaa ttttgactgg tcactaccac taccacggta tggacatctg gggccaaggg
360
accacggtca ccgtctcctc a
381
<210> 130
<211> 127
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 130
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Met Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ser Ser Asn Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ala Thr Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asp Thr Ala Gly Asp Thr Tyr Tyr Pro Asp Ser Val Lys
50 55 60
Gly Arg Phe Ile Ile Ser Arg Glu Asn Ala Lys Asn Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Gly Asp Thr Ala Val Tyr Tyr Cys Thr
85 90 95
Arg Glu Pro Arg Asn Tyr Glu Ile Leu Thr Gly His Tyr His Tyr His
100 105 110
Gly Met Asp Ile Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 131
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 131
ggattcacct ccagtaacta cgac
24
<210> 132
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 132
Gly Phe Thr Ser Ser Asn Tyr Asp
1 5
<210> 133
<211> 21
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 133
attgatactg ctggggacac t
21
<210> 134
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 134
Ile Asp Thr Ala Gly Asp Thr
1 5
<210> 135
<211> 63
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 135
acaagggagc cccgaaatta cgaaattttg actggtcact accactacca cggtatggac
60
atc
63
<210> 136
<211> 21
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 136
Thr Arg Glu Pro Arg Asn Tyr Glu Ile Leu Thr Gly His Tyr His Tyr
1 5 10 15
His Gly Met Asp Ile
20
<210> 137
<211> 324
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 137
gacatccaga tgacccagtc gccatcctcc ctgtctgcat ctgtaggaga cagagtcacc
60
atcacttgcc gggcaagtca ggccattaga aatgatttag gctggtatca gcagaaacca
120
gggaaagccc ctaaactcct gatctatact gcattcagtt tacagagtgg ggtcccatca
180
aggttcagcg gcagtaaatc tggcacagac ttcactctca ccatcagcag cctgcagcct
240
gaagattttg cgacttatta ctgtctgcag gattacacta atcctcggac gttcggccaa
300
gggaccaagg tggagatcaa acga
324
<210> 138
<211> 108
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 138
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ala Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Thr Ala Phe Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Lys Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Asp Tyr Thr Asn Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 139
<211> 18
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 139
caggccatta gaaatgat
18
<210> 140
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 140
Gln Ala Ile Arg Asn Asp
1 5
<210> 141
<211> 9
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 141
actgcattc
9
<210> 142
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 142
Thr Ala Phe
1
<210> 143
<211> 27
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 143
ctgcaggatt acactaatcc tcggacg
27
<210> 144
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 144
Leu Gln Asp Tyr Thr Asn Pro Arg Thr
1 5
<210> 145
<211> 378
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 145
gaggtgcagc tggtggagtc ggggggaggc atggtacagc ctggggggtc cctgagactc
60
tcctgtgcag cctctggatt cacctccagt aactacgaca tgcactgggt ccgccaagct
120
acaggaaaag gtctggagtg ggtctcaagt attgatactg ctggggacac ttactatcca
180
gactccgtga agggccgctt tatcatctcc agagaaaatg ccaaaaactc cctgtatctt
240
caaatgaata gcctgagagc cggggacacg gctgtgtatt actgtacaag ggagccccga
300
aattacgaaa ttttgactgg tcactaccac taccacggta tggacatctg gggccaaggg
360
accacggtca ccgtctcc
378
<210> 146
<211> 126
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 146
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Met Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ser Ser Asn Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ala Thr Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Asp Thr Ala Gly Asp Thr Tyr Tyr Pro Asp Ser Val Lys
50 55 60
Gly Arg Phe Ile Ile Ser Arg Glu Asn Ala Lys Asn Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Gly Asp Thr Ala Val Tyr Tyr Cys Thr
85 90 95
Arg Glu Pro Arg Asn Tyr Glu Ile Leu Thr Gly His Tyr His Tyr His
100 105 110
Gly Met Asp Ile Trp Gly Gln Gly Thr Thr Val Thr Val Ser
115 120 125
<210> 147
<211> 321
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 147
gccatccaga tgacccagtc gccatcctcc ctgtctgcat ctgtaggaga cagagtcacc
60
atcacttgcc gggcaagtca ggccattaga aatgatttag gctggtatca gcagaaacca
120
gggaaagccc ctaaactcct gatctatact gcattcagtt tacagagtgg ggtcccatca
180
aggttcagcg gcagtaaatc tggcacagac ttcactctca ccatcagcag cctgcagcct
240
gaagattttg cgacttatta ctgtctgcag gattacacta atcctcggac gttcggccaa
300
gggaccaagg tggaaatcaa a
321
<210> 148
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 148
Ala Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ala Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Thr Ala Phe Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Lys Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Asp Tyr Thr Asn Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 149
<211> 357
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 149
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc
60
tcctgtgcag cctctggatt cgccttcagt aactatggca tgcactgggt ccgccaggct
120
ccaggcaagg ggctggaatg ggtgacattt atatcatatg atggaagtaa taaatactat
180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat
240
ctgcaagtga acagcctgag agctgaggac acggctgtgt attactgtgc gaaagaagca
300
gtattagctg ccctctttga ctactggggc cagggaaccc tggtcaccgt ctcctca
357
<210> 150
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 150
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ala Phe Ser Asn Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Phe Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Val Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Ala Val Leu Ala Ala Leu Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 151
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 151
ggattcgcct tcagtaacta tggc
24
<210> 152
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 152
Gly Phe Ala Phe Ser Asn Tyr Gly
1 5
<210> 153
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 153
atatcatatg atggaagtaa taaa
24
<210> 154
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 154
Ile Ser Tyr Asp Gly Ser Asn Lys
1 5
<210> 155
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 155
gcgaaagaag cagtattagc tgccctcttt gactac
36
<210> 156
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 156
Ala Lys Glu Ala Val Leu Ala Ala Leu Phe Asp Tyr
1 5 10
<210> 157
<211> 336
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 157
gacatcgtga tgacccagtc tccagactcc ctggctgtgt ctctgggcga gagggccacc
60
atcaactgca agtccagcca gagtgtttta tacagctcca acaatcagaa ctacttagct
120
tggtaccagc agaaaccagg acagcctcct aagctgctca tttactgggc atctacccgg
180
gaatccgggg tccctgaccg attcagtggc agcgggtctg ggacagattt cactctcacc
240
atcaacagcc tgcaggctga agatgtggca gtttattact gtcagcaata ttatagtact
300
cctacgttcg gccaagggac caaggtggaa atcaaa
336
<210> 158
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 158
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Gln Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Asn Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Thr Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 159
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 159
cagagtgttt tatacagctc caacaatcag aactac
36
<210> 160
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 160
Gln Ser Val Leu Tyr Ser Ser Asn Asn Gln Asn Tyr
1 5 10
<210> 161
<211> 9
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 161
tgggcatct
9
<210> 162
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 162
Trp Ala Ser
1
<210> 163
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 163
cagcaatatt atagtactcc tacg
24
<210> 164
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 164
Gln Gln Tyr Tyr Ser Thr Pro Thr
1 5
<210> 165
<211> 357
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 165
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc
60
tcctgtgcag cctctggatt cacgttcaat acctatggca tgcactgggt ccgccaggct
120
ccagtcaagg ggctggagtg ggtggcattt atatcaaatg ataagagtaa tacattctat
180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgttt
240
ctggaaatga acagcctgac agctgaggac acggctgttt attactgtgc gaaagagtcc
300
attttagcag ccctctttga ctactggggc cagggaaccc tggtcactgt ctcctca
357
<210> 166
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 166
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Val Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Ser Asn Asp Lys Ser Asn Thr Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Glu Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Ser Ile Leu Ala Ala Leu Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 167
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 167
ggattcacgt tcaataccta tggc
24
<210> 168
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 168
Gly Phe Thr Phe Asn Thr Tyr Gly
1 5
<210> 169
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 169
atatcaaatg ataagagtaa taca
24
<210> 170
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 170
Ile Ser Asn Asp Lys Ser Asn Thr
1 5
<210> 171
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 171
gcgaaagagt ccattttagc agccctcttt gactac
36
<210> 172
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 172
Ala Lys Glu Ser Ile Leu Ala Ala Leu Phe Asp Tyr
1 5 10
<210> 173
<211> 336
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 173
gacatcgtga tgacccagtc tccagactcc ctggctgtgt ctctgggcga gagggccacc
60
atcaactgca agtccagcca gagtgtttta tacagctcca acaataagaa ttacttagct
120
tggtaccaac agaaaccaag acagcctctt aaactactca tttactgggc atctattcgg
180
gaatccgggg tccctgaccg attcagtggc agcgggtctg ggacagattt cactctcacc
240
atcagcagcc tgcaggctga agatgtggca gtttattact gtcagcaatt ttatagtgtt
300
cccacttttg gccaggggac caagctggag atcaaa
336
<210> 174
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 174
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Arg Gln
35 40 45
Pro Leu Lys Leu Leu Ile Tyr Trp Ala Ser Ile Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Phe Tyr Ser Val Pro Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 175
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 175
cagagtgttt tatacagctc caacaataag aattac
36
<210> 176
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 176
Gln Ser Val Leu Tyr Ser Ser Asn Asn Lys Asn Tyr
1 5 10
<210> 177
<211> 9
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 177
tgggcatct
9
<210> 178
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 178
Trp Ala Ser
1
<210> 179
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 179
cagcaatttt atagtgttcc cact
24
<210> 180
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 180
Gln Gln Phe Tyr Ser Val Pro Thr
1 5
<210> 181
<211> 357
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 181
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc
60
tcctgtgcag cctctggatt cacgtttagt acctttggca tgcactgggt ccgccaggct
120
ccagtcaagg ggctggagtg ggtggctttt atatcaaatg ataagaataa taaattctat
180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaggga cacgctatat
240
ctgcaaatga acagcctgac acctgaggac acggctgttt attactgtgc gaaagagtcc
300
attttagcag ccctctttga ctactggggc cagggaaccc tggtcaccgt ctcctca
357
<210> 182
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 182
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Val Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Ser Asn Asp Lys Asn Asn Lys Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asp Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Thr Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Ser Ile Leu Ala Ala Leu Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 183
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 183
ggattcacgt ttagtacctt tggc
24
<210> 184
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 184
Gly Phe Thr Phe Ser Thr Phe Gly
1 5
<210> 185
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 185
atatcaaatg ataagaataa taaa
24
<210> 186
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 186
Ile Ser Asn Asp Lys Asn Asn Lys
1 5
<210> 187
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 187
gcgaaagagt ccattttagc agccctcttt gactac
36
<210> 188
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 188
Ala Lys Glu Ser Ile Leu Ala Ala Leu Phe Asp Tyr
1 5 10
<210> 189
<211> 336
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 189
gacatcgtga tgacccagtc tccagactcc ctggctgtgt ctctgggcga gagggccacc
60
atcaactgca agtccagcca gagtgtttta tacagctcca acaataaaaa ttacttagct
120
tggtaccagc agaaaccagg acagcctctt aaacttctca tttactgggc atctattcgg
180
gaatccgggg tccctgaccg attcagtggc agcgggtctg ggacagattt cactctcacc
240
atcagcagcc tgcaggctga agatgtggca gtttattact gtcagcaatt ttatactgtt
300
cccacttttg gcctggggac caagctggag atcaaa
336
<210> 190
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 190
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Leu Lys Leu Leu Ile Tyr Trp Ala Ser Ile Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Phe Tyr Thr Val Pro Thr Phe Gly Leu Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 191
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 191
cagagtgttt tatacagctc caacaataaa aattac
36
<210> 192
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 192
Gln Ser Val Leu Tyr Ser Ser Asn Asn Lys Asn Tyr
1 5 10
<210> 193
<211> 9
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 193
tgggcatct
9
<210> 194
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 194
Trp Ala Ser
1
<210> 195
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 195
cagcaatttt atactgttcc cact
24
<210> 196
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 196
Gln Gln Phe Tyr Thr Val Pro Thr
1 5
<210> 197
<211> 357
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 197
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc
60
tcctgtgtag cctctggatt caccttcagg aactatgaca tgcactgggt ccgccaggct
120
cctggcaagg ggctggaatg ggtggcagtt acatcatctg atggacttaa taaattctat
180
tcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtct
240
ctgcaaatta ccggcctgag agctgaggac acggctgtgt attactgtgc gaaagagtcc
300
attttagcag ccctctttga ctactggggc cagggaaccc tggtcaccgt ctcctca
357
<210> 198
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 198
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Val Ala Ser Gly Phe Thr Phe Arg Asn Tyr
20 25 30
Asp Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Thr Ser Ser Asp Gly Leu Asn Lys Phe Tyr Ser Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Ser
65 70 75 80
Leu Gln Ile Thr Gly Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Ser Ile Leu Ala Ala Leu Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 199
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 199
ggattcacct tcaggaacta tgac
24
<210> 200
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 200
Gly Phe Thr Phe Arg Asn Tyr Asp
1 5
<210> 201
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 201
acatcatctg atggacttaa taaa
24
<210> 202
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 202
Thr Ser Ser Asp Gly Leu Asn Lys
1 5
<210> 203
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 203
gcgaaagagt ccattttagc agccctcttt gactac
36
<210> 204
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 204
Ala Lys Glu Ser Ile Leu Ala Ala Leu Phe Asp Tyr
1 5 10
<210> 205
<211> 336
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 205
gacatcgtga tgacccagtc tccagactcc ctggctgtgt ctctgggcga gagggccacc
60
atcaactgca agtccagcca gagtgtttta tacagctcca acaataagaa ctacttggct
120
tggtaccagc agaaaccagg acagcctcct aagctgctct tttactgggc atctacccgg
180
gaatccgggg tccctgaccg attcagtggc agcgggtctg ggacagattt cactctcacc
240
atcagcagcc tgcaggctga agatgtggca gtttattact gtcagcaaca ttatactact
300
cccacttttg gccaggggac caagctggag atcaaa
336
<210> 206
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 206
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Phe Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
His Tyr Thr Thr Pro Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 207
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 207
cagagtgttt tatacagctc caacaataag aactac
36
<210> 208
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 208
Gln Ser Val Leu Tyr Ser Ser Asn Asn Lys Asn Tyr
1 5 10
<210> 209
<211> 9
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 209
tgggcatct
9
<210> 210
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 210
Trp Ala Ser
1
<210> 211
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 211
cagcaacatt atactactcc cact
24
<210> 212
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 212
Gln Gln His Tyr Thr Thr Pro Thr
1 5
<210> 213
<211> 357
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 213
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc
60
tcctgtgcag cctctggatt caccttcagt agctatggca tgcactgggt ccgccagact
120
ccgggcaagg ggctggagtg ggtggcattt atatcatatg atggaaataa taaatactat
180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgttt
240
ctgcaaatga acagcctgag agctgaggac acggctgtgt attactgtgc gaaagagtcc
300
attttagcag ccctctttga ctactggggc cagggaaccc tggtcaccgt ctcctca
357
<210> 214
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 214
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Thr Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Ser Ile Leu Ala Ala Leu Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 215
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 215
ggattcacct tcagtagcta tggc
24
<210> 216
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 216
Gly Phe Thr Phe Ser Ser Tyr Gly
1 5
<210> 217
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 217
atatcatatg atggaaataa taaa
24
<210> 218
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 218
Ile Ser Tyr Asp Gly Asn Asn Lys
1 5
<210> 219
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 219
gcgaaagagt ccattttagc agccctcttt gactac
36
<210> 220
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 220
Ala Lys Glu Ser Ile Leu Ala Ala Leu Phe Asp Tyr
1 5 10
<210> 221
<211> 336
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 221
gacatcgtga tgacccagtc tccagactcc ctggctgtgt ctctgggcga gagggccacc
60
atcaactgca agtccagcca gagtgtttta tacagctcca acaataagaa ctacttagct
120
tggtaccagc agaaacctgg acagcctcct aagctgctca tttactgggc atctacccgg
180
gaatccgggg tccctgaccg attcagtggc agcgggtctg ggacagattt cactctcacc
240
atcagcagcc tgcaggctga agatgtggca ctttattact gtcaacaata ttataatact
300
cccacttttg gccaggggac caagctggag atcaaa
336
<210> 222
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 222
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Leu Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Asn Thr Pro Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 223
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 223
cagagtgttt tatacagctc caacaataag aactac
36
<210> 224
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 224
Gln Ser Val Leu Tyr Ser Ser Asn Asn Lys Asn Tyr
1 5 10
<210> 225
<211> 9
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 225
tgggcatct
9
<210> 226
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 226
Trp Ala Ser
1
<210> 227
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 227
caacaatatt ataatactcc cact
24
<210> 228
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 228
Gln Gln Tyr Tyr Asn Thr Pro Thr
1 5
<210> 229
<211> 357
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 229
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc
60
tcctgtgcag cctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct
120
ccagtcaagg ggctggagtg ggtggcattt atatcatatg atggaagtaa taaatactat
180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat
240
ctccaaatga acagcctgac agctgaggac acggctgttt attactgtgc gaaagagtcc
300
attttagcag ccctctttga ctactggggc cagggaaccc tggtcaccgt ctcctca
357
<210> 230
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 230
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Val Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Ser Ile Leu Ala Ala Leu Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 231
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 231
ggattcacct tcagtagcta tggc
24
<210> 232
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 232
Gly Phe Thr Phe Ser Ser Tyr Gly
1 5
<210> 233
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 233
atatcatatg atggaagtaa taaa
24
<210> 234
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 234
Ile Ser Tyr Asp Gly Ser Asn Lys
1 5
<210> 235
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 235
gcgaaagagt ccattttagc agccctcttt gactac
36
<210> 236
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 236
Ala Lys Glu Ser Ile Leu Ala Ala Leu Phe Asp Tyr
1 5 10
<210> 237
<211> 336
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 237
gacatcgtga tgacccagtc tccagactcc ctggctgtgt ctctgggcga gagggccacc
60
atcaactgca agtccagcca gagtgtttta tacagttcca acaataagaa ctacttagct
120
tggtaccagc agaaaccaag acagcctcct aagctgctca tttactgggc atctattcgg
180
gaatccgggg tccctgaccg attcagtggc agcgggtctg ggacagattt cattctcacc
240
atcagcagcc tgcaggctga agatgtggca gtttattact gtcagcaatt ttatagtatt
300
cccacttttg gccaggggac caagctggag atcaaa
336
<210> 238
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 238
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Arg Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Ile Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Ile Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Phe Tyr Ser Ile Pro Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 239
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 239
cagagtgttt tatacagttc caacaataag aactac
36
<210> 240
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 240
Gln Ser Val Leu Tyr Ser Ser Asn Asn Lys Asn Tyr
1 5 10
<210> 241
<211> 9
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 241
tgggcatct
9
<210> 242
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 242
Trp Ala Ser
1
<210> 243
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 243
cagcaatttt atagtattcc cact
24
<210> 244
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 244
Gln Gln Phe Tyr Ser Ile Pro Thr
1 5
<210> 245
<211> 357
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 245
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc
60
tcctgtgcag cctctggatt cacctttagt agctatggca tgcactgggt ccgccaggct
120
ccagtcaagg ggctggagtg ggtggcattt atatcaaatg ataaaagtaa taaatattat
180
gcagactcct tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat
240
ctgcaaatga acagcctgac agctgaagac acggctgttt attactgtgc gaaagagtcc
300
attttagcag ccctctttga ctattggggc cagggaaccc tggtcaccgt ctcctca
357
<210> 246
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 246
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Val Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Ser Asn Asp Lys Ser Asn Lys Tyr Tyr Ala Asp Ser Leu
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Ser Ile Leu Ala Ala Leu Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 247
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 247
ggattcacct ttagtagcta tggc
24
<210> 248
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 248
Gly Phe Thr Phe Ser Ser Tyr Gly
1 5
<210> 249
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 249
atatcaaatg ataaaagtaa taaa
24
<210> 250
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 250
Ile Ser Asn Asp Lys Ser Asn Lys
1 5
<210> 251
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 251
gcgaaagagt ccattttagc agccctcttt gactat
36
<210> 252
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 252
Ala Lys Glu Ser Ile Leu Ala Ala Leu Phe Asp Tyr
1 5 10
<210> 253
<211> 336
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 253
gacatcgtga tgacccagtc tccagactcc ctggctgtgt ctctgggcga gagggccacc
60
atcaactgca agtccagcca gagtgtttta tacagctcca acaataagaa ctacttagct
120
tggtaccagc agaaaccaag acagcctcct aagctactca tttactgggc atctattcgg
180
gaatccgggg tccctgaccg attcagtggc agcgggtctg ggacagattt cactctcacc
240
atcagcagcc tgcaggctga agatgtggca gtttattact gtcaacaatt ttatagtgtt
300
cccacttttg gccaggggac caagctggag atcaaa
336
<210> 254
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 254
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Arg Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Ile Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Phe Tyr Ser Val Pro Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 255
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 255
cagagtgttt tatacagctc caacaataag aactac
36
<210> 256
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 256
Gln Ser Val Leu Tyr Ser Ser Asn Asn Lys Asn Tyr
1 5 10
<210> 257
<211> 9
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 257
tgggcatct
9
<210> 258
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 258
Trp Ala Ser
1
<210> 259
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 259
caacaatttt atagtgttcc cact
24
<210> 260
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 260
Gln Gln Phe Tyr Ser Val Pro Thr
1 5
<210> 261
<211> 357
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 261
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc
60
tcctgtgcag cctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct
120
ccagtcaagg ggctggagtg ggtggcattt atatcatttg atggaagtaa taaatactat
180
acagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat
240
ctccaaatga acagcctgac agctgaggac acggctattt attactgtgc gaaagagtcc
300
attttagcag ccctctttga ctactggggc cagggaaccc tggtcactgt ctcctca
357
<210> 262
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 262
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Val Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Ser Phe Asp Gly Ser Asn Lys Tyr Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Lys Glu Ser Ile Leu Ala Ala Leu Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 263
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 263
ggattcacct tcagtagcta tggc
24
<210> 264
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 264
Gly Phe Thr Phe Ser Ser Tyr Gly
1 5
<210> 265
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 265
atatcatttg atggaagtaa taaa
24
<210> 266
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 266
Ile Ser Phe Asp Gly Ser Asn Lys
1 5
<210> 267
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 267
gcgaaagagt ccattttagc agccctcttt gactac
36
<210> 268
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 268
Ala Lys Glu Ser Ile Leu Ala Ala Leu Phe Asp Tyr
1 5 10
<210> 269
<211> 336
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 269
gacatcgtga tgacccagtc tccagactcc ctggctgtgt ctctgggcga gagggccacc
60
atcaactgca agtccagcca gagtgtttta tacagctcca acaataagaa ctacttagct
120
tggtaccagc agaaaccaag acagcctcct aacctgctca tttactgggc atctattcgg
180
gaatccgggg tccctgaccg attcagtggc agcgggtctg ggacagattt cactctcacc
240
atcagcagcc tgcaggctga agatgtggca ttttattact gtcagcaatt ttatagtatt
300
cccacttttg gccaggggac caagctggag atcaaa
336
<210> 270
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 270
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Arg Gln
35 40 45
Pro Pro Asn Leu Leu Ile Tyr Trp Ala Ser Ile Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Phe Tyr Tyr Cys Gln Gln
85 90 95
Phe Tyr Ser Ile Pro Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 271
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 271
cagagtgttt tatacagctc caacaataag aactac
36
<210> 272
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 272
Gln Ser Val Leu Tyr Ser Ser Asn Asn Lys Asn Tyr
1 5 10
<210> 273
<211> 9
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 273
tgggcatct
9
<210> 274
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 274
Trp Ala Ser
1
<210> 275
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 275
cagcaatttt atagtattcc cact
24
<210> 276
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 276
Gln Gln Phe Tyr Ser Ile Pro Thr
1 5
<210> 277
<211> 357
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 277
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc
60
tcctgtgcag cctctggatt cacctttagg acctatggca tgcactgggt ccgccaggct
120
ccagtcaagg ggctggagtg ggtggcattt atatcaaagg atggaagtga taaatactat
180
gtagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgttt
240
ctgcaaatga acagcctgac agctgaggac acggctgttt attattgtgc gaaagagtcc
300
attttagcag ccctctttga ctactggggc cagggaaccc tggtcactgt ctcctca
357
<210> 278
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 278
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Thr Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Val Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Ser Lys Asp Gly Ser Asp Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Ser Ile Leu Ala Ala Leu Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 279
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 279
ggattcacct ttaggaccta tggc
24
<210> 280
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 280
Gly Phe Thr Phe Arg Thr Tyr Gly
1 5
<210> 281
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 281
atatcaaagg atggaagtga taaa
24
<210> 282
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 282
Ile Ser Lys Asp Gly Ser Asp Lys
1 5
<210> 283
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 283
gcgaaagagt ccattttagc agccctcttt gactac
36
<210> 284
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 284
Ala Lys Glu Ser Ile Leu Ala Ala Leu Phe Asp Tyr
1 5 10
<210> 285
<211> 336
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 285
gacatcgtga tgacccagtc tccagactcc ctggctgtgt ctctgggcga gagggccacc
60
atcaactgca agtccagcca gagtgtttta tacagctcca acaataagaa ctacttagct
120
tggtaccagc agaaaccaag acagcctcct aaactcctca tttactgggc atctaatcgg
180
gaatccgggg tccctgaccg attcagtggc agcgggtctg ggacagattt cactctcacc
240
atcagcagcc tgcaggctga agatgtggca gtttattact gtcagcaatt ttatagtgtt
300
cccacttttg gccaggggac caagctggag atcaaa
336
<210> 286
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 286
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Arg Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Asn Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Phe Tyr Ser Val Pro Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 287
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 287
cagagtgttt tatacagctc caacaataag aactac
36
<210> 288
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 288
Gln Ser Val Leu Tyr Ser Ser Asn Asn Lys Asn Tyr
1 5 10
<210> 289
<211> 9
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 289
tgggcatct
9
<210> 290
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 290
Trp Ala Ser
1
<210> 291
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 291
cagcaatttt atagtgttcc cact
24
<210> 292
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 292
Gln Gln Phe Tyr Ser Val Pro Thr
1 5
<210> 293
<211> 357
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 293
caggtgcagc tggtggagtc tgggggaggc gtggtccagc ctgggaggtc cctgagactc
60
tcctgtgcag cctctggatt cacctttagt agctatggca tgcactgggt ccgccaggct
120
ccagtcaagg ggctggagtg ggtggcattt atatcaaatg ataaaagtaa taaatactat
180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat
240
ctgcaaatga acagcctgac agctgaggac acggctgttt attactgtgc gaaagagtcc
300
attttagcag ccctctttga ctcctggggc cagggaaccc tggtcaccgt ctcctca
357
<210> 294
<211> 119
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 294
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Val Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Ser Asn Asp Lys Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Thr Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Ser Ile Leu Ala Ala Leu Phe Asp Ser Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 295
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 295
ggattcacct ttagtagcta tggc
24
<210> 296
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 296
Gly Phe Thr Phe Ser Ser Tyr Gly
1 5
<210> 297
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 297
atatcaaatg ataaaagtaa taaa
24
<210> 298
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 298
Ile Ser Asn Asp Lys Ser Asn Lys
1 5
<210> 299
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 299
gcgaaagagt ccattttagc agccctcttt gactcc
36
<210> 300
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 300
Ala Lys Glu Ser Ile Leu Ala Ala Leu Phe Asp Ser
1 5 10
<210> 301
<211> 336
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 301
gacatcgtga tgacccagtc tccagactcc ctggctgtgt ctctgggcga gagggccacc
60
atcaactgca agtccagcca gagtgtttta tacagctcca acaataagaa ctacttagct
120
tggtaccagc agaaaccaag acagcctcct aagctgctca tttactgggc atctattcgg
180
gaatccgggg tccctgaccg attcagtggc agcgggtctg gggcagattt cactctcacc
240
atcagcagcc tgcaggctgc agatgtggca gtttattact gtcagcaatt ttatagtgtt
300
cccacttttg gccaggggac caagctggag atcaaa
336
<210> 302
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 302
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Arg Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Ile Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Ala Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Ala Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Phe Tyr Ser Val Pro Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 303
<211> 36
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 303
cagagtgttt tatacagctc caacaataag aactac
36
<210> 304
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 304
Gln Ser Val Leu Tyr Ser Ser Asn Asn Lys Asn Tyr
1 5 10
<210> 305
<211> 9
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 305
tgggcatct
9
<210> 306
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 306
Trp Ala Ser
1
<210> 307
<211> 24
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 307
cagcaatttt atagtgttcc cact
24
<210> 308
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 308
Gln Gln Phe Tyr Ser Val Pro Thr
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧЕСКИЙ БЕЛОК | 2019 |
|
RU2784486C1 |
| БЕЛКИ, СВЯЗЫВАЮЩИЕ ГЛЮКАГОНОВЫЕ РЕЦЕПТОРЫ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2820628C2 |
| АНТИТЕЛА К ТАУ И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2787779C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, НАЦЕЛЕННЫЕ НА АНТИГЕН СОЗРЕВАНИЯ В-КЛЕТОК, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2829097C2 |
| АНТИТЕЛО ПРОТИВ LILRB1 И ЕГО ПРИМЕНЕНИЯ | 2021 |
|
RU2813373C1 |
| АНТИТЕЛА ЧЕЛОВЕКА ПРОТИВ АНГИОПОЭТИН-ПОДОБНОГО БЕЛКА 4 ЧЕЛОВЕКА | 2010 |
|
RU2580045C2 |
| ЛЕЧЕНИЕ И ИНГИБИРОВАНИЕ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ЛЕГКИХ У ПАЦИЕНТОВ С АЛЛЕЛЯМИ РИСКА В ГЕНАХ, КОДИРУЮЩИХ IL33 И IL1RL1 | 2018 |
|
RU2776241C2 |
| СВЯЗЫВАЮЩИЕ ДОМЕНЫ АНТИТЕЛА К CD3 И СОДЕРЖАЩИЕ ИХ АНТИТЕЛА, А ТАКЖЕ СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2018 |
|
RU2807040C2 |
| АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТ ОПУХОЛЕВУЮ ТКАНЬ, ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ | 2020 |
|
RU2806915C2 |
| СКОНСТРУИРОВАННЫЕ PH-ЗАВИСИМЫЕ АНТИТЕЛА К CD3, А ТАКЖЕ СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2020 |
|
RU2832079C2 |
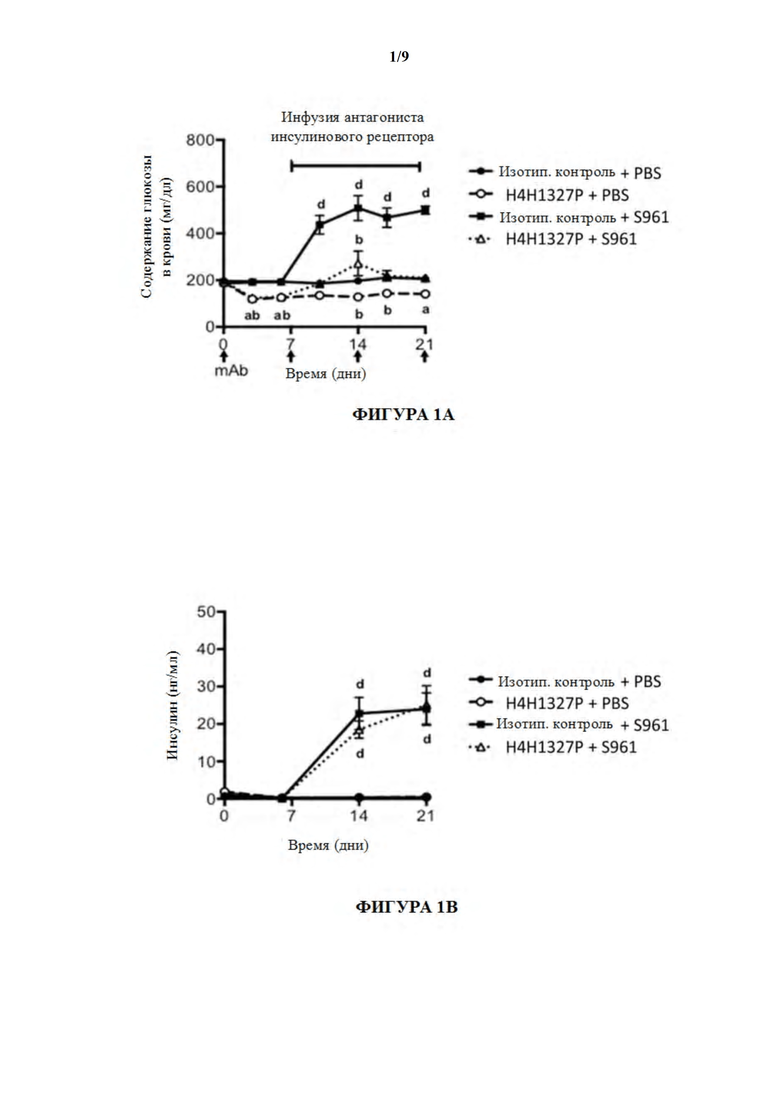
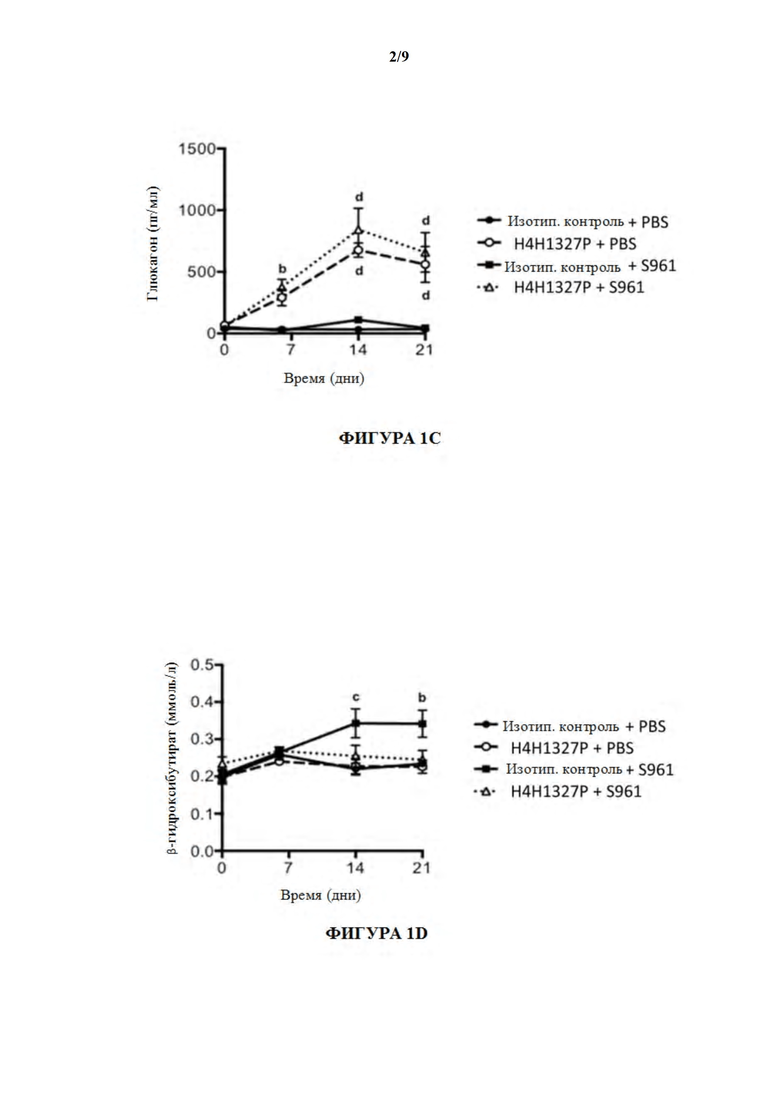
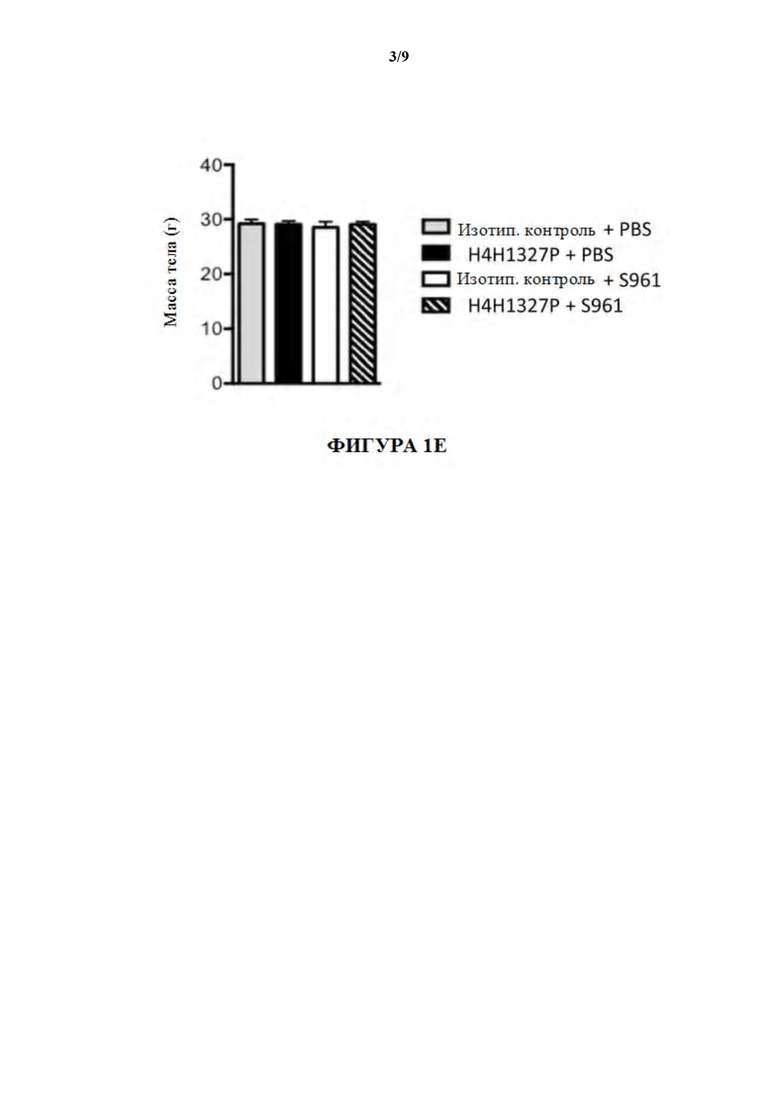
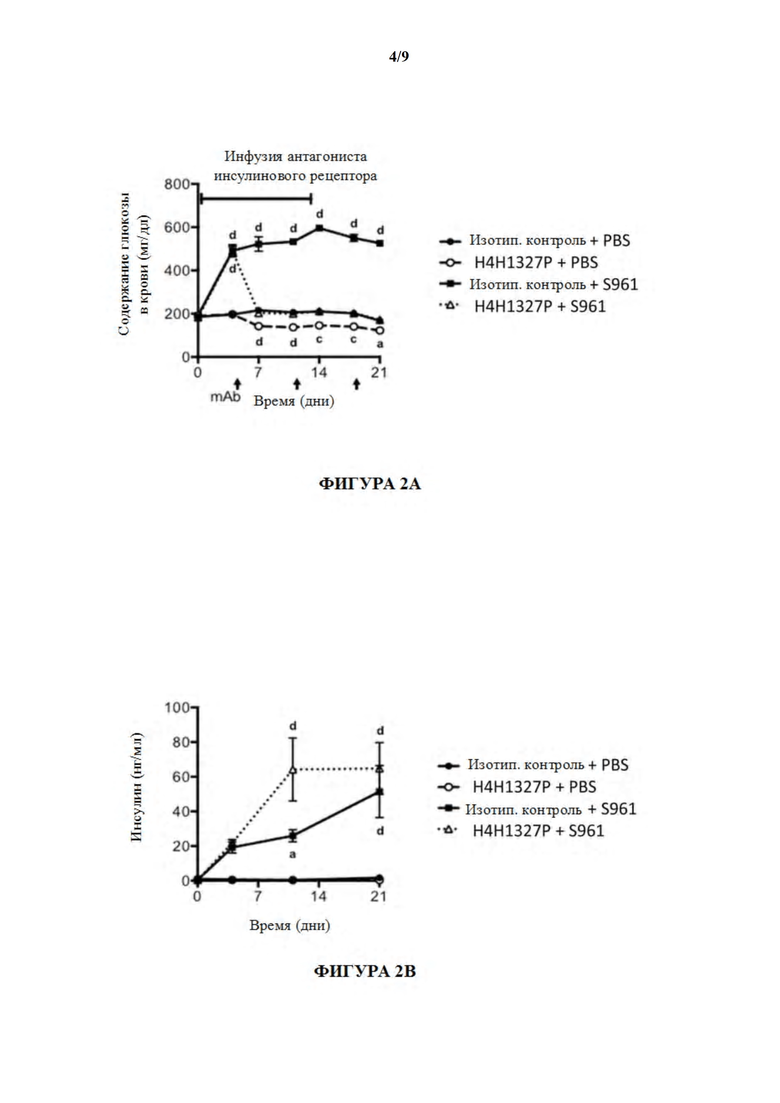
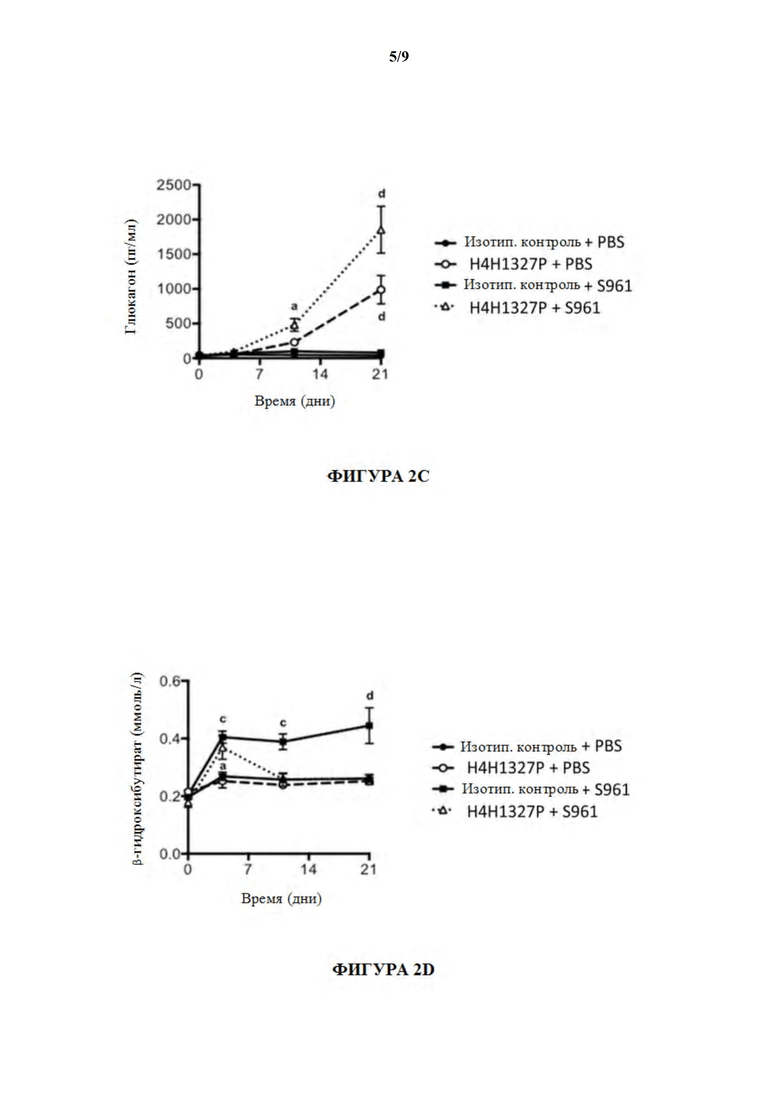
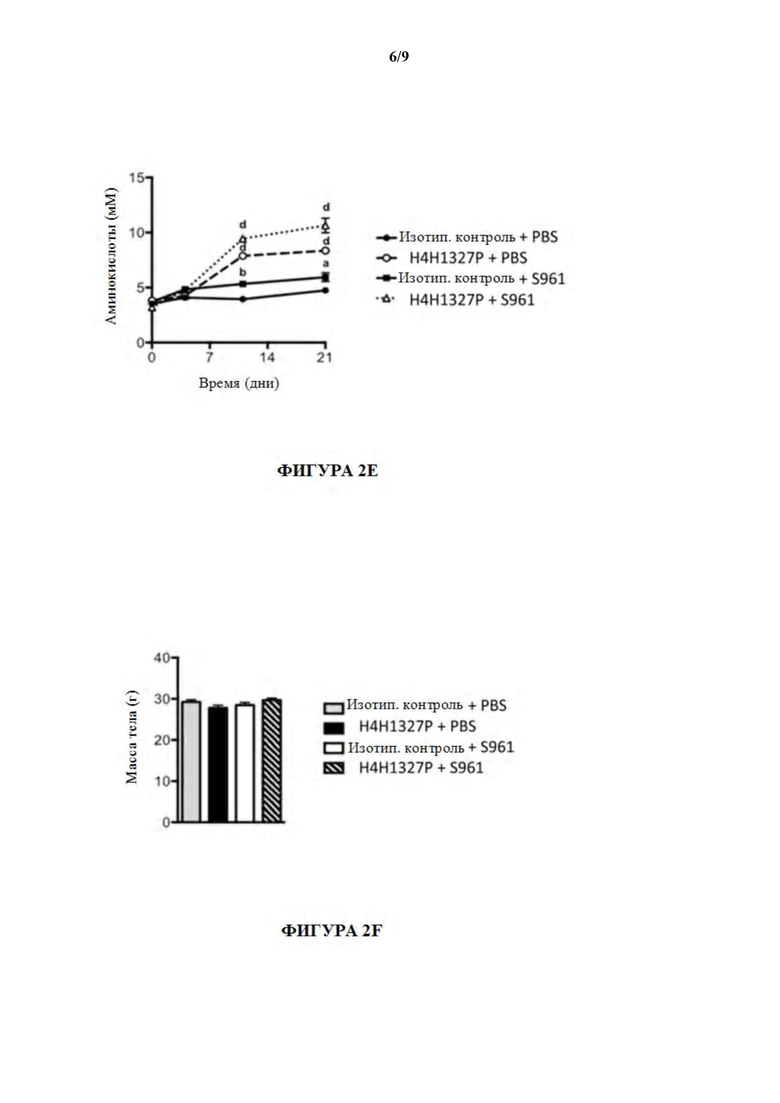

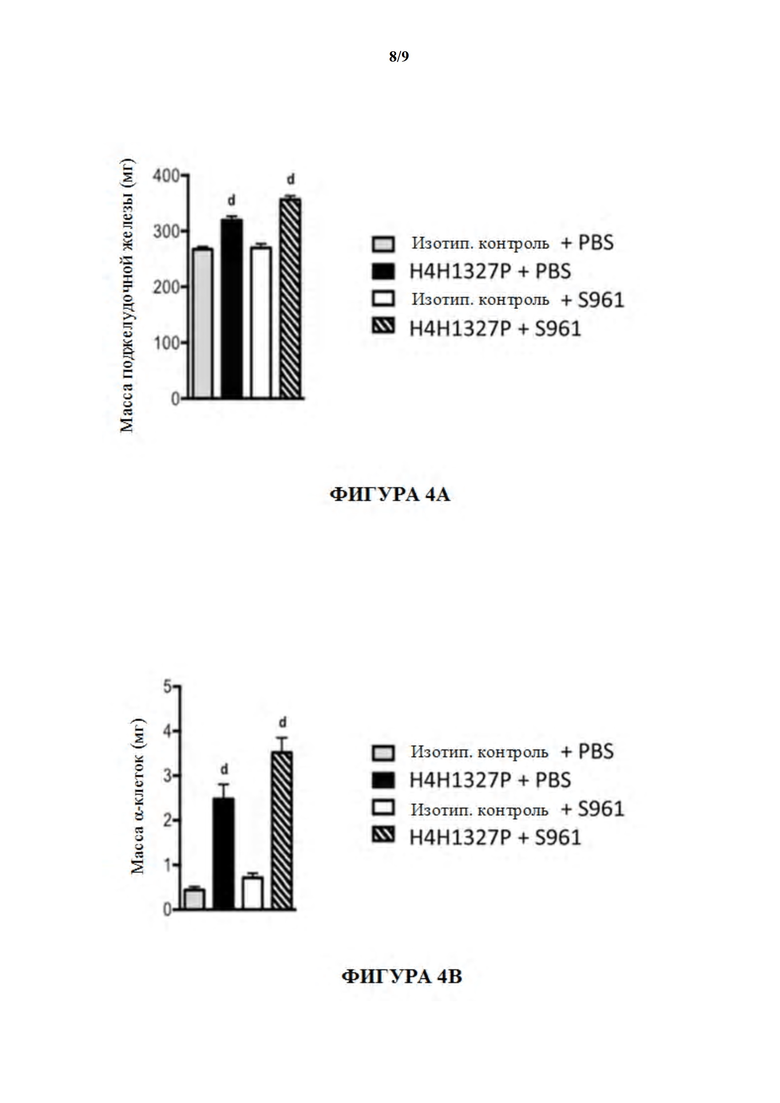
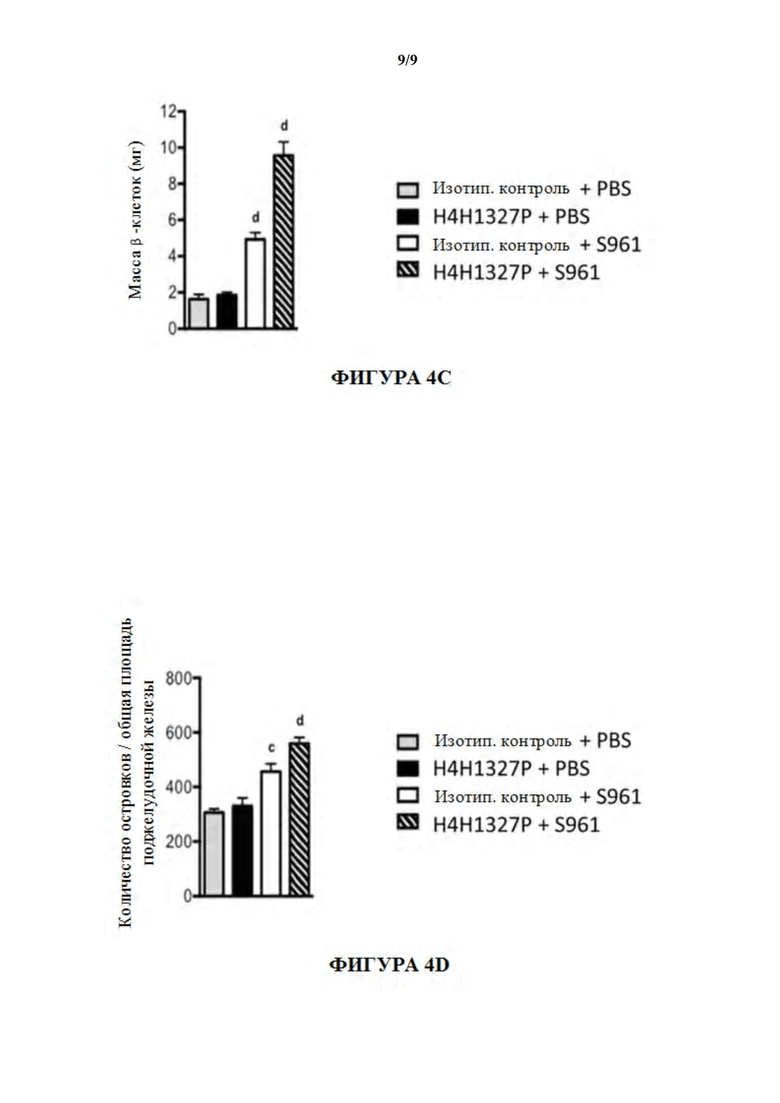
Группа изобретений относится к фармацевтической промышленности, а именно к применению композиции, содержащей антагонист глюкагонового рецептора (GCGR), представляющий собой антитело или его антигенсвязывающий фрагмент. Применение композиции, содержащей антагонист глюкагонового рецептора (GCGR), представляющий собой антитело или его антигенсвязывающий фрагмент, которое содержит: вариабельную область тяжелой цепи (HCVR), содержащую HCDR1, HCDR2 и HCDR3 из HCVR, содержащей аминокислотную последовательность из SEQ ID NOs: 86; и вариабельную область легкой цепи (LCVR), содержащую LCDR1, LCDR2 и LCDR3 из LCVR, содержащей аминокислотную последовательность из SEQ ID NOs: 88 для снижения содержаний глюкозы в крови и/или содержаний кетоновых тел или лечения состояния или заболевания, ассоциированного или частично характеризующегося высоким содержанием глюкозы в крови или повышенным содержанием кетоновых тел, или по меньшей мере одного симптома или осложнения, ассоциированного с состоянием или заболеванием, у пациента с тяжелой инсулинорезистентностью, причем предусматривающее введение пациенту с тяжелой инсулинорезистентностью терапевтически эффективного количества композиции, так что содержания глюкозы в крови или содержания кетоновых тел снижаются, или состояние или заболевание облегчается, или по меньшей мере один симптом или осложнение, ассоциированное с состоянием или заболеванием, облегчается или его тяжесть снижается; при этом пациент с тяжелой инсулинорезистентностью: получает экзогенный инсулин в дозах более 100-200 единиц в день, имеет хронически повышенные содержания эндогенного инсулина в крови, имеет содержания инсулина натощак выше 50-70 мкЕд/мл, имеет пиковые содержания инсулина выше 350 мкЕд/мл, имеет значения индекса чувствительности к инсулину ниже 2×104 мкЕд/мл⋅мин, и/или демонстрирует скорость утилизации глюкозы ниже 2 мг/кг⋅мин. Вышеописанная группа позволяет эффективно облегчать симптомы и состояния, ассоциированные с тяжелой инсулинрезистентностью. 6 н. и 42 з.п. ф-лы., 4 ил., 8 табл., 4 пр.
1. Применение композиции, содержащей антагонист глюкагонового рецептора (GCGR), представляющий собой антитело или его антигенсвязывающий фрагмент, которое содержит: вариабельную область тяжелой цепи (HCVR), содержащую HCDR1, HCDR2 и HCDR3 из HCVR, содержащей аминокислотную последовательность из SEQ ID NOs: 86; и вариабельную область легкой цепи (LCVR), содержащую LCDR1, LCDR2 и LCDR3 из LCVR, содержащей аминокислотную последовательность из SEQ ID NOs: 88 для снижения содержаний глюкозы в крови и/или содержаний кетоновых тел или лечения состояния или заболевания, ассоциированного или частично характеризующегося высоким содержанием глюкозы в крови или повышенным содержанием кетоновых тел, или по меньшей мере одного симптома или осложнения, ассоциированного с состоянием или заболеванием, у пациента с тяжелой инсулинорезистентностью, причем предусматривающее введение пациенту с тяжелой инсулинорезистентностью терапевтически эффективного количества композиции, так что содержания глюкозы в крови или содержания кетоновых тел снижаются, или состояние или заболевание облегчается, или по меньшей мере один симптом или осложнение, ассоциированное с состоянием или заболеванием, облегчается или его тяжесть снижается;
при этом пациент с тяжелой инсулинорезистентностью:
получает экзогенный инсулин в дозах более 100-200 единиц в день,
имеет хронически повышенные содержания эндогенного инсулина в крови,
имеет содержания инсулина натощак выше 50-70 мкЕд/мл,
имеет пиковые содержания инсулина выше 350 мкЕд/мл,
имеет значения индекса чувствительности к инсулину ниже 2×104 мкЕд/мл⋅мин, и/или демонстрирует скорость утилизации глюкозы ниже 2 мг/кг⋅мин.
2. Применение по п. 1, при котором пациент с тяжелой инсулинорезистентностью страдает от состояния или заболевания, выбранного из группы, состоящей из следующего: синдром Донохью, синдром Рабсона-Менденхолла, инсулинорезистентность типа А, инсулинорезистентность типа В, синдром HAIR-AN (гиперандрогения, инсулинорезистентность и акантокератодермия), псевдоакромегалия, синдром Альстрема, миотоническая дистрофия, синдром Вернера, липодистрофия, цирроз печени, моногенное морбидное ожирение, гиперпроинсулинемия, недостаточность карбоксипептидазы E, нарушенный метаболизм аргинина, синдром Барде-Бидля и состояние или заболевание, ассоциированное с наличием генетического варианта, который вызывает тяжелую инсулинорезистентность.
3. Применение по п. 1, при котором наблюдается активность расщепляющей инсулин протеазы в сыворотке пациентов.
4. Применение по п. 1, при котором наблюдаются нейтрализующие антитела к инсулину или антитела к рецептору инсулина в сыворотке пациентов.
5. Применение по п. 1, при котором тяжелая инсулинорезистентность ассоциирована с генетическим вариантом одного или нескольких генов, выбранным из группы, состоящей из INSR, PSMD6, ADRA2A, AGPAT2, AKT2, APPL1, BBS1, BSCL2, CIDEC, GRB10, IRS2, KLF14, LEP, LEPR, LMNA, MC4R, PCNT, PIK2CA, POLD1, PPARG, PTPRD, PTRF, RASGRP1, TBC1D4 и TCF7L2.
6. Применение по п. 1, при котором антагонист GCGR вводят одновременно с инсулином.
7. Применение по п. 1, при котором композицию вводят пациенту в комбинации по меньшей мере с одним дополнительным терапевтическим средством.
8. Применение по п. 7, при котором по меньшей мере одно дополнительное терапевтическое средство выбирают из группы, состоящей из следующего: инсулин, бигуанид, hIGF1, лептин, пиоглитазон, вилдаглиптин, акарбоза, ингибитор альфа-гликозидазы, L-аргинин, ингибитор дипептидил-пептидазы-4, секретоген инсулина, агонист рецептора амилина, сенсибилизатор инсулина, FGF21, ингибитор SGLT2, ингибитор SGLT1, агонист GLP-1, активатор рецептора GLP-1, β3 адренергический агонист, агонист NPR1, антагонист NPR3, трийодтиронин, второй ингибитор GCG и второй антагонист GCGR.
9. Применение по п. 1, при котором антагонист GCGR представляет собой антитело.
10. Применение по п. 1, при котором антагонист GCGR представляет собой антигенсвязывающий фрагмент.
11. Применение по п. 1, при котором
HCDR1 содержит аминокислотную последовательность из SEQ ID NO: 72,
HCDR2 содержит аминокислотную последовательность из SEQ ID NO: 74,
HCDR3 содержит аминокислотную последовательность из SEQ ID NO: 76,
LCDR1 содержит аминокислотную последовательность из SEQ ID NO: 80,
LCDR2 содержит аминокислотную последовательность из SEQ ID NO: 82, и
LCDR3 содержит аминокислотную последовательность из SEQ ID NO: 84.
12. Применение по п. 1, при котором выделенное антитело или его антигенсвязывающий фрагмент представляет собой антитело, которое содержит: вариабельную область тяжелой цепи (HCVR), содержащую аминокислотную последовательность из SEQ ID NOs: 86; и вариабельную область легкой цепи (LCVR), содержащую аминокислотную последовательность из SEQ ID NOs: 88.
13. Применение по п. 7, при котором дополнительное терапевтическое средство представляет собой секретоген инсулина, который выбирают из группы, состоящей из сульфонилмочевин, антагонистов чувствительных к АТФ калиевых каналов и меглитинидов.
14. Применение по п. 7, при котором дополнительное терапевтическое средство представляет собой сенсибилизатор инсулина, который выбирают из группы, состоящей из тиазолидиндиона и росиглитазона.
15. Применение по п. 1, при котором кетоновые тела представляют собой бета-гидроксибутират.
16. Применение композиции, содержащей антитело антагонист GCGR или его антигенсвязывающий фрагмент, которое содержит: вариабельную область тяжелой цепи (HCVR), содержащую HCDR1, HCDR2 и HCDR3 из HCVR, содержащей аминокислотную последовательность из SEQ ID NOs: 86; и вариабельную область легкой цепи (LCVR), содержащую LCDR1, LCDR2 и LCDR3 из LCVR, содержащей аминокислотную последовательность из SEQ ID NOs: 88 для лечения пациента с тяжелой инсулинорезистентностью, при котором пациент проявляет повышенное содержание глюкозы в крови, предусматривающее введение пациенту терапевтически эффективного количества композиции;
при этом пациент с тяжелой инсулинорезистентностью:
получает экзогенный инсулин в дозах более 100-200 единиц в день,
имеет хронически повышенные содержания эндогенного инсулина в крови,
имеет содержания инсулина натощак выше 50-70 мкЕд/мл,
имеет пиковые содержания инсулина выше 350 мкЕд/мл,
имеет значения индекса чувствительности к инсулину ниже 2×104 мкЕд/мл⋅мин, и/или демонстрирует скорость утилизации глюкозы ниже 2 мг/кг⋅мин.
17. Применение по п. 16, при котором пациент с тяжелой инсулинорезистентностью страдает от состояния или заболевания, выбранного из группы, состоящей из следующего: синдром Донохью, синдром Рабсона-Менденхолла, инсулинорезистентность типа А, инсулинорезистентность типа В, синдром HAIR-AN (гиперандрогения, инсулинорезистентность и акантокератодермия), псевдоакромегалия, синдром Альстрема, миотоническая дистрофия, синдром Вернера, липодистрофия, цирроз печени, моногенное морбидное ожирение, гиперпроинсулинемия, недостаточность карбоксипептидазы E, нарушенный метаболизм аргинина, синдром Барде-Бидля и состояние или заболевание, ассоциированное с наличием генетического варианта, который вызывает тяжелую инсулинорезистентность.
18. Применение по п. 16, при котором наблюдается активность расщепляющей инсулин протеазы в сыворотке пациентов.
19. Применение по п. 16, при котором наблюдаются нейтрализующие антитела к инсулину или антитела к рецептору инсулина в сыворотке пациентов.
20. Применение по п. 16, при котором тяжелая инсулинорезистентность ассоциирована с генетическим вариантом одного или нескольких генов, выбранным из группы, состоящей из INSR, PSMD6, ADRA2A, AGPAT2, AKT2, APPL1, BBS1, BSCL2, CIDEC, GRB10, IRS2, KLF14, LEP, LEPR, LMNA, MC4R, PCNT, PIK2CA, POLD1, PPARG, PTPRD, PTRF, RASGRP1, TBC1D4 и TCF7L2.
21. Применение по п. 16, при котором антагонист GCGR вводят одновременно с инсулином.
22. Применение по п. 16, при котором композицию вводят пациенту в комбинации по меньшей мере с одним дополнительным терапевтическим средством.
23. Применение по п. 22, при котором по меньшей мере одно дополнительное терапевтическое средство выбирают из группы, состоящей из следующего: инсулин, бигуанид, hIGF1, лептин, пиоглитазон, вилдаглиптин, акарбоза, ингибитор альфа-гликозидазы, L-аргинин, ингибитор дипептидил-пептидазы-4, секретоген инсулина, агонист рецептора амилина, сенсибилизатор инсулина, FGF21, ингибитор SGLT2, ингибитор SGLT1, агонист GLP-1, активатор рецептора GLP-1, β3 адренергический агонист, агонист NPR1, антагонист NPR3, трийодтиронин, второй ингибитор GCG и второй антагонист GCGR.
24. Применение по п. 16, при котором антагонист GCGR представляет собой антитело.
25. Применение по п. 16, при котором антагонист GCGR представляет собой антигенсвязывающий фрагмент.
26. Применение по п. 16, при котором
HCDR1 содержит аминокислотную последовательность из SEQ ID NO: 72,
HCDR2 содержит аминокислотную последовательность из SEQ ID NO: 74,
HCDR3 содержит аминокислотную последовательность из SEQ ID NO: 76,
LCDR1 содержит аминокислотную последовательность из SEQ ID NO: 80,
LCDR2 содержит аминокислотную последовательность из SEQ ID NO: 82, и
LCDR3 содержит аминокислотную последовательность из SEQ ID NO: 84.
27. Применение по п. 16, при котором выделенное антитело или его антигенсвязывающий фрагмент представляет собой антитело, которое содержит: вариабельную область тяжелой цепи (HCVR), содержащую аминокислотную последовательность из SEQ ID NOs: 86; и вариабельную область легкой цепи (LCVR), содержащую аминокислотную последовательность из SEQ ID NOs: 88.
28. Применение по п. 22, при котором дополнительное терапевтическое средство представляет собой секретоген инсулина, который выбирают из группы, состоящей из сульфонилмочевин, антагонистов чувствительных к АТФ калиевых каналов и меглитинидов.
29. Применение по п. 22, при котором дополнительное терапевтическое средство представляет собой сенсибилизатор инсулина, который выбирают из группы, состоящей из тиазолидиндиона и росиглитазона.
30. Применение композиции, содержащей антитело антагонист GCGR или его антигенсвязывающий фрагмент, которое содержит: вариабельную область тяжелой цепи (HCVR), содержащую HCDR1, HCDR2 и HCDR3 из HCVR, содержащей аминокислотную последовательность из SEQ ID NOs: 86; и вариабельную область легкой цепи (LCVR), содержащую LCDR1, LCDR2 и LCDR3 из LCVR, содержащей аминокислотную последовательность из SEQ ID NOs: 88 для снижения количества и/или дозировки инсулина, необходимого для лечения пациента с тяжелой инсулинорезистентностью, при котором пациент проявляет тяжелую инсулинорезистентность и повышенное содержание глюкозы в крови до лечения, предусматривающее введение пациенту терапевтически эффективного количества композиции;
при этом пациент с тяжелой инсулинорезистентностью:
получает экзогенный инсулин в дозах более 100-200 единиц в день,
имеет хронически повышенные содержания эндогенного инсулина в крови,
имеет содержания инсулина натощак выше 50-70 мкЕд/мл,
имеет пиковые содержания инсулина выше 350 мкЕд/мл,
имеет значения индекса чувствительности к инсулину ниже 2×104 мкЕд/мл⋅мин, и/или демонстрирует скорость утилизации глюкозы ниже 2 мг/кг⋅мин.
31. Применение по п. 30, при котором антагонист GCGR вводят одновременно с инсулином.
32. Применение по п. 31, при котором количество и/или дозировку инсулина снижают на приблизительно 30% - приблизительно 95% при введении одновременно с антагонистом GCGR.
33. Применение по п. 31, при котором количество и/или дозировку инсулина снижают приблизительно на 90% при введении одновременно с антагонистом GCGR.
34. Применение по п. 30, при котором пациент с тяжелой инсулинорезистентностью страдает от состояния или заболевания, выбранного из группы, состоящей из следующего: синдром Донохью, синдром Рабсона-Менденхолла, инсулинорезистентность типа А, инсулинорезистентность типа В, синдром HAIR-AN (гиперандрогения, инсулинорезистентность и акантокератодермия), псевдоакромегалия, синдром Альстрема, миотоническая дистрофия, синдром Вернера, липодистрофия, цирроз печени, моногенное морбидное ожирение, гиперпроинсулинемия, недостаточность карбоксипептидазы E, нарушенный метаболизм аргинина, синдром Барде-Бидля и состояние или заболевание, ассоциированное с наличием генетического варианта, который вызывает тяжелую инсулинорезистентность.
35. Применение по п. 30, при котором наблюдается активность расщепляющей инсулин протеазы в сыворотке пациентов.
36. Применение по п. 30, при котором наблюдаются нейтрализующие антитела к инсулину или антитела к рецептору инсулина в сыворотке пациентов.
37. Применение по п. 30, при котором тяжелая инсулинорезистентность ассоциирована с генетическим вариантом одного или нескольких генов, выбранным из группы, состоящей из INSR, PSMD6, ADRA2A, AGPAT2, AKT2, APPL1, BBS1, BSCL2, CIDEC, GRB10, IRS2, KLF14, LEP, LEPR, LMNA, MC4R, PCNT, PIK2CA, POLD1, PPARG, PTPRD, PTRF, RASGRP1, TBC1D4 и TCF7L2.
38. Применение по п. 30, при котором композицию вводят пациенту в комбинации по меньшей мере с одним дополнительным терапевтическим средством.
39. Применение по п. 38, при котором по меньшей мере одно дополнительное терапевтическое средство выбрано из группы, состоящей из следующего: бигуанид, hIGF1, лептин, пиоглитазон, вилдаглиптин, акарбоза, ингибитор альфа-гликозидазы, L-аргинин, ингибитор дипептидил-пептидазы-4, секретоген инсулина, агонист рецептора амилина, сенсибилизатор инсулина, FGF21, ингибитор SGLT2, ингибитор SGLT1, агонист GLP-1, активатор рецептора GLP-1, β3 адренергический агонист, агонист NPR1, антагонист NPR3, трийодтиронин, второй ингибитор GCG и второй антагонист GCGR.
40. Применение по п. 30, при котором антагонист GCGR представляет собой выделенное антитело.
41. Применение по п. 30, при котором антагонист GCGR представляет собой антигенсвязывающий фрагмент.
42. Применение по п. 30, при котором
HCDR1 содержит аминокислотную последовательность из SEQ ID NO: 72,
HCDR2 содержит аминокислотную последовательность из SEQ ID NO: 74,
HCDR3 содержит аминокислотную последовательность из SEQ ID NO: 76,
LCDR1 содержит аминокислотную последовательность из SEQ ID NO: 80,
LCDR2 содержит аминокислотную последовательность из SEQ ID NO: 82, и
LCDR3 содержит аминокислотную последовательность из SEQ ID NO: 84.
43. Применение по п. 30, при котором выделенное антитело или антигенсвязывающий фрагмент представляет собой антитело, которое содержит: вариабельную область тяжелой цепи (HCVR), содержащую аминокислотную последовательность из SEQ ID NOs: 86; и вариабельную область легкой цепи (LCVR), содержащую аминокислотную последовательность из SEQ ID NOs: 88.
44. Применение по п. 38, при котором дополнительное терапевтическое средство представляет собой секретоген инсулина, который выбирают из группы, состоящей из сульфонилмочевин, антагонистов чувствительных к АТФ калиевых каналов и меглитинидов.
45. Применение по п. 38, при котором дополнительное терапевтическое средство представляет собой сенсибилизатор инсулина, который выбирают из группы, состоящей из тиазолидиндиона и росиглитазона.
46. Применение композиции, содержащей ингибитор передачи сигнала GCGR, который представляет собой антитело или его антигенсвязывающий фрагмент, которое содержит: вариабельную область тяжелой цепи (HCVR), содержащую HCDR1, HCDR2 и HCDR3 из HCVR, содержащей аминокислотную последовательность из SEQ ID NOs: 86; и вариабельную область легкой цепи (LCVR), содержащую LCDR1, LCDR2 и LCDR3 из LCVR, содержащей аминокислотную последовательность из SEQ ID NOs: 88 для снижения содержаний глюкозы в крови и/или содержаний бета-гидроксибутирата или лечения состояния или заболевания, ассоциированного или частично характеризующегося высоким содержанием глюкозы в крови или высокими содержаниями кетоновых тел, или по меньшей мере одного симптома или осложнения, ассоциированного с состоянием или заболеванием у пациента с тяжелой инсулинорезистентностью, предусматривающее введение пациенту с тяжелой инсулинорезистентностью терапевтически эффективного количества композиции, так что содержания глюкозы в крови или содержания бета-гидроксибутирата снижаются, или состояние или заболевание облегчается, или по меньшей мере один симптом или осложнение, ассоциированное с состоянием или заболеванием, облегчается или его тяжесть снижается;
при этом пациент с тяжелой инсулинорезистентностью:
получает экзогенный инсулин в дозах более 100-200 единиц в день,
имеет хронически повышенные содержания эндогенного инсулина в крови,
имеет содержания инсулина натощак выше 50-70 мкЕд/мл,
имеет пиковые содержания инсулина выше 350 мкЕд/мл,
имеет значения индекса чувствительности к инсулину ниже 2×104 мкЕд/мл⋅мин, и/или
демонстрирует скорость утилизации глюкозы ниже 2 мг/кг⋅мин.
47. Применение композиции, содержащей ингибитор передачи сигнала GCGR, который представляет собой антитело или его антигенсвязывающий фрагмент, которое содержит: вариабельную область тяжелой цепи (HCVR), содержащую HCDR1, HCDR2 и HCDR3 из HCVR, содержащей аминокислотную последовательность из SEQ ID NOs: 86; и вариабельную область легкой цепи (LCVR), содержащую LCDR1, LCDR2 и LCDR3 из LCVR, содержащей аминокислотную последовательность из SEQ ID NOs: 88 для подавления продукции глюкозы в печени у пациента с тяжелой инсулинорезистентностью, предусматривающее введение пациенту с тяжелой инсулинорезистентностью терапевтически эффективного количества композиции, так что продукция глюкозы в печени подавляется;
при этом пациент с тяжелой инсулинорезистентностью:
получает экзогенный инсулин в дозах более 100-200 единиц в день,
имеет хронически повышенные содержания эндогенного инсулина в крови,
имеет содержания инсулина натощак выше 50-70 мкЕд/мл,
имеет пиковые содержания инсулина выше 350 мкЕд/мл,
имеет значения индекса чувствительности к инсулину ниже 2×104 мкЕд/мл⋅мин, и/или демонстрирует скорость утилизации глюкозы ниже 2 мг/кг⋅мин.
48. Применение композиции, содержащей ингибитор передачи сигнала GCGR,
который представляет собой антитело или его антигенсвязывающий фрагмент, которое содержит: вариабельную область тяжелой цепи (HCVR), содержащую HCDR1, HCDR2 и HCDR3 из HCVR, содержащей аминокислотную последовательность из SEQ ID NOs: 86; и вариабельную область легкой цепи (LCVR), содержащую LCDR1, LCDR2 и LCDR3 из LCVR, содержащей аминокислотную последовательность из SEQ ID NOs: 88 для увеличения массы β-клеток у пациента с тяжелой инсулинорезистентностью, предусматривающее введение пациенту терапевтически эффективного количества композиции, так что масса β-клеток увеличивается по отношению к массе β-клеток до лечения;
при этом пациент с тяжелой инсулинорезистентностью:
получает экзогенный инсулин в дозах более 100-200 единиц в день,
имеет хронически повышенные содержания эндогенного инсулина в крови,
имеет содержания инсулина натощак выше 50-70 мкЕд/мл,
имеет пиковые содержания инсулина выше 350 мкЕд/мл,
имеет значения индекса чувствительности к инсулину ниже 2×104 мкЕд/мл⋅мин, и/или
демонстрирует скорость утилизации глюкозы ниже 2 мг/кг⋅мин.
| WO 2012071372 А2, 24.03.2017 | |||
| WO 2016044337 А1, 24.03.2016 | |||
| US 2012128679 A1, 24.05.2012 | |||
| US 2016075778 А1, 17.03.2016. |
Авторы
Даты
2022-05-23—Публикация
2017-08-29—Подача