ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[001] Данная заявка заявляет приоритет по предварительной заявке США №62/451603, поданной 27 января 2017 г., которая тем самым включена в данный документ посредством ссылки в полном объеме.
Область изобретения
[002] Данное раскрытие в целом относится к белкам, таким как антитела, которые связываются с глюкагоновым рецептором (GCGR - glucagon receptor), в том числе GCGR человека, а также способам применения связывающих белков для лечения и/или предупреждения заболеваний.
Уровень техники
[003] Глюкагон представляет собой пептидный гормон, состоящий из 29 аминокислот, секретируемый альфа-клетками поджелудочной железы. Секреция глюкагона, как правило, повышается в ответ на снижение уровней глюкозы в крови, к примеру, во время голодания. Глюкагон может повышать концентрацию глюкозы в крови в результате стимуляции гликогенолиза и глюкогенеогенеза в печени. В отличие от этого инсулин продуцируется бета-клетками поджелудочной железы. Стимулом для секреции инсулина является высокий уровень глюкозы в крови. Несмотря на то, что всегда имеет место низкий уровень инсулина, секретируемого поджелудочной железой, количество, секретируемое в кровь, повышается по мере того, как уровень глюкозы в крови возрастает. Аналогичным образом, по мере того, как уровень глюкозы в крови снижается, количество инсулина, секретируемого бета-клетками поджелудочной железы, снижается. Действуя совместно, глюкагон и инсулин способствуют поддержанию нормальных уровней глюкозы в крови.
[004] Глюкагон связывается с глюкагоновым рецептором (GCGR) и активирует его. GCGR представляет собой члена типа рецепторов, сопряженных с G-белком (GPCR) класса B. GPCR характеризуются N-концевым внеклеточным доменом, коровой областью из семи трансмембранных альфа-спиралей и цитоплазматической C-концевой областью. В типичном случае GPCR ассоциированы с одним или несколькими внутриклеточными сигнальными путями с участием эффекторных белков. Эффекторные белки представляют собой гетеротримерные белки, связывающиеся с гуаниновыми нуклеотидами (G-белки), такие как Gα (Gαs, Gαi и Gαo), Gβ и Gγ.
[005] В результате связывания G-белка стимуляция GCGR может приводить к активации аденилатциклазных и цАМФ-зависимых внутриклеточных сигнальных путей, а также передаче сигнала, опосредованного фосфоинозитолом. Последующее повышение экспрессии ферментов глюконеогенеза, в том числе фосфоенолпируваткарбоксикиназы, фруктозо-1,6-бифосфатазы и глюкозо-6-фосфатазы, способствует глюконеогенезу. В дополнение к этому, передача сигнала с участием GCGR может приводить к активации гликогенфосфорилазы и ингибированию гликогенсинтазы, и, тем самым, способствовать гликогенолизу.
[006] У здорового индивидуума бета-клетки поджелудочной железы функционируют таким образом, что запасают и высвобождают инсулин. В типичном случае бета-клетки быстро отвечают на всплески концентраций глюкозы в крови путем секреции некоторого количества своего запасенного инсулина, одновременно продуцируя больше инсулина. Проблемы возникают, когда уровни глюкозы в крови не регулируются эффективно.
[007] Заболевания, нарушения и патологические состояния, ассоциированные с повышенными уровнями глюкозы в крови, включают в себя гипергликемию и проблемы со здоровьем, возникающие в результате гипергликемии, в том числе сахарный диабет 1 типа и 2 типа. Заболевания, нарушения и патологические состояния, ассоциированные с нарушением функции бета-клеток, включают в себя гипергликемию и болезни обмена веществ, такие как сахарный диабет 1 типа и 2 типа. Способность субъекта продуцировать и секретировать инсулин в кровь и регулировать уровень глюкозы в крови может быть значительно нарушена, когда субъект имеет заболевание, ассоциированное с нарушением функции бета-клеток. Необходимы новые способы и терапевтические агенты для лечения заболеваний, нарушений и патологических состояний, ассоциированных с повышенными уровнями глюкозы в крови, гипергликемией и/или нарушением функции бета-клеток.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[008] В данном раскрытии предложены белки, которые связываются с глюкагоновыми рецепторами (GCGR), в том числе связывающие белки, такие как антитела, и способы их применения. Такие связывающие белки («GCGR-связывающие белки») (например, антитела) могут связываться с полипептидом GCGR, фрагментом GCGR или эпитопом GCGR. GCGR-связывающие белки могут представлять собой антагонисты (например, ингибировать связывание глюкагона с GCGR, ингибировать индуцированную глюкагоном передачу сигнала с участием GCGR или ингибировать комплекс глюкагон/GCGR). В данном раскрытии также предложены способы лечения или предупреждения заболеваний, нарушений или патологических состояний, связанных с дефектами бета-клеток, или их симптомов, с помощью эффективных количеств GCGR-связывающих белков, описанных в данном документе (например, антител). В некоторых вариантах осуществления заболевания, нарушения или патологические состояния, связанные с дефектами бета-клеток, включают в себя нерегулируемый уровень глюкозы, гипергликемию, болезни обмена веществ (например, сахарный диабет 1 и 2 типа) и/или любое заболевание, при котором имеет место потеря функции бета-клеток.
[009] В данном раскрытии также предложены связывающие белки, в том числе антитела или их фрагменты, которые (i) связываются с GCGR человека, (ii) ингибирую передачу сигнала с участием глюкагона, (iii) ингибируют передачу сигнала с участием GCGR и/или (iv) конкурируют с глюкагоном за взаимодействие с GCGR (например, антитела, содержащие последовательности CDR, вариабельной области тяжелой цепи и/или вариабельной области легкой цепи, показанные в Табл. 1-10).
[0010] В некоторых вариантах осуществления GCGR-связывающие белки представляют собой антитела или гуманизированные антитела, которые связываются с полипептидом GCGR, фрагментом GCGR или эпитопом GCGR. В некоторых вариантах осуществления анти-GCGR антитело содержит, по меньшей мере, одну CDR тяжелой цепи и/или, по меньшей мере, одну CDR легкой цепи моноклонального антитела, обозначенного как 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 или 14E9, описанного в данном документе (например, Табл. 1-10) или его гуманизированного варианта. В определенных вариантах осуществления анти-GCGR антитело дополнительно содержит, по меньшей мере, одну каркасную область аминокислотной последовательности человеческого иммуноглобулина или его варианта.
[0011] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит шесть CDR или, по меньшей мере, не менее шести CDR антитела, определенного в Табл. 1-10. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит одну, две, три, четыре, пять или шесть CDR, выбранных из CDR1, CDR2, CDR3 тяжелой цепи и/или CDR1, CD2, CDR3 легкой цепи антитела, определенного в Табл. 1-10. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит одну, две, три, четыре, пять или шесть CDR моноклонального антитела, обозначенного как 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 или 14E9, описанного в данном документе, или его гуманизированного варианта. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) дополнительно содержит опорную область или каркасную(каркасные) область(области) аминокислотной последовательности человеческого иммуноглобулина или его варианта.
[0012] В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело. В некоторых вариантах осуществления антитело представляет собой гуманизированное антитело, моноклональное антитело, антигенсвязывающий фрагмент или любую их комбинацию. В некоторых вариантах осуществления антитело представляет собой моноклональное антитело. В некоторых вариантах осуществления антитело представляет собой гуманизированное антитело. В некоторых вариантах осуществления антитело представляет собой гуманизированное моноклональное антитело, которое связывается с полипептидом GCGR (например, экспрессируемым на клеточной поверхности или растворенным GCGR), фрагментом GCGR или эпитопом GCGR. В некоторых вариантах осуществления антитело представляет собой человеческое антитело. В некоторых вариантах осуществления антитело представляет собой химерное антитело. В некоторых вариантах осуществления антитело представляет собой биспецифическое или мультиспецифическое антитело. В некоторых вариантах осуществления антитело представляет собой фрагмент антитела, содержащий, по меньшей мере, один антигенсвязывающий сайт. В некоторых вариантах осуществления антитело представляет собой антитело IgG. В некоторых вариантах осуществления антитело представляет собой антитело IgG1, антитело IgG2 или антитело IgG4.
[0013] В данном раскрытии также предложены связывающие белки, в том числе антитела или их фрагменты, которые (i) связываются с эпитопом GCGR человека и GCGR яванского макака («яванского макака»), распознаваемым антителом, содержащим вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26; или (ii) конкурируют за связывание с GCGR человека с антителом, содержащим вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления в данном документе предложены связывающие белки, в том числе антитела или их фрагменты, которые связываются с участком, в том числе эпитопом, GCGR человека или GCGR яванского макака. В некоторых вариантах осуществления GCGR-связывающие белки (например, антитела) могут ингибировать передачу сигнала с участием глюкагона, ингибировать передачу сигнала с участием GCGR или ингибировать комплекс глюкагон/GCGR в клетке, которая экспрессирует GCGR человека. Помимо этого, в некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело, и указанное антитело представляет собой моноклональное антитело, гуманизированное антитело, человеческое антитело и/или химерное антитело.
[0014] В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело, которое специфически связывает GCGR человека, при этом указанное антитело содержит: (a) CDR1 тяжелой цепи, содержащую GFTFTNHWLG (SEQ ID NO:1), CDR2 тяжелой цепи, содержащую DIYPGGYYINYNEKFKG (SEQ ID NO:2), CDR3 тяжелой цепи, содержащую HTNYGSDY (SEQ ID NO:3), и/или (b) CDR1 легкой цепи, содержащую RSSQSIVDSYGNTFLE (SEQ ID NO:4), CDR2 легкой цепи, содержащую KVSNRLS (SEQ ID NO:5), и CDR3 легкой цепи, содержащую FQGSHVPWT (SEQ ID NO:6). В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело, которое специфически связывает GCGR человека, при этом указанное антитело содержит (a) вариабельную область тяжелой цепи, последовательность которой на, по меньшей мере, 90% идентична SEQ ID NO:25, и вариабельную область легкой цепи, последовательность которой на, по меньшей мере, 90% идентична SEQ ID NO:26; или (b) вариабельную область тяжелой цепи, последовательность которой на, по меньшей мере, 90% идентична SEQ ID NO:220, и вариабельную область легкой цепи, последовательность которой на, по меньшей мере, 90% идентична SEQ ID NO:221. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело, которое специфически связывает GCGR человека, при этом указанное антитело содержит: (a) вариабельную область тяжелой цепи, последовательность которой на, по меньшей мере, 95% идентична SEQ ID NO:25, и вариабельную область легкой цепи, последовательность которой на, по меньшей мере, 95% идентична SEQ ID NO:26; или (b) вариабельную область тяжелой цепи, последовательность которой на, по меньшей мере, 95% идентична SEQ ID NO:220, и вариабельную область легкой цепи, последовательность которой на, по меньшей мере, 95% идентична SEQ ID NO:221. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело, которое специфически связывает GCGR человека, при этом указанное антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело, которое специфически связывает GCGR человека, при этом указанное антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221.
[0015] В другом аспекте в данном раскрытии предложены GCGR-связывающие белки (например, антитела), (i) которые конкурентно блокируют (например, дозозависимым образом) анти-GCGR антитело, описанное в данном документе (например, антитело 6B5 с последовательностями CDR, определенными в Табл. 1) от связывания с полипептидом GCGR (например, экспрессируемым на клеточной поверхности или растворенным GCGR), фрагментом GCGR или эпитопом GCGR, и/или (ii) которые связываются с эпитопом GCGR, который связывается анти-GCGR антителом, описанным в данном документе (например, антителом 6B5). В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурентно блокирует моноклональное антитело 6B5, описанное в данном документе, или его гуманизированный вариант, от связывания с полипептидом GCGR (например, экспрессируемым на клеточной поверхности или растворенным GCGR), фрагментом GCGR или эпитопом GCGR. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) связывается с эпитопом GCGR, который связывается (например, распознается) моноклональным антителом 6B5, описанным в данном документе, или его гуманизированным вариантом.
[0016] В некоторых вариантах осуществления GCGR-связывающий белок конкурирует за связывание с GCGR, по меньшей мере, с одним из анти-GCGR антител, описанных в данном документе. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом указанное эталонное антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом указанное эталонное антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:27, CDR2 тяжелой цепи, содержащую SEQ ID NO:28, CDR3 тяжелой цепи, содержащую SEQ ID NO:29, CDR1 легкой цепи, содержащую SEQ ID NO:30, CDR2 легкой цепи, содержащую SEQ ID NO:31, и CDR3 легкой цепи, содержащую SEQ ID NO:32. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом указанное эталонное антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:53, CDR2 тяжелой цепи, содержащую SEQ ID NO:54, CDR3 тяжелой цепи, содержащую SEQ ID NO:55, CDR1 легкой цепи, содержащую SEQ ID NO:56, CDR2 легкой цепи, содержащую SEQ ID NO:31, и CDR3 легкой цепи, содержащую SEQ ID NO:32. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом указанное эталонное антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:73, CDR2 тяжелой цепи, содержащую SEQ ID NO:74, CDR3 тяжелой цепи, содержащую SEQ ID NO:75, CDR1 легкой цепи, содержащую SEQ ID NO:76, CDR2 легкой цепи, содержащую SEQ ID NO:77, и CDR3 легкой цепи, содержащую SEQ ID NO:78. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом указанное эталонное антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:99, CDR2 тяжелой цепи, содержащую SEQ ID NO:100, CDR3 тяжелой цепи, содержащую SEQ ID NO:101, CDR1 легкой цепи, содержащую SEQ ID NO:102, CDR2 легкой цепи, содержащую SEQ ID NO:103, и CDR3 легкой цепи, содержащую SEQ ID NO:104. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом указанное эталонное антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:124, CDR2 тяжелой цепи, содержащую SEQ ID NO:125, CDR3 тяжелой цепи, содержащую SEQ ID NO:126, CDR1 легкой цепи, содержащую SEQ ID NO:127, CDR2 легкой цепи, содержащую SEQ ID NO:128, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом указанное эталонное антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:146, CDR2 тяжелой цепи, содержащую SEQ ID NO:147, CDR3 тяжелой цепи, содержащую SEQ ID NO:148, CDR1 легкой цепи, содержащую SEQ ID NO:149, CDR2 легкой цепи, содержащую SEQ ID NO:128, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом указанное эталонное антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:166, CDR2 тяжелой цепи, содержащую SEQ ID NO:167, CDR3 тяжелой цепи, содержащую SEQ ID NO:168, CDR1 легкой цепи, содержащую SEQ ID NO:169, CDR2 легкой цепи, содержащую SEQ ID NO:170, и CDR3 легкой цепи, содержащую SEQ ID NO:171. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом указанное эталонное антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:190, CDR2 тяжелой цепи, содержащую SEQ ID NO:191, CDR3 тяжелой цепи, содержащую SEQ ID NO:192, CDR1 легкой цепи, содержащую SEQ ID NO:169, CDR2 легкой цепи, содержащую SEQ ID NO:128, и CDR3 легкой цепи, содержащую SEQ ID NO:193. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом указанное эталонное антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:190, CDR2 тяжелой цепи, содержащую SEQ ID NO:205, CDR3 тяжелой цепи, содержащую SEQ ID NO:206, CDR1 легкой цепи, содержащую SEQ ID NO:207, CDR2 легкой цепи, содержащую SEQ ID NO:128, и CDR3 легкой цепи, содержащую SEQ ID NO:6.
[0017] В некоторых вариантах осуществления антитело, которое конкурирует за связывание с GCGR, содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления антитело, которое конкурирует за связывание с GCGR, содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления антитело, которое конкурирует за связывание с GCGR, содержит (a) вариабельную область тяжелой цепи, содержащую SEQ ID NO:51, и вариабельную область легкой цепи, содержащую SEQ ID NO:52; (b) вариабельную область тяжелой цепи, содержащую SEQ ID NO:71, и вариабельную область легкой цепи, содержащую SEQ ID NO:72; (c) вариабельную область тяжелой цепи, содержащую SEQ ID NO:97, и вариабельную область легкой цепи, содержащую SEQ ID NO:98; (d) вариабельную область тяжелой цепи, содержащую SEQ ID NO:122, и вариабельную область легкой цепи, содержащую SEQ ID NO:123; (e) вариабельную область тяжелой цепи, содержащую SEQ ID NO:144, и вариабельную область легкой цепи, содержащую SEQ ID NO:145; (f) вариабельную область тяжелой цепи, содержащую SEQ ID NO:164, и вариабельную область легкой цепи, содержащую SEQ ID NO:165; (g) вариабельную область тяжелой цепи, содержащую SEQ ID NO:188, и вариабельную область легкой цепи, содержащую SEQ ID NO:189; (h) вариабельную область тяжелой цепи, содержащую SEQ ID NO:203, и вариабельную область легкой цепи, содержащую SEQ ID NO:204; или (i) вариабельную область тяжелой цепи, содержащую SEQ ID NO:218, и вариабельную область легкой цепи, содержащую SEQ ID NO:219.
[0018] В некоторых вариантах осуществления GCGR-связывающий белок связывает тот же самый эпитоп на GCGR, что и, по меньшей мере, одно из антител, описанных в данном документе. В некоторых вариантах осуществления GCGR-связывающий белок связывает эпитоп на GCGR, который перекрывается с эпитопом на GCGR, связываемым, по меньшей мере, одним из антител, описанных в данном документе. В некоторых вариантах осуществления GCGR-связывающий белок связывает тот же самый эпитоп, что и антитело, содержащее CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи, выбранное из группы, состоящей из: 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления GCGR-связывающий белок связывает эпитоп, который перекрывается с эпитопом, связываемым антителом, содержащим CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи, выбранным из группы, состоящей из: 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления GCGR-связывающий белок связывает тот же самый эпитоп, что и антитело, содержащее вариабельную область тяжелой цепи и вариабельную область легкой цепи, выбранное из группы, состоящей из: Hz6B5, 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления GCGR-связывающий белок связывает эпитоп, который перекрывается с эпитопом, связываемым антителом, содержащим вариабельную область тяжелой цепи и вариабельную область легкой цепи, выбранное из группы, состоящей из: Hz6B5, 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9.
[0019] В некоторых вариантах осуществления GCGR-связывающий белок представляет собой гуманизированное антитело, содержащее тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO:234, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO:236.
[0020] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело), описанный в данном документе, комбинируют, конъюгируют или рекомбинантно связывают с диагностическим агентом, детектируемым агентом или терапевтическим агентом. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело, которое конъюгируют с маркером пригодным для детекции. В некоторых вариантах осуществления детектируемый агент выбирают из группы, состоящей из радиоизотопа, металлохелатора, фермента, флуоресцентного соединения, биолюминесцентного соединения или хемилюминесцентного соединения. В некоторых вариантах осуществления терапевтический агент выбирают из группы, состоящей из: бигуанидов и соединений сульфомочевины (например, метформина, толбутамида, хлорпропамида, ацетогексамида, толазамида, глибенкламида, глибурида и глипизида), тиазолидиндионов (например, росиглитазона и пиоглитазона), аналогов GLP-1, PPAR-гамма-агонистов, ингибиторов дипептидилпептидазы-4 (DPP-4) (например, JANUVIA и ONGLYZA), бромокриптина, секвестрантов желчных кислот (например, колесевелама), инсулина (например, болюсных и базальных аналогов), ингибиторов альфа-глюкозидазы (например, акарбозы, роглибозы), ингибиторов SGLT-2 и лекарственных препаратов для подавления аппетита и для похудения (например, XENICAL).
[0021] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело), описанный в данном документе, ингибирует передачу сигнала с участием GCGR в клетках, экспрессирующих GCGR. В некоторых вариантах осуществления GCGR-связывающий белок ингибирует индуцированную глюкагоном передачу сигнала с участием GCGR. В некоторых вариантах осуществления GCGR-связывающий белок ингибирует активность GCGR в клетке. В некоторых вариантах осуществления GCGR-связывающий белок ингибирует цАМФ-активность в клетке.
[0022] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело), описанный в данном документе, (i) снижает уровни глюкозы в крови; (ii) повышает уровень C-пептида; и/или (iii) повышает уровень инсулина. В некоторых вариантах осуществления уровень C-пептида измеряют в образце крови, образце сыворотки крови, образце плазмы крови или образце поджелудочной железы. В некоторых вариантах осуществления уровень инсулина измеряют в образце крови, образце сыворотки крови, образце плазмы крови или образце поджелудочной железы.
[0023] В другом аспекте в данном раскрытии предложена клетка, содержащая или продуцирующая GCGR-связывающий белок, описанный в данном документе. В некоторых вариантах осуществления клетка содержит антитело, описанное в данном документе (например, определенное последовательностями CDR в Табл. 1-10). В некоторых вариантах осуществления клетка содержит антитело, обозначенное 6B5, или гуманизированную версию, обозначенную Hz6B5. В некоторых вариантах осуществления клетка продуцирует антитело, описанное в данном документе (например, определенное последовательностями CDR в Табл. 1-10). В некоторых вариантах осуществления клетка продуцирует антитело, обозначенное 6B5, или гуманизированную версию, обозначенную Hz6B5.
[0024] В другом аспекте в данном раскрытии предложены композиции, содержащие GCGR-связывающий белок, описанный в данном документе. В некоторых вариантах осуществления в данном раскрытии предложены фармацевтические композиции, содержащие GCGR-связывающие белок, описанный в данном документе, и фармацевтически приемлемый носитель.
[0025] В некоторых вариантах осуществления каждого из вышеупомянутых аспектов, а также других аспектов и/или вариантов осуществления, описанных в других разделах в данном документе, GCGR-связывающий белок является выделенным. В некоторых вариантах осуществления GCGR-связывающий белок является по сути чистым.
[0026] В другом аспекте в данном раскрытии предложены полинуклеотидные молекулы, содержащие полинуклеотид, который кодирует GCGR-связывающий белок (например, антитело), описанный в данном документе. В некоторых вариантах осуществления молекулы нуклеиновых кислот кодируют тяжелую цепь иммуноглобулина, легкую цепь иммуноглобулина, вариабельную область тяжелой цепи, вариабельную область легкой цепи, CDR тяжелой цепи и/или CDR легкой цепи GCGR-связывающих белков (например, антител), которые связываются с GCGR, фрагментом GCGR или эпитопом GCGR. В некоторых вариантах осуществления молекула нуклеиновой кислоты кодирует вариабельную область тяжелой цепи и/или вариабельную область легкой цепи моноклонального антитела, обозначенного как 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 или 14E9, описанных в данном документе (см., например, Табл. 1-10), или его гуманизированного варианта. В некоторых вариантах осуществления молекула нуклеиновой кислоты дополнительно кодирует опорную или каркасную область аминокислотной последовательности человеческого иммуноглобулина или его варианта. В некоторых вариантах осуществления полинуклеотидная молекула содержит полинуклеотид, который кодирует полипептид SEQ ID NO:233, SEQ ID NO:234, SEQ ID NO:235 или SEQ ID NO:236. В некоторых вариантах осуществления полинуклеотидная молекула содержит полинуклеотид, который кодирует полипептид, содержащий SEQ ID NO:233 и SEQ ID NO:235. В некоторых вариантах осуществления полинуклеотидная молекула содержит полинуклеотид, который кодирует полипептид, содержащий SEQ ID NO:234 и SEQ ID NO:236. В некоторых вариантах осуществления полинуклеотид является выделенным. В некоторых вариантах осуществления полинуклеотид является по сути чистым.
[0027] Также в данном документе предложены векторы, которые содержат молекулы нуклеиновой кислоты, кодирующие GCGR-связывающий белок (например, антитело), а также клетки, которые содержат вектор и/или полинуклеотиды. В некоторых вариантах осуществления в данном раскрытии предложены способы продуцирования GCGR-связывающего белка (например, антитела) с помощью культивирования клеток-хозяев, предложенных в данном документе, в условиях, которые способствуют продуцированию GCGR-связывающего белка.
[0028] В другом аспекте в данном раскрытии предложены способы применения GCGR-связывающих белков (например, антител), описанных в данном документе. В некоторых вариантах осуществления способ ингибирования передачи сигнала с участием GCGR в клетке включает в себя приведение клетки в контакт с GCGR-связывающим белком (например, антителом), описанным в данном документе. В некоторых вариантах осуществления клетка экспрессирует GCGR человека. В некоторых вариантах осуществления передача сигнала с участием GCGR индуцируется глюкагоном.
[0029] В некоторых вариантах осуществления способ уменьшения или снижения уровней глюкозы в крови у субъекта включает введение субъекту терапевтически эффективного количества GCGR-связывающего белка (например, антитела), описанного в данном документе. В некоторых вариантах осуществления способ повышения уровня С-пептида в крови у субъекта включает введение субъекту терапевтически эффективного количества GCGR-связывающего белка (например, антитела), описанного в данном документе. В некоторых вариантах осуществления способ повышения уровня инсулина в крови у субъекта включает введение субъекту терапевтически эффективного количества GCGR-связывающего белка (например, антитела), описанного в данном документе. В некоторых вариантах осуществления способ уменьшения или снижения уровней глюкозы в крови и повышения уровня С-пептида в крови у субъекта включает введение субъекту терапевтически эффективного количества GCGR-связывающего белка (например, антитела), описанного в данном документе. В некоторых вариантах осуществления уровень C-пептида измеряют в образце крови, образце сыворотки крови, образце плазмы крови или образце поджелудочной железы. В некоторых вариантах осуществления уровень инсулина измеряют в образце крови, образце сыворотки крови, образце плазмы крови или образце поджелудочной железы.
[0030] В некоторых вариантах осуществления способ лечения сахарного диабета 1 типа у субъекта включает введение субъекту терапевтически эффективного количества GCGR-связывающего белка (например, антитела), описанного в данном документе. В некоторых вариантах осуществления сахарный диабет 1 типа представляет собой латентный аутоиммунный сахарный диабет взрослых (LADA). В некоторых вариантах осуществления способ лечения сахарного диабета 2 типа у субъекта включает введение субъекту терапевтически эффективного количества GCGR-связывающего белка (например, антитела), описанного в данном документе. В некоторых вариантах осуществления способ лечения гипергликемии у субъекта включает введение субъекту терапевтически эффективного количества GCGR-связывающего белка (например, антитела), описанного в данном документе.
[0031] В некоторых вариантах осуществления способ лечения или предупреждения заболевания, нарушения или патологического состояния, ассоциированного с нарушением функции бета-клеток, у субъекта включает введение субъекту терапевтически эффективного количества GCGR-связывающего белка (например, антитела), описанного в данном документе. В некоторых вариантах осуществления способ лечения или предупреждения заболевания, нарушения или патологического состояния, связанного с дефектами бета-клеток, или их симптома, у субъекта включает введение субъекту терапевтически эффективного количества GCGR-связывающего белка (например, антитела), описанного в данном документе. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние представляет собой гипергликемию. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние представляет собой сахарный диабет 1 типа. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние представляет собой сахарный диабет 2 типа. В некоторых вариантах осуществления способов, описанных в данном документе, лечение (i) снижает уровни глюкозы в крови, (ii) повышает уровень C-пептида в крови, (iii) повышает уровни C-пептида в поджелудочной железе, (iv) снижает уровни глюкозы и повышает уровень C-пептида в крови, и/или (v) снижает уровни глюкозы в крови и повышает уровень C-пептида в поджелудочной железе. В некоторых вариантах осуществления способ улучшения функции бета-клеток у субъекта включает введение субъекту терапевтически эффективного количества GCGR-связывающего белка (например, антитела), описанного в данном документе. В некоторых вариантах осуществления на улучшение функции бета-клеток указывает снижение уровня глюкозы в крови, повышение уровня C-пептида и/или повышение уровня инсулина.
[0032] В некоторых вариантах осуществления способов, описанных в данном документе, субъект получает суточную дозу инсулина. В некоторых вариантах осуществления способов, описанных в данном документе, субъект не получает суточную дозу инсулина. В некоторых вариантах осуществления способов, описанных в данном документе, субъект имеет сахарный диабет 1 типа или его симптом. В некоторых вариантах осуществления способов, описанных в данном документе, субъект имеет сахарный диабет 2 типа или его симптом. В некоторых вариантах осуществления способов, описанных в данном документе, субъект имеет гипергликемию. В некоторых вариантах осуществления способов, описанных в данном документе, субъект имеет инсулинорезистентность. В некоторых вариантах осуществления способов, описанных в данном документе, субъект имеет инсулинзависимый сахарный диабет. В некоторых вариантах осуществления способов, описанных в данном документе, субъект имеет инсулиннезависимый сахарный диабет.
[0033] В некоторых вариантах осуществления способов, описанных в данном документе, субъект имеет заболевание, нарушение или патологическое состояние, связанное с дефектами бета-клеток, или их симптом. В некоторых вариантах осуществления способов, описанных в данном документе, заболевание, нарушение или патологическое состояние, связанное с дефектами бета-клеток, представляет собой сахарный диабет 1 типа. В некоторых вариантах осуществления способов, описанных в данном документе, заболевание, нарушение или патологическое состояние, связанное с дефектами бета-клеток, представляет собой сахарный диабет 2 типа. В некоторых вариантах осуществления способов, описанных в данном документе, заболевание, нарушение или патологическое состояние, связанное с дефектами бета-клеток, представляет собой болезнь обмена веществ. В некоторых вариантах осуществления способов, описанных в данном документе, один или несколько симптомов предупреждают или лечат.
[0034] В некоторых вариантах осуществления способов, описанных в данном документе, субъект имеет повышение глюкагона в сыворотке крови, инсулина в сыворотке крови и/или C-пептида после введения GCGR-связывающего белка, описанного в данном документе. В некоторых вариантах осуществления способов, описанных в данном документе, субъект имеет снижение уровня глюкозы в крови (например, уровня глюкозы в цельной крови, сыворотке крови или плазме крови) после введения GCGR-связывающего белка, описанного в данном документе. В некоторых вариантах осуществления способов, описанных в данном документе, субъект имеет снижение уровня глюкозы в крови и повышение C-пептида (например, C-пептида в сыворотке крови, C-пептида в поджелудочной железе или и то, и другое).
[0035] В некоторых вариантах осуществления способов, описанных в данном документе, способ предусматривает введение, по меньшей мере, одного дополнительного терапевтического агента субъекту. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой лекарственный препарат для лечения сахарного диабета или гипергликемии. В некоторых вариантах осуществления лекарственный препарат для лечения сахарного диабета или гипергликемии представляет собой бигуанид, сульфомочевину, производное меглитинида, ингибитор альфа-глюкозидазы, тиазолидиндион (TZD), агонист глюкагоноподобного пептида 1 (GLP-1), ингибитор дипептидилпептидазы 4 (DPP-4), селективный ингибитор натрий-глюкозного котранспортера 2 (SGLT-2), инсулин или инсулиномиметик, амилиномиметик, секвестрант желчных кислот и/или агонист дофаминовых рецепторов. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой лекарственный препарат для лечения ожирения, лекарственный препарат для подавления аппетита или лекарственный препарат для похудения. В некоторых вариантах осуществления субъект получает суточную дозу инсулина. В некоторых вариантах осуществления суточную дозу инсулина снижают после введения GCGR-связывающего белка (например, антитела).
[0036] В некоторых вариантах осуществления способов, описанных в данном документе, эффективное количество GCGR-связывающего белка (например, антитела) составляет от приблизительно 1 мг/кг до приблизительно 100 мг/кг. В некоторых вариантах осуществления эффективное количество представляет собой количество, которое приблизительно от 2 раз до приблизительно 10 раз больше, чем количество, необходимое для снижения уровня глюкозы в крови (например, уровня глюкозы в цельной крови, сыворотке крови или плазме крови) у субъекта. В некоторых вариантах осуществления количество составляет в приблизительно 2 раза больше, в приблизительно 3 раза больше, в приблизительно 4 раза больше, в приблизительно 5 раз больше, в приблизительно 6 раз больше, в приблизительно 6 раз больше, в приблизительно 7 раз больше, в приблизительно 8 раз больше, в приблизительно 9 раз больше или в приблизительно 10 раз больше, чем количество, необходимое для снижения уровня глюкозы в крови у субъекта.
[0037] В некоторых вариантах осуществления способов, описанных в данном документе, эффективное количество GCGR-связывающего белка вводят в четырех или более дозах, например, 4, 5, 6, 7, 8, 9, 10 или более дозах, или любых их интервалах. В некоторых вариантах осуществления эффективное количество доставляют еженедельно в течение четырех или более недель, например, приблизительно 5 недель, приблизительно 6 недель, приблизительно 8 недель, приблизительно 10 недель, приблизительно 12 недель, приблизительно 4 месяцев, приблизительно 5 месяцев, приблизительно 6 месяцев, приблизительно 1 года, приблизительно 2 лет или дольше, или любых их интервалов. В некоторых вариантах осуществления эффективное количество доставляют приблизительно один раз в две недели, приблизительно один раз в три недели или приблизительно один раз в четыре недели.
[0038] В некоторых вариантах осуществления способов, описанных в данном документе, в которых субъект ранее получал дозу GCGR-связывающего белка, количество вводимого связывающего белка составляет от в приблизительно 2 раза больше до в приблизительно 10 раз больше, чем предшествующая доза антитела. В некоторых вариантах осуществления предшествующая доза представляла собой индивидуальную дозу.
[0039] Если аспекты или варианты осуществления данного раскрытия описаны с точки зрения группы Маркуша или другой группы альтернатив, то данное раскрытие охватывает не только всю группу, упомянутую в качестве целого, но и также каждого члена группы отдельно, и все возможные подгруппы главной группы, а также главную группу, в которой отсутствует один или нескольких из членов группы. В данном раскрытии также предложено явное исключение одного или нескольких из любого из членов группы в заявляемом изобретении.
Краткое описание графических материалов
[0040] На Фиг. 1A-1 и 1A-2 изображены выравнивания последовательностей вариабельных областей тяжелых цепей анти-GCGR антител, обозначаемых 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. Границы CDR указаны в соответствии с нумерацией Кабат, AbM, Чотиа, Контакта и IMGT.
[0041] На Фиг. 1B-1 и 1B-2 изображены выравнивания последовательностей вариабельных областей легких цепей анти-GCGR антител, обозначаемых 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. Границы CDR указаны в соответствии с нумерацией Кабата, AbM, Чотиа, Контакта и IMGT.
[0042] На Фиг. 2 изображена совокупность репрезентативных результатов, полученных на основании эксперимента сканирования аланином, показывающих связывание анти-GCGR антитела 6B5 с 3 вариантами внеклеточного домена GCGR, содержащими единичные аминокислотные замены.
[0043] На Фиг. 3 изображены результаты эксперимента, включающего в себя введение анти-GCGR антител 3H5, 6B5 и 5B11 в мышиной модели TET-DTA.
[0044] На Фиг. 4A-4C изображены результаты эксперимента, включающего в себя введение анти-GCGR антител 3H5, 6B5 и 5B11 в мышиной модели TET-DTA. (A) Уровни инсулина в плазме крови; (B) содержание C-пептида в плазме крови; и (C) содержание инсулина в поджелудочной железе.
[0045] На Фиг. 5A-5C изображены результаты эксперимента, включающего в себя введение гуманизированного химерного анти-GCGR антитела Hz6B5.07mc в мышиной модели TET-DTA. (A) Уровни глюкозы в крови; (B) содержание C-пептида в плазме крови; и (C) содержание инсулина в поджелудочной железе.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0046] В данном изобретении предложены белки, которые связывают глюкагоновые рецепторы (GCGR). GCGR-связывающие белки могут включать в себя антитела и могут связывать полноразмерный GCGR, фрагмент GCGR (например, внеклеточный домен) и/или эпитоп GCGR. Связывающие белки (например, антитела) могут представлять собой антагонисты, которые имеют способность (i) ингибировать связывание глюкагона с GCGR, (ii) ингибировать индуцированную глюкагоном передачу сигнала с участием GCGR, (iii) ингибировать комплекс глюкагон/GCGR или (iv) ингибировать передачу сигнала с участием GCGR. Связывающие белки (например, антитела) могут быть пригодны в способах лечения или предупреждения гипергликемии, сахарного диабета, ожирения и/или заболеваний, нарушений или патологических состояний, связанных с дефектами бета-клеток, или их симптомов.
[0047] Связывающие белки (например, антитела), раскрытые в данном документе, имеют общую характеристику конкурирования с друг с другом за связывание GCGR. Это конкурирование предполагает, что каждый белок связывается с одним и же участком GCGR (например, одним и тем же эпитопом или перекрывающимися эпитопами). Результаты, описанные в данном документе, свидетельствуют о том, что эффекты, наблюдаемые в случае анти-GCGR антитела, происходящего или основанного на антителе 6B5 или антителе в эпитопной группе 6B5, могут быть экстраполированы на другие анти-GCGR антитела, имеющие ту же самую или аналогичную специфичность эпитопа. К примеру, активности in vitro нескольких иллюстративных антител в Примерах 2-4, а также эффекты in vivo иллюстративных антител в Примере 6, являются репрезентативными для различных активностей и эффектов анти-GCGR антител, описанных в данном документе.
I. Определения
[0048] Если не определено иное, технические и научные термины в данном раскрытии имеют значения, которые обычно понимаются специалистами в данной области техники. В целях интерпретации данного описания будет использоваться следующее описание терминов и при необходимости, термины, используемые в форме единственного числах также будут включать в себя множественное число и наоборот. В случае, если любое описание термина, изложенного далее, конфликтует с любым документом, включенным в данный документ посредством ссылки, данное описание термина, изложенного далее, необходимо контролировать.
[0049] Термин «связывающий агент», используемый в данном документе, относится к молекуле, которая связывает конкретный антиген или мишень (например, GCGR). Связывающий агент может содержать белок, пептид, нуклеиновую кислоту, углевод, липид или низкомолекулярное соединение. В некоторых вариантах осуществления связывающий агент содержит связывающий белок. В некоторых вариантах осуществления связывающий представляет собой связывающий белок. В некоторых вариантах осуществления связывающий агент содержит антитело или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления связывающий агент представляет собой антитело или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления связывающий агент содержит альтернативный белковый каркас или искусственный каркас и антигенсвязывающий сайт, содержащий CDR или производные CDR. В некоторых вариантах осуществления связывающий агент представляет собой слитый белок, содержащий антигенсвязывающий сайт. В некоторых вариантах осуществления связывающий агент представляет собой биспецифическую или мультиспецифическую молекулу, содержащую, по меньшей мере, один антигенсвязывающий сайт.
[0050] Термин «антитело», используемый в данном документе, относится к иммуноглобулиновой молекуле, которая распознает и связывает мишень с помощью, по меньшей мере, одного антигенсвязывающего сайта. Термин «антитело» используется в данном документе в самом широком смысле и охватывает различные структуры антител, в том числе, но не ограничиваясь ими, поликлональные антитела, рекомбинантные антитела, моноклональные антитела, химерные антитела, гуманизированные антитела, человеческие антитела, биспецифические антитела, мультиспецифические антитела, диатела, триотела, тетратела, антитела с одноцепочечными Fv-фрагментами (scFv), однодоменные антитела (например, верблюжьи антитела/антитела ламы) и фрагменты антител.
[0051] Термин «интактное антитело» или «полноразмерное антитело» относится к антителу, имеющему структуру, по сути аналогичную структуре нативного антитела. Оно включает в себя антитело, содержащее две легкие цепи, каждая из которых содержит вариабельную область, и константную область легкой цепи (CL), и две тяжелые цепи, каждая из которых содержит вариабельную область, и, по меньшей мере, константные области тяжелой цепи CH1, CH2 и CH3.
[0052] Термин «фрагмент антитела», используемый в данном документе, относится к молекуле, отличной от интактного антитела, которая содержит часть антитела и, как правило, антигенсвязывающий сайт. Примеры фрагментов антител включают в себя, но не ограничиваясь ими, Fab, Fab', F(ab')2, Fv, связанные дисульфидными связями Fv (sdFv), Fd, линейные антитела, молекулы одноцепочечных антител (например, scFv), диатела, триотела, тетратела, минитела, антитела с двойным вариабельным доменом (DVD), антитела с одиночным вариабельным доменом и мультиспецифические антитела, образованные из фрагментов антител.
[0053] Термин «вариабельная область», используемый в данном документе, относится к области легкой цепи антитела или области тяжелой цепи антитела, которые участвуют в связывания антитела с антигеном. Вариабельная область тяжелой цепи антитела и легкой цепи антитела имеют аналогичные структуры, и, как правило, содержат четыре каркасные области и три области, определяющие комплементарность (CDR) (также известные как гипервариабельные области).
[0054] Термин «каркасные области» относится к аминокислотным остаткам, отличным от других остатков CDR в вариабельной области. Вариабельная область, как правило, содержит четыре каркасные области, FR1, FR2, FR3 и FR4.
[0055] Термин «моноклональное антитело», используемое в данном документе, относится к популяции по сути гомогенных антител, участвующих в высокоспецифическом распознавании и связывании одной антигенной детерминанты или эпитопа. Отдельные антитела, образующие популяцию, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Термин «моноклональное антитело» охватывает интактные и полноразмерные антитела, а также фрагменты антител (например, Fab, Fab′, F(ab′)2, Fv), одноцепочечные (scFv) антитела, слитые белки, содержащие фрагмент антитела, и другие модифицированные иммуноглобулиновые молекулы, содержащие антигенсвязывающий сайт. Кроме того, термин «моноклональное антитело» относится к таким антителам, созданным с помощью ряда методик, в том числе, но не ограничиваясь ими, продуцирования гибридомой, фагового дисплея библиотек, рекомбинантной экспрессии и трансгенных животных.
[0056] Термин «химерное антитело», используемый в данном документе, относится к антителу, в котором часть тяжелой цепи и/или легкой цепи, происходит из определенного источника или вида, в то время как оставшаяся часть тяжелой и/или легкой цепи происходит из другого источника или вида.
[0057] Термин «гуманизированное антитело», используемый в данном документе, относится к химерному антителу, которое, как правило, содержит человеческие иммуноглобулины (например, реципиентное антитело), в которых нативные остатки CDR замещены остатками из соответствующих CDR от не относящегося к человеку вида (например, донорское антитело), например, мыши, крысы, кролика или не относящегося к человеку примата, при этом донорское антитело имеет необходимую специфичность, аффинность и/или активность. В некоторых случаях один или несколько остатков в пределах одной или нескольких каркасных областей человеческого иммуноглобулина замещены соответствующими не относящимися к человеку остатками. Кроме того, гуманизированные антитела могут содержать остатки, которые не встречаются в реципиентном антителе или в донорском антителе. Эти модификации могут быть выполнены с целью дополнительного усовершенствования и/или оптимизации характеристик антител. Гуманизированное антитело может содержать вариабельные области, содержащие все или почти все из CDR, которые соответствуют не относящемуся к человеку иммуноглобулину, и все или почти все из каркасных областей, которые соответствуют таковым человеческого иммуноглобулина. В некоторых вариантах осуществления гуманизированное антитело будет содержать, по меньшей мере, часть Fc-области иммуноглобулина (например, шарнирную область, CH1, CH2 и/или CH3), в типичном случае таковую человеческого иммуноглобулина.
[0058] Термин «человеческое антитело», используемое в данном документе, относится к антителу, которое имеет аминокислотную последовательность, которая соответствует антителу, продуцируемому человеком, и/или антителу, которое было создано с помощью методик, которые известны специалистам в данном области техники, для создания человеческих антител. Эти методики включают в себя, но не ограничиваясь ими, библиотеки фагового дисплея, библиотеки дрожжевого дисплея, трансгенные животные и технология B-клеточной гибридомы. Человеческое антитело, определенное в данном документе, исключает гуманизированное антитело, содержащее остатки из не относящемуся к человеку источника.
[0059] Термины «эпитоп» и «антигенная детерминанта» используются в данном документе взаимозаменяемо и относятся к части антигена или мишени, способных распознаваться и быть связанными определенным связывающим агентом или связывающим белком (например, антителом). Если антиген или мишень представляют собой полипептид, эпитопы могут быть образованы как из заменимых аминокислот, так и из незаменимых аминокислот, соединенных с помощью третичной связи белка. Эпитопы, образованные из заменимых аминокислот (также обозначаемые как линейные эпитопы), в типичном случае сохраняются при денатурации белка, в то время как эпитопы, образованные с помощью третичной связи (также обозначаемые как конформационные эпитопы), в типичном случае утрачиваются при денатурации белка. Эпитоп в типичном случае содержит, по меньшей мере, 3 и более типично, по меньшей мере, 5, 6, 7 или 8-10 аминокислот в уникальной пространственной конформации. Эпитопы можно прогнозировать с помощью любого из большого количества программных биоинформационных средств, доступных в интернете. Рентгеноструктурная кристаллография может быть использована для характеристики эпитопа на целевом белке с помощью анализа взаимодействий аминокислотных остатков комплекса антиген/антитело.
[0060] Термин «специфически связывается», используемый в данном документе, относится к связывающему белку (например, антителу), который взаимодействует более часто, более быстро, с большей продолжительностью, с больше аффинностью или с несколькими комбинациями вышеуказанного в отношении определенного антигена, эпитопа, белка или целевой молекулы, чем с альтернативными веществами. В некоторых вариантах осуществления белок (например, антитело), который специфически связывает антиген (например, GCGR человека), может связывать родственные антигены (например, GCGR яванского макака). Антитело, которое специфически связывает антиген, может быть идентифицировано, к примеру, с помощью иммунологических анализов, ИФА, анализов Biacore, FACS или других методик, известных специалистам в данной области техники.
[0061] Термины «полипептид», «пептид» и «белок» используются в данном документе взаимозаменяемо и относятся к полимерам из аминокислот любой длины. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты и он может прерываться не аминокислотами. Укзанные термины также охватывают аминокислотный полимер, который был модифицирован естественным образом или в результате вмешательства; например, в результате образования дисульфидной связи, гликозилирования, липидирования, ацетилирования, фосфорилирования или любой другой манипуляции или модификации. Также в указанное определение включены, к примеру, полипептиды, содержащие один или несколько аналогов аминокислоты, в том числе, но не ограничиваясь ими, не встречающиеся в природе аминокислоты, а также другие модификации, известные в данной области техники. Понятно, что поскольку полипептиды по данному раскрытию могут быть основаны на антителах, термин «полипептид» охватывает полипептиды в виде одной цепи и полипептиды из двух или более ассоциированных цепей.
[0062] Термины «полинуклеотид», «нуклеиновая кислота» и «молекула нуклеиновой кислоты» используются в данном документе взаимозаменяемо, относятся к полимерам из нуклеотидов любой длины и включают в себя ДНК и РНК. Нуклеотиды могут представлять собой полинуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания, и/или их аналоги, или любой субстрат, который может быть включен в полимер с помощью ДНК- или РНК-полимеразы.
[0063] Термины «идентичность» или процент «идентичности» в контексте двух или более нуклеиновых кислот или полипептидов относятся к двум или более последовательностям или подпоследовательностям, которые представляют собой то же самое или имеют определенный процент нуклеотидов или аминокислотных остатков, которые являются одинаковыми, при сравнении и выравнивании (введении гэпов, при необходимости) с целью максимального соответствия, без учета каких-либо консервативных замен в виде части идентичности последовательности. Процент идентичности может быть измерен с помощью компьютерных программ или алгоритмов сравнения последовательностей или с помощью визуальной проверки. Различные алгоритмы и компьютерные программы, которые могут быть использованы для получения выравниваний аминокислотных или нуклеотидных последовательностей, известны в данной области техники. Они включают в себя, но не ограничиваясь ими, BLAST, ALIGN, Megalign, BestFit, GCG Wisconsin Package и их варианты. В некоторых вариантах осуществления два полинуклеотида или полипептида по данному изобретению являются по сути идентичными, означая, что они на, по меньшей мере, 70%, на, по меньшей мере, 75%, на, по меньшей мере, 80%, на, по меньшей мере, 85%, на, по меньшей мере, 90% и в некоторых вариантах осуществления на, по меньшей мере, 95%, 96%, 97%, 98%, 99% идентичны нуклеотидам или аминокислотным остаткам, при сравнении и выравнивании с целью максимального соответствия, измеряемого с помощью алгоритма сравнения последовательностей или визуальной проверки. В некоторых вариантах осуществления идентичность существует на протяжении участка последовательностей, который составляет, по меньшей мере, приблизительно 10,, по меньшей мере, приблизительно 20,, по меньшей мере, приблизительно 40-60 нуклеотидов или аминокислотных остатков,, по меньшей мере, приблизительно 60-80 нуклеотидов или аминокислотных остатков в длину, или любое целое значение между ними. В некоторых вариантах осуществления идентичность существует на протяжении более длинного участка, чем 60-80 нуклеотидов или аминокислотных остатков, например,, по меньшей мере, приблизительно 80-100 нуклеотидов или аминокислотных остатков, и в некоторых вариантах осуществления последовательности являются по сути идентичными на протяжении полной длины последовательностей, подлежащих сравнению, к примеру, (i) кодирующей области нуклеотидной последовательности или (ii) аминокислотной последовательности.
[0064] Фраза «консервативная аминокислотная замена», используемая в данном документе, относится к замене, при которой один аминокислотный остаток замещен другим аминокислотным остатком, имеющим аналогичную боковую цепь. Семейства аминокислотных остатков, имеющих аналогичные боковые цепи, в целом были определены в данной области техники, в том числе основные боковые цепи (например, лизин, аргинин, гистидин), кислые боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин). К примеру, замена фенилаланина на тирозин считается консервативной заменой. Как правило, консервативные замены в последовательностях полипептидов и/или антител не подавляют связывание полипептида или антитела с целевым связывающим сайтом. Способы идентификации нуклеотидных и консервативных аминокислотных замен, которые не устраняют связывание, хорошо известны в данной области техники.
[0065] Термин «вектор», используемый в данном документе, означает конструкцию, которая способна доставлять и обычно экспрссировать один или несколько генов, представляющих интерес, в клетке-хозяине. Примеры векторов включают в себя, но не ограничиваясь ими, вирусные векторы, экспрессионные векторы на основе оголенной ДНК или РНК, плазмиды, космиды или фаговые векторы, ДНК- или РНК-экспрессионные векторы, ассоциированные с катионными конденсирующими агентами, а также ДНК- или РНК-экспрессионные векторы, инкапсулированные в липосомы.
[0066] Термин «выделенный», используемый в данном документе, относится к полипептиду, растворенному белку, антителу, полинуклеотиду, вектору, клетке или композиции, которая находится в форме, не встречающейся в природе. «Выделенное» антитело по сути не содержит вещества из клеточного источника, из которого она происходит. В некоторых вариантах осуществления выделенные полипептиды, растворенные белки, антитела, полинуклеотиды, векторы, клетки или композиции, представляют собой таковые, которые были очищены до степени, в которой они больше не существуют в форме, в которой они встречаются в природе. В некоторых вариантах осуществления полипептид, растворенный белок, антитело, полинуклеотид, вектор, клетка или композиция, которые являются выделенными, по сути являются чистыми. Полипептид, растворенный белок, антитело, полинуклеотид, вектор, клетка или композиция могут быть выделены из природного источника, такого как разработанная клеточная линия.
[0067] Термин «по сути чистый», используемый в данном документе, относится к веществу, которое является на, по меньшей мере, 50% чистым (т.е., не содержит контаминантов), на, по меньшей мере, 90% чистым, на, по меньшей мере, 95% чистым, на, по меньшей мере, 98% чистым или на, по меньшей мере, 99% чистым.
[0068] Термин «субъект» относится к любому животному (например, млекопитающему), в том числе, но не ограничиваясь ими, человеку, не относящимся к человеку приматам, собачьим, кошачьим, кроликам, грызунам и т.п., которое представляет собой реципиента лечения или терапии. Как правило, термины «субъект» и «пациент» используются в данном документе взаимозаменяемо в отношении субъекта-человека.
[0069] Термин «фармацевтически приемлемый», используемый в данном документе, относится к веществу, одобренному или подлежащему одобрению регуляторным органом или приведенному в Фармакопеи США, Европейской Фармакопеи или других общепризнанных фармакопеях, для применения у животных, в том числе человека.
[0070] Термины «фармацевтически приемлемый наполнитель, носитель или вспомогательное вещество» или «допустимый фармацевтический носитель», используемые в данном документе, относятся к наполнителю, носителю или вспомогательному веществу, которое вводится субъекту, совместно, по меньшей мере, с одним терапевтическим агентом (например, антителом), и которое не оказывает эффекта на фармакологическую активность терапевтического агента. Как правило, специалисты в данной области техники и FDA США считают, что фармацевтически допустимый наполнитель, носитель или вспомогательное вещество представляют собой неактивный ингредиент любого состава.
[0071] Термин «фармацевтический состав» или «фармацевтическая композиция», используемые в данном документе, относится к препарату, который находится в такой форме, чтобы способствовать тому, чтобы биологическая активность агента (например, антитела) была эффективной. Фармацевтический состав или композиция, как правило, содержит дополнительные компоненты, такие как фармацевтически приемлемый наполнитель, носитель, вспомогательное вещество, буферы и т.д.
[0072] Термин «эффективное количество» или «терапевтически эффективное количество», используемый в данном документе, относится к количеству связывающего белка (например, антитела), которое является достаточным для снижения и/или ослабления тяжести и/или продолжительности заболевания, нарушения или патологического состояния и/или симптома у субъекта. Указанный термин также охватывает количество связывающего белка, необходимого для (i) снижения или ослабления развития или прогрессирования определенного заболевания, нарушения или патологического состояния, (ii) снижения или ослабления повторного развития, развития или начала наступления определенного заболевания, нарушения или патологического состояния и/или (iii) улучшения или усиления профилактического(профилактических) или терапевтического(терапевтических) эффекта(эффектов) другого агента или терапии (например, агента, отличного от связывающих белков, предложенных в данном документе).
[0073] Термин «терапевтический эффект», используемый в данном документе, относится к эффекту и/или способности связывающего белка (например, антитела) снижать и/или ослаблять тяжесть и/или продолжительность заболевания, нарушения или патологического состояния и/или симптома у субъекта. Указанный термин также охватывает способность связывающего белка (i) снижать или ослаблять развитие или прогрессирование определенного заболевания, нарушения или патологического состояния, (ii) снижать или ослаблять повторное развитие, развитие или начало наступления определенного заболевания, нарушения или патологического состояния и/или (iii) улучшать или усиливать профилактический (профилактические) или терапевтический(терапевтические) эффект(эффекты) другого агента или терапии (например, агента, отличного от связывающих белков, предложенных в данном документе).
[0074] Термин «лечить» или «лечение» или «лечебный» или «оказывать лечение» или «ослаблять» или «ослабление» или «ослабляющий» или «вызывать ослабление», используемый в данном документе, относится как к (1) терапевтическим мерам, которые направлены на излечение, замедление, уменьшение симптомов и/или остановку прогрессирования патологического состояния или нарушения, так и к (2) профилактическим или превентивным мерам, которые направлены на предупреждение или замедление развития патологического состояния или нарушения, в отношении которых происходит целенаправленное воздействие. Таким образом, нуждающиеся в лечении включают тех, кто уже имеет нарушение, тех, кто имеет риск наличия/развития нарушения, и тех, у кого нарушение подлежит предупреждению.
[0075] Термин «предупреждать» или «предупреждение» или «предупреждающий», используемый в данном документе, относится к частичному или полному ингибированию развития, повторного развития, начала наступления или распространения заболевания, нарушения или патологического состояния или их симптома у субъекта.
[0076] Термин «профилактический агент», используемый в данном документе, относится к агенту, который частично или полностью ингибирует развитие, повторное развитие, начало наступления или распространение заболевания, нарушения или патологического состояния или их симптома у субъекта.
[0077] В данном документе отсылка на «приблизительно» или «примерно» в связи со значением или параметром включает в себя (и описывает) варианты осуществления, которые направлены на это значение или параметр. К примеру, описание, относящееся к «приблизительно X» включает в себя описание «X».
[0078] Используемая в данном раскрытии и форме изобретения форма единственного числа включает в себя ссылки на форму множественного числа, если в контексте четко не указано иное.
[0079] Следует понимать, что какие бы варианты осуществления ни описывались в данном документе термином «содержащий», также предусмотрены другие аналогичные варианты осуществления, описанные терминами «состоящий из» и/или «состоящий по сути из». Следует также понимать, что какие бы варианты осуществления ни описывались в данном документе фразой «состоящий по сути из», также предусмотрены другие аналогичные варианты осуществления, описанные терминами «состоящий из».
[0080] Термин «и/или», используемый в фразе, такой как «A и/или B» в данном документе, предполагает включать в себя как A, так и B; A или B; A (только); и B (только). Аналогичным образом, термин «и/или», используемый в фразе, такой как «A, B и/или C» предполагает охват каждого из следующих вариантов осуществления: А, В и С; А, В или С; А или С; А или В; В или С; А и С; А и В; В и С; А (только); В (только) и С (только).
II. GCGR-связывающие белки
[0081] Аминокислотные (a.к.) последовательности для GCGR человека (например, № P47871 в UniProtKB), GCGR яванского макака («яванского макака») (например, идент. № XP_005585314.1 в NCBI), GCGR мыши (например, № Q61606 в UniProtKB) и GCGR крысы (например, № P30082 в UniProtKB) известны специалистам в данной области техники и репрезентативные последовательности предложены в данном документе в виде SEQ ID NO:222, SEQ ID NO:227, SEQ ID NO:228 и SEQ ID NO:229 соответственно. Используемая в данном документе отсылка на аминокислотные положения GCGR относится к нумерации аминокислотных последовательностей, включающих в себя сигнальную последовательность.
[0082] В данном раскрытии предложены агенты, которые специфически связывают GCGR. В некоторых вариантах осуществления агенты, которые связывают GCGR, представляют собой белки. Как правило, эти белки обозначаются в данном документе как «GCGR-связывающие белки». В некоторых вариантах осуществления GCGR-связывающий белок специфически связывает фрагмент GCGR. В некоторых вариантах осуществления GCGR-связывающий белок специфически связывает внеклеточный домен GCGR. В некоторых вариантах осуществления GCGR-связывающий белок специфически связывает часть или фрагмент внеклеточного домена GCGR. В некоторых вариантах осуществления GCGR-связывающий белок специфически связывает эпитоп GCGR. В некоторых вариантах осуществления GCGR-связывающий белок специфически связывает GCGR человека. В некоторых вариантах осуществления GCGR-связывающий белок специфически связывает GCGR яванского макака. В некоторых вариантах осуществления GCGR-связывающий белок специфически связывает GCGR человека и GCGR яванского макака. В некоторых вариантах осуществления GCGR-связывающий белок специфически связывает GCGR мыши. Неограничивающие примеры GCGR-связывающих белков могут быть обнаружены в публикациях патентов США №№ 2009/0041784, 2009/0252727, 2012/0128679; 2014/0335091, и международной публикации № WO 2011/030935.
[0083] В некоторых вариантах осуществления GCGR-связывающий белок связывается в пределах аминокислот 26-136 GCGR человека. В некоторых вариантах осуществления GCGR-связывающий белок связывается в пределах аминокислот 28-123 GCGR человека. В некоторых вариантах осуществления GCGR-связывающий белок связывается в пределах аминокислот 80-119 GCGR человека.
[0084] В некоторых вариантах осуществления GCGR-связывающий белок связывается в пределах аминокислот 26-136 SEQ ID NO:222. В некоторых вариантах осуществления GCGR-связывающий белок связывается в пределах аминокислот 28-123 SEQ ID NO:222. В некоторых вариантах осуществления GCGR-связывающий белок связывается в пределах аминокислот 80-119 SEQ ID NO:222. В некоторых вариантах осуществления GCGR-связывающий белок связывается в пределах SEQ ID NO:224. В некоторых вариантах осуществления GCGR-связывающий белок связывается в пределах SEQ ID NO:225. В некоторых вариантах осуществления GCGR-связывающий белок связывается в пределах SEQ ID NO:226.
[0085] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) связывает эпитоп, содержащий, по меньшей мере, одно из L38, L85, R94, и W106 SEQ ID NO:222. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) связывает эпитоп, который не содержит Y84, W106 и/или R111 SEQ ID NO:222.
[0086] В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело. В некоторых вариантах осуществления антитело представляет собой рекомбинантное антитело. В некоторых вариантах осуществления антитело представляет собой моноклональное антитело. В некоторых вариантах осуществления антитело представляет собой химерное антитело. В соответствии с некоторыми вариантами осуществления антитело представляет собой гуманизированное антитело. В соответствии с некоторыми вариантами осуществления антитело представляет собой человеческое антитело. В некоторых вариантах осуществления антитело представляет собой антитело IgA, IgD, IgE, IgG или IgM. В некоторых вариантах осуществления антитело представляет собой антитело IgG1. В некоторых вариантах осуществления антитело представляет собой антитело IgG2. В некоторых вариантах осуществления антитело представляет собой антитело IgG4. В некоторых вариантах осуществления антитело представляет собой фрагмент антитела, содержащий антигенсвязывающий сайт. В некоторых вариантах осуществления антитело представляет собой биспецифическое антитело или мультиспецифическое антитело. В некоторых вариантах осуществления антитело представляет собой моновалентное антитело. В некоторых вариантах осуществления антитело представляет собой моноспецифическое антитело. В некоторых вариантах осуществления антитело представляет собой бивалентное антитело.
[0087] В некоторых вариантах осуществления антитело является выделенным. В некоторых вариантах осуществления антитело является по сути чистым.
[0088] В некоторых вариантах осуществления GCGR-связывающие белки представляют собой поликлональные антитела. Поликлональные антитела могут быть получены с помощью любого известного способа. В некоторых вариантах осуществления поликлональные антитела получают с помощью иммунизации животного (например, кролика, крысы, мыши, козы, осла) антигеном, представляющим интерес (например, очищенным пептидным фрагментом, рекомбинантным белком или слитым белком), путем множественных подкожных или интраперитонеальных инъекций. В некоторых вариантах осуществления антиген конъюгируют с носителем, таким как гемоцианин лимфы улитки (KLH), сывороточный альбумин, бычий тироглобулин или ингибитор трипсина соевых бобов. Антиген (с белковым носителем или без него) разбавляют в стерильном солевом растворе и обычно комбинируют с адъювантом (например, полным или неполным адъювантом Фрейнда) с образованием стабильной эмульсии. После достаточного периода времени поликлональные антитела извлекают из иммунизированного животного, обычно из крови или асцитической жидкости. Поликлональные антитела могут быть очищены из сыворотки крови или асцитической жидкости в соответствии со стандартными способами в данной области техники, но не ограничиваясь ими, аффинной хроматографией, ионообменной хроматографией, гель-электрофорезом и диализом.
[0089] В некоторых вариантах осуществления GCGR-связывающий белок представляет собой моноклональное антитело. В некоторых вариантах осуществления моноклональные антитела получают с помощью способов с использованием гибридомы, известных специалисту в данной области техники. К примеру, с помощью способа на основе гибридомы мышь, крысу, кролика, хомяка или другое подходящее животное-хозяина иммунизируют, как описано выше, чтобы вызвать продуцирование антител. В некоторых вариантах осуществления лимфоциты иммунизируют in vitro. В некоторых вариантах осуществления иммунизирующий антиген представляет собой человеческий белок или его фрагмент. В некоторых вариантах осуществления иммунизирующий антиген представляет собой мышиный белок или его фрагмент.
[0090] После иммунизации лимфоциты выделяют с помощью подходящей клеточной линии миеломы с использованием, к примеру, полиэтиленгликоля. Клетки гибридомы отбирают с помощью специализированных сред, известных в данной области техники, а неслитые лимфоциты и клетки миеломы не выживают процесс отбора. Гибридомы, которые продуцируют моноклональные антитела, направленные специфически против выбранного антигена, могут быть идентифицированы с помощью ряда способов скрининга, в том числе, но не ограничиваясь ими, иммунопреципитации, иммуноблоттинга и анализов связывания in vitro (например, проточной цитометрии, FACS, ИФА, Biacore и радиоиммунологического анализа). Непосредственно после идентификации клеток гибридомы, которые продуцируют антитела необходимой специфичности, аффинности и/или активности, клоны могут быть субклонированы с помощью методик предельного разведения. Гибридомы можно размножать либо в культуре in vitro с помощью стандартных способов, либо in vivo в виде асцитных опухолей у животного. Моноклональные антитела могут быть очищены из культуральной среды или асцитической жидкости в соответствии со стандартными способами в данной области техники, но не ограничиваясь ими, аффинной хроматографией, ионообменной хроматографией, гель-электрофорезом и диализом.
[0091] В некоторых вариантах осуществления моноклональные антитела получают с помощью методик на основе рекомбинантной ДНК, известных специалисту в данной области техники. К пример, полинуклеотиды, кодирующие моноклональное антитело, выделяют из зрелых B-клеток или клеток гибридомы, например, с помощью RT-PCR с использованием олигонуклеотидных праймеров, которые специфически амплифицируют гены, кодирующие тяжелую и легкую цепи антитела, а их последовательность определяют с помощью стандартных методик. Выделенные полинуклеотиды, кодирующие тяжелую и легкую цепи, затем клонируют в подходящие экспрессионные векторы, которые продуцируют моноклональные антитела при трансфекции в такие клетки-хозяева, такие как E. coli, клетки COS обезьяны, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые иным образом не продуцируют иммуноглобулиновые белки.
[0092] В некоторых вариантах осуществления рекомбинантные моноклональные антитела или их фрагменты выделяют из библиотек фагового дисплея, экспрессирующих вариабельные домены или CDR необходимого вида. Скрининг фаговых библиотек можно осуществлять с помощью различных методик, известных в данной области техники.
[0093] В некоторых вариантах осуществления моноклональное антитело модифицируют, к примеру, с помощью технологии рекомбинантной ДНК с получением альтернативных антител. В некоторых вариантах осуществления константные домены легкой цепи и тяжелой цепи мышиного моноклонального антитела замещают на константные области человеческого антитела с получением химерного антитела, или на не относящийся к иммуноглобулину полипептид с получением слитого антитела. В некоторых вариантах осуществления константные области усекают или удаляют с получением необходимого фрагмента антитела моноклонального антитела. Сайт-направленный мутагенез или мутагенез высокой плотности вариабельной (вариабельных) области (областей) может быть использован для оптимизации, к примеру, специфичности и аффинности моноклонального антитела.
[0094] В некоторых вариантах осуществления GCGR-связывающий белок представляет собой гуманизированное антитело. Различные способы получения гуманизированных антител известны в данной области техники. В некоторых вариантах осуществления человеческое антитело содержит один или несколько аминокислотных остатков, которые были введены в него из источника, который не относится к человеку. Эти не относящиеся к человеку аминокислотные остатки часто называется «донорскими» остатками, которые в типичном случае получают из «донорского» вариабельного домена. В некоторых вариантах осуществления гуманизацию осуществляют с помощью замещения одной или нескольких последовательностей не относящихся к человеку CDR на соответствующие последовательности CDR из человеческого антитела. В некоторых вариантах осуществления гуманизированные антитела конструируют с помощью привития CDR, при котором аминокислотные остатки всех шести CDR исходного не относящегося к человеку антитела (например, грызуна) прививают в последовательности вариабельных областей тяжелой и легкой цепей человеческого антитела.
[0095] Решение касательно того, какую вариабельную область тяжелой цепи и/или вариабельную область легкой цепи выбирают для получения гуманизированного антитела, можно принимать на основании множества факторов и множества способов. В некоторых вариантах осуществления используют способ «наилучшего приближения», при котором последовательность вариабельной области не относящегося к человеку (например, грызуна) антитела подвергают скринингу против всей библиотеки известных последовательностей человеческих вариабельных областей. Человеческую последовательность, которая является наиболее похожей на таковую последовательности грызуна, выбирают в качестве последовательности человеческой вариабельной области для гуманизированного антитела. В некоторых вариантах осуществления используют способ, при котором выбирают определенную последовательность вариабельной области, происходящую из всех человеческих антител определенной подгруппы легкой или тяжелой цепей. В некоторых вариантах осуществления последовательность вариабельной области происходит из консенсусных последовательностей наиболее распространенных человеческих подклассов. В некоторых вариантах осуществления гены зародышевой линии человека используют в качестве источника последовательностей вариабельных областей.
[0096] Другие способы иммунизации включают в себя, но не ограничиваясь ими, способ, называемый «супергуманизацией», который описан в качестве прямого переноса CDR в каркасную область зародышевой линии человека, способ, называемый Human String Content (HSC), который основан на измерении «человечности антитела», способы на основе получения больших библиотек гуманизированных вариантов (в том числе библиотек фагового, рибосомного дрожжевого дисплея), а также способы на основе шаффлинга каркасных областей.
[0097] В некоторых вариантах осуществления GCGR-связывающий белок представляет собой человеческое антитело. Человеческие антитела могут быть непосредственно получены с помощью различных методик, известных в данной области техники. В некоторых вариантах осуществления человеческие антитела получают из иммортализированных B-лимфоцитов человека, иммунизированных in vitro. В некоторых вариантах осуществления человеческие антитела получают из лимфоцитов, выделенных из иммунизированного индивида. В любом случае клетки, которые продуцируют антитело, направленное против целевого антигена, могут быть получены и выделены. В некоторых вариантах осуществления человеческое антитело выбирают из фаговой библиотеки, при этом фаговая библиотека экспрессирует человеческие антитела. В альтернативном случае технология фагового дисплея может быть использована для продуцирования человеческих антител и фрагментов антител in vitro, к примеру, из репертуаров генов вариабельных областей иммуноглобулинов от иммунизированных доноров. Методики получения и применения фаговых библиотек антител известны в данной области техники. Непосредственно после того, как антитела идентифицированы, могут быть использованы стратегии созревания аффинности, известные в данной области техники, в том числе, но не ограничиваясь ими, шаффлинг цепей и сайт-направленный мутагенез, с целью получения человеческих антител с более высокой аффинностью. В некоторых вариантах осуществления человеческие антитела получают у трансгенных мышей, которые содержат локусы человеческих иммуноглобулинов. Непосредственно после иммунизации эти мыши способны продуцировать полный репертуар человеческих антител в отсутствие продуцирования эндогенных иммуноголбулинов.
[0098] В некоторых вариантах осуществления GCGR-связывающий белок представляет собой биспецифическое антитело. Биспецифические антитела способны распознавать и связывать, по меньшей мере, два различных антигена или эпитопа. Различные эпитопы могут либо находиться в одной и той же молекуле (например, два эпитопа на GCGR), либо на разных молекулах (например, один эпитоп на GCGR и один эпитоп на другой мишени). В некоторых вариантах осуществления биспецифическое антитело имеет усиленную активность по сравнению с отдельным антителом или с комбинацией из более чем одного антитела. В некоторых вариантах осуществления биспецифическое антитело имеет сниженную токсичность по сравнению с отдельным антителом или с комбинацией из более чем одного антитела. Специалистам в данной области техники известно, что любой терапевтический агент может иметь уникальную фармакокинетику (PK) (например, время полужизни в кровотоке). В некоторых вариантах осуществления биспецифическое антитело имеет способность синхронизировать PK двух активных связывающих агентов, при этом два отдельных связывающих агента имеют различные PK профили. В некоторых вариантах осуществления биспецифическое антитело имеет способность сосредотачивать активности двух агентов в общей области (например, ткани) у субъекта. В некоторых вариантах осуществления биспецифическое антитело имеет способность сосредотачивать активности двух агентов в общей мишени (например, конкретном типе клеток). В некоторых вариантах осуществления биспецифическое антитело имеет способность направлять активности двух агентов на более чем один биологический путь или функцию. В некоторых вариантах осуществления биспецифическое антитело имеет способность целенаправленно воздействовать на две различные клетки и связывать их вместе.
[0099] В некоторых вариантах осуществления биспецифическое антитело имеет сниженную токсичность и/или побочные эффекты. В некоторых вариантах осуществления биспецифическое антитело имеет сниженную токсичность и/или побочные эффекты по сравнению со смесью из двух антител или антителами в качестве отдельно взятых агентов. В некоторых вариантах осуществления биспецифическое антитело имеет повышенный терапевтический индекс. В некоторых вариантах осуществления биспецифическое антитело имеет повышенный терапевтический индекс по сравнению со смесью из двух антител или антителами в качестве отдельно взятых агентов.
[00100] Несколько методик получения биспецифических антител известны специалистам в данной области техники. В некоторых вариантах осуществления биспецифические антитела содержат константные области тяжелых цепей с модификациями в аминокислотах, которые представляют собой часть поверхности контакта между двух тяжелыми цепями. В некоторых вариантах осуществления биспецифические антитела получают с помощью стратегии выступы-во-впадины (KIH). В некоторых вариантах осуществления биспецифические антитела содержат вариантные шарнирные области, способные образовывать дисульфидные связи между тяжелыми цепями. В некоторых вариантах осуществления биспецифические антитела содержат тяжелые цепи с изменениями аминокислот, которые приводят к измененным электростатическим взаимодействиям. В некоторых вариантах осуществления биспецифические антитела содержат тяжелые цепи с изменениями аминокислот, которые приводят к измененным гидрофобным/гидрофильным взаимодействиям. Биспецифические антитела могут представлять собой интактные антитела или фрагменты антитела, содержащих антигенсвязывающие сайты.
[00101] Также предусмотрены антитела с более чем двумя валентностями. К примеру, могут быть получены триспецифические или тетраспецифические антитела. Таким образом, в некоторых вариантах осуществления антитела к GCGR являются мультиспецифическими.
[00102] В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело, которое связывает GCGR. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело, которое связывает GCGR человека. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело, которое связывает GCGR яванского макака. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело, которое связывает GCGR человека и GCGR яванского макака. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело, которое связывает GCGR мыши. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело, которое связывает участок или фрагмент GCGR. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело, которое связывает внеклеточный домен GCGR. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело, которое связывает фрагмент или часть внеклеточного домена GCGR. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело, которое связывает эпитоп GCGR. В некоторых вариантах осуществления эпитоп GCGR представляет собой линейный эпитоп. В некоторых вариантах осуществления эпитоп GCGR представляет собой конформационный эпитоп.
[00103] В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело, которое содержит одно, два, три, четыре, пять и/или шесть CDR из любого из антител, описанных в данном документе. В некоторых вариантах осуществления анти-GCGR антитело содержит (i) одну, две и/или CDR тяжелой цепи из Табл. 1-10, и/или (ii) одну, две и/или три CDR легкой цепи из Табл. 1-10. CDR определяют с помощью множества способов/систем, известных специалистам в данной области. Эти системы и/или определения были разработаны и усовершенствованы в течение нескольких лет и включают в себя Кабат, Чотиа, IMGT, AbM и «Контакт». Определение в соответствии с Кабат основано на вариабельности последовательностей и, как правило, является наиболее широко используемым. Определение в соответствии с Чотиа основано на положении областей структурных петель. Система IMGT основана на вариабельности последовательностей и положении в структуре вариабельного домена. Определение в соответствии с AbM представляет собой компромиссное решение между определением в соответствии с Кабат и определением в соответствии с Чотиа. Определение «Контакт» основано на анализе доступных кристаллических структур антитела. Система в соответствии с Примерами, включенными в Табл. 1-10, представляет собой комбинацию системы в соответствии с Кабат и системы в соответствии с Чотиа.
[00104] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит представленные в Примерах CDR1, CDR2 и CDR3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 1. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 1. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 1. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией IMGT и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией IMGT из Табл. 1. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Контакт и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Контакт из Табл. 1. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией AbM и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией AbM из Табл. 1.
[00105] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит представленные в Примерах CDR1, CDR2 и CDR3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 2. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 2. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 2. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией IMGT и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией IMGT из Табл. 2. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Контакт и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Контакт из Табл. 2. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией AbM и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией AbM из Табл. 2.
[00106] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит представленные в Примерах CDR1, CDR2 и CDR3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 3. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 3. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 3. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией IMGT и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией IMGT из Табл. 3. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией IMGT и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией IMGT из Табл. 3. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Контакт и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Контакт из Табл. 3. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией AbM и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией AbM из Табл. 3.
[00107] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит представленные в Примерах CDR1, CDR2 и CDR3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 4. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 4. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 4. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией IMGT и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией IMGT из Табл. 4. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Контакт и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Контакт из Табл. 4. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией AbM и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией AbM из Табл. 4.
[00108] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит представленные в Примерах CDR1, CDR2 и CDR3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 5. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 5. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 5. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией IMGT и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией IMGT из Табл. 5. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Контакт и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Контакт из Табл. 5. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией AbM и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией AbM из Табл. 5.
[00109] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит представленные в Примерах CDR1, CDR2 и CDR3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 6. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 6. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 6. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией IMGT и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией IMGT из Табл. 6. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Контакт и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Контакт из Табл. 6. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией AbM и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией AbM из Табл. 6.
[00110] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит представленные в Примерах CDR1, CDR2 и CDR3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 7. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 7. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 7. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией IMGT и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией IMGT из Табл. 7. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Контакт и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Контакт из Табл. 7. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией AbM и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией AbM из Табл. 7.
[00111] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит представленные в Примерах CDR1, CDR2 и CDR3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 8. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 8. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 8. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией IMGT и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией IMGT из Табл. 8. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Контакт и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Контакт из Табл. 8. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией AbM и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией AbM из Табл. 8.
[00112] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит представленные в Примерах CDR1, CDR2 и CDR3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 9. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 9. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 9. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией IMGT и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией IMGT из Табл. 9. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Контакт и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Контакт из Табл. 9. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией AbM и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией AbM из Табл. 9.
[00113] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит представленные в Примерах CDR1, CDR2 и CDR3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 10. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 10. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 10. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией IMGT и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией IMGT из Табл. 10. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией Контакт и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Контакт из Табл. 10. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи с соответствии с нумерацией AbM и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией AbM из Табл. 10.
[00114] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи из антитела, обозначенного 6B5. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи из антитела, обозначенного 3H5. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи из антитела, обозначенного 5B11. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи из антитела, обозначенного 1C1. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи из антитела, обозначенного 1C3. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи из антитела, обозначенного 1H2. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи из антитела, обозначенного 4F8. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи из антитела, обозначенного 13G9. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи из антитела, обозначенного 14F4. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи из антитела, обозначенного 14E9.
Таблица 1: Последовательности антитела 6B5
(SEQ ID NO:1)
(SEQ ID NO:7)
(SEQ ID NO:12)
(SEQ ID NO:13)
(SEQ ID NO:18)
(SEQ ID NO:1)
KFKG
(SEQ ID NO:2)
(SEQ ID NO:8)
KFKG
(SEQ ID NO:2)
(SEQ ID NO:14)
(SEQ ID NO:19)
(SEQ ID NO:24)
(SEQ ID NO:3)
(SEQ ID NO:9)
(SEQ ID NO:3)
(SEQ ID NO:15)
(SEQ ID NO:20)
(SEQ ID NO:3)
FLE
(SEQ ID NO:4)
(SEQ ID NO:10)
FLE
(SEQ ID NO:4)
(SEQ ID NO:16)
EWY
(SEQ ID NO:21)
FLE
(SEQ ID NO:4)
(SEQ ID NO:5)
(SEQ ID NO:11)
(SEQ ID NO:5)
(SEQ ID NO:11)
(SEQ ID NO:22)
(SEQ ID NO:5)
(SEQ ID NO:6)
(SEQ ID NO:6)
(SEQ ID NO:6)
(SEQ ID NO:17)
(SEQ ID NO:23)
(SEQ ID NO:6)
QVQLQQSGTELVRPGTSVKISCKASGFTFTNHWLGWVKQRPGHGLEWIGDIYPGGYYINYNEKFKG
KATLTADTSSSTAYMQLSSLTSEDSAVYFCARHTNYGSDYWGQGTTLTVSS
DVLMTQIPLSLPVSLGDQASISCRSSQSIVDSYGNTFLEWYLQKPGQSPKLLIYKVSNRLSGVPDRFSG
TGAGTDFTLKISRVEAEDLGIYYCFQGSHVPWTFGGGTKLEIK
Таблица 2: Последовательности антитела 3H5
(SEQ ID NO:27)
(SEQ ID NO:33)
(SEQ ID NO:38)
(SEQ ID NO:39)
(SEQ ID NO:44)
(SEQ ID NO:27)
KFKN
(SEQ ID NO:28)
(SEQ ID NO:34)
KFKN
(SEQ ID NO:28)
(SEQ ID NO:40)
STH
(SEQ ID NO:45)
(SEQ ID NO:50)
(SEQ ID NO:29)
(SEQ ID NO:35)
(SEQ ID NO:29)
(SEQ ID NO:41)
(SEQ ID NO:46)
(SEQ ID NO:29)
TYLD
(SEQ ID NO:30)
(SEQ ID NO:36)
TYLD
(SEQ ID NO:30)
(SEQ ID NO:42)
DWY
(SEQ ID NO:47)
TYLD
(SEQ ID NO:30)
(SEQ ID NO:31)
(SEQ ID NO:37)
(SEQ ID NO:31)
(SEQ ID NO:37)
(SEQ ID NO:48)
(SEQ ID NO:31)
(SEQ ID NO:32)
(SEQ ID NO:32)
(SEQ ID NO:32)
(SEQ ID NO:43)
(SEQ ID NO:49)
(SEQ ID NO:32)
QVQLQQSGAELVKPGASVRLSCKASGNTFTNYWMHWVKQRPGQGLEWIGMIHPNSGSTHY
NEKFKNKATLTVDKSSNTAYMQLSGLTSEDSAVYYCGATADYVMDYWGQGTSVTVSS
DIVLTQTPLSLPVNIGDQASISCKSTKSLLNSDGFTYLDWYLQKPGQSPQLLINLVSNRFSGVP
DRFSGSGSGTEFILKISRVEAEDLGVYYCFQSNFLPLTFGAGTKLELK
Таблица 3: Последовательности антитела 5B11
(SEQ ID NO:53)
(SEQ ID NO:57)
(SEQ ID NO:61)
(SEQ ID NO:62)
(SEQ ID NO:65)
(SEQ ID NO:53)
(SEQ ID NO:54)
(SEQ ID NO:58)
(SEQ ID NO:54)
(SEQ ID NO:40)
(SEQ ID NO:66)
(SEQ ID NO:70)
(SEQ ID NO:55)
(SEQ ID NO:59)
(SEQ ID NO:55)
(SEQ ID NO:63)
(SEQ ID NO:67)
(SEQ ID NO:55)
TYLD
(SEQ ID NO:56)
(SEQ ID NO:60)
TYLD
(SEQ ID NO:56)
(SEQ ID NO:64)
(SEQ ID NO:68)
TYLD
(SEQ ID NO:56)
(SEQ ID NO:31)
(SEQ ID NO:37)
(SEQ ID NO:31)
(SEQ ID NO:37)
(SEQ ID NO:69)
(SEQ ID NO:31)
(SEQ ID NO:32)
(SEQ ID NO:32)
(SEQ ID NO:32)
(SEQ ID NO:43)
(SEQ ID NO:49)
(SEQ ID NO:32)
QVQLQQSGAELVKPGASVKLSCKASGNTFTSHWMHWVKQRPGQGLEWIGMSHPNSGSSNYSG
KFKSKATLTVDRSSSTAYMQLNSLTSEDSAVYYCARTDYDYDGDYWGQGTTLTVSS
DVVLTQTPLSLPVNIGDQASISCKSSKSLLNSDGLTYLDWYLQKPGQSPQLLIYLVSNRFSGVPDR
FSGSGSGTDFTLKISRVEADDLGVYYCFQSNFLPLTFGAGTKLELK
Таблица 4: Последовательности антитела 1C1
(SEQ ID NO:73)
(SEQ ID NO:79)
(SEQ ID NO:84)
(SEQ ID NO:85)
(SEQ ID NO:90)
(SEQ ID NO:73)
(SEQ ID NO:74)
(SEQ ID NO:80)
(SEQ ID NO:74)
(SEQ ID NO:86)
(SEQ ID NO:91)
(SEQ ID NO:96)
(SEQ ID NO:75)
(SEQ ID NO:81)
(SEQ ID NO:75)
(SEQ ID NO:87)
(SEQ ID NO:92)
(SEQ ID NO:75)
YMH
(SEQ ID NO:76)
(SEQ ID NO:82)
YMH
(SEQ ID NO:76)
(SEQ ID NO:88)
(SEQ ID NO:93)
YMH
(SEQ ID NO:76)
(SEQ ID NO:77)
(SEQ ID NO:83)
(SEQ ID NO:77)
(SEQ ID NO:83)
(SEQ ID NO:94)
(SEQ ID NO:77)
(SEQ ID NO:78)
(SEQ ID NO:78)
(SEQ ID NO:78)
(SEQ ID NO:89)
(SEQ ID NO:95)
(SEQ ID NO:78)
EVQLQQSGPELVKPGATVKMSCKASGYTFTRNVIHWVKQKPGQGLEWIGYINPYNDGAKYNA
KFKGKATVTSDKSSSTAYMELSSLTSEDSAVYYCARWGNYEDFAMDYWGQGTSVTVSS
NIVLTQSPPSLAVSLGQRATISCRASESVDIYGNSYMHWYQQKPGQPPKLLIYLASNLESGVPAR
FSGSGSRTEFSLTIDPVEAGDAATYYCQQNNEDPFTFGGGTKLEIK
Таблица 5: Последовательности антитела 1C3
(SEQ ID NO:99)
(SEQ ID NO:105)
(SEQ ID NO:110)
(SEQ ID NO:111)
(SEQ ID NO:115)
(SEQ ID NO:99)
YNENFKG
(SEQ ID NO:100)
(SEQ ID NO:106)
YNENFKG
(SEQ ID NO:100)
(SEQ ID NO:86)
(SEQ ID NO:116)
(SEQ ID NO:121)
MDY
(SEQ ID NO:101)
MAMDY
(SEQ ID NO:107)
MDY
(SEQ ID NO:101)
(SEQ ID NO:112)
MAMD
(SEQ ID NO:117)
MDY
(SEQ ID NO:101)
DSFVH
(SEQ ID NO:102)
(SEQ ID NO:108)
DSFVH
(SEQ ID NO:102)
(SEQ ID NO:113)
(SEQ ID NO:118)
DSFVH
(SEQ ID NO:102)
(SEQ ID NO:103)
(SEQ ID NO:109)
(SEQ ID NO:103)
(SEQ ID NO:109)
(SEQ ID NO:119)
(SEQ ID NO:103)
(SEQ ID NO:104)
(SEQ ID NO:104)
(SEQ ID NO:104)
(SEQ ID NO:114)
(SEQ ID NO:120)
(SEQ ID NO:104)
EVQLQQSGPELVKPGASVKMSCKASGYTFTSSVMHWVKQKPGQALEWIGYINPYNDGTKYN
ENFKGKATLTSDRSSTTAYMELSSLTSEDSAVYYCVTGAGYDRGPMAMDYWGQGTSVTVSS
NIVLTQSPASLAVSLGQRATISCRASESVDSYGDSFVHWYQQKPGQPPKLLIYFASNLESGVPA
RFSGSGSRTDFTLTIDPVEADDTATYYCQQNNEVPFTFGSGTKLELK
Таблица 6: Последовательности антитела 1H2
(SEQ ID NO:124)
(SEQ ID NO:129)
(SEQ ID NO:133)
(SEQ ID NO:134)
(SEQ ID NO:138)
(SEQ ID NO:124)
(SEQ ID NO:125)
(SEQ ID NO:130)
(SEQ ID NO:125)
(SEQ ID NO:135)
(SEQ ID NO:139)
(SEQ ID NO:143)
(SEQ ID NO:126)
(SEQ ID NO:131)
(SEQ ID NO:126)
(SEQ ID NO:136)
(SEQ ID NO:140)
(SEQ ID NO:126)
YLE
(SEQ ID NO:127)
(SEQ ID NO:132)
YLE
(SEQ ID NO:127)
(SEQ ID NO:137)
(SEQ ID NO:141)
YLE
(SEQ ID NO:127)
(SEQ ID NO:128)
(SEQ ID NO:11)
(SEQ ID NO:128)
(SEQ ID NO:11)
(SEQ ID NO:142)
(SEQ ID NO:128)
(SEQ ID NO:6)
(SEQ ID NO:6)
(SEQ ID NO:6)
(SEQ ID NO:17)
(SEQ ID NO:23)
(SEQ ID NO:6)
QVQLQQPGAELVKPGASVKMSCKVSGYTFTSYWITWVKQRPGQGLEWIGDIHPGGGDTNYNK
KFKSKATLTVDTSSSTAYMQLSSLTSEDSAVYHCTSDDNYVGFTYWGQGTLVTVSA
DVLMTQTPLSLPVSLGDQASISCRSSQTIIHSDGNTYLEWYLQKPGQSPILLIYKVSNRFSGVPDR
FSGSGSGTDFTLKISRVEAEDLGVYYCFQGSHVPWTFGGGTKLEIK
Таблица 7: Последовательности антитела 4F8
(SEQ ID NO:146)
(SEQ ID NO:150)
(SEQ ID NO:154)
(SEQ ID NO:155)
(SEQ ID NO:159)
(SEQ ID NO:146)
YNDKFKG
(SEQ ID NO:147)
(SEQ ID NO:151)
YNDKFKG
(SEQ ID NO:147)
(SEQ ID NO:156)
YDN
(SEQ ID NO:160)
(SEQ ID NO:163)
(SEQ ID NO:148)
FTY
(SEQ ID NO:152)
(SEQ ID NO:148)
(SEQ ID NO:157)
FT
(SEQ ID NO:161)
(SEQ ID NO:148)
GNTYLE
(SEQ ID NO:149)
(SEQ ID NO:153)
GNTYLE
(SEQ ID NO:149)
(SEQ ID NO:158)
WY
(SEQ ID NO:162)
GNTYLE
(SEQ ID NO:149)
(SEQ ID NO:128)
(SEQ ID NO:11)
(SEQ ID NO:128)
(SEQ ID NO:11)
(SEQ ID NO:142)
(SEQ ID NO:128)
(SEQ ID NO:6)
(SEQ ID NO:6)
(SEQ ID NO:6)
(SEQ ID NO:17)
(SEQ ID NO:23)
(SEQ ID NO:6)
QVQLQQSGAELVRPGTSVTMSCKAAGYTFSNYWIGWVKQRPGHGLEWIGDIYPGGFYDNYND
KFKGKATLTTDTSSSTAYMQLSSLTSEDSAIYYCTRSGGLPGAGFTYWGQGTLVTVSA
DVLMTQTPLSLPVSLGDQASISCRSSQHIVYSDGNTYLEWYLQKPGQSPKLLIYKVSNRFSGVPD
RFSGSGSGTDFTLEISRVEAEDLGVYYCFQGSHVPWTFGGGTKLEIK
Таблица 8: Последовательности антитела 13G9
(SEQ ID NO:166)
(SEQ ID NO:172)
(SEQ ID NO:176)
(SEQ ID NO:177)
(SEQ ID NO:182)
(SEQ ID NO:166)
YNGKFKG
(SEQ ID NO:167)
(SEQ ID NO:173)
YNGKFKG
(SEQ ID NO:167)
(SEQ ID NO:178)
(SEQ ID NO:183)
(SEQ ID NO:187)
(SEQ ID NO:168)
(SEQ ID NO:174)
(SEQ ID NO:168)
(SEQ ID NO:179)
(SEQ ID NO:184)
(SEQ ID NO:168)
GNTYLE
(SEQ ID NO:169)
(SEQ ID NO:175)
GNTYLE
(SEQ ID NO:169)
TY
(SEQ ID NO:180)
WY
(SEQ ID NO:185)
GNTYLE
(SEQ ID NO:169)
(SEQ ID NO:170)
(SEQ ID NO:11)
(SEQ ID NO:170)
(SEQ ID NO:11)
(SEQ ID NO:142)
(SEQ ID NO:170)
(SEQ ID NO:171)
(SEQ ID NO:171)
(SEQ ID NO:171)
(SEQ ID NO:181)
(SEQ ID NO:186)
(SEQ ID NO:171)
QVQLQQSGAELVRPGTSVKISCKASGYTFTNYWLGWVKQRPGHGLEWIGDIYPGGDYNNYNG
KFKGKATLTADTSSSTAYIQLSSLTSEDSAVYFCVRSDDGYSWGQGTTLTVSS
DVLMTQTPLSLPVSLGDQASISCRSSQSIVDSYGNTYLEWYQQKPGQSPTLLIYKVSNRFAGVPD
RFSGSGSGTDFTLKISRVEAEDLGVYYCFQGSHIPWTFGGGTKVEIK
Таблица 9: Последовательности антитела 14F4
(SEQ ID NO:190)
(SEQ ID NO:172)
(SEQ ID NO:154)
(SEQ ID NO:177)
(SEQ ID NO:198)
(SEQ ID NO:190)
YNEKFKG
(SEQ ID NO:191)
(SEQ ID NO:194)
YNEKFKG
(SEQ ID NO:191)
(SEQ ID NO:156)
YSN
(SEQ ID NO:199)
(SEQ ID NO:202)
(SEQ ID NO:192)
(SEQ ID NO:195)
(SEQ ID NO:192)
(SEQ ID NO:196)
(SEQ ID NO:200)
(SEQ ID NO:192)
GNTYLE
(SEQ ID NO:169)
(SEQ ID NO:175)
GNTYLE
(SEQ ID NO:169)
TY
(SEQ ID NO:180)
WY
(SEQ ID NO:185)
GNTYLE
(SEQ ID NO:169)
(SEQ ID NO:128)
(SEQ ID NO:11)
(SEQ ID NO:128)
(SEQ ID NO:11)
(SEQ ID NO:142)
(SEQ ID NO:128)
(SEQ ID NO:193)
(SEQ ID NO:193)
(SEQ ID NO:193)
(SEQ ID NO:197)
(SEQ ID NO:201)
(SEQ ID NO:193)
QVQLQQSGAELVRPGTSVNMSCKATGYTFTNYWIGWVKQRPGHGLEWIGDIFPGGFYSNYNE
KFKGKATLTTDTSSSTGYMQLSSLTSEDSAIYYCARIWDRGFDYWGQGTTLTVSS
DVLMTQSPLSLPVSLGDQASISCRSSQSIVDSYGNTYLEWYLQKPGQSPKLLIYKVSNRFSGVPD
RFSGSGSGTDFTLKISRVEAEDRGLYYCFQGSHVPYTFGGGTKLEIK
Таблица 10: Последовательности антитела 14E9
(SEQ ID NO:190)
(SEQ ID NO:172)
(SEQ ID NO:154)
(SEQ ID NO:177)
(SEQ ID NO:198)
(SEQ ID NO:190)
YNAKFKD
(SEQ ID NO:205)
(SEQ ID NO:208)
YNAKFKD
(SEQ ID NO:205)
(SEQ ID NO:211)
YTN
(SEQ ID NO:214)
(SEQ ID NO:217)
(SEQ ID NO:206)
(SEQ ID NO:209)
(SEQ ID NO:206)
(SEQ ID NO:212)
(SEQ ID NO:215)
(SEQ ID NO:206)
DGNTYLE
(SEQ ID NO:207)
(SEQ ID NO:210)
GNTYLE
(SEQ ID NO:207)
(SEQ ID NO:213)
WY
(SEQ ID NO:216)
NTYLE
(SEQ ID NO:207)
(SEQ ID NO:128)
(SEQ ID NO:11)
(SEQ ID NO:128)
(SEQ ID NO:11)
(SEQ ID NO:142)
(SEQ ID NO:128)
(SEQ ID NO:6)
(SEQ ID NO:6)
(SEQ ID NO:6)
(SEQ ID NO:17)
(SEQ ID NO:23)
(SEQ ID NO:6)
QVQLQQSGAELVRPGTSVKMSCKAAGYTFTNYWIGWVKQRPGHGLEWIGDISPGNYYTNYNA
KFKDKVSLTADTSSSTAYMQLSSLTSEDSAIYYCARYDEFAYWGQGTLVTVSA
DVLMTQTPLSLSVSLGDQASISCRSSQSIVHSDGNTYLEWYLQKPGQSPKLLIYKVSNRFSGVPD
RFSGSGSGTDFTLKISRVEAEDLGVYYCFQGSHVPWTFGGGTKLEIK
[00115] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит (a) CDR1 тяжелой цепи, содержащую SEQ ID NO:1, 7, 12, 13 или 18; CDR2 тяжелой цепи, содержащую SEQ ID NO:2, 8, 14, 19 или 24; и CDR3 тяжелой цепи, содержащую SEQ ID NO:3, 9, 15 или 20; и/или (b) CDR1 легкой цепи, содержащую SEQ ID NO:4, 10, 16 или 21; CDR2 легкой цепи, содержащую SEQ ID NO:5, 11 или 22; и CDR3 легкой цепи, содержащую SEQ ID NO:6, 17 или 23. В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит CDR1 тяжелой цепи, содержащую GFTFTNHWLG (SEQ ID NO:1); CDR2 тяжелой цепи, содержащую DIYPGGYYINYNEKFKG (SEQ ID NO:2); и CDR3 тяжелой цепи, содержащую HTNYGSDY (SEQ ID NO:3). В некоторых вариантах осуществления a GCGR-связывающий белок дополнительно содержит CDR1 легкой цепи, содержащую RSSQSIVDSYGNTFLE (SEQ ID NO:4); CDR2 легкой цепи, содержащую KVSNRLS (SEQ ID NO:5); и CDR3 легкой цепи, содержащую FQGSHVPWT (SEQ ID NO:6). В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит CDR1 легкой цепи, содержащую RSSQSIVDSYGNTFLE (SEQ ID NO:4); CDR2 легкой цепи, содержащую KVSNRLS (SEQ ID NO:5); и CDR3 легкой цепи, содержащую FQGSHVPWT (SEQ ID NO:6). В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит CDR1 тяжелой цепи, содержащую GFTFTNHWLG (SEQ ID NO:1), CDR2 тяжелой цепи, содержащую DIYPGGYYINYNEKFKG (SEQ ID NO:2), CDR3 тяжелой цепи, содержащую HTNYGSDY (SEQ ID NO:3), CDR1 легкой цепи, содержащую RSSQSIVDSYGNTFLE (SEQ ID NO:4), CDR2 легкой цепи, содержащую KVSNRLS (SEQ ID NO:5), и CDR3 легкой цепи, содержащую FQGSHVPWT (SEQ ID NO:6).
[00116] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит: (a) CDR1 тяжелой цепи, содержащую GFTFTNHWLG (SEQ ID NO:1) или ее вариант, содержащий 1, 2, 3 или 4 аминокислотные замены; CDR2 тяжелой цепи, содержащую DIYPGGYYINYNEKFKG (SEQ ID NO:2), или ее вариант, содержащий 1, 2, 3 или 4 аминокислотные замены; CDR3 тяжелой цепи, содержащую HTNYGSDY (SEQ ID NO:3), или ее вариант, содержащий 1, 2, 3 или 4 аминокислотных замен; CDR1 легкой цепи, содержащую RSSQSIVDSYGNTFLE (SEQ ID NO:4), или ее вариант, содержащий 1, 2, 3 или 4 аминокислотных замен; CDR2 легкой цепи, содержащую KVSNRLS (SEQ ID NO:5), или ее вариант, содержащий 1, 2, 3 или 4 аминокислотных замен; и CDR3 легкой цепи, содержащую FQGSHVPWT (SEQ ID NO:6), или ее вариант, содержащий 1, 2, 3 или 4 аминокислотных замен. В некоторых вариантах осуществления аминокислотные замены представляют собой консервативные замены. В некоторых вариантах осуществления замены выполняют в виде части процесса гуманизации. В некоторых вариантах осуществления замены выполняют в виде части процесса гуманизации зародышевой линии. В некоторых вариантах осуществления замены выполняют в виде части процесса созревания аффинности. В некоторых вариантах осуществления замены выполняют в виде части процесса оптимизации.
[00117] В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:7, CDR2 тяжелой цепи, содержащую SEQ ID NO:8, CDR3 тяжелой цепи, содержащую SEQ ID NO:9, и/или CDR1 легкой цепи, содержащую SEQ ID NO:10, CDR2 легкой цепи, содержащую SEQ ID NO:11, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:12, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, и/или CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:13, CDR2 тяжелой цепи, содержащую SEQ ID NO:14, CDR3 тяжелой цепи, содержащую SEQ ID NO:15, и/или CDR1 легкой цепи, содержащую SEQ ID NO:16, CDR2 легкой цепи, содержащую SEQ ID NO:11, и CDR3 легкой цепи, содержащую SEQ ID NO:17. В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:18, CDR2 тяжелой цепи, содержащую SEQ ID NO:19, CDR3 тяжелой цепи, содержащую SEQ ID NO:20, и/или CDR1 легкой цепи, содержащую SEQ ID NO:21, CDR2 легкой цепи, содержащую SEQ ID NO:22, и CDR3 легкой цепи, содержащую SEQ ID NO:23. В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:24, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, и/или CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6.
[00118] В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1; CDR2 тяжелой цепи, содержащую SEQ ID NO:2; и CDR3 тяжелой цепи, содержащую SEQ ID NO:3. В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:7; CDR2 тяжелой цепи, содержащую SEQ ID NO:8; и CDR3 тяжелой цепи, содержащую SEQ ID NO:9. В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:12; CDR2 тяжелой цепи, содержащую SEQ ID NO:2; и CDR3 тяжелой цепи, содержащую SEQ ID NO:3. В другом варианте осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:13; CDR2 тяжелой цепи, содержащую SEQ ID NO:14; и CDR3 тяжелой цепи, содержащую SEQ ID NO:15. В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:18; CDR2 тяжелой цепи, содержащую SEQ ID NO:19; и CDR3 тяжелой цепи, содержащую SEQ ID NO:20. В другом варианте осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1; CDR2 тяжелой цепи, содержащую SEQ ID NO:24; и CDR3 тяжелой цепи, содержащую SEQ ID NO:3. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело. В соответствии с некоторыми вариантами осуществления антитело представляет собой гуманизированное антитело. В другом варианте осуществления GCGR-связывающий белок представляет собой антигенсвязывающий фрагмент антитела.
[00119] В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 легкой цепи, содержащую SEQ ID NO:4; CDR2 легкой цепи, содержащую SEQ ID NO:5; и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления a GCGR-связывающий белок содержит CDR1 легкой цепи, содержащую SEQ ID NO:10; CDR2 легкой цепи, содержащую SEQ ID NO:11; и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 легкой цепи, содержащую SEQ ID NO:4; CDR2 легкой цепи, содержащую SEQ ID NO:5; и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления a GCGR-связывающий белок содержит CDR1 легкой цепи, содержащую SEQ ID NO:16; CDR2 легкой цепи, содержащую SEQ ID NO:11; и CDR3 легкой цепи, содержащую SEQ ID NO:17. В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 легкой цепи, содержащую SEQ ID NO:21; CDR2 легкой цепи, содержащую SEQ ID NO:22; и CDR3 легкой цепи, содержащую SEQ ID NO:23. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело. В соответствии с некоторыми вариантами осуществления антитело представляет собой гуманизированное антитело. В другом варианте осуществления GCGR-связывающий белок представляет собой антигенсвязывающий фрагмент антитела.
[00120] В некоторых вариантах осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:7, CDR2 тяжелой цепи, содержащую SEQ ID NO:8, CDR3 тяжелой цепи, содержащую SEQ ID NO:9, CDR1 легкой цепи, содержащую SEQ ID NO:10, CDR2 легкой цепи, содержащую SEQ ID NO:11, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:12, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:13, CDR2 тяжелой цепи, содержащую SEQ ID NO:14, CDR3 тяжелой цепи, содержащую SEQ ID NO:15, CDR1 легкой цепи, содержащую SEQ ID NO:16, CDR2 легкой цепи, содержащую SEQ ID NO:11, и CDR3 легкой цепи, содержащую SEQ ID NO:17. В некоторых вариантах осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:18, CDR2 тяжелой цепи, содержащую SEQ ID NO:19, CDR3 тяжелой цепи, содержащую SEQ ID NO:20, CDR1 легкой цепи, содержащую SEQ ID NO:21, CDR2 легкой цепи, содержащую SEQ ID NO:22, и CDR3 легкой цепи, содержащую SEQ ID NO:23. В другом варианте осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:24, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело. В соответствии с некоторыми вариантами осуществления антитело представляет собой гуманизированное антитело. В другом варианте осуществления GCGR-связывающий белок представляет собой антигенсвязывающий фрагмент антитела.
[00121] В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1; CDR2 тяжелой цепи, содержащую SEQ ID NO:2; CDR3 тяжелой цепи, содержащую SEQ ID NO:3, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В другом варианте осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:7; CDR2 тяжелой цепи, содержащую SEQ ID NO:8; CDR3 тяжелой цепи, содержащую SEQ ID NO:9, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:12; CDR2 тяжелой цепи, содержащую SEQ ID NO:2; CDR3 тяжелой цепи, содержащую SEQ ID NO:3, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В другом варианте осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:13; CDR2 тяжелой цепи, содержащую SEQ ID NO:14; CDR3 тяжелой цепи, содержащую SEQ ID NO:15, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:18; CDR2 тяжелой цепи, содержащую SEQ ID NO:19; CDR3 тяжелой цепи, содержащую SEQ ID NO:20, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В другом варианте осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1; CDR2 тяжелой цепи, содержащую SEQ ID NO:24; CDR3 тяжелой цепи, содержащую SEQ ID NO:3, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело. В соответствии с некоторыми вариантами осуществления антитело представляет собой гуманизированное антитело. В другом варианте осуществления GCGR-связывающий белок представляет собой антигенсвязывающий фрагмент антитела.
[00122] В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1; CDR2 тяжелой цепи, содержащую SEQ ID NO:2; CDR3 тяжелой цепи, содержащую SEQ ID NO:3, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В другом варианте осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:7; CDR2 тяжелой цепи, содержащую SEQ ID NO:8; CDR3 тяжелой цепи, содержащую SEQ ID NO:9, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:12; CDR2 тяжелой цепи, содержащую SEQ ID NO:2; CDR3 тяжелой цепи, содержащую SEQ ID NO:3, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В другом варианте осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:13; CDR2 тяжелой цепи, содержащую SEQ ID NO:14; CDR3 тяжелой цепи, содержащую SEQ ID NO:15, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:18; CDR2 тяжелой цепи, содержащую SEQ ID NO:19; CDR3 тяжелой цепи, содержащую SEQ ID NO:20, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В другом варианте осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1; CDR2 тяжелой цепи, содержащую SEQ ID NO:24; CDR3 тяжелой цепи, содержащую SEQ ID NO:3, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело. В соответствии с некоторыми вариантами осуществления антитело представляет собой гуманизированное антитело. В другом варианте осуществления GCGR-связывающий белок представляет собой антигенсвязывающий фрагмент антитела.
[00123] В некоторых вариантах осуществления a GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25; CDR1 легкой цепи, содержащую SEQ ID NO:4; CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления a GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25; CDR1 легкой цепи, содержащую SEQ ID NO:10; CDR2 легкой цепи, содержащую SEQ ID NO:11, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления a GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25; CDR1 легкой цепи, содержащую SEQ ID NO:16; CDR2 легкой цепи, содержащую SEQ ID NO:11, и CDR3 легкой цепи, содержащую SEQ ID NO:17. В некоторых вариантах осуществления a GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25; CDR1 легкой цепи, содержащую SEQ ID NO:21; CDR2 легкой цепи, содержащую SEQ ID NO:22, и CDR3 легкой цепи, содержащую SEQ ID NO:23. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело. В соответствии с некоторыми вариантами осуществления антитело представляет собой гуманизированное антитело. В другом варианте осуществления GCGR-связывающий белок представляет собой антигенсвязывающий фрагмент антитела.
[00124] В некоторых вариантах осуществления a GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220; CDR1 легкой цепи, содержащую SEQ ID NO:4; CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления a GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220; CDR1 легкой цепи, содержащую SEQ ID NO:10; CDR2 легкой цепи, содержащую SEQ ID NO:11, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления a GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220; CDR1 легкой цепи, содержащую SEQ ID NO:16; CDR2 легкой цепи, содержащую SEQ ID NO:11, и CDR3 легкой цепи, содержащую SEQ ID NO:17. В некоторых вариантах осуществления a GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220; CDR1 легкой цепи, содержащую SEQ ID NO:21; CDR2 легкой цепи, содержащую SEQ ID NO:22, и CDR3 легкой цепи, содержащую SEQ ID NO:23. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело. В соответствии с некоторыми вариантами осуществления антитело представляет собой гуманизированное антитело. В другом варианте осуществления GCGR-связывающий белок представляет собой антигенсвязывающий фрагмент антитела.
[00125] В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1; CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237); и CDR3 тяжелой цепи, содержащую SEQ ID NO:3. В другом варианте осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:7; CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237); и CDR3 тяжелой цепи, содержащую SEQ ID NO:9. В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:12; CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237); и CDR3 тяжелой цепи, содержащую SEQ ID NO:3. В другом варианте осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:13; CDR2 тяжелой цепи, содержащую DIX1GGX2YX3NYNX4KHKX5 (SEQ ID NO:237); и CDR3 тяжелой цепи, содержащую SEQ ID NO:15. В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:18; CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237); и CDR3 тяжелой цепи, содержащую SEQ ID NO:20. В другом варианте осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:11; CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237); и CDR3 тяжелой цепи, содержащую SEQ ID NO:3. В некоторых вариантах осуществления X1 представляет собой Y, H, F или S. В некоторых вариантах осуществления X1 представляет собой Y. В другом варианте осуществления X1 представляет собой H. В некоторых вариантах осуществления X1 представляет собой F. В других вариантах осуществления X1 представляет собой S. В некоторых вариантах осуществления X2 представляет собой Y, G, F или D. В некоторых вариантах осуществления X2 представляет собой Y. В другом варианте осуществления X2 представляет собой G. В некоторых вариантах осуществления X2 представляет собой F. В других вариантах осуществления X2 представляет собой D. В некоторых вариантах осуществления X3 представляет собой I, T, D, N или S. В некоторых вариантах осуществления X3 представляет собой I. В другом варианте осуществления X3 представляет собой T. В некоторых вариантах осуществления X3 представляет собой D. В других вариантах осуществления X3 представляет собой N. В некоторых вариантах осуществления X3 представляет собой S. В некоторых вариантах осуществления X4 представляет собой E, K, D, G или A. В некоторых вариантах осуществления X4 представляет собой E. В другом варианте осуществления X4 представляет собой K. В некоторых вариантах осуществления X4 представляет собой D. В других вариантах осуществления X4 представляет собой G. В некоторых вариантах осуществления X4 представляет собой A. В некоторых вариантах осуществления X5 представляет собой G, S или D. В некоторых вариантах осуществления X5 представляет собой G. В другом варианте осуществления X5 представляет собой S. В некоторых вариантах осуществления X5 представляет собой D. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело. В соответствии с некоторыми вариантами осуществления антитело представляет собой гуманизированное антитело. В другом варианте осуществления GCGR-связывающий белок представляет собой антигенсвязывающий фрагмент антитела.
[00126] В некоторых вариантах осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237), CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:7, CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237), CDR3 тяжелой цепи, содержащую SEQ ID NO:9, CDR1 легкой цепи, содержащую SEQ ID NO:10, CDR2 легкой цепи, содержащую SEQ ID NO:11, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:12, CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237), CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:13, CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237), CDR3 тяжелой цепи, содержащую SEQ ID NO:15, CDR1 легкой цепи, содержащую SEQ ID NO:16, CDR2 легкой цепи, содержащую SEQ ID NO:11, и CDR3 легкой цепи, содержащую SEQ ID NO:17. В некоторых вариантах осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:18, CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237), CDR3 тяжелой цепи, содержащую SEQ ID NO:20, CDR1 легкой цепи, содержащую SEQ ID NO:21, CDR2 легкой цепи, содержащую SEQ ID NO:22, и CDR3 легкой цепи, содержащую SEQ ID NO:23. В некоторых вариантах осуществления X1 представляет собой Y, H, F или S. В некоторых вариантах осуществления X1 представляет собой Y. В другом варианте осуществления X1 представляет собой H. В некоторых вариантах осуществления X1 представляет собой F. В других вариантах осуществления X1 представляет собой S. В некоторых вариантах осуществления X2 представляет собой Y, G, F или D. В некоторых вариантах осуществления X2 представляет собой Y. В другом варианте осуществления X2 представляет собой G. В некоторых вариантах осуществления X2 представляет собой F. В других вариантах осуществления X2 представляет собой D. В некоторых вариантах осуществления X3 представляет собой I, T, D, N или S. В некоторых вариантах осуществления X3 представляет собой I. В другом варианте осуществления X3 представляет собой T. В некоторых вариантах осуществления X3 представляет собой D. В других вариантах осуществления X3 представляет собой N. В некоторых вариантах осуществления X3 представляет собой S. В некоторых вариантах осуществления X4 представляет собой E, K, D, G или A. В некоторых вариантах осуществления X4 представляет собой E. В другом варианте осуществления X4 представляет собой K. В некоторых вариантах осуществления X4 представляет собой D. В других вариантах осуществления X4 представляет собой G. В некоторых вариантах осуществления X4 представляет собой A. В некоторых вариантах осуществления X5 представляет собой G, S или D. В некоторых вариантах осуществления X5 представляет собой G. В другом варианте осуществления X5 представляет собой S. В некоторых вариантах осуществления X5 представляет собой D. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело. В соответствии с некоторыми вариантами осуществления антитело представляет собой гуманизированное антитело. В другом варианте осуществления GCGR-связывающий белок представляет собой антигенсвязывающий фрагмент антитела.
[00127] В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1; CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237); CDR3 тяжелой цепи, содержащую SEQ ID NO:3; и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В другом варианте осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:7; CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237); CDR3 тяжелой цепи, содержащую SEQ ID NO:9; и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:12; CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237); CDR3 тяжелой цепи, содержащую SEQ ID NO:3; и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В другом варианте осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:13; CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237); CDR3 тяжелой цепи, содержащую SEQ ID NO:15; и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:18; CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237); CDR3 тяжелой цепи, содержащую SEQ ID NO:20; и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1; CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237); CDR3 тяжелой цепи, содержащую SEQ ID NO:3; и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В другом варианте осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:7; CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237); CDR3 тяжелой цепи, содержащую SEQ ID NO:9; и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:12; CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237); CDR3 тяжелой цепи, содержащую SEQ ID NO:3; и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В другом варианте осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:13; CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237); CDR3 тяжелой цепи, содержащую SEQ ID NO:15; и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:18; CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237); CDR3 тяжелой цепи, содержащую SEQ ID NO:20; и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления X1 представляет собой Y, H, F или S. В некоторых вариантах осуществления X1 представляет собой Y. В другом варианте осуществления X1 представляет собой H. В некоторых вариантах осуществления X1 представляет собой F. В других вариантах осуществления X1 представляет собой S. В некоторых вариантах осуществления X2 представляет собой Y, G, F или D. В некоторых вариантах осуществления X2 представляет собой Y. В другом варианте осуществления X2 представляет собой G. В некоторых вариантах осуществления X2 представляет собой F. В других вариантах осуществления X2 представляет собой D. В некоторых вариантах осуществления X3 представляет собой I, T, D, N или S. В некоторых вариантах осуществления X3 представляет собой I. В другом варианте осуществления X3 представляет собой T. В некоторых вариантах осуществления X3 представляет собой D. В других вариантах осуществления X3 представляет собой N. В некоторых вариантах осуществления X3 представляет собой S. В некоторых вариантах осуществления X4 представляет собой E, K, D, G или A. В некоторых вариантах осуществления X4 представляет собой E. В другом варианте осуществления X4 представляет собой K. В некоторых вариантах осуществления X4 представляет собой D. В других вариантах осуществления X4 представляет собой G. В некоторых вариантах осуществления X4 представляет собой A. В некоторых вариантах осуществления X5 представляет собой G, S или D. В некоторых вариантах осуществления X5 представляет собой G. В другом варианте осуществления X5 представляет собой S. В некоторых вариантах осуществления X5 представляет собой D. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело. В соответствии с некоторыми вариантами осуществления антитело представляет собой гуманизированное антитело. В другом варианте осуществления GCGR-связывающий белок представляет собой антигенсвязывающий фрагмент антитела.
[00128] В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238); CDR2 легкой цепи, содержащую SEQ ID NO:5; и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления a GCGR-связывающий белок содержит CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238); CDR2 легкой цепи, содержащую SEQ ID NO:11; и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238); CDR2 легкой цепи, содержащую SEQ ID NO:5; и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления a GCGR-связывающий белок содержит CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238); CDR2 легкой цепи, содержащую SEQ ID NO:11; и CDR3 легкой цепи, содержащую SEQ ID NO:17. В некоторых вариантах осуществления a GCGR-связывающий белок содержит CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238); CDR2 легкой цепи, содержащую SEQ ID NO:22; и CDR3 легкой цепи, содержащую SEQ ID NO:23. В некоторых вариантах осуществления X6 представляет собой S, T или H. В некоторых вариантах осуществления X6 представляет собой S. В другом варианте осуществления X6 представляет собой T. В некоторых вариантах осуществления X6 представляет собой H. В некоторых вариантах осуществления X7 представляет собой D, H или Y. В некоторых вариантах осуществления X7 представляет собой D. В другом варианте осуществления X7 представляет собой H. В некоторых вариантах осуществления X7 представляет собой Y. В некоторых вариантах осуществления X8 представляет собой Y или D. В некоторых вариантах осуществления X8 представляет собой Y. В другом варианте осуществления X8 представляет собой D. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело. В соответствии с некоторыми вариантами осуществления антитело представляет собой гуманизированное антитело. В другом варианте осуществления GCGR-связывающий белок представляет собой антигенсвязывающий фрагмент антитела.
[00129] В некоторых вариантах осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238), CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:7, CDR2 тяжелой цепи, содержащую SEQ ID NO:8, CDR3 тяжелой цепи, содержащую SEQ ID NO:9, CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238), CDR2 легкой цепи, содержащую SEQ ID NO:11, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:12, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238), CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:13, CDR2 тяжелой цепи, содержащую SEQ ID NO:14, CDR3 тяжелой цепи, содержащую SEQ ID NO:15, CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238), CDR2 легкой цепи, содержащую SEQ ID NO:11, и CDR3 легкой цепи, содержащую SEQ ID NO:17. В некоторых вариантах осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:18, CDR2 тяжелой цепи, содержащую SEQ ID NO:19, CDR3 тяжелой цепи, содержащую SEQ ID NO:20, CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238), CDR2 легкой цепи, содержащую SEQ ID NO:22, и CDR3 легкой цепи, содержащую SEQ ID NO:23. В другом варианте осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:24, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238), CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления X6 представляет собой S, T или H. В некоторых вариантах осуществления X6 представляет собой S. В другом варианте осуществления X6 представляет собой T. В некоторых вариантах осуществления X6 представляет собой H. В некоторых вариантах осуществления X7 представляет собой D, H или Y. В некоторых вариантах осуществления X7 представляет собой D. В другом варианте осуществления X7 представляет собой H. В некоторых вариантах осуществления X7 представляет собой Y. В некоторых вариантах осуществления X8 представляет собой Y или D. В некоторых вариантах осуществления X8 представляет собой Y. В другом варианте осуществления X8 представляет собой D. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело. В соответствии с некоторыми вариантами осуществления антитело представляет собой гуманизированное антитело. В другом варианте осуществления GCGR-связывающий белок представляет собой антигенсвязывающий фрагмент антитела.
[00130] В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238), CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238), CDR2 легкой цепи, содержащую SEQ ID NO:11, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238), CDR2 легкой цепи, содержащую SEQ ID NO:11, и CDR3 легкой цепи, содержащую SEQ ID NO:17. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238), CDR2 легкой цепи, содержащую SEQ ID NO:22, и CDR3 легкой цепи, содержащую SEQ ID NO:23. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238), CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238), CDR2 легкой цепи, содержащую SEQ ID NO:11, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238), CDR2 легкой цепи, содержащую SEQ ID NO:11, и CDR3 легкой цепи, содержащую SEQ ID NO:17. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238), CDR2 легкой цепи, содержащую SEQ ID NO:22, и CDR3 легкой цепи, содержащую SEQ ID NO:23. В некоторых вариантах осуществления X6 представляет собой S, T или H. В некоторых вариантах осуществления X6 представляет собой S. В другом варианте осуществления X6 представляет собой T. В некоторых вариантах осуществления X6 представляет собой H. В некоторых вариантах осуществления X7 представляет собой D, H или Y. В некоторых вариантах осуществления X7 представляет собой D. В другом варианте осуществления X7 представляет собой H. В некоторых вариантах осуществления X7 представляет собой Y. В некоторых вариантах осуществления X8 представляет собой Y или D. В некоторых вариантах осуществления X8 представляет собой Y. В другом варианте осуществления X8 представляет собой D. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело. В соответствии с некоторыми вариантами осуществления антитело представляет собой гуманизированное антитело. В другом варианте осуществления GCGR-связывающий белок представляет собой антигенсвязывающий фрагмент антитела.
[00131] В некоторых вариантах осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237), CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238), CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:7, CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237), CDR3 тяжелой цепи, содержащую SEQ ID NO:9, CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238), CDR2 легкой цепи, содержащую SEQ ID NO:11, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:12, CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237), CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238), CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В другом варианте осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:13, CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237), CDR3 тяжелой цепи, содержащую SEQ ID NO:15, CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238), CDR2 легкой цепи, содержащую SEQ ID NO:11, и CDR3 легкой цепи, содержащую SEQ ID NO:17. В некоторых вариантах осуществления GCGR-связывающий белок содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:18, CDR2 тяжелой цепи, содержащую DIX1PGGX2YX3NYNX4KHKX5 (SEQ ID NO:237), CDR3 тяжелой цепи, содержащую SEQ ID NO:20, CDR1 легкой цепи, содержащую RSSQX6IVX7SX8GNTYLE (SEQ ID NO:238), CDR2 легкой цепи, содержащую SEQ ID NO:22, и CDR3 легкой цепи, содержащую SEQ ID NO:23. В некоторых вариантах осуществления X1 представляет собой Y, H, F или S. В некоторых вариантах осуществления X1 представляет собой Y. В другом варианте осуществления X1 представляет собой H. В некоторых вариантах осуществления X1 представляет собой F. В других вариантах осуществления X1 представляет собой S. В некоторых вариантах осуществления X2 представляет собой Y, G, F или D. В некоторых вариантах осуществления X2 представляет собой Y. В другом варианте осуществления X2 представляет собой G. В некоторых вариантах осуществления X2 представляет собой F. В других вариантах осуществления X2 представляет собой D. В некоторых вариантах осуществления X3 представляет собой I, T, D, N или S. В некоторых вариантах осуществления X3 представляет собой I. В другом варианте осуществления X3 представляет собой T. В некоторых вариантах осуществления X3 представляет собой D. В других вариантах осуществления X3 представляет собой N. В некоторых вариантах осуществления X3 представляет собой S. В некоторых вариантах осуществления X4 представляет собой E, K, D, G или A. В некоторых вариантах осуществления X4 представляет собой E. В другом варианте осуществления X4 представляет собой K. В некоторых вариантах осуществления X4 представляет собой D. В других вариантах осуществления X4 представляет собой G. В некоторых вариантах осуществления X4 представляет собой A. В некоторых вариантах осуществления X5 представляет собой G, S или D. В некоторых вариантах осуществления X5 представляет собой G. В другом варианте осуществления X5 представляет собой S. В некоторых вариантах осуществления X5 представляет собой D. В некоторых вариантах осуществления X6 представляет собой S, T или H. В некоторых вариантах осуществления X6 представляет собой S. В другом варианте осуществления X6 представляет собой T. В некоторых вариантах осуществления X6 представляет собой H. В некоторых вариантах осуществления X7 представляет собой D, H или Y. В некоторых вариантах осуществления X7 представляет собой D. В другом варианте осуществления X7 представляет собой H. В некоторых вариантах осуществления X7 представляет собой Y. В некоторых вариантах осуществления X8 представляет собой Y или D. В некоторых вариантах осуществления X8 представляет собой Y. В другом варианте осуществления X8 представляет собой D. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело. В некоторых вариантах осуществления антитело представляет собой гуманизированное антитело. В другом варианте осуществления GCGR-связывающий белок представляет собой антигенсвязывающий фрагмент антитела.
[00132] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит (a) CDR1 тяжелой цепи, содержащую SEQ ID NO:27, 33, 38, 39 или 44; CDR2 тяжелой цепи, содержащую SEQ ID NO:28, 34, 40, 45 или 50; и CDR3 тяжелой цепи, содержащую SEQ ID NO:29, 35, 41 или 46; и/или (b) CDR1 легкой цепи, содержащую SEQ ID NO:30, 36, 42 или 47; CDR2 легкой цепи, содержащую SEQ ID NO:31, 37 или 48; и CDR3 легкой цепи, содержащую SEQ ID NO:32, 43 или 49. В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит (a) CDR1 тяжелой цепи, содержащую SEQ ID NO:27, CDR2 тяжелой цепи, содержащую SEQ ID NO:28, CDR3 тяжелой цепи, содержащую SEQ ID NO:29, и/или (b) CDR1 легкой цепи, содержащую SEQ ID NO:30, CDR2 легкой цепи, содержащую SEQ ID NO:31, и CDR3 легкой цепи, содержащую SEQ ID NO:32.
[00133] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит (a) CDR1 тяжелой цепи, содержащую SEQ ID NO:53, 57, 61, 62 или 65; CDR2 тяжелой цепи, содержащую SEQ ID NO:54, 58, 40, 66 или 70; и CDR3 тяжелой цепи, содержащую SEQ ID NO:55, 59, 63 или 67; и/или (b) CDR1 легкой цепи, содержащую SEQ ID NO:56, 60, 64 или 68; CDR2 легкой цепи, содержащую SEQ ID NO:31, 37 или 69; и CDR3 легкой цепи, содержащую SEQ ID NO:32, 43 или 49. В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:53, CDR2 тяжелой цепи, содержащую SEQ ID NO:54, CDR3 тяжелой цепи, содержащую SEQ ID NO:55, и/или CDR1 легкой цепи, содержащую SEQ ID NO:56, CDR2 легкой цепи, содержащую SEQ ID NO:31, и CDR3 легкой цепи, содержащую SEQ ID NO:32.
[00134] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит (a) CDR1 тяжелой цепи, содержащую SEQ ID NO:73, 79, 84, 85 или 90; CDR2 тяжелой цепи, содержащую SEQ ID NO:74, 80, 86, 91 или 96; и CDR3 тяжелой цепи, содержащую SEQ ID NO:75, 81, 87 или 92; и/или (b) CDR1 легкой цепи, содержащую SEQ ID NO:76, 82, 88 или 93; CDR2 легкой цепи, содержащую SEQ ID NO:77, 83 или 94; и CDR3 легкой цепи, содержащую SEQ ID NO:78, 89 или 95. В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:73, CDR2 тяжелой цепи, содержащую SEQ ID NO:74, CDR3 тяжелой цепи, содержащую SEQ ID NO:75 и/или CDR1 легкой цепи, содержащую SEQ ID NO:76, CDR2 легкой цепи, содержащую SEQ ID NO:77, и CDR3 легкой цепи, содержащую SEQ ID NO:78.
[00135] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит (a) CDR1 тяжелой цепи, содержащую SEQ ID NO:99, 105, 110, 111 или 115; CDR2 тяжелой цепи, содержащую SEQ ID NO:100, 106, 86, 116 или 121; и CDR3 тяжелой цепи, содержащую SEQ ID NO:101, 107, 112 или 117; и/или (b) CDR1 легкой цепи, содержащую SEQ ID NO:102, 108, 113 или 118; CDR2 легкой цепи, содержащую SEQ ID NO:103, 109 или 119; и CDR3 легкой цепи, содержащую SEQ ID NO:104, 114 или 120. В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:99, CDR2 тяжелой цепи, содержащую SEQ ID NO:100, CDR3 тяжелой цепи, содержащую SEQ ID NO:101, и/или CDR1 легкой цепи, содержащую SEQ ID NO:102, CDR2 легкой цепи, содержащую SEQ ID NO:103, и CDR3 легкой цепи, содержащую SEQ ID NO:104.
[00136] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит (a) CDR1 тяжелой цепи, содержащую SEQ ID NO:124, 129, 133, 134 или 138; CDR2 тяжелой цепи, содержащую SEQ ID NO:125, 130, 135, 139 или 143; и CDR3 тяжелой цепи, содержащую SEQ ID NO:126, 131, 136 или 140; и/или (b) CDR1 легкой цепи, содержащую SEQ ID NO:127, 132, 137 или 141; CDR2 легкой цепи, содержащую SEQ ID NO:128, 11 или 142; и CDR3 легкой цепи, содержащую SEQ ID NO:6, 17 или 23. В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:124, CDR2 тяжелой цепи, содержащую SEQ ID NO:125, CDR3 тяжелой цепи, содержащую SEQ ID NO:126, и/или CDR1 легкой цепи, содержащую SEQ ID NO:127, CDR2 легкой цепи, содержащую SEQ ID NO:128, и CDR3 легкой цепи, содержащую SEQ ID NO:6.
[00137] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит (a) CDR1 тяжелой цепи, содержащую SEQ ID NO:146, 150, 154, 155 или 159; CDR2 тяжелой цепи, содержащую SEQ ID NO:147, 151, 156, 160 или 163; и CDR3 тяжелой цепи, содержащую SEQ ID NO:148, 152, 157 или 161; и/или (b) CDR1 легкой цепи, содержащую SEQ ID NO:149, 153, 158 или 162; CDR2 легкой цепи, содержащую SEQ ID NO:128, 11 или 142; и CDR3 легкой цепи, содержащую SEQ ID NO:6, 17 или 23. В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:146, CDR2 тяжелой цепи, содержащую SEQ ID NO:147, CDR3 тяжелой цепи, содержащую SEQ ID NO:148, и/или CDR1 легкой цепи, содержащую SEQ ID NO:149, CDR2 легкой цепи, содержащую SEQ ID NO:128, и CDR3 легкой цепи, содержащую SEQ ID NO:6.
[00138] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит (a) CDR1 тяжелой цепи, содержащую SEQ ID NO:166, 172, 176, 177 или 182; CDR2 тяжелой цепи, содержащую SEQ ID NO:167, 173, 178, 183 или 187; и CDR3 тяжелой цепи, содержащую SEQ ID NO:168, 174, 179 или 184; и/или (b) CDR1 легкой цепи, содержащую SEQ ID NO:169, 175, 180 или 185; CDR2 легкой цепи, содержащую SEQ ID NO:170, 11 или 142; и CDR3 легкой цепи, содержащую SEQ ID NO:171, 181 или 186. В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:166, CDR2 тяжелой цепи, содержащую SEQ ID NO:167, CDR3 тяжелой цепи, содержащую SEQ ID NO:168, и/или CDR1 легкой цепи, содержащую SEQ ID NO:169, CDR2 легкой цепи, содержащую SEQ ID NO:170, и CDR3 легкой цепи, содержащую SEQ ID NO:171.
[00139] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит (a) CDR1 тяжелой цепи, содержащую SEQ ID NO:190, 172, 154, 177 или 198; CDR2 тяжелой цепи, содержащую SEQ ID NO:191, 194, 156, 199 или 202; и CDR3 тяжелой цепи, содержащую SEQ ID NO:192, 195, 196 или 200; и/или (b) CDR1 легкой цепи, содержащую SEQ ID NO:169, 175, 180 или 185; CDR2 легкой цепи, содержащую SEQ ID NO:128, 11 или 142; и CDR3 легкой цепи, содержащую SEQ ID NO:193, 197 или 201. В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:190, CDR2 тяжелой цепи, содержащую SEQ ID NO:191, CDR3 тяжелой цепи, содержащую SEQ ID NO:192, и/или CDR1 легкой цепи, содержащую SEQ ID NO:169, CDR2 легкой цепи, содержащую SEQ ID NO:128, и CDR3 легкой цепи, содержащую SEQ ID NO:193.
[00140] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) содержит (a) CDR1 тяжелой цепи, содержащую SEQ ID NO:190, 172, 154, 177 или 198; CDR2 тяжелой цепи, содержащую SEQ ID NO:205, 208, 211, 214 или 217; и CDR3 тяжелой цепи, содержащую SEQ ID NO:206, 209, 212 или 215; и/или (b) CDR1 легкой цепи, содержащую SEQ ID NO:207, 210, 213 или 216; CDR2 легкой цепи, содержащую SEQ ID NO:128, 11 или 142; и CDR3 легкой цепи, содержащую SEQ ID NO:6, 17 или 23. В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:190, CDR2 тяжелой цепи, содержащую SEQ ID NO:205, CDR3 тяжелой цепи, содержащую SEQ ID NO:206, и/или CDR1 легкой цепи, содержащую SEQ ID NO:207, CDR2 легкой цепи, содержащую SEQ ID NO:128, и CDR3 легкой цепи, содержащую SEQ ID NO:6.
[00141] В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:25, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:26. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:25. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:26. В некоторых вариантах осуществления a GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:25, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:26. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и/или вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую по сути из SEQ ID NO:25, и вариабельную область легкой цепи, состоящую по сути из SEQ ID NO:26. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую из SEQ ID NO:25, и вариабельную область легкой цепи, состоящую из SEQ ID NO:26. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антитело. В некоторых вариантах осуществления антитело представляет собой гуманизированное антитело. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой антигенсвязывающий фрагмент антитела.
[00142] В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:51, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:52. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:51. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:52. В некоторых вариантах осуществления a GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:51, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:52. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:51, и/или вариабельную область легкой цепи, содержащую SEQ ID NO:52. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:51, и вариабельную область легкой цепи, содержащую SEQ ID NO:52. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую по сути из SEQ ID NO:51, и вариабельную область легкой цепи, состоящую по сути из SEQ ID NO:52. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую из SEQ ID NO:51, и вариабельную область легкой цепи, состоящую из SEQ ID NO:52.
[00143] В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:71, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:72. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:71. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:72. В некоторых вариантах осуществления a GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:71, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:72. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:71, и/или вариабельную область легкой цепи, содержащую SEQ ID NO:72. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:71, и вариабельную область легкой цепи, содержащую SEQ ID NO:72. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую по сути из SEQ ID NO:71, и вариабельную область легкой цепи, состоящую по сути из SEQ ID NO:72. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую из SEQ ID NO:71, и вариабельную область легкой цепи, состоящую из SEQ ID NO:72.
[00144] В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:97, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:98. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:97. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:98. В некоторых вариантах осуществления a GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:97, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:98. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:97, и/или вариабельную область легкой цепи, содержащую SEQ ID NO:98. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:97, и вариабельную область легкой цепи, содержащую SEQ ID NO:98. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую по сути из SEQ ID NO:97, и вариабельную область легкой цепи, состоящую по сути из SEQ ID NO:98. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую из SEQ ID NO:97, и вариабельную область легкой цепи, состоящую из SEQ ID NO:98.
[00145] В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:122, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:123. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:122. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:123. В некоторых вариантах осуществления a GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:122, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:123. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:122, и/или вариабельную область легкой цепи, содержащую SEQ ID NO:123. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:122, и вариабельную область легкой цепи, содержащую SEQ ID NO:123. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую по сути из SEQ ID NO:122, и вариабельную область легкой цепи, состоящую по сути из SEQ ID NO:123. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую из SEQ ID NO:122, и вариабельную область легкой цепи, состоящую из SEQ ID NO:123.
[00146] В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:144, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:145. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:144. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:145. В некоторых вариантах осуществления a GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:144, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:145. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:144, и/или вариабельную область легкой цепи, содержащую SEQ ID NO:145. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:144, и вариабельную область легкой цепи, содержащую SEQ ID NO:145. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую по сути из SEQ ID NO:144, и вариабельную область легкой цепи, состоящую по сути из SEQ ID NO:145. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую из SEQ ID NO:144, и вариабельную область легкой цепи, состоящую из SEQ ID NO:145.
[00147] В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:164, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:165. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:164. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:165. В некоторых вариантах осуществления a GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:164, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:165. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:164, и/или вариабельную область легкой цепи, содержащую SEQ ID NO:165. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:164, и вариабельную область легкой цепи, содержащую SEQ ID NO:165. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую по сути из SEQ ID NO:164, и вариабельную область легкой цепи, состоящую по сути из SEQ ID NO:165. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую из SEQ ID NO:164, и вариабельную область легкой цепи, состоящую из SEQ ID NO:165.
[00148] В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:188, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:189. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:188. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:189. В некоторых вариантах осуществления a GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:188, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:189. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:188, и/или вариабельную область легкой цепи, содержащую SEQ ID NO:189. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:188, и вариабельную область легкой цепи, содержащую SEQ ID NO:189. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую по сути из SEQ ID NO:188, и вариабельную область легкой цепи, состоящую по сути из SEQ ID NO:189. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую из SEQ ID NO:188, и вариабельную область легкой цепи, состоящую из SEQ ID NO:189.
[00149] В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:203, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:204. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:203. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:204. В некоторых вариантах осуществления a GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:203, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:204. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:203, и/или вариабельную область легкой цепи, содержащую SEQ ID NO:204. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:203, и вариабельную область легкой цепи, содержащую SEQ ID NO:204. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую по сути из SEQ ID NO:203, и вариабельную область легкой цепи, состоящую по сути из SEQ ID NO:204. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую из SEQ ID NO:203, и вариабельную область легкой цепи, состоящую из SEQ ID NO:204.
[00150] В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:218, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:219. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:218. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:219. В некоторых вариантах осуществления a GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:218, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:219. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:218, и/или вариабельную область легкой цепи, содержащую SEQ ID NO:219. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:218, и вариабельную область легкой цепи, содержащую SEQ ID NO:219. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую по сути из SEQ ID NO:218, и вариабельную область легкой цепи, состоящую по сути из SEQ ID NO:219. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую из SEQ ID NO:218, и вариабельную область легкой цепи, состоящую из SEQ ID NO:219.
[00151] В некоторых вариантах осуществления GCGR-связывающий белок представляет собой гуманизированную версию любого антитела, раскрытого в данном документе. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой гуманизированную версию антитела 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 или 14E9. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой гуманизированную версию антитела 6B5, к примеру, Hz6B5. В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:220, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 80% идентичную SEQ ID NO:221. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:220. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 85%, на, по меньшей мере, приблизительно 90%, на, по меньшей мере, приблизительно 95%, на, по меньшей мере, приблизительно 97% или на, по меньшей мере, приблизительно 99% идентичную SEQ ID NO:221. В некоторых вариантах осуществления a GCGR-связывающий белок содержит вариабельную область тяжелой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:220, и/или вариабельную область легкой цепи, имеющую последовательность, на, по меньшей мере, приблизительно 95% идентичную SEQ ID NO:221. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и/или вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую по сути из SEQ ID NO:220, и вариабельную область легкой цепи, состоящую по сути из SEQ ID NO:221. В некоторых вариантах осуществления GCGR-связывающий белок содержит вариабельную область тяжелой цепи, состоящую из SEQ ID NO:220, и вариабельную область легкой цепи, состоящую из SEQ ID NO:221. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой гуманизированное антитело, содержащее вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221.
[00152] Как известно специалистам в данной области техники, антитела (и другие связывающие агенты) могут быть охарактеризованы с помощью анализов эпитоп-специфической сортировки. Эпитоп-специфическая сортировка основана на конкурентных иммунологических анализах с целью характеристики совокупности антител по отношению к целевому белку. Каждое антитело подвергают скринингу по отношению ко всем из других антител в совокупности в отношении связывания с мишенью попарным образом с целью определения того, блокирует ли первое антитело второе антитело от связывания с мишенью. После скрининга каждое антитело имеет профиль, образованный на основании результатов конкурентных анализов. Антитела с аналогичными профилями (например, они блокируют или не блокируют аналогичные антитела) «сортируются эпитоп-специфическим образом» совместно и рассматриваются как связывающиеся с одним и тем же эпитопом, близкородственным эпитопом или перекрывающимся эпитопом. В некоторых вариантах осуществления антитела, которые специфически связывают GCGR, сортируются в «эпитопную группу». В некоторых вариантах осуществления антитело сортируют в эпитопную группу антител, описанных в данном документе. В некоторых вариантах осуществления антитело сортируют в эпитопную группу, содержащую, по меньшей мере, одно антитело из группы, состоящей из: 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9.
[00153] В некоторых вариантах осуществления альтернативные GCGR-связывающие белки (например, антитела) конкурируют за связывание с GCGR с одним или несколькими из антител, описанных в данном документе. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) связывает тот же самый эпитоп, что и одно из антител, описанных в данном документе. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) связывает эпитоп, перекрывающийся с эпитопом, связываемым одним из антител, описанных в данном документе. Связывающие белки (например, антитела), которые конкурируют или связываются с одним и тем же эпитопом, что и первое антитело, часто демонстрируют аналогичные функциональные свойства.
[00154] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с антителом, содержащим одну, две, три, четыре, пять или все шесть CDR из антитела, определенного в Табл. 1-10. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует с антителом, содержащим вариабельную область тяжелой цепи и вариабельную область легкой цепи, выбранные из таковых, представленных в Табл. 1-10.
[00155] В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с анти-GCGR антителом, описанным в данном документе. В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом эталонное антитело содержит: (a) CDR1 тяжелой цепи, содержащую GFTFTNHWLG (SEQ ID NO:1); CDR2 тяжелой цепи, содержащую DIYPGGYYINYNEKFKG (SEQ ID NO:2); CDR3 тяжелой цепи, содержащую HTNYGSDY (SEQ ID NO:3); и (b) CDR1 легкой цепи, содержащую RSSQSIVDSYGNTFLE (SEQ ID NO:4); CDR2 легкой цепи, содержащую KVSNRLS (SEQ ID NO:5); и CDR3 легкой цепи, содержащую FQGSHVPWT (SEQ ID NO:6). В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом указанное эталонное антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:27; CDR2 тяжелой цепи, содержащую SEQ ID NO:28; CDR3 тяжелой цепи, содержащую SEQ ID NO:29; CDR1 легкой цепи, содержащую SEQ ID NO:30; CDR2 легкой цепи, содержащую SEQ ID NO:31; и CDR3 легкой цепи, содержащую SEQ ID NO:32. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом указанное эталонное антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:53; CDR2 тяжелой цепи, содержащую SEQ ID NO:54; CDR3 тяжелой цепи, содержащую SEQ ID NO:55; CDR1 легкой цепи, содержащую SEQ ID NO:56; CDR2 легкой цепи, содержащую SEQ ID NO:31; и CDR3 легкой цепи, содержащую SEQ ID NO:32. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом указанное эталонное антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:73; CDR2 тяжелой цепи, содержащую SEQ ID NO:74; CDR3 тяжелой цепи, содержащую SEQ ID NO:75; CDR1 легкой цепи, содержащую SEQ ID NO:76; CDR2 легкой цепи, содержащую SEQ ID NO:77; и CDR3 легкой цепи, содержащую SEQ ID NO:78. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом указанное эталонное антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:99; CDR2 тяжелой цепи, содержащую SEQ ID NO:100; CDR3 тяжелой цепи, содержащую SEQ ID NO:101; CDR1 легкой цепи, содержащую SEQ ID NO:102; CDR2 легкой цепи, содержащую SEQ ID NO:103; и CDR3 легкой цепи, содержащую SEQ ID NO:104. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом указанное эталонное антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:124; CDR2 тяжелой цепи, содержащую SEQ ID NO:125; CDR3 тяжелой цепи, содержащую SEQ ID NO:126; CDR1 легкой цепи, содержащую SEQ ID NO:127; CDR2 легкой цепи, содержащую SEQ ID NO:128; и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом указанное эталонное антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:146; CDR2 тяжелой цепи, содержащую SEQ ID NO:147; CDR3 тяжелой цепи, содержащую SEQ ID NO:148; CDR1 легкой цепи, содержащую SEQ ID NO:149; CDR2 легкой цепи, содержащую SEQ ID NO:128; и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом указанное эталонное антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:166; CDR2 тяжелой цепи, содержащую SEQ ID NO:167; CDR3 тяжелой цепи, содержащую SEQ ID NO:168; CDR1 легкой цепи, содержащую SEQ ID NO:169; CDR2 легкой цепи, содержащую SEQ ID NO:170; и CDR3 легкой цепи, содержащую SEQ ID NO:171. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом указанное эталонное антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:190; CDR2 тяжелой цепи, содержащую SEQ ID NO:191; CDR3 тяжелой цепи, содержащую SEQ ID NO:192; CDR1 легкой цепи, содержащую SEQ ID NO:169; CDR2 легкой цепи, содержащую SEQ ID NO:128; и CDR3 легкой цепи, содержащую SEQ ID NO:193. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом указанное эталонное антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:190; CDR2 тяжелой цепи, содержащую SEQ ID NO:205; CDR3 тяжелой цепи, содержащую SEQ ID NO:206; CDR1 легкой цепи, содержащую SEQ ID NO:207; CDR2 легкой цепи, содержащую SEQ ID NO:128; и CDR3 легкой цепи, содержащую SEQ ID NO:6.
[00156] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конкурирует за связывание с GCGR с эталонным антителом, при этом эталонное антитело содержит (a) вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26; (b) вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221; (c) вариабельную область тяжелой цепи, содержащую SEQ ID NO:51, и вариабельную область легкой цепи, содержащую SEQ ID NO:52; (d) вариабельную область тяжелой цепи, содержащую SEQ ID NO:71, и вариабельную область легкой цепи, содержащую SEQ ID NO:72; (e) вариабельную область тяжелой цепи, содержащую SEQ ID NO:97, и вариабельную область легкой цепи, содержащую SEQ ID NO:98; (f) вариабельную область тяжелой цепи, содержащую SEQ ID NO:122, и вариабельную область легкой цепи, содержащую SEQ ID NO:123; (g) вариабельную область тяжелой цепи, содержащую SEQ ID NO:144, и вариабельную область легкой цепи, содержащую SEQ ID NO:145; (h) вариабельную область тяжелой цепи, содержащую SEQ ID NO:164, и вариабельную область легкой цепи, содержащую SEQ ID NO:165; (i) вариабельную область тяжелой цепи, содержащую SEQ ID NO:188, и вариабельную область легкой цепи, содержащую SEQ ID NO:189; (j) вариабельную область тяжелой цепи, содержащую SEQ ID NO:203, и вариабельную область легкой цепи, содержащую SEQ ID NO:204; и/или (k) вариабельную область тяжелой цепи, содержащую SEQ ID NO:218, и вариабельную область легкой цепи, содержащую SEQ ID NO:219.
[00157] В некоторых вариантах осуществления GCGR-связывающий белок, описанный в данном документе, содержит антитела (например, полноразмерные антитела), в которых, по меньшей мере, одна или несколько из константных областей были модифицированы или удалены. В некоторых вариантах осуществления антитела могут содержать модификации одной или нескольких из константных областей тяжелой цепи (CH1, CH2 или CH3) и/или константной области легкой цепи (CL). В некоторых вариантах осуществления константная область тяжелой цепи модифицированных антител содержит, по меньшей мере, одну человеческую константную область. В некоторых вариантах осуществления константная область тяжелой цепи модифицированных антител содержит более одной человеческой константной области. В некоторых вариантах осуществления модификации константной области включают в себя добавления, делеции или замены одной или нескольких аминокислот в одной или нескольких областях. В некоторых вариантах осуществления одну или несколько областей частично или полностью удаляли из константных областей модифицированных антител. В некоторых вариантах осуществления ведь домен CH2 удаляли из антитела (конструкции ΔCH2). В некоторых вариантах осуществления удаленный константный домен замещали коротким аминокислотным спейсером, который обеспечивает некоторую часть молекулярной гибкости, в типичном случае придаваемую отсутствующей константной областью. В некоторых вариантах осуществления модифицированное антитело содержит домен CH3, непосредственно слитый с шарнирной областью антитела. В некоторых вариантах осуществления модифицированное антитело содержит пептидный спейсер, вставленный между шарнирной областью и модифицированными доменами CH2 и/или CH3.
[00158] В данной области техники известно, что константная(константные) область(области) антитела опосредует(опосредуют) несколько эффекторных функций. Например, связывание компонента C1 комплемента с Fc-областью антитела IgG или IgM (связанной с антигеном) активирует систему комплемента. Активация комплемента является важной в опсонизации и лизисе клеточных патогенов. Активация комплемента также стимулирует воспалительный ответ и может быть включена в аутоиммунную гиперчувствительность. Помимо этого, Fc-область антитела может связывать клетку, экспрессирующую Fc-рецептор (FcR). Существует ряд Fc-рецепторов, которые являются специфическими в отношении различных классов антител, в том числе IgG (гамма-рецепторы), IgE (эпсилон-рецепторы), IgA (альфа-рецепторы) и IgM (мю-рецепторы). Связывание антитела с Fc-рецепторами на клеточной поверхности активирует ряд важных и разнообразных биологических ответов, в том числе поглощение и разрушение покрытых антителом частиц, выведение иммунных комплексов, лизис покрытых антителами целевых клеток с помощью клеток-киллеров (называемый антителозависимой клеточной цитотоксичностью или ADCC), высвобождение воспалительных медиаторов, плацентарный перенос и контроль продуцирования иммуноглобулинов.
[00159] В некоторых вариантах осуществления антитело содержит вариантную Fc-область. Аминокислотные последовательности Fc-области IgG1, IgG2, IgG3 и IgG4 человека известны специалистам в данной области техники (например, IgG1 человека - SEQ ID NO:230). Fc-области с аминокислотными вариациями были идентифицированы в нативных антителах. В некоторых вариантах осуществления вариантную Fc-область разрабатывают с заменами в конкретных аминокислотных положениях по сравнению с нативной Fc-областью (например, SEQ ID NO:231 и SEQ ID NO:232).
[00160] В некоторых вариантах осуществления модифицированные антитела обеспечивают измененные эффекторные функции, которые, в свою очередь, влияют на биологический профиль вводимого антитела. К примеру, в некоторых вариантах осуществления делеция или инактивация (посредством точечных мутаций или других средств) константной области могут снизить связывание Fc-рецептора с циркулирующим модифицированным антителом. В некоторых вариантах осуществления модификации константной области повышают время полужизни антитела в сыворотке крови. В некоторых вариантах осуществления модификации константной области снижают время полужизни антитела в сыворотке крови. В некоторых вариантах осуществления модификации константной области усиливают или повышают ADCC и/или комплементзависимую цитотоксичность (CDC) антитела. В некоторых вариантах осуществления модификации константной области снижают или устраняют ADCC и/или CDC антитела. К примеру, специфические аминокислотные замены в Fc-области IgG1 человека соответствующими остатками IgG2 или IgG4 могут снижать эффекторные функции (например, ADCC и CDC) в модифицированном антителе. Таким образом, в некоторых вариантах осуществления антитело не имеет одной или нескольких эффекторных функций. В некоторых вариантах осуществления антитело не имеет активности, связанной с ADCC, и/или не имеет активности, связанной с CDC. В некоторых вариантах осуществления антитело не связывает Fc-рецептор и/или факторы комплемента. В некоторых вариантах осуществления антитело не имеет эффекторной(эффекторных) функции(функций). В некоторых вариантах осуществления константную область модифицируют с целью устранения дисульфидных связей или олигосахаридных фрагментов. В некоторых вариантах осуществления константную область модифицируют с целью добавления/замещения одной или нескольких аминокислот, с целью получения, к примеру, одного или нескольких сайтов прикрепления цитотоксинов или углеводов. В этом отношении можно нарушать активность или эффекторную функцию, обеспечиваемую конкретной последовательностью или областью, при этом по сути сохранять структуру, связывающую активность и другие необходимые характеристики модифицированного антитела.
[00161] Модификации в константной области антител, описанных в данном документе, могут быть выполнены с помощью хорошо известных биохимических методик или методик молекулярной разработки. В некоторых вариантах осуществления варианты антител могут быть получены с помощью введения подходящих нуклеотидных изменений в кодирующую ДНК и/или с помощью синтеза необходимого антитела или полипептида.
[00162] Данное раскрытие дополнительно включает в себя дополнительные варианты и эквиваленты, которые являются по сути гомологичными по отношению к рекомбинантным, моноклональным, химерным, гуманизированным и человеческим антителам или фрагментам антител, описанных в данном документе. В некоторых вариантах осуществления может быть желательным повышение аффинности связывания антитела. В некоторых вариантах осуществления может быть желательной модуляция других биологических функций антитела, в том числе, но не ограничиваясь ими, специфичности, термоустойчивости, уровня экспрессии, эффекторной(эффекторных) функции(функций), гликозилирования, иммуногенности и/или растворимости. Специалистам в данной области техники будет понятно, что некоторые аминокислотные изменения могут изменять посттрансляционные модификации антитела, такие как замена числа или положения сайтов гликозилирования или изменение мембранных характеристик заякоривания.
[00163] Вариации могут представлять собой замену, делецию или вставку одного или нескольких нуклеотидов, кодирующих антитело или полипептид, что приводит к изменению аминокислотной последовательности по сравнению с нативной последовательностью антитела или полипептида. Аминокислотные замены могут быть результатом замены одной аминокислоты другой аминокислотой, имеющей аналогичные структурные и/или химические свойства, такой как замена лейцина серином, например, замены консервативных аминокислот. Вставки или делеции могут необязательно находиться в диапазоне от приблизительно 1 до 5 аминокислот. В некоторых вариантах осуществления замена, делеция или вставка содержит менее чем 25 аминокислотных замен, менее чем 20 аминокислотных замен, менее чем 15 аминокислотных замен, менее чем 10 аминокислотных замен, менее чем 5 аминокислотных замен, менее чем 4 аминокислотные замены, менее чем 3 аминокислотные замены или менее чем 2 аминокислотные замены по отношению к исходной молекуле. Вариации аминокислотной последовательности, которые являются биологически пригодными и/или релевантными, могут быть определены с помощью систематического получения вставок, делеций или замен в последовательности и исследования полученных в результате вариантных белков в отношении активности по сравнению с исходным белком.
[00164] В некоторых вариантах осуществления варианты могут включать в себя добавление аминокислотных остатков на амино- или карбокситерминальном конце антитела или полипептида. Длина дополнительных аминокислотных остатков может находиться в диапазоне от одного остатка до сотни или более остатков. В некоторых вариантах осуществления вариант содержит N-концевой метионильный остаток. В некоторых вариантах осуществления вариант содержит дополнительный полипептид/белок, т.е., слитый белок. В некоторых вариантах осуществления вариант содержит детектируемую метку и/или белок (например, фермент).
[00165] В некоторых вариантах осуществления цистеиновый остаток, не включенный в поддерживание надлежащей конформации антитела, может быть замещен или удален с целью модуляции характеристик антитела, к примеру, с целью повышения устойчивости к окислению и/или предупреждения аберрантного дисульфидного перекрестного связывания. В отличие от этого, в некоторых вариантах осуществления один или несколько цистеиновых остатков может быть добавлен для образования дисульфидной(дисульфидных) связи(связей) с целью повышения устойчивости.
[00166] В некоторых вариантах осуществления антитело по данному раскрытию является «деиммунизированным». Деиммунизация антител, как правило, состоит из конкретных аминокислотных мутаций (например, замен, делеций, добавлений) с целью удаления T-клеточных эпитопов без значительного снижения аффинности связывания или других необходимых активностей антитела.
[00167] Вариантные антитела или полипептиды, описанные в данном документе, могут быть получены с помощью способов, известных в данной области техники, в том числе, но не ограничиваясь ими, сайт-направленного мутагенеза, сканирующего аланином мутагенеза и мутагенеза путем ПЦР.
[00168] В некоторых вариантах осуществления GCGR-связывающий белок, описанный в данном документе, является химически модифицированным. В некоторых вариантах осуществления связывающий белок представляет собой антитело, которое было химически модифицировано с помощью гликозилирования, ацетилирования, пегилирования, фосфорилирования, амидирования, дериватизации с помощью известных защитных/блокирующих групп, протеолитического расщепления и/или связывания с другим белком. Любая из многочисленных химических модификаций может быть выполнена с помощью известных методик.
[00169] Данное раскрытие охватывает связывающие белки, построенные на основе не относящихся к иммуноглобулинам каркасов, при этом белки связываются с тем же самым эпитопом или по сути тем же самым эпитопом что и анти-GCGR антитело, раскрытое в данном документе. В некоторых вариантах осуществления не относящийся к иммуноглобулину связывающий белок представляет собой белок, который конкурирует с анти-GCGR антителом, описанным в данном документе, в конкурентном анализе связывания. В некоторых вариантах осуществления альтернативный связывающий белок содержит каркасный белок. Как правило, каркасные белки могут быть распределены в одну из трех групп на основе архитектуры своего остова: (1) каркасы, состоящие из α-спиралей; (2) малые каркасы с несколькими вторичными структурами или неупорядоченной архитектурой α-спиралей и β-листов; и (3) каркасы, состоящие преимущественно из β-листов. Каркасные белки включают в себя, но не ограничиваясь ими, антикалины, которые основаны на липокалиновом каркасе; аднектины, которые основаны на 10-м домене человеческого фибронектина 3 типа; аффитела, которые основаны на B-домене в Ig-связывающей области белка А Staphylococcus aureus; дарпины, которые основаны на доменных белках с анкиринвым повтором; финомеры, которые основаны на домене SH3 Fyn-протеинкиназы человека; аффитины, которые основаны на Sac7d из Sulfolobus acidocaldarius; аффилины, которые основаны на γ-B-кристаллине человека или человеческом убиквитине; авимеры, которые основаны на A-доменах мембранных рецепторных белков; ноттины (минибелки с цистеиновым узлом), которые основаны на стабильной 30-аминокислотной встречно-параллельной β-нитевой белковой складке; и ингибирующие каркасы на основе домена Куница, которые основаны на структуре, которая содержит три дисульфидные связи и три петли. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий одну или несколько CDR из антитела, определенного в Табл. 1-10. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий представленные в Примерах CDR1, CDR2 и CD3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 1. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 1. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 1. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий представленные в Примерах CDR1, CDR2 и CD3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 2. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 2. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 2. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий представленные в Примерах CDR1, CDR2 и CD3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 3. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 3. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 3. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий представленные в Примерах CDR1, CDR2 и CD3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 4. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 4. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 4. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий представленные в Примерах CDR1, CDR2 и CD3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 5. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 5. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 5. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий представленные в Примерах CDR1, CDR2 и CD3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 6. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 6. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 6. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий представленные в Примерах CDR1, CDR2 и CD3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 7. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 7. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 7. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий представленные в Примерах CDR1, CDR2 и CD3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 8. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 8. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 8. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий представленные в Примерах CDR1, CDR2 и CD3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 9. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 9. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 9. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий представленные в Примерах CDR1, CDR2 и CD3 тяжелой цепи и представленные в Примерах CDR1, CDR2 и CDR3 легкой цепи из Табл. 10. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Кабат и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Кабат из Табл. 10. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий CDR1, CDR2 и CD3 тяжелой цепи в соответствии с нумерацией Чотиа и CDR1, CDR2 и CDR3 легкой цепи в соответствии с нумерацией Чотиа из Табл. 10. В некоторых вариантах осуществления GCGR-связывающий белок содержит разработанный каркасный белок, содержащий шесть CDR из антител 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 или 14E9.
[00170] В общих чертах взаимодействия антиген-антитело являются нековалентными и обратимыми, образованными с помощью комбинации водородных связей, гидрофобных взаимодействий, электростатических и вандервальсовых сил. При описании силы комплекса антиген-антитело обычно упоминают аффинность и/или авидность. Связывание антитела со своим антигеном является необратимым процессом, и аффинность связывания в типичном случае описывают в виде равновесной константы диссоциации (KD). KD представляет собой соотношение скорости диссоциации антитела (koff) (как быстро оно диссоциирует от антигена) к скорости ассоциации антитела (kon) (как быстро оно связывается со своим антигеном). В некоторых вариантах осуществления значения KD определяют в результате измерения скоростей kon и koff специфического взаимодействия антитело/антиген и затем использования соотношения этих значений для расчета значения KD. Значения KD могут быть использованы для оценки и упорядочения силы отдельных взаимодействий антитело/антиген. Чем ниже значение KD антитела, тем выше аффинность антитела в отношении его мишени. Авидность представляет собой показатель общей силы комплекса антитело-антиген. Она зависит от трех основных параметров: (i) аффиности антитела по отношению к эпитопу, (ii) валентности как антитела, так и антигена, и (iii) структурного упорядочивания частей, которые взаимодействуют.
[00171] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) связывает GCGR с константой диссоциации (KD) приблизительно 1 мкМ или менее, приблизительно 100 нМ или менее, приблизительно 40 нМ или менее, приблизительно 20 нМ или менее, приблизительно 10 нМ или менее, приблизительно 1 нМ или менее, приблизительно 0,1 нМ или менее, 50 пМ или менее, 10 пМ или менее или 1 пМ или менее. В некоторых вариантах осуществления GCGR-связывающий белок связывает GCGR с KD приблизительно 20 нМ или менее. В некоторых вариантах осуществления GCGR-связывающий белок связывает GCGR с KD приблизительно 10 нМ или менее. В некоторых вариантах осуществления GCGR-связывающий белок связывает GCGR с KD приблизительно 1 нМ или менее. В некоторых вариантах осуществления GCGR-связывающий белок связывает GCGR с KD приблизительно 0,5 нМ или менее. В некоторых вариантах осуществления GCGR-связывающий белок связывает GCGR с KD приблизительно 0,1 нМ или менее. В некоторых вариантах осуществления GCGR-связывающий белок связывает GCGR с KD приблизительно 50 пМ или менее. В некоторых вариантах осуществления GCGR-связывающий белок связывает GCGR с KD приблизительно 25 пМ или менее. В некоторых вариантах осуществления GCGR-связывающий белок связывает GCGR с KD приблизительно 10 пМ или менее. В некоторых вариантах осуществления GCGR-связывающий белок связывает GCGR с KD приблизительно 1 пМ или менее. В некоторых вариантах осуществления константа диссоциации связывающего белка (например, антитела) с GCGR представляет собой константу диссоциации, определенную с использованием слитого белка GCGR, содержащего, по меньшей мере, участок или фрагмент GCGR, иммобилизированный на чипе Biacore. В некоторых вариантах осуществления константа диссоциации связывающего белка (например, антитела) с GCGR представляет собой константу диссоциации, определенную с использованием внеклеточного домена GCGR (или части/фрагмента внеклеточного домена), иммобилизированного на чипе Biacore. В некоторых вариантах осуществления константа диссоциации связывающего белка (например, антитела) с GCGR представляет собой константу диссоциации, определенную с использованием связывающего белка, захваченного анти-человеческий IgG антителом, на чипе Biacore, или растворенным GCGR или его фрагментом.
[00172] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) связывает GCGR с полумаксимальной эффективной концентрацией (ЕС50) приблизительно 1 мкМ или менее, приблизительно 100 нМ или менее, приблизительно 40 нМ или менее, приблизительно 20 нМ или менее, приблизительно 10 нМ или менее, приблизительно 1 нМ или менее или приблизительно 0,1 нМ или менее. В некоторых вариантах осуществления GCGR-связывающий белок связывается с GCGR человека с ЕС50 приблизительно 1 мкМ или менее, приблизительно 100 нМ или менее, приблизительно 40 нМ или менее, приблизительно 20 нМ или менее, приблизительно 10 нМ или менее, приблизительно 1 нМ или менее или приблизительно 0,1 нМ или менее. В некоторых вариантах осуществления GCGR-связывающий белок связывается с GCGR мыши и/или GCGR человека с ЕС50 приблизительно 40 нМ или менее, приблизительно 20 нМ или менее, приблизительно 10 нМ или менее, приблизительно 1 нМ или менее или приблизительно 0,1 нМ или менее.
[00173] Связывающие белки (например, антитела), описанные в данном документе, могут быть получены с помощью любого подходящего способа, известного в данной области техники. Такие способы варьируют от способов прямого синтеза белка до конструирования последовательности ДНК, кодирующей полипептидные последовательности и экспрессирующие такие последовательности в подходящей клетке. В некоторых вариантах осуществления последовательность ДНК конструируют с помощью рекомбинантной технологии или синтеза последовательности ДНК, кодирующей белок дикого типа, представляющий интерес. Необязательно последовательность можно подвергать мутагенезу с помощью сайт-специфического мутагенеза с получением ее функциональных вариантов. В некоторых вариантах осуществления последовательность ДНК, кодирующую полипептид, представляющий интерес, конструируют с помощью химического синтеза с использованием автоматического синтезатора ДНК. Олигонуклеотиды можно конструировать на основе аминокислотной последовательности необходимого полипептида и отбора тех кодонов, которые являются предпочтительными в клетках-хозяевах, в которых будет продуцироваться рекомбинантный полипептид, представляющий интерес. К синтезу полинуклеотидной последовательности, кодирующей выделенный полипептид, представляющий интерес, могут быть применимы стандартные способы. К примеру, для конструирования гена с возможной последовательностью, восстановленной по полипептиду, может быть использована полная аминокислотная последовательность. Кроме того, может быть синтезирован олигомер ДНК, содержащий нуклеотидную последовательность, кодирующую конкретный выделенный полипептид. К примеру, можно синтезировать несколько небольших олигонуклеотидов, кодирующих участки необходимого полипептида, а затем лигировать их. Для комплементарной сборки отдельные олигонуклеотиды в типичном случае содержат 5' или 3' выступающие концы.
[00174] Непосредственно после сборки (с помощью синтеза, сайт-направленного мутагенеза или другого способа) полинуклеотидные последовательности, кодирующие выделенный полипептид, представляющий интерес, могут быть включены в экспрессионный вектор и функционально связаны с последовательностью контроля экспрессии, подходящей для экспрессии белка в необходимом хозяине. Соответствующая сборка может быть о подтверждена с помощью сиквенирования нуклеотидов, картирования с использованием рестрикционных ферментов и/или экспрессии биологически активного полипептида в подходящем хозяине. Как хорошо известно специалистам в данной области техники, с целью получения высоких уровней экспрессии трансфицированного гена в хозяине ген должен быть функционально связан с последовательностями контроля экспрессии транскрипции или трансляции, которые являются функциональными в выбранном хозяине экспрессии.
[00175] В некоторых вариантах осуществления рекомбинантные экспрессионные векторы используют для амплификации и экспрессии кодируемых ДНК антител или их фрагментов против GCGR человека. К примеру, рекомбинантные экспрессионные векторы могут представлять собой реплицируемые конструкции ДНК, которые имеют синтетические или полученные из кДНК фрагменты ДНК, кодирующие полипетидную цепь GCGR-связывающего белка, такого как анти-GCGR антитело или его антигенсвязывающий фрагмент, функционально связанные с подходящими регуляторными элементами транскрипции и/или трансляции, происходящими из генов млекопитающих, микроорганизмов, вирусов или насекомых. Единица транскрипции, как правило, содержит совокупность из (1) генетического элемента или элементов, имеющих регуляторную роль в экспрессии генов, к примеру, промоторов или энхансеров транскрипции, (2) структурной или кодирующей последовательности, которая транскрибируется в мРНк и транслируется в белок, и (3) соответствующих последовательностей инициации и терминации транскрипции и трансляции. Регуляторные элементы могут включать в себя операторную последовательность для контроля транскрипции. Дополнительно может быть включена способность репликации в хозяине, обычно обеспечиваемая точкой начала репликации и геном, по которому ведется отбор, для облегчения распознавания трансформантов. Области ДНК являются «функционально связанными», если они функционально связаны друг с другом. К примеру, ДНК сигнального пептида (секреторная лидерная последовательность) функционально связана с ДНК полипептида, если она экспрессируется в виде предшественника, который участвует в секреции полипептида; промотор функционально связан с кодирующей последовательностью, если он контролирует транскрипцию последовательности; или сайт связывания рибосомы функционально связан с кодирующей последовательностью, если он расположен так, чтобы обеспечивать трансляцию. В некоторых вариантах осуществления структурные элементы, которые предполагают использовать в экспрессионных системах дрожжевых грибов, включают в себя лидерную последовательность, способствующую внеклеточной секреции транслируемого белка клеткой-хозяином. В некоторых вариантах осуществления в случаях, когда рекомбинантный белок экспрессируется без лидерной или транспортной последовательности, полипептид может содержать N-концевой метиониновый остаток. Этот остаток затем может быть необязательно отщеплен из экспрессируемого рекомбинантного белка с получением конечного продукта.
[00176] Выбор последовательности контроля экспрессии и экспрессионного вектора, как правило, зависит от выбора хозяина. Могут быть использована самые различные комбинации хозяин экспрессии/экспрессионный вектор. Пригодные экспрессионные векторы для эукариотических хозяев включают в себя, к примеру, векторы, содержащие последовательности контроля экспрессии, из SV40, вируса папилломы крупного рогатого скота, аденовируса и цитомегаловируса. Пригодные экспрессионные векторы для бактериальных хозяев включают известные бактериальные плазмиды, такие как плазмиды из E. coli, в том числе pCR1, pBR322, pMB9 и их производные, а также плазмиды более широкого диапазона хозяев, такие как M13 и другие нитчатые фаги с одноцепочечной ДНК.
[00177] GCGR-связывающие белки (например, антитела) по данному раскрытию могут экспрессироваться из одного или нескольких векторов. К примеру, в некоторых вариантах осуществления полипептид тяжелой цепи экспрессируется одним вектором, а полипептид легкой цепи экспрессируется вторым вектором. В некоторых вариантах осуществления полипептид тяжелой цепи и полипептид легкой цепи экспрессируются одним вектором.
[00178] Подходящие клетки-хозяева для экспрессии GCGR-связывающего белка (например, антитела) или белка GCGR или его фрагмента с целью применения в качестве антигена или иммуногена, включают в себя клетки прокариот, дрожжевых грибов, насекомых или клетки высших эукариот под контролем подходящих промоторов. Прокариоты включают в себя грамотрицательные или грамположительные организмы, к примеру, E. coli или Bacillus. Клетки высших эукариот включают в себя устойчивые линии клеток, происходящие от млекопитающих, описанные ниже. Также могут быть использованы системы бесклеточной трансляции. Подходящие клонирующие и экспрессионные векторы для применения с бактериальными, грибными, дрожжевыми клеточными хозяевами и клеточными хозяевами млекопитающих, а также способы продуцирования белка, в том числе продуцирования антител, хорошо известны специалистам в данной области техники.
[00179] Различные системы культивирования млекопитающих могут быть использованы для экспрессии рекомбинантных полипептидов. Экспрессия рекомбинантных белков в клетках млекопитающих может быть предпочтительной, поскольку эти белки, как правило, надлежащим образом упаковываются, подходящим образом модифицируются и являются биологически функциональными. Примеры подходящих линий клеток-хозяев млекопитающих включают в себя, но не ограничиваясь ими, клеточные линии COS-7 (происходящие из почки обезьяны), L-929 (происходящие из мышиных фибробластов), C127 (происходящие из опухоли молочной железы мыши), 3T3 (происходящие из мышиных фибробластов), CHO (происходящие из яичника китайского хомячка), HeLa (происходящие из рака шейки матки человека), BHK (происходящие из фибробластов почки хомяка), HEK-293 (происходящие из эмбриональной почки) и их варианты. Экспрессионные векторы млекопитающих могут содержать нетранскрибируемые элементы, такие как точка начала репликации, подходящий промотор и энхансер, связанные с геном, подлежащим экспрессии, и другие 5' или 3' фланкирующие нетранскрибируемые последовательности, и 5' или 3' нетранскрибируемые последовательности, такие как необходимые участки связывания рибосомы, сайт полиаденилирования, донорный сайт сплайсинга, акцепторный сайт сплайсинга и последовательности терминации транскрипции.
[00180] Экспрессия рекомбинантных белков в системах культивирования клеток насекомых (например, бакуловирусных) также обеспечивает надежный способ продуцирования корректно свернутых и биологически функциональных белков. Бакуловирусные системы для продуцирования гетерологичных белков в клетках насекомых хорошо известны специалистам в данной области техники.
[00181] Таким образом, в данном изобретении предложены клетки, содержащие GCGR-связывающие белки, описанные в данном документе. В некоторых вариантах осуществления клетки продуцируют GCGR-связывающие белки, описанные в данном документе. В некоторых вариантах осуществления клетки продуцируют антитело. В некоторых вариантах осуществления клетки продуцируют антитело, которое связывает GCGR человека. В некоторых вариантах осуществления клетки продуцируют антитело, которое связывает GCGR яванского макака. В некоторых вариантах осуществления клетки продуцируют антитело, которое связывает GCGR человека и GCGR яванского макака. В некоторых вариантах осуществления клетки продуцируют антитело, обозначенное 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 или 14E9. В некоторых вариантах осуществления клетки продуцируют антитело, обозначенное 6B5. В некоторых вариантах осуществления клетки продуцируют гуманизированную версию антитела 6B5, обозначаемого как Hz6B5. В соответствии с некоторыми вариантами осуществления клетка представляет собой клетку гибридомы. В соответствии с некоторыми вариантами осуществления клетка представляет собой клетку млекопитающего. В соответствии с некоторыми вариантами осуществления клетка представляет собой прокариотическую клетку. Согласно некоторым вариантам осуществления клетка представляет собой эукариотическую клетку.
[00182] Белки, продуцируемые клеткой-хозяином, могут быть очищены в соответствии с любым подходящим способом. Стандартные способы включают в себя хроматографию (например, ионообменную хроматографию, аффинную хроматографию и колоночную хроматографию с использованием молекулярных сит), центрифугирование, дифференциальное растворение или любую другую стандартную методики для очистки белка. Аффинные тэги, такие как гексагистидин, мальтозосвязывающий домен, последовательности оболочки вируса гриппа и глутатион-S-трансфераза могут быть присоединены к белку с целью обеспечения легкой очистки при прохождении по соответствующей колонке для аффинной хроматографии. Аффинная хроматография, используемая для очистки иммуноглобулинов, может включать в себя хроматографию с использованием белка A, белка G и белка L. Выделенные белки могут быть физически охарактеризованы с помощью таких методик, как протеолиз, эксклюзионная хроматография (SEC), масс-спектрометрия (МС), ядерный магнитный резонанс (ЯМР), изоэлектрическое фокусирование (IEF), высокоэффективная жидкостная хроматография (ВЭЖХ) и рентгеновская кристаллография. Чистота выделенных белков может быть определена с помощью методик, известных специалистам в данной области, в том числе, но не ограничиваясь ими, SDS-PAGE, SEC, капиллярный гель-электрофорез, IEF и капиллярное изоэлектрическое фокусирование (cIEF).
[00183] В некоторых вариантах осуществления супернатанты из экспрессионных систем, которые секретируют рекомбинантный белок в культуральную среду, сначала концентрируют с помощью коммерчески доступного фильтра для концентрирования белка, например, ультрафильтрационного блока Amicon® или Millipore Pellicon®. После стадии концентрирования концентрат может быть нанесен на соответствующую матрицу для очистки. В некоторых вариантах осуществления используют анионобменную смолу, к примеру, матрицу или субстрат, имеющий боковые диэтиламиноэтиловые (DEAE) группы. Матрицы могут быть акриламидного, агарозного, декстранового, целлюлозного или других типов, обычно используемых в очистке белка. В некоторых вариантах осуществления используют этап обмена катионов. Подходящие катионные обменники включают в себя различные нерастворимые матрицы, содержащие сульфопропиловые или карбоксиметиловые группы. В некоторых вариантах осуществления используют среду на основе гидроксиапатита, в том числе, но не ограничиваясь ими, керамический гидроксиапатит (CHT). В некоторых вариантах осуществления для дополнительной очистки рекомбинантного белка используют один или несколько этапов ВЭЖХ с обращенной фазой с использованием гидрофобных сред для ОФ-ВЭЖХ, например, силикагеля, имеющего боковые метильные или другие алифатические группы. В некоторых вариантах осуществления используют хроматографию гидрофобного взаимодействия (HIC) для разделения рекомбинантных белков на основе их гидрофобности. HIC представляет собой пригодную методику разделения для очистки белков, при этом поддерживается биологическая активность благодаря применению условий и матриц, которые функционируют в менее денатурирующих условиях, чем некоторые другие методики. Некоторые или все из вышеизложенных этапов очистки в различных комбинациях могут быть использованы для получения гомогенного рекомбинантного белка.
[00184] GCGR-связывающие белки по данному раскрытию могут быть проанализированы в отношении своих физических/химических свойств и/или биологических активностей с помощью различных анализов, известных в данной области техники. В некоторых вариантах осуществления GCGR-связывающий белок (например, анти-GCGR антитело) оценивают в отношении его способности связывать GCGR. Анализы связывания включают в себя, но не ограничиваясь ими, Biacore, ИФА и FACS.
[00185] В некоторых вариантах осуществления антитела, полученные, против GCGR, характеризуют на основании их связывающих свойств. В некоторых вариантах осуществления антитела группируют совместно на основании эпитопа, который каждое отдельное антитело распознает и/или связывает, процесс, которой известен как «эпитоп-специфическая сортировка». Как правило, при эпитоп-специфической сортировке антитела исследуют попарным комбинаторным образом и антитела, которые конкурируют друг с другом (т.е., связывают тот же самый или аналогичные эпитопы), группируют вместе в группы. К примеру, при количественном анализе связывания первое антитело вначале иммобилизируют на поверхности и предварительно перемешанный раствор второго антитела и антигена/целевого белка пропускают через иммобилизированное первое антитело. Совместно антиген/целевой белок иммобилизируют на поверхности и два антитела пропускают через иммобилизированный антиген и они конкурируют за связывание с иммобилизированным антигеном/целевым белком. В каждой из таких методик могут быть идентифицированы антитела, которые блокируют друг друга. Профиль конкурентного блокирования создают для каждого антитела по отношению к другим антителам. Результаты определяют, в какую группу помещается каждое антитело. Способы эпитоп-специфической сортировки с высокой пропускной способностью известны в данной области техники и позволяют осуществлять скрининг и характеристику больших количеств антитела в течение короткого периода времени. Антитела, которые связывают аналогичные эпитопы, часто имеют аналогичные функции. В отличие от этого, антитела, которые связывают различные эпитопы, могут иметь различные функциональные активности.
[00186] Связывание эпитопов представляет собой процесс идентификации связывающего сайта (например, эпитопа) на целевом белке, который антитело (или другой связывающий агент) связывает. Ряд способов известны в данной области техники для картирования связывающих сайтов и/или эпитопов на целевых белках. Эти способы включают в себя мутагенез, в том числе, но не ограничиваясь ими, сайт-направленный мутагенез и сканирующий аланином мутагенез; сканирование доменов или фрагментов; пептидное сканирование (например, технология Pepscan); способы дисплея (например, фагового дисплея, микробного дисплея и рибосомного/мРНК-дисплея); способы, включающие протеолиз и масс-спектроскопию; и структурный анализ (например, рентгеноструктурная кристаллография и ЯМР).
[00187] В некоторых вариантах осуществления анти-GCGR антитела характеризуют с помощью анализов, в том числе, но не ограничиваясь ими, N-концевого сиквенирования, аминокислотного анализа, высокоэффективной жидкостной хроматографии (ВЭЖХ), масс-спектрометрии, ионообменной хроматографии и переваривания папаином.
[00188] В некоторых вариантах осуществления GCGR-связывающий белок (например, анти-GCGR антитело) исследуют в отношении его способности модулировать активность GCGR. В некоторых вариантах осуществления предложены анализы для идентификации анти-GCGR антител, которые усиливают активность GCGR. В некоторых вариантах осуществления предложены анализы для идентификации анти-GCGR антител, которые ингибируют активность GCGR. Циклическая АМФ (цАМФ) представляет собой один из наиболее важных внутриклеточных посредников GPCR. Во многих типах клеток продуцирование цАМФ является результатом регуляции аденилатциклазы Gα-субъединицей G-белка. К примеру, активация GCGR глюкагоном приводит к продуцированию цАМФ. В некоторых вариантах осуществления активация GCGR может быть оценена с помощью анализа продуцирования цАМФ и, в свою очередь, антагонисты GCGR могут подлежать скринингу в отношении их способности ингибировать продуцирование цАМФ. К примеру, в некоторых вариантах осуществления клетки получают и распределяют на планшеты, а затем инкубируют с GCGR-связывающим белком (например, анти-GCGR антителом). После подходящего периода времени смесь клетка/GCGR-связывающий белок инкубируют с глюкагоном. В конечном итоге уровни цАМФ определяют в клетках, обработанных GCGR-связывающими белками и сравнивают с уровнями цАМФ в подходящих контрольных клетках. В некоторых вариантах осуществления определяют IC50 антагониста GCGR (например, анти-GCGR антитела). «IC50» относится к полумаксимальной ингибирующей концентрации агента и представляет собой показатель эффективности агента в ингибировании конкретной биологической или биохимической функции.
[00189] В данном раскрытии также предложены конъюгаты, содержащие любой из GCGR-связывающих белков, описанных в данном документе. В некоторых вариантах осуществления анти-GCGR антитело прикрепляется к второй молекуле. В некоторых вариантах осуществления анти-GCGR антитело конъюгируют с цитотоксическим агентом или фрагментом. В некоторых вариантах осуществления анти-GCGR антитело конъюгируют с цитотоксическим агентом с образованием ADC (конъюгата антитело-лекарственный препарат). В некоторых вариантах осуществления цитотоксичесий агент представляет собой химиотерапевтический агент, в том числе, но не ограничиваясь ими, метотрексат, адриамицин/доксорубицин, мелфалан, митомицин C, хлорамбуцил, дуокармицин, даунорубицин, пирролобензолдиазепины (PBD) или другие интеркалирующие агенты. В некоторых вариантах осуществления цитотоксический агент представляет собой ингибитор микротрубочек, в том числе, но не ограничиваясь ими, ауристатины, майтанзиноиды (например, DMI и DM4) и тубулизины. В некоторых вариантах осуществления цитотоксический агент представляет собой ферментативно активный токсин бактериальной, грибной, растительной или животной природы, или их фрагменты, в том числе, но не ограничиваясь ими, А-цепь дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, А-цепь экзотоксина, А-цепь рицина, А-цепь абрина, А-цепь модецина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) конъюгируют с одним или несколькими низкомолекулярными токсинами, такими как калихеамицины, майтансиноиды, трихотены и CC1065. Также может быть использовано производное любого из этих токсинов, поскольку производное сохраняет цитотоксическую активность.
[00190] Конъюгаты, содержащие белок (например, антитело), могут быть использованы с помощью любого подходящего способа, известного в данной области техники. В некоторых вариантах осуществления конъюгаты получают с помощью различных бифункциональных связывающих белок агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (таких как диметиладипимидат HCl), активных сложных эфиров (таких как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)-этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол).
[00191] В некоторых вариантах осуществления GCGR-связывающий белок (например, анти-GCGR антитело) конъюгируют с детектируемым веществом или молекулой, которая позволяет использовать белок для диагностики и/или детекции. Детектируемое вещество может быть выбрано из группы, включающей, но не ограничиваясь ими, ферменты, такие как пероксидаза хрена, щелочная фосфатаза, бета-галактозидаза и ацетилхолинэстераза; простетические группы, такие как стрептавидин/биотин и авидин/биотин; флуоресцентные вещества, такие как умбеллиферон, флуоресцеин, флуоресцеина изотиоционат, родамин, дихлортриазиниламинфлуоресцеин и фикоэритрин; биолюминесцентные вещества, такие как люцифераза, люциферин и экворин; хемилюминесцентные вещества, такие как люминол и акридиний; радиоактивные вещества, такие как 131I, 125I, 123I, 121I,14C, 35S, 3H, 115In, 113In, 112In, 111In, 99mTc, 201Ti, 68Ga, 67Ga, 103Pd, 99Mo, 133Xe, 18F, 153Sm, 177Lu, 159Gd, 149Pm, 140La, 175Yb, 166Ho, 90Y, 47Sc, 186Re, 188Re, 142Pr, 105Rh, 97Ru, 68Ge, 57Co, 65Zn, 85Sr, 32P, 153Gd, 169Yb, 51Cr, 54Mn, 75Se, 113Sn, 67Cu, 212Bi и 117Sn; позитрон-эмиттирующие вещества; и нерадиоактивные парамагнитные ионы металлов.
[00192] В некоторых вариантах осуществления GCGR-связывающий белок (например, анти-GCGR антитело), описанный данном документе, может быть конъюигровано со вторым антителом с образованием гетероконъюгата антитела.
[00193] В некоторых вариантах осуществления GCGR-связывающий белок (например, анти-GCGR антитело), описанный в данном документе, может быть прикреплен к твердой подложке и использован в иммунологических анализах или для очистки целевого антигена. Такие твердые подложки включают в себя, но не ограничиваясь ими, стекло, целлюлозу, полиакриламид, нейлон, полистирен, поливинилхлорид или полипропилен.
III. Полинуклеотиды
[00194] В некоторых вариантах осуществления данное раскрытие охватывает полинуклеотиды, содержащие GCGR-связывающий белок, описанный в данном документе. Термин «полинуклеотиды, кодирующие полипептиды» охватывает полинуклеотид, который содержит только кодирующие последовательности для полипептида, а также полинуклеотид, который содержит дополнительные кодирующие и/или некодирующие последовательности. Полинуклеотиды по данному раскрытию могут находиться в форме РНК или в форме ДНК. ДНК включает в себя кДНК, геномную ДНК и синтетическую ДНК; и может быть двуцепочечной или одноцепочечной, и будучи одноцепочечной, может представлять собой кодирующую нить или некодирующую (антисмысловую) нить.
[00195] В некоторых вариантах осуществления полинуклеотид содержит полинуклеотид (например, нуклеотидную последовательность), кодирующий полипептид, содержащий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO:220, 221, 25, 26, 51, 52, 71, 72, 97, 98, 122, 123, 144, 145, 164, 165, 188, 189, 203, 204, 218 и 219. В некоторых вариантах осуществления полинуклеотид содержит полинуклеотид (например, нуклеотидную последовательность), кодирующий полипептид, содержащий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO:233, 234, 235 и 236. В некоторых вариантах осуществления полинуклеотид содержит полинуклеотид (например, нуклеотидную последовательность), кодирующий полипептид, содержащий более одной аминокислотной последовательности, выбранной из группы, состоящей из: SEQ ID NO: 220, 221, 25, 26, 51, 52, 71, 72, 97, 98, 122, 123, 144, 145, 164, 165, 188, 189, 203, 204, 218 и 219. В некоторых вариантах осуществления полинуклеотид содержит полинуклеотид (например, нуклеотидную последовательность), кодирующий полипептид, содержащий более одной аминокислотной последовательности, выбранной из группы, состоящей из: SEQ ID NO: 233, 234, 235 и 236. В некоторых вариантах осуществления полинуклеотид содержит полинуклеотид (например, нуклеотидную последовательность), кодирующий полипептид, содержащий SEQ ID NO:233 и SEQ ID NO:235. В некоторых вариантах осуществления полинуклеотид содержит полинуклеотид (например, нуклеотидную последовательность), кодирующий полипептид, содержащий SEQ ID NO:234 и SEQ ID NO:236.
[00196] В некоторых вариантах осуществления полинуклеотид содержит полинуклеотид, имеющий нуклеотидную последовательность, на, по меньшей мере, приблизительно 80% идентичную, на, по меньшей мере, приблизительно 85% идентичную 90%, на, по меньшей мере, приблизительно 95% идентичную и в некоторых вариантах осуществления на, по меньшей мере, приблизительно 96%, 97%, 98% или 99% идентичную полинуклеотиду, кодирующему аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO:220, 221, 25, 26, 51, 52, 71, 72, 97, 98, 122, 123, 144, 145, 164, 165, 188, 189, 203, 204, 218 и 219. В некоторых вариантах осуществления полинуклеотид содержит полинуклеотид, имеющий нуклеотидную последовательность, на, по меньшей мере, приблизительно 80% идентичную, на, по меньшей мере, приблизительно 85% идентичную 90%, на, по меньшей мере, приблизительно 95% идентичную и в некоторых вариантах осуществления на, по меньшей мере, приблизительно 96%, 97%, 98% или 99% идентичную полинуклеотиду, кодирующему аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO:233, 234, 235 и 236. Также предложен полинуклеотид, который содержит полинуклеотид, который гибридизируется с полинуклеотидом, кодирующим аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 220, 221, 25, 26, 51, 52, 71, 72, 97, 98, 122, 123, 144, 145, 164, 165, 188, 189, 203, 204, 218, 219, 233, 234, 235 и 236. В некоторых вариантах осуществления гибридизация происходит в условиях высокой жесткости, как известно специалистам в данной области техники.
[00197] В некоторых вариантах осуществления полинуклеотид содержит кодирующую последовательность для полипептида (например, антитела), слитого в одной и той же рамке считывания с полинуклеотидом, который облегчает, к примеру, экспрессию и секрецию полипептида из клетки-хозяина (например, лидерной последовательности, которая функционирует в качестве секреторной последовательности для контроля транспорта полипептида). Полипептид может иметь лидерную последовательность, расщепляемую клеткой-хозяином, с образованием «зрелой» формы полипептида.
[00198] В некоторых вариантах осуществления полинуклеотид содержит кодирующую последовательность для полипептида (например, антитела), слитого в одной и той же рамке считывания, с маркерной последовательностью или последовательностью тэга. К примеру, в некоторых вариантах осуществления маркерная последовательность представляет собой гексагистидиновый тэг, поставляемый вектором, который способствует эффективной очистке полипептида, слитого с маркером, в случае бактериального хозяина. В некоторых вариантах осуществления маркерная последовательность представляет собой гемагглютининовый (HA) тэг, происходящий из белка гемагглютинина вируса гриппа в случае, если используется относящийся к млекопитающему хозяин (например, клетки COS-7). В некоторых вариантах осуществления маркерная последовательность представляет собой FLAG-тэг. В некоторых вариантах осуществления маркер может быть использован в сочетании с другими тэгами аффинности.
[00199] Данное раскрытие дополнительно относится к вариантам полинуклеотидов, описанных в данном документе, при этом вариант кодирует, к примеру, фрагменты, аналоги и/или производные полипептида. В некоторых вариантах осуществления в данном раскрытии предложен полинуклеотид, при этом полинуклеотид имеющий нуклеотидную последовательность, на, по меньшей мере, приблизительно 80% идентичную, на, по меньшей мере, приблизительно 85% идентичную 90%, на, по меньшей мере, приблизительно 95% идентичную и в некоторых вариантах осуществления на, по меньшей мере, приблизительно 96%, 97%, 98% или 99% идентичную полинуклеотиду, кодирующему полипептид, содержащий GCGR-связывающий белок, описанный в данном документе.
[00200] Используемая в данном документе фраза «полинуклеотид, имеющий нуклеотидную последовательность, на по меньшей мере, к примеру, 95% идентичную эталонной нуклеотидной последовательности» предполагает означать, что нуклеотидная последовательность полинуклеотида является идентичной эталонной последовательности, за исключением того, что полинуклеотидная последовательность может содержать до пяти мутаций включительно на каждые 100 нуклеотидов эталонной нуклеотидной последовательности. Другими словами, для получения полинуклеотида, имеющего нуклеотидную последовательность, на, по меньшей мере, 95% идентичную эталонной нуклеотидной последовательности, до 5% включительно нуклеотидов в эталонной последовательности может быть удалено или замещено другим нуклеотидом, или ряд нуклеотидов до 5% включительно от всех нуклеотидов в эталонной последовательности может быть вставлено в эталонную последовательность. Эти мутации эталонной последовательности могут происходить в 5′- или 3′-концевых положениях эталонной нуклеотидной последовательности или в любом месте между этими концевыми последовательностями, вставленными как отдельно между нуклеотидами в эталонной последовательности, так и в одной или нескольких прилегающих группах в эталонной последовательности.
[00201] Полинуклеотидные варианты могут содержать изменения в кодирующих областях, некодирующих областях или и в обеих. В некоторых вариантах осуществления полинуклеотидный вариант содержат изменения, которые приводят к молчащим заменам, добавлениям или делециям, но не изменяют свойства или активности кодируемого полипептида. В некоторых вариантах осуществления полинуклеотидный вариант содержит молчащие замены, которые приводят к отсутствию изменения аминокислотной последовательности полипептида (вследствие вырожденного генетического кода). Полинуклеотидные варианты могут быть получены по разным причинам, к примеру, с целью оптимизации экспрессии кодонов для определенного хозяина (например, изменения кодонов в человеческой мРНК на таковые, предпочтительные бактериальным хозяином, таким как E. coli). В некоторых вариантах осуществления полинуклеотидный вариант содержит, по меньшей мере, одну молчащую мутацию в некодирующей или кодирующей области последовательности.
[00202] В некоторых вариантах осуществления полинуклеотидный вариант получают для модулирования или изменения экспрессии (или уровней экспрессии) кодируемого полипептида. В некоторых вариантах осуществления полинуклеотидный вариант получают для повышения экспрессии кодируемого полипептида. В некоторых вариантах осуществления полинуклеотидный вариант получают для снижения экспрессии кодируемого полипептида. В некоторых вариантах осуществления полинуклеотидный вариант имеет повышенную экспрессию кодируемого полипептида по сравнению с исходной полинуклеотидной последовательностью. В некоторых вариантах осуществления полинуклеотидный вариант имеет пониженную экспрессию кодируемого полипептида по сравнению с исходной полинуклеотидной последовательностью.
[00203] В некоторых вариантах осуществления полинуклеотиды являются выделенными. В некоторых вариантах осуществления полинуклеотиды являются по сути чистыми.
[00204] Также предложены векторы и клетки, содержащие полинуклеотиды, описанные в данном документе. В некоторых вариантах осуществления экспрессионный вектор содержит полинуклеотидную молекулу. В некоторых вариантах осуществления клетка-хозяин содержит экспрессионный вектор. В некоторых вариантах осуществления клетка-хозяин содержит экспрессионный вектор, содержащий полинуклеотидную молекулу. В некоторых вариантах осуществления клетка-хозяин содержит полинуклеотидную молекулу.
IV. Способы применения и фармацевтические композиции
[00205] GCGR-связывающий белок по данному раскрытию может быть использован, к примеру, в терапевтических способах in vitro, ex vivo и in vivo. В некоторых вариантах осуществления данное раскрытие предлагает способы, либо in vivo, либо in vitro, включающие воздействие на клетку GCGR-связывающего белка (например, анти-GCGR антитела).
[00206] GCGR-связывающие белки (например, антитела), описанные в данном документе, пригодны в ряде областей применения, в том числе, но не ограничиваясь им, терапевтическом лечении ряда синдромов, нарушений и/или заболеваний. В некоторых вариантах осуществления предложен способ лечения заболевания, нарушения или патологического состояния у субъекта, при этом способ включает введение субъекту эффективного количества анти-GCGR антитела, описанного в данном документе. В определенных вариантах осуществления способ лечения заболевания, нарушения или патологического состояния у субъекта включает введение субъекту эффективного количества фармацевтического состава, содержащего анти-GCGR антитело, описанное в данном документе, и необязательно, по меньшей мере, одного дополнительного терапевтического агента.
[00207] В некоторых вариантах осуществления GCGR-связывающий белок, описанный в данном документе, вводят человеку с терапевтическими целями. В некоторых вариантах осуществления GCGR-связывающий белок, описанный в данном документе, вводят не относящемуся к человеку млекопитающему (например, примату, собаке, кошке, свинье, крысе или мыши). В некоторых вариантах осуществления GCGR-связывающий белок вводят не относящемуся к человеку млекопитающему с ветеринарными целями или для исследования в животной модели заболевания человека. В некоторых вариантах осуществления животные модели пригодны для оценки терапевтической эффективности GCGR-связывающего белка, описанного в данном документе (например, исследования дозы и/или временной динамики введения).
[00208] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело), описанный в данном документе, является пригодным в способах ингибирования активности GCGR. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело), описанный в данном документе, является пригодным в способах ингибирования активности глюкагона. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело), описанный в данном документе, является пригодным в способах уменьшения или снижения уровней глюкозы в крови. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело), описанный в данном документе, является пригодным в способах повышения уровней С-пептида в крови. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело), описанный в данном документе, является пригодным в способах повышения уровней инсулина в крови. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело), описанный в данном документе, является пригодным в способах повышения уровней инсулина в поджелудочной железе. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой анти-GCGR антитело, выбранное из группы, состоящей из 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой антитело, которое содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой антитело, которое содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой антитело, которое содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой анти-GCGR антитело Hz6B5.
[00209] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело), описанный в данном документе, является пригодным в способах лечения гипергликемии. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело), описанный в данном документе, является пригодным в способах лечения сахарного диабета. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело), описанный в данном документе, является пригодным в способах лечения сахарного диабета 1 типа. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело), описанный в данном документе, является пригодным в способах лечения сахарного диабета 2 типа. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой анти-GCGR антитело, выбранное из группы, состоящей из 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой антитело, которое содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой антитело, которое содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой антитело, которое содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой анти-GCGR антитело Hz6B5.
[00210] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело), описанный в данном документе, является пригодным для лечения заболевания, нарушения или патологического состояния, ассоциированного с нарушением функции бета-клеток. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело), описанный в данном документе, является пригодным для лечения заболевания, нарушения или патологического состояния, связанного с дефектами бета-клеток. Фраза «заболевание, нарушение или патологическое состояние, ассоциированное с нарушением функции бета-клеток» используется в данном документе взаимозаменяемо с фразой «заболевание, нарушение или патологическое состояние, связанное с дефектами бета-клеток». Используемая в данном документе фраза «заболевание, нарушение или патологическое состояние, ассоциированное с нарушением функции бета-клеток» относится к любому заболеванию, которое полностью или частично вызвано или является результатом дефекта или недостаточности бета-клеток. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние, ассоциированное с нарушением функции бета-клеток, представляет собой сахарный диабет. В определенных вариантах осуществления заболевание, нарушение или патологическое состояние, ассоциированное с нарушением функции бета-клеток, представляет собой инсулинзависимый сахарный диабет или сахарный диабет 1 типа (например, ювенильный сахарный диабет, лабильный сахарный диабет, инсулинзависимый сахарный диабет (IDDM)). В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние, ассоциированное с нарушением функции бета-клеток, представляет собой инсулиннезависимый сахарный диабет (NIDDM)/сахарный диабет 2 типа. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние, ассоциированное с нарушением функции бета-клеток, представляет собой латентный аутоиммунный сахарный диабет взрослых (LADA). В определенных вариантах осуществления заболевание, нарушение или патологическое состояние, ассоциированное с нарушением функции бета-клеток, представляет собой дислипидемию и одно из ее последствий (например, атеросклероз, ишемическую болезнь сердца и нарушения мозгового кровообращения), гиперлипидемию, гипергликемию, связанное с гипергликемией нарушение (например, повреждение почек (например, повреждение канальцев или нефропатия), дегенерацию печени, повреждение глаз (например, диабетическую ретинопатию или катаракты), и нарушения, связанные с диабетической стопой), гиперхолестеринемию, гипертриглицеридемию, гипертензию, сердечнососудистое заболевание, инсульт, сердечную недостаточность, гиперинсулинемию, диабетическое осложнение, нарушение толерантности к глюкозе, инсулинорезистентность, нарушенный метаболизм глюкозы, «преддиабет» (нарушение содержания глюкозы в крови натощак или нарушение толерантности к глюкозе), ожирение (в том числе коморбидные состояния ожирения, такие как, но не ограничиваясь ими, синдром обструктивного апноэ во сне, неалкогольная жировая болезнь печени (NAFLD), неалкогольный стеатогепатит (NASH) и синдром поликистозных яичников), или нежелательный вес или масса тела (например, выше нормального индекс массы тела, или «ИМТ», по отношению к подходящему сопоставимому субъекту сопоставимого возраста, пола, расы и т.д.), или комбинацию из их двух или более. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние, ассоциированное с нарушением функции бета-клеток, представляет собой NAFLD. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние, ассоциированное с нарушением функции бета-клеток, представляет собой NASH. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой анти-GCGR антитело, выбранное из группы, состоящей из 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой антитело, которое содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой антитело, которое содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой антитело, которое содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой анти-GCGR антитело Hz6B5.
[00211] В некоторых вариантах осуществления способ, описанный в данном документе, включает лечение, предупреждение или облегчение заболевания, нарушения или патологического состояния, в том числе лечение, предупреждение или облегчение одного или нескольких симптомов заболевания, нарушения или патологического состояния у субъекта. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние, подлежащее лечению или предупреждению, включает в себя нарушение утилизации глюкозы и последствия, ассоциированные с ним, в том числе сахарный диабет (1 типа и 2 типа), гестационный сахарный диабет, гипергликемию, инсулинорезистентность, нарушенный метаболизм глюкозы, «преддиабет» или другие физиологические нарушения, ассоциированные с ними, или которые являются результатом гипергликемического состояния, в том числе, к примеру, гистопатологические изменения, такие как деструкция бета-клеток поджелудочной железы. В некоторых вариантах осуществления субъект с заболеванием, нарушением или патологическим состоянием, нуждающийся в лечении, имеет уровень глюкозы крови натощак более чем приблизительно 100 мг/дл. Другие связанные с гипергликемией нарушения включают, но не ограничиваясь ими, нарушение почек (например, нарушение канальцев или нефропатию), дегенерацию печени, нарушение глаз (например, диабетическую ретинопатию или катаракты), и нарушения, связанные с диабетической стопой. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние, подлежащее лечению или предупреждению, включает в себя дислипидемию и последствия, ассоциированные с ней, такие как атеросклероз, ишемическая болезнь сердца, нарушения мозгового кровообращения и т.п. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние, подлежащее лечению или предупреждению, ассоциировано с метаболическим синдромом, в том числе, но не ограничиваясь ими, ожирением и повышенной массой тела, NAFLD, NASH, PCOS, тромбозами, гиперкоагуляционными и протромбическими состояниями (артериальным и венозным), гипертензией, сердечнососудистым заболеванием, инсультом и сердечной недостаточностью. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние, подлежащее лечению или предупреждению, представляет собой ожирение. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние, подлежащее лечению или предупреждению, представляет собой NAFLD. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние, подлежащее лечению или предупреждению, представляет собой NASH. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние, подлежащее лечению или предупреждению, включает в себя атеросклероз, хронические воспалительные заболевания кишечника (например, болезнь Крона и язвенный колит), астму, красную волчанку, артрит или другие воспалительные ревматические нарушения. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние, подлежащее лечению или предупреждению, включает в себя опухоли жировых клеток, липоматозные карциномы, в том числе, к примеру, липосаркомы, солидные опухоли и новообразования. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние, подлежащее лечению или предупреждению, включает в себя нейродегенеративные заболевания и/или демиелинизирующие нарушения центральной и периферической нервных систем и/или неврологические заболевания, в том числе нейровоспалительные процессы и/или другие периферические нейропатии, в том числе болезнь Альцгеймера, рассеянный склероз, болезнь Паркинсона, прогрессирующую многоочаговую лейкоэнцефалопатию и синдром Гиейена-Барре. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние, подлежащее лечению или предупреждению, включает в себя кожные и дерматологические нарушения и/или нарушения процессов заживления ран, в том числе эритематозно-сквамозные дерматозы. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние, подлежащее лечению или предупреждению, включает в себя синдром X, остеоартрит и острый респираторный дистресс-синдром. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой анти-GCGR антитело, выбранное из группы, состоящей из 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой антитело, которое содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой антитело, которое содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой антитело, которое содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой анти-GCGR антитело Hz6B5.
[00212] В некоторых вариантах осуществления a GCGR-связывающий белок (например, антитело), описанный в данном документе, используют для лечения или предупреждения заболевания, нарушения или патологического состояния, в том числе, к примеру, гипергликемии, сахарного диабета 1 типа, сахарного диабета 2 типа, ожирения, дислипидемии, NASH, сердечнососудистого заболевания, метаболического синдрома или в широком смысле любого заболевания, нарушения или патологического состояния, при котором желательно ингибировать эффекты глюкагона in vivo. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой анти-GCGR антитело, выбранное из группы, состоящей из 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой антитело, которое содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой антитело, которое содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой антитело, которое содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления способов, описанных в данном документе, GCGR-связывающий белок представляет собой анти-GCGR антитело Hz6B5.
[00213] В некоторых вариантах осуществления способ лечения сахарного диабета 1 типа у субъекта включает введение субъекту терапевтически эффективного количества анти-GCGR-антитела, описанного в данном документе. Сахарный диабет 1 типа представляет собой аутоиммунное заболевание, характеризующееся высокими уровнями глюкозы в крови, являющиеся результатом потери массы и/или функции бета-клеток поджелудочной железы и потери продуцирования инсулина. Симптомы сахарного диабета 1 типа, как правило, представляют собой результат гипергликемии и расщепления жировой массы тела. Симптомы включают в себя, но не ограничиваясь ими, избыточную жажду (полидипсию), учащенное мочеиспускание (полиурию), чрезмерное чувство голода (полифагию), крайнюю усталость, потерю веса и кетоны, присутствующие в моче. В некоторых вариантах осуществления сахарный диабет 1 типа представляет собой латентный аутоиммунный сахарный диабет взрослых (LADA). В некоторых вариантах осуществления анти-GCGR антитело выбирают из группы, состоящей из 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления анти-GCGR антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления анти-GCGR антитело представляет собой Hz6B5.
[00214] В некоторых вариантах осуществления способ лечения сахарного диабета 2 типа у субъекта включает введение субъекту терапевтически эффективного количества анти-GCGR-антитела, описанного в данном документе. Как правило, сахарный диабет 2 типа, является результатом инсулинорезистентности и/или сниженной секреции инсулина. В тоже же время многие субъекты с сахарным диабетом 2 типа также имеют значительно сниженную массу и функцию бета-клеток поджелудочной железы, что в конечном итоге приводит к недостаточности инсулина. Симптомы сахарного диабета 2 типа включают в себя, но не ограничиваясь ими, гипергликемию, усталость, сухость или зуд кожи, размытое зрение, повышенную жажду, учащенное мочеиспускание, медленное заживание порезов или ран, высокую частоту инфекций, а также онемение и покалывание стопы. В случае отсутствия лечения может возникать большинство серьезных симптомов, в том числе тяжелая гипергликемия (например, уровни глюкозы свыше 600 мг/дл), летаргия, спутанность сознания, шок и/или гиперосмолярная гипергликемическая некетоническая кома. В некоторых вариантах осуществления анти-GCGR антитело выбирают из группы, состоящей из 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления анти-GCGR антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления анти-GCGR антитело представляет собой Hz6B5.
[00215] В некоторых вариантах осуществления способ лечения гипергликемии у субъекта включает введение субъекту терапевтически эффективного количества анти-GCGR-антитела, описанного в данном документе. Используемый в данном документе термин «гиперкликемия» или «гипергликемический» при использовании с отсылкой на заболевание, нарушение или патологическое состояние субъекта, относится к временному или хроническому аномально высокому уровню глюкозы, присутствующей в крови субъекта. Заболевание, нарушение или патологическое состояние может быть вызвано задержкой метаболизма и всасывания глюкозы, в результате чего субъект проявляет нарушение толерантности к глюкозе или состояние повышенного уровня глюкозы, в типичном случае не встречающееся у нормальных субъектов. Считается, что уровни глюкозы в крови натощак находятся в «нормальном» диапазоне при менее чем приблизительно 100 мг/дл, в случае нарушенного метаболизма - от приблизительно 100 до 126 мг/дл, и в случае сахарного диабета - более чем приблизительно 126 мг/дл. В некоторых вариантах осуществления анти-GCGR антитело выбирают из группы, состоящей из 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления анти-GCGR антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления анти-GCGR антитело представляет собой Hz6B5.
[00216] В некоторых вариантах осуществления способ лечения ожирения или нежелательной массы тела у субъекта (в том числе коморбидных состояний ожирения, к примеру, синдрома обструктивного апноэ во сне, артрита, рака (например, молочной железы, эндометрия и толстой кишки), камней желчного пузыря или гипергликемии) включает введение субъекту терапевтически эффективное количество анти-GCGR антитела, описанного в данном документе. В некоторых вариантах осуществления субъект имеет индексы массы тела более чем 25, к примеру, 25-30, 30-35, 35-40 или более чем 40. В некоторых вариантах осуществления анти-GCGR антитело выбирают из группы, состоящей из 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления анти-GCGR антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления анти-GCGR антитело представляет собой Hz6B5.
[00217] В некоторых вариантах осуществления способ лечения заболевания, нарушения или патологического состояния, ассоциированного с нарушением функции бета-клеток, у субъекта включает введение субъекту терапевтически эффективного количества анти-GCGR антитела, описанного в данном документе. В некоторых вариантах осуществления способ лечения заболевания, нарушения или патологического состояния, связанного с дефектами бета-клеток, у субъекта включает введение субъекту терапевтически эффективного количества анти-GCGR антитела, описанного в данном документе. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние представляет собой сахарный диабет 1 типа. В некоторых вариантах осуществления заболевание, нарушение или патологическое состояние представляет собой сахарный диабет 2 типа. В некоторых вариантах осуществления анти-GCGR антитело выбирают из группы, состоящей из 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления анти-GCGR антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления анти-GCGR антитело представляет собой Hz6B5.
[00218] В некоторых вариантах осуществления способов, описанных в данном документе, лечение (i) снижает уровни глюкозы в крови, (ii) повышает уровень C-пептида в крови, (iii) повышает уровни C-пептида в поджелудочной железе, (iv) снижает уровни глюкозы и повышает уровень C-пептида в крови, и/или (v) снижает уровни глюкозы в крови и повышает уровень C-пептида в поджелудочной железе. В некоторых вариантах осуществления способов, описанных в данном документе, лечение снижает уровни глюкозы в крови. В некоторых вариантах осуществления способов, описанных в данном документе, лечение повышает уровень C-пептида в крови. В некоторых вариантах осуществления способов, описанных в данном документе, лечение повышает уровни C-пептида в поджелудочной железе. В некоторых вариантах осуществления способов, описанных в данном документе, лечение снижает уровни глюкозы в крови и повышает уровень C-пептида в крови. В некоторых вариантах осуществления способов, описанных в данном документе, лечение снижает уровни глюкозы в крови и повышает уровень C-пептида в поджелудочной железе. В некоторых вариантах осуществления лечение повышает уровень инсулина в крови. В некоторых вариантах осуществления лечение повышает уровень/содержание инсулина в поджелудочной железе.
[00219] В некоторых вариантах осуществления способ улучшения функции бета-клеток у субъекта включает введение субъекту терапевтически эффективного количества анти-GCGR-антитела, описанного в данном документе. В некоторых вариантах осуществления на улучшение функции бета-клеток указывает снижение уровня глюкозы в крови, повышение уровня C-пептида и/или повышение уровня инсулина. В некоторых вариантах осуществления продуцирование инсулина оценивают с помощью любого прямого или непрямого способа, известного специалистам в данной области техники. В некоторых вариантах осуществления анти-GCGR антитело выбирают из группы, состоящей из 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления анти-GCGR антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления анти-GCGR антитело представляет собой Hz6B5.
[00220] В некоторых вариантах осуществления способ уменьшения или снижения уровней глюкозы в крови у субъекта включает введение субъекту терапевтически эффективного количества анти-GCGR-антитела, описанного в данном документе. В некоторых вариантах осуществления способ повышения уровня инсулина в крови у субъекта включает введение субъекту терапевтически эффективного количества анти-GCGR антитела, описанного в данном документе. В некоторых вариантах осуществления способ повышения уровня инсулина в поджелудочной железе у субъекта включает введение субъекту терапевтически эффективного количества анти-GCGR антитела, описанного в данном документе. В некоторых вариантах осуществления способ повышения уровня С-пептида в крови у субъекта включает введение субъекту терапевтически эффективного количества анти-GCGR антитела, описанного в данном документе. В некоторых вариантах осуществления способ повышения уровня инсулина в крови у субъекта включает введение субъекту терапевтически эффективного количества анти-GCGR антитела, описанного в данном документе. В некоторых вариантах осуществления способ уменьшения или снижения уровней глюкозы в крови и повышения уровня С-пептида в крови у субъекта включает введение субъекту терапевтически эффективного количества анти-GCGR антитела, описанного в данном документе. В некоторых вариантах осуществления способов, описанных в данном документе, уровень C-пептида измеряют в образце крови, образце сыворотки крови, образце плазмы крови или образце поджелудочной железы. В некоторых вариантах осуществления способов, описанных в данном документе, уровень инсулина измеряют в образце крови, образце сыворотки крови, образце плазмы крови или образце поджелудочной железы. В некоторых вариантах осуществления анти-GCGR антитело выбирают из группы, состоящей из 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления анти-GCGR антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления анти-GCGR антитело представляет собой Hz6B5.
[00221] В определенных вариантах осуществления способ включает оценку эффективности анти-GCGR антитела, описанного в данном документе, в предупреждении или лечении заболевания, нарушения или патологического состояния, связанного с дефектами бета-клеток, у субъекта, при этом способ включает сравнение функции бета-клеток у субъекта до и после введения антитела. В некоторых вариантах осуществления повышение функции бета-клеток после введения антитела по сравнению с ситуацией до введения антитела указывает на эффективность антитела в предупреждении или лечении заболевания, нарушения или патологического состояния, связанного с дефектами бета-клеток, или их симптома. В некоторых вариантах осуществления способ включает оценку эффективности анти-GCGR антитела, описанного в данном документе, в предупреждении или лечении заболевания, нарушения или патологического состояния, связанного с дефектами бета-клеток, у субъекта, при этом способ включает сравнение уровня С-пептида в сыворотке крови или плазме крови у субъекта до и после введения антитела. В некоторых вариантах осуществления повышение уровня С-пептида в сыворотке крови или плазме крови после введения антитела по сравнению с ситуацией до введения антитела указывает на эффективность антитела в предупреждении или лечении заболевания, нарушения или патологического состояния, связанного с дефектами бета-клеток, или их симптома. В некоторых вариантах осуществления способ включает оценку эффективности анти-GCGR антитела, описанного в данном документе, в предупреждении или лечении заболевания, нарушения или патологического состояния, связанного с дефектами бета-клеток, у субъекта, при этом способ включает сравнение экспрессии генов Ins1, Ins2 и/или Ngn3 в поджелудочной железе у субъекта до и после введения антитела. В некоторых вариантах осуществления повышение экспрессии Ins1, Ins2 и/или Ngn3 в поджелудочной железе после введения антитела по сравнению с ситуацией до введения антитела указывает на эффективность антитела в предупреждении или лечении заболевания, нарушения или патологического состояния, связанного с дефектами бета-клеток, или их симптома. В некоторых вариантах осуществления снижение уровня глюкозы в крови после введения антитела по сравнению с ситуацией до введения антитела указывает на эффективность антитела в предупреждении или лечении заболевания, нарушения или патологического состояния, связанного с дефектами бета-клеток, или их симптома. В некоторых вариантах осуществления способ дополнительно включает одно или несколько последующих введений антитела субъекту после оценки эффективности. В некоторых вариантах осуществления анти-GCGR антитело выбирают из группы, состоящей из 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления анти-GCGR антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления анти-GCGR антитело представляет собой Hz6B5.
[00222] В некоторых вариантах осуществления способ включает выбор группы субъектов, имеющих заболевание, нарушение или патологическое состояние, связанное с дефектами бета-клеток, или их симптом, на основании функции бета-клеток с целью прогноза клинического ответа, отслеживания клинического ответа или отслеживания комплаентности субъекта дозированию анти-GCGR антителом, описанных в данном документе. В некоторых вариантах осуществления различных способов, предложенных в данном документе, субъект имеет повышенную функцию бета-клеток после лечения. В определенных вариантах осуществления способ включает выбор группы субъектов, имеющих заболевание, нарушение или патологическое состояние, связанное с дефектами бета-клеток, или их симптом, на основании уровня C-пептида в сыворотке крови, уровня инсулина в крови, уровня инсулина в поджелудочной железе и/или уровня глюкозы в крови с целью прогноза клинического ответа, отслеживания клинического ответа или отслеживания комплаентности субъекта дозированию анти-GCGR антителом, описанных в данном документе. В некоторых вариантах осуществления различных способов, предложенных в данном документе, субъект имеет повышенный уровень C-пептида в сыворотке крови, повышенный уровень инсулина в сыворотке крови, повышенный уровень инсулина в поджелудочной железе и/или сниженный уровень глюкозы в крови после лечения. В определенных вариантах осуществления способ включает выбор группы субъектов, имеющих заболевание, нарушение или патологическое состояние, связанное с дефектами бета-клеток, или их симптом, на основании экспрессии генов Ins1, Ins2 и/или Ngn3 в поджелудочной железе с целью прогноза клинического ответа, отслеживания клинического ответа или отслеживания комплаентности субъекта дозированию анти-GCGR антителом, описанных в данном документе. В некоторых вариантах осуществления различных способов, предложенных в данном документе, субъект имеет повышенную экспрессию Ins1, Ins2 и/или Ngn3 после лечения. В определенных вариантов осуществления уровни сравнивают с нормальной популяцией. В некоторых вариантах осуществления различных способов, предложенных в данном документе, субъект представляет собой субъекта, нуждающегося в лечении. В некоторых вариантах осуществления анти-GCGR антитело выбирают из группы, состоящей из 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления анти-GCGR антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления анти-GCGR антитело представляет собой Hz6B5.
[00223] В некоторых вариантов осуществления способов, описанных в данном документе, способ включает введение GCGR-связывающего белка (например, антитела), описанного в данном документе, в комбинации с, по меньшей мере, одним дополнительным терапевтическим агентом или терапевтическим лечением. При лечении двумя или несколькими терапевтическими агентами часто используют агенты, которые функционируют в результате различных механизмов действия, хотя это не требуется. Комбинированная терапия с использованием агентов с различными механизмами действия может приводить к дополнительным или синергическим эффектам. Комбинированная терапия может обеспечивать более низкую дозу каждого агента, чем используется в монотерапии, тем самым, снижая токсические побочные эффекты и/или повышая терапевтический индекс агента(агентов). Комбинированная терапия может снижать вероятность того, что будет развиваться устойчивость к агенту.
[00224] В некоторых вариантах осуществления комбинация GCGR-связывающего белка (например, антитела), описанного в данном документе, и, по меньшей мере, одного дополнительного терапевтического агента, приводит к аддитивным или синергическим результатам. В некоторых вариантах осуществления комбинированная терапия приводит к повышению терапевтического индекса GCGR-связывающего белка. В некоторых вариантах осуществления комбинированная терапия приводит к повышению терапевтического индекса дополнительного(дополнительных) агента(агентов). В некоторых вариантах осуществления комбинированная терапия приводит к снижению токсичности и/или побочных эффектов GCGR-связывающего белка. В некоторых вариантах осуществления комбинированная терапия приводит к снижению токсичности и/или побочных эффектов дополнительного(дополнительных) агента(агентов).
[00225] В некоторых вариантах осуществления дополнительный терапевтический агент может быть введен до, совместно или после введения GCGR-связывающего белка. В некоторых вариантах осуществления, по меньшей мере, один дополнительный терапевтический агент содержит 1, 2, 3 или более дополнительных терапевтических агентов.
[00226] Комбинированное введение может включать в себя совместное введение, либо в одном фармацевтическом составе, либо с использованием отдельных составов, или последовательное введение в любом порядке, но, как правило, в пределах периода времени таким образом, чтобы все активные агенты могли оказывать свои биологические активности. Приготовление и схемы дозирования дополнительных терапевтических агентов могут быть использованы в соответствии с инструкциями производителя или определяться эмпирически опытным врачом.
[00227] Дополнительные терапевтические агенты могут быть введены в комбинации с GCGR-связывающими белками, описанными в данном документе. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой анти-GCGR антитело, выбранное из группы, состоящей из 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления анти-GCGR антитело содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления анти-GCGR антитело содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой анти-GCGR антитело Hz6B5. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой лекарственный препарат для лечения гипергликемии или сахарного диабета. Лекарственные препараты для лечения гипергликемии или сахарного диабета включают в себя, но не ограничиваясь ими, инсулин и инсулиномиметики; γ-агонисты PPAR (рецепторов, активируемых пролифераторами пероксисом), такие как пиоглитазон, троглитазон, циглитазон, ривоглитазон, росиглитазон и другие 2,4-тиазолидиндионовые производные; ингибиторы DPP-4, такие как ситаглиптин (JANUVIA), вилдаглиптин, саксаглиптин, линаглиптин (TRADJENTA), дутоглиптин, гемиглиптин и алоглиптин (NESINA); аналоги GLP-1, такие как эксенатид, лираглутид, таспоглутид, албиглутид и лисисенатид; бигуанидиновые производные, такие как метформин (GLUMETZA, GLUCOPHAGE), буформин и фенформин; АТФ-чувствительные модуляторы калиевых каналов, такие как митиглинид, репаглинид и натеглинид; производные сульфомочевины, такие как толбутамид, хлорпропамид, толазамид, ацетогексамид, глипизид, гликлазид, глимепирид, глиборнурид, глисоперид, глибенкламид, глисентид, глисоламид, глибузол и гликлопирамид; ингибиторы α-глюкозидазы, такие как миглитол (GLYSET), акарбоза (PRECOSE) и воглибоза; и ингибиторы SGLT2, такие как канаглифлозин (INVOKANA), дапаглифлозин (FARXIGA) и эмпаглифлозин (JARDIANCE).
[00228] В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой лекарственный препарат для лечения ожирения. Лекарственные препараты для лечения ожирения включают в себя, но не ограничиваясь ими, орлистат (XENICAL), фентермин/топирамат (QSYMIA), лоркасерин (BELVIQ), налтрексон/бупропион (CONTRAVE) и лираглутид (SAXENDA).
[00229] В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой гиполипидемический лекарственный препарат или гипохолестеринемический лекарственный препарат. Гиполипидемические лекарственные препараты включают в себя, но не ограничиваясь ими, фибраты, статины, омега-3 жирные кислоты и ниацин. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой фибрат. Фибраты представляют собой класс амфипатических карбоновых кислот и включают в себя, но не ограничиваясь ими, алюминия клофибрат, безафибрат, ципрофибрат, холинофенобрат, клинофибрат, клофибрат (например, ATROMID-S), клофибрид, фенофибрат (например, FIBRICOR, LOFIBRA, TRICOR), гемфиброзил (например, LOPID), ронифибрат, симфибрат и фенофибриновую кислоту. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой статин. Статины представляют собой ингибиторы редуктазы HMG-CoA и включают в себя, но не ограничиваясь ими, аторвастатин (LIPITOR), флувастатин (LESCOL), ловастатин (MEVACOR), правастатин (PRAVACHOL), розувастатин (ZOCOR) и питавастатин (LIVALO). В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой ниацин (витамин B3). В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой омега-3 жирную кислоту.
[00230] В некоторых вариантах осуществления дополнительный терапевтический агент выбирают из группы, включающей в себя, но не ограничиваясь ими, антагонисты глюкагоновых рецепторов; GLP-1, миметики GLP-1 и агонисты рецепторов GLP-1; GIP, миметики GIP и агонисты рецепторов GIP; PACAP, миметики PACAP и агонисты рецепторов PACAP 3 типа; гипохолестеринемические агенты, такие как ингибиторы HMG-CoA-редуктазы, секвестранты, никотиниловый спирт, никотиновая кислота и ее соли, агонисты PPAR-альфа, двойные агонисты PPAR-альфа/гамма, ингибиторы всасывания холестерина, ингибиторы ацил-CoA:холестеринацилтрансферазы, антиоксиданты и модуляторы LXR; агонисты PPAR-дельта; соединения для похудения; ингибиторы подвздошнокишечного переносчика желчных кислот; противовоспалительные агенты, за исключением глюкокортикоидов; ингибиторы протеинтирозинфосфатазы-1B (PTP-IB) и антагонисты/обратные агонисты CB1.
[00231] В некоторых вариантах осуществления дополнительный терапевтический агент выбирают из группы, включающей в себя, но не ограничиваясь ими, анальгетические агенты, антибиотики или иммуномодулирующие агенты, или любой другой агент, приведенный в Фармакопее США и/или настольном справочнике врача. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой нестероидный противовоспалительный лекарственный препарат (NSAID), такой как аспирин, ибупрофен и другие производные пропионовой кислоты (альминопрофен, беноксапрофен, буклоксовая кислота, карпрофен, фенбуфен, фенопрофен, флупрофен, флурбипрофен, индопрофен, кетопрофен, миропрофен, напроксен, оксапрозин, пирпрофен, пранопрофен, супрофен, тиапрофеновая кислота и тиоксапрофен), производные уксусной кислоты (индометацин, ацеметацин, алклофенак, клиданак, диклофенак, фенклофенак, фенклозовая кислота, фентиазак, фуирофенак, ибуфенак, изоксепак, окспинак, сулиндак, тиопинак, толметин, зидометацин и зомепирак), производные фенамовой кислоты (флуфенамовая кислота, меклофенамовая кислота, мефенамовая кислота, нифлумовая кислота и толфенамовая кислота), производные бифенилкарбоновой кислоты (дифлунисал и флуфенисал), оксикамы (изоксикам, пироксикам, судоксикам и теноксикам), салицилаты (ацетилсалициловая кислота, сульфасалазин) и пиразолоны (апазон, безпиперилон, фепразон, мефебутазон, оксифенбутазон, фенилбутазон). В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой ингибитор циклооксигеназы-2 (COX-2). В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой стероид, такой как преднизолон, преднизон, метилпреднизолон, бетаметазон, дексаметазон или гидрокортизон. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой цитокин-подавляющий противовоспалительный лекарственный препарат (CSAID) или антитело или антагонист по отношению к другим цитокинам или фактором роста человека, таким как TNF, LT, IL-1β, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF и PDGF. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой антагонист ФНО, такой как антитело к ФНО (например, REMICADE), фрагмент анти-ФНО антитела (например, CDP870), растворенный ФНО-рецептор p55 или p75 или его производные, ENBREL, LENERCEPT, растворенный рецептор IL-13, ингибитор ФНО-альфа-конвертирующего фермента (TACE), ингибитор IL-1, интерлейкин 11, анти-P7s, гликопротеиновый лиганд p-селектина (PSGL), интерферон-бета-1a (AVONEX), интерферон-бета-1b (BETASERON), копаксон, гипербарический кислород, внутривенный иммуноглобулин или кладрибин. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой бетатрофин. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой цилиарный нейротрофический фактор (CNTF).
[00232] Для лечения заболевания подходящая доза GCGR-связывающего белка (например, антитела) по данному раскрытию зависит от нарушения или заболевания, подлежащих лечению, тяжести или течения нарушения или заболевания, восприимчивости нарушения или заболевания, вне зависимости от того вводится ли агент для терапевтических или профилактических целей, предшествующей терапии, клинической истории пациента и т.д. GCGR-связывающий белок может быть введен один раз или в течение курса лечения, продолжающегося от несколько дней до нескольких месяцев, или до тех пор пока не выполнено излечение или не достигнуто сведения состояния заболевания к минимуму.
[00233] Будет понятно, что комбинация GCGR-связывающего белка (например, антитела), описанного в данном документе, и, по меньшей мере, одного дополнительного терапевтического агента может быть введена в любом порядке или совместно. В некоторых вариантах осуществления GCGR-связывающий белок вводят субъектам, которые ранее прошли лечение терапевтическим агентом. В некоторых вариантах осуществления GCGR-связывающий белок и второй терапевтический агент вводят по сути одновременно или совместно. К примеру, субъекту можно вводить GCGR-связывающий белок при прохождении курса лечения вторым терапевтическим агентом (например, противодиабетическим агентом). В некоторых вариантах осуществления GCGR-связывающий белок вводят в течение 1 года после лечения вторым терапевтическим агентом. В некоторых вариантах осуществления GCGR-связывающий белок вводят в течение 10, 8, 6, 4 или 2 месяцев после любого лечения вторым терапевтическим агентом. В некоторых вариантах осуществления GCGR-связывающий белок вводят в течение 4, 3, 2 или 1 недели после любого лечения вторым терапевтическим агентом. В некоторых вариантах осуществления GCGR-связывающий белок вводят в течение 5, 4, 3, 2 или 1 дней после любого лечения вторым терапевтическим агентом. Кроме того, будет понятно, что два (или более) агентов или препаратов могут быть введены субъекту в течение нескольких часов или минут (т.е., по сути одновременно).
[00234] Доза GCGR-связывающего белка (например, антитела), описанного в данном документе, может варьировать в зависимости от природы и/или тяжести заболевания или нарушения, а также состояния субъекта. В некоторых вариантах осуществления доза белка составляет от 0,01 мкг до 100 мг/кг веса тела, от 0,1 мкг до 100 мг/кг веса тела, от 1 мкг до 100 мг/кг веса тела, от 1 мг до 100 мг/кг веса тела, от 1 мг до 80 мг/кг веса тела, от 10 мг до 100 мг/кг веса тела, от 10 мг до 75 мг/кг веса тела или от 10 мг до 50 мг/кг веса тела. В некоторых вариантах осуществления доза белка составляет от приблизительно 0,1 мг до приблизительно 20 мг/кг веса тела. В некоторых вариантах осуществления доза белка составляет приблизительно 0,5 мг/кг веса тела. В некоторых вариантах осуществления доза белка составляет приблизительно 1 мг/кг веса тела. В некоторых вариантах осуществления доза белка составляет приблизительно 1,5 мг/кг веса тела. В некоторых вариантах осуществления доза белка составляет приблизительно 2 мг/кг веса тела. В некоторых вариантах осуществления доза белка составляет приблизительно 2,5 мг/кг веса тела. В некоторых вариантах осуществления доза белка составляет приблизительно 5 мг/кг веса тела. В некоторых вариантах осуществления доза белка составляет приблизительно 7,5 мг/кг веса тела. В некоторых вариантах осуществления доза белка составляет приблизительно 10 мг/кг веса тела. В некоторых вариантах осуществления доза белка составляет приблизительно 12,5 мг/кг веса тела. В некоторых вариантах осуществления доза белка составляет приблизительно 15 мг/кг веса тела. В некоторых вариантах осуществления дозу белка вводят один раз или более ежедневно, еженедельно, ежемесячно или ежегодно. В некоторых вариантах осуществления дозу белка вводят один раз в неделю, один раз в две недели, один раз в три недели или один раз в четыре недели.
[00235] В данном раскрытии предложены композиции, содержащие GCGR-связывающий белок (например, антитело), описанный в данном документе. В некоторых вариантах осуществления композиция содержит анти-GCGR антитело, выбранное из группы, состоящей из 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления композиция содержит анти-GCGR антитело, которое содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления композиция содержит анти-GCGR антитело, которое содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления композиция содержит анти-GCGR антитело, которое содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления композиция содержит анти-GCGR антитело Hz6B5. В данном раскрытии также предложены фармацевтические композиции, содержащие GCGR-связывающий белок (например, антитело), описанный в данном документе, и фармацевтически приемлемую основу. В некоторых вариантах осуществления фармацевтическая композиция содержит анти-GCGR антитело, выбранное из группы, состоящей из 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления фармацевтическая композиция содержит анти-GCGR антитело, которое содержит CDR1 тяжелой цепи, содержащую SEQ ID NO:1, CDR2 тяжелой цепи, содержащую SEQ ID NO:2, CDR3 тяжелой цепи, содержащую SEQ ID NO:3, CDR1 легкой цепи, содержащую SEQ ID NO:4, CDR2 легкой цепи, содержащую SEQ ID NO:5, и CDR3 легкой цепи, содержащую SEQ ID NO:6. В некоторых вариантах осуществления фармацевтическая композиция содержит анти-GCGR антитело, которое содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:25, и вариабельную область легкой цепи, содержащую SEQ ID NO:26. В некоторых вариантах осуществления фармацевтическая композиция содержит анти-GCGR антитело, которое содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220, и вариабельную область легкой цепи, содержащую SEQ ID NO:221. В некоторых вариантах осуществления фармацевтическая композиция содержит анти-GCGR антитело Hz6B5.
[00236] Составы получают для хранения и/или применения в результате комбинирования очищенного белка или антитела по данному раскрытию с фармацевтически приемлемой основой (например, носителем или наполнителем). Специалисты в данной области техники, как правило, считают, что фармацевтически приемлемые носители, наполнители и/или стабилизаторы представляют собой неактивные ингредиенты состава или фармацевтической композиции. Состав, полученный для хранения связывающего белка, может отличаться или не совпадать с составом или композицией, приготовленными для применения у субъекта, к примеру, препарата для внутривенного введения.
[00237] Подходящие фармацевтически приемлемые основы включают в себя, но не ограничиваясь ими, нетоксичные буферы, такие как фосфатный, цитратный, или другие органические кислоты; соли, такие как хлорид натрия; антиоксиданты, в том числе аскорбиновая кислота и метионин; консерванты, такие как хлорид октадецилдиметилбензиламмония ; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол и м-крезол; низкомолекулярные полипептиды (например, имеющие менее чем приблизительно 10 аминокислотных остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; углеводы, такие как моносахариды, дисахариды, глюкоза, манноза или декстрины; хелатирующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов, такие как комплексы Zn-белок; и неионные поверхностно-активные вещества, такие как TWEENTM или полиэтиленгликоль (PEG). (Remington: The Science and Practice of Pharmacy, 22nd Edition, 2012, Pharmaceutical Press, London.). В некоторых вариантах осуществления состав находится в форме водного раствора. В некоторых вариантах осуществления состав является лиофилизированным или находится в альтернативной высушенной форме.
[00238] Терапевтический состав может представлять собой единичную лекарственную форму. Такие составы включают в себя таблетки, пилюли, капсулы, порошки, гранулы, растворы или суспензии в воде или неводных средах, или суппозитории. В твердых композициях, таких как таблетки, основной активный ингредиент смешивают с фармацевтическим носителем. Стандартные ингредиенты для таблетирования включают в себя кукурузный крахмал, лактозу, сахарозу, сорбит, тальк, стеариновую кислоту, стеарат магния, дикальция фосфат или камеди, а также разбавители (например, воду). Они могут быть использованы для образования твердой композиции до придания ей лекарственной формы, содержащей смесь соединения по данному раскрытию, или ее нетоксичную фармацевтически приемлемую соль. Твердую композицию до придания ей лекарственной формы затем разделяют на единичные лекарственные формы типа, описанного выше. Таблетки, пилюли и т.д. состава или композиции могут быть покрыты или иным образом компаундированы с получением лекарственной формы, обеспечивающей преимущество пролонгированного действия. К примеру, таблетка или пилюля может содержать внутреннюю композицию, покрытую внешним компонентом. Кроме того, эти два слоя могут быть разделены энтеросолюбильным слоем, который предназначен для защиты от растворения и способствует прохождению внутреннего компонента интактным через желудок или замедлению его высвобождения. Для таких энтеросолюбильных слоев или оболочек может быть использован ряд веществ, при этом такие вещества включают в себя ряд полимерных кислот и смесей полимерных кислот с такими веществами, как шеллак, цетиловый спирт и ацетилцеллюлоза.
[00239] Связывающие белки по данному раскрытию могут быть составлены в любой подходящей форме для доставки в целевую клетку/ткань. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) составляют в виде липосомы, микрочастицы, микрокапсулы, альбуминовой микросферы, микроэмульсии, наночастицы, нанокапсулы или макроэмульсии. В некоторых вариантах осуществления фармацевтический состав включает в себя белок по данному раскрытию, образующий комплекс с липосомами. Способы получения липосом известны специалистам в данной области техники. К примеру, некоторые липосомы могут быть получены с помощью обращенно-фазового выпаривания с липидной композицией, содержащей фосфатидилхолин, холестерин и PEG-дериватизированный фосфатидилэтаноламин (PEG-PE).
[00240] В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) составляют в виде препарата для замедленного высвобождения. Подходящие примеры препаратов с замедленным высвобождением включают в себя полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие агент, при этом матрицы находятся в форме изделий определенной формы (например, пленок или микрокапсул). Матрицы для замедленного высвобождения включают в себя, но не ограничиваясь ими, сложные полиэфиры, гидрогели, такие как поли(2-гидроксиэтил-метакрилат) или поли(виниловый спирт), полилактиды, сополимеры L-глутаминовой кислоты и 7 этил-L-глутамата, не поддающийся разложению этилен-винилацетат, поддающиеся разложению сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT™ (инъекционные микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и лейпролида ацетата), изобутират ацетата сахарозы и поли-D-(-)-3-гидроксимасляная кислота.
[00241] Фармацевтические композиции или составы по данному раскрытию могут быть введены любым количеством путей либо для локального, либо для системного лечения. Введение может быть местным с помощью эпидермальных или трансдермальных пластырей, мазей, лосьонов, кремов, гелей, капель, суппозиториев, спреев, жидкостей и порошков; легочным с помощью ингаляции или инсуффляции порошков или аэрозолей, в том числе с помощью небулайзера для интратрахеального или интраназального применения; пероральным; или парентеральным, в том числе внутривенным, внутриартериальным, интратуморальным, подкожным, интраперитонеальным, внутримышечным (например, инъекция или инфузия) или интракраниальным (например, интратекальным или интравентрикулярным).
[00242] Различные системы доставки известны и могут быть использованы для введения GCGR-связывающего белка (например, антитела), описанного в данном документе. В некоторых вариантах осуществления GCGR-связывающий белок (например, антитело) или композицию, описанные в данном документе, доставляют в системе с контролируемым высвобождением или замедленным высвобождением. В некоторых вариантах осуществления для достижения контролируемого или замедленного высвобождения используют насос. В некоторых вариантах осуществления для достижения контролируемого или замедленного высвобождения GCGR-связывающего белка (например, антитела), описанного в данном документе, используют полимерные материалы. Примеры полимеров, используемых в составах с замедленным высвобождением, включают в себя, но не ограничиваясь ими, поли-2-гидроксиэтилметакрилат, полиметилметакрилат, полиакриловую кислоту, сополимер полиэтилена и винилацетата, полиметилакриловую кислоту, полигликолиды (PLG), полиангидриды, поли-N-винилпирролидон, поливиниловый спирт (PVA), полиакриламид, полиэтиленгликоль (ПЭГ), полилактиды (PLA), полилактид-ко-гликолиды (PLGA) и сложные полиортоэфиры. Любой полимер, используемый в составе для замедленного высвобождения, должен быть инертным, не содержать выщелачиваемых примесей, стабильным при хранении, стерильным и биоразрушаемым.
[00243] В некоторых вариантах осуществления дополнительные системы доставки используют для введения GCGR-связывающего белка (например, антитела), описанного в данном документе, в том числе, но не ограничиваясь ими, устройства для доставки инъекционных лекарственных препаратов и осмотические наносы. Устройства для доставки инъекционных лекарственных препаратов включают в себя, к примеру, переносные устройства (например, аутоинжекторы) или надеваемые устройства. Различные типы систем на основе осмотических насосов могут включать в себя системы с одним компартментом системы с двумя компартментами и системы с множественными компартментами.
V. Анализы и/или наборы, содержащие GCGR-связывающие белки
[00244] В некоторых вариантах осуществления анти-GCGR антитела и их фрагменты, описанные в данном документе, являются пригодными для детекции GCGR в биологическом образце. Такие анти-GCGR антитела могут включать в себя таковые, которые связываются с GCGR человека и/или GCGR яванского макака, но не ингибируют активность GCGR. Термин «детекция», используемый в данном документе, охватывает количественную или качественную детекцию. В некоторых вариантах осуществления биологический образец представляет собой клетку, ткань, кровь или другую жидкость тела.
[00245] В некоторых вариантах осуществления способ детекции GCGR в биологическом образце включает приведение биологического образца в контакт с анти-GCGR антителом в условиях, допускающих связывание анти-GCGR антитела с GCGR, и детекцию того, образовался ли комплекс между анти-GCGR антителом и GCGR. Способы могут включать анализы, известные специалистам в данной области техники, такие как анализы на основе вестерн-блоттинга, радиоиммунологические анализы, ИФА (иммуноферментные анализы), «сэндвич»-вариант иммуноферментных анализов, анализы на основе иммунопреципитации, флуоресцентные иммунологические анализы, иммуноанализы с использованием белка A и иммуногистохимический анализ (IHC).
[00246] В некоторых вариантах осуществления анти-GCGR антитело метят детектируемой меткой. Детектируемая метка может представлять собой флуоресцентную молекулу, хемилюминесцентную молекулу, биолюминесцентную молекулу, фермент или радиоизотоп.
[00247] В данном раскрытии предложены наборы, которые содержат GCGR-связывающий белок (например, антитело), описанный в данном документе, и которые могут быть использованы для осуществления способов, описанных в данном документе. В некоторых вариантах осуществления набор содержит, по меньшей мере, один очищенный GCGR-связывающий белок в одном или нескольких контейнерах. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой анти-GCGR антитело, выбранное из группы, состоящей из 6B5, 3H5, 5B11, 1C1, 1C3, 1H2, 4F8, 13G9, 14F4 и 14E9. В некоторых вариантах осуществления GCGR-связывающий белок представляет собой анти-GCGR антитело Hz6B5. В некоторых вариантах осуществления наборы содержат все из компонентов, необходимых и/или достаточных для выполнения анализа на детекцию, в том числе все контроли, указания для выполнения анализов и любые необходимые компьютерные программы для анализа и представления результатов. Специалист в данной области техники с готовностью признает, что раскрытые GCGR-связывающие белки по данному раскрытию могут быть легко включены в один из установленных форматов наборов, которые хорошо известны в данной области техники. Дополнительно представлены наборы, которые содержат GCGR-связывающий белок (например, антитело), а также, по меньшей мере, один дополнительный терапевтический агент.
ПРИМЕРЫ
Пример 1
Получение антител
[00248] Антитела к глюкагоновому рецептору (GCGR) получали с помощью инъекции мышам (i) клеток, экспрессирующих GCGR человека, или (ii) растворенный белок с His тэгами, содержащий внеклеточный домен GCGR человека.
[00249] Клетки, экспрессирующие GCGR, получали следующим образом. Клетки CHO 3E7 трансфицировали последовательностью нуклеиновой кислоты, кодирующей GCGR человека. Клетки анализировали в отношении экспрессии GCGR с помощью FACS и выделяли позитивные клетки. Растворенный белок, содержащий внеклеточный домен GCGR человека, получали с помощью стандартных рекомбинантных методик, и очищали с помощью His тэга. Мышей иммунизировали мембранным препаратом клеток, экспрессирующих GCGR, или растворенным белком GCGR. Мышей бустер-иммунизировали с целью индукции высоких титров. Титры антител в сыворотке крови определяли с помощью ИФА и FACS. Суспензии отдельных клеток лимфоцитов получали из селезенки и дренирующих лимфатических узлов мышей с подходящими титрами. Лимфоциты сливали с клетками миеломы SP2/0 в соотношении 1:1 с помощью электрослияния. Слитые клетки высевали в 384-луночные планшеты в присутствии среды для отбора HAT. Через 10-14 дней после культивирования супернатанты собирали и изначально подвергали скринингу с помощью (i) FACS с использованием клеток, экспрессирующих GCGR, или (ii) Biacore с использованием растворенного GCGR (например, внеклеточного домена GCGR) с целью идентификации связывающих веществ.
Пример 2
Скрининг в отношении связывания GCGR
[00250] Супернатанты, образованные из слияний гибридом, описанных в Примере 1, подвергали скринингу в отношении связывания с GCGR человека с использованием клеток CHO, которые стабильно экспрессировали полноразмерный GCGR, в анализе связывания на основе FACS или платформе для HCS CellInsight™ (ThermoFischer Scientific). Вкратце, супернатанты гибридом инкубировали с клетками, экспрессирующими GCGR человека, в течение 30 минут при 4°C. После промывания смесью PBS/1% BSA/0,1% азид клетки инкубировали с меченым анти-мышиный Fc антителом (Jackson Immunoresearch) в течение 30 минут при 4°C. После промывания смесью PBS/1% BSA/0,1% азид клетки анализировали с помощью проточного цитометра (инструмент BD FACSCalibur) и компьютерных программ для цитометрического анализа (FlowJo) или платформы CellInsight™.
[00251] В некоторых вариантах осуществления супернатанты подвергали скринингу в отношении связывания с GCGR человека с помощью системы Biacore SPR. Вкратце, анти-мышиный Fc антитело (Sigma-Aldrich) иммобилизировали на всех всех четырех проточных ячейках чипа CM5 с использованием реагентов для иммобилизации по аминогруппе (GE Healthcare LifeSciences). Супернатанты гибридом разбавляли в три раза буфером PBS-P (PBS, содержащим 0,005% P20) и инъецировали в течение 30 секунд над проточными ячейками 2, 3 и 4 с целью захвата исследуемых антител и использовали проточную ячейку 1 в качестве эталона. Следующим этапом была инъекция растворенного внеклеточного домена GCGR человека (100 нМ в буфере PBS-P) со скоростью потока 50 мкл/мин и отслеживания кинетики связывания при 25°C. Данные кинетического характера собирали в динамике и подгоняли с помощью уравнения одновременного глобального соответствия с целью получения констант аффинности (значения KD) для каждого антитела.
[00252] Более чем 1500 антител идентифицировали в качестве связывающихся с GCGR человека. Подсовокупность положительных связывающихся веществ очищали и затем повторно исследовали в отношении их аффинностей связывания с GCGR человека и GCGR яванского макака. Антитела упорядочивали по рангам на основании их аффинностей связывания с GCGR человека, определенными с помощью Biacore.
[00253] Репрезентативные результаты описывали в виде значений KD (нМ), как показано в Табл. 11.
Таблица 11
Пример 3
Дополнительные анализы связывания и конкурентного связывания
[00254] Антитела, идентифицированные как связывающиеся с GCGR, описанные в Примере 2, оценивали в анализах конкурентного связывания и/или экспериментах с эпитоп-специфической сортировкой.
[00255] Для оценки связывающих сайтов антител с внеклеточным доменом GCGR человека эксперименты с эпитоп-специфической сортировкой выполняли в системе Octet® QK 384 (ForteBio). Значения KD для иллюстративных антител получали с помощью компьютерной программы ForteBio. Иллюстративные антитела 6B5, 13G9, 14E9, 14F4, 4F8, 1G7, 1A8, 1H7, 1A2, 1B4, 1C1, 1H2, 1C3 и 1D2 иммобилизировали на биосенсорных наконечниках. Растворенный домен GCGR человека (500 нМ) инкубировали с антителами в течение 3 минут. Это приводило к образованию комплекса антитело-GCGR на биосенсорном наконечнике. Биосенсорные наконечники со связанным комплексом антитело-GCGR затем погружали в раствор антител 6B5, 5B11 или 3H5 и изменение сигнала измеряли в виде сдвига в нм. Результаты репрезентативного эксперимента показаны в Табл. 12. Если антитело в растворе распознавало тот же самый эпитоп, что и антитело, иммобилизированное на поверхности наконечника, то наблюдали сдвиг сигнала < 0,1 нм (уровень шума Octet®). Если антитело в растворе распознавало отличный эпитоп по отношению к иммобилизированному антителу, то наблюдали сдвиг сигнала >0,15 нм. В последнем варианте развития событий антитело в растворе могло связываться с комплексом иммобилизированное антитело-GCGR (предположительно с другим эпитопом), приводя к наблюдаемому повышению сигнала.
[00256] В экспериментах конкурентного связывания с использованием системы Octet антитело 6B5 конкурировало само с собой за связывание с GCGR, а также конкурировало с антителами 13G9, 14E9, 14F4, 4F8, 1G7, 1A8, 1H7, 1A2, 1B4, 1C1, 1H2, 1C3 и 1D2. Как показано в Табл. 12, антитела 5B11 и 3H5 также конкурировали с антителами 6B5, 13G9, 14E9, 14F4, 4F8, 1G7, 1A8, 1H7, 1A2, 1B4, 1C1, 1H2, 1C3 и 1D2. Эти результаты свидетельствовали о том, что все эти антитела связываются с одним и тем же эпитопом, аналогичным эпитопом и/или перекрывающимся эпитопом. Таким образом, эти антитела группировали в виде членов эпитопной группы 6B5.
Таблица 12
с использованием антитела в растворе (нм)
Пример 4
Функциональные анализы
[00257] Иллюстративные антитела, которые связываются с GCGR, как описано в Примерах 1-3, исследовали в отношении их функциональной активности в клеточных анализах. Поскольку глюкагон стимулирует цАМФ посредством активации GCGR, анти-GCGR антитела исследовали в отношении их способности ингибировать индуцированное глюкагоном продуцирование цАМФ. Для этих экспериментов уровень внутриклеточного цАМФ измеряли с помощью набора для анализа цАМФ в клетке в соответствии с инструкциями производителя (Cisbio). Вкратце, клетки CHO, трансфицированные кДНК полноразмерного GCGR человека, высевали по 1000 клеток/лунка в 384-луночном планшете. Анти-GCGR антитела последовательно разводили с помощью культуральной среды, содержащей 5 нМ глюкагона (Sigma), и 5 мкл добавляли в каждую лунку. Клетки инкубировали в течение одного часа в темноте. Каждый планшет для анализа считывали с помощью флуоресцентного планшет-ридера при 615 нм/665 нм.
[00258] Результаты нескольких репрезентативных анализов цАМФ с использованием анти-GCGR антител 6B5, 5B11, 3H5, 1H7, 1A2, 1B4, 1C1, 1H2, 1C3, 13G9, 13E9, 14F4 и 4F8 показаны в Табл. 13. Результаты показаны в виде определений IC50 для каждого антитела.
Таблица 13
Пример 5
Гуманизированное антитело
[00259] Несколько анти-GCGR антител, описанных в Примерах 1-4, выбирали для анализа последовательностей. Аминокислотные последовательности CDR и вариабельных областей тяжелой и легкой цепей показаны в Табл. 1-10, а вариабельные последовательности тяжелой и легкой цепи выравнены на Фиг. 1A-1 и 1A-2. Иллюстративное анти-GCGR антитело, 6B5, выбирали для гуманизации. Последовательности зародышевой линии человека, которые имели значительное сходство с последовательностями вариабельной области тяжелой цепи и вариабельной области легкой цепи 6B5 идентифицировали. Подходящие человеческие каркасные акцепторы для вариабельной области тяжелой цепи включали в себя IGHV1-46, IGHV1-2, IGHV1-69 и IGHV5-51. Подходящие каркасные акцепторы для вариабельной области легкой цепи включали в себя IGKV2-30, IGKV3-20, IGKV3-11 или IGKV1-39. Учет множества факторов, в том числе сходства последовательностей, биофизических свойств и потенциальной иммуногенности, привел к выбору человеческих каркасных последовательностей IGHV1-69 и IGKV2-30. Затем последовательности каркаса 4 выбирали с помощью аналогичного подхода. Последовательности вариабельной области тяжелой цепи и вариабельной области легкой цепи мышиного 6B5 изучали против человеческих иммуноглобулиновых последовательностей в базе данных Immunogenetics (IMGT). IGHJ6-1, а также IGKJ2-1 выбирали в качестве человеческих донорских последовательностей. Последовательности CDR мышиного 6B5 затем переносили (например, прививали) в соответствующие положения IGHV1-69 и IGKV2-30 и добавляли остатки J-области, соответствующие каркасу 4. Полученную в результате последовательность белка восстанавливали обратно в последовательность ДНК, оптимизировали с помощью замены кодонов в отношении экспрессии в клетках млекопитающих и синтезировали (GeneArt/LifeTechnologies). Затем синтезированный фрагмент ДНК клонировали с помощью In-Fusion (Clontech) в вектор pTT5 (NRC Biotechnology Research Institute) с целью получения экспрессионных конструкций сигнальный пептид hIgGK-гуманизированное 6B5vH-константная область hIgG1 и сигнальный пептид hIgGK-гуманизированное 6B5VK-константная область hIgGK (HC-199-69a и LC-199-30a соответственно). После этого отдельные остатки в каркасных областях выбирали эмпирически и подвергали обратному мутированию в мышиные остатки с помощью сайт-направленного мутагенеза QuikChange (Agilent). Для определения того, были ли выбранные обратные мутации эффективными в отношении аффинностей связывания гуманизированных антител с GCGR, происходящим из последовательностей мышиного 6B5, различные мутированные последовательности тяжелой цепи экспрессировали с легкой цепью химерного 6B5 и наоборот (мутированные последовательности легкой цепи экспрессировали с тяжелой цепью химерного 6B5). Неожиданным образом было обнаружено, что полностью гуманизированные последовательности с нулевыми обратными мутациями показали аналогичные аффинности связывания по сравнению с полностью мышиным антителом, а также несколькими дополнительными гуманизированными последовательностями. В отличие от этого, большинство гуманизированных вариантов легких цепей показали сниженное связывание. Неожиданным образом было обнаружено, что один из вариантов легких цепей (LC-199-30e с обратной мутацией F42Y) показал сопоставимые аффинности связывания, а второй вариант (LC-199-30g с мутацией R52L) показал полезные мутации. В дополнительных анализах LC-199-30e совместно с дополнительным вариантом легкой цепи с этими двумя обратными мутациями (LC-199-30i) исследовали в комбинации с гуманизированными вариантами тяжелой цепи. После исследования в дополнительных анализах, таких как описанные в Примерах 2-4 (например, анализы связывания, аффинности и цАМФ), HC-199-69f и LC-199-30i выбирали в качестве гуманизированных последовательностей вариабельной области тяжелой цепи и вариабельной области легкой цепи.
Пример 6
Анализ сканирования аланином
[00260] С целью облегчения сбора информации в отношении эпитопа GCGR, с которым связывается эпитопная группа 6B5, осуществляли «мутагенез сканирующий аланином мутагенез». Платформа сканирующего аланином мутагенеза представляет собой методику, используемую для картирования как линейных, так и конформационных антигенных эпитопов с помощью оценки эффектов точечных мутаций в целевом белке. Одиночные остатки в целевом белке замещают аланином по очереди с целью конструирования библиотеки мутантов. Каждый вариант анализируют в отношении его способности связываться с антителом, представляющим интерес. Неспособность связывания свидетельствует о том что данная аминокислота представляет собой часть или является важной для связывающего сайта или эпитопа. Аминокислоты во внеклеточном домене GCGR подвергали мутированию в аланин и анти-GCGR антитело Hz6B5 исследовали в отношении связывания с мутантами по аланину. Антитело Hz6B5 содержит вариабельную область тяжелой цепи, содержащую SEQ ID NO:220 (также обозначаемую как HC-199-69f) и вариабельную область легкой цепи, содержащую SEQ ID NO:221 (также обозначаемую как LC-199-30i).
[00261] Каждое из внеклеточного домена GCGR дикого типа и мутантов по аланину трансфицировали в клетки 293XP и инкубировали в течение 24 часов. Антитело Hz6B5 инкубировали с трансфицированными клетками в течение 30 минут при 4°C. После промывания смесью PBS/1% BSA/0,1% азид клетки инкубировали с меченым анти-мышиный Fc антителом (Jackson Immunoresearch) в течение 30 минут при 4°C. После промывания смесью PBS/1% BSA/0,1% азид клетки анализировали с помощью проточного цитометра BD (инструмент FACSCalibur) и компьютерных программ для цитометрического анализа (FlowJo). Образец сыворотки крови от мыши, иммунизированной GCGR человека, использовали в качестве положительного контроля с целью подтверждения экспрессии мутантов по аланину.
[00262] Иллюстративная совокупность результатов представлена в Табл. 14 и на Фиг. 2.
Таблица 14
(% положительных клеток)
кровопускание из мыши
Пример 7
Исследования на животных
[00263] Иллюстративные анти-GCGR антитела 5B11, 3H5 и 6B5 оценивали в исследованиях на животных. Анти-GCGR антитела исследовали в отношении их эффектов на уровень глюкозы в крови в мышиной модели TET-DTA.
[00264] Трансгенных мышей TET-DTA получали с помощью скрещивания двух трансгенных линий: 1) B6.Cg-Tg(tetO-DTA), которая экспрессирует дифтерийный токсин A (DTA) под контролем тетрациклинового оператора (tetO; также называемого тетрациклин-чувствительный элемент (TRE) или tet-оператор) и минимального промотора цитомегаловируса; и 2) Ins2-rtTA, которая экспрессирует обратный контролируемый тетрациклином трансактивирующий белок (rtTA) под контролем промотора инсулина 2 крысы (Ins2). У образующихся в результате двойных трансгенных мышей TET-DTA экспрессия дифтерийного токсина А бета-клетками поджелудочной железы регулируется аналогом тетрациклина, доксициклином (dox). При индукции доксициклином продуцирование дифтерийного токсина А приводит к деструкции бета-клеток поджелудочной железы.
[00265] Трансгенным мышам TET-DTA вводили доксициклин с помощью кормовой диеты (2000 мг/кг). Самцов мышей в возрасте от пяти до шести недель обрабатывали доксициклином в течение 4 дней и отслеживали уровни глюкозы в крови. В пределах примерно 1 недели уровни глюкозы в крови повышались до примерно 500 мг/дл.
[00266] Через одну неделю после обработки доксициклином мышей обрабатывали анти-GCGR антителами 3H5, 6B5 или 5B11 или контрольным анти-KLH антителом. Антитела инъецировали интраперитонеально в дозе 10 мг/кг один раз в неделю в течение четырех недель. Один раз в неделю уровни глюкозы в крови после приема пищи измеряли в крови из хвоста с помощью тест-полосок ACCU-CHEK Active и измерительного прибора ACCU-CHEK Active (Roche Diagnostics) в соответствии с инструкциями производителя.
[00267] Как изображено на Фиг. 3, обработка анти-GCGR антителами 5B11, 3H5 или 6B5 значительно снижала уровни глюкозы в крови у обработанных мышей. В частности, к неделе 4 уровень глюкозы в крови в крови от мышей, обработанных анти-GCGR антителом 6B5, снижали до примерно 200 мг/дл, т.е. уровня, эквивалентного уровню глюкозы у мышей до деструкции бета-клеток.
[00268] Уровни инсулина в плазме крови, уровни C-пептида в плазме крови и содержание инсулина в поджелудочной железе определяли в конце 4 недель обработки с целью оценки функции бета-клеток. Для определения уровня инсулина и C-пептида в крови после четырехчасового периода голодания кровь из хвоста собирали от мышей в четырех группах обработки. Цельную кровь (приблизительно 50 мкл/мышь) из надрезов хвоста мышей собирали в обычные капиллярные трубки. Сыворотку и клетки крови отделяли с помощью центрифугирования трубок в центрифуге Autocrit Ultra™ 3 (Becton Dickinson). Коммерчески доступные наборы для ИФА (ALPCO) использовали для анализа содержания инсулина и C-пептида в крови в соответствии с инструкциями производителя. Для определения содержания инсулина в поджелудочной железе после умерщвления мышей примерно 50 мг ткани поджелудочной железы гомогенизировали в кислом спирте с помощью TissueLyser™ (QIAGEN). Образцы инкубировали на встряхивателе в холодной комнате в течение ночи. После центрифугирования образцов в течение 15 минут при 12000 об./мин. супернатанты использовали для анализа содержания инсулина с помощью ИФА. Образцы последовательно разводили от 1:20 до 1:200 и анализировали с помощью ИФА.
[00269] Как изображено на Фиг. 4A и 4B, обработка анти-GCGR антителами 3H5, 5B11 и 6B5 повышала уровни как инсулина, так и C-пептида в плазме крови. К примеру, после обработки антителом 6B5 уровни инсулина в плазме крови повышались примерно в 4 раза по сравнению с обработкой контрольным антителом. Аналогичным образом, после обработки антителом 6B5 уровни С-пептида в плазме крови повышались приблизительно в 2 раза по сравнению с обработкой контрольным антителом. Помимо этого, как изображено на Фиг. 4C, обработка анти-GCGR антителами 3H5, 5B11 или 6B5 повышала содержание инсулина в поджелудочной железе. В данном эксперименте обработка анти-GCGR антителом 6B5 повышала содержание инсулина в поджелудочной железе более чем в 10 раз по сравнению с обработкой контрольным антителом.
[00270] Эти результаты свидетельствуют о том. что обработка анти-GCGR антителами улучшала функцию бета-клеток у мышей TET-DTA после деструкции бета-клеток.
[00271] Аналогичный эксперимент, как описано выше, осуществляли в мышиной модели TET-DTA с целью оценки гуманизированной версии анти-GCGR антитела 6B5, Hz6B5.07mc. Антитело Hz6B5.07mc представляет собой химерное антитело, которое содержит гуманизированную вариабельную область тяжелой цепи, гуманизированную вариабельную область легкой цепи и мышиные константные области тяжелой цепи и легкой цепи.
[00272] Как изображено на Фиг. 5A и 5B, обработка анти-GCGR антителом Hz6B5.07mc значительно снижала уровень глюкозы в крови и повышала уровень C-пептида в крови. Помимо этого, как изображено на Фиг. 5C, обработка анти-GCGR антителом Hz6B5.07mc значительно повышала содержание инсулина в поджелудочной железе.
[00273] Эти результаты продемонстрировали, что гуманизированная версия анти-GCGR антитела имела аналогичные функциональные свойства, что и исходное анти-GCGR антитело.
[00274] Несмотря на то, что изложенное выше данное изобретение было достаточно подробно описано с помощью иллюстраций и примеров в целях ясности понимания, описания и примеры не следует воспринимать как ограничивающие объем данного раскрытия. Варианты осуществления данного раскрытия, описанные в данном документе, предполагают носить исключительно иллюстративный характер, а специалисты в данной области будут распознавать многочисленные эквиваленты конкретным процедурам, описанным в данном документе. Считается, что все такие эквиваленты находятся в объеме данного раскрытия и охвачены вариантами осуществления.
[00275] Все публикации, патенты, заявки на выдачу патента, интернет-сайты и номера доступа/последовательности в базах данных, включающие в себя как полинуклеотидные, так и полипептидные последовательности, цитируемые в данном документе, тем самым включены в полном объеме для всех целей в той же самой степени, как если бы каждая отдельная публикация, патент, заявка на выдачу патента, интернет-сайт и номер доступа/последовательность в базах данных были особо и отдельно указаны с целью такого включения посредством ссылки.
[00276] Далее представлены последовательности, раскрытые в данной заявке, за исключением последовательностей, определенных в Табл. 1-10.
Вариабельная область тяжелой цепи Hz6B5 (SEQ ID NO:220)
QVQLVQSGAEVKKPGSSVKVSCKASGFTFTNHWLGWVRQAPGQGLEWIGDIYPGGYYINY
NEKFKGRVTITADESTSTAYMELSSLRSEDTAVYYCARHTNYGSDYWGQGTTVTVSS
Вариабельная область легкой цепи Hz6B5 (SEQ ID NO:221)
DVVMTQSPLSLPVTLGQPASISCRSSQSIVDSYGNTFLEWYQQRPGQSPRLLIYKVSNRLS
GVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCFQGSHVPWTFGQGTKLEIK
Аминокислотная последовательность CGCR человека с подчеркнутой предполагаемой сигнальной последовательностью (SEQ ID NO:222)
mppcqpqrpllllllllacqpqvpsaqvmdflfekwklygdqchhnlsllppptelvcnr
tfdkyscwpdtpanttaniscpwylpwhhkvqhrfvfkrcgpdgqwvrgprgqpwrdasq
cqmdgeeievqkevakmyssfqvmytvgyslslgalllalailgglsklhctrnaihanl
fasfvlkassvlvidgllrtrysqkigddlsvstwlsdgavagcrvaavfmqygivanyc
wllveglylhnllglatlpersffslylgigwgapmlfvvpwavvkclfenvqcwtsndn
mgfwwilrfpvflailinffifvrivqllvaklrarqmhhtdykfrlakstltlipllgv
hevvfafvtdehaqgtlrsaklffdlflssfqgllvavlycflnkevqselrrrwhrwrl
gkvlweerntsnhrassspghgppskelqfgrgggsqdssaetplagglprlaespf
Аминокислотная последовательность CGCR человека без предполагаемой сигнальной последовательности (SEQ ID NO:223)
aqvmdflfekwklygdqchhnlsllppptelvcnrtfdkyscwpdtpanttaniscpwyl
pwhhkvqhrfvfkrcgpdgqwvrgprgqpwrdasqcqmdgeeievqkevakmyssfqvmy
tvgyslslgalllalailgglsklhctrnaihanlfasfvlkassvlvidgllrtrysqk
igddlsvstwlsdgavagcrvaavfmqygivanycwllveglylhnllglatlpersffs
lylgigwgapmlfvvpwavvkclfenvqcwtsndnmgfwwilrfpvflailinffifvri
vqllvaklrarqmhhtdykfrlakstltlipllgvhevvfafvtdehaqgtlrsaklffd
lflssfqgllvavlycflnkevqselrrrwhrwrlgkvlweerntsnhrassspghgpps
kelqfgrgggsqdssaetplagglprlaespf
Внеклеточный домен CGCR человека (аминокислоты 26-136) (SEQ ID NO:224)
aqvmdflfekwklygdqchhnlsllppptelvcnrtfdkyscwpdtpanttaniscpwyl
pwhhkvqhrfvfkrcgpdgqwvrgprgqpwrdasqcqmdgeeievqkevak
Внеклеточный домен CGCR человека (аминокислоты 28-123) (SEQ ID NO:225)
vmdflfekwklygdqchhnlsllppptelvcnrtfdkyscwpdtpanttaniscpwylpw
hhkvqhrfvfkrcgpdgqwvrgprgqpwrdasqcqm
Внеклеточный домен CGCR человека (аминокислоты 80-119) (SEQ ID NO:226)
scpwylpwhhkvqhrfvfkrcgpdgqwvrgprgqpwrdas
GCGR яванского макака (SEQ ID NO:227)
MPPCQPRRPLLLLLLLLACQPQAPSAQVMDFLFEKWKLYGDQCHHNLSLLPPPTELVCNR
TFDKYSCWPDTPANTTANISCPWYLPWHHKVQHRFVFKRCGPDGQWVRGPRGQPWRDASQ
CQMDGEELEVQKEVAKMYSSFQVMYTVGYSLSLGALLLALAVLGGISKLHCTRNAIHANL
FVSFVLKASSVLVIDGLLRTRYSQKIGDDLSVSIWLSDGAVAGCRVAAVFMQYGVVANYC
WLLVEGLYLHNLLGLATLPERSFFSLYLGIGWGAPMLFIIPWVVVRCLFENIQCWTSNDN
MGFWWILRFPVFLAILINFFIFIRIVHLLVAKLRAREMHHTDYKFRSFQGLLVAVLYCFL
NKEVQSELRRHWHRWRLGKVLQEERGTSNHKAPSAPGQGLPGKKLQSGRDGGSQDSSAEI
PLAGGLPRLAESPFSTLLGPQLGLDSGT
GCGR мыши (SEQ ID NO:228)
MPLTQLHCPHLLLLLLVLSCLPEAPSAQVMDFLFEKWKLYSDQCHHNLSLLPPPTELVCN
RTFDNYSCWPDTPPNTTANISCPWYLPWCHKVQHRLVFKRCGPDGQWVRGPRGQPWRNAS
QCQLDDEEIEVQKGVAKMYSSQQVMYTVGYSLSLGALLLALVILLGLRKLHCTRNYIHGN
LFASFVLKAGSVLVIDWLLKTRYSQKIGDDLSVSVWLSDGAMAGCRVATVIMQYGIIPNY
CWLLVEGVYLYSLLSLATFSERSFFSLYLGIGWGAPLLFVIPWVVVKCLFENVQCWTSND
NMGFWWILRIPVFLALLINFFIFVHIIQLLVAKLRAHQMHYADYKFRLARSTLTLIPLLG
VHEVVFAFVTDEHAQGTLRSTKLFFDLFLSSFQGLLVAVLYCFLNKEVQAELMRRWRQWQ
EGKALQEERLASSHGSHMAPAGPCHGDPCEKLQLMSAGSSSGTGCVPSMETSLASSLPRL
ADSPT
GCGR крысы (SEQ ID NO:229)
MLLTQLHCPYLLLLLVVLSCLPKAPSAQVMDFLFEKWKLYSDQCHHNLSLLPPPTELVCN
RTFDKYSCWPDTPPNTTANISCPWYLPWYHKVQHRLVFKRCGPDGQWVRGPRGQSWRDAS
QCQMDDDEIEVQKGVAKMYSSYQVMYTVGYSLSLGALLLALVILLGLRKLHCTRNYIHGN
LFASFVLKAGSVLVIDWLLKTRYSQKIGDDLSVSVWLSDGAVAGCRVATVIMQYGIIANY
CWLLVEGVYLYSLLSITTFSEKSFFSLYLCIGWGSPLLFVIPWVVVKCLFENVQCWTSND
NMGFWWILRIPVLLAILINFFIFVRIIHLLVAKLRAHQMHYADYKFRLARSTLTLIPLLG
VHEVVFAFVTDEHAQGTLRSTKLFFDLFFSSFQGLLVAVLYCFLNKEVQAELLRRWRRWQ
EGKALQEERMASSHGSHMAPAGTCHGDPCEKLQLMSAGSSSGTGCEPSAKTSLASSLPRL
ADSPT
IgG1 человека (SEQ ID NO:230)
ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSS
GLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGG
PSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYN
STYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREE
MTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRW
QQGNVFSCSVMHEALHNHYTQKSLSLSPGK
IgG1 E233A/L235A человека (SEQ ID NO:231)
ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSS
GLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPALAGG
PSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYN
STYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREE
MTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRW
QQGNVFSCSVMHEALHNHYTQKSLSLSPGK
IgG1 L234A/L235A человека (SEQ ID NO:232)
ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSS
GLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEAAGG
PSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYN
STYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREE
MTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRW
QQGNVFSCSVMHEALHNHYTQKSLSLSPGK
Аминокислотная последовательность тяжелой цепи Hz6B5 с подчеркнутой сигнальной последовательностью (SEQ ID NO:233)
mdmrvpaqllgllllwlrgarcQVQLVQSGAEVKKPGSSVKVSCKASGFTFTNHWLGWVR
QAPGQGLEWIGDIYPGGYYINYNEKFKGRVTITADESTSTAYMELSSLRSEDTAVYYCAR
HTNYGSDYWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSW
NSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPK
SCDKTHTCPPCPAPALAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWY
VDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISK
AKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVL
DSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
Аминокислотная последовательность тяжелой цепи Hz6B5 без сигнальной последовательности (SEQ ID NO:234)
QVQLVQSGAEVKKPGSSVKVSCKASGFTFTNHWLGWVRQAPGQGLEWIGDIYPGGYYINY
NEKFKGRVTITADESTSTAYMELSSLRSEDTAVYYCARHTNYGSDYWGQGTTVTVSSAST
KGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLY
SLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPALAGGPSV
FLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTY
RVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTK
NQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQG
NVFSCSVMHEALHNHYTQKSLSLSPGK
Легкая цепь Hz6B5 с подчеркнутой сигнальной последовательностью (SEQ ID NO:235)
mdmrvpaqllgllllwlrgarcDVVMTQSPLSLPVTLGQPASISCRSSQSIVDSYGNTFL
EWYQQRPGQSPRLLIYKVSNRLSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCFQGSH
VPWTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNA
LQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGE
C
Легкая цепь Hz6B5 без сигнальной последовательности (SEQ ID NO:236)
DVVMTQSPLSLPVTLGQPASISCRSSQSIVDSYGNTFLEWYQQRPGQSPRLLIYKVSNRL
SGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCFQGSHVPWTFGQGTKLEIKRTVAAPSV
FIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSL
SSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
Консенсусная последовательность CDR2 тяжелой цепи (SEQ ID NO:237)
DIX1PGGX2YX3NYNX4KHKX5, где X1 представляет собой Y, H, F или S; X2 представляет собой Y, G, F или D; X3 представляет собой I, T, D, N или S; X4 представляет собой E, K, D, G или A; X5 представляет собой G, S или D
Консенсусная последовательность CDR1 легкой цепи (SEQ ID NO:238)
RSSQX6IVX7SX8GNTYLE, где X6 представляет собой S, T или H; X7 представляет собой D, H или Y; X8 представляет собой Y или D
Перечень последовательностей
[00277] Данное описание подается с копией машинно-читаемой формы (CRF - computer readable form) Перечня последовательностей. CRF под названием 13370-070-228_SEQ_LISTING.txt, которая была создана 25 января 2018 г. и размер которой составляет 108270 байтов, идентична бумажной копии Перечня последовательностей и включена в данный документ посредством ссылки в полном объеме.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> NGM BIOPHARMACEUTICALS, INC.
<120> БЕЛКИ, СВЯЗЫВАЮЩИЕ ГЛЮКАГОНОВЫЕ РЕЦЕПТОРЫ, И СПОСОБЫ ИХ
ПРИМЕНЕНИЯ
<130> 13370-070-228
<140> Настоящим находится на переуступлении
<141>
<150> 62/451603
<151> 27 января 2017 г.
<160> 238
<170> Версия PatentIn 3.5
<210> 1
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 1
Gly Phe Thr Phe Thr Asn His Trp Leu Gly
1 5 10
<210> 2
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 2
Asp Ile Tyr Pro Gly Gly Tyr Tyr Ile Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 3
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 3
His Thr Asn Tyr Gly Ser Asp Tyr
1 5
<210> 4
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 4
Arg Ser Ser Gln Ser Ile Val Asp Ser Tyr Gly Asn Thr Phe Leu Glu
1 5 10 15
<210> 5
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 5
Lys Val Ser Asn Arg Leu Ser
1 5
<210> 6
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 6
Phe Gln Gly Ser His Val Pro Trp Thr
1 5
<210> 7
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 7
Gly Phe Thr Phe Thr Asn His Trp
1 5
<210> 8
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 8
Ile Tyr Pro Gly Gly Tyr Tyr Ile
1 5
<210> 9
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 9
Ala Arg His Thr Asn Tyr Gly Ser Asp Tyr
1 5 10
<210> 10
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 10
Gln Ser Ile Val Asp Ser Tyr Gly Asn Thr Phe
1 5 10
<210> 11
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 11
Lys Val Ser
1
<210> 12
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 12
Asn His Trp Leu Gly
1 5
<210> 13
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 13
Gly Phe Thr Phe Thr Asn His
1 5
<210> 14
<211> 4
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 14
Pro Gly Gly Tyr
1
<210> 15
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 15
Thr Asn Tyr Gly Ser Asp
1 5
<210> 16
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 16
Ser Gln Ser Ile Val Asp Ser Tyr Gly Asn Thr Phe
1 5 10
<210> 17
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 17
Gly Ser His Val Pro Trp
1 5
<210> 18
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 18
Thr Asn His Trp Leu Gly
1 5
<210> 19
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 19
Trp Ile Gly Asp Ile Tyr Pro Gly Gly Tyr Tyr Ile Asn
1 5 10
<210> 20
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 20
Ala Arg His Thr Asn Tyr Gly Ser Asp
1 5
<210> 21
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 21
Val Asp Ser Tyr Gly Asn Thr Phe Leu Glu Trp Tyr
1 5 10
<210> 22
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 22
Leu Leu Ile Tyr Lys Val Ser Asn Arg Leu
1 5 10
<210> 23
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 23
Phe Gln Gly Ser His Val Pro Trp
1 5
<210> 24
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 24
Asp Ile Tyr Pro Gly Gly Tyr Tyr Ile Asn
1 5 10
<210> 25
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи 6B5
<400> 25
Gln Val Gln Leu Gln Gln Ser Gly Thr Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Asn His
20 25 30
Trp Leu Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Gly Tyr Tyr Ile Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg His Thr Asn Tyr Gly Ser Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 26
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи 6B5
<400> 26
Asp Val Leu Met Thr Gln Ile Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val Asp Ser
20 25 30
Tyr Gly Asn Thr Phe Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Leu Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Thr Gly Ala Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Ile Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 27
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 27
Gly Asn Thr Phe Thr Asn Tyr Trp Met His
1 5 10
<210> 28
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 28
Met Ile His Pro Asn Ser Gly Ser Thr His Tyr Asn Glu Lys Phe Lys
1 5 10 15
Asn
<210> 29
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 29
Thr Ala Asp Tyr Val Met Asp Tyr
1 5
<210> 30
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 30
Lys Ser Thr Lys Ser Leu Leu Asn Ser Asp Gly Phe Thr Tyr Leu Asp
1 5 10 15
<210> 31
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 31
Leu Val Ser Asn Arg Phe Ser
1 5
<210> 32
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 32
Phe Gln Ser Asn Phe Leu Pro Leu Thr
1 5
<210> 33
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 33
Gly Asn Thr Phe Thr Asn Tyr Trp
1 5
<210> 34
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 34
Ile His Pro Asn Ser Gly Ser Thr
1 5
<210> 35
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 35
Gly Ala Thr Ala Asp Tyr Val Met Asp Tyr
1 5 10
<210> 36
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 36
Lys Ser Leu Leu Asn Ser Asp Gly Phe Thr Tyr
1 5 10
<210> 37
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 37
Leu Val Ser
1
<210> 38
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 38
Asn Tyr Trp Met His
1 5
<210> 39
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 39
Gly Asn Thr Phe Thr Asn Tyr
1 5
<210> 40
<211> 4
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 40
Pro Asn Ser Gly
1
<210> 41
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 41
Ala Asp Tyr Val Met Asp
1 5
<210> 42
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 42
Thr Lys Ser Leu Asn Ser Asp Gly Phe Thr Tyr
1 5 10
<210> 43
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 43
Ser Asn Phe Leu Pro Leu
1 5
<210> 44
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 44
Thr Asn Tyr Trp Met His
1 5
<210> 45
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 45
Trp Ile Gly Met Ile His Pro Asn Ser Gly Ser Thr His
1 5 10
<210> 46
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 46
Gly Ala Thr Ala Asp Tyr Val Met Asp
1 5
<210> 47
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 47
Leu Asn Ser Asp Gly Phe Thr Tyr Leu Asp Trp Tyr
1 5 10
<210> 48
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 48
Leu Leu Ile Asn Leu Val Ser Asn Arg Phe
1 5 10
<210> 49
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 49
Phe Gln Ser Asn Phe Leu Pro Leu
1 5
<210> 50
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 50
Met Ile His Pro Asn Ser Gly Ser Thr His
1 5 10
<210> 51
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи 3H5
<400> 51
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Arg Leu Ser Cys Lys Ala Ser Gly Asn Thr Phe Thr Asn Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile His Pro Asn Ser Gly Ser Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asn Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Gly Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Gly Ala Thr Ala Asp Tyr Val Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 52
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи 3H5
<400> 52
Asp Ile Val Leu Thr Gln Thr Pro Leu Ser Leu Pro Val Asn Ile Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Lys Ser Thr Lys Ser Leu Leu Asn Ser
20 25 30
Asp Gly Phe Thr Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Asn Leu Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Ile Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Ser
85 90 95
Asn Phe Leu Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 53
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 53
Gly Asn Thr Phe Thr Ser His Trp Met His
1 5 10
<210> 54
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 54
Met Ser His Pro Asn Ser Gly Ser Ser Asn Tyr Ser Gly Lys Phe Lys
1 5 10 15
Ser
<210> 55
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 55
Thr Asp Tyr Asp Tyr Asp Gly Asp Tyr
1 5
<210> 56
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 56
Lys Ser Ser Lys Ser Leu Leu Asn Ser Asp Gly Leu Thr Tyr Leu Asp
1 5 10 15
<210> 57
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 57
Gly Asn Thr Phe Thr Ser His Trp
1 5
<210> 58
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 58
Ser His Pro Asn Ser Gly Ser Ser Asn
1 5
<210> 59
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 59
Ala Arg Thr Asp Tyr Asp Tyr Asp Gly Asp Tyr
1 5 10
<210> 60
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 60
Lys Ser Leu Leu Asn Ser Asp Gly Leu Thr Tyr
1 5 10
<210> 61
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 61
Ser His Trp Met His
1 5
<210> 62
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 62
Gly Asn Thr Phe Thr Ser His
1 5
<210> 63
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 63
Asp Tyr Asp Tyr Asp Gly Asp
1 5
<210> 64
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 64
Ser Lys Ser Leu Leu Asn Ser Asp Gly Leu Thr Tyr
1 5 10
<210> 65
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 65
Thr Ser His Trp Met His
1 5
<210> 66
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 66
Trp Ile Gly Met Ser His Pro Asn Ser Gly Ser Ser Asn
1 5 10
<210> 67
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 67
Ala Arg Thr Asp Tyr Asp Tyr Asp Gly Asp
1 5 10
<210> 68
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 68
Leu Asn Ser Asp Gly Leu Thr Tyr Leu Asp Trp Tyr
1 5 10
<210> 69
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 69
Leu Leu Ile Tyr Leu Val Ser Asn Arg Phe
1 5 10
<210> 70
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 70
Met Ser His Pro Asn Ser Gly Ser Ser Asn
1 5 10
<210> 71
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи 5B11
<400> 71
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Asn Thr Phe Thr Ser His
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ser His Pro Asn Ser Gly Ser Ser Asn Tyr Ser Gly Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Arg Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Asp Tyr Asp Tyr Asp Gly Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 72
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи 5B11
<400> 72
Asp Val Val Leu Thr Gln Thr Pro Leu Ser Leu Pro Val Asn Ile Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Lys Ser Ser Lys Ser Leu Leu Asn Ser
20 25 30
Asp Gly Leu Thr Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Asp Asp Leu Gly Val Tyr Tyr Cys Phe Gln Ser
85 90 95
Asn Phe Leu Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 73
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 73
Gly Tyr Thr Phe Thr Arg Asn Val Ile His
1 5 10
<210> 74
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 74
Tyr Ile Asn Pro Tyr Asn Asp Gly Ala Lys Tyr Asn Ala Lys Phe Lys
1 5 10 15
Gly
<210> 75
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 75
Trp Gly Asn Tyr Glu Asp Phe Ala Met Asp Tyr
1 5 10
<210> 76
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 76
Arg Ala Ser Glu Ser Val Asp Ile Tyr Gly Asn Ser Tyr Met His
1 5 10 15
<210> 77
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 77
Leu Ala Ser Asn Leu Glu Ser
1 5
<210> 78
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 78
Gln Gln Asn Asn Glu Asp Pro Phe Thr
1 5
<210> 79
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 79
Gly Tyr Thr Phe Thr Arg Asn Val
1 5
<210> 80
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 80
Ile Asn Pro Tyr Asn Asp Gly Ala
1 5
<210> 81
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 81
Ala Arg Trp Gly Asn Tyr Glu Asp Phe Ala Met Asp Tyr
1 5 10
<210> 82
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 82
Glu Ser Val Asp Ile Tyr Gly Asn Ser Tyr
1 5 10
<210> 83
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 83
Leu Ala Ser
1
<210> 84
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 84
Arg Asn Val Ile His
1 5
<210> 85
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 85
Gly Tyr Thr Phe Thr Arg Asn
1 5
<210> 86
<211> 4
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 86
Pro Tyr Asn Asp
1
<210> 87
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 87
Gly Asn Tyr Glu Asp Phe Ala Met Asp
1 5
<210> 88
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 88
Ser Glu Ser Val Asp Ile Tyr Gly Asn Ser Tyr
1 5 10
<210> 89
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 89
Asn Asn Glu Asp Pro Phe
1 5
<210> 90
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 90
Thr Arg Asn Val Ile His
1 5
<210> 91
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 91
Trp Ile Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Ala Lys
1 5 10
<210> 92
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 92
Ala Arg Trp Gly Asn Tyr Glu Asp Phe Ala Met Asp
1 5 10
<210> 93
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 93
Asp Ile Tyr Gly Asn Ser Tyr Met His Trp Tyr
1 5 10
<210> 94
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 94
Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu
1 5 10
<210> 95
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 95
Gln Gln Asn Asn Glu Asp Pro Phe
1 5
<210> 96
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 96
Tyr Ile Asn Pro Tyr Asn Asp Gly Ala Lys
1 5 10
<210> 97
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи 1C1
<400> 97
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Thr Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Asn
20 25 30
Val Ile His Trp Val Lys Gln Lys Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Ala Lys Tyr Asn Ala Lys Phe
50 55 60
Lys Gly Lys Ala Thr Val Thr Ser Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Trp Gly Asn Tyr Glu Asp Phe Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 98
<211> 111
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи 1C1
<400> 98
Asn Ile Val Leu Thr Gln Ser Pro Pro Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Ile Tyr
20 25 30
Gly Asn Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Glu Phe Ser Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Ala Gly Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Asp Pro Phe Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 99
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 99
Gly Tyr Thr Phe Thr Ser Ser Val Met His
1 5 10
<210> 100
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 100
Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys Tyr Asn Glu Asn Phe Lys
1 5 10 15
Gly
<210> 101
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 101
Gly Ala Gly Tyr Asp Arg Gly Pro Met Ala Met Asp Tyr
1 5 10
<210> 102
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 102
Arg Ala Ser Glu Ser Val Asp Ser Tyr Gly Asp Ser Phe Val His
1 5 10 15
<210> 103
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 103
Phe Ala Ser Asn Leu Glu Ser
1 5
<210> 104
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 104
Gln Gln Asn Asn Glu Val Pro Phe Thr
1 5
<210> 105
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 105
Gly Tyr Thr Phe Thr Ser Ser Val
1 5
<210> 106
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 106
Ile Asn Pro Tyr Asn Asp Gly Thr
1 5
<210> 107
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 107
Ala Arg Gly Ala Gly Tyr Asp Arg Gly Pro Met Ala Met Asp Tyr
1 5 10 15
<210> 108
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 108
Glu Ser Val Asp Ser Tyr Gly Asp Ser Phe
1 5 10
<210> 109
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 109
Phe Ala Ser
1
<210> 110
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 110
Ser Ser Val Met His
1 5
<210> 111
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 111
Gly Tyr Thr Phe Thr Ser Ser
1 5
<210> 112
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 112
Ala Gly Tyr Asp Arg Gly Pro Met Ala Met Asp
1 5 10
<210> 113
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 113
Ser Glu Ser Val Asp Ser Tyr Gly Asp Ser Phe
1 5 10
<210> 114
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 114
Asn Asn Glu Val Pro Phe
1 5
<210> 115
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 115
Thr Ser Ser Val Met His
1 5
<210> 116
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 116
Trp Ile Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys
1 5 10
<210> 117
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 117
Ala Arg Gly Ala Gly Tyr Asp Arg Gly Pro Met Ala Met Asp
1 5 10
<210> 118
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 118
Asp Ser Tyr Gly Asp Ser Phe Val His Trp Tyr
1 5 10
<210> 119
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 119
Leu Leu Ile Tyr Phe Ala Ser Asn Leu Glu
1 5 10
<210> 120
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 120
Gln Gln Asn Asn Glu Val Pro Phe
1 5
<210> 121
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 121
Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys
1 5 10
<210> 122
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи 1C3
<400> 122
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Ser
20 25 30
Val Met His Trp Val Lys Gln Lys Pro Gly Gln Ala Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys Tyr Asn Glu Asn Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Arg Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Val Thr Gly Ala Gly Tyr Asp Arg Gly Pro Met Ala Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 123
<211> 111
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи 1C3
<400> 123
Asn Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Ser Tyr
20 25 30
Gly Asp Ser Phe Val His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Phe Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Ala Asp Asp Thr Ala Thr Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Val Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 124
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 124
Gly Tyr Thr Phe Thr Ser Tyr Trp Ile Thr
1 5 10
<210> 125
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 125
Asp Ile His Pro Gly Gly Gly Asp Thr Asn Tyr Asn Lys Lys Phe Lys
1 5 10 15
Ser
<210> 126
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 126
Asp Asp Asn Tyr Val Gly Phe Thr Tyr
1 5
<210> 127
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 127
Arg Ser Ser Gln Thr Ile Ile His Ser Asp Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 128
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 128
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 129
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 129
Gly Tyr Thr Phe Thr Ser Tyr Trp
1 5
<210> 130
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 130
Ile His Pro Gly Gly Gly Asp Thr
1 5
<210> 131
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 131
Ala Arg Asp Asp Asn Tyr Val Gly Phe Thr Tyr
1 5 10
<210> 132
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 132
Gln Thr Ile Ile His Ser Asp Gly Asn Thr Tyr
1 5 10
<210> 133
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 133
Ser Tyr Trp Ile Thr
1 5
<210> 134
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 134
Gly Tyr Thr Phe Thr Ser Tyr
1 5
<210> 135
<211> 4
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 135
Pro Gly Gly Gly
1
<210> 136
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 136
Asp Asn Tyr Val Gly Phe Thr
1 5
<210> 137
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 137
Ser Gln Thr Ile Ile His Ser Asp Gly Asn Thr Tyr
1 5 10
<210> 138
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 138
Thr Ser Tyr Trp Ile Thr
1 5
<210> 139
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 139
Trp Ile Gly Asp Ile His Pro Gly Gly Gly Asp Thr Asn
1 5 10
<210> 140
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 140
Ala Arg Asp Asp Asn Tyr Val Gly Phe Thr
1 5 10
<210> 141
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 141
Ile His Ser Asp Gly Asn Thr Tyr Leu Glu Trp Tyr
1 5 10
<210> 142
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 142
Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe
1 5 10
<210> 143
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 143
Asp Ile His Pro Gly Gly Gly Asp Thr Asn
1 5 10
<210> 144
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи 1H2
<400> 144
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Val Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Ile Thr Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile His Pro Gly Gly Gly Asp Thr Asn Tyr Asn Lys Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr His Cys
85 90 95
Thr Ser Asp Asp Asn Tyr Val Gly Phe Thr Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 145
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи 1H2
<400> 145
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Thr Ile Ile His Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Ile Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 146
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 146
Gly Tyr Thr Phe Ser Asn Tyr Trp Ile Gly
1 5 10
<210> 147
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 147
Asp Ile Tyr Pro Gly Gly Phe Tyr Asp Asn Tyr Asn Asp Lys Phe Lys
1 5 10 15
Gly
<210> 148
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 148
Ser Gly Gly Leu Pro Gly Ala Gly Phe Thr Tyr
1 5 10
<210> 149
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 149
Arg Ser Ser Gln His Ile Val Tyr Ser Asp Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 150
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 150
Gly Tyr Thr Phe Ser Asn Tyr Trp
1 5
<210> 151
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 151
Ile Tyr Pro Gly Gly Phe Tyr Asp Asn
1 5
<210> 152
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 152
Ala Arg Ser Gly Gly Leu Pro Gly Ala Gly Phe Thr Tyr
1 5 10
<210> 153
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 153
Gln His Ile Val Tyr Ser Asp Gly Asn Thr Tyr
1 5 10
<210> 154
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 154
Asn Tyr Trp Ile Gly
1 5
<210> 155
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 155
Gly Tyr Thr Phe Ser Asn Tyr
1 5
<210> 156
<211> 4
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 156
Pro Gly Gly Phe
1
<210> 157
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 157
Gly Gly Leu Pro Gly Ala Gly Phe Thr
1 5
<210> 158
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 158
Ser Gln His Ile Val Tyr Ser Asp Gly Asn Thr Tyr
1 5 10
<210> 159
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 159
Ser Asn Tyr Trp Ile Gly
1 5
<210> 160
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 160
Trp Ile Gly Asp Ile Tyr Pro Gly Gly Phe Tyr Asp Asn
1 5 10
<210> 161
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 161
Ala Arg Ser Gly Gly Leu Pro Gly Ala Gly Phe Thr
1 5 10
<210> 162
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 162
Val Tyr Ser Asp Gly Asn Thr Tyr Leu Glu Trp Tyr
1 5 10
<210> 163
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 163
Asp Ile Tyr Pro Gly Gly Phe Tyr Asp Asn
1 5 10
<210> 164
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи 4F8
<400> 164
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Thr Met Ser Cys Lys Ala Ala Gly Tyr Thr Phe Ser Asn Tyr
20 25 30
Trp Ile Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Gly Phe Tyr Asp Asn Tyr Asn Asp Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Thr Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Thr Arg Ser Gly Gly Leu Pro Gly Ala Gly Phe Thr Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ala
115 120
<210> 165
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи 4F8
<400> 165
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln His Ile Val Tyr Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Glu Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 166
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 166
Gly Tyr Thr Phe Thr Asn Tyr Trp Leu Gly
1 5 10
<210> 167
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 167
Asp Ile Tyr Pro Gly Gly Asp Tyr Asn Asn Tyr Asn Gly Lys Phe Lys
1 5 10 15
Gly
<210> 168
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 168
Ser Asp Asp Gly Tyr Ser
1 5
<210> 169
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 169
Arg Ser Ser Gln Ser Ile Val Asp Ser Tyr Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 170
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 170
Lys Val Ser Asn Arg Phe Ala
1 5
<210> 171
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 171
Phe Gln Gly Ser His Ile Pro Trp Thr
1 5
<210> 172
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 172
Gly Tyr Thr Phe Thr Asn Tyr Trp
1 5
<210> 173
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 173
Ile Tyr Pro Gly Gly Asp Tyr Asn
1 5
<210> 174
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 174
Ala Arg Ser Asp Asp Gly Tyr Ser
1 5
<210> 175
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 175
Gln Ser Ile Val Asp Ser Tyr Gly Asn Thr Tyr
1 5 10
<210> 176
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 176
Asn Tyr Trp Leu Gly
1 5
<210> 177
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 177
Gly Tyr Thr Phe Thr Asn Tyr
1 5
<210> 178
<211> 4
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 178
Pro Gly Gly Asp
1
<210> 179
<211> 4
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 179
Asp Asp Gly Tyr
1
<210> 180
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 180
Ser Gln Ser Ile Val Asp Ser Tyr Gly Asn Thr Tyr
1 5 10
<210> 181
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 181
Gly Ser His Ile Pro Trp
1 5
<210> 182
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 182
Thr Asn Tyr Trp Leu Gly
1 5
<210> 183
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 183
Trp Ile Gly Asp Ile Tyr Pro Gly Gly Asp Tyr Asn Asn
1 5 10
<210> 184
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 184
Ala Arg Ser Asp Asp Gly Tyr
1 5
<210> 185
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 185
Val Asp Ser Tyr Gly Asn Thr Tyr Leu Glu Trp Tyr
1 5 10
<210> 186
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 186
Phe Gln Gly Ser His Ile Pro Trp
1 5
<210> 187
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 187
Asp Ile Tyr Pro Gly Gly Asp Tyr Asn Asn
1 5 10
<210> 188
<211> 115
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи 13G9
<400> 188
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Leu Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Gly Asp Tyr Asn Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Ile Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Val Arg Ser Asp Asp Gly Tyr Ser Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser
115
<210> 189
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи 13G9
<400> 189
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val Asp Ser
20 25 30
Tyr Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln Lys Pro Gly Gln Ser
35 40 45
Pro Thr Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ala Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Ile Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 190
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 190
Gly Tyr Thr Phe Thr Asn Tyr Trp Ile Gly
1 5 10
<210> 191
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 191
Asp Ile Phe Pro Gly Gly Phe Tyr Ser Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 192
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 192
Ile Trp Asp Arg Gly Phe Asp Tyr
1 5
<210> 193
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 193
Phe Gln Gly Ser His Val Pro Tyr Thr
1 5
<210> 194
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 194
Ile Phe Pro Gly Gly Phe Tyr Ser
1 5
<210> 195
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 195
Ala Arg Ile Trp Asp Arg Gly Phe Asp Tyr
1 5 10
<210> 196
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 196
Trp Asp Arg Gly Phe Asp
1 5
<210> 197
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 197
Gly Ser His Val Pro Tyr
1 5
<210> 198
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 198
Thr Asn Tyr Trp Ile Gly
1 5
<210> 199
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 199
Trp Ile Gly Asp Ile Phe Pro Gly Gly Phe Tyr Ser Asn
1 5 10
<210> 200
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 200
Ala Arg Ile Trp Asp Arg Gly Phe Asp
1 5
<210> 201
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 201
Phe Gln Gly Ser His Val Pro Tyr
1 5
<210> 202
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 202
Asp Ile Phe Pro Gly Gly Phe Tyr Ser Asn
1 5 10
<210> 203
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи 14F4
<400> 203
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Asn Met Ser Cys Lys Ala Thr Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Ile Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Phe Pro Gly Gly Phe Tyr Ser Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Thr Asp Thr Ser Ser Ser Thr Gly Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Ile Trp Asp Arg Gly Phe Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 204
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи 14F4
<400> 204
Asp Val Leu Met Thr Gln Ser Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val Asp Ser
20 25 30
Tyr Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Arg Gly Leu Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 205
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 205
Asp Ile Ser Pro Gly Asn Tyr Tyr Thr Asn Tyr Asn Ala Lys Phe Lys
1 5 10 15
Asp
<210> 206
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 206
Tyr Asp Glu Phe Ala Tyr
1 5
<210> 207
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 207
Arg Ser Ser Gln Ser Ile Val His Ser Asp Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 208
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 208
Ile Ser Pro Gly Asn Tyr Tyr Thr
1 5
<210> 209
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 209
Ala Arg Tyr Asp Glu Phe Ala Tyr
1 5
<210> 210
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 210
Gln Ser Ile Val His Ser Asp Gly Asn Thr Tyr
1 5 10
<210> 211
<211> 4
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 211
Pro Gly Asn Tyr
1
<210> 212
<211> 4
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 212
Asp Glu Phe Ala
1
<210> 213
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 213
Ser Gln Ser Ile Val His Ser Asp Gly Asn Thr Tyr
1 5 10
<210> 214
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 214
Trp Ile Gly Asp Ile Ser Pro Gly Asn Tyr Tyr Thr Asn
1 5 10
<210> 215
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 215
Ala Arg Tyr Asp Glu Phe Ala
1 5
<210> 216
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 216
Val His Ser Asp Gly Asn Thr Tyr Leu Glu Trp Tyr
1 5 10
<210> 217
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность CDR
<400> 217
Asp Ile Ser Pro Gly Asn Tyr Tyr Thr Asn
1 5 10
<210> 218
<211> 115
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи 14E9
<400> 218
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ala Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Ile Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Ser Pro Gly Asn Tyr Tyr Thr Asn Tyr Asn Ala Lys Phe
50 55 60
Lys Asp Lys Val Ser Leu Thr Ala Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Tyr Asp Glu Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ala
115
<210> 219
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи 14E9
<400> 219
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Ser Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 220
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи Hz6B5
<400> 220
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Asn His
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Gly Tyr Tyr Ile Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg His Thr Asn Tyr Gly Ser Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 221
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи Hz6B5
<400> 221
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val Asp Ser
20 25 30
Tyr Gly Asn Thr Phe Leu Glu Trp Tyr Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Leu Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 222
<211> 477
<212> PRT
<213> Homo sapiens
<220>
<223> CGCR человека с прогнозируемой сигнальной последовательностью
<400> 222
Met Pro Pro Cys Gln Pro Gln Arg Pro Leu Leu Leu Leu Leu Leu Leu
1 5 10 15
Leu Ala Cys Gln Pro Gln Val Pro Ser Ala Gln Val Met Asp Phe Leu
20 25 30
Phe Glu Lys Trp Lys Leu Tyr Gly Asp Gln Cys His His Asn Leu Ser
35 40 45
Leu Leu Pro Pro Pro Thr Glu Leu Val Cys Asn Arg Thr Phe Asp Lys
50 55 60
Tyr Ser Cys Trp Pro Asp Thr Pro Ala Asn Thr Thr Ala Asn Ile Ser
65 70 75 80
Cys Pro Trp Tyr Leu Pro Trp His His Lys Val Gln His Arg Phe Val
85 90 95
Phe Lys Arg Cys Gly Pro Asp Gly Gln Trp Val Arg Gly Pro Arg Gly
100 105 110
Gln Pro Trp Arg Asp Ala Ser Gln Cys Gln Met Asp Gly Glu Glu Ile
115 120 125
Glu Val Gln Lys Glu Val Ala Lys Met Tyr Ser Ser Phe Gln Val Met
130 135 140
Tyr Thr Val Gly Tyr Ser Leu Ser Leu Gly Ala Leu Leu Leu Ala Leu
145 150 155 160
Ala Ile Leu Gly Gly Leu Ser Lys Leu His Cys Thr Arg Asn Ala Ile
165 170 175
His Ala Asn Leu Phe Ala Ser Phe Val Leu Lys Ala Ser Ser Val Leu
180 185 190
Val Ile Asp Gly Leu Leu Arg Thr Arg Tyr Ser Gln Lys Ile Gly Asp
195 200 205
Asp Leu Ser Val Ser Thr Trp Leu Ser Asp Gly Ala Val Ala Gly Cys
210 215 220
Arg Val Ala Ala Val Phe Met Gln Tyr Gly Ile Val Ala Asn Tyr Cys
225 230 235 240
Trp Leu Leu Val Glu Gly Leu Tyr Leu His Asn Leu Leu Gly Leu Ala
245 250 255
Thr Leu Pro Glu Arg Ser Phe Phe Ser Leu Tyr Leu Gly Ile Gly Trp
260 265 270
Gly Ala Pro Met Leu Phe Val Val Pro Trp Ala Val Val Lys Cys Leu
275 280 285
Phe Glu Asn Val Gln Cys Trp Thr Ser Asn Asp Asn Met Gly Phe Trp
290 295 300
Trp Ile Leu Arg Phe Pro Val Phe Leu Ala Ile Leu Ile Asn Phe Phe
305 310 315 320
Ile Phe Val Arg Ile Val Gln Leu Leu Val Ala Lys Leu Arg Ala Arg
325 330 335
Gln Met His His Thr Asp Tyr Lys Phe Arg Leu Ala Lys Ser Thr Leu
340 345 350
Thr Leu Ile Pro Leu Leu Gly Val His Glu Val Val Phe Ala Phe Val
355 360 365
Thr Asp Glu His Ala Gln Gly Thr Leu Arg Ser Ala Lys Leu Phe Phe
370 375 380
Asp Leu Phe Leu Ser Ser Phe Gln Gly Leu Leu Val Ala Val Leu Tyr
385 390 395 400
Cys Phe Leu Asn Lys Glu Val Gln Ser Glu Leu Arg Arg Arg Trp His
405 410 415
Arg Trp Arg Leu Gly Lys Val Leu Trp Glu Glu Arg Asn Thr Ser Asn
420 425 430
His Arg Ala Ser Ser Ser Pro Gly His Gly Pro Pro Ser Lys Glu Leu
435 440 445
Gln Phe Gly Arg Gly Gly Gly Ser Gln Asp Ser Ser Ala Glu Thr Pro
450 455 460
Leu Ala Gly Gly Leu Pro Arg Leu Ala Glu Ser Pro Phe
465 470 475
<210> 223
<211> 452
<212> PRT
<213> Homo sapiens
<220>
<223> CGCR человека с прогнозируемой сигнальной последовательностью
<400> 223
Ala Gln Val Met Asp Phe Leu Phe Glu Lys Trp Lys Leu Tyr Gly Asp
1 5 10 15
Gln Cys His His Asn Leu Ser Leu Leu Pro Pro Pro Thr Glu Leu Val
20 25 30
Cys Asn Arg Thr Phe Asp Lys Tyr Ser Cys Trp Pro Asp Thr Pro Ala
35 40 45
Asn Thr Thr Ala Asn Ile Ser Cys Pro Trp Tyr Leu Pro Trp His His
50 55 60
Lys Val Gln His Arg Phe Val Phe Lys Arg Cys Gly Pro Asp Gly Gln
65 70 75 80
Trp Val Arg Gly Pro Arg Gly Gln Pro Trp Arg Asp Ala Ser Gln Cys
85 90 95
Gln Met Asp Gly Glu Glu Ile Glu Val Gln Lys Glu Val Ala Lys Met
100 105 110
Tyr Ser Ser Phe Gln Val Met Tyr Thr Val Gly Tyr Ser Leu Ser Leu
115 120 125
Gly Ala Leu Leu Leu Ala Leu Ala Ile Leu Gly Gly Leu Ser Lys Leu
130 135 140
His Cys Thr Arg Asn Ala Ile His Ala Asn Leu Phe Ala Ser Phe Val
145 150 155 160
Leu Lys Ala Ser Ser Val Leu Val Ile Asp Gly Leu Leu Arg Thr Arg
165 170 175
Tyr Ser Gln Lys Ile Gly Asp Asp Leu Ser Val Ser Thr Trp Leu Ser
180 185 190
Asp Gly Ala Val Ala Gly Cys Arg Val Ala Ala Val Phe Met Gln Tyr
195 200 205
Gly Ile Val Ala Asn Tyr Cys Trp Leu Leu Val Glu Gly Leu Tyr Leu
210 215 220
His Asn Leu Leu Gly Leu Ala Thr Leu Pro Glu Arg Ser Phe Phe Ser
225 230 235 240
Leu Tyr Leu Gly Ile Gly Trp Gly Ala Pro Met Leu Phe Val Val Pro
245 250 255
Trp Ala Val Val Lys Cys Leu Phe Glu Asn Val Gln Cys Trp Thr Ser
260 265 270
Asn Asp Asn Met Gly Phe Trp Trp Ile Leu Arg Phe Pro Val Phe Leu
275 280 285
Ala Ile Leu Ile Asn Phe Phe Ile Phe Val Arg Ile Val Gln Leu Leu
290 295 300
Val Ala Lys Leu Arg Ala Arg Gln Met His His Thr Asp Tyr Lys Phe
305 310 315 320
Arg Leu Ala Lys Ser Thr Leu Thr Leu Ile Pro Leu Leu Gly Val His
325 330 335
Glu Val Val Phe Ala Phe Val Thr Asp Glu His Ala Gln Gly Thr Leu
340 345 350
Arg Ser Ala Lys Leu Phe Phe Asp Leu Phe Leu Ser Ser Phe Gln Gly
355 360 365
Leu Leu Val Ala Val Leu Tyr Cys Phe Leu Asn Lys Glu Val Gln Ser
370 375 380
Glu Leu Arg Arg Arg Trp His Arg Trp Arg Leu Gly Lys Val Leu Trp
385 390 395 400
Glu Glu Arg Asn Thr Ser Asn His Arg Ala Ser Ser Ser Pro Gly His
405 410 415
Gly Pro Pro Ser Lys Glu Leu Gln Phe Gly Arg Gly Gly Gly Ser Gln
420 425 430
Asp Ser Ser Ala Glu Thr Pro Leu Ala Gly Gly Leu Pro Arg Leu Ala
435 440 445
Glu Ser Pro Phe
450
<210> 224
<211> 111
<212> PRT
<213> Homo sapiens
<220>
<223> Внеклеточный домен CGCR человека (аминокислоты 26-136)
<400> 224
Ala Gln Val Met Asp Phe Leu Phe Glu Lys Trp Lys Leu Tyr Gly Asp
1 5 10 15
Gln Cys His His Asn Leu Ser Leu Leu Pro Pro Pro Thr Glu Leu Val
20 25 30
Cys Asn Arg Thr Phe Asp Lys Tyr Ser Cys Trp Pro Asp Thr Pro Ala
35 40 45
Asn Thr Thr Ala Asn Ile Ser Cys Pro Trp Tyr Leu Pro Trp His His
50 55 60
Lys Val Gln His Arg Phe Val Phe Lys Arg Cys Gly Pro Asp Gly Gln
65 70 75 80
Trp Val Arg Gly Pro Arg Gly Gln Pro Trp Arg Asp Ala Ser Gln Cys
85 90 95
Gln Met Asp Gly Glu Glu Ile Glu Val Gln Lys Glu Val Ala Lys
100 105 110
<210> 225
<211> 96
<212> PRT
<213> Homo sapiens
<220>
<223> Внеклеточный домен CGCR человека (аминокислоты 28-123)
<400> 225
Val Met Asp Phe Leu Phe Glu Lys Trp Lys Leu Tyr Gly Asp Gln Cys
1 5 10 15
His His Asn Leu Ser Leu Leu Pro Pro Pro Thr Glu Leu Val Cys Asn
20 25 30
Arg Thr Phe Asp Lys Tyr Ser Cys Trp Pro Asp Thr Pro Ala Asn Thr
35 40 45
Thr Ala Asn Ile Ser Cys Pro Trp Tyr Leu Pro Trp His His Lys Val
50 55 60
Gln His Arg Phe Val Phe Lys Arg Cys Gly Pro Asp Gly Gln Trp Val
65 70 75 80
Arg Gly Pro Arg Gly Gln Pro Trp Arg Asp Ala Ser Gln Cys Gln Met
85 90 95
<210> 226
<211> 40
<212> PRT
<213> Homo sapiens
<220>
<223> Внеклеточный домен CGCR человека (аминокислоты 80-119)
<400> 226
Ser Cys Pro Trp Tyr Leu Pro Trp His His Lys Val Gln His Arg Phe
1 5 10 15
Val Phe Lys Arg Cys Gly Pro Asp Gly Gln Trp Val Arg Gly Pro Arg
20 25 30
Gly Gln Pro Trp Arg Asp Ala Ser
35 40
<210> 227
<211> 448
<212> PRT
<213> Macaca fascicularis
<220>
<223> GCGR – яванский макак
<400> 227
Met Pro Pro Cys Gln Pro Arg Arg Pro Leu Leu Leu Leu Leu Leu Leu
1 5 10 15
Leu Ala Cys Gln Pro Gln Ala Pro Ser Ala Gln Val Met Asp Phe Leu
20 25 30
Phe Glu Lys Trp Lys Leu Tyr Gly Asp Gln Cys His His Asn Leu Ser
35 40 45
Leu Leu Pro Pro Pro Thr Glu Leu Val Cys Asn Arg Thr Phe Asp Lys
50 55 60
Tyr Ser Cys Trp Pro Asp Thr Pro Ala Asn Thr Thr Ala Asn Ile Ser
65 70 75 80
Cys Pro Trp Tyr Leu Pro Trp His His Lys Val Gln His Arg Phe Val
85 90 95
Phe Lys Arg Cys Gly Pro Asp Gly Gln Trp Val Arg Gly Pro Arg Gly
100 105 110
Gln Pro Trp Arg Asp Ala Ser Gln Cys Gln Met Asp Gly Glu Glu Leu
115 120 125
Glu Val Gln Lys Glu Val Ala Lys Met Tyr Ser Ser Phe Gln Val Met
130 135 140
Tyr Thr Val Gly Tyr Ser Leu Ser Leu Gly Ala Leu Leu Leu Ala Leu
145 150 155 160
Ala Val Leu Gly Gly Ile Ser Lys Leu His Cys Thr Arg Asn Ala Ile
165 170 175
His Ala Asn Leu Phe Val Ser Phe Val Leu Lys Ala Ser Ser Val Leu
180 185 190
Val Ile Asp Gly Leu Leu Arg Thr Arg Tyr Ser Gln Lys Ile Gly Asp
195 200 205
Asp Leu Ser Val Ser Ile Trp Leu Ser Asp Gly Ala Val Ala Gly Cys
210 215 220
Arg Val Ala Ala Val Phe Met Gln Tyr Gly Val Val Ala Asn Tyr Cys
225 230 235 240
Trp Leu Leu Val Glu Gly Leu Tyr Leu His Asn Leu Leu Gly Leu Ala
245 250 255
Thr Leu Pro Glu Arg Ser Phe Phe Ser Leu Tyr Leu Gly Ile Gly Trp
260 265 270
Gly Ala Pro Met Leu Phe Ile Ile Pro Trp Val Val Val Arg Cys Leu
275 280 285
Phe Glu Asn Ile Gln Cys Trp Thr Ser Asn Asp Asn Met Gly Phe Trp
290 295 300
Trp Ile Leu Arg Phe Pro Val Phe Leu Ala Ile Leu Ile Asn Phe Phe
305 310 315 320
Ile Phe Ile Arg Ile Val His Leu Leu Val Ala Lys Leu Arg Ala Arg
325 330 335
Glu Met His His Thr Asp Tyr Lys Phe Arg Ser Phe Gln Gly Leu Leu
340 345 350
Val Ala Val Leu Tyr Cys Phe Leu Asn Lys Glu Val Gln Ser Glu Leu
355 360 365
Arg Arg His Trp His Arg Trp Arg Leu Gly Lys Val Leu Gln Glu Glu
370 375 380
Arg Gly Thr Ser Asn His Lys Ala Pro Ser Ala Pro Gly Gln Gly Leu
385 390 395 400
Pro Gly Lys Lys Leu Gln Ser Gly Arg Asp Gly Gly Ser Gln Asp Ser
405 410 415
Ser Ala Glu Ile Pro Leu Ala Gly Gly Leu Pro Arg Leu Ala Glu Ser
420 425 430
Pro Phe Ser Thr Leu Leu Gly Pro Gln Leu Gly Leu Asp Ser Gly Thr
435 440 445
<210> 228
<211> 485
<212> PRT
<213> Mus musculus
<220>
<223> GCGR - мышь
<400> 228
Met Pro Leu Thr Gln Leu His Cys Pro His Leu Leu Leu Leu Leu Leu
1 5 10 15
Val Leu Ser Cys Leu Pro Glu Ala Pro Ser Ala Gln Val Met Asp Phe
20 25 30
Leu Phe Glu Lys Trp Lys Leu Tyr Ser Asp Gln Cys His His Asn Leu
35 40 45
Ser Leu Leu Pro Pro Pro Thr Glu Leu Val Cys Asn Arg Thr Phe Asp
50 55 60
Asn Tyr Ser Cys Trp Pro Asp Thr Pro Pro Asn Thr Thr Ala Asn Ile
65 70 75 80
Ser Cys Pro Trp Tyr Leu Pro Trp Cys His Lys Val Gln His Arg Leu
85 90 95
Val Phe Lys Arg Cys Gly Pro Asp Gly Gln Trp Val Arg Gly Pro Arg
100 105 110
Gly Gln Pro Trp Arg Asn Ala Ser Gln Cys Gln Leu Asp Asp Glu Glu
115 120 125
Ile Glu Val Gln Lys Gly Val Ala Lys Met Tyr Ser Ser Gln Gln Val
130 135 140
Met Tyr Thr Val Gly Tyr Ser Leu Ser Leu Gly Ala Leu Leu Leu Ala
145 150 155 160
Leu Val Ile Leu Leu Gly Leu Arg Lys Leu His Cys Thr Arg Asn Tyr
165 170 175
Ile His Gly Asn Leu Phe Ala Ser Phe Val Leu Lys Ala Gly Ser Val
180 185 190
Leu Val Ile Asp Trp Leu Leu Lys Thr Arg Tyr Ser Gln Lys Ile Gly
195 200 205
Asp Asp Leu Ser Val Ser Val Trp Leu Ser Asp Gly Ala Met Ala Gly
210 215 220
Cys Arg Val Ala Thr Val Ile Met Gln Tyr Gly Ile Ile Pro Asn Tyr
225 230 235 240
Cys Trp Leu Leu Val Glu Gly Val Tyr Leu Tyr Ser Leu Leu Ser Leu
245 250 255
Ala Thr Phe Ser Glu Arg Ser Phe Phe Ser Leu Tyr Leu Gly Ile Gly
260 265 270
Trp Gly Ala Pro Leu Leu Phe Val Ile Pro Trp Val Val Val Lys Cys
275 280 285
Leu Phe Glu Asn Val Gln Cys Trp Thr Ser Asn Asp Asn Met Gly Phe
290 295 300
Trp Trp Ile Leu Arg Ile Pro Val Phe Leu Ala Leu Leu Ile Asn Phe
305 310 315 320
Phe Ile Phe Val His Ile Ile Gln Leu Leu Val Ala Lys Leu Arg Ala
325 330 335
His Gln Met His Tyr Ala Asp Tyr Lys Phe Arg Leu Ala Arg Ser Thr
340 345 350
Leu Thr Leu Ile Pro Leu Leu Gly Val His Glu Val Val Phe Ala Phe
355 360 365
Val Thr Asp Glu His Ala Gln Gly Thr Leu Arg Ser Thr Lys Leu Phe
370 375 380
Phe Asp Leu Phe Leu Ser Ser Phe Gln Gly Leu Leu Val Ala Val Leu
385 390 395 400
Tyr Cys Phe Leu Asn Lys Glu Val Gln Ala Glu Leu Met Arg Arg Trp
405 410 415
Arg Gln Trp Gln Glu Gly Lys Ala Leu Gln Glu Glu Arg Leu Ala Ser
420 425 430
Ser His Gly Ser His Met Ala Pro Ala Gly Pro Cys His Gly Asp Pro
435 440 445
Cys Glu Lys Leu Gln Leu Met Ser Ala Gly Ser Ser Ser Gly Thr Gly
450 455 460
Cys Val Pro Ser Met Glu Thr Ser Leu Ala Ser Ser Leu Pro Arg Leu
465 470 475 480
Ala Asp Ser Pro Thr
485
<210> 229
<211> 485
<212> PRT
<213> Rattus norvegicus
<220>
<223> GCGR - крыса
<400> 229
Met Leu Leu Thr Gln Leu His Cys Pro Tyr Leu Leu Leu Leu Leu Val
1 5 10 15
Val Leu Ser Cys Leu Pro Lys Ala Pro Ser Ala Gln Val Met Asp Phe
20 25 30
Leu Phe Glu Lys Trp Lys Leu Tyr Ser Asp Gln Cys His His Asn Leu
35 40 45
Ser Leu Leu Pro Pro Pro Thr Glu Leu Val Cys Asn Arg Thr Phe Asp
50 55 60
Lys Tyr Ser Cys Trp Pro Asp Thr Pro Pro Asn Thr Thr Ala Asn Ile
65 70 75 80
Ser Cys Pro Trp Tyr Leu Pro Trp Tyr His Lys Val Gln His Arg Leu
85 90 95
Val Phe Lys Arg Cys Gly Pro Asp Gly Gln Trp Val Arg Gly Pro Arg
100 105 110
Gly Gln Ser Trp Arg Asp Ala Ser Gln Cys Gln Met Asp Asp Asp Glu
115 120 125
Ile Glu Val Gln Lys Gly Val Ala Lys Met Tyr Ser Ser Tyr Gln Val
130 135 140
Met Tyr Thr Val Gly Tyr Ser Leu Ser Leu Gly Ala Leu Leu Leu Ala
145 150 155 160
Leu Val Ile Leu Leu Gly Leu Arg Lys Leu His Cys Thr Arg Asn Tyr
165 170 175
Ile His Gly Asn Leu Phe Ala Ser Phe Val Leu Lys Ala Gly Ser Val
180 185 190
Leu Val Ile Asp Trp Leu Leu Lys Thr Arg Tyr Ser Gln Lys Ile Gly
195 200 205
Asp Asp Leu Ser Val Ser Val Trp Leu Ser Asp Gly Ala Val Ala Gly
210 215 220
Cys Arg Val Ala Thr Val Ile Met Gln Tyr Gly Ile Ile Ala Asn Tyr
225 230 235 240
Cys Trp Leu Leu Val Glu Gly Val Tyr Leu Tyr Ser Leu Leu Ser Ile
245 250 255
Thr Thr Phe Ser Glu Lys Ser Phe Phe Ser Leu Tyr Leu Cys Ile Gly
260 265 270
Trp Gly Ser Pro Leu Leu Phe Val Ile Pro Trp Val Val Val Lys Cys
275 280 285
Leu Phe Glu Asn Val Gln Cys Trp Thr Ser Asn Asp Asn Met Gly Phe
290 295 300
Trp Trp Ile Leu Arg Ile Pro Val Leu Leu Ala Ile Leu Ile Asn Phe
305 310 315 320
Phe Ile Phe Val Arg Ile Ile His Leu Leu Val Ala Lys Leu Arg Ala
325 330 335
His Gln Met His Tyr Ala Asp Tyr Lys Phe Arg Leu Ala Arg Ser Thr
340 345 350
Leu Thr Leu Ile Pro Leu Leu Gly Val His Glu Val Val Phe Ala Phe
355 360 365
Val Thr Asp Glu His Ala Gln Gly Thr Leu Arg Ser Thr Lys Leu Phe
370 375 380
Phe Asp Leu Phe Phe Ser Ser Phe Gln Gly Leu Leu Val Ala Val Leu
385 390 395 400
Tyr Cys Phe Leu Asn Lys Glu Val Gln Ala Glu Leu Leu Arg Arg Trp
405 410 415
Arg Arg Trp Gln Glu Gly Lys Ala Leu Gln Glu Glu Arg Met Ala Ser
420 425 430
Ser His Gly Ser His Met Ala Pro Ala Gly Thr Cys His Gly Asp Pro
435 440 445
Cys Glu Lys Leu Gln Leu Met Ser Ala Gly Ser Ser Ser Gly Thr Gly
450 455 460
Cys Glu Pro Ser Ala Lys Thr Ser Leu Ala Ser Ser Leu Pro Arg Leu
465 470 475 480
Ala Asp Ser Pro Thr
485
<210> 230
<211> 330
<212> PRT
<213> Homo sapiens
<220>
<223> IgG1 человека
<400> 230
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 231
<211> 330
<212> PRT
<213> Homo sapiens
<220>
<223> IgG1 E233A/L235A человека
<400> 231
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Ala Leu Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 232
<211> 330
<212> PRT
<213> Homo sapiens
<220>
<223> IgG1 L234A/L235A человека
<400> 232
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 233
<211> 469
<212> PRT
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь Hz6B5 с сигнальной последовательностью
<400> 233
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Arg Gly Ala Arg Cys Gln Val Gln Leu Val Gln Ser Gly Ala Glu
20 25 30
Val Lys Lys Pro Gly Ser Ser Val Lys Val Ser Cys Lys Ala Ser Gly
35 40 45
Phe Thr Phe Thr Asn His Trp Leu Gly Trp Val Arg Gln Ala Pro Gly
50 55 60
Gln Gly Leu Glu Trp Ile Gly Asp Ile Tyr Pro Gly Gly Tyr Tyr Ile
65 70 75 80
Asn Tyr Asn Glu Lys Phe Lys Gly Arg Val Thr Ile Thr Ala Asp Glu
85 90 95
Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp
100 105 110
Thr Ala Val Tyr Tyr Cys Ala Arg His Thr Asn Tyr Gly Ser Asp Tyr
115 120 125
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly
130 135 140
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
145 150 155 160
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
165 170 175
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
180 185 190
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
195 200 205
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
210 215 220
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
225 230 235 240
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Ala Leu
245 250 255
Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
260 265 270
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
275 280 285
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
290 295 300
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
305 310 315 320
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
325 330 335
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
340 345 350
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
355 360 365
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
370 375 380
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
385 390 395 400
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
405 410 415
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
420 425 430
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
435 440 445
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
450 455 460
Leu Ser Pro Gly Lys
465
<210> 234
<211> 447
<212> PRT
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь Hz6B5 без сигнальной последовательности
<400> 234
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Asn His
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Gly Tyr Tyr Ile Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg His Thr Asn Tyr Gly Ser Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Ala Leu Ala Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 235
<211> 241
<212> PRT
<213> Искусственная последовательность
<220>
<223> Легкая цепь Hz6B5 с сигнальной последовательностью
<400> 235
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Arg Gly Ala Arg Cys Asp Val Val Met Thr Gln Ser Pro Leu Ser
20 25 30
Leu Pro Val Thr Leu Gly Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser
35 40 45
Gln Ser Ile Val Asp Ser Tyr Gly Asn Thr Phe Leu Glu Trp Tyr Gln
50 55 60
Gln Arg Pro Gly Gln Ser Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn
65 70 75 80
Arg Leu Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
85 90 95
Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val
100 105 110
Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Trp Thr Phe Gly Gln Gly
115 120 125
Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile
130 135 140
Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val
145 150 155 160
Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys
165 170 175
Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu
180 185 190
Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu
195 200 205
Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr
210 215 220
His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu
225 230 235 240
Cys
<210> 236
<211> 219
<212> PRT
<213> Искусственная последовательность
<220>
<223> Легкая цепь Hz6B5 без сигнальной последовательности
<400> 236
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val Asp Ser
20 25 30
Tyr Gly Asn Thr Phe Leu Glu Trp Tyr Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Leu Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 237
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Консенсусная последовательность CDR2 тяжелой цепи
<220>
<221> misc_feature
<222> (3)..(3)
<223> Xaa может представлять собой любую встречающуюся в природе
аминокислоту
<220>
<221> misc_feature
<222> (7)..(7)
<223> Xaa может представлять собой любую встречающуюся в природе
аминокислоту
<220>
<221> misc_feature
<222> (9)..(9)
<223> Xaa может представлять собой любую встречающуюся в природе
аминокислоту
<220>
<221> misc_feature
<222> (13)..(13)
<223> Xaa может представлять собой любую встречающуюся в природе
аминокислоту
<220>
<221> misc_feature
<222> (17)..(17)
<223> Xaa может представлять собой любую встречающуюся в природе
аминокислоту
<400> 237
Asp Ile Xaa Pro Gly Gly Xaa Tyr Xaa Asn Tyr Asn Xaa Lys His Lys
1 5 10 15
Xaa
<210> 238
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Консенсусная последовательность CDR1 легкой цепи
<220>
<221> misc_feature
<222> (5)..(5)
<223> Xaa может представлять собой любую встречающуюся в природе
аминокислоту
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa может представлять собой любую встречающуюся в природе
аминокислоту
<220>
<221> misc_feature
<222> (10)..(10)
<223> Xaa может представлять собой любую встречающуюся в природе
аминокислоту
<400> 238
Arg Ser Ser Gln Xaa Ile Val Xaa Ser Xaa Gly Asn Thr Tyr Leu Glu
1 5 10 15
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| C3-СВЯЗЫВАЮЩИЕ АГЕНТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2802307C2 |
| АНТИТЕЛА, НАЦЕЛЕННЫЕ НА АНТИГЕН СОЗРЕВАНИЯ В-КЛЕТОК, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2766094C2 |
| АНТИТЕЛА ПРОТИВ MICA/B, БЛОКИРУЮЩИЕ ШЕДДИНГ MICA/B, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2815101C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЪЮГАТА АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ ЭРИБУЛИНА | 2020 |
|
RU2840013C1 |
| АНТИТЕЛА К РМEL17 И КОНЪЮГАТЫ НА ИХ ОСНОВЕ | 2019 |
|
RU2831785C2 |
| БЕЛОК, СВЯЗЫВАЮЩИЙ АНТИГЕН ST2 | 2021 |
|
RU2841164C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К NAV1.7 | 2019 |
|
RU2776821C2 |
| АНТИТЕЛА К ХИМЕРНЫМ АНТИГЕННЫМ РЕЦЕПТОРАМ, ПОЛУЧЕННЫМ ИЗ 4G7 | 2020 |
|
RU2826051C2 |
| АНТИТЕЛА ПРОТИВ АЛЬФА-СУБЪЕДИНИЦЫ ИЛ-7R И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2811912C2 |
| БЕЛОК, СВЯЗЫВАЮЩИЙСЯ С NKG2D, CD16 И С ОПУХОЛЕСПЕЦИФИЧЕСКИМ АНТИГЕНОМ | 2018 |
|
RU2826991C2 |




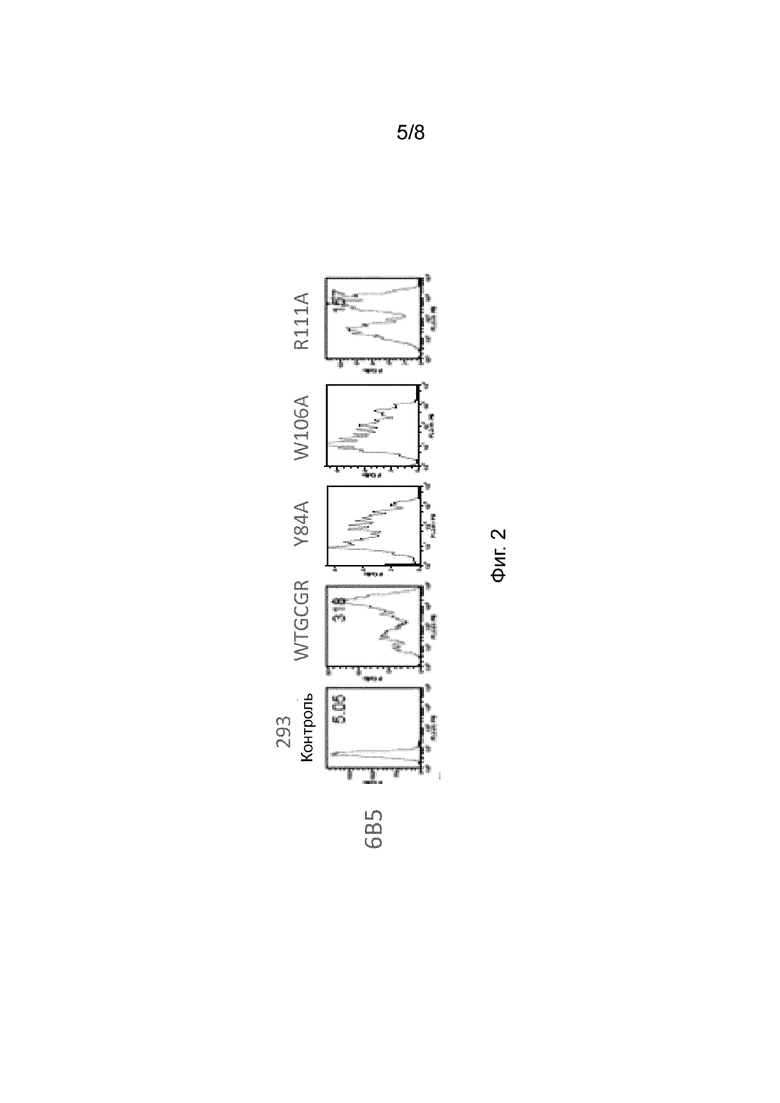
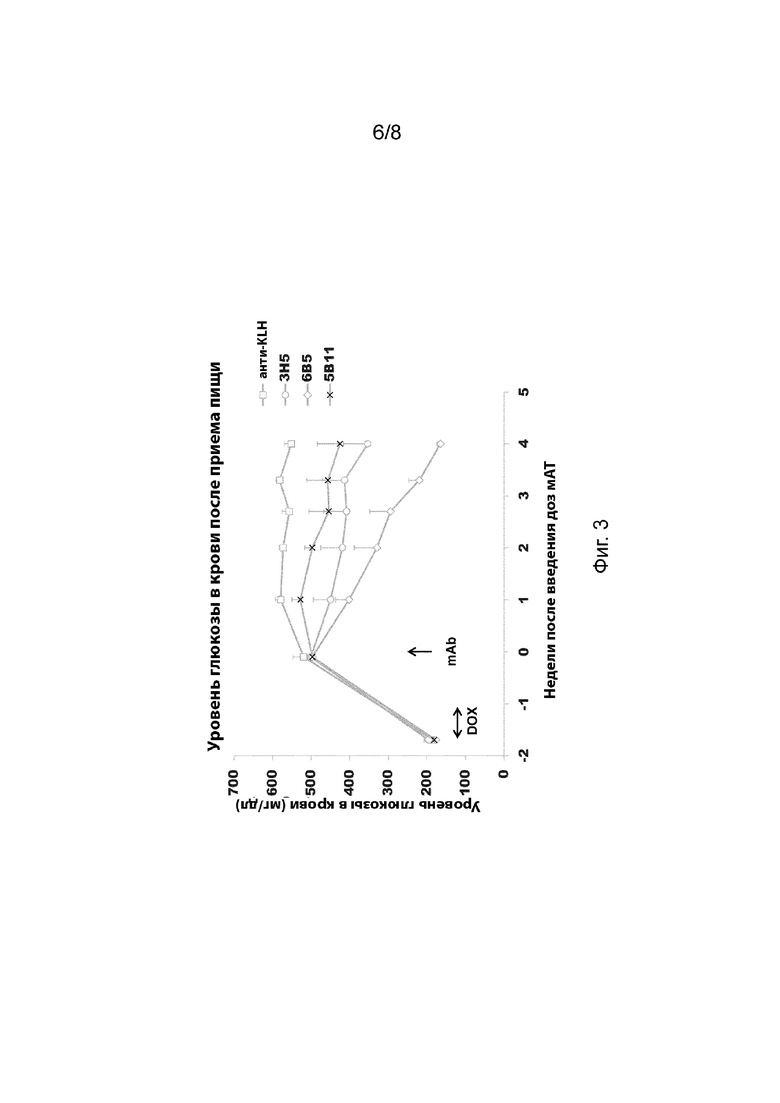

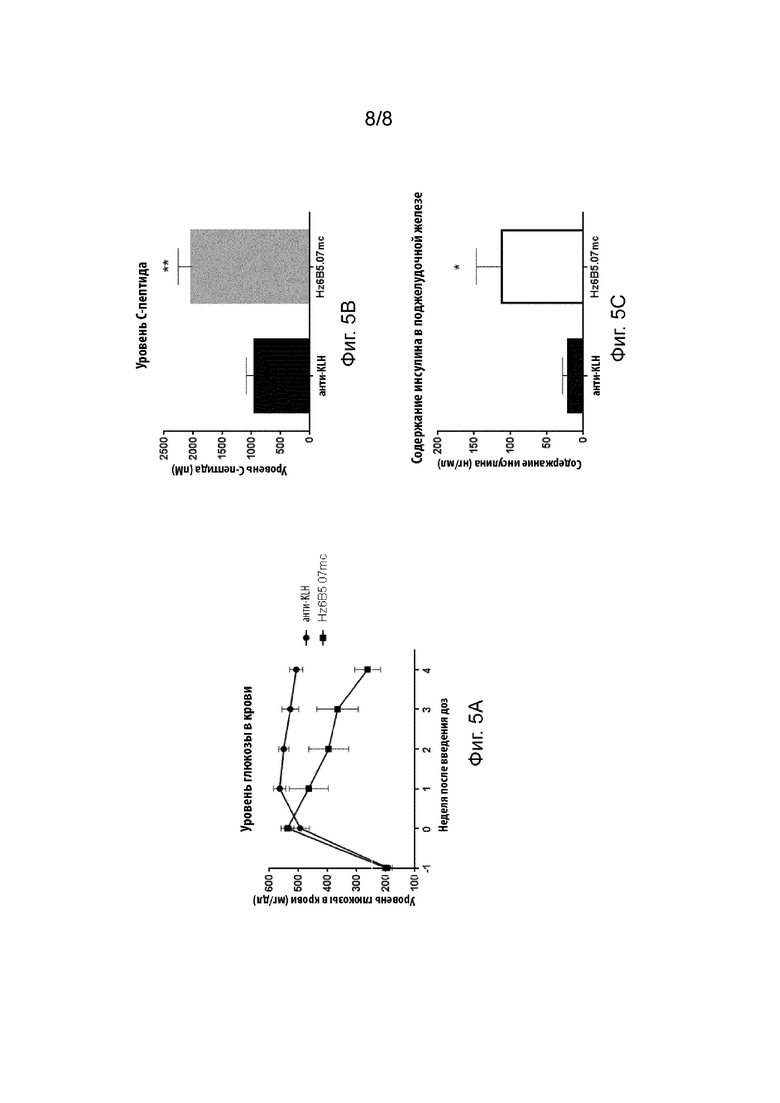
Изобретение относится к области биохимии, в частности к антителу или его фрагменту, которые специфически связывают глюкагоновый рецептор человека (GCGR). Также раскрыты полинуклеотид, кодирующий указанное антитело; экспрессионный вектор, содержащий указанный полинуклеотид; клетка, содержащая указанный вектор; фармацевтическая композиция, содержащая указанное антитело. Раскрыт способ получения указанного антитела. Изобретение позволяет эффективно лечить заболевания, нарушения и патологические состояния, ассоциированные с повышенными уровнями глюкозы в крови. 17 н. и 21 з.п. ф-лы, 7 пр., 14 табл., 5 ил.
1. Антитело или его фрагмент, которые специфически связывают глюкагоновый рецептор человека (GCGR), где указанные антитело или его фрагмент содержат:
(a) вариабельную область тяжелой цепи (VH), содержащую область, определяющую комплементарность (CDR) 1 VH (VH CDR1), содержащую аминокислотную последовательность, приведенную в SEQ ID NO:1, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:2, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:3; и вариабельную область легкой цепи (VL), содержащую VL CDR1 легкой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:4, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:5, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:6;
(b) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:7, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:8, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:9; и VL, содержащую VL CDR1 легкой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:10, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:11, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:6;
(с) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:12, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:2, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:3; и VL, содержащую VL CDR1 легкой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:4, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:5, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:6;
(d) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:13, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:14, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:15; и VL, содержащую VL CDR1 легкой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:16, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:11, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:17;
(e) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:18, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:19, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:20; и VL, содержащую VL CDR1 легкой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:21, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:22, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:23; или
(f) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:1, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:24, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:3; и VL, содержащую VL CDR1 легкой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:4, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:5, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:6.
2. Антитело или его фрагмент по п. 1, где указанные антитело или его фрагмент содержат: VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:1, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:2, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:3; и VL, содержащую VL CDR1 легкой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:4, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:5, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:6.
3. Антитело или его фрагмент по п. 1 или 2, где:
VH содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичности SEQ ID NO:25, и VL содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичности SEQ ID NO:26; или
VH содержит аминокислотную последовательность, имеющую 90% идентичности SEQ ID NO:220, и VL содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичности SEQ ID NO:221.
4. Антитело или его фрагмент по п. 1 или 2, где:
VH содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности SEQ ID NO:25, и VL содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности SEQ ID NO:26; или
VH содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности SEQ ID NO:220, и VL содержит аминокислотную последовательность, имеющую 95% идентичности SEQ ID NO:221.
5. Антитело или его фрагмент по п. 1 или 2, где VH содержит аминокислотную последовательность, приведенную в SEQ ID NO:25, и VL содержит аминокислотную последовательность, приведенную в SEQ ID NO:26.
6. Антитело или его фрагмент, которые специфически связывают GCGR человека, где указанные антитело или его фрагмент содержат вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:220, и вариабельную область легкой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:221.
7. Антитело или его фрагмент, которые специфически связывают глюкагоновый рецептор человека (GCGR), где указанные антитело или его фрагмент содержат:
(a) (1) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:27, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:28, VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:29, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:30, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:31, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:32;
(2) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:33, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:34, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:35, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:36, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:37, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:32;
(3) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:38, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:28, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:29, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:30, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:31, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:32;
(4) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:39, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:40, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:41, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:42, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:37, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:43;
(5) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:44, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:45, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:46, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:47, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:48, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:49; или
(6) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:27, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:50, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:29, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:30, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:31, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:32;
(b) (1) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:53, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:54, VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:55, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:56, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:31, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:32;
(2) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:57, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:58, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:59, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:60, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:37, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:32;
(3) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:61, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:54, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:55, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:56, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:31, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:32;
(4) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:62, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:40, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:63, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:64, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:37, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:43;
(5) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:65, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:66, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:67, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:68, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:69, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:49; или
(6) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:53, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:70, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:55, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:56, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:31, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:32;
(с) (1) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:27, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:73, VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:74, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:75, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:76, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:77;
(2) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:79, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:80, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:81, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:82, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:83, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:78;
(3) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:84, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:74, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:75, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:76, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:77, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:78;
(4) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:85, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:86, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:87, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:88, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:83, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:89;
(5) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:90, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:91, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:92, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:93, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:94, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:95; или
(6) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:73, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:96, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:75, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:76, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:77, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:78;
(d) (1) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:99, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:100, VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:101, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:102, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:103, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:104;
(2) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:105, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:106, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:107, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:108, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:109, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:104;
(3) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:110, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:100, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:101, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:102, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:103, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:104;
(4) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:111, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:86, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:112, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:113, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:109, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:114;
(5) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:115, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:116, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:117, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:118, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:119, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:120; или
(6) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:99, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:121, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:101, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:102, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:103, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:104;
(e) (1) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:124, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:125, VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:126, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:127, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:128, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:6;
(2) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:129, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:130, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:131, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:132, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:11, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:6;
(3) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:133, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:125, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:126, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:127, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:128, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:6;
(4) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:134, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:135, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:136, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:137, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:11, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:17;
(5) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:138, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:139, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:140, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:141, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:142, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:23; или
(6) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:124, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:143, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:126, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:127, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:128, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:6;
(f) (1) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:146, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:147, VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:148, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:149, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:128, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:6;
(2) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:150, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:151, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:152, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:153, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:11, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:6;
(3) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:154, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:147, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:148, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:149, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:128, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:6;
(4) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:155, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:156, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:157, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:158, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:11, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:17;
(5) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:159, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:160, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:161, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:162, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:142, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:23; или
(6) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:146, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:163, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:148, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:149, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:128, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:6;
(g) (1) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:166, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:167, VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:168, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:169, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:170, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:171;
(2) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:172, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:173, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:174, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:175, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:11, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:171;
(3) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:176, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:167, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:168, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:169, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:170, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:171;
(4) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:177, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:178, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:179, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:180, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:11, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:181;
(5) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:182, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:183, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:184, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:185, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:142, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:186; или
(6) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:166, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:187, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:168, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:169, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:170, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:171;
(h) (1) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:190, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:191, VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:192, CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:169, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:128, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:193;
(2) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:172, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:194, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:195, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:175, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:11, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:193;
(3) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:154, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:191, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:192, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:169, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:128, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:193;
(4) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:177, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:156, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:196, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:180, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:11, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:197;
(5) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:198, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:199, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:200, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:185, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:142, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:201; или
(6) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:190, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:202, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:192, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:169, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:128, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:193; или
(i) (1) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:190, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:205, VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:206, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:207, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:128, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:6;
(2) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:172, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:208, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:209, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:210, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:11, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:6;
(3) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:154, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:205, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:206, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:207, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:128, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:6;
(4) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:177, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:211, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:212, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:213, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:11, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:17;
(5) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:198, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:214, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:215, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:216, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:142, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:23; или
(6) VH, содержащую VH CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:190, VH CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:217, и VH CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:206, и VL, содержащую VL CDR1, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:207, VL CDR2, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:128, и VL CDR3, содержащую аминокислотную последовательность, приведенную в SEQ ID NO:6.
8. Антитело или его фрагмент по п. 7, где:
(a) VH содержит аминокислотную последовательность, на, по меньшей мере, 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:51, и VL содержит аминокислотную последовательность, на, по меньшей мере, 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:52;
(b) VH содержит аминокислотную последовательность, на, по меньшей мере, 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:71, и VL содержит аминокислотную последовательность, на, по меньшей мере, 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:72;
(c) VH содержит аминокислотную последовательность, на, по меньшей мере, 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:97, и VL содержит аминокислотную последовательность, на, по меньшей мере, 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:98;
(d) VH содержит аминокислотную последовательность, на, по меньшей мере, 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:122, и VL содержит аминокислотную последовательность, на, по меньшей мере, 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:123;
(e) VH содержит аминокислотную последовательность, на, по меньшей мере, 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:144, и VL содержит аминокислотную последовательность, на, по меньшей мере, 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:145;
(f) VH содержит аминокислотную последовательность, на, по меньшей мере, 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:164, и VL содержит аминокислотную последовательность, на, по меньшей мере, 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:165;
(g) VH содержит аминокислотную последовательность, на, по меньшей мере, 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:188, и VL содержит аминокислотную последовательность, на, по меньшей мере, 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:189;
(h) VH содержит аминокислотную последовательность, на, по меньшей мере, 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:203, и VL содержит аминокислотную последовательность, на, по меньшей мере, 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:204; или
(i) VH содержит аминокислотную последовательность, на, по меньшей мере, 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:218, и VL содержит аминокислотную последовательность, на, по меньшей мере, 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:219.
9. Антитело или его фрагмент по п. 7 или 8, где:
(a) VH содержит SEQ ID NO:51, и VL содержит SEQ ID NO:52;
(b) VH содержит SEQ ID NO:71, и VL содержит SEQ ID NO:72;
(c) VH содержит SEQ ID NO:97, и VL содержит SEQ ID NO:98;
(d) VH содержит SEQ ID NO:122, и VL содержит SEQ ID NO:123;
(e) VH содержит SEQ ID NO:144, и VL содержит SEQ ID NO:145;
(f) VH содержит SEQ ID NO:164, и VL содержит SEQ ID NO:165;
(g) VH содержит SEQ ID NO:188, и VL содержит SEQ ID NO:189;
(h) VH содержит SEQ ID NO:203, и VL содержит SEQ ID NO:204; или
(i) VH содержит SEQ ID NO:218, и VL содержит SEQ ID NO:219.
10. Антитело или его фрагмент по любому из пп. 1-4 и 6-8, где указанное антитело представляет собой гуманизированное антитело.
11. Антитело или его фрагмент по любому из пп. 1-9, где указанное антитело представляет собой химерное антитело.
12. Антитело или его фрагмент по любому из пп. 1-11, где указанное антитело представляет собой антитело IgG.
13. Антитело или его фрагмент по п. 12, где указанное антитело представляет собой антитело IgG1, антитело IgG2 или антитело IgG4.
14. Антитело или его фрагмент по любому из пп. 1-4 и 6, где указанное антитело содержит тяжелую цепь, которая содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:234, и легкую цепь, которая содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичную аминокислотной последовательности, приведенной в SEQ ID NO:236.
15. Антитело или его фрагмент, которые специфически связывают GCGR человека, где указанное антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:234, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:236.
16. Полинуклеотид, кодирующий антитело или его фрагмент по любому из пп. 1-15.
17. Пара полинуклеотидов, кодирующая антитело или его фрагмент по любому из пп. 1-15.
18. Экспрессионный вектор, содержащий полинуклеотид по п. 16 или пару полинуклеотидов по п. 17.
19. Пара экспрессионных векторов, содержащая полинуклеотиды, кодирующие антитело или его фрагмент по любому из пп. 1-15.
20. Клетка для получения антитела или его фрагмента по любому из пп. 1-15, где указанная клетка содержит полинуклеотид по п. 16, пару полинуклеотидов по п. 17, экспрессионный вектор по п. 18 или пару экспрессионных векторов по п. 19.
21. Клетка по п. 20, продуцирующая антитело или его фрагмент по любому из пп. 1-15.
22. Способ получения антитела или его фрагмента по любому из пп. 1-15, включающий: (a) культивирование клетки по п. 20 или 21 и (b) выделение антитела или его фрагмента, необязательно где указанный способ дополнительно включает составление выделенных антитела или его фрагмента в виде стерильной фармацевтической композиции.
23. Фармацевтическая композиция для лечения нарушения утилизации глюкозы у субъекта, содержащая терапевтически эффективное количество антитела или его фрагмента по любому из пп. 1-15 и фармацевтически приемлемый носитель.
24. Фармацевтическая композиция по п. 23, где нарушение утилизации глюкозы представляет собой сахарный диабет, латентный аутоиммунный сахарный диабет взрослых, гестационный сахарный диабет, инсулинорезистентность, «преддиабет», заболевания, ассоциированные с аномальным метаболизмом глюкозы, гипергликемию, или физиологическое нарушение, ассоциированное с гипергликемическим состоянием, или которое является его результатом.
25. Фармацевтическая композиция по п. 23, где нарушение утилизации глюкозы представляет собой сахарный диабет 1 типа.
26. Фармацевтическая композиция по п. 23, где нарушение утилизации глюкозы представляет собой сахарный диабет 2 типа.
27. Фармацевтическая композиция для лечения метаболического синдрома или заболевания или нарушения, связанных с метаболическим синдромом, у субъекта, содержащая терапевтически эффективное количество антитела или его фрагмента по любому из пп. 1-15 и фармацевтически приемлемый носитель.
28. Фармацевтическая композиция по п. 27, где заболевание или нарушение, связанные с метаболическим синдромом, представляют собой ожирение или повышенную массу тела, неалкогольную жировую болезнь печени (NAFLD), неалкогольный стеатогепатит (NASH), гипертензию, сердечнососудистое заболевание, инсульт и сердечную недостаточность.
29. Фармацевтическая композиция для лечения дислипидемии или последствий, ассоциированных с ней, у субъекта, содержащая терапевтически эффективное количество антитела или его фрагмента по любому из пп. 1-15 и фармацевтически приемлемый носитель.
30. Фармацевтическая композиция по п. 29, где указанные последствия, ассоциированные с ней, представляют собой атеросклероз, ишемическую болезнь сердца и нарушение мозгового кровообращения.
31. Фармацевтическая композиция для уменьшения или снижения уровней глюкозы в крови у субъекта, содержащая терапевтически эффективное количество антитела или его фрагмента по любому из пп. 1-15 и фармацевтически приемлемый носитель.
32. Фармацевтическая композиция для повышения уровня С-пептида в крови у субъекта, содержащая терапевтически эффективное количество антитела или его фрагмента по любому из пп. 1-15 и фармацевтически приемлемый носитель.
33. Фармацевтическая композиция для повышения уровня инсулина в крови у субъекта, содержащая терапевтически эффективное количество антитела или его фрагмента по любому из пп. 1-15 и фармацевтически приемлемый носитель.
34. Фармацевтическая композиция для улучшения функции бета-клеток у субъекта, содержащая терапевтически эффективное количество антитела или его фрагмента по любому из пп. 1-15 и фармацевтически приемлемый носитель.
35. Фармацевтическая композиция по любому из пп. 23-34, где фармацевтическая композиция предназначена для введения субъекту в комбинации с по меньшей мере одним дополнительным терапевтическим агентом.
36. Фармацевтическая композиция по п. 35, где по меньшей мере один дополнительный терапевтический агент представляет собой лекарственный препарат для лечения сахарного диабета или гипергликемии.
37. Фармацевтическая композиция по п. 36, где указанный лекарственный препарат для лечения сахарного диабета или гипергликемии представляет собой бигуанид, сульфомочевину, производное меглитинида, ингибитор альфа-глюкозидазы, тиазолидиндион (TZD), агонист глюкагоноподобного пептида 1 (GLP-1), ингибитор дипептидилпептидазы 4 (DPP-4), селективный ингибитор натрий-глюкозного котранспортера 2 (SGLT-2), инсулин или инсулиномиметик, амилиномиметик, секвестрант желчных кислот и/или агонист дофаминовых рецепторов.
38. Фармацевтическая композиция по любому из пп. 23-37, где субъект представляет собой человека.
| WO 2009041621 A1, 02.04.2009 | |||
| WO 2009055711 A2, 30.04.2009 | |||
| WO 2011030935 A1, 17.03.2011 | |||
| СПОСОБ ИММУНОЛОГИЧЕСКОГО АНАЛИЗА БЕЛКА CXCL1 ЧЕЛОВЕКА | 2009 |
|
RU2521669C2 |
Авторы
Даты
2024-06-06—Публикация
2018-01-26—Подача