Область техники, к которой относится изобретение
Изобретете относится к области биотехнологии и генной инженерии растений, а именно к способу получения однодольного растения при помощи технологии редактирования генома растений CRISPR/Cas9 путем целенаправленного воздействия на нуклестидную последовательность консервативного участка промоторной области гена VRN-1A однодольных зерновых культур системами редактирования генома CRISPR/Cas9, в которых используются молекулы РНК-проводника или сконструированный на его основе экспрессионный ДНК-вектор.
Предшествующий уровень техники
Время от посева до колошения имеет важное практическое значение для производителей пшеницы, поэтому значительные усилия селекционеров направлены на сокращение вегетационного периода у культурных сортов пшеницы.
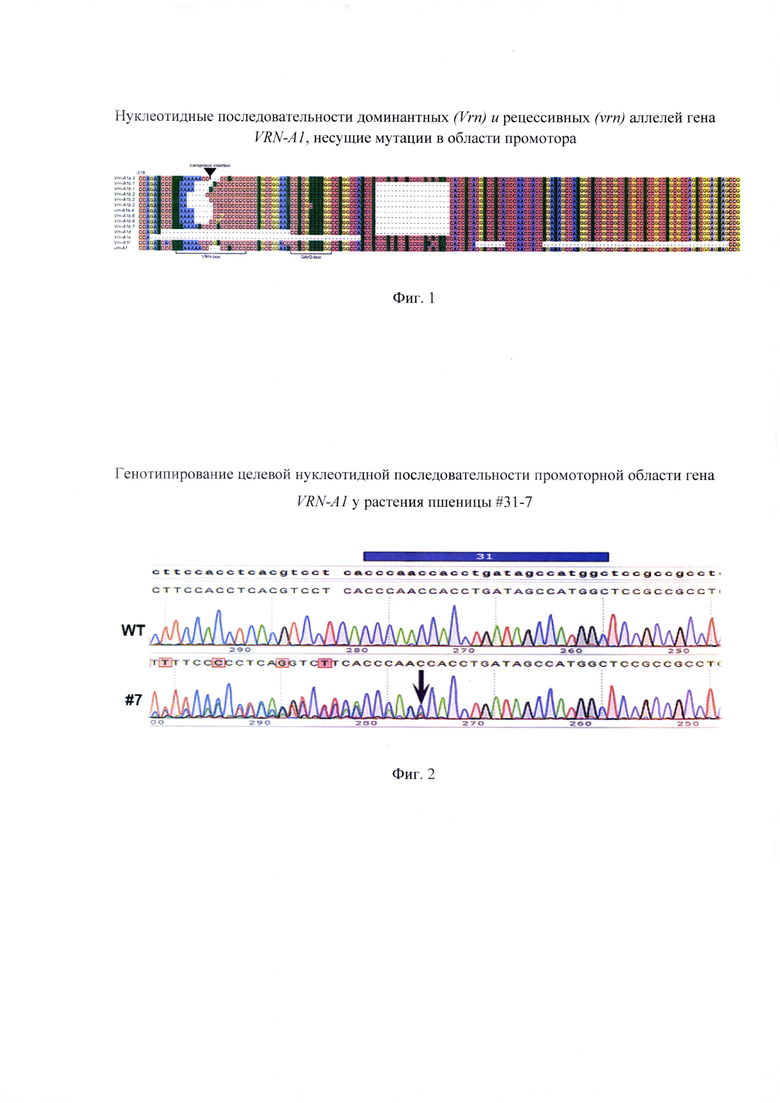
Способность растений пшеницы переходить к репродуктивному развитию зависит от функционирования двух основных систем генов развития - VRN (vernalization - ответ на яровизацию) и PPD (photoperiodic - чувствительность к фотопериоду. У представителей Triticeae чувствительность к яровизации контролируется группой скоординировано функционирующих генов VRN1, VRN2 и VRN3. Важнейшая роль в регуляции ответа на яровизацию принадлежит гену VRN1, кодирующему MADS-box транскрипционный фактор (Trevaskis et al., 2007), который необходим для закладки и поддержания флоральной меристемы в точке роста побега пшеницы. У озимых форм потребность в яровизации связана с тем. что VRN1 гены находятся в рецессивном состоянии и их экспрессия блокирована до наступления периода воздействия пониженных температур. Для перехода озимой пшеницы к репродуктивному развитию необходимо, чтобы уровень транскрипта VRN1 достиг определенного порогового значения (Loukoianov et al. 2005). Отсутствие потребности в яровизации у яровых сортов связано с существенными изменениями нуклеотидной последовательности промотора или первого интрона гена VRN-A1 (Yan et al. 2004: Fu et al. 2005). Показано, что промотор генов VRN1 содержит консервативные цис-элементы (CArG-. VRN- и G-боксы), представляющие собой мишени для транскрипционных факторов, участвующих в ответе на яровизацию. Известен ряд нуклеотидных модификаций промотора VRN-A1 (Konopatskaia et al. 2016; Muterko et al. 2016) (Фиг. 1). Наиболее распространенный доминантный аллель Vrn-Ala отличается от рецессивного аллеля vrn-Al транспозонными вставками повторяющихся последовательностей в VRN-box участке промотора (Фиг. 1). Другие доминантные аллели содержат делеционные фрагменты разной протяженности в различных участках, таких как VRN-box (аллели Vrn-Alb, Vrn-Ald, Vrn-Ale), CArG-box (аллели Vrn-Ale), G-box (аллели Vrn-Alf), а также делеции размером 20 п. н. в участке между -136 и -157 п. н. (аллели Vrn-Alb, Vrn-Ald) или крупную делецию размером 50 п. н. в участке между -62 и -112 п. н. (аллели Vrn-Alf) (Фиг. 1). Помимо делеций, доминантные аллельные варианты Vrn-Alb, Vrn-Ald. Vrn-Ale также могут содержать единичные нуклеотидные замены в VRN-box участке промотора (Фиг. 1). Крупная делеция размером 50 п. н. в участке между -62 и -112 п. н. а также 8 п. н. нуклеотидная делеция в G-box была обнаружена только у аллеля Vrn-Alf яровых диких видов пшеницы секции Timopheevii (Фиг. 1), и не присутствует у представителей современных культурных видов мягкой и твердой пшеницы (Muterko et al. 2016).
Возможность контролировать сроки колошения путем точечного изменения аллелей VRN1 позволит упростить процесс получения новых высокопродуктивных сортов, соответствующих современным требованиям. Примечательно, что в настоящий момент не обнаружены какие либо природные яровые и озимые формы пшеницы с измененной последовательностью промотора VRN1 в области между -113 и -122 п. н., а также отсутствуют искусственные мутантные формы зерновых с модификациями промотора VRN1 в областях между -62 и -120 п. н. Получение растений, несущих новые (или аналогичные диким представителям) аллели генов VRN1, имеющих мутации в регуляторных областях гена на неизменном генетическом фоне, представляет собой техническую проблему, для решения которой необходимо расширение арсенала средств, доступных селекционерам. В качестве решения этой проблемы настоящее изобретение предлагает способ получения однодольного растения с измененной при помощи технологии редактирования генома растений CRISPR/Cas9 последовательностью промотора гена VRN1.
Сущность изобретения
Задачей изобретения является разработка способа получения однодольного растения с биаллельными мутациями в промоторной области гена VRN-A1.
Для решения данной задачи предлагается способ, согласно которому получают конструкцию pgRNA-VRNA1#31, смешивают эту конструкцию с вектором, кодирующим последовательность Cas9, переносят эту смесь в клетки пшеницы с помощью генной пушки для внесения мутаций в промоторную область гена VRN-1A и проводят отбор растений-регенерантов с отредактированным геномом.
В другом аспекте настоящее изобретение также относится к однодольному растению #31-7, полученному этим способом.
Использование РНК-проводника, в составе экспрессионного вектора pgRNA-VRNA1#31 в описываемом примере, позволило одновременно внести мутации в целевую нуклеотидную последовательность консервативного участка промоторной области гена VRN-A1 мягкой пшеницы (вставка дополнительного нуклеотида в одном аллеле, делеция нуклеотида в другом аллеле), не затрагивая гомеологичные варианты гена VRN-1 других элементарных геномов, и в дальнейшем закрепить полученные мутации в последующем поколении нетрансгенных растений, несущих гомозиготные аллели.
Краткое описание чертежей
Фигура 1. Сравнительная характеристика нуклеотидной последовательности доминантных (Vrn) и рецессивных (vrn) аллелей гена VRN-A1, несущих мутации в области промотора, идентифицированных у видов и сортов полиплоидной пшеницы (согласно Konopatskaia et al. 2016; с модификациями).
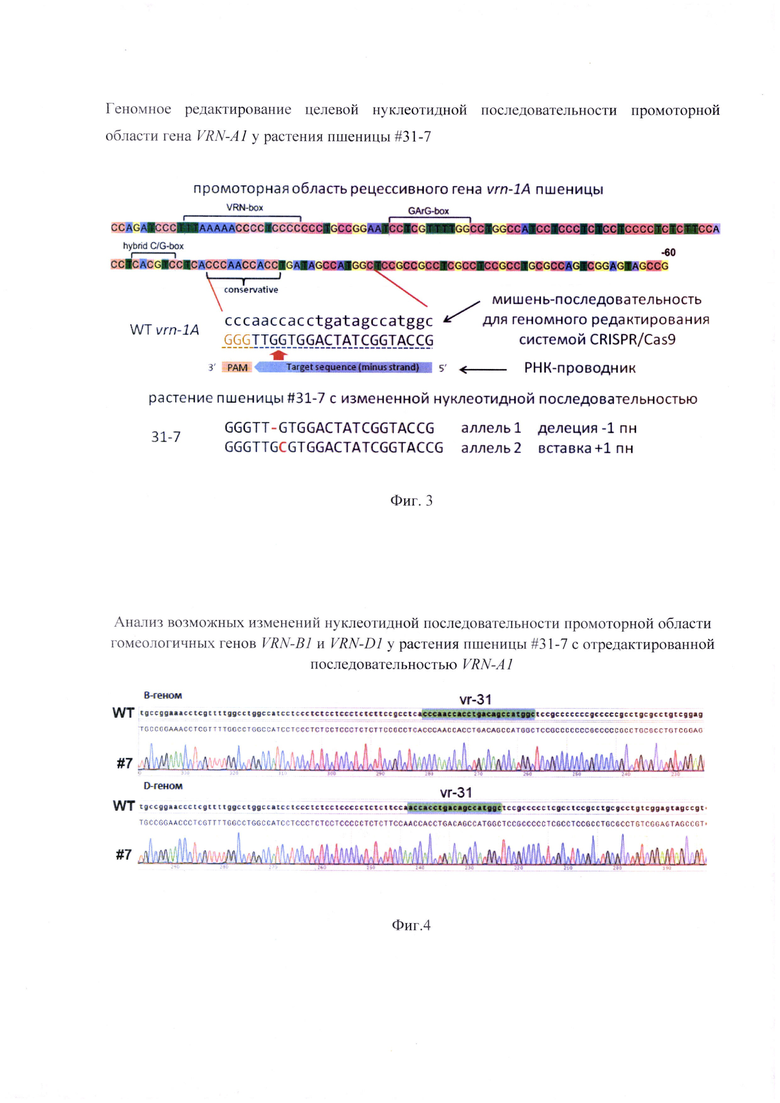
Фигура 2. Генотипирование целевой нуклеотидной последовательности промоторной области VRN-A1 методом секвенирования по Сэнгеру. Представлены нуклеотидные последовательности аллелей в целевом фрагменте контрольного растения (WT) и растения пшеницы #31-7 с биаллельными изменениями в сравнении с WT, а именно вставкой одного дополнительного нуклеотида в одном аллеле, и делеции другого нуклеотида в другом аллеле. которые отмечены стрелкой.
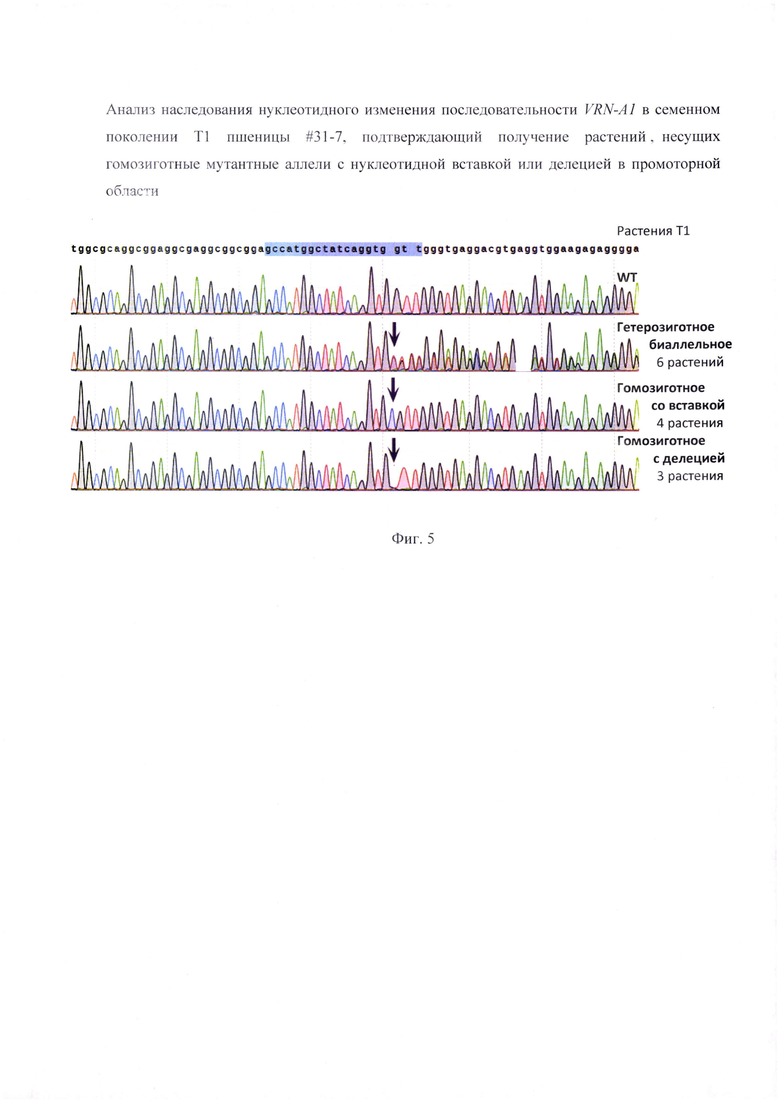
Фигура 3. Генотипирование мутантных аллелей в промоторной области рецессивного гена VRN-A1 относительно целевой последовательности, являющейся мишенью для РНК-проводника vr-31. Представлена последовательность целевой мишени, которой комплементарна последовательность РНК-проводника (заглавные буквы) в которой указана РАМ последовательность и стрелкой указан предпочтительный сайт разрезания ДНК. Красным цветом выделена вставка дополнительного нуклеотида или делеция нуклеотида в каждом из аллелей у пшеницы #31 -7.
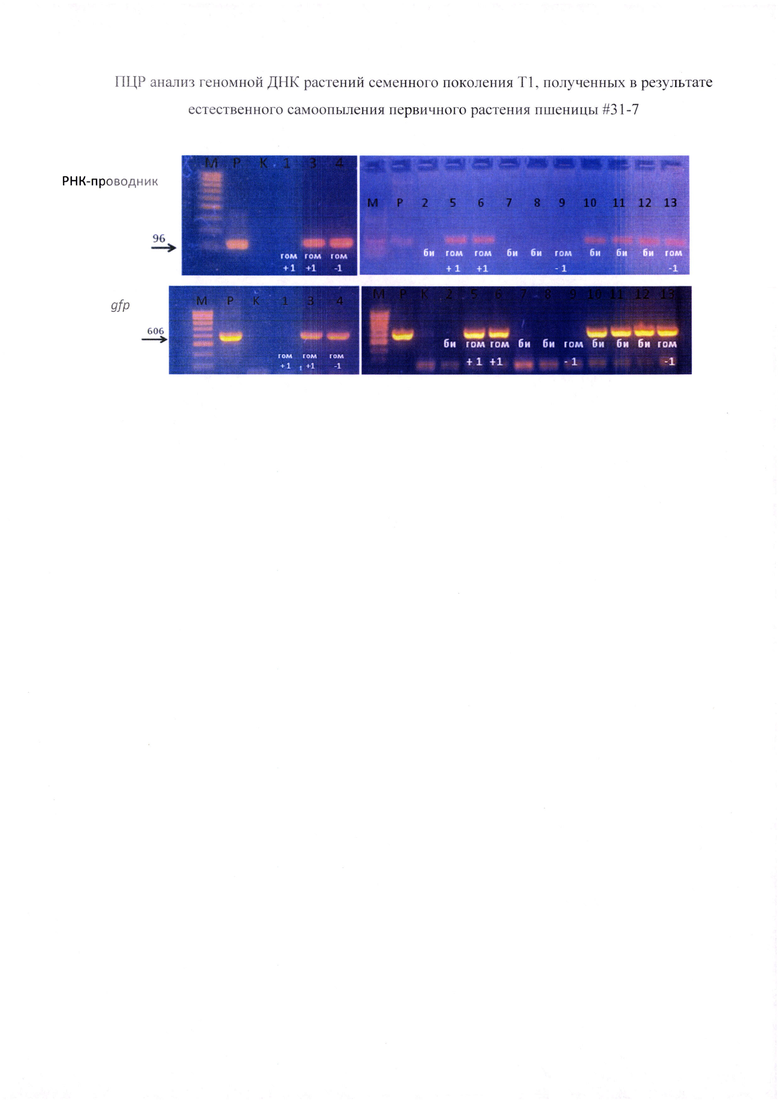
Фигура 4. Анализ возможных изменений нуклеотидной последовательности промоторной области генов VRN-1B и VRN-1D у растения пшеницы #31-7 с измененной последовательностью VRN-A1. Представлены результаты секвенирования по Сэнгеру в сравнении с референсными последовательностями (WT) промоторной области генов VRN-1B и VRN-1D, включая фрагмент имеющий сходство с последовательностью РНК-проводника vr-31, использующегося для редактирования генома.
Фигура 5. Характерные примеры генотипирования целевой нуклеотидной последовательности промоторной области VRN-A1 методом секвенирования по Сэнгеру в семенном поколении Т1 растения #31-7. Представлены нуклеотидные последовательности в сравнении с не мутатными аллелями (WT), в том числе би-алельное гетерозиготное растение Т1 с одновременной вставкой одного дополнительного нуклеотида в одном из аллелей и делецией другого нуклеотида в другом аллеле, би-алельное гомозиготного растение несущее две аллели VRN-A1 со вставкой дополнительного нуклеотида, и би-алельное гомозиготное растение несущее две аллели VRN-A1 с делецией одного нуклеотида. Изменения отмечены стрелкой. Указано общее число полученных растений.
Фигура 6. ПЦР анализ геномной ДНК растений семенного поколения Т1, полученных в результате естественного самоопыления первичного растения пшеницы #31 -7. Наличие искомых фрагментов последовательности РНК-проводника размером 96 п. н. (находится в составе кассеты экспрессии pgRNA-VRNA1#31) и фрагмента 606 п. н. характерного для репортерного гена gfp (находится в составе кассеты экспрессии одновременно несушей последовательности bar Cas9. и gfp) подтверждена у восьми образцов. На Фигуре 6. представлены агарозные гели, содержащие ПЦР-продукты праймеров специфичных для gfp и РНК-проводника, где М - маркер молекулярного веса; Р - ДНК плазмиды pGCB (положительный контроль для gfp) или pgRNA-VRNA1#31 (положительный контроль для РНК-проводника): К - нетрансгенное растение 'Chinese Spring' (отрицательный контроль), W - смесь без добавления ДНК, 1-13 -индивидуальные растения Т1. Результат ПЦР сопоставлен с результатами секвенирования фрагмента нуклеотидной последовательности промоторной области VRN-A1, где би - би-алельное гетерозиготное растение Т1 с одновременной вставкой одного дополнительного нуклеотида в одном из аллелей и делецией другого нуклеотида в другом аллеле, гом +1 -гомозиготного растение несущее две аплели VRN-A1 со вставкой дополнительного нуклеотида, гом -1 - гомозиготное растение несущее две аллели VRN-A1 с делецией нуклеотида.
Пример 1
Получение гетерозиготного трансгенного растения мягкой пшеницы #31-7 содержащего биаллельные мутации в обоих аллелях промоторной области гена VRN-A1 однодольных зерновых путем геномного редактирования с помощью РНК-проводника. Для получения индивидуального растений с отредактированным геномом требуется взаимодействие комплексов Саз9-РНК-проводник с геномной ДНК. Векторную конструкцию pgRNA-VRNA1#31, полученную на основе вектора pU6-gRNA (Addgene plasmid #53062; http://n2t.net/addgene:53062) и содержащую первую нуклеотидную последовательность SEQ ID NO: 1 и вторую нуклеотидную последовательность SEQ ID NO: 2, фланкирующую первую последовательность с 3'-конца, смешивали с вектором, кодирующим последовательность нуклеазы Cas9 содержащим ген-селективный маркер bar. и репортерный ген gfp, и переносили в клетки пшеницы с помощью генной пушки для внесения мутаций в промоторную область гена VRN-A1. В качестве эксплантов использовали эмбриогенные каллусы, инициированные из тканей незрелых зиготических зародышей пшеницы 'Chinese Spring' (Triticum aestivum L.). В результате генетической трансформации отобрали растение #31-1. демонстрирующее одновременно устойчивость к селективному гербициду и флуоресценцию репортерного гена GFP (оба гена содержатся в экспрессионной кассете совместно с последовательностью Cas9). Наличие вставок последовательностей «инструментов» геномного редактирования, а именно РНК-проводника, находящегося в составе вектора pgRNA-VRNA1#31, и последовательности нуклеазы Cas9 подтвердили ПЦР анализом тотальной ДНК, выделенной из #31-7. В геноме растения #31-7 присутствовала последовательность, кодирующая Cas9, и последовательность РНК-проводника (наблюдали амплификацию характерных фрагментов).
Одновременное наличие вставки и делении нуклеотидов в промоторной области гена VRN-A1 подтвердили путем генотипирования фрагмента включающего нуклеотидную последовательность, являющеюся мишенью РНК-проводника (Фиг. 2). Для этого фрагмент гена VRN-A1 амплифицировали с помощью праймеров CTGAATTCTGAAAGGAAAAATTCTGCTCG/ACTGGTACCGAAGGCGTATTGGGGAAC. ПЦР-продукты очищали набором GeneJET PCR Purification Kit (Thermo) и секвенировали с применением секвенирующего праймера TTACCATGACTCGGTGGAG. Дополнительно к этому, для подтверждения избирательности и точности разработанного РНК-проводника проводили анализ аналогичного участка промотора гомеологичнных VRN-1 генов присутствующих в элементарных геномах В и D пшеницы. Для этого предварительно секвенировали фрагмент промоторной области генов Vrn-B1 и Vrn-D1, полученный путем его амплификации с геномной ДНК пшеницы 'Chinese Spring' с использованием праймеров
CTGAATTCATAGTAGTATAAAAAGGACAATTG/CTGGTACCACCGAATCAACCAAACAGTG и CTGAATTCGTATAAAAGGAAAATTGTGCTCT/ACTGGTACCATCAACCAAACAGCCCCG, соответственно. Полученные фрагменты очищали набором GeneJET PCR Purification Kit (Thermo) и секвенировали с применением секвенирующего праймера TTACCATGACTCGGTGGAG. Сиквенсы фрагментов Vrn-A1, Vrn-B1 и Vrn-D1 трансгенных растений расшифровывали; последовательности раскладывали на аллели. В качестве контроля (референсная последовательность) использовали геномную ДНК пшеницы 'Chinese Spring' (Фиг. 2, Фиг. 4).
Генотиприровакие нуклеотидной последовательности показало наличие дополнительного нуклеотида а одном аллеле и нуклеотидной делении в другом аллеле в сравнении с немодифицированной последовательностью рецессивного гена VRN-A1, (Фиг. 2). Согласно генотипированию, растение #31-7 является гетерозиготным биаллельным, поскольку оба аллеля имеют мутации, при этом мутации отличаются. Эти изменения возникли в результате функциональной активности РНК-проводника vr-31, поскольку тзменения обнаружены в ожидаемом сайте расщепления молекулы ДНК комплексом Cas9-РНК-проводник (Фиг. 3). Анализ аналогичной нуклеотидной последовательности гомеологичных генов Vrn-B1 и Vrn-D1 подтвердил отсутствие каких-либо изменений (Фиг. 4). Таким образом, получено растение пшеницы, несущее отличающиеся биаллели нуклеотидной последовательности промотерной области гена VRN-A1 SEQ ID NO: 3 и SEQ ID NO: 4.
Пример 2
Получение трансгенного растения мягкой пшеницы #31-1 содержащего гомозиготные мутантные аллели с нуклеотидной вставкой или нуклеотидной делецией в промоторной области гена VRN-A1 однодольных зерновых.
В результате самоопыления первичного растения #31 -7, получение которого описано в Примере 1 (содержит одну мутантную аллель со вставкой дополнительного нуклеотида и другую аллель с делецией нуклеотида), получили семенное поколение Т1. Индивидуальные растения Т1 проанализировали на наследование мутантных аллелей и закрепление мутаций. Наследование нуклеотидных изменений в промоторной области гена VRN-A1 подтверждали путем секвенирования фрагмента нуклеотидной последовательности, являющеюся мишенью РНК-проводника, аналогично тому, как описано в Примере 1. Анализ потомства от самоопыления показал наличие трех типов наследования нуклеотидных изменений промоторной области гена VRN-A1 (Фиг. 5). Шесть из тринадцати проанализированных растений Т1 сохранили гетерозиготный характер наследования мутаций (присутствуют одновременно и вставка, и делеция в разных аллелях), аналогично первичному трансгенному растению #31-7 (Фиг. 5). Четыре из десяти проанализированных растений Т1 содержали одинаковые нуклеотидные вставки в обеих аллелях. Три растения Т1 содержали одинаковые нуклеотидные делении в обеих аллелях. Это подтверждено характерным хромотографическим распределением нуклеотидных пиков (Фиг. 5). Таким образом, получили как гомозиготное растения пшеницы, наследующие мутантные аллели с нуклеотидной вставкой, так и гомозиготное растения наследующие мутантные аллели с делецией нуклеотида в промоторной области гена VRN-A1 однодольных зерновых, привнесенные геномным редактированием.
Пример 3
Получение нетрансгенного растения мягкой пшеницы #31-7, содержащего гомозиготные мутантные аллели с нуклеотидными изменениями в промоторной области гена VRN-A1 однодольных зерновых.
Успешное применение технологий геномного редактирования в селекции пшеницы ограничивается тем. что в геноме первичного растения, полученного в результате переноса векторов, остаются последовательности кодирующие компоненты системы редактирования CRISPR/Cas9, из-за чего мутантные растения являются ГМО (Miroshnichenko et al. 2019). Пшеница является преимущественно самоопыляемым видом растений, размножающимся исключительно семенами. Благодаря этому, существует возможность «очищения» генома в последующих поколениях от функциональных трансггнных вставок, кодирующих компоненты систем редактирования при условии, что трансгенная вставка (кодирующая гидовую РНК и белок Cas9) и целевой ген-мишень находятся в различных хромосомах первичных мутантных растений. В дальнейшем, в результате самоопыления или скрещивания с нетрансгенным образцом в последующих поколениях (T1-Т3 или F1-F2) отбираются сеянцы, у которых при сохранении отредактированной целевой мишени, чужеродная последовательность не наследуется. Трансгенная вставка в первичных трансгенных растения пшеницы проявляет себя как доминантный признак. Являясь гетерозиготной, при самоопылении она наследуется по классической модели однолокусного наследования генов. В результате, ряд растений последующего поколения не наследует трансгенную вставку.
Поиск растений, не наследующих трансгенную вставку подтверждали ПЦР анализом тотальной ДНК, выделенной из растений Т1, проанализированных на наличие мутации в промоторной области VRN-A1. На Фиг. 6 представлен образец агарозных гелей после проведения ПЦР анализа. Подтвердили, что геном восьми растений Т1, полученных от самоопыления трансформанта #31-7, содержит трансгенные последовательности, т.к. наблюдали амплификацию фрагмента размером 606 п. н. характерного для репортерного гена gfp (находится в составе кассеты экспрессии одновременно несущей последовательности bar, Cas9, и gfp) и фрагмента размером 96 п. н. характерного для РНК-проводника (находится в составе кассеты экспрессии pgRNA-VRNA1#31). Сопоставление результатов ПЦР с результатами секвенирования фрагмента нуклеотидной последовательности промоторной области VRN-A1 подтвердило получение нетрансгенных растений пшеницы несущих привнесенную мутацию, а именно: растения #31-7-1, содержащего оба мутантных аллеля VRN-A1 со вставкой дополнительного нуклеотида, а также растения #31-7-9, содержащих два мутантных аллеля VRN-A1 с нуклеотидной делецией (Фиг. 6). Помимо этого, получены би-аллельные гетерозиготные растения Т1 (3 шт.), не содержащие трансгенной вставки, которые могут быть в дальнейшем использованы для получения нетрасгенных линий с привнесенными мутациями.
Финансирование работ по созданию настоящего изобретения проводилось из средств Соглашения №075-15-2019-1667 от «31» октября 2019 г. о предоставлении из федерального бюджета грантов в форме субсидий в соответствии с пунктом 4 статьи 78.1 Бюджетного кодекса Российской Федерации на осуществление государственной поддержки создания и развития центра геномных исследований мирового уровня «Курчатовский геномный центр» в рамках реализации федерального проекта «Развитие научной и научно-производственной кооперации» национального проекта «Наука».
Список литературы
Fu D, Szucs Р, Yan L, et al. (2005). Large deletions within the first intron in VRN-1 are associated with spring growth habit in barley and wheat. Mol. Genet. Genomics. 273, 54-65.
Konopatskaia I, Vavilova V, Kondratenko EY, et al. (2016). VRN1 genes variability in tetraploid wheat species with a spring growth habit. BMC Plant Biol. 16(Suppl 3):244.
Loukoianov A, Yan L, Blechl A, et al. (2005). Regulation of VRN-1 vernalization genes in normal and transgenic polyploid wheat. Plant Physiol. 138(4), 2364-2373.
Miroshnichenko DN, Shulga OA, Timerbaev VR, DolgovSV. (2019). Achievements, Challenges, and Prospects in the Production of Nontransgenic, Genome-Edited Plants. Appl Biochem Micro+(2019), 55 (9) 825-845.
Muterko A, Kalendar R, Salina E (2016). Novel alleles of the VERNALIZATION 1 genes in wheat are associated with modulation of DNA curvature and flexibility in the promoter region. BMC Plant Biol, 16(Suppl 1), 9.
Trevaskis В, Hemming MN, Dennis ES, et al. (2007). The molecular basis of vernalization-induced flowering in cereals. Trends Plant Sci. 12, 352-357.
Yan L, Helguera M, Kato K. et al. (2004). Allelic variation at the VRN-1 promoter region in polyploid wheat. Theor. Appl. Genet. 109:1677-1186.
--->
Перечень последовательностей
<110> ФГБНУ ВНИИСБ
<120> СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЯ ПШЕНИЦЫ С БИАЛЛЕЛЬНЫМИ МУТАЦИЯМИ В ПРОМОТОРНОЙ
ОБЛАСТИ ГЕНА VRN-А1 ПРИ ПОМОЩИ ТЕХНОЛОГИИ РЕДАКТИРОВАНИЯ ГЕНОМА РАСТЕНИЙ
CRISPR/CAS9
<160> 4
<210> 1
<211> 20
<212> РНК
<213> Искусственная последовательность
<400> 20
GCCAUGGCUAUCAGGUGGUU
<210> 2
<211> 76
<212> РНК
<213> Искусственная последовательность
<400> 76
GUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC
<210> 3
<211> 698
<212> ДНК
<213> Последовательность промоторной области гена VRN-А1, аллель 1
<400> 698
TGAAAGGAAAAATTCTGCTCGTTTTTTTGCTCTGTGGTGTGTGTTTGTGGCGAGAGAAAATGATTTGGGGAAAGCAAAATCC
GGAGATTCGCACGTACGATCGTTCGACACGTCGACGCCCGGCGGGCCCGGGGTGGGGCATCGTGTGGCTGCAGGACCGCGGG
GCCCCGCAAAGCGGGCCGGGCCAATGGGTGCTCGACAGCGGCTATGCTCCAGACCAGCCCGGTATTGCATACCGCGCTCGGG
GCCAGATCCCTTTAAAAACCCCTCCCCCCCTGCCGGAATCCTCGTTTTGGCCTGGCCATCCTCCCTCTCCTCCCCTCTCTTC
CACCTCACGTCCTCACCCAACACCTGATAGCCATGGCTCCGCCGCCTCGCCTCCGCCTGCGCCAGTCGGAGTAGCCGTCGCG
GTCTGCCGGTGTTGGAGGGTAGGGGCGTAGGGTTGGCCCGGTTCTCGAGCGGAGATGGGGCGGGGGAAGGTGCAGCTGAAGC
GGATCGAGAACAAGATCAACCGGCAGGTGACCTTCTCCAAGCGCCGCTCGGGGCTTCTCAAGAAGGCGCACGAGATCTCCGT
GCTCTGCGACGCCGAGGTCGGCCTCATCATCTTCTCCACCAAGGGAAAGCTCTACGAGTTCTCCACCGAGTCATGGTAAATT
AAGCACGCGCTGTCTTTAAATTTGTTCCCCAATACGCCTTCG
<210> 4
<211> 700
<212> ДНК
<213> Последовательность промоторной области гена VRN-А1, аллель 2
<400> 700
TGAAAGGAAAAATTCTGCTCGTTTTTTTGCTCTGTGGTGTGTGTTTGTGGCGAGAGAAAATGATTTGGGGAAAGCAAAATCC
GGAGATTCGCACGTACGATCGTTCGACACGTCGACGCCCGGCGGGCCCGGGGTGGGGCATCGTGTGGCTGCAGGACCGCGGG
GCCCCGCAAAGCGGGCCGGGCCAATGGGTGCTCGACAGCGGCTATGCTCCAGACCAGCCCGGTATTGCATACCGCGCTCGGG
GCCAGATCCCTTTAAAAACCCCTCCCCCCCTGCCGGAATCCTCGTTTTGGCCTGGCCATCCTCCCTCTCCTCCCCTCTCTTC
CACCTCACGTCCTCACCCAACGCACCTGATAGCCATGGCTCCGCCGCCTCGCCTCCGCCTGCGCCAGTCGGAGTAGCCGTCG
CGGTCTGCCGGTGTTGGAGGGTAGGGGCGTAGGGTTGGCCCGGTTCTCGAGCGGAGATGGGGCGGGGGAAGGTGCAGCTGAA
GCGGATCGAGAACAAGATCAACCGGCAGGTGACCTTCTCCAAGCGCCGCTCGGGGCTTCTCAAGAAGGCGCACGAGATCTCC
GTGCTCTGCGACGCCGAGGTCGGCCTCATCATCTTCTCCACCAAGGGAAAGCTCTACGAGTTCTCCACCGAGTCATGGTAAA
TTAAGCACGCGCTGTCTTTAAATTTGTTCCCCAATACGCCTTCG
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЯ ПШЕНИЦЫ С НУКЛЕОТИДНОЙ ДЕЛЕЦИЕЙ В ПРОМОТОРНОЙ ОБЛАСТИ ГЕНА VRN-A1 ПРИ ПОМОЩИ ТЕХНОЛОГИИ РЕДАКТИРОВАНИЯ ГЕНОМА РАСТЕНИЙ CRISPR/CAS9 | 2020 |
|
RU2772577C2 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЯ ПШЕНИЦЫ С НУКЛЕОТИДНОЙ ВСТАВКОЙ В ПРОМОТОРНОЙ ОБЛАСТИ ГЕНА VRN-A1 ПРИ ПОМОЩИ ТЕХНОЛОГИИ РЕДАКТИРОВАНИЯ ГЕНОМА РАСТЕНИЙ CRISPR/CAS9 | 2020 |
|
RU2772578C2 |
| МОЛЕКУЛА РНК-ПРОВОДНИКА ДЛЯ ГЕНОМНОГО РЕДАКТИРОВАНИЯ ПРОТОМОТОРНОЙ ОБЛАСТИ ГЕНА VRN-A1 ОДНОДОЛЬНЫХ ЗЕРНОВЫХ С ПРИМЕНЕНИЕМ СИСТЕМЫ CRISPR/CAS9 | 2020 |
|
RU2762831C1 |
| Молекула РНК-проводника sgRNA для внесения мутаций в консервативный участок промоторной области гена PPD-D1 мягкой пшеницы с применением системы редактирования генома CRISPR/Cas9 | 2024 |
|
RU2822358C1 |
| КОМПОЗИЦИИ ДЛЯ ИНДУКЦИИ ГАПЛОИДИИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2771141C2 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЯ КАРТОФЕЛЯ С БИАЛЛЕЛЬНЫМИ МУТАЦИЯМИ В КОДИРУЮЩЕЙ ОБЛАСТИ ГЕНА EDR1 ПРИ ПОМОЩИ ТЕХНОЛОГИИ РЕДАКТИРОВАНИЯ ГЕНОМА РАСТЕНИЙ CRISPR/CAS9 | 2022 |
|
RU2824558C2 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЯ КАРТОФЕЛЯ С БИАЛЛЕЛЬНЫМИ МУТАЦИЯМИ В КОДИРУЮЩЕЙ ОБЛАСТИ ГЕНА EDR1 ПРИ ПОМОЩИ ТЕХНОЛОГИИ РЕДАКТИРОВАНИЯ ГЕНОМА РАСТЕНИЙ CRISPR/CAS9 | 2022 |
|
RU2817379C2 |
| ГЕТЕРОЗИГОТНЫЕ ПО CENH3 ОДНОДОЛЬНЫЕ РАСТЕНИЯ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ ДЛЯ ИНДУКЦИИ ГАПЛОИДОВ И ОДНОВРЕМЕННОГО РЕДАКТИРОВАНИЯ ГЕНОМА | 2021 |
|
RU2832578C1 |
| ГЕНЕТИЧЕСКАЯ КОНСТРУКЦИЯ НА ОСНОВЕ СИСТЕМЫ РЕДАКТИРОВАНИЯ ГЕНОМА CRISPR/CAS9, КОДИРУЮЩАЯ НУКЛЕАЗУ CAS9, ДЛЯ ГЕНОМНОГО РЕДАКТИРОВАНИЯ ОДНОДОЛЬНЫХ ЗЕРНОВЫХ КУЛЬТУР НА ОСНОВЕ ДВОЙНОГО ОТБОРА РАСТЕНИЙ | 2020 |
|
RU2762830C1 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЯ КАРТОФЕЛЯ С ТЕТРААЛЛЕЛЬНЫМИ МУТАЦИЯМИ В КОДИРУЮЩЕЙ ОБЛАСТИ ГЕНА EDR1 ПРИ ПОМОЩИ ТЕХНОЛОГИИ РЕДАКТИРОВАНИЯ ГЕНОМА РАСТЕНИЙ CRISPR/CAS9 | 2022 |
|
RU2817383C2 |
Изобретение относится к области биотехнологии, в частности к способу получения растения пшеницы с биаллельными мутациями в промоторной области гена VRN-A1. Также изобретение относится к растению пшеницы с биаллельными мутациями в промоторной области гена VRN-А1. Изобретение эффективно для упрощения процесса получения новых высокопродуктивных сортов, соответствующих современным требованиям. 2 н.п. ф-лы, 6 ил., 3 пр.
1. Способ получения растения пшеницы с биаллельными мутациями в промоторной области гена VRN-A1, включающий в себя следующие этапы:
получение конструкции на основе вектора pU6-gRNA, содержащей первую нуклеотидную последовательность SEQ ID NO: 1 и вторую нуклеотидную последовательность SEQ ID NO: 2, фланкирующую первую последовательность с 3'-конца,
смешивание этой конструкции с вектором, кодирующим последовательность Cas9,
перенесение этой смеси в клетки пшеницы с помощью генной пушки для внесения мутаций в промоторную область гена VRN-1A и
отбор растений-регенерантов с биаллельными мутациями в промоторной области гена VRN-A1, где растения имеют отличающиеся биаллели промотерной области гена VRN-A1, имеющие нуклеотидные последовательности SEQ ID NO: 3 и SEQ ID NO: 4.
2. Растение пшеницы с биаллельными мутациями в промоторной области гена VRN-А1 для дальнейшего применения в селекционном процессе, полученное способом по п. 1, где растение имеет отличающиеся биаллели промотерной области гена VRN-A1, имеющие нуклеотидные последовательности SEQ ID NO: 3 и SEQ ID NO: 4.
| KONOPATSKAIA I | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| MUTERKO A | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2022-05-23—Публикация
2020-10-26—Подача