Перекрестная ссылка на родственные заявки
Данная заявка заявляет приоритет по первоначальной заявке США №62/467420, поданной 6 марта 2017 года, раскрытие которой включено в данный документ во всей своей полноте посредством ссылки.
Область изобретения
В целом, настоящее изобретение относится к способам и композициям для определения активности терапевтической клеточной композиции.
Предшествующий уровень техники
Анализы активности предназначены для предсказания терапевтической активности клеточной композиции посредством выявления или измерения одного или более биологических маркеров, которые связаны с одним или более физиологическими свойствами. Поскольку терапевтические механизмы действия могут варьировать у терапевтических клеточных композиций, тем не менее, может быть сложно идентифицировать биологическую функцию, которая была бы воспроизводимо связана с релевантными биологическими или биофизическими свойствами. Кроме того, поскольку терапевтические механизмы действия могут зависеть от сложных биологических путей, может быть особенно проблематичным идентифицировать то, какие признаки продукта являются наиболее релевантными для определения активности. Тем не менее, крайне важной является разработка анализов активности, которые бы отражали терапевтические свойства клеточных композиций и обеспечивали бы надежное измерение однородности показателей качества от партии к партии.
В настоящем раскрытии описан новый анализ активности для оценивания терапевтической эффективности клеток, облегчающих трансплантацию (вспомогательных клеток) (FC - от англ. facilitating cell), и/или альфа-бета TCR+ Т-клеток (от англ. T-cell receptor - Т-клеточный рецептор).
Краткое изложение сущности изобретения
В данном документе описаны способы и композиции для оценивания активности вспомогательных клеток и/или альфа-бета TCR+ Т-клеток.
В одном аспекте предложен способ определения активности образца, который включает вспомогательные клетки (FC), и/или альфа-бета TCR+ Т-клетки. Такой способ обычно включает приведение образца, включающего FC и/или альфа-бета TCR+ Т-клетки, в контакт с митогенным стимулом; и определение числа FC и/или альфа-бета TCR+ Т-клеток в образце, в которых рибосомный белок S6 является фосфорилированным (pS6). Как описано в данном документе, число FC и/или альфа-бета TCR+ Т-клеток в образце, в которых фосфорилирован pS6, характеризует активность FC и/или альфа-бета TCR+ Т-клеток, соответственно, в образце.
Репрезентативные митогенные стимулы без ограничения включают форбол-12-миристат-13-ацетат (РМА - от англ. phorbol 12-myristate 13-acetate) с иономицином, фитогемагглютинин (РНА - от англ. phytohaemagglutinin), конканавалин А (conA - англ. concanavalin А) и митоген лаконоса (PWM - от англ. pokeweed mitogen). В некоторых воплощениях образец приводят в контакт с митогенным стимулом на период времени от примерно 5 мин до примерно 60 мин (например, от примерно 20 мин до примерно 30 мин).
В некоторых воплощениях образец включает от примерно 100000 до примерно 2000000 FC и/или альфа-бета TCR+ Т-клеток. В некоторых воплощениях число FC и/или альфа-бета TCR+ Т-клеток в образце, в которых pS6 фосфорилирован, определяют с использованием флуоресцентно-меченого антитела против pS6. В некоторых воплощениях связывание флуоресцентно-меченого антитела выявляют с использованием FACS (от англ. fluorescent-activated cell sorting - сортировка клеток с активированной флуоресценцией).
В некоторых воплощениях способ осуществляют перед замораживанием FC и/или альфа-бета TCR+ Т-клеток. В некоторых воплощениях способ осуществляют на FC и/или альфа-бета TCR+ Т-клетках, которые были заморожены.
В некоторых воплощениях по меньшей мере 30% FC в образце представляют собой pS6+. В некоторых воплощениях по меньшей мере 30% альфа-бета TCR+ Т-клеток в образце представляют собой pS6+.
В другом аспекте предложен способ определения терапевтической дозы FC и/или альфа-бета TCR+ Т-клеток. Такой способ обычно включает предоставление образца клеток, включающего FC и/или альфа-бета TCR+ Т-клетки; определение активности образца клеток. Как описано в данном документе, активность образца клеток может быть показателем терапевтической дозы FC и/или альфа-бета TCR+ Т-клеток.
В другом аспекте изделие, которое включает антитело против фосфорилированной формы pS6 и по меньшей мере одно из следующих антител: антитело против CD3, антитело против CD8 и антитело против альфа-бета TCR.
В некоторых воплощениях изделие включает антитело против фосфорилированной формы pS6, антитело против CD3 и антитело против альфа-бета Т-клеточного рецептора (TCR). В некоторых воплощениях изделие включает антитело против фосфорилированной формы pS6 и антитело против CD8. В некоторых воплощениях изделие включает антитело против фосфорилированной формы pS6, антитело против CD3, антитело против CD8 и антитело против альфа-бета TCR.
Изделие, как описано в данном документе, может дополнительно включать митогенный стимул. Изделие, как описано в данном документе, может дополнительно включать по меньшей мере одну флуоресцентную метку. Изделие, как описано в данном документе, может дополнительно включать по меньшей мере одну флуоресцентную метку для каждого антитела. В некоторых воплощениях каждая из по меньшей мере одной флуоресцентной метки для каждого антитела отличима от другой.
Если не определено иное, все технические и научные термины, используемые в данном документе, имеют такое же значение, какое обычно понятно одному из рядовых специалистов в данной области, к которой принадлежат способы и композиции заявки. Несмотря на то, что материалы и методы, похожие или эквивалентные материалам и методам, описанным в данном документе, можно использовать на практике или в тестировании способов и композиций изобретения, ниже описаны подходящие материалы и методы. Кроме того, материалы, методы и примеры являются только иллюстративными и не предназначены для того, чтобы быть ограничивающими. Все публикации, патентные заявки, патенты и другие ссылки, упомянутые в данном документе, включены во всей своей полноте посредством ссылки.
Описание чертежей
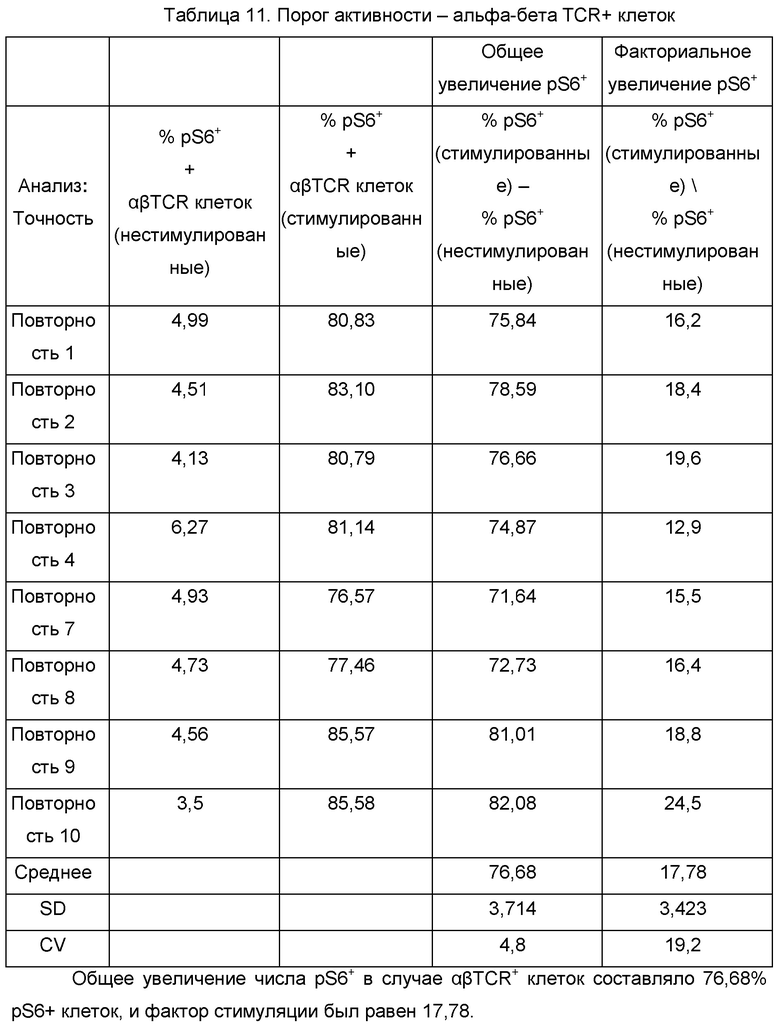
На Фиг. 1 показано гейтирование FC (CD8+/TCR-).
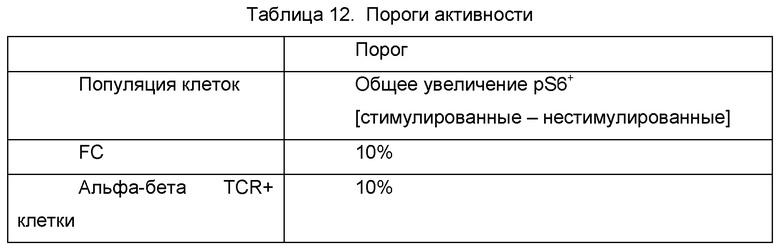
Фиг. 2 представляет собой график, показывающий избирательность pS6 в отношении FC.
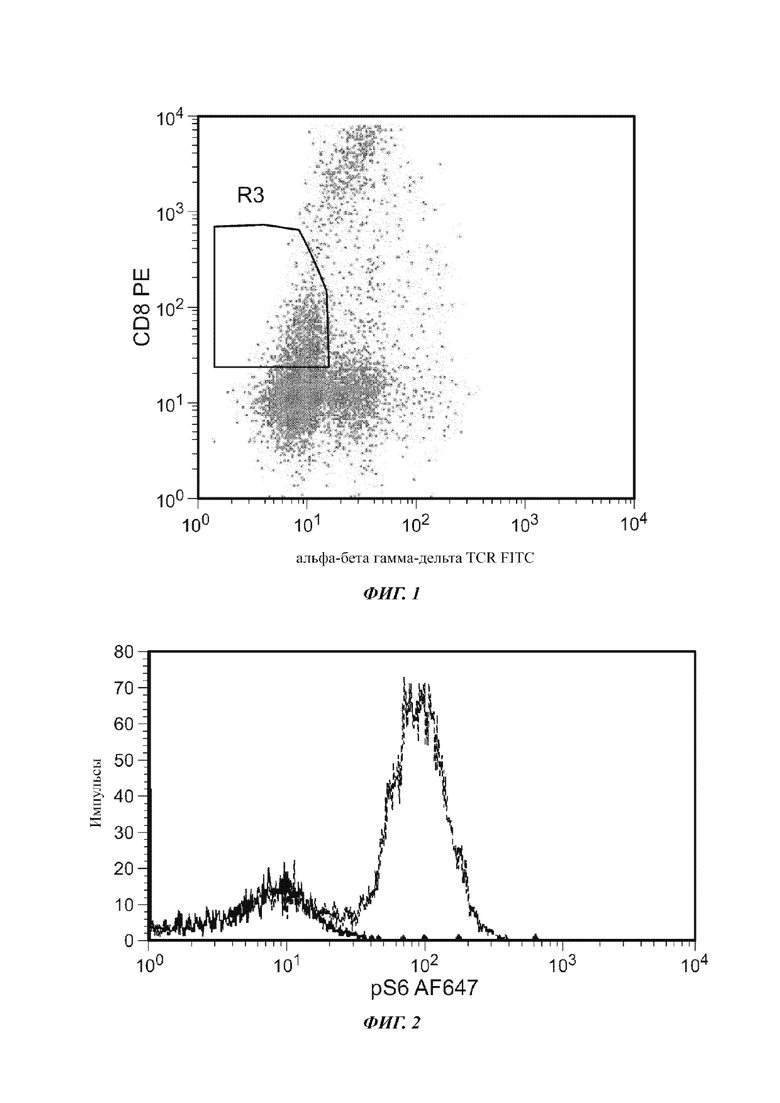
На Фиг. 3 показано гейтирование альфа-бета TCR+ клеток.
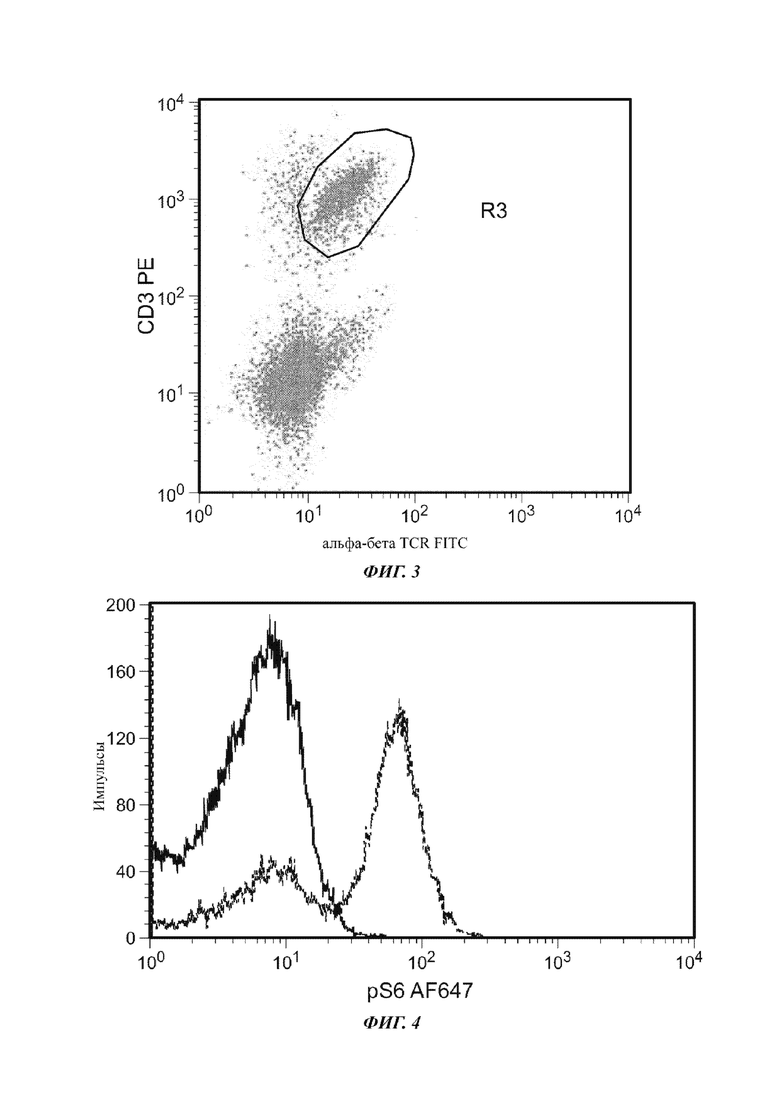
Фиг. 4 представляет собой график, показывающий избирательность pS6 в отношении альфа-бета TCR+ клеток.
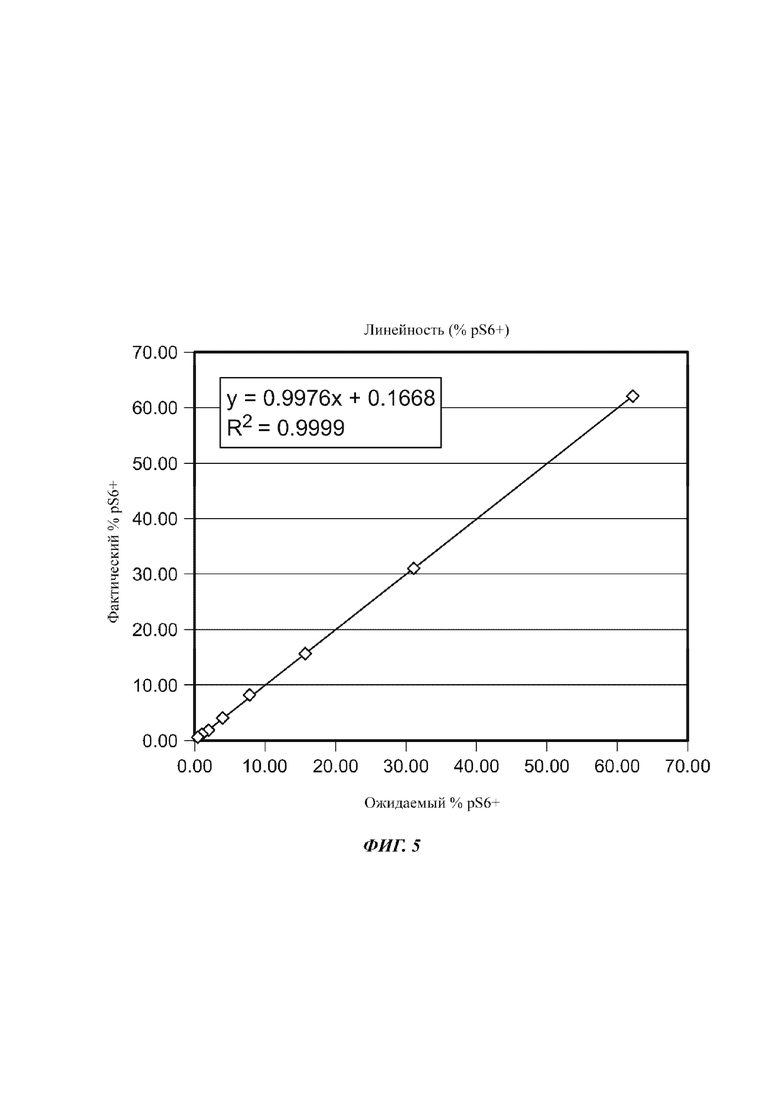
На Фиг. 5 показано линейное приближение pS6+ в отношении FC.
Подробное описание
Согласно данному раскрытию предложены способы определения активности FC и/или альфа-бета TCR+ Т-клеток. FC и альфа-бета TCR+ Т клетки представляют собой два из трех исходных компонентов в терапевтической клеточной композиции, которая описана в патенте США №№8632768 и 9452184. Принимая во внимание текущее терапевтическое и клиническое применение данной терапевтической клеточной композиции, быстрый и количественный способ оценивания активности терапевтической клеточной композиции и, более конкретно, FC и альфа-бета TCR+ Т-клеток в ней, после получения и перед введением пациенту, был бы очень полезным.
В процессе получения терапевтической композиции HSC (от англ. haemopoietic stem cell - гемопоэтическая стволовая клетка), FC и альфа-бета- TCR+ Т-клеток или после того, как такая терапевтическая композиция была получена, образец клеток из композиции можно отбирать и приводить в контакт с митогенным стимулом. Обычно, FC и/или альфа-бета TCR+ Т-клетки (например, приблизительно от 100000 до 2000000 FC и/или альфа-бета TCR+ Т-клетки) приводят в контакт с митогенным стимулом. В контексте данного документа митогенные стимулы или просто митогены относятся к соединениям (например, белкам, небольшим молекулам и т.д.), которые инициируют прохождение клетками митоза. Репрезентативные митогенные стимулы включают, без ограничения, форбол-12-миристат-13-ацетат (РМА; также известный как 12-O-тетрадеканоилфорбол-13-ацетат (ТРА - от англ. 12-O-tetradecanoylphorbol-13-acetate)) с иономицином, фитогемагглютинин (РНА), конканавалин А (conA) и митоген лаконоса (PWM). В некоторых примерах имеющаяся в продаже смесь для стимуляции клеток (например, кат. №00-4970, ThermoFisher Scientific) может быть использована в условиях от производителя. В качестве альтернативы, эксперименты по разведению или титрованию можно проводить для определения количества и времени воздействия конкретного митогена, который производит максимальное количество стимуляции и/или сигнал, указывающий на активность в терапевтической клеточной композиции, как описано в данном документе.
Обычно, в совокупности примерно от 100000 до примерно 2000000 клеток (то есть, из терапевтической клеточной композиции, которая включает HSC, FC и альфа-бета TCR+ Т-клетки) приводят в контакт с митогеном, хорошо перемешивают (например, посредством вибромешалки) и поддерживают при температуре примерно 37°С в течение от примерно 5 минут до примерно 60 минут (то есть, один час) (например, примерно от 5 минут до примерно 50 минут; от примерно 5 минут до примерно 30 минут; от примерно 5 минут до примерно 15 минут; от примерно 10 минут до примерно 45 минут; от примерно 10 минут до примерно 30 минут; от примерно 15 минут до примерно 45 минут; от примерно 15 минут до примерно 30 минут; от примерно 20 минут до примерно 60 минут; от примерно 20 минут до примерно 40 минут; от примерно 30 минут до примерно 45 минут; от примерно 30 минут до примерно 60 минут; от примерно 45 минут до примерно 60 минут). Продолжительность периода времени, в течение которого FC и/или альфа-бета TCR+ Т-клетки подвергаются действию митогенных стимулов, зависит, отчасти, от конкретных используемых митогенных стимулов; в некоторых воплощениях FC и/или альфа-бета TCR+ Т-клетки подвергают действию митогенных стимулов в течение примерно 15 минут в инкубаторе с 5% CO2, установленном на 37°С.
После того, как клетки были простимулированы митогеном в течение соответствующего периода времени, определяют число FC и/или альфа-бета TCR+ Т-клеток, в которых рибосомный белок S6 («S6») фосфорилирован («pS6»). Следует понимать, что наиболее распространенный и эффективный способ определения числа клеток заключается в применении одного или более флуоресцентных антител и анализа на основе сортировки клеток с активированной флуоресценцией (FACS). В настоящих способах дифференциально флуоресцентно-меченые антитела можно использовать для окрашивания стимулированных клеток антителами против CD3, против CD8, против альфа-бета TCR и против фосфо-S6 (то есть против pS6). Совокупность FC обозначают как CD8+ и альфа-бета TCR-, в то время как активные FC обозначают как CD8+, альфа-бета TCR- и фосфо-S6+ (то есть, pS6+). Аналогично, совокупность альфа-бета TCR+ Т-клеток обозначают как CD3+, в то время как активные альфа-бета TCR+ Т-клетки обозначают как CD3+и pS6+. Антитела, которые можно использовать в способах, описанных в данном документе, имеются в продаже. См., например, BD Biosciences (например, кат. №№.563423; 557757; 555916; 557760; 557746; 561951; 563625; 563826; 561674; 560433; 560434; или 560435); Abnova Corp. (например, кат. №№ МАВ12370; МАВ9820; МАВ4591; МАВ4596; ab99859; ab95648; МАВ6560; или МАВ6559); или eBiosciences (например, кат. №№12-0039; 50-0037; 25-0087; 9047-0087; 46-9986; 11-9986; 12-9007; или 48-9007).
В данной области известно большое количество флуоресцентных меток, которые можно использовать при FACS. Большое количество разных меток, которое можно распределять по категориям в соответствии с длиной волны света, который они испускают (например, красный, фиолетовый, желтый, зеленый, синий), делает возможным одновременное или сопутствующее выявление множества антител и их соответствующих мишеней связывания. Например, антитела против CD3, CD8 и альфа-бета TCR, описанные в данном документе, могут быть дифференциально мечены таким образом, чтобы можно было отличить FC от альфа-бета TCR+ Т-клеток, и антитело против фосфорилированной формы pS6 также может быть мечено, отлично от других меченых антител, таким образом, чтобы можно было отличить FC с фосфорилированным S6 (то есть, pS6) от FC с нефосфорилированным S6, а также альфа-бета TCR+ Т-клетки с фосфорилированным S6 (то есть, pS6) от альфа-бета TCR+ Т-клеток с нефосфорилированным S6. Без ограничения, репрезентативные флуоресцентные метки включают, например, Alexa fluor 488, Alexa fluor 532, Alexa fluor 647, Alexa fluor 700, Cyanine 5, Cyanine 5.5, Cyanine 7, флуоресцентный изотиоцианат (FITC - от англ. Fluorescein isothiocyanate - флуоресцеин изотиоцианат), фикоэритрин (РЕ - от англ. Phycoerythrin), eFluor 450, eFluor 506, eFluor 610, eFluor 660 и eFluor 780. Флуоресцентные метки могут быть получены, например, из EMD Millipore (Дармштадт, Германия); abcam (Кембридж, Кембриджшир, Великобритания) и Promega (Мэдисон, WI).
Например, при получении в соответствии с GMP (от англ. good manufacturing practices - правила надлежащей производственной практики), установленными для клинического применения, небольшую часть конечной терапевтической клеточной композиции можно приводить в контакт с митогенными стимулами в течение соответствующего периода времени и затем анализировать посредством FACS для определения процента FC и альфа-бета TCR+ клеток, которые содержат pS6. В некоторых воплощениях примерно шесть миллионов лейкоцитов стимулируют митогеном. Обычно, из 6 миллионов лейкоцитов, ожидается, что примерно 250000 клеток представляют собой альфа-бета TCR+ Т-клетки, и, как ожидается, примерно 25000 клеток представляют собой FC. Образцы можно оценивать перед криоконсервацией и/или после криоконсервации и оттаивания. В последнем случае, образец, подлежащий оценке в отношении активности, можно криоконсервировать в отдельном флаконе. Тестирование активности можно проводить перед подготовкой пациентов к введению терапевтической клеточной композиции и можно использовать для определения того, имеет ли терапевтическая клеточная композиция достаточное количество клеток для введения. Описанные в данном документе способы определения активности FC и/или альфа-бета TCR+ Т-клеток являются количественными, и их можно осуществлять за 2-4 часа, что делает данные способы очень полезными в клинических условиях.
Как описано в данном документе, число FC и/или альфа-бета TCR+ Т-клеток в образце, в которых S6 был фосфорилирован, является показателем активности данных клеток в образце. Термин «активность», в том виде, в контексте данного документа, относится к числу клеток в образце, которые отвечают на митогенный стимул фосфорилированием S6. Клетки, которые отвечают таким образом (то есть, фосфорилированием S6), считаются активными, поскольку они могут отвечать на внеклеточные сигналы и инициировать перепрограммирование ядра в ответ на данные сигналы. Определение активности клеток (например, FC и альфа-бета TCR+ Т-клеток) после получения и/или какого-либо другого типа манипуляции (например, замораживание, оттаивание, транспортировка/отправка) может являться критически важным компонентом в получении терапевтической клеточной композиции и определении биологического качества данной терапевтической клеточной композиции. Что важно, анализ активности, описанный в данном документе, также можно использовать для определения и количественной оценки стабильности терапевтической клеточной композиции во время и/или после хранения (например, криоконсервации).
В случае клеточных терапий желательно подтверждать или определять активность одного или более типов клеток в клеточной композиции. В настоящем случае желательно, чтобы по меньшей мере примерно 30% FC в клеточной композиции являлись pS6+ (то есть, чтобы по меньшей мере примерно 30% FC в образце являлись активными) или по меньшей мере примерно 30% альфа-бета TCR+ Т-клеток в клеточной композиции являлись pS6+(то есть, чтобы по меньшей мере примерно 30% альфа-бета TCR+ Т-клеток в образце являлись активными). В настоящем случае желательно, чтобы по меньшей мере примерно 30% FC в клеточной композиции являлись pS6+ (то есть, чтобы по меньшей мере примерно 30% FC в образце являлись активными) и по меньшей мере примерно 30% альфа-бета TCR+ Т-клеток в клеточной композиции являлись pS6+ (то есть, чтобы по меньшей мере примерно 30% альфа-бета TCR+ Т-клеток в образце являлись активными).
Следует понимать, что фраза «по меньшей мере 30%», в том виде, в котором она используется в данном документе в отношении терапевтической клеточной композиции или каких-либо конкретных типов клеток из нее, может относиться, например, к по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95%. Также следует понимать, что ссылка на по меньшей мере 30% может относиться к, например, от примерно 30% до примерно 90%, от примерно 30% до примерно 80%, от примерно 30% до примерно 70%, от примерно 40% до примерно 80%, от примерно 40% до примерно 70%, от примерно 40% до примерно 60%, от примерно 50% до примерно 80%, от примерно 50% до примерно 70%, от примерно 60% до примерно 90%, от примерно 60% до примерно 80%, от примерно 70% до примерно 80%, от примерно 75% до примерно 80% или от примерно 80% до примерно 90%.
В некоторых примерах один или более документов (например, Сертификаты качества) могут сопровождать терапевтическую клеточную композицию. Документы, которые могут быть приложены к терапевтической клеточной композиции, могут, например, сообщать об одном или более из следующего: суммарный процент pS6+ или активных клеток (относительно общего числа клеток) в терапевтической клеточной композиции; процент pS6+ или активных FC в терапевтической клеточной композиции; процент pS6+ или активных альфа-бета TCR+ Т-клеток в терапевтической клеточной композиции; число pS6+ или активных FC в терапевтической клеточной композиции; и/или число pS6+ или активных альфа-бета TCR+ Т-клеток в терапевтической клеточной композиции. В документах, которые могут быть приложены к терапевтической клеточной композиции, также может быть указана рекомендованная дозировка (например, общее число клеток, число pS6+ или активных клеток или объем) и/или схема дозирования.
Способы, описанные в данном документе, таким образом, можно использовать для определения подходящей терапевтической дозы клеточной композиции, которая включает FC и/или альфа-бета TCR+ Т-клетки. Например, активность образца клеток, который включает FC и/или альфа-бета TCR+ Т-клетки, можно определять, как описано в данном документе, и на основе активности одного из двух типов клеток или как FC, так и альфа-бета TCR+ Т-клеток, можно определять терапевтическую дозу и в дальнейшем вводить пациенту. В контексте данного документа подходящая терапевтическая доза относится к дозе, которая обеспечивает приживление трансплантата при отсутствии реакции «трансплантат против хозяина» и при отсутствии какой-либо токсичности (например, от альфа-бета TCR+ Т-клеток).
Согласно данному раскрытию также предложены изделия. Изделия, как описано в данном документе, могут включать, например, одно или более антител, описанных в данном документе. Например, одно или более антител, которые специфично связываются с CD3, CD8, альфа-бета TCR и/или pS6, могут быть включены в изделие, как описано в данном документе.
Изделия, как описано в данном документе, также могут включать одну или более флуоресцентных меток. Следует понимать, что флуоресцентная метка может быть предложена для каждого из антител в изделии. Также следует понимать, что когда флуоресцентная метка предложена для каждого из антител, каждая из данных флуоресцентных меток может быть отличной (например, отличимой от другой). Кроме того, одно или более антител в изделии могут быть предложены уже мечеными; в качестве альтернативы, флуоресцентные метки могут быть предложены отдельно (например, в отдельных флаконах) от антител для мечения конечным потребителем.
Изделия могут включать дополнительные компоненты, такие как, без ограничения, один или более митогенов (например, форбол-12-миристат-13-ацетат (РМА) с иономицином, фитогемагглютинин (РНА), конканавалин А (conA) или митоген лаконоса (PWM)), среды для клеточных культур, один или более буферов, реагентов и/или кофакторов. Изделия также могут включать один или более контейнеров, например, флаконы, кюветы, пробирки, культуральные планшеты и тому подобное, для проведения стадий, необходимых для определения активности FC и/или альфа-бета TCR+ Т-клеток.
Согласно настоящему изобретению могут быть использованы общепринятые методики молекулярной биологии, микробиологии, биохимические методики и методики генной инженерии в пределах компетентности в данной области. Такие методики полностью объясняются в литературе. Изобретение будет дополнительно описано в следующих примерах, которые не ограничивают объем способов и композиций изобретения, описанных в формуле изобретения.
ПРИМЕРЫ
Пример 1 - Принцип способов
Способы, описанные в данном документе, могут быть использованы для определения активности криоконсервированного конечного продукта из процесса изготовления терапевтической клеточной композиции, называемого в данном документе FCRx.
Механизм действия вспомогательных клеток (FC) и альфа-бета TCR+ клеток представляет собой сложный процесс, включающий миграцию клеток, поддержку приживления стволовых клеток и развитие иммунной толерантности. Фосфорилирование рибосомного белка S6 - мишени (pS6), участвующего в синтезе белка и пролиферации клеток, было разработано в качестве суррогатного анализа для того, чтобы показывать, что FC и альфа-бета TCR+ клетки способны отвечать на митогенный стимул после криоконсервации. Фосфорилирование S6 количественно оценивали в образцах нестимулированных и стимулированных клеток, окрашенных панелью антител для FC или альфа-бета TCR+, и увеличение pS6 при стимуляции определяли для обеих субпопуляций клеток.
Иммунофенотипирование представляет собой методику, используемую для исследования белков, экспрессируемых клетками. Оно включает мечение клеток флуоресцентными антителами, направленными против антигенов клеточной поверхности или внутриклеточных белков. Меченые клетки анализировали на проточном цитометре, лазерном приборе, способном анализировать тысячи клеток в секунду в отношении размера, клеточной вариабельности и флуоресцентных свойств.
Т-клетки демонстрировали CD3 на своей клеточной поверхности. Посредством использования мышиного антитела против человеческого CD3, меченного фикоэритрином (РЕ), выявляли положительный сигнал флуоресценции. Субпопуляция CD8 Т-клеток экспрессировала CD8 на своей клеточной поверхности. Посредством использования мышиного антитела против человеческого CD8, меченного РЕ, выявляли положительный сигнал флуоресценции. Т-клетки демонстрировали TCR (состоящий из альфа-бета и гамма-дельта субъединиц) на своей клеточной поверхности. При мечении мышиным антителом против альфа-бета TCR человека, конъюгированным с флуоресцеин изотиоцианатом (FITC), выявляли положительный сигнал флуоресценции. При мечении мышиным антителом против гамма-дельта TCR человека, конъюгированным с FITC, выявляли положительный сигнал флуоресценции. Альфа-бета TCR+ клетки демонстрировали фенотип альфа-бета TCR+ CD3+. Вспомогательные клетки (FC) демонстрировали фенотип альфа-бета TCR - гамма-дельта TCR-CD8+. Стимулированные клетки экспрессировали pS6 в клетке. Используя антитело против pS6, меченное alexa fluor 647 (AF647), выявляли положительный сигнал флуоресценции.
Описано иммунофенотипирование для FC и альфа-бета TCR+ клеток. См., например, патент США №№8632768 и 9452184. Таким образом, данное раскрытие сфокусировано на применении фосфорилирования S6 в качестве показателя активности FC и альфа-бета TCR+ Т-клеток.
В стратегии квалификации использовали криоконсервированный конечный продукт от тренировочного запуска процесса изготовления FCRx (Партия ICT-R&D052615). Образцы анализировали на проточных цитометрах FACSCalibur (BD Biosciences), которые проходили аттестации монтажа, функционирования и эксплуатационных характеристик.
Анализ pS6 квалифицировали без применения положительного контроля (PC - от англ. positive control) или испытания пригодности системы (SST - от англ. system suitability test). Обычно, PC или SST будут представлять собой клетку человека, стимулированную митогеном, и измеренный внутриклеточный сигнал pS6. Однако, образец FCRx содержал гетерогенную смесь клеток, и авторы изобретения анализировали фенотип исследуемых конкретных субпопуляций клеток и оценивали pS6 окрашивание после стимуляции митогеном; таким образом, тестируемый образец служил своим собственным SST.
Кроме того, различия в ответе PC вследствие вариабельности доноров также будут фактором, и не было конкретного PC, имеющегося у поставщика. Применение и осуществление анализа PC или SST будут дополнительно исследованы во время полной валидации, но не оказывали влияния на квалификацию pS6 анализа для применения в оценивании активности конечного продукта FCRx.
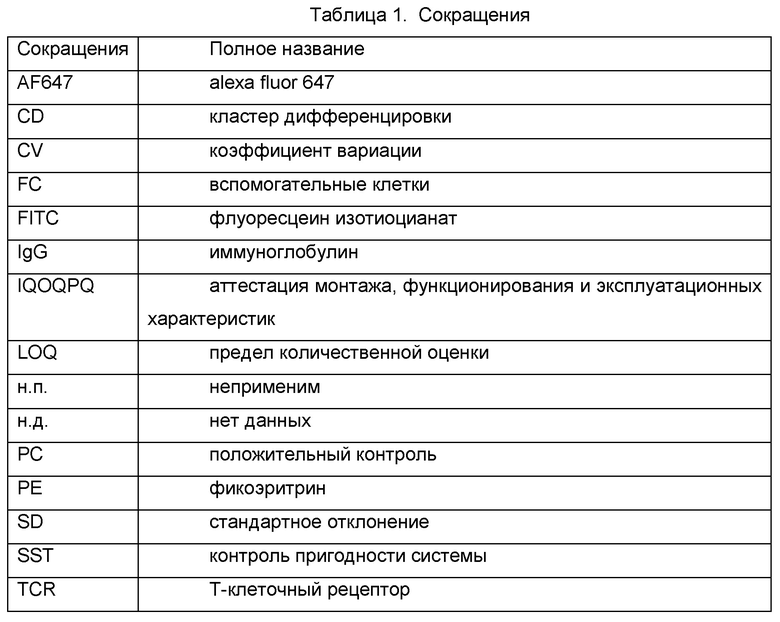
Были использованы следующие сокращения:
Пример 2 - Избирательность pS6
Избирательность антитела против pS6 оценивали, используя конечный продукт FCRx для подтверждения того, что отрицательный и положительный сигналы флуоресценции получали от нестимулированных и стимулированных клеток, соответственно. Поскольку нестимулированные клетки демонстрировали низкий уровень фосфорилирования S6 (то есть, pS6), избирательность также оценивали по увеличению фосфорилирования pS6 в стимулированных клетках. Избирательность антитела против pS6 показана повышенной частотой встречаемости клеток FC (Фиг. 1), которые окрашиваются за счет pS6 в стимулированном образце (красная кривая), по сравнению с нестимулированным образцом (синяя кривая) (Фиг. 2). Избирательность антитела против pS6 показана повышенной частотой встречаемости альфа-бета TCR+ клеток (Фиг. 3), которые окрашиваются за счет pS6 в стимулированном образце (красная кривая), по сравнению с нестимулированным образцом (синяя кривая) (Фиг. 4).
Со ссылкой на Фиг. 1, FC четко идентифицировали с фенотипом альфа-бета TCR- гамма-дельта TCR- CD8+ и подвергали гейтированию с использованием области R3. Затем pS6 окрашивание FC оценивали с использованием однопараметрической гистограммы.
Со ссылкой на Фиг. 2, репрезентативное наложение распределения флуоресценции нестимулированных FC (синяя кривая) и стимулированных FC (красная кривая), окрашенных антителом против pS6. Стимулированные клетки, окрашенные антителом против pS6, демонстрировали явное разделение (больше 1 log) интенсивности флуоресценции для pS6+ клеток, по сравнению с pS6- клетками. Нестимулированный образец имел 24,81% pS6+ клеток со средней интенсивностью флуоресценции (MFI - от англ. mean fluorescence intensity) 5,8. Стимулированный образец имел 78,94% pS6+ клеток с MFI 89,1, демонстрируя 15-кратное увеличение флуоресценции, по сравнению с pS6- клетками.
Со ссылкой на Фиг. 3, альфа-бета TCR+ клетки четко идентифицировали с фенотипом альфа-бета TCR+/CD3+ и подвергали гейтированию, используя область R3. Затем pS6 окрашивание альфа-бета TCR+ клеток оценивали, используя однопараметрическую гистограмму.
Со ссылкой на Фиг. 4, репрезентативное наложение распределения флуоресценции нестимулированных альфа-бета TCR+ клеток (синяя кривая) и стимулированных альфа-бета TCR+ клеток (красная кривая), окрашенных антителом против pS6. Стимулированные клетки, окрашенные антителом против pS6, демонстрировали четкое разделение (больше 1 log) интенсивности флуоресценции для pS6+ клеток, по сравнению с pS6- клетками. Нестимулированный образец имел 4,98% pS6+ клеток с MFI 5,27. Стимулированный образец имел 81,47% pS6+ клеток с MFI 62,99, демонстрируя 12-кратное увеличение флуоресценции, по сравнению с pS6- клетками.
Эти данные соответствовали критериям приемлемости в отношении избирательности и указывают на то, что данный анализ является специфичным к pS6.
Пример 3 - Точность способов
Точность анализа pS6 определяли по выделению клеток по оценке линейности. Данные показаны для pS6+ FC (Таблица 2) с использованием результатов по линейности (Таблица 5).
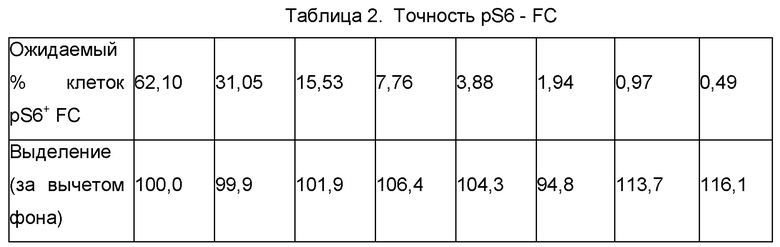
Выделение клеток pS6+ FC составляло от 94,8% до 116,1% для популяции клеток pS6+ FC, составляющей от 62,1% до 0,49% субпопуляции FC. Это указывает на то, что анализ pS6 имеет точность в пределах 16,1% номинальной величины. При этом достигалось целевое значение плюс/минус 30% расчетного % pS6+ клеток.
Пример 4 - Внутрианалитическая сходимость
Внутрианалитическую сходимость способа оценивали по четырем повторностям из «Аналитик 1, День 1 и Прибор 1». Данные по pS6+ FC и альфа-бета TCR+ клеткам показаны в Таблице 3.
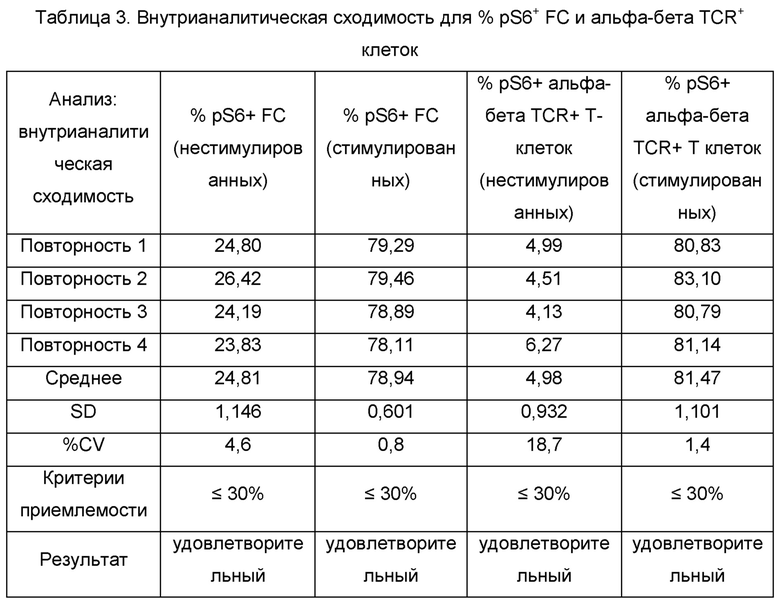
% CV для pS6+ клеток в нестимулированных и стимулированных образцах от четырех повторностей конечного продукта FCRx, окрашенного панелями для FC и альфа-бета TCR+ клеток, составляли меньше/равно 30% и соответствовали критериям приемлемости.
Пример 5 - Промежуточная сходимость
Промежуточную сходимость способа оценивали по данным, полученным двумя аналитиками за два дня на двух отдельных проточных цитометрах. Данные по pS6+ FC и альфа-бета TCR+ клеткам показаны в Таблице 4.

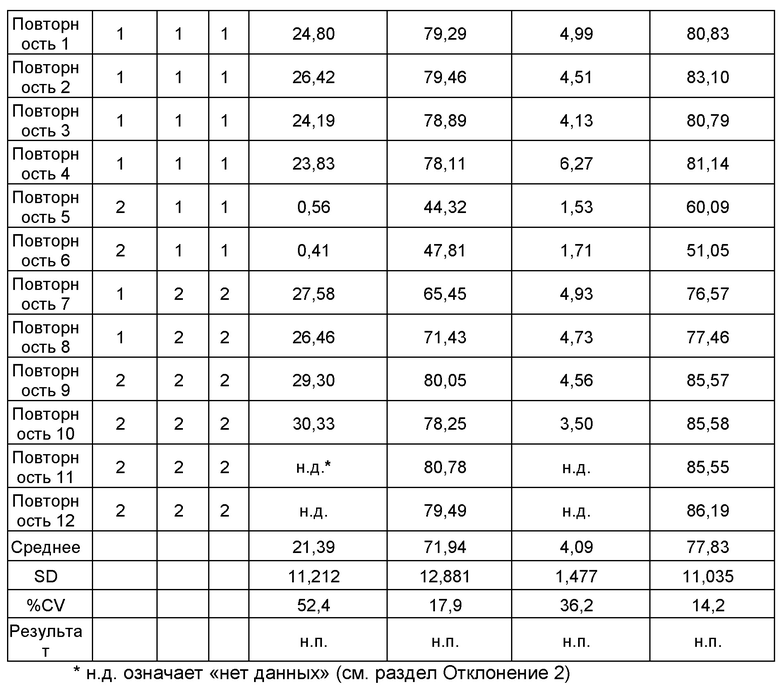
% CV по десяти или двенадцати повторностям клеток конечного продукта FCRx, анализируемый за два дня двумя аналитиками с использованием двух цитометров, составил 52,4% для pS6+ FC (нестимулированных), 17,9% для pS6+ FC (стимулированных), 36,2% для pS6+ альфа-бета TCR+ клеток (нестимулированных) и 14,2% для pS6+ альфа-бета TCR+ клеток (стимулированных). Результаты от «Аналитик 2, День 1» демонстрировали более низкий % pS6+ как для FC, так и для альфа-бета TCR+ нестимулированных клеток, по сравнению с результатами от «Аналитик, 1 День 1» и от обоих аналитиков за 2 дня. Не было критерия приемлемости для промежуточной сходимости, а были приведены первоначальные данные.
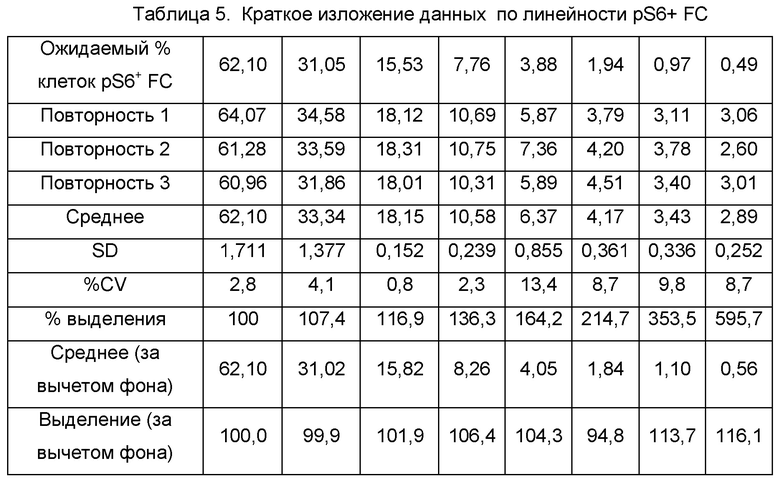
Пример 6 - Линейность pS6
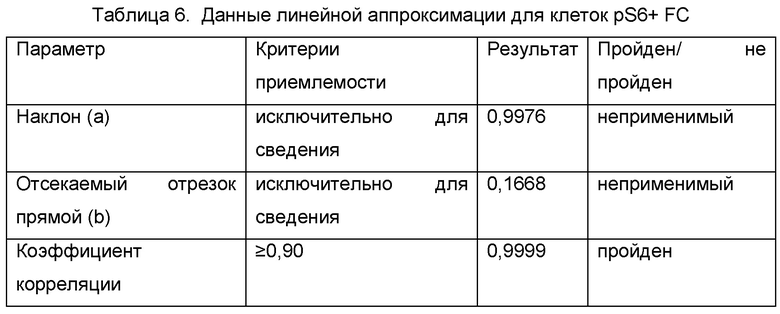
Линейность анализа pS6 определяли посредством серийного разведения стимулированных клеток, окрашенных на FC и pS6, стимулированными клетками, окрашенными только на FC. Средние значения ожидаемого % фосфорилирования откладывали на графике в виде зависимости независимой переменной от % фосфорилирования, поскольку применяли зависимую переменную и линейный регрессионный анализ с использованием уравнения у=ах+b (Таблица 5, Фиг. 5, Таблица 6).
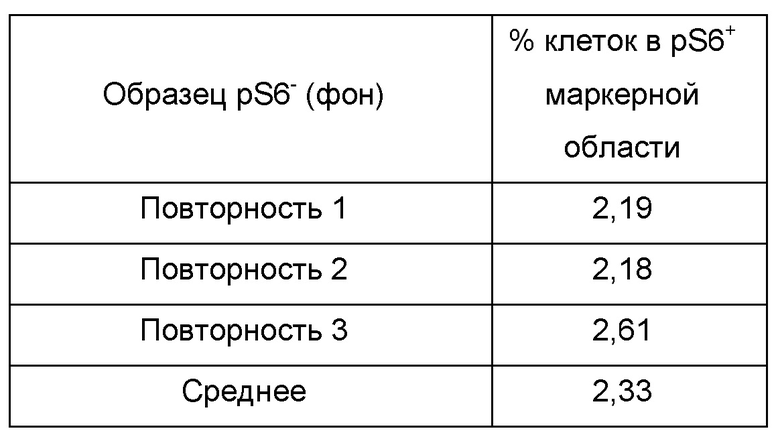
Для определения линейности анализа для определения pS6+ клеток стимулированный образец, который не был окрашен на pS6 (pS6-), использовали для разведения клеток pS6+. Из-за автофлуоресценции клеток приблизительно 2,33% pS6- клеток были захвачены в маркерной области, используемой для количественного определения % pS6+ клеток. Вследствие этого, данную величину вычитали из общего среднего результата % pS6+ и данное среднее значение (за вычетом фона) использовали для оценки линейности анализа.
Пример 7 - Устойчивость или стабильность образца
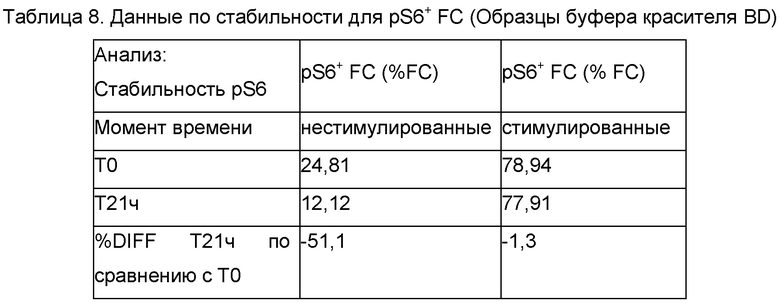
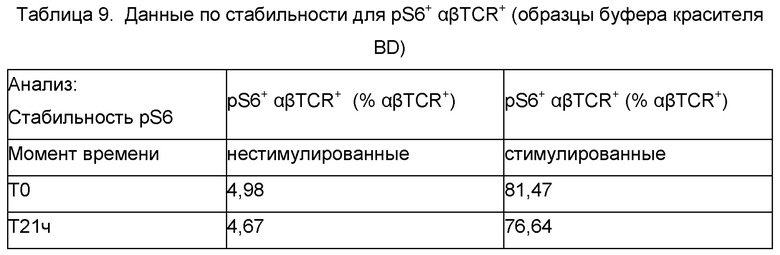
Стабильность pS6 окрашивания оценивали посредством исследования времени хранения с использованием криоконсервированного образца конечного продукта FCRx. Образец оттаивали, окрашивали панелью для FC и pS6 и затем делили на три отдельные аликвоты. Одну аликвоту ресуспендировали в буфере красителя BD и анализировали на проточном цитометре (Время 0 минут, Т0). Дополнительные аликвоты фиксировали в 4% параформальдегиде на льду и тестировали в момент времени 15 минут (Т15 мин) после фиксации и 20 часов (Т20 ч) после хранения при 2°С - 8°С. Данные по Т15 мин сравнивали с моментом времени Т0, и данные по моменту времени Т20 ч сравнивали с моментом времени Т15 мин в отношении изменений в % pS6+ FC и рассчитывали в виде % Разницы (%DIFF) (Таблица 7). Кроме того, образцы, окрашенные панелью для FC, панелью для альфа-бета TCR+ клеток и pS6, которые анализировали на внутрианалитическую сходимость в день 1, хранили в холодильнике в течение ночи в буфере красителя BD и повторно анализировали на следующий день (Т21 ч). Из-за небольшого объема образца, остающегося после первичного анализа, данные образцы объединяли и повторно анализировали как один образец. Данные по моменту времени Т21 ч сравнивали с усредненными данными по моменту времени Т0 в отношении изменений в % pS6+ FC, % pS6+ альфа-бета TCR+ и рассчитывали в виде %DIFF (Таблица 8).
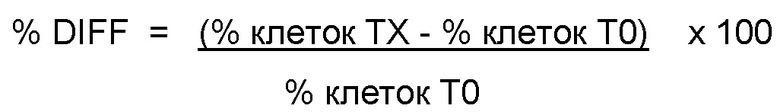
Точные периоды времени для хранения образцов базировались на времени начала анализа образцов на FACSCalibur, которое записывали в электронных файлах listmode.


Образцы, которые хранили в 2% параформальдегиде, демонстрировали снижение уровня pS6+ FC как в нестимулированных, так и стимулированных образцах. Однако, фиксированные образцы, хранящиеся в холодильнике в течение 20 ч, имели сопоставимые уровни pS6+ клеток, в сравнении с образцами, анализируемыми через 15-минут после фиксации.
Образцы, которые хранили в течение ночи в буфере красителя BD, имели сопоставимые уровни pS6+ FC и pS6+ альфа-бета TCR+ клеток, в сравнении с такими же образцами, анализируемыми днем раньше.
Пример 8 - Диапазон и предел количественной оценки
Анализ активности pS6 phosflow демонстрировал линейность с приемлемой точностью вплоть до 0,56% pS6+ клеток с использованием панели для окрашивания FC. Поскольку FC обычно представляют собой более низкочастотную субпопуляцию клеток, чем альфа-бета TCR+ клетки, для pS6 определяли линейность с использованием FC панели и применяли как для FC, так и для альфа-бета TCR+ клеток. Верхняя граница диапазона тестируемых pS6+ клеток составляла 62,10%, что соответствовало уровню фосфорилирования pS6, наблюдаемому в неразведенном образце стимулированных pS6+ FC для того анализа, с точностью 2,8% CV для образцов, тестируемых в трех повторностях. Таким образом, можно предположить, что конечный продукт с частотой встречаемости pS6+ клеток выше, чем у продуктов, тестируемых в данной квалификации, также бы демонстрировал приемлемую линейность, поскольку более высокая частота событий показывает статистически более низкую вариабельность. Таким образом, диапазон анализа pS6 phosflow составляет от 0,56% до 100% pS6+ клеток с LOQ (от англ. limit of quantitation - предел количественного определения) 0,56%.
Пример 9 - Порог активности
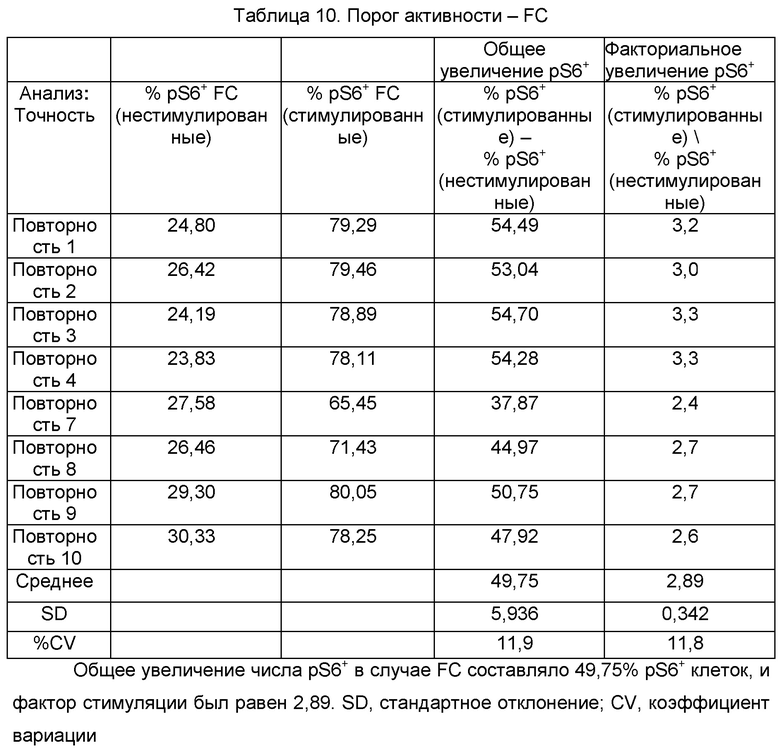
В данной квалификации анализа использовали одну репрезентативную партию конечного продукта FCRx, при этом многочисленные флаконы тестируемого материала подвергали оттаиванию и анализировали на протяжении трех дней тестирования. Анализ активности на основе pS6 требует применения для фосфорилирования pS6 в FC и альфа-бета TCR+ клетках конкретных критериев для определения того, являются ли клетки активными. Это может быть определено или общим увеличением числа pS6+ клеток в стимулированном образце, по сравнению с нестимулированным образцом (% pS6+ (стимулированный образец) минус % pS6+ (нестимулированный образец)), или факториальным увеличением числа pS6+ клеток в стимулированном образце, по сравнению с нестимулированным образцом с помощью расчета фактора стимуляции (% pS6+ (стимулированный образец) / % pS6+ (нестимулированный образец)). Результаты тестирования точности оценивали для обоих данных определений порога, и они обобщены в Таблице 10 и Таблице 11. Результаты по «аналитик 2, день 1» опускали, поскольку они возможно являлись выбросами, и результаты по «аналитик, день 2» опускали там, где повторные нестимулированные образцы не анализировали, как подробно описано в разделе «Отклонение 2».
Пример 10 - Отклонения от протокола валидации
Имело место два отклонения от протокола валидации.
Отклонение 1
CO2-инкубатор, используемый при квалификации, не проходил IQOQPQ. Температуру инкубатора и CO2 контролировали во время действий по квалификации анализа с использованием показаний на инкубаторе. Кроме того, температуру и CO2 контролировали с использованием откалиброванного термометра и датчика температуры, и набора Fyrite перед и после действий по квалификации анализа. Все показания температуры и CO2 находились в пределах требуемых эксплуатационных нормативов для инкубатора, и клетки стимулировали и они экспрессировали pS6, что указывало на то, что условия эксплуатации инкубатора были целесообразными. Таким образом, данное отклонение не оказывало влияния на качество или целостность данных.
Отклонение 2
Аналитик 2 имел недостаточное количество клеток для получения двух наборов повторных образцов для промежуточной сходимости на день 2. Двойной набор нестимулированных клеток для FC и альфа-бета TCR+ клеток исключали. Дублированные стимулированные клетки получали с 300 мкл образца на пробирку, и соответственно регулировали объем антитела, используемого для окрашивания клеточной поверхности. Общую оценку промежуточной сходимости проводили с использованием n=10 образцов для нестимулированных клеток и n=12 образцов для стимулированных клеток. Таким образом, данное отклонение не оказывало влияния на качество или целостность данных.
Пример 11 - Обсуждение и краткое изложение
Результаты квалификационных испытаний продемонстрировали, что антитело против pS6, используемое в анализе активности phosflow, было избирательным. Антитело pS6AF647 демонстрировало положительный пик с разделением флуоресценции более чем 1 log порядок, по сравнению с популяцией pS6- клеток в том же образце. Фосфорилирование pS6 увеличивалось во всех стимулированных образцах, по сравнению с нестимулированным контролем. Способность выявлять FC и альфа-бета TCR+ клетки не ухудшалась в результате процедуры внутриклеточного окрашивания phosflow, таким образом фосфорилирование pS6 количественно оценивали в данных двух клеточных субпопуляциях. Эти данные указывают на то, что клоны антител, конъюгированных с флуорохромом, которые распознают специфичные антигены клеточной поверхности и pS6, можно использовать в сочетании с анализом активности pS6 phosflow.
Анализ pS6 phosflow продемонстрировал внутрианалитическую сходимость 4,8% CV и 0,8% CV для образцов панели нестимулированных и стимулированных FC, соответственно, и 18,7% CV и 1,4% CV для образцов панели нестимулированных и стимулированных альфа-бета TCR+ клеток, соответственно. Эти данные находились в пределах критериев приемлемости меньше/равно 30% CV. Промежуточная сходимость, измеренная двумя аналитиками с использованием двух цитометров, за два дня, составляла 52,4% CV и 17,9% CV для нестимулированных и стимулированных FC, соответственно, и 36,2% CV и 14,2% CV для нестимулированных и стимулированных альфа-бета TCR+ клеток, соответственно. Отсутствовали критерии приемлемости для промежуточной сходимости, и приведены первоначальные данные. Однако, авторы изобретения действительно наблюдали результаты с более низким % pS6+ в случае «аналитик 2, день 1» тестирования точности, по сравнению с результатами вариантов «аналитик 1, дни 1 и 2» и «аналитик 2, день 2». Определяли, что это было обусловлено недостаточным ресуспендированием клеток во время стадии окрашивания pS6 и указывает на то, что существуют решающие стадии в процедуре анализа, которые могут способствовать вариабельности результатов анализа. Несмотря на то, что промежуточная сходимость была высокой в случае нестимулированных образцов (36,2% - 52,4% CV), стимулированные образцы демонстрировали промежуточную сходимость от 14,2% CV до 17,9% CV. Это характеризует одну партию конечного продукта FCRx, и вариабельность результатов анализа нужно будет дополнительно оценивать с использованием дополнительных партий конечного продукта для определения общей вариабельности среди доноров и способов изготовления, а также вариабельности, которая может быть внесена во время процедуры оттаивания криоконсервированных тестируемых образцов.
Анализ демонстрировал линейность, исходя из коэффициента корреляции больше/равно 0,90, CV повторностей меньше/равно 30% и выделения в пределах плюс/минус 30% ожидаемого значения вплоть до 0,56% pS6+ клеток. Верхняя граница линейности зависела от относительной частоты отдельной популяции pS6+ клеток, присутствующих в материале квалификационного испытания, которая составляла 62,10% pS6+ клеток в случае тестирования линейности. Вследствие этого, можно предположить, что конечный продукт с частотами встречаемости pS6+ клеток выше, чем у конечного продукта, тестируемого в данной квалификации, также демонстрировал бы приемлемую линейность, поскольку более высокие частоты событий показывают статистически более низкую вариабельность. Таким образом, линейность и диапазон, как можно предположить, составляют от 0,56% pS6+ клеток вплоть до 100% pS6+ клеток. Линейность оценивали только с использованием панели FC, так как данная субпопуляция обычно имеет более низкую частоту событий, чем альфа-бета TCR+ клетки, таким образом, представляет более строгую оценку линейности анализа. Таким образом, эти данные будут использоваться для применения критериев линейности фосфорилирования pS6 как в FC, так и в альфа-бета TCR+ клетках.
Поскольку в продаже отсутствовали контрольные клетки для оценки точности pS6+ клеток, точность оценивали по ожидаемому выделению клеток, определяемому во время тестирования линейности. Неразбавленный образец pS6+ клеток имел 62,10% pS6+ клеток и, вследствие этого, как предполагалось, являлся номинальной величиной. Фактическое выделение pS6+ клеток из серии последовательных разведений сравнивали с ожидаемым результатом, и определяли точность измерений. На основе результатов по линейности точность в пределах плюс/минус 30% номинала, как было показано, составляла вплоть до 0,56% pS6+ FC, что стало установленным LOQ анализа. Таким образом, эти данные указывают на то, что способ является точным для выявления pS6+ FC и альфа-бета TCR+ клеток.
Стабильность образцов тестировали для образцов, которые хранили в холодильнике в течение ночи в буфере красителя BD, и также для образцов, которые хранили в фиксаторе клеток (2% параформальдегид). Все клетки фиксировали после стадии окрашивания поверхности и стимуляции в процедуре окрашивания pS6, но данная оценка устойчивости оценивала хранение конченого образца в буфере красителя BD в соответствии со способом или хранение в фиксаторе 2% параформальдегид. Для образцов FC, которые хранили в фиксаторе, 15-минутная фиксация приводила к потере pS6+ клеток на вплоть до 31,3%, по сравнению с образцом, хранящимся в буфере красителя BD. Однако, последующее хранение образца в холодильнике в течение 21 ч показывало отсутствие дополнительной потери pS6+ клеток. Для образцов, хранящихся в холодильнике в буфере красителя BD, потеря составляла 51,1% и 1,3% pS6+ клеток в образцах нестимулированных и стимулированных FC, соответственно. Образцы альфа-бета TCR+ клеток, хранящиеся в буфере красителя BD, показывали потерю вплоть до 6,15% pS6+ клеток после хранения в течение 21 ч в буфере красителя BD. Эти данные указывают на то, что образцы анализа pS6 phosflow нужно запускать на проточном цитометре в день получения.
Порог активности оценивали посредством сравнения % pS6+ клеток в стимулированном образце с % pS6+ клеток в нестимулированном образце и для FC, и для альфа-бета TCR+ клеток. FC демонстрировали обще увеличение % pS6+ клеток 49,75% после стимуляции и факториальное увеличение 2,89. Альфа-бета TCR+ клетки демонстрировали общее увеличение % pS6+ клеток 76,68% после стимуляции, и факториальное увеличение 17,78. Для партии тестируемого конечного продукта FCRx альфа-бета TCR+ клетки демонстрировали более высокий уровень pS6+ фосфорилирования после стимуляции, по сравнению с FC, указывая на то, что для каждого типа клеток будет требоваться особые критерии для порога активности. В квалификации анализа использовали только одну партию конечного продукта FCRx, и среди разных флаконов одной и той же партии при оттаивании и анализе наблюдали некоторую вариабельность, а так же вариабельность среди аналитиков. Таким образом, следующие пороги активности (Таблица 12) предложены, исходя из данных данной квалификации, и они будут дополнительно оцениваться и уточняться с использованием подлежащих сбору данных из анализа дополнительных партий конечного продукта FCRx, из научных исследований, производства для клинических исследований фазы II и валидации анализа.
Данный способ оценки активности FC и альфа-бета TCR+ клеток в конечном продукте FCRx считается аттестованным. Анализ является избирательным, точным и со сходимостью результатов, с пределом количественного определения 0,56% pS6+ клеток и диапазоном 0,56% - 100% pS6+ клеток. Образцы нужно анализировать в день получения.
Пример 12 - Клиническое применение
Криофлаконы с конечным продуктом подвергали оттаиванию, и для определения функциональности или активности Т-клеток и FC в конечном продукте использовали анализы активности. Данные результаты коррелировали с анализами жизнеспособности клеток, проводимыми с использованием 7AAD и трипанового синего.
Следует понимать, что в то время, как способы и композиции изобретения описаны в данном документе в связи с целым рядом разных аспектов, приведенное выше описание разных аспектов предназначено для иллюстрации, а не ограничения объема данных способов и композиций изобретения. Другие аспекты, преимущества и модификации находятся в пределах объема следующей формулы изобретения.
Раскрыты способы и композиции, которые могут быть использованы для, могут быть использованы в связи с, могут быть использованы в получении для или представляют собой продукты раскрытых способов и композиций. В данном документе раскрыты данные и другие материалы, и следует понимать, что раскрыты комбинации, подмножества, взаимодействия, группы и т д. данных способов и композиций. То есть, в то время, как конкретная ссылка на каждую из разнообразных отдельных и объединенных комбинаций и преобразований данных композиций и способов не может быть прямо раскрыта, каждая конкретно рассмотрена и описана в данном документе. Например, если раскрыта и обсуждается конкретная композиция изобретения или конкретный способ, и обсуждается целый ряд композиций или способов, все до единой комбинации и преобразования композиций и способов конкретно рассматриваются, если особо не указано обратное. Аналогично, любое их подмножество или комбинация также конкретно рассмотрена и раскрыта.
Группа изобретений относится к определению активности терапевтической клеточной композиции. Раскрыт способ определения активности образца, содержащего вспомогательные клетки (FC) и/или альфа-бета TCR+ T-клетки, включающий приведение образца, содержащего FC и/или альфа-бета TCR+ T-клетки, в контакт с митогенным стимулом; и определение числа FC и/или альфа-бета TCR+ T-клеток в образце, в которых рибосомный белок S6 фосфорилирован (pS6); где число FC и/или альфа-бета TCR+ T-клеток в образце, в которых pS6 фосфорилирован, характеризует активность FC и/или альфа-бета TCR+ T-клеток, соответственно, в образце, где способ осуществляют перед замораживанием FC и/или альфа-бета TCR+ T-клеток или осуществляют на FC и/или альфа-бета TCR+ T-клетках, которые были заморожены. Также раскрыты способ определения терапевтической дозы FC и/или альфа-бета TCR+ Т-клеток с использованием указанного способа определения активности и изделие для осуществления указанного способа определения активности. Группа изобретений обеспечивает быстрый и количественный способ оценивания активности терапевтической клеточной композиции. 3 н. и 12 з.п. ф-лы, 5 ил., 12 табл., 12 пр.
1. Способ определения активности образца, содержащего вспомогательные клетки (FC) и/или альфа-бета TCR+ T-клетки, включающий:
- приведение образца, содержащего FC и/или альфа-бета TCR+ T-клетки, в контакт с митогенным стимулом; и
- определение числа FC и/или альфа-бета TCR+ T-клеток в образце, в которых рибосомный белок S6 фосфорилирован (pS6),
где число FC и/или альфа-бета TCR+ T-клеток в образце, в которых pS6 фосфорилирован, характеризует активность FC и/или альфа-бета TCR+ T-клеток, соответственно, в образце,
где способ осуществляют перед замораживанием FC и/или альфа-бета TCR+ T-клеток или осуществляют на FC и/или альфа-бета TCR+ T-клетках, которые были заморожены.
2. Способ по п. 1, в котором образец содержит от 100000 до 2000000 FC и/или альфа-бета TCR+ T-клеток.
3. Способ по п. 1, в котором митогенный стимул выбран из группы, состоящей из форбол-12-миристат-13-ацетата (PMA) с иономицином, фитогемагглютинина (PHA), конканавалина A (conA) и митогена лаконоса (PWM).
4. Способ по п. 1, в котором образец приводят в контакт с митогенным стимулом в течение периода времени от 5 мин до 60 мин.
5. Способ по п. 1, в котором образец приводят в контакт с митогенным стимулом в течение периода времени от 20 мин до 30 мин.
6. Способ по п. 1, в котором число FC и/или альфа-бета TCR+ T-клеток в образце, в которых pS6 фосфорилирован, определяют с использованием флуоресцентно-меченого антитела против pS6.
7. Способ по п. 6, в котором связывание флуоресцентно-меченого антитела выявляют с использованием FACS (сортировка клеток с активированной флуоресценцией).
8. Способ по п. 1, в котором по меньшей мере 30% FC в образце представляют собой pS6+.
9. Способ по п. 1, в котором по меньшей мере 30% альфа-бета TCR+ T-клеток в образце представляют собой pS6+.
10. Способ определения терапевтической дозы FC и/или альфа-бета TCR+ T-клеток, включающий:
предоставление образца клеток, содержащего FC и/или альфа-бета TCR+ T-клетки;
определение активности данного образца клеток способом по п. 1,
где активность образца клеток указывает на терапевтическую дозу FC и/или альфа-бета TCR+ T-клеток.
11. Изделие для осуществления способа по п. 1, содержащее антитело против фосфорилированной формы pS6 и антитело против альфа-бета T-клеточного рецептора (TCR).
12. Изделие по п. 11, дополнительно содержащее митогенный стимул.
13. Изделие по любому из пп. 11, 12, дополнительно содержащее по меньшей мере одну флуоресцентную метку.
14. Изделие по любому из пп. 11-13, дополнительно содержащее по меньшей мере одну флуоресцентную метку для каждого антитела.
15. Изделие по п. 14, в котором каждая из по меньшей мере одной флуоресцентной метки для каждого антитела отличима от другой.
| SALMOND R.J | |||
| et al | |||
| MAPK, Phosphatidylinositol 3-Kinase, and Mammalian Target of Rapamycin Pathways Converge at the Level of Ribosomal Protein S6 Phosphorylation to Control Metabolic Signaling in CD8 T Cells // The Journal of Immunology, 2009, V.183, pp.7388-7397 | |||
| US 8242248 B2, 14.08.2012 | |||
| YU J | |||
| et al | |||
| Regulation of T-cell activation and |
Авторы
Даты
2022-07-12—Публикация
2018-03-06—Подача