Область техники
Настоящее изобретение относится в целом к обработке электрофизиологических сигналов и данных абляции и, в частности, к оптимизации параметров абляции сердца с помощью машинного обучения (ML).
Уровень техники
Способы и системы для планирования и направления процедуры абляции на основании данных пациента при лечении сердечной аритмии были ранее описаны в патентной литературе. Например, в патенте США № 9463072 описан способ и система специфического для пациента планирования и направления электрофизиологических вмешательств. Специфическую для пациента анатомическую модель сердца получают на основе данных визуализации сердца пациента. Специфическую для пациента электрофизиологическую модель сердца получают на основании специфической для пациента анатомической модели сердца и электрофизиологических измерений у пациента. Виртуальные электрофизиологические вмешательства выполняют с использованием специфической для пациента электрофизиологической модели сердца. Вычисляют имитированный сигнал электрокардиограммы (ЭКГ) в ответ на каждое виртуальное электрофизиологическое вмешательство. В вариантах осуществления изобретения используют усовершенствованные алгоритмы машинного обучения, методику LBM-EP (метод решеточных уравнений Больцмана для электрофизиологии) для моделирования электрофизиологии сердца в режиме, приближенном к реальному времени, и модель генерирования сигналов ЭКГ для прогнозирования и отображения специфических для пациента электрокардиограмм после виртуальных электрофизиологических (ЭФ) способов терапии.
В качестве другого примера, в патенте США № 9277970 описан способ и система специфического для пациента планирования и направления процедуры абляции при сердечной аритмии. Специфическую для пациента анатомическую модель сердца получают на основе данных о предоперационной визуализации сердца. Специфическую для пациента анатомическую модель сердца привязывают к системе координат интраоперационной визуализации, получаемой во время процедуры абляции. Генерируют одну или более направляющих карт участка абляции на основе привязанной специфической для пациента анатомической модели сердца и специфичных для пациента интраоперационных измерений в ходе процедуры абляции. Направляющие карты участка абляции могут включать в себя диффузионные карты миокарда и карты длительности потенциалов действия. Направляющие карты участка абляции генерируют с использованием вычислительной модели электрофизиологии сердца, которая персонализирована путем подгонки параметров модели электрофизиологии сердца с использованием специфических для пациента интраоперационных измерений. Направляющие карты участка абляции отображаются устройством отображения во время процедуры абляции. В одном варианте осуществления привязка специфической для пациента анатомической модели сердца к интраоперационному трехмерно-ротационному ангиографическому изображению, полученному во время процедуры абляции, включает в себя расчет вероятностной карты перикарда сердца на трехмерном ротационном ангиографическом изображении с использованием алгоритма машинного обучения.
Сущность изобретения
В варианте осуществления настоящего изобретения, описанном ниже в настоящем документе, предложена система, включающая в себя интерфейс и процессор. Интерфейс выполнен с возможностью приема данных, характеризующих первоначальную операцию абляции, применяемую к области сердца пациента. Процессор выполнен с возможностью автоматического задания, на основании полученных данных, если это необходимо, дополнительной операции абляции для применения к данной области.
В некоторых вариантах осуществления процессор выполнен с возможностью задания дополнительной абляции путем оценки качества первоначальной операции абляции и задания дополнительной операции абляции в случае обнаружения того, что качество первоначальной операции абляции не соответствует критерию качества.
В некоторых вариантах осуществления данные, характеризующие первоначальную операцию абляции, включают в себя по меньшей мере одно из глубины повреждения; радиуса повреждения; большой оси повреждения; малой оси повреждения; трехмерного положения повреждения; анатомического положения повреждения; и площади поверхности повреждения.
В одном варианте осуществления процессор выполнен с возможностью указания местоположения для повторной абляции при задании дополнительной операции абляции.
В другом варианте осуществления процессор выполнен с возможностью указания зазора в участке точек абляции при задании дополнительной операции абляции.
В еще одном варианте осуществления процессор выполнен с возможностью указания в режиме реального времени того, что дополнительную абляцию необходимо выполнять в непосредственной близости к участку точек абляции при задании дополнительной операции абляции.
В некоторых вариантах осуществления процессор дополнительно выполнен с возможностью указания значений одного или более параметров абляции для применения в дополнительной абляции при задании дополнительной операции абляции.
В некоторых вариантах осуществления данные, характеризующие первоначальную операцию абляции, включают в себя по меньшей мере одно из сигнала электрокардиограммы (ЭКГ) с поверхности тела; изменения сигнала ЭКГ с поверхности тела; внутрисердечного сигнала ЭКГ; изменения внутрисердечного сигнала ЭКГ; импеданса абляционного электрода; изменения импеданса абляционного электрода; температуры подвергнутой абляции ткани; изменения температуры подвергнутой абляции ткани; усилия, действующего на подвергнутую абляции ткань; изменения усилия, действующего на подвергнутую абляции ткань; типа абляционного катетера; трехмерного местоположения точки абляции; прогнозируемого анатомического местоположения точки абляции; продолжительности абляции в точке абляции; скорости орошения; мощности, подаваемой во время абляции.
В других вариантах осуществления данные, характеризующие первоначальную операцию абляции, включают в себя одно или оба из изменения ультразвукового отражения ткани, подвергнутой абляции, и изменения магнитно-резонансного изображения (МРТ) подвергнутой абляции ткани.
В некоторых вариантах осуществления процессор выполнен с возможностью автоматического задания дополнительной операции абляции путем применения обученной модели машинного обучения (ML).
В одном варианте осуществления ML-модель включает в себя по меньшей мере одно из автокодировщика, вариационного автокодировщика, общей состязательной сети (GAN), случайного леса (RF), контролируемого ML и ML с подкреплением.
В соответствии с другим вариантом осуществления настоящего изобретения дополнительно предложен способ, включающий прием данных, характеризующих первоначальную операцию абляции, примененную к области сердца пациента. Дополнительную операцию абляции, если ее применение к области сочтено необходимым, процессор задает автоматически на основании полученных данных.
Краткое описание чертежей
Настоящее изобретение станет более понятным из следующего подробного описания вариантов осуществления, представленных вместе со следующими чертежами, на которых:
Фиг. 1 - схематическая наглядная иллюстрация катетерной системы абляции с электрофизиологическим (ЭФ) отслеживанием, анализом сигнала и необратимой электропорацией (IRE) в соответствии с примером осуществления настоящего изобретения;
Фиг. 2 - алгоритм глубокого обучения для оценки повреждения, основанный на автокодировщике и случайном лесе (RF), в соответствии с примером осуществления настоящего изобретения;
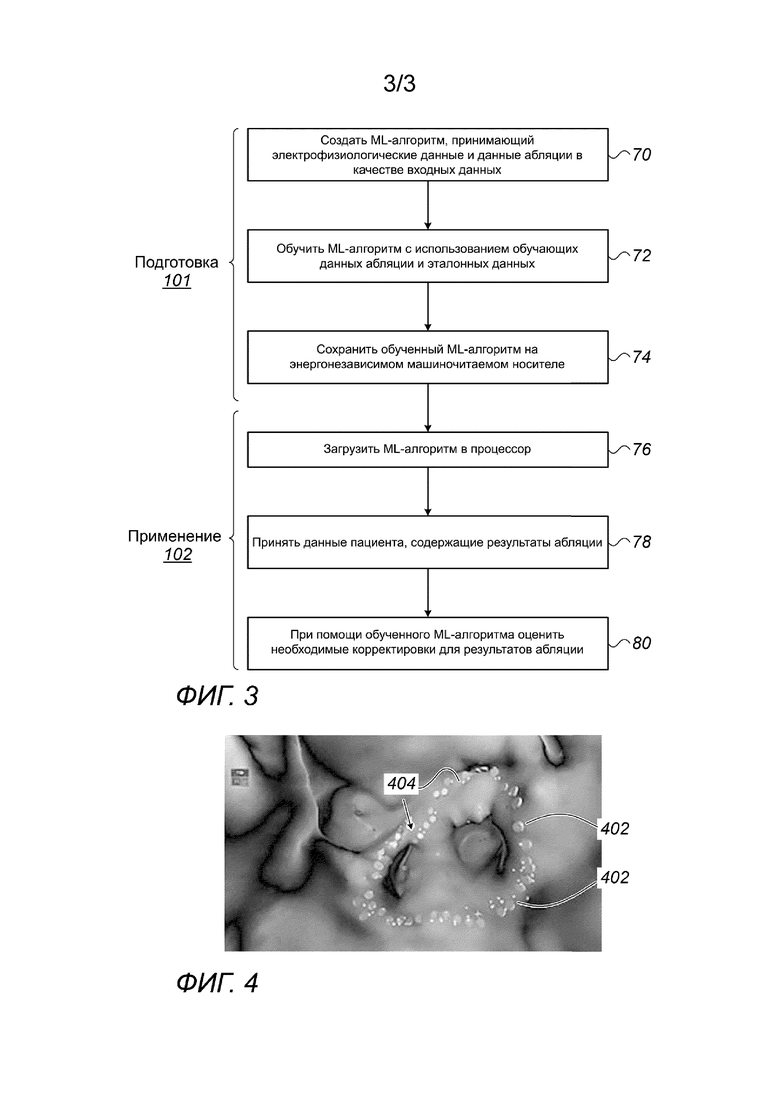
Фиг. 3 - блок-схема обучения и применения для формирования логического заключения модели машинного обучения (ML), предназначенной для оценки и коррекции результатов абляции в соответствии с альтернативными примерами осуществления настоящего изобретения; и
Фиг. 4 - снимок экрана визуализации изоляции легочных вен (PVI), спланированной с использованием ML-модели, показанной на Фиг. 3, в соответствии с примером осуществления настоящего изобретения.
Подробное описание вариантов осуществления изобретения
Общее описание
Абляция сердца является распространенной процедурой, которую применяют для лечения аритмий путем формирования повреждений в сердечной ткани пациента. Такие повреждения могут быть образованы с помощью необратимой электропорации (IRE) или с использованием других типов абляционной энергии, таких как радиочастотная (РЧ) энергия, и оба этих варианта могут быть применены с помощью катетера. При IRE-абляции катетер передвигают таким образом, чтобы электроды, расположенные на дистальном конце катетера, вошли в контакт с тканью. Впоследствии между электродами подаются биполярные импульсы высокого напряжения, и сильные импульсы электрического поля, генерируемые в ткани, вызывают гибель клеток и формирование повреждения. При РЧ-абляции к ткани подают переменный РЧ-ток с помощью одного или более электродов, что вызывает гибель клеток под воздействием тепла.
Как правило, во время процедуры абляции в камере сердца для коррекции аритмии важно добиться, чтобы абляционное повреждение было как непрерывным, так и трансмуральным (имело достаточную глубину). Отсутствие любой из характеристик обычно приводит к «утечкам» волнового фронта через ткань, подвергнутую абляции. Для проверки на наличие утечек, например, при процедуре изоляции легочной вены (PVI), врач выполняет стимуляцию (т. е. подает сигнал) в сердце с одной стороны абляционной линии так, чтобы стимулировать сердце, и проверяет, присутствует ли сигнал на другой стороне. Если сигнал не появляется, то, как и предполагалось, была достигнута электрическая изоляция. Однако если сигнал появляется, то врач, как правило, добавляет точки абляции.
Можно измерять такие параметры, как индекс непрерывности абляционной линии (ACLI) для оценки непрерывности и трансмуральности абляционной линии. Однако такие параметры можно оценивать только после завершения процедуры абляции, так что PVI можно проверять только после формирования всей петли.
Таким образом, типичный текущий рабочий процесс может иметь следующие стадии:
1. первая «абляционная петля» изоляции легочной вены;
2. проверка посредством стимулирования;
3. абляция ткани для закрытия зазора на основании результатов стимуляции; и/или
2. проверка при помощи лекарственных средств, например, аденозина, который инициирует аритмию;
3. абляция ткани для закрытия зазора.
Следует понимать, что стадия 2 с провокационным введением аденозина, описанная выше, не может быть реализована в повседневной клинической работе, поскольку ее, как правило, используют в исследовательской среде.
Даже если во время операции будет достигнута изоляция, аритмия может вернуться позже. В этом случае может потребоваться «переделка» процедуры.
В вариантах осуществления настоящего изобретения, описанных ниже в настоящем документе, предложены системы и способы машинного обучения (ML) для прогнозирования успешности процедуры абляции сердца на основании информации, полученной в процессе лечения (например, полученной с помощью самого абляционного катетера), как описано ниже. Прогнозирования достигают путем оценки (i) в некоторых вариантах осуществления - свойств повреждения, например, уровня трансмуральности повреждения, и (ii) в других вариантах осуществления - уровня непрерывности и трансмуральности повреждения при абляции. Последние варианты осуществления могут дать врачу направляющие указания в режиме реального времени, в случае необходимости в дополнительных точках абляции.
В некоторых вариантах осуществления процессор принимает данные, которые характеризуют первоначальную операцию абляции, примененную к области сердца пациента. Процессор автоматически задает, на основании полученных данных, если это необходимо, дополнительную операцию абляции для применения к данной области. Например, процессор оценивает качество первоначальной операции абляции, и при обнаружении того, что качество первоначальной операции абляции не соответствует критерию качества (например, достижению непрерывности и/или трансмуральности), задает дополнительную операцию абляции.
Варианты осуществления настоящего изобретения можно использовать для предоставления рекомендации по очаговому источнику и шаблонам повторяющейся активации (RAP). Варианты осуществления настоящего изобретения также можно использовать для предоставления оценки качества абляции и «оптимальной» стратегии абляции стойких стимуляторов фибрилляции предсердий (AF), носителей RAP, очагов и фиброзной ткани.
В одном варианте осуществления настоящего изобретения генерируют модель машинного обучения (ML), такую как искусственная нейронная сеть (ANN). ANN-модель обучают с использованием данных первоначальной абляции, содержащих сигналы электрокардиограммы (ЭКГ) с поверхности тела, сигналы внутрисердечной ЭКГ (всЭКГ) (также называемые электрограммами (ЭГ)), информацию о трехмерном местоположении для собранных данных, а также параметры абляции, которые включают в себя мощность, используемую для абляции, продолжительность абляции, температуру, измеренную во время абляции, и импеданс катетерного электрода, через который выполняют абляцию. Другие параметры, используемые для обучения модели, включают в себя, без ограничений, используемый катетер, усилие, измеренное катетером, и изменения параметров, таких как температура и импеданс. После создания модели значения по меньшей мере некоторых из этих параметров используются моделью, чтобы прийти к результатам, формируемым моделью.
В некоторых вариантах осуществления для обучения используют эталонные данные, полученные на основе клинических и доклинических обучающих данных абляции. Такие данные могут включать в себя фактические параметры повреждения, полученные для диапазона абляционных мощностей, включая такие параметры, как площадь поверхности и глубина некроза ткани.
При выполнении абляции у нового пациента процессор, используя ML-модель, оценивает абляционное повреждение, например, его радиус и глубину, и сообщает эту информацию врачу. Значения, как правило, выводятся на графический пользовательский интерфейс (GUI), который также может обеспечивать визуализацию абляции.
В других вариантах осуществления изобретения обученная ML-модель после первой абляционной петли идентифицирует места, которые являются потенциальными кандидатами для «переделки» абляции.
Кроме этого, непосредственно перед и/или во время новой абляции процессор может использовать модель, чтобы, используя данные об абляции (т. е. любые данные, полученные во время процедуры абляции) для конкретного пациента, спрогнозировать уровни непрерывности и трансмуральности абляции.
Использование описанных выше ML-моделей позволяет врачу сократить затраты времени на процедуру по сравнению таковыми для текущего рабочего процесса путем прогнозирования результатов процедур абляции. Модели позволяют врачу создавать эффективную изоляцию при помощи абляционной линии, т. е. линии, имеющей высокую оценку непрерывности и трансмуральности при первом проведении процедуры абляции. Таким образом, использование моделей позволяет упростить, ускорить и повысить эффективность процесса по сравнению с системами предшествующего уровня техники.
Хотя в настоящем документе в качестве примера использована ANN-модель, специалист в данной области может выбирать из других доступных для применения ML-моделей, таких как обучение по дереву решений, машины опорных векторов (SVM) и Байесовские сети. ANN-модели включают в себя, например, сверточную нейронную сеть (CNN), автокодировщик и вероятностную нейронную сеть (PNN). Как правило, один или более используемых процессоров (совместно называемые здесь и далее «процессор») программируют в программном обеспечении, содержащем конкретный алгоритм, который позволяет процессору выполнять каждую из описанных выше стадий и функций, указанных выше. Как правило, обучение осуществляют с использованием вычислительной системы, содержащей множество процессоров, таких как графические процессоры (GPU) или тензорные процессоры (TPU). Однако любой из этих процессоров также может представлять собой центральный процессор (ЦП).
Возможность оценки в режиме реального времени параметров абляционного повреждения (например, диаметра, глубины), а также непрерывности и трансмуральности на основании ограниченных данных, описанных выше, для формирования логического вывода ML-алгоритмом, позволяет легко оценивать качество абляционного лечения, может обеспечивать более точный профиль абляции и, как правило, улучшение результатов процедуры абляции.
Описание системы
На Фиг. 1 представлена схематическая наглядная иллюстрация катетерной системы 20 абляции с электрофизиологическим (ЭФ) отслеживанием, анализом сигнала и необратимой электропорацией (IRE) в соответствии с вариантом осуществления настоящего изобретения. Система 20 может представлять собой, например, систему CARTO® 3 производства компании Biosense-Webster, г. Ирвайн, штат Калифорния, США. Как показано, система 20 содержит катетер 21, имеющий ствол 22, который врач 30 вводит в сердце 26 (врезка 25) пациента 28. На изображенном примере врач 30 вводит ствол 22 через оболочку 23, манипулируя стволом 22 с помощью манипулятора 32, находящегося рядом с проксимальным концом катетера.
В варианте осуществления, описанном в настоящем документе, катетер 21 может быть использован для любой приемлемой диагностической цели и/или абляции ткани, например, для электрофизиологического картирования сердца 26 и IRE-абляции соответственно. Устройство 35 для регистрации ЭКГ может принимать различные виды сигналов ЭКГ, регистрируемых системой 20 в ходе процесса.
Как показано на врезке 25, дистальный конец ствола 22 катетера 21 оснащен многоэлектродным корзинчатым катетером 40. На врезке 45 показана конструкция множества электродов 48 корзинчатого катетера 40. Проксимальный конец катетера 21 соединен с пультом 24 управления для передачи, например, электрограмм, полученных с электродов 48.
Пульт 24 управления содержит процессор 41, как правило, компьютер общего назначения, с соответствующими схемами 38 входного каскада и интерфейса для приема ЭФ-сигналов (например, сигналов ЭКГ), а также отличных от ЭФ-сигналов (таких как сигналы положения) от электродов 48 катетера 21. Для этого процессор 41 соединен с электродами 48 посредством проводов, проходящих внутри ствола 22. Схемы 38 интерфейса дополнительно выполнены с возможностью приема сигналов ЭКГ, например, от многоканального (например, в 12 отведениях) устройства для регистрации ЭКГ, которое может представлять собой устройство 35 для регистрации ЭКГ, а также сигналов, отличных от ЭКГ, от электродов 49 на поверхности тела. Как правило, электроды 49 прикрепляют к коже грудной клетки и ног пациента 28. Процессор 41 соединен с электродами 49 при помощи проводов, проходящих через кабель 39 для приема сигналов от электродов 49.
Четыре электрода 49 на поверхности тела обозначены в соответствии со стандартными протоколами ЭКГ: MA (правая рука), LA (левая рука), ML (правая нога) и LL (левая нога). Центральная терминаль Уилсона (WCT) может быть образована при помощи трех из четырех указанных электродов 49 на поверхности тела, и результирующий сигнал ЭКГ, VWCT, принимают схемы 38 интерфейса.
Во время процедуры ЭФ-картирования местоположения электродов 48 отслеживают, когда они находятся в сердце 26 пациента. Для этого электрические сигналы пропускают между электродами 48 и электродами 49 на поверхности тела. На основании этих сигналов и с учетом известных положений электродов 22 на теле пациента процессор 41 рассчитывает оценочное местоположение каждого электрода 22 внутри сердца пациента. Такое отслеживание может быть выполнено с использованием системы активной токовой локализации (ACL) производства компании Biosense-Webster (г. Ирвайн, штат Калифорния, США), которая описана в патенте США № 8456182, описание которого включено в настоящий документ путем ссылки.
Таким образом, процессор может связывать любой заданный сигнал, полученный от электродов 48, такой как ЭГ, с местоположением, в котором был получен этот сигнал. Процессор 41 использует информацию, содержащуюся в данных сигналах, для построения ЭФ-карты, такой как карта локального времени активации (LAT), для отображения на дисплее. В показанном варианте осуществления процессор 41 оценивает непрерывность и трансмуральность повреждений, формируемых системой абляции, с помощью алгоритма, включающего ML-алгоритм, примененный к ЭФ и другим данным (например, скорости орошения), как описано применительно к Фиг. 2 и 3.
Для выполнения IRE-абляции электроды 48 соединены (например, коммутированы) с генератором 47 импульсов IRE, содержащим управляемую процессором схему переключения (например, ряд реле, не показан) в пульте 24 управления. Используя оценки, обеспеченные описанной методикой, такие как уровень непрерывности абляции, процессор 41 или врач может выбирать, какие электроды следует подключать к генератору 37 импульсов для подачи IRE-импульсов (посредством схемы переключения).
В ходе IRE-абляции, описанные ниже данные первоначальной абляции можно использовать при формировании логического заключения при помощи одной из приведенных выше ML-моделей для дополнительной оценки (например, в режиме реального времени) параметров повреждений, как описано применительно к Фиг. 2, а также непрерывности и трансмуральности группы повреждений.
Для выполнения описанных в настоящем документе функций на процессоре 41, как правило, установлено программное обеспечение. Программное обеспечение может быть загружено в процессор в электронном виде, например, передано по сети, или альтернативно или дополнительно может быть предоставлено и/или может храниться на энергонезависимом материальном носителе, таком как магнитное, оптическое или электронное запоминающее устройство. В частности, процессор 41 выполняет специальный алгоритм, описанный в настоящем документе и показанный, например, на Фиг. 3, благодаря которому процессор 41 выполняет стадии, дополнительно описанные ниже.
Направляемая абляция сердца с использованием ML
На Фиг. 2 представлена иллюстрация работы модели машинного обучения (ML) в соответствии с примером осуществления настоящего изобретения. Модель построена на основе случайного леса регрессионных деревьев, основанных на обучающих данных абляции, описанных ниже. Классификатор 204 случайного леса представляет собой комитет деревьев решений, в котором на каждое дерево решений подают подсовокупность атрибутов данных и делают прогноз на основании этой подсовокупности. Состояние фактических прогнозируемых деревьями решений значений учитывается при получении окончательных ответов 208 и 210 случайного леса. Классификатор случайного леса по существу уменьшает переобучение, которое присутствует в отдельном дереве решений, что приводит к гораздо более надежному и точному классификатору.
Модель основана на автокодировщиках с глубоким обучением, а также на случайном лесе регрессионных деревьев. Автокодировщики выполняют сокращение размерности до набора признаков u, который в дальнейшем служит в качестве пространства признаков для оценки повреждения.
Автокодировщик 202 содержит две части: кодировщик и декодировщик. Кодировщик картирует входной сигнал (в настоящем документе - сигнал ЭКГ и/или сигнал всЭКГ) в скрытое представление (u) посредством нелинейного преобразования. Затем декодировщик картирует скрытое представление обратно в реконструированные данные посредством другого нелинейного преобразования:

В вариантах осуществления настоящего изобретения для реконструкции ЭКГ и всЭКГ используют одну и ту же сетевую архитектуру. Функция нормализация L2 минимизирована, чтобы вывести набор весовых коэффициентов 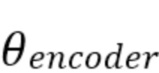 ,
,  для реконструкции всЭКГ (или ЭКГ с поверхности тела). Автокодировщик реализован с использованием полносвязанной сверточной нейронной сети (FCN) кодировщика и декодировщика с заранее заданным числом слоев. Затем выполняют регрессию с использованием случайного леса на основе закодированного представления u, параметров анамнеза (например, длительность фибрилляции предсердий, класс NYHA) пациента, демографических данных пациента (например, возраст, индекс массы тела (ИМТ)) и признаков абляции (например, мощность, температурный профиль), чтобы спрогнозировать глубину повреждения.
для реконструкции всЭКГ (или ЭКГ с поверхности тела). Автокодировщик реализован с использованием полносвязанной сверточной нейронной сети (FCN) кодировщика и декодировщика с заранее заданным числом слоев. Затем выполняют регрессию с использованием случайного леса на основе закодированного представления u, параметров анамнеза (например, длительность фибрилляции предсердий, класс NYHA) пациента, демографических данных пациента (например, возраст, индекс массы тела (ИМТ)) и признаков абляции (например, мощность, температурный профиль), чтобы спрогнозировать глубину повреждения.
В данном варианте осуществления в модели в качестве входного слоя пространства признаков абляции как входных данных случайного леса используют пространство признаков абляции. Пространством признаков абляции называются характеристики абляции (например, мощность, импеданс, падение импеданса, стабильность, индекс абляции и координаты x, y, z каждой точки абляции в сердечной ткани). Каждая точка абляции включает такие признаки, как временная последовательность с дискретизацией шестьдесят (60) раз в секунду, поэтому изменяющийся во времени характер каждой точки абляции также моделируется и служит частью пространства признаков абляции.
Анатомическая структура каждой точки абляции также является частью входного пространства модели. Например, если прогнозируется, что точка является частью правосторонней широкой циркулярной абляции (WACA), то ML-модель WACA будет причислять участки абляции к одному из следующих участков:
1. Правый нижний
2. Правый задний
3. Правый верхний
4. Правый передний
Для левосторонней WACA каждый участок абляции будет связан с одним из следующих участков:
1. Левый нижний
2. Левый задний
3. Левый передний
4. Левый верхний
5. Реберный
ML-модель, которая классифицирует участок абляции таким способом, представлена в предварительной заявке на патент № 63/059,060 под названием Automatic Segmentation of Anatomical Structures of Wide Area Circumferential Ablation Points, поданной 30 июля 2020 г., принадлежащей подателю настоящей заявки на патент.
Описанная модель выводит оценки площади 210 поверхности повреждения (в виде радиуса) и глубины 208 повреждения, и их применяет компьютерный процессор 206. В процессе работы процессор применяет к построенной модели алгоритм, включающий ввод данных из процедуры абляции и вывод оценок 208 и 210 повреждения.
В этом варианте осуществления используемые эталонные обучающие данные абляции получают из клинических и доклинических данных. Некоторые данные рассчитывают на основе операций со вскрытием грудной клетки in vivo, выполняемых у свиней и/или овец. При этих операциях у овец и свиней как в предсердиях, так и в желудочках создают повреждения с использованием диапазона мощностей для достижения различной глубины повреждения. Собирают данные по площади поверхности и глубине некроза ткани.
Кроме того, в случае с субъектами-людьми можно подавать энергию разной мощности для достижения различных значений глубины повреждения. Энергию, подаваемую как в предсердия, так и в желудочки, а также площадь поверхности и глубину некроза можно измерять с помощью ультразвука/МРТ (магнитно-резонансной томографии).
Как у субъектов-животных, так и у людей сбор обучающих данных абляции включает в себя сигналы ЭКГ и внутрисердечной ЭКГ, тип абляционного катетера (например, очаговый, лассо, корзинчатый, баллонный), трехмерное местоположение точек абляции, продолжительность абляции в каждой точке, использовалось ли орошение (и если да, скорость орошения), импеданс абляционного электрода, подаваемую мощность и температурный профиль, измеренный во время абляции. Дополнительные необязательные данные включают в себя внутрисердечную ультразвуковую визуализацию, внешнюю ультразвуковую визуализацию, КТ в реальном времени и МРТ в реальном времени.
Указанные выше данные используют в качестве входных данных для модели случайного леса регрессионных деревьев.
Как показано на Фиг. 2, модель оценивает глубину и площадь некроза ткани, используя два выходных узла, включая среднюю глубину повреждения и площадь поверхности повреждения в качестве радиуса повреждения. В альтернативном варианте осуществления генерируется модель с тремя выходными узлами, в которой площадь поверхности повреждения оценивают с использованием большой и малой осей эллипса.
Во всех вариантах осуществления оцененная площадь поверхности некроза после каждой абляции отображается в режиме реального времени.
На Фиг. 3 представлена блок-схема обучения и применения для формирования логического заключения модели машинного обучения (ML), предназначенной для оценки и коррекции результатов абляции в соответствии с альтернативными вариантами осуществления настоящего изобретения. В частности, варианты осуществления, описанные со ссылкой на Фиг. 3, помогают решить, требуется ли переделка абляции в сердечной камере и где ее следует делать.
В одном варианте осуществления алгоритма модель может быть использована после первой «абляционной петли» для идентификации потенциальных мест для переделки абляции, т. е. для повторной абляции.
В описанном варианте осуществления изобретения в модели применяют полносвязанную нейронную сеть с пространством признаков абляции в качестве входного слоя. Сеть имеет два скрытых слоя, содержащих блоки линейной ректификации (ReLU), и один выходной нейрон - вспомогательный двоичный первый классификатор - содержащий обозначение успеха или переделки абляции. Весовые коэффициенты в сети оценивают с использованием оптимизатора градиентного спуска для сведения к минимуму потерь из-за перекрестной энтропии.
В случаях, когда первый классификатор прогнозирует переделку, второй классификатор помечает повреждения с «малой глубиной» и «малой поверхностью» в качестве потенциальных мест для повторного выполнения абляции.
В другом варианте осуществления алгоритма, который активируется после нескольких абляций, но до завершения первого цикла PVI, алгоритм выявляет потенциальные зазоры в участке точек абляции, например, если существует сегмент из точек абляции на расстоянии 50 мм рядом друг с другом и одна из абляций имела малое падение импеданса, а катетер находится на расстоянии 20 мм от этого сегмента, то система уведомляет врача об этих потенциальных зазорах.
В еще одном варианте осуществления алгоритма система выдает уведомление «в режиме реального времени», как правило, во время абляции, если имеется потенциальный зазор в предыдущих абляциях или если необходимо выполнить дополнительную абляцию вблизи текущей точки абляции.
В дополнительном варианте осуществления алгоритма система указывает врачу, где находится следующая точка, в которой необходимо выполнить абляцию. Система также выводит используемые параметры абляции и их значения вплоть до завершения абляции. Как правило, алгоритм определяет, достигнуто ли завершение, и соответствующим образом уведомляет об этом врача.
Алгоритм в соответствии с одним представленным вариантом осуществления разделен на две части: подготовка 101 алгоритма и применение 102 алгоритма.
При подготовке алгоритма происходит процесс, который начинается со стадии 70 моделирования ML, с созданием ML-алгоритма для оценки результатов абляции. Такая модель может представлять собой, среди прочих вариантов, контролируемую ML-модель или ML-модель с подкреплением, вариационный автокодировщик и общую состязательную сеть (GAN). Модель принимает, наряду с другими входными данными, описанными ниже, ЭФ-данные и результаты абляции.
Затем, используя базу данных, содержащую обучающие данные абляции и эталонные данные, процессор обучает алгоритм на стадии 72 обучения ML-алгоритма.
В некоторых вариантах осуществления обучающие данные абляции для модели делятся на две категории: данные первых сеансов абляции, при которых достигнут немедленный успех, и данные первых сеансов абляции, при которых необходима процедура переделки (например, после обнаружения того, что качество первоначальной операции абляции не соответствует критерию качества, такому как достижение непрерывности).
В описанном варианте осуществления обучающие данные абляции могут включать в себя информацию, полученную в результате фактического лечения с помощью системы, такой как CARTO, например:
1. Тип абляционного катетера
2. Трехмерное местоположение точек абляции
3. Анатомическое местоположение точек абляции
4. Мощность, используемая для абляции
5. Продолжительность абляции в точке
6. Орошение
7. Стабильность катетера, т. е. усилие, прикладываемое к катетеру во время абляции
8. Параметры, относящиеся к области абляции для проверки трансмуральности абляции на основании «спрогнозированной» ширины ткани.
9. ЭКГ в 12 отведениях или любой тип поверхностной ЭКГ и всЭКГ
10. Реакция ткани, например, температура, изменение отражения ультразвука, уменьшение сигнала ЭКГ, изменение импеданса
11. Отдельные данные с внешних устройств, например, МРТ и/или УЗИ
12. Данные внешних устройств в сочетании с любыми элементами 1-10.
В альтернативном описанном варианте осуществления обучающие данные абляции могут включать в себя обучающие данные, основанные на изображениях, созданных с использованием системы CARTO® (или сходной системы). Такие изображения включают в себя:
1. Сгенерированные наборы изображений, основанные на различных картах CARTO: LAT, Voltage, VisiTag (например, шарообразный маркер на изображении, показанном на Фиг. 4. Размер и цвет шарика указывают на поданную мощность и время подачи) и т. д. для каждой из стадий операции (левые легочные вены, правые легочные вены) и для разных стадий абляции.
2. Изображения, полученные в нескольких фиксированных видах.
3. Начало обучения, включая изображения изоляции левой легочной вены и изоляцию правой легочной вены.
Вторая стадия обучения, включая изображения секции изоляции (части полной PVI).
4. Все изображения карт с одними и теми же видами, а также изображения для обучения, включая все способы окрашивания CARTO: карта напряжений, карты LAT, биполярные карты.
5. Изображения всех вариантов абляционных меток, которые обычно генерируют только для машинного обучения (включая стандартные карты CARTO VisiTag/SurPoints/Ablation Index и дополнительные карты, которые представляют другие параметры, такие как окрашивание шариков VisiTag на основании стабильности катетера во время абляции или окрашивание шариков VisiTag на основании любых других параметров, которые могут внести вклад в машинное обучение):
• Стандартные точки абляции CARTO
• Точки с цветовым градиентом в соответствии с любым из следующих параметров:
○ Поданная энергия
○ Усилие на катетере
○ Угол катетера
○ Предыдущее местоположение катетера
○ Абляционная мощность
○ Время абляции
○ Температура
○ Биполярное падение внутрисердечной электрограммы
○ Стабильность катетера
○ Дыхание во время абляции
○ Орошение
В любом из описанных вариантов осуществления коррекции первой петли PVI также можно использовать в обучающих данных. Эти коррекции могут включать следующее:
a. параметры дополнительных точек абляции, такие как тип абляционного катетера, трехмерное местоположение точек абляции, мощность, используемая для абляции, продолжительность абляции в точке, орошение, стабильность катетера, усилие на катетере, и/или:
b. изображения абляций, выполненных в качестве коррекции. Изображения могут включать в себя местоположение абляции и поданную энергию, если изображения получены сразу же после переделки абляции.
В дополнение к вышеописанным обучающим данным, для построения модели также используют эталонные данные, как показано на фигуре. Эталонные данные обычно основаны на больничных базах данных, и они могут быть разделены на две секции:
а. Немедленный успех, который определяют путем стимуляции и/или провокационного введения аденозина, в результате чего нет необходимости в последующем наблюдении на кратких сроках.
b. Успех при последующем наблюдении в течение 12 месяцев, который определяют путем анализа случаев переделок, случаев с информацией о последующем наблюдении и клиническими исследованиями, включающими последующее наблюдение.
В некоторых вариантах осуществления эталонные данные могут содержать критерии успеха по эффективности и критерии клинического успеха, определенные в исследовании PRECEPT авторами Mansour M, и др., озаглавленном Persistent atrial fibrillation ablation with contact force sensing catheter: The prospective multicenter PRECEPT Trial и опубликованном в журнале JACC: Clinical Electrophysiology, Volume 6, Issue 8, Август 2020.
В некоторых вариантах осуществления эталонные данные могут содержать полученные данные, которые не представлены врачу, поскольку не дают известного клинического преимущества.
Хотя приведенное выше описание относится к вариантам осуществления, включающим две отдельные модели машинного обучения, следует понимать, что варианты осуществления могут быть объединены в одну модель, реализованную для выполнения функций обоих вариантов осуществления.
Подготовка алгоритма заканчивается сохранением обученной модели на энергонезависимом машиночитаемом носителе, таком как USB-диск (карта памяти), на стадии 74 сохранения обученной модели. В альтернативных вариантах осуществления модель отправляют заранее, a ее оптимизированные параметры (такие как веса ANN) отправляют отдельно после обучения.
При применении 102 алгоритма выполняют процесс, который начинается со стадии 76 загрузки алгоритма, во время которого пользователь загружает в процессор либо ML-модель целиком, либо ее оптимизированные параметры (например, веса). Затем процессор, такой как процессор 28, принимает данные пациента, сходные по типу с данными, использованными для обучения, например, ЭКГ и электрограммы с электродов 49 и 48 соответственно, на стадии 78 приема данных пациента.
Затем, используя обученную ML-модель для формирования логического заключения, процессор вводит данные выбранного пациента в модель и реализует алгоритм на модели таким образом, что модель способна, например, выводить дополнительную операцию абляции (например, корректирующую операцию), необходимую для увеличения непрерывности абляции, на стадии 80 рекомендаций по абляции. После установки на процессор обученную модель можно использовать с несколькими пациентами.
Пример блок-схемы, показанный на Фиг. 3, выбран исключительно для обеспечения концептуальной ясности. Настоящий вариант осуществления также может содержать дополнительные стадии алгоритма, такие как получение указаний о степени физического контакта электродов с исследуемой тканью. Эта и другие возможные стадии намеренно исключены из описания в настоящем документе, чтобы упростить представление блок-схемы.
На Фиг. 4 представлен снимок экрана визуализации изоляции легочных вен (PVI), спланированной с использованием ML-модели, показанной на Фиг. 3, в соответствии с вариантом осуществления настоящего изобретения.
На Фиг. 4 представлен вывод «механизма оценки» (например, ML-алгоритма, показанного на Фиг. 3), который оценивает непрерывность и трансмуральность PVI. В одном варианте осуществления во время стадии обучения механизм оценки имеет набор случаев, в которые квалифицированный врач внес следующую информацию:
1. Анатомическое местоположение абляции (левосторонняя WACA, правосторонняя WACA, линия свода и т. д.)
2. Тип абляции (эффективная, неэффективная абляция, точки абляции с немедленным восстановлением соединения или точка переделки абляции)
3. Ширина и глубина абляции
На основании описанного выше пространства признаков ML-алгоритм обеспечивает прогноз для каждой абляции на предмет ее эффективности (например, вероятности в диапазоне от нуля до единицы), ширины и глубины повреждения. Механизм также может дать рекомендацию по зонам потенциальных участков немедленного восстановления соединения или участков долгосрочного (для переделки) восстановления соединения.
Диски 402, показанные на фигуре, представляют точку абляции, а размер (и/или цвет диска по шкале серого) генерируются механизмом оценки автоматически, отображая непрерывность или трансмуральность PVI. Размер дисков может представлять вероятность эффективности абляции, а также может представлять ширину и/или глубину повреждения.
В некоторых вариантах осуществления механизм также может давать рекомендацию об областях 404 абляции во избежание ситуации переделки.
Несмотря на то что варианты осуществления, описанные в настоящем документе, главным образом касаются кардиологических применений, способы и системы, описанные в настоящем документе, можно также применять в других медицинских областях, таких как почечная денервация, после переобучения с вводом соответствующих данных и с учетом соответствующих критериев успеха.
Таким образом, следует понимать, что описанные выше варианты осуществления приведены лишь в качестве примера и что настоящее изобретение не ограничено вариантами, показанными и подробно описанными выше в настоящем документе. Напротив, объем настоящего изобретения включает в себя как комбинации, так и подкомбинации различных вышеописанных признаков, а также их варианты и модификации, которые будут очевидны специалистам в данной области после ознакомления с приведенным выше описанием и которые не были описаны на предшествующем уровне техники. Документы, включенные в настоящую заявку на патент путем ссылки, следует считать неотъемлемой частью заявки, за исключением того, что, если определение терминов в этих включенных документах противоречит определениям, сделанным явным или неявным образом в настоящем описании, следует учитывать только определения настоящего описания.


Группа изобретений относится к медицине, а именно к системе и способу проведения направляемой абляции сердца. Система содержит интерфейс, процессор. Интерфейс выполнен для приема данных, характеризующих первоначальную операцию абляции, применяемую к области сердца пациента. Процессор выполнен для автоматического задания, на основе полученных данных, дополнительной операции абляции для применения к данной области путем применения обученной модели машинного обучения ML. При этом ML-модель построена на основе случайного леса регрессионных деревьев, основанных на обучающих данных абляции и на автокодировщиках с глубоким обучением, картирующих ЭКГ сигнал. В другом варианте ML-модель обучена посредством карты LAT или биполярных карт. При исполнении способа принимают данные, характеризующие первоначальную операцию абляции. При этом на основе полученных данных процессор автоматически задает дополнительную операцию абляции для применения к данной области путем применения обученной модели машинного обучения. За счет совместного применения таких методов машинного обучения, как автокодировщики и случайный лес регрессионных деревьев, достигается уменьшение объема данных, которые должен обрабатывать предиктор, при одновременном повышении точности предиктора за счет устранения переобучения, тем самым повышая эффективность модели, то есть обеспечивается управление абляцией сердца с более высокой точностью прогнозирования за счет уменьшения размерности входных данных, при этом система управления абляцией сердца может более эффективно определять, требуется ли дальнейшая абляция, для избегания повторной операции, что улучшает эффективность и результаты абляции. За счет обучения модели посредством карты LAT или биполярных карт обеспечивается формирование логического вывода системой, основанной на машинном обучении, что обеспечивает более точный профиль абляции, при этом система управления абляцией сердца за счет обучения на основании ограниченных данных может более эффективно определять, требуется ли дальнейшая абляция, для избегания повторной операции, что также улучшает эффективность и результаты абляции. 3 н. и 16 з.п. ф-лы, 4 ил.
1. Система для проведения направляемой абляции сердца, содержащая:
интерфейс, выполненный с возможностью приема данных, характеризующих первоначальную операцию абляции, применяемую к области сердца пациента; и
процессор, выполненный с возможностью автоматического задания, на основе полученных данных, дополнительной операции абляции для применения к данной области, путем применения обученной модели машинного обучения (ML), причем ML-модель построена на основе случайного леса регрессионных деревьев, основанных на обучающих данных абляции и на автокодировщиках с глубоким обучением, картирующих ЭКГ сигнал.
2. Система по п. 1, в которой процессор выполнен с возможностью задания дополнительной абляции путем оценки качества первоначальной операции абляции и задания дополнительной операции абляции в случае обнаружения того, что качество первоначальной операции абляции не соответствует критерию качества, такому как достижение непрерывности и/или трансмуральности.
3. Система по п. 1, в которой данные, характеризующие первоначальную операцию абляции, содержат по меньшей мере одно из:
глубины повреждения; радиуса повреждения;
большой оси эллиптического повреждения;
малой оси эллиптического повреждения;
трехмерного положения повреждения;
анатомического положения повреждения и
площади поверхности повреждения.
4. Система по п. 1, в которой процессор выполнен с возможностью указания местоположения для повторной абляции при задании дополнительной операции абляции.
5. Система по п. 1, в которой процессор выполнен с возможностью указания зазора в участке точек абляции при задании дополнительной операции абляции.
6. Система по п. 1, в которой процессор выполнен с возможностью указания в режиме реального времени того, что дополнительную абляцию необходимо выполнять в непосредственной близости к участку точек абляции при задании дополнительной операции абляции.
7. Система по п. 1, в которой процессор дополнительно выполнен с возможностью указания значений одного или более параметров абляции для применения в дополнительной абляции при задании дополнительной операции абляции.
8. Система по п. 1, в которой данные, характеризующие первоначальную операцию абляции, содержат по меньшей мере одно из:
сигнала электрокардиограммы с поверхности тела (ЭКГ);
изменения сигнала ЭКГ с поверхности тела;
внутрисердечного сигнала ЭКГ;
изменения внутрисердечного сигнала ЭКГ;
импеданса абляционного электрода;
изменения импеданса абляционного электрода;
температуры ткани, подвергнутой абляции;
изменения температуры подвергнутой абляции ткани;
усилия, действующего на подвергнутую абляции ткань;
изменения усилия, действующего на подвергнутую абляции ткань;
типа абляционного катетера;
трехмерного местоположения точки абляции;
прогнозируемого анатомического местоположения точки абляции;
продолжительности абляции в точке абляции;
скорости орошения и
мощности, подаваемой во время абляции.
9. Система по п. 8, в которой данные, характеризующие первоначальную операцию абляции, содержат:
изменение ультразвукового отражения подвергнутой абляции ткани и/или
изменение магнитно-резонансного изображения (МРТ) подвергнутой абляции ткани.
10. Способ проведения направляемой абляции сердца, включающий:
прием данных, характеризующих первоначальную операцию абляции, применяемую к области сердца пациента; и
автоматическое задание процессором, на основе полученных данных, дополнительной операции абляции для применения к данной области, путем применения обученной модели машинного обучения (ML), причем ML-модель построена на основе случайного леса регрессионных деревьев, основанных на обучающих данных абляции и на автокодировщиках с глубоким обучением, картирующих ЭКГ сигнал.
11. Способ по п. 11, при котором задание дополнительной абляции включает оценку качества первоначальной операции абляции и задание дополнительной операции абляции в случае обнаружения того, что качество первоначальной операции абляции не соответствует критерию качества, такому как достижение непрерывности и/или трансмуральности.
12. Способ по п. 10, при котором данные, характеризующие первоначальную операцию абляции, содержат по меньшей мере одно из:
глубины повреждения; радиуса повреждения;
большой оси эллиптического повреждения; малой оси эллиптического повреждения; трехмерного положения повреждения; анатомического положения повреждения и площади поверхности повреждения.
13. Способ по п. 10, при котором задание дополнительной операции абляции включает указание местоположения для повторной абляции.
14. Способ по п. 10, при котором задание дополнительной операции абляции включает указание зазора в участке точек абляции.
15. Способ по п. 10, при котором задание дополнительной операции абляции включает указание в режиме реального времени того, что дополнительную абляцию необходимо выполнять в непосредственной близости к участку точек абляции.
16. Способ по п. 10, в котором задание дополнительной операции абляции включает указание значений одного или более параметров абляции для применения в дополнительной операции абляции.
17. Способ по п. 10, при котором данные, характеризующие первоначальную операцию абляции, содержат по меньшей мере одно из:
сигнала электрокардиограммы с поверхности тела (ЭКГ);
изменения сигнала ЭКГ с поверхности тела;
внутрисердечного сигнала ЭКГ;
изменения внутрисердечного сигнала ЭКГ;
импеданса абляционного электрода;
изменения импеданса абляционного электрода;
температуры ткани, подвергнутой абляции;
изменения температуры подвергнутой абляции ткани;
усилия, действующего на подвергнутую абляции ткань;
изменения усилия, действующего на подвергнутую абляции ткань;
типа абляционного катетера;
трехмерного местоположения точки абляции;
прогнозируемого анатомического местоположения точки абляции;
продолжительности абляции для каждой точки;
скорости орошения и
мощности, подаваемой во время абляции.
18. Способ по п. 17, при котором данные, характеризующие первоначальную операцию абляции, содержат:
изменение ультразвукового отражения подвергнутой абляции ткани и/или
изменение магнитно-резонансного изображения (МРТ) подвергнутой абляции ткани.
19. Система для проведения направляемой абляции сердца, содержащая:
интерфейс, выполненный с возможностью приема данных, характеризующих первоначальную операцию абляции, применяемую к области сердца пациента; и
процессор, выполненный с возможностью автоматического задания, на основе полученных данных, дополнительной операции абляции для применения к данной области, путем применения модели машинного обучения (ML), обученной посредством по меньшей мере одного из карт LAT и биполярных карт.
| RU 2017133464 A, 27.03.2019 | |||
| WO 2016181318 A1, 17.11.2016 | |||
| US 2014180273 A1, 26.06.2014 | |||
| WO 2018092071 A1, 24.05.2018 | |||
| US 2015294082 A1, 15.10.2015 | |||
| US 2019254564 A1, 22.08.2019. |
Авторы
Даты
2022-09-14—Публикация
2020-09-21—Подача