Изобретение относится к медицинской иммунологии, а именно к способам оценки местного иммунитета.
Изобретение может быть использовано в медицине для исследования состояния местного иммунитета у больных псориазом и мониторинга его изменений при апробации различных препаратов и схем лечения таких пациентов.
Псориаз - хроническое аутоиммунное воспалительное заболевание кожи, имеющее преимущественно Т-клеточную природу с доказанным механизмом цитокиновой регуляции [1]. На стадии индукции заболевания различные повреждающие факторы приводят к высвобождению антимикробных пептидов, в частности LL37, что является защитным механизмом при повреждении кератиноцитов, однако из-за сбоя в регуляции механизмов врожденного и адаптивного иммунитета, защитные механизмы превращаются в аутоагрессивные. LL37, связываясь с ДНК из разрушенных кератиноцитов, активируют плазмоцитоидные дендритные клетки к синтезу интерферонов I типа, которые запускают созревание классических дендритных клеток. Последние презентируют аутоантигены Т-лимфоцитам, которые дифференцируются в аутоагрессивные эффекторы Th1, Th7 и Th22 типов, реализующие аутоиммунное воспаление в псориатической бляшке. Этим сложным процессом дирижирует система цитокинов. На данный момент считается доказанным, что цитокиновая ось интерлейкинов (IL)-23/IL-17/IL-22 является ведущей в иммунопатогенезе псориаза. Эти цитокины, а также вовлеченные в процесс IFN-γ, IL-21 и TNF вызывают активную пролиферацию кератиноцитов, привлекают новые провоспалительные клетки в зону псориатической бляшки, что приводит к утолщению эпидермиса и гиперкератозу, которые и формируют клинические симптомы - красные, зудящие, возвышающиеся над кожей бляшки, покрытые серебристыми чешуйками. Указанные цитокины формируют петлю обратной положительной связи, поддерживающую хроническое воспаление в псориатической бляшке [2]. Несмотря на интенсивные исследования в этой области, далеко не все еще понятно относительно роли этих и некоторых других цитокинов в иммунопатогенезе псориаза.
В иммунном ответе кожи можно выделить следующие этапы.
1. Повреждение эпидермиса бактериями, вирусами, грибками, физическими или химическими повреждающими факторами индуцирует выработку кератиноцитами цитокинов. Под влиянием патогенов, проникших через поврежденный эпидермис, аутоантигенов из разрушенных повреждением клеток и цитокинов происходит активация клеток Лангерганса и дермальных дендритных клеток. Клетки Лангерганса и дермальные дендритные клетки, экспрессирующие на своей поверхности комплексы HLA-антигенный пептид, покидают кожу и мигрируют в регионарный лимфатический узел [3].
2. Взаимодействие активированных дендритных клеток, нагруженных антигенными пептидами с наивными Т-лимфоцитами в регионарном лимфоузле при поддержке провоспалительных цитокинов приводит к формированию антиген-специфических хелперов и цитотоксических лимфоцитов [4]. Антигенные пептиды могут быть представлены компонентами патогенов (противоинфекционный ответ) или аутоантигенами (при аутоиммунном заболевании).
3. В воспаленном очаге кожи создаются условия для проникновения активированных лимфоцитов через эндотелий сосудов, в результате активированные CD4+ и CD8+клетки мигрируют в кожу [5].
4. Активированные CD4+ и CD8+клетки продуцируют соответствующие цитокины и атакуют инфицированные клетки при противоинфекционном иммунитете или собственные здоровые клетки при аутоиммунных заболеваниях, привлекая за счет продукции цитокинов и хемокинов в очаг дополнительные клетки-эффекторы [6]. Из приведенного краткого описания видно, что большинство важных иммунологических событий происходит непосредственно в коже, в очаге поражения.
Исследование изменений в параметрах иммунитета традиционно проводят в венозной крови из-за доступности взятия биологического материала [7, 8]. Недостатком такого подхода является то, что в венозной крови содержится суммарное по всему организму количество тех же цитокинов. Только очень выраженные отклонения в концентрации цитокинов или субпопуляционном составе лимфоцитов в очаге воспаления в коже будут обнаружены в венозной крови, поскольку нивелируются отсутствием воспалительной реакции в других частях организма. Для анализа именно местных реакций используют метод биопсии псориатической бляшки [9]. Для этого специальным инструментом в зоне воспаления срезают маленький поверхностный участок кожи (около 4 мм) и либо окрашивают специальными красителями и изучают под микроскопом клеточный состав в очаге поражения, либо культивируют клетки и затем изучают. Такой метод исследования позволяет увидеть изменения в параметрах иммунитета именно на местном уровне. Существенным недостатком этого метода является его травматичность, невозможность его применения в рутинной практике и для динамического наблюдения, например, при исследовании действия тех или иных препаратов и схем их применения для терапии кожных заболеваний.
Капиллярная кровь, взятая рядом с очагом поражения, представляется более адекватным материалом исследования для оценки именно местных процессов, происходящих в зоне воспаления.
В качестве аналогов предлагаемого метода выбрано два патента. Патент РФ №2620561 [10] предусматривает выявление в венозной крови пациента с предполагаемым диагнозом псориаз мутации С-597А в гене IL-10 и снижение в сыворотке крови концентрации IL-10 ниже 1,9 пг/мл. Недостаток метода заключается в том, что наличие такой мутации действительно способствует возникновению псориаза, но сама мутация встречается редко даже у псориатических больных, и более 90% таких больных имеют нормальный, а иногда повышенный уровень IL-10, как по данным литературы, так и по нашим данным. Данный метод применим только у небольшого процента больных, имеющих данную мутацию.
Второй патент РФ №2703314 [11] предусматривает взятие биоптата из псориатической бляшки и иммуногистохимическое исследование его на наличие повышенной экспрессии IL-36γ. При окрашивании более 4 рядов эпидермиса диагностируют псориаз. Недостаток метода заключается в том, что хотя IL-36γ действительно патогномоничен для псориаза, взятие биоптата из воспаленной зоны псориатической бляшки приводит к формированию рубца на месте биопсии. Данный метод травматичен и может быть применен только в редких случаях спорного диагноза, когда невозможно диагностировать псориаз неинвазивными методами. К сожалению, в РФ не зарегистрированы тест-системы для определения IL-36γ в сыворотке крови методом ИФА, поэтому мы не исследовали уровень этого цитокина в нашей разработке.
В качестве прототипа выбрана статья [12].
В этой статье были сопоставлены уровни 22 субпопуляций мононуклеаров и 13 цитокинов в венозной и капиллярной крови здоровых и больных псориазом.
Различия состоят в том, что в указанной статье проводилось определение 22 субпопуляций мононуклеаров. В результате проведенных дополнительных исследований мы показали, что не все эти субпопуляции вовлечены в псориатический процесс. Была проведена оценка значимости уровней исследованных субпопуляций у больных псориазом. Для 12-и субпопуляций мононуклеаров и 13-и цитокинов в капиллярной крови были получены значимые различия с соответствующими параметрами группы здорового контроля. Эти параметры были включены нами в комплекс необходимых исследований. Учитывая тот факт, что в иммунопатогенез псориаза преимущественно вовлечены Т-клетки и NK-клетки [1, 2, 4, 6, 7, 8, 9], еще 4 субпопуляции были включены в перечень необходимых параметров:
CD3+- Т-клетки, CD3+CD4+ - Т-хелперы, CD3+CD8+ - цитотоксические Т-клетки и CD3-CD16/56+ - NK-клетки, несмотря на то что для этих субпопуляций различия с группой здоровых доноров были не значимы. Наличие этих субпопуляций в комплексном обследовании пациента позволяет всесторонне охарактеризовать состояние его иммунитета. Более того, нельзя говорить о различиях какой-либо субпопуляции Т-хелперов, не учитывая уровня всех Т-хелперов и Т-клеток в целом. Кроме того, пациенты, больные псориазом, не одинаковы и при исследовании большего количества пациентов различия могут стать значимыми. В результате количество субпопуляций было оптимизировано и сокращено с 22 до 16, что уменьшает расходы реактивов при постановке тестов. Также после дополнительной доработки был скорректирован состав цитокинов, значимо вовлеченных в иммунопатогенез псориаза. Вместо IL-10, уровень которого не отличался от группы здоровых, был добавлен цитокин sCD40L, уровень которого оказался значимым у псориатических больных. Кроме того, в указанной статье не исследовалась возможность оценки с помощью предложенного метода эффективности проводимой терапии псориатическим пациентам, что крайне важно как для индивидуального подбора метода лечения, так и для проведения клинических исследований новых топических препаратов.
Технической проблемой, решаемой изобретением, является разработка простого и удобного способа определения и оценки местного иммунитета у больных псориазом, позволяющего также осуществлять динамическое наблюдение за параметрами иммунитета в зоне воспаления при проведении терапии топическими препаратами.
Поставленная задача достигается путем определения субпопуляционного состава мононуклеаров и цитокинового профиля в капиллярной крови, взятой вблизи очага воспаления у больных псориазом.
Изначально было неясно, возможно ли из малого количества капиллярной крови определить достаточное количество цитокинов и субпопуляций клеток, а также есть ли различия в концентрации цитокинов и уровнях основных субпопуляций в капиллярной и венозной крови. Для ответов на эти вопросы были проведены исследования по сопоставлению указанных параметров иммунитета в капиллярной и венозной крови здоровых людей. Было показано, что при использовании специализированных минипробирок типа Microvette 200 К3 EDTA, рассчитанных на взятие 200 мкл капиллярной крови, можно собрать 400 мкл капиллярной крови в две микроветы. Этого объема вполне достаточно для определения 16 субпопуляций мононуклеаров при 4-х цветном способе окрашивания и 13 цитокинов при использовании мультиплексного метода их тестирования. Этих 29-и параметров вполне достаточно для детального изучения местного иммунитета. Также было показано, что у здоровых людей концентрация изученных цитокинов и уровни субпопуляций мононуклеаров, как в процентном, так и в абсолютном выражении немного выше в капиллярной, чем венозной крови, однако эти различия не были статистически значимыми.
Технический результат изобретения заключается в том, что заявленный способ оценки местного иммунитета у больных псориазом:
1) позволяет количественно оценивать состояние местного иммунитета у больных псориазом, что дает возможность охарактеризовать степень отклонений исследуемых параметров у конкретного пациента от группы здорового контроля;
2) позволяет оценить в динамике изменения параметров местного иммунитета, характеризующих эффективность применения терапии топическими препаратами.
3) предложенный метод менее травматичный, чем метод биопсии и более информативный, чем исследование тех же параметров в венозной крови.
Сущность изобретения заключается в следующем.
Для исследования параметров иммунитета были сформированы 2 группы. В группу 1 были включены 16 больных псориазом (аутоиммунное заболевание), в группу 2-15 практически здоровых людей без видимых поражений кожного покрова. Капиллярную кровь собирали в 2 микроветы с ЭДТА по 200 мкл (всего 400 мкл) у здоровых из пальца кисти руки, а у больных из пальца рядом с очагом воспаления. Венозную кровь брали из локтевой вены в вакуумные пробирки с ЭДТА 3 мл для сопоставления результатов исследования. Из первой микроветы подсчитывали клинический анализ крови на гематологическом анализаторе Sysmex XS (расход крови 50 мкл). Форменным элементам крови во второй микровете давали осесть путем отстаивания и аккуратно отбирали 50 мкл плазмы в микропробирку типа Эппендорф, замораживали и хранили при -30°С для определения концентрации цитокинов. Оставшуюся кровь из двух микровет смешивали и раскапывали по 50 мкл в пробирки типа «фалькон», в которые заранее были внесены анти-CD-антитела, меченные флюорохромами. Аналогичную процедуру проводили для венозной крови с той разницей, что все действия осуществлялись из одной пробирки, т.к. объема 3 мл вполне достаточно для всех проводимых исследований. Композиция антител представлена в таблице 1. Данная комбинация позволила идентифицировать 13 субпопуляций лимфоцитов и 3 субпопуляции моноцитов (всего 16 субпопуляций). Этого вполне достаточно, чтобы всесторонне оценить клеточный состав иммунитета. Следует отметить, что в зависимости от целей и задач конкретного исследования состав композиций может быть изменен.

Примечание: первая позиция обозначает флуорохром флуоресцин-изоцианат (fluorescein isocyanate - FITC), вторая - фикоэритрин (phycoerithrin - РЕ), третья -перидинин-хлорофилл-протеин (peridinin chlorophyll protein - PerCP) и четвертая -аллофикоцианин (allophycocyanin - АРС).
Пробирки инкубировали 20 минут при t 4°С в темноте, затем добавляли лизирующий буфер в количестве 2 мл, инкубировали 10 минут при комнатной температуре, центрифугировали и удаляли надосадок. В пробирки добавляли отмывающий буфер, центрифугировали, сливали надосадок и добавляли 500 мкл Cell Wash, перемешивали встряхиванием и подсчитывали на проточном цитометре BD FacsCantoII (США), программа сбора и обработки информации FACSDiva. Цитокины в плазме капиллярной и венозной крови (IL-1β, IL-4, IL-6, IL-17A, IL-17F, IL-21, IL-22, IL-23, IL-25, IL-33, IFN-γ, TNF, sCD40L) определяли мультиплексным методом с использованием коммерческих тест-систем Th-17, определяемый динамический диапазон 0,2-3200 пг/мл (BioRad, США). Подсчет результатов осуществляли на LED-анализаторе MagPix (Luminex, США), согласно инструкции производителя. Преимущество метода состоит в том, что он позволяет определять до 50 цитокинов в одной пробе в 50 мкл плазмы крови. Следует также подчеркнуть, что количество и конкретный состав определяемых цитокинов можно варьировать в зависимости от целей и задач конкретного исследования. Существуют наборы на 8, 10, 23, 27, 40 цитокинов, также возможно создать индивидуальную панель цитокинов под конкретную задачу. Полученные результаты представлены в таблицах 2 и 3.
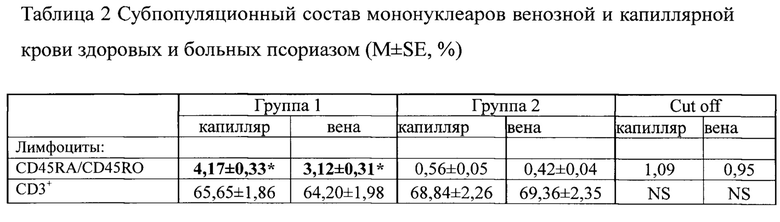
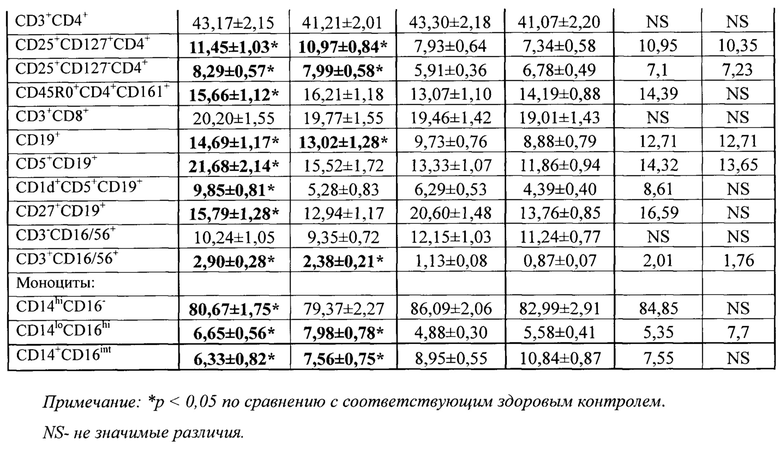
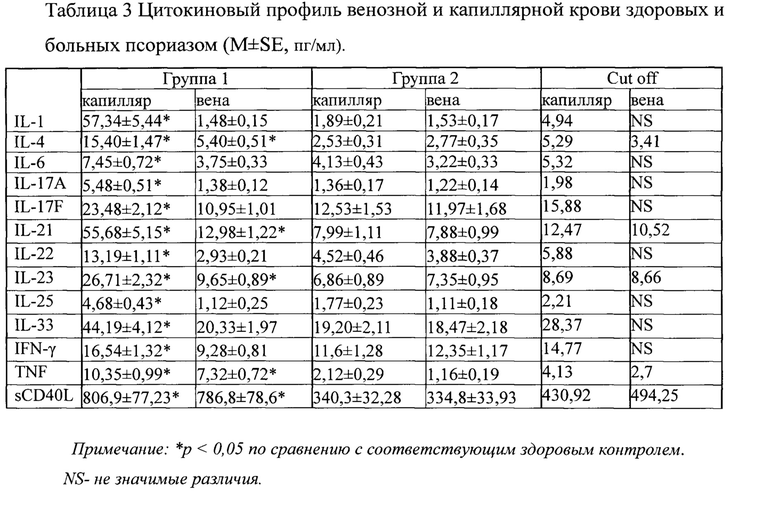
Из приведенных данных видно, что в группе пациентов с псориазом (группа 1) уровни 7-и субпопуляций из 16 исследованных отличаются от соответствующих показателей группы здорового контроля и в капиллярной и в венозной крови. Еще 5 субпопуляций отличаются от группы здоровых только в капиллярной крови. Еще более выраженные различия можно наблюдать в концентрации цитокинов. Так в группе с псориазом (группа 1) концентрация 13-и цитокинов отличалась от параметров группы здоровых в капиллярной крови и только у 5-и цитокинов в венозной крови.
Для выяснения информативности разработанного метода был проведен ROC-анализ с помощью построения операционных характеристических кривых (Receiver Operating Characteristic curve, сокращенно ROC-кривых), используемых для оценки диагностической эффективности метода. На основании полученных данных был произведен расчет пороговых значений (cut off) для параметров, значимо отличающихся в группе больных от группы здоровых (см. табл.2, 3). Рассчитанные значения cut of позволяют с чувствительностью 95% и специфичностью 100% разделять больных псориазом и здоровых. Не для всех выбранных параметров удалось рассчитать cut off из-за высокой степени изменчивости этих параметров. Так для капиллярной крови cut off удалось рассчитать для всех выбранных цитокинов и для 12 из 16 субпопуляций, а в венозной крови только для 5 из 13 цитокинов и 7 из 16 субпопуляций. Тем не менее, согласно современным представлениям об иммунопатогенезе псориаза и роли в нем выбранных параметров, считаем необходимым определять все указанные параметры и ориентироваться на представленные значения группы здоровых доноров в тех случаях, когда cut of не указан.
Таким образом, если значение какого-либо параметра выше рассчитанного для него значения cut off, то это свидетельствует об изменении состояния местного иммунитета при псориазе. Чем больше параметров превышает значение cut off, тем активнее местный иммунитет у данного пациента вовлечен в патогенез заболевания.
Предложенный способ определения субпопуляционного состава и цитокинового профиля в капиллярной крови особенно важен при изучении эффективности применения топических лекарственных препаратов.
Осуществление способа изобретения поясняется на следующем примере.
Пример. В таблице 4 приведены результаты исследования вышеописанных параметров в капиллярной и венозной крови до и после лечения пациентов группы 1 топическим глюкокортикостероидом в течение 14 дней, согласно клиническим рекомендациям.
Из приведенных данных видно, что на момент окончания лечения в капиллярной крови выявлено 11 параметров (3 субпопуляции и 8 цитокинов), значимо отличающихся от исходного уровня. В венозной крови выявлено 5 значимо отличающихся параметров (2 субпопуляции и 3 цитокина). Следует отметить, что препараты с другим механизмом действия могут оказывать влияние на другие параметры иммунитета.

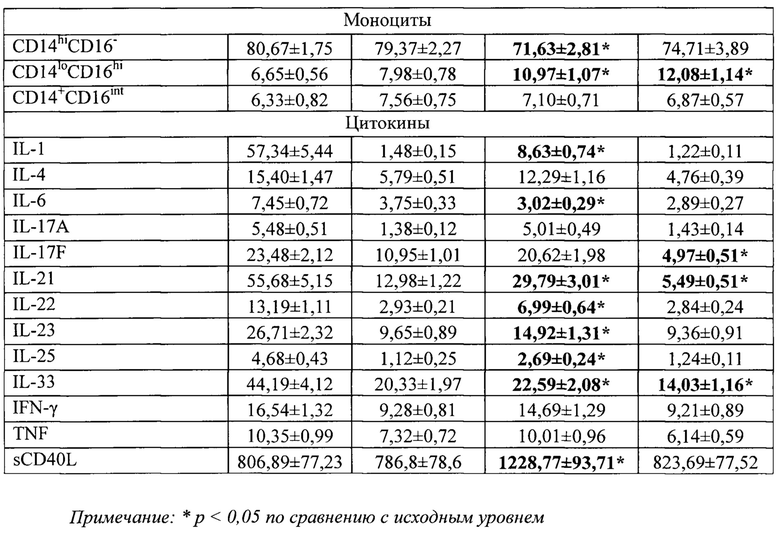
Таким образом, в капиллярной крови удается выявить большее количество измененных параметров как по уровню субпопуляций иммунокомпетентных клеток, так и по концентрации цитокинов, чем в венозной крови. Очевидно, что определение иммунологических параметров в капиллярной крови, взятой рядом с местом воспаления более информативно, чем определение тех же параметров в венозной крови и существенно менее травматично, чем метод биопсии. Объема капиллярной крови 400 мкл, взятой в 2 микроветы по 200 мкл достаточно для исследования клинического анализа крови, 16 субпопуляций мононуклеаров и 13 цитокинов. Разработанный способ определения и оценки местного иммунитета в капиллярной крови больных псориазом дает больший объем информации при исследовании терапевтического действия топических препаратов.
Список литературы
1. Liang Y., Sarkar M.K., Tsoi L.C., Gudjonsson J.E. Psoriasis: A mixed autoimmune and autoinflammatory disease. Curr. Opin. Immunol. 2017, Vol. 49, pp. - 8. doi: 10.1016/j.coi.2017.07.007
2. Rendon A., Schakel K. Psoriasis Pathogenesis and Treatment. Int. J. Mol. Sci. 2019, Vol.20, pp.1475, doi: 10.3390/ijms20061475.
3. Wang, A.; Bai, Y.P. Dendritic cells: The driver of psoriasis. J. Dermatol. 2020, Vol. 47, pp.104-113. doi: 10.1111/1346-8138.15184.
4. Schmitt N., Ueno H. Regulation of human helper T cell subset differentiation by cytokines. Curr. Opin. Immunol. 2015, Vol.34, pp.130-136. doi: 10.1016/j.coi.2015.03.007.
5. Meitei H.T., Jadhav N., Lai G. CCR6-CCL20 axis as a therapeutic target for autoimmune diseases. Autoimmun. Rev. 2021, Vol. 20, pp. 102846.
6. Ogawa, E.; Sato, Y.; Minagawa, A.; Okuyama, R. Pathogenesis of psoriasis and development of treatment. J. Dermatol. 2018, Vol.45, pp.264-272. doi: 10.1016/j.autrev.2021.102846.
7. Колерова A.B., Амирах Кызы Микаилова Д., Бейманова М.А., Блинова Е.А. «Характеристика CD4+ центральных и эффекторных клеток памяти при псориазе» // Медицинская иммунология, 2021. - Т. 23, №4. - С. 969-974. doi: 10.15789/1563-0625-СОС-2288.
8. Michalak-Stoma A., Bartosinska J., Kowal M., Juszkiewicz-Borowiec M., Gerkowicz A., Chodorowska G. Serum Levels of Selected Thl7 and Th22 Cytokines in Psoriatic Patients. Disease Markers 2013, Vol.35, Issue 6, pp.625-631 http://dx.doi.org/10.1155/2013/856056
9. Kurihara K., Fujiyama T, Phadungsaksawasdi P., Ito T, Tokura Y. Significance of IL-17A-producing CD8+CD103+skin resident memory T cells in psoriasis lesion and their possible relationship to clinical course. J.. Dermatol. Sci. 2019, Vol.95, pp.21-27. doi: 10.1016/j.jdermsci.2019.06.002.
10. Патент 2620561 Российская Федерация МПК G01N 33/49. Способ диагностики псориаза. / Смирнова С.В., Смольникова М.В., Барило А.А., патентообладатель ФГБНУ ФИЦ КНЦ СО РАН (RU) / - №2015151152, заявл. 27.11.2015
11. Патент 2703314 Российская Федерация МПК G01N 33/53. Способ дифференциальной диагностики бляшечного псориаза с другими хроническими заболеваниями кожи. / Пашкин А.Ю., Жуков А.С, Хайрутдинов В.Р., Самцов А.В., Гуреев М.А., Гарабаджиу А.В., патентообладатель ФГБВОУ ВО "Военно-медицинская академия имени С.М. Кирова" Министерства обороны Российской Федерации (RU)/- №2019122522, заявл. 15.07.2019
12. Сенникова С.В., Топтыгина А.П., Семикина Е.Л., Закиров Р.Ш., Акулова С.С. Субпопуляционный состав мононуклеаров и цитокиновый профиль венозной и капиллярной крови больных псориазом и здоровых людей. Медицинская иммунология. - 2021. - Т. 23. - №6. - С. 1333-1346 doi: 10.15789/1563-0625-MSA-2391
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ БЕСПЛОДИЯ У ЖЕНЩИН С ГИПОТАЛАМИЧЕСКИМ СИНДРОМОМ | 2019 |
|
RU2712627C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ НЕВЫНАШИВАНИЯ БЕРЕМЕННОСТИ У ЖЕНЩИН С ГИПОТАЛАМИЧЕСКИМ СИНДРОМОМ | 2019 |
|
RU2712628C1 |
| Способ лечения онкологических заболеваний | 2020 |
|
RU2741701C1 |
| Способ дифференциальной диагностики инфекционного мононуклеоза Эпштейна-Барр-вирусной этиологии, острого бактериального тонзиллита и острого вирусного гепатита "В" у взрослых | 2017 |
|
RU2687563C2 |
| СПОСОБ ДИАГНОСТИКИ ВТОРИЧНОЙ ИММУНОЛОГИЧЕСКОЙ НЕДОСТАТОЧНОСТИ ПРИ ТУБЕРКУЛЕЗЕ ЛЕГКИХ | 2012 |
|
RU2504784C1 |
| Способ прогнозирования продолжительности жизни больных с метастатическими формами опухолей | 2023 |
|
RU2821659C1 |
| Способ раннего прогнозирования отдаленного исхода хронической обструктивной болезни легких. | 2021 |
|
RU2795193C1 |
| Способ оценки риска прогрессирования метастатического колоректального рака после анти-VEGF терапии | 2024 |
|
RU2823505C1 |
| Способ прогнозирования развития метастазов у больных нерезектабельным трижды негативным раком молочной железы | 2023 |
|
RU2802141C1 |
| Способ оценки эффективности терапии in vitro и in vivo в мышиной экспериментальной модели имиквимод-индуцированного псориазоподобного дерматита | 2023 |
|
RU2829630C1 |
Изобретение относится к медицине, а именно к медицинской иммунологии, и может быть использовано для оценки местного иммунитета у больных псориазом. У пациента с псориазом производят взятие капиллярной крови из пальца рядом с очагом псориатического воспаления в коже. На проточном цитометре подсчитывают процент 16-ти субпопуляций мононуклеаров. Мультиплексным методом проводят определение концентрации 13-ти цитокинов IL-1, IL-4, IL-6, IL-17A, IL-17F, IL-21, IL-22, IL-23, IL-25, IL-33, IFN-γ, TNF, sCD40L. Если значение какого-либо параметра из вышеуказанных цитокинов и субпопуляций мононуклеаров CD45RA+/CD45RO+, CD25+CD127+CD4+, CD25+CD127-CD4+, CD45RO+CD4+CD161+, CD19+, CD5+CD19+, CD1d+CD5+CD19+, CD27+CD19+, CD3+CD16/56+, CD14loCD16hi выше рассчитанного для него значения cut off, а для субпопуляций мононуклеаров CD14hiCD16- и CD14+CD16int ниже рассчитанного для них значения cut off, при условии, что значения субпопуляций мононуклеаров CD3+; CD3+CD4+; CD3+CD8+; CD3-CD16/56+ отличаются от значений соответствующих параметров, полученных для группы здорового контроля, оценивают изменение состояния местного иммунитета при псориазе. Способ обеспечивает количественную оценку состояния местного иммунитета у больных псориазом за счет анализа изменений параметров местного иммунитета в капиллярной крови. 4 табл., 1 пр.
Способ оценки местного иммунитета у больных псориазом, отличающийся тем, что последовательно выполняют следующие этапы:
- у пациента с псориазом производят взятие капиллярной крови из пальца рядом с очагом псориатического воспаления в коже в 2 микроветы с ЭДТА по 200 мкл в каждой;
- из первой микроветы после оседания форменных элементов крови в результате отстаивания при комнатной температуре отбирают 50 мкл плазмы для исследования цитокинового профиля;
- оставшуюся часть крови из первой микроветы смешивают с кровью из второй микроветы и осуществляют 4-цветное окрашивание проб капиллярной крови пациента с помощью флуоресцентно меченных моноклональных анти-CD-антител с последующим лизированием эритроцитов и подсчетом на проточном цитометре процента 16-ти субпопуляций мононуклеаров;
- оценку полученных результатов для 12-ти следующих субпопуляций мононуклеаров проводят, сопоставляя результат, полученный у конкретного больного, с рассчитанными cut off: CD45RA+/CD45RO+ - 1,09%; CD25+CD127+CD4+ - 10,95%; CD25+CD127-CD4+ - 7,1%; CD45RO+CD4+CD161+ - 14,39%; CD19+ - 12,71%; CD5+CD19+ - 14,32%; CD1d+CD5+CD19+ - 8,61%; CD27+CD19+ - 16,59%; CD3+CD16/56+ - 2,01%; CD14hiCD16- - 84,85%; CD14loCD16hi - 5,35%; CD14+CD16int - 7,55%;
- для остальных 4-х субпопуляций мононуклеаров при сопоставлении учитываются значения соответствующих параметров, полученных для группы здорового контроля: CD3+ - 68,84±2,26%; CD3+CD4+ - 43,30±2,18%; CD3+CD8+ - 19,46±1,42%; CD3-CD16/56+ - 12,15±1,03%;
- проводят определение концентрации 13-ти цитокинов мультиплексным методом в плазме капиллярной крови, ранее отобранной в количестве 50 мкл из первой микроветы, и полученные значения концентрации цитокинов сопоставляют с рассчитанными значениями cut off: IL-1 - 4,94 пг/мл; IL-4 - 5,29 пг/мл; IL-6 - 5,32 пг/мл; IL-17A - 1,98 пг/мл; IL-17F - 15,88 пг/мл; IL-21 - 12,47 пг/мл; IL-22 - 5,88 пг/мл; IL-23 - 8,69 пг/мл; IL-25 - 2,21 пг/мл; IL-33 - 28,37 пг/мл; IFN-γ - 14,77 пг/мл; TNF - 4,13 пг/мл; sCD40L - 430,92 пг/мл;
- если значение какого-либо параметра из вышеуказанных цитокинов и субпопуляций мононуклеаров CD45RA+/CD45RO+, CD25+CD127+CD4+, CD25+CD127-CD4+, CD45RO+CD4+CD161+, CD19+, CD5+CD19+, CD1d+CD5+CD19+, CD27+CD19+, CD3+CD16/56+, CD14loCD16hi выше рассчитанного для него значения cut off, а для субпопуляций мононуклеаров: CD14hiCD16- и CD14+CD16int ниже рассчитанного для них значения cut off, при условии, что значения 4-х субпопуляций мононуклеаров CD3+; CD3+CD4+; CD3+CD8+; CD3-CD16/56+ отличаются от значений соответствующих параметров, полученных для группы здорового контроля, оценивают изменение состояния местного иммунитета при псориазе и чем больше параметров имеют такие отклонения, тем активнее местный иммунитет у данного пациента вовлечен в патогенез заболевания.
| RU 2016119878 A, 28.11.2017 | |||
| СЕННИКОВА С.В | |||
| и др | |||
| Субпопуляционный состав мононуклеаров и цитокиновый профиль венозной и капиллярной крови больных псориазом и здоровых людей | |||
| Медицинская иммунология | |||
| Способ регенерирования сульфо-кислот, употребленных при гидролизе жиров | 1924 |
|
SU2021A1 |
| ЖИЛЬЦОВ И.В | |||
| Основы медицинской статистики | |||
| Дизайн биомедицинских исследований: практическое руководство / И.В | |||
| Жильцов, | |||
Авторы
Даты
2023-09-26—Публикация
2022-10-18—Подача