ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к новым кристаллическим формам сульфонамидных соединений, обладающих ингибирующей активностью в отношении рибонуклеотидредуктазы, к фармацевтическим композициям, содержащим кристаллическую форму соединений, и к способам их получения и применения.
УРОВЕНЬ ТЕХНИКИ
[0002] Рибонуклеотидредуктаза (далее также называемая «RNR») состоит из гетероолигомера большой субъединицы M1 и малой субъединицы M2, при этом экспрессия обеих субъединиц необходима для ферментативной активности. RNR распознает рибонуклеозид-5'-дифосфат (далее также называемый «NDP») в качестве субстрата и катализирует его восстановление до 2'-дезоксирибонуклеозид-5'-дифосфата (далее также называемого «dNDP»). RNR является лимитирующим скорость ферментом в de novo пути синтеза dNTP и играет существенную роль в синтезе и восстановлении ДНК.
[0003] Ферментативная активность RNR тесно связана с клеточной пролиферацией, и сообщалось, что ее ферментативная активность особенно высока при раке. При различных типах солидных опухолей и раке крови сообщалось о многочисленных корреляциях со сверхэкспрессией субъединицы М2 RNR и ее влиянии на прогноз рака. Кроме того, ингибирование роста клеток достигается за счет ингибирования RNR, и был описан in vivo противоопухолевый эффект в клеточных линиях, полученных из нескольких типов рака и в неклинических моделях. Таким образом, существует обоснованное предположение, что RNR является важной молекулярной мишенью для лечения рака.
[0004] Принято считать, что гидроксимочевина (далее также называемая «HU») и 3-аминопиридин-2-карбоксальдегидтиосемикарбазон (далее также называемый «3-AP») проявляют ингибирующую активность в отношении RNR. Эти соединения, однако, отличаются по структуре от сульфонамидных соединений настоящего изобретения. Хотя HU клинически используется уже более 30 лет, ее ингибирующая активность в отношении RNR слаба, и ее действие ограничено. Резистентность к применению HU также считается проблемой. 3-АР способен хелатировать ионы металлов, особенно ионы железа (Fe), тем самым ингибируя RNR, но было высказано предположение, что 3-AP оказывает нецелевое воздействие на различные другие белки, содержащие ион Fe, что приводит к побочным эффектам, таким как гипоксия, одышка, метгемоглобинемия и тому подобное в клинических случаях.
[0005] Соответственно, существует необходимость в разработке мощного ингибитора RNR, который не хелатирует ионы металлов и может применяться для лечения заболеваний, связанных с RNR, таких как рак.
[0006] Кроме того, существует потребность в разработке ингибитора RNR, который удобен в обращении. Известно, что способность накапливать электростатический заряд и гигроскопичность биологически активного соединения влияют на обращение с соединением при его включении в потенциальную фармацевтическую композицию. Например, активные соединения, которые подвергаются воздействию статического электричества, могут создавать проблемы в процессе производства, такие как снижение выхода и неравномерная упаковка. Таким образом, предпочтительным является активное химическое соединение, имеющее низкий электростатический заряд. Гигроскопичные соединения представляют проблемы, связанные с поглощением ими влаги, что приводит к изменениям массы соединения в зависимости от количества воды, присутствующей в окружающей среде, затрудняя точную оценку биологической эффективности соединения и обеспечение однородности фармацевтических композиций, содержащих соединение. Соответственно, желательно использовать активное химическое соединение с низкой гигроскопичностью.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0007] Одной из целей настоящего изобретения является предложить новую, стабильную и имеющую меньшую электростатичность кристаллическую форму, сокристалл и/или соль соединения, которое является мощным и селективным ингибитором RNR и может применяться в качестве противоопухолевого средства или терапевтического средства при лечении других заболеваний, связанных с RNR.
[0008] В результате проведения обширных исследований по идентификации химического соединения, которое удовлетворяет описанным выше требованиям, авторы настоящего изобретения обнаружили стабильные, с низкой электростатичностью и негигроскопичные формы сульфонамидных соединений, обладающие превосходной ингибирующей активностью в отношении RNR, и применимые в качестве терапевтического средства для лечения опухолей и других заболеваний, связанных с RNR. Эти сульфонамидные соединения существуют в виде кристаллической формы, такой как сокристаллы, и/или в виде соли.
[0009] Различные аспекты настоящего изобретения содержатся в следующих пунктах [1] - [28].
[1] Кристаллическая форма соединения, выбранного из группы, состоящей из следующих:
5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-хлор-2-(N-((1S,2R)-2-(3-этил-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамид;
5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамид;
N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-5-хлор-4-гидрокси-4-метилхроман-8-сульфонамид;
5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамид; и
5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид.
[2] Кристаллическая форма по п.[1], где химическая чистота кристаллической формы составляет 90% или более.
[3] Кристаллическая форма по п.[1] или п.[2], где оптическая чистота кристаллической формы составляет 100% э.и.
[4] Кристаллическая форма по любому из п.п.[1]-[3], где кристаллическая форма стабильна под воздействием условий примерно 40°С и примерно 75% относительной влажности в течение примерно 4 недель.
[5] Кристаллическая форма по любому из п.п.[1]-[4], где кристаллическая форма дополнительно содержит бензойную кислоту.
[6] Кристаллическая форма по любому из п.п.[1]-[5], где кристаллическая форма представляет собой сокристалл бензойной кислоты и соединения.
[7] Фармацевтическая композиция, содержащая (i) кристаллическую форму по любому из п.п.[1]-[6] и (ii) фармацевтически приемлемый носитель.
[8] Способ ингибирования рибонуклеотидредуктазы in vivo, включающий введение нуждающемуся в этом человеку терапевтически эффективного количества фармацевтической композиции по п.[7]. В некоторых вариантах осуществления ингибирование рибонуклеотидредуктазы происходит в опухолевой клетке человека.
[9] Противоопухолевое средство, содержащее кристаллическую форму по любому из п.п.[1]-[6] в качестве активного ингредиента. В некоторых вариантах осуществления противоопухолевое средство представляет собой пероральное противоопухолевое средство.
[10] Применение кристаллической формы по любому из п.п.[1]-[6] для получения ингибитора рибонуклеотидредуктазы.
[11] Применение кристаллической формы по любому из п.п.[1]-[6] в качестве лекарственного средства.
[12] Применение кристаллической формы по любому из п.п.[1]-[6] в качестве противоопухолевого средства. В некоторых вариантах осуществления противоопухолевое средство представляет собой пероральное противоопухолевое средство.
[13] Кристаллическая форма по любому из п.п.[1]-[6] для применения в качестве ингибитора рибонуклеотидредуктазы.
[14] Кристаллическая форма по любому из п.п.[1]-[6] для применения в профилактике или лечении опухолей.
[15] Кристаллическая форма по любому из п.п.[1]-[6] для применения в профилактике или лечении опухолей путем перорального введения соединения.
[16] Кристаллическая форма по любому из п.п.[1]-[6], где соединение или бензойная кислота могут быть замещены одним или более радиоактивными изотопами или нерадиоактивным изотопом.
[17] Соль бензойной кислоты соединения, выбранного из группы, состоящей из следующих:
5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-хлор-2-(N-((1S,2R)-2-(3-этил-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамид;
5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамид;
N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-5-хлор-4-гидрокси-4-метилхроман-8-сульфонамид;
5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамид; и
5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид.
[18] Фармацевтическая композиция, содержащая (i) соль бензойной кислоты п.[17] и (ii) фармацевтически приемлемый носитель.
[19] Способ ингибирования рибонуклеотидредуктазы in vivo, включающий введение нуждающемуся в этом субъекту-человеку терапевтически эффективного количества фармацевтической композиции по п.[18]. В некоторых вариантах осуществления ингибирование рибонуклеотидредуктазы происходит в опухолевой клетке субъекта-человека.
[20] Противоопухолевое средство, содержащее соль бензойной кислоты по п.[17] в качестве активного ингредиента. В некоторых вариантах осуществления противоопухолевое средство представляет собой пероральное противоопухолевое средство.
[21] Применение соли бензойной кислоты п.[17] для получения ингибитора рибонуклеотидредуктазы.
[22] Применение соли бензойной кислоты п.[17] в качестве лекарственного средства.
[23] Применение соли бензойной кислоты п.[17] в качестве противоопухолевого средства. В некоторых вариантах осуществления противоопухолевое средство представляет собой пероральное противоопухолевое средство.
[24] Соль бензойной кислоты п.[17] для применения в качестве ингибитора рибонуклеотидредуктазы.
[25] Соль бензойной кислоты п.[17] для применения в профилактике или лечении опухолей.
[26] Соль бензойной кислоты п.[17] для применения в профилактике или лечении опухолей путем перорального введения соединения.
[27] Соль бензойной кислоты п.[17], где бензойная кислота может быть замещена одним или более радиоактивным изотопом или нерадиоактивным изотопом.
[28] Настоящее изобретение относится к кристаллическим формам по любому из п.п.[1]-[6], сокристаллам п.[6] и/или солям бензойной кислоты п.[17], которые действуют как ингибиторы RNR.
[00010] Кристаллические формы, сокристаллы и/или соли бензойной кислоты настоящего изобретения проявляют превосходную ингибирующую активность в отношении RNR и стабильность, а также просты в обращении, поскольку они являются негигроскопичными и/или неэлектростатическими. Соответственно, кристаллические формы, сокристаллы и/или соли бензойной кислоты, описанные в данном документе, подходят для применения при лечении заболеваний, связанных с RNR.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[00011] На фиг.1 представлена диаграмма, иллюстрирующая суточные вариации относительного объема опухоли (далее также называемого «RTV») после лечения иллюстративным соединением, описанным в настоящей заявке.
[00012] На фиг.2 представлена диаграмма, иллюстрирующая суточные вариации RTV после лечения иллюстративным соединением, описанным в настоящей заявке.
[00013] На фиг.3 представлена диаграмма, иллюстрирующая суточные вариации RTV после лечения иллюстративным соединением, описанным в настоящей заявке.
[00014] На фиг.4 представлена диаграмма, иллюстрирующая суточные вариации RTV после лечения иллюстративным соединением, описанным в настоящей заявке.
[00015] На фиг.5 показана иллюстративная кристаллическая форма, описанная в настоящей заявке. Иллюстративная кристаллическая форма имела размер кристалла 0,15 × 0,20 × 0,25 мм, была бесцветной и имела форму пластины.
[00016] На фиг.6 представлена порошковая рентгендифрактограмма (XRD) иллюстративного сокристалла.
[00017] На фиг.7 показана кривая дифференциальной сканирующей калориметрии (DSC) иллюстративного сокристалла.
[00018] На фиг.8 показаны изотермические кривые адсорбции/десорбции влаги сокристалла иллюстративного соединения (A) и свободной формы этого же соединения (B).
[00019] На фиг.9 показан результат моделирования рентгеновской дифракционной картины на основе результата анализа монокристалла иллюстративного сокристалла бензойной кислоты.
[00020] На фиг.10 - фиг.12 представлены данные измерения оптической чистоты иллюстративной кристаллической формы.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[00021] Настоящее изобретение относится к кристаллическим формам, сокристаллам или солям бензойной кислоты соединения, выбранного из группы, состоящей из следующих:
5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-хлор-2-(N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-бром-2-(N-((1S,2R)-2-(2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-хлор -2-(N-(1S,2R)-2-(2-фторнафталин-1-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил) сульфамоил)бензамид;
5-хлор-2-(N-((1S,2R)-2-(3-этил-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-бром-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
2-(N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-5-хлор-бензамид;
5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-6-(пирролидин-1-карбонил)пиридин-2-сульфонамид;
5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамид;
5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамид;
N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-5-хлор-4-гидрокси-4-метилхроман-8-сульфонамид;
5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамид;
5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид;
3-хлор-6-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-N, N-диметилпиколинамид;
4-амино-2-метокси-N-((1S,2R)-2-(8-метилнафталин-1-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамид;
4-амино-N-((1S,2R)-2-(2,3-дигидро-1H-инден-4-ил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-2-метоксибензолсульфонамид; и
5-хлор-2-(((1S,2R)-метил-d3-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид.
[00022] В некоторых вариантах осуществления соединение выбрано из группы, состоящей из следующих:
5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-хлор-2-(N-((1S,2R)-2-(3-этил-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил) бензамид;
5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамид;
5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамид;
N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-5-хлор-4-гидрокси-4-метилхроман-8-сульфонамид;
5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамид; и
5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид.
[00023] В дополнительных вариантах осуществления соединение выбрано из группы, состоящей из следующих:
5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид;
5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамид; и
5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид.
[00024] В некоторых вариантах осуществления соединение представляет собой 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид. В некоторых вариантах осуществления настоящее изобретение относится к кристаллической форме 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида или сокристаллу бензойной кислоты и соединения.
[00025] В некоторых вариантах осуществления соединение представляет собой 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид. В некоторых вариантах осуществления настоящее изобретение относится к кристаллическим формам 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида или сокристаллу бензойной кислоты и соединения.
[00026] В некоторых вариантах осуществления соединение представляет собой 5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид. В некоторых вариантах осуществления настоящее изобретение относится к кристаллической форме 5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида или сокристаллу бензойной кислоты и соединения.
[00027] В некоторых вариантах осуществления соединение представляет собой 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамид. В некоторых вариантах осуществления настоящее изобретение относится к кристаллической форме 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамида или сокристаллу бензойной кислоты и соединения.
[00028] В некоторых вариантах осуществления соединение представляет собой 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид. В некоторых вариантах осуществления настоящее изобретение относится к кристаллической форме 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамида или сокристаллу бензойной кислоты и соединения.
[00029] Кристаллические формы соединений, сокристаллы и/или соли бензойной кислоты настоящего изобретения и их интермедиаты могут быть выделены и очищены с помощью хорошо известных методов разделения и очистки, таких как рекристаллизация, кристаллизация, дистилляция и колоночная хроматография.
[00030] Когда оптические изомеры, стереоизомеры, таутомеры или поворотные изомеры возможны в виде кристаллической формы соединений, сокристаллов или солей бензойной кислоты настоящего изобретения, но не представлены в явном виде, подразумевается, что кристаллические формы соединений, сокристаллы и/или соли бензойной кислоты охватывают эти изомеры по отдельности или в виде их смесей. Например, если не утверждается иное, когда кристаллическая форма соединения, сокристалл и/или соль бензойной кислоты настоящего изобретения присутствует в виде рацемата, возможные энантиомеры и/или диастереомеры, которые могут быть разделены из рацемата, также рассматриваются как охватываемые настоящим изобретением. Энантиомеры и/или диастереомеры обычно могут быть получены хорошо известными способами синтеза.
[00031] Как используется в настоящем документе и если не указано иное, термин «кристалл» и родственные термины, используемые в данном документе, когда они используются для описания соединения, вещества, модификации, материала, компонента или продукта, означает, что соединение, вещество, модификация, материал, компонент или продукт являются по существу кристаллическими, как определено по данным рентгендифракционного анализа. См., например, Remington: The Science and Practice of Pharmacy, 21st edition, Lippincott, Williams and Wilkins, Baltimore, MD (2005); The United States Pharmacopeia, 23rd ed. 1843-1844 (1995).
[00032] Как используется в настоящем документе и если не указано иное, термин «кристаллическая форма» и родственные термины в данном документе относятся к твердым формам, которые являются кристаллическими. Кристаллические формы включают однокомпонентные кристаллические формы и многокомпонентные кристаллические формы, и могут необязательно включать, без ограничения, сокристаллы, соли (включая фармацевтически приемлемые соли), полиморфы, сольваты, гидраты и/или другие молекулярные комплексы. В некоторых вариантах осуществления кристаллическая форма вещества может по существу не содержать аморфных форм и/или других кристаллических форм. В некоторых вариантах осуществления кристаллическая форма вещества может содержать менее чем примерно 0,1%, 0,5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или 50% одной или более аморфных форм и/или других кристаллических форм по массе.
[00033] Термин «сокристалл» относится к молекулярному комплексу, полученному из ряда образователей сокристаллов, известных в данной области. В отличие от соли, сокристалл обычно не включает перенос водорода между образователем сокристалла и лекарственным средством, и вместо этого включает межмолекулярные взаимодействия, такие как образование водородной связи, группирование ароматического кольца или дисперсионные силы, между образователем сокристалла и сульфонамидным соединением в кристаллической структуре. В некоторых вариантах осуществления настоящее изобретение относится к сокристаллу, содержащему или состоящему из бензойной кислоты и сульфонамидного соединения, как описано в настоящей заявке.
[00034] Как используется в настоящем документе и если не указано иное, термины «полиморфы», «полиморфные формы» и родственные термины в данном документе относятся к двум или более кристаллическим формам, которые состоят по существу из одной и той же молекулы, молекул и/или ионов. Как и разные кристаллические формы, разные полиморфы могут иметь различные физические свойства, такие как, например, температура плавления, удельная теплота плавления, растворимость, свойства растворимости и/или колебательные спектры, в результате расположения или конформации молекул и/или ионов в кристаллической решетке. Различия в физических свойствах могут влиять на такие фармацевтические параметры, как стабильность при хранении, спрессовываемость и плотность (важные при составлении и производстве продукта) и скорость растворения (важный фактор биодоступности). Различия в стабильности могут быть вызваны изменением химической реакционной способности (например, разное окисление, благодаря которому лекарственная форма обесцвечивается быстрее в том случае, когда содержит один полиморф, по сравнению с формой, содержащей другой полиморф) или механическими изменениями (например, таблетки крошатся при хранении, так как кинетически предпочтительный полиморф превращается в термодинамически более стабильный полиморф) или и того и другого (например, таблетки одного полиморфа более чувствительны к разрушению при высокой влажности). В результате различий растворимости/растворения в крайнем случае некоторые полиморфные превращения могут приводить к потере активности или в другом крайнем случае - к токсичности. Кроме того, физические свойства могут быть важны при обработке (например, один полиморф может с большей вероятностью образовывать сольваты или же может с трудом поддаваться фильтрованию и отмыванию от примесей, и форма частиц и распределение по размерам могут быть разными у разных полиморфов).
[00035] Как используется в настоящем документе и если не указано иное, термин «аморфный», «аморфная форма» и родственные термины, используемые в настоящем документе, означают, что рассматриваемое вещество, компонент или продукт не является по существу кристаллическим, что определяют по данным рентгендифракционного анализа. В частности, термин «аморфная форма» описывает неупорядоченную твердую форму, т. е. твердую форму, лишенную дальнего кристаллического порядка.
[00036] Термин «фармацевтически приемлемая соль» относится к солям, полученным из различных органических и неорганических противоионов, известных в данной области. Фармацевтически приемлемая соль может быть безопасной для потребления животным или человеком.
[00037] В одном аспекте изобретение относится к кристаллической форме сульфонамидного соединения, как описано выше. В некоторых вариантах осуществления структура кристалла сульфонамидного соединения, описанного в настоящем документе, включает листовидную, пластинчатую и/или планарную кристаллическую структуру.
[00038] Способы определения кристаллических форм и аморфных форм включают, без ограничения, термогравиметрический анализ (TGA), дифференциальную сканирующую калориметрию (DSC), рентгеновскую порошковую дифрактометрию (XRPD), монокристальную рентгеновскую дифрактометрию, колебательную спектроскопию, например, инфракрасную (ИК) и рамановскую спектроскопию, ядерную магнитно-резонансную (ЯМР) спектроскопию в твердой фазе и растворе, оптическую микроскопию, оптическую микроскопию с нагреванием, сканирующую электронную микроскопию (SEM), электронную кристаллографию и количественный анализ, анализ размера частиц (PSA), анализ площади поверхности, определения растворимости, определения растворения, элементный анализ и анализ по методу Карла Фишера. Характеристические параметры элементарной ячейки могут быть определены с использованием одного или более методов, таких как, без ограничения, рентгеновская дифракция и нейтронная дифракция, включая монокристальную дифракцию и порошковую дифракцию. Методы, подходящие для анализа данных порошковой дифракции, включают уточнение профиля, например, уточнение по Ритвельду, которое можно использовать, например, для анализа дифракционных пиков, связанных с одной фазой в образце, содержащем более одной твердой фазы. Другие способы, подходящие для анализа данных порошковой дифракции, включают индексирование элементарной ячейки, которое позволяет специалисту в данной области определить параметры элементарной ячейки из образца, содержащего кристаллический порошок.
[00039] В спектре порошковой рентгеновской дифракции угол дифракции и общая картина могут быть важными для идентификации идентичности кристалла из-за характера данных. Относительная интенсивность спектра порошковой рентгеновской дифракции может варьировать в зависимости от направления роста кристаллов, размера частиц или условий измерения и, следовательно, не должна интерпретироваться строго. Кроме того, некоторые значения, полученные из различных спектров, могут вызывать некоторые ошибки в зависимости от направления роста кристаллов, размера частиц, условий измерения и тому подобного. Например, угол дифракции может быть углом дифракции (2θ±0,2°) в спектре порошковой рентгеновской дифракции, что означает, что угол дифракции может отдельно находиться в диапазоне ±0,2° от любого конкретного значения, если не указано иное.
[00040] В некоторых вариантах осуществления изобретение относится к кристаллической форме 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида. В дополнительных вариантах осуществления рентгеновская дифрактограмма этой кристаллической формы имеет два или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более, или девять пиков при (2θ±0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0°) 6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°. В других вариантах осуществления кристаллическая форма 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида имеет эндотермический пик от примерно 154, 155, 156, 157, 158, 159, 160 или 161°С до примерно 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170°С по данным DSC. В некоторых вариантах осуществления кристаллическая форма 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида имеет эндотермический пик от 155°С до 168°С, от 158°С до 162°С, от 159°С до 161°С, от 159°С до 165°С или от 160°С до 163°С по данным DSC. В дополнительных вариантах осуществления кристаллическая форма 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида имеет эндотермический пик примерно 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170°С по данным DSC. В дополнительных вариантах осуществления оптическая чистота данной кристаллической формы составляет 100% э.и.
[00041] В некоторых вариантах осуществления изобретение относится к кристаллической форме 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида. В дополнительных вариантах осуществления рентгеновская дифрактограмма этой кристаллической формы имеет два или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более, или девять пиков при (2θ±0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0°) 6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°. В других вариантах осуществления кристаллическая форма 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида имеет эндотермический пик от примерно 154, 155, 156, 157, 158, 159, 160 или 161°С до примерно 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170°С по данным DSC. В некоторых вариантах осуществления кристаллическая форма 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида имеет эндотермический пик от 155°С до 168°С, от 158°С до 162°С, от 159°С до 161°С, от 159°С до 165°С или от 160°С до 163°С по данным DSC. В дополнительных вариантах осуществления кристаллическая форма 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида имеет эндотермический пик примерно 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170 °С по данным DSC. В дополнительных вариантах осуществления оптическая чистота данной кристаллической формы составляет 100% э.и.
[00042] В некоторых вариантах осуществления изобретение относится к кристаллической форме 5-хлор-2-(N-((1S,2R)-2-(3-этил-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида. В дополнительных вариантах осуществления рентгеновская дифрактограмма этой кристаллической формы имеет два или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более, или девять пиков при (2θ±0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0 °) 6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°. В других вариантах осуществления кристаллическая форма 5-хлор-2-(N-((1S,2R)-2-(3-этил-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида имеет эндотермический пик от примерно 154, 155, 156, 157, 158, 159, 160 или 161 °С до примерно 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170 °С по данным DSC. В некоторых вариантах осуществления кристаллическая форма 5-хлор-2-(N-((1S,2R)-2-(3-этил-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида имеет эндотермический пик от 155°С до 168°С, от 158°С до 162°С, от 159°С до 161°С, от 159°С до 165°С или от 160°С до 163°С по данным DSC. В дополнительных вариантах осуществления кристаллическая форма 5-хлор-2-(N-((1S,2R)-2-(3-этил-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида имеет эндотермический пик примерно 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170 °С по данным DSC. В дополнительных вариантах осуществления оптическая чистота данной кристаллической формы составляет 100% э.и.
[00043] В некоторых вариантах осуществления изобретение относится к сокристаллу бензойной кислоты и 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида. В дополнительных вариантах осуществления рентгеновская дифрактограмма этого сокристалла имеет два или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более, или девять пиков при (2θ±0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0°) 6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°. В других вариантах осуществления данный сокристалл имеет эндотермический пик от примерно 154, 155, 156, 157, 158, 159, 160 или 161 °С до примерно 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170°С по данным DSC. В некоторых вариантах осуществления сокристалл бензойной кислоты и 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида имеет эндотермический пик от 155°С до 168°С, от 158°С до 162°С, от 159°С до 161°С, от 159°С до 165°С или от 160°С до 163°С по данным DSC. В дополнительных вариантах осуществления данный сокристалл имеет эндотермический пик примерно 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170 °С по данным DSC. В дополнительных вариантах осуществления оптическая чистота данного сокристалла бензойной кислоты составляет 100% э.и.
[00044] В некоторых вариантах осуществления изобретение относится к кристаллической форме 5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида. В дополнительных вариантах осуществления рентгеновская дифрактограмма этой кристаллической формы имеет два или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более, или девять пиков при (2θ±0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0 °) 6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°. В других вариантах осуществления кристаллическая форма 5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида имеет эндотермический пик от примерно 154, 155, 156, 157, 158, 159, 160 или 161 °С до примерно 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170 °С по данным DSC. В некоторых вариантах осуществления кристаллическая форма 5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил) бензамида имеет эндотермический пик от 155°С до 168°С, от 158°С до 162°С, от 159°С до 161°С, от 159°С до 165°С или от 160°С до 163°С по данным DSC. В дополнительных вариантах осуществления кристаллическая форма 5-хлор-2-(N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил) бензамида имеет эндотермический пик примерно 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170 °С по данным DSC. В дополнительных вариантах осуществления оптическая чистота данной кристаллической формы составляет 100% э.и.
[00045] В некоторых вариантах осуществления изобретение относится к кристаллической форме 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамида. В дополнительных вариантах осуществления рентгеновская дифрактограмма этой кристаллической формы имеет два или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более, или девять пиков при (2θ±0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0°) 6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°. В других вариантах осуществления кристаллическая форма 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамида имеет эндотермический пик от примерно 154, 155, 156, 157, 158, 159, 160 или 161°С до примерно 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170 °С по данным DSC. В некоторых вариантах осуществления кристаллическая форма 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамида имеет эндотермический пик от 155°С до 168°С, от 158°С до 162°С, от 159°С до 161°С, от 159°С до 165°С или от 160°С до 163°С по данным DSC. В дополнительных вариантах осуществления кристаллическая форма 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамида имеет эндотермический пик примерно 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170 °С по данным DSC. В дополнительных вариантах осуществления оптическая чистота данной кристаллической формы составляет 100% э.и.
[00046] В некоторых вариантах осуществления изобретение относится к кристаллической форме 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамида. В дополнительных вариантах осуществления рентгеновская дифрактограмма этой кристаллической формы имеет два или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более, или девять пиков при (2θ±0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0 °) 6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°. В других вариантах осуществления кристаллическая форма 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамида имеет эндотермический пик от примерно 154, 155, 156, 157, 158, 159, 160 или 161°С до примерно 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170°С по данным DSC. В некоторых вариантах осуществления кристаллическая форма 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамида имеет эндотермический пик от 155°С до 168°С, от 158°С до 162°С, от 159°С до 161°С, от 159°С до 165°С или от 160°С до 163°С по данным DSC. В дополнительных вариантах осуществления кристаллическая форма 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метилхроман-8-сульфонамида имеет эндотермический пик примерно 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170 °С по данным DSC. В дополнительных вариантах осуществления оптическая чистота данной кристаллической формы составляет 100% э.и.
[00047] В некоторых вариантах осуществления изобретение относится к кристаллической форме N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-5-хлор-4-гидрокси-4-метилхроман-8-сульфонамида. В дополнительных вариантах осуществления рентгеновская дифрактограмма этой кристаллической формы имеет два или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более, или девять пиков при (2θ±0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0°) 6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°. В других вариантах осуществления кристаллическая форма N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-5-хлор-4-гидрокси-4-метилхроман-8-сульфонамида имеет эндотермический пик от примерно 154, 155, 156, 157, 158, 159, 160 или 161 °С до примерно 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170°С по данным DSC. В некоторых вариантах осуществления кристаллическая форма N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-5-хлор-4-гидрокси-4-метилхроман-8-сульфонамида имеет эндотермический пик от 155°С до 168°С, от 158°С до 162°С, от 159°С до 161°С, от 159°С до 165°С или от 160°С до 163°С по данным DSC. В дополнительных вариантах осуществления кристаллическая форма N-((1S,2R)-2-(3-бром-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-5-хлор-4-гидрокси-4-метилхроман-8-сульфонамида имеет эндотермический пик примерно 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170 °С по данным DSC. В дополнительных вариантах осуществления оптическая чистота данной кристаллической формы составляет 100% э.и.
[00048] В некоторых вариантах осуществления изобретение относится к кристаллической форме 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамида. В дополнительных вариантах осуществления рентгеновская дифрактограмма этой кристаллической формы имеет два или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более, или девять пиков при (2θ±0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0 °) 6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°. В других вариантах осуществления кристаллическая форма 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамида имеет эндотермический пик от примерно 154, 155, 156, 157, 158, 159, 160 или 161 °С до примерно 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170 °С по данным DSC. В некоторых вариантах осуществления кристаллическая форма 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамида имеет эндотермический пик от 155°С до 168°С, от 158°С до 162°С, от 159°С до 161°С, от 159°С до 165°С или от 160°С до 163°С по данным DSC. В дополнительных вариантах осуществления кристаллическая форма 5-хлор-N-((1S,2R)-2-(3-хлор-6-фтор-2-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамида имеет эндотермический пик примерно 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170 °С по данным DSC. В дополнительных вариантах осуществления оптическая чистота данной кристаллической формы составляет 100% э.и.
[00049] В некоторых вариантах осуществления изобретение относится к кристаллической форме 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамида. В дополнительных вариантах осуществления рентгеновская дифрактограмма этой кристаллической формы имеет два или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более, или девять пиков при (2θ±0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0 °) 6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°. В других вариантах осуществления кристаллическая форма 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамида имеет эндотермический пик от примерно 154, 155, 156, 157, 158, 159, 160 или 161 °С до примерно 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170 °С по данным DSC. В некоторых вариантах осуществления кристаллическая форма 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамида имеет эндотермический пик от 155°С до 168°С, от 158°С до 162°С, от 159°С до 161°С, от 159°С до 165°С или от 160°С до 163°С по данным DSC. В дополнительных вариантах осуществления кристаллическая форма 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамида имеет эндотермический пик примерно 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169 или 170 °С по данным DSC. В дополнительных вариантах осуществления оптическая чистота данной кристаллической формы составляет 100% э.и.
[00050] В некоторых вариантах осуществления рентгеновская дифрактограмма кристаллической формы настоящего изобретения имеет два или более пика при (2Ɵ±0,2°) 6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°. В некоторых вариантах осуществления кристаллическая форма имеет эндотермический пик от 155°C до 168°C по данным DSC. В дополнительных вариантах осуществления кристаллическая форма настоящего изобретения может характеризоваться комбинацией описанных выше вариантов осуществления, которые не противоречат друг другу. Например, кристаллическая форма может характеризоваться комбинацией описанных выше пиков рентгеновской дифрактограммы и описанного выше эндотермического пика, измеренного методом DSC.
[00051] Термин «примерно», используемый для максимальной температуры эндотермического пика на кривой DSC, означает, что значение температуры находится в диапазоне±2, 3, 4 или 5 °C от этого значения.
[00052] Если в настоящем документе не указано иное, термин «примерно» при использовании в связи с числовым значением или диапазоном значений, который приводится для характеристики конкретной твердой формы, например, конкретная температура или температурный диапазон; изменение массы, такое как, например, изменение массы в зависимости от температуры или влажности; содержание растворителя или воды в пересчете, например, на массу или процентное содержание; или положение пика, такое как, например, в анализе методом ИК или рамановской спектроскопии или XRPD; указывают, что значение или диапазон значений могут отклоняться до степени, считающейся приемлемой для специалиста в данной области техники, при этом все еще описывая данную конкретную твердую форму. Например, в конкретных вариантах осуществления термин «примерно» при использовании в данном контексте и, если не указано иное, указывает, что числовое значение или диапазон значений может варьировать в пределах 25, 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1, 0,5 или 0,25% от приведенного значения или диапазона значения.
[00053] В некоторых вариантах осуществления кристаллическая форма, сокристалл или соль бензойной кислоты, описанные в данном документе, могут содержать множество кристаллов (кристаллических полиморфов), имеющих пространственно регулярное расположение атомов и различные физико-химические свойства. В дополнительных вариантах осуществления кристаллическая форма, сокристалл или соль бензойной кислоты, описанные в данном документе, могут представлять собой смесь с кристаллическими полиморфами.
[00054] В некоторых вариантах осуществления в кристаллической форме, сокристалле или соли бензойной кислоты настоящего изобретения молярное отношение сульфонамидного соединения к бензойной кислоте составляет от примерно 0,4 до примерно 1,6, от примерно 0,6 до примерно 1,4, от примерно 0,8 до примерно 1,2, от примерно 0,9 до примерно 1,1, или от примерно 1 до примерно 1. В дополнительных вариантах осуществления в кристаллической форме, сокристалле или соли бензойной кислоты настоящего изобретения молярное отношение сульфонамидного соединения к бензойной кислоте составляет от примерно 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,1, 1,2, 1,3 до примерно 1,3, 1,2, 1,1, 1,0, 0,9, 0,8, 0,7, 0,6, 0,5 или 0,4. В других вариантах осуществления молярное отношение сульфонамидного соединения к бензойной кислоте составляет примерно 1:1.
[00055] В соответствии с некоторыми вариантами осуществления кристаллических форм, сокристаллов или солей бензойной кислоты настоящего изобретения сульфонамидное соединение или бензойная кислота могут быть замещены одним или более радиоактивным изотопом или нерадиоактивным изотопом.
[00056] В некоторых вариантах осуществления оптическая чистота кристаллической формы, сокристалла или соли бензойной кислоты, описанных в настоящем документе, составляет по меньшей мере примерно 70, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5 или 99,8%. Используемый здесь термин «оптическая чистота» или «хиральная чистота» относится к отношению наблюдаемого оптического вращения образца, имеющего смесь энантиомеров, к оптическому вращению одного чистого энантиомера. В дополнительных вариантах осуществления оптическая чистота составляет примерно 95% или более. В других вариантах осуществления оптическая чистота составляет примерно 98% или более. В еще одних вариантах осуществления оптическая чистота составляет примерно 100%. В некоторых вариантах осуществления оптическая чистота может быть измерена с помощью ВЭЖХ. В некоторых вариантах осуществления настоящее изобретение относится к способам повышения оптической чистоты сульфонамидного соединения, описанного в настоящем документе, путем смешивания сульфонамидного соединения с бензойной кислотой или путем образования кристаллической формы, сокристалла или соли бензойной кислоты с помощью способов, описанных в настоящем документе.
[00057] В некоторых вариантах осуществления кристаллическая форма, сокристалл или соль бензойной кислоты соединения, описанного в настоящем документе, могут быть физически и/или химически чистыми. В некоторых вариантах осуществления кристаллическая форма, сокристалл или соль бензойной кислоты соединения, описанного в настоящем документе, могут быть по меньшей мере примерно на 100, 99, 98, 97, 96, 95, 94, 93, 92, 91, 90, 89, 88, 87, 86, 85, 84, 83, 82, 81 или 80% физически и/или химически чистыми. В некоторых вариантах осуществления кристаллическая форма, сокристалл или соль бензойной кислоты соединения, описанного в настоящем документе, являются по существу чистыми. Как используется в данном описании и если не указано иное, образец, содержащий конкретную кристаллическую форму или аморфную форму, которая является «по существу чистой», например, по существу, не содержащей других твердых форм и/или других химических соединений, содержит в частных вариантах осуществления менее чем примерно 25%, 20%, 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,75%, 0,5%, 0,25% или 0,1% масс. одной или более других твердых форм и/или других химических соединений.
[00058] В некоторых вариантах осуществления кристаллическая форма, сокристалл или соль бензойной кислоты, описанные в данном документе, являются стабильными в условиях примерно 30, 40, 50, 60, 70 или 80°С и примерно 65, 70, 75, 80 или 85% относительной влажности в течение примерно 1, 2, 3, 4, 5, 6, 7, 8, 12, 16, 24, 36, 48, 60, 72, 84, 96, 108, 120, 132, 144, или 156 недель или более и в течение примерно 160, 156, 150, 138, 126, 114, 102, 90, 78, 66, 54, 42, 30, 24, 18, 12 или 6 недель или менее. Состояние может быть закрытым или открытым состоянием. Используемый в данном описании термин «закрытое» состояние может означать, что крышка бутыли, содержащей образец, закрыта или запечатана во время эксперимента на стабильность, а «открытое» состояние может означать, что крышка открыта. В дополнительных вариантах осуществления кристаллическая форма, сокристалл или соль бензойной кислоты, описанные в данном документе, являются стабильными в условиях примерно 40°С и примерно 75% относительной влажности в течение примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21 или 22 недель. В некоторых вариантах осуществления состояние представляет собой закрытое состояние. В других вариантах осуществления кристаллическая форма, сокристалл или соль бензойной кислоты, описанные в данном документе, являются стабильными в условиях примерно 40°С и примерно 75% относительной влажности в течение примерно 4 недель. В некоторых вариантах осуществления состояние представляет собой закрытое состояние. Таким образом, кристаллические формы, сокристаллы или соли бензойной кислоты, описанные в настоящем документе, проявляют превосходную стабильность при хранении в течение длительного периода времени. При этом, термин «стабильный» означает, что (i) изменение в оптической чистоте составляет примерно 1,0%, 0,5%, 0,3%, 0,1%, 0,05% или 0,01% или менее по сравнению с исходной оптической чистотой, (ii) увеличение количества примесей составляет примерно 1,0%, 0,5%, 0,3%, 0,1%, 0,05% или 0,01% или менее по сравнению с исходным количеством примесей, и/или (iii) рентгендифрактограмма сохраняет 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% или более начальных пиков при (2θ±0,2°).
[00059] Другой аспект настоящего изобретения относится к способу получения кристаллической формы, сокристалла и/или соли бензойной кислоты, описанных в данном документе, причем способ включает: растворение бензойной кислоты и сульфонамидного соединения, описанных в данном документе, в системе растворителей, содержащей по меньшей мере два растворителя; и перенасыщение системы растворителей до тех пор, пока кристаллическая форма, сокристалл и/или соль бензойной кислоты не сформируются и не будут выделены из системы растворителей. В другом аспекте настоящее изобретение относится к способу получения кристаллической формы сульфонамидного соединения, описанного в настоящем документе, из некристаллической формы, причем способ включает: растворение бензойной кислоты и сульфонамидного соединения в системе растворителей, содержащей по меньшей мере два растворителя; и перенасыщение системы растворителей до тех пор, пока из системы растворителей не выкристаллизуется продукт.
[00060] В некоторых вариантах осуществления способ может также включать добавление или смешивание бензойной кислоты с сульфонамидным соединением, описанным в данном документе. В дополнительных вариантах осуществления от примерно 0,8, 0,9, 1, 2, 3, 4 или 5 до примерно 1, 2, 3, 4, 5, 6, 7, 8 или 9 молярных эквивалентов бензойной кислоты относительно сульфонамидного соединения может быть смешано с сульфонамидным соединением. В некоторых вариантах осуществления способ может также включать добавление или смешивание от примерно 0,8 до примерно 5, от примерно 2 до примерно 5, от примерно 3 до примерно 5, от примерно 1 до примерно 4, или от примерно 1 до 6 молярных эквивалентов бензойной кислоты с сульфонамидным соединением, описанным в настоящем документе. В дополнительных вариантах осуществления примерно 1, 2, 3, 4, 5, 6 или 7 молярных эквивалентов бензойной кислоты относительно сульфонамидного соединения может быть смешано с сульфонамидным соединением.
[00061] В дополнительных вариантах осуществления стадия растворения может включать добавление или смешивание системы растворителей с бензойной кислотой и сульфонамидным соединением, при этом система растворителей присутствует в количестве от примерно 10 до примерно 40 раз, от примерно 20 до примерно 30 раз или от примерно 10 до примерно 30 раз большем по объему, включая примерно 10, 11, 12, 13, 14, 15, 18, 20, 22, 25, 27, 30, 35, 38 или 40 раз. В других вариантах осуществления стадия растворения может включать добавление системы растворителей с бензойной кислотой и сульфонамидным соединением, при этом система растворителей присутствует в количестве от примерно 10, 15, 20, 25, 30, 35, 40 раз до примерно 60, 55, 50, 45, 40, 35 или 30 раз большем по объему. В дополнительных вариантах осуществления по меньшей мере один из по меньшей мере двух растворителей в системе растворителей представляет собой гептан или толуол. В других вариантах осуществления система растворителей содержит гептан и толуол.
[00062] В других вариантах осуществления в системе растворителей или в смешанном растворе гептана и толуола доля толуола составляет от примерно 5, 6, 7, 8, 9, 10 или 11 до примерно 10, 15, 17 или 20%, включая примерно 5, 8, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 и 20%. В других вариантах осуществления в смешанном растворе гептана и толуола доля толуола составляет от 5 до 20%, от 10 до 20%, от 5 до 10% или от 8 до 15%.
[00063] В некоторых вариантах осуществления стадия перенасыщения включает нагревание системы растворителей. В других вариантах осуществления стадия перенасыщения включает перемешивание суспензии со стадии растворения при температуре выше комнатной или от примерно 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55 или 56 °C до примерно 50, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65 или 66 °С в течение от примерно 1, 2, 3, 4 или 5 часов до примерно 4, 5, 6, 7, 8, 9, 10, 15, 20, 30 или 40 часов. В еще одних вариантах осуществления стадия перенасыщения включает перемешивание суспензии при температуре от примерно 40°С до примерно 60°С, от примерно 50°С до примерно 60°С, от примерно 40°С до примерно 50°С, или от примерно 38°С до примерно 65°С в течение от примерно 1 ч до примерно 40 ч, от примерно 3 ч до примерно 4 ч, от примерно 4 ч до примерно 5 ч, или от примерно 3 ч до примерно 10 ч. В дополнительных вариантах осуществления стадия перенасыщения включает перемешивание суспензии при температуре от примерно 40°C до примерно 60°С в течение от примерно 3 ч до примерно 10 ч.
[00064] В некоторых вариантах осуществления способ получения кристаллической формы, сокристалла и/или соли бензойной кислоты, описанный здесь, дополнительно включает промывку продукта, полученного на стадии перенасыщения, для удаления оставшегося избытка бензойной кислоты.
[00065] Хотя пролекарства кристаллических форм, сокристаллов или солей бензойной кислоты, как описано здесь, также включены в настоящее изобретение, термин «пролекарство» относится к соединениям, которые превращаются в описанное здесь соединение или его соль реакцией с ферментом или желудочной кислотой в физиологических условиях in vivo, т.е. соединениям, которые превращаются в соединение настоящего изобретения или его соль путем ферментативного окисления, восстановления или гидролиза и тому подобного, или соединениям, которые превращаются в описанное в настоящем документе соединение или его соль под действием желудочной кислоты. Кроме того, пролекарство описанного здесь соединения или его соли может быть соединением, которое превращается в описанное здесь соединение или его соль в физиологических условиях, таких как описанные в Hirokawa Shoten 1990 annual "Development of Pharmaceuticals" Vol. 7, Molecular Design, pages 163-198.
[00066] Кроме того, кристаллические формы, сокристаллы или соли бензойной кислоты настоящего изобретения могут представлять собой сольваты (например, гидраты и т.д.) или несольваты, и обе формы охватываются описанным здесь соединением или его солью. Соединения, меченные изотопами (например, дейтерием, 3H, 14C, 35S, 125I и т.д.) и тому подобное, также охватываются соединениями, описанными в настоящей заявке, или их солью.
[00067] Кристаллическая форма, сокристалл или соль бензойной кислоты, описанные в настоящем документе, проявляют ингибирующую активность в отношении RNR. Кристаллическая форма, сокристалл или соль бензойной кислоты, описанные здесь, подходят в качестве лекарственного средства для профилактики или лечения связанных с RNR заболеваний, не вызывая побочных эффектов, основанных на нецелевых воздействиях ионов железа, требующих белка, благодаря своей превосходной ингибирующей активности в отношении RNR и своей структуре и отсутствию хелатирования ионов металлов. «Заболевание, связанное с RNR», включает заболевания, частота которых может быть снижена или симптомы которых находятся в стадии ремиссии или ослабления и/или полного излечения за счет удаления или подавления и/или ингибирования функций RNR. Такие заболевания включают, например, злокачественные опухоли. Рассматриваемые злокачественные опухоли не имеют особых ограничений и могут включать рак головы и шеи, рак желудочно-кишечного тракта (например, рак пищевода, рак желудка, рак двенадцатиперстной кишки, рак печени, рак желчных протоков (например, рак желчного пузыря или желчевыводящих путей и т.д.), рак поджелудочной железы, колоректальный рак (например, рак толстой кишки, рак прямой кишки и т.д.), и т.д.), рак легких (например, немелкоклеточный рак легкого, мелкоклеточный рак легкого, мезотелиому и т.д.), рак молочной железы, генитальный рак (например, рак яичников и рак матки (например, рак шейки матки, рак эндометрия, и т.д.) и т.д.), рак мочеполовой системы (например, рак почки, рак мочевого пузыря, рак предстательной железы, тестикулярную опухоль и т.д.), опухоли кроветворной ткани (например, лейкоз, злокачественную лимфому, множественную миелому и т.д.), опухоли кости и мягких тканей, рак кожи, опухоли головного мозга и тому подобное.
[00068] «RNR» в данном документе включает человеческую RNR или нечеловеческую RNR.
[00069] Соответственно, настоящее изобретение предлагает ингибитор RNR, который включает кристаллическую форму, сокристалл или соль бензойной кислоты, описанные в данном документе в качестве активного ингредиента. Кроме того, настоящее изобретение относится к применению кристаллической формы, сокристалла или соли, описанных в данном документе, для получения ингибиторов RNR. Настоящее изобретение также предлагает применение кристаллической формы, сокристалла или соли бензойной кислоты, описанных в данном документе, в качестве ингибиторов RNR. Кроме того, настоящее изобретение предлагает кристаллическую форму, сокристалл или соль бензойной кислоты, описанные в данном документе, для применения в профилактике или лечении нарушений, связанных с ингибиторами RNR.
[00070] В еще одном варианте осуществления настоящее изобретение предлагает лекарственное средство, содержащее кристаллическую форму, сокристалл или соль бензойной кислоты, описанные в данном документе, в качестве активного ингредиента. Кроме того, настоящее изобретение относится к применению кристаллической формы, сокристалла или соли бензойной кислоты, описанных в данном документе, для получения лекарственного средства. Кроме того, настоящее изобретение предлагает применение в качестве лекарственных средств кристаллической формы, сокристалла или соли бензойной кислоты, описанных в данном документе. Кроме того, настоящее изобретение предлагает кристаллическую форму, сокристалл или соль бензойной кислоты, описанные в данном документе, для применения в качестве лекарственного средства.
[00071] В еще одном варианте осуществления настоящее изобретение предлагает фармацевтическую композицию, содержащую кристаллическую форму, сокристалл или соль бензойной кислоты, описанные в данном документе, и фармацевтически приемлемый носитель. Кристаллическая форма, сокристалл или соль бензойной кислоты, описанные в данном документе, имеют низкую или нулевую гигроскопичность и низкую способность накапливать электростатический заряд, что приводит к превосходным свойствам обработки. По мере снижения гигроскопичности решается проблема сохранения и контроля влажности, присутствующей в состоянии хранения, и во время изготовления твердого препарата, такого как таблетка или капсула, качество препарата (однородность) можно легко контролировать путем контроля массы. Кроме того, поскольку способность накапливать электростатический заряд низкая, прилипание к производственному оборудованию и упаковке является незначительным.
[00072] В некоторых вариантах осуществления лекарственное средство или фармацевтическая композиция представляет собой терапевтическое средство для заболеваний, связанных с RNR, и в более предпочтительном варианте осуществления лекарственное средство или фармацевтическая композиция представляет собой противоопухолевое средство.
[00073] В дополнительных вариантах осуществления настоящее изобретение относится к введению эффективного количества кристаллической формы, сокристалла или соли бензойной кислоты, описанных в данном документе, нуждающемуся в этом субъекту, для обеспечения способа подавления активности RNR. Кроме того, настоящее изобретение включает введение эффективного количества кристаллической формы, сокристалла или соли бензойной кислоты, описанных в данном документе, субъекту для обеспечения способа предотвращения, ослабления или лечения заболеваний, связанных с RNR. В некоторых вариантах осуществления способ предотвращения, ослабления или лечения заболеваний, связанных с RNR, представляет собой способ предотвращения, ослабления или лечения опухолей. В данном способе субъекты включают в себя человека или отличных от человека животных (например, коров, свиней, лошадей, собак, кошек и тому подобное), нуждающихся в таком способе. В дополнительных вариантах осуществления субъект может быть субъектом, страдающим от заболевания, связанного с RNR, описанного в данном документе.
[00074] При использовании кристаллической формы, сокристалла или соли бензойной кислоты, описанных в данном документе в качестве фармацевтического средства, его необязательно вводят в состав вместе с фармацевтически приемлемым носителем, и могут быть выбраны различные лекарственные формы в соответствии с профилактическими или терапевтическими целями, и в качестве лекарственных форм используются, например, пероральные средства, инъекции, суппозитории, мази и любые подобные пластыри. Поскольку кристаллическая форма, сокристалл или соль бензойной кислоты, описанные в данном документе, обладает превосходной всасываемостью при пероральном введении, пероральные агенты являются предпочтительными. Данные лекарственные формы могут быть получены обычными способами, известными в данной области техники.
[00075] Что касается фармацевтически приемлемых носителей, в качестве фармацевтических материалов используются различные традиционные органические или неорганические вещества-носители, вводимые в состав как: эксципиенты, связующие, разрыхлители, смазывающие вещества, красители для твердых препаратов; и растворители, солюбилизаторы, суспендирующие средства, изотонизирующие средства, буферы, смягчающие средства для жидких препаратов и тому подобное. Кроме того, при необходимости также можно использовать фармацевтические добавки, которые включают консерванты, антиоксиданты, красители, подсластители, ароматизаторы и стабилизаторы.
[00076] Что касается фармацевтически приемлемых носителей и фармацевтических добавок, то обычно они включают, например, в качестве эксципиента: лактозу, сахарозу, хлорид натрия, глюкозу, крахмал, карбонат кальция, каолин, микрокристаллическую целлюлозу, кремниевую кислоту и тому подобное; в качестве связующих: воду, этанол, пропанол, простой сироп, раствор глюкозы, раствор крахмала, раствор желатина, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилкрахмал, метилцеллюлозу, этилцеллюлозу, шеллак, фосфат кальция, поливинилпирролидон, и тому подобное; в качестве разрыхлителей: сухой крахмал, альгинат натрия, порошкообразный агар, гидрокарбонат натрия, карбонат кальция, лаурилсульфат натрия, моноглицерид стеариновой кислоты, лактозу и тому подобное; в качестве смазывающих веществ: очищенный стеарат талька, буру, полиэтиленгликоль и тому подобное; в качестве красителей: оксид титана, оксид железа и тому подобное; в качестве ароматизаторов: сахарозу, апельсиновую цедру, лимонную кислоту, винную кислоту и тому подобное.
[00077] Твердый препарат для перорального применения может быть получен путем добавления эксципиента к кристаллической форме, сокристаллу или соли бензойной кислоты, описанным в данном документе, и при необходимости также могут быть добавлены связующие, разрыхлители, смазывающие вещества, красители или ароматизаторы и тому подобное, с последующим введением в состав таблеток, покрытых оболочкой таблеток, гранул, порошков, капсул и тому подобного.
[00078] Инъекционные формы могут быть получены путем добавления регуляторов рН, буферов, стабилизаторов, изотонических средств, местных анестетиков и тому подобного к кристаллической форме, сокристаллу или соли бензойной кислоты, описанным в данном документе, с последующим введением в состав подкожных, внутримышечных и внутривенных инъекционных форм обычным способом.
[00079] При получении ректального суппозитория суппозиторий может быть изготовлен обычным способом после добавления эксципиента и, если необходимо, поверхностно-активного вещества и тому подобного к активному ингредиенту, описанному в данном документе. При получении в виде мази, например пасты, крема и геля, основу, стабилизатор, смачивающий агент, консервант и тому подобное смешивают по мере необходимости и готовят обычным способом. Например, в качестве основы могут использоваться белый вазелин, парафин, глицерин, производные целлюлозы, полиэтиленгликоль, силикон, бентонит и тому подобное. В качестве консервантов могут использоваться метилпарагидроксибензоат, этилпарагидроксибензоат, пропилпарагидроксибензоат и тому подобное. В случае изготовления пластыря мазь, крем, гель, паста или тому подобное могут быть нанесены на подложку известным способом. В качестве подложки может быть использован тканый материал, изготовленный из хлопка, штапельного, синтетического волокна, нетканый материал, пленка из мягкого винилхлорида, полиэтилена, полиуретана или тому подобного или листовой пенопласт.
[00080] Количество кристаллической формы, сокристалла или соли бензойной кислоты, описанных здесь, которое должно входить в состав в каждой единичной дозированной форме, описанной выше, может составлять, в общем случае, на единичную дозированную форму, от примерно 0,05 мг, 0,1 мг, 1 мг, 5 мг, 10 мг или 20 мг до примерно 100 мг, 500 мг или 1000 мг для перорального препарата, от примерно 0,01 мг или 0,1 мг до примерно 200 мг, 300 мг или 500 мг для инъекционной формы, и от примерно 1 мг, 5 мг или 10 мг до примерно 100 мг, 500 мг или 1000 мг для суппозиториев, при условии, что эти количества могут быть изменены в зависимости от симптомов пациентов, у которых они должны применяться, или от их лекарственных форм.
[00081] Кроме того, суточная доза лекарственного средства с лекарственной формой составляет применительно к кристаллической форме, сокристаллу или описанной здесь соли от 0,05 мг в сутки до 5000 мг в сутки для взрослого человека (масса тела 50 кг), предпочтительно от 0,1 мг до 2000 мг, и предпочтительно указанные выше количества вводят один или два-три раза в сутки при условии, что их можно изменять в зависимости от симптомов пациента, веса, возраста или пола и тому подобного.
[00082] Аналогичные вещества, описанные на фиг.10 - фиг.12, также включены в настоящую заявку. Аналогичные вещества настоящего изобретения могут быть синтезированы известными способами или могут быть получены из коммерчески доступных продуктов. Аналогичные вещества могут быть идентифицированы путем сравнения времен удерживания при высокоэффективной жидкостной хроматографии, масс-спектров и результатов анализа с использованием детектора на фотодиодной матрице (PDA) между полученными таким образом аналогичными веществами и аналогичными веществами, детектированными в соответствии с настоящим изобретением.
[00083] Кроме того, эти аналогичные вещества могут быть количественно измерены методом с использованием внешнего стандарта или методом с использованием внутреннего стандарта.
[00084] Когда эти аналогичные вещества возможно содержатся в качестве примесей в лекарственном средстве или фармацевтическом препарате, эти аналогичные вещества регулируются в соответствии с руководством ICH-Q3A Международного совета по гармонизации технических требований к фармацевтическим препаратам для использования человеком. Способ настоящего изобретения является весьма полезным, поскольку возможно подтвердить соответствие стандарту руководства.
[00085] Аналогичные вещества приведены в следующей таблице.
[00086] [Таблица 1]
(2S,3R)-2-((2-карбамоил-4-хлорфенил)сульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановая кислота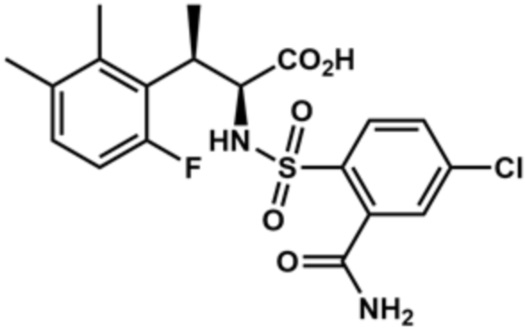
5-((1S,2R)-1-(5-хлор-1,1-диоксидо-3-оксобензо[d]изотиазол-2(3H)-ил)-2-(6-фтор-2,3-диметилфенил)пропил)-1,3,4-оксадиазол-2(3H)-он
5-хлор-2-(N-((2S,3R)-3-(6-фтор-2,3-диметилфенил)-1-гидразинил-1-оксобутан-2-ил)сульфамоил)бензамид
5-хлор-2-(N-((1S,2R)-2-(2-фтор-5-метилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид

Примеры
[00087] Настоящее изобретение в соответствии с некоторыми вариантами осуществления описано ниже более подробно с помощью экспериментальных примеров, но настоящее изобретение не предполагает ограничения этими примерами.
[00088] Различные реагенты, использованные в примерах, представляли собой коммерчески доступные продукты, если не утверждается иное. Колонку Biotage Ltd. SNAP-ULTRA (зарегистрированный товарный знак), заполненную диоксидом кремния, использовали для колоночной хроматографии на силикагеле, или колонку производства Biotage SNAP KP-C18-HS (зарегистрированный товарный знак), заполненную диоксидом кремния, использовали для обращенно-фазовой колоночной хроматографии на силикагеле. ВЭЖХ очистку с помощью препаративной обращенно-фазовой колоночной хроматографии выполняли в следующих условиях. Объем вводимой пробы и градиент осуществлялись соответствующим образом.
Колонка: YMC-Actus Triart C18, 30 × 50 мм, 5 мкм
УФ-детекция: 254 нм
Скорость потока в колонке: 40 мл/мин
Подвижная фаза: вода/ацетонитрил (0,1% муравьиной кислоты)
Вводимый объем: 1,0 мл
Градиент: вода/ацетонитрил (от 10% до 90%)
[00089] AL400 (400MHz; JEOL (JEOL)) и Mercury400 (400МГц; Agilent Technologies) использовали для спектров ЯМР, и тетраметилсилан использовали в качестве внутреннего стандарта, когда тетраметилсилан включали в тяжелый растворитель, в остальных случаях определение осуществляли с использованием растворителя для ЯМР в качестве внутреннего стандарта, приводя все значения δ в м.д. Кроме того, определяли спектры ЖХМС в следующих условиях с использованием спектрометра Waters ACQUITY SQD (квадрупольный).
Колонка: Waters ACQUITY UPLC (зарегистрированный товарный знак) BEH C18, 2,1 × 50 мм, 1,7 мкм
МС-детекция: с отрицательной ESI
УФ-детекция: 254 нм и 280 нм
Скорость потока в колонке: 0,5 мл/мин
Подвижная фаза: вода/ацетонитрил (0,1% муравьиной кислоты)
Вводимый объем: 1 мкл
[Таблица 2] Градиент
Аббревиатуры имеют значения, указанные ниже.
с: синглет
д: дублет
т: триплет
кв: квартет
дд: дублет дублетов
дт: дублет триплетов
тд: триплет дублетов
тт: триплет триплетов
ддд: дублет дублетов дублетов
ддт: дублет дублетов триплетов
дтд: дублет триплетов дублетов
тдд: триплет дублетов дублетов
м: мультиплет
ушир.: уширенный
ушир.с: уширенный синглет
ДМСО-d6: дейтерированный диметилсульфоксид
CDCl3: тяжелый хлороформ
CD3OD: тяжелый метанол
CDI: 1,1’-карбоксиметилсульфонилдиимидазол
DAST: N,N-трифторид диэтиламиносеры
DIBAL-H: гидрид диизобутилалюминия
DMF: диметилформамид
ДМСО: диметилсульфоксид
THF: тетрагидрофуран
WSC=EDCI=1-этил-3-(3-диметиламинопропил)карбодиимид
HOBt=1-гидроксибензотриазол
[00090] Ссылочный пример A1: 2-(1-бромэтил)-1-фтор-3,4-диметилбензол
[00091] [Формула I]

[00092] (Стадия 1) 1-(6-фтор-2,3-диметилфенил)этанол
[00093] После добавления по каплям раствора метилмагнийбромида в простом диэтиловом эфире (3,0 М, 70 мл) в THF-раствор 6-фтор-2,3-диметилбензальдегида (22,0 г) (300 мл) при 0°С реакционную смесь перемешивали при комнатной температуре в течение 1 ч. В условиях ледяной бани по каплям добавляли насыщенный водный раствор хлорида аммония (150 мл) и добавляли этилацетат (200 мл), и полученный продукт разделяли на различные слои. Органический слой последовательно промывали HCl (1М, 200 мл), водой (200 мл) и насыщенным солевым раствором (200 мл), и затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 1-(6-фтор-2,3-диметилфенил)этанола (23,7 г).
[00094] (Стадия 2) Трибромид фосфора (26,5 мл) добавляли по каплям при 0°С к раствору в хлороформе (120 мл) 1-(6-фтор-2,3-диметилфенил)этанола (23,7 г), полученного на указанной выше стадии 1, и реакционный раствор перемешивали в течение 30 мин при 0°С. Реакционную смесь добавляли в охлажденный на ледяной бане насыщенный водный раствор гидрокарбоната натрия (1 л). После добавления к смеси хлороформа (500 мл) полученный продукт разделяли на разные слои, и органический слой последовательно промывали водой (200 мл) и насыщенным солевым раствором (200 мл). Органический слой сушили над безводным сульфатом магния с получением указанного в заголовке соединения (29,5 г) путем концентрирования при пониженном давлении.
[00095] Ссылочный пример A2 и А3: Альдегид и метилмагнийбромид подвергали реакции друг с другом в качестве исходного материала таким же образом, как и в ссылочном примере А1, стадия 1 и стадия 2, и затем продукт реакции подвергали взаимодействию с трибромидом фосфора с получением соединения ссылочного примера A2 и A3, показанных ниже.
[00096] [Таблица 3]



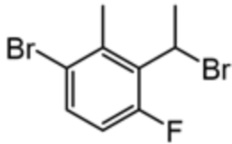
[00097] Ссылочный пример A4: 2-(1-бромэтил)-4-этил-1-фтор-3-метилбензол
[00098] [Формула II]

[00099] (Стадия 1) 2-бром-3-этил-6-фторбензальдегид
[000100] К раствору в THF (150 мл) 2-бром-1-этил-4-фторбензола (14,4 г) добавляли по каплям THF раствор диизопропиламида лития (1,5 М, 54 мл) при -78°C. После перемешивания реакционного раствора в течение 30 мин добавляли DMF (6,5 мл) и смесь дополнительно перемешивали в течение 20 мин. Воду (50 мл) и соляную кислоту (6 М, 50 мл) последовательно добавляли по каплям к реакционному раствору и смесь дважды экстрагировали гексаном (100 мл). Объединенный органический слой дважды промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, и получали 2-бром-3-этил-6-фторбензальдегид (14,5 г).
[000101] (Стадия 2) 3-этил-6-фтор-2-метилбензальдегид
[000102] К 1,4-диоксановому раствору (200 мл) 2-бром-3-этил-6-фторбензальдегида, полученному на стадии 1 выше (14,5 г), добавляли воду (90 мл), трикалийфосфат (32,0 г), метилбороновую кислоту (6,4 г) и добавку [бис(дифенилфосфино)ферроцен]палладий(II) дихлориддихлорметана (1,75 г), и реакционный раствор нагревали с обратным холодильником при 110°С в течение 2 ч. Реакционному раствору давали возможность остыть до комнатной температуры и смесь дополнительно перемешивали в течение 2 ч после добавления гексана (90 мл). Реакционный раствор фильтровали через CELITE, и фильтрат отделяли после того, как остаток промывали гексаном. Органический слой дважды промывали насыщенным солевым раствором (100 мл) и после сушки над безводным сульфатом натрия концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) и получали 3-этил-6-фтор-2-метилбензальдегид (8,4 г).
[000103] (Стадия 3) В соответствии со способами, описанными в ссылочном примере А1, стадии 1 и 2, используя 3-этил-6-фтор-2-метилбензальдегид (8,4 г), полученный на указанной выше стадии 2, осуществляли такую же операцию с получением соединения ссылочного примера А4.
[000104] Ссылочный пример B1: (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановая кислота
[000105] [Формула III]

[000106] Раствор DMF (50 мл) 2-(1-бромэтил)-1-фтор-3,4-диметилбензола (14,0 г), полученный в ссылочном примере А1, добавляли по каплям к DMF раствору (50 мл) (S)-2-[o-[(N-бензилпролил)амино]фенил]бензилиденамино-ацетат-(2-)-N,N,N-никеля(II) (14,5 г) и гидроксида калия (16,3 г), и смесь перемешивали при той же температуре в течение 1 ч. К реакционному раствору добавляли насыщенный раствор хлорида аммония (50 мл) и этилацетат (50 мл), слои разделяли и водный слой экстрагировали дважды этилацетатом (50 мл). Объединенные органические слои последовательно промывали водой (50 мл) и насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат/гексан). Полученное соединение растворяли в метаноле (120 мл), добавляли соляную кислоту (3 М, 90 мл) и смесь перемешивали при 80°C в течение 45 мин. Метанол отгоняли при пониженном давлении и к остатку добавляли хлороформ (50 мл) и воду (50 мл). Водный слой промывали хлороформом (50 мл) и концентрировали при пониженном давлении. Остаток очищали с помощью обращенно-фазовой колоночной хроматографии на силикагеле (метанол/вода) с получением указанного в заголовке соединения (2,0 г). 1H ЯМР (CD3OD) δ: 7,03 (дд, J=8,2, 5,7 Гц, 1H), 6,79 (дд, J=11,7, 8,4 Гц, 1H), 3,74-3,87 (м, 2H), 2,29 (с, 3H), 2,25 (с, 3H), 1,40 (дд, J=6,8, 2,4 Гц, 3H)
[000107] Ссылочные примеры B2-B4:
[000108] После реакции алкилирующего агента, полученного в ссылочных примерах А2-А4, и (S)-2-[o-[(N-бензилпролил)амино]фенил]бензилиденаминоацетат-(2-)-N, N, N-никеля(II), соединения ссылочных примеров В2-В4, показанные ниже, получали кислотным гидролизом.
[000109] [Таблица 4]
(Номер ссылочного примера или структурная формула)


[000110] Ссылочный пример C1: 5-хлор-8-(хлорсульфонил)-4-метил-d3-хроман-4-илацетат
[000111] [Формула IV]

[000112] (Стадия 1) 8-бром-5-хлор-4-метилхроман-4-ол
[000113] THF (50 мл) добавляли к раствору в простом диэтилэтиловом эфире (1,0 М, 63 мл) метилиодид-d3-магния, и THF-раствор (50 мл) 8-бром-5-хлорхроман-4-она (7,5 г) добавляли по каплям при комнатной температуре. Реакционный раствор перемешивали в течение 10 мин при той же температуре и слой отделяли. На ледяной бане медленно по каплям добавляли соляную кислоту (1 М, 50 мл), и в отдельные слои добавляли этилацетат (50 мл). Водный слой экстрагировали этилацетатом (50 мл) и объединенный органический слой промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 8-бром-5-хлор-4-метилхроман-4-ола (7,7 г).
[000114] (Стадия 2) 8-бром-5-хлор-4-метил-d3-хроман-4-илацетат
[000115] К раствору в безводной уксусной кислоте (100 мл) 8-бром-5-хлор-4-метилхроман-4-ола (7,7 г), полученного на указанной выше стадии 1, добавляли по каплям ацетонитрильный раствор (12 мл) трифторметансульфоната скандия(III) (340 мг) при -40°С, и реакционный раствор перемешивали в течение 30 мин при той же температуре. Насыщенный водный раствор гидрокарбоната натрия (100 мл) и этилацетат (100 мл) последовательно добавляли к реакционному раствору и слои разделяли. Водный слой экстрагировали этилацетатом (100 мл), и объединенные органические слои дважды промывали насыщенным водным раствором гидрокарбоната натрия (100 мл) и один раз насыщенным солевым раствором (100 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 8-бром-5-хлор-4-метил-d3-хроман-4-илацетата (8,9 г).
[000116] (Стадия 3) 8-(бензилтио)-5-хлор-4-метил-d3-хроман-4-илацетат
[000117] К 1,4-диоксановому раствору (70 мл) 8-бром-5-хлор-4-метил-d3-хроман-4-ил ацетата (6,7 г), полученного на указанной выше стадии 2, добавляли 4,5-бис(дифенилфосфино)-9,9-диметилксантен (600 мг), трис(дибензилиденацетон)дипалладий (0) (480 мг), N, N-диизопропилэтиламин (7,2 мл) и бензилмеркаптан (2,8 мл), и реакционный раствор перемешивали в течение 2 ч при 90°С. Реакционному раствору давали возможность остыть до комнатной температуры и фильтровали через CELITE. После промывки остатка гексаном (50 мл) к фильтрату добавляли воду (50 мл) и слой отделяли. Органический слой промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Реакционный раствор концентрировали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 8-(бензилтио)-5-хлор-4-метил-d3-хроман-4-илацетата (6,3 г).
[000118] (Стадия 4) К ацетонитрильному раствору (100 мл) 8-(бензилтио)-5-хлор-4-метил-d3-хроман-4-ил ацетата (6,3 г), полученного на указанной выше стадии 3, добавляли воду (3 мл), уксусную кислоту (4,3 мл) и 1,3-дихлор-5,5-диметилгидантоин (7,2 г) при 0°С, и реакционный раствор перемешивали в течение 30 мин при той же температуре. Насыщенный водный раствор гидрокарбоната натрия (70 мл) и этилацетата (70 мл) добавляли к реакционному раствору и слои разделяли. Водный слой экстрагировали этилацетатом (70 мл). Объединенные органические слои промывали насыщенным солевым раствором (70 мл), сушили над безводным сульфатом натрия, и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения (5,3 г).
[000119] Ссылочные примеры C2-C4: В соответствии со способом ссылочного примера С1, стадии 1-4, соединения ссылочного примера С2 синтезировали с исходными материалами, перечисленными в следующей таблице. В соответствии со способом ссылочных примеров C1, стадии 3 и 4, были синтезированы соединения ссылочных примеров C3 и C4.
[000120] [Таблица 5]





[000121] Ссылочный пример D1: 5-((1S,2R)-1-амино-2-(6-фтор-2,3-диметилфенил)пропил)-1,3,4-оксадиазол-2-(3H)-он моногидрохлорид
[000122] [Формула V]

[000123] (Стадия 1) (2S,3R)-2-((трет-бутоксикарбонил)амино)-3-(6-фтор-2,3-диметилфенил)бутановая кислота
[000124] Воду (9 мл), 1,4-диоксан (9 мл) и триэтиламин (955 мкл) последовательно добавляли к (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановой кислоте (515 мг), полученной в ссылочном примере B1, и смесь охлаждали до 0°C. Ди-трет-бутилдикарбонат (650 мг) добавляли в реакционный раствор при той же температуре, и смесь перемешивали в течение 45 мин. Реакционный раствор добавляли к соляной кислоте (1 М, 20 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат/2% уксусная кислота) с получением (2S,3R)-2-((трет-бутоксикарбонил)амино)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (745 мг).
[000125] (Стадия 2) Трет-бутил-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)карбамат
[000126] К THF-раствору (14,0 мл) (2S,3R)-2-(трет-бутоксикарбониламино)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (440 мг), полученной на указанной выше стадии 1, добавляли CDI (302 мг), и реакционный раствор перемешивали при комнатной температуре в течение 20 мин. Реакционный раствор охлаждали до 0°С, добавляли гидразинмоногидрат (200 мкл), и смесь перемешивали при той же температуре в течение 30 мин. Реакционный раствор добавляли в воду (20 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. CDI (560 мг) добавляли к 1,4-диоксановому раствору (14 мл) полученного остатка, и реакционный раствор перемешивали при комнатной температуре в течение 30 мин. Реакционный раствор добавляли в воду (20 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением трет-бутил-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)карбамата (356 мг).
[000127] (Стадия 3) Трет-бутил-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)карбамат (550 мг), полученный на указанной выше стадии 2, растворяли в соляной кислоте-1,4-диоксане (4 M, 5,0 мл), и реакционный раствор перемешивали при комнатной температуре в течение 1,5 ч. Реакционный раствор концентрировали при пониженном давлении с получением указанного в заголовке соединения.
[000128] Ссылочный пример D2 и D3: В соответствии со способом, описанным в ссылочном примере D1, стадии 1-3, синтезировали следующие соединения ссылочных примеров D2 и D3.
[000129] [Таблица 6]
(Номер ссылочного примера или структурная формула)

[000130] Пример 1: 5-бром-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамид
[000131] (Стадия 1) К раствору в 1,4-диоксане (5,0 мл) и воде (5,0 мл) (2S,3R)-2-амино-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (300 мг), полученной в ссылочном примере B1, добавляли триэтиламин (570 мкл) и затем охлаждали до 0°C. К реакционному раствору добавляли 4-бром-2-цианобензол-1-сульфонилхлорид (362 мг), и смесь перемешивали при той же температуре в течение 45 мин. Реакционный раствор добавляли к соляной кислоте (1 М, 15 мл) и экстрагировали этилацетатом (15 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат/2% уксусная кислота) с получением (2S,3R)-2-(4-бром-2-цианoфенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (465 мг).
[000132] (Стадия 2) К THF-раствору (5,0 мл) (2S,3R)-2-(4-бром-2-цианoфенилсульфонамидо)-3-(6-фтор-2,3-диметилфенил)бутановой кислоты (465 мг), полученной на указанной выше стадии 1, добавляли CDI (210 мг), и реакционный раствор перемешивали при комнатной температуре в течение 20 мин. Реакционный раствор охлаждали до 0°С, добавляли гидразинмоногидрат (200 мкл), и смесь перемешивали при той же температуре в течение 20 мин. Реакционный раствор добавляли в воду (20 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. CDI (211 мг) добавляли к 1,4-диоксановому раствору (4,0 мл) полученного остатка, и реакционный раствор перемешивали при 45°C в течение 1 ч. Реакционный раствор добавляли в воду (20 мл) и экстрагировали этилацетатом (20 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением 4-бром-2-цианo-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамида (386 мг).
[000133] (Стадия 3) В ДМСО-раствор (5,0 мл) 4-бром-2-цианo-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)бензолсульфонамида (386 мг), полученного на указанной выше стадии 2, последовательно добавляли на ледяной бане водный пероксид водорода (1,0 мл) и карбонат калия (420 мг), и реакционный раствор перемешивали при 60°C в течение 2,5 ч. Реакционный раствор медленно добавляли к соляной кислоте (1 М, 15 мл) на ледяной бане и затем экстрагировали этилацетатом (15 мл). Органический слой промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения.
[000134] Примеры 2-4
[000135] Соединения примеров 2-4 синтезировали в соответствии со способом примера 1, стадии 1-3. Необходимые исходные материалы приведены в следующей таблице.
[000136] [Таблица 7]



[000137] Пример 5: 5-хлор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидрокси-4-метил-d3-хроман-8-сульфонамид, изомер A и изомер B
[000138] (Стадия 1) 5-хлор-8-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-4-метил-d3-хроман-4-илацетат
[000139] В пиридиновый раствор (1,5 мл) 5-((1S,2R)-1-амино-2-(6-фтор-2,3-диметилфенил)пропил)-1,3,4-оксадиазол-2(3H)-он моногидрохлорида (45 мг), полученный в ссылочном примере D1, добавляли 5-хлор-8-(хлорсульфонил)-4-метил-d3-хроман-4-илацетат (80 мг), полученной в ссылочном примере C1, и реакционный раствор перемешивали при комнатной температуре в течение 12 ч. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат) с получением указанного в заголовке соединения (59 мг) в виде диастереомерной смеси 1:1.
[000140] (Стадия 2) 1:1 диастереомерную смесь 5-хлор-8-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)-4-метил-d3-хроман-4-илацетата (59 мг), полученную со стадии 1 выше, растворяли в метаноле (2,0 мл) и воде (1,0 мл), добавляли гидроксид лития (5 мг), и реакционный раствор перемешивали при 55°C в течение 1 ч. После концентрирования реакционного раствора к остатку добавляли соляную кислоту (1 М, 10 мл) и этилацетат (10 мл), и слои разделяли. Водный слой экстрагировали этилацетатом (10 мл), и объединенные органические слои промывали насыщенным солевым раствором (10 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой ВЭЖХ (вода/ацетонитрил), и фракции концентрировали с получением каждого из двух диастереомерных продуктов. Вещество, элюированное первым, было обозначено как соединение А, и вещество, элюированное позже, было обозначено как соединение В.
[000141] Примеры 6-8: В соответствии со способом примера 5, стадия 2, синтезировали следующие соединения примеров 6-8. В случае разделения диастереомеров элюированное раньше соединение было обозначено как A, и элюированное позже соединение - как B. Соотношение диастереомеров смеси составляло 1:1, если не указано иное. Необходимые исходные материалы приведены в следующей таблице.
[000142] [Таблица 8]
[000143] Пример 9: 5-фтор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-гидроксихроман-8-сульфонамид, изомер A и изомер B
[000144] (Стадия 1) При использовании 5-((1S,2R)-1-амино-2-(6-фтор-2,3-диметилфенил)пропил)-1,3,4-оксадиазол-2(3 H)-он моногидрохлорида (40 мг), полученного из ссылочного примера D1, и 5-фтор-4-оксохроман-8-сульфонилхлорида, (60 мг), полученного из ссылочного примера C3, получали 5-фтор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-оксохроман-8-сульфонамид (44 мг) в соответствии со способом примера 5, стадия 1.
[000145] (Стадия 2) Борогидрид натрия (13,5 мг) добавляли в этанольный раствор (2,0 мл) 5-фтор-N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)-4-оксохроман-8-сульфонамида (44 мг), полученный со стадии 1 выше, и реакционный раствор перемешивали при комнатной температуре в течение 30 мин. После концентрирования реакционного раствора при пониженном давлении к остатку добавляли воду (10 мл) и этилацетат (10 мл), отделяли, и водный слой экстрагировали этилацетатом (10 мл). Объединенный органический слой промывали насыщенным солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой ВЭЖХ (вода/ацетонитрил), и фракции концентрировали с получением каждого из двух диастереомерных продуктов. Вещество, элюированное первым, было обозначено как соединение А, и вещество, элюированное позже, было обозначено как соединение В.
[000146] Пример 10: В соответствии со способом примера 5, стадия 1, и примера 9, стадия 2, синтезировали соединения примера 10, показанные ниже. В случае разделения диастереомеров элюированное первым соединение было обозначено как A, и элюированное позднее соединение - как B. Соотношение диастереомеров смеси составляло 1:1, если не указано иное. Необходимые исходные материалы приведены в следующей таблице.
[000147] [Таблица 9]
[000148] В качестве сравнительного примера получали соединение следующей формулы.
[000149] [Формула VI]
[000150] 1H ЯМР (CD3OD) δ: 7,54 (д, J=8,4 Гц, 2H), 7,17-7,29 (м, 5H), 7,08-7,14 (м, 2H), 4,55-4,61 (м, 1H), 3,00-3,13 (м, 2H), 2,39 (с, 3H)
[000151] Далее приведены структурные формулы и физические свойства соединений из примеров 1-10.
[000152] [Таблица 10]
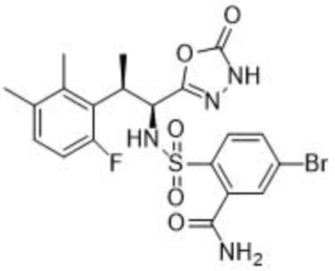
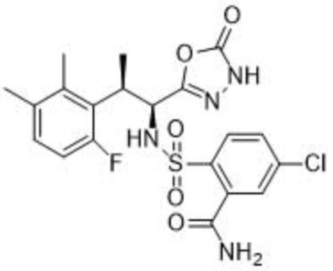
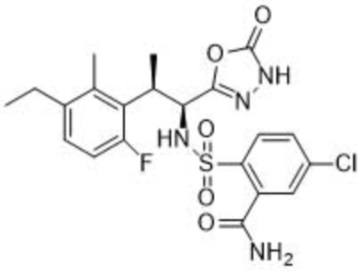











[000153] Экспериментальный пример: Соединение в соответствии с настоящим изобретением оценивали с помощью приведенного ниже способа тестирования.
[000154] Экспериментальный пример 1: Эффект ингибирования человеческой RNR
[000155] Ингибирующую активность в отношении реакции восстановления рибонуклеотида (далее называемой реакцией RNR) тестируемого соединения определяли путем измерения образования дезоксицитидиндифосфата (далее называемого dCDP) из цитидиндифосфата (в дальнейшем называемого CDP) следующим способом.
[000156] Субъединицу M1 человека и субъединицу M2 человека (мутант, лишенный аминоконцевых 59 аминокислот), которые слиты с гистидиновой меткой на аминоконце, сверхэкспрессировали в Escherichia coli и солюбилизировали после сбора, и меченные гистидином белки М1 и М2 человека очищали на никель-хелатной колонке.
[000157] Для измерения ингибирующей активности тестируемого соединения в отношении реакции RNR был использован способ, описанный в Cancer Research 64, 1-6 (2004).
[000158] Во-первых, тестируемые соединения последовательно разбавляли ДМСО. Затем белок М1 человека и белок M2 человека добавляли в водный раствор альбумина, полученный из 0,02% фетальной бычьей сыворотки, добавляли ДМСО раствор соединения настоящего изобретения или контрольный раствор ДМСО (конечная концентрация ДМСО составляла 1%), и смеси давали отстояться в течение 20 мин. После этого добавляли реакционный буфер [50 мМ буфера HEPES (рН 7,2) в конечной концентрации, 4 мМ ацетата магния в конечной концентрации, 100 мМ хлорида калия в конечной концентрации, 6 мМ дитиотреитола в конечной концентрации, 2 мМ аденозинтрифосфата в конечной концентрации, 0,24 мМ никотинамидадениндинуклеотидфосфата в конечной концентрации] и 10 мкМ CDP в конечной концентрации, и инкубировали при 37°С в течение 30 мин для проведения реакции RNR. Сразу после реакции реакцию останавливали нагреванием при 100°С в течение 15 мин с последующим центрифугированием при 10000 об/мин в течение 10 мин. После центрифугирования часть (5 мкл) полученного супернатанта анализировали с помощью высокоэффективной жидкостной хроматографии (Shimadzu Corporation, Prominence), с использованием Shim-pack XR-ODS (производства Shimadzu GLC Co., 3,0 × 100 мм). Элюирование проводили при длине волны измерения 265 нм при скорости потока 0,5 мл/мин с 9 мин градиентом концентрации от смеси 12:13 подвижной фазы A (10 мМ дигидрофосфата калия (pH 6,7), 10 мМ тетрабутиламмония, 0,25% метанола) и подвижной фазы B (50 мМ дигидрофосфата калия (pH 6,7), 5,6 мМ тетрабутиламмония, 30% метанола) в той же смеси 2:3 для измерения CDP субстрата (КТ 5,9 мин) и продукта реакции dCDP (КТ 6,2 мин).
[000159] Ингибирующую активность тестируемого соединения определяли с помощью следующего уравнения, и концентрации тестируемых соединений, ингибирующих реакцию RNR на 50%, представлены как IC50 (мкМ) в таблицах с 19-1 по 19-3.
[000160] [Математическая формула 1]
Степень ингибирования (%) = (1 - (Количество полученного dCDP при добавлении тестируемого соединения (пмоль) / Количество полученного dCDP контроля (пмоль))) × 100
[000161] В результате, из приведенной ниже таблицы видно, что соединение настоящего изобретения обладает превосходным ингибирующим RNR действием. В отличие от этого, соединение сравнительного примера 1 имело IC50 43 мкМ и не проявляло ингибирующей активности в отношении RNR, как это было обнаружено в примерах соединений настоящего изобретения.
[000162] [Таблица 11]
[000163] Экспериментальный пример 2: Ингибирующее действие на пролиферацию клеток клеточной линии рака молочной железы человека
[000164] Клетки HCC 1806, полученные из клеточной линии рака молочной железы человека, ежедневно пассировали при плотности клеток, не превышающей 80% в среде, рекомендованной АТСС Roswell Park Memorial Institute (RPMI-1640), содержащей 10% фетальную бычью сыворотку (FBS). Чтобы начать тестирование активности ингибирования пролиферации клеток, клетки HCC 1806 суспендировали в указанной выше среде после высевания при 180 мкл в каждой лунке 96-луночного плоскодонного планшета, так, чтобы количество клеток на лунку составляло 2000, клетки культивировали при 37°С в течение 1 дня в инкубаторе, содержащем 5% газообразного диоксида углерода. На следующий день тестируемое соединение растворяли в ДМСО и 20 мкл раствора лекарственной добавки, последовательно разбавленного дистиллированной водой до 10-кратной конечной концентрации, добавляли в каждую лунку культурального планшета клеток, и клетки культивировали при 37°С в течение 72 ч в инкубаторе, содержащем 5% газообразного диоксида углерода. После культивирования в течение 72 ч в каждую лунку добавляли 20 мкл глутаральдегида и оставляли стоять в течение 30 мин, затем планшет промывали 10 раз водой и сушили. В каждую лунку добавляли 100 мкл раствора красителя (0,05% кристаллического фиолетового в 20% растворе метанола) и выдерживали в течение 30 мин, затем пластину 10 раз промывали водой и сушили. 100 мкл раствора экстракта (0,1 н. NaH2 PO4 : 100% этанол=1:1) добавляли в каждую лунку и смешивали, и смесь измеряли при длине волны 540 нм с использованием планшет-ридера (MTP-450, производства Corona Electric Co., Ltd.). Степень ингибирования роста рассчитывали по следующей формуле и определяли концентрацию (IC50 (мкМ)) тестируемого соединения для 50% ингибирования. Результаты показаны в таблице 11.
[000165] Степень ингибирования роста (%) = {(C-B) - (T-B)} / (C-B) × 100
[000166] T: Оптическая плотность лунки, в которую добавили тестируемое соединение
[000167] C: Оптическая плотность лунок, в которые не добавляли тестируемое соединение
[000168] B: Оптическая плотность лунок, в которые не добавляли клеточную суспензию
[000169] В результате, как видно из следующей ниже таблицы, было выявлено, что соединения настоящего изобретения обладают ингибирующей рост активностью в отношении раковых клеток.
[000170] [Таблица 12]
[000171] Экспериментальный пример 3. Ингибирующее действие на пролиферацию клеток клеточных линий рака человека
[000172] В соответствии со способом экспериментального примера 2 оценивали ингибирующее действие на пролиферацию клеток на различных линиях раковых клеток, как описано в таблицах 12 и 13.
[000173] В результате, как видно из следующей ниже таблицы, было выявлено, что соединения настоящего изобретения обладают ингибирующей рост активностью в отношении различных типов раковых клеток, полученных от человека.
[000174] [Таблица 13]
[000175] [Таблица 14]
[000176] Экспериментальный пример 4: Оценка противоопухолевого действия с использованием клеточной линии (MV-4-11) рака крови человека, модель подкожной трансплантации (in vivo)
[000177] Клеточную линию MV-4-11 рака крови человека трансплантировали подкожно голой мыши, и в то время, когда объем опухоли голых мышей с трансплантированной опухолью достигал примерно 100-300 мм3, четыре мыши относили к каждой группе путем случайной стратификации таким образом, чтобы среднее значение объема опухоли для каждой группы было одинаковым (день 0), и соединение настоящего изобретения вводили перорально ежедневно в дозе 100 мг/кг/сут один раз в сутки в течение 14 дней.
[000178] С целью сравнения хронологического изменения пролиферации опухоли при введении каждого исследуемого соединения, относительный объем опухоли (RTV), принимая объем опухоли в момент отнесения к группе за 1, в качестве скорости пролиферации опухоли рассчитывали в соответствии со следующей ниже формулой, и изменение среднего значения RTV каждой отдельной особи представлено на фиг.1 - фиг.4.
[000179] RTV = (объем опухоли в день измерения объема опухоли) / (объем опухоли в момент отнесения к группе)
[000180] Среднее значение RTV в группе с введением соединения настоящего изобретения в последний день оценки было меньше среднего значения RTV в контрольной группе, и когда показано статистически значимое различие (t-критерий Стьюдента), было установлено, что соединение настоящего изобретения является в значительной степени эффективным, и статически значимое различие отмечено знаком * на фигуре (*: p <0,05).
[000181] Таким образом, было обнаружено, что соединение настоящего изобретения обладает значительным противоопухолевым действием.
[000182] Экспериментальный пример 5: Формирование иллюстративного образца кристаллической формы, сокристалла или соли
[000183] Соединение, выбранное из примеров 1-10 выше, пытались кристаллизовать в общей сложности с 47 вторичными соединениями (гидроксид натрия, гидроксид калия, L-аргинин, гидроксид кальция, гидроксид холина, диэтиламин, L-лизин, диэтаноламин, трометамин, этилендиамин, щавелевая кислота, дибензоил-L-винная кислота, малеиновая кислота, глутаминовая кислота, малоновая кислота, фумаровая кислота, L-винная кислота, 4-гидроксибензамид, никотинамид, изоникотинамид, сахарин, галактаровая кислота, лимонная кислота, D-глюкуроновая кислота, L-яблочная кислота, этилендиамин, глутаровая кислота, янтарная кислота, мочевина, аргинин, бензойная кислота, аскорбиновая кислота, метилпарабен, ванилин, гликолевая кислота, соляная кислота, гиппуровая кислота, L-молочная кислота, метансульфоновая кислота, фосфорная кислота, моногидрат п-толуолсульфоновой кислоты, серная кислота, L-аланин, глицин, меглумин, L-пролин, L-серин, L-валин), но только комбинация с бензойной кислотой образовывала иллюстративный образец кристаллической формы, сокристалла или соли.
[000184] Первоначально 93 мг соединения, выбранного из примеров 1-10, растворяли в 500 мкл изопропилацетата и раствор перемешивали при 60°С; в образец добавляли 233 мкл раствора бензойной кислоты в метаноле (концентрация: 0,8672 ммоль/мл). Смесь перемешивали при 60°C в течение 10 мин, фильтровали через предварительно нагретый шприцевой фильтр (0,2 мкм, нейлон) и затем охлаждали до температуры окружающей среды, с последующим хранением при пониженной температуре, выпариванием и перемешиванием геля, полученного в результате выпаривания в 1 мл гептана в условиях окружающей среды в течение 30 дней, с получением иллюстративного образца, содержащего 1 эквивалент бензойной кислоты. Однако при таком способе производства потребовалось более 30 дней производственного периода, и было получено только примерно 10 мг иллюстративного образца.
[000185] В другом примере 3 г иллюстративного образца получали способом суспендирования аналогичного количества того же соединения в смеси растворителей гептан-толуол и перемешивали при температуре 40°C или выше. Например, к 3000 мг соединения, выбранного из примеров 1-10, добавляли 1518 мг бензойной кислоты, а также 57 мл гептана и 3 мл толуола. Суспензию перемешивали в течение примерно 4,5 ч при нагревании при 60°С. Суспензию собирали фильтрацией, промывали смесью гептана и толуола в соотношении 19:1 и нагревали при 60°С. Твердое вещество извлекали и сушили с получением 3420,6 мг (степень извлечения 91%) продукта с химической чистотой 98,67% и оптической чистотой 100% э.и. 1H-ЯМР(CDCl3) δ: 8,77 (с, 1H), 8,09 (д, J=8,0 Гц, 2H), 7,89 (д, J=8,0 Гц, 1H), 7,60 (т, J=7,2 Гц, 1H), 7,54 (д, J=2 Гц, 1H), 7,40-7,51 (м, 3H), 6,91 (дд, J=6,0 Гц, 8,4 Гц, 1H), 6,87 (д, 9,6 Гц, 1H), 6,67 (дд, J=8,0 Гц, 8,4 Гц, 1H), 6,55 (ушир. с, 1H), 6,34 (ушир. с, 1H), 4,88 (дд, J=9,6 Гц, 10,4 Гц, 1H), 3,40-3,55 (м, 1H), 2,15 (с, 6H), 1,42 (д, J=6,8 Гц, 3H).
[000186] Суспензию фильтровали и твердое вещество промывали смесью гептана и толуола и нагревали при 60°С. В результате оценки физико-химических свойств полученной кристаллической формы, сокристалла или соли, неожиданно было обнаружено, что этот продукт обладает превосходной стабильностью при хранении, кроме того, имеет низкую гигроскопичность и способность накапливать электростатический заряд и прост в обращении.
[000187] В другом примере, к 1000 мг соединения, выбранного из примеров 1-10, добавляли 506 мг бензойной кислоты, а также 19 мл гептана и 1 мл толуола. Суспензию перемешивали в течение примерно 3,5 ч при нагревании при 60°С. Суспензию собирали фильтрацией, промывали смесью гептана и толуола в соотношении 19:1 и нагревали при 60°С. Твердое вещество извлекали и сушили с получением 947 мг (степень извлечения: 75,6%) иллюстративного образца.
[000188] Кроме того, среди 47 видов вторичных соединений, используемых для исследования кристаллизации, были вторичные соединения, содержащие основную функциональную группу (или катион), но настоящее соединение, которое является кислотным, не образовывало кристалл с этими основными вторичными соединениями. Таким образом, было неожиданным, что кислотное соединение образовывало кристаллическую форму, сокристалл или соль только с бензойной кислотой, которая является кислотным соединением. Кроме того, невозможно предвидеть, какими физико-химическими свойствами обладает полученная кристаллическая форма, сокристалл или соль.
[000189] Экспериментальный пример 6: Структурные характеристики
[000190] Анализ монокристаллов: 5 мл гептана, 3 мл н-пропилацетата и 203,3 мг бензойной кислоты добавляли к 100 мг образца из экспериментального примера 5 с использованием соединения примера 2 (далее также называемого «иллюстративным образцом настоящего изобретения») и растворяли при 80°С. К растворенному продукту добавляли 810 мг бензойной кислоты и растворяли. Добавляли небольшое количество продукта, и смесь оставляли стоять в течение ночи при 60°С. После этого температуру понижали до 50°С и оставляли стоять в течение 6 дней для получения кристаллов для анализа монокристаллов.
[000191] Измерение проводили при следующих условиях измерения и обработку данных проводили с помощью программного обеспечения CrysAlisPro для измерения и обработки данных, пакета программ для анализа структуры CrystalStructure и интегрированного программного обеспечения PDXL для порошковой рентгенографии.
Устройство: XtaLAB PRO MM 007
Источник рентгеновского излучения: Cu Kα (λ=1,54184 Å)
Напряжение трубки - ток трубки: 40 кВ - 30 мА
Температура измерения: -173°C (при использовании распылительного низкотемпературного устройства)
Диаметр коллиматора: 0,3 мм
Длина камеры: 39,71 мм
Угол вибрации: 0,25°
Время экспозиции: 0,25 с/образец
Общее количество измерений: 14476 пластин
Общее время измерения: 1 ч 35 мин
[000192] Результаты показаны ниже и на фиг.5.
Кристаллическая система: моноклинная система
Пространственная группа: P21/n (№ 4)
Постоянная решетки: a=13,89023 (9) Å
b=7,77623 (4) Å
c=14,00408 (9) Å
α=90°
β=110,5202 (7)°
γ=90°
Объем элементарной ячейки: 1416,653 (16) Å 3
[000193] Данные порошковой рентгеновской дифракции иллюстративного образца настоящего изобретения измеряли в соответствии со следующими условиями испытаний.
Устройство: EMPYREAN производства PANalytical
Метод отражения (интенсивный метод)
Мишень: Cu
Ток рентгеновской трубки: 40 мА
Напряжение рентгеновской трубки: 45 кВ
Диапазон сканирования: 2θ= 5,0-40,0°
Шаг: 2θ= 0,0131°
Среднее время/шаг: 8,670 с
Скорость сканирования: 0,0015°/с
Щель расходимости: 1°
Щель рассеивания: 2,0 мм
Приемная щель: 8,0 мм
[000194] Рентгеновский дифракционный спектр показан на фиг.6. Профиль порошковой рентгендифрактограммы образца имеет углы дифракции (2θ±0,2°) 6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°.
[000195] Экспериментальный пример 7: Дифференциальная сканирующая калориметрия (DSC анализ)
[000196] DSC анализ иллюстративного образца настоящего изобретения осуществляли в соответствии со следующими условиями испытаний.
Устройство: DSC 1 STAR SYSTEM производства METTLER TOLEDO
Образец: приблизительно 1 мг
Контейнер для образцов: сделан из алюминия
Диапазон повышения температур: 25-290 °С
Скорость повышения температуры: 10 °C/мин.
Атмосферный газ: азот
Скорость потока газообразного азота: 50 мл/мин.
[000197] Эксплуатация устройств, включая обработку данных, осуществлялась в соответствии с руководством, прилагаемым к устройству DSC. Результирующая кривая DSC показана на фиг.7. Как видно в результатах DSC, эндотермический пик (вершина пика) отмечался при 162°С.
[000198] На фиг.9 показан результат моделирования профиля XRD на основе результата анализа монокристалла и характеристические пики угла дифракции (2θ±0,2°) (6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°) соответствуют приведенному выше примеру.
[000199] Экспериментальный пример 8: Гигроскопичность
[000200] Испытание адсорбции/десорбции влаги осуществляли в соответствии со следующими условиями.
[000201] Приблизительно 10-15 мг образца помещали в специальный кварцевый держатель, и массу каждого образца при каждой влажности непрерывно измеряли и регистрировали при следующих условиях. Эксплуатация устройства, включая обработку данных, осуществлялась в соответствии со способом и процедурой, указанными в инструкции для каждого устройства.
Устройство: VTI SA+ (производства TA Instruments Inc.)
Температура сушки: 60°C
Скорость нагрева: 1°С/мин
Равновесие сушки: в диапазоне, не превышающем 300 мин, подтверждают, что не происходит уменьшения на 0,01% масс. в течение 5 мин
Температура измерения: 25°C
Равновесие увлажнения: в диапазоне, не превышающем 120 мин, подтверждают, что не происходит увеличения на 0,01% масс. в течение 5 мин
Программа относительной влажности: Увеличение на 5% RH от 5% RH до 95% RH, и уменьшение на 5% RH от 95% RH до 5% RH
[000202] Когда свободная форма соединения была первоначально получена в виде аморфного вещества, свободная форма имела гигроскопичность (фиг.8), а также обладала высокой способностью накапливать электростатический заряд. В данном случае выражение «свободная форма» относится к аморфному веществу, представленному одним только лекарственным веществом. Однако, как описано выше, была получена кристаллическая форма, сокристалл или соль свободной формы соединения примера 2, и этот образец не имел гигроскопичности (фиг.8) и обладал низкой способностью накапливать электростатический заряд.
[000203] Как показано на фиг.8, гигроскопичность полученного продукта (измельченного в продукта) характеризовалась изменением массы примерно на 0,1% при относительной влажности 95% в испытании на адсорбцию/десорбцию влаги и, соответственно, продукт практически не проявлял гигроскопичности. Эти физико-химические свойства превосходят гигроскопичность и способностью накапливать электростатический заряд свободной формы того же соединения.
[000204] Полученный твердый продукт примера 2 обладал низкой способностью накапливать электростатический заряд, и наблюдалось незначительное прилипание к шпателю или стеклянной бутыли.
[000205] В качестве сравнительного примера для вышеописанного соединения проводили распылительную сушку с целью удаления остаточного растворителя. 2 г соединения растворяли в 18 г этанола и распылительную сушку осуществляли в следующих условиях.
После нагревания подводимого тепла: прогрессия
Температура отработанного тепла: 78°С
Скорость потока подачи: 5 мл/мин
Скорость потока распыляемого азота 350 л/ч
[000206] Полученный высушенный распылением продукт высушивали при пониженном давлении в атмосфере при 90°С в течение 1 ч с получением свободной формы соединения, которая была аморфной, обладала высокой способностью накапливать электростатический заряд и проявляла сильное прилипание, когда ее переносили шпателем или в стеклянной бутыли. Кроме того, как показано на фиг.8, наблюдалось увеличение массы примерно на 3,8% при относительной влажности 95% в испытании на адсорбцию/десорбцию влаги. Этот сравнительный пример также использовали для испытания на стабильность ниже.
[000207] Экспериментальный пример 9: Испытание на стабильность
[000208] Первоначально химическую чистоту измеряли следующими способами.
[000209] Количество аналогичных веществ в растворе образца измеряли с помощью ВЭЖХ анализа. Эксплуатация устройства, включая обработку данных, осуществлялась в соответствии с руководством, прилагаемым к устройству (т.е. Prominence-i). Примерно 2 мг иллюстративного образца настоящего изобретения растворяли в 4 мл смеси (17:3) подвижная фаза А/подвижная фаза В, и полученную смесь использовали в качестве раствора образца.
Колонка: CAPCELL PAK ADME производства Shiseido (4,6 × 150 мм, 3 мкм)
УФ-детекция: 220 нм
Температура колонки: 40°C
Скорость потока в колонке: 1,0 мл/мин
Подвижная фаза: A; 5 мМ фосфатный буфер, рН 6,2/Ацетонитрил (4:1)
B: ацетонитрил
Вводимый объем: 5 мкл
Температура охладителя проб: 5°C
Время сбора: 40 мин
[000210] [Таблица 15] Градиент для ВЭЖХ
об.%
об.%
[000211] Стабильность твердого иллюстративного образца настоящего изобретения и свободной формы, полученной выше, тестировали после того, как образец хранили при 40°С/75% RH (в закрытом и открытом состоянии) в течение 2 недель или 4 недель. Открытое состояние означает, что крышка со стеклянной бутыли была снята и бутыль закрыта салфеткой Kimwipe.
Точки измерения: 2 недели и 4 недели
Хранимое количество: примерно 50-60 мг
Контейнер для хранения: бутыль из коричневого стекла
[000212] [Таблица 16]
Химическая чистота (%)
Общее количество аналогичных веществ (%)
Химическая чистота (%)
Общее количество аналогичных веществ (%)
[000213] После хранения образец давал только небольшое количество аналогичных веществ, демонстрируя превосходную стабильность по сравнению со сравнительным примером, имеющим свободную форму. Таким образом, было подтверждено, что образец настоящего изобретения обладает превосходной стабильностью.
[000214] Оптическую чистоту также измеряли в следующих условиях ВЭЖХ.
Детектор: УФ при 240 нм
Колонка: CHIRALPAK IE (4,6 × 250 мм, 5 мкм)/Daicel Corp.
Температура колонки: 40°C
Подвижная фаза: н-гексан/этанол/этаноламин/уксусная кислота (65:35:0,5:0,2)
Скорость потока: 1,0 мл/мин
Вводимый объем: 5 мкл
Температура образца: 5°C
Временной интервал измерения: 40 мин
[000215] Предел количественного определения (LOQ):
[000216] Соединение - RR, RS,SS: 0,05%
[000217] Оптическую чистоту измеряли также с добавлением 0,2% оптического изомера.
[000218] Стабильность твердого иллюстративного образца настоящего изобретения и свободной формы, полученной выше, тестировали до и после того, как образец хранили при 40°С/75% RH (в закрытом и открытом состоянии) в течение 24 ч. Через 24 ч никаких существенных изменений в оптической чистоте не наблюдалось.
[000219] Результаты измерения оптической чистоты показаны на фиг.10 - фиг.12.
[000220] Экспериментальный пример 10: Испытания растворимости
[000221] Примерно 15 мг иллюстративного образца настоящего изобретения добавляли к 1 мл каждого растворителя и оставляли набухать при 37°С в течение 2 ч в защищенных от света условиях. После центрифугирования каждый супернатант фильтровали и 0,7 мл смеси воды и ацетонитрила (1:1) добавляли к 0,1 мл фильтрата. Испытание на растворимость проводили с 5 мкл растворителя в соответствии со следующими условиями.
Детектор: Ультрафиолетовый спектрофотометр (длина волны: 230 нм)
Колонка: CAPCELPAK ADME (4,6 × 150 мм, 3 мм)
Температура колонки: постоянная температура примерно 40°С
Подвижная фаза А: A: смесь 5 мМ фосфатного буфера (pH 6,52) и ацетонитрила (4:1)
B: Ацетонитрил
После подвижной фазы: проводили контроль градиента, смешивая подвижные фазы A и B, как указано в следующей таблице ниже.
Скорость потока: 1,0 мл/мин
Временной интервал измерения: в течение 12 мин после введения
[000222] [Таблица 17] Градиент для ВЭЖХ
образца (мин)
[000223] Результаты испытания на растворимость показаны в таблице 18 ниже.
[000224] [Таблица 18] Данные растворимости
рН 1,2
[000225] Никаких существенных изменений не наблюдалось в картине XRD после 2 ч исследования растворимости, и не наблюдалось существенных различий между формой свободной кислоты и иллюстративным образцом настоящего изобретения.
[000226] Экспериментальный пример 11: Испытание на стабильность в твердом состоянии
[000227] Стабильность твердого иллюстративного образца настоящего изобретения и свободной формы, полученной выше, тестировали после того, как образец хранили при 40°С/75% RH (в открытом состоянии), 70°С (закрытым) и 80°С (закрытым) через 2 недели или 4 недели. Открытое состояние означает, что крышка со стеклянной бутыли была снята и бутыль закрыта салфеткой Kimwipe, 70°С и 80°С (закрытый).
[000228] Точки измерения: 2 недели и 4 недели
[000229] Хранимое количество: примерно 30 мг
[000230] Контейнер для хранения: бутыль из коричневого стекла
[000231] Количество аналогичных веществ в растворе образца измеряли с помощью ВЭЖХ анализа. Эксплуатация устройства, включая обработку данных, осуществлялась в соответствии с руководством, прилагаемым к устройству (т.е. Prominence-i). Примерно 2 мг иллюстративного образца настоящего изобретения растворяли в 4 мл смеси (17:3) подвижная фаза А/подвижная фаза В, и полученную смесь использовали в качестве раствора образца.
Колонка: CAPCELL PAK ADME производства Shiseido (4,6 × 150 мм, 3 мкм)
УФ-детекция: 220 нм
Температура колонки: 40°C
Скорость потока в колонке: 1,0 мл/мин
Подвижная фаза: A; 5 мМ фосфатный буфер, рН 6,5/Ацетонитрил (4:1)
B: ацетонитрил
Вводимый объем: 5 мкл
Температура охладителя проб: 5°C
Время сбора: 40 мин
[000232] [Таблица 19] Градиент для ВЭЖХ
об.%
об.%
[000233] [Таблица 20]
(открытый)
Химическая чистота (%)
Общее количество аналогичных веществ (%)
Химическая чистота (%)
Общее количество аналогичных веществ (%)
| название | год | авторы | номер документа |
|---|---|---|---|
| СУЛЬФОНАМИДНОЕ СОЕДИНЕНИЕ ИЛИ ЕГО СОЛЬ | 2017 |
|
RU2732572C2 |
| ПРОТИВООПУХОЛЕВЫЙ АГЕНТ | 2018 |
|
RU2770824C2 |
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ NAMPT | 2011 |
|
RU2617424C2 |
| СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ ИЛИ ИХ СОЛИ | 2009 |
|
RU2481329C2 |
| ЗАМЕЩЕННЫЕ ГЕТЕРОАРИЛОМ ПИРИДИНЫ И СПОСОБЫ ПРИМЕНЕНИЯ | 2017 |
|
RU2756743C2 |
| НОВОЕ ПРОИЗВОДНОЕ ФЕНИЛПИРРОЛА | 2009 |
|
RU2470917C2 |
| ПРОИЗВОДНЫЕ ГЕТЕРОАРИЛКАРБАМОИЛБЕНЗОЛА | 2004 |
|
RU2330030C2 |
| НОВЫЕ ГЕТЕРОАРИЛТРИАЗОЛЬНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ПЕСТИЦИДОВ | 2020 |
|
RU2824488C2 |
| ПРОИЗВОДНЫЕ АДАМАНТИЛА, ПОЛЕЗНЫЕ ДЛЯ ЛЕЧЕНИЯ JNK-ОПОСРЕДОВАННОГО РАССТРОЙСТВА | 2012 |
|
RU2626890C2 |
| ГЕТЕРОАРОМАТИЧЕСКИЕ МОДУЛЯТОРЫ РЕТИНОЛ-СВЯЗАННОГО ОРФАННОГО РЕЦЕПТОРА ГАММА | 2017 |
|
RU2771280C2 |






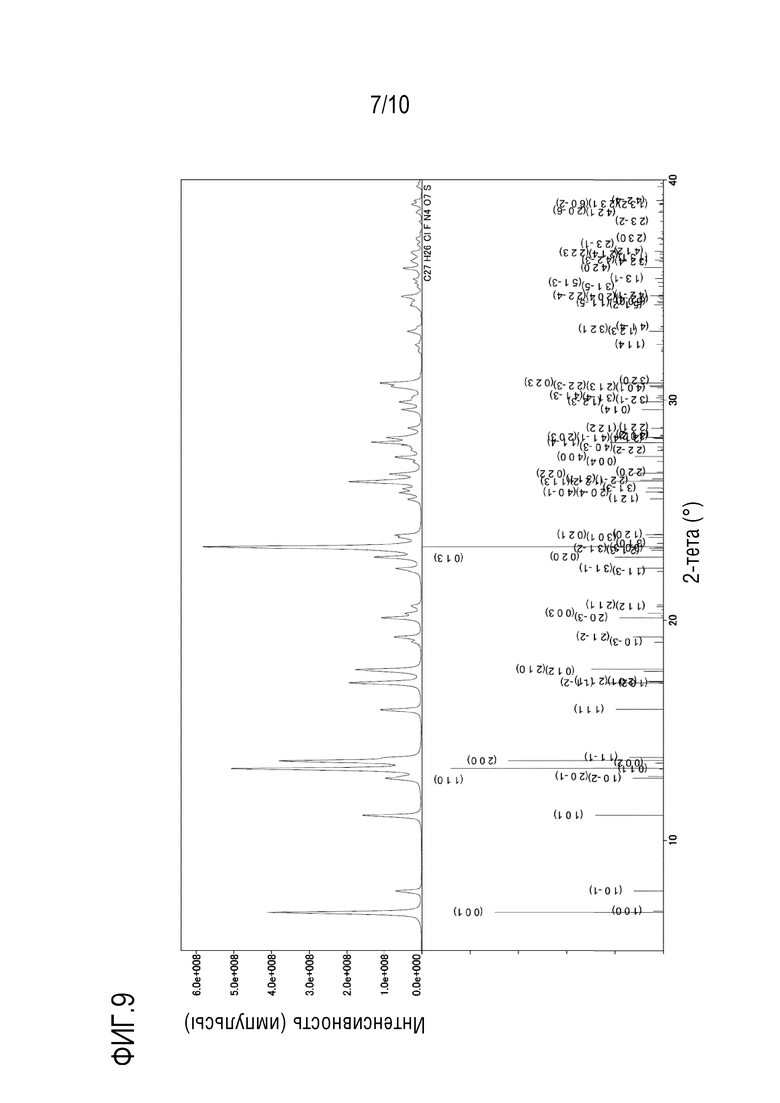

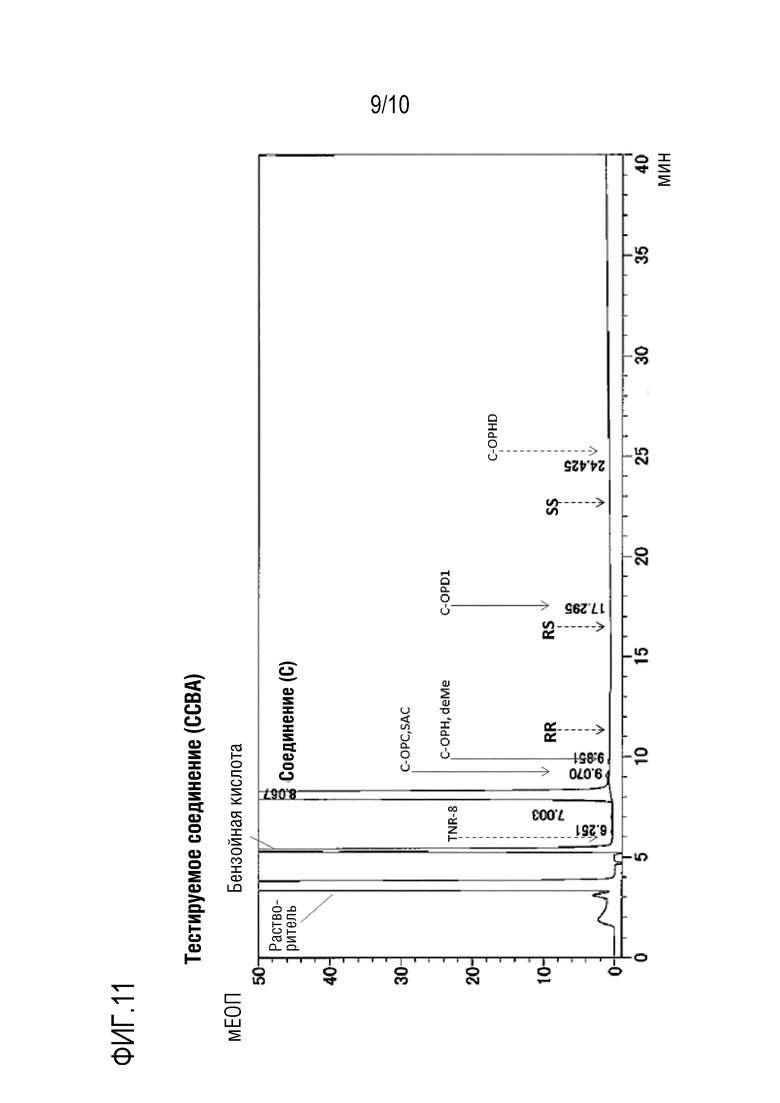

Изобретение относится к сокристаллу бензойной кислоты и 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида, где порошковая рентгеновская дифрактограмма сокристалла содержит пять или больше пиков при (2θ ± 0,2°) 6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°. Также изобретение относится к фармацевтической композиции, обладающей ингибирующей активностью в отношении рибонуклеотидредуктазы, содержащей (i) сокристалл бензойной кислоты и 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида, и (ii) фармацевтически приемлемый носитель. Изобретение относится к способу ингибирования рибонуклеотидредуктазы in vivo, включающему введение нуждающемуся в этом субъекту-человеку терапевтически эффективного количества фармацевтической композиции по изобретению. Сокристаллу бензойной кислоты и 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида применяют для получения ингибитора рибонуклеотидредуктазы, в качестве лекарственного средства для ингибирования активности в отношении рибонуклеотидредуктазы. Технический результат - сокристалл бензойной кислоты и 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида, обладающий свойствами стабильности, меньшую электростатичности, которое является мощным и селективным ингибитором рибонуклеотидредуктазы. 8 н. и 10 з.п. ф-лы, 20 табл., 12 ил., 10 пр.
1. Сокристалл бензойной кислоты и 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида, где порошковая рентгеновская дифрактограмма сокристалла содержит пять или больше пиков при (2θ ± 0,2°) 6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°.
2. Сокристалл по п.1, где сокристалл имеет эндотермический пик от 155 до 168°С, измеренный с помощью ДСК.
3. Сокристалл по п.2, где сокристалл имеет эндотермический пик при 162°С, измеренный с помощью ДСК.
4. Сокристалл по п.1, где порошковая рентгеновская дифрактограмма сокристалла содержит пики при (2θ ± 0,2°) 6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°.
5. Сокристалл по п.1, где порошковая рентгеновская дифрактограмма сокристалла содержит пики при (2θ ± 0,2°) 6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°, и где сокристалл имеет эндотермический пик при 162°С, измеренный с помощью ДСК.
6. Сокристалл бензойной кислоты и 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамида, где молярное отношение бензойной кислоты к 5-хлор-2-(N-((1S,2R)-2-(6-фтор-2,3-диметилфенил)-1-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)пропил)сульфамоил)бензамиду составляет 1:1, и где порошковая рентгеновская дифрактограмма сокристалла содержит пять или больше пиков при (2θ ± 0,2°) 6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°.
7. Сокристалл по п.6, в котором сокристалл имеет эндотермический пик от 155 до 168°С, измеренный с помощью ДСК.
8. Сокристалл по п.7, где сокристалл имеет эндотермический пик при 162°С, измеренный с помощью ДСК.
9. Сокристалл по п.6, где порошковая рентгеновская дифрактограмма сокристалла содержит пики при (2θ ± 0,2°) 6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°.
10. Сокристалл по п.6, где порошковая рентгеновская дифрактограмма сокристалла содержит пики при (2θ ± 0,2°) 6,8°, 7,8°, 11,2°, 13,4°, 13,7°, 16,0°, 17,1°, 17,8° и 23,2°, и где сокристалл имеет эндотермический пик при 162°С, измеренный с помощью ДСК.
11. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении рибонуклеотидредуктазы, содержащая (i) сокристалл по любому из пп.1-10, и (ii) фармацевтически приемлемый носитель.
12. Способ ингибирования рибонуклеотидредуктазы in vivo, включающий введение нуждающемуся в этом субъекту-человеку терапевтически эффективного количества фармацевтической композиции по п.11.
13. Способ по п.12, в котором ингибирование рибонуклеотидредуктазы происходит в опухолевой клетке субъекта-человека.
14. Противоопухолевое средство, обладающее ингибирующей активностью в отношении рибонуклеотидредуктазы, содержащее сокристалл по любому из пп.1-10 в качестве активного ингредиента.
15. Противоопухолевое средство по п.14, где противоопухолевое средство представляет собой пероральное противоопухолевое средство.
16. Применение сокристалла по любому из пп.1-10 для получения ингибитора рибонуклеотидредуктазы.
17. Применение сокристалла по любому из пп.1-10 в качестве лекарственного средства для ингибирования активности в отношении рибонуклеотидредуктазы.
18. Применение сокристалла по любому из пп.1-10 для получения перорального противоопухолевого средства, обладающего ингибирующей активностью в отношении рибонуклеотидредуктазы.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| ПРОИЗВОДНЫЕ ТРИАЗОЛА | 2007 |
|
RU2409570C2 |
| Ahmad, M | |||
| F., Huff, S | |||
| E., Pink, J., Alam, I., Zhang, A., Perry, K., et al.: " Identification of Non-nucleoside Human Ribonucleotide Reductase Modulators", Journal of Medicinal Chemistry, 2015, v.58(24), р.9498-9509 (doi:10.1021/acs.jmedchem.5b00929) | |||
| WO | |||
Авторы
Даты
2022-10-11—Публикация
2018-11-28—Подача