Изобретение относится к области биотехнологии и ветеринарной медицине и может быть использовано, в частности, для получения микрокапсулированных пробиотических препаратов.
Многочисленные исследования отечественных и зарубежных ученых подтверждают, что пробиотики - живые микроорганизмы, «проживающие» в кишечнике человека и животных, оказывают выраженное влияние на организм хозяина. При этом позитивное действие пробиотиков проявляется как на местном уровне, так и на способности участвовать в регуляции метаболизма в целом.
В животноводстве и ветеринарной медицине пробиотические препараты используют для улучшения процессов пищеварения и с целью стимуляции роста; устранения расстройств желудочно-кишечного тракта, возникающих вследствие резкого изменения состава рациона, нарушений режима кормления, технологических и других стрессов; коррекции нормальной микрофлоры кишечника после антимикробной терапии, стимуляции местной иммунной защиты и повышения общей резистентности организма. Однако все коммерческие пробиотические препараты имеют общий недостаток - это слабая устойчивость к кислой среде желудка. После прохождения желудка большая часть пробиотических бактерий погибает. Поэтому помещение пробиотиков в макрокапсулы (макроконтейнеры) не решают данную проблему в животноводстве. Так макрокапсулы, попадая в ротовую полость, пережевываются животными и эффект капсулирования теряется. В этой связи разработка микрокапсулирования пробиотиков является актуальной задачей, так как кислотоустойчивые микрокапсулы не разрушаются в ротовой полости в процессе жевания, транзитом проходят желудок и поступают в кишечник, где под действием щелочной среды разрушаются и пробиотические бактерии выходят непосредственно в кишечник. В кишечнике пробиотики размножаются и оказывают позитивное влияние на организм. Исходя из вышеизложенного разработка новых способов микрокапсулирования пробиотиков является актуальной задачей.
В настоящее время известен способ получения микрокапсул бактерий, который предусматривает приготовление дисперсии лиофилизированной биомассы бактерий в расплаве С12-С24 жирной кислоты при температуре от 40°С до 75°С и при соотношении от 50 до 90 масс. % жирной кислоты с последующей подачей полученной смеси на вращающийся диск инкапсулятора, работающего в пределах 2000-4000 об/мин (Патент РФ №2096452. - 1997. авт.В.М. Ратерфорд и др.). Недостатком данного способа является длительность процесса и применение специального дорогостоящего оборудования.
Существует способ получения микрокапсулированных форм лактобактерий с использованием сополимера акриловой и метакриловой кислот, заключающийся в том, что лиофилизированную культуру микроорганизмов диспергируют в водной суспензии сополимера. Полученную суспензию впрыскивают в жидкий сверхлегкий парафин, минеральные масла, легкие растительные масла, содержащие 0,1-0,5% стеарата алюминия и 3-7% ПЭГ-400 (полиэтиленгликоля), гомогенизируют до образования эмульсии с частицами желаемого размера и оставляют при постоянном нагревании и перемешивании 100-300 об/мин до формирования микрокапсул (Патент РФ №2171672. - 2000 г., авт. В.А. Быков и др.). Недостатком указанного способа является многоэтапность и длительность процесса.
Известен способ получения микрокапсул, содержащих живые микроорганизмы, на основе поливинилпирролидона, отличающихся тем, что лиофилизированную культуру микроорганизмов диспергируют в 30-50%-ном водном растворе поливинилпирролидона в соотношении 1:10-1:15 по массе при перемешивании до образования устойчивой взвеси, добавляют 10-30%-ный водный раствор танина, смесь перемешивают до формирования микрокапсул (Патент РФ №2220716. -2004, авт. Д.В. Сомов и др.).
Недостатком данного способа является сложность и многоэтапность технологического процесса.
Существует способ инкапсуляции интестевита, характеризующийся тем, что 100 мг пробиотика интестевита растворяют до 1 мл диоксана, или диметилсульфоксида, или диметилформамида, диспергируют полученную смесь в раствор натрий карбоксиметилцеллюлозы в ацетоне, содержащий 300 мл указанного полимера, в присутствии 0,01 г препарата Е472с при перемешивании, доливают 1 мл дистиллированной воды, полученную суспензию отфильтровывают и сушат (Патент РФ №2544169. -2015, авт. О.Б. Сеин и др.).
Известен способ инкапсуляции лактобифадола в оболочку из карбоксиметилцеллюлозы, характеризующийся тем, что пробиотик лактобифадола растворяют в диоксане или диметилсульфоксиде, или диметилформамиде, добавляют полученный раствор лактобифадола к раствору натрийкарбоксиметилцеллюлозы в серном эфире и в присутствии препарата Е472с при перемешивании 1000 об/сек. При этом лактобифадол и натрий карбоксиметилцеллюлозу берут в массовом соотношении 1:3, затем добавляют 1 мл дистиллированной воды. Полученную суспензию отфильтровывают и сушат (Патент РФ №2545742. - 2015, авт.А.А. Кролевец и др.).
Известен способ инкапсуляции лактобифадола, который заключается в том, что пробиотик лактобифадол диспергируют в суспензию альгината натрия в гексане в присутствии препарата Е472с при перемешивании 1000 об/с.Далее приливают четырехлористый углерод, полученную суспензию нанокапсул отфильтровывают и сушат при комнатной температуре, при этом соотношение ядро/оболочка в нанокапсулах составляет 1:3, или 1:5, или 5:1 (Патент РФ №2570379. - 2015, авт. А.А. Кролевец, О.Б. Сеин, и др.).
Известен способ получения нанокапсул пробиотиков, заключающийся в том, что в качестве оболочки используют альгинат натрия, который осаждают из суспензии в бензоле в присутствии сложного эфира глицерина с одной-двумя молекулами пищевых жирных кислот и с одной-двумя молекулами лимонной кислоты путем добавления гексана в качестве осадителя, при этом массовое соотношение пробиотика : альгинат натрия составляет 1:3, 1:5 или 5:1 (Патент РФ №2595830, - 2016, авт. А.А. Кролевец, Сеин О.Б. и др.).
Общим недостатком способов, указанных в вышеперечисленных патентах РФ (№2544169, №2545742, №2570379; №2595830), является использование в технологическом процессе веществ (ацетон, диоксан, бензол, гексан, эфир, четыреххлористый углерод), которые снижают жизнеспособность пробиотических бактерий, подвергающихся микрокапсулированию.
В качестве прототипа выбран способ микрокапсуляции энзимспорина, который характеризуется тем, что 1,0 г пробиотика энзимспорина диспергируют в суспензию 3,0 г альгината натрия в 100 мл дистиллированной воды при перемешивании 800-1000 об/мин и осаждают 100 мл 50%-ного ацетона в присутствии 25 мл 0,2 М раствора хлорида кальция при постоянном перемешивании в течение 15-20 мин. Затем отвержденные микрокапсулы фильтруют на фильтре Шотта и высушивают при 30-35°С (Патент РФ №2689164, авт. Трубников Д.В., Сеин О.Б., Горобец А.Ю., Трубникова Е.А. - 2019 г. ). К недостаткам способа, взятого за прототип, можно отнести: использование в качестве оболочки микрокапсул альгината натрия, имеющего низкую устойчивость к соляной кислоте желудка; применение в качестве осадителя ацетона, оказывающего отрицательное влияние на жизнеспособность пробиотических бактерий; получение микрокапсул с большим различием в размерах (80-150 мкм).
Технической задачей изобретения является повышение биологической активности микрокапсулированного препарата за счет снижения потерь пробиотических бактерий в процессе микрокапсулирования.
Решение технической задачи достигается тем, что для микрокапсулирования пробиотика Ветом 1 его предварительно перемешивают с очищенной водой до однородного состояния и полученную суспензию смешивают с равным по объему количеством 4%-ного раствора альгината натрия. Затем с использованием специального устройства-дозатора нашей конструкции (Патент РФ №194572. -2019, авт. О.Б. Сеин и др.) с высоты 20-25 см полученную смесь диспергируют в 0,2 М раствор кальция хлорида. Процесс диспергирования проводят при постоянном перемешивании со скоростью вращения мешалки 50-60 об/мин в течение 20-25 мин до образования постоянных взвесей. Сформировавшиеся микрокапсулы отделяют фильтрованием и помещают в 0,4-0,5%-ный раствор хитозана, в котором их выдерживают 50-60 мин. После этого микрокапсулы отделяют на фильтре Шотта, промывают очищенной водой и высушивают при 30-35°С.
Отличительной особенностью разработанного способа получения микрокапсул является:
- использование в качестве ядра пробиотика Ветом 1;
- применение для диспергирования пробиотика Ветом 1 в смеси с альгинатом натрия в раствор кальция хлорида специального устройства-дозатора, имеющего 8 капельниц, что позволяет получить микрокапсулы более стабильного (одинакового) размера;
- дополнительная обработка сформировавшихся микрокапсул в 0,4-0,5%-ном растворе хитозана, что повышает устойчивость микрокапсул к кислой среде желудка.
Используемый в способе пробиотик Ветом 1 является препаратом ветеринарного назначения, представляет собой сухую бакмассу живых спорообразующих бактерий Bacillus subtilis штамм DSM 32424. Данные бактерии выделяют в кишечнике животных антибиотикоподобные субстанции, ферменты и другие биологически активные вещества, под действием которых нормализуется биоценоз кишечника, кислотность среды, пищеварение, всасывание и метаболизм минеральных веществ, белков, аминокислот, углеводов и солей желчных кислот. Пробиотик Ветом 1 стимулирует клеточный и гуморальный иммунитет, повышает резистентность животных к инфекционным заболеваниям.
Альгинат натрия относится к полисахаридам, широко используется в медицине. В пищевой промышленности (Е401) применяется как загуститель и стабилизатор. Получают альгинат натрия из бурых или красных водорослей.
Хитозан является производным линейного полисахарида, получают его из хитина ракообразных. Благодаря своей катионной природе, хитозан способен образовывать нерастворимые полиэлектролитные комплексы с анионными полимерами, что широко используется в технологии капсулирования.
Результатом предлагаемого способа является получение микрокапсул Ветом 1 в альгинате натрия с выходом микрокапсул 80-85%, имеющих стабильные размеры, устойчивые к кислой среде желудка и разрушающиеся в щелочной среде кишечника с беспрепятственным поступлением содержимого капсул (пробиотических бактерий) в его полость.
Пример получения микрокапсул Ветом 1. 5,0 г пробиотика Ветом 1 вносят в 50,0 мл очищенной воды и перемешивают до однородного состояния в магнитной мешалке. Полученную суспензию смешивают с равным по объему количеством 4%-ного раствора альгината натрия. Затем с использованием устройства-дозатора с высоты 20-25 см полученную смесь диспергируют в 0,2 М раствор кальция хлорида. Процесс диспергирования проводят при постоянном перемешивании со скоростью вращения мешалки 50-60 об/мин в течение 20-25 мин до образования постоянных взвесей. Сформировавшиеся микрокапсулы отделяют фильтрованием и помещают в 0,4-0,5% раствор хитозана, в котором их выдерживают 50-60 мин. После этого микрокапсулы отделяют на фильтре Шотта, промывают и высушивают при 30-35°С.
Полученные микрокапсулы представляют собой сферические частицы серого цвета размером от 0,55 до 0,75 мм. Выход готовых микрокапсул составил 80-85%.
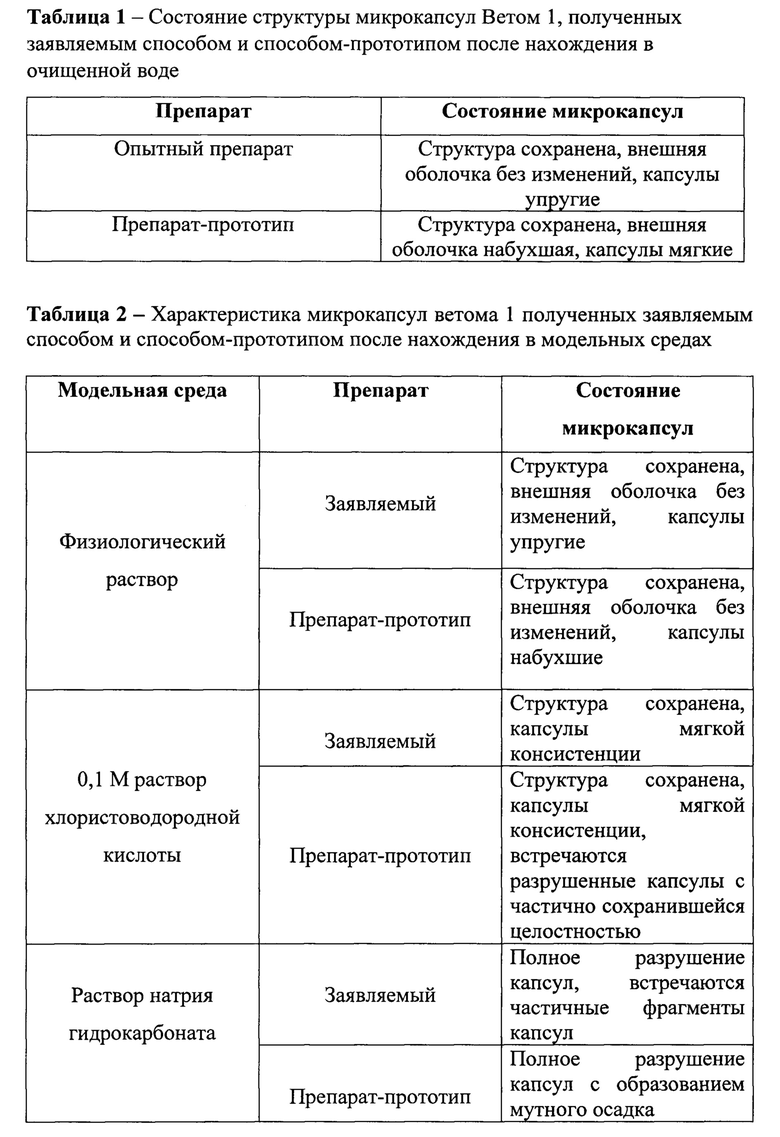
Физико-химические свойства микрокапсул Ветом 1, полученных с использованием разработанного способа и способа-прототипа, определяли в двух экспериментах.
В первом эксперименте изучали влияние водной среды на структуру микрокапсул. Было установлено (табл. 1), что микрокапсулы, полученные заявляемым способом, после 60-минутного нахождения в воде сохраняли свою структуру, органолептически они определялись как плотные и упругие образования. Микрокапсулы, полученные с использованием способа-прототипа, также сохраняли свою структуру, однако внешняя их оболочка была набухшей и мягкой.
Во втором эксперименте изучали влияние желудочной и кишечной среды на структуру микрокапсул. Эксперименты были проведены в соответствии с требованиями Государственной Фармакопеи РФ (М.: Науч. Центр экспертизы средств медицинского применения, 2008. - Вып. 1. - 704 с), согласно которым кишечнорастворимые лекарственные формы не должны распадаться в течение 60 минут в растворе кислоты хлористоводородной (0,1 М) и после промывания водой должны распадаться в растворе натрия гидрокарбоната (рН 7,5-8,0) в течение 60 мин. Результаты исследований представлены в таблице 2, из которой следует, что микрокапсулы, полученные по заявляемому способу и способу-прототипу, сохраняли свою структуру как в физиологическом растворе, так и в 0,1 М растворе хлористоводородной кислоты. В то же время при тестировании препарата-прототипа в 0,1 М растворе хлористоводородной кислоты микрокапсулы имели мягкую консистенцию, встречались разрушенные микрокапсулы с частичным сохранением целостности и структуры.
Бактериологические свойства полученного микрокапсулированного препарата и препарата-прототипа исследовали в ОБУ «Курская областная ветеринарная лаборатория». Количественное содержание изучаемых пробиотических микроорганизмов, входящих в состав препаратов, определяли оптическим методом (по стандартам мутности) и использованием камеры Горяева. При анализе количества жизнеспособных клеток исследуемых микроорганизмов разрушали оболочку микрокапсул фосфатным буфером с рН 7,8-8,0, титровали культуру и высевали пробиотические бактерии на питательную среду. В качестве контроля использовали стандартную культуру в аналогичных разведениях.
В ходе проведенных бактериологических исследований было установлено, что количество жизнеспособных бактерий в заявляемом препарате составляло 5,0⋅10 - 5,4⋅10, а в препарате-прототипе - 3,8⋅10 - 4,7⋅10 в 1 грамме препарата.
Проведенные исследования свидетельствуют о том, что заявляемый способ позволяет получить микрокапсулированный пробиотический препарат Ветом 1 с более выраженными биологическими свойствами по сравнению с препаратом-прототипом.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ микрокапсулирования пробиотика ветоспорина | 2023 |
|
RU2815782C1 |
| Способ получения микрокапсулированного энзимспорина | 2021 |
|
RU2780885C1 |
| Способ микрокапсуляции энзимспорина | 2018 |
|
RU2689164C1 |
| Способ микрокапсулирования спирулины и хлореллы | 2022 |
|
RU2799558C1 |
| Способ получения микрокапсулированных половых феромонов быка | 2023 |
|
RU2815783C1 |
| Способ повышения обмена веществ и неспецифической резистентности у сельскохозяйственных животных | 2021 |
|
RU2763842C1 |
| Способ микрокапсуляции спирулины | 2022 |
|
RU2801795C1 |
| Способ микрокапсулирования экстракта шиповника | 2024 |
|
RU2840163C1 |
| СПОСОБ ПОЛУЧЕНИЯ МИКРОКАПСУЛ АНТИСЕПТИКА-СТИМУЛЯТОРА ДОРОГОВА (АСД) 2 ФРАКЦИЯ В КАППА-КАРРАГИНАНЕ | 2021 |
|
RU2798114C2 |
| Способ микрокапсулирования половых феромонов хряка | 2022 |
|
RU2829958C2 |
Изобретение относится к области биотехнологии и ветеринарной медицины и может быть использовано для получения микрокапсулированных пробиотических препаратов. Способ получения микрокапсул пробиотика Ветом 1 заключается в том, что пробиотик Ветом 1 смешивают с очищенной водой до однородного состояния, полученную суспензию пробиотика смешивают с равным по объему количеством 4%-ного раствора альгината натрия и с использованием устройства-дозатора, имеющего 8 капельниц, с высоты 20-25 см полученную смесь диспергируют в 0,2 М раствор кальция хлорида при постоянном перемешивании со скоростью вращения мешалки 50-60 об/мин в течение 20-25 мин. Затем сформировавшиеся микрокапсулы отделяют фильтрованием и помещают в 0,4-0,5%-ный раствор хитозана на 50-60 мин. После чего микрокапсулы отделяют на фильтре Шотта, промывают и высушивают при 30-35°С. Способ обеспечивает получение микрокапсул Ветом 1 с выходом микрокапсул 80-85%, имеющих стабильные размеры, устойчивые к кислой среде желудка и разрушающиеся в щелочной среде кишечника с беспрепятственным поступлением содержимого капсул (пробиотических бактерий) в его полость. 2 табл.
Способ получения микрокапсул пробиотика Ветом 1 в альгинате натрия, отличающийся тем, что пробиотик Ветом 1 смешивают с очищенной водой, доводят до однородного состояния, суспензию пробиотика смешивают с равным по объему количеством 4%-ного раствора альгината натрия и с использованием устройства-дозатора, имеющего 8 капельниц, с высоты 20-25 см полученную смесь диспергируют в 0,2 М раствор кальция хлорида при постоянном перемешивании со скоростью вращения мешалки 50-60 об/мин в течение 20-25 мин, сформировавшиеся микрокапсулы отделяют фильтрованием и помещают в 0,4-0,5%-ный раствор хитозана на 50-60 мин, затем микрокапсулы отделяют на фильтре Шотта, промывают и высушивают при 30-35°С.
| Способ микрокапсуляции энзимспорина | 2018 |
|
RU2689164C1 |
| СПОСОБ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ПРЕПАРАТА "ЭНЗИМСПОРИН" В ПРОЦЕССЕ МИКРОКАПСУЛЯЦИИ | 2020 |
|
RU2736377C2 |
| УСТРОЙСТВО для НАПОЛНЕНИЯ ТАРЫ ЖИДКОСТЬЮ | 0 |
|
SU194572A1 |
| СПОСОБ ИНКАПСУЛЯЦИИ ВЕТОМА 1.1, ОБЛАДАЮЩЕГО СУПРАМОЛЕКУЛЯРНЫМИ СВОЙСТВАМИ | 2013 |
|
RU2549956C2 |
| CN 104887647 A, 09.09.2015 | |||
| CN 108669565 A, 19.10.2018 | |||
| CN 103222539 B, 06.05.2015 | |||
| CN 103704718 B, 27.04.2016. | |||
Авторы
Даты
2022-10-18—Публикация
2021-05-13—Подача