ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет по предварительной заявке США №62/812839, поданной 1 марта 2019 г., раскрытие которой включено в данный документ посредством ссылки, как если бы оно было приведено в полном объеме. Настоящая заявка испрашивает приоритет по предварительной заявке США №62/949785, поданной 18 декабря 2019 г., раскрытие которой включено в данный документ посредством ссылки, как если бы оно было приведено в полном объеме.
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[0002] Настоящее изобретение относится к ингибиторам SOS1, применимым при лечении заболеваний или расстройств. В частности, в настоящем изобретении рассмотрены соединения и композиции, ингибирующие SOS1, способы лечения заболеваний, связанных с SOS1, и способы синтеза этих соединений.
УРОВЕНЬ ТЕХНИКИ
[0003] Белки семейства RAS, включая KRAS (гомолог вирусного онкогена саркомы крыс Кирстена V-Ki-ras2), NRAS (гомолог вирусного онкогена нейробластомы RAS) и HRAS (вирусный онкоген саркомы мышей Харви) и любые их мутанты, представляют собой малые ГТФазы, которые существуют в клетках в ГТФ-связанном или ГДФ-связанном состояниях (McCormick et al., J. Mol. Med. (Berl)., 2016, 94(3):253-8; Nimnual et al., Sci. STKE., 2002, 2002(145):pl36). Белки семейства RAS имеют слабую природную активность ГТФазы и демонстрируют низкие скорости нуклеотидного обмена (Hunter et al., Mol. Cancer Res., 2015, 13(9): 1325-35). Связывание активирующих ГТФазу белков (GAP), таких как NF1, повышает активность ГТФазы белков семейства RAS. Связывание факторов обмена гуаниновых нуклеотидов (GEF), таких как SOS1 (Son of Sevenless 1), способствует высвобождению ГДФ из белков семейства RAS, делая возможным связывание ГТФ (Chardin et al., Science, 1993, 260(5112): 1338-43). В ГТФ-связанном состоянии белки семейства RAS являются активными и привлекают эффекторные белки, включая RAF и фосфоинозитид-3-киназу (PI3K), стимулируя RAF/митоген или регулируемые внеклеточными сигналами киназы (MEK/ERK). В опубликованных данных говорится о критической роли SOS1 в активации мутантного KRAS и онкогенной сигнализации при раке (Jeng et al., Nat. Commun., 2012, 3:1168). Снижение уровней SOS1 уменьшало скорость пролиферации и выживаемость опухолевых клеток, несущих мутацию KRAS, при этом в клеточных линиях KRAS дикого типа не наблюдали никакого эффекта. Эффект потери SOS1 нельзя исправить внесением мутированного в каталитическом сайте SOS1, что демонстрирует важную роль активности SOS1 GEF в мутантных раковых клетках KRAS.
[0004] SOS1 играет критически важную роль в активации сигнализации белков семейства RAS при раке посредством механизмов, отличных от мутаций в белках семейства RAS. SOS1 взаимодействует с адаптерным белком Grb2, а получаемый в результате комплекс SOS1/Grb2 связывается с активированными/фосфорилированными рецепторными тирозинкиназами (например, EGFR, ErbB2, ErbB3, ErbB4, PDGFR-A/B, FGFR1/2/3, IGF1R, INSR, ALK, ROS, TrkA, TrkB, TrkC, RET, c-MET, VEGFR1/2/3, AXL) (Pierre et al., Biochem. Pharmacol., 2011, 82(9): 1049-56). SOS1 также рекрутируется другими фосфорилированными рецепторами клеточной поверхности, такими как Т-клеточный рецептор (TCR), В-клеточный рецептор (BCR) и рецептор моноцитарного колониестимулирующего фактора (Salojin et al., J. Biol. Chem. 2000, 275(8):5966-75). Такая локализация SOS1 в плазматической мембране, проксимально к белкам семейства RAS, делает возможной стимуляцию SOS1 активации белков семейства RAS. Активация SOS1 белков семейства RAS также может быть опосредована взаимодействием SOS1/Grb2 с онкопротеином BCR-ABL, обычно встречающемся при хроническом миелогенном лейкозе (Kardinal et al., 2001, Blood, 98:1773-81; Sini et al., Nat. Cell Biol., 2004, 6(3):268-74). Кроме того, изменения в SOS1 были связаны с раком. Мутации SOS1 встречаются при эмбриональных рабдомиосаркомах, опухолях яичка из клеток Сертоли, зернистоклеточных опухолях кожи (Denayer et al., Genes Chromosomes Cancer, 2010, 49(3):242-52) и аденокарциноме легкого (Cancer Genome Atlas Research Network, Nature, 2014, 511 (751 l):543-50). В то же время сверхэкспрессия SOS1 была описана в случае рака мочевого пузыря (Watanabe et al., IUBMB Life, 2000, 49(4):317-20) и рака предстательной железы (Timofeeva et al., Int. J. Oncol., 2009; 35(4):751-60). Помимо рака, наследственные мутации SOS1 связаны с патогенезом RASonarnfi, таких как, например, синдром Нунан (СН), кардио-фацио-кожный синдром (КФК) и наследственный фиброматоз десны типа 1 (Pierre et al., Biochem. Pharmacol., 2011, 82(9): 1049-56).
[0005] SOS1 также является GEF для активации ГТФаз RAC1 (Ras-родственный С3 субстрат ботулотоксина 1) (Innocenti et al., J. Cell Biol., 2002, 156(1): 125-36). RAC1, как и белки семейства RAS, связан с патогенезом ряда раков человека и других заболеваний (Bid et al., Mol. Cancer Ther. 2013, 12(10): 1925-34).
[0006] Son of Sevenless 2 (SOS2), гомолог SOS1 в клетках млекопитающих, действует как GEF для активации белков семейства RAS (Pierre etal., Biochem. Pharmacol., 2011, 82(9): 1049-56; Buday et al., Biochim. Biophys. Acta., 2008, 1786(2): 178-87). Опубликованные данные по мышиным моделям с нокаутом позволяют предположить избыточную роль для SOS1 и SOS2 в гомеостазе у взрослых мышей. В то время как нокаут SOS1 в зародышевой линии у мышей приводит к летальности на средних сроках эмбрионального созревания (Qian et al., EMBO J., 2000, 19(4):642-54), взрослые мыши с системным кондициональным нокаутом SOS1 жизнеспособны (Baltanas et al., Mol. Cell. Biol., 2013, 33(22):4562-78). Нацеливание на ген SOS2 не приводит к какому-либо выраженному фенотипу у мышей (Esteban et al., Mol. Cell. Biol., 2000, 20(17):6410-3). В противоположность этому, двойной нокаут SOS1 и SOS2 приводит к быстрой летальности у взрослых мышей (Baltanas et al., Mol. Cell. Biol., 2013, 33(22): 4562-78). Эти опубликованные данные позволяют предположить, что избирательное нацеливание на отдельные изоформы SOS (например, избирательное нацеливание на SOS1) может нормально переноситься с достижением терапевтического индекса между обусловленными SOS1/белком семейства RAS видами рака (или другими связанными с SOS1/белком семейства RAS патологиями) и нормальными клетками и тканями.
[0007] Ожидается, что избирательное фармакологическое ингибирование каталитического связывания SOS1 с белками семейства RAS будет предотвращать опосредованную SOS1 активацию белков семейства RAS до ГТФ-связанной формы. Ожидается, что такие ингибирующие SOS1 соединения будут последовательно ингибировать сигнализацию в клетках после белков семейства RAS (например, фосфорилирование ERK). Ожидается, что в раковых клетках, ассоциированных с зависимостью от белков семейства RAS (например, линиях мутантных раковых клеток KRAS), ингибирующие SOS1 соединения будут обеспечивать противораковую эффективность (например, ингибирование пролиферации, выживаемости, метастазирования и т.д.). Высокая активность ингибирования связывания 8081:белок семейства RAS (значения IC50 на наномолярном уровне) и фосфорилирования ERK в клетках (значения IC50 на наномолярном уровне) являются желательными характеристиками для ингибирующего SOS1 соединения. Кроме того, желательной характеристикой ингибирующего SOS1 соединения было бы ингибирование SOS1 в большей мере, чем SOS2. Это заключение основано на жизнеспособном фенотипе мышей с нокаутом SOS1 и летальности мышей с двойным нокаутом SOS1/SOS2, как описано выше.
[0008] Эти характеристики отсутствовали в ранее описанных ингибирующих SOS1 соединениях. В последние десятилетия взаимодействие белков семейства RAS и SOS1 привлекало все больше внимания. Было предпринято, с ограниченным успехом, несколько попыток идентифицировать и оптимизировать связывающие соединения, нацеленные на эффекторный сайт связывания RAS или каталитический сайт связывания SOS 1 (избранный обзор смотрите в Lu et al., ChemMedChem. 2016, 11(8): 814-21).
[0009] Недавно были идентифицированы малые активирующие молекулы, которые связываются с липофильным карманом SOS1 в непосредственной близости с сайтом связывания RAS (Bums et al., Proc.Natl. Acad. Sci. 2014, 111(9):3401-6). Однако связывание этих молекул, по-видимому, приводит к повышению нуклеотидного обмена и, соответственно, активации RAS вместо дезактивации.
[0010] В попытке стабилизировать белок-белковое взаимодействие белков семейства RAS с SOS1 и предотвратить перезагрузку белков семейства RAS с ГТФ, впоследствии было идентифицировано несколько фрагментов (Winter et al., J. Med. Chem. 2015, 58(5):2265-74). Однако обратимое связывание фрагментов с SOS1 не транслируется в измеримый эффект на нуклеотидный обмен, и лишь слабый эффект наблюдали для фрагментов, ковалентно связанных с RAS.
[0011] Также недавно проводили исследования, в которых объединили рациональный дизайн и скрининговые платформы, чтобы идентифицировать низкомолекулярные ингибиторы SOS1 (Evelyn et al., Chem. Biol. 2014, 21 (12): 1618-28; Evelyn et al., J. Biol. Chem. 2015, 290(20): 12879-98; Zheng et al., WO 2016/077793), т.е. соединения, которые связываются с SOS1 и ингибируют белок-белковое взаимодействие с белками семейства RAS. Хотя были идентифицированы соединения с небольшим ингибирующим эффектом на SOS1, эффекты на обмен гуаниновых нуклеотидов и модуляцию клеточной передачи сигнала (например, фосфорилирование ERK) являются слабыми.
КРАТКОЕ ОПИСАНИЕ
[0012] Настоящее изобретение относится к соединениям, способным ингибировать активность SOS1. В настоящем изобретении дополнительно предложены способ получения соединений, фармацевтических препаратов, содержащих такие соединения, и способы применения таких соединений и композиций при лечении заболеваний и расстройств, связанных с аберрантной активностью SOS1.
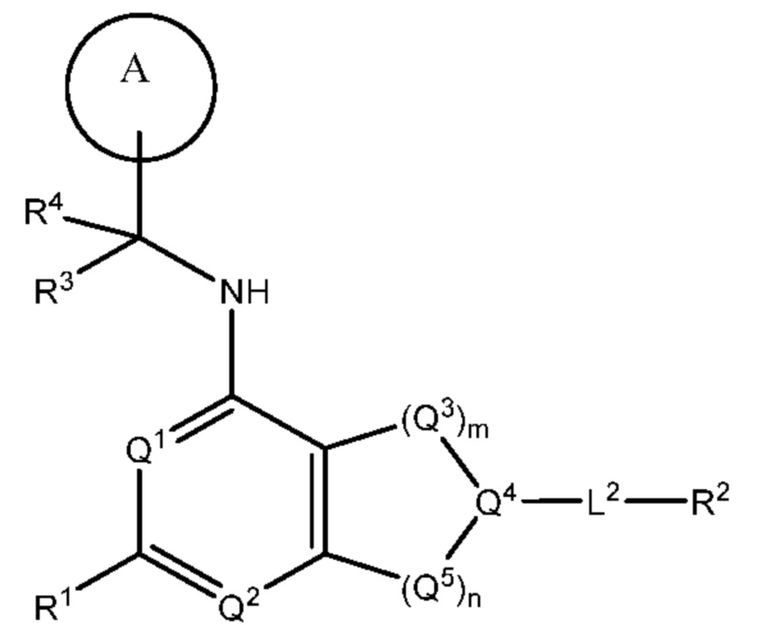
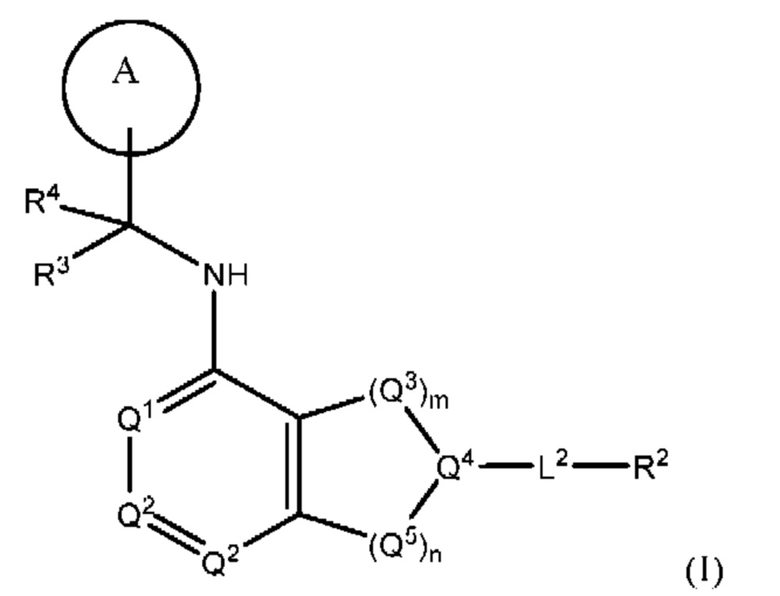
[0013] Один аспект настоящего изобретения относится к соединениям формулы (I):
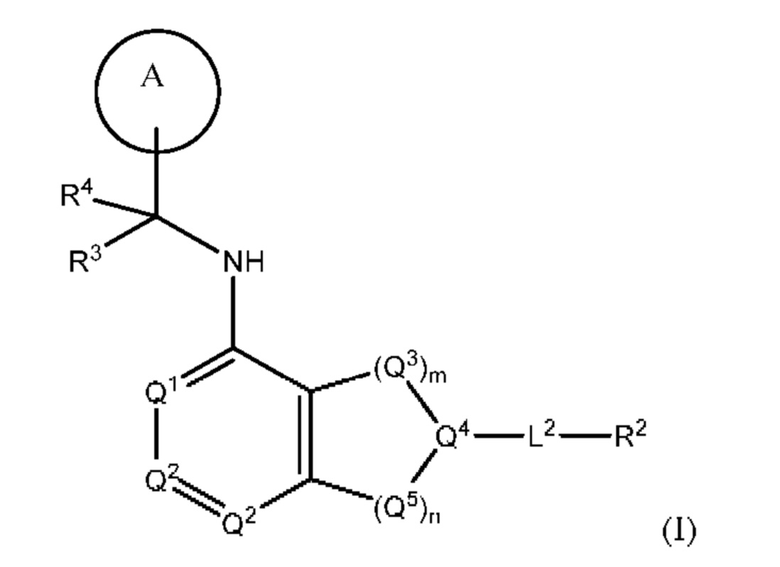
или его фармацевтически приемлемые соль, сольват, изомер, пролекарство или таутомер, где:
Q1 представляет собой СН или N;
Q4 представляет собой СН, С или N;
каждый Q2 независимо представляет собой C-R1 или N, где один Q2 представляет собой N, а другой Q2 представляет собой C-R1;
каждый из Q3 и Q5 независимо представляет собой C(RQC)2, NRQN, СО, О, S или SO2, где каждый RQC независимо представляет собой Н, F, О, Br или 6-10-членный арил, а каждый RQN независимо представляет собой Н, С1-6 алкил или 6-10-членный арил;
где по меньшей мере один из Q1, Q2, Q3, Q4 и Q5 представляет собой N, NRQN, О или SO2;
m равно 0, 1, 2 или 3;
n равно 0, 1, 2 или 3;
причем если m равно 0, то n не равно 0;
R1 выбран из группы, состоящей нз Н, С1-6 алкила, галогена, -CONHR1a -NHR1a, OR1a циклопропила, азетадннила и -CN; где каждый С1-6 алкил и азетидннил необязательно замещен галогеном, R1a, -NHR1a или -OR1a; где R1a представляет собой Н, C1-6 алкил, циклопропил, 3-6-членный гетероциклил или C1-6 галогеналкил;
L2 выбран из группы, состоящей из связи, -С(О)-, -С(O)O-, -C(O)NH(CH2)o-, -S(O)2-  , -С(O)(СН2)р-, -(CH2)р- и -О-;
, -С(O)(СН2)р-, -(CH2)р- и -О-;
где о равно 0, 1 или 2; и где р представляет собой число от 1 до 6;
R2 выбран из группы, состоящей из Н, С1-6 алкила, -NR2bR2c, -OR2a, 3-14-членного циклоалкила, 3-14-членного циклоалкенила, 3-14-членного гетероциклила, 6-10-членного арила и 5-10-членного гетероарила; где каждый С1-6 алкил, 3-14-членный циклоалкил, 3-14-членный циклоалкенил, 3-14-членный гетероциклил, 6-10-членный арил и 5-10-членный гетероарил независимо необязательно замещен С1-6 алкилом, C1-6 галогеналкилом, C1-6 гидроксиалкилом, С1-6 метоксиалкилом, -ОН, -OR2a, оксо, =N, галогеном, -C(O)R2a, -C(O)OR2a, -C(O)NR2bR2c, -SO2R2a, -CN, -NR2bR2c, 3-6-членным циклоалкилом, 3-7-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом;
где R2a представляет собой Н, C1-6 алкил, C1-6 г ало ген алкил, 3-7-членный гетероциклил или -(СН2)rOCH3, где г равно 1, 2 или 3;
где R2b представляет собой Н или C1-6 алкил;
где R2c представляет собой Н или C1-6 алкил;
R3 и R4 независимо представляют собой Н или C1-6 алкил, необязательно замещенный галогеном или -ОН; где по меньшей мере один из R3 и R4 представляет собой Н или где R3 и R4 вместе с атомом, к которому они присоединены, в совокупности образуют 3-6-членный цикл о алкил; и
А представляет собой необязательно замещенный 6-членный арил или необязательно замещенный 5-6-членный гетероарил;
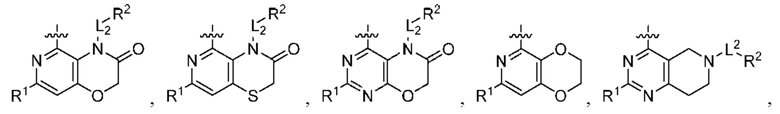
при условии, что когда  представляет собой
представляет собой 
то R1 не представляет собой Н.
[0014] Один аспект настоящего изобретения относится к соединениям формулы (I-а):
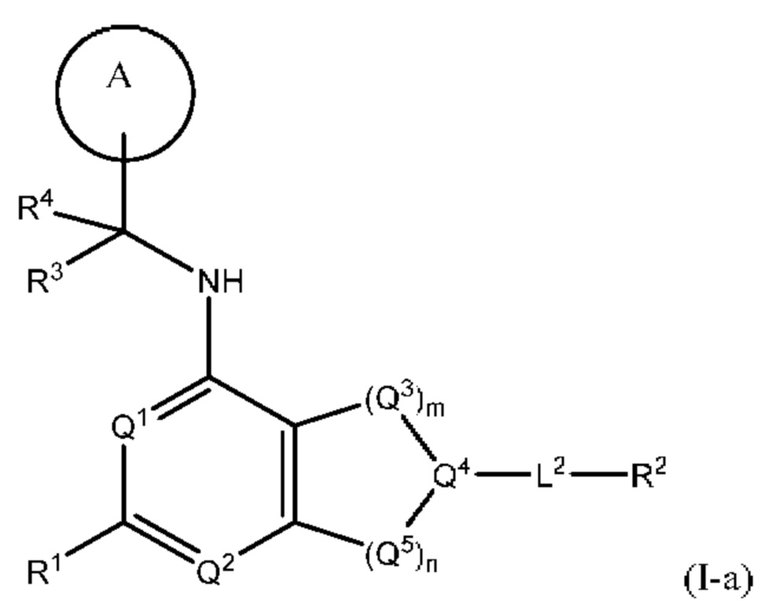
или его фармацевтически приемлемые соль, сольват, изомер, пролекарство или таутомер, где:
Q1, Q3, Q4, Q5, rn, n и А соответствуют определению в формуле (I);
Q2 представляет собой СН или N;
где по меньшей мере один из Q1, Q2, Q3, Q4 и Q5 представляет собой N, NRQN, О или SO2;
R1 выбран из группы, состоящей из Н, галогена, C1-6 алкила, циклопропила, -CN и -OR1a; где R1a представляет собой Н или C1-6 алкил;
L2 выбран из группы, состоящей из связи, -С(О)-, -С(O)O- -C(O)NH(CH2)O-, -S(O)2-, -С(O)(СН2)р-, -(СН2)р- или -О-; где о равно 0, 1 или 2; и где р представляет собой число от 1 до 6;
R2 выбран из группы, состоящей из Н, (CH2)qCH3, 3-14-членного циклоалкила, 3-14-членного циклоалкенила, 3-14-членного гетероциклила, 6-10-членного арила и 5-10-членного гетероарила; где q представляет собой число от 1 до 5; где каждый 3-14-членный циклоалкил, 3 14-членный циклоалкенил, 3 14-членный гетероциклил, 6 10-членный арил или 5 10-членный гетероарил необязательно замещен C1-6 алкилом, -OH, галогеном, C(O)R2a или -C(O)NR2bR2c; где R2a представляет собой Ci-6 алкил или -(СН2)rOCH3, где r равно 1, 2 или 3; где R2b представляет собой Н или C1-6 алкил; и где R2c представляет собой Н или C1-6 алкил; и
R3 и R4 независимо представляют собой Н или C1-6 алкил; где по меньшей мере один из R3 и R4 не представляет собой Н; или R3 и R4 вместе с атомом, к которому они присоединены, в совокупности образуют 3-6-членный циклоалкил; и
причем условие формулы (I) также применимо к формуле (I-а).
[0015] Другой аспект настоящего изобретения относится к соединениям формулы (V):
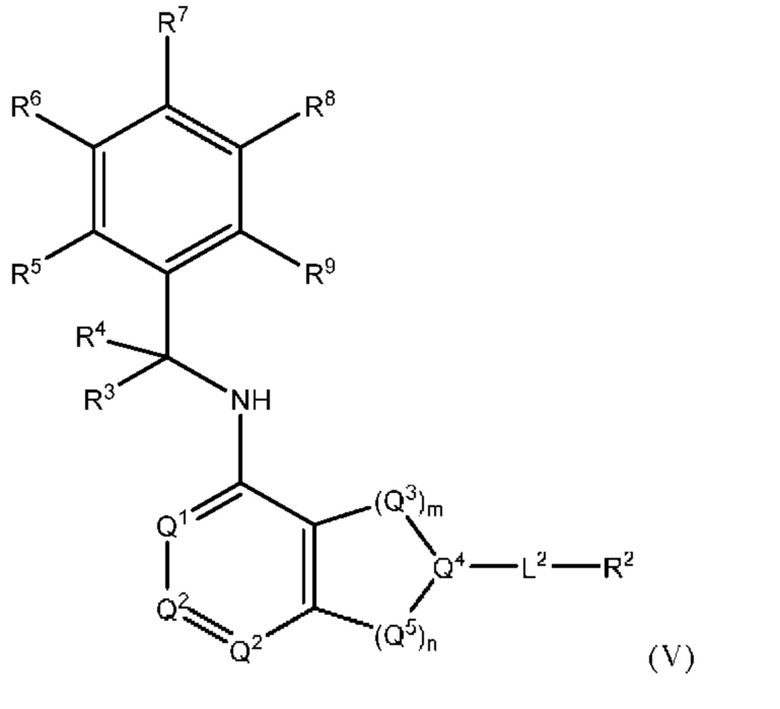
или его фармацевтически приемлемые соль, сольват, изомер, пролекарство или таутомер, где:
L2, Q1, Q2, Q3, Q4, Q5, m, n, R1, R2, R3 и R4 соответствуют определению в формуле (I);
R5, R6, R7, R8 и R9 независимо выбраны из группы, состоящей из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -ОН, галогена, -NO2, -CN, -NR11R12, -SR10, -S(O)2NR11R12, -S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, -C(O)R10 и -CO2R10, где каждый C1-6 алкил, C2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен -ОН, галогеном, -NO2, оксо, -CN, -R10, -OR10, -NR11R12, -SR10, -S(O)2NR11R12, -S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, 3-8-членным циклоалкилом, 3-14-членным гетероциклилом, 6 10-членным арилом или 5 10-членным гетероарилом, или любые два смежных R5, R6, R7, R8 и R9 образуют 3-14-членное конденсированное кольцо;
R10, R11 и R12 в каждом случае независимо выбраны из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -OR13, -SR13, галогена, -NR13R14, -NO2 и -CN; и
R13 и R14 в каждом случае независимо выбраны из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила или 3-14-членного гетероциклила, где каждый C1-6 алкил, С2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен ОН, SH, -NH2, NO2 или -CN; и
причем условие формулы (I) также применимо к формуле (V).
[0016] Другой аспект настоящего изобретения относится к соединениям формулы (V-а):
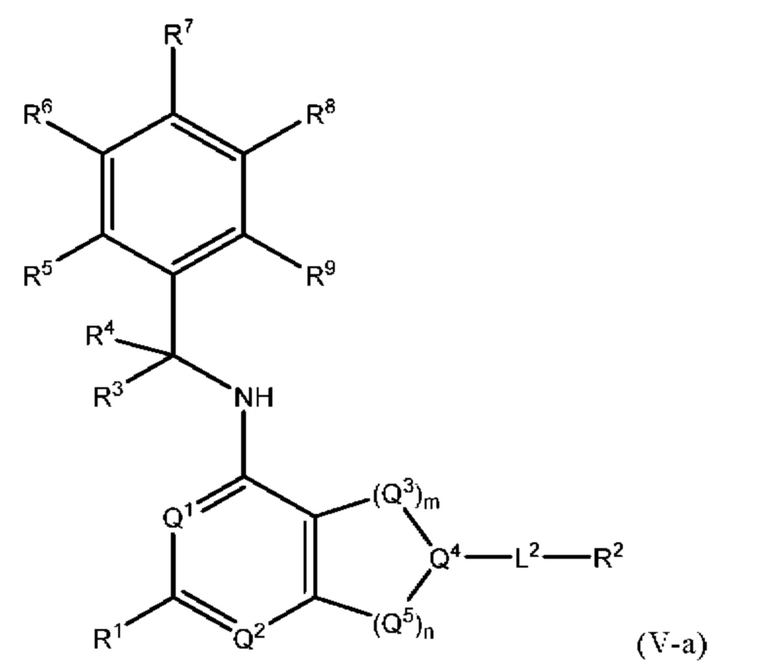
или его фармацевтически приемлемые соль, сольват, изомер, пролекарство или таутомер, где:
Q1, Q3, Q4, Q5, m, n, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13 и R14 соответствуют определению в формуле (V);
Q2 представляет собой СН или N;
где по меньшей мере один из Q1, Q2, Q3, Q4 и Q5 представляет собой N, NRQN, О или SO2;
R1 выбран из группы, состоящей из Н, галогена, С1-6в алкила, циклопропила, -CN и -OR1a; где R1a представляет собой Н или С1-6 алкил; и
L2 выбран из группы, состоящей из связи, -С(О)-, -С(O)O- -C(O)NH(CH2)о-, -S(O)2-, -С(O)(СН2)р-, -(СН2)р- или -О-; где о равно 0, 1 или 2; и где р представляет собой число от 1 до 6; и
причем условие формулы (I) также применимо к формуле (V-a).
[0017] Другой аспект настоящего изобретения относится к соединениям формулы (VI):
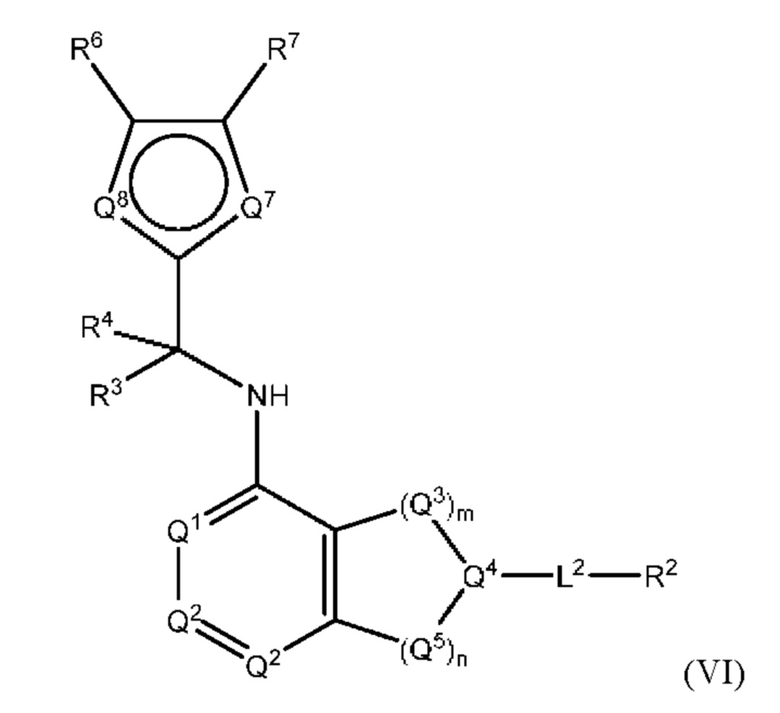
или его фармацевтически приемлемые соль, сольват, изомер, пролекарство или таутомер, где:
L2, Q1, Q2, Q3, Q4, Q5, m, n, R1, R2, R3 и R4 соответствуют определению в формуле (I);
Q7 и Q8 каждый независимо представляют собой СН, N, NH, О или S при условии, что по меньшей мере один из Q7 и Q8 представляет собой N, NH, О или S;
R6 и R7 независимо выбраны из группы, состоящей из Н, D, C1-6е алкила, С2-6 алкенила, 4 8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -ОН, галогена, -NO2, -CN, -NR11R12, -SR10, -S(O)2NR11R12, -S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, -C(O)R10 и -CO2R10, где каждый C1-6 алкил, C2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен -ОН, галогеном, -NO2, оксо, -CN, -R10, -OR10, -NR11R12, -SR10, -S(O)2NR11R12, -S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, 3-8-членным циклоалкилом, 3-14-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом,
R10, R11 и R12 в каждом случае независимо выбраны из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -OR13, -SR13, галогена, -NR13R14, -NO2 и -CN; и
R13 и R14 в каждом случае независимо выбраны из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила или 3-14-членного гетероциклила, где каждый C1-6 алкил, С2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен -ОН, -SH, -NH2, -NO2 или -CN; и
причем условие формулы (I) также применимо к формуле (VI).
[0018] Другой аспект настоящего изобретения относится к соединениям формулы (VI-а):
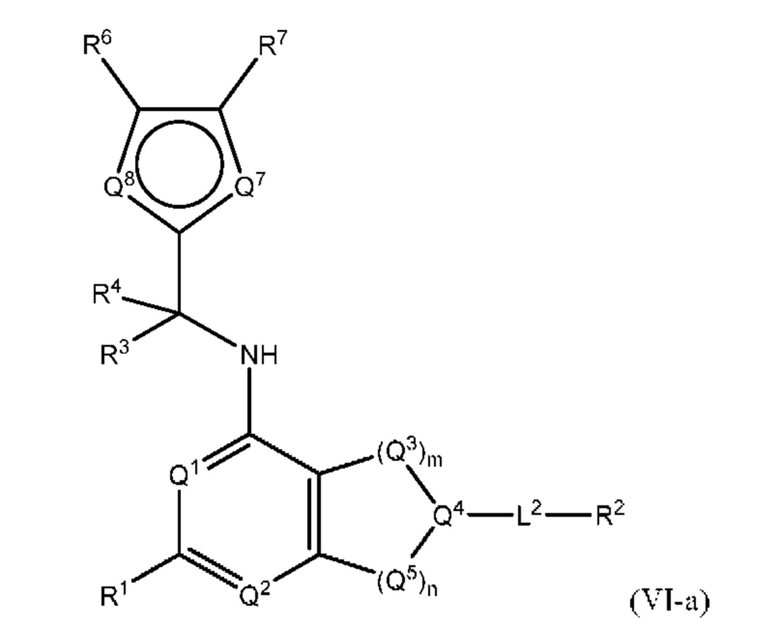
где L2, Q1, Q2, Q3, Q4, Q5, Q7, Q8, R1, R2, R3, R4, R6 и R7 соответствуют определению в формуле (VI), а условие формулы (I) также применимо к формуле (VI-a).
[0019] Другой аспект настоящего изобретения относится к фармацевтической композиции, содержащей соединение или его фармацевтически приемлемую соль, сольват, гидрат, таутомер или изомер, приведенные выше, и фармацевтически приемлемый носитель.
[0020] Другой аспект настоящего изобретения относится к способу ингибирования SOS1 у субъекта, включающему введение субъекту соединения или его фармацевтически приемлемой соли, сольвата, гидрата, таутомера или изомера, или фармацевтической композиции, описанных выше.
[0021] Другой аспект настоящего изобретения относится к способу ингибирования взаимодействия SOS1 и белка семейства RAS в клетке или ингибирования взаимодействия SOS1 и RAC1 в клетке, включающему введение в клетку соединения или его фармацевтически приемлемой соли, сольвата, гидрата, таутомера или изомера, или фармацевтической композиции, описанных выше.
[0022] Другой аспект настоящего изобретения относится к способу лечения или предотвращения заболевания, причем лечение или предотвращение заболевания характеризуется ингибированием взаимодействия SOS1 и белка семейства RAS или ингибированием взаимодействия SOS1 и RAC1, при этом способ включает введение нуждающемуся в этом субъекту эффективного количества соединения или его фармацевтически приемлемой соли, сольвата, гидрата, таутомера или изомера, или фармацевтической композиции, описанных выше.
[0023] Другой аспект настоящего изобретения относится к способу лечения или предотвращения рака у нуждающегося в этом субъекта, включающему введение субъекту эффективного количества соединения или его фармацевтически приемлемой соли, сольвата, гидрата, таутомера или изомера, или фармацевтической композиции, описанных выше.
[0024] Другой аспект настоящего изобретения относится к соединению или его фармацевтически приемлемой соли, сольвату, гидрату, таутомеру или изомеру, или фармацевтической композиции, приведенным выше, для применения в качестве лекарственного средства.
[0025] Другой аспект настоящего изобретения относится к применению соединения или его фармацевтически приемлемой соли, сольвата, гидрата, таутомера или изомера, или фармацевтической композиции, описанных выше, в производстве лекарственного средства для применения в ингибировании связывания hSOS1 с Н-, или N-, или K-RAS, включая их клинически известные мутации, которое ингибирует реакцию нуклеотидного обмена, катализируемую hSOS1, в присутствии концентрации 20 мкМ или меньше, но которое практически неактивно против EGFR-киназы в концентрациях 20 мкМ или меньше.
[0026] Другой аспект настоящего изобретения относится к применению соединения или его фармацевтически приемлемой соли, сольвата, гидрата, таутомера или изомера, или фармацевтической композиции, описанных выше, в производстве лекарственного средства для применения в ингибировании связывания hSOS1, в частности с белком K-RAS G12C, которое ингибирует реакцию нуклеотидного обмена, катализируемую hSOS1, в присутствии концентрации 20 мкМ или меньше, но которое практически неактивно против EGFR-киназы в концентрациях 20 мкМ или меньше.
[0027] В настоящем изобретении также предложены соединение или его фармацевтически приемлемая соль, пролекарство, сольват, гидрат, таутомер или изомер, или фармацевтическая композиция, приведенные выше, которые применимы в ингибировании SOS1.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0028] На Фиг. 1А приведен график, демонстрирующий эффективность ежесуточного введения соединения А в дозе 50 и 250 мг/кг п/о и MRTX1257 в дозе 10 мг/кг на рост опухолевых клеток in vivo в модели с ксенотрансплантантом НМРЛ NCI-H358 с использованием самок бестимусных мышей линии balb/c.
[0029] На Фиг. 1В приведен график, демонстрирующий изменение массы тела мышей в исследовании эффективности с Фиг. 1А.
[0030] На Фиг. 1С изображена структура MRTX1257.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0031] Подробности настоящего изобретения изложены ниже в прилагаемом описании. Хотя способы и материалы, подобные или эквивалентные описанным в данном документе, можно использовать при практической реализации или тестировании настоящего изобретения, далее будут описаны иллюстративные способы и материалы. Другие признаки, предметы и преимущества настоящего изобретения станут очевидны из описания и формулы изобретения. В описании и прилагаемой формуле изобретения формы единственного числа включают также множественное число, если из контекста явно не следует иное. Если не указано иное, все употребляемые в данном документе технические и научные термины имеют общепринятые значения, понятные специалисту в области, к которой принадлежит настоящее изобретение. Все патенты и публикации, цитируемые в этом описании, в полном объеме включены в данный документ посредством ссылки.
Термины
[0032] Единственное число употребляется в данном описании для обозначения одного или более чем одного (т.е. по меньшей мере одного) грамматического объекта. В качестве примера, «элемент» означает один элемент или более одного элемента.
[0033] Термин «и/или» употребляется в данном описании для обозначения как «и», так и «или», если не указано иное. Употребление термина «или» подразумевает «и/или», если он явно не относится исключительно к альтернативным вариантам или же если альтернативные варианты не являются взаимоисключающими, при этом в описании допускается определение, которое относится только к альтернативным вариантам и «и/или».
[0034] В контексте данного документа термин «около» употребляется для указания того, что значение включает стандартное отклонение для устройства или способа, используемого для определения этого значения. В определенных вариантах осуществления термин «около» относится к диапазону значений, которые находятся в пределах 25%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или менее в любую сторону (больше или меньше) от указанного значения, если не указано иное или если иное очевидно из контекста (например, когда такое число будет превышать 100% возможного значения).
[0035] Под «необязательный» или «необязательно» подразумевается, что описанное далее событие или обстоятельство может произойти или может не произойти, и что описание включает случаи, когда событие или обстоятельство происходит, и случаи, когда оно не происходит. Например, «необязательно замещенный арил» включает как «арил», так и «замещенный арил» по определению данного документа. Специалистам в данной области техники будет понятно в отношении любой группы, содержащей один или более заместителей, что такие группы не подразумевают внесение каких-либо замен или профилей замен, которые являются стерически непрактичными, синтетически нереализуемыми и\или изначально нестабильными.
[0036] Если не указано иное, термин «необязательно замещенный» означает, что любая группа может быть замещена или не замещена одним или более (например, 0, 1, 2, 3, 4 или 5 или более, или любым диапазоном этих значений) заместителями, перечисленными для этой группы, в которой указанные заместители могут быть одинаковыми или разными. В одном варианте осуществления необязательно замещенная группа содержит 1 заместитель. В другом варианте осуществления необязательно замещенная группа содержит 2 заместителей. В другом варианте осуществления необязательно замещенная группа содержит 3 заместителей. В другом варианте осуществления необязательно замещенная группа содержит 4 заместителей. В другом варианте осуществления необязательно замещенная группа содержит 5 заместителей. Например, необязательно замещенная алкильная группа может представлять собой полностью насыщенную алкильную цепь (т.е. чистый углеводород). В альтернативном варианте такая же необязательно замещенная алкильная группа может содержать заместители, отличные от водорода. Например, она может, в любой точке на протяжении цепи, быть связанной с атомом галогена, гидроксильной группой или любым другим заместителем, описанным в данном документе. Таким образом, термин «необязательно замещенный» означает, что данный химический фрагмент потенциально может содержать другие функциональные группы, но необязательно содержит какие-либо дополнительные функциональные группы.
[0037] В контексте данного документа «алкил» может означать неразветвленную цепь или разветвленную насыщенную цепь, содержащую от 1 до 10 атомов углерода. Репрезентативные насыщенные алкильные группы включают, но не ограничиваются этим, метил, этил, н-пропил, изопропил, 2-метил-1-пропил, 2-метил-2-пропил, 2-метил-1-бутил, 3-метил-1-бутил, 2-метил-3-бутил, 2,2-диметил-1-пропил, 2-метил-1-пентил, 3-метил-1-пентил, 4-метил-1-пентил, 2-метил-2-пентил, 3-метил-2-пентил, 4-метил-2-пентил, 2,2-диметил-1-бутил, 3,3-диметил-1-бутил, 2-этил-1-бутил, бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил и т.п., а также более длинные алкильные группы, такие как гептил, октил и т.п. Алкильная группа может быть замещенной или незамещенной. Алкильные группы, содержащие три или более атомов углерода, могут быть неразветвленными или разветвленными. В контексте данного документа «низший алкил» обозначает алкильную группу, содержащую от 1 до 6 атомов углерода.
[0038] В контексте данного документа термин «гетероалкил» относится к «алкильной» группе (по определению в данном документе), в которой по меньшей мере один атом углерода был замещен гетероатомом (например, атомом О, N или S). Гетероатом может находиться в середине или в конце радикала.
[0039] Термин «алкенил» означает алифатическую углеводородную группу, содержащую двойную углерод-углеродную связь, которая может быть неразветвленной или разветвленной и содержать от 2 до 6 атомов углерода в цепи. Некоторые алкенильные группы содержат от 2 до около 4 атомов углерода в цепи. Термин «разветвленный» означает, что одна или более низших алкильных групп, таких как метил, этил или пропил, присоединены к линейной алкенильной цепи. Типовые алкенильные группы включают этенил, пропенил, н-бутенил и изобутенил. С2-С6 алкенильная группа представляет собой алкенильную группу, содержащую от 2 до 6 атомов углерода.
[0040] Термин «алкинил» означает алифатическую углеводородную группу, содержащую тройную углерод-углеродную связь, которая может быть неразветвленной или разветвленной и содержать от 2 до 6 атомов углерода в цепи. Некоторые алкинильные группы содержат от 2 до около 4 атомов углерода в цепи. Термин «разветвленный» означает, что одна или более низших алкильных групп, таких как метил, этил или пропил, присоединены к линейной алкинильной цепи. Типовые алкинильные группы включают этинил, пропинил, н-бутинил, 2-бутинил, 3-метил бутинил и н-пентинил. С2-С6 алкинильная группа представляет собой алкинильную группу, содержащую от 2 до 6 атомов углерода.
[0041] В контексте данного документа термин «гало» или «галоген» означает группу фтора, хлора, брома или йода.
[0042] В контексте данного документа термин «оксо» относится к группе «=O». Когда оксо-группа связана с атомом углерода, она также может сокращенно называться С(О) или С=O. Оксо-группа также может быть связана с атомом серы (например, S=O и S(O)2) или при атоме фосфора (например, Р=O, РО2, РО3, РО4 и т.д.).
[0043] В контексте данного документа термин «имин» относится к группе «=N». Когда имин связан с атомом углерода, он также может сокращенно называться C=N. Азот также может быть связан двойной связью с серой, например, S=N, что называется тиоимином.
[0044] Термин «кольцевые атомы», употребляемый в сочетании с терминами, относящимися к описанным в данном документе кольцевым системам (например, циклоалкилу, циклоалкенилу, арилу, гетероциклилу или гетероарилу), относится к общему числу кольцевых атомов, присутствующих в системе. Следовательно, «кольцевые атомы» не включают атомы, присутствующие в присоединенном к кольцу заместителе. Таким образом, число «кольцевых атомов» включает все атомы, присутствующие в конденсированном кольце. Например, 2-индолильное кольцо, 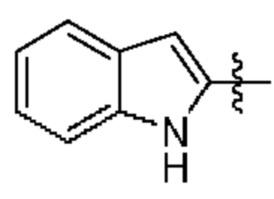 , считается 5-членным гетероарилом, но также является гетероарилом, содержащим 9 кольцевых атомов. В другом примере пиридин считается 6-членным гетероарилом и является гетероарилом, содержащим 6 кольцевых атомов.
, считается 5-членным гетероарилом, но также является гетероарилом, содержащим 9 кольцевых атомов. В другом примере пиридин считается 6-членным гетероарилом и является гетероарилом, содержащим 6 кольцевых атомов.
[0045] «Циклоалкил» относится к одиночному насыщенному полностью углеродному кольцу, содержащему от 3 до 20 кольцевых атомов углерода (т.е. С3-С20 циклоалкил), например от 3 до 15 кольцевых атомов, например от 3 до 12 кольцевых атомов. В определенных вариантах осуществления циклоалкильная группа является моноциклической («моноциклический циклоалкил») или содержит конденсированную, соединенную мостиковой связью или спирокольцевую систему, такую как бициклическая система («бициклический циклоалкил»), и может быть насыщенной. «Циклоалкил» включает кольцевые системы, в которых циклоалкильное кольцо по определению выше конденсировано с одной или более циклоалкильными, циклоалкенильными, гетероциклильными, арильными или гетероарильными группами, при этом точка присоединения находится на циклоалкильном кольце, и в таких случаях указанное число атомов углерода продолжает означать число атомов углерода в циклоалкильном кольце, содержащем точку присоединения. Примеры циклоалкильных групп включают циклогексил, циклогептил, 2-адамантил (' ), 2-(2,3-дигидро-1Н-инден) (
), 2-(2,3-дигидро-1Н-инден) (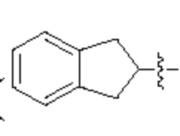 ) и 9-флуоренил (
) и 9-флуоренил ( ). Как указано выше, циклоалкильные кольца могут дополнительно характеризоваться числом кольцевых атомов. Например, циклогексильное кольцо представляет собой С6 циклоалкильное кольцо с 6 кольцевыми атомами, тогда как 2-(2,3-дигидро-1H-инден) представляет собой С5 циклоалкильное кольцо с 9 кольцевыми атомами. Также, например, 9-флуоренил представляет собой С5 циклоалкильное кольцо с 13 кольцевыми атомами, а 2-адамантил представляет собой С6 циклоалкил с 10 кольцевыми атомами.
). Как указано выше, циклоалкильные кольца могут дополнительно характеризоваться числом кольцевых атомов. Например, циклогексильное кольцо представляет собой С6 циклоалкильное кольцо с 6 кольцевыми атомами, тогда как 2-(2,3-дигидро-1H-инден) представляет собой С5 циклоалкильное кольцо с 9 кольцевыми атомами. Также, например, 9-флуоренил представляет собой С5 циклоалкильное кольцо с 13 кольцевыми атомами, а 2-адамантил представляет собой С6 циклоалкил с 10 кольцевыми атомами.
[0046] В контексте данного документа термин «циклоалкенил» может относиться к частично насыщенному, моноциклическому, конденсированному или спирополициклическому полностью углеродному кольцу, содержащему от 3 до 18 атомов углерода на кольцо и содержащему по меньшей мере одну двойную связь. «Циклоалкенил» включает кольцевые системы, в которых циклоалкенильное кольцо по определению выше конденсировано с одной или более циклоалкильными, циклоалкенильными, гетероциклильными, арильными или гетероарильными группами, при этом точка присоединения находится на циклоалкенильном кольце, и в таких случаях указанное число атомов углерода продолжает означать число атомов углерода в циклоалкенильном кольце, содержащем точку присоединения. Циклоалкенильные кольца могут дополнительно характеризоваться числом кольцевых атомов. Примеры циклоалкенила включают 1-циклогекс-1-енил и циклопент-1-енил.
[0047] В контексте данного документа термин «арил» относится к одиночному полностью углеродному ароматическому кольцу или множественной конденсированной полностью углеродной кольцевой системе, где по меньшей мере одно из колец является ароматическим. Например, в определенных вариантах осуществления арильная группа содержит от 5 до 20 кольцевых атомов углерода, от 5 до 14 кольцевых атомов углерода или от 5 до 12 кольцевых атомов углерода. Арил также включает множественные конденсированные кольцевые системы (например, кольцевые системы, содержащие 2, 3 или 4 кольца), содержащие от 9 до 20 атомов углерода, в которых по меньшей мере одно кольцо является ароматическим, а другие кольца могут быть ароматическими или неароматическими (т.е. циклоалкил). «Арил» включает кольцевые системы, в которых арильное кольцо по определению выше конденсировано с одной или более циклоалкильными, циклоалкенильными, гетероциклильными, арильными или гетероарильными группами, и при этом точка присоединения находится на арильном кольце, и в таких случаях указанное число атомов углерода продолжает означать число атомов углерода в арильном кольце, содержащем точку присоединения. Примеры арильных групп включают фенил и 5-(2,3-дигидро-1H-инден): 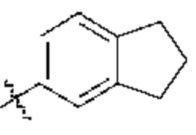 . Как указано выше, арильные кольца могут дополнительно характеризоваться числом кольцевых атомов. Например, фенил представляет собой С6 арил с 6 кольцевыми атомами, тогда как 5-(2,3-дигидро-1H-инден) представляет собой С6 арил с 9 кольцевыми атомами.
. Как указано выше, арильные кольца могут дополнительно характеризоваться числом кольцевых атомов. Например, фенил представляет собой С6 арил с 6 кольцевыми атомами, тогда как 5-(2,3-дигидро-1H-инден) представляет собой С6 арил с 9 кольцевыми атомами.
[0048] В контексте данного документа термин «гетероциклил» относится к одиночному насыщенному или частично ненасыщенному неароматическому кольцу или неароматической множественной кольцевой системе (включая конденсированные и спирополициклические), которые содержат по меньшей мере один гетероатом в кольце (по меньшей мере один кольцевой гетероатом, выбранный из кислорода, азота, фосфора и серы). Если не указано иное, гетероциклильная группа содержит от 5 до около 20 кольцевых атомов, например от 5 до 15 кольцевых атомов, например от 5 до 10 кольцевых атомов. Таким образом, этот термин включает одиночные насыщенные или частично ненасыщенные кольца (например, 3-, 4-, 5-, 6- или 7-членные кольца), содержащие от около 1 до 6 кольцевых атомов углерода и от около 1 до 3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, в кольце. Этот термин включает одиночные насыщенные или частично ненасыщенные кольца (например, 5-, 6-, 7-, 8-, 9- или 10-членные кольца), содержащие от около 4 до 9 кольцевых атомов углерода и от около 1 до 3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, в кольце. «Гетероциклил» включает кольцевые системы, в которых гетероциклильное кольцо по определению выше конденсировано с одной или более циклоалкильными, циклоалкенильными, гетероциклильными, арильными или гетероарильными группами, при этом точка присоединения находится на гетероциклильном кольце, и в таких случаях указанное число членов кольца продолжает означать число кольцевых атомов в гетероциклильном кольце, содержащем точку присоединения. Гетероциклильные кольца могут дополнительно характеризоваться числом кольцевых атомов. Примеры гетероциклильных групп включают пиперидинил (6-членный гетероцикл с 6 кольцевыми атомами), азепанил (7-членный гетероцикл с 7 кольцевыми атомами) и 3-хроманил (6-членный гетероцикл с 10 кольцевыми атомами) 
[0049] В контексте данного документа термин «гетероарил» относится к одиночному ароматическому кольцу, которое содержит по меньшей мере один атом, отличный от атома углерода, в кольце, при этом атом выбран из группы, состоящей из кислорода, азота и серы; этот термин также также включает множественные конденсированные кольцевые системы, которые содержат по меньшей мере одно такое ароматическое кольцо. Таким образом, этот термин включает одиночные гетероарильные кольца, содержащие от около 1 до 10 кольцевых атомов углерода и 1-5 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы, в кольцах. Атомы серы и азота также могут присутствовать в окисленной форме при условии, что кольцо является ароматическим. «Гетероарил» включает кольцевые системы, в которых гетероарильное кольцо по определению выше конденсировано с одной или более циклоалкильными, циклоалкенильными, гетероциклильными, арильными или гетероарильными группами, при этом точка присоединения находится на гетероарильном кольце, и в таких случаях число членов кольца продолжает означать число членов кольца в гетероарильном кольце, содержащем точку присоединения. Гетероарильные кольца могут дополнительно характеризоваться числом кольцевых атомов. Например, пиридин является 6-членным гетероарилом, содержащим 6 кольцевых атомов.
[0050] Данное изобретение также включает фармацевтические композиции, содержащие эффективное количество описанного соединения и фармацевтически приемлемый носитель. Типовые «фармацевтически приемлемые соли» включают, например, растворимые в воде и нерастворимые в воде соли, такие как ацетат, амсонат (4,4-диаминостильбен-2,2-дисульфонат), бензолсульфонат, бензонат, бикарбонат, бисульфат, битартрат, борат, бромид, бутират, соли кальция, эдетат кальция, камзилат, карбонат, хлорид, цитрат, клавулариат, дигидрохлорид, эдетат, эдизилат, эстолат, эзилат, фиунарат, глуцептат, глюконат, глутамат, гликолиларсанилат, гексафторфосфат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, йодид, изетионат, лактат, лактобионат, лаурат, соли магния, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, мукат, напзилат, нитрат, N-метилглюкаминаммониевую соль, 3-гидрокси-2-нафтоат, олеат, оксалат, пальмитат, памоат (1,1-метен-бис-2-гидрокси-3-нафтоат, эйнбонат), пантотенат, фосфат/дифосфат, пикрат, полигалактуронат, пропионат, п-толуолсульфонат, салицилат, стеарат, субацетат, сукцинат, сульфат, сульфосалицилат, сурамат, таннат, тартрат, теоклат, тозилат, триэтиодид и валерат.
[0051] Термин «таутомеры» относится к группе соединений, которые имеют одинаковые число и тип атомов, но отличаются по связности и находятся в равновесии друг с другом. «Таутомер» является одним членом этой группы соединений. Как правило, представлен один таутомер, но следует понимать, что эта одна структура представляет все возможные таутомеры, которые могут существовать. Примеры включают енол-кетонный таутомеризм. Если представлен кетон, следует понимать, что как енольная, так и кетонная формы являются частью настоящего изобретения.
[0052] Соединения по настоящему изобретению также могут включать все изотопы атомов, встречающихся в промежуточных или конечных соединениях. Изотопы включают те атомы, которые имеют одно атомное число, но разные массовые числа. Например, изотопы водорода включают тритий и дейтерий. Один или более составляющих атомов соединений по настоящему изобретению можно заменять или замещать изотопами атомов в природном или неприродном количестве. В некоторых вариантах осуществления соединение содержит по меньшей мере один атом дейтерия. Например, один или более атомов водорода в соединении по настоящему изобретению можно заменять или замещать дейтерием. В некоторых вариантах осуществления соединение содержит два или более атомов дейтерия. В некоторых вариантах осуществления соединение содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 атомов дейтерия. Методы синтеза для включения изотопов в органические соединения известны в данной области техники.
[0053] В контексте данного изобретения термин «пролекарство», означает соединение, которое может быть преобразовано in vivo в процессе метаболизма (например, посредством гидролиза) в описываемое соединение. Кроме того, в контексте данного документа пролекарство представляет собой лекарство, которое неактивно в организме, но преобразуется в организме, как правило, во время всасывания или после всасывания в желудочно-кишечном тракте, в активное соединение. Преобразование пролекарства в активное соединение в организме может происходить химически или биологически (т.е. при участии фермента).
[0054] Термин «сольват» относится к комплексу с вариабельной стехиометрией, образуемому растворенным веществом и растворителем. В целях данного настоящего изобретения такие растворители могут не препятствовать биологической активности растворенного вещества. Примеры подходящих растворителей включают, но не ограничиваются этим, воду, МеОН, EtOH и АсОН. Сольваты, в том случае, когда молекулой растворителя является вода, обычно называются гидратами. Гидраты включают композиции, содержащие стехиометрические количества воды, а также композиции, содержащие вариабельные количества воды.
[0055] Термин «изомер» относится к соединениям, которые имеют одинаковую композицию и молекулярную массу, но отличаются по физическим и/или химическим свойствам. Структурная разница может состоять в строении (геометрические изомеры) или в способности к вращению плоскости поляризованного света (стереоизомеры). В отношении стереоизомеров соединения по данному документу могут иметь один или более асимметричных атомов углерода и могут существовать в виде рацематов, рацемических смесей и в виде отдельных энантиомеров и диастереомеров.
[0056] Термин «изомер» относится к группе соединений, которые имеют одинаковые число и тип атомов и обладают одинаковой связностью между этими атомами, но отличаются по трехмерной структуре. Термин «стереоизомер» относится к любому члену этой группы соединений. Например, стереоизомер может представлять собой энантиомер или диастереомер.
[0057] Термин «энантиомер» относятся к паре стереоизомеров, которые являются не совпадающими при наложении зеркальными изображениями друг друга. Термин «энантиомер» относится к одному члену этой пары стереоизомеров. Термин «рацемический» относится к 1:1 смеси пары энантиомеров.
[0058] Термин «диастереомеры» относится к группе стереоизомеров, которые нельзя сопоставить при наложении путем вращения вокруг одинарных связей. Например, цис- и транс- двойные связи, эндо- и экзо- замена в бициклических кольцевых системах и соединения, содержащие несколько стереогенных центров с разными относительными конфигурациями, считаются диастереомерами. Термин «диастереомер» относится к любому члену этой группы соединений. В некоторых представленных примерах определенный способ синтеза может позволить получить один диастереомер или смесь диастереомеров.
[0059] Термин «эффективное количество», употребляемый в связи с соединением, представляет собой количество, эффективное для лечения или предотвращения заболевания у субъекта, как описано в данном документе.
[0060] В контексте данного изобретения термин «носитель» охватывает эксципиенты и разбавители и означает материал, композицию или несущую среду, такие как жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или инкапсулирующий материал, участвующие в переносе или транспорте фармацевтического агента из одного органа или участка организма в другой орган или участок организма субъекта.
[0061] Термин «лечение» в отношении субъекта относится к улучшению по меньшей мере одного симптома расстройства субъекта. Лечение включает излечение, улучшение или по меньшей мере частичное уменьшение интенсивности расстройства.
[0062] Термин «предотвращать» или «предотвращение» в отношении субъекта относится к предупреждению появления у субъекта заболевания или расстройства. Предотвращение включает профилактическое лечение. Например, предотвращение может включать введение субъекту описанного в данном документе соединения до появления у субъекта заболевания, и при этом введение предотвратит появление заболевания у субъекта.
[0063] Термины «ингибирование» и «снижение» или любые вариации этих терминов включают любое измеримое или полное ингибирование для достижения необходимого результата. Например, снижение может составлять около, не более чем около или по меньшей мере около 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 99% или более, или любой получаемый из этих значений диапазон снижения активности (например, активности связывания SOS1:белок семейства Ras) по сравнению с нормой.
[0064] Если не указано иное, термин «расстройство» употребляется в данном изобретении для обозначения заболевания, патологического состояния или болезни и взаимозаменяемо употребляется с этими терминами.
[0065] В контексте данного изобретения термин «вводить» или «введение» относится как к непосредственному введению описанного соединения, или фармацевтически приемлемой соли описанного соединения, или композиции субъекту, так и к введению пролекарственного производного или аналога соединения, или фармацевтически приемлемой соли соединения, или композиции субъекту, которые могут образовывать эквивалентное количество активного соединения в организме субъекта.
[0066] «Пациент» или «субъект» представляет собой млекопитающее, например, человека, мышь, крысу, морскую свинку, собаку, кошку, лошадь, корову, свинью или отличного от человека примата, такого как обезьяна, шимпанзе, бабуин или макак-резус.
Соединения описанных формул
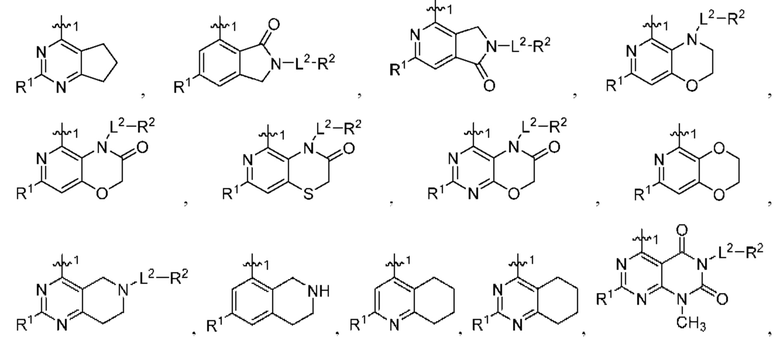
[0067] В некоторых вариантах осуществления настоящее изобретение относится к соединениям следующих формул:
или его фармацевтически приемлемые соль, сольват, изомер, пролекарство или таутомер, где:
Q1 и Q2 независимо представляют собой СН или N;
каждый из Q3 и Q5 независимо представляет собой C(RQC)2, NRQN, СО, О или SO2, где каждый RQC независимо представляет собой Н, F, С1, Br или арил, а каждый RQN независимо представляет собой Н, С1-6 алкил или арил;
Q4 представляет собой СН или N;
где по меньшей мере один из Q1, Q2, Q3, Q4 и Q5 представляет собой N, NRQN, О или SO2;
m равно 0, 1, 2 или 3;
n равно 0, 1, 2 или 3;
причем если m равно 0, то n не равно 0;
R1 представляет собой Н, галоген, C1-6 алкил, 3-членный циклоалкил, -CN или -OR1a; где R1a представляет собой Н или С1-6 алкил;
L2 представляет собой связь, -С(О), -С(O)O-, -C(O)NH(CH2)o-, -S(O)2-, -С(O)(СН2)p-, -(СН2)р- или -О-; где о равно 0, 1 или 2; и где р представляет собой число от 1 до 6;
R2 представляет собой Н, -(СН2)qCH3, циклоалкил, циклоалкенил, гетероциклил, арил, гетероарил; где q представляет собой число от 1 до 5; где каждый циклоалкил, циклоалкенил, гетероциклил, арил или гетероарил необязательно замещен одним или более C1-6 алкилом, -ОН, галогеном, -C(O)R2a или -C(O)NR2bR2c; где R2a представляет собой C1-6 алкил или -(СН2)rOCH3, где г равно 1, 2 или 3; где R2b представляет собой Н или C1-6 алкил; и где R2c представляет собой Н или С1-6 алкил;
R3 и R4 независимо выбраны из группы, состоящей из Н и C1-6 алкила; где по меньшей мере один из R3 и R4 не представляет собой Н; или R3 и R4 вместе с атомом, к которому они присоединены, в совокупности образуют 3-6-членный циклоалкил; и
А представляет собой необязательно замещенный 6-членный арил или необязательно замещенный 5-6-членный гетероарил;
при условии, что когда 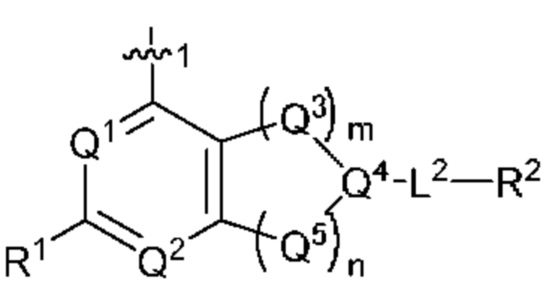 представляет собой
представляет собой 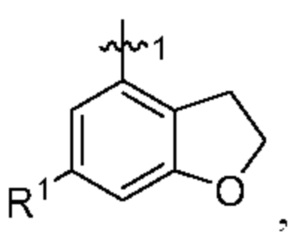
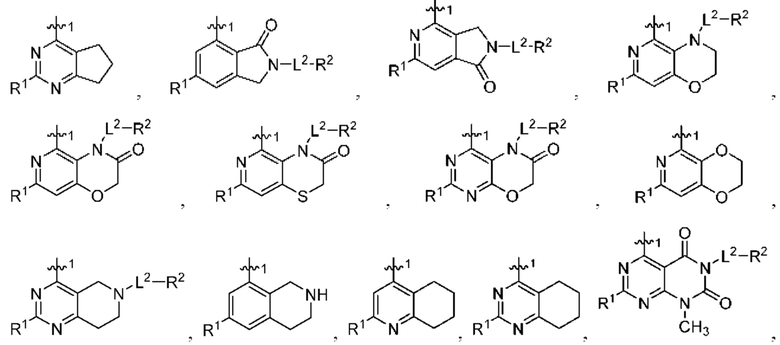
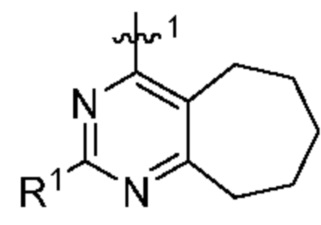 или
или  ; то R1 не представляет собой Н.
; то R1 не представляет собой Н.
[0068] В других вариантах осуществления настоящее изобретение относится к соединениям следующих формул:
или его фармацевтически приемлемые соль, сольват, изомер, пролекарство или таутомер, где:
Q1 и Q2 независимо представляют собой СН или N;
каждый из Q3 и Q5 независимо представляет собой C(RQC)2, NRQN, СО, О или SO2, где каждый RQC независимо представляет собой Н, F, Cl, Br или арил, а каждый RQN независимо представляет собой Н, C1-6 алкил или арил;
Q4 представляет собой СН или N;
где по меньшей мере один из Q1, Q2, Q3, Q4 и Q5 представляет собой N, NRQN, О или SO2;
m равно 0, 1, 2 или 3;
n равно 0, 1, 2 или 3;
причем если m равно 0, то n не равно 0;
R1 представляет собой Н, галоген, C1-6 алкил, 3-членный циклоалкил, -CN или -OR1a; где R1a представляет собой Н или C1-6 алкил;
L2 представляет собой связь, -С(О), -С(O)O-, -C(O)NH(CH2)O-, -S(O)2-, -С(O)(СН2)p-, -(СН2)р- или -О-; где о равно 0, 1 или 2; и где р представляет собой число от 1 до 6;
R2 представляет собой Н, -(СН2)qCH3, циклоалкил, циклоалкенил, гетероциклил, арил, гетероарил; где q представляет собой число от 1 до 5; где каждый циклоалкил, циклоалкенил, гетероциклил, арил или гетероарил необязательно замещен одним или более C1-6 алкилом, -ОН, галогеном, -C(O)R2a или -C(O)NR2bR2c; где R2a представляет собой C1-6 алкил или -(СН2)rOCH3, где г равно 1, 2 или 3; где R2b представляет собой Н или C1-6 алкил; и где R2c представляет собой Н или С1-6 алкил;
R3 и R4 независимо выбраны из группы, состоящей из Н и C1-6 алкила; где по меньшей мере один из R3 и R4 не представляет собой Н; или R3 и R4 вместе с атомом, к которому они присоединены, в совокупности образуют 3-6-членный циклоалкил; и
R5, R6, R7, R8 и R9 независимо выбраны из группы, состоящей из Н, D, C1-6 алкила, С2-6 алкенила, С4-8 циклоалкенила, С2-6 алкинила, С3-8 циклоалкила, -ОН, галогена, -NO2, -CN, -NR11R12, -SR10, -S(O)2NR11R12, -S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, -C(O)R10 или -CO2R10, где каждый алкил, алкенил, циклоалкенил, алкинил или циклоалкил необязательно замещен одним или более -ОН, галогеном, -NO2, оксо, -CN, -R10, -OR10, -NR11R12, -SR10, -S(O)2NR11R12,
-S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, гетероциклом, арилом или гетероарилом;
R10, R11 и R12 независимо в каждом случае представляют собой Н, D, C1-6 алкил, С2-6 алкенил, С4-8 циклоалкенил, С2-6 алкинил, С3-8 циклоалкил, моноциклический 3-12-членный гетероцикл, полициклический 3-12-членный гетероцикл, -OR13, -SR13, галоген, -NR13R14, -NO2 или -CN;
R13 и R14 независимо в каждом случае представляют собой Н, D, С1-6 алкил, С2-6 алкенил, С4-8 циклоалкенил, С2-6 алкинил, С3-8 циклоалкил, моноциклический 3-12-членный гетероцикл, полициклический 3-12-членный гетероцикл, где каждый алкил, алкенил, циклоалкенил, алкинил, циклоалкил или гетероцикл необязательно замещен одним или более -ОН, -SH, -NH2, -NO2 или -CN;
при условии, что когда 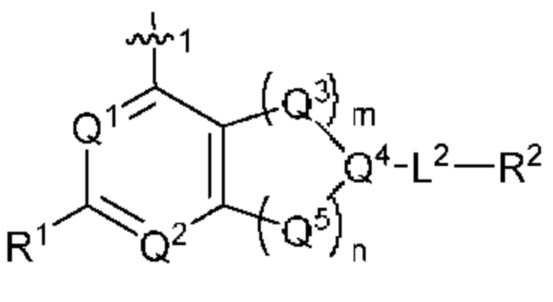 представляет собой
представляет собой  ,
, 
 ; то R1 не представляет собой Н.
; то R1 не представляет собой Н.
Дополнительные соединения описанных формул
[0069] В настоящем изобретении предложены соединения формулы (I),
или его фармацевтически приемлемые соль, сольват, изомер, пролекарство или таутомер, где:
Q1 представляет собой СН или N;
Q4 представляет собой СН, С или N;
каждый Q2 независимо представляет собой C-R1 или N, где один Q2 представляет собой N, а другой Q2 представляет собой C-R1;
каждый из Q3 и Q5 независимо представляет собой C(RQC)2, NRQN, СО, О, S или SO2, где каждый RQC независимо представляет собой Н, F, О, Br или 6-10-членный арил, а каждый RQN независимо представляет собой Н, С1-6 алкил или 6 10-членный арил;
где по меньшей мере один из Q1, Q2, Q3, Q4 и Q5 представляет собой N, NRQN, О или SO2;
m равно 0, 1, 2 или 3;
n равно 0, 1, 2 или 3;
причем если m равно 0, то n не равно 0;
R1 выбран из группы, состоящей из Н, С1-6 алкила, галогена, -CONHR1a, -NHR1a, -OR1a, циклопропила, азетидинила и -CN; где каждый C1-6 алкил и азетидинил необязательно замещен галогеном, R1a, -NHR1a или -OR1a; где R1a представляет собой Н, С1-6 алкил, циклопропил, 3-6-членный гетероциклил или C1-6 галогеналкил;
L2 выбран из группы, состоящей из связи, -С(О)-, -С(O)O-, -C(O)NH(CH2)o-, S(O)2-, 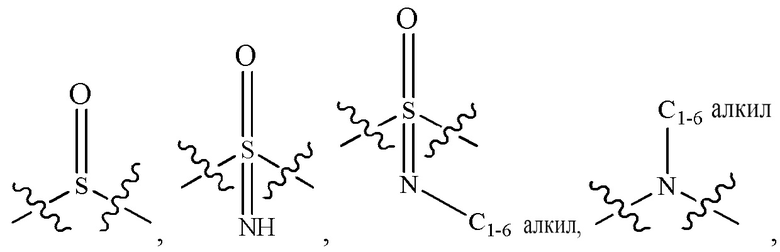 -C(O)(CH2)p, -(СВ2)р- и -O-; где о равно 0,1 или 2; и где р представляет собой число от 1 до 6;
-C(O)(CH2)p, -(СВ2)р- и -O-; где о равно 0,1 или 2; и где р представляет собой число от 1 до 6;
R2 выбран из группы, состоящей из Н, Cl-6 алкила, -NR2bR2c, -OR2a, 3-14-членного циклоалкил а, 3-14-членного циклоалкенила, 3-14-членного гетероциклила, 6-10-членного арила и 5-10-членного гетер о арил а; где каждый C1-6 алкил, 3-14-членный циклоалкил, 3-14-членный циклоалкенил, 3-14-членный гетероциклил, 6-10-членный арил и 5-10-членный гетероарил независимо необязательно замещен C1-6 алкилом, C1-6 галогеналкилом, C1-6 гидроксиалкилом, C1-6 метоксиалкилом, -ОН, -OR2a, оксо, =N, галогеном, -C(O)R2a, -C(O)OR2a, -C(O)NR2bR2c, -SO2R2a, -CN, -NR2bR2c, 3-6-членным циклоалкилом, 3-7-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом;
где R2a представляет собой Н, C1-6 алкил, C1-6 галогеналкил, 3-7-членный гетероциклил или -(СН2)rOCH3,где r равно 1, 2 или 3;
где R2b представляет собой Н или C1-6 алкил;
где R2c представляет собой Н или C1-6 алкил;
R3 и R4 независимо представляют собой Н или C1-6 алкил, необязательно замещенный галогеном или -ОН; где по меньшей мере один из R3 и R4 представляет собой Н или где R3 и R4 вместе с атомом, к которому они присоединены, в совокупности образуют 3-6-членный циклоалкил; и
А представляет собой необязательно замещенный 6-членный арил или необязательно замещенный 5-6-членный гетероарил;
при условии, что когда 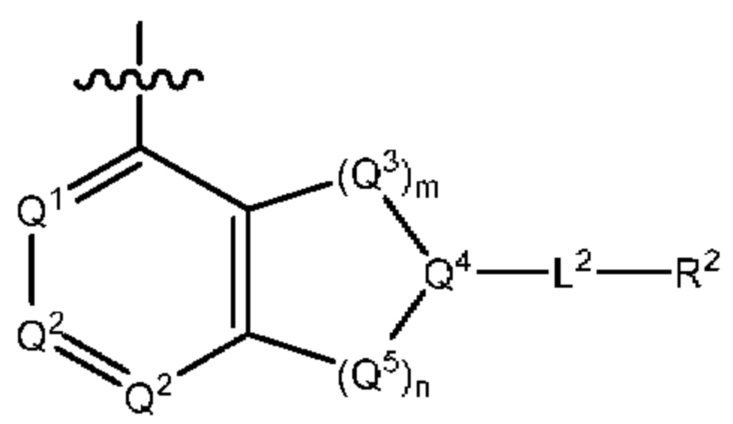 представляет собой
представляет собой 
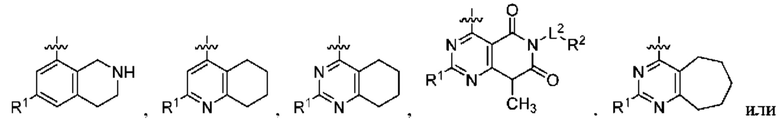
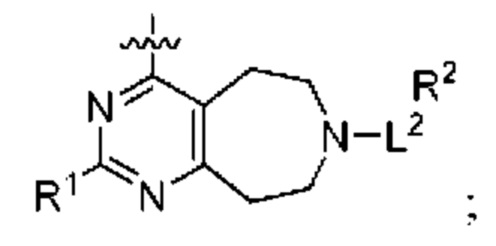
то R1 не представляет собой Н.
[0070] В настоящем изобретении предложены соединения формулы (1-а),
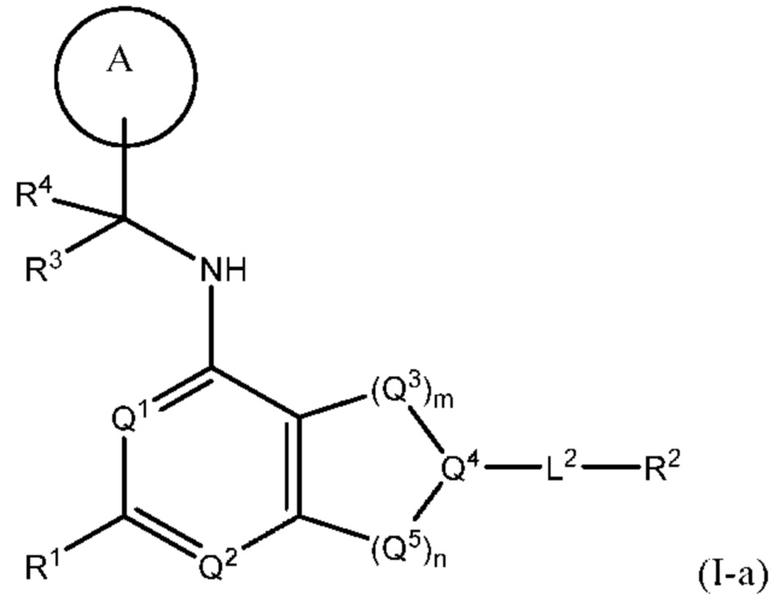
или его фармацевтически приемлемые соль, сольват, изомер, пролекарство или таутомер, где:
Q1, Q3, Q4, Q5, m, n и А соответствуют определению в формуле (I);
Q2 представляет собой СН или N;
где по меньшей мере один из Q1, Q2, Q3, Q4 и Q5 представляет собой N, NRQN, О или SO2;
R1 выбран из группы, состоящей из Н, галогена, C1-6 алкила, циклопропила, -CN и -OR1a; где R1a представляет собой Н или Cl-6 алкил;
L2 выбран из группы, состоящей из связи, -С(О)-, -С(O)O-, -C(O)NH(CH2)o-, S(O)2-, -С(O)(СН2)р- (СН2)р- или -О-; где о равно 0, 1 или 2; и где р представляет собой число от 1 до 6;
R2 выбран из группы, состоящей из Н, -(СН2)qCH3, 3-14-членного циклоалкила, 3-14-членного циклоалкенила, 3-14-членного гетероциклила, 6-10-членного арила и 5-10-членного гетероарила; где q представляет собой число от 1 до 5; где каждый 3-14-членный циклоалкил, 3-14-членный циклоалкенил, 3-14-членный гетероциклил, 6-10-членный арил или 5-10-членный гетероарил необязательно замещен Cl-6 алкилом, -ОН, галогеном, -C(O)R2a или -C(O)NR2bR2c; где R2a представляет собой Cl-6 алкил или -(СН2)rOCH3, где r равно 1, 2 или 3; где R2b представляет собой Н или Cl-6 алкил; и где R2c представляет собой Н или C1-6 алкил; и
R3 и R4 независимо представляют собой Н или C1-6 алкил; где по меньшей мере один из R3 и R4 не представляет собой Н; или R3 и R4 вместе с атомом, к которому они присоединены, в совокупности образуют 3-6-членный циклоалкил.
[0071] В настоящем изобретении предложены соединения формулы (II-а), (II-b) или (II-с), 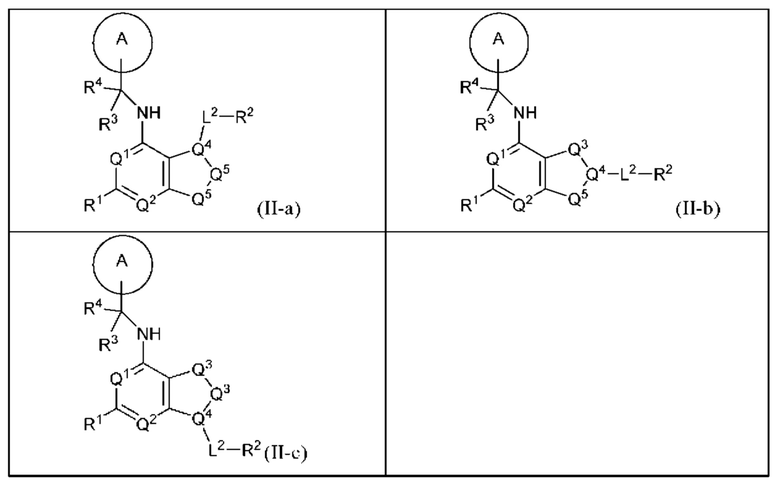
и их фармацевтически приемлемые соли, пролекарства, сольваты, гидраты, таутомеры или изомеры, где:
Q1 и Q2 независимо представляют собой СН или N;
каждый из Q3 и Q5 независимо представляет собой C(RQC)2, NRQN, СО, О или SO2, где каждый RQC независимо представляет собой Н, F, Cl, Br или арил, а каждый RQN независимо представляет собой Н, Cl-6 алкил или арил (например, 6-10-членный арил);
Q4 представляет собой СН или N;
где по меньшей мере один из Q1, Q2, Q3, Q4 и Q5 представляет собой N, NRQN, О или SO2;
R1 представляет собой Н, галоген, Cl-6 алкил, циклопропил, -CN или -OR1a; где R1a представляет собой Н или Cl-6 алкил;
L2 представляет собой связь, -С(О)-, -С(O)O-, -C(O)NH(CH2)o-, S(O)2-, -С(O)(СН2)р-, (СН2)р- или -О-; где о равно 0, 1 или 2; и где р представляет собой число от 1 до 6;
R2 представляет собой Н, (CH2)qCH3, циклоалкил (например, 3-14-членный циклоалкил), циклоалкенил (например, 3-14-членный циклоалкенил), гетероциклил (например, 3-14-членный гетероциклил), арил (например, 6-10-членный арил), гетероарил (например, 5-10-членный гетероарил); где q представляет собой число от 1 до 5; где каждый циклоалкил, циклоалкенил, гетероциклил, арил или гетероарил необязательно замещен одним или более Cl-6 алкилом, -ОН, галогеном, -C(O)R2a или -C(O)NR2bR2c; где R2a представляет собой Cl-6 алкил или -(СН2)rOCH3, где г равно 1, 2 или 3; где R2b представляет собой Н или C1-6 алкил; и где R2c представляет собой Н или Cl-6 алкил;
R3 и R4 независимо выбраны из группы, состоящей из Н и C1-6 алкила; где по меньшей мере один из R3 и R4 не представляет собой Н; или R3 и R4 вместе с атомом, к которому они присоединены, в совокупности образуют 3-6-членный циклоалкил; и
А представляет собой необязательно замещенный 6-членный арил или необязательно замещенный 5 6-членный гетероарил;
при условии, что когда 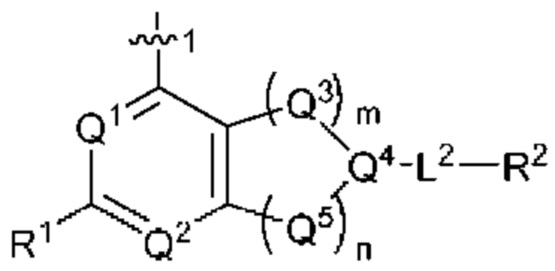 представляет собой
представляет собой 
 то R1 не представляет собой Н.
то R1 не представляет собой Н.
[0072] В настоящем изобретении предложены соединения формулы (III-а), (III-b), (III-с) или (III-d)
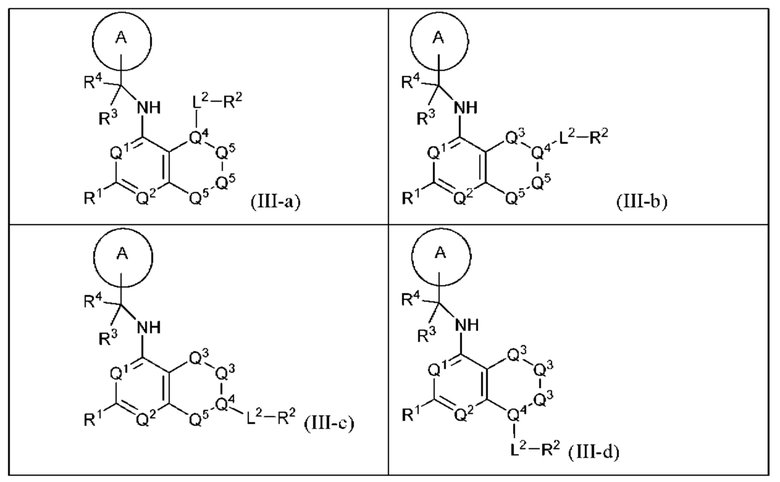
и их фармацевтически приемлемые соли, пролекарства, сольваты, гидраты, таутомеры или изомеры, где:
Q1 и Q2 независимо представляют собой СН или N;
каждый из Q3 и Q5 независимо представляет собой C(RQC)2, NRQN, СО, О или SO2, где каждый RQC независимо представляет собой Н, F, Cl, Br или арил, а каждый RQN независимо представляет собой Н, Cl-6 алкил или арил (например, 6-10-членный арил);
Q4 представляет собой СН или N;
где по меньшей мере один из Q1, Q2, Q3, Q4 и Q5 представляет собой N, NRQN, О или SO2;
R1 представляет собой Н, галоген, Cl-6 алкил, циклопропил, -CN или -OR1a; где R1a представляет собой Н или C1-6 алкил;
L2 представляет собой связь, -С(О)-, -С(O)O- -C(O)NH(CH2)o- S(O)2- -С(O)(СН2)р-, (СН2)р- или -О-; где о равно 0, 1 или 2; и где р представляет собой число от 1 до 6;
R2 представляет собой Н, -(СН2)qCH3, циклоалкил (например, 3-14-членный циклоалкил), циклоалкенил (например, 3-14-членный циклоалкенил), гетероциклил (например, 3-14-членный гетероциклил), арил (например, 6-10-членный арил), гетероарил (например, 5-10-членный гетероарил); где q представляет собой число от 1 до 5; где каждый циклоалкил, циклоалкенил, гетероциклил, арил или гетероарил необязательно замещен одним или более Cl-6 алкилом, -ОН, галогеном, -C(O)R2a или -C(O)NR2bR2c; где R2a представляет собой C1-6 алкил или -(СН2)rOCH3, где r равно 1, 2 или 3; где R2b представляет собой Н или C1-6 алкил; и где R2c представляет собой Н или С1-6 алкил;
R3 и R4 независимо выбраны из группы, состоящей из Н и Cl-6 алкила; где по меньшей мере один из R3 и R4 не представляет собой Н; или R3 и R4 вместе с атомом, к которому они присоединены, в совокупности образуют 3 6-членный циклоалкил; и
А представляет собой необязательно замещенный 6-членный арил или необязательно замещенный 5 6-членный гетероарил;
при условии, что когда 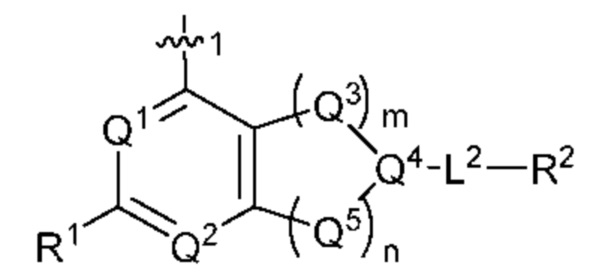 представляет собой
представляет собой 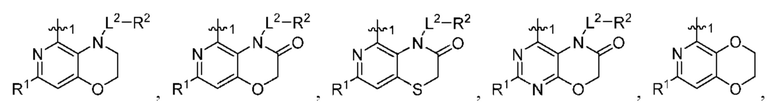
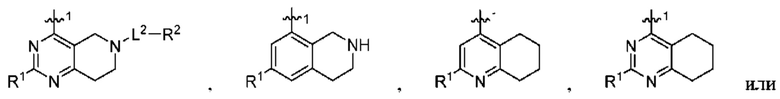
 то R1 не представляет собой Н.
то R1 не представляет собой Н.
[0073] В настоящем изобретении предложены соединения формулы (IV-a), (IV-b), (IV-с), (IV-d) или (IV-e),
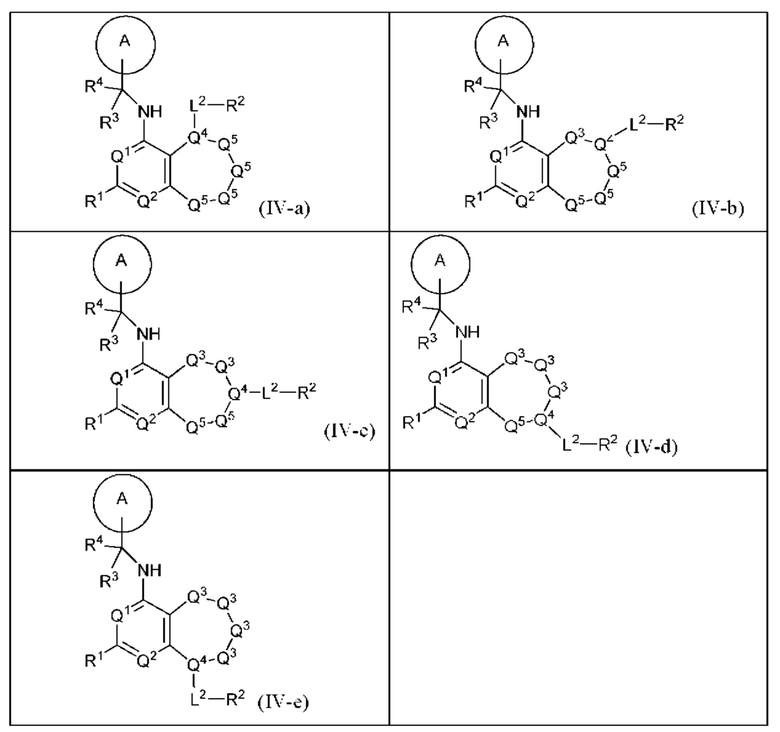
и их фармацевтически приемлемые соли, пролекарства, сольваты, гидраты, таутомеры или изомеры, где:
Q1 и Q2 независимо представляют собой СН или N;
каждый из Q3 и Q5 независимо представляет собой C(RQC)2, NRQN, СО, О или SO2, где каждый RQC независимо представляет собой Н, F, Cl, Br или арил, а каждый RQN независимо представляет собой Н, Cl-6 алкил или арил (например, 6-10-членный арил);
Q4 представляет собой СН или N;
где по меньшей мере один из Q1, Q2, Q3, Q4 и Q5 представляет собой N, NRQN, О или SO2;
R1 представляет собой Н, галоген, Cl-6 алкил, циклопропил, -CN или -OR1a; где R1a представляет собой Н или C1-6 алкил;
L2 представляет собой связь, -С(О)-, -С(O)O- -C(O)NH(CH2)o- S(O)2- С(O)(СН2)р-, (СН2)р- или -О-; где о равно 0, 1 или 2; и где р представляет собой число от 1 до 6;
R2 представляет собой Н, -(СН2)qCH3, циклоалкил (например, 3-14-членный циклоалкил), циклоалкенил (например, 3-14-членный циклоалкенил), гетероциклил (например, 3-14-членный гетероциклил), арил (например, 6-10-членный арил), гетероарил (например, 5-10-членный гетероарил); где q представляет собой число от 1 до 5; где каждый циклоалкил, циклоалкенил, гетероциклил, арил или гетероарил необязательно замещен одним или более Cl-6 алкилом, -ОН, галогеном, -C(O)R2a или -C(O)NR2bR2c; где R2a представляет собой C1-6 алкил или -(СН2)rOCH3, где г равно 1, 2 или 3; где R2b представляет собой Н или C1-6 алкил; и где R2c представляет собой Н или Cl-6 алкил;
R3 и R4 независимо выбраны из группы, состоящей из Н и Cl-6 алкила; где по меньшей мере один из R3 и R4 не представляет собой Н; или R3 и R4 вместе с атомом, к которому они присоединены, в совокупности образуют 3-6-членный циклоалкил; и
А представляет собой необязательно замещенный 6-членный арил или необязательно замещенный 5 6-членный гетероарил;
при условии, что когда  представляет собой
представляет собой 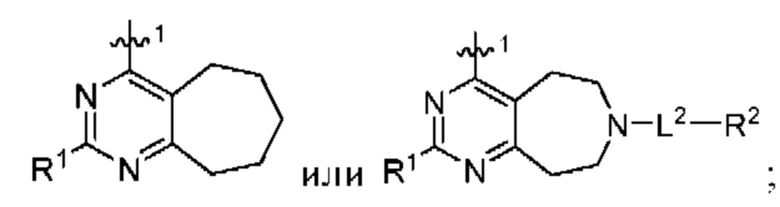 то R1 не представляет собой Н.
то R1 не представляет собой Н.
[0074] Как описано в данном документе для формулы (I)-(IV), А представляет собой необязательно замещенный 6-членный арил или необязательно замещенный 5-6-членный гетероарил.
[0075] В определенных вариантах осуществления формулы (I)-(IV) А представляет собой необязательно замещенный 6-членный арил. В определенных вариантах осуществления А представляет собой необязательно замещенный 5-6-членный гетероарил. В определенных вариантах осуществления А представляет собой необязательно замещенный 5-членный гетероарил. В определенных вариантах осуществления А представляет собой необязательно замещенный 6-членный гетероарил.
[0076] В определенных вариантах осуществления формулы (I)-(IV) А представляет собой необязательно замещенный 6-членный арил, в котором заместители образуют конденсированное кольцо, т.е. группа А является бициклической группой. В определенных вариантах осуществления группа А представляет собой конденсированную бициклическую группу, содержащую 18 кольцевых атомов или меньше, 14 кольцевых атомов или меньше или 10 кольцевых атомов или меньше. Слитое кольцо может представлять собой 3-8-членный циклоалкил, 4-8-членный циклоалкенил, 3-14-членный гетероциклил или 3-8-членный гетероарил. В некоторых вариантах осуществления бициклическое кольцо необязательно замещено одним тремя заместителями.
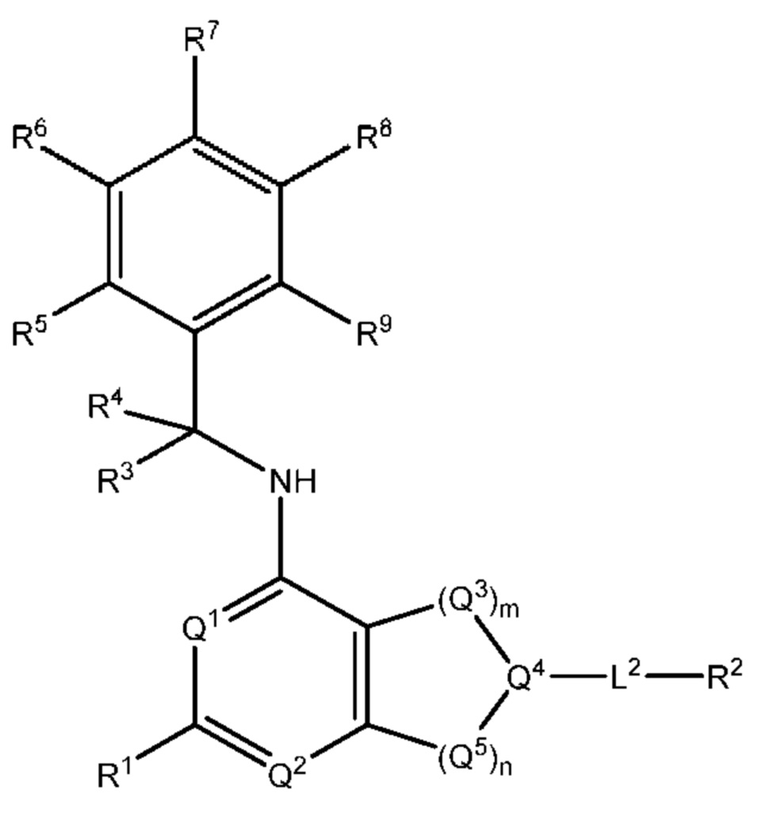
[0077] В определенных вариантах осуществления формулы (I)-(IV) А представляет собой 6-членный арил. В определенных вариантах осуществления формулы I, А представляет собой 6-членный арил, который замещен R5, R6, R7, R8 и R9, как описано в данном документе и показано ниже:
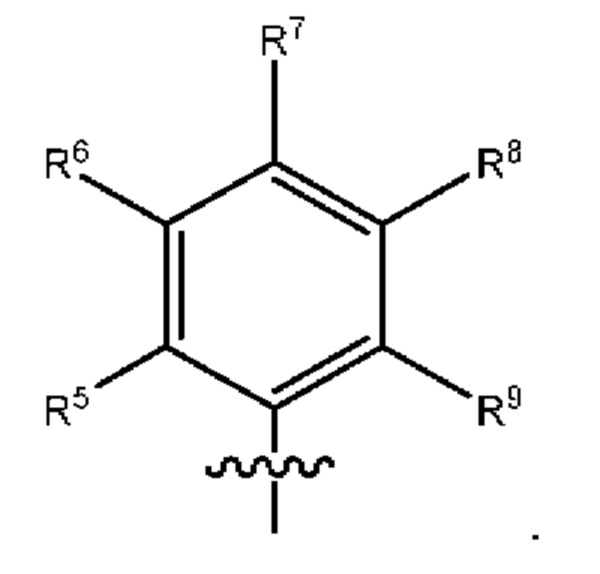
[0078] В некоторых вариантах осуществления R5, R6, R7, R8 и R9 независимо выбраны из группы, состоящей из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -ОН, галогена, -NO2, -CN, -NR11R12, -SR10, S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, -C(O)R10 и -CO2R10, где каждый Cl-6 алкил, C2-6 алкенил, 4-8-членный циклоалкенил, С2-6алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен -ОН, галогеном, -NO2, оксо, -CN, -R10, -OR10, -NR11R12, -SR10, S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, 3-8-членным циклоалкилом, 3-14-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом, или любые два смежных R5, R6, R7, R8 и R9 образуют 3-14 -членное конденсированное кольцо.
[0079] В некоторых вариантах осуществления R5, R6, R7, R8 и R9 независимо выбраны из группы, состоящей из Н, D, C1-6алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, -ОН, галогена, -NO2, -CN, -NR11R12, -SR10, S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, -C(O)R10 и -CO2R10, где каждый C1-6 алкил, С2-6алкенил, 4-8-членный циклоалкенил, С2-6 алкинил и 3-8-членный циклоалкил независимо необязательно замещен -ОН, галогеном, -NO2, оксо, -CN, -R10, -OR10, -NR11R12, -SR10, S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, 3-14-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом.
[0080] Выше R10, R11 и R12 в каждом случае независимо выбраны из Н, D, C1-6алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -OR13, -SR13, галогена, -NR13R14, -NO2 и -CN.
[0081] Выше R13 и R14 в каждом случае независимо выбраны из Н, D, Cl-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила и 3-14-членного гетероциклила, где каждый Cl-6 алкил, С2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен ОН, -SH, -NH2, -NO2 или -CN.
[0082] В определенных вариантах осуществления формулы (I)-(IV) А представляет собой 5 6-членный гетероарил.
[0083] В определенных вариантах осуществления формулы I, А представляет собой 5-членный гетероарил, который замещен R6 и R7, как описано в данном документе и показано ниже:

[0084] В некоторых вариантах осуществления Q7 и Q8 независимо представляют собой СН, N, NH, О или S при условии, что по меньшей мере один из Q7 и Q8 представляет собой N, NH, О или S.
[0085] В некоторых вариантах осуществления R6 и R7 независимо выбраны из группы, состоящей из Н, D, C1-6алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -ОН, галогена, -NO2, -CN, -NR11R12, -SR10, S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, -C(O)R10 и -CO2R10, где каждый Cl-6 алкил, C2-6 алкенил, 4-8-членный циклоалкенил, C2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен -OH, галогеном, -NO2, оксо, -CN, -R10, -OR10, -NR11R12, -SR10, S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, 3-8-членным циклоалкилом, 3-14-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом.
[0086] В некоторых вариантах осуществления R6 и R7 независимо выбраны из группы, состоящей из Н, D, C1-6алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6алкинила, 3-8-членного циклоалкила, -ОН, галогена, -NO2, -CN, -NR11R12, -SR10, S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, -C(O)R10 и -CO2R10, где каждый Cl-6 алкил, C2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил и 3-8-членный циклоалкил независимо необязательно замещен -ОН, галогеном, -NO2, оксо, -CN, -R10, -OR10, -NR11R12, -SR10, S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, 3-14-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом.
[0087] Выше R10, R11 и R12 в каждом случае независимо выбраны из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -OR13, -SR13, галогена, -NR13R14, -NO2 или -CN.
[0088] Выше R13 и R14 в каждом случае независимо выбраны из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила или 3-14-членного гетероциклила, где каждый Cl-6 алкил, С2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен -ОН, -SH, -NH2, -NO2 или -CN.
[0089] В определенных вариантах осуществления формулы (I)-(IV) А представляет собой 6-членный гетероарил. В определенных вариантах осуществления формулы I, А представляет собой 6-членный гетероарил, который замещен R5, R6, R7, R8 и R9, как описано в данном документе и показано ниже:
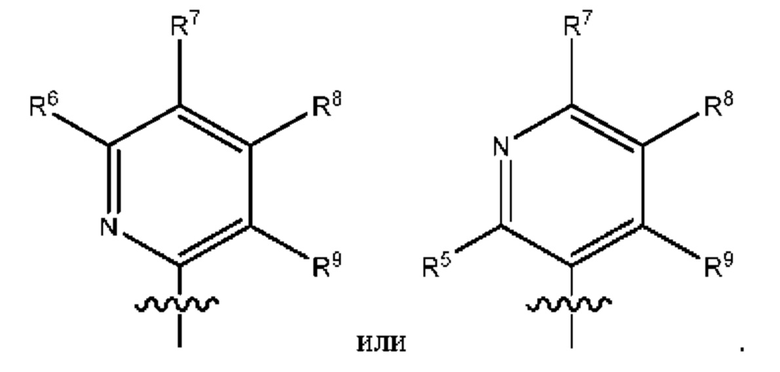
[0090] В некоторых вариантах осуществления R5, R6, R7, R8 и R9 независимо выбраны из группы, состоящей из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -ОН, галогена, NO2, -CN, -NR11R12, -SR10, S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, -C(O)R10 и -CO2R10, где каждый C1-6 алкил, C2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен -ОН, галогеном, -NO2, оксо, -CN, -R10, -OR10, -NR11R12, -SR10, S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, 3-8-членным циклоалкилом, 3-14-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом, или любые два смежных R7, R8 и R9 образуют 3-14-членное конденсированное кольцо.
[0091] В некоторых вариантах осуществления R5, R6, R7, R8 и R9 независимо выбраны из группы, состоящей из Н, D, C1-6алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, -ОН, галогена, -NO2, -CN, -NR11R12, -SR10, S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, -C(O)R10 и -CO2R10, где каждый C1-6 алкил, С2-6алкенил, 4-8-членный циклоалкенил, С2-6 алкинил и 3-8-членный циклоалкил независимо необязательно замещен -ОН, галогеном, -NO2, оксо, -CN, -R10, -OR10, -NR11R12, -SR10, S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, 3-14-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом.
[0092] Выше R10, R11 и R12 в каждом случае независимо выбраны из Н, D, C1-6алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -OR13, -SR13, галогена, -NR13R14, -NO2 и -CN.
[0093] Выше R13 и R14 в каждом случае независимо выбраны из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила и 3-14-членного гетероциклила, где каждый Cl-6 алкил, С2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен ОН, -SH, NH2, NO2 или -CN.
[0094] В настоящем изобретении предложены соединения формулы (V),
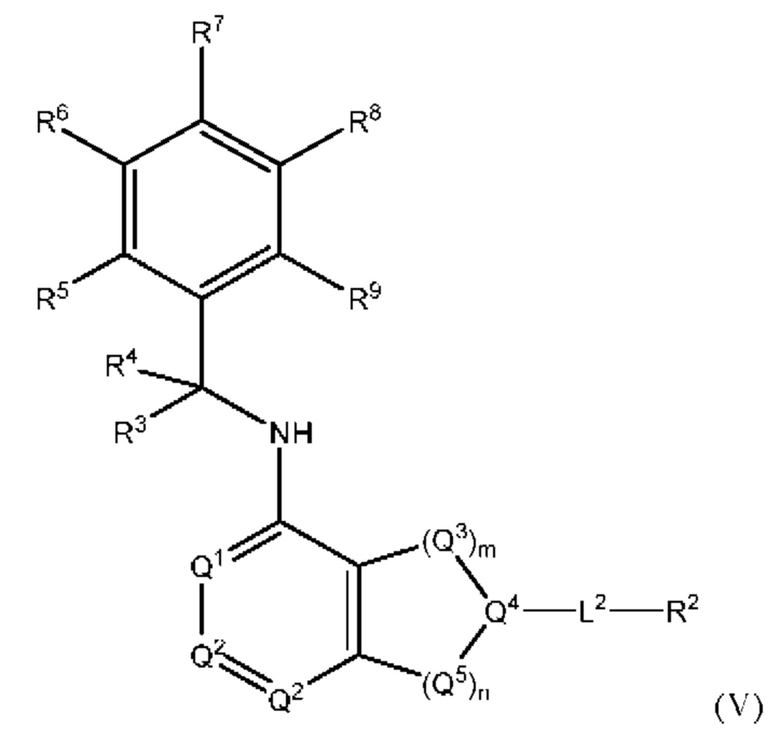
или его фармацевтически приемлемые соль, сольват, изомер, пролекарство или таутомер, где:
L2, Q1, Q2, Q3, Q4, Q5, m, n, R1, R2, R3 и R4 соответствуют определению в формуле (I);
R5, R6, R7, R8 и R9 независимо выбраны из группы, состоящей из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -ОН, галогена, -NO2, -CN, -NR11R12, -SR10, S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, -C(O)R10 и -CO2R10, где каждый Cl-6 алкил, C2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен -ОН, галогеном, -NO2, оксо, -CN, -R10, -OR10, -NR11R12, -SR10, S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, 3-8-членным циклоалкилом, 3-14-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом, или любые два смежных R5, R6, R7, R8 и R9 образуют 3-14-членное конденсированное кольцо;
R10, R11 и R12 в каждом случае независимо выбраны из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -OR13, -SR13, галогена, -NR13R14, -NO2 и -CN; и
R13 и R14 в каждом случае независимо выбраны из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила и 3-14-членного гетероциклила, где каждый Cl-6 алкил, С2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен -ОН, -SH, -NH2, -NO2 или -CN.
[0095] В настоящем изобретении предложены соединения формулы (V-a),
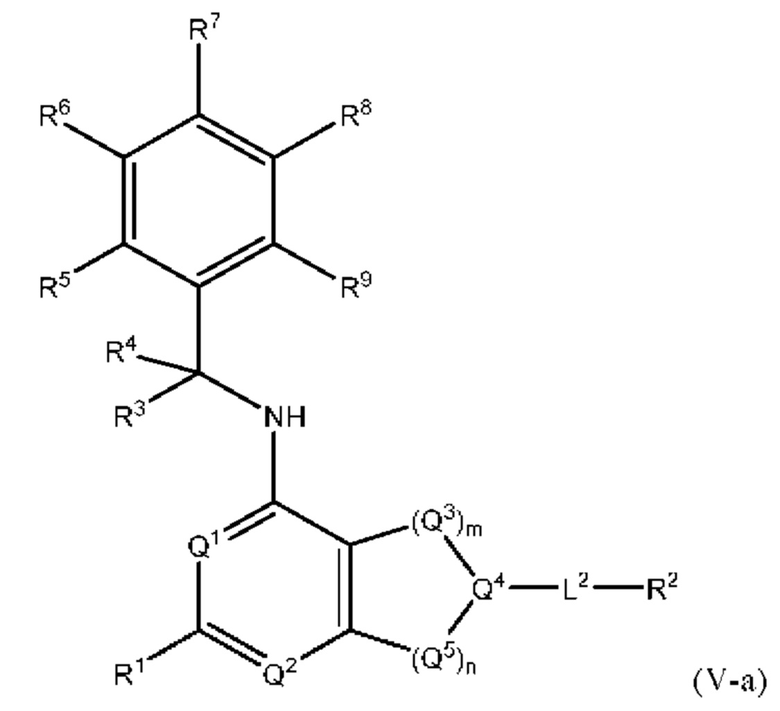
или его фармацевтически приемлемые соль, сольват, изомер, пролекарство или таутомер, где:
Q1, Q3, Q4, Q5, m, n, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13 и R14 соответствуют определению в формуле (V);
Q2 представляет собой СН или N;
где по меньшей мере один из Q1, Q2, Q3, Q4 и Q5 представляет собой N, NRQN, О или SO2;
R1 выбран из группы, состоящей из Н, галогена, C1-6 алкила, циклопропила, CN и OR1a; где R1a представляет собой Н или C1-6 алкил; и
L2 выбран из группы, состоящей из связи, -С(О)-, -С(O)O-, -C(O)NH(CH2)o-, S(O)2-, -С(O)(СН2)р- (СН2)р- или -О-; где о равно 0, 1 или 2; и где р представляет собой число от 1 до 6.
[0096] В настоящем изобретении предложены соединения формулы (V-b),
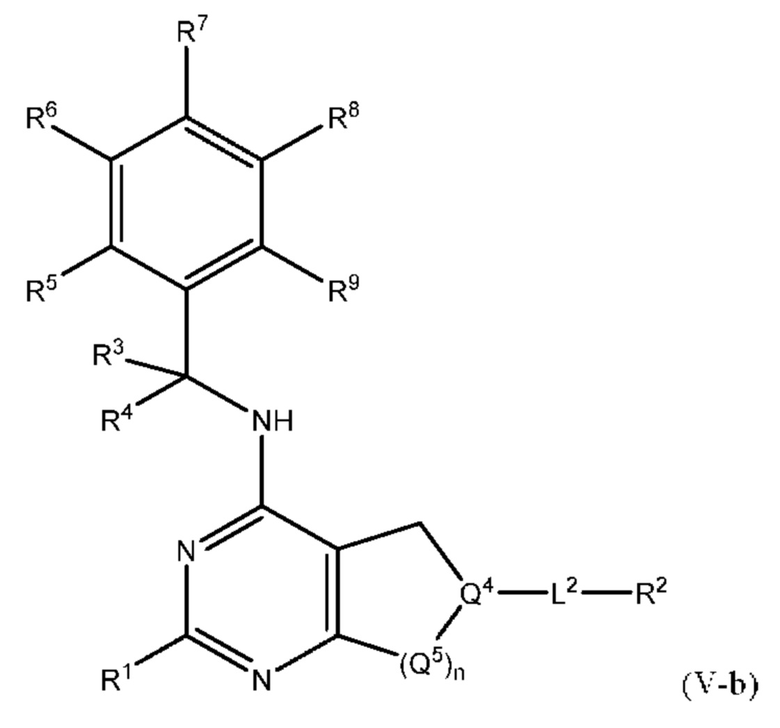
или его фармацевтически приемлемые соль, сольват, изомер, пролекарство или таутомер, где:
Q4 представляет собой СН, С или N;
каждый Q5 независимо представляет собой CH2, N-СН3 или СО, а n равно 1 или 2;
L2 выбран из группы, состоящей из связи, -С(О)-, S(O)2-,-C(O)NH(CH2)o-, С(O)(СН2)р-, (СН2)р-; где о равно 0, 1 или 2; и где р представляет собой число от 1 до 6;
R1 выбран из группы, состоящей из Н, C1-6 алкила, галогена, -CONHR1a, -NHR1a, -OR1a и азетидинила; где каждый C1-6 алкил и азетидинил необязательно замещен галогеном, R1a, -NHR1a или -OR1a; где R1a представляет собой Н, Cl-6 алкил, циклопропил, 3-6-членный гетероциклил или Cl-6 галогеналкил;
R2 выбран из группы, состоящей из Н, C1-6 алкила, -NR2bR2c, -OR2a, 3-14-членного циклоалкила, 3-14-членного циклоалкенила, 3-14-членного гетероциклила, 6-10-членного арила и 5-10-членного гетероарила; где каждый C1-6 алкил, 3-14-членный циклоалкил, 3-14-членный циклоалкенил, 3-14-членный гетероциклил, 6-10-членный арил и 5-10-членный гетероарил независимо необязательно замещен Cl-6 алкилом, Cl-6 галогеналкилом, C1-6 гидроксиалкилом, C1-6 метоксиалкилом, -ОН, -OR2a, оксо, =N, галогеном, -C(O)R2a, -C(O)OR2a, -C(O)NR2bR2c, -SO2R2a, -CN, -NR2bR2c, 3-6-членным циклоалкилом, 3-7-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом;
где R2a представляет собой Н, Cl-6 алкил, Cl-6 галогеналкил, 3-7-членный гетероциклил или -(СН2)rOCH3, где r равно 1, 2 или 3;
где R2b представляет собой Н или C1-6 алкил;
где R2c представляет собой Н или C1-6 алкил;
каждый из R3 и R4 независимо выбран из группы, состоящей из -Н, -СН3 и -СН2СН3;
R5, R6, R7, R8 и R9 независимо выбраны из группы, состоящей из Н, Cl-6 алкила, 4-8-членного циклоалкенила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, галогена и NR11R12, где каждый C1-6 алкил, 4-8-членный циклоалкенил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен -OH, галогеном, -CN, -R10, -OR10, -NR11R12, 3-8-членным циклоалкилом или 3-14-членным гетероциклилом; или любые два смежных R5, R6, R7, R8 и R9 образуют 4-8-членное циклоалкенильное конденсированное кольцо, 3-8-членное циклоалкильное конденсированное кольцо или 3-14-членное гетероциклильное конденсированное кольцо, где 4-8-членное циклоалкенильное конденсированное кольцо, 3-8-членное циклоалкильное конденсированное кольцо или 3-14-членное гетероциклильное конденсированное кольцо необязательно замещены -F или -СН2ОН; и
R10, R11 и R12 в каждом случае независимо выбраны из Н, Cl-6 алкила, 3-8-членного циклоалкила или 3-14-членного гетероциклила.
[0097] В некоторых вариантах осуществления структуры (V-b), R1 выбран из группы, состоящей из -Н, -CH3, -Cl, -ОН, -CH2F, -CF2CH2NH2, -CF2CH2OH, -CONH2, 
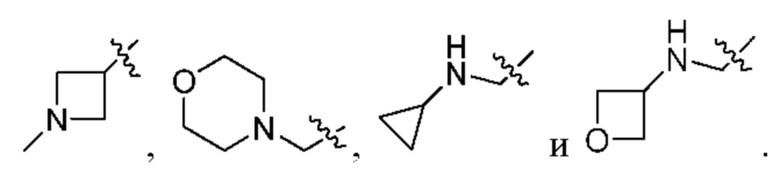
[0098] В некоторых вариантах осуществления структуры (V-b), R5, R6, R7, R8 и R9 независимо выбраны из группы, состоящей из -Н, -CF3, -NH2, -F, -Br, -CHF2, -CH2F, -СН3, -CF2CH2OH, -CF2CH2NH2, -CF2CH2OCH3, -CHFCH2OH, -CF2C(CH3)2OH, -CH2CH2OH, -CH(СН2)СН2ОН, -C(CH3)2CN, 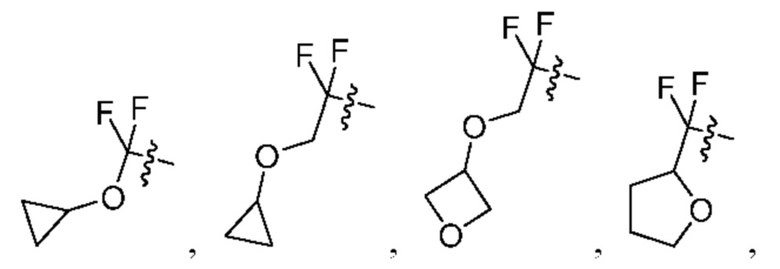
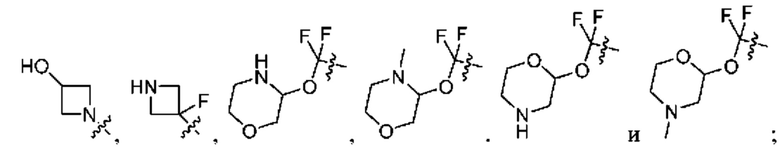 или любые два смежных R5, R6, R7, R8 и R9 образуют 4-8-членное циклоалкенильное конденсированное кольцо, 3-8-членное циклоалкильное конденсированное кольцо или 3-14-членное гетероциклильное конденсированное кольцо, где 4-8-членное циклоалкенильное конденсированное кольцо, 3-8-членное циклоалкильное конденсированное кольцо или 3-14-членное гетероциклильное конденсированное кольцо необязательно замещены -F или -СН2ОН.
или любые два смежных R5, R6, R7, R8 и R9 образуют 4-8-членное циклоалкенильное конденсированное кольцо, 3-8-членное циклоалкильное конденсированное кольцо или 3-14-членное гетероциклильное конденсированное кольцо, где 4-8-членное циклоалкенильное конденсированное кольцо, 3-8-членное циклоалкильное конденсированное кольцо или 3-14-членное гетероциклильное конденсированное кольцо необязательно замещены -F или -СН2ОН.
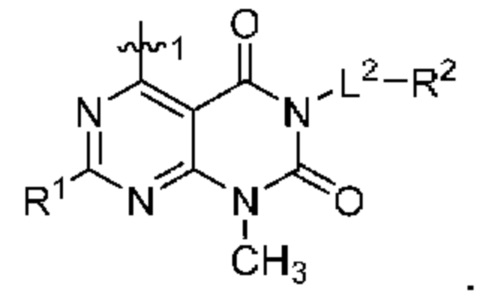
[0099] В настоящем изобретении предложены соединения формулы (VI),
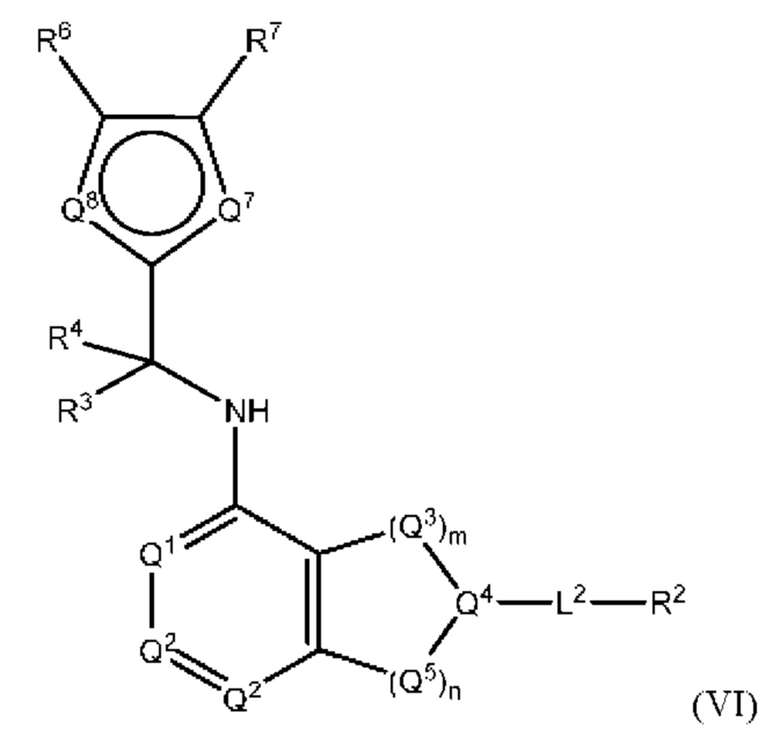
или его фармацевтически приемлемые соль, сольват, изомер, пролекарство или таутомер, где:
L2, Q1, Q2, Q3, Q4, Q5, m, n, R1, R2, R3 и R4 соответствуют определению в формуле (I);
Q7 и Q8 каждый независимо представляют собой СН, N, NH, О или S при условии, что по меньшей мере один из Q7 и Q8 представляет собой N, NH, О или S;
R6 и R7 независимо выбраны из группы, состоящей из Н, D, С1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -ОН, галогена, -NO2, -CN, -NR11R12, -SR10, -S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, -C(O)R10 и -CO2R10, где каждый С1-6 алкил, C2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен -ОН, галогеном, -NO2, оксо, -CN, -R10, -OR10, -NR11R12, -SR10, S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, 3-8-членным циклоалкилом, 3-14-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом,
R10, R11 и R12 в каждом случае независимо выбраны из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -OR13, -SR13, галогена, -NR13R14, -NO2 и -CN; и
R13 и R14 в каждом случае независимо выбраны из Н, D, С1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила и 3-14-членного гетероциклила, где каждый С1-6 алкил, С2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен -ОН, -SH, -NH2, -NO2 или -CN.
[00100] В настоящем изобретении предложены соединения формулы (VI-a),
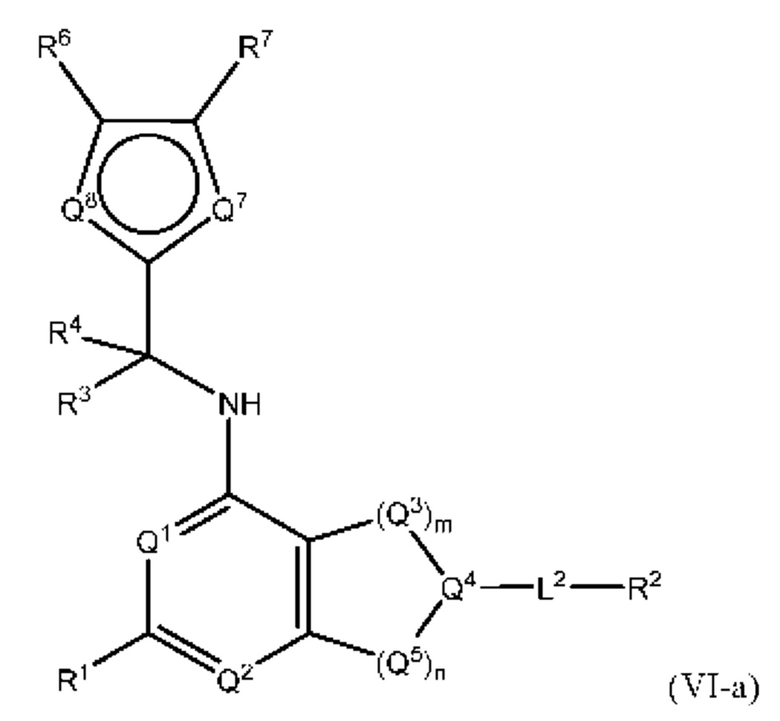
или их фармацевтически приемлемые соли, пролекарства, сольваты, гидраты, таутомеры или изомеры, где Q1, Q2, Q3, Q5, Q7, Q8, R1, R2, R3, R4, R6, R7, L2, m и n описаны как выше.
[00101] В настоящем изобретении предложены соединения формулы (VII-а) и (VII-b),
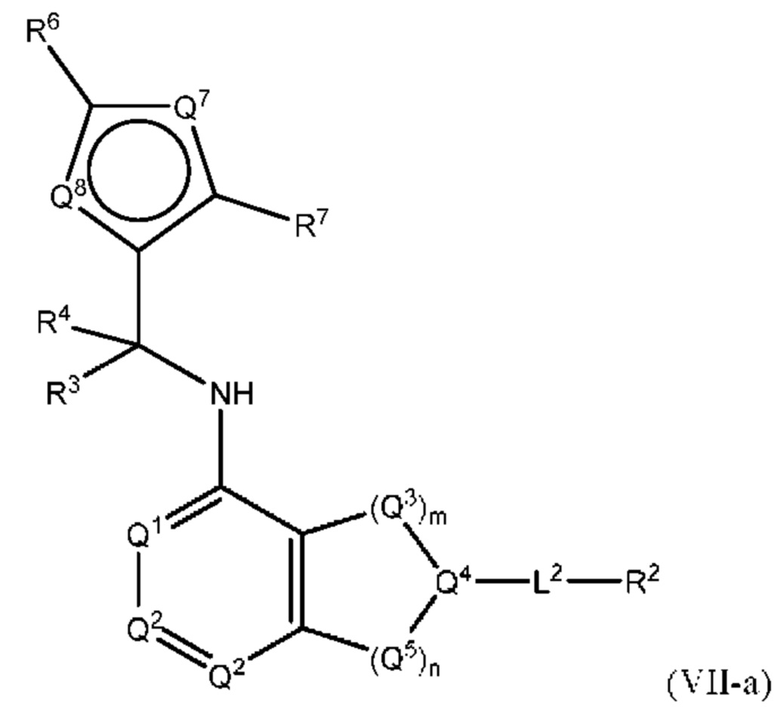
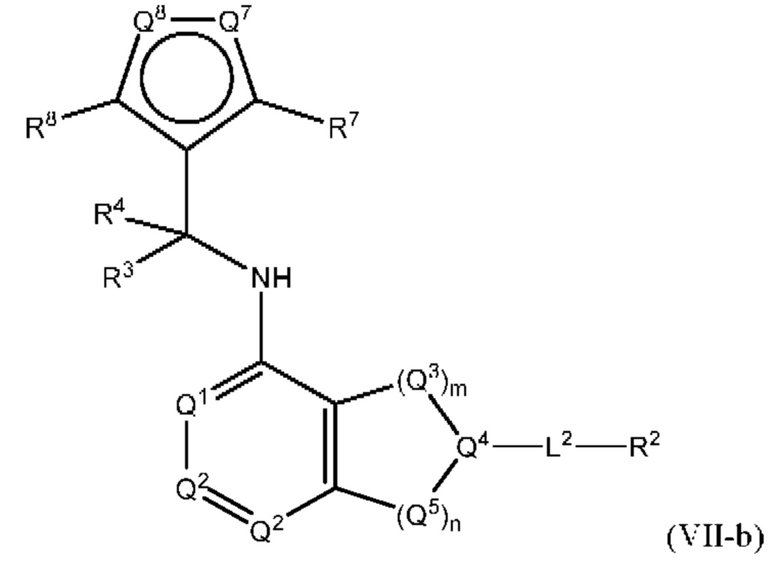
или его фармацевтически приемлемые соль, сольват, изомер, пролекарство или таутомер, где:
L2, Q1, Q2, Q3, Q4, Q5, m, n, R1, R2, R3 и R4 соответствуют определению в формуле (I);
Q7 и Q8 каждый независимо представляют собой СН, N, NH, О или S при условии, что по меньшей мере один из Q7 и Q8 представляет собой N, NH, О или S;
R6 и R7 независимо выбраны из группы, состоящей из Н, D, С1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -ОН, галогена, -NO2, -CN, -NR11R12, -SR10, -S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, -C(O)R10 и -CO2R10, где каждый С1-6 алкил, C2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен -ОН, галогеном, -NO2, оксо, -CN, -R10, -OR10, -NR11R12, -SR10, S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, 3-8-членным циклоалкилом, 3-14-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом,
R10, R11 и R12 в каждом случае независимо выбраны из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -OR13, -SR13, галогена, -NR13R14, -NO2 и -CN; и
R13 и R14 в каждом случае независимо выбраны из Н, D, С1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила и 3-14-членного гетероциклила, где каждый С1-6 алкил, С2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен -ОН, -SH, -NH2, -NO2 или -CN.
[00102] В настоящем изобретении предложены соединения формулы (VII-c) и (VII-d),
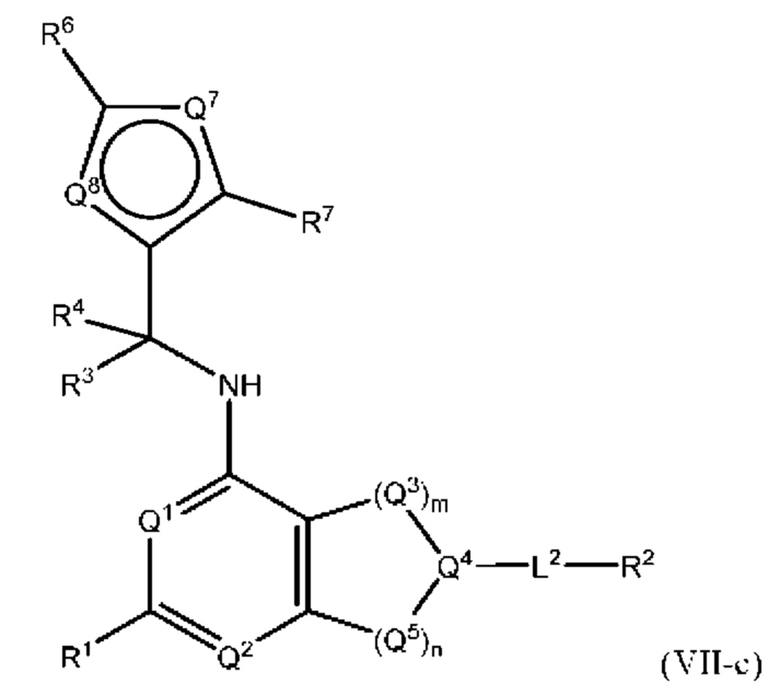
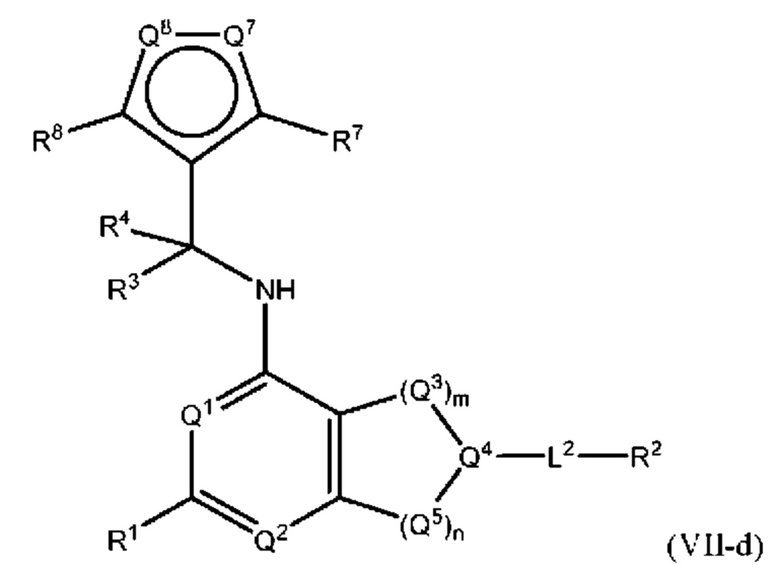
или их фармацевтически приемлемые соли, пролекарства, сольваты, гидраты, таутомеры или изомеры, где Q1, Q2, Q3, Q5, Q7, Q8, R1, R2, R3, R4, R6, R7, L2, m и n описаны как выше.
[00103] В настоящем изобретении предложены соединения формулы (VIII-а) и (VIII-b),

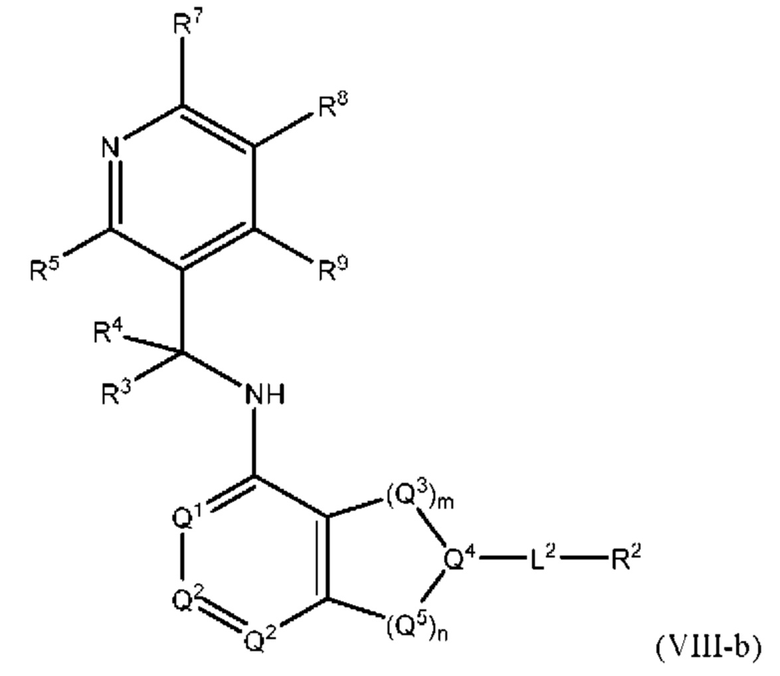
или его фармацевтически приемлемые соль, сольват, изомер, пролекарство или таутомер, где:
L2, Q1, Q2, Q3, Q4, Q5, m, n, R1, R2, R3 и R4 соответствуют определению в формуле (I);
R5, R6, R7, R8 и R9 независимо выбраны из группы, состоящей из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -ОН, галогена, -NO2, -CN, -NR11R12, -SR10, S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, -C(O)R10 и -CO2R10, где каждый С1-6 алкил, C2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен -ОН, галогеном, -NO2, оксо, -CN, -R10, -OR10, -NR11R12, -SR10, S(O)2NR11R12, S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, 3-8-членным циклоалкилом, 3-14-членным гетероциклилом, 6 10-членным арилом или 5 10-членным гетероарилом, или любые два смежных R7, R8 и R9 образуют 3-14-членное конденсированное кольцо;
R10, R11 и R12 в каждом случае независимо выбраны из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -OR13, -SR13, галогена, -NR13R14, -NO2 и -CN; и
R13 и R14 в каждом случае независимо выбраны из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила и 3-14-членного гетероциклила, где каждый С1-6 алкил, C2-6 алкенил, 4-8-членный циклоалкенил, C2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен -ОН, SH, -NH2, NO2 или -CN.
[00104] В настоящем изобретении предложены соединения формулы (VIII-c) и (VIII-d),
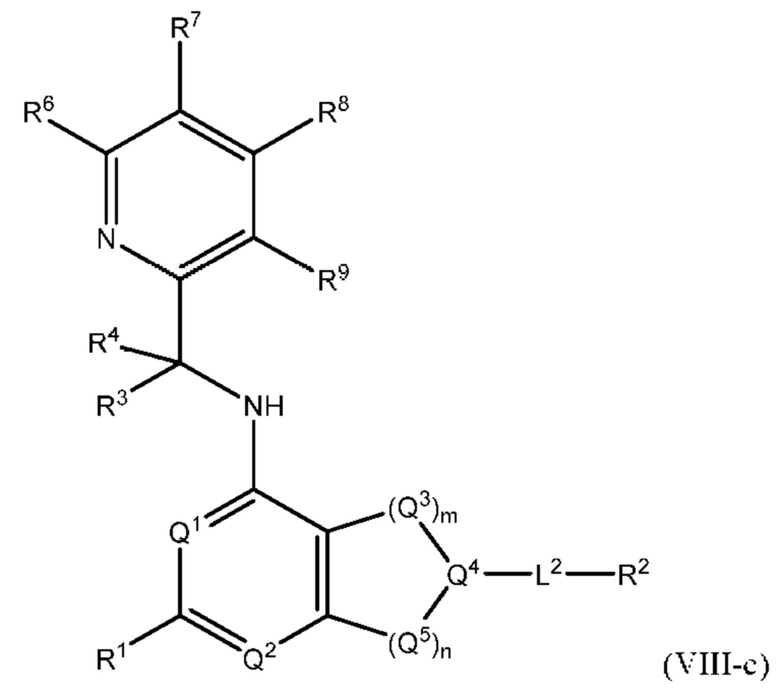
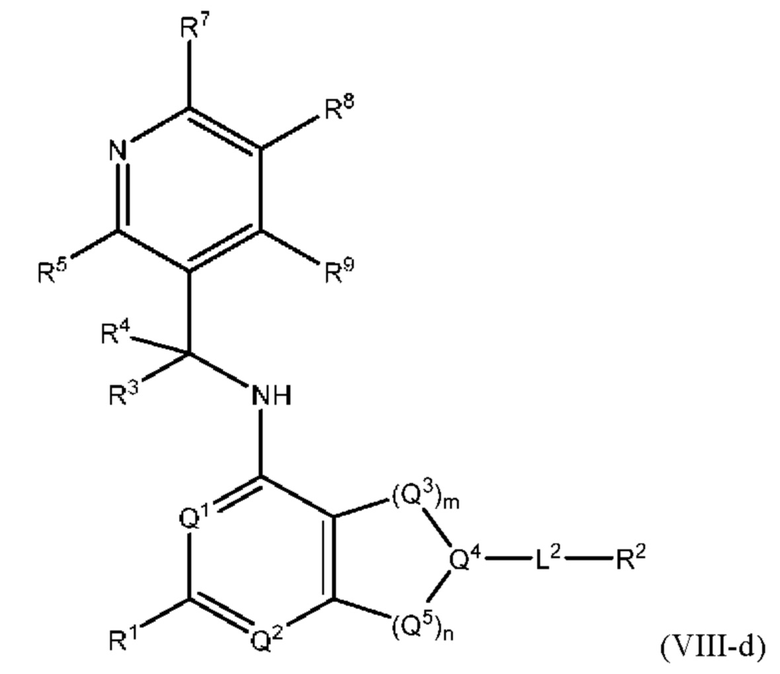
или их фармацевтически приемлемые соли, пролекарства, сольваты, гидраты, таутомеры или изомеры, где Q1, Q2, Q3, Q5, R1, R2, R3, R4, R5, R6, R7, L2, m и n описаны как выше.
[00105] Как описано выше, m равно 0, 1, 2 или 3; n равно 0, 1, 2 или 3; причем если m равно 0, то n не равно 0. В определенных вариантах осуществления m равно 0. В определенных вариантах осуществления m равно 1. В определенных вариантах осуществления m равно 2. В определенных вариантах осуществления m равно 3. В определенных вариантах осуществления n равно 0. В определенных вариантах осуществления n равно 1. В определенных вариантах осуществления п равно 2. В определенных вариантах осуществления n равно 3.
[00106] В определенных вариантах осуществления m равно 1, а n равно 1. В определенных вариантах осуществления m равно 1, а n равно 2. В определенных вариантах осуществления m равно 2, an равно 1. В определенных вариантах осуществления m равно 1, а n равно 3. В определенных вариантах осуществления m равно 2, a n равно 2.
[00107] Как описано выше, Q1 и Q2 независимо представляют собой СН или N. В определенных вариантах осуществления Q1 представляет собой СН. В определенных вариантах осуществления Q1 представляет собой N. В определенных вариантах осуществления Q2 представляет собой СН. В определенных вариантах осуществления Q2 представляет собой N.
[00108] Как описано выше, Q4 представляет собой С или N. В определенных вариантах осуществления Q4 представляет собой С. В определенных вариантах осуществления Q4 представляет собой N.
[00109] Как описано выше, каждый из Q3 и Q5 независимо представляет собой C(RQC)2, NRQN, СО, О или SO2, где каждый RQC независимо представляет собой Н, F, Cl, Br или арил (например, 6-10-членный арил), а каждый RQN независимо представляет собой Н, C1-6 алкил или арил (например, 6-10-членный арил). В определенных вариантах осуществления каждый из Q3 и Q5 независимо представляет собой C(RQC)2, NRQN, О или SO2, где каждый RQC независимо представляет собой Н, F, Cl, Br или арил (например, 6-10-членный арил), а каждый RQN независимо представляет собой Н, С1-6 алкил или арил (например, 6-10-членный арил). В определенных вариантах осуществления каждый из Q3 и Q5 независимо представляет собой C(RQC)2 или NRQN, где каждый RQC независимо представляет собой Н, F, Cl, Br или арил (например, 6-10-членный арил), а каждый RQN независимо представляет собой Н, C1-6 алкил или арил (например, 6-10-членный арил). В определенных вариантах осуществления Q3 и Q5 независимо представляют собой СН2 или NH. В определенных вариантах осуществления Q3 и Q5 независимо представляют собой СН2.
[00110] В некоторых вариантах осуществления 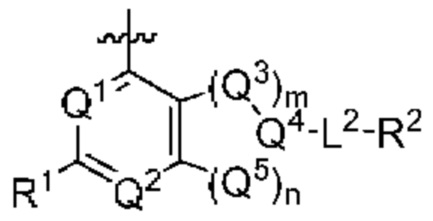 выбран из группы, состоящей из
выбран из группы, состоящей из 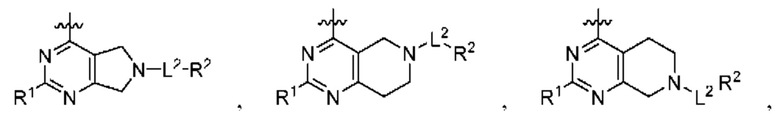
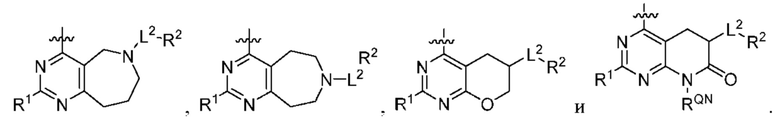
[00111] В некоторых вариантах осуществления 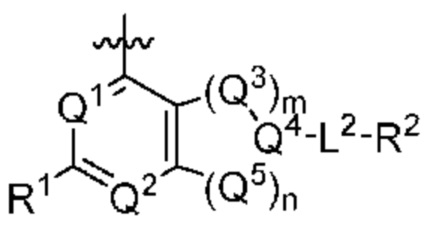 представляет собой
представляет собой
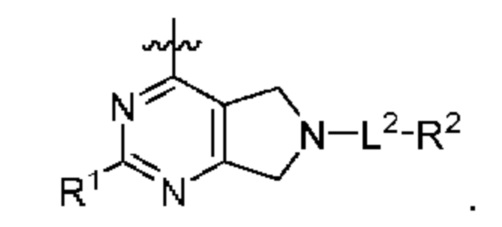
[00112] В некоторых вариантах осуществления 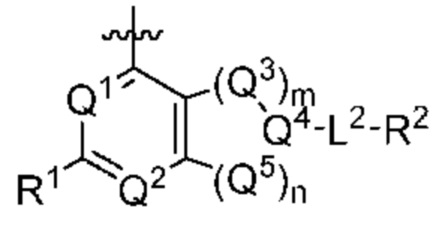 представляет собой
представляет собой
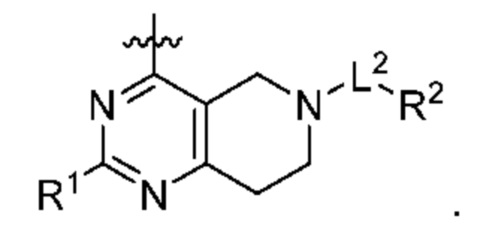
[00113] В некоторых вариантах осуществления 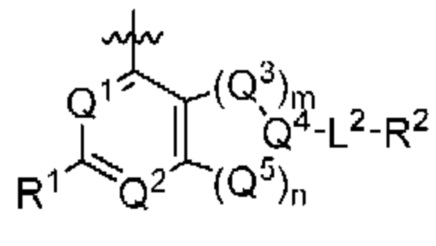 представляет собой
представляет собой
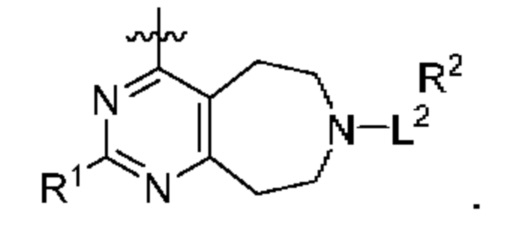
[00114] В определенных вариантах осуществления  выбран из группы, состоящей из
выбран из группы, состоящей из 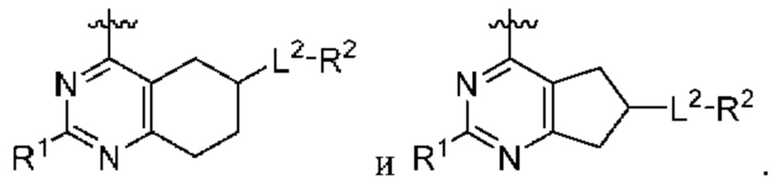
[00115] В некоторых вариантах осуществления R1 выбран из группы, состоящей из Н, C1-6 алкила, галогена, -CONHR1a, -NHR1a, -OR1a, циклопропила, азетидинила и -CN; где каждый C1-6 алкил и азетидинил необязательно замещен галогеном, R1a, -NHR1a или -OR а; где R1a представляет собой Н, С1-6 алкил, циклопропил, 3-6-членный гетероциклил или С1-6 галогеналкил.
[00116] В некоторых вариантах осуществления R1 выбран из группы, состоящей из Н, С1-6 алкила, галогена, -NHR1a, -OR1a, азетидинила, циклопропила и -CN; где каждый С1-6 алкил и азетидинил необязательно замещен галогеном, -R1a, -NHR1a или -OR1a; где R1a представляет собой Н, С1-6 алкил, 3-6-членный гетероциклил или С1-6 галогеналкил.
[00117] В некоторых вариантах осуществления R1 представляет собой Н, галоген, С1-6 алкил, циклопропил, -CN или -OR1a; где R1a представляет собой Н или С1-6 алкил. В определенных вариантах осуществления R1 представляет собой галоген, С1-6 алкил, циклопропил, -CN или -OR1a; где R1a представляет собой Н или С1-6 алкил.
[00118] В определенных вариантах осуществления R1 представляет собой Н. В определенных вариантах осуществления R1 представляет собой галоген. В определенных вариантах осуществления R1 представляет собой С1-6 алкил. В определенных вариантах осуществления R1 представляет собой C1 алкил, С2 алкил, С3 алкил, С4 алкил, С5 алкил или С6 алкил. В некоторых вариантах осуществления С1-6 алкил является замещенным. В определенных вариантах осуществления R1 представляет собой циклопропил. В определенных вариантах осуществления R1 представляет собой -CN. В определенных вариантах осуществления R1 представляет собой -OR1a; где R1a представляет собой Н или C1-6 алкил. В определенных вариантах осуществления R1 представляет собой -ОН. В определенных вариантах осуществления R1 представляет собой -OR1a; где R1a представляет собой C1-6 алкил.
[00119] В определенных вариантах осуществления R1 выбран из группы, состоящей из Н, -СН3, -СН2ОН, -CH2NH2, -СН2СН3, -CF2CH2OH, -CONH2, -Cl, -Br, -I, циклопропила, -OH, -CN, -ОСН3, -ОСН2СН3, -NHCH3, -OHF2, -CF3, -OCF3, 
[00120] В определенных вариантах осуществления R1 выбран из группы, состоящей из Н, -СН3, -CH2OH, -CH2NH2, -СН2СН3, -Cl, -Br, -I, циклопропила, -ОН, -CN, -ОСН3, - ОСН2СН3, -NHCH3, -CHF2, -OF3, -OCF3 и
[00121] В некоторых вариантах осуществления L2 выбран из группы, состоящей из связи, -С(О)- -С(O)O- -C(O)NH(CH2)o- -S(O)2-, 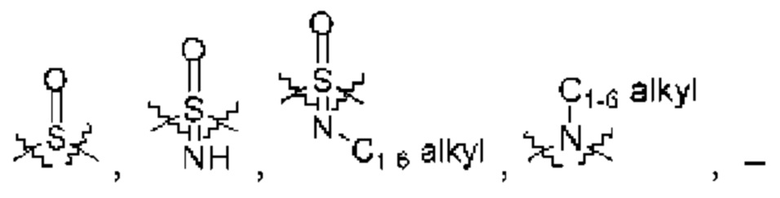 С(O)(СН2)р-, -(СН2)p- и -О-; где о равно 0, 1 или 2, и где р представляет собой число от 1 до 6. В некоторых вариантах осуществления, в которых L2 содержит карбонильную группу, атом углерода карбонильной группы связан с Q4.
С(O)(СН2)р-, -(СН2)p- и -О-; где о равно 0, 1 или 2, и где р представляет собой число от 1 до 6. В некоторых вариантах осуществления, в которых L2 содержит карбонильную группу, атом углерода карбонильной группы связан с Q4.
[00122] В некоторых вариантах осуществления L2 выбран из группы, состоящей из связи, -С(О)-, -C(O)O-, -C(O)NH(CH2)o-, -S(O)2-, -С(O)(СН2)р-, -(СН2)р- и -О-, где о равно 0, 1 или 2, и где р представляет собой число от 1 до 6. В некоторых вариантах осуществления, в которых L2 содержит карбонильную группу, атом углерода карбонильной группы связан c Q4.
[00123] В некоторых вариантах осуществления L2 выбран из группы, состоящей из 

[00124] В определенных вариантах осуществления L2 представляет собой связь. В определенных вариантах осуществления L2 представляет собой -С(О)- В определенных вариантах осуществления L2 представляет собой -С(O)O- где кар 6 он ильная группа связана с Q7. В определенных вариантах осуществления L2 представляет собой -C(O)NH(CH2)o-где карбонильная группа связана с Q7. В определенных вариантах осуществления L2 представляет собой -S(O)2-. В определенных вариантах осуществления L2 представляет собой -С(O)(СН2)р- В определенных вариантах осуществления L2 представляет собой -(СН2)р- В определенных вариантах осуществления L2 представляет собой -О-.
[00125] Как описано в данном документе, о равно 0, 1 или 2. В определенных вариантах осуществления о равно 0. В определенных вариантах осуществления о равно 1. В определенных вариантах осуществления о равно 2.
[00126] Как описано в данном документе, р представляет собой число от 1 до 6. В определенных вариантах осуществления р равно 1. В определенных вариантах осуществления р равно 2. В определенных вариантах осуществления р равно 3. В определенных вариантах осуществления р равно 4. В определенных вариантах осуществления р равно 5. В определенных вариантах осуществления р равно 6.
[00127] В некоторых вариантах осуществления R2 выбран из группы, состоящей из Н, С1-6 алкила, -NR2bR2c, -OR2a, 3-14-членного циклоалкила, 3-14-членного циклоалкенила, 3-14-членного гетероциклила, 6-10-членного арила и 5-10-членного гетероарила; где каждый C1-6 алкил, 3-14-членный циклоалкил, 3-14-членный циклоалкенил, 3-14-членный гетероциклил, 6-10-членный арил и 5-10-членный гетероарил независимо необязательно замещен С1-6 алкилом, -ОН, -OR, оксо, =N, галогеном, -C(O)R2a, -C(00)R2a, -C(O)NR2bR2c, -CN, -NR2bR2c, 3-6-членным циклоалкилом, 3-7-членным гетероциклилом, 6-10-членным арилом или 5 10-членным гетероарилом;
где R2a представляет собой Н, C1-6 алкил, С1-6 галогеналкил, 3-7-членный гетероциклил или -(СН2)rOCH3, где г равно 1, 2 или 3;
где R2b представляет собой Н или C1-6 алкил;
где R2c представляет собой Н или C1-6 алкил.
[00128] В некоторых вариантах осуществления R2 выбран из группы, состоящей из Н, (CH2)qCH3, 3-14-членного циклоалкила, 3-14-членного циклоалкенила, 3-14-членного гетероциклила, 6-10-членного арила и 5-10-членного гетероарила; где q представляет собой число от 1 до 5; где каждый 3-14-членный циклоалкил, 3-14-членный циклоалкенил, 3-14-членный гетероциклил, 6-10-членный арил и 5-10-членный гетероарил независимо необязательно замещен C1-6 алкилом, -ОН, галогеном, -C(O)R2a или -C(O)NR2bR2c; где R2a представляет собой C1-6 алкил или -(СН2)rOCH3, где г равно 1, 2 или 3; где R2b представляет собой Н или C1-6 алкил; и где R2c представляет собой Н или С1-6 алкил.
[00129] В определенных вариантах осуществления R2 представляет собой Н. В некоторых вариантах осуществления R2 представляет собой -СН3. В некоторых вариантах осуществления R2 представляет собой СН(СН3)2. В определенных вариантах осуществления R2 представляет собой С1-6 алкил, необязательно замещенный галогеном или -OR2a. В определенных вариантах осуществления R2 представляет собой -(СН2)qCH3. В некоторых вариантах осуществления R2 представляет собой -СН2СН2ОН. В некоторых вариантах осуществления R2 представляет собой СН2СН2ОСН2СН3. В некоторых вариантах осуществления R2 представляет собой ОСН3. В определенных вариантах осуществления R2 представляет собой -(СН2)qCH3, где q представляет собой число от 1 до 5. В определенных вариантах осуществления q равно 1. В определенных вариантах осуществления q равно 2. В определенных вариантах осуществления q равно 3. В определенных вариантах осуществления q равно 4. В определенных вариантах осуществления q равно 5. В определенных вариантах осуществления R2 представляет собой C1-6 алкил, необязательно замещенный -NR2bR2c. В некоторых вариантах осуществления R2 представляет собой C1 алкил, замещенный -NR2bR2c, a R2b и R2c не представляют собой Н или -СН3. В некоторых вариантах осуществления R2 представляет собой C1 алкил, замещенный -NR2bR2c, a R2b и R2c оба представляют собой -СН3.
[00130] В определенных вариантах осуществления R2 представляет собой -NR2bR2c, где R2b представляет собой Н или С1-6 алкил; и где R2c представляет собой Н или С1-6 алкил. В некоторых вариантах осуществления R2 представляет собой NHCH3. В некоторых вариантах осуществления R2 представляет собой -(СН3)2.
[00131] В некоторых вариантах осуществления R2 выбран из группы, состоящей из 3-14-членного циклоалкила, 3-14-членного циклоалкенила, 3-14-членного гетероциклила, 6-10-членного арила и 5-10-членного гетероарила. В некоторых вариантах осуществления, в которых R2 содержит циклическую структуру, L2 представляет собой связь, а циклическая структура, выбранная из 3-14-членного циклоалкила, 3-14-членного циклоалкенила, 3-14-членного гетероциклила, 6-10-членного арила и 5-10-членного гетероарила, представляет собой спироструктуру, связанную с Q4. Например, 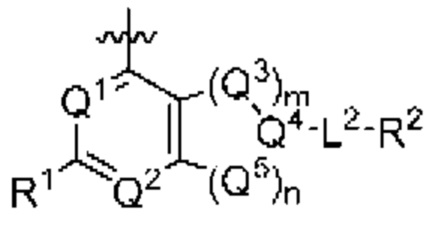 содержит группу, имеющую структуру
содержит группу, имеющую структуру 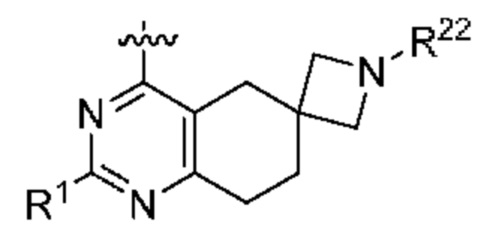 или
или 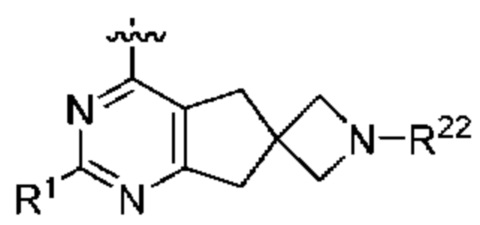 , где R22 представляет собой H, C1-6 алкил, 3-6-членный циклоалкил, 3-7-членный гетероциклил, 6-10-членный арил или 5-10-членный гетероарил.
, где R22 представляет собой H, C1-6 алкил, 3-6-членный циклоалкил, 3-7-членный гетероциклил, 6-10-членный арил или 5-10-членный гетероарил.
[00132] В определенных вариантах осуществления R2 представляет собой 3-14-членный гетероциклил, где 3-14-членный гетероциклил необязательно замещен C1-6 алкилом, необязательно замещенным -OR2a, -ОН, -OR2a, оксо, =N, галогеном, C(O)R2a, -C(OO)R2a, -C(O)NR2bR2c, -CN, -NR2bR2c, 3-6-членным циклоалкилом, 3-7-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом; где R2a представляет собой Н, С1-6 алкил, C1-6 галогеналкил, 3-7-членный гетероциклил или -(СН2)rOCH3, где r равное 1, 2 или 3; где R2b представляет собой Н или С1-6 алкил; и где R2c представляет собой Н или С1-6 алкил.
[00133] В определенных вариантах осуществления R2 представляет собой 3-14-членный гетероциклил, причем 3-14-членный гетероциклил необязательно замещен С1-6 алкилом, ОН, галогеном, -C(O)R2a или -C(O)NR2bR2c; где R2a представляет собой C1-6 алкил или -(СН2)rOCH3, где r равно 1, 2 или 3; где R2b представляет собой Н или С1-6 алкил; и где R2c представляет собой Н или C1-6 алкил.
[00134] В некоторых вариантах осуществления R2 выбран из 
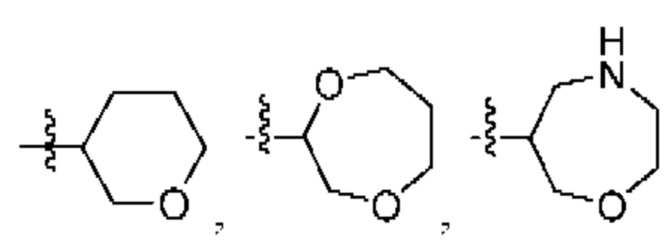 и
и 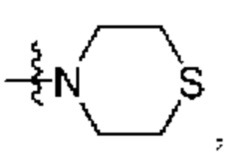 каждый из которых может быть необязательно замещен, например, в любом атоме углерода, азота или серы.
каждый из которых может быть необязательно замещен, например, в любом атоме углерода, азота или серы.
[00135] В некоторых вариантах осуществления R2 выбран из 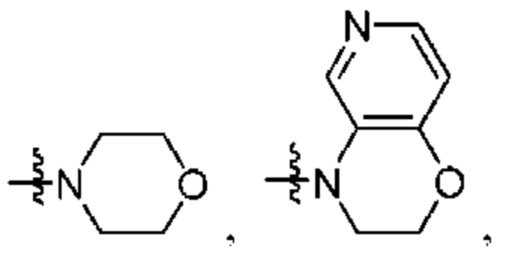
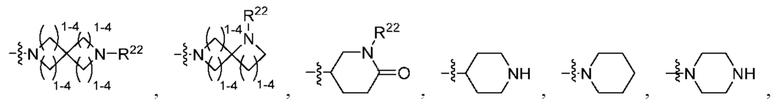
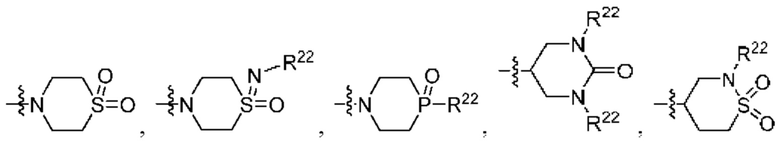 и
и 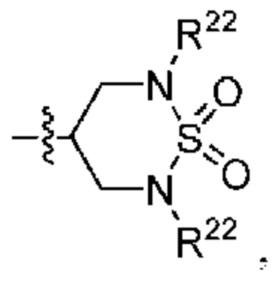 где R22 представляет собой Н, С1-6 алкил, 3-6-членный циклоалкил, 3-7-членный гетероциклил, 6-10-членный ар ил или 5-10-членный гетероарил.
где R22 представляет собой Н, С1-6 алкил, 3-6-членный циклоалкил, 3-7-членный гетероциклил, 6-10-членный ар ил или 5-10-членный гетероарил.
[00136] В некоторых вариантах осуществления R2 выбран из 
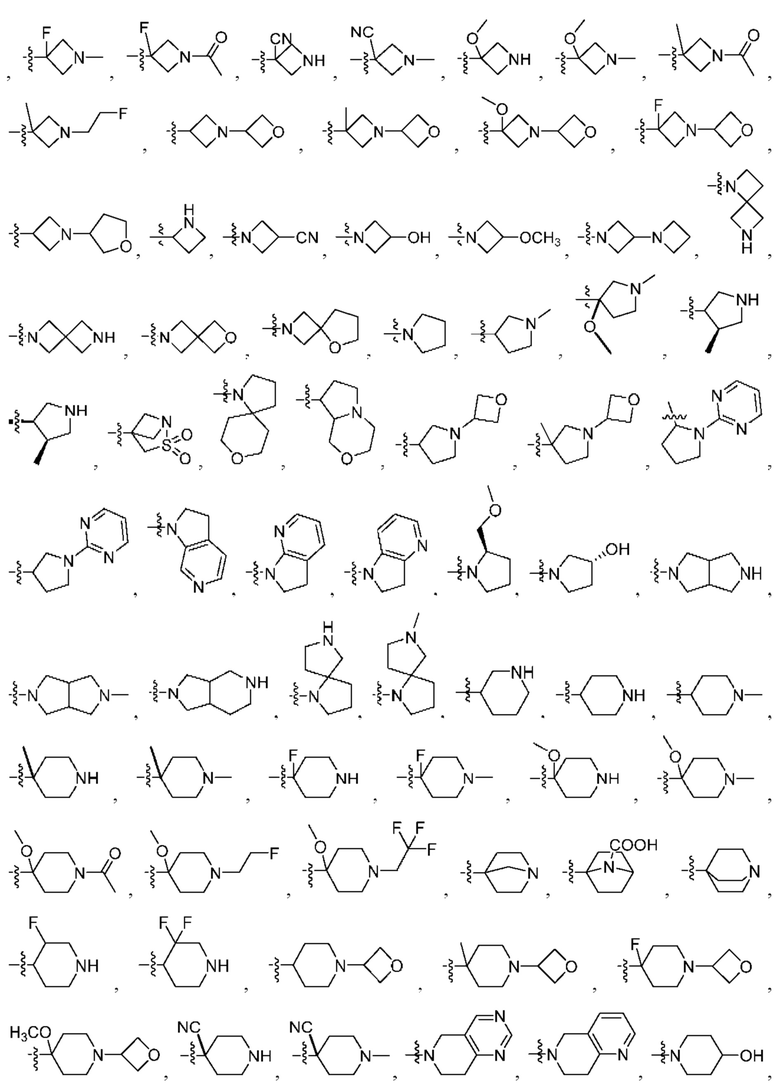
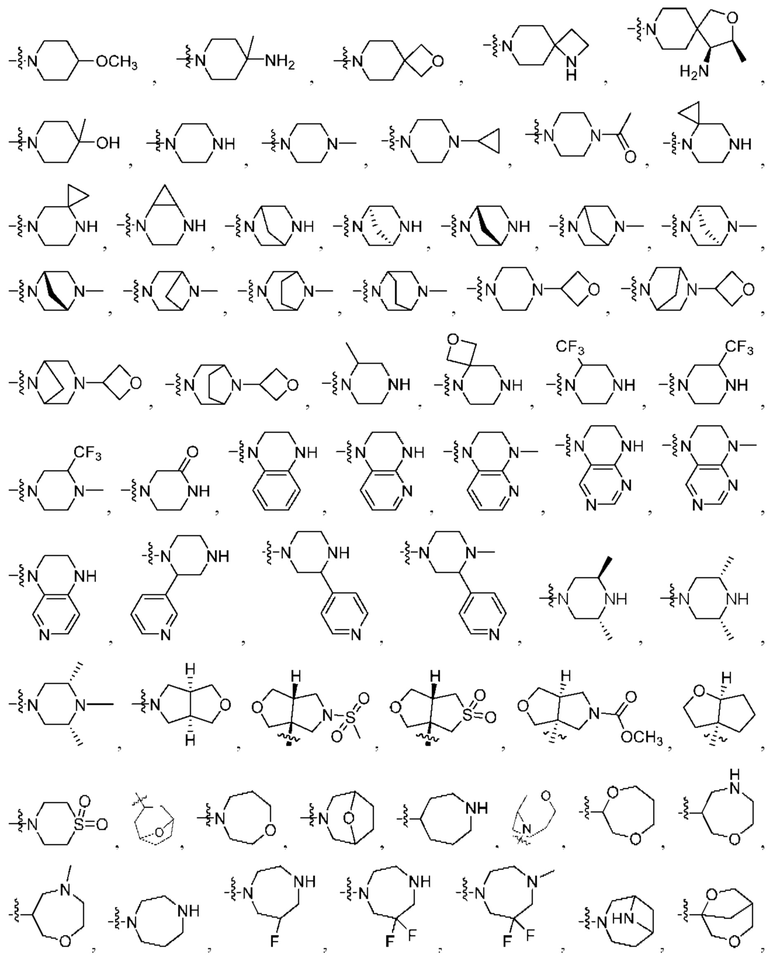
 и
и 
[00137] В некоторых вариантах осуществления R2 выбран из 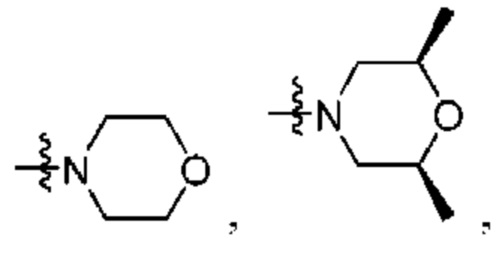
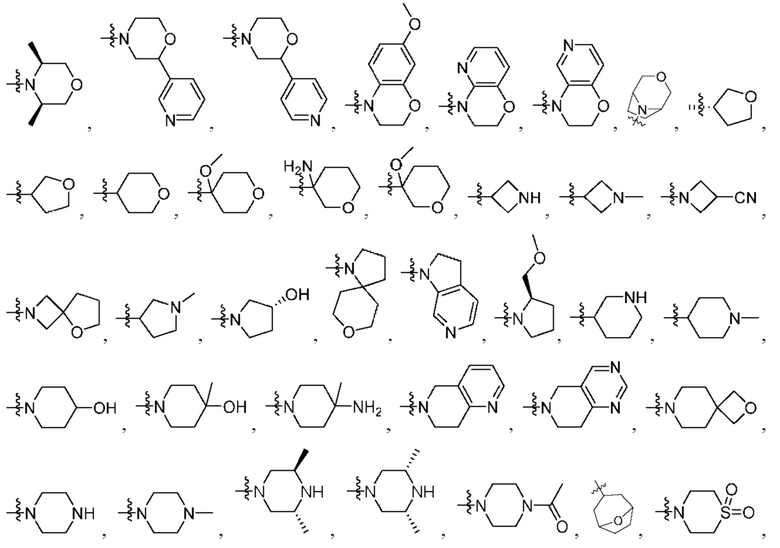
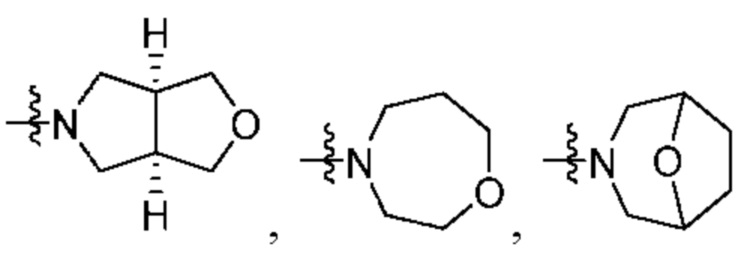 и
и 
[00138] В определенных вариантах осуществления R2 представляет собой 5-10-членный гетероарил, где 5-10-членный гетероарил необязательно замещен С1-6 алкилом, необязательно замещенным -OR2a, -ОН, -OR2a, оксо, галогеном, -C(O)R2a, -C(OO)R2a, -C(O)NR2bR2c, -CN, -NR2bR2c, 3-6-членным циклоалкилом, 3-7-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом; где R2a представляет собой Н, C1-6 алкил, C1-6 галогеналкил, 3-7-членный гетероциклил или -(СН2)rOCH3, где r равное 1, 2 или 3; где R2b представляет собой Н или C1-6 алкил; и где R2c представляет собой Н или С1-6 алкил.
[00139] В определенных вариантах осуществления R2 представляет собой 5-10-членный гетероарил, причем 5-10-членный гетероарил необязательно замещен C1-6 алкилом, -OH, галогеном, -C(O)R2a или -C(O)NR2bR2c; где R2a представляет собой С1-6 алкил или -(СН2)rOCH3, где r равно 1, 2 или 3; где R2b представляет собой Н или C1-6 алкил; и где R2c представляет собой Н или C1-6 алкил.
[00140] В некоторых вариантах осуществления R2 выбран из 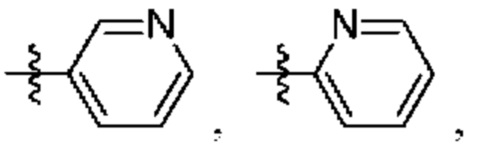
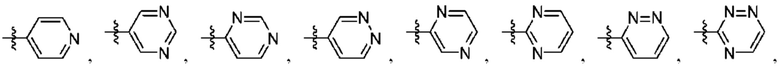
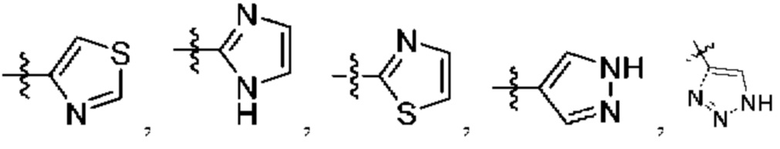 и
и  каждый из которых может быть замещен, например, в атоме углерода, атоме азота или атоме серы. 5-10-членным гетероарил может быть моноциклическим или полициклическим, включая конденсированные кольца с арильным, гетероарильным, циклоалкильным или гетероциклильным кольцами.
каждый из которых может быть замещен, например, в атоме углерода, атоме азота или атоме серы. 5-10-членным гетероарил может быть моноциклическим или полициклическим, включая конденсированные кольца с арильным, гетероарильным, циклоалкильным или гетероциклильным кольцами.
[00141] В некоторых вариантах осуществления R2 выбран из 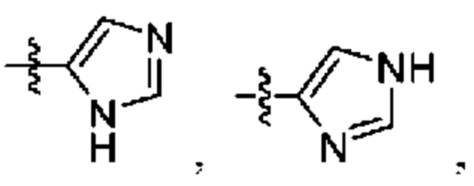
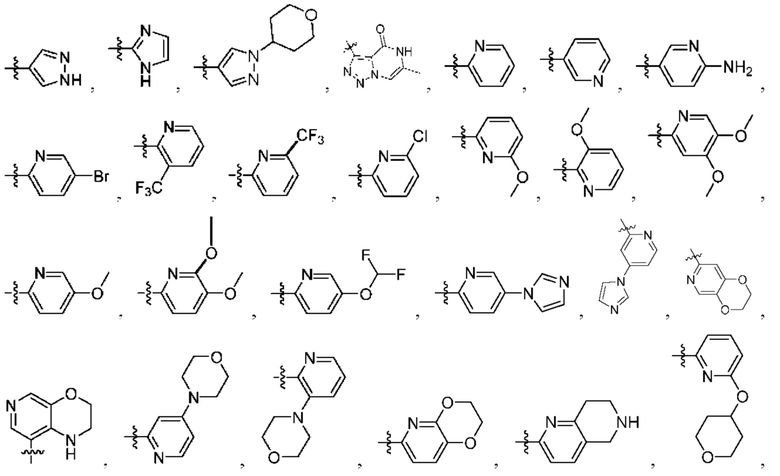
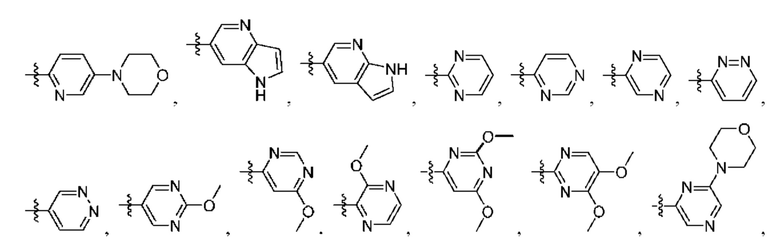
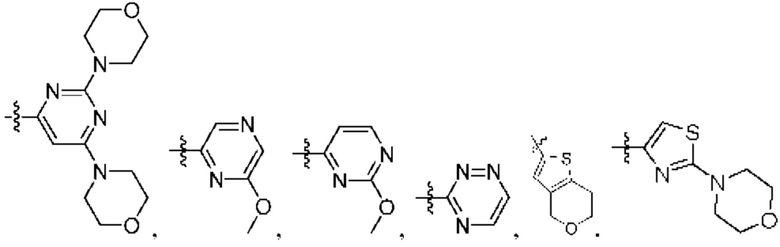 и
и 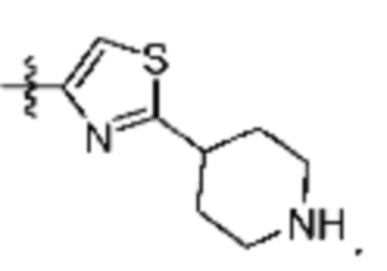
[00142] В определенных вариантах осуществления R2 представляет собой 6-10-членный арил, где 6-10-членный арил необязательно замещен С1-6 алкилом, необязательно замещенным -OR2a, -ОН, -OR2a, оксо, галогеном, -C(O)R2a, -C(OO)R2a, -C(O)NR2bR2c, -CN, -NR2bR2c, 3-6-членным циклоалкилом, 3-7-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом; где R2a представляет собой Н, C1-6 алкил, C1-6 галогеналкил, 3-7-членный гетероциклил или -(CH2)rOCH3, где r равное 1, 2 или 3; где R2b представляет собой Н или C1-6 алкил; и где R2c представляет собой Н или C1-6 алкил.
[00143] В определенных вариантах осуществления R2 представляет собой 6-10-членный арил, причем 6-10-членный арил необязательно замещен С1-6 алкилом, -ОН, галогеном, -C(O)R2a или -C(O)NR2bR2c; где R2a представляет собой C1-6 алкил или -(СН2)rOCH3, где r равно 1, 2 или 3; где R2b представляет собой Н или С1-6 алкил; и где R2c представляет собой Н или С1-6 алкил.
[00144] В некоторых вариантах осуществления R2 представляет собой фенильное кольцо, которое является необязательно замещенным. Фенильное кольцо может содержать конденсированное кольцо, в том числе с гетероарильным, гетероциклильным и циклоалкильным кольцами. В некоторых вариантах осуществления R2 выбран из 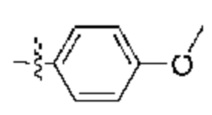
 и
и 
[00145] В определенных вариантах осуществления R2 представляет собой 3-14-членный циклоалкил, где 3-14-членный циклоалкил необязательно замещен С1-6 алкилом, необязательно замещенным -OR2a, -ОН, -OR2a, оксо, галогеном, -C(O)R2a, -C(OO)R2a, -C(O)NR2bR2c, -CN, -NR2bR2c, 3-6-членным циклоалкилом, 3-7-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом; где R2a представляет собой Н, С1-6 алкил, C1-6 галогеналкил, 3-7-членный гетероциклил или -(СН2)rOCH3, где r равное 1, 2 или 3; где R2b представляет собой Н или С1-6 алкил; и где R2c представляет собой Н или С1-6 алкил.
[00146] В определенных вариантах осуществления R2 представляет собой 3-14-членный циклоалкил, причем 3-14-членный циклоалкил необязательно замещен C1-6 алкилом, -ОН, галогеном, -C(O)R или -C(O)NR2bR2c; где R2a представляет собой С1-6 алкил или (CH2)rOCH3, где r равно 1, 2 или 3; где R2b представляет собой Н или C1-6 алкил; и где R2c представляет собой Н или С1-6 алкил.
[00147] В некоторых вариантах осуществления R2 выбран из циклопропила, циклобутила, циклопентила и циклогексила, каждый из которых необязательно замещен. Циклоалкил может содержать конденсированное кольцо, в том числе с арильным (например, 6-10-членным арильным), гетероарильным (например, 5-10-членным гетероарильным), гетероциклильным (например, 3-14-членным гетероциклильным) и циклоалкильным (например, 3-8-членным циклоалкильным) кольцами.
[00148] В некоторых вариантах осуществления R2 выбран из 
 и
и 
[00149] В некоторых вариантах осуществления R2 выбран из 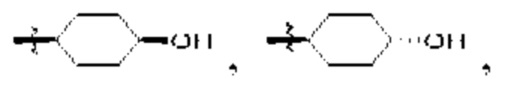
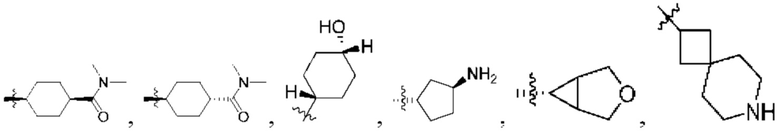 и
и 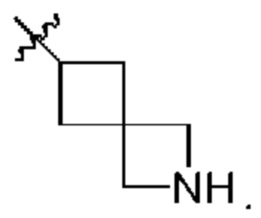
[00150] В определенных вариантах осуществления R2 представляет собой 3-14-членный циклоалкенил, где 3-14-членный циклоалкенил необязательно замещен C1-6 алкилом, необязательно замещенным -OR2a, -ОН, -OR2a, оксо, галогеном, -C(O)R2a, -C(OO)R2a, -C(O)NR2bR2c, -CN, -NR2bR2c, 3-6-членным циклоалкилом, 3-7-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом; где R2a представляет собой Н, С1-6 алкил, C1-6 галогеналкил, 3-7-членный гетероциклил или -(СН2)rOCH3, где r равное 1, 2 или 3; где R2b представляет собой Н или С1-6 алкил; и где R2c представляет собой Н или С1-6 алкил.
[00151] В определенных вариантах осуществления R2 представляет собой 3-14-членный циклоалкенил, причем 3-14-членный циклоалкенил необязательно замещен C1-6 алкилом, -ОН, галогеном, -C(O)R2a или -C(O)NR2bR2c; где R2a представляет собой С1-6 алкил или -(СН2)rOCH3, где r равно 1, 2 или 3; где R2b представляет собой Н или С1-6 алкил; и где R2c представляет собой Н или С1-6 алкил.
[00152] В определенных вариантах осуществления L2 представляет собой связь, a R2 представляет собой Н.
[00153] В некоторых вариантах осуществления R3 и R4 независимо представляют собой Н или C1-6 алкил, необязательно замещенный галогеном или -ОН; где по меньшей мере один из R3 и R4 представляет собой Н или где R3 и R4 вместе с атомом, к которому они присоединены, в совокупности образуют 3-6-членный циклоалкил.
[00154] В некоторых вариантах осуществления R3 и R4 независимо выбраны из группы, состоящей из Н и С1-6 алкила; где по меньшей мере один из R3 и R4 не представляет собой Н; или R3 и R4 вместе с атомом, к которому они присоединены, в совокупности образуют 3-6-членный циклоалкил.
[00155] В определенных вариантах осуществления R3 представляет собой Н. В определенных вариантах осуществления R3 представляет собой C1-6 алкил, такой как C1 алкил, С2 алкил, С3 алкил, С4 алкил, С5 алкил или С6 алкил.
[00156] В определенных вариантах осуществления R4 представляет собой Н. В определенных вариантах осуществления R4 представляет собой C1-6 алкил, такой как C1 алкил, С2 алкил, С3 алкил, С4 алкил, С5 алкил или С6 алкил.
[00157] В определенных вариантах осуществления R3 представляет собой Н, a R4 представляет собой С1-6 алкил, такой как C1 алкил, С2 алкил, С3 алкил, С4 алкил, С5 алкил или С6 алкил.
[00158] В определенных вариантах осуществления R3 и R4 вместе с атомом, к которому они присоединены, в совокупности образуют 3-6-членный циклоалкил, такой как 3-, 4-, 5-или 6-членный циклоалкил.
[00159] В некоторых вариантах осуществления R5, R6, R7, R8 и R9 независимо выбраны из группы, состоящей из Н, D, С1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -ОН, галогена, NO2, -CN, -NR11R12, -SR10, -S(O)2NR11R12, -S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, -C(O)R10 и -CO2R10, где каждый C1-6 алкил, C2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен -OH, галогеном, -NO2, оксо, -CN, -R10, -OR10, -NR11R12, -SR10, -S(O)2NR11R12, -S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, 3-8-членным циклоалкилом, 3-14-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом.
[00160] В некоторых вариантах осуществления R5, R6, R7, R8 и R9 независимо выбраны из группы, состоящей из Н, D, С1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, -ОН, галогена, -NO2, -CN, -NR11R12, -SR10, -S(O)2NR11R12, -S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, -C(O)R10 и -CO2R10, где каждый C1-6 алкил, С2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил и 3-8-членный циклоалкил независимо необязательно замещен -ОН, галогеном, -NO2, оксо, -CN, -R10, -R10, -NR11R12, -SR10, S(O)2NR11R12, -S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, 3-14-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом.
[00161] В некоторых вариантах осуществления любые два смежных R5, R6, R7, R8 и R9 образуют 3-14-членное конденсированное кольцо, или 3-10-членное конденсированное кольцо, или 3-6-членное конденсированное кольцо. Другими словами, в некоторых вариантах осуществления группа А представляет собой конденсированную бициклическую группу, содержащую 18 кольцевых атомов или меньше, 14 кольцевых атомов или меньше или 10 кольцевых атомов или меньше. Слитое кольцо может представлять собой 3-8-членный циклоалкил, 4-8-членный циклоалкенил, 3-14-членный гетероциклил или 3-8-членный гетероарил. В некоторых вариантах осуществления бициклическое кольцо необязательно замещено одним тремя заместителями, выбранными из C1-6 алкила, необязательно замещенного -ОН, -ОН, галогеном, -NO2, оксо, -CN, -R10, -OR10, -NR11R12, -SR10, -S(O)2NR11R12, -S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, 3-14-членным гетероциклилом, 6-10-членным арилом или 5-10-членным гетероарилом.
[00162] В некоторых вариантах осуществления R10, R11 и R12 в каждом случае независимо выбраны из Н, D, С1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, -OR13, -SR13, галогена, -NR13R14, NO2 и -CN.
[00163] В некоторых вариантах осуществления R13 и R14 в каждом случае независимо выбраны из Н, D, С1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила и 3-14-членного гетероциклила, где каждый С1-6 алкил, С2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил независимо необязательно замещен -ОН, -SH, -NH2, -NO2 или -CN.
[00164] В определенных вариантах осуществления от одного до трех из R5, R6, R7, R8 и R9 представляют собой С1-6 алкил, необязательно замещенный галогеном. В определенных вариантах осуществления от одного до трех из R5, R6, R7, R8 и R9 представляют собой CF3. В определенных вариантах осуществления от одного до трех из R5, R6, R7, R8 и R9 представляют собой CHF2.
[00165] В определенных вариантах осуществления от одного до трех из R5, R6, R7, R8 и R9 представляют собой С1-6 алкил, необязательно замещенный галогеном или -ОН. В определенных вариантах осуществления от одного до трех из R5, R6, R7, R8 и R9 представляют собой С1-6 алкил, необязательно замещенный фтором и -OH.
[00166] В определенных вариантах осуществления от одного до трех из R5, R6, R7, R8 и R9 представляют собой галоген, а от одного до трех из R5, R6, R7, R8 и R9 представляют собой C1-6 алкил, необязательно замещенный галогеном. В определенных вариантах осуществления от одного до трех из R5, R6, R7, R8 и R9 представляют собой фтор, а от одного до трех из R5, R6, R7, R8 и R9 представляют собой С1-6 алкил, необязательно замещенный фтором.
[00167] В определенных вариантах осуществления от одного до трех из R5, R6, R7, R8 и R9 представляют собой -NH2.
[00168] В определенных вариантах осуществления от одного до трех из R5, R6, R7, R8 и R9 представляют собой -NH2; а один из R5, R6, R7, R8 и R9 представляет собой C1-6 алкил, необязательно замещенный галогеном. В определенных вариантах осуществления от одного до трех из R5, R6, R7, R8 и R9 представляют собой -NH2; а один из R5, R6, R7, R8 и R9 представляет собой CF3.
[00169] В некоторых вариантах осуществления А выбран из:
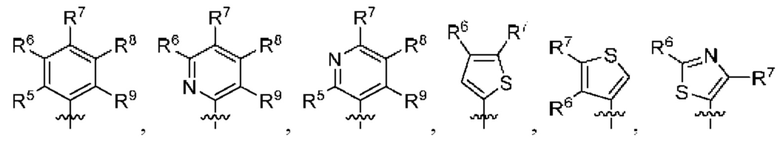 и
и 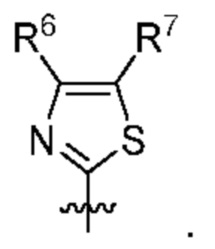
[00170] В некоторых вариантах осуществления А выбран из:
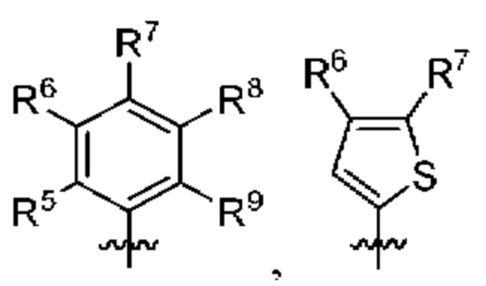 и
и 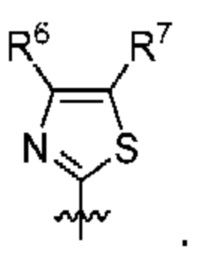
[00171] В некоторых вариантах осуществления А выбран из:
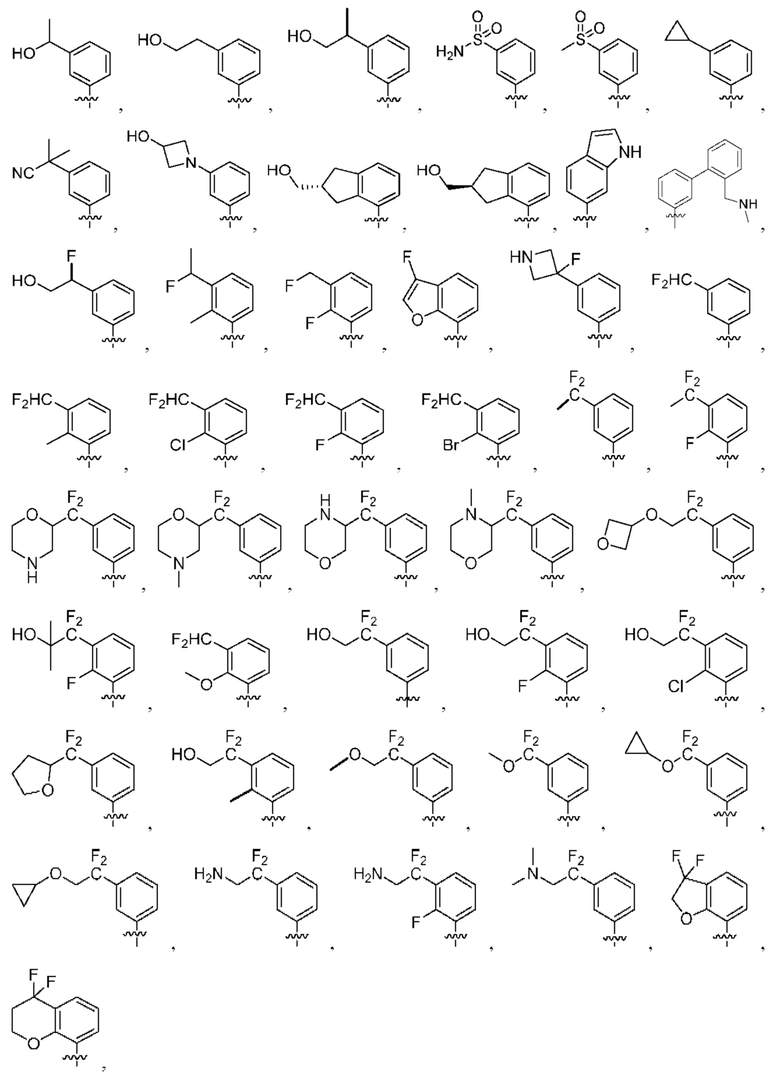
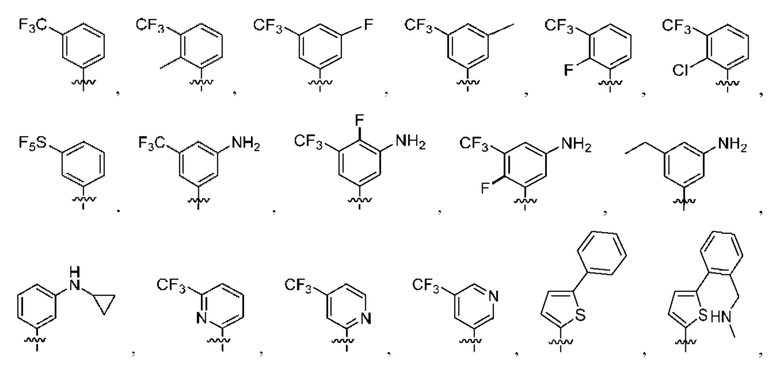
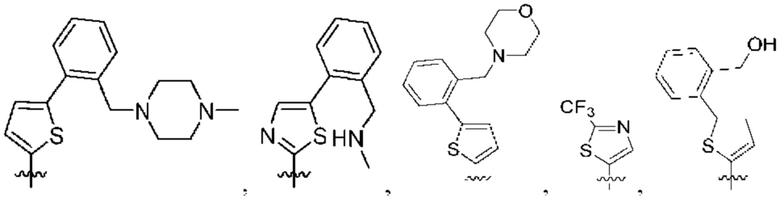 и
и 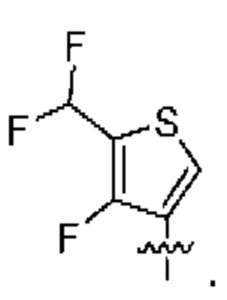
[00172] В некоторых вариантах осуществления А выбран из:
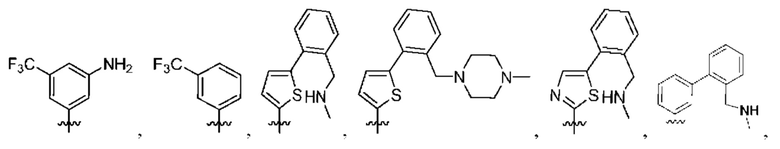
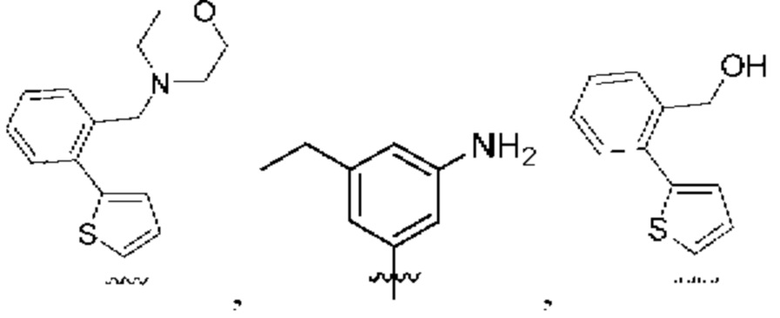 и
и 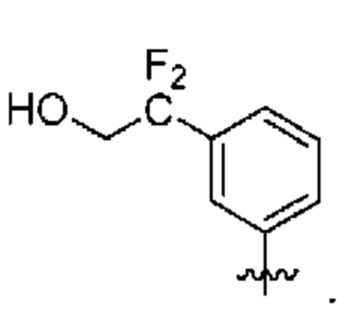
[00173] В некоторых вариантах осуществления соединение формулы (I-а) или (V-a) или его фармацевтически приемлемая соль, сольват, стереоизомер или таутомер, имеет одну, две, три или более из следующих характеристик:
a) 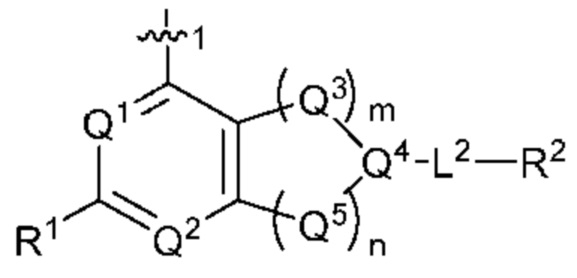 выбрано из группы, состоящей из
выбрано из группы, состоящей из 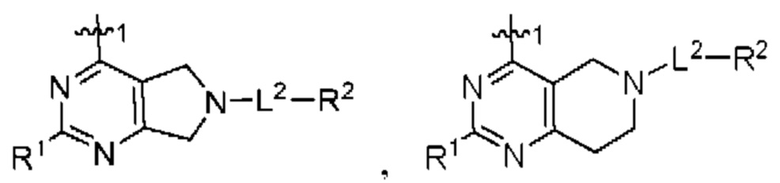 и
и 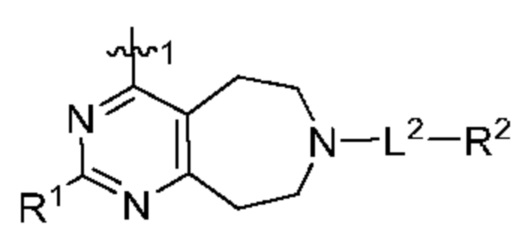 , где 1 представляет точку присоединения кольца А к атому азота;
, где 1 представляет точку присоединения кольца А к атому азота;
b) R3 представляет собой Н, a R4 представляет собой С1-6 алкил;
c) L2 представляет собой связь или -С(О)-;
d) R2 представляет собой необязательно замещенный циклоалкил (например, 3-8-членный циклоалкил), необязательно замещенный циклоалкенил (например, 4-8-членный циклоалкенил) или необязательно замещенный гетероциклил (например, 3-14-членный гетероциклил).
[00174] В некоторых вариантах осуществления соединение формулы (V-a) или его фармацевтически приемлемая соль, сольват, стереоизомер или таутомер, имеет одну, две, три или более из следующих характеристик:
a) 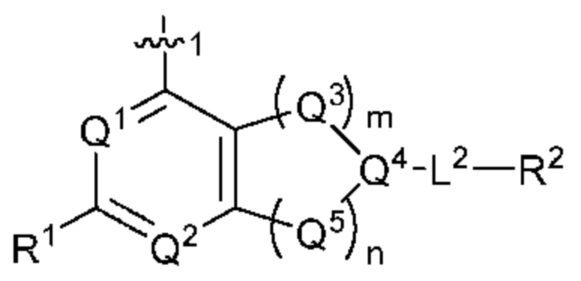 выбрано из группы, состоящей из
выбрано из группы, состоящей из 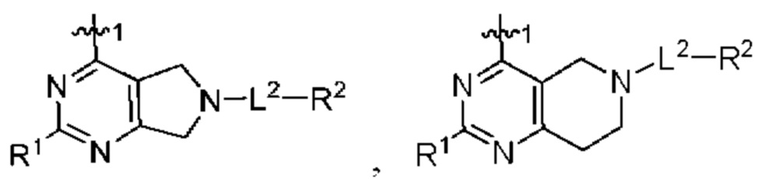 и
и 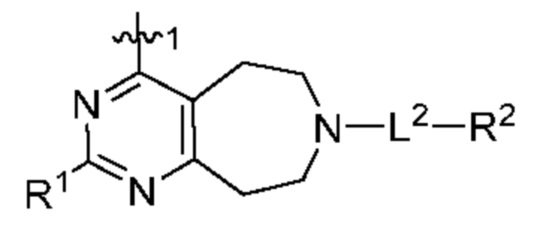 , где 1 представляет точку присоединения кольца А к атому азота;
, где 1 представляет точку присоединения кольца А к атому азота;
b) от одного до трех из R5, R6, R7, R8 и R9 представляют собой C1-6 алкил, причем алкил необязательно замещен одним или более атомами галогена;
c) R3 представляет собой Н, a R4 представляет собой С1-6 алкил;
d) L2 представляет собой связь или -С(О)-;
e) R2 представляет собой необязательно замещенный циклоалкил (например, 3-8-членный циклоалкил), необязательно замещенный циклоалкенил (например, 4-8-членный циклоалкенил) или необязательно замещенный гетероциклил (например, 3-14-членный гетероциклил).
[00175] В настоящем изобретении предложено соединение формулы (I-а), или его фармацевтически приемлемая соль, сольват, изомер, пролекарство или таутомер, которое представляет собой
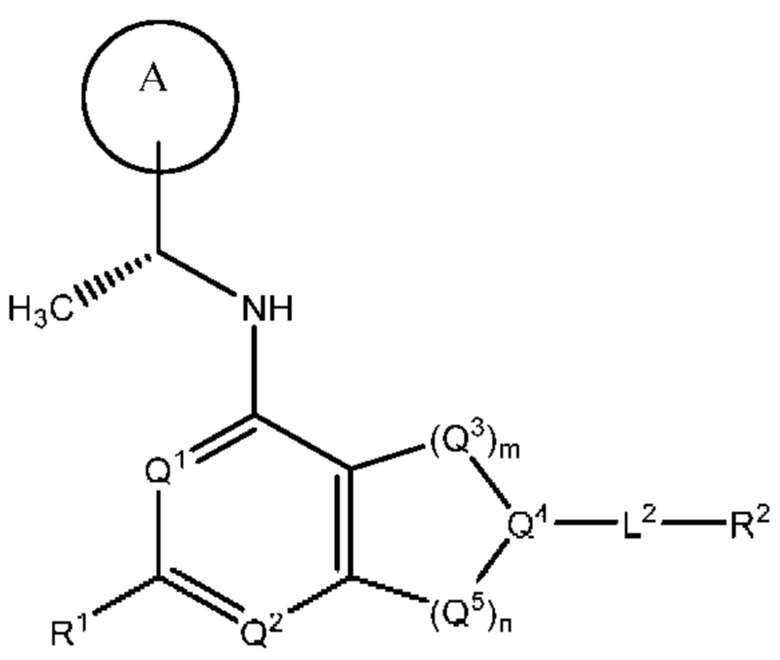
где A, L2, Q1, Q2, Q3, Q4, Q5, R1, R2, m и n соответствуют определению выше.
[00176] В настоящем изобретении предложено соединение формулы (V-a), или его фармацевтически приемлемая соль, сольват, изомер, пролекарство или таутомер, которое представляет собой
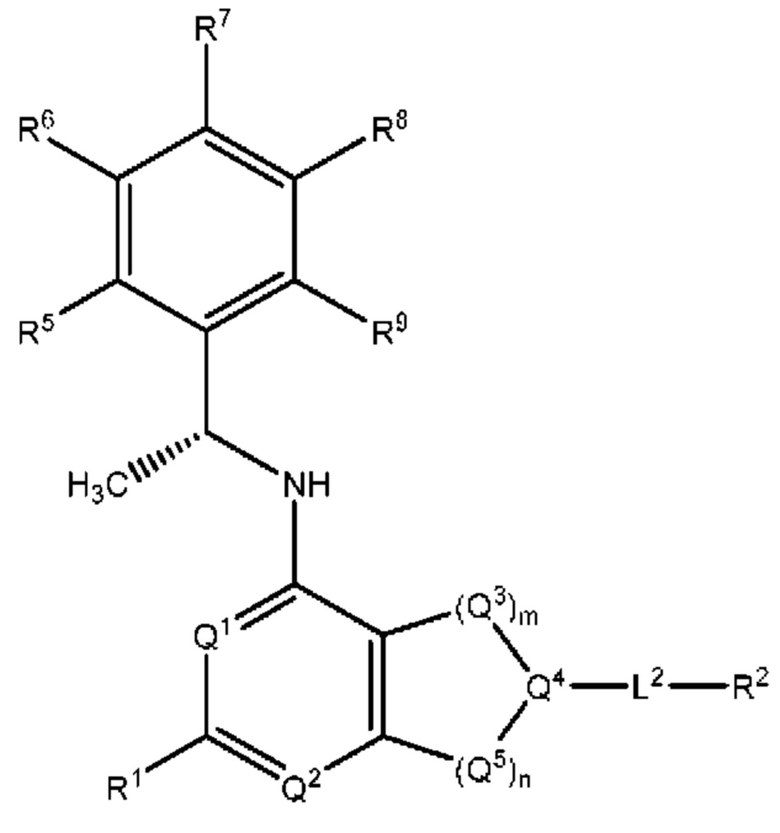
где L2, Q1, Q2, Q3, Q4, Q5, R1, R2, R4, R5, R6, R7, R8, R9, m и n соответствуют определению выше.
[00177] В настоящем изобретении предложены соединения и их фармацевтически приемлемые соли, сольваты, стереоизомеры и таутомеры, выбранные из группы, состоящей из соединений из таблицы А:
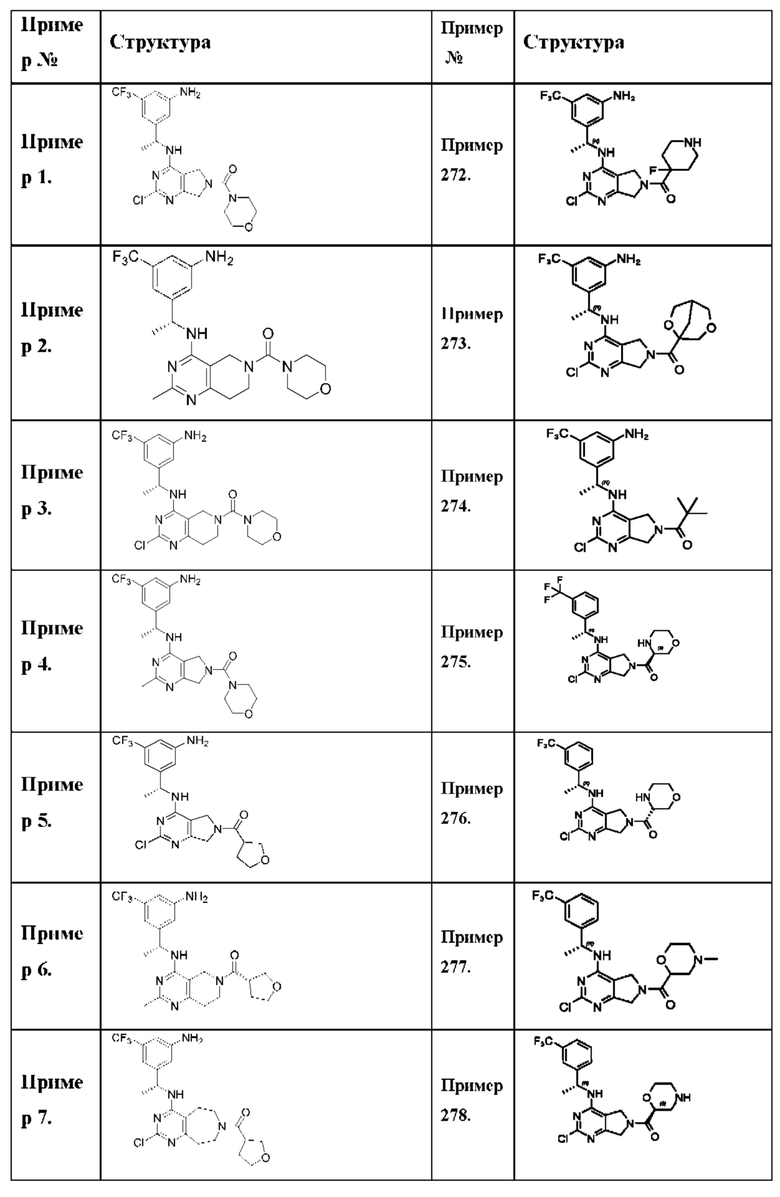
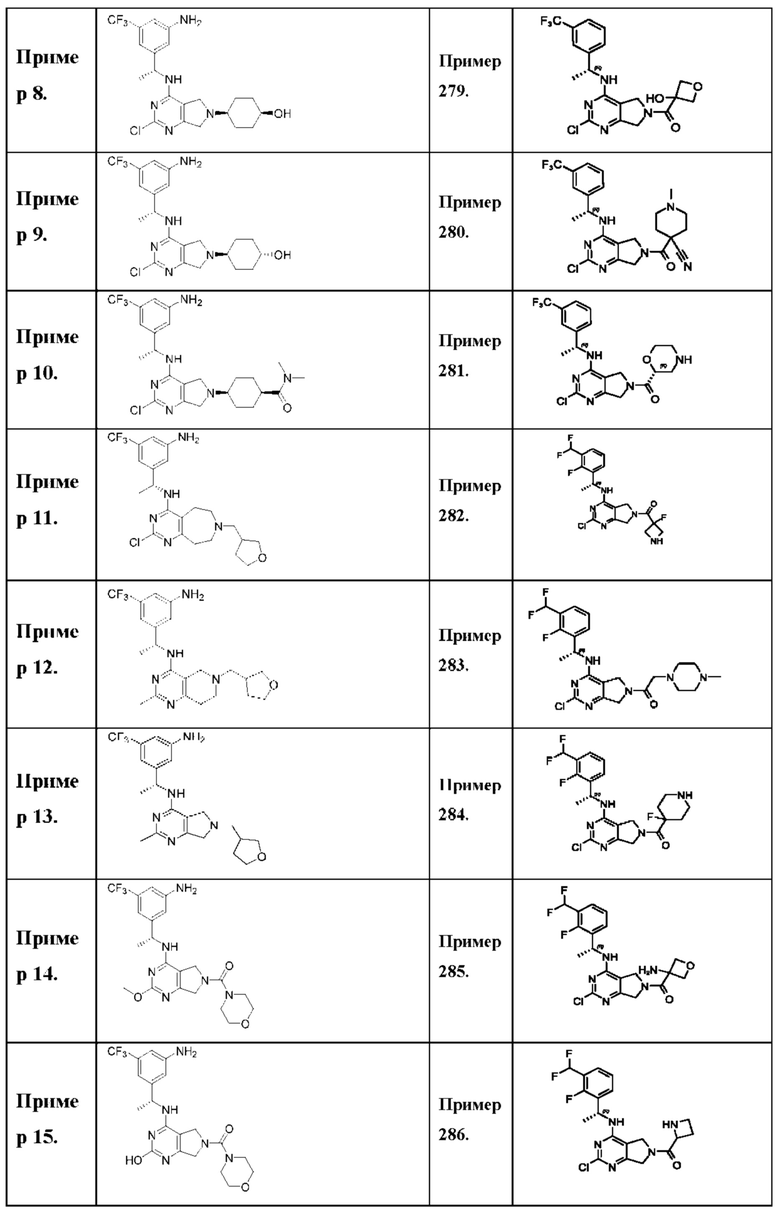
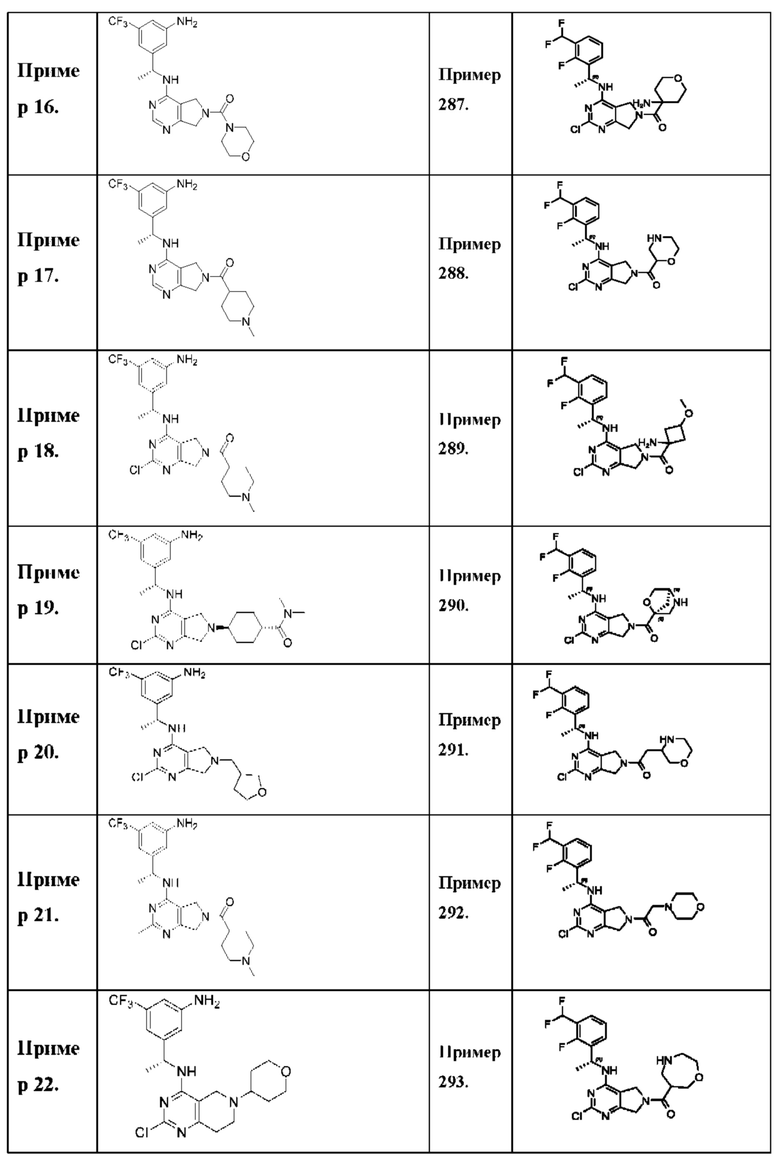
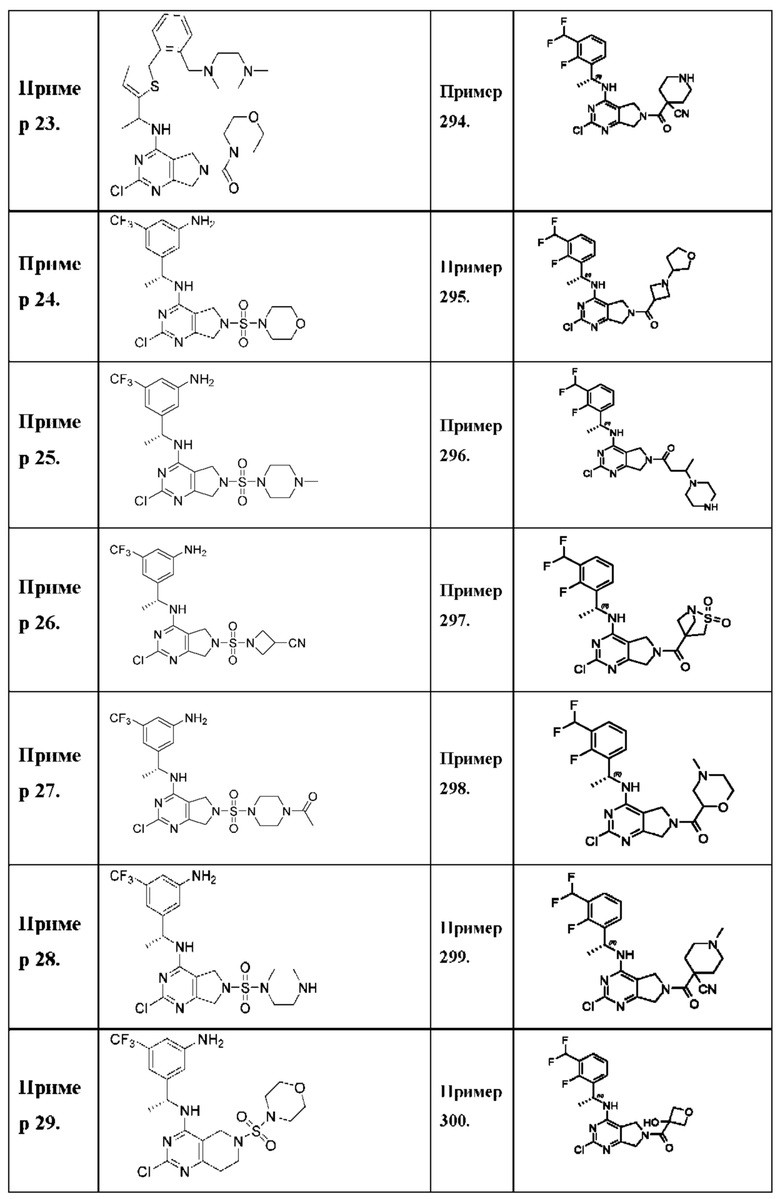
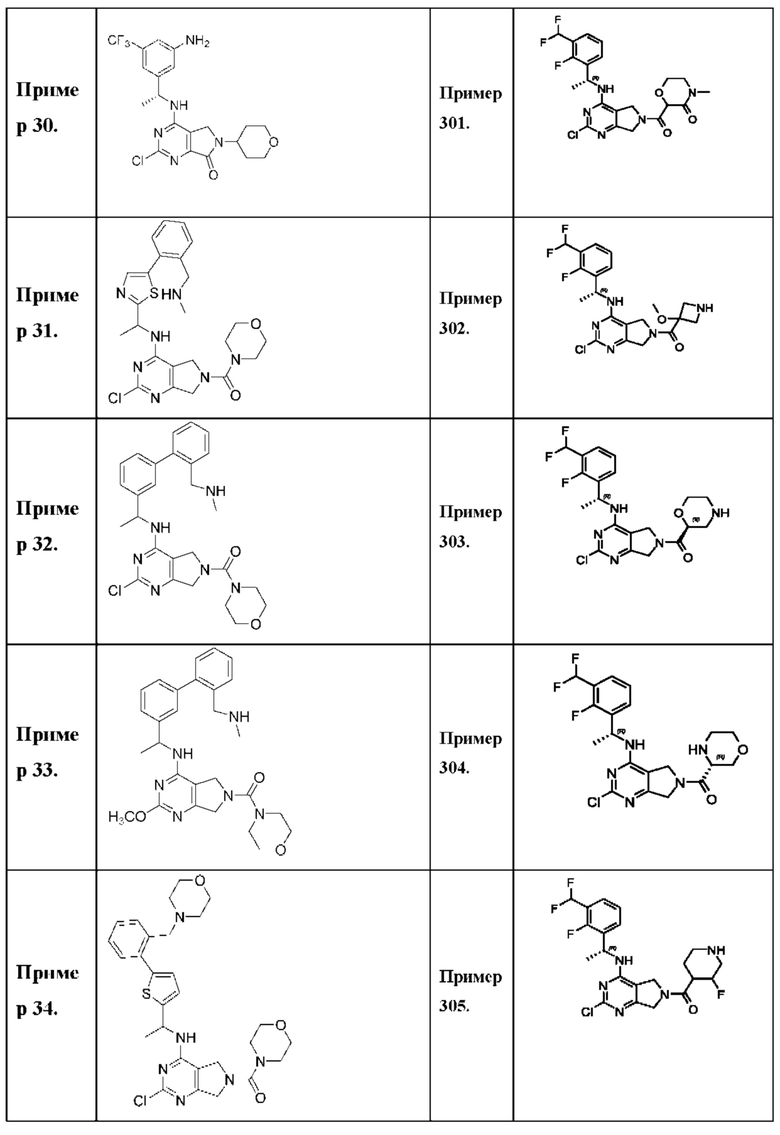
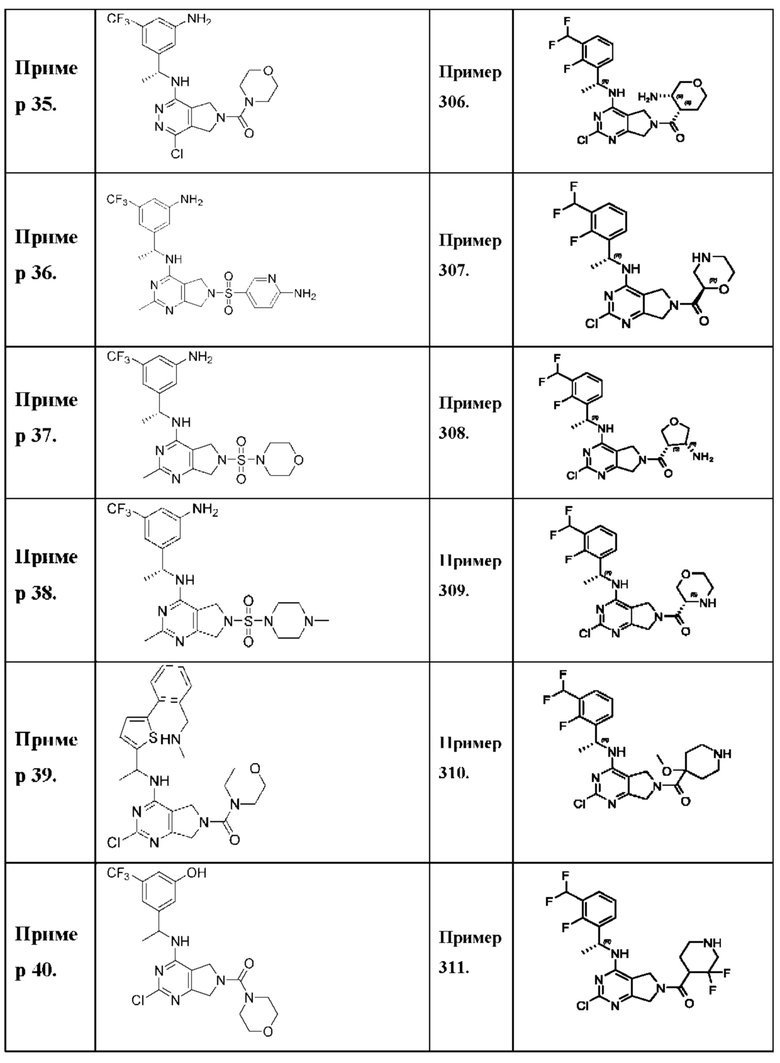
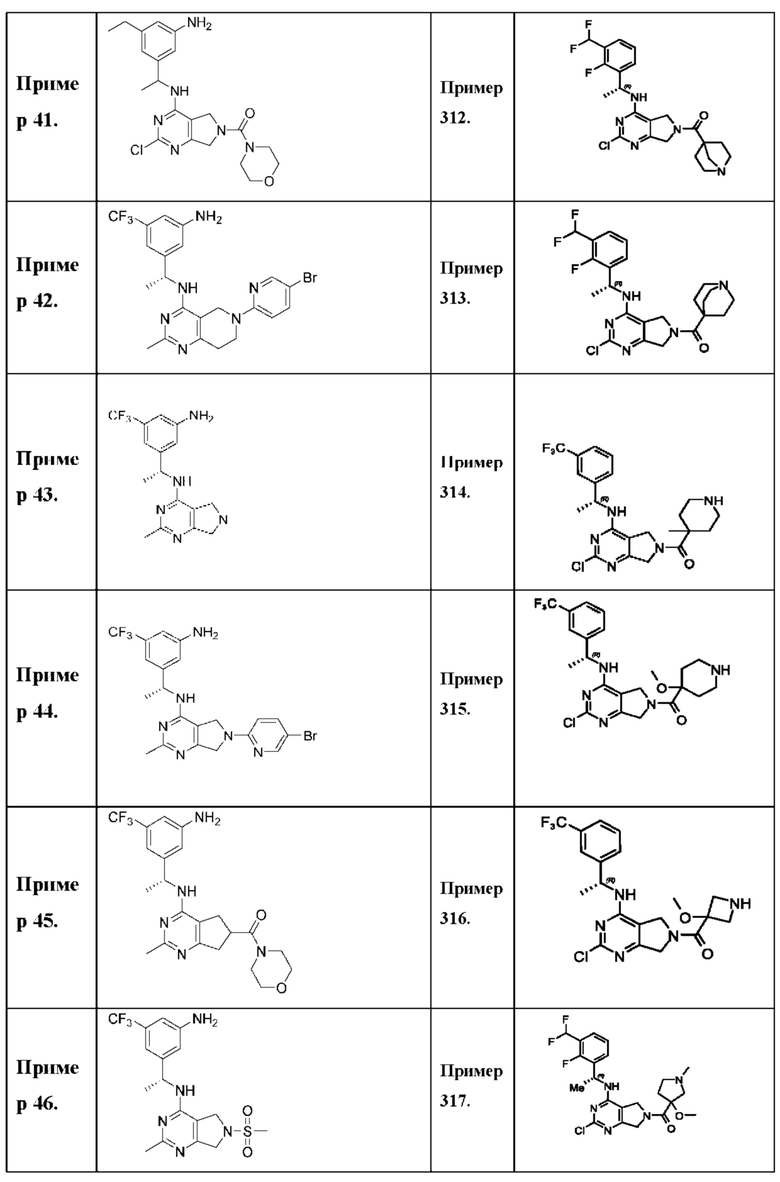
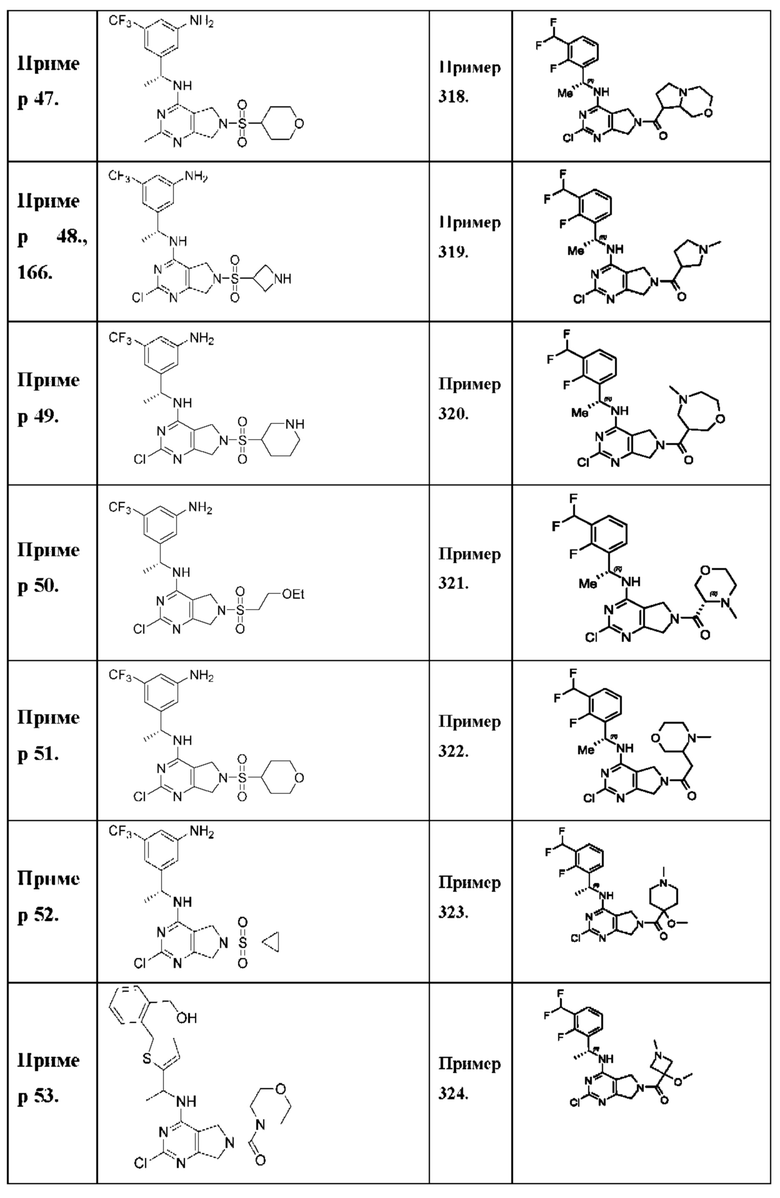
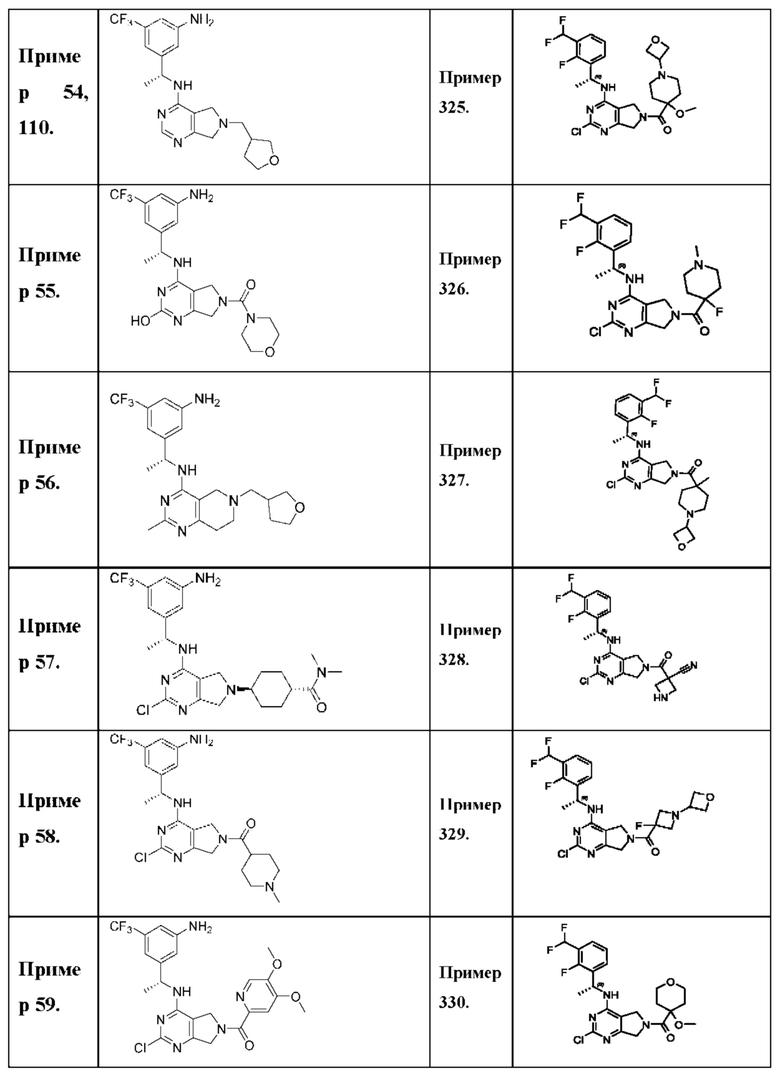
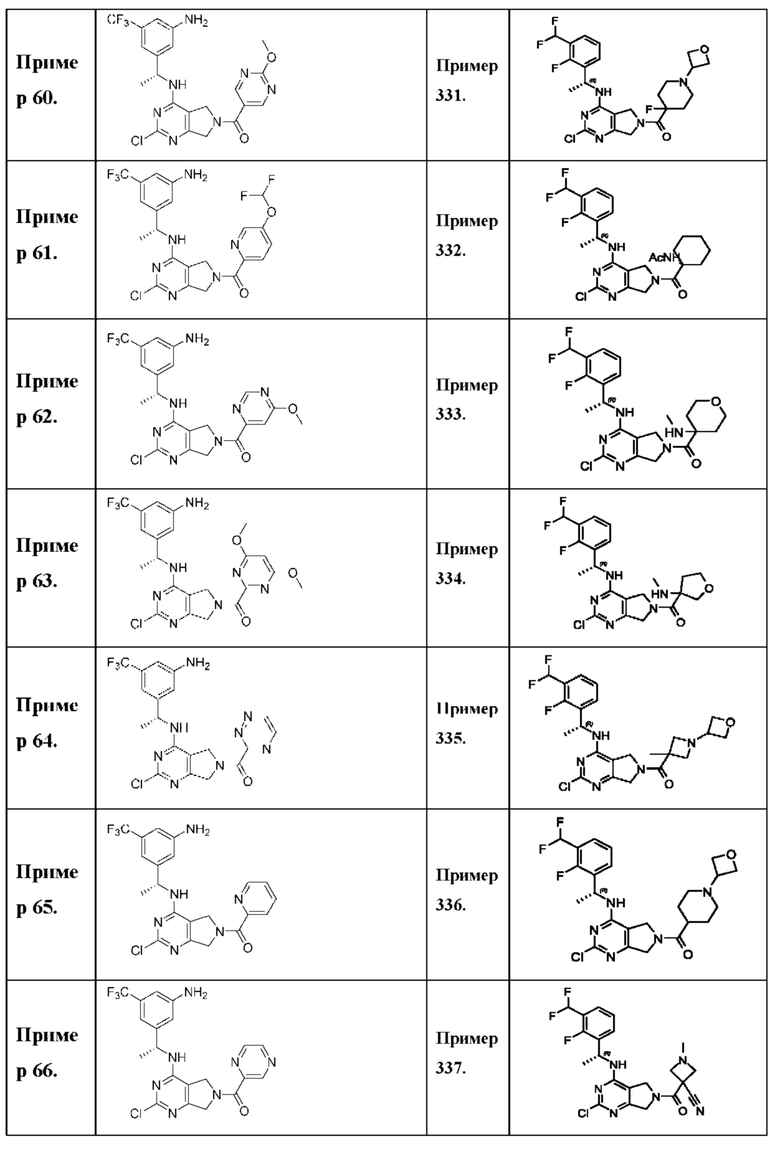
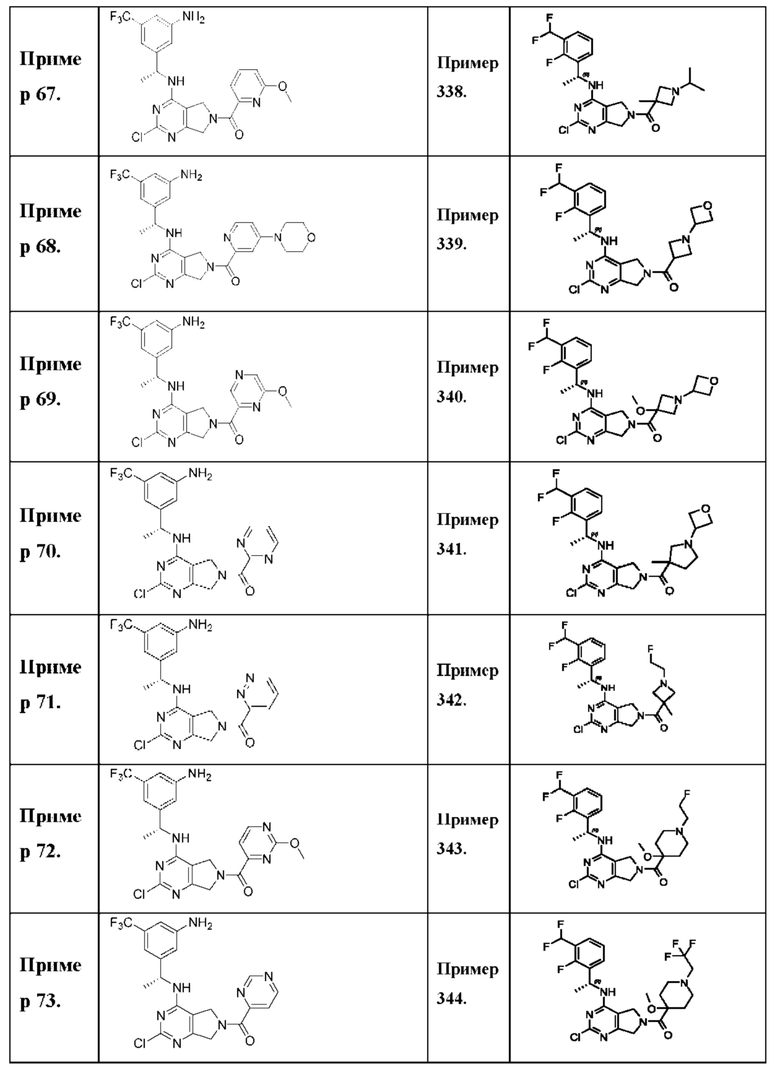
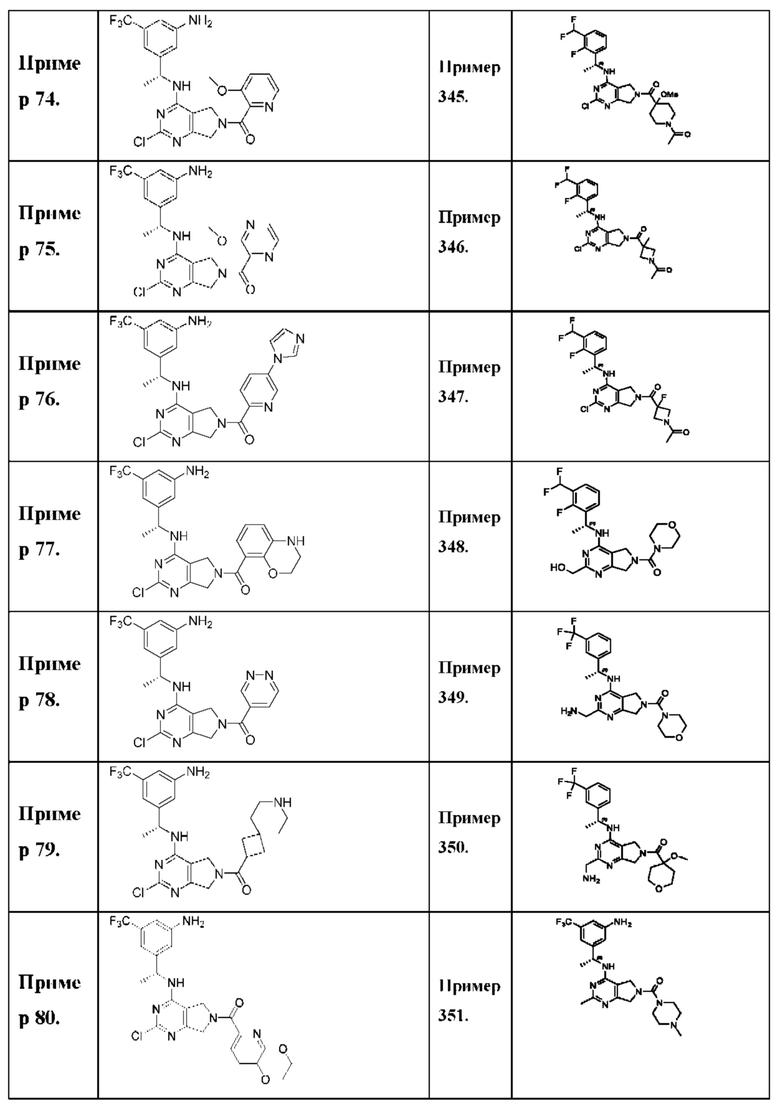
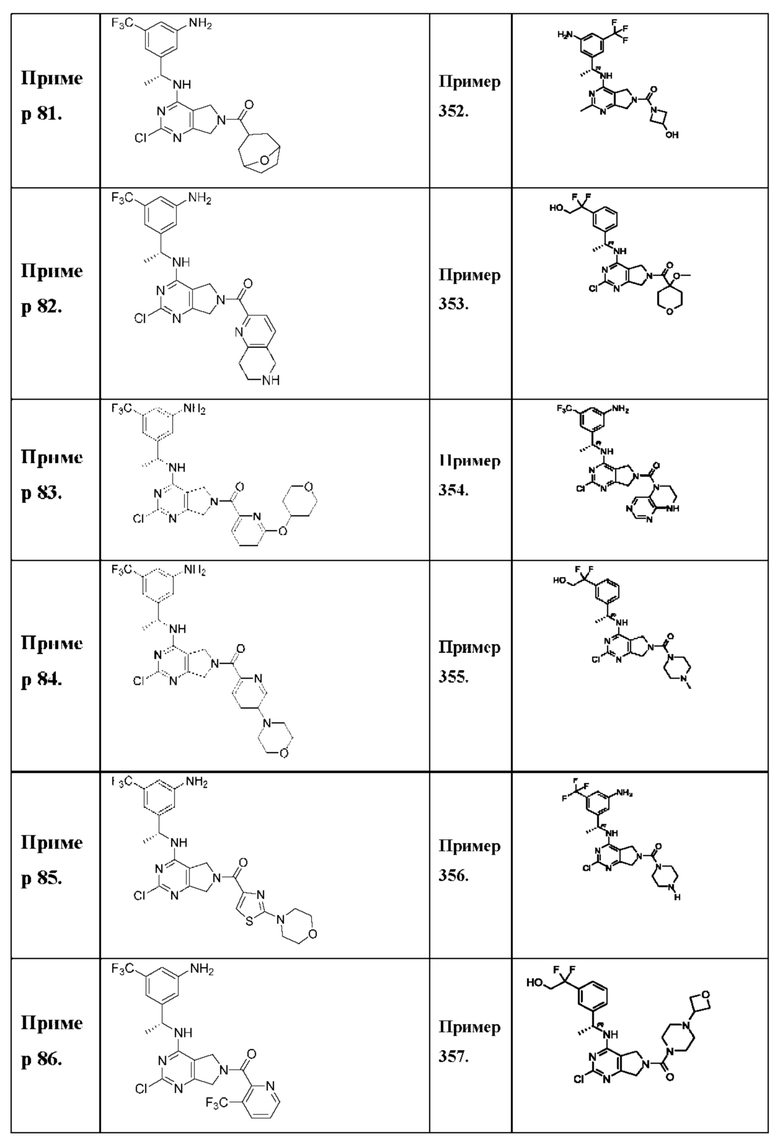
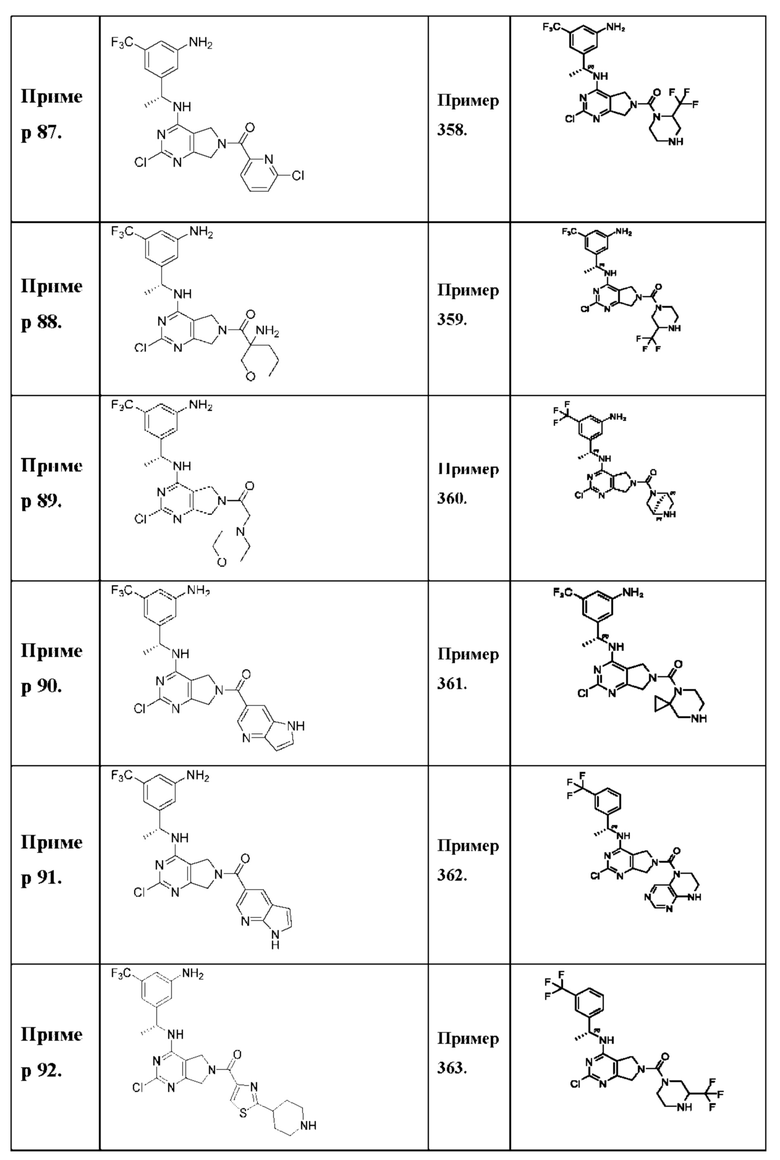
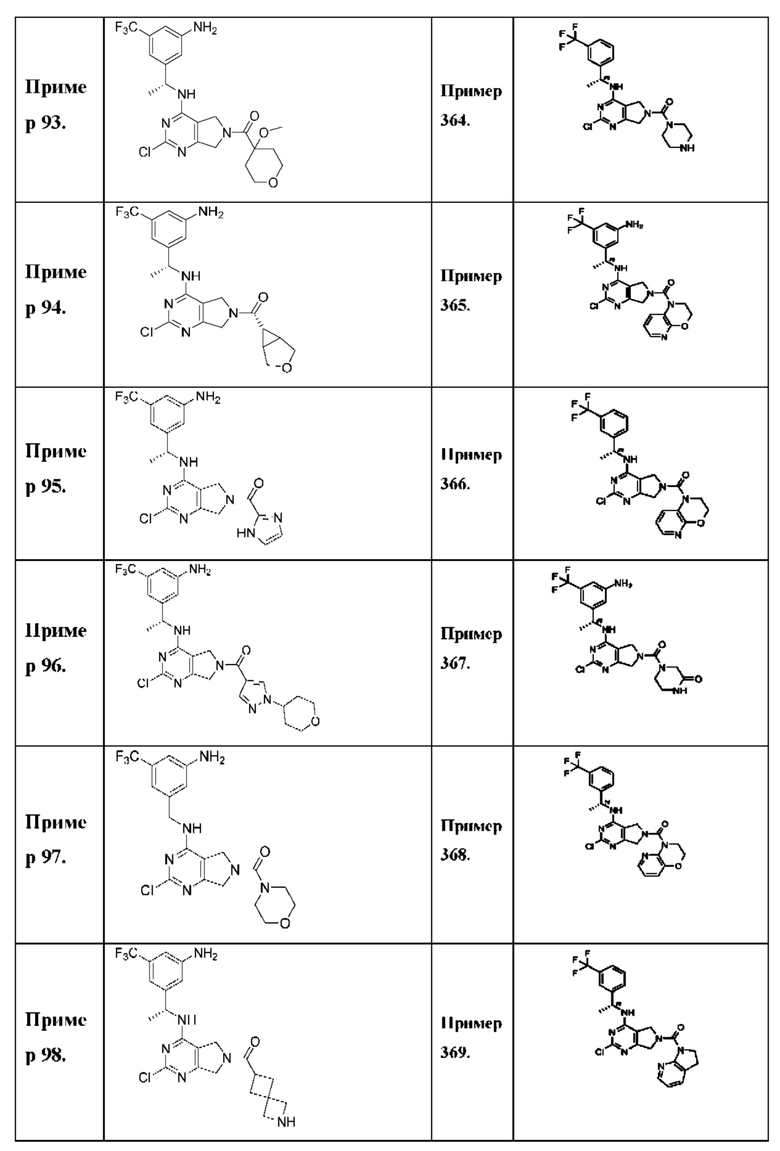
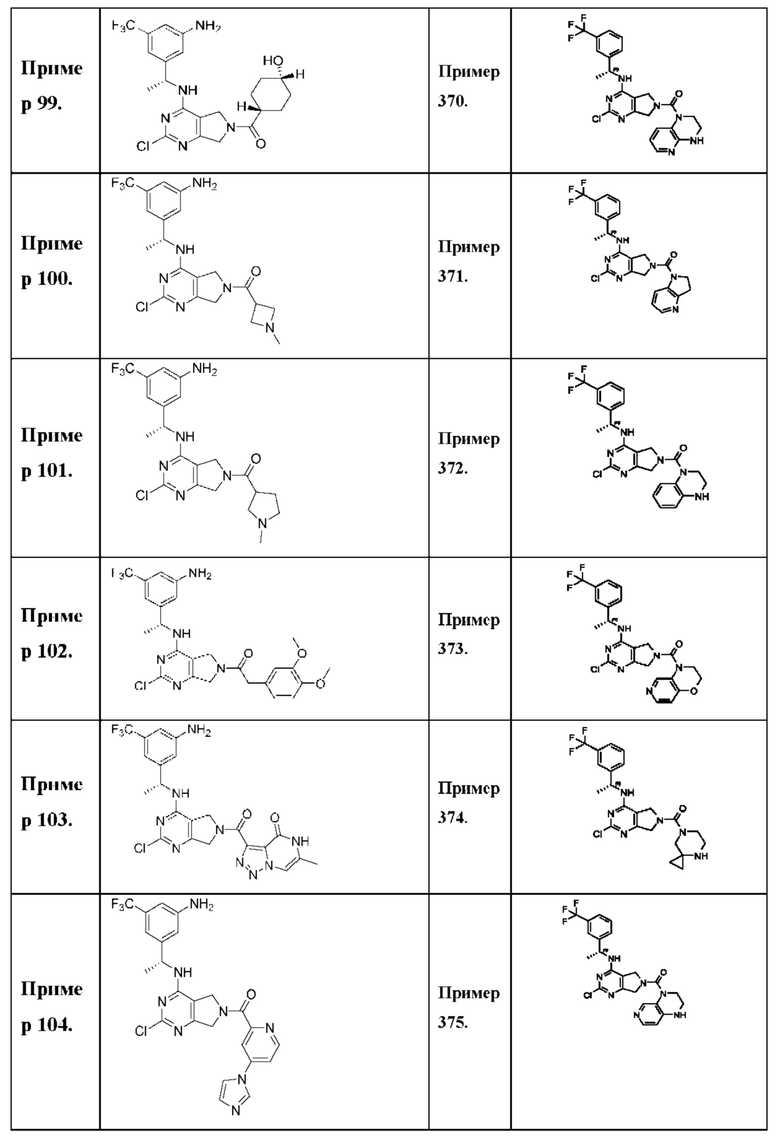
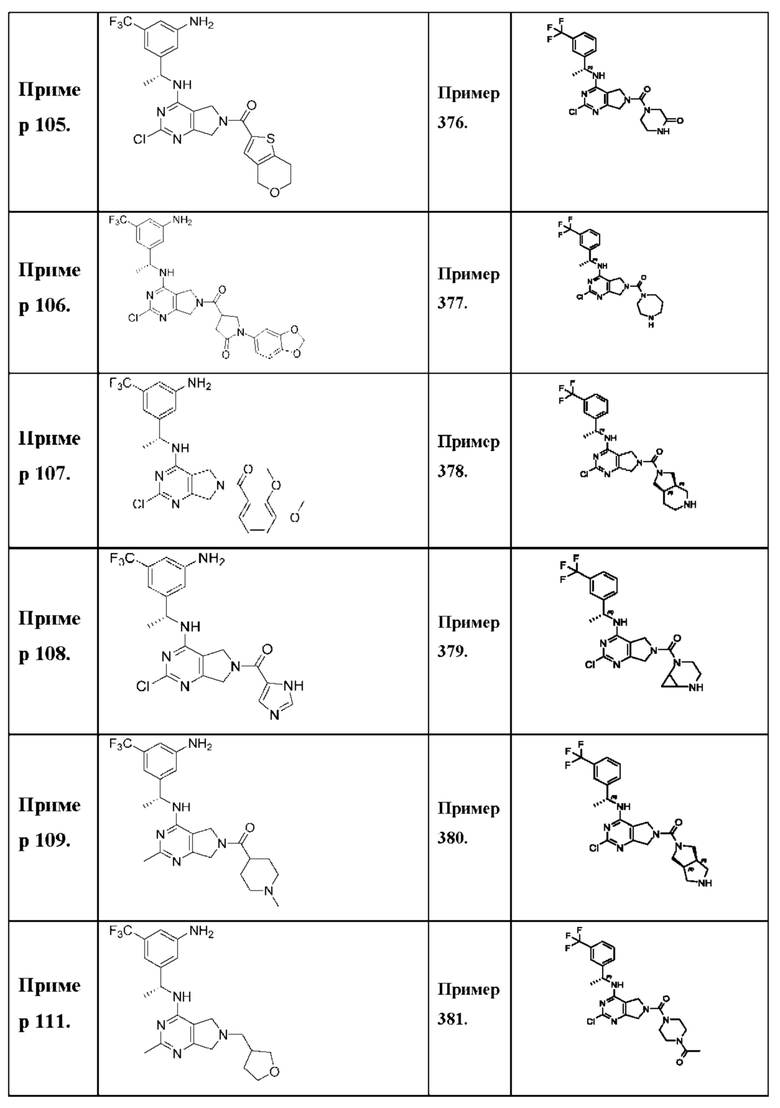
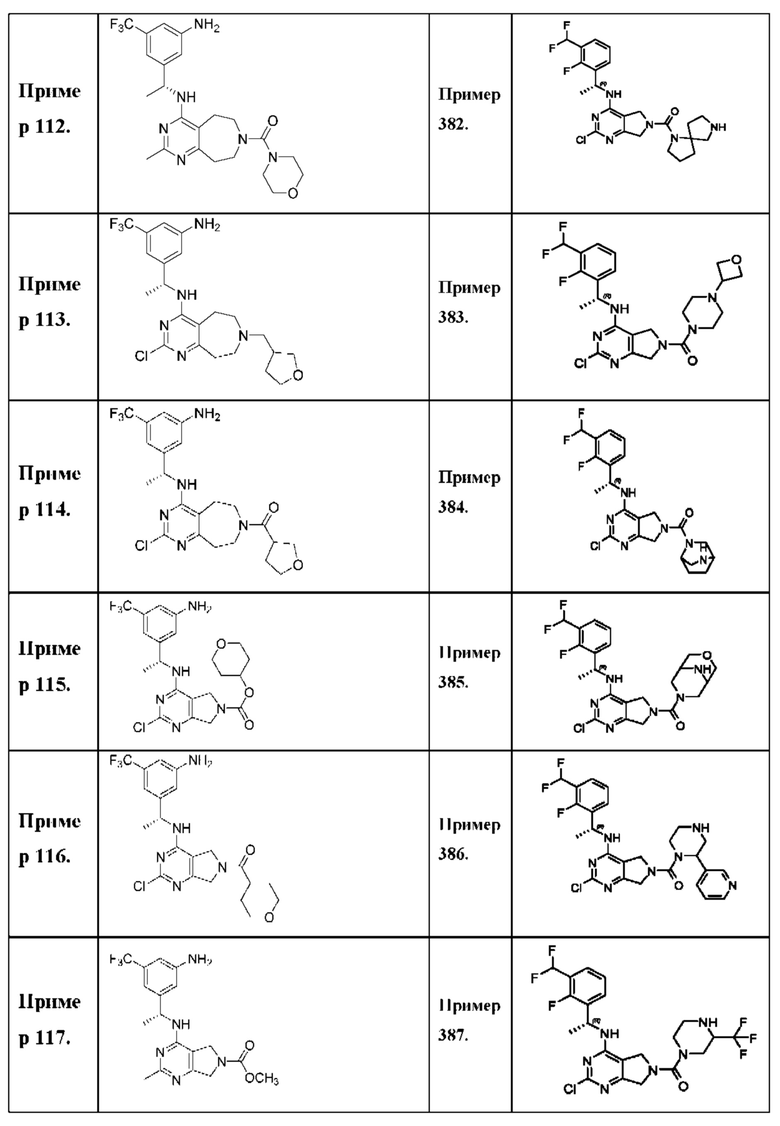

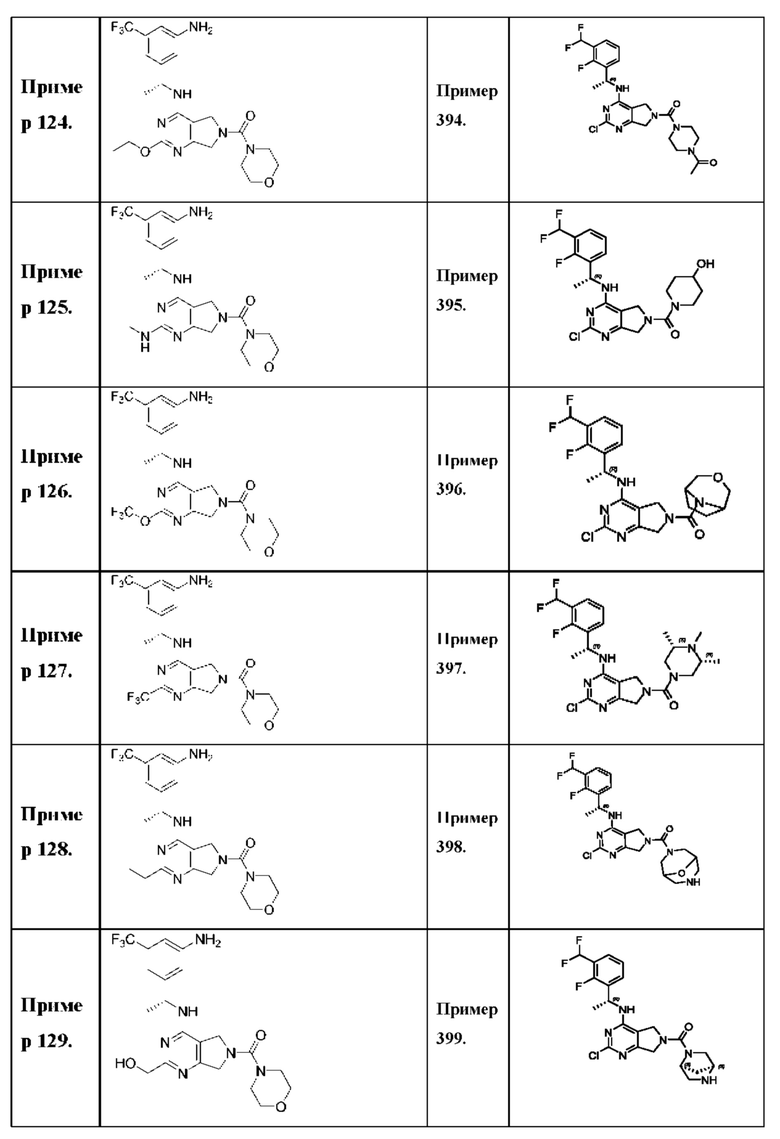
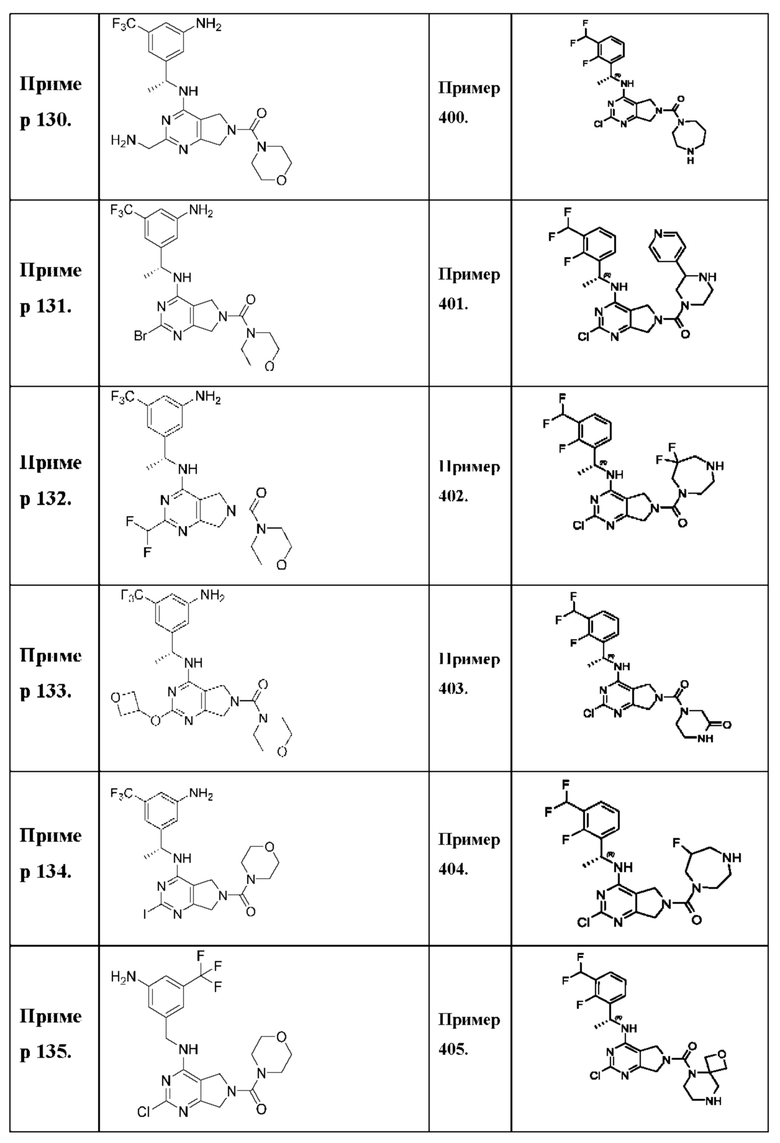
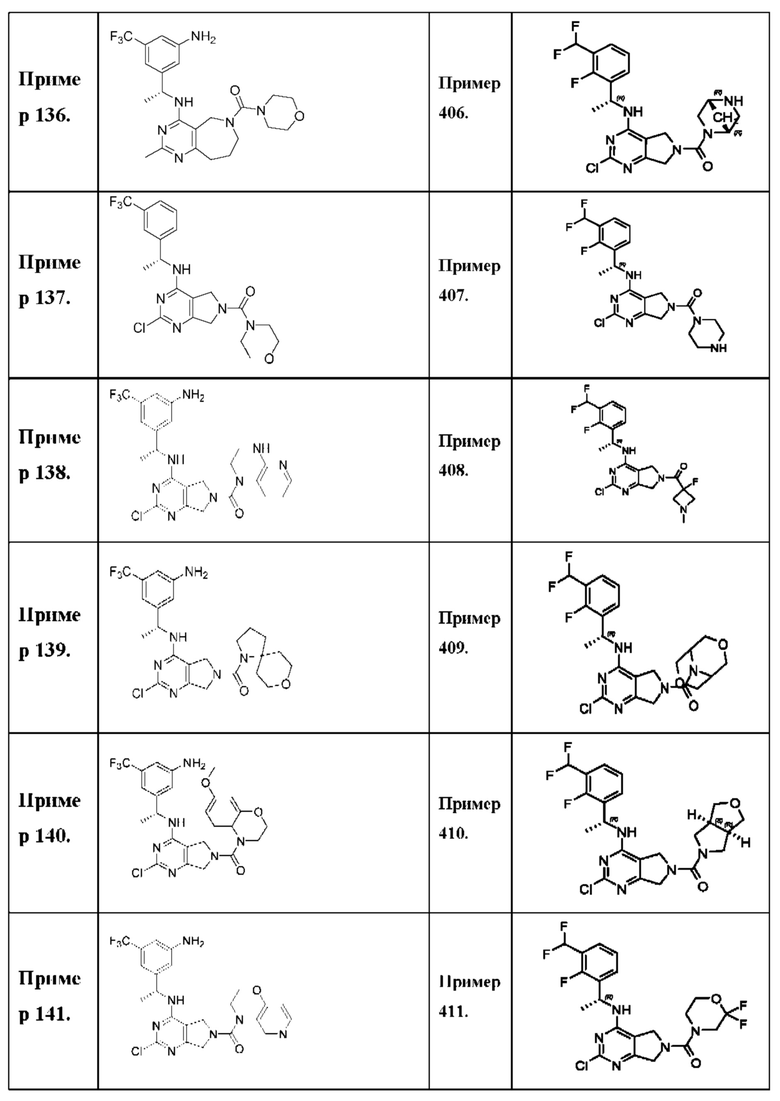
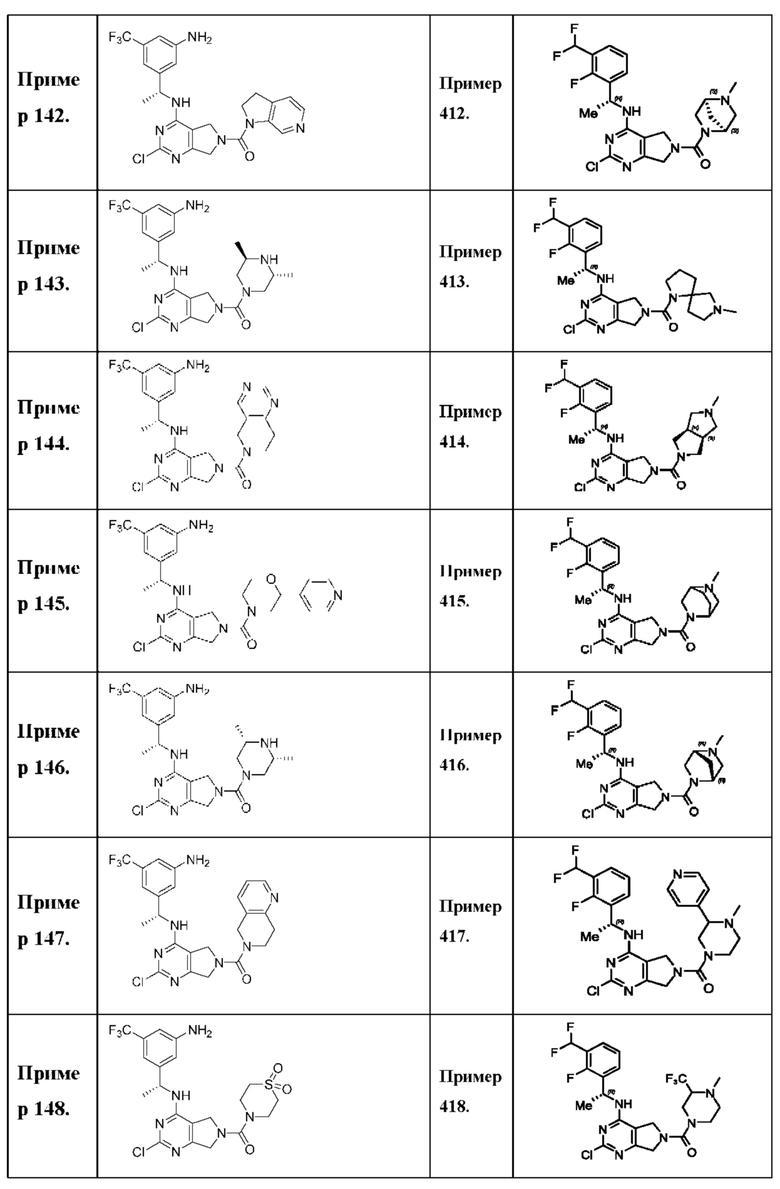
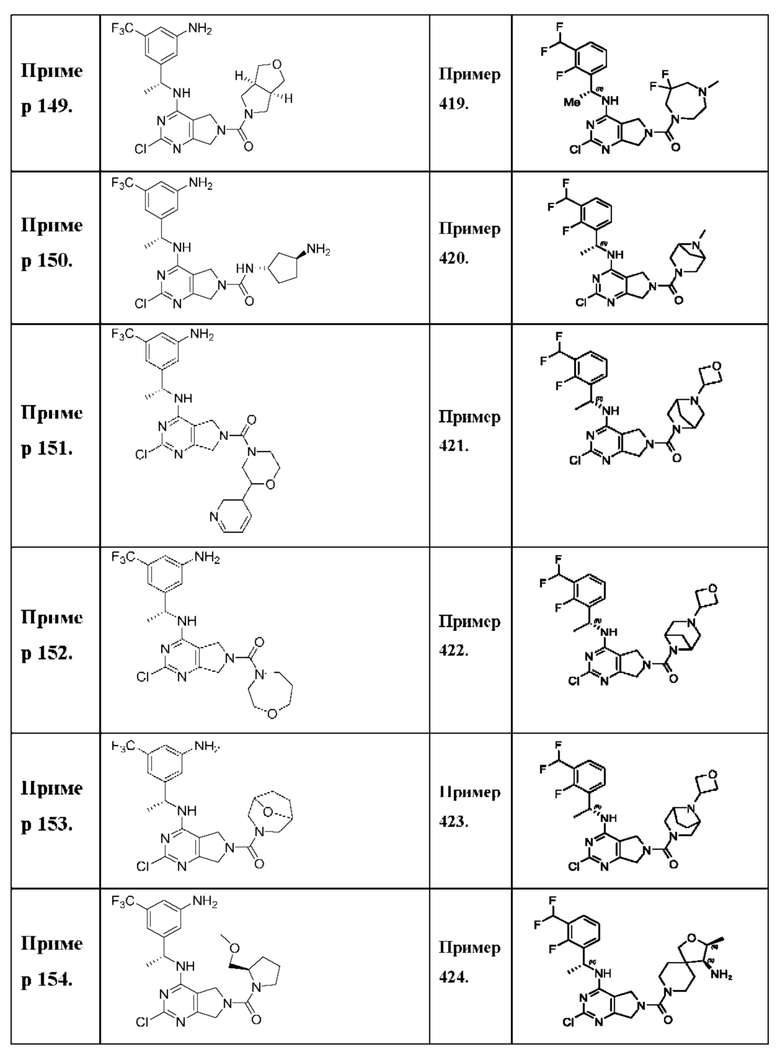
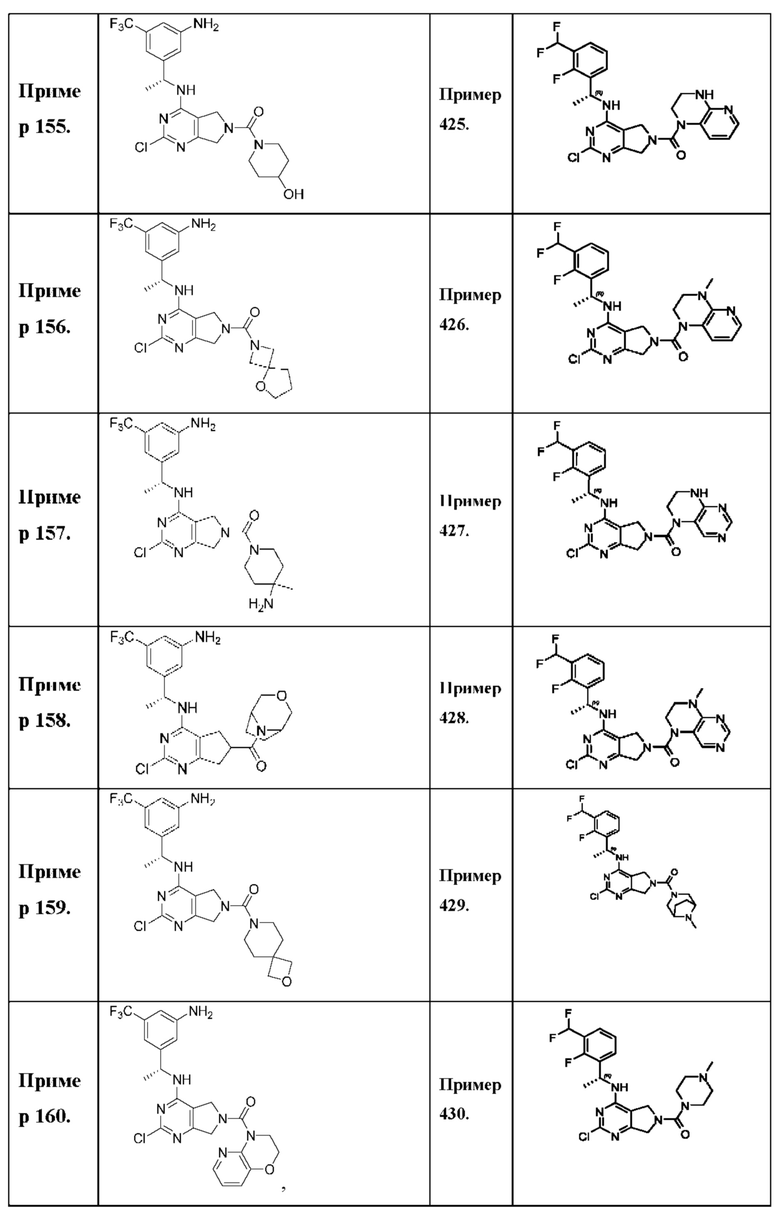
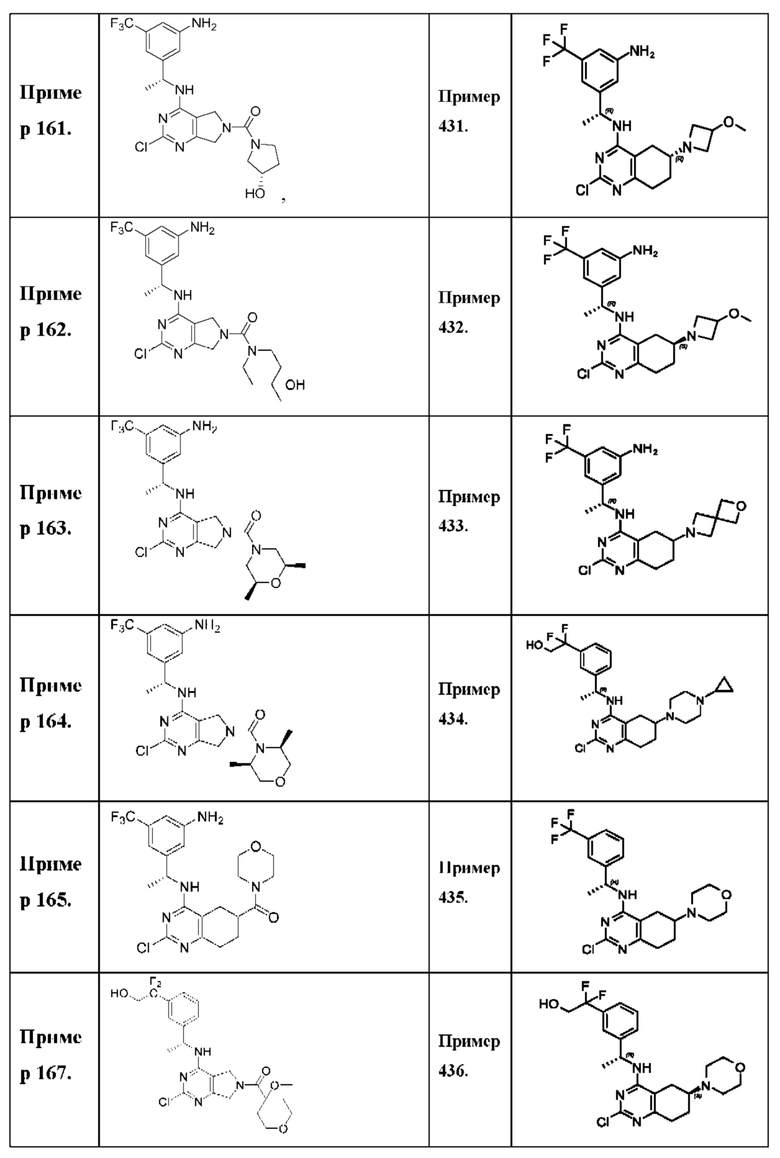
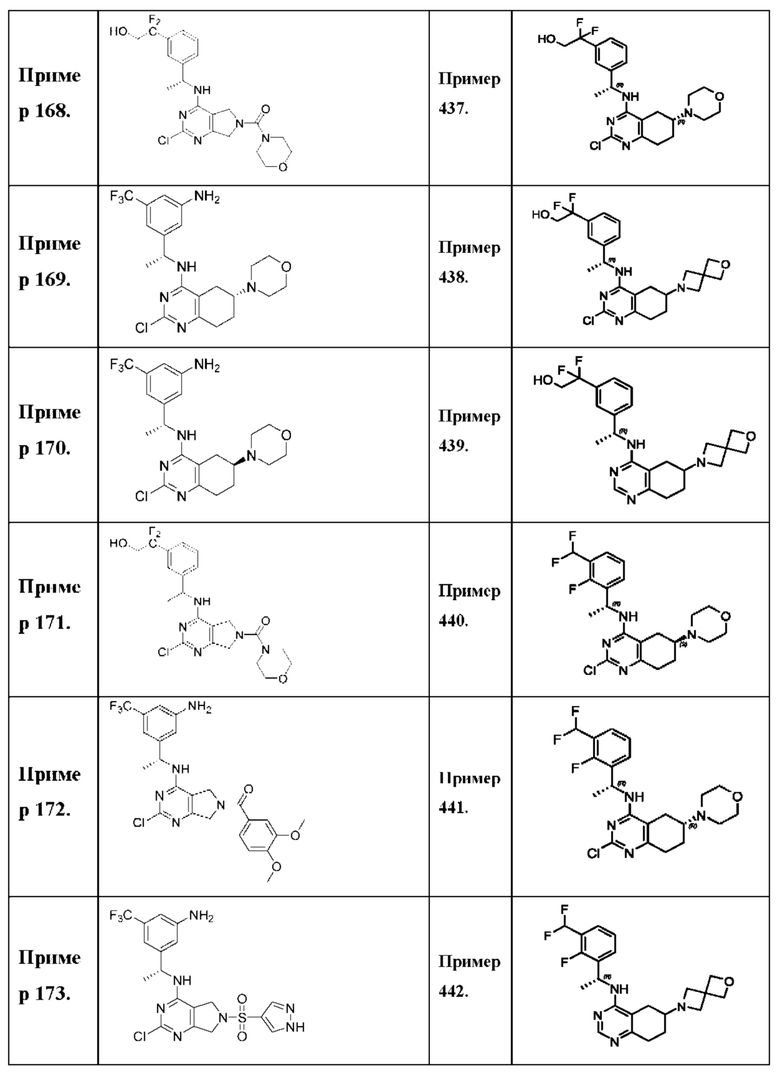
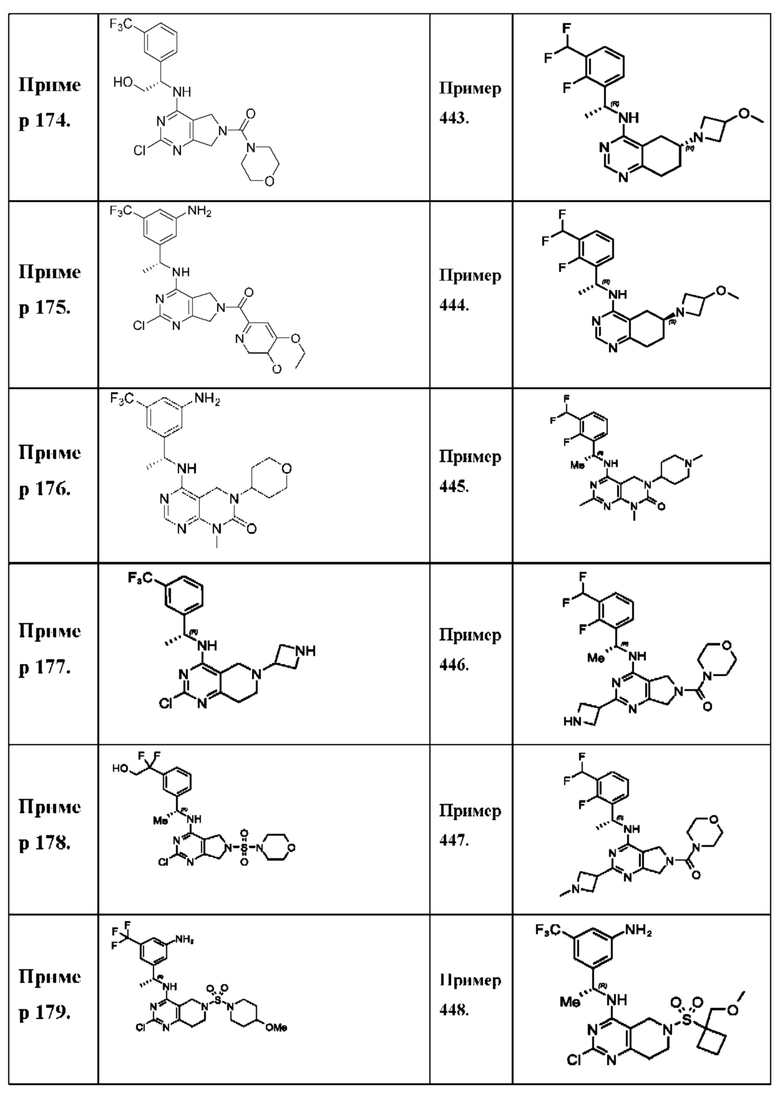
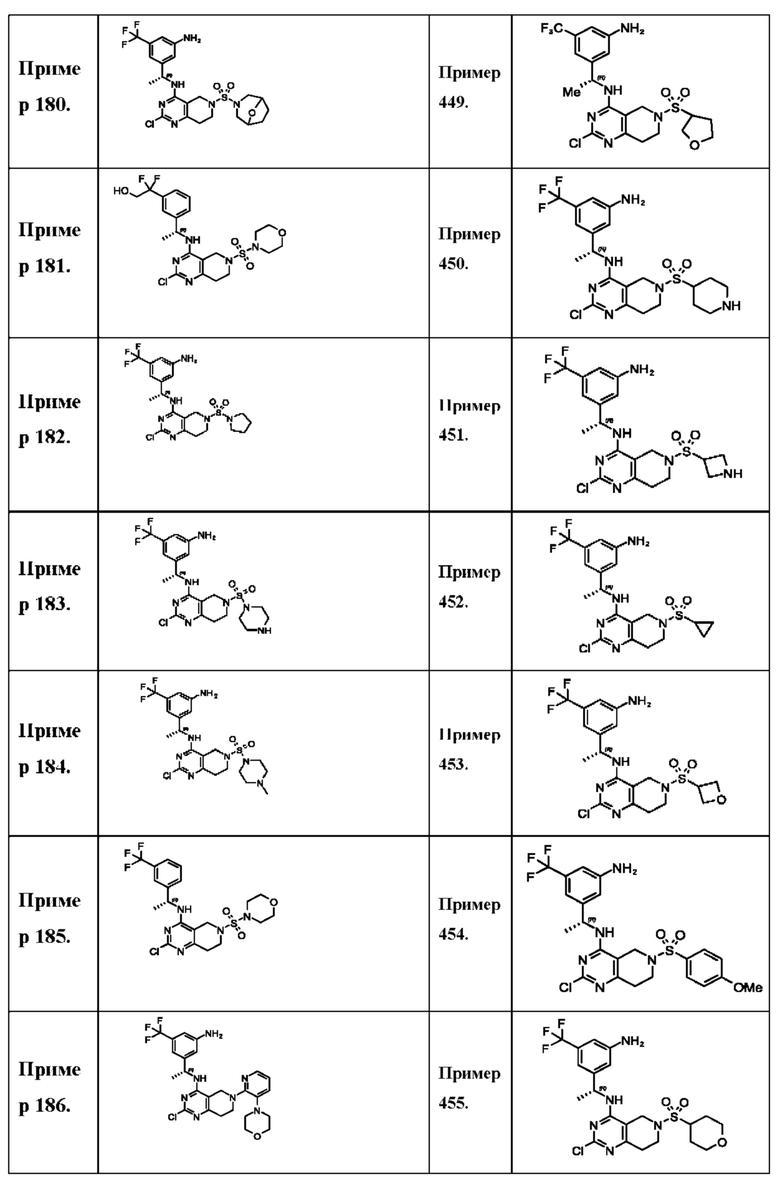
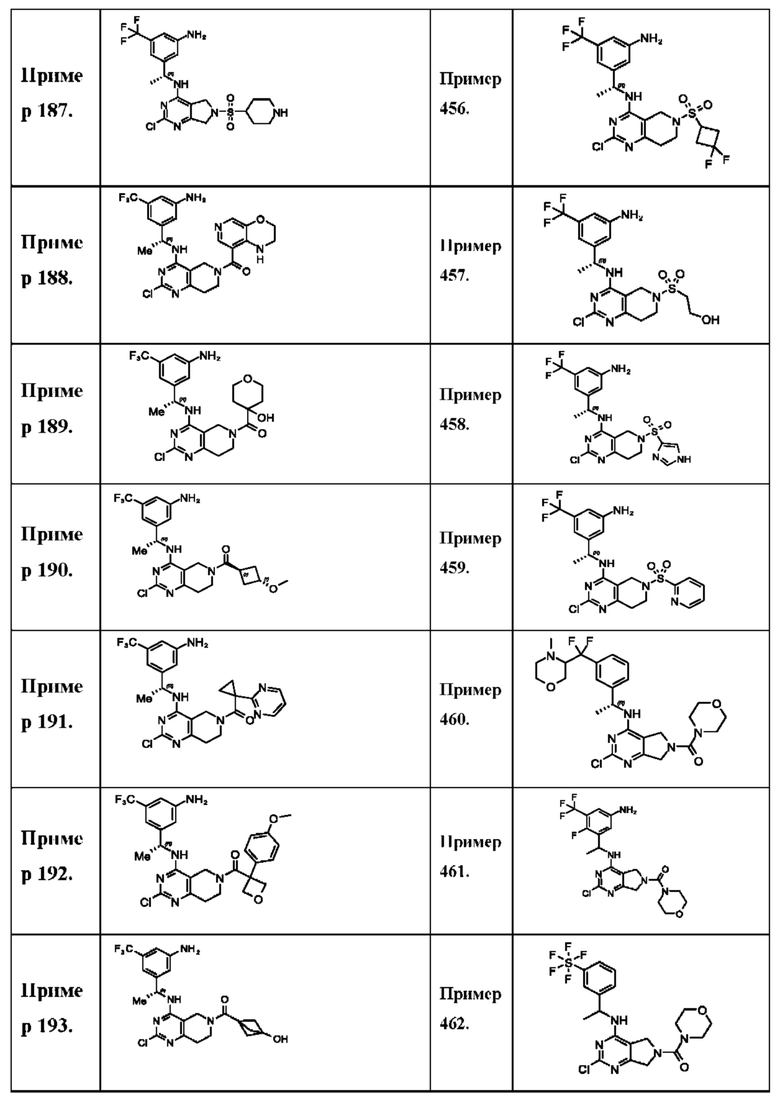
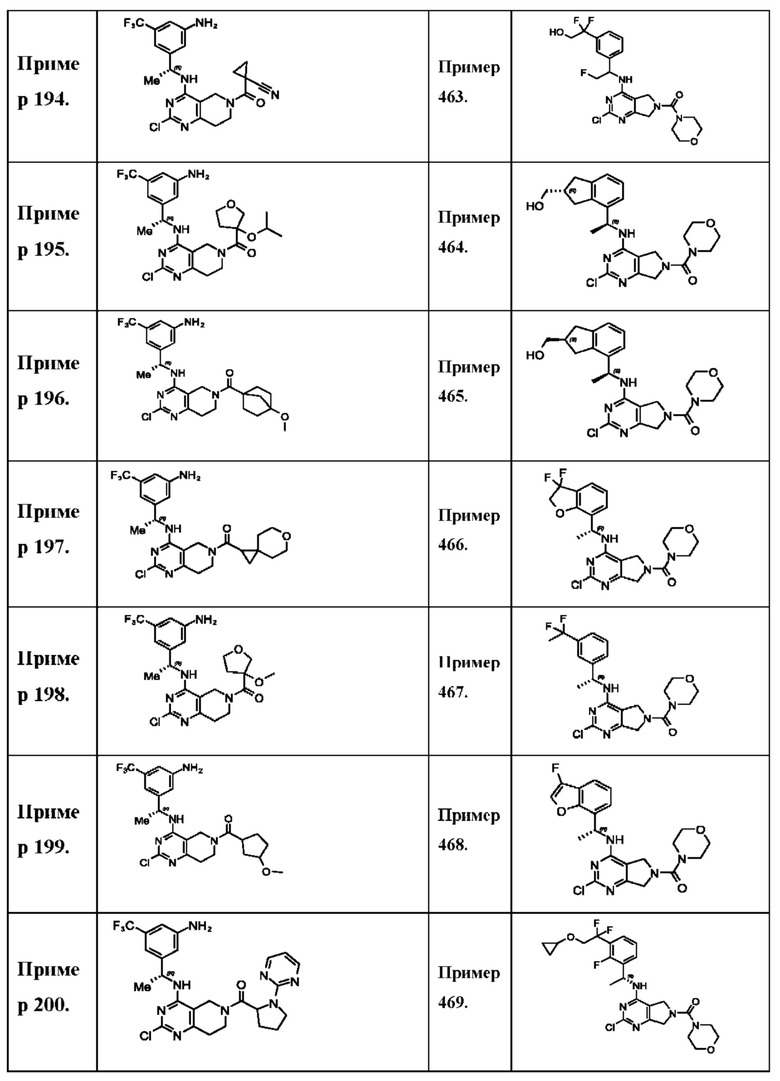
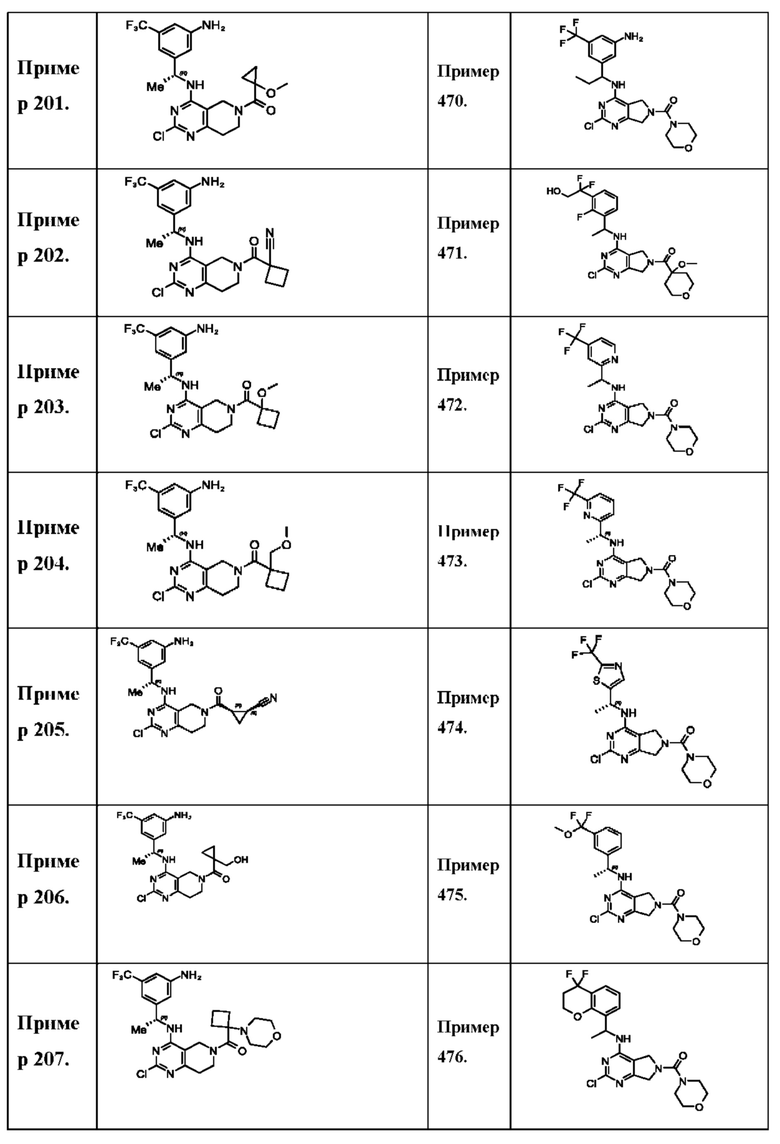
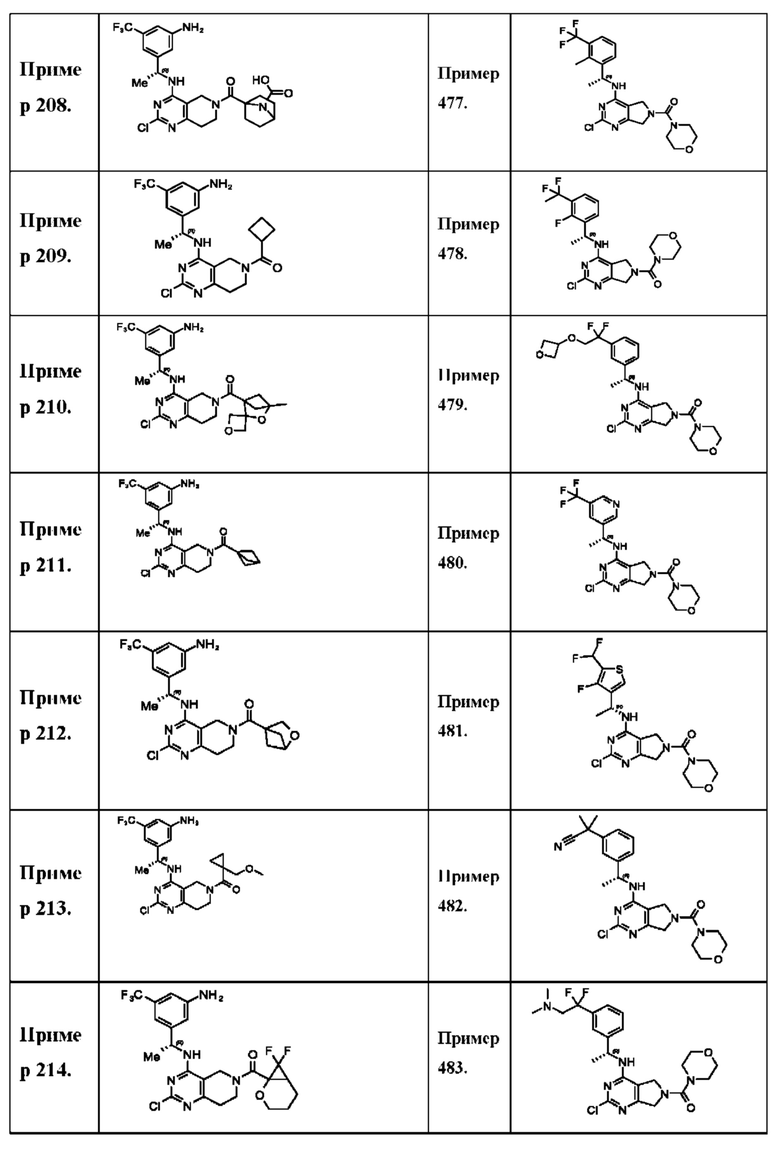
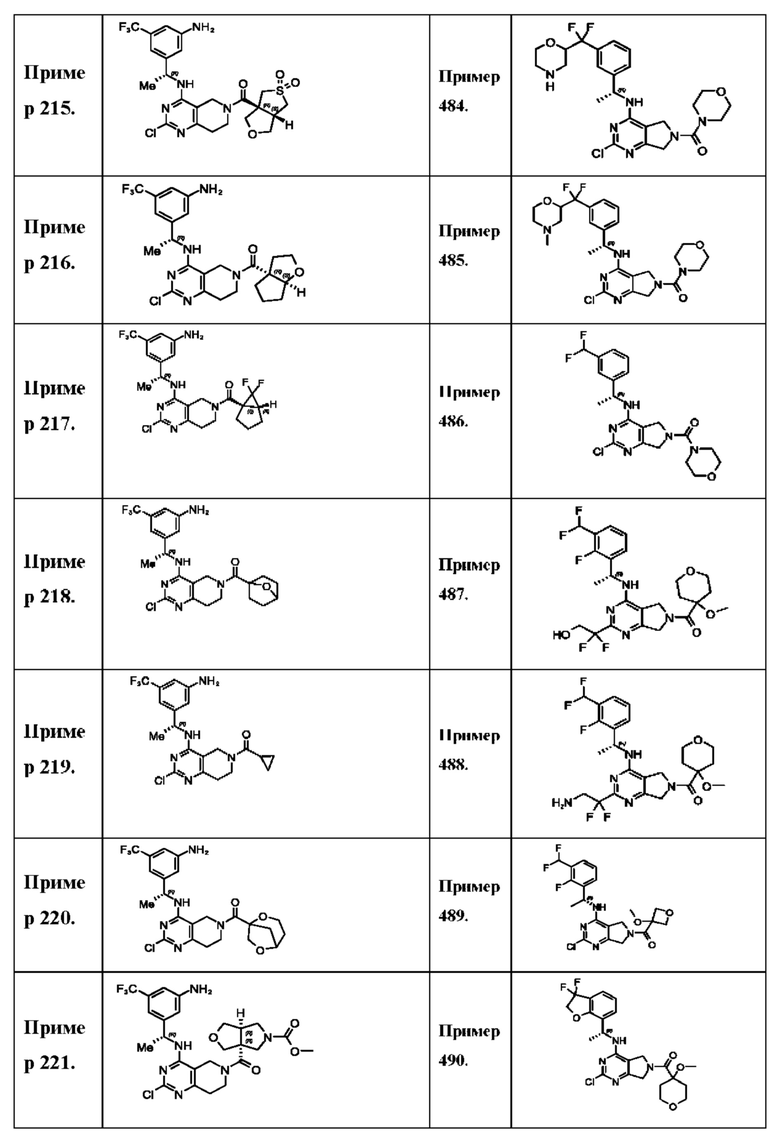
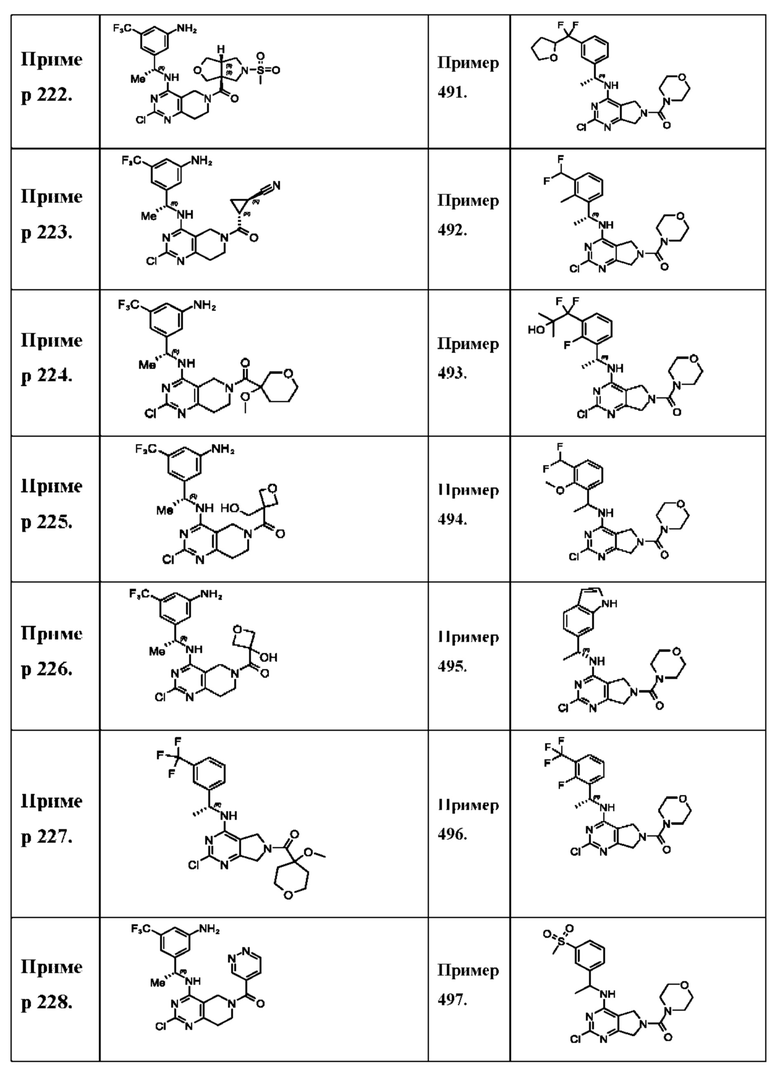
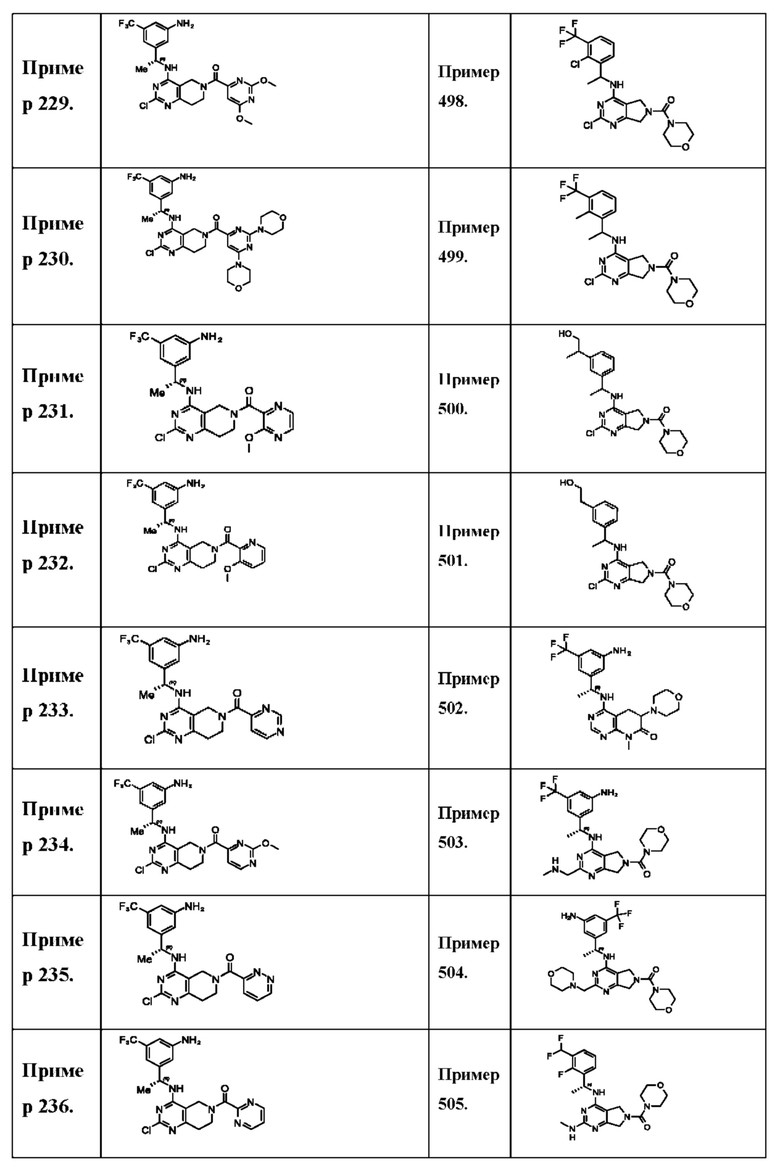
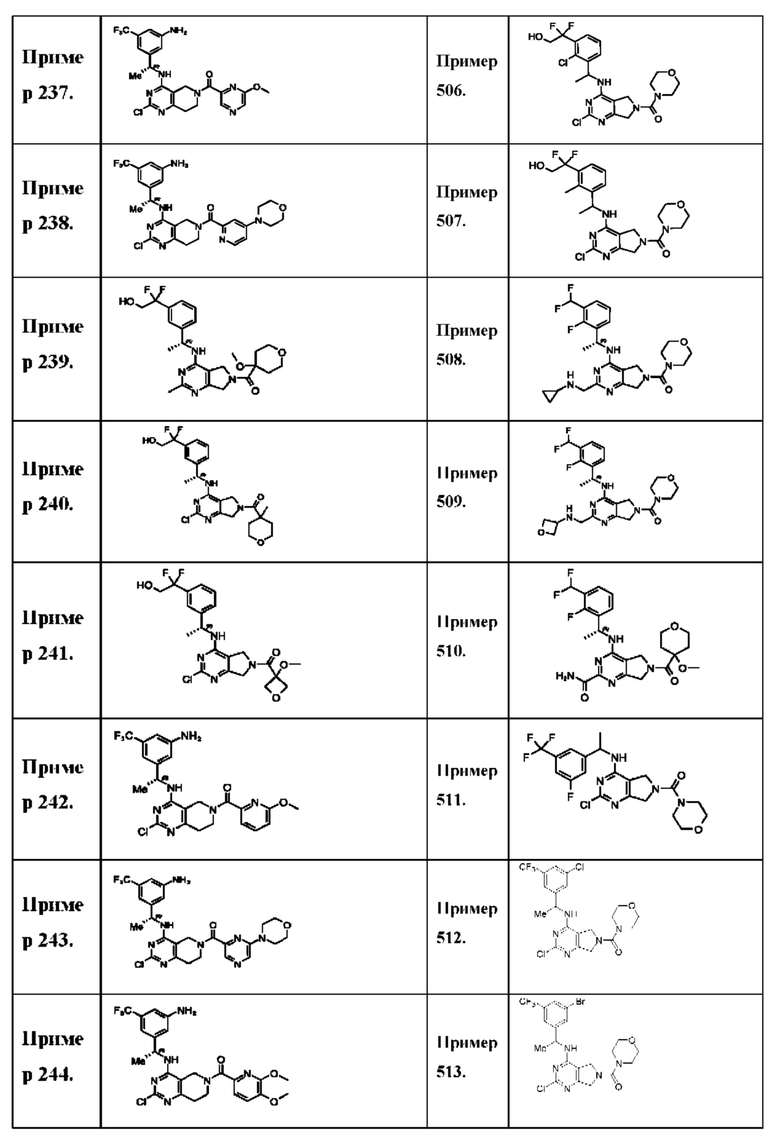
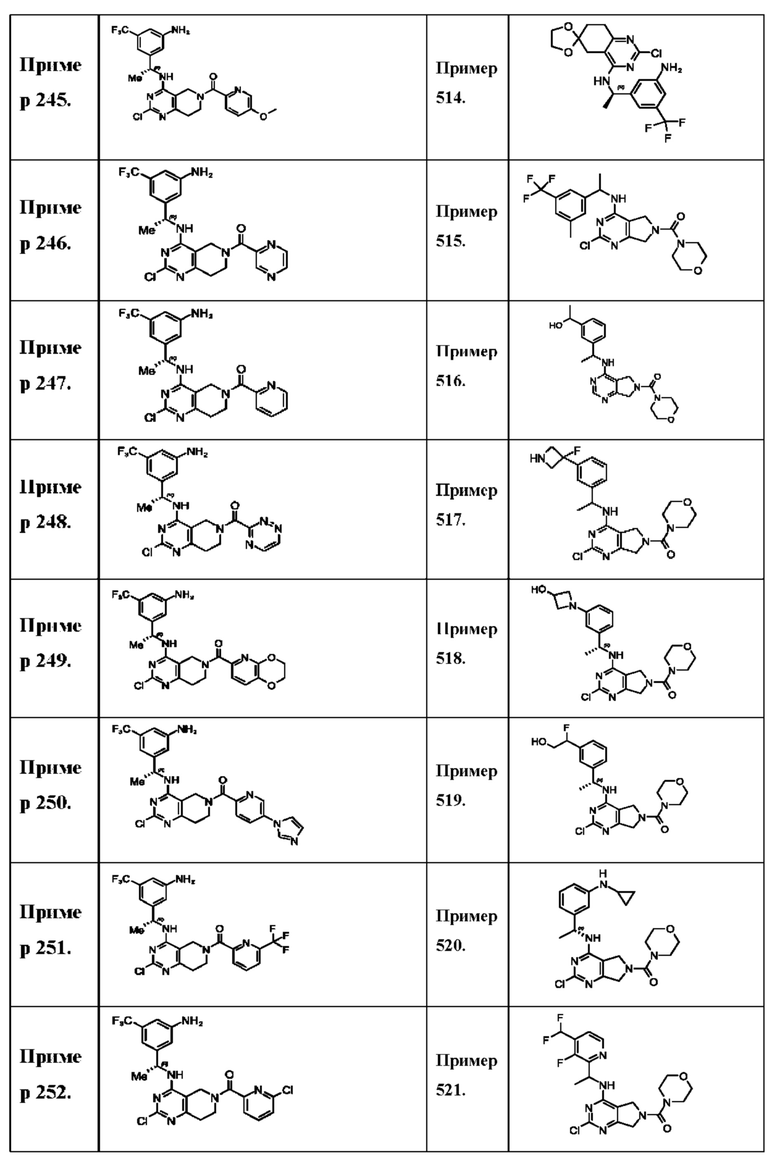
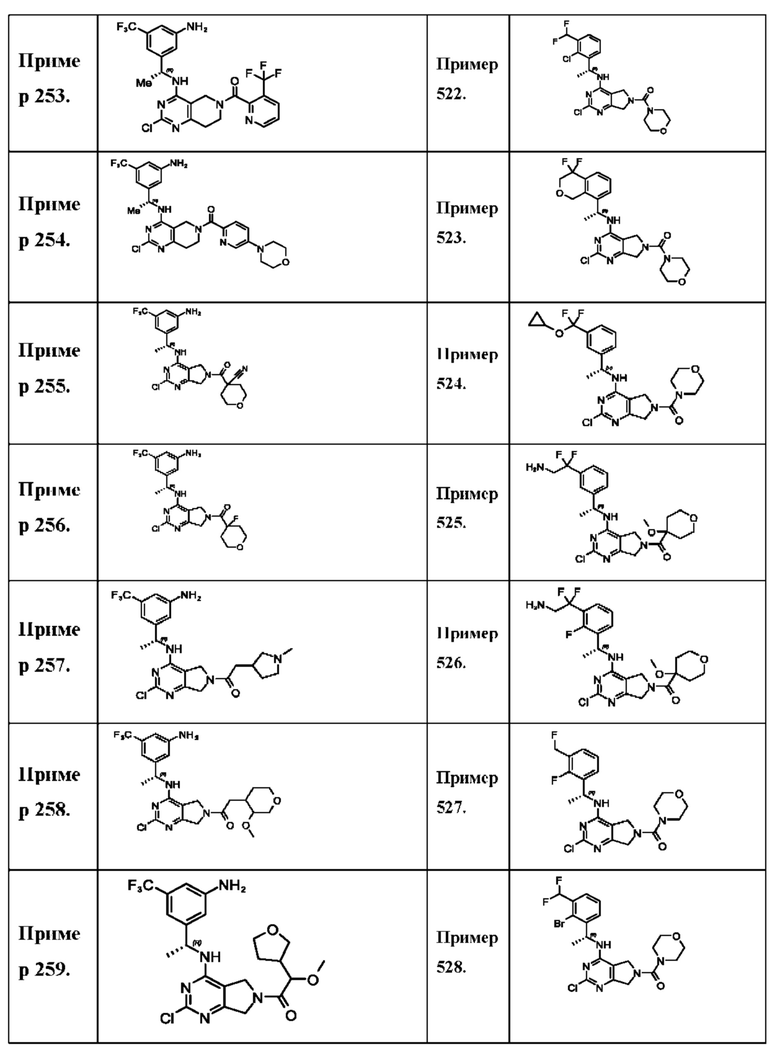
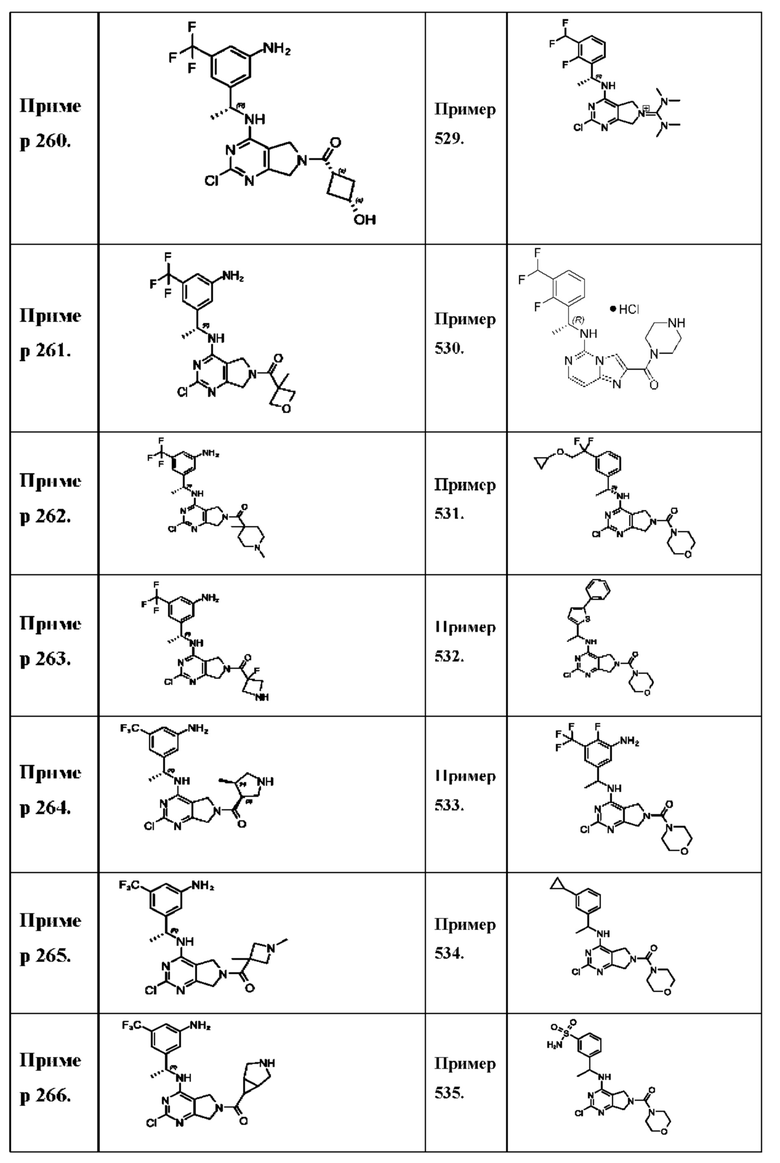
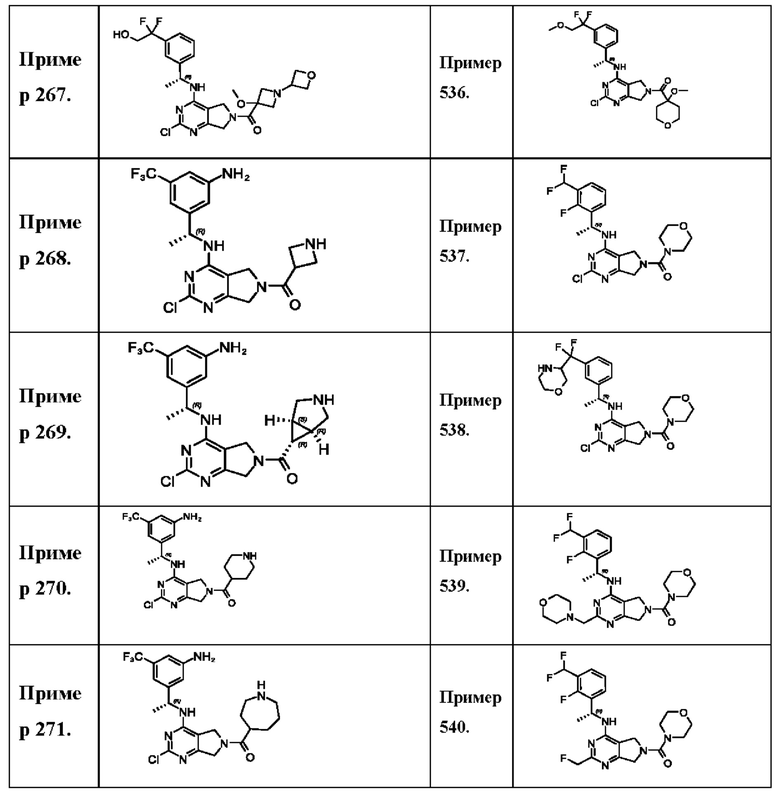
[00178] В настоящем изобретении предложены соединения и их фармацевтически приемлемые соли, сольваты, стереоизомеры и таутомеры, выбранные из группы, состоящей из соединений из набора 1:
Набор 1: Некоторые соединения по настоящему изобретению
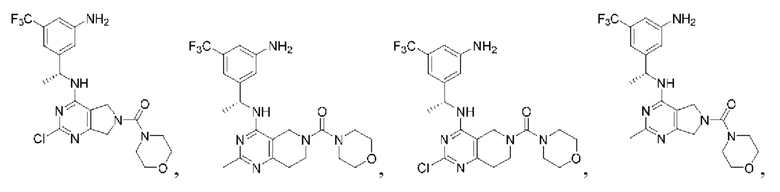
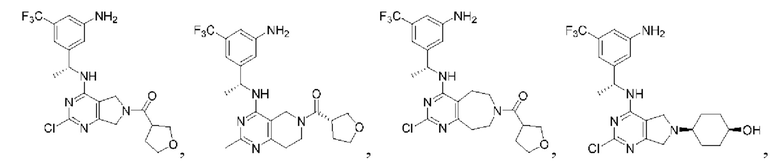
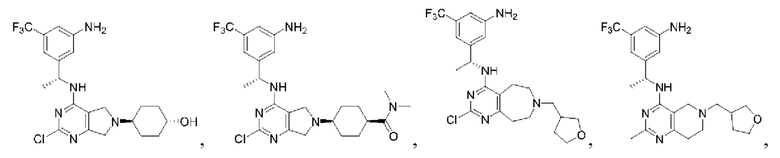
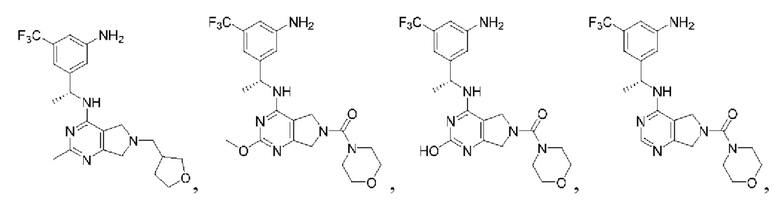
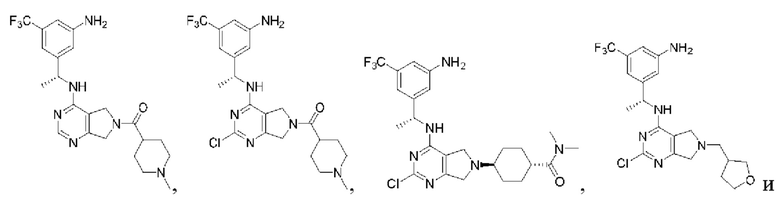
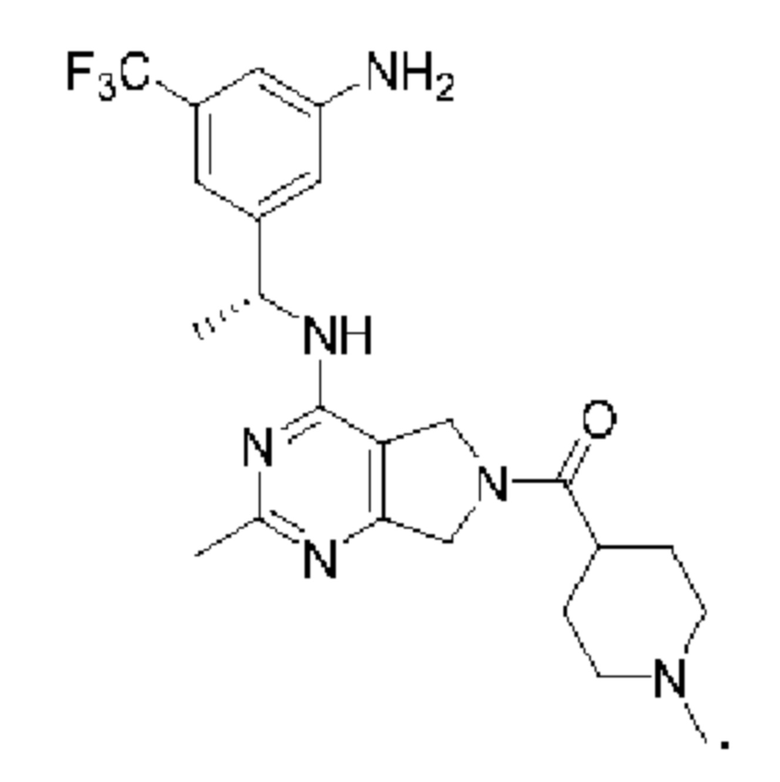
[00179] В настоящем изобретении предложены соединения и их фармацевтически приемлемые соли, сольваты, стереоизомеры и таутомеры, выбранные из группы, состоящей из соединений из набора 2:
Набор 2: Некоторые соединения по настоящему изобретению
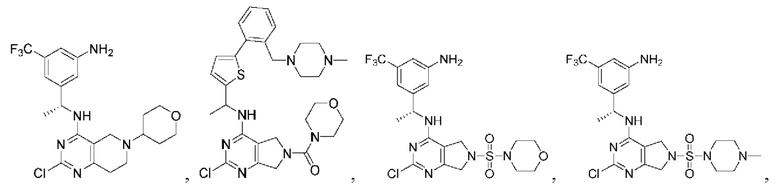
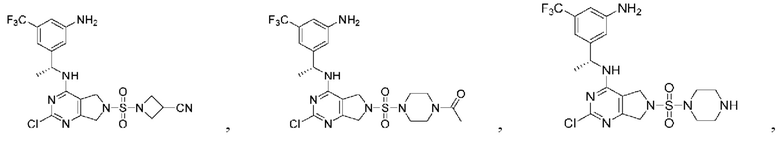
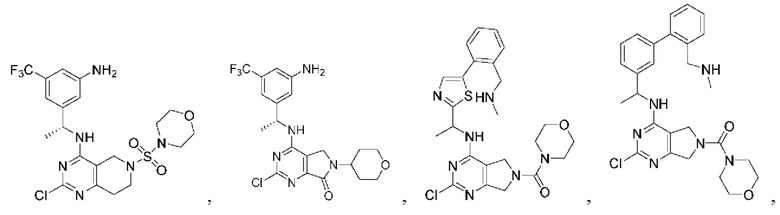
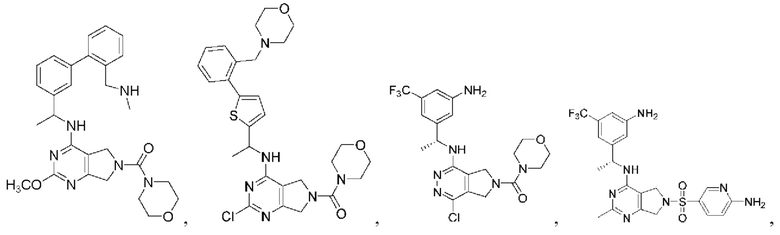
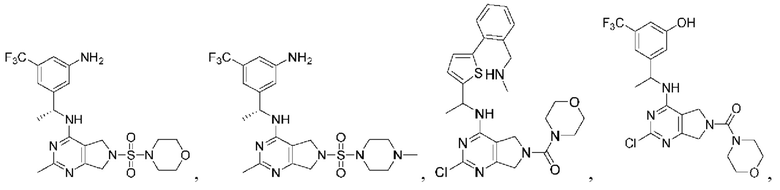
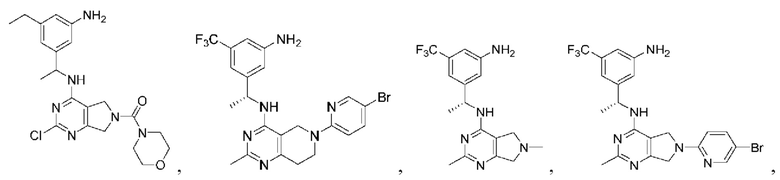
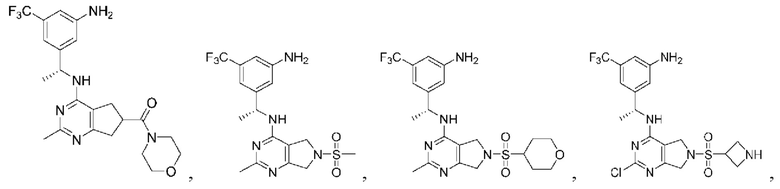
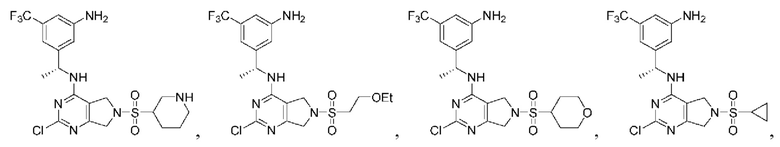
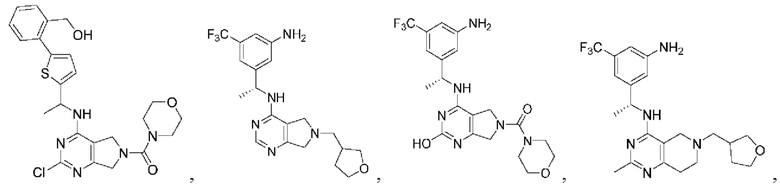
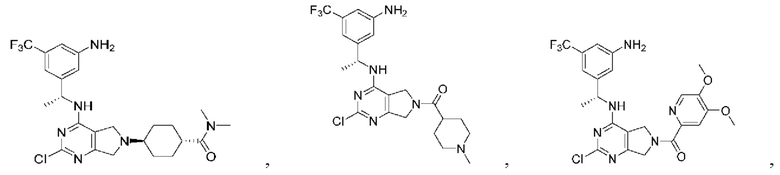
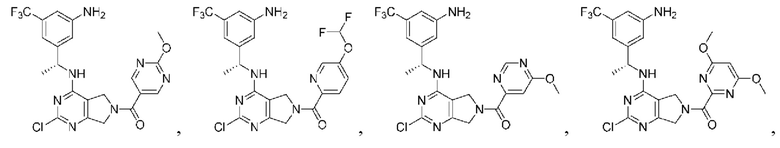
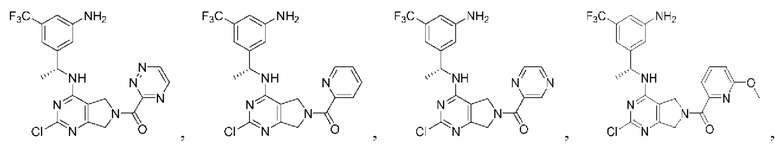
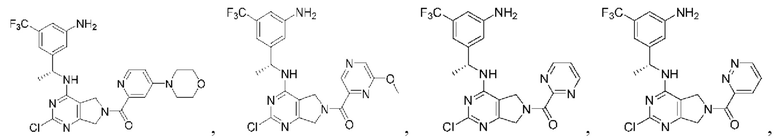
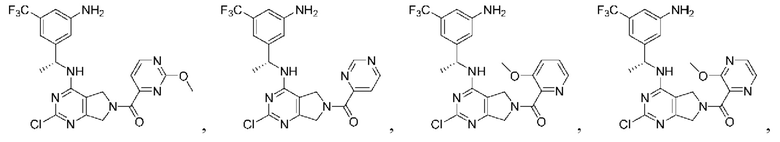
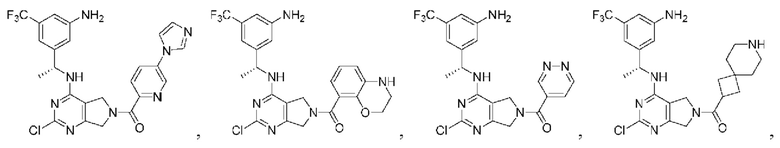
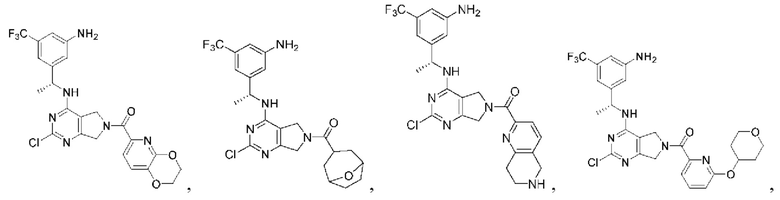
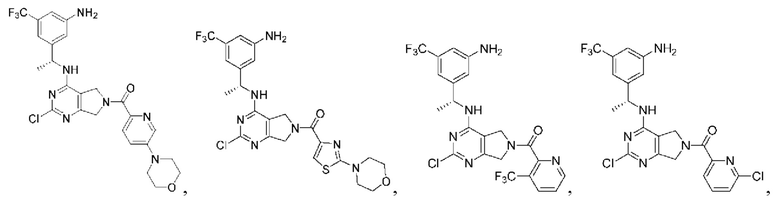
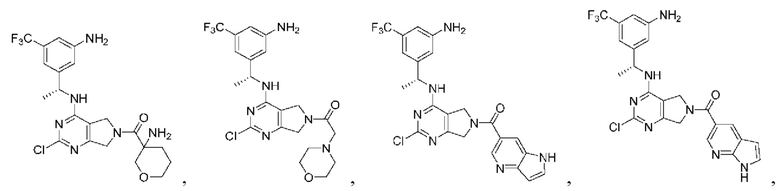
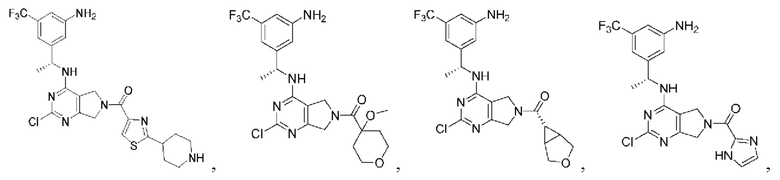
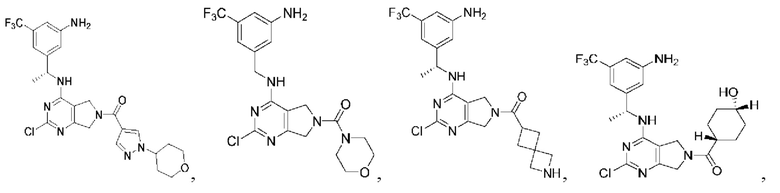
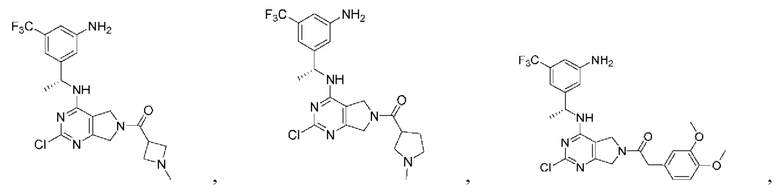
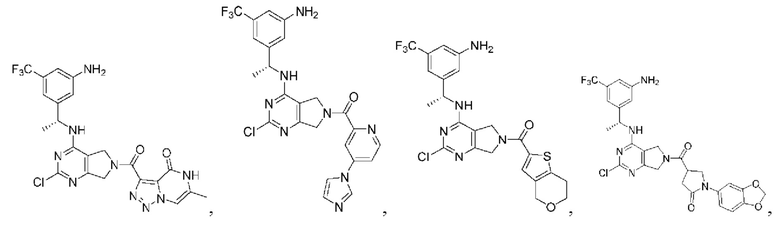
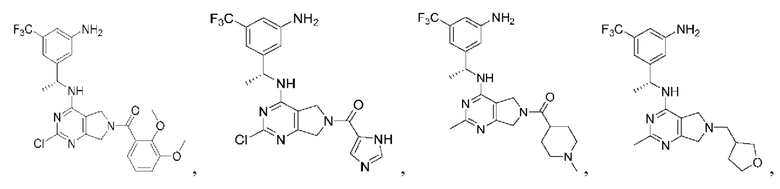
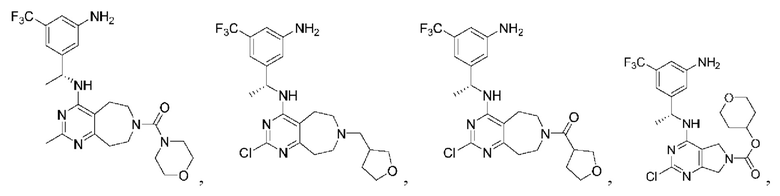
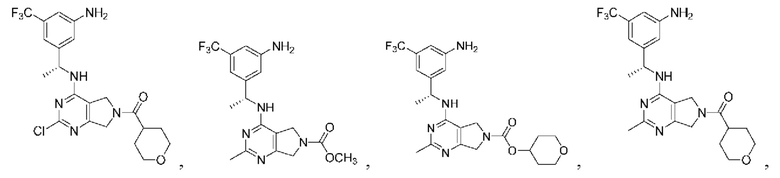
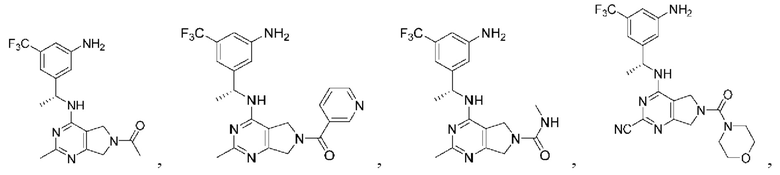
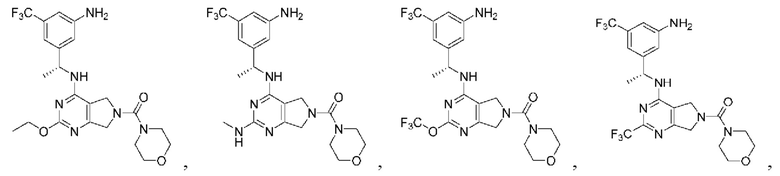
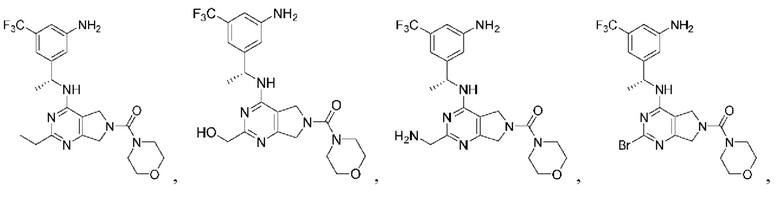
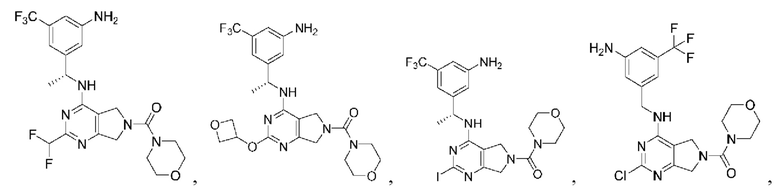
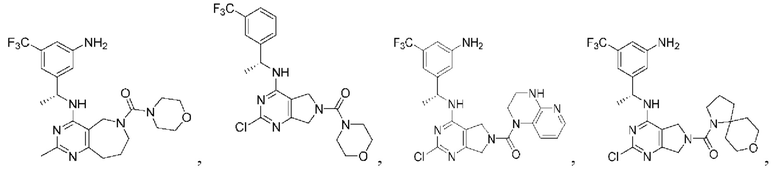
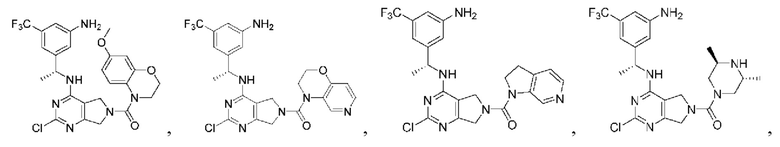
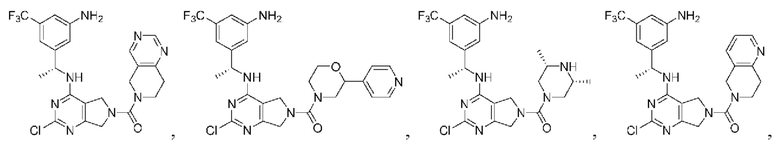
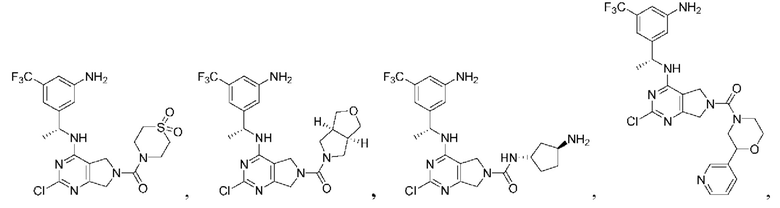
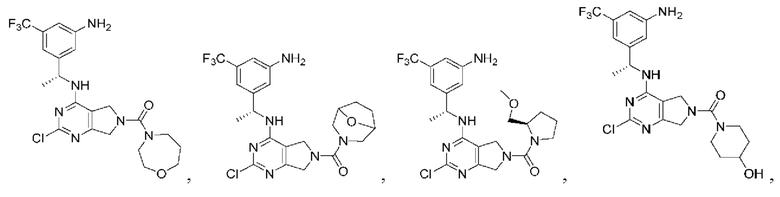
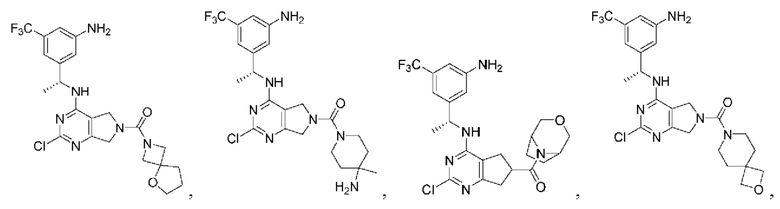
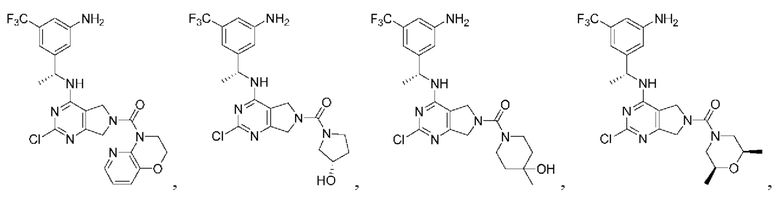
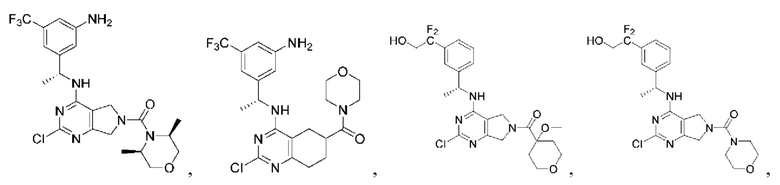
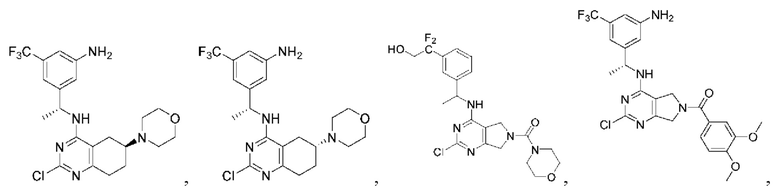
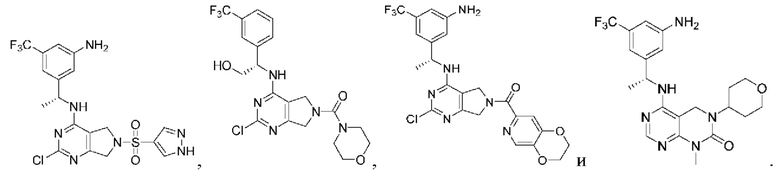
[00180] В настоящем изобретении предложены соединения и их фармацевтически приемлемые соли, сольваты, стереоизомеры и таутомеры, выбранные из группы, состоящей из соединений из набора 3:
Набор 3: Некоторые соединения по настоящему изобретению
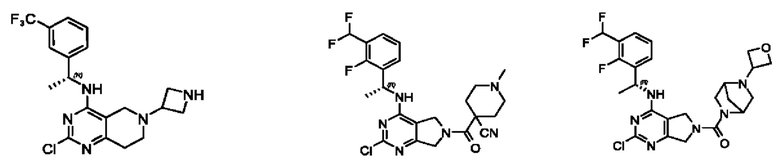
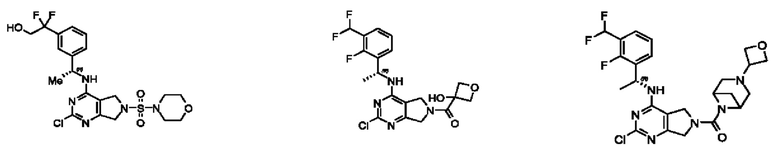
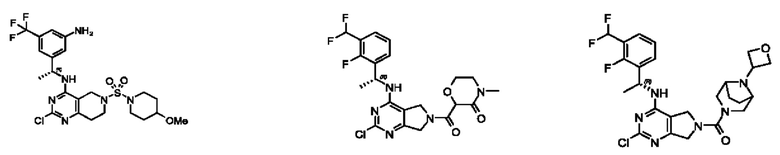
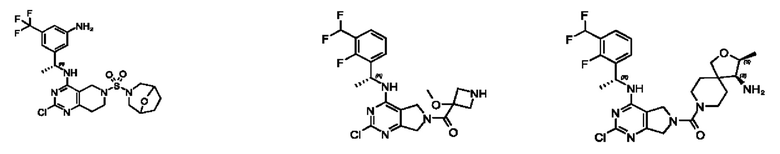
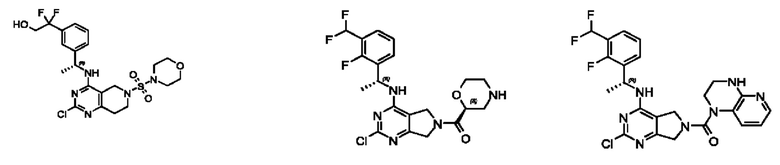
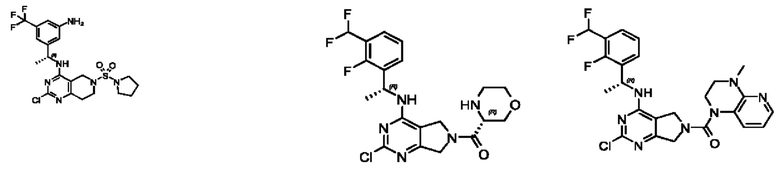
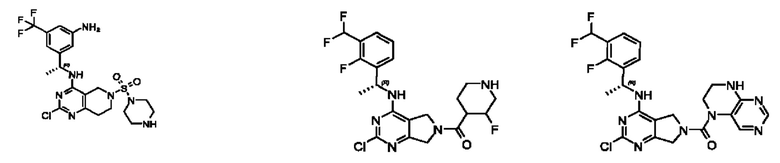
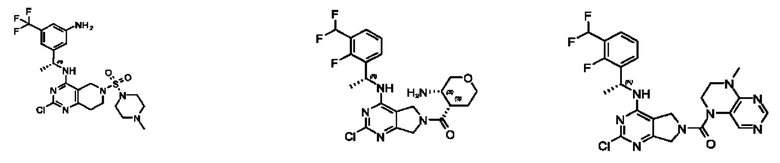
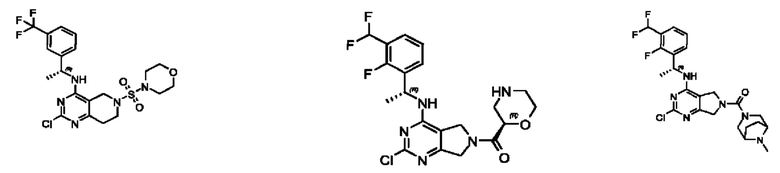
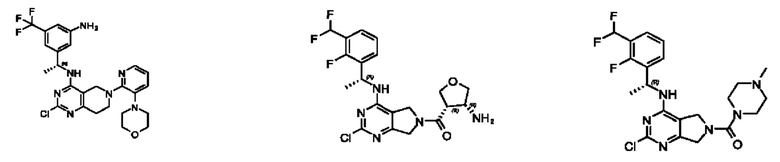
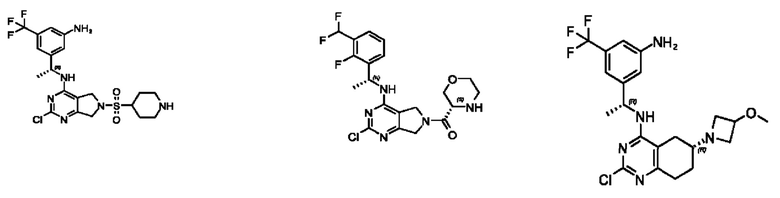
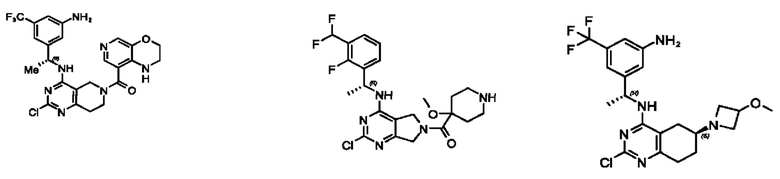
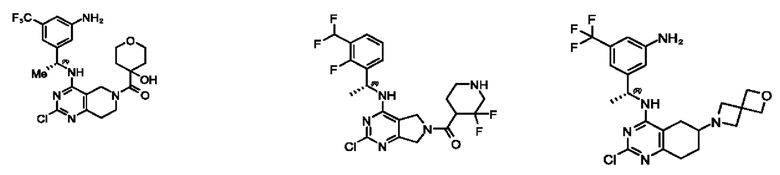
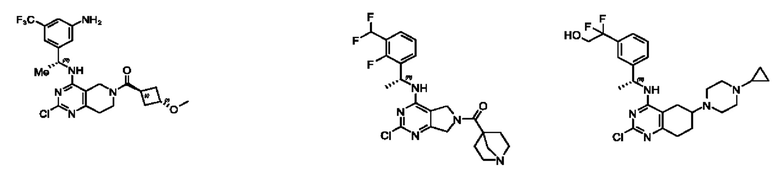
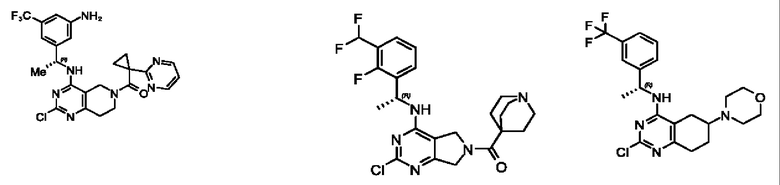
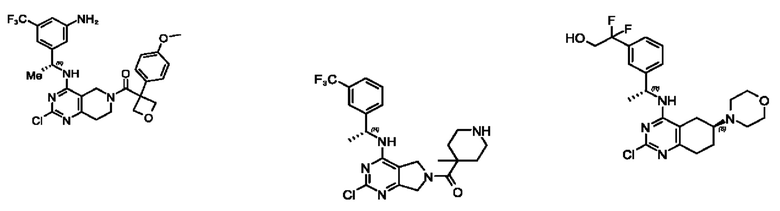
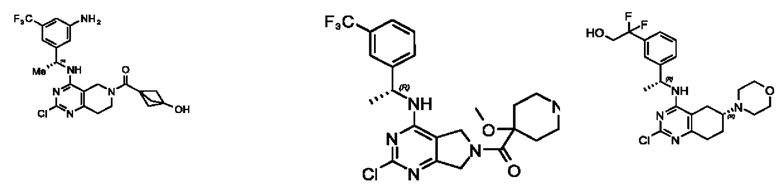
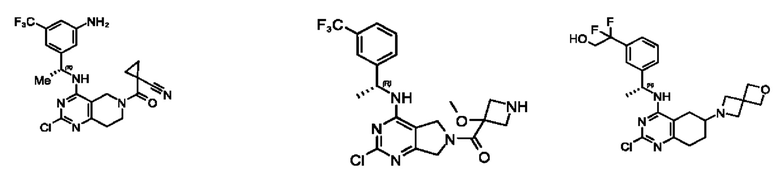
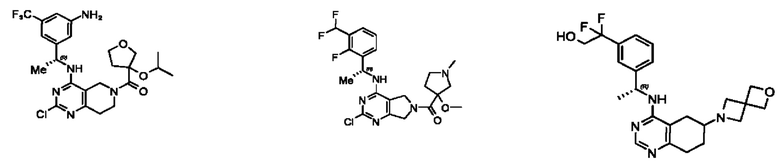
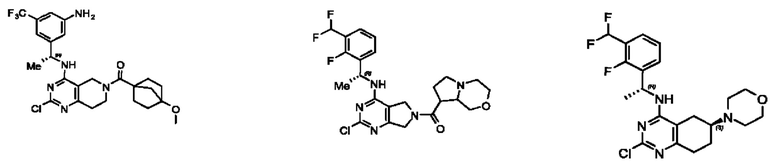
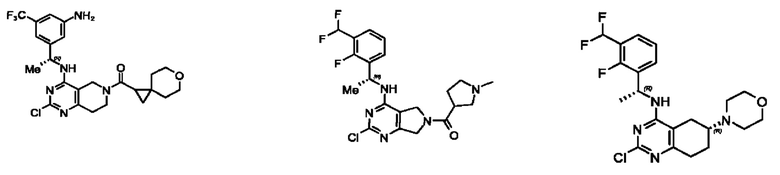
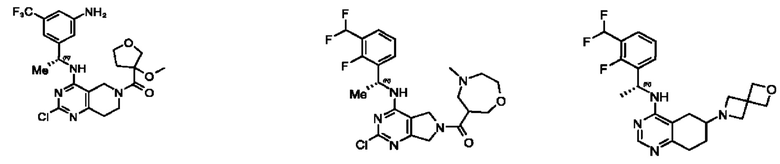
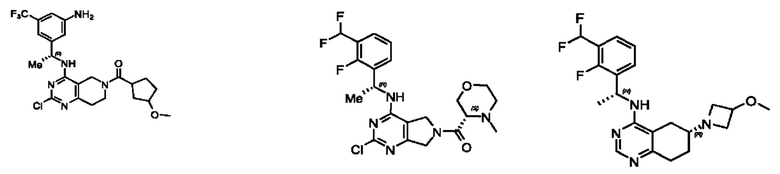
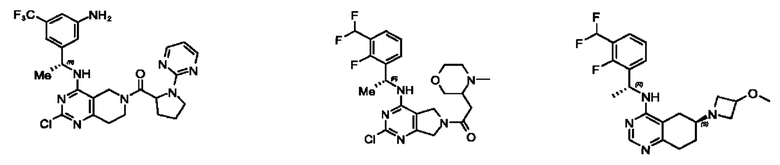
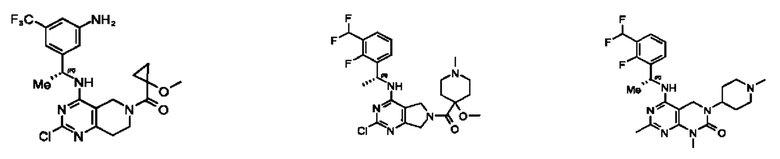
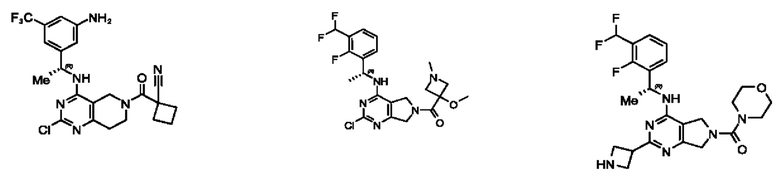
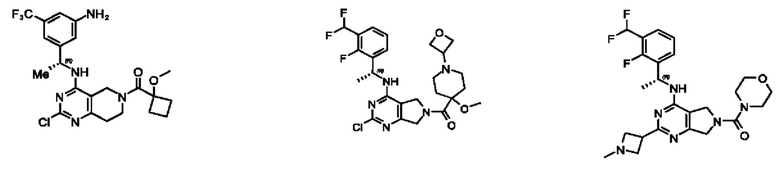
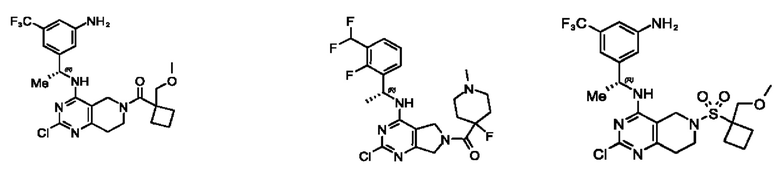
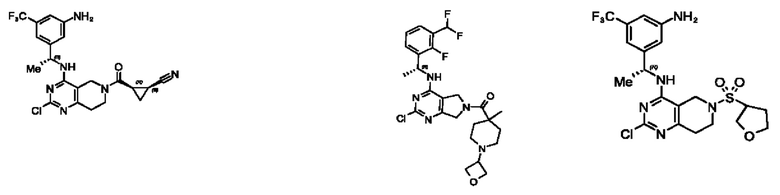
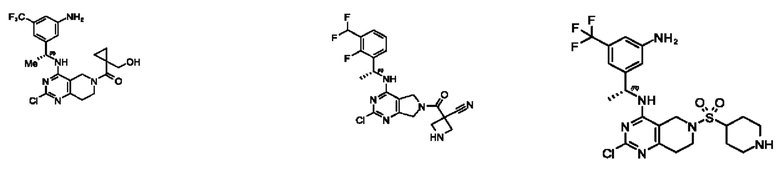
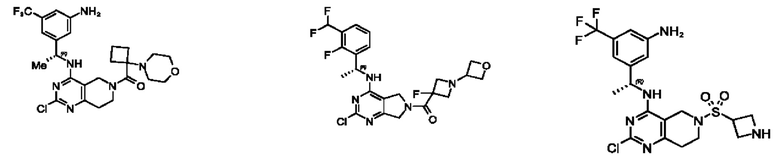
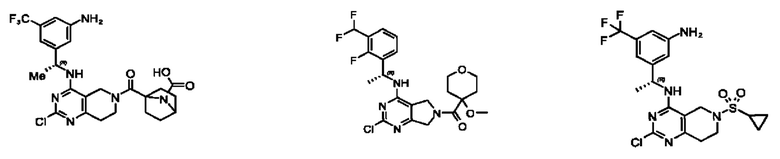
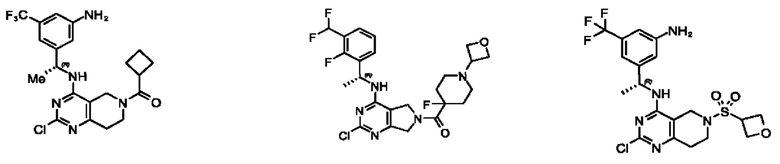
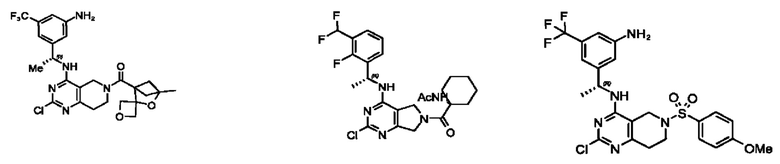
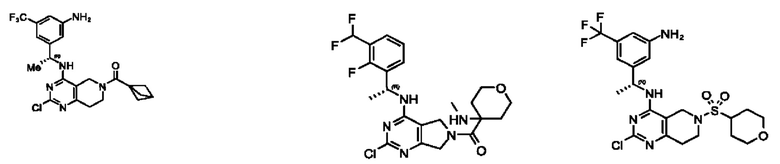
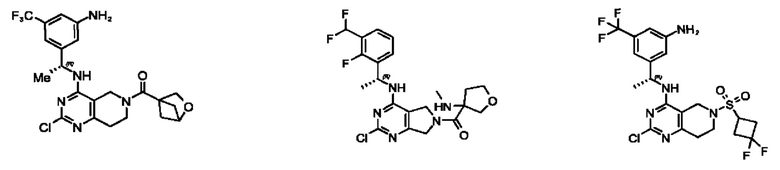
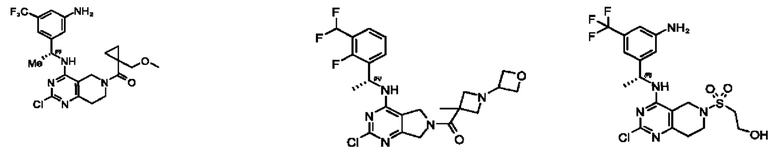
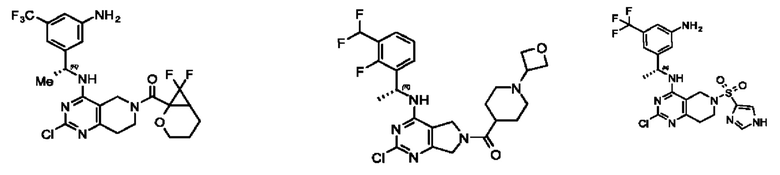
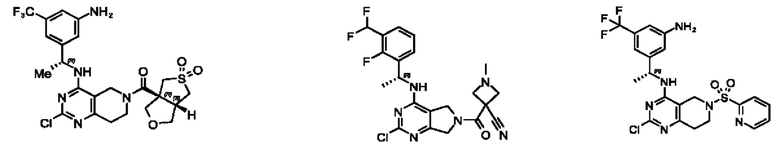
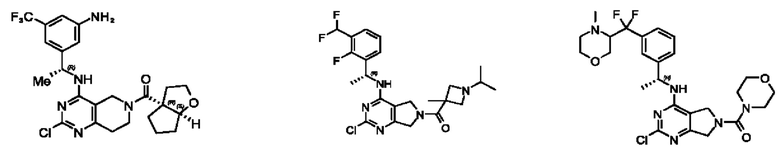
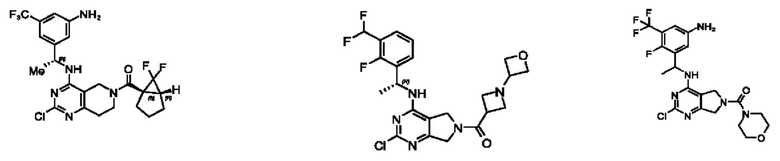
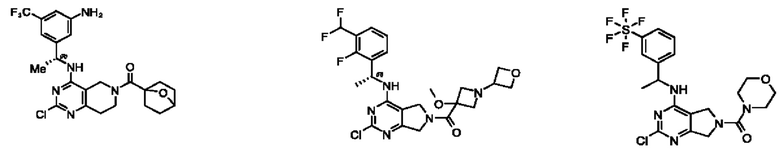

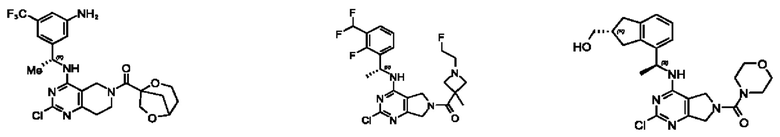
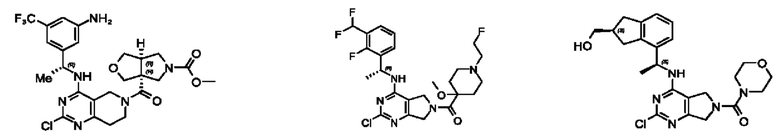
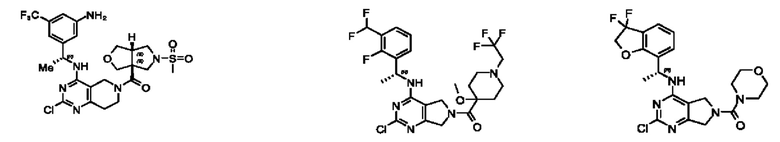
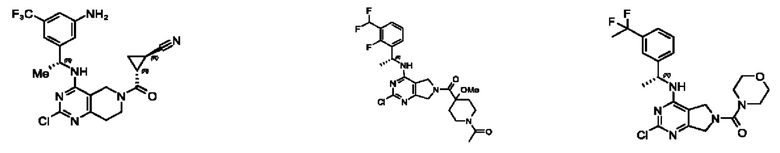
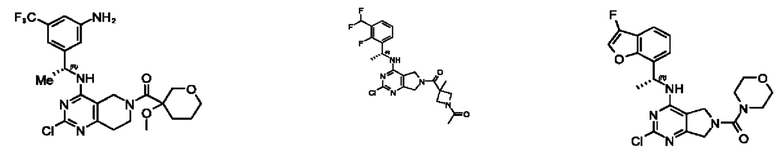
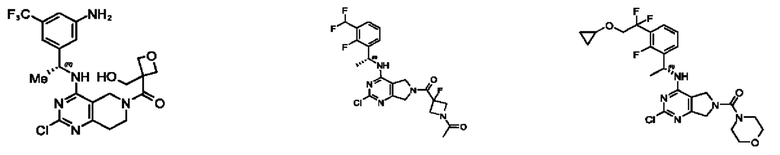
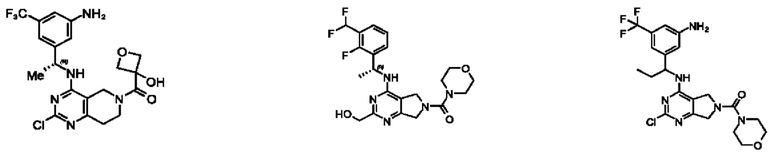
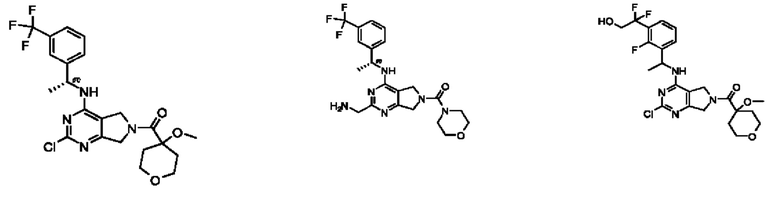
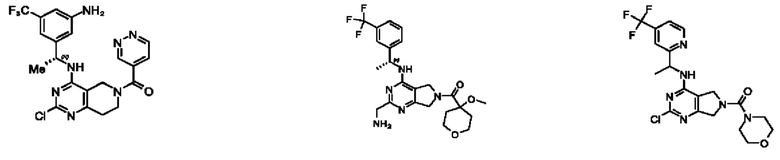
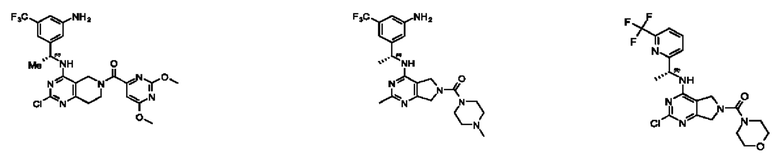
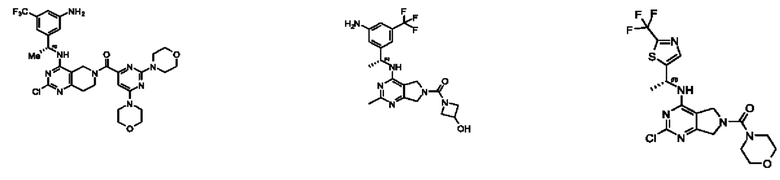
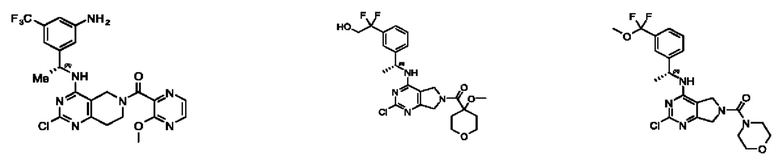
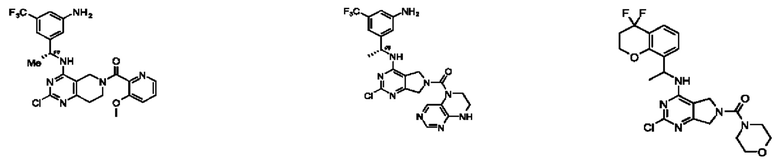
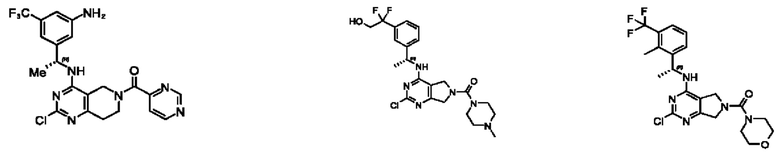
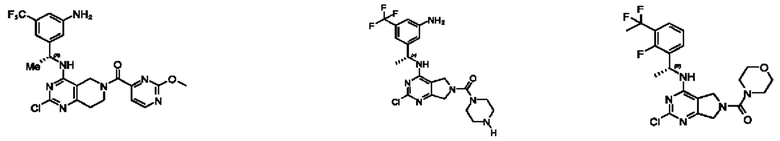
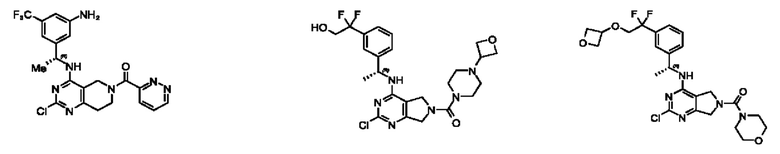
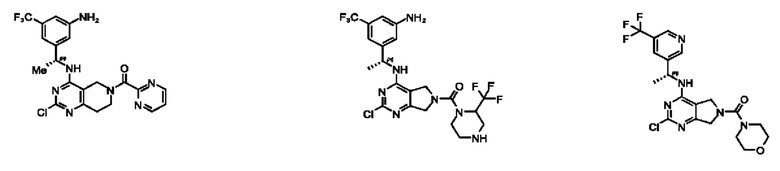
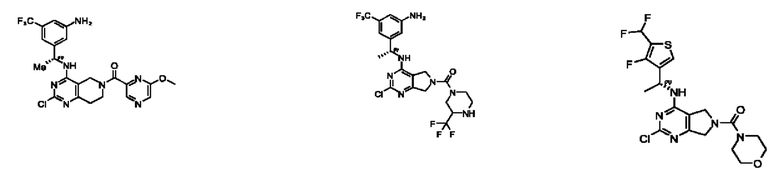
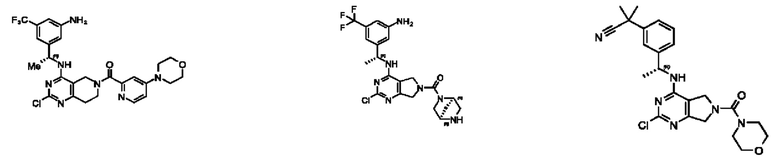
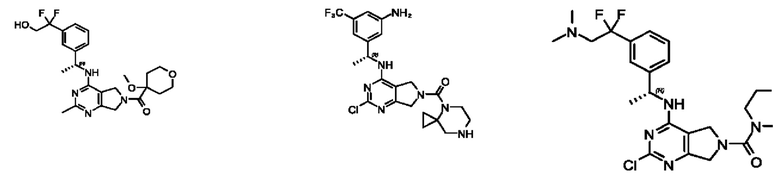
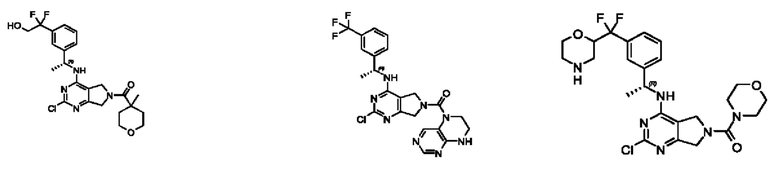
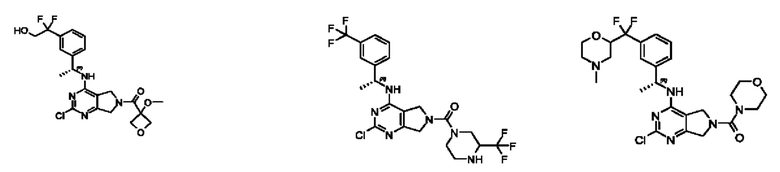
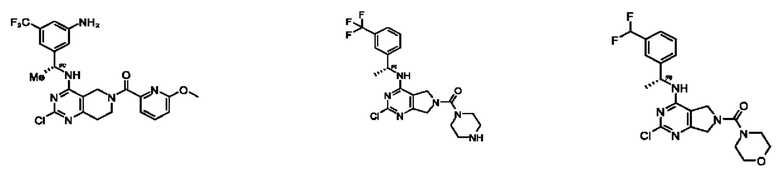
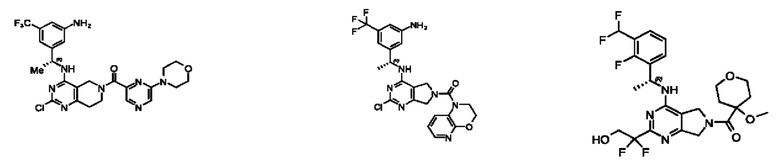
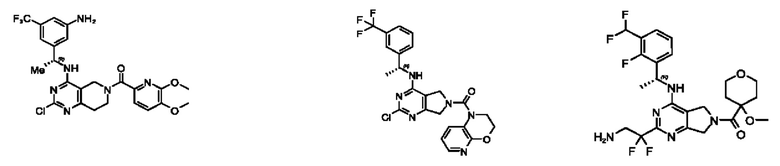
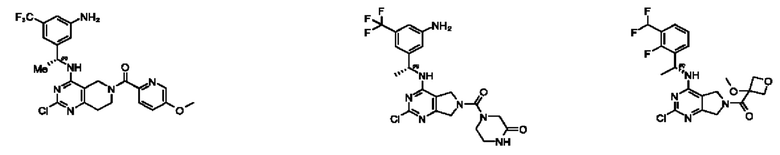
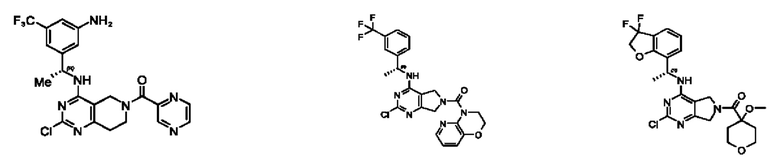
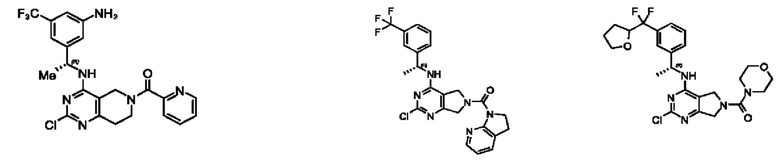
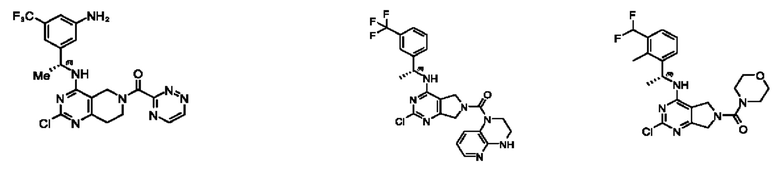
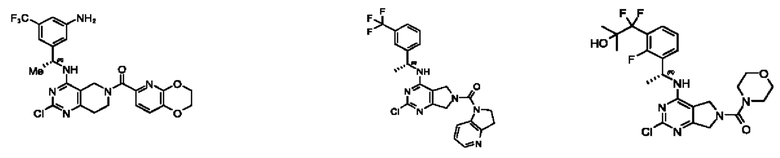
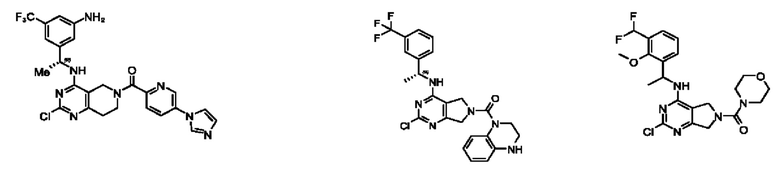
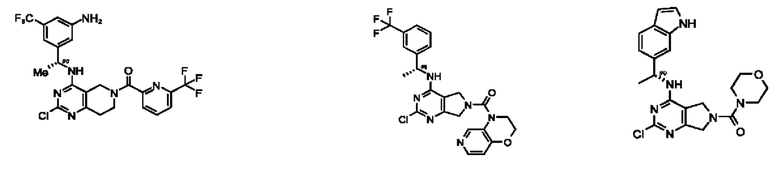
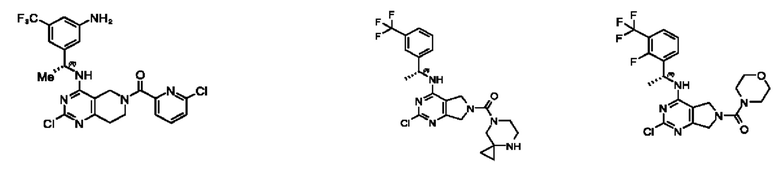
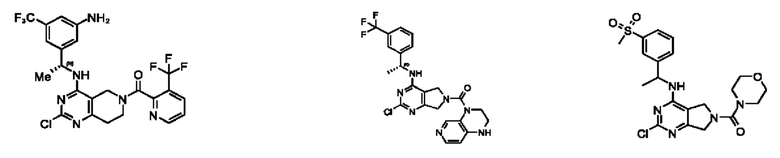
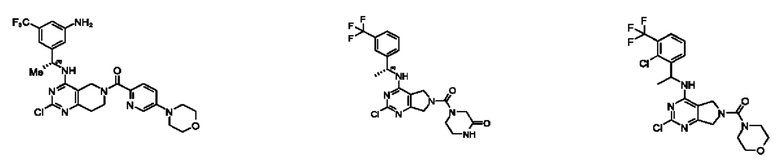
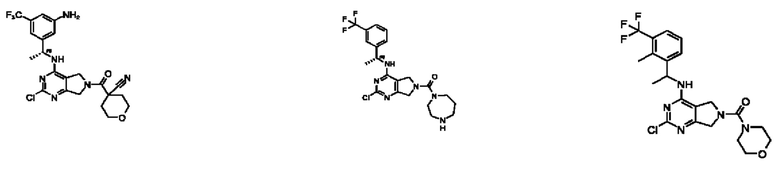
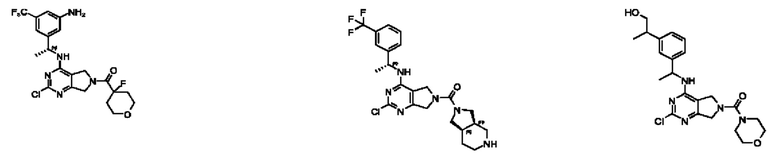
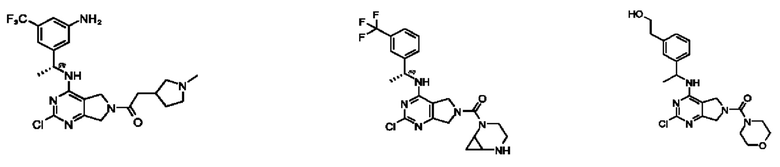
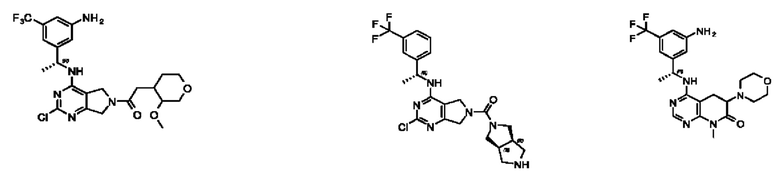
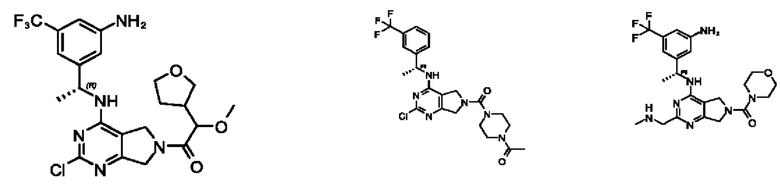
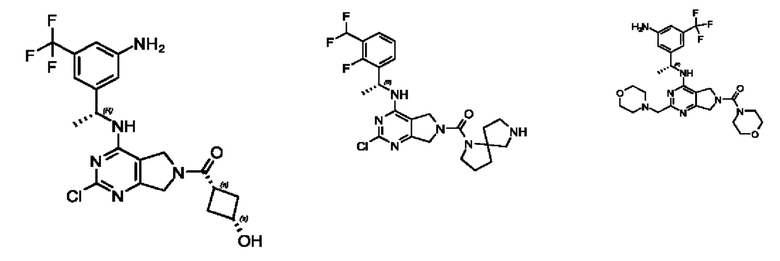
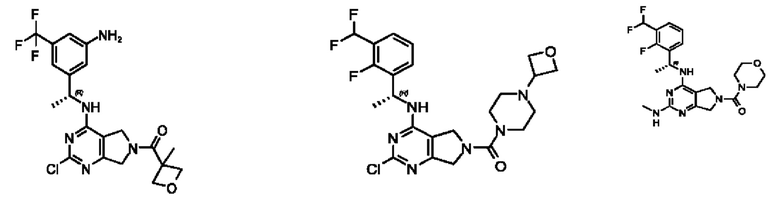
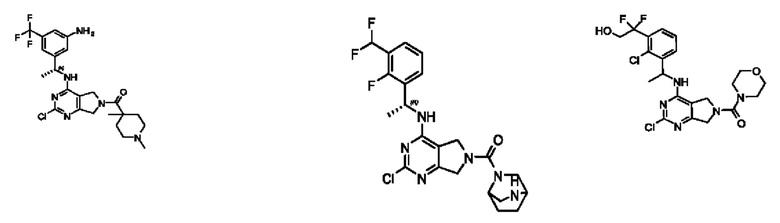
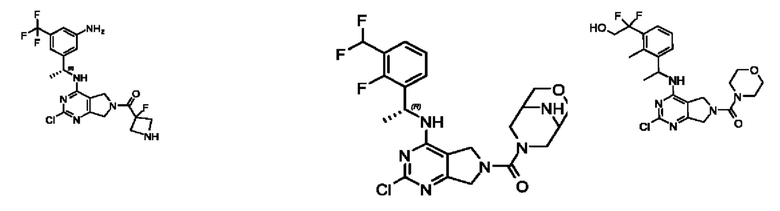
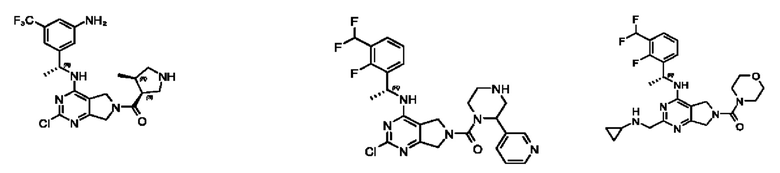
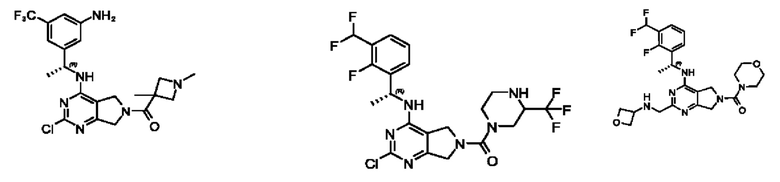
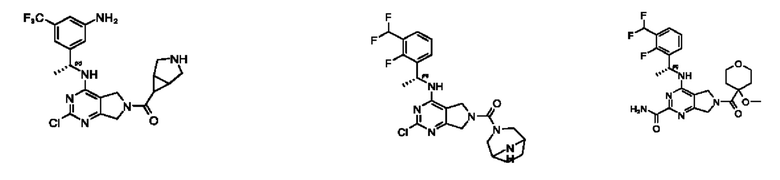
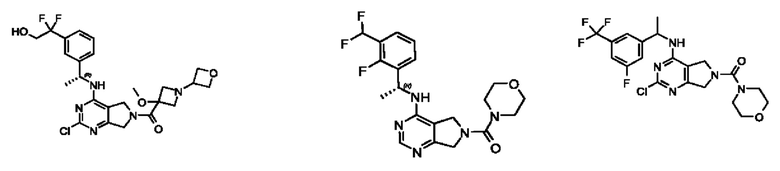
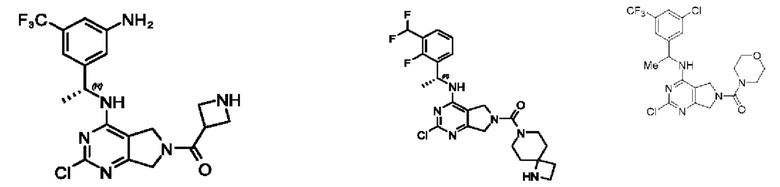

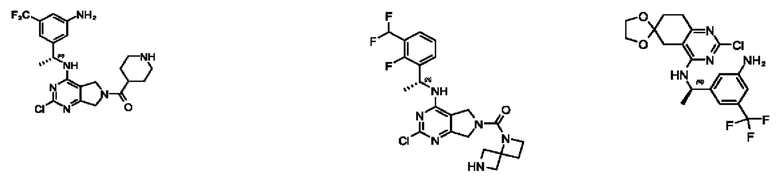
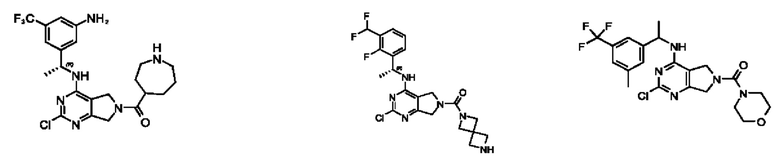
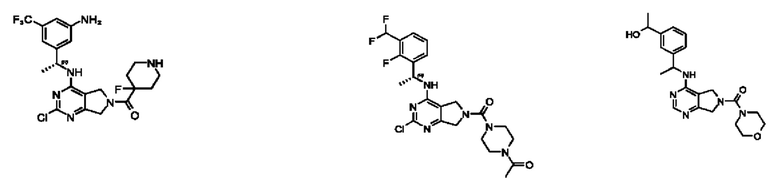
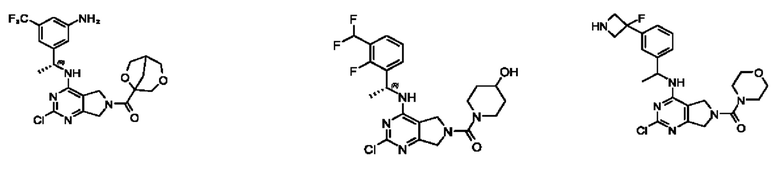
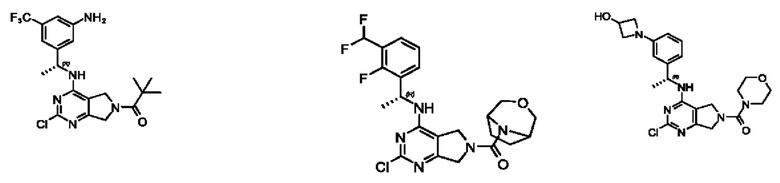
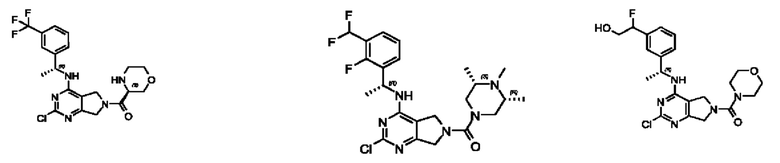
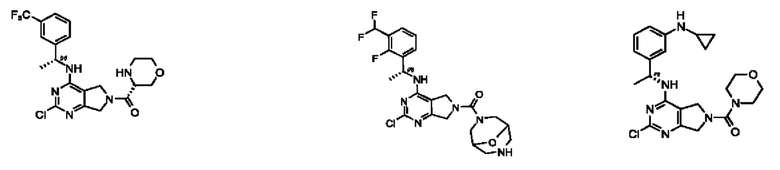
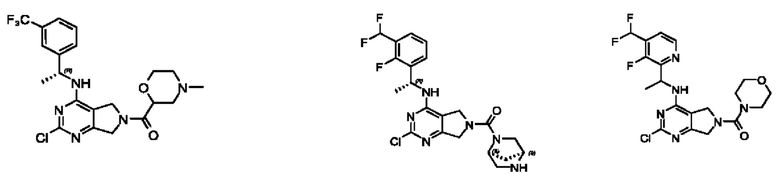
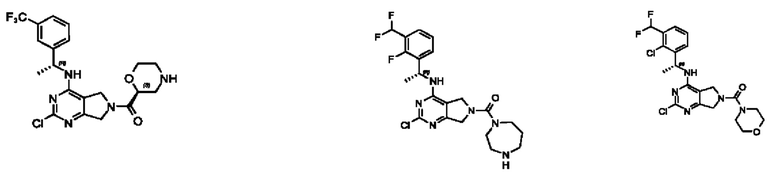
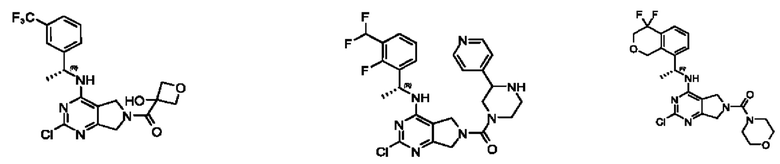
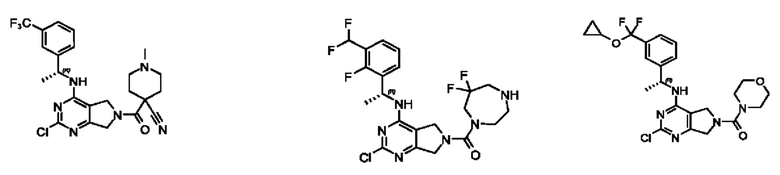
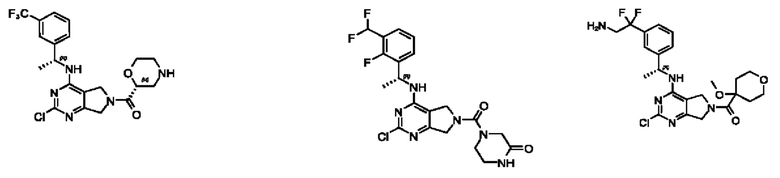
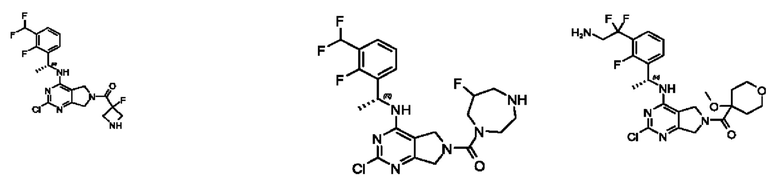
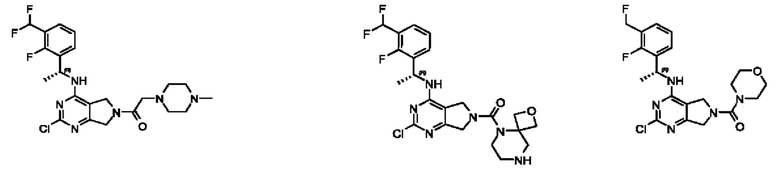
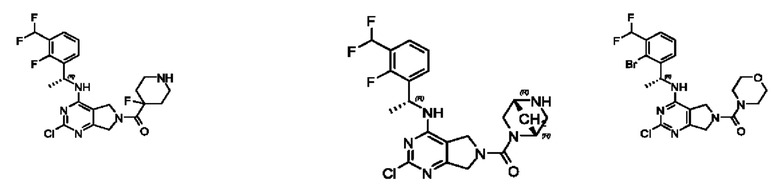
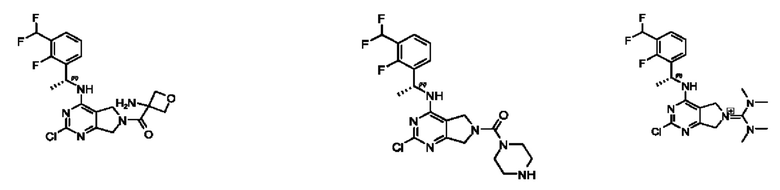
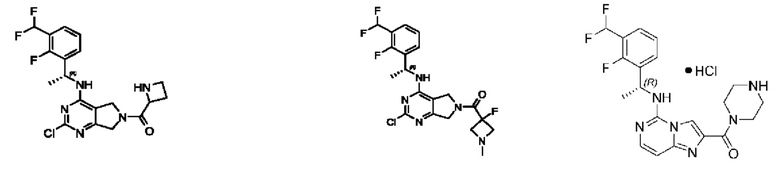
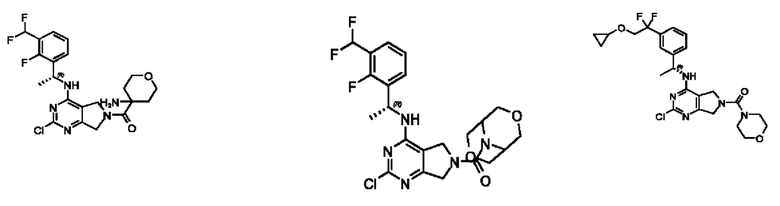
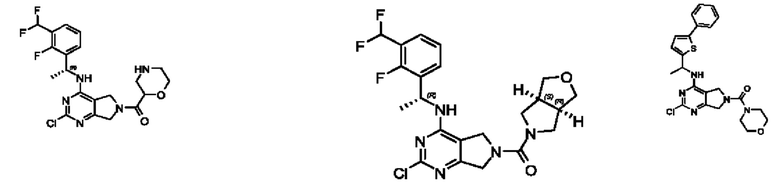
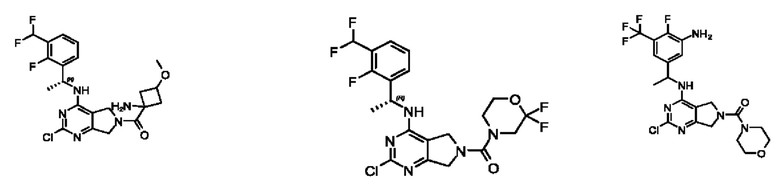
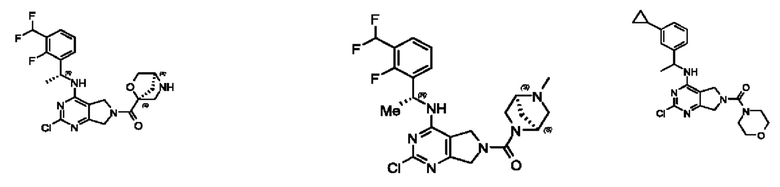
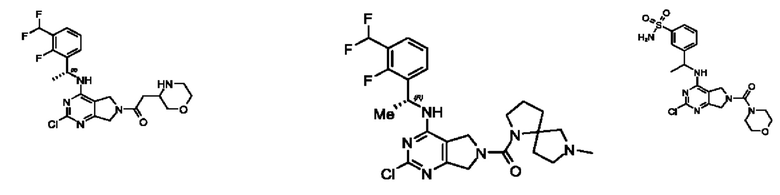
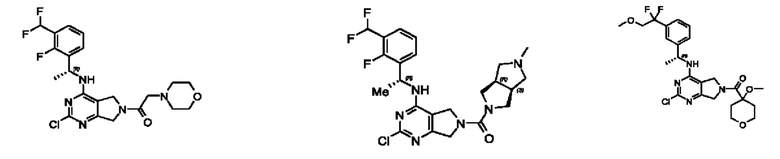
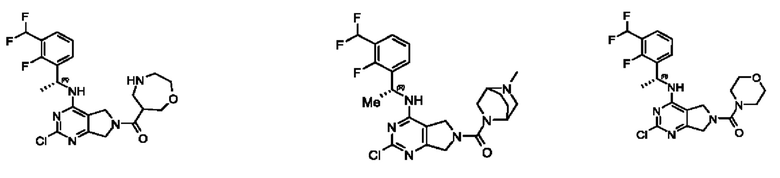
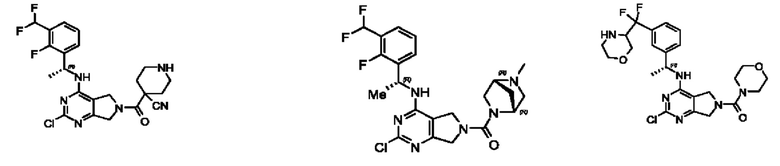
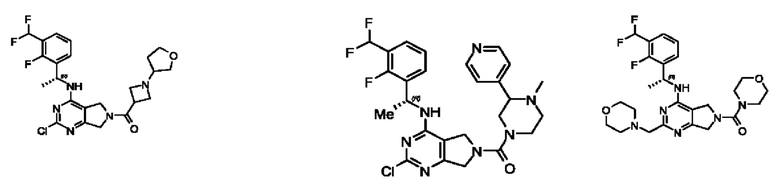
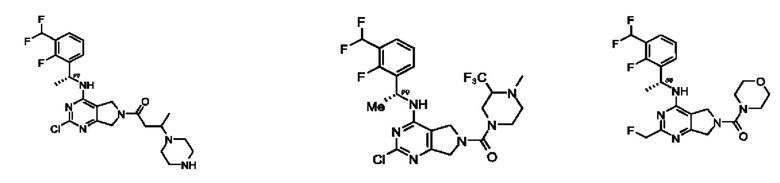
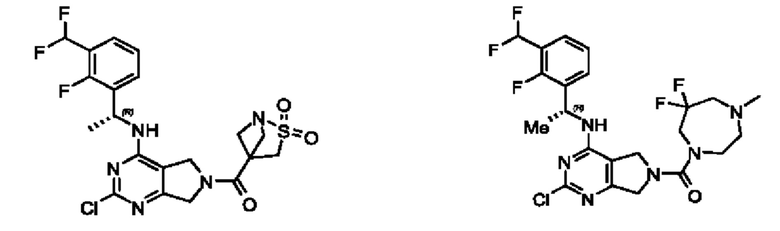
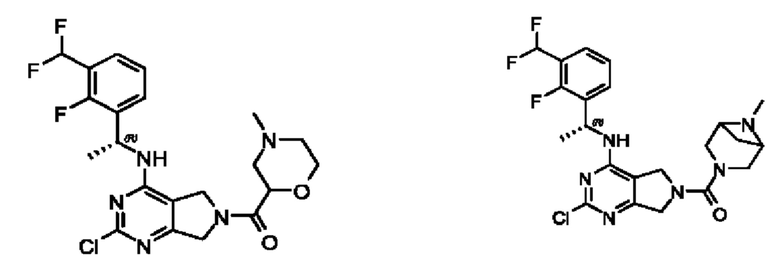
Способы синтеза описанных соединений
[00181] Соединения по настоящему изобретению можно получать рядом способов, включая стандартную химию. Подходящие пути синтеза изображены на схемах, приведенных ниже.
[00182] Соединения любой из описанных в данном документе формул можно получать способами, известными в области органического синтеза, частично приведенными на следующих схемах синтеза и в примерах. Понятно, что на описанных ниже схемах при необходимости применяют защитные группы для чувствительных или реакционноспособных групп в соответствии с общими принципами или химией. С защитными группами работают в соответствии со стандартными способами органического синтеза (Т.W. Greene and P.G.M. Wilts, "Protective Groups in Organic Synthesis", Third edition, Wiley, New York 1999). Эти группы удаляют на подходящей стадии синтеза соединения, используя способы, которые легко доступны для специалиста в данной области техники. Процессы отбора, а также реакционные условия и порядок их проведения должны быть сопоставимыми с получением соединений любой формулы, описанных в данном документе.
[00183] Специалистам в данной области техники будет понятно, существует ли стереоцентр в любом из соединений по настоящему изобретению. Соответственно, настоящее изобретение включает оба возможных стереоизомера (если это не указано в синтезе) и включает не только рацемические соединения, но также и отдельные энантиомеры и/или диастереомеры. Если соединение необходимо в виде одного энантиомера или диастереомера, его можно получить посредством стереоспецифического синтеза или посредством разделения конечного продукта или любого подходящего промежуточного соединения. Разделение конечного продукта, промежуточного соединения или исходного материала можно проводить любым подходящим способом, известным в данной области техники. Смотрите, например, "Stereochemistry of Organic Compounds" авторства E.L. Eliel, S.H. Wilen, and L.N. Mander (Wiley-Interscience, 1994).
Получение соединений
[00184] Описанные в данном документе соединения можно получать из коммерчески доступных исходных материалов или синтезировать, используя известные органические, неорганические и/или ферментативные процессы.
[00185] Соединения по настоящему изобретению можно получать рядом способов, хорошо известных специалистам в области органического синтеза. В качестве примера соединения по изобретению можно синтезировать, используя описанные ниже способы, вместе со способами синтеза, известными в области синтетической органической химии, или их вариации, что очевидно для специалистов в данной области техники. Эти способы включают, но не ограничиваются этим, способы, описанные ниже.
Схема 1. Общий синтез 4-(бензиламино)-5,7-дигидро-6Н-пирроло[3,4-d]пиримидин-6-карбоксамида
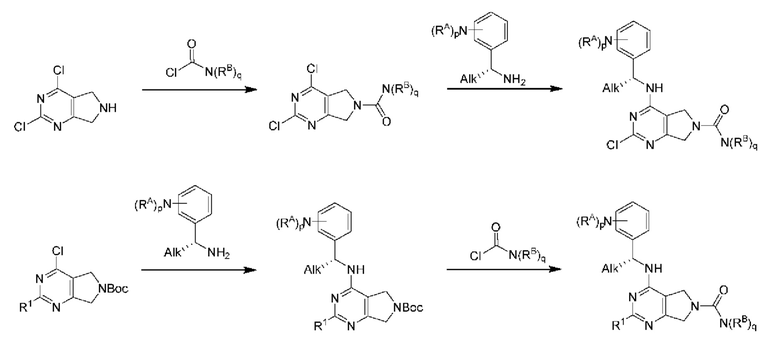
[00186] Общий синтез 4-(бензиламино)-2-хлоро-5,7-дигидро-6Н-пирроло[3,4-d]пиримидин-6-карбоксамидов приведен на схеме 1. 2,4-дихлор-6,7-дигидро-5Н-пирроло[3,4-d]пиримидин или аналогичное соответствующим образом замещенное галогенированное гетероциклическое кольцо можно сопрягать с замещенным хлорангидридом карбаминовой кислоты в присутствии органического основания (например, ДИЭА). Потом полученную в результате промежуточную мочевину можно сопрягать с замещенным бензиламином с получением 5,7-дигидро-6Н-пирроло[3,4-d]пиримидин-6-карбоксамида. Для получения конечного соединения могут потребоваться дополнительные этапы снятия защиты и/или функционализации.
[00187] В альтернативном варианте соответствующим образом защищенные 4-(бензиламино)-2-алкил-5,7-дигидро-6Н-пирроло[3,4-d]пиримидин-6-карбоксамиды можно синтезировать из 2-хлор-4-алкил-6,7-дигидро-5Н-пирроло[3,4-d]пиримидина или аналогичного соответствующим образом замещенного галогенированного гетероциклическое кольца, которое сопрягают с бензиламином в присутствии основания, с последующим снятием защиты. Последующее сопряжение с соответствующим образом замещенным хлорангидридом карбаминовой кислоты в присутствии органического основания (например, ДИЭА) приводит в образованию мочевины. Для получения конечного соединения могут потребоваться дополнительные этапы снятия защиты и/или функционализации.
Схема 2. Общий синтез 1-(4-(бензиламино)-2-хлор-5,7-дигидро-6Н-пирроло[3,4-d]пиримидин-6-ил)амидов
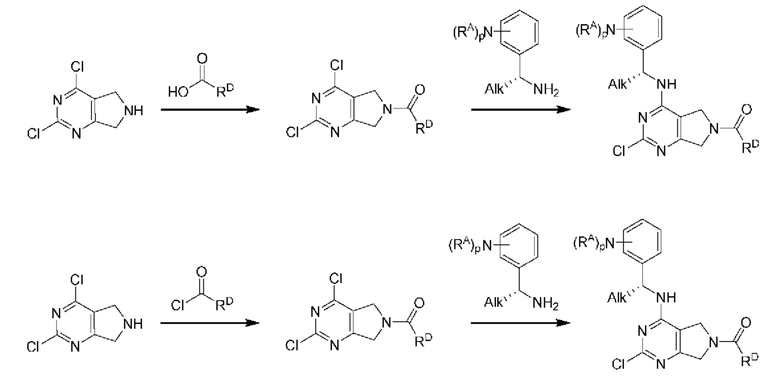
[00188] Общий синтез 1-(4-(бензиламино)-2-хлор-5,7-дигидро-6Н-пирроло[3,4-d]пиримидин-6-ил)амидов приведен на схеме 2. 2,4-дихлор-6,7-дигидро-5Н-пирроло[3,4-d]пиримидин или аналогичное соответствующим образом замещенное галогенированное гетероциклическое кольцо можно сопрягать с замещенной карбоновой кислотой в присутствии связующих агентов (например, ТЗР). Потом полученный в результате промежуточный амид можно сопрягать с замещенным бензиламином с получением 5,7-дигидро-6Н-пирроло[3,4-d]пиримидин-6-ил-амида. Для получения конечного соединения могут потребоваться дополнительные этапы снятия защиты и/или функционализации.
[00189] В альтернативном варианте 1-(4-(бензиламино)-2-хлор-5,7-дигидро-6Н-пирроло[3,4-d]пиримидин-6-ил)амиды можно синтезировать из 2,4-дихлор-6,7-дигидро-5Н-пирроло[3,4-d]пиримидина или аналогичного соответствующим образом замещенного галогенированного гетероциклическое кольца, сопряженного с хлоридом карбоновой кислоты в присутствии органического основания (например, ДИЭА). Потом полученный в результате промежуточный амид можно сопрягать с замещенным бензиламином с получением 5,7-дигидро-6Н-пирроло[3,4-d]пиримидин-6-ил-амида. Для получения конечного соединения могут потребоваться дополнительные этапы снятия защиты и/или функционализации.
Схема 3. Общий синтез N-бензил-2-хлор-6-алкил-6,7-дигидро-5Н-пирроло[3,4-d]пиримидин-4-амина.
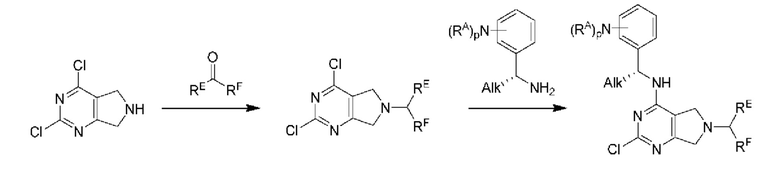
[00190] Общий синтез N-бензил-2-хлор-6-алкил-6,7-дигидро-5Н-пирроло[3,4-d]пиримидин-4-аминов приведен на схеме 3. 2,4-дихлор-6,7-дигидро-5Н-пирроло[3,4-d]пиримидин или аналогичное соответствующим образом замещенное галогенированное гетероциклическое кольцо можно сопрягать с замещенным кетоном в присутствии восстанавливающего агента (например, NaBH(ОАс)3). Потом полученный в результате промежуточный алкил можно сопрягать с замещенным бензиламином с получением N-бензил-6-алкил-6,7-дигидро-5Н-пирроло[3,4-d]пиримидин-4-амина. Для получения конечного соединения могут потребоваться дополнительные этапы снятия защиты и/или функционализации.
[00191] В настоящем изобретении предложено соединение формулы Int-I:

и его соли, пролекарства, сольваты, гидраты, таутомеры и изомеры, где:
X1 представляет собой F, Cl, Br или I;
X2 представляет собой F, Cl, Br или I.
Q1 и Q2 независимо представляют собой СН или N;
каждый из Q3 и Q5 независимо представляет собой C(RQC)2, NRQN, CO; O или SO2, где каждый RQC независимо представляет собой Н, F, Cl, Br или арил, а каждый RQN независимо представляет собой Н, C1-6 алкил или арил;
Q4 представляет собой СН или N;
где по меньшей мере один из Q1, Q2, Q3, Q4 и Q5 представляет собой N, NRQN, О или SO2;
m равно 0, 1, 2 или 3;
n равно 0, 1, 2 или 3;
причем если m равно 0, то n не равно 0;
L2 представляет собой связь, -С(O)-, -С(O)O-, -C(O)NH(CH2)o-, -S(O)2-, -С(O)(СН2)р-, -(СН2)р- или -O-; где о равно 0, 1 или 2; и где р представляет собой число от 1 до 6;
R2 представляет собой Н, -(CH2)qCH3, циклоалкил, циклоалкенил, гетероциклил, арил, гетероарил; где q представляет собой число от 1 до 5; где каждый циклоалкил, циклоалкенил, гетероциклил, арил или гетероарил необязательно замещен одним или более C1-6 алкилом, -ОН, галогеном, -C(O)R2a или -C(O)NR2bR2c; где R2a представляет собой C1-6 алкил или -(СН2)rOCH3, где r равно 1, 2 или 3; где R2b представляет собой Н или C1-6 алкил;
и где R2c представляет собой Н или C1-6 алкил.
[00192] В настоящем изобретении предложено соединение формулы Int-Ia:
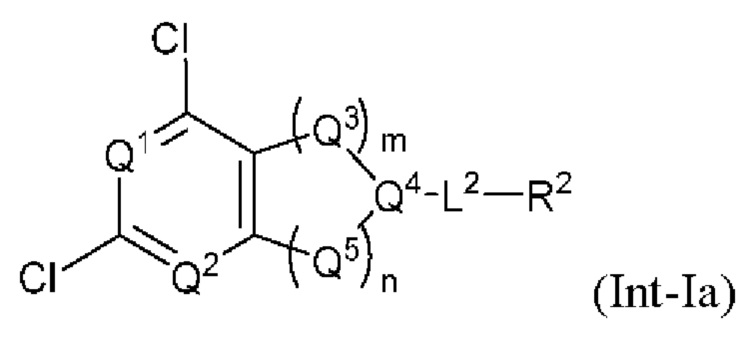
и его соли, пролекарства, сольваты, гидраты, таутомеры и изомеры, где:
Q1 и Q2 независимо представляют собой СН или N;
каждый из Q3 и Q5 независимо представляет собой C(RQC)2, NRQN, CO, O или SO2, где каждый RQC независимо представляет собой Н, F, Cl, Br или арил, а каждый RQN независимо представляет собой Н, C1-6 алкил или арил;
Q4 представляет собой СН или N;
где по меньшей мере один из Q1, Q2, Q3, Q4 и Q5 представляет собой N, NRQN, О или SO2;
m равно 0, 1, 2 или 3;
n равно 0, 1, 2 или 3;
причем если m равно 0, то n не равно 0;
L2 представляет собой связь, -С(O)-, -С(O)O-, -C(O)NH(CH2)o-, -S(O)2-, -С(O)(СН2)р-, -(СН2)р- или -O-; где о равно 0, 1 или 2; и где р представляет собой число от 1 до 6;
R2 представляет собой Н, -(CH2)qCH3, циклоалкил, циклоалкенил, гетероциклил, арил, гетероарил; где q представляет собой число от 1 до 5; где каждый циклоалкил, циклоалкенил, гетероциклил, арил или гетероарил необязательно замещен одним или более C1-6 алкилом, -ОН, галогеном, -C(O)R2a или -C(O)NR2bR2c; где R2a представляет собой C1-6 алкил или -(СН2)rOCH3.
[00193] В настоящем изобретении предложено соединение и его соли; сольваты, стереоизомеры и таутомеры, выбранные из группы, состоящей из:
 и
и  В настоящем изобретении предложено соединение и его соли, сольваты, стереоизомеры и таутомеры, имеющее формулу:
В настоящем изобретении предложено соединение и его соли, сольваты, стереоизомеры и таутомеры, имеющее формулу:
Терапевтическое применение
[00194] Благодаря своим биологическим свойствам соединения по настоящему изобретению, их таутомеры, рацематы, энантиомеры, диастереомеры, их смеси и соли всех вышеупомянутых форм могут быть пригодны для лечения заболеваний, характеризуемых избыточной или аномальной клеточной пролиферацией, таких как рак.
[00195] Например, с помощью соединений по настоящему изобретению можно лечить, без ограничения ими, следующие виды рака, опухолей и других пролиферативных заболеваний:
[00196] раки/опухоли/карциномы головы и шеи: например, раки/опухоли/карциномы носовой полости, придаточных пазух носа, носоглотки, ротовой полости (включая губы, десна, альвеолярный гребень, ретромолярный треугольник, дно ротовой полости, язык, твердое небо, слизистую оболочку рта), ротоглотки (включая основание языка, гланды, миндаликовые волоски, мягкое небо, миндаликовая пазуху, стенку глотки), среднего уха, гортани (включая преддверие полости гортани, голосовую щель, подголосовую полость, голосовые связки), гортаноглотки, слюнных желез (включая малые слюнные железы); внутриглазные раки (например, увеальную меланому) и глазные и придаточные раки;
[00197] раки/опухоли/карциномы легкого: например, немелкоклеточный рак легкого (НМРЛ) (плоскоклеточную карциному, веретеноклеточную карциному, аденокарциному, крупноклеточную карциному, светлоклеточную карциному, бронхоальвеолярную карциному), мелкоклеточный рак легкого (МРЛ) (овсяноклеточный рак, рак из промежуточных клеток, комбинированный овсяноклеточный рак);
[00198] новообразования средостения: например, нейрогенные опухоли (включая нейрофиброму, неврилемому, злокачественную шванному, нейросаркому, ганглионейробластому, ганглионеврому, нейробластому, феохромоцитому, параганглиому), герминогенные опухоли (включая семиному, тератому, несеминому), опухоли вилочковой железы (включая тимому, тимолипому, карциному вилочковой железы, карциноид вилочковой железы), мезенхимальные опухоли (включая фиброму, фибросаркому, липому, липосаркому, миксому, мезотелиому, лейомиому, лейомиосаркому, рабдомиосаркому, ксантогранулему, мезенхимому, гемангиому, гемангиоэндотелиому, гемангиоперицитому, лимфангиому, лимфангиоперицитому, лимфангиомиому), астроцитому (церебральную, церебеллярную, диффузную, фибриллярную, анапластическую, пилоцитарную, протоплазматическую, гемистоцитарную), глиобластому, глиомы, олигодендроглиомы, олигоастроцитомы, эпендимомы, эпендимобластомы, опухоли хориоидного сплетения, медуллобластомы, менингиомы, шванномы, гемангиобластомы, гемангиомы, гемангиоперицитомы, невромы, ганглионевромы, нейробластомы, ретинобластомы, невриномы (например, слуховые), опухоли оси позвоночника;
[00199] раки/опухоли/карциномы желудочно-кишечного (ЖК) тракта: например, опухоли/карциномы/раки пищевода, желудка (рак желудка), поджелудочной железы, печени и желчных протоков (включая гепатоцеллюлярную карциному (ГЦК), например, детскую ГЦК, фиброламеллярную ГЦК, комбинированную ГЦК, веретеноклеточную ГЦК, светлоклеточную ГЦК, гигантоклеточную ГЦК, карциносаркому ГЦК, склерозирующую ГЦК; гепатобластому; холангиокарциному; холангиоцеллюлярную карциному; цистаденокарциному печени; ангиосаркому, гемангиоэндотелиому, лейомиосаркому, злокачественную шванному, фибросаркому, опухоль Клатскина), желчного пузыря, внепеченочных желчных протоков, тонкого кишечника (включая двенадцатиперстную кишку, тонкую кишку, подвздошную кишку), толстого кишечника (включая слепую кишку, толстую кишку, прямую кишку, анус; колоректальный рак, опухоль желудочно-кишечной стромы (ОЖКС)), мочеполовой системы (в том числе почки, например, почечной лоханки, почечно-клеточную карциному (ПКК), нефробластому (опухоль Вильмса), гипернефрому, опухоль Гравитца; мочеточника; мочевого пузыря, например, рак мочевого протока, рак уротелия; уретры, например, дистальный, бульбомембранозный, простатический; предстательной железы (андрогензависимый, андроген-независимый, кастрационно-резистентный, гормонально-независимый, гормонально-рефрактерный), полового члена);
[00200] раки/опухоли/карциномы яичка: например, семиномы, несеминомы;
[00201] гинекологические раки/опухоли/карциномы: например, опухоли/карциномы/раки яичника, фаллопиевой трубы, брюшной полости, шейки матки, вагины, тела матки (в том числе эндометрия, дна матки);
[00202] раки/опухоли/карциномы молочной железы: например, карциному молочной железы (инфильтративно-протоковую, коллоидную, лобулярно-инвазивную, тубулярную, аденокистозную, папиллярную, медуллярную, муцинозную), гормон-рецептор-положительный рак молочной железы (эстроген-рецептор-положительный рак молочной железы, прогестерон-рецептор-положительный рак молочной железы), HER2-положительный рак молочной железы, трижды негативный рак молочной железы, болезнь Педжета молочной железы;
[00203] раки/опухоли/карциномы эндокринной системы: например, опухоли/карциномы/раки эндокринных желез, щитовидной железы (карциномы/опухоли щитовидной железы; папиллярные, фолликулярные, анапластические, медуллярные), паращитовидной железы (карциномы/опухоли паращитовидной железы), коры надпочечников (карциномы/опухоли коры надпочечников), гипофиза (включая пролактиному, краниофарингиому), вилочковой железы, надпочечников, эпифиза, каротидной железы, опухоли из островков поджелудочной железы, параганглия, панкреатические эндокринные опухоли (ПЭО; нефункциональные ПЭО, опухоль из РР-клеток, гастриному, инсулиному, ВИПому, глюкагоному, соматостатиному, СРФому, АКТому), карциноидные опухоли;
[00204] саркомы мягких тканей: например, фибросаркому, фиброзную гистиоцитому, липосаркому, лейомиосаркому, рабдомиосаркому, ангиосаркому, лимфангиосаркому, саркому Капоши, гломусную опухоль, гемангиоперицитому, синовиальную саркому, гигантоклеточную опухоль сухожильных влагалищ, солитарную фиброзную опухоль плевры и брюшной полости, диффузную мезотелиому, злокачественную опухоль оболочек периферических нервов (ЗООПН), зернистоклеточную опухоль, светлоклеточную саркому, меланоцитарную шванному, плексосаркому, нейробластому, ганглионейробластому, нейроэпителиому, внескелетную саркому Юинга, параганглиому, внескелетную хондросаркому, внескелетную остеосаркому, мезенхимому, альвеолярную саркому мягких тканей, эпителиоидную саркому, внепочечную рабдоидную опухоль, десмопластическую мелкоклеточную опухоль;
[00205] саркомы кости: например, миелому, ретикулоклеточную саркому, хондросаркому (включая центральную, периферическую, светлоклеточную, мезенхимальную хондросаркому), остеосаркому (включая паростальную, периостальную, низкодифференцированную поверхностную, мелкоклеточную, индуцированную облучением остеосаркому, саркому Педжета), опухоль Юинга, злокачественную гигантоклеточную опухоль, адамантиному, (фиброзную) гистиоцитому, фибросаркому, хордому, мелко- и круглоклеточную саркому, гемангиоэндотелиому, гемангиоперицитому, остеохондрому, остеоид-остеому, остеобластому, эозинофильную гранулему, хондробластому;
[00206] мезотелиому: например, плевральную мезотелиому, брюшинную мезотелиому;
[00207] раки кожи: например, базальноклеточную карциному, плоскоклеточную карциному, карциному из клеток Меркеля, меланому (включая кожную, поверхностную распространяющуюся, злокачественное лентиго, акральную лентигинозную, нодулярную, интраокулярную меланому), актинический кератоз, рак века;
[00208] новообразования периферической и центральной нервной системы и головного мозга: например, астроцитому (церебральную, церебеллярную, диффузную, фибриллярную, анапластическую, пилоцитарную, протоплазматическую, гемистоцитарную), глиобластому, глиомы, олигодендроглиомы, олигоастроцитомы, эпендимомы, эпендимобластомы, опухоли хориоидного сплетения, медуллобластомы, менингиомы, шванномы, гемангиобластомы, гемангиомы, гемангиоперицитомы, невромы, ганглионевромы, нейробластомы, ретинобластомы, невриномы (например, слуховые), опухоли оси позвоночника, нейрогенные опухоли (включая нейрофиброму, неврилемому, злокачественную шванному, нейросаркому, ганглионейробластому, ганглионеврому, нейробластому, феохромоцитому, параганглиому), герминогенные опухоли (включая семиному, тератому, несеминому), опухоли вилочковой железы (включая тимому, тимолипому, карциному вилочковой железы, карциноид вилочковой железы), мезенхимальные опухоли (включая фиброму, фибросаркому, липому, липосаркому, миксому, мезотелиому, лейомиому, лейомиосаркому, рабдомиосаркому, ксантогранулему, мезенхимому, гемангиому, гемангиоэндотелиому, гемангиоперицитому, лимфангиому, лимфангиоперицитому, лимфангиомиому);
[00209] лимфомы и лейкозы: например, В-клеточные неходжкинские лимфомы (НХЛ) (включая мелкоклеточную лимфоцитарную лимфому (МЛЛ), лимфоплазмацитоидную лимфому (ЛПЛ), мантийноклеточную лимфому (МКЛ), фолликулярную лимфому (ФЛ), дифузную крупноклеточную лимфому (ДККЛ), лимфому Беркитта (ЛБ)), лейкоз Беркитта, Т-клеточные неходжкинские лимфомы (включая анапластическую крупноклеточную лимфому (АККЛ), Т-клеточный лейкоз/лимфому взрослых (ТЛЛВ), кожную Т-клеточную лимфому (КТКЛ), периферическую Т-клеточную лимфому (ПТКЛ)), лимфобластную Т-клеточную лимфому (Т-ЛБЛ), Т-клеточную лимфому взрослых, лимфобластную В-клеточную лимфому (В-ЛБЛ), иммуноцитому, хронический В-клеточный лимфоцитарный лейкоз (В-ХЛЛ), хронический Т-клеточный лимфоцитарный лейкоз (Т-ХЛЛ) В-мелкоклеточную лимфоцитарную лимфому (В-МКЛ), кожную Т-клеточную лимфому (CTLC), первичную лимфому центральной нервной системы (ПЛЦНС), иммунобластому, болезнь Ходжкина (БХ) (включая нодулярную БХ с лимфоидным преобладанием (НБХЛП), БХ с нодулярным склерозом (БХНС), БХ со смешанной целлюлярностью (БХСЦ), богатую лимфоцитами классическую БХ, БХ с лимфоидным истощением (БХЛИ)), лейкоз из больших гранулярных лейкоцитов (БГЛ), хронический миелогенный лейкоз (ХМЛ), острый миелогенный/миелоидный лейкоз (ОМЛ), острый лимфатический/лимфобластный лейкоз (ОЛЛ), острый промиелоцитарный лейкоз (ОПЛ), хронический лимфоцитарный/лимфатический лейкоз (ХЛЛ), пролимфоцитарный лейкоз (ПЛЛ), волосатоклеточный лейкоз, хронический миелогенный/миелоидный лейкоз (ХМЛ), миелому, плазмацитому, множественную миелому (ММ), плазмацитому, миелодиспластический синдром (МДС), хронический миеломоноцитарный лейкоз (ХММЛ), ЮММЛ (ювенильный миеломоноцитарный лейкоз), острый лейкоз неопределенного происхождения, миелопролиферативные новообразования, бластное плазмацитоидное дендритное клеточное новообразование, лейкоз из ранних предшественников Т-клеток, лейкоз/лимфому естественных клеток-киллеров, миелоидные/лимфоидные новообразования с эозинофилией, миелоидную саркому, транзиторный аномальный миелопоэз; и
[00210] раки без выявленного первичного очага (РБПО).
[00211] Подразумевается, что все раки/опухоли/карциномы, упомянутые выше, которые характеризуются определенным расположением/происхождением в организме, включают как первичные опухоли, таки и возникшие из них метастатические опухоли.
[00212] Все раки/опухоли/карциномы, упомянутые выше, можно дополнительно различать по их гистопатологической классификации:
[00213] эпителиальные раки, например, плоскоклеточная карцинома (ПКК) (карцинома in situ, поверхностно инвазивная, веррукозная карцинома, псевдосаркома, анапластическая, переходно-клеточная, лимфоэпителиальная), аденокарцинома (АК) (хорошо дифференцированная, муцинозная, папиллярная, плейоморфная гигантоклеточная, протоковая, мелкоклеточная, перстневидно-клеточная, веретеноклеточная, светлоклеточная, овсяноклеточная, коллоидная, железисто-плоскоклеточная, мукоэпидермоидная, аденокистозная), муцинозная цистаденокарцинома, ацинарно-клеточная карцинома, крупноклеточная карцинома, мелкоклеточная карцинома, нейроэндокринные опухоли (мелкоклеточная карцинома, параганглиома, карциноид); онкоцитарная карцинома; и
[00214] неэпителиальные и мезенхимальные раки, например, саркомы (фибросаркома, хондросаркома, рабдомиосаркома, лейомиосаркома, гемангиосаркома, гигантоклеточная саркома, лимфосаркома, фиброзная гистиоцитома, липосаркома, ангиосаркома, лимфангиосаркома, нейрофибросаркома), лимфома, меланома, герминогенные опухоли, гематологические новообразования, смешанные и недифференцированные карциномы.
[00215] Соединения по настоящему изобретению можно применять в терапевтических схемах в контексте лечения первой линии, второй линии или любой другой последующей линии.
[00216] Соединения по изобретению можно применять для предотвращения, краткосрочного или долгосрочного лечения вышеупомянутых заболеваний, необязательно также в комбинации с лучевой терапией, и/или хирургическим вмешательством, и/или другими соединениями.
[00217] Конечно, вышесказанное также включает применение соединений по настоящему изобретению в различных способах лечения вышеуказанных заболеваний путем введения нуждающемуся в этом пациенту терапевтически эффективной дозы, а также применение этих соединений для производства лекарственных средств для лечения таких заболеваний, а также фармацевтических композиций, содержащих такие соединения по изобретению, а также изготовления и/или производства лекарственных средств, содержащих такие соединения по изобретению, и т.п.
Дополнительные способы применения описанных соединений
[00218] Один аспект настоящего изобретения относится к способу ингибирования SOS1 у нуждающегося в этом субъекта, включающему введение субъекту ингибитора SOS1 по настоящему изобретению или его фармацевтически приемлемой соли, сольвата, гидрата, таутомера или изомера.
[00219] Другой аспект настоящего изобретения относится к способу лечения или предотвращения заболевания, которое обусловлено или характеризуется модификацией взаимодействия SOS1 и белка семейства RAS и/или RAC1, у нуждающегося в этом субъекта. Этот способ включает введение пациенту, нуждающемуся в лечении заболеваний или расстройств, связанных с модуляцией SOS1, эффективного количества соединения любой описанной в данном документе формулы или его фармацевтически приемлемой соли, сольвата, изомера, пролекарства или таутомера.
[00220] В определенных вариантах осуществления предложен способ ингибирования взаимодействия SOS1 и белка семейства RAS в клетке или ингибирования взаимодействия SOS1 и RAC1 в клетке, включающий введение в клетку соединения любой описанной в данном документе формулы или его фармацевтически приемлемой соли, сольвата, гидрата, таутомера или изомера и фармацевтически приемлемого носителя.
[00221] В определенных вариантах осуществления предложен способ лечения или предотвращения рака у нуждающегося в этом субъекта, включающий введение субъекту эффективного количества соединения любой описанной в данном документе формулы или его фармацевтически приемлемой соли, сольвата, гидрата, таутомера или изомера.
[00222] В определенных вариантах осуществления заболевание может представлять собой, но не ограничивается этим, рак. В определенных вариантах осуществления заболевание или рак выбраны из группы, состоящей из рака поджелудочной железы, рака легкого, колоректального рака, холангиокарциномы, множественной миеломы, меланомы, рака матки, рака эндометрия, рака щитовидной железы, острого миелоидного лейкоза, ЮММЛ (ювенильного миеломоноцитарного лейкоза), острого лимфобластного лейкоза/лимфомы, лимфом, опухолей центральной и периферической нервной системы, эпителиальной и неэпителиальной опухолей и мезенхимальной опухоли, рака мочевого пузыря, рака уротелия, рака желудка, рака шейки матки, плоскоклеточной карциномы головы и шеи, диффузной В-крупноклеточной лимфомы, рака пищевода, хронического лимфоцитарного лейкоза, гепатоцеллюлярного рака, рака молочной железы, рака яичника, рака предстательной железы, глиобластомы, рака почки и сарком.
[00223] В определенных вариантах осуществления заболевание может представлять собой, но не ограничивается этим, рак. В определенных вариантах осуществления заболевание или рак выбраны из группы, состоящей из рака поджелудочной железы, рака легкого, колоректального рака, холангиокарциномы, множественной миеломы, меланомы, рака матки, рака эндометрия, рака щитовидной железы, острого миелоидного лейкоза, рака мочевого пузыря, рака уротелия, рака желудка, рака шейки матки, плоскоклеточной карциномы головы и шеи, диффузной В-крупноклеточной лимфомы, рака пищевода, хронического лимфоцитарного лейкоза, гепатоцеллюлярного рака, рака молочной железы, рака яичника, рака предстательной железы, глиобластомы, рака почки и сарком.
[00224] В определенных вариантах осуществления заболевание может представлять собой, но не ограничивается этим, RASопатию. В определенных вариантах осуществления RASoпaтия выбрана из группы, состоящей из нейрофиброматоза 1 типа (НФ1), синдрома Нунан (СН), синдрома Нунан с множественным лентигинозом (СНМЛ), синдрома капиллярной мальформации - артериовенозной мальформации (КП-АВМ), синдрома Костелло (СК), кардио-фацио-кожного синдрома (КФК), синдрома Легиуса и наследственного фиброматоза десен.
[00225] Другой аспект настоящего изобретения относится к способу ингибирования SOS1. Этот способ включает введение нуждающемуся в этом пациенту эффективного количества соединения любой описанной в данном документе формулы или его фармацевтически приемлемой соли, сольвата, изомера, пролекарства или таутомера.
[00226] Настоящее изобретение относится к композициям, способным модулировать активность (например, ингибировать) SOS1. Настоящее изобретение также относится к терапевтическому применению таких соединений.
[00227] Описанные соединения можно вводить в эффективных количествах для лечения или предотвращения расстройства и/или предотвращения его развития у субъектов.
[00228] Другой аспект настоящего изобретения относится к соединению любой описанной в данном документе формулы или его фармацевтически приемлемой соли, гидрату, сольвату, пролекарству, стереоизомеру или таутомеру для применения в лечении или предотвращении заболевания, обусловленного модификацией взаимодействия SOS1 и белка семейства RAS и/или RAC1. Другой аспект настоящего изобретения относится к соединению любой описанной в данном документе формулы или его фармацевтически приемлемой соли, гидрату, сольвату, пролекарству, стереоизомеру или таутомеру для применения в лечении или предотвращении заболевания, которое характеризуется ингибированием взаимодействия SOS1 с белком семейства RAS или взаимодействия SOS1 cRAC1.
[00229] Другой аспект настоящего изобретения относится к соединению любой описанной в данном документе формулы или его фармацевтически приемлемой соли, гидрату, сольвату, пролекарству, стереоизомеру или таутомеру для применения в лечении или предотвращении заболевания, причем лечение или предотвращение осуществляется или характеризуется ингибированием взаимодействия SOS1 и белка семейства RAS или ингибированием взаимодействия SOS1 и RA.
[00230] Другой аспект настоящего изобретения относится к соединению любой описанной в данном документе формулы или его фармацевтически приемлемой соли, гидрату, сольвату, пролекарству, стереоизомеру или таутомеру для применения в ингибировании связывания hSOS1 с Н-, или N-, или K-RAS, включая их клинически известные мутации, которое ингибирует реакцию нуклеотидного обмена, катализируемую hSOS1, в присутствии концентрации 20 мкМ или меньше, но которое практически неактивно против EGFR-киназы в концентрациях 20 мкМ или меньше, для получения лекарственного средства для лечения или профилактики гиперпролиферативного расстройства.
[00231] Другой аспект настоящего изобретения относится к соединению любой описанной в данном документе формулы или его фармацевтически приемлемой соли, гидрату, сольвату, пролекарству, стереоизомеру или таутомеру для производства лекарственного средства для ингибирования связывания hSOS1, в частности с белком K-RAS G12C или другим мутантом Ras, описанным в данном документе, которое ингибирует реакцию нуклеотидного обмена, катализируемую hSOS1, в присутствии концентрации 20 мкМ или меньше, но которое практически неактивно против EGFR-киназы в концентрациях 20 мкМ или меньше, для получения лекарственного средства для лечения или профилактики гиперпролиферативного расстройства.
[00232] В другом аспекте настоящее изобретение относится к применению соединения любой описанной в данном документе формулы или его фармацевтически приемлемой соли, гидрата, сольвата, пролекарства, стереоизомера или таутомера в производстве лекарственного средства для лечения или предотвращения заболевания.
[00233] Введение описанных соединений можно осуществлять любым способом введения для терапевтических агентов. Эти способы включают системное и локальное введение, такие как пероральное, назальное, парентеральное, внутривенное, трансдермальное, подкожное, вагинальное, буккальное, ректальное или местное введение. Аналогично, их также можно вводить внутривенным (как болюсным, так и инфузионным), внутрибрюшинным, подкожным или внутримышечным путем, а все применяемые пути хорошо известны специалистам в области фармацевтики.
[00234] В зависимости от предполагаемого способа введения описанные соединения или фармацевтические композиции могут находиться в твердой, полутвердой или жидкой дозированной форме, такой как, например, инъекционные препараты, таблетки, суппозитории, пилюли, капсулы для замедленного высвобождения, эликсиры, настойки, эмульсии, сиропы, порошки, жидкости, суспензии или т.п., иногда в единичных дозировках и в соответствии с традиционной фармацевтической практикой.
[00235] Иллюстративные фармацевтические композиции представляют собой таблетки и желатиновые капсулы, содержащие соединение по изобретению и фармацевтически приемлемый носитель, такой как а) разбавитель, например, очищенная вода, триглицеридные масла, такие как гидрогенизированные или частично гидрогенизированные растительные масла или их смеси, кукурузное масло, оливковое масло, подсолнечное масло, сафлоровое масло, рыбьи жиры, такие как ЭПК или ДГК или их сложные эфиры или триглицериды, или смеси, омега-3 жирные кислоты или их производные, лактоза, декстроза, сахароза, маннит, сорбит, целлюлоза, натрий, сахарин, глюкоза и/или глицин; b) лубрикант, например, диоксид кремния, тальк, стеариновая кислота, ее магниевая или кальциевая соль, олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и/или полиэтиленгликоль; также для таблеток; с) связующее вещество, например, алюмосиликат магния, крахмальная паста, желатин, трагакант, метилцеллюлоза, карбоксиметилцеллюлоза натрия, карбонат магния, природные сахара, такие как глюкоза или бета-лактоза, кукурузные подсластители, природные и синтетические камеди, такие как аравийская камедь, трагакант или альгинат натрия, воски и/или поливинилпирролидон, в случае необходимости; d) разрыхлитель, например, крахмалы, агар, метилцеллюлоза, бентонит, ксантановая камедь, альгиновая кислота или ее натриевая соль или шипучие смеси; е) абсорбент, краситель, ароматизатор и подсластитель; f) эмульсификатор или диспергирующий агент, такой как Твин 80, лабрасол, ГПМЦ, ДОСС, капроил 909, лабрафак, лабрафил, пецеол, транскутол, капмул МСМ, капмул PG-12, каптекс 355, гелуцир, витамин Е TGPS или другой приемлемый эмульсификатор; и/или g) агент, который повышает всасывание соединения, такой как циклодекстрин, гидроксипропил-циклодекстрин, ПЭГ400 и ПЭГ200.
[00236] Жидкие, в частности, инъекционные, композиции можно, например, готовить путем растворения, диспергирования и т.д. Например, описанное соединение растворяют или смешивают с фармацевтически приемлемым растворителем, таким как, например, вода, солевой раствор, водный раствор декстрозы, глицерин, этанол и т.п., чтобы, таким образом, получить инъекционный изотонический раствор или суспензию. Белки, такие как альбумин, хиломикронные частицы или сывороточные белки, можно использовать для солюбилизации описанных соединений.
[00237] Описанные соединения также можно составлять в виде суппозитория, который можно готовить из жирных эмульсий или суспензий; используя полиалкиленгликоль, такой как пропиленгликоль, в качестве носителя.
[00238] Описанные соединения также можно вводить в форме систем доставки на основе липосом, таких как мелкие моноламеллярные везикулы, крупные моноламеллярные везикулы и мультиламеллярные везикулы. Липосомы можно получать из ряда фосфолипидов, содержащих холестерин, стеариламин или фосфатидилхолины. В некоторых вариантах осуществления пленку из липидных компонентов гидратируют водным раствором лекарственного препарата для образования липидного слоя, инкапсулирующего лекарственный препарат, как описано, например, в патенте США №5262564, содержание которого включено в данный документ посредством ссылки.
[00239] Описанные соединения также можно доставлять, используя моноклональные антитела в качестве индивидуальных носителей, с которыми сопряжены описанные соединения. Описанные соединения также могут быть сопряжены с растворимыми полимерами в качестве нацеливаемых лекарственных носителей. Такие полимеры могут включать поливинилпирролидон, пирановый сополимер, полигидроксипропилметакриламид-фенол, полигидроксиэтиласпарамид-фенол или полиэтиленоксид-полилизин, замещенный остатками пальмитоила. Кроме того, описанные соединения также могут быть сопряжены с классом биоразлагаемых полимеров, применяемых для обеспечения контролируемого высвобождения лекарственного препарата, например, полимолочной кислотой, поли-эпсилон-капролактоном, полигидроксимасляной кислотой, сложными полиортоэф ирами, полиацеталями, полидигидропиранами, полицианоакрилатами и перекрестно-сшитыми или амфипатическими блок-сополимерами гидрогелей. В одном варианте осуществления описанные соединения не связаны ковалентно с полимером, например, полимером поликарбоновой кислоты или полиакрилатом.
[00240] Парентеральное инъекционное введение в общем случае используют для подкожных, внутримышечных или внутривенных инъекций и инфузий. Инъекционные препараты можно готовить в традиционных формах, в виде жидких растворов или суспензий или твердых форм, подходящих для растворение в жидкости перед инъекцией.
[00241] Другой аспект настоящего изобретения относится к фармацевтической композиции, содержащей соединение по настоящему изобретению и фармацевтически приемлемый носитель. Фармацевтически приемлемый носитель может дополнительно включать эксципиент, разбавитель или поверхностно-активное вещество.
[00242] Композиции можно готовить в соответствии с традиционными способами смешивания, грануляции или покрытия, соответственно, а представленные фармацевтические композиции могут содержать от около 0,1% до около 99%, от около 5% до около 90% или от около 1% до около 20% описанного соединения по массе или объему.
[00243] Схему дозирования, в которой используется описанное соединение, выбирают в соответствии с различными факторами, включая тип, вид, возраст, массу, пол и патологическое состояние пациента; тяжесть патологического состояния, подлежащего лечению; путь введения; почечную или печеночную функцию пациента; и конкретное применяемое описанное соединение. Врач или ветеринар, являющийся специалистом в данной области техники, может легко определить и назначить эффективное количество лекарственного препарата, необходимое для предотвращения, противодействия или сдерживания прогрессирования патологического состояния.
[00244] Эффективное дозированное количество описанных соединений, используемое для достижения указанных эффектов, находится в диапазоне от около 0,5 мг до около 5000 мг описанного соединения, необходимого для лечения патологического состояния. Композиции для in vivo или in vitro применения могут содержать около 0,5, 5, 20, 50, 75, 100, 150, 250, 500, 750, 1000, 1250, 2500, 3500 или 5000 мг описанного соединения или количество, находящееся в диапазоне от одного количества до другого количества в перечне доз. В одном варианте осуществления композиции представлены в форме таблеток, которые можно подсчитать.
Комбинированная терапия
[00245] Способы по изобретению могут включать применение соединения по изобретению отдельно или в комбинации с одним или более дополнительными видами терапии (например, нелекарственными видами лечения или терапевтическими агентами). Комбинированная терапия может, например, объединять два вида терапии или может объединять три вида терапии (например, тройная терапия или три терапевтических агента) или более. Дозировки одного или более дополнительных видов терапии (например, нелекарственных видов лечения или терапевтических агентов) могут быть снижены по сравнению со стандартными дозировками при отдельном применении. Например, дозы можно определять эмпирически из лекарственных комбинаций и пер мутаций или можно выводить с помощью изоболографического анализа (например. Black et al., Neurology 65:S3-S6 (2005)).
[00246] Соединение по настоящему изобретению можно вводить до, после или одновременно с одним или более такими дополнительными видами терапии. В комбинации дозировки соединения по изобретению и дозировки одного или более дополнительных видов терапии (например, нелекарственного лечения или терапевтического агента) могут обеспечивать терапевтический эффект (например, синергетический или аддитивный терапевтический эффект). Соединение по настоящему изобретению и дополнительный вид терапии, такой как противораковый агент, можно вводить вместе, например в одной фармацевтической композиции, или отдельно, и при раздельном введении оно может происходить одновременно или последовательно. Такое последовательное введение может происходить с небольшим или большим разнесением во времени.
[00247] В некоторых вариантах осуществления дополнительный вид терапии представляет собой введение агентов, ограничивающих побочные эффекты (например, агентов, предназначенных для снижения частоты или тяжести побочных эффектов лечения). Например, в некоторых вариантах осуществления соединения по настоящему изобретению также можно использовать в комбинации с терапевтическим агентом для лечения тошноты. Примеры агентов, которые можно использовать для лечения тошноты, включают: дронабинол, гранисетрон, метоклопрамид, ондансетрон и прохлорпемазин или их фармацевтически приемлемые соли.
[00248] В некоторых вариантах осуществления один или более дополнительных видов терапии включают нелекарственное лечение (например, хирургическое вмешательство или лучевую терапию). В некоторых вариантах осуществления один или более дополнительных видов терапии включают терапевтический агент (например, соединение или биологический препарат, которые представляют собой антиангиогенный агент, ингибитор передачи сигналов, антипролиферативный агент, ингибитор гликолиза или ингибитор аутофагии). В некоторых вариантах осуществления один или более дополнительных видов терапии включают нелекарственное лечение (например, хирургическое вмешательство или лучевую терапию) и терапевтический агент (например, соединение или биологический препарат, которые представляют собой антиангиогенный агент, ингибитор передачи сигналов, антипролиферативный агент, ингибитор гликолиза или ингибитор аутофагии). В других вариантах осуществления один или более дополнительных видов терапии включают два терапевтических агента. В других вариантах осуществления один или более дополнительных видов терапии включают три терапевтических агента. В некоторых вариантах осуществления один или более дополнительных видов терапии включают четыре или более терапевтических агентов.
Нелекарственные виды терапии
[00249] Примеры нелекарственного лечения включают, но не ограничиваются этим, лучевую терапию, криотерапию, гипертермию, хирургическое вмешательство (например, хирургическое удаление опухолевой ткани) и адоптивный перенос Т-клеток (ACT).
[00250] В некоторых вариантах осуществления соединения по изобретению можно использовать в качестве адъювантной терапии после хирургического вмешательства. В некоторых вариантах осуществления соединения по изобретению можно использовать в качестве неоадъювантной терапии перед хирургическим вмешательством.
[00251] Лучевую терапию можно использовать для ингибирования аномального клеточного роста или лечения гиперпролиферативного расстройства, такого как рак, у субъекта (например, млекопитающего (например, человека)). Технологии применения лучевой терапии известны в данной области техники. Лучевую терапию можно применять с помощью одного из нескольких способов или комбинации способов, включая, без ограничения, наружную дистанционную терапию, внутреннюю лучевую терапию, излучение из имплантата, стереотаксическую радио хирургию, системную лучевую терапию, радиотерапию и перманентную или временную интерстициальную брахитерапию. В контексте данного документа термин «брахитерапия» относится к лучевой терапии, обеспечиваемой пространственно ограниченным радиоактивным материалом, введенным в организм в месте или вблизи опухоли или другого участка пролиферативной патологической ткани. Подразумевается, что этот термин включает, без ограничения, радиоактивные изотопы (например, At-211, I-131, I-125, Y-90, Re-186, Re-188, Sm-153, Bi-212, P-32 и радиоактивные изотопы Lu). Подходящие источники излучения для применения в качестве изменяющего клетки вещества по настоящему изобретению включают как твердые вещества, так и жидкости. В качестве неограничивающего примера, источник излучения может представлять собой радионуклид, такой как I-125, I-131, Yb-169, Ir-192 в качестве твердого источника, I-125 в качестве твердого источника, или другие радионуклиды, которые испускают фотоны, бета-частицы, гамма-излучение или другое терапевтическое излучение. Радиоактивный материал, также может представлять собой жидкость, состоящую из любого раствора радионуклида(ов), например, раствора I-125 или I-131, или же радиоактивная жидкость может быть получена с помощью суспензии подходящей жидкости, содержащей небольшие частицы твердых радионуклидов, таких как Au-198 или Y-90. Кроме того, радионуклиды могут быть представлены в виде геля или радиоактивных микросфер.
[00252] В некоторых вариантах осуществления соединения по настоящему изобретению могут делать аномальные клетки более восприимчивыми к лечению с помощью излучения в целях уничтожения или ингибирования роста таких клеток. Соответственно, изобретение дополнительно относится к способу сенсибилизации аномальных клеток млекопитающего в отношении лечения с помощью излучения, который включает введение млекопитающему количества соединения по настоящему изобретению, эффективного для сенсибилизации аномальных клеток в отношении лечения с помощью излучения. Количество соединения в этом способе можно определить в соответствии со способами определения эффективных количеств таких соединений, описанными в данном документе. В некоторых вариантах осуществления соединения по изобретению можно использовать в качестве адъювантной терапии после лучевой терапии или неоадъювантной терапии перед лучевой терапией.
[00253] В некоторых вариантах осуществления нелекарственное лечение представляет собой адоптивный перенос Т-клеток (ACT). В некоторых вариантах осуществления Т-клетка представляет собой активированную Т-клетку. Т-клетка может быть модифицирована для экспрессии химерного антигенного рецептора (CAR). CAR-модифицированные Т-клетки (CAR-Т) можно получать любым способом, известным в данной области техники. Например, CAR-1-клетки можно создавать путем внесения подходящего экспрессионного вектора, кодирующего CAR, в Т-клетку. Перед размножением и генетической модификацией Т-клеток источник Т-клеток получают от субъекта. Т-клетки можно получать из ряда источников, включая мононуклеарные клетки периферической крови, костный мозг, ткань лимфатических узлов, пуповинную кровь, ткань вилочковой железы, ткань из места инфекции, асциты, плевральный выпот, ткань селезенки и опухоли. В определенных вариантах осуществления настоящего изобретения можно использовать любое количество линий Т-клеток, доступных в данной области техники. В некоторых вариантах осуществления Т-клетка представляет собой аутологичную Т-клетку. Как до, так и после генетической модификации Т-клеток для экспрессии необходимого белка (например, CAR), Т-клетки можно активировать и размножать, в общем случае используя методы описанные, например, в патентах США 6352694; 6534055; 6905680; 6692964; 5858358; 6887466; 6905681; 7144575; 7067318; 7172869; 7232566; 7175843; 7572631; 5883223; 6905874; 6797514; и 6867041.
Терапевтические агенты
[00254] Терапевтический агент может представлять собой соединение, используемое в лечении рака и симптомов, связанных с ним.
[00255] Например, терапевтический агент может представлять собой стероид. Соответственно, в некоторых вариантах осуществления один или более дополнительных видов терапии включают стероид. Подходящие стероиды могут включать, но не ограничиваются эти: 21-ацетоксипрегненолон, алклометазон, альгестон, амцинонид, беклометазон, бетаметазон, будесонид, хлорпреднизон, клобетазол, клокортолон, клопреднол, кортикостерон, кортизон, кортивазол, дефлазакорт, дезонид, дезоксиметазон, дексаметазон, дифлоразон, дифлукортолон, дифлупреднат, эноксолон, флуазакорт, флуклоронид, флуметазон, флунизолид, флуоцинолона ацетонид, флуоцинонид, флуокортин бутил, флуокортолон, фторметолон, флуперолона ацетат, флупреднидена ацетат, флупреднизолон, флурандренолид, флутиказона пропионат, формокортал, галцинонид, галобетазола пропионат, галометазон, гидрокортизон, лотепреднола этабонат, мазипредон, медризон, мепреднизон, метилпреднизолон, мометазона фуроат, параметазон, предникарбат, преднизолон, преднизолона 25-диэтиламиноацетат, преднизолона натрия фосфат, преднизон, преднивал, преднилиден, римексолон, тиксокортол, триамцинолон, триамцинолона ацетонид, триамцинолона бенетонид и триамцинолона гексацетонид и их соли или производные.
[00256] Дополнительные примеры терапевтических агентов, которые можно использовать в комбинации с соединением по настоящему изобретению, включают соединения, описанные в следующих патентах: патенты США №№6258812, 6630500, 6515004, 6713485, 5521184, 5770599, 5747498, 5990141, 6235764 и 8623885, и заявки на международный патент WO 01/37820, WO 01/32651, WO 02/68406, WO 02/66470, WO 02/55501, WO 04/05279, WO 04/07481, WO 04/07458, WO 04/09784, WO 02/59110, WO 99/45009, WO 00/59509, WO 99/61422, WO 00/12089 и WO 00/02871.
[00257] Терапевтический агент может представлять собой биологический препарат (например, цитокин (например, интерферон или интерлейкин, такой как IL-2)), используемый при лечении рака или связанных с ним симптомов. В некоторых вариантах осуществления биологический препарат представляет собой биологический препарат на основе иммуноглобулина, например, моноклональное антитело (например, гуманизированное антитело, полностью человеческое антитело, Fc-слитый белок или его функциональный фрагмент), которое агонизирует мишень для стимуляции противоракового ответа или антагонизирует антиген, важный для рака. Также включены конъюгаты антитело - лекарственный препарат.
[00258] Терапевтический агент может представлять собой ингибитор контрольных точек. В одном варианте осуществления ингибитор контрольных точек представляет собой ингибирующее антитело (например, моноспецифическое антитело, такое как моноклональное антитело). Антитело может быть, например, гуманизированным или полностью человеческим. В некоторых вариантах осуществления ингибитор контрольных точек представляет собой слитый белок, например слитый с Fc-рецептором белок. В некоторых вариантах осуществления ингибитор контрольных точек представляет собой агент, такой как антитело, который взаимодействует с белком контрольной точки. В некоторых вариантах осуществления ингибитор контрольных точек представляет собой агент, такой как антитело, который взаимодействует с лигандом белка контрольной точки. В некоторых вариантах осуществления ингибитор контрольных точек является ингибитором (например, ингибирующим антителом или низкомолекулярным ингибитором) CTLA-4 (например, анти-CTLA-4 антитело или слитый белок). В некоторых вариантах осуществления ингибитор контрольных точек является ингибитором или антагонистом (например, ингибирующим антителом или низкомолекулярным ингибитором) PD-1. В некоторых вариантах осуществления ингибитор контрольных точек является ингибитором или антагонистом (например, ингибирующим антителом или низкомолекулярным ингибитором) PDL-1. В некоторых вариантах осуществления ингибитор контрольных точек является ингибитором или антагонистом (например, ингибирующим антителом, или Fc-слитым белком, или низкомолекулярным ингибитором) PDL-2 (например, слитым белком PDL-2/Ig). В некоторых вариантах осуществления ингибитор контрольных точек является ингибитором или антагонистом (например, ингибирующим антителом или низкомолекулярным ингибитором) В7-Н3, В7-Н4, BTLA, HVEM, TIM3, GAL9, LAG3, VISTA, KIR, 2B4, CD160, CGEN-15049, CHK1, CHK2, A2aR, лигандов семейства В-7 или их комбинации. В некоторых вариантах осуществления ингибитор контрольных точек представляет собой пембролизумаб, ниволумаб, PDR001 (NVS), REGN2810 (Sanofi/Regeneron), антитело к PD-L1, такое как, например, авелумаб, дурвалумаб, атезолизумаб, пидилизумаб, JNJ-63723283 (JNJ), BGB-A317 (BeiGene & Celgene), или ингибитор контрольных точек, описанный в Preusser, M. et al. (2015) Nat. Rev. Neurol., включая, без ограничения, ипилимумаб, тремелимумаб, ниволумаб, пембролизумаб, АМР224, АМР514/ MEDI0680, BMS936559, MED14736, MPDL3280A, MSB0010718C, BMS986016, IMP321, лирилумаб, IPH2101, 1-7F9 и KW-6002.
[00259] Терапевтический агент может представлять собой агент, который лечит рак или связанные с ним симптомы (например, цитотоксический агент, непептидные малые молекулы или другое соединение, применимое для лечения рака или связанных с ним симптомов, что в целом называется «противораковым агентом»). Противораковые агенты могут представлять собой, например, химиотерапевтические вещества или агенты для таргетной терапии.
[00260] Противораковые агенты включают ингибиторы митоза, интеркалирующие антибиотики, ингибиторы факторов роста, ингибиторы клеточного цикла, ферменты, ингибиторы топоизомеразы, модификаторы биологического ответа, алкилирующие агенты, антиметаболиты, аналоги фолиевой кислоты, аналоги пиримидина, аналоги пурина и родственные ингибиторы, алкалоиды барвинка, эпиподофиллотоксины, антибиотики, L-аспарагиназу, ингибиторы топоизомеразы, интерфероны, координационные комплексы платины, антрацендион-замещенную мочевину, производные метилгидразина, адренокортикальный супрессант, адренокортикостероиды, прогестины, эстрогены, антиэстрогены, андрогены, антиандрогены и аналог гонадотропин-высвобождающего гормона. Дополнительные противораковые агенты включают лейковорин (LV), иринотекан, оксалиплатин, капецитабин, паклитаксел и доксетаксел. В некоторых вариантах осуществления один или более дополнительных видов терапии включают два или более противораковых агентов. Два или более противораковых агентов можно использовать в коктейле для введения в комбинации или вводить отдельно. Подходящие схемы дозирования комбинированных противораковых агентов известны в данной области техники и описаны, например, в Saltz et al., Proc. Am. Soc. din. Oncol. 18:233a (1999) и Douillard et al.. Lancet 355(9209): 1041-1047 (2000).
[00261] Другие неограничивающие примеры противораковых агентов включают Гливек® (иматиниба мезилат); Кипролис® (карфилзомиб); Велкейд® (бортезомиб); Касодекс (бикалутамид); Ирессу® (гефитиниб); алкилирующие агенты, такие как тиотепа и циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогенины (в частности буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; СС-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); криптофицины (в частности криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодиктиин А; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид мехлоретаминоксида, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урациловый иприт; нитрозомочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимустин; антибиотики, такие как ендииновые антибиотики (например, калихеамицин, в частности калихеамицина гаммалл и калихеамицина омегалл (смотрите, например, Agnew, Chem. Intl. EdEngl. 33:183-186 (1994)); динемицин, такой как динемицин А; бисфосфонаты, такие как клодронат; эсперамицин; хромофор на основе неокарциностатина и родственные хромофоры на основе хромопротеина и ендииновых антибиотиков, аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, калихеамицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, адриамицин (доксорубицин), морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин, дезоксидоксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, келамицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, циностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; средства, угнетающие функции надпочечников, такие как аминоглютетимид, митотан, трилостан; восполнители фолиевой кислоты, такие как фролиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; эльфорнитин; эллиптиния ацетат; эпотилон, такой как эпотилон В; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лонидамин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновую кислоту; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2''-трихлортриэтиламин; трихотецены, такие как токсин Т-2, верракурин А, роридин А и ангуидин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-С»); циклофосфамид; тиотепу; таксоиды, например таксол® (паклитаксел), абраксан® (не содержащий кремофоры, состав альбумин-сконструированных наночастиц паклитаксела) и таксотер® (доксетаксел); хлорамбуцил; тамоксифен (Нолвадекс™); ралоксифен; ингибирующие ароматазу 4(5)-имидазолы; 4-гидрокситамоксифен; триоксифен; кеоксифен; LY 117018; онапристон; торемифен (Фарестон®); флутамид, нилутамид, бикалутамид, лейпролид, гозерелин; хлорамбуцил; гемцитабин Гемзар®; 6-тиогуанин; меркаптопурин; координационные комплексы платины, такие как цисплатин, оксалиплатин и карбоплатин; винбластин; платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; Навелбин® (винорелбин); новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; ибандронат; иринотекан (например, СРТ-11); ингибитор топоизомеразы RFS 2000; дифторметилорнитин (ДМФО); ретиноиды, такие как ретиноевая кислота; эсперамицины; капецитабин (например, Кселода®); и фармацевтически приемлемые соли любого из вышеперечисленного.
[00262] Дополнительные неограничивающие примеры противораковых агентов включают трастузумаб (Герцептин®), бевацизумаб (Авастин®), цетуксимаб (Эрбитукс®), ритуксимаб (Ритуксан®), Таксол®, Аримидекс®, ABVD, авицин, абаговомаб, акридина карбоксамид, адекатумумаб, 17-N-аллиламино-17-деметоксигелданамицин, альфарадин, алвоцидиб, 3-аминопиридин-2-карбоксальдегид тиосемикарбазон, амонафид, антрацендион, анти-CD22 иммунотоксины, антинеопластические агенты (например, антинеопластические агенты, не специфические в отношении клеточного цикла, и другие описанные в данном документе антинеопластические агенты), противоопухолевые травы, апазиквон, атипримод, азатиоприн, белотекан, бендамустин, BIBW 2992, бирикодар, бросталлицин, бриостатин, бутионина сульфоксимин, CBV (химиотерапия), каликулин, дихлоруксусную кислоту, дискодермолид, эльзамитруцин, эноцитабин, эрибулин, экзатекан, экзисулинд, ферругинол, фородезин, фосфестрол, схему химиотерапии ICE, IT-101, имексон, имиквимод, индолокарбазол, ирофулвен, ланиквидар, ларотаксел, леналидомид, лукантон, луртотекан, мафосфамид, митозоломид, нафоксидин, недаплатин, олапариб, ортатаксел, РАС-1, папайю, пиксантрон, ингибиторы протеасом, ребеккамицин, резиквимод, рубитекан, SN-38, салиноспорамид А, сапацитабин, Стэнфорд V, свайнсонин, талапорфин, тариквидар, тегафур-урацил, темодар, тезетаксел, триплатины тетранитрат, трис(2-хлорэтил)амин, троксацитабин, урамустин, вадимезан, винфлунин, ZD6126 и зосуквидар.
[00263] Дополнительные неограничивающие примеры противораковых агентов включают натуральные продукты, такие как алкалоиды барвинка (например, винбластин, винкристин и винорелбин), эпидиподофиллотоксины (например, этопозид и тенипозид), антибиотики (например, дактиномицин (актиномицин D), даунорубицин доксорубицин и идарубицин), антрациклины, митоксантрон, блеомицины, пликамицин (митрамицин), митомицин, ферменты (например, L-аспарагиназу, которая системно метаболизирует L-аспаргин и удаляет клетки, которые не обладают способностью синтезировать собственный аспарагин), антитромбоцитарные агенты, антипролиферативные/антимитотические алкилирующие агенты, такие как азотные иприты (например, мехлорэтамин, циклофосфамид и аналоги, мелфалан, хлорамбуцил), этиленимины и метилмеламины (например, гексаметилмеламин и тиотепу), ингибиторы CDK (например, ингибитор CDK 4/6, такой как рибоциклиб, абемациклиб или палбоциклиб), селициклиб, UCN-01, P1446A-05, PD-0332991, динациклиб, Р27-00, АТ-7519, RGB286638 и SCH727965), алкилсульфонаты (например, бусульфан), нитрозомочевины (например, кармустин (BCNU) и аналоги, и стрептозоцин), тразены-дакарбазин (DTIC), антипролиферативные/антимитотические антиметаболиты, такие как аналоги фолиевой кислоты, аналоги пиримидина (например, фторурацил, флоксуридин и цитарабин), аналоги пурина и родственные ингибиторы (например, меркаптопурин, тиогуанин, пентостатин и 2-хлордезоксиаденозин), ингибиторы ароматазы (например, анастрозол, эксеместан и летрозол) и координационные комплексы платины (например, цисплатин, карбоплатин), прокарбазин, гидроксимочевину, митотан, аминоглютетимид, ингибиторы гистондеацетилазы (HDAC) (например, трихостатин, бутират натрия, апицидин, субероиланилид гидроксамовую кислоту, вориностат, LBH 589, ромидепсин, ACY-1215 и панобиностат), ингибиторы mTOR (например, вистусертиб, темсиролимус, эверолимус, ридафоролимус и сиролимус), ингибиторы KSP(Eg5) (например, Array 520), ДНК-связывающие агенты (например, Залипсис®), ингибиторы PI3K, такие как ингибитор PI3K дельта (например, GS-1101 и TGR-1202), ингибитор PI3K дельта и гамма (например, CAL-130), копанлисиб, алпелисиб и иделалисиб; мультикиназный ингибитор (например, TG02 и сорафениб), гормоны (например, эстроген) и агонисты гормонов, такие как агонисты гормона, высвобождающего лютеинизирующий гормон (LHRH) (например, гозерелин, лейпролид и трипторелин), BAFF-нейтрализующее антитело (например, LY2127399), ингибиторы IKK, ингибиторы p38MAPK, анти-IL6 (например, CNT0328), ингибиторы теломераз (например, GRN 163L), ингибиторы аврора-киназы (например, MLN8237), моноклональные антитела клеточной поверхности (например, анти-CD38 (HUMAX-CD38), анти-CS1 (например, элотузумаб), ингибиторы HSP90 (например, 17 AAG и KOS 953), ингибиторы PI3K/Akt (например, перифосин), ингибиторы Akt (например, GSK-2141795), ингибиторы PKC (например, энзастаурин), FTI (например, Зарнестра™), анти-CD138 (например, ВТ062), Torc1/2-специфические ингибиторы киназ (например, INK128), агенты, нацеленные на ER/UPR (например, MKC-3946), ингибиторы cFMS (например, ARRY-382), ингибиторы JAK1/2 (например, CYT387), ингибиторы PARP (например, олапариб и велипариб (АВТ-888)) и антагонисты BCL-2.
[00264] В некоторых вариантах осуществления противораковый агент выбран из мехлорэтамина, камптотецина, ифосфамида, тамоксифена, ралоксифена, гемцитабина, Навелбина®, сорафениба или любого аналога или производного варианта вышеперечисленного.
[00265] В некоторых вариантах осуществления противораковый агент представляет собой ингибитор ALK. Неограничивающие примеры ингибиторов ALK включают церитиниб, ТАЕ-684 (NVP-TAE694), PF02341066 (кризотиниб или 1066), алектиниб; бригатиниб; энтректиниб; энсартиниб (Х-396); лорлатиниб; ASP3026; СЕР-37440; 4SC-203; TL-398; PLB1003; TSR-011; СТ-707; ТРХ-0005 и АР26113. Дополнительные примеры ингибиторов ALK-киназы описаны в примерах 3-39 WO 05016894.
[00266] В некоторых вариантах осуществления противораковый агент представляет собой ингибитор элемента после рецепторной тирозинкиназы (RTK)/рецептора фактора роста (например, ингибитор SHP2 (например, SHP099, TN0155, RMC-4550, RMC-4630, JAB-3068), ингибитор другого SOS1 (например, BI-1701963), ингибитор Raf, ингибитор MEK, ингибитор ERK, ингибитор PI3K, ингибитор PTEN, ингибитор АКТ или ингибитор mTOR (например, ингибитор mTORC1 или ингибитор mTORC2). В некоторых вариантах осуществления противораковый агент представляет собой JAB-3312. В некоторых вариантах осуществления противораковый агент представляет собой ингибитор Ras (например, AMG 510, MRTX1257, LY349946, MRTX849, ARS-3248 (JNJ-74699157) или ARS-1620) или вакцину Ras, или другую терапевтическую модальность, разработанную, чтобы прямым или косвенным образом снижать онкогенную активность Ras.
[00267] В некоторых вариантах осуществления белок Ras представляет собой белок дикого типа. В некоторых вариантах осуществления рак содержит мутацию Ras. В некоторых вариантах осуществления мутация выбрана из:
(a) следующих мутантов K-Ras: G12D, G12V, G12C, G13D, G12R, G12A, Q61H, G12S, А146Т, G13C, Q61L, Q61R, K117N, A146V, G12F, Q61K, L19F, Q22K, V14I, А59Т, А146Р, G13R, G12L или G13V и их комбинаций;
(b) следующих мутантов H-Ras: Q61R, G13R, Q61K, G12S, Q61L, G12D, G13V, G13D, G12C, K117N, А59Т, G12V, G13C, Q61H, G13S, A18V, D119N, G13N, А146Т, А66Т, G12A, A146V, G12N или G12R и их комбинаций; и
(c) следующих мутантов N-Ras: Q61R, Q61K, G12D, Q61L, Q61H, G13R, G13D, G12S, G12C, G12V, G12A, G13V, G12R, P185S, G13C, А146Т, G60E, Q61P, A59D, E132K, E49K, T50I, A146V или А59Т и их комбинаций;
или комбинации любого из вышеперечисленного (например, K-Ras G12C и K-Ras G13C). В некоторых вариантах осуществления рак содержит мутацию Ras, выбранную из группы, состоящей из G12C, G13C, G12A, G12D, G13D, G12S, G13S, G12V и G13V.
[00268] В некоторых вариантах осуществления терапевтический агент, который можно комбинировать с соединением по настоящему изобретению, представляет собой ингибитор пути МАР-киназы (MAPK) (или «ингибитор MAPK»). Ингибиторы MAPK включают, но не ограничиваются этим, один или более ингибиторов MAPK, описанных в Cancers (Basel) 2015 Sep; 7(3): 1758-1784. Например, ингибитор MAPK может быть выбран из одного или более из траметиниба, биниметиниба, селуметиниба, кобиметиниба, LErafAON (NeoPharm), ISIS 5132; вемурафениба, пимасертиба, ТАК733, R04987655 (СН4987655); CI-1040; PD-0325901; CH5126766; MAP855; AZD6244; рефаметиниба (RDEA 119/BAY 86-9766); GDC-0973/XL581; AZD8330 (ARRY-424704/ARRY-704); R05126766 (Roche, описанного в PLoS One. 2014 Nov 25;9(11)); и GSK1120212 (или JTP-74057, описанного в din Cancer Res. 2011 Mar 1;17(5):989-1000).
[00269] В некоторых вариантах осуществления противораковый агент является разрушителем или ингибитором сигнальных путей RAS-RAF-ERK, PI3K-AKT-TOR или PI3K-AKT. Ингибитор PI3K/AKT может включать, но не ограничивается этим, один или более ингибиторов PI3K/AKT, описанных в Cancers (Basel) 2015 Sep; 7(3): 1758-1784. Например, ингибитор PI3K/AKT может быть выбран из одного или более из NVP-BEZ235; BGT226; XL765/SAR245409; SF1126; GDC-0980; PI-103; PF-04691502; PKI-587; GSK2126458.
[00270] В некоторых вариантах осуществления противораковый агент является антагонистом PD-1 или PD-L1.
[00271] В некоторых вариантах осуществления дополнительные терапевтические агенты включают ингибиторы EGFR, ингибиторы IGF-1R, ингибиторы MEK, ингибиторы PI3K, ингибиторы АКТ, ингибиторы TOR, ингибиторы MCL-1, ингибиторы BCL-2, ингибиторы SHP2, ингибиторы протеасом и иммунную терапию.
[00272] Ингибиторы IGF-1R включают линситиниб или его фармацевтически приемлемую соль.
[00273] Ингибиторы EGFR включают, но не ограничиваются этим, низко молекулярные антагонисты, ингибиторы-антитела или специфические антисмысловые нуклеотиды или миРНК. Применимые ингибиторы-антитела EGFR включают цетуксимаб (Эрбитукс®), панитумумаб (Вектибикс®), залутумумаб, нимотузумаб и матузумаб. Дополнительные ингибиторы EGFR на основе антител включают анти-EGFR антитело или фрагмент антитела, которые могут частично или полностью блокировать активацию EGFR его природным лигандом. Неограничивающие ингибиторов EGFR на основе антител включают описанные в Modjtahedi et al., Br. J. Cancer 1993, 67:247-253; Teramoto et al., Cancer 1996, 77:639-645; Goldstein et al., din. Cancer Res. 1995, 1:1311-1318; Huang et al., 1999, Cancer Res. 15:59(8): 1935-40; nYangetal., Cancer Res. 1999, 59:1236-1243. Ингибитор EGFR может представлять собой моноклональное антитело Mab E7.6.3 (Yang, 1999 выше) или Mab C225 (доступ АТСС № НВ-8508), или антитело или фрагмент антитела, имеющие их специфичность связывания.
[00274] Низкомолекулярные антагонисты EGFR включают гефитиниб (Иресса®), эрлотиниб (Тарцева®) и лапатиниб (Тайкерб®). Смотрите, например, Yan et al., Pharmacogenetics and Pharmacogenomics hi Oncology Therapeutic Antibody Development, BioTechniques 2005, 39(4): 565-8; и Paez et al., EGFR Mutations In Lung Cancer Correlation With Clinical Response To Gefitinib Therapy, Science 2004, 304(5676): 1497-500. Дополнительные неограничивающие примеры низкомолекулярных ингибиторов EGFR включают любые из ингибиторов EGFR, описанных в следующих патентных публикациях, и все фармацевтически приемлемые соли таких ингибиторов EGFR: ЕР 0520722; ЕР 0566226; WO 96/33980; патент США №5747498,; WO 96/30347; ЕР 0787772; WO 97/30034; WO 97/30044; WO 97/38994; WO 97/49688; ЕР 837063; WO 98/02434; WO 97/38983; WO 95/19774; WO 95/19970; WO 97/13771; WO 98/02437; WO 98/02438; WO 97/32881; DE 19629652; WO 98/33798; WO 97/32880; WO 97/32880; ЕР 682027; WO 97/02266; WO 97/27199; WO 98/07726; WO 97/34895; WO 96/31510; WO 98/14449; WO 98/14450; WO 98/14451; WO 95/09847; WO 97/19065; WO 98/17662; патент США №5789427; патент США №5650415; патент США №5656643; WO 99/35146; WO 99/35132; WO 99/07701; и WO 92/20642. Дополнительные неограничивающие примеры низкомолекулярных ингибиторов EGFR включают любые из ингибиторов EGFR, описанных в Traxler et al., Exp. Opin. Ther. Patents 1998, 8(12):1599-1625. В некоторых вариантах осуществления ингибитор EGFR представляет собой осимертиниб.
[00275] Ингибиторы MEK включают, но не ограничиваются этим, пимасертиб, селуметиниб, кобиметиниб (Котеллик®), траметиниб (Мекинист®) и биниметиниб (Мектови®). В некоторых вариантах осуществления ингибитор MEK нацелен на мутацию MEK, которая представляет собой мутацию MEK1 класса I, выбранную из D67N; P124L; P124S; и L177V. В некоторых вариантах осуществления мутация MEK представляет собой мутацию MEK1 класса II, выбранную из ДЕ51-Q58; AF53-Q58; E203K; L177M; C121S; F53L; K57E; Q56P; и K57N.
[00276] Ингибиторы PI3K включают, но не ограничиваются этим, вортманнин; аналоги 17-гидроксивортманнина, описанные в WO 06/044453; 4-[2-(1Н-индазол-4-ил)-6-[[4-(метилсульфонил)пиперазин-1-ил]метил]тиено[3,2-d]пиримидин-4-ил]морфолин (также известный как пиктилисиб или GDC-0941 и описанный в WO 09/036082 и WO 09/055730); 2-метил-2-[4-[3-метил-2-оксо-8-(хинолин-3-ил)-2,3-дигидроимидазо[4,5-с]хинолин-1-ил]фенил]пропионитрил (также известный как BEZ 235 или NVP-BEZ 235 и описанный в WO 06/122806); (S)-1-(4-((2-(2-аминопиримидин-5-ил)-7-метил-4-морфолинотиено[3,2-d]пиримидин-6-ил)метил)пиперазин-1-ил)-2-гидроксипропан-1-он (описанный в WO 08/070740); LY294002 (2-(4-морфолинил)-8-фенил-4Н-1-бензопиран-4-он (доступный от Axon Medchem); PI 103 гидрохлорид (3-[4-(4-морфолинилпиридо-[3',2':4,5]фуро[3,2-d]пиримидин-2-ил]фенола гидрохлорид (доступный от Axon Medchem); PIK 75 (2-метил-5-нитро-2-[(6-бромимидазо[1,2-а]пиридин-3-ил)метилен]-1-метилгидразин-бензолсульфоновую кислоту, моногидрохлорид) (доступный от Axon Medchem); PIK 90 (N-(7,8-диметокси-2,3-дигидро-имидазо[1,2-с]хиназолин-5-ил)-никотинамид (доступный от Axon Medchem); AS-252424 (5-[1-[5-(4-фтор-2-гидроксифенил)-фуран-2-ил]-мет-(Z)-илиден]-тиазолидин-2,4-дион (доступный от Axon Medchem); TGX-221 (7-метил-2-(4-морфолинил)-9-[1-(фениламино)этил]-4Н-пиридо-[1,2-а]пиримидин-4-он (доступный от Axon Medchem); XL-765; и XL-147. Другие ингибиторы PI3K включают деметоксивиридин, перифозин, CAL101, РХ-866, BEZ235, SF1126, INK1117, IPI-145, ВКМ120, XL147, XL765, паломид 529, GSK1059615, ZSTK474, PWT33597, IC87114, TGI 00-115, CAL263, PI-103, GNE-477, CUDC-907 и AEZS-136.
[00277] Ингибиторы АКТ включают, но не ограничиваются этим, Akt-1-1 (ингибирует Akt1) (Barnett et al., Biochem. J. 2005, 385(Pt. 2): 399-408); Akt-1-1,2 (ингибирует Ak1 и 2) (Barnett et al., Biochem. J. 2005, 385(Pt. 2): 399-408); API-59CJ-Ome (например, Jin et al., Br. J. Cancer 2004, 91:1808-12); соединения 1-Н-имидазо[4,5-с]пиридинила (например, WO 05/011700); индол-3-карбинол и его производные (например, патент США №6656963; Sarkar and Li J Nutr. 2004, 134(12 Suppl):3493S-3498S); перифозин (например, препятствует мембранной локализации Akt; Dasmahapatra et al. Clin. Cancer Res. 2004, 10(15):5242-52); аналоги фосфатидилинозитол эфирлипида (например, Gills and Dennis Expert. Opin.Investig. Drugs 2004, 13:787-97); и трицирибин (TCN или API-2, или идентификатор NCI: NSC 154020; Yang et al., Cancer Res. 2004, 64:4394-9).
[00278] Ингибиторы mTOR включают, но не ограничиваются этим, АТФ-конкурентные ингибиторы mTORC1/mTORC2, например, PI-103, РР242, РР30; торин 1; усилители FKBP12; производные 4Н-1-бензопиран-4-она; и рапамицин (также известный как сиролимус) и его производные, включая: темсиролимус (Торизел®); эверолимус (Афинитор®; WO 94/09010); ридафоролимус (также известный как дефоролимус или АР23573); рапалоги, например, описанные в WO 98/02441 и WO 01/14387, например, АР23464 и АР23841; 40-(2-гидроксиэтил)рапамицин; 40-[3-гидрокси(гидроксиметил)метилпропаноат]-рапамицин (также известный как СС1779); 40-эпи-(тетразолит)-рапамицин (также называемый АВТ578); 32-деоксорапамицин; 16-пентинилокси-32(S)-дигидрорапамицин; производные, описанные в WO 05/005434; производные, описанные в патентах США №№5258389, 5118677, 5118678, 5100883, 5151413, 5120842 и 5256790, и в WO 94/090101, WO 92/05179, WO 93/111130, WO 94/02136, WO 94/02485, WO 95/14023, WO 94/02136, WO 95/16691, WO 96/41807, WO 96/41807 и WO 2018204416; и фосфор-содержащие производные рапамицина (например, WO 05/016252). В некоторых вариантах осуществления ингибитор mTOR представляет собой бистерический ингибитор (смотрите, например, WO 2018204416, WO 2019212990 и WO 2019212991), такой как RMC-5552.
[00279] Ингибиторы BRAF, которые можно использовать в комбинации с соединениями по изобретению, включают, например, вемурафениб, дабрафениб и энкорафениб. BRAF может содержать мутацию BRAF класса 3. В некоторых вариантах осуществления мутация BRAF класса 3 выбрана из одной или более следующих аминокислотных замен в человеческом BRAF: D287H; P367R; V459L; G466V; G466E; G466A; S467L; G469E; N581S; N581I; D594N; D594G; D594A; D594H; F595L; G596D; G596R и А762Е.
[00280] Ингибиторы MCL-1 включают, но не ограничиваются этим, AMG-176, MIK665 и S63845. Белок лейкоза из миелоидных клеток 1 (MCL-1) является одним из ключевых антиапоптотических членов семейства белков В-клеточной лимфомы-2 (BCL-2). Сверхэкспрессия MCL-1 была связана с прогрессированием опухоли, а также с резистентностью, не только к традиционной химиотерапии, но также к таргетным терапевтическим препаратам, включая ингибиторы BCL-2, такие как АВТ-263.
[00281] В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой ингибитор SHP2. SHP2 представляет собой нерецепторную протеин-тирозинфосфатазу, кодируемую геном PTPN11, которая участвует во многих клеточных функциях, включая пролиферацию, дифференцировку, поддержание клеточного цикла и миграцию. SHP2 имеет два Ν-концевых домена Src-гомологии 2 (N-SH2 и C-SH2), каталитический домен (РТР) и С-концевой хвост.Два домена SH2 регулируют субклеточную локализацию и функциональную регуляцию SHP2. Эта молекула существует в неактивной, самоингибируемой конформации, стабилизируемой сетью связывания, включающей остатки из обоих доменов N-SH2 и РТР. Стимуляция, например, цитокинами или факторами роста, действующими через рецепторные тирозинкиназы (RTK), приводит к обнажению каталитического сайта, результатом чего является ферментативная активация SHP2.
[00282] SHP2 участвует в сигнализации через пути RAS-митоген-активируемой протеинкиназы (МАРК), JAK-STAT или фосфоинозитол-3-киназы-АКТ. Мутации в гене ΡΤΡΝ11 и впоследствии в SHP2 были идентифицированы при нескольких нарушениях развития человека, таких как синдром Нунан и синдром «леопард», а также при раках человека, таких как ювенильный миеломоноцитарный лейкоз, нейробластома, меланома, острый миелоидный лейкоз и раки молочной железы, легкого и толстой кишки. Некоторые из этих мутаций дестабилизируют самоингибируемую конформацию SHP2 и стимулируют самоактивацию или повышенную обусловленную факторами роста активацию SHP2. Следовательно, SHP2 представляет собой очень привлекательную мишень для разработки новых вариантов терапии для лечения различных заболеваний, включая рак. Было показано, что ингибитор SHP2 (например, RMC-4550 или SHP099) в комбинации с ингибитором пути RAS (например, ингибитором МЕК) ингибируют пролиферацию нескольких раковых клеточных линий in vitro (например, рака поджелудочной железы, легкого, яичника и молочной железы). Таким образом, комбинированная терапия, включающая ингибитор SHP2 с ингибитором пути RAS, могла бы стать общей стратегией для предотвращения резистентности опухолей для широкого диапазона злокачественных заболеваний, и может стать основой тройной комбинации ингибиторов с ингибитором SOS1.
[00283] Неограничивающие примеры таких ингибиторов SHP2, известных в данной области техники, включают: Chen et al. Mol Pharmacol. 2006, 70, 562; Sarver et al., J. Med. Chem. 2017, 62, 1793; Xie et al.,J. Med. Chem. 2017, 60, 113734; и Igbe et al, Oncotarget, 2017, 8, 113734; и заявки PCT: WO 2015107493; WO 2015107494; WO 201507495; WO 2016203404; WO 2016203405; WO 2016203406; WO 2011022440; WO 2017156397; WO 2017079723; WO 2017211303; WO 2012041524; WO 2017211303; WO 2019051084; WO 2017211303; US 20160030594; US 20110281942; WO 2010011666; WO 2014113584; WO 2014176488; WO 2017100279; WO 2019051469; US 8637684; WO 2007117699; WO 2015003094; WO 2005094314; WO 2008124815; WO 2009049098; WO 2009135000; WO 2016191328; WO 2016196591; WO 2017078499; WO 2017210134; WO 2018013597; WO 2018129402; WO 2018130928; WO 20181309928; WO 2018136264; WO 2018136265; WO 2018160731; WO 2018172984; и WO 2010121212, каждая из которых включена в данный документ посредством ссылки.
[00284] В некоторых вариантах осуществления ингибитор SHP2 связывается в активном сайте. В некоторых вариантах осуществления ингибитор SHP2 представляет собой необратимый ингибитор смешанного типа. В некоторых вариантах осуществления ингибитор SHP2 связывается в аллостерическом сайте, например, нековалентный аллостерический ингибитор. В некоторых вариантах осуществления ингибитор SHP2 представляет собой ковалентный ингибитор SHP2, такой как ингибитор, нацеленный на остаток цистеина (С333), который находится за пределами активного сайта фосфатазы. В некоторых вариантах осуществления ингибитор SHP2 представляет собой обратимый ингибитор. В некоторых вариантах осуществления ингибитор SHP2 представляет собой необратимый ингибитор. В некоторых вариантах осуществления ингибитор SHP2 представляет собой SHP099. В некоторых вариантах осуществления ингибитор SHP2 представляет собой ΤΝO155. В некоторых вариантах осуществления ингибитор SHP2 представляет собой RMC-4550. В некоторых вариантах осуществления ингибитор SHP2 представляет собой RCM-4630. В некоторых вариантах осуществления ингибитор SHP2 представляет собой JAB-3068.
[00285] Ингибиторы протеасом включают, но не ограничиваются этим, карфилзомиб (Кипролис®), бортезомиб (Велкейд®)и опрозомиб.
[00286] Иммунная терапия включает, но не ограничивается этим, моноклональные антитела, иммуномодулирующие имиды (IMiD), агонисты GITR, генетически сконструированные Т-клетки (например, CAR-T-клетки), биспецифические антитела (например, BiTE) и анти-PD-1, анти-PDL-1, анти-CTLA4, анти-LAG1 и анти-ОХ40 агенты).
[00287] Иммуномодулирующие агенты (IMiD) представляют собой класс иммуномодулирующих лекарственных препаратов (лекарственных препаратов, которые корректируют иммунные ответы), содержащих имидную группу. Класс IMiD включает талидомид и его аналоги (леналидомид, помалидомид и апремиласт).
[00288] Типовые анти-PD-1 антитела и способы их применения описаны в Goldberg et al., Blood 2007, 110(1): 186-192; Thompson et al., Clin. Cancer Res. 2007, 13(6):1757-1761; и WO 06/121168 A1), а также описаны в другом месте данного документа.
[00289] Агонисты GITR включают, но не ограничиваются этим, GITR-слитые белки и анти-GITR антитела (например, двухвалентные анти-GITR антитела), такие как GITR слитый белок, описанный в патенте США №6111090, патенте США №8586023, WO 2010/003118 и WO 2011/090754; или анти-GITR антитело, описанное, например, в патенте США №7025962, ЕР 1947183, патенте США №7812135, патенте США №8388967, патенте США №8591886, патенте США №7618632, ЕР 1866339 и WO 2011/028683, WO 2013/039954, WO 05/007190, WO 07/133822, WO 05/055808, WO 99/40196, WO 01/03720, WO 99/20758, WO 06/083289, WO 05/115451 и WO 2011/051726.
[00290] Другим примером терапевтического агента, который можно использовать в комбинации с соединениями по изобретению, является антиангио генный агент. Антиангиогенные агенты включают, но не ограничиваются этим, in vitro синтетически полученные химические композиции, антитела, антигенсвязывающие области, радионуклиды и их комбинации и конъюгаты. Антиангиогенный агент может являться агонистом, антагонистом, аллостерическим модулятором, токсином или, в более общем смысле, его действие может заключаться в ингибировании или стимуляции его мишени (например, активации или ингибировании рецептора или фермента) и, следовательно, он может способствовать гибели клетки или останавливать рост клетки. В некоторых вариантах осуществления один или более дополнительных видов терапии включают антиангиогенный агент.
[00291] Антиангиогенные агенты могут представлять собой ингибиторы ММР-2 (матричной металлопротеиназы 2), ингибиторы ММР-9 (матричной металлопротеиназы 9) и ингибиторы СОХ-II (циклооксигеназы 11). Неограничивающие примеры антиангиогенных агентов включают рапамицин, темсиролимус (CCI-779), эверолимус (RAD001), сорафениб, сунитиниб и бевацизумаб. Примеры применимых ингибиторов СОХ-II включают алекоксиб, вальдекоксиб и рофекоксиб. Примеры применимых ингибиторов матричной металлопротеиназы описаны в WO 96/33172, WO 96/27583, WO 98/07697, WO 98/03516, WO 98/34918, WO 98/34915, WO 98/33768, WO 98/30566, WO 90/05719, WO 99/52910, WO 99/52889, WO 99/29667, WO 99007675, ЕР 0606046, ЕР 0780386, ЕР 1786785, ЕР 1181017, ЕР 0818442, ЕР 1004578 и US 20090012085, и патентах США №№5863949 и 5861510. Предпочтительными ингибиторами ММР-2 и ММР-9 являются те, которые характеризуются слабой активностью ингибирования ММР-1 или ее отсутствием. Более предпочтительными являются те, которые избирательно ингибируют ММР-2 или АМР-9 в сравнении с другими матричными металлопротеиназами (т.е. МАР-1, ММР-3, ММР-4, ММР-5, ММР-6, ММР- 7, ММР- 8, ММР-10, ММР-11, ММР-12 и ММР-13). Некоторыми конкретными примерами ингибиторов ММР являются AG-3340, RO 32-3555 и RS 13-0830.
[00292] Дополнительные типовые антиангиогенные агенты включают агенты, ингибирующие KDR (рецептор киназного домена) (например, антитела и антигенсвязывающие области, которые специфически связываются с рецептором киназного домена), анти-VEGF агенты (например, антитела или антигенсвязывающие области, которые специфически связывают VEGF, или растворимые рецепторы VEGF, или его лиганд-связывающую область), такие как VEGF-TRAP™, и агенты против рецептора VEGF (например, антитела или антигенсвязывающие области, которые специфически связываются с ним), агенты, ингибирующие EGFR (например, антитела или антигенсвязывающие области, которые специфически связываются с ним), такие как Вектибикс® (панитумумаб), эрлотиниб (Тарцева®), анти-Ang1 и анти-Ang2 агенты (например, антитела или антигенсвязывающие области, связывающиеся с ними или с их рецепторами, например, Tie2/Tek) и ингибирующие агенты против Tie2-киназы (например, антитела или антигенсвязывающие области, которые специфически связываются с ней). Другие антиангиогенные агенты включают Кампат, IL-8, B-FGF, антагонисты Тек (US2003/0162712; US 6413932), анти-TWEAK агенты (например, специфически связывающиеся антитела или антигенсвязывающие области, или антагонисты растворимого рецептора TWEAK; смотрите US 6727225), дизинтегриновый домен ADAM для антагонизации связывания интегрина с его лигандами (US 2002/0042368), специфически связывающиеся антитела или антигенсвязывающие области против рецептора eph или против эфрина(патенты США №№5981245; 5728813; 5969110; 6596852; 6232447; 6057124 и представители этого патентного семейства) и анти-PDGF-BB антагонисты (например, специфически связывающиеся антитела или антигенсвязывающие области), а также антитела или антигенсвязывающие области, специфически связывающиеся с лигандами PDGF-BB, и агенты, ингибирующие PDGFR-киназу (например, антитела или антигенсвязывающие области, которые специфически связываются с ней). Дополнительные антиангиогенные агенты включают: SD-7784 (Pfizer, USA); циленгитид (Merck KGaA, Germany, EPO 0770622); пегаптаниб октанатрий (Gilead Sciences, USA); альфастатин, (BioActa, UK); M-PGA, (Celgene, USA, US 5712291); иломастат, (Arriva, USA, US 5892112); эмаксаниб, (Pfizer, USA, US 5792783); ваталаниб, (Novartis, Switzerland); 2-метоксиэстрадиол (EntreMed, USA); TLC ELL-12 (Elan, Ireland); анекортава ацетат (Alcon, USA); альфа-0148 Mab (Amgen, USA); CEP-7055 (Cephalon, USA); анти-Vn Mab (Crucell, Netherlands), DAC-антиангиоген (ConjuChem, Canada); ангиоцидин (InKine Pharmaceutical, USA); KM-2550 (Kyowa Hakko, Japan); SU-0879 (Pfizer, USA); CGP-79787 (Novartis, Switzerland, EP 0970070); технология ARGENT (Ariad, USA); YIGSR-Stealth (Johnson & Johnson, USA); фрагмент фибриногена-Е (BioActa, UK); ингибитор ангиогенеза (Trigen, UK); TBC-1635 (Encysive Pharmaceuticals, USA); SC-236 (Pfizer, USA); ABT-567 (Abbott, USA); метастатин (EntreMed, USA); маспин (Sosei, Japan); 2-метоксиэстрадиол (Oncology Sciences Corporation, USA); ER-68203-00 (IV AX, USA); BeneFin (Lane Labs, USA); Tz-93 (Tsumura, Japan); TAN-1120 (Takeda, Japan); FR-111142 (Fujisawa, Japan, JP 02233610); тромбоцитарный фактор 4 (RepliGen, USA, EP 407122); антагонист фактора роста сосудистого эндотелия (Borean, Denmark); бевацизумаб (pINN) (Genentech, USA); ингибиторы ангиогенеза (SUGEN, USA); XL 784 (Exelixis, USA); XL 647 (Exelixis, USA); MAb, альфа5бета3 интегрин второго поколения (Applied Molecular Evolution, USA и Medlmmune, USA); энзастаурина гидрохлорид (Lilly, USA); CEP 7055 (Cephalon, USA и Sanofi-Synthelabo, France); ВС 1 (Genoa Institute of Cancer Research, Italy); антиангиогенные препараты на основе rBPI 21 и BPI (ХОМА, USA); PI 88 (Progen, Australia); циленгитид (Merck KGaA, German; Munich Technical University, Germany, Scripps Clinic and Research Foundation, USA); AVE 8062 (Ajinomoto, Japan); AS 1404 (Cancer Research Laboratory, New Zealand); SG 292, (Telios, USA); эндостатин (Boston Childrens Hospital, USA); ATN 161 (Attenuon, USA); 2-метоксиэстрадиол (Boston Childrens Hospital, USA); ZD 6474, (AstraZeneca, UK); ZD 6126, (Angiogene Pharmaceuticals, UK); PPI 2458, (Praecis, USA); AZD 9935, (AstraZeneca, UK); AZD 2171, (AstraZeneca, UK); ваталаниб (pINN), (Novartis, Switzerland и Schering AG, Germany); ингибиторы пути тканевого фактора, (EntreMed, USA); пегаптаниб (Pinn), (Gilead Sciences, USA); ксанторизол, (Yonsei University, South Korea); генную вакцину, VEGF-2, (Scripps Clinic and Research Foundation, USA); SPV5.2, (Supratek, Canada); SDX 103, (University of California at San Diego, USA); PX 478, (ProlX, USA); метастатин, (EntreMed, USA); тропонин I, (Harvard University, USA); SU 6668, (SUGEN, USA); ΟΧΙ 4503, (OXiGENE, USA); о-гуанидины, (Dimensional Pharmaceuticals, USA); мотупорамин С, (British Columbia University, Canada); CDP 791, (Celltech Group, UK); атипримод (pINN), (GlaxoSmithKline, UK); Ε 7820, (Eisai, Japan); CYC 381, (Harvard University, USA); AE 941, (Aeterna, Canada); ангиогенную вакцину, (EntreMed, USA); ингибитор активатора плазминогенаурокиназы, (Dendreon, USA); оглуфанид (pINN), (Melmotte, USA); ингибиторы HIF-1альфа, (Xenova, UK); CEP 5214, (Cephalon, USA); BAY RES 2622, (Bayer, Germany); ангиоцидин (InKine, USA); A6, (Angstrom, USA); KR 31372, (Korea Research Institute of Chemical Technology, South Korea); GW 2286, (GlaxoSmithKline, UK); EHT 0101, (ExonHit, France); CP 868596, (Pfizer, USA); CP 564959, (OSI, USA); CP 547632, (Pfizer, USA); 786034, (GlaxoSmithKline, UK); KRN 633, (Kirin Brewery, Japan); систему внутриглазной доставки лекарств, 2-метоксиэстрадиол; ангинекс (Maastricht University, Netherlands, и Minnesota University, USA); ABT 510 (Abbott, USA); AAL 993 (Novartis, Switzerland); VEGI (ProteomTech, USA); ингибиторы фактора некроза опухоли альфа; SU 11248 (Pfizer, USA и SUGEN USA); ABT 518, (Abbott, USA); YH16 (Yantai Rongchang, China); S-3APG (Boston Childrens Hospital, USA и EntreMed, USA); MAb, KDR (ImClone Systems, USA); MAb, альфа5бета (Protein Design, USA); ингибитор KDR-киназы (Celltech Group, UK, и Johnson & Johnson, USA); GFB 116 (South Florida University, USA и Yale University, USA); CS 706 (Sankyo, Japan); пролекарство комбретастатин A4 (Arizona State University, USA); хондроитиназу AC (IBEX, Canada); BAY RES 2690 (Bayer, Germany); AGM 1470 (Harvard University, USA, Takeda, Japan, и TAP, USA); AG 13925 (Agouron, USA); тетратиомолибдат (University of Michigan, USA); GCS 100 (Wayne State University, USA) CV 247 (Ivy Medical, UK); CKD 732 (Chong Kun Dang, South Korea); ирсогладин (Nippon Shinyaku, Japan); RG 13577 (Aventis, France); WX 360 (Wilex, Germany); скваламин, (Genaera, USA); RPI 4610 (Sirna, USA); ингибиторы гепараназы (hiSight, Israel); KL 3106 (Kolon, South Korea); Honokiol (Emory University, USA); ZK CDK (Schering AG, Germany); ZK Angio (Schering AG, Germany); ZK 229561 (Novartis, Switzerland, и Schering AG, Germany); XMP 300 (XOMA, USA); VGA 1102 (Taisho, Japan); антагонисты VE-кадгерина-2 (ImClone Systems, USA); вазостатин (National Institutes of Health, USA); Flk-1 (ImClone Systems, USA); TZ 93 (Tsumura, Japan); ТумСтатин (Beth Israel Hospital, USA); усеченный растворимый FLT 1 (рецептор 1 фактора роста сосудистого эндотелия) (Merck & Со, USA); лиганды Tie-2 (Regeneron, USA); и ингибитор тромбоспондина 1 (Allegheny Health, Education and Research Foundation, USA).
[00293] Дополнительные примеры терапевтических агентов, которые можно использовать в комбинации с соединениями по изобретению, включают агенты (например, антитела, антигенсвязывающие области или растворимые рецепторы), которые специфически связывают и ингибируют активность факторов роста, такие как антагонисты фактора роста гепатоцитов (HGF, также известного как рассеивающий фактор), и антитела или антигенсвязывающие области, которые специфически связывают его рецептор c-Met.
[00294] Другим примером терапевтического агента, который можно использовать в комбинации с соединениями по изобретению, является ингибитор аутофагии. Ингибиторы аутофагии включают, но не ограничиваются этим, хлорохин, 3-метиладенин, гидроксихлорохин (Плаквенил™), бафиломицин А1, 5-амино-4-имидазол карбоксамид-рибозид (AICAR), окадаиковую кислоту, подавляющие аутофагию токсины водорослей, которые ингибируют протеинфосфатазы типа 2А или типа 1, аналоги сАМР и лекарственные препараты, которые повышают уровни сАМР, такие как аденозин, LY204002, N6-меркаптопурин-рибозид и винбластин. Кроме того, также можно использовать миРНК, которая ингибирует экспрессию белков, включая, но не ограничиваясь этим, ATG5 (которые вовлечены в аутофагию). В некоторых вариантах осуществления один или более дополнительных видов терапии включают ингибитор аутофагии.
[00295] Другим примером терапевтического агента, который можно использовать в комбинации с соединениями по изобретению, является антинеопластический агент. В некоторых вариантах осуществления один или более дополнительных видов терапии включают антинеопластический агент. Неограничивающие примеры антинеопластических агентов включают ацеманнан, акларубицин, алдеслейкин, алемтузумаб, алитретиноин, алтретамин, амифостин, аминолевулиновую кислоту, амрубицин, амсакрин, анагрелид, анастрозол, анцер, анцестим, арглабин, триоксид мышьяка, ВАМ-002 (Novelos), бексаротен, бикалутамид, броксуридин, капецитабин, целмолейкин, цетрореликс, кладрибин, клотримазол, цитарабин окфосфат, DA 3030 (Dong-A), даклизумаб, денилейкин-дифтитокс, деслорелин, дексразоксан, дилазеп, доцетаксел, докозанол, доксеркальциферол, доксифлуридин, доксорубицин, бромокриптин, кармустин, цитарабин, фторурацил, диклофенак HIT, интерферон-альфа, даунорубицин, доксорубицин, третиноин, эдельфозин, эдреколомаб, эфлорнитин, эмитефур, эпирубицин, эпоэтин бета, этопозид фосфат, эксеместан, эксисулинд, фадрозол, филграстим, финастерид, флударабина фосфат, форместан, фотемустин, нитрат галлия, гемцитабин, гемтузумаб озогамицин, комбинацию гимерацил/отерацил/тегафур, гликопин, гозерелин, гептаплатин, хорионический гонадотропин человека, фетальный альфа-фетопротеин человека, ибандроновую кислоту, идарубицин (имиквимод, интерферон-альфа, природный интерферон-альфа, интерферон-альфа-2, интерферон-альфа-2а, интерферон-альфа-2b, интерферон-альфа-N1, интерферон-альфа-n3, интерферон-альфа-con-1, природный интерферон-альфа, интерферон-бета, интерферон-бета-1а, интерферон-бета-1b, интерферон-гамма, природный интерферон-гамма-1а, интерферон-гамма-1b, интерлейкин-1 бета, йобенгуан, иринотекан, ирсогладин, ланреотид, LC 9018 (Yakult), лефлуномид, ленограстим, лентинана сульфат, летрозол, лейкоцитарный интерферон-альфа, лейпрорелин, левамизол+фторурацил, лиарозол, лобаплатин, лонидамин, ловастатин, мазопрокол, меларсопрол, метоклопрамид, мифепристон, милтефозин, миримостим, несовпадающую двухцепочечную РНК, митогуазон, митолактол, митоксантрон, молграмостим, нафарелин, налоксон+пентазоцин, нартограстим, недаплатин, нилутамид, носкапин, новый стимулирующий эритропоэз белок, октреотид NSC 631570, опрелвекин, осатерон, оксалиплатин, паклитаксел, памидроновую кислоту, пэгаспаргазу, пэг-интерферон-альфа-2b, пентозанполисульфат натрия, пентостатин, пицибанил, пирарубицин, кроличье антитимоцитарное поликлональное антитело, полиэтиленгликоль-интерферон-альфа-2а, порфимер натрия, ралоксифен, ралтитрексед, расбуриказу, этидронат рения Re 186, ретинамид RII, ритуксимаб, ромуртид, лексидронам самария (153 Sm), сарграмостим, сизофиран, собузоксан, сонермин, хлорид стронция-89, сурамин, тазонермин, тазаротен, тегафур, темопорфин, темозоломид, тенипозид, тетрахлордекаоксид, талидомид, тималфазин, тиреотропин-альфа, топотекан, торемифен, тозитумомаб-йод 131, трастузумаб, треосульфан, третиноин, трилостан, триметрексат, трипторелин, природный фактор некроза опухоли альфа, убенимекс, вакцину от рака мочевого пузыря, вакцину Маруяма, вакцину на основе лизата меланомы, валрубицин, вертепорфин, винорелбин, вирулизин, циностатин стималамер или золендроновую кислоту; абареликс; АЕ 941 (Aeterna), амбамустин, антисмысловой олигонуклеотид, bcl-2 (Genta), АРС 8015 (Dendreon), децитабин, дексаминоглутетимид, диазиквон, EL 532 (Elan), ЕМ 800 (Endorecherche), энилурацил, этанидазол, фенретинид, филграстим SD01 (Amgen), фулвестрант, галоцитабин, иммуноген гастрин 17, генную терапию HLA-B7 (Vical), гранулоцитарно-макрофагальный колониестимулирующий фактор, гистамина дигидрохлорид, ибритутомаб тиуксетан, иломастат, IM 862 (Cytran), интерлейкин-2, ипроксифен, LDI 200 (Milkhaus), леридистим, линтузумаб, СА 125 MAb (Biomira), противораковое MAb (Japan Pharmaceutical Development), HER-2 и Fc MAb (Medarex), идиотипическое 105AD7 MAb (CRC Technology), идиотипическое CEA MAb (Trilex), LYM-1-йод 131 MAb (Techni clone), MAb с полиморфным эпителиальным муцином-иттрием 90 (Antisoma), маримастат, меногарил, митумомаб, мотексафин гадолиния, MX 6 (Galderma), неларабин, нолатрексед, белок Ρ 30, пегвисомант, пеметрексед, порфиромицин, приномастат, RL 0903 (Shire), рубитекан, сатраплатин, фенилацетат натрия, спарфозиевую кислоту, SRL 172 (SR Pharma), SU 5416 (SUGEN), ТА 077 (Tanabe), тетратиомолибдат, талибластин, тромбопоэтин, олова этилэтиопурпурин, тирапазамин, противораковую вакцину (Biomira), вакцину от меланомы (New York University), вакцину от меланомы (Sloan Kettering Institute), вакцину от меланомы на основе онколизата (New York Medical College), вирусную вакцину на основе лизата клеток меланомы (Royal Newcastle Hospital) или валсподар.
[00296] Дополнительные примеры терапевтических агентов, которые можно использовать в комбинации с соединениями по изобретению, включают ипилимумаб (Ервой®); тремелимумаб; галиксимаб; ниволумаб, также известный как BMS-936558 (Опдиво®); пембролизумаб (Кейтруда®); авелумаб (Бавенцио®); АМР224; BMS-936559; MPDL3280A, также известный как RG7446; MEDI-570; AMG557; MGA271; IMP321; BMS-663513; PF-05082566; CDX-1127; анти-ОХ40 (Providence Health Services); huMAbOX40L; атацицепт; CP-870893; лукатумумаб; дацетузумаб; муромонаб-CD3; ипилимумаб; MEDI4736 (Imfinzi®); MSB0010718C; AMP 224; адалимумаб (Хумира®); адо-трастузумаб эмтанзин (Кадсила®); афлиберцепт (Эйлеа®); алемтузумаб (Кампат®); базиликсимаб (Симулект®); белимумаб (Бенлиста®); базиликсимаб (симулект®); белимумаб (бенлиста®); брентуксимаб ведотин (Адцетрис®); канакинумаб (Иларис®); цертолизумаб пэгол (Химзиа®); даклизумаб (Зенапакс®); даратумумаб (Дарзалекс®); деносумаб (Пролиа ®); экулизумаб (Солирис®); эфализумаб (Раптива®); гемтузумаб озогамицин (Милотарг®); голимумаб (Симпони®); ибритутомаб тиуксетан (Зевалин®); инфликсимаб (Ремикейд®); мотавизумаб (Нумакс®); натализумаб (Тизабри®); обинутузумаб (Газива®); офатумумаб (Арцерра®); омализумаб (Ксолар®); паливизумаб (Синагис®); пертузумаб (Перьета®); ранибизумаб (Луцентис®); раксибакумаб (Абтракс®); тоцилизумаб (Актемра®); тозитумомаб; тозитумомаб-i-131; тозитумомаб и тозитумомаб-i-131 (Бексар®); устекинумаб (Стелара®); AMG 102; AMG 386; AMG 479; AMG 655; AMG 706; AMG745; и AMG951.
[00297] В некоторых вариантах осуществления дополнительное соединение, используемое в комбинированной терапии с соединением по настоящему изобретению, выбрано из группы, состоящей из ингибитора CDK4/6 (например, абемациклиба, палбоциклиба или рибоциклиба), ингибитора KRAS:GDP G12C (например, AMG 510, MRTX 1257) или ингибитора другого мутантного Ras:GDP, ингибитора KRAS:GTP G12C или ингибитора другого мутантного Ras:GTP, ингибитора МЕК (например, рефаметиниба, селуметиниба, траметиниба или кобиметиниба), ингибитора SHP2 (например, TNO155, RMC-4630), ингибитора ERK и ингибитора RTK (например, ингибитора EGFR).
[00298] В некоторых вариантах осуществления дополнительное соединение, используемое в комбинированной терапии с соединением по настоящему изобретению, выбрано из группы, состоящей из АВТ-737, АТ-7519, карфилзомиба, кобиметиниба, данусертиба, дазатиниба, доксорубицина, GSK-343, JQ1, MLN-7243, NVP-ADW742, паклитаксела, палбоциклиба и воласертиба. В некоторых вариантах осуществления дополнительное соединение, используемое в комбинированной терапии с соединением по настоящему изобретению, выбрано из группы, состоящей из нератиниба, ацетиниба и реверсина.
[00299] Описанные в данном документе соединения можно использовать в комбинации с описанными в данном документе агентами или другими подходящими агентами, в зависимости от подлежащего лечению патологического состояния. Следовательно, в некоторых вариантах осуществления одно или более соединений по изобретению можно вводить совместно с другими видами терапии, описанными в данном документе. При применении в комбинированной терапии описанные в данном документе соединения можно вводить со вторым агентом одновременно или раздельно. Введение в комбинации включает одновременное введение двух агентов в одной дозированной форме, одновременное введение отдельных дозированных форм и раздельное введение. Это означает, что описанное в данном документе соединение и любой из описанных в данном документе агентов можно смешивать вместе в одной дозированной форме и вводить одновременно. В альтернативном варианте соединение по изобретению и любой из описанных в данном документе видов терапии можно вводить одновременно, причем оба агента находятся в отдельных составах. В другом альтернативном варианте можно вводить соединение по настоящему изобретению, а за ним - любой из описанных в данном документе видов терапии, или наоборот. В некоторых вариантах осуществления протокола раздельного введения соединение по изобретению и любой из описанных в данном документе видов терапии вводят с интервалом в несколько минут, или несколько часов, или несколько суток.
[00300] В некоторых вариантах осуществления в комбинированной терапевтической схеме применяют два терапевтических агента, один - соединение по настоящему изобретению, а второй выбран из описанных в данном документе терапевтических агентов. В некоторых вариантах осуществления в комбинированной терапевтической схеме применяют три терапевтических агента, один - соединение по настоящему изобретению, а два выбраны из описанных в данном документе терапевтических агентов. В некоторых вариантах осуществления в комбинированной терапевтической схеме применяют четыре или более терапевтических агентов, один - соединение по настоящему изобретению, а три выбраны из описанных в данном документе терапевтических агентов.
[00301] В некоторых вариантах осуществления любых описанных в данном документе способов первый вид терапии (например, соединение по изобретению) и один или более дополнительных видов терапии применяют одновременно или последовательно в любом порядке. Первый терапевтический агент можно вводить немедленно, за 1 час, за 2 часа, за 3 часа, за 4 часа, за 5 часов, за 6 часов, за 7 часов, за 8 часов, за 9 часов, за 10 часов, за 11 часов, за 12 часов, за 13 часов, 14 часов, за часов 16, за 17 часов, за 18 часов, за 19 часов за 20 часов, за 21 час, за 22 часа, за 23 часа, за 24 часа или за 1-7, 1-14, 1-21 или 1-30 суток до или после одного или более дополнительных видов терапии.
[00302] В изобретении также представлены наборы, содержащие (а) фармацевтическую композицию, содержащую агент (например, соединение по изобретению), описанный в данном документе, и (b) вкладыш в упаковку с инструкциями по выполнению любого из описанных в данном документе способов. В некоторых вариантах осуществления набор содержит (а) фармацевтическую композицию, содержащую агент (например, соединение по изобретению), описанный в данном документе, (b) один или более дополнительных видов терапии (например, нелекарственное лечение или терапевтический агент) и (с) вкладыш в упаковку с инструкциями по выполнению любого из описанных в данном документе способов.
[00303] Поскольку один аспект настоящего изобретения предусматривает лечение заболевания или связанных с ним симптомов с помощью комбинации фармацевтически активных соединений, которые можно вводить раздельно, изобретение дополнительно относится к комбинированию отдельных фармацевтических композиций в форме набора. Набор может содержать две отдельные фармацевтические композиции: соединение по настоящему изобретению и один или более дополнительных видов терапии. Набор может содержать контейнер для размещения отдельных композиций, такой как разделенная бутылка или разделенный пакет из фольги. Дополнительные примеры контейнеров включают шприцы, коробки и пакеты. В некоторых вариантах осуществления набор может содержать инструкции по применению отдельных компонентов. Форма набора является в особенности преимущественной, когда отдельные компоненты предпочтительно вводить в разных дозированных формах (например, пероральной и парентеральной), вводить с разными интервалами между дозированиями, или когда рекомендовано титрование отдельных компонентов комбинации назначившим ее специалистом в области здравоохранения.
[00304] В этом разделе по комбинированной терапии все ссылки на описанные агенты включены посредством ссылки независимо от того, указано это в явном виде или нет.
ПРИМЕРЫ
[00305] Данное изобретение дополнительно проиллюстрировано следующими примерами и примерами синтеза, которые не следует воспринимать как ограничение данного изобретения по объему или сущности конкретными описанными в данном документе процедурами. Следует понимать, что примеры приведены в целях иллюстрации некоторых вариантов осуществления и не подразумевают ограничения объема изобретения. Кроме того, следует понимать, что можно прибегнуть к различным другим вариантам осуществления, модификациям и их эквивалентам, которые могут быть предложены специалистами в данной области техники без отступления от сущности настоящего изобретения и/или объема прилагаемой формулы изобретения.
[00306] Определения, используемые в следующих примерах и в других местах данного документа:
Пример 1. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-(морфолин-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина
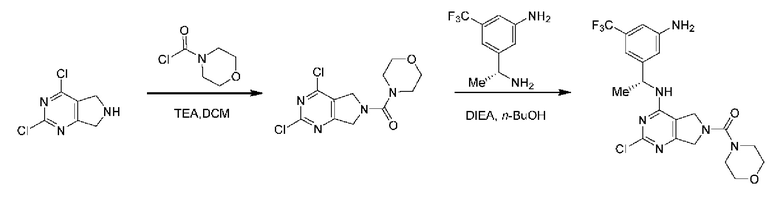
Этап 1.
[00307] В смесь 2,4-дихлор-6,7-дигидро-5H-пирроло[3,4-d]пиримидин (105 мг, 551 мкмоль) и ТЭА (230 мкл, 1,65 ммоль) в ДХМ (1 мл) добавляли морфолин-4-карбонилхлорид (64 мкл, 551,44 мкмоль), смесь перемешивали при 25°С в течение 1 ч и потом концентрировали при пониженном давлении. Неочищенный остаток очищали посредством препаративной ТСХ с получением (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (20 мг, выход 12%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C11H13Cl2N4O2: 303,0; полученное 303,1.
Этап 2.
[00308] В смесь (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (20 мг, 66 мкмоль) и 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилина гидрохлорида (21 мг, 86 мкмоль) в n-BuOH (1 мл) добавляли ДИЭА (114,92 мкл, 660 мкмоль). Смесь перемешивали при 100°С в течение 2 ч, охлаждали до кт и фильтровали. Растворитель удаляли при пониженном давлении, а неочищенный продукт очищали посредством препаративной ВЭЖХ с получением [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-5,7-дигидропирроло[3,4-d]тримидин-6-ил]-морфолинометанона (6 мг, выход 19%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H23ClF3N6O2: 471,1; полученное 471,0; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 6,91 (д, J=9,54 Гц, 2 Н) 6,81 (с, 1 Н) 5,29-5,38 (м, 1 Н) 4,54-4,65 (м, 4 Н) 3,68-3,76 (м, 4 Н) 3,33-3,36 (м, 4 Н) 1,54 (д, J=7,09 Гц 3 Н).
Пример 2. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6-(морфолин-4-карбонил)-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-4-амина
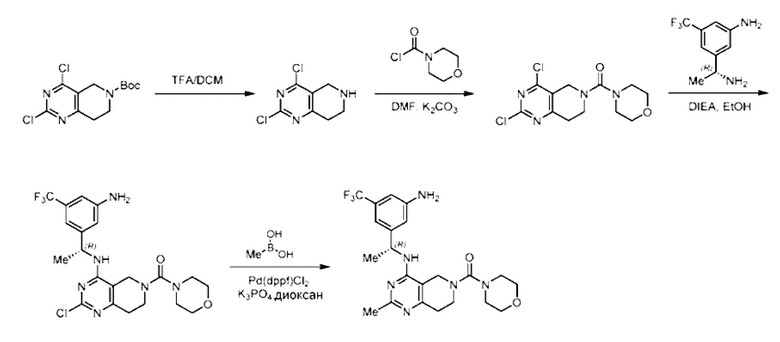
Этап 1.
[00309] В смесь трет-бутил 2,4-дихлор-7,8-дигадро-5Н-пиридо[4,3-d]пиримидин-6-карбоксилата (0,2 г, 660 мкмоль) в ДХМ (3 мл) добавляли ТФУ (1 мл) при 20°С. Смесь перемешивали при 20°С в течение 12 ч, а потом концентрировали с получением 2,4-дихлор-5,6,7,8-тетрагидропиридо[4,3-d]пиримидина (0,21 г) в виде желтого твердого вещества, которое использовали на следующем этапе без дополнительной очистки. 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 4,41 (с, 2 Н) 3,62 (т, J=6,28 Гц, 2 Н) 3,21 (т, J=6,28 Гц, 2 Н).
Этап 2.
[00310] В смесь 2,4-дихлор-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин трифторацетата (0,21 г, 660 мкмоль) в ТГФ (5 мл) добавляли морфолин-4-карбонилхлорид (77 мкл, 660 мкмоль) и ТЭА (460 мкл, 3,3 ммоль). Смесь перемешивали при 20°С в течение 1 ч, и потом концентрировали при пониженном давлении. Неочищенный материал очищали посредством силикагелевой хроматографии с получением (2,4-дихлор-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-6-ил)-морфолинометанона (0,2 г, выход 95%), 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 4,42 (с, 2 Н) 3,66-3,74 (м, 4 Н) 3,60 (т, J=5,84 Гц, 2 Н) 3,33-3,38 (м, 4 Н) 3,01 (т, J=5,84 Гц, 2 Η).
Этап 3.
[00311] В смесь (2,4-дихлор-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-6-ил)-морфолинометанона (0,2 г, 630 мкмоль) в бутан-1-оле (4 мл) добавляли 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилин гидрохлорид (182 мг, 757 мкмоль) и ДИЭА (1,1 мл, 6,31 ммоль). Смесь перемешивали при 90°С в течение 3 ч, и потом концентрировали при пониженном давлении. Неочищенный остаток очищали посредством силикагелевой хроматографии с получением [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-6-ил]-морфолинометанона (0,28 г, выход 71%). 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 6,94 (с, 1 Н) 6,91 (с, 1 Н) 6,81 (с, 1 Н) 5,39 (кв, J=7,06 Гц, 1 Н) 4,16 (с, 2 Н) 3,68-3,71 (м, 4 Н) 3,53 (т, J=5,84 Гц, 2 Н) 3,32-3,37 (м, 4 Н) 2,75 (с, 2 Н) 1,56 (д, J=7,06 Гц, 3 Н).
Этап 4.
[00312] В раствор [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-6-ил]-морфолинометанона (0,28 г, 577 мкмоль) в ДМЭ (3 мл) добавляли метилбороновую кислоту (242 мг, 4,0 ммоль), Н2О (0,6 мл), Na2CO3 (367 мг, 3,5 ммоль) и Pd(PPh3)4 ([1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий (II), 133 мг, 115 мкмоль). Реакционную смесь перемешивали при 100°С в течение 16 ч, охлаждали до комнатной температуры и концентрировали при пониженном давлении. Неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-6-ил]-морфолинометанона (6 мг, выход 2%). 1H ЯМР (400 МГц, Метанол-d4) δ м. д. 6,93 (с, 2 Н) 6,78 (с, 1 Н) 5,43-5,50 (м, 1 Н) 4,16 (с, 2 Н) 3,65-3,76 (м, 4 Н) 3,54 (т, J=5,95 Гц, 2 Н) 3,33 (шир. с, 4 Н) 3,31-3,35 (м, 1 Н) 2,74 (т, J=5,62 Гц, 2 Н) 2,33 (с, 3 Н) 1,54 (д, J=7,06 Гц, 3 Н); ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H28F3N6O2: 465,2; полученное 465,2.
Пример 3. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-(мор?олин-4-?арбонил)-5Н,6Н,7Н,8Н-пиридо[4,3-d]пиримидин-4-амина
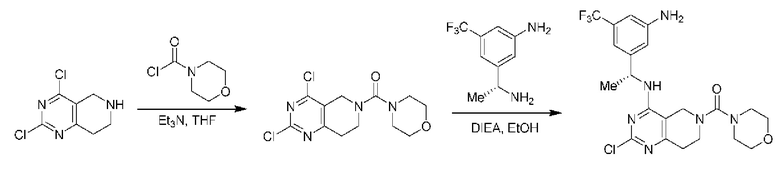
Этап 1.
[00313] В раствор 2,4-дихлор-5,6,7,8-тетрагидропиридо[4,3-d]пиримидина (200 мг, 980 мкмоль) и морфолин-4-карбонилхлорида (137 мкл, 1Д8 ммоль) в ТГФ (5 мл) добавляли ТЭА (409 мкл, 2,94 ммоль). Смесь перемешивали при 0°С в течение 0,5 ч и потом охлаждали до 25°С в течение 2 ч. Добавляли воду (20 мл) и экстрагировали смесь EtOAc. Объединенные органические фазы промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ТСХ с получением (2,4-дихлор-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-6-ил)-морфолинометанона (150 мг, выход 48%). 1H ЯМР (400 МГц, ДМСО-d6) δ м. д. 4,30 (с, 2 Η) 3,61-3,55 (м, 4 Η) 3,49 (т, J=5,75 Гц, 2 Η) 3,25-3,19 (м, 4 Η) 2,96 (т, J=5,69 Гц, 2 Η).
Этап 2.
[00314] В смесь (2,4-дихлор-7,8-дигидро-5Н-пиридо[4,3-d]пиримидин-6-ил)-морфолинометано на (50 мг, 157 мкмоль) и 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилина (41 мг, 205 мкмоль) в EtOH (2 мл) добавляли ДИЭА (82 мкл, 473 мкмоль). Реакционную смесь перемешивали при 100°С в течение 3 ч, охлаждали до кт и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-6-ил]-морфолинометанона (15 мг, выход 19%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H25ClF3N6O2: 485,2; полученное 485,2; 1H ЯМР (400 МГц, Метанол-d4) δ м. д. 6,94 (с, 1 Н) 6,91 (с, 1 Н) 6,81 (с, 1 Н) 5,39 (кв, J=7,05 Гц, 1 Н) 4,16 (с, 2 Н) 3,71-3,66 (м, 4 Н) 3,53 (т, J=5,81 Гц, 2 Н) 3,35-3,32 (м, 4 Н) 2,75 (т, J=5,62 Гц, 2 Н) 1,56 (д, J=6,97 Гц, 3 Н).
Пример 4. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6-(морфолин-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина
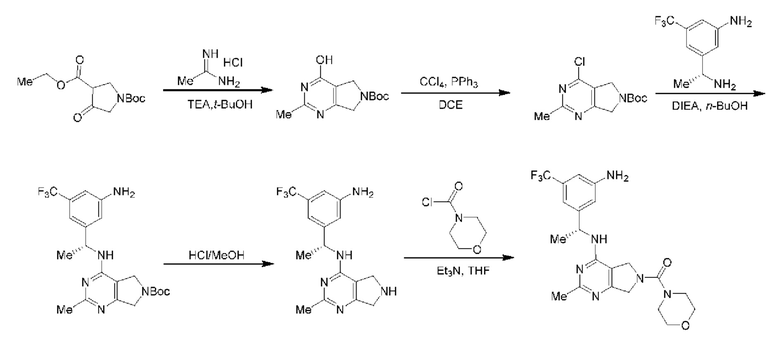
Этап 1.
[00315] В смесь O1-трет-бутил О3-этил 4-оксопирролидина-1,3-дикарбоксилата (4 г, 15,6 ммоль) и ацетамидина гидрохлорида (1,47 г, 15,6 ммоль) в f-BuOH (40 мл) добавляли ТЭА (5,6 мл, 40,4 ммоль). Реакционную смесь перемешивали при 90°С в течение 1 ч, охлаждали до кт и удаляли растворитель при пониженном давлении. Неочищенный продукт очищали с помощью обращенно-фазовой колонки с получением трет-бутил 4-гидрокси-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилата (1 г, выход 25%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C12H18N3O3: 252,1; полученное 252,3.
Этап 2.
[00316] В смесь трет-бутил 4-гидрокси-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилата (440 мг, 1,75 ммоль) и PPh3 (918 мг, 3,5 ммоль) в ДХЭ (4 мл) добавляли CCl4 (505 мкл, 5,25 ммоль). Смесь перемешивали при 70°С в течение 3 ч. Реакционную смесь охлаждали до кт и удаляли растворитель при пониженном давлении с получением неочищенного остатка, который объединяли с другой партией (80 ммоль исходного материала) для очистки посредством колоночной хроматографии с получением трет-бутил 4-хлор-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилата (460 мг, выход 67%). 1Н ЯМР (400 МГц, Метанол-d4) δ=4,73-4,59 (м, 4Н), 2,71-2,61 (м, 3Н), 1,58-1,48 (м, 9Н).
Этап 3.
[00317] В смесь трет-бутил 4-хлор-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилата (200 мг, 741 мкмоль) и 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилина (196 мг, 964 мкмоль) в n-BuOH (2 мл) добавляли ДИЭА (387 мкл, 2,2 ммоль). Реакционную смесь перемешивали при 110°С в течение 12 ч, охлаждали до кт и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством колоночной хроматографии с получением трет-бутил 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилата (250 мг, выход 77%). 1Н ЯМР (400 МГц, Метанол-d4) δ=6,96-6,87 (м, 2Н), 6,81-6,76 (м, 1H), 5,46-5,34 (м, 1H), 4,54-4,40 (м, 4Н), 2,42-2,35 (м, 3Н), 2,01 (с, 2Н), 1,52 (д, J=2,0 Гц, 10Н).
Этап 4.
[00318] трет-бутил 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилат (140 мг, 320 мкмоль) растворяли в HCl/МеОН (3 мл). После перемешивания при кт в течение 1 ч растворитель удаляли при пониженном давлении с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6,7-дигидро-5H-пирроло[3,4-d]пиримидин-4-амина гидрохлорид (119 мг, выход 99%). 1Н ЯМР (400 МГц, Метанол-d4) δ=7,91-7,81 (м, 2Н), 7,62-7,58 (м, 1H), 5,72-5,64 (м, 1H), 4,76-4,62 (м, 4Н), 2,59-2,54 (м, 3Н), 1,73-1,64 (м, 3Н).
Этап 5.
[00319] В смесь N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6,7-дигидро-5Н-пирроло[3,4-d]пиримидин-4-амина гидрохлорида (110 мг, 294,27 мкмоль) в ТГФ (2 мл) добавляли ТЭА (163 мкл, 1,18 ммоль) и морфолин-4-карбонилхлорид (34 мкл, 294 мкмоль) при 0°С. Смесь перемешивали при 25°С в течение 30 мин, растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона формиата (41 мг, выход 27%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H26F3N6O2: 450,3; полученное; 450,3; 1Н ЯМР (400 МГц, Метанол-d4) δ=8,21 (с, 1H), 6,96-6,87 (м, 2Н), 6,84-6,78 (м, 1H), 5,46-5,36 (м, 1H), 4,60 (д, J=17,0 Гц, 4Н), 3,75-3,71 (м, 4Н), 3,38-3,35 (м, 4Н), 2,40 (с, 3Н), 1,53 (д, J=6,8 Гц, 3Н).
Пример 5. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-(оксолан-3-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина

Этап 1.
[00320] В раствор тетрагидрофуран-3-карбоновой кислоты (20 мкл, 205 мкмоль) и 2,4-дихлор-6,7-дигидро-5H-пирроло[3,4-d]пиримидин трифторацетата (52 мг, 171 мкмоль) в ТГФ (1 мл) добавляли ДИПЭА (89 мкл, 513 мкмоль) и Т3Р (76 мкл, 257 мкмоль). Смесь перемешивали при 20°С в течение 0,5 ч. Растворитель удаляли при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением (4,6-дихлор-1,3-дигидропирроло[3,4-с]пиридин-2-ил)-тетрагидрофуран-3-ил-метанона (20 мг, 70 мкмоль) в виде белого твердого вещества. 1Н ЯМР (400 МГц, Хлороформ-d) δ м. д. 4,89-4,98 (м, 2 Н) 4,85 (д, J=13,94 Гц, 2 Н) 4,06-4,15 (м, 1 Н) 3,96-4,03 (м, 4 Н) 3,87-3,95 (м, 4 Н) 3,78-3,87 (м, 2 Н) 3,18-3,29 (м, 1 Н) 3,07-3,17 (м, 2 Н) 2,10-2,32 (м, 6 Н).
Этап 2.
[00321] В раствор (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-тетрагидрофуран-3-ил-метанона (20 мг, 70 мкмоль) и 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилина (18 мг, 90 мкмоль) в n-BuOH (1 мл) добавляли ДИЭА (121 мкл, 694 мкмоль). Реакционную смесь перемешивали при 100°С в течение 2 ч, охлаждали до кт и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-тетрагидрофуран-3-ил-метанона (6 мг, выход 19%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H21ClF3N5O2: 455,9; полученное 456,1; 1Н ЯМР (400 МГц, ДМСО-d6) δ м. д. 7,97-8,02 (м, 1 Н) 7,84-7,88 (м, 1 Н) 6,80-6,88 (м, 2 Н) 6,72-6,78 (м, 1 Н) 5,31-5,40 (м, 2 Н) 5,16-5,28 (м, 1 Н) 4,69 (дд, J=4,41, 1,54 Гц, 2 Н) 4,40-4,53 (м, 2 Н) 3,91-4,00 (м, 1 Н) 3,69-3,82 (м, 3 Н) 3,19-3,31 (м, 1 Н) 2,16 (д, J=7,28 Гц, 2 Н) 1,44-1,52 (м, 3 Н).
Пример 6. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6-(оксолан-3-карбонил)-5H,6H,7H,8H-пиридо[4,3-d]пиримидин-4-амина
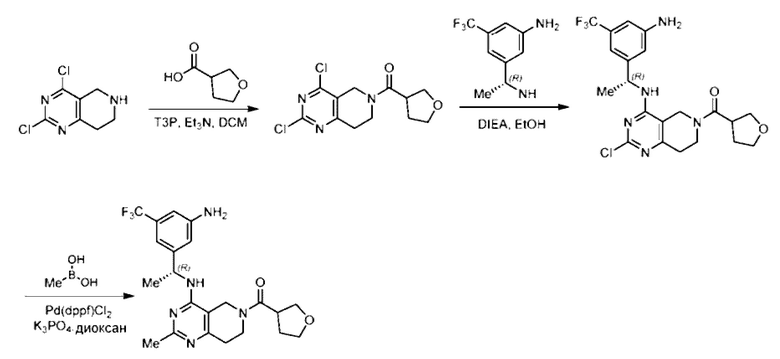
Этап 1.
[00322] В смесь тетрагидрофуран-3-карбоновой кислоты (76 мкл, 792 мкмоль) и 2,4-дихлор-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин трифторацетата (0,21 г, 660 мкмоль) в ТГФ (5 мл) добавляли ДИЭА (345 мкл, 1,98 ммоль), Т3Р (295 мкл, 990 мкмоль). Смесь перемешивали при 25°С в течение 0,5 ч, и потом концентрировали при пониженном давлении. Неочищенный остаток очищали посредством силикагелевой хроматографии с получением (2,4-дихлор-7,8-дигадро-5H-пиридо[4,3-d]пиримидин-6-ил)-тетрагидрофуран-3-ил-метанона (0,1 г, выход 50%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 4,69-4,79 (м, 2 Н) 3,78-4,03 (м, 6 Н) 3,48-3,63 (м, 1 Н) 3,04 (т, J=5,87 Гц, 1 Н) 2,94 (т, J=5,75 Гц, 1 Н) 2,06-2,30 (м, 2 Н).
Этап 2.
[00323] В раствор (2,4-дихлор-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-6-ил)-тетрагидрофуран-3-ил-метанона (0,1 г, 331 мкмоль) в бутан-1-оле (1 мл) добавляли 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилин гидрохлорид (88 мг, 364 мкмоль) и ДИЭА (576 мкл, 3,31 ммоль). Смесь перемешивали при 90°С в течение 4 ч, и потом концентрировали при пониженном давлении. Неочищенный остаток очищали посредством препаративной ТСХ с получением [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-7,8-дигидро-5Н-пиридо[4,3-d]пиримидин-6-ил]-тетрагидрофуран-3-ил-метанона (0,13 г, выход 84%).
Этап 3.
[00324] В раствор [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-7,8-дигидро-5Н-пиридо[4,3-d]пиримидин-6-ил]-тетрагидрофуран-3-ил-метанона (130 мг, 277 мкмоль) в диоксане (2 мл) добавляли метилбороновую кислоту (99 мг, 1,7 ммоль), H2O (0,4 мл), K3PO4 (352 мг, 1,7 ммоль) и Pd(dppf)Cl2-CH2Cl2 (45 мг, 55 мкмоль). Смесь перемешивали при 80°С в течение 2 ч в атмосфере N2. После охлаждения до кт, растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-7,8-дигидро-5Н-пиридо[4,3-d]пиримидин-6-ил]-тетрагидрофуран-3-ил-метанона (10 мг, выход 8%) в виде формиата. ЖХМС (ПЭР): m/z: [М+Н], рассчитанное для C22H27F3N5O2: 450,2; полученное 450,2; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 6,93 (шир. д, J=9,66 Гц, 2 Н) 6,79 (шир. с, 1 Н) 5,40-5,57 (м, 1 Н) 4,49 (д, J=5,01 Гц, 2 Н) 3,77-4,04 (м, 7 Н) 3,52-3,60 (м, 1 Н) 2,64-2,84 (м, 2 Н) 2,37 (с, 3 Н) 2,00-2,27 (м, 2 Н) 1,53-1,62 (м, 3 Н).
Пример 7. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-7-(оксолан-3-карбонил)-5Н,6Н,7Н,8Н,9Н-пиримидо[4,5-d]азепин-4-амина
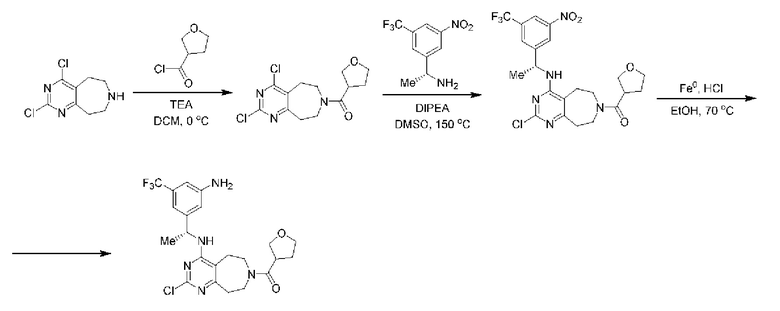
Этап 1.
[00325] Раствор тетрагидрофуран-3-карбонилхлорида (106 мг, 0,79 ммоль) в безводном ДХМ (0,4 мл) добавляли в раствор 2,4-дихлор-5Н,6Н,7Н,8Н,9Н-пиримидо[4,5-d]азепина гидрохлорида (0,2 г, 0,79 ммоль) в ДХМ (6 мл) и ТЭА (0,49 мл, 3,54 ммоль) при 0°С в атмосфере аргона. После перемешивания в течение 12 ч реакционную смесь разводили ДХМ и промывали водой и солевым раствором. Объединенные органические фазы сушили над Na2SO4, растворитель удаляли при пониженном давлении, а неочищенный продукт очищали посредством флэш-хроматографии с получением 2,4-дихлор-7-(оксолан-3-карбонил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепина(122 мг, выход 49%). СВЭЖХ (ИЭР): m/z: [М+Н], рассчитанное для C13H15C12N3O2: 316,2; полученное 316,5.
Этап 2.
[00326] Дегазированную смесь 2,4-дихлор-7-(оксолан-3-карбонил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепина (122 мг, 0,39 ммоль), ДИПЭА (269 мкл, 1,54 ммоль) и (1R)-1-[3-нитро-5-(трифторметил)фенил]этан-1-амина гидрохлорида (115 мг, 0,42 ммоль) в безводном ДМСО (3,5 мл) перемешивали в течение 1 ч при 150°С в микроволновом реакторе. После охлаждения до кт реакционную смесь разводили водой и экстрагировали Et2O. Объединенные органические фазы промывали водой и сушили над Na2SO4, Растворитель удаляли при пониженном давлении, а неочищенный продукт очищали посредством флэш-хроматографии с получением 2-хлор-N-[(1R)-1-[3-нитро-5-(трифтор-метил)фенил]этил]-7-(оксолан-3-карбонил)-5H,6H,7H,8H,9H-пиримидо-[4,5-d]азепин-4-амина (130 мг, выход 66%). 1Н ЯМР (300 МГц, Хлороформ-d) δ 8,44 (с, 1Н), 8,39 (с, 1Н), 8,03 (д, J=13,1 Гц, 1H), 5,51 (шир. с, 1H), 5,46-5,34 (м, 1H), 4,07-3,92 (м, 2Н), 3,84 (дд, J=27,2, 10,9 Гц, 6Н), 3,29-3,13 (м, 3Н), 2,74 (с, 2Н), 2,10 (дд, J=13,3, 6,0 Гц, 2Н), 1,69 (д, J=6,9 Гц, 3Н).
Этап 3.
[00327] В раствор 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-карбонил)-5H,6H,7H,8H,9H-пиримидо-[4,5-d]азепин-4-амина (130 мг, 0,25 ммоль) в EtOH (2,5 мл) добавляли порошок железа (78 мг, 1,39 ммоль) и НСlводн (1 М, 1,0 мл, 1,0 ммоль). Смесь перемешивали в течение 12 ч при 70°С. Реакционную смесь фильтровали через целит, промывали МеОН и удаляли растворитель при пониженном давлении. Неочищенный продукт очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифтор-метил)фенил]этил]-2-хлор-7-(оксолан-3-карбонил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амина (40 мг, выход 33%). ЖХМС (ИЭР): СВЭЖХ (ИЭР): m/z: [М+Н], рассчитанное для C22H25ClF3N5O2: 483,9; полученное 484,1; 1Н ЯМР (300 МГц, Метанол-d4) δ 6,98-6,84 (м, 2Н), 6,79 (с, 1H), 5,39-5,20 (м, 1H), 3,93 (кв, J=7,9 Гц, 1H), 3,88-3,66 (м, 6Н), 3,44 (π, J=7,9 Гц, 1H), 3,09-2,93 (м, 2Н), 2,84 (дт, J=11,7, 6,4 Гц, 2Н), 2,23-1,98 (м, 2Н), 1,98-1,84 (м, 1H), 1,61-1,45 (м, 3Н).
Пример 8. Синтез цис-4-(4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-хлор-5H,6H,7H-пирроло[3,4-d]пиримидин-6-ил)циклогексан-1-ола
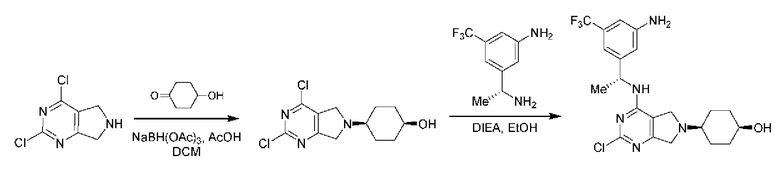
Этап 1.
[00328] В смесь 2,4-дихлор-6,7-дигидро-5H-пирроло[3,4-d]пиримидина гидрохлорида (200 мг, 883 мкмоль) в ДХМ (1,4 мл) и АсОН (0,6 мл) добавляли NaBH(OAc)3 (468 мг, 2,21 ммоль) и 4-гидроксициклогексанон (101 мг, 883 мкмоль). Смесь перемешивали при 25°С в течение 3 ч и потом фильтровали. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением цис-4-(2,4-дихлор-5H-пирроло[3,4-d]пиримидин-6(7H)-ил)циклогексанола (60 мг, 208,21 мкмоль, выход 23,58%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C12H16Cl2N3O: 288,1; полученное 287,8.
Этап 2.
[00329] В смесь цис-4-(2,4-дихлор-5Н-пирроло[3,4-d]пиримидин-6(7H)-ил)циклогексанола (58 мг, 201,27 мкмоль, 1 же.) в n-BuOH (1 мл) добавляли 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилин (53 мг, 262 мкмоль) и ДИЭА (351 мкл, 2,0 ммоль). Смесь перемешивали при 100°С в течение 8 ч, охлаждали до кт и фильтровали. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением цис-4-(4-(((R)-1-(3-амино-5-(трифторметил)фенил)этил)амино)-2-хлор-5H-пирроло[3,4-d]пиримидин-6(7H)-ил)циклогексанола (8 мг, выход 9%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H26ClF3N5O: 456,2; полученное 456,0; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 6,90 (д, J=8,31 Гц, 2 Н) 6,80 (с, 1 Н) 5,26-5,35 (м, 1 Н) 3,84 (д, J=19,44 Гц, 5 Н) 2,50-2,59 (м, 1 Н) 1,68-1,84 (м, 6 Н) 1,56-1,65 (м, 2 Н) 1,52 (д, J=6,97 Гц, 3 Н).
Пример 9. Синтез транс-4-(4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-хлор-5H,6H,7H-пирроло[3,4-d]пиримидин-6-ил)циклогексан-1-ола
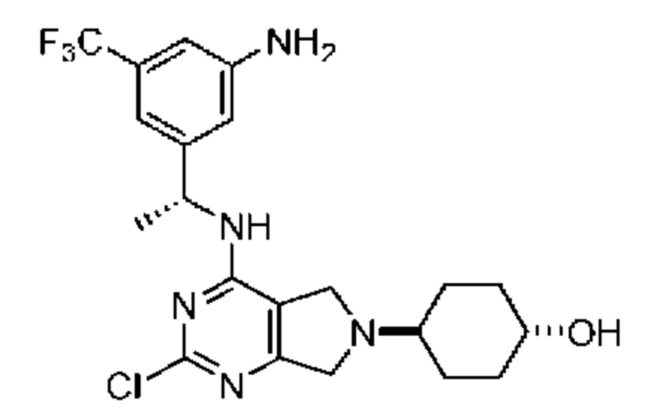
[00330] транс-4-(4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-хлор-5H,6H,7H-пирроло[3,4-d]пиримидин-6-ил)циклогексан-1-ол синтезировали способом, аналогичным цис-4-(4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-хлор-5H,6H,7H-пирроло[3,4-d]пиримидин-6-ил)циклогексан-1-олу, за исключением того, что цис-4-(2,4-дихлор-5Н-пирроло[3,4-d]пиримидин-6(7H)-ил)циклогексанол заменяли транс-4-(2,4-дихлор-5H-пирроло[3,4-d]пиримидин-6(7H)-ил)циклогексанолом. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H26ClF3N5O: 456,2; полученное 456,0; 1H ЯМР (400 МГц, Метанол-d4) δ м. д. 6,89 (д, J=6,48 Гц, 2 Н,) 6,80 (с, 1 Н) 5,30 (д, J=5,99 Гц, 1 Н) 3,84 (д, J=18,58 Гц, 4 Н) 3,51-3,58 (м, 1 Н) 2,48 (с, 1 Н) 1,96-2,10 (м, 4 Н) 1,52 (д, J=7,09 Гц, 3 Н) 1,29-1,37 (м, 4 Н).
Пример 10. Синтез цис-4-(4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-хлор-5H,6H,7H-пирроло[3,4-d]пиримидин-6-ил)-N,N-диметилци?логе?сан-1-карбоксамида
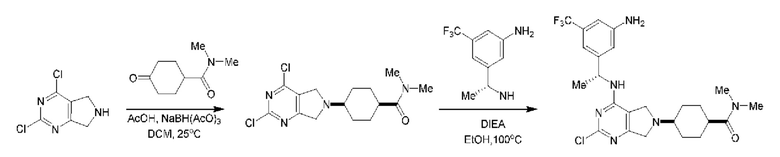
Этап 1.
[00331] В смесь 2,4-дихлор-6,7-дигидро-5Н-пирроло[3,4-d]пиримидина трифторацетата (1,68 г, 5,53 ммоль) и N,N-диметил-4-оксо-циклогексанкарбоксамида (935 мг, 5,53 ммоль) в ДХМ (11,2 мл) добавляли уксусную кислоту (4,8 мл) и NaBH(OAc)3 (4,10 г, 19,3 ммоль).
Смесь перемешивали при 25°С в течение 3 ч. Растворитель удаляли при пониженном давлении, а остаток разводили в Н2О. Смесь экстрагировали EtOAc, а объединенные органические фазы промывали солевым раствором и сушили над NaSO4. Растворитель удаляли при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением цис-4-(2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-N,N-диметил-циклогексанкарбоксамида (500 мг, выход 26%) и транс-4-(2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-N,N-диметил-циклогексанкарбоксамида (150 мг, выход 8%. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C15H21Cl2N4O: 343,10; полученное 343,2.
Этап 2.
[00332] В раствор 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилина (93 мг, 454 мкмоль) и цис-4-(2,4-дихлор- 5,7-дигидропирроло [3,4-d] пиримидин-6-ил)-N,N-диметил-циклогексанкарбоксамида (120 мг, 350 мкмоль) в n-BuOH (1 мл) добавляли ДИЭА (609 мкл, 3,5 ммоль). Реакционную смесь перемешивали при 100°С в течение 5 ч, охлаждали до кт и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством препаративной ВЭЖХ с получением цис-4-[4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-Ν,Ν-диметил-циклогексанкарбоксамида (20 мг, выход 11%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C24H31ClF3N6O: 511,2; полученное 511,1; 1Н ЯМР (400 МГц, Хлороформ-d) δ м. д. 6,96 (с, 1 Η) 6,82 (шир. д, J=9,66 Гц, 2 Н) 5,28-5,39 (м, 1 Н) 4,75 (шир. д, J=2,08 Гц, 1 Н) 3,92 (шир. с, 2 Н) 3,83 (шир. с, 2 Н) 3,75 (шир. с, 2 Н) 3,05 (с, 3 Н) 2,93 (с, 3 Н) 2,69 (шир. с, 1 Н) 2,61 (шир. с, 1 Н) 1,95 (шир. д, J=11,74 Гц, 4 Н) 1,58 (с, 3 Н) 1,45-1,55 (м, 4 Н).
Пример 22. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-тетрагидропиран-4-ил-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-4-амина
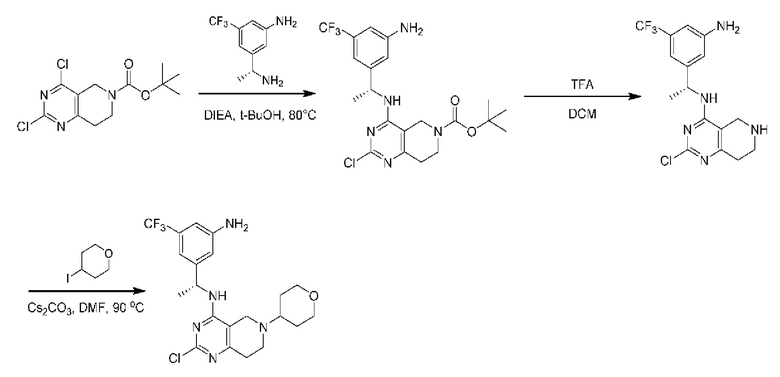
Этап 1.
[00333] В смесь трет-бутил 2,4-дихлор-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-6-карбоксилата (150 мг, 493 мкмоль) в t-BuOH (0,5 мл) добавляли ДИПЭА (859 мкл, 4,93 ммоль) и 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилин (121 мг, 0,59 ммоль). Смесь перемешивали при 80°С в течение 3 ч, растворитель удаляли при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением трет-бутил 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-6-карбоксилата (0,15 г, выход 25%). 1H ЯМР (400 МГц, Метанол-d4) δ м. д. 6,94 (с, 1H), 6,91 (с, 1H), 6,82-6,79 (м, 1H), 5,45-5,30 (м, 1H), 4,39-4,31 (м, 2Н).
Этап 2.
[00334] В смесь трет-бутил 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-6-карбоксилата (150 мг, 0,32 ммоль) в ДХМ (0,9 мл) добавляли ТФУ (0,3 мл). Смесь перемешивали при кт в течение 30 мин, а растворитель удаляли при пониженном давлении с получением ТФУ-соли N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-4-амина (0,15 г, выход 97%). 1H ЯМР (400 МГц, Метанол-d4) δ м. д. 7,46 (с, 1H), 7,39 (с, 1H), 7,26 (с, 1H), 5,48-5,33 (м, 1Н), 4,18 (с, 2Н), 3,56-3,53 (м, 2Н), 2,96-2,93 (м, 2Н), 1,61 (д, J=4,0 Гц, 3Н).
Этап 3.
[00335] В смесь ТФУ-соли N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-4-амина (150 мг, 0,31 ммоль) в ДМФ (1 мл) добавляли Cs2CO3 (805 мг, 2,47 ммоль) и 4-йодтетрагидропиран (327 мг, 1,54 ммоль). Смесь перемешивали при 100°С в течение 2 ч, растворитель удаляли при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ (× 2) с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-тетрагидропиран-4-ил-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-4-амина (5 мг, выход 3,5%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H26ClF3N5O: 456,2; полученное 456,2; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 6,91 (с, 1H) 6,89 (с, 1Н) 6,80 (с, 1H) 5,42-5,33 (м, 1H) 4,08-4,00 (м, 2Н) 3,54-3,40 (м, 4Н) 2,92-2,87 (м, 2Н) 2,75-2,71 (м, 3Н) 1,93 (д, J=12,0 Гц, 2Н) 1,74-1,64 (м, 2Н) 1,55 (д, J=4,0 Гц, 3Н).
Пример 177. Синтез (R)-6-(азетидин-3-ил)-2-хлор-N-(1-(3-(трифторметил)фенил)этил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-4-амина
[00336] (R)-6-(азетидин-3-ил)-2-хлор-N-(1-(3-(трифторметил)фенил)этил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-4-амин синтезировали способом, аналогичным примеру 22.
[00337] Пример 23. Синтез [2-хлор-4-[1-[5-[2-[(4-метилпиперазин-1-ил)метил]фенил]-2-тиенил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона
Этап 1.
[00338] Смесь 1-метил-4-[[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил]пиперазина (1,7 г, 5,4 ммоль), 1-(5-бром-2-тиенил)этанона (1,21 г, 5,91 ммоль), K2CO3 (2,23 г, 16,13 ммоль), Pd(PPh3)4 (621 мг, 538 мкмоль) в 1,4-диоксане (5 мл) и Н2О (1 мл) дегазировали и продували N2 (х 3). Смесь нагревали до 110°С и перемешивали в течение 4 ч в атмосфере N2, потом разводили в Н2О (10 мл) и экстрагировали EtOAc (5 мл x 3). Объединенные органические слои промывали солевым раствором (10 мл), сушили над Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением 1-[5-[2-[(4-метилпиперазин-1-ил)метил]фенил]-2-тиенил]этенони (1 г, выход 59%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C18H23N2OS: 315,15; полученное 315,1.
Этап 2.
[00339] В смесь 1-[5-[2-[(4-метилпиперазин-1-ил)метил]фенил]-2-тиенил]этанона (800 мг, 2,54 ммоль) в ТГФ (5 мл) добавляли 2-метилпропан-2-сульфинамид (617 мг, 5,09 ммоль) и Ti(OEt)4 (2,1 мл, 10,2 ммоль). Смесь нагревали до 80°С и перемешивали в течение 16 ч. Смесь охлаждали до 0°С, потом добавляли LiBH4 (222 мг, 10,2 ммоль) и МеОН (103 мкл, 2,54 ммоль), нагревали смесь до кт и перемешивали в течение 1 ч. Добавляли, Н2О (25 мл) смесь фильтровали, концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением 2-метил-N-[1-[5-[2-[(4-метилпиперазин-1-ил)метил]фенил]-2-тиенил]этил]пропан-2-сульфинамида (620 мг, выход 58%). 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 7,49-7,30 (м, 5Н), 7,09-7,06 (м, 2Н), 4,78 (кв, J = 6,8 Гц, 1H), 3,33 (с, 2Н), 3,04-2,97 (м, 2Н), 2,77 (дд, J = 8,8, 4,4 Гц, 5Н), 2,55-2,50 (м, 2Н), 1,68 (д, J = 6,4 Гц, 3Н), 1,23 (с, 9Н).
Этап 3.
[00340] Смесь 2-метил-N-[1-[5-[2-[(4-метилпиперазин-1-ил)метил]фенил]-2-тиенил] этил]пропан-2-сульфинамида (620 мг, 1,48 ммоль) в 4 Μ HCl в МеОН (1 мл, 4 ммоль) перемешивали при кт в течение 1 ч. Смесь концентрировали при пониженном давлении с получением 1-[5-[2-[(4-метилпиперазин-1-ил)метил]фенил]-2-тиенил]этанамина (300 мг, выход 64%).
Этап 4.
[00341] В смесь 1-[5-[2-[(4-метилпиперазин-1-ил)метил]фенил]-2-тиенил]этанамина (100 мг, 0,32 ммоль) в t-BuOH (1 мл) добавляли ДИПЭА (221 мкл, 1,27 ммоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанон (96 мг, 0,32 ммоль). Смесь нагревали до 80°С и перемешивали в течение 4 ч, растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[1-[5-[2-[(4-метилпиперазин-1-ил)метил]фенил]-2-тиенил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (50 мг, выход 24%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C29H37ClN7O2S: 582,23; полученное 582,3; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 7,43-7,37 (м, 2Н), 7,34-7,28 (м, 2Н), 7,10-7,04 (м, 2Н), 5,75 (д, J = 6,8 Гц, 1H), 4,61 (с, 4Н), 3,75-3,70 (м, 4Н), 3,52 (с, 2Н), 3,39-3,35 (м, 4Н), 2,41 (с, 8Н), 2,25 (с, 3Н), 1,72 (д, J = 6,8 Гц, 3Н).
[00342] Пример 24. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-морфолиносульфонил-5,7-дигидропирроло[3,4-d]пиримидин-4-амина
Этап 1.
[00343] В смесь трет-бутил 2,4-дихлор-5,7-дигадрогафроло[3,4-d]пиримидин-6-карбоксилата (200 мг, 0,69 ммоль) и 3-[(1R)-1-аминоэтал]-5-(трифторметил)аншшна (169 мг, 0,83 ммоль) в n-BuOH (4 мл) добавляли ДИПЭА (1,2 мл, 6,9 ммоль). Смесь нагревали до 100°С и перемешивали в течение 2 ч, растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением трет-бутил 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилата (300 мг, выход 95%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H24ClF3N5O2: 458,15; полученное 458,2.
Этап 2.
[00344] Смесь mpem-бутил 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилата (150 мг, 0,33 ммоль) в ТФУ (1 мл) и ДХМ (3 мл) перемешивали при кт в течение 30 мин. Смесь концентрировали при пониженном давлении с получением ТФУ-соли. N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6,7-дигидро-5Н-пирроло[3,4-d]пиримидин-4-амина (154 мг, выход 100%).
Этап 3.
[00345] В смесь N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6,7-дигидро-5H-пирроло[3,4-d]пиримидин-4-амина (154 мг, 0,33 ммоль) и морфолин-4-сульфонилхлорида (61 мг, 0,33 ммоль) в ДХМ (3 мл) при 0°С по каплям добавляли ТЭА (454 мкл, 3,3 ммоль). Смесь нагревали до кт, перемешивали в течение 1 ч и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-морфолиносульфонил-5,7-дигидропирроло[3,4-d]пиримидин-4-амина (46 мг, выход 27%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C19H23ClF3N6O3S: 507,11; полученное 507,1; 1Η ЯМР (400 МГц, ДМСО-d6) δ м. д. 8,12 (д, J = 8,2 Гц, 1H), 6,82 (с, 1H), 6,76 (с, 1Н), 6,71 (с, 1H), 5,57 (с, 2Н), 5,18 (t, J = 7,2 Гц, 1H), 4,52-4,40 (м, 4Н), 3,67-3,59 (м, 4Н), 3,20-3,13 (м, 4Н), 1,43 (д, J = 7,0 Гц, 3Н).
[00346] Примеры в таблице 1 ниже синтезировали способом, аналогичным примеру 24.
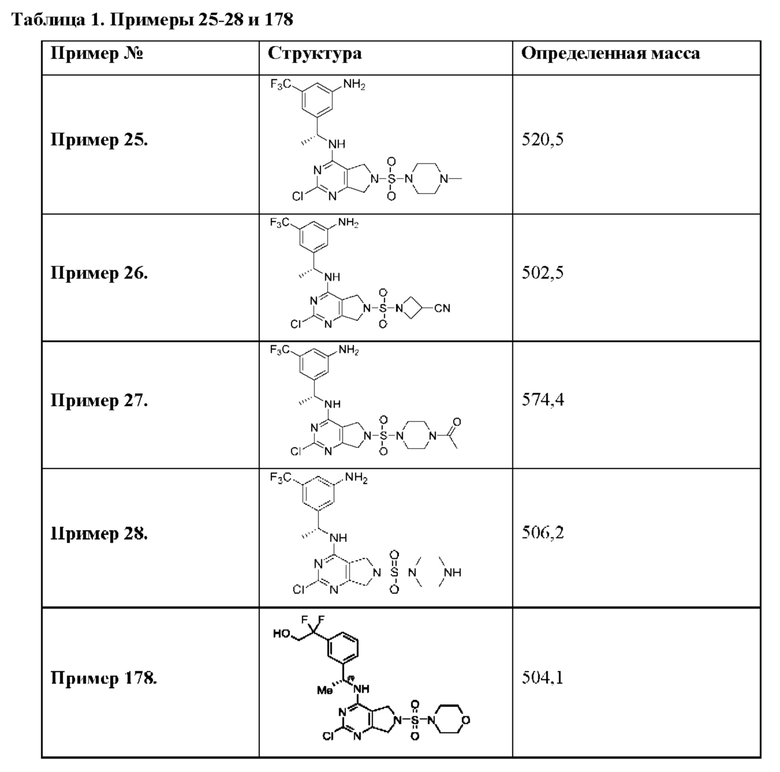 Пример 29. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-морфолиносульфонил-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-4-амина
Пример 29. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-морфолиносульфонил-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-4-амина
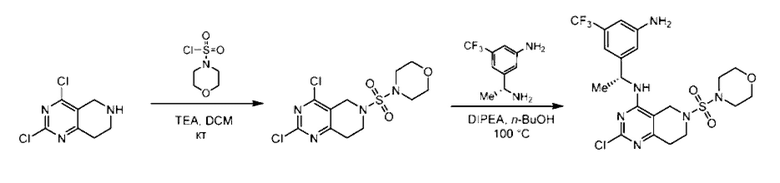
Этап 1.
[00347] В смесь ТФУ-соли 2,4-дихлор-5,6,7,8-тетрагидропиридо[4,3-d]пиримидина (209 мг, 0,66 ммоль) и морфолин-4-сульфонилхлорида (610 мг, 3,3 ммоль) в ДХМ (6 мл) при 0°С по каплям добавляли ТЭА(1,83мл, 13,1 ммоль). Смесь перемешивали при 0°С в течение 30 мин, потом растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением 4-[(2,4-дихлор-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-6-ил)сульфонил]морфолина (160 мг, выход 69%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C11H15Cl2N4O3S: 353,02; полученное 353,0; 1Н ЯМР (400 МГц, ДМСО-d6) δ м. д. 4,40 (с, 2Н), 3,63 (дд, J = 5,4, 2,5 Гц, 6Н), 3,20-3,14 (м, 4Н),3,01 (с, 2Н).
Этап 2.
[00348] В смесь 4-[(2,4-дихлор-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-6-ил)сульфонил]морфолина (160 мг, 0,45 ммоль) и 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилина (111 мг, 0,54 ммоль) в n-BuOH (4 мл) добавляли ДИПЭА (789 мкл, 4,53 ммоль). Смесь нагревали до 100°С и перемешивали в течение 10 ч. Смесь фильтровали, растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-морфолиносульфонил-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-4-амина (96 мг, выход 41%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H25ClF3N6O3S: 521,13; полученное 521,1; 1Н ЯМР (400 МГц, ДМСО-d6) δ м. д. 7,68 (д, J = 7,8 Гц, 1Н), 6,83 (с, 1Н), 6,77 (с, 1Н), 6,71 (с, 1Н), 5,57 (с, 2Н), 5,25 (т, J = 7,3 Гц, 1Н), 4,18 (с, 2Н), 3,64-3,60 (м, 4Н), 3,52 (т, J = 5,7 Гц, 2Н), 3,17-3,13 (м, 4Н), 2,70 (т, J = 5,0 Гц, 2Н), 1,47 (д, J = 7,0 Гц, 3Н).
[00349] Примеры в таблице 2 ниже синтезировали способом, аналогичным примеру 29.
Таблица 2. Примеры 179-185
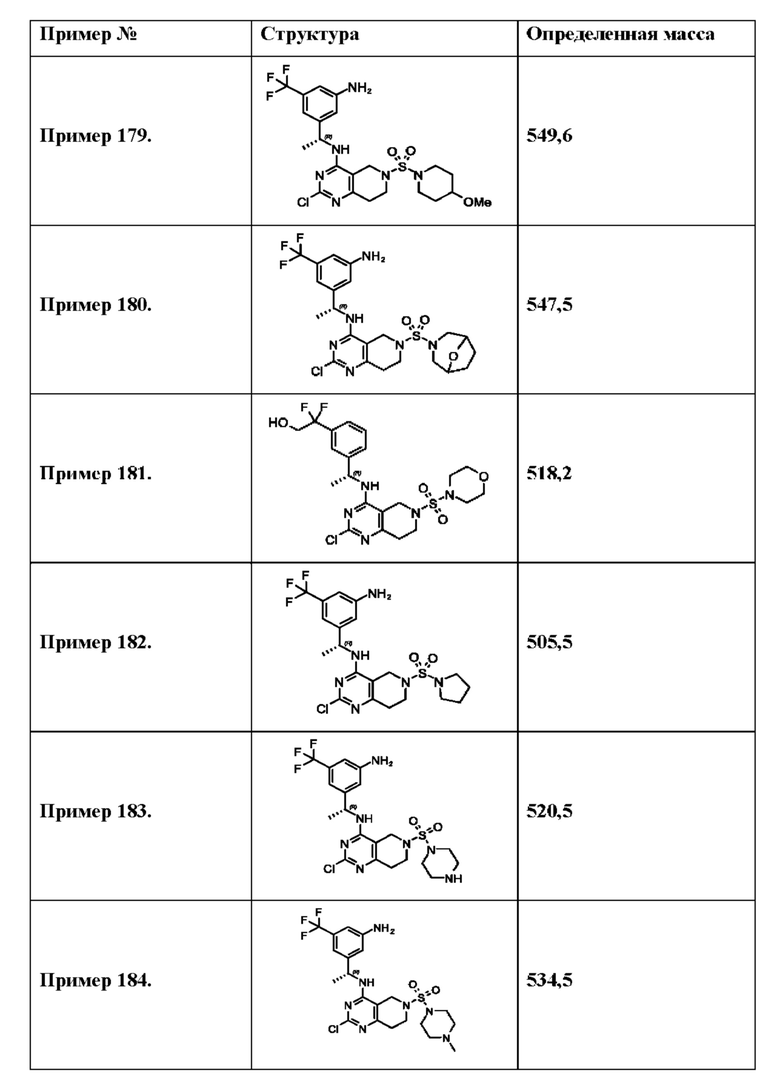
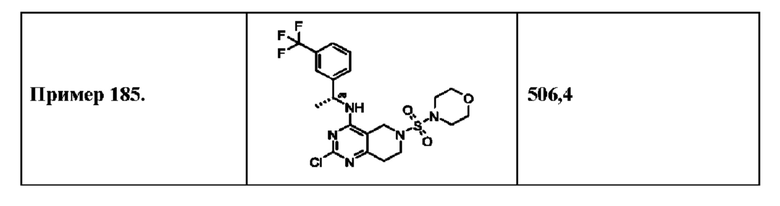
Пример 30. Синтез 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-6-тетрагидропиран-4-ил-5H-пирроло [3,4-d]пиримидин-7-она
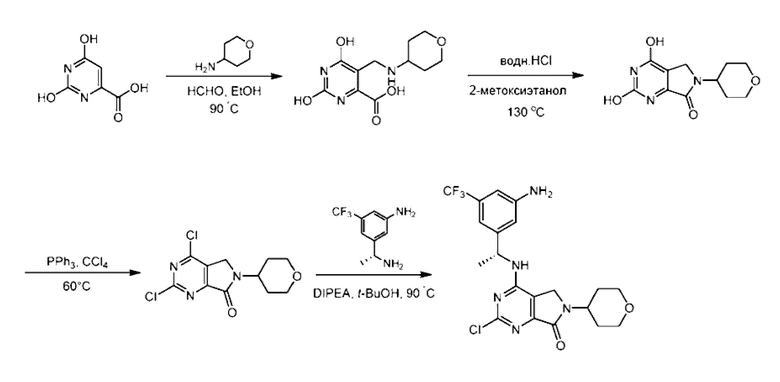
Этап 1.
[00350] В смесь 2,6-дигадроксипиримидин-4-карбоновой кислоты (200 мг, 1,28 ммоль) и тетрагидропиран-4-амина (194 мг, 1,92 ммоль) в EtOH (4 мл) добавляли 37% водный НСНО (0,95 мл, 12,8 ммоль). Смесь нагревали до 90°С и перемешивали в течение 10 ч в закатанном флаконе. После охлаждения добавляли Н2О (1 мл), смесь фильтровали, а фильтрационный осадок сушили с получением 2,6-дигидрокси-5-[(тетрагидропиран-4-иламино)метил]пиримидин-4-карбоновой кислоты (120 мг, выход 35%). ЖХМС (ИЭР): m/z: [М-Н], рассчитанное для C11H14N3O5: 268,1; полученное 268,0; 1Н ЯМР (400 МГц, D2O) δ м. д. 3,91 (дд, J = 12,0, 2,4 Гц, 2Н), 3,49 (с, 2Н), 3,40 (дт, J = 12,0, 1,6 Гц, 2Н), 2,65 (тт, J = 10,8,4,0 Гц, 1Н), 1,78 (дд, J= 12,8, 2,0 Гц, 2Н), 1,38-1,23 (м, 2Н).
Этап 2.
[00351] В смесь 2,6-дигидрокси-5-[(тетрагидропиран-4-иламино)метил]пиримидин-4-карбоновой кислоты (120 мг, 0,45 ммоль) в 2-метоксиэтаноле (0,7 мл) добавляли 12 Μ HCl (0,37 мл, 4,5 ммоль). Смесь нагревали до 130°С и перемешивали в течение 18 ч. Смесь охлаждали до кт, фильтровали, а фильтрационный осадок сушили с получением 2,4-дигидрокси-6-тетрагидропиран-4-ил-5H-пирроло[3,4-d]пиримидин-7-она (100 мг, выход 89%). 1H ЯМР (400 МГц, ДМСО-d6) δ м. д. 11,83 (шир. с, 1H), 11,27 (шир. с, 1H), 4,18 (с, 2Н), 4,16-4,07 (м, 1H), 3,91 (дд, J = 11,2, 3,6 Гц, 2Н), 3,41 (т, J = 11,2 Гц, 2Н), 1,78 (дкв, J = 12,0, 4,0 Гц, 2Н), 1,68-1,60 (м, 2Н).
Этап 3.
[00352] В смесь 2,4-дигидрокси-6-тетрагидропиран-4-ил-5H-пирроло[3,4-d]пиримидин-7-она (100 мг, 0,4 ммоль) в ДХЭ (3 мл) добавляли PPh3 (418 мг, 1,59 ммоль) и CCl4 (0,19 мл, 2,0 ммоль). Смесь нагревали до 60°С и перемешивали в течение 12 ч, потом фильтровали. Растворитель концентрировали при пониженном давлении с получением 2,4-дихлор-6-тетрагидропиран-4-ил-5H-пирроло[3,4-d]пиримидин-7-она (75 мг, выход 65%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C11H12Cl2N3O2: 288,02; полученное 288,0.
Этап 4.
[00353] В смесь 2,4-дихлор-6-тетрагидропиран-4-ил-5H-пирроло[3,4-d]пиримидин-7-она (75 мг, 0,26 ммоль) в t-BuOH (0,5 мл) добавляли 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилин (64 мг, 0,31 ммоль) и ДИПЭА (91 мкл, 0,52 ммоль). Смесь нагревали до 90°С в закатанном флаконе и перемешивали в течение 30 мин, потом фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-6-тетрагидропиран-4-ил-5H-пирроло[3,4-d]пиримидин-7-она (55 мг, выход 45%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H22ClF3N5O2: 456,13; полученное 456,1; 1Н ЯМР (400 МГц, ДМСО-d6) δ м. д. 8,60 (шир. д, J = 7,8 Гц, 1H), 6,85 (с, 1Н), 6,80 (с, 1H), 6,72 (с, 1H), 5,56 (шир. с, 2Н), 5,24 (т, J = 7,2 Гц, 1H), 4,32 (с, 2Н), 4,28-4,16 (м, 1H), 3,96 (м, 2Н), 3,48-3,32 (м, 2Н), 1,73 (м, 4Н), 1,48 (д, J = 6,8 Гц, 3Н).
Пример 31. Синтез 2-хлор-4-[1-[5-[2-(метиламинометил)фенил]тиазол-2-ил]этиламино]-5,7-дигидр опирр оло [3,4-d]пиримидин-6-ил]-морфолинометанона
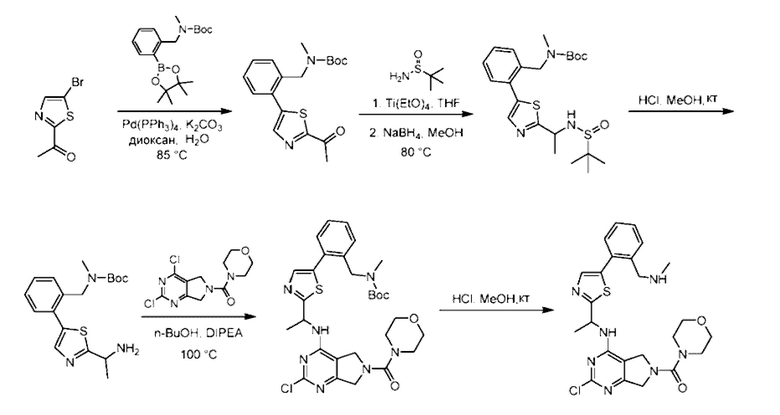
Этап 1.
[00354] В смесь 1-(5-бромтиазол-2-ил)этанона (0,8 г, 3,9 ммоль) в 1,4-диоксане (8 мл) и Н2О (1,6 мл) добавляли K2CO3 (2,15 г, 15,5 ммоль), трет-бутил N-метил-N-[[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил]карбамат (2,02 г, 5,8 ммоль) и Pd(PPh3)4 (449 мг, 0,4 ммоль) в атмосфере N2. Смесь нагревали до 85°С и перемешивали в течение 16 ч, потом охлаждали и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением трет-бутил N-[[2-(2-ацетилтиазол-5-ил)фенил]метил]-N-метил-карбамата (0,8 г, выход 60%). ЖХМС (ИЭР): m/z: [M+H-tBu], рассчитанное для C14H15N2O3S: 291,0; полученное 291,0.
Этап 2.
[00355] В смесь трет-бутил N-[2-(2-цеетилтиазол-5-ил)фенил]метил]-N-метил-карбамата (1,2 г, 3,46 ммоль) в ТГФ (20 мл) добавляли 2-метилпропан-2-сульфинамид (630 мг, 5,2 ммоль) и Ti(OEt)4 (2,51 мл, 12,1 ммоль). Смесь нагревали до 80°С и перемешивали в течение 2 ч. Смесь охлаждали до 0°С, медленно добавляли МеОН (140 мкл, 3,5 ммоль) и NaBH4 (262 мг, 6,93 ммоль), потом нагревали до кт и перемешивали в течение 30 мин. Смесь фильтровали, растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением трет-бутил N-[[2-[2-[1-(трет-бутилсульфиниламино)этил]тиазол-5-ил]фенил]метил]-N-метил-карбамата (1 г, выход 64%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H34N3O3S2: 452,2; полученное 452,2.
Этап 3.
[00356] В смесь трет-бутил N-[[2-[2-[1-(трет-бутилсульфиниламино)этил]тиазол-5-ил] фенил]метил]-трет-метил-карбамата (0,6 г, 1,33 ммоль) в МеОН (20 мл) добавляли 4 Μ HCl в МеОН (664 мкл, 2,66 ммоль). Смесь перемешивали при кт в течение 1 ч, а растворитель концентрировали при пониженном давлении с получением трет-бутил N-[[2-[2-(1-аминоэтил)тиазол-5-ил]фенил]метил]-N-метил-карбамата (462 мг), который непосредственно использовали на следующем этапе без дополнительной очистки. ЖХМС (ИЭР): m/z: [М+Н] рассчитанное для C18H26N3O2S: 348,2; полученное 348,2; 1Н ЯМР (400 МГц, CDCl3) δ м. д. 7,70-7,62 (м, 1H), 7,50-7,29 (м, 4Н), 4,98-4,89 (м, 1H), 4,62-4,41 (м, 3Н), 2,86-2,67 (м, 4Н), 2,01-1,90 (м, 3Н), 1,52-1,49 (м, 3Н).
Этап 4.
[00357] В смесь трет-бутил N-[[2-[2-(1-аминоэтил)тиазол-5-ил]фенил]метил]-N-метил-карбамата (462 мг, 1,33 ммоль) в n-BuOH (5 мл) добавляли (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанон (403 мг, 1,33 ммоль) и ДИПЭА (695 мкл, 4,0 ммоль). Смесь нагревали до 100°С и перемешивали в течение 3 ч, растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением трет-бутил N-[[2-[2-[1-[[2-хлор-6-(морфолин-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]тиазол-5-ил]фенил]метил]-Ν-метил-карбамати (0,3 г, выход 37%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C29H37ClN7O4S: 614,2; полученное 614,2.
Этап 5.
[00358] Смесь трет-бутил N-[[2-[2-[1-[[2-хлор-6-(морфолин-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]тиазол-5-ил]фенил]метил]-N-метил-карбамата (200 мг, 0,33 ммоль) в 4 Μ HCl в МеОН (5 мл) перемешивали при кт в течение 1 ч. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением 2-хлор-4-[1-[5-[2-(метиламинометил)фенил]тиазол-2-ил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (40 мг, выход 23%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C24H29ClN7O2S: 514,2; полученное 514,2; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 8,54-8,42 (м, 1H), 7,71 (с, 1H), 7,63-7,44 (м, 4Н), 5,78-5,66 (м, 1H), 4,69^,58 (м, 4Н), 4,25-4,17 (м, 2Н), 3,77-3,68 (м, 4Н), 3,39-3,33 (м, 4Н), 2,61 (с, ЗН), 1,77 (д, J = 7,1 Гц, 2Н).
Примеры 32 и 33. Синтез [2-хлор-4-[1-[3-[2-(метиламинометил)фенил]фенил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона и [2-метокси-4-[1-[3-[2-(метиламинометил) фенил] фенил этиламино]-5,7-дигидропирроло[3,4-d] пиримидин-6-ил]-морфолинометанона
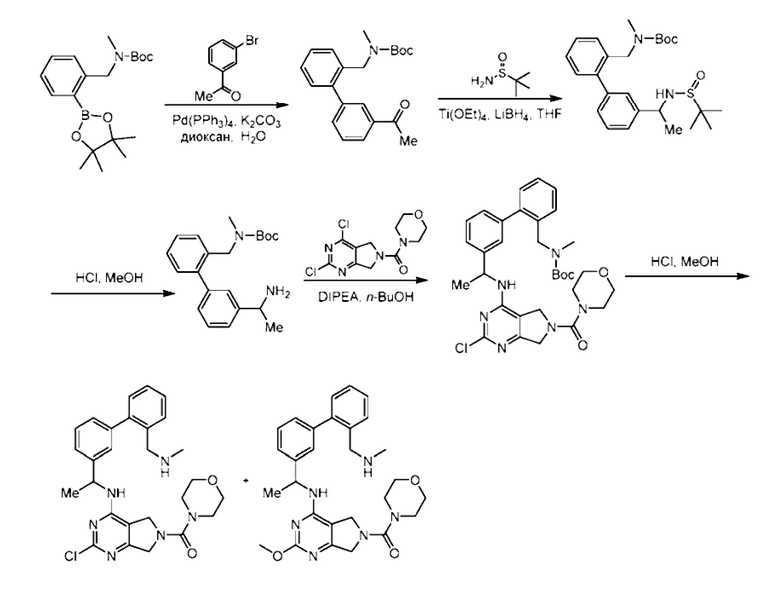
Этап 1.
[00359] В смесь трет-бутил N-метил-N-[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил]карбамата (2,62 г, 7,54 ммоль) в 1,4-диоксане (16 мл) и H2O (3,5 мл) добавляли 1-(3-бромфенил)этанон (1 г, 5,0 ммоль), Pd(PPh3)4 (581 мг, 0,5 ммоль) и K2CO3 (2,78 г, 20,1 ммоль). Смесь нагревали до 85°С и перемешивали в течение 16 ч. Смесь охлаждали, фильтровали, растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением трет-бутил N-[[2-(3-ацетилфенил)фенил]метил]-N-метил-карбамата (1,5 г, 4,42 ммоль, выход 88%). 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 8,00 (д, J = 6,2 Гц, 1Н), 7,89 (с, 1Н), 7,61-7,50 (м, 2Н), 7,43-7,33 (м, 2Н), 7,29 (д, J = 7,6 Гц, 1Н), 7,23 (д, J = 7,2 Гц, 1Н), 4,40 (с, 2Н), 2,63 (с, 5Н), 1,47-1,29 (м, 9Н).
Этап 2.
[00360] В смесь трет-бутил N-[[2-(3-ацетилфенил)фенил]метил]-N-метил-карбамата (1 г, 2,95 ммоль) в ТГФ (10 мл) добавляли 2-метилпропан-2-сульфинамид (714 мг, 5,89 ммоль) и Ti(OEt)4 (2,44 мл, 11,78 ммоль) при кт в течение 5 мин. После добавления смесь нагревали до 80°С и перемешивали в течение 12 ч. Смесь охлаждали до 0°С, добавляли LiBH4 (257 мг, 11,78 ммоль) и перемешивали смесь при 0°С в течение 2 ч. Добавляли H2O (5 мл) при 0°С и фильтровали смесь. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением трет-бутил N-[[2-[3-[1-(трет-бутилсульфиниламино)этил]фенил]фенил]метил]-N-метил-карбамата (500 мг, выход 38%). 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 7,44-7,38 (м, 2Н), 7,37-7,30 (м, 3Н), 7,24 (м, 2Н), 7,20-7,16 (м, 1H), 4,56-1,49 (м, 1H), 4,41 (д, J = 3,5 Гц, 1H), 2,78-2,50 (м, 3Н), 1,54 (д, J = 6,8 Гц, 3Н), 1,45-1,34 (м, 9Н), 1,24 (с, 9Н).
Этап 3.
[00361] В смесь трет-бутил N-[[2-[3-[1-(трет-бутилсульфиниламино)этил]фенил]фенил]метил]-N-метил-карбамата (500 мг, 1,12 ммоль) в МеОН (20 мл) добавляли 4 Μ HCl в МеОН (562 мкл, 2,24 ммоль). Смесь перемешивали при кт в течение 1 ч, потом по каплям добавляли NaOH в МеОН (5 мл) до рН ~8. Растворитель концентрировали при пониженном давлении, а остаток суспендировали в ДХМ/МеОН (20 мл), перемешивали в течение 30 мин, фильтровали и концентрировали растворитель при пониженном давлении с получением трет-бутил N-[[2-[3-(1-аминоэтил)фенил]фенил]метил]-N-метил-карбамата (400 мг). 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 7,55-7,49 (м, 1H), 7,45 (д, J = 6,5 Гц, 1H), 7,42-7,30 (м, 4Н), 7,28 (д, J = 7,5 Гц, 1H), 7,25-7,21 (м, 1H), 4,49-4,38 (м, 3Н), 2,66 (с, 3Н), 1,63 (д, J = 6,8 Гц, 3Н), 1,49-1,33 (м, 9Н).
Этап 4.
[00362] В смесь (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометано на (178 мг, 0,58 ммоль) в n-BuOH (3 мл) добавляли трет-бутил N-[[2-[3-(1-аминоэтил)фенил]фенил]метил]-N-метил-карбамат (200 мг, 0,58 ммоль) и ДИПЭА (307 мкл, 1,76 ммоль). Смесь нагревали до 100°С и перемешивали в течение 3 ч, потом растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением трет-бутил N-[[2-[4-[1-[[2-хлор-6-(морфолин-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]тиазол-2-ил]фенил]метил]-N-метил-карбамата (250 мг, выход 69%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C32H40ClN6O4: 607,3; полученное 607,3; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 7,44-7,37 (м, 2Н), 7,36-7,27 (м, 3Н), 7,23 (т, J = 6,3 Гц, 2Н), 7,16 (с, 1Н), 5,37 (д, J = 6,5 Гц, 1H), 4,83 (с, 1H), 4,67-1,51 (м, 4Н), 4,42-1,26 (м, 2Н), 3,75-3,68 (м, 4Н), 3,39-3,33 (м, 4Н), 2,59 (д, J= 17,1 Гц, 3Н), 1,61 (д, J = 7,1 Гц, 3Н), 1,47-1,29 (м, 9Н).
Этап 5.
[00363] Смесь трет-бутил N-[[2-[3-[1-[[2-хлор-6-(морфолин-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]фенил]фенил]метил]-N-метил-карбамата (100 мг, 0,16 ммоль) в 4 Μ HCl в МеОН (2 мл) перемешивали при кт в течение 1 ч. Растворитель концентрировали при пониженном давлении, потом разводили МеОН (10 мл) и доводили рН до ~8 добавлением по каплям NaOH в МеОН. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[1-[3-[2-(метиламинометил)фенил]фенил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометано на (5,6 мг, выход 6%) и [2-метокси-4-[1-[3-[2-(метиламинометил)фенил]фенил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометано на (3,6 мг, выход 4%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C27H32ClN6O2: 507,2; полученное 507,2; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 7,49-7,39 (м, 4Н), 7,38-7,31 (м, 3Н), 7,27-7,18 (м, 2Н), 5,41 (д, J = 6,6 Гц, 1H), 4,65-4,54 (м, 4Н), 3,75-3,67 (м, 7Н), 3,38-3,33 (м, 5Н), 2,20 (с, 3Н), 1,61 (д, J= 7,1 Гц, 3Н); ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C28H35N6O3: 503,2; полученное 503,3; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 7,47-7,37 (м, 3Н), 7,37-7,29 (м, 3Н), 7,24-7,16 (м, 2Н), 5,46-5,31 (м, 1H), 4,59 (с, 2Н), 4,50 (д, J = 1,8 Гц, 2Н), 3,77 (с, 3Н), 3,74-3,70 (м, 4Н), 3,62 (с, 2Н), 3,40-3,35 (м, 4Н), 2,14 (с, 3Н), 1,60(д,7 = 7,1Гц,3Н).
Пример 34. Синтез [2-хлор-4-[1-[5-[2-(морфолинометил)фенил]-2-тиенил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона
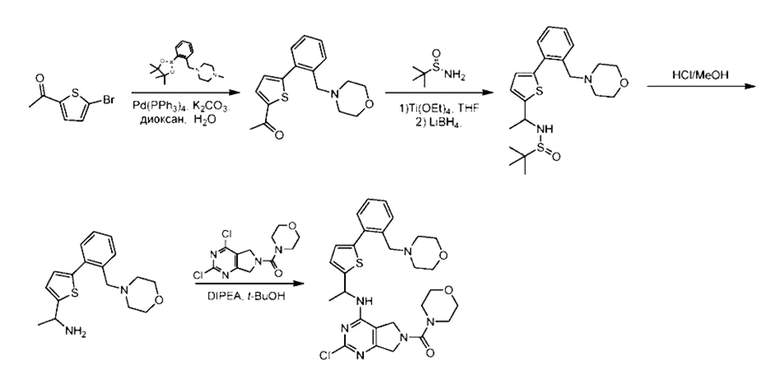
Этап 1.
[00364] 1-[5-[2-(морфолинометал)фенил]-2-тиенил]этанон синтезировали способом, аналогичным 1-[5-[2-[(4-метилпиперазин-1-ил)метил]фенил]-2-тиенил]этенону, за исключением того, что 1-метил-4-[[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил]пиперазин заменяли 4-[[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил]морфолином. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C17H20NO2S: 302,11; полученное 302,1.
Этап 2.
[00365] 2-метил-N-[(1R)-1-[5-[2-(морфолинометил)фенил]-2-тиенил]этил]пропан-2-сульфонамид синтезировали способом, аналогичным 2-метил-N-[1-[5-[2-[(4-метилтперазин-1-ил)метил]фенил]-2-тиенил]этил]пропан-2-сульфинамиду, за исключением того, что 1-[5-[2-[(4-метилпиперазин-1-ил)метил]фенил]-2-тиенил]этенон заменяли 1-[5-[2-(морфолинометил)фенил]-2-тиенил]этеноном. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H31N2O2S2: 407,17; полученное 407,2; 1Н ЯМР (400 МГц, CDCl3) δ м. д. 7,48-7,40 (м, 2Н), 7,34-7,28 (м, 2Н), 7,14 (д, J = 3,2 Гц, 1Н), 7,02 (д, J = 3,6 Гц, 1Н), 4,85 (м, J = 6,2 Гц, 1Н), 3,70 (с, 4Н), 3,50 (с, 2Н), 2,46 (с, 4Н), 1,64 (д, J = 6,4 Гц, 3Н), 1,25 (с, 9Н).
Этап 3.
[00366] 1-[5-[2-(морфолинометил) фенил]-2-тиенил]этанамин синтезировали способом, аналогичным 1-[5-[2-[(4-метилпиперазин-1-ил)метил]фенил]-2-тиенил]этанамину, за исключением того, что 2-метил-N-[1-[5-[2-[(4-метилпиперазин-1-ил)метил]фенил]-2-тиенил]этил]-пропан-2-сульфинамид заменяли 2-метил-N-[(1R)-1-[5-[2-(морфолинометил)фенил]-2-тиенил]этил]-пропан-2-сульфонамидом. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C17H23N2OS: 303,15; полученное 303,1.
Этап 4.
[00367] [2-хлор-4-[1-[5-[2-(морфолинометил)фенил]-2-тиенил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанон синтезировали способом, аналогичным [2-хлор-4-[1-[5-[2-[(4-метилпиперазин-1 -ил)метил]фенил]-2-тиенил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанону, за исключением того, что 1-[5-[2-[(4-метилпиперазин-1-ил)метил]фенил]-2-тиенил]этанамин заменяли 1-[5-[2-(морфолинометил) фенил]-2-тиенил]этанамином. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C28H34ClN6O3S: 569,20; полученное 569,2; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 7,45-7,41 (м, 1H), 7,41-7,36 (м, 1H), 7,33-7,25 (м, 2Н), 7,07 (д, J = 3,6 Гц, 1H), 7,03 (д, J = 3,6 Гц, 1H), 5,76-5,68 (м, 1H), 4,59 (с, 4Н), 3,74-3,67 (м, 4Н), 3,62-3,55 (м, 4Н), 3,49 (с, 2Н), 3,37-3,33 (м, 4Н), 2,37 (с, 4Н), 1,70 (д, J = 6,6 Гц, 3Н).
Пример 35. Синтез [1-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-4-хлор-5,7-дигидропирроло [3,4-d]пиридазин-6-ил]-морфолинометанона
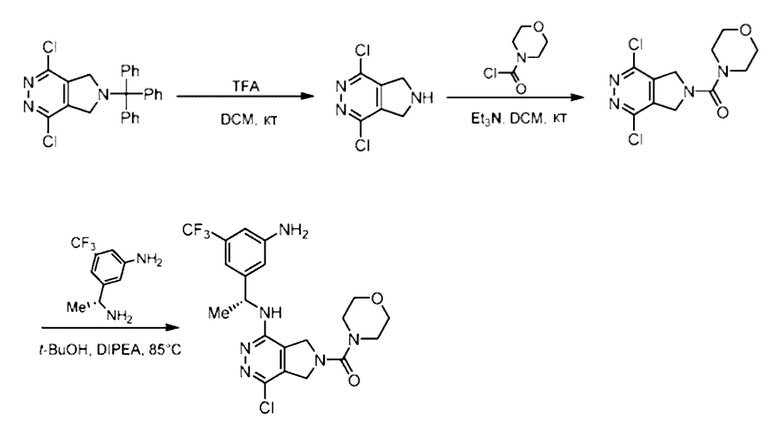
Этап 1.
[00368] В смесь 1,4-дихлор-6-тритил-5,7-дигидропирроло[3,4-d]пиридазина (1,5 г, 3,47 ммоль) в ДХМ (15 мл) добавляли ТФУ (2,57 мл, 34,7 ммоль) при 0°С. Смесь перемешивали при кт в течение 4 ч, потом растворитель концентрировали при пониженном давлении с получением ТФУ-соли 1,4-дихлор-6,7-дигидро-5H-пирроло[3,4-d]пиридазина (1 г).
Этап 2.
[00369] В смесь морфолин-4-карбонилхлорида (1,15 мл, 9,87 ммоль) в ДХМ (10 мл) при 0°С добавляли ТЭА (2,06 мл, 14,8 ммоль) и 1,4-дихлор-6,7-дигидро-5H-пирроло[3,4-d]пиридазин (1 г, 3,3 ммоль). Смесь перемешивали при кт в течение 5 ч, растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением (1,4-дихлор-5,7-дигидропирроло[3,4-d]пиридазин-6-ил)-морфолинометано на (100 мг, выход 10%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C11H13Cl2N4O2: 303,0; полученное 303,1; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 4,95 (с, 4Н), 3,75-3,70 (м, 4Н), 3,42-3,37 (м, 4Н).
Этап 3.
[00370] В смесь (1,4-дихлор-5,7-дигидропирроло[3,4-d]пиридазин-6-ил)-морфолинометано на (100 мг, 0,33 ммоль) в t-BuOH (1 мл) добавляли 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилин (142 мг, 0,69 ммоль) и ДИПЭА (289 мкл, 1,65 ммоль) при кт в атмосфере N2. Смесь нагревали до 85°С в закатанном флаконе и перемешивали в течение 12 ч. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением [1-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-4-хлор-5,7-дигидропирроло[3,4-d]пиридазин-6-ил]-морфолинометано на (6 мг, выход 4%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H23ClF3N6O2: 471,1; полученное 471,2; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 6,93 (д, J = 5,6 Гц, 2Н), 6,77 (с, 1H), 5,31-5,24 (м, 1H), 4,80-4,76 (м, 4Н), 3,76-3,71 (м, 4Н), 3,41-3,36 (м, 4Н), 1,56 (д, J = 7,0 Гц, 3Н).
Пример 36. Синтез (R)-N-(1-(3-амино-5-(трифторметил)фенил)этил)-6-((6-аминопиридин-3-ил)сульфонил)-2-метил-6,7-дигидро-5H-пирроло[3,4-d]пиримидин-4 амина
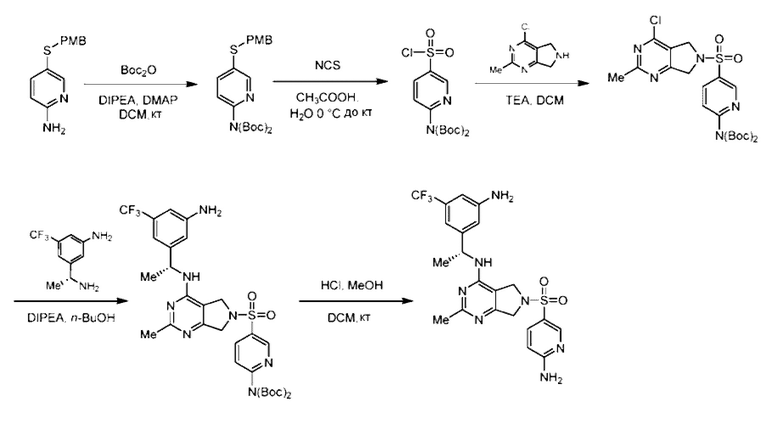
Этап 1.
[00371] В смесь 5-((4-метоксибензил)тио)пиридин-2-амина (3,5 г, 14,2 ммоль), ДМАП (1,74 г, 14,2 ммоль), ДИПЭА (7,4 мл, 42,6 ммоль) в ДХМ (120 мл) добавляли ди-трет-бутил дикарбонат (18,6 г, 85,3 ммоль). Смесь продували N2 (х 3), перемешивали при кт в течение 16 ч, потом экстрагировали EtOAc (30 мл x 3). Объединенные органические слои промывали H2O (30 мл x 2) и солевым раствором (30 мл x 2), сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением трет-бутил N-трет-бутоксикарбонил-N-[5-[(4-метоксифенил)метилсульфанил]-2-пиридил]карбамата (2,5 г, выход 34%; примечание: чистота 85%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C23H31N2O5S: 447,19; полученное 447,1; 1Н ЯМР (400 МГц, ДМСО-d6) δ м. д. 8,32 (д, J = 2,4 Гц, 1Н), 7,82 (дд, J = 8,4 Гц, 1Н), 7,26 (м, 3Н), 6,83 (д, J = 8,8 Гц, 2Н), 4,24 (с, 2Н), 3,70 (с, 3Н), 1,37 (с, 18Н).
Этап 2.
[00372] В смесь трет-бутил N-трет-бутоксикарбонил-N-[5-[(4-метоксифенил)метилсульфанил]-2-пиридил]карбамата (2,0 г, 4,5 ммоль) в АсОН (60 мл) и Н2О (15 мл) при 0°С добавляли N-хлорсукцинимид (4,19 г, 31,4 ммоль). Смесь нагревали до кт и перемешивали в течение 5 ч, потом экстрагировали EtOAc (30 мл x 3). Объединенные органические слои промывали H2O (30 мл x 2) и солевым раствором (30 мл x 2), сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением трет-бутил N-трет-бутоксикарбонил-N-(5-хлорсульфонил-2-пиридил)карбамата (1,1 г, выход 38%; примечание: чистота 60%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C15H22ClN2O6S: 393,08; полученное 393,0.
Этап 3.
[00373] В смесь 4-хлор-2-метил-6,7-дигидро-5H-пирроло[3,4-d]пиримидина (80 мг, 0,47 ммоль) в ДХМ (6 мл) при -30°С по каплям добавляли ТЭА (197 мкл, 1,42 ммоль), потом по каплям добавляли трет-бутил N-трет-бутоксикарбонил-N-(5-хлорсульфонил-2-пиридил)карбамат чистоты 60% (309 мг, 0,47 ммоль) при -30°С. Смесь нагревали до кт и перемешивали в течение 1 ч, потом экстрагировали ДХМ (30 мл x 3). Объединенные органические слои промывали Н2О (30 мл x 2) и солевым раствором (30 мл x 2), сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ТСХ с получением трет-бутил N-трет-бутоксикарбонил-N-[5-[(4-хлор-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-6-л)сульфонил]-2-пиридил]карбамата (190 мг, выход 33%; примечание: чистота 75%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H29ClN5O6S: 526,14; полученное 526,2.
Этап 4.
[00374] Смесь трет-бутил N-трет-бутоксикарбонил-N-[5-[(4-хлор-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)сульфонил]-2-пиридил]карбамата (170 мг, 0,24 ммоль; примечание: чистота 75%) (R)-3-(1-аминоэтил)-5-(трифторметил)анилина (74 мг, 0,36 ммоль) и ДИПЭА (127 мкл, 0,73 ммоль) в n-BuOH (16 мл) продували N2 (х 3), потом нагревали до 110°С и перемешивали в течение 3,5 ч. Смесь экстрагировали EtOAc (20 мл x 3), а объединенные органические слои промывали Н2О (20 мл x 2) и солевым раствором (20 мл x 2), сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ТСХ с получением трет-бутил N-[5-[[4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]сульфонил]-2-пиридил]-N-трет-бутоксикарбонил-карбамата (100 мг, выход 49%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C31H39F3N7O6S: 694,26; полученное 694,2.
Этап 5.
[00375] Смесь трет-бутил N-[5-[[4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-6-л]сульфонил]-2-пиридил]-N-трет-бутоксикарбонил-карбамата (90 мг, 87 мкмоль) в 4 Μ HCl в МеОН (5 мл) дегазировали N2 (х 3), потом перемешивали при кт в течение 1 ч. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением (R)-N-(1-(3-амино-5-(трифторметил) фенил)этил)-6-((6-аминопиридин-3-ил)сульфонил)-2-метил-6,7-дигидро-5H-пирроло[3,4-d]пиримидин-4-амина (21 мг, выход 81%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H23F3N7O2S: 494,15; полученное 494,1; 1Н ЯМР (400 МГц, ДМСО-d6) δ м. д. 8,32 (с, 1Н), 7,20 (д, J = 8,4 Гц, 1Н), 7,48 (д, J = 8,0 Гц, 1Н), 6,98 (с, 2Н), 6,80 (с, 1Н), 6,75 (с, 1Н),6,67 (с, 1Н), 6,50 (д,J = 9,2Гц, 1Н) 5,52 (шир. с, 2Н), 5,23 (м, 1Н), 4,29-4,34 (м, 4Н), 2,29 (с, 3Н), 1,39 (д, J = 6,8 Гц, 3Н).
Пример 37. Синтез (R)-N-(1-(3-амино-5-(трифторметил)фенил)этил)-2-метил-6-(морфолиносульфонил)-6,7-дигидро-5H-пирроло[3,4-d]пиримидин-4-амина

Этап 1.
[00376] В смесь морфолин-4-сульфонилхлорида (901 мг, 4,85 ммоль) в ДХМ (6 мл) добавляли ДИПЭА (507 мкл, 2,91 ммоль) и HCl-соль 4-хлор-2-метил-6,7-дигидро-5H-пирроло[3,4-d]пиримидина (0,1 г, 0,5 ммоль) в ДХМ (3 мл). Смесь перемешивали при кт в течение 13 ч, потом добавляли МеОН (15 мл) и удаляли растворитель при пониженном давлении. Остаток растирали с МеОН (2,5 мл) и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением 4-((4-хлор-2-метил-5H-пирролο[3,4-d]пиримидин-6(7H)-ил)сульфонил)морфолина (0,07 г). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C11H16ClN3O3S: 319,06; полученное 319,0; 1Н ЯМР (400 МГц, CDC13) δ м. д. 4,68-4,75 (м, 4Н), 3,74-3,81 (м, 4Н), 3,28-3,35 (м, 4Н), 2,74 (с, 3Н).
Этап 2.
[00377] В смесь 4-((4-хлор-2-метил-5H-пирроло[3,4-d]пиримидин-6(7H)-
Пример 38. Синтез (R)-N-(1-(3-амино-5-(трифторметил)фенил)этил)-2-метил-6-((4-метилпиперазин-1-ил)сульфонил)-6,7-дигидро-5H-пирроло[3,4-d]пиримидин-4-амина
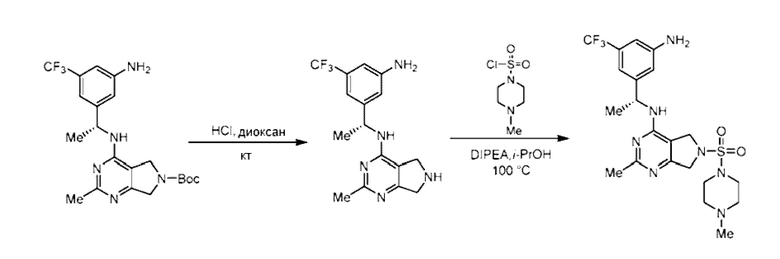
Этап 1.
[00378] Смесь (R)-трет-бутил 4-((1 -(3-амино-5-(трифторметил)фенил)этил)амино)-2-метил-5H-1пирроло[3,4-d]пиримидин-6(7H)-карбоксилата (150 мг, 0,34 ммоль) в 4 Μ HCl в МеОН (2 мл) дегазировали и продували N2 (х 3). Смесь перемешивали при кт в течение 3 ч, потом растворитель концентрировали при пониженном давлении с получением (R)-N-(1 -(3-амино- 5-(трифторметил)фенил)этил)-2 -метил-6,7-дигидро-5H-пирроло[3,4-d]пиримидин-4-амина (110 мг, выход 88%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C16H19F3N5: 338,15; полученное 338,1.
Этап 2.
[00379] В смесь (R)-N-(1-(3-амино-5-(трифторметил)фенил)этал)-2-метил-6,7-дигидро-5H-пирроло[3,4-d]пиримидин-4-амина (110 мг, 0,33 ммоль) в i-PrOH (2 мл) добавляли ДИПЭА (284 мкл, 1,63 ммоль) и 4-метилпиперазин-1-сульфонилхлорид (65 мг, 0,33 ммоль). Смесь нагревали до 100°С в закатанном флаконе и перемешивали в течение 16ч. Смесь концентрировали при пониженном давлении, а остаток разводили в H2O (2 мл) и экстрагировали EtOAc (2 мл x 3). Объединенные органические слои промывали солевым раствором (1 мл), сушили над Na2SO4, и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением (R)-N-(1-(3-амино-5-(трифторметил)фенил)этил)-2-метил-6-((4-метилпиперазин-1-ил)сульфонил)-6,7-дигидро-5Н-пирроло[3,4-d]пиримидин-4-амина (75 мг, выход 46%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H29F3N7O2S: 500,2; полученное 500,2; 1H ЯМР (400 МГц, CDCl3) δ м. д. 7,00 (с, 1 Н), 6,82 (с, 2 Н), 5,36 (с, 1 Н), 4,75 (с, 1 Н), 4,41-4,61 (м, 4 Н), 3,70 (с, 2 Н), 3,34-3,39 (м, 4 Н), 2,49-2,60 (м, 7 Н), 2,37 (с, 3Н), 1,59 (с, 2Н).
Пример 39. Синтез [2-хлор-4-[1-[5-[2-(метиламинометил)фенил]-2-тиенил]этиламино]-5,7-дигидропиррало [3,4-d]пиримидин-6-ил]-морфолинометанона
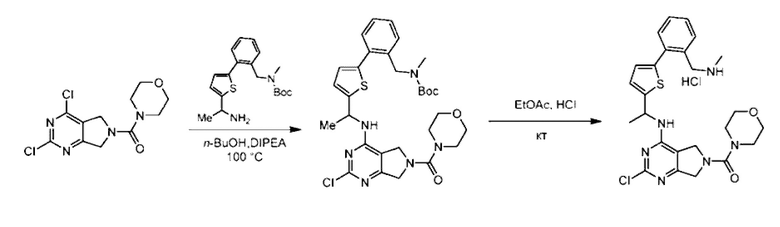
Этап 1.
[00380] трет-бутил-N-[[2-[5-[1-[[2-хлор-6-(морфолин-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]-2-тиенил]фенил]метил]-N-метил-карбамат синтезировали способом, аналогичным трет-бутил N-[[2-[4-[1-[[2-хлор-6-(морфолин-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]тиазол-2-ил]фенил]метил]-N-метил-карбамату, за исключением того, что трет-бутил N-[[2-[3-(1-аминоэтил)фенил]фенил]метил]-Ν-метил-карбамат заменяли трет-бутил-N-[[2-[5-(1-аминоэтил)-2-тиенил]фенил]метил]-N-метил-карбаматом. 1Н ЯМР (400 МГц, CDCl3) δ м. д. 7,35-7,38 (м, 2Н), 7,24-7,30 (м, 2Н), 7,00 (с, 1Н), 6,84 (д, J = 2,8 Гц, 1Н), 5,72 (с, 1Н), 5,02 (с, 1Н), 4,53-4,67 (м, 6H),3,71 (м, 4H), 3,33-3,40 (м, 4Н),2,74(д, 3Н), 1,73 (д, J = 6,8, 3Н), 1,46 (м, 9Н).
Этап 2.
[00381] Смесь трет-бутил N-[2-[5-[1-[[2-хлор-6-(морфолин-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]-2-тиенил]фенил]метил]-N-метил-карбамата (0,06 г, 0,1 ммоль) в 4 Μ HCl в EtOAc (1 мл) перемешивали при кт в течение 1 ч. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[1-[5-[2-(метиламинометил)фенил]-2-тиенил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона HCl-соль (15,2 мг, выход 28%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C25H29ClN6O2S: 513,18; полученное 513,2; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 7,56-7,60 (м, 1Н), 7,48-7,53 (м, 3Н), 7,14 (д, J = 3,6 Гц, 1Н), 7,00 (д, J = 3,6 Гц, 1Н), 5,75-5,8 (м, 1Н), 4,65 (д, J = 7,2 Гц, 4Н), 4,34 (с, 2Н), 3,72 (т, J = 4,8 Гц, 4Н), 3,37 (т, J = 4,8 Гц, 4Н), 2,65 (с, 3Н), 3,68 (с, 3Н), 1,74 (м, 3Н).
Пример 40. Синтез [2-хлор-4-[1-[3-гидрокси-5-(трифторметил)фенил]этиламино]-5,7-дигидропирроло [3,4-d]пиримидин-6-ил] -морфолинометанона
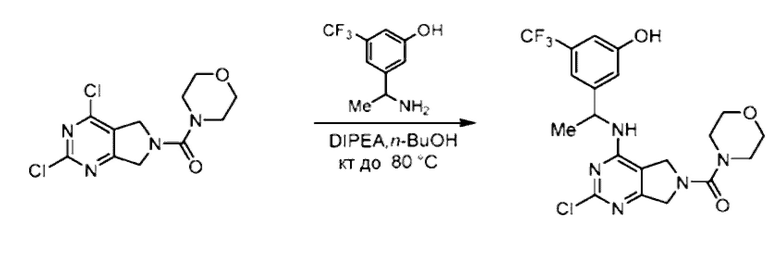
Этап 1.
[00382] В смесь (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (100 мг, 0,33 ммоль) и 3-(1-аминоэтил)-5-(трифторметил)фенола (68 мг, 0,33 ммоль) в n-BuOH (1 мл) добавляли ДИПЭА (115 мкл, 0,66 ммоль). Смесь нагревали до 80 °С и перемешивали в течение 3 ч. Смесь фильтровали, растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[1-[3-гидрокси-5-(трифторметил)фенил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (20 мг, выход 13%). ЖХМС (ИЭР): m/z: [М-Н], рассчитанное для C20H22ClF3N5O3: 472,13; полученное 472,2; 1Н ЯМР (400 МГц, ДМСО-d6) 5м. д. 10,18-10,04 (шир. м, 1Н), 8,14 (шир. д, J = 7,6 Гц, 1Н), 7,16 (с, 1Н), 7,03 (с, 1Н), 6,90 (с, 1Н), 5,32-5,18 (м, 1Н), 4,64-4,45 (м, 4Н), 3,61 (д, J = 4,4 Гц, 4Н), 3,24 (д, J = 4,0 Гц, 4Н), 1,47 (д, J = 7,2 Гц, 3Н).
Пример 41. Синтез [4-[1-(3-амино-5-этил-фенил)этиламино]-2-хлор-5,7-дигидропирроло [3,4-d]пиримидин-6-ил] -морфолинометанона
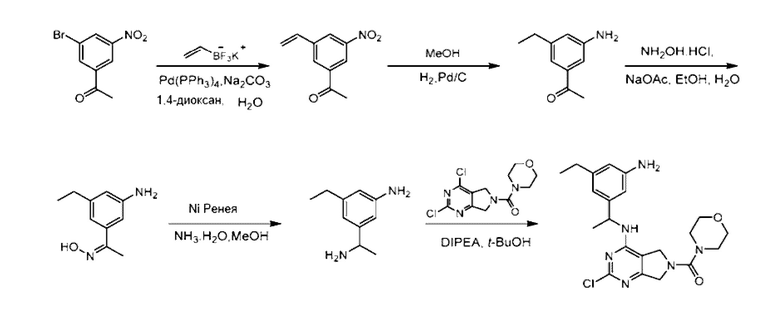
Этап 1.
[00383] В смесь 1-(3-бром-5-нитро-фенил)этанона (1,3 г, 5,33 ммоль) в 1,4-диоксане (12 мл) и Н2О (3 мл) в атмосфере N2 добавляли трифтор(винил)борат калия (785 мг, 5,86 ммоль), Pd(PPh3)4 (616 мг, 0,53 ммоль) и Na2CO3 (1,13 г, 10,7 ммоль). Смесь нагревали до 90°С и перемешивали в течение 10 ч. Добавляли Н2О (10 мл) и экстрагировали смесь EtOAc (10 мл x 3). Объединенные органические слои промывали солевым раствором (20 мл), сушили над Na2SO4, и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением 1-(3-нитро-5-винил-фенил)этанона (500 мг, выход 49%). 1Н ЯМР (400 МГц, CDCl3) δ м. д. 8,64 (с, 1Н), 8,45 (с, 1Н), 8,28 (с, 1Н), 6,83 (дд, J = 17,6, 11,2 Гц, 1Н), 6,00 (д, J= 17,6 Гц, 1Н), 5,56 (д, J = 10,8 Гц, 1Н), 2,71 (д, J =2,0 Гц, 3Н).
Этап 2.
[00384] В смесь 1-(3-нитро-5-винил-фенил)этанона (250 мг, 1,31 ммоль) в МеОН (2 мл) добавляли 10% масс. Pd/C (1,54 г, 1,31 ммоль). Смесь перемешивали в атмосфере Н2 (15 фунт/кв. дюйм) в течение 3 ч. Смесь фильтровали, растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ТСХ с получением 1-(3-амино-5-этил-фенил)этанона (110 мг, выход 52%). 1Н ЯМР (400 МГц, CDCl3) δ м. д. 7,19 (с, 1H), 7,10 (с, 1H), 6,74 (с, 1H), 3,75 (шир. с, 2Н), 2,63 (кв, J = 7,6 Гц, 2Н), 2,58-2,54 (м, 3Н), 1,56 (с, 1H), 1,24 (т, J = 7,6 Гц, 3Н).
Этап 3.
В смесь NH2OH.HCl (64 мг, 0,92 ммоль) в EtOH (1 мл) и H2O (0,5 мл) добавляли NaOAc (126 мг, 1,53 ммоль) и 1-(3-амино-5-этил-фенил)этанон (100 мг, 0,61 ммоль). Смесь нагревали до 80°С и перемешивали в течение 5 ч. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ТСХ с получением 1-(3-амино-5-этил-фенил)этаноноксима (100 мг, выход 92%). 1Н ЯМР (400 МГц, CDCl3) δ м. д. 6,84 (с, 1H), 6,76 (с, 1Н), 6,58 (с, 1Н), 4,91-4,27 (м, 2Н), 2,64-2,54 (м, 2Н), 2,34-2,21 (м, 3Н), 1,23 (т, J = 7,6 Гц, 3Н).
Этап 4.
В смесь 1-(3-амино-5-этил-фенил)этаноноксима (100 мг, 0,56 ммоль) в МеОН (0,5 мл) добавляли 30% водный NH3 (72 мкл, 0,56 ммоль) и Ni Ренея (48 мг, 0,56 ммоль). Смесь перемешивали при кт в течение 4 ч в атмосфере H2 (15 фунт/кв. дюйм). Смесь фильтровали и концентрировали фильтрат при пониженном давлении с получением 3-(1-аминоэтил)-5-этил-анилина (150 мг), который использовали на следующем этапе без дополнительной очистки. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C10H17N2: 165,13; полученное 165,3.
Этап 5.
В смесь (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (83 мг, 0,27 ммоль) в t-BuOH (1 мл) добавляли ДИПЭА (447 мкл, 2,74 ммоль) и 3-(1-аминоэтил)-5-этил-анилин (90 мг, 0,55 ммоль). Смесь нагревали до 50°С и перемешивали в течение 1 ч, потом растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением [4-[1-(3-амино-5-этил-фенил)этиламино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометано на (7 мг, выход 3%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H28ClN6O2: 431,19; полученное 431,2; 1H ЯМР (400 МГц, Метанол-d4) δм. д. 6,61 (с, 1Н), 6,58 (с, 1Н), 6,49 (с, 1H), 5,30 (м, 1H), 4,58 (д, J = 14,0 Гц, 4Н), 3,78-3,67 (м, 4Н), 3,38-3,33 (м, 4Н), 2,53 (кв, J = 7,6 Гц, 2Н), 1,52 (д, J = 7,2 Гц, 3Н), 1,19 (т, J = 7,6 Гц, 3Н).
Пример 42. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-6-(5-бром-2-пиридил)-2-метил-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-4-амина
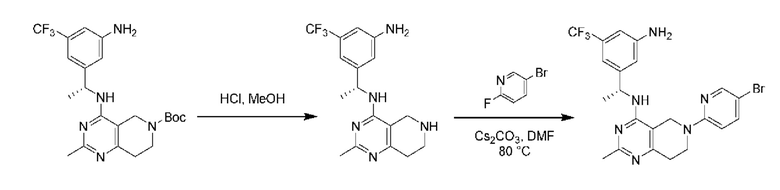
Этап 1.
[00385] К трет-бутил 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-6-карбоксилату (0,25 г, 0,55 ммоль) добавляли HCl в МеОН (10 мл) и перемешивали смесь при кт в течение 1 ч. Растворитель концентрировали при пониженном давлении с получением HCl-соли N-[(1R)-l-[3-амино-5-(трифторметил)фенил]этил]-2-метил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-4-амина (0,22 г). 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 7,89 (д, J = 10,8 Гц, 2Н), 7,60 (с, 1H), 5,81-5,67 (м, 1H), 4,40 (д, J = 16,0 Гц, 1H), 4,29 (д, J = 16,0 Гц, 1Н), 3,64 (т, J = 6,2 Гц, 2Н), 3,19-3,10 (м, 2Н), 2,55 (с, 3Н), 1,73 (д, J = 7,l Гц, 3Н).
Этап 2.
[00386] В смесь HCl-соли N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-4-амина (0,22 г, 0,57 ммоль) в ДМФ (3 мл) добавляли 5-бром-2-фтор-пиридин (200 мг, 1,13 ммоль) и Cs2CO3 (1,11 г, 3,40 ммоль). Смесь нагревали до 80°С и перемешивали в течение 13 ч. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением HCO2H-соли N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-6-(5-бром-2-пиридил)-2-метил-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-4-амина (43 мг, выход 14%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H23BrF3N6: 507,1; полученное 507,1; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 8,38 (с, 1H), 8,20 (д, J = 2,5 Гц, 1H), 7,70 (дд, J = 9,1, 2,5 Гц, 1H), 6,95 (дд, J = 9,5, 3,2 Гц, 3Н), 6,80 (с, 1H), 5,52 (д, J = 7,0 Гц, 1H), 4,46-4,31 (м, 2Н), 4,00-3,83 (м, 2Н), 2,82 (т, J = 5,3 Гц, 2Н), 2,41 (с, 3Н), 1,60 (д, J = 7,0 Гц, 3Н).
Пример 186. Синтез (R)-N-(1-(3-амино-5-(трифторметал)фенил)этил)-2-хлор-6-(3-морфолинопиридин-2-ил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-4-амина
[00387] (R)-N-(1-(3-амино-5-(трифторметил)фенил)этил)-2-хлор-6-(3-морфолинопиридин-2-ил)-5,6,7,8-тетрагидропиридо[4,3-d]пиримидин-4-амин синтезировали способом, аналогичным примеру 42.
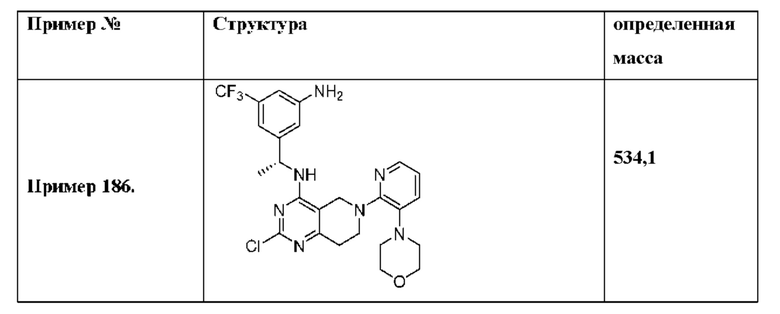
Пример 43. Синтез [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-пирроло[2,1-f] [1,2,4]триазин-6-ил]-(3 -гидроксиазетидин-1-ил)метанона
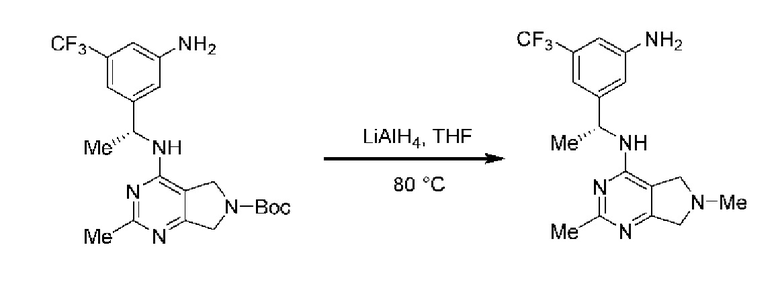
Этап 1.
[00388] В смесь трет-бутил 4-[[(1H)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилата (100 мг, 0,23 ммоль) в ТГФ (1 мл) добавляли LiAlH4 (13 мг, 0,34 ммоль). Смесь нагревали до 80°С и перемешивали в течение 1 ч. Смесь охлаждали до 15°С, потом добавляли Н2О (3 мл) и экстрагировали смесь EtOAc (5 мл x 3). Объединенные органические слои промывали солевым раствором (5 мл), сушили над Na2SO4, и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-пирроло[2,1-f][1,2,4]триазин-6-ил]-(3-гидроксиазетидин-1-ил)метанона (36 мг, выход 43%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C17H20F3N5: 352,2; полученное 352,1; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 8,41-8,22 (м, 1H), 6,90 (д, J = 5,4 Гц, 2Н), 6,79 (с, 1Н), 5,39 (д, J = 7,3 Гц, 1H), 4,11-4,01 (м, 4Н), 2,78 (с, 3Н), 2,40 (с, 3Н), 1,52 (д, J = 6,8 Гц, 3Н).
Пример 44. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-6-(5-бром-2-пиридил)-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-4-амина
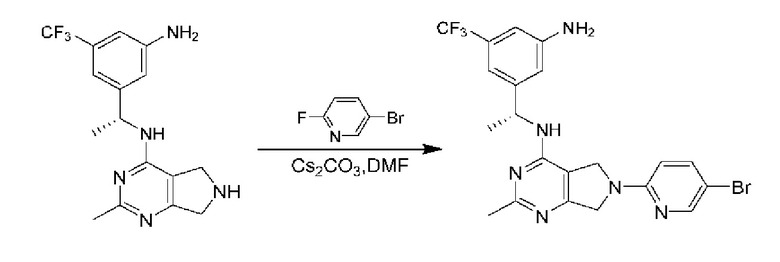
Этап 1.
[00389] В смесь HCl-соли N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6,7-дигидро-5/7-пирроло[3,4-d]пиримидин-4-амина (128 мг, 0,38 ммоль) и 5-бром-2-фтор-пиридина (200 мг, 1,14 ммоль) в ДМФ (3 мл) добавляли Cs2CO3 (618 мг, 1,90 ммоль). Смесь нагревали до 85°С, перемешивали в течение 5 ч и потом фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-6-(5-бром-2-пиридил)-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-4-амина (44 мг, выход 23%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H21BrF3N6: 493,09; полученное 493,1; 1H ЯМР (400 МГц, Метанол-d4) δ м. д. 8,17 (с, 1H), 7,71 (дд, J = 8,9, 2,4 Гц, 1H), 6,96 6,90 (м, 2Н), 6,81-6,77 (м, 1H), 6,61-6,57 (м, 1H), 5,49-5,41 (м, 1H), 4,65-4,61 (м, 1H), 4,56 (д, J = 4,4 Гц, 4Н), 2,43-2,41 (м, 3Н), 1,57-1,54 (м, 3Н).
Пример 45. Синтез [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-6,7-дигидро-5H-циклопента [d]пиримидин-6-ил] -морфолинометанона
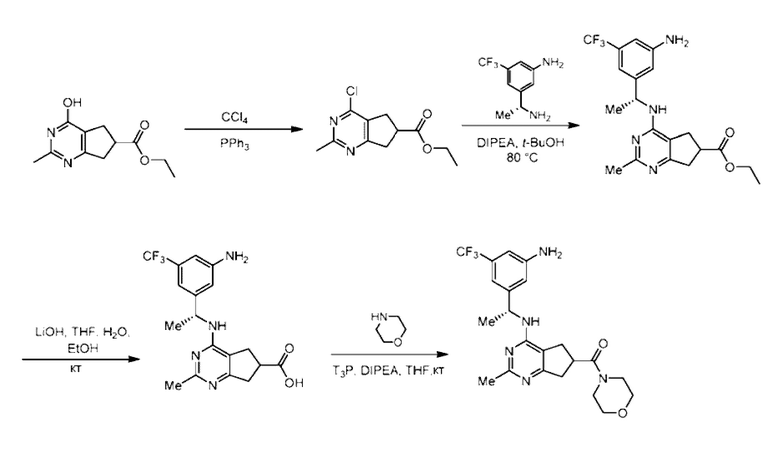
Этап 1.
[00390] В смесь этил 4-гидрокси-2-метил-6,7-дигидро-5H-циклопента[d]пиримидин-6-карбоксилата (500 мг, 2,25 ммоль) в ДХЭ (5 мл) добавляли CCl4 (649 мкл, 6,75 ммоль) и Ph3P (1,18 г, 4,50 ммоль). Смесь нагревали до 70°С и перемешивали в течение 2 ч, вливали в Н2О (3 мл) и экстрагировали EtOAc (2 мл x 3). Объединенные органические слои промывали солевым раствором (1 мл), сушили над Na2SO4, и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением этил 4-хлор-2-метил-6,7-дигидро-5H-циклопента[d]пиримидин-6-карбоксилата (400 мг, выход 74%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C11H14ClN2O2: 241,1; полученное 241,0.
Этап 2.
[00391] В смесь этил 4-хлор-2-метил-6,7-дигидро-5H-циклопента[d]пиримидин-6-карбоксилата (200 мг, 0,83 ммоль) в t-BuOH (0,2 мл) в атмосфере N2 добавляли 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилин (170 мг, 0,83 ммоль) и ДИПЭА (434 мкл, 2,49 ммоль). Смесь нагревали до 80°С и перемешивали в течение 20 ч, вливали в Н2О (1 мл) и экстрагировали EtOAc (1 мл x 3). Объединенные органические слои промывали солевым раствором (1 мл), сушили над Na2SO4, и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ТСХ с получением этил 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-6,7-дигидро-5H-циклопента[d]пиримидин-6-карбоксилата (170 мг, выход 50%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H24F3N4O2: 409,2; полученное 409,2; 1Н ЯМР (400 МГц, CDCl3) δ м. д. 6,93 (с, 1H), 6,75 (д, J = 15,2 Гц, 1H), 6,74-6,67 (м, 1H), 5,43-5,20 (м, 1H), 4,57-4,26 (м, 1H), 4,18-4,07(м, 2Н), 3,35-3,21 (м, 1H), 3,18-3,01 (м, 2Н), 2,98-2,77 (м, 2Н), 2,41 (с, 3Н), 1,48 (т, J = 6,8 Гц, 3Н).
Этап 3.
[00392] В смесь этил 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил] амино]-2-метил-6,7-дигидро-5H-циклопента[d]пиримидин-6-карбоксилата (170 мг, 0,42 ммоль) в ТГФ (0,8 мл) добавляли LiOH.H2O (18 мг, 0,42 ммоль), Н2О (0,6 мл) и EtOH (0,4 мл). Смесь перемешивали при кт в течение 1 ч, потом концентрировали при пониженном давлении с получением 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-6,7-дигидро-5H-циклопента[d]пиримидин-6-карбоновой кислоты (150 мг, выход 95%), которую непосредственно использовали на следующем этап. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C18H20F3N4O2: 381,1; полученное 381,2; 1Н ЯМР (400 МГц, CDCl3) δ м. д. 6,93-6,91 (м, 1H), 6,70 (м, 1H), 6,67 (м, 1H), 5,34-5,29 (м, 1H), 2,93 (м, 2Н), 2,91-2,89 (м, 1H), 2,86-2,85 (м, 2Н), 2,34-2,33 (м, 3Н), 1,48-1,44 (м, 3Н).
Этап 4.
[00393] [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-6,7-дигидро-5H-циклопента[d]пиримидин-6-ил]-морфолинометанон синтезировали способом, аналогичным [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]тиено[3,2-[d]пиримидин-6-ил]-морфолинометанону, за исключением того, что 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]тиено[3,2-d]пиримидин-6-карбоновую кислоту заменяли на 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-6,7-дигидро-5H-циклопента[d]пиримидин-6-карбоновую кислоту. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H27F3N5O2: 450,2; полученное 450,2; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 6,92 (м, 1H), 6,89 (м, 1Н), 6,77 (с, 1H), 5,41-5,37 (с, 1H), 3,71-3,67 (с, 2Н), 3,67-3,66 (м, 4Н), 3,63-3,61 (м, 2Н), 3,12-3,11 (м, 2Н), 3,05-3,03 (м, 2Н), 3,01-2,92 (м, 1H), 2,35 (с, 3Н), 1,52-1,50 (м, 3Н).
Пример 46. Синтез (R)-N-(1-(3-амино-5-(трифторметил)фенил)этил)-2-метил-6-(метилсульфонил)-6,7-дигидро-5H-пирроло[3,4-d]пиримидин-4-амина
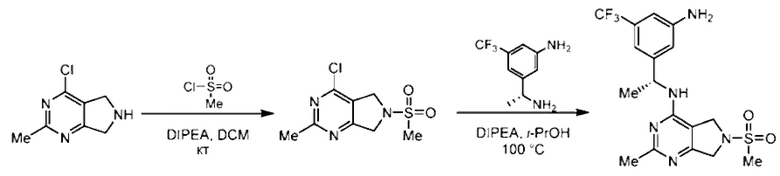
Этап 1.
[00394] В смесь 4-хлор-2-метил-6,7-дигидро-5H-пирроло[3,4-d]пиримидина (100 мг, 0,59 ммоль) и ДИПЭА (308 мкл, 1,77 ммоль) в ДХМ (3 мл) при 0°С добавляли метансульфонилхлорид (55 мкл, 0,71 ммоль). Смесь оставляли нагреваться до кг и перемешивали в течение 3 ч. Смесь разводили ДХМ (6 мл), промывали солевым раствором (1 мл), сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением 4-хлор-2-метил-6-(метилсульфонил)-6,7-дигидро-5H-пирроло[3,4-d]пиримидина (135 мг, выход 92%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C8H11ClN3O2S: 248,0; полученное 248,1.
Этап 2.
[00395] (R)-N-(1-(3-амино-5-(трифторметил)фенил)этил)-2-метил-6-(метилсульфонил)-6,7-дигидро-5H-пирроло[3,4-d]пиримидин-4-амин синтезировали способом, аналогичным (R)-N-(1-(3-амино-5-(трифторметил)фенил)этил)-2-метил-6-(морфолиносульфонил)-6,7-дигидро-5H-пирроло[3,4-d]пиримидин-4-амину, за исключением того, что 4-((4-хлор-2-метил-5H-пирроло[3,4-d]пиримидин-6(7H)-ил)сульфонил)морфолин заменяли 4-хлор-2-метил-6-(метилсульфонил)-6,7-дигидро-5H-пирроло[3,4-d]пиримидином. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C17H21F3N5O2S: 416,13; полученное 416,1; 1Н ЯМР (400 МГц, CDCl3) δ м.д. 6,99 (с, 1Н), 6,82 (м, 2Н), 5,38 (м, 1Н), 4,66-4,77 (шир. с, 1Н), 4,52 (с, 4Н), 3,91 (шир. с, 2Н), 2,89 (с, 3Н), 2,47-2,55 (м, 3Н), 1,58 (с, 3Н).
Пример 47. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6-тетрагидропиран-4-илсульфонил-5,7-дигидропирроло[3,4-d]пиримидин-4-амина
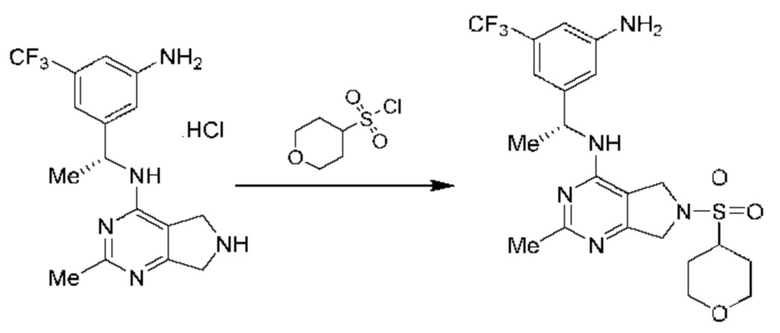
Этап 1.
[00396] В смесь HCl-соли N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6,7-дигидро-5H-пирроло[3,4-d]пиримидин-4-амина (135 мг, 0,36 ммоль) и тетрагидропиран-4-сульфонилхлорида (67 мг, 0,36 ммоль) в MeCN (0,9 мл) и 1,4-диоксана (0,6 мл) добавляли ТЭА (151 мкл, 1,08 ммоль). Смесь перемешивали при кт в течение 30 мин, потом концентрировали при пониженном давлении. Остаток разводили Н2О (20 мл) и экстрагировали EtOAc (10 мл×3). Объединенные органические слои промывали солевым раствором (20 мл), сушили над Na2SO4, и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6-тетрагидропиран-4-илсульфонил-5,7-дигидропирроло[3,4-d]пиримидин-4-амина (90 мг, выход 51%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H27F3N5O3S: 486,2; полученное 486,1; 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 6,90 (д, J=10,8 Гц, 2Н), 6,78 (с, 1H), 5,44-5,34 (м, 1H), 4,61 (с, 2Н), 4,53 (д, J=2,0 Гц, 2Н), 4,05-3,97 (м, 2Н), 3,59-3,49 (м, 1H), 3,46-3,37 (м, 2Н), 2,39 (с, 3Н), 2,01-1,80 (м, 4Н), 1,51 (д, J=7,2 Гц, 3Н).
[00397] Примеры в таблице 3 ниже синтезировали способом, аналогичным примеру 47.
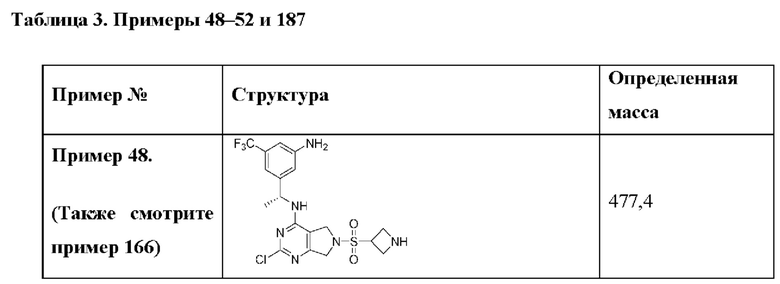
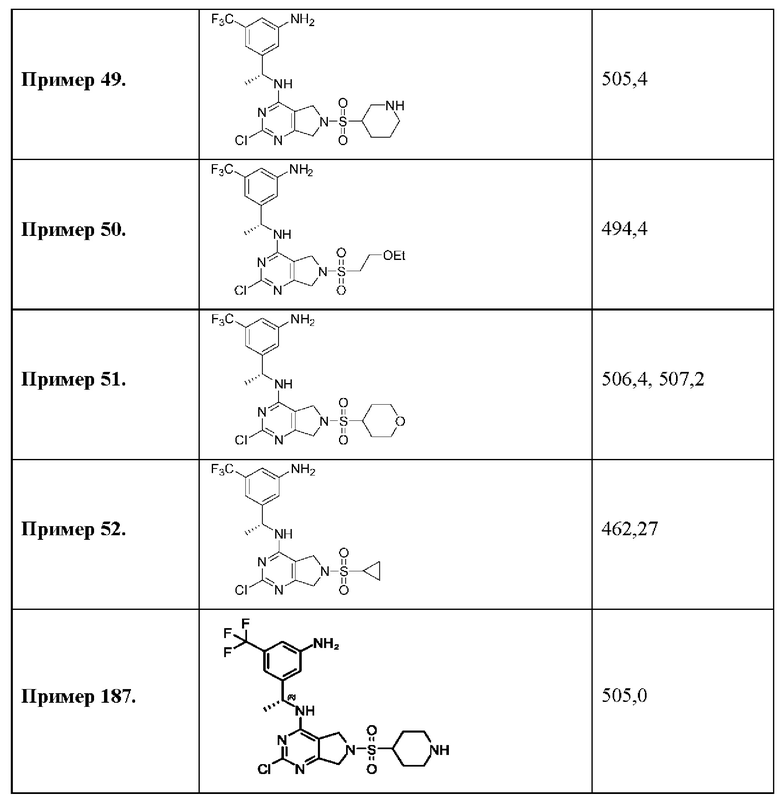
Пример 53. Синтез [2-хлор-4-[1-[5-[2-(гидроксиметил)фенил]-2-тиенил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона
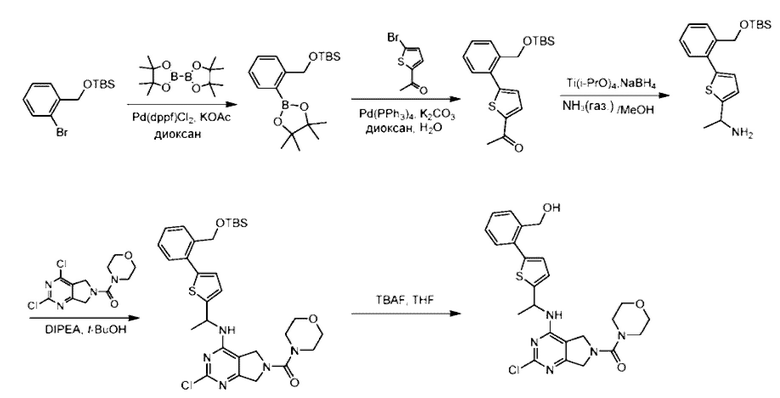
Этап 1.
[00398] В смесь (2-бромфенил)метокси-трет-бутил-диметилсилана (1,0 г, 3,3 ммоль) и бис(пинаколато)дибора (1,0 г, 4,0 ммоль) в 1,4-диоксане (15 мл) в атмосфере N2 добавляли KOAc (652 мг, 6,64 ммоль) и Pd(dppf)Cl2.CH2Cl2 (271 мг, 0,33 ммоль). Смесь нагревали до 100°С и перемешивали в течение 10 ч. Добавляли Н2О (20 мл) и экстрагировали смесь EtOAc (20 мл×2). Объединенные органические слои промывали солевым раствором (20 мл), сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением трет-бутил-диметил-[[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метокси]силана (1 г, выход 87%). 1Н ЯМР (400 МГц, CDCl3) δ м.д. 7,79-7,75 (м, 1Н), 7,61 (д, J=7,6 Гц, 1Н), 7,45 (дт, J=7,6 1,6 Гц, 1Н), 7,26-7,21 (м, 1Н), 5,03 (с, 2Н), 1,34 (с, 12Н), 0,96 (с, 9Н), 0,10 (с, 6Н).
Этап 2.
[00399] В смесь трет-бутил-диметил-[[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метокси]силана (1,0 г, 2,9 ммоль) и 1-(5-бром-2-тиенил)этанона (589 мг, 2,9 ммоль) в 1,4-диоксане (10 мл) и Н2О (2 мл) добавляли Pd(PPh3)4 (332 мг, 0,29 ммоль) и K2CO3 (1,59 г, 11,48 ммоль). Смесь нагревали до 100°С и перемешивали в течение 10 ч. Добавляли Н2О (20 мл) и экстрагировали смесь EtOAc (20 мл×2). Объединенные органические слои промывали солевым раствором (20 мл), сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением 1-[5-[2-[[трет-бутил(диметил)силил]оксиметил]фенил]-2-тиенил]этанона (0,85 г, выход 85%). 1H ЯМР (400 МГц, CDCl3) δ м.д. 7,68 (д, J=4,0 Гц, 1H), 7,62 (д, J=7,6 Гц, 1H), 7,42 (д, J=7,6 Гц, 2Н), 7,34 (с, 1H), 7,18 (д, J=4,0 Гц, 1H), 4,76 (с, 2Н), 2,60 (с, 3Н), 0,93 (с, 9Н), 0,08 (с, 6Н).
Этап 3.
[00400] В смесь 1-[5-[2-[[трет-бутил(диметил)силил]оксиметил]фенил]-2-тиенил]этанона (0,8 г, 2,3 ммоль) в МеОН (10 мл) добавляли NH3 (118 мг, 6,93 ммоль) и Ti(i-PrO)4 (1,36 мл, 4,62 ммоль). Смесь перемешивали при кт в течение 10 ч, потом добавляли NaBH4 (131 мг, 3,46 ммоль) и перемешивали смесь при кт в течение 1 ч. Смесь вливали в ледяную H2O (10 мл) и экстрагировали EtOAc (10 мл×3). Объединенные органические слои промывали солевым раствором (20 мл), сушили безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением 1-[5-[2-[[трет-бутил(диметил)силил]оксиметил]фенил]-2-тиенил]этанамина (400 мг, выход 50%). 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,53 (д, J=7,2 Гц, 1Н), 7,29-7,40 (м, 3Н), 7,04 (д, J=3,6 Гц, 1H), 6,93 (д, J=3,6 Гц, 1H), 4,74 (с, 2Н), 4,23 (кв, J=6,4 Гц, 1Н), 2,12 (шир. с, 2Н), 1,37 (д, J=6,4 Гц, 3Н), 0,88 (с, 9Н), 0,05 (с, 6Н).
Этап 4.
[00401] В смесь 1-[5-[2-[[трет-бутил(диметил)силил]оксиметил]фенил]-2-тиенил]этанамина (100 мг, 0,29 ммоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (87 мг, 0,29 ммоль) в t-BuOH (3 мл) добавляли ДИПЭА (100 мкл, 0,58 ммоль). Смесь нагревали до 100°С в закатанном флаконе и перемешивали в течение 10 ч, потом разводили в H2O (10 мл) и экстрагировали EtOAc (5 мл×2). Объединенные органические слои промывали солевым раствором (10 мл), сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением [4-[1-[5-[2-[[трет-бутил(диметил)силил]оксиметил]фенил]-2-тиенил]этиламино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона(150 мг, выход 85%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C30H41ClN5O3SSi: 614,2; полученное 614,2.
Этап 5.
[00402] В смесь [4-[1-[5-[2-[[трет-бутил(диметил)силил]оксиметил]фенил]-2-тиенил]этиламино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (100 мг, 0,16 ммоль) в ТГФ (5 мл) добавляли 1 М ТБАФ в ТГФ (326 мкл, 0,33 ммоль). Смесь перемешивали при кт в течение 1 ч, потом вливали в ледяную Н2О (5 мл) и экстрагировали EtOAc (5 мл×4). Объединенные органические слои промывали солевым раствором (5 мл), сушили безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[1-[5-[2-(гидроксиметил)фенил]-2-тиенил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (45 мг, выход 55%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C24H27ClN5O3S: 500,14; полученное 500,2; 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,28 (д, J=8,0 Гц, 1H), 7,57 (д, J=7,2 Гц, 1H), 7,39-7,33 (м, 2Н), 7,32-7,27 (м, 1H), 7,12 (д, J=3,6 Гц, 1Н), 7,06 (д, J=2,8 Гц, 1H), 5,59 (шир. т J=7,2 Гц, 1H), 5,24 (т, J=5,6 Гц, 1H), 4,58-4,48 (м, 6Н), 3,66-3,58 (м, 4Н), 3,26-3,21 (м, 4Н), 1,62 (д, J=6,8 Гц, 3Н).
Пример 54. (Также смотрите пример 110) Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-6-(тетрагидрофуран-3-илметил)-5,7-дигидропирроло[3,4-d]пиримидин-4-амина
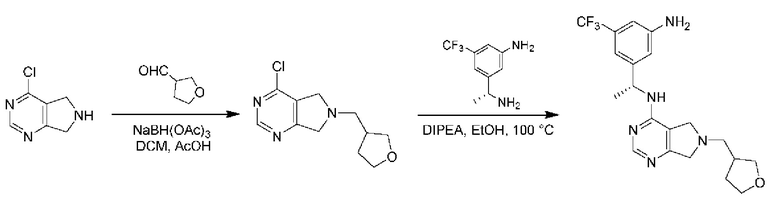
Этап 1.
[00403] В смесь ТФУ-соли 4-хлор-6,7-дигидро-5H-пирроло[3,4-d]пиримидин (450 мг, 1,67 ммоль) и тетрагидрофуран-3-карбальдегида (151 мкл, 1,67 ммоль) в ДХМ (3,5 мл) и АсОН (1,5 мл) добавляли NaBH(OAc)3 (884 мг, 4,17 ммоль). Смесь перемешивали при кт в течение 1 ч, потом концентрировали при пониженном давлении. Остаток разводили Н2О (20 мл) и экстрагировали EtOAc (10 мл×3). Объединенные органические слои промывали солевым раствором (20 мл), сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением остатка. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением 4-хлор-6-(тетрагидрофуран-3-илметил)-5,7-дигидропирроло[3,4-d]пиримидина (120 мг). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C11H15ClN3O: 240,1; полученное 240,1.
Этап 2.
[00404] В смесь 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилина (205 мг, 1,0 ммоль) и 4-хлор-6-(тетрагидрофуран-3-илметил)-5,7-дигидропирроло[3,4-d]пиримидина (120 мг, 0,50 ммоль) в EtOH (2,5 мл) добавляли ДИПЭА (872 мкл, 5,0 ммоль). Смесь нагревали до 100°С и перемешивали в течение 2 ч, потом растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-6-(тетрагидрофуран-3-илметил)-5,7-дигидропирроло[3,4-d]пиримидин-4-амина (10 мг, выход 5%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H25F3N5O: 408,2; полученное 408,1; 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 8,27 (с, 1Н), 6,89 (с, 2Н), 6,78 (с, 1Н), 5,32 (кв, J=6,8 Гц, 1Н), 3,97-3,83 (м, 6Н), 3,77 (кв, J=7,8 Гц, 1Н), 3,55 (дд, J=8,6, 6,4 Гц, 1Н), 2,84-2,73 (м, 2Н), 2,53 (тд, J=14,4, 7,2 Гц, 1Н), 2,18-2,07 (м, 1Н), 1,75-1,56 (м, 1Н), 1,52 (д, J=6,8 Гц, 3Н).
Пример 55. Синтез [4-[[(1R)-1-[3-амино-(трифторметил)фенил]этил]амино]-2-метокси-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона и [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-гидрокси-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона

Этап 1.
[00405] В смесь HCl-соли 2,4-дихлор-6,7-дигидро-5H-пирроло[3,4-d]пиримидина (340 мг, 1,5 ммоль) и морфолин-4-карбонилхлорида (175 мкл, 1,5 ммоль) в ДХМ (5 мл) добавляли ДИПЭА (1,3 мл, 7,5 ммоль). Смесь перемешивали при кт в течение 3 ч, потом растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (400 мг, выход 88%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C11H13Cl2N4O2: 303,03; полученное 302,8; 1Н ЯМР (400 МГц, CD3CN) δ м.д. 4,76 (с, 4Н), 3,63-3,69 (м, 4Н), 3,25-3,31 (м, 4Н).
Этап 2.
[00406] В смесь (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (400 мг, 1,32 ммоль) и 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилина (269 мг, 1,32 ммоль) в MeCN (10 мл) добавляли ДИПЭА (1,15 мл, 6,60 ммоль). Смесь нагревали до 80°С и перемешивали в течение 2 ч, потом растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона(350 мг, выход 56%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H23ClF3N6O2: 471,14; полученное 470,9; 1Н ЯМР (400 МГц, CDCl3) δ м.д. 6,96 (с, 1H), 6,82 (с, 2Н), 5,35 (шир. с, 1H), 4,85 (д, J=14,8 Гц, 1H), 4,55-4,62 (м, 4Н), 3,92 (с, 2Н), 3,70-3,75 (м, 4Н), 3,32-3,37 (м, 4Н), 1,59 (д, J=6,8 Гц, 3Н).
Этап 3.
[00407] В смесь [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (110 мг, 0,23 ммоль) в МеОН (1 мл) добавляли метоксид натрия, чистота 30% (84 мг, 0,47 ммоль). Смесь нагревали до 80°С в закатанном флаконе и перемешивали в течение 2 ч, потом добавляли насыщенный NH4Cl (2 мл) и экстрагировали смесь EtOAc (2 мл×3). Объединенные органические слои промывали солевым раствором (2 мл), сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением [4-[[(1R)-1-[3-амино-(трифторметил)фенил]этил]амино]-2-метокси-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (42 мг, выход 39%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H26F3N6O3: 467,20; полученное 467,0; 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 6,91 (д, J=8,8 Гц, 2Н), 6,79 (с, 1H), 5,25 (шир. д, J=6,4 Гц, 1H), 4,59 (с, 2Н), 4,47-4,55 (м, 2Н), 3,78 (с, 3Н), 3,69-3,75 (м, 4Н), 3,35 (д, J=4,0 Гц, 4Н), 1,54 (д, J=7,1 Гц, 3Н).
Этап 4.
[00408] В смесь [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метокси-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (200 мг, 0,43 ммоль) и NaI (122 мг, 0,82 ммоль) в MeCN (5 мл) добавляли TMSCl (109 мкл, 0,86 ммоль). Смесь нагревали до 90°С в закатанном флаконе и перемешивали в течение 12 ч. Смесь фильтровали, растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-гидрокси-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (83 мг, выход 43%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H24F3N6O3: 453,18; полученное 453,1; 1Н ЯМР (400 МГц, CDCl3) δ м.д. 6,95 (м, 2Н), 6,79 (с, 1Н), 5,43 (м, 1Н) 4,56 (с, 2Н), 4,50 (с, 2Н), 3,71 (м, 4Н), 3,46 (м, 4Н), 1,51 (д, J=6,8 Гц, 3Н).
Пример 56. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6-(тетрагидрофуран-3-илметил)-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-4-амина
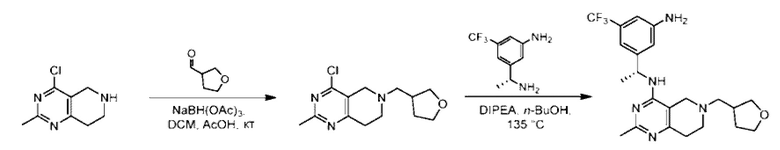
Этап 1.
[00409] В смесь ТФУ-соли 4-хлор-2-метил-5,6,7,8-тетрагидропиридо[4,3-d]пиримидина (0,53 г, 1,78 ммоль) и тетрагидрофуран-3-карбальдегида (482 мкл, 5,34 ммоль) в ДХМ (7 мл) добавляли АсОН (3 мл) и NaBH(ОАс)3 (1,89 г, 8,9 ммоль). Смесь перемешивали при кт в течение 12 ч, а растворитель концентрировали при пониженном давлении, потом разводили Н2О (20 мл) и экстрагировали EtOAc (10 мл×5). Объединенные органические слои промывали солевым раствором (30 мл), сушили над Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением 4-хлор-2-метил-6-(тетрагидрофуран-3-илметил)-7,8-дигидро-5H-пиридо[4,3-d]пиримидина (0,23 г, выход 48%). 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 3,94-3,85 (м, 2Н), 3,84-3,70 (м, 4Н), 3,60-3,53 (м, 1Н), 3,11-2,96 (м, 4Н), 2,78 (д, J=8,0 Гц, 2Н), 2,61 (с, 3Н), 2,19-2,08 (м, 1Н), 1,74-1,68 (м, 1Н).
Этап 2.
[00410] В смесь 4-хлор-2-метил-6-(тетрагидрофуран-3-илметил)-7,8-дигидро-5H-пиридо[4,3-d]пиримидина (0,13 г, 0,49 ммоль) в n-BuOH (2 мл) добавляли 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилин (198 мг, 0,97 ммоль) и ДИПЭА (846 мкл, 4,86 ммоль). Смесь нагревали до 135°С в закатанном флаконе и перемешивали в течение 12 ч, потом растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ (×2) с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6-(тетрагидрофуран-3-илметил)-7,8-дигидро-5H-пиридо[4,3-d]пиримидин-4-амина (35 мг, выход 17%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H29F3N5O: 436,2; полученное 436,1; 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 6,92 (с, 1Н), 6,90 (с, 1Н), 6,78 (с, 1Н), 5,52-5,38 (м, 1Н), 3,94-3,84 (м, 2Н), 3,79-3,74 (м, 1Н), 3,58-3,52 (м, 1Н), 3,40 (д, J=8,0 Гц, 2Н), 2,86-2,76 (м, 2Н), 2,75-2,65 (м, 3Н), 2,63-2,58 (м, 2Н), 2,34 (с, 3Н), 2,14-2,07 (м, 1Н), 1,74-1,62 (м, 1Н), 1,53 (д, J=4,0 Гц, 3Н).
Пример 57. Синтез 4-[4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-N,N-диметил-циклогексанкарбоксамида
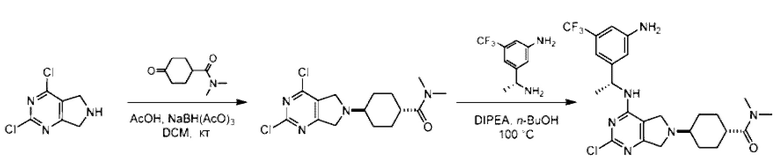
Этап 1.
[00411] В смесь ТФУ-соли 2,4-дихлор-6,7-дигидро-5H-пирроло[3,4-d]пиримидина (1,68 г, 5,53 ммоль), N,N-диметил-4-оксо-1-циклогексанкарбоксамида (935 мг, 5,53 ммоль) в ДХМ (11,2 мл) и АсОН (4,8 мл) добавляли NaBH(ОАс)3 (4,10 г, 19,3 ммоль). Смесь перемешивали при кт в течение 3 ч, потом растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением 4-(2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-N,N-диметил-циклогексанкарбоксамида (150 мг, выход 8%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C15H21Cl2N4O: 343,10; полученное 343,2.
Этап 2.
[00412] В смесь 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилина (93 мг, 0,46 ммоль) и 4-(2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-N,N-диметил-циклогексанкарбоксамида (120 мг, 0,35 ммоль) в n-BuOH (1 мл) добавляли ДИПЭА (609 мкл, 3,5 ммоль). Смесь нагревали до 100°С и перемешивали в течение 5 ч, потом растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением 4-[4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-N,N-диметил-циклогексанкарбоксамида (20 мг, выход 11%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C24H31ClF3N6O: 511,21; полученное 511,4; 1Н ЯМР (400 МГц, CDCl3) δ м.д. 6,95 (с, 1H), 6,81 (с, 2Н), 5,31 (м, 1H), 4,73-4,85 (м, 1Н), 3,73-3,95 (м, 5Н), 3,06 (с, 3Н), 2,95 (с, 3Н), 2,42-2,56 (м, 2Н), 2,09 (шир. д, J=10,8 Гц, 2Н), 1,84 (м, 2Н), 1,60-1,71 (м, 2Н), 1,56 (д, J=6,8 Гц, 3Н), 1,27-1,30 (м, 2Н).
Пример 58. Синтез [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-(1-метил-4-пиперидил)метанона
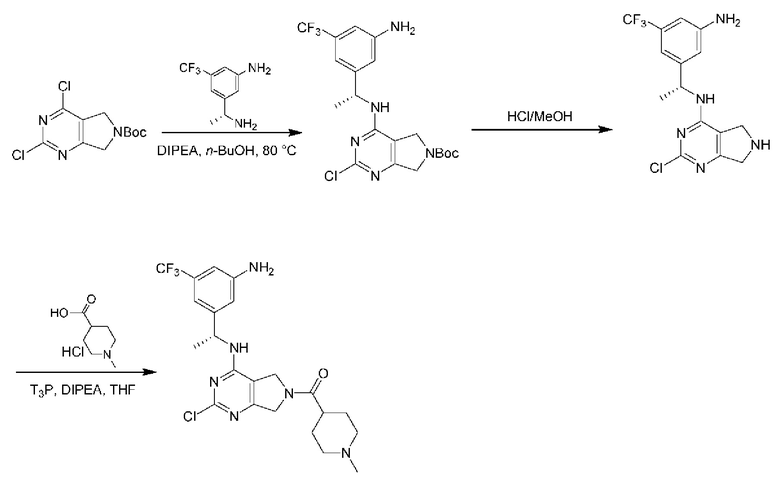
Этап 1.
[00413] В смесь 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилина (265 мг, 1,3 ммоль) в n-BuOH (15 мл) добавляли трет-бутил 2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилат (301 мг, 1,0 ммоль) и ДИПЭА (678 мкл, 3,9 ммоль). Смесь нагревали до 80°С и перемешивали в течение 10 ч, потом растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением трет-бутил 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилата (385 мг, выход 65%). 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 6,91 (м, 2Н), 6,81 (с, 1H), 5,33-5,30 (м, 1Н), 4,51-4,43 (м, 4Н), 1,54-1,48 (м, 12Н).
Этап 2.
[00414] Смесь трет-бутил 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилата (380 мг, 0,83 ммоль) в 4 М HCl в МеОН (15 мл, 60 ммоль) перемешивали при 15°С в течение 1,5 ч. Растворитель концентрировали при пониженном давлении с получением HCl-соли N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6,7-дигидро-5H-пирроло[3,4-d]пиримидин-4-амина (350 мг). 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 7,88 (с, 1H), 7,82 (с, 1H), 7,61 (с, 1H), 5,44 (кв, J=7,2 Гц, 1H), 4,67-4,53 (м, 2Н), 4,42 (с, 2Н), 1,64 (д, J=7,2 Гц, 3Н).
Этап 3.
[00415] В смесь HCl-соли N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6,7-дигидро-5H-пирроло[3,4-d]пиримидин-4-амина(350 мг, 0,89 ммоль) в ТГФ (5 мл) при 15°С добавляли 1-метилпиперидин-4-карбоновую кислоту (127 мг, 0,89 ммоль), ДИПЭА (619 мкл, 3,55 ммоль) и Т3Р (396 мкл, 1,33 ммоль). Смесь перемешивали при 15°С в течение 1,5 ч, потом растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-(1-метил-4-пиперидил)метанона (85 мг, выход 20%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H27ClF3N6O: 483,18; полученное 483,3; 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 6,93-6,90 (м, 2Н), 6,81 (д, J=1,6 Гц, 1H), 5,34 (д, J=7,2 Гц, 1H), 4,76-4,34 (м, 2Н), 4,52 (д, J=7,2 Гц, 2Н), 3,00-2,94 (м, 2Н), 2,59-2,55 (м, 1H), 2,29 (с, 3Н), 2,12-2,10 (м, 2Н), 1,85-1,83 (м, 4Н), 1,54 (дд, J=7,2, 5,2 Гц, 3Н).
[00416] Примеры в таблице 4 ниже синтезировали способом, аналогичным примеру 58.
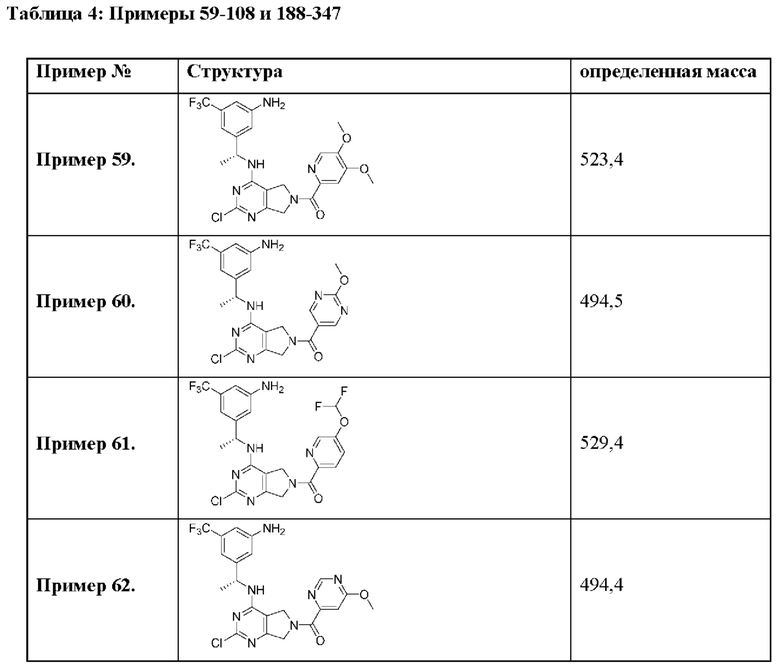
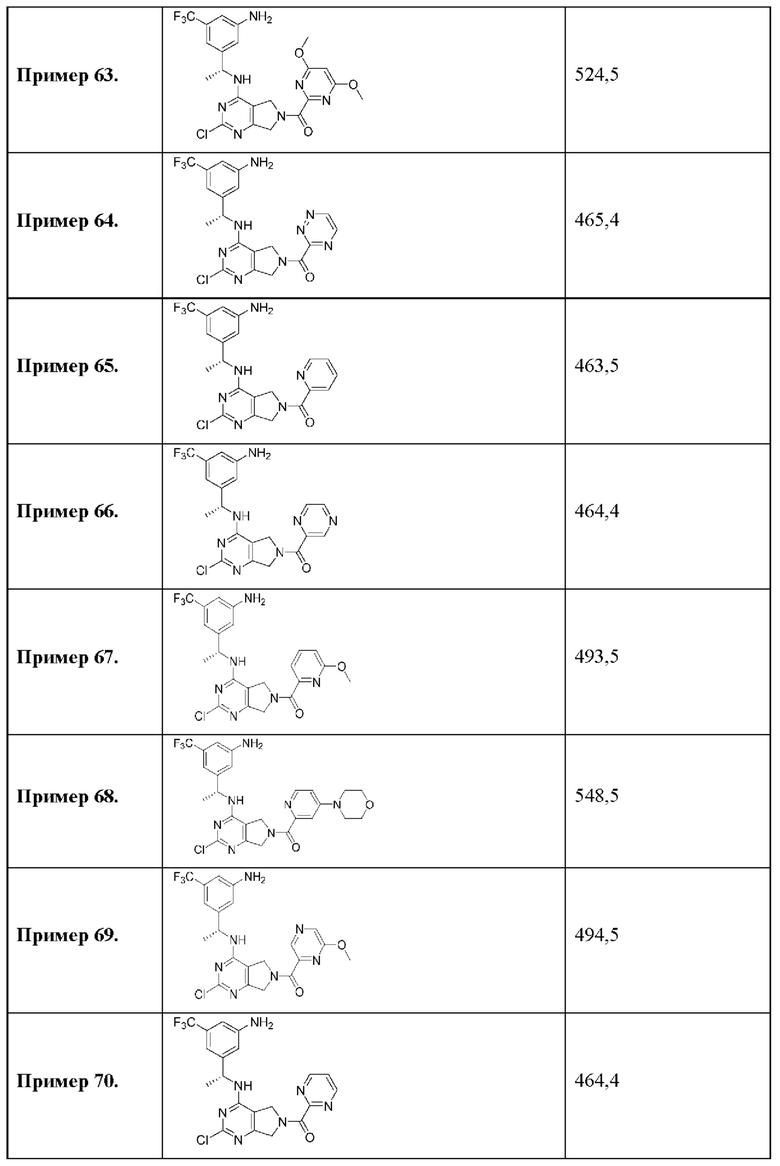
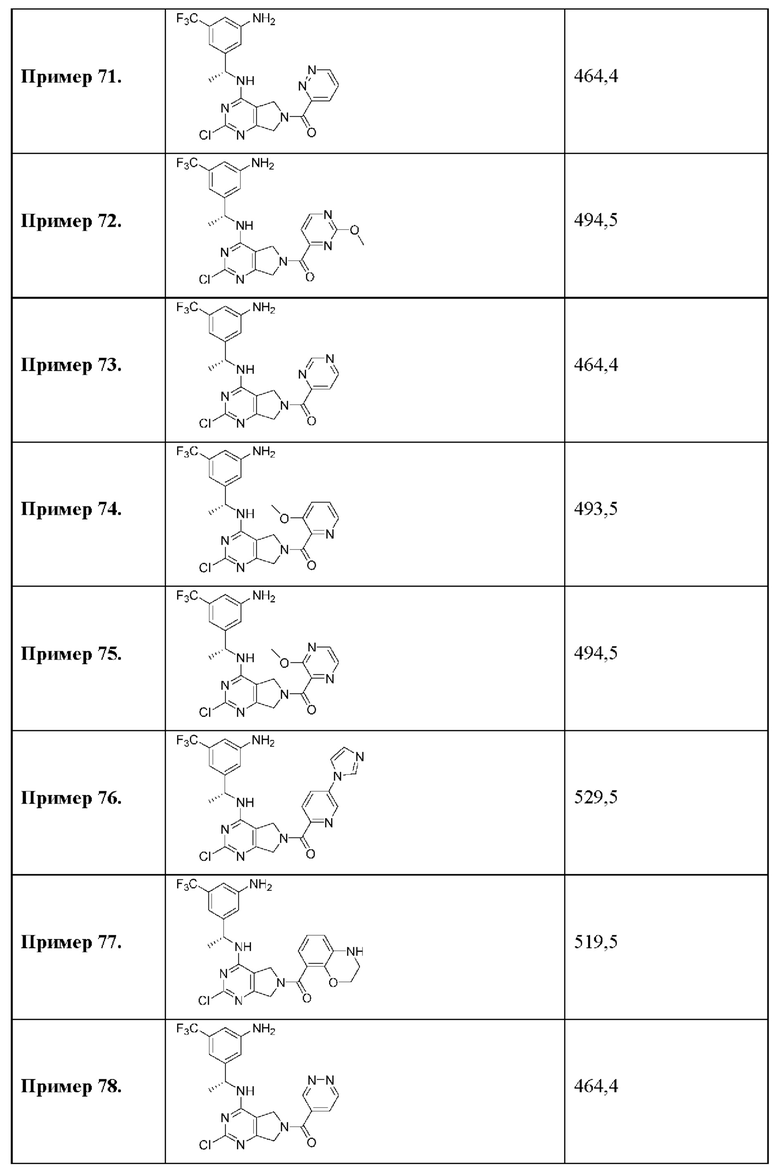
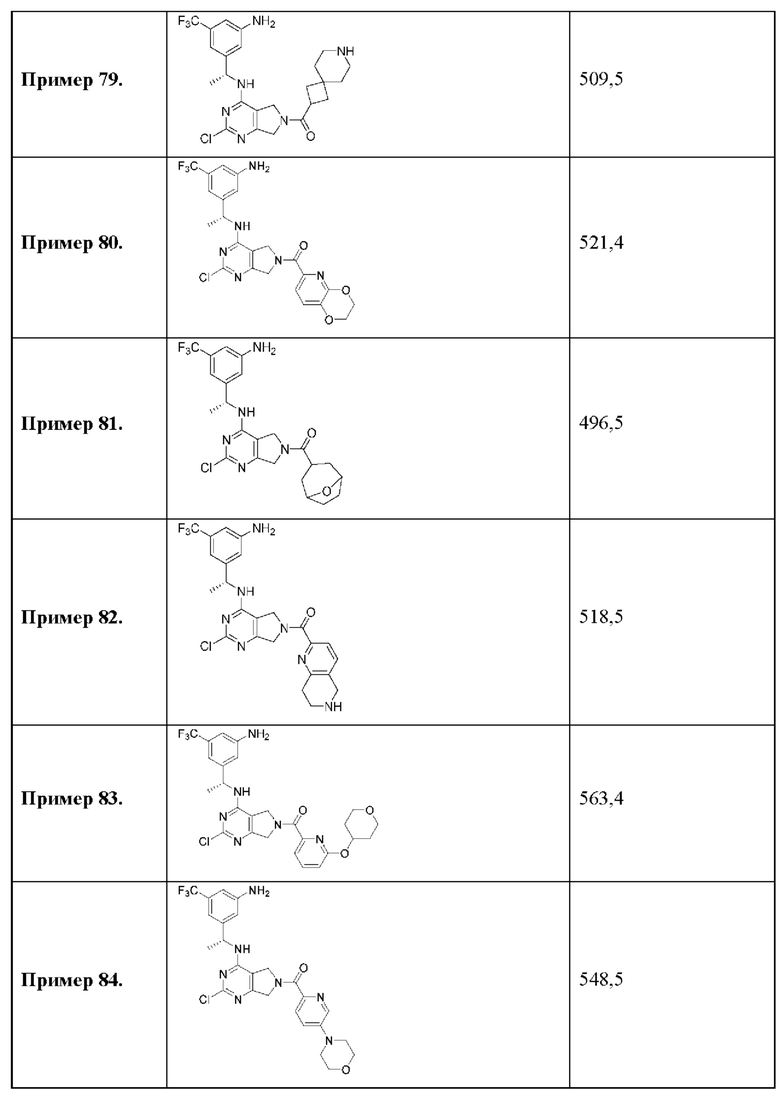
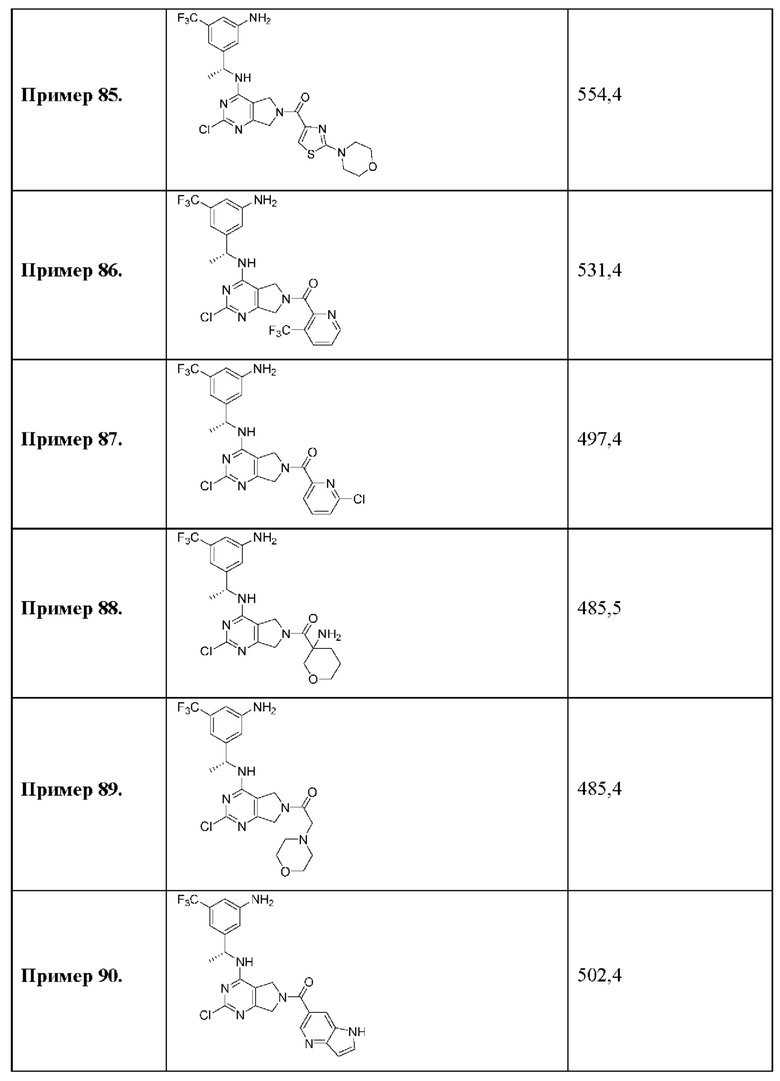
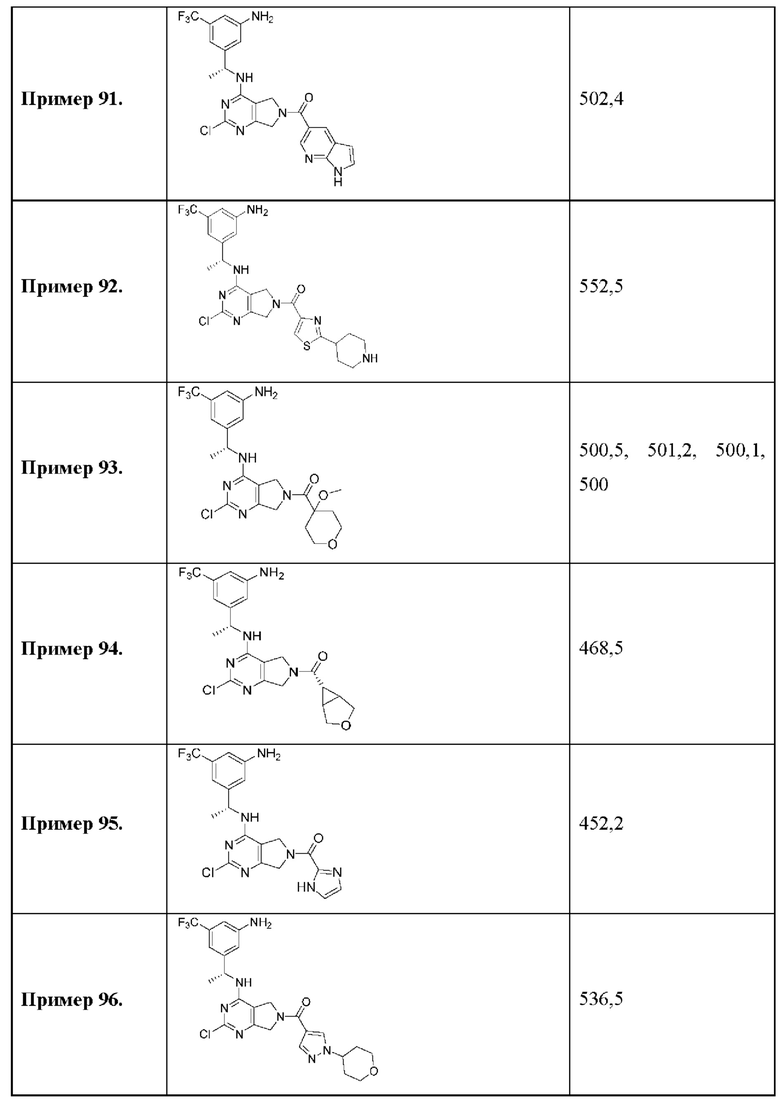
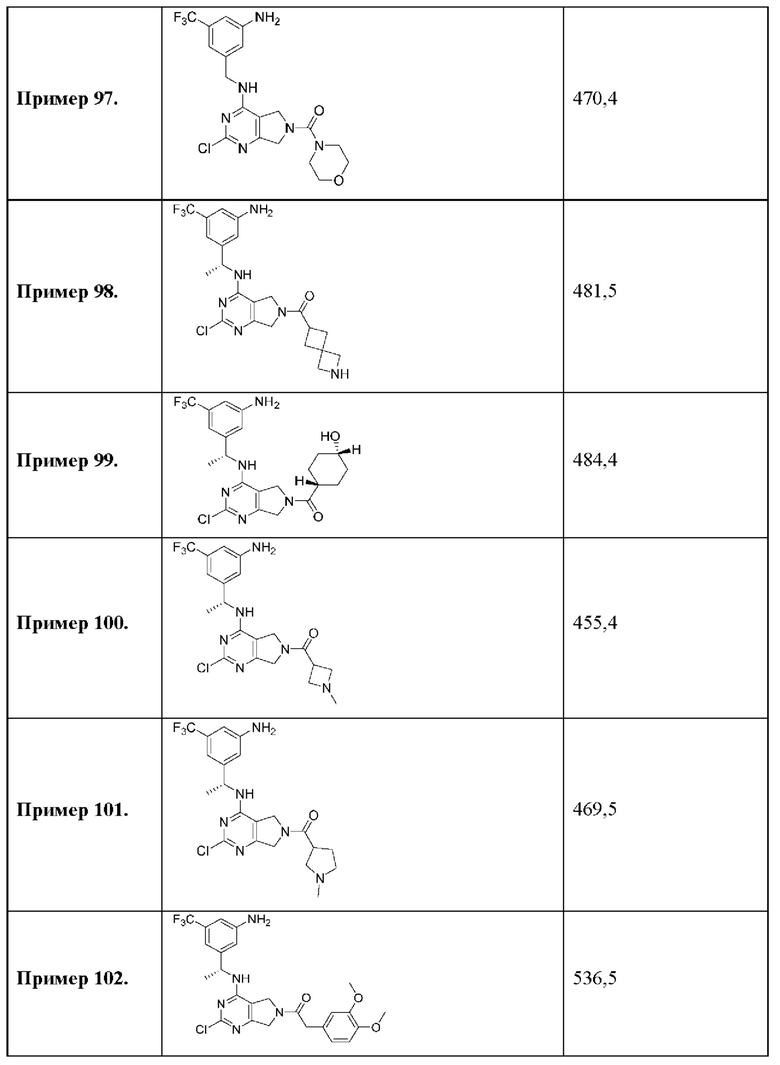
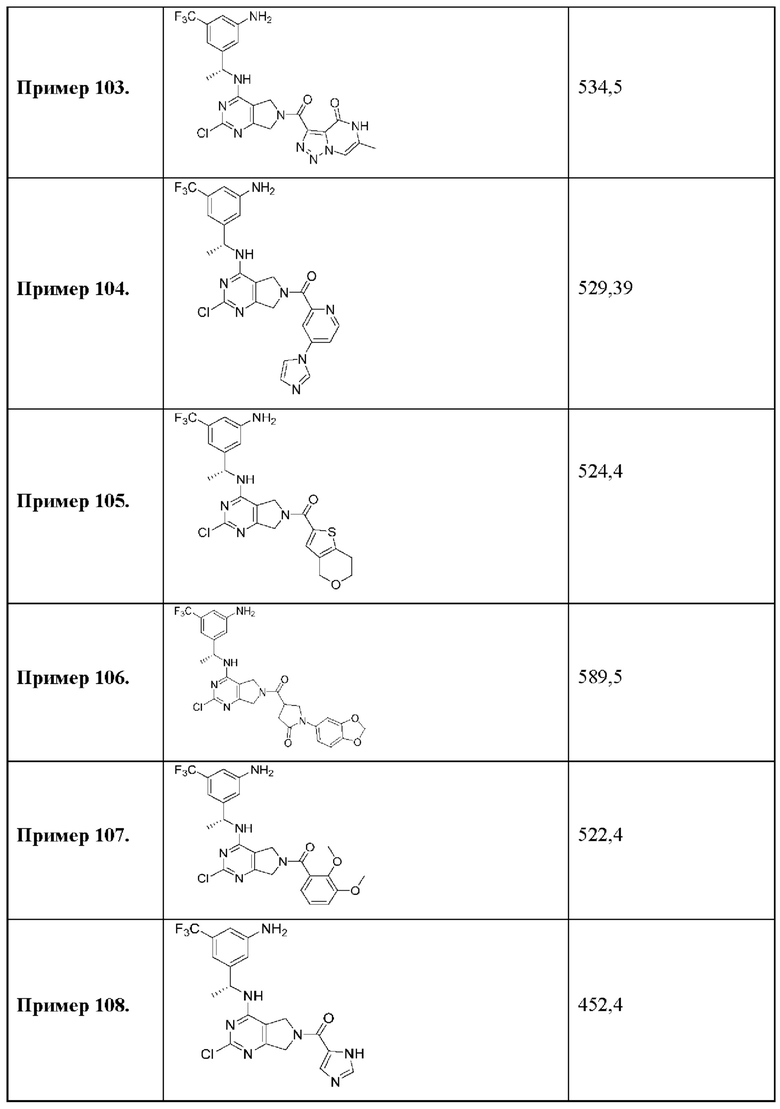
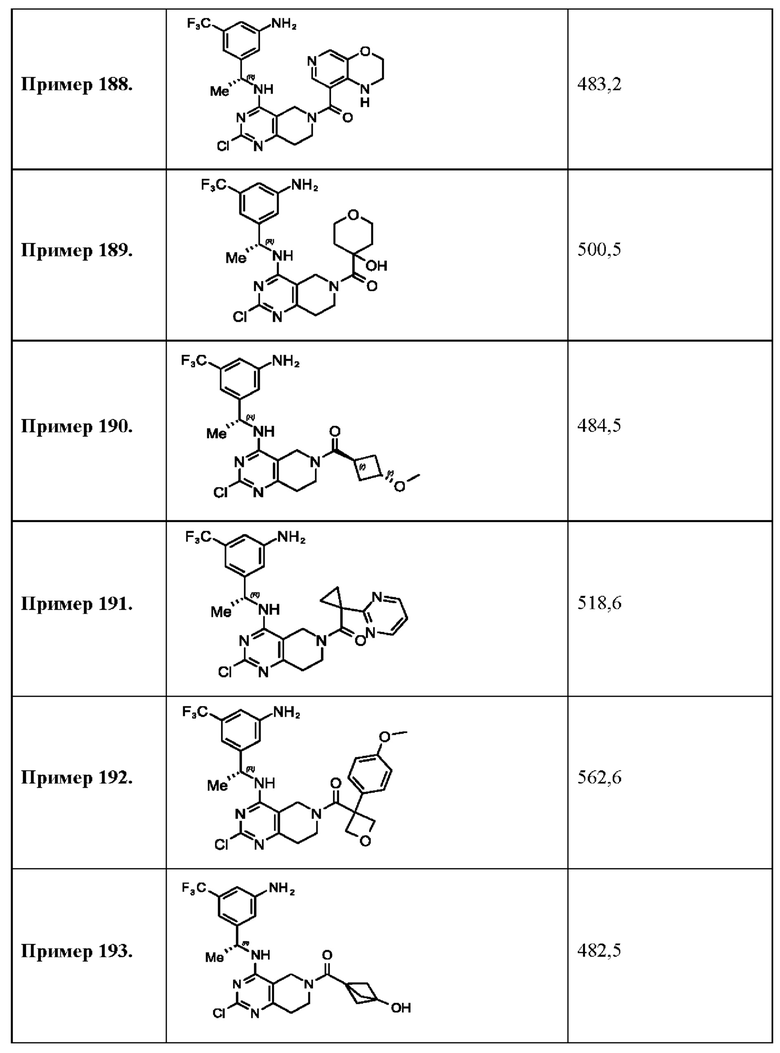
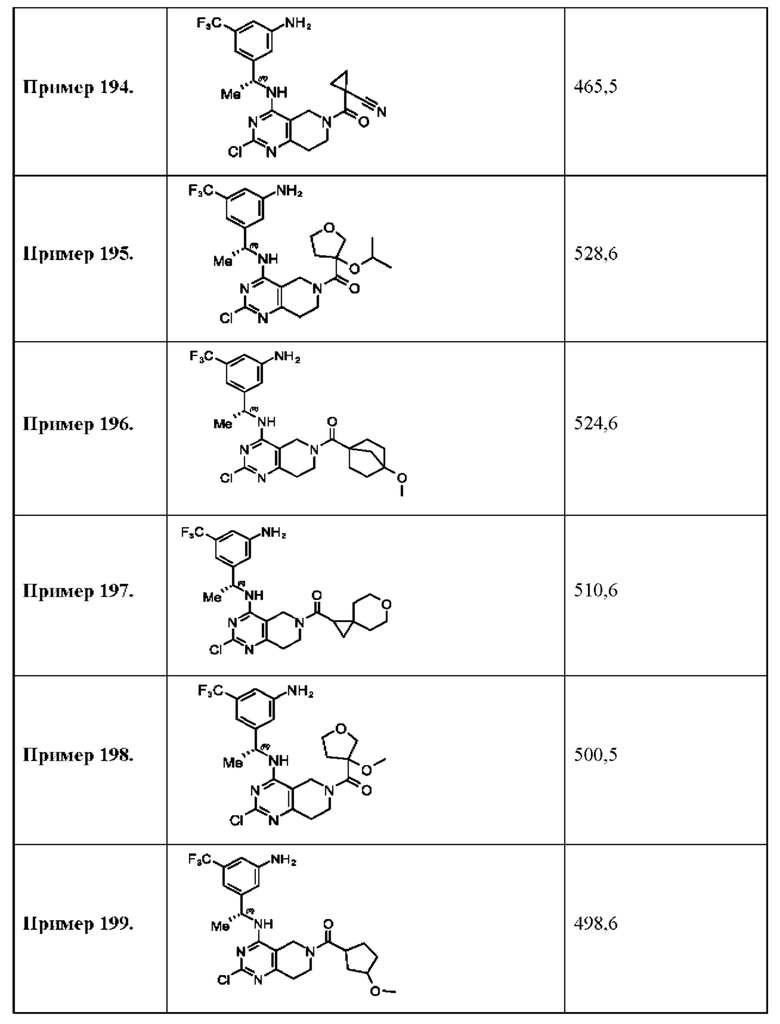
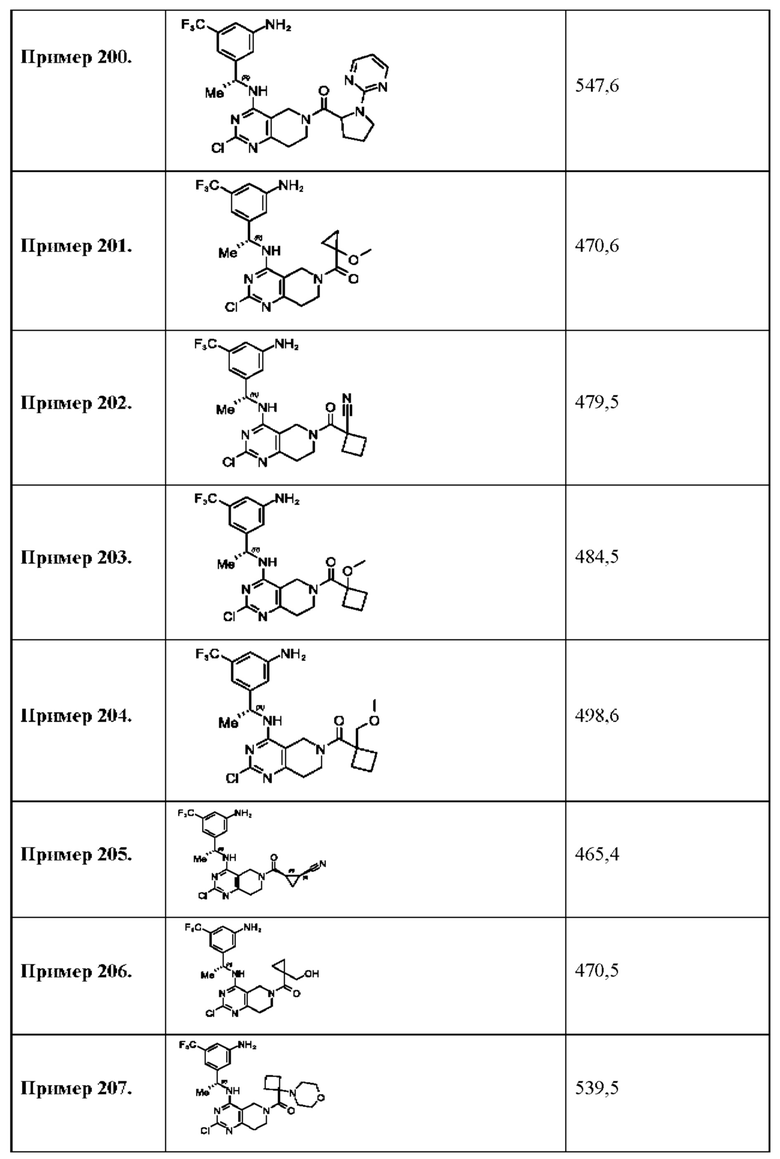
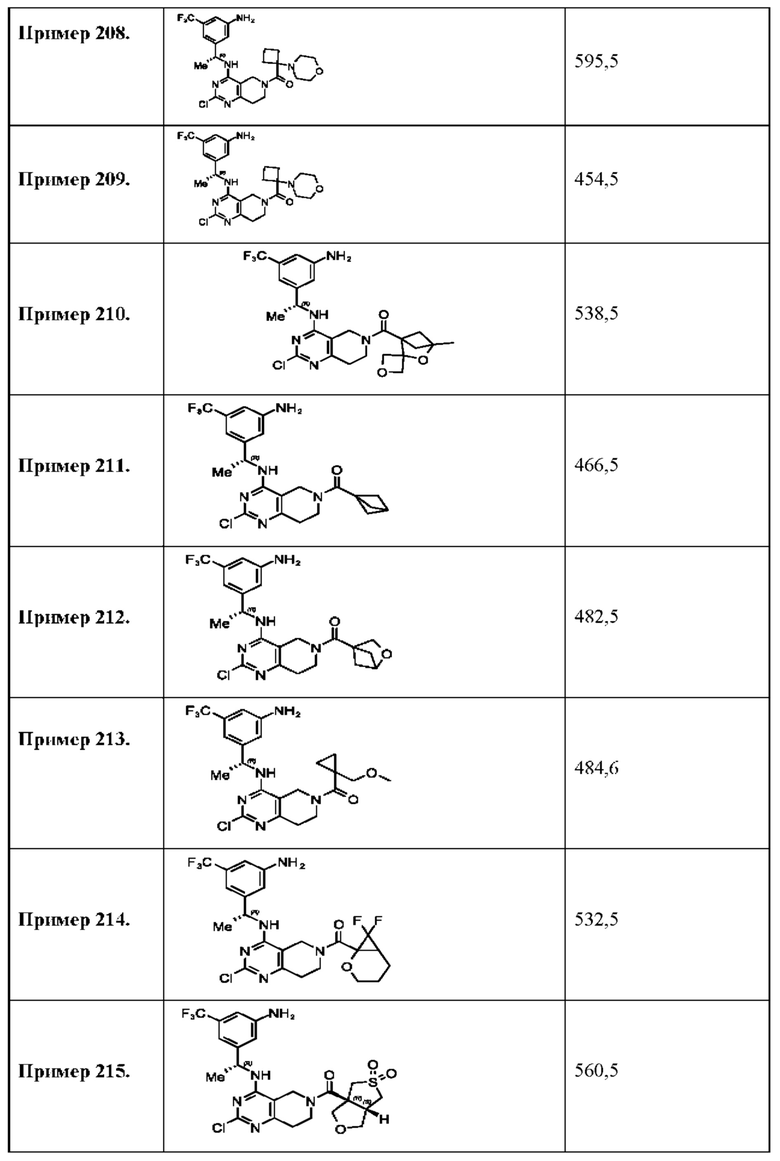
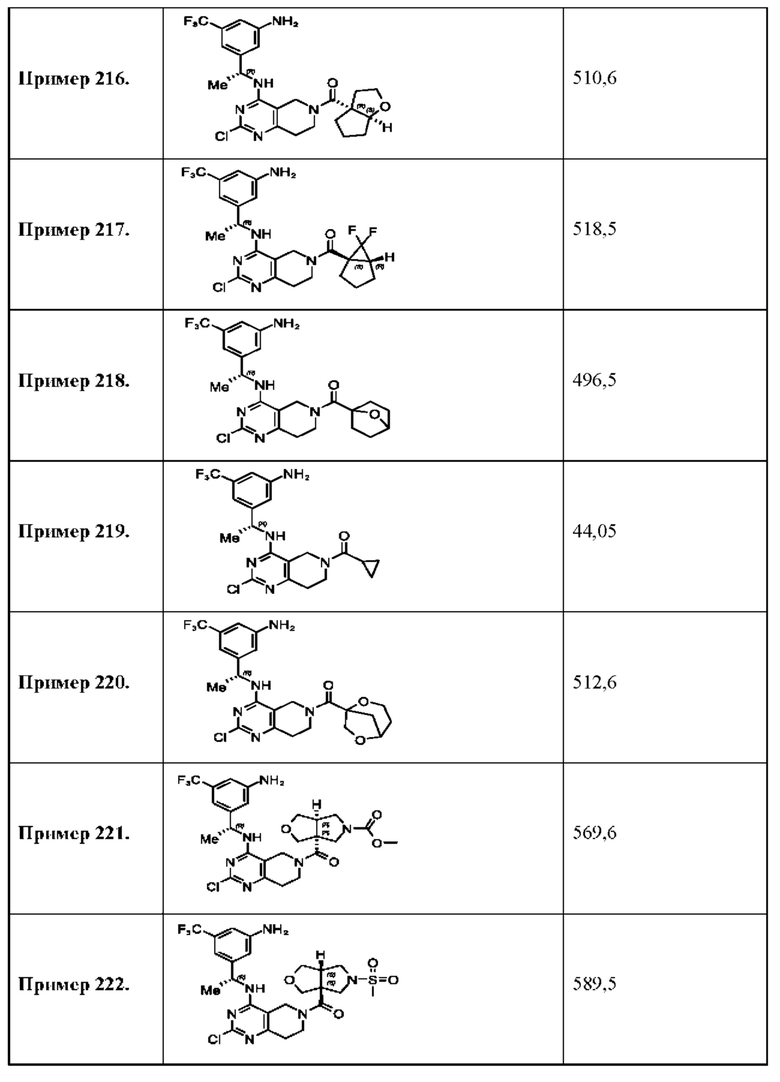
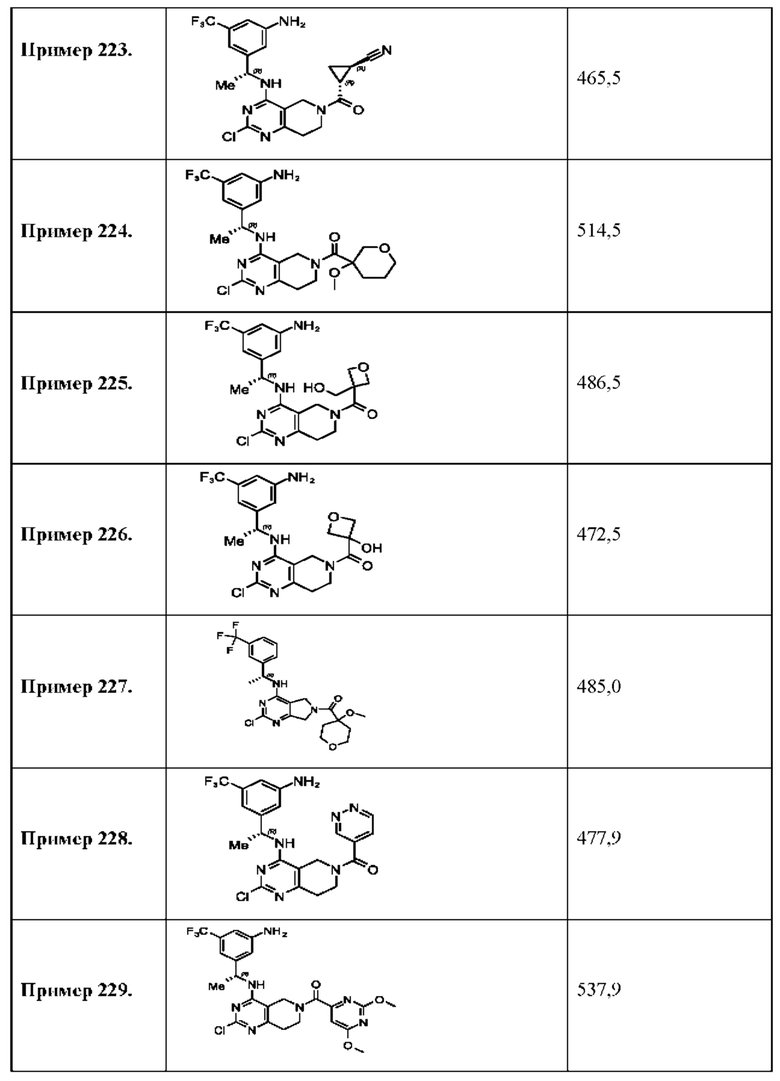
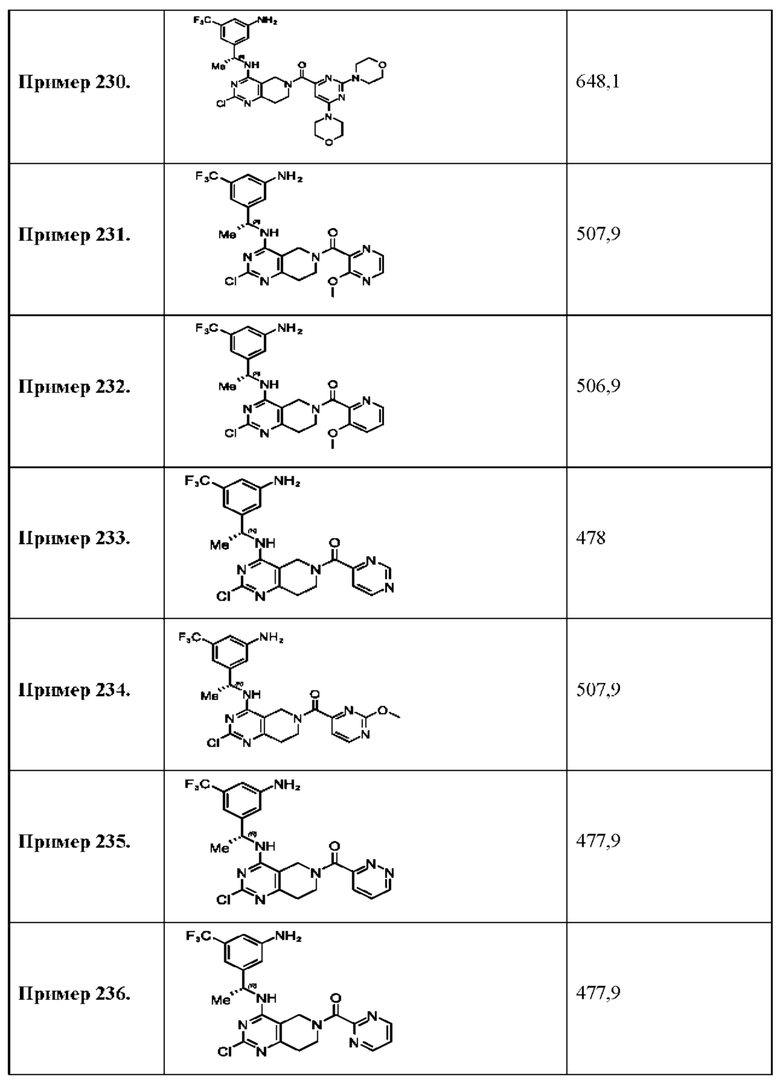
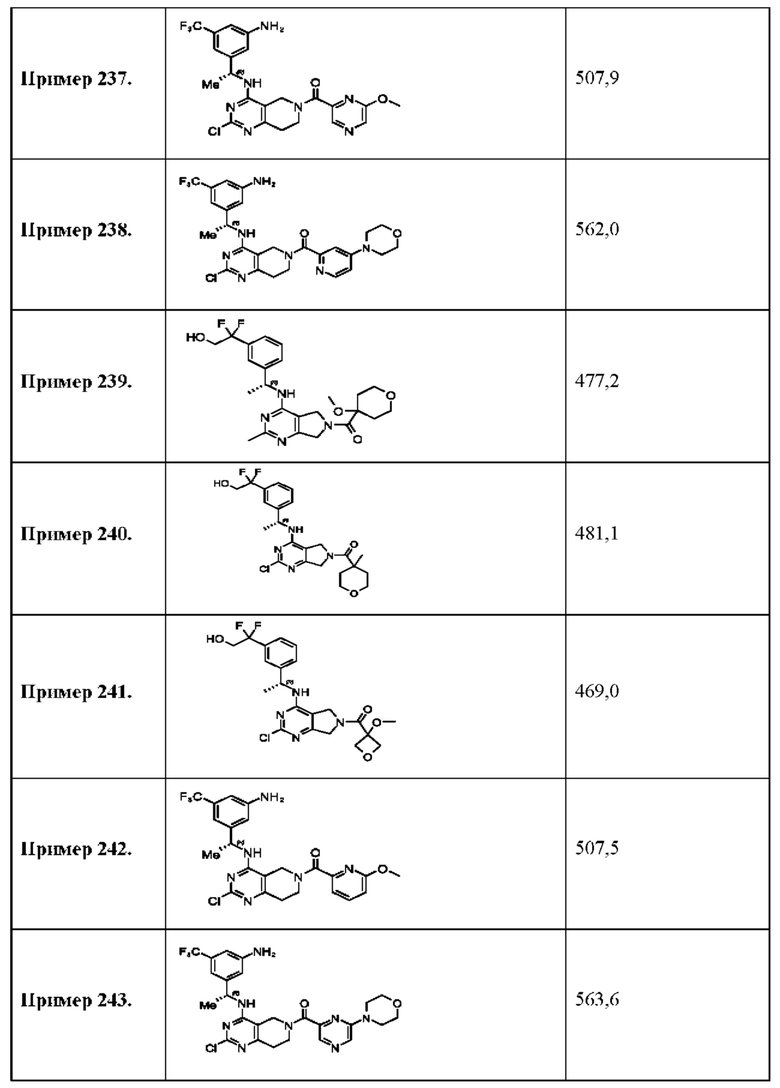
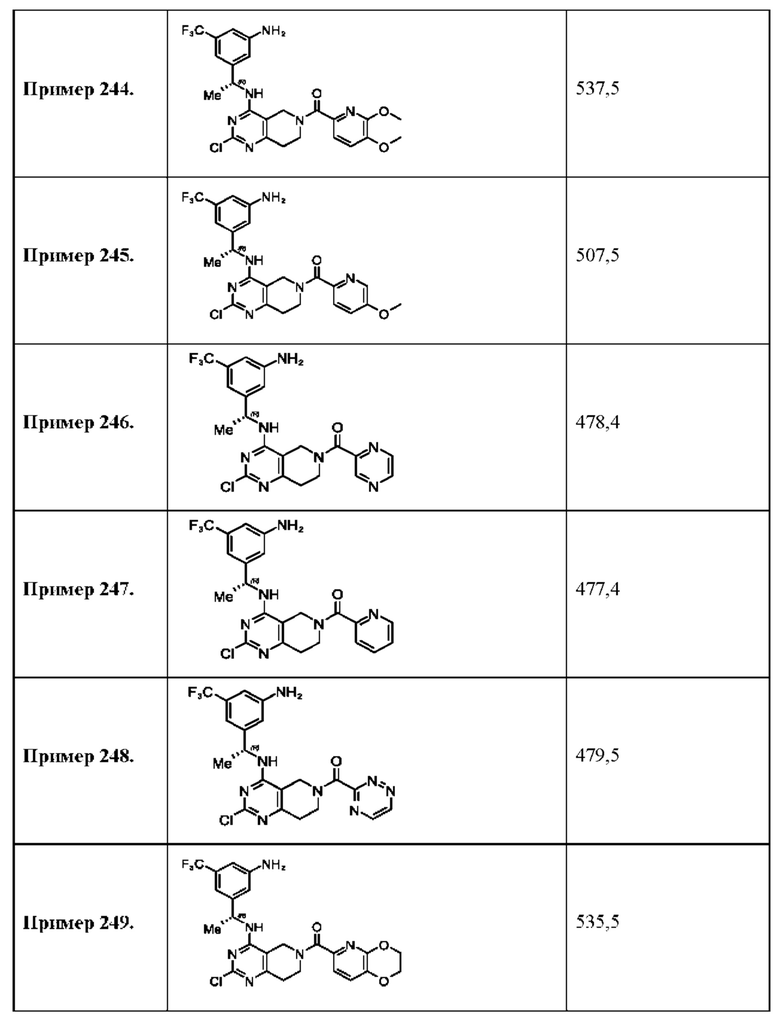
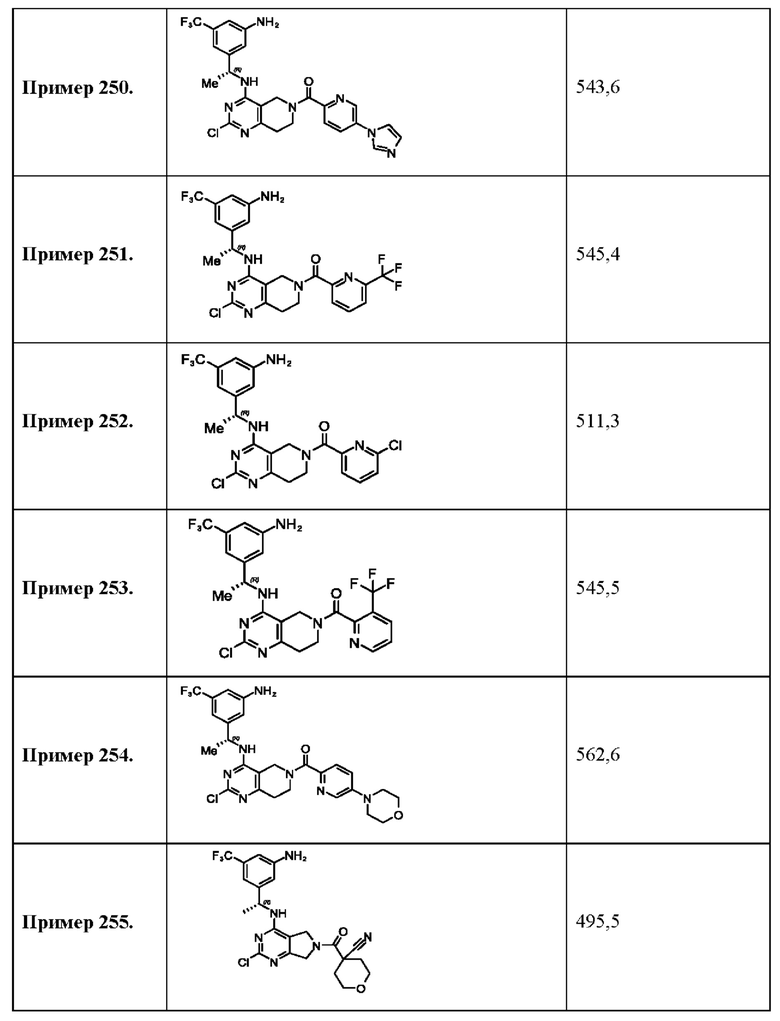
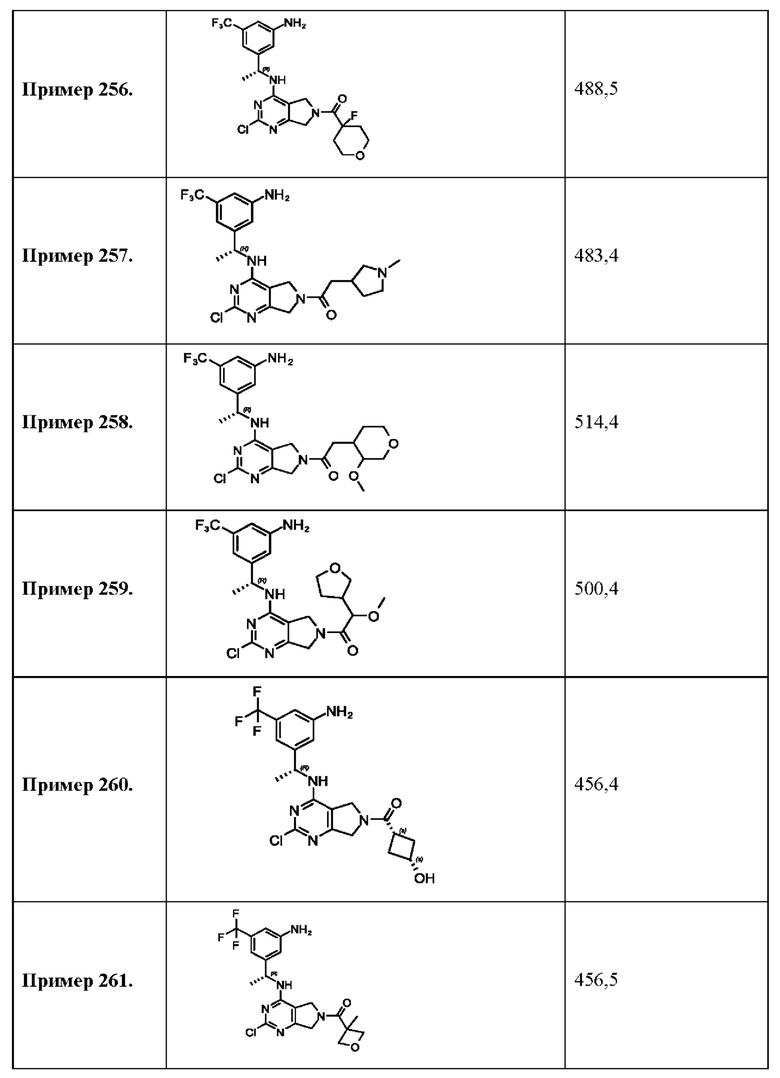
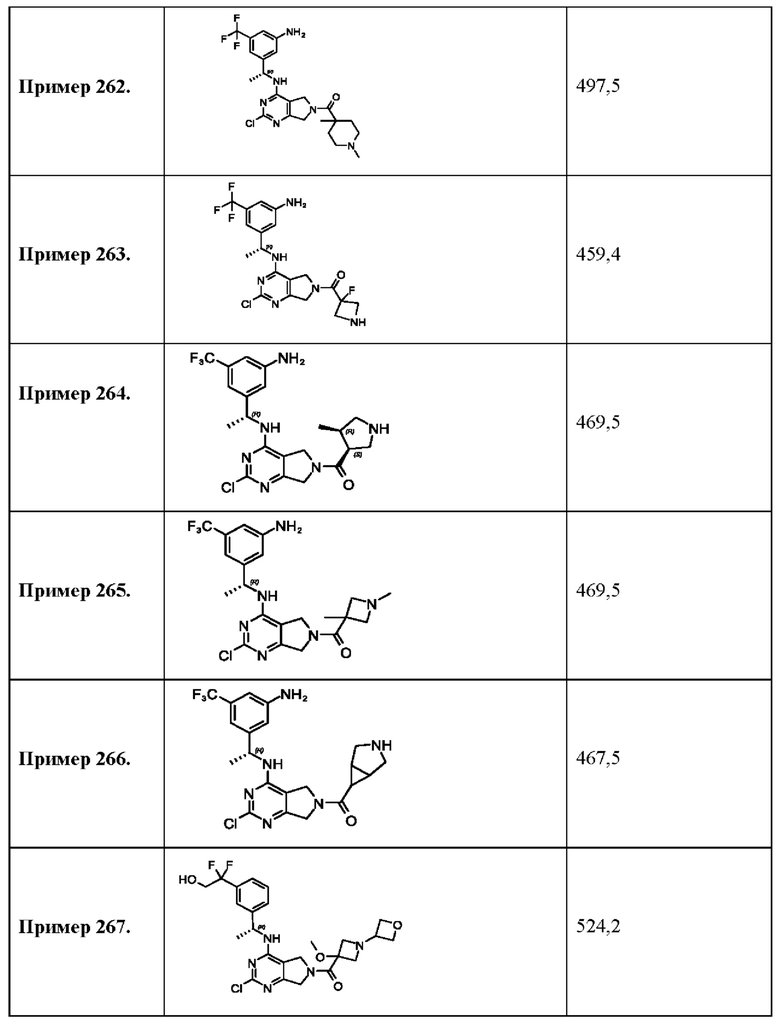
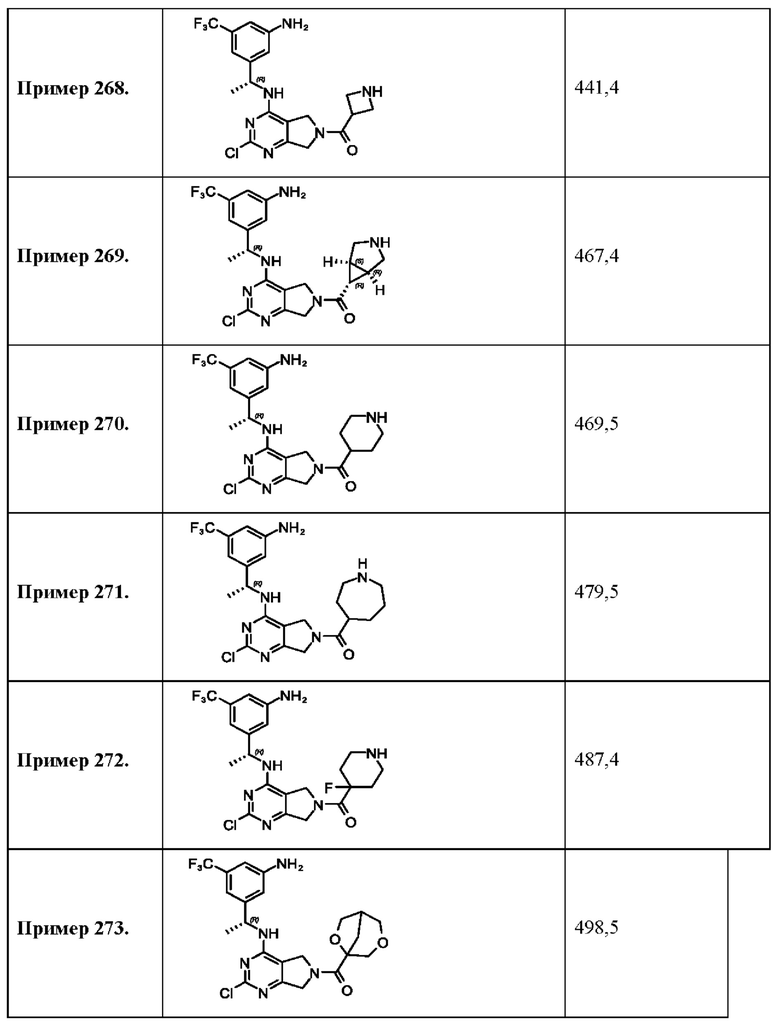
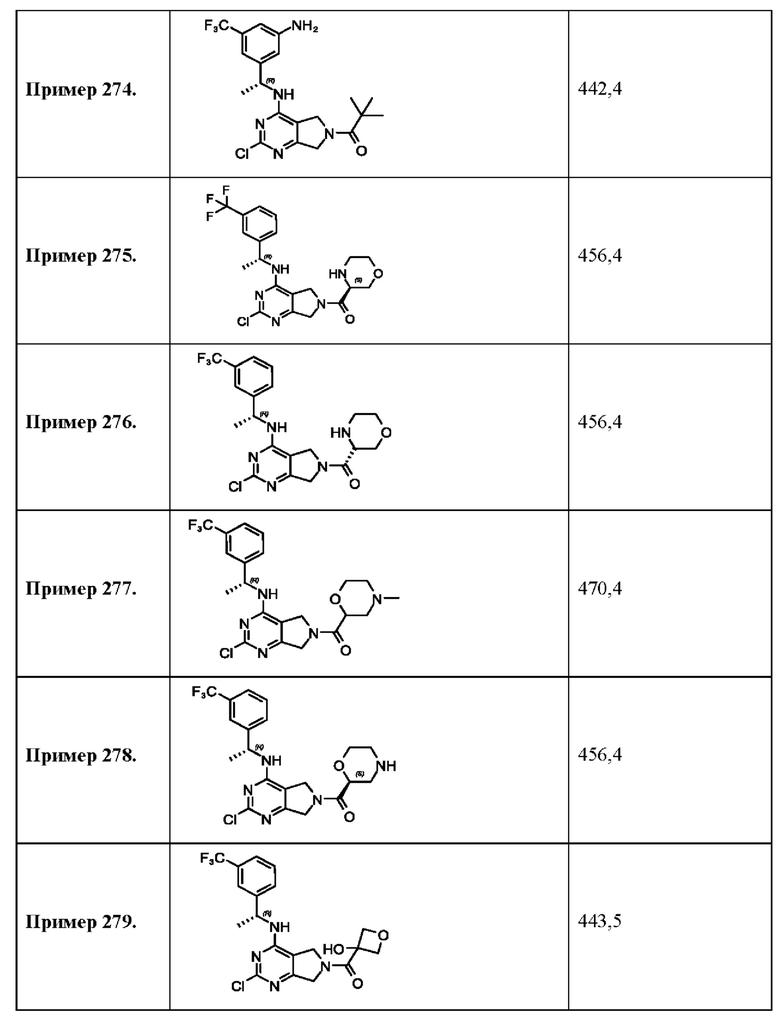
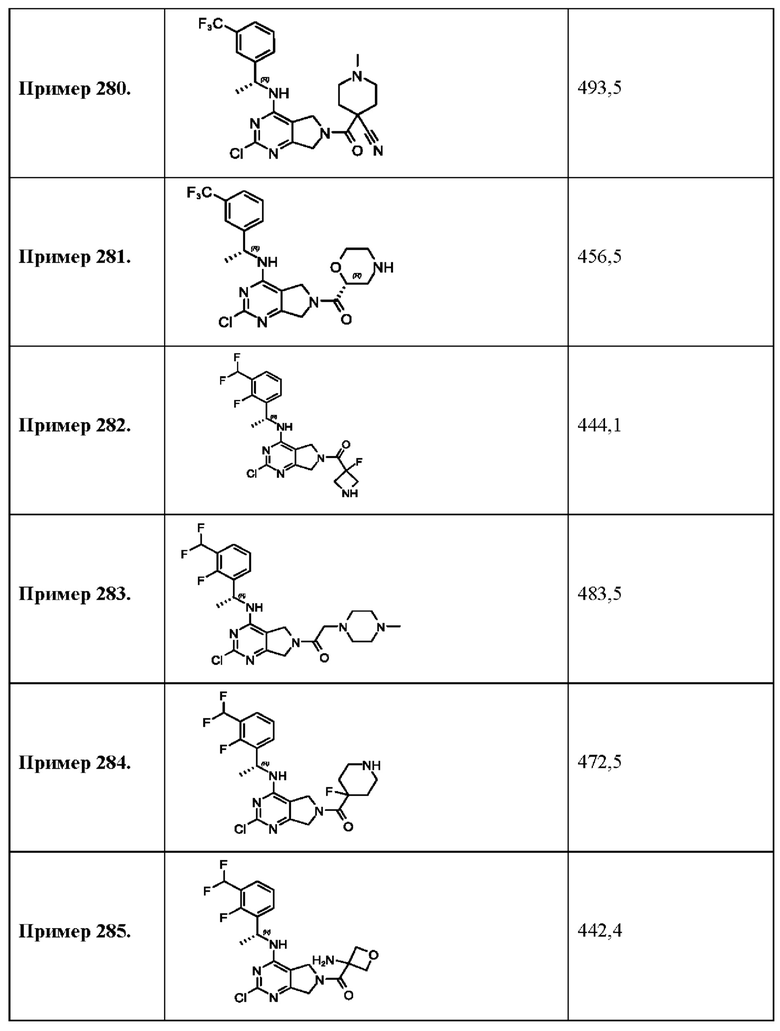
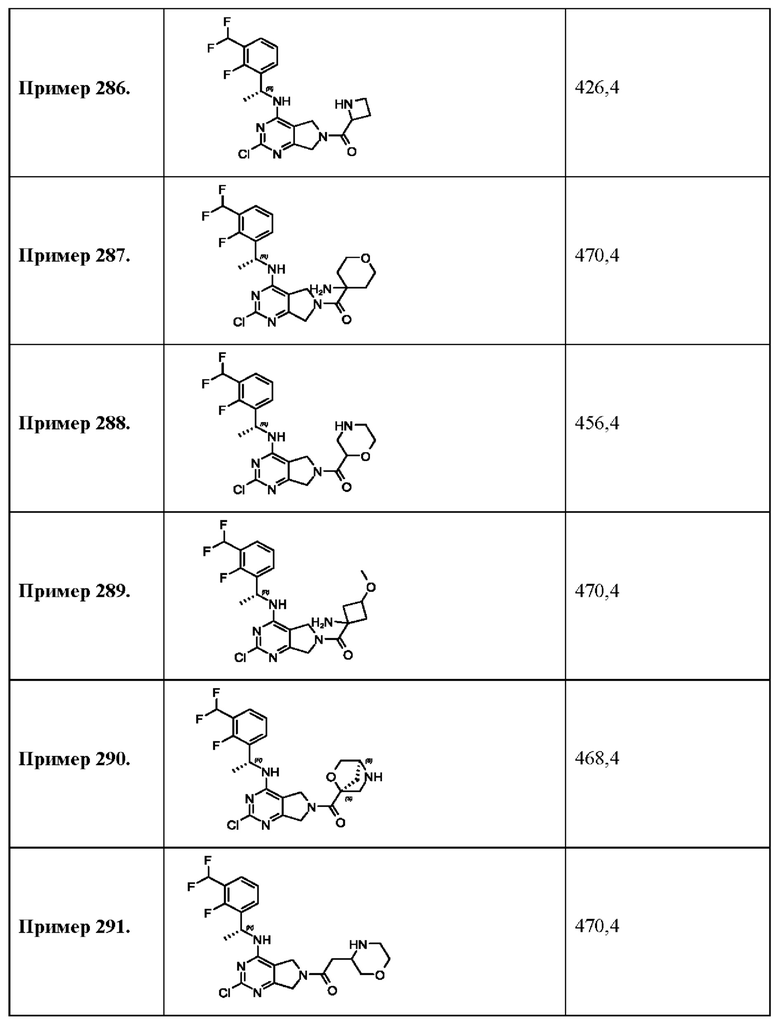
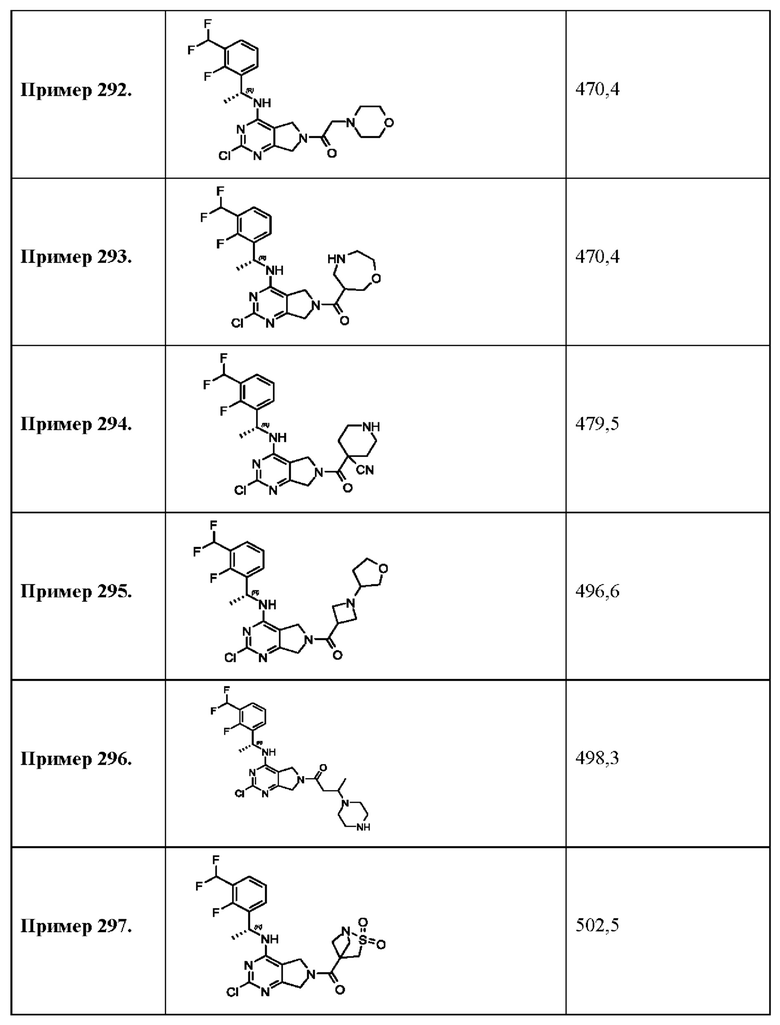
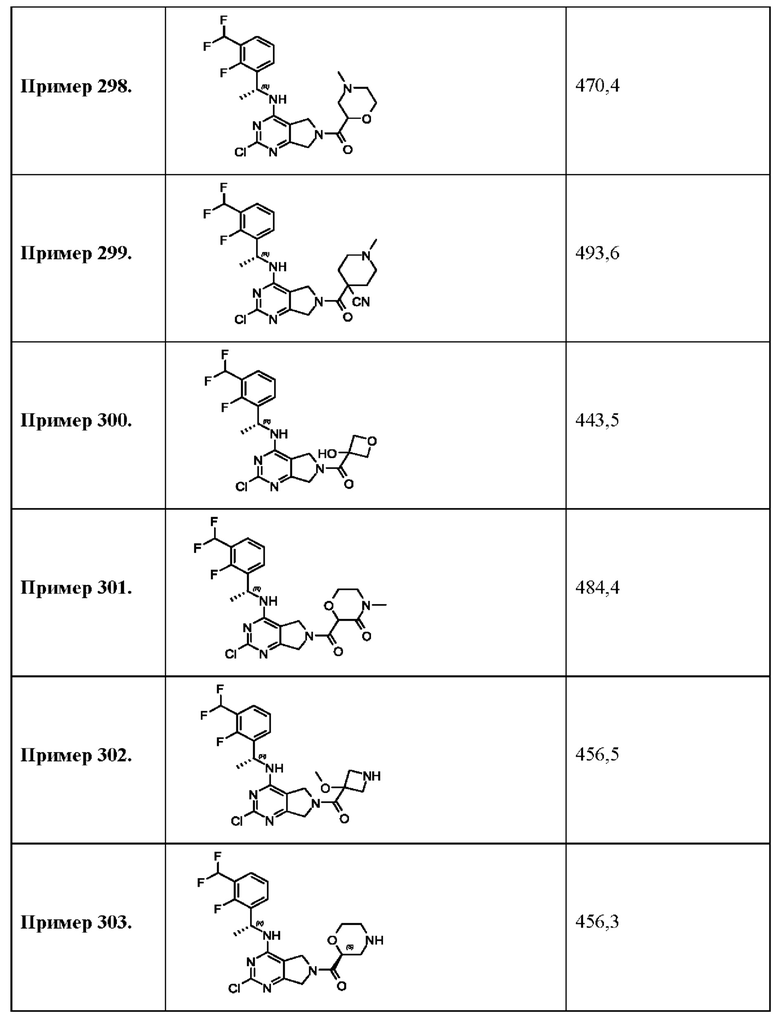
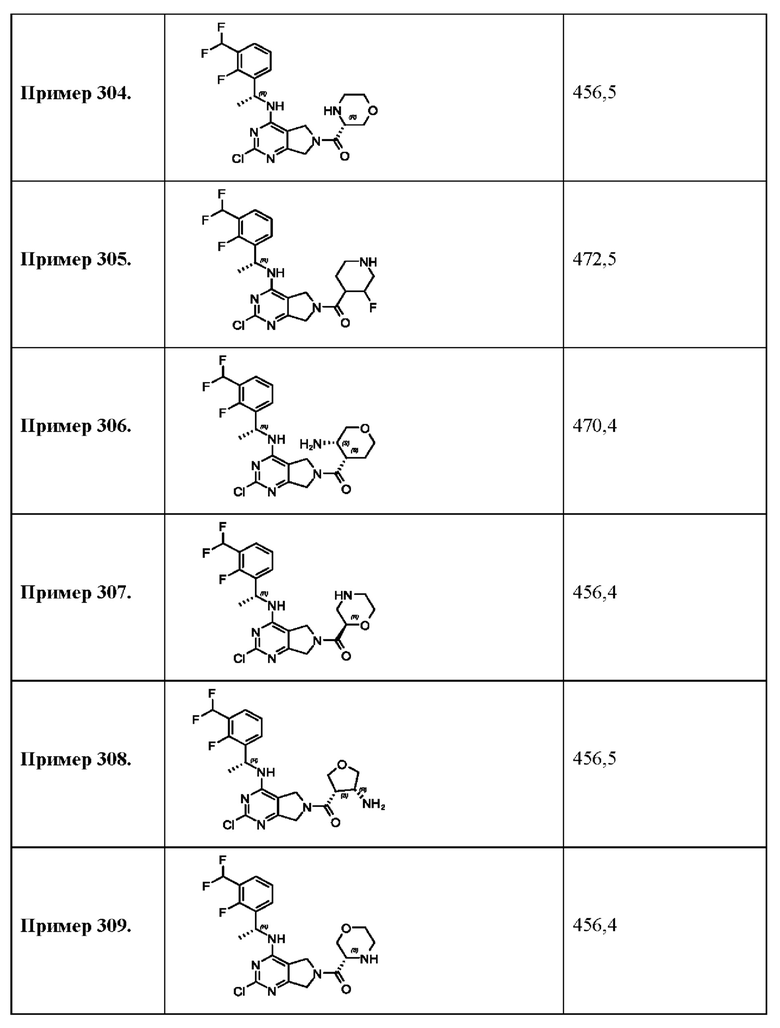
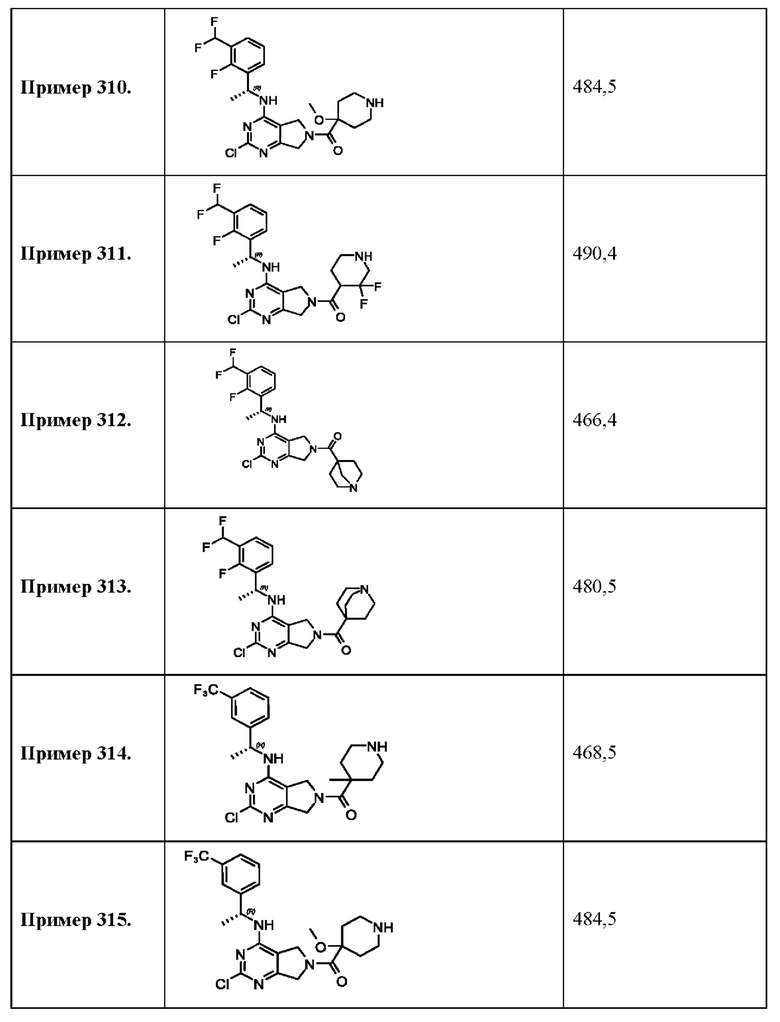
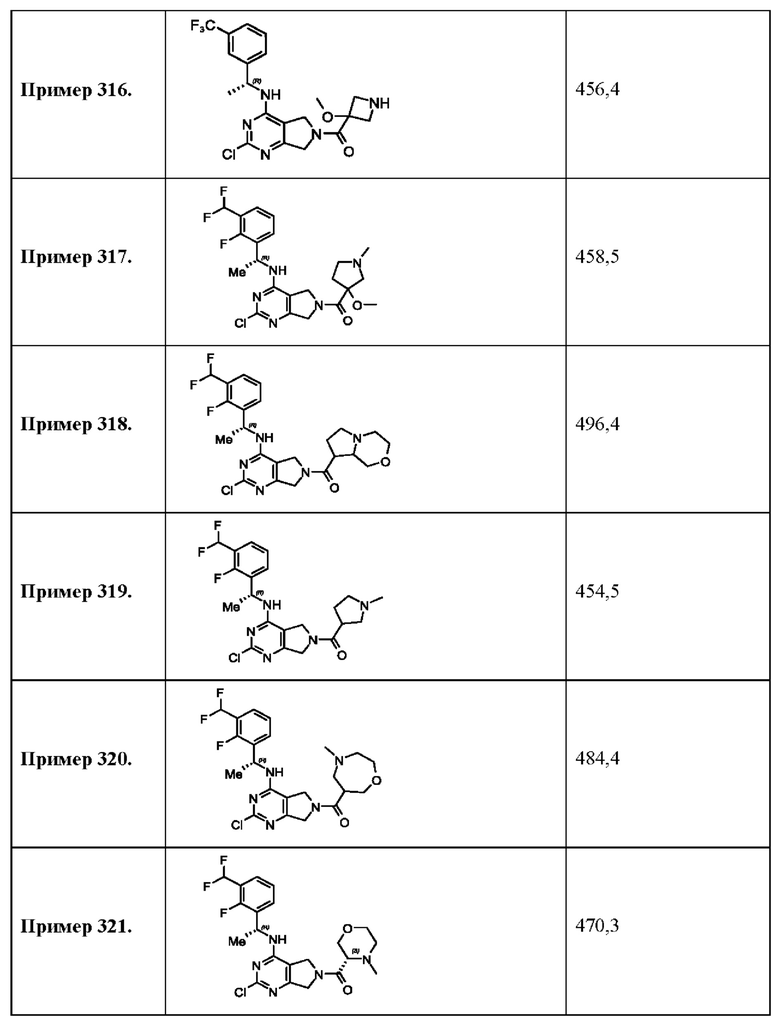
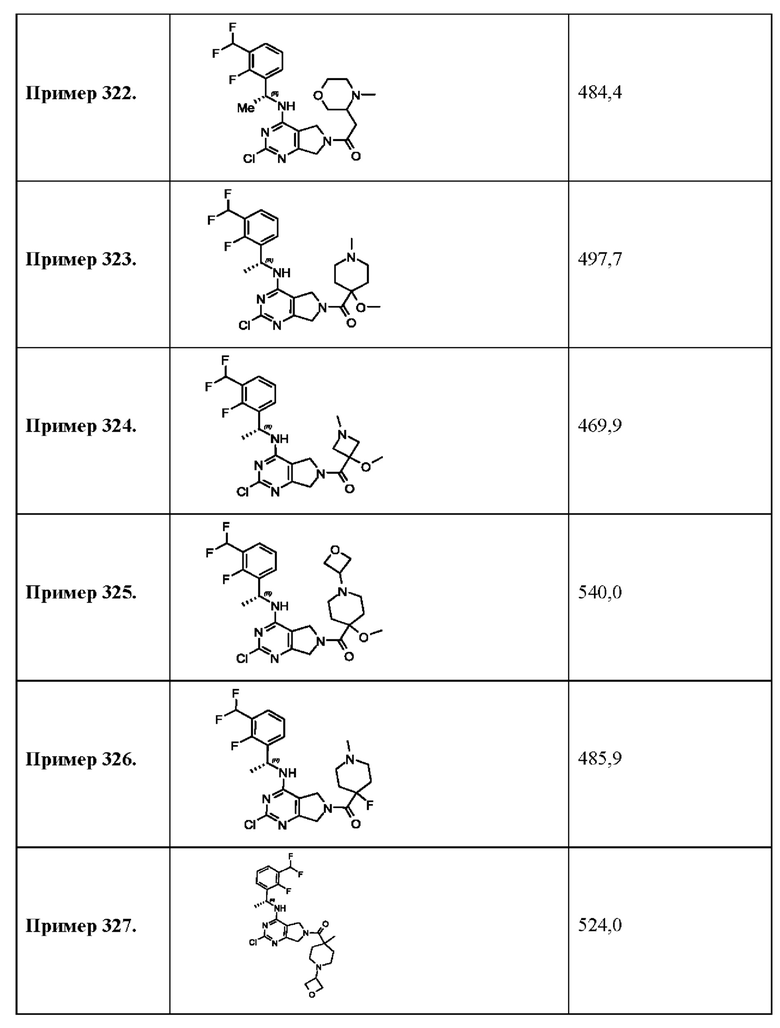
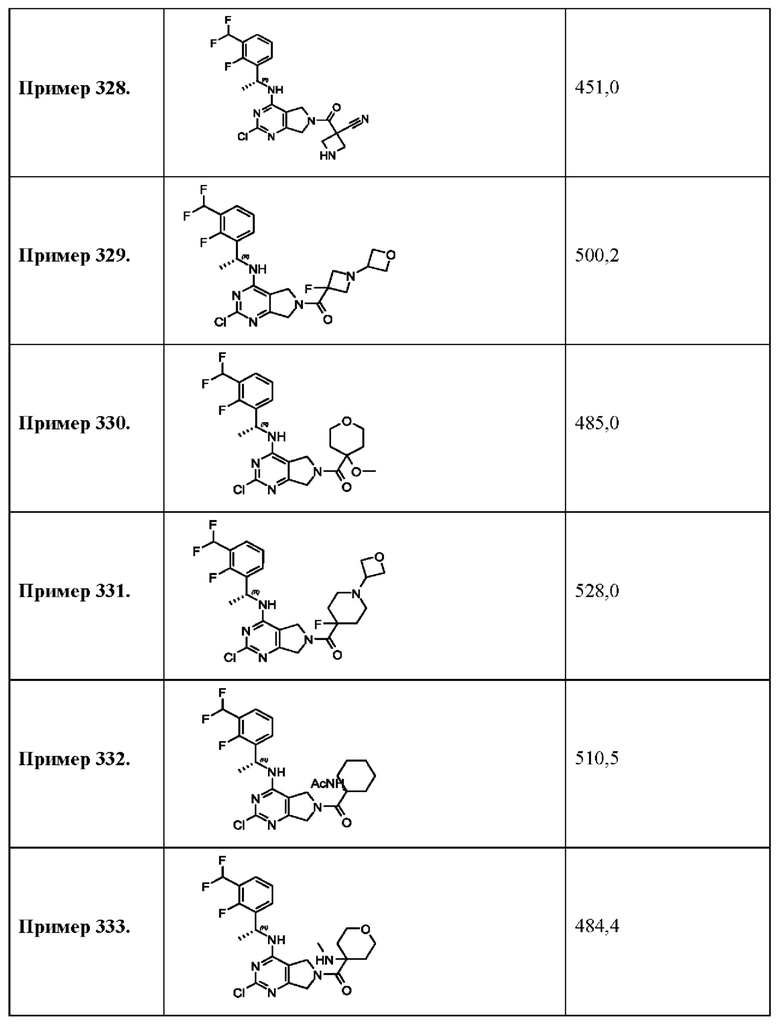
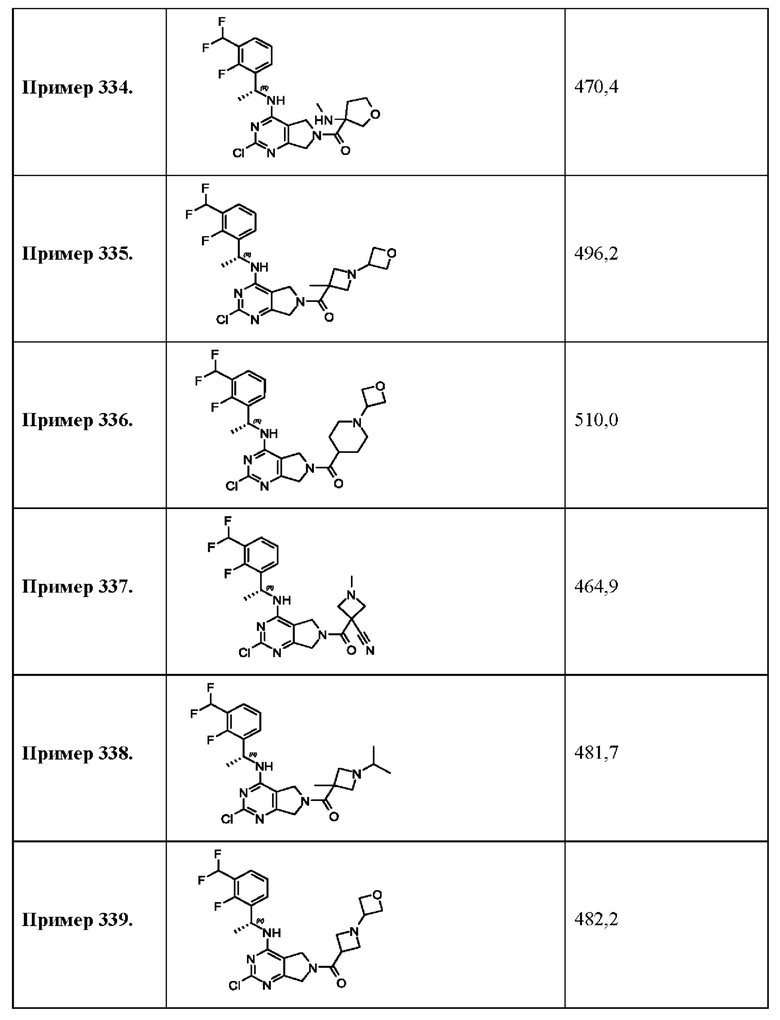
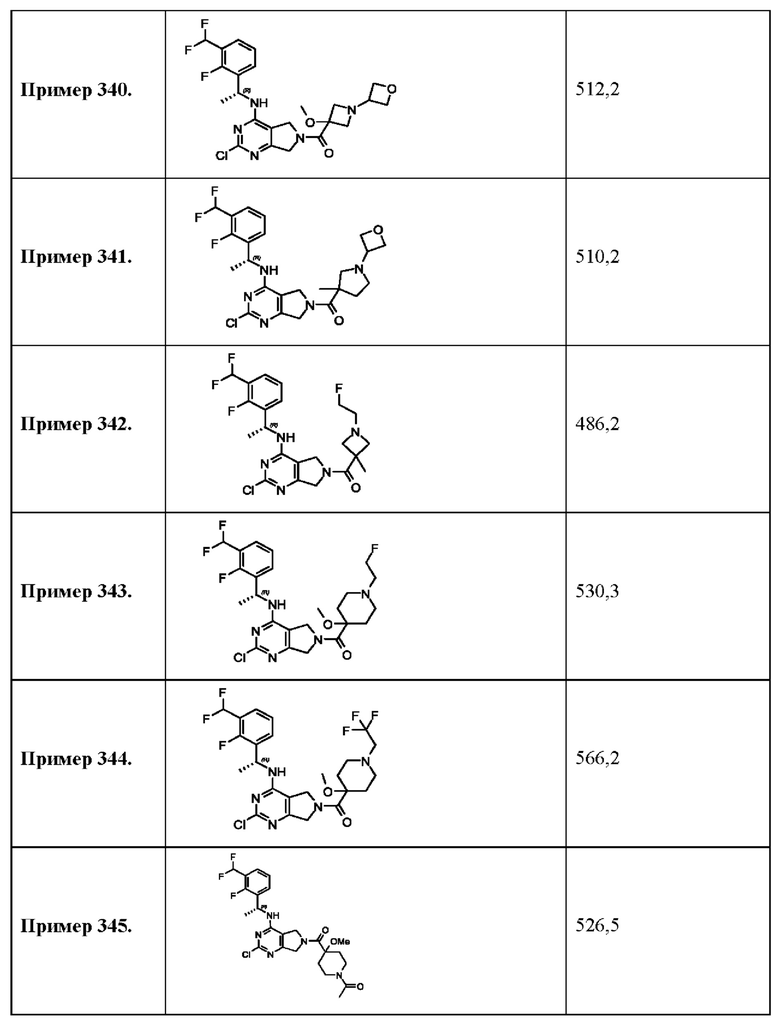
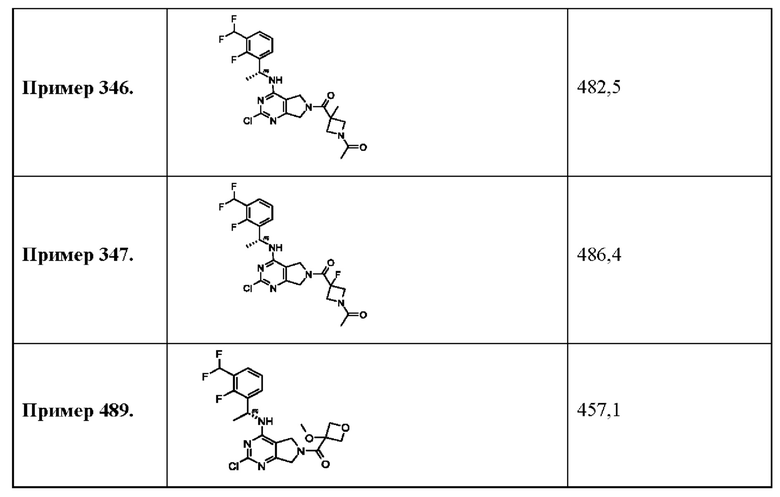
Пример 109. Синтез [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-5,7-дигидропирроло[3,4-d]пиримидин 6 ил]-(1-метил-4-пиперидил)метанона
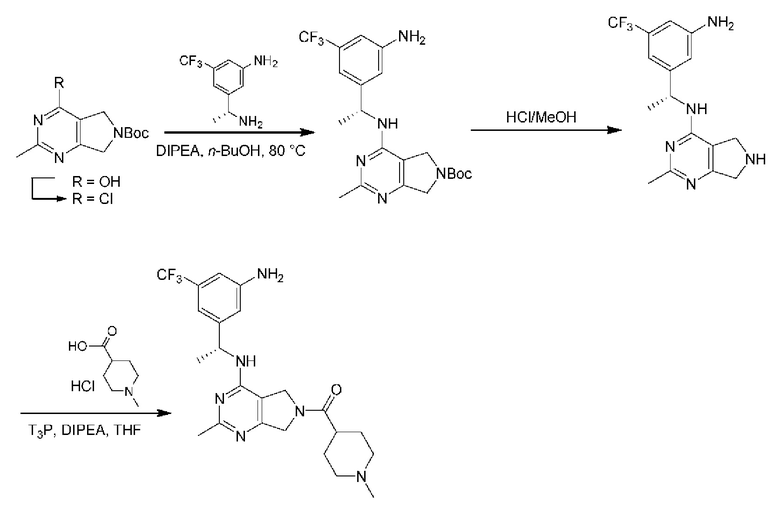
Этап 1.
[00417] В смесь трет-бутил 4-гидрокси-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилата (500 мг, 2,0 ммоль) и Ph3P (1,04 г, 3,98 ммоль) в ДХЭ (5 мл) добавляли CCl4 (574 мкл, 5,97 ммоль). Смесь нагревали до 70°С и перемешивали в течение 3 ч, потом растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением трет-бутил 4-хлор-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилата (240 мг, выход 45%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C12H17ClN3O2: 270,09; полученное 270,0; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 4,66 (д, J=4,0 Гц, 4Н), 2,72-2,62 (м, 3Н), 1,55-1,50 (м, 9Н).
Этап 2.
[00418] трет-бутил 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилат синтезировали способом, аналогичным трет-бутил 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилату, за исключением того, что трет-бутил 2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилат заменяли трет-бутил 4-хлор-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилатом. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H27F3N5O2: 438,20; полученное 438,3; 1Н ЯМР (400 МГц, Метанол-d4) δ 6,91 (д, J=12,6 Гц, 2Н), 6,81-6,75 (м, 1H), 5,46-5,31 (м, 1Н), 4,54-4,39 (м, 4Н), 2,39 (с, 3Н), 2,01 (с, 3Н), 1,52 (с, 9Н).
Этап 3.
[00419] HCl-соль N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6,7-дигидро-5H-пирроло[3,4-d]пиримидин-4-амина синтезировали способом, аналогичным HCl-соли N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6,7-дигидро-5H-пирроло[3,4-d]пиримидин-4-амина, за исключением того, что трет-бутил 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилат заменяли трет-бутил 4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилатом. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C16H19F3N5: 338,15; полученное 338,2.
Этап 4.
[00420] [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-(1-метил-4-пиперидил)метанон синтезировали способом, аналогичным [4-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-(1-метил-4-пиперидил)метанону, за исключением того, что HCl-соль N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6,7-дигидро-5H-пирроло[3,4-d]пиримидин-4-амина заменяли HCl-солью N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6,7-дигадро-5H-пирроло[3,4-d]пиримидин-4-амина. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C23H30F3N6O: 463,24; полученное 463,2; 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 6,95-6,89 (м, 2Н), 6,82-6,76 (м, 1Н), 5,46-5,36 (м, 1Н), 4,79-4,70 (м, 2Н), 4,52 (д, J=7,0 Гц, 2Н), 2,97 (т, J=10,0 Гц, 2Н), 2,64-2,53 (м, 1Н), 2,44-2,38 (м, 3Н), 2,29 (с, 3Н), 2,18-2,05 (м, 2Н), 1,90-1,80 (м, 4Н), 1,53 (t, J=6,0 Гц, 3Н).
Пример 110. (Также смотрите пример 54) Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-(тетрагидрофуран-3-илметил)-5,7-дигидропирроло [3,4-d]пиримидин-4-амина
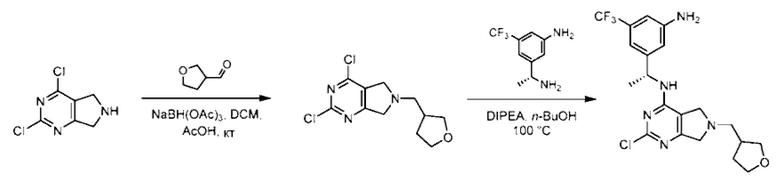
Этап 1.
[00421] 2,4-дихлор-6-(тетращдрофуран-3-илметил)-5,7-дигидропирроло[3,4-d]пиримидин синтезировали способом, аналогичным 4-хлор-6-(тетрагидрофуран-3-илметил)-5,7-дигадропирроло[3,4-d]пиримидину, за исключением того, что ТФУ-соль 4-хлор-6,7-дигидро-5H-пирроло[3,4-d]пиримидина заменяли ТФУ-солью 2,4-дихлор-6,7-дигидро-5H-пирроло[3,4-d]пиримидина. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C11H14Cl2N3O: 274,04; полученное 274,2.
Этап 2.
[00422] N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-(тетрагидрофуран-3-илметил)-5,7-дигидропирроло[3,4-d]пиримидин-4-амин синтезировали способом, аналогичным N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-6-(тетрагидрофуран-3-илметил)-5,7-дигидропирроло[3,4-d]пиримидин-4-амину, за исключением того, что 4-хлор-6-(тетрагидрофуран-3-илметил)-5,7-дигидропирроло[3,4-d]пиримидин заменяли 2,4-дихлор-6-(тетрагидрофуран-3-илметил)-5,7-дигидропирроло[3,4-d]пиримидином. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H24ClF3N5O: 442,15; полученное 442,2; 1Н ЯМР (400 МГц, CDCl3) δ м. д. 6,95 (с, 1Н), 6,82 (с, 2Н), 5,32 (м, 1Н), 4,67-4,79 (м, 1Н), 3,72-3,91 (м, 8Н), 3,56 (дд, J=8,0, 6,4 Гц, 1Н), 2,72 (шир. д, J=7,6 Гц, 2Н), 2,42-2,45 (м, 1Н), 2,06-2,07 (м, 1Н), 1,60-1,67 (м, 1Н), 1,57 (д, J=6,8 Гц, 3Н).
Пример 111. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6-(тетрагидрофуран-3-илметил)-5,7-дигидропирроло[3,4-d]пиримидин-4-амина
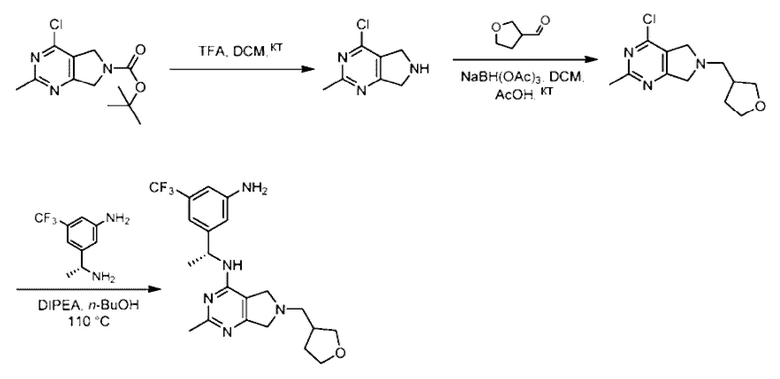
Этап 1.
[00423] В смесь трет-бутил 4-хлор-2-метил-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилата (600 мг, 2,2 ммоль)в ДХМ (3 мл) добавляли ТФУ (3 мл). Смесь перемешивали при кт в течение 1 ч, потом растворитель концентрировали при пониженном давлении с получением ТФУ-соли 4-хлор-2-метил-6,7-дигидро-5H-пирроло[3,4-d] пиримидина (630 мг, выход 100%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C7H9ClN3: 170,04; полученное 170,2.
Этап 2.
[00424] 4-хлор-2-метил-6-(тетрагидрофуран-3-илметил)-5,7-дигидропирроло[3,4-d]пиримидин синтезировали способом, аналогичным 4-хлор-6-(тетрагидрофуран-3-илметил)-5,7-дигидропирроло[3,4-d]пиримидину, за исключением того, что ТФУ-соль 4-хлор-6,7-дигидро-5H-пирроло[3,4-d]пиримидина заменяли ТФУ-солью 4-хлор-2-метил-6,7-дигидро-5H-пирроло[3,4-d]пиримидина. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C12H17ClN3O: 254,10; полученное 254,2.
Этап 3.
[00425] N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этал]-2-метил-6-(тетрагидрофуран-3-илметил)-5,7-дигидропирроло[3,4-d]пиримидин-4-амин синтезировали способом, аналогичным N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-6-(тетрагидрофуран-3-илметил)-5,7-дигидропирроло[3,4-d]пиримидин-4-амину, за исключением того, что 4-хлор-6-(тетрагидрофуран-3-илметил)-5,7-дигидропирроло[3,4-d]пиримидин заменяли 4-хлор-2-метил-6-(тетрагидрофуран-3-илметил)-5,7-дигидропирроло[3,4-d] пиримидином. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H27F3N5O: 422,21; полученное 422,2; 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 6,90 (д, J=8,0 Гц, 2Н), 6,79 (с, 1Н), 5,42-5,32 (м, 1Н), 3,96-3,73 (м, 8Н), 3,57-3,51 (м, 1Н), 2,82-2,75 (м, 2Н), 2,58-2,46 (м, 1Н), 2,40-2,35 (м, 3Н), 2,17-2,08 (м, 1Н), 1,74-1,63 (м, 1Н), 1,51 (д, J=7,0 Гц, 3Н).
Пример 112. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-7-(морфолин-4-карбонил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]-азепин-4-амина
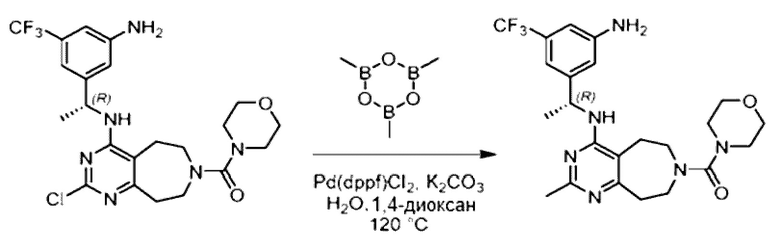
Этап 1.
[00426] Сосуд для микроволновой обработки наполняли N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-7-(морфолин-4-карбонил)-5Н,6Н,7Н-8Н,9Н-пиримидо[4,5-d]-азепин-4-амином (35 мг, 0,07 ммоль), триметилбороксином, 50% раствор в ТГФ (118 мкл, 0,42 ммоль), и K2CO3 (20 мг, 0,14 ммоль) в 1,4-диоксане (1,3 мл) и H2O (0,4 мл). Смесь дегазировали и добавляли Pd(dppi)Cl2 (5 мг, 0,01 ммоль), потом смесь нагревали до 120°С и перемешивали в течение 40 мин под микроволновым излучением. Смесь очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-7-(морфолин-4-карбонил)-5H,6H,7Н,8Н,9Н-пиримидо[4,5-d]-азепин-4-амина (15 мг, выход 43%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C23H29F3N6O2: 478,52; полученное 479,22; 1Н ЯМР (300 МГц, Метанол-d4) δ м.д. 6,92 (с, 1Н),6,90 (с, 1Н), 6,77 (с, 1Н), 5,38 (кв, J=7,2 Гц, 1Н), 3,65 (т, J=4,7 Гц, 4Н), 3,53 (дд, J=6,5, 4,4 Гц, 4Н), 3,21 (т, J=4,7 Гц, 4Н), 3,03-2,93 (м, 2Н), 2,92-2,78 (м, 2Н), 2,32 (с, 3Н), 1,52 (д, J=7,1 Гц, 3Н).
Пример 113. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амина
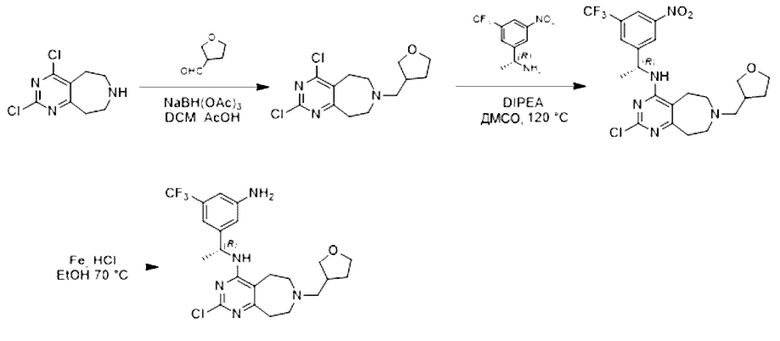
Этап 1.
[00427] Смесь 2,4-дихлор-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепина (300 мг, 1,38 ммоль), тетрагидрофуран-3-карбоксальдегида, 50 масс. % в Н2О (747 мкл, 4,13 ммоль), и АсОН (826 мг, 787 мкл, 13,76 ммоль) в ДХМ (15,3 мл) нагревали до 60°С в герметично закрытой пробирке и перемешивали в течение 1 ч. Смесь охлаждали до 0°С и частями добавляли NaBH(ОАс)3 (583 мг, 2,75 ммоль). Смесь медленно нагревали до кт в течение 2,5 ч, потом гасили 1 М NaOH и экстрагировали EtOAc. Объединенные органические слои промывали NaHCO3, сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением 2,4-ддхлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепина (258 мг, выход 62%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C13H17Cl2N3O: 302,2; полученное 302,55; 1Н ЯМР (300 МГц, CDCl3) δ м. д. 3,92-3,81 (м, 1Н), 3,75 (кв, J=7,7 Гц, 1Н), 3,56 (дд, J=9,4, 3,7 Гц, 1Н), 3,19-3,03 (м, 4Н), 2,77-2,58 (м, 3Н), 2,44 (д, J=12,4 Гц, 3Н), 2,08-1,93 (м, 1Н), 1,69-1,56 (м, 1Н), 1,56 (с, 2Н).
Этап 2.
[00428] Смесь 2,4-дихлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепина (255 мг, 0,85 ммоль) и HCl-соли (1R)-1-[3-нитро-5-(трифторметил)фенил]этан-1-амина (252 мг, 0,92 ммоль) в безводном ДМСО (7,7 мл) продували Ar. Добавляли ДИПЭА (488 мкл, 3,37 ммоль) и нагревали смесь до 120°С в течение 2 ч под микроволновым облучением. Добавляли H2O и Et2O и экстрагировали водный слой Et2O (х2).
Объединенные органические слои промывали Н2О, сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-илметил)-5H,6H,7H,8Н,9Н-пиримидо[4,5-d]азепин-4-амина (152 мг, выход 36%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H25ClF3N5O3: 499,92; полученное 501,10; 1H ЯМР (300 МГц, CDCl3) δ м. д. 8,43 (с, 1H), 8,38 (с, 1H), 8,03 (с, 1H), 5,39 (п, J=6,8 Гц, 1H), 5,08 (с, 1H), 3,96-3,82 (м, 2Н), 3,75 (кв, J=7,7 Гц, 1H), 3,57 (дд, J=8,2, 4,4 Гц, 1H), 2,96 (с, 2Н), 2,70 (с, 4Н), 2,62 (с, 2Н), 2,49 (с, 3Н), 2,11-1,98 (м, 1H), 1,67 (д, J=7,0 Гц, 3Н).
Этап 3.
[00429] Порошок Fe (93 мг, 1,67 ммоль) и 1 М HCl (1,22 мл, 1,22 ммоль) добавляли в смесь 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амина (152 мг, 0,3 ммоль) в EtOH (3 мл). Смесь нагревали до 70°С и перемешивали в течение ночи. Смесь фильтровали через целит®, фильтрационный осадок промывали МеОН, а растворитель концентрировали при пониженном давлении. Остаток растворяли в EtOAc, промывали NaHCO3 и экстрагировали водный слой EtOAc (х3). Объединенные органические слои сушили над безводным Na2SO4, растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амина (74 мг, выход 52%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H27ClF3N5O: 469,94; полученное 470,17; 1Н ЯМР (300 МГц, Метанол-d4) δ м. д. 6,90 (д, J=8,4 Гц, 2Н), 6,80 (с, 1H), 5,29 (кв, J=7,0 Гц, 1H), 3,93-3,78 (м, 2Н), 3,74 (кв, J=7,7 Гц, 1H), 3,57-3,48 (м, 1H), 2,88 (т, J=5,1 Гц, 2Н), 2,85-2,75 (м, 2Н), 2,74-2,59 (м, 4Н), 2,57-2,43 (м, 3Н), 2,13-1,98 (м, 1H), 1,64 (дкв, J=13,7, 7,7 Гц, 1H), 1,52 (д, J=7,1 Гц, 3Н).
Пример 114. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-7-(оксолан-3-карбонил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амина
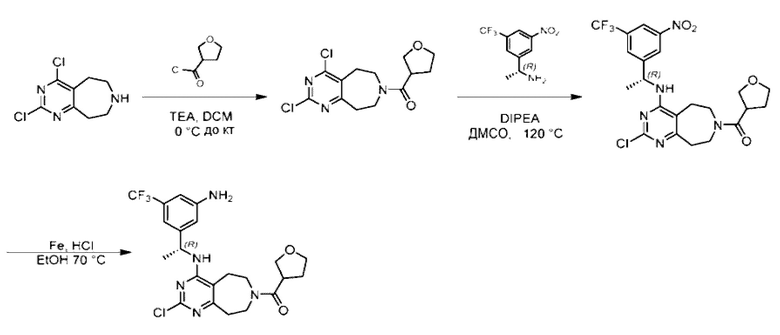
Этап 1.
[00430] Тетрагидрофуран-3-карбонилхлорид (106 мг, 0,79 ммоль) в ДХМ (0,4 мл) по каплям добавляли в смесь HCl-соли 2,4-дихлор-5H,6H,7H,8H,9Н-пиримидо[4,5-d]азепина (0,2 г, 0,79 ммоль) в ДХМ (6 мл) и ТЭА (0,49 мл, 3,54 ммоль) при 0°С в атмосфере Ar. Смесь перемешивали при кт в течение ночи, потом разводили ДХМ и промывали H2O и солевым раствором. Объединенные водные слои экстрагировали ДХМ (х2), а объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением 2,4-дихлор-7-(оксолан-3-карбонил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепина (122 мг, выход 49%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C13H15Cl2N3O2: 316,18; полученное 316,55; 1Н ЯМР (300 МГц, CDCl3) δ м. д. 3,89 (тд, J=8,1, 5,3 Гц, 1Н), 3,80-3,70 (м, 2Н), 3,73-3,62 (м, 4Н), 3,40 (м, 1Н), 3,22-3,15 (м, 1Н), 3,11 (кв, J=5,3 Гц, 2Н), 3,06-2,99 (м, 1Н), 2,52 (д, J=2,1 Гц, 1Н), 2,10-1,99 (м, 1Н), 1,98-1,90 (м, 1Н).
Этап 2.
[00431] 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-карбонил)-5H,6H,7H,8H,9H-пиримидо-[4,5-d]азепин-4-амин синтезировали способом, аналогичным 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амину, за исключением того, что 2,4-дихлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин заменяли 2,4-дихлор-7-(оксолан-3-карбонил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепином. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H23ClF3N5O4: 513,90; полученное 515,05; 1Н ЯМР (300 МГц, CDCl3) δ м. д. 8,44 (с, 1H), 8,39 (с, 1H), 8,03 (д, J=13,1 Гц, 1H), 5,51 (шир. с, 1H), 5,46-5,34 (м, 1H), 4,07-3,92 (м, 2Н), 3,84 (дд, J=27,2, 10,9 Гц, 6Н), 3,29-3,13 (м, 3Н), 2,74 (с, 2Н), 2,10 (дд, J=13,3, 6,0 Гц, 2Н), 1,69 (д, J=6,9 Гц, 3Н).
Этап 3.
[00432] N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-7-(оксолан-3-карбонил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амин синтезировали способом, аналогичным N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амину, за исключением того, что 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амин заменяли 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-карбонил)-5H,6H,7H,8H,9H-пиримидо-[4,5-d]азепин-4-амином. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H25ClF3N5O2: 483,92; полученное 484,13; 1Н ЯМР (300 МГц, Метанол-d4) δ м. д. 6,98-6,84 (м, 2Н), 6,79 (с, 1H), 5,39-5,20 (м, 1H), 3,93 (кв, J=7,9 Гц, 1H), 3,88-3,66 (м, 6Н), 3,44 (п, J=7,9 Гц, 1H), 3,09-2,93 (м, 2Н), 2,84 (дт, J=11,7, 6,4 Гц, 2Н), 2,23-1,98 (м, 2Н), 1,98-1,84 (м, 1H), 1,61-1,45 (м, 3Н).
Пример 115. Синтез оксан-4-ил 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-хлор-5Н,6Н,7H-пирроло[3,4-d]пиримидин-6-карбоксилата
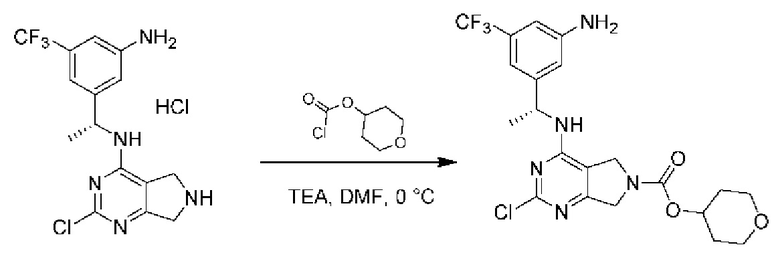
Этап 1.
[00433] В смесь HCl-соли N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-5Н,6Н,7H-пирроло[3,4-d]пиримидин-4-амина (239 мг, 0,51 ммоль) и ТЭА (355 мкл, 2,55 ммоль) в ДМФ (6 мл) при 0°С в атмосфере Ar добавляли оксан-4-ил хлорформиат (84 мг, 0,51 ммоль) в ДМФ (2,4 мл). Смесь перемешивали при 0°С в течение 1 ч, потом добавляли насыщенный NH4Cl и экстрагировали смесь Et2O/EtOAc (х2). Объединенные органические слои промывали NaHCO3, H2O и солевым раствором, сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением оксан-4-ил 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-хлор-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбоксилата (130 мг, выход 52%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H23ClF3N5O3: 485,14; полученное 486,15; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 8,22-8,11 (м, 1Н), 6,82 (с, 1Н), 6,76 (с, 1Н), 6,70 (с, 1Н), 5,57 (с, 2Н), 5,25-5,11 (м, 1Н), 4,90-4,75 (м, 1Н), 4,58-4,35 (м, 4Н), 3,88-3,75 (м, 2Н), 3,56-3,41 (м, 2Н), 1,96-1,81 (м, 2Н), 1,65-1,51 (м, 2Н), 1,47-1,39 (м, 3Н).
Пример 116. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-(оксан-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
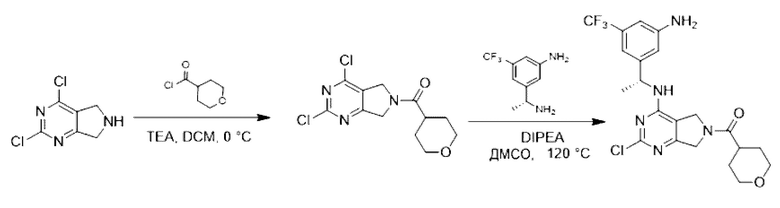
Этап 1.
[00434] В смесь HCl-соли 2,4-дихлор-5H,6H,7H-пирроло[3,4-d]пиримидина (400 мг, 1,78 ммоль) и ТЭА (990 мкл, 7,13 ммоль) в ДХМ (12 мл) при 0°С в атмосфере Ar добавляли раствор тетрагидро-2H-пиран-4-карбонилхлорида (230 мкл, 1,87 ммоль) в ДХМ (1,0 мл). Смесь перемешивали при 0°С в течение 30 мин, потом добавляли H2O и экстрагировали смесь ДХМ (х5). Объединенные органические слои сушили над безводным Na2SO4, фильтровали, потом растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением 2,4-дихлор-6-(оксан-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидина (463 мг, выход 86%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C12H13Cl2N3O2: 301,04; полученное 302,5; 1Н ЯМР (300 МГц, ДМСО-d6) δ 5,31-4,91 (м, 2Н), 4,77-4,43 (м, 2Н), 4,07-3,72 (м, 2Н), 3,67-3,35 (м, 2Н), 3,01-2,71 (м, 1Н), 1,94-1,52 (м, 4Н).
Этап 2.
[00435] В продутую Ar смесь 2,4-ддхлор-6-(оксан-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидина (200 мг, 0,66 ммоль) и HCl-соли 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилина (142 мг, 0,69 ммоль) в ДМСО (6,0 мл) добавляли ДИПЭА (460 мкл, 2,6 ммоль). Смесь нагревали до 120°С под микроволновым излучением и перемешивали в течение 30 мин, потом разводили Et2O и промывали H2O. Водный слой экстрагировали Et2O, а объединенные органические слои промывали водой (х2), сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-(оксан-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (180 мг). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H23ClF3N5O2: 469,15; полученное 470,0; 1Н ЯМР (400 МГц, ДМСО-d6) δ м. д. 7,71 (с, 1Н), 6,87 (д, J=4,7 Гц, 2Н), 6,79 (с, 1Н), 5,31-5,21 (м, 1Н), 5,19-5,13 (м, 2Н), 4,60 (с, 4Н), 3,93 (д, J=11,4 Гц, 2Н), 3,51-3,35 (м, 2Н), 2,80-2,72 (м, 1Н), 1,73-1,65 (м, 4Н), 1,52 (д, J=7,0 Гц, 3Н).
Пример 117. Синтез метил 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-метил-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбоксилата
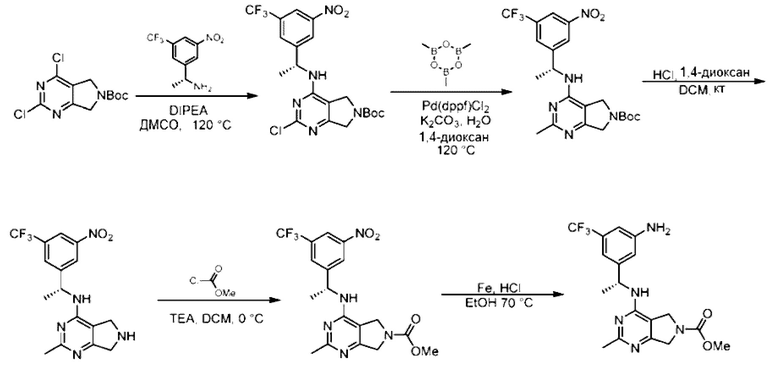
Этап 1.
[00436] трет-бутил 2-хлор-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбоксилат синтезировали способом, аналогичным 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амину, за исключением того, что 2,4-дихлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин заменяли трет-бутил 2,4-дихлор-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбоксилатом. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H21ClF3N5O4: 487,12; полученное 487,95; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 8,55 (с, 1Н), 8,37 (с, 1Н), 8,31 (д, J=7,7 Гц, 1Н), 8,27 (с, 1Н), 5,51-5,40 (м, 1H), 4,50-4,29 (м, 4Н), 1,54 (д, J=7,0 Гц, 3Н), 1,50-1,40 (м, 9Н).
Этап 2.
[00437] В продутую Ar смесь трет-бутия 2-хлор-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбоксилата (795 мг, 1,63 ммоль) и триметилбороксина, 50% раствор в ТГФ (1,23 г, 9,8 ммоль), в 1,4-диоксане (12,7 мл) добавляли K2CO3 (450 мг, 3,26 ммоль) в Н2О (8 мл). Смесь продували Ar еще в течение 15 мин, потом добавляли Pd(dppf)Cl2 (119 мг, 0,16 ммоль). Смесь нагревали до 120°С под микроволновым излучением и перемешивали в течение 1 ч. После этого добавляли дополнительное количество триметилбороксина, 50% раствор в ТГФ (409 мг, 3,26 ммоль), и Pd(dppi)Cl2 (60 мг, 81 мкмоль), потом смесь нагревали до 120°С под микроволновым излучением и перемешивали в течение 45 мин. Смесь фильтровали через слой целита®, а фильтрационный осадок промывали EtOAc. Фильтрат промывали Н2О, потом сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением трет-бутал 2-метил-4-{[(1H)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбоксилата (258 мг, выход 34%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H24F3N5C4: 467,18; полученное 468,30; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 8,56 (с, 1H), 8,33 (с, 1H), 8,27 (с, 1Н), 7,74 (д, J=7,6 Гц, 1Н), 5,60-5,43 (м, 1Н), 4,55-4,24 (м, 4Н), 2,27 (с, 3Н), 1,53 (д, J=7,0 Гц, 3Н), 1,50-1,40 (м, 9Н).
Этап 3.
[00438] Смесь трет-бутал 2-метил-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбоксилата (233 мг, 0,50 ммоль) в ДХМ (3,5 мл) и 4 M HCl в 1,4-диоксане (1,6 мл, 6,5 ммоль) перемешивали при кт в течение ночи. Растворитель концентрировали при пониженном давлении с получением HCl-соли 2-метил-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (198 мг, выход 90%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C16H18Cl2F3N5O2: 367,13; полученное 367,90; 1Н ЯМР (300 МГц, Метанол-d4) δ м. д. 8,58 (с, 1H), 8,46 (с, 1H), 8,21 (с, 1H), 5,77-5,68 (м, 1Н), 4,69-4,61 (м, 4Н), 2,57 (с, 3Н), 1,73 (д, J=7,1 Гц, 3Н).
Этап 4.
[00439] В смесь HCl-соли 2-метил-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (163 мг, 0,37 ммоль) в ДХМ (4,9 мл) и ТЭА (258 мкл, 1,85 ммоль) при 0°С в атмосфере Ar добавляли раствор метилхлорформиата (66 мг, 0,37 ммоль) в ДХМ (0,8 мл). Смесь перемешивали при 0°С в течение 1 ч, потом промывали насыщенным NH4Cl (х2) и насыщенным NaHCO3 (х1). Водный слой NH4Cl экстрагировали ДХМ (х3), а водный слой NaHCO3 экстрагировали ДХМ (х2).
Объединенные органические слои сушили над безводным Na2SO4, фильтровали, а растворитель концентрировали при пониженном давлении с получением метил 2-метил-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбоксилата (146 мг, выход 93%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C18H18F3N5O4: 425,13; полученное 426,00; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 8,57 (с, 1H), 8,34 (с, 1H), 8,28 (с, 1H), 7,79-7,67 (м, 1H), 5,58-5,46 (м, 1Н), 4,56-4,31 (м, 4Н), 3,68 (д, J=2,9 Гц, 3Н), 2,29 (с, 3Н), 1,53 (д, J=7,0 Гц, 3Н).
Этап 5.
[00440] Метил 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-метил-5Н,6Н,7H-пирроло[3,4-d]пиримидин-6-карбоксилат синтезировали способом, аналогичным N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амину, за исключением того, что 2-хлор-N-[(1H)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-илметил)-5Н,6Н,7H,8H,9H-пиримидо[4,5-d]азепин-4-амин заменяли метил 2-метил-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбоксилатом. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C18H20F3N5O2: 395,16; полученное 396,18; 1Н ЯМР (300 МГц, ДМСО-d6) δ 7,68-7,38 (м, 1H), 6,84 (с, 1H), 6,78 (с, 1H), 6,68 (с, 1H), 5,53 (с, 2Н), 5,39-5,22 (м, 1H), 4,46 (д, J=9,2 Гц, 2Н), 4,37 (д, J=9,1 Гц, 2Н), 3,67 (с, 3Н), 2,31 (с, 3Н), 1,42 (д, J=7,0 Гц, 3Н).
Пример 118. Синтез оксан-4-ил 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-метил-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбоксилата
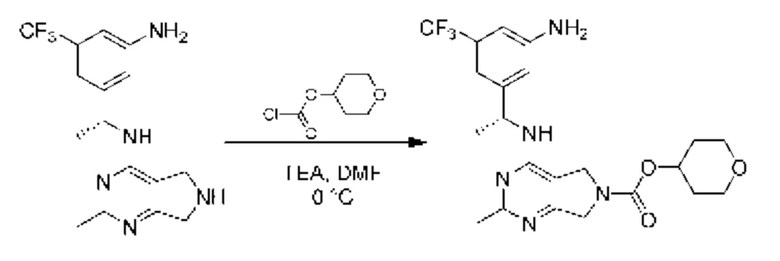
Этап 1.
[00441] В смесь HCl-соли N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-5Н,6Н,7H-пирроло[3,4-d]пиримидин-4-амина (228 мг, 0,51 ммоль) в ДМФ (6,8 мл) и ТЭА (355 мкл, 2,55 ммоль) при 0°С в атмосфере Ar добавляли раствор оксан-4-ил хлорформиата (84 мг, 0,51 ммоль) в ДМФ (2,3 мл). Смесь перемешивали при 0°С в течение 1 ч, потом добавляли насыщенный NH4Cl. Смесь экстрагировали Et2O/EtOAc, а водный слой экстрагировали Et2O. Объединенные органические слои промывали H2O и солевым раствором, потом сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением оксан-4-ил 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-метил-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбоксилата (88 мг, выход 37%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H26F3N5O3: 465,20; полученное 466,13; 1H ЯМР (400 МГц, ДМСО-d6) δ м. д. 7,17 (д, J=8,0 Гц, 1H), 6,88 (с, 1H), 6,86 (с, 1H), 6,74 (с, 1H), 5,38-5,30 (м, 1H), 5,20 (с, 2Н), 4,90-4,82 (м, 1H), 4,50 (с, 2Н), 4,39 (с, 2Н), 3,89-3,81 (м, 2Н), 3,56-3,47 (м, 2Н), 2,34 (с, 3H), 1,98-1,89 (м, 2Н), 1,68-1,57 (м, 2Н), 1,48 (д, J=7,0 Гц, 3H).
Пример 119. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6-(оксан-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
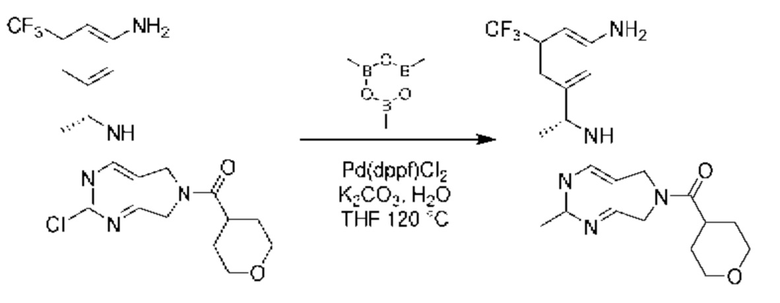
Этап 1.
[00442] В продутую Ar смесь N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-(оксан-4-карбонил)-5Н,6Н,7H-пирроло[3,4-d]пиримидин-4-амина (336 мг, 0,72 ммоль) и триметилбороксина, 50% раствор в ТГФ (539 мг, 4,29 ммоль), добавляли K2CO3 (198 мг, 1,43 ммоль) в H2O (3,4 мл). Смесь продували Ar еще в течение 15 мин, потом добавляли Pd(dppf)Cl2 (52 мг, 72 мкмоль). Смесь нагревали до 120°С под микроволновым излучением и перемешивали в течение 1 ч. Смесь фильтровали через слой целита®, а фильтрационный осадок промывали EtOAc. Фильтрат промывали H2O и солевым раствором, потом сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6-(оксан-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (49 мг). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H26F3N5O2: 449,20; полученное 450,00; 1Н ЯМР (400 МГц, ДМСО-d6) δ м. д. 7,20 (с, 1H), 6,90-6,83 (м, 2Н), 6,74 (с, 1H), 5,39-5,30 (м, 1H), 5,19 (с, 2Н), 4,75-4,34 (м, 4Н), 3,91 (с, 2Н), 3,51-3,32 (м, 2Н), 2,84-2,72 (м, 1H), 2,35 (с, 3H), 1,74-1,61 (м, 4Н), 1,48 (д, J=7,0 Гц, 3H).
Пример 120. Синтез 1-(4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-метил-5H,6H,7H-пирроло[3,4-d]пиримидин-6-ил)этан-1-она

Этап 1.
[00443] 1-(2-хлор-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-6-ил)этан-1-он синтезировали способом, аналогичным 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амину, за исключением того, что 2,4-дихлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин заменяли 1-{2,4-дихлор-5H,6H,7H-пирроло[3,4-d]пиримидин-6-ил}этан-1-оном. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C17H15ClF3N5O3: 429,08; полученное 429,95.
Этап 2.
[00444] В смесь 1-(2-хлор-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}- 5H,6H,7H-пирроло[3,4-d]пиримидин-6-ил)этан-1-она (583 мг, 1,36 ммоль) в EtOH (12 мл) и 1 М HCl (5,4 мл) добавляли порошок Fe (417 мг, 7,46 ммоль). Смесь нагревали до 70°С и перемешивали в течение 5 ч. Добавляли EtOAc и промывали смесь насыщенным NaHCO3, потом сушили над безводным Na2SO4, фильтровали и концентрировали растворитель при пониженном давлении с получением 1-(4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-хлор-5H,6H,7H-пирроло[3,4-d]пиримидин-6-ил)этан-1-она(443 мг). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C17H17ClF3N5O: 399,11; полученное 399,90; 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,18 (д, J=8,0 Гц, 1H), 6,83 (с, 1H), 6,77 (д, J=5,8 Гц, 1Н), 6,75-6,62 (м, 1Н), 5,57 (с, 2Н), 5,20 (кв, J=7,0 Гц, 1Н), 4,71-4,58 (м, 2Н), 4,51-4,31 (м, 2Н), 2,05 (д, J=9,7 Гц, 3H), 1,45 (дд, J=7,0, 5,4 Гц, 3H).
Этап 3.
[00445] 1-(4-{[(1R)-1-[3-амино-5-(трифторметал)фенил]этал]амино}-2-метил-5H,6H,7H-пирроло[3,4-d]пиримидин-6-ил)этан-1-он синтезировали способом, аналогичным N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6-(оксан-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амину, за исключением того, что N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-(оксан-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амин заменяли 1-(4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-хлор-5H,6H,7H-пирроло[3,4-d]пиримидин-6-ил)этан-1-оном. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C18H20F3N5O: 379,16; полученное 380,27; 1Н ЯМР (400 МГц, ДМСО-d4 100°С) δ м. д. 7,17 (с, 1Н), 6,88 (д, J=7,1 Гц, 2Н), 6,74 (с, 1Н), 5,42-5,30 (м, 1Н), 5,20 (с, 2Н), 4,60 (д, J=20,9 Гц, 2Н), 4,42 (д, J=42,1 Гц, 2Н), 2,35 (с, 3H), 2,06 (с, 3H), 1,48 (д, J=6,8 Гц, 3H).
Пример 121. Синтез N-(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-(пиридин-3-карбонил)-5Н,6Н,7H-пирроло[3,4-d]пиримидин-4-амина
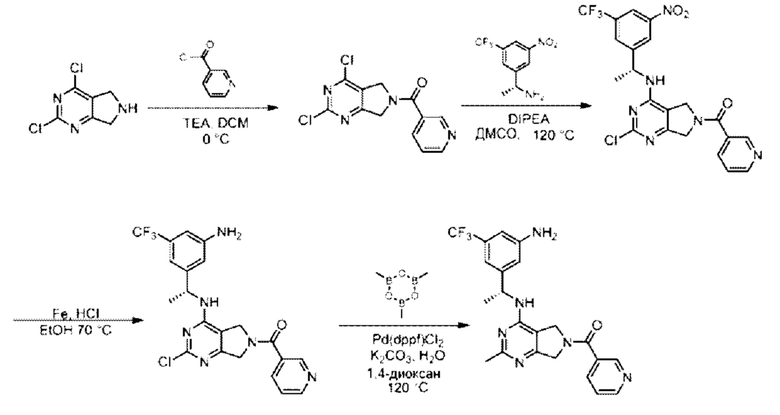
Этап 1.
[00446] 3-{2,4-дихлор-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбонил}пиридин синтезировали способом, аналогичным 2,4-дихлор-6-(оксан-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидину, за исключением того, что тетрагидро-2H-пиран-4-карбонилхлорид заменяли пиридин-3-карбонилхлоридом. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C12H8Cl2N4O: 294,01; полученное 294,90; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 8,84 (д, J=2,2 Гц, 1H), 8,75 (дт, J=4,8, 2,3 Гц, 1H), 8,10 (дт, J=7,9, 2,0 Гц, 1H), 7,58 (дт, J=8,5, 4,6 Гц, 1H), 4,99 (д, J=6,9 Гц, 2Н), 4,92 (д, J=3,7 Гц, 2Н).
Этап 2.
[00447] 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-6-(пиридин-3-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амин синтезировали способом, аналогичным 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амину, за исключением того, что 2,4-дихлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин заменяли 3-{2,4-дихлор-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбонил}пиридином. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H16ClF3N6O3: 492,09; полученное 492,95; 1H ЯМР (300 МГц, ДМСО-d6) δ м. д. 8,83 (д, J=9,7 Гц, 1H), 8,77-8,66 (м, 1H), 8,59 (с, 1H), 8,50 (с, 1H), 8,45-8,33 (м, 1H), 8,27 (д, J=22,1 Гц, 1H), 8,16-7,92 (м, 1H), 7,64-7,42 (м, 1H), 5,64-5,37 (м, 1H), 4,98-4,35 (м,4Н), 1,74-1,43 (м, 3H).
Этап 3.
[00448] N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-(пиридин-3-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амин синтезировали способом, аналогичным 1-(4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-хлор-5H,6H,7H-пирроло[3,4-d]пиримидин-6-ил)этан-1-ону, за исключением того, что 1-(2-хлор-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-6-ил)этан-1-он заменяли 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-6-(пиридин-3-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амином. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H18ClF3N6O: 462,86; полученное 463,0.
Этап 4.
[00449] N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6-(пиридин-3-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амин синтезировали способом, аналогичным N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6-(оксан-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амину, за исключением того, что N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-(оксан-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амин заменяли N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-(пиридин-3-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амином. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H21F3N6O: 442,17; полученное 443,17; 1Н ЯМР (400 МГц, ДМСО-d6 100°С) δ м. д. 8,82 (д, J=2,3 Гц, 1Н), 8,74-8,65 (м, 1Н), 8,01 (дт, J=7,9, 2,0 Гц, 1Н), 7,57-7,42 (м, 1Н), 7,20 (с, 1Н), 6,86 (с, 2Н), 6,74 (с, 1Н), 5,40-5,29 (м, 1Н), 5,19 (с, 2Н), 4,66 (с, 2Н), 4,60 (с, 2Н), 2,35 (с, 3H), 1,47 (д, J=7,0 Гц, 3H).
Пример 122. Синтез 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-N,2-диметил-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбоксамида
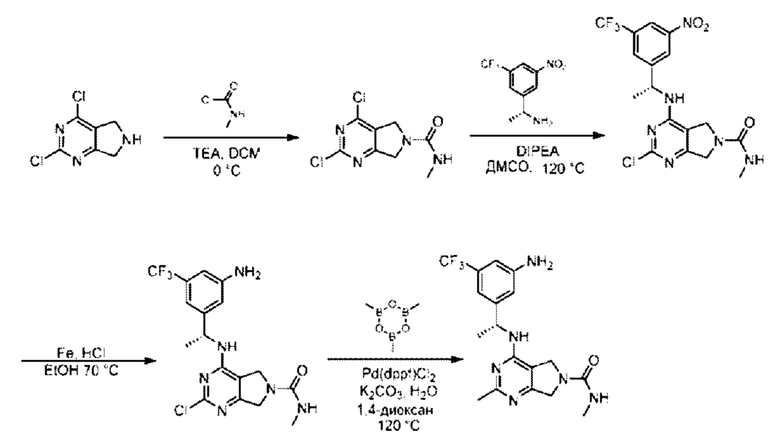
Этап 1.
[00450] 2,4-дихлор-N-метил-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбоксамид синтезировали способом, аналогичным 2,4-дихлор-6-(оксан-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидину, за исключением того, что тетрагидро-2H-пиран-4-карбонилхлорид заменяли метиламиноформилхлоридом. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C8H8Cl2N4O: 246,01; полученное 247,4; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 6,59-6,48 (м, 1H), 4,68-4,63 (м, 2Н), 4,63-4,58 (м, 2Н), 2,64 (д, J=4,3 Гц, 3H).
Этап 2.
[00451] 2-хлор-N-метил-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбоксамид синтезировали способом, аналогичным 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амину, за исключением того, что 2,4-дихлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин заменяли 2,4-дихлор-N-метил-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбоксамидом. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C17H16ClF3N6O3: 444,09; полученное 445,0; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 8,57 (с, 1Н), 8,37 (с, 1H), 8,29 (с, 1H), 8,25 (с, 1Н), 6,32 (д, J=4,6 Гц, 1H), 5,53-5,39 (м, 1H), 4,45 (д, J=8,8 Гц, 2Н), 4,36 (с, 2Н), 2,64 (д, J=4,3 Гц, 3H), 1,54 (д, J=7,0 Гц, 3H).
Этап 3.
[00452] 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-хлор-N-метил-5Н,6Н,7H-пирроло[3,4-d]пиримидин-6-карбоксамид синтезировали способом, аналогичным 1-(4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-хлор-5H,6H,7H-пирроло[3,4-d]пиримидин-6-ил)этан-1-ону, за исключением того, что 1-(2-хлор-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-6-ил)этан-1-он заменяли 2-хлор-N-метил-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбоксамидом. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C17H16ClF3N6O3: 414,12; полученное 415,0.
Этап 4.
[00453] 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-N,2-диметил-5Н,6Н,7H-пирроло[3,4-d]пиримидин-6-карбоксамид синтезировали способом, аналогичным N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6-(оксан-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амину, за исключением того, что N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-(оксан-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амин заменяли 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-хлор-N-метил-5Н,6Н,7H-пирроло[3,4-d]пиримидин-6-карбоксамидом. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C18H21F3N6O: 394,17; полученное 395,28; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 7,51 (д, J=8,2 Гц, 1H), 6,85 (с, 1H), 6,78 (с, 1Н), 6,68 (с, 1H), 6,27 (д, J=4,7 Гц, 1H), 5,53 (с, 2Н), 5,38-5,22 (м, 1Н), 4,40 (с, 2Н), 4,31 (с, 2Н), 2,63 (д, J=4,1 Гц, 3H), 2,31 (с, 3H), 1,42 (д, J=7,0 Гц, 3H).
Пример 123. Синтез 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-2-карбонитрила
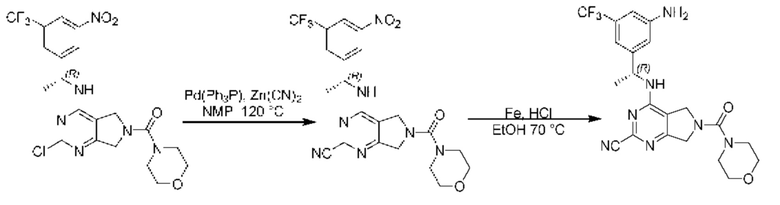
Этап 1.
[00454] Смесь 2-хлор-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (300 мг, 0,6 ммоль), Zn(CN)2 (84 мг, 0,72 ммоль) и Pd(PPh3)4 (48,5 мг, 42 мкмоль) в NMP (9 мл) в атмосфере Ar нагревали до 120°С и перемешивали в течение ночи. Добавляли дополнительную аликвоту Zn(CN)2 (84 мг, 0,72 ммоль) и Pd(PPh3)4 (48,5 мг, 42 мкмоль) и перемешивали смесь при 120°С в течение уикенда. Добавляли 2 М NH3 (12 мл) и экстрагировали смесь Et2O (9 × 50 мл). Объединенные органические слои сушили над безводным Na2SO4, фильтровали, и концентрировали растворитель при пониженном давлении с получением 6-(морфолин-4-карбонил)-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-2-карбонитрила (480 мг, выход >100%; примечание: неочищенный продукт). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H20F3N7O4: 491,15; полученное 492,66.
Этап 2.
[00455] 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-6-(морфолин-4-карбонил)-5Н,6Н,7H-пирроло[3,4-d]пиримидин-2-карбонитрил синтезировали способом, аналогичным N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амину, за исключением того, что 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-илметил)-5Н,6Н,7H,8H,9H-пиримидо[4,5-d]азепин-4-амин заменяли 6-(морфолин-4-карбонил)-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-2-карбонитрилом. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H22F3N7O2: 461,18; полученное 462,00; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 8,28 (д, J=7,0 Гц, 1Н), 6,84 (с, 1Н), 6,78 (с, 1Н), 6,71 (с, 1Н), 5,72-5,51 (м, 2Н), 5,30-5,18 (м, 1Н), 4,78-4,49 (м, 4Н), 3,63 (т, J=4,7 Гц, 4Н), 3,26 (т, J=4,9 Гц, 4Н), 1,46 (д, J=7,0 Гц, 3H).
Пример 124. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-этокси-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
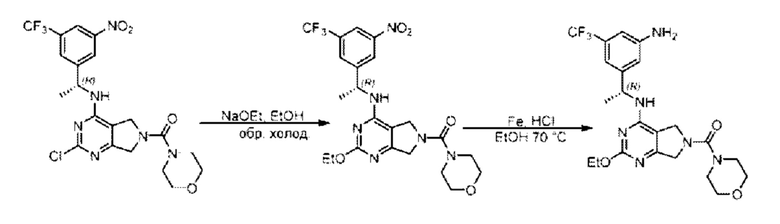
Этап 1.
[00456] Смесь 2-хлор-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]-этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (400 мг, 0,8 ммоль) и NaOEt (434 мг, 6,38 ммоль) в EtOH (13,4 мл) нагревали до рефлюкса и перемешивали в течение ночи. Растворитель концентрировали при пониженном давлении, добавляли Н2О и экстрагировали смесь EtOAc (× 3). Объединенные органические слои сушили над безводным Na2SO4, фильтровали, концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением 2-этокси-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]-этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (81 мг, выход 20%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H25F3N6O5: 510,18; полученное 511,30; 1Н ЯМР (400 МГц, CDCl3) δ м. д. 8,41 (с, 1Н), 8,39 (с, 1Н), 7,96 (с, 1Н), 5,43 (и, J=6,9 Гц, 1Н), 4,77 (д, J=6,2 Гц, 1Н), 4,64 (д, J=2,1 Гц, 2Н), 4,53 (с, 2Н), 4,21 (дд, J=10,5, 7,1 Гц, 1Н), 4,08 (дкв, J=10,6, 7,0 Гц, 1Н), 3,76-3,70 (м, 4Н), 3,43-3,30 (м, 4Н), 1,66 (д, J=7,0 Гц, 3H), 1,27 (т, J=7,2 Гц, 3H).
Этап 2.
[00457] N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-этокси-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амин синтезировали способом, аналогичным N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амину, за исключением того, что 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амин заменяли 2-этокси-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]-этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амином. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H27F3N6O3: 480,21; полученное 481,00; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 7,67 (д, J=7А Гц, 1Н), 6,79 (с, 1Н), 6,75 (с, 1Н), 6,67 (д, J=2,5 Гц, 1Н), 5,53 (с, 2Н), 5,13 (т, J=7,l Гц, 1Н), 4,58-4,49 (м, 2Н), 4,42 (с, 2Н), 4,13 (кв, J=7,0 Гц, 2Н), 3,62 (т, J=4,6 Гц, 4Н), 3,23 (т, J=4,6 Гц, 4Н), 1,42 (д, J=7,0 Гц, 3H), 1,16 (т, J=7,0 Гц, 3H).
Пример 125. Синтез N4-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-N2-метил-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-2,4-диамина
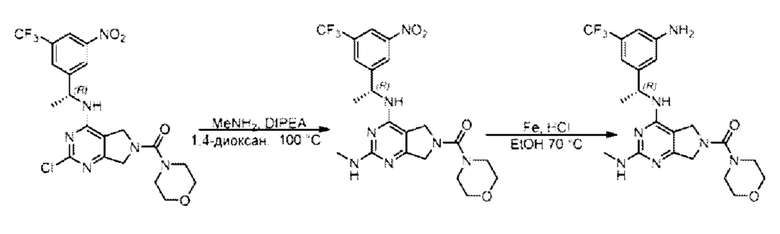
Этап 1.
[00458] В смесь 2-хлор-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]-этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (200 мг, 0,4 ммоль) в 1,4-диоксане (2,6 мл) добавляли MeNH2 (3,19 мл, 6,39 ммоль) и ДИПЭА (0,28 мл, 1,6 ммоль). Смесь нагревали до 100°С и перемешивали в течение 24 ч, потом растворитель концентрировали при пониженном давлении, добавляли Н2О и экстрагировали смесь EtOAc. Объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением N2-метил-6-(морфолин-4-карбонил)-N4-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-2,4-диамина (180 мг). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H24F3N7O4: 495,18; полученное 496,00; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 8,53 (с, 1H), 8,33 (с, 1H), 8,25 (с, 1H), 7,41 (д, J=7,5 Гц, 1Н), 6,38 (д, J=4,9 Гц, 1H), 5,42 (кв, J=7,2 Гц, 1H), 4,56-4,40 (м, 2Н), 4,31 (с, 2Н), 3,63 (т, J=4,7 Гц, 4Н), 3,23 (т, J=4,8 Гц, 4Н), 2,62 (д, J=4,7 Гц, 3H), 1,52 (д, J=7,1 Гц, 3H).
Этап 2.
[00459] N4-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-N2-метил-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-2,4-диамин синтезировали способом, аналогичным N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амину, за исключением того, что 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-илметил)-5Н,6Н,7H,8H,9H-пиримидо[4,5-d]азепин-4-амин заменяли N2-метил-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-2,4-диамином. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H26F3N7O2: 465,21; полученное 465,86; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 7,18 (д, J=7,8 Гц, 1H), 6,79 (д, J=9,7 Гц, 2Н), 6,67 (д, J=1,9 Гц, 1H), 6,40-6,28 (м, 1H), 5,51 (с, 2Н), 5,21 (т, J=6,8 Гц, 1H), 4,44 (д, J=6,0 Гц, 2Н), 4,32 (с, 2Н), 3,63 (т, J=4,5 Гц, 4Н), 3,22 (т, J=4,6 Гц, 4Н), 2,66 (д, J=4,7 Гц, 3H), 1,41 (д, J=7,0 Гц, 3H).
Пример 126. Синтез N-[(1R)-1-[3-амино-5-(трифтор-метил)фенил]этил]-6-(морфолин-4-карбонил)-2-(трифтор-метокси)-5H,6H,7H-пирроло-[3,4-d]пиримидин-4-амина
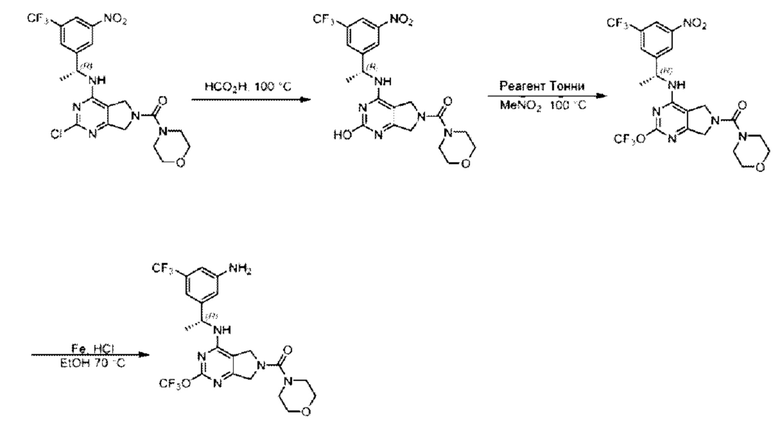
Этап 1.
[00460] Смесь 2-хлор-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло-[3,4-d]пиримидин-4-амина (500 мг, 1,0 ммоль) в муравьиной кислоте (12,5 мл) перемешивали при 100°С в течение ночи. Добавляли H2O и экстрагировали смесь ДХМ (× 3). Объединенные органические экстракты сушили над безводным Na2SO4, фильтровали и концентрировали растворитель при пониженном давлении. Неочищенный остаток растирали с ДХМ, фильтровали, а фильтрационный осадок промывали ДХМ с получением 6-(морфолин-4-карбонил)-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-2-ола (312 мг, выход 65%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H21F3N6O5: 482,15; полученное 483,30; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 10,86 (с, 1Н), 8,51 (с, 1Н), 8,36 (с, 1Н), 8,24 (с, 1Н), 7,90 (д, J=7,7 Гц, 1Н), 5,51 (т, J=7,2 Гц, 1Н), 4,66-4,20 (м, 4Н), 3,61 (т, J=4,6 Гц, 4Н), 3,23 (т, J=4,7 Гц, 4Н), 1,50 (д, J=7,0 Гц, 3H).
Этап 2.
[00461] В смесь продутого воздухом 6-(морфолин-4-карбонил)-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло-[3,4-d]-пиримидин-2-ола (290 мг, 0,6 ммоль) в MeNO2 (6 мл) добавляли реагент Тоньи (298 мг, 0,9 ммоль). Смесь нагревали до 100°С и перемешивали в течение ночи. Добавляли дополнительную аликвоту реагента Тоньи (99 мг, 0,3 ммоль) и перемешивали смесь при 100°С в течение 4 ч, потом добавляли еще реагент Тоньи (99 мг, 0,3 ммоль) и перемешивали смесь еще в течение 4 ч. Добавляли Н2О и экстрагировали смесь ДХМ (× 3). Объединенные органические слои сушили над безводным Na2SO4, фильтровали, концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением 6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)-фенил]этил]-2-(трифторметокси)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (130 мг, выход 39%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H20F6N6O5: 550,14; полученное 551,05; 1Н ЯМР (400 МГц, ДМСО-d6) δ м. д. 8,51 (с, 1H), 8,42 (д, J=7,0 Гц, 1H), 8,36 (с, 1H), 8,21 (с, 1H), 5,32 (т, J=7,0 Гц, 1H), 4,76-4,55 (м, 2Н), 4,52 (с, 2Н), 3,62 (т, J=4,7 Гц, 4Н), 3,24 (т, J=4,6 Гц, 4Н), 1,56 (д, J=7,1 Гц, 3H); 19F ЯМР (376 МГц, ДМСО-d6) δ м. д. -55,6, -61,4.
Этап 3.
[00462] N-[(1R)-1-[3-амино-5-(трифтор-метил)фенил]этил]-6-(морфолин-4-карбонил)-2-(трифторметокси)-5H,6H,7H-пирроло-[3,4-d]пиримидин-4-амин синтезировали способом, аналогичным N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амину, за исключением того, что 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-илметил)-5Н,6Н,7H,8H,9H-пиримидо[4,5-d]азепин-4-амин заменяли 6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)-фенил]этил]-2-(трифторметокси)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амином. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H22F6N6O3: 520,17; полученное 521,17; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 8,25 (д, J=7,6 Гц, 1H), 6,80 (с, 1Н), 6,75 (с, 1Н), 6,70 (с, 1H), 5,54 (с, 2Н), 5,10 (т, J=7,0 Гц, 1H), 4,61-4,27 (м, 4Н), 3,62 (т, J=4,6 Гц, 4Н), 3,24 (т, J=4,7 Гц, 4Н), 1,46 (д, J=7,0 Гц, 3H).
Пример 127. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-6-(морфолин-4-карбонил)-2-(трифторметил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
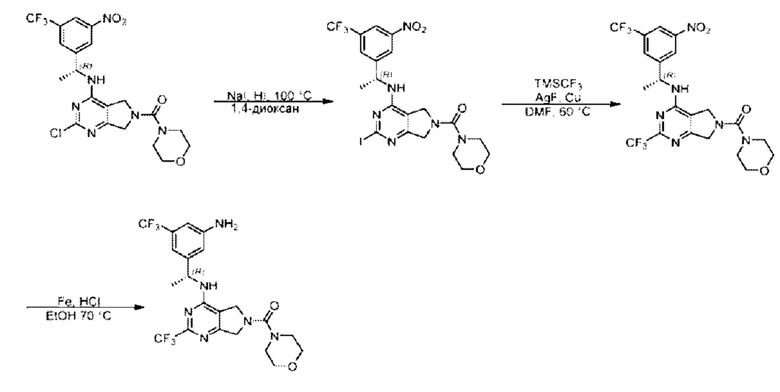
Этап 1.
[00463] В смесь 2-хлор-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]тримидин-4-амина (300 мг, 0,6 ммоль) и Nal (359 мг, 2,4 ммоль) в 1,4-диоксане (6 мл) добавляли HI, 57% водный раствор (96 мкл, 0,72 ммоль). Смесь нагревали до 100°С и перемешивали в течение ночи. Добавляли насыщенный водный Na2CO3 и экстрагировали смесь ДХМ (8 × 50 мл). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали растворитель при пониженном давлении с получением 2-йод-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина и 2-хлор-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (приблиз. отношение 4:6, 385 мг). Неочищенный продукт использовали на следующем этапе без дополнительной очистки. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H20F3IN6O4: 592,05; полученное 593,5.
Этап 2.
[00464] Эту реакцию проводили параллельно в 4 партиях в масштабе, проиллюстрированном ниже.
[00465] В смесь AgF (22,4 мг, 0,18 ммоль) и CF3SiMe3 (0,12 мл, 0,8 ммоль), перемешиваемую в ДМФ (1,9 мл) в атмосфере Ar в течение 20 мин, добавляли Cu (16,8 мг, 0,26 ммоль). Смесь перемешивали при кт в течение 2 ч, потом добавляли смесь 2-йод-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина и 2-хлор-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (отношение 4:6; 95 мг, 0,16 ммоль). Реакционную смесь нагревали до 60°С и перемешивали в течение ночи. Объединенные реакционные смеси экстрагировали Et2O (8 × 40 мл), а объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении с получением 6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифтор-метил)фенил]этил]-2-(трифторметил)-5Н,6Н,7H-пирроло[3,4-d]пиримидин-4-амина (210 мг, 61%). Неочищенный продукт использовали на следующем этапе без дополнительной очистки. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H20F6N6O4: 534,14; полученное 535,05.
Этап 3.
[00466] N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-6-(морфолин-4-карбонил)-2-(трифторметил)-5Н,6Н,7H-пирроло[3,4-d]пиримидин-4-амин синтезировали способом, аналогичным N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амину, за исключением того, что 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-илметил)-5Н,6Н,7H,8H,9H-пиримидо[4,5-d]азепин-4-амин заменяли 6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифтор-метил)фенил]этил]-2-(трифторметил)-5Н,6Н,7H-пирроло [3,4-d]пиримидин-4-амином. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H22F6N6O2: 504,17; полученное 505,18. 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 8,24 (д, J=7,8 Гц, 1Н), 6,86 (с, 1Н), 6,78 (с, 1Н), 6,70 (с, 1H), 5,56 (с, 2Н), 5,34-5,13 (м, 1H), 4,62 (с, 4Н), 3,63 (т, J=5,2 Гц, 4Н), 3,26 (т, J=4,9 Гц, 4Н), 1,48 (д, J=7,0 Гц, 3H).
Пример 128. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-этил-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина 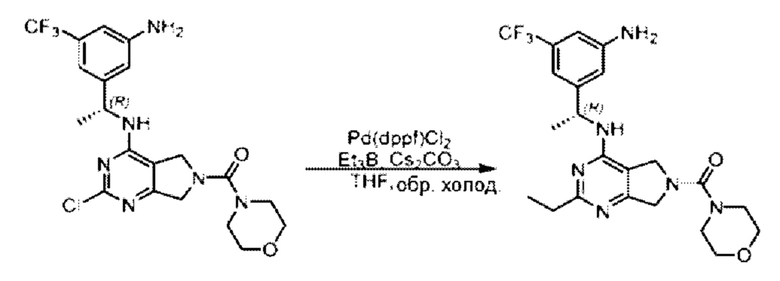
Этап 1.
[00467] В смесь N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (250 мг, 0,53 ммоль), Cs2CO3 (519 мг, 1,59 ммоль) и Pd(dppf)Cl2⋅CH2Cl2 (26 мг, 0,03 ммоль) в ТГФ (1 мл) в атмосфере Ar добавляли триэтилборат, 1 М раствор в гексане (1,06 мл, 1,06 ммоль). Смесь нагревали до рефлюкса и перемешивали в течение ночи, потом добавляли 1 М HCl и перемешивали смесь при кт в течение 1 ч. Добавляли NaHCO3, экстрагировали смесь ДХМ, а объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-этил-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (66 мг, выход 27%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H27F3N6O2: 464,21; полученное 465,15; 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,51 (д, J=7,7 Гц, 1Н), 6,84 (с, 1Н), 6,79 (с, 1Н), 6,67 (с, 1Н), 5,52 (с, 2Н), 5,29 (кв, J=7,6 Гц, 1Н), 4,59-4,50 (м, 2Н), 4,47 (с, 2Н), 3,73-3,54 (м, 4Н), 3,24 (т, J=4,7 Гц, 4Н), 2,63-2,54 (м, 2Н), 1,44 (д, J=7,0 Гц, 3H), 1,11 (т, J=7,6 Гц, 3H).
Пример 129. Синтез (4-{[(1R)-1-[3-амино-5-(трифторметил)-фенил]этил]амино}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-2-ил) метанола
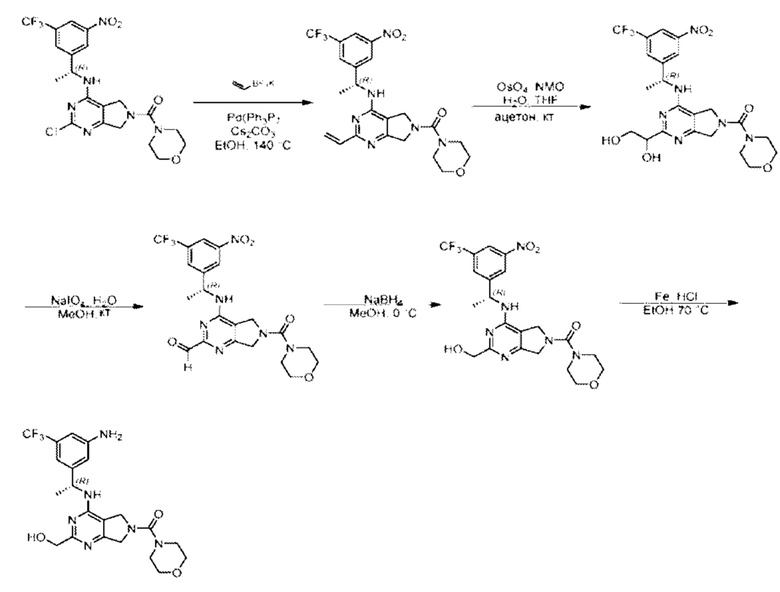
Этап 1.
[00468] В продутую Ar смесь 2-хлор-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (1,0 г, 2,0 ммоль), CS2CO3 (976 мг, 3,0 ммоль) и винилтрифторбората калия (348 мг, 2,60 ммоль) в EtOH (40 мл) добавляли Pd(PPh3)4 (231 мг, 0,2 ммоль). Смесь нагревали до 140°С под микроволновым излучением и перемешивали в течение 30 мин, потом фильтровали через слой целита®, а фильтрационный осадок промывали EtOAc. Фильтрат промывали H2O и экстрагировали водный слой EtOAc (× 3). Объединенные органические слои сушили над безводным Na2SO4, фильтровали, растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением 2-этенил-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (682 мг, выход 69%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H23F3N6O4: 492,17; полученное 593,1; 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,58 (с, 1Н), 8,33 (д, J=1,8 Гц, 2Н), 7,83 (д, J=7,2 Гц, 1Н), 7,69-7,51 (м, 1Н), 6,49 (дд, J=17,3, 10,3 Гц, 1Н), 6,29 (дд, J=17,3, 2,5 Гц, 1Н), 5,59-5,45 (м, 1Н), 4,73-4,32 (м, 4Н), 3,64 (т, J=4,6 Гц, 4Н), 3,25 (т, J=4,7 Гц, 4Н), 1,56 (д, J=7,0 Гц, 3H).
Этап 2.
[00469] В смесь 2-этенил-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)-фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (682 мг, 1,39 ммоль) в ТГФ (5,7 мл), ацетона (5,7 мл) и Н2О (5,7 мл) добавляли 4-метилморфолин Диоксид (649 мг, 5,54 ммоль) и OsO4, 2,5% масс, в t-BuOH (0,59 мл, 0,058 ммоль). Смесь перемешивали при кт в течение 12 ч, потом добавляли раствор бисульфита натрия и экстрагировали смесь EtOAc (× 2). Объединенные органические слои сушили над MgSO4, фильтровали, растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением 1-[6-(морфолин-4-карбонил)-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-2-ил]этан-1,2-диола (417 мг, выход 61%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H25F3N6O6: 526,18; полученное 527,15; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 8,64-8,57 (м, 1Н), 8,34 (с, 1H), 8,32 (с, 1Н), 7,86 (т, J=6,6 Гц, 1Н), 5,60 (кв, J=6,8 Гц, 1H), 4,71 (дд, J=28,0, 6,4 Гц, 1Н), 4,64-4,55 (м, 2Н), 4,52 (с, 2Н), 4,46-4,37 (м, 1H), 4,35-4,19 (м, 1H), 3,63 (т, J=4,6 Гц, 4Н), 3,25 (т, J=4,7 Гц, 4Н), 1,55 (д, J=7,1 Гц, 3H).
Этап 3.
[00470] В смесь 1-[6-(морфолин-4-карбонил)-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-2-ил]этан-1,2-диола (417 мг, 0,79 ммоль) в МеОН (6,5 мл) и Н2О (6,5 мл) добавляли NaIO4 (508 мг, 2,38 ммоль). Смесь перемешивали при кт в течение 12 ч, потом добавляли Н2О и экстрагировали смесь EtOAc. Объединенные органические слои сушили над MgSO4, фильтровали, растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением 6-(морфолин-4-карбонил)-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-2-карбальдегида (287 мг, выход 73%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H21F3N6O5: 494,15; полученное 495,00; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 9,68 (с, 1H), 8,60 (с, 1H), 8,34 (с, 2Н), 8,19 (д, J=7,5 Гц, 1H), 5,69-5,48 (м, 1H), 4,83-4,48 (м, 4Н), 3,64 (т, J=4,6 Гц, 4Н), 3,27 (т, J=4,6 Гц, 4Н), 1,60 (д, J=7,1 Гц, 3H).
Этап 4.
[00471] В смесь 6-(морфолин-4-карбонил)-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]-этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-2-карбальдегида (90 мг, 0,18 ммоль) в МеОН (0,6 мл) при 0°С добавляли NaBH4 (69 мг, 0,18 ммоль). Смесь перемешивали при 0°С в течение 30 мин, потом добавляли ледяную H2O (10 мл) и концентрировали растворитель при пониженном давлении. Остаток экстрагировали ДХМ, объединенные органические слои сушили над MgSO4, фильтровали, а растворитель концентрировали при пониженном давлении с получением [6-(морфолин-4-карбонил)-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-2-ил]-метанола (82 мг, выход 91%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H23F3N6O5: 496,17; полученное 497,6.
Этап 5.
[00472] (4-{[(1R)-1-[3-амино-5-(трифторметил)-фенил]этил]амино}-6-(морфолин-4-карбонил)-5Н,6Н,7H-пирроло[3,4-d]пиримидин-2-ил)метанол синтезировали способом, аналогичным N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амину, за исключением того, что 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-илметил)-5Н,6Н,7H,8H,9N-пиримидо[4,5-d]азепин-4-амин заменяли [6-(морфолин-4-карбонил)-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-2-ил]-метанолом. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H25F3N6O3: 466,19; полученное 467,18; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 7,64 (д, J=8,1 Гц, 1Н), 6,84 (с, 1H), 6,79 (с, 1H), 6,68 (с, 1Н), 5,57-5,49 (м, 2Н), 5,46-5,30 (м, 1H), 4,70 (т, J=5,7 Гц, 1H), 4,61-4,47 (м, 4Н), 4,30 (д, J=5,7 Гц, 2Н), 3,70-3,57 (м, 4Н), 3,29-3,19 (м, 4Н), 1,44 (д, J=7,0 Гц, 3H).
Пример 348. (R)-(4-((1-(3-(дифторметил)-2-фторфенил)этил)амино)-2-(гидроксиметил)-5,7-дигидро-6Н-пирроло[3,4-d] пиримидин-6-ил)(морфолино)метанона
[00473] (R)-(4-((1-(3-(дифторметил)-2-фторфенил)этил)амино)-2-(гидроксиметил)-5,7-дигидро-6Н-пирроло[3,4-(1]пиримидин-6-ил)(морфолино)метанон синтезировали способом, аналогичным примеру 129.

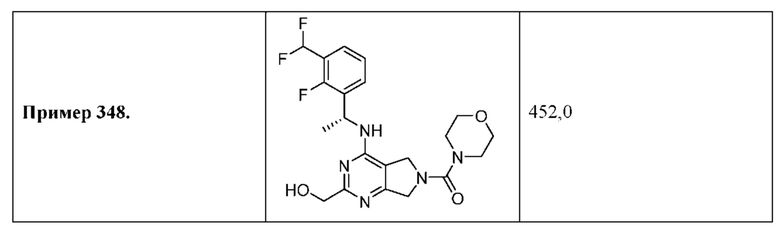
Пример 130. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-(аминометил)-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
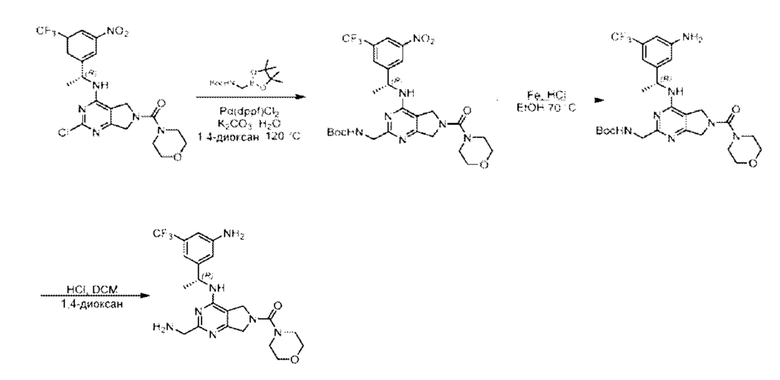
Этап 1.
[00474] В продутую Ar смесь 2-хлор-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (329 мг, 0,66 ммоль) и сложного пинаколового эфира N-Boc-аминометилбороновой кислоты (507 мг, 1,97 ммоль) в 1,4-диоксане (6,6 мл) добавляли K2CO3 (182 мг, 1,31 ммоль) в Н2О (3,9 мл). Смесь продували Ar еще в течение 15 мин, потом добавляли Pd(dppf)Cl2 (48 мг, 66 мкмоль). Смесь нагревали до 120°С под микроволновым излучением и перемешивали в течение 2 ч. Добавляли дополнительное количество сложного пинаколового эфира N-Boc-аминометилбороновой кислоты (169 мг, 0,66 ммоль) и Pd(dppf)Cl2 (24 мг, 33 мкмоль), нагревали смесь до 120°С под микроволновым излучением и перемешивали в течение 5 ч. Смесь фильтровали через слой целита®, а фильтрационный осадок промывали МеОН. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением трет-бутил N-{[6-(морфолин-4-карбонил)-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-2-ил]метил}карбамата (440 мг). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C26H32F3N7O6: 595,24; полученное 596,05.
Этап 2.
[00475] трет-бутил N-[(4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-2-ил)метил]карбамат синтезировали способом, аналогичным N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амину, за исключением того, что 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амин заменяли трет-бутил N-{[6-(морфолин-4-карбонил)-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5Н,6Н,7H-пирроло[3,4-d]пиримидин-2-ил]метил}карбаматом. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C26H34F3N7O4: 565,60; полученное 566,20.
Этап 3.
[00476] В смесь трет-бутил N-[(4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-2-ил)метил]карбамата (325 мг, 0,57 ммоль) в ДХМ (4,9 мл) при 0°С добавляли 4 М HCl в 1,4-диоксане (1,9 мл, 7,5 ммоль). Смесь оставляли нагреваться до кт и перемешивали в течение ночи, потом разделяли между ДХМ и насыщенным NaHCO3. Водную фазу экстрагировали ДХМ (× 2), объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-(аминометил)-6-(морфолин-4-карбонил)-5Н,6Н,7H-пирроло[3,4-d]пиримидин-4-амина (50 мг, выход 19%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H26F3N7O2: 465,21; полученное 465,93; 1Н ЯМР (300 МГц, ДМСО-d6] δ м. д. 7,59 (д, J=7,7 Гц, 1H), 6,84 (с, 1H), 6,79 (с, 1H), 6,67 (с, 1H), 5,52 (с, 2Н), 5,37-5,26 (м, 1H), 4,59-4,45 (м, 4Н), 3,63 (т, J=4,6 Гц, 4Н), 3,55 (с, 2Н), 3,24 (т, J=4,7 Гц, 4Н), 2,02 (шир. с, 2Н), 1,44 (д, J=7,0 Гц, 3H).
Пример 349. (R)-(2-(аминометил)-4-((1-(3-(дифторметил)фенил)этил)амино)-5,7-дигидро-6Н-пирроло[3,4-d]пиримидин 6-ил)(морфолино)метанон
[00477] (R)-(2-(аминометил)-4-((1-(3-(дифторметил)фенил)этил)амино)-5,7-дигидро-6Н-пирроло[3,4-d]пиримидин-6-ил)(морфолино)метанон синтезировали способом, аналогичным примеру 130.
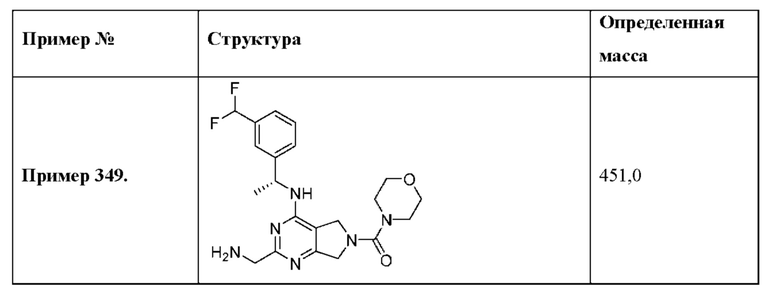
Пример 350. (R)-(2-(аминометил)-4-((1-(3-(трифторметил)фенил)этил)амино)-5,7-дигидро-6H-пирроло[3,4-d]пиримидин-6-ил)(4-метокситетрагидро-2H-пиран-4-ил)метанон
[00478] (R)-(2-(аминометил)-4-((1-(3-(трифторметил)фенил)этил)амино)-5,7-дигидро-6Н-пирроло[3,4-d]пиримидин-6-ил)(4-метокситетрагидро-2Н-пиран-4-ил)метанон синтезировали способом, аналогичным примеру 130.
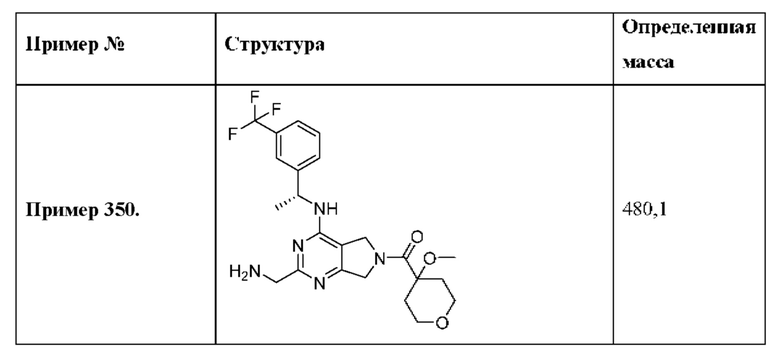
Пример 131. Синтез N-[(1R)-1-[3-амино-5-(трифтор-метил)фенил]этил]-2-бром-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
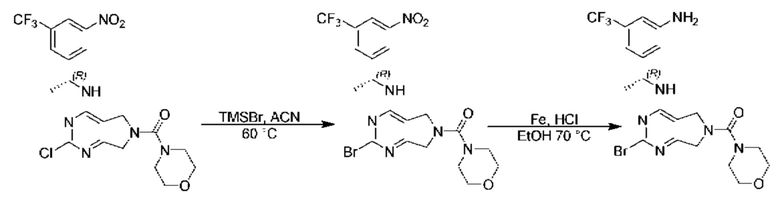
Этап 1.
[00479] В смесь 2-хлор-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]-этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (200 мг, 0,4 ммоль) в MeCN (5 мл) добавляли TMSBr (122 мг, 0,8 ммоль). Смесь нагревали до 60°С и перемешивали в течение ночи. Растворитель концентрировали при пониженном давлении, остаток разводили в водном NaHCO3 и экстрагировали EtOAc (× 3). Объединенные органические слои сушили над безводным Na2SO4, фильтровали, а растворитель концентрировали при пониженном давлении с получением 2-бром-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (248 мг). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H20BrF3N6O4: 544,07; полученное 546,80; 1H ЯМР (300 МГц, ДМСО-d6) δ м. д. 8,55 (т, J=1,9 Гц, 1H), 8,37 (д, J=2,0 Гц, 1H), 8,27 (с, 2Н), 5,53-5,34 (м, 1H), 4,52 (кв, J=14,5, 13,3 Гц, 4Н), 3,62 (т, J=4,6 Гц, 4Н), 3,24 (т, J=4,6 Гц, 4Н), 1,55 (д, J=6,8 Гц, 3H).
Этап 2.
[00480] N-[(1R)-1-[3-амино-5-(трифтор-метил)фенил]этил]-2-бром-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амин синтезировали способом, аналогичным N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амину, за исключением того, что 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амин заменяли 2-бром-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амином. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H22BrF3N6O2: 514,09; полученное 515,04; 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,09 (д, J=7,6 Гц, 1H), 6,81 (с, 1Н),6,76 (с, 1Н), 6,71 (д, J=1,9 Гц, 1Н), 5,57 (с, 2Н), 5,18 (т, J=7,1 Гц, 1Н), 4,64-4,38 (м, 4Н), 3,62 (т, J=4,6 Гц, 4Н), 3,23 (т, J=4,7 Гц, 4Н), 1,44 (д, J=7,0 Гц, 3H).
Пример 132. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-(дифторметил)-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
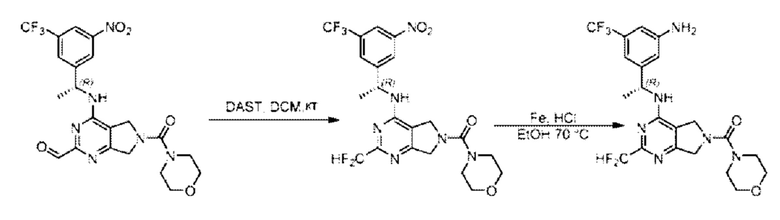
Этап 1.
[00481] В смесь 6-(морфолин-4-карбонил)-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-2-карбальдегида (257 мг, 0,52 ммоль) в ДХМ (5,1 мл) добавляли DAST (42 мг, 0,26 ммоль). Смесь перемешивали при кт в течение ночи, потом добавляли насыщенный NaHCO3 и экстрагировали смесь ДХМ. Объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали растворитель при пониженном давлении с получением 2-(дифторметил)-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (219 мг, выход 82%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H21F5N6O4: 516,15; полученное 517,0.
Этап 2.
[00482] N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-(дифторметил)-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амин синтезировали способом, аналогичным N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амину, за исключением того, что 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амин заменяли 2-(дифторметил)-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амином. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H23F5N6O2: 486,18; полученное 487,19; 1H ЯМР (400 МГц, ДМСО-d6) δ м. д. 8,00 (д, J=8,0 Гц, 1H), 6,85 (с, 1H), 6,80 (с, 1H), 6,70 (с, 1H), 6,59 (т, J=54,6 Гц, 1H), 5,55 (с, 2Н), 5,38-5,25 (м, 1H), 4,65-4,53 (м, 4Н), 3,64 (т, J=4,6 Гц, 4Н), 3,26 (т, J=4,6 Гц, 4Н), 1,48 (д, J=7,0 Гц, 3H); 19F ЯМР (376 МГц, ДМСО-d6) δ м. д. -61,3, -118,2 (дд, J=54,6, 6,1 Гц).
Пример 133. Синтез N-[(1R)-1-[3-амино-5-(трифтор-метил)фенил]этил]-6-(морфолин-4-карбонил)-2-(оксетан-3-ил-окси)-5H,6H,7H-пирроло [3,4-d]пиримидин-4-амина
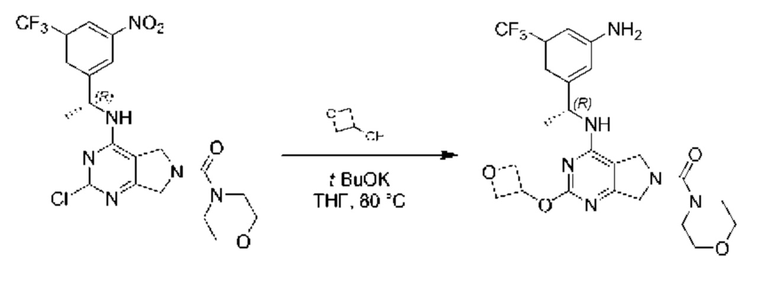
Этап 1.
[00483] В смесь 3-оксетанола (222 мг, 2,99 ммоль) в ТГФ (8,6 мл) добавляли трет-бутоксид калия (363 мг, 2,99 ммоль). Смесь нагревали до 50°С и перемешивали в течение 15 мин, потом охлаждали до кт и добавляли (R)-(4-((1-(3-амино-5-(трифторметил)фенил)этил)амино)-2-хлор-5,7-дигидро-6Н-пирроло[3,4-с1]пиримидин-6-ил)(морфолино)метанон (300 мг, 0,6 ммоль) в ТГФ (5 мл). Смесь нагревали до 80°С и перемешивали в течение ночи, потом добавляли Н2О и экстрагировали смесь EtOAc. Объединенные органические экстракты сушили над безводным Na2SO4, фильтровали и удаляли растворитель при пониженном давлении. Неочищенный продукт растирали с i-PrOH, фильтровали, растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифтор-метил)фенил]этил]-6-(морфолин-4-карбонил)-2-(оксетан-3-ил-окси)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (11,7 мг, выход 4%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C23H27F3N6O4: 508,20; полученное 509,22; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 7,77 (д, J=7,5 Гц, 1H), 6,80 (с, 1H), 6,74 (с, 1H), 6,68 (с, 1H), 5,56 (с, 2Н), 5,28 (т, J=5,6 Гц, 1H), 5,15-5,04 (м, 1H), 4,81 (т, J=6,9 Гц, 1Н), 4,60 (т, J=7,0 Гц, 1H), 4,55-4,45 (м, 3H), 4,43 (с, 2Н), 4,34-4,23 (м, 1H), 3,62 (т, J=4,7 Гц, 4Н), 3,23 (т, J=4,7 Гц, 4Н), 1,42 (д, J=7,0 Гц, 3H).
Пример 134. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-йодо-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
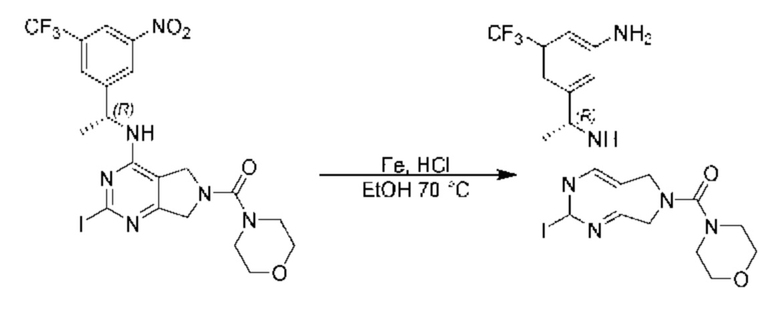
Этап 1.
[00484] N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-йод-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амин синтезировали способом, аналогичным N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амину, за исключением того, что 2-хлор-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-7-(оксолан-3-илметил)-5H,6H,7H,8H,9H-пиримидо[4,5-d]азепин-4-амин заменяли 1:1 смесью 2-йод-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина и 2-хлор-6-(морфолин-4-карбонил)-H-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H22F6N6O2: 562,33; полученное 563,11; 1Н ЯМР (400 МГц, ДМСО-d6) δ м. д. 7,98 (д, J=7,8 Гц, 1H), 6,82 (с, 1H), 6,75 (с, 1H), 6,71 (с, 1H), 5,57 (с, 2Н), 5,16 (т, J=7,4 Гц, 1H), 4,49 (д, J=15,4 Гц, 4Н), 3,61 (т, J=4,6 Гц, 4Н), 3,23 (т, J=4,8 Гц, 4Н), 1,44 (д, J=7,0 Гц, 3H).
Пример 135. Синтез N-{[3-амино-5-(трифторметил)фенил]-метил}-2-хлор-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло-[3,4-d]пиримидин-4-амина
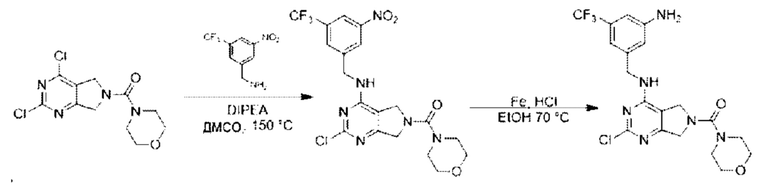
Этап 1.
[00485] Смесь 4-{2,4-дихлор-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбонил}морфолина (250 мг, 0,82 ммоль) и HCl-соли [3-нитро-5-(трифторметил)фенил]метанамина (222 мг, 0,87 ммоль) в безводном ДМСО (7,5 мл) продували Ar. Добавляли ДИПЭА (575 мкл, 3,3 ммоль) и нагревали смесь до 150°С под микроволновым излучением в течение 1 ч. Добавляли H2O и Et2O и экстрагировали водный слой Et2O (× 3). Объединенные органические слои промывали H2O, сушили над безводным Na2SO4, фильтровали, а растворитель концентрировали при пониженном давлении с получением 2-хлор-6-(морфолин-4-карбонил)-N-{[3-нитро-5-(трифторметил)-фенил]метил}-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (200 мг, выход 50%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C19H18ClF3N6O4: 486,10; полученное 487,10.
Этап 2.
[00486] Порошок Fe (126 мг, 2,26 ммоль) и 1 М HCl (1,64 мл, 1,64 ммоль) добавляли в смесь 2-хлор-6-(морфолин-4-карбонил)-N-{[3-нитро-5-(трифторметил)-фенил]метил}-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (200 мг, 0,41 ммоль) в EtOH (4,1 мл). Смесь нагревали до 70°С и перемешивали в течение ночи. Смесь фильтровали через целит®, фильтрационный осадок промывали МеОН, а растворитель концентрировали при пониженном давлении. Остаток растворяли в ДХМ, промывали NaHCO3 и экстрагировали водный слой ДХМ (× 3). Объединенные органические слои сушили над безводным Na2SO4, растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением N-{[3-амино-5-(трифторметил)фенил]метил}-2-хлор-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (32 мг, выход 17%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C19H20ClF3N6O2: 456,13; полученное 457,14; 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,31 (т, J=5,7 Гц, 1Н), 6,81-6,41 (м, 3H), 5,60 (с, 2Н), 4,59-4,43 (м, 6Н), 3,61 (т, J=4,6 Гц, 4Н), 3,23 (т, J=4,2 Гц, 4Н).
Пример 136. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6-(морфолин-4-карбонил)-5H,6H,7H,8H,9H-пиримидо[5,4-с]азепин-4-амина
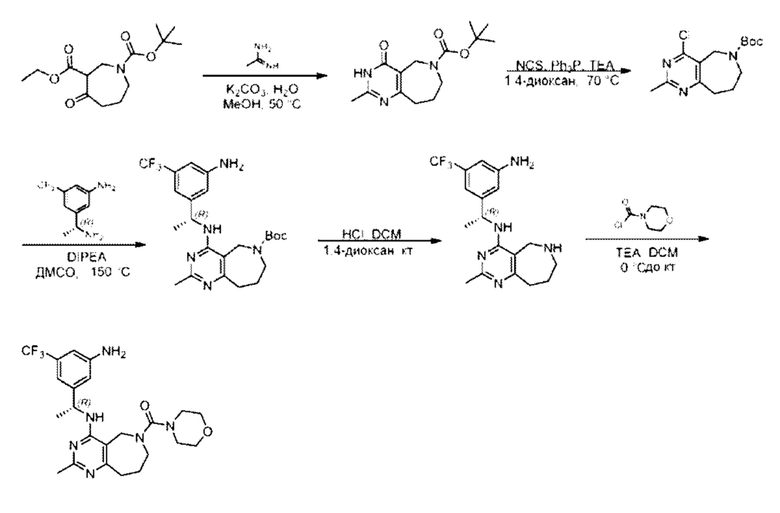
Этап 1.
[00487] Смесь 1-трет-бутил 3-этил 4-оксоазепан-1,3-дикарбоксилата (3,0 г, 10,5 ммоль), HCl-соли ацетамидина (1,19 г, 12,61 ммоль) и K2CO3 (2,18 г, 15,77 ммоль) в МеОН (42 мл) и Н2О (12 мл) в атмосфере Ar нагревали до 50°С и перемешивали в течение ночи. Смесь подкисляли 1 М HCl и экстрагировали ДХМ (9 × 100 мл). Объединенные органические слои промывали солевым раствором, сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением трет-бутил 2-метил-4-оксо-3H,4H,5H,6H,7H,8H,9H-пиримидо[5,4-с]азепин-6-карбоксилата (1,89 г, выход 64%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C14H21N3O3: 279,16; полученное 280,15; 1Н ЯМР (300 МГц, CDCl3) δ м. д. 13,09 (с, 1Н), 4,54-4,38 (м, 2Н), 3,69-3,62 (м, 2Н), 2,96-2,85 (м, 2Н), 2,47 (с, 3H), 1,99-1,88 (м, 2Н), 1,43 (с, 9Н).
Этап 2.
[00488] Смесь Ph3P (1,83 г, 6,98 ммоль) и N-хлорсукцинимида (0,93 г, 6,98 ммоль) в 1,4-диоксане (39 мл) перемешивали в атмосфере Ar при кт в течение 30 мин. Добавляли трет-бутил 2-метил-4-оксо-3H,4H,5H,6H,7H,8H,9H-пиримидо[5,4-с]азепин-6-карбоксилат (1,3 г, 4,65 ммоль), нагревали смесь до 70°С и перемешивали в течение 4 ч. Добавляли Et3N (130 мкл) и концентрировали растворитель при пониженном давлении. Остаток разделяли между H2O и ДХМ и экстрагировали водный слой ДХМ (3 × 40 мл). Объединенные органические слои сушили над безводным Na2SO4, фильтровали, растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением mpem-бутил 4-хлор-2-метил-5H,6H,7H,8H,9H-пиримидо[5,4-с]азепин-6-карбоксилата (1,14 г, выход 82%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C14H20ClN3O2: 297,12; полученное 298,05; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 4,70-4,59 (м, 2Н), 3,62 (т, J=5,6 Гц, 2Н), 3,11-2,98 (м, 2Н), 2,53 (с, 3H), 1,83-1,72 (м, 2Н), 1,32 (с, 9Н).
Этап 3.
[00489] Смесь трет-бутил 4-хлор-2-метил-5Н,6Н,7H,8H,9H-пиримидо[5,4-с]азепин-6-карбоксилата (850 мг, 2,86 ммоль) и HCl-соли 3-(1-аминоэтил)-5-(трифторметил)анилина (723 мг, 3,0 ммоль) растворяли в ДМСО (17 мл). Смесь продували Ar и одной частью добавляли ДИПЭА (2 мл, 11,4 ммоль). Смесь нагревали до 150°С под микроволновым излучением и перемешивали в течение 5 ч, потом разводили Et2O и H2O и экстрагировали водный слой Et2O (16 × 50 мл). Объединенные органические слои сушили над безводным Na2SO4, фильтровали, растворитель концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением трет-бутил 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-метил-5H,6H,7H,8H,9H-пиримидо[5,4-с]азепин-6-карбоксилата (140 мг, выход 11%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C23H30F3N5O2: 465,23; полученное 466,4.
Этап 4.
[00490] В смесь mpem-бутил 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-метил-5H,6H,7H,8H,9H-пиримидо[5,4-с]азепин-6-карбоксилата (130 мг, 0,28 ммоль) в ДХМ (2,3 мл) в атмосфере Ar добавляли 4 М НС1 в 1,4-диоксане (0,9 мл, 3,63 ммоль). Смесь перемешивали при кт в течение ночи, а растворитель концентрировали при пониженном давлении с получением HCl-соли N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-5H,6H,7H,8H,9H-пиримидо[5,4-с]азепин-4-амина (86 мг, выход 84%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C18H22F3N5: 365,18; полученное 366,25; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 9,50 (м, 1Н), 7,13 (с, 1Н), 7,08 (с, 1Н), 6,94 (д, J=10,9 Гц, 1Н), 6,89 (с, 1Н), 5,52-5,44 (м, 1Н), 4,53-4,48 (м, 2Н), 3,40-3,33 (м, 2Н), 3,19-3,14 (м, 2Н), 1,98-1,91 (м, 2Н), 1,57 (д, J=7,0 Гц, 3Н), 1,35 (с, 3Н).
Этап 5.
[00491] В смесь HCl-соли N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-5Н,6Н,7H,8H,9H-пиримидо[5,4-с]азепин-4-амина (0,12 г, 0,33 ммоль) в ДХМ (3,6 мл) и Et3N (0,23 мл, 1,64 ммоль) при 0°С в атмосфере Ar добавляли раствор морфолин-4-карбонилхлорида (52 мг, 0,34 ммоль) в ДХМ (0,2 мл). Смесь нагревали до кт и перемешивали в течение ночи, потом растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-метил-6-(морфолин-4-карбонил)-5H,6H,-7H,8H,9H-пиримидо[5,4-с]азепин-4-амина (27 мг, выход 17%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C23H29F3N6O2: 478,23; полученное 479,2; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 7,05 (д, J=7,9 Гц, 1Н), 6,92 (с, 1Н), 6,85 (с, 1Н), 6,67 (с, 1Н), 5,46 (с, 2Н), 5,28 (т, J=7,2 Гц, 1Н), 4,22 (с, 2Н), 3,57-3,46 (м, 6Н), 3,04-2,97 (м, 5Н), 2,77 (д, J=8,7 Гц, 3Н), 2,22 (с, 3Н), 1,83-1,71 (м, 2Н), 1,44 (д, J=7,0 Гц, 3Н).
Пример 137. Синтез 2-хлор-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-(трифторметил)фенил]этил]-5Н,6Н,7Н-пирроло [3,4-d]пиримидин-4-амина
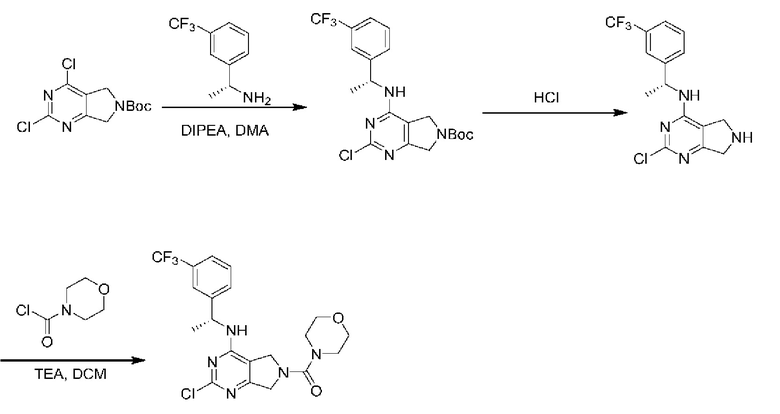
Этап 1.
[00492] В смесь HCl-соли (1Н)-1-[3-(трифторметил)фенил]этан-1-амина (388 мг, 1,71 ммоль) и трет-бутил 2,4-дихлор-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбоксилата (500 мг, 1,72 ммоль) в ДМА (1,72 мл) добавляли ДИПЭА (598 мкл, 3,44 ммоль). Смесь перемешивали при кт в течение 1 ч, потом разводили H2O и экстрагировали EtOAc. Объединенные органические слои промывали солевым раствором, сушили над MgSO4, фильтровали, а растворитель удаляли при пониженном давлении с получением трет-бутил 2-хлор-4-{[(1Н)-1-[3-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбоксилата (673 мг), который использовали на следующем этапе без дополнительной очистки. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H23ClF3N4O2: 443,2; полученное 443,4.
Этап 2.
[00493] трет-бутил 2-хлор-4-{[(1R)-1-[3-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-6-карбоксилат (673 мг, 1,51 ммоль) растворяли в 4 М HCl в 1,4-диоксане/МеОН (3 мл). Смесь нагревали до 40°С и перемешивали в течение 1 ч, потом растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением 2-хлор-N-[(1R)-1-[3-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (181 мг, выход 35%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C15H15ClF3N4: 343,1; полученное 343,2.
Этап 3.
[00494] В смесь 2-хлор-N-[(1R)-1-[3-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (90 мг, 0,26 ммоль) в ДХМ (0,7 мл) при 0°С добавляли раствор морфолин-4-карбонилхлорида (1 мл; 0,79 ммоль) и Et3N(180 мкл, 1,30 ммоль). Смесь оставляли нагреваться до кт и перемешивали в течение 1 ч, потом растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением 2-хлор-6-(морфолин-4-карбонил)-N-[(1Н)-1-[3-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (29 мг, выход 24%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H22ClF3N5O2: 456,1; полученное 456,5; 1Н ЯМР (500 МГц, Метанол-d4) δ м. д. 7,71 (д, J=2,1 Гц, 1Н), 7,68-7,64 (м, 1Н), 7,56-7,49 (м, 2Н), 5,43 (кв, J=7,1 Гц, 1Н), 4,62 (д, J=2,5 Гц, 2Н), 4,56 (дт, J=5,0, 2,2 Гц, 2Н), 3,74-3,69 (м, 4Н), 3,37-3,33 (м, 4Н), 1,59 (д, J=7,0 Гц, 3Н).
[00495] Примеры в таблице 5 ниже синтезировали способом, аналогичным примеру 137.

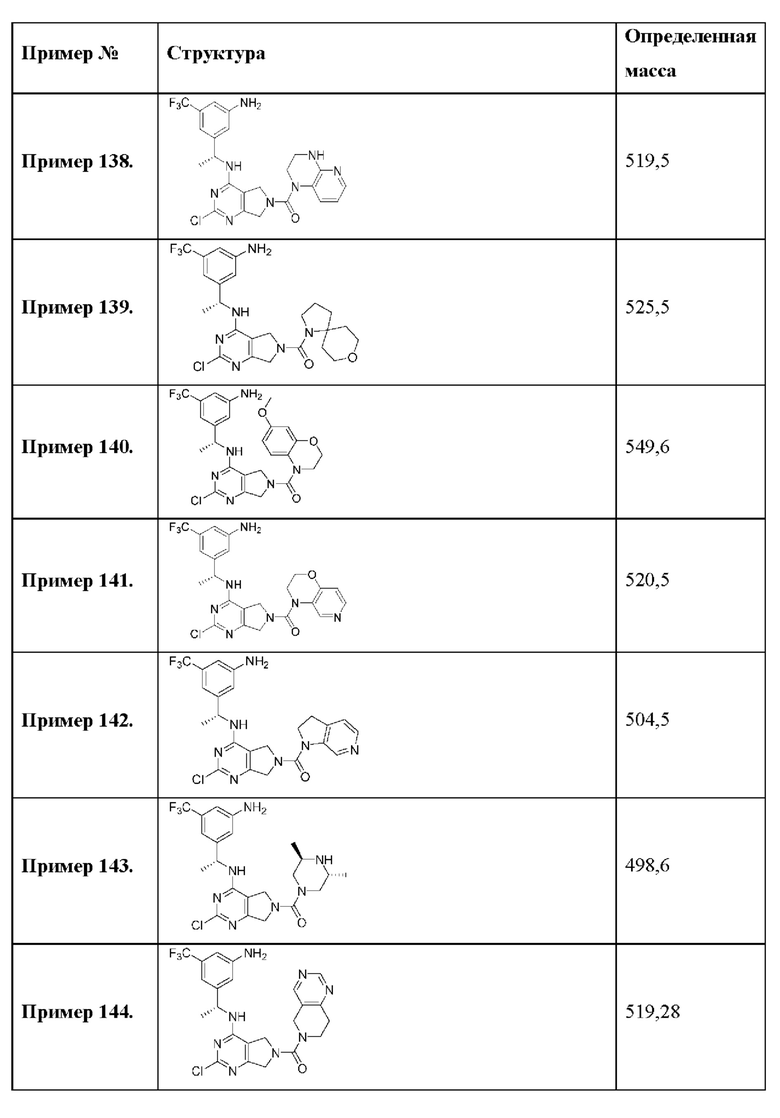
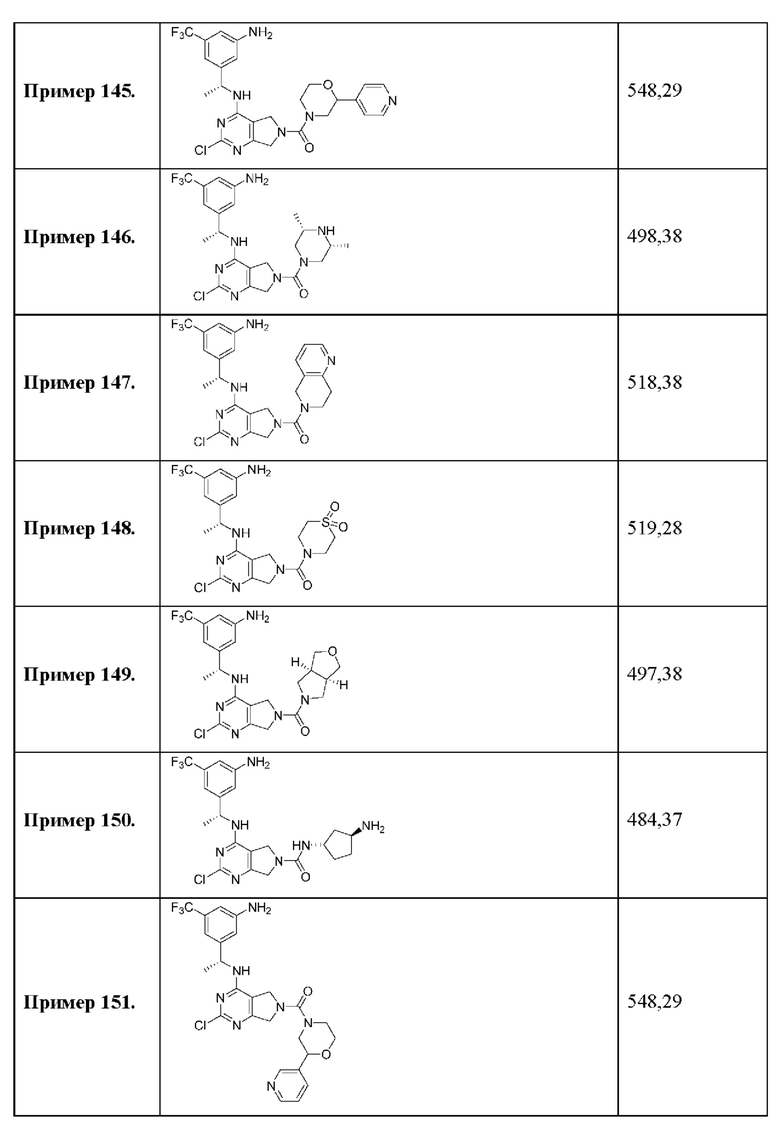
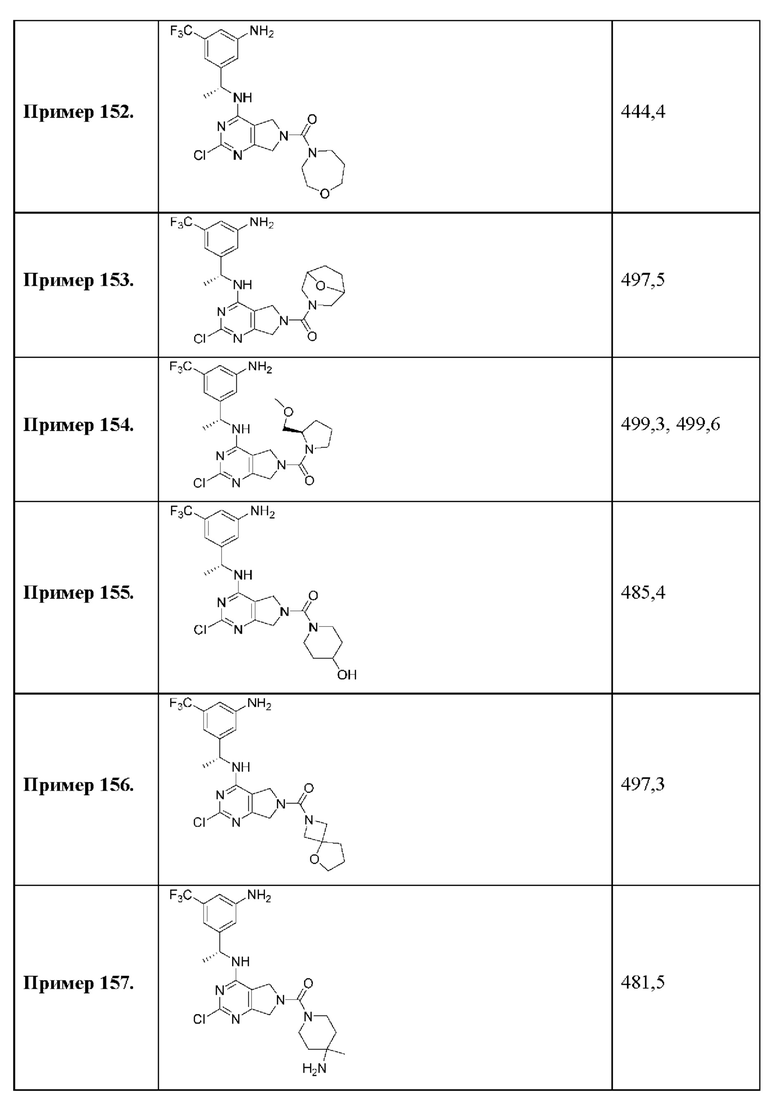
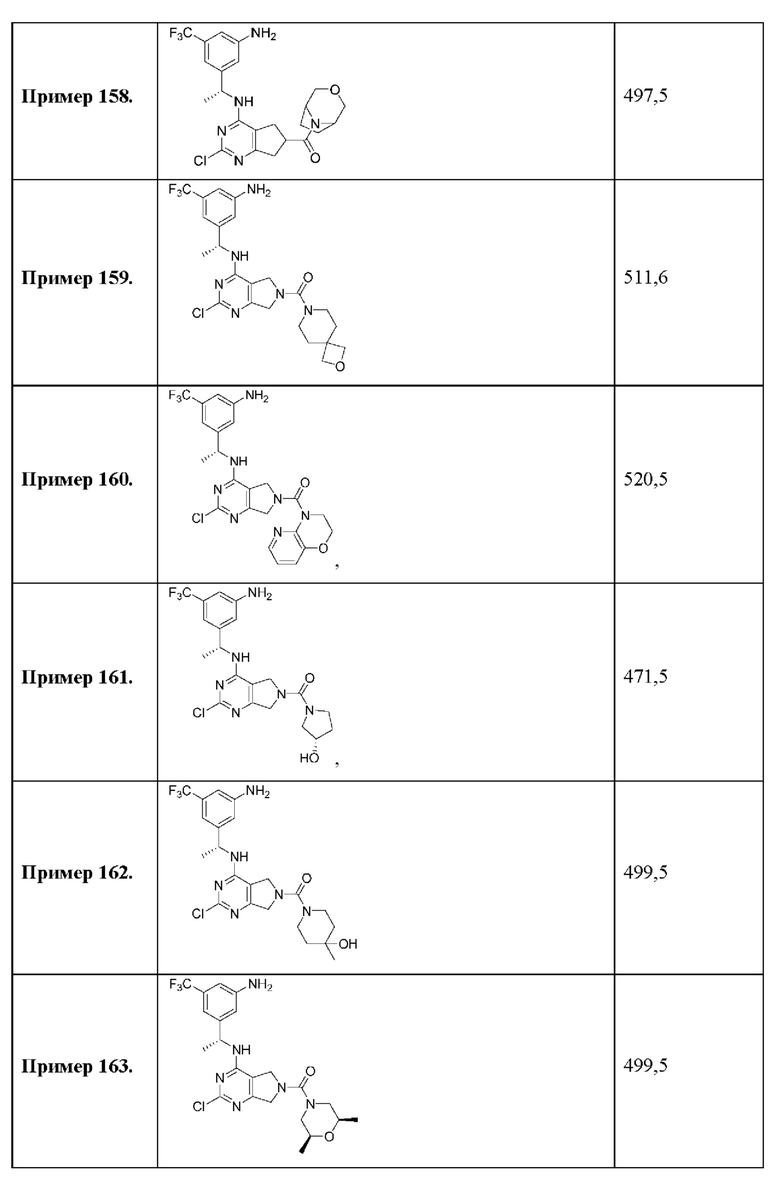
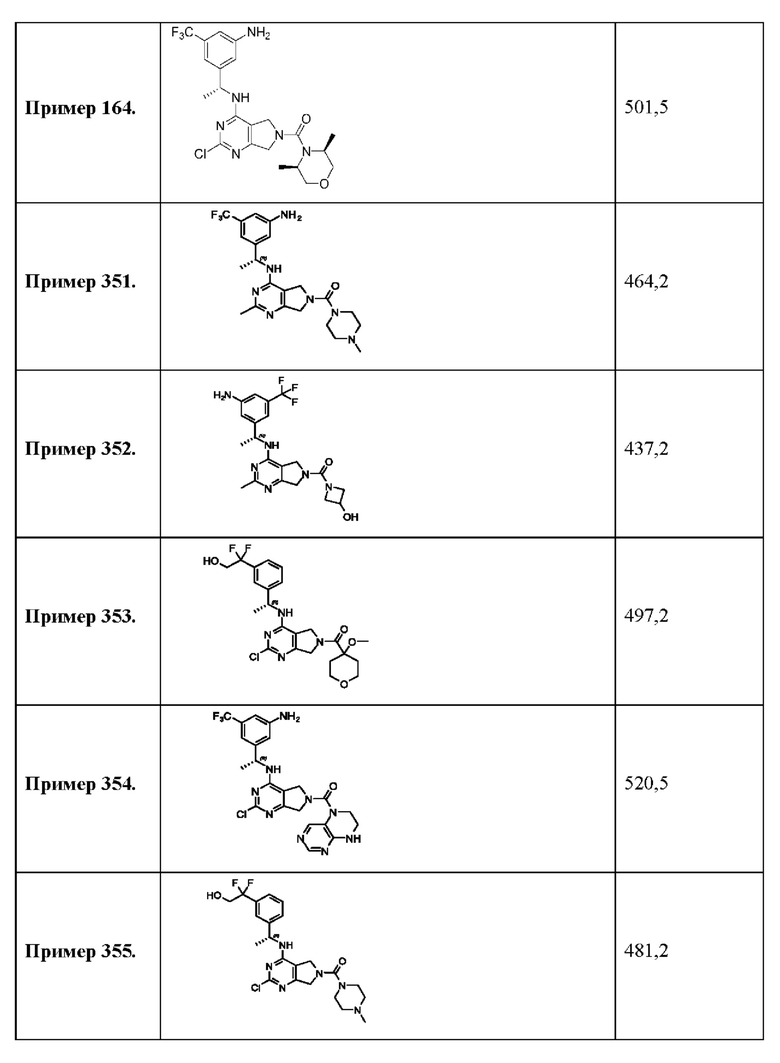
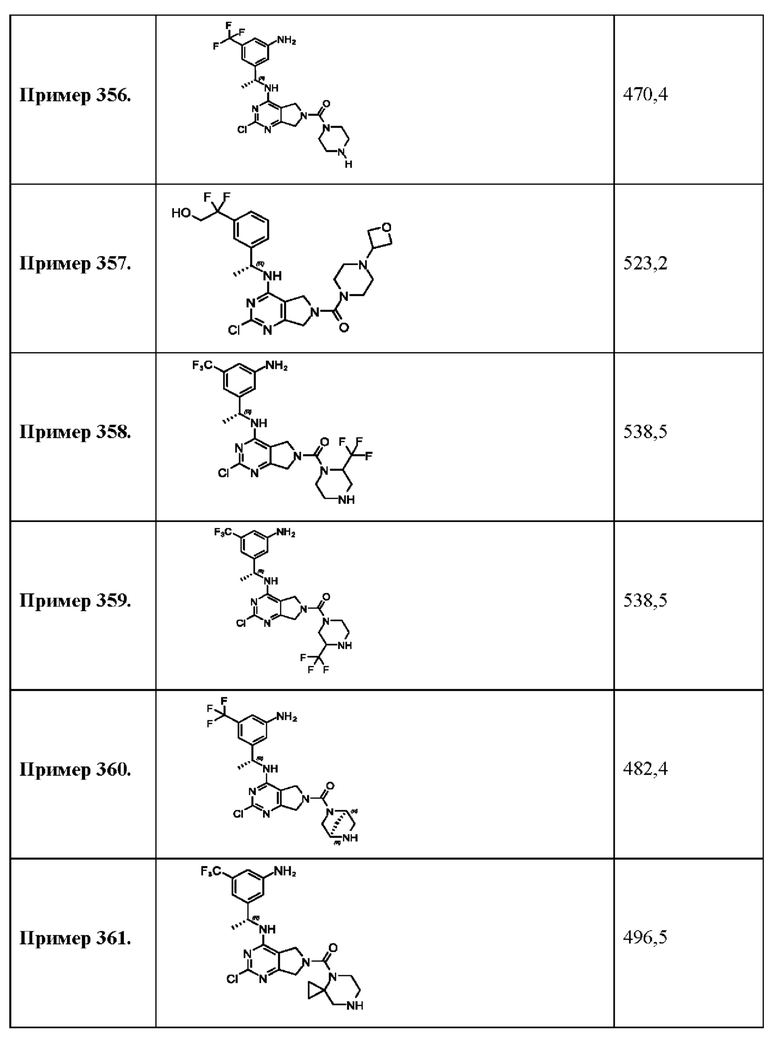
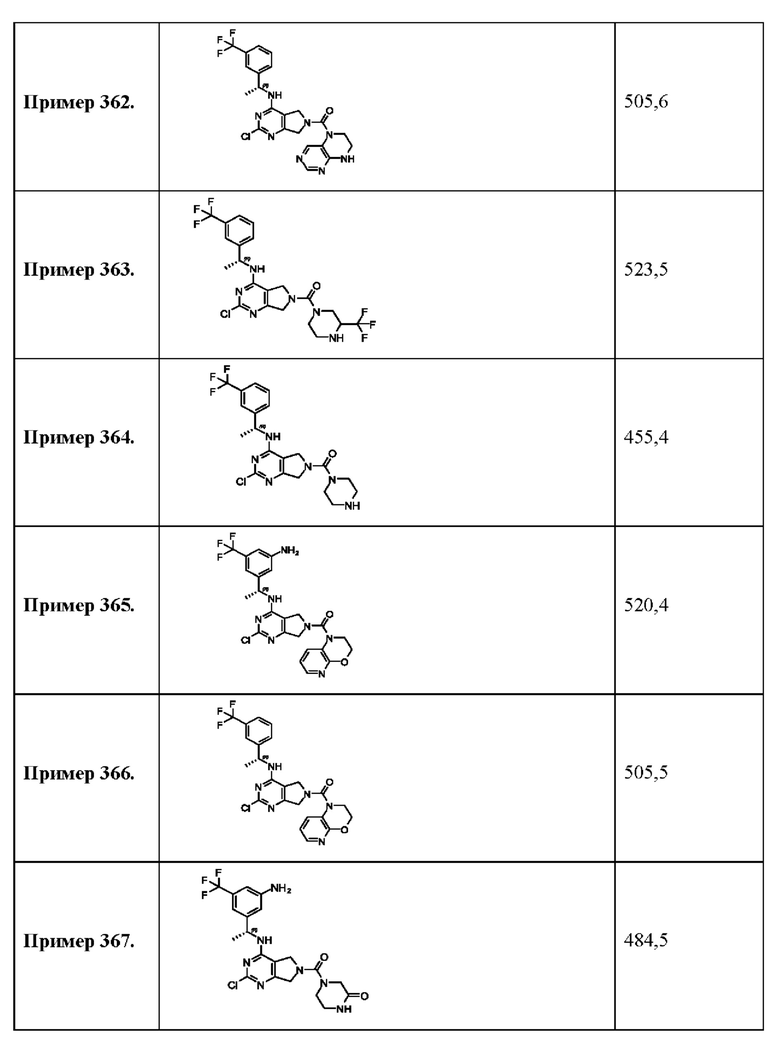
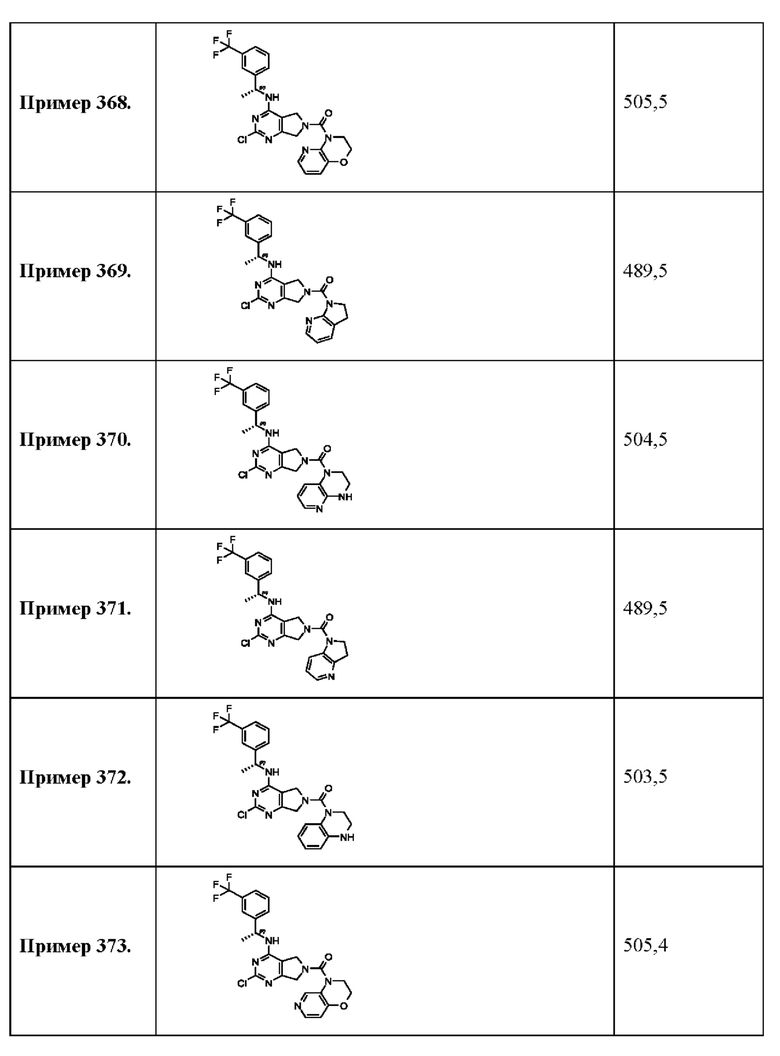
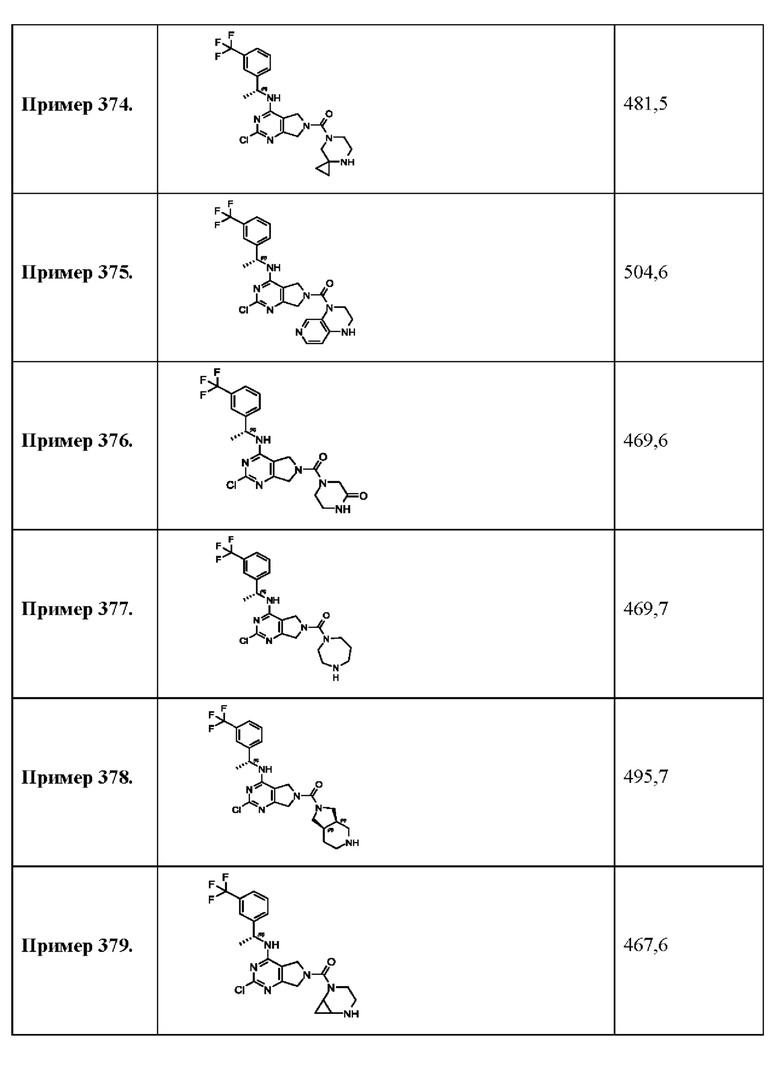
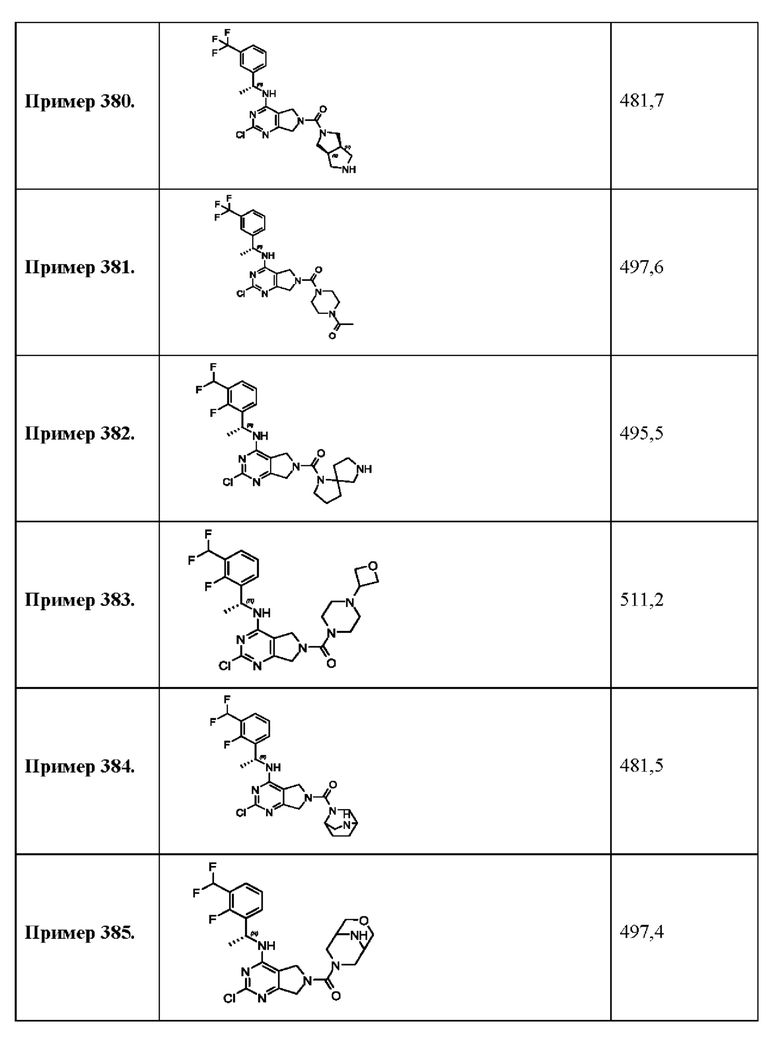
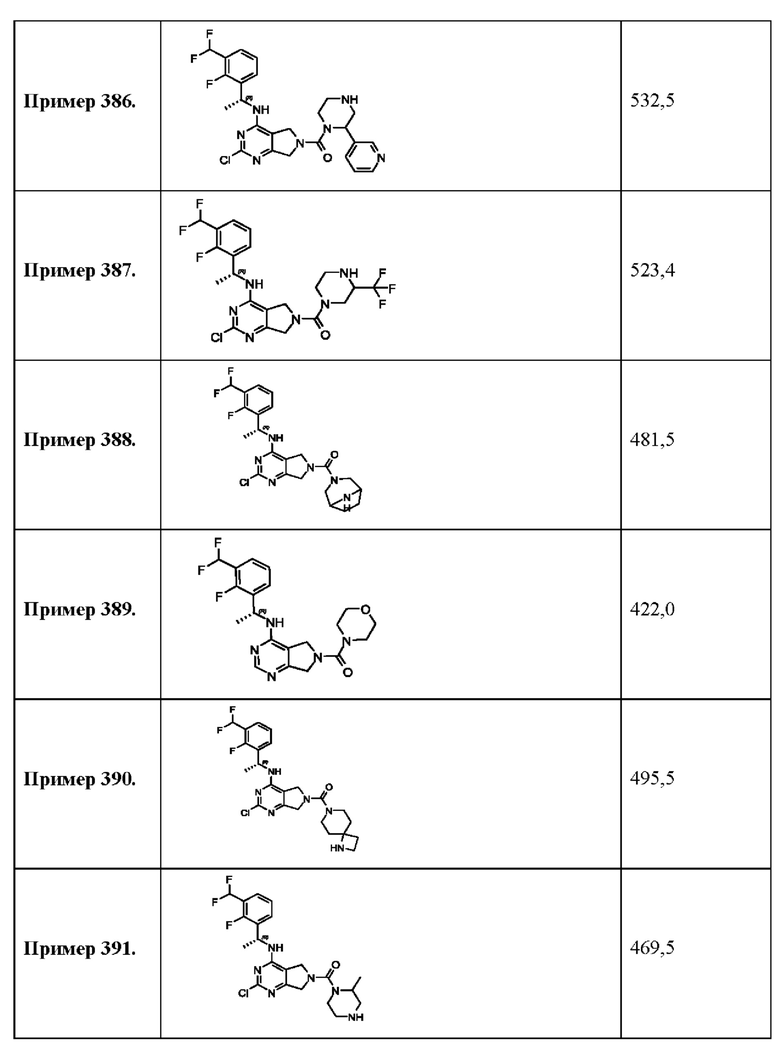
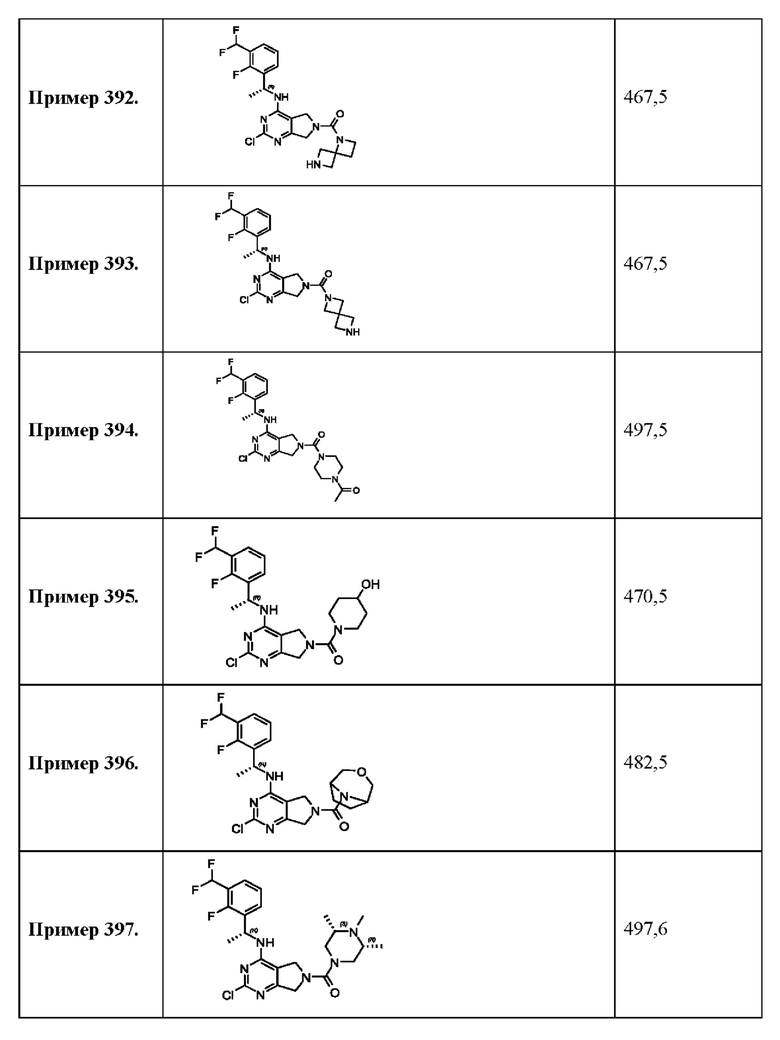
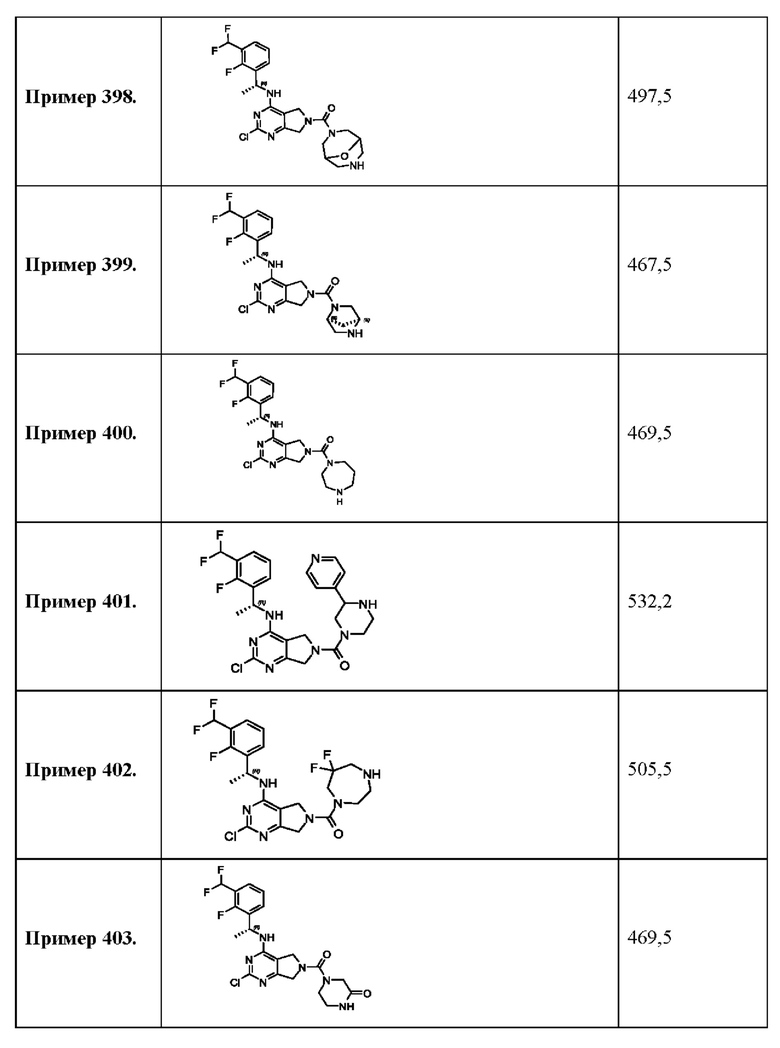
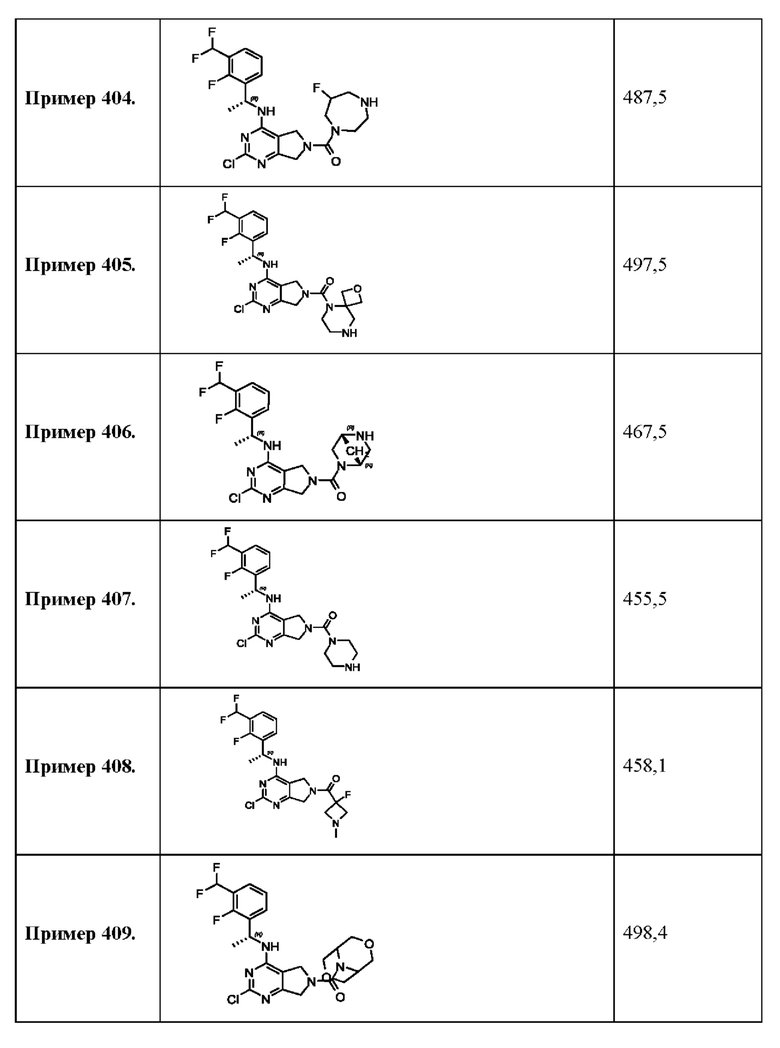
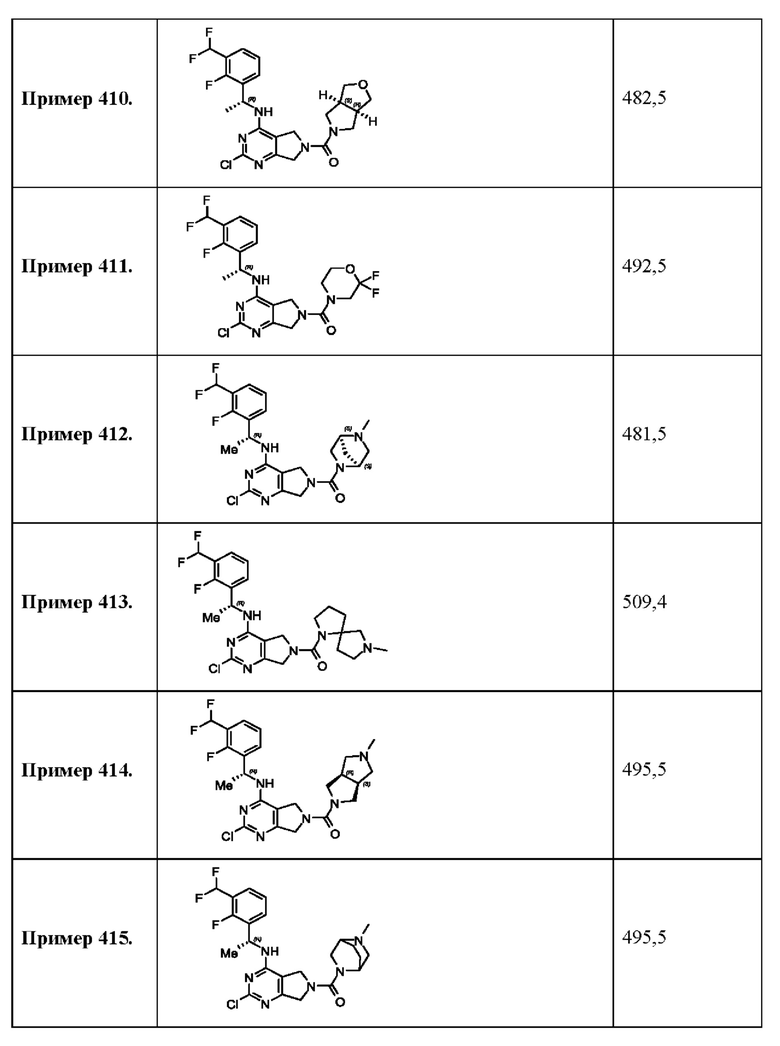
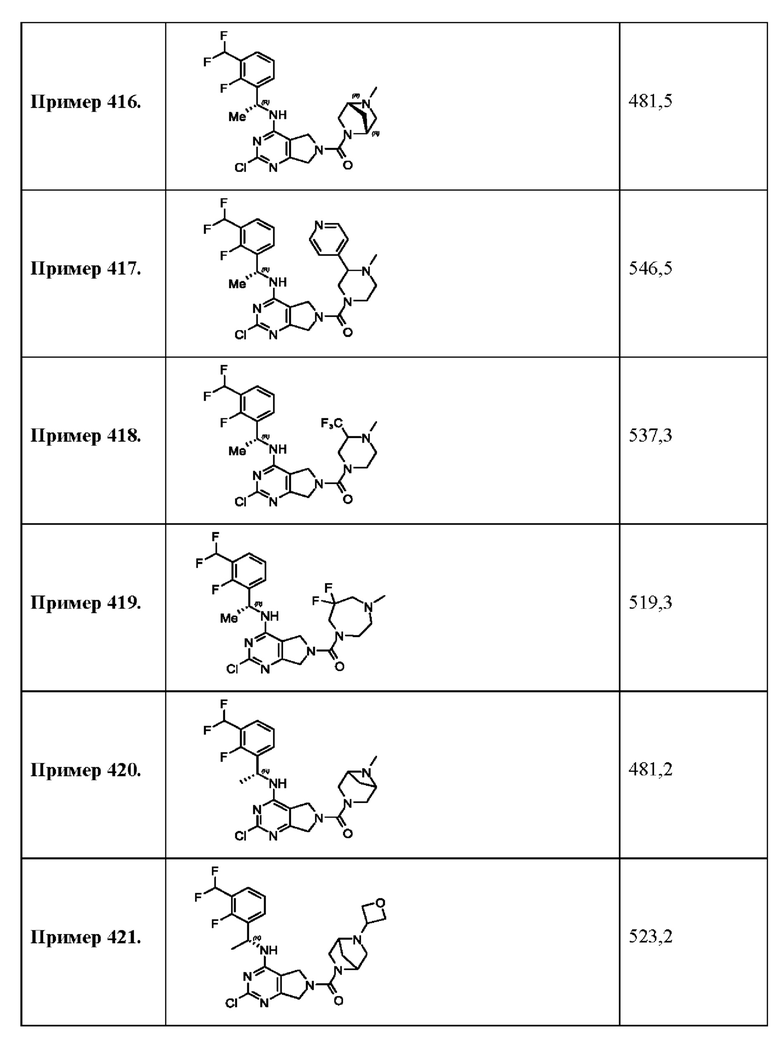
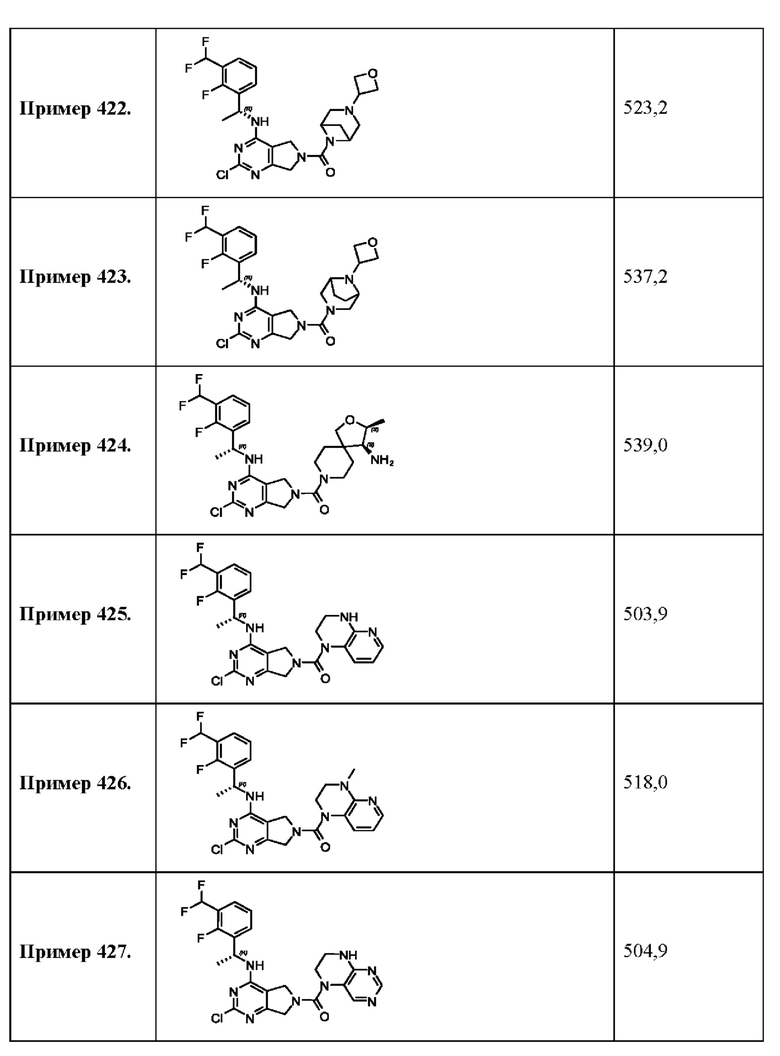
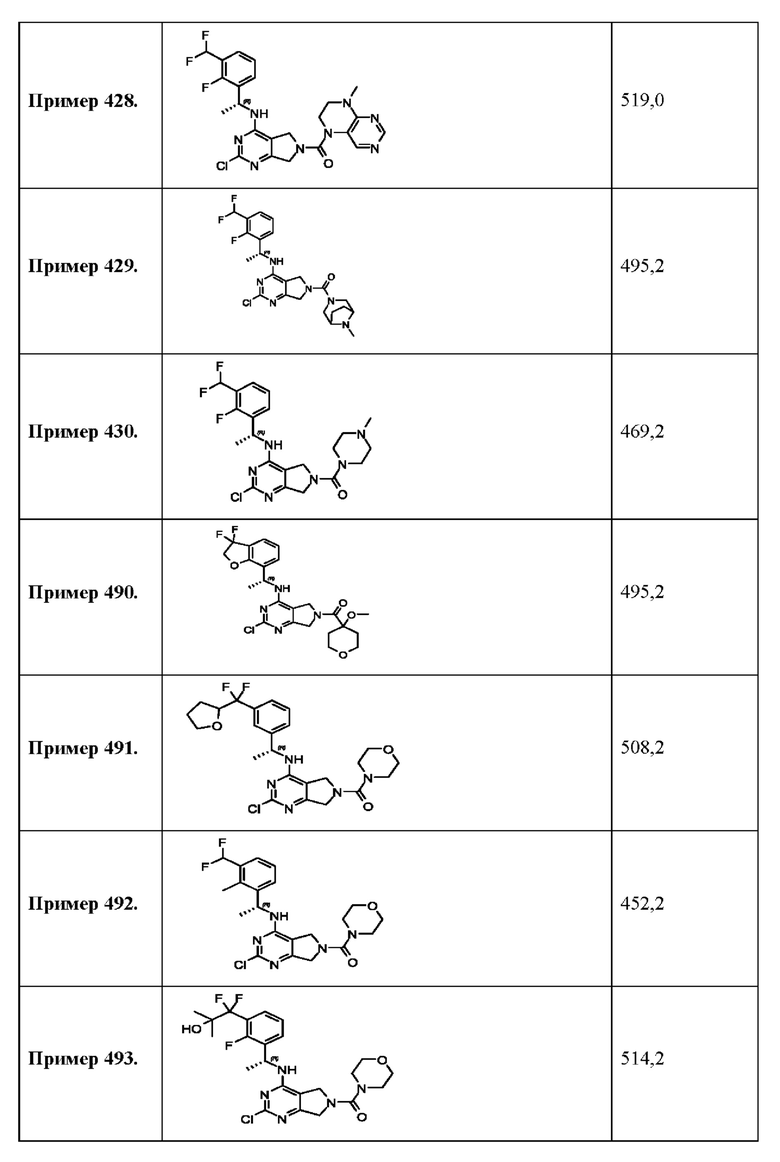
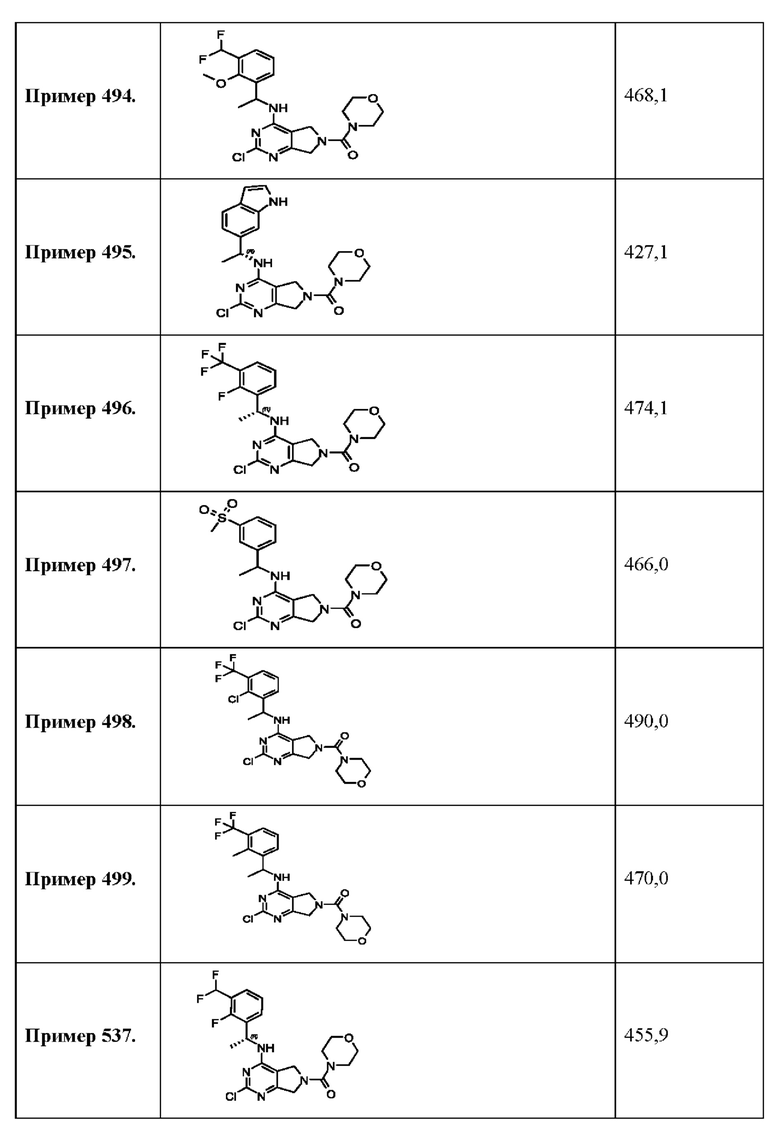
Пример 165. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-(морфолин-4-карбонил)-5,6,7,8-тетрагидрохиназолин-4-амина
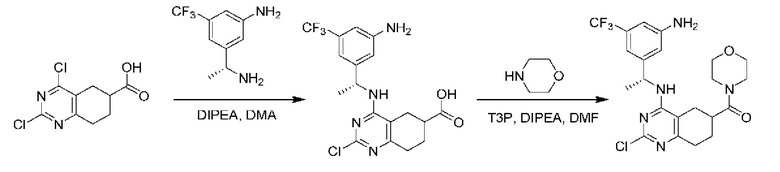
Этап 1.
[00496] В смесь 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилина (82 мг, 0,40 ммоль) и 2,4-дихлор-5,6,7,8-тетрагидрохиназолин-6-карбоновой кислоты (100 мг, 0,40 ммоль) в ДМА (1 мл) добавляли ДИПЭА (140 мкл, 0,81 ммоль). Смесь нагревали до 40°С и перемешивали в течение ночи, а растворитель удаляли при пониженном давлении с получением 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-хлор-5,6,7,8-тетрагидрохиназолин-6-карбоновой кислоты (167 мг), которую использовали на следующем этапе без дополнительной очистки. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C18H19ClF3N4O2: 415,1; полученное 415,4.
Этап 2.
[00497] В смесь 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-хлор-5,6,7,8-тетрагидрохиназолин-6-карбоновой кислоты (167 мг, 0,40 ммоль) и морфолина(35 мкл, 0,40 ммоль) в ДМФ (2 мл) добавляли ДИПЭА (210 мкл, 1,21 ммоль) и Т3Р, 50% масс. в ДМФ (384 мкл, 0,61 ммоль). Смесь перемешивали при кт в течение 1 ч, потом смесь разводили Н2О (по меньшей мере 25% по объему) и очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-(морфолин-4-карбонил)-5,6,7,8-тетрагидрохиназолин-4-амина (42 мг, выход 21%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H26ClF3N5O2: 484,2; полученное 484,4; 1H ЯМР (500 МГц, Метанол-d4) δ м. д. 6,94 (с, 1Н), 6,90 (дт, J=7,4, 1,9 Гц, 1Н), 6,80 (т, J=1,9 Гц, 1Н), 5,35 (дт, J=12,2, 6,9 Гц, 1Н), 3,67 (дддд, J=23,6, 19,2, 7,8, 5,0 Гц, 8Н), 3,15 (м, 1Н), 2,82-2,62 (м, 2Н), 2,58 (дд, J=8,9, 6,8 Гц, 2Н), 2,06-1,94 (м, 1Н), 1,84 (дтд, J=13,4, 11,2, 5,5 Гц, 1Н), 1,54 (дд, J=7,1, 1,1 Гц, 3Н).
Пример 166 (также пример 48). Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-6-(азетидин-3-сульфонил)-2-хлор-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
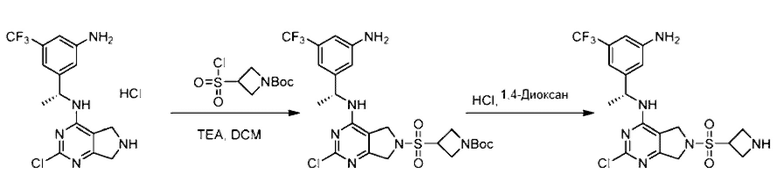
Этап 1.
[00498] В смесь HCl-соли N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (200 мг,0,51 ммоль) и ТЭА (352 мкл, 2,53 ммоль) в ДХМ (5 мл) добавляли трет-бутил 3-(хлорсульфонил)азетидин-1-карбоксилат (129 мг, 0,51 ммоль). Смесь перемешивали при кт в течение 1 ч, а растворитель удаляли при пониженном давлении с получением трет-бутил 3-[(4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-хлор-5H,6H,7H-пирроло[3,4-d]пиримидин-6-ил)сульфонил]азетидин-1-карбоксилата (292 мг), который использовали на следующем этапе без дополнительной очистки. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C23H29ClF3N6O4S: 577,2; полученное 577,5.
Этап 2.
[00499] трет-бутил 3-[(4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-хлор-5H,6H,7H-пирроло[3,4-d]пиримидин-6-ил)сульфонил]азетидин-1-карбоксилат (292 мг, 0,51 ммоль) растворяли в 4 М HCl в 1,4-диоксане/МеОН (1 мл). Смесь нагревали до 40°С и перемешивали в течение 1 ч, растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-6-(азетидин-3-сульфонил)-2-хлор-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (29 мг, выход 12%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C18H21ClF3N6O2S: 477,1; полученное 477,4; 1Н ЯМР (500 МГц, Метанол-d4) δ м. д. 6,93-6,87 (м, 2Н), 6,83-6,79 (м, 1Н), 5,32 (д, J=1,4 Гц, 1Н), 4,63-4,54 (м, 3Н), 4,53-4,49 (м, 2Н), 4,27 (д, J=7J Гц, 4Н), 1,53 (д, J=7,0 Гц, 3Н).
Пример 167. Синтез [2-хлор-4-[[(1R)-1-[3-(1,1-дифтор-2-гидрокси-этил)фенил]этил]амино]-5,7-Дигидропирроло[3,4-d|пиримидин-6-ил]-(4-метокситетрагидропиран-4-ил)метанона
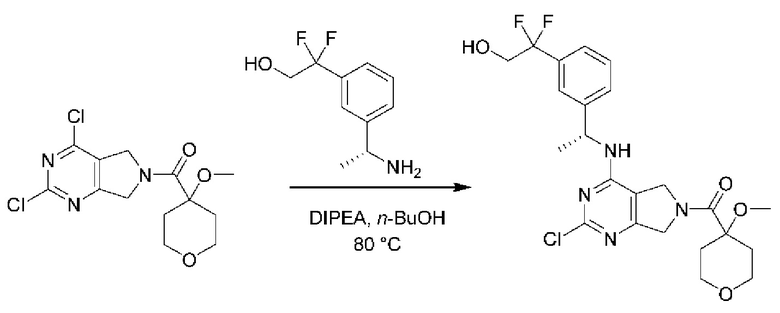
Этап 1.
[00500] Смесь 2-[3-[(1R)-1-аминоэтил]фенил]-2,2-дифтор-этанола (100 мг, 0,5 ммоль), (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-(4-метокситетрагидропиран-4-ил)метанона (165 мг, 0,5 ммоль) и ДИПЭА (260 мкл, 1,49 ммоль) в и-BuOH (3 мл) нагревали до 80°С и перемешивали в течение 5 ч. Смесь фильтровали, а фильтрат очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[3-(1,1-дифтор-2-гидрокси-этил)фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-(4-метокситетрагидропиран-4-ил)метанона (35 мг, выход 14%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C23H28ClF2N4O4: 497,18; полученное 497,1; 1Н ЯМР (400 МГц, ДМСО-d6) δ м. д. 8,33 (шир. дд, J=11,5, 8,1, 1Н), 7,59 (с, 1Н), 7,55-7,51 (м, 1Н), 7,46 (дт, J=7,5, 3,8 Гц, 1Н), 7,43-7,38 (м, 1Н), 5,64 (т, J=6,3 Гц, 1Н), 5,35 (кв, J=6,9 Гц, 1Н), 4,89-4,76 (м, 2Н), 4,60-4,46 (м, 2Н), 3,85 (дт, J=14,4, 6,4 Гц, 2Н), 3,19 (с, 3Н), 3,21-3,12 (м, 3Н), 1,97-1,84 (м, 4Н), 1,51 (т, J=6,8 Гц, 3Н).
Пример 168. Синтез [2-хлор-4-[[(1R)-1-[3-(1,1-дифтор-2-гидрокси-этил)фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона
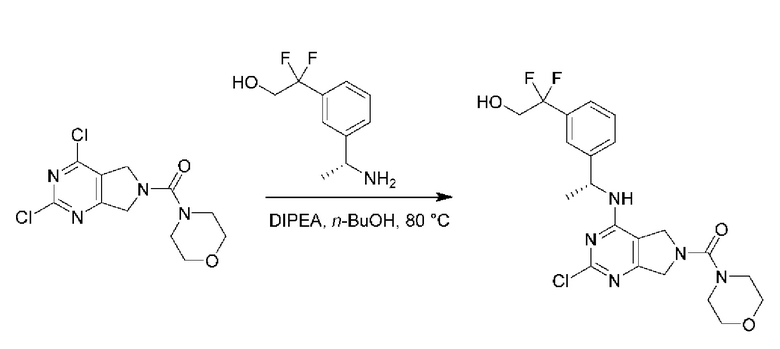
Этап 1.
[00501] Смесь 2-[3-[(1R)-1-аминоэтил]фенил]-2,2-дифтор-этанола (100 мг, 0,5 ммоль), (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (151 мг, 0,5 ммоль) и ДИПЭА (260 мкл, 1,49 ммоль) в n-BuOH (3 мл) нагревали до 80°С и перемешивали в течение 5 ч. Смесь фильтровали, а фильтрат очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[3-(1,1-дифтор-2-гидрокси-этил)фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (35 мг, выход 15%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H25ClF2N5O3: 468,16; полученное 468,1; 1Н ЯМР (400 МГц, ДМСО-d6) δ м. д. 8,17 (шир. д, J=8,0 Гц, 1Н), 7,55 (с, 1Н), 7,50 (д, J=7,6 Гц, 1Н), 7,44 (т, J=7,6 Гц, 1Н), 7,38 (д, J=7,6 Гц, 1Н), 5,62 (т, J=6,4 Гц, 1Н), 5,33 (м, 1Н), 4,61-4,43 (м, 4Н), 3,83 (дт, J=14,2, 6,4 Гц, 2Н), 3,67-3,59 (м, 4Н), 3,28-3,20 (м, 4Н), 1,50 (д, J=7,0 Гц, 3Н).
Примеры 169 и 170. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-морфолино-5,6,7,8-тетрагидрохиназолин-4-амина
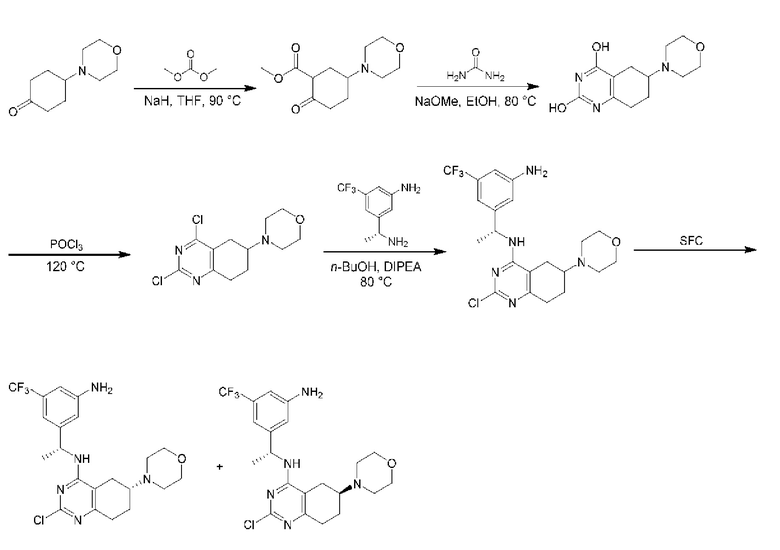
Этап 1.
[00502] В смесь 4-морфолиноциклогексанона (4,0 г, 21,8 ммоль) и диметилкарбоната (40 мл, 475 ммоль) добавляли NaH, 60% дисперсия в масле (1,75 г, 43,7 ммоль). Смесь нагревали до рефлюкса и перемешивали в течение 2 ч, потом добавляли H2O (50 мл) и подкисляли смесь водной HCl до рН ~5. Смесь экстрагировали EtOAc (50 мл ×5), сушили над Na2SO4, фильтровали, а растворитель концентрировали при пониженном давлении с получением метил 5-морфолино-2-оксо-циклогексанкарбоксилата (4 г, выход 76%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C12H20NO4: 242,13; полученное 242,1.
Этап 2.
[00503] В смесь метил 5-морфолино-2-оксо-циклогексанкарбоксилата (4,0 г, 16,6 ммоль) и мочевины (4,44 мл, 82,9 ммоль) в EtOH (100 мл) добавляли NaOMe (4,48 г, 82,9 ммоль). Смесь нагревали до 80°С и перемешивали в течение 16 ч, потом добавляли Н2О (50 мл) и подкисляли смесь водной HCl до рН ~5. Растворитель концентрировали при пониженном давлении, а остаток растирали с EtOAc (40 мл) при 50°С в течение 30 мин. Смесь фильтровали, а остаток сушили в вакууме с получением 6-морфолино-5,6,7,8-тетрагидрохиназолин-2,4-диола (4 г). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C12H18N3O3: 252,13; полученное 252,1.
Этап 3.
[00504] Смесь 6-морфолино-5,6,7,8-тетрагидрохиназолин-2,4-диола (1,0 г, 4 ммоль) и POCl3 (10 мл) нагревали до 100°С и перемешивали в течение 1 ч. Растворитель концентрировали при пониженном давлении, добавляли Н2О (20 мл) и доводили рН до ~8 с помощью водного NaHCO3. Смесь экстрагировали EtOAc (30 мл ×4), объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали растворитель при пониженном давлении с получением 4-(2,4-дихлор-5,6,7,8-тетрагидрохиназолин-6-ил)морфолина (230 мг, выход 17%; примечание: чистота 85%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C12H16Cl2N3O: 288,06; полученное 288,0.
Этап 4.
[00505] В смесь 4-(2,4-дихлор-5,6,7,8-тетрагидрохиназолин-6-ил)морфолина (200 мг, 0,69 ммоль) и 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилина (213 мг, 1,04 ммоль) в t-BuOH (2 мл) добавляли ДИПЭА (604 мкл, 3,47 ммоль). Смесь нагревали до 90°С и перемешивали в течение 10 ч. Смесь концентрировали при пониженном давлении, добавляли Н2О (20 мл) и экстрагировали смесь EtOAc (20 мл ×4). Объединенные органические слои сушили над Na2SO4, фильтровали, растворитель концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-морфолино-5,6,7,8-тетрагидрохиназолин-4-амина (50 мг, выход 15%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H26ClF3N5O: 456,17; полученное 456,2; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 6,91-6,94 (м, 2Н), 6,81 (с, 1Н), 5,34-5,40 (м, 1Н), 3,78 (т, J=3,6 Гц, 4Н), 2,82 (д, J=4,4 Гц, 5Н), 2,69-2,73 (м, 3Н), 2,44-2,33 (м, 1Н), 2,21 (д, J=12,4 Гц, 1Н), 1,68-1,70 (м, 1Н), 1,56 (д, J=7,2 Гц, 3Н).
Этап 5.
[00506] N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-морфолино-5,6,7,8-тетрагидрохиназолин-4-амин разделяли посредством СФХ с получением каждого энантиомера (60 мг и 52 мг). Энантиомер 1: ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H26ClF3N5O: 456,17; полученное 456,0; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 6,91-6,94 (м, 2Н), 6,80 (с, 1Н), 5,34-5,40 (м, 1Н), 3,75 (т, J=3,6 Гц, 4Н), 2,69-2,76 (м, 8Н), 2,36-2,37 (м, 1Н), 2,21 (д, J=12,4 Гц, 1Н), 1,56-1,64 (м, 1Н), 1,54 (д, J=7,2 Гц, 3Н). Энантиомер 2: ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H26ClF3N5O: 456,17; полученное 456,0; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 6,90-6,93 (м, 2Н), 6,80 (с, 1Н), 5,33-5,36 (м, 1Н), 3,75 (т, J=3,6 Гц, 4H), 2,66-2,70 (м, 8Н), 2,31-2,38 (м, 1Н), 2,20 (д, J=12,4 Гц, 1Н), 1,56-1,63 (м, 1Н), 1,55 (д, J=7,2 Гц, 3Н).
[00507] Следующие примеры 431-444, приведенные в таблице 6, синтезировали способом, аналогичным примерам 169 и 170.
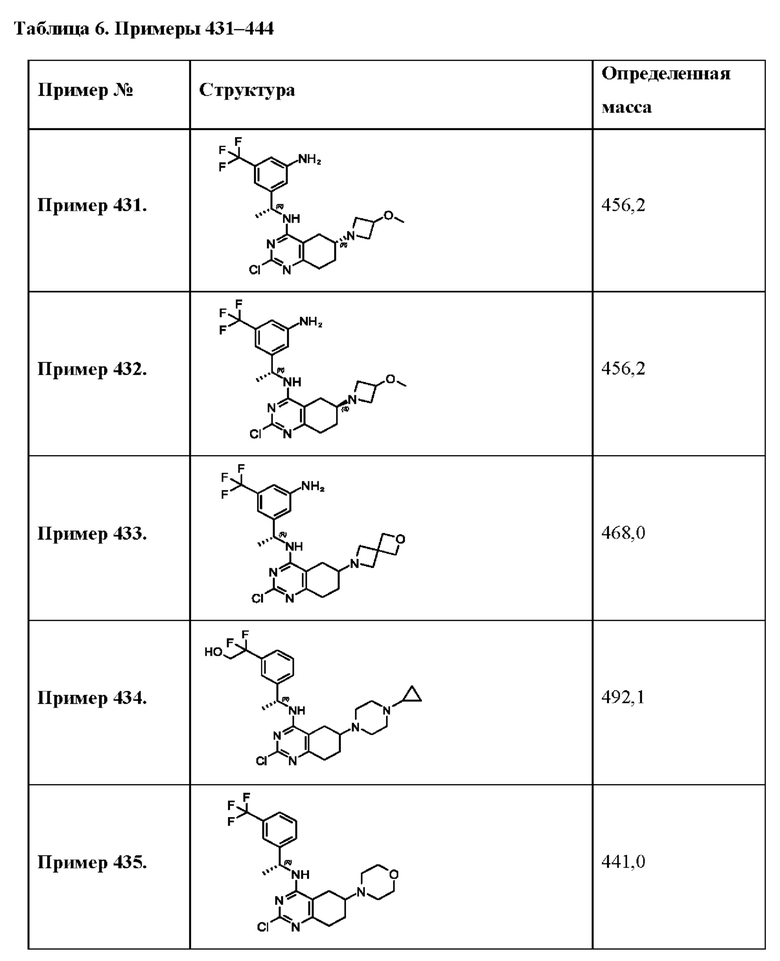
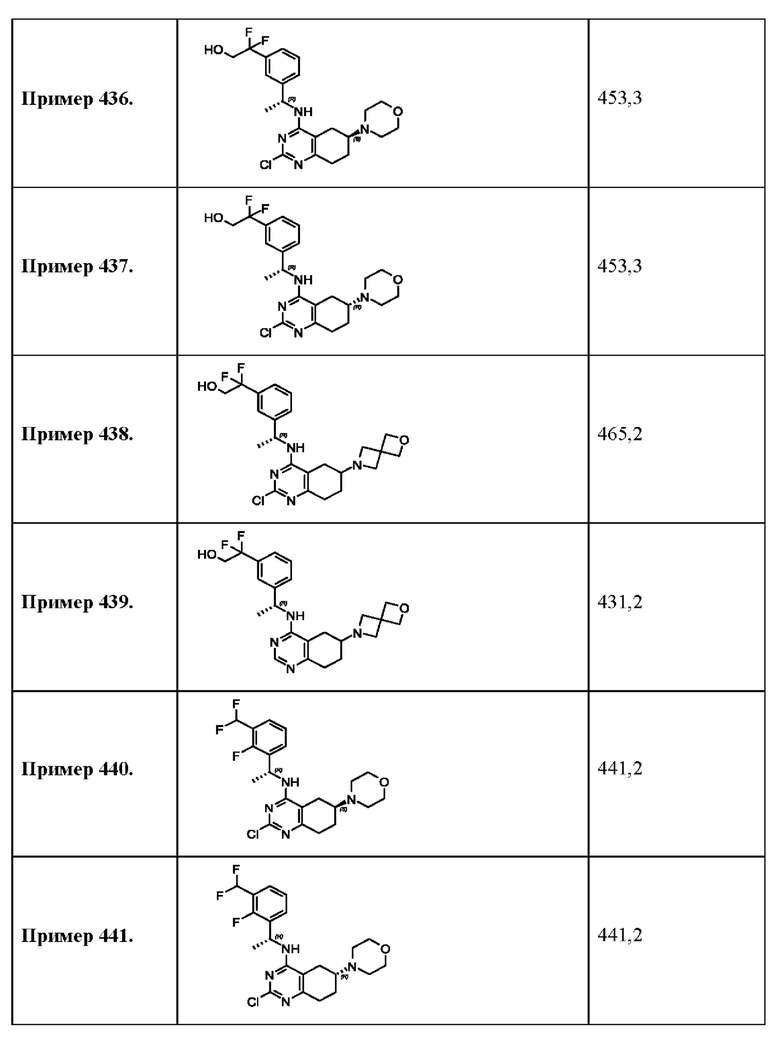
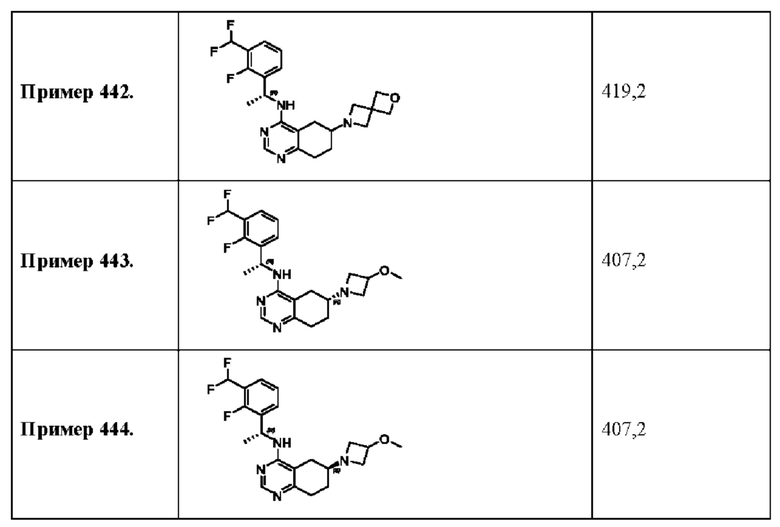
Пример 171. Синтез [2-хлор-4-[1-[3-(1,1-дифтор-2-гидрокси-этил)фенил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона
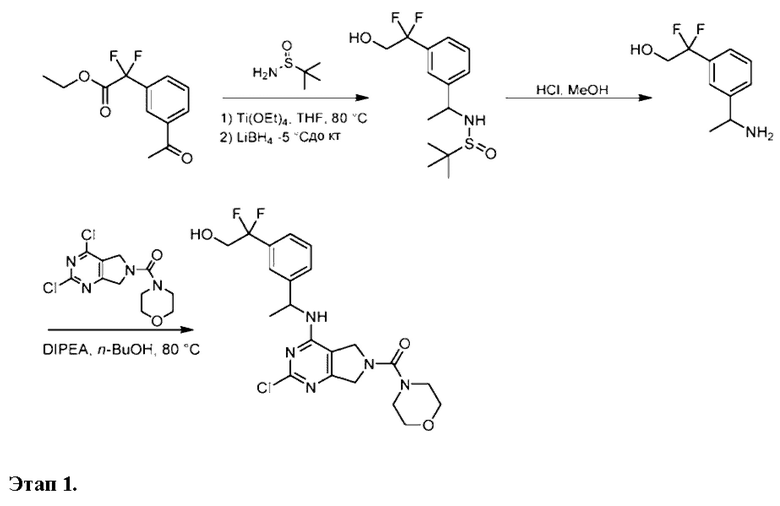
[00508] В смесь 2-метилпропан-2-сульфинамида (400 мг, 3,3 ммоль) и этил 2-(3-ацетилфенил)-2,2-дифторацетата (400 мг, 1,65 ммоль) в ТГФ (5 мл) при кт добавляли Ti(OEt)4 (1,03 мл, 4,95 ммоль). Смесь нагревали до 80°С и перемешивали в течение 11 ч. Смесь охлаждали до -5°С, добавляли МеОН (67 мкл, 1,65 ммоль) и LiBH4 (36 мг, 1,65 ммоль). Смесь перемешивали при кт в течение 1 ч, потом охлаждали до 0°С, добавляли Н2О (10 мл) и экстрагировали EtOAc (15 мл × 3). Объединенные органические слои промывали солевым раствором (30 мл), сушили над безводным Na2SO4 и фильтровали. Растворитель концентрировали при пониженном давлении, а остаток очищали с получением N-[1-[3-(1,1-дифтор-2-гидрокси-этил)фенил]этил]-2-метил-пропан-2-сульфинамида (90 мг, выход 18%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C14H22F2NO2S: 306,13; полученное 306,0; 1Н ЯМР (400 МГц, CDCl3) δ м. д. 7,55 (с, 1H), 7,49-7,42 (м, 3H), 4,56 (м, 1Н), 3,97 (дт, J=12,4, 3,6 Гц, 2Н), 3,47 (д, J=3,6 Гц, 1H), 2,81 (шир. с, 1H), 1,55 (д, J=6,4 Гц, 3H), 1,23 (с, 9Н).
Этап 2.
[00509] В смесь N-[1-[3-(1,1-дифтор-2-гидрокси-этил)фенил]этил]-2-метил-пропан-2-сульфинамида (90 мг, 0,29 ммоль) в МеОН (2 мл) добавляли 4 М HCl в МеОН (147 мкл, 0,58 ммоль). Смесь перемешивали при кт в течение 12 ч, потом нейтрализовали до рН ~7 добавлением NaOH в МеОН, фильтровали, а фильтрат концентрировали при пониженном давлении. Остаток промывали ДХМ/МеОН (5: 1), а объединенные органические слои концентрировали при пониженном давлении с получением 2-[3-(1-аминоэтил)фенил]-2,2-дифтор-этанола (55 мг, выход 93%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C10H14F2NO: 202,10; полученное 202,1; 1Н ЯМР (400 МГц, ДМСО-d6) δ м. д. 8,46 (шир. с, 2Н), 7,69 (с, 1H), 7,64 (д, J=6,4 Гц, 1H), 7,59-7,50 (м, 2Н), 5,69 (т, J=6,0 Гц, 1H), 4,48 (кв, J=6,8 Гц, 1H), 3,87 (дт, J=14,2, 6,0 Гц, 2Н), 1,51 (д, J=6,8 Гц, 3H).
Этап 3.
[00510] Смесь 2-[3-(1-аминоэтил)фенил]-2,2-дифтор-этанола (55 мг, 0,27 ммоль), (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (83 мг, 0,27 ммоль) и ДИПЭА (143 мкл, 0,82 ммоль) в n-BuOH (2 мл) нагревали до 80°С и перемешивали в течение 24 ч. Смесь фильтровали, а фильтрат очищали посредством препаративной ВЭЖХ (х 2) с получением [2-хлор-4-[1-[3-(1,1-дифтор-2-гидрокси-этил)фенил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (18 мг, выход 14%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H25ClF2N5O3: 468,16; полученное 468,1; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 7,59 (с, 1Н), 7,51 (д, J=6,6 Гц, 1Н), 7,46-7,39 (м, 2Н), 5,43 (кв, J=6,8 Гц, 1Н), 4,62-4,60 (м, 2Н), 4,57-4,55 (м, 2Н), 3,88 (дт, J=13,2, 1,6 Гц, 2Н), 3,75-3,69 (м, 4Н), 3,38-3,33 (м, 4Н), 1,59 (д, J=7,2 Гц, 3H).
Пример 176. Синтез (R)-5-((1-(3-амино-5-(трифторметил)фенил)этил)амино)-1-метил-3-(тетрагидро-2Н-пиран-4-ил)-3,4-дигидропиримидо[4,5-d]пиримидин-2(1Н)-она
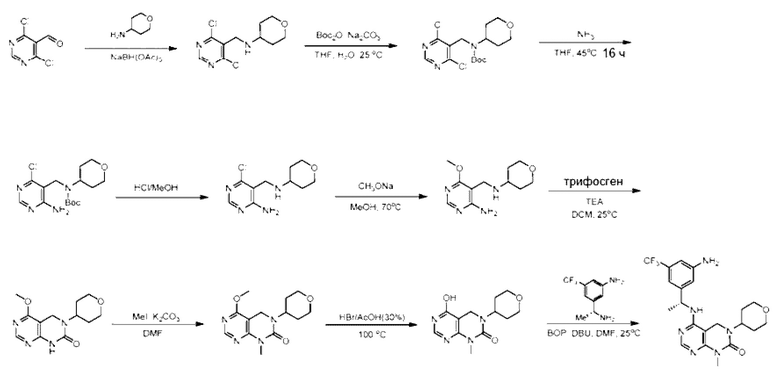
Этап 1.
[00511] В раствор 4,6-дихлорпиримидин-5-карбальдегида (7,5 г, 42 ммоль) в ДХЭ (80 мл) и НОАс (8 мл) добавляли тетрагидропиран-4-амин (6,4 г, 64 ммоль) и NaBH(ОАс)3 (27 г, 127 ммоль) при 0°С. Реакционную смесь перемешивали при 25°С в течение 2 ч, а потом разводили Н2О. Смесь использовали на следующем этапе без дополнительной очистки. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C10H13Cl2N3O: 262,0; полученное 262,0.
Этап 2.
[00512] В раствор N-[(4,6-дихлорпиримидин-5-ил)метил]тетрагидропиран-4-амина (12 г, 46 ммоль) в H2O (100 мл) и ТГФ (100 мл) добавляли (Вос)2O (30 г, 137 ммоль) и Na2CO3 (9,7 г, 92 ммоль). Реакционную смесь перемешивали при 25°С в течение 12 ч и потом разводили H2O. Смесь экстрагировали EtOAc, объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Остаток очищали с помощью силикагелевой колонки с получением трет-бутил N-[(4,6-дихлорпиримидин-5-ил)метил]-N-тетрагидропиран-4-ил-карбамата (13 г, выход 78%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C15H21Cl2N3O3: 362,1; полученное 362,3.
Этап 3.
[00513] Раствор трет-бутил N-[(4,6-дихлорпиримидин-5-ил)метил]-N-тетрагидропиран-4-ил-карбамата (13 г, 36 ммоль) в ТГФ (40 мл) и NH3 (30% в H2O, 80 мл) перемешивали при 45°С в течение 16 ч. После охлаждения до кт добавляли воду и экстрагировали смесь EtOAc. Объединенные органические слои промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением трет-бутил N-[(4-амино-6-хлор-пиримидин-5-ил)метил]-N-тетрагидропиран-4-ил-карбамата (4,1 г, выход 33%). 1Н ЯМР (400 МГц, Хлороформ-d) δ=8,24 (с, 1H), 4,62 (с, 2Н), 4,00-3,96 (м, 2Н), 3,49-3,47 (м, 1H), 3,33-3,27 (м, 2Н), 2,20-2,11 (м, 2Н), 1,61 (с, 1H), 1,52 (с, 9Н), 1,48-1,44 (м, 2Н).
Этап 4.
[00514] Раствор трет-бутил N-[(4-амино-6-хлор-пиримидин-5-ил)метил]-N-тетрагидропиран-4-ил-карбамата (4,1 г, 12 ммоль) в HCl/МеОН (4 М, 60 мл) перемешивали при 25°С в течение 2 ч. Растворитель удаляли при пониженном давлении, а остаток разводили МеОН. Раствор доводили до рН ~12 добавлением MeOH/NaOH до рН -12. Растворитель удаляли при пониженном давлении с получением 6-хлор-5-[(тетрагидропиран-4-иламино)метил]пиримидин-4-амина (4,1 г, неочищенный). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C11H19N4O2: 239,1; полученное 239,1.
Этап 5.
[00515] В раствор 6-хлор-5-[(тетрагидропиран-4-иламино)метил]пиримидин-4-амина (4,1 г, 17 ммоль) в МеОН (60 мл) добавляли CH3ONa (4,56 г, 84,5 ммоль). Смесь перемешивали при 70°С в течение 3 ч. Растворитель удаляли при пониженном давлении. Остаток разводили Н2О и экстрагировали EtOAc. Объединенные органические фазы промывали солевым раствором, сушили над Na2SO4, а растворитель удаляли при пониженном давлении с получением 6-метокси-5-[(тетрагидропиран-4-иламино)метил]пиримидин-4-амина (3,1 г, выход 77%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C11H19N4O2: 239,1; полученное 239,1.
Этап 6.
[00516] В раствор 6-метокси-5-[(тетрагидропиран-4-иламино)метил]пиримидин-4-амина (3,1 г, 13 ммоль) в ДХМ (30 мл) добавляли трифосген (39 г, 130 ммоль) в ДХМ (15 мл) при 0°С. ТЭА (54 мл, 390 ммоль) добавляли при 0° и перемешивали смесь при 0°С в течение 30 мин. Охлаждающую баню убирали и оставляли реакционную смесь перемешиваться при 25°С в течение 2 ч. Добавляли водный NaHCO3 и экстрагировали смесь EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством колоночной хроматографии с получением 5-метокси-3-тетрагидропиран-4-ил-1,4-дигидропиримидо[4,5-d]пиримидин-2-она (1,5 г, выход 44%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C12H16N4O3: 265,1; полученное 265,1.
Этап 7.
[00517] В раствор 5-метокси-3-тетрагидропиран-4-ил-1,4-дигидропиримидо[4,5-d]пиримидин -2-она (400 мг, 1,5 ммоль) в ДМФ (6 мл) добавляли К2СО3 (418 мг, 3,0 ммоль) и CH3I (188 мкл, 3,0 ммоль). Смесь перемешивали при 25°С в течение 2 ч. Реакционную смесь разводили Н2О и экстрагировали EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством препаративной ТСХ с получением 5-метокси-1-метил-3-тетрагидропиран-4-ил-4Н-пиримидо[4,5-d]пиримидин-2-она (135 мг, выход 32%). 1H ЯМР (400 МГц, Хлороформ-d) δ=8,44 (с, 1H), 4,67-4,62 (м, 1H), 4,25 (с, 2Н), 4,08-4,05 (м, 2Н), 4,01 (с, 3H), 3,57-3,50 (м, 2Н), 3,39 (с, 3H), 1,95-1,91 (м, 2Н), 1,69-1,63 (м, 2Н).
Этап 8.
[00518] Раствор 5-метокси-1-метил-3-тетрагидропиран-4-ил-4Н-пиримидо[4,5-d]пиримидин-2-она (135 мг, 485 мкмоль) в HBr (33% в АсОН, 2,5 мл, 15 ммоль) перемешивали при 100°С в течение 1 ч. После охлаждения до кт растворитель удаляли при пониженном давлении с получением 5-гидрокси-1-метил-3-тетрагидропиран-4-ил-4Н-пиримидо[4,5-d]пиримидин-2-она (130 мг, неочищенный). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C12H16N4O3: 265,1; полученное 265,1.
Этап 9.
[00519] В раствор 5-гидрокси-1-метил-3-тетрагидропиран-4-ил-4Н-пиримидо[4,5-d] пиримидин-2-она (130 мг, 492 мкмоль) и 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилина (110 мг, 541 мкмоль) в ДМФ (2 мл) добавляли ВОР (326 мг, 738 мкмоль) и ДБУ (222 мл, 1,48 ммоль). Смесь перемешивали при 25°С в течение 16 ч. Реакционную смесь разводили H2O и экстрагировали EtOAc. Объединенные органические фазы промывали солевым раствором, сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Остаток очищали посредством препаративной ВЭЖХ с получением 5-[[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-1-метил-3-тетрагидропиран-4-ил-4Н-пиримидо[4,5-d]пиримидин-2-она (20 мг, выход 9%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H26F3N6O2: 451,2; полученное 451,2; 1Н ЯМР (400 МГц, Метанол-d4) δ=8,14 (с, 1H), 6,94 (д, J=7,8 Гц, 2Н), 6,84 (с, 1H), 5,42-5,30 (м, 1H), 4,60-4,48 (м, 1Н), 4,28 (с, 2Н), 4,08-4,03 (м, 2Н), 3,61-3,47 (м, 2Н), 3,28 (с, 3H), 2,12-2,00 (м, 2Н), 1,64 (м, 2Н), 1,56 (д, J=7,0 Гц, 3H).
Пример 348. Синтез (4-{[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]амино}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-2-ил)метанола
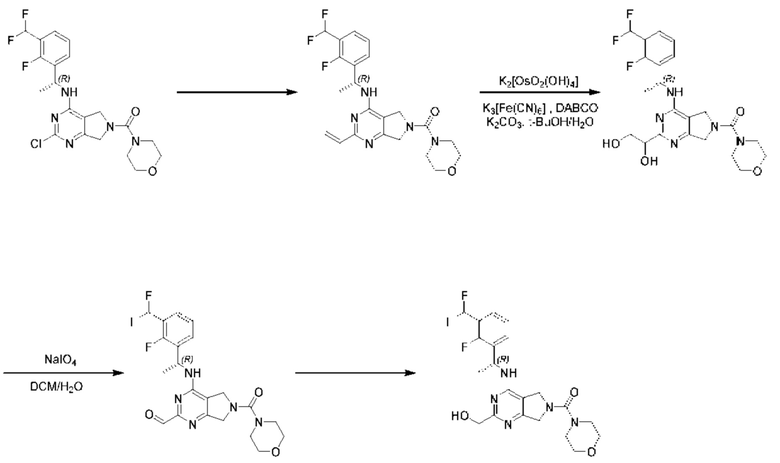
Этап 1.
[00520] N-[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]-2-этенил-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло-[3,4-d]пиримидин-4-амин синтезировали способом, аналогичным 2-этенил-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амину, за исключением того, что 2-хлор-6-(морфолин-4-карбонил)-R-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амин заменяли 2-хлор-N-[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амином с получением (1,95 г, выход 100%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H24F3N5O2: 447,19; полученное 448,40; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 7,79 (д, J=7,1 Гц, 1H), 7,47 (т, J=7,0 Гц, 1H), 7,27 (т, J=7,7 Гц, 1H), 7,22 (т, J=54,3 Гц, 1H), 6,46 (дд, J=17,3, 10,3 Гц, 1H), 6,23 (дд, J=17,3, 2,5 Гц, 1H), 5,66-5,52 (м, 1H), 5,48 (дд, J=10,3, 2,5 Гц, 1H), 4,71-4,40 (м, 4Н), 3,63 (т, J=4,7 Гц, 4Н), 3,25 (т, J=4,7 Гц, 4Н), 1,50 (д, J=7,0 Гц, 3H).
Этап 2.
[00521] В смесь N-[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]-2-этенил-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (1,93 г, 4,31 ммоль) в t-BuOH (92,6 мл) и H2O (92,6 мл) добавляли K3[Fe(CN)6] (5,11 г, 15,5 ммоль), К2СО3 (2,14 г, 15,5 ммоль) и DABCO (34 мг, 0,30 ммоль), а потом - дигидрат осмата калия (VI) (16 мг, 0,04 ммоль). Смесь перемешивали при кт в течение 12 ч, потом добавляли раствор бисульфита натрия и экстрагировали смесь EtOAc (х 2). Объединенные органические слои сушили над безводным MgSO4, фильтровали, концентрировали при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением 1-(4-{[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]амино}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-2-ил)этан-1,2-диола (1,40 г, выход 68%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H26F3N5O4: 481,19; полученное 482,10; 1H ЯМР (300 МГц, ДМСО-d6) δ м. д. 7,82 (т, J=8,2 Гц, 1H), 7,64 (т, J=7,5 Гц, 1H), 7,49 (т, J=7,0 Гц, 1H), 7,29 (т, J=7,7 Гц, 1H), 7,22 (т, J=54,4 Гц, 1H), 5,61 (кв, J=6,7 Гц, 1H), 4,68 (д, J=5,9 Гц, 1H), 4,66-4,49 (м, 4Н), 4,44 (т, J=6,0 Гц, 1H), 4,39-4,12 (м, 1H), 3,64 (т, J=5,6, 3,7 Гц, 4Н), 3,58-3,39 (м, 2Н), 3,25 (т, J=4,7 Гц, 4Н), 1,51 (д, J=7,0 Гц, 3H).
Этап 3.
[00522] В смесь 1-(4-{[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]амино}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-2-ил)этан-1,2-диола (1,40 г, 2,9 ммоль) в ДХМ (89,7 мл) и H2O (11,2 мл) добавляли силикагель (22,4 г) и NaIO4 (1,87 г, 8,7 ммоль). Смесь перемешивали при кт в течение 12 ч, потом фильтровали через слой целита®, а фильтрационный осадок промывали ДХМ. Фильтрат разводили Н2О и разделяли слои, потом водный слой экстрагировали ДХМ. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали при пониженном давлении с получением 4-{[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]амино}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-2-карбальдегида (1,26 г, выход 96%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H22F3N5O3: 449,17; полученное 450,05; 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 9,66 (с, 1H), 8,14 (д, J=7,5 Гц, 1H), 7,67 (т, J=7,4 Гц, 1H), 7,51 (т, J=7,1 Гц, 1Н), 7,30 (т, J=7,7 Гц, 1Н), 7,24 (т, J=54,4 Гц, 1H), 5,75-5,64 (м, 1Н), 4,86-4,29 (м, 4Н), 3,65 (т, J=5,6, 3,7 Гц, 4Н), 3,27 (т, J=4,7 Гц, 4Н), 1,55 (д, J=7,0 Гц, 3H).
Этап 4.
[00523] (4-{[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]амино}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-2-ил)метанол синтезировали способом, аналогичным [6-(морфолин-4-карбонил)-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-2-ил]-метанолу, за исключением того, что 6-(морфолин-4-карбонил)-4-{[(1R)-1-[3-нитро-5-(трифторметил)фенил]-этил]амино}-5H,6H,7H-пирроло[3,4-d]пиримидин-2-карбальдегид заменяли 4-{[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]амино}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-2-карбальдегидом с получением (120 мг, выход 70%). 1Н ЯМР (300 МГц, ДМСО-d6) δ м. д. 7,78 (д, J=7,6 Гц, 1H), 7,64 (т, J=7,4 Гц, 1H), 7,50 (т, J=7,1 Гц, 1H), 7,29 (т, J=7,7 Гц, 1H), 7,22 (т, J=54,4 Гц, 1H), 5,66 (т, J=7,2 Гц, 1H), 4,67 (т, J=5,9 Гц, 1H), 4,63-4,46 (м, 4Н), 4,34-4,18 (м, 2Н), 3,64 (т, J=4,6 Гц, 4Н), 3,26 (т, J=4,7 Гц, 4Н), 1,50 (д, J=7,0 Гц, 3H).
Пример 445. (R)-5-((1-(3-(дифторметил)-2-фторфенил)этил)амино)-1,7-диметил-3-(1-метилпиперидин-4-ил)-3,4-дигидропиримидо[4,5-d]пиримидин-2(1H)-он
[00524] (R)-5-((1-(3-(дифторметил)-2-фторфенил)этил)амино)-1,7-диметил-3-(1-метилпиперидин-4-ил)-3,4-дигидропиримидо[4,5-d]пиримидин-2(1Н)-он синтезировали способом, аналогичным примеру 176.

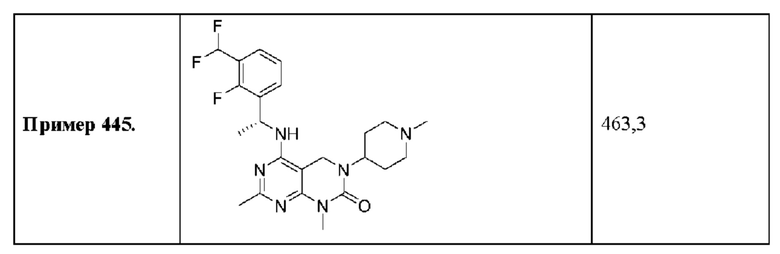
Пример 446. Синтез [2-(азетидин-3-ил)-4-[[(1R)-1-[3-(дифторметил)-2-фтор-фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона
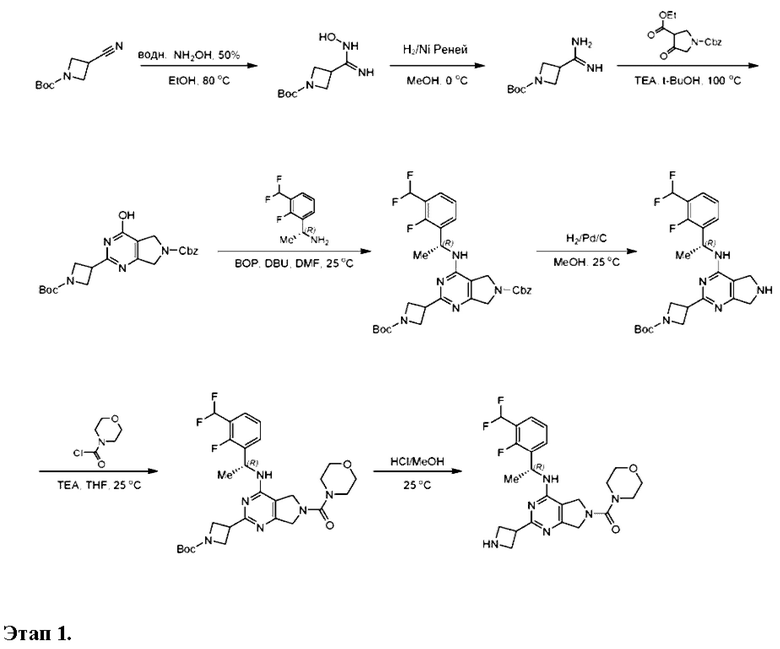
Этап 1.
[00525] В раствор трет-бутил 3-цианоазетидин-1-карбоксилата(1 г, 5,49 ммоль) в EtOH (25 мл) добавляли водн. гидроксиламин (181,26 мг, 5,49 ммоль, 1 мл) в атмосфере N2. Смесь нагревали до 80°С, перемешивали в течение 24 часов. Реакционную смесь концентрировали при пониженном давлении с получением трет-бутил 3-(N-гидроксикарбамимидоил)азетидин-1-карбоксилата (1,3 г, неочищенный). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C9H18N3O3: 216,1; полученное 216,2; 1Н ЯМР (400 МГц, ДМСО-d6) δ=9,10 (с, 1H), 5,48 (с, 2Н), 3,89 (с, 4Н), 3,09-3,23 (м, 1H), 1,38 (с, 9Н).
Этап 2.
[00526] В раствор трет-бутил 3-(N-гидроксикарбамимидоил)азетидин-1-карбоксилата (1 г, 4,65 ммоль) в МеОН (25 мл) добавляли Ni Ренея (200 мг, 2,33 ммоль) в атмосфере N2. Суспензию дегазировали в условиях вакуума и несколько раз продували Н2. Смесь перемешивали в атмосфере Н2 при 0°С в течение 8 часов. Реакционную смесь фильтровали, а фильтрат концентрировали при пониженном давлении с получением трет-бутил 3-карбамимидоилазетидин-1-карбоксилата (900 мг, неочищенный). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C9H18N3O2: 200,1; полученное 200,2; 1Н ЯМР (400 МГц, ДМСО-d6) δ=5,99 (с, 2Н), 3,96-3,77 (м, 4Н), 3,25-3,07 (м, 1H), 1,41-1,31 (м, 9Н).
Этап 3.
[00527] В раствор трет-бутил 3-карбамимидоилазетидин-1-карбоксилата (800 мг, 4,02 ммоль) и O1-бензил О3-этил 4-оксопирролидин-1,3-дикарбоксилата (1,29 г, 4,42 ммоль) в t-BuOH (16 мл) одной частью добавляли ТЭА (1,22 г, 12,05 ммоль, 1,68 мл) при кт в атмосфере N2. Смесь нагревали до 100°С, перемешивали в течение 4 часов. Реакцию медленно гасили Н2О (20 мл), а потом экстрагировали EtOAc (50 мл × 3). Объединенную органическую фазу промывали солевым раствором (50 мл), сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали посредством колоночной хроматографии с получением бензил 2-(1-трет-бутоксикарбонилазетидин-3-ил)-4-гидрокси-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилата (1,3 г, выход 75,92%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H27N4O5: 427,2; полученное 427,3.
Этап 4.
[00528] В смесь бензил 2-(1-трет-бутоксикарбонилазетидин-3-ил)-4-гидрокси-5,7-дигидропирроло [3,4-d]пиримидин-6-карбоксилата (800 мг, 1,88 ммоль) и (1R)-1-[3-(дифторметил)-2-фтор-фенил]этанамина (425,85 мг, 2,25 ммоль) в ДМФ (16 мл) одной частью добавляли ВОР (1,33 г, 3,00 ммоль), ДБУ (856,74 мг, 5,63 ммоль, 848,26 мкл) при 15°С в атмосфере N2. Смесь перемешивали при 15°С в течение 12 часов. Реакцию медленно гасили Н2О (20 мл), а потом экстрагировали EtOAc (20 мл × 3). Объединенную органическую фазу промывали солевым раствором (20 мл), сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали посредством колоночной хроматографии с получением бензил 2-(1-трет-бутоксикарбонилазетидин-3-ил)-4-[[(1R)-1-[3-(дифторметил)-2-фтор-фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилата (300 мг, выход 26,76%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C31H35F3N5O4: 598,3; полученное 598,4.
Этап 5.
[00529] В раствор бензил 2-(1-трет-бутоксикарбонилазетидин-3-ил)-4-[[(1H)-1-[3-(дифторметил)-2-фтор-фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилата (100 мг, 167,33 мкмоль) в МеОН (2 мл) добавляли Pd/C (10 мг) в атмосфере N2. Суспензию дегазировали в условиях вакуума и несколько раз продували H2. Смесь перемешивали в атмосфере Н2 при кт в течение 3 часов. Реакционную смесь фильтровали, а фильтрат концентрировали при пониженном давлении с получением трет-бутил-3-[4-[[(1H)-1-[3-(дифторметил)-2-фтор-фенил]этил]амино]-6,7-дигидро-5Н-пирроло[3,4-d]пиримидин-2-ил]азетидин-1-карбоксилата (70 мг, выход 90,26%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C23H29F3N5O2: 464,2; полученное 464,4.
Этап 6.
[00530] В раствор трет-бутил 3-[4-[[(1H)-1-[3-(дифторметил)-2-фтор-фенил]этил]амино]-6,7-дигидро-5Н-пирроло[3,4-d]пиримидин-2-ил]азетидин-1-карбоксилата (70 мг, 151,03 мкмоль) и морфолин-4-карбонилхлорида (22,59 мг, 151,03 мкмоль, 17,65 мкл) в ТГФ (1 мл) одной частью добавляли ТЭА (61,13 мг, 604,11 мкмоль, 84,08 мкл) при кт в атмосфере N2. Смесь перемешивали при кт в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением трет-бутил 3-[4-[[(1R)-1-[3-(дифторметил)-2-фтор-фенил]этил]амино]-6-(морфолин-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-2-ил]азетидин-1-карбоксилата (43 мг, выход 49,38%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C28H36F3N6O4: 577,3; полученное 577,2.
Этап 7.
[00531] В смесь трет-бутил 3-[4-[[(1H)-1-[3-(дифторметил)-2-фтор-фенил]этил]амино]-6-(морфолин-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-2-ил]азетидин-1-карбоксилата (43 мг, 74,57 мкмоль) в МеОН (2 мл) одной частью добавляли HCl/МеОН (4 М, 1 мл) при кт в атмосфере N2. Смесь перемешивали при кт в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали посредством препаративной ВЭЖХ с получением [2-(азетидин-3-ил)-4-[[(1H)-1-[3-(дифторметил)-2-фтор-фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил] морф олино метано на (12 мг, выход 33,56%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C23H28F3N6O2: 477,2; полученное; 477,2; 1H ЯМР (400 МГц, Метанол-d4) δ=7,55-7,62 (м, 1H), 7,44-7,51 (м, 1H), 7,22-7,28 (м, 1H), 6,85-7,16 (м, 1H), 5,67-5,75 (м, 1H), 4,66-4,72 (м, 2Н), 4,58-4,64 (м, 2Н), 4,18-4,37 (м, 3H), 4,09-4,17 (м, 1H), 3,98-4,09 (м, 1H), 3,71-3,77 (м, 4Н), 3,35-3,40 (м, 4Н), 1,59-1,63 (м, 3H).
Пример 447. (R)-(4-((1-(3-(дифторметил)-2-фторфенил)этил)амино)-2-(1-метилазетидин-3-ил)-5,7-дигидро-6Н-пирроло[3,4-d]пиримидин-6-ил)(морфолино)метанон
[00532] (R)-(4-((1-(3-(дифторметил)-2-фторфенил)этил)амино)-2-(1-метилазетидин-3-ил)-5,7-дигидро-6Н-пирроло[3,4-d]пиримидин-6-ил)(морфолино)метанон синтезировали способом, аналогичным примеру 446.
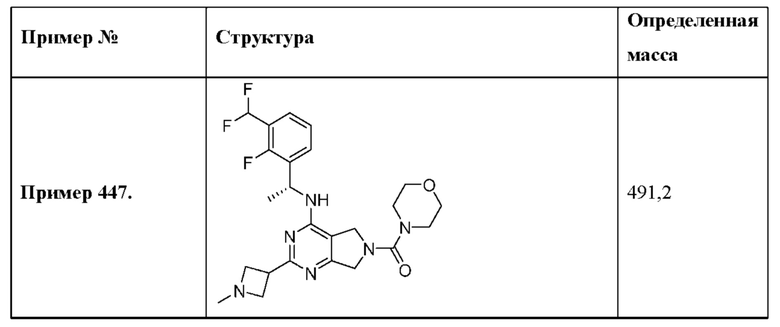
Пример 448. Синтез (R)-N-(1-(3-амино-5-(трифторметил)фенил)этил)-2-хлор-6-((1-(метоксиметил)циклобутил)сульфонил)-5,6,7,8-тетрагидропиридо[4,3-d] пиримидин-4 амина
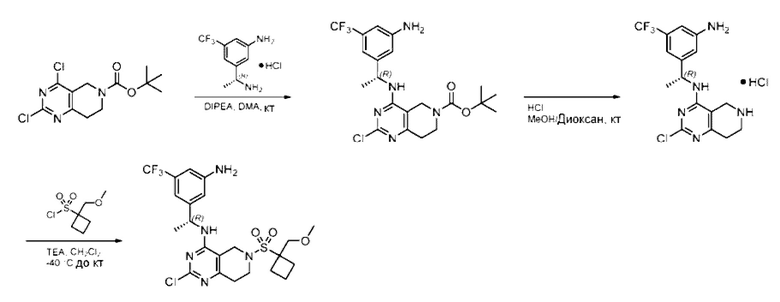
Этап 1
[00533] В смесь 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилина (4,02 г, 19,6 ммоль) и трет-бутил 2,4-дихлор-5Н,6Н,7Н,8Н-пиридо[4,3-d]пиримидин-6-карбоксилата (6,00 г, 19,7 ммоль) в ДМА (40 мл) добавляли ДИПЭА (30,0 мл, 172 ммоль). Реакционную смесь перемешивали в течение ночи при кт. Реакцию гасили водой, экстрагировали EtOAc, обрабатывали солевым раствором, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении до красного масла, этот материал очищали посредством флэш-хроматографии с получением трет-бутил 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-хлор-5Н,6Н,7Н,8Н-пиридо[4,3-d]пиримидин-6-карбоксилата (6,92 г, выход 74%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H26ClF3N5O2: 472,2; полученное 472,3.
Этап 2
[00534] В раствор трет-бутил 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-2-хлор-5Н,6Н,7Н,8Н-пиридо[4,3-d]пиримидин-6-карбоксилата (6,92 г, 14,6 ммоль) в метаноле (10 мл), добавляли 4 М раствор HCl в диоксане (30 мл, 120 ммоль). Реакционную смесь перемешивали при кт в течение 1 часа, потом концентрировали в вакууме с получением N-[(17?)-1-[3-амино-5-(трифторметил)фенил]этил]-2,6-дихлор-5Н,6Н,7Н,8Н-пиридо[4,3-d]пиримидин-4-амина (5,32 г, выход 89%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C16H18ClF3N5: 372,1; полученное 372,4.
Этап 3
[00535] В раствор N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2,6-дихлор-5Н,6Н,7Н,8Н-пиридо[4,3-d]пиримидин-4-амина (106 мг, 260 мкмоль) и триэтиламина (358 мкл, 2,58 ммоль) в ДХМ (5,0 мл) при -40°С добавляли 1-(метоксиметил)циклобутан-1-сульфонилхлорид (159 мг, 578 мкмоль). Охлаждающую баню убирали и перемешивали реакционную смесь при кт в течение 2 суток. Потом реакционную смесь концентрировали при пониженном давлении, а полученное в результате твердое вещество очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-{[1-(метоксиметил)циклобутил]сульфонил}-5Н,6Н,7Н,8Н-пиридо[4,3-d]пиримидин-4-амина (37,7 мг, выход 27%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H28ClF3N5O3S: 534,15; полученное 534,5; 1Н ЯМР (500 МГц, Метанол-d4) δ 6,83 (с, 1Н), 6,80 (с, 1H), 6,70 (с, 1Н), 5,28 (кв, J=7,0 Гц, 1H), 4,19-4,10 (м, 2Н), 3,65 (с, 2Н), 3,55-3,47 (м, 2Н), 3,15 (с, 3H), 2,65-2,56 (м, 4Н), 2,09-1,91 (м, 4Н), 1,45 (д, J=7,0 Гц, 3H).
[00536] Следующие примеры 449 459, приведенные в таблице 7, синтезировали способом, аналогичным примеру хх.
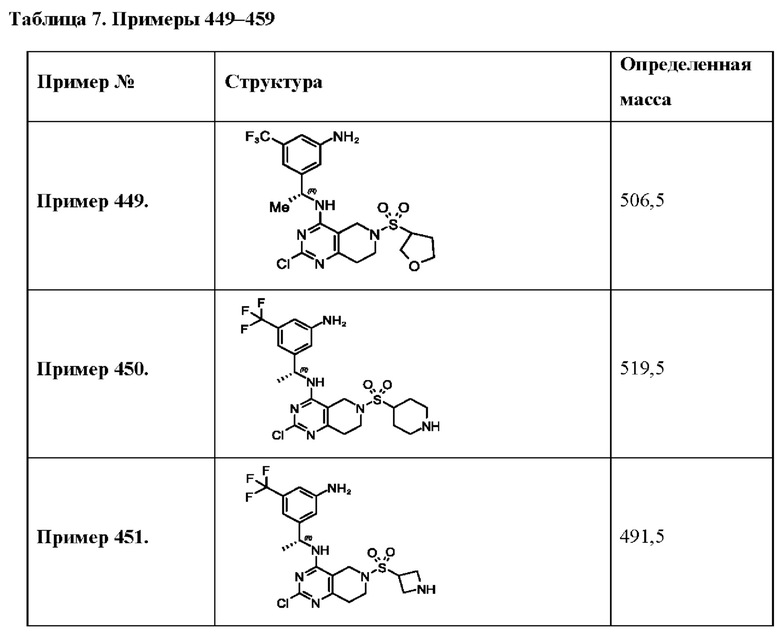
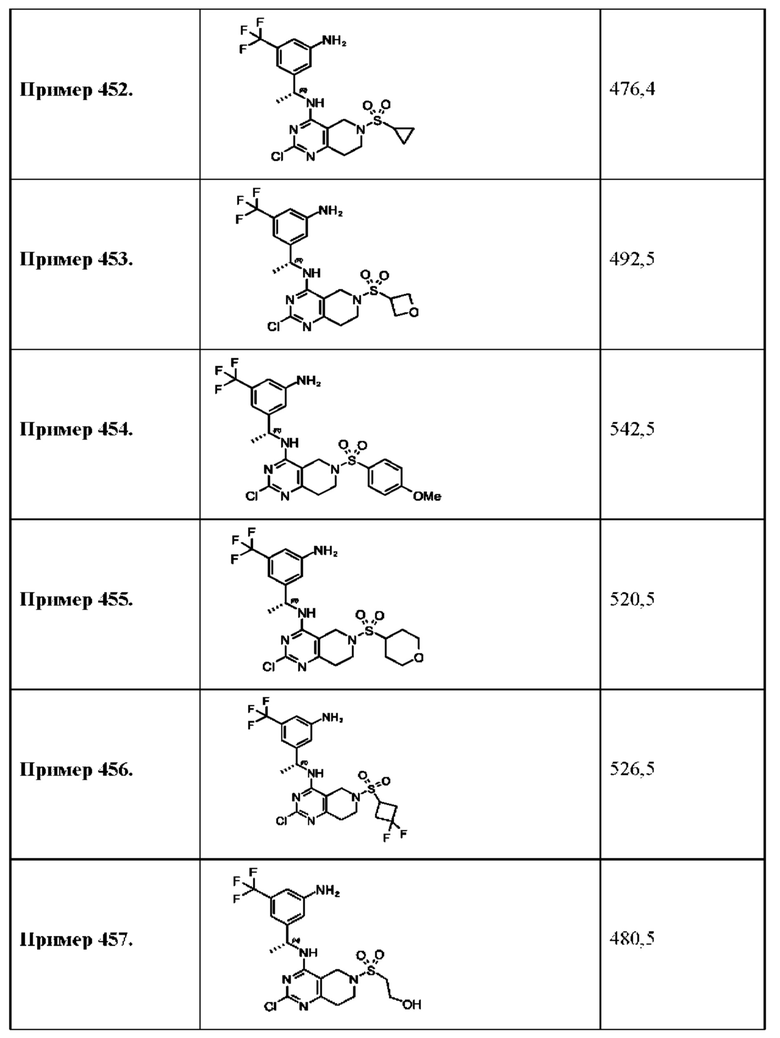
Примеры 538 и 460. Синтез (2-хлор-4-(((1R)-1-(3-(дифтор(морфолин-3-ил)метил)фенил) этил) амино)-5,7-дигидро-6Н-пирроло[3,4-d]пиримидин-6-ил)(морфолино)метанона (пример 538) и (2-хлор-4-(((1R)-1-(3-(дифтор(4-метилморфолин-3-ил)метил)фенил)этил)амино)-5,7-дигидро-6Н-пирроло[3,4-и]пиримидин-6-ил)(морфолино)метанона (пример 460)
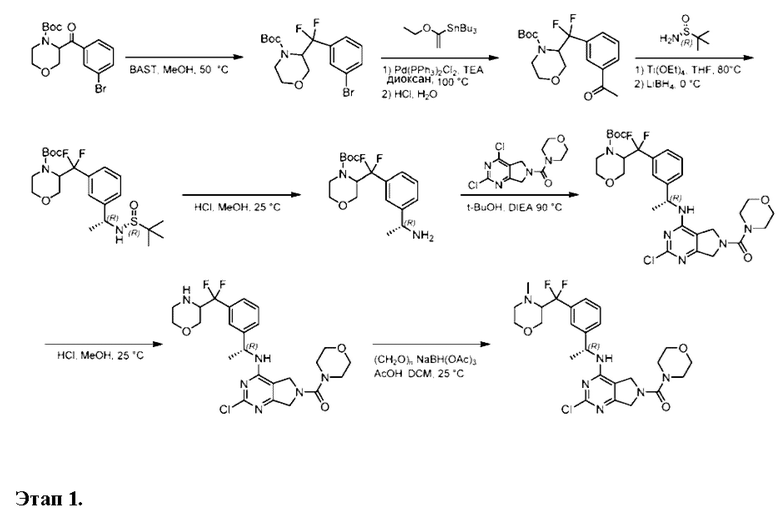
[00537] В смесь трет-бутил 3-(3-бромбензоил)морфолин-4-карбоксилата (1,1 г, 2,97 ммоль) в BAST (10 мл) добавляли МеОН (12,0 мкл, 297 мкмоль) при 25°С. Смесь перемешивали при 50°С в течение 6 ч, потом гасили H2O (5 мл), экстрагировали EtOAc, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии с получением трет-бутил 3-[(3-бромфенил)-дифтор-метил]морфолин-4-карбоксилата (500 мг, выход 43%). 1H ЯМР (400 МГц, Метанол-d4) δ м. д. 7,70-7,58 (м, 2Н), 7,48-7,35 (м, 2Н), 4,42-4,23 (м, 2Н), 3,95-3,83 (м, 2Н), 3,69-3,58 (м, 1H), 3,47-3,40 (м, 1H), 1,31-1,22 (м, 9Н).
Этап 2.
[00538] Смесь трет-бутил 3-[(3-бромфенил)-дифтор-метил]морфолин-4-карбоксилата (500 мг, 1,27 ммоль), трибутил(1-этоксивинил)станнана (691 мг, 1,91 ммоль), ТЭА(444 мкл, 3,19 ммоль) и Pd(PPh3)2Cl2 (89,5 мг, 127 мкмоль) в диоксане (5 мл) продували N2, потом смесь перемешивали при 100°С в течение 4 ч в атмосфере N2. Реакцию гасили 2 М водным раствором HCl (5 мл) и перемешивали смесь в течение 1 ч, потом фильтровали. Фильтрат экстрагировали EtOAc (30 мл × 2), а объединенные органические экстракты обрабатывали водой (20 мл) и KF (100 мг) и перемешивали смесь в течение 2 ч. Смесь фильтровали, а органический слой обрабатывали солевым раствором (5 мл), сушили над Na2SO3, фильтровали и концентрировали в вакууме. Неочищенный остаток очищали посредством препаративной ТСХ с получением трет-бутил 3-[(3-ацетилфенил)-дифтор-метил]морфолин-4-карбоксилата (300 мг, выход 66%). 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 8,17-8,08 (м, 2Н), 7,80-7,58 (м, 2Н), 4,48-4,24 (м, 2Н), 3,92 (д, 2Н), 3,65 (дд, J=12,8, 4,0 Гц, 1H), 3,53-3,38 (м, 2Н), 2,66 (с, 3H), 1,29-1,16 (м, 9Н).
Этап 3.
[00539] В раствор трет-бутил 3-[(3-ацетилфенил)-дифтор-метил]морфолин-4-карбоксилата (270 мг, 760 мкмоль) в ТГФ (2 мл) добавляли Ti(OEt)4 (473 мкл, 2,28 ммоль) и 2-метилпропан-2-сульфинамид (184 мг, 1,52 ммоль). Смесь перемешивали при 80°С в течение 7 ч. После охлаждения до -4°С, добавляли МеОН (30,7 мкл, 760 мкмоль), а потом - LiBH4 (49,6 мг, 2,28 ммоль), и перемешивали смесь при 0°С в течение 1 ч. Реакционную смесь медленно вливали в H2O (4 мл) и ТГФ (4 мл), фильтровали через целит®, промывали ТГФ и выпаривали при пониженном давлении. Неочищенный остаток очищали посредством препаративной ТСХ с получением трет-бутил 3-[[3-[(1R)-1-[[(R)-трет-бутилсульфинил]амино]этил]фенил]-дифтор-метил]морфолин-4-карбоксилата (220 мг, 63%). 1H ЯМР (400 МГц, Метанол-d4) δ м. д. 7,58-7,37 (м, 4Н), 4,58-4,50 (м, 1Н), 4,22-4,14 (м, 1H), 3,95-3,86 (м, 1Н), 3,58 (дд, J=12,4, 3,6 Гц, 1H), 3,51-3,35 (м, 2Н), 1,53 (д, J=6,8 Гц, 3H), 1,39-1,25 (м, 9Н), 1,24 (с, 9Н).
Этап 4.
[00540] В раствор трет-бутил 3-[[3-[(1R)-1-[[(1R)-трет-бутилсульфинил]амино]этил]фенил]-дифтор-метил]морфолин-4-карбоксилата (270 мг, 586 мкмоль) в МеОН (2 мл), добавляли 4 М раствор HCl в МеОН (293 мкл, 1,17 ммоль). Реакционную смесь перемешивали при 25°С в течение 30 мин, потом гасили добавлением NaOH до рН=7. Полученную в результате смесь фильтровали и концентрировали при пониженном давлении с получением трет-бутил 3-[[3-[(1R)-1-аминоэтил]фенил]-дифтор-метил]морфолин-4-карбоксилата (200 мг, выход 96%). 1H ЯМР (400 МГц, Метанол-d4) δ м. д. 7,61-7,34 (м, 4Н), 4,26-4,16 (м, 2Н), 4,01-3,85 (м, 2Н), 3,64-3,60 (м, 1H), 3,57-3,37 (м, 3H), 1,52-1,41 (м, 3H), 1,38-1,16 (м, 9Н).
Этап 5.
[00541] В смесь трет-бутил 3-[[3-[(1R)-1-аминоэтил]фенил]-дифтор-метил]морфолин-4-карбоксилата (100 мг, 280 мкмоль) в t-BuOH (2 мл) добавляли ДИПЭА (97,7 мкл, 561 мкмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанон (128 мг, 421 мкмоль). Смесь перемешивали при 90°С в течение 1 часа, потом гасили добавлением H2O, экстрагировали EtOAc, сушили над Na2SO3, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали посредством препаративной ТСХ с получением трет-бутил 3-[[3-[(1R)-1-[[2-хлор-6-(морфолин-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]фенил]-дифтор-метил]морфолин-4-карбоксилата (80 мг, выход 46%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C29H38ClF2N6O5: 623,2; полученное 623,2.
Этап 6.
[00542] Раствор 3-[[3-[(1R)-1-[[2-хлор-6-(морфолин-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]фенил]-дифтор-метил]морфолин-4-карбоксилата (80 мг, 128,39 мкмоль) в 4 М растворе HCl в метаноле (32 мкл, 128 мкмоль) перемешивали при 25°С в течение 1 ч. Смесь концентрировали при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1H)-1-[3-[дифтор(морфолин-3-ил)метил]фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (27,0 мг, выход 40%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C24H30ClF2N6O3: 523,2; полученное 523,2; 1Н ЯМР (400 МГц, Метаноле) 5 м. д. 7,60-7,53 (м, 2Н), 7,47 (т, J=7,2 Гц, 1H), 7,39 (д, J=7,2 Гц, 1H), 5,39 (кв, J=6,4 Гц, 1H), 4,62-4,56 (м, 4Н), 3,80-3,67 (м, 6Н), 3,53-3,41 (м, 3H), 3,38-3,34 (м, 4Н), 2,94-2,88 (м, 2Н), 1,60 (д, J=7,2 Гц, 3H).
Этап 7.
[00543] В раствор [2-хлор-4-[[(1R)-1-[3-[дифтор(морфолин-3-ил)метил]фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (50 мг, 96 мкмоль) в АсОН (1,2 мл) и ДХМ (3 мл) добавляли NaBH(OAc)3 (50,7 мг, 239 мкмоль) и параформальдегид (50 мг). реакционную смесь перемешивали при 25°С в течение 12 ч, потом концентрировали при пониженном давлении и очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1H)-1-[3-[дифтор-(4-метилморфолин-3-ил)метил]фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (30 мг, выход 58%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C25H32ClF2N6O3: 537,2; полученное 537,2; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 7,55-7,50 (м, 2Н), 7,44-7,33 (м, 2Н), 5,40-5,31 (м, 1H), 4,63-4,54 (м, 4Н), 3,74-3,65 (м, 5Н), 3,51-3,41 (м, 2Н), 3,45-3,35 (м, 4Н), 3,25-3,16 (м, 2Н), 2,93-2,84 (м, 1H), 2,81-2,74 (м, 1H), 2,53-2,45 (м, 3H), 2,43-2,37 (м, 1H), 1,59 (д, J=7,2 Гц, 3H).
Пример 461. Синтез (4-((1-(5-амино-2-фтор-3-(трифторметил)фенил)этил)амино)-2-хлор-5,7-дигидро-6H-пирроло[3,4-d]пиримидин-6-ил)(морфолино)метанона
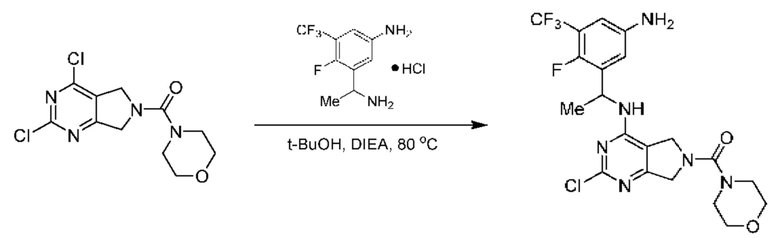
Этап 1.
[00544] В раствор HCl-соли 3-(1-аминоэтил)-4-фтор-5-(трифторметил)анилина (5,0 мг, 19 мкмоль) в t-BuOH (0,5 мл) добавляли ДИЭА (10,1 мкл, 58,0 мкмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанон (5,86 мг, 19,3 мкмоль). Смесь перемешивали при 80°С в течение 2 ч, потом концентрировали при пониженном давлении. Неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [4-[1-[5-амино-2-фтор-3-(трифторметил)фенил]этиламино]2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (3,0 мг, выход 32%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H22ClF4N6O2: 489,1; полученное 489,1; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 6,90-6,87 (м, 1Н), 6,83-6,79 (м, 1H), 5,62-5,45 (м, 1Н) 4,73-4,54 (м, 4Н), 3,76-3,71 (м, 4 Н), 3,39-3,30 (м, 4Н), 1,55 (д, J=7,0 Гц, 3H).
Пример 462. Синтез 2-хлор-4-((1-(3-(пентафтор-16-сульфанеил)фенил)этил)амино)-5,7-дигидро-6Н-пирроло[3,4-d]пиримидин-6-ил)(морфолино)метанона
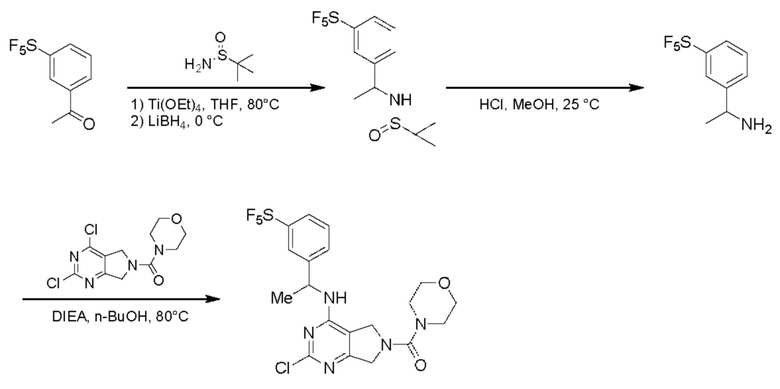
Этап 1.
[00545] В смесь 1-[3-(пентафтор-сульфанил)фенил]этанона (100 мг, 406 мкмоль) и 2-метилпропан-2-сульфинамида (98,5 мг, 812 мкмоль) в ТГФ (1,5 мл) добавляли Ti(OEt)4 (253 мкл, 1,22 ммоль) при 25°С.Реакционную смесь нагревали до 90°С и перемешивали в течение 3 ч. Потом смесь охлаждали до 0°С, потом добавляли LiBH4 (8,85 мг, 406 мкмоль) и МеОН (16,4 мкл, 406 мкмоль) и перемешивали смесь при 0°С в течение 30 мин. Смесь гасили добавлением Н2О при 0°С и фильтровали. Растворитель удаляли при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением 2-метил-N-[1-[3-(пентафтор-сульфанил)фенил]этил]пропан-2-сульфинамида (60 мг, выход 42%). 1Н ЯМР (400 МГц, Хлороформ-d) δ м. д. 7,77-7,66 (м, 2Н), 7,55-7,51 (м, 1H), 7,50-7,44 (м, 1Н), 4,67-4,58 (м, 1H), 3,49-3,45 (м, 1H), 1,56 (д, J=6,6 Гц, 3H), 1,25 (с, 9Н).
Этап 2.
[00546] В раствор 2-метил-N-[1-[3-(пентафтор-сульфанил)фенил]этил]пропан-2-сульфинамида (60 мг, 170 мкмоль, 1 экв.) в МеОН (0,5 мл) добавляли 4 М HCl в МеОН (128 мкл, 512 мкмоль). Смесь перемешивали при 25°С в течение 30 мин. Растворитель удаляли при пониженном давлении с получением 1-[3-(пентафтор-сульфанил)фенил]этанамина (60 мг). 1Н ЯМР (400 МГц, Хлороформ-d) δ м. д. 7,93 (с, 1Н), 7,77 (д, J=8,1 Гц, 1H), 7,69 (д, J=7,1 Гц, 1Н), 7,54-7,48 (м, 1H), 3,82-3,81 (м, 1H), 1,75-1,66 (м, 3H).
Этап 3.
[00547] В раствор 1-[3-(пентафтор-сульфанил)фенил]этанамина (60 мг, 240 мкмоль) в n-BuOH (2 мл) добавляли (2,4-дихлор-5,7-дигидропирроло[3,4-d]пирамидин-6-ил)-морфолинометанон (73,6 мг, 243 мкмоль) и ДИЭА (211 мкл, 1,21 ммоль). Смесь перемешивали при 80°С в течение 12 ч, и потом концентрировали при пониженном давлении. Неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[1-[3-(пентафтор-сульфанил)фенил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона(26 мг, выход 20%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C19H22ClF5N5O2S: 514,1; полученное 514,1; 1H ЯМР (400 МГц, Хлороформ-d) δ м. д. 7,80-7,78 (м, 1H), 7,72-7,67 (м, 1H), 7,57-7,53 (м, 1H), 7,51-7,44 (м, 1H), 5,50-5,43 (м, 1H), 4,91 (д, J=6,2 Гц, 1H), 4,66-4,54 (м, 4Н), 3,77-3,69 (м, 4Н), 3,39-3,30 (м, 4Н), 1,65 (д, J=6,8 Гц, 3H).
Пример 463. Синтез (2-хлор-4-((1-(3-(1,1-дифтор-2-гидроксиэтил)фенил)-2-фторэтил)амино)-5,7-дигидро-6Н-пирроло[3,4-d]пиримидин-6-ил)(морфолино)метанона
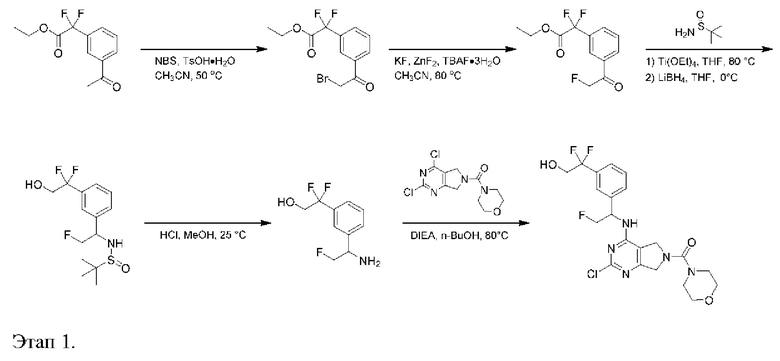
[00548] В раствор этил 2-(3-ацетилфенил)-2,2-дифторацетата (14,0 г, 57,8 ммоль) в MeCN (140 мл) добавляли NBS (10,3 г, 57,8 ммоль) и TsOH⋅H2O (11,0 г, 57,8 ммоль). Реакционную смесь перемешивали при 50°С в течение 15 ч, потом смесь добавляли в ледяную воду и нейтрализовали NaHCO3. Смесь экстрагировали EtOAc, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали посредством колоночной хроматографии с получением этил 2-[3-(2-бромацетил) фенил]-2,2-дифторацетата (8,0 г, выход 43%). 1Н ЯМР (400 МГц, Хлороформ-d) δ м. д. 8,23 (с, 1H), 8,14 (д, J=7,6 Гц, 1H), 7,87 (д, J=7,6 Гц, 1H), 7,63 (т, J=7,6 Гц, 1H), 4,47 (с, 2Н), 4,33 (кв, J=7,2 Гц, 2Н), 1,33 (т, J=7,2 Гц, 3H).
Этап 2.
[00549] Раствор KF (452 мг, 7,79 ммоль), TBAF⋅3H2O (3,68 г, 11,7 ммоль) и ZnF2 (1,61 г, 15,6 ммоль) в MeCN (50 мл) перемешивали при 80°С в течение 1 ч, потом добавляли этил 2-[3-(2-бромацетил)фенил]-2,2-дифторацетат (5,0 г, 16 ммоль) и перемешивали смесь при 80°С в течение 10 ч. Потом реакционную смесь добавляли в ледяную воду, экстрагировали EtOAc, сушили над Na2SO4 и концентрировали при пониженном давлении. Неочищенный остаток очищали посредством колоночной хроматографии с получением этил 2,2-дифтор-2-[3-(2-фторацетил)фенил] ацетата (2,3 г, выход 57%). 1H ЯМР (400 МГц, Хлороформ-d) δ м. д. 8,15 (с, 1Н), 8,06 (д, J=7,6 Гц, 1H), 7,89 (д, J=7,6 Гц, 1H), 7,64 (т, J=8,0 Гц, 1H), 5,54 (д, J=46,8 Гц, 2Н), 4,33 (кв, J=7,2 Гц, 2Н), 1,33 (т, J=7,2 Гц, 3H).
Этап 3.
[00550] В раствор этил 2,2-дифтор-2-[3-(2-фторацетил)фенил]ацетата (0,50 г, 1,9 ммоль) и 2-метилпропан-2-сульфинамида (256 мг, 2,11 ммоль) в ТГФ (5 мл) добавляли Ti(OEt)4 (1,20 мл, 5,76 ммоль). Смесь перемешивали при 80°С в течение 10 ч, потом охлаждали до 0°С. Добавляли МеОН (77,8 мкл, 1,92 ммоль) и LiBH4 (83,7 мг, 3,84 ммоль) и перемешивали смесь при 0°С в течение 1 ч. Реакционную смесь добавляли в ледяную воду, фильтровали, сушили над Na2SO4 и концентрировали при пониженном давлении. Неочищенный продукт очищали посредством препаративной ТСХ с получением N-[1-[3-(1,1-дифтор-2-гидрокси-этил)фенил]-2-фтор-этил]-2-метил-пропан-2-сульфинамида (0,30 г, выход 48%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C14H21F3NO2S: 324,1; полученное 324,1.
Этап 4.
[00551] В смесь N-[1-[3-(1,1-дифтор-2-гидрокси-этил)фенил]-2-фтор-этил]-2-метил-пропан-2-сульфинамида (100 мг, 309 мкмоль) в МеОН (1 мл) добавляли 4 М раствор HCl в МеОН (232 мкл, 928 мкмоль). Смесь перемешивали при 25°С в течение 2 ч, потом обрабатывали 1 М раствором NaOH в МеОН для доведения до рН=8 и концентрировали при пониженном давлении с получением 2-[3-(1-амино-2-фтор-этил) фенил]-2, 2-дифтор-этанола (55 мг, неочищенный). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C10H13F3NO: 220,0; полученное 220,1.
Этап 5.
[00552] В раствор 2-[3-(1-амино-2-фтор-этил) фенил]-2,2-дифтор-этанола (50 мг, 230 мкмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (69,2 мг, 228 мкмоль) в n-BuOH (1 мл) добавляли ДИЭА (79,5 мкл, 456 мкмоль). Реакционную смесь перемешивали при 80°С в течение 5 ч, потом фильтровали, концентрировали при пониженном давлении и очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[1-[3-(1,1-дифтор-2-гидрокси-этил)фенил]-2-фтор-этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (20 мг, выход 18%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H24ClF3N5O3: 486,1; полученное 486,1. 1H ЯМР (400 МГц, Метанол-d4) δ м. д. 7,63 (с, 1H), 7,56 (с, 1H), 7,52-7,44 (м, 2Н), 5,76-5,64 (м, 1Н), 4,78 (д, J=6,4 Гц, 1H), 4,67 (с, 2Н), 4,66 (с, 1H), 4,59 (с, 2Н), 3,89 (t,J=13,2 Гц, 2Н), 3,77-3,68 (м, 4Н), 3,40-3,34 (м, 4Н).
Примеры 464 и 465. Синтез (2-хлор-4-(((R)-1-((R)-2-(гидроксиметил)-2,3-дигидро-1Н-инден-4-ил)этил)амино)-5,7-дигидро-6H-пирроло[3,4-d]пиримидин-6-ил)(морфолино)метанона и (2-хлор-4-(((R)-1-((S)-2-(гидроксиметил)-2,3-дигидро-1Н-инден-4-ил)этил)амино)-5,7-дигидро-6Н-1пирроло[3,4-d]пиримидин-6-ил)(морфолино)метанона
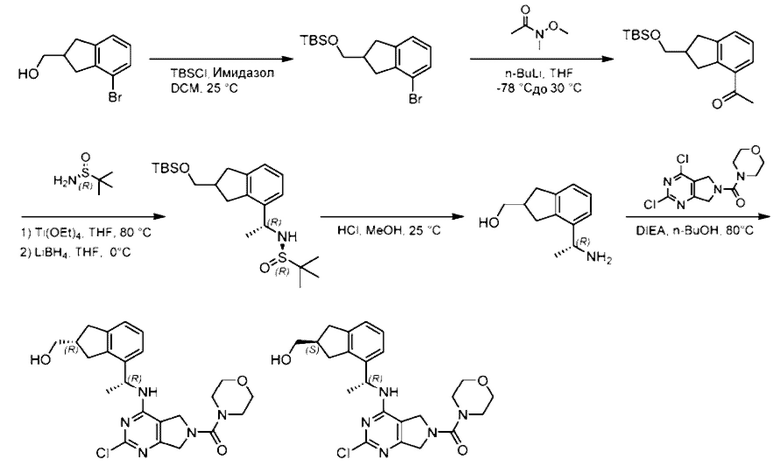
Этап 1.
[00553] В смесь (4-броминдан-2-ил)метанола (900 мг, 3,96 ммоль) в ДХМ (3 мл) добавляли имидазол (1,08 г, 15,6 ммоль) и TBSCl (1,19 г, 7,93 ммоль) и перемешивали смесь при 25°С в течение 90 мин. Потом реакцию гасили H2O, экстрагировали EtOAc, сушили над Na2SO4 и концентрировали при пониженном давлении. Неочищенный остаток очищали посредством препаративной ТСХ с получением (4-броминдан-2-ил)метокси-трет-бутил-диметилсилана (990 мг, выход 73%). 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 7,25 (д, J=7,8, 1Н), 7,12 (м, 1Н), 7,01 (м, 1Н), 3,64-3,55 (м, 2Н), 3,15-3,07 (м, 1Н), 3,05-2,95 (м, 1Н), 2,71-2,60 (м, 3H), 0,88 (с, 9Н), 0,05 (с, 6Н).
Этап 2.
[00554] В смесь (4-броминдан-2-ил)метокси-трет-бутил-диметилсилана (990 мг, 2,90 ммоль) в ТГФ (2 мл) добавляли 2,5 М раствор n-BuLi в гексанах (2,32 мл, 5,80 ммоль) при -78°С в атмосфере N2 и перемешивали смесь при -78°С в течение 2 ч. Потом добавляли раствор N-метокси-N-метилацетамида (449 мг, 4,35 ммоль) в ТГФ (2 мл) при -30°С в атмосфере N2 и перемешивали смесь при -30°С в течение 1 ч. Реакцию гасили добавлением Н2О, потом экстрагировали EtOAc, сушили над Na2SO4 и концентрировали при пониженном давлении. Неочищенный остаток очищали посредством препаративной ТСХ с получением 1-[2-[[трет-бутил(диметил)силил]оксиметил]индан-4-ил]этанона (290 мг, выход 33%). 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 7,70 (д, J=7,7 Гц, 1Н), 7,36 (д, J=7,3 Гц, 1H), 7,22 (т, J=7,6 Гц, 1H), 3,54 (д, J=6,5 Гц, 2Н), 3,23 (д, J=8,2 Гц, 1H), 3,05-2,95 (м, 2Н), 2,75-2,68 (м, 1H), 2,62-2,54 (м, 1H), 2,51 (с, 3H), 0,87 (с, 9Н), 0,04 (с, 6Н).
Этап 3.
[00555] В смесь 1-[2-[[трет-бутил(диметил)силил]оксиметил]индан-4-ил]этанона (270 мг, 887 мкмоль) в ТГФ (2 мл) добавляли Ti(OEt)4 (607 мг, 2,66 ммоль) и (R)-2-метилпропан-2-сульфинамид (215 мг, 1,77 ммоль). Смесь нагревали до 80°С и перемешивали в течение 7 ч. Смесь охлаждали до -4°С, потом добавляли МеОН (35,9 мкл, 887 мкмоль) и LiBH4 (58,0 мг, 2,66 ммоль) и перемешивали реакционную смесь при 0°С в течение 1 ч. Смесь медленно вливали в 1:1 Н2О/ТГФ, потом фильтровали через целит®, промывали ТГФ и выпаривали фильтрат при пониженном давлении. Неочищенный остаток очищали посредством препаративной ТСХ с получением (R)-N-((1R)-1-(2-(((трет-бутилдиметилсилил)окси)метил)-2,3-дигидро-1Н-инден-4-ил)этил)-2-метилпропан-2-сульфинамида (200 мг, выход 55%). 1H ЯМР (400 МГц, Метанол-d4) δ м. д. 7,21 (д, J=7,6 Гц, 1H), 7,15-7,08 (м, 2Н), 4,60-4,56 (м, 1H), 3,64-3,59 (м, 2Н), 3,01-2,95 (м, 2Н), 2,85-2,61 (м, 3H), 1,48 (д, J=6,7 Гц, 3H), 1,21 (с, 9Н), 0,91 (с, 9Н), 0,07 (с, 6Н).
Этап 4.
[00556] В смесь (R)-N-((1R)-1-(2-(((трет-бутилдиметилсилил)окси)метил)-2,3-дигидро-1Н-инден-4-ил)этил)-2-метилпропан-2-сульфинамида (200 мг, 488 мкмоль) в МеОН (3 мл) добавляли 4 М раствор HCl в МеОН (1,22 мл, 4,88 ммоль). Смесь перемешивали при 25°С в течение 2 ч, потом фильтровали и концентрировали при пониженном давлении с получением (4-((R)-1-аминоэтил)-2,3-дигидро-1Н-инден-2-ил)метанола (93 мг, неочищенный). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C12H18NO: 192,0; полученное 192,0.
Этап 5.
[00557] В смесь (4-((R)-1-аминоэтил)-2,3-дигидро-1Н-инден-2-ил)метанола (40 мг, 87 мкмоль, выход 33%) в t-BuOH (2 мл) добавляли ДИЭА (60,1 мкл, 345 мкмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанон (34,9 мг, 115 мкмоль) при 25°С. Смесь перемешивали при 80°С в течение 3 ч, потом концентрировали при пониженном давлении. Неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[(2R)-2-(гидроксиметил)индан-4-ил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (12,6 мг, выход 32%) и [2-хлор-4-[[(1R)-1-[(2S)-2-(гидроксиметил)индан-4-ил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (5,5 мг, выход 14%).
[00558] Данные для [2-хлор-4-[[(1R)-1-[(2R)-2-(гидроксиметил)индан-4-ил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона:
[00559] ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C23H29ClN5O3: 458,2; полученное 458,2; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 7,17-7,06 (м, 3H), 5,36 (д, J=7,1 Гц, 1H), 4,60-4,52 (м, 4Н), 3,74-3,69 (м, 4Н), 3,64-3,59 (м, 1H), 3,53 (д, J=7,5 Гц, 1H), 3,36-3,32 (м, 4Н), 3,10-3,02 (м, 2Н), 2,97-2,91 (м, 1Н), 2,78 (д, J=5,5 Гц, 1H), 2,71-2,63 (м, 1Н), 1,53 (д, J=6,8 Гц, 3H).
[00560] Данные для [2-хлор-4-[[(1R)-1-[(2S)-2-(гидроксиметил)индан-4-ил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона:
[00561] ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C23H29ClN5O3: 458,2; полученное 458,2; 1H ЯМР (400 МГц, Метанол-d4) δ м. д. 7,16-7,07 (м, 3H), 5,38-5,30 (м, 1Н), 4,59-4,55 (м, 4Н), 3,69-3,73 (м, 4Н), 3,56 (д, J=6,4 Гц, 2Н), 3,34 (д, J=5,1 Гц, 4Н), 3,05-2,95 (м, 2Н), 2,77-2,69 (м, 3H), 1,52 (д, J=7,1 Гц, 3H).
Пример 466. Синтез [2-хлор-4-[[(1R)-1-(3,3-дифтор-2Н-бензофуран-7-ил)этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона
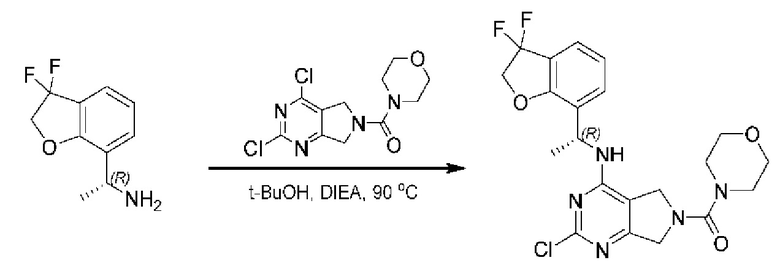
Этап 1.
[00562] В раствор (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометано на (65,0 мг, 214 мкмоль) в t-BuOH (1,5 мл) добавляли (1R)-1-(3,3-дифтор-2Н-бензофуран-7-ил)этанамин гидрохлорид (58,4 мг, 248 мкмоль) и ДИЭА (187 мкл, 1,07 ммоль). Реакционную смесь перемешивали при 90°С в течение 1 ч, потом концентрировали при пониженном давлении. Неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-(3,3-дифтор-2Н-бензофуран-7-ил)этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (23 мг, выход 23%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H23ClF2N5O3: 466,1; полученное 466,1; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 7,50-7,45 (м, 1H), 7,45-7,41 (м, 1H), 7,09-7,03 (м, 1H), 5,54-5,47 (м, 1Н), 4,72 (т, J=16,1 Гц, 2Н), 4,66-4,54 (м, 4Н), 3,76-3,68 (м, 4Н), 3,39-3,33 (м, 4Н), 1,58 (д, J=7,1 Гц, 3H).
Пример 467. Синтез [2-хлор-4-[[(1R)-1-[3-(1,1-дифторэтил)фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона
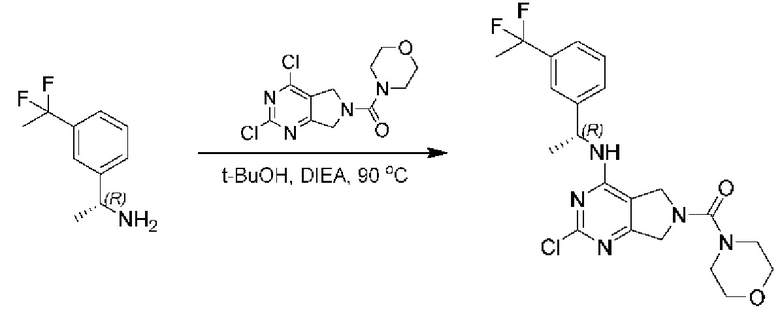
Этап 1.
[00563] В раствор (1R)-1-[3-(1,1-дифторэтил)фенил]этанамина (60,0 мг, 324 мкмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (98,2 мг, 324 мкмоль) в t-BuOH (2 мл) добавляли ДИЭА (169 мкл, 972 мкмоль). Смесь перемешивали при 90°С в течение 1 ч, потом добавляли в ледяную воду, экстрагировали EtOAc, сушили над Na2SO4 и концентрировали при пониженном давлении. Неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[3-(1,1-дифторэтил)фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (60 мг, выход 40%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H25ClF2N5O2: 452,2; полученное 451,9; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 7,58 (с, 1Н), 7,54-7,46 (м, 1H), 7,45-7,37 (м, 2Н), 5,41 (кв, J=6,4 Гц, 1Н), 4,61 (с, 2Н), 4,57 (с, 2Н), 3,75-3,68 (с, 4Н), 3,38-3,30 (с, 4Н), 1,90 (т, J=18,4 Гц, 3H), 1,58 (д, J=7,2 Гц, 3H).
Пример 468. Синтез [2-хлор-4-[[(1R)-1-(3-фторбензофуран-7-ил)этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-формолинометанона
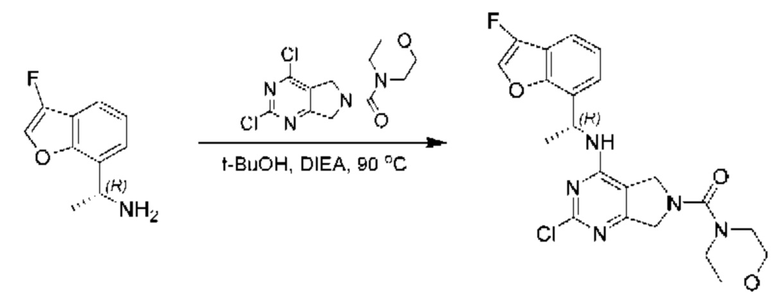
Этап 1.
[00564] Смесь (1H)-1-(3-фторбензофуран-7-ил)этанамина (50,0 мг, 279 мкмоль), (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (102 мг, 335 мкмоль) и ДИЭА (243 мкл, 1,40 ммоль) в t-BuOH (1 мл) продували N2 и потом перемешивали при 90°С в течение 15 ч. Потом смесь концентрировали при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1H)-1-(3-фторбензофуран-7-ил)этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (22,6 мг, выход 17%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H22ClFN5O3: 446,1; полученное 446,1; 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 7,86 (д, J=4,0 Гц, 1Н) 7,49 (д, J=8,0 Гц, 1H) 7,34 (д, J=8,0 Гц, 1H) 7,29-7,22 (м, 1Н) 5,80 (кв, J=8,0 Гц, 1Н) 4,77-4,57 (м, 4Н), 3,74-3,69 (м, 4Н) 3,37-3,31 (м, 4Н) 1,66 (д, J=8,0 Гц, 3H).
Пример 469. Синтез [2-хлор-4-[[(1R)-1-[3-[2-(циклопропокси)-1,1-дифторэтил]-2-фтор-фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона
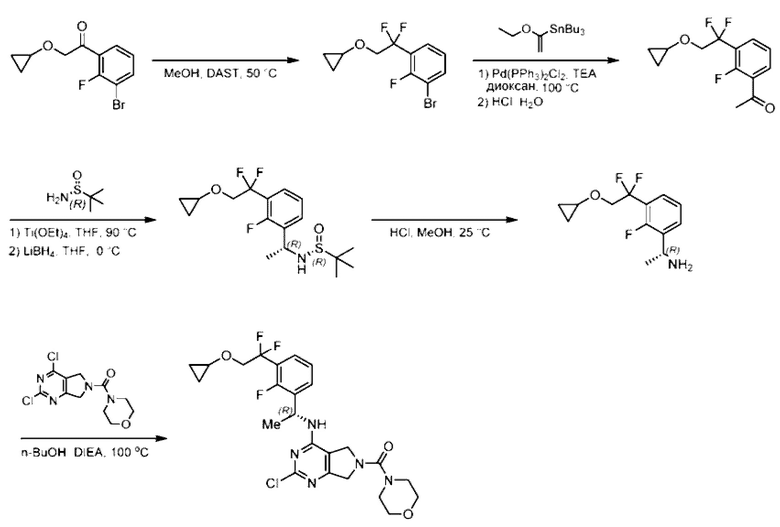
Этап 1.
[00565] В раствор 1-(3-бром-2-фтор-фенил)-2-(циклопропокси)этанона (1,85 г, 6,77 ммоль) в DAST (20 мл) добавляли МеОН (2,74 мкл, 67,7 мкмоль) и перемешивали реакционную смесь при 50°С в течение 12 ч. Потом смесь вливали в воду и экстрагировали EtOAc. Объединенные органические экстракты промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Потом неочищенный остаток очищали посредством колоночной хроматографии с получением бром-3-[2-(цикл опропокси)-1,1-дифторэтил]-2-фтор-бензола (1,5 г, выход 75%). 1Н ЯМР (400 МГц, Метанол-d4) δ м. д. 7,67 (т, J=7 Гц, 1Н), 7,52 (т, J=7,2 Гц, 1Н), 7,15-7,08 (м, 1Н), 4,06 (т, J=13,5 Гц, 2Н), 3,46-3,42 (м, 1Н), 0,60-0,54 (м, 2Н), 0,51-0,45 (м, 2Н).
Этап 2.
[00566] В смесь 1-бром-3-[2-(циклопропокси)-1,1-дифторэтил]-2-фтор-бензола (500 мг, 1,69 ммоль) и трибутил(1-этоксивинил)станнана (858 мкл, 2,54 ммоль) в диоксане (5 мл) добавляли ТЭА (590 мкл, 4,24 ммоль) и Pd(PPh3)2Cl2 (119 мг, 169 мкмоль). Смесь продували газообразным аргоном, потом перемешивали при 100°С в течение 12 ч. После охлаждения до кт добавляли 2 М водный раствор HCl (10 мл, 20 ммоль) и перемешивали смесь при в течение 1 ч (рН=2). Реакционную смесь экстрагировали EtOAc, а объединенные органические экстракты обрабатывали водным раствором KF (20 мл, 5 г KF) и перемешивали в течение 2 ч. Смесь фильтровали, а раствор промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали посредством колоночной хроматографии с получением 1-[3-[2-(циклопропокси)-1,1-дифторэтил]-2-фтор-фенил]этанона (360 мг, выход 82%). 1H ЯМР (400 МГц, Хлороформ-d) δ м.д. 7,89 (т, J=6,8 Гц, 1Н), 7,67 (т, J=6,8 Гц, 1Н), 7,25-7,18 (м, 1H), 4,01 (т, J=13,4 Гц, 2Н), 3,38-3,34 (м, 1H), 2,60-2,58 (м, 3Н), 0,53-0,35 (м, 4Н).
Этап 3.
[00567] В смесь 1-[3-[2-(циклопропокси)-1,1-дифторэтил]-2-фтор-фенил]этанона (360 мг, 1,39 ммоль) и (R)-(+)-2-метил-2-пропансульфинамида (253 мг, 2,09 ммоль) в ТГФ (5 мл) добавляли Ti(OEt)4 (1,45 мл, 6,97 ммоль). Смесь нагревали до 90°С и перемешивали в течение 2 ч. Смесь охлаждали до 0°С. Добавляли МеОН (56,4 мкл, 1,39 ммоль) и LiBH4 (33,4 мг, 1,53 ммоль) и перемешивали смесь при 0°С в течение 30 мин. Реакционную смесь вливали в 1:1 H2O/ТГФ, потом фильтровали через целит® и концентрировали при пониженном давлении. Неочищенный остаток очищали посредством колоночной хроматографии с получением (R)-N-((R)-1-(3-(2-циклопропокси-1,1-дифторэтил)-2-фторфенил)этил)-2-метилпропан-2-сульфинамида (170 мг, выход 34%). 1Н ЯМР (400 МГц, Хлороформ-d) δ м.д. 7,53-7,48 (м, 2Н), 7,22 (т, J=7,6 Гц, 1H), 4,88-4,86 (м, 1H), 4,05 (т, J=13,6 Гц, 2Н), 3,52 (шир. д, J=4,8 Гц, 1H), 3,44 (м, 1H), 1,54 (д, J=6,4 Гц, 3Н), 1,23 (с, 9Н), 0,60-0,54 (м, 2Н), 0,50-0,44 (м, 2Н).
Этап 4.
[00568] В смесь (R)-N-((R)-1-(3-(2-циклопропокси-1,1-дифторэтил)-2-фторфенил)этил)-2-метилпропан-2-сульфинамида (170 мг, 467 мкмоль) в МеОН (2 мл) добавляли 4 М раствор HCl в МеОН (468 мкл, 1,87 ммоль). Реакционную смесь перемешивали при 25°С в течение 30 мин. Потом смесь концентрировали при пониженном давлении, по каплям обрабатывали NaOH в МеОН до рН=7, потом снова концентрировали при пониженном давлении. Остаток растворяли в 10:1 ДХМ:МеОН и фильтровали. Фильтрат концентрировали при пониженном давлении с получением (1R)-1-[3-[2-(циклопропокси)-1,1-дифторэтил]-2-фтор-фенил]этанамина (121 мг, неочищенный).
Этап 5.
[00569] В смесь (1R)-1-[3-[2-(циклопропокси)-1,1-дифторэтил]-2-фтор-фенил]этанамина (121 мг, 467 мкмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (212 мг, 700 мкмоль) в n-BuOH (2 мл) добавляли ДИЭА (406 мкл, 2,33 ммоль). Реакционную смесь перемешивали при 100°С в течение 12 ч. Потом смесь фильтровали, а фильтрат очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[3-[2-(циклопропокси)-1,1-дифторэтил]-2-фтор-фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (72 мг, выход за два этапа 29%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C24H28ClF3N5O3: 526,2; полученное 526,4. 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 7,54 (т, J=6,8 Гц, 1Н), 7,44 (т, J=6,6 Гц, 1H), 7,22 (т, J=7,6 Гц, 1H), 5,59 (кв, J=7,2 Гц, 1H), 4,65 (шир. с, 2Н), 4,60-4,55 (м, 2Н), 4,06 (т, J=13,4 Гц, 2Н), 3,75-3,69 (м, 4Н), 3,42-3,38 (м, 1H), 3,38-3,34 (м, 4Н), 1,59 (д, J=6,8 Гц, 3Н), 0,39-0,44 (м, 4Н).
Пример 470. Синтез N-{1-[3-амино-5-(трифторметил)фенил]пропил}-2-хлор-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
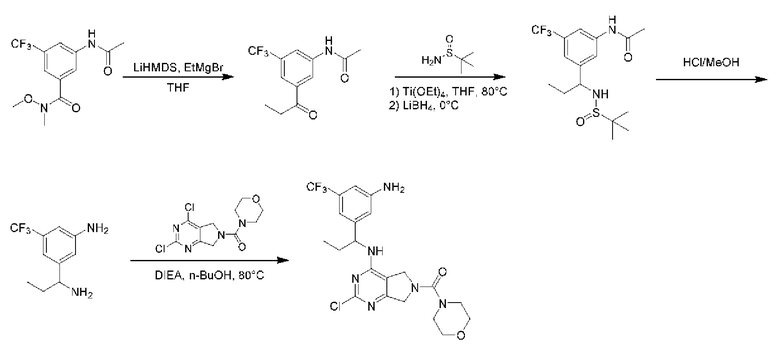
Этап 1.
[00570] В раствор 3-ацетамидо-N-метокси-N-метил-5-(трифторметил)бензамида (5 г, 17,23 ммоль) в ТГФ (35 мл) добавляли LiHMDS (1 М, 17,23 мл) при 0°С, реакционную смесь перемешивали при 0°С в течение 0,5 ч, а потом добавляли EtMgBr (2 М, 30,15 мл) при 0°С. Реакционную смесь перемешивали при 25°С в течение 0,5 ч, а потом выливали на лед и доводили до рН~4 с помощью 2 М HCl. После экстракции EtOAc объединенную органическую фазу промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением N-[3-пропаноил-5-(трифторметил)фенил]ацетамида (3,3 г, выход 73,9%) в виде светло-желтого твердого вещества. 1H ЯМР (400 МГц, Хлороформ-d) δ м.д. 8,22 (с, 1Н) 8,19 (с, 1Н) 7,97 (шир. с, 1Н) 7,91 (с, 1Н) 3,03 (кв, J=7,2 Гц, 2Н) 2,25 (с, 3Н) 1,24 (т, J=7,2 Гц, 3Н).
Этап 2.
[00571] В смесь N-[3-пропаноил-5-(трифторметил)фенил]ацетамида (3,3 г, 12,73 ммоль), 2-метилпропан-2-сульфинамида (3,09 г, 25,46 ммоль) в ТГФ (30 мл) добавляли Ti(OEt)4 (8,71 г, 38,19 ммоль, 7,92 мл) при 25°С. Смесь перемешивали при 90°С в течение 10 ч. После охлаждения до 0°С, добавляли МеОН (407,90 мг, 12,73 ммоль, 515,16 мкл), потом - LiBH4 (277,31 мг, 12,73 ммоль) и перемешивали полученную в результате смесь при 0°С в течение 1 ч. Добавляли Н2О, смесь фильтровали. Фильтрат экстрагировали EtOAc, а объединенные органические слои промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением N-[3-[1-(трет-бутилсульфиниламино)пропил]-5-(трифторметил)фенил]ацетамида (2,5 г, выход 53,89%) в виде желтого твердого вещества. 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 7,89 (с, 1Н) 7,73 (с, 1Н) 7,43 (с, 1Н) 4,22 (т, J=7,2 Гц, 1Н) 2,15 (с, 3Н) 1,97 (м, 1Н) 1,80 (м, 1Н) 1,23 (с, 9Н) 0,92 (т, J=7,4 Гц, 3Н).
Этап 3.
[00572] Раствор N-[3-[1-(трет-бутилсульфиниламино)пропил]-5-(трифторметил)фенил]ацетамида (500 мг, 1,37 ммоль) в HCl/МеОН (4 М, 10 мл) перемешивали при 25°С в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении, а неочищенный остаток разводили МеОН (2 мл) и доводили до рН ~8 с помощью водного NaOH. Удаление растворителя при пониженном давлении дало 3-(1-аминопропил)-5-(трифторметил)анилин (290 мг, выход 96,9%) в виде бесцветного масла. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C10H14F3N2: 219,1; полученное 219,0.
Этап 4.
[00573] В раствор (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолино метано на (100 мг, 329,88 мкмоль) и 3-(1-аминопропил)-5-(трифторметил)анилина (107,98 мг, 494,8 мкмоль) в n-BuOH (2 мл) добавляли ДИЭА (127,90 мг, 989,63 мкмоль, 172,38 мкл). Смесь перемешивали при 80°С в течение 10 ч. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [4-[1-[3-амино-5-(трифторметил)фенил]пропиламино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (57,8 мг, выход 35,01%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H25ClF3N6O2: 485,2; полученное 485,1; 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 6,92 (с, 1Н) 6,89 (с, 1Н) 6,81 (с, 1Н) 5,09 (с, 1Н) 4,62 (с, 2Н) 4,57 (с, 2Н) 3,72 (т, J=4,6 Гц, 4Н) 3,35 (т, J=4,6 Гц, 4Н) 1,95-1,84 (м, 2Н) 0,97 (т, J=7,4 Гц, 3Н).
Пример 471. Синтез 2-[3-(1-{[2-хлор-6-(4-метоксиоксан-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-ил]амино}этил)-2-фторфенил]-2,2-дифторэтан-1-ола
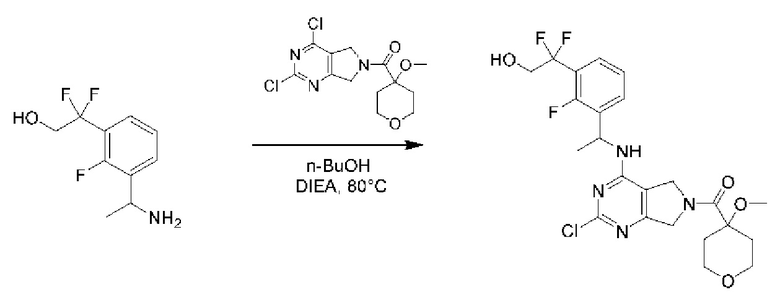
Этап 1.
[00574] В раствор 2-[3-(1-аминоэтил)-2-фтор-фенил]-2,2-дифторэтанола гидрохлорида (80 мг, 312,9 мкмоль) в n-BuOH (2 мл) добавляли ДИЭА (121,32 мг, 938,7 мкмоль, 163,5 мкл) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-(4-метокситетрагидропиран-4-ил)метанон (103,94 мг, 312,91 мкмоль). Смесь перемешивали при 80°С в течение 2 ч. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[1-[3-(1,1-дифтор-2-гидрокси-этил)-2-фтор-фенил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-(4-метокситетрагидропиран-4-ил)метанона (60 мг, выход 37,2%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C23H27ClF3N4O4: 515,2; полученное 515,2; 1Н ЯМР (400 МГц, Метанол-d4) δ=7,54-7,59 (м, 1H), 7,45-7,52 (м, 1H), 7,22-7,28 (м, 1H), 5,63-5,66 (м, 1Н),4,98-5,07 (с, 2Н), 4,51-4,62 (м, 2Н), 4,01-3,98 (м, 2Н), 3,76-3,82 (м, 4Н), 3,23-3,33 (м, 3Н), 1,94-2,12 (м, 4Н), 1,60 (д, J=6,8 Гц, 3Н).
Пример 472. Синтез 2-хлор-6-(морфолин-4-карбонил)-N-{1-[4-(трифторметил)пиридин-2-ил]этил}-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
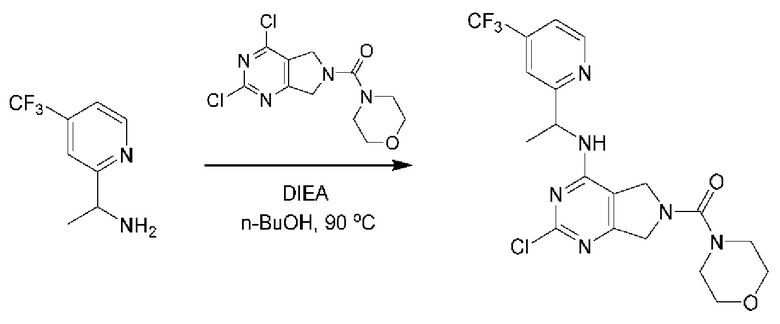
Этап 1.
[00575] В раствор 1-[4-(трифторметил)-2-пиридил]этанамина (100,00 мг, 525,86 мкмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (159,41 мг, 525,86 мкмоль) в и-BuOH (1 мл) добавляли ДИЭА (135,9 мг, 1,05 ммоль, 183,19 мкл). Смесь перемешивали при 90°С в течение 1 ч. После охлаждения до кт смесь фильтровали, а фильтрационный осадок очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[1-[4-(трифторметил)-2-пиридил] этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (50 мг, выход 20,68%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C19H21ClF3N6O2: 457,1; полученное 457,1; 1Н ЯМР (400 МГц, Метанол-d4) δ=8,75 (д, J=5,2 Гц, 1H), 7,73 (с, 1H), 7,56 (д, J=4,4 Гц, 1H), 5,45 (кв, J=7,2 Гц, 1H), 4,67 (с, 2Н), 4,58 (с, 2Н), 3,76-3,70 (м, 4Н), 3,39-3,34 (м, 4Н), 1,63 (д, J=7,2 Гц, 3Н).
Пример 473. Синтез 2-хлор-6-(морфолин-4-карбонил)-N-[(1R)-1-[6-(трифторметил)пиридин-2-ил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
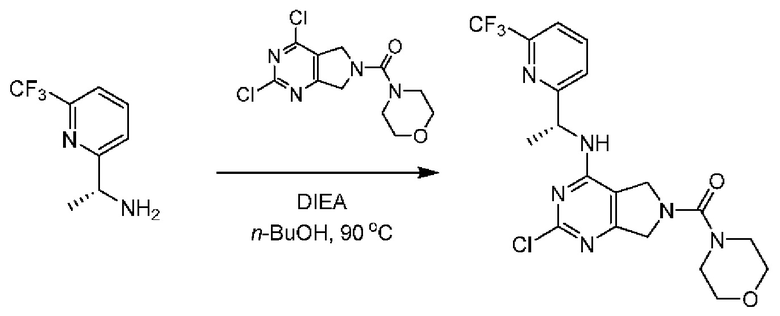
Этап 1.
[00576] В раствор (1R)-1-[6-(трифторметил)-2-пиридил]этанамина (0,1 г, 525,86 мкмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (159,41 мг, 525,86 мкмоль) в n-BuOH (2 мл) добавляли ДИЭА (135,93 мг, 1,05 ммоль, 183,19 мкл). Смесь перемешивали при 90°С в течение 1 ч, и потом вливали в ледяную воду. После экстракции ДХМ объединенную органическую фазу сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[6-(трифторметил)-2-пиридил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (80 мг, выход 23%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C19H21ClF3N6O2: 457,1; полученное 457,0; 1H ЯМР (400 МГц, Хлороформ-d) δ=7,91 (т, J=7,6 Гц, 1H), 7,63 (д, J=7,6 Гц, 1H), 7,54 (д, J=7,6 Гц, 1H), 6,29 (шир. д, J=7,2 Гц, 1H), 5,52 (т, J=6,8 Гц, 1H), 4,69 4,77 (м, 1Н), 4,55-4,66 (м, 3Н), 3,70-3,79 (м, 4Н), 3,42-3,32 (м, 4Н), 1,61 (д, J=6,8 Гц, 3Н).
Пример 474. Синтез 2-хлор-6-(морфолин-4-карбонил)-N-[(1R)-1-[2-(трифторметил)-1,3-тиазол-5-ил]этил]-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина
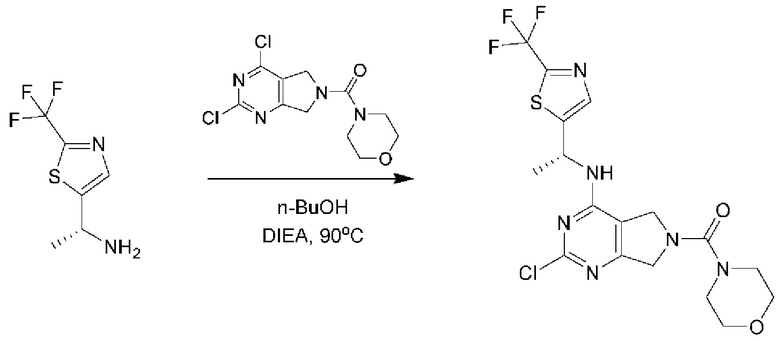
Этап 1.
[00577] Смесь (1R)-1-[2-(трифторметил)тиазол-5-ил]этанамина (120 мг, 611,64 мкмоль), (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (185,41 мг, 611,64 мкмоль) и ДИЭА (395,25 мг, 3,06 ммоль, 532,69 мкл) в n-BuOH (4 мл) дегазировали, потом перемешивали при 90°С в течение 10 ч в атмосфере N2. После охлаждения до кт растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[2-(трифторметил)тиазол-5-ил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (5,8 мг, выход 2,05%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C17H19ClF3N6O2S: 463,09; полученное 462,8; 1Н ЯМР (400 МГц, Метанол-d4) δ=7,96 (с, 1Н) 5,76 (кв, J=7,00 Гц, 1Н), 4,55-4,63 (м, 4Н), 3,78-3,65 (м, 4Н), 3,37-3,33 (м, 4Н), 1,76 (д, J=7,0 Гц, 3Н).
Пример 475. Синтез 2-хлор-N-[(1R)-1-{3-[дифтор(метокси)метил]фенил}этил]-6-(морфолин-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-в]пиримидин-4-амина
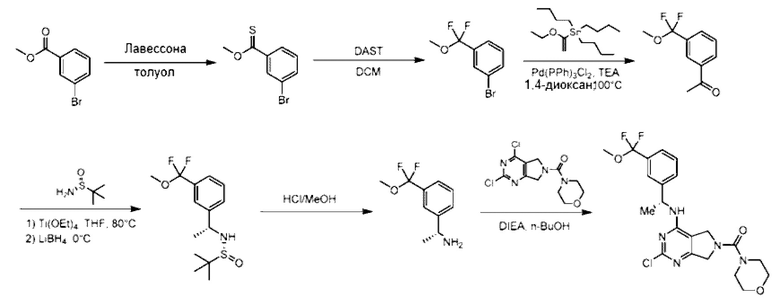
Этап 1.
[00578] В раствор метил 3-бромбензоата (10 г, 46,50 ммоль) в толуоле (10 мл) добавляли 2,4-бис(4-метоксифенил)-2,4-дитиоксо-1,3,2,4-дитиадифосфетан (20,69 г, 51,15 ммоль). Смесь перемешивали в микроволновом реакторе при 140°С в течение 4 ч. После охлаждения до кт растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением О-метил 3-бромбензолкарботиоата (4 г, выход 37,22%). 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 8,29 (т, J=1,76, 1Н) 8,08-8,16 (м, 1Н) 7,70-7,77 (м, 1Н) 7,34 (т, J=7,94, 1Н) 4,27-4,33 (м, 3Н).
Этап 2.
[00579] В раствор О-метил 3-бромбензолкарботиоата (3 г, 12,98 ммоль) в ДХМ (14 мл) добавляли DAST (6,28 г, 38,94 ммоль, 5,15 мл) и NBS (5,54 г, 31,15 ммоль). Смесь перемешивали при 25°С в течение 16 ч, и потом вливали в водный бикарбонат.Водную фазу экстрагировали ДХМ, а объединенную органическую фазу промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением 1-бром-3-[дифтор(метокси)метил]бензола (2,5 г, выход 81,25%). 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 7,71 (с, 1Н) 7,62-7,66 (м, 1Н) 7,54-7,57 (м, 1Н) 7,33-7,40 (м, 1Н) 3,69 (с, 3Н).
Этап 3.
[00580] В смесь 1-бром-3-[дифтор(метокси)метил]бензола (1 г, 4,22 ммоль) и трибутил(1-этоксивинил)станнана (2,29 г, 6,33 ммоль, 2,14 мл) в диоксане (10 мл) добавляли ТЭА (1,07 г, 10,55 ммоль, 1,47 мл) и Pd(PPh3)2Cl2 (296,11 мг, 421,87 мкмоль). Смесь продували N2 и потом перемешивали в атмосфере N2 при 100°С в течение 3 ч, после чего смесь охлаждали до кт и добавляли водн. HCl (5 мл, 1 М). Смесь перемешивали при кт в течение 1 ч и потом фильтровали. Фильтрат экстрагировали EtOAc, а объединенные органические слои вливали в водн. KF (20 мл, 5 г KF) и перемешивали в течение 2 ч. Смесь фильтровали, а органический слой промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении. Неочищенный остаток очищали посредством колоночной хроматографии с получением 1-[3-[дифтор(метокси)метил]фенил]этанона (530 мг, выход 62,8%). 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 8,17 (с, 1Н) 8,11-8,13 (д, J=8, 1Н) 7,81-7,83 (д, J=7,2, 1Н) 7,58-7,62 (м, J=8, 1Н) 3,79 (с, 3Н) 2,62 (с, 3Н).
Этап 4.
[00581] В раствор 1-[3-[дифтор(метокси)метил]фенил]этанона (530 мг, 2,65 ммоль) и (R)-2-метилпропан-2-сульфинамида (481,34 мг, 3,97 ммоль) в ТГФ (5 мл) добавляли тетраэтоксититан (3,02 г, 13,24 ммоль, 2,75 мл) и перемешивали смесь при 90°С в течение 3 ч. После охлаждения до 0°С добавляли LiBH4 (63,43 мг, 2,91 ммоль) и МеОН (84,83 мг, 2,65 ммоль, 107,13 мкл) и перемешивали реакционную смесь при 0°С в течение 30 мин. Потом реакционную смесь вливали в воду и экстрагировали водную фазу EtOAc. Объединенную органическую фазу промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением N-[(1R)-1-[3-[дифтор(метокси)метил]фенил]этил]-2-метил-пропан-2-сульфинамида (640 мг, выход 60,95%). 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 7,67 (с, 1Н) 7,53-7,59 (м, 1Н) 7,48-7,52 (м, 1Н) 7,42-7,47 (м, 1Н) 4,55 (кв, J=6,72, 1Н) 3,72 (с, 3Н) 1,48-1,62 (м, 3Н) 1,18-1,34 (м, 9Н).
Этап 5.
[00582] В раствор N-[(1R)-1-[3-[дифтор(метокси)метил]фенил]этил]-2-метил-пропан-2-сульфинамида (200 мг, 654,92 мкмоль) в диоксане (2 мл) добавляли HCl/диоксан (4 М, 327,46 мкл). Смесь перемешивали при 25°С в течение 2 ч. Растворитель удаляли при пониженном давлении с получением (1R)-1-[3-[дифтор(метокси)метил]фенил]этанамина (131,78 мг, неочищенный), который использовали на следующем этапе без очистки. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C10H14F2NO: 202,1; полученное 202,2.
Этап 6.
[00583] В раствор (1R)-1-[3-[дифтор(метокси)метил]фенил]этанамина (131 мг, 651,05 мкмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (197,36 мг, 651,05 мкмоль) в n-BuOH (2 мл) добавляли ДИЭА (252,43 мг, 1,95 ммоль, 340,20 мкл). Смесь перемешивали при 100°С в течение 3 ч. После охлаждения до кт растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[3-[дифтор(метокси)метил]фенш1]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (30 мг, выход 9,61%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H25ClF2N5O3: 468,2; полученное 468,2; 1Н ЯМР (400 МГц, MeOH-d6) δ м.д. 7,64 (с, 1Н) 7,51-7,53 (д, J=8 Гц, 1Н) 7,45-7,47 (д, 1Н) 7,38-7,42 (т, J=8 Гц, 1Н) 5,38-5,42 (м, 1Н) 4,54-4,59 (м, 4Н) 3,69-3,72 (м, 4Н) 3,68 (с, 3Н) 3,30-3,34 (м, 4Н) 1,56 (д, J=7,2, 3Н).
Пример 476. Синтез 2-хлор-N-[1-(4,4-дифтор-3,4-дигидро-2Н-1-бензопиран-8-ил)этил]-6-(морфолин-4-карбонил)-5Н,6Н,7H-пирроло[3,4-d]пиримидин-4-амина
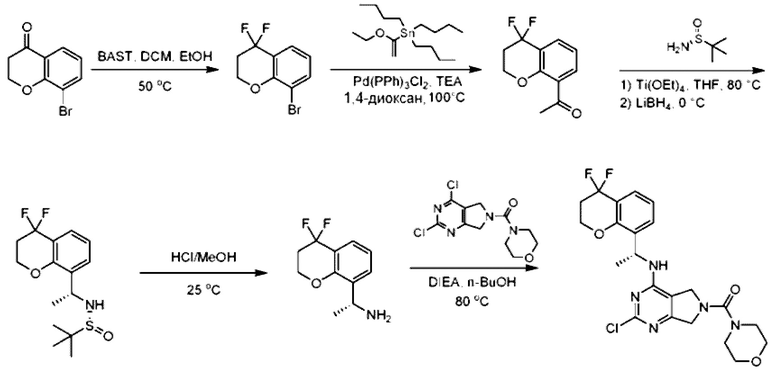
Этап 1.
[00584] В раствор 8-бромохроман-4-она (1 г, 4,40 ммоль) в ДХМ (5 мл) и EtOH (0,1 мл) добавляли BAST (9,74 г, 44,04 ммоль, 9,65 мл). Смесь перемешивали при 50°С в течение 36 ч. После охлаждения до кт добавляли водный NaHCO3 и экстрагировали смесь EtOAc. Объединенные органические слои промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением 8-бром-4,4-дифторхромана (0,6 г, выход 54,70%). 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 7,63 (д, J=8,0 Гц, 1Н) 7,55 (д, J=7,2 Гц, 1Н) 6,95 (т, J=8,0 Гц, 1Н) 4,49-4,39 (м, 2Н) 2,60-2,43 (м, 2Н).
Этап 2.
[00585] В смесь 8-бром-4,4-дифторхромана (600 мг, 2,41 ммоль) и трибутил(1-этоксивинил)станнана (1,31 г, 3,61 ммоль, 1,22 мл) в диоксане (10 мл) добавляли ТЭА (609,45 мг, 6,02 ммоль, 838,31 мкл) и Pd(PPh3)2Cl2 (169,10 мг, 240,91 мкмоль). Смесь продували Ar и перемешивали при 100°С в течение 10 ч. После охлаждения до кт по каплям добавляли 2 М HCl до рН ~2 и перемешивали смесь в течение 3 ч. Потом смесь фильтровали и экстрагировали фильтрат EtOAc. Объединенный органический слой вливали в водн. KF (30 мл, около 10 г KF) и перемешивали в течение 20 мин. Смесь фильтровали, а органический слой промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии (SiO2, петролейный эфир : Этилацетат = от 1:0 до 5:1) с получением 1-(4,4-дифторхроман-8-ил)этанона (460 мг, выход 89,98%). 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 7,81-7,75 (м, 2Н) 7,11 (т, J=7,6 Гц, 1Н) 4,52-4,46 (м, 2Н) 2,59 (с, 3Н) 2,58-2,50 (м, 2Н).
Этап 3.
[00586] В смесь 1-(4,4-дифторхроман-8-ил)этанона (460 мг, 2,17 ммоль) и (R)-2-метилпропан-2-сульфинамида (525,49 мг, 4,34 ммоль) в ТГФ (5 мл) добавляли Ti(OEt)4 (1,98 г, 8,67 ммоль, 1,80 мл) при 25°С. Смесь перемешивали при 80°С в течение 10 ч. После охлаждения до 0°С добавляли МеОН (69,46 мг, 2,17 ммоль, 87,73 мкл), потом - LiBH4 (51,95 мг, 2,38 ммоль) и перемешивали смесь при 0°С в течение 1 ч. Добавляли воду и фильтровали смесь. Фильтрат экстрагировали EtOAc, а объединенные органические слои промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением N-[1-(4,4-дифторхроман-8-ил)этил]-2-метил-пропан-2-сульфинамида (480 мг, выход 69,76%). 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 7,49 (т, J=9,2 Гц, 2Н) 7,03 (т, J=7,6 Гц, 1Н) 4,77 (кв, J=6,7 Гц, 1Н) 4,41 (т, J=5,2 Гц, 2Н) 2,43-2,56 (м, 2Н) 1,46 (д, J=6,8 Гц, 3Н) 1,21 (с, 9Н).
Этап 4.
[00587] Раствор N-[1-(4,4-дифторхроман-8-ил)этил]-2-метил-пропан-2-сульфинамида (200,00 мг, 630,13 мкмоль) в HCl/МеОН (4 М, 5 мл) перемешивали при 25°С в течение 1 ч. Реакционную смесь концентрировали при пониженном давлении с получением 1-(4,4-дифторхроман-8-ил)этанамина гидрохлорида (150 мг, выход 95,34%), который использовали без дополнительной очистки. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C11H14F2NO: 214,1; полученное 214,2.
Этап 5.
[00588] В раствор 1-(4,4-дифторхроман-8-ил)этанамин гидрохлорида (150 мг, 600,76 мкмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (182,12 мг, 600,76 мкмоль) в n-BuOH (1,5 мл) добавляли ДИЭА (388,21 мг, 3,00 ммоль, 523,19 мкл). Смесь перемешивали при 80°С в течение 10 ч. После охлаждения до кт удаляли растворитель при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[1-(4,4-дифторхроман-8-ил)этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (99,1 мг, выход 34,18%) в виде белого твердого вещества. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H25ClF2N5O3: 480,2; полученное 480,2; 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 7,46 (д, J=7,6 Гц, 1Н) 7,39 (д, J=7,6 Гц, 1Н) 6,99 (т, J=7,6 Гц, 1Н) 5,58 (д, J=6,0 Гц, 1Н) 4,63 (с, 2Н) 4,55 (д, J=2,4 Гц, 2Н) 4,43 (т, J=5,6 Гц, 2Н) 3,72 (т, J=4,6 Гц, 4Н) 3,35 (т, J=4,6 Гц, 4Н) 2,56-2,46 (м, 2Н) 1,52 (д, J=6,8 Гц, 3Н).
Пример 477. Синтез 2-хлор-N-[(1R)-1-[2-метил-3-(трифторметил)фенил]этил]-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
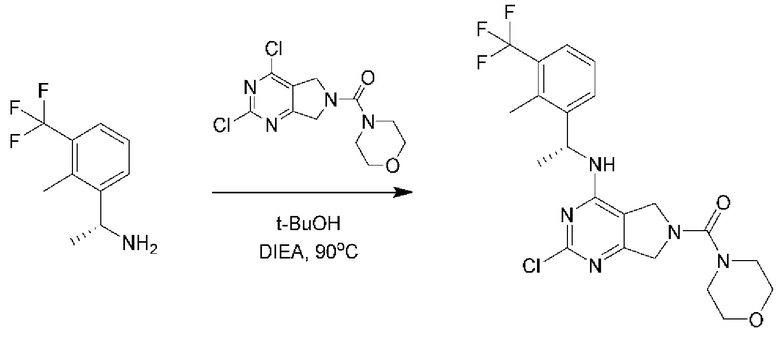
Этап 1.
[00589] Смесь (1R)-1-[2-метил-3-(трифторметил)фенил]этанамина (70 мг, 344,48 мкмоль), (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (114,87 мг, 378,93 мкмоль) и ДИЭА (222,61 мг, 1,72 ммоль, 300,01 мкл) в t-BuOH (2.1 мл) продували N2 и перемешивали при 90°С в течение 15 ч в атмосфере N2. После охлаждения до кт растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[2-метил-3-(трифторметил)фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (29 мг, выход 17,72%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H24ClF3N5O2: 470,15; полученное 470,1; 1H ЯМР (400 МГц, Метанол-d4) δ=7,62 (д, J=7,7 Гц, 1Н), 7,54 (д, J=7,8 Гц, 1H), 7,36-7,27 (м, 1H), 5,60 (кв, J=7,0 Гц, 1Н), 4,63 (с, 2Н), 4,56 (д, J=3,9 Гц, 2Н), 3,75-3,70 (м, 4Н), 3,35-3,34 (м, 4Н), 2,60 (с, 3Н), 1,54 (д, J=7,1 Гц, 3Н).
Пример 478. Синтез 2-хлор-N-[(1R)-1-[3-(1,1-дифторэтил)-2-фторфенил]этил]-6-(морфолин-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина
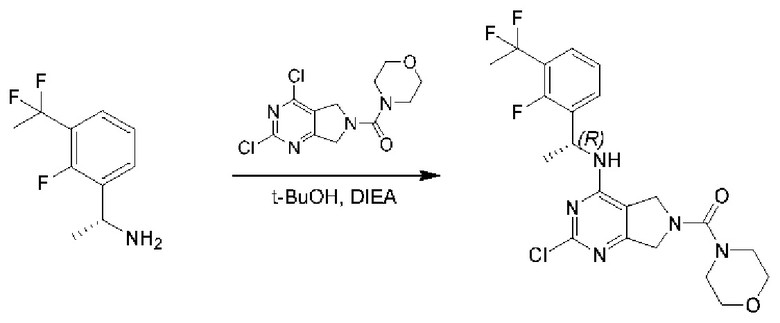
Этап 1.
[00590] В раствор (1R)-1-[3-(1,1-дифторэтил)-2-фтор-фенил]этанамина (90 мг, 442,90 мкмоль) в t-BuOH (2 мл) добавляли (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанон (134,26 мг, 442,90 мкмоль) и ДИЭА (171,73 мг, 1,33 ммоль, 231,44 мкл). Потом смесь перемешивали при 90°С в течение 2 ч. После охлаждения до кт смесь фильтровали, а фильтрационный осадок очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[3-(1,1-дифторэтил)-2-фтор-фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (70,92 мг, 149,03 мкмоль, выход 33,65%, чистота 98,74%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H24ClF3N5O2: 470,2; полученное 470,2; 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 7,50 (t, J=7,2 Гц, 1Н), 7,45 (т, J=7,2 Гц, 1Н), 7,16-7,24 (м, 1Н), 5,59 (м, 1Н), 4,65 (с, 2Н), 4,57 (д, J=2,4 Гц, 2Н), 3,69-3,76 (м, 4Н), 3,34-3,38 (м, 4Н), 1,99 (т, J=18,6 Гц, 3Н), 1,59 (д, J=7,2 Гц, 3Н).
Пример 479. Синтез 2-хлор-N-[(1R)-1-{3-[1,1-дифтор-2-(оксетан-3-илокси)этил]фенил}этил]-6-(морфолин-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина
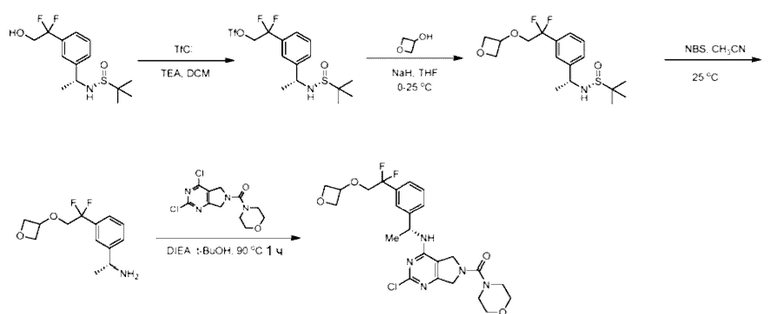
Этап 1.
[00591] В раствор N-[(1R)-1-[3-(1,1-дифтор-2-гидрокси-этил)фенил]этил]-2-метил-пропан-2-сульфинамида (12,08 г, 39,56 ммоль) в ДХМ (120 мл) добавляли трифторметансульфонилхлорид (10 г, 59,34 ммоль, 6,29 мл) и Et3N (16,01 г, 158,24 ммоль, 22,02 мл) при -60°С. Охлаждающую баню убирали и перемешивали смесь при 25°С в течение 2 ч. Добавляли водный хлорид аммония и экстрагировали смесь EtOAc. Объединенную органическую фазу промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением [2-[3-[(1R)-1-[[(R)-трет-бутилсульфинил]амино]этил]фенил]-2,2-дифторэтил]трифторметансульфоната (10 г, выход 57,79%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C15H21F5NO4S2: 438,1; полученное 438,0.
Этап 2.
[00592] В раствор оксетан-3-ола (677,37 мг, 9,14 ммоль) в ТГФ (5 мл) добавляли NaH (109,72 мг, 2,74 ммоль, 60% масс. в минеральном масле) при 0°С. Смесь перемешивали при 0°С в течение 1 ч перед добавлением [2-[3-[(1R)-1-[[(R)-трет-бутилсульфинил]амино]этил]фенил]-2,2-дифторэтил]трифторметансульфоната (0,4 г, 914,40 мкмоль) и перемешивали смесь при 25°С в течение 10 ч. Реакционную смесь вливали в ледяную воду и экстрагировали EtOAc. Объединенную органическую фазу промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-[1,1-дифтор-2-(оксетан-3-илокси)этил]фенил]этил]-2-метил-пропан-2-сульфинамида (100 мг, выход 30,26%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C17H26F2NO3S: 362,2; полученное 362,1.
Этап 3.
[00593] В раствор N-[(1R)-1-[3-[1,1-дифтор-2-(оксетан-3-илокси)этил]фенил]этил]-2-метил-пропан-2-сульфинамида (70 мг, 193,67 мкмоль, 1 экв.) в MeCN (3 мл) добавляли NBS (34,47 мг, 193,67 мкмоль) и перемешивали реакционную смесь при 25°С в течение 1 ч. Смесь вливали в водн. Na2SO3, перемешивали в течение 15 мин и фильтровали. Растворитель удаляли при пониженном давлении с получением (1R)-1-[3-[1,1-дифтор-2-(оксетан-3-илокси)этил]фенил]этанамина (49 мг, неочищенный), который использовали без дополнительной очистки. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C13H18F2NO2: 258,1; полученное 258,1.
Этап 4.
[00594] В раствор (1R)-1-[3-[1,1-дифтор-2-(оксетан-3-илокси)этил]фенил]этанамина (49 мг, 190,46 мкмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (57,74 мг, 190,46 мкмоль) в t-BuOH (2 мл) добавляли ДИЭА (49,23 мг, 380,91 мкмоль, 66,35 мкл). Смесь перемешивали при 90°С в течение 1 ч. После охлаждения до кт смесь фильтровали, а фильтрационный осадок очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[3-[1,1-дифтор-2-(оксетан-3-илокси)этил]фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (28 мг, выход 27,15%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C24H29ClF2N5O4: 524,2; полученное 524,2; 1H ЯМР (400 МГц, Метанол-d4) δ=7,58 (с, 1H), 7,53 (д, J=6,8 Гц, 1H), 7,39-7,46 (м, 2Н), 5,37-5,45 (м, 1Н), 4,67-4,88 (м, 5Н), 4,62-4,66 (м, 2Н), 4,46-4,50 (м, 1H), 4,35-4,45 (м, 1H), 3,88-3,93 (м, 2Н), 3,70-3,73 (м, 4Н), 3,33-3,36 (м, 4Н), 1,58 (д, J=7,2 Гц, 3Н).
Пример 480. Синтез 2-хлор-6-(морфолин-4-карбонил)-N-[(1R)-1-[5-(трифторметил)пиридин-3-ил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
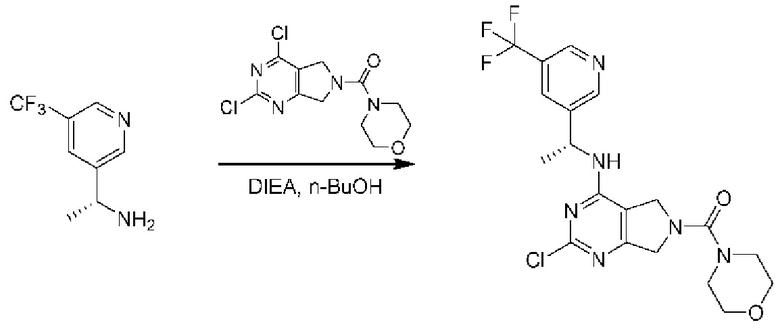
Этап 1.
[00595] В раствор (1R)-1-[5-(трифторметил)-3-пиридил]этанамина гидрохлорида (115 мг, 507,44 мкмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (153,83 мг, 507,44 мкмоль) в n-BuOH (2 мл) добавляли ДИЭА (131,17 мг, 1,01 ммоль, 176,77 мкл) и перемешивали смесь при 90°С в течение 1 ч. После охлаждения до кт реакционную смесь фильтровали и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[5-(трифторметил)-3-пиридил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (23,5 мг, выход 10,08%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C19H21ClF3N6O2: 457,1; полученное 457,1; 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 8,87 (с, 1Н) 8,77 (с, 1Н) 8,17 (с, 1Н) 5,44 (кв, J=7,2 Гц, 1Н) 4,65 (с, 2Н) 4,58 (с, 2Н) 3,72 (т, J=4,6 Гц, 4Н) 3,36 (т, J=4,6 Гц, 4Н) 1,65 (д, J=6,8 Гц, 3Н).
Пример 481. Синтез 2-хлор-N-[(1R)-1-[5-(дифторметил)-4-фтортиофен-3-ил]этил]-6-(морфолин-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина
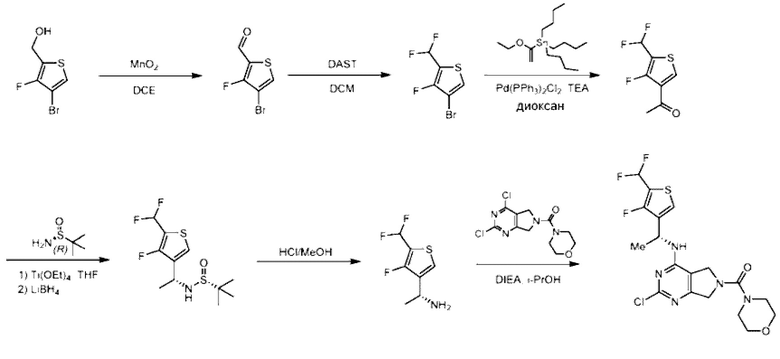
Этап 1.
[00596] В раствор (4-бром-3-фтор-2-тиенил)метанола (1,6 г, 7,58 ммоль) в ДХЭ (70 мл) добавляли MnO2 (3,30 г, 37,91 ммоль). Потом смесь нагревали с обратным холодильником в течение 2 ч при 85°С. После охлаждения до кт смесь фильтровали, а растворитель удаляли при пониженном давлении с получением 4-бром-3-фтортиофен-2-карбальдегида (1,4 г, выход 88,34%).1Н ЯМР (400 МГц, Хлороформ-d) δ=10,04 (м, 1Н), 7,63 (м, 1Н).
Этап 2.
[00597] В смесь 4-бром-3-фтортиофен-2-карбальдегида(1,4 г, 6,70 ммоль) в ДХМ (14 мл) добавляли DAST (2,70 г, 16,74 ммоль, 2,21 мл) при 0°С в атмосфере N2. Смесь перемешивали при 20°С в течение 2 ч. Смесь вливали в воду и экстрагировали EtOAc. Объединенную органическую фазу промывали солевым раствором, сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством колоночной хроматографии с получением 4-бром-2-(дифторметил)-3-фтортиофена (850 мг, выход 54,93%).1Н ЯМР (400 МГц, Хлороформ-d) δ=7,34-7,39 (м, 1Н), 6,77-7,08 (м, 1Н).
Этап 3.
[00598] В смесь 4-бром-2-(дифторметил)-3-фтортиофена (850 мг, 3,68 ммоль) и трибутил(1-этоксивинил)станнана (1,99 г, 5,52 ммоль, 1,86 мл) в диоксане (9 мл) добавляли ТЭА (930,72 мг, 9,20 ммоль, 1,28 мл) и Pd(PPh3)2Cl2 (258,24 мг, 367,91 мкмоль). Смесь продували N2, а потом перемешивали при 90°С в течение 2 ч в атмосфере N2. После охлаждения до кт рН доводили до рН=2, используя водную HCl, и перемешивали смесь в течение 30 мин. После фильтрации фильтрат экстрагировали EtOAc. Объединенную органическую фазу вливали в водн. KF (30 мл, около 3 г KF) и перемешивали в течение 1 ч. Смесь фильтровали, а органический слой промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением 1-[5-(дифторметил)-4-фтор-3-тиенил]этанона (630 мг, выход 88,19%). 1Н ЯМР (400 МГц, Хлороформ-d) δ=8,12 (д, J=4,0 Гц, 1H), 6,78-7,13 (м, 1H), 2,54 (д, J=2,8 Гц, 3Н).
Этап 4.
[00599] В раствор 1-[5-(дифторметил)-4-фтор-3-тиенил]этанона (600 мг, 3,09 ммоль), (R)-2-метилпропан-2-сульфинамида (561,77 мг, 4,64 ммоль) в ТГФ (6 мл) добавляли Ti(OEt)4 (2,11 г, 9,27 ммоль, 1,92 мл) и перемешивали смесь при 80°С в течение 3 ч. Потом реакционную смесь охлаждали до 0°С и добавляли LiBH4 (87,51 мг, 4,02 ммоль). Через 30 мин реакционную смесь вливали в ледяную воду, а полученную в результате смесь фильтровали. Фильтрат экстрагировали EtOAc, а объединенные органические фазы сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а остаток очищали посредством колоночной хроматографии с получением N-[(1R)-1-[5-(дифторметил)-4-фтор-3-тиенил]этил]-2-метил-пропан-2-сульфинамида (520 мг, выход 56,21%). 1Н ЯМР (400 МГц, Хлороформ-d) δ=7,32 (д, J=4,6, 1H), 6,77-7,05 (м, 1H), 4,58 (м, 1Н), 3,45 (д, J=4,4, 1H), 1,56 (д, J=6,8, 3Н), 1,23 (с, 9Н).
Этап 5.
[00600] В смесь N-[(1R)-1-[5-(дифторметил)-4-фтор-3-тиенил]этил]-2-метил-пропан-2-сульфинамида (200 мг, 668,06 мкмоль) в МеОН (2 мл) добавляли HCl/МеОН (4 М, 668,06 мкл) при 25°С. Смесь перемешивали при 25°С в течение 2 ч. Растворитель потом удаляли при пониженном давлении, а остаток растворяли в МеОН (2 мл). Добавляли MeOH/NaOH, чтобы довести рН смеси до 8. Полученный в результате остаток растирали с ДХМ/МеОН=10/1, фильтровали, а растворитель удаляли при пониженном давлении с получением (1R)-1-[5-(дифторметил)-4-фтор-3-тиенил]этанамина (120 мг, выход 92,02%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C7H9F3NS: 196,1; полученное 196,1.
Этап 6.
[00601] В раствор (1R)-1-[5-(дифторметил)-4-фтор-3-тиенил]этанамина (120 мг, 614,74 мкмоль) в t-BuOH (3 мл) добавляли (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанон (186,35 мг, 614,74 мкмоль) и ДИЭА (238,35 мг, 1,84 ммоль, 321,23 мкл). Смесь перемешивали при 90°С в течение 2 ч. После охлаждения до кт остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[5-(дифторметил)-4-фтор-3-тиенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (58,6 мг, выход 20,62%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C18H20ClF3N5O2S: 462,1 полученное 462,0; 1Н ЯМР (400 МГц, Метанол-d4) δ=7,50 (д, J=4,4, 1Н), 6,86-7,23 (м, 1Н), 5,44 (м, 1Н), 4,57-4,63 (м, 4Н), 3,70-3,75 (м, 4Н), 3,34-3,37 (м, 4Н), 1,59 (д, J=7,2, 3Н).
Пример 482. Синтез 2-{3-[(1R)-1-{[2-хлор-6-(морфолин-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-ил]амино]этил]фенил]-2-метилпропаннитрила
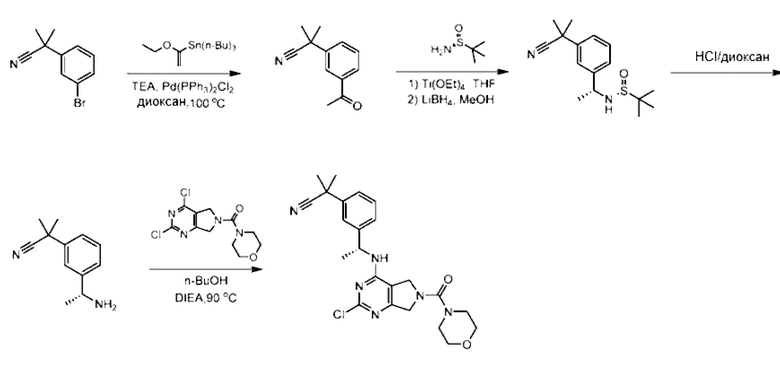
Этап 1.
[00602] В смесь 2-(3-бромфенил)-2-метил-пропаннитрила (2 г, 8,92 ммоль) в диоксане (20 мл) добавляли ТЭА (2,26 г, 22,31 ммоль, 3,11 мл), трибутил(1-этоксивинил)станнан (3,87 г, 10,71 ммоль, 3,61 мл) и Рв(PPh3)2Cl2 (626,42 мг, 892,47 мкмоль). Смесь перемешивали при 100°С в атмосфере аргона в течение 3 ч. После охлаждения до кт реакционную смесь фильтровали и добавляли в фильтрат 1 М HCl (20 мл). Смесь перемешивали при 20°С в течение 0,5 ч, добавляли водный KF и перемешивали реакционную смесь в течение 0,5 ч. После экстракции EtOAc объединенные органические фазы сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством колоночной хроматографии с получением 2-(3-ацетилфенил)-2-метил-пропаннитрила (1,4 г, выход 83,78%). 1Н ЯМР (400 МГц, Хлороформ-d) δ м.д. 8,06 (д, J=1,6 Гц, 1Н) 7,91 (д, J=8 Гц, 1Н) 7,70-7,77 (м, 1Н) 7,48-7,56 (м, 1Н) 2,64 (с, 3Н) 1,74-1,82 (с, 6Н).
Этап 2.
[00603] В раствор 2-(3-ацетилфенил)-2-метил-пропаннитрила (900 мг, 4,81 ммоль) и (R)-2-метилпропан-2-сульфинамида (640,84 мг, 5,29 ммоль) в ТГФ (15 мл) добавляли Ti(OEt)4 (2,19 г, 9,61 ммоль, 1,99 мл). Смесь перемешивали при 70°С в течение 16 ч. После охлаждения до кт смесь вливали в воду и экстрагировали EtOAc. Объединенные органические слои промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением (NZ)-N-[l-[3-(-циано-1-метил-этил)фенил]этилиден]-2-метил-пропан-2-сульфинамида (1,40 г, неочищенный) в виде желтого масла. В смесь (NZ)-N-[1-[3-(1-циано-1-метил-этил)фенил]этилиден]-2-метил-пропан-2-сульфинамида (1,4 г, 4,82 ммоль) в МеОН (15 мл) добавляли LiBH4 (210,02 мг, 9,64 ммоль) при -30°С в атмосфере N2. Охлаждающую баню удаляли, перемешивали реакционную смесь при кт в течение 30 мин перед добавлением Н2О (20 мл) и экстрагировали водную фазу EtOAc. Объединенную органическую фазу промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением N-[(1R)-1-[3-(1-циано-1-метил-этил)фенил]этил]-2-метил-пропан-2-сульфинамида (550 мг, выход 39,02%). 1H ЯМР (400 МГц, Хлороформ-d) δ м.д. 7,40 (с, 1Н) 7,26-7,34 (м, 2Н) 7,18-7,25 (м, 1Н) 4,54 (квд, J=6,62, 3,00 Гц, 1Н) 3,27 (шир. д, J=2,08 Гц, 1Н) 1,66 (д, J=0,98 Гц, 6Н) 1,47 (д, J=6,60 Гц, 3Н) 1,07-1,22 (м, 9Н).
Этап 3.
[00604] Смесь of N-[(1R)-1-[3-(1-циано-1-метил-этил)фенил]этил]-2-метил-пропан-2-сульфинамида (170 мг, 581,32 мкмоль) в HCl/диоксане (4 М, 1,45 мл) перемешивали в течение 1 ч при 20°С. Растворитель удаляли при пониженном давлении с получением 2-[3-[(1R)-1-аминоэтил]фенил]-2-метил-пропаннитрила гидрохлорида (130 мг, выход 99,51%), который использовали без дополнительной очистки. 1Н ЯМР (400 МГц, Хлороформ-d) δ м.д. 8,66 (шир. с, 3Н) 7,63 (с, 1Н) 7,49 (шир. д, J=7,03 Гц, 1Н) 7,34-7,46 (м, 2Н) 4,45 (с, 1Н) 3,71 (с, 3Н) 1,72 (д, J=10,85 Гц, 6Н) 1,42 (с, 3Н).
Этап 4.
[00605] В смесь 2-[3-[(1R)-1-аминоэтил]фенил]-2-метил-пропаннитрила гидрохлорида (130 мг, 578,47 мкмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (157,82 мг, 520,63 мкмоль) в t-BuOH (2 мл) добавляли ДИЭА (373,82 мг, 2,89 ммоль, 503,80 мкл). Смесь перемешивали при 90°С в атмосфере N2 в течение 1 ч. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением 2-[3-[(1R)-1-[[2-хлор-6-(морфолин-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]фенил]-2-метил-пропаннитрила (67,31 мг, выход 23,68%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C23H28ClN6O2: 455,2; полученное 455,2; 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 7,59 (с, 1Н) 7,39 (с, 3Н) 5,43 (д, J=5,07 Гц, 1Н) 4,63 (с, 4Н) 3,72 (с, 4Н) 3,36 (с, 4Н) 1,73 (д, J=1,54 Гц, 6Н) 1,62 (д, J=4,85 Гц, 3Н).
Пример 483. Синтез 2-хлор-N-[(1R)-1-{3-[2-(диметиламино)-1,1-дифторэтил]фенил}этил]-6-(морфолин-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина
Этап 1.
[00606] В раствор N- [(1R)-1-[3-(1,1-дифтор-2-гидрокси-этил)фенил]этил]-2-метил-пропан-2-сульфинамида (2,00 г, 6,55 ммоль) в ДХМ (20 мл) добавляли трифторметансульфонилхлорид (1,66 г, 9,82 ммоль, 1,04 мл) и Et3N (2,65 г, 26,20 ммоль, 3,65 мл) при -78°С. Охлаждающую баню удаляли и перемешивали смесь при 25°С в течение 2 ч. Реакцию гасили добавлением водного хлорида аммония, разводили водой и экстрагировали EtOAc. Органическую фазу промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением [2-[3-[(1R)-1-[[(R)-трет-бутилсульфинил]амино]этил]фенил]-2,2-дифторэтил]трифторметансульфоната (2 г, выход 69,81%), который использовали без дополнительной очистки. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C16H21F5NO4S2: 438,2; полученное 438,0.
Этап 2.
[00607] В раствор [2-[3-[(1R)-1-[[(R)-трет-бутилсульфинил]амино]этил]фенил]-2,2-дифторэтил]трифторметансульфоната(2,00 г, 4,57 ммоль) в ДХМ (20 мл) добавляли Me2NH (4 М, 3,43 мл) и ТЭА (1,85 г, 18,29 ммоль, 2,55 мл) при 0°С. Охлаждающую баню удаляли и перемешивали смесь при 25°С в течение 2 ч. Реакцию гасили добавлением водного хлорида аммония, разводили водой и экстрагировали EtOAc. Органическую фазу промывали солевым раствором и сушили над Na2SO4. Остаток очищали посредством колоночной хроматографии с получением N-[(1R)-1-[3-[2-(диметиламино)-1,1-дифторэтил]фенил]этил]-2-метил-пропан-2-сульфинамида (1,3 г, выход 76,98%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C16H27F2N2OS: 333,2; полученное 333,1.
Этап 3.
[00608] В раствор N-[(1R)-1-[3-[2-(диметиламино)-1,1-дифторэтил]фенил]этил]-2-метил-пропан-2-сульфинамида (500,00 мг, 1,50 ммоль) в МеОН (5 мл) добавляли HCl/МеОН (4 М, 1,50 мл) и перемешивали смесь при 20°С в течение 2 ч. Растворитель удаляли при пониженном давлении, а остаток растирали с МТБЭ и ацетонитрилом. Твердое вещество растворяли в МеОН (2 мл) и добавляли раствор MeOH/NaOH до рН=8. После фильтрации растворитель удаляли при пониженном давлении, а остаток растирали с ДХМ:МеОН=10:1, а потом - с ацетонитрилом. После фильтрации фильтрационный осадок сушили в вакууме с получением 2-[3-[(1R)-1-аминоэтил]фенил]-2,2-дифтор-N,N-диметилэтанамина (0,3 г, выход 87,38%), который использовали без дополнительной очистки. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C12H19F2N2: 229,1; полученное 229,4.
Этап 4.
[00609] В раствор 2-[3-[(1R)-1-аминоэтил]фенил]-2,2-дифтор-N,N-диметилэтанамина (100 мг, 438,06 мкмоль) в t-BuOH (2 мл) добавляли ДИЭА (169,85 мг, 1,31 ммоль, 228,90 мкл) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанон (132,79 мг, 438,06 мкмоль). Реакционную смесь перемешивали при 90°С в течение 3 ч. После охлаждения до кт смесь фильтровали, а фильтрационный осадок очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[3-[2-(диметиламино)-1,1-дифторэтил]фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (35 мг, выход 15,82%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C24H30ClF2N6O2: 495,2; полученное 495,1 1H ЯМР (400 МГц, Метанол-d4) δ=7,57 (с, 1Н), 7,51 (д, J=7,2 Гц, 1Н), 7,45-7,37 (м, 2Н), 5,40 (д, J=6,8 Гц, 1Н), 4,55-4,64 (м, 4Н), 3,70-3,74 (м, 4Н), 3,34-3,37 (м, 4Н), 2,98 (т, J=15,2 Гц, 2Н), 2,27 (с, 6Н), 1,59 (д, J=7,2 Гц, 3Н).
Пример 484. Синтез 2-хлор-N-[(1R)-1-{3-[дифтор(морфолин-2-ил)метил]фенил}этил]-6-(морфолин-4-карбонил)-5Н,6Н,7H-пирроло[3,4-d]пиримидин-4-амина
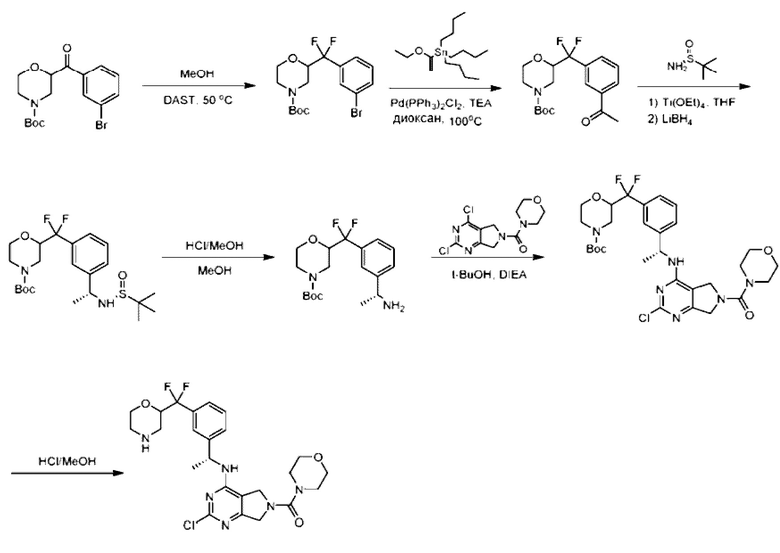
Этап 1.
[00610] В раствор трет-бутил 2-(3-бромбензоил)морфолин-4-карбоксилата (1,8 г, 4,86 ммоль) в DAST (5 мл) добавляли МеОН (15,58 мг, 486,17 мкмоль, 19,67 мкл) при 25°С. Смесь перемешивали при 60°С в течение 2 ч, охлаждали до кт и добавляли в ледяную воду. Добавляли водный NaHCO3 до рН=7 и экстрагировали смесь EtOAc. Объединенные органические фазы промывали солевым раствором, сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством колоночной хроматографии с получением трет-бутил 2-[(3-бромфенил)-дифтор-метил]морфолин-4-карбоксилата (1,1 г, выход 57,68%). 1Н ЯМР (Хлороформ-d, 400 МГц) δ м.д.=7,66 (с, 1Н), 7,60 (д, J=8,4 Гц, 1Н), 7,44 (д, J=7,2 Гц, 1Н), 7,29-7,34 (м, 1Н), 4,13 (м, 1Н), 3,92 (дд, J=7,4, 1Н), 3,72-3,87 (м, 2Н), 3,45-3,52 (м, 1Н), 2,92 (с, 2Н), 1,47 (с, 9Н).
Этап 2.
[00611] В смесь трет-бутил 2-[(3-бромфенил)-дифтор-метил]морфолин-4-карбоксилата (1,1 г, 2,80 ммоль) и трибутил(1-этоксивинил)станнана (1,52 г, 4,21 ммоль, 1,42 мл) в диоксане (10 мл) добавляли ТЭА (709,45 мг, 7,01 ммоль, 975,86 мкл) и Pd(PPh3)2Cl2 (196,84 мг, 280,44 мкмоль). Смесь продували N2, а потом перемешивали при 100°С в течение 3 ч в атмосфере N2. После охлаждения до кт в смесь добавляли HCl (15 мл, 0,8 М) и перемешивали в течение 0,5 ч (рН=2). Потом смесь фильтровали и экстрагировали фильтрат EtOAc. Объединенные органические слои вливали в водн. KF (30 мл, около 3 г KF) и перемешивали в течение 1 ч при кт. Смесь фильтровали, а органический слой промывали солевым раствором, сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством колоночной хроматографии с получением трет-бутил 2-[(3-ацетилфенил)-дифтор-метил]морфолин-4-карбоксилата (835 мг, выход 83,78%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C18H24F2NO4: 356,2; полученное 356,4.
Этап 3.
[00612] В раствор трет-бутил 2-[(3-ацетилфенил)-дифтор-метил]морфолин-4-карбоксилата (835 мг, 2,35 ммоль) и (R)-2-метилпропан-2-сульфинамида (711,94 мг, 5,87 ммоль) в ТГФ (9 мл) добавляли Ti(OEt)4 (2,68 г, 11,75 ммоль, 2,44 мл) и перемешивали смесь при 80°С в течение 3 ч. После охлаждения до 0°С добавляли LiBH4 (66,54 мг, 3,05 ммоль) и перемешивали реакционную смесь в течение 30 мин. Потом смесь добавляли в ледяную воду и фильтровали. Фильтрат экстрагировали EtOAc и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением трет-бутил 2-[[3-[(1R)-1-[[(R)-трет-бутилсульфинил]амино]этил]фенил]-дифтор-метил]морфолин-4-карбоксилата (570 мг, выход 52,67%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H35F2N2O4S: 461,2; полученное 461,1.
Этап 4.
[00613] В раствор трет-бутил 2-[[3-[(1R)-1-[[(R)-трет-бутилсульфинил]амино]этил]фенил]-дифтор-метил]морфолин-4-карбоксилата (570 мг, 1,24 ммоль) в МеОН (6 мл) добавляли HCl/MeOH (4 М, 618,79 мкл) при 25°С и перемешивали полученную в результате смесь в течение 4 ч при кт. Растворитель удаляли при пониженном давлении, а неочищенный остаток растворяли в МеОН (5 мл). Потом добавляли раствор MeOH/NaOH до рН=8. Смесь фильтровали и удаляли растворитель при пониженном давлении. Неочищенный остаток растирали с ДХМ:МеОН=10/1, а растворитель удаляли при пониженном давлении с получением трет-бутил 2-[[3-[(1R)-1-аминоэтил]фенил]-дифтор-метил]морфолин-4-карбоксилата (520 мг, неочищенный), который использовали без дополнительной очистки. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C18H27F2N2O3: 357,2; полученное 357,1.
Этап 5.
[00614] В раствор трет-бутил 2-[[3-[(1R)-1-аминоэтил]фенил]-дифтор-метил]морфолин-4-карбоксилата (470 мг, 1,32 ммоль) в t-BuOH (5 мл) добавляли (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанон (399,76 мг, 1,32 ммоль) и ДИЭА (511,31 мг, 3,96 ммоль, 689,09 мкл). Смесь перемешивали при 90°С в течение 2 ч. После охлаждения до кт реакцию гасили добавлением 15 мл воды. Смесь экстрагировали EtOAc, а объединенные органические слои промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением трет-бутил 2-[[3-[(1R)-1-[[2-хлор-6-(морфолин-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]фенил]-дифтор-метил]морфолин-4-карбоксилата (570 мг, выход 65,83%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C29H38ClF2N6O5: 623,3; полученное 623,1.
Этап 6.
[00615] Раствор трет-бутил 2-[[3-[(1H)-1-[[2-хлор-6-(морфолин-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]фенил]-дифтор-метил]морфолин-4-карбоксилата (470 мг, 754,31 мкмоль) в HCl/МеОН (5 мл) перемешивали при 25°С в течение 0,5 ч. Растворитель удаляли при пониженном давлении, а неочищенный остаток растворяли в МеОН. В полученную в результате смесь добавляли раствор MeOH/NaOH до рН=8. Смесь фильтровали, а неочищенный остаток растирали с ДХМ/МеОН=10/1. Растворитель удаляли при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[3-[дифтор(морфолин-2-ил)метил]фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (230,3 мг, выход 57,10%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C24H30ClF2N6O3: 523,2; полученное 523,2; 1H ЯМР (Метанол-d4, 400 МГц) δ м.д.=7,52 (т, J=5,8 Гц, 2Н), 7,39-7,45 (м, 1H), 7,35-7,39 (м, 1H), 5,41 (д, J=6,8 Гц, 1H), 4,62 (с, 2Н), 4,57 (д, J=2,0 Гц, 2Н), 3,77-3,93 (м, 2Н), 3,70-3,74 (м, 4Н), 3,48-3,56 (м, 1H), 3,34-3,38 (м, 4Н), 2,93 (м, 1H), 2,58-2,74 (м, 3Н), 1,58 (д, J=6,8 Гц, 3Н).
Пример 485. Синтез 2-хлор-N-[(1R)-1-{3-[дифтор(4-метилморфолин-2-ил)метил]фенил}этил]-6-(морфолин-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина
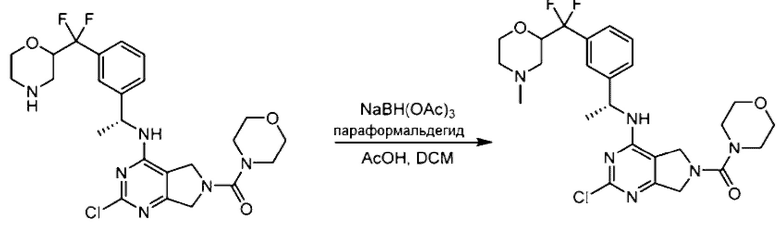
Этап 1.
[00616] В раствор [2-хлор-4-[[(1R)-1-[3-[дифтор(морфолин-2-ил)метил]фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (100 мг, 191,21 мкмоль) в АсОН (1,2 мл) и ДХМ (3 мл) добавляли NaBH(ОАс)3 (101,32 мг, 478,04 мкмоль) и параформальдегид (100 мг). Смесь перемешивали при 25°С в течение 2 ч. Смесь вливали в ледяную воду и экстрагировали EtOAc. Объединенную органическую фазу промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[3-[дифтор-(4-метилморфолин-2-ил)метил]фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (8,3 мг, выход 7,68%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C25H32ClF2N6O3: 537,2; полученное 537,3; 1Н ЯМР (Метанол-d4, 400 МГц): δ=7,50-7,55 (м, 2Н), 7,40-7,45 (м, 1H), 7,35-7,40 (м, 1Н), 5,33-5,45 (м, 1Н), 4,63 (с, 2Н), 4,57 (s, 2Н), 3,88-3,98 (м, 1Н), 3,84 (м, 1Н), 3,70-3,76 (м, 4Н), 3,57 (м, 1Н), 3,33-3,39 (м, 4Н), 2,82 (д, J=11,3 Гц, 1Н), 2,61-2,69 (м, 1Н), 2,26 (д, J=3,9 Гц, 3Н), 1,89-2,11 (м, 2Н), 1,59 (д, J=7,2 Гц, 3Н).
Пример 486. Синтез 2-хлор-N-[(1R)-1-[3-(дифторметил)фенил]этил]-6-(морфолин-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина
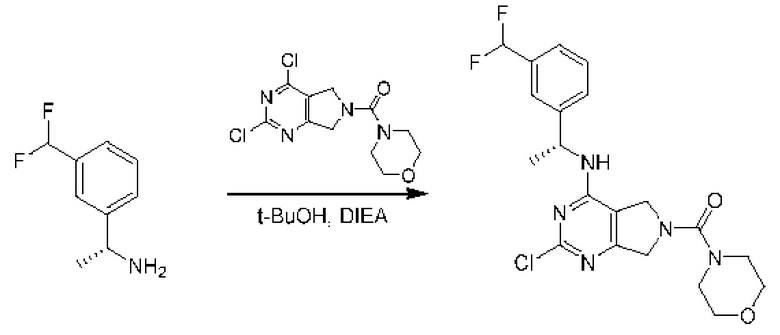
Этап 1.
[00617] В смесь (1R)-1-[3-(дифторметил)фенил]этанамина гидрохлорида (150 мг, 722,38 мкмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (218,98 мг, 722,38 мкмоль) в t-BuOH (1 мл) добавляли ДИЭА (280,09 мг, 2,17 ммоль, 377,48 мкл). Смесь перемешивали при 90°С в атмосфере N2 в течение 1 ч. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[3-(дифторметил)фенил]этал]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (52,26 мг, выход 16,52%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H23ClF2N5O2: 438,1; полученное 438,1; 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 7,39-7,59 (м, 4Н) 6,65 (т, J=56,8, 1Н) 5,39-5,54 (м, 1Н) 5,08 (д, J=6,48 Гц, 1Н) 4,48-4,70 (м, 4Н) 3,61-3,81 (м, 4Н) 3,22-3,42 (м, 4Н) 1,63 (д, J=6,97 Гц, 4Н).
Пример 487. Синтез (R)-(2-(1,1-дифтор-2-гидроксиэтил)-4-((1-(3-(дифторметил)-2-фторфенил)этил)амино)-5,7-дигидро-6Н-пирроло[3,4-d]пиримидин-6-ил)(4-метокситетрагидро-2Н-пиран-4-ил)метанона
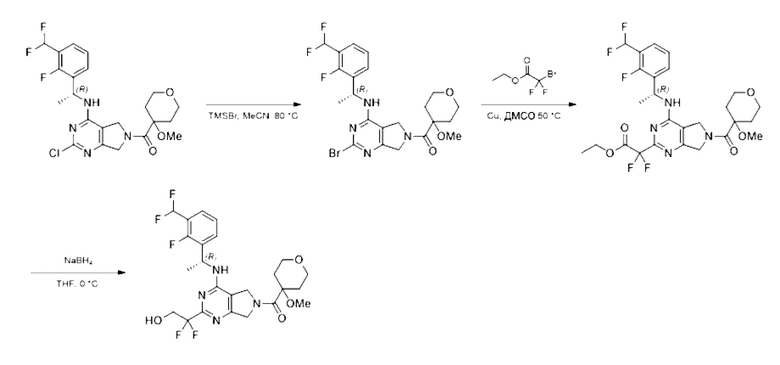
Этап 1.
[00618] В раствор 2-хлор-N-[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]-6-(4-метокси-оксан-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина (1,0 г, 2,1 ммоль) в безводном АЦН (7,5 мл), добавляли триметилбромсилан (820 мкл, 6,3 ммоль). Реакционную смесь перемешивали в течение 3 суток при 80°С. Растворитель выпаривали, а остаток гасили насыщенным водным NaHCO3 и экстрагировали EtOAc. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали с получением 2-бром-N-[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]-6-(4-метоксиоксан-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина (840 мг, выход 76%). ЖХМС (ИЭР): m/z: [М-Н], рассчитанное для C22H23BrF3N4O3: 527,10; полученное 527,79.
Этап 2.
[00619] В раствор этил бромдифторацетата (390 мкл, 3,07 ммоль) в ДМСО (3,8 мл) добавляли медь (195 мг, 3,07 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, потом добавляли 2-бром-N-[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]-6-(4-метокси-оксан-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амин (650 мг, 1,23 ммоль) и перемешивали реакционную смесь при 50°С в течение 3 ч. Реакционную смесь гасили ледяной водой, фильтровали и экстрагировали EtOAc. Объединенные органические слои сушили над безводным Na2SO4, фильтровали, концентрировали при пониженном давлении, а остаток очищали посредством флэш-хроматографии с получением этил 2-(4-{[(1H)-1-[3-(дифторметил)-2-фторфенил]этил]амино}-6-(4-метоксиоксан-4-карбонил)-5Н,6Н,7Н-пирроло-[3,4-d]пиримидин-2-ил)-2,2-дифторацетата (620 мг, выход 88%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C26H30F5N4O5: 573,21; полученное 573,35.
Этап 3.
[00620] В раствор 2-(4-{[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]амино}-6-(4-метокси-оксан-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-2-ил)-2,2-дифторацетата (565 мг, 0,99 ммоль) в безводном ТГФ (28 мл) при 0°С добавляли борогидрид натрия (112 мг, 2,96 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре, потом добавляли насыщенный раствор NH4Cl и экстрагировали смесь EtOAc. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением 2-(4-{[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]амино}-6-(4-метоксиоксан-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-2-ил)-2,2-дифторэтан-1-ола (477 мг; выход 91%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C24H28F5N4O4: 531,20; полученное 531,15. 1Н ЯМР (300 МГц, ДМСО-d6) δ 8,28-8,22 (м, 1Н), 7,63 (т, J=7,6 Гц, 1Н), 7,49 (т, J=7,2 Гц, 1Н), 7,37-7,24 (м, 1Н), 7,42-7,00 (м, 1Н), 5,61-5,49 (м, 1Н), 5,35 (т, J=6,5 Гц, 1Н), 4,92-4,85 (м, 2Н), 4,65-4,57 (м, 2Н), 4,04-3,49 (м, 6Н), 3,18 (с, 3Н), 2,05-1,81 (м, 4Н), 1,53 (дд, J=7,1, 4,3 Гц, 3Н).
Пример 488. Синтез 2-(2-амино-1,1-дифторэтил)-N-[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]-6-(4-метоксиоксан-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина
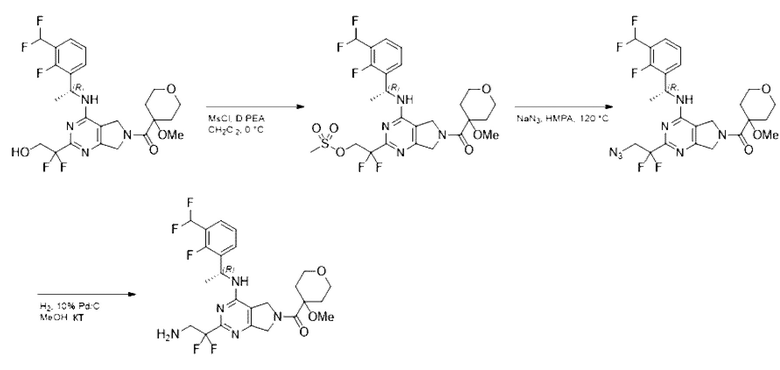
Этап 1.
[00621] В перемешиваемый раствор 2-(4-{[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]амино}-6-(4-метоксиоксан-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-2-ил)-2,2-дифторэтан-1-ола (220 мг, 0,41 ммоль) и ДИПЭА (87 мкл, 0,50 ммоль) в ДХМ (7,7 мл) по каплям добавляли метансульфонилхлорид (35 мкл, 0,46 ммоль) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Потом реакцию гасили насыщенным раствором NaHCO3 и экстрагировали EtOAc. Объединенные органические слои сушили над Na2SO4, потом фильтровали и концентрировали при пониженном давлении с получением 2-(4-{[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]амино}-6-(4-метоксиоксан-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-2-ил)-2,2-дифторэтил метансульфоната (280 мг, количественный). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для точной массы для C25H30F5N4O6S: 609,17; полученное 609,05.
Этап 2.
[00622] В перемешиваемый раствор 2-(4-{[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]амино}-6-(4-метоксиоксан-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-2-ил)-2,2-дифторэтил метансульфоната (192 мг, 0,32 ммоль) в НМРА (6,7 мл) добавляли азид натрия (103 мг, 1,58 ммоль). Реакционную смесь перемешивали в течение ночи при 120°С, потом гасили водой и экстрагировали диэтиловым эфиром. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Полученный в результате материал очищали посредством флэш-хроматографии с получением 2-(2-азидо-1,1-дифторэтил)-N-[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]-6-(4-метоксиоксан-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина (118 мг, выход 67%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C24H27F5N7O3: 556,20; полученное 556,15.
Этап 3.
[00623] В раствор 2-(2-азидо-1,1-дифторэтил)-N-[(1R)-1-[3-(дифторметил)-2-фторфенил]-этил]-6-(4-метоксиоксан-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина (105 мг, 0,19 ммоль) в МеОН (5,3 мл) добавляли 10% палладий на углероде (42 мг). Смесь дегазировали, повторно наполняли водородом (4х) и перемешивали в течение 2 ч, потом фильтровали через слой целита®, а фильтрационный осадок промывали метанолом, ацетоном и ДХМ. Фильтрат очищали посредством препаративной ВЭЖХ с получением 2-(2-амино-1,1 -дифторэтил)-N- [(1R)-1-[3-(дифторметил)-2-фторфенил]этил]-6-(4-метоксиоксан-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина (32,9 мг, выход 33%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C24H29F5N5O3: 530,21; полученное 529,81; 1H ЯМР (300 МГц, ДМСО-d6) δ 8,33-8,20 (м, 1H), 7,62 (т, J=7,5 Гц, 1H), 7,49 (т, J=7,1 Гц, 1H), 7,32-7,24 (м, 1H), 7,22 (т, J=54,4 Гц, 1H), 5,54 (д, J=9,7 Гц, 1H), 4,97-4,81 (м, 2Н), 4,70-4,52 (м, 2Н), 3,77-3,53 (м, 4Н), 3,25-2,98 (м, 5Н), 2,08-1,77 (м, 4Н), 1,53 (дд, J=7,1, 4,3 Гц, 3Н), 1,39 (с, 2Н).
Пример 500. Синтез 2-[3-(1-{[2-хлор-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-ил]амино}этил)фенил]пропан-1-ола
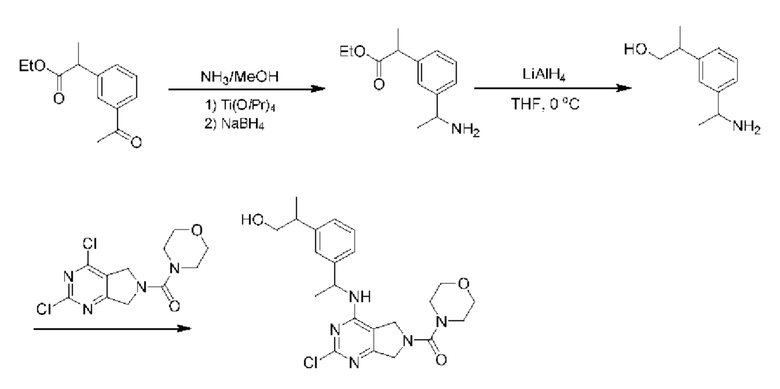
Этап 1.
[00624] В смесь этил 2-(3-ацетилфенил)пропаноата (400 мг, 1,82 ммоль) и 2 М NH3 в МеОН (4,6 мл, 9,2 ммоль) при кт добавляли изопропоксид титана (IV) (1,1 мл, 3,63 ммоль). Смесь перемешивали при кт в течение, потом добавляли NaBH4 (240 мг, 6,4 ммоль) и перемешивали смесь при кт еще в течение 30 мин. Смесь концентрировали при пониженном давлении и к остатку добавляли H2O, потом фильтровали через слой целита®, а фильтрационный осадок промывали EtOAc и МеОН. Фильтрат концентрировали при пониженном давлении, потом разводили EtOAc и промывали Н2О и солевым раствором. Объединенные водные слои экстрагировали EtOAc (х4), а объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением этил 2-[3-(1-аминоэтил)фенил]пропаноата (360 мг, выход 90%), который непосредственно использовали на следующем этапе без дополнительной очистки. 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,33-7,03 (м, 4Н), 4,15-3,89 (м, 3Н), 3,73 (кв, J=7,1 Гц, 1H), 1,37 (д, J=7,1 Гц, 3Н), 1,22 (д, J=6,6 Гц, 3Н), 1,13 (т, J=7,1 Гц, 3Н).
Этап 2.
[00625] В смесь 2 М LiAlH4 в ТГФ (1,44 мл, 2,88 ммоль) в ТГФ (19 мл) при 0°С добавляли раствор этил 2-[3-(1-аминоэтил)фенил]пропаноата (319 мг, 1,44 ммоль) в ТГФ (9,6 мл) в течение 5 мин. Смесь оставляли нагреваться до кт и перемешивали в течение 1 ч, потом гасили H2O (114 мкл) и 15% водным NaOH (114 мкл). После перемешивания в течение 10 мин добавляли дополнительную аликвоту H2O (228 мкл). Смесь перемешивали в течение 2 ч, фильтровали, а фильтрационный осадок промывали ТГФ. Фильтрат концентрировали при пониженном давлении с получением 2-[3-(1-аминоэтил)фенил]пропан-1-ола (240 мг, выход 93%). Этот продукт использовали на следующем этапе без дополнительной очистки. 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,27-6,93 (м, 4Н), 4,61 (т, J=5,3 Гц, 1H), 3,93 (кв, J=6,6 Гц, 1Н), 3,55-3,37 (м, 2Н), 2,84-2,69 (м, 1H), 1,76 (шир. с, 2Н), 1,22 (д, J=6,6 Гц, 3Н), 1,18 (д, J=7,0 Гц, 3Н).
Этап 3.
[00626] 2-[3-(1-{[2-хлор-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-ил]амино}этил)фенил]пропан-1-ол синтезировали способом, аналогичным 2-хлор-N-{1-[3-(дифторметил)-2-фторфенил]этил}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-йГ]пиримидин-4-амину, за исключением того, что 1-[3-(дифторметил)-2-фторфенил]этан-1-амин заменяли 2-[3-(1-аминоэтил)фенил]пропан-1-олом с получением (227 мг, выход 53%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H28ClN5O3: 445,19; полученное 446,04; 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,11 (д, J=8,0 Гц, 1H), 7,29-7,16 (м, 3Н), 7,13-7,06 (м, 1H), 5,38-5,17 (м, 1Н), 4,64 (т, J=5,2 Гц, 1H), 4,59-4,43 (м, 4Н), 3,63 (т, J=4,6 Гц, 4Н), 3,55-3,38 (м, 2Н), 3,24 (т, J=4,7 Гц, 4Н), 2,85-2,71 (м, 1H), 1,48 (д, J=7,0 Гц, 3Н), 1,19 (дд, J=7,0, 1,9 Гц, 3Н).
Пример 501. Синтез 2-[3-(1-{[2-хлор-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-ил]амино}этил)фенил]этан-1-ола
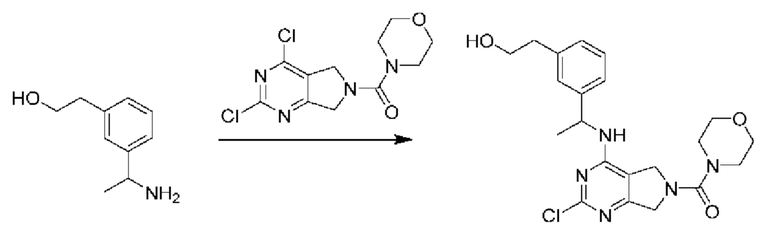
Этап 1.
[00627] 2-[3-(1-{[2-хлор-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-ил]амино}этил)фенил]этан-1-ол синтезировали способом, аналогичным 2-хлор-N-{1-[3-(дифторметил)-2-фторфенил]этил}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амину, за исключением того, что 1-[3-(дифторметил)-2-фторфенил]этан-1-амин заменяли 2-[3-(1-аминоэтил)фенил]этан-1-олом с получением (226 мг, выход 46%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H26ClN5O3: 431,17; полученное 432,00; 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,10 (д, J=8,0 Гц, 1H), 7,29-7,15 (м, 3Н), 7,14-7,05 (м, 1H), 5,27 (т, J=7,3 Гц, 1H), 4,65 (т, J=5,2 Гц, 1H), 4,53 (д, J=13,0 Гц, 4Н), 3,68-3,53 (м, 6Н), 3,24 (т, J=4,6 Гц, 4Н), 2,72 (т, J=7,1 Гц, 2Н), 1,48 (д, J=7,0 Гц, 3Н).
Пример 502. Синтез 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино]-8-метил-6-(морфолин-4-ил)-5Н,6Н,7Н,8H-пиридо[2,3-d]пиримидин-7-она
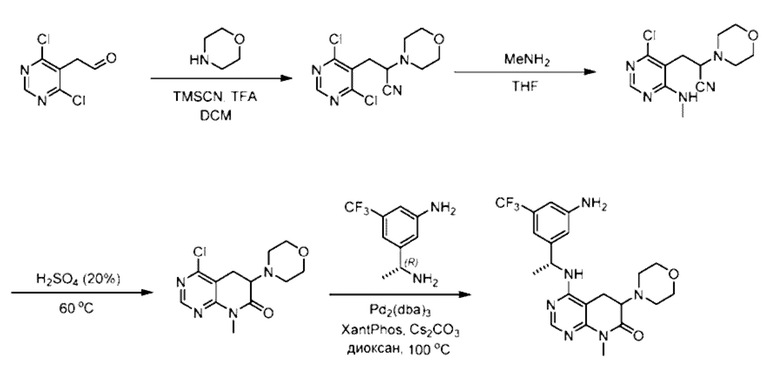
Этап 1.
[00628] В смесь 2-(4,6-дихлорпиримидин-5-ил)ацетальдегида (6,0 г, 31,4 ммоль) в ДХМ (180 мл) при -15°С в атмосфере Ar добавляли морфолин (2,9 мл, 32,9 ммоль) и ТФУ (7,2 мл, 94,2 ммоль). Смесь нагревали до кт и перемешивали в течение ночи, потом добавляли TMSCN (7,9 мл, 62,8 ммоль) и перемешивали смесь при кт в течение ночи. Добавляли H2O и K2CO3 и экстрагировали смесь ДХМ. Органический слой сушили, фильтровали, концентрировали при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением 3-(4,6-дихлорпиримидин-5-ил)-2-(морфолин-4-ил)пропаннитрила (3,7 г, выход 41%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C11H12Cl2N4O: 286,04; полученное 287,05; 1Н ЯМР (300 МГц, CDCl3) δ м.д. 8,76 (с, 1Н), 3,98 (т, J=8,0 Гц, 1Н), 3,80-3,70 (м, 4Н), 3,41 (дд, J=8,0, 1,8 Гц, 2Н), 2,88 (дт, J=10,1, 4,6 Гц, 2Н), 2,57 (дт, J=10,3, 4,5 Гц, 2Н).
Этап 2.
[00629] В смесь 3-(4,6-дихлорпиримидин-5-ил)-2-(морфолин-4-ил)пропаннитрила (4,10 г, 14,3 ммоль) в ТГФ (123 мл) в атмосфере Ar добавляли 2 М MeNH2 в ТГФ (17,8 мл, 35,7 ммоль). Смесь перемешивали при кт в течение ночи, потом разделяли между H2O и EtOAc. Органический слой сушили, фильтровали, а фильтрат концентрировали при пониженном давлении с получением 3-[4-хлор-6-(метиламин о) пиримидин-5-ил]-2-(морфолин-4-ил)пропаннитрила (4,27 г, выход 100%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C12H16ClN5O: 281,10; полученное 282,00; 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,23 (с, 1Н), 7,54 (д, J=4,8 Гц, 1Н), 4,10-3,97 (м, 2Н), 3,68-3,55 (м, 4Н), 3,16 (дд, J=14,6, 8,7 Гц, 1H), 2,98 (дд, J=14,6, 7,9 Гц, 1H), 2,87 (д, J=4,4 Гц, 3Н), 2,77-2,65 (м, 2Н), 1,99 (с, 1Н).
Этап 3.
[00630] Смесь 3-[4-хлор-6-(метиламино)пиримидин-5-ил]-2-(морфолин-4-ил)пропаннитрила (2,0 г, 7,1 ммоль) и 20% раствора H2SO4 (85 мл) перемешивали при 50°С в течение ночи, потом при 60°С еще в течение 1 суток. Добавляли Н2О и NaHSO3 и экстрагировали смесь EtOAc. Органический слой концентрировали при пониженном давлении, а неочищенный продукт очищали посредством колоночной хроматографии с получением 4-хлор-8-метил-6-(морфолин-4-ил)-5H,6H,7H,8H-пиридо[2,3-d]пиримидин-7-она (287 мг, выход 14%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C12H15ClN4O2: 282,09; полученное 283,10; 1Н ЯМР (300 МГц, CDCl3) δ м.д. 8,65 (с, 1H), 3,69 (т, J=4,4 Гц, 4Н), 3,47 (с, 3Н), 3,44 (дд, J=7,6, 5,7 Гц, 1H), 3,28 (дд, J=16,9, 7,7 Гц, 1H), 3,12 (дд, J=17,0, 5,6 Гц, 1H), 2,69 (т, J=4,9 Гц, 4Н).
Этап 4.
[00631] В смесь 4-хлор-8-метил-6-(морфолин-4-ил)-5Н,6Н,7Н,8Н-пиридо[2,3-d]пиримидин-7-она (159 мг, 0,56 ммоль) и HCl-соли 3-[(1R)-1-аминоэтил]-5-(трифторметил)анилина (162 мг, 0,68 ммоль) в 1,4-диоксане (4,8 мл) в герметично закрытой пробирке добавляли Cs2CO3 (458 мг, 1,40 ммоль). Смесь продували Ar в течение 10 мин, потом добавляли Pd2(dba)3 (26 мг, 0,28 ммоль) и XantPhos (33 мг, 0,56 ммоль). Смесь нагревали до 100°С и перемешивали в течение ночи, потом фильтровали через целит® и экстрагировали фильтрат EtOAc. Органический слой сушили над безводным Na2SO4, фильтровали, фильтрат концентрировали при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением 4-{[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]амино}-8-метил-6-(морфолин-4-ил)-5Н,6Н,7Н,8Н-пиридо[2,3-d]пиримидин-7-она (102 мг, выход 40%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H26F3N6O2: 450,20; полученное 451,15; 1Н ЯМР (300 МГц, CDCl3) δ м.д. 8,54 (с, 1H), 7,90 (с, 1H), 7,75 (с, 1H), 7,37 (с, 1H), 6,53 (с, 1H), 4,26 (кв, J=6,5 Гц, 1H), 3,74 (т, J=4,6 Гц, 4Н), 3,57 (т, J=8,1 Гц, 1H), 3,47 (с, 3Н), 2,92 (д, J=8,1 Гц, 2Н), 2,80 (дт, J=4,8 Гц, 4Н), 2,20 (с, 1H), 1,46 (д, J=6,6 Гц, 3Н).
Пример 503. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-[(метиламино)метил]-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]-пиримидин-4-амина
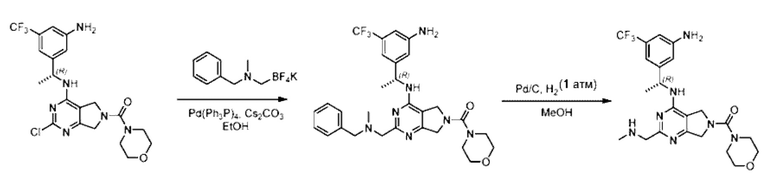
Этап 1.
[00632] Смесь N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-хлор-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (600 мг, 1,27 ммоль), N-бензил-N-метил-аминометилтрифторбората калия (399 мг, 1,66 ммоль) и Cs2CO3 (623 мг, 1,91 ммоль) в EtOH (21,2 мл) продували Ar. Добавляли Pd(Ph3P)4 (147 мг, 0,13 ммоль), нагревали смесь до 135°С и перемешивали в течение ночи. Смесь фильтровали через слой целита®, а фильтрат концентрировали при пониженном давлении, потом разделяли между EtOAc и H2O. Водный слой экстрагировали EtOAc (х4), объединенные органические слои сушили над Na2SO4, фильтровали, концентрировали при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-{[бензил(метил)амино]метил}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (425 мг, выход 59%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C29H34F3N7O2: 569,27; полученное 570,25; 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,58 (д, J=7,6 Гц, 1Н), 7,34-7,12 (м, 5Н), 6,79 (д, J=7,3 Гц, 2Н), 6,65 (с, 1Н), 5,49 (д, J=5,5 Гц, 2Н), 5,29 (т, J=7,3 Гц, 1Н), 4,68-4,43 (м, 4Н), 3,63 (т, J=4,6 Гц, 4Н), 3,52 (с, 2Н), 3,49 (д, J=2,0 Гц, 2Н), 3,25 (т, J=4,7 Гц, 4Н), 2,09 (с, 3Н), 1,46 (д, J=7,0 Гц, 3Н).
Этап 2.
[00633] Смесь N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-{[бензил(метил)-амино]метил}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (425 мг, 0,74 ммоль) в МеОН (19,1 мл) в атмосфере Ar выливали и повторно набирали (х3). Pd на углероде (20 масс. %, 85 мг) добавляли в атмосфере Ar, колбу опустошали и помещали смесь в атмосферу H2 (баллон). Смесь перемешивали при кт в течение ночи, потом фильтровали через слой целита®, фильтрат концентрировали при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифтор-метил)фенил]этил]-2-[(метиламино)метил]-6-(морфолин-4-карбонил)-5Н,6Н,7H-пирроло[3,4-d]-пиримидин-4-амина (115 мг, выход 35%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H28F3N7O2: 479,23; полученное 480,09; 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,62 (д, J=7,5 Гц, 1Н), 6,80 (д, J=12,8 Гц, 2Н), 6,67 (д, J=1,9 Гц, 1H), 5,51 (с, 2Н), 5,24 (т, J=7,3 Гц, 1H), 4,68-4,40 (м, 4Н), 3,63 (т, J=4,6 Гц, 4Н), 3,58-3,38 (м, 2Н), 3,24 (т, J=4,6 Гц, 4Н), 2,14 (с, 3Н), 1,44 (д, J=7,0 Гц, 3Н).
Пример 504. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-[(морфолин-4-ил)-метил]-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина

Этап 1.
[00634] N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-[(морфолин-4-ил)-метил]-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амин синтезировали способом, аналогичным N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2-{[бензил(метил)амино]метил}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амину, за исключением того, что N-бензил-N-метил-аминометилтрифторборат калия заменяли (морфолин-4-ил)метилтрифторборатом калия с получением (61 мг, выход 31%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C25H32F3N7O3: 535,25; полученное 536,1; 1Н ЯМР (300 МГц, Метанол-d4) δ м.д. 6,85 (с, 2Н), 6,75 (с, 1Н), 5,34 (кв, J=7,0 Гц, 1Н), 4,72-4,64 (м, 2Н), 4,61 (т, 2Н), 3,74 (т, J=4,7 Гц, 4Н), 3,57 (т, 4Н), 3,38 (т, J=4,7 Гц, 4Н), 2,41 (дт, J=9,2, 5,0 Гц, 4Н), 1,54 (д, J=7,1 Гц, 3Н).
[00635] Следующий пример 539 синтезировали способом, аналогичным примеру хх.
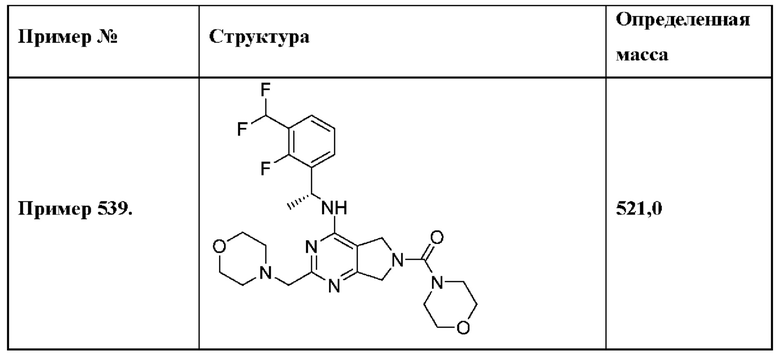
Пример 505. Синтез N4-[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]-N2-метил-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-2,4-диамина
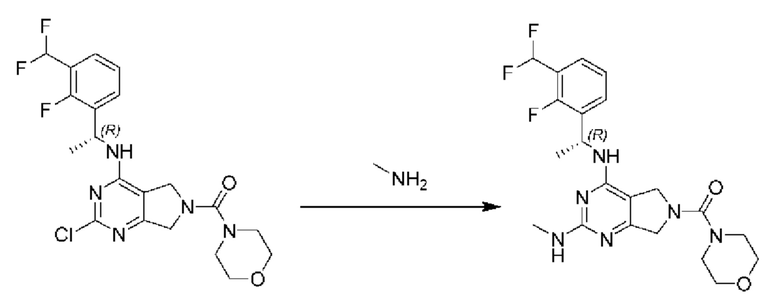
Этап 1.
[00636] N4-[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]-N2-метил-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-2,4-диамин синтезировали способом, аналогичным N2-метил-6-(морфолин-4-карбонил)-N4-[(1R)-1-[3-нитро-5-(трифторметил)фенил]этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-2,4-диамину, за исключением того, что 2-хлор-6-(морфолин-4-карбонил)-N-[(1R)-1-[3-нитро-5-(трифторметил)фенил]-этил]-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амин заменяли 2-хлор-N-[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амином с получением (156 мг, выход 63%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H25F3N6O2: 450,20; полученное 450,97; 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,59 (т, J=7,4 Гц, 1H), 7,47 (т, J=7,1 Гц, 1H), 7,36-7,24 (м, 2Н), 7,20 (т, J=54,4 Гц, 1H), 6,38-6,18 (м, 1Н), 5,54 (п, J=7,0 Гц, 1Н), 4,48 (кв, J=13,3 Гц, 2Н), 4,31 (с, 2Н), 3,63 (т, 4Н), 3,23 (т, J=4,6 Гц, 4Н), 2,59 (д, J=4,6 Гц, 3Н), 1,46 (д, J=7,0 Гц, 3Н).
Пример 506. Синтез 2-[2-хлор-3-(1-{[2-хлор-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-ил]амино}этил)фенил]-2,2-дифторэтан-1-ола
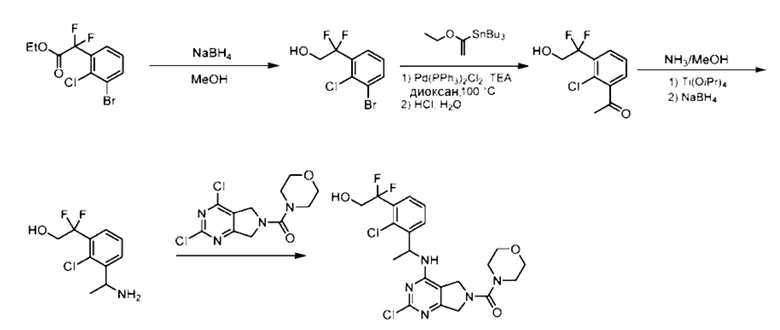
Этап 1.
[00637] В смесь этил 2-(3-бром-2-хлорфенил)-2,2-дифторацетата (1,06 г, 3,38 ммоль) в МеОН (21,8 мл) при 0°С добавляли NaBH4 (256 мг, 6,76 ммоль). Смесь нагревали до кт и перемешивали в течение 2 ч, потом добавляли водный NH4Cl и экстрагировали смесь Et2O (х3). Объединенные органические слои сушили над Na2SO4, фильтровали, фильтрат концентрировали при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением 2-(3-бром-2-хлорфенил)-2,2-дифторэтан-1-ола (345 мг, выход 38%). 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,15-7,78 (м, 1Н), 7,65 (дд, J=7,9, 1,6 Гц, 1Н), 7,42 (т, J=7,9 Гц, 1Н), 5,70 (т, J=6,5 Гц, 1Н), 4,02 (тд, J=14,2,6,5 Гц, 2Н).
Этап 2.
[00638] Смесь 2-(3-бром-2-хлорфенил)-2,2-дифторэтан-1-ола (345 мг, 1,27 ммоль) и Et3N (350 мкл, 2,54 ммоль) в 1,4-диоксане (3,9 мл) в толстостенной пробирке дегазировали Ar. Добавляли трибутил(1-этоксивинил)олово (558 мкл, 1,65 ммоль) и Pd(PPh3)2Cl2 (89 мг, 0,13 ммоль), смесь нагревали до 80°С и перемешивали в течение ночи. После охлаждения добавляли 1 М HCl, перемешивали смесь в течение 1 ч, потом разделяли водный и органический слои. В органический слой добавляли 1 М раствор KF и интенсивно перемешивали смесь в течение 1 ч, потом фильтровали через слой целита®. Разделяли водный и органический слои и повторяли процедуру с 1 М KF. Органический слой сушили над Na2SO4, фильтровали, фильтрат концентрировали при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением 1-[2-хлор-3-(1,1-дифтор-2-гидроксиэтил)фенил]этан-1-она (161 мг, выход 54%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C10H9ClF2O2: 234,03; полученное 234,95; 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,80-7,64 (м, 2Н), 7,56 (т, J=7,7 Гц, 1Н), 5,71 (т, J=6,5 Гц, 1Н), 4,02 (тд, J=14,3, 6,5 Гц, 2Н), 2,58 (с, 3Н).
Этап 3.
[00639] 2-[3-(1-аминоэтил)-2-хлорфенил]-2,2-дифторэтан-1-ол синтезировали способом, аналогичным этил 2-[3-(1-аминоэтил)фенил]пропаноату, за исключением того, что этил 2-(3-ацетилфенил)пропаноат заменяли 1-[2-хлор-3-(1,1-дифтор-2-гидроксиэтил)фенил]этан-1-оном с получением (123 мг, выход 76%).
Этап 4.
[00640] 2-[2-хлор-3-(1-{[2-хлор-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-ил]амино}этил)фенил]-2,2-дифтор-этан-1-ол синтезировали способом, аналогичным 2-хлор-N-{1-[3-(дифторметил)-2-фторфенил]этил}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амину, за исключением того, что 1-[3-(дифторметил)-2-фторфенил]этан-1-амин заменяли 2-[3-(1-аминоэтил)-2-хлорфенил]-2,2-дифторэтан-1-олом с получением (56 мг, выход 32%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H23ClF2N5O3: 520,24; полученное 521,0; 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,28 (д, J=7,5 Гц, 1H), 7,64 (д, J=7,5 Гц, 1H), 7,52 (дд, J=7,9, 1,8 Гц, 1H), 7,44 (т, J=7,7 Гц, 1Н), 5,67 (дт, J=13,9, 6,7 Гц, 2Н), 4,69-4,42 (м, 4Н), 4,03 (тт, J=13,7, 6,4 Гц, 2Н), 3,63 (т, J=4,6 Гц, 4Н), 3,25 (т, J=4,6 Гц, 4Н), 1,47 (д, J=6,9 Гц, 3Н).
Пример 507. Синтез 2-[3-(1-{[2-хлор-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-ил]амино}этил)-2-метилфенил]-2,2-дифторэтан-1-ола
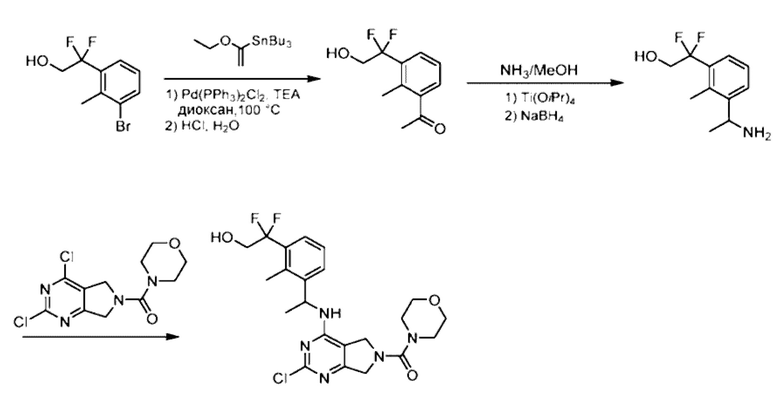
Этап 1.
[00641] 1-[3-(1,1-дифтор-2-гидроксиэтил)-2-метилфенил]этан-1-ол синтезировали способом, аналогичным 1-[2-хлор-3-(1,1-дифтор-2-гидроксиэтил)фенил]этан-1-ону, за исключением того, что 2-(3-бром-2-хлорфенил)-2,2-дифторэтан-1-ол заменяли 2-(3-бром-2-метилфенил)-2,2-дифторэтан-1-олом с получением (482 мг, выход 56%). 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,72 (д, J=7,6 Гц, 1Н), 7,59 (дд, J=8,0, 1,4 Гц, 1Н),7,41 (т, J=7,8 Гц, 2Н), 5,70 (т, J=6,5 Гц, 1Н), 3,91 (тд, J=14,4, 6,4 Гц, 2Н), 2,56 (с, 3Н), 2,38 (т, J=2,2 Гц, 3Н).
Этап 2.
[00642] 2-[3-(1-аминоэтил)-2-метилфенил]-2,2-дифторэтан-1-ол синтезировали способом, аналогичным этил 2-[3-(1-аминоэтил)фенил]пропаноату, за исключением того, что этил 2-(3-ацетилфенил)пропаноат заменяли 1-[3-(1,1-дифтор-2-гидроксиэтил)-2-метилфенил]этан-1-олом с получением (211 мг, выход 93%), который непосредственно использовали на следующем этапе.
Этап 3.
[00643] 2-[3-(1-{[2-хлор-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-ил]амино}этил)-2-метилфенил]-2,2-дифторэтан-1-ол синтезировали способом, аналогичным 2-хлор-N-{1-[3-(дифторметил)-2-фторфенил]этил}-6-(морфолин-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амину, за исключением того, что 1-[3-(дифторметил)-2-фторфенил]этан-1-амин заменяли 2-[3-(1-аминоэтил)-2-метилфенил]-2,2-дифторэтан-1-олом с получением (118 мг, выход 50%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H26ClF2N5O3: 481,17; полученное 481,66; 1Н ЯМР (300 МГц, Метанол-d4) δ м.д. 7,50 (д, J=7,7 Гц, 1Н), 7,43 (д, J=7,6 Гц, 1H), 7,24 (т, J=7,8 Гц, 1H), 5,61 (кв, J=6,9 Гц, 1H), 4,67-4,50 (м, 4Н), 3,96 (тд, J=13,9, 4,4 Гц, 2Н), 3,76-3,68 (м, 4Н), 3,40-3,33 (м, 4Н), 2,57 (с, 3Н), 1,53 (д, J=6,9 Гц, 3Н); 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,26 (д, J=7,4 Гц, 1Н), 7,55 (д, J=7,6 Гц, 1H), 7,37 (дд, J=7,9, 1,5 Гц, 1H), 7,28 (т, J=7,7 Гц, 1Н), 5,68 (т, J=6,4 Гц, 1H), 5,55-5,39 (м, 1H), 4,63-4,40 (м, 4Н), 3,89 (тд, J=14,7, 6,3 Гц, 2Н), 3,63 (т, J=4,6 Гц, 3Н), 3,24 (т, J=4,8 Гц, 4Н), 1,45 (д, J=6,9 Гц, 3Н).
Пример 508. Синтез 2-[(циклопропиламино)метил]-N-{1-[3-(дифторметил)-2-фторфенил]этил}-6-(морфолин-4-карбонил)-5H,6Н,7Н-пирроло[3,4-d] пиримидин-4-амина
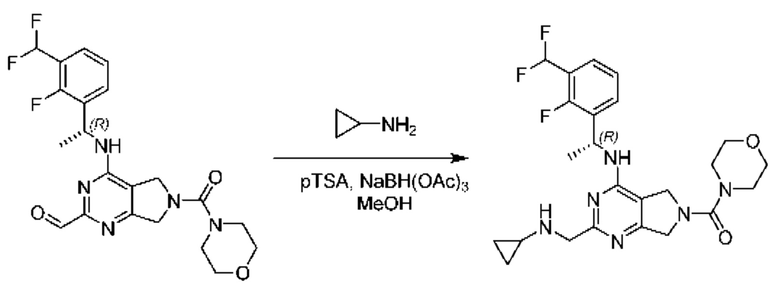
Этап 1.
[00644] В смесь 4-({1-[3-(дифторметил)-2-фторфенил]этил}амино)-6-(морфолин-4-карбонил)-5Н,6Н,7H-пирроло[3,4-d]пиримидин-2-карбальдегида (200 мг, 0,44 ммоль) в МеОН (4 мл) при кт добавляли циклопропиламин (40 мкл, 0,58 ммоль) и pTSA (7,7 мг, 0,04 ммоль). Смесь перемешивали при кт в течение ночи, потом добавляли NaBH(OAc)3 (28 мг, 0,44 ммоль) и перемешивали смесь при кт еще в течение 30 мин. Смесь концентрировали при пониженном давлении, а остаток разводили насыщенным NH4Cl и экстрагировали EtOAc. Объединенные органические слои сушили над безводным MgSO4, фильтровали, фильтрат концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением 2-[(циклопропиламино)метил]-N-{1-[3-(дифторметил)-2-фторфенил]этил}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (41 мг, выход 19%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C24H29F3N6O2: 490,23; полученное 491,01; 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,79 (д, J=7,0 Гц, 1H), 7,66-7,55 (м, 1H), 7,47 (т, J=7,1 Гц, 1H), 7,26 (т, J=7,7 Гц, 1H), 7,21 (т, J=54,4 Гц, 1Н), 5,56 (кв, J=7,0 Гц, 1H), 4,71-4,45 (м, 4Н), 3,75-3,59 (м, 4Н), 3,54 (д, J=6,3 Гц, 2Н), 3,25 (т, J=4,6 Гц, 4Н), 2,45-2,35 (с, 1H), 1,89-1,78 (м, 1H), 1,51 (д, J=7,0 Гц, 3Н), 0,31- 0,01 (м, 4Н); 1H ЯМР (300 МГц, Метанол-d4) δ м.д. 7,57 (т, J=7,4 Гц, 1H), 7,48 (т, J=7,0 Гц, 1H), 7,24 (т, J=7,8 Гц, 1H), 7,02 (т, J=54,9 Гц, 1H), 5,66 (кв, J=7,1 Гц, 1H), 4,71 (с, 2Н), 4,62 (с, 2Н), 3,87-3,60 (м, 6Н), 3,50-3,37 (м, 4Н), 1,99-1,85 (м, 1Н), 1,62 (д, J=7,1 Гц, 3Н), 0,46-0,25 (м, 4Н).
Пример 509. Синтез N-[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]-6-(морфолин-4-карбонил)-2-{[(оксетан-3-ил)амино]метил}-5H,6H,7H-пирроло-[3,4-d]пиримидин-4-амина
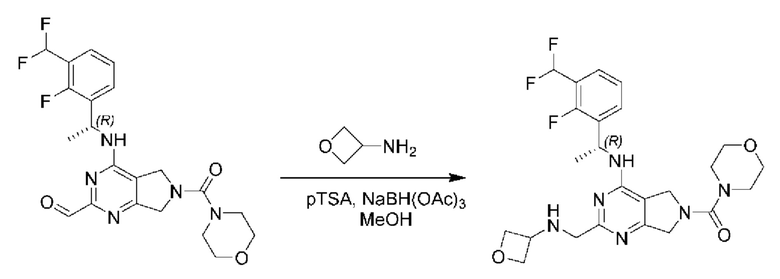
Этап 1.
[00645] N-[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]-6-(морфолин-4-карбонил)-2-{[(оксетан-3-ил)амино]метил}-5H,6H,7H-пирроло-[3,4-d]пиримидин-4-амин синтезировали способом, аналогичным 2-[(циклопропиламино)метил]-N-{1-[3-(дифторметил)-2-фторфенил]этил}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амину, за исключением того, что циклопропиламин заменяли HCl-солью оксетан-3-амина и Et3N с получением (11 мг, выход 59%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C24H29F3N6O3: 506,23; полученное 507,03; 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,80 (д, J=7,1 Гц, 1H), 7,62 (т, J=7,4 Гц, 1H), 7,50 (т, J=7,2 Гц, 1H), 7,29 (т, J=7,7 Гц, 1H), 7,23 (т, J=54,4 Гц, 1H), 5,65-5,51 (м, 1H), 4,76-4,46 (м, 4Н), 4,38 (дт, J=13,1, 6,6 Гц, 2Н), 4,08 (дт, J=18,6, 6,2 Гц, 2Н), 3,74 (т, J=6,4 Гц, 1H), 3,64 (т, 4Н), 3,47 (с, 2Н), 3,26 (т, J=4,7 Гц, 4Н), 1,75 (с, 1H), 1,51 (д, J=7,0 Гц, 3Н).
Пример 510. Синтез 4-{[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]-амино}-6-(4-метоксиоксан-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-2-карбоксамида
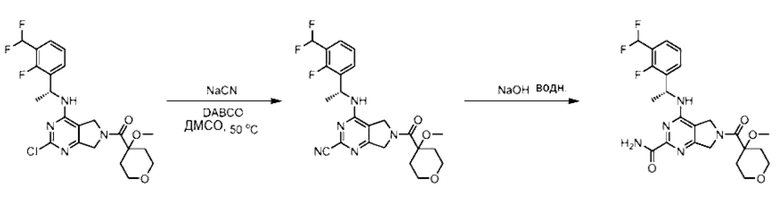
Этап 1.
[00646] Смесь 2-хлор-N-[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]-6-(4-метоксиоксан-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина (300 мг, 0,62 ммоль), 5050 (61 мг, 1,2 ммоль), DABCO (69 мг, 0,62 ммоль) в ДМСО (6 мл) и изопропаноле (3 мл) нагревали до 50°С и перемешивали в течение ночи. Смесь уменьшали в объеме для удаления изопропанола, а потом экстрагировали Et2O (х3). Объединенные органические слои сушили над Na2SO4, фильтровали, а фильтрат концентрировали при пониженном давлении с получением 4-{[(1R)-1-[3-(дифторметил)-2-фторфенил]-этил]амино}-6-(4-метоксиоксан-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-2-карбонитрила (330 мг, выход 100%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C23H24F3N5O3: 475,18; полученное 476,18; 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,64-8,49 (м, 1Н), 7,65 (т, J=7,6 Гц, 1H), 7,54 (т, J=7,2 Гц, 1Н), 7,33 (тд, J=7,7, 3,2 Гц, 1Н), 7,24 (т, J=54,2 Гц, 1Н), 5,62-5,46 (м, 1Н), 4,90 (д, J=27,2 Гц, 2Н), 4,72-4,48 (м, 2Н), 3,77-3,54 (м, 4Н), 3,32 (д, J=7,2 Гц, 2Н), 3,17 (д, J=13,3 Гц, 2Н), 2,01-1,79 (м, 4Н), 1,53 (дд, J=7,0, 4,5 Гц, 3Н).
Этап 2.
[00647] В смесь 4-{[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]амино}-6-(4-метокси-оксан-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-2-карбонитрила (325 мг, 0,68 ммоль) в ТГФ (6,5 мл) добавляли NaOH (109 мг, 2,7 ммоль) и H2O (1,3 мл). Смесь охлаждали до 0°С и по каплям добавляли H2O2 (279 мкл, 2,7 ммоль), потом оставляли нагреваться до кт и перемешивали в течение ночи. Добавляли H2O, смесь перемешивали в течение 5 мин и экстрагировали EtOAc (х4). Объединенные органические слои сушили над безводным Na2SO4, фильтровали, фильтрат концентрировали при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением 4-{[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]-амино}-6-(4-метоксиоксан-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-2-карбоксамида (151 мг, выход 45%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C23H26F3N5O4: 493Д9; полученное 494,00; 1Н ЯМР (300 МГц, Метанол-d4) δ м.д. 7,62 (т, J=7,7 Гц, 1H), 7,48 (т, J=7,3 Гц, 1Н), 7,25 (т, J=7,7 Гц, 1Н), 6,99 (т, J=54,8 Гц, 1H), 5,71 (кв, J=7,0 Гц, 1H), 5,02 (д, J=30,2 Гц, 2Н), 4,72 (д, J=13,0 Гц, 2Н), 3,85-3,70 (м, 4Н), 3,29 (с, 1H), 3,25 (с, 2Н), 2,18-1,92 (м, 4Н), 1,63 (д, J=7,0 Гц, 3Н); 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,15 (т, J=8,7 Гц, 1H), 7,68 (д, J=7,4 Гц, 2Н), 7,59 (с, 1H), 7,51 (т, J=7,2 Гц, 1H), 7,31 (дт, J=7,6, 3,8 Гц, 1H), 7,21 (т, J=54,4 Гц, 1Н), 5,73 (т, J=7,1 Гц, 1H), 4,89 (д, J=24,0 Гц, 2Н), 4,61 (д, J=22,3 Гц, 2Н), 3,63 (д, J=18,7 Гц, 4Н), 3,18 (д, J=12,3 Гц, 3Н), 2,03-1,79 (м, 4Н), 1,57-1,49 (м, 3Н).
Пример 511. Синтез 2-хлор-N-[(1R)-l-[3-фтор-5-(трифторметил)фенил]этил]-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
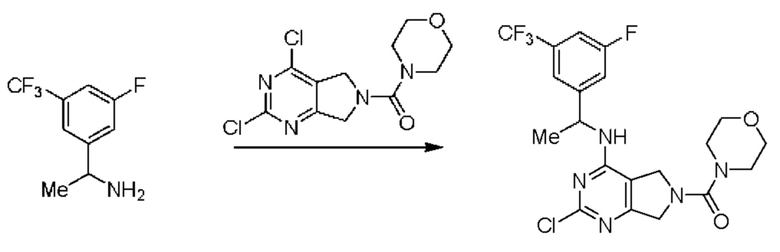
Этап 1.
[00648] 2-хлор-N-[(1R)-1-[3-фтор-5-(трифторметил)фенил]этил]-6-(морфолин-4-карбонил)-5Н,6Н,7H-пирроло[3,4-d]пиримидин-4-амин синтезировали способом, аналогичным 2-хлор-N-{1-[3-(дифторметил)-2-фторфенил]этил}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амину, за исключением того, что 1-[3-(дифторметил)-2-фторфенил]этан-1-амин заменяли (1R)-1-[3-фтор-5-(трифторметил)фенил]этан-1-амином с получением (227 мг, выход 80%). ЖХМС (ИЭР): m/z: [М-Н], рассчитанное для C20H20ClF4N5O2: 473,12; полученное 471,74; 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,16 (д, J=7,6 Гц, 1H), 7,64 (с, 1H), 7,60-7,52 (м, 2Н), 5,42-5,26 (м, 1H), 4,67-445 (м, 4Н), 3,70-3,55 (м, 4Н), 3,29-3,19 (м, 4Н), 1,50 (д, J=7,0 Гц, 3Н).
Пример 512. Синтез 2-хлор-N-[(1R)-1-[3-хлор-5-(трифторметил)фенил]этил]-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
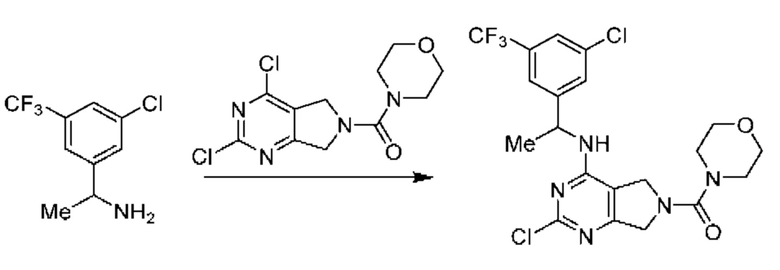
Этап 1.
[00649] 2-хлор-N-[(1R)-1-[3-хлор-5-(трифторметил)фенил]этил]-6-(морфолин-4-карбонил)-5Н,6Н,7H-пирроло[3,4-d]пиримидин-4-амин синтезировали способом, аналогичным 2-хлор-N-{1-[3-(дифторметил)-2-фторфенил]этил}-6-(морфолин-4-карбонил)-5Н,6Н,7H-пирроло[3,4-d]пиримидин-4-амину, за исключением того, что 1-[3-(дифторметил)-2-фторфенил]этан-1-амин заменяли (1R)-1-[3-хлор-5-(трифторметил)фенил]этан-1-амином с получением (251 мг, выход 87%). ЖХМС (ИЭР): m/z: [М-Н], рассчитанное для C20H20Cl2F3N5O2: 489,09; полученное 487,65; 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,16 (д, J=7,6 Гц, 1H), 7,78 (с, 1H), 7,77-7,72 (м, 2Н), 5,38-5,27 (м, 1H), 4,68-4,45 (м, 4Н), 3,67-3,58 (м, 4Н), 3,29-3,19 (м, 4Н), 1,50 (д, J=7,0 Гц, 3Н).
Пример 513. Синтез 2-хлор-N-[(1R)-1-[3-бром-5-(трифторметил)фенил]этил]-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
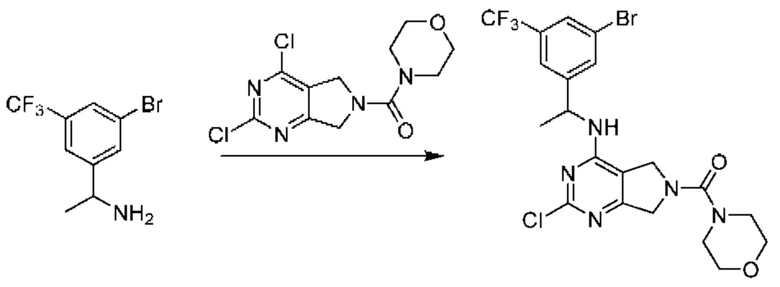
Этап 1.
[00650] 2-хлор-N-[(1R)-1-[3-бром-5-(трифторметил)фенил]этил]-6-(морфолин-4-карбонил)-5Н,6Н,7H-пирроло[3,4-d]пиримидин-4-амин синтезировали способом, аналогичным 2-хлор-N-{1-[3-(дифторметил)-2-фторфенил]этил}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амину, за исключением того, что 1-[3-(дифторметил)-2-фторфенил]этан-1-амин заменяли (1R)-1-[3-бром-5-(трифторметил)фенил]этан-1-амином с получением (160 мг, выход 60%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C20H20BrClF3N5O2: 533,04; полученное 535,9; 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,15 (д, J=7,6 Гц, 1H), 7,92 (с, 1H), 7,85 (с, 1H), 7,79 (с, 1H), 5,32 (п, J=6,4 Гц, 1H), 4,67-4,39 (м, 4Н), 3,62 (т, J=4,6 Гц, 4Н), 3,24 (т, J=4,7 Гц, 4Н), 1,50 (д, J=7,0 Гц, 3Н).
Пример 514. Синтез N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2'-хлор-7',8'-дигидро-5'H-спиро[1,3-диоксолан-2,6'-хиназолин]-4'-амина
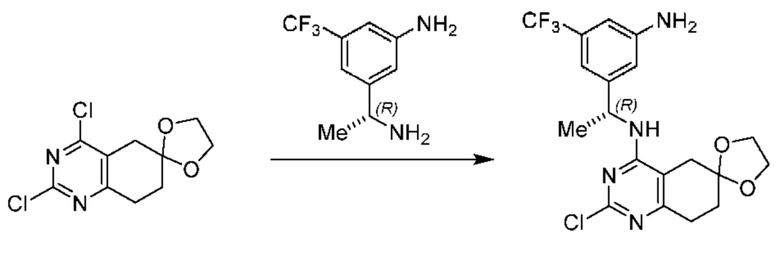
Этап 1.
[00651] Смесь 2',4'-дихлор-7',8'-дигидро-5'H-спиро[1,3-диоксолан-2,6'-хиназолина] (104 мг, 0,4 ммоль) и HCl-соли 3-(1-аминоэтил)-5-(трифторметил)анилина (101 мг, 0,42 ммоль) в ДМСО (3 мл) продували Ar. Добавляли ДИПЭА (0,28 мл, 1,6 ммоль), а смесь нагревали до 150°С под микроволновым излучением и перемешивали в течение 1 ч. Смесь разводили Н2О и Et2O и экстрагировали водный слой Et2O (х2) и Et2O/EtOAc (1:1). Объединенные органические слои промывали Н2О, сушили над Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-амино-5-(трифторметил)фенил]этил]-2'-хлор-7',8'-дигидро-5'H-спиро[1,3-диоксолан-2,6'-хиназолин]-4'-амина (102 мг, выход 60%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C19H20CIF3N4O2: 428,12; полученное 429,01; 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,38 (д, J=8,0 Гц, 1H), 6,85 (с, 1H), 6,77 (с, 1H), 6,70 (с, 1H), 5,56 (с, 2Н), 5,20 (п, J=7,1 Гц, 1H), 3,98 (с, 4Н), 2,69 (т, J=6,7 Гц, 2Н), 2,62 (с, 2Н), 1,88 (т, J=6,7 Гц, 2Н), 1,45 (д, J=7,0 Гц, 3Н).
Пример 515. Синтез 2-хлор-N-[(1R)-l-[3-метил-5-(трифторметил)фенил]этил]-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
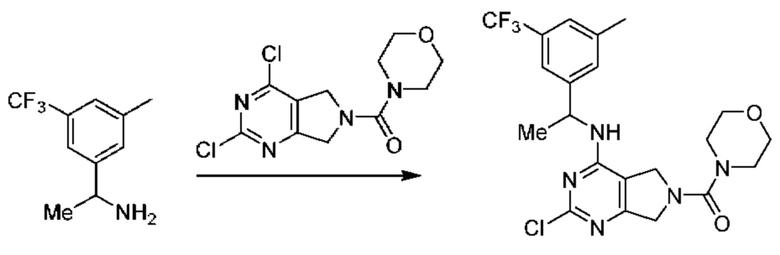
Этап 1.
[00652] 2-хлор-N-[(1R)-1-[3-метил-5-(трифторметил)фенил]этил]-6-(морфолин-4-карбонил)-5Н,6Н,7H-пирроло[3,4-d]пиримидин-4-амин синтезировали способом, аналогичным 2-хлор-N-{1-[3-(дифторметил)-2-фторфенил]этил}-6-(морфолин-4-карбонил)-5Н,6Н,7H-пирроло[3,4-d]пиримидин-4-амину, за исключением того, что 1-[3-(дифторметил)-2-фторфенил]этан-1-амин заменяли HCl-солью (1R)-1-[3-метил-5-(трифторметил)фенил]этан-1-амина с получением (148 мг, выход 64%). ЖХМС (ИЭР): m/z: [М-Н], рассчитанное для C21H23CIF3N5O2: 469,15; полученное 467,76; 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,15 (д, J=7,8 Гц, 1H), 7,54 (с, 1H), 7,50 (с, 1H), 7,42 (с, 1Н), 5,35-5,26 (м, 1Н), 4,66-4,43 (м, 4Н), 3,67-3,58 (м, 4Н), 3,27-3,20 (м, 4Н), 2,38 (с, 3Н), 1,49 (д, J=7,0 Гц, 3Н).
Пример 516. Синтез [4-[1-[3-(1-гидроксиэтил)фенил]этиламино]-5,7-дигидропирроло[3,4-в]пиримидин-6-ил]-морфолинометанона
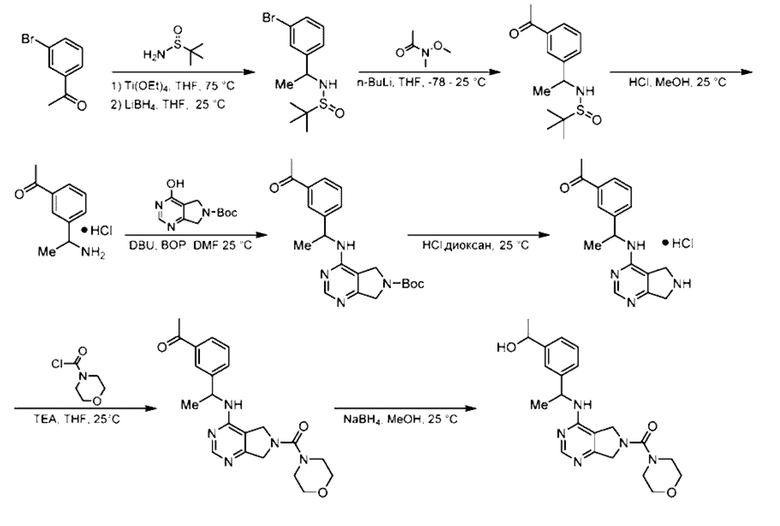
Этап 1.
[00653] В смесь 1-(3-бромфенил)этанона (3,31 мл, 25,1 ммоль) и 2-метилпропан-2-сульфинамида (3,04 г, 25,1 ммоль) вТГФ (50 мл) одной частью добавляли Ti(OEt)4 (10,4 мл, 50,2 ммоль) в атмосфере N2. Смесь нагревали до 75°С и перемешивали в течение 14 ч. Смесь охлаждали до 0°С, потом добавляли МеОН (937 мкл, 23,1 ммоль) и LiBH4 (504 мг, 23,2 ммоль) и перемешивали полученную в результате смесь в течение 2 ч при 25°С. Добавляли H2O (30 мл) и экстрагировали смесь EtOAc. Объединенные органические экстракты обрабатывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением N-[1-(3-бромфенил)этил]-2-метил-пропан-2-сульфинамида (5,5 г, выход 78%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C12H19BrNOS: 304,0; полученное 304,0.
Этап 2.
[00654] В смесь N-[1-(3-бромфенил)этил]-2-метил-пропан-2-сульфинамида (2,0 г, 6,57 ммоль) в ТГФ (35 мл) одной частью добавляли а 2,5 М раствор n-Buli (7,89 мл, 19,7 ммоль) при -78°С в атмосфере N2. Смесь перемешивали при -78°С в течение 30 мин, потом добавляли N-метокси-N-метил-ацетамид (908 мкл, 8,55 ммоль) в ТГФ (5 мл) и перемешивали смесь при 25°С в течение 2 ч. Смесь добавляли в ледяную воду (50 мл), перемешивали в течение 20 мин и экстрагировали EtOAc. Объединенные органические экстракты промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением N-[1-(3-ацетилфенил)этил]-2-метил-пропан-2-сульфинамида (800 мг, неочищенный), который непосредственно переносили в следующую реакцию.
Этап 3.
[00655] N-[1-(3-ацетилфенил)этил]-2-метил-пропан-2-сульфинамид (794 мг, 2,97 ммоль) растворяли в 4 М растворе HCl в метаноле (10 мл, 40 ммоль) и перемешивали смесь при 25°С в течение 30 мин. Потом смесь фильтровали и концентрировали при пониженном давлении с получением 1-[3-(1-аминоэтил)фенил]этанона гидрохлорида (450 мг, выход за 2 этапа 42%). 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,64 (шир. с, 3Н) 8,16 (с, 1H) 7,95 (д, J=7,6 Гц, 1H) 7,79 (д, J=7,6 Гц, 1Н) 7,58 (т, J=7,6 Гц, 1H) 4,48-4,52 (м, 1H) 2,61 (с, 3Н) 1,54 (д, J=6,4 Гц, 3Н).
Этап 4.
[00656] В смесь 1-[3-(1-аминоэтил)фенил]этанона гидрохлорида (250 мг, 1,53 ммоль) и трет-бутил 4-оксо-5,7-дигидро-4аН-пирроло[3,4-d]пиримидин-6-карбоксилата (363 мг, 1,53 ммоль) в ДМФ (12 мл) одной частью добавляли ДБУ (693 мкл, 4,60 ммоль) и ВОР (1,02 г, 2,30 ммоль) в атмосфере N2. Смесь перемешивали при 25°С в течение 14 ч. Потом смесь фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали посредством флэш-хроматографии с получением трет-бутил 4-[[(1R)-1-(3-ацетилфенил)этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилата (200 мг, выход 34%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H27N4O3: 383,2; полученное 383,2.
Этап 5.
[00657] трет-бутил 4-[1-(3-ацетилфенил) этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-карбоксилат (170 мг, 445 мкмоль) растворяли в 4 М растворе HCl в диоксане (10 мл, 40 ммоль) и перемешивали при 25°С в течение 30 мин. Смесь фильтровали и концентрировали при пониженном давлении с получением 1-[3-[1-(6,7-дигидро-5Н-пирроло[3,4-d]пиримидин-4-иламино)этил]фенил]этенона гидрохлорида (75 мг, неочищенный). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C16H19N4O: 283,2; полученное 283,1.
Этап 6.
[00658] В смесь морфолин-4-карбонилхлорида (40,7 мг, 273 мкмоль) и ТЭА (173 мкл, 1,24 ммоль) в ТГФ (2 мл) добавляли 1-[3-[1-(6,7-дигидро-5Н-пирроло[3,4-d]пиримидин-4-иламино)этил]фенил]этанона гидрохлорид (70 мг, 220 мкмоль). Смесь перемешивали при 25°С в течение 2 ч. Смесь фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством препаративной ТСХ с получением 1-[3-[1-[[6-(морфолин-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]фенил]этанона (50 мг, выход 51%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H26N5O3: 396,2; полученное 396,2; 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,30 (шир. с, 1H) 7,96 (с, 1H) 7,82 (д, J=7,6 Гц, 1H) 7,72 (д, J=7,6 Гц, 1Н) 7,64 (д, J=7,6 Гц, 1H) 7,46 (т, J=7,6 Гц, 1Н) 5,41 (т, J=7,2 Гц, 1H) 4,47-4,69 (м, 4Н) 3,60-3,66 (м, 4Н) 3,26 (м, 4Н) 2,57 (с, 3Н) 1,50 (д, J=6,8 Гц, 3Н).
Этап 7.
[00659] В смесь 1-[3-[1-[[6-(морфолин-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]фенил]этанона (45 мг, 114 мкмоль) в МеОН (1 мл) добавляли NaBH4 (4,3 мг, 114 мкмоль) 0°С в атмосфере N2. Смесь нагревали до 25°С и перемешивали в течение 2 ч. Смесь гасили водой (0,2 мл), фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [4-[1-[3-(1-гидроксиэтил)фенил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (10 мг, выход 22%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H28N5O3: 398,2; полученное 398,1; 1Н ЯМР (400 МГц, Хлороформ-d) δ м.д. 8,52 (с, 1H) 7,40 (с, 1H) 7,38-7,25 (м, 3Н), 5,46-5,36 (м, 1H) 4,98-4,90 (м, 1H) 4,73 (шир. с, 1H) 3,74 (т, J=4,8 Гц, 4Н) 3,36 (т, J=4,8 Гц, 4Н) 1,94 (д, J=14,4 Гц, 1Н) 1,62 (д, J=6,8 Гц, 3Н) 1,51 (дд, J=6,8, 2,0 Гц, 3Н).
Пример 517. Синтез [2-хлор-4-[1-[3-(3-фторазетидин-3-ил)фенил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона
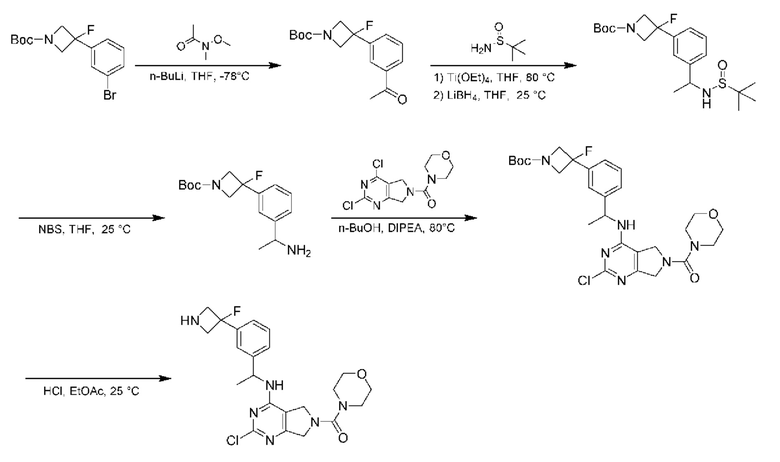
Этап 1.
[00660] В раствор трет-бутил 3-(3-бромфенил)-3-фтор-азетидин-1-карбоксилата (1,0 г, 3,03 ммоль) в ТГФ (10 мл) добавляли а 2,5 М раствор n-BuLi (3,03 мл, 7,58 ммоль) при -78°С. Смесь перемешивали в течение 1 ч, потом в реакционную смесь добавляли N-метокси-N-метил-ацетамид (468 мг, 4,54 ммоль, 482,94 μл) при -78°С и перемешивали смесь при в течение 4 ч. Смесь гасили водой, экстрагировали EtOAc, обрабатывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением остатка. Неочищенный остаток очищали посредством силикагелевой хроматографии с получением трет-бутил 3-(3-ацетилфенил)-3-фтор-азетидин-1-карбоксилата (240 мг, выход 9%). 1H ЯМР (400 МГц, Хлороформ-d) δ м.д. 7,98 (с, 1Н) 7,88 (д, J=7,6 Гц, 1Н) 7,61 (д, J=7,6 Гц, 1Н) 7,47 (т, J=8,0 Гц, 1Н) 4,36 (дд, J=22,4, 10,0 Гц, 2Н) 4,20 (дд, J=19,2, 10,0 Гц, 2Н) 2,56 (с, ЗН) 1,40 (с, 9Н).
Этап 2.
[00661] В смесь трет-бутил 3-(3-ацетилфенил)-3-фтор-азетидин-1-карбоксилата (240 мг, 818 мкмоль) и 2-метилпропан-2-сульфинамида (198 мг, 1,64 ммоль) в ТГФ (2,5 мл) добавляли Ti(OEt)4 (679 [μл, 3,27 ммоль). Смесь нагревали до 80°С и перемешивали в течение 4 ч. Смесь охлаждали до 0°С, потом по каплям добавляли 2 М раствор LiBH4 (409 мкл, 818 мкмоль) и перемешивали полученную в результате смесь в течение 1 ч при 0°С. В реакционную смесь добавляли воду, а потом экстрагировали EtOAc, обрабатывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали посредством флэш-хроматографии с получением трет-бутил 3-[3-[1-(трет-бутилсульфиниламино)этил]фенил]-3-фтор-азетидин-1-карбоксилата (120 мг, выход 37%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H32FN2O3S: 399,2; полученное 399,2.
Этап 3.
[00662] Раствор трет-бутил 3-[3-[1-(трет-бутилсульфиниламино)этил]фенил]-3-фтор-азетидин-1-карбоксилата (120 мг, 301 мкмоль) и N-бромсукцинимида (59,0 мг, 331 мкмоль) в ТГФ (1,5 мл) перемешивали при 25°С в течение 1 ч. Смесь концентрировали при пониженном давлении с получением остатка, который очищали посредством препаративной ВЭЖХ с получением трет-бутил 3-[3-(1-аминоэтил)фенил]-3-фтор-азетидин-1-карбоксилата (60 мг, выход 68%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C16H24FN2O2: 295,2; полученное 295,1.
Этап 4.
[00663] В раствор трет-бутил 3-[3-(1-аминоэтил)фенил]-3-фтор-азетидин-1-карбоксилата (60 мг, 204 мкмоль) в n-ВиОН (1,5 мл) добавляли 2,4-дихлор-5,7-дигидропирроло [3,4-d]пиримидин-6-ил)-морфолинометанон (61,8 мг, 204 мкмоль) и ДИПЭА (142 мкл, 815 мкмоль). Смесь перемешивали в течение 3 ч при 80°С. Смесь гасили водой, экстрагировали EtOAc, обрабатывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением остатка. Неочищенный остаток очищали посредством колоночной хроматографии с получением трет-бутил 3-[3-[1-[[2-хлор-6-(морфолин-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]фенил]-3-фтор-азетидин-1-карбоксилата (100 мг, выход 87%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C27H35ClFN6O4: 561,2; полученное 561,3.
Этап 5.
[00664] трет-бутил 3-[3-[1-[[2-хлор-6-(морфолин-4-карбонил)-5,7-дигидропирроло [3,4-d]пиримидин-4-ил]амино]этил]фенил]-3-фтор-азетидин-1-карбоксилат (100 мг, 178 мкмоль) растворяли в 4 М растворе HCl в EtOAc (89,1 мкл, 356 мкмоль) и перемешивали раствор в течение 2 ч при 25°С. Смесь концентрировали при пониженном давлении с получением остатка. Неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[1-[3-(3-фторазетидин-3-ил)фенил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (40 мг, выход 45%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H27ClFN6O2: 461,2; полученное 461,1; 1Н ЯМР (400 МГц, Хлороформ-d) δ м.д. 7,90 (с, 1Н) 7,47-7,38 (м, 3Н) 6,45 (шир. с, 1Н) 5,52 (шир. с, 1Н) 4,34-4,34 (м, 8Н) 3,77-3,66 (м, 4Н) 3,37-3,28 (м, 4Н) 1,61 (д, J=6,8 Гц, 3Н).
Пример 518. Синтез [2-хлор-4-[[(1R)-1-[3-(3-гидроксиазетидин-1-ил)фенил]этил]амино]-5,7-дигидропирроло[3,4-(1]пиримидин-6-ил]-морфалинометанона
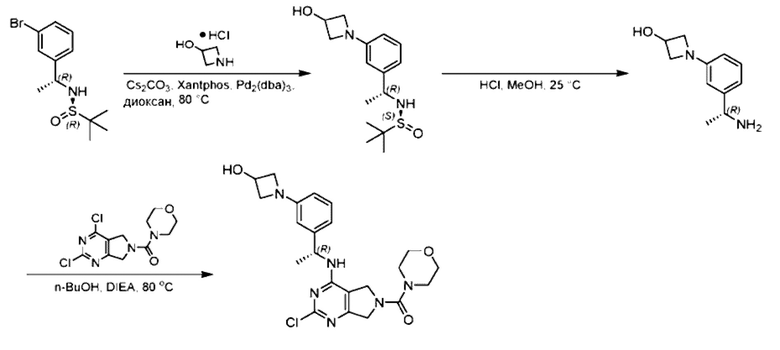
Этап 1.
[00665] В смесь N-[(1R)-1-(3-бромфенил)этил]-2-метил-пропан-2-сульфинамида (0,50 г, 1,64 ммоль), азетидин-3-ола гидрохлорида (360 мг, 3,29 ммоль) и Cs2CO3 (1,61 г, 4,93 ммоль) в диоксане (5 мл) добавляли Xantphos (95,1 мг, 164 мкмоль) и Pd2(dba)3 (75,3 мг, 82,2 мкмоль) в атмосфере N2. Смесь нагревали до 100°С и перемешивали в течение 18 ч в атмосфере N2. Реакционную смесь фильтровали, а фильтрат концентрировали при пониженном давлении с получением остатка, который очищали посредством флэш-хроматографии с получением N-[(1R)-1-[3-(3-гидроксиазетидин-1-ил)фенил]этил]-2-метил-пропан-2-сульфинамида (160 мг, выход 33%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C15H25N2O2S: 297,2; полученное 297,3.
Этап 2.
[00666] В смесь N-[(1R)-1-[3-(3-гидроксиазетидин-1-ил)фенил]этил]-2-метил-пропан-2-сульфонамида (90 мг, 304 мкмоль) в МеОН (0,9 мл) добавляли 4 М раствор HCl в МеОН (152 мкл, 608 мкмоль). Смесь перемешивали при 25°С в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении, остаток разводили МеОН (3 мл) и обрабатывали раствор раствором NaOH в МеОН до рН=8. Смесь концентрировали при пониженном давлении с получением остатка, который потом разводили 5:1 смесью CH2Cl2: МеОН (3 мл), фильтровали и концентрировали при пониженном давлении с получением 1-[3-[(1R)-1-аминоэтил]фенил]азетидин-3-ола гидрохлорида (65 мг, выход 94%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C11H17N2O: 193,1; полученное 193,1.
Этап 3.
[00667] В смесь 1-[3-[(1R)-1-аминоэтил]фенил]азетидин-3-ола (110 мг, 572 мкмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (173 мг, 572 мкмоль) в n-BuOH (2,8 мл) добавляли ДИЭА (498 мкл, 2,86 ммоль). Смесь перемешивали при 80°С в течение 3 ч. Потом смесь фильтровали, а фильтрат очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[3-(3-гидроксиазетидин-1-ил)фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (14 мг, выход 5%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H28ClN6O3: 459,2; полученное 459,3; 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 7,14 (т, J=8,0 Гц, 1H), 6,76 (д, J=7,6 Гц, 1H), 6,55 (с, 1H), 6,39 (д, J=8,0 Гц, 1H), 5,37-5,30 (м, 1H), 4,69-4,61 (м, 1H), 4,61-4,53 (м, 4Н), 4,12 (т, J=8,0 Гц, 2Н), 3,75-3,68 (м, 4Н), 3,60-3,53 (м, 2Н), 3,39-3,33 (м, 4Н), 1,54 (д, J=7,2 Гц, 3Н).
Пример 519. Синтез [2-хлор-4-[[(1R)-1-[3-(1-фтор-2-гидрокси-этил)фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона
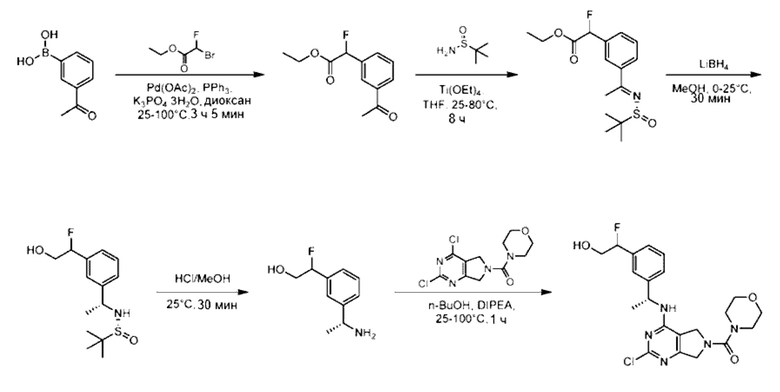
Этап 1.
[00668] В смесь (3-ацетилфенил)бороновой кислоты (885,42 мг, 5,40 ммоль, 712,56 цл), K3PO4⋅3Н2О (2,16 г, 8,10 ммоль), Pd(OAc)2 (30,31 мг, 135,00 μмоль) и PPh3 (141,64 мг, 540,00 μмоль) одной частью добавляли диоксан (8 мл) при кт в атмосфере N2. Смесь перемешивали при кт в течение 5 мин, потом по каплям добавляли этил 2-бром-2-фторацетат (500 мг, 2,70 ммоль, 318,47 μл) при кт в атмосфере N2. Реакционную смесь перемешивали и нагревали до 100°С в течение 3 ч. Смесь фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии с получением этил 2-(3-ацетилфенил)-2-фторацетата (280 мг, выход 46,25%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C12H14FO3: 225,08; полученное 225,1; 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,05 (м, 1 Н) 8,01 (м, 1 Н) 7,70-7,72 (м, 1 Н) 7,63-7,65 (м, 1 Н) 6,22-6,33 (д, 1 Н) 4,19 (кв, J=7,2 Гц, 2 Н) 2,61 (с, 3 Н) 1,16 (т, J=7,2 Гц, 3 Н).
Этап 2.
[00669] В смесь 2-метилпропан-2-сульфинамида (151,35 мг, 1,25 ммоль) и этил 2-(3-ацетилфенил)-2-фторацетата (280 мг, 1,25 ммоль) в ТГФ (5 мл) одной частью добавляли Ti(OEt)4 (569,69 мг, 2,50 ммоль, 517,90 μл) при кт в атмосфере N2. Смесь перемешивали и нагревали до 80°С в течение 8 ч с получением этил 2-[3-[(Z)-N-[(R)-трет-бутилсульфинил]-С-метил-карбонимидоил]фенил]-2-фторацетата (400 мг, выход 97,84%) в виде неочищенной смеси, которую использовали на следующем этапе без очистки. ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C16H23FNO3S: 328,13; полученное 328,1.
Этап 3.
[00670] В смесь этил 2-[3-[(Z)-N-трет-бутилсульфинил-С-метил-карбонимидоил]фенил]-2-фторацетата (400,00 мг, 1,22 ммоль) в ТГФ (5 мл) частями добавляли МеОН (39,15 мг, 1,22 ммоль, 49,44 μл) и LiBH4 (93,15 мг, 4,28 ммоль) при 0°С в атмосфере N2. Смесь перемешивали при кт в течение 30 мин. В смесь добавляли воду (2 мл) и перемешивали в течение 5 мин. Водную фазу экстрагировали EtOAc. Объединенную органическую фазу промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии с получением N-[(1R)-1-[3-(1-фтор-2-гидрокси-этил)фенил]этил]-2-метил-пропан-2-сульфинамида (220 мг, выход 62,66%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C14H23FNO2S: 288,14; полученное 288,1.
Этап 4.
[00671] Смесь N-[(1R)-1-[3-(1-фтор-2-гидрокси-этил)фенил]этил]-2-метил-пропан-2-сульфинамида (220 мг, 765,50 μмоль) в 4 М HCl/МеОН (4 мл) перемешивали при кт в течение 30 мин. Смесь концентрировали при пониженном давлении. К остатку добавляли насыщ. раствор NaOH/MeOH до рН=7, потом фильтровали и концентрировали при пониженном давлении. Неочищенный продукт растирали с ДХМ (1 мл) при кт в течение 5 мин, фильтрат концентрировали при пониженном давлении с получением 2-[3-[(1R)-1-аминоэтил]фенил]-2-фторэтанола (200 мг, неочищенный). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C10H15FNO: 184,11; полученное 184,1.
Этап 5.
[00672] В смесь (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (82,73 мг, 272,89 μмоль) и 2-[3-[(1R)-1-аминоэтил]фенил]-2-фторэтанола (100 мг, 545,79 μмоль) в n-BuOH (2 мл) одной частью добавляли ДИЭА (105,81 мг, 818,68 μмоль, 142,60 μл) при кт в атмосфере N2. Смесь перемешивали и нагревали до 100°С в течение 1 ч. Смесь фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[3-(1-фтор-2-гидрокси-этил)фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (35 мг, выход 27,15%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C21H26ClFN5O3: 450,16; полученное 450,1; 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,11 (шир. д, J=8,4 Гц, 1 Н) 7,32-7,41 (м, 3 Н) 7,24 (д, J=5,2 Гц, 1 Н) 5,42-5,57 (м, 1 Н) 5,28 -5,30 (м, 1 Н) 5,17-5,18 (м, 1 Н) 4,5-4,54 (м, 4 Н) 3,61-3,72 (м, 6 Н) 3,23-3,25 (м, 4 Н) 1,48 (д, J=7,2 Гц, 3 Н).
Пример 520. Синтез 2-хлор-N-[(1R)-1-[3-(циклопропиламино)фенил]этил]-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
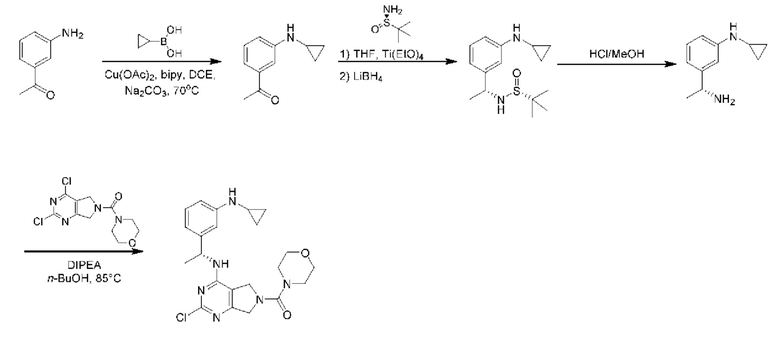
Этап 1.
[00673] В раствор циклопропилбороновой кислоты (6,36 г, 73,98 ммоль) и 1-(3-аминофенил)этанона (2 г, 14,80 ммоль) в ДХЭ (20 мл) добавляли бипиридин (2,31 г, 14,80 ммоль), Na2CO3 (3,14 г, 29,59 ммоль) и Cu(ОАс)2 (2,69 г, 14,80 ммоль). Смесь перемешивали при 70°С в течение 8 ч в атмосфере N2. После охлаждения до кт реакционную смесь фильтровали и добавляли в фильтрат воду. Водную фазу экстрагировали ДХМ, объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством силикагелевой хроматографии с получением 1-[3-(циклопропиламино)фенил]этанона (750 мг, выход 28,93%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C11H14NO: 176,10; полученное 176,1.
Этап 2.
[00674] Раствор 1-[3-(циклопропиламино)фенил]этанона (100 мг, 570,69 μмоль), 2-метилпропан-2-сульфинамида (138,34 мг, 1,14 ммоль) и Ti(OEt)4 (520,72 мг, 2,28 ммоль, 473,38 μл) в ТГФ (1 мл) перемешивали при 80°С в течение 4 ч. После охлаждения до 0°С добавляли LiBH4 (2 М, 285,34 μл) и перемешивали полученную в результате смесь в течение 1 ч при 0°С. Добавляли воду и фильтровали реакционную смесь. Водную фазу экстрагировали EtOAc, объединенные органические фазы промывали солевым раствором, сушили над безводным Na2SO4 и удаляли растворитель при пониженном давлении.
Неочищенный остаток очищали посредством препаративной TCX с получением N-[(1R)-1-[3-(циклопропиламино)фенил]этил]-2-метил-пропан-2-сульфинамида (60 мг, выход 37,49%).
Этап 3.
[00675] Раствор N-[(1R)-1-[3-(циклопропиламино)фенил]этил]-2-метил-пропан-2-сульфинамида (60 мг, 213,96 υ μoλ) в HCl/MeOH (4 M, 1 мл) перемешивали при 25°C в течение 0,5 ч. pH доводили до 7 с помощью насыщ. раствора NaOH/MeOH, растворитель удаляли при пониженном давлении, а неочищенный остаток перемешивали с ДХМ/МеОН (5:1, 5 мл) в течение 10 мин. После фильтрации растворитель удаляли при пониженном давлении с получением 3-[(1R)-аминоэтил]-N-циклопропил-анилина (44 мг, выход 86,34%). 1H ЯМР (400 МГц, Хлороформ-d) δ м.д. 7,14-7,18 (м, 1 H) 6,83 (с, 1 H) 6,73-6,78 (м, 2 H) 4,16-4,23 (м, 1 H) 3,81 (шир. д, J=0,8 Гц, 2 H) 3,49 (с, 1 H) 2,37-2,42 (м, 1 H) 1,58 (д, J=6,8 Гц, 3 H) 0,72-0,75 (м, 2 H) 0,48-0,50 (м, 2 H).
Этап 4.
[00676] B раствор (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (68,80 мг, 226,94 υ μoλ) в n-BuOH (1 мл) добавляли ДИЭА (293,30 мг, 2,27 ммоль, 395,29 μл) и 3-[(1R)-1-аминоэтил]-N-циклопропил-анилин (40 мг, 226,94 υ μoλ). Смесь перемешивали при 85°C в течение 10 ч. После охлаждения до кт растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[3-(циклопропиламино)фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (12 мг, выход 11,41%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C22H28ClN6O2: 443,19; полученное 443,3; 1H ЯМР (400 МГц, Хлороформ-d) δ м.д. 7,20 (т, J=7,6 Гц, 1 H) 6,72-6,77 (м, 3 H) 5,25-5,30 (м, 1 H) 4,87 (шир. с, 1 H) 4,56 (с, 4 H) 3,71-3,73 (м, 4 H) 3,32-3,34 (м, 4 H) 2,43-2,45 (м, 1 H) 1,59 (д, J=6,8 Гц, 3 H) 0,75-0,76 (м, 2 H) 0,51-0,53 (м, 2 H).
Пример 521. Синтез 2-хлор-N-{1-[4-(дифторметил)-3-фторпиридин-2-ил]этил}-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
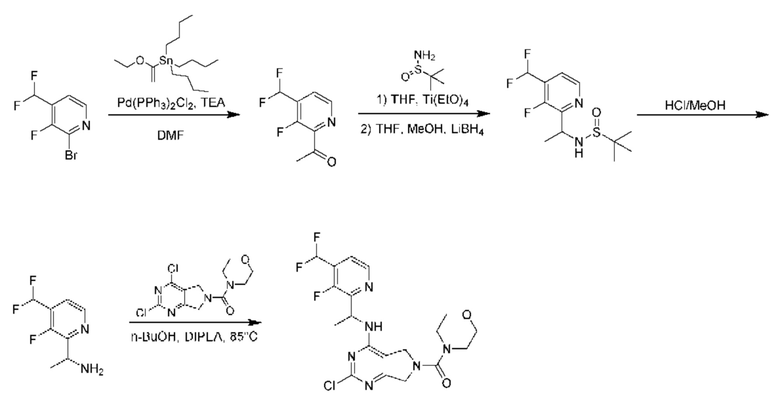
Этап 1.
[00677] B смесь 2-бром-4-(дифторметил)-3-фтор-пиридина (0,8 г, 3,54 ммоль) в ДМФ (5 мл) одной частью добавляли Pd(PPh3)2Cl2 (124,23 мг, 177,00 υ μoλ) и трибутил(1-этоксивинил)станнан (1,53 г, 4,25 ммоль, 1,43 мл) при 25°C в атмосфере N2. Смесь нагревали до 100°C и перемешивали в течение 2 ч. Добавляли водный CsF (10 мл) и перемешивали смесь в течение 10 мин. После фильтрации водную фазу экстрагировали EtOAc, объединенные органические фазы промывали солевым раствором, сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Добавляли водную HCl (2 M, 8,00 мл) и перемешивали смесь при 25°C в течение 1 ч. Добавляли воду и после экстракции EtOAc объединенные органические фазы промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением 1-[4-(дифторметил)-3-фтор-2-пиридил]этанона (0,4 г, выход 57,42%). 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 8,54-8,64 (м, 1H), 7,82-7,84 (т, J=4,4 Гц, 1H), 7,13 (т, J=54,0 Гц, 1H), 2,68 (с, 3Н).
Этап 2.
[00678] B смесь 1-[4-(дифторметил)-3-фтор-2-пиридил]этанона (400 мг, 2,11 ммоль) в ТГФ (5 мл) добавляли Ti(OEt)4 (1,93 г, 8,46 ммоль, 1,75 мл) и 2-метилпропан-2-сульфинамид (512,65 мг, 4,23 ммоль) при 25°С в атмосфере N2. Смесь перемешивали при 80°C в течение 2 ч. После охлаждения до 0°С, добавляли LiBH4 (184,28 мг, 8,46 ммоль) и MeOH (67,76 мг, 2,11 ммоль, 85,58 μл) и перемешивали реакционную смесь при 0°C в течение 1 ч. Смесь вливали в ледяную воду и экстрагировали водную фазу EtOAc. Объединенные органические фазы промывали солевым раствором и сушили над безводным Na2SO4. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением N-[1-[4-(дифторметил)-3-фтор-2-пиридил]этил]-2-метил-пропан-2-сульфонамида (0,470 г, выход 75,50%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C12H18F3N2SO: 294,10; полученное 295,1.
Этап 3.
[00679] B раствор N-[1-[4-(дифторметил)-3-фтор-2-пиридил]этил]-2-метил-пропан-2-сульфинамида (0,180 г, 611,55 υ μoλ) в MeOH (7 мл) добавляли HCl/MeOH (4 M, 305,77 μл) и перемешивали реакционную смесь при 25°C в течение 0,5 ч. Растворитель удаляли при пониженном давлении, а неочищенный остаток растворяли в MeOH (4 мл) и доводили до pH=7 с помощью насыщ. раствора NaOH/MeOH. Растворитель удаляли при пониженном давлении, а остаток растворяли в ДХМ:MeOH (5:1, 5 мл). Смесь фильтровали и концентрировали с получением 1-[4-(дифторметил)-3-фтор-2-пиридил]этанамина (50 мг, выход 42,99%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C8H10F3N2: 191,07; полученное 191,1.
Этап 4.
[00680] B смесь 1-[4-(дифторметил)-3-фтор-2-пиридил]этанамина (100 мг, 525,86 μмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (191,29 мг, 631,03 μмоль) в n-BuOH (2 мл) добавляли ДИЭА (339,82 мг, 2,63 ммоль, 457,98 μл). Потом смесь нагревали до 80°C и перемешивали в течение 2 ч в атмосфере N2. После удаления растворителя при пониженном давлении неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[1-[4-(дифторметил)-3-фтор-2-пиридил]этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (70 мг, выход 28,70%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C19H21ClF3N6O4: 456,13; полученное 457,2; 1H ЯМР (400 МГц, Метанол-d) δ м.д. 8,46 (д, J=4,8 Гц, 1H), 7,52 (т, J=5,2 Гц, 1H), 7,10 (т, J=54 Гц, 1H), 5,66-5,72 (м, 1H), 4,65 (с, 2H), 4,54 (д, J=1,6 Гц, 2H), 3,71-3,73 (м, 4H), 3,34-3,37 (м, 4H), 1,60 (д, J=7,2 Гц, 3Н).
Пример 522. Синтез 2-хлор-N-[(1R)-1-[2-хлор-3-(дифторметил)фенил]этил]-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
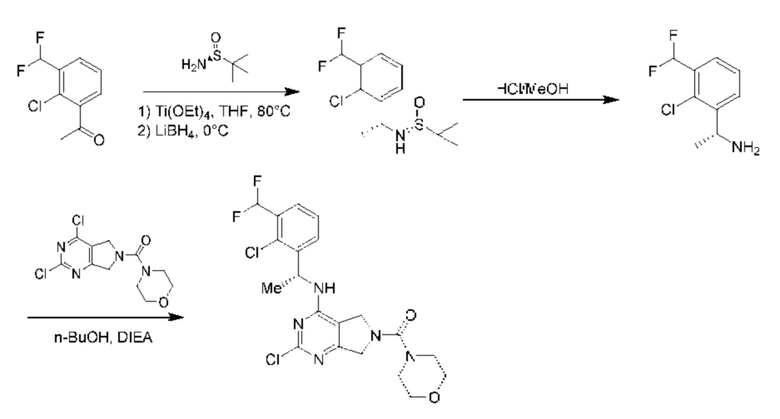
Этап 1.
[00681] Смесь 1-[2-хлор-3-(дифторметил)фенил]этанона (250 мг, 1,22 ммоль), 2-метилпропан-2-сульфинамида (296,19 мг, 2,44 ммоль) и Ti(OEt)4 (1,11 г, 4,89 ммоль, 1,01 мл) в ТГФ (2 мл) перемешивали при 80°C в течение 4 ч. После охлаждения до 0°C добавляли LiBH4 (2 M, 610,95 μл) и перемешивали реакционную смесь в течение 1 ч при 0°С. Добавляли воду и экстрагировали смесь EtOAc. Объединенные органические фазы промывали солевым раствором, сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[2-хлор-3-(дифторметил)фенил]этил]-2-метил-пропан-2-сульфинамида (160 мг, выход 53,33%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C13H19ClF2NOS: 310,08; полученное 310,1.
Этап 2.
[00682] Раствор N-[(1R)-1-[2-хлор-3-(дифторметил)фенил]этил]-2-метил-пропан-2-сульфинамида (150 мг, 484,18 μмоль) в HCl/MeOH (1,3 мл, 4 M) перемешивали при 25°C в течение 0,5 ч. pH доводили до 7 с помощью насыщ. раствора NaOH/MeOH. Растворитель удаляли при пониженном давлении, а остаток перемешивали с ДХМ/МеОН (10:1) (4 мл) в течение 10 мин и потом фильтровали. Растворитель удаляли при пониженном давлении с получением (1R)-1-[2-хлор-3-(дифторметил)фенил]этанамина (62 мг, выход 62,27%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C9H11ClF2N: 206,05; полученное 206,1.
Этап 3.
[00683] B раствор (1R)-1-[2-хлор-3-(дифторметил)фенил]этанамин (62,00 мг, 301,51 μмоль) в n-BuOH (0,6 мл) добавляли ДИЭА (311,74 мг, 2,41 ммоль, 420,13 μл) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанон (100,54 мг, 331,66 μмоль). Смесь перемешивали при 85°C в течение 10 ч. После охлаждения до кт растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[2-хлор-3-(дифторметил)фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (61 мг, выход 42,54%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C20H22Cl2F2N5O2: 472,10; полученное 472,1; 1H ЯМР (400 МГц, Метанол-d) δ м.д. 7,57-7,60 (м, 2 H) 7,40-7,44 (м, 1 H) 7,11 (т, J=54,8 Гц, 1 H) 5,72-5,73 (м, 1 H) 4,66 (м, 2 H) 4,57 (м, 2 H) 3,72-3,74 (м, 4 H) 3,35-3,37 (м, 4 H) 1,57 (д, J=7,2 Гц, 3 H).
Пример 523. Синтез 2-хлор-N-[(1R)-1-(4,4-дифтор-3,4-дигидро-1Н-2-бензопиран-8-ил)этил]-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
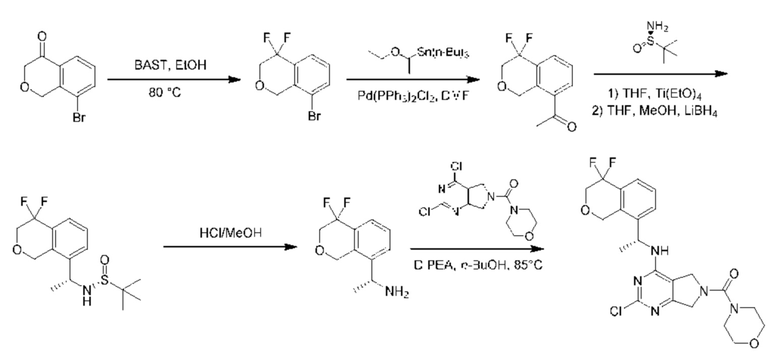
Этап 1.
[00684] B раствор 8-бромизохроман-4-она (200 мг, 880,85 μмоль) в BAST (2 мл) добавляли EtOH (4,06 мг, 88,08 μмоль, 5,15 μл). Смесь перемешивали при 80°C в течение 2 ч. После охлаждения до кт добавляли воду и экстрагировали смесь EtOAc. Объединенную органическую фазу промывали солевым раствором и сушили над безводным Na2SO4. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением соединения 8-бром-4,4-дифторизохромана (400 мг, выход 91,17%). 1H ЯМР (400 МГц, Метаноле) δ м.д. 7,69 (д, J=7,6 Гц, 2H), 7,36 (т, J=8,0 Гц, 1H), 4,77 (с, 2H), 4,06-4,11 (м, 2H).
Этап 2.
[00685] B раствор 8-бром-4,4-дифторизохромана (0,4 г, 1,61 ммоль) и трибутил(1-этоксивинил)станнана (696,05 мг, 1,93 ммоль, 650,51 μл) в ДМФ (4 мл) добавляли Pd(PPh3)2Cl2 (56,37 мг, 80,30 μмоль). Смесь перемешивали при 100°C в течение 2 ч в атмосфере N2. Добавляли водный CsF (5 мл) и перемешивали смесь в течение 10 мин. Водную фазу экстрагировали EtOAc. Объединенные органические фазы промывали солевымраствором, сушили над Na2SO4, арастворитель удаляли при пониженном давлении с получением 8-(1-этоксивинил)-4,4-дифторизохромана (1 г, неочищенный), который использовали без дополнительной очистки. ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C13H15F2O2: 241,10; полученное 241,0.
Этап 3.
[00686] Раствор 8-(1-этоксивинил)-4,4-дифторизохромана (1 г, 4.16 ммоль) в 2 H HCl (10 мл) перемешивали при 25°C в течение 1 ч. Смесь экстрагировали EtOAc, а объединенную органическую фазу промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии (SiO2, петролейный эфир: EtOAc=от 100:1 до 0:1) с получением 1-(4,4-дифторизохроман-8-ил)этанона (90 мг, выход 10,19%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C11H11F2O2: 213,1; полученное 213,2.
Этап 4.
[00687] B смесь 1-(4,4-дифторизохроман-8-ил)этанона (90 мг, 424,14 μмоль) и 2-метилпропан-2-сульфинамида (102,81 мг, 848,29 μмоль) в ТГФ (1 мл) добавляли Ti(OEt)4 (387,00 мг, 1,70 ммоль, 351,82 μл) при 25°С. Смесь перемешивали при 80°C в течение 1 ч. После охлаждения до 0°C в смесь добавляли MeOH (13,59 мг, 424,14 μмоль, 17,16 μл) и LiBH4 (36,96 мг, 1,70 ммоль) при 0°С. Смесь перемешивали при 25°C в течение 1 ч. Добавляли воду и экстрагировали смесь EtOAc. Объединенные органические фазы промывали солевым раствором, сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством колоночной хроматографии с получением соединения N-[(1R)-1-(4,4-дифторизохроман-8-ил)этил]-2-метил-пропан-2-сульфинамида (40 мг, выход 29,71%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C15H22F2NO2S: 318,13; полученное 318,2.
Этап 5.
[00688] B раствор N-[(1R)-1-(4,4-дифторизохроман-8-ил)этил]-2-метил-пропан-2-сульфинамида (40 мг, 126,03 μмоль) в MeOH (2 мл) добавляли HCl/MeOH (4 M, 63,01 μл). Смесь перемешивали при 25°C в течение 1 ч. Растворитель удаляли при пониженном давлении, а остаток разводили в MeOH (2 мл). pH доводили до pH=7 с помощью насыщ. раствора NaOH/MeOH. Потом смесь концентрировали и перерастворяли в смеси ДХМ и MeOH (5:1, 5 мл). После фильтрации растворитель удаляли при пониженном давлении с получением (1R)-1-(4,4-дифторизохроман-8-ил)этанамина (40 мг, неочищенный). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C11H14F2NO: 214,1; полученное 214,2.
Этап 6.
[00689] B раствор (1R)-1-(4,4-дифторизохроман-8-ил)этанамина (40 мг, 187,60 μмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (68,24 мг, 225,12 μмоль) в n-BuOH (1 мл) добавляли ДИЭА (242,46 мг, 1,88 ммоль, 326,76 μл). Смесь перемешивали при 85°C в течение 1 ч. После охлаждения до кт растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-(4,4-дифторизохроман-8-ил)этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (23 мг, выход 25,16%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C22H25ClF2N5O3: 480,15; полученное 480,2; 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 7,53-7,58 (м, 1H), 7,37-7,42 (м, 1H), 5,36 (д, J=15,2 Гц, 1H), 5,15-5,20 (м, 1H), 4,97 (д, J=15,6 Гц, 1H), 4,54-4,61 (м, 4H), 4,03-4,12 (м, 2H), 3,70-3,73 (м, 4H), 3,33-3,36 (м, 4H), 1,54 (д, J=6,8 Гц, 3Н).
Пример 524. Синтез 2-хлор-N-[(1R)-1-[3-(циклопропоксидифторметил)фенил]этил]-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
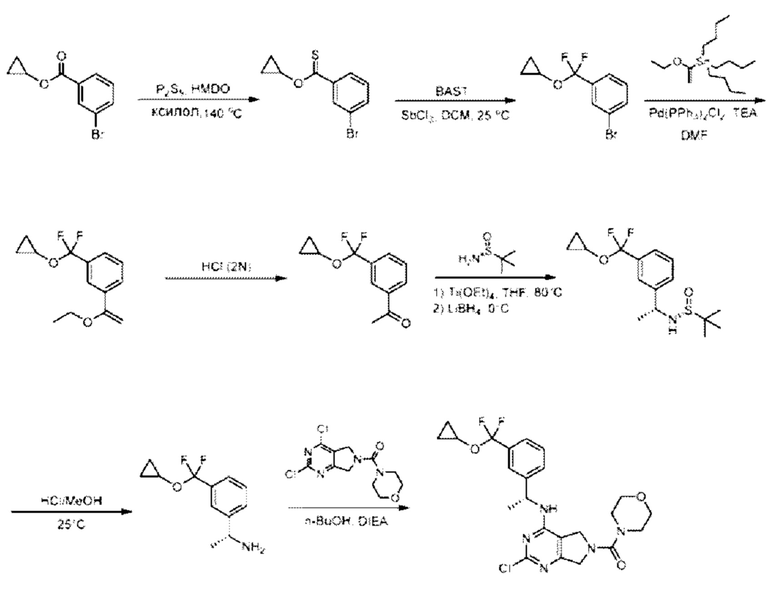
Этап 1.
[00690] P2S5 (1,01 г, 4,56 ммоль, 485,26 μл) и триметил(триметилсилокси)силан (2,96 г, 18,25 ммоль, 3,88 мл) добавляли в раствор циклопропил 3-бромбензоата (4,4 г, 18,25 ммоль) в XYLENE (44 мл) и перемешивали раствор при 140°C в течение 12 ч. Реакционную смесь охлаждали до 0°С, вливали в водн. K2CO3 и экстрагировали МТБЭ. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством колоночной хроматографии на силикагеле с получением О-циклопропил 3-бромбензолкарботиоата (3,2 г, вьгход 68,18%). 1Н ЯМР (400 МГц, CDCl3) δ м.д. 8,27 (т, J=2,0 Гц, 1H), 8,10 (т, J=8,0 Гц, 1H), 7,68 (т, J=7,2 Гц, 1H), 7,30 (т, J=4,0 Гц, 1H), 4,78-4,80 (м, 1H), 0,99-1,02 (м, 4H).
Этап 2.
[00691] SbCl3 (47,90 мг, 210,00 μмоль) и 2-метокси-N-(2-метоксиэтил)-N-(трифтор-сульфанил)этанамин (650,44 мг, 2,94 ммоль, 644,00 μл) добавляли в раствор О-циклопропил 3-бромбензолкарботиоата (0,54 г, 2,10 ммоль) в ДХМ (6 мл). Раствор перемешивали при 25°С в течение 2 ч. Реакционную смесь вливали в воду и экстрагировали ДХМ. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством колоночной хроматографии на силикагеле (петролейный эфир:EtOAc=от 1:0 до 0:1) с получением 1-бром-3-[циклопропокси(дифтор)метил]бензола (0,5 г, 90,50%). 1H ЯМР (400 МГц, CDCl3) δ м.д. 7,74 (с, 1H), 7,60 (д, J=8,0 Гц, 1H), 7,53 (д, J=8,0 Гц, 1H), 7,30 (т, J=8,0 Гц, 1H), 3,91-3,94 (м, 1H), 0,84-0,88 (м, 2H), 0,67-0,72 (м, 2H).
Этап 3.
[00692] B смесь 1-бром-3-[циклопропокси(дифтор)метил]бензола (0,4 г, 1,52 ммоль) в ДМФ (4 мл) добавляли Pd(PPh3)2Cl2 (53,36 мг, 76,02 μмоль) и трибутил(1-этоксивинил)станнан (658,94 мг, 1,82 ммоль, 615,83 μл). Смесь нагревали до 100°C и перемешивали в атмосфере N2 в течение 2 ч. Добавляли насыщенный водный CsF и перемешивали смесь в течение 10 мин. Водную фазуэкстрагировали МТБЭ, объединенную органическую фазу промывали солевым раствором, сушили над Na2SO4 и удаляли растворитель при пониженном давлении с получением 1-[циклопропокси(дифтор)метил]-3-(1-этоксивинил)бензола(0,75 г, неочищенный). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C14H17F2O2: 255,12; полученное 255,2.
Этап 4.
[00693] Раствор 1-[циклопропокси(дифтор)метил]-3-(1-этоксивинил)бензола(0,75 г, 2,95 ммоль) в водн. HCl (2 M, 7,50 мл) перемешивали при 20°C в течение 1 ч. Смесь вливали в воду и экстрагировали EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством колоночной хроматографии на силикагеле с получением 1-[3-[циклопропокси(дифтор)метил]фенил]этанона(0,13 г, выход 19,48%). 1H ЯМР (400 МГц, CDCl3) δ м.д. 8,17 (с, 1H), 8,06 (д, J=7,6 Гц, 1H), 7,80 (д, J=7,6 Гц, 1H), 7,54 (т, J=7,6 Гц, 1H), 3,95-3,97 (м, 1H), 2,64 (с, 3H), 0,86-0,95 (м, 2H), 0,70-0,73 (м, 2H).
Этап 5.
[00694] B смесь 1-[3-[циклопропокси(дифтор)метил]фенил]этанона (100 мг, 442,05 μмоль) и (R)-2-метилпропан-2-сульфинамида (107,15 мг, 884,10 μмоль) в ТГФ (2 мл) добавляли Ti(OEt)4 (403,34 мг, 1,77 ммоль, 366,67 μл). Потом смесь перемешивали при 70°C в течение 3 ч. После охлаждения до 0°C добавляли MeOH (14,16 мг, 442,05 μмоль, 17,89 μл) и LiBH4 (38,52 мг, 1,77 ммоль, 1,50 мл) и перемешивали смесь при 0°C в течение 1 ч. Добавляли воду и экстрагировали смесь EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством препаративной TCX с получением N-[(1R)-1-[3-[циклопропокси(дифтор)метил]фенил]этил]-2-метил-пропан-2-сульфинамида (0,12 г, выход 81,91%). 1H ЯМР (400 МГц, CDCl3) δ м.д. 7,56 (с, 1H), 7,52 (д, J=7,6 Гц, 1H), 7,47 (д, J=8,0 Гц, 1H), 7,41 (т, J=7,2 Гц, 1H), 4,58-4,61 (м, 1H), 3,92-3,94 (м, 1H), 3,41 (с, 1H), 1,53 (д, J=6,4 Гц, 3H), 1,25 (с, 9H), 0,85-0,88 (м, 2H), 0,68-0,70 (м, 2H).
Этап 6.
[00695] HCl/MeOH (4 M, 181,04 μл) добавляли в раствор N-[(1R)-1-[3-[циклопропокси(дифтор)метил]фенил]этил]-2-метил-пропан-2-сульфинамида (0,12 г, 362,08 μмоль) в MeOH (2,4 мл). Раствор перемешивали при 20°C в течение 2 ч. pH смеси доводили до 8 с помощью NaOH в MeOH. Растворитель удаляли при пониженном давлении, а остаток добавляли в раствор 6 мл (MeOH:ДХМ=1:5). Суспензию перемешивали при 20°C в течение 10 мин, а растворитель удаляли при пониженном давлении с получением (1R)-1-[3-[циклопропокси(дифтор) метил]фенил]этанамина (0,1 г, неочищенный). 1H ЯМР (400 МГц, CDCl3) δ м.д. 8,61 (шир. с, 2H), 7,68 (с, 1H), 7,64 (д, J=8,0 Гц, 1H), 7,57 (д, J=8,0 Гц, 1H), 7,42 (т, J=7,6 Гц, 1H), 4,39-4,46 (м, 1H), 3,91-3,93 (м, 1H), 1,66 (д, J=6,8 Гц, 3H), 0,83-0,87 (м, 2H), 0,63-0,68 (м, 2H).
Этап 7.
[00696] B раствор (1R)-1-[3-[циклопропокси(дифтор)метил]фенил]этанамина (0,1 г, 440,04 μмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (160,08 мг, 528,05 рмоль) в n-BuOH (2 мл) добавляли ДИЭА (284,36 мг, 2,20 ммоль, 383,24 μл). Смесь перемешивали при 100°C в течение 3 ч. После охлаждения до кт смесь вливали в воду и экстрагировали EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[3-[циклопропокси(дифтор)метил]фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (63 мг, выход 25,56%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C23H27ClF2N5O3: 494,17; полученное 494,3; 1H ЯМР (400 МГц, CDCl3) δ м.д. 7,60 (с, 1H), 7,53 (д, J=8,0 Гц, 1H), 7,48 (д, J=7,2 Гц, 1H), 7,42 (т, J=8,0 Гц, 1H), 5,45-5,46 (м, 1H), 4,87-4,88 (м, 1H), 4,57-4,59 (м, 4H), 3,92-3,95 (м, 1H), 3,73 (т, J=4,8 Гц, 4H), 3,34 (т, J=4,8 Гц, 4H), 1,63 (д, J=7,2 Гц, 3 H), 0,844),88 (м, 2H), 0,66-0,71 (м, 2H).
Пример 525. Синтез N-[(1R)-1-[3-(2-амино-1,1-дифторэтил)фенил]этил]-2-хлор-6-(4-метоксиоксан-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримвдин-4-амина
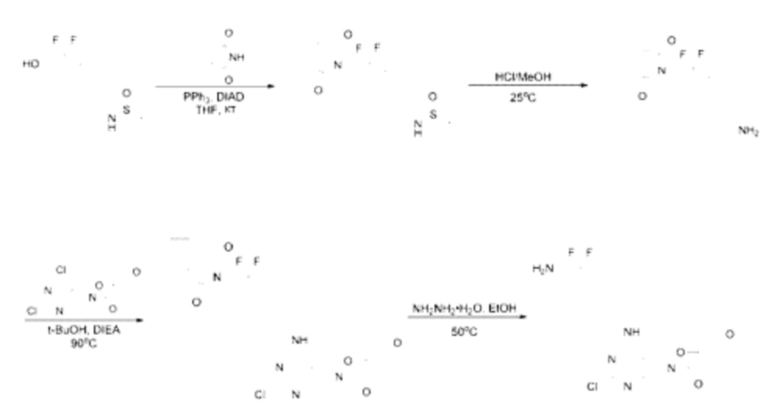
Этап 1.
[00697] B раствор N-[(1R)-1-[3-(1,1-дифтор-2-гидрокси-этил)фенил]этил]-2-метил-пропан-2-сульфинамида (2 г, 6,55 ммоль) и изоиндолин-1,3-диона (1,93 г, 13,10 ммоль) в ТГФ (20 мл) по каплям добавляли PPh3 (3,44 г, 13,10 ммоль) и ДИАД (2,65 г, 13,10 ммоль, 2,55 мл) при -78°С. Реакционную смесь перемешивали при 25°C в течение 12 ч, растворитель удаляли при пониженном давлении, а остаток растворяли в H2O и экстрагировали EtOAc. Объединенные органические слои промывали солевым раствором и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-[2-(1,3-диоксоизоиндолин-2-ил)-1,1-дифторэтил]фенил]этил]-2-метилпропан-2-сульфинамида (380 мг, выход 12%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C22H25F2N2O3S: 435,1; полученное 435,2.
Этап2.
[00698] Враствор N-[(1R)-1-[3-[2-(1,3-диоксоизоиндолин-2-ил)-1,1-дифторэтил]фенил]этил]-2-метилпропан-2-сульфинамида (350 мг, 805,53 μмоль) в MeOH (3,5 мл) добавляли HCl/MeOH (4 M, 402,76 μл). Смесь перемешивали при 25°C в течение 2 ч и потом доводили до pH=7~8 с помощью насыщ. NaOH/MeOH. Растворитель удаляли при пониженном давлении с получением 2-[2-[3-[(1R)-1-аминоэтил]фенил]-2,2-дифторэтил]изоиндолин-1,3-диона (266 мг, неочищенный), который использовали без дополнительной очистки. ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C18H17F2N2O2: 331,1; полученное 331,2.
Этап 3.
[00699] B раствор 2-[2-[3-[(1R)-1-аминоэтил]фенил]-2,2-дифторэтил]изоиндолин-1,3-диона (266 мг, 805,26 μмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-(4-метокситетрагидропиран-4-ил)метанона (267,49 мг, 805,26 μмоль) в t-BuOH (1 мл) добавляли ДИЭА (1,04 г, 8,05 ммоль, 1,40 мл). Реакционную смесь перемешивали при 90°C в течение 8 ч, охлаждали до кт и удаляли растворитель при пониженном давлении. Остаток разводили H2O и экстрагировали EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Неочищенный остаток очищали посредством колоночной хроматографии с получением 2-[2-[3-[(1R)-1-[[2-хлор-6-(4-метокситетрагидропиран-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]фенил]-2,2-дифторэтил]изоиндолин-1,3-диона (260 мг, выход 51,57%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C31H31ClF2N5O5: 626,2; полученное 626,4.
Этап 4.
[00700] B раствор 2-[2-[3-[(1R)-1-[[2-хлор-6-(4-метокситетрагидропиран-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]фенил]-2,2-дифторэтил]изоиндолин-1,3-диона (100 мг, 159,73 μмоль) в EtOH (0,5 мл) добавляли NH2NH2⋅H2O (8,00 мг, 159,73 μмоль, 7,76 μл). Смесь перемешивали при 50°C в течение 2 ч. Добавляли воду и смесь напрямую очищали посредством препаративной ВЭЖХ с получением [4-[[(1R)-1-[3-(2-амино-1,1-дифторэтил)фенил]этил]амино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-(4-метокситетрагидропиран-4-ил)метанона (10 мг, выход 12,62%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C23H29ClF2N5O3: 496,2; полученное 496,2; 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 7,58 (с, 1 H) 7,52 (д, J=7,2 Гц, 1 H) 7,39-7,46 (м, 2 H) 5,40-5,43 (м, 1 H) 4,96 (с, 1 H) 4,87 (с, 1 H) 4,61 (д, J=16,4 Гц, 2 H) 3,76-3,77 (м, 4 H) 3,16-3,27 (м, 5 H) 1,92-2,10 (м, 4 H) 1,59 (д, J=7,2 Гц, 3 H).
Пример 526. Синтез N-[(1R)-1-[3-(2-амино-1,1-дифторэтил)-2-фторфенил]этил]-2-хлор-6-(4-метоксиоксан-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина
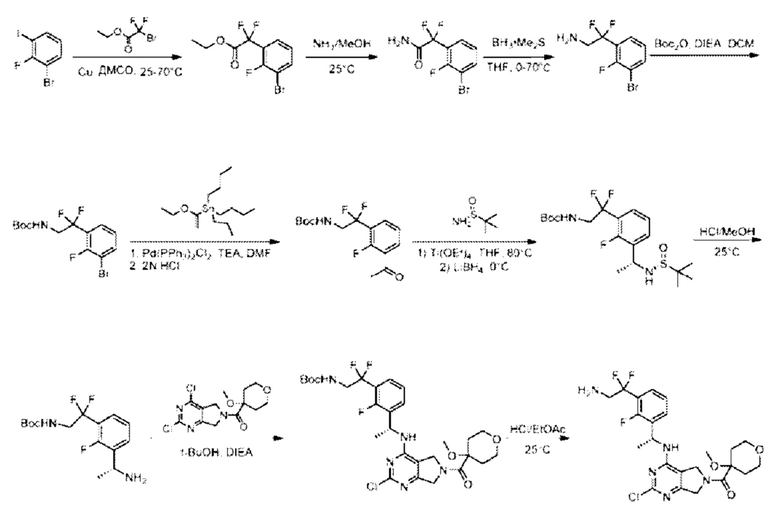
Этап 1.
[00701] B раствор этил 2-бром-2,2-дифторацетата (10,12 г, 49,85 ммоль, 6,40 мл) в ДМСО (70 мл) добавляли Cu (3,80 г, 59,82 ммоль, 424,27 μл) при 25°С. Реакционную смесь перемешивали при 25°C в течение 1 ч, после чего добавляли 1-бром-2-фтор-3-йод-бензол (6 г, 19,94 ммоль). Полученную в результате реакционную смесь экстрагировали при 70°C в течение 3 ч. Реакционную смесь оставляли охлаждаться до комнатной температуры и потом разводили H2O (60 мл). Смесь фильтровали и экстрагировали раствор EtOAc. Объединенную органическую фазу промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Полученный в результате остаток очищали посредством силикагелевой хроматографии с получением этил 2-(3-бром-2-фтор-фенил)-2,2-дифторацетата (4,8 г, выход 81,03%). 1H ЯМР (400 МГц, CDCl3) δ м.д. 7,68-7,72 (м, 1 H) 7,59 (т, J=6,4 Гц, 1 H) 7,15 (т, J=8,0 Гц, 1 H) 4,37 (кв, J=7,2 Гц, 2 H) 1,34 (т, J=7,2 Гц, 3 H).
Этап2.
[00702] Раствор этил 2-(3-бром-2-фтор-фенил)-2,2-дифторацетата (4,8 г, 16,16 ммоль) в 5 M NH3/MeOH (50 мл) перемешивали при 25°C в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении с получением 2-(3-бром-2-фтор-фенил)-2,2-дифторацетамида (4,2 г, выход 96,98%). 1H ЯМР (400 МГц, CDCl3) δ м.д. 7,70 (т, J=7,2 Гц, 1 H) 7,62 (т, J=6,8 Гц, 1 H) 7,15 (т, J=7,6 Гц, 1 H) 6,25 (шир. д, J=205,6 Гц, 2 H)
Этап 3.
[00703] Метилсульфид бора (10 M, 10,97 мл) по каплям добавляли в раствор 2-(3-бром-2-фтор-фенил)-2,2-дифторацетамида (4,2 г, 15,67 ммоль) в ТГФ (42 мл) при 0°С. Реакционную смесь перемешивали при 0°C в течение 0,5 ч. Потом смесь перемешивали при 70°C в течение 10 ч. Реакционную смесь охлаждали до 25°C и гасили добавлением по каплям 2 H HCl (50 мл) до доведения pH до pH=9. Смесь экстрагировали EtOAc и промывали солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Полученный в результате остаток очищали посредством силикагелевой хроматографии с получением 2-(3-бром-2-фтор-фенил)-2,2-дифторэтанамина (2,5 г, выход 62,80%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C8H8BrF3N: 253,97; полученное 254,0.
Этап 4.
[00704] B раствор 2-(3-бром-2-фтор-фенил)-2,2-дифторэтанамина (2,4 г, 9,45 ммоль) в ТГФ (25 мл) добавляли ДИПЭА (2,44 г, 18,89 ммоль, 3,29 мл) и Boc2O (2,06 г, 9,45 ммоль, 2,17 мл). Смесь перемешивали при 25°C в течение 3 ч. Реакционную смесь разводили водой и потом экстрагировали EtOAc. Объединенные органические слои промывали насыщенным водным раствором NaCl (30 мл), сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением трет-бутил N-[2-(3-бром-2-фтор-фенил)-2,2-дифторэтил]карбамата (3,0 г, выход 84,28%, чистота 94%). 1H ЯМР (400 МГц, CDCl3) δ м.д. 7,65 (т, J=6,4 Гц, 1 H) 7,47 (т, J=6,8 Гц, 1 H) 7,09 (т, J=7,6 Гц, 1 H) 4,83-4,85 (м, 1 H) 3,82-3,90 (м, 2 H) 1,36 (с, 9 H)
Этап 5.
[00705] B раствор трет-бутил N-[2-(3-бром-2-фтор-фенил)-2,2-дифторэтил]карбамата (3,0 г, 8,47 ммоль) в ДМФ (40 мл) одной частью добавляли Pd(PPh3)2Cl2 (297,28 мг, 423,53 μмоль) и трибутил(1-этоксивинил)станнан (4,28 г, 11,86 ммоль, 4,00 мл) при 20°C в атмосфере N2. Смесь нагревали до 100°C в течение 2 ч. Добавляли насыщенный CsF (50 мл), а полученную в результате смесь перемешивали в течение 10 мин и потом фильтровали. Водную фазу экстрагировали EtOAc. Объединенную органическую фазу промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Потом в смесь добавляли 1 H водный раствор HCl (40 мл). Реакционную смесь перемешивали при 25°C в течение 2 ч. Смесь экстрагировали EtOAc. Объединенную органическую фазу промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Оставшийся остаток очищали посредством колоночной хроматографии с получением трет-бутил N-[2-(3-ацетил-2-фтор-фенил)-2,2-дифторэтил]карбамата (1,65 г, выход 61,39%). 1H ЯМР (400 МГц, CDCl3) δ м.д. 7,90-8,10 (м, 1 H) 7,69-7,72 (м, 1 H) 7,28-7,30 (м, 1 H) 7,85-7,87 (м, 1 H) 3,88-3,97 (м, 2 H) 2,68 (д, J=5,6 Гц, 3 H) 1,33 (с, 9 H)
Этап 6.
[00706] B раствор трет-бутил N-[2-(3-ацетил-2-фтор-фенил)-2,2-дифторэтил]карбамата (300 мг, 945,47 μмоль) и 2-метилпропан-2-сульфинамида (229,18 мг, 1,89 ммоль) в ТГФ (4 мл) добавляли Ti(OEt)4 (862,68 мг, 3,78 ммоль, 784,25 μл). Смесь перемешивали при 80°C в течение 4 ч. Потом реакционную смесь охлаждали до 0°C и добавляли в смесь LiBH4 (20,60 мг, 945,47 μмоль, 472,73 μл). Реакционную смесь перемешивали при 0°C в течение 1 ч. Реакционную смесь разводили водой (2 мл) и фильтровали. Полученный в результате фильтрат экстрагировали EtOAc. Объединенную органическую фазу промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали посредством силикагелевой хроматографии с получением трет-бутил N-[2-[3-[(1R)-1-[[((R)-трет-бутилсульфинил]амино]этил]-2-фтор-фенил]-2,2-дифторэтил]карбамата (120 мг, выход 30,04%). 1H ЯМР (400 МГц, CDCl3) δ м.д. 7,45-7,50 (м, 2 H) 7,10-7,22 (м, 1 H) 4,81-4,85 (м, 1 H) 3,84-3,95 (м, 2 H) 1,56 (д, J=6,8 Гц, 3 H) 1,35 (с, 9 H) 1,24 (с, 9 H)
Этап 7.
[00707] B раствор трет-бутил N-[2-[3-[(1R)-1-[[(R)-трет-бутилсульфинил]амино]этил]-2-фтор-фенил]-2,2-дифторэтил]карбамата (120 мг, 284,02 μмоль) в MeOH (1 мл) добавляли HCl/MeOH (4 M, 142,01 μл). Смесь перемешивали при 25°C в течение 2 ч. Потом доводили pH до 7 добавлением насыщ. раствора NaOH/MeOH. Полученную в результате смесь концентрировали в вакууме. Оставшийся остаток перемешивали с ДХМ/МеОН (5:1) (5 мл) в течение 10 мин, потом фильтровали и концентрировали в вакууме с получением трет-бутил N-[2-[3-[(1R)-1-аминоэтил]-2-фтор-фенил]-2,2-дифторэтил]карбамата (90 мг, 282,72 μмоль, выход 99,54%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C15H22F3N2O2: 319,16; полученное 319,2.
Этап 8.
[00708] B раствор трет-бутил N-[2-[3-[(1R)-1-аминоэтил]-2-фтор-фенил]-2,2-дифторэтил]карбамата (90 мг, 282,72 μмоль) в n-BuOH (1 мл) добавляли (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-(4-метокситетрагидропиран-4-ил)метанон (103,31 мг, 310,99 μмоль) и ДИЭА (146,16 мг, 1,13 ммоль, 196,98 μл). Смесь перемешивали при 80°C в течение 2 ч. Реакционную смесь гасили водой (1 мл) и потом экстрагировали EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Полученный в результате остаток очищали посредством колоночной хроматографии с получением трет-бутил N-[2-[3-[(1R)-1-[[2-хлор-6-(4-метокситетрагидропиран-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]-2-фтор-фенил]-2,2-дифторэтил]карбамата (120 мг, выход 69,12%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C28H36ClF3N5O5: 614,24; полученное 614,3; RT=0,859 мин, 1H ЯМР (400 МГц, MeOH) δ м.д. 7,52 (м, 1 H) 7,41 (м, 1 H) 7,18 (м, 1 H) 5,57-5,60 (м, 1 H) 4,90-5,00 (м, 2 H) 4,56-4,67 (м, 2 H) 3,65-3,77 (м, 6 H) 3,24 (д, J=14,8 Гц, 3 H) 2,04-2,10 (м, 2 H) 1,86-1,96 (м, 2 H) 1,60-1,63 (м, 3 H) 1,22 (с, 9 H)
Этап 9.
[00709] B раствор трет-бутил N-[2-[3-[(1R)-1-[[2-хлор-6-(4-метокситетрагидропиран-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]-2-фтор-фенил]-2,2-дифторэтил]карбамата (120 мг, 195,42 μмоль) в EtOAc (1 мл) добавляли HCl/EtOAc (4 M, 97,71 μл). Реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении, а полученный в результате остаток очищали посредством препаративной ВЭЖХ с получением [4-[[(1R)-1-[3-(2-амино-1,1-дифторэтил)-2-фтор-фенил]этил]амино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-(4-метокситетрагидропиран-4-ил)метанона (38 мг, выход 37,59%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C23H28ClF3N5O3: 514,18; полученное 514,3; 1H ЯМР (400 МГц, CDCl3) δ м.д. 7,45-7,51 (м, 2 H) 7,19-7,24 (м, 1 H) 5,58-5,60 (м, 1 H) 4,87-5,12 (м, 1 H) 4,84 (д, J=15,6 Гц, 2 H) 4,67 (д, J=23,6 Гц, 2 H) 3,72-3,82 (м, 4 H) 3,33 (т, J=16,0 Гц, 2 H) 3,23 (д, J=24,0 Гц, 3 H) 2,09-2,18 (м, 2 H) 1,85-1,93 (м, 2 H) 1,65 (д, J=7,2 Гц, 3 H)
Пример 527. Синтез 2-хлор-N-[(1R)-1-[2-фтор-3-(фторметил)фенил]этил]-6-(морфолин-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина
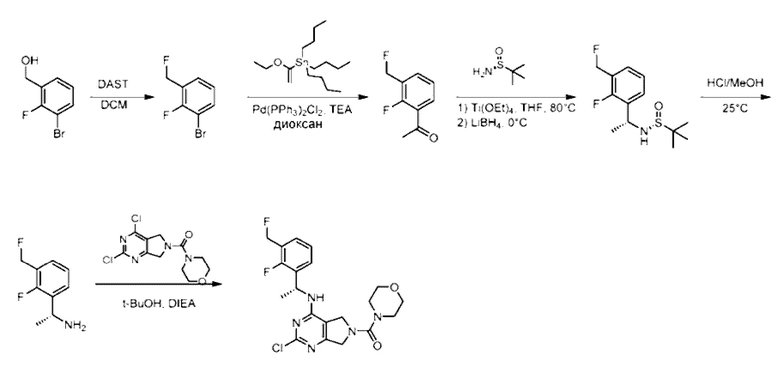
Этап 1.
[00710] B раствор (3-бром-2-фтор-фенил)метанола (1 г, 4,88 ммоль) в ДХМ (10 мл) добавляли DAST (1,57 г, 9,75 ммоль, 1,29 мл) в ДХМ (10 мл) при 0°С в атмосфере N2. Потом реакционную смесь нагревали до 25°C и перемешивали в течение 2 ч. Реакционную смесь разводили водой, а водную фазуэкстрагировали EtOAc. Объединенную органическую фазу промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Полученный в результате остаток очищали посредством колоночной хроматографии с получением 1-бром-2-фтор-3-(фторметил)бензола (0,8 г, неочищенный). 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 7,62-7,66 (м, 1H), 7,43-7,47 (м, 1H), 7,13-7,17 (м, 1H), 5,48 (д, J=48,0 Гц, 2H).
Этап2.
[00711] B раствор 1-бром-2-фтор-3-(фторметил)бензола (0,5 г, 2,42 ммоль) в ДМФ (3 мл) одной частью добавляли Pd(PPh3)2Cl2 (84,76 мг, 120,76 μмоль) и трибутил(1-этоксивинил) станнан (1,05 г, 2,90 ммоль, 978,25 μл) при 25°С в атмосфере N2. Смесьнагревалидо 100°C и перемешивали в течение 2 ч. Потом добавляли водный CsF (3 мл), а реакционную смесь перемешивали в течение 10 мин и потом фильтровали. Водную фазу экстрагировали EtOAc. Объединенную органическую фазу промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Полученный в результате остаток растворяли в 2 H HCl (10 мл), и перемешивали при 25°C в течение 2 ч. Смесь очищали посредством колоночной хроматографии с получением 1-[2-фтор-3-(фторметил)фенил]этанона (150 мг, выход 36,50%). 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 7,87-7,95 (м, 1H), 7,70-7,73 (м, 1H), 7,31-7,36 (м, 1H), 5,53 (д, J=48,4 Гц 2H), 2,64 (д, J=4,8 Гц, 3H). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C9H9F2O: 171,05; полученное 171,2.
Этап 3.
[00712] B раствор 1-[2-фтор-3-(фторметил)фенил]этанона (0,150 г, 881,55 μмоль) в ТГФ (5 мл) добавляли Ti(OEt)4 (804,36 мг, 3,53 ммоль, 731,23 μл) и 2-метилпропан-2-сульфинамид (213,69 мг, 1,76 ммоль) при 25°C в атмосфере N2. Смесь перемешивали при 80°C в течение 2 ч. После охлаждения до 0°C в смесь добавляли LiBH4 (76,80 мг, 3,53 ммоль) и MeOH (28,24 мг, 881,55 μмоль, 35,67 μл) и перемешивали смесь в течение 1 ч при 0°С. Остаток разводили водой и экстрагировали EtOAc. Объединенную органическую фазу промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Оставшийся остаток очищали с получением N-[(1R)-1-[2-фтор-3-(фторметил)фенил]этил]-2-метил-пропан-2-сульфинамида (100 мг, выход 41,20%). 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 7,53-7,57 (м, 1H), 7,36-7,39 (м, 1H), 7,19-7,23 (м, 1H), 5,47 (д, J=49,2 Гц 2H), 4,79-4,82 (м, 1H), 1,52 (д, J=6,8 Гц, 3H), 1,21 (с, 9H). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C13H20NF2OS: 276,12; полученное 276,2.
Этап 4.
[00713] B раствор N-[(1R)-1-[2-фтор-3-(фторметил)фенил]этил]-2-метил-пропан-2-сульфинамида (100 мг, 363,16 μмоль) в МеОН (3 мл) добавляли HCl/МеОН (4M, 181,58 μл) при 25°С. Смесь перемешивали в течение 2 ч, после чего реакционную смесь концентрировали. Остаток растворяли в MeOH (4 мл), доводили до pH=7 с помощью насыщ. раствора NaOH в MeOH, а потом концентрировали. Оставшийся остаток растворяли в ДХМ и MeOH (5: 1, 5 мл), фильтровали и концентрировали с получением (1R)-1-[2-фтор-3-(фторметил)фенил]этанамина (50 мг, выход 80,43%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C9H12F2N: 172,19; полученное 172,2. 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 7,49-7,53 (м, 1H), 7,33-7,37 (м, 1H), 7,19-7,22 (м, 1H), 5,45 (д, J=48,0 Гц 2H), 4,27-4,39 (м, 1H), 1,41 (д, J=6,8 Гц, 3H).
Этап 5.
[00714] B раствор (1R)-1-[2-фтор-3-(фторметил)фенил]этанамина (0,05 г, 292,08 μмоль) и (2,4-дихлор-5,7-дигадропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (97,40 мг, 321,29 μмоль) в n-BuOH (1 мл) добавляли ДИЭА (188,75 мг, 1,46 ммоль, 254,37 μл) при 25°С. Потом реакционную смесь перемешивали при 80°C в течение 2 ч. Смесь фильтровали и очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[2-фтор-3-(фторметил)фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (59,3 мг, 135,43 μмоль, выход 46,37%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C20H23ClF2N5O2: 438,14; полученное 438,3. 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 7,34-7,45 (м, 2H), 7,15-7,19 (м, 1H), 5,57-5,62 (м, 1H), 5,45 (д, J=48,0 Гц 2H), 4,61-4,64 (м, 2H), 4,56-4,57 (м, 1H), 4,55-4,59 (м, 1H), 3,66-3,73 (м, 4H), 3,34-3,37 (м, 4H), 1,55 (д, J=7,2 Гц, 3H)
Пример 528. Синтез N-[(1R)-1-[2-бром-3-(дифторметил)фенил]этил]-2-хлор-6-(морфолин-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина
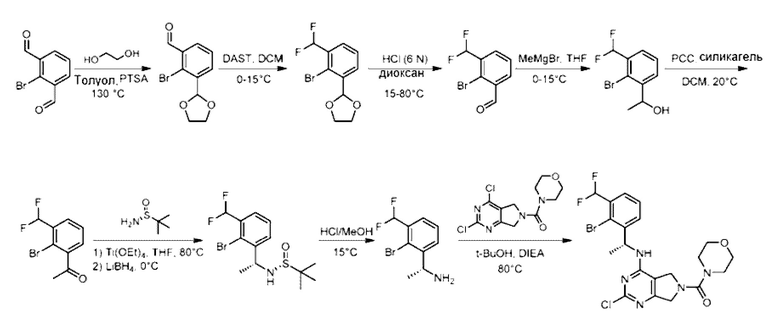
Этап 1.
[00715] B раствор 2-бромбензол-1,3-дикарбальдегида (1,5 г, 7,04 ммоль) в толуоле (27 мл) добавляли 4-метилбензолсульфоновой кислоты гидрат (26,79 мг, 140,83 μмоль), а полученную в результате смесь нагревали до 130°С. B течение 3 ч добавляли этиленгликоль (437,04 мг, 7,04 ммоль, 393,73 μл), а воду, образуемую из реакционной смеси, удаляли с помощью ловушки Дина - Старка. Потом смесь перемешивали при 130°C еще в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры, промывали насыщенным раствором NaHCO3 и экстрагировали ДХМ. Органическую фазу промывали солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Полученный в результате остаток очищали посредством колоночной хроматографии с получением 2-бром-3-(1,3-диоксолан-2-ил)бензальдегида (1,1 г, выход 60,77%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C10H10BrO3: 256,97; полученное 257,0. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,33 (с, 1H), 7,86 (д, J=7,6 Гц, 2H), 7,58-7,62 (м, 1H), 6,11 (с, 1H), 4,02-4,11 (м, 4H).
Этап 2.
[00716] B раствор 2-бром-3-(1,3-диоксолан-2-ил)бензальдегида (2 г, 7,78 ммоль) в ДХМ (20 мл) добавляли N-этил-N-(трифтор-сульфанил)этанамин (3,76 г, 23,34 ммоль, 3,08 мл) при 0°C в атмосфере N2. Потом полученную в результате перемешивали при 15°C в течение 2 ч. Потом раствор вливали в ледяную воду и разделяли между насыщенным бикарбонатом натрия и EtOAc. Смесь экстрагировали EtOAc. Органические слои объединяли и концентрировали в вакууме. Полученный в результате остаток очищали посредством колоночной хроматографии с получением 2-[2-бром-3-(дифторметил)фенил]-1,3-диоксолана (1,67 г, выход 76,92%). 1H ЯМР (400 МГц, CDCl3) δ м.д. 7,74 (д, J=7,6 Гц, 1H), 7,69 (д, J=7,6 Гц, 1H), 7,47 (т, J=7,6 Гц, 1H), 7,00 (т, J=54,4 Гц, 1H), 6,17 (с, 1H), 4,10-4,18 (м, 4H).
Этап 3.
[00717] B раствор 2-[2-бром-3-(дифторметил)фенил]-1,3-диоксолана (1,6 г, 5,73 ммоль) в диоксане (16 мл) добавляли водн. HCl (6 M, 16,00 мл) при 15°C и перемешивали полученную в результате смесь при 80°C в течение 10 ч. Раствор вливали в воду и EtOAc и экстрагировали водный слой EtOAc. Объединенную органическую фазу промывали солевым раствором, сушили над безводным MgSO4 и концентрировали в вакууме. Остаток очищали посредством колоночной хроматографии с получением 2-бром-3-(дифторметил)бензальдегида (1,15 г, выход 85,35%). 1H ЯМР (400 МГц, CDCl3) м.д. 10,47 (с, 1H), 8,04 (д, J=7,6 Гц, 1H), 7,91 (д, J=7,6 Гц, 1H), 7,58 (т, J=7,6 Гц, 1H), 7,05 (т, J=54,4 Гц, 1H).
Этап 4.
[00718] B раствор 2-бром-3-(дифторметил)бензальдегида (1,05 г, 4,47 ммоль) в ТГФ (10 мл) добавляли MeMgBr (3 M, 1,94 мл) при 0°C в атмосфере N2 и перемешивали полученную в результате смесь при 15° в течение 3 ч. Реакционную смесь вливали в ледяную воду и подкисляли с помощью 4 H водного раствора HCl до pH 2 ~ 3. Полученную в результате смесь экстрагировали EtOAc, объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением 1-[2-бром-3-(дифторметил)фенил]этанола (1,05 г, выход 93,61%). 1H ЯМР (400 МГц, CDCl3) δ м.д. 7,77 (д, J=7,6 Гц, 1H), 7,59 (д, J=7,6 Гц, 1H), 7,48 (т, J=7,6 Гц, 1H), 6,98 (т, J=54,8 Гц, 1H), 5,32-5,37 (м, 1H), 1,96 (шир. с, 1H), 1,51 (д, J=6,4 Гц, 3H)
Этап 5.
[00719] B раствор 1-[2-бром-3-(дифторметил)фенил]этанола (1 г, 3,98 ммоль) в ДХМ (10 мл) добавляли PCC (2,58 г, 11,95 ммоль) и силикагель (2,58 г, 42,94 ммоль) при 20°C в атмосфере N2. Реакционную смесь перемешивали при 20°C в течение 1 ч. Реакционный раствор фильтровали и концентрировали при пониженном давлении. Полученный в результате остаток очищали посредством колоночной хроматографии с получением l-[2-бром-3-(дифторметил)фенил]этанона (683 мг, выход 68,85%). 1H ЯМР (400 МГц, CDCl3) δ м.д. 7,75 (дд, J=2,4, 7,6 Гц, 1H), 7,47-7,53(м, 2H), 6,99 (т, J=54,8 Гц, 1H), 2,64 (с, 3H)
Этап 6.
[00720] B раствор 1-[2-бром-3-(дифторметил)фенил]этанона (680 мг, 2,73 ммоль) в ТГФ (8 мл) добавляли 2-метилпропан-2-сульфинамид (661,84 мг, 5,46 ммоль) и Ti(OEt)4 (2,49 г, 10,92 ммоль, 2,26 мл) в атмосфере N2. Реакционную смесь перемешивали при 80°C в течение 3 ч, после чего в реакционный раствор добавляли LiBH4 (59,48 мг, 2,73 ммоль) при 0°С. Полученную в результате смесь перемешивали при 0°C в течение 2 ч. Потом реакционную смесь вливали в ледяную воду. Водный слой экстрагировали EtOAc, объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Оставшийся остаток очищали посредством колоночной хроматографии с получением N-[(1R)-1-[2-бром-3-(дифторметил)фенил]этил]-2-метил-пропан-2-сульфинамида (350 мг, выход 35,46%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C13H19BrF2NOS: 354,03; полученное 354,1. 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 7,75 (д, J=7,6 Гц, 1H), 7,58 (д, J=6,4 Гц, 1H), 7,52 (т, J=7,6 Гц, 1H), 7,06 (т, J=54,8 Гц, 1H), 5,01-5,06 (м, 1H), 1,49 (д, J=6,8 Гц, 3H), 1,22 (с, 9H).
Этап 7.
[00721] Раствор N-[(1R)-1-[2-бром-3-(дифторметил)фенил]этил]-2-метил-пропан-2-сульфинамида (100 мг, 282,28 μмоль) в HCl/MeOH (4 M, 1 мл) перемешивали при 15°C в течение 3 ч. Потом реакционную смесь доводили до pH 7 с помощью насыщ. раствора NaOH/MeOH, после чего смесь концентрировали при пониженном давлении. Полученный в результате остаток растворяли в ДХМ (3 мл) и MeOH (0,6 мл) и фильтровали раствор. Полученный в результате органический слой концентрировали при пониженном давлении с получением (1R)-1-[2-бром-3-(дифторметил)фенил]этанамина (60 мг, выход 84,99%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C9H11BrF2N: 250,00; полученное 250,0. 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 7,65-7,76 (м, 3H), 7,10 (т, J=54,4 Гц, 1H), 5,02-5,07 (м, 1H), 1,64 (д, J=6,8 Гц, 3H)
Этап 8.
[00722] B раствор (1R)-1-[2-бром-3-(дифторметил)фенил]этанамина (60 мг, 239,92 μмоль) в t-BuOH (1 мл) добавляли (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанон (72,73 мг, 239,92 μмоль) и ДИЭА (93,02 мг, 719,76 μмоль, 125,37 μл) в атмосфере N2. Реакционную смесь перемешивали при 80°C в течение 2 ч. Смесь вливали в воду и экстрагировали водную фазу EtOAc. Объединенную органическую фазу промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Оставшийся остаток очищали посредством препаративной ВЭЖХ с получением [4-[[(1R)-1-[2-бром-3-(дифторметил)фенил]этил]амино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (51 мг, выход 40,96%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C20H22BrClF2N5O2: 516,05; полученное 516,1. 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 7,55-7,58 (м, 2H), 7,45 (т, J=7,2 Гц, 1H), 7,10 (т, J=54,8 Гц, 1H), 5,68-5,72 (м, 1H), 4,57-4,66 (м, 4H), 3,69-3,77 (м, 4H), 3,35-3,39 (м, 4H), 1,55 (д, J=7,2 Гц, 3H)
Пример 529. Синтез 1-[2-хлор-4-[[(1R)-1-[3-(дифторметил)-2-фтор-фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ий-6-илиден]-N,N,N',N'-тетраметил-метандиаминформиата
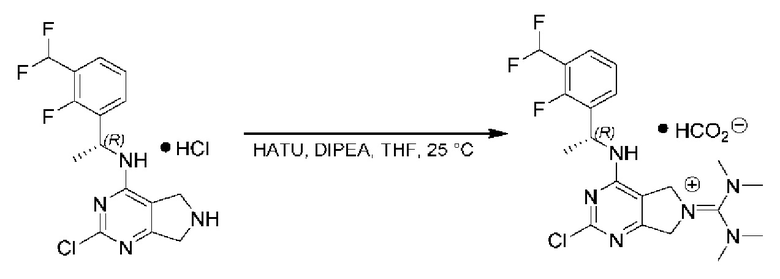
Этап 1.
[00723] B смесь 2-хлор-N-[(1R)-1-[3-(дифторметил)-2-фтор-фенил]этил]-6,7-дигидро-5Н-пирроло[3,4-d]пиримидин-4-амина гидрохлорида (50 мг, 132 мкмоль) и (3-гидроксиоксетан-3-карбонил)оксилития (16,4 мг, 132 мкмоль) в ТГФ (1 мл) добавляли HATU (11,7 мкл, 198 мкмоль) и ДИЭА (68,9 мкл, 396 мкмоль). Смесь перемешивали при 25°C в течение 10 ч в атмосфере N2. Потом реакционную смесь фильтровали, а фильтрат очищали посредством препаративной ВЭЖХ с получением 1-[2-хлор-4-[[(1R)-1-[3-(дифторметил)-2-фтор-фенил] этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ий-6-илиден]-N,N,N',N'-тетраметил-метандиаминформиата (20 мг, выход 34%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C20H25ClF3N6: 441,2; полученное 441,2; 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 7,58 (т, J=7,2 Гц, 1H) 7,50 (т, J=6,8 Гц, 1H) 7,26 (т, J=7,2 Гц, 1H) 6,99 (т, J=54,8 Гц, 1H) 5,66-5,56 (м, 1H) 4,67 (шир. с, 2H) 4,58 (шир. с, 2H) 3,04 (с, 12H) 1,61 (д, J=6,8 Гц, 3H).
Пример 530. Синтез [5-[[(1R)-1-[3-(дифторметил)-2-фтор-фенил]этил]амино]имидазо[1,2-с]пиримидин-2-ил]-пиперазин-1-ил-метанона гидрохлорида
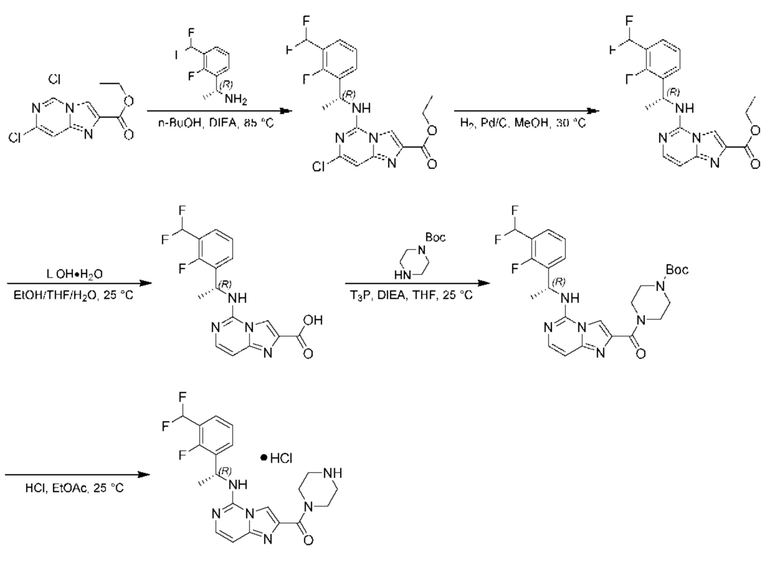
Этап 1.
[00724] B смесь этил 5,7-дихлоримидазо[1,2-с]пиримидин-2-карбоксилата (450 мг, 1,73 ммоль) и (1R)-1-[3-(дифторметил)-2-фтор-фенил]этанамина (327 мг, 1,73 ммоль) в n-BuOH (1 мл) добавляли ДИЭА (1,12 г, 8,65 ммоль). Реакционную смесь перемешивали при 85°C в атмосфере N2 в течение 3 ч. Смесь гасили добавлением воды (10 мл) и экстрагировали EtOAc. Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали посредством колоночной хроматографии с получением этил 7-хлор-5-[[(1R)-1-[3-(дифторметил)-2-фтор-фенил]этил]амино]имидазо[1,2-с]пиримидин-2-карбоксилата (640 мг, выход 90%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C18H17ClF3N4O2: 413,1; полученное 413,1.
Этап 2.
[00725] B раствор этил 7-хлор-5-[[(1R)-1-[3-(дифторметил)-2-фтор-фенил]этил]амино] имидазо[1,2-с]пиримидин-2-карбоксилата (640 мг, 1,55 ммоль) в MeOH (1 мл) добавляли 10% Pd/C (43,6 мг, 31,01 мкмоль) в атмосфере N2. Суспензию дегазировали в условиях вакуума и три раза продували газообразным H2. Смесь перемешивали в условиях H2 (15 фунт/кв. дюйм) при 30°C в течение 3 ч. Потом реакционную смесь фильтровали и концентрировали фильтрат с получением этил 5-[[(1R)-1-[3-(дифторметил)-2-фтор-фенил]этил]амино]имидазо[1,2-с]пиримидин-2-карбоксилата (580 мг, выход 99%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C18H18F3N4O2: 379,1; полученное 379,1; 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 9,01 (с, 1H) 8,10 (д, J=7,2 Гц, 1H) 7,67 (т, J=7,2 Гц, 1H) 7,52 (т, J=7,2 Гц, 1H) 7,27 (т, J=7,6 Гц, 1H) 6,86-7,14 (м, 2H) 5,73 (кв, J=7,2 Гц, 1H) 4,50 (кв, J=7,2 Гц, 2H) 1,74 (д, J=7,2 Гц, 3H) 1,45 (т, J=7,2 Гц, 3H).
Этап 3.
[00726] B смесь этил 5-[[(1R)-1-[3-(дифторметил)-2-фтор-фенил]этил]амино]имидазо [1,2-с]пиримидин-2-карбоксилата (580 мг, 1,53 ммоль) в EtOH (2 мл), ТГФ (2 мл) и H2O (2 мл) добавляли LiOH⋅H2O (162 мг, 3,83 ммоль). Смесь перемешивали при 25°C в течение 2 ч в атмосфере N2. Реакционную смесь обрабатывали раствором HCl (2 H в H2O) до pH ~ 4, потом экстрагировали CH2Cl2, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением 5-[[(1R)-1-[3-(дифторметил)-2-фтор-фенил]этил]амино]имидазо[1,2-с]пиримидин-2-карбоновой кислоты (0,50 г, неочищенная). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C16H12F3N4O2: 349,1; полученное 349,0; 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 8,47 (с, 1H) 7,65-7,55 (м, 2H) 7,49 (т, J=6,8 Гц, 1H) 7,23 (т, J=7,6 Гц, 1H) 7,14-6,87 (м, 2H) 5,66 (кв, J=6,4 Гц, 1H) 1,67 (д, J=7,2 Гц, 3H).
Этап 4.
[00727] B смесь 5-[[(1R)-1-[3-(дифторметил)-2-фтор-фенил]этил]амино]имидазо[1,2-с]пиримидин-2-карбоновой кислоты (100 мг, 285 мкмоль) и трет-бутил пиперазин-1-карбоксилата (53,2 мг, 285 мкмоль) в ТГФ (2 мл) добавляли Т3Р (273 мг, 428 мкмоль) и ДИЭА (249 мкл 1,43 ммоль). Смесь перемешивали при 25°C в течение 10 ч в атмосфере N2. Реакционную смесь гасили водой, экстрагировали EtOAc, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали посредством колоночной хроматографии с получением трет-бутил 4-[5-[[(1R)-1-[3-(дифторметил)-2-фтор-фенил]этил]амино]имидазо[1,2-с]пиримидин-2-карбонил]пиперазин-1-карбоксилата (120 мг, выход 81%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C25H30F3N6O3: 519,2; полученное 519,2; 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 8,44 (с, 1H) 7,63-7,59 (м, 2H) 7,50 (т, J=7,2 Гц, 1H) 7,24 (т, J=7,6 Гц, 1H) 7,00 (т, J=55,2 Гц, 1H) 6,81 (д, J=6,4 Гц, 1H) 5,66 (кв, J=6,8 Гц, 1H) 3,98-3,77 (м, 4H) 3,53 (шир. с, 4H) 1,67 (д, J=6,8 Гц, 3H) 1,47 (с, 9H).
Этап 5.
[00728] трет-бутил-4-[5-[[(1R)-1-[3-(дифторметил)-2-фтор-фенил]этил]амино]имидазо[1,2-с]пиримидин-2-карбонил]пиперазин-1-карбоксилат (120 мг, 231 мкмоль) перемешивали в 4 M растворе HCl в EtOAc (578 мкл, 2,31 ммоль) при 25°C в течение 1 ч. Потом реакционную смесь фильтровали с получением [5-[[(1R)-1-[3-(дифторметил)-2-фтор-фенил]этил]амино]имидазо[1,2-с]пиримидин-2-ил]-пиперазин-1-ил-метанона гидрохлорида (60 мг, выход 61%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C20H22F3N6O: 419,2; полученное 419,2; 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 9,12 (с, 1H) 8,12 (д, J=6,8 Гц, 1H) 7,77 (т, J=7,2 Гц, 1H) 7,52 (т, J=7,2 Гц, 1H) 7,27 (т, J=8,0 Гц, 1H) 7,14-7,00 (м, 2H) 5,76 (кв, J=6,8 Гц, 1H) 4,14-4,08 (м, 4H) 3,42 (т, J=5,2 Гц, 4H) 1,76 (д, J=7,2 Гц, 3H).
Пример 531. Синтез [2-хлор-4-[[(1R)-1-[3-[2-(циклопропокси)-1,1-дифторэтил]фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона
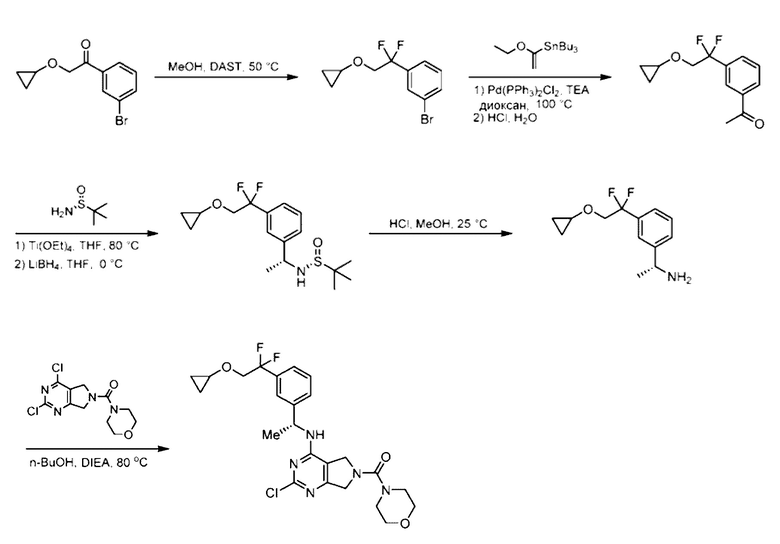
Этап 1.
[00729] B раствор 1-(3-бромфенил)-2-(циклопропокси)этанона (430 мг, 1,69 ммоль) в DAST (4,5 мл) добавляли MeOH (6,82 мкл, 169 мкмоль) при 25°С. Смесь нагревали до 50°C и перемешивали в течение 12 ч. Потом смесь разводили ледяной водой (10 мл) и экстрагировали EtOAc, обрабатывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали посредством колоночной хроматографии с получением 1-бром-3-[2-(циклопропокси)-1,1-дифторэтил]бензола (250 мг, выход 54%). 1H ЯМР (400 МГц, Хлороформ-d) δ м.д. 7,67 (с, 1H) 7,60-7,58 (м, 1H) 7,47-7,44 (м, 1H) 7,33-7,27 (м, 1H) 3,90 (т, J=12 Гц, 2H) 3,46-3,41 (м, 1H) 0,60-0,46 (м, 4H).
Этап 2.
[00730] B раствор 1-бром-3-[2-(циклопропокси)-1,1-дифторэтил]бензола (100 мг, 361 мкмоль) и трибутил(1-этоксивинил)станнана (183 мкл, 541 мкмоль) в 1,4-диоксане (2 мл) добавляли ТЭА (126 мкл, 902 мкмоль) и Pd(PPh3)2Cl2 (25,3 мг, 36,1 мкмоль). Смесь продували газообразным N2, потом нагревали до 100°C и перемешивали в течение 2 ч. Добавляли 2 M водный раствор HCl (20 мл) и перемешивали смесь в течение 5 ч. Смесь фильтровали и экстрагировали фильтрат EtOAc. Объединенные органические слои вливали в водн. раствор KF (10 мл) и перемешивали в течение 1 ч. Смесь фильтровали, а фильтрат обрабатывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали посредством препаративной TCX с получением 1-[3-[2-(циклопропокси)-1,1-дифторэтил]фенил]этанона (20 мг, выход 23%). 1H ЯМР (400 МГц, Хлороформ-d) δ м.д. 8,09 (с, 1H) 8,03 (д, J=8 Гц, 1H) 7,71 (д, J=8 Гц, 1H) 7,54 (т, J=8 Гц, 1H) 3,94 (т, J=14 Гц, 2H) 3,44-3,40 (м, 1H) 2,63 (с, 3H) 0,57-0,44 (м, 4H).
Этап 3.
[00731] B раствор 1-[3-[2-(циклопропокси)-1,1-дифторэтил]фенил]этанона (300 мг, 1,25 ммоль) в ТГФ (4 мл) добавляли (R)-2-метил-2-пропансульфинамид (303 мг, 2,50 ммоль) и Ti(OEt)4 (1,04 мл, 4,99 ммоль). Смесь нагревали до 80°C и перемешивали в течение 2 ч. Смесь охлаждали до 0°С, добавляли MeOH (50,5 мкл, 1,25 ммоль) и LiBH4 (29,9 мг, 1,37 ммоль) и перемешивали полученную в результате смесь в течение 1 ч при 0°С. Добавляли H2O (10 мл), смесь фильтровали, а фильтрат экстрагировали EtOAc. Объединенные органические экстракты обрабатывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии с получением N-[(1R)-1-[3-[2-(циклопропокси)-1,1-дифторэтил]фенил]этил]-2-метил-пропан-2-сульфинамида (215 мг, выход 49%). 1H ЯМР (400 МГц, Хлороформ-d) δ м.д. 7,49 (с, 1H) 7,46-7,44 (м, 3H) 4,63-4,57 (м, 1H) 3,94 (т, J=14 Гц, 2H) 3,46-3,42 (м, 1H) 1,57-1,53 (м, 3H) 1,25 (с, 9H) 0,60-0,45 (м, 4H).
Этап 4.
[00732] B раствор N-[(1R)-1-[3-[2-(циклопропокси)-1,1-дифторэтил]фенил]этил]-2-метил-пропан-2-сульфинамида (60 мг, 173 мкмоль) в MeOH (1 мл) добавляли 4 M раствор HCl в MeOH (86,8 мкл, 347 мкмоль). Смесь перемешивали при 25°C в течение 2 ч. Добавляли насыщенный раствор NaOH в MeOH до pH ~ 7 и концентрировали смесь при пониженном давлении. Остаток разводили в 10:1 смеси ДХМ/МеОН, перемешивали в течение 30 мин, потом фильтровали и концентрировали с получением (1R)-1-[3-[2-(циклопропокси)-1,1-дифторэтил]фенил]этанамина (41,9 мг, неочищенный). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C13H18F2NO: 242,1; полученное: 242,1.
Этап 5.
[00733] B раствор (1R)-1-[3-[2-(циклопропокси)-1,1-дифторэтил]фенил]этанамина (41,9 мг, 174 мкмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил) морфолинометанона (52,6 мг, 174 мкмоль) в t-BuOH (1,5 мл) добавляли ДИЭА (151 μл, 868 мкмоль). Смесь перемешивали при 80°C в течение 16 ч. Смесь фильтровали и концентрировали при пониженном давлении, а неочищенный остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[3-[2-(циклопропокси)-1,1-дифторэтил]фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (7,1 мг, выход 8%). ЖХМС (ИЭР): m/z: [M+H], рассчитанное для C24H29ClF2N5O3: 508,1; полученное 508,2; 1H ЯМР (400 МГц, Метанол-d4) δ м.д. 7,56 (с, 1H) 7,52 (д, J=8 Гц, 1H) 7,45-7,38 (м, 2H) 5,43-5,39 (м, 1H) 4,63 (шир. с, 2H) 4,57 (шир. с, 2H) 3,96-3,89 (м, 2H) 3,74-3,71 (м, 4H) 3,37-3,35 (м, 5H) 1,59 (д, J=8 Гц, 3H) 0,41-0,39 (м, 4H).
Пример 532. Синтез [2-хлор-4-[1-(5-фенил-2-тиенил)этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона
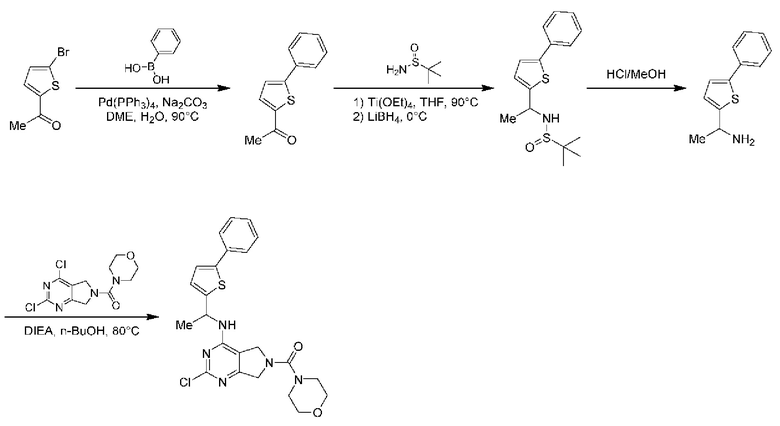
Этап 1.
[00734] B раствор 1-(5-бром-2-тиенил)этанона (1 г, 4,88 ммоль) и фенилбороновой кислоты (713,48 мг, 5,85 ммоль) в ДМЭ (10 мл) и H2O (2 мл) добавляли Na2CO3 (1,55 г, 14,63 ммоль) и Pd(PPh3)4 (1,13 г, 975,27 μмоль). Смесь перемешивали при 90°C в течение 16 ч в атмосфере N2, потом разводили водой и экстрагировали EtOAc. Объединенную органическую фазу промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии с получением 1-(5-фенил-2-тиенил)этанона (750 мг, выход 76,04%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C12H11OS: 203,5; полученное 203,2.
Этап 2.
[00735] В раствор 1-(5-фенил-2-тиенил)этанона (750 мг, 3,71 ммоль) в ТГФ (7,5 мл) добавляли 2-метилпропан-2-сульфинамид (898,80 мг, 7,42 ммоль) и Ti(OEt)4 (2,54 г, 11,12 ммоль, 2,31 мл). Смесь перемешивали при 90°С в течение 16 ч. Потом в смесь добавляли МеОН (118,81 мг, 3,71 ммоль, 150,05 μл) и LiBH4 (242,31 мг, 11,12 ммоль) при 0°C и перемешивали в течение 1 ч. Потом реакционную смесь разводили водой (10,0 мл) и экстрагировали EtOAc. Объединенную органическую фазу промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии с получением 2-метил-N-[1-(5-фенил-2-тиенил)этил]пропан-2-сульфинамида (385 мг, выход 33,71%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C16H22NOS2: 308,1; полученное 308,2.
Этап 3.
[00736] Раствор 2-метил-N-[1-(5-фенил-2-тиенил)этил]пропан-2-сульфинамида (380 мг, 1,24 ммоль) в HCl/МеОН (4 М, 4 мл) перемешивали при кт в течение 2 ч. В смесь добавляли NaOH/MeOH до РН=8. Смесь концентрировали при пониженном давлении с получением 1-(5-фенил-2-тиенил)этанамина (250 мг, выход 99,50%). ЖХМС (ИЭР): m/z: [M-NH2], рассчитанное для C12H11S: 187,06; полученное 187,1.
Этап 4.
[00737] В раствор 1-(5-фенил-2-тиенил)этанамина (150 мг, 737,82 μмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (246,03 мг, 811,60 μмоль) в n-BuOH (1,5 мл) добавляли ДИЭА (286,07 мг, 2,21 ммоль, 385,54 μл). Смесь перемешивали при 80°С в течение 16 ч. Смесь концентрировали при пониженном давлении и очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[1-(5-фенил-2-тиенил)этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолино-метанона (50 мг, выход 14,42%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C23H25ClN5O2S: 470,1; полученное 470,1; 1Н ЯМР (400 МГц, ДМСО-d6) δ м. д. 8,27-8,29 (д, J=8,00, 1Н) 7,58-7,60 (д, J=8,40, 2Н) 7,35-7,40 (м, 3Н) 7,26-7,30 (т, J=7,20, 1Н) 7,03-7,04 (д, J=3,20 Гц, 1Н) 5,54-5,57 (м, 1Н) 4,52 (с, 4Н) 3,60-3,62 (т, J=4,40, 4Н) 3,22-3,24 (т, J=4,40, 4Н) 1,60-1,62 (д, J=7,20, 3Н).
Пример 533. Синтез [4-[1-[3-амино-4-фтор-5-(трифторметил)фенил]этиламино]-2-хлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона
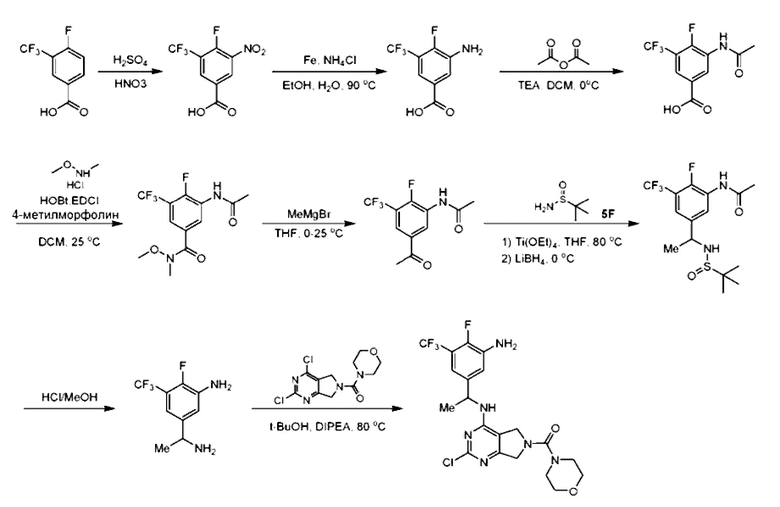
Этап 1.
[00738] В смесь 4-фтор-3-(трифторметил)бензойной кислоты (3 г, 14,42 ммоль) в HNO3 (25 мл) добавляли H2SO4 (6,90 г, 70,35 ммоль, 3,75 мл) при 0°С. Смесь перемешивали при 75°С в течение 5 ч. Реакционную смесь гасили ледяной водой (40 мл) и экстрагировали EtOAc. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением 4-фтор-3-нитро-5-(трифторметил)бензойной кислоты (2,5 г, выход 68,52%). 1Н ЯМР (400 МГц, ДМСО-d6) δ=8,78 (дд, J=4,5, 1Н), 8,47 (дд, J=3,25, 1Н).
Этап 2.
[00739] В раствор 4-фтор-3-нитро-5-(трифторметил)бензойной кислоты (2,5 г, 9,88 ммоль) в EtOH (10 мл) и H2O (5 мл) добавляли NH4Cl (264,17 мг, 4,94 ммоль) и Fe (1,65 г, 29,63 ммоль) при кт. Смесь перемешивали при кт в течение 5 ч. Реакционную смесь гасили ледяной водой (40 мл) и экстрагировали EtOAc. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением 3-амино-4-фтор-5-(трифторметил)бензойной кислоты (2,2 г, выход 99,83%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C8H6F4NO2: 224,0; полученное 224,0.
Этап 3.
[00740] В раствор 3-амино-4-фтор-5-(трифторметил)бензойной кислоты (2,2 г, 9,86 ммоль) в ДХМ (10 мл) добавляли ТЭА (997,73 мг, 9,86 ммоль, 1,37 мл) и ацетил ацетат (3,52 г, 34,51 ммоль, 3,23 мл). Смесь перемешивали при кт в течение 3 ч. В реакционную смесь добавляли насыщ. NaHCO3 (5 мл). Смесь фильтровали и экстрагировали фильтрат ДХМ. Объединенный органический слой сушили над безводным Na2SO4 и фильтровали. Растворитель удаляли при пониженном давлении, а неочищенный остаток очищали посредством колоночной хроматографии с получением 3-ацетамидо-4-фтор-5-(трифторметил)бензойной кислоты (2,6 г, выход 99,45%). 1Н ЯМР (Хлороформ-d, 400 МГц) δ м.д.=8,85 (с, J=6,0 Гц 1H), 8,08 (д, J=4,8 Гц, 1H), 2,19 (м, 3Н)
Этап 4.
[00741] В раствор 3-ацетамидо-4-фтор-5-(трифторметил)бензойной кислоты (2,6 г, 9,81 ммоль) в ДХМ (20 мл) добавляли HOBt (2,65 г, 19,61 ммоль), 4-метилморфолин (2,98 г, 29,42 ммоль, 3,23 мл), N-метоксиметанамина гидрохлорид (1,91 г, 14,27 ммоль) и ЭДКИ (3,76 г, 19,61 ммоль). Смесь перемешивали при кт в течение 5 ч. реакционную смесь концентрировали при пониженном давлении, а остаток разводили Н2О (20 мл) и экстрагировали EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением остатка. Остаток очищали посредством колоночной хроматографии с получением 3-ацетамидо-4-фтор-N-метокси-N-метил-5-(трифторметил)бензамида (1,3 г, выход 43,01%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C12H13F4N2O3: 309,1; полученное 309,1.
Этап 5.
[00742] В раствор 3-ацетамидо-4-фтор-N-метокси-N-метил-5-(трифторметил)бензамида (1 г, 3,24 ммоль) в ТГФ (10 мл) добавляли LiHMDS (1 М, 3,24 мл) при 0°С и перемешивали в течение 30 мин. Потом в смесь добавляли MeMgBr (3 М, 1,08 мл). Смесь перемешивали при 0°С в течение 3 ч. Реакционную смесь вливали в ледяную воду (2 мл) и доводили до рН=4 с помощью HCl, потом экстрагировали EtOAc. Объединенную органическую фазу промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали посредством препаративной ТСХ с получением N-[5-ацетил-2-фтор-3-(трифторметил)фенил]ацетамида (700 мг, выход 81,98%).
Этап 6.
[00743] В раствор N-[5-ацетил-2-фтор-3-(трифторметил)фенил]ацетамида (110 мг, 417,95 μмоль) в ТГФ (5 мл) добавляли Ti(OEt)4 (286,02 мг, 1,25 ммоль, 260,02 μл) и 2-метилпропан-2-сульфинамид (101,31 мг, 835,90 μмоль) при кт. Смесь перемешивали при 80°С в течение 4 ч. После охлаждения до -4°С в смесь добавляли МеОН (1 мл), потом LiBH4 (27,31 мг, 1,25 ммоль) при 0°С и перемешивали в течение 1 ч. Реакционную смесь медленно вливали в H2O (2 мл) и ТГФ (2 мл), потом фильтровали через целит. Фильтрационный осадок промывали ТГФ, фильтрат концентрировали при пониженном давлении, а остаток очищали посредством препаративной ТСХ с получением N-[5-[l-(трет-бутилсульфиниламино)этил]-2-фтор-3-(трифторметил)фенил]ацетамида (140 мг, выход 90,93%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C15H21F4N2O2S: 369,1; полученное 369,1.
Этап 7.
[00744] В раствор N-[5-[1-(трет-бутилсульфиниламино)этил]-2-фтор-3-(трифторметил)фенил]ацетамида (140 мг, 380,03 μмоль) в МеОН (1 мл) добавляли HCl/МеОН (4 М, 95,01 Смесь перемешивали при кт в течение 8 ч. Смесь концентрировали при пониженном давлении с получением остатка. Остаток растворяли в МеОН (1 мл). В раствор добавляли насыщ. MeOH/NaOH до рН=8. Раствор фильтровали и концентрировали при пониженном давлении с получением остатка. Остаток промывали ДХМ/МеОН=10/1, фильтровали, а фильтрат концентрировали при пониженном давлении с получением 5-(1-аминоэтил)-2-фтор-3-(трифторметил)анилина (50 мг, выход 59,22%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C9H11F4N2: 223,1; полученное 223,1.
Этап 8.
[00745] В раствор 5-(1-аминоэтил)-2-фтор-3-(трифторметил)анилина 2 HCl (50 мг, 169,43 μмоль) в n-BuOH (1 мл) добавляли ДИЭА (65,69 мг, 508,29 μмоль, 88,53 μл) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанон (56,50 мг, 186,37 μмоль) при кт. Смесь перемешивали при 80°С в течение 2 ч. Смесь концентрировали при пониженном давлении, а остаток очищали посредством препаративной ВЭЖХ с получением [4-[1-[3-амино-4-фтор-5-(трифторметил)фенил]этиламино]-2-хлор-5,7-дигадропирроло[3,4-d]пиримидин-6-ил]-морфолинометанона (60 мг, выход 72,44%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C20H22ClF4N6O2: 489,1; полученное 489,1; 1Н ЯМР (400 МГц, Метанол-d4) δ=7,07 (д, J=7,9, 1Н), 6,89 (д, J=4,0, 1Н), 5,30 (д, J=6,5, 1Н), 4,59 (д, J=14,4, 4Н), 3,76-3,70 (м, 4Н), 3,35 (д, J=4,4, 4Н), 1,53 (д, J=7,0, 3Н).
Пример 534. Синтез [2-хлор-4-[1-(3-циклопропилфенил)этиламино]-5,7-дигидропирроло [3,4-d]пиримидин-6-ил]-морфолинометанона
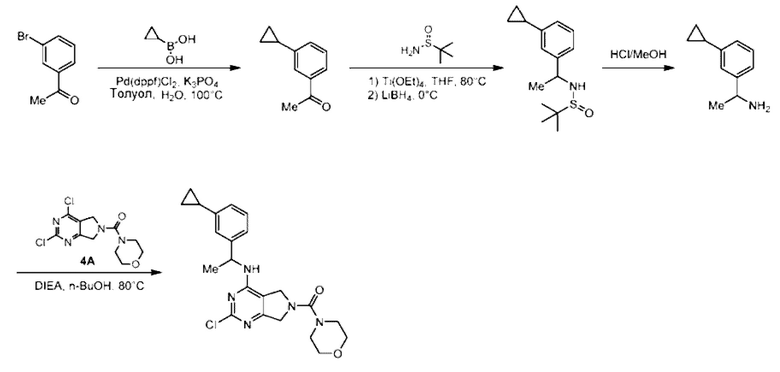
Этап 1.
[00746] В раствор 1-(3-бромфенил)этанона (1 г, 5,02 ммоль, 662,25 μл) в толуоле (10 мл) добавляли циклопропилбороновую кислоту (863,10 мг, 10,05 ммоль), Pd(dppf)Cl2 (367,61 мг, 502,40 μмоль), K3PO4 (3,20 г, 15,07 ммоль) и Н2О (0,5 мл). Реакционную смесь перемешивали и нагревали до 100°С в атмосфере N2 в течение 10 ч. Реакционную смесь разводили Н2О (10 мл) и экстрагировали EtOAc. Объединенные органические слои промывали водной NaCl, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением остатка. Остаток очищали посредством колоночной хроматографии с получением 1-(3-циклопропилфенил)этанона (580 мг, выход 72,06%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C11H13O: 161,1; полученное 161,0; 1Н ЯМР (400 МГц, Хлороформ-d) δ м.д. 7,73 (дт, J=7,6, 1,4 Гц, 1Н) 7,68 (т, J=1,8 Гц, 1Н) 7,35 (т, J=7,6 Гц, 1Н) 7,27 (дт, J=7,6, 1,4 Гц, 1Н) 2,60 (с, 3Н) 2,00-1,93 (м, 1Н) 1,04-0,99 (м, 2Н) 0,77-0,73 (м, 2Н).
Этап 2.
[00747] В смесь 1-(3-циклопропилфенил)этанона (580 мг, 3,62 ммоль), 2-метилпропан-2-сульфинамида (877,54 мг, 7,24 ммоль) в ТГФ (10 мл) добавляли Ti(OEt)4 (2,48 г, 10,86 ммоль, 2,25 мл) при кт. Смесь перемешивали при 90°С в течение 10 ч. После охлаждения до 0°С в смесь добавляли МеОН (116,00 мг, 3,62 ммоль, 146,50 μл) и LiBH4 (78,86 мг, 3,62 ммоль) при 0°С и перемешивали в течение 1 ч. Реакционную смесь разводили Н2О (10 мл) и фильтровали. Фильтрат экстрагировали EtOAc. Объединенные органические слои промывали водной NaCl, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением остатка. Остаток очищали посредством колоночной хроматографии с получением N-[1-(3-циклопропилфенил)этил]-2-метил-пропан-2-сульфинамида (380 мг, выход 39,55%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C15H24NOS: 266,2; полученное 266,1; 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 7,22-7,18 (м, 1Н) 7,15-7,11 (м, 2Н) 6,96-6,94 (м, 1Н) 4,42 (кв, J=6,8 Гц, 1Н) 1,94-1,87 (м, 1Н) 1,48 (д, J=6,8 Гц, 3Н) 1,22 (с, 9Н) 0,97-0,92 (м, 2Н) 0,70-0,66 (м, 2Н).
Этап 3.
[00748] Раствор N-[1-(3-циклопропилфенил)этил]-2-метил-пропан-2-сульфинамида (380 мг, 1,43 ммоль) в HCl/МеОН (4 М, 10 мл) перемешивали при кт в течение 0,5 ч. Реакционную смесь концентрировали при пониженном давлении с получением 1-(3-циклопропилфенил) этанамина HCl (280 мг, выход 99,04%).
Этап 4.
[00749] В раствор (2,4-дихлор-5Н-пирроло[3,4-d]пиримидин-6(7Н)-ил)(морфолино)метанона (150 мг, 494,81 μмоль) в n-BuOH (2 мл) добавляли ДИЭА (319,76 мг, 2,47 ммоль, 430,94 μл) и 1-(3-циклопропилфенил)этанамин HCl (117,39 мг, 593,78 μмоль). Смесь перемешивали при 80°С в течение 12 ч. Реакционную смесь концентрировали при пониженном давлении с получением остатка. Остаток очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[1-(3-циклопропилфенил)этиламино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-морфолинометано на (74,3 мг, выход 34,75%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C22H27ClN5O2: 428,2; полученное 428,2; 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 7,20-7,12 (м, 3Н) 6,93 (дт, J=7,2, 1,6 Гц, 1Н) 5,36 (кв, J=6,8 Гц, 1Н) 4,59-1,55 (м, 4Н) 3,72 (т, J=4,8 Гц, 4Н) 3,35 (т, J=4,6 Гц, 4Н) 1,92-1,86 (м, 1Н) 1,54 (д, J=6,8 Гц, 3Н) 0,96-0,92 (м, 2Н) 0,69-0,65 (м, 2Н).
Пример 535. Синтез 3-[1-[[2-хлор-6-(морфолин-4-карбонил)-5,7-дигидропирроло[3,4-d]пиримидин-4-ил]амино]этил]бензолсульфонамида
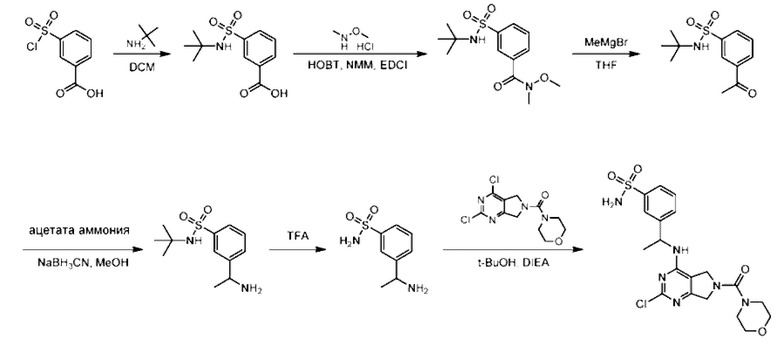
Этап 1.
[00750] В раствор 3-хлорсульфонилбензойной кислоты (1 г, 4,53 ммоль) в ДХМ (10 мл) добавляли раствор 2-метилпропан-2-амина (1,16 г, 15,86 ммоль, 1,67 мл). Смесь перемешивали при 0°С в течение 0,5 ч и при кт в течение 2 ч. Во время реакции образовалось белое твердое вещество. Твердое вещество фильтровали и промывали 10 мл ДХМ. Твердое вещество добавляли в 20 мл H2O и медленно добавляли 5 Н водную HCl (при перемешивании) рН ~5. Смесь перемешивали при кт в течение 30 мин. Смесь фильтровали, промывали водой и сушили в вакууме с получением 3-(трет-бутилсульфамоил)бензойной кислоты (0,9 г, выход 77,17%). 1Н ЯМР (400 МГц, ДМСО-d6) δ м. д. 8,37 (т, J=1,6 Гц, 1 Н) 8,13 (дт, J=7,6, 1,4 Гц, 1 Н) 8,05 (дт, J=7,6, 1,4 Гц, 1 Н) 7,70 (т, J=7,8 Гц, 2 Н) 1,09 (с, 9 Н).
Этап 2.
[00751] В раствор 3-(трет-бутилсульфамоил)бензойной кислоты (0,6 г, 2,33 ммоль) в ДХМ (15 мл) добавляли HOBt (630,17 мг, 4,66 ммоль) и N-метоксиметанамина гидрохлорид (409,43 мг, 4,20 ммоль), потом - ЭДКИ (894,04 мг, 4,66 ммоль) и 4-метилморфолин (707,58 мг, 7,00 ммоль, 769,11 μл). Смесь перемешивали при кт в течение 12 ч. Реакционную смесь промывали H2O и водным раствором NaCl, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением 3-(трет-бутилсульфамоил)-N-метокси-N-метилбензамида (630 мг, выход 89,95%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C13H21N2O4S: 301,1; полученное 301,1; 1Н ЯМР (400 МГц, Хлороформ-d) δ м.д. 8,24 (т, J=1,4 Гц, 1 Н) 8,00-7,98 (м, 1 Н) 7,89-7,87 (м, 1 Н) 7,56 (т, J=7,8 Гц, 1 Н) 4,55 (с, 1 Н) 3,54 (с, 3 Н) 3,39 (с, 3 Н) 1,25 (с, 9 Н).
Этап 3.
[00752] В раствор 3-(трет-бутилсульфамоил)-N-метокси-N-метилбензамида (0,5 г, 1,66 ммоль) в ТГФ (10 мл) по каплям добавляли MeMgBr (3 М, 1,66 мл) при -78°С. Смесь перемешивали при -78°С в течение 20 мин, а потом нагревали до кт в течение 12 ч. Реакционную смесь гасили водным NH4Cl (5 мл) при -78°С, потом смесь экстрагировали EtOAc. Органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением 3-ацетил-N-трет-бутил-бензолсульфонамида(310 мг, выход 72,94%). 1H ЯМР (400 МГц, Хлороформ-d) δ м.д. 8,46 (т, J=1,6 Гц, 1 Н) 8,14-8,09 (м, 2 Н) 7,62 (т, J=7,8 Гц, 1 Н) 4,56 (с, 1 Н) 2,66 (с, 3 Н) 1,26 (с, 9 Н).
Этап 4.
[00753] В раствор 3-ацетил-N-трет-бутил-бензолсульфонамида (260 мг, 1,02 ммоль) в МеОН (3 мл) добавляли раствор NaBH3CN (95,99 мг, 1,53 ммоль) и NH4OAc (784,91 мг, 10,18 ммоль) в МеОН (3 мл). Смесь перемешивали при кт в течение 24 ч. Реакционную смесь подкисляли до рН ~2, используя 1 Н HCl, а потом концентрировали при пониженном давлении. Остаток перерастворяли в воде, а потом экстрагировали EtOAc. Водный слой подщелачивали до рН ~10, используя насыщенный раствор гидроксида натрия, а потом экстрагировали EtOAc, фильтровали и концентрировали при пониженном давлении с получением 3-(1-аминоэтил)-N-трет-бутил-бензолсульфонамида (77 мг, выход 29,50%).
Этап 5.
[00754] Раствор 3-(1-аминоэтил)-N-трет-бутил-бензолсульфонамида (77 мг, 300,35 μмоль) в ТФУ (2 мл) перемешивали при кт в течение 5 ч. Смесь концентрировали при пониженном давлении с получением 3-(1-аминоэтил)бензолсульфонамида ТФУ (90 мг, выход 95,34%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C8H13N2O2S: 201,1; полученное 201,0.
Этап 6.
[00755] В раствор 3-(1-аминоэтил)бензолсульфонамида ТФУ (90 мг, 286,37 μмоль) и (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-морфолинометанона (86,81 мг, 286,37 μмоль) в n-BuOH (1 мл) добавляли ДИЭА (185,06 мг, 1,43 ммоль, 249,40 μл). Смесь перемешивали при 80°С в течение 10 ч. Реакционную смесь фильтровали и концентрировали при пониженном давлении с получением остатка. Остаток очищали посредством препаративной ВЭЖХ с получением 3-[1-[[2-хлор-6-(морфолин-4-карбонил)-5,7-дигадропирроло[3,4-d]пиримидин-4-ил]амино]этил]бензолсульфонамида (36 мг, выход 26,92%). ЖХМС (ИЭР): m/z: [М+Н], рассчитанное для C19H24ClN6O4S: 467,1; полученное 467,0; 1Н ЯМР (400 МГц, Метанол-d4) δ м.д. 7,93 (с, 1 Н) 7,79 (д, J=8,0 Гц, 1 Н) 7,63 (д, J=7,6 Гц, 1 Н) 7,51 (т, J=7,8 Гц, 1 Н) 5,45 (кв, J=6,8 Гц, 1 Н) 4,64-4,57 (м, 4 Н) 3,73 (t,J=4,8 Гц, 4 Н) 3,36 (т, J=4,6 Гц, 4 Н) 1,60 (д, J=6,8 Гц, 3 Н).
Пример 536. Синтез [2-хлор-4-[[(1R)-1-[3-(1,1-дифтор-2-метокси-этил)фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-(4-метокситетрагидропиран-4-ил)метанона
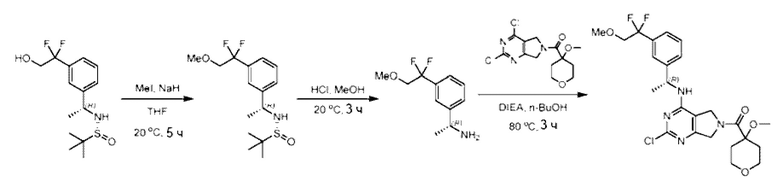
Этап 1.
[00756] В смесь N-[(1R)-1-[3-(1,1-дифтор-2-гидрокси-этил)фенил]этил]-2-метил-пропан-2-сульфинамида (500 мг, 1,64 ммоль), NaH (65,49 мг, 1,64 ммоль) в ТГФ (10 мл) добавляли MeI (464,79 мг, 3,27 ммоль, 203,85 μл). Смесь перемешивали при кт в течение 5 ч в атмосфере N2. Реакционную смесь гасили 20 мл воды при 0°С, а потом экстрагировали EtOAc. Объединенные органические слои промывали 30 мл солевого раствора, сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением остатка. Остаток очищали посредством колоночной хроматографии с получением N-[(1R)-1-[3-(1,1-дифтор-2-метокси-этил)фенил]этил]-2-метил-пропан-2-сульфинамида (200 мг, выход 38,24%). ЖХМС (ИЭР): m/z: [М+Н] рассчитанное для C15H24F2NO2S:320,l; полученное 320,1; 1Н ЯМР (400 МГц, CDCl3) δ м.д.=7,51-7,41 (м, 4Н), 4,60 (квд, J=6,4, 2,8 Гц, 1Н), 3,82 (т, J=13,2 Гц, 2Н), 3,45 (с, 3Н), 3,44 (шир. с, 1Н), 1,54 (д, J=6,4 Гц,3Н), 1,25 (с, 9Н).
Этап 2.
[00757] В смесь N-[(1R)-1-[3-(1,1-дифтор-2-метокси-этил)фенил]этил]-2-метил-пропан-2-сульфинамида (200 мг, 626,16 μмоль) в МеОН (5 мл) добавляли HCl/МеОН (4 М, 313,08 Смесь перемешивали при кт в течение 3 ч. Реакционную смесь нейтрализовали до рН=7 с помощью NaOH в метаноле и фильтровали. Фильтрат концентрировали при пониженном давлении с получением остатка. Остаток промывали дихлорметаном:метанолом (5:1). Органические фазы объединяли и концентрировали при пониженном давлении с получением (1R)-1-[3-(1,1-дифтор- 2-метокси-этил)фенил]этанамина (120 мг, выход 89,04%). ЖХМС (ИЭР): m/z: [М+Н] рассчитанное для C11H16F2NO:216,1; полученное 216,0; 1Н ЯМР (400 МГц, ДМСО-d6) δ м.д.=7,70 (с, 1H), 7,68-7,62 (м, 1H), 7,57-7,50 (м, 2Н), 4,40 (кв, J=6,8 Гц, 1H), 3,92 (т, J=13,6 Гц, 2Н), 3,34 (с, 3Н), 1,47 (д, J=6,8 Гц, 3Н).
Этап 3.
[00758] Смесь (1R)-1-[3-(1,1-дифтор-2-метокси-этил)фенил]этанамина (60 мг, 278,76 μмоль), (2,4-дихлор-5,7-дигидропирроло[3,4-d]пиримидин-6-ил)-(4-метокситетрагидро-пиран-4-ил)метанона (92,60 мг, 278,76 μмоль) и ДИЭА (108,08 мг, 836,28 μмоль, 145,66 μл) в n-BuOH (2 мл) перемешивали при 80°С в течение 3 ч. Реакционную смесь фильтровали. Фильтрат очищали посредством препаративной ВЭЖХ с получением [2-хлор-4-[[(1R)-1-[3-(1,1-дифтор-2-метокси-этил)фенил]этил]амино]-5,7-дигидропирроло[3,4-d]пиримидин-6-ил]-(4-метокситетрагидропиран-4-ил)метанона (25 мг, выход 16,06%). ЖХМС (ИЭР): m/z: [М+Н] рассчитанное для C24H30ClF2N4O4: 511,2; полученное 511,2; 1H ЯМР (400 МГц, ДМСО-d6) δ м.д.=8,37-8,25 (м, 1H), 7,59 (с, 1H), 7,56-7,49 (м, 1H), 7,49-7,38 (м, 2Н), 5,37-5,28 (м, 1H), 4,87-4,75 (м, 2Н), 4,59-1,47 (м, 2Н), 3,89 (t,J=13,8 Гц, 2Н), 3,74-3,54 (м, 4Н), 3,17 и 3,13 (с, 3Н), 2,02-1,81 (м, 4Н), 1,50 (т, J=6,8 Гц, 3Н); 19F ЯМР (376 МГц, ДМСО-d6) δ м.д.=-101,02 (т, J=13,8 Гц), -101,06 (т, J=13,8 Гц).
Пример 540. Синтез N-[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]-2-(фторметил)-6-(морфолин-4-карбонил)-5H,6H,7H-пирроло[3,4-d]пиримидин-4-амина
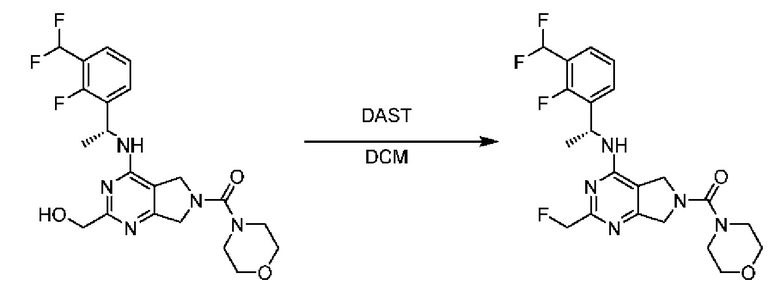
Этап 1.
[00759] В раствор (4-{[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]амино}-6-(морфолин-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-2-ил)метанола (420 мг, 0,93 ммоль) в ДХМ (12,6 мл) добавляли DAST (123 мкл, 0,93 моль) при 0°С и перемешивали смесь при в течение 2 ч при кт. Реакционную смесь гасили насыщ. водн. раствором NaHCO3 и экстрагировали ДХМ. Объединенные органические экстракты сушили над Na2SO4 и удаляли растворитель при пониженном давлении. Неочищенный продукт очищали посредством препаративной ВЭЖХ с получением N-[(1R)-1-[3-(дифторметил)-2-фторфенил]этил]-2-(фторметил)-6-(морфолин-4-карбонил)-5Н,6Н,7Н-пирроло[3,4-d]пиримидин-4-амина (19 мг, выход=5%). ЖХМС (ИЭР): точная масса для C21H23F4N5O2: 454,2; [М+Н]+=454,0 полученное; 1H ЯМР (300 МГц, ДМСО-d6) δ 7,91 (д, J=7,5 Гц, 1H), 7,64 (т, J=7,4 Гц, 1H), 7,50 (т, J=7,1 Гц, 1H), 7,29 (т, J=7,7 Гц, 1H), 7,23 (т, J=54,3 Гц, 1H), 5,72-5,54 (м, 1H), 5,15 (дд, J=47,0, 3,8 Гц, 2Н), 4,74-1,48 (м, 4Н), 3,64 (т, J=4,6 Гц, 4Н), 3,26 (т, J=4,7 Гц, 4Н), 1,51 (д, J=7,0 Гц, 3Н).
Биологические примеры
Анализ ассоциаций Bodipy-FL-GTP.
[00760] Этот анализ использовали для определения активности, с которой соединения ингибируют SOS1-опосредованный обмен KRAS-4B:GDP на KRAS-4B:GTP в определенных биохимических условиях. Низкое значение IC50 для заданного соединения указывает на высокую активность указанного соединения в ингибировании активности фактора обмена гуаниновых нуклеотидов (GEF) SOS1 на KRAS-4B в этих аналитических условиях.
[00761] Реагенты: BODIPY FL GTP (ThermoFisher Scientific, кат. G12411); KRAS4-B (Cytoskeleton Inc., кат.CSRS03); SOS1 (Cytoskeleton Inc., кат. CS-GE02); 2x аналитический буфер: 40 мМ Трис-HCl, рН 7,5; 100 мМ NaCl; 20 мМ MgCl2; 0,1 мг/мл БСА; 0,02% NP-40
[00762] Аналитическая процедура: Исследуемые соединения растворяли в ДМСО для создания 20 мМ основных маточных растворов. Эти маточные растворы потом разводили в серии 3× разведения в 100% ДМСО для получения 100× маточных растворов соединений. По 1 мкл маточного раствора каждого исследуемого соединения вносили в две соседние лунки 96-луночного аналитического планшета перед проведением анализа. Приготовление реакционной смеси: Для получения «реакционной смеси» при комнатной температуре смешивали следующие компоненты (5,75 мл 2× обменного буфера; 3,22 мл MilliQ ddH2O; 3 мкл 5 мМ BODIPY FL GTP; 230 мкл 50 мкМ KRAS-4B; общий объем 9,203 мл. Инициация реакции: По 80 мкл реакционной смеси пипеткой вносили в каждую лунку черного 96-луночного планшета с половинным объемом лунок (Corning, кат. 3686), содержащим 1 мкл ДМСО или 1 мкл исследуемого соединения в концентрациях, приведенных выше. Потом в каждую лунку добавляли по 20 мкл 1 мкМ SOS1 для инициации реакции. В случае контрольных лунок без GEF его заменяли 1× обменным буфером. Кинетические измерения: Реакционную смесь отслеживали в микропланшетном ридере SpectraMax М2 (Molecular Devices) согласно следующему протоколу: 5 секунд быстрого кругового смешивания перед первым считыванием; 61 считываний, промежуток 30 секунд; аналитическая температура: 22°С; длина волны возбуждения: 485 нм; длина волны испускания: 513 нм. Анализ данных: Значения Vmax для кривых SOS1-опосредованного обмена BODIPY FL GTP в присутствии исследуемых соединений нормализовали относительно колонок с наиболее разведенным исследуемым образцом или контрольных лунок, содержащих только ДМСО, для получения % активности для каждой концентрации исследуемого соединения. Графики зависимости % активности от Log10 концентрации соединения аппроксимировали с помощью нелинейной регрессии 4-параметрической логистической моделью.
Анализ ассоциаций Bodipy-FL-GTP (мкМ)
[00763] Результаты анализа ассоциаций Bodipy-FL-GTP приведены в таблице 8 ниже. Пояснение к таблице активности: <1 мкМ+; 1-5 мкМ++; >5 мкМ+++.


Анализ способа действия: Ингибирование активности нуклеотидного обмена SOS1
[00764] Целью этого анализа было изучение характеристик ингибирующей активности соединений на нуклеотидный обмен SOS1 KRAS. Данные были представлены в виде значений IC50 на основании сигнала TR-FRET.
[00765] Примечание - следующий протокол описывает процедуру для определения ингибирования активности нуклеотидного обмена SOS1 KRAS iдикого типа в ответ на соединение по изобретению. Можно использовать других мутантов KRAS и другие изоформы RAS.
[00766] В аналитическом буфере, содержащем 20 мМ ГЭПЭС, рН 7,5, 150 мМ NaCl, 5 мМ MgCl2, 0,05% Твин-20, 0,1% БСА, 1 мМ ДТТ, создавали концентрационные серии соединений в диапазоне от 100 мкМ до 1,7 нМ в одиннадцати 3-кратных серийных разведениях в 384-луночном аналитическом планшете в объеме 20 мкл. Сначала очищенный не содержащий метку каталитический домен SOS1 (остатки 564-1049) разводили в аналитическом буфере в концентрации 100 нМ, а потом в планшеты с соединениями непосредственно распределяли по 20 мкл содержащего SOS1 раствора. Смесь SOS1/соединение инкубировали при комнатной температуре с постоянным перемешиванием на орбитальном шейкере в течение 20 минут, чтобы реакция достигла равновесия. Смесь KRAS готовили путем разведения 66,7 нМ avi-меченного KRAS (остатки 1-169), 3,33 нМ стрептавидина-Tb и 333 нМ EDA-GTP-DY-647P1 в аналитическом буфере. Эту смесь готовили непосредственно перед добавлением смеси SOS1/соединение, чтобы предотвратить естественный нуклеотидный обмен. Потом в 384-луночный черный круглодонный планшет с малым объемом последовательно добавляли 5 мкл предварительно инкубированной смеси SOS1/соединение мкл и 7,5 мкл смеси KRAS и инкубировали при комнатной температуре с постоянным встряхиванием в течение 30 минут. Флуоресценцию с временным разрешением измеряли на планшет-ридере PerkinElmer Envision. ДМСО и 10 мкМ соединения (i) использовали в качестве отрицательного и положительного контроля, соответственно.
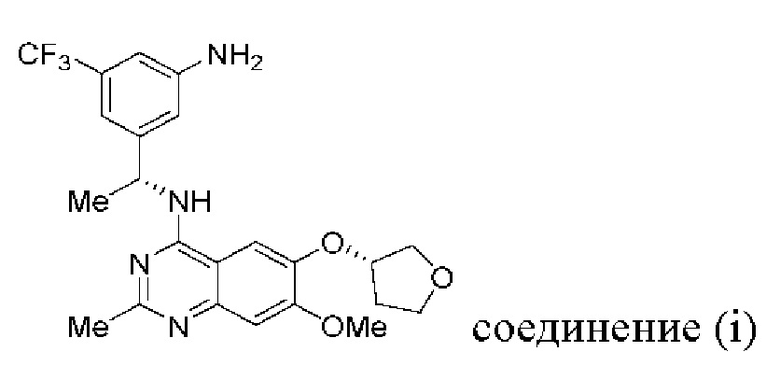
[00767] Для каждого соединения проводили по три повтора. Данные нормализовали следующим образом: (Положительный контроль - Сигнал образца)/(Положительный контроль - отрицательный контроль)*100. Данные аппроксимировали, используя четырехпараметрическую логистическую аппроксимацию.
[00768] Результаты анализа SOS1 TR-FRET IC50 приведены в таблице 9 ниже: Пояснение к таблице 6. ≤1 мкМ+; >1 мкМ++.
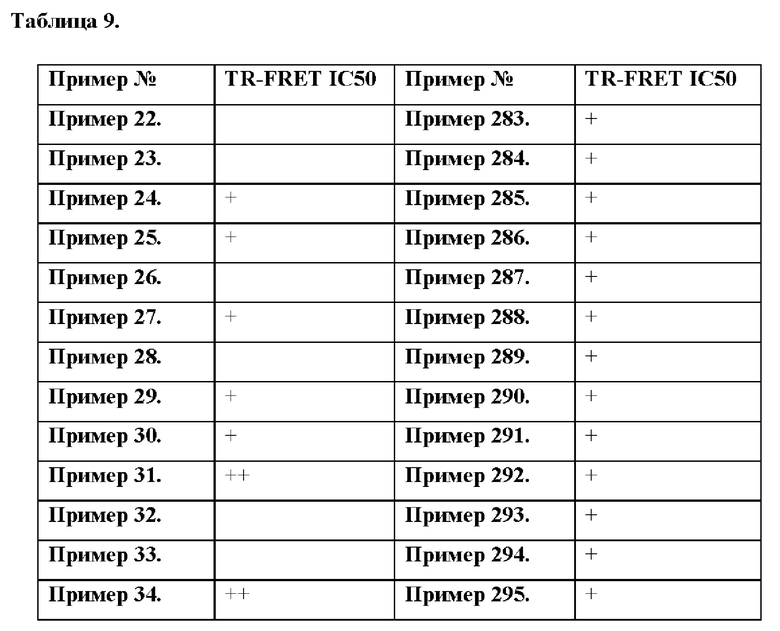

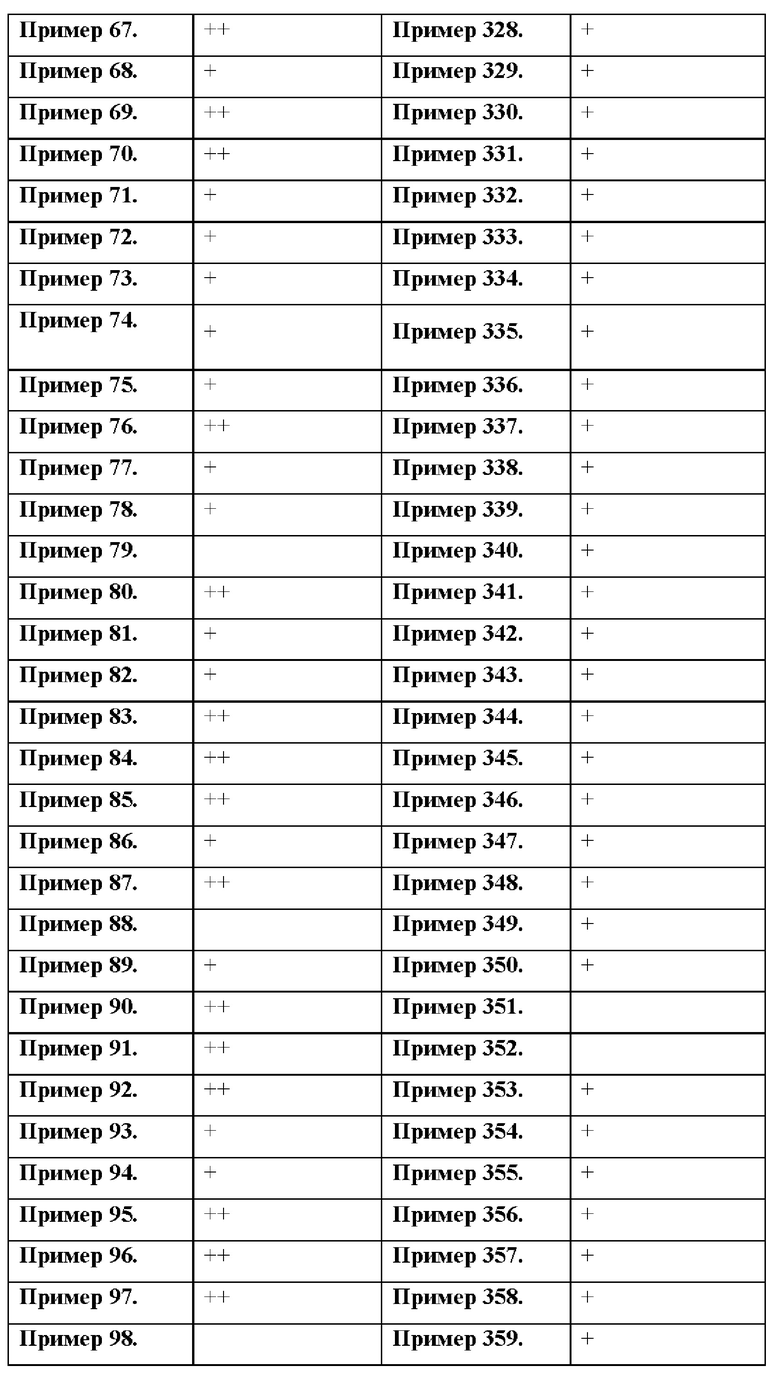






Анализ активности: Измерение аффинности связывания соединений по изобретению с SOS1 с помощью поверхностного плазменного резонанса (ППР)
[00769] Целью анализа ППР было измерение прямого связывания соединений с каталитическим доменом SOS1 (остатки 564-1049), иммобилизованном на сенсорном чипе. Данные представлены в виде значений равновесной константы диссоциации (Kd).
[00770] Используя инструмент GE Biacore 8K для ППР, avi-меченный белок каталитического домена SOS1 иммобилизовали до уровня приблизительно 6000 единиц ответа (ЕО) на покрытом стрептавидином сенсорном чипе ППР в аналитическом буфере, содержащем 0,01 М ГЭПЭС, 0,15 М NaCl и 0,05% об./об. сурфактанта Р20. В аналитическом буфере, содержащем 2% ДМСО, создавали концентрационные серии исследуемых соединений в диапазоне от 5 мкМ до 4,9 нМ в десяти 2-кратных разведениях. Для каждого исследуемого соединения создавали отдельный 0 мкМ образец для использования во время последующего вычитания двух референсных сигналов. Для каждого исследуемого соединения отдельные образцы разведения серийно проводили через иммобилизованный белок SOS1 при скорости потока 50 мкл/минута, чтобы определить связывание с SOS1. Диссоциацию связанного исследуемого соединения от белка SOS1 определяли незамедлительно путем проведения аналитического буфера через поверхность сенсора и определения снижения сигнала связывания до исходного уровня, наблюдаемого в отсутствие соединения. Это повторяли для всех разведений соединения в каждой серии. Уровень связывания для каждой концентрации исследуемого соединения определяли непосредственно перед концом фазы ассоциации, а вторичный построенный график отображает уровень связывания в зависимости от концентрации исследуемого соединения для каждой серии разведения соединения. Эти данные аппроксимировали моделью, описывающей обратимое равновесное 1:1 связывание между исследуемым соединением и SOS1, что дает оценочное значение Kd для взаимодействия.
[00771] Результаты для SOS1, полученные с помощью поверхностного плазмонного резонанса (ППР), приведены в таблице 10 ниже:
Пояснение к таблице 7. ≤0,4 мкМ+; >0,4 мкМ++.
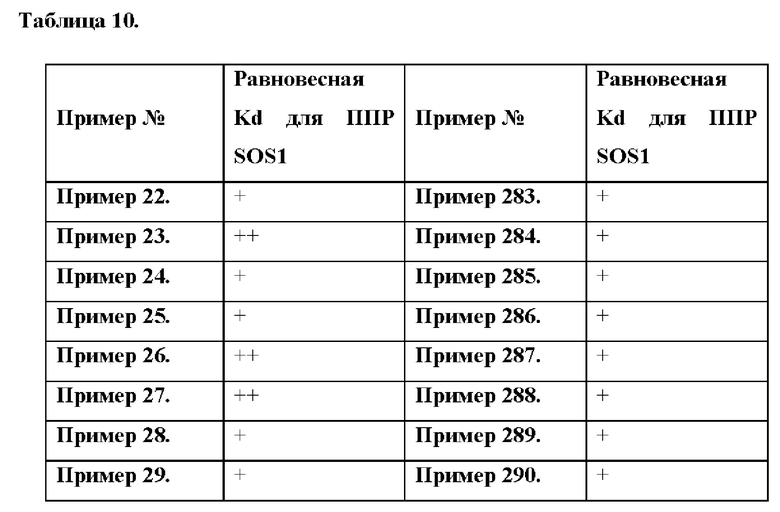





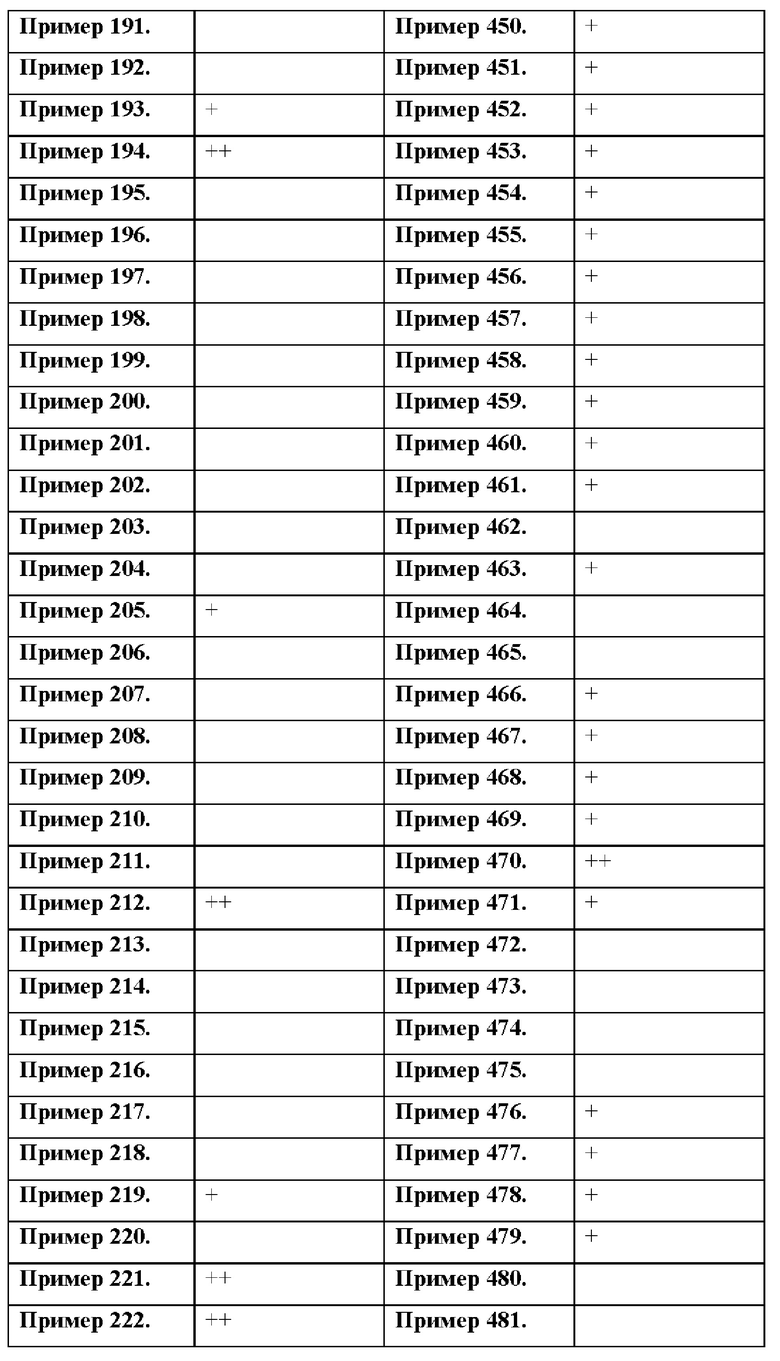


Анализ активности: pERK
[00772] Целью этого анализа является определение способности исследуемых соединений ингибировать функцию SOS1 в клетках. SOS1 активирует белки RAS путем катализа преобразования RAS-ГДФ в RAS-ГТФ в ответ на активацию рецепторной тирозинкиназы. Активация RAS индуцирует последовательность клеточных сигнальных событий, которая приводит к повышению фосфорилирования ERK в треоните 202 и тирозине 204 (pERK). Описанная ниже процедура позволяет определять уровень клеточного pERK в ответ на исследуемые соединения в клетках РС-9 (EGFR Ex19Del).
[00773] Клетки РС-9 выращивали и поддерживали, используя среду и процедуры, рекомендованные АТСС. Через одни сутки после добавления соединения клетки высевали в 384-луночные планшеты для клеточного культивирования (40 мкл/лунка) и выращивали в течение ночи в инкубаторе при 37°С, 5% СО2. Исследуемые соединений готовили в 10, 3-кратных разведениях в ДМСО с максимальной концентрацией 10 мМ. В день анализа в каждую лунку клеточного культурального планшета добавляли 40 нл исследуемого соединения, используя жидкостный манипулятор Echo550 (LabCyte). Концентрации исследуемого соединения исследовали в двух повторах с наибольшей исследуемой концентрацией 10 мкМ. После добавления соединения клетки инкубировали в течение 1 часа при 37°С, 5% СО2. После инкубации культуральную среду удаляли и один раз промывали клетки фосфатно-солевым буфером.
[00774] Уровень клеточного pERK определяли, используя аналитический набор AlphaLISA SureFire Ultra p-ERKl/2 (PerkinElmer). Клетки лизировали в 25 мкл лизисного буфера со встряхиванием при 600 об/мин при комнатной температуре в течение 15 минут. Лизат (10 мкл) переносили в 384-луночный Opti-планшет (PerkinElmer) и добавляли 5 мкл акцепторной смеси. Планшет центрифугировали при 1000 об/мин в течение 1 минуты и инкубировали в темноте в течение 2 часов. После этой инкубации добавляли 5 мкл донорной смеси, планшет герметично закрывали и центрифугировали при 1000 об/мин в течение 1 минуты, и инкубировали смесь в течение 2 часов при комнатной температуре. Сигнал считывали на планшет-ридере Envision (PerkinElmer), используя стандартные установки AlphaLISA. Анализ исходных данных проводили в Excel (Microsoft) и Prism (GraphPad). Строили график зависимости сигнала от десятичного логарифма концентрации соединений и определяли IC50 путем аппроксимации 4-параметрической сигмоидальной моделью ответа на концентрацию.
[00775] Результаты анализа SOS1 pERK IC50 приведены в таблице 11 ниже: Пояснение к таблице 8. ≤1 мкМ+; >1 мкМ++.







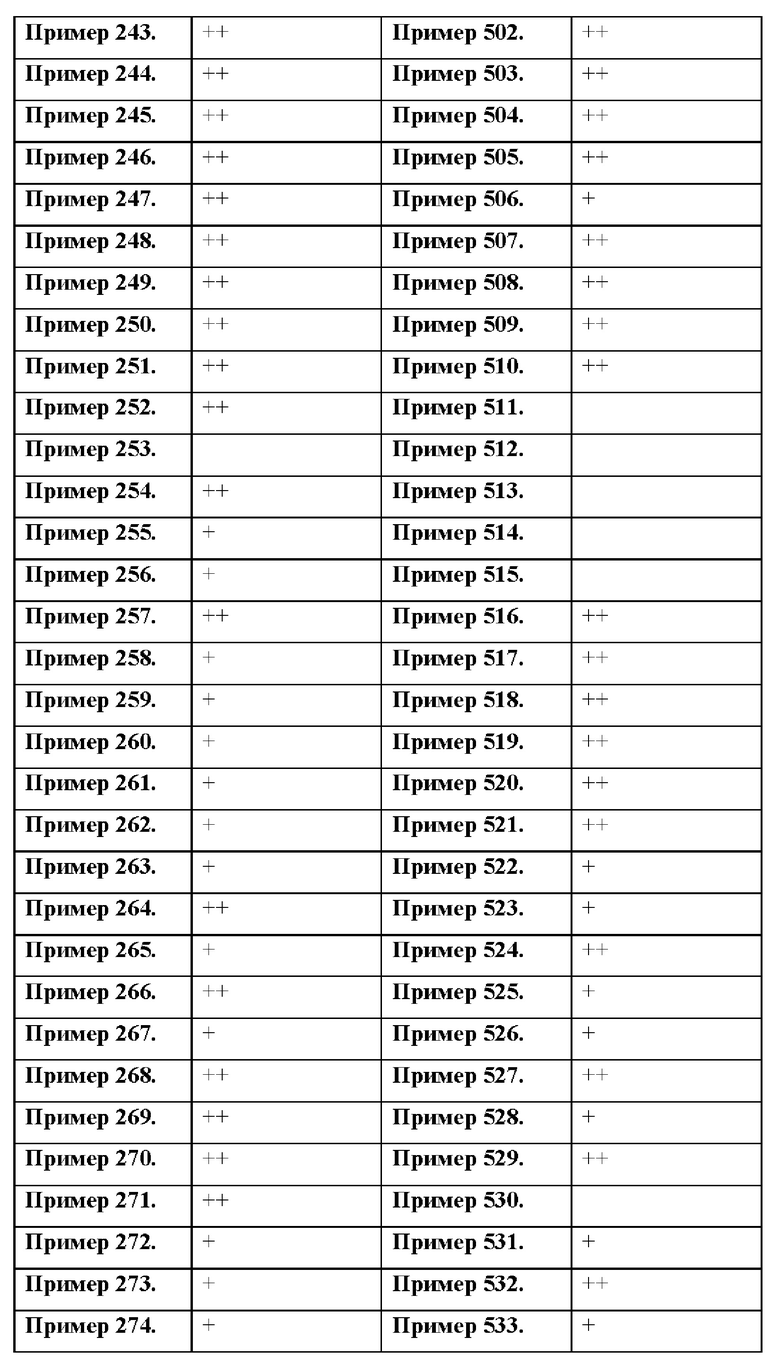

Эффект ингибитора SOS1 (соединения А) на in vivo рост опухолевых клеток, отдельно и в комбинации с ингибитором KRASG12C MRTX1257
[00776] Цель: Оценить эффективность ингибитора SOS1 - соединения А отдельно и в комбинации с ингибитором KRAS G12C MRTX1257 после перорального введения в модели с ксенотрансплантантом немелкоклеточного рака легкого человека (НМРЛ) NCI-H358 с бестимусными мышами.
[00777] Методы: Эффект ингибитора SOS1 по настоящему изобретению (соединения А) на рост опухолевых клеток in vivo оценивали в модели с ксенотрансплантантом НМРЛ NCI-Н358, используя самок бестимусных мышей линии balb/c (возрастом 6-8 недель). Мышам подкожно в бок имплантировали опухолевые клетки Н358 в 50% матригеле (5е6 клеток/мышь). После достижения опухолями среднего размера ~200 мм3 мышей рандомизировали в группы обработки и введения исследуемого препарата или носителя (2% НРМС, 0,1% Твин в 50 мМ натрий-цитратном буфере, рН 4). Массу тела и объем опухолей (с использованием цифрового штангенциркуля) измеряли дважды в неделю до конца исследования. Соединения вводили ежесуточно с помощью желудочного зонда.
[00778] Результаты: На Фиг. 1А показана эффективность повторяемого ежесуточного введения соединения А в дозе 50 и 250 мг/кг и/о (ингибирование роста опухолей, ИРО=44 и 78%, соответственно) и MRTX1257 в дозе 10 мг/кг (76%). Соединение А в дозе 250 мг/кг и MRTX1257 в качестве единственного агента вызывали значительное ингибирование роста опухолей по сравнению с контрольным носителем, ***р≤0,001 и *р≤0,05, соответственно, по оценке объема опухолей с помощью обычного однофакторного ANOVA наряду с множественными сравнениями с помощью апостериорного критерия Тьюки в программном обеспечении Graphpad Prism. Следует отметить, что для модели Н358 MRTX1257 в дозе 50 мг/кг обеспечивал регрессию, поэтому для изучения комбинированного эффекта с соединением А использовали субоптимальную дозу.
[00779] При введении в комбинации соединение А в дозе 50 мг/кг с MRTX1257 в дозе 10 мг/кг обеспечивали среднюю регрессию 21%. На момент завершения исследования 7/10 мышей в комбинированной группе достигли регрессии опухолей, составляющей >10% снижения относительно исходного уровня.
[00780] По оценкам массы тела все варианты обработки были хорошо переносимы в течение исследования (Фиг. 1В). На Фиг. 1С показана структура MRTX1257. MRTX1257 является коммерчески доступным (CAS №2206736-04-9).
[00781] Заключение: Соединение А демонстрировало статистически значимую и дозозависимую эффективность в модели с ксенотрансплантантом немелкоклеточного рака легкого NCI-H358 после ежесуточного перорального введения в дозе 50 мг/кг и 250 мг/кг.MRTX1257 также демонстрировал эффективность в этой модели в субоптимальной дозе 10 мг/кг ежесуточно. Соединение А в качестве единственного агента и в комбинации MRTX1257 было хорошо переносимо, а результатом комбинированной схемы стала регрессия у 7/10 мышей на момент завершения исследования.
Эквиваленты
[00782] Хотя настоящее изобретение было описано в сочетании с конкретными вариантами осуществления, приведенными выше, для специалистов в данной области техники будет очевидно существование многих альтернативных вариантов, модификаций и других их вариаций. Подразумевается, что все такие альтернативные варианты, модификации и вариации находятся в рамках сущности и объема настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2827714C1 |
| КЛАСС БИФУНКЦИОНАЛЬНЫХ ХИМЕРНЫХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ ДЛЯ НАПРАВЛЕННОГО РАЗРУШЕНИЯ АНДРОГЕННЫХ РЕЦЕПТОРОВ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2825000C2 |
| МОДУЛЯТОРЫ MAS-СВЯЗАННОГО РЕЦЕПТОРА G-БЕЛКА X2 И СВЯЗАННЫЕ С НИМИ ПРОДУКТЫ И СПОСОБЫ | 2021 |
|
RU2841536C1 |
| ИНГИБИТОРЫ РЕПЛИКАЦИИ ВИРУСА ГРИППА, СПОСОБЫ ИХ ПРИМЕНЕНИЯ И ИСПОЛЬЗОВАНИЕ | 2016 |
|
RU2737190C2 |
| ПИРРОЛОПИРИМИДИНЫ В КАЧЕСТВЕ ПОТЕНЦИАТОРОВ МВТР | 2017 |
|
RU2757457C2 |
| ЗАМЕЩЕННЫЕ 1,2-ДИГИДРО-3Н-ПИРАЗОЛО[3,4-D]ПИРИМИДИН-3-ОНЫ | 2019 |
|
RU2812726C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
| НОВОЕ ПРОИЗВОДНОЕ ПИПЕРИДИНА И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ИНГИБИРОВАНИЯ АУТОТАКСИНА | 2022 |
|
RU2834850C2 |
| СОЕДИНЕНИЯ АЗАЛАКТАМА В КАЧЕСТВЕ ИНГИБИТОРОВ HPK1 | 2021 |
|
RU2819642C1 |
| ЗАМЕЩЕННЫЕ ПИРАЗОЛОПИРИМИДИНЫ И ЗАМЕЩЕННЫЕ ПУРИНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ УБИКВИТИН-СПЕЦИФИЧЕСКОЙ ПРОЦЕССИРУЮЩЕЙ ПРОТЕАЗЫ 1 (USP1) | 2019 |
|
RU2833222C2 |
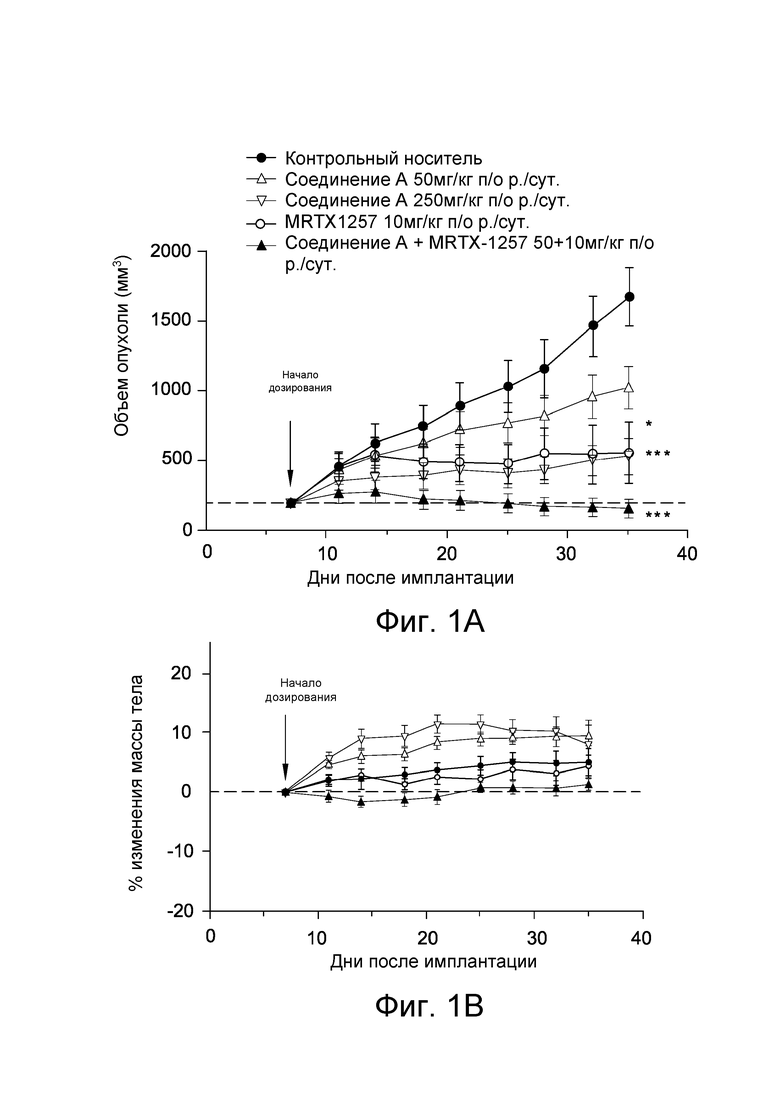
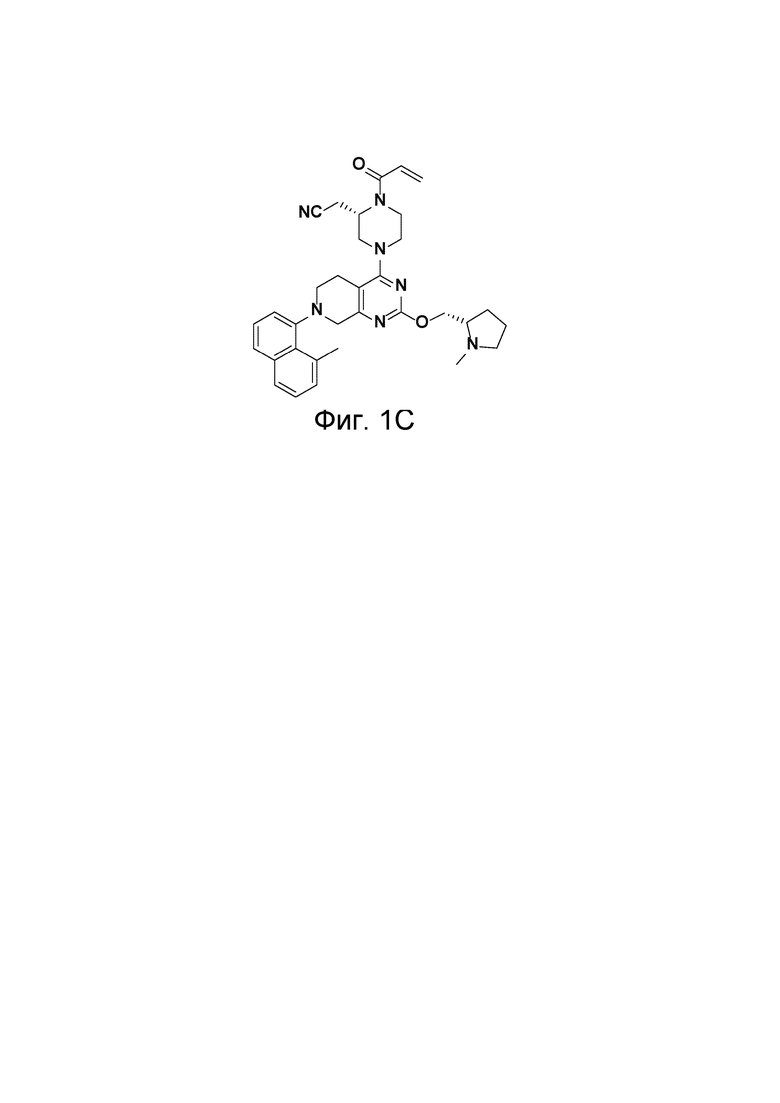
Изобретение относится к области химии и фармацевтики, а именно к соединениям формулы (I), обладающим свойствами ингибиторов SOS1 и их применению. Раскрываются соединения формулы (I), их фармацевтически приемлемые соли, сольваты, гидраты, стереоизомеры и таутомеры, обладающие свойствами ингибиторов SOS1, а также фармацевтические композиции на их основе, Способ ингибирования SOS1, Способ ингибирования взаимодействия SOS1 и белка семейства RAS в клетке или ингибирования взаимодействия SOS1 и RAC1 в клетке, Способ лечения или предотвращения заболевания, причем лечение или предотвращение заболевания характеризуется ингибированием взаимодействия SOS1 и белка семейства RAS или ингибированием взаимодействия SOS1 и RAC1 и Способ лечения или предотвращения рака с их использованием. В общей формул (I) Q1 представляет собой N; Q2 представляет собой N; Q4 представляет собой N; каждый из Q3 и Q5 независимо представляет собой C(RQC)2, NRQN, O, S или SO2, где каждый RQC независимо представляет собой H, F, Cl, Br или 6-10-членный арил, а каждый RQN независимо представляет собой H, C1-6 алкил или 6-10-членный арил; m равно 0, 1, 2 или 3; n равно 0, 1, 2 или 3; причем если m равно 0, то n не равно 0; R1 выбран из группы, состоящей из H, C1-6 алкила, галогена, –CONHR1a, -NHR1a, –OR1a, циклопропила, азетидинила и –CN; где каждый C1-6 алкил и азетидинил необязательно замещен галогеном, R1a, -NHR1a или –OR1a; где R1a представляет собой H, C1-6 алкил, циклопропил, 3-6-членный гетероциклил, включающий 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, или C1-6 галогеналкил; L2 выбран из группы, состоящей из связи, –C(O)–, –C(O)O–, –C(O)NH(CH2)o–, –S(O)2–, 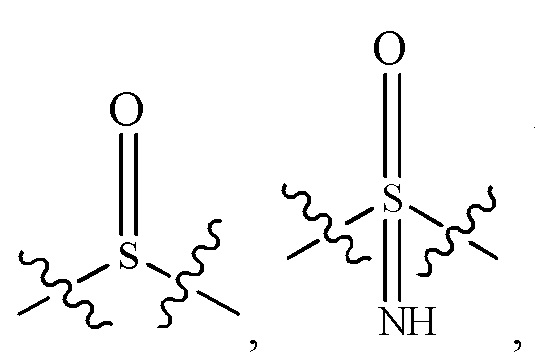
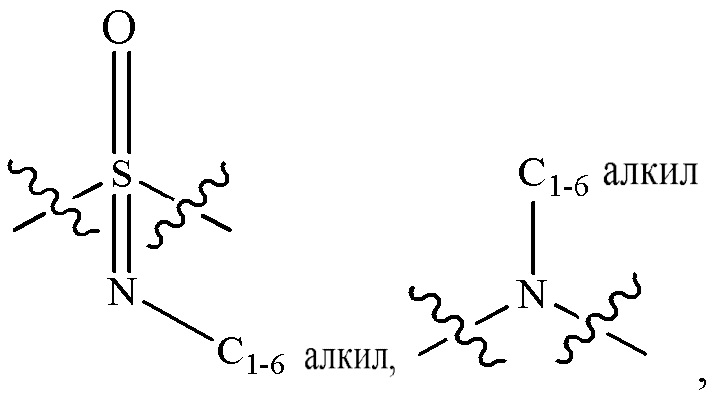 –C(O)(CH2)p–, –(CH2)p– и –O–; где o равно 0, 1 или 2; и где p представляет собой число от 1 до 6; R2 выбран из группы, состоящей из H, C1-6 алкила, -NR2bR2c, -OR2a, 3-14-членного циклоалкила, 3-14-членного циклоалкенила, 3-14-членного гетероциклила, включающего 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, 6-10-членного арила и 5-10-членного гетероарила, включающего 1-5 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы; где каждый C1-6 алкил, 3-14-членный циклоалкил, 3-14-членный циклоалкенил, 3-14-членный гетероциклил, включающий 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, 6-10-членный арил и 5-10-членный гетероарил, включающий 1-5 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы независимо необязательно замещен C1-6 алкилом, C1-6 галогеналкилом, C1-6 гидроксиалкилом, C1-6 метоксиалкилом, –OH, –OR2a, оксо, =N, галогеном, –C(O)R2a, –C(O)OR2a, –C(O)NR2bR2c, -SO2R2a, –CN, -NR2bR2c, 3-6-членным циклоалкилом, 3–7-членным гетероциклилом, включающим 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, 6-10-членным арилом или 5-10-членным гетероарилом, включающим 1-5 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы; R5, R6, R7, R8 и R9 независимо выбраны из группы, состоящей из H, D, C1-6 алкила, C2-6 алкенила, 4-8-членного циклоалкенила, C2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, включающего от 1 до 3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, -OH, галогена, -NO2, -CN, -NR11R12, -SR10, -S(O)2NR11R12, -S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, -C(O)R10 и -CO2R10, где каждый C1-6 алкил, C2-6 алкенил, 4-8-членный циклоалкенил, C2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил, включающий 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, независимо необязательно замещены -OH, галогеном, -NO2, оксо, -CN, -R10, -OR10, -NR11R12, -SR10, -S(O)2NR11R12, -S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, 3-8-членным циклоалкилом, 3-14-членным гетероциклилом, содержащим 1-3 кольцевых гетероатома, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, 6-10-членным арилом или 5-10-членным гетероарилом, содержащим 1-5 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы, или любые два соседних R5, R6, R7, R8 и R9 образуют 3-14-членное конденсированное кольцо. 6 н. и 17 з.п. ф-лы, 3 ил., 2 табл., 540 пр.
–C(O)(CH2)p–, –(CH2)p– и –O–; где o равно 0, 1 или 2; и где p представляет собой число от 1 до 6; R2 выбран из группы, состоящей из H, C1-6 алкила, -NR2bR2c, -OR2a, 3-14-членного циклоалкила, 3-14-членного циклоалкенила, 3-14-членного гетероциклила, включающего 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, 6-10-членного арила и 5-10-членного гетероарила, включающего 1-5 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы; где каждый C1-6 алкил, 3-14-членный циклоалкил, 3-14-членный циклоалкенил, 3-14-членный гетероциклил, включающий 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, 6-10-членный арил и 5-10-членный гетероарил, включающий 1-5 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы независимо необязательно замещен C1-6 алкилом, C1-6 галогеналкилом, C1-6 гидроксиалкилом, C1-6 метоксиалкилом, –OH, –OR2a, оксо, =N, галогеном, –C(O)R2a, –C(O)OR2a, –C(O)NR2bR2c, -SO2R2a, –CN, -NR2bR2c, 3-6-членным циклоалкилом, 3–7-членным гетероциклилом, включающим 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, 6-10-членным арилом или 5-10-членным гетероарилом, включающим 1-5 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы; R5, R6, R7, R8 и R9 независимо выбраны из группы, состоящей из H, D, C1-6 алкила, C2-6 алкенила, 4-8-членного циклоалкенила, C2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, включающего от 1 до 3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, -OH, галогена, -NO2, -CN, -NR11R12, -SR10, -S(O)2NR11R12, -S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, -C(O)R10 и -CO2R10, где каждый C1-6 алкил, C2-6 алкенил, 4-8-членный циклоалкенил, C2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил, включающий 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, независимо необязательно замещены -OH, галогеном, -NO2, оксо, -CN, -R10, -OR10, -NR11R12, -SR10, -S(O)2NR11R12, -S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, 3-8-членным циклоалкилом, 3-14-членным гетероциклилом, содержащим 1-3 кольцевых гетероатома, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, 6-10-членным арилом или 5-10-членным гетероарилом, содержащим 1-5 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы, или любые два соседних R5, R6, R7, R8 и R9 образуют 3-14-членное конденсированное кольцо. 6 н. и 17 з.п. ф-лы, 3 ил., 2 табл., 540 пр.
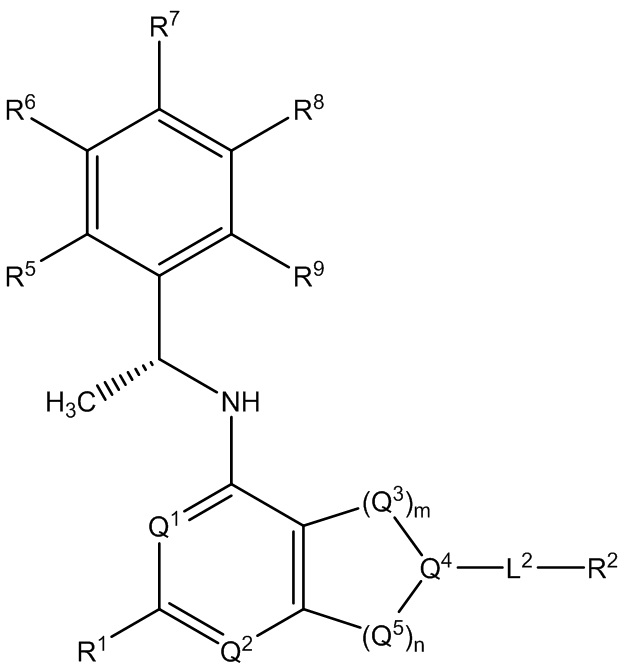 (I)
(I)
1. Соединение, имеющее структуру:
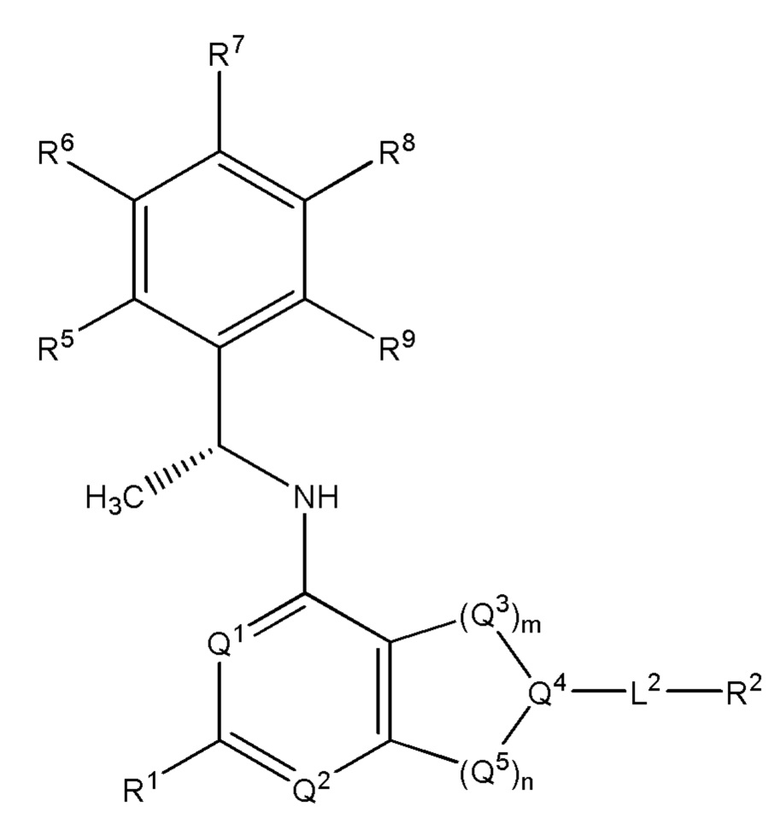
или его фармацевтически приемлемые соль, сольват, гидрат, стереоизомер или таутомер, где:
Q1 представляет собой N;
Q2 представляет собой N;
Q4 представляет собой N;
каждый из Q3 и Q5 независимо представляет собой C(RQC)2, NRQN, О, S или SO2, где каждый RQC независимо представляет собой Н, F, Cl, Br или 6-10-членный арил, а каждый RQN независимо представляет собой Н, C1-6 алкил или 6-10-членный арил;
m равно 0, 1, 2 или 3;
n равно 0, 1, 2 или 3;
причем если m равно 0, то n не равно 0;
R1 выбран из группы, состоящей из Н, C1-6 алкила, галогена, -CONHR1a, -NHR1a, -OR1a, циклопропила, азетидинила и -CN; где каждый C1-6 алкил и азетидинил необязательно замещен галогеном, R1a, -NHR1a или -OR1a; где R1a представляет собой Н, C1-6 алкил, циклопропил, 3-6-членный гетероциклил, включающий 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, или C1-6 галогеналкил;
L2 выбран из группы, состоящей из связи, -С(О)-, -С(O)O-, -C(O)NH(CH2)o-, -
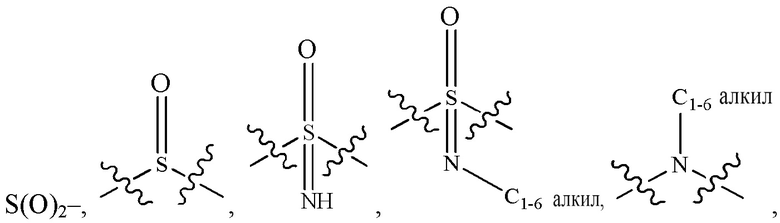 -С(O)(СН2)р-, -(СН2)р- и -О-; где о равно 0, 1 или 2; и где р представляет собой число от 1 до 6;
-С(O)(СН2)р-, -(СН2)р- и -О-; где о равно 0, 1 или 2; и где р представляет собой число от 1 до 6;
R2 выбран из группы, состоящей из Н, C1-6 алкила, -NR2bR2c, -OR2a, 3-14-членного циклоалкила, 3-14-членного циклоалкенила, 3-14-членного гетероциклила, включающего 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, 6-10-членного арила и 5-10-членного гетероарила, включающего 1-5 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы; где каждый C1-6 алкил, 3-14-членный циклоалкил, 3-14-членный циклоалкенил, 3-14-членный гетероциклил, включающий 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, 6-10-членный арил и 5-10-членный гетероарил, включающий 1 -5 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы независимо необязательно замещен C1-6 алкилом, C1-6 галогеналкилом, C1-6 гидроксиалкилом, C1-6 метоксиалкилом, -ОН, -OR2a, оксо, =N, галогеном, -C(O)R2a, -C(O)OR2a, -C(O)NR2bR2c, -SO2R2a, -CN, -NR2bR2c, 3-6-членным циклоалкилом, 3-7-членным гетероциклилом, включающим 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, 6-10-членным ар илом или 5-10-членным гетероарилом, включающим 1-5 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы;
где R2a представляет собой Н, C1-6 алкил, C1-6 галогеналкил, 3-7-членный гетероциклил, включающий 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, или -(СН2)rOCH3, где г равно 1, 2 или 3;
где R2b представляет собой Н или C1-6 алкил;
где R2c представляет собой Н или C1-6 алкил;
R5, R6, R7, R8 и R9 независимо выбраны из группы, состоящей из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, включающего от 1 до 3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, -ОН, галогена, -NO2, -CN, -NR11R12, -SR10, -S(O)2NR11R12, -S(O)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, -C(O)R10 и -CO2R10, где каждый C1-6 алкил, С2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил, включающий 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, независимо необязательно замещены -ОН, галогеном, -NO2, оксо, -CN, -R10, -OR10, -NR11R12, -SR10, -S(O)2NR11R12, -S(0)2R10, -NR10S(O)2NR11R12, -NR10S(O)2R11, -S(O)NR11R12, -S(O)R10, -NR10S(O)NR11R12, -NR10S(O)R11, 3-8-членным циклоалкилом, 3-14-членным гетероциклилом, содержащим 1-3 кольцевых гетероатома, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, 6-10-членным арилом или 5-10-членным гетероарилом, содержащим 1-5 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы, или любые два соседних R5, R6, R7, R8 и R9 образуют 3-14-членное конденсированное кольцо;
R10, R11 и R12 в каждом случае независимо выбраны из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила, 3-14-членного гетероциклила, включающего от 1 до 3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, -OR13, -SR13, галогена, -NR13R14, -NO2 и -CN; и
R13 и R14 в каждом случае независимо выбраны из Н, D, C1-6 алкила, С2-6 алкенила, 4-8-членного циклоалкенила, С2-6 алкинила, 3-8-членного циклоалкила и 3-14-членного гетероциклила, включающего 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, где каждый C1-6 алкил, С2-6 алкенил, 4-8-членный циклоалкенил, С2-6 алкинил, 3-8-членный циклоалкил и 3-14-членный гетероциклил, включающий от 1 до 3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, независимо необязательно замещены -ОН, -SH, -NH2, -NO2 или -CN;
при условии, что когда 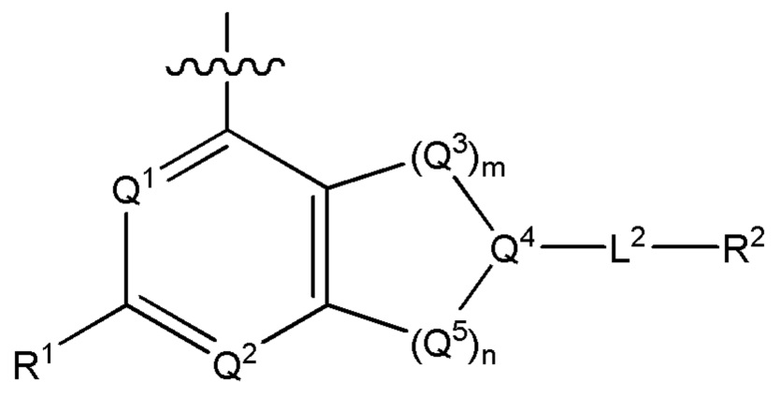 представляет собой
представляет собой 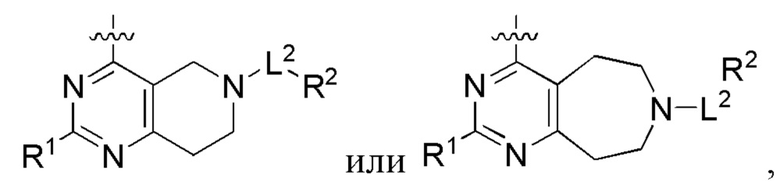
то R1 не представляет собой Н.
2. Соединение по п. 1, или его фармацевтически приемлемые соль, сольват, гидрат, стереоизомер или таутомер, где:
R1 выбран из группы, состоящей из Н, галогена, C1-6 алкила, циклопропила, -CN и -OR1a; где R1a представляет собой Н или C1-6 алкил;
L2 выбран из группы, состоящей из связи, -С(О)-, -С(O)O- -C(O)NH(CH2)o-, -S(O)2- -С(O)(СН2)р-, -(СН2)р- или -О-; где о равно 0, 1 или 2; и где р представляет собой число от 1 до 6; и
R2 выбран из группы, состоящей из Н, -(CH2)qCH3, 3-14-членного циклоалкила, 3-14-членного циклоалкенила, 3-14-членного гетероциклила, включающего 1-3 кольцевых атомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, 6-10-членного арила и 5-10-членного гетероарила, включающего 1-5 кольцевых атомов, выбранных из группы, состоящей из кислорода, азота и серы; где q представляет собой число от 1 до 5; где каждый 3-14-членный циклоалкил, 3-14-членный циклоалкенил, 3-14-членный гетероциклил, включающий 1-3 кольцевых атомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, 6-10-членный арил или 5-10-членный гетероарил, включающий 1-5 кольцевых атомов, выбранных из группы, состоящей из кислорода, азота и серы, необязательно замещен C1-6 алкилом, -ОН, галогеном, -C(O)R2a или -C(O)NR2bR2c; где R2a представляет собой C1-6 алкил или -(СН2)rOCH3, где r равно 1, 2 или 3; где R2b представляет собой Н или C1-6 алкил; и где R2c представляет собой Н или C1-6 алкил.
3. Соединение по п. 1, или его фармацевтически приемлемые соль, сольват, гидрат, стереоизомер или таутомер, где:
R1 выбран из группы, состоящей из Н, галогена, C1-6 алкила, циклопропила, -CN и -OR1a; где R1a представляет собой Н или C1-6 алкил; и
L2 выбран из группы, состоящей из связи, -С(О)-, -С(O)O-, -C(O)NH(CH2)o-, -S(O)2-, -С(O)(СН2)р-, -(СН2)р- или -О-; где о равно 0, 1 или 2; и где р представляет собой число от 1 до 6.
4. Соединение по п. 1 или его фармацевтически приемлемые соль, сольват, гидрат, стереоизомер или таутомер, где 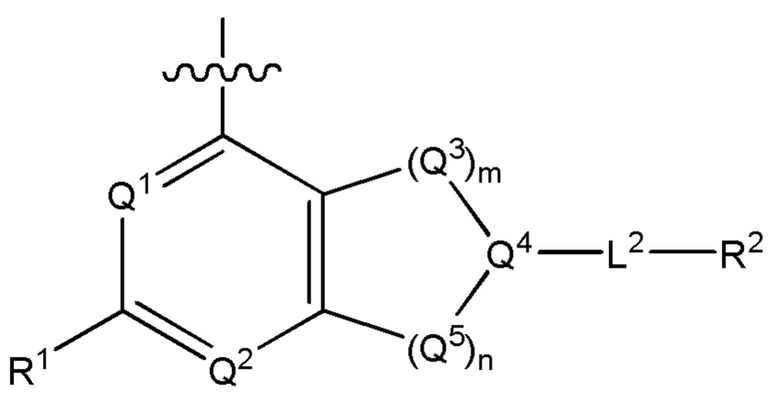 выбран из группы, состоящей из
выбран из группы, состоящей из 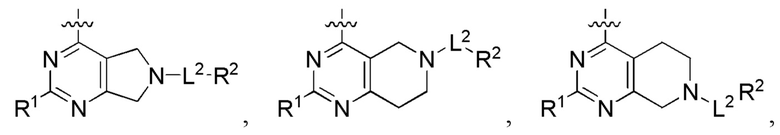
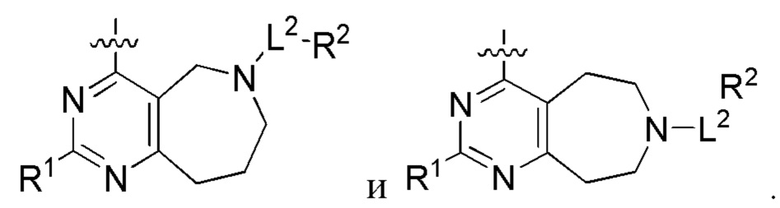
5. Соединение по п. 1 или его фармацевтически приемлемые соль, сольват, гидрат, стереоизомер или таутомер, где 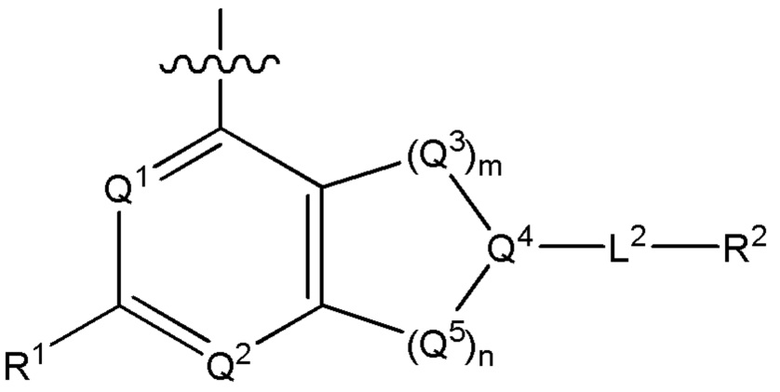 выбран из группы, состоящей из
выбран из группы, состоящей из 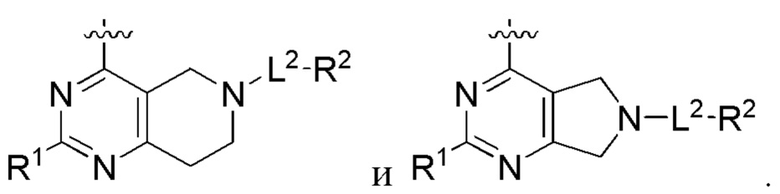
6. Соединение по любому из пп. 1-5 или его фармацевтически приемлемые соль, сольват, гидрат, стереоизомер или таутомер, где R1 выбран из группы, состоящей из H, C1-6 алкила, галогена, -NHR1a, -OR1a, циклопропила и -CN; где каждый C1-6 алкил необязательно замещен галогеном, -NHR1a или -OR1a; где R1a представляет собой Н, C1-6 алкил, 3-6-членный гетероциклил, включающий 1-3 кольцевых гетероатома, выбранных из группы, состоящей из кислорода, азота и серы, или C1-6 галогеналкил.
7. Соединение по любому из пп. 1-5 или его фармацевтически приемлемые соль, сольват, гидрат, стереоизомер или таутомер, где R1 представляет собой Н, галоген, C1-6 алкил, циклопропил, -CN или -OR1a; где R1a представляет собой Н или C1-6 алкил.
8. Соединение по любому из пп. 1-7 или его фармацевтически приемлемые соль, сольват, гидрат, стереоизомер или таутомер, где L2 выбран из группы, состоящей из связи, -С(О)-, -С(O)O-, -C(O)NH(CH2)o-, -S(O)2-, -С(O)(СН2)р-, -(СН2)р- и -О-; где о равно 0, 1 или 2; и где р представляет собой число от 1 до 6.
9. Соединение по любому из пп. 1-7 или его фармацевтически приемлемые соль, сольват, гидрат, стереоизомер или таутомер, где L2 выбран из группы, состоящей из  и
и 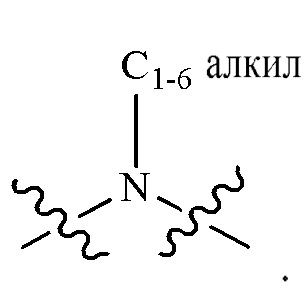
10. Соединение по любому из пп. 1-9 или его фармацевтически приемлемые соль, сольват, гидрат, стереоизомер или таутомер, где R2 выбран из группы, состоящей из Н, C1-6 алкила, -NR2bR2c, -OR2a, 3-14-членного циклоалкила, 3-14-членного циклоалкенила, 3-14-членного гетероциклила, включающего 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, 6-10-членного арила и 5-10-членного гетероарила, включающего 1-5 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы; где каждый C1-6 алкил, 3-14-членный циклоалкил, 3-14-членный циклоалкенил, 3-14-членный гетероциклил, включающий 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, 6-10-членный арил и 5-10-членный гетероарил, включающий 1-5 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы, независимо необязательно замещен d.6 алкилом, -ОН, -OR2a, оксо, =N, галогеном, -C(O)R2a, -C(O)OR2a, -C(O)NR2bR2c, -CN, -NR2bR2c, 3-6-членным циклоалкилом, 3-7-членным гетероциклилом, включающим 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, 6-10-членным арилом или 5-10-членным гетероарилом, включающим 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы.
11. Соединение по любому из пп. 1-10 или его фармацевтически приемлемые соль, сольват, гидрат, стереоизомер или таутомер, где R2 представляет собой 3-14-членный гетероциклил, включающий 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, где 3-14-членный гетероциклил, включающий 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, необязательно замещен C1-6 алкилом, необязательно замещенным -OR2a, -ОН, -OR2a, оксо, =N, галогеном, -C(O)R2a, -C(O)OR2a, -C(O)NR2bR2c, -SO2R2a, -CN, -NR2bR2c, 3-6-членным циклоалкилом, 3-7-членным гетероциклилом, включающим 1-3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, 6-10-членным арилом или 5-10-членным гетероарилом, включающим 1-5 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы; где R2a представляет собой Н, C1-6 алкил, C1-6 галогеналкил, 3-7-членный гетероциклил, включающий 1 -3 кольцевых гетероатомов, выбранных из группы, состоящей из кислорода, азота, фосфора и серы, или -(СН2)rOCH3, где r равно 1, 2 или 3; где R2b представляет собой Н или C1-6 алкил; и где R2c представляет собой Н или C1-6 алкил.
12. Соединение по п. 1 или его фармацевтически приемлемые соль, сольват, гидрат, стереоизомер или таутомер, выбранные из группы, состоящей из:
13. Соединение по п. 1 или его фармацевтически приемлемые соль, сольват, гидрат, стереоизомер или таутомер или изомер, выбранные из группы, состоящей из:
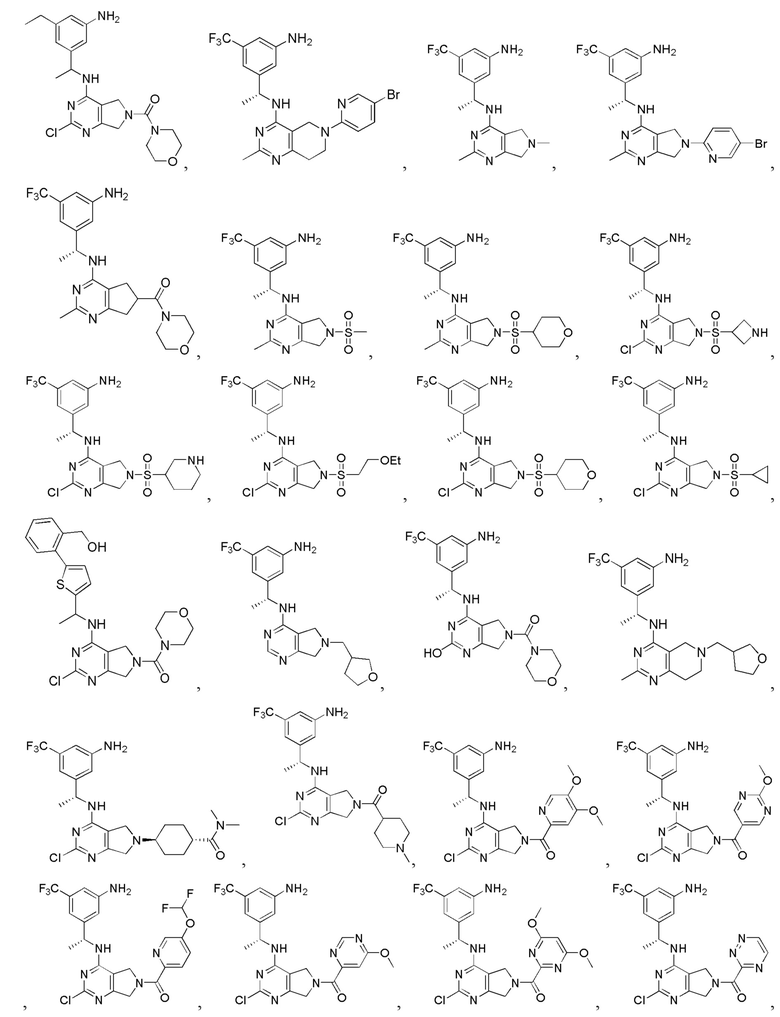
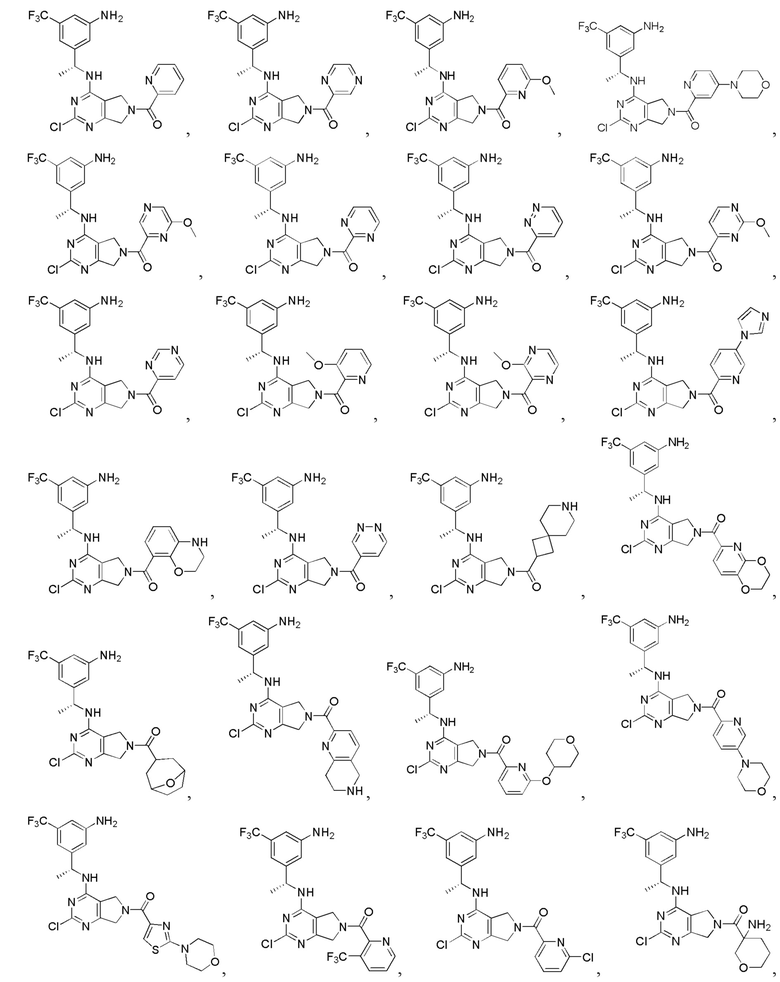
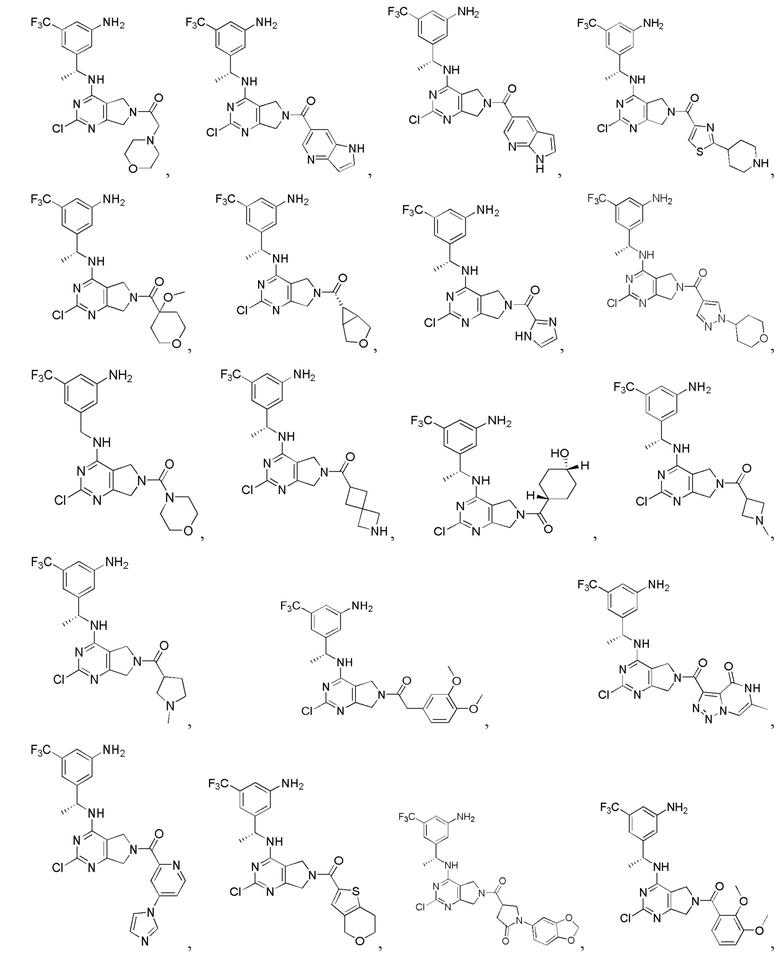
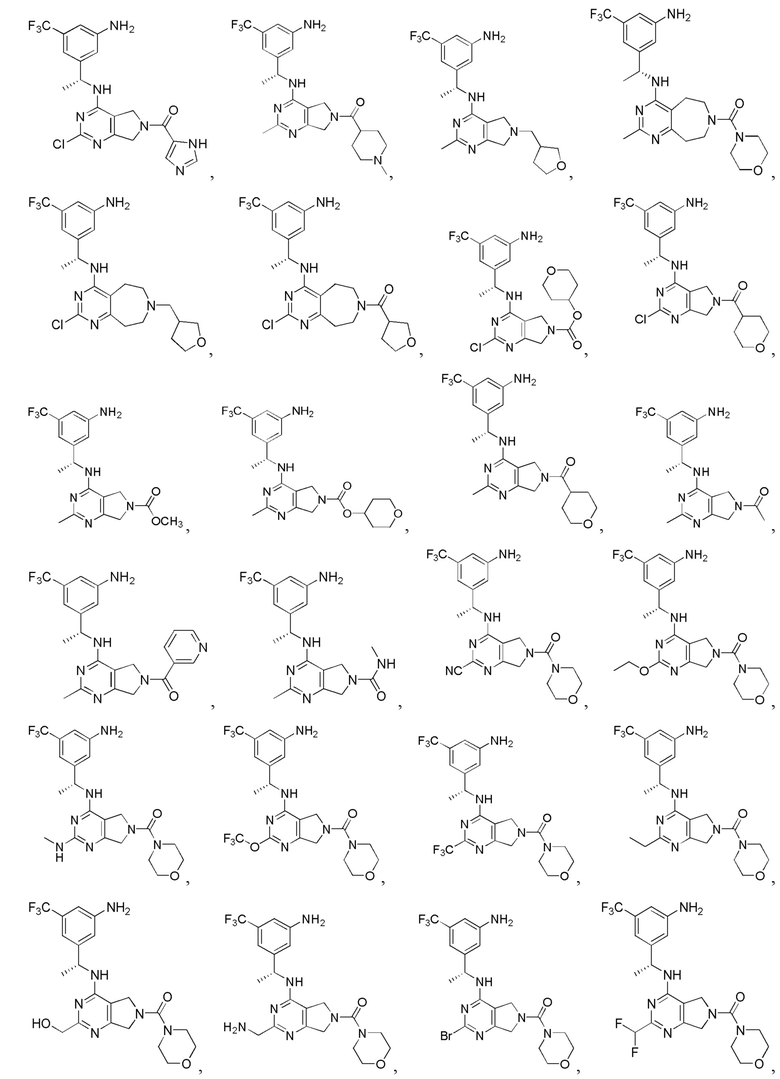
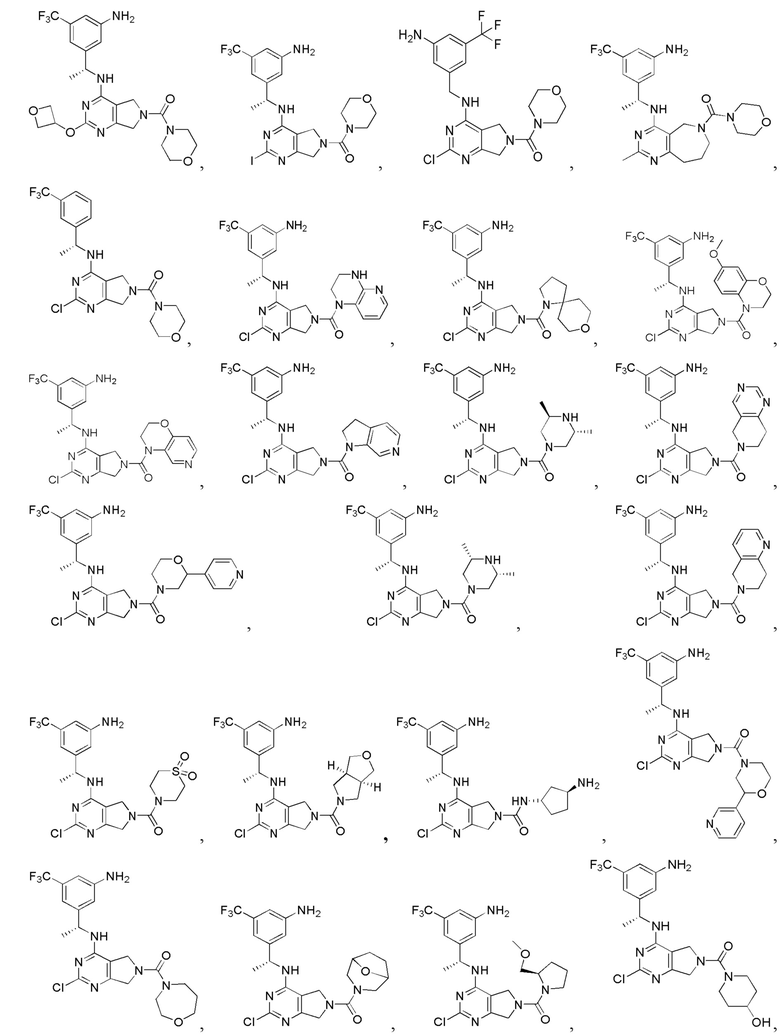
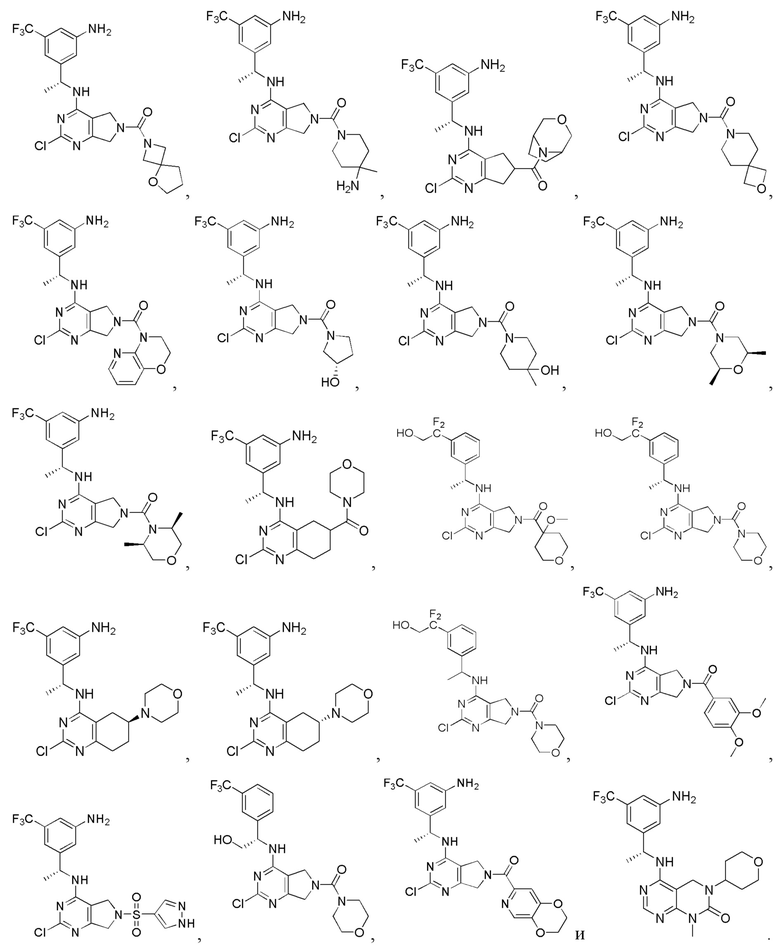
14. Соединение по п. 1 или его фармацевтически приемлемые соль, сольват, гидрат, стереоизомер или таутомер, выбранные из группы, состоящей из:
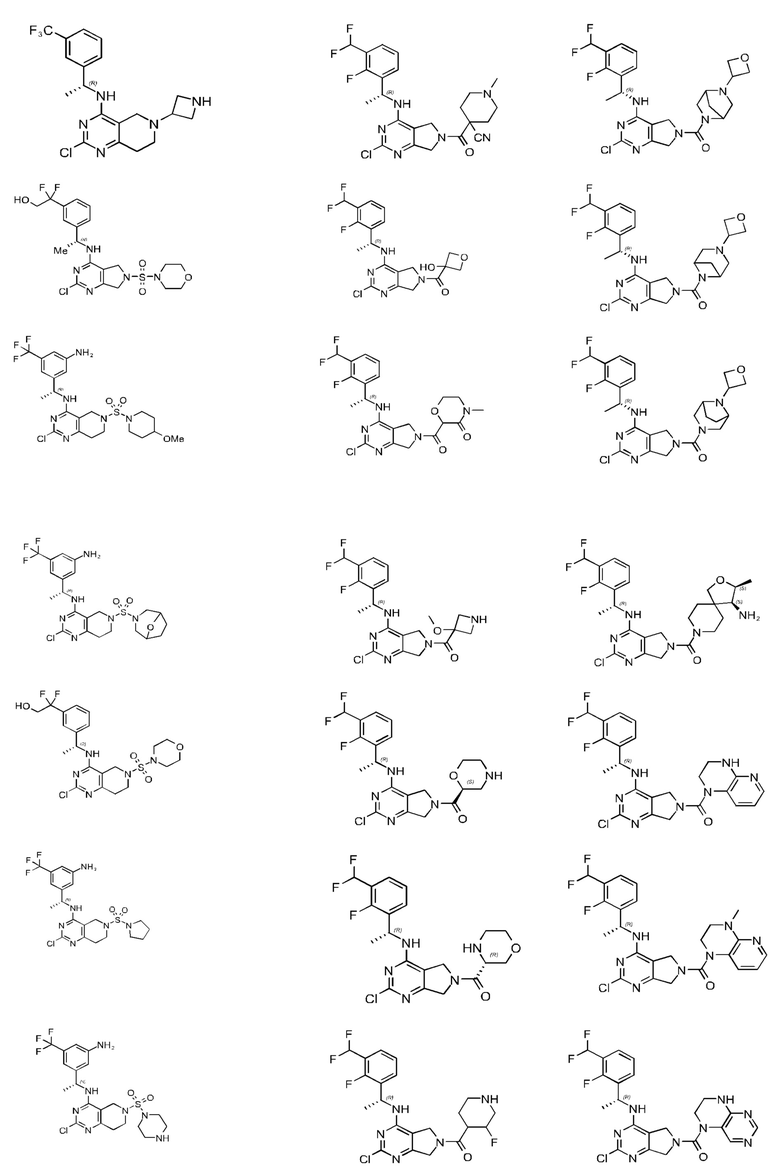
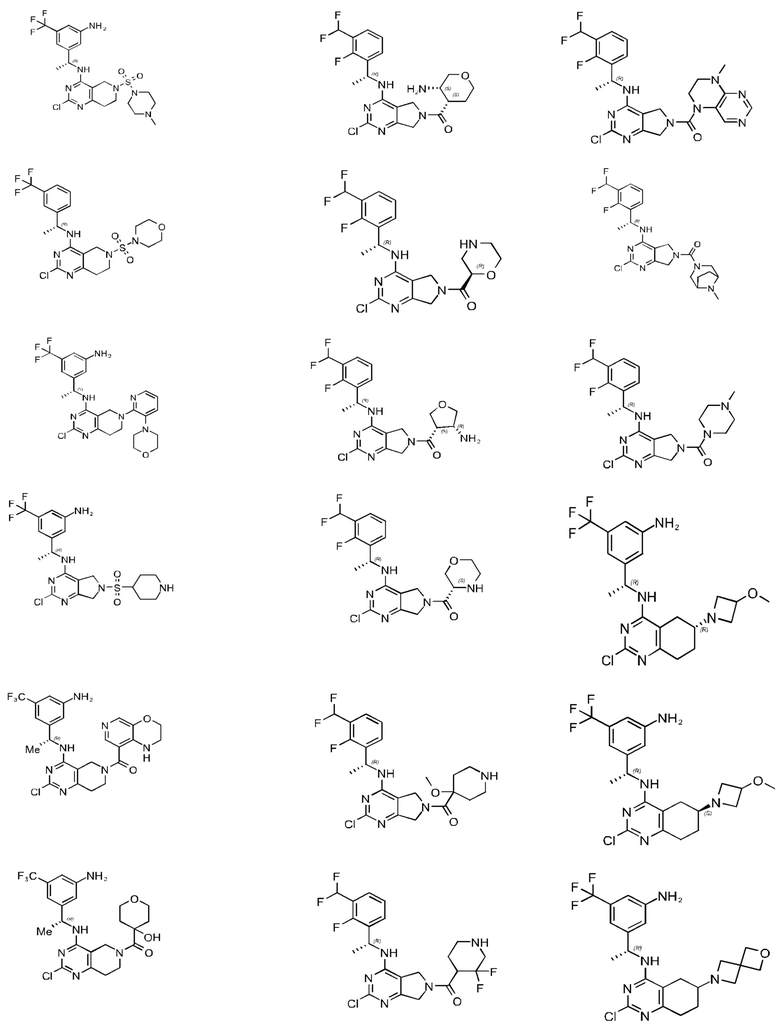
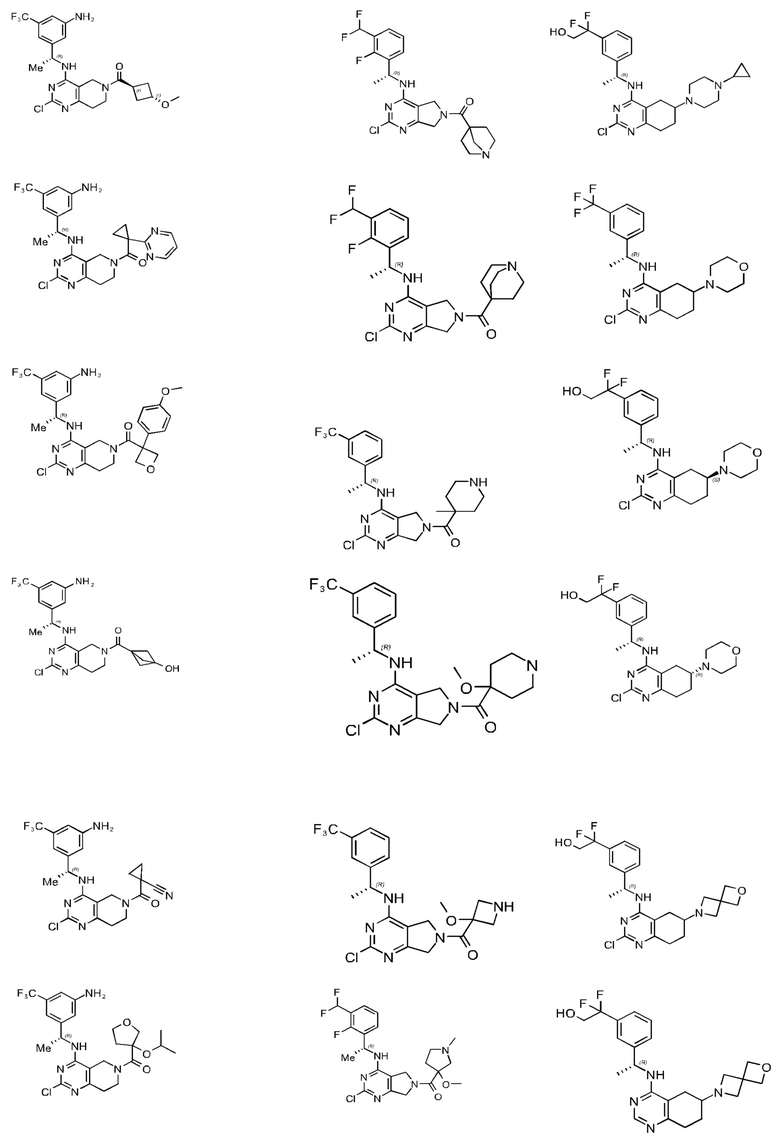
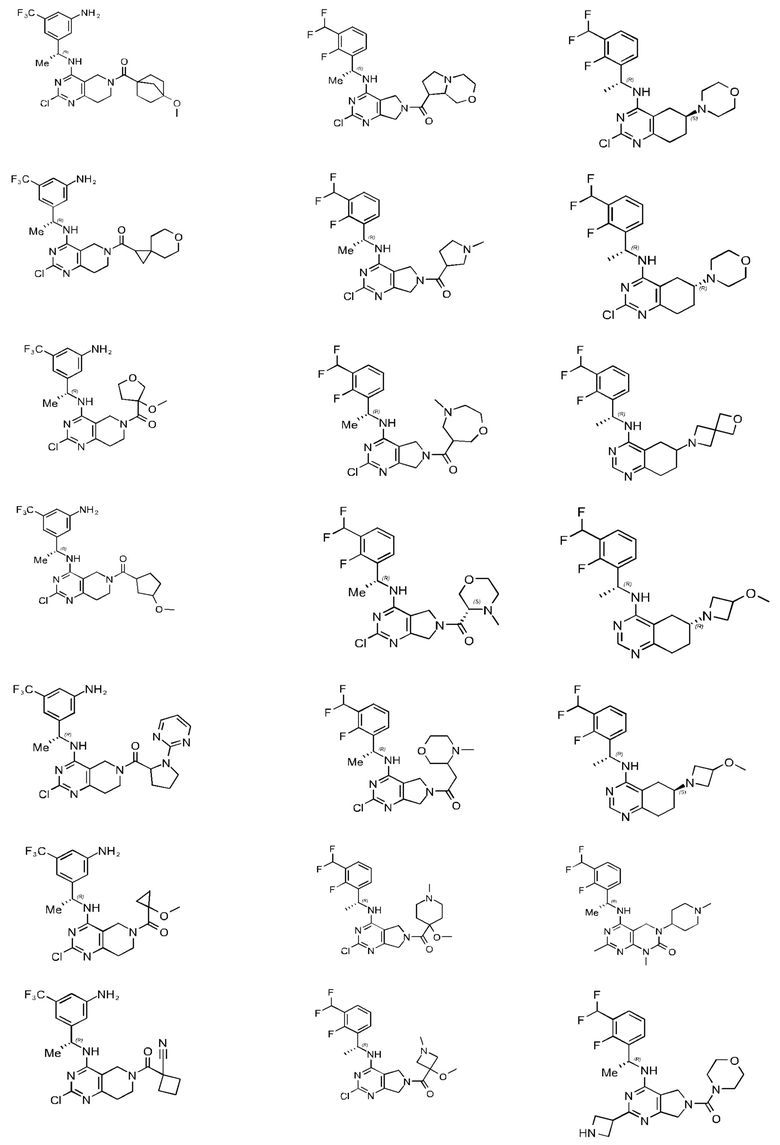
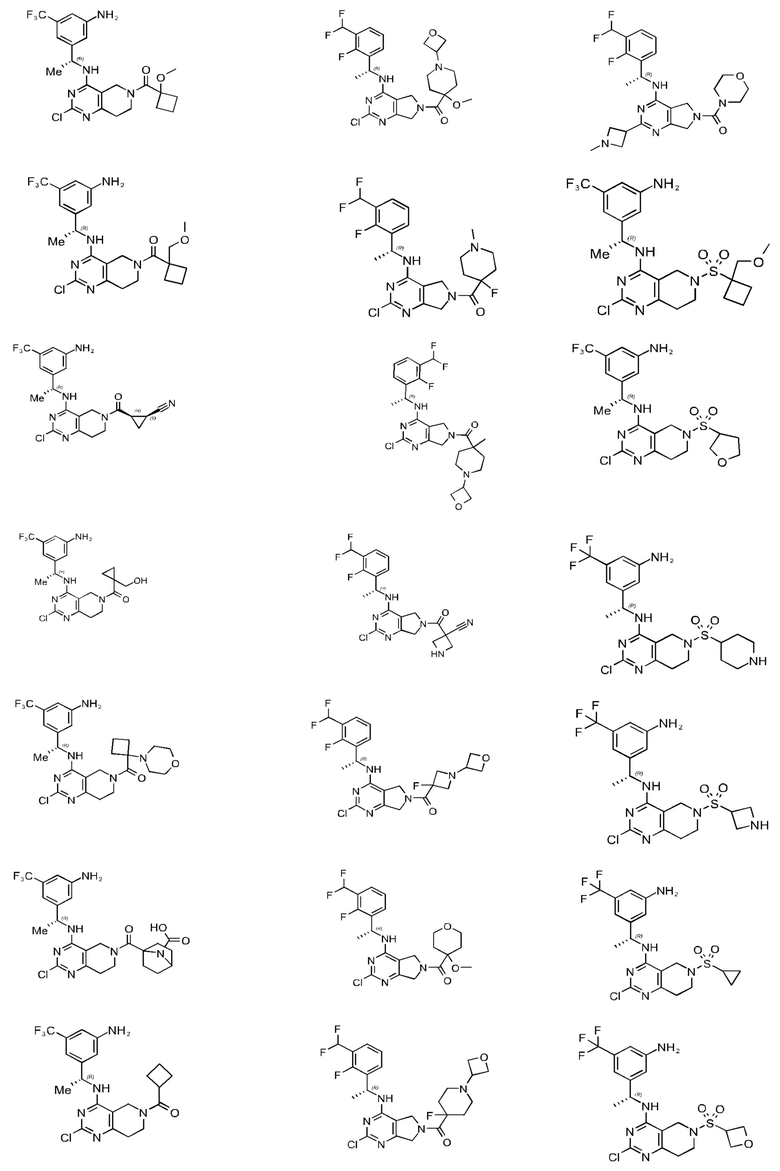
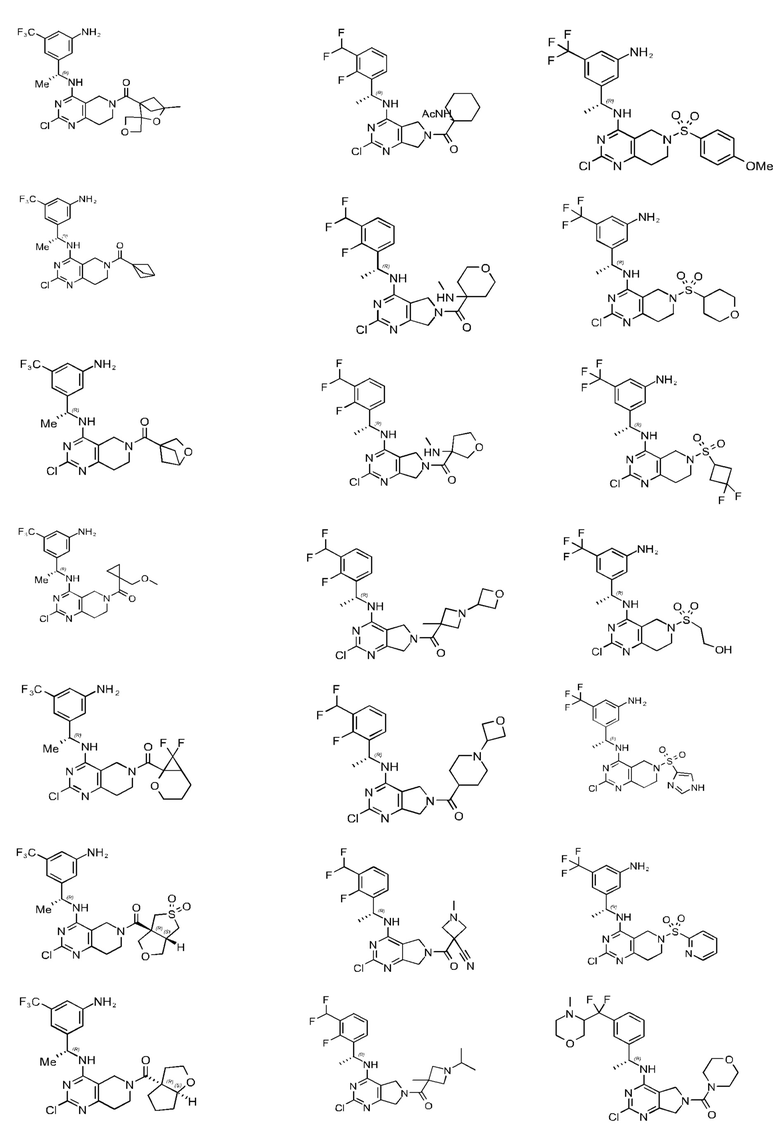
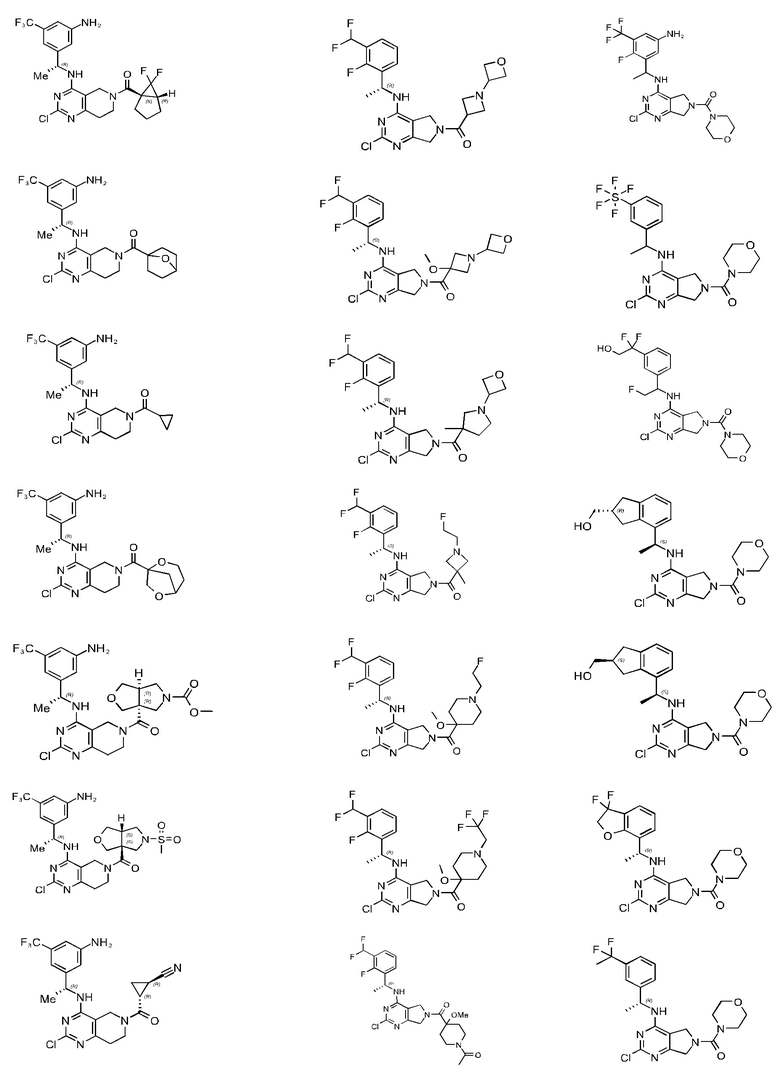
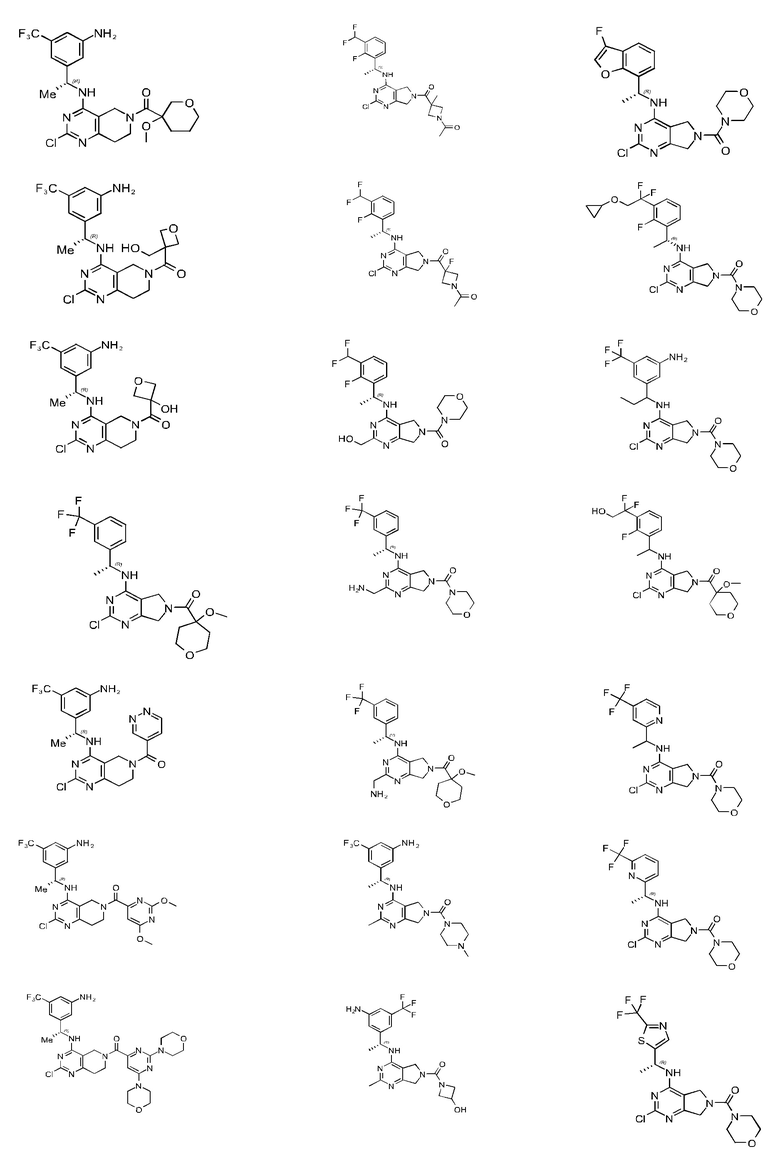
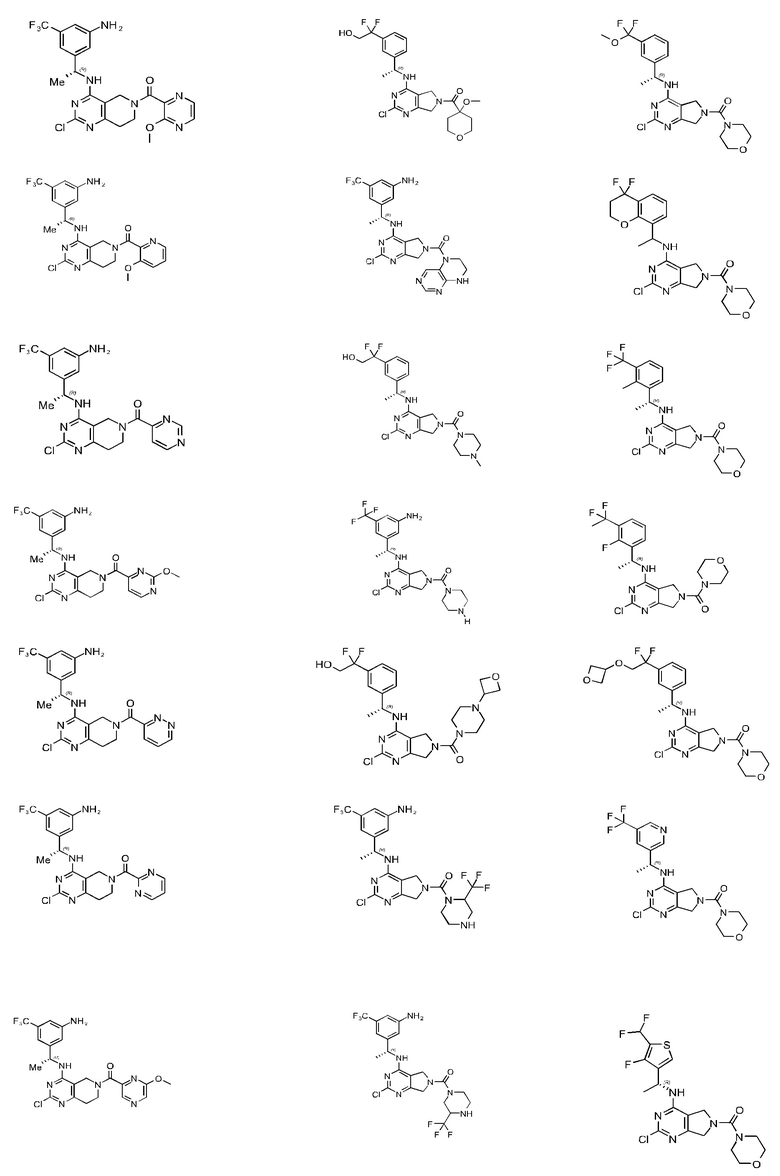
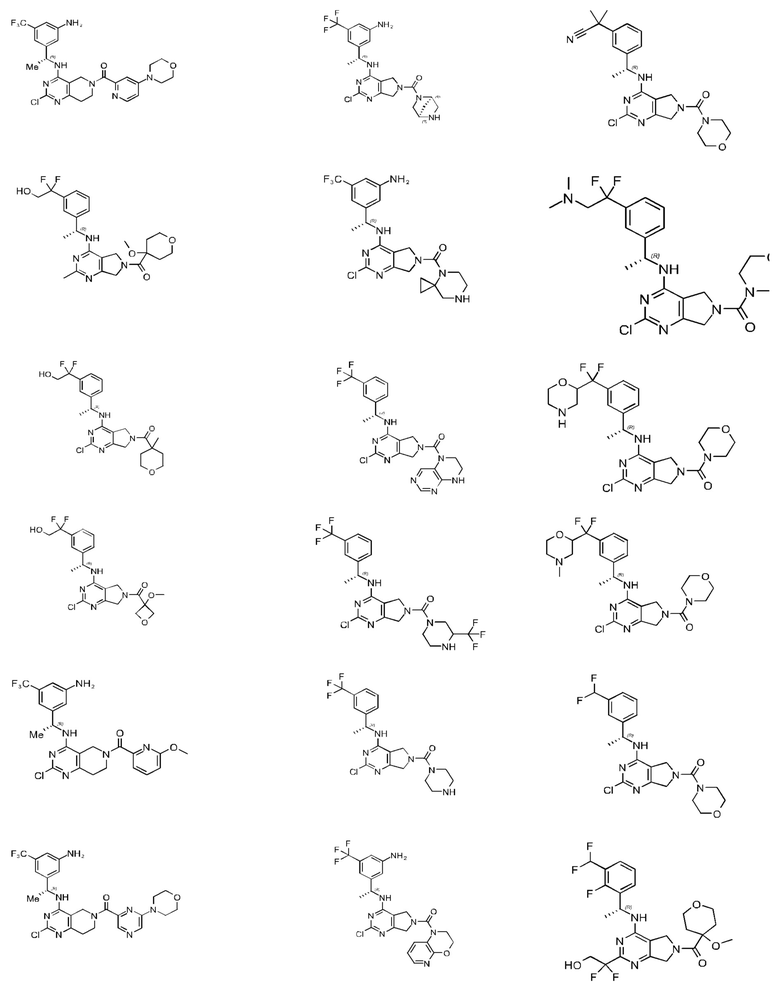
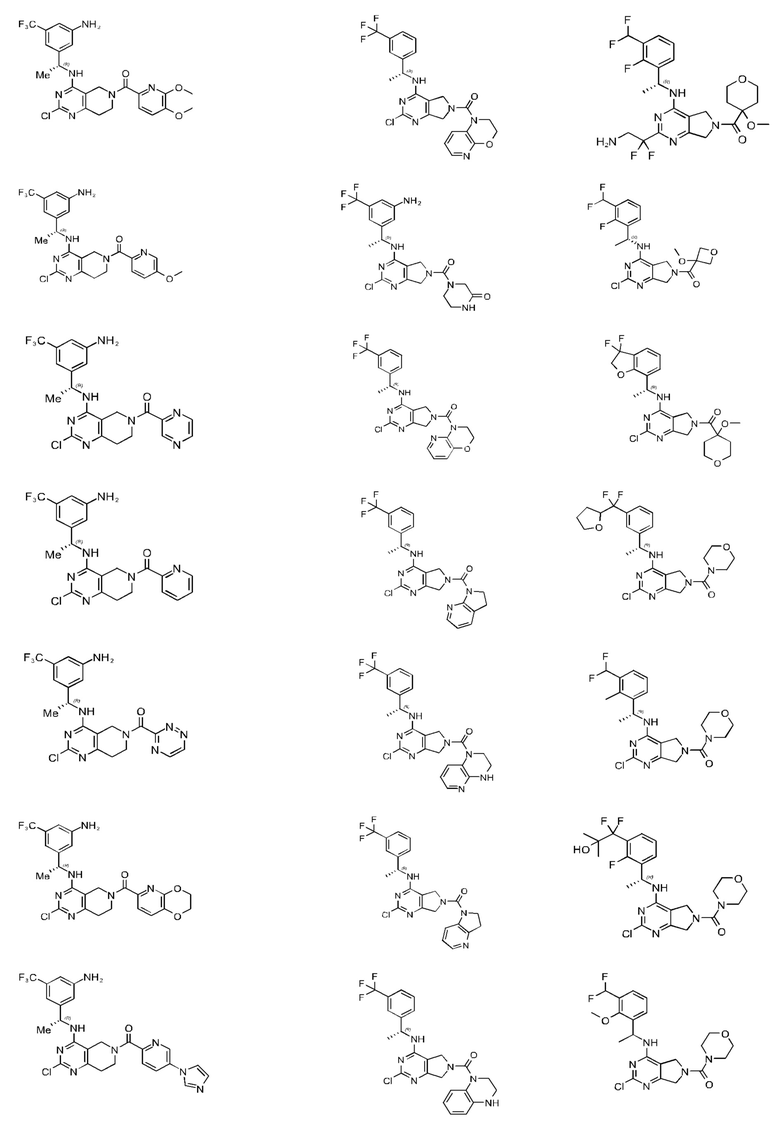
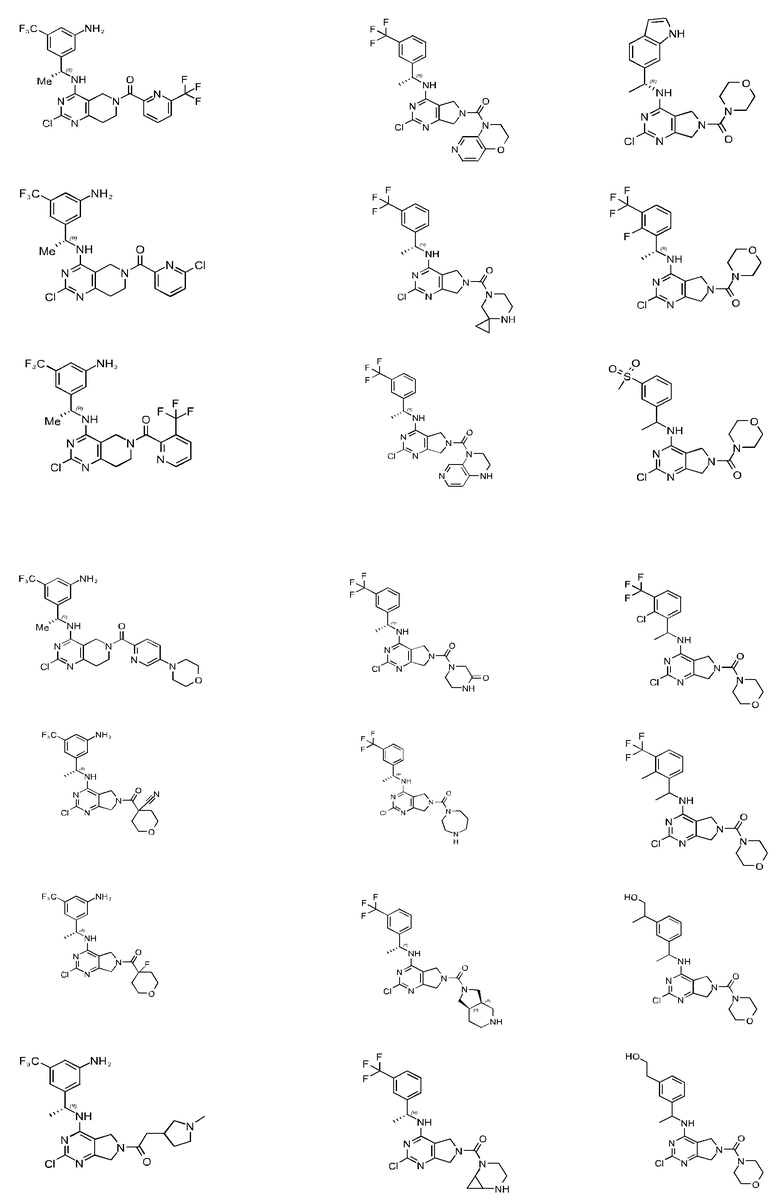
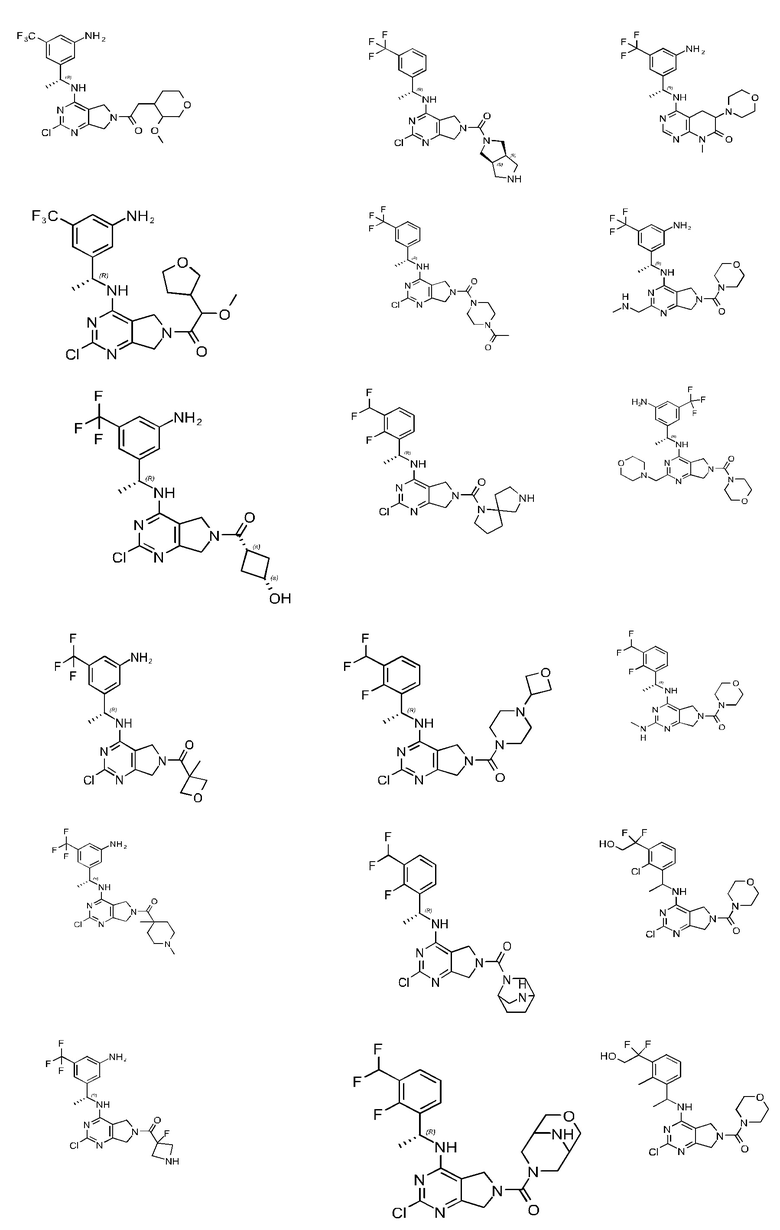
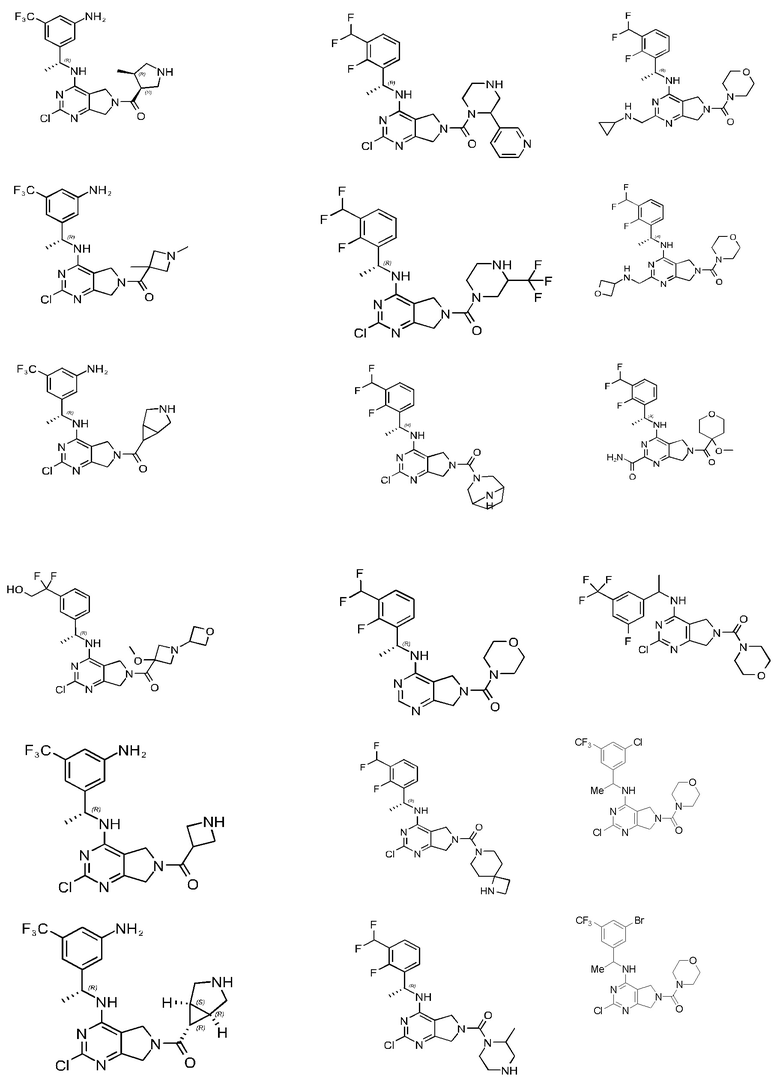
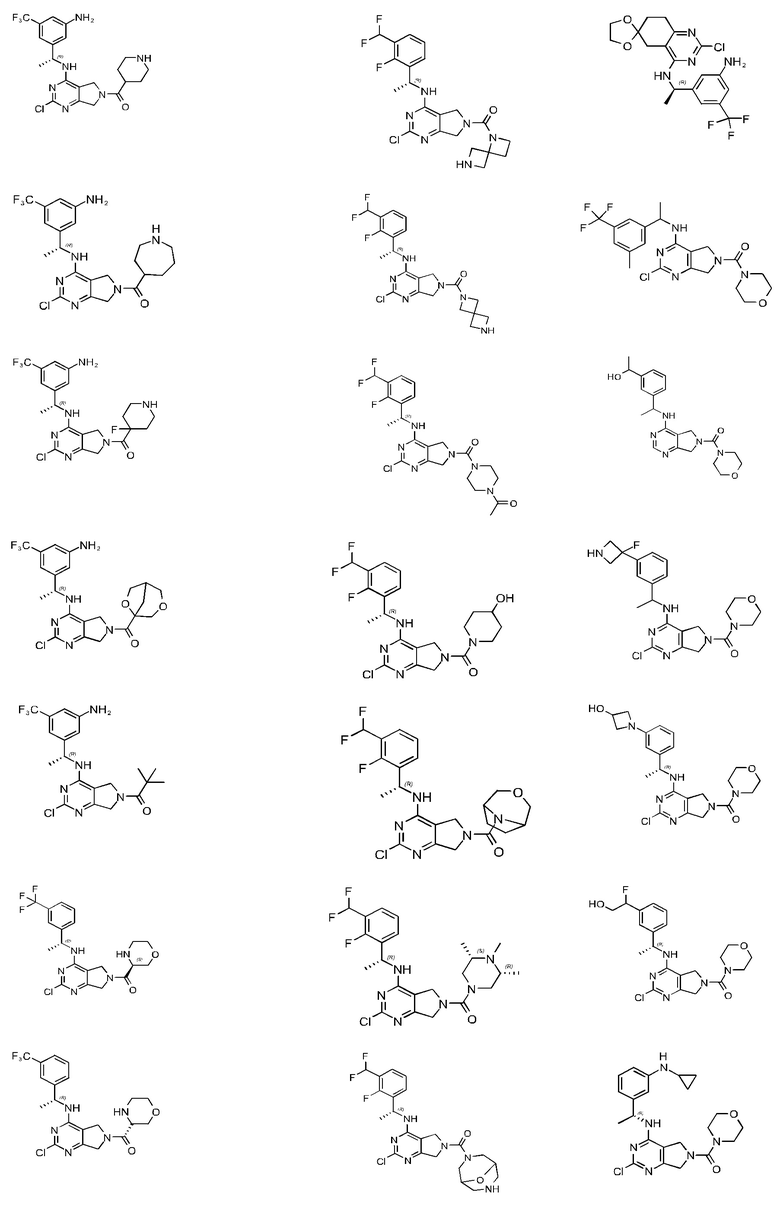

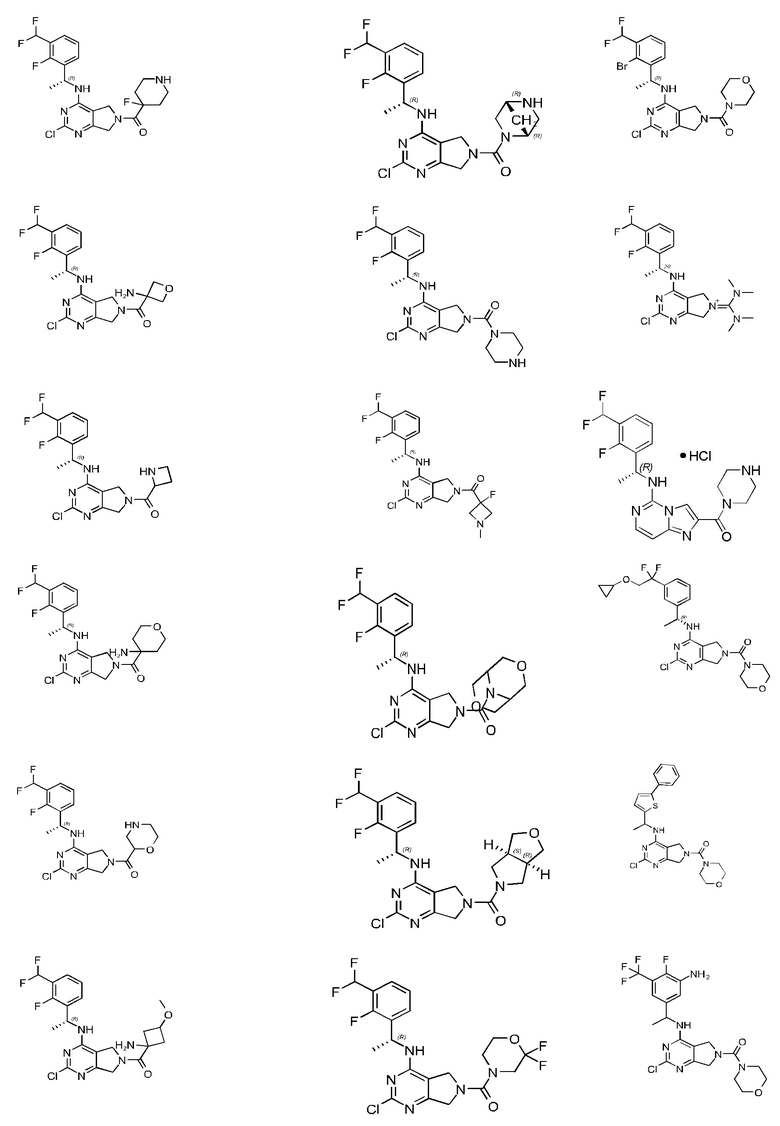
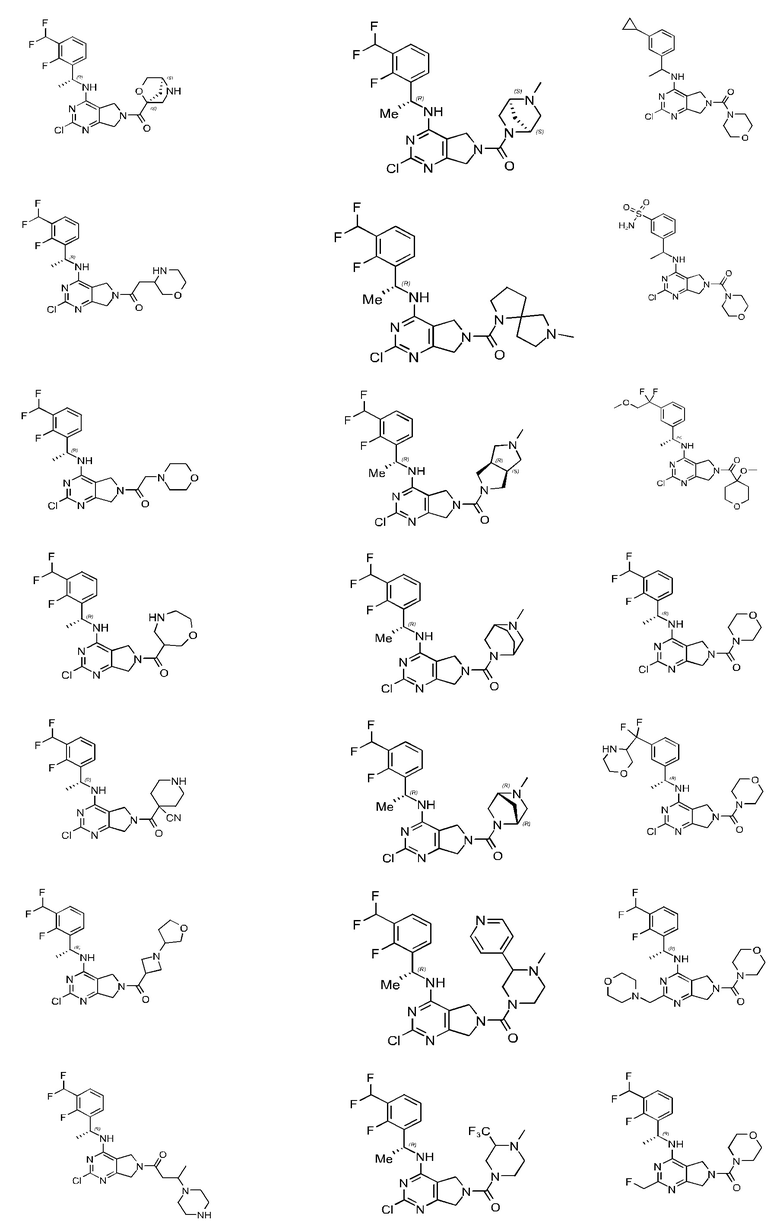
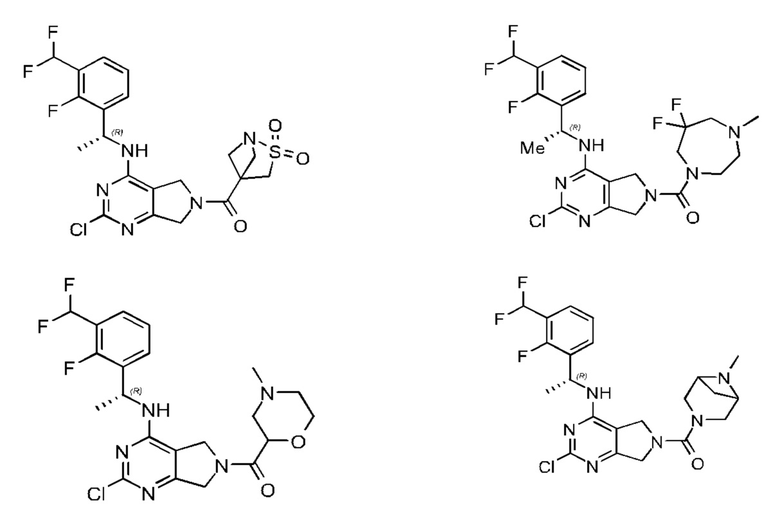
15. Соединение по п. 1 или его фармацевтически приемлемые соль, сольват, гидрат, стереоизомер или таутомер, выбранные из группы, состоящей из:
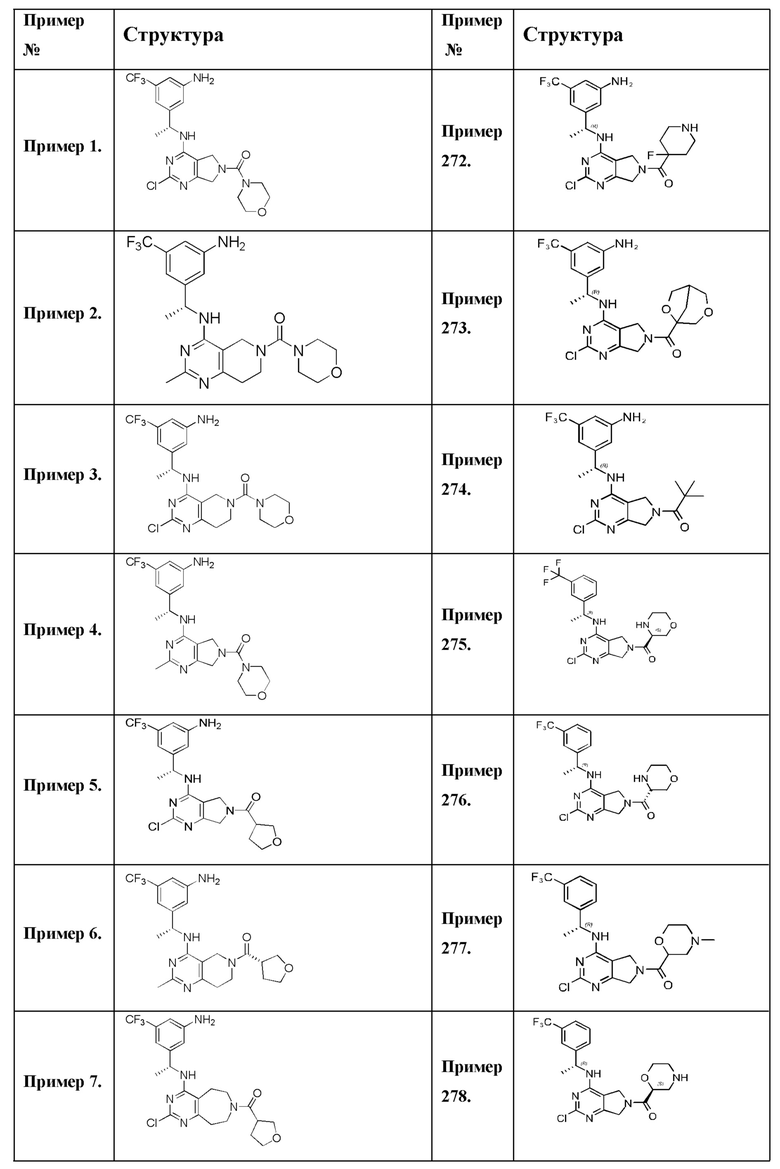
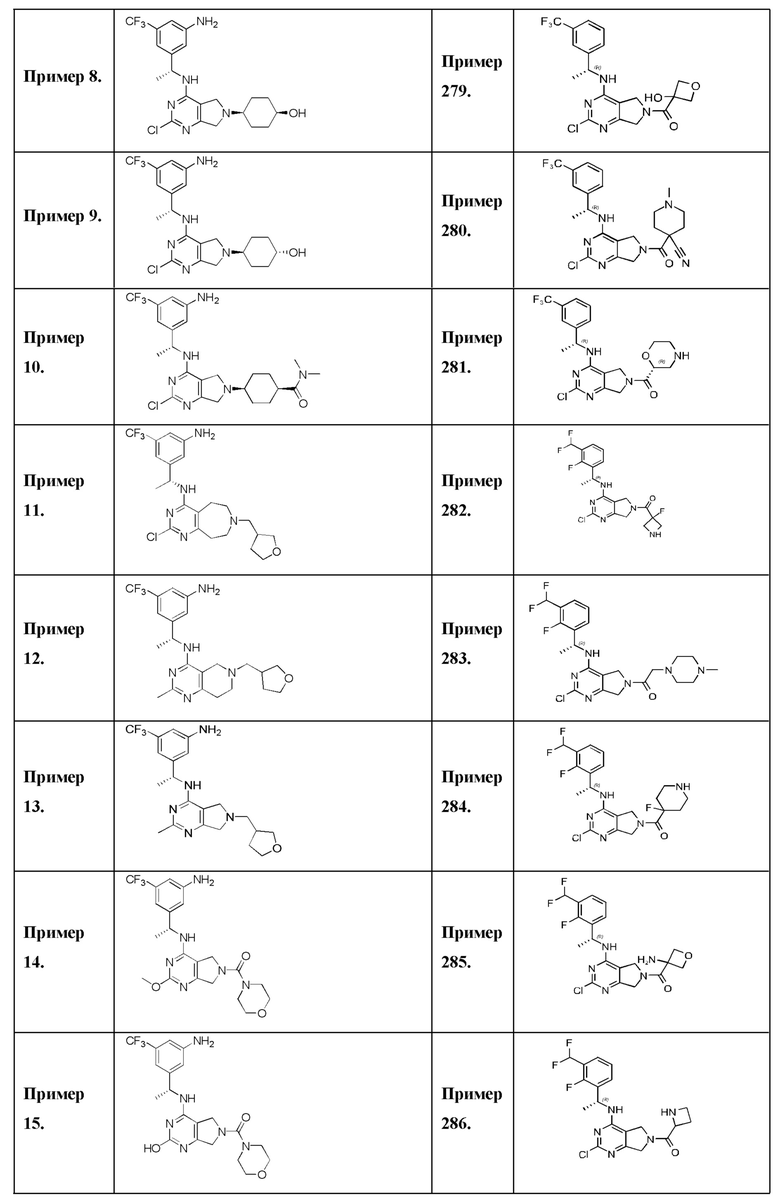
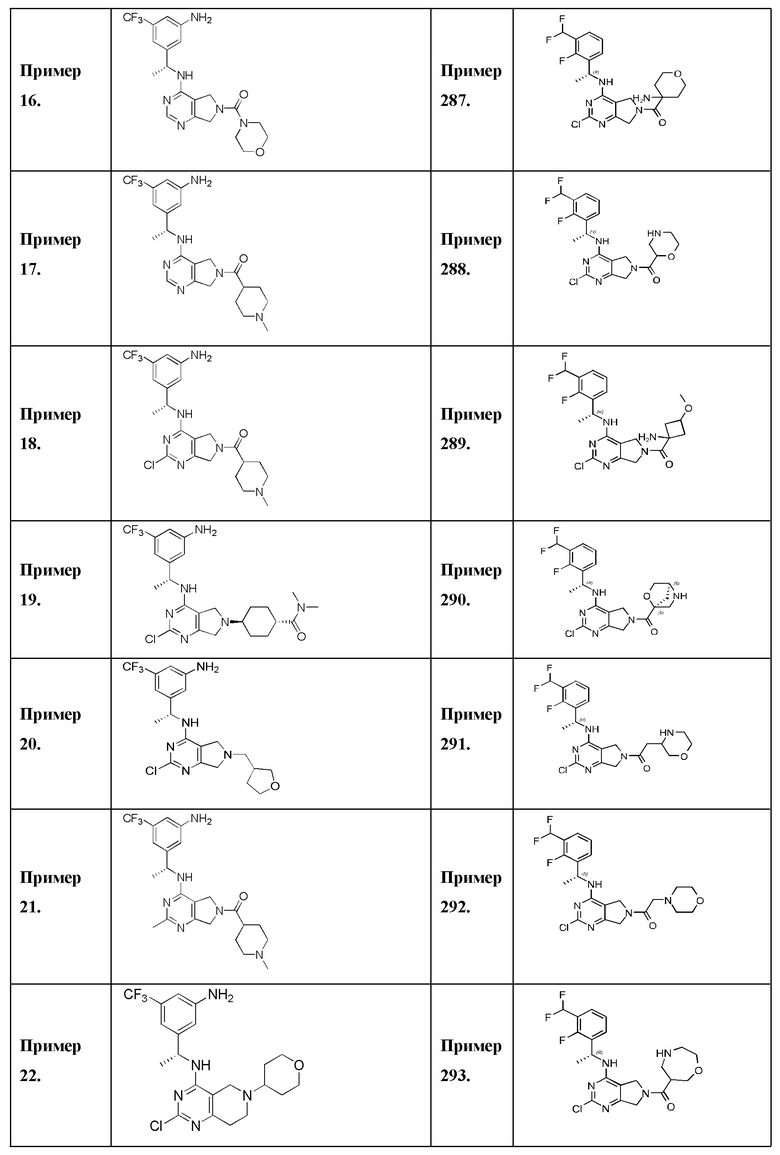
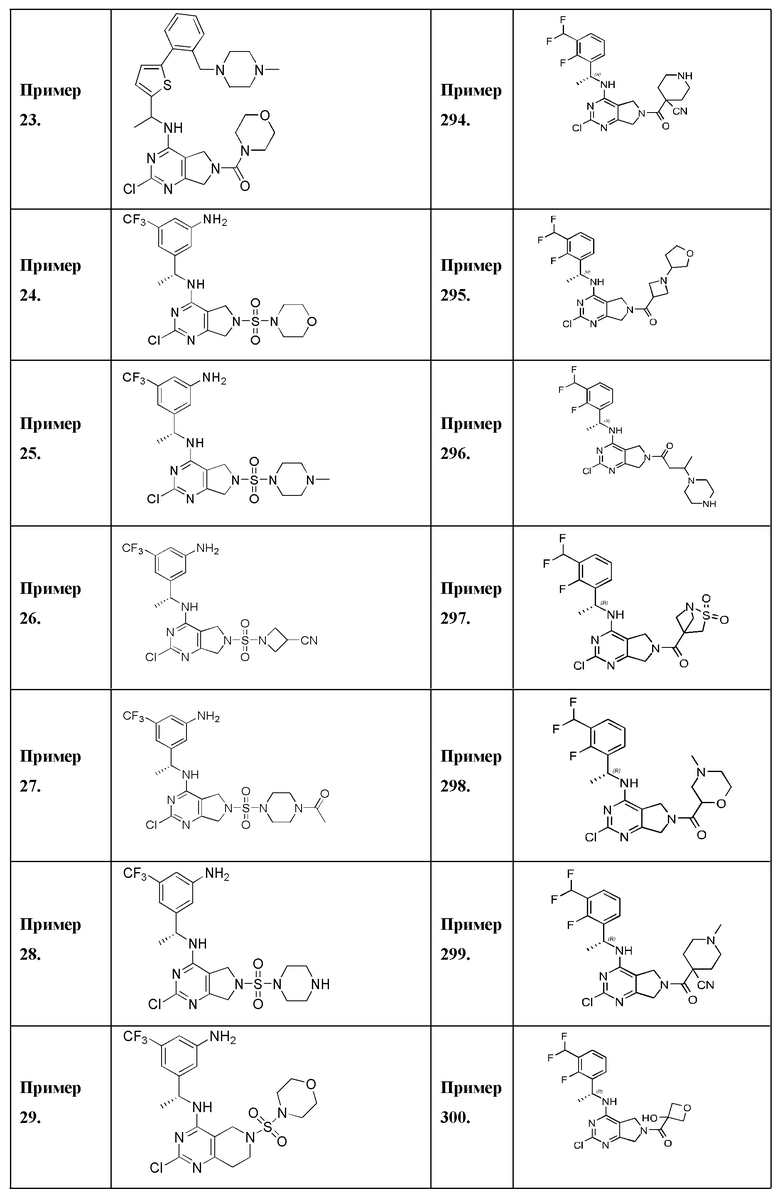
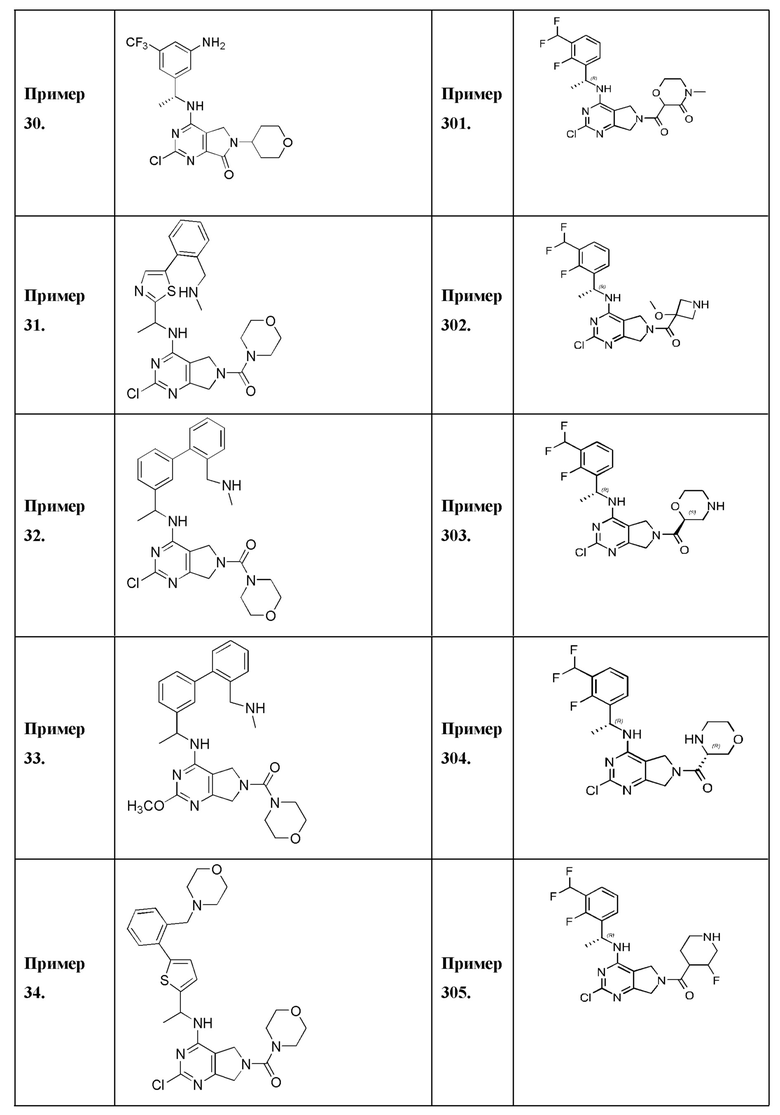
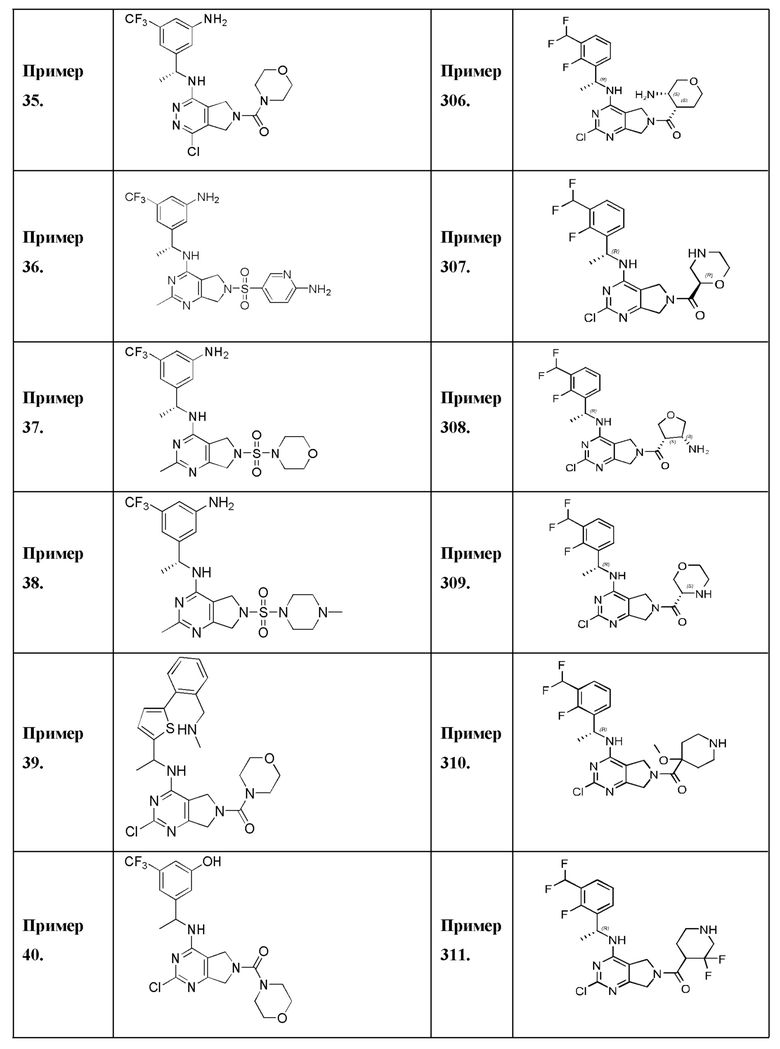
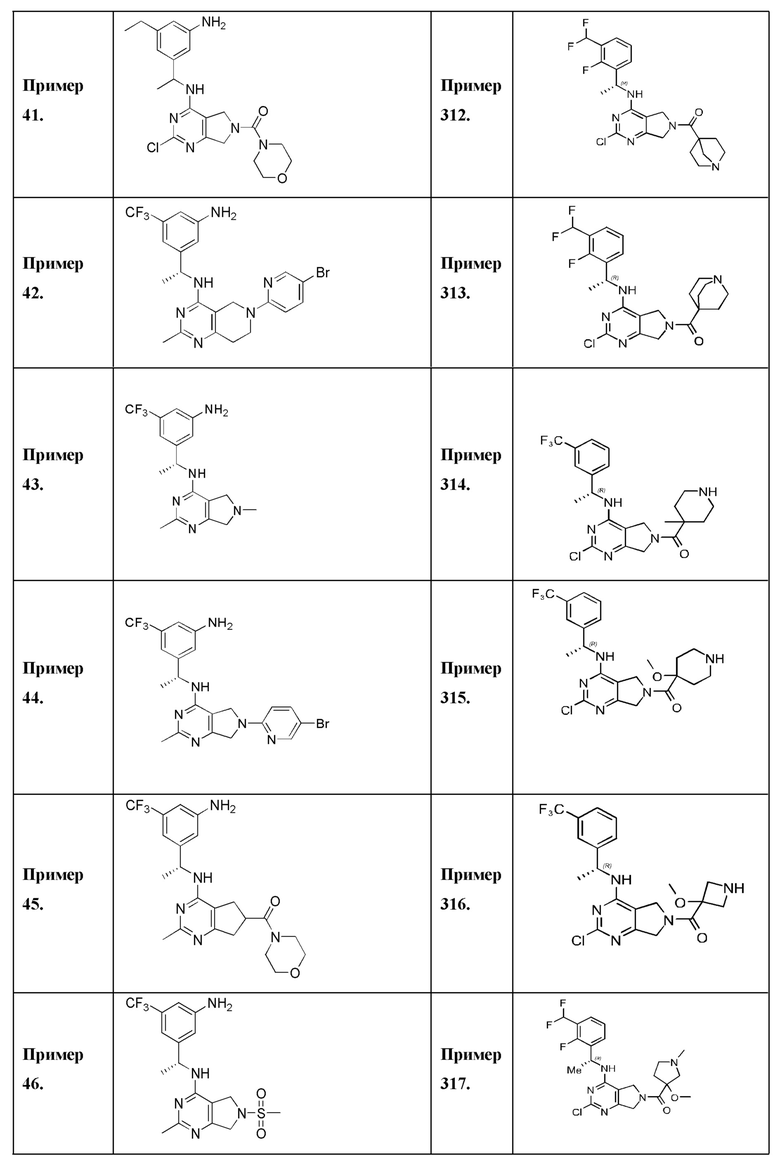
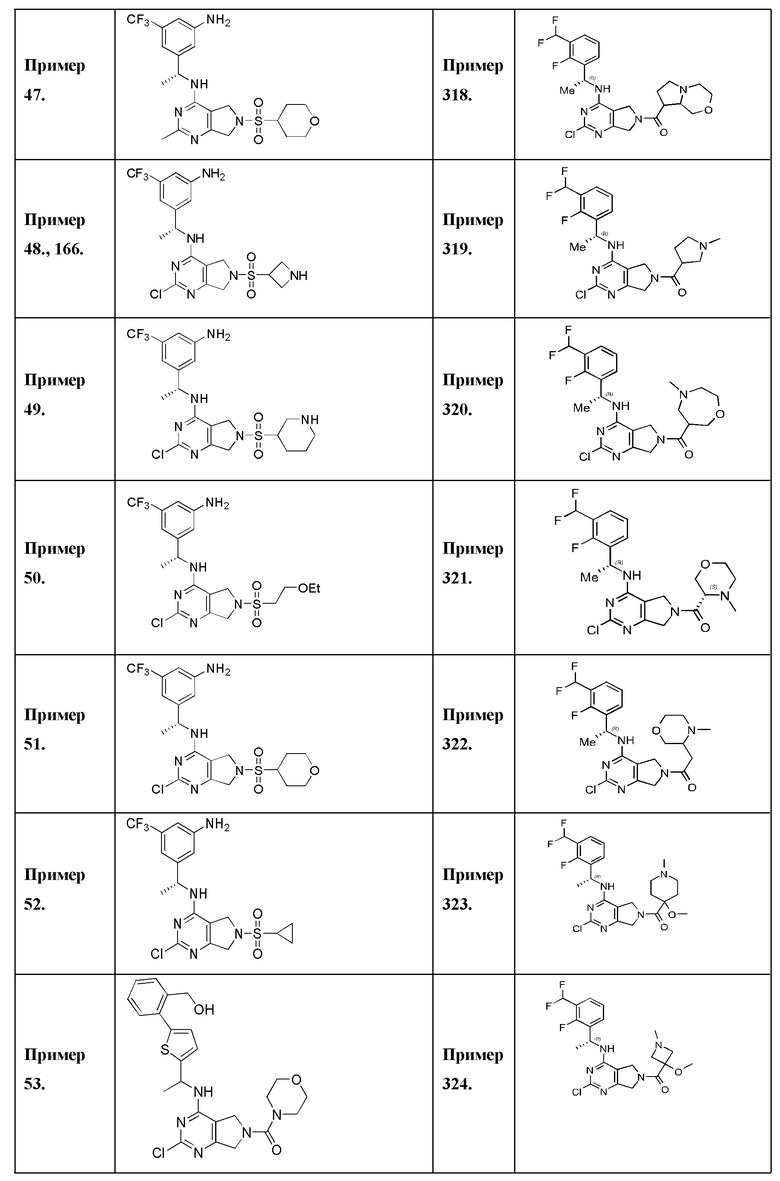
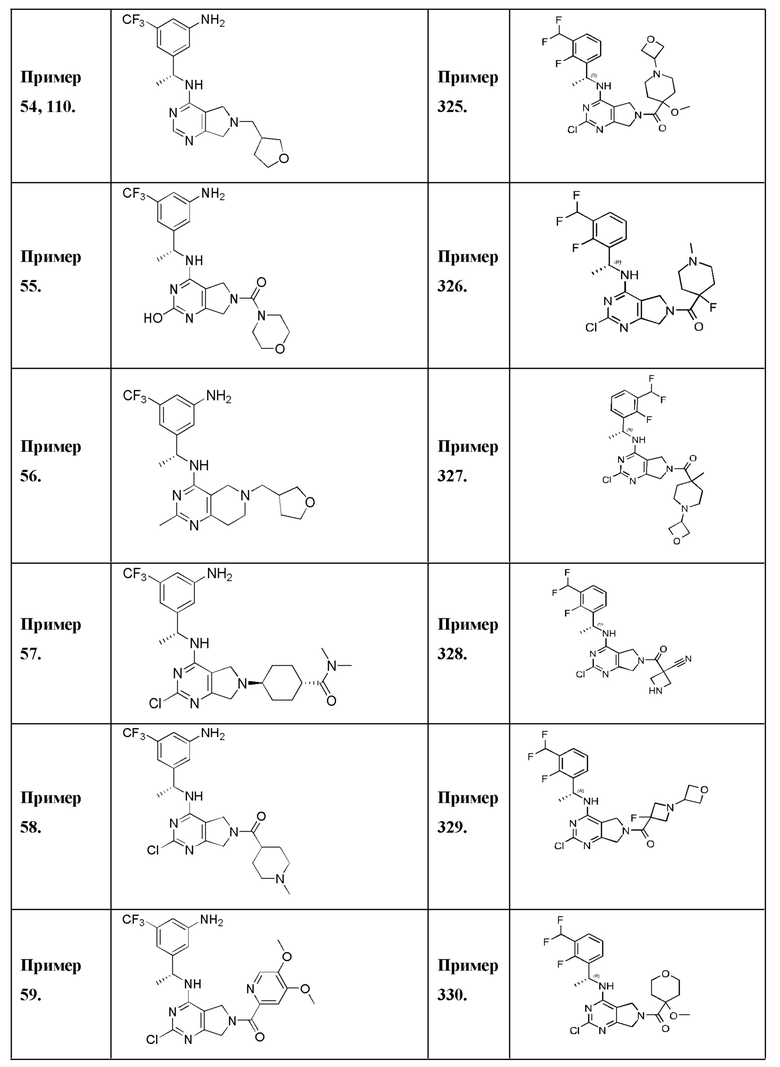
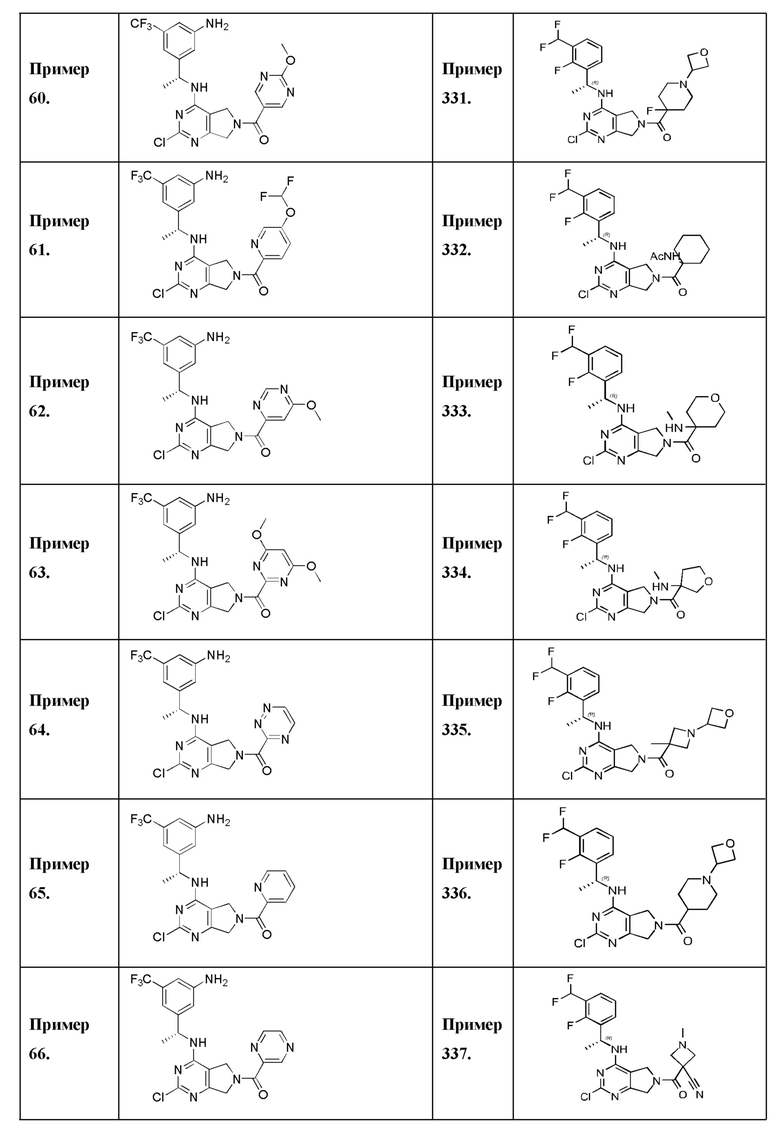
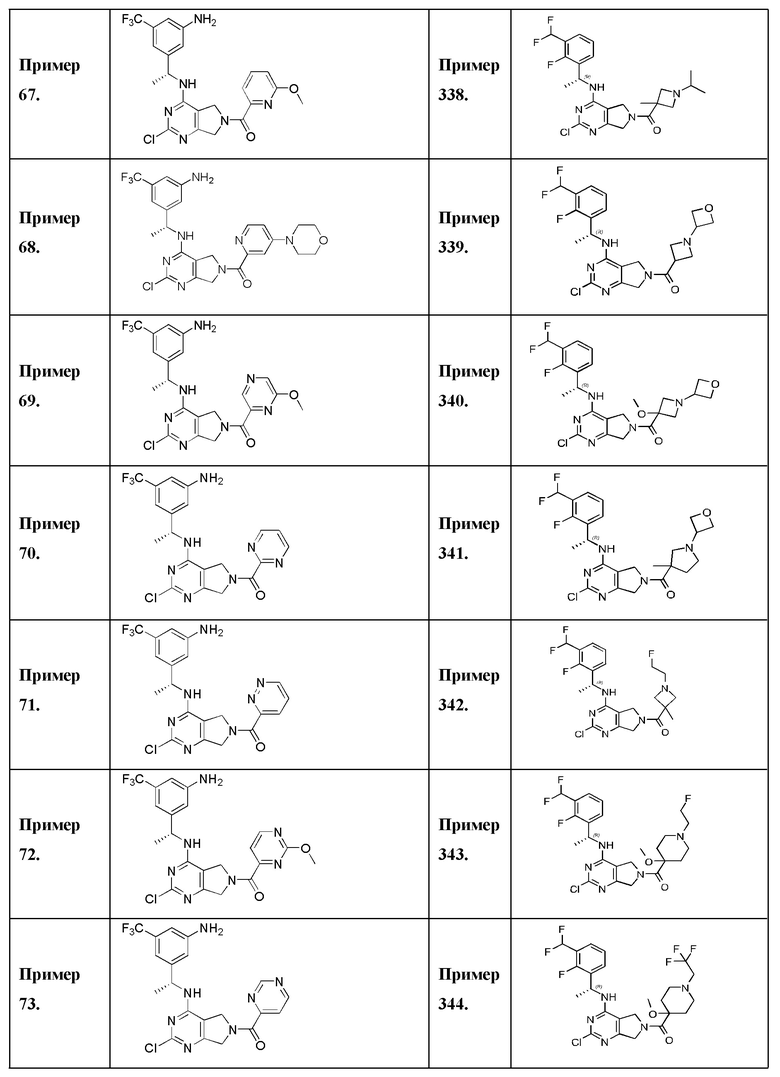
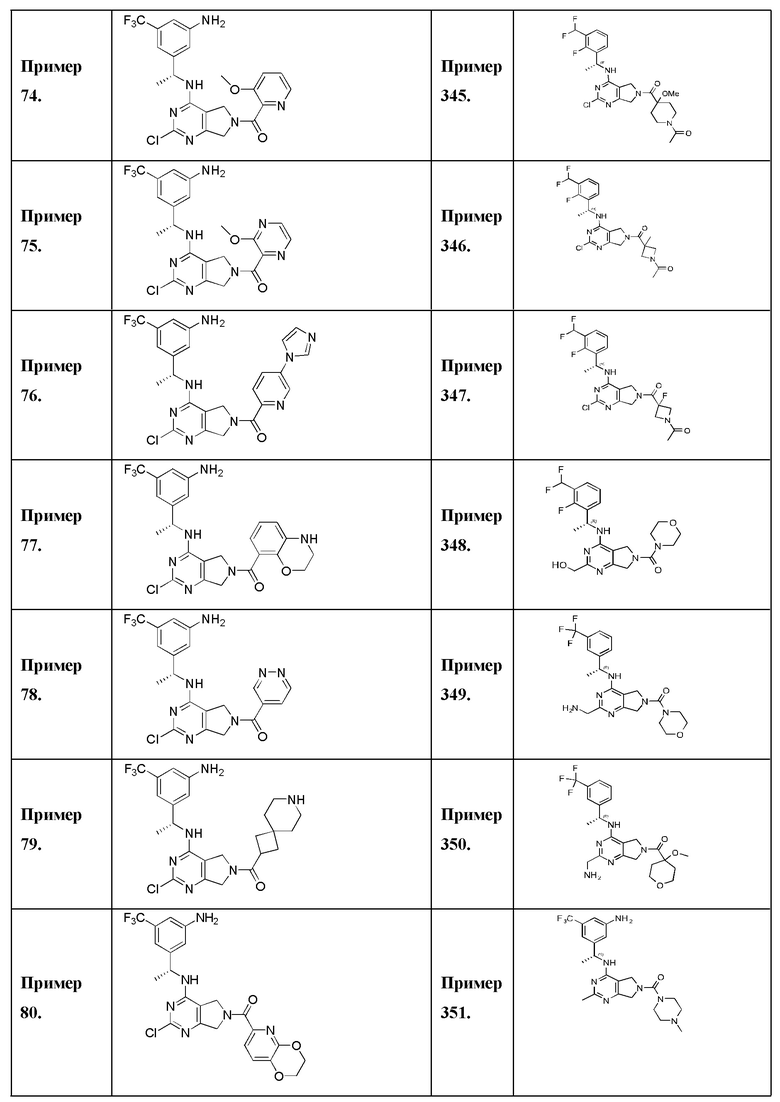
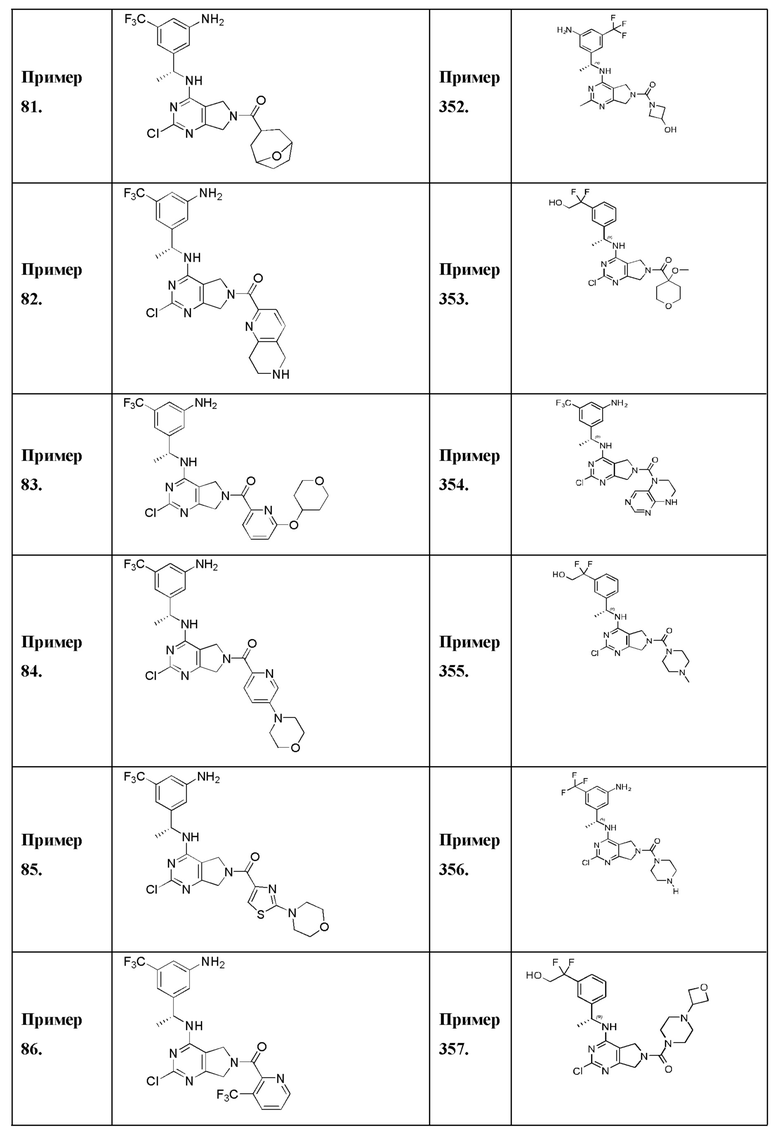
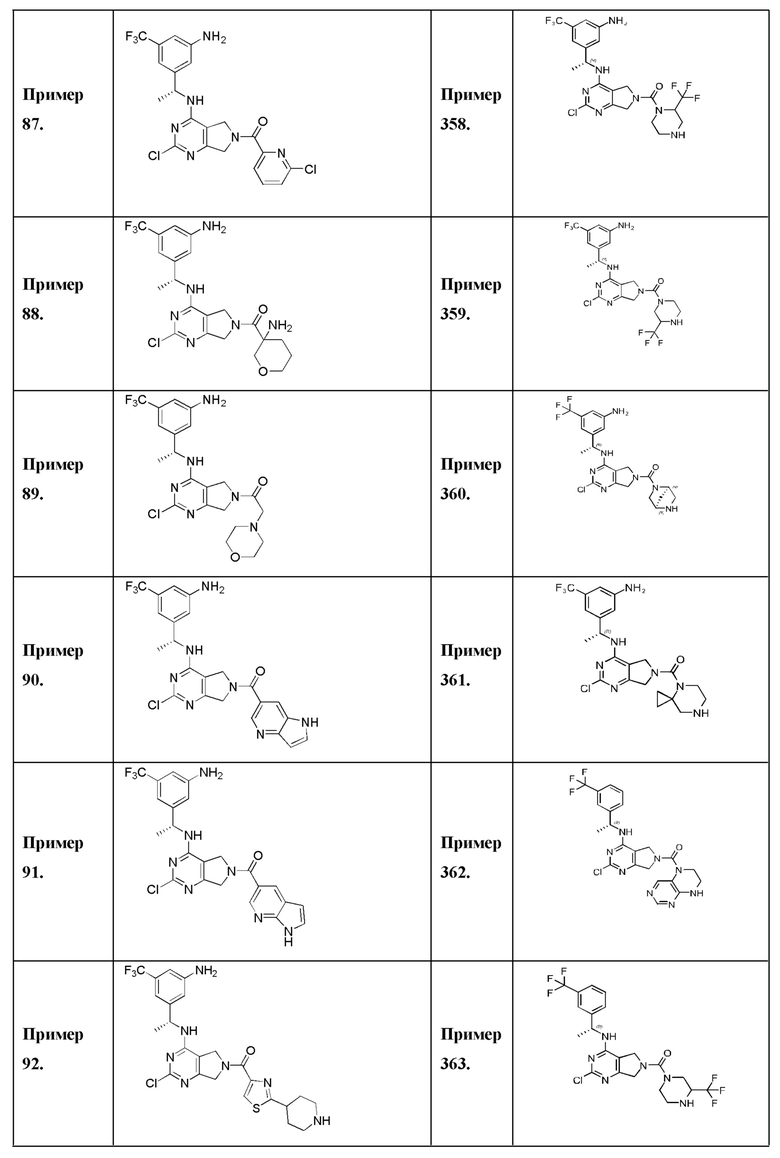
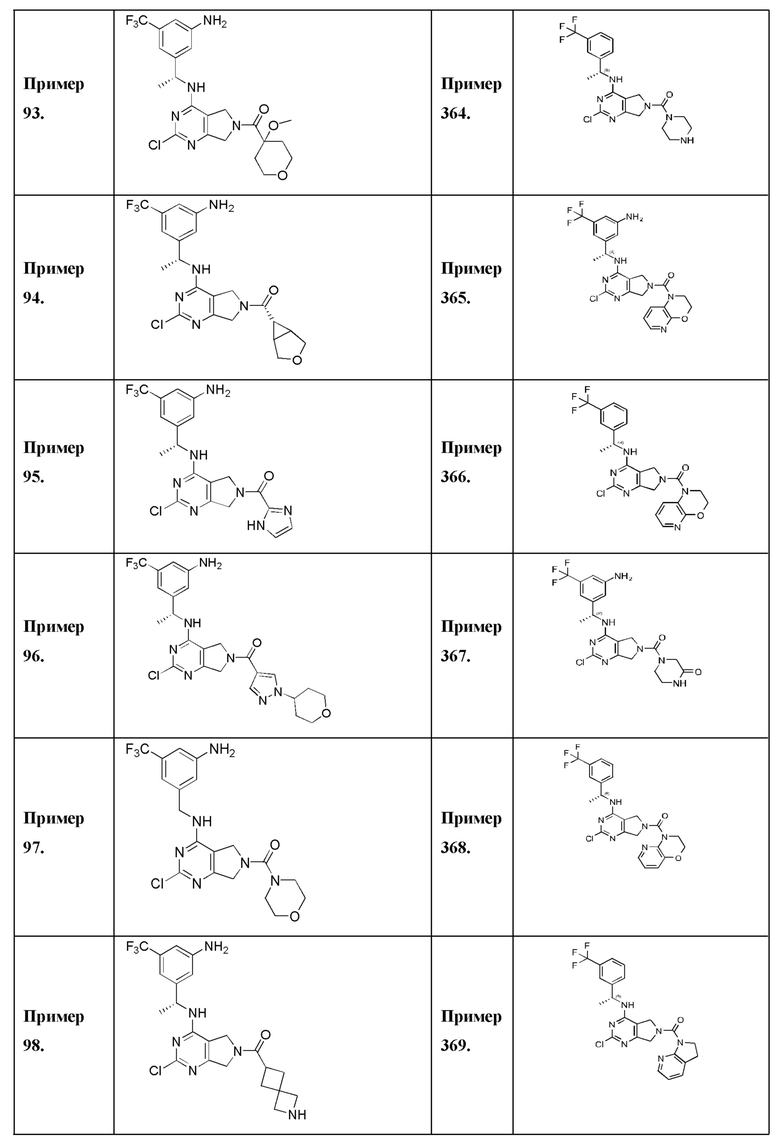
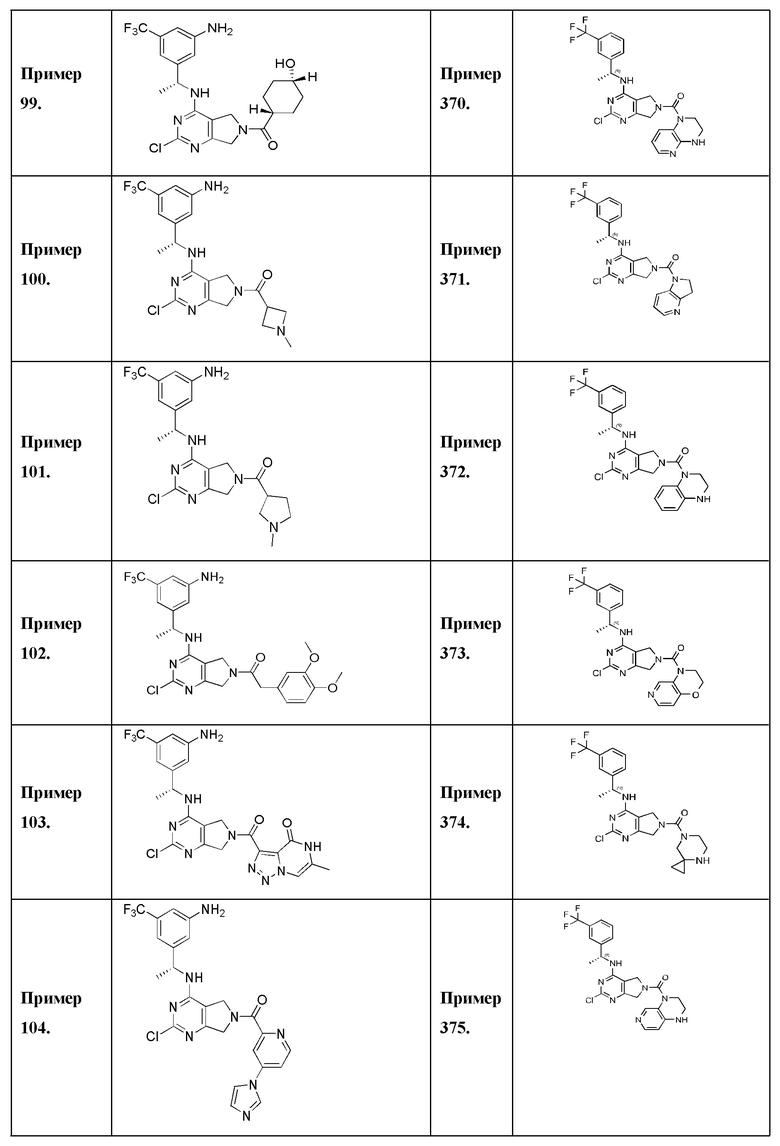
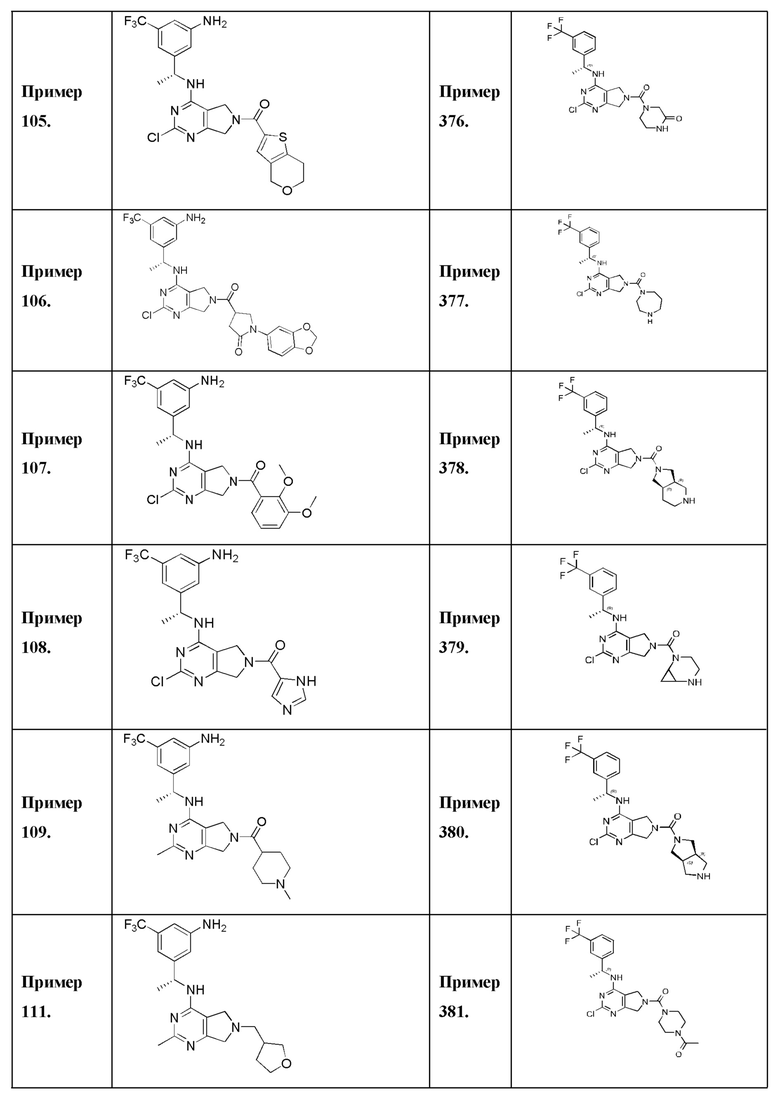
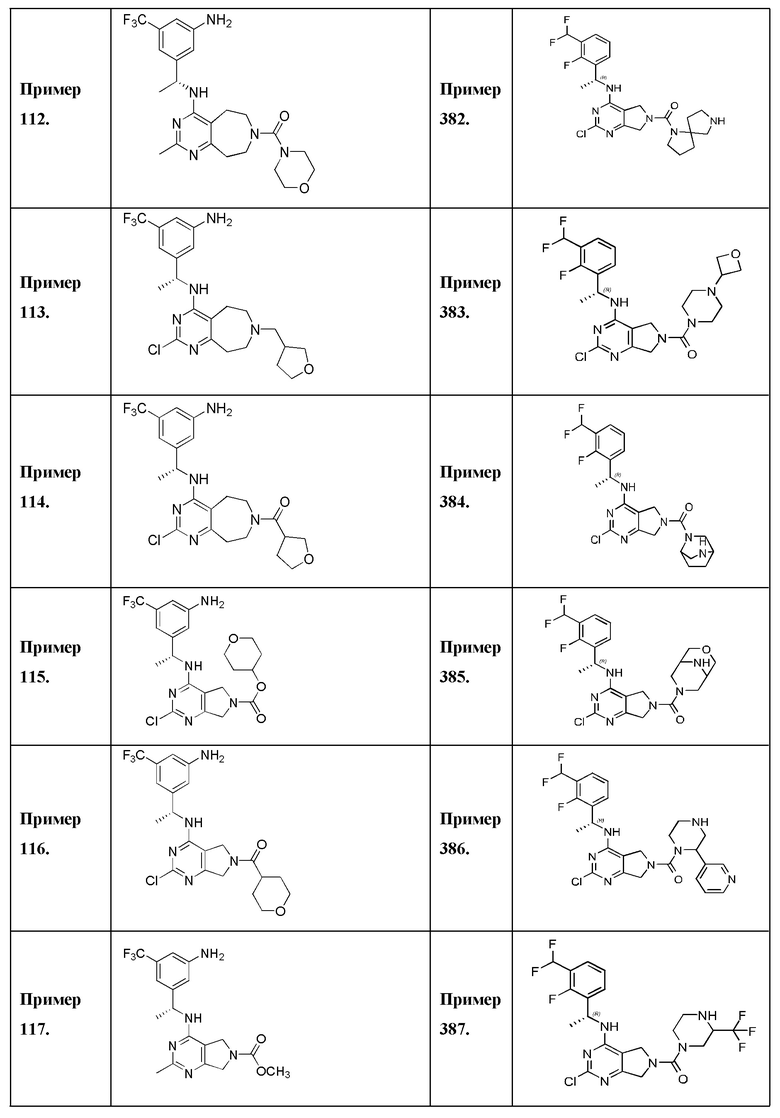
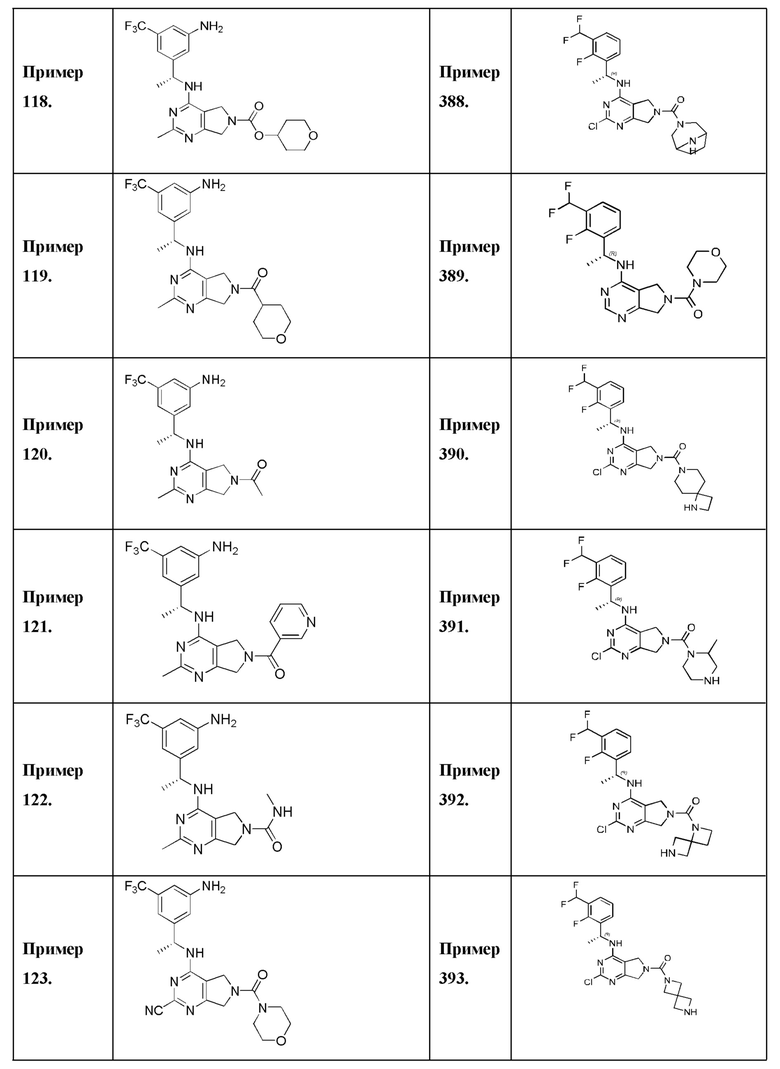
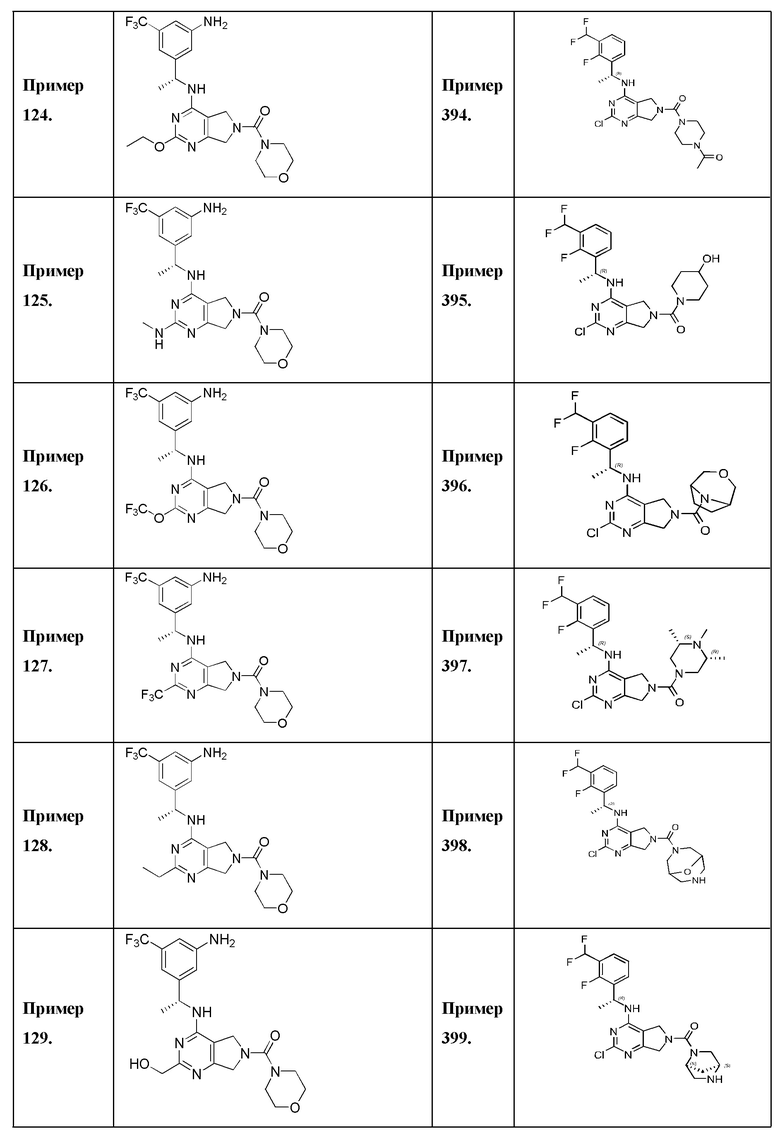
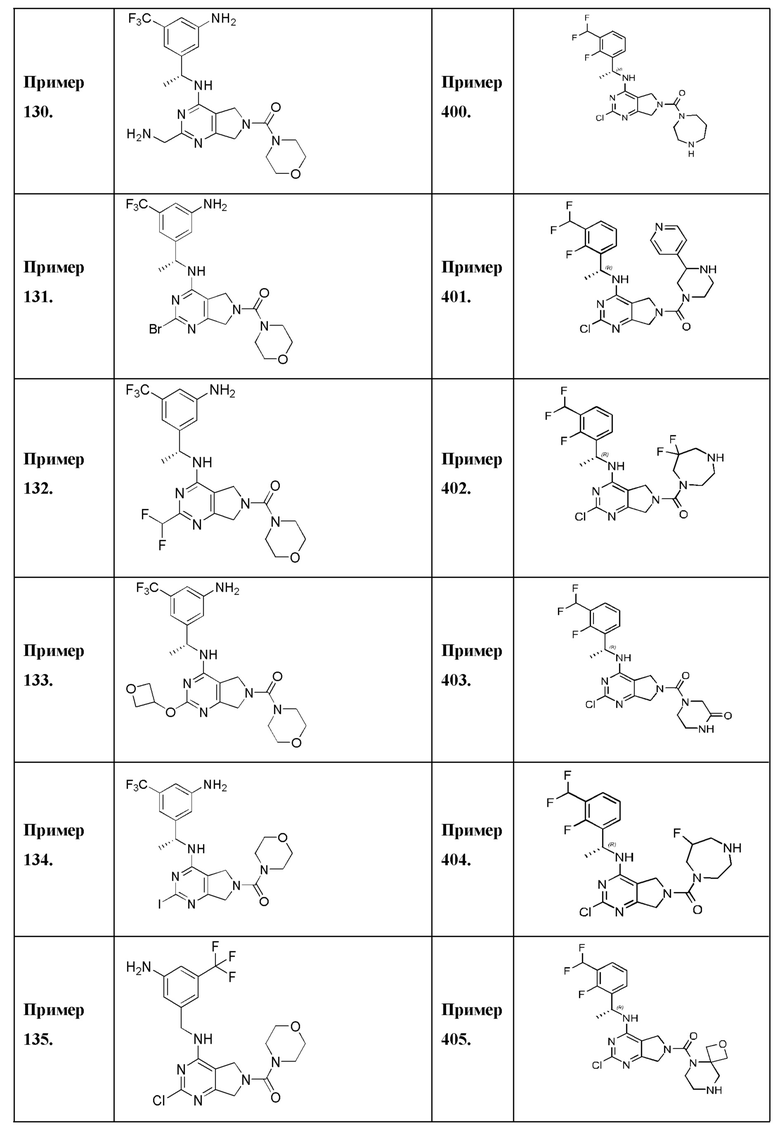
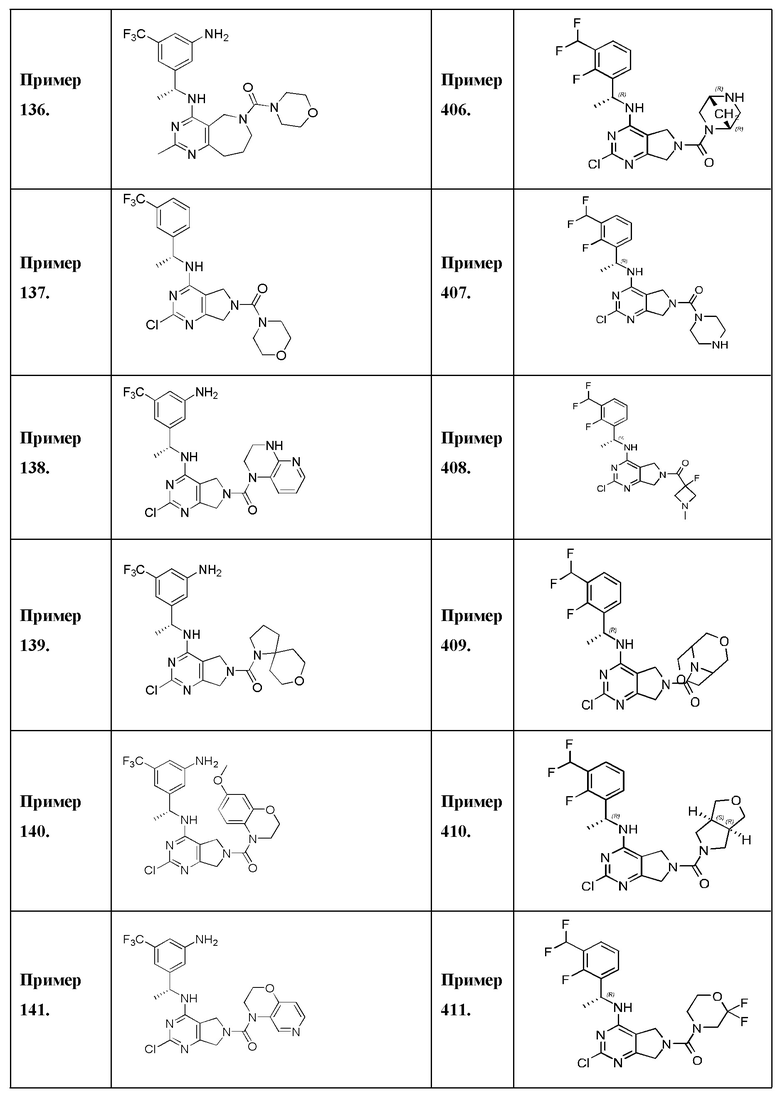
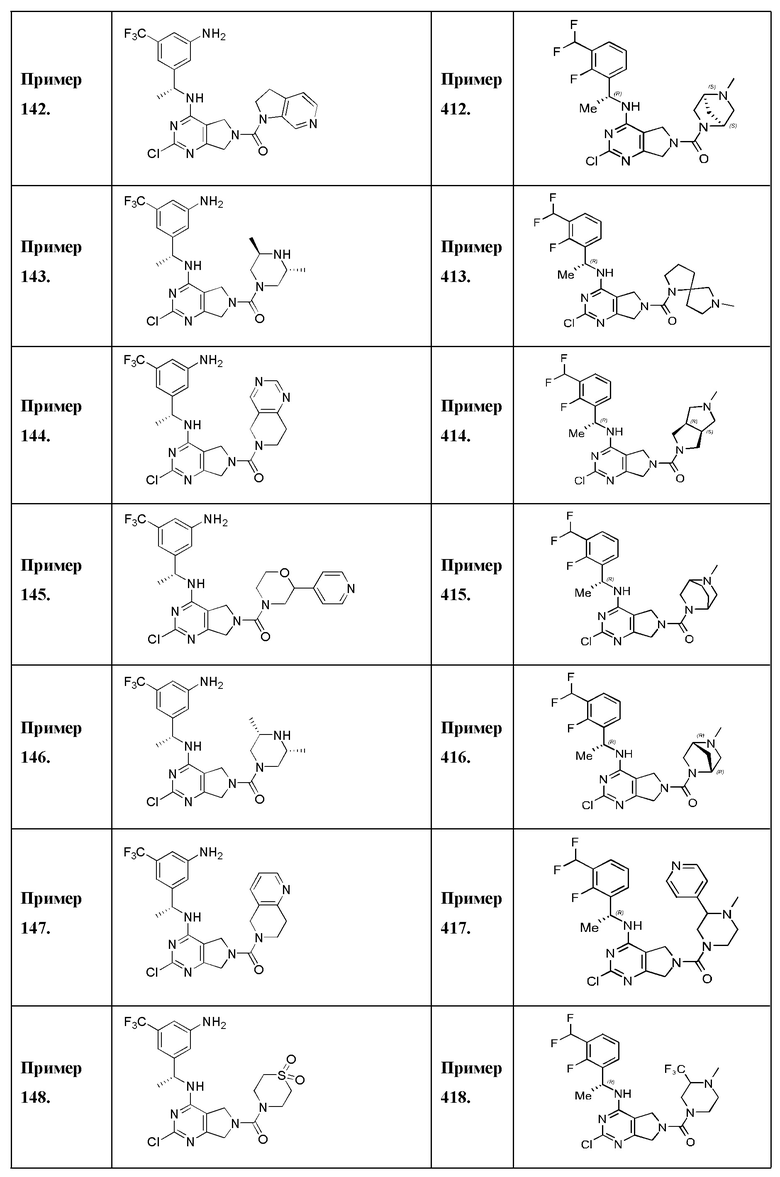
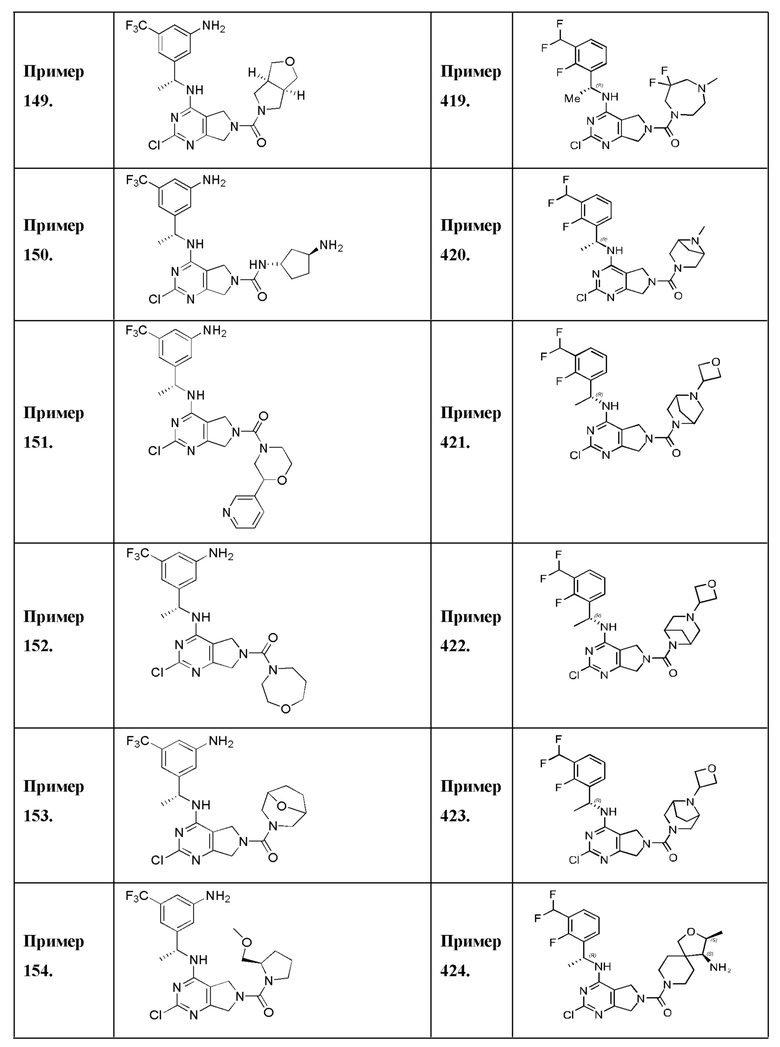
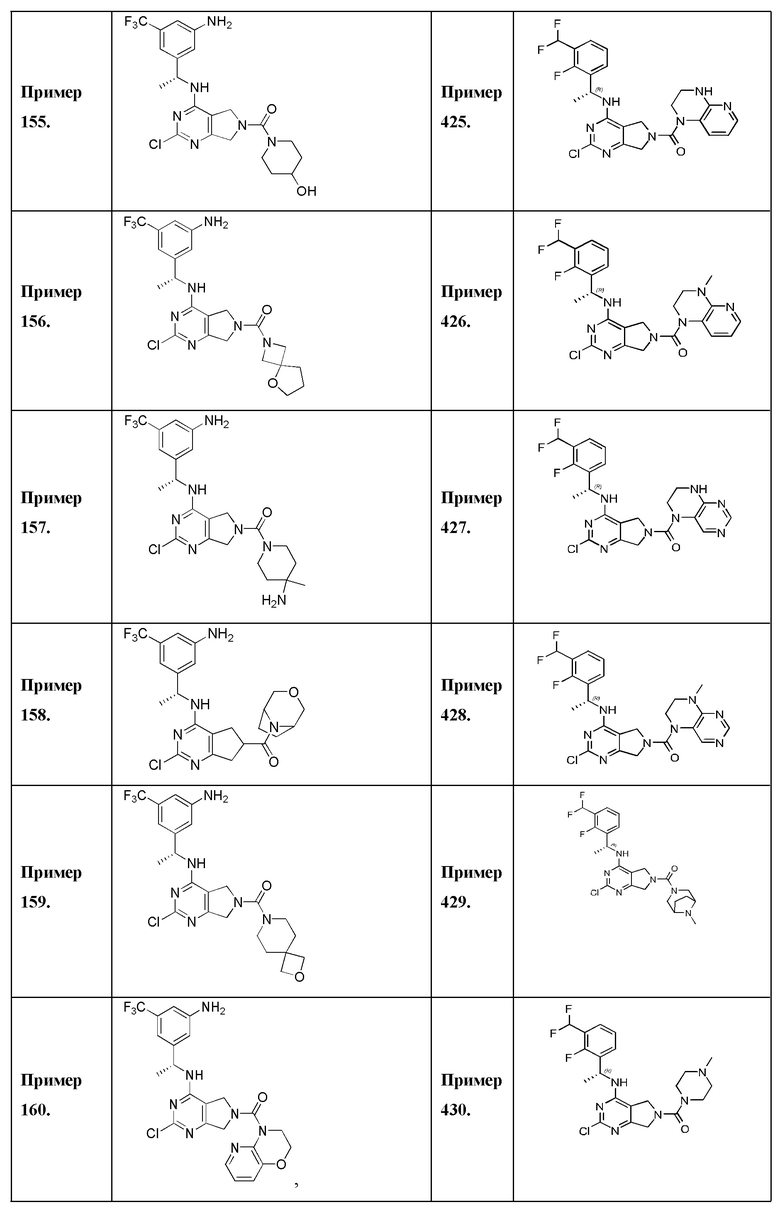
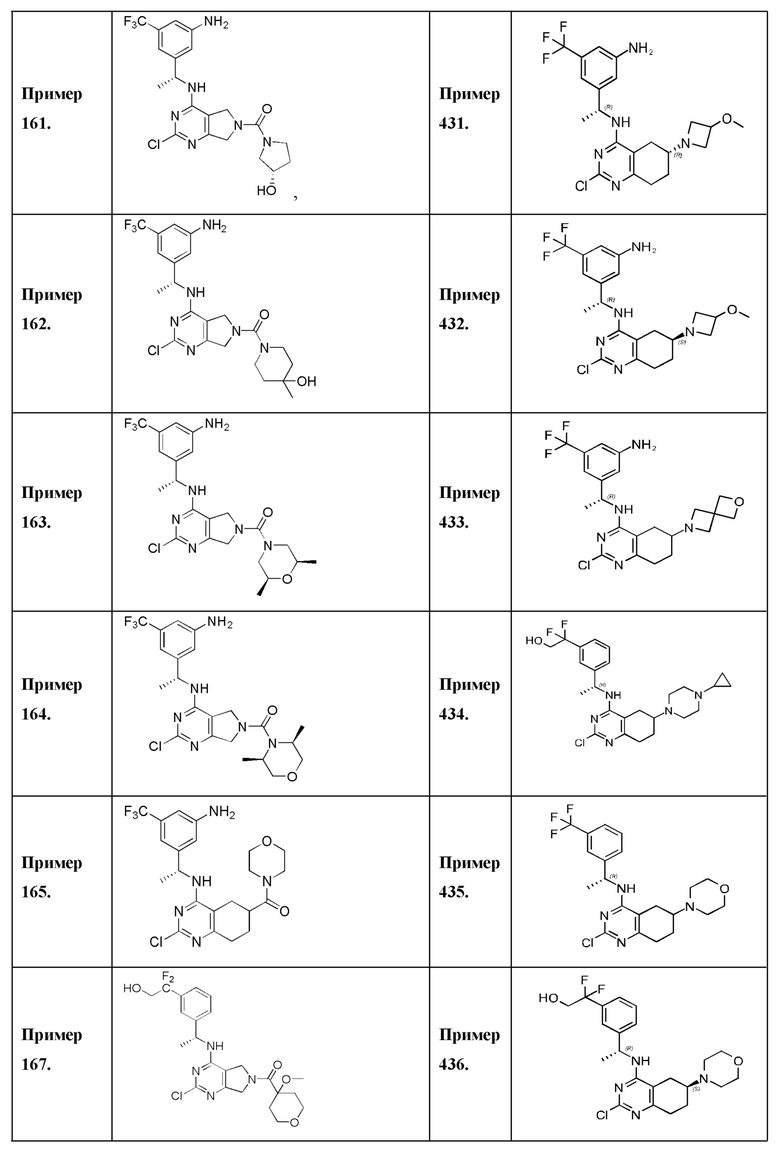
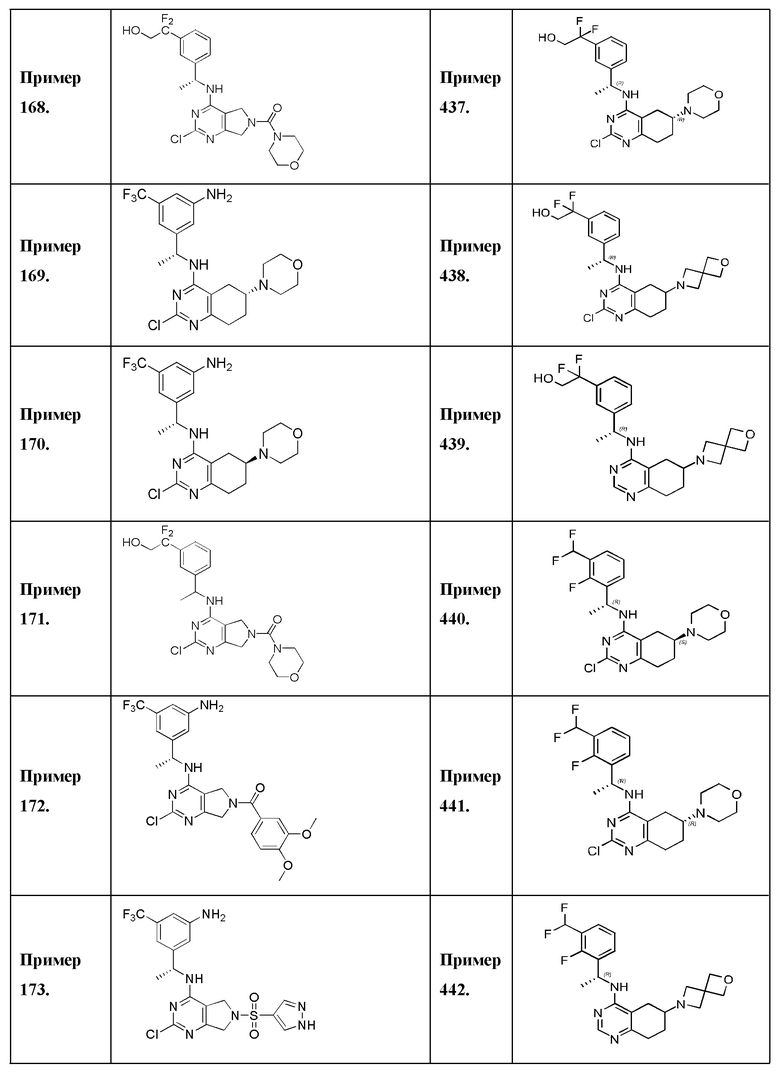
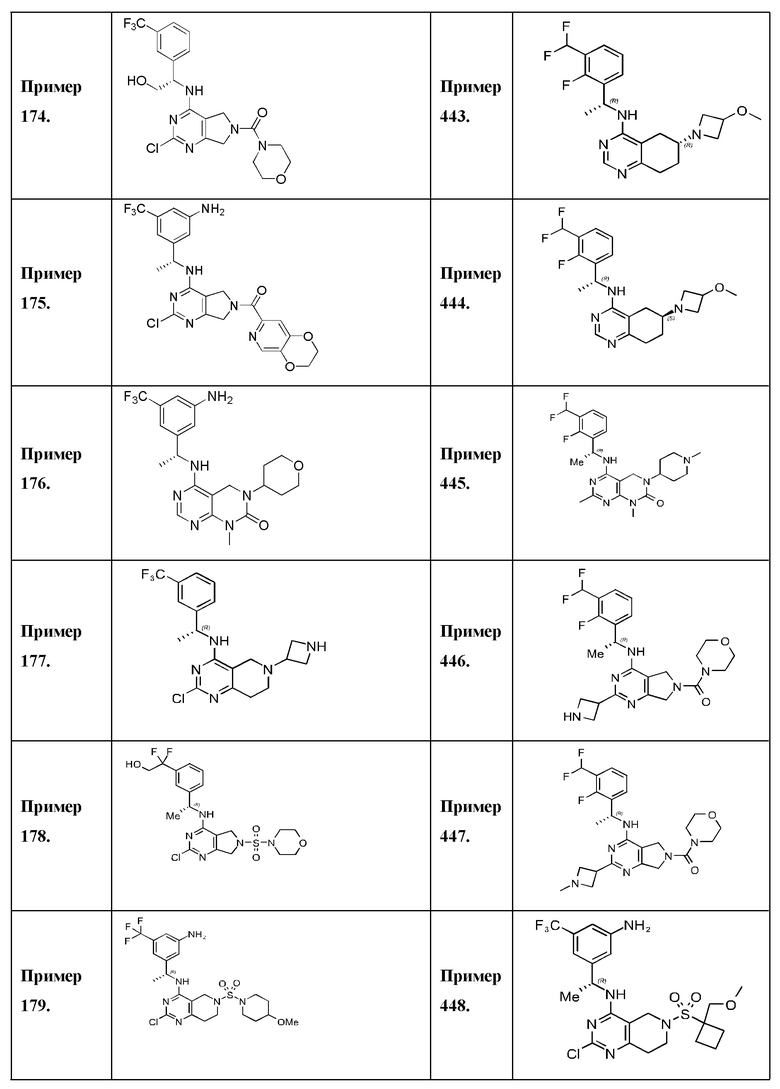
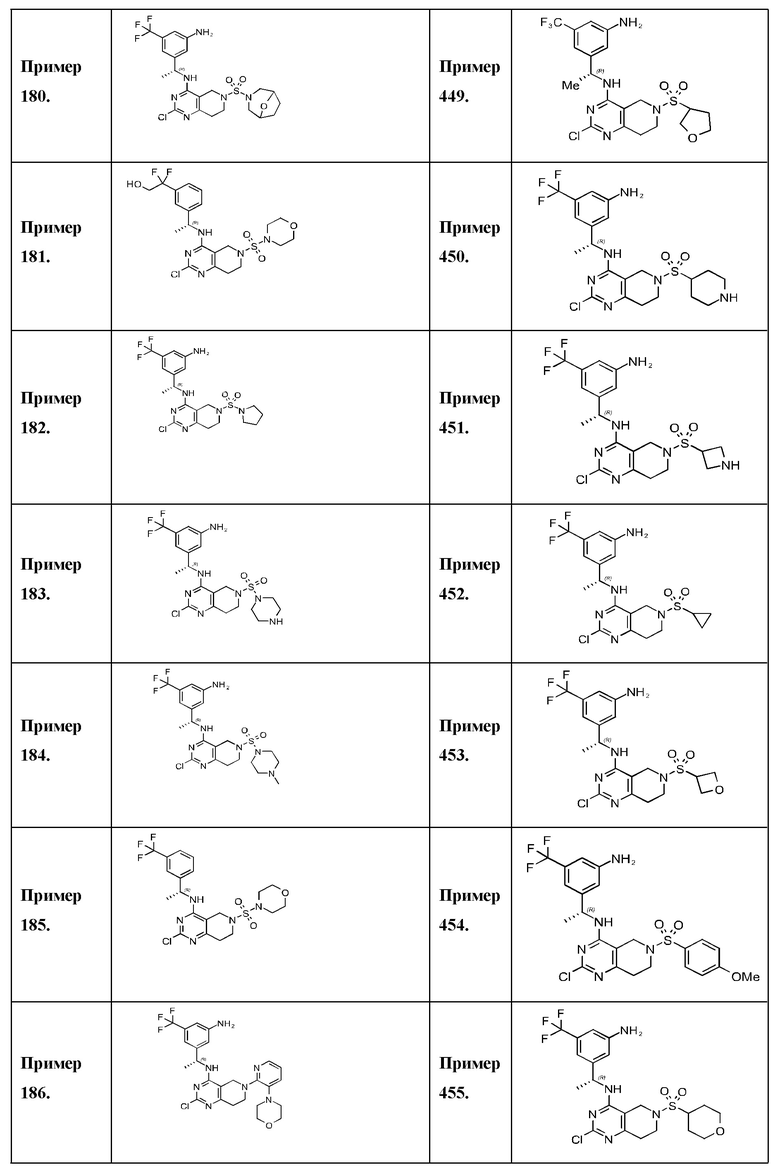
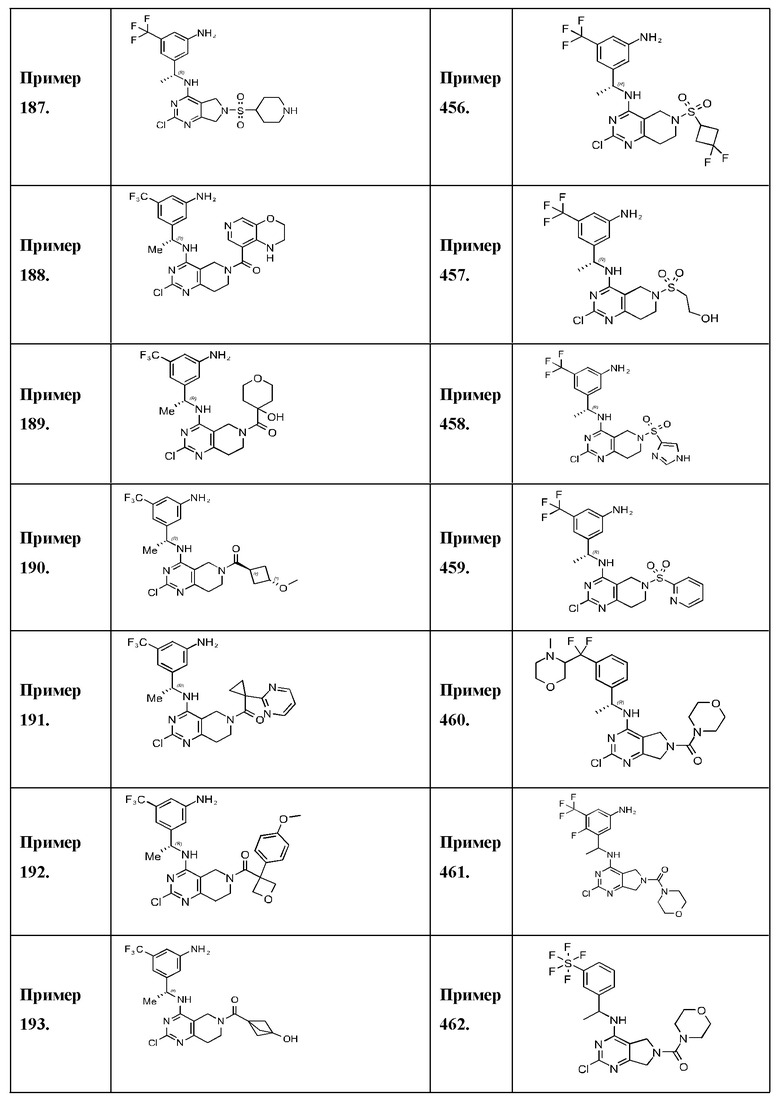
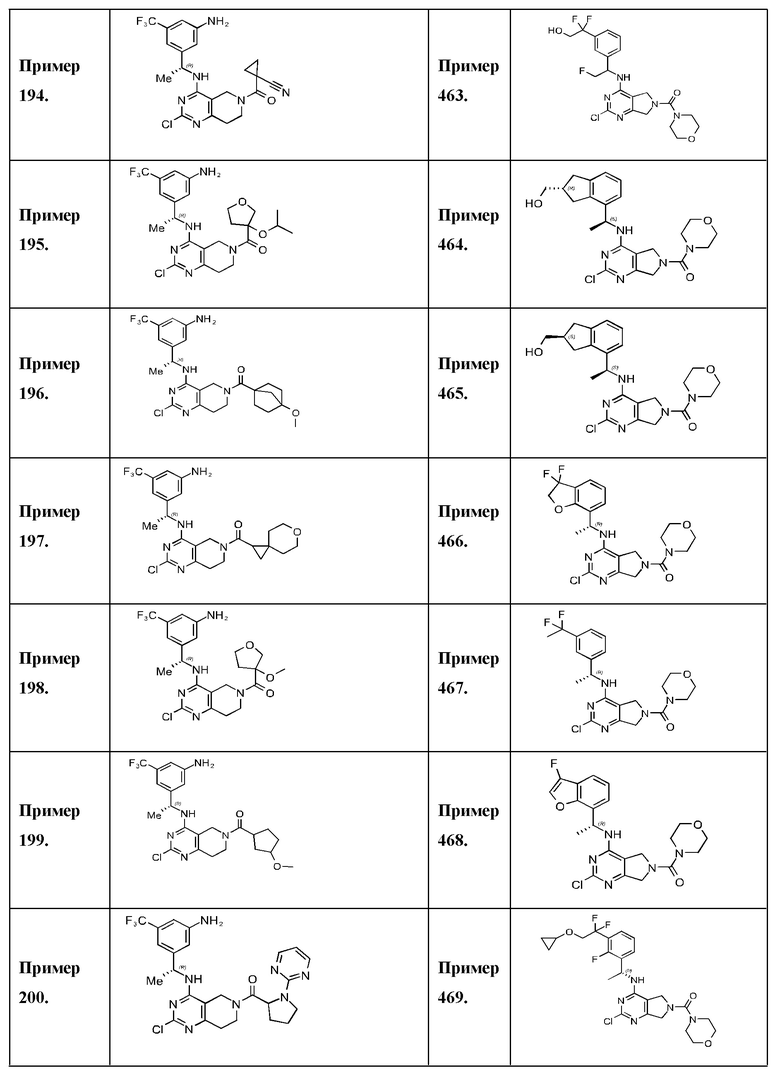
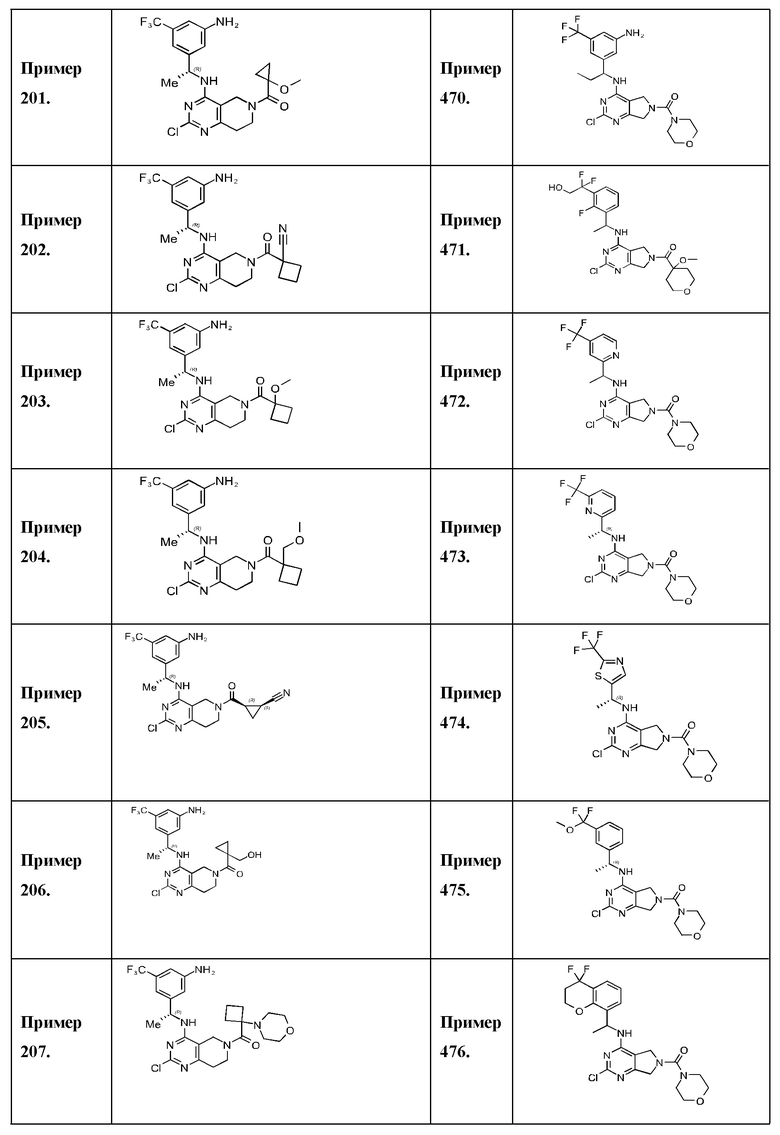
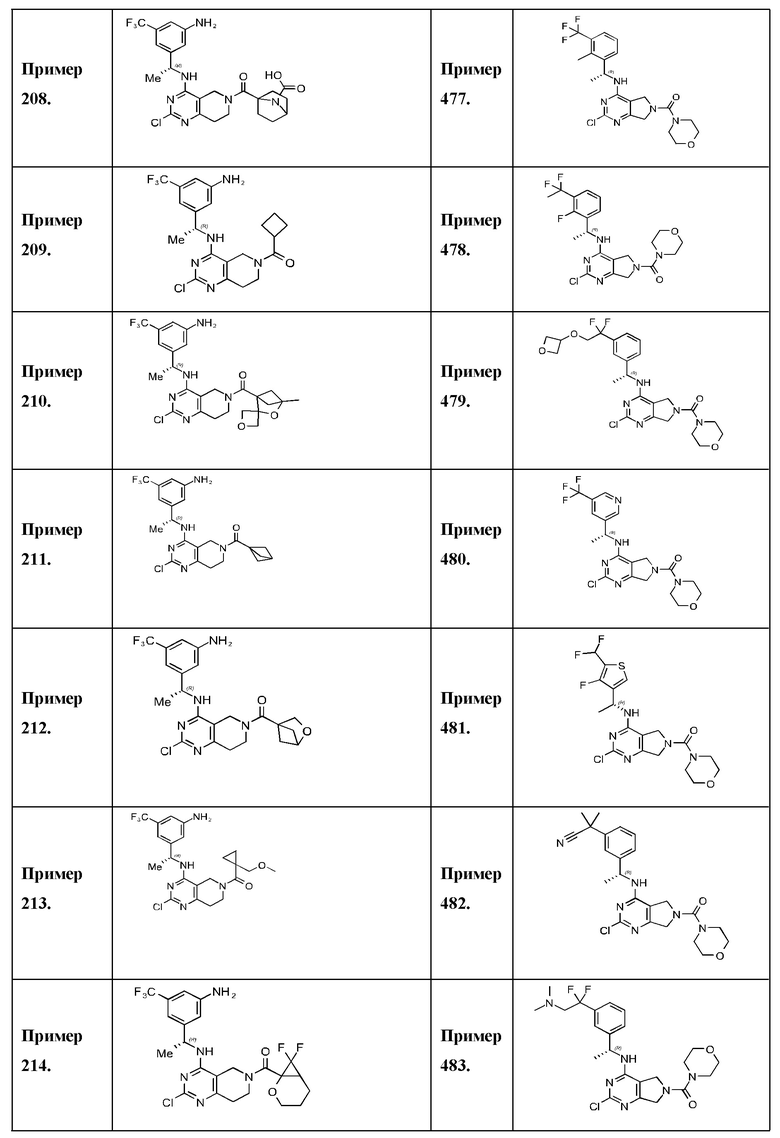
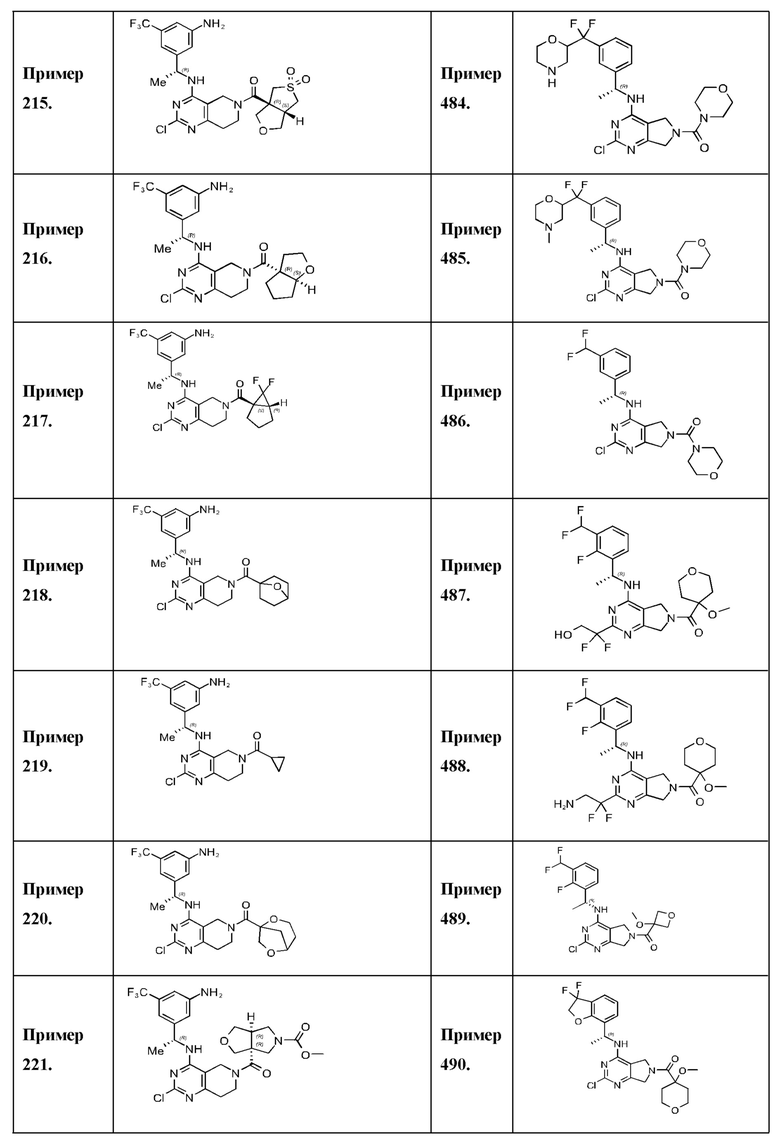
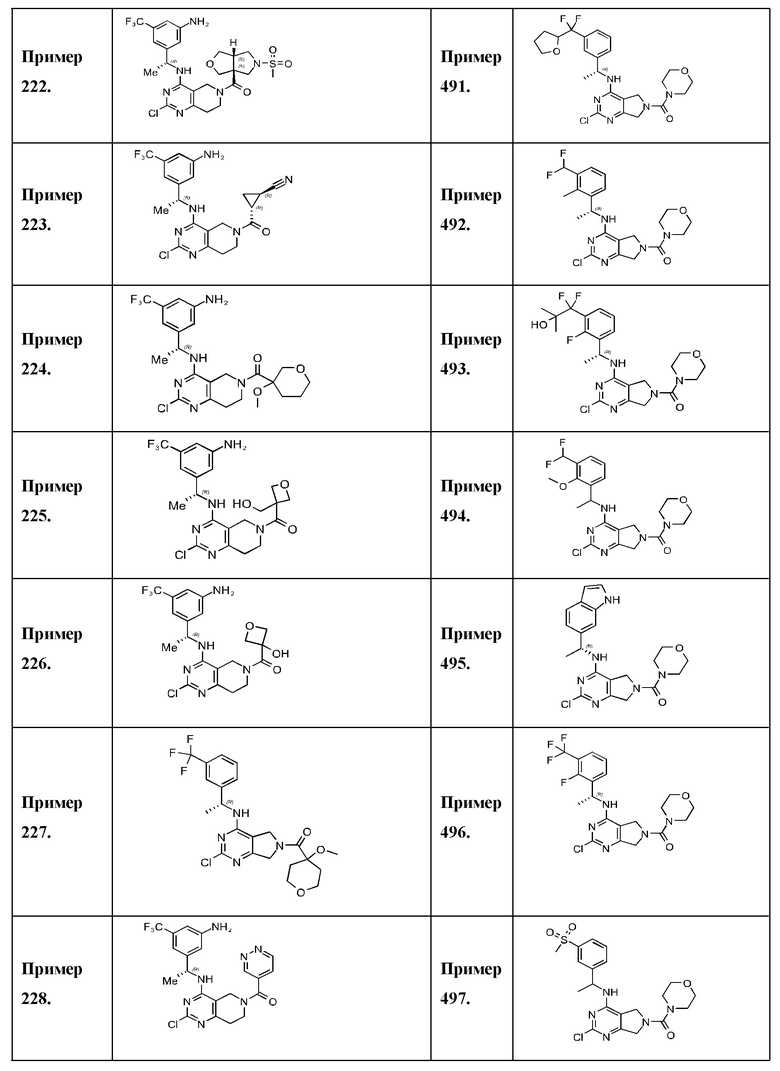
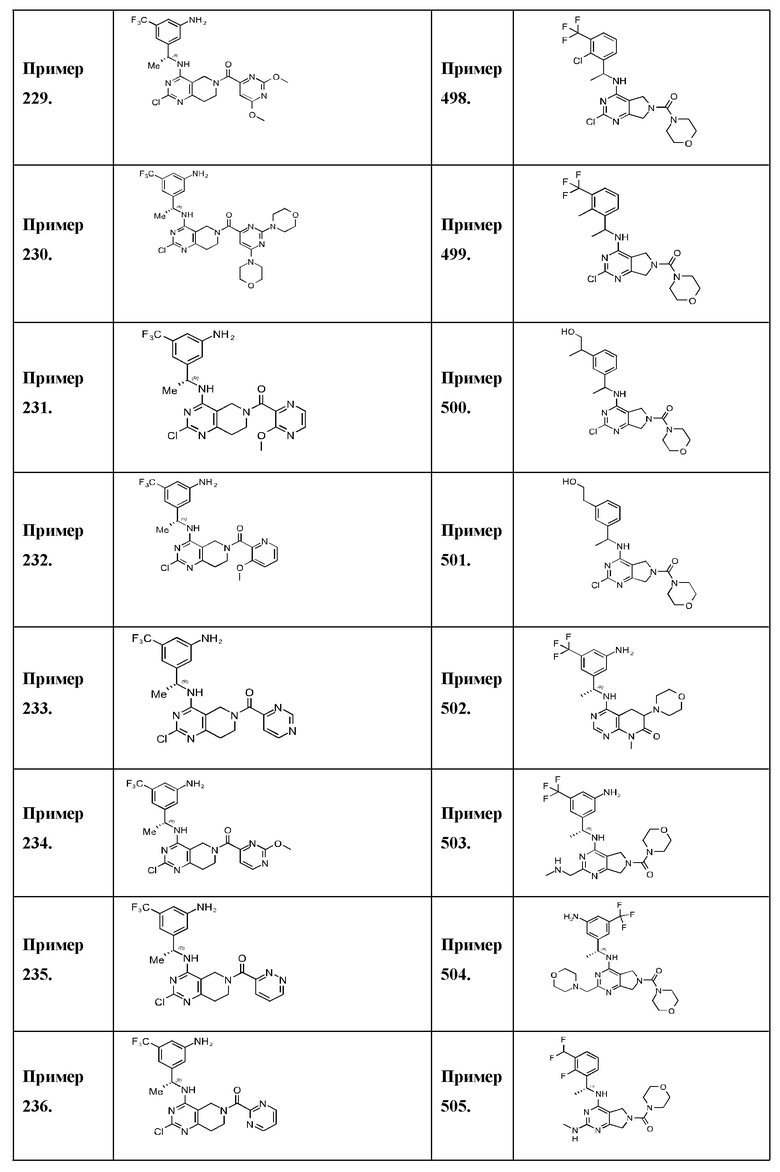
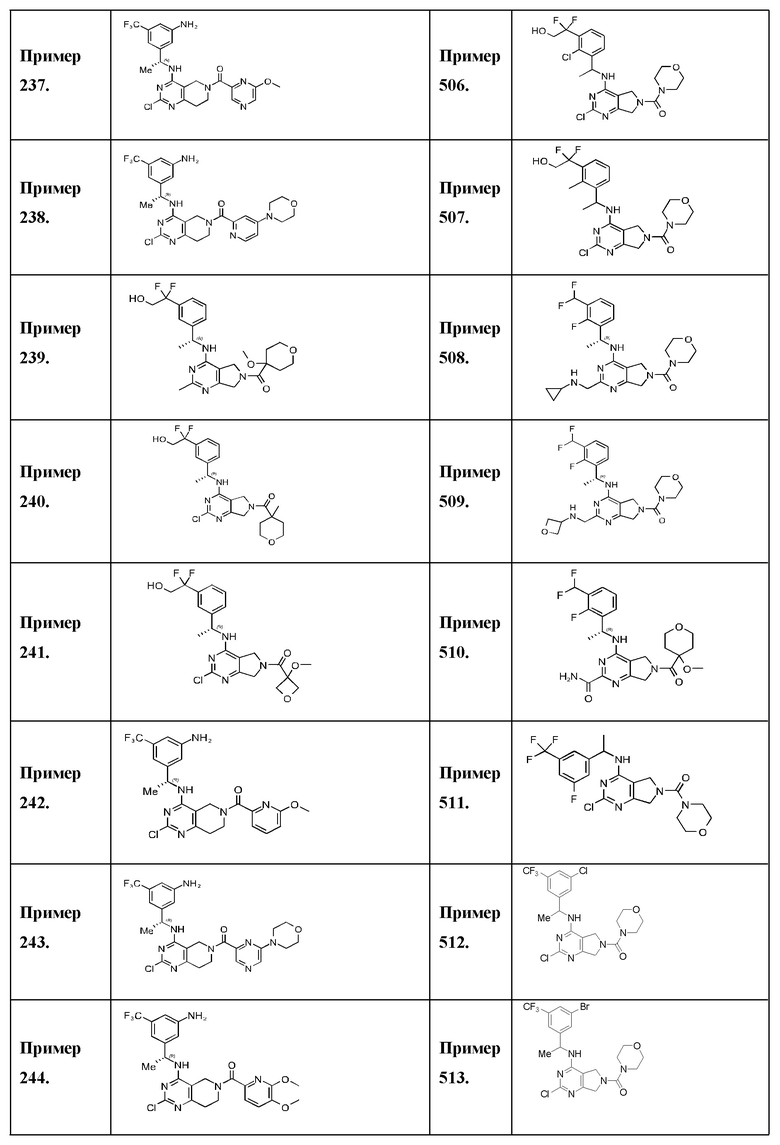
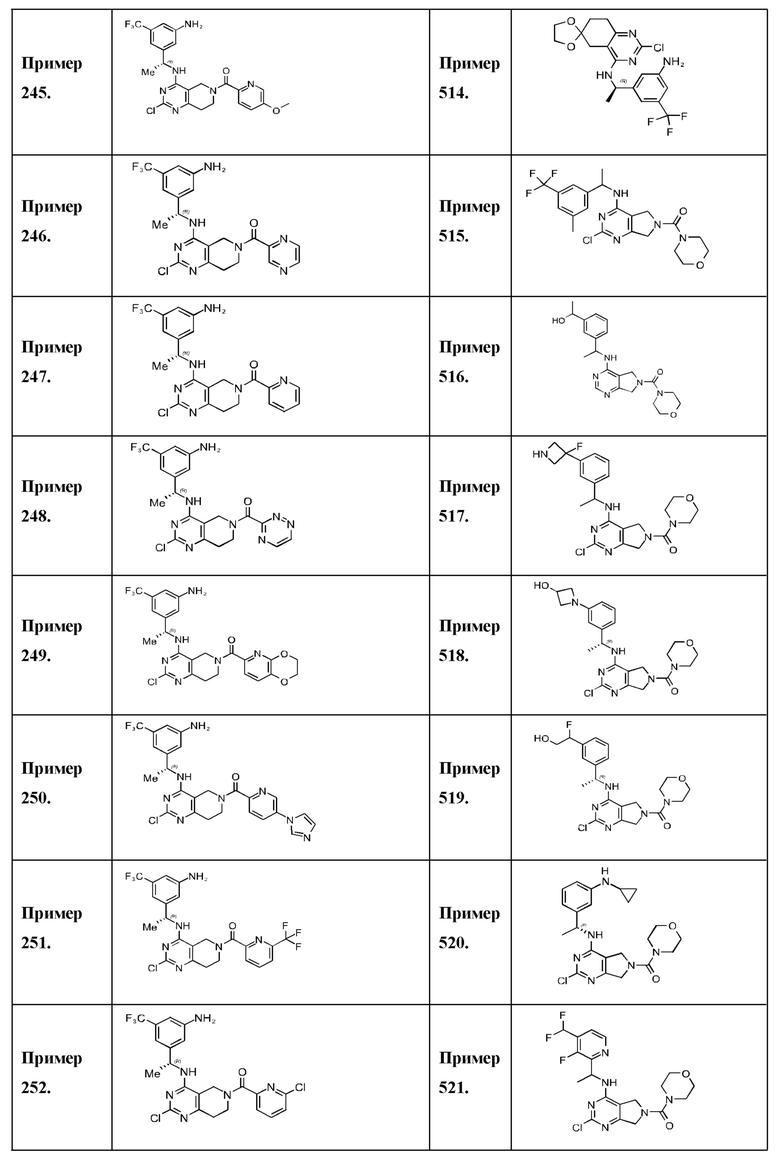
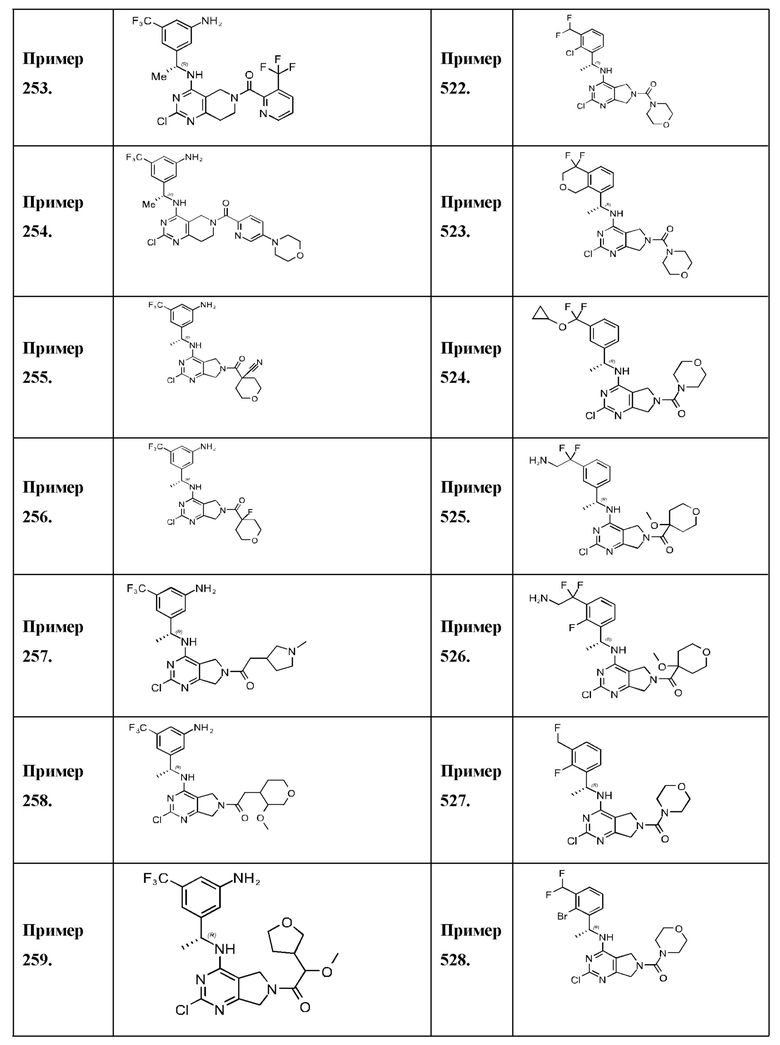
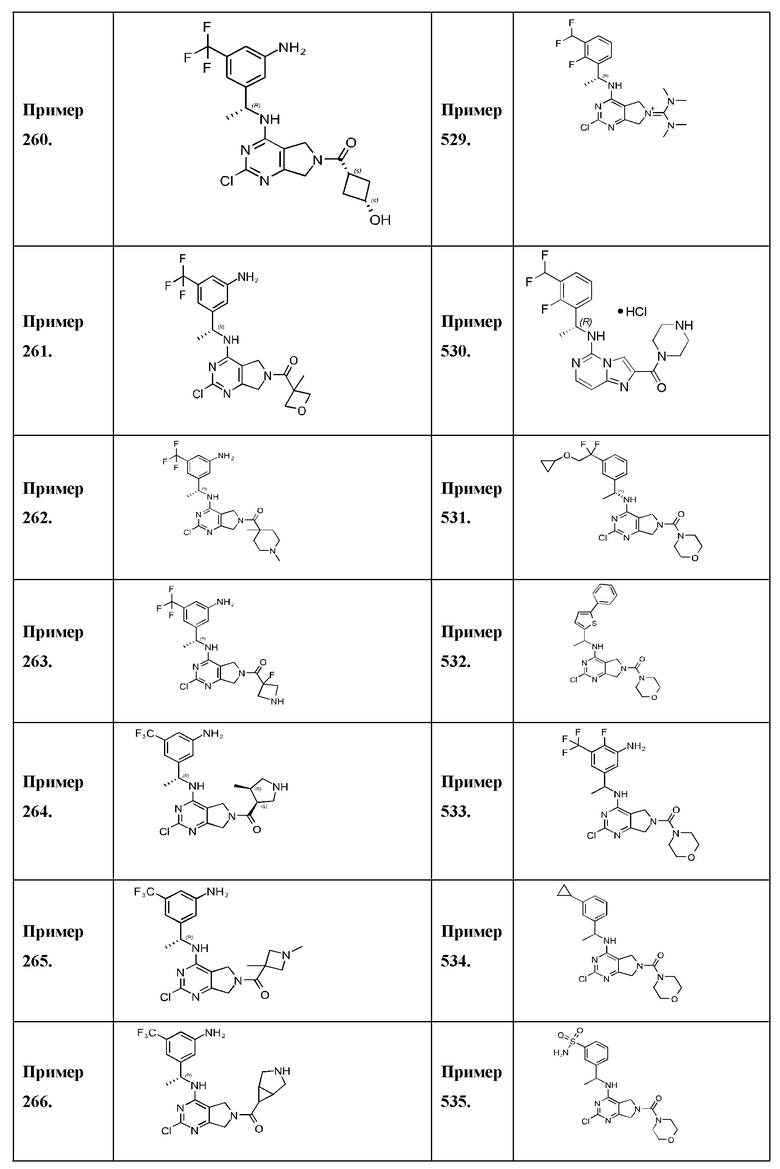
16. Фармацевтическая композиция для ингибирования SOS1 у субъекта, нуждающегося в лечении, содержащая эффективное количество соединения по любому из пп. 1-15 или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера или таутомера и фармацевтически приемлемый носитель.
17. Способ ингибирования SOS1 у субъекта, включающий введение субъекту эффективного количества соединения по любому из пп. 1-15 или его фармацевтически приемлемых соли, сольвата, гидрата, стереоизомера или таутомера.
18. Способ ингибирования взаимодействия SOS 1 и белка семейства RAS в клетке или ингибирования взаимодействия SOS1 и RAC1 в клетке, включающий введение в клетку соединения по любому из пп. 1-15 или его фармацевтически приемлемых соли, сольвата, гидрата, стереоизомера или таутомера.
19. Способ лечения или предотвращения заболевания, причем лечение или предотвращение заболевания характеризуется ингибированием взаимодействия SOS1 и белка семейства RAS или ингибированием взаимодействия SOS1 и RAC1, при этом способ включает введение нуждающемуся в этом субъекту эффективного количества соединения по любому из пп. 1-15 или его фармацевтически приемлемых соли, сольвата, гидрата, стереоизомера или таутомера.
20. Способ лечения или предотвращения рака у нуждающегося в этом субъекта, включающий введение субъекту эффективного количества соединения по любому из пп. 1-15 или его фармацевтически приемлемых соли, сольвата, гидрата, стереоизомера или таутомера.
21. Способ по п. 19 или 20, отличающийся тем, что заболевание или рак выбраны из группы, состоящей из рака поджелудочной железы, рака легкого, колоректального рака, гематологического рака, холангиокарциномы, множественной миеломы, меланомы, рака матки, рака эндометрия, рака щитовидной железы, острого миелоидного лейкоза, рака мочевого пузыря, рака уротелия, рака желудка, рака шейки матки, плоскоклеточной карциномы головы и шеи, диффузной В-крупноклеточной лимфомы, рака пищевода, хронического лимфоцитарного лейкоза, гепатоцеллюлярного рака, рака молочной железы, рака яичника, рака предстательной железы, глиобластомы, рака почки и сарком.
22. Способ по п. 21, отличающийся тем, что заболевание представляет собой RASопатию.
23. Способ по п. 22, отличающийся тем, что RASопатия выбрана из группы, состоящей из нейрофиброматоза 1 типа (НФ1), синдрома Нунан (СН), синдрома Нунан с множественным лентигинозом (СНМЛ), синдрома капиллярной мальформации -артериовенозной мальформации (КП-АВМ), синдрома Костелло (СК), кардио-фацио-кожного синдрома (КФК), синдрома Легиуса и наследственного фиброматоза десен.
| WO 2014015291 A1, 23.01.2014 | |||
| WO 2016115434 A1, 21.07.2016 | |||
| Leonard O | |||
| Ross, Leon Goodman, and B | |||
| R | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Горный компас | 0 |
|
SU81A1 |
| WO 2017014323 A1, 26.01.2017 | |||
| WO 2018115380 A1, 28.06.2018 | |||
| WO 2018172250 A1, 27.09.2018 | |||
| WO 2006119504 A3, | |||
Авторы
Даты
2024-01-15—Публикация
2020-03-02—Подача