Изобретение относится к области биотехнологии и позволяет получить липосомальные наноконтейнеры с иммобилизированным ферментом в виде мультиламеллярных липосом со средним размером 60-70 нм, которые за счет замедленного высвобождения лекарственного средства могут быть использованы для лечения желудочно-кишечного тракта как человека, так и животных благодаря тому, что образованы из фосфолипидов природного происхождения и фермента, улучшающего пищеварение.
Липосомы – это полые частицы, содержимое которых ограничено фосфолипидной оболочкой. Они играют огромную роль для эффективной доставки лекарственных средств в клетки-мишени организма. Еще в 60-х годах XX века было установлено, что фосфолипидные мембраны обладают свойством полупроницаемого барьера (Choudhury A., Ahmed F.R.S., Hossen M.N. et al. Liposome: a carrier for effective drug delivery. Journal of Applied Pharmaceutical Research 2020;8(1):22-8. DOI: 10.3923/pjbs.2006.1181.1191).
На сегодняшний день установлено, что около миллиарда людей страдает белково-энергетической недостаточностью. Белковая недостаточность представляет собой болезненное состояние организма, связанное с недостаточным поступлением и усвоением белка либо с его усиленным распадом (Скутова, В.А. Острый панкреатит: Актуальные вопросы диагностики и комплексного лечения / В.А. Скутова, А.И. Данилов, Ж.А. Феоктистова // Вестник Смоленской государственной медицинской академии. – 2016. – № 2. – C. 78–84. ). По данным ВОЗ на сегодняшний день у здорового человека коэффициент усвоения белка максимально может быть равен 0,9. А это значит, что в идеальных условиях из 20 грамм белка усваивается 18 грамм. Остальные белки переходят в толстый кишечник, начинаются процессы гниения, вызывая интоксикацию. Зачастую, такие ферментные препараты как МЕЗИМ® ФОРТЕ, ПАНГРОЛ® не достаточно эффективны при обострениях, т.к. большая часть действующих ферментов либо инактивируется в желудочно-кишечном тракте (ЖКТ), либо разрушается под действием агрессивной среды желудка (Функ, С.В. Мезим форте в лечении болевой формы хронического панкреатита с умеренными проявлениями внешнесекреторной недостаточности поджелудочной железы /С. В. Функ// Медицина и экология. – 2012. – № 2. – С. 70–72. Можейко, Л.А. Секреция и рекреция панкреатических ферментов. Секреция панкреатических ферментов / Л.А. Можейко // Журнал Гродненского государственного медицинского университета. – 2017. – № 4. – C. 381–385).
Липосомы находят широкое применение в качестве наноконтейнеров для лекарственных препаратов, что обусловлено главным образом близостью свойств липидных носителей и природных биомембран (Lamichhane N., Udayakuma T.S., D'Souza W.D. et al. Liposomes: Clinical Applications and Potential for Image-Guided Drug Delivery. Molecules 2018;23(2):288. DOI: 10.3390/ molecules23020288. PMID: 29385755).
Известен способ получения мультиламеллярной липосомной композиции для замедленного высвобождения лекарственного средства. В данном методе нанокапсулы получают с ионным градиентом между внутренней и внешней оболочкой за счет смешивания раствора водной фазы и липидсодержащего раствора в различных соотношениях, где введение лекарственного средства во внутреннюю часть липосомной композиции движущей силой, осуществляют за счет силы, возникающей в результате ионного градиента (патент RU 2577683 C2 от 2010-12-27). Недостатком данного способа является использование водной фазы, а не органического растворителя.
Известен метод получения двухслойных липосом с иммобилизированными β-каротиноидами. Способ получения липосомальных препаратов на основе смешивания в емкости биологически активного вещества, фосфолипидов и растворителя, отличается тем, что в смесь дополнительно вводят порошкообразный наполнитель и после достижения однородности массы растворитель при перемешивании отгоняют в условиях пониженного давления. Причем фосфолипиды и растворитель вводят в емкость в виде раствора (RU 2130771 C1 от 1999-05-27).
Известен способ получения липосомальных лекарственных препаратов путем приготовления раствора лекарственного средства (ЛС) в смеси воды, этилового спирта, поверхностно-активного вещества (ПАВ), липидов и введении в него многоступенчато при интенсивном перемешивании буферного раствора. В ходе процесса образуется дисперсия липосом, содержащих ЛС, в водно-спиртовом растворе липосом, содержащих ЛС (Евр. пат. N 0158441, кл. A 61 K 9/50, 1985). В данном способе получения липосомальных препартов 500 мг яичного лецитина растворяли в 400 мг этилового спирта и 100 мг водного раствора (500 мг/мл) БАВ - глюкозы и 100 мг ПАВ - спана-80 и перемешивали. К полученной композиции добавляли дробно 4 мл 50 mM фосфатного буфера с pH 7.4 при интенсивном встряхивании в ходе процесса добавления, а также через 1, 15 и 30 минут после добавления буферного раствора. Затем через время добавляли еще 6 мл буферного раствора и встряхивали. Данный способ является сложным и достаточно долгим в исполнении. Также встряхивание эмульсии является менее эффективным способом получения липосом в отличии от диспергирования ультразвуковым дезинтегратором.
Maurer et al. в US 7094423 от 2006-08-22 описывают способ получения липосом с имммобилизированными нуклеиновыми кислотами. В данном способе предварительно получают полые везикулы в водном растворе, далее добавляют этиловый спирт с концентрацией 25-40% с добавлением нуклеиновых кислот. Затем смесь диафильтровали для удаления этанола.
В данном методе используют этиловый спирт с низкой концентрацией, помимо это получение изначально полых везикул в водном растворе приводит к низкому выходу липосомальных наноконтейнеров в эмульсии.
В патенте US20040142025 A1 от 2004-07-22 описывается липосомальный аппарат и способы получения липидной везикулы, инкапсулирующей нуклеиновую кислоту внутри. Способ включает обеспечение водного раствора в первом резервуаре и обеспечение органического липидного раствора во втором резервуаре. При этом для получения липидного раствора используется этанол.
Минусом данного метода является низкий процент инкапсуляции РНК в липосомы за счет использования водного раствора.
Наиболее близким является способ получения липосом, описанный в патенте RU 2621145 от 2015-11-03. Согласно данному способу получают однослойные липосомы из соевого лецитина. Способ получения липосом характеризуется тем, что 1%-ный раствор лецитина в этиловом спирте испаряют в роторном испарителе IKA RV10 control при температуре водяной бани 60°С, в результате на стенке испарительной колбы получают пленку липидов, далее добавляют сантимолярный натрий-фосфатный буфер pH 7,4 в объеме, равном объему раствора лецитина в этиловом спирте, перемешивают в течение 1 минуты, далее полученный раствор подвергают воздействию ультразвуком в течение 15 минут, за счет чего на выходе получают монодисперсную гомогенную систему с размером частиц 59,9-106,2 нм. Недостатком данного метода является небольшая частота дезинтеграции эмульсии. Помимо этого, не учтен факт растворимости лецитина в спирте, так как данный субстрат малорастворим в данном растворителе. Вышеописанные минусы приводят к неполному растворению лецитина и меньшему проценту образовавшихся липосом. А также согласно данному способу не предусмотрена возможность использования липосом в качестве наноконтейнеров для адресной доставки ферментного препарата.
Следовательно, существует потребность в создании способа инкапсулирования ферментных препаратов в липосомы без использования водных растворов, многостадийных и долгосрочных методов.
Задачей данного изобретения является разработка усовершенствованного, простого в техническом плане способа получения липосомальных наноконтейнеров с иммобилизированным ферментом.
Техническим результатом является решение поставленной задачи, обеспечивающей получение мультиламеллярных липосомальных наноконтейнеров с иммобилизированным ферментом, размеры частиц которых составляют 60-70 нм.
Технический результат достигается предложенным способом, включающим приготовление раствора лецитина в этиловом спирте, испарение указанного раствора в роторном испарителе при температуре водяной бани 60℃ до образования на колбе пленки липидов желто-коричневого цвета, внесение натрий - фосфатного буфера с pH=7,4 в объеме, равном объему раствора лецитина в этиловом спирте, перемешивание и обработку ультразвуком, в который внесены следующие изменения:
- используют 0,3% раствор лецитина в этиловом спирте, для приготовления которого его выдерживают 15 минут в ультразвуковой бане, с нагревом до 55℃ и при 60 Гц, что позволяет улучшить растворение лецитина; - ферментный препарат вносят в виде раствора в заранее подготовленном натрий - фосфатном буфере с pH=7,4 после отфильтровывания 0,3% раствора лецитина в этиловом спирте и испарения фильтрата в роторном испарителе с использованием диафрагменного насоса со скоростью вращения 2500 оборотов;
- продолжают перемешивать в течение 2 минут без использования вакуума и нагрева;
- после чего колбу помещают в ультразвуковую баню на 5 минут при 60 Гц.
Новизна и изобретательский уровень предложенного способа заключается в:
- инкапсулировании ферментного препарата в мультиламеллярный липосомальный наноконтейнер, позволяющий обеспечить достижение максимального терапевтического эффекта за счет адресной доставки ферментного препарата путем высвобождения фермента в 12-перстной кишке благодаря многослойности наноконтейнера и устойчивости оболочки в среде желудка;
- использование 0,3% раствора лецитина в спирте при приготовлении которого используется ультразвуковая баня, что обеспечивает полное растворение летицина.
Конкретный пример использования заявленного изобретения.
Мультиламеллярные липосомы с инкапсулированным ферментом получают методом дегидратации. В способе используют соевый лецитин, в состав которого входит 34% фосфатидилхолинов, 26% фосфатидилэтаноламинов, 19% фосфатидилинозитолов, 4% фосфатидных кислот, 9% фосфатидилглицеринов, 8% полифосфатидных кислот. Помимо этого лецитин из сои является более распространенным и дешевым. В качестве фермента используют ферментный препарат панкреатин - экстракт содержимого поджелудочной железы, в состав которого входят панкреатические ферменты амилаза, липаза и протеаза, которые участвуют в переваривании углеводов, жиров и белков.
Для получения мультиламеллярных липосомальных наноконтейнеров к навеске 0,3 грамм лецитина приливают 100 миллилитров этилового спирта. Далее помещают раствор на 15 минут в ультразвуковую баню с нагревом до 55℃ и при 60 Гц для растворения лецитина. Затем полученную смесь отфильтровывают через бумажный фильтр «синяя лента». Полученный фильтрат переносят в колбу роторного испарителя с подключенным диафрагменным насосом модели GM-2,00 Daihan scientific со скоростью вращения 2500 оборотов и испаряют 0,3% раствор летицина в спирте при температуре водяной бани 60℃. После образования на колбе пленки липидов желто-коричневого цвета вносят заранее подготовленный фосфатный буфер с pH=7,4 в объеме 100 мл и продолжают перемешивание при скорости вращения 2500 оборотов без нагрева и с отключенным диафрагменным насосом. Натрий - фосфатный буфер с pH=7,4 готовят из 8,1 мл 0,2М раствора гидрофосфата натрия и 1,9 мл 0,2 М раствора дигидрофосфата натрия с последующим доведением до объема 100 мл, затем вводят в буфер 10 мг ферментного препарата панкреатина. Спустя 2 минуты после начала перемешивания колбу помещают в ультразвуковую баню без нагрева на 5 минут при 60 Гц. В результате получают эмульсию, содержащую мультиламеллярные липосомальные наноконтейнеры с иммобилизированным ферментом размером от 24,5 нм до 90 нм, средний размер липосом составляет 60-70 нм.
Исследование иммобилизации панкреатина в липосомальные наноконтейнеры.
1. Определение протеолитической активности панкреатина
Для определения протеолитической активности панкреатина подготовили опытную пробирку с 2 мл полученной эмульсии и контрольную пробирку с 2 мл натрий - фосфатного буферного раствора, содержащего 10 мг панкреатина. В контрольную пробирку прилили 4 мл 14% раствора трихлоруксусной кислоты. Затем в каждую пробирку прилили по 2 мл 1% раствора казеина, перемешали и выдержали в водяной бане при 30℃ в течение 30 минут. Далее в опытную пробирку прилили 4 мл 14% трихлоруксусной кислоты. После чего содержимое обеих пробирок профильтровали через фильтр «синяя лента» и к каждому фильтрату добавили по 1 мл 2Н реактива Фолина-Чокалтеу. Пробирки инкубировали 30 минут при комнатной температуре для проведения реакции. Визуальным результатом реакции на белки являлось изменение цвета растворов с желтого на салатовый. После стабилизации окраски определяли оптическую плотность содержимого пробирок при 760 нм на УФ/Вид спектрофотометре для исследования нано- и микрообъемов жидкостей NABI NICRODIGITAL. Провели по 4 измерения, которые свели к среднему арифметическому (Таблица 1).
Таблица 1
Оптическая плотность
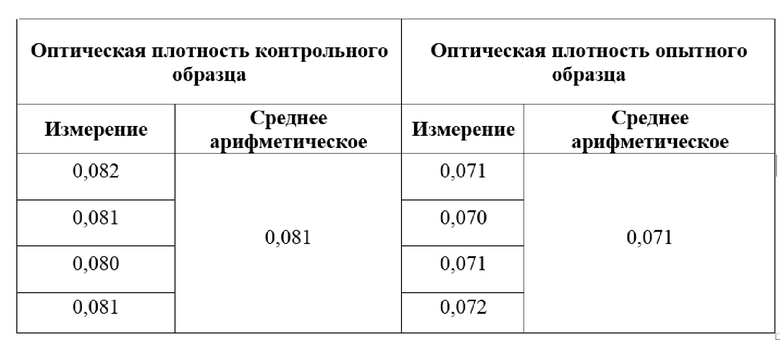
Затем провели расчет протеолитической активности панкреатина по следующей формуле, взятой из источника Методические указания к лабораторному практикуму по дисциплине "Биохимия". Ферменты-гидролазы: Часть II. «Витамины и ферменты» (О.Н. Макасеева. - Могилев: Могилевский технологический институт, 2000. - 73 с.):
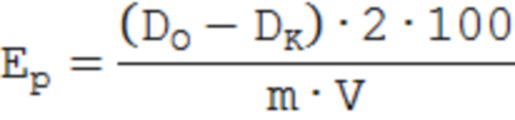
где Ер – протеолитическая активность (в условных единицах);
DО – оптическая плотность опытного раствора после стабилизации окраски;
DК – оптическая плотность контрольного раствора после стабилизации окраски;
2 – коэффициент для пересчета на 1 г;
100 – общий объем вытяжки, мл;
m – навеска летицина, г, рассчитанная как 0,3/30, исходя из образованного количества липосом;
V – объем вытяжки ферментного препарата панкреатина, взятого для анализа, мл.

На основе полученного результата можно сделать вывод о том, что панкреатин имеет протеолитическую активность в 100 условных единиц. При образовании липосом, фермент иммобилизируется, а следовательно значение активности должно быть отрицательным. Следовательно, можно утверждать, что включение ферментного препарата в липосомальные наноконтейнеры. произошло на 100%.
2. Измерение размеров липосомальных наноконтейнеров.
Для измерения размеров липосом использовали метод общего динамического светорассеяния Dynamic light scattering, DLS, который заключается в анализе движения частиц, вызванного тепловым шумом или электрофоретической силой. Определено, что полученная эмульсия состоит из многослойных липосомальных наноконтейнеров размером от 24,5 нм до 90 нм, а средний размер липосом составляет 60-70 нм.
3. Исследования поведения предложенной пищевой добавки в ЖКТ человека.
3.1. Исследование стабильности проводили на модельных средах стандарт-титров с заданными значениями водородного показателя: 1,65; 7,0; 7,7. Показатели брали из расчета рН-среды пищеварительной системы человека. Ротовая полость – 6,8-7,2; желудок – 1,5-1,8; 12-перстная кишка – 7,5-8,0. Оценку термолабильности проводили согласно физиологическим показателям температуры тела человека в диапазоне 36-39℃. Временной диапазон исследований составил от 0 до 72 часов, максимального времени переваривания пищи у человека.
Подготовка образцов: по 1 мл эмульсии, содержащей липосомальные наноконтейнеры с иммобилизированным ферментом, помещали в лабораторные пробирки, приливали по 10 мл раствора стандарт-титра рН-среды равного 1,65; 7,0; 7,7. Каждую пробирку закрыли и термостатировали при температуре 36, 37, 38 и 39℃. Общее время анализа составило 72 часа. Через каждые 24 часа оценивали протеолитическую активность ферментов в эмульсии с указанием условных единиц активности панкреатина (Таблица 2).
Таблица 2
Оценка влияния температуры и рН-среды на образец полученной эмульсии по показаниям протеолитической активности.*
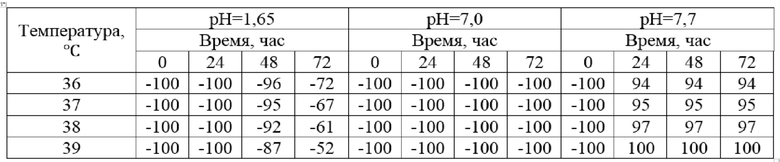
*Условные обозначения: -100 – протеолитическая активность фермента в условных единицах
На основании проведенного исследования можно сделать вывод о том, что в ротовой полости разрушения мультиламеллярных липосом не происходит, в желудке разрушение наступает только на 2 сутки, что в условиях реалий жизни невозможно, а в 12-перстной кишке полностью активируется уже в течение 24 часов.
3.2. Для изучения начального времени высвобождения панкреатина определяли протеолитическую активность без измерения оптической плотности, а только по переходу окраски из желтого в салатовый. Анализ образцов проводили визуально в трех повторностях через 4 часа при рН в диапазоне от 7,4 до 8,0 и температуре 36,7 (Таблица 3).
Таблица 3
Определение начального времени высвобождения панкреатина*
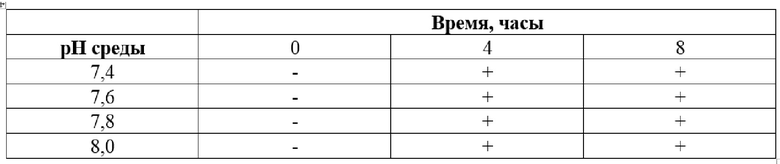
*Условные обозначения: «-» нет изменения цвета; «+» есть изменение цвета.
Анализируя полученные данные, можно сделать вывод о том, что начальное высвобождение фермента происходит в слабощелочной среде уже через 4 часа.
3.3. Для изучения полного времени высвобождения фермента используется методика определения протеолитической активности панкреатина по методике, описанной в примере 1. Для контроля смотрели оптическую плотность раствора в течении 72 часов через каждые 24 часа в диапазоне рН от 7,4 до 8,0. (Таблица 4).
Таблица 4. Определение полного времени высвобождения панкреатина*

*Условные обозначения: -100 – протеолитическая активность фермента в условных единицах
Исходя из полученных данных можно сделать вывод о том, что полное высвобождение фермента в 12-перстной кишке происходит сразу, так как липосомальные наноконтейнеры с иммобилизированным ферментом в кислой среде желудка из мультиламеллярных превращались в моноламеллярные и затем быстро разрушались под действием слабощелочной среды в 12-перстной кишке.
Таким образом, поставленная задача решена и технический результат по созданию простого способа получения липосомальных наноконтейнеров с иммобилизированным ферментом с средним размером частиц 60-70 нм, обеспечивающих достижение максимального терапевтического эффекта за счет адресной доставки ферментного препарата путем высвобождения фермента в 12-перстной кишке благодаря многослойности наноконтейнера и устойчивости оболочки в среде желудка, достигнут.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения липосом | 2015 |
|
RU2621145C2 |
| ЛИПОСОМАЛЬНОЕ СРЕДСТВО НА ОСНОВЕ УБИХИНОЛА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2605616C1 |
| СПОСОБ ПОЛУЧЕНИЯ СИСТЕМЫ ДОСТАВКИ ВОДОНЕРАСТВОРИМЫХ И ПЛОХОРАСТВОРИМЫХ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ И ЛЕКАРСТВЕННАЯ ФОРМА НА ЕЕ ОСНОВЕ | 2006 |
|
RU2325151C2 |
| ЛИПОСОМАЛЬНАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2012 |
|
RU2516893C1 |
| СРЕДСТВО НА ОСНОВЕ БИСНАФТАЗАРИНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2016 |
|
RU2669374C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИОФИЛИЗИРОВАННЫХ ЛИПОСОМ | 1997 |
|
RU2144352C1 |
| СРЕДСТВО ВНУТРИКЛЕТОЧНОЙ ДОСТАВКИ БИОЛОГИЧЕСКИ АКТИВНОГО ВЫСОКОМОЛЕКУЛЯРНОГО СОЕДИНЕНИЯ НА ОСНОВЕ НАНОЧАСТИЦ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2014 |
|
RU2541121C1 |
| СРЕДСТВО С ЛИПОСОМАМИ, СОДЕРЖАЩИМИ ЯНТАРНУЮ КИСЛОТУ И ЭКСТРАКТ ПРОПОЛИСА, ОБЛАДАЮЩЕЕ ДЕЗИНТОКСИКАЦИОННОЙ И АНТИОКСИДАНТНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2561591C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФОСФОЛИПИДНОГО НОСИТЕЛЯ ХОЛЕСТЕРИНА | 1994 |
|
RU2097038C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИПОСОМАЛЬНЫХ ПРЕПАРАТОВ | 1998 |
|
RU2130771C1 |
Изобретение относится к области химии и фармацевтики, а именно к способу получения липосомальных наноконтейнеров с иммобилизированным ферментом, включающему приготовление 0,3% раствора лецитина в этиловом спирте, который перед помещением в роторный испаритель выдерживают 15 мин в ультразвуковой бане с нагревом до 55°С и при 60 Гц и затем отфильтровывают, испарение фильтрата в роторном испарителе, которое осуществляют с использованием диафрагменного насоса со скоростью вращения 2500 оборотов при температуре водяной бани 60°С до образования на колбе пленки липидов желто-коричневого цвета, внесение натрий-фосфатного буфера с pH 7,4 в объеме, равном объему раствора лецитина в этиловом спирте, причем ферментный препарат вносят в виде раствора в натрий-фосфатном буфере с pH 7,4 и продолжают перемешивать в течение 2 мин без использования вакуума и нагрева; после чего помещают в ультразвуковую баню без нагрева на 5 мин при 60 Гц. Технический результат заключается в получении мультиламеллярных липосомальных наноконтейнеров с иммобилизированным ферментом, обеспечивающих адресную доставку ферментного препарата путем высвобождения фермента в 12-перстной кишке. 4 табл., 1 пр.
Способ получения липосомальных наноконтейнеров с иммобилизированным ферментом, включающий приготовление раствора лецитина в этиловом спирте, испарение указанного раствора в роторном испарителе при температуре водяной бани 60°С до образования на колбе пленки липидов желто-коричневого цвета, внесение натрий-фосфатного буфера с pH 7,4 в объеме, равном объему раствора лецитина в этиловом спирте, перемешивание и обработку ультразвуком, отличающийся тем, что используют 0,3% раствор лецитина в этиловом спирте, который перед помещением в роторный испаритель выдерживают 15 мин в ультразвуковой бане, с нагревом до 55°С и при 60 Гц и затем отфильтровывают, испарение фильтрата в роторном испарителе осуществляют с использованием диафрагменного насоса со скоростью вращения 2500 оборотов; ферментный препарат вносят в виде раствора в натрий-фосфатном буфере с pH 7,4 и продолжают перемешивать в течение 2 мин без использования вакуума и нагрева; после чего помещают в ультразвуковую баню без нагрева на 5 мин при 60 Гц.
| КУЗУБОВА Е | |||
| В | |||
| и др | |||
| Наноразмерные липосомы как контейнеры лекарственных веществ // XI Международный молодежный форум "Образование | |||
| Наука | |||
| Производство" | |||
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
| - С | |||
| ДЕЛИТЕЛЬНЫЙ СТАНОК ДЛЯ НАРЕЗКИ МАСШТАБНЫХ ЛИНЕЕК | 1924 |
|
SU1059A1 |
| ZHU C | |||
| Y | |||
| et al | |||
| Recent Strategies for the Immobilization of Therapeutic Enzymes // Polymers | |||
| Способ получения продуктов конденсации фенолов с формальдегидом | 1924 |
|
SU2022A1 |
| - Vol | |||
| Паровоз для отопления неспекающейся каменноугольной мелочью | 1916 |
|
SU14A1 |
| - No | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| - Art | |||
| Машина для изготовления резиновых шин со шнурками | 1925 |
|
SU1409A1 |
| СПОСОБ ПОЛУЧЕНИЯ СИСТЕМЫ ДОСТАВКИ ВОДОНЕРАСТВОРИМЫХ И ПЛОХОРАСТВОРИМЫХ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ И ЛЕКАРСТВЕННАЯ ФОРМА НА ЕЕ ОСНОВЕ | 2006 |
|
RU2325151C2 |
| RU | |||
Авторы
Даты
2022-11-23—Публикация
2022-05-16—Подача