Изобретение относится к медицине, химико-фармацевтической промышленности, а именно к способу получения средства для офтальмологического применения на основе биснафтазарина в виде липосом, обладающего противовоспалительным и противоаллергическим действием. Заявляемая липосомальная композиция в качестве активного компонента содержит выделенный из игл и панциря зеленого морского ежа Strongylocentrotus droebachiensis пигмент биснафтазарин - этилиден-6,6'-бис(2,3,7-три-гидроксинафтазарин), липиды в виде фосфолипидов и стеринов, сорастворитель, водную фазу и криопротекторы. Липосомальная структура обеспечивает растворимость биснафтазаринов, их стабильность и офтальмобиодоступность при инсталляциях в форме глазных капель.
Офтальмологические лекарственные формы для местного применения быстро удаляются из конъюнктивального мешка, поэтому время поглощения лекарства составляет только несколько минут, определяя низкую биодоступность лекарственного препарата, обычно менее 5%. Роговица является следующим существенным барьером на пути лекарственных препаратов. Роговица является не только барьером для механических повреждений, но также обеспечивает избирательную проницаемость для химических соединений с целью поддержания гомеостаза в тканях передней камеры глаза. Обеспечение доставки необходимых для жизни веществ определяет наличие в эпителии роговицы развитых систем облегченного и активного транспорта. С целью повышения эффективности, увеличения локальной биодоступности были предложены многочисленные системы контролируемого высвобождения офтальмологических препаратов на основе растворимых полимеров [Breton P., Larras V., Roy D. et al. Biocompatible poly(methylidene malonate)made materials for pharmaceutical and biomedical applications. Eur. J. Pharm. Biopharm. 2008; 68: 479-495]. По ряду причин (сложность использования, раздражающее действие) эти системы не смогли вытеснить местное применение лекарственных препаратов. В связи с этим оптимизация существующих офтальмологических лекарственных средств для местного применения остается актуальной задачей. Использование веществ, повышающих проницаемость роговицы, наиболее эффективно в отношении гидрофильных и крупных молекул. С целью увеличения транспорта лекарственных веществ через роговицу используют специфические системы доставки. Двойственный с физико-химической точки зрения характер слезного барьера, а также гетерогенная структура роговицы обусловливают значительный интерес к липосомам как системе доставки лекарств. Уникальное строение фосфолипидного бислоя липосом делает их в одинаковой степени толерантными к гидрофильной и липофильной средам. Наряду с этим липосомы могут транспортировать липофильные вещества за счет растворения в липидной оболочке [Аляутдин Р.К, Иежица И.Н., Агарвал Р. Транспорт лекарственных средств через роговицу глаза: перспективы применения липосомальных лекарственных форм. Вестник Офтальмологии. 2014; 4: 117-122].
Важным преимуществом использования липосомальных форм является то, что фармакологически активные соединения, заключенные в состав липосом, сохраняют свою активную форму и остаются стабильными, не подвергаясь воздействию тех или иных систем организма, и не оказывают токсического воздействия на здоровые клетки организма.
Одним из перспективных направлений создания липосомальных форм является создание водорастворимых лекарственных форм на основе гидрофобных субстанций, что способствует увеличению их биодоступности и эффективности (Фармацевтическая разработка: концепция и практические рекомендации. Научно-практическое руководство для фармацевтической отрасли. Под ред. С.Н. Быковского и др., 2015. 472 с.).
Инкапсулирование веществ в липосомы можно проводить рядом способов, основными из которых являются следующие:
- пленочный метод подразумевает образование тонкой пленки из фосфолипида при выпаривании органического растворителя с последующим ее диспергированием в подходящей водной среде;
- ультразвуковой метод позволяет получить липосомы при суспендировании подходящего липида в водной среде с последующей обработкой смеси ультразвуком;
- методы, основанные на применении растворителей: быстрое смешивание липида в этаноле и воде путем впрыскивания липида в водный раствор.
Помимо достаточно трудоемкой технологии производства липосом, могут возникать некоторые сложности их использования из-за фазовой нестабильности в течение времени, что выражается в оседании и разделении фаз, слиянии и агломерации липосом при хранении.
Часто в состав липосом включают холестерин, т.к. это вещество способно моделировать физико-химические свойства липидного бислоя. Его добавление в соотношении к фосфолипиду от 1:1 до 2:1 повышает стабильность бислоя и снижающего его проницаемость. Действие холестерина основано на том, что кислород его гидроксильной группы связывает метальные группы фосфотидилхолина, а гидроксильная группа холестерина взаимодействует с С=O/Р=O группами фосфатидилхолина (Аршинова О.Ю. и др. Особенности лиофилизации липосомальных лекарственных препаратов (обзор). Хим.-Фармац. Ж. 2011; 46(4): 29-34).
Биснафтазарины являются димерными представителями полигидроксинафтохиноновых пигментов и способны проявлять значительную антиоксидантную активность, например, способны нейтрализовать действие основных инициаторов неферментативного процесса окисления мембранных липидов - катионов железа, накапливающихся в зоне ишемического повреждения ткани (Kuwahara R. et al. Antioxidant property of polyhydroxylated naphthoquinone pigments from shells of purple sea urchin Anthocidaris crassispina. LWT-Food Sci. Technol. 2009, 42(7): 1296-1300). Известно, что бинафтохиноновые пигменты из панцирей зеленых морских ежей вследствие наличия большого числа гидроксильных групп обладают антирадикальной активностью в отношении DPPH-радикала, которая превышает таковую мономерного эхинохрома А (Pozharitskaya О. N. et al. Evaluation of free radical-scavenging activity of sea urchin pigments using HPTLC with post-chromatographic derivatization. Chromatographia. 2013; 76(19-20): 1353-1358).
Выделенный пигментный комплекс биснафтазаринов из игл и панциря зеленого морского ежа Strongylocentrotus droebachiensis, обогащенный этилиден-6,6'-бис(2,3,7-три-гидроксинафтазарином), проявил значимую противовоспалительную активность на модели «каррагениновый воздушный мешочек у крыс» и на модели аллергического конъюнктивита у кроликов (Патент РФ 2545692, дата публикации 10.04.2015).
Несмотря на высокую фармакологическую активность, применимость пигментов нафтохинонового ряда в виде растворов в медицинской практике осложнена в связи с их низкой растворимостью и нестабильностью в водных растворах и, как следствие, низкой биодоступностью (Не J. Complex of shikonin and β-cyclodextrins by using supercritical carbon dioxide. J. Inclusion Phenomena Macrocyclic Chem. 2009; 63(3-4): 249-255; Li D. M. et al. Extraction, structural characterization and antioxidant activity of polyhydroxylated 1,4-naphthoquinone pigments from spines of sea urchin Glyptocidaris crenularis and Strongylocentrotus intermedius. Eur. Food Research Technol. 2013; 237(3): 331-339).
Повышение растворимости плохорастворимых субстанций может быть достигнуто путем создания солей на их основе. Из существующего уровня техники известно средство - наиболее близкий аналог - лекарственный препарат «Гистохром», проявляющего антиоксидантное и кардиопротективное действие, применяемый для лечения инфаркта миокарда, ишемической болезни сердца, а также травм и ожогов глаз, и представляющий собой водный раствор ди- и три-натриевых солей эхинохрома (2,3,5,6,8-пентагидрокси-7-этил-1,4-нафтохинон), выделенного из плоских морских ежей (Патент РФ №2137472, дата публикации 20.09.1999).
Другим способом, позволяющим получить водные растворы гидрофобных веществ, является создание липосомальных форм. Известен способ получения и применения липосом на основе растительного пигмента шиконина (5,8-дигидрокси-3(1'-гидрокси-4-метилпент-3-енил)-1,4-нафтохинона), обладающего ранозаживляющим, антимикробным, противовоспалительным и антиоксидантным действиями (Патент CN №102091037 (А), дата публикации 15.06.2011).
Наиболее близким к заявляемому изобретению является средство, представляющее собой молекулярно-капсулированную форму эхинохрома из плоских морских ежей, получаемую за счет создания условий при молекулярном капсулировании, при которых происходит связывание эхинохрома с полярной частью молекул ПАВ, позволяющее стабилизировать эхинохром в водной среде при концентрации до 0,5% и более. В качестве ПАВ выбирают структурно дифильные поверхностно-активные вещества, а именно кремофор RH-40, кремофор EL, кремофор А 25, кремофор А 6, Soluplus® (привитый сополимер поливинилкапролактама, поливинилацетата и полиэтиленгликоля), твин-80 или смеси мономерных и полимерных ПАВ. ПАВ из приведенного списка отличаются строением молекул, но имеют общий признак: значение гидрофильно-липофильного баланса (ГЛБ) для этих ПАВ находится в диапазоне 12-18. В качестве дополнительной стабилизации - для предотвращения преждевременного окисления активной компоненты, допускается присутствие структурно-дифильной добавки - антиоксиданта (например, аскорбиновой кислоты, аскорбилпальмитата) (Патент РФ 2500396, дата публикации 10.12.2013).
Данный подход позволяет стабилизировать эхинохром. Однако недостатком данного метода является то, что не описана возможность использования композиции для создания лекарственных средств. При этом эффект стабилизации водного раствора эхинохрома А за счет введения полимеров может носить временный характер: данных о времени стабильности полученных композиций в патенте отсутствуют.
Имеющаяся информация о липосомальных формах относится к широкому кругу веществ различной природы: от неорганических ионов до белков и нуклеиновых кислот (Патент РФ 2514000, дата публикации 27.04.2014; Патент РФ 2516893, дата публикации 20.05.2014; Патент РФ 2494729, дата публикации 10.10.2013; Патент РФ 2492863, дата публикации 20.09.2013; Патент РФ 2477632, дата публикации 20.03.2013).
Вместе с тем, несмотря на многочисленные разработки липосомальных препаратов, на сегодняшний день технологическое решение по вопросу создания приемлемой и стабильной при хранении липосомальной формы димерных пигментов полигидроксинафтохинонового ряда отсутствует. А на современном рынке лекарственные препараты на основе липосомальной формы пигментов полигидроксинафтохинонового ряда растительного и животного происхождения не представлены.
Патентная информация о липосомальной форме глазных капель на основе пигментов биснафтазаринов, обладающих противовоспалительным, противоаллергическим действиями, так же о способах получения таких липосом и препаратов на его основе отсутствует.
Таким образом, задачей настоящего изобретения является создание липосомальной композиции на основе пигмента биснафтазарина, выделяемого из игл и панциря зеленого морского ежа Strongylocentrotus droebachiensis, этилиден-6,6'-бис(2,3,7-три-гидроксинафтазарин), с высоким коэффициентом захвата и стабильностью удержания активного соединения, с целью получения офтальмологического средства с повышенной биоусвояемостью и противовоспалительной активностью.
Поставленная задача получения липосомальной формы на основе биснафтазарина достигается следующим способом: используя органический растворитель готовят раствор фосфолипидов с пигментным комплексом и сорастворителем с последующим диспергированием липидной фракции в водной среде для получения суспензии липидных везикул с включенным в них биологически активным веществом, далее гомогенизируют суспензию липидных везикул и отделяют липосомы размером не более 250 нм с включенным в них биологически активным веществом. Глазные капли на основе липосомальной композиции могут дополнительно содержать криопротекторы.
Используемый в качестве биологически активного компонента пигмент биснафтазарин - этилиден-6,6'-бис(2,3,7-три-гидроксинафтазарин), получают по разработанной ранее технологии (Патент РФ 2545692, дата публикации 10.04.2015). Содержание активного компонента в составе липосом для создания офтальмологического средства в виде глазных капель варьируется в пределах 0,01-0,50 масс %.
Фосфолипидная составляющая липосом может быть представлена как отдельно фосфолипидами животного или растительного происхождения, так и/или их смесью, взятых в любом сочетании и соотношении. Наиболее предпочтительными липидными компонентами мембран по настоящему изобретению являются фосфолипиды и/или производные фосфолипидов. Экспериментально показано, что в качестве липидной фазы предпочтительно использовать от 10 до 80% смеси фосфотидилхолина и холестерина.
В качестве органического растворителя используют этанол. Предпочтительнее использовать подкисленный этанол, а именно 0,16% раствор соляной кислоты в 95% этиловом спирте. Органический растворитель удаляют отгонкой под вакуумом и температуре 30-40°С, используя роторной испаритель.
Согласно заявляемому изобретению в качестве водной (внутренней) фазы липосом предпочтительно использовать буферные растворы, такие как фосфатный буферный раствор, нитратный буферный раствор и фосфатно-солевой буферный физиологический раствор, физиологический солевой раствор и другие. Наиболее предпочтительным является создание водной фазы с применением буферного раствора, причем с концентраций от 5 до 200 мМ, а более предпочтительной является концентрация 10-100 мМ. Не существует конкретных ограничений в отношении рН внутренней фазы липосом, однако предпочтительными являются значения от 3 до 11, и более предпочтительными - от 6 до 8.
Наиболее предпочтительно в качестве водной среды для диспергирования липидной фракции используют 0,01 М фосфатный буфер с рН равным 7,4.
В качестве сорастворителя пигментного комплекса используют неионогенное поверхностно-активное вещество. Согласно экспериментальным данный предпочтительно использовать твин-80.
Согласно заявляемому изобретению измельчение липосом проводят путем обработки ультразвуком. Наиболее предпочтительно с помощью обработки ультразвуком с частотой 15-30 кГц в течение 1-60 минут в ледяной бане, наиболее предпочтительно в течение 10-40 минут.
Очистку липосом проводят с помощью последовательной фильтрации полученного раствора через мембранные фильтры с размером пор 0,45 мкм и 0,22 мкм.
Удаление не включенного в состав визикул активного компонента осуществляется путем проведения диализа при перемешивании на магнитной мешалке и при 4°С в течение 2 часов с применением диализных мешков (OrDial D-Clean, 10 кДа, 25 кДа, производитель Orange Scientific). В качестве принимающего раствора наиболее приемлемым является использование 5%-го раствора глюкозы. Для наибольшего эффекта по истечении 2х часов заливается свежая порция принимающего раствора, и диализ осуществляется повторно в тех же условиях. В результате проведенных процедур очистки получаемое таким образом липосомальное средство характеризуется средним диаметром частиц 101±5 нм.
Стабильность липосомальной композиции повышается за счет добавления в качесве криопротекторов. Наиболее предпочтительно в качестве криопротектора использовать трегалозу.
Несмотря на отсутствие ограничений по содержанию, предпочтительно, чтобы концентрация сахара составляла от 2 до 20% (вес/объем), и более предпочтительно - от 5 до 10% (вес/объем).
Изобретение иллюстрируется следующими примерами.
Пример 1.
а) приготовление водной фазы: готовят 500 мл 0,01 М фосфатного буфера (рН 7,4) и растворяют в нем 12,5 г трегалозы.
б) приготовление липофильной фазы: предварительно растворяют в 50 мл 0,16% раствора соляной кислоты в 95% спирта этилового 50 мг пигментного комплекса биснафтазаринов. Фосфолипидную смесь фосфатидилхолина и холестерина в количестве 5,25 г готовят в соотношении 5:1 (массовое соотношение), затем добавляют 3,75 г сорастворителя твина-20. Расплавляют смесь при температуре 55°С.
В полученный расплав количественно переносят спиртовый раствор пигментного комплекса и перемешивают до получения прозрачного раствора. После этого быстро переносят полученный раствор в 500 мл водной среды (0,01 М фосфатный буфер, рН 7,4 с трегалозой) при температуре 55°С и перешивают в течение 30 минут. Этанол отгоняют под вакуумом при температуре 35-40°С на роторном испарителе IKA (Германия), а полученный раствор доводят водой до 500 мл. Приготовленную суспензию обрабатывают ультразвуком частоты 15 кГц в течение 20 минут, непрерывно охлаждая ледяной водой (ультразвуковой диспергатор 4710 Cole-Parmer Instruments, США). Липосомы размером не более 220 нм отделяют, последовательно отфильтровывая через стерильные мембранные фильтры с размером пор 0,45 и 0,22 мкм.
Полученные липосомы фасуют во флаконы вместимостью 5 мл.
Пример 2.
а) приготовление водной фазы: готовят 250 мл 0,01 М фосфатного буфера (рН 7,4) и растворяют в нем 12,5 г трегалозы.
б) приготовление липофильной фазы: предварительно растворяют в 250 мл 0,16% раствора соляной кислоты в 95% спирта этилового 500 мг пигментного комплекса биснафтазаринов. Фосфолипидную смесь фосфатидилхолина и холестерина в количестве 3 г готовят в соотношении 4:1 (массовое соотношение), затем добавляют 2 г сорастворителя твина-80. Расплавляют смесь при температуре 55°С.
В полученный расплав количественно переносят спиртовый раствор пигментного комплекса и перемешивают до получения прозрачного раствора. После этого быстро переносят полученный раствор в 250 мл водной среды (0,01 М фосфатный буфер, рН 7,4 с трегалозой) при температуре 55°С и перешивают в течение 30 минут. Этанол отгоняют под вакуумом при температуре 30-35°С на роторном испарителе IKA (Германия), а полученный раствор доводят водой до 500 мл. Приготовленную суспензию обрабатывают ультразвуком частоты 30 кГц в течение 30 минут, непрерывно охлаждая ледяной водой (ультразвуковой диспергатор 4710 Cole-Parmer Instruments, США). Липосомы размером не более 220 нм отделяют, последовательно отфильтровывая через стерильные мембранные фильтры с размером пор 0,45 и 0,22 мкм.
Полученные липосомы фасуют во флаконы вместимостью 5 мл.
Пример 3.
а) приготовление водной фазы: готовят 100 мл 0,01 М фосфатного буфера (рН 7,4) и растворяют в нем 5 г трегалозы.
б) приготовление липофильной фазы: предварительно растворяют в 100 мл 0,16% раствора соляной кислоты в 95% спирта этилового 100 мг пигментного комплекса биснафтазаринов. Фосфолипидную смесь фосфатидилхолина марки липоид С100 (LIPOID GmbH (Германия)) и холестерина в количестве 1,05 г готовят в соотношении 6,22:1 (массовое соотношение), затем добавляют 0,75 г сорастворителя твина-80. Расплавляют смесь при температуре 55°С.
В полученный расплав количественно переносят спиртовый раствор пигментного комплекса и перемешивают до получения прозрачного раствора. После этого, используя шприц, быстро переносят полученный раствор быстро переносят полученный раствор в 100 мл водной среды (0,01 М фосфатный буфер, рН 7,4 с трегалозой) при температуре 55°С и перешивают в течение 30 минут. Этанол отгоняют под вакуумом при температуре 30-35°С на роторном испарителе IKA (Германия), а полученный раствор доводят водой до 100 мл. Приготовленную суспензию обрабатывают ультразвуком частоты 30 кГц в течение 40 минут, непрерывно охлаждая ледяной водой (ультразвуковой диспергатор 4710 Cole-Parmer Instruments, США). Для удаления субстанции, которая не инкапсулирована в липосому, проводится диализ при 4°С в течение 2 часов с применением диализных мешков 25 кДа (OrDial D-Clean, производитель Orange Scientific), и 5%-го раствора глюкозы в качестве внешнего раствора, с перемешиванием на магнитной мешалке. После замены внешнего раствора проводится еще один диализ в течение двух часов с одновременным перемешиванием. Липосомы размером не более 220 нм отделяют, последовательно отфильтровывая через стерильные мембранные фильтры с размером пор 0,45 и 0,22 мкм.
Средневзвешенный размер частиц липосом определяют методом динамического рассеяния света с помощью прибора для динамического рассеяния света (модель Zetasizer Nano ZS производства Malvern Instruments Ltd.). Липосомы, приготовленные таким образом, имеют средний диаметр частиц 101,0±5,0 нм.
Полученную липосомальную композицию фасуют во флаконы вместимостью 5 мл.
Пример 4.
а) в качестве водной фазы используют деионизированную воду
б) приготовление липофильной фазы: предварительно растворяют в 50 мл 0,16% раствора соляной кислоты в 95% спирта этилового 50 мг пигментного комплекса биснафтазаринов. Фосфолипидную смесь фосфатидилхолина марки липоид С100 (LIPOID GmbH (Германия)) и холестерина в количестве 1,05 г готовят в соотношении 6,22:1 (массовое соотношение), затем добавляют 0,75 г сорастворителя твина-80. Расплавляют смесь при температуре 55°С.
После этого спиртовой раствор отгоняют под вакуумом на роторном испарителе IKA (Германия) при температуре 30-3 5°С до получения тонкой пленки. Полученную пленку диспергируют в 100 мл деионизированной воды в течение 1 часа до полного перехода высушенных веществ в водную фазу. Полученную суспензию обрабатывают ультразвуком частоты 30 кГц в течение 30 минут, непрерывно охлаждая ледяной водой (ультразвуковой диспергатор 4710 Cole-Parmer Instruments, США). Липосомы размером не более 220 нм отделяют, используя фильтры с размером пор 0,45 и 0,22 мкм.
Полученную липосомальную композицию фасуют во флаконы вместимостью 5 мл.
Пример 5.
а) приготовление водной фазы: готовят 250 мл 0,01 М фосфатного буфера (рН 7,4) и растворяют в нем 6,25 г трегалозы.
б) приготовление липофильной фазы: предварительно растворяют в 50 мл 0,16%о раствора соляной кислоты в 95% спирта этилового 100 мг пигментного комплекса биснафтазаринов. Фосфолипидную смесь фосфотидилхолина и холестерина в количестве 2,5 г готовят в соотношении 4:1 (массовое соотношение), затем добавляют 1 г сорастворителя твина-80. Расплавляют смесь при температуре 55°С.
В полученный расплав количественно переносят спиртовый раствор пигментного комплекса и перемешивают до получения прозрачного раствора. После этого, используя шприц, быстро переносят полученный раствор быстро переносят полученный раствор в 100 мл водной среды (0,01 М фосфатный буфер, рН 7,4 с трегалозой) при температуре 55°С и перешивают в течение 30 минут.
Затем этанол отгоняют на роторном испарителе IKA (Германия) под вакуумом при температуре 30-35°С, а полученный раствор доводят водой до 250 мл. Полученную суспензию обрабатывают ультразвуком частоты 15 кГц в течение 15 минут, непрерывно охлаждая ледяной водой (ультразвуковой диспергатор 4710 Cole-Parmer Instruments, США). Для удаления субстанции, которая не инкапсулирована в липосому, проводится диализ при 4°С в течение 2 часов с применением диализных мешков 25 кДа (OrDial D-Clean, производитель Orange Scientific), и 5%-го раствора глюкозы в качестве внешнего раствора, с перемешиванием на магнитной мешалке. После замены внешнего раствора проводится еще один диализ в течение двух часов с одновременным перемешиванием. Липосомы размером не более 220 нм отделяют, последовательно отфильтровывая через стерильные мембранные фильтры с размером пор 0,45 и 0,22 мкм.
Полученную липосомальную композицию фасуют во флаконы вместимостью 5 мл.
Пример 6. Для оценки коэффициента захвата активного вещества предложенную в настоящем изобретении липосомальную композицию подвергали диализу. Концентрацию активного вещества в принимающем растворе измеряли спектрофотометрическим методом при длине волны 340 нм, определяя количество активного соединения, не инкапусилированного в липосомы. Коэффициент захвата пигментного комплекса биснафтазаринов составлял не менее 85%.
Используя метод динамического светорассеяния путем измерения среднего размера частиц в нм, была подтверждена стабильность полученных образцов липосом при длительном хранении: средний размер сохраняется в течение длительного времени, что свидетельствует об отсутствии разрушения липосом, слипания или агрегации. Установлено, что после 12 месяцев хранения при температуре +2-8°С размеры полученных липосом, содержащих пигментный комплекс биснафтазаринов, не изменяются. Полученные данные свидетельствуют о том, что заявляемая липосомальная форма стабильна при хранении как минимум в течение 1 года.
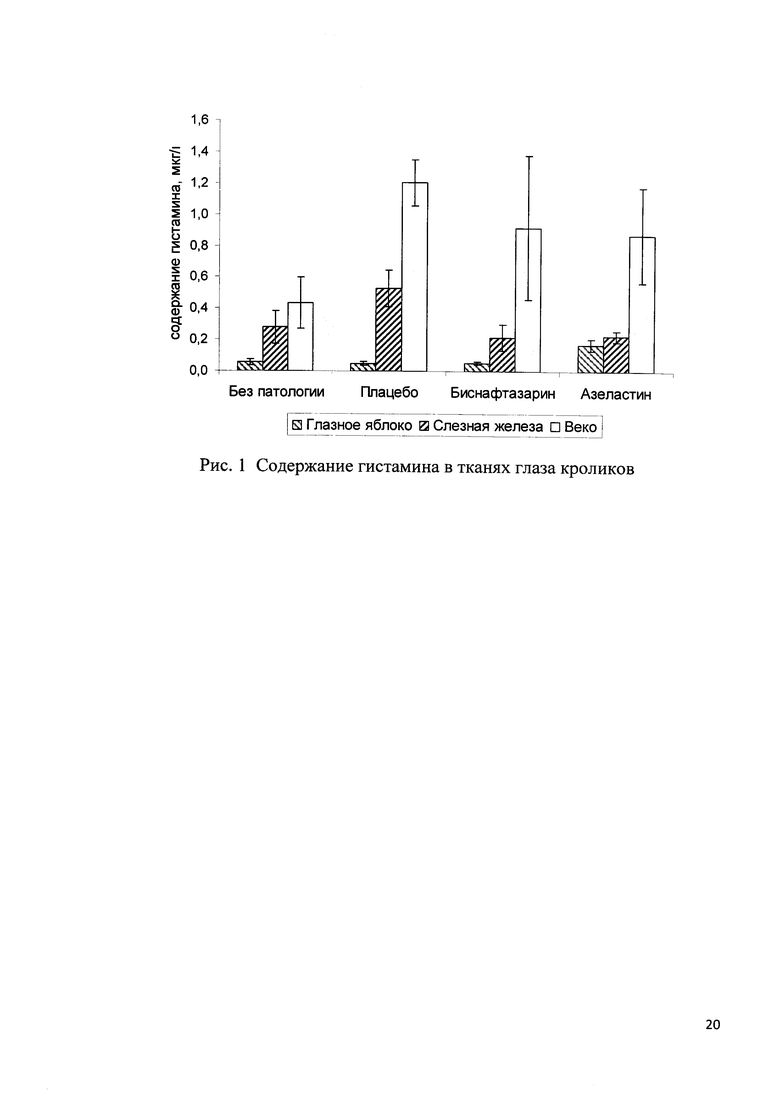
Пример 7. Антигистаминное действие оценивали на модели аллергического конъюнктивита (АК), индуцированного путем местного нанесения раствора «Compound 48/80» на конъюнктиву глаза кролика.
В контрольной группе патологию индуцировали на правом глазу, левый глаз остался интактным. В экспериментальных группах индуктор наносили на оба глаза. В день индукции препараты вводили за 60 минут до индукции патологии и через 15, 30, 45 и 60 минут по 1 капле в каждый глаз. Ежедневно проводили клинический осмотр глаза кролика. Через 2 часа после индукции патологии были взяты мазки-смывы с каждого глаза кролика на предметное стекло для оценки клеточного состава. На 5-й день эксперимента животные были эвтаназированы. Выделяли правое глазное яблоко с конъюнктивой и слезной железой для гистологического исследования и левое глазное яблоко с конъюнктивой и слезной железой для анализа гистамина методом ВЭЖХ.
По данным определения гистамина методом ВЭЖХ-УФ (Рис. 1) в слезной железе было зафиксировано статистически значимое увеличение уровня гистамина при индукции патологии по сравнению с содержанием гистамина в слезной железе интактного глаза. Во всех группах, получавших исследуемые препараты, наблюдалось статистически значимое снижение гистамина в слезной железе по отношению к уровню гистамина слезной железы правого глаза (АК) контрольной группы, получавшей плацебо.
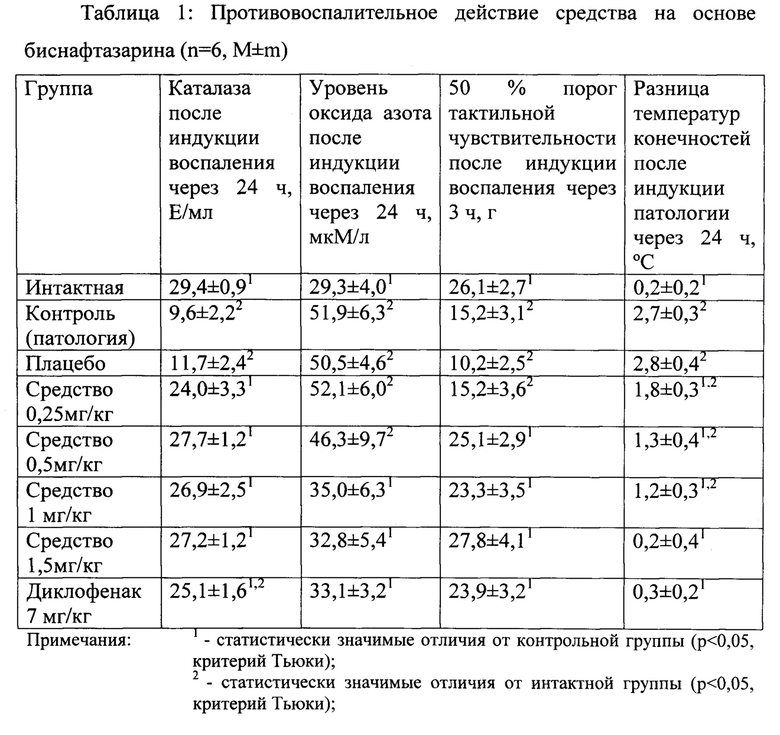
Пример 8. Противовоспалительное действие на модели каррагенинового отека лапы крысы.
Острое воспаление индуцировали на 14 день исследования введением 50 мкл 0,5% раствора λ-каррагенина подкожно в плантарную поверхность правой задней («опытной) лапы крысы (субплантарно) [Current Protocols in Pharmacology. Models of inflammation. Carrageenan induced paw edema in the rat // John Wiley & Sons, Inc. Contributed by Phyllis E. Whiteley and Stacie A. Dalrymple. 1998. Unit 5.4.1-5.4.3.]. В левую заднюю (контрольную) лапу вводили физиологический раствор в объеме 50 мкл.
Спустя 3, 6 и 24 часа после индукции воспаления каррагенином оценивали степень выраженности тактильной аллодинии с помощью калиброванных микрофиламентов вон Фрая. Определение среднеэффективного порога тактильной реактивности проводили по методу Чаплан («up-down method»; [Chaplan S.R., Bach F.W., Pogrel J.W. et al. Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Methods. 1994; 53: 55-63]). Для проведения теста животных помещали в индивидуальные пластиковые боксы на решетчатый пол. После двадцатиминутного периода адаптации к плантарной поверхности задних лап животных прикладывали калиброванные микрофиламенты в порядке увеличения площади сечения филамента. Через 3 часа после индукции воспаления каррагенином оценивали степень выраженности тактильной аллодинии с помощью калиброванных микрофиламентов вон Фрая. Спустя 24 часа после индукции воспаления каррагенином измеряли температуру задних лап животных. По разнице температур опытной и контрольной лап судили о степени развития воспалительного процесса Данные представлены в таблице 1.
В опытных группах через 3 часа регистрировали развитие тактильной аллодинии, что проявлялось в наличии статистически значимых отличий ее показателей (50% порог чувствительности) в этих группах от контрольной группы. Через 24 часа после индукции воспаления статистически значимых отличий между всеми группами по этому параметру не наблюдали. Температура лап в контрольной и опытной группе плацебо были статистически значимо повышены по сравнению с интактной группой. В опытных группах, получавших средство на основе биснафтазарина наблюдали дозозависимое снижение разницы температуры опытной и контрольной конечностей. При этом эффект, наблюдаемый при использовании диклофенака в дозе 7 мг/кг был сравним с эффектом при применении средства на основе биснафтазарина в дозе 1,5 мг/кг. Введение средства на основе биснафтазарина приводило к снижению уровня оксида азота и нормализации активности каталазы через 24 ч, сравнимое с действием диклофенака при достижении уровня интактных животных. Изменение всех изученных показателей под влиянием средства на основе биснафтазарина происходило дозозависимо.
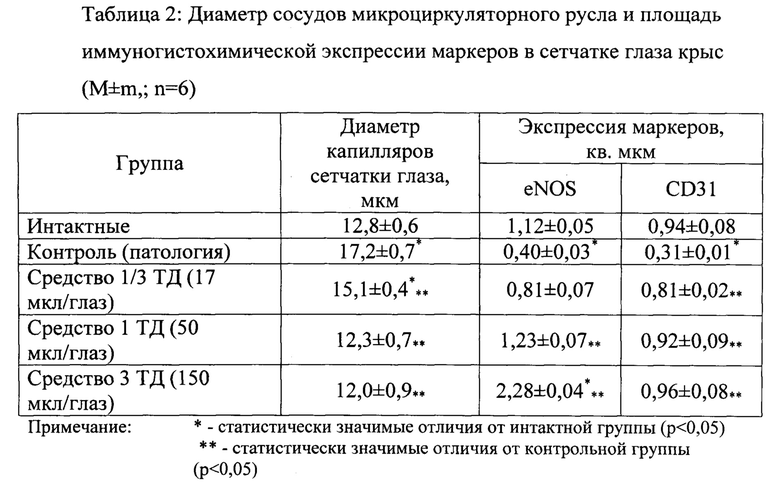
Пример 9. Исследование ретинопротекторного действия средства на основе биснафтазарина на модели диабетической ретинопатии у крыс
Моделирование диабетической ретинопатии осуществляли с помощью двухкратного подкожного введения водного раствора аллоксана в дозе 75 мг/кг голодавшим в течение суток животным. Длительность развития патологии - 90 дней. Контроль развития патологии осуществляли путем определения уровня глюкозы и гликозилированного гемоглобина в крови экспериментальных животных.
Метод введения - местный (в конъюктивальный мешок), длительность введения составляла 90 дней (с первого дня индукции патологии).
По окончании исследования животные были эвтаназированы, глазное яблоко энуклеировали. Глазное яблоко с конъюнктивой и слезной железой помещалось в 10% раствор нейтрального формалина в течение 24 часов, после чего материал проходил стандартную обработку в спиртах нарастающей концентрации (70-95%), ксилоле и парафине для изготовления гистологических препаратов с толщиной серийных парафиновых срезов 3-7 мкм. Для микроскопического исследования срезы окрашивались гематоксилином и эозином. Экспрессия эндотелиальной синтазы оксида азота, которая катализирует синтез NO, определялась иммуногистохимическим исследованием с помощью моноклональных антител к eNOS производства фирмы Novocastra в разведении 1:80 по стандартному протоколу. Иммуногистохимическое исследование CD31 (РЕСАМ-1) проводили с использованием моноклональных антител (клон 1А10) производства фирмы Novocastra в разведении 1:100 по стандартному протоколу. Маркер пролиферации Ki67 определялся с помощью моноклональных антител (клон RTU-Ki67-ММ1) производства фирмы Novocastra, проапоптотический маркер р53 также определялся с помощью моноклональных антител (клон РАЬ240) производства фирмы DakoCytomation в разведении 1:80, для оценки экспрессии антиапоптотического белка Mcl-1 использовались моноклональные антитела (клон 38G3, RTU-форма) производства фирмы Novocastra.
Морфологическое исследование и микрофотографирование гистологических препаратов проводилось при помощи светооптического микроскопа Leica DM LS. Микроморфометрическое исследование выполнялось с помощью окуляр-микрометра «Reichert».
При применении исследуемого препарата в терапевтической дозе (ТД), а также в дозах в 3 раза ниже, и в 3 раза больше наблюдалось снижение диаметра капилляров сетчатки глаза (Табл. 2). При иммуногистохимическом исследовании 3-х доз исследуемого препарата экспрессия eNOS резко увеличивалась и наблюдалась в эндотелии сосудов и слоях аксонов фоторецепторов, биполярных нейронов и ганглиозных клеток. Экспрессия CD31 в эндотелии сосудов выражено увеличивалась при применении препарата в 3-х дозах. Изменение всех изученных показателей под влиянием средства на основе биснафтазарина происходило дозозависимо.
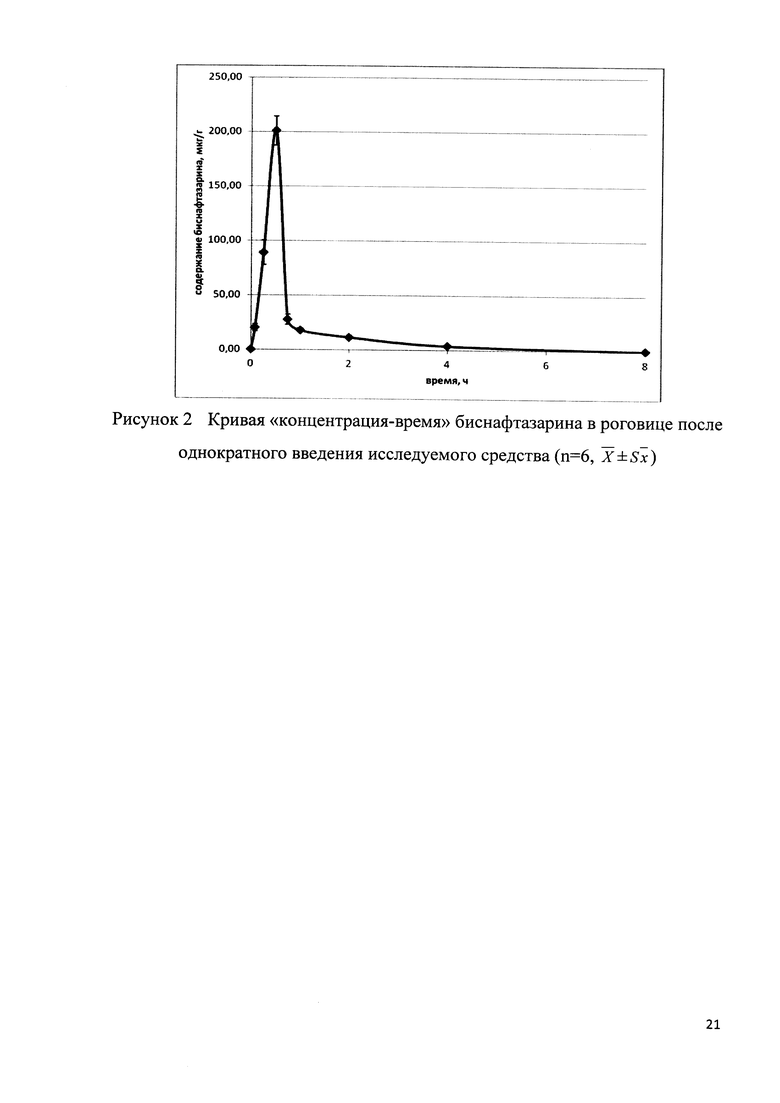
Пример 10. Фармакокинетика средства на основе биснафтазарина при закапывании в конъюнктивальный мешок на кроликах.
С применением разработанных методик выполнен анализ образцов плазмы крови и тканей глаза (роговица, хрусталик, стекловидное тело, сетчатка), полученных от лабораторных животных после введения им препарата на основе биснафтазарина.
Установлено, что средство на основе биснафтазарина при однократном введении и введении в высшей суточной дозе не обладает системной доступностью. Полученные данные свидетельствуют о том, что при инстилляции исследуемого препарата максимальная концентрация биснафтазарина в роговице глаза достигается через полчаса и составляет 200,8±13,3 мкг/г. Среднее время удержания биснафтазарина в роговице и период выведения имеют невысокие значения (менее 2 часов), что свидетельствует о быстром его выведении (Рис. 2).
Таким образом, средство в виде липосом на основе биснафтазарина эффективно для применения в офтальмологии.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛИПОСОМАЛЬНОЕ СРЕДСТВО НА ОСНОВЕ УБИХИНОЛА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2605616C1 |
| ЛИПОСОМАЛЬНАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2012 |
|
RU2516893C1 |
| ГОТОВЫЙ К ПРИМЕНЕНИЮ СОСТАВ ДЛЯ ЛИПОСОМАЛЬНОЙ ИНЪЕКЦИИ ВИНКРИСТИНА СУЛЬФАТА | 2016 |
|
RU2676762C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИПОСОМАЛЬНОЙ ФОРМЫ БИОЛОГИЧЕСКИ АКТИВНОГО ВЕЩЕСТВА | 2011 |
|
RU2477632C1 |
| Способ получения липосомальной косметической сыворотки в сухой лиофилизированной форме для ухода за кожей лица, шеи и зоны декольте | 2023 |
|
RU2825130C1 |
| ЛИПОСОМАЛЬНАЯ КОМПОЗИЦИЯ | 2010 |
|
RU2476216C1 |
| ЛИПОСОМАЛЬНАЯ КОМПОЗИЦИЯ ДЛИТЕЛЬНОГО ДЕЙСТВИЯ С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2012 |
|
RU2571077C2 |
| КОМПОЗИЦИЯ РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ В ВИДЕ ЛИПОСОМАЛЬНОЙ ФОРМЫ | 2015 |
|
RU2604133C1 |
| ЛИПОСОМАЛЬНАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2012 |
|
RU2514000C1 |
| ЛИПОСОМАЛЬНАЯ НАНОКАПСУЛА | 2010 |
|
RU2462236C2 |
Изобретение относится к фармацевтической промышленности, а именно к способу получения средства для офтальмологического применения на основе биснафтазарина в виде липосом, обладающего противовоспалительным и противоаллергическим действием. Способ получения средства для офтальмологического применения на основе биснафтазарина в виде липосом, обладающего противовоспалительным и противоаллергическим действием, в котором отдельно готовят водную и липидную фазы, водную фазу готовят путем смешивания 0,01 М фосфатного буфера с рН, равным 7,4, и растворяют в нем трегалозу, а липидную фазу готовят путем расплавления смеси фосфотидилохина и холестерина с Твином-80, далее в полученный расплав переносят этилиден-6,6'-бис(2,3,7-тригидроксинафтазарина), растворенный в спиртовом растворе соляной кислоты, и перемешивают до получения прозрачного раствора с последующим добавлением водной фазы, полученную смесь перемешивают, удаляют этиловый спирт под вакуумом, доводят объем водой, полученную суспензию обрабатывают ультразвуком, очищают от неинкапсулированной субстанции и отфильтровывают через мембранный фильтр при определенных условиях (варианты). Средство для офтальмологического применения на основе биснафтазарина в виде липосом, обладающее противовоспалительным и противоаллергическим действием. Вышеописанное решение позволяет получить липосомальную структуру, которая обеспечивает растворимость биснафтазаринов, их стабильность и офтальмобиодоступность при инсталляциях в форме глазных капель. 4 н.п. ф-лы, 2 ил., 2 табл., 9 пр.
1. Способ получения средства для офтальмологического применения на основе биснафтазарина в виде липосом, обладающего противовоспалительным и противоаллергическим действием, в котором отдельно готовят водную и липидную фазы, водную фазу готовят путем смешивания 500 мл 0,01 М фосфатного буфера с рН, равным 7,4, и растворяют в нем 12,5 г трегалозы, а липидную фазу готовят путем расплавления 5,25 г смеси фосфотидилхолина и холестерина в массовом соотношении 5:1 с 3,75 г Твина-80 при 55°С в течение 30 мин, далее в полученный расплав переносят 50 мг этилиден-6,6'-бис(2,3,7-тригидроксинафтазарина), растворенного в 50 мл 0,16% спиртового раствора соляной кислоты, и перемешивают до получения прозрачного раствора с последующим добавлением водной фазы, полученную смесь перемешивают в течение 30 мин при температуре 55°С, удаляют этиловый спирт под вакуумом, доводят объем водой до 500 мл, полученную суспензию обрабатывают ультразвуком с частотой 15-30 кГц в течение 15-40 мин на ледяной бане, очищают от неинкапсулированной субстанции путем диализа 5% раствором глюкозы с применением диализных мешков при перемешивании при 4°С через мембраны с размером пор 10 кДа, 25кДа, отфильтровывают через мембранный фильтр с размером пор 0,45 и 0,22 мкм.
2. Способ получения средства для офтальмологического применения на основе биснафтазарина в виде липосом, обладающего противовоспалительным и противоаллергическим действием, в котором отдельно готовят водную и липидную фазы, водную фазу готовят путем смешивания 250 мл 0,01 М фосфатного буфера с рН, равным 7,4, и растворяют в нем 12,5 г трегалозы, а липидную фазу готовят путем расплавления 3 г смеси фосфотидилхолина и холестерина в массовом соотношении 4:1 с 2 г Твина-80 при 55°С в течение 30 мин, далее в полученный расплав переносят 500 мг этилиден-6,6'-бис(2,3,7-тригидроксинафтазарина), растворенного в 250 мл 0,16% спиртового раствора соляной кислоты, и перемешивают до получения прозрачного раствора с последующим добавлением водной фазы, полученную смесь перемешивают в течение 30 мин при температуре 55°С, удаляют этиловый спирт под вакуумом, доводят объем водой до 500 мл, полученную суспензию обрабатывают ультразвуком с частотой 15-30 кГц в течение 15-40 мин на ледяной бане, очищают от неинкапсулированной субстанции путем диализа 5% раствором глюкозы с применением диализных мешков при перемешивании при 4°С через мембраны с размером пор 10 кДа, 25кДа, отфильтровывают через мембранный фильтр с размером пор 0,45 и 0,22 мкм.
3. Способ получения средства для офтальмологического применения на основе биснафтазарина в виде липосом, обладающего противовоспалительным и противоаллергическим действием, в котором отдельно готовят водную и липидную фазы, водную фазу готовят путем смешивания 100 мл 0,01 М фосфатного буфера с рН, равным 7,4, и растворяют в нем 5 г трегалозы, а липидную фазу готовят путем расплавления 1,05 г смеси фосфотидилхолина и холестерина в массовом соотношении 6,22:1 с 0,75г Твина-80 при 55°С в течение 30 мин, далее в полученный расплав переносят 100 мг этилиден-6,6'-бис(2,3,7-тригидроксинафтазарина), растворенного в 100 мл 0,16% спиртового раствора соляной кислоты, и перемешивают до получения прозрачного раствора с последующим добавлением водной фазы, полученную смесь перемешивают в течение 30 мин при температуре 55°С, удаляют этиловый спирт под вакуумом, доводят объем водой до 100 мл, полученную суспензию обрабатывают ультразвуком с частотой 15-30 кГц в течение 15-40 мин на ледяной бане, очищают от неинкапсулированной субстанции путем диализа 5% раствором глюкозы с применением диализных мешков при перемешивании при 4°С через мембраны с размером пор 10 кДа, 25кДа, отфильтровывают через мембранный фильтр с размером пор 0,45 и 0,22 мкм.
4. Средство, полученное способом по любому из пп. 1-3 для офтальмологического применения на основе биснафтазарина в виде липосом, обладающее противовоспалительным и противоаллергическим действием.
9. Способ по п. 6, где средство для офтальмологического применения получают путем последовательной фильтрации через мембранные фильтры с размером пор 0,45 мкм и 0,22 мкм.
| СПОСОБ ОПРЕДЕЛЕНИЯ ИНДИВИДУАЛЬНЫХ ПОКАЗАНИЙ К ХИРУРГИЧЕСКОМУ ЛЕЧЕНИЮ БОЛЬНЫХ С ГАСТРОЭЗОФАГЕАЛЬНОЙ РЕФЛЮКСНОЙ БОЛЕЗНЬЮ | 2014 |
|
RU2545892C1 |
| Офтан Катахром (Oftan Catachrom) | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| Липофлавон | |||
| Современные аспекты фармакотерапии кератитов различной этиологии//Провизор, 2005, N 12 | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| SHUQIN XIA et al | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Фотоэлектрический гемоглобинометр | 1986 |
|
SU1386905A1 |
| ЛИПОСОМАЛЬНОЕ СРЕДСТВО НА ОСНОВЕ УБИХИНОЛА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2605616C1 |
Авторы
Даты
2018-10-11—Публикация
2016-09-15—Подача