Предлагаемое изобретение относится к области органической химии, а именно - к химии полициклических каркасных и нитросоединений, конкретно, к новым, неописанным в литературе, энергоемким производным N,N'-метилен-бис(полинитро-2,4,6,8,10,12-гексаазаизовюрцитанов) общей формулы:
 где
где
R1=R2=Η (Ia), NO (Iв), CH2N3 (Iг), NO2 (Iд), CH2C(NO2)3 (Ie); R1=NO, R2=NO2 (Iб) и к способам их получения.
Соединения формулы I могут найти применение в качестве высокоэнергетических компонентов смесевых твердых ракетных топлив. В литературе представлены энергоемкие N,N'-метилен-бис-соединения общей формулы:
R-CH2-R (II), где
1) 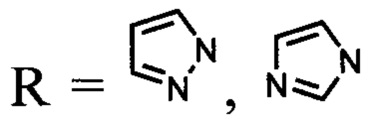 [S. Lupsor, F. Aonofriesei, Μ. Iovu, "Antibacterial activity of aminals and hemiaminals of pyrazole and imidazole", Med. Chem. Res., 2012, 21, 3035-3042];
[S. Lupsor, F. Aonofriesei, Μ. Iovu, "Antibacterial activity of aminals and hemiaminals of pyrazole and imidazole", Med. Chem. Res., 2012, 21, 3035-3042];
2)  [
[ Т. Kustermann, Т. Lenz, J. Stierstorfer, "Improving the energetic properties of dinitropyrazoles by utilization of current concepts", Eur. J. Inorg. Chem., 2018, 4125-4132];
Т. Kustermann, Т. Lenz, J. Stierstorfer, "Improving the energetic properties of dinitropyrazoles by utilization of current concepts", Eur. J. Inorg. Chem., 2018, 4125-4132];
3)  [(a) D. Fischer, J. L. Gottfried,
[(a) D. Fischer, J. L. Gottfried,  K. Karaghiosoff, J. Stierstorfer, T. G. Witkowski, "Synthesis and investigation of advanced energetic materials based on bispyrazolylmethanes", Angew. Chem., 2016, 128, 16366-16369; (6) P. Yin, J. Zhang, G. H. Imler, D. A. Parrish, J. M. Shreeve, "Polynitro-functionalized dipyrazolo-l,3,5-triazinanes: energetic polycyclization toward high density and excellent molecular stability", Angew. Chem., 2017, 129, 8960-8964];
K. Karaghiosoff, J. Stierstorfer, T. G. Witkowski, "Synthesis and investigation of advanced energetic materials based on bispyrazolylmethanes", Angew. Chem., 2016, 128, 16366-16369; (6) P. Yin, J. Zhang, G. H. Imler, D. A. Parrish, J. M. Shreeve, "Polynitro-functionalized dipyrazolo-l,3,5-triazinanes: energetic polycyclization toward high density and excellent molecular stability", Angew. Chem., 2017, 129, 8960-8964];
4)  [N. Kim, B. Lee, H. J. Shin, J. H. Park, K. Kwon, S. Kim, Y. G. Kim, "Bis(4-azido-3,5-dinitro-1H-pyrazol-1-yl)methane as a new green primary explosive", Bull. Korean Chem. Soc., 2020, 41, 913-917];
[N. Kim, B. Lee, H. J. Shin, J. H. Park, K. Kwon, S. Kim, Y. G. Kim, "Bis(4-azido-3,5-dinitro-1H-pyrazol-1-yl)methane as a new green primary explosive", Bull. Korean Chem. Soc., 2020, 41, 913-917];
5)  [A.H. Терпигорев, Μ.Б. Щербинин, А.Г. Базанов, И В. Целинский, "Деалкилирование 1-алкил-3-нитро-1,2,4-триазолов при действии трет-бутилата калия", Журн. Орг. Хим., 1982, 18, 587-588];
[A.H. Терпигорев, Μ.Б. Щербинин, А.Г. Базанов, И В. Целинский, "Деалкилирование 1-алкил-3-нитро-1,2,4-триазолов при действии трет-бутилата калия", Журн. Орг. Хим., 1982, 18, 587-588];
6) 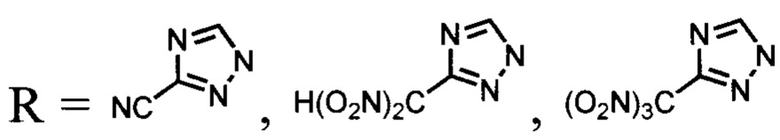 [G. Zhao, D. Kumar, P. Yin, С.He, G. Η. Imler, D. A. Parrish, J. M. Shreeve, "Construction of polynitro compounds as high-performance oxidizers via a two-step nitration of various functional groups", Org. lett, 2019, 21, 1073-1077];
[G. Zhao, D. Kumar, P. Yin, С.He, G. Η. Imler, D. A. Parrish, J. M. Shreeve, "Construction of polynitro compounds as high-performance oxidizers via a two-step nitration of various functional groups", Org. lett, 2019, 21, 1073-1077];
7)  где FzNO2=нитрофуразанил [А.В. Сергиевский, Т. В. Романова, С.Φ. Мельникова, И.В. Целинский, Реакционная способность 3,5-бис-(4-амино-1,2,5-оксадиазол-3-ил)-1,2,4-триазола, Журн. Орг. Хим., 2005, 41, 261-267];
где FzNO2=нитрофуразанил [А.В. Сергиевский, Т. В. Романова, С.Φ. Мельникова, И.В. Целинский, Реакционная способность 3,5-бис-(4-амино-1,2,5-оксадиазол-3-ил)-1,2,4-триазола, Журн. Орг. Хим., 2005, 41, 261-267];
8)  [J. W. Fischer, R. A. Hollins, С.K. Lowe-Ma, R. A. Nissan, R.
[J. W. Fischer, R. A. Hollins, С.K. Lowe-Ma, R. A. Nissan, R.
D. Chapman, "Synthesis and characterization of 1,2,3,4-cyclobutanetetranitramine derivatives", J. Org. Chem., 1996, 61, 9340-9343];
Кроме того, в литературе описаны энергоемкие полинитро-2,4,6,8,10,12-гексаазаизовюрцитаны общей формулы:
 где
где
1) R1, R2=Η [A. J. Bellamy, A. MacCuish, P. Golding, Μ. F. Mahon, "The use of trifluoroacetyl as an N- and O-protecting group during the synthesis of energetic compounds containing nitramine and/or nitrate ester groups", Propellants, Explos., Pyrotech, 2007, 32, 20-31];
2) R1=NO2 и R2=C(O)N3, R1=R2=C(O)N3 [K. Dong, Yu. Wang, X. B. Gong, J. Zhang, Ch. H. Sun, S. P. Pang, "Formyl azido substituted nitro hexaazaisowurtzitane - synthesis, characterization and energetic properties", New J. Chem., 2013, 37, 3685-3691];
3) R1=NO2 и R2=CH2C(NO2)3, R1=R2=CH2C(NO2)3 [О.А. Лукьянов, Η.И. Шлыкова, Г.В. Похвиснева, Т.В. Терникова, С.В. Никитин, Г.А. Смирнов, Ю.В. Нелюбина, П.В. Дороватовский, Т.С. Конькова, Н.В. Муравьев, А.Н. Пивкина, Оптимизация ключевых стадий синтеза и изучение основных физико-химических свойств высокоэнергоемких соединений - 4-(2,2,2-тринитроэтил)-2,6,8,10,12-пентанитрогексаазаизовюрцитана и 4,10-бис(2,2,2-тринитроэтил)-2,6,8,12-тетранитрогексаазаизовюрцитана", Изв. АН. Сер. Хим., 2017, 66, 1066-1073];
4) R1=ΝO2 и R2=CH2C(NO2)2F, R1=CH2C(NO2)3 и R2=CH2C(NO2)2F [Ο.Α. Лукьянов, Η.И. Шлыкова, Г.В. Похвиснева, Т.В. Терникова, К.А. Моногаров, Д.Б. Мееров, Ю.В. Нелюбина, П.В. Дороватовский, Т.С. Конькова, Изв. АН. Сер. Хим., 2019, 68, 110-115];
5) R1=ΝO2 и R2=CH2N3, R1=R2=CH2N3 [О. A. Luk'yanov, V. V. Parakhin, Ν. I. Shlykova, A. O. Dmitrienko, Ε. K. Melnikova, T. S. Kon'kova, K. A. Monogarov, D. В. Meerov, "Energetic N-azidomethyl derivatives of polynitro hexaazaisowurtzitanes series: CL-20 analogues having the highest enthalpy", New J. Chem., 2020, 44, 8357-8365];
6) R1=NO2 и R2=CH2N(NO2)H, CH2N(NO2)CH3,  CH2N(NO2)(CH2)2NHNO2, CH2N(NO2)(CH2)2N(NO2)CH3 [V. V. Parakhin, G. V. Pokhvisneva, Т. V. Ternikova, S. V. Nikitin, G. A. Smirnov, T. S. Kon'kova, D. B. Lempert, A. N. Pivkina, "Energetic alkylnitramine-functionalized pentanitro hexaazaisowurtzitanes: towards advanced less sensitive CL-20 analogues", J. Mater. Chem. A, 2022, 10, 818-828].
CH2N(NO2)(CH2)2NHNO2, CH2N(NO2)(CH2)2N(NO2)CH3 [V. V. Parakhin, G. V. Pokhvisneva, Т. V. Ternikova, S. V. Nikitin, G. A. Smirnov, T. S. Kon'kova, D. B. Lempert, A. N. Pivkina, "Energetic alkylnitramine-functionalized pentanitro hexaazaisowurtzitanes: towards advanced less sensitive CL-20 analogues", J. Mater. Chem. A, 2022, 10, 818-828].
R1=NO2 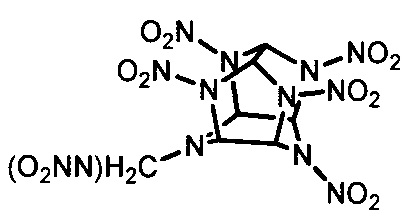 [V. V. Parakhin, G. V. Pokhvisneva, Т. V. Ternikova, S. V. Nikitin, G. A. Smirnov, T. S. Kon'kova, D. B. Lempert, A. N. Pivkina, "Energetic alkylnitramine-functionalized pentanitro hexaazaisowurtzitanes: towards advanced less sensitive CL-20 analogues", J. Mater. Chem. A, 2022, 10, 818-828].
[V. V. Parakhin, G. V. Pokhvisneva, Т. V. Ternikova, S. V. Nikitin, G. A. Smirnov, T. S. Kon'kova, D. B. Lempert, A. N. Pivkina, "Energetic alkylnitramine-functionalized pentanitro hexaazaisowurtzitanes: towards advanced less sensitive CL-20 analogues", J. Mater. Chem. A, 2022, 10, 818-828].
В литературе также описан наиболее перспективный полинитро-2,4,6,8,10,12-гексаазаизовюрцитан с R1=R2=NO2 (2,4,6,8,10,12-гексанитро-2,4,6,8,10,12-гексаазаизовюрцитан (CL-20, ГНИВ)) [А. Т. Nielsen, А. P. Chafin, S. L. Christian, D. W. Moore, Μ. P. Nadler, R. A. Nissan, D. J. Vanderah, R. D. Gilardi, C. F. George, J. L. Flippen-Anderson, "Synthesis of polyazapolycyclic caged polynitramines", Tetrahedron, 1998, 54, 11793-11812].
Наиболее близким по структуре и по назначению является описанный в литературе N,N'-бис[(2,6,8,10,12-пентанитро-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метил] нитрамид (IV).

[1. Патент RU 2772602, C1, 23.05.2022; 2. V. V. Parakhin, G. V. Pokhvisneva, T. V. Ternikova, S. V. Nikitin, G. A. Smirnov, T. S. Kon'kova, D. B. Lempert, A. N. Pivkina, "Energetic alkylnitramine-functionalized pentanitro hexaazaisowurtzitanes: towards advanced less sensitive CL-20 analogues", J. Mater. Chem. A, 2022, 10, 818-828].
Соединение (IV) характеризуется хорошей термостабильностью и сравнительно большой плотностью, но при этом у него недостаточно высока энтальпия образования и теплота сгорания.
Технической задачей настоящего изобретения является создание новых энергоемких бис(2,4,6,8,10,12-гексаазаизовюрцитанов) с более высокими значениями энтальпией образования и теплотой сгорания, при сохранении высокой плотности, термической устойчивости и умеренной чувствительностью к трению, а также разработка способов их получения. Поставленная техническая задача достигается новыми неописанными в литературе N,N'-метилен-бис(полинитро-2,4,6,8,10,12-гексаазаизовюрцитанами) общей формулы:
 где
где
R1=R2=Η (Ia), NO (Iв), CH2N3 (Iг), NO2 (Iд), CH2C(NO2)3 (Ie); R1=NO, R2=NO2 (Iб), и способами их получения.
Предлагаемые соединения формулы I отличаются от всех известных 2,4,6,8,10,12-гексаазаизовюрцитанов наличием в одной структуре двух связанных N,N'-метиленовым мостиком полинитро-2,6,8,10,12-гексаазаизовюрцитановых нитраминокаркасов, содержащих дополнительные эксплозофорные группы. Указанное сочетание обеспечивает как высокий энергетический потенциал, так и устойчивость этих соединений к внешним воздействиям.
Предлагаемый N,N'-метилен-бис(полинитро-2,4,6,8,10,12-гексаазаизовюрцитан) формулы I, где R1=R2=Η (Ia), получают путем последовательной обработки 4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитана (V) формальдегидом в среде хлорорганического растворителя в присутствии газообразного галогеноводорода, затем метанолом, и взаимодействием образующегося в результате этого 10-метоксиметил-4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитана (VI) с каталитическим количеством сильной неорганической кислоты в среде хлорорганического растворителя, полученный при этом бис(2,6,8,12-тетранитро-10-трифторацетил-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метан (VII) обрабатывают аммиаком в среде хлорорганического растворителя, что приводит к образованию целевого продукта бис(2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метана (Iа).
На стадии получения 10-метоксиметил-4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитана (VI) в качестве хлорорганического растворителя используют, например, дихлорэтан (ДХЭ), в качестве галогеноводорода применяют, например, хлороводород, а формальдегид используют, например, в виде параформальдегида. На стадии получения бис(2,6,8,12-тетранитро-10-трифторацетил-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метана (VII) в качестве сильной неогранической кислоты применяют, например, серную кислоту, а в качестве хлороганического растворителя используют, например, дихлорэтан. На стадии получении бис(2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метана (Iа) в качестве хлороганического растворителя используют, например, дихлорметан.
Предлагаемый N,N'-метилен-бис(полинитро-2,4,6,8,10,12-гексаазаизовюрцитан) формулы I, где R1=NO, R2=NO2 (Iб), получают путем последовательной обработки 4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитана (V) формальдегидом в среде хлорорганического растворителя в присутствии газообразного галогеноводорода, затем метанолом, образующийся в результате этого 10-метоксиметил-4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (VI) подвергают взаимодействию с ацетатом натрия в среде этанола, полученный при этом 4-метоксиметил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (VIII) обрабатывают нитрозирующим реагентом в среде полярного органического растворителя с образованием 4-метоксиметил-10-нитрозо-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитана (IX), который подвергают взаимодействию с 4-метоксиметил-2,6,8,10,12-пентанитро-2,4,6,8,10,12-гексаазаизовюрцитаном (Ха) в присутствии тетрафторбората нитрозония в среде апротонного полярного растворителя, в результате чего образуется целевой продукт -[(2,6,8,12-тетранитро-10-нитрозо-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)-(14,18,20,22,24-пентанитро-2,4,6,8,10,12-гексаазаизовюрцитан-16-ил)]метан (Iб).
На стадии получения 10-метоксиметил-4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитана (VI) в качестве хлорорганического растворителя используют, например, дихлорэтан, в качестве галогеноводорода применяют, например, хлороводород, а формальдегид используют, например, в виде параформальдегида. На стадии получения 4-метоксиметил-10-нитрозо-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитана (IX) в качестве нитрозирующего реагента в полярном органическом растворителе используют, например, систему «нитрит натрия/уксусная кислота». На стадии получения [(2,6,8,12-тетранитро-10-нитрозо-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)-(14,18,20,22,24-пентанитро-2,4,6,8,10,12-гексаазаизовюрцитан-16-ил)]метана (Iб) в качестве апротонного полярного растворителя используют, например, ацетонитрил.
Предлагаемые N,N-метилен-бис(полинитро-2,4,6,8,10,12-гексаазаизовюрцитаны) формулы I, где R1=R2=NO (Iв) и CH2N3 (Iг), получают путем последовательной обработки 4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитана (V) формальдегидом в среде хлорорганического растворителя в присутствии газообразного галогеноводорода, затем метанолом, образующийся в результате этого 10-метоксиметил-4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (VI) подвергают взаимодействию с ацетатом натрия в среде этанола, полученный при этом 4-метоксиметил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (VIII) обрабатывают нитрозирующим реагентом в среде полярного органического растворителя с образованием 4-метоксиметил-10-нитрозо-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитана (IX), который подвергают обработке тетрафторборатом нитрозония в среде апротонного полярного растворителя, образующийся при этом целевой продукт бис(2,6,8,12-тетранитро-10-нитрозо-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метан (Iв) выделяют, далее при необходимости соединение (Iв) последовательно обрабатывают формальдегидом в среде галогенангидридов кислот, затем метанолом, образующийся при этом бис(2,6,8,12-тетранитро-10-метоксиметил-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метан (XI) подвергают взаимодействию с формальдегидом в среде галогенангидридов кислот с последующей обработкой реакционной смеси азидом натрия в среде апротонного полярного растворителя в присутствии четвертичной аммонийной соли и выделением образующегося в результате целевого продукта бис(2,6,8,12-тетранитро-10-азидометил-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метана (Iг).
На стадии получения 10-метоксиметил-4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитана (VI) в качестве хлорорганического растворителя используют, например, дихлорэтан, в качестве галогеноводорода применяют, например, хлороводород, а формальдегид используют, например, в виде параформальдегида. На стадии получения 4-метоксиметил-10-нитрозо-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитана (IX) в качестве нитрозирующего реагента в органическом полярном растворителе используют, например, систему «нитрит натрия/уксусная кислота». На стадии получения бис(2,6,8,12-тетранитро-10-нитрозо-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метан (Iв) в качестве апротонного полярного растворителя используют, например, ацетонитрил. На стадии получения бис(2,6,8,12-тетранитро-10-метоксиметил-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метана (XI) в качестве галогенангидридов кислот используют, например, ацетилхлорид, а формальдегид используют, например, в виде параформальдегида. На стадии получения бис(2,6,8,12-тетранитро-10-азидометил-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метана (Iг) в качестве галогенангидридов кислот используют, например, ацетилхлорид, формальдегид используют, например, в виде параформальдегида, в качестве четвертичной аммонийной соли применяют, например, бромид тетраэтиламмония, а в качестве апротонного полярного растворителя используют, например, ацетонитрил.
Предлагаемые N,N'-метилен-бис(полинитро-2,4,6,8,10,12-гексаазаизовюрцитаны) формулы I, где R1=R2=NO2 (Iд) или СН2(NО2)3 (Iе), получают обработкой соответствующего 4-метоксиметилполинитро-2,4,6,8,10,12-гексаазаизовюрцитана общей формулы:
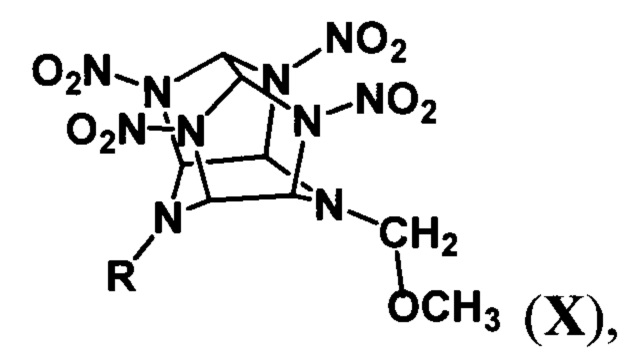 где
где
R=NO2 (Ха) или R=CH2(NO2)3 (Хб), каталитическим количеством сильной неорганической кислоты в среде хлорорганического растворителя с последующим выделением образующегося при этом целевого продукта. При получении бис(2,6,8,10,12-пентанитро-2,4,6,8,10,12-
гексаазаизовюрцитан-4-ил)метана (Iд) и бис[2,6,8,12-тетранитро-10-(2,2,2-тринитроэтил)-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил]метана (1е) в качестве сильной неогранической кислоты применяют, например, серную кислоту, а в качестве хлороганического растворителя используют, например, дихлорэтан. Процессы получения целевых продуктов Iа, Iб, Iв и Iг протекают по следующей схеме:

Процесс получения целевых продуктов 1д и 1е протекает по следующей схеме:

В качестве высокоэнергетических компонентов (энергетических наполнителей, окислителей) смесевых твердых ракетных топлив применяются энергоемкие органические соединения, в роли которых обычно выступают штатные взрывчатые вещества, такие как гексоген и октоген, а также перспективное высокоэнергоемкое соединение - 2,4,6,8,10,12-гексанитро-2,4,6,8,10,12-гексаазаизовюрцитан (CL-20, ГНИВ). Недостатком указанных энергоемких соединений является низкие энтальпия образования и теплота сгорания, а также высокая чувствительность к трению (таблица).

Техническим результатом предлагаемого изобретения является создание и разработка способов получения новых, неописанных в литературе, высокоэнергоемких соединений – N,N'-метилен-бис(полинитро-2,4,6,8,10,12-гексаазаизовюрцитанов) общей формулы I, представляющие собой два связанных N,N'-метиленовым мостиком полинитро-2,6,8,10,12-гексаазаизовюрцитановых нитраминокаркаса, содержащих дополнительные эксплозофорные группы, и характеризующиеся сочетанием высокой плотности и термической стойкости, наряду с большей энтальпией образования и теплотой сгорания, а также меньшей чувствительностью к трению, в сравнении со взрывчатыми веществами аналогичного назначения (см. таблицу).
Эти соединения могут найти применение в качестве высокоэнергетических компонентов смесевых твердых ракетных топлив.
Настоящее изобретение характеризуется следующими примерами.
Исходные соединения: 4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (V) [A. J. Bellamy, A. MacCuish, P. Golding, Μ. F. Mahon, "The use of trifluoroacetyl as an 7V-and O-protecting group during the synthesis of energetic compounds containing nitramine and/or nitrate ester groups", Propellants, Explos., Pyrotech., 2007, 32, 20-31], 4-метоксиметил-2,6,8,10,12-пентанитро-2,4,6,8,10,12-гексаазаизовюрцитан (Xa) [Т.В. Терникова, Г.В. Похвиснева, О.А. Лукьянов, Синтез 4- и 6-(тетразолилметил)пентанитрогексаазаизовюрцитана, Изв. АН. Сер. Хим., 2019, 68, 1874-1877] и 4-метоксиметил-10-(2,2,2-тринитроэтил)-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (Хб) [О.А. Лукьянов, Н.И. Шлыкова, Г.В. Похвиснева, Т.В. Терникова, С.В. Никитин, Г.А. Смирнов, Ю.В. Нелюбина, П.В. Дороватовский, Т.С. Конькова, Н.В. Муравьев, А Н. Пивкина, "Оптимизация ключевых стадий синтеза и изучение основных физико-химических свойств высокоэнергетических соединений - 4-(2,2,2-тринитроэтил)-2,6,8,10,12-пентанитрогексаазаизовюрцитана и 4,10-бис(2,2,2-тринитроэтил)-2,6,8,12-тетранитрогексаазаизовюрцитана", Изв. АН. Сер. Хим., 2017, 66, 1066-1073] получены по опубликованным методикам.
Пример 1.
Сухой НСl борбатировали через суспензию 4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (V) (4,16 г, 9,37 ммоль) и параформальдегида (1,13 г, 37,5 ммоль) в сухом дихлорэтане (70 мл) при 20°С и перемешивании в течение 2 ч, и растворитель удалили в вакууме. К остатку прибавили сухой МеОН (20 мл), реакционную смесь выдержали при 20°С и перемешивании в течение 0,5 ч и разбавили водой (500 мл). Выделившийся осадок отфильтровали, промыли водой и высушили на воздухе. Был выделен 10-метоксиметил-4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (VI) (4,02 г, выход: 88%) в виде бесцветного порошка, т. пл. 180-183°С. 1H ЯМР (600,13 МГц, ацетон-d6): δ 3,34 (с, 3 Н, Me), 4,64 и 4,69 (2 д, JН,H=6 Гц, 2 Н, СН2), 6,80 и 6,83 (2 д, JH,H=7 Гц, 2 Н, СН), 7,30 и 7,65 (2 д, JH,H=6 Гц, 2 Н, СН), 8,02 (м, 2 Н, СН) м.д. 13С{1H} ЯМР (150,9 МГц, ацетон-d6): δ 55,9 (Me), 67,4 и 69,9 (СН), 74,0 и 74,2 (СН), 76,0 (СН), 84,4 (СН2), 116,3 (кв, JC,CF=288 Гц, С=O), 156,5 (кв, JC,F=39 Гц, CF3) м.д. 14N ЯМР (43,37 МГц, ацетон-d6): δ -41 (Δν1/2=83 Гц) (2 ΝO2), -37 (Δν1/2=92 Гц) (2 ΝO2) м.д. 19F ЯМР (564,69 МГц, ацетон-d6): δ -68,96 (CF3) м.д. ИК (KВr): ν~ 3048 (ср) и 3016 (сл) (СН2/Ме), 1735 (с) (С=O), 1605 (с), 1589 (оч. с) и 1554 (с) (асим. NNO2), 1330 (с), 1293 (с) и 1265 (оч. с) (сим. NNO2) см-1. МСВР (ЭРИ): m/z вычислено для [C10H11F3N10O10+Na+]: 511,0504; найдено [M+Na]+: 511,0522.
К суспензии 10-метоксиметил-4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (VI) (0,600 г, 1,23 ммоль) в сухом дихлорэтане (15 мл) прибавили медленно по каплям 92% H2SO4 (0,2 мл). Реакционную смесь выдержали при 20°С и перемешивании 40 мин, после чего растворитель удалили в вакууме. К остатку прибавили воду (200 мл), выделившийся осадок отфильтровали, промыли дистиллированной водой до нейтрального рН промывных вод, высушили на воздухе, затем промыли Et2O (3×5 мл) и высушили в вакууме. Был выделен бис(2,6,8,12-тетранитро-10-трифторацетил-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метан (VII) (0,488 г, выход: 88%) были выделены в виде бесцветного порошка, т. пл. 220-223°С (разд.). 1H ЯМР (600,13 МГц, ацетон-d6): δ 4,64 и 4,67 (2 с, 2 Н, СН2), 6,73 и 7,35 (2 с, 4 Н, 2 СН2,3), 6,79, 7,03, 7,53 и 7,70 (4 с, 4 Н, СН), 8,14 и 8,21 (2 с, 4 Н, СН) м.д. 13С{1Н} ЯМР (150,9 МГц, ацетон-d6): δ 67,1 (СН2), 67,7 (СН), 69,8 (СН), 74,0 (СН), 74,2 (СН), 76,1 (СН), 77,6 (СН), 116,2 (кв, JC,CF=288 Гц, С=O), 156,3 (кв, JC,F=39 Гц, CF3) м.д. 14N ЯМР (43,37 МГц, ацетон-d6): δ -41 (Δν1/2=180 Гц) (4 ΝO2), -38 (Δν1/2=245 Гц) (4 ΝO2) м.д. 19F ЯМР (564,69 МГц, ацетон-d6): δ -68,84 (CF3) м.д. ИК (KBr): ν~ 3041 (ср) (СН2), 1742 (с) (С=O), 1606 (оч. с) и 1539 (с) (асим. NNO2), 1328 (с), 1291 (оч. с) и 1266 (оч. с) (сим. ΝΝO2) см-1. МСВР (ЭРИ): m/z вычислено для [C17H14F6N20O18+Na+]: 923,0591; найдено [M+Na]+: 923,0745.
Суспензию бис(2,6,8,12-тетранитро-10-трифторацетил-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метан (VII) (0,200 г, 0,222 ммоль) в СН2Сl2 (15 мл) насытили газообразным аммиаком, реакционную смесь выдержали при 20°С и перемешивании в течение ~1,5 ч, выделившийся осадок отфильтровали, последовательно промыли EtOH (2 мл) и водой (100 мл), затем высушили на воздухе. Продукт был дополнительно очищен путем переосаждения CH2Cl2 из раствора в этилацетате и высушили вакуумом. Был выделен бис(2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метан (Iа) (0,054 г, выход: 34%) в виде бесцветного порошка, разл. (наблюдаемое на столике Кофлера, 5°С⋅мин-1): 202°С. Плотность (пикнометр, 30°С): 1,839 г⋅см-3. 1H ЯМР (600,13 МГц, ДМСО-d6): δ 4,24 (с, 2 Н, СН2), 6,12 (уш.с, 6 Н, СН и ΝΗ), 6,26 (уш.с, 4 Н, СН), 7,75 (с, 4 Н, СН) м.д. 13С{1H} ЯМР (150,9 МГц, ДМСО-d6): δ 67,4 (СН2), 71,5 (СН), 71,6 (СН), 74,1 (СН) м.д. 14Ν ЯМР (43,37 МГц, ДМСО-d6): δ -34 (Δν1/2=558 Гц) (8 NO2) м.д. 15N ЯМР ([INVGATED], 60,8 МГц, ДМСО-d6): δ -176,7, -174,9, -35,8, -34,4 м.д. ИК (KBr): ν~ 3380 (ср) (ΝΗ), 3041 (ср) (СН2), 1580 (оч. с) и 1543 (с) (асим. NNO2), 1328 (оч. с), 1290 (оч. с) и 1267 (оч. с) (сим. NNO2) см-1. MCBP (ЭРИ): m/z вычислено для [C13H16N20O16+Na+]: 731,0945; найдено [M+Na]+: 731,0945.
Пример 2.
Сухой НСl борбатировали через суспензию 4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (V) (4,16 г, 9,37 ммоль) и параформальдегида (1,13 г, 37,5 ммоль) в сухом дихлорэтане (70 мл) при 20°С и перемешивании в течение 2 ч, и растворитель удалили в вакууме. К остатку прибавили сухой МеОН (20 мл), реакционную смесь выдержали при 20°С и перемешивании в течение 0,5 ч и разбавили водой (500 мл). Выделившийся осадок отфильтровали, промыли водой и высушили на воздухе. Был выделен 10-метоксиметил-4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (VI) (4,02 г, выход: 88%) в виде бесцветного порошка, т. пл. 180-183°С. 1H ЯМР (600,13 МГц, ацетон-d6): δ 3,34 (с, 3 Н, Me), 4,64 и 4,69 (2 д, JH,H=6 Гц, 2 Н, СН2), 6,80 и 6,83 (2 д, JH,H=7 Гц, 2 Н, СН), 7,30 и 7,65 (2 д, JH,H=6 Гц, 2 Н, СН), 8,02 (м, 2 Н, СН) м.д. 13С{1H} ЯМР (150,9 МГц, ацетон-d6): δ 55,9 (Me), 67,4 и 69,9 (СН), 74,0 и 74,2 (СН), 76,0 (СН), 84,4 (СН2), 116,3 (кв, JC,CF=288 Гц, С=O), 156,5 (кв, JC,F=39 Гц, CF3) м.д. 14N ЯМР (43,37 МГц, ацетон-d6): δ -41 (Δν1/2=83 Гц) (2 NO2), -37 (Δν1/2=92 Гц) (2 ΝO2) м.д. 19F ЯМР (564,69 МГц, ацетон-d6): δ -68,96 (CF3) м.д. ИК (KBr): ν~ 3048 (ср) и 3016 (сл) (СН2/Ме), 1735 (с) (С=O), 1605 (с), 1589 (оч. с) и 1554 (с) (асим. ΝΝO2), 1330 (с), 1293 (с) и 1265 (оч. с) (сим. NNO2) см-1. МСВР (ЭРИ): m/z вычислено для [C10H11F3N10O10+Na+]: 511,0504; найдено [M+Na]+: 511,0522.
К раствору NaOAc (0,880 г, 10,7 ммоль) в ЕtOН (40 мл) прибавили 10-метоксиметил-4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (VI) (4,00 г, 8,20 ммоль). Реакционную смесь выдержали при 20°С и перемешивании в течение 2 ч, образовавшийся осадок отфильтровали, последовательно промыли ЕtOН (5 мл) и водой (200 мл), затем высушили на воздухе. Был выделен 4-метоксиметил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (VIII) (2,69 г, выход: 84%) в виде бесцветного порошка, mp 180-182°С (разд.). 1Н ЯМР (300,1 МГц, ацетон-d6): δ 3,39 (с, 3 Н, Me), 4,76 (с, 2 Н, СН2), 5,50 (уш.с, 1 Η, NH), 6,35 (д, JH,H=8 Гц, 2 Н, СН), 6,47 (д, JH,H=8 Гц, 2 Н, СН), 7,69 (с, 2 Н, СН) м.д. 13С ЯМР (75,5 МГц, ацетон-d6): δ 55,8 (Me), 85,0 (СН2), 72,4 и 72,5 (СН), 73,2 (СН), 75,5 (СН) м.д. 14N ЯМР (21,7 МГц, ацетон-d6): δ -35 (Δν1/2=60 Гц) (4 ΝO2) м.д. ИК (KBr): ν~ 3304 (ср) (ΝΗ), 3052 (ср), 3036 (ср) и 3013 (сл) (СН2/Ме), 1583 (оч. с), 1547 (с) и 1526 (с) (асим. NNO2), 1328 (с), 1292 (оч. с) и 1260 (с) (сим. ΝΝO2) см-1. МСВР (ЭРИ): m/z вычислено для [C8H12N10O9+Na+]: 415,0681; найдено [M+Na]+: 415,0676.
К суспензии 4-метоксиметил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитана (VIII) (2,60 г, 6,63 ммоль) в АсОН (26 мл) прибавили медленно по порциям NaNO2 (1,05 г, 15,2 ммоль). Реакционную смесь выдержали при 20°С и перемешивании в течение 3 ч и затем разбавили водой (500 мл). Выделившийся осадок отфильтровали, промыли водой и высушили на воздухе. Был выделен 4-метоксиметил-10-нитрозо-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (IX) (2,74 г, выход: 98%) в виде бесцветного порошка, т. пл. 215-218°С (разл.). 1Н ЯМР (300,1 МГц, ацетон-d6): δ 3,26 (с, 3 Н, Me), 4,62 и 4,68 (2 с, 2 Н, СН2), 6,70 и 6,92 (2 д, JH,H=8 Гц, 2 Н, СН), 7,85 и 8,01 (2 д, JН,H=7 Гц, 2 Н, СН), 8,02 (с, 2 Н, СН) м.д. 13С ЯМР (75,5 МГц, ацетон-d6): δ 56,2 (Me), 84,7 (СН2), 61,0 и 73, (СН), 74,4 и 74,6 (СН), 75,9 и 76,8 (СН) м.д. 14N ЯМР (21,7 МГц, ацетон-d6): δ -41 (Δν1/2=66 Гц) (4 NO2), -37 (Δν1/2=53 Гц) (4 NO2) м.д. ИК (KBr): ν~ 3050 (с) и 3010 (с) (СН2/Ме), 1589 (оч. с), 1564 (с) и 1548 (с) (асим. NNO2 и асим. NNO), 1325 (с), 1289 (с) и 1265 (оч. с) (сим. NNO2) см-1. МСВР (ЭРИ): m/z вычислено для [C8H11N11O10+Na+]: 444,0583; найдено [М+Na]+: 444,0576.
К раствору 4-метоксиметил-10-нитрозо-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитана (IX) (0,208 г, 0,475 ммоль) и 4-метоксиметил-2,6,8,10,12-пентанитро-2,4,6,8,10,12-гексаазаизовюрцитана (Χ) (0,200 г, 0,475 ммоль) в сухом MeCN (7 мл) прибавили NOBF4 (0,040 г, 0,342 ммоль). Реакционную смесь выдержали при 20°С и перемешивании в течение 1 ч, затем вылили в ледяную воду (100 мл). Выделившийся осадок отфильтровали, промыли водой и высушили на воздухе. Продукт был выделен при помощи препаративной ТСХ (элюент, этилацетат-гексан, 1:2). Полученное вещество может быть дополнительно очищено путем переосождения водой из раствора в MeCN, с последующим нагреванием в воде при 50-60°С в течение 40 мин и высушили в вакууме. Был получен [(2,6,8,12-тетранитро- 10-нитрозо-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)-(14,18,20,22,24-пентанитро-2,4,6,8,10,12-гексаазаизовюрцитан-16-ил)]метан (Iб) (0,280 г, выход: 75%) в виде бесцветного порошка. Плотность (пикнометр, 25°С): 1,902 г⋅см-3. ДСК (5°С⋅мин-1): начало 210°С, макс 231°С. Чувствительность к трению: F50=160 Ν. 1H ЯМР (600,13 МГц, ДМСО-d6): 4,25 и 4,28 (2 с, 2 Н, СН2), 6,29, 6,38, 6,44 и 6,66 (2 с, 2 Н, СН), 6,54 (с, 2 Н, СН), 7,55 и 7,70 (с, 2 Н, СН), 7,77 (2 с, 2 Н, СН), 8,02 (с, 4 Н, СН) м.д. 13С{1Н} ЯМР (150,9 МГц, ДМСО-d6): δ 66,3 (СН2), 59,8 и 71,8 (2 СН), 70,2 (2 СН), 72,9 (2 СН), 73,1 (2 СН), 74,7 (2 СН), 74,4, 74,9, 75,1, 75,3 и 75,7 (2 СН) м.д. 14N ЯМР (43,37 МГц, ДМСО-d6): δ -40 (Δν1/2=693 Гц) (5 ΝO2), -38 (Δν1/2=674 Гц) (4 Ν02) м.д. 15Ν ЯМР ([INVGATED], 60,8 МГц, ДМСО-d6): δ -322,4, -199,1, -183,7, -177,8 и -176,1, -178,7, -181,2, -179,5, -40,0 и -39,2, -39,5 (2 Ν), -35,6 и -36,3, -37,1 и -37,0, 173,9 м.д. ИК (KBr): ν~ 3033 (м) (СН2), 1596 (оч. с) и 1560 (с) (асим. ΝΝO2 и асим. NNO), 1330 (м), 1288 (с) и 1264 (оч. с) (сим. NNO2) см-1. МСВР (ЭРИ): m/z вычислено для [C13H14N22O19+Na+]: 805,0698; найдено [М+Na]+: 805,0697.
Пример 3.
Сухой НСl борбатировали через суспензию 4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (V) (4,16 г, 9,37 ммоль) и параформальдегида (1,13 г, 37,5 ммоль) в сухом дихлорэтане (70 мл) при 20°С и перемешивании в течение 2 ч, и растворитель удалили в вакууме. К остатку прибавили сухой МеОН (20 мл), реакционную смесь выдержали при 20°С и перемешивании в течение 0,5 ч и разбавили водой (500 мл). Выделившийся осадок отфильтровали, промыли водой и высушили на воздухе. Был выделен 10-метоксиметил-4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (VI) (4,02 г, выход: 88%)
К раствору NaOAc (0,880 г, 10,7 ммоль) в ЕtOН (40 мл) прибавили 10-метоксиметил-4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (VI) (4,00 г, 8,20 ммоль). Реакционную смесь выдержали при 20°С и перемешивании в течение 2 ч, образовавшийся осадок отфильтровали, последовательно промыли ЕЮН (5 мл) и водой (200 мл), затем высушили на воздухе. Был выделен 4-метоксиметил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (VIII) (2,69 г, выход: 84%о).
К суспензии 4-метоксиметил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитана (VIII) (2,60 г, 6,63 ммоль) в АсОН (26 мл) прибавили медленно по порциям NaNO2 (1,05 г, 15,2 ммоль). Реакционную смесь выдержали при 20°С и перемешивании в течение 3 ч и затем разбавили водой (500 мл). Выделившийся осадок отфильтровали, промыли водой и высушили на воздухе. Был выделен 4-метоксиметил-10-нитрозо-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (IX) (2,74 г, выход: 98%).
К раствору 4-метоксиметил-10-нитрозо-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитана (IX) (1,33 г, 3,16 ммоль) в MeCN (15 мл) прибавили NOBF4 (0,267 г, 2,28 ммоль). Реакционную смесь выдержали при 20°С и перемешивании в течение 1 ч и затем вылили в ледяную воду (300 мл). Выделившийся осадок отфильтровали, промыли водой и высушили на воздухе. Сырец тщательно промыли Εt2O (3×10 мл) и переосадили водой с раствора в MeCN. Полученный продукт может быть дополнительно очищен при помощи препаративной ТСХ (элюент, этилацетат-гексан, 1:4), с последующим переосаждением водой из раствора в MeCN, нагреванием в воде при 50°С в течение 2 ч и сушкой в вакууме. Был получен бис(2,6,8,12-тетранитро-10-нитрозо-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метан (Iв) (0,88 г, выход: 73%) в виде бесцветного порошка. Плотность (пикнометр, 25°С): 1,845 г⋅см-3. ДСК (5°С⋅мин-1): начало 213°С, макс 229°С. Чувствительность к трению: F50=185 Η. 1H ЯМР (600,13 МГц, ДМСО-d6): 4,21 (с, 2 Н, СН2), 6,29 и 6,55 (2 с, 2 Н, СН), 7,54 и 7,77 (2 с, 2 Н, СН), 8,00 (с, 4 Н, СН) м.д. 13С{1Н} ЯМР (150,9 МГц, ДМСО-d6): δ 59,7 и 59,9 (СН), 66,1 (СН2), 71,1 и 71,8 (СН), 72,9, 73,0 и 73,1 (СН), 74,8, 75,1, 75,3 и 75,7 (СН) м.д. 14Ν ЯМР (43,37 МГц, ДМСО-d6): δ -40 (Δν1/2=740 Гц) (8 Ν02) м.д. 15Ν ЯМР ([INVGATED], 60,8 МГц, ДМСО-d6): δ -321,7, -183,8 и -176,4, -181,4, -180,5, -178,5 и -177,8, -142,9 и -142,8, -40,1 и -40,0, -36,4 и -35,7, 171,9 и 172,3 м.д. ИК (KBr): ν~ 3037 (с) (СН2), 1602 (оч. с) и 1545 (с) (асим. NNO2 и асим. ΝNO), 1328 (с), 1289 (оч. с) и 1264 (оч. с) (сим. ΝΝO2) см-1. МСВР (ЭРИ): m/z вычислено для [C13H14N22O18+Na+]: 789,0749; найдено [Μ+Na]+: 789,0748.
Суспензию бис(2,6,8,12-тетранитро-10-нитрозо-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метана (1в) (0,200 г, 0,261 ммоль) и параформальдегида (0,080 г, 2,67 ммоль) в АсСl (2,0 мл, 28,3 ммоль) выдержали при 15°С и перемешивании в течение 3 ч, и избыток АсСl удалили в вакууме. К остатку прибавили сухой МеОН (4,0 мл), реакционную смесь выдержали при 20°С и перемешивании в течение 1 ч и затем разбавили водой (100 мл). Выделившийся осадок отфильтровали, промыли водой и высушили на воздухе. Продукт был очищен при помощи препаративной ТСХ (элюент, этилацетат-гексан, 1:2). Был выделен бис(2,6,8,12-тетранитро-10-метоксиметил-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метан (XI) (0,095 г, выход: 46%) в виде бесцветного порошка, т. пл. 225-229°С (разл.). 1H ЯМР (300,1 МГц, ацетон-d6): δ 3,38 (с, 3 Н, Me), 4,63 (с, 6 Н, СН2), 6,56 (д, JH,H=7 Гц, 4 Н, СН), 6,66 (д, JH,H=7 Гц, 4 Н, СН), 7,95 (с, 4 Н, СН) м.д. 13С ЯМР (75,5 МГц, ацетон-d6): δ 56,2 (Me), 68,8 (СН2), 84,4 (СН2), 73,3 (2 СН), 75,4 (СН и СН) м.д. 14N ЯМР (21,7 МГц, ацетон-d6): δ -36 (Δν1/2=139 Гц) (8 NO2) м.д. ИК (KBr): ν~ 3040 (m) (СН2/Ме), 1584 (оч. с) и 1537 (с) (асим. NNO2), 1326 (с), 1290 (оч. с) и 1266 (оч. с) (сим. ΝNO2) см-1. МСВР (ЭРИ): m/z вычислено для [C17H24N20O18+Na+]: 819,1470; найдено [M+Na]+: 819,1461.
Суспензию бис(2,6,8,12-тетранитро-10-метоксиметил-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метана (XI) (0,100 г, 0,126 ммоль) в АсСl (1,0 мл, 14,1 ммоль) выдержали при 20°С и перемешивании в течение 1 ч, и избыток АсСl удалили в вакууме. К остатку прибавили сухой MeCN (3 мл), NaN3 (0,050 г, 0,769 ммоль) и NEt4Br (0,050 г, 0,240 ммоль). Полученную суспензию выдержали при 20°С и перемешивании в течение 2 ч, затем растворитель удалили в вакууме. К остатку прибавили этилацетат, и полученный раствор пропустили через слой силикагеля. Был выделен бис(2,6,8,12-тетранитро-10-азидометил-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метан (Iг) (0,022 г, выход: 21%) при помощи препаративной ТСХ (элюент, этилацетат-гексан, 1:2) в виде бесцветного порошка, разл. (наблюдаемое на столике Кофлера, 5°С⋅мин-1): 195°С. Плотность (пикнометр, 31°С): 1,749 г⋅см-3. 1Н ЯМР (600,13 МГц, ДМСО-d6): δ 4,28 (с, 2 Н, СН2), 4,68 (с, 4 Н, СН2), 6,28 (с, 4 Н, СН2,3), 6,37 (с, 4 Н, СН), 7,92 (с, 4 Н, СН) м.д. 13С{1H} ЯМР (150,9 МГц, ДМСО-d6): δ 67,5 (СН2), 67,8 (СН2), 72,0 (СН), 73,6 (СН), 74,8 (СН) м.д. 14Ν ЯМР (43,37 МГц, ДМСО-d6): δ -135 (Δν1/2=401 Гц) (2 Ν, Ν3), -36 (Δν1/2=673 Гц) (8 ΝO2) м.д. 15Ν ЯМР ([INVGATED], 60,8 МГц, ДМСО-d6): δ -322,9, -320,1, -302,1 (Ν3), -176,4, -176,1, -166,4 (Ν3), -134,3 (Ν3), -35,9, -35,6 м.д. ИК (KBr): ν~ 3039 (м) (СН2), 2109 (с) (Ν3), 1587 (оч. с) и 1543 (с) (асим. ΝNO2), 1328 (с), 1285 (оч. с) и 1266 (оч. с) (сим. NNO2) см-1. МСВР (ЭРИ): m/z вычислено для [C15H18N26O16+Na+]: 841,1286; найдено [М+Na]+: 841,1294.
Пример 4.
К суспензии 4-метоксиметил-2,6,8,10,12-пентанитро-2,4,6,8,10,12-гексаазаизовюрцитана (Ха) (1,35 г, 3,09 ммоль) в сухом дихлорэтане (25 мл) медленно по каплям прибавили 92% H2SO4 (0,5 мл). Реакционную смесь выдержали при 20°С в течение 3 ч, и растворитель удалили в вакууме. К остатку прибавили воду (300 мл), выделившийся осадок отфильтровали, промыли дистиллированной водой до нейтральной рН промывных вод и высушили на воздухе. Сырец прокипятили в ЕtOН в течение 15 мин и высушили в вакууме. Полученный продукт может быть дополнительно очищен путем переосаждения водой из раствора в MeCN, с последующим кипячением в воде в течение 4 ч и сушкой в вакууме. Был выделен бис(2,6,8,10,12-пентанитро-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метан (Iд) (1,01 г, выход: 82%) в виде бесцветного порошка. Плотность (пикнометр, 25°С): 1,953 г⋅см-3. ДСК (5°С⋅мин-1): начало 226°С, макс 235°С. Чувствительность к трению: F50=165 Η. 1Н ЯМР (600,13 МГц, ацетонов): δ 4,71 (с, 2 Н, СН2), 6,94 (д, JH,H=8 Гц, 4 Н, СН), 7,97 (д, JH,H=7 Гц, 4 Н, СН), 8,15 (с, 4 Н, СН) м.д. 1H ЯМР (300,1 МГц, ДМСО-d6): δ 4,30 (с, 2 Н, СН2), 6,55 (д, JH,H=8 Гц, 4 Н, СН), 7,97 (д, JH,H=7 Гц, 4 Н, СН), 8,15 (с, 4 Н, СН) м.д. 13С ЯМР (150,9 МГц, ацетон-d6): δ 68,1 (СН2), 71,2 (СН), 74,1 (СН), 76,0 (СН) м.д. 14Ν ЯМР (43,37 МГц, ацетон-d6): δ -40 (Δν1/2=192 Гц) (6 ΝO2), -38 (Δν1/2=219 Гц) (4 ΝO2) м.д. 15Ν ЯМР ([INVGATED], 60,8 МГц, ацетон-d6): δ -321,3, -199,9, -178,2, -179,2, -40,9, -39,9, -37,0 м.д. ИК (KBr): ν~ 3042 (с) (СН2), 1592 (оч. с) и 1545 (оч. с) (асим. NNO2), 1330 (оч. с), 1287 (оч. с) и 1267 (оч. с) (сим. ΝΝO2) см-1. МСВР (ЭРИ): m/z вычислено для [C13H14N22O20+Na+]: 821,0647; найдено [М+Na]+: 821,0650.
Пример 5.
К суспензии 4-метоксиметил-10-(2,2,2-тринитроэтил)-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитана (Хб) (1,08 г, 1,95 ммоль) в сухом дихлорэтане (35 мл) медленно по каплям прибавили 92% H2SO4 (0,1 мл). Реакционную смесь выдержали при 80°С и перемешивании в течение 2 ч, охладили до 20°С, затем раствор удалили в вакууме. Был выделен бис[2,6,8,12-тетранитро-10-(2,2,2-тринитроэтил)-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил]метан (Iе) (0,939 г, выход: 93%) из остатка при помощи колоночной хроматографии на силикагеле (элюент, ацетон-гексан, 1:3) в виде бесцветного порошка. Плотность (пикнометр, 26°С): 1,881 г⋅см-3. ДСК (5°С⋅мин-1): начало 215°С, макс 222°С. Чувствительность к трению: F50=95 Η. 1H ЯМР (600,13 МГц, ДМСО-d6): δ 4,06 (с, 2 Н, СН2), 5,30 (с, 4 Н, СН2), 6,15 (д, JH,H=7 Гц, 4 Н, СН), 6,44 (д, JH,H=8 Гц, 4 Н, СН), 7,96 (с, 4 Н, СН) м.д. 1H ЯМР (300,1 МГц, ацетон-d6): δ 4,40 (с, 2 Н, СН2), 5,50 (с, 4 Н, СН2), 6,50 (д, JH,H=9 Гц, 4 Н, СН), 6,82 (д, JH,H=9 Гц, 4 Н, СН), 8,12 (с, 4 Н, СН). 13C{1H} ЯМР (150,9 МГц, ДМСО-d6): δ 53,4 (СН2), 65,8 (СН2), 71,8 (СН), 73,1 (СН), 76,3 (СН), 126,8 (С) м.д. 13С ЯМР (75,5 МГц, ацетон-d6): δ 53,6 (СН2), 65,8 (СН2), 71,9 (СН), 75,9 (СН), 76,4 (СН), 126,8 (С) м.д. 14Ν ЯМР (43,37 МГц, ДМСО-d6): δ -31 (Δν1/2=233 Гц) (8 ΝNO2), -30 (Δν1/2=98 Гц) (2 СМ)2) м.д. 15N ЯМР ([INVGATED], 60,8 МГц, ДМСО-d6): δ -337,9, -321,0, -176,7, -176,0, -36,8, -34,7, -30,2 м.д. ИК (KBr): ν~ 3046 (м) и 3012 (м) (СН2), 1610 (оч. с) (асим. CNO2), 1590 (оч. с) и 1572 (оч. с) (асим. ΝΝO2), 1305 (оч. с) и 1268 (оч. с) (сим. ΝΝO2 и CNO2) см-1. Элементный анализ для C17H18N26O28 (1034,49): вычислено С, 19,74; Н, 1,75; N, 35,20%; найдено С, 19,86; Н, 1,73; N, 35,04%.
| название | год | авторы | номер документа |
|---|---|---|---|
| Циано-полинитро-2,4,6,8,10,12-гексаазаизовюрцитаны и способы их получения | 2024 |
|
RU2828547C1 |
| Нитраминопроизводные 2,6,8,10,12-пентанитро-2,6,8,10,12-гексаазаизовюрцитана и способы их получения | 2021 |
|
RU2772602C1 |
| 4(10)-(2-Фтор-2,2-динитроэтил)полинитрогексаазаизовюрцитаны и способ их получения | 2018 |
|
RU2663300C1 |
| СПОСОБ ПОЛУЧЕНИЯ [1,2,3,4]ТЕТРАЗИНО[5,6-е][1,2,3,4]ТЕТРАЗИН-1,3,6,8-ТЕТРАОКСИДА | 2015 |
|
RU2593993C1 |
| 4-(3,4-ДИБРОМТИОФЕНИЛКАРБОНИЛ)-2,6,8,10,12-ПЕНТААЦЕТИЛ-2,4,6,8,10,12 ГЕКСААЗАИЗОВЮРЦИТАН В КАЧЕСТВЕ АНАЛЬГЕТИЧЕСКОГО СРЕДСТВА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2021 |
|
RU2769523C1 |
| ОДНОРЕАКТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ 4,10-ДИ(2-ЭТОКСИАЦЕТИЛ)-2,6,8,12-ТЕТРААЦЕТИЛ-2,4,6,8,10,12-ГЕКСААЗАТЕТРАЦИКЛО[5,5,0,0,0]ДОДЕКАНА | 2023 |
|
RU2834298C1 |
| 3-(ТРИНИТРОМЕТИЛ-ONN-АЗОКСИ)-4-НИТРАМИНОФУРАЗАНЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2485108C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-АРИЛ-1,5,3-ДИТИАЗОНАНОВ | 2014 |
|
RU2559361C1 |
| ПРОИЗВОДНЫЕ 4-(3,4-ДИБРОМТИОФЕНКАРБОНИЛ)-2,6,8,12-ТЕТРААЦЕТИЛ-2,4,6,8,10,12-ГЕКСААЗАТЕТРАЦИКЛО[5,5,0,03,11,05,9]ДОДЕКАНА С САЛИЦИЛОВЫМИ КИСЛОТАМИ В КАЧЕСТВЕ АНАЛЬГЕТИЧЕСКИХ СРЕДСТВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2022 |
|
RU2802003C1 |
| 4-(3,4-ДИБРОМТИОФЕНКАРБОНИЛ)-10-ИЗОНИКОТИНИЛ-2,6,8,12-ТЕТРААЦЕТИЛ-2,4,6,8,10,12-ГЕКСААЗАТЕТРАЦИКЛО[5,5,0,0,0]ДОДЕКАН В КАЧЕСТВЕ АНАЛЬГЕТИЧЕСКОГО СРЕДСТВА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2022 |
|
RU2799639C1 |
Группа изобретений относится к области органической химии, а именно к N,N'-метилен-бис(полинитро-2,4,6,8,10,12-гексаазаизовюрцитанам) общей формулы:

где R2=Η (Ia), NO (Iв), CH2N3 (Iг), NO2 (Iд), CH2C(NO2)3 (Ie); R1=NO, R2=NO2 (Iб), и к способам их получения. Технический результат: N`,N`-метилен-бис(полинитро-2,4,6,8,10,-гексаазаизовюрцитаны) общей формулы I, которые могут найти применение в качестве высокоэнергетических компонентов смесевых твердых ракетных топлив. 5 н. и 1 з.п. ф-лы, 1 табл., 5 пр.
1. N,N'-метилен-бис(полинитро-2,4,6,8,10,12-гексаазаизовюрцитаны) общей формулы:
 где
где
R1=R2=Η (Ia), NO (Iв), CH2N3 (Iг), NO2 (Iд), CH2C(NO2)3 (Ie); R1=NO, R2=NO2 (Iб).
2. N,N'-метилен-бис(полинитро-2,4,6,8,10,12-гексаазаизовюрцитаны) общей формулы I по п. 1 в качестве высокоэнергетических компонентов смесевых твердых ракетных топлив.
3. Способ получения N,N'-метилен-бис(полинитро-2,4,6,8,10,12-гексаазаизовюрцитана) общей формулы I по п. 1, где R1=R2=Η (Ia), заключающийся в том, что 4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (V) подвергают последовательной обработке формальдегидом в среде хлорорганического растворителя в присутствии газообразного галогеноводорода, затем метанолом с последующим взаимодействием образующегося при этом 10-метоксиметил-4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитана (VI) с каталитическим количеством сильной неорганической кислоты в среде хлорорганического растворителя и полученный при этом бис(2,6,8,12-тетранитро-10-трифторацетил-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метан (VII) обрабатывают аммиаком в среде хлорорганического растворителя с последующим выделением образующегося при этом бис(2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метана (Ia).
4. Способ получения N,N'-метилен-бис(полинитро-2,4,6,8,10,12-гексаазаизовюрцитана) общей формулы I по п. 1, где R1=NO, R2=NO2 (Iб), заключающийся в том, что 4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (V) подвергают последовательной обработке формальдегидом в среде хлорорганического растворителя в присутствии газообразного галогеноводорода, затем метанолом, образующийся при этом 10-метоксиметил-4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (VI) подвергают взаимодействию с ацетатом натрия в среде этанола, полученный при этом 4-метоксиметил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (VIII) обрабатывают нитрозирующим реагентом в среде полярного органического растворителя с образованием 4-метоксиметил-10-нитрозо-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитана (IX), который подвергают взаимодействию с 4-метоксиметил-2,6,8,10,12-пентанитро-2,4,6,8,10,12-гексаазаизовюрцитаном (Ха) в присутствии тетрафторбората нитрозония в среде апротонного полярного растворителя с последующим выделением образующегося при этом [(2,6,8,12-тетранитро-10-нитрозо-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)-(14,18,20,22,24-пентанитро-2,4,6,8,10,12-гексаазаизовюрцитан-16-ил)]метана (Iб).
5. Способ получения N,N'-метилен-бис(полинитро-2,4,6,8Д0Д2-гексаазаизовюрцитанов) общей формулы I по п. 1, где R1=R2=NO (Iв), R1=R2=CH2N3 (Iг), заключающийся в том, что 4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (V) подвергают последовательной обработке формальдегидом в среде хлорорганического растворителя в присутствии газообразного галогеноводорода, затем метанолом, образующийся при этом 10-метоксиметил-4-трифторацетил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (VI) подвергают взаимодействию с ацетатом натрия в среде этанола, полученный при этом 4-метоксиметил-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитан (VIII) обрабатывают нитрозирующим реагентом в среде полярного органического растворителя с образованием 4-метоксиметил-10-нитрозо-2,6,8,12-тетранитро-2,4,6,8,10,12-гексаазаизовюрцитана (IX), который подвергают обработке тетрафторборатом нитрозония в среде полярного органического растворителя, образующийся при этом бис(2,6,8,12-тетранитро-10-нитрозо-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метан (Iв) выделяют, далее при необходимости соединение (Iв) последовательно обрабатывают формальдегидом в среде галогенангидридов кислот, затем метанолом, образующийся при этом бис(2,6,8,12-тетранитро-10-метоксиметил-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метан (XI) подвергают взаимодействию с формальдегидом в среде галогенангидридов кислот с последующей обработкой реакционной смеси азидом натрия в среде апротонного полярного растворителя в присутствии четвертичной аммонийной соли и выделением образующегося при этом бис(2,6,8,12-тетранитро-10-азидометил-2,4,6,8,10,12-гексаазаизовюрцитан-4-ил)метана (Iг).
6. Способ получения N,N'-метилен-бис(полинитро-2,4,6,8,10,12-гексаазаизовюрцитанов) общей формулы I по п. 1, где R1=R2=NO2 (1д) или R1=R2=CH2(NO2)3 (Ie), заключающийся в том, что соответствующий 4-метоксиметилполинитро-2,4,6,8,10,12-гексаазаизовюрцитан общей формулы:
 где
где
R=NO2 (Ха) или R=СН2(NO2)3 (Хб), подвергают обработке каталитическим количеством сильной неорганической кислоты в среде хлорорганического растворителя с последующим выделением образующегося при этом целевого продукта.
| Нитраминопроизводные 2,6,8,10,12-пентанитро-2,6,8,10,12-гексаазаизовюрцитана и способы их получения | 2021 |
|
RU2772602C1 |
| О | |||
| A | |||
| Lukyanov et al., Energetic N-azidomethyl derivatives of polynitro hexaazaisowurtzitanes series: CL-20 analogues having the highest enthalpy | |||
| New Journal of Chemistry, 2020, V.44, p | |||
| Автоматический предохранитель от раскатывания у саней | 1926 |
|
SU8357A1 |
| A | |||
| J | |||
| Bellamy et al., "The use of trifluoroacetyl as an N- and O-protecting group during the synthesis of energetic | |||
Авторы
Даты
2022-12-19—Публикация
2022-11-03—Подача