Настоящее изобретение относится к новым соединениям и меченым радиометками комплексам, включающим хелатирующий агент, ПСА-связывающую молекулу (PSA - Prostate Specific Membrane Agent - ПСА Простат Специфический мембранный Антиген) и альбумин-связывающую молекулу, соединенными между собой подходящими линкерами и спейсерами, и предназначенным для использования в качестве диагностических и/или терапевтических радиофармсредств. В частности, соединения и комплексы, заявленные в настоящем изобретении, могут применяться как (терагностические) трейсеры, визуализирующие агенты и терапевтические агенты для выявления ПСА-экспрессирующих таргетных клеток и тканей, а также лечения и диагностики рака.
Рак предстательной железы (PC - Prostate cancer - ПР - Рак Предстательной железы) занимает лидирующее место среди всех раковых заболеваний в США и странах Европы. По крайней мере 1-2 миллиона мужчин в восточном полушарии страдают от рака предстательной железы, при этом установлено, что заболевание будет поражать каждого шестого мужчину в возрасте от 55 до 85 лет. Согласно данным Американского Онкологического Общества, приблизительно 161000 новых случаев рака предстательной железы ежегодно диагностируется в США. Пятилетняя выживаемость пациентов с IV стадией метастатического рака простаты составляет только 29%.
Поскольку метастатический рак простаты становится гормонорезистентным, в запасе остается лишь несколько терапевтических опций, часто с очень низкой вероятностью успеха. Согласно современным медицинским руководствам, обычно рекомендуется антимитотическая химиотерапия доцетакселем. Однако лечение практически всегда связано с серьезными побочными реакциями и лишь незначительно улучшает показатели выживаемости. Таким образом, ранняя диагностика и точный мониторинг потенциальных рецидивов является важной задачей. Диагностика рака простаты основана на исследовании гистопатологических или цитологических образцов железы. Существующие методики визуализации для контроля лечения и мониторинга прогрессирующего или рецидивирующего рака простаты включают компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ) и ультразвуковое исследование, однако часто их недостаточно для эффективного контроля и лечения заболевания. Соответственно, существует большая клиническая необходимость в создании более эффективных инструментов как для ранней диагностики, так и для лечения ПР.
Хорошо известно, что опухолевые клетки могут экспрессировать уникальные белки, имеющие модифицированную структуру вследствие мутации, или могут избыточно экспрессировать нормальные (т.е. не мутированные) белки, которые в норме образуются в экстремально низких количествах неопухолевыми клетками. Опухолевые агенты могут быть упрощенно разделены на две категории на основании паттерна экспрессии: специфические к опухоли антигены (TSA - Tumor Specific Antigens), которые присутствуют только на поверхности опухолевых клеток и отсутствуют на здоровых клетках, и ассоциированные с опухолью антигены (TAA - Tumor-Associated Antigens), которые присутствуют на некоторых опухолевых клетках, а также на здоровых клетках. Специфические к опухоли антигены появляются в результате мутации протоонкогенов и опухолевых супрессоров, что приводит к аномальной продукции белка, при этом экспрессия ассоциированных с опухолью агентов в целом обусловлена мутацией других генов, не имеющих отношения к образованию опухоли.
Экспрессия таких белков на поверхности опухолевых клеток дает возможность диагностировать и типировать заболевание путем определения этих маркеров опухоли. Связывающие белок агенты или небольшие лекарственные молекулы, несущие визуализирующие метки и способные распознавать такие опухолевые маркеры, обычно используются для неинвазивной диагностики и визуализации раковых заболеваний.
Перспективные новые серии низкомолекулярных визуализирующих агентов связываются с простат-специфическим мембранным антигеном (ПСА). ПСА, также известный как фолатгидролаза I (FTG1 - Folate hydrolase I - ФТГ1), представляет собой трансмембранный гликопротеин II типа, состоящий из 750 аминокислот. Ген ПСА расположен в коротком плече 11 хромосомы и функционирует и как фолатгидролаза, и как нейропептидаза. Он обладает свойствами нейропептидазы, эквивалентным свойствам глутаматкарбоксипептидазы II (GCPII), которая обозначается термином “мозговой ПСА” и может модулировать глутаматэргический перенос путем отщепления N-ацетил-аспартил-глутамата (NAAG) на N-ацетиласпартат (NAA) и глутамат (Nan, F.; et al. J Med Chem 2000, 43, 772-774). DF
ПСА (i) главным образом ограничен предстательной железой (хотя в небольших количествах определяется в неоваскулярной сети некоторых других солидных опухолей, включая мочевой пузырь, поджелудочную железу, легкие и почки, но никогда в нормальных сосудах), (ii) обильно экспрессируется как белок на различных стадиях рака простаты (в количествах вплоть до 106 молекул ПСА на одну раковую клетку), (iii) присутствует на поверхности клеток, но не уходит циркулировать, и (iv) ассоциирован с ферментативной и сигнальной активностью. Кроме того, экспрессия ПСА также сверх-регулируется в слабо дифференцированных андроген-нечувствительных или метастатических раковых клетках, при этом экспрессия обычно коррелирует с прогрессированием заболевания.
Уникальная экспрессия ПСА делает его важным маркером рака простаты (и некоторых других видов рака). Кроме того, ПСА представляет собой хорошую внеклеточную мишень для визуализирующих агентов. ПСА поглощается клеткой после связывания с лигандом и, таким образом, является не только отличной мишенью для таргетной радиоизотопной терапии (с использованием радиоизотопов, излучающих частицы), но также может применяться для других лечебных стратегий, включая клеточноспецифическую доставку в опухоль иммунотоксинов, переориентирование иммунных клеток, активацию пролекарств, ПСА вакцины и иммунизацию ДНК плазмидами и аденовирусами. Поскольку он слабо экспрессируется здоровыми тканями, ПСА также является потенциальной мишенью для высокодозной терапии с минимальным уровнем побочных эффектов.
В прошлом уже были разработаны несколько антигенов против ПСА, несущих терапевтические или диагностические молекулы. Управление по контролю качества продуктов и лекарств США (FDA) одобрило радио-иммуноконъюгат анти-ПСА моноклонального тела (mAb) 7Е11, также известный, как PROSTASCINT®, который используется для диагностики метастаз и рецидивов рака простаты. Успешное использование указанного радиофармацевтического агента ограничено по причине того, что данное антитело связывается с внутриклеточным доменом ПСА, следовательно, может атаковать только мертвые клетки. Кроме того, использование моноклональных антител и фрагментов антител в качестве визуализирующих фрагментов часто ограничено по причине их медленного почечного клиренса, гетерогенного распределения, плохого проникновения в опухолевые ткани и иммуногенного потенциала. Для преодоления указанных трудностей были разработаны небольшие молекулы ПСА-связывающих агентов, способные связываться с внеклеточным доменом ПСА, предназначенные для PET/КТ и SPECT/КТ визуализации, включая радиомеченый N-[N-[(S)-1,3-дикарбоксипропил]-карбамоил]-S-[11C]метил-l-цистеин (DCFBC) и несколько пептимиметических ПСА ингибиторов на основе мочевины (см. Bouchelouche et al. Discov Med. 2010 Jan; 9(44): 55-61), включая ПСА-лиганд MIP-1095 (Hillier et al. Cancer Res. 2009 Sep 1; 69(17): 6932-40), в настоящее время находящийся на стадии клинического исследования, и DOTA-конъюгированный ПСА-ингибитор PSMA-617, разработанный  et al (JNM 2015, 56: 914-920 и EP 2862857 A1), который распространяется по организму и быстро выводится из кровотока (J Nucl Med. 2015; 56(11): 1697-705). Однако, несмотря на то, что быстрый и системный доступ значительно усиливает связывание агента с опухолевыми клетками и проникновение в них, у доступных в настоящее время ПСА-связывающих агентов имеется риск того, что они будут опосредовать неспецифические ненаправленные взаимодействия в нормальных тканях, экспрессирующих мишень, а также риск накопления радиофармсредств в экскреторных органах (таких, как почки). Таким образом, неопухолевые ткани могут подвергаться воздействию радиоактивных доз, которые рано или поздно приведут к необратимым повреждениям тканей. Было показано, что различные меченые радиоактивными изотопами небольшие ПСА-связывающие агенты (включая PSMA-617) накапливаются в слезных и слюнных железах пациентов и могут приводить к повреждению железистой ткани, в особенности при использовании альфа-излучающих радионуклидов (Zechmann et al. Eur J Nucl Med Mol Imaging, 2014; 41(7):1280-92 и Kratochwil et al. J Nucl Med. 2017 Apr 13. pii: jnumed.117.191395, doi: 10.2967/jnumed.117.191395 [Epub]). Одним из возможных решений является использование ПСА-связывающих агентов с высокой аффинностью к ПСА (Kratochwil et al. J Nucl Med. 2015; 293-298 и Chatalic et al. Theragnostics. 2016; 6: 849-861).
et al (JNM 2015, 56: 914-920 и EP 2862857 A1), который распространяется по организму и быстро выводится из кровотока (J Nucl Med. 2015; 56(11): 1697-705). Однако, несмотря на то, что быстрый и системный доступ значительно усиливает связывание агента с опухолевыми клетками и проникновение в них, у доступных в настоящее время ПСА-связывающих агентов имеется риск того, что они будут опосредовать неспецифические ненаправленные взаимодействия в нормальных тканях, экспрессирующих мишень, а также риск накопления радиофармсредств в экскреторных органах (таких, как почки). Таким образом, неопухолевые ткани могут подвергаться воздействию радиоактивных доз, которые рано или поздно приведут к необратимым повреждениям тканей. Было показано, что различные меченые радиоактивными изотопами небольшие ПСА-связывающие агенты (включая PSMA-617) накапливаются в слезных и слюнных железах пациентов и могут приводить к повреждению железистой ткани, в особенности при использовании альфа-излучающих радионуклидов (Zechmann et al. Eur J Nucl Med Mol Imaging, 2014; 41(7):1280-92 и Kratochwil et al. J Nucl Med. 2017 Apr 13. pii: jnumed.117.191395, doi: 10.2967/jnumed.117.191395 [Epub]). Одним из возможных решений является использование ПСА-связывающих агентов с высокой аффинностью к ПСА (Kratochwil et al. J Nucl Med. 2015; 293-298 и Chatalic et al. Theragnostics. 2016; 6: 849-861).
Не так давно, Kelly et al (J Nucl Med. 2017 pii: jnumed.116.188722. doi: 10.2967/jnumed.116.188722. [Epub ahead of print]) изучили агенты, обладающие аффинностью как к ПСА, так и к человеческому сывороточному альбумину - (HSA - Human Serum Albumine - ЧСА). Лиганды, разработанные Kelly et al включают молекулу пара-(йодофенил)масляной кислоты для связывания с HSA, и ПСА-связывающую молекулу на основе мочевины. В соединениях, разработанных Kelly et al, радиотерапевтическая молекула йода (131I) ковалентно связана с HSA-связывающей молекулой, которая, в свою очередь, напрямую соединена с ПСА-связывающей молекулой посредством углеводородной цепи. Однако указанные соединения имеют ограничения, связанные с возможностью использовать лишь один радионуклид - йод. Кроме того, не было продемонстрировано выраженного захвата/интернализации агента клетками-мишенями.
Другой подход был предложен Choy et al, Theranostics 2017; 7(7): 1928-1939, которые оценивали 177Lu- меченый ингибитор ПСА на основе фосфорамидата с альбумин-связывающей молекулой в составе. Хелатирующий агент DOTA, объединенный с 177Lu радионуклидом, также был связан с необратимым ингибитором ПСА CTT1298 (EP 2970345 A1). ПСА-связывающая молекула на основе одного фосфорамидата, демонстрирует крайне низкую стабильность, особенно при повышенных температурах (повышенные температуры в условиях длительной повышенной кислотности приводят к гидролизу P-N связи фосфороамидата), которые требуются для координативной реакции присоединения радиоактивной метки посредством хелатирующих агентов, таких как DOTA. Следовательно, прямая реакция присоединения радиоактивной метки не может быть осуществлена, и необходимо использовать многоэтапный подход с предварительным мечением. Таким образом, вначале должен быть получен 177Lu-DOTA-азид в качестве предшественника, затем предшественник необходимо связать с молекулой ПСА, модифицированной бензоциклооктином. В заключении, необходимо осуществить тщательную HPLC очистку комбинированного соединения; переработку HPLC-элюента (в атмосфере N2) и растворение в физиологической среде. Эту процедуру маловероятно осуществить в клинической практике, поскольку требуется работа с высокорадиоактивными соединениями. Доклинические данные о биораспределении демонстрируют неудовлетворительное действие меченого радиоактивной меткой агента, в частности, что касается соотношения опухолевые клетки/почки, которое не превышало 1.
Несмотря на существенный прогресс в последние годы, диагностика и лечение рака предстательной железы до сих пор остается сложной задачей. Для ранней диагностики и лечения рака простаты необходимы новые диагностические или визуализирующие агенты, способные высокоизбирательно связываться с простатическими опухолевыми клетками и демонстрирующие хорошие фармакокинетические свойства, позволяющие быстро и неинвазивно визуализировать опухоль и оказывать терапевтический эффект.
Таким образом, задача настоящего изобретения состоит в преодолении недостатков средств, известных из области техники, для удовлетворения нужд медицины.
Указанная задача решается с помощью настоящего изобретения, описанного далее, и более детально представленного в формуле изобретения.
Общие замечания
Несмотря на то, что настоящее изобретение подробно раскрывается ниже, должно быть понятно, что данное изобретение не ограничивается определенными методологиями, протоколами, и реагентами, описанными здесь, поскольку они могут различаться. Также должно быть понятно, что используемая в описании терминология никоим образом не ограничивает сущности настоящего изобретения, которая находится в пределах формулы изобретения. Если дополнительно не оговаривается иное, все технические и научные термины, используемые в описании, имеют общепринятые значения, известные специалистам в указанных областях.
Далее раскрываются аспекты настоящего изобретения. Указанные элементы перечислены в рамках различных вариантов осуществления настоящего изобретения, однако должно быть понятно, что они могут комбинироваться различным образом и в любом количестве и формировать новые варианты осуществления изобретения. Различным образом описанные примеры и предпочтительные варианты осуществления настоящего изобретения не должны истолковываться как ограничивающие сущность изобретения рамками конкретных вариантов его осуществления.
Настоящее описание следует понимать как поддерживающее и охватывающее воплощения изобретения, которые представляют собой ясным образом раскрытые аспекты в комбинации с любым числом других раскрытых и/или предпочтительных элементов. Более того, любые комбинации и перестановки всех приведенных элементов следует считать раскрытыми в описании настоящей заявки, если его контекст не свидетельствует об обратном.
Во всем тексте описания и формулы изобретения, если в описании не указано иное, термин «содержат», а также его производные «содержит» и «содержащий» следует понимать, как относящийся к включению какого-либо компонента, составляющего или стадии, но не к исключению любого другого не указанного компонента, составляющего или стадии. Термин «состоит из» относится к конкретному воплощению понятия «содержит», причем любые другие не указанные компоненты, составляющие или стадии исключаются. В контексте настоящего изобретения термин «содержит» охватывает понятие «состоит из». Термин «содержащий», таким образом, охватывает понятие «включающий» так же, как и «состоящий», например композиция, содержащая Х может состоять исключительно из Х, а может включать какие-либо еще дополнительные ингредиенты, скажем Х+Y.
Артикли „a“ и „an“ и „the” и аналогичные указывающие речевые единицы, используемые в контексте настоящего изобретения для его описания (особенно в разделе формула изобретения) относятся как к единственному, так и ко множественному числу, если дополнительно не оговаривается иное или иное не следует непосредственно из контекста (примечание: в русском языке артикли не используются). Описание диапазона значений здесь призвано выступать в качестве упрощенного метода обращения к каждому индивидуальному значению в пределах данного диапазона. За исключением случаев, когда иное указано в настоящем описании, каждое индивидуальное значение включено в описание таким образом, как если бы оно было указано в настоящем описании в индивидуальном порядке. Никакие формулировки в данном описании не должны рассматриваться как указывающие на какой-либо необъявленный элемент, имеющий важное значение для практического применения настоящего изобретения.
Словосочетание “практически” не исключает термина “полностью” т.е. композиция, которая “практически полностью” свободна от соединения Y, может быть полностью очищена от соединения Y. Там, где это необходимо словосочетание “практически” может быть исключено из описания изобретения.
Термин „около” используемый по отношению к численной величине x означает x±10%.
Согласно настоящему изобретению, если дополнительно не оговаривается иное, различные альтернативные варианты осуществления изобретения могут комбинироваться между собой.
Для большей ясности и удобства чтения, далее в описании представлены определения. Любые технические признаки, упомянутые в данных определениях, могут рассматриваться в контексте практически каждого варианта осуществления изобретения. Дополнительные определения и объяснения могут быть предоставлены специально в контексте указанных вариантов осуществления изобретения.
ОПРЕДЕЛЕНИЯ
Термин „углеводородный радикал” относится к углеводородным группам, т.е. к углеводородным цепочкам, предпочтительно независимо друг от друга выбранным из группы алкила, алкенила, алкинила, арила или аралкила.
Термин „алкил“ объединяет линейные соединения („с неразветвленной цепью”), соединения с разветвленной цепью, а также циклические радикалы, включающие от 1 до 13 атомов углевода, предпочтительно, 1-20, 1-15, 1-10, 1-8, 1-6, 1-4, 1-3 или 1-2 атома углерода. В частности, термин „C1-12 алкил“ относится к углеводородным радикалам, чья углеводородная цепочка является прямой или разветвленной, или циклической и включает от 1 до 12 атомов углерода. Конкретными примерами алкильных остатков являются метил, этил, пропил, изопропил, бутил, пентил, гексил, октил, децил, ундецил, додецил, тридецил, тетрадецил, пентадецил, гексадецил, гептадецил, октадецил, нонадецил, эйкозил, геникозил, докозил, трикозил, тетракозил, пентакозил, гексакозил, гептакозил, октакозил, нонакозил или триакозил, включая их различные разветвленные и/или циклические изомеры, например трет-бутил или изопептил и т.д. Циклические изомеры также могут обозначаться в описании термином „циклоалкил”, который используется по отношению к насыщенным алициклическим углеводородным остаткам, включающим 3 кольцевых атома углерода. “Насыщенные” линейные, разветвленные и циклические алкильные группы также объединены указанным термином. Термин также объединяет “гетероалкилы”, к которым относятся алкильные группы, в которых один или несколько атомов углерода в составе углеродной цепи замещены гетероатомом, таким как (без ограничений указанными), N, O и S. Гетероциклические группы включают ненасыщенные, частично насыщенные и насыщенные циклические системы, такие как, например, имидазолинильные и имидазолидильные группы. Гетероциклические группы включают, без ограничений указанными, азиридинил, азетидинил, пирролидинил, имидазолидинил, пиразолидинил, тиазолидинил, тетрагидротиофенил, тетрагидрофуранил, диоксолил, фуранил, тиофенил, пирролил, пирролинил, имидазолил, имидазолинил, пиразолил, пиразолинил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, тиазолинил, изотиазолил, тиадиазолил, оксадиазолил, пиперидил, пиперазинил, морфолинил, тиоморфолинил, тетрагидропиранил, тетрагидротиопиронил, оксатиан, диоксил, диатианил, пиранил, пиридил, пиримидинил, пирадазинил, пиразинил, триазинил, дигидропиридил, дигидродитиинил, дигидротионил, гомопиперазинил, хинуклидил, индолил, индолинил, изоиндолил, азаиндолил (пирролопиридил), индазолил, индолизинил, бензотриазолил, бензаимидазолил, бензофуранил, бензотиофенил, бензтиазолил, бензоксадиазолил, бензоксазинил, бензодитиинил, бензоксатиинил, бензотиазинил, бензоксазолил, бензотиазолил, бензотиадиазолил, бензо[1,3]диоксолил, пиразолопиридил, имидазопиридил (азабензимидазолил), триазолопиридил, изоксазолопиридил, пуринил, ксантинил, аденинил, гуанинил, хинолинил, изохинолинил, хинолизинил, хиноксалинил, хиназолинил, циннолинил, фталазинил, нафтиридинил, птеридинил, тианафталенил, дигидробензотиазинил, дигидробензофуранил, дигидроиндолил, дигидробензодиоксинил, тетрагидроиндолил, тетрагидроинлазолил, тетрагидробензимидазолил, тетрагидробензотриазолил, тетрагидропирролопиридил, гетрагидропиразолопиридил, тетрагидроимидазопиридил, тетрагидротриазолопиридил и тетрагидрохинолиниловые группы. Гетероциклические группы могут быть замещенными и незамещенными. Типичные замещенные гетероциклические группы могут быть монозамещенными или замещенными более, чем на один атом, примерами являются, без ограничений указанными, такие группы как пиридил или морфолинил, которые являются 2-, 3-, 4-, 5- или 6-замещенными, или дизамещенными различными заместителями, такими, как перечислены выше.
Термин “циклический” объединяет термин “полициклический”, который описывает структуры с одним или более кольцом в составе. В частности, термин “циклический” также относится к спироциклическим структурам, в которых два или более кольца имеют один общий атом, а также к 5 конденсированным полициклическим соединениям, в которых два или более кольца имеют два общих атома.
Термин “алкенил”, используемый в настоящем изобретении, объединяет линейные, разветвленные и циклические радикалы, содержащие от 2 до 30 атомов углерода, предпочтительно 2-20, 2-15, 2-10, 2-8, 2-6, 2-4 или 2-3 атома углерода, включая по крайней мере одну двойную связь между атомами углерода. Конкретными примерами “алкенильных” групп являются разнообразные ненасыщенные эквиваленты алкенов, например те, что описаны по отношению к алкильным группам, названные согласно общепринятым требованиям, известным специалистам в данной области, в зависимости от количества и расположения двойных связей между атомами углерода, например, бутандиилиден (butanediylidene), 1-пропанил-3-илиден. “Алкенильные” группы предпочтительно имеют по крайней мере 1, более предпочтительно 2, 3, 4, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16 двойных связей, при этом двойная связь предпочтительно расположена в следующих позициях углеводородной цепи: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28 или 29. Алкенильные группы могут быть как замещенными, так и незамещенными.
Термин “алкинил”, используемый в настоящем описании, объединяет линейные, разветвленные и циклические радикалы, содержащие от 2 до 30 атомов углерода, предпочтительно 2-20, 2-15, 2-10, 2-8, 2-6, 2-4 или 2-3 атома углерода, включая по крайней мере одну тройную связь между атомами углерода. Конкретными примерами “алкинильных” групп являются разнообразные ненасыщенные эквиваленты алкилов, например те, что описаны по отношению к алкильным группам, названные согласно общепринятым требованиям, известным специалистам в данной области, в зависимости от количества и расположения тройных связей между атомами углерода. “Алкинильные” группы предпочтительно имеют по крайней мере 1, более предпочтительно 2, 3, 4, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16 тройных связей, при этом тройная связь предпочтительно расположена в следующих позициях углеводородной цепи: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28 или 29. Алкинильные группы могут быть как замещенными, так и незамещенными.
Термин “арил” относится к моноциклическим или полициклическим, или конденсированным полициклическим ароматическим кольцевым системам. Термин объединяет моноциклические или полициклические, или конденсированные полициклические ароматические “гетероарильные” кольцевые системы, в которых по крайней мере один атом углерода в кольце замещен гетероатомом. В большинстве случаев термины “арил” и “гетероарил” относятся к группам, содержащим 3-30 атомов углерода, например 3-10 атомов, чаще 2-6 атомов углерода.
Термины “арилалкил” или “аралкил” являются взаимозаменяемыми и относятся к группам, содержащим по крайней мере одну алкильную группу и по крайней мере одну арильную группу согласно определениям выше. В аралкильной группе, как следует из определения, аралкильная группа соединена с другой молекулой вещества или конъюгата согласно изобретению посредством алкильной группы, например бензильной группы.
Термин “галоген” или “гало”, используемый здесь, включает атом фтора (F), хлора (Cl), брома (Br), йода (I).
Термин “гетероатом” включает N, O, S и P, предпочтительно N и O.
Термин „замещенный” относится к углеводородной группе, как определено здесь (например, алкильной или алкенильной группе), в которой одна или более связь с углеродным атомом, имеющимся в составе группы, замещена связью с атомом другого вещества - не углерода и не водорода. К замещенным группам также относятся группы, в которых одна или более связь с атомом углерода или водорода замещена одной или более связью, включая двойную или тройную связь с гетероатомом. Таким образом, „замещенная” группа будет замещена одним или более заместителем, если дополнительно не оговаривается иное. Таким образом, “замещенная” группа будет замещена одним или более заместителем, если в описании дополнительно не оговаривается иное. Согласно некоторым вариантам осуществления изобретения, замещенная группа замещена 1, 2, 3, 4, 5 или 6 заместителями. Примерами замещающих групп являются галогены (т.е. F, Cl, Br и I); гидроксилы, алкокси, алкенокси, алкинокси, арилокси, аралкилокси, гетероциклилокси и гетероциклилалкокси группы; карбонилы (оксо); карбоксилы; сложные эфиры; уретаны; оксимы; гидркосиламины; алкоксиамины; аралкоксиамины; тиолы; сульфиды; сульфоксиды; сульфоны; сульфонилы; сульфонамиды; амины; N-оксиды; гидразины; гидразиды; гидразоны; азиды; амиды; соединения мочевины; амидины; гуанидины; энамины; имиды; изоцианаты; изотиоцианаты; цианаты; тиоцианаты; имины; нитрогруппы; нитрилы (т.е. CN), галоалкил; аминоалкил; гидроксиалкил; циклоалкил и подобные соединения.
Конъюгаты
Настоящее изобретение относится к новым плазматическим протеин-связывающим ПСА-лигандам с улучшенными таргетными противоопухолевыми свойствами и благоприятным фармакокинетическим профилем. Используемый в настоящем описании термин “фармакокинетика”, предпочтительно, включает стабильность, биораспределение, период полувыведения и/или клиренс лекарственного или диагностического агента в организме субъекта. Настоящее изобретение относится к новым конъюгатам, образованным путем ковалентного соединения ПСА-пептидомиметических связывающих молекул на основе мочевины посредством подходящих спейсеров и линкеров с хелатирующим агентом, способным, с одной стороны, образовывать комплексы с лекарственными/диагностическими молекулами радиоактивных веществ, а с другой стороны с молекулами, связывающими человеческий сывороточный альбумин (HSA). Было показано, что спейсерные и линкерные группы, соединяющие связывающие молекулы и хелатирующие агенты, ключевым образом определяют таргетные и фармакокинетические свойства конечных конъюгатов. Новые конъюгаты, предпочтительно, обладают улучшенными и специфическими свойствами, а именно лучше захватываются и интернализируются клетками. Авторы изобретения продемонстрировали, что ПСА-связывающие молекулы (1) лучше осуществляли компартментализацию конъюгатов в крови (при этом воздействия на здоровые ткани, не являющиеся мишенями, ограничены без нарушения доступа к опухолевой сосудистой системе), (2) имели более продолжительный плазматический клиренс, и (3) лучше поглощались опухолевыми клетками и задерживались в них (за счет увеличения количества пассажей через опухолевое ложе). Таким образом, введение ПСА-связывающей молекулы существенно улучшает биораспределение и, в конечном счете, терапевтическую эффективность соединений, заявленных в настоящем изобретении.
В частности, было продемонстрировано, что заявленные конъюгаты интенсивнее захватываются опухолями по сравнению с другими известными из области техники ПСА-лигандами. Такие улучшенные характеристики конъюгатов связанные с их усиленным захватом опухолевыми клетками, в частности позволяют снизить вводимую активность, но при этом сохранить желаемую дозировку, необходимую для достижения терапевтического эффекта или достаточного поглощения клетками в случае их использования для визуализации (диагностики). В связи с этим, конъюгаты представлены в форме радиоактивных меченых комплексов с хелатирующим агентом, объединяющим лекарственный и/или диагностический радиоактивный изотоп (обычно изотоп металла). Снижение необходимой дозы новых конъюгатов (и в особенности их меченых радиоактивными (металлами) метками комплексов) среди прочих имеет следующие преимущества: (1) требуется меньшее количество радиоактивного вещества (снижается радиоактивность), что приводит в конечном счете к меньшим производственным затратам и большей доступности - оба фактора существенны в отношении альфа-активных веществ, таких как, например, 225Ac, которые трудно и дорого производить и предпочтительно к увеличению сроков годности веществ за счет меньшего самооблучения, которое обычно приводит к распаду радиоактивных комплексов (т.е. радиолизу); (2) пациент получает меньшую суммарную поглощенную дозу облучения (что предпочтительно делает возможным амбулаторное лечение, а также оказывает менее вредное воздействие на окружающую среду).
Таким образом, конъюгаты, заявленные в соответствии с настоящим изобретением, являются перспективными лекарственными средствами с оптимальными характеристиками как для радионуклидной визуализации, так и для эндорадиотерапии.
В целом, новые ПСА лиганды, заявленные в настоящем изобретении (также обозначаемые в описании терминами “конъюгаты” или” соединения”), таким образом, включают первую концевую группу (хелатирующий агент), вторую концевую группу (альбумин-связывающую молекулу) и третью концевую группу (ПСА-связывающую молекулу), которые ковалентно соединены или связаны между собой посредством подходящих линкеров или спейсеров.
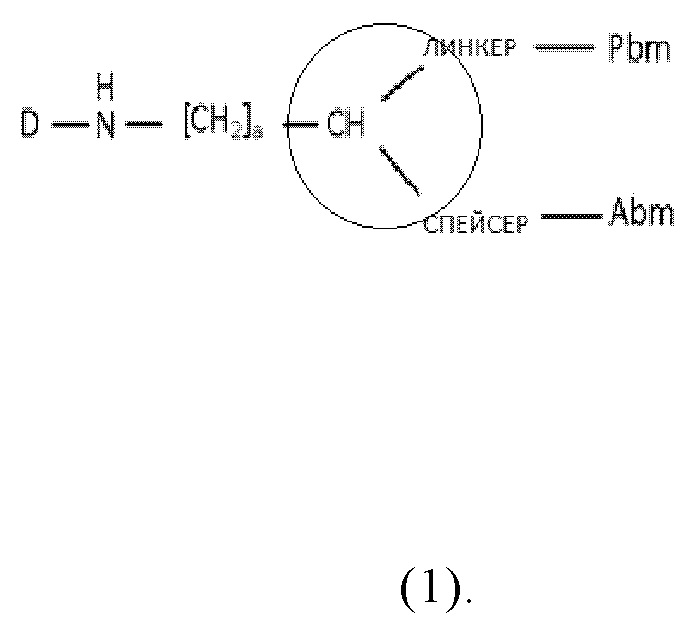
Согласно первому аспекту, настоящее изобретение относится к соединению общей формулы (1):
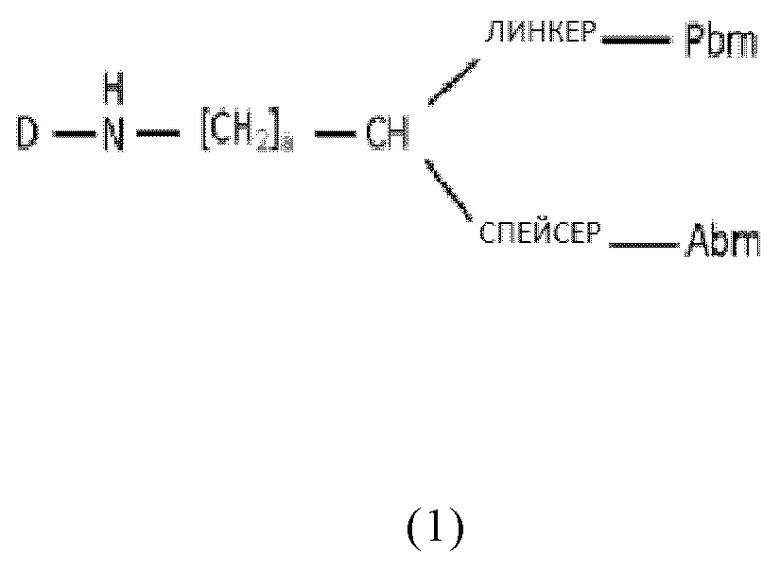
где
D представляет собой хелатирующий агент, предпочтительно как раскрыто в описании,
Abm представляет собой альбумин связывающую молекулу, предпочтительно как раскрыто в описании,
Pbm представляет собой ПСА-связывающую молекулу, предпочтительно как раскрыто в описании,
спейсер включает по меньшей мере одну C-N связь,
линкер имеет общую формулу (6), как раскрыто в описании,
a представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, и
-CH- группа в общей формуле (1) является “точкой разветвления”, соединяющей ПСА-связывающую молекулу (Pbm) и альбумин-связывающую молекулу (Abm);
или к его фармацевтически приемлемым солям, сложным эфирам, сольватам или меченым радиоактивной меткой комплексам.
Предпочтительные значения D, Abm, Pbm, линкера и спейсера раскрыты в представленном описании.
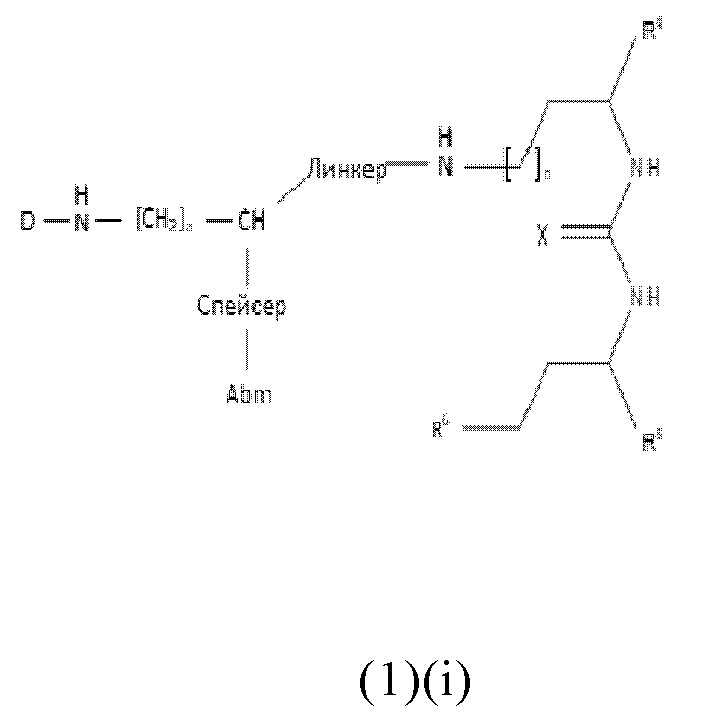
В частности, настоящее изобретение относится к соединениям общей формулы (1)(i) или (1)(ii):
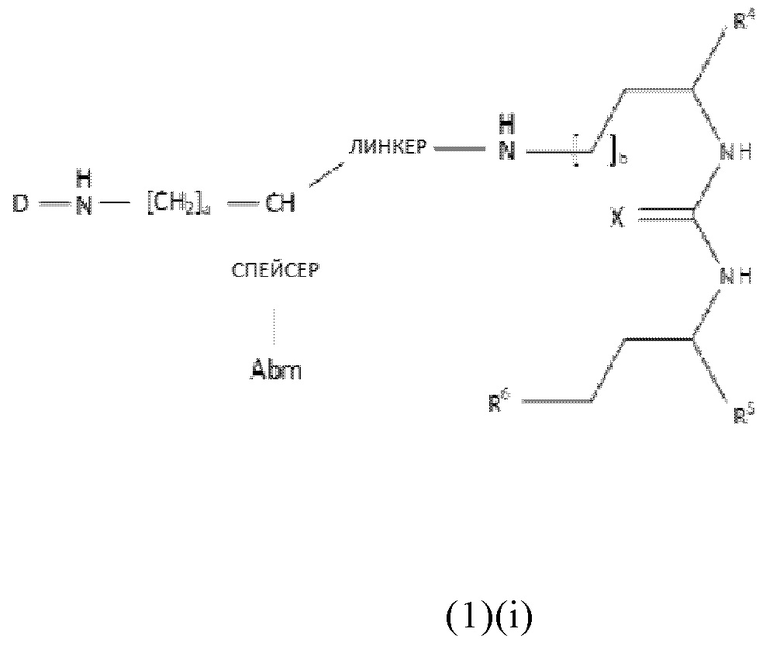
где
Abm представляет собой альбумин связывающую молекулу, предпочтительно как раскрыто в описании,
Pbm представляет собой ПСА-связывающую молекулу, предпочтительно как раскрыто в описании,
D представляет собой хелатирующий агент, предпочтительно выбранный из группы, включающей 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA), N,N"-бис[2-гидрокси-5-(карбоксиэтил)бензил]этилендиамин-N,N"-диуксусную кислоту (HBED-CC), 1,4,7-триазациклононан-1,4,7-триуксусную кислоту (NOTA), 2-(4,7-бис(карбоксиметил)-1,4,7-триазононан-1-ил)пентандиовую кислоту (NODAGA), 2-(4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододекан-1-ил)пентадиовую кислоту (DOTAGA), 1,4,7-триазациклононан фосфиновую кислоту (TRAP), 1,4,7-триазацидононан-1-[метил(2-карбоксиэтил)фосфиновую кислоту]-4,7-бис[метил(2-гидроксиметил)фосфиновую кислоту] (NOPO), 3,6,9,15-тетраазабицикло[9,3,1]пентадека-1(15),11,13-триен-3,6,9-триуксусную кислоту (PCTA), N'-{5-[ацетил(гидрокси)амино]пентил}-N-[5-({4-[(5-аминопентил)(гидрокси)амино]-4-оксобутаноил}амино)пентил]-N-гидроксисукцинамид (DFO) и диэтилентриаминпентауксусную кислоту (DTPA), или их производные,
X каждый независимо выбран из O, N, S или P,
R1 и R2 каждый независимо представляет собой H, F, Cl, Br, I, разветвленный, неразветвленный или циклический C1-C12 углеводород, C2-C12 алкенил, C2-C12 алкинил, OR6, OCOR6, CHO, COR6, CH2OR6, NR6R7, CONR6R7, COOR6, CH2NR6R7, SR6, =O, =S или =NH, или R1 и R2 соединены между собой с образованием циклической структуры, включающей разветвленную, неразветвленную или циклическую C1-C10 углеводородную группу, при этом указанная углеводородная группа необязательно прерывается не более 2 гетероатомами и необязательно замещена не более 3 группами, независимо выбранными из F, Cl, Br, I, OR6, OCOR6, COOR6, CHO, COR6, CH2OR6, NR6R7, CH2NR6R7, и SR7, =O, =S и =NH,
Y выбран из группы, включающей прямую связь или линейный, разветвленный или циклический необязательно замещенный C1-C12 алкил, необязательно прерываемый не более чем двумя гетероатомами, OR6, OCOR6, CHO, COR6, CH2OR6, NR6R7, COOR6, CH2NR6R7, SR6, =O, =S или =NH, при этом одна или более не-соседняя CH2-группа независимо может быть замещена -O-, -CO-, -CO-O-, -O-CO-, -NR6-, -NR6-CO-, -CO-NR6-, -NR6-COO-, -O-CO-NR6-, -NR6-CO-NR6-, -CH=CH- , -C≡C-, -O-CO-O-, SR6-, SO3R6-,
R6 и R7 каждый независимо выбран из H или разветвленного, неразветвленного или циклического C1-12 углеводорода,
R3, R4 и R5 каждый независимо выбран из группы, включающей -COH, -CO2H, -SO2H, -SO3H, -SO4H, -PO2H, -PO3H, -PO4H2, C(O)-(C1-C10)алкил, -C(O)-O(C1-C10)алкил, -C(O)-NHR8 или -C(O)-NR8R9, при этом R8 и R9 каждый независимо выбран из группы, включающей H, связь, (C1-C10)алкилен, F, Cl, Br, I, C(O), C(S), -C(S)-NH-бензил-, -C(O)-NH-бензил, -C(O)-(C1-C10)алкилен, -(CH2)p-NH, -(CH2)p-(C1-C10)алкилен, -(CH2)p-NH-C(O)-(CH2)q, -(CHrCH2)t-NH-C(O)-(CH2)p, -(CH2)p-CO-COH, -(CH2)p-CO-CO2H, -(CH2)p-C(O)NH-C[(CH2)q-COH]3, -C[(CH2)p-COH]3, -(CH2)p-C(O)NH-C[(CH2)q-CO2H]3, -C[(CH2)p-CO2H]3 или -(CH2)p-(C5-C14)гетероарил,
спейсер включает хотя бы одну C-N связь,
линкер имеет общую формулу (6), как раскрыто в описании,
a, b, p, q, r, t каждый независимо представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10;
или к их фармацевтически приемлемым солям, сложным эфирам, сольватам или меченым радиоактивной меткой комплексам.
Отдельно подчеркивается, что структура раскрытая в формуле (1) ниже, включает по крайней мере одну пептидную связь:
Заявленные в настоящем изобретении конъюгаты, представляют собой лиганды, обладающие афинностью по отношению к ПСА и сывороточному альбумину. Термин “лиганд”, используемый здесь, относится к соединению, способному взаимодействовать (присоединяться, связываться) с мишенью (здесь ПСА или HSA). Конъюгаты, заявленные в настоящем изобретении, могут быть функционально определены как “ ПСА таргетные агенты”. Предпочтительно, “лиганды” обладают способностью селективно связываться со своей мишенью. Термин “селективное связывание” означает, что соединение связывается с большей аффиностью со своей предполагаемой мишенью, чем с молекулами, которые его мишенями не являются.
“Аффиность связывания”- это сила взаимодействия между лигандом (т.е. небольшой органической молекулой, белком или нуклеиновой кислотой) и его мишенью/партнером по связыванию. Обычно аффинность связывания измеряется и обозначается с использованием константы равновесного связывания (KD), которая представляет собой соотношение между показателями скорости диссоциации (koff) и скорости ассоциации (kon), которые применяются для оценки и ранжирования сил биомолекулярного взаимодействия. Скорость ассоциации (Kon) показывает, насколько быстро лиганд связывается с мишенью, а скорость диссоциации (Koff) показывает, насколько быстро лиганд отсоединяется от своей мишени. KD (Koff/Kon) и аффинность связывания обратнозависимы. Таким образом, термин “селективное связывание” предпочтительно означает, что лиганд связывается со своей предполагаемой мишенью с такой KD, которая меньше чем KD связывания этого лиганда с другой молекулой, которая не является его мишенью. Существует множество способов измерения аффинности связывания и константы диссоциации, например ELISA, анализ задержки электрофоретического сдвига в геле, анализ аффиной абсорбции, равновесный диализ, аналитическое ультрацентрифугирование, поверхностный плазмонный резонанс и спектроскопический анализ.
В контексте настоящего изобретения, величина KD ПСА-связывающей молекулы (HSA-связывающей молекулы) с молекулой не являющейся мишенью по крайней мере в 1,5 раза, предпочтительно по крайней мере в 2-, 3-, 5-, 10-, 15-, 20-, 25-, 30-, 35-, 40-, 45-, 50-, 60-, 70-, 80-, 90-, 100- 200-, 300-, 400-, 500-, 750-, или 1000-раз превышает величину KD для связывания заявленного конъюгата или молекулы с ПСА (HSA) человека.
В контексте настоящего изобретения дополнительно является предпочтительным, чтобы конъюгаты связывались с ПСА с высокой аффинностью связывания и величиной KD в наномолярных пределах (nM), и с умеренной аффинностью и величиной KD в микромолярных пределах (μM (микромолярных)) связывались с HSA.
В частности, является предпочтительным сбалансировать аффинности связывания для ПСА и HSA таким образом, чтобы усилить поглощение вещества опухолевыми клетками и его сохранение в них, а также увеличить плазматический клиренс, и при этом одновременно уменьшить потенциальное вредное воздействие на клетки, не являющиеся мишенями. В частности, конъюгаты, заявленные в настоящем изобретении, могут демонстрировать более высокую аффинность связывания по отношению к ПСА, чем к HSA.
В частности, настоящее изобретение относится к соединениям общей формулы (1)(i):
где
Abm представляет собой альбумин-связывающую молекулу,
D представляет собой хелатирующий агент, предпочтительно выбранный из группы, включающей 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA), N,N''-бис[2-гидрокси-5-(карбоксиэтил)бензил]этилендиамин-N,N''-диуксусную кислоту (HBED-CC), 1,4,7-триазациклононан-1,4,7-триуксусную кислоту (NOTA), 2-(4,7-бис(карбоксиметил)-1,4,7-триазононан-1-ил)пентандиовую кислоту (NODAGA), 2-(4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододекан-1-ил)пентадиовую кислоту (DOTAGA), 1,4,7-триазациклононан фосфиновую кислоту (TRAP), 1,4,7-триазацидононан-1-[метил(2-карбоксиэтил)фосфиновую кислоту]-4,7-бис[метил(2-гидроксиметил)фосфиновую кислоту] (NOPO), 3,6,9,15-тетраазабицикло[9,3,1]пентадека-1(15),11,13-триен-3,6,9-триуксусную кислоту (PCTA), N'-{5-[ацетил(гидрокси)амино]пентил}-N-[5-({4-[(5-аминопентил)(гидрокси)амино]-4-оксобутаноил}амино)пентил]-N-гидроксисукцинамид (DFO) и диэтилентриаминпентауксусную кислоту (DTPA), или их производные,
X каждый независимо выбран из O, N, S или P,
R3, R4 и R5 каждый независимо представляет собой -COH, -CO2H, -SO2H, -SO3H, -SO4H, -PO2H, -PO3H, -PO4H2, -C(O)-(C1-C10)алкил, C(O)-O(C1-C10)алкил, -C(O)-NHR8 или -C(O)-NR8R9, при этом R8 и R9 каждый независимо представляет собой H, связь, (C1-C10)алкилен, F, Cl, Br, I, C(O), C(S), -C(S)-NH-бензил-, -C(O)-NH-бензил, C(O)-(C1-C10)алкилен, -(CH2)p-NH, -(CH2)p-(C1-C10)алкилен, -(CH2)p-NH-C(O)-(CH2)q, -(CHrCH2)t-NH-C(O)-(CH2)p, -(CH2)p-CO-COH, -(CH2)p-CO-CO2H, -(CH2)p-C(O)NH-C[(CH2)q-COH]3, -C[(CH2)p-COH]3, -(CH2)p-C(O)NH-C[(CH2)q-CO2H]3, -C[(CH2)p-CO2H]3 или -(CH2)p-(C5-C14)гетероарил,
спейсер включает хотя бы одну C-N связь,
линкер имеет общую формулу (6), как раскрыто здесь,
a, b, p, q, r, t каждый независимо представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10;
или к их фармацевтически приемлемым солям, сложным эфирам, сольватам или меченым радиоактивной меткой комплексам.
В частности, настоящее изобретение относится к наиболее предпочтительным конъюгатам общей формулы (11):
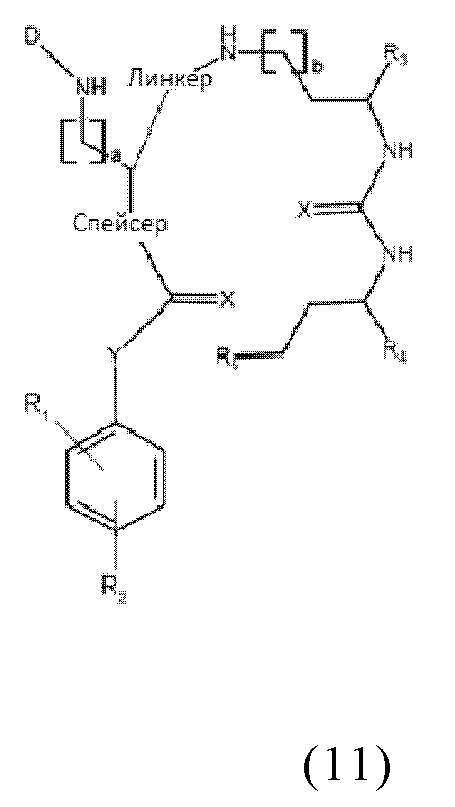
где
D представляет собой хелатирующий агент, предпочтительно выбранный из группы, включающей 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA), N,N''-бис[2-гидрокси-5-(карбоксиэтил)бензил]этилендиамин-N,N''-диуксусную кислоту (HBED-CC), 1,4,7-триазациклононан-1,4,7-триуксусную кислоту (NOTA), 2-(4,7-бис(карбоксиметил)-1,4,7-триазононан-1-ил)пентандиовую кислоту (NODAGA), 2-(4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододекан-1-ил)пентадиовую кислоту (DOTAGA), 1,4,7-триазациклононан фосфиновую кислоту (TRAP), 1,4,7-триазацидононан-1-[метил(2-карбоксиэтил)фосфиновую кислоту]-4,7-бис[метил(2-гидроксиметил)фосфиновую кислоту] (NOPO), 3,6,9,15-тетраазабицикло[9,3,1]пентадека-1(15),11,13-триен-3,6,9-триуксусную кислоту (PCTA), N'-{5-[ацетил(гидрокси)амино]пентил}-N-[5-({4-[(5-аминопентил)(гидрокси)амино]-4-оксобутаноил}амино)пентил]-N-гидроксисукцинамид (DFO) и диэтилентриаминпентауксусную кислоту (DTPA), или их производные,
X каждый независимо выбран из O, N, S или P,
R1 и R2 каждый независимо представляет собой H, F, Cl, Br, I, разветвленный, неразветвленный или циклический необязательно замещенный C1-C12 углеводород, C2-C12 алкенил, C2-C12 алкинил, OR6, OCOR6, CHO, COR6, CH2OR6, NR6R7, CONR6R7, COOR6, CH2NR6R7, SR6, =O, =S или =NH, или R1 и R2 соединены между собой с образованием циклической структуры, включающей разветвленную, неразветвленную или циклическую C1-C10 углеводородную группу, при этом указанная углеводородная группа необязательно прерывается не более 2 гетероатомами и необязательно замещена не более 3 группами, независимо выбранными из F, Cl, Br, I, OR6, OCOR6, COOR6, CHO, COR6, CH2OR6, NR6R7, CH2NR6R7, и SR7, =O, =S и =NH,
Y выбран из группы, включающей прямую связь или линейный, разветвленный или циклический необязательно замещенный C1-C12 алкил, необязательно прерываемый не более чем двумя гетероатомами, OR6, OCOR6, CHO, COR6, CH2OR6, NR6R7, COOR6, CH2NR6R7, SR6, =O, =S или =NH, при этом одна или более не-соседняя CH2-группа независимо может быть замещена -O-, -CO-, -CO-O-, -O-CO-, -NR6-, -NR6-CO-, -CO-NR6-, -NR6-COO-, -O-CO-NR6-, -NR6-CO-NR6-, -CH=CH-, C≡C-, -O-CO-O-, SR6-, SO3R6-,
R6 и R7 каждый независимо выбран из H или разветвленного, неразветвленного или циклического C112 углеводорода,
R3, R4 и R5 каждый независимо выбран из группы, включающей -COH, -CO2H, -SO2H, -SO3H, -SO4H, -PO2H, -PO3H, -PO4H2, C(O)-(C1-C10)алкил, -C(O)-O(C1-C10)алкил, -C(O)-NHR8 или -C(O)-NR8R9, при этом R8 и R9 каждый независимо выбран из группы, включающей H, связь, (C1-C10)алкилен, F, Cl, Br, I, C(O), C(S), -C(S)-NH-бензил-, -C(O)-NH-бензил, -C(O)-(C1-C10)алкилен, -(CH2)p-NH, -(CH2)p-(C1-C10)алкилен, -(CH2)p-NH-C(O)-(CH2)q, -(CHrCH2)t-NH-C(O)-(CH2)p, -(CH2)p-CO-COH, -(CH2)p-CO-CO2H, -(CH2)p-C(O)NH-C[(CH2)q-COH]3, -C[(CH2)p-COH]3, -(CH2)p-C(O)NH-C[(CH2)q-CO2H]3, -C[(CH2)p-CO2H]3 или -(CH2)p-(C5-C14)гетероарил,
спейсер включает хотя бы одну C-N связь,
линкер имеет структурную формулу (6):
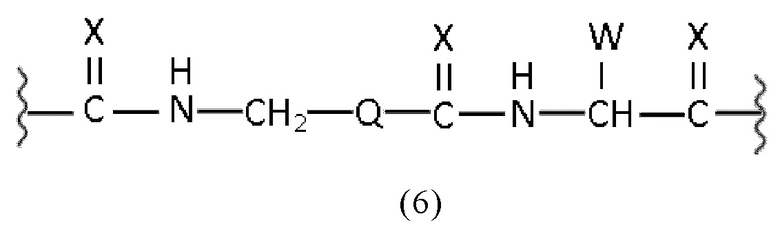
где Х каждый независимо представляет собой O, N, S или P,
Q выбран из замещенного или незамещенного алкила, алкиларила и циклоалкила, предпочтительно из замещенного или незамещенного C5-C14 арила, C5-C14 алкиларила или C5-C14 циклоалкила,
W выбран из -(CH2)c-арила или -(CH2)c-гетероарила, при этом c представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, и
a, b, p, q, r, t каждый независимо представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10,
или к их фармацевтически приемлемым солям, сложным эфирам, сольватам или меченым радиоактивной меткой комплексам.
Альбумин-связывающая молекула
Конъюгаты, заявленные в настоящем изобретении, включают (если сравнивать их с уже известными ПСА лигандами) альбумин-связывающий элемент (также обозначаемый как “альбумин-связывающая молекула”), как раскрывается в описании, которое предпочтительно обладает способностью селективно связываться с сывороточным альбумином человека (HSA). Термин “селективное связывание” раскрыт выше.
Альбумин связывающий элемент (Abm) может представлять собой любой элемент, способный связываться с альбумином.
Наиболее предпочтительными альбумин связывающими элементами являются элементы, описанные ниже. Альбумин-связывающий элемент может, предпочтительно, нековалентно связываться с сывороточным альбумином, предпочтительно, человеческим сывороточным альбумином, обычно с аффинностью связывания приблизительно менее 100 мкМ (микромоль), например приблизительно от 3 мкМ (микромоль) до 50 мкМ (микромоль).
Человеческий Сывороточный Альбумин (HSA) является лидером по содержанию в плазме крови и составляет приблизительно половину объема всех сывороточных белков. Термин “Человеческий Сывороточный Альбумин” или “HSA”, используемый в настоящем описании, предпочтительно относится к сывороточному альбумину человека, кодируемому геном ALB. Более предпочтительно, термин относится к белку, который числится в базе данных UniProt под номером P02768 (вариант доступа 240, последняя модификация 10 мая 2017), а также к его функциональным вариантам, изоформам, фрагментам или (пост-трансляционным, или иначе модифицированным) производным.
Без желания быть связанными какой-либо специфической теорией, авторы предположили, что альбумин связывающий элемент (Abm) в составе заявленных конъюгатов, предпочтительно увеличивает период их полувыведения из плазмы крови и влияет на компартментализацию заявленных конъюгатов в крови, улучшая их доступ к ПСА-экспрессирующим (опухолевым) клеткам или тканям-мишеням, что приводит к увеличению отношения опухолевые мишени / не-опухолевые мишени для ПСА-экспрессирующих нормальных (неопухолевых) органов (таких как почки, слезные и слюнные железы).
Таким образом, альбумин связывающий элемент, как предполагается, обеспечивает улучшенный фармакокинетический профиль заявленным конъюгатам, предпочтительно без влияния (уменьшения или уничтожения) желаемой функции хелатирующего агента и ПСА-связывающего элемента.
С точки зрения структуры, типичные альбумин связывающие элементы, в соответствии с настоящим изобретением, могут предпочтительно содержать линейные и разветвленные группы, содержащие 1-40 атомов углерода и дистальную кислотную группу. Подходящие альбумин связывающие элементы среди прочих описаны в заявках US 2010/172844 A1, WO 2013/024035 A1 и WO 2008/053360 A2, которые включены в настоящее описание в качестве ссылок во всей своей полноте.
Согласно изложенному выше, в конъюгатах согласно настоящему изобретению, альбумин-связывающий элемент имеет общую формулу (2):
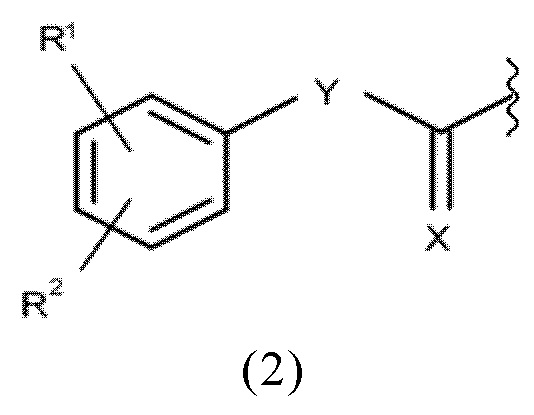
где
R1 и R2 каждый независимо выбран из группы, включающей H, F, Cl, Br, I, разветвленный, неразветвленный или циклический C1-C12 углеводород, C2-C12 алкенил, C2-C12 алкинил, OR6, OCOR6, CHO, COR6, CH2OR6, NR6R7, CONR6R7, COOR6, CH2NR6R7, SR6, =O, =S или =NH, или R1 и R2 соединены между собой с образованием циклической структуры, включающей разветвленную, неразветвленную или циклическую C1-C10 углеводородную группу, при этом указанная углеводородная группа необязательно прерывается не более 2 гетероатомами и необязательно замещена не более 3 группами, независимо выбранными из F, Cl, Br, I, OR6, OCOR6, COOR6, CHO, COR6, CH2OR6, NR6R7, CH2NR6R7, и SR7, =O, =S и =NH,
Y выбран из группы, включающей прямую связь или линейный, разветвленный или циклический необязательно замещенный C1-C12 алкил, необязательно прерываемый не более чем двумя гетероатомами, OR6, OCOR6, CHO, COR6, CH2OR6, NR6R7, COOR6, CH2NR6R7, SR6, =O, =S или =NH, при этом одна или более не-соседняя CH2-группа независимо может быть замещена -O-, -CO-, -CO-O-, -O-CO-, -NR6-, -NR6-CO-, -CO-NR6-, -NR6-COO-, -O-CO-NR6-, -NR6-CO-NR6-, -CH=CH- , -C≡C-, -O-CO-O-, SR6-, SO3R6-,
R6 и R7 каждый независимо выбран из H или разветвленного или неразветвленного, или циклического C1-12 углеводорода, и
X представляет собой O, N, P и S.
Радикалы R1 и R2 могут находиться в орто-, мета- или пара-положении.
Если R1 и R2 объединены вместе таким образом, что они образуют циклическую структуру, то указанная циклическая структура предпочтительно представляет собой линейную или разветвленную углеводородную цепь из 3-12, предпочтительно 3-10, еще более предпочтительно 3-9, 3-8, 3-7, 3-6, 3-5, 3-4 или 4 атомов углерода, которые в двух положениях присоединены к фенильному кольцу, т.е. образуют две связи с указанным фенильным кольцом, таким образом, образуя кольцевую структуру конденсированную с указанным фенильным кольцом. В частности, указанная циклическая структура может быть выбрана из соединений (замещенных или незамещенных) адамантила. Предпочтительно, указанные две связи располагаются в мета (3-) и пара (4-) положениях, в орто-(2-) и мета положениях или в орто- и пара- положениях указанного фенильного кольца. Указанная циклическая структура необязательно прерывается не более чем 2, предпочтительно 1 или ни одним гетероатомом. Предпочтительно, указанная циклическая структура может представлять собой фрагмент цепи C4 (1,4-дирадикал), присоединенный своим 1 и 4 атомами к указанному фенильному кольцу, с образованием шестичленного кольца соединенного с указанным фенильным кольцом, предпочтительно в мета- и пара- положениях указанного фенильного кольца, т.е. предпочтительно с образованием мета- и пара-конденсированного шестичленного кольца.
Предпочтительно, R1 и R2 каждый независимо выбран из H, галогена, предпочтительно йода или брома, и C1-6 алкила, предпочтительно C1-3 алкила, еще более предпочтительно метила. Более предпочтительно, R1 представляет собой H, а R2 выбран из галогена, предпочтительно йода или брома, и C1-6 алкила, предпочтительно C1-3 алкила, еще более предпочтительно метила. Еще более предпочтительно, R1 представляет собой H, а R2 представляет собой H или находится в пара-положении и выбран из йода, брома и метила.
Предпочтительно, Y может представлять собой разветвленный необязательно замещенный C1-C12 углеводород, более предпочтительно линейный или разветвленный необязательно замещенный C1-C10 углеводород, еще более предпочтительно линейный или разветвленный необязательно замещенный C1-C6 углеводород, наиболее предпочтительно линейный или разветвленный необязательно замещенный C1-C3 углеводород.
Более предпочтительно, Y может представлять собой -(CH2)3-.
Предпочтительно, X может представлять собой O.
Таким образом, альбумин связывающая молекула формулы (2) предпочтительно может включать или состоять из одной из формул (2a)-(2c):

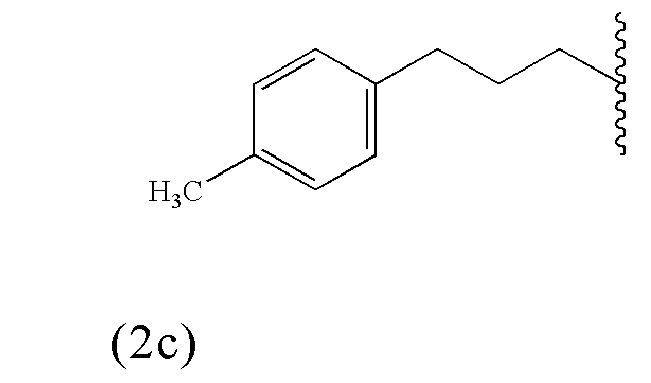
Другие возможные, потенциально менее предпочтительные, альбумин-связывающие молекулы раскрываются среди прочих в заявке US 2010/0172844 A1.
Согласно предпочтительным вариантам осуществления настоящего изобретения, соединения имеют любую из общих формул (11.1)-(11.3):
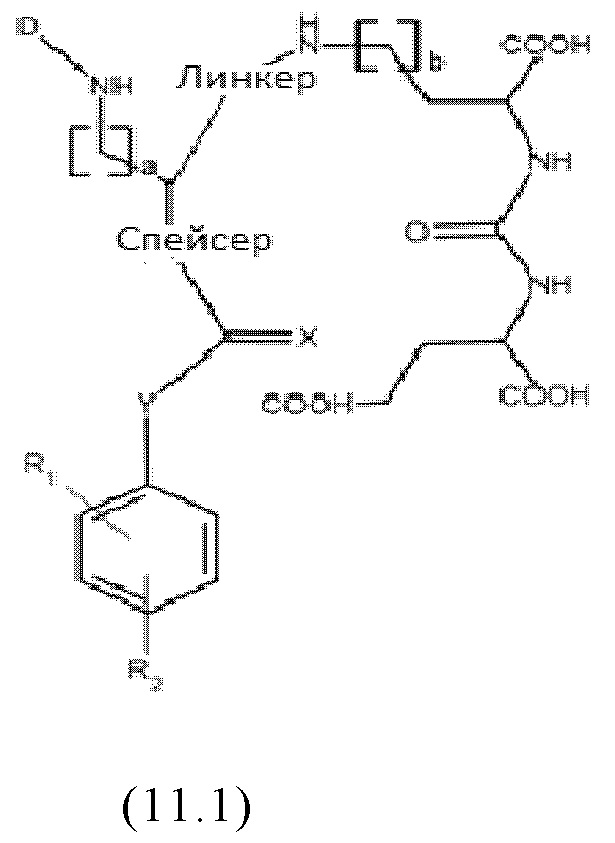
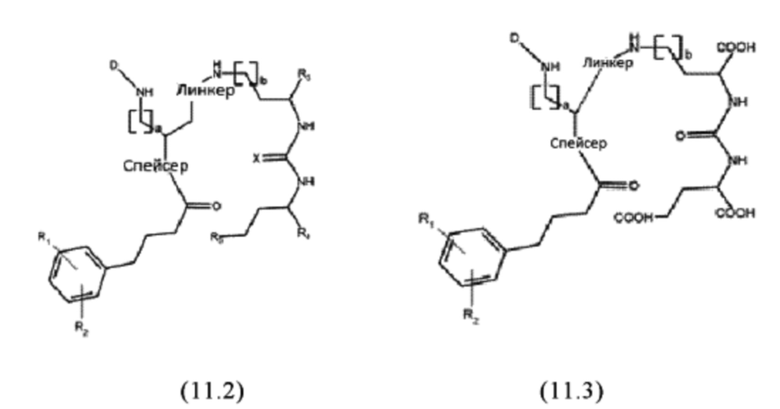
где D, линкер, X, R1-R5, a и b имеют значения, как они определены для общей формулы (11).
Спейсер
В заявленных конъюгатах альбумин-связывающий элемент конъюгирован (т.е. ковалентно связан или соединен) с -СН- “точкой разветвления” посредством “спейсера”. Термин “спейсер”, используемый в настоящем описании, используется для специального обозначения группы, соединяющей и заполняющей пространство между альбумин-связывающим элементом и -СН- “точкой разветвления” и/или “отделения” указанных групп от остальных групп/элементов конъюгата.
Предпочтительно, спейсер позволяет избежать пространственных помех между альбумин-связывающим элементом и остальными группами или элементами заявленного конъюгата и обеспечивает достаточную мобильность и пластичность. Кроме того, предпочтительно спейсер может быть сконструирован таким образом, чтобы обеспечивать, поддерживать и/или разрешать достаточное HSA связывание, высокоаффинное ПСА-связывание, а также быстрое и желательно селективное проникновение ПСА-конъюгированного комплекса в ПСА-позитивные клетки-мишени.
Авторы настоящего изобретения определили, что предпочтительно спейсер должен содержать по крайней мере одну C-N связь. Подходящие спейсеры, предпочтительно, должны быть стабильными in vivo. Дизайн спейсера чаще всего зависит от структуры целого конъюгата и, предпочтительно, выбирается таким образом, чтобы обеспечивать функциональность остального конъюгата (например, связывание с ПСА, связывание с HSA, интернализацию и т.д.). Соответственно, спейсеры могут быть, в частности, ригидными или пластичными, влиять на липофильность или гидрофильность целого конъюгата, и так далее.
Предпочтительно, спейсер может включать линейный или разветвленный необязательно замещенный C1-C20 углеводород, содержащий не более 5 гетероатомов, более предпочтительно C1-C12 углеводород, еще более предпочтительно C2-C6 углеводород, наиболее предпочтительно C2-C4 углеводород. Предпочтительно, углеводород включает по крайней мере не более 4 гетероатомов, предпочтительно N.
Предпочтительно, спейсер представляет собой группу -[CHR10]u-NR11-, где R10 и R11 каждый независимо выбран из H и разветвленного, неразветвленного или циклического C1-C12 углеводорода, где u представляет собой целое число, выбранное из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10. Более предпочтительно, R10 и R11 могут представлять собой H, а u представляет собой целое число, выбранное из 2, 3 или 4. Более предпочтительно, R10 и R11 представляют собой H, а u равен 4.
Таким образом, предпочтительно заявленные конъюгаты могут включать спейсер формулы (3a)
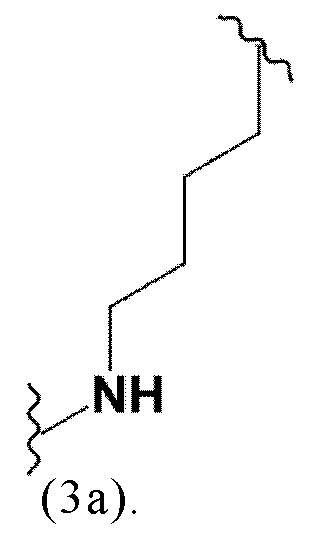
Соответственно, предпочтительные конъюгаты, заявленные в настоящем изобретении (например, ПСА-АЛБ-03 и ПСА-АЛБ-06, раскрытые в примерах), содержат альбумин-связывающий элемент формулы (2а)-(2b), прикрепленный к “точке разветвления” с помощью спейсера формулы (3а).
Альтернативно или дополнительно, спейсер может содержать по крайней мере один аминокислотный остаток. Используемый в описании термин “аминокислотный остаток” относится к специфическому мономеру аминокислоты как к части молекулы в составе спейсера.
“Аминокислота” представляет собой любую органическую молекулу, которая содержит как кислую (обычно карбоксильную (-COOH)), так и амино (-NH2) функциональную группу. Одна или обе указанные группы могут быть, возможно, модифицированными. Аминогруппа и кислотная группа могут располагаться в любом положении по отношению друг к другу, однако аминокислоты обычно представляют собой 2-аминокарбоксильные кислоты, 3-аминокарбоксильные кислоты, 4-аминокарбоксильные кислоты и т.д. Аминогруппа может быть прикреплена к 1му, 2му, 3му, 4му, 5му, 6му, 7му, 8му, 9му, 10му (и т.д.) но не более чем к 20му атому углеводорода аминокислот(ы). Другими словами, аминокислота(ы) могут представлять собой альфа-, бета-, гамма-, дельта-, ипсилон (и т.д.), но не более чем омега-аминокислоту(ы). Предпочтительно, кислотная группа представляет собой карбокси (-COOH) группу. Однако, другие кислотные группы, такие как -OPO3H, -PO3H, -OSO3H или -SO3H также являются допустимыми.
Предпочтительно, аминокислотный остаток получен на основе аминокислот существующих в природе или их производных. Кроме того, является предпочтительным, чтобы аминокислотный остаток были получен из альфа(α-)аминокислот, при этом указанная кислота может быть D- или L-аминокислотой.
Более предпочтительно, указанные аминокислоты являются D- или L- энантиомерами аминокислот, выбранных из группы, включающей аргинин, аспарагин, аспартат, цистеин, глутамат, глутамин, глицин, гистидин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин и/или валин.
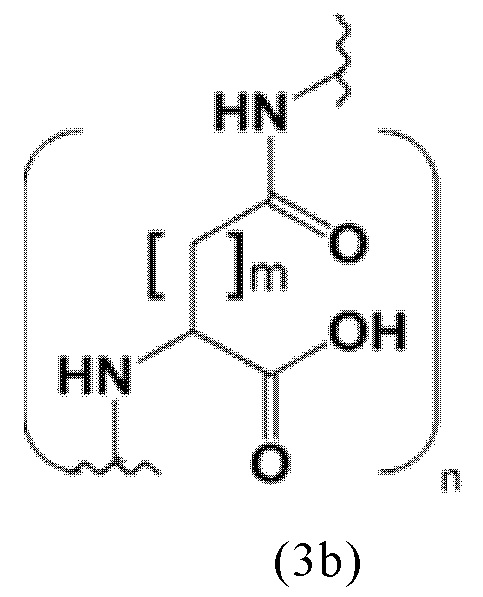
Более предпочтительно, указанные аминокислоты представляют собой (D-/L-) аспарагиновую кислоту, глутаминовую кислоту или лизин. Спейсер может включать 1, 2, 3, 4 или 5 аминокислотных остатка, в частности D-аспартат, D-глутамат или L-лизин. Заявленные конъюгаты, содержащие D-энантиомер, могут иметь дополнительный благоприятный эффект, заключающийся в снижении скорости метаболизации и, таким образом, клиренса из плазмы крови. Предпочтительно, спейсер может содержать 2-3 указанных аминокислотных остатка, в частности остатки D-аспартата или D-глутамата. Другими словами, спейсер может включать пептид, который, предпочтительно, состоит из 2-5 аминокислот, более предпочтительно, из 2-3 аминокислот. Альтернативно, спейсер может содержать 1-2 аминокислотных остатка, предпочтительно L-лизин.
Таким образом, заявленные конъюгаты могут включать спейсер формулы (3b)
где
m представляет собой целое число 1 или 2,
n представляет собой целое число, выбранное из 1, 2, 3, 4 или 5, предпочтительно 2 или 3.
Альтернативно, спейсер может включать аминокислотный остаток, соединенный с “точкой разветвления” с помощью линейной или разветвленной необязательно замещенной C1-C20 углеводородной группы, содержащей по крайней мере один N гетероатом.
Таким образом, заявленные конъюгаты могут включать спейсер формулы (3с):
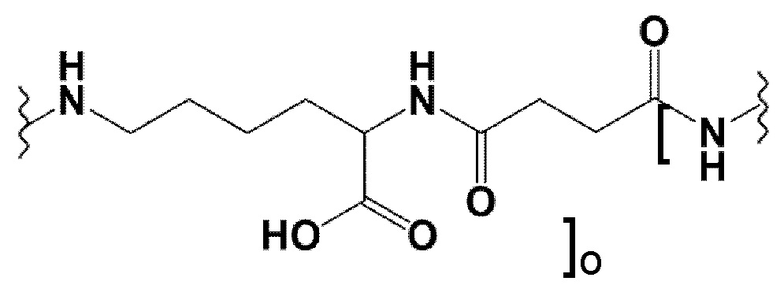
где о представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10. Предпочтительно, o равно 5.
Согласно предпочтительным вариантам осуществления настоящего изобретения, заявленные конъюгаты могут иметь одну из следующих общих формул (12.1)-(12.4) или (13.1)-(13.4):
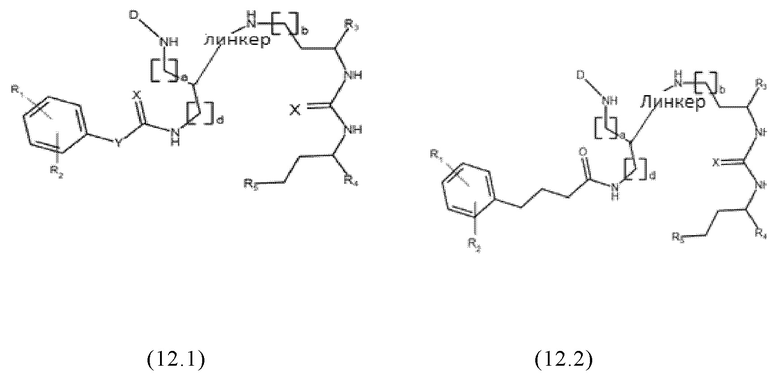
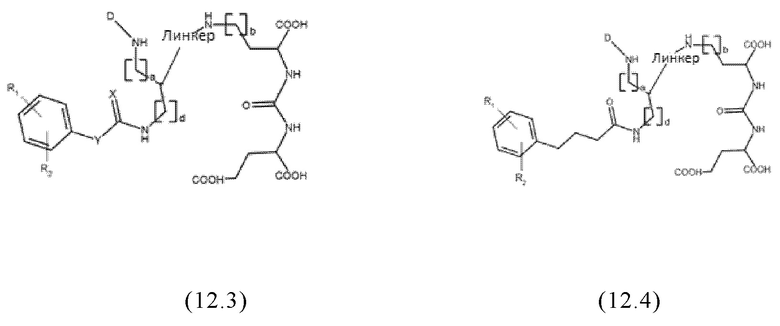
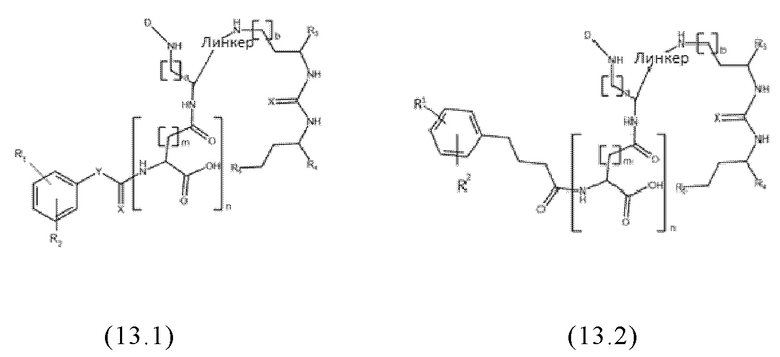
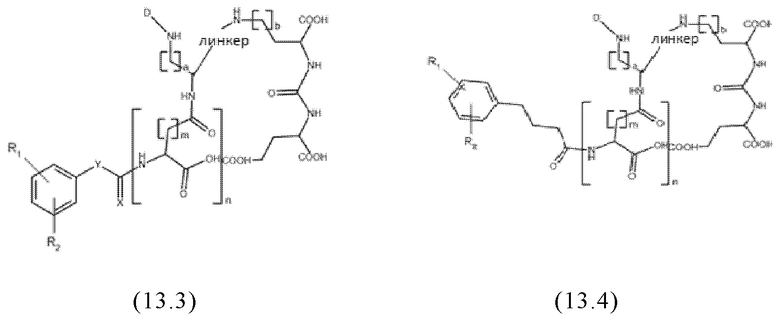
где значения D, спейсера, линкера, X, R1-R5, a, b, m, n в общих формулах (12.1)-(12.4) и (13.1)-(13.4) являются такими же, как определены для общих формул (1) и (11), и d представляет собой целое число, выбранное из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, более предпочтительно 1, 2, 3, 4, 5 или 6.
Хелатирующий агент
Конъюгаты, заявленные в настоящем изобретении, также содержат хелатирующий агент.
Термины “хелатирующий агент” или “хелатирующий остаток” в настоящем описании взаимозаменяемо используются для обозначения полидентатных (с многократными связями) лигандов, способных формировать две или более отдельные координационные связи с центральным (“координационным”) ионом (металла). В частности, такие молекулы или молекулы, способные быть донором одной пары электронов, могут также обозначаться термином “основания по Льиюсу”. Центральный ион (метала) обычно координируется двумя или более электронными парами хелатирующего агента. Термины “бидентатный хелатирующий агент”, “тридентатный хелатирующий агент” и “ тетрадентатный хелатирующий агент” хорошо известны в данной области техники и относятся к хелатирующим агентам, имеющим соответственно две, три или четыре пары электронов, которые агент может легко и одновременно отдать иону металла, который координируется хелатирующим агентом. Обычно электронные пары хелатирующего агента формируют координационные связи с одним центральным ионом металла; однако, в конкретных примерах, хелатирующий агент может формировать координационные связи с одним или более ионом металла, при этом возможны различные варианты связей.
Термины “координирующий” или “координационный” относятся к взаимодействиям, в которых один донор множества электронных пар координационно связывается (или “координируется”) с центральным ионом металла, т.е. отдает две или более пары электронов.
Предпочтительно, хелатирующий агент выбирается на основании способности координироваться с желаемым центральным ионом металла, обычно, радиоактивным, что детально изложено в описании.
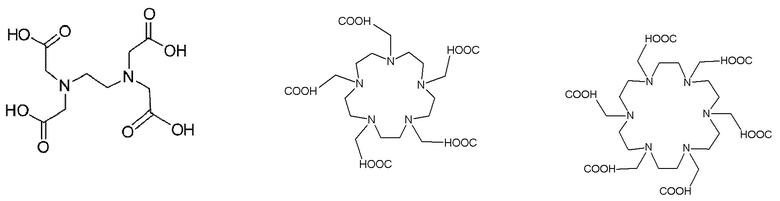
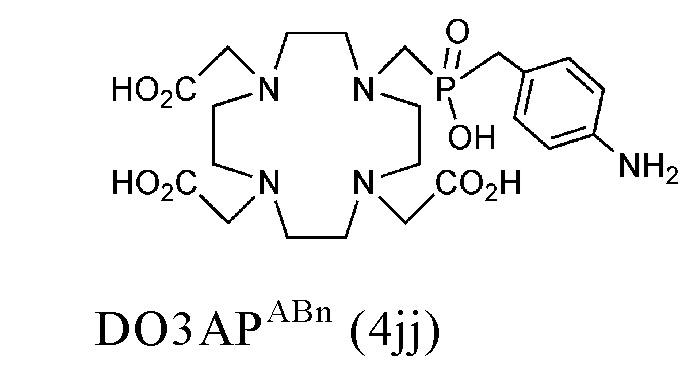
Таким образом, хелатирующий агент D может иметь одну из представленных ниже формул (4a)-(4jj):
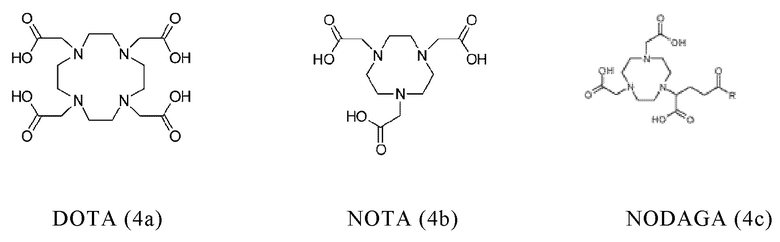
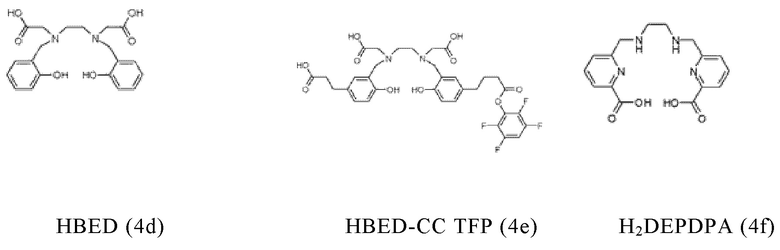
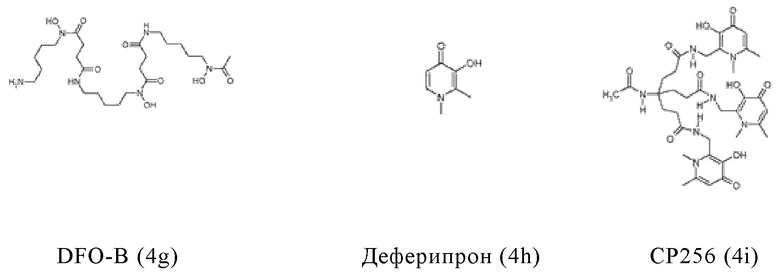
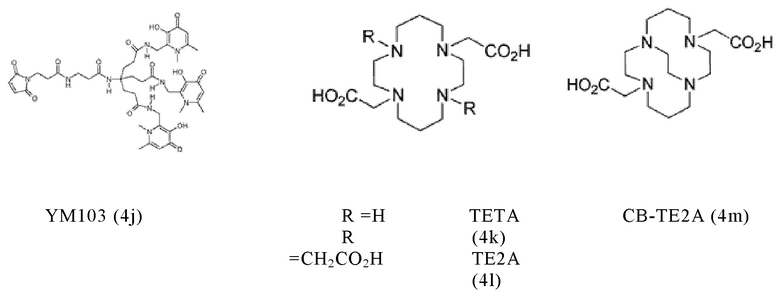
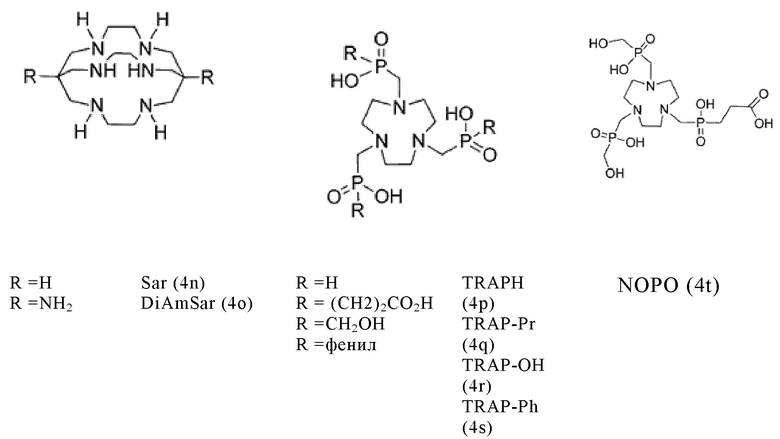
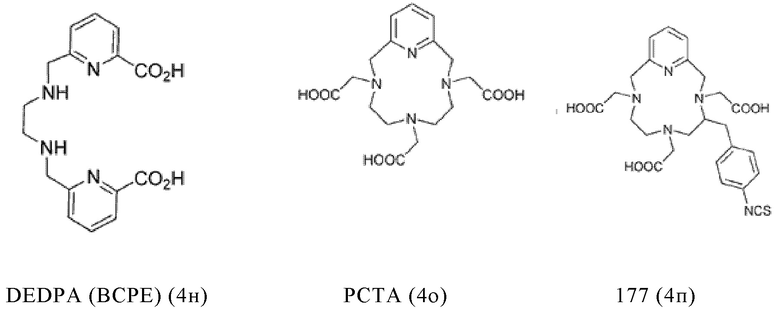
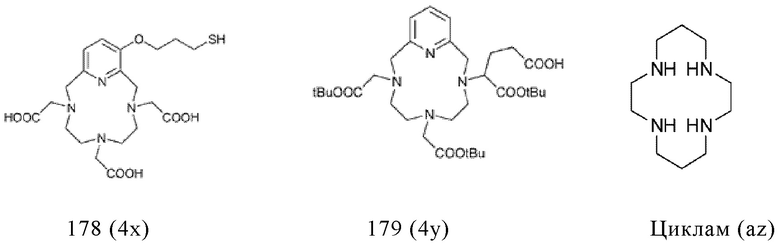
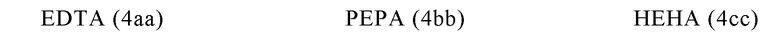
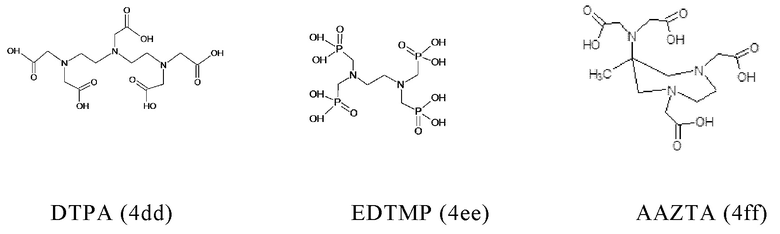
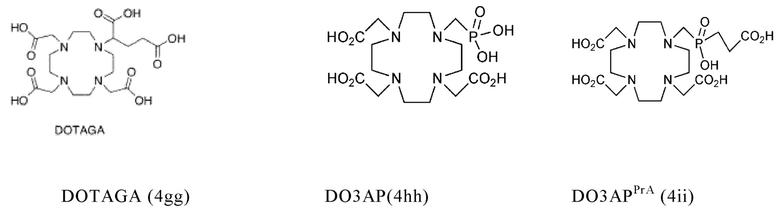
Предпочтительно, хелатирующий агент может представлять собой DOTA (1,4,7,10-тетраазациклододекан-1,4,7,10-тетраукскусную кислоту, которая имеет формулу (4а)), NODAGA (2-(4,7-бис(карбоксиметил)-1,4,7-триазонан-1-ил)-пентандиовую кислоту, которая имеет формулу (4с)), или их производные.
Согласно некоторым предпочтительным вариантам осуществления настоящего изобретения, хелатирующий агент может представлять собой DOTA. Согласно другим предпочтительным вариантам осуществления настоящего изобретения, хелатирующий агент представляет собой NODAGA.
Предпочтительно, DOTA эффективно образует комплексы с диагностическими (например, 68Ga) и терапевтическими (например, 90Y или 177Lu) радиоактивными веществами и, таким образом, позволяет использовать один и тот же конъюгат как в целях визуализации, так и в целях лечения, т.е. в качестве терагностического средства. Производные DOTA, способные образовывать комплексы с радиоактивными изотопами Скандия (43Sc, 44Sc, 47Sc), включая DO3AP (который имеет формулу (4hh)), DO3APPrA (который имеет формулу (4ii)) или DO3APABn (который имеет формулу (4jj)) также являются предпочтительными и описаны у Kerdjoudj et al, Dalton Trans., 2016, 45, 1398-1409.
Другими предпочтительными хелатирующими агентами в контексте настоящего изобретения являются N,N''-бис[2-гидрокси-5-(карбоксиэтил)-бензил]этилендиамин-N,N''-диуксусная кислота (HBED-CC), ), 1,4,7-триазациклононан-1,4,7-триуксусная кислота (NOTA), 2-(4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододекан-1-ил)пентадиовая кислота (DOTAGA), 1,4,7-триазациклононан фосфиновая кислота (TRAP), 1,4,7-триазацидононан-1-[метил(2-карбоксиэтил)фосфиновая кислота]-4,7-бис[метил(2-гидроксиметил)фосфиновая кислота] (NOPO), 3,6,9,15-тетраазабицикло[9,3,1]пентадека-1(15),11,13-триен-3,6,9-триуксусная кислота (PCTA), N'-{5-[ацетил(гидрокси)амино]пентил}-N-[5-({4-[(5-аминопентил)(гидрокси)амино]-4-оксобутаноил}амино)пентил]-N-гидроксисукцинамид (DFO) и диэтилентриаминпентауксусная кислота (DTPA), или их производные.
Хелатирующая группа, например DOTA, может образовывать комплекс с центральным ионом металла, в частности, с радиоактивным веществом, как определено в описании. Альтернативно, хелатирующая группа, например DOTA, может не образовывать комплекс с центральным ионом металла, в частности, с радиоактивным веществом, как определено в описании, и таким образом, находиться в свободной форме. В тех случаях, когда хелатирующий агент (DOTA) не находится в комплексе с указанным ионом металла, карбоксильная кислотная группа хелатирующего агента может находиться либо в форме свободной кислоты, либо в форме соли.
ПСА связывающий элемент
Конъюгаты, заявленные в настоящем изобретении, содержат ПСА-связывающий элемент (также обозначаемый в описании как “ПСА-связывающая молекула”), который предпочтительно способен селективно связываться с ПСА человека. Термин “селективное связывание” раскрыт выше.
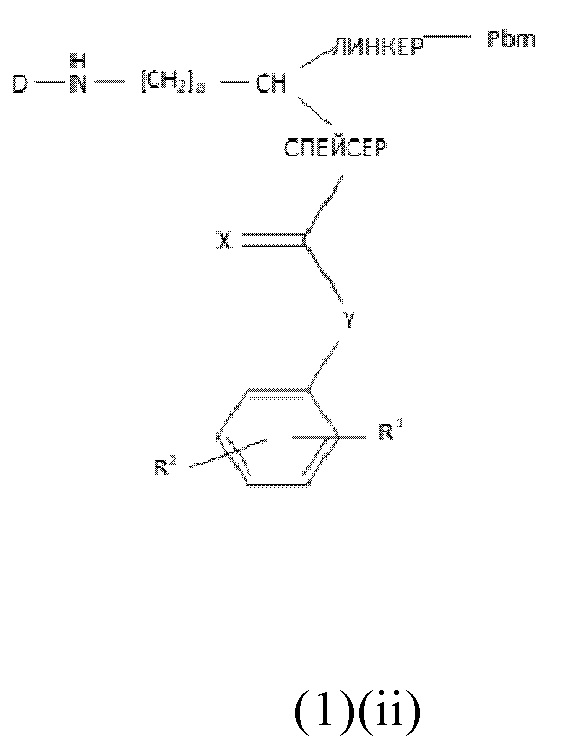
В частности, настоящее изобретение относится к соединениям общей формулы (1)(ii):
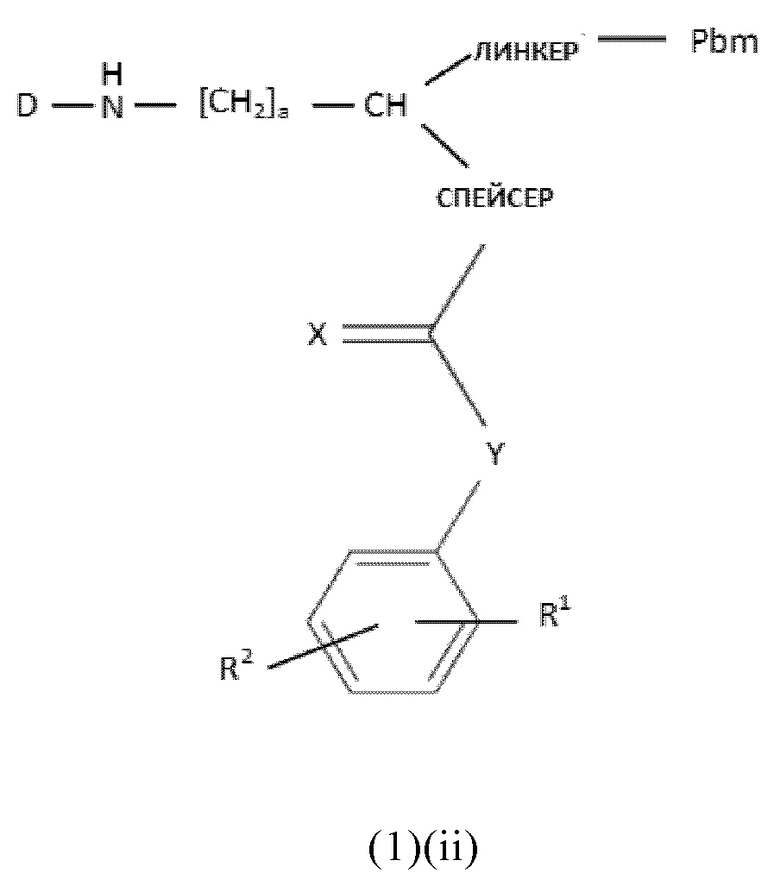
где
Pbm представляет собой ПСА-связывающую молекулу,
D представляет собой хелатирующий агент, предпочтительно выбранный из группы, включающей 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA), N,N''-бис[2-гидрокси-5-(карбоксиэтил)бензил]этилендиамин-N,N''-диуксусную кислоту (HBED-CC), 1,4,7-триазациклононан-1,4,7-триуксусную кислоту (NOTA), 2-(4,7-бис(карбоксиметил)-1,4,7-триазононан-1-ил)пентандиовую кислоту (NODAGA), 2-(4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододекан-1-ил)пентадиовую кислоту (DOTAGA), 1,4,7-триазациклононанфосфиновую кислоту (TRAP), 1,4,7-триазацидононан-1-[метил(2-карбоксиэтил)фосфиновую кислоту]-4,7-бис[метил(2-гидроксиметил)фосфиновую кислоту] (NOPO), 3,6,9,15-тетраазабицикло[9,3,1]пентадека-1(15),11,13-триен-3,6,9-триуксусную кислоту (PCTA), N'-{5-[ацетил(гидрокси)амино]пентил}-N-[5-({4-[(5-аминопентил)(гидрокси)амино]-4-оксобутаноил}амино)пентил]-N-гидроксисукцинамид (DFO) и диэтилентриаминпентауксусную кислоту (DTPA), или их производные,
X представляет собой O, N, S или P,
R1 и R2 каждый независимо представляет собой H, F, Cl, Br, I, разветвленный, неразветвленный или циклический C1-C12 углеводород, C2-C12 алкенил, C2-C12 алкинил, OR6, OCOR6, CHO, COR6, CH2OR6, NR6R7, CONR6R7, COOR6, CH2NR6R7, SR6, =O, =S или =NH, или R1 и R2 соединены между собой с образованием циклической структуры, включающей разветвленную, неразветвленную или циклическую C1-C10 углеводородную группу, где указанная углеводородная группа необязательно прерывается не более 2 гетероатомами и необязательно замещена не более 3 группами, независимо выбранными из F, Cl, Br, I, OR6, OCOR6, COOR6, CHO, COR6, CH2OR6, NR6R7, CH2NR6R7, и SR7, =O, =S и =NH,
Y выбран из группы, включающей прямую связь или линейный, разветвленный или циклический необязательно замещенный C1-C12 алкил, необязательно прерываемый не более чем двумя гетероатомами, OR6, OCOR6, CHO, COR6, CH2OR6, NR6R7, COOR6, CH2NR6R7, SR6, =O, =S или =NH, при этом одна или более не-соседняя CH2-группа независимо может быть замещена -O-, -CO-, -CO-O-, -O-CO-, -NR6-, -NR6-CO-, -CO-NR6-, -NR6-COO-, -O-CO-NR6-, -NR6-CO-NR6-, -CH=CH-, C≡C-, -O-CO-O-, SR6-, SO3R6-,
R6 и R7 каждый независимо выбран из H или разветвленного, неразветвленного или циклического C1-12 углеводорода,
спейсер включает хотя бы одну C-N связь,
линкер имеет общую формулу (6), как определено в описании, и
a, b, p, q, r, t каждый независимо представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10,
или к их фармацевтически приемлемым солям, сложным эфирам, сольватам или меченым радиоактивной меткой комплексам.
ПСА-связывающий элемент обратимо или необратимо связывается с ПСА, обычно с аффинностью связывания менее чем приблизительно 100 мкМ (микромоль).
Простат-специфический мембранный антиген человека (ПСА) (также известный как глутаматкарбоксипептидаза II (GCPII), фолатгидролаза I, фолиполи-гамма-глутаматкарбоксипептидаза (FGCP) и N-ацетилированная-альфа-связанная кислая дипептидаза I (NAALADase I)) представляет собой трансмембранную цинковую металлопептидазу II типа, которая в большом количестве экспрессируется в нервной системе, простате, почках и тонком кишечнике. Она считается опухолевым маркером при раке предстательной железы. Термин “простат-специфический мембранный антиген человека” или “ПСА”, используемый в настоящем описании, предпочтительно относится к белку, кодируемому геном человека FOLH1. Более предпочтительно, термин относится к белку, который числится в базе данных UniProt под номером. Q04609 (номер доступа 186, последняя модификация 10 мая 2017 г.), а также к его функциональным вариантам, изоформам, фрагментам или (пост-трансляционным, или иначе модифицированным) производным.
ПСА-связывающий элемент может, в целом, представлять собой связывающий элемент способный селективно (при необходимости необратимо) связываться с Простатспецифическим Мембранным Антигеном (человека) (см. Chang Rev Urol. 2004; 6(Suppl 10): S13-S18).
ПСА-связывающий элемент предпочтительно выбирается на основании способности проявлять селективную аффиность по отношению к ПСА. Предпочтительные ПСА-связывающие элементы описаны в заявках WO2013/022797A1, WO2015/055318A1 и патенте EP 2862857 A1, которые включены в настоящее описание в качестве ссылок во всей своей полноте.
Таким образом, в конъюгатах, заявленных в настоящем изобретении, ПСА-связывающий элемент, предпочтительно имеет общую формулу (5):
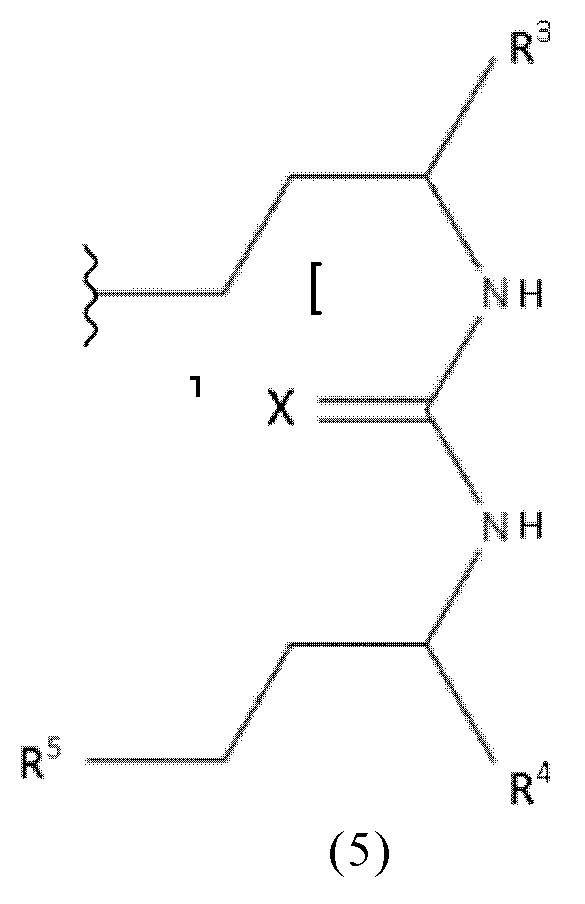
где
X представляет собой O, N, S или P,
R3, R4 и R5 каждый независимо выбран из группы, включающей -COH, -CO2H, -SO2H, -SO3H, -SO4H, -PO2H, -PO3H, -PO4H2, C(O)-(C1-C10)алкил, -C(O)-O(C1-C10)алкил, -C(O)-NHR8 или -C(O)-NR8R9, при этом R8 и R9 каждый независимо выбран из группы, включающей H, связь, (C1-C10)алкилен, F, Cl, Br, I, C(O), C(S), -C(S)-NH-бензил-, -C(O)-NH-бензил, -C(O)-(C1-C10)алкилен, -(CH2)p-NH, -(CH2)p-(C1-C10)алкилен, -(CH2)p-NH-C(O)-(CH2)q, -(CHrCH2)t-NH-C(O)-(CH2)p, -(CH2)p-CO-COH, -(CH2)p-CO-CO2H, -(CH2)p-C(O)NH-C[(CH2)q-COH]3, -C[(CH2)p-COH]3, -(CH2)p-C(O)NH-C[(CH2)q-CO2H]3, -C[(CH2)p-CO2H]3 или -(CH2)p-(C5-C14)гетероарил, и
b, p, q, r, t каждый независимо представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10.
В предпочтительных ПСА-связывающих элементах, b представляет собой целое число, выбранное из 1, 2, 3, 4 или 5, R3, R4 и R5 каждый представляет собой CO2H, а X представляет собой O.
Линкер
В заявленных конъюгатах ПСА-связывающий элемент присоединен/прикреплен к -CH- “точке разветвления” посредством подходящего линкера. Термин “линкер” используется в настоящем описании для специфического обозначения группы, которая соединяет или сцепляет и, таким образом, увеличивает расстояние между ПСА-связывающим элементом и -CH- “точкой разветвления”, и/или “отделяет” ПСА-связывающий элемент от оставшегося конъюгата.
Предпочтительно, линкер позволяет избежать пространственных помех между ПСА-связывающим элементом и остальными группами или элементами заявленного конъюгата, и обеспечивает достаточную мобильность и пластичность. Кроме того, предпочтительно, линкер может быть сконструирован таким образом, чтобы обеспечивать, поддерживать и/или разрешать достаточное ПСА-связывание, высокоаффинное ПСА-связывание, а также быстрое и желательно селективное проникновение ПСА-конъюгированного комплекса в ПСА-позитивные клетки-мишени.
ПСА-связывающие элементы, в частности, предпочтительные ПСА-связывающие элементы общей формулы (5), могут быть присоединены к заявленному конъюгату посредством подходящего линкера, как описано, например в заявке EP2862857A1. Указанный линкер может придавать заявленному конъюгату оптимальные липофильные свойства для того, чтобы увеличить ПСА-связывание и клеточный захват с последующей интернализацией. Линкер предпочтительно может содержать по крайней мере одну циклическую группу и по крайней мере одну ароматическую группу (в частности, в группе Q и W).
Таким образом, в заявленных конъюгатах предпочтительные линкеры могут иметь общую формулу (6)
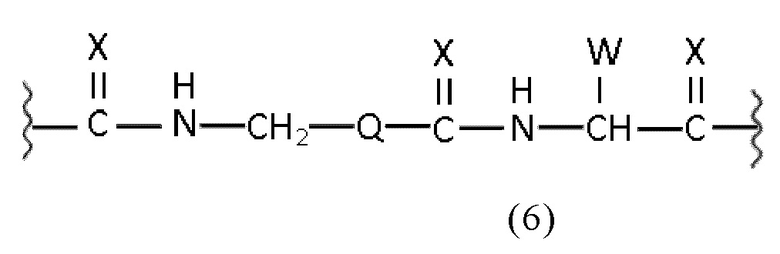
где
X каждый независимо выбран из O, N, S или P,
Q выбран из замещенного или незамещенного арила, алкиларила или циклоалкила, предпочтительно из замещенного или незамещенного C5-C14 арила, C5-C14 алкиларила или C5-C14 циклоалкила,
W выбран из -(CH2)c-арила или -(CH2)c-гетероарила, где c представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10.
Без желания быть связанными с какой-либо специфической теорией, авторы изобретения считают, что гидрофильные или полярные функциональные группы в составе линкера или в качестве боковых цепей (в частности, Q, W) могут выгодно увеличивать ПСА-связывающие свойства заявленного конъюгата.
При этом группа Q представляет собой замещенный арил, алкиларил или циклоалкил, где возможные заместители перечислены выше в разделе “Определения” и включают, без ограничений указанными, галогены (т.е. F, Cl, Br, и I); гидроксилы; алкокси, алкенокси, алкинокси, арилокси, аралкилокси, гетероциклилокси и гетероциклилалкоксигруппы, карбонилы (оксо); карбоксилы; сложные эфиры; соединения мочевины; оксимы, гидроксиламины; алкоксиамины; аралкоксиамины, тиолы, сульфиды, сульфоксиды, сульфоны, сульфонилы, амины, N-оксиды, гидразины, гидразиды, гидразоны, азиды, амиды, соединения мочевины, амидины, гуанидины, энамины, имиды, изоцианаты, изотиоцианаты, цианаты, тиоцианаты, имины, нитро группы, нитрилы (т.е. CN), галоалкилы, аминоалкилы, гидроксиалкилы, циклоалкилы.
Предпочтительно, Q выбран из замещенного или незамещенного C5-C7 циклоалкила.
Предпочтительно, W выбран из -(CH2)c-нафтила, (CH2)c-фенила, -(CH2)c-бифенила, -(CH2)c-индолила, -(CH2)c-бензотиазолила, где c представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10. Более предпочтительно, W выбран из -(CH2)-нафтила, -(CH2)-фенила, -(CH2)-бифенила, -(CH2)-индолила или -(CH2)-бенотиазолила.
Предпочтительно, каждый X представляет собой O.
Таким образом, наиболее предпочтительный линкер, соединяющий ПСА-связывающий элемент с заявленным конъюгатом, может иметь следующую структурную формулу (6а)
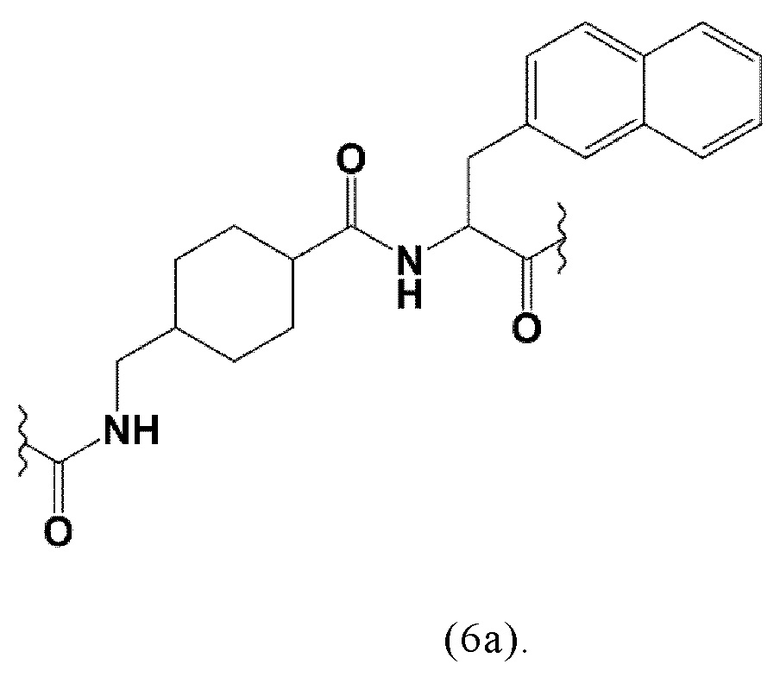
В конъюгатах, заявленных в настоящем изобретении и описанных в любой из структурных формул, представленных здесь, заместители или группы, идентифицированные как временно замещающие, могут быть (если это допустимо) определены следующим образом.
D представляет собой хелатирующий агент, предпочтительно выбранный из группы, включающей 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA), N,N''-бис[2-гидрокси-5-(карбоксиэтил)бензил]этилендиамин-N,N''-диуксусную кислоту (HBED-CC), 1,4,7-триазациклононан-1,4,7-триуксусную кислоту (NOTA), 2-(4,7-бис(карбоксиметил)-1,4,7-триазононан-1-ил)пентандиовую кислоту (NODAGA), 2-(4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододекан-1-ил)пентадиовую кислоту (DOTAGA), 1,4,7-триазациклононан фосфиновую кислоту (TRAP), 1,4,7-триазацидононан-1-[метил(2-карбоксиэтил)фосфиновую кислоту]-4,7-бис[метил(2-гидроксиметил)фосфиновую кислоту] (NOPO), 3,6,9,15-тетраазабицикло[9,3,1]пентадека-1(15),11,13-триен-3,6,9-триуксусную кислоту (PCTA), N'-{5-[ацетил(гидрокси)амино]пентил}-N-[5-({4-[(5-аминопентил)(гидрокси)амино]-4-оксобутаноил}амино)пентил]-N-гидроксисукцинамид (DFO) и диэтилентриаминпентауксусную кислоту (DTPA), или их производные, Более предпочтительно, D может быть выбран из DOTA, NODAGA или их производных.
X каждый независимо выбран из O, N, S или P. Более предпочтительно, каждый X представляет собой О.
R1 и R2 каждый независимо представляет собой H, F, Cl, Br, I, разветвленный, неразветвленный или циклический C1-C12 углеводород, C2-C12 алкенил, C2-C12 алкинил, OR6, OCOR6, CHO, COR6, CH2OR6, NR6R7, CONR6R7, COOR6, CH2NR6R7, SR6, =O, =S или =NH, или R1 и R2 соединены между собой с образованием циклической структуры, включающей разветвленную, неразветвленную или циклическую C1-C10 углеводородную группу, при этом указанная углеводородная группа необязательно прерывается не более 2 гетероатомами и необязательно замещена не более 3 группами, независимо выбранными из F, Cl, Br, I, OR6, OCOR6, COOR6, CHO, COR6, CH2OR6, NR6R7, CH2NR6R7 и SR7, =O, =S и =NH, при этом R6 и R7 каждый независимо выбран из Н или разветвленного, неразветвленного или циклического C1-С12 углеводорода. Более предпочтительно, R1 может представлять собой H и R2 выбран из галогена, предпочтительно йода или брома, и C1-С6 алкила, предпочтительно C1-С3 алкила, еще более предпочтительно метила. Еще более предпочтительно, R1 представляет собой H и R2 представляет собой H, или может находиться в пара-положении и представлять собой йод, бром или метил.
Y предпочтительно выбран из группы, включающей прямую связь и линейный, разветвленный или циклический, C1-C12 алкил, необязательно прерываемый не более чем двумя гетероатомами, необязательно замещенный по крайней мере одним галогеном, разветвленным или неразветвленным или циклическим C1-C10 углеводородом, OR6, OCOR6, CHO, COR6, CH2OR6, NR6R7, COOR6, CH2NR6R7, SR6, =O, =S или =NH, при этом одна или более не-соседняя CH2-группа независимо может быть замещена -O-, -CO-, -CO-O-, -O-CO-, -NR6-, -NR6-CO-, -CO-NR6-, -NR6-COO-, -O-CO-NR6-, -NR6-CO-NR6-, -CH=CH- , -C≡C-, -O-CO-O-, SR6-, SO3R6-, при этом R6 и R7 каждый независимо выбран из H или разветвленного, неразветвленного или циклического C1-С12 углеводорода. Более предпочтительно, Y может быть линейным или разветвленным необязательно замещенным C1-C12 углеводородом, более предпочтительно линейным или разветвленным необязательно замещенным C1-C10 углеводородом, еще более предпочтительно линейным или разветвленным необязательно замещенным C1-C6 углеводородом, наиболее предпочтительно линейным или разветвленным необязательно замещенным C1-C3 углеводородом. Более предпочтительно, Y представляет собой -(CH2)3-.
R3, R4 и R5 каждый независимо выбран из группы, включающей -COH, -CO2H, -SO2H, -SO3H, -SO4H, -PO2H, -PO3H, -PO4H2, -C(O)-(C1-C10)алкил, -C(O)-O(C1-C10)алкил, -C(O)-NHR8 или -C(O)-NR8R9 , при этом R8 и R9 каждый независимо выбран из группы, включающей H, связь, (C1-C10)алкилен, F, Cl, Br, I, C(O), C(S), -C(S)-NH-бензил-, -C(O)-NH-бензил, -C(O)-(C1-C10)алкилен, -(CH2)p-NH, -(CH2)p-(C1-C10)алкилен, -(CH2)p-NH-C(O)-(CH2)q, (CHrCH2)t-NH-C(O)-(CH2)p, -(CH2)p-CO-COH, -(CH2)p-CO-CO2H, -(CH2)p-C(O)NH-C[(CH2)q-COH]3, -C[(CH2)p-COH]3, -(CH2)p-C(O)NH-C[(CH2)q-CO2H]3, C[(CH2)p-CO2H]3 или -(CH2)p-(C5-C14)гетероарил, более предпочтительно R3, R4 и R5 представляет собой -CO2H.
Спейсер предпочтительно может содержать одну C-N связь. Более предпочтительно, спейсер может иметь формулы (3а), (3b) или 3(с), как раскрыто здесь.
Линкер, предпочтительно имеет общую формулу (6), как раскрыто здесь. Более предпочтительно, линкер может иметь формулу (6а), как раскрыто здесь.
Q предпочтительно выбран из замещенного или незамещенного арила, алкиларила или циклоалкила, предпочтительно из замещенного или незамещенного C5-C14 арила, C5-C14 алкиларила или C5-C14 циклоалкила.
W предпочтительно выбран из -(CH2)c-арила или -(CH2)c-гетероарила, где c предпочтительно представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10.
А предпочтительно представляет собой аминокислотный остаток. Более предпочтительно, А выбран из (D-)Аспартата, (D-)Глутамата или (L-Лизина).
V предпочтительно выбран из прямой связи, N или необязательно замещенного C1-C12 углеводорода, содержащего не более трех гетероатомов, где указанный гетероатом предпочтительно представляет собой N.
n предпочтительно представляет собой целое число, выбранное из 1, 2, 3, 4 или 5, предпочтительно 1, 2 или 3.
m предпочтительно представляет собой 0 или 1.
a, b, p, q, r, t предпочтительно каждый независимо представляет собой 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10.
В соответствии с вышеизложенным, предпочтительные конъюгаты согласно настоящему изобретению имеют общую формулу (1а):

где
D представляет собой хелатирующий агент, предпочтительно выбранный из группы, включающей 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA), N,N''-бис[2-гидрокси-5-(карбоксиэтил)бензил]этилендиамин-N,N''-диуксусную кислоту (HBED-CC), 1,4,7-триазациклононан-1,4,7-триуксусную кислоту (NOTA), 2-(4,7-бис(карбоксиметил)-1,4,7-триазононан-1-ил)пентандиовую кислоту (NODAGA), 2-(4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододекан-1-ил)пентадиовую кислоту (DOTAGA), 1,4,7-триазациклононан фосфиновую кислоту (TRAP), 1,4,7-триазацидононан-1-[метил(2-карбоксиэтил)фосфиновую кислоту]-4,7-бис[метил(2-гидроксиметил)фосфиновую кислоту] (NOPO), 3,6,9,15-тетраазабицикло[9,3,1]пентадека-1(15),11,13-триен-3,6,9-триуксусную кислоту (PCTA), N'-{5-[ацетил(гидрокси)амино]пентил}-N-[5-({4-[(5-аминопентил)(гидрокси)амино]-4-оксобутаноил}амино)пентил]-N-гидроксисукцинамид (DFO) и диэтилентриаминпентауксусную кислоту (DTPA), или их производные,
X каждый независимо выбран из O, N, S или P,
R1 и R2 каждый независимо представляет собой H, F, Cl, Br, I, разветвленный, неразветвленный или циклический C1-C12 углеводород, C2-C12 алкенил, C2-C12 алкинил, OR6, OCOR6, CHO, COR6, CH2OR6, NR6R7, CONR6R7, COOR6, CH2NR6R7, SR6, =O, =S или =NH, или R1 и R2 соединены между собой с образованием циклической структуры, включающей разветвленную, неразветвленную или циклическую C1-C10 углеводородную группу, при этом указанная углеводородная группа необязательно прерывается не более 2 гетероатомами и необязательно замещена не более 3 группами, независимо выбранными из F, Cl, Br, I, OR6, OCOR6, COOR6, CHO, COR6, CH2OR6, NR6R7, CH2NR6R7 и SR7, =O, =S и =NH,
Y предпочтительно выбран из группы, включающей прямую связь или линейный, разветвленный или циклический, C1-C12 алкил, необязательно прерываемый не более чем двумя гетероатомами, OR6, OCOR6, CHO, COR6, CH2OR6, NR6R7, COOR6, CH2NR6R7, SR6, =O, =S или =NH, при этом одна или более не-соседняя CH2-группа независимо может быть замещена -O-, -CO-, -CO-O-, -O-CO-, -NR6-, -NR6-CO-, -CO-NR6-, -NR6-COO-, -O-CO-NR6-, -NR6-CO-NR6-, -CH=CH- , -C≡C-, -O-CO-O-, SR6-, SO3R6,
R6 и R7 каждый независимо выбран из H или разветвленного или неразветвленного или циклического C1-С12 углеводорода,
R3, R4 и R5 каждый независимо выбран из группы, включающей -COH, -CO2H, -SO2H, -SO3H, -SO4H, -PO2H, -PO3H, -PO4H2, -C(O)-(C1-C10)алкил, -C(O)-O(C1-C10)алкил, -C(O)-NHR8 или -C(O)-NR8R9, при этом R8 и R9 каждый независимо выбран из группы, включающей H, связь, (C1-C10)алкилен, F, Cl, Br, I, C(O), C(S), -C(S)-NH-бензил-, -C(O)-NH-бензил, C(O)-(C1-C10)алкилен, -(CH2)p-NH, -(CH2)p-(C1-C10)алкилен, -(CH2)p-NH-C(O)-(CH2)q, -(CHrCH2)t-NH-C(O)-(CH2)p, -(CH2)p-CO-COH, -(CH2)p-CO-CO2H, -(CH2)p-C(O)NH-C[(CH2)q-COH]3, -C[(CH2)p-COH]3, -(CH2)p-C(O)NH-C[(CH2)q-CO2H]3, -C[(CH2)p-CO2H]3 или -(CH2)p-(C5-C14)гетероарил,
спейсер содержит по крайней мере одну C-N связь,
линкер имеет общую формулу (6), как определено выше, и
a, b, p, q, r, t каждый независимо представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10,
или их фармацевтически приемлемые соли, сложные эфиры, сольваты или меченые радиоактивной меткой комплексы.
Более предпочтительно, конъюгат согласно настоящему изобретению может иметь общую формулу (12.4) или (13.4):

где
D представляет собой хелатирующий агент, предпочтительно выбранный из группы, включающей 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA), N,N''-бис[2-гидрокси-5-(карбоксиэтил)бензил]этилендиамин-N,N''-диуксусную кислоту (HBED-CC), 1,4,7-триазациклононан-1,4,7-триуксусную кислоту (NOTA), 2-(4,7-бис(карбоксиметил)-1,4,7-триазононан-1-ил)пентандиовую кислоту (NODAGA), 2-(4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододекан-1-ил)пентадиовую кислоту (DOTAGA), 1,4,7-триазациклононан фосфиновую кислоту (TRAP), 1,4,7-триазацидононан-1-[метил(2-карбоксиэтил)фосфиновую кислоту]-4,7-бис[метил(2-гидроксиметил)фосфиновую кислоту] (NOPO), 3,6,9,15-тетраазабицикло[9,3,1]пентадека-1(15),11,13-триен-3,6,9-триуксусную кислоту (PCTA), N'-{5-[ацетил(гидрокси)амино]пентил}-N-[5-({4-[(5-аминопентил)-(гидрокси)амино]-4-оксобутаноил}амино)пентил]-N-гидроксисукцинамид (DFO) и диэтилентриаминпентауксусную кислоту (DTPA), или их производные,
R1 и R2 каждый предпочтительно независимо выбран из Н, галогена, предпочтительно йода или брома, или C1-С6 алкила, предпочтительно C1-С3 алкила, еще более предпочтительно метила;
линкер имеет общую формулу (6), как определено выше, более предпочтительно, линкер имеет общую формулу (6a), как определено выше,
a, b, d, m, n каждый независимо представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, более предпочтительно a и b каждый независимо представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5 или 6;
b, d и m каждый независимо представляет собой целое число, выбранное из 1, 2, 3, 4, 5 или 6.
Более предпочтительно, заявленные конъюгаты имеют общую формулу (1b)
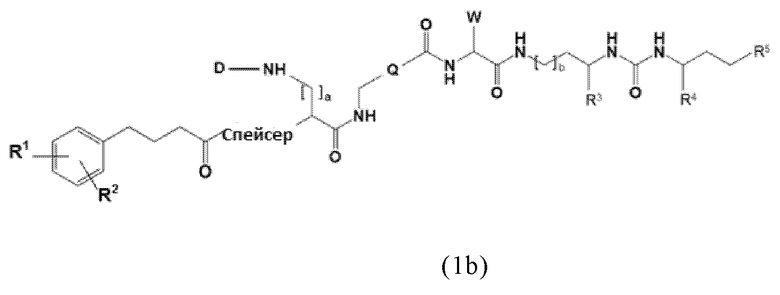
где
D представляет собой хелатирующий агент, предпочтительно выбранный из группы, включающей 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA), N,N''-бис[2-гидрокси-5-(карбоксиэтил)бензил]этилендиамин-N,N''-диуксусную кислоту (HBED-CC), 1,4,7-триазациклононан-1,4,7-триуксусную кислоту (NOTA), 2-(4,7-бис(карбоксиметил)-1,4,7-триазононан-1-ил)пентандиовую кислоту (NODAGA), 2-(4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододекан-1-ил)пентадиовую кислоту (DOTAGA), 1,4,7-триазациклононан фосфиновую кислоту (TRAP), 1,4,7-триазацидононан-1-[метил(2-карбоксиэтил)фосфиновую кислоту]-4,7-бис[метил(2-гидроксиметил)фосфиновую кислоту] (NOPO), 3,6,9,15-тетраазабицикло[9,3,1]пентадека-1(15),11,13-триен-3,6,9-триуксусную кислоту (PCTA), N'-{5-[ацетил(гидрокси)амино]пентил}-N-[5-({4-[(5-аминопентил)-(гидрокси)амино]-4-оксобутаноил}амино)пентил]-N-гидроксисукцинамид (DFO) и диэтилентриаминпентауксусную кислоту (DTPA), или их производные,
Q выбран из замещенного или незамещенного арила, алкиларила или циклоалкила,
W представляет собой -(CH2)d-арил или -(CH2)d- гетероарил,
R1 и R2 каждый независимо выбран из группы, включающей H, F, Cl, Br, I, разветвленный, линейный или циклический C1-C12 углеводород, необязательно включающий 2 гетероатома и необязательно замещенный не более чем 3 группами, независимо выбранными из F, Cl, Br, I, разветвленных, неразветвленных или циклических C1-C12 углеводородов, OR7, OCOR7, COOR7, CHO, COR7, CH2OR7, NR7R8, CH2NR7R8 и SR8, =O, =S и =NH, где R7 и R8 каждый независимо представляет собой H или разветвленный, неразветвленный или циклический C1-С12 углеводород; предпочтительно R1 и R2 каждый независимо представляет собой H, Br, I и линейный C1-C12 алкил;
R3, R4 и R5 каждый независимо представляет собой -COH, CO2H, -SO2H, -SO3H, -SO4H, -PO2H, -PO3H, -PO4H2, -C(O)-(C1-C10)алкил, C(O)-O(C1-C10)алкил, -C(O)-NHR8 или -C(O)-NR8R9, где R8 и R9 каждый независимо выбран из группы, включающей H, связь, (C1-C10)алкилен, F, Cl, Br, I, C(O), C(S), -C(S)-NH-бензил-, -C(O)-NH-бензил, -C(O)-(C1-C10)алкилен, -(CH2)p-NH, -(CH2)p-(C1-C10)алкилен, -(CH2)p-NH-C(O)-(CH2)q, -(CHrCH2)t-NH-C(O)-(CH2)p, -(CH2)p-CO-COH, -(CH2)p-CO-CO2H, (CH2)p-C(O)NH-C[(CH2)q-COH]3, -C[(CH2)p-COH]3, -(CH2)p-C(O)NH-C[(CH2)q-CO2H]3, -C[(CH2)p-CO2H]3 или -(CH2)p-(C5-C14)гетероарил,
a, b, d, p, q, r, s и t каждый независимо представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, и
спейсер содержит по крайней мере одну C-N связь,
или их фармацевтически приемлемые соли, сложные эфиры, сольваты или меченые радиоактивной меткой комплексы.
В предпочтительных конъюгатах общей формулы (1b) к значениям “D”, “Q”, “W”, “a”, “b”, “R1”, “R2”, R3”, “R4” и/или “R5” применимо любое из представленных ниже определений, предпочтительно по крайней мере два, более предпочтительно по крайней мере три, еще более предпочтительно по крайней мере четыре, или наиболее предпочтительно, все представленные ниже определения.
D может представлять собой любой подходящий хелатирующий агент (например, как раскрыто здесь), более предпочтительно D представляет собой DOTA, DOTA, HBED-CC, NOTA, NODAGA, DOTAGA, TRAP, NOPO, PCTA, DFO, DTPA или их производные. Более предпочтительно, D представляет собой DOTA, NODAGA, DO3AP, DO3APPrA или DO3APABn.
Q может быть выбран из замещенного или незамещенного C5-C7 циклоалкила. W может быть выбран из -(CH2)-нафтила, -(CH2)-фенила, -(CH2)-бифенила, -(CH2)-индолила или -(CH2)-бензотиазолила, более предпочтительно W представляет собой -(CH2)-нафтил.
a, b каждый независимо представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5 или 6.
R1 и R2 каждый независимо выбран из H, йода и C1-C3 алкила, и R3, R4 и R5 каждый представляет собой CO2H.
Такие предпочтительные конъюгаты могут иметь общую формулу (1с):
[ ]a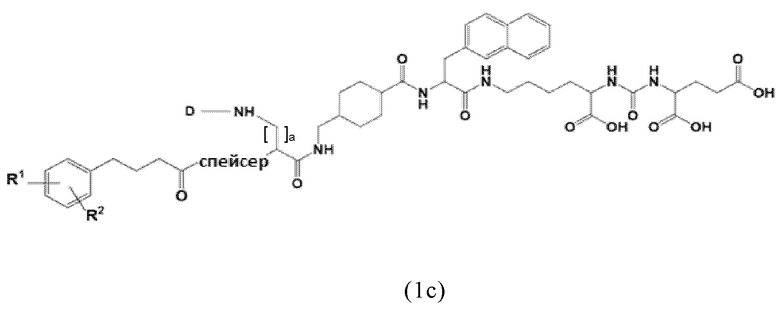
где
любое одно, по крайней мере два, более предпочтительно по крайней мере три, наиболее предпочтительно все из определений приведенных ниже, могут быть применимы для “D”,“a”, “R1” и/или “R2”:
D может быть выбран из DOTA, DOTA, HBED-CC, NOTA, NODAGA, DOTAGA, TRAP, NOPO, PCTA, DFO, DTPA или их производных, более предпочтительно D может быть выбран из DOTA, NODAGA, DO3AP, DO3APPrA или DO3APABn,
a может представлять собой целое число, выбранное из 0, 1, 2, 3, 4, 5 или 6,
R1 и R2 каждый независимо представляет собой H, йод или C1-C3 алкил, и
спейсер содержит по крайней мере одну C-N связь,
или их фармацевтически приемлемые соли, сложные эфиры, сольваты или меченые радиоактивной меткой комплексы.
В предпочтительных конъюгатах общей формулы (1с),
a может быть равен 0, и
спейсер может представлять собой -[CHR10]u-NR11-, где R10 и R11 каждый независимо может быть выбран из Н и разветвленного, неразветвленного или циклического C1-C12 углеводорода, где u может представлять собой целое число, выбранное из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10. В предпочтительных конъюгатах общей формулы (1а), спейсер имеет формулу (3а). Соответственно, указанные предпочтительные конъюгаты имеют общую формулу (7а):
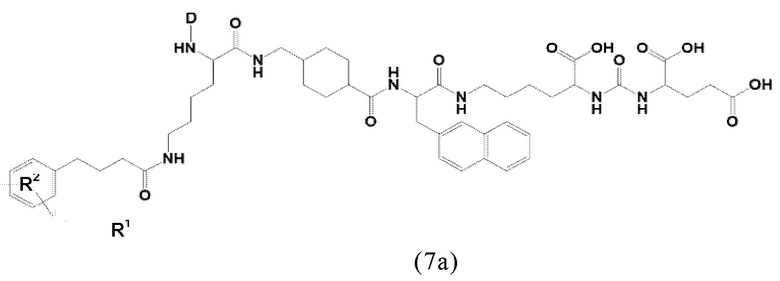
где
D может быть выбран из DOTA, DOTA, HBED-CC, NOTA, NODAGA, DOTAGA, TRAP, NOPO, PCTA, DFO, DTPA или их производных, более предпочтительно D может быть выбран из DOTA, NODAGA, DO3AP, DO3APPrA или DO3APABn,
R1 и R2 каждый независимо может быть выбран из H, йода или C1-C3 алкила,
или их фармацевтически приемлемые соли, сложные эфиры, сольваты и меченые радиоактивной меткой комплексы.
В частности, предпочтительные конъюгаты согласно настоящему изобретению могут иметь формулу (7а)(i), (7a)(ii) или (7a)(iii):
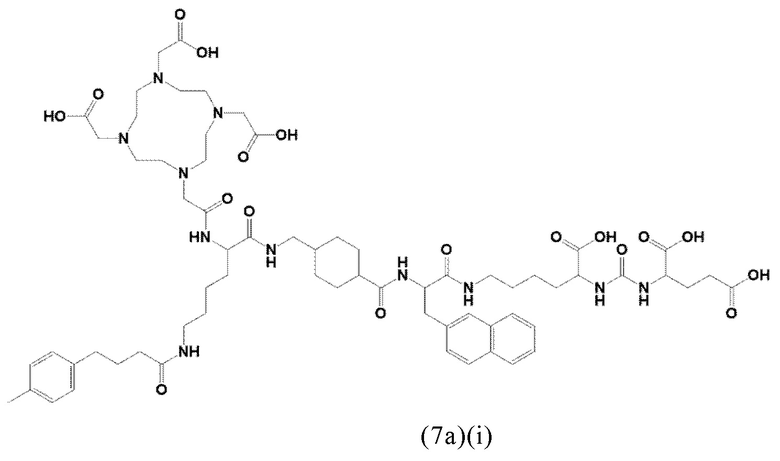
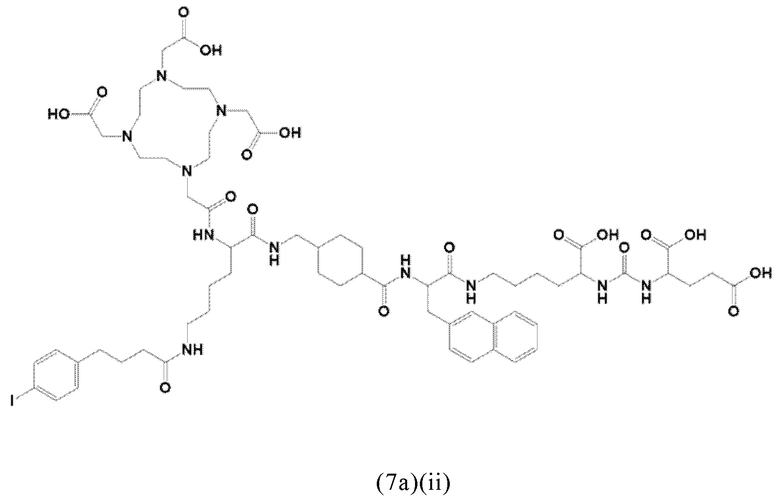

или их фармацевтически приемлемые соли, сложные эфиры, сольваты и меченые радиоактивной меткой комплексы.
Конъюгаты формулы (7а)(i) также обозначаются здесь как “ПСА-06” или “ПСА-АЛБ-06”.
Конъюгаты формулы (7а)(ii) также обозначаются здесь как “ПСА-03” или “ПСА-АЛБ-03”. Конъюгаты формулы (7а)(iii) также обозначаются здесь как “ПСА-89” или “ПСА-АЛБ-89”.
Альтернативно, в предпочтительных конъюгатах общей формулы (1с) спейсер содержит по крайней мере один аминокислотный остаток, выбранный из (D-/L-) аспартата, глутамата или лизина. Предпочтительно, спейсер может содержать по крайней мере 1, 2, 3, 4 или не более 5 аминокислотных остатков, предпочтительно независимо выбранных из (D-/L-) аминокислотных остатков аспартата, глутамата или лизина.
Такие конъюгаты могут предпочтительно содержать спейсер общей формулы (3b) или (3с). Таким образом, указанные предпочтительные конъюгаты могут иметь общую формулу (7b):

где
D может быть выбран из DOTA, DOTA, HBED-CC, NOTA, NODAGA, DOTAGA, TRAP, NOPO, PCTA, DFO, DTPA или их производных, более предпочтительно D может быть выбран из DOTA, NODAGA, DO3AP, DO3APPrA или DO3APABn,
R1 и R2 каждый независимо выбран из H, йода или C1-C3 алкила,
А представляет собой аминокислотный остаток, предпочтительно выбранный из (D-)Аспартата, (D)-Глутамата или (L-Лизина),
V выбран из прямой связи, N или необязательно замещенного C1-C12 углеводорода, содержащего не более 3 гетероатомов, где указанный гетероатом предпочтительно представляет собой N,
n представляет собой целое число, выбранное из 1, 2, 3, 4 или 5, предпочтительно 1, 2 или 3,
и a представляет собой целое число, выбранное из 1, 2, 3, 4, 5 или 6,
или их фармацевтически приемлемые соли, сложные эфиры, сольваты и меченые радиоактивной меткой комплексы.
В частности, указанные конъюгаты могут иметь формулу (7b)(i), (7b)(ii) или (7b)(iii):
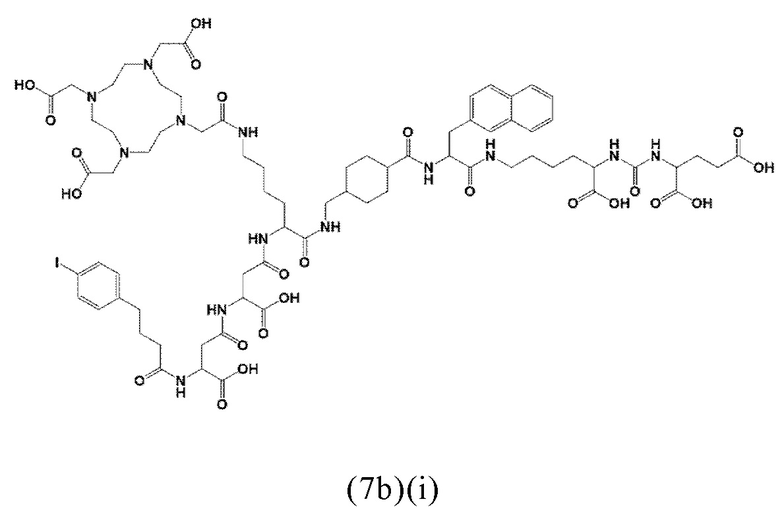
или их фармацевтически приемлемые соли, сложные эфиры, сольваты и меченые радиоактивной меткой комплексы.
Конъюгаты формулы (7b)(ii) также обозначаются здесь как “ПСА-05” или “ПСА-АЛБ-05”.
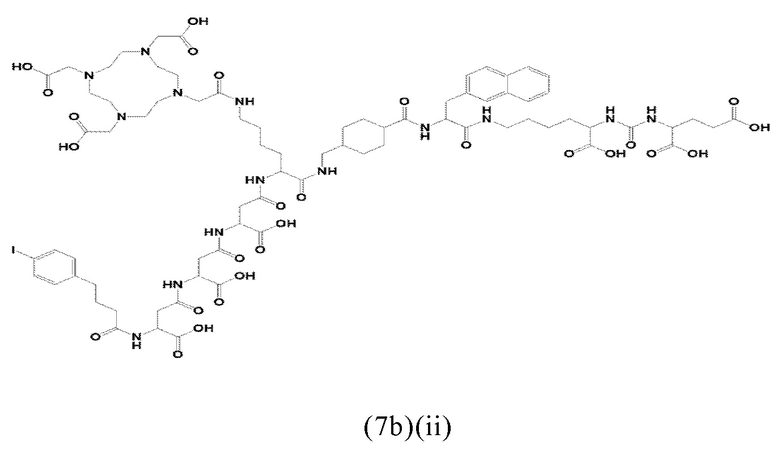
или их фармацевтически приемлемые соли, сложные эфиры, сольваты и меченые радиоактивной меткой комплексы.
Конъюгаты формулы (7b)(ii) также обозначаются в описании как “ПСА-07” или “ПСА-АЛБ-07”.
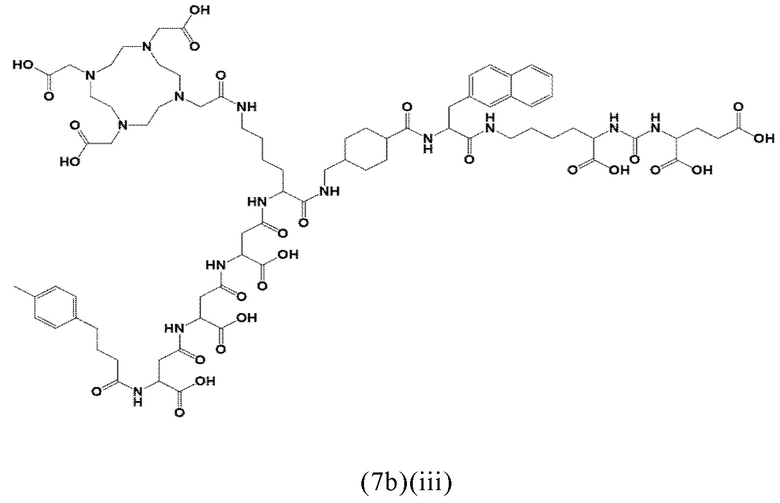
или их фармацевтически приемлемые соли, сложные эфиры, сольваты и меченые радиоактивной меткой комплексы.
Конъюгаты формулы (7b)(iii) также обозначаются здесь как “ПСА-08” или “ПСА-АЛБ-08”.
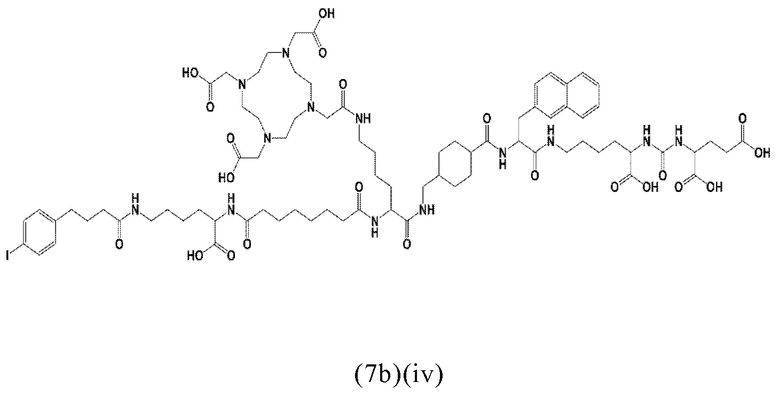
или их фармацевтически приемлемые соли, сложные эфиры, сольваты и меченые радиоактивной меткой комплексы.
Конъюгаты формулы (7b)(iv) также обозначаются здесь как “ПСА-04” или “ПСА-АЛБ-04”.
Настоящее изобретение также относится к конъюгатам структурной формулы (14), (15) и (16):
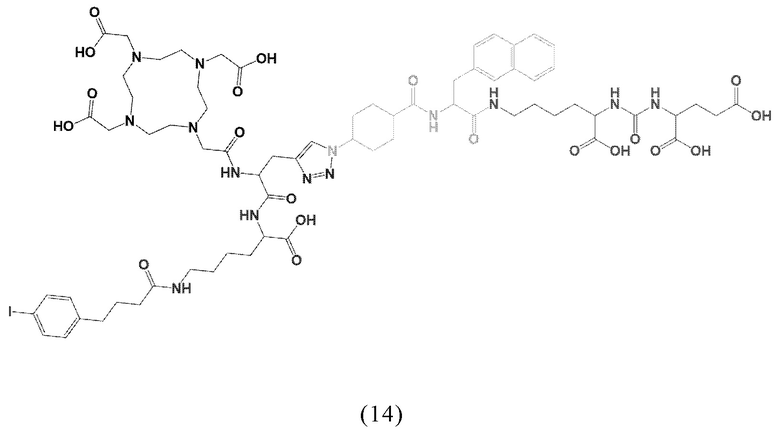
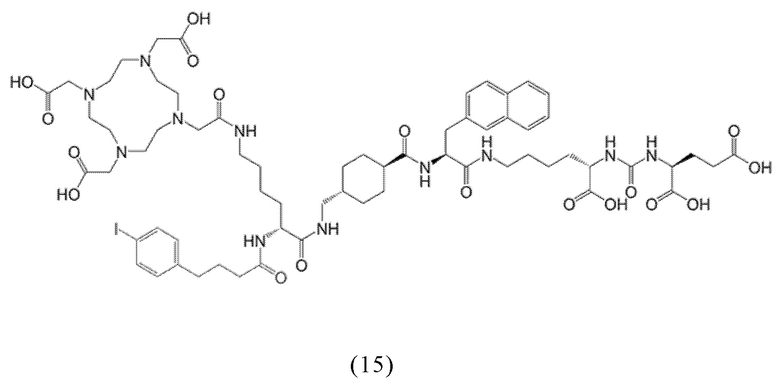
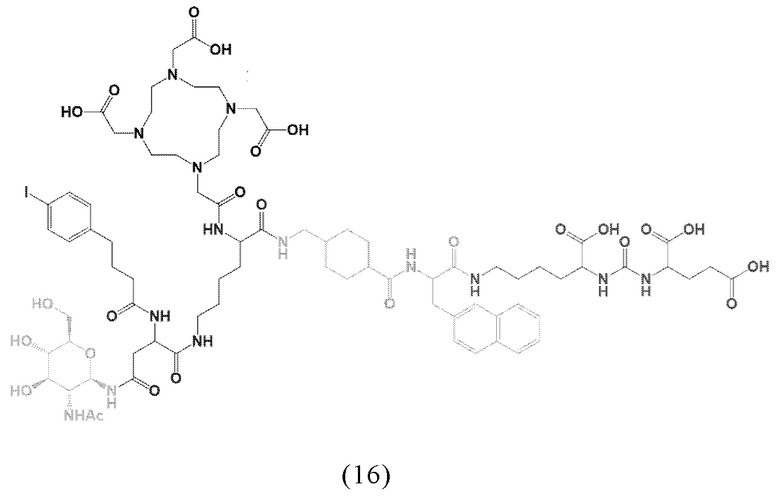
Фармацевтически приемлемые соли
Настоящее изобретение также относится к фармацевтически приемлемым солям заявленных конъюгатов.
Процесс получения фармацевтической композиции хорошо известен специалистам в данной области. Фармацевтически приемлемые соли заявленных конъюгатов могут быть получены при помощи стандартных методик, например, путем взаимодействия любого свободного основания и/или кислоты заявленного конъюгата и стехиометрического количества желаемого солеобразующего вещества, кислоты или основания соответственно.
К фармацевтически доступным солям в соответствии с настоящим изобретением относятся соли неорганических катионов, таких как натрий, калий, кальций, магний, цинк и аммоний, а также соли с органическими основаниями. К подходящим органическим основаниям относятся N-метил-D-глюкамин, аргинин, бензатин, диоламин, оламин, прокам и трометамин. Фармацевтически приемлемые соли в соответствии с настоящим изобретением также подразумевают соли, полученные из органических или неорганических кислот. К подходящим анионам относятся ацетат, адипиат, безилат, бромид, камсилат, хлорид, цитрат, эдисилат, эстолат, фумарат, глуцептат, глюконат, глюкоронат, гиппурат, гиклат, гидробромид, гидрохлорид, йод, изетионат, лактат, лактобионат, малеат, месилат, метилбромид, метилсульфат, напсилат, нитрат, олеат, памоат, фосфат, полигалактуронат, стеарат, сукцинат, сульфат, сульфосалицилат, таннат, тартрат, терефталат, тозилат и триэтиодид.
Комплексные / Некомплексные формы
Настоящее изобретение также относится к конъюгатам, описанным здесь, где хелатирующий агент D может образовывать комплекс с ионом металла (например, радиоактивного металла), а может оставаться свободным.
Термин “радионуклид” (или “радиоизотоп”) относится к изотопам природных или искусственных элементов с нестабильным нейтронно-протонным соотношением, поэтому изотоп распадается с эмиттированием корпускулярных частиц (т.е. протонов (альфа-излучение) или электронов (бета-излучение) или электромагнитного поля (гамма-излучение). Другими словами, радионуклиды подвергаются радиоактивному распаду. Хелатирующий агент D может образовывать комплекс с любым известным радионуклидом. Такой радиоизотоп предпочтительно может быть полезным для визуализации или лечения рака. К таким радионуклидам, без ограничений указанными, относятся 94Tc, 99mTc, 90In, 111In, 67Ga, 68Ga, 86Y, 90Y, 177Lu, 151Tb, 186Re, 188Re, 64Cu, 67Cu, 55Co, 57Co, 43Sc, 44Sc, 47Sc, 225Ac, 213Bi, 212Bi, 212Pb, 227Th, 153Sm, 166Ho, 152Gd, 153Gd, 157Gd или 166Dy. Выбор подходящего радиоактивного вещества может зависеть, среди прочих, от таких факторов как химическая структура и хелатирующая способность хелатирующего агента D, а также от того, какая область применения планируется у конечного (комплексного) конъюгата (т.е. диагностическая или терапевтическая). В частности, бета-эмиттеры, такие как 90Y, 131I, 161Tb и 177Lu могут использоваться для сопутствующей системной радиотерапии. Использование DOTA в качестве хелатирующего агента позволяет эффективно использовать такие радиоизотопы как 68Ga, 43,44,47Sc, 177Lu, 161Tb, 225Ac, 213Bi, 212Bi, 212Pb.
Согласно некоторым предпочтительным вариантам осуществления настоящего изобретения, радионуклид представляет собой 177Lu. Согласно некоторым предпочтительным вариантам осуществления настоящего изобретения, радионуклид представляет собой 44Sc. Согласно некоторым вариантам осуществления настоящего изобретения, радионуклид представляет собой 64Cu. Согласно некоторым предпочтительным вариантам осуществления настоящего изобретения, радионуклид представляет собой 68Ga.
Выбор подходящего сочетания конъюгатов и радионуклидов находится в рамках знаний и компетенции специалиста в указанной области. В частности, согласно некоторым предпочтительным вариантам осуществления настоящего изобретения, хелатирующим агентом может быть DOTA, а радионуклидом 177Lu. Согласно другим предпочтительным вариантам осуществления настоящего изобретения, хелатирующим агентом может быть DOTA, а радионуклидом 68Ga. Согласно другим предпочтительным вариантам осуществления настоящего изобретения, хелатирующим агентом может быть DOTA, а радионуклидом 44Sc. Согласно еще одному предпочтительному варианту осуществления настоящего изобретения, хелатирующим агентом может быть DOTA, а радионуклидом 64Cu. Согласно другому предпочтительному варианту осуществления настоящего изобретения, хелатирующим агентом может быть NODAGA, а радионуклидом 64Cu.
Сложные эфиры и Пролекарства
Настоящее изобретение также включает заявленные конъюгаты в их этерифицированной форме, в частности, когда этерификации подвергаются свободные карбоксильные группы. Такие этерифицированные соединения могут представлять собой пролекарства заявленных конъюгатов. Подходящими пролекарствами в форме сложных эфиров являются различные алкильные сложные эфиры, включая насыщенные и ненасыщенные C8-C18 жирные кислоты.
Энантиомеры
Заявленные конъюгаты могут существовать в определенных геометрических или стереоизометрических формах. Кроме того, соединения также могут быть оптически активными. Заявленные конъюгаты могут также включать цис- и транс-изомеры, R- и S- энантиомеры, диастереомеры, (D)-изомеры, (L)-изомеры, рацемические смеси таких соединений и другие их смеси. Дополнительные асимметричные атомы углерода могут присутствовать в составе заместителя, такого как алкильная группа. Если, например, требуется определенный энантиомер группы или конъюгата, то он может быть получен при помощи асимметричного синтеза или путем реакции с хиральным вспомогательным элементом, при этом полученная диастереометрическая смесь разделяется, и вспомогательная группа удаляется для получения чистого желательного энантиомера. Альтернативно, если группа или конъюгат содержат основную функциональную группу, такую как аминогруппа, или кислую функциональную группу, такую как карбоксил, то диастереомерные соли получают при помощи подходящего оптически активного основания или кислоты, с последующим разделением диастереомеров посредством фракционной кристаллизации или хроматографии и восстановлением чистых энантиомеров, что хорошо известно специалистам в данной области.
“Стереоизомер” - это один стереоизомер соединения, практически полностью свободный от других стереоизомеров этого соединения. Следовательно, стереоизометрически чистое соединение, имеющее один хиральный центр, будет полностью свободно от противоположного энантиомера этого соединения. Стереоизометрически чистое соединение с двумя хиральными центрами будет практически полностью свободно от других диастереомеров соединения. Типичное стереоизометрически чистое соединение содержит приблизительно более чем 80% по весу одного стереоизомера и приблизительно менее 20% по весу других стереоизомеров, например, более чем 90% по весу одного стереоизомера и приблизительно менее 10% по весу других стереоизомеров, или более чем 95% по весу одного стереоизомера и приблизительно менее 5% по весу других стереоизомеров, или более чем 97% по весу одного стереоизомера и приблизительно менее 3% по весу других стереоизомеров соединения.
Таким образом, все формулы, представленные здесь, включают их энантиомеры и/или стереоизомеры.
Комплексы, меченые радиоактивной меткой
Согласно дополнительному аспекту, настоящее изобретение также относится к применению заявленных конъюгатов для получения меченых радиоактивной меткой комплексов. Такие комплексы предпочтительно включают конъюгат согласно настоящему изобретению и радионуклид. Хелатирующий агент D, предпочтительно, координирует радионуклид с формированием радиоактивного комплекса. Подходящие радионуклиды могут быть выбраны из терагностических изотопов металлов и включают, без ограничений указанными, 94Tc, 99mTc, 90In, 111In, 67Ga, 68Ga, 86Y, 90Y, 177Lu, 151Tb, 186Re, 188Re, 64Cu, 67Cu, 55Co, 57Co, 43Sc, 44Sc, 47Sc, 225Ac, 213Bi, 212Bi, 212Pb, 227Th, 153Sm, 166Ho, 152Gd, 153Gd, 157Gd или 166Dy.
Согласно дополнительному аспекту, настоящее изобретение также относится к комплексам, включающим радионуклид (предпочтительно, выбранный из группы представленных выше) и конъюгат согласно настоящему изобретению.
Фармацевтическая композиция
Согласно дополнительному аспекту, настоящее изобретение также относится к фармацевтической композиции, включающей заявленный конъюгат (включая фармацевтически приемлемые соли, сложные эфиры, сольваты и радиомеченые комплексы, как здесь описано), а также фармацевтически приемлемый носитель и/или эксципиент.
Термин “фармацевтически приемлемый” относится к веществу или агенту, которое совместимо с заявленным конъюгатом и не мешает реализации его диагностической и терапевтической активности и не подавляет ее. Фармацевтически приемлемые носители предпочтительно имеют достаточно высокую степень очистки и достаточно низкую токсичность, что делает их пригодными для введения пациенту.
Лекарственные формы, носители и эксципиенты
Фармацевтически приемлемые эксципиенты могут выполнять разные функции и включают, без ограничений указанными, растворители, филлеры, объемообразующие средства, носители, дезинтегранты, связывающие агенты, смазывающие агенты, глиданты, покрывающие агенты, растворители и со-растворители, буферные агенты, консерванты, адъюванты, антиоксиданты, смачивающие агенты, пеногасители, загустители, подсластители, вкусовые агенты и увлажняющие агенты.
Подходящие фармацевтически приемлемые экципиенты обычно выбирают на основании лекарственной формы (фармацевтической) композиции.
Для (фармацевтических) композиций в жидкой форме подходящими фармацевтически доступными экципиентами являются растворители, разбавители и носители, такие как (не содержащие пирогенных примесей) вода (изотонические) солевые растворы, например, фосфатный или цитратный буферный раствор, жирные масла, овощные масла, такие как, например, арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло; этанол, полиолы (например, глицерол, пропиленгликоль, полиэтиленгликоль и подобные); лецитин; поверхностно-активные вещества; консерванты, такие как бензиловый спирт, парабены, хлорбутанол, фенол, аскорбиновая кислота, тимеросал и подобные; изотонические агенты, такие как сахара, полиспирты, такие как маннитол, сорбитол или хлорид натрия; моностеарат алюминия или желатин; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота (ЭДТА); буферы, такие как ацетаты, цитраты или фосфаты, и агенты для регулирования тоничности, такие как хлорид натрия или декстроза. Величина pH может регулироваться кислотами или основаниями, такими как соляная кислота или гидроксид натрия. Буферы могут быть гипертоническими, изотоническими или гипотоническими с учетом специфической референсной среды, т.е. буфер содержит большее, равное или меньшее количество соли по отношению к основной среде, при этом предпочтительно используются такие концентрации упомянутых выше солей, которые не приводят к повреждению клеток в результате осмоса или других концентрационных эффектов. Референсная среда представляет собой жидкость, существующую in vivo, такую как кровь, лимфа, цитозольные жидкости или другие жидкости тела, или например, жидкости, которые могут использоваться в качестве референсной среды in vitro, такие как известные буферы или жидкости. Такие общепринятые буферы или жидкости хорошо известны специалистам в данной области.
Жидкие (фармацевтические) композиции, которые вводятся посредством инъекции и, в особенности, посредством внутривенной инъекции, должны предпочтительно быть стерильными и стабильными во время производства и хранения. Такие композиции обычно готовят по рецептуре растворов для парентерального введения, которые не содержат пирогенных примесей, имеют подходящую величину рН, являются изотоническими и поддерживают стабильность основных ингредиентов(а).
Для жидких фармацевтических композиций подходящими фармацевтически доступными эксципиентами и носителями являются вода, обычно не содержащая пирогенных примесей вода; изотонический солевой раствор или буферные (водные) растворы, например, фосфат, цитрат и другие буферные растворы. В частности, для инъекционных лекарственных форм заявленных (фармацевтических) композиций может использоваться вода или предпочтительно буфер, а еще более предпочтительно водный буфер, который может содержать натриевую соль, например, по крайней мере 50 мМ натриевой соли; кальциевую соль, например, по крайней мере 0,01 мМ кальциевой соли; и необязательно калиевую соль, например, по крайней мере 3 мМ калиевой соли.
Соли натрия, кальция и необязательно калия, могут находиться в форме галогенидов, например хлоридов, йодидов или бромидов; в форме гидроксидов, карбонатов, гидрокарбонатов или сульфатов и т.д. Без ограничений указанными, примерами натриевых солей являются NaCl, NaI, NaBr, Na2CO3, NaHCO3, Na2SO4, примерами возможных калиевых солей являются, например KCl, KI, KBr, K2CO3, KHCO3, K2SO4, а примерами кальциевых солей являются например CaCl2, CaI2, CaBr2, CaCO3, CaSO4, Ca(OH)2. Кроме того, органические анионы упомянутых выше катионов могут содержаться в буфере.
Буферы, подходящие для инъекционных лекарственных форм перечисленных выше, могут содержать соли, такие как хлорид натрия (NaCl), хлорид кальция (CaCl2) и необязательно хлорид калия (KCl), при этом помимо хлоридов могут присутствовать дополнительные анионы. CaCl2 также может быть замещен другой солью, такой как KCl. Обычно соли в инъекционном буфере присутствуют в концентрации по крайней мере 50 мМ хлорида натрия, (NaCl) по крайней мере 3 мМ хлорида калия (KCl) и по крайней мере 0,01 мМ хлорида кальция (CaCl2).
Инъекционный буфер может быть гипертоническим, изотоническим или гипотоническим с учетом специфической референсной среды, т.е. буфер содержит большее, равное или меньшее количество соли по отношению к основной среде, при этом, предпочтительно, используются такие концентрации упомянутых выше солей, которые не приводят к повреждению клеток в результате осмоса или других концентрационных эффектов.
Для (фармацевтических) композиций в (полу-)твердых лекарственных формах подходящими фармацевтически доступными экципиентами и носителями являются связующие агенты, такие как микрокристаллическая целлюлоза, трагантовая камедь или желатин; крахмал или лактоза; сахара, такие как, например, лактоза, глюкоза и сахароза; крахмалы, такие как, например, кукурузный крахмал или картофельный крахмал; целлюлоза и ее производные; такие как, например, натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза, ацетат целлюлозы; дезинтегранты, такие как альгиновая кислота; смазывающие агенты, такие как стеарат магния; глиданты, такие как стериновая кислота, стеарат магния; сульфат кальция, коллоидная двуокись кремния и подобные вещества; подсластители, такие как сахароза или сахарин; и/или вкусовые агенты, такие как перечная мята, метилсалицилат или апельсиновая вкусовая добавка.
В целом, (фармацевтические) композиции для местного введения могут быть в таких лекарственных формах, как крема, мази, гели, пасты или порошки. (Фармацевтические) композиции для перорального применения могут выпускаться в таких лекарственных формах как таблетки, капсулы, жидкости, порошки или в форме составов с замедленным высвобождением. Однако, в соответствии с предпочтительными вариантами осуществления настоящего изобретения, заявленные (фармацевтические) композиции вводят парентерально, в частности, посредством внутривенной или внутриопухолевой инъекции, поэтому они изготовлены в жидкой или лиофилизированной лекарственной форме, предназначенной для парентерального введения, как описано выше. Лекарственные формы для парентерального введения обычно хранятся во флаконах, IV пакетах, ампулах, картриджах или предварительно заполненных шприцах и могут вводиться инъекционно, ингаляционно или при помощи аэрозолей, при этом инъекционный путь является предпочтительным.
(Фармацевтическая) композиция может быть представлена в лиофилизированной форме. Лиофилизированные (фармацевтические) композиции перед введением предпочтительно восстанавливаются в подходящем буфере на эффективном водном носителе.
(Фармацевтические) композиции, предпочтительно, содержат безопасное и эффективное количество заявленного конъюгата (ов) или меченых радиоактивной меткой комплексов (а).
Используемый в описании термин “безопасное и эффективное количество” относится к такому количеству агента(ов), которое является достаточным для постановки диагноза и/или для появления существенных положительных изменений в течении заболевания, для лечения которого вводится агент. В то же время, однако, “безопасное и эффективное количество” достаточно невелико и позволяет избежать возникновения серьезных нежелательных реакций, т.е. по сути, позволяет достичь разумного баланса между преимуществами и рисками. Кроме того, “безопасное и эффективное количество” будет отличаться в зависимости от конкретного состояния, которое необходимо диагностировать или лечить, а также от возраста и физического состояния пациента, тяжести заболевания, продолжительности лечения, сопутствующей терапии пациента, а также от природы конкретного использованного в композиции фармацевтически приемлемого экципиента или носителя, и подобных факторов.
Заявленные конъюгаты также предполагается использовать для приготовления лекарственного средства, предпочтительно для лечения рака, в особенности для лечения и/или профилактики рака простаты, рака поджелудочной железы, рака почек или рака мочевого пузыря.
Набор
Согласно дополнительному аспекту, настоящее изобретение также относится к набору, включающему заявленный конъюгат(ы) (включая фармацевтически приемлемые соли, сложные эфиры, сольваты или меченые радиоактивными метками комплексы) и/или фармацевтическую композицию(и) согласно настоящему изобретению.
При необходимости набор может содержать по крайней мере один дополнительный агент из списка, приведенного для фармацевтической композиции, включая радионуклид, противомикробный агент, стабилизирующий агент и подобные соединения.
Набор может состоять из двух или более частей, каждая из которых содержит любой из компонентов, описанных например выше, в подходящих контейнерах. Например, каждый контейнер может быть в форме флаконов, бутылок, мягких бутылок, банок, герметичных пакетов, конвертов или мешочков, туб и блистерных упаковок или любой другой подходящей форме, при этом такие контейнеры предотвращают преждевременное смешивание компонентов. Каждый из различных компонентов может предоставляться отдельно, или некоторые различные компоненты могут предоставляться вместе (т.е. в одном контейнере).
Контейнер также может представлять собой отделение или камеру в самой упаковке, например флаконе, тубе, банке или конверте, или пакете, или блистерной упаковке или бутылке, таким образом, содержимое одного отделения не способно физически контактировать с содержимым другого отделения перед их преднамеренным смешиванием фармацевтом или лечащим врачом.
Набор или части набора может также содержать технические инструкции, включающие информацию о введении и дозировке любого из компонентов.
Терапевтические и диагностические способы и их применение
Согласно дополнительному аспекту, настоящее изобретение относится к заявленным конъюгатам (включая их фармацевтически приемлемые соли, сложные эфиры, сольваты и меченые радиоактивными метками комплексы), фармацевтическим композициям или наборам, предназначенным для применения в медицине и/или диагностике. Предпочтительно, такие заявленные конъюгаты, фармацевтические композиции или наборы используются для медицинских целей в отношении человека. Таким образом, настоящее изобретение также относится к указанным заявленным конъюгатам, фармацевтической композиции или набору для применения в качестве медицинского препарата.
Заявленные конъюгаты, предпочтительно, обладают способностью селективно связываться с мембраной простат-специфического антигена (ПСА). В соответствии с одним из вариантов воплощения, настоящее изобретение также относится к заявленным конъюгатам, фармацевтическим композициям или наборам, предназначенным для применения в способе для определения присутствия клеток и/или тканей, экспрессирующих простат-специфический мембранный антиген (ПСА).
ПСА экспрессируется, главным образом, злокачественными раковыми клетками. Используемый в описании термин “рак” относится к новообразованиям, характеризующимся неконтролируемой и обычно быстрой пролиферацией клеток, которые стремятся проникнуть в окружающие ткани, а также обладают способностью метастазировать в отдаленные регионы человеческого тела. Термин объединяет как доброкачественные, так и злокачественные новообразования. Злокачественность при раке обычно характеризуется такими признаками, как анаплазия, инвазивность и метастазирование, при этом доброкачественные опухоли обычно не обладают такими свойствами. Термин также относится к новообразованиям, характеризующимся опухолевым ростом, а также к раку кровеносной и лимфатической системы.
В частности, ПСА может экспрессироваться в повышенных количествах в раковых клетках предстательной железы, поджелудочной железы, почек или мочевого пузыря.
В соответствии с еще одним из вариантов воплощения, настоящее изобретение относится к заявленным конъюгатам (включая их фармацевтически приемлемые соли, сложные эфиры, сольваты и меченые радиоактивными метками комплексы), фармацевтической композиции или набору, предназначенным для применения в способе диагностики, лечения и/или профилактики рака простаты, рака поджелудочной железы, рака почек или рака мочевого пузыря.
Термин “диагноз” или “диагностика” относится к процессу выявления заболевания по характерным симптомам и проявлениям и/или как в данном случае, к анализу биологических маркеров (таких, как белки или гены), свойственных данному заболеванию.
Термин “лечение” заболевания включает процессы профилактики или предотвращения заболевания (что, по сути, означает не допустить развитие клинических симптомов); ингибирования заболевания (т.е. прекращения или подавления развития клинических симптомов); и/или облегчение течения заболевания (т.е. инициирование регресса существующих симптомов). Следует иметь в виду, что не всегда возможно различить процессы “предотвращения” и “супрессии” заболевания или патологического состояния до тех пор, пока окончательные индикаторные признаки или события неизвестны, или скрыты. Соответственно, термин “профилактика” очевидно относится к типу “лечения”, которое объединяет “предотвращение” и “супрессию”. Таким образом, термин “лечение” также включает термин “профилактика”.
Термины “субъект”, “пациент” или “индивидуум”, используемые здесь, обычно относятся к людям и нечеловекоподобным животным, предпочтительно млекопитающим (например, нечеловекоподобным приматам, включая мармозеток, тамаринов, паукообразных обезьян, совинолицых мартышек, зеленых мартышек, беличьих обезьян и павианов, макак, шимпанзе, орангутангам, гориллам; коровам; лошадям; овцам; свиньям; курам; кошкам; собакам; мышам; крысам; кроликам; морским свинкам и т.д.), включая химерных и трансгенных животных и моделей заболевания. В контексте настоящего изобретения термин “субъект” предпочтительно относится к нечеловекоподобным приматам или человеку, более предпочтительно к человеку.
Способы и методы, описанные здесь и имеющие отношение к диагностике, лечению или профилактике рака, в частности, рака предстательной железы, рака поджелудочной железы, рака почек или рака мочевого пузыря, предпочтительно могут включать стадии (а) введения заявленного конъюгата (включая его фармацевтически приемлемые соли, сложные эфиры, сольваты и меченые радиоактивными метками комплексы), фармацевтической композиции или набора пациенту, и (b) получение рентгенологического изображения организма указанного пациента.
Заявленные конъюгаты, фармацевтические композиции или наборы обычно вводятся парентерально. Введение может осуществляться системно, в частности путем внутривенной (в/в), подкожной, внутримышечной или внутрикожной инъекции. Альтернативно, введение может осуществляться местно, в частности, посредством внутриопухолевой инъекции.
Заявленные конъюгаты, фармацевтические композиции или наборы могут вводиться субъекту, нуждающемуся в этом, несколько раз в день, ежедневно, через день, еженедельно или ежемесячно. Предпочтительно лечение, диагностика или профилактика эффективны при использовании эффективных доз заявленных конъюгатов, фармацевтических композиций или наборов.
Эффективные дозы заявленных конъюгатов могут быть определены при помощи рутинных методик, например, с использованием моделей животных. К таким животным относятся, без ограничений указанными, кролики, овцы, мыши, крысы, собаки и нечеловекоподобные приматы. Терапевтическая эффективность и токсичность заявленных конъюгатов или меченых радиоактивным веществом комплексов может быть определена при помощи стандартных фармацевтических процедур, принятых, например, для определения LD50 (доза, летальная для 50% популяции) и ED50 (доза, терапевтически эффективная для 50% популяции) и проводимых в культуре клеток или на экспериментальных животных. Соотношение токсических и терапевтических эффектов может быть выражено в виде терапевтического индекса и представлено в виде соотношения LD50/ED50. Данные, полученные при изучении культуры клеток или в результате исследований на животных, могут использоваться для определения диапазона доз для человека. Дозы заявленных конъюгатов, предпочтительно, находятся в пределах циркулирующих концентраций, которые включают ED50 с низкой токсичностью или без нее.
Например, терапевтически или диагностически эффективные дозы заявленных конъюгатов могут находиться в пределах приблизительно от 0,001 мг до 10 мг, предпочтительно в пределах приблизительно от 0,01 мг до 5 мг, более предпочтительно в пределах приблизительно от 0,1 мг до 2 мг на единицу дозы или приблизительно от 0,01 нмоль до 1 ммоль на единицу дозы, в частности, от 1 нмоль до 1 ммоль на единицу дозы, предпочтительно от 1 микромоль до 1 ммоль на единицу дозы. Также подразумевается, что терапевтически или диагностически эффективные дозы заявленных конъюгатов могут находиться в диапазоне (на кг массы тела) приблизительно от 0,01 мг/кг до 10 г/кг, предпочтительно приблизительно от 0,05 мг/кг до 5 г/кг, более предпочтительно приблизительно от 0,1 мг/кг до 2,5 г/кг. Благодаря своим благоприятным фармакокинетическим свойствам, заявленные конъюгаты предпочтительно могут вводиться в более низких дозах, чем другие ПСА-лиганды, что является их преимуществом.
Как утверждается выше, настоящее изобретение позволяет использовать заявленные конъюгаты в терагностических целях, включая таргетное воздействие на ПСА-экспрессирующие клетки. Используемый в описании термин “терагностический” относится к “только диагностическим”, “только лечебным”, а также к “лечебно-диагностическим” методам. Согласно дополнительному аспекту, настоящее изобретение относится к способу in vitro определения присутствия клеток и/или тканей, экспрессирующих простат-специфический мембранный антиген (ПСА), включающий (а) контактирование указанных клеток и/или тканей экспрессирующих простат-специфический мембранный антиген (ПСА) с заявленными конъюгатами (включая их фармацевтические приемлемые соли, сложные эфиры, сольваты и меченые радиоактивными метками комплексы), фармацевтическими композициями или наборами и (b) использование способов визуализации для выявления указанных клеток и/или тканей, необязательно рентгенологической визуализации.
В in vivo и in vitro методах и способах, заявленных в соответствии с настоящим изобретением, рентгенологическая визуализация может выполняться при помощи любых средств и методов, известных специалистам в данной области. Предпочтительно, рентгенологическая визуализация подразумевает позитронную эмиссионную томографию (PET-КТ) или однофотонную эмиссионную компьютерную томографию (SPECT = ОФЭКТ). Клетки или ткани мишени, исследуемые при помощи рентгенологической визуализации с использованием заявленных конъюгатов, предпочтительно включают (возможно опухолевые) клетки или ткани предстательной железы, клетки или ткани селезенки (также возможно опухолевые) или ткани и клетки почек (также возможно опухолевые).
Согласно in vivo и in vitro методам и способам, заявленным в соответствии с настоящим изобретением, обнаружение ПСА-экспрессирующих клеток или тканей может свидетельствовать о наличии опухоли (клеток) предстательной железы, метастатической опухоли (клеток) предстательной железы, опухоли (клеток) почек, опухоли (клеток) мочевого пузыря, а также о наличии комбинации указанных опухолей. Следовательно, заявленные конъюгаты (включая фармацевтически приемлемые соли, сложные эфиры, сольваты и меченые радиоактивными метками комплексы), фармацевтические композиции и наборы могут использоваться конкретно для диагностики (и при необходимости лечения) рака предстательной железы, рака почек, рака поджелудочной железы и рака мочевого пузыря.
ОПИСАНИЕ ФИГУР
ФИГУРА 1: Хроматограммы для (A) 177Lu-ПСА-АЛБ-01, (Б) 177Lu-ПСА-АЛБ-03, (В) 177Lu-ПСА-АЛБ-04, (Г) 177Lu-ПСА-АЛБ-05, (Д) 177Lu-ПСА-АЛБ-06, (Е) 177Lu-ПСА-АЛБ-07, и (Ж) 177Lu-ПСА-АЛБ-08, меченных при активности 50 МБк/нмоль, полученные при контроле качества соединений с помощью HPLC.
ФИГУРА 2: Коэффициент распределения n-Октанола/PBS для 177Lu-ПСА-АЛБ-01 (n=3), 177Lu-ПСА-АЛБ-03 (n=3), 177Lu-ПСА-АЛБ-04 (n=1), 177Lu-ПСА-АЛБ-05 (n=1), 177Lu-ПСА-АЛБ-06 (n=1), 177Lu-ПСА-АЛБ-07 (n=1), 177Lu-ПСА-АЛБ-08 (n=1) по сравнению с контрольным веществом 177Lu-ПСА-617 (n=3).
ФИГУРА 3: Данные ультрафильтрационного анализа для 177Lu-ПСА-АЛБ-01 (n=2), 177Lu-ПСА-АЛБ-03 (n=2), 177Lu-ПСА-АЛБ-04 (n=1), 177Lu-ПСА-АЛБ-05 (n=1), 177Lu-ПСА-АЛБ-06 (n=2), 177Lu-ПСА-АЛБ-07 (n=2), 177Lu-ПСА-АЛБ-08 (n=2) по сравнению с контрольным веществом 177Lu-ПСА-617 (n=2).
ФИГУРА 4: Захват и интернализация 177Lu-ПСА-АЛБ-01 (n=2), 177Lu-ПСА-АЛБ-03 (n=2), 177Lu-ПСА-АЛБ-04 (n=1), 177Lu-ПСА-АЛБ-05 (n=1), 177Lu-ПСА-АЛБ-06 (n=2), 177Lu-ПСА-АЛБ-07 (n=2), 177Lu-ПСА-АЛБ-08 (n=2) по сравнению с контрольным веществом 177Lu-ПСА-617 (n=3). (A&В) Данные получены для ПСА-позитивных клеток PC-3 PIP. (Б&Г) и для ПСА-негативных клеток PC-3 flu.
ФИГУРА 5: Данные по биораспределению соединений 177Lu-ПСА-АЛБ-01 и 177Lu-ПСА-АЛБ-03 (A), 177Lu-ПСА-АЛБ-04 и 177Lu-ПСА-АЛБ-05 (Б) и 177Lu-ПСА-АЛБ-06, 177Lu-ПСА-АЛБ-07 и 177Lu-ПСА-АЛБ-08 (В) в тканях мышей-опухоленосителей PC-3 PIP/flu.
ФИГУРА 6: Окончательные данные по (А) опухолевому захвату (Б), соотношению опухоль/кровоток (В), соотношению опухоль/почка, (Г) и опухоль/печень для 177Lu-ПСА-АЛБ-01-08.
ФИГУРА 7: Сцинтиграфические изображения в разные временные точки после введения.
ФИГУРА 8: SPECT-КТ изображения различных участков после введения препарата.
ФИГУРА 9: PET-КТ изображения, полученные спустя 1 и 3 часа после введения соединения ПСА-АЛБ-06, меченного радиоактивным Галлием-68.
ФИГУРА 10: (A) Данные о биораспределении соединения 44Sc-ПСА-АЛБ-06 в организме мышей-опухоленосителей PC-3 PIP/flu через 1, 4 и 6 часов после введения. (Б) Данные о биораспределении соединения 177Lu-ПСА-АЛБ-06 организме мышей-опухоленосителей PC-3 PIP/flu через 1, 4 и 24 часа после введения.
ФИГУРА 11: PET/КТ изображения мышей-опухоленосителей PC-3 PIP/flu, представленные с помощью алгоритма проекции максимальных интенсивностей (MIPs) с одной шкалой для всех временных интервалов. (А) PET/КТ скан, полученный через 1 ч после введения 44Sc-ПСА-АЛБ-06. (Б) PET/КТ скан, полученный через 4 ч после введения 44Sc-ПСА-АЛБ-06, (В) PET/КТ скан, полученный через 20 ч после введения 44Sc-ПСА-АЛБ-06.
ФИГУРА 12: PET/КТ изображения мышей-опухоленосителей PC-3 PIP/flu, представленные с помощью алгоритма проекции максимальных интенсивностей (MIPs) с одной шкалой для всех временных интервалов. (А/В) PET/КТ скан, полученный через час после введения 44Sc-ПСА-АЛБ-06.
ФИГУРА 13: PET/КТ изображения мышей-опухоленосителей PC-3 PIP/flu, представленные с помощью алгоритма проекции максимальных интенсивностей (MIPs) с одной шкалой для всех временных интервалов. (А/В) PET/КТ скан, полученный через 20 ч после введения 44Sc-ПСА-АЛБ-06.
ФИГУРА 14: Полулогарифмические графики, построенные на основании данных ультрафильтрации для расчета B50 величин 64Cu-ПСА-АЛБ-06 (B50=770) и 64Cu-ПСА-АЛБ-89 (B50=454) после инкубации в человеческой плазме с различной концентрацией белка (среднее ± SD, n≥3).
ФИГУРА 15: Клеточный захват и интернализация (среднее ± SD, n=3) 64Cu-ПСА-АЛБ-89 и 64Cu-ПСА-АЛБ-06 (А) ПСА-позитивными PC-3 PIP клетками и (В) ПСА-негативными PC-3 flu клетками.
ФИГУРА 16: Профиль биораспределения в тканях соединения 64Cu-ПСА-АЛБ-89, введенного голым мышам линии Balb/c привитым PC-3 PIP и PC-3 flu опухолевыми ксенотрансплантатами, через 1 ч, 4 ч и 24 ч после инъекции. Величины представляют собой среднее ± SD от величин, полученных для n = 3-6 мышей.
ФИГУРА 17: PET/КТ изображения представленные с помощью алгоритма проекции максимальных интенсивностей. (А-Г) PET/КТ изображения мышей через 1 ч, 4 ч, 16 ч и 24 ч после введения 64Cu-ПСА-АЛБ-89. Шкала была выстроена путем отрезания 2% от фонового для лучшей визуализации опухолей, почек и печени. (ПСА+ = PC-3 PIP опухолевый ксенотрансплантат; ПСА- = PC-3 flu опухолевый ксенотрансплантат; Ki = почка; Li = печень; Bl = мочевой пузырь).
ФИГУРА 18: ПСА-связывающий предшественник, используемый для синтеза ПСА-АЛБ-02/-05/-07.
ФИГУРА 19: Химическая структура (A) ПСА-АЛБ-02, (Б) ПСА-АЛБ-05, и (В) ПСА-АЛБ-07.
ФИГУРА 20: Графики, демонстрирующие стабильность 177Lu-ПСА-АЛБ-02, 177Lu-ПСА-АЛБ-05, и 177Lu-ПСА-АЛБ-07, а также 177Lu-ПСА-617 в течение 24-ти часового периода времени в (А) отсутствии и (Б) присутствии аскорбиновой кислоты. Величины представляют собой среднее ± SD трех независимых измерений.
ФИГУРА 21: Захват и интернализация 177Lu-ПСА-АЛБ-02, 177Lu-ПСА-АЛБ-05, и 177Lu-ПСА-АЛБ-07 по сравнению с 177Lu-ПСА-617. (А) Данные, полученные для ПСА-позитивных PC-3 PIP клеток. Столбцы показывают среднюю величину ± SD для трех независимых измерений, проведенных трижды. (В) Данные, полученные для ПСА-негативных PC-3 PIP клеток. Столбцы показывают среднюю величину ± SD для трех независимых измерений, проведенных трижды
ФИГУРА 22: Данные о биораспределении (с поправкой на радиоактивный распад) не более чем через 192 ч после инъекции соединения, полученные для всех трех альбумин-связывающих 177Lu-ПСА лигандов, а также для 177Lu-ПСА-617. (А) Данные о биораспределении 177Lu-ПСА-АЛБ-02, (Б) 177Lu-ПСА-АЛБ-05, (В) 177Lu-ПСА-АЛБ-07, и (Г) 177Lu-ПСА-617. Величины представляют собой среднее ± SD от величин, полученных для n = 3-6 мышей.
ФИГУРА 23: Графики показывающие данные о биораспределении (без поправки на радиоактивный распад) через 192 ч после введения (А) 177Lu-ПСА-АЛБ-02, (Б) 177Lu-ПСА-АЛБ-05, и (В) 177Lu-ПСА-АЛБ-07. Каждая точка на графике представляет собой среднее ± SD от величин, полученных для n = 3-6 мышей.
ФИГУРА 24: SPECT/КТ изображения, представленные с помощью алгоритма проекции максимальных интенсивностей (MIPs), мышей-опухоленосителей PC-3 PIP/flu через 24 ч после введения (А) 177Lu-ПСА-АЛБ-02, (B) 177Lu-ПСА-АЛБ-05, и (C) 177Lu-ПСА-АЛБ-07. ПСА+ = ПСА-позитивная PC-3 PIP опухоль; ПСА− = ПСА-негативная PC-3 flu опухоль; Ki = почка; Bl = мочевой пузырь; Li = печень.
ФИГУРА 25: (A/Б/В) SPECT/КТ изображения, представленные с помощью алгоритма проекции максимальных интенсивностей (MIPs), мышей-опухоленосителей PC-3 PIP/flu через 4 ч (А), 24 ч (Б) и 72 ч (В) после введения 177Lu-ПСА-АЛБ-02. (Г, Д, Е) SPECT/КТ изображения, представленные с помощью алгоритма проекции максимальных интенсивностей (MIPs), мышей-опухоленосителей PC-3 PIP/flu через 4 ч (Г), 24 ч (Д) и 72 ч (Е) после введения 177Lu-ПСА-617. ПСА+ = ПСА-позитивная PC-3 PIP опухоль; ПСА− = ПСА-негативная PC-3 flu опухоль; Ki = почка; Bl = мочевой пузырь; Li = печень.
ФИГУРА 26: SPECT/КТ изображения, представленные с помощью алгоритма проекции максимальных интенсивностей (MIPs), мышей-опухоленосителей PC-3 PIP/flu в различные временные точки после введения 177Lu-АЛБ-03 и 177Lu-ПСА-АЛБ-06 (A - В). MIPs для мышей через (A) 4 ч, (Б) 24ч, и (В) 72 ч после введения 177Lu-АЛБ-03 (25 МБк, 1 нмоль). (Г - Е) MIPs для мышей через (Г) 24 ч, (E) 24 ч и (F) 72 ч после введения 177Lu-ПСА-АЛБ-06 (25 МБк, 1нмоль). ПСА+ = ПСА-позитивная PC-3 PIP опухоль; ПСА− = ПСА-негативная PC-3 flu опухоль; Ki = почка; Bl = мочевой пузырь;
ФИГУРА 27: Исследование терапии мышей-опухоленосителей линии PC-3 PIP соединениями 177Lu-ПСА-АЛБ-06 и 177Lu-ПСА-617. (А) Кривые опухолевого роста применительно к объему опухоли на День 0 (принят за 1) для мышей, которые получали солевой раствор (Группа А), мышей, получавших 2 МБк 177Lu-ПСА-617 (Группа Б), 5 МБк 177Lu-ПСА-617 (Группа C), 2 МБк 177Lu-ПСА-АЛБ-06 (Группа D), и 5 МБк 177Lu-ПСА-АЛБ-06 (Группа E). Данные собраны за период времени до гибели первого животного из соответствующей группы. (Б) График Каплана-Мейра для Групп А-Е. (С) Относительная масса тела для Групп А-Е.
ПРИМЕРЫ
Пример 1: Получение и in vivo анализ DOTA-функционализированных Альбумин-связывающих ПСА лигандов
1.1 МАТЕРИАЛЫ И МЕТОДЫ
1.1.1 НОВЫЕ ПСА ЛИГАНДЫ (ОБЗОР)
Все семь вариантов ПСА лигандов с портативной альбумин-связывающей молекулой были синтезированы при помощи твердофазного синтеза, который, как было показано, является наиболее подходящим для получения описанных выше альбумин-аффинных ПСА лигандов.
Многоэтапный синтез (19 этапов для ПСА-АЛБ-01, 17 этапов для ПСА-АЛБ-03, 20 этапов для ПСА-АЛБ-04 и ПСА-АЛБ-05, 17 этапов для ПСА-АЛБ-06, 23 этапа для ПСА-АЛБ-07 и ПСА-АЛБ-08) позволил получить указанные соединения в изолированном состоянии с общим выходом продукта 26-49%. Сырые продукты были очищены при помощи полупрепаративной обращено-фазовой высоко эффективной жидкостной хроматографии (RP-HPLC - Reverse-Phase High Performance Liquid Chromatography - ВЭЖХ c обращенной фазой), степень очистки конечных соединений составляла >98%. Исследование описанных выше соединений осуществляли при помощи аналитической RP-HPLC и MALDI-MS (Матрично-активированной лазерной десорбции) или ESI-MS (Масс-спектрометрии с иионизацией распылением), соответственно. Результаты анализа представлены в Таблице 1.1.
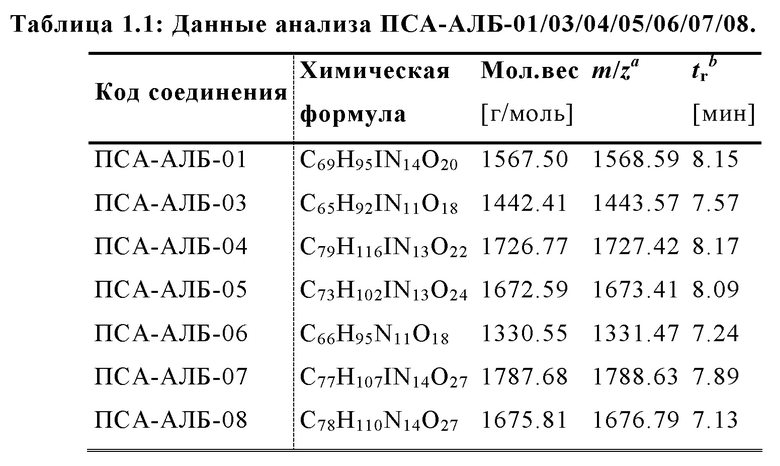
a Масс-спектрометрия немеченого лиганда, определенная как [M+H]+;
b Время удерживания немеченого лиганда при аналитической RP-HPLC. На аналитической колонке (100 х 4.6 мм) использовали Chromolith RP-18e стационарную фазу с мобильными фазами, состоявшими из 0,1% TFA в воде (А) и ACN (Б). Для аналитических серий использовали линейный градиент растворителя А (90-10% в 10 мин) в растворителе В при скорости потока 1 мл/мин.
Пептидомиметический фармакопор для ПСА (L-Глу-NH-CO-NH-L-Лиз связывающий элемент; этап 1-6) синтезировали по аналогии с синтезом, описанным в Eder et al, Bioconjug. Chem. 2012, 23: 688-697. Молекулу линкера (2-нафтил- L-Ала-NH-CO-транс-CHX-N3 или 2-нафтил-L-Ала-NH-CO-транс-CHX-Me-NH2; этап 7-10) синтезировали при помощи стандартного Fmoc (9-фторэнилметилокикарбонил) протокола, как ранее было описано у  et al, JNM 2015, 56: 914-920. Два указанных промежуточных этапа синтеза, позволяющие получить предшественник ПСА-лиганда, применяли аналогично для всех остальных соединений (этап 1-8). Однако, последний связывающий блок линкерного участка ПСА-АЛБ-01 [транс-4-азидоциклогексанкарбоксильная кислота, этап 9-10] был заменен транс-4-(Fmoc-аминометил) циклогексан-карбоксильной кислотой (этап 9-10) во время синтеза ПСА-АЛБ-03/04/05/06/07/08.
et al, JNM 2015, 56: 914-920. Два указанных промежуточных этапа синтеза, позволяющие получить предшественник ПСА-лиганда, применяли аналогично для всех остальных соединений (этап 1-8). Однако, последний связывающий блок линкерного участка ПСА-АЛБ-01 [транс-4-азидоциклогексанкарбоксильная кислота, этап 9-10] был заменен транс-4-(Fmoc-аминометил) циклогексан-карбоксильной кислотой (этап 9-10) во время синтеза ПСА-АЛБ-03/04/05/06/07/08.
ПСА-АЛБ-01
Для синтеза ПСА-АЛБ-01 применяли экономный способ объединения по принципу “голова-к-хвосту” очищенного ПСА-предшественника со свободными азидогруппами и очищенной альбумин-связывающей молекулой [4-(p-йодофенил) масляная кислота-L-Лиз] с соединением пропаргил-Глу (этап 11-17). После эффективного слияния указанных двух предшественников посредством триазолового кольца (этап 18), проводили дополнительную очистку для удаления избытка CuSO4⋅5 H2O. В результате получали ПСА-АЛБ-01 путем конъюгации с хелатирующим агентом DOTA в форме его активного эфира (DOTA-NHS эфир; этап 19).
Структурная формула ПСА-АЛБ-01 представлена ниже:

ПСА-АЛБ-03
Для получения ПСА-АЛБ-03 применяли прямой односторонний синтез на полимерной подложке. Далее осуществляли присоединение Fmoc-L-Лиз(Alloc)-OH к ПСА-предшественнику, удаление защитных групп Fmoc, конъюгацию DOTA трис(tBu)-эфира, удаление защитных групп Alloc и конъюгацию 4-(p-йодофенил) масляной кислоты (этап 11-16). В результате получали ПСА-АЛБ-03 путем перемешивания и последующего отделения от полимерной подложки при помощи смеси TFA: TIPS:H2O (этап 17).
Структурная формула ПСА-АЛБ-03 представлена ниже:
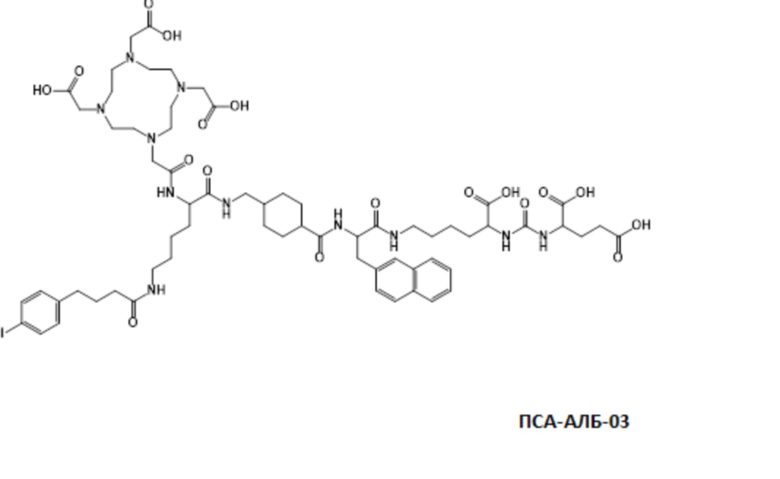
ПСА-АЛБ-04
Для получения ПСА-АЛБ-04, применяли экономный способ синтеза “голова-к-хвосту”, включавший присоединение покрытого смолой ПСА-предшественника к DOTA-конъюгированному L-Лиз и очищенному альбумин-связывающему элементу [4-(пара-йодофенил) масляная кислота-L-Лиз] посредством прямой конъюгации двух вторичных аминов (этапы 11-18). После эффективного соединения указанных двух предшественников с использованием эфира субериновой кислоты бис(N-гидроксисукцинимида) (этап 19), получали ПСА-АЛБ-04 путем перемешивания и последующего отделения от смолы при помощи смеси TFA: TIPS:H2O (этап 20).
Структурная формула ПСА-АЛБ-04 представлена ниже:
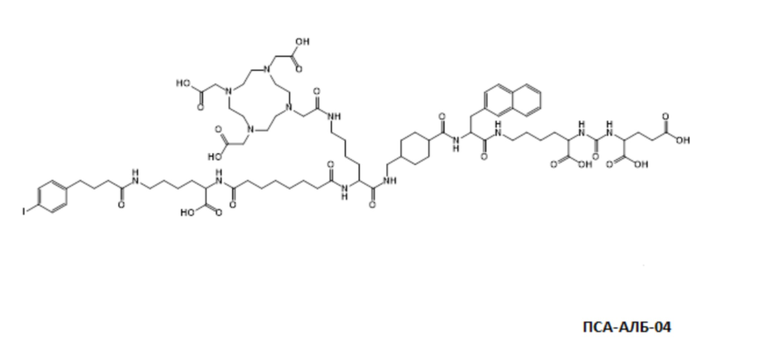
ПСА-АЛБ-05
Для получения ПСА-АЛБ-05 применяли прямой односторонний синтез на полимерной подложке. После присоединение Fmoc-L-Лиз(Alloc)-OH к ПСА-предшественнику, осуществляли удаление защитных групп Fmoc, конъюгацию Fmoc-D-Asp-OtBu, удаление защитных групп Fmoc и конъюгацию 4-(p-йодофенил) масляной кислоты, удаление защитных групп Alloc и конъюгацию DOTA трис(tBu)-эфира (этапы 11-19). ПСА-АЛБ-05 путем перемешивания и последующего отделения от полимерной подложки при помощи смеси TFA:TIPS:H2O (этап 20).
Структурная формула ПСА-АЛБ-05 представлена ниже:
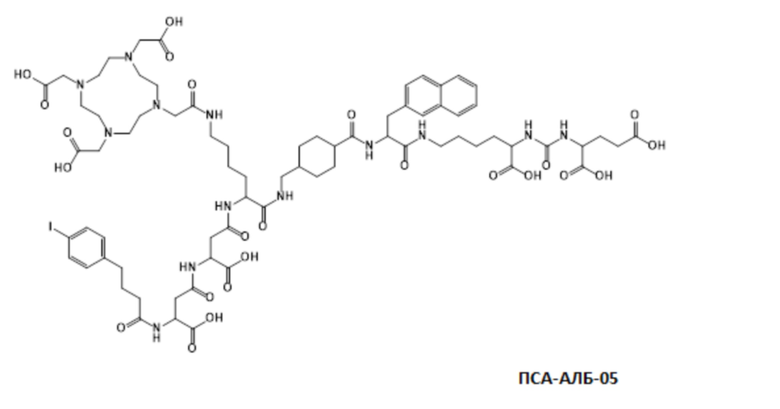
ПСА-АЛБ-06
Для получения ПСА-АЛБ-06 применяли прямой односторонний синтез на полимерной подложке. После присоединение Fmoc-L-Лиз(Alloc)-OH к ПСА-предшественнику, осуществляли удаление защитных групп Fmoc, конъюгацию, DOTA трис(tBu)-эфира, удаление защитных групп Alloc и конъюгацию p-(толил) масляной кислоты (этапы 11-16). В результате получали ПСА-АЛБ-06 путем перемешивания и последующего отделения от полимерной подложки при помощи смеси TFA:TIPS:H2O (этап 17).
Структурная формула ПСА-АЛБ-06 представлена ниже:
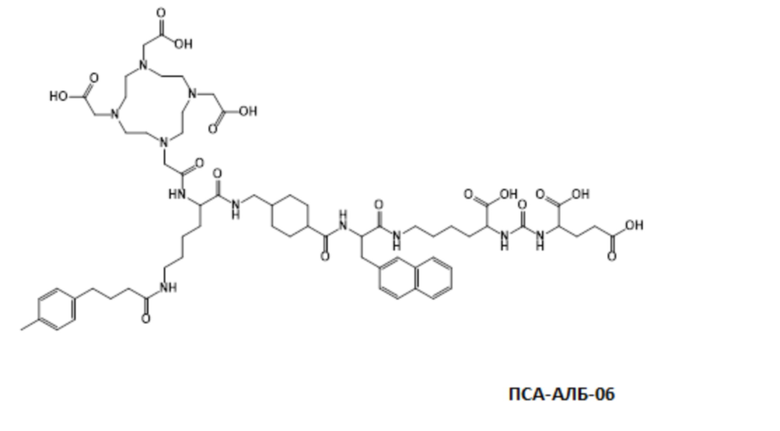
ПСА-АЛБ-07
Для получения ПСА-АЛБ-07 применяли прямой односторонний синтез на полимерной подложке. После присоединение Fmoc-L-Лиз(Alloc)-OH к ПСА-предшественнику, осуществляли удаление защитных групп Fmoc, конъюгацию Fmoc-D-Asp-OtBu, удаление защитных групп Fmoc, вторую Fmoc-D-Asp-OtBu конъюгацию, удаление защитных групп Fmoc, третью Fmoc-D-Asp-OtBu конъюгацию, удаление защитных групп Fmoc, конъюгацию 4-(p-йодофенил)масляной кислоты, удаление защитных групп Alloc и конъюгацию DOTA трис(tBu)-эфира (этап 11-22). В результате получали ПСА-АЛБ-07 путем перемешивания и последующего отделения от полимерной подложки при помощи смеси TFA:TIPS:H2O (этап 23).
Структурная формула ПСА-АЛБ-07 представлена ниже:
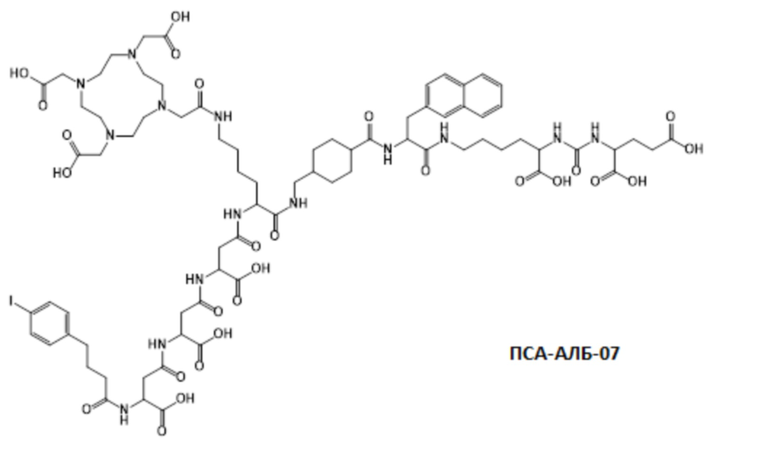
ПСА-АЛБ-08
Для получения ПСА-АЛБ-08 применяли прямой односторонний синтез на полимерной подложке. После присоединение Fmoc-L-Лиз(Alloc)-OH к ПСА-предшественнику, осуществляли удаление защитных групп Fmoc, конъюгацию Fmoc-D-Asp-OtBu, удаление защитных групп Fmoc, вторую Fmoc-D-Asp-OtBu конъюгацию, удаление защитных групп Fmoc, третью Fmoc-D-Asp-OtBu конъюгацию, удаление защитных групп Fmoc, конъюгацию (p-толил)масляной кислоты, удаление защитных групп Alloc и конъюгацию DOTA трис(tBu)-эфира (этап 11-22). В результате получали ПСА-АЛБ-08 путем перемешивания и последующего отделения от полимерной подложки при помощи смеси TFA:TIPS:H2O (этап 23).
Структурная формула ПСА-АЛБ-08 представлена ниже:
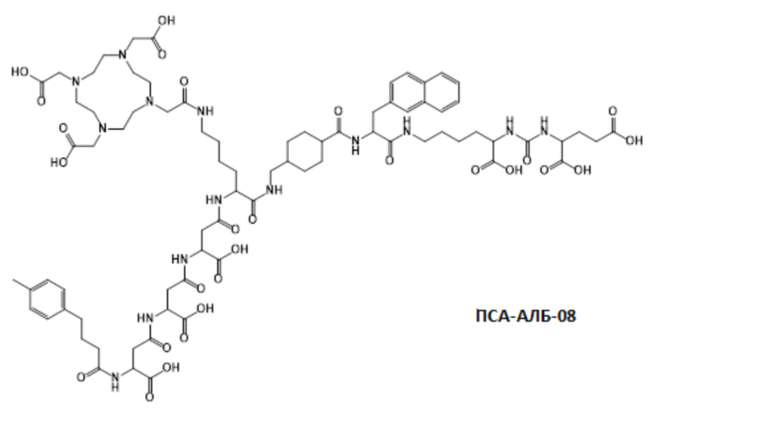
1.1.2 СИНТЕЗ ПСА-АЛБ-03-08 (Подробно)
а) Синтез связывающего элемента Глутамат-карбамид-Лизина.
Вначале 2-Хлортритил хлоридную смолу {(2-CT-Resin; Merck; номер в каталоге 8550170005), 0.30 ммоль, замещающая способность 1.63 ммоль/г, 100-200 MESH, 1% DVB, общий набухающий объем в CH2Cl2 >4.2 мЛ/г, [184 мг]} в шприце объемом 5 мл с фильтром и заглушкой комби-стоппером перемешивали с безводным дихлорметане (DCM) в течение 45 мин.
Затем 2-СТ-смолу трижды промывали безводным DCM с последующим взаимодействием с 1,2 экв Alloc (N-аллилоксикарбонил), а также Fmoc (N-фторэнилметоксикарбонил) - защищенным L-Лизином {(Fmoc-Lys(Alloc)-OH; Merck; номер в каталоге 8521240005), 0.36 ммоль, 452.50 г/mol, [163 мг], (1)} и 4,8 экв. N,N-диизопропилэтиленамином {(DIPEA), 1.44 ммоль, 129.24 г/моль, 0.742 г/мл, [251 мкЛ]}в 3 мл безводного DCM.
Связывание первой защищенной аминокислоты на смоле (2) протекало в течение 16-ти часового курса при легком перемешивании. Смолу с иммобилизованным L-лизином (2) трижды промывали DSM и трижды DCM2. Не вступившие в реакцию хлортритиловые группы, оставшиеся на смоле, пятикратно промывали смесью DCM, метанола (MeOH) и DIPEA в соотношении 17:2:1 (20 мл).
Смолу с Alloc и Fmoc -защищенным L-лизином последовательно трижды промывали DCM1, трижды DCM2 и трижды N,N-диметилформамидом (DMF1), и, наконец, трижды DMF2. Селективное удаление Fmoc-защищенных групп осуществляли путем промывания смеси DMF и пиперидином в соотношении 1:1 сначала однократно в течение 2 минут, затем еще раз в течение 5 минут для получения продукта (3). Затем Alloc-защищенный L-лизин трижды промывали DMF1, трижды DMF2, трижды DCM1, и наконец, трижды DCM2.
На следующем этапе, для получения изоцианата молекулы глутамила III использовали 10 экв tBu-защищенного L-глутамат гидрохлорида {(H-Glu(OtBu)-OtBu⋅HCl; Merck; номер в каталоге 8540960005), 3.0 ммоль, 295.8 г/моль, [887 мг], I} Подходящее количество tBu-защищенного L-глутамата растворяли в 150 мл DCM2 с последующим добавлением 3 мл DIPEA.
Полученный раствор по каплям в течение 4 ч добавляли в колбу с 1 ммоль ледяного бис(трихлорметил)карбоната {(BTC; Sigma; номер в каталоге 15217-10G), 296.75 г/моль, [297 мг], III} в 5 мл сухого DCM.
Затем одну порцию смолы с иммобилизованным L-лизином с одной свободной NH2-группой (3) добавляли к раствору изоцианата молекулу глутамила III и интенсивно перемешивали в течение 16 ч для получения иммобилизованного на смоле соединения бис(tBu)-Глу-карбамид-Лиз(Alloc) (4).
Полученный продукт (4) на подложке из смолы отфильтровывали и промывали трижды DCM1 и трижды DCM2.
Отщепление Alloc-защитных групп осуществляли путем взаимодействия с 0,15 экв TPP Pd {[тетракис(трифенилфосфин)палладий (0); Sigma; Catalog номер в каталоге 216666-1G], 0.045 ммоль, 1155.56 г/моль, [105 мг]} в присутствии 15 экв морфолина {4.5 ммоль, 87.12 г/моль, 0.999 г/мл, [392 мкл]} в 3 мл безводного DCM. Общее количество Pd и морфолина разделили на две порции и провели успешную реакцию путем встряхивания каждого реактива в течение 1 часа. Реакцию осуществляли в темноте с использованием алюминиевой фольги.
Затем смолу трижды промывали DCM1, трижды DCM2, трижды DMF1 и, наконец, трижды DMF2. Для удаления остатков палладия смолу дополнительно десять раз промывали 1% DIPEA в DMF (300 мкл DIPEA в 30 мл DMF2) и затем еще 10 раз по 5 минут раствором купрала {(диэтилдитиокарбамат тригидрат натрия; Sigma; номер в каталоге D3506-100G), 225.31 г/моль} в DMF2 в концентрации 15 мг/мл (450 мг купрала в 30 мл DMF2). Иммобилизованный на смоле и бис(tBu)-защищенный Глу-карбамид-Лиз (5) затем трижды промывали DMF1, трижды DMF2, трижды DCM1, трижды DCM2 и, наконец, трижды диэтиловым эфиром (Et2O) и высушивали в вакууме.
Полученный таким способом элемент (5), связывающий простат-специфический мембранный антиген (ПСА) затем использовали в следующей реакции для синтеза всех семи соединений (ПСА-АЛБ-01/03/04/05/06/07/08).
Краткое описание всего описанного выше процесса синтеза бис(tBu)-защищенного Глу-карбамид-Лиз фармакопора представлено на Схеме 1.1.
Схема 1.1: Синтез связывающего элемента Глутамат-карбамид-Лизин для ПСА-АЛБ - 01/03/04/05/06/07/08.
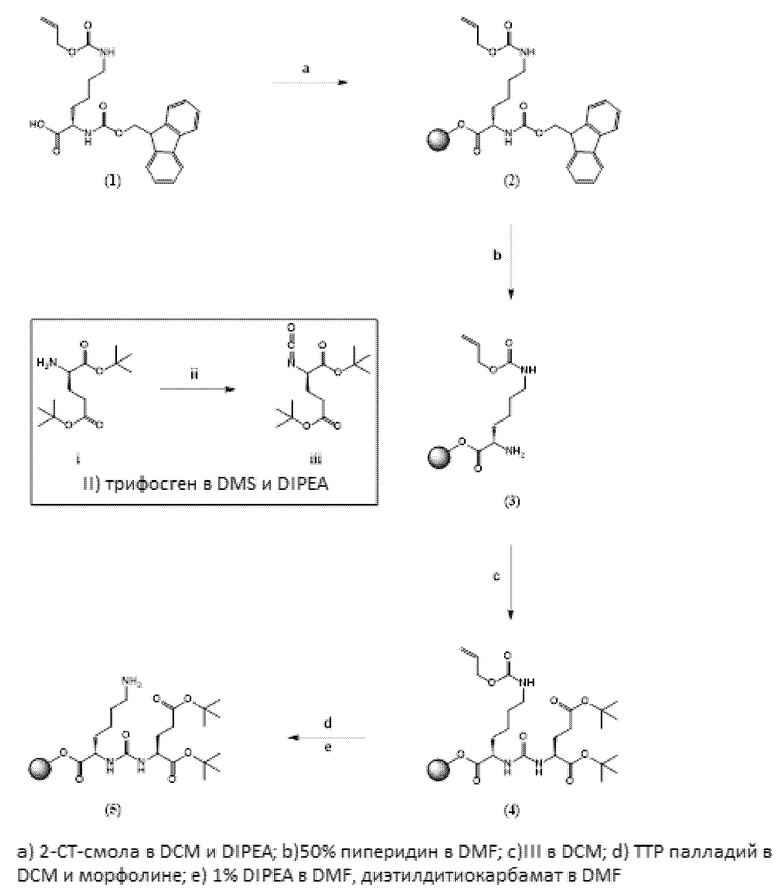
Иммобилизованный на смоле бис(tBu)-защищенный связывающий элемент (5) сначала перемешивали в безводном DCM в течение 45 мин. Предварительно набухший фармакофор трижды промывали DCM2, трижды DMF1 и трижды DMF2.
б) Синтез линкерного участка
Относительно смолы (0,1 ммоль), 4 экв Fmoc-защищенного 2-нафтил-L-аланина {(Fmoc-2Nal-OH; Bachem; номер в каталоге B-2100), 0.40 ммоль, 437.50 г/моль, [175.0 мг]}, соответствующего первому структурному блоку линкерного участка, активировали 3,96 экв. HBTU {(O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний-гексафторфосфат; Sigma; номер в каталоге 12804-25G-F), 0.39 ммоль, 379.24 г/моль, [147.9 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [71 мкл]} в безводном DMF.
Через две минуты после добавления DIPEA раствор добавляли к иммобилизованному на предварительно набухшей в DMF смоле бис(tBu)-защищенному фармакопору (3) и перемешивали в течение 1 ч.
Последовательно, смолу с бис(tBu)-защищенным Глу-карбамид-Лизином и Fmoc-защищенным 2-нафтил-L-аланином (6) трижды отмывают DMF1 и трижды DMF2.
На следующем этапе 4 экв второго структурного блока, который представляет собой азидоциклогексанкарбоксильную кислоту {(N3-1,4-транс-CHC-OH; Iris Biotech; номер в каталоге HAA2235.0001), 0.40 с, 169.18 г/моль, [67.7 mg]} для ПСА-АЛБ-01 или для Fmoc-защищенной транексамовой кислоты{(транс-4-(Fmoc-аминометил)циклогексан-карбоксильная кислота; Sigma; номер в каталоге 58446-5G-F), 0.40 ммоль, 379.45 г/моль, [151.8 мг]} для ПСА-АЛБ-03/04/05/06/07/08 активировали 3.96 экв HBTU {(Sigma; Номер в каталоге12804-25G-F), 0.39 ммоль, 379.24 г/моль, [147.9 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [71 мкл]} в безводном DMF. Через две минуты после добавления DIPEA, раствор добавляли к предварительно набухшему в DMF соединению (7) и перемешивали в течение 1 часа.
Последовательно смолу с бис(tBu)-защищенной Глу-карбамид-Лиз-2-нафитил-L-аланином и азидоциклогексанкарбоксильной кислотой (8А) трижды отмывали DMF1, трижды DMF2, трижды DCM1, трижды DCM2, и наконец, трижды Et2O и высушивали в вакууме. Конечный ПСА-предшественник (9А), получали путем перемешивания с последующим отщеплением от смолы в течение 2 часов со смесью, включавшей трифторуксусную кислоту (TFA), триизопропилсилан (TPS) и H2O в соотношении 95:2.5:2.5. TFA выпаривали, сырой продукт растворяли в ацетонитриле (ACN) и воде в соотношении 1:1 и очищали посредством RP-HPLC.
Дополнительно, смолу с бис(tBu)-защищенному Глу-карбамид-Лиз-2-нафитил-L-аланином и Fmoc-защищенной транексамовой кислотой (8Б) трижды отмывали DMF1 и трижды DMF2. Селективное отщепление Fmoc-защищенных групп от соединения (8Б) осуществляли путем отмывания смеси DMF и пиперидина в соотношении 1:1 один раз в течение 2 мин и затем снова в течение 5 мин для получения продуктов (9Б).
Описанный выше процесс синтеза кратко изображен на Схеме 1.2.
Схема 1.2: Синтез Линкерного участка, предшественника для ПСА-АЛБ-03/04/05/06/07/08.
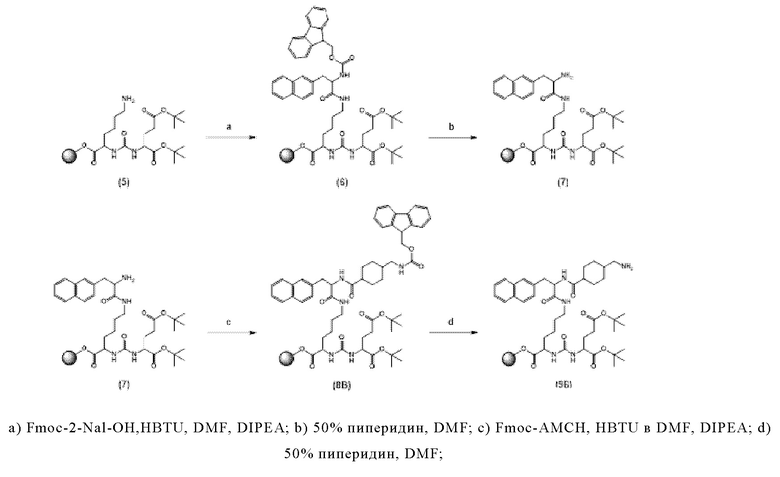
в) Синтез ПСА-АЛБ-03
Относительно количества покрытого лизином ПСА-предшественника (9Б), использовали 4 экв Fmoc-, а также Alloc-защищенного L-лизина ({(Fmoc-Lys(Alloc)-OH; Merck; Номер в каталоге 8521240005), 0.40 ммоль, 452.50 г/моль, [181 мг]} который активировали 3.96 экв HBTU {(Sigma; Номер в каталоге12804-25G-F), 0.396 ммоль, 379.24 г/моль, [149 ]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл]} в безводном DMF. Через две минуты после добавления DIPEA, раствор добавляли к иммобилизованному на предварительно набухшей в DMF смоле бис(tBu)-защищенному предшественнику ПСА (9В) и перемешивали в течение 1 ч.
Селективное отщепление Fmoc-защитных групп от конечного соединения (10Б) осуществляли путем промывания смесью DMF и пиперидина в соотношении 1:1 один раз в течение 2 мин и затем снова в течение 5 мин для получения продуктов (11Б).
Конъюгацию хелатирующего агента с иммобилизованным на смоле соединением (11Б) осуществляли с 2 экв DOTA-трис(t-Bu)эфира {([2-(4,7,10-трис(2-(t-бутокси)-2-оксоэтил)-1,4,7,10-тетраазациклододекан-1-ил)уксусная кислота]; CheMatech; номер в каталоге137076-54-1), 0.20 ммоль, 572.73 г/моль [115 мг]}. Структурный элемент, связывающий хелатирующий агент, активировали 1,98 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.198 ммоль, 379.24 г/моль, [75 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл]} в безводном DMF. Через две минуты после добавления DIPEA, раствор добавляют к иммобилизованному на смоле и предварительно набухшему в DMF соединению (11Б). Присоединение хелатирующего агента DOTA продолжалось в течение 2 часов при легком перемешивании. Полученное соединение (12Б) затем трижды отмывали DMF1, трижды DMF2, затем трижды DCM1, и, наконец, трижды DCM2.
Отщепление Alloc-защитных групп от соединения (12В) осуществляли путем взаимодействия с 0,03 экв TPP Pd {(Sigma; Catalog номер в каталоге 216666-1G], 0.03 ммоль, 1155.56 г/моль, [35 мг]} в присутствии 30 экв морфолина {3,0 ммоль, 87.12 г/моль, 0.999 г/мл, [262 мкл]} в 3 мл безводного DCM. Реакцию осуществляли в течение 2-х часов в темноте с использованием алюминиевой фольги.
Затем смолу трижды промывали DCM1, трижды DCM2, трижды DMF1 и, наконец, трижды DMF2. Для удаления остатков палладия смолу дополнительно десять раз промывали 1% DIPEA в DMF (300 мкл DIPEA в 30 мл DMF2) и затем еще 10 раз по 5 минут раствором купрала {(Sigma; номер в каталоге D3506-100G), 225.31 г/моль} в DMF2 в концентрации 15 мг/мл (450 мг купрала в 30 мл DMF2). Полученное соединение (13Б) затем трижды отмывали в DMF1 и трижды в DMF2.
Наконец для объединения альбумин-связывающего элемента, 4 экв йодофенил-масляной кислоты {([4-(p-йодофенил)масляная кислота]; Sigma; I5634-5G), 0.40 ммоль, 290.10 г/моль, [116 мг]} активировали 3.96 HBTU {(Sigma; Номер в каталоге12804-25G-F), 0.396 ммоль, 379.24 г/моль, [149 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл]} в безводном DMF. Через две минуты после добавления DIPEA, раствор добавляли к иммобилизованному на смоле и предварительно набухшему в DMF продукту (13Б) и перемешивали в течение 1 ч.
Полученное соединение (14Б) затем трижды отмывали DMF1, трижды DMF2, трижды DCM1, трижды DCM2 и, наконец, трижды Et2O и высушивали в вакууме.
Конечное соединение ПСА-АЛБ-03 получали путем перемешивания и последующего отщепления от смолы в течение 2-х часов со смесью, включавшей TFA, TIPS и H2O в соотношении 95:2.5:2.5. TFA выпаривали, сырой продукт растворяли в ACN и воде в соотношении 1:1 и очищали посредством RP-HPLC. Описанный выше процесс синтеза кратко изображен на Схеме 1.3.
 Схема 1.3: Объединение Альбумин-связывающего элемента, хелатирующего агента DOTA и предшественника ПСА для ПСА-АЛБ-03
Схема 1.3: Объединение Альбумин-связывающего элемента, хелатирующего агента DOTA и предшественника ПСА для ПСА-АЛБ-03
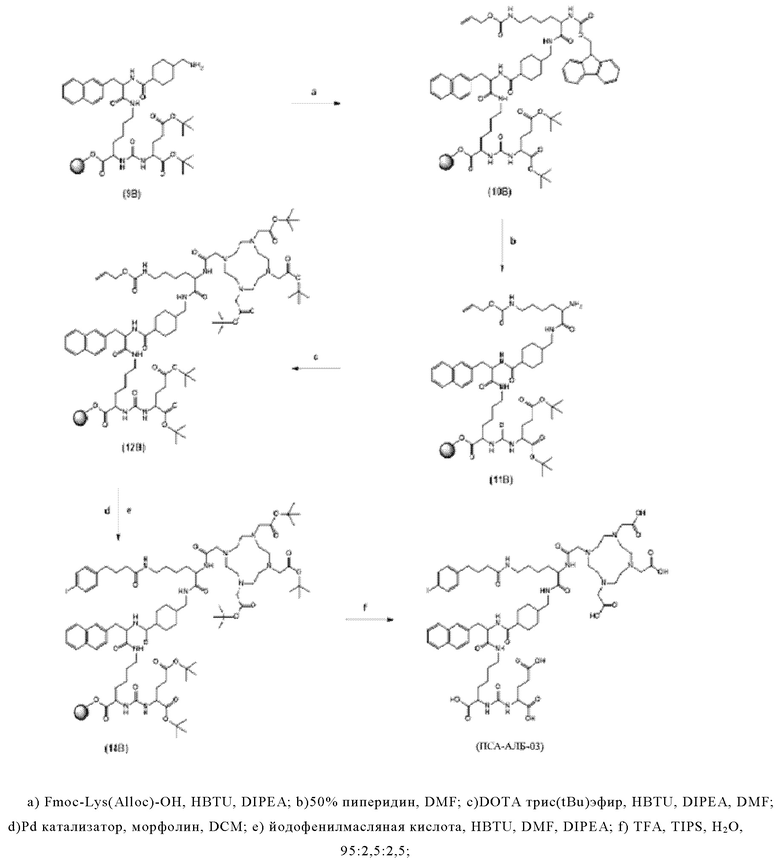
г) Синтез ПСА-АЛБ-04
Относительно количества покрытого лизином предшественника ПСА (9Б), 4 экв Dde, а также Fmoc защищенного L-лизина {(Dde-Lys(Fmoc)-OH; Merck; номер в каталоге 8540000001), 0.40 ммоль, 532.63 г/моль, [213 мг]} активировали 3.96 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.396 ммоль, 379.24 г/моль, [149 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл]} в безводном DMF. Через две минуты после добавления DIPEA, раствор добавляли к предварительно набухшему в DMF и иммобилизованному бис(tBu)- защищенному предшественнику ПСА (9B) и перемешивали в течение часа.
Полученное соединение (10Б) затем трижды промывали DMF1 и трижды DMF2. Селективное отщепление Fmoc-защитной группы от конечного соединения (10Б) осуществляли путем промывания смесью DMF и пиперидина в соотношении 1:1 один раз в течение 2 минут и затем еще раз в течение 5 минут для получения продукта 11(Б).
Конъюгацию хелатирующего агента и иммобилизованного на смоле соединения (11Б) осуществляли с 3 экв DOTA-трис(t-Bu)эфира {([2-(4,7,10-трис(2-(t-бутокси)-2-оксоэтил)- 1,4,7,10-тетраазациклододекан-1-ил)уксусная кислота]; CheMatech; номер в каталоге 137076-54-1), 0.30 ммоль, 572.73 г/моль[171 мг]}. Структурный блок, связывающий хелатирующий агент активировали 2,97 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.297 ммоль, 379.24 г/моль, [112 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл]} в безводном DMF. Через две минуты после добавления DIPEA, раствор добавляли к предварительно набухшему в DMF и иммобилизованному на смоле соединению (11Б). Присоединение хелатирующего агента DOTA происходило в течение 2-х часов при легком перемешивании.
Полученное соединение (12Б) затем трижды промывали DMF1 и трижды DMF2. Селективное отщепление Dde-защитной группы от конечного соединения (12Б) осуществляли путем промывания смеси 2% гидразином в DMF дважды в течение 5 минут и затем еще раз в течение 10 минут для получения конечного продукта (13Б).
Относительно количества покрытого смолой продукта (13Б), 2 экв дисукцинимидил суберата {([бис(N-гидроксисукцинимидовый эфир субериновой кислоты)]; Sigma; 68528-80-3), 0.20 ммоль, 368.34 г/моль, [74 мг]} активировали 1.98 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.198 ммоль, 379.24 г/моль, [73 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл]} в безводном DMF. Через две минуты после добавления DIPEA, раствор добавляли к иммобилизованному на смоле и предварительно набухшему в DMF продукту (13Б) и перемешивали в течение 1 часа.
Полученное соединение (14Б) затем промывали трижды DMF1 и трижды DMF2.
Описанный выше процесс синтеза кратко изображен на Схеме 1.4.
Схема 1.4: Объединение хелатирующего агента DOTA, ПСА предшественника и активного эфира ПСА-АЛБ-04

Синтез сопровождался параллельным получением альбумин-связывающего предшественника, начиная с 2-хлортритил хлорид смолы {(2-CT-Resin; Merck; номер в каталоге 8550170005), 0.20 ммоль, замещающая емкость 1.63 ммоль/г, 100-200 MESH, 1% DVB, общий объем набухания в CH2Cl2 >4.2 мл/г, [123 мг]} в 5 мл шприце с фильтром и комби стоппером, которую предварительно перемешивали с безводным дихлорметаном (DCM) в течение 45 минут.
Затем 2-СТ смолу трижды промывали безводным DCM после чего проводили реакцию с 1,2 экв Dde- а также Fmoc-защищенным L-лизином {(Dde-Lys(Fmoc)-OH; Bachem; номер в каталоге E-3385.0001), 0.24 ммоль, 532.64 г/моль, [128 мг] (15B)} и 4.8 экв DIPEA {0.96 ммоль, 129.24 г/моль, 0.742 г/мл, [167 мкл]} в 3 мл безводного DCM.
Присоединение первой защищенной аминокислоты к смоле (16Б) протекало в течение 16 часов при одновременном легком перемешивании.
Иммобилизованный на смоле L-лизин (16Б) трижды промывали DCM1 и трижды DCM2. Не вступившие в реакцию хлортритиловые группы, оставшиеся на смоле, пятикратно промывали смесью DCM, MeOH, и DIPEA в соотношении 17:2:1 (20 мл).
Последовательно, смолу с Dde и Fmoc-защищенным L-лизином промывали трижды DCM1, трижды DCM2, трижды DMF1, и наконец, трижды DMF2. Селективное отщепление Fmoc-защитных групп осуществляли путем промывания смесью DMF и пиперидина в соотношении 1:1 один раз в течение 2 мин и затем еще один раз в течение 5 минут для получения продукта (17Б).
Dde-защищенный L-лизин затем промывали трижды DMF1 и трижды DMF2, трижды DCM1, трижды DCM2 и, наконец, трижды Et2O и высушивали в вакууме.
Полученный таким образом покрытый смолой Dde-защищенный L-лизин (17Б) разделяли на две порции и одну из них использовали в следующей реакции. Такой покрытый смолой продукт перемешивали с безводным DCM в течение 45 минут и затем последовательно промывали трижды DMF и трижды DMF2.
Относительно количества смолы с иммобилизованным на ней лизином, 4 экв йодофенилмасляной кислоты {([4-(p-йодофенил)масляная кислота]; Sigma; I5634-5G), 0.40 ммоль, 290.10 г/моль, [116 мг]} активировали 3.96 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.396 ммоль, 379.24 г/моль, [149 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл]} в безводном DMF. Через две минуты после добавления DIPEA, раствор добавляли к иммобилизованному на смоле и предварительно набухшему в DMF продукту (17Б) и перемешивали в течение 1 часа.
Смолу с иммобилизованным Dde-защищенным L-лизином и йодофенил масляной кислотой (18Б) трижды промывали DMF1 и трижды DMF2. Селективное отщепление Dde-защитных групп от конечного соединения (18Б) осуществляли путем отмывания смеси 2% гидразином в DMF дважды в течение 5 минут и затем еще раз в течение 10 минут для получения продукта (19Б).
Альбумин-связывающий элемент (20B) получали путем перемешивания и последующего отщепления от смолы в течение 2 ч с использованием смеси, включавшей 5% TFA в DCM. Смесь растворителей выпаривали из продукта, сырой продукт растворяли в ACN и воде в соотношении 1:1 и очищали при помощи RP-HPLC.
Описанный выше процесс синтеза кратко изображен на Схеме 1.5.
Схема 1.5: Объединение альбумин-связывающего элемента для ПСА-АЛБ-04
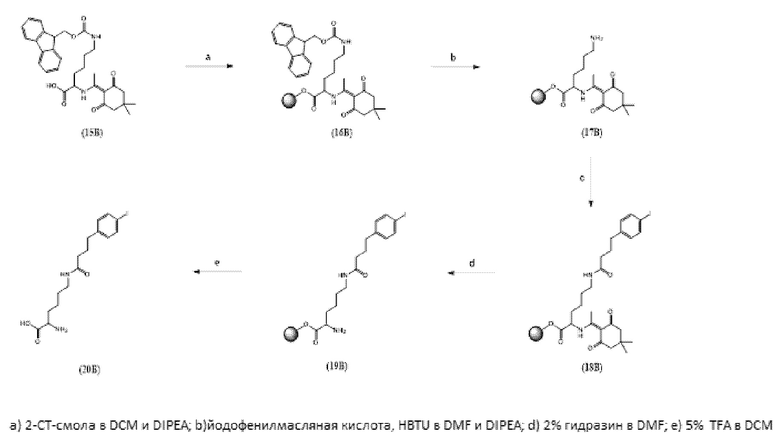
Наконец, осуществляли конъюгацию 3 экв очищенного альбумин-связывающего элемента (20Б). Продукт (20Б) растворяли в сухом DMF и добавляли 100 мкл DIPEA. Через две минуты после добавления DIPEA раствор (20Б) добавляли к иммобилизованному на смоле и предварительно набухшему в DMF продукту (14В) и перемешивали в течение 1 часа.
Полученное соединение (21Б) затем трижды промывали DMF1, трижды DMF2, трижды DCM1, трижды DCM2 и, наконец, трижды Et2O и высушивали в вакууме.
Конечное соединение ПСА-АЛБ-04 получали путем перемешивания и последующего отщепления от смолы в течение 2-х часов с использованием смеси, включавшей TFA, TIPS и H2O в соотношении 95:2.5:2.5. TFA выпаривали, сырой продукт растворяли в ACN и воде в соотношении 1:1 и очищали при помощи RP-HPLC.
Описанный выше процесс синтеза кратко изображен на Схеме 1.6.
Схема 1.6: Объединение альбумин-связывающего элемента и конъюгированного с DOTA ПСА предшественника для ПСА-АЛБ-04.
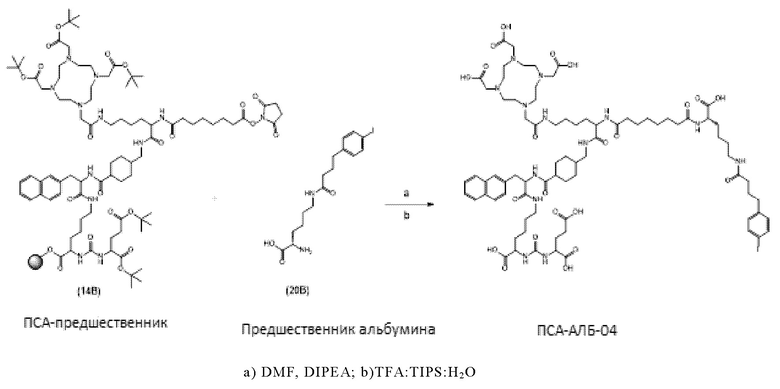
д) Синтез ПСА-АЛБ-05
Относительно количества покрытого лизином ПСА предшественника (9Б), 4 экв Fmoc, а также Alloc защищенного L-лизина {(Fmoc-Lys(Alloc)-OH; Merck; номер в каталоге 8521240005), 0.40 ммоль, 452.50 г/моль, [181 мг]} активировали 3.96 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.396 ммоль, 379.24 г/моль, [149 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл ]} в безводном DMF. Через две минуты после добавления DIPEA раствор добавляли к иммобилизованному на смоле и предварительно набухшему в DMF бис(tBu)-защищенному предшественнику ПСА (9В) и перемешивали в течение 1 часа.
Затем полученное соединение (10б) трижды промывали DMF1 и трижды DMF2. Селективное отщепление Fmoc-защитной группы от конечного соединения (10Б) осуществляли путем промывания смесью DMF и пиперидина в соотношении 1:1 один раз в течение 2 минут и затем еще раз в течение 5 минут для получения конечного продукта (11Б).
Относительно количества покрытого лизином ПСА предшественника (11Б), 3 экв Fmoc, а также tBu-защищенного D-аспартата {(Fmoc-D-Asp-OtBu; Merck; номер в каталоге 8521440001), 0.30 ммоль, 411.45 г/моль, [123 мг]} активировали 2.97 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.297 ммоль, 379.24 г/моль, [112 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл ]} в безводном DMF. Через две минуты после добавления DIPEA раствор добавляли к иммобилизованному на смоле и предварительно набухшему в DMF бис(tBu)-защищенному предшественнику ПСА (11Б) и перемешивали в течение 1 часа.
Полученное соединение (12Б) затем трижды промывали DMF1 и трижды DMF2. Селективное отщепление Fmoc-защитной группы от конечного соединения (12Б) осуществляли путем промывания смесью DMF и пиперидина в соотношении 1:1 один раз в течение 2 минут и затем еще раз в течение 5 минут для получения конечного продукта (13Б).
Относительно количества лизин- и аспартат-покрытого ПСА предшественника (13Б), 3 экв Fmoc, а также tBu -защищенного D-аспартата {(Fmoc-D-Asp-OtBu; Merck; номер в каталоге 8521440001), 0.30 ммоль, 411.45 г/моль, [123 мг]} активировали 2.97 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.297 ммоль, 379.24 г/моль, [112 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл ]} в безводном DMF. Через две минуты после добавления DIPEA раствор добавляли к иммобилизованному на смоле и предварительно набухшему в DMF бис(tBu)-защищенному предшественнику ПСА (11Б) и перемешивали в течение 1 часа.
Полученное соединение (14Б) затем трижды промывали DMF1 и трижды DMF2. Селективное отщепление Fmoc-защитной группы от конечного соединения (14Б) осуществляли путем промывания смесью DMF и пиперидина в соотношении 1:1 один раз в течение 2 минут и затем еще раз в течение 5 минут для получения конечного продукта (15Б).
Относительно количества покрытого смолой продукта (15Б) использовали 4 экв йодофенил-масляной кислоты {([4- (p-йодофенил)масляная кислота]; Sigma; I5634-5G), 0.40 ммоль, 290.10 г/моль, [116 мг]}, которую активировали 3.96 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.396 ммоль, 379.24 г/моль, [149 мг]} в присутствии безводного DMF. Через две минуты после добавления DIPEA, раствор добавляли к иммобилизованному на смоле и предварительно набухшему в DMF продукту (15Б) и перемешивали в течение 1 часа.
Полученное соединение (16Б) затем трижды промывали DMF1 и трижды DMF2, трижды DCM1 и, наконец, трижды DCM2.
Отщепление Alloc-защитных групп от соединения (16Б) осуществляли путем взаимодействия с 0,03 экв TPP Pd {(Sigma; Catalog номер в каталоге 216666-1G], 0.03 ммоль, 1155.56 г/моль, [35 мг]} в присутствии 30 экв морфолина {3,0 ммоль, 87.12 г/моль, 0.999 г/мл, [262 мкл]} в 3 мл безводного DCM. Реакцию осуществляли в течение 2-х часов в темноте с использованием алюминиевой фольги.
Затем смолу трижды промывали DCM1, трижды DCM2, трижды DMF1 и, наконец, трижды DMF2. Для удаления остатков палладия смолу дополнительно десять раз промывали 1% DIPEA в DMF (300 мкл DIPEA в 30 мл DMF2) и затем еще 10 раз по 5 минут раствором купрала {(Sigma; номер в каталоге D3506-100G), 225.31 г/моль} в DMF2 в концентрации 15 мг/мл (450 мг купрала в 30 мл DMF2). Полученное соединение (17Б) затем отмывали трижды DMF1 и трижды DMF2.
Конъюгацию хелатирующего агента с иммобилизованным на смоле соединением (17Б) осуществляли с 3 экв DOTA-трис(t-Bu)эфира {([2-(4,7,10-трис(2-(t-бутокси)-2-оксоэтил)-1,4,7,10-тетраазациклододекан-1-ил)уксусная кислота]; CheMatech; номер в каталоге 137076-54-1), 0.20 ммоль, 572.73 г/моль [171 мг]}. Структурный элемент, связывающий хелатирующий агент, активировали 2,97 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.297 ммоль, 379.24 г/моль, [112 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл]} в безводном DMF. Через две минуты после добавления DIPEA, раствор добавляют к иммобилизованному на смоле и предварительно набухшему в DMF соединению (17Б). Присоединение хелатирующего агента DOTA продолжалось в течение 2 часов при легком перемешивании. Полученное соединение (18Б) затем трижды отмывали DMF1, трижды DMF2, затем трижды DCM1, и, наконец, трижды DCM2 и, наконец, трижды Et2O и высушивали в вакууме.
Конечное соединение ПСА-АЛБ-05 получали путем перемешивания и последующего отщепления от смолы в течение 2-х часов с использованием смеси, включавшей TFA, TIPS и H2O в соотношении 95:2.5:2.5. TFA выпаривали, сырой продукт растворяли в ACN и воде в соотношении 1:1 и очищали при помощи RP-HPLC.
Описанный выше процесс синтеза кратко изображен на Схеме 1.7.
Схема 1.7: Объединение Альбумин-Связывающего элемента, хелатирующего агента DOTA и ПСА предшественника для ПСА-АЛБ-05.
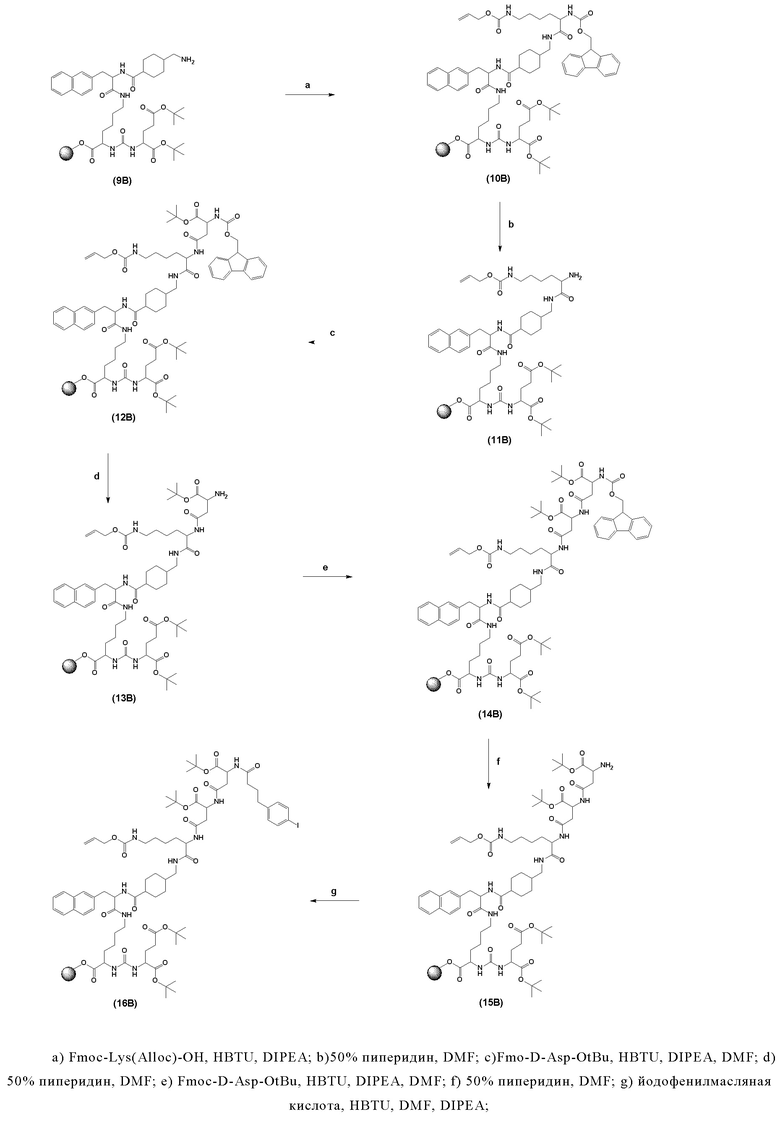
Схема 1.7 (продолжение): Объединение Альбумин-Связывающего элемента, хелатирующего агента DOTA и ПСА предшественника для ПСА-АЛБ-05.
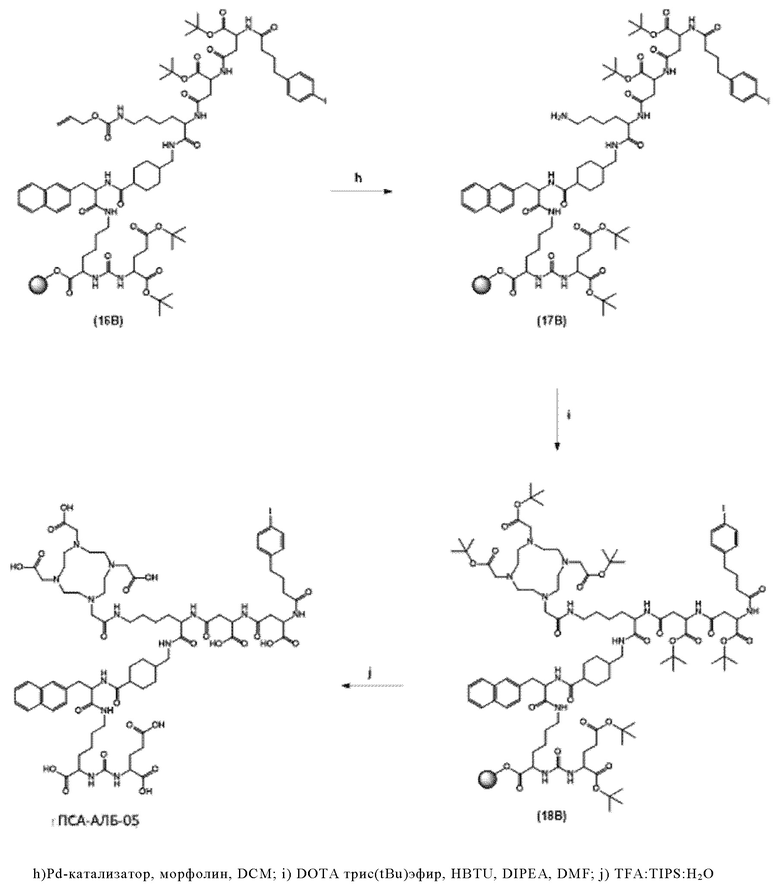
Относительно количества покрытого лизином ПСА предшественника (9), использовали 4 экв Fmoc, а также Alloc защищенного L-лизина {(Fmoc-Lys(Alloc)-OH; Merck; номер в каталоге 8521240005), 0.40 ммоль, 452.50 г/моль, [181 мг]} который активировали 3.96 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.396 ммоль, 379.24 г/моль, [149 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл ]} в безводном DMF. Через две минуты после добавления DIPEA раствор добавляли к иммобилизованному на смоле и предварительно набухшему в DMF бис(tBu)-защищенному предшественнику ПСА (9) и перемешивали в течение 1 часа.
Селективное удаление Fmoc-защитной группы с соединения (10) осуществляли путем промывания смесью DMX и пиперидина в соотношении 1:1 один раз в течение 2 минут и затем снова в течение 5 минут для получения продуктов (11).
Конъюгацию хелатирующего агента с иммобилизованным на смоле соединением (11) осуществляли с 2 экв DOTA-трис(t-Bu)эфира {([2-(4,7,10-трис(2-(t-бутокси)-2-оксоэтил)-1,4,7,10-тетраазациклододекан-1-ил)уксусная кислота]; CheMatech; номер в каталоге 137076-54-1), 0.20 ммоль, 572.73 г/моль [115 мг]}. Структурный элемент, связывающий хелатирующий агент, активировали 1,98 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.297 ммоль, 379.24 г/моль, [75 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл]} в безводном DMF. Через две минуты после добавления DIPEA, раствор добавляют к иммобилизованному на смоле и предварительно набухшему в DMF соединению (11). Присоединение хелатирующего агента DOTA продолжалось в течение 2 часов при легком перемешивании. Полученное соединение (12) затем трижды отмывали DMF1, трижды DMF2, затем трижды DCM1, и, наконец, трижды DCM2.
Отщепление Alloc-защитных групп осуществляли путем взаимодействия с 0,15 экв TPP Pd {( Sigma; Catalog номер в каталоге 216666-1G], 0.03 ммоль, 1155.56 г/моль, [35 мг]} в присутствии 30 экв морфолина {3.0 ммоль, 87.12 г/моль, 0.999 г/мл, [262 мкл]} в 3 мл безводного DCM. Реакцию осуществляли в темноте с использованием алюминиевой фольги.
Затем смолу трижды промывали DCM1, трижды DCM2, трижды DMF1 и, наконец, трижды DMF2. Для удаления остатков палладия смолу дополнительно десять раз промывали 1% DIPEA в DMF (300 мкл DIPEA в 30 мл DMF2) и затем еще 10 раз по 5 минут раствором купрала {(Sigma; номер в каталоге D3506-100G), 225.31 г/моль} в DMF2 в концентрации 15 мг/мл (450 мг купрала в 30 мл DMF2). Полученное соединение (13) затем трижды промывали DMF1 и трижды DMF2.
Наконец, для реакции объединения альбумин-связывающего элемента использовали 4 экв толил-масляной кислоты {([4-(p-толил)масляная кислота]; ABCR; AB119212), 0.40 ммоль, 178.23 г/моль, [71 мг]}, которую активировали 3.96 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.396 ммоль, 379.24 г/моль, [149 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл]} в безводном DMF. Через две минуты после добавления DIPEA раствор добавляли к иммобилизованному на смоле и предварительно набухшему в DMF продукту (13) и перемешивали в течение 1 часа.
Полученное соединение (14) затем трижды промывали DMF1, трижды DMF2, трижды DCM1, трижды DCM2 и, наконец, трижды Et2O и высушивали в вакууме.
Конечное соединение ПСА-АЛБ-06 получали путем перемешивания и последующего отщепления от смолы в течение 2-х часов с использованием смеси, включавшей TFA, TIPS и H2O в соотношении 95:2.5:2.5. TFA выпаривали, сырой продукт растворяли в ACN и воде в соотношении 1:1 и очищали при помощи RP-HPLC
Описанный выше процесс синтеза кратко изображен на Схеме 1.8.
Схема 1.8: Объединение Альбумин-Связывающего элемента, хелатирующего агента DOTA и ПСА предшественника для ПСА-АЛБ-06.

е) Синтез ПСА-АЛБ-07
Относительно количества покрытого лизином ПСА предшественника (9Б), использовали 4 экв Fmoc, а также Alloc защищенного L-лизина {(Fmoc-Lys(Alloc)-OH; Merck; номер в каталоге 8521240005), 0.40 ммоль, 452.50 г/моль, [181 мг]} который активировали 3.96 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.396 ммоль, 379.24 г/моль, [149 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл ]} в безводном DMF. Через две минуты после добавления DIPEA раствор добавляли к иммобилизованному на смоле и предварительно набухшему в DMF бис(tBu)-защищенному предшественнику ПСА (9В) и перемешивали в течение 1 часа.
Полученное соединение (10Б) затем трижды промывали DMF1, и трижды DMF2.
Селективное удаление Fmoc-защитной группы с соединения (10Б) осуществляли путем промывания смесью DMX и пиперидина в соотношении 1:1 один раз в течение 2 минут и затем снова в течение 5 минут для получения продуктов (11Б).
Относительно количества лизин-покрытого ПСА предшественника (11Б), 3 экв Fmoc, а также tBu -защищенного D-аспартата {(Fmoc-D-Asp-OtBu; Merck; номер в каталоге 8521440001), 0.30 ммоль, 411.45 г/моль, [123 мг]} активировали 2.97 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.297 ммоль, 379.24 г/моль, [112 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл ]} в безводном DMF. Через две минуты после добавления DIPEA раствор добавляли к иммобилизованному на смоле и предварительно набухшему в DMF бис(tBu)-защищенному предшественнику ПСА (11Б) и перемешивали в течение 1 часа.
Полученное соединение (12Б) затем трижды промывали DMF1, и трижды DMF2.
Селективное удаление Fmoc-защитной группы с полученного соединения (12Б) осуществляли путем промывания смесью DMX и пиперидина в соотношении 1:1 один раз в течение 2 минут и затем снова в течение 5 минут для получения продуктов (13Б).
Относительно количества лизин- и аспартат-покрытого ПСА предшественника (13Б), 3 экв Fmoc, а также tBu -защищенного D-аспартата {(Fmoc-D-Asp-OtBu; Merck; номер в каталоге 8521440001), 0.30 ммоль, 411.45 г/моль, [123 мг]} активировали 2.97 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.297 ммоль, 379.24 г/моль, [112 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл ]} в безводном DMF. Через две минуты после добавления DIPEA раствор добавляли к иммобилизованному на смоле и предварительно набухшему в DMF бис(tBu)-защищенному предшественнику ПСА (13Б) и перемешивали в течение 1 часа.
Полученное соединение (14Б) затем трижды промывали DMF1 и трижды DMF2.
Селективное удаление Fmoc-защитной группы с полученного соединения (14Б) осуществляли путем промывания смесью DMX и пиперидина в соотношении 1:1 один раз в течение 2 минут и затем снова в течение 5 минут для получения продуктов (15Б).
Относительно количества лизин- и аспартат-покрытого ПСА предшественника (15Б), 3 экв Fmoc, а также tBu -защищенного D-аспартата {(Fmoc-D-Asp-OtBu; Merck; номер в каталоге 8521440001), 0.30 ммоль, 411.45 г/моль, [123 мг]} активировали 2.97 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.297 ммоль, 379.24 г/моль, [112 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл ]} в безводном DMF. Через две минуты после добавления DIPEA раствор добавляли к иммобилизованному на смоле и предварительно набухшему в DMF бис(tBu)-защищенному предшественнику ПСА (15Б) и перемешивали в течение 1 часа.
Полученное соединение (16Б) затем трижды промывали DMF1, и трижды DMF2.
Селективное удаление Fmoc-защитной группы с полученного соединения (14Б) осуществляли путем промывания смесью DMX и пиперидина в соотношении 1:1 один раз в течение 2 минут и затем снова в течение 5 минут для получения продуктов (17Б).
Относительно количества покрытого смолой продукта (17Б) использовали 4 экв йодофенил-масляной кислоты {([4- (p-йодофенил)масляная кислота]; Sigma; I5634-5G), 0.40 ммоль, 290.10 г/моль, [116 мг]}, которую активировали 3.96 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.396 ммоль, 379.24 г/моль, [149 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл]}. Через две минуты после добавления DIPEA, раствор добавляли к иммобилизованному на смоле и предварительно набухшему в DMF продукту (17Б) и перемешивали в течение 1 ч.
Полученное соединение (18Б) затем трижды промывали DMF1 и трижды DMF2, трижды DCM1 и, наконец, трижды DCM2.
Отщепление Alloc-защитных групп от соединения (18Б) осуществляли путем взаимодействия с 0,03 экв TPP Pd {( Sigma; Catalog номер в каталоге 216666-1G], 0.03 ммоль, 1155.56 г/моль, [35 мг]} в присутствии 30 экв морфолина {3.0 ммоль, 87.12 г/моль, 0.999 г/мл, [262 мкл]} в 3 мл безводного DCM. Реакцию осуществляли в темноте в течение 2 часов с использованием алюминиевой фольги.
Затем смолу трижды промывали DCM1, трижды DCM2, трижды DMF1 и, наконец, трижды DMF2. Для удаления остатков палладия смолу дополнительно десять раз промывали 1% DIPEA в DMF (300 мкл DIPEA в 30 мл DMF2) и затем еще 10 раз по 5 минут раствором купрала {(Sigma; номер в каталоге D3506-100G), 225.31 г/моль} в DMF2 в концентрации 15 мг/мл (450 мг купрала в 30 мл DMF2). Полученное соединение (19Б) затем трижды промывали DMF1 и трижды DMF2.
Конъюгацию хелатирующего агента с иммобилизованным на смоле соединением (19Б) осуществляли с 3 экв DOTA-трис(t-Bu)эфира {([2-(4,7,10-трис(2-(t-бутокси)-2-оксоэтил)-1,4,7,10-тетраазациклододекан-1-ил)уксусная кислота]; CheMatech; номер в каталоге 137076-54-1), 0.30 ммоль, 572.73 г/моль [171 мг]}. Структурный элемент, связывающий хелатирующий агент, активировали 2,97 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.297 ммоль, 379.24 г/моль, [112 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл]} в безводном DMF. Через две минуты после добавления DIPEA, раствор добавляют к иммобилизованному на смоле и предварительно набухшему в DMF соединению (17Б). Присоединение хелатирующего агента DOTA продолжалось в течение 2 часов при легком перемешивании.
Полученное соединение (20Б) затем трижды отмывали DMF1, трижды DMF2, затем трижды DCM1, и, наконец, трижды DCM2 и, наконец, трижды Et2O и высушивали в вакууме.
Конечное соединение ПСА-АЛБ-07 получали путем перемешивания и последующего отщепления от смолы в течение 2-х часов с использованием смеси, включавшей TFA, TIPS и H2O в соотношении 95:2.5:2.5. TFA выпаривали, сырой продукт растворяли в ACN и воде в соотношении 1:1 и очищали при помощи RP-HPLC.
Описанный выше процесс синтеза кратко изображен на Схеме 1.9.
Схема 1.9: Объединение Альбумин-Связывающего элемента, хелатирующего агента DOTA и ПСА предшественника для ПСА-АЛБ-07.

Схема 1.9 (продолжение): Объединение Альбумин-Связывающего элемента, хелатирующего агента DOTA и ПСА предшественника для ПСА-АЛБ-07.
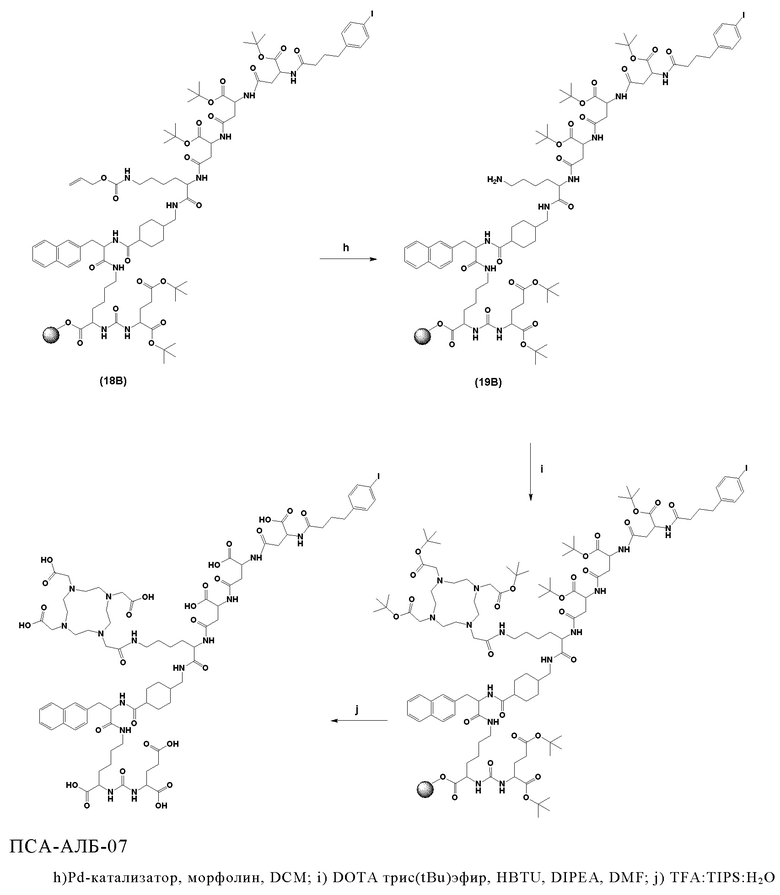
ж) Синтез ПСА-АЛБ-08
Относительно количества покрытого лизином ПСА предшественника (9Б), использовали 4 экв Fmoc, а также Alloc защищенного L-лизина {(Fmoc-Lys(Alloc)-OH; Merck; номер в каталоге 8521240005), 0.40 ммоль, 452.50 г/моль, [181 мг]} который активировали 3.96 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.396 ммоль, 379.24 г/моль, [149 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл ]} в безводном DMF. Через две минуты после добавления DIPEA раствор добавляли к иммобилизованному на смоле и предварительно набухшему в DMF бис(tBu)-защищенному предшественнику ПСА (9В) и перемешивали в течение 1 часа.
Полученное соединение (10Б) затем трижды промывали DMF1, и трижды DMF2. Селективное удаление Fmoc-защитной группы с соединения (10Б) осуществляли путем промывания смесью DMX и пиперидина в соотношении 1:1 один раз в течение 2 минут и затем снова в течение 5 минут для получения продуктов (11Б).
Относительно количества лизин- и аспартат-покрытого ПСА предшественника (11Б), 3 экв Fmoc, а также tBu -защищенного D-аспартата {(Fmoc-D-Asp-OtBu; Merck; номер в каталоге 8521440001), 0.30 ммоль, 411.45 г/моль, [123 мг]} активировали 2.97 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.297 ммоль, 379.24 г/моль, [112 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл ]} в безводном DMF. Через две минуты после добавления DIPEA раствор добавляли к иммобилизованному на смоле и предварительно набухшему в DMF бис(tBu)-защищенному предшественнику ПСА (11Б) и перемешивали в течение 1 часа.
Полученное соединение (12Б) затем трижды промывали DMF1, и трижды DMF2. Селективное удаление Fmoc-защитной группы с соединения (12Б) осуществляли путем промывания смесью DMX и пиперидина в соотношении 1:1 один раз в течение 2 минут и затем снова в течение 5 минут для получения продуктов (15Б).
Относительно количества лизин- и аспартат-покрытого ПСА предшественника (13Б), 3 экв Fmoc, а также tBu -защищенного D-аспартата {(Fmoc-D-Asp-OtBu; Merck; номер в каталоге 8521440001), 0.30 ммоль, 411.45 г/моль, [123 мг]} активировали 2.97 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.297 ммоль, 379.24 г/моль, [112 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл ]} в безводном DMF. Через две минуты после добавления DIPEA раствор добавляли к иммобилизованному на смоле и предварительно набухшему в DMF бис(tBu)-защищенному предшественнику ПСА (11Б) и перемешивали в течение 1 часа.
Полученное соединение (14Б) затем трижды промывали DMF1, и трижды DMF2. Селективное удаление Fmoc-защитной группы с соединения (12Б) осуществляли путем промывания смесью DMX и пиперидина в соотношении 1:1 один раз в течение 2 минут и затем снова в течение 5 минут для получения продуктов (15Б).
Относительно количества лизин- и аспартат-покрытого ПСА предшественника (15Б), 3 экв Fmoc, а также tBu -защищенного D-аспартата {(Fmoc-D-Asp-OtBu; Merck; номер в каталоге 8521440001), 0.30 ммоль, 411.45 г/моль, [123 мг]} активировали 2.97 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.297 ммоль, 379.24 г/моль, [112 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл ]} в безводном DMF. Через две минуты после добавления DIPEA раствор добавляли к иммобилизованному на смоле и предварительно набухшему в DMF бис(tBu)-защищенному предшественнику ПСА (11Б) и перемешивали в течение 1 часа.
Полученное соединение (16Б) затем трижды промывали DMF1, и трижды DMF2. Селективное удаление Fmoc-защитной группы с соединения (14Б) осуществляли путем промывания смесью DMX и пиперидина в соотношении 1:1 один раз в течение 2 минут и затем снова в течение 5 минут для получения продуктов (17Б).
Относительно количества покрытого смолой продукта (17Б) использовали 4 экв толил-масляной кислоты (0,40 ммоль), которую активировали 3.96 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.297 ммоль, 379.24 г/моль, [112 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл ]} в безводном DMF. Полученное соединение (18Б) затем трижды отмывали DMF1, трижды DMF2, трижды DCM2, трижды DCM1 и, наконец, трижды DCM2.
Отщепление Alloc-защитных групп от соединения (18Б) осуществляли путем взаимодействия с 0,03 экв TPP Pd {( Sigma; Catalog номер в каталоге 216666-1G], 0.03 ммоль, 1155.56 г/моль, [35 мг]} в присутствии 30 экв морфолина {3.0 ммоль, 87.12 г/моль, 0.999 г/мл, [262 мкл]} в 3 мл безводного DCM. Реакцию осуществляли в темноте в течение 2 часов с использованием алюминиевой фольги.
Затем смолу трижды промывали DCM1, трижды DCM2, трижды DMF1 и, наконец, трижды DMF2. Для удаления остатков палладия смолу дополнительно десять раз промывали 1% DIPEA в DMF (300 мкл DIPEA в 30 мл DMF2) и затем еще 10 раз по 5 минут раствором купрала {(Sigma; номер в каталоге D3506-100G), 225.31 г/моль} в DMF2 в концентрации 15 мг/мл (450 мг купрала в 30 мл DMF2). Полученное соединение (19Б) затем трижды промывали DMF1 и трижды DMF2.
Конъюгацию хелатирующего агента с иммобилизованным на смоле соединением (19Б) осуществляли с 3 экв DOTA-трис(t-Bu)эфира {([2-(4,7,10-трис(2-(t-бутокси)-2-оксоэтил)-1,4,7,10-тетраазациклододекан-1-ил)уксусная кислота]; CheMatech; номер в каталоге 137076-54-1), 0.30 ммоль, 572.73 г/моль [171 мг]}. Структурный элемент, связывающий хелатирующий агент, активировали 2,97 экв HBTU {(Sigma; номер в каталоге 12804-25G-F), 0.297 ммоль, 379.24 г/моль, [112 мг]} в присутствии 4 экв DIPEA {0.40 ммоль, 129.24 г/моль, 0.742 г/мл, [70 мкл]} в безводном DMF. Через две минуты после добавления DIPEA, раствор добавляют к иммобилизованному на смоле и предварительно набухшему в DMF соединению (17Б). Присоединение хелатирующего агента DOTA продолжалось в течение 2 часов при легком перемешивании.
Полученное соединение (20Б) затем трижды отмывали DMF1, трижды DMF2, затем трижды DCM1, и, наконец, трижды DCM2 и, наконец, трижды Et2O и высушивали в вакууме.
Конечное соединение ПСА-АЛБ-07 получали путем перемешивания и последующего отщепления от смолы в течение 2-х часов с использованием смеси, включавшей TFA, TIPS и H2O в соотношении 95:2.5:2.5. TFA выпаривали, сырой продукт растворяли в ACN и воде в соотношении 1:1 и очищали при помощи RP-HPLC
Описанный выше процесс синтеза кратко изображен на Схеме 1.10.
Схема 1.10: Объединение альбумин-связывающей молекулы, хелатирующего агента, DOTA и ПСА предшественника для ПСА-АЛБ-08.
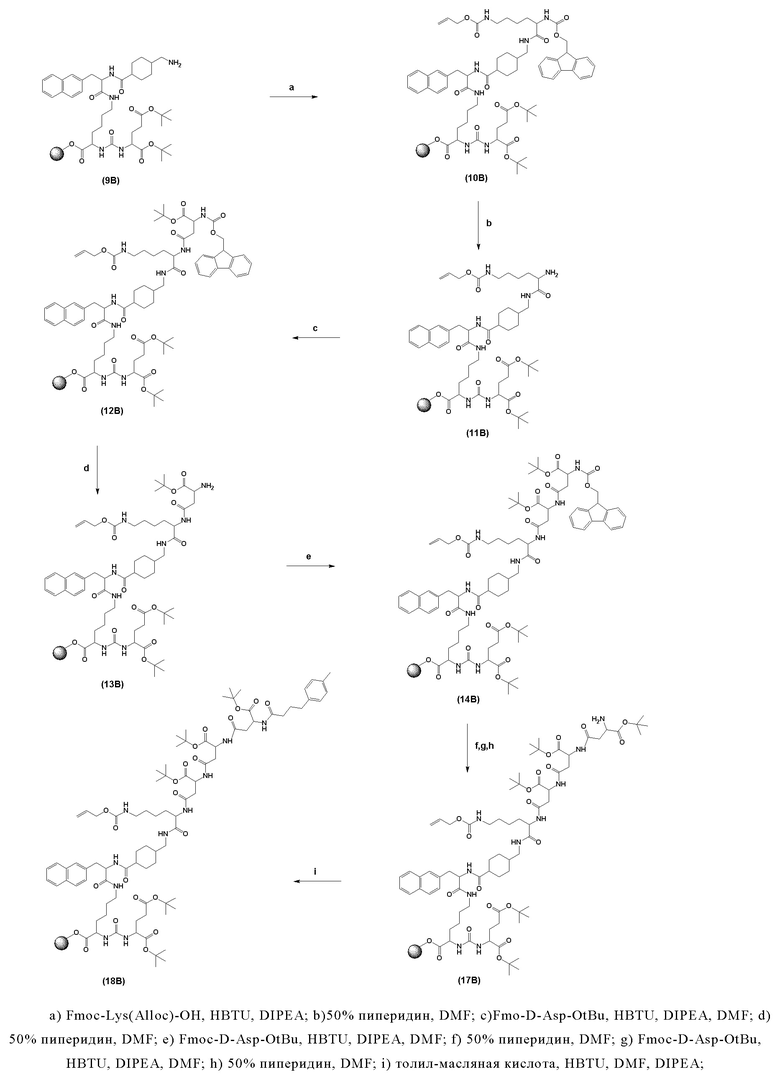
Схема 1.10 (продолжение): Объединение альбумин-связывающей молекулы, хелатирующего агента, DOTA и ПСА предшественника для ПСА-АЛБ-08.
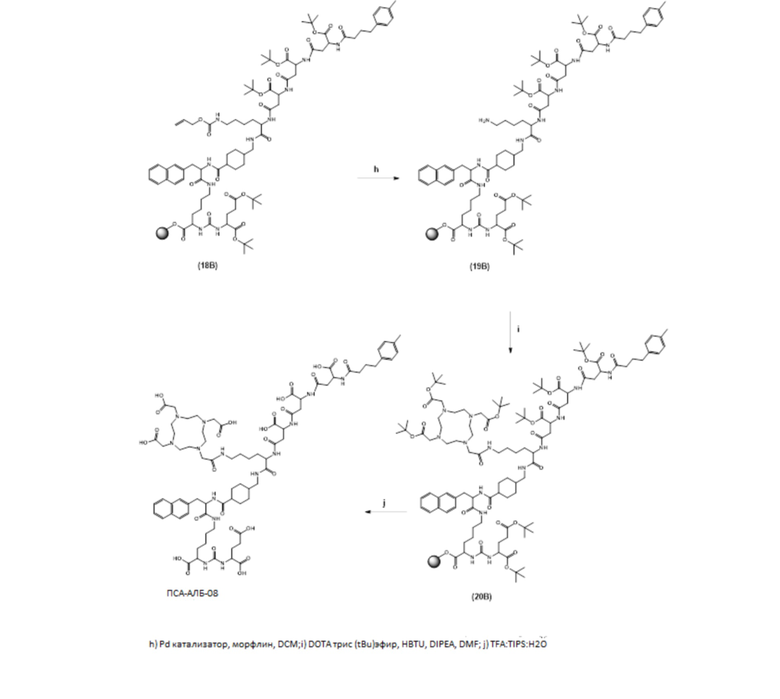
1.1.3: ВВЕДЕНИЕ МЕЧЕНОГО АТОМА 177Lu В ПСА ЛИГАНДЫ И ИХ ОЦЕНКА IN VITRO
In vitro исследования осуществляли с использованием 177Lu-ПСА-АЛБ-01/-03/-04/-05/-06/-07/-08. Они включали первичную оценку точности введения метки, определение коэффициентов распределения для n-октанол/PBS и исследование связывания сывороточных белков. Кроме того, эксперименты для оценки захвата и интернализации соединений осуществляли при помощи ПСА-трансфицированной мышиной линии ПСА поз PC-3 PIP (позитивный контроль) и mock-трансфицированной мышиной линии ПСА нег PC-3 flu (негативный контроль).
а) ПСА-лиганды и радионуклиды
ПСА -лиганды 177Lu-ПСА-АЛБ-01/-03/-04/-05/-06/-07/-08 синтезировали как описано выше. Контрольное соединение (ПСА-617) получали в компании “Advanced Biochemical Compounds” (ABX GmbH, Radeberg, Germany). Свободный от носителя изотоп 177Lu в 0.05 M HCl получали в компании Isotope Technologies Garching (ITG GmbH, Germany).
б) Введение радиоактивной метки
Основной раствор ПСА-617 получали путем разведения в воде MilliQ до конечной концентрации 1 ммоль. 177Lu-ПСА-АЛБ-01/-03/-04/-05/-06/-07/-08 разводили в воде MilliQ /DMSO до получения конечной концентрации 1 моль. Все соединения помечали 177Lu в 1:5 смеси ацетата натрия (0.5 моль, pH 8) и HCl (0.05 моль, pH ~1) при pH 3.5-4.5. Соединения помечали 177Lu при специфической активности, составлявшей от 5 до 50 МБк/нмоль в зависимости от условий эксперимента. Реакционную смесь инкубировали в течение 15 минут при 95°C с последующим контролем качества с использованием высокоэффективной жидкостной хроматографии с обращено-фазной колонкой С-18 (XterraTM MS, C18, 5 мкм, 150×4.6 мм; Waters). Мобильная фаза включала MilliQ воду с 0,1% трифторуксусной кислотой (А) и ацетонитрилом (Б) с градиентом 95% А и 5% до 20% А и 80% B в течение 15 минут при скорости потока 1,0 мл/мин. Радиоактивные лиганды разводили водой MilliQ, содержащей Na-DTPA (50 мкм (микромоль)) перед нанесением на колонку для HPLC.
в) Определение коэффициента распределения для n-Octanol/PBS
177Lu-ПСА-АЛБ-01/-03/-04/-05/-06/-07/-08 и ПСА-617 помечали 177Lu при специфической активности 50 МБк/нмоль. Затем в реакционную пробирку, содержащую 1475 мкл PBS рН 7,5 и 1500 мкЛ n-октанола, добавляли радиоактивный лиганд (0.5 МБк; 10 пкмоль, 25 мкл). Затем содержимое пробирок перемешивали вихревым способом с последующим этапом центрифугирования для разделения фаз. Наконец, радиоактивность установленного объема PBS и n-октанола измеряли в гамма-счетчике (Perkin Elmer, Wallac Wizard 1480) для расчета коэффициентов распределения, выраженных через логарифм соотношения количества импульсов в минуту (cpm - Count Per Minute), измеренных в фазу n-октанола к количеству импульсов в минуту в фазу PBS.
г) Ультрафильтрация
Связывание 177Lu-ПСА-АЛБ-01/-03/-04/-05/-06/-07/-08 и 177Lu-ПСА-617 в плазме определяли при помощи ультрафильтрации.
Следовательно, соединения помечали 177Lu при специфической активности 50 МБк/нмоль и инкубировали с образцами человеческой плазмы или PBS при комнатной температуре. Свободную фракцию и связанную с плазмой фракцию разделяли при помощи прибора для ультрафильтрации на центрифуге (4104 фильтрационных единиц [Millipore]; 30000 Da номинальное ограничение по молекулярному весу, метилцеллюлозные мембраны для микрочастиц). Инкубационный раствор помешали в прибор для ультрафильтрации и центрифугировали при 2500 об/мин в течение 40 мин при 20°C. Собирали образцы из фильтрата и анализировали их радиоактивность при помощи гамма-счетчика. Количество соединения, связавшееся с плазмой, определяли как фракцию радиоактивности, измеренную в фильтрате по отношению к соответствующему исходному раствору (принято за 100%).
д) Анализ процесса клеточной интернализации
Изучение процессов клеточного захвата и интернализации осуществляли с 177Lu-ПСА-АЛБ-01/-03/-04/-05/-06/-07/-08 и контрольным соединением 177Lu-ПСА-617 с использованием ПСА-трансфицированной ПСАпол+ PC-3 PIP клеточной линии и mock-трансфицированных ПСАотр- PC-3 flu клеточной линии, для изучения специфичности новых соединений.
Клетки выращивали на клеточной среде RPMI, обогащенной 10% фетальной телячьей сывороткой, L-глутамином, антибиотиками и пиромуцином (2 мкг/мл) при 37°C и 5% CO2 (стандартные условия). Стандартную клеточную культуру получали два раза в неделю с использованием PBS/ЭДТА (2 ммоль) для промывания клеток и трипсина для отделения клеток. Клетки переносили на 12-луночные планшеты (~3×105 клеток в 2 мл RPMI среды на лунку) и оставляли для адгезии и роста на ночь при стандартных условиях. Затем удаляли супернатант и клетки промывали PBS pH 7.4, после чего добавляли RPMI среду без добавок (975 мкл/лунка). Соединения помечали 177Lu при специфической активности 5 МБк/нмоль и разводили 1.5 МБк/мл в 0.05% бычьем сывороточном альбумине (с)/0.9% NaCl растворе для предотвращения налипания к пластиковым флаконам. Клетки инкубировали с 25 мкл (~37.5 кБк на лунку) меченых радиоактивной меткой ПСА лигандов при стандартных условиях в течение 2 ч и 4 ч, соответственно. После инкубации клетки трижды отмывали ледяным PBS и определяли общий захват меченых радиоактивными метками лигандов (ПСА-связанная фракция на поверхности и интернализированная фракция). Фракцию интернализированного радиоактивного лиганда оценивали в клетках, которые промывали ледяным PBS, с последующей инкубацией с проявляющим буфером в течение 10 минут (0.05 M глицинового проявляющего буфера в 100 ммоль NaCl, pH 2.8) и дополнительно отмывали вновь ледяным PBS. Клеточные образцы лизировали добавлением NaOH (1 M, 1 мл) в каждую лунку. Образцы клеточных суспензий анализировали на γ-счетчике (Perkin Elmer, Wallac Wizard 1480). После гомогенизации клеточных суспензий, определяли концентрацию белков в каждом образце с использованием набора Micro BCA Protein Assay (Pierce, Therma Scientific). Результаты выражали как процент от общей величины добавленной радиоактивности на 150 мкг/мл белка.
1.2 РЕЗУЛЬТАТЫ
1.2.1 ЭФФЕКТИВНОСТЬ ВВЕДЕНИЯ МЕТОК
ПСА-АЛБ-01 и -03 были удачно мечены 177Lu при специфической активности не более 100 МБк/нмоль и прекрасным радиоактивным выходом >98%. ПСА-АЛБ-04, -05, -06, -07 и -08 в предварительных испытаниях были мечены 177Lu при специфической активности не более 50 МБк/нмоль и прекрасным радиоактивным выходом >97%.
Специфическая активность радиоактивного изотопа, которая использовалась в экспериментах (если дополнительно не оговаривается иное) составляла 50 МБк/нмоль. Радиохимическая чистота соединений, которые использовались для исследований for in vitro и in vivo всегда была >97% (Фигура 1).
1.2.2 КОЭФФИЦИЕНТ РАСПРЕДЕЛЕНИЯ ДЛЯ n-ОКТАНОЛ/PBS
177Lu-ПСА-АЛБ-01, -03, -04 и -06 продемонстрировали одинаковые коэффициенты распределения для n-октанола/PBS (LogD величина), в то время как коэффициенты для 177Lu-ПСА-АЛБ-05, -07 и -08 свидетельствовали о том, что эти соединения чуть более гидрофильны. В целом, полученные результаты говорят о том, что введение альбумин-связывающего элемента снижает гидрофильность по сравнению с контрольным соединением 177Lu-ПСА-617, однако все соединения тем не менее являются гидрофильными с величинами logD > 2.7 (Фигура 2).
1.2.3 АЛЬБУМИН-СВЯЗЫВАЮЩИЕ СВОЙСТВА
Анализ 177Lu-ПСА-АЛБ-01, -03, -04, -05, -06 и -07 при помощи ультрафильтрации показал высокую способность соединений связываться с белками плазмы (>94%), при этом они не проникали через фильтр при инкубации с образцами человеческой плазмы. Способность легко проникать через фильтр у соединений была продемонстрирована при их инкубации в PBS без белков плазмы (Рисунок 3). Новые синтезированные соединения продемонстрировали более выраженную способность связываться с плазматическими белками по сравнению с контрольным соединением 177Lu-ПСА-617, у которого связанная с альбумином фракция составила лишь около 44% (Фигура 3)
1.2.4 ИНТЕРНАЛИЗАЦИЯ
Клеточный захват и интернализацию ПСА лигандов 177Lu-ПСА-АЛБ-01, 03, -04, -05, -06, -07 и -08 изучали и сравнивали с контрольным соединением 177Lu-ПСА-617 на клеточной линии PC-3 PIP/flu (Фигура 4). Захват всех соединений PC-3 PIP клетками (ПСАпоз+) была сопоставима с захватом соединения 177Lu-ПСА-617 через 2 ч или 4 ч, соответственно. Интересно что, интернализированная фракция ПСА лигандов была больше, чем у 177Lu-ПСА-617 через 2 ч и 4 ч соответственно. Скорость интернализации 177Lu-ПСА-АЛБ-06 и 177Lu-ПСА-АЛБ-08 опять же была сопоставима со скоростью для 177Lu-ПСА-617. Захват радиоактивных лигандов PC-3 flu клетками (ПСАотр-) составил <0.5%, что доказывает высоко ПСА-специфичный захват/интернализацию всех соединений.
Пример 2: Исследование ПСА лигандов in vivo на мышиных опухолевых моделях
Свойства 177Lu-ПСА-АЛБ-01, -03, -04, -05, -06, -07 и -08 изучали in vivo. Для этого иммунодефицитным Balb/c голым мышам вводили ПСА поз PC-3 PIP и ПСА нег PC-3 flu клетки. После внутривенного (в/в) введения лигандов, проводили SPECT/КТ обследование и анализ экстенсивного биораспределения. Данные о захвате опухолевыми клетками, соотношение опухолевые клетки/кровь, опухолевые клетки/почки и опухолевые клетки/печень для 177Lu-ПСА-АЛБ-01-08 представлены на Фигурах 5 и 6.
2.1 МАТЕРИАЛЫ И МЕТОДЫ
2.1.1 МЫШИНЫЕ ОПУХОЛЕВЫЕ МОДЕЛИ
Мышей возрастом 5-6 недель получали в лаборатории Charles River, Sulzfeld, Germany. Бестимусным мышам женского пола линии Balb/c подкожно в правое плечо вводили PC-3 PIP клетки (6 x 106 клеток в 100 мкл в сбалансированном солевом растворе Хенкса (HBSS) с Ca2+/Mg2+), а в левое плечо PC-3 flu клетки (5 x 106 клеток в 100 мкл HBSS Ca2+/Mg2+). Две недели спустя, когда опухоли достигли размера приблизительно 200-300 мм3, достаточного для изучения биораспределения и визуализации.
2.1.2 АНАЛИЗ БИОРАСПРЕДЕЛЕНИЯ
Биораспределение анализировали при помощи мышей опухоленосителей линии PC-3 PIP/flu, которым вводили опухолевые клетки за две недели до введения ПСА лигандов. Радиоактивные лиганды разводили 0,9% NaCl и вводили внутривенно в объеме 100-200 мкл. Мышей усыпляли через разное время после инъекции (после введения) радиоактивных лигандов. Получали образцы выбранных тканей и органов, взвешивали и измеряли радиоактивность при помощи гамма-счетчика. К полученным результатам применяли поправку на радиоактивный распад и выражали как процент введенной величины радиоактивности на грамм образца ткани (% IA/г).
2.1.3 ВИЗУАЛИЗАЦИЯ ПРИ ПОМОЩИ SPECT/КТ
SPECT/КТ исследование проводили при помощи специально предназначенной небольшой SPECT/КТ камеры для животных (NanoSPECT/CTTM, Mediso Medical Imaging Systems, Budapest, Hungary). ПСА лиганды помечали при специфической активности в 5 МБк/нмоль и разводили в солевом растворе, содержащем 0.05% BSA. Сканирование выполняли через 4 ч, 24 ч и 72 ч после введения меченых радиоактивным веществом лигандов (25 МБк, 1 нмоль, 100 мкл). Данные первично обрабатывали при помощи программного обеспечения NanoSPECT/CTTM, пост-обработку проводили при помощи VivoQuant (версия 3.0, inviCRO Imaging Services and Software, Boston USA). Применяли пост-реконструкционный фильтр Гауса (ПШПВ = 1 мм) и на изображениях устанавливали шкалу радиоактивности (минимальная величина = 0,095 Бк/воксел, максимальная величина - 95 Бк/воксел).
2.1.4 ЛЕЧЕНИЕ МОДЕЛЬНЫХ МЫШЕЙ
Мышей, статистически идентичных по массе тела и объему опухоли, разделяли на 5 групп (Группы A - Д, n=6) и на День 0 исследования вводили им только носитель (солевой раствор, содержащий BSA 0,05%, Группа А), 177Lu-ПСА-617 (Группы Б и В) и 177Lu-ПСА-АЛБ-06 (Группы Г и Д) соответственно. (Таблица 2.1). Мыши из групп Б и Г получили 2 МБк радиоактивного лиганда (1 нмоль/мышь), в то время как мыши из Групп В и Д получили 5 МБк радиоактивного лиганда (1 нмоль/мышь. Мышей наблюдали, через день измеряли массу тела и объем опухоли в течение 12 недель. Мышей усыпляли, когда были достигнуты предварительно установленные конечные точки эксперимента, или по завершении исследования на День 84. Относительная масса тела (RBW) определялась как соотношение [BWx/BW0], где BWx - масса тела в граммах в заданный день х, а BW0 - масса тела животных в граммах на начало исследования, т.е. в День 0. Величину опухоли определяли путем измерения ее самого длинного размера (L) и размера, перпендикулярного первому (W) при помощи цифрового калипера. Объем опухоли (V) рассчитывали при помощи уравнения V=0.5*(L*W2)]. Относительный объем опухоли (RTV) определялась как соотношение [TVx/TV0], где TVx представляет собой объем опухоли в мм3 в заданный день x, а TV0 объем опухоли в мм3 на начало исследования, т.е. в День 0.
a Радиоактивность в шприце, измеренная до и после введения соответствующему животному.
b Существенных различий между величинами, измеренными для каждой группы, отмечено не было (p>0,05).
Эффективность терапии радионуклидами выражали через индекс задержки роста опухоли (TGDx), который рассчитывали, как время, необходимое для достижения опухоли объема, в 10 раз превышающего исходный, на День 0. Индекс задержки роста опухоли [TGDIx = TGDx(T)/TGDx(C)] рассчитывали как соотношение TGDx для мышей, получавших лечение (T) к показателю для контрольных животных (С) для двухкратного (x=2, TGD2) и 5-кратного (x=5, TGD5) увеличения опухолевого объема. Для оценки нежелательных побочных эффектов сравнивали показатели массы тела животных в день усыпления первого контрольного животного. После эвтаназии изымали у животных почки, печень и головной мозг и взвешивали их. Соотношения массы для органов (почки/головной мозг и печень/головной мозг) рассчитывали, используя массу органов, измеренную в день смерти животных.
Значимость данных анализировали, как раскрыто в разделе результаты исследования, с использованием однофакторного дисперсионного анализа (ANOVA) с последующим множественным сравнением при помощи критерия Тьюки на программном обеспечении GraphPad Prism (версия 7). Величина р<0,05 считалась статистически значимой. Анализ выживаемости осуществляли на кривых Каплана-Майера и при помощи тестов логарифмического ряда (Мантела-Хаенжела).
2.2 РЕЗУЛЬТАТЫ
2.2.1 БИОРАСПРЕДЕЛЕНИЕ 177Lu-ПСА-АЛБ-01 И 177Lu-ПСА-АЛБ-03
Распределение 177Lu-ПСА-АЛБ-01 и 177Lu-ПСА-АЛБ-03 в тканях изучали на протяжении 8 дней. Соединения 177Lu-ПСА-АЛБ-01 и 177Lu-ПСА-АЛБ-03 продемонстрировали одинаковые профили распределения в тканях (Фигура 5А).
Высокий уровень радиоактивности, который может наблюдаться в кровеносном русле в ранние временные точки, медленно, но уверенно снижается с течением времени.
Захват обоих радиоактивных лигандов ПСАпол+ PC-3 PIP опухолями увеличивался до достижения плато и практически не падал до окончания исследования. Захват PC-3 flu опухолями был существенно ниже уровня в крови, что говорит о высокой специфичности ПСА-связывания и захвата in vivo (Фигура 5A). Данные о биораспределении 177Lu-ПСА-АЛБ-01 и -03 представлены в Таблице 2.2 и 2.3 ниже.
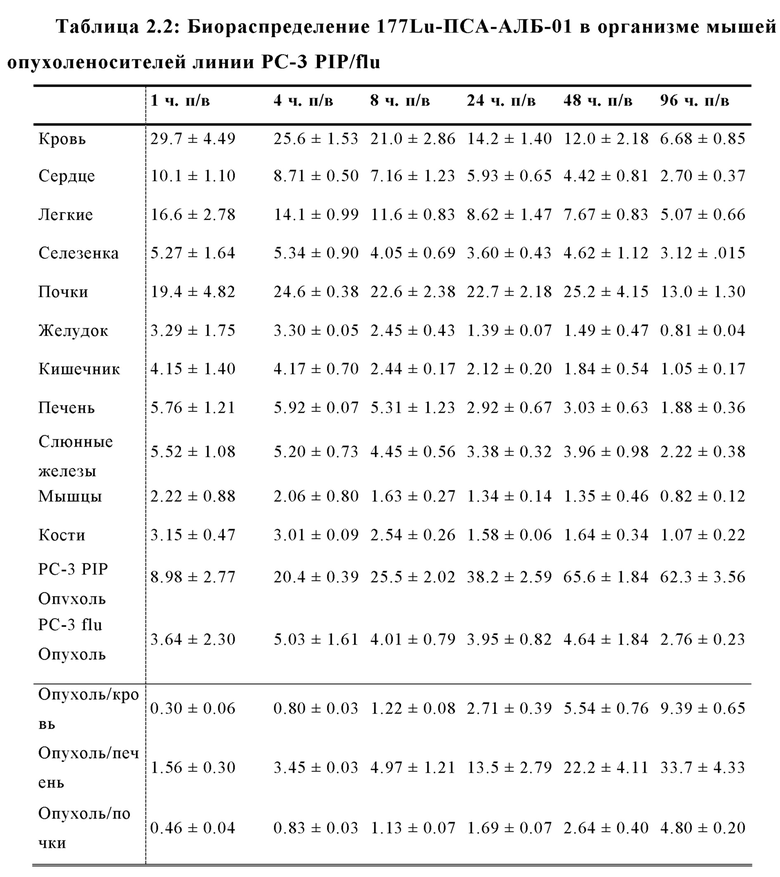

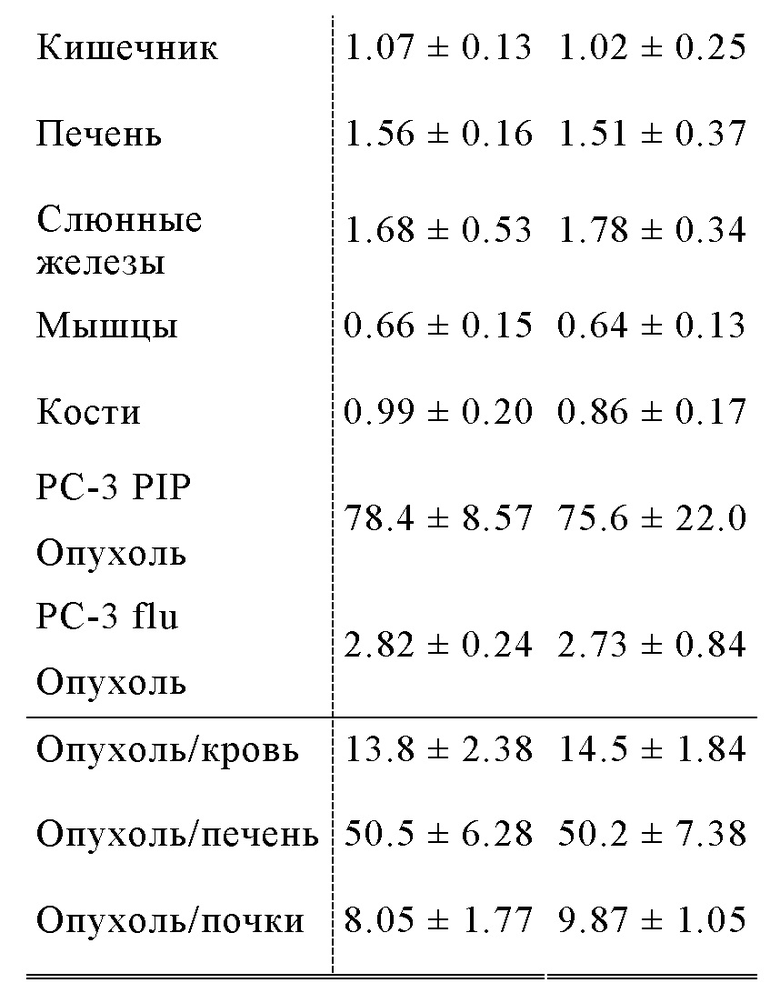
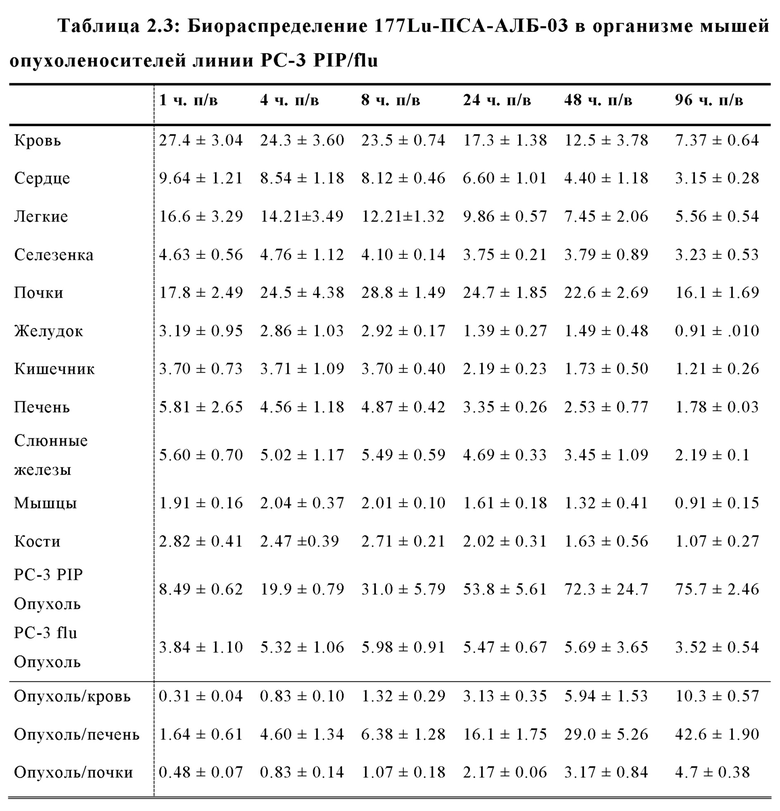
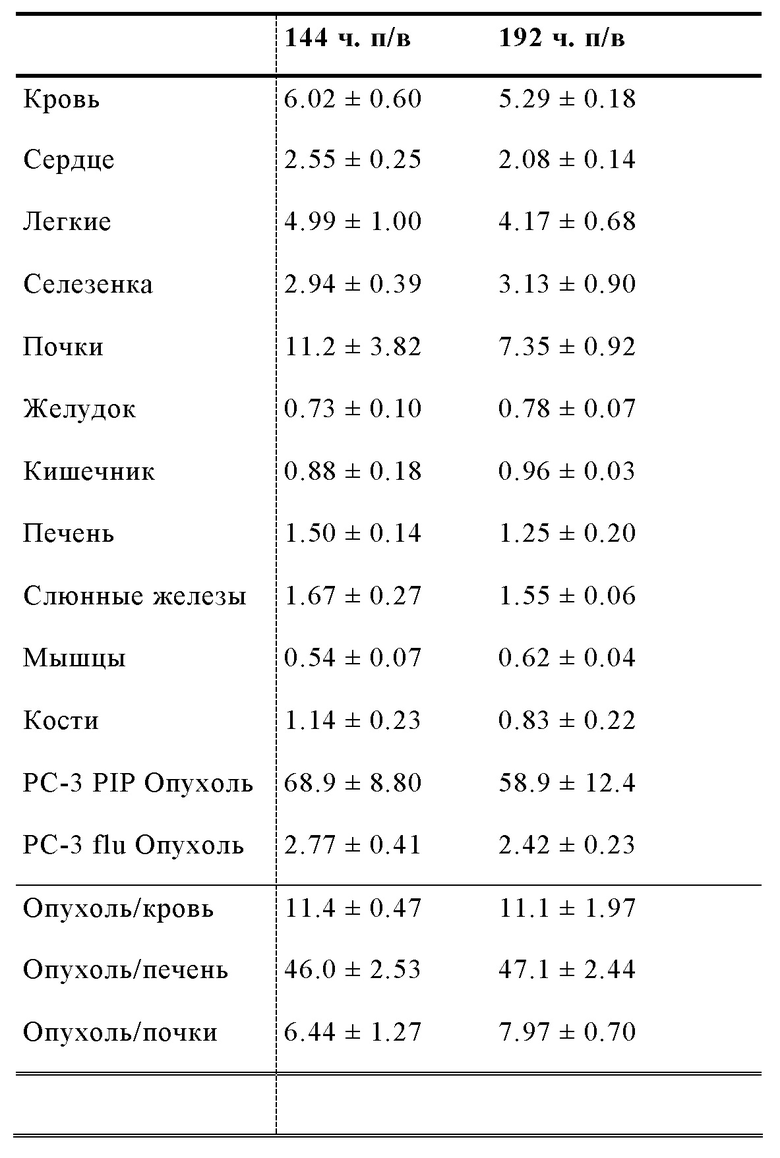
2.2.2 БИОРАСПРЕДЕЛЕНИЕ 177Lu-ПСА-АЛБ-04 И 177Lu-ПСА-АЛБ-05
Распределение 177Lu-ПСА-АЛБ-04 и 177Lu-ПСА-АЛБ-05 в тканях изучали на протяжении 8 дней (Фигура 5Б).
Высокий уровень радиоактивности в крови животных после введения 177Lu-ПСА-АЛБ-04 наблюдался на начальных этапах исследования и оставался значимо высоким. Наблюдалось большое накопление в ПСАпол+ PC-3 PIP опухолях, которое медленно уменьшалось к окончанию исследования. Активность, накопленная в ПСАотр- PC-3 flu опухолях и других органах (не-мишенях) была существенно ниже уровня в крови, что свидетельствует о высокой ПСА-специфичности связывания и захвата in vivo.
Высокий уровень радиоактивности в кровеносном русле животных, получивших 177Lu-ПСА-АЛБ-05 быстро снижался и оставался низким до окончания исследования. Наиболее высокий уровень захвата радиоактивных лигандов наблюдался в ПСАпол+ PC-3 PIP опухолях у мышей, которым вводили 177Lu-ПСА-АЛБ-05 с последующим отмыванием от опухолевых тканей. Захват в PC-3 flu опухолями и другими тканями был существенно ниже уровня в крови, что свидетельствует о высокой ПСА-специфичности связывания и захвата in vivo. Данные о биораспределении 177Lu-ПСА-АЛБ-04 и -05 представлены в Таблице 2.4 и 2.5 ниже.
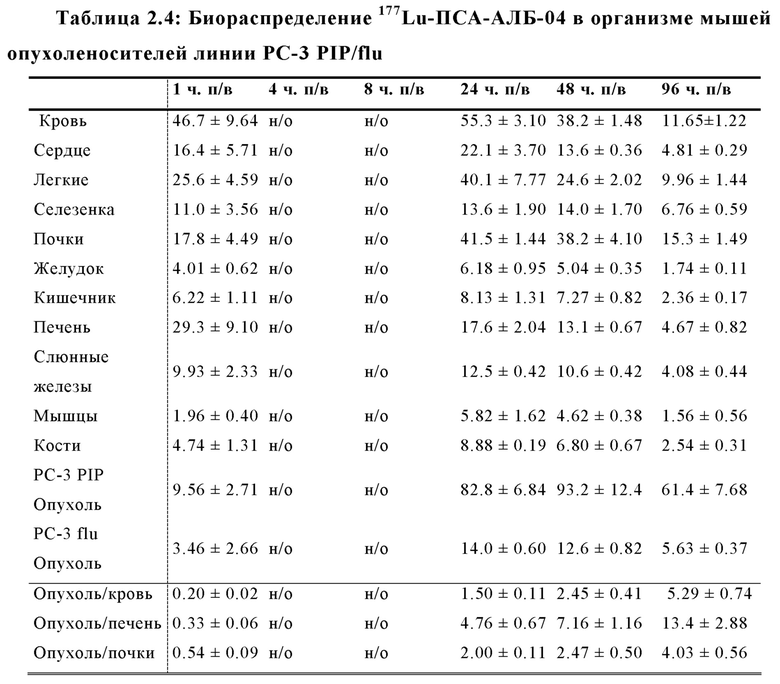
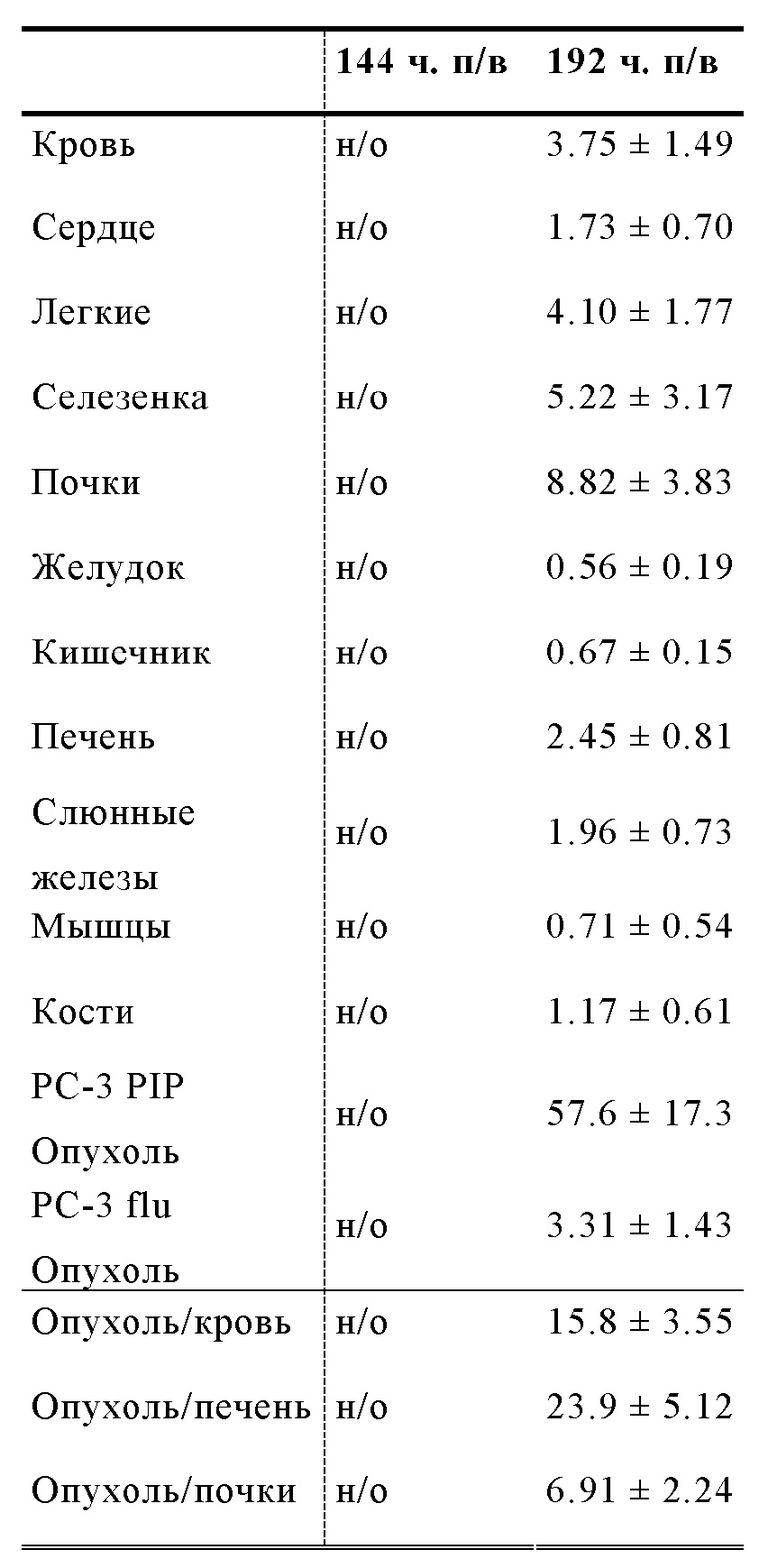
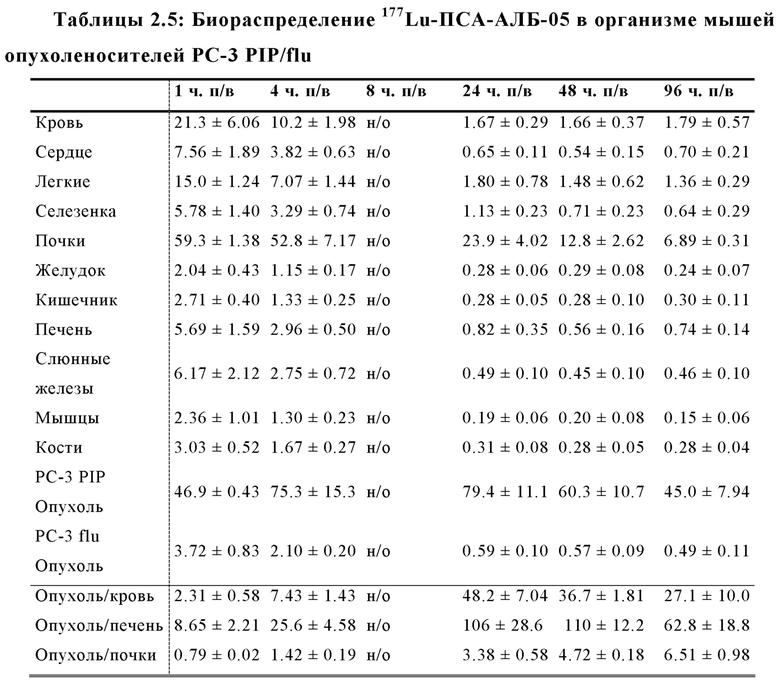
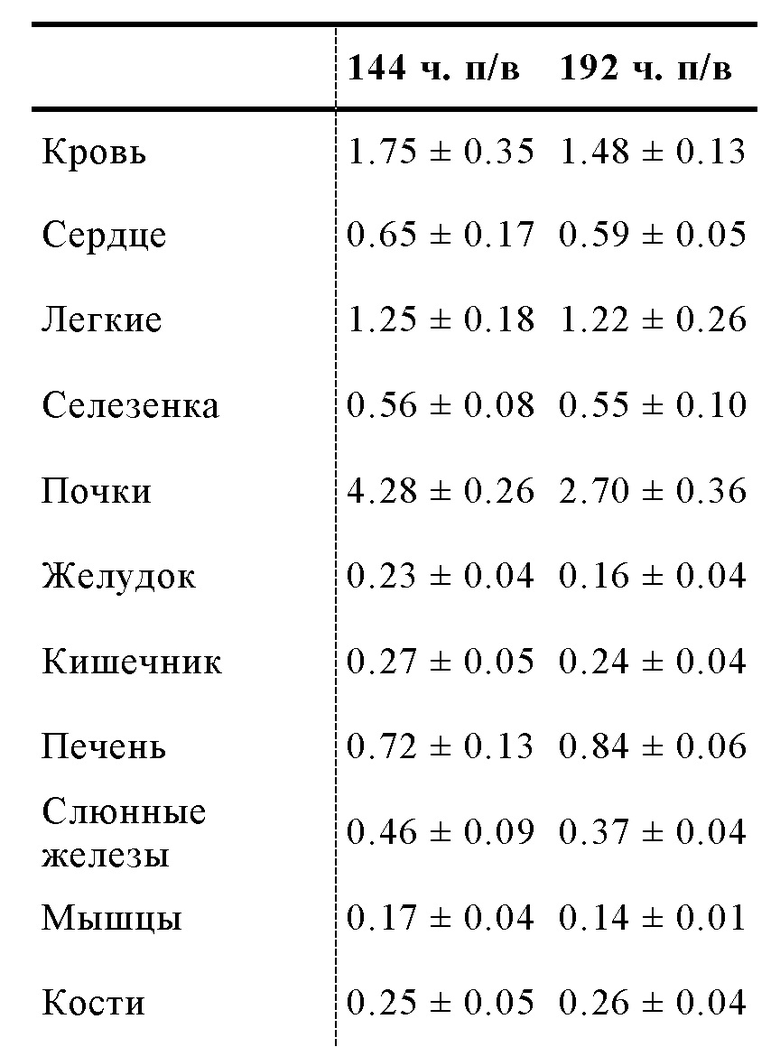
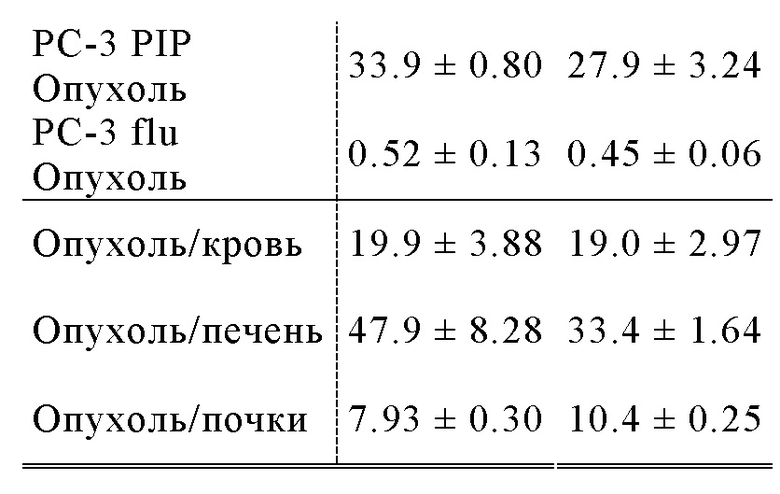
2.2.3 БИОРАСПРЕДЕЛЕНИЕ 177Lu-ПСА-АЛБ-06, 177Lu-ПСА-АЛБ-07, 177Lu-ПСА-АЛБ-08
Распределение 177Lu-ПСА-АЛБ-06, -07 и -08 в тканях анализировали не позднее чем через 3 дня после введения (Фигура 5В).
Уровни радиоактивности всех соединений в крови быстро снижались и были сопоставимы на протяжении всего исследования. Наиболее выраженная аккумуляция в ПСАпоз+ PC-3 PIP опухолях наблюдалась для соединения 177Lu-ПСА-АЛБ-06, которая медленно и постепенно снижалась к моменту окончания исследования. Активность накопления в ПСАнег- PC-3 flu опухолях и других органах (не мишенях) была ниже уровня в крови, что свидетельствует о наличии ПСА-специфического связывания и захвата in vivo для всех тестируемых соединений. Данных биораспределения для 177Lu-ПСА-АЛБ-06, -07 и -08 представлены в Таблице 2.6, 2.7 и 2.8 ниже.
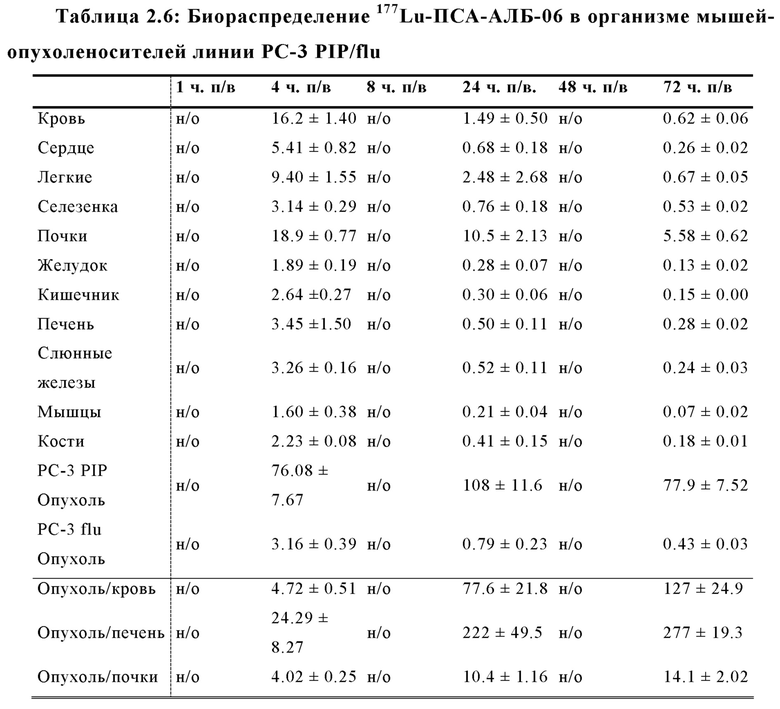

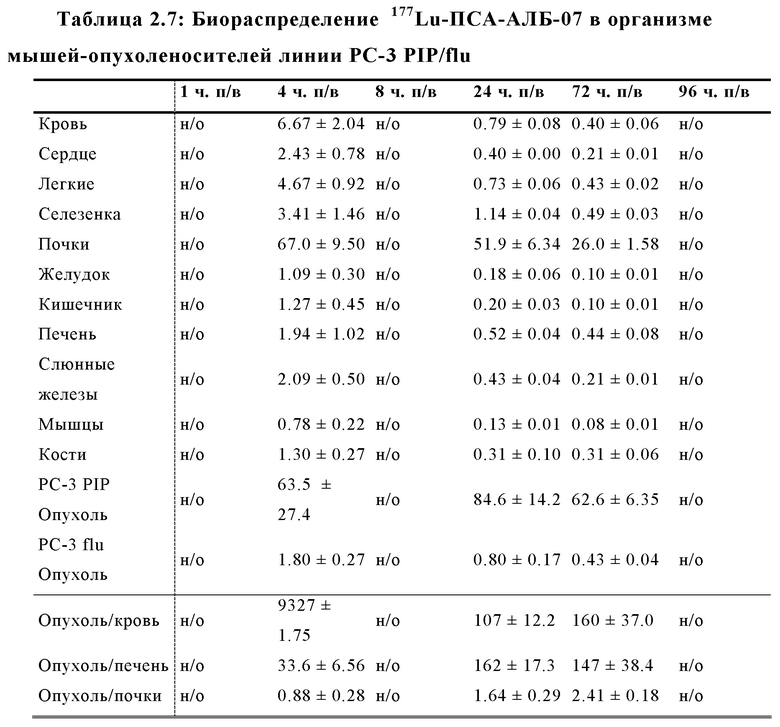


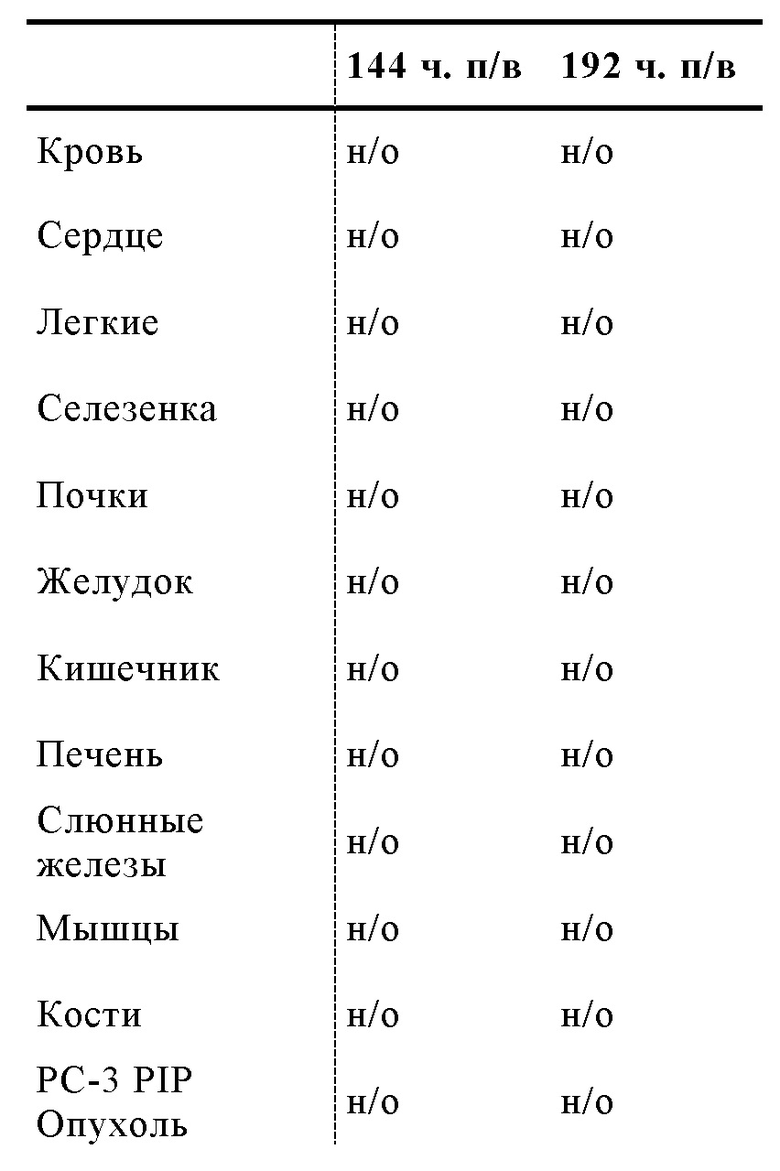
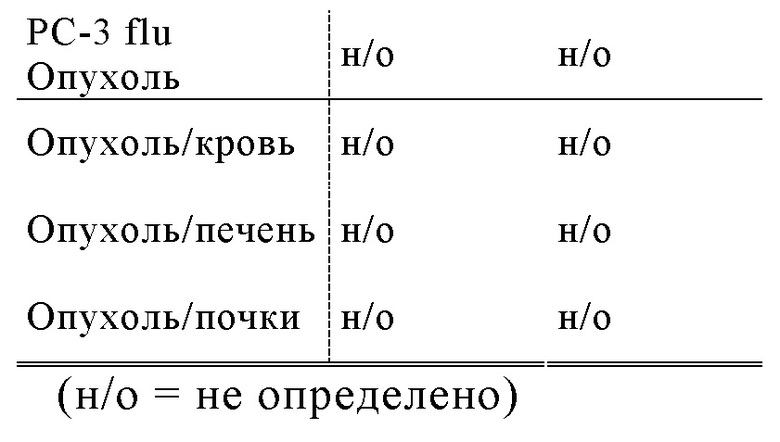
2.2.4 SPECT/КТ визуализирующие исследования
SPECT/КТ изображения мышей опухоленосителей линии PC-3 PIP/flu получали в различные временные точки после введения 177Lu-ПСА-АЛБ-03 и 177Lu-ПСА-АЛБ-06. Точная введенная радиоактивность 177Lu-ПСА-АЛБ-03 и 177Lu-ПСА-АЛБ-06 составляла 25 МБк и 23 МБк, соответственно. Наиболее благоприятный паттерн распределения in vivo для 177Lu-ПСА-АЛБ-03 и 177Lu-ПСА-АЛБ-06 представлен на Фигуре 26.
2.2.5 ЛЕЧЕНИЕ МОДЕЛЬНЫХ МЫШЕЙ
У контрольных животных (Группа A) отмечался постоянный рост опухоли в течение времени, который был сопоставим со скоростью опухолевого роста у мышей, получавших низко-активный 177Lu-ПСА-617 (Группа Б: 2 МБк/мышь). Индексы задержки роста опухоли у животных в Группе Б (TGDI2=0.8, TGDI5=1.4, Таблица 2.9) были, тем не менее, аналогичны величинам для контрольных животных, у которых TGDI был определен как равный 1. Первое контрольное животное достигло конечной точки на День 16, в то время как одно животное из Группы Б были вынуждены усыпить на День 12 (Таблица 2,9). Лечение оказалось эффективным у животных, у которых использовался высокоактивный 177Lu-ПСА-617 (Группа В: 5 МБк/мышь) или низкоактивный 177Lu-ПСА-АЛБ-06 (Группа Г: 2 МБк/мышь). Индексы TGDI2 и TGDI5 были идентичны для мышей из обеих групп (Groups В и Г) и, следовательно, мышей были вынуждены усыпить в одинаковые временные промежутки (Группа C: День 26 - День 40; Группа Г: День 28 - День 44; данные не представлены). У мышей, получавших высокоактивный 177Lu-ПСА-АЛБ-06 (Группа Д: 5 МБк/мышь), опухолевый рост ингибировался наиболее эффективно. У четырех животных из Группы Г опухоли полностью исчезли, рецидива не было до момента окончания исследования на День 84.
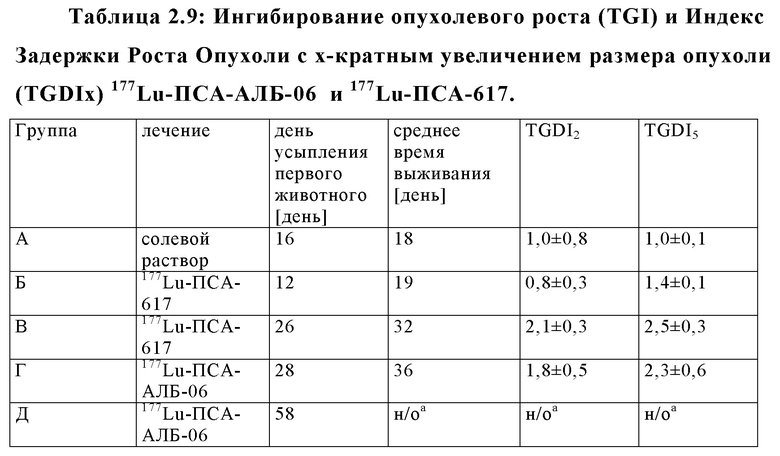
н/оa не определено т.к. животное было живо на момент окончания исследования
Мыши, получавшие высокоактивные 177Lu-ПСА-617 или низкоактивные 177Lu-ПСА-АЛБ-06, демонстрировали существенно большее время средней выживаемости (Группа В: День 32, Группа Г: День 36, Таблица 2.9, Фигура 27). На момент окончания исследования на День 84, четверо животных, получавших высокоактивный 177Lu-ПСА-АЛБ-06 (Группа Д), все еще были живы и, таким образом, время средней выживаемости осталось неопределенным.
Пример 3: Клиническое исследование ПСА лигандов
3.1: СЛУЧАЙ 1:
Соединение ПСА-АЛБ-06, меченое терапевтическим радиоактивным изотопом Лютецием 177, использовалось в рамках индивидуального терапевтического исследования у пациента, страдающего умеренно дифференцированной аденокарциномой предстательной железы с распространенными метастазами в обе доли печени, а также диссеминированными остеобластическими метастазами (в тазовом регионе) и политопным обширным поражением лимфатических узлов. Анализ биораспределения и действие in vivo меченого радиоактивной меткой ПСА-АЛБ-06 проводили при помощи SPECT-КТ.
Визуализацию при помощи SPECT-КТ проводили в разные временные точки, не позднее, чем через 46 часов после инъекции (п/в). Была установлена длительная циркуляция соединения ПСА-АЛБ-06 в крови и улучшенный профиль биодоступности (Фигура 7). Клиренс в крови был завершен в течение первых часов, в то время как неспецифический захват здоровыми органами (в частности, печенью, слюнными железами, почками) оставался умеренным на протяжении всего времени исследования. SPECT-КТ продемонстрировали практически полный специфический захват меченого радиоактивным изотопом соединения в опухолевых тканях (Фигура 8).
Эти первые результаты, полученные при исследовании на человеке, подтверждают доклинические открытия относительно улучшенного фармакокинетического профиля соединений, демонстрирующих потенциал для лечения ПСА-позитивных опухолей.
3.2 СЛУЧАЙ 2:
Соединение ПСА-АЛБ-06, меченое терапевтическим радиоактивным изотопом Галлием-68, использовалось в рамках индивидуального терапевтического исследования у пациента, страдающего метастазирующим, кастрационно-резистентным раком предстательной железы, в качестве диагностических агентов для PET-КТ. Опухолевые ткани могут быть визуализированы при помощи PET с высокой специфичностью, в то время как базовая радиоактивность в здоровых органах, не являющихся мишенью, остается умеренной (Фигура 9). Высокая контрастность изображений увеличивается с течением времени, что подтверждает пролонгированный клиренс соединений в крови и высокоспецифичный захват опухолевыми клетками.
Пример 4: Изучение эффективности ПСА лигандов в комбинации с 44Sc для использования в диагностике при помощи PET-КТ
4.1 ДАННЫЕ О БИОРАСПРЕДЕЛЕНИИ 44Sc-ПСА-АЛБ
44Sc получали в устройстве Injector 2 в Институте Пауля Шеррера, как сообщалось ранее2
Введение радиоактивной метки в соединение ПСА-АЛБ-06 осуществляли как было описано авторами ранее с использованием клинически установленного лиганда ПСА-1675. Анализ биораспределения проводили на голых мышах женского пола линии Balb/c, несущих ПСА-позитивные PC-3 PIP опухолевые клетки (в правом плече) и ПСА-негативные PC-3 flu опухолевые клетки (в левом плече). Для этих целей мышам вводили опухолевые клетки за 12-14 дней до введения радиоактивного лиганда. Мышей усыпляли и вскрывали через 1 ч., 4 ч. и 6 ч после инъекции (п/в). (Фигура 10А, Таблица 4.1). 44Sc-ПСА-АЛБ-06 изучали через 6 ч после введения, в то время как данные для 177Lu-ПСА-АЛБ-06 доступны в течение24 ч п/в. (Фигура 10B).
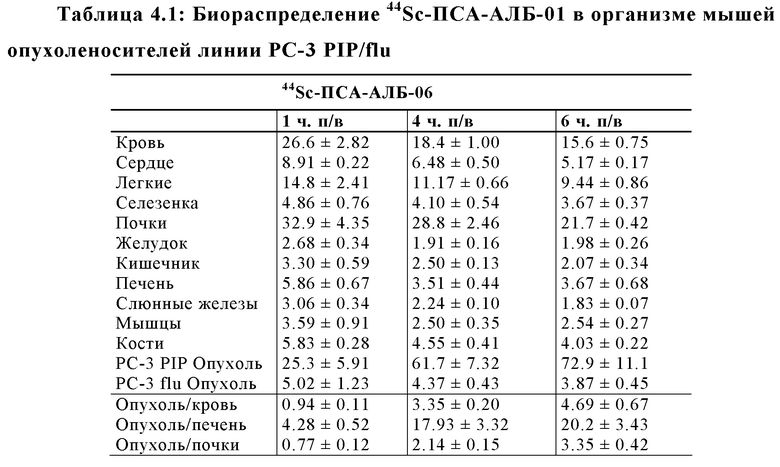
4.2.3 PET/КТ визуализация у мышей, получивших 44Sc-ПСА-АЛБ-06
PET/КТ исследования проводили при помощи специальной маленькой PET/КТ камеры для животных (G8, Perkin Elmer, U.S.) как ранее было описано авторами.5 Изображения получали через 1 ч., 4 ч, и 20 ч после введения 5 МБк 44Sc-ПСА-АЛБ-06. На Фигуре 11 представлены сканы, полученные при помощи одной шкалы плотности. Дополнительные изображения получали при помощи дополнительной отрегулированной шкалы для того, чтобы визуализировать органы и ткани максимально возможно. На Фигуре 12 представлен скан через 1 час после введения, когда радиоактивное соединение главным образом циркулирует в крови и не произошло его специфическое накопление в ПСА-позитивных опухолевых тканях.
На Фигуре 13 представлен скан через 20 ч. п/в полученный при помощи дополнительной шкалы. Благодаря этой шкале возможно получить максимально точное изображение опухоли в то время, как общая радиоактивность в крови уже снизилась.
4.3 ЗАКЛЮЧЕНИЕ
Введение радиоактивных меток в соединение было успешно осуществлено с использованием радиоактивного изотопа 44Sc при его специфической активности 5 МБк/нмоль. Анализ биораспределения соединения и данные PET-КТ визуализации свидетельствуют о том, что 44Sc-ПСА-АЛБ-06 обладает теми же свойствами, что и соединение 177Lu-ПСА-АЛБ-06, что было установлено ранее. Благодаря высокому опухолевому захвату 44Sc-ПСА-АЛБ-0 считается, что указанный радиоактивный лиганд может быть полезным инструментом для визуализации даже небольших опухолевых очагов в поздние временные отрезки (>4 ч. п/в), когда базовая активность уже снизилась. Клиническое применение указанных открытий представляет наиболее перспективным и должно быть изучено следующим этапом для подтверждения предложенной концепции.
Пример 5: Дизайн и доклиническая оценка NODAGA-функционализированных альбумин-связывающих ПСА лигандов
Был разработан длительно циркулирующий ПСА-направленный агент, подходящий для стабильного образования комплексов с медью, который можно использовать для контрастирования рака простаты с помощью PET-КТ в отдаленные временные точки. Таким образом, хелатирующий агент DOTA в ПСА-АЛБ-06 был замещен хелатирующим агентом NODAGA с образованием ПСА-АЛБ-89. ПСА-АЛБ-89 и ПСА-АЛБ-06 метили 64Cu и изучали их радиолитическую стабильность, способность связываться с сывороточным альбумином и захват ПСА-позитивными PC-3 PIP и ПСА-негативными PC-3 flu опухолевыми клетками. Анализ биораспределения и PET/КТ визуализацию осуществляли на мышах-опухоленосителях PC-3 PIP/flu.
Структурная формула ПСА-АЛБ-89 представлена ниже:
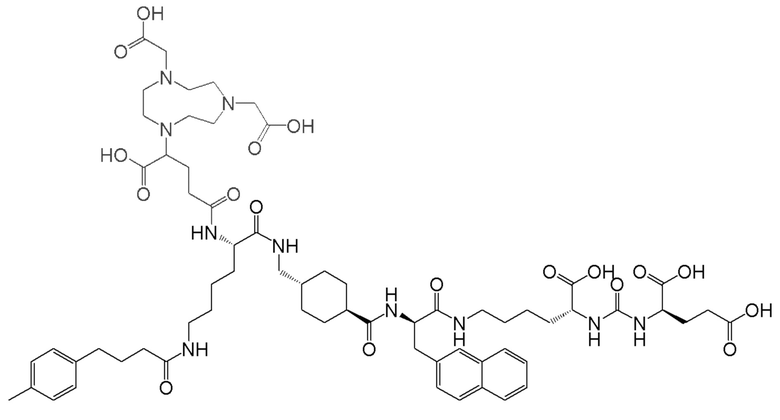
5.1 МАТЕРИАЛЫ И МЕТОДЫ
Твердофазный синтез ПСА-лиганда
NODAGA-функционализированный ПСА лиганд, обозначаемый как ПСА-АЛБ-89 синтезировали с использованием платформы для твердофазного синтеза, как описано ранее для синтеза соединения ПСА-АЛБ-06 (см. Пример 1). Единственное различие касалось конъюгации хелатирующего агента на последнем этапе синтеза (Схема 5.1). Конъюгацию осуществляли с 3 экв NODAGA-трис(t-Bu)эфир [4-(4,7-бис(2-(терт-бутокси)-2-оксоэтил)-1,4,7-триазациклононан-1-ил)-5(терт-бутокси)-5-оксопентаноевой кислоты], активированным 2,97 экв O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфата (HBTU) в присутствии 4 экв N,N-диизопропилэтиламина (DIPEA) в безводном N,N-диметилформамиде (DMF). Присоединение хелатирующего агента NODAGA происходило в течение 3 ч при медленном перемешивании. Конечный продукт отщепляли от смолы и последовательно удаляли защитные группы в течение 2 ч с использованием смеси, включавшей трифторуксусную кислоту (TFA), триизопропилсилан (TIPS) и H2O в соотношении 95:2.5:2.5 (об/об).
Схема 5.1: Синтез NODAGA-функционализированного ПСА лиганда
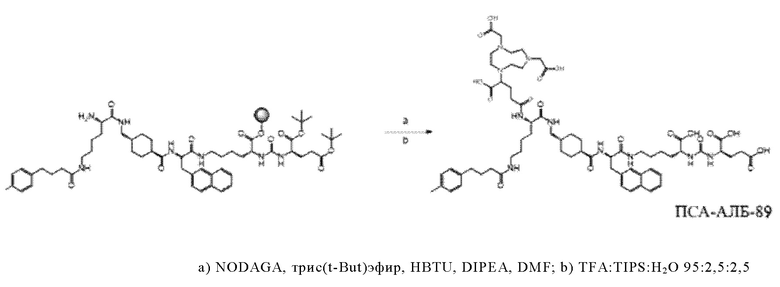
5.2 РЕЗУЛЬТАТЫ
Синтез ПСА лиганда. ПСА-АЛБ-89 синтезировали в твердой фазе с использованием подложки, по аналогии с синтезом ПСА-АЛБ-06 (Пример 1). Вместо конъюгации хелатирующего агента DOTA, использовали NODAGA хелатирующий агент (Схема 5.1). С помощью описанного многоэтапного синтеза (17 этапов) удалось получить соединение с высокой степенью очистки (>98%) с общим выходом 8.7% после очищения с помощью полупрепаративной ВЖЭХ.
Введение радиоактивной метки, стабильность и свойства in vitro 64Cu-меченых ПСА лигандов. ПСА-АЛБ-89 и ПСА-АЛБ-06 метили радиоактивной 64Cu при специфической активности не более 50 МБк/нмоль. Радиоактивные лиганды продемонстрировали высокую степень радиохимической чистоты (>98%) и одинаковое время задержки (~11 мин). 64Cu-ПСА-АЛБ-89 и 64Cu-ПСА-АЛБ-06 были стабильны (>92%) в течение периода времени, по крайней мере, 4 ч. Коэффициент распределения n-октанол/PBS (logD величины) для 64Cu-ПСА-АЛБ-89 (-2.3±0.7) были немного, но несущественно выше (p>0.05), чем logD величины для 64Cu-ПСА-АЛБ-06 (-3.1±0.1).
Альбумин-связывающие свойства. 64Cu-ПСА-АЛБ-89 и 64Cu-ПСА-АЛБ-06 продемонстрировали одинаковое связывание с белками плазмы (>92%) при инкубации в человеческой плазме. Полумаксимальное связывание (B50) 64Cu-ПСА-АЛБ-89 достигалась при соотношении [БСА]--[радиоактивный лиганд] равном 454. Это указывает на чуть более интенсивное связывание, чем было обнаружено для 64Cu-ПСА-АЛБ-89, для которого полумаксимальное связывание достигалось при соотношении [БСА]--[радиоактивный лиганд] равном 770 (Фигура 14).
Клеточный захват и интернализация. Клеточный захват 64Cu-ПСА-АЛБ-89 PC-3 PIP клетками составлял ~46%, а интернализированная фракция ~14% после инкубации в течение 2 ч при 37°C. Клеточный захват увеличивался медленно через 4 часа инкубации (~52%), в то время как интернализированная фракция оставалась неизменной (~14%). Аналогичные величины были определены для 64Cu-ПСА-АЛБ-06 (Фигура 15A). Захват in PC-3 flu клетками был ниже 0.5% для обоих радиоактивных лигандов, что доказывает ПСА-специфичный клеточный захват (Фигура 15B).
Анализ биораспределения. Профиль распределения в тканях для 64Cu-ПСА-АЛБ-89 оценивали в течение 24 ч у мышей-опухоленосителей (Фигура 16, Таблица 5.1). Наблюдалось быстрое снижение активности в кровеносном русле с течением времени (<3.2 % IA/g и <1.4% IA/g через 24 ч п/в, соответственно). Быстрое и интенсивное накопление 64Cu-ПСА-АЛБ-89 в PC-3 PIP опухолях наблюдалось сразу после введения соединения (25.9±3.41% IA/g через 1 ч п/в) и медленно увеличивалось к концу эксперимента (97.1±7.01% IA/g через 24 ч п/в). Накопление радиоактивности в PC-3 flu опухолевых клетках, не экспрессирующих ПСА, в целом было ниже уровня в крови. Паттерн захвата 64Cu-ПСА-АЛБ-89 клетками печени продемонстрировал уровень радиоактивности сопоставимый с таковым в кровеносном русле или даже ниже (Фигура 17). Соотношение распределения опухоль/почки с течением времени увеличивалось, хотя величины после введения соединения 64Cu-ПСА-АЛБ-89 были относительно низкими. Соотношение распределения опухоль/клетки для 64Cu-ПСА-АЛБ-89 были высокими. Соотношения распределения опухоль/мышцы повышались с течением времени до 200±38.2 через 24 ч п/в.

PET/КТ исследования. PET/КТ визуализацию осуществляли в течение 24 ч у мышей-опухоленосителей PC-3 PIP/flu в различные временные отрезки после введения меченого 64Cu радиоактивного лиганда (Фигура 17). 64Cu-ПСА-АЛБ-89 в значительном количестве в ПСА-позитивных опухолевых (PC-3 PIP опухоли), в то время как в ПСА-негативных опухолях (PC-3 flu tumor) захват отсутствовал. С помощью визуализации было показано, что через 16 ч после инъекции соотношение опухоль/почки для накопленного радиоактивного лиганда было определенно >1 и увеличивалось с течением времени. Базовые сигналы от других органов и тканей, возникающая из-за общей радиоактивности в крови были видны на изображениях, полученных через 1 ч п/в.
5.3 ОБСУЖДЕНИЕ
В описанном примере были синтезированы длительно циркулирующие ПСА-лиганды, меченые 64Cu с целью осуществления PET-КТ даже через день после введения радиолигандов. ПСА-АЛБ-89 синтезировали как было описано ранее для ПСА-АЛБ-06, однако вместо объединяющего хелатирующего агента DOPA использовали хелатирующий агент NODAGA, как уже ранее выполнялось группой авторов для других агентов-мишеней.
ПСА-АЛБ-89 метили 64Cu при высокой специфической активности и радиохимической чистоты (50 МБк/нмоль; >95%), что предполагает получение высококачественного синтезированного лиганда, а также прекрасную радиохимическую чистоту 64Cu, который был получен своими силами в институте Пауля Шеррера (PSI) in vitro, 64Cu-ПСА-АЛБ-89 и 64Cu-ПСА-АЛБ-06 оба оставались стабильными после инкубации в течение нескольких часов при комнатной температуре с незначительной деградацией, определяемой через 24 ч после введения. Такие результаты позволяют предположить, что NODAGA- и DOTA-хелатирующие агенты оба образуют стабильные комплексы с 64Cu in vitro.
Альбумин-связывающие свойства 64Cu-ПСА-АЛБ-89 были аналогичны таковым 64Cu-ПСА-АЛБ-06 при тестировании in vitro. Специфичность связывания с ПСА не менялась в зависимости от использованного хелатирующего агента, что подтверждается тем, что у 64Cu-ПСА-АЛБ-89 и 64Cu-ПСА-АЛБ-06 были аналогичные параметры клеточного связывания и интернализированные фракции in vitro.
Данные о профиле биораспределения, полученные при помощи хорошо изученных мышиных опухолевых моделей с использованием ПСА-позитивных и ПСА-негативных опухолевых клеток, показали, что опухолевый захват 64Cu-ПСА-АЛБ-89 был существенно выше во все временные точки после введения, вероятно, вследствие более длительной циркуляции в крови. Максимальный опухолевый захват 64Cu-ПСА-АЛБ-89 достигался только к концу исследования (через 24 ч п/в). PET/КТ изображения подтвердили благоприятный профиль распределения 64Cu-ПСА-АЛБ-89 в тканях, принимая во внимание повышенный захват опухолевыми клетками и накопление в печени. Незначительное накопление препарата в печени является важным фактором, поскольку рак предстательной железы может метастазировать в печень, которые в других случаях могут быть не замечены по причине неспецифического радиоактивного накопления.
5.4 ЗАКЛЮЧЕНИЕ
В настоящем примере хелатирующий агент DOTA в составе ПСА-АЛБ-06 был заменен на хелатирующий агент NODAGA для обеспечения стабильной координации 64Cu для выполнения PET визуализации. 64Cu-ПСА-АЛБ-89 продемонстрировал повышенную стабильность in vivo, которая выражалась в усиленной аккумуляции соединения опухолевыми клетками без существенной задержки тканями печени.
Пример 6: Получение и оценка дополнительных DOTA-функционализированных ПСА-связывающих лигандов
6.1 МАТЕРИАЛЫ И МЕТОДЫ
Твердофазный синтез Альбумин-связывающих ПСА-лигандов.
ПСА лиганды, обозначенные как ПСА-АЛБ-02, ПСА-АЛБ-05 и ПСА-АЛБ-07, соответственно, были разработаны и синтезированы на платформе для твердофазного синтеза. ПСА-связывающий фармакопор на основе мочевины - l-Glu-NH-CO-NH-l-Lys - был синтезирован на 2-хлортритильной смоле (2-CT) по аналогии с методом, описанным у Eder et al. (2012). Линкерный участок, включающий молекулы 2-нафтил-l-Ala и trans-циклогексил, синтезировали как описано в Примере 1. Такой иммобилизованный на смоле и bis(t-Bu)-защищенный предшественник, - l-Glu-NH-CO-NH-l-Lys-2-Nal-l-Ala-NH2-Me-1,4-trans-CHX, обозначаемый в описании как соединение 1 - использовался как основа для синтеза трех альбумин-связывающих ПСА лигандов (Фигура 18).
Следующие этапы синтеза, включавшие конъюгацию структурного элемента на основе лизина и селективное отщепление Nα-Fmoc-защитных групп, осуществляли для всех трех соединений. Относительно количество иммобилизованного на смоле и bis(t-Bu)-защищенного предшественника (0,3 ммоль; соединение (1)), использовали 4 экв Nα-Fmoc- и Nε-Alloc-защищенного L-лизина (Fmoc-Lys(Alloc)-OH), которые активировали 3.96 экв O-(бензотриазол-1-ил)-N,N,N',N'- тетраметилуроний-гексафторфосфат (HBTU)в присутствии 4 экв N,N-диизопрпилэтиленамина (DIPEA) в N,N-диметилформамиде (DMF) и перемешивали в течение 1 ч. Затем осуществляли последовательное селективное удаление Nα-Fmoc-защитных групп смесью DMF и пиперидина в соотношении 1:1 (об/об). Полученный предшественник (2) использовали для последующего синтеза, который был специфичным для каждого конкретного соединения.
ПСА-АЛБ-02. Синтез ПСА-АЛБ-02 осуществляли путем объединения альбумин-связывающего элемента с иммобилизованным на смоле предшественником (0.1ммоль; соединение (2)) с использованием 4 экв 4-(p-йодофенил)масляной кислоты, активированной 3.96 экв HBTU в присутствии 4 экв DIPEA в DMF в течение 1 часа при медленном перемешивании. Затем последовательно осуществляли отщепление Nε-Alloc- защитных групп от соединения (3) при помощи 0,03 экв {[тетракис(трифенилфосфин) палладия (0) (TPP Pd) в присутствии 30 экв морфолина в дихлорметане (DCM) в течение 2-х часов при полной темноте. Для удаления остатков палладия смолу дополнительно промывали 1% DIPEA в DMF и затем раствором натрия диэтилдитиокарбамата в DMF (c=15 мг/мл). Наконец, осуществляли конъюгацию хелатирующего агента с иммобилизованным на смоле соединением, с использованием 2 экв DOTA-трис(t-Bu) эфира [2-(4,7,10-трис(2-(t-бутокси)-2-оксоэтил)-1,4,7,10-тетраазацикло-додекан-1-ил) уксусной кислоты] активированной 1.98 экв HBTU в присутствии 4 экв DIPEA в DMF. Объединение хелатирующего агента DOTA проходило в течение 2 ч при медленном перемешивании. Полученное соединение (4) промывали DMF, DCM и, наконец, Et2O с последующим высушиванием в вакууме. Продукт отщепляли от смолы и последовательно удаляли защитные группы в течение 2 ч с использованием смеси, включавшей трифторуксусную кислоту (TFA), триизопропилсилан (TPS) и H2O в соотношении 95:2.5:2.5 (об/об). TFA выпаривали, сырой продукт растворяли в ацетонитриле (ACN) и воде в соотношении 1:1 (об/об) и очищали посредством высокоэффективной жидкостной хроматографии в обратной фазе (RP-HPLC) с помощью полупрепаративной колонки (сопутствующая информация). Свойства ПСА-АЛБ-02 изучали при помощи аналитической RP-HPLC (сопутствующая информация) и масс-спектрометрии с лазерной десорбцией/ионизацией (MALDI-MS) или масс-спектрометрии с ионизацией распылением (ESI-MS), соответственно.
Описанный выше процесс синтеза кратко изображен на Схеме 6.1.
Схема 6.1: Конъюгация ПСА предшественника, альбумин-связывающего элемента и хелатирующего агента DOTA для образования
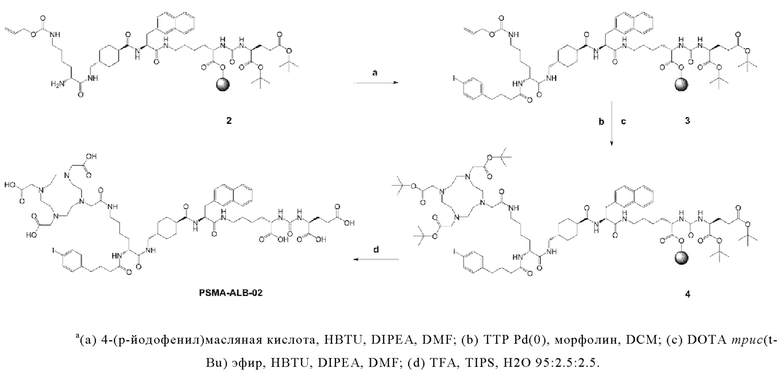
ПСА-АЛБ-05 и ПСА-АЛБ-07. Синтез ПСА-АЛБ-05 осуществляли путем объединения структурного блока на основе D-аспартата с иммобилизованным на смоле предшественником (0,1 ммоль; соединение (2)) с использованием 3 экв N-Fmoc- и Oβ-t-Bu-защищенного d-аспартата (Fmoc-d-Asp-O-t-Bu), активированного 2.97 экв HBTU в присутствии 4 экв DIPEA в DMF в течение 1 ч при медленном перемешивании. Селективное отщепление N-Fmoc-защитных групп от полученного соединения осуществляли как описано выше. Аналогично повторяли присоединение одной дополнительной защитной группы Fmoc-d-Asp-O-t-Bu и последующее отщепление N-Fmoc с образованием соединения (5). На следующем этапе 4 экв 4-(p-йодофенил) масляной кислоты активировали 3.96 экв HBTU в присутствии 4 экв DIPEA в DMF и перемешивали в течение 1 ч. Селективное отщепление Nε-Alloc-защитной группы от продукта (6) происходило как описано выше. Конъюгацию хелатируюшего агента с иммобилизованным на смоле соединением осуществляли с 2 экв DOTA-трис(трет-бутилового) эфира, активированного1.98 экв HBTU в присутствии 4 экв DIPEA в DMF в течение 2 ч при медленном перемешивании. Полученное соединение (7) промывали DMF, DCM и, наконец, Et2O с последующим высушиванием в вакууме. Продукт отщепляли от смолы и последовательно удаляли защитные группы в течение 2 ч с использованием смеси, включавшей TFA, TPS и H2O в соотношении 95:2.5:2.5 (об/об). TFA выпаривали, сырой продукт растворяли в ацетонитриле (ACN) и воде в соотношении 1:1 (об/об) и очищали посредством RP-HPLC (сопутствующая информация). Свойства ПСА-АЛБ-05 изучали при помощи аналитической RP-HPLC (сопутствующая информация) и MALDI-MS или ESI-MS, соответственно.
Синтез и очищение ПСА-АЛБ-07 осуществляли по аналогии с ПСА-АЛБ-05 с одним дополнительным присоединением третьей защитной группы Fmoc-d-Asp-O-t-Bu и последующим отщеплением N-Fmoc (8). На следующих этапах осуществляли конъюгацию 4-(p-йодофенил) масляной кислоты (9) с последующим селективным отщеплением Nε-Alloc-защитной группы и конъюгацией с DOTA-трис(t-Bu) эфиром (10). После отщепления от смолы, от соединения последовательно удаляли защитные группы и очищали/изучали свойства как описано для ПСА-АЛБ-05 (сопутствующая информация). Синтез ПСА-АЛБ-05 и ПСА-АЛБ-07 кратко представлен на Схеме 6.2. Стабильность каждого ПСА лиганда в форме лиофилизированного порошка тестировали с помощью RP-HPLC и MALDI-MS после длительного хранения (2 и 4 месяцев, соответственно) в морозильной камере (-18°C).
Схема 6.2: Конъюгация ПСА предшественника, альбумин-связывающего элемента и хелатирующего агента DOTA для образования (А) ПСА-АЛБ-05 и (Б) ПСА-АЛБ-07а.
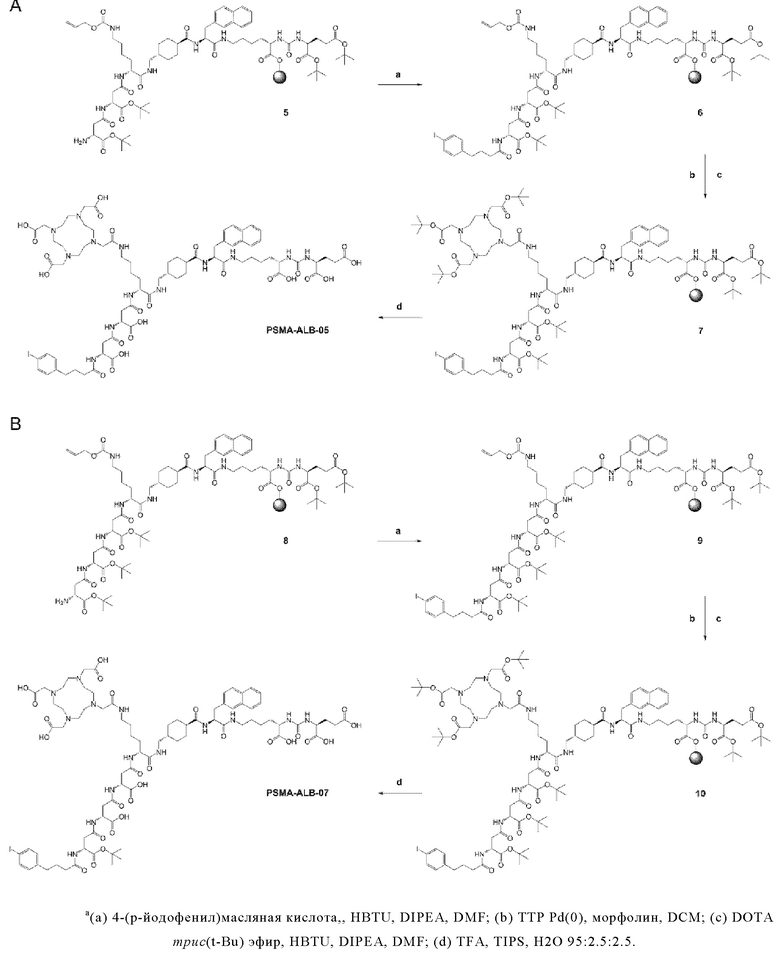
Введение радиоактивной метки и изучение стабильности
Новые ПСА лиганды (PSMA-ALB-02, ПСА-АЛБ-05 и ПСА-АЛБ-07, соответственно), а также ПСА-617 (Advanced Biochemical Compounds, ABX GmbH, Radeberg, Germany) растворяли в воде MilliQ, содержащей 10-15% раствор ацетата натрия (0.5 M, pH 8) для получение 1 мМ основных растворов для последующего введения радиоактивных меток. ПСА лиганды метили радиоактивным 177Lu (без добавления носителя 177LuCl3 в 0.04 M HCl предоставлен компанией Isotope Technologies Garching (ITG GmbH, Germany)) в смеси ацетата натрия (0.5 M, pH 8) и HCl (0.05 M) при pH 4 и специфической активности 5-50 МБк/нмоль. Реакционную смесь инкубировали в течение 10 минут при 95°C. Контроль качества радиоактивных лигандов осуществляли при помощи RP-HPLC (поддерживающая информация). Раствор с радиоактивными лигандами использовали в дальнейшем для экспериментов in vitro и in vivo без дополнительных этапов очищения.
Стабильность радиоактивных лигандов с течением времени определяли с помощью RP-HPLC. ПСА лиганды метили 177Lu (250 МБк) при специфической активности 50 МБк/нмоль как без добавления, так и с добавлением l-аскорбиновой кислоты (0.5 M, 3 мг), с последующим разведением в солевом растворе до концентрации радиоактивности 250 МБк/500 мкл. Эффективность введения радиоактивных меток определяли непосредственно после получения растворов (t = 0 ч), а целостность соединений анализировали после инкубации в течение различных временных промежутков (t = 1 ч, 4 ч и 24 ч, соответственно) при комнатной температуре. Количество интактного соединения подсчитывали путем интегрирования хроматографического пика продукта по отношению к сумме всех радиоактивных пиков продуктов распада неизвестной структуры и следов свободного 177Lu, которые принимали за 100%.
Определение коэффициентов распределения n-октанол/PBS (LogD величины).
Коэффициенты распределения (logD величины) для 177Lu-меченых радиоактивных лигандов определяли при помощи метода встряхиваемой колбы с использованием жидкофазной экстракции с последующей сепарацией фаз, как было описано ранее.
Вкратце, ПСА лиганды метили радиоактивным 177Lu при специфической активности в 50 МБк/нмоль. Образец лиганда, меченого радиоактивной меткой, смешивали с фосфатно-солевым буфером (PBS) и n-октанолом с последующим интенсивным перемешиванием вихревым способом. После центрифугирования для разделения фаз, активность в каждом слое измеряли при помощи гамма-счетчика (Perkin Elmer, Wallac Wizard 1480). Для каждого соединения проводили три эксперимента с пятью параллельными анализами.
Фильтрационный анализ.
Способность радиоактивных лигандов связываться с белками мышиной и человеческой плазмы определяли при помощи ультрафильтрационного анализа, как было описано ранее (Пример 1). 177Lu-меченые ПСА лиганды (50 МБк/нмоль) растворяли в мышиной (Rockland, USA) и человеческой (Stiftung Blutspede SRK Aargau-Solothurn, Switzerland), соответственно, и инкубировали в течение 15 мин при комнатной температуре. Вдобавок, радиоактивные лиганды растворяли в PBS (буферный раствор без белков) для контрольного эксперимента. Аликвоты растворов наносили на колонку для ультрафильтрации и центрифугировали. Активность отфильтрованного образца измеряли при помощи гамма-счетчика и использовали для расчета активности связавшихся белков плазмы (оставшихся на мембране фильтра), выраженной через процент от общей добавленной активности. Проводили три независимых эксперимента для каждого радиоактивного лиганда (177Lu-ПСА-АЛБ-02, 177Lu-ПСА-АЛБ-05 и 177Lu-ПСА-АЛБ-07, соответственно), каждый эксперимент повторяли дважды. Дополнительный эксперимент проводили дважды с использованием 177Lu-ПСА-617. Статистический анализ (однофакторный дисперсионный анализ (ANOVA) с множественными сравнениями по Бонферрони для оценки результатов) проводили при помощи программного обеспечения GraphPad Prism, версия 7.
Величина p<0.05 считалась статистически значимой.
Клеточный захват и интернализация.
Суммарную связавшуюся с ПСА на поверхности клеток фракцию, а также интернализованную фракцию (обозначается термином клеточный захват), а также отдельно интернализованную фракцию радиоактивных лигандов определяли при специфической активности в 5 МБк/нмоль с использованием ПСА-позитивных PC-3 PIP и ПСА-негативных PC-3 flu клеток, как было описано ранее (Пример 1). Раствор с радиоактивной меткой разводили солевым раствором, содержащим 0.05% (масса/объем) альбумина бычьей сыворотки (BSA) для предотвращения адгезии раствора к лабораторным пробиркам и флаконам. Дополнительное разведение раствора радиоактивного лиганда со средой для клеточной культуры привело к конечной концентрации BSA в 0,00125%, которая не оказывала влияния на клеточный захват и интернализацию радиоактивных лигандов т.к. была пренебрежимо мала. Параллельно с каждым экспериментом с новым радиоактивным лигандов проводили контрольные эксперименты с 177Lu-PSMA-617. Каждый эксперимент проводили трижды, при этом для каждого лиганда проводили также по три эксперимента.
Анализ биораспределения.
Биораспределение изучали через 1 ч, 4 ч, 24 ч, 48 ч, 96 ч и 192 ч после введения радиоактивных лигандов, меченых при специфической активности 5 МБк/нмоль. Масса опухоли на момент введения радиоактивного лиганда составляла 150±40 мг, что соответствует среднему объему приблизительно 150 мм3. В латеральную хвостовую вену мышам вводили соответствующий радиоактивный лиганд (5МБк, 1 нмоль, 100 мкл), разведенный в солевом растворе. К солевому раствору добавляли BSA (0,05%) для предотвращения абсорбции радиоактивного лиганда к стенкам флаконов и шприцов. Мышей усыпляли в различное время после введения соединения (п/в), извлекали отобранные ткани и органы, взвешивали и измеряли активность при помощи гамма-счетчика. Для каждой временной точки использовали группу из 3-6 животных. Вдобавок проводили блокирующие исследования путем введения 2-(фосфометил)-пентандиовой кислоты (2-PMPA, 500 нмоль, 100 мкл), разведенной в солевом растворе. Раствор 2-PMPA вводили за 15 минут до введения 177Lu-ПСА-АЛБ-02, животных усыпляли через 1 ч и 4 ч п/в, соответственно. Результаты с поправкой на радиоактивный распад выражали как процент от общей введенной активности на грамм массы тканей (% IA/г). Площадь под кривой (AUC) определяли для всех трех альбумин-связывающих ПСА лигандов и 177Lu-ПСА-617 на основании данных о биораспределении в опухолях, почках и крови без поправки на радиоактивный распад, полученных при помощи программного обеспечения GraphPad Prism Software, версия 7.
Статистический анализ осуществляли для сравнения площадей под кривой (AUCs), полученных на основании набора данных о биораспределении с использованием однофакторного дисперсионного анализа (ANOVA) однофакторный дисперсионный анализ с множественными сравнениями по Бонферрони для оценки результатов при помощи программного обеспечения GraphPad Prism Software (версия 7). Величина p <0.05 считалась статистически значимой.
SPECT/КТ визуализирующие исследования.
SPECT/КТ исследования осуществляли через 4 ч, 24 ч и 72 ч после введения радиоактивного лиганда. Животным в латеральную хвостовую вену вводили соответствующий радиоактивный лиганд (25 МБк, 1 нмоль, 100 мкл), разведенный в солевом растворе, содержащем 0.05% BSA. Кроме того, SPECT/КТ выполняли через 1 ч, 4 ч и 24 ч после введения 177Lu-ПСА-АЛБ-02 у мышей, которые получили 2-PMPA (500 нмоль, 100 мкл) или ПСА-АЛБ-02 (100 нмоль, 100 мкл) без радиоактивной метки, за 15 минут до введения радиоактивного лиганда для блокировки ПСА. SPECT/КТ исследования проводили при помощи специальной маленькой SPECT/КТ камеры (NanoSPECT/CTTM, Mediso Medical Imaging Systems, Budapest, Hungary). Сначала выполняли SPECT в течение 45 минут, затем КТ в течение 7,5 минут. Во время исследования in vivo мышей усыпляли смесью изофлурана и кислорода. Данные первично обрабатывали при помощи программного обеспечения NanoSPECT/CTTM, пост-обработку проводили при помощи VivoQuant (версия 3.0, inviCRO Imaging Services and Software, Boston USA). Применяли пост-реконструкционный фильтр Гауса (ПШПВ= 1 мм) и на изображениях устанавливали шкалу радиоактивности (минимальная величина = 0,095 Бк/воксел, максимальная величина - 95 Бк/воксел).
6.2 РЕЗУЛЬТАТЫ
Синтез ПСА лигандов. ПСА лиганды с альбумин-связывающим элементом синтезировали при помощи платформы для твердофазного синтеза с использованием стандартного Fmoc(9-флуоренилметилоксикарбонил) протокола (Фигура 19). Синтез начинали с иммобилизации С-конца первой аминокислоты на 2-СТ смоле и продолжали в направлении C→N. На последнем этапе соединение отщепляли от смолы с последующим полным удалением защитных групп, оба процесса происходили в кислой среде. Многоэтапный синтез ПСА-АЛБ-02 (17 этапов), ПСА-АЛБ-05 (20 этапов) и ПСА-АЛБ-07 (22 этапов) позволил получить соединения с высокой степенью чистоты (>98%) и общим выходом 12.9-21.2% после очищения при помощи полупрепаративной HPLC (Таблица 6.1). Все три ПСА лиганда были стабильными в течение, по крайней мере, 4-х месяцев в форме лиофилизированных порошков, хранившихся при температуре -18°C.
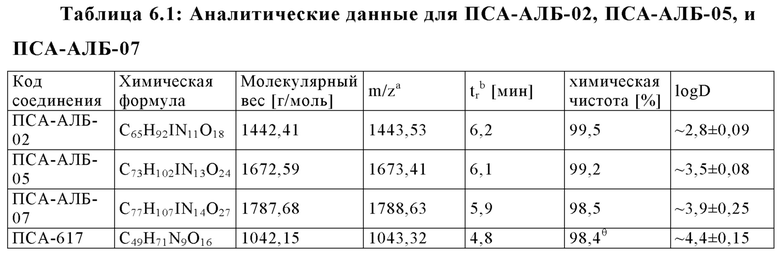
a Масс-спектрометрия немеченых лигандов, определенная как [M+H]+.
bВремя удерживания немеченого лиганда при аналитической RP-HPLC. Аналитическая колонка (100 х 4,6 мм), использовали стационарную фазу Chromolith RP-18e с мобильными фазами, содержащими 0,1%TFA в воде (А) и ACN (В). Для аналитических прогонов использовали линейный градиент растворителя А (90-10% за 10 мин) в растворителе В при скорости потока 1 мл/мин.
θЧистоту ПСА-617 устанавливали на основании сертификата ABX GmbH для данного соединения.
Введение радиоактивной метки, стабильность и in vitro свойства 177Lu-ПСА лигандов.
ПСА-АЛБ-02, ПСА-АЛБ-05 и ПСА-АЛБ-07 метили 177Lu при специфической активности не более чем 50 МБк/нмоль. Радиоактивные лиганды демонстрировали высокую степень радиохимической чистоты >98%. Добавление L-аскорбиновой кислоты приводило к выходу ~97% интактного 177Lu-ПСА-АЛБ-02, ~96% 177Lu-ПСА-АЛБ-05 и ~89% интактного 177Lu-ПСА-АЛБ-07 через 24 ч (Фигура 20В). 177Lu-ПСА-617 был менее стабильным, выход составил ~86% интактного соединения через 4 ч, однако, полный распад (<2% интактного соединения) наблюдался через 24 ч (Фигура 20А). Присутствие L-аскорбиновой кислоты предотвращало радиолиз полностью, что приводило к выходу >98% интактного 177Lu-ПСА-617 даже через 24 ч (Фигура 20В). Коэффициент распределения n-октанол/PBS (величина logD) для 177Lu-ПСА-АЛБ-02 (-2.8±0.09) была наибольшей. Самая низкая величина logD была получена для 177Lu-ПСА-617 (-4.4±0.15).
Изучение клеточного захвата и связывания с альбумином in vitro
Захват 177Lu-ПСА-АЛБ-02, 177Lu-ПСА-АЛБ-05 и 177Lu-ПСА-АЛБ-07 PC-3 PIP клетками находился в пределах 52-57%, в то время как интернализированная фракция составляла от 18 до 24% после периода инкубации в течение 2 ч при температуре 37 °C (Фигура 21A). Через 4 ч инкубации клеточный захват и интернализация незначительно увеличились до 60-63% и 20-26%, соответственно. 177Lu-PSMA-617 продемонстрировал аналогичные величины клеточного захвата (58%), однако только 12% радиоактивного лиганда интернализировалось после 4 ч инкубации. Захват PC-3 flu клетками был ниже 0,5% для всех альбумин-связывающих радиоактивных лигандов, а также для 177Lu-PSMA-617 (Фигура 21B).
Результаты ультрафильтрации подтверждают выраженную способность 177Lu-ПСА-АЛБ-02, 177Lu-ПСА-АЛБ-05 и 177Lu-ПСА-АЛБ-07связываться с белками плазмы при инкубации с мышиной плазмой (87±1,0%, 77±2,1% и 64±2,1%, соответственно) и плазмой человека (95±1.2%, 95±0.6 и 95±0.1%, соответственно). Полученные величины были существенно выше (p <0.05), чем для 177Lu-PSMA-617, что указывает на очень низкую способность данного соединения связываться с белками мышиной плазмы (9.3±1.1 %) и лишь незначительное связывание с белками человеческой плазмы (57±2.3%). Контрольные эксперименты, которые проводились с PBS, показали, что задержка радиоактивных лигандов на фильтре (<5%) была, по всей видимости, обусловлена абсорбцией соединений на фильтрационном приборе (данные не представлены).
Анализ биораспределения.
Распределение 177Lu-ПСА-АЛБ-02, 177Lu-ПСА-АЛБ-05 и 177Lu-ПСА-АЛБ-07 в тканях оценивали на мышах-опухоленосителях линии PC-3 PIP и PC-3 flu после введения в правое и левое плечо, соответственно. Период наблюдения составил 192 ч (Фигура 22).
Захват всех радиоактивных лигандов PC-3 PIP опухолевыми клетками имел одинаковый кинетический профиль. 177Lu-ПСА-АЛБ-02 быстро накапливался в опухоли, уже через 4 ч п/в аккумуляция составила 78.4±12.8% IA/г и сохранялась на этом уровне в течение 24 ч п/в (76.4±2.49% IA/г). Все новые соединения, в частности 177Lu-ПСА-АЛБ-02, демонстрировали высокие уровни активности (18-21% IA/г), быстрый клиренс радиоактивности из крови и быстрый почечный клиренс. Максимальный опухолевый захват 177Lu-ПСА-617 составлял ~56% IA/г уже через 4 ч п/в, к 192 ч он снизился приблизительно до 20% IA/г. Он быстро вымывался из кровеносного русла, уже через 1 ч достигал уровня <1% IA/г, кроме того, он неуклонно вымывался почками: ~10% IA/g через 1 ч п/в до <1% IA/г через 24 ч п/в. Уровни радиоактивности во всех остальных тканей был существенно ниже уровней в крови и постепенно снижался с течением времени. Соотношения опухоль/кровь, опухоль/почки и опухоль/печень были выше для всех новых соединений, в особенности для 177Lu-ПСА-АЛБ-02. По причине быстрого выведения почками, соотношение опухоль/неизмененные окружающие ткани для 177Lu-ПСА-617 было высоким.
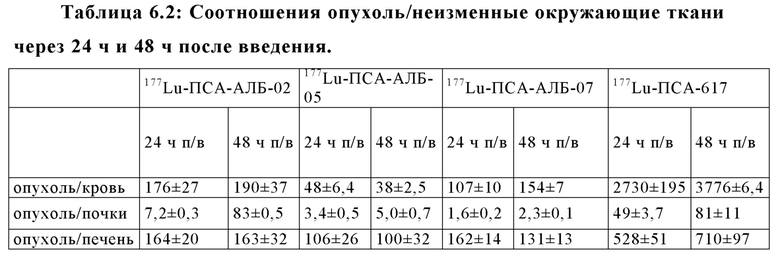
Дополнительные исследования проводились для того, чтобы заблокировать ПСА путем введения 2-PMPA перед инъекцией 177Lu-ПСА-АЛБ-02. Захват опухолевыми PC-3 PIP клетками снижался на 65% (17.6±3.24% IA/г) и 41% (46.0±7.29% IA/г) через 1 ч и 4 ч п/в, соответственно, при сравнении с незаблокированным захватом в те же временные точки. Накопленная радиоактивность в почках снижалась до 81% и 59% через 1 ч и 4 ч соответственно после введения радиоактивного лиганда. Во всех других органах и тканях наблюдалось слабое и неотчетливое снижение накопленной радиоактивности (данные не представлены).
Для расчета площади под кривой (AUC) использовали данные об аккумуляции радиоактивных лигандов в кровеносном русле, опухолях, почках и печени без поправки на радиоактивный распад, (Рисунок 23, Таблица 6.3).
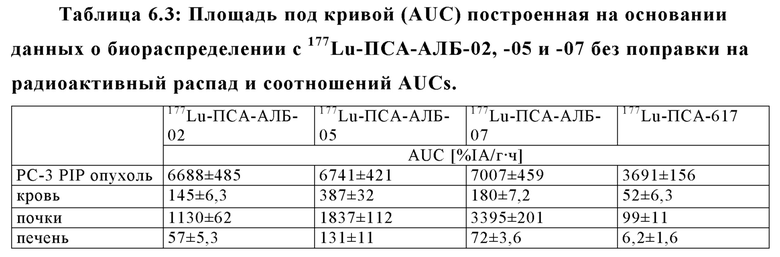
Для всех новых радиоактивных лигандов были определены сопоставимые AUCs, отражающие захват опухолевыми клетками PC-3 PIP, которые были практически в два раза больше, чем AUC (p<0.05), рассчитанная для 177Lu-PSMA-617. Для всех радиоактивных лигандов соотношения распределения опухоль/кровь, опухоль/почка и опухоль/печень были высокими. Для 177Lu-PSMA-617 высокое соотношение TBR: накопление в опухоли/в неизмененных тканях и большая площадь под кривой были обусловлены быстрым почечным клиренсом данного радиоактивного лиганда (Таблица 6.2).
SPECT/КТ визуализирующие исследования. SPECT/КТ изображения получали для мышей привитых PC-3 PIP/flu опухолями, через 4 ч, 24 ч и 72 ч после введения новых радиоактивных лигандов, а также 177Lu-ПСА-617 (Фигура 24 и 25).
Накопление всех альбумин-связывающих радиоактивных лигандов в PC-3 PIP опухолевых ксенотрансплантатах было одинаковым через 24 ч п/в. Почечный захват, в особенности для 177Lu-ПСА-АЛБ-02 был низким. Время зависимые SPECT/КТ изображения, полученные с 177Lu-ПСА-АЛБ-02 выявили снижение соотношения опухоль/окружающие неизмененные ткани с течением времени.По сравнению с 177Lu-ПСА-617, захват 177Lu-ПСА-АЛБ-02 опухолевыми клетками существенно увеличивался в течение всего времени исследования, аналогичное накопление происходило и в почках (Фигура 25). В ПСА-негативных PC-3 flu опухолях активного накопления не наблюдалось.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ СВЯЗЫВАЮЩИЕ ОПУХОЛЕВЫЙ АНТИГЕН АГЕНТЫ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2831681C2 |
| Лиганды PSMA для визуализации и эндорадиотерапии | 2018 |
|
RU2807076C2 |
| ПСМА-ТАРГЕТНОЕ СОЕДИНЕНИЕ И ЕГО КОМПЛЕКС С РАДИОНУКЛИДАМИ ДЛЯ ТЕРАНОСТИКИ ОПУХОЛЕЙ, ЭКСПРЕССИРУЮЩИХ ПСМА | 2022 |
|
RU2803734C1 |
| СОЕДИНЕНИЕ ПЕПТИДНОЙ ПРИРОДЫ, ОБЛАДАЮЩЕЕ СПОСОБНОСТЬЮ СВЯЗЫВАТЬСЯ С ПСМА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2823164C2 |
| КОНЪЮГАТ, СОДЕРЖАЩИЙ ЛИГАНД РЕЦЕПТОРОВ НЕЙРОТЕНЗИНА, И ЕГО ПРИМЕНЕНИЕ | 2015 |
|
RU2743781C2 |
| КОНЪЮГАТЫ АНТАГОНИСТА ПЕПТИДА АНАЛОГА БОМБЕЗИНА | 2009 |
|
RU2523531C2 |
| ЦИКЛИЧЕСКИЙ ОКТАПЕПТИД, РАДИОФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО НА ЕГО ОСНОВЕ И СПОСОБ ПРИМЕНЕНИЯ РАДИОФАРМАЦЕВТИЧЕСКОГО СРЕДСТВА ДЛЯ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННЫХ (ФАРМАЦЕВТИЧЕСКИХ) СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ НОВООБРАЗОВАНИЙ, ЭКСПРЕССИРУЮЩИХ СОМАТОСТАТИНОВЫЕ РЕЦЕПТОРЫ | 2013 |
|
RU2528414C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА ПСМА-ТАРГЕТНОГО СОЕДИНЕНИЯ НА ОСНОВЕ МОЧЕВИНЫ Lu-PS-161 И КОМПЛЕКС | 2023 |
|
RU2808636C1 |
| ЛИГАНДЫ РЕЦЕПТОРА НЕЙРОТЕНЗИНА | 2013 |
|
RU2671970C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2004 |
|
RU2355418C2 |
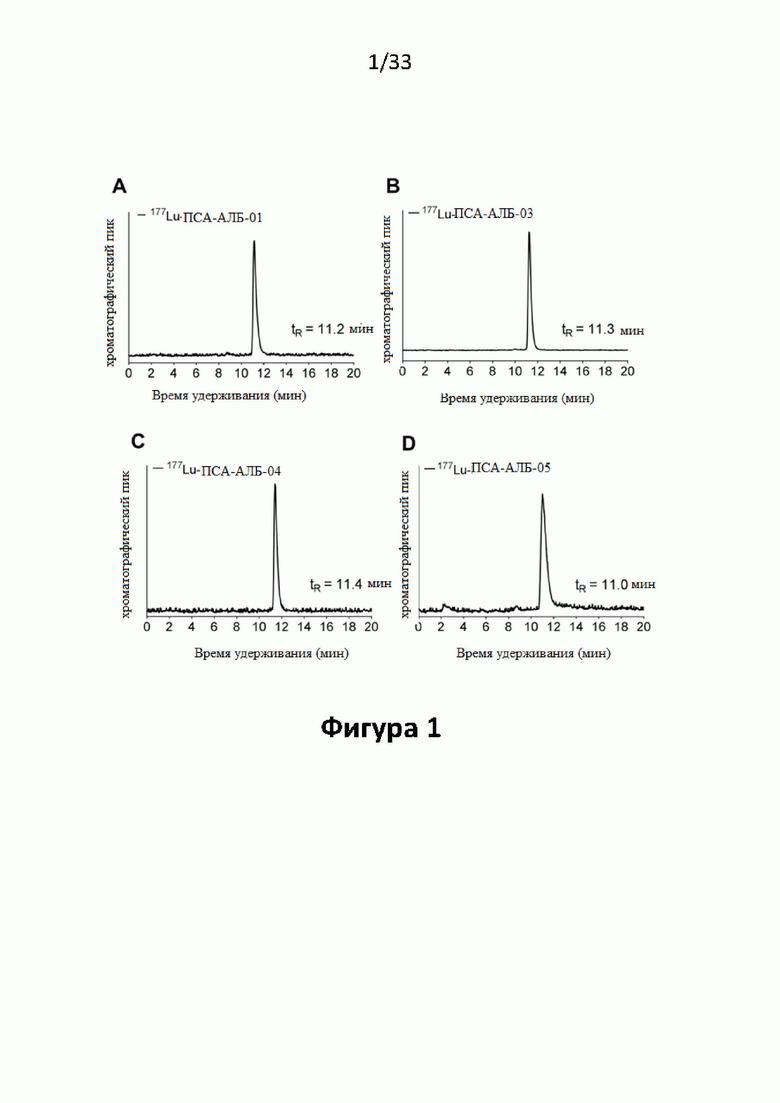


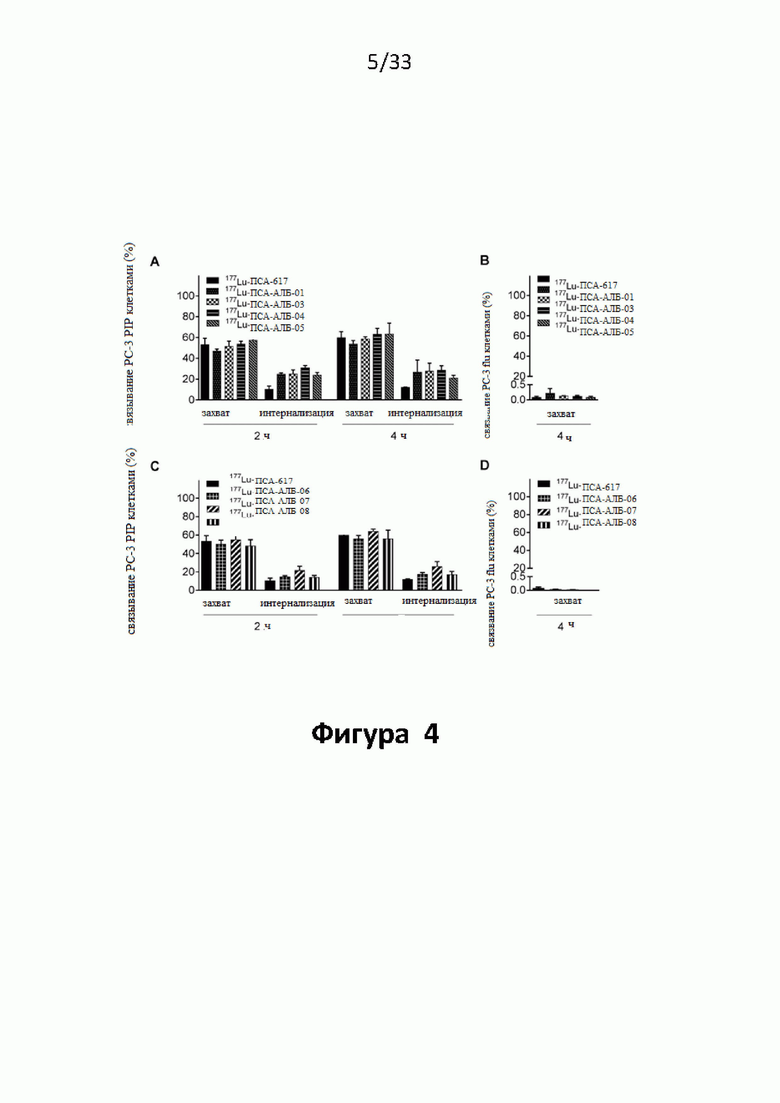
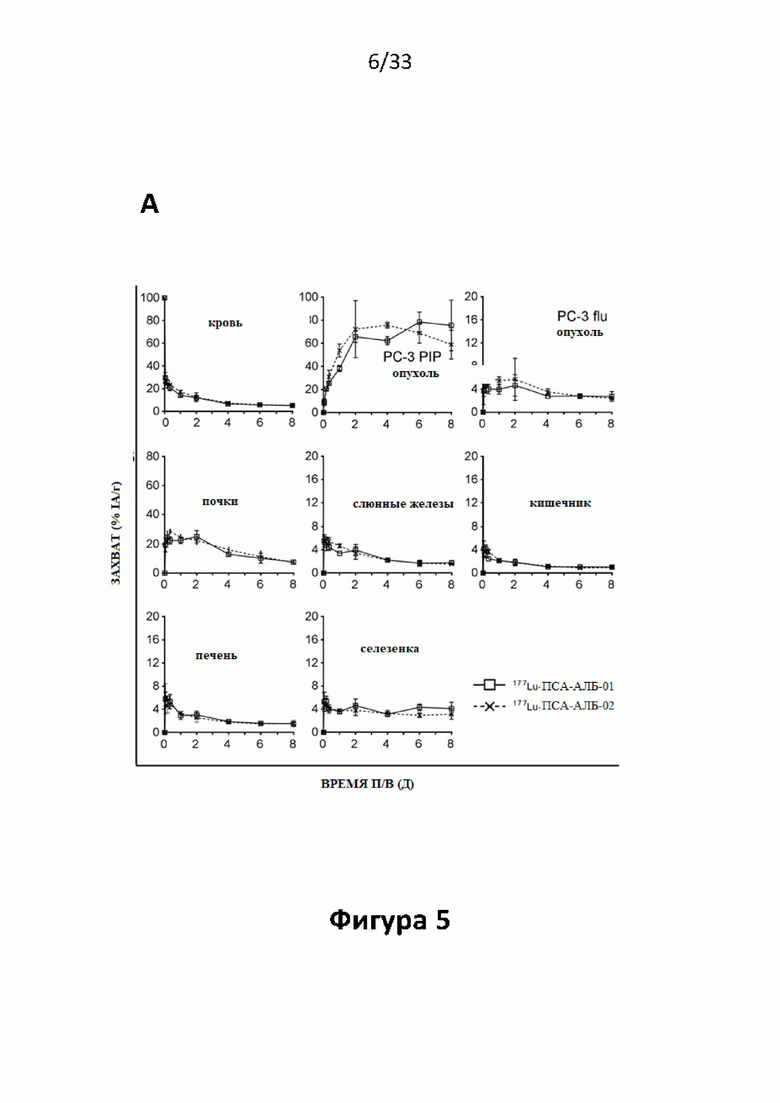
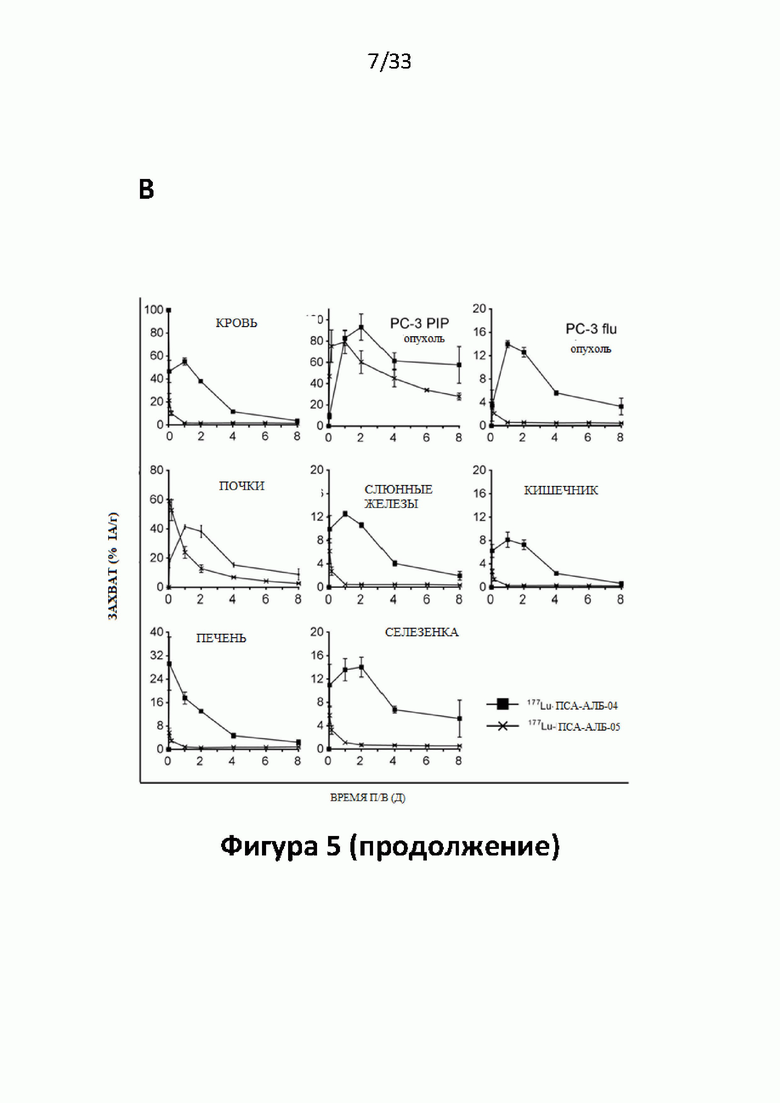
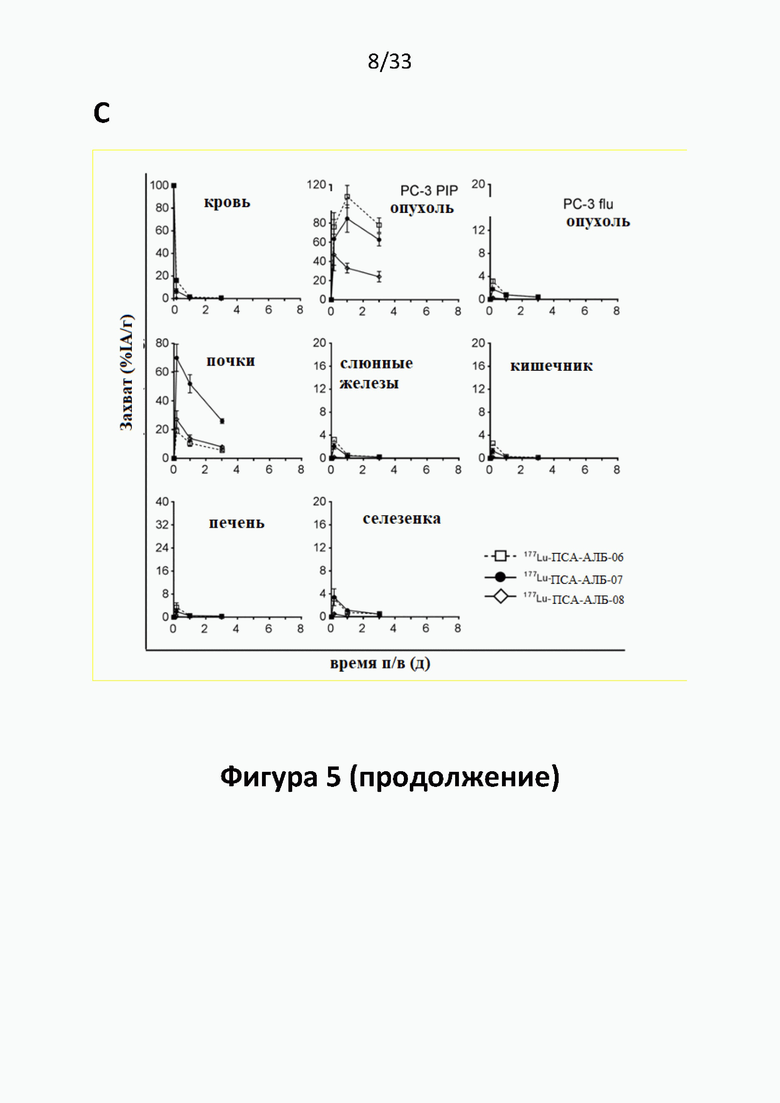
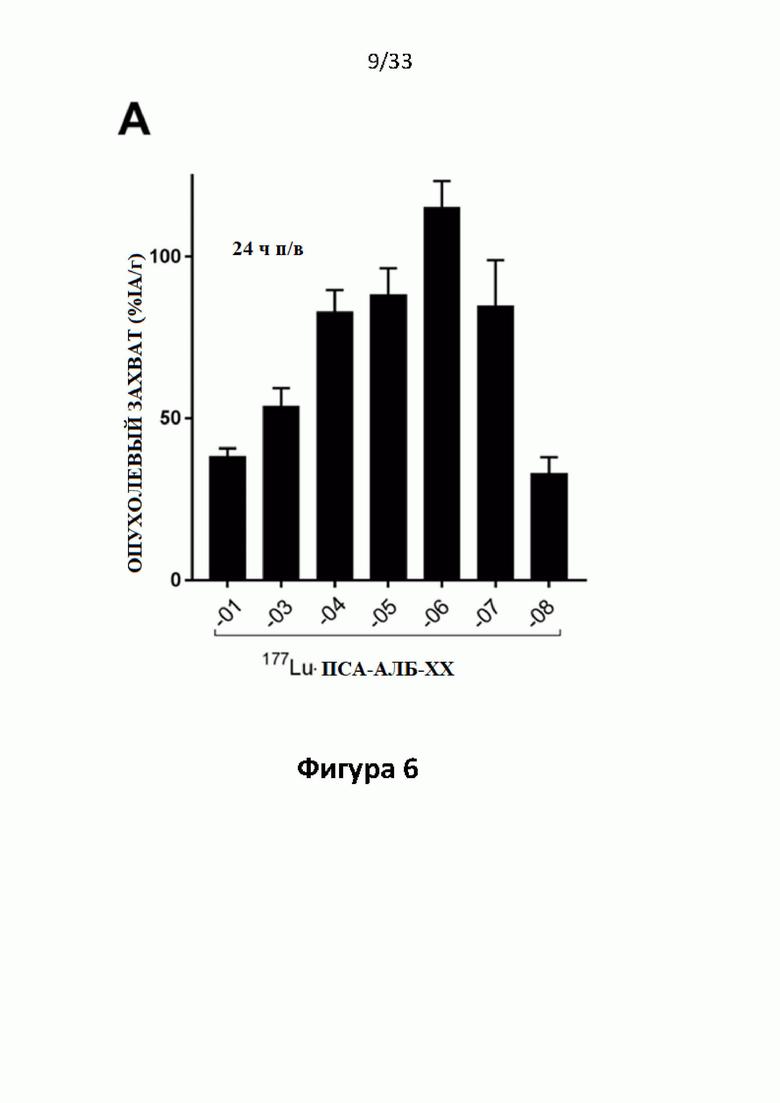
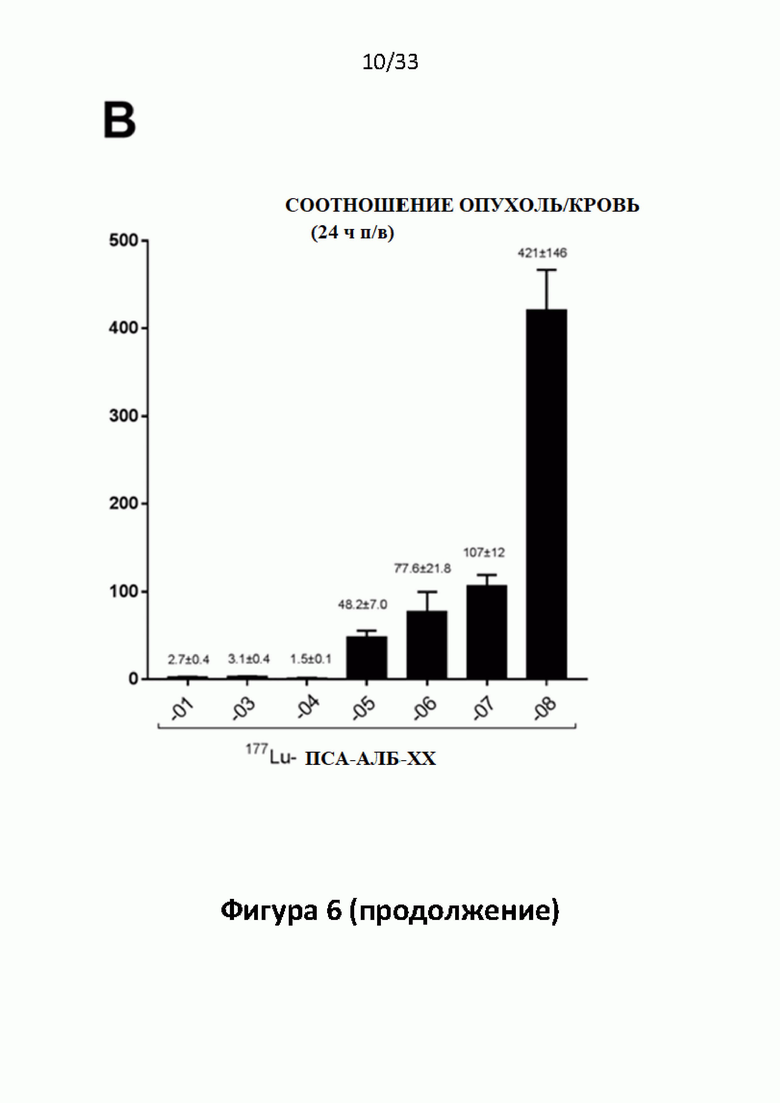
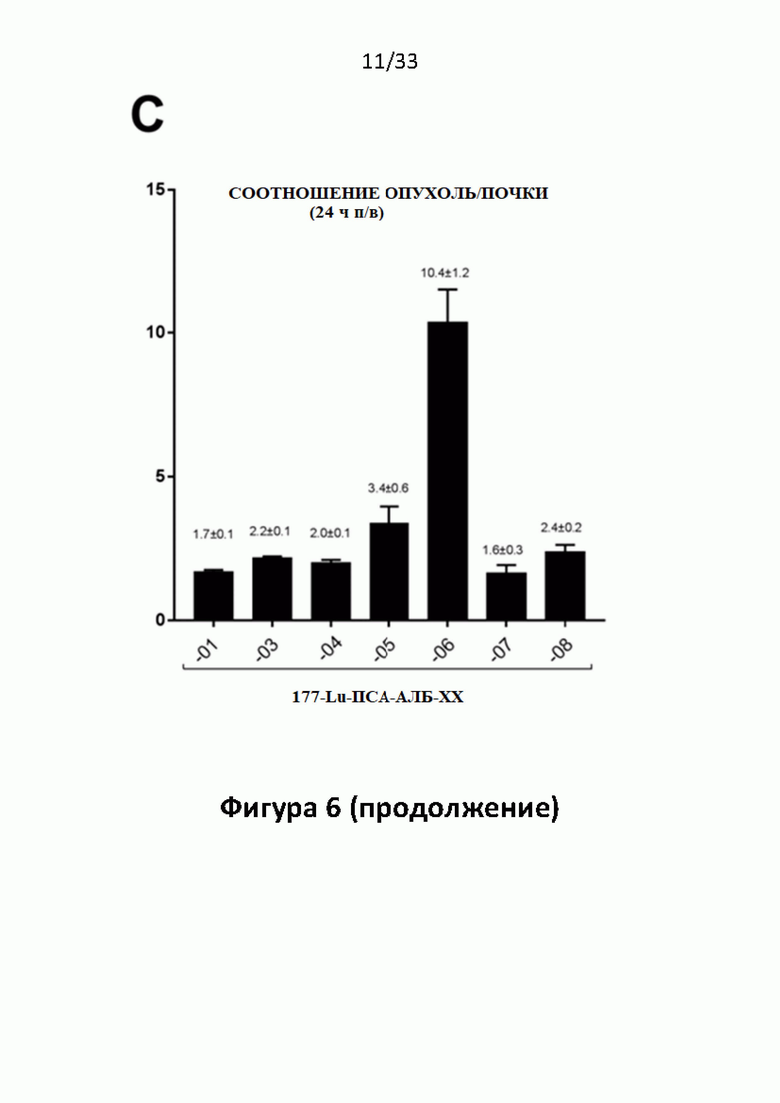
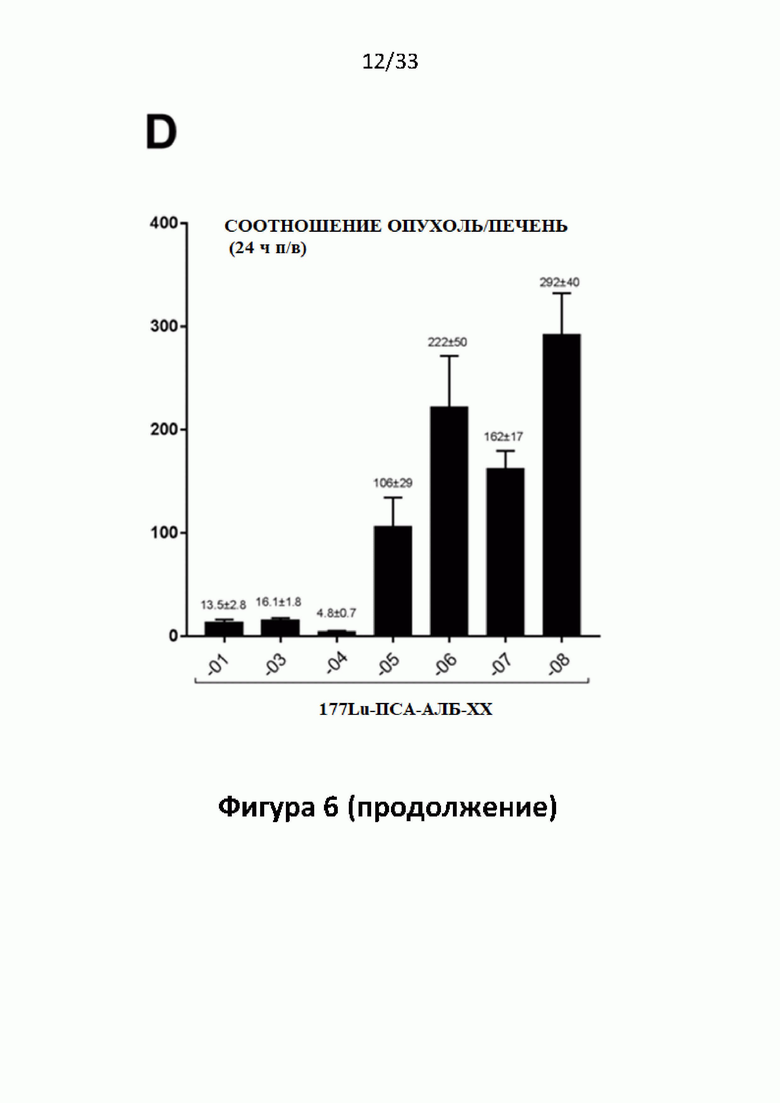
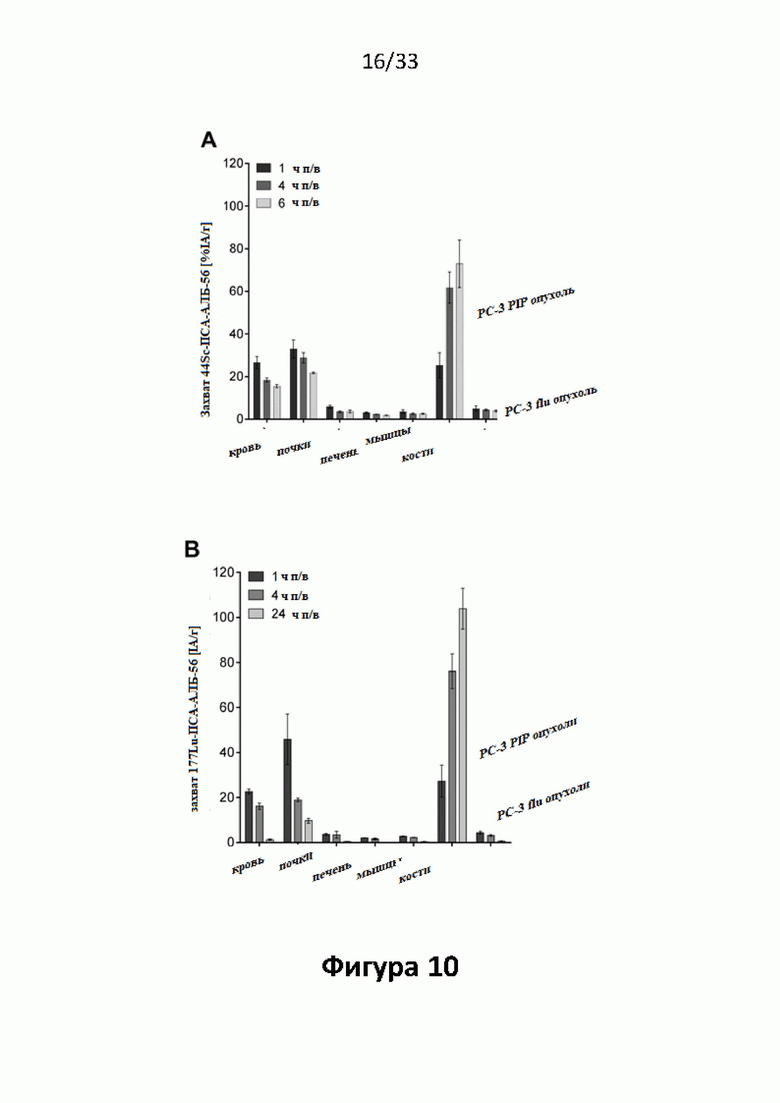
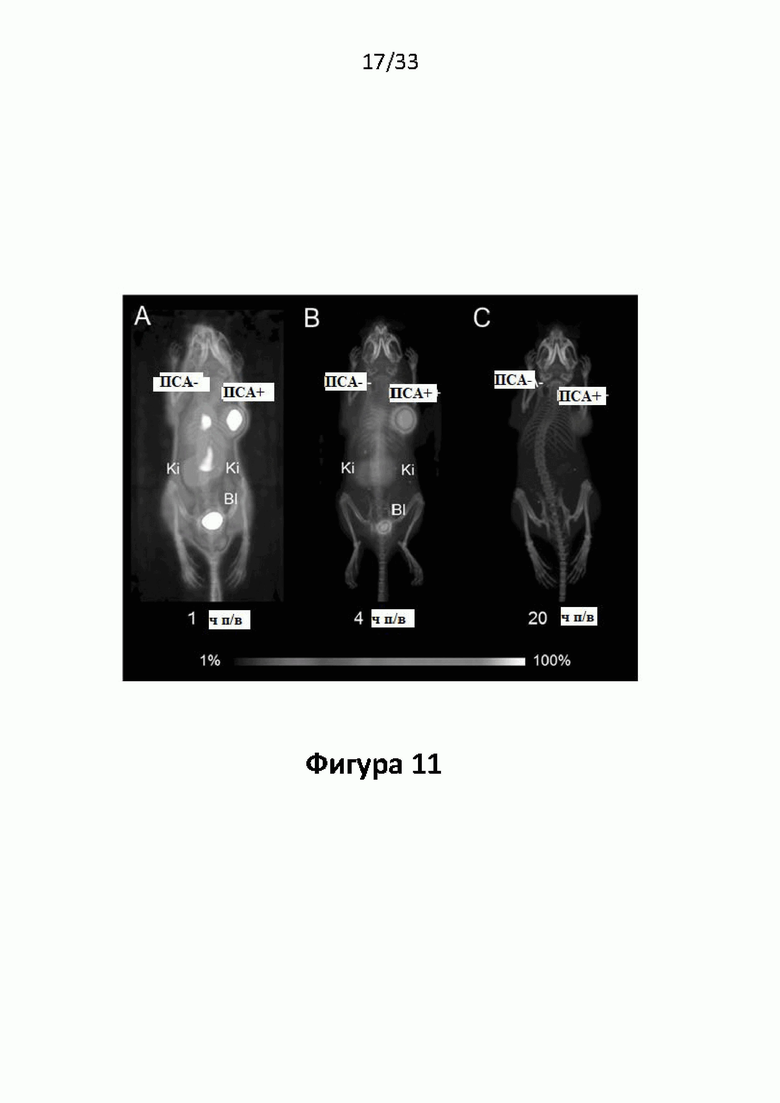
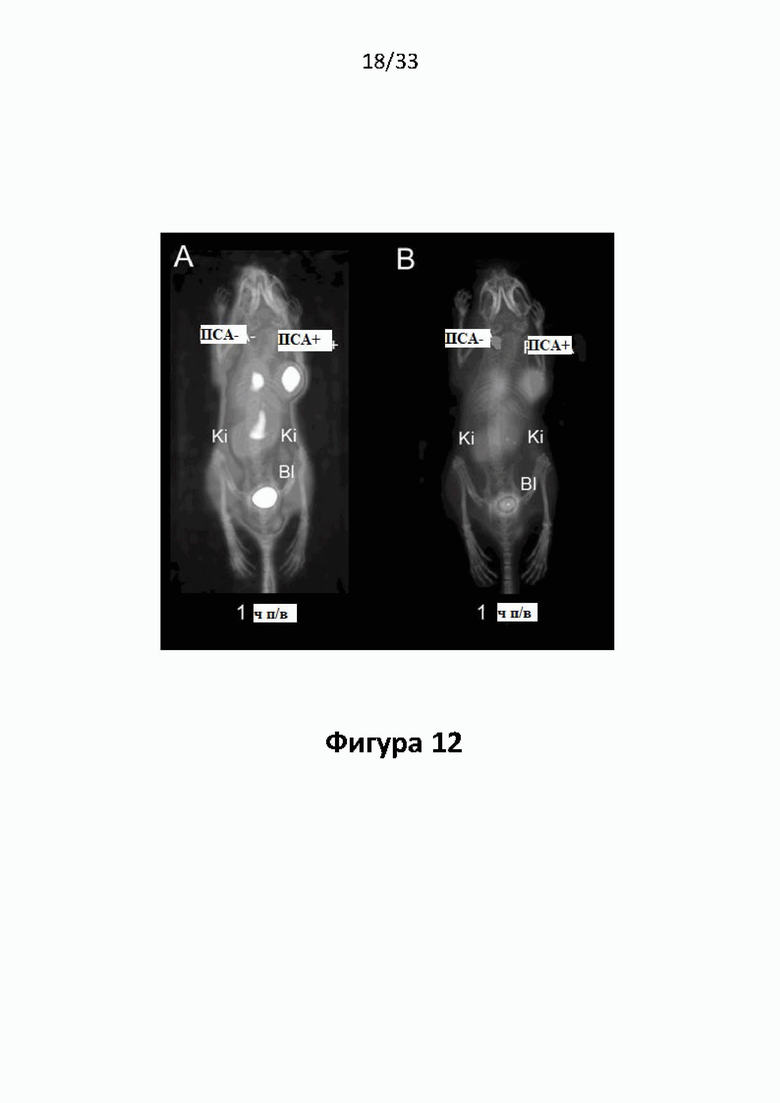
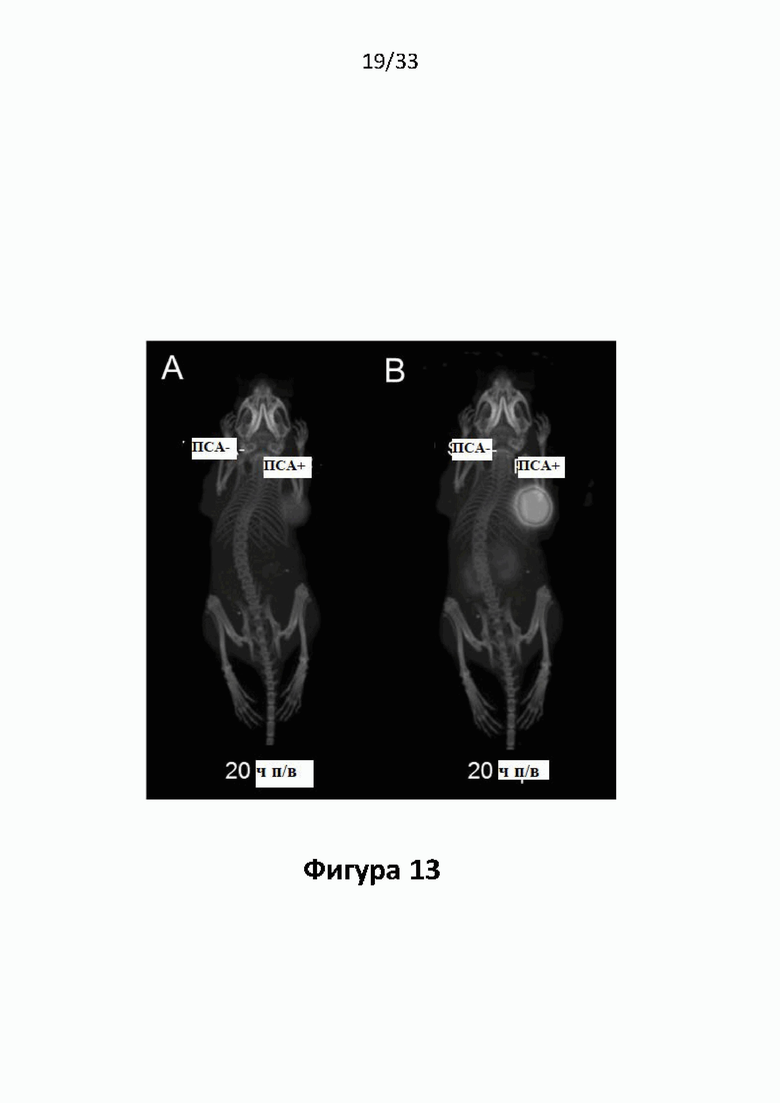
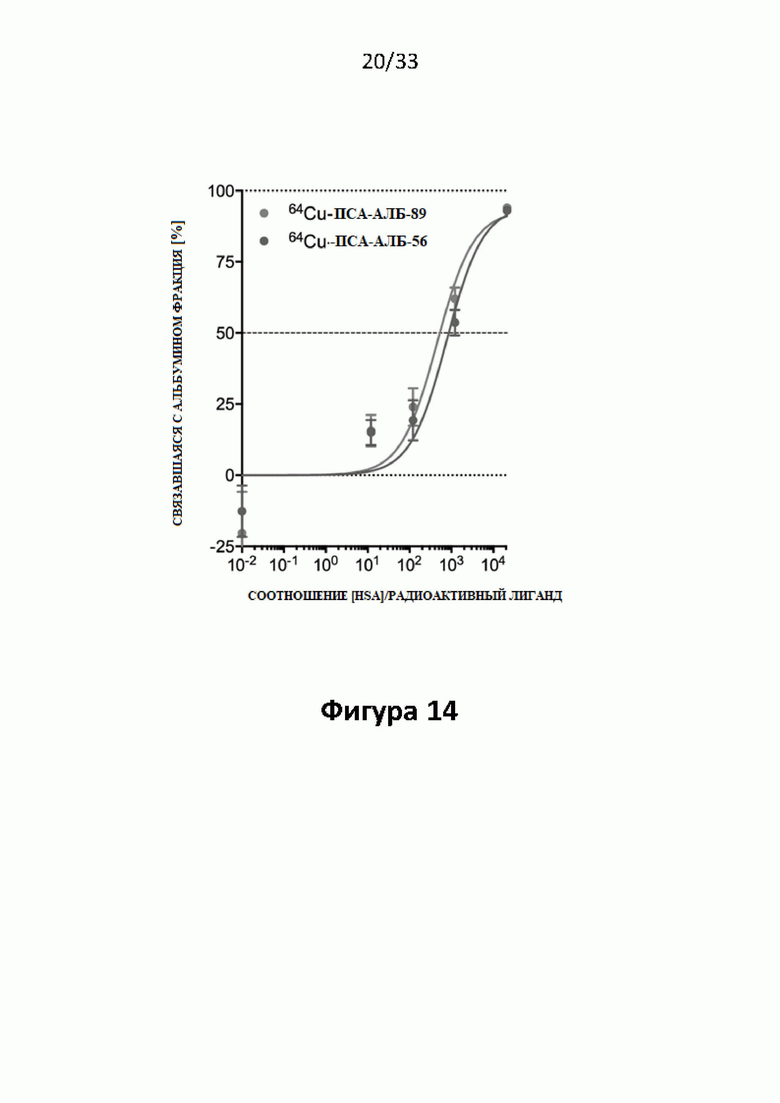
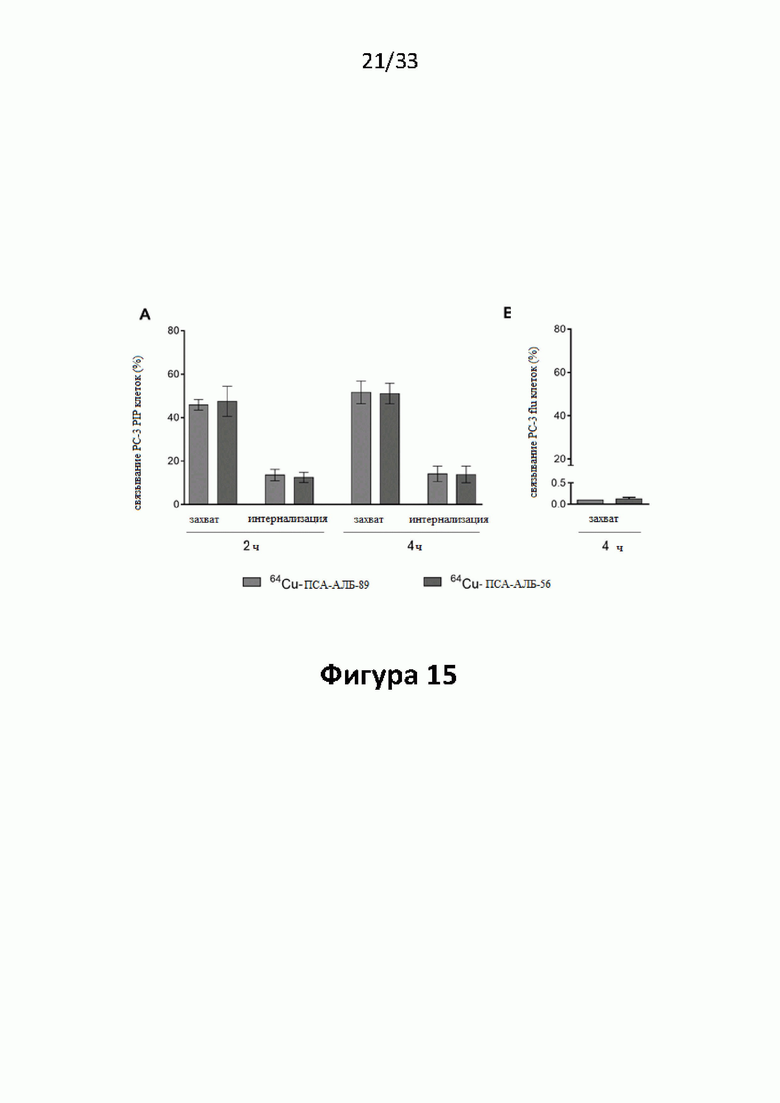
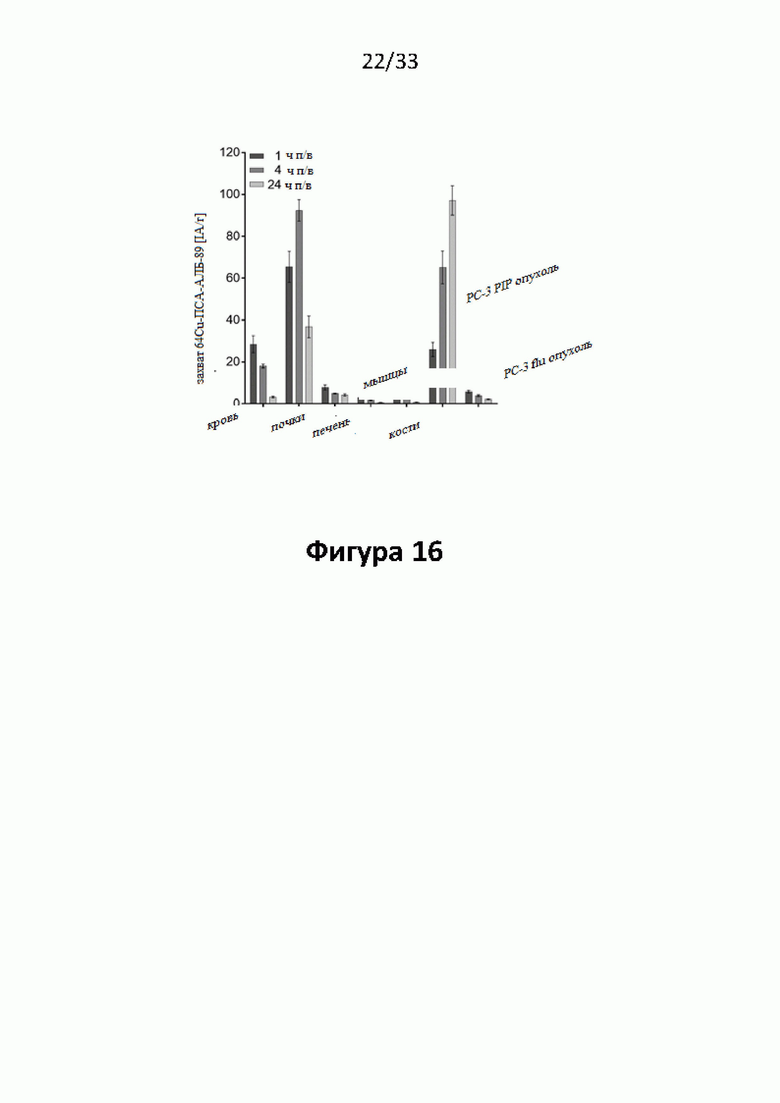
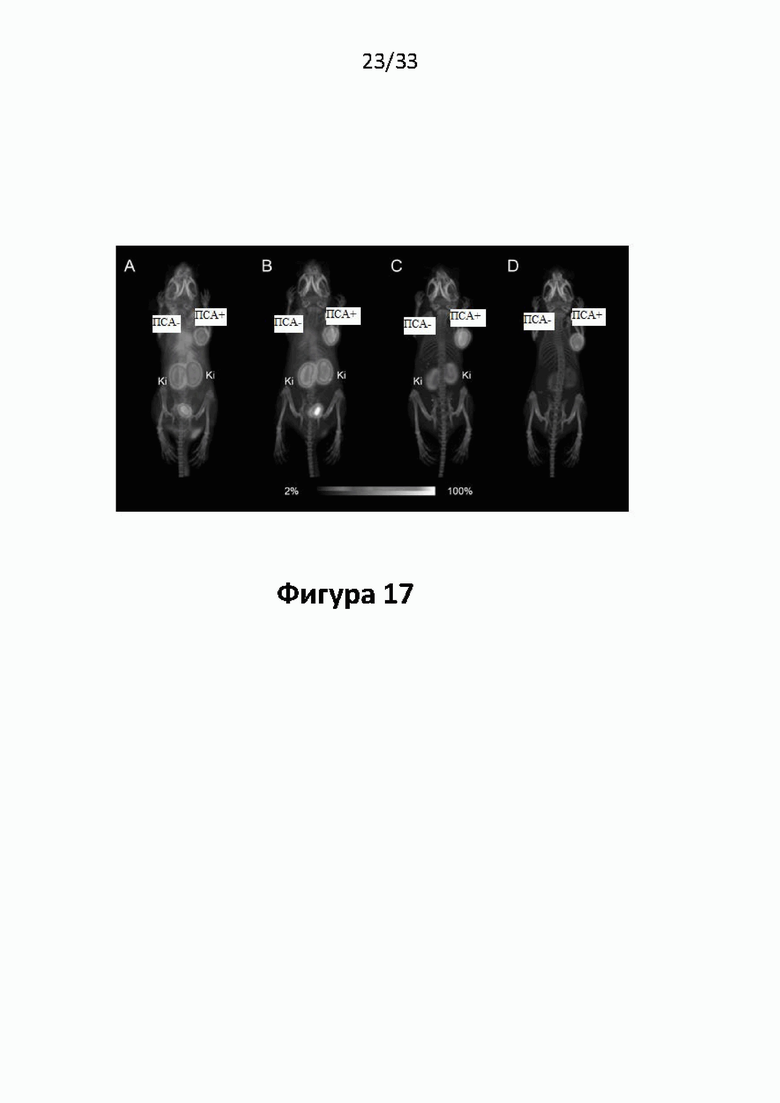
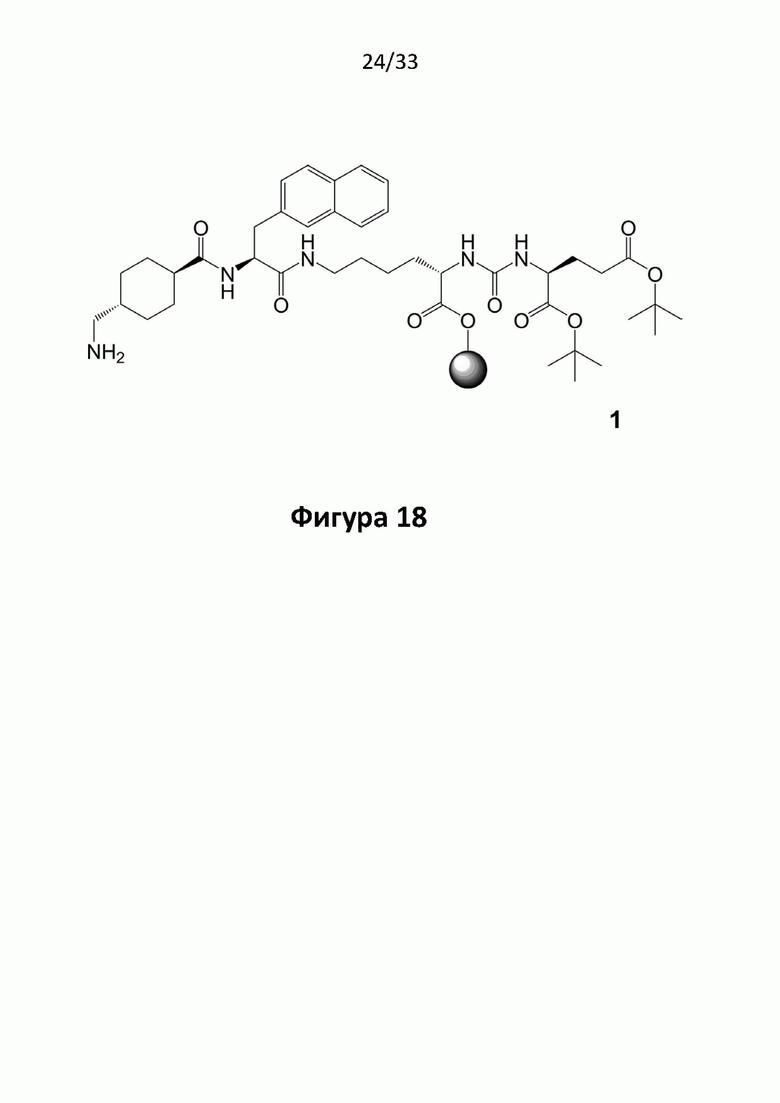
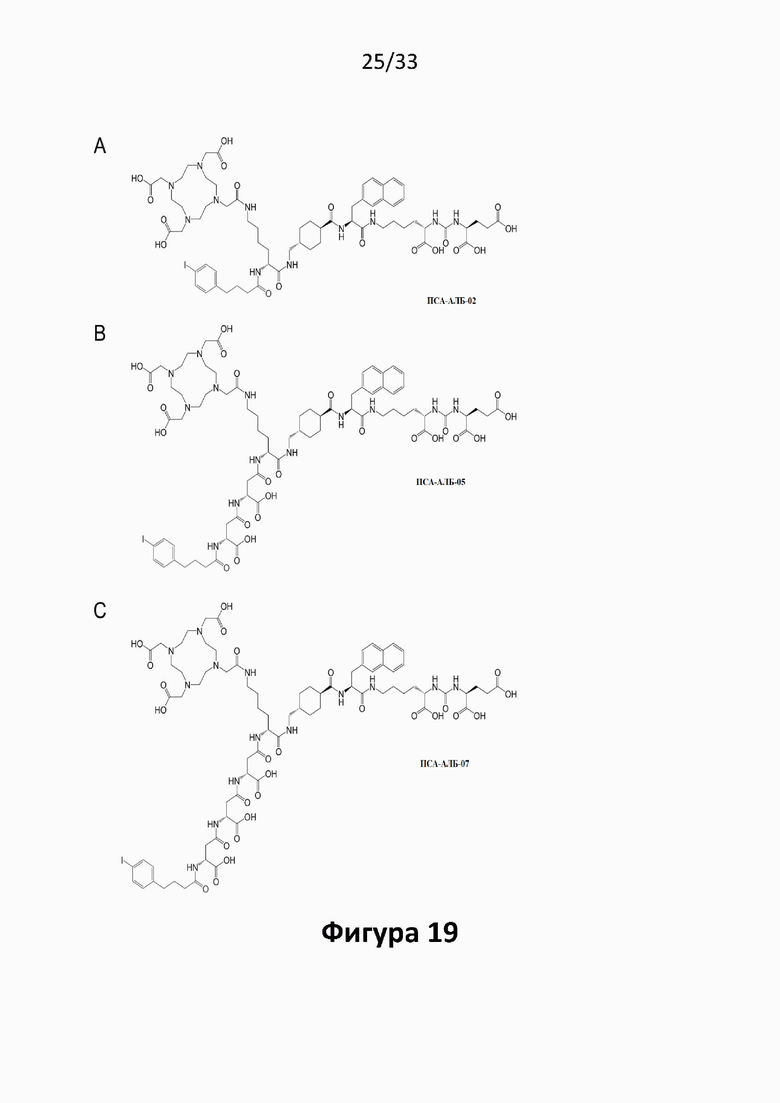
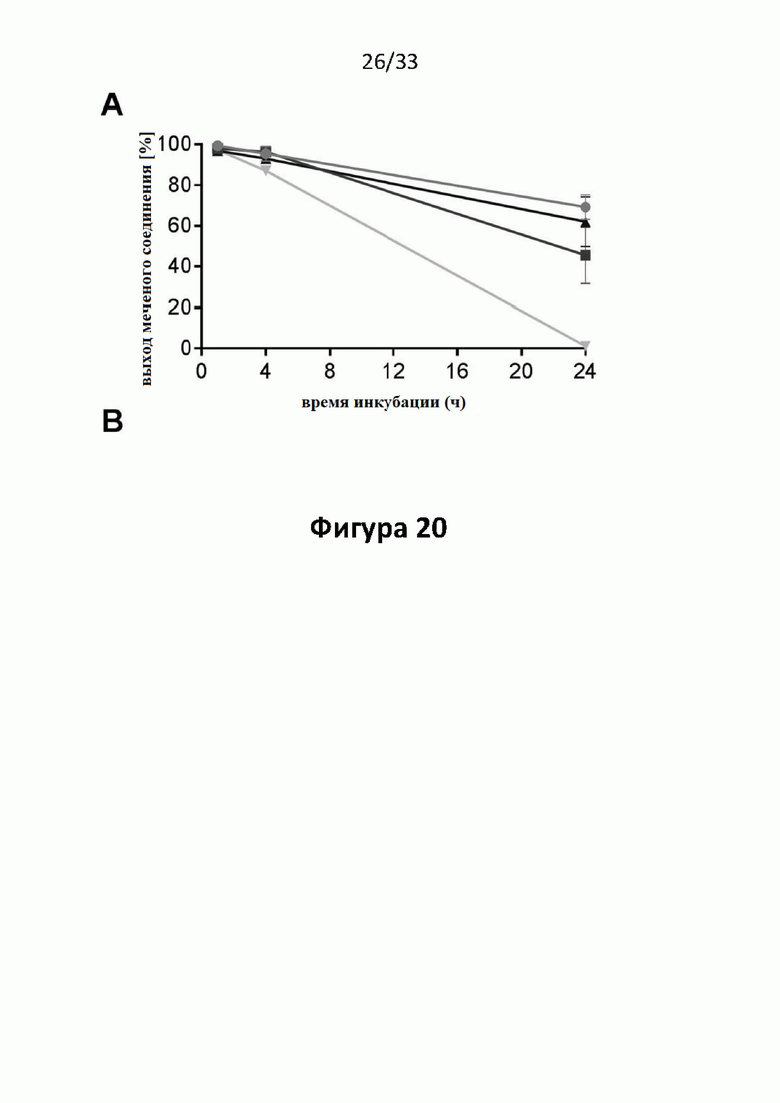
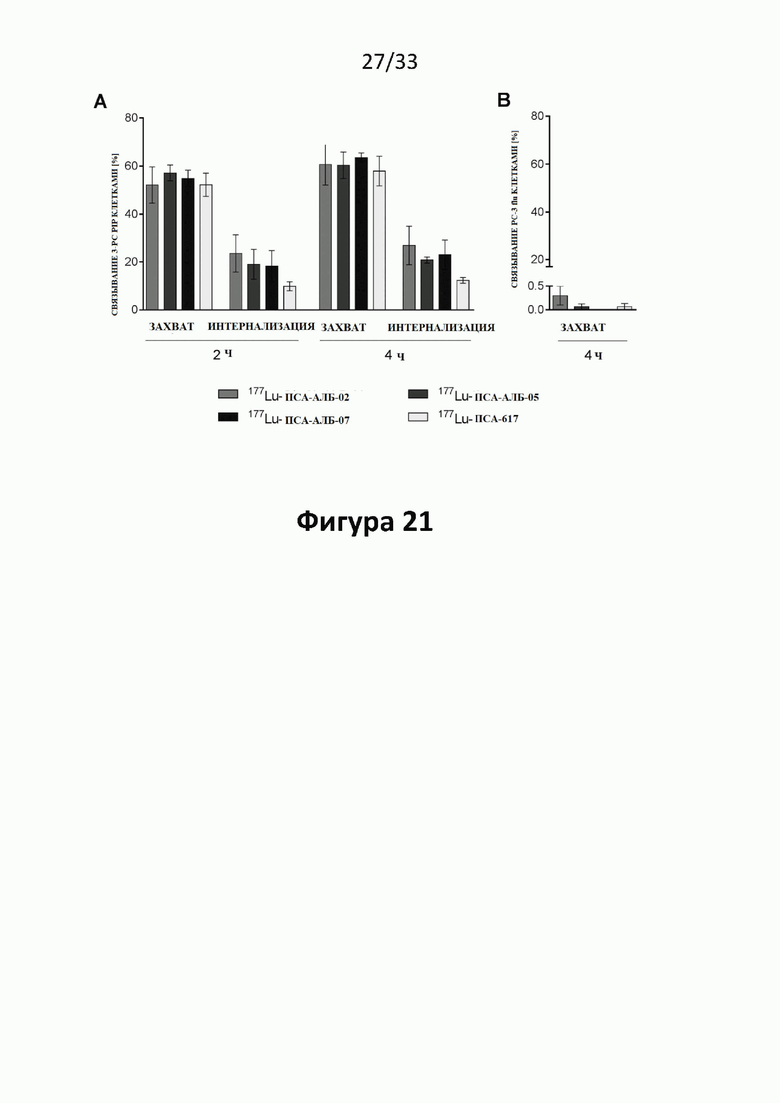
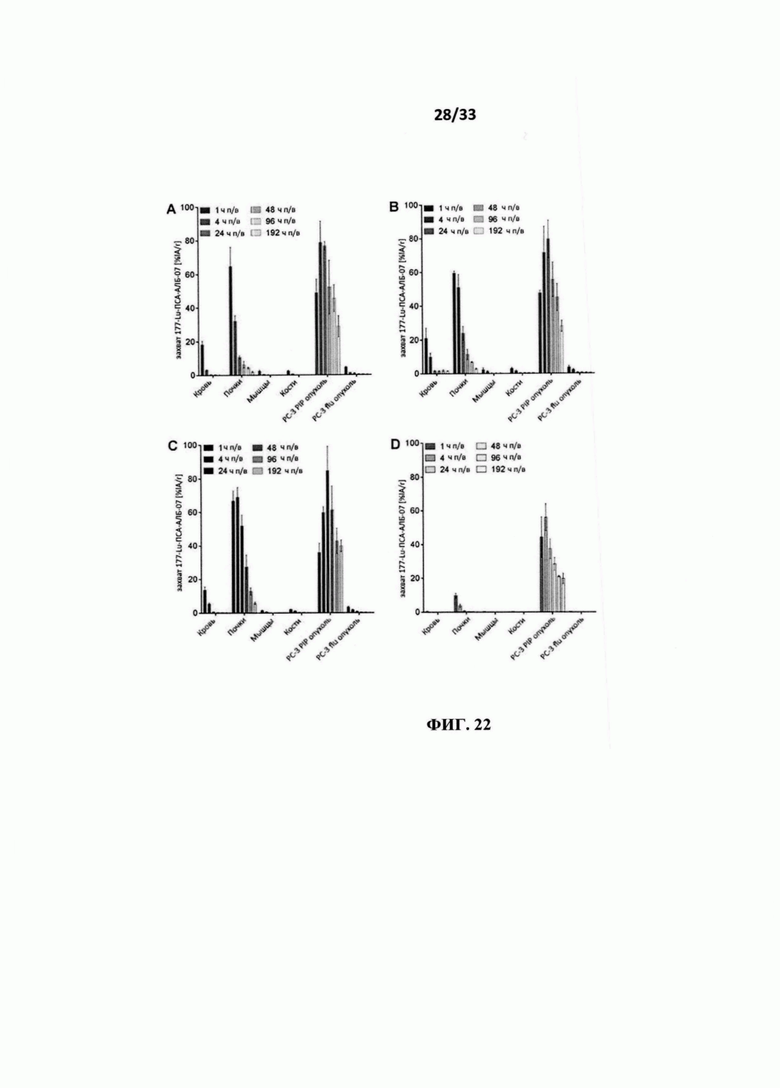
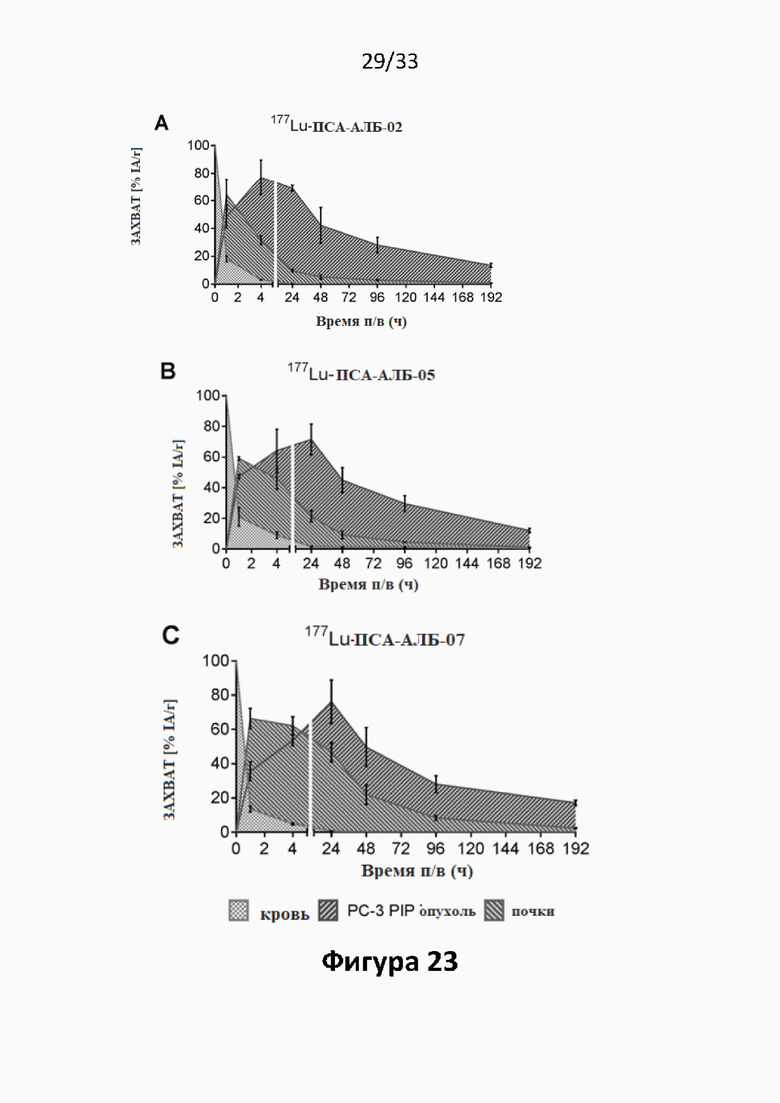
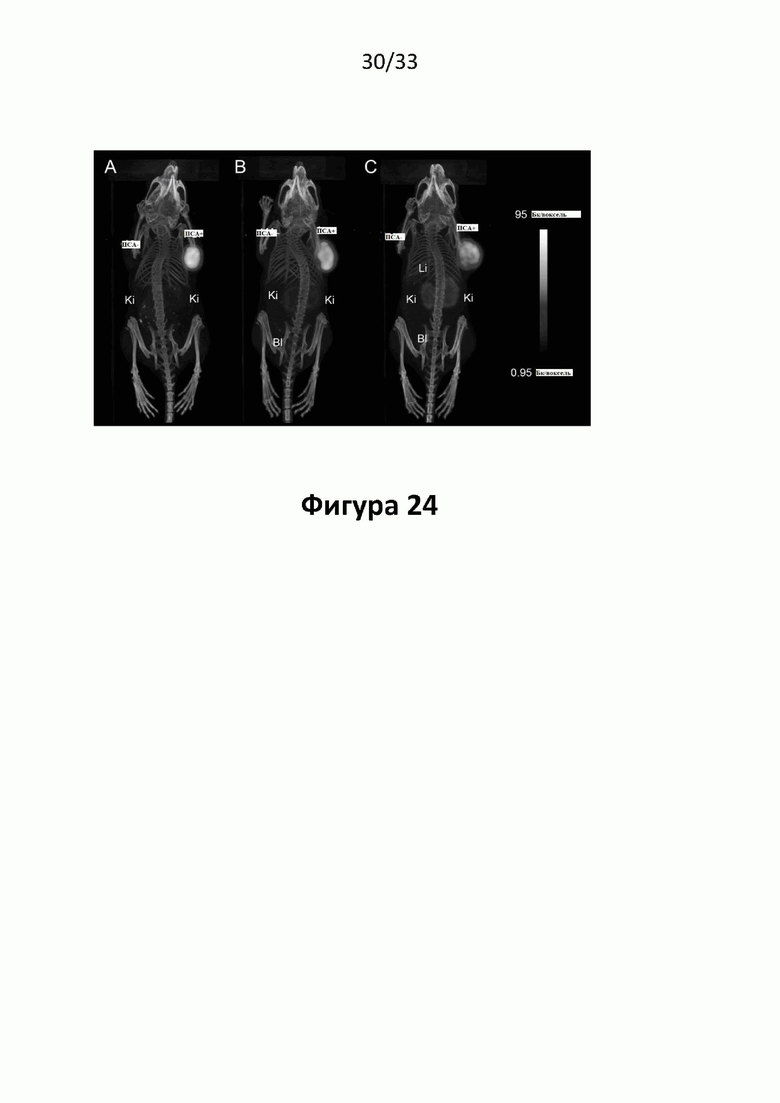

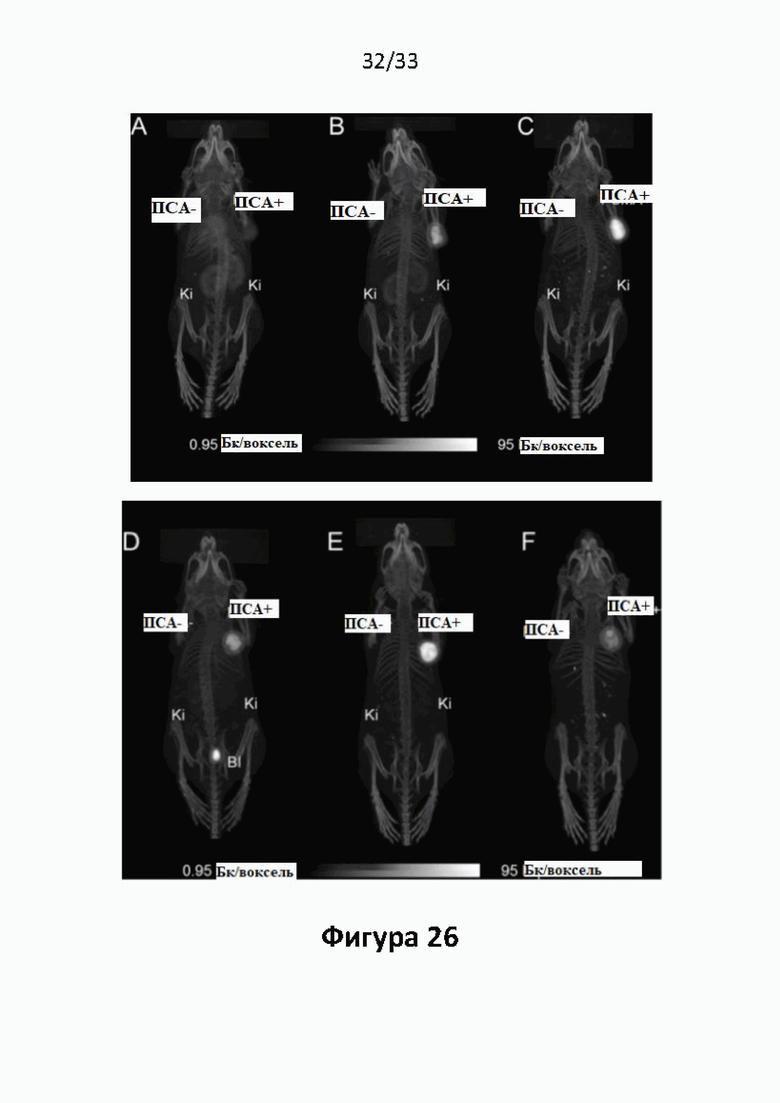
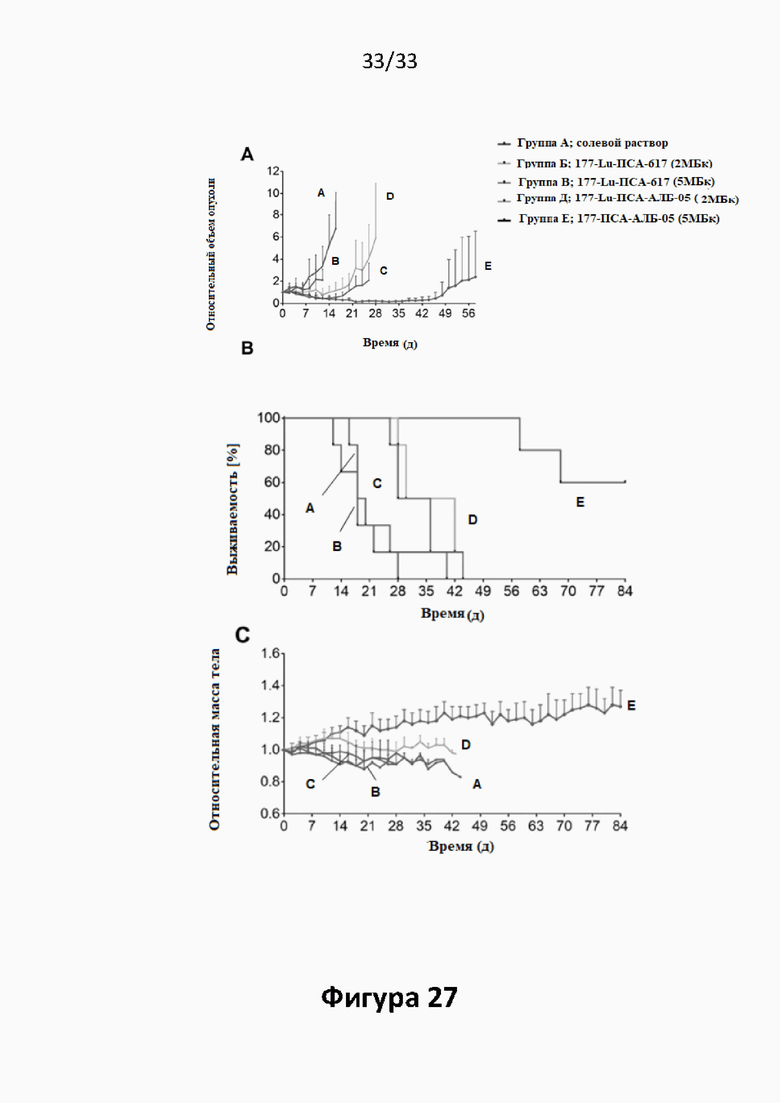
Изобретение относится к соединению общей формулы (1а) или его фармацевтически приемлемым солям или меченым радиоактивной меткой комплексам, которые обладают способностью селективно связываться с мембраной простат-специфического антигена (ПСА) и могут найти применение в качестве радиофармацевтических средств, визуализирующих агентов, а также для лечения рака. В формуле (1а) D представляет собой хелатирующий остаток, выбранный из группы, включающей 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA), 2-(4,7-бис(карбоксиметил)-1,4,7-триазононан-1-ил)пентандиовую кислоту (NODAGA), 2-(4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододекан-1-ил)пентадиовую кислоту (DOTAGA) или их производные, X каждый независимо выбран из О, R1 и R2 каждый независимо представляет собой Н, F, Cl, Br, I или C1-C12 алкил, Y выбран из группы, включающей прямую связь или C1-C12 алкил, R3, R4 и R5 каждый независимо выбран из -CO2H, спейсер имеет формулу (3а), (3b) или (3с), где m представляет собой целое число 1 или 2, n представляет собой целое число, выбранное из 1, 2, 3, 4 или 5, о представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, линкер имеет структурную формулу (6), где X каждый независимо представляет собой О, Q выбран из С5-С14 циклоалкила, W выбран из -(СН2)с-арила, где с представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, и a, b каждый независимо представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10. Изобретение относится также к применению указанных соединений для получения меченых радиоактивной меткой комплексов, меченым радиоактивной меткой комплексам, фармацевтическим композициям и наборам, содержащим данные соединения, вариантам применения указанных соединений, комплексов, композиций и наборов, в том числе для диагностики, лечения и/или профилактики рака предстательной железы, поджелудочной железы, почек или мочевого пузыря, способу in vitro определения присутствия клеток и/или тканей, экспрессирующих ПСА. 10 н. и 26 з.п. ф-лы, 27 ил., 15 табл., 6 пр.
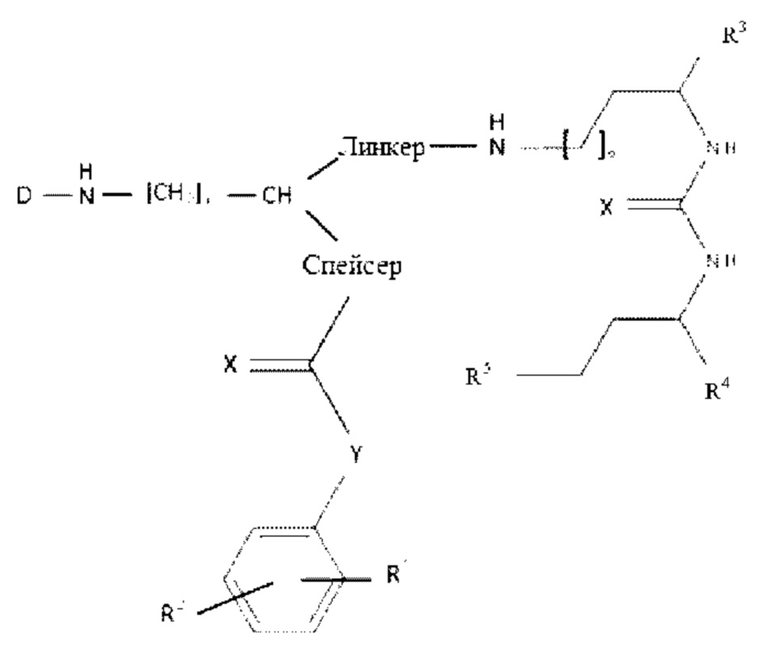

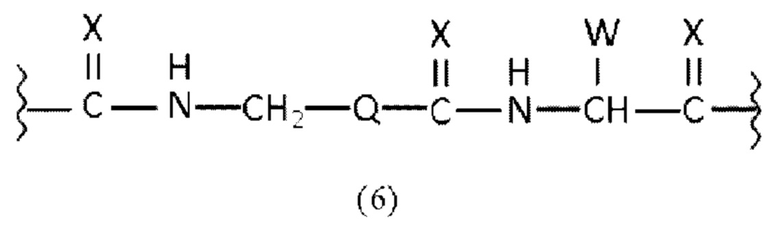
1. Соединение общей формулы (1а)
 ,
,
где D представляет собой хелатирующий остаток, выбранный из группы, включающей 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA), 2-(4,7-бис(карбоксиметил)-1,4,7-триазононан-1-ил)пентандиовую кислоту (NODAGA), 2-(4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододекан-1-ил)пентадиовую кислоту (DOTAGA) или их производные,
X каждый независимо выбран из О,
R1 и R2 каждый независимо представляет собой Н, F, Cl, Br, I или C1-C12 алкил,
Y выбран из группы, включающей прямую связь или C1-C12 алкил,
R3, R4 и R5 каждый независимо выбран из -CO2H,
спейсер имеет формулу (3а), (3b) или (3с)
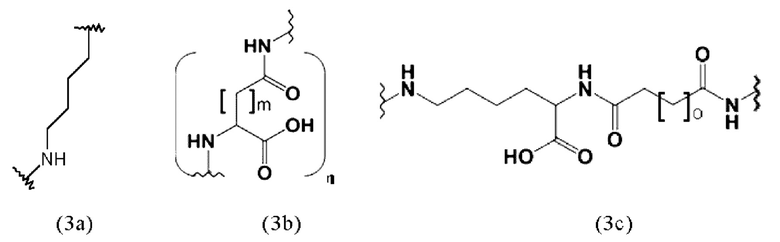 ,
,
где m представляет собой целое число 1 или 2,
n представляет собой целое число, выбранное из 1, 2, 3, 4 или 5,
о представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10,
линкер имеет структурную формулу (6)
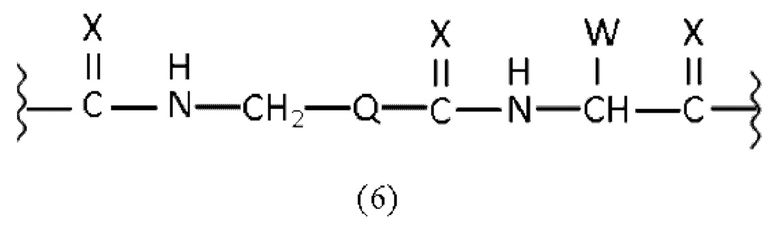 ,
,
где X каждый независимо представляет собой О,
Q выбран из С5-С14 циклоалкила,
W выбран из -(СН2)с-арила, где с представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, и
a, b каждый независимо представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10,
или его фармацевтически приемлемые соли или меченые радиоактивной меткой комплексы.
2. Соединение по п. 1, где указанное соединение имеет общую формулу (11)
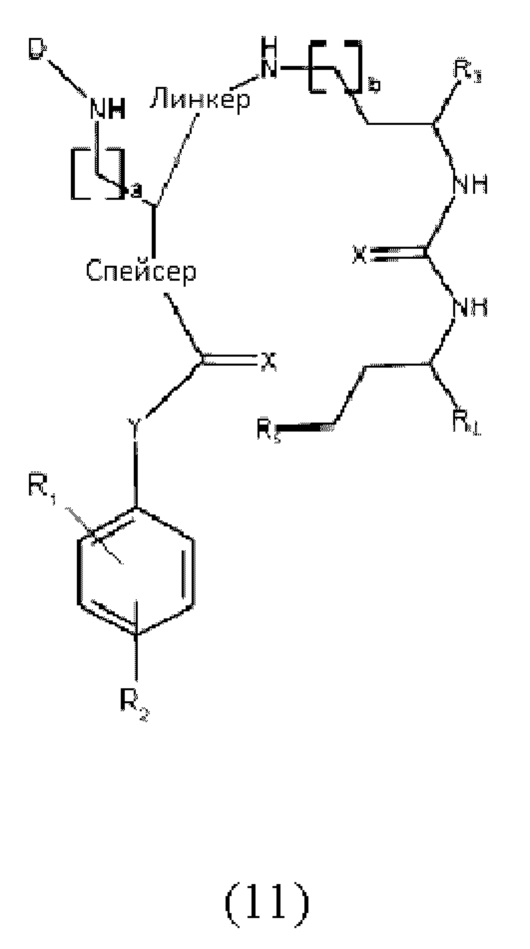 ,
,
где D представляет собой хелатирующий остаток, выбранный из группы, включающей 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA), 2-(4,7-бис(карбоксиметил)-1,4,7-триазононан-1-ил)пентандиовую кислоту (NODAGA), 2-(4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододекан-1-ил)пентадиовую кислоту (DOTAGA) или их производные,
X каждый независимо выбран из О,
R1 и R2 каждый независимо представляет собой Н, F, Cl, Br, I или С1-С12 алкил,
Y выбран из группы, включающей прямую связь или линейный или разветвленный С1-С12 алкил,
R3, R4 и R5 каждый независимо выбран из -CO2H,
спейсер имеет формулу (3а), (3b) или (3с)
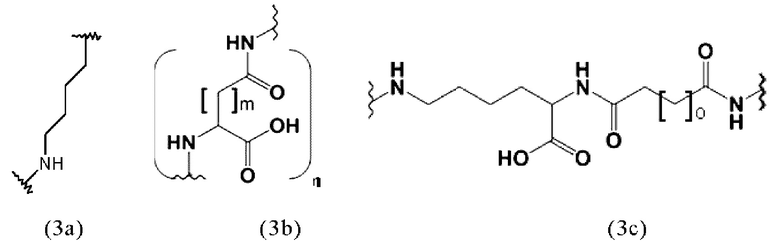 ,
,
где m представляет собой целое число 1 или 2,
n представляет собой целое число, выбранное из 1, 2, 3, 4 или 5,
о представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10,
линкер имеет структурную формулу (6)
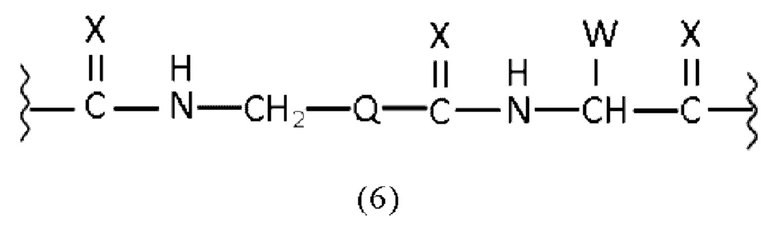 ,
,
где X каждый независимо представляет собой О,
Q выбран из С5-С14 циклоалкила,
W выбран из -(СН2)с-арила, где с представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, и
a, b каждый независимо представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10,
или его фармацевтически приемлемые соли или меченые радиоактивной меткой комплексы.
3. Соединение по любому из пп. 1, 2, где хелатирующий остаток D выбран из DOTA, NODAGA, DO3AP, DO3APPrA или DO3APABn.
4. Соединение по любому из пп. 1-3, где Y представляет собой линейный или разветвленный C1-С10 алкил, предпочтительно линейный или разветвленный C1-С6 алкил, более предпочтительно линейный или разветвленный C1-С3 алкил.
5. Соединение по п. 4, где Y представляет собой линейный С1-С3 алкил.
6. Соединение по любому из предшествующих пунктов, где R1 и R2 каждый независимо выбран из Н и галогена, предпочтительно йода или брома, и С1-6 алкила, предпочтительно С1-3 алкила, более предпочтительно метила.
7. Соединение по п. 6, где в общей формуле (1а) группа
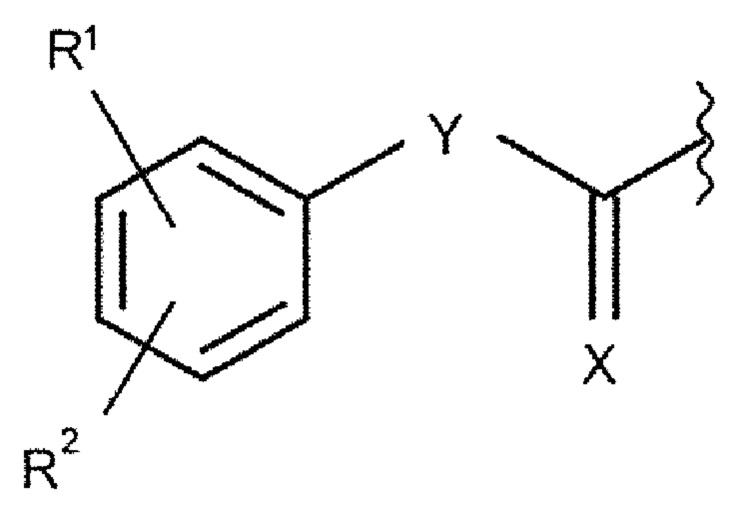
представляет собой одну из структурных формул (2а), (2b) или (2с)
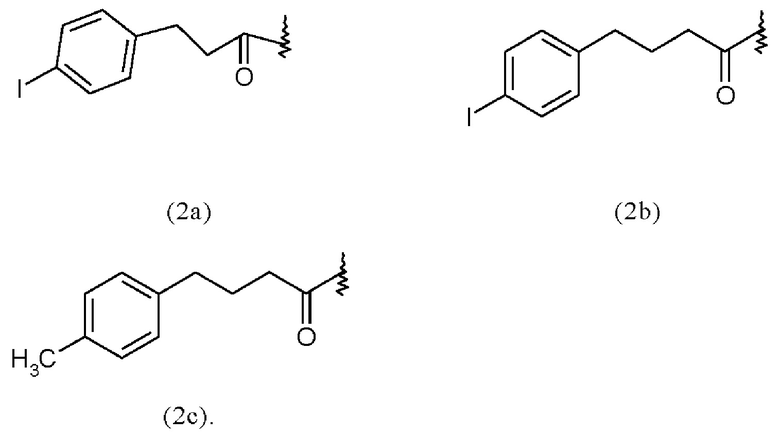
8. Соединение по любому из пп. 2-7, где указанное соединение имеет одну из общих формул (11.1)-(11.3)
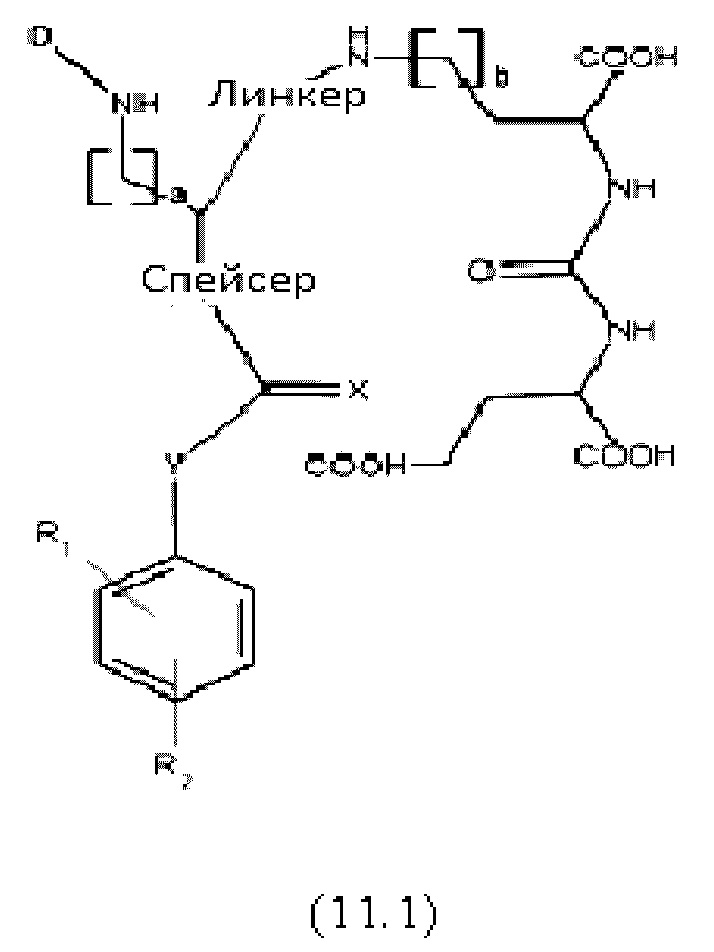
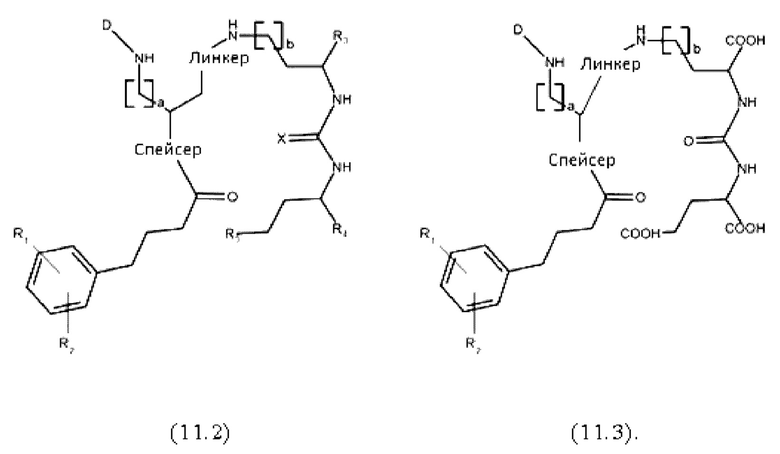
9. Соединение по любому из пп. 2-8, где указанное соединение имеет одну из общих формул (12.1)-(12.4) или (13.1)-(13.4)
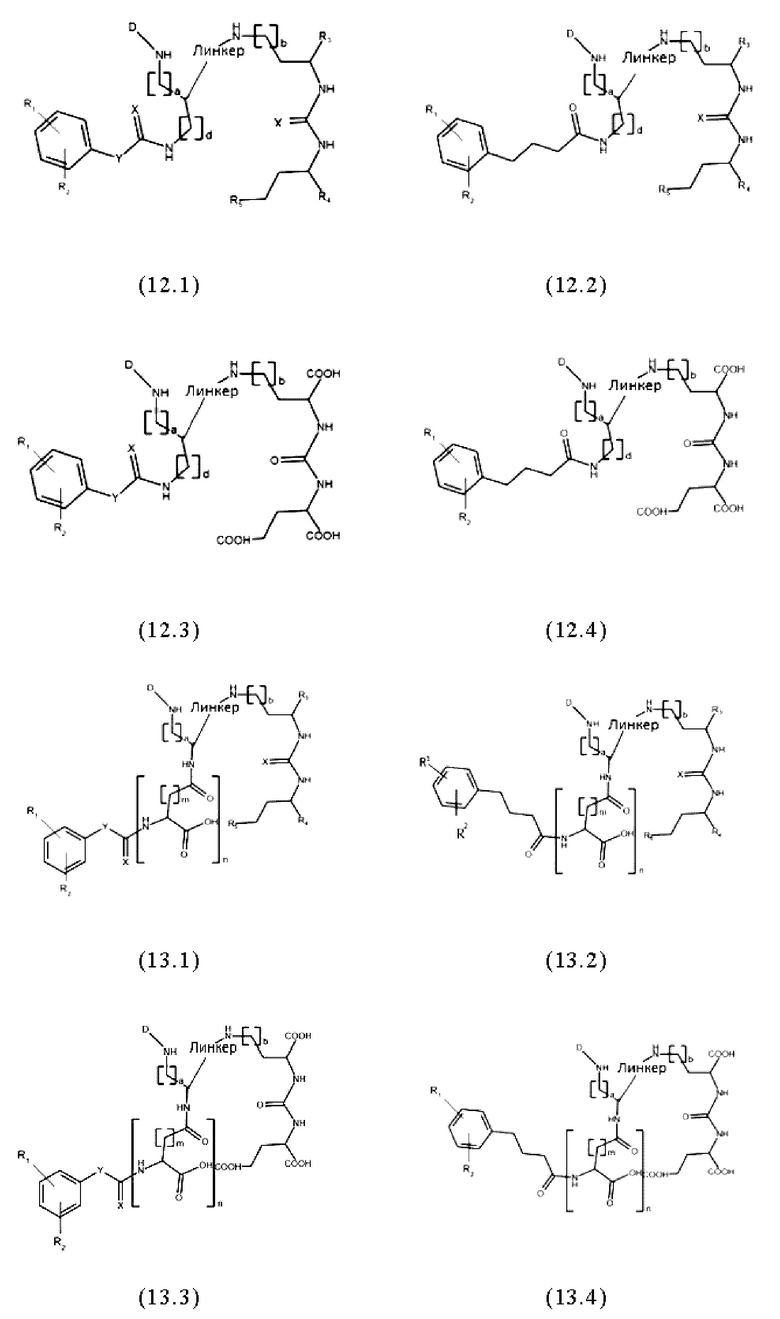
или его фармацевтически приемлемые соли или меченые радиоактивной меткой комплексы,
где D, спейсер, линкер, X, R1-R5, a, b, m, n имеют значения, определенные в п. 2, и d равен 4,
более предпочтительно D представляет собой хелатирующий остаток, выбранный из группы, включающей 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA), 2-(4,7-бис(карбоксиметил)-1,4,7-триазононан-1-ил)пентандиовую кислоту (NODAGA), 2-(4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододекан-1-ил)пентадиовую кислоту (DOTAGA) или их производные,
R1 и R2 каждый независимо выбран из Н, галогена, предпочтительно йода или брома, или С1-6 алкила, предпочтительно С1-3 алкила, еще более предпочтительно метила,
линкер имеет общую формулу (6), как определено выше, более предпочтительно линкер имеет общую формулу (6а)
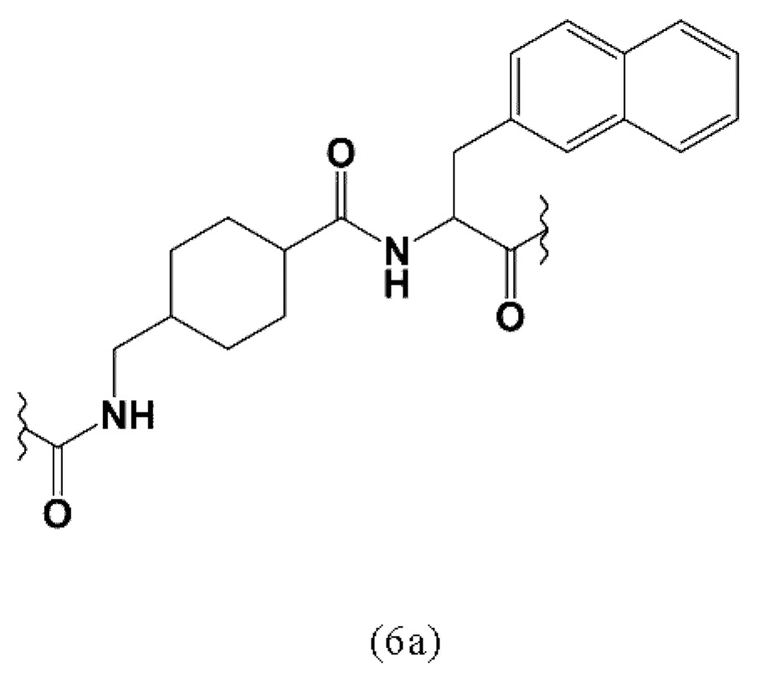 ,
,
a, b каждый независимо представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, d равен 4, m представляет собой целое число 1 или 2 и n представляет собой целое число, выбранное из 0, 1, 2, 3, 4 или 5, более предпочтительно а и b каждый независимо представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5 или 6.
10. Соединение по любому из предшествующих пунктов, где Q выбран из С5-С7 циклоалкила.
11. Соединение по п. 10, где Q представляет собой циклогексил.
12. Соединение по любому из предшествующих пунктов, где W выбран из -(СН2)с-нафтила, -(СН2)с-фенила, -(СН2)с-бифенила, где с представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10.
13. Соединение по п. 12, где W представляет собой -(СН2)-нафтил.
14. Соединение по любому из предшествующих пунктов, где линкер имеет структурную формулу (6а)

15. Соединение по п. 14, где указанное соединение имеет общую формулу (1с)
или его фармацевтически приемлемые соли или меченые радиоактивной меткой комплексы.
16. Соединение по п. 15, где указанное соединение имеет общую формулу (7а)
или его фармацевтически приемлемые соли или меченые радиоактивной меткой комплексы.
17. Соединение по п. 16, где указанное соединение имеет структурную формулу (7a)(i), (7a)(ii) или (7a)(iii)
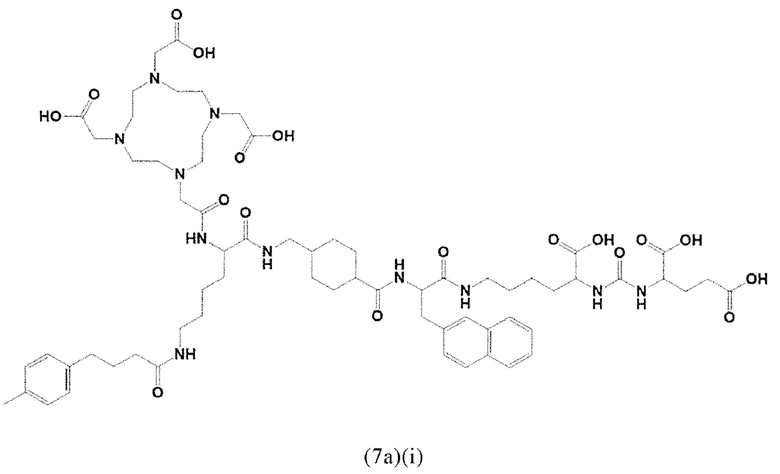

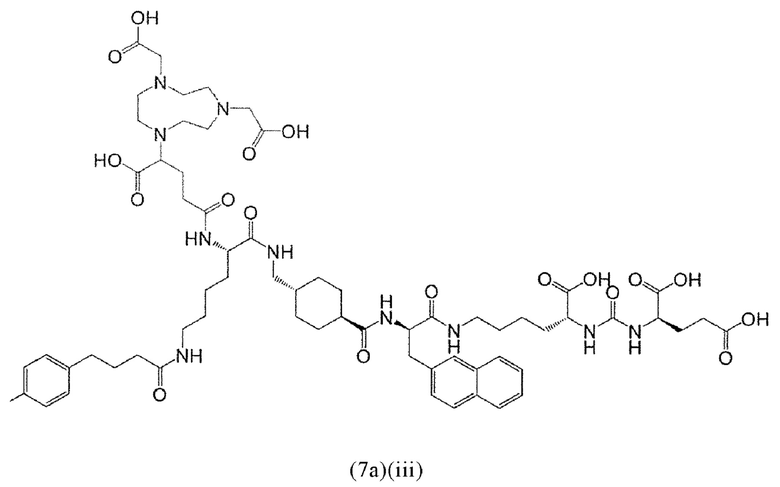
или фармацевтически приемлемые соли и меченые радиоактивными метками комплексы соединений (7a)(i), (7a)(ii) или (7a)(iii).
18. Соединение по любому из предшествующих пунктов, где указанный спейсер имеет формулу (3b) или (3с)
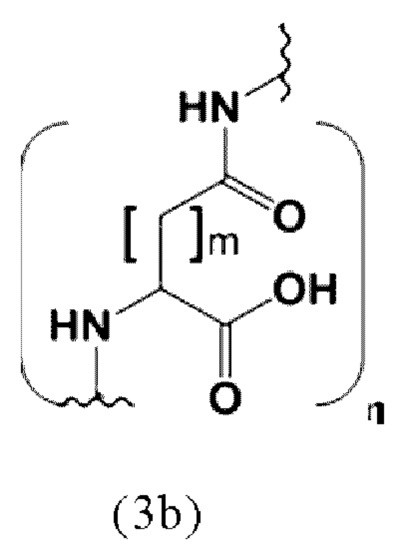 ,
,
где m представляет собой целое число, выбранное из 1 или 2, и n представляет собой целое число, выбранное из 1, 2, 3, 4 или 5, предпочтительно 1, 2 или 3;
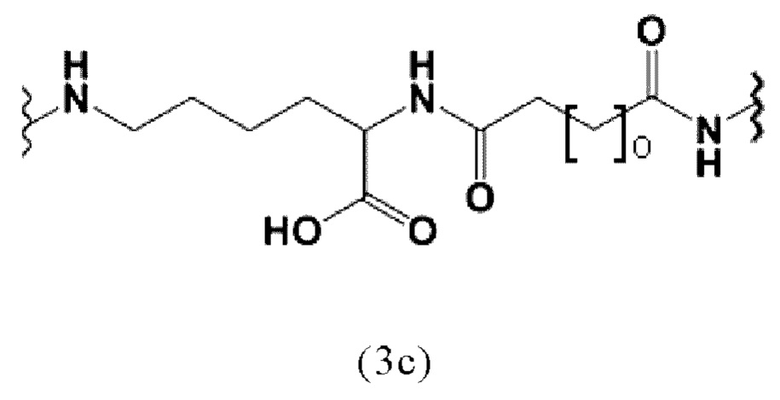 ,
,
где о представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10.
19. Соединение по п. 18, где указанное соединение имеет структурную формулу (7b)(i), (7b)(ii) или (7b)(iii)

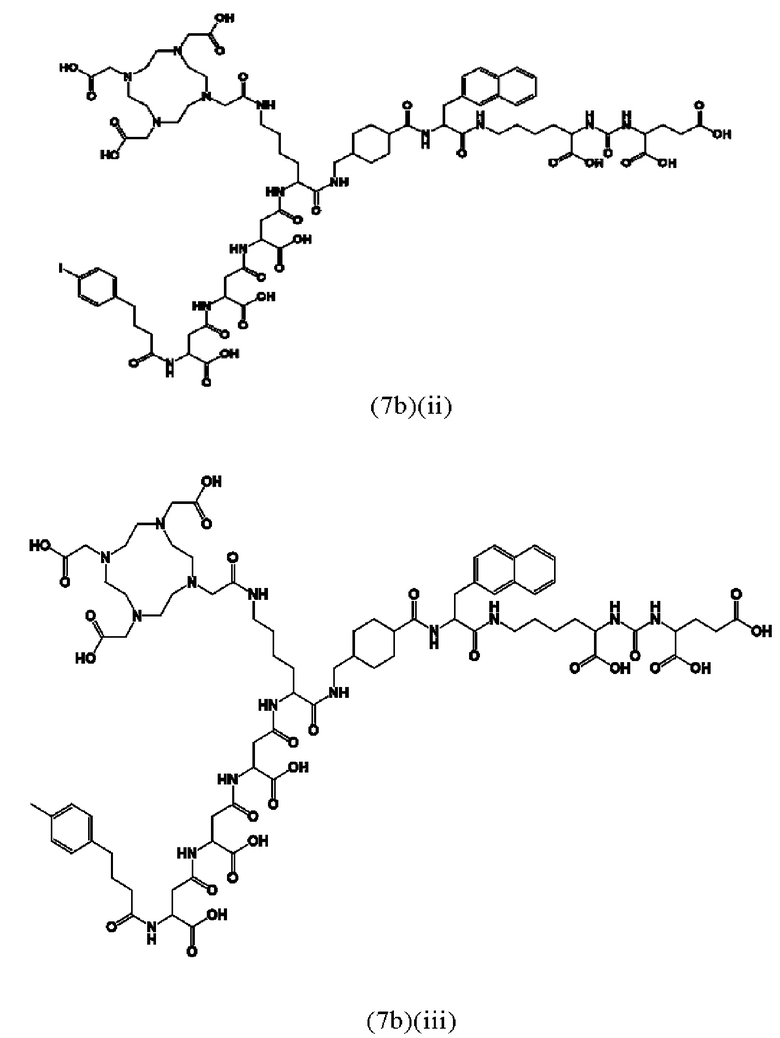
или фармацевтически приемлемые соли или меченые радиоактивными метками комплексы соединений (7b)(i), (7b)(ii) или (7b)(iii).
20. Применение соединения по любому из пп. 1-19 для получения меченых радиоактивной меткой комплексов.
21. Меченый радиоактивной меткой комплекс, содержащий радионуклид и соединение по любому из пп. 1-19.
22. Меченый радиоактивной меткой комплекс по п. 21, где металл выбран из группы, включающей 94Тс, 99mTc, 90In, 111In, 67Ga, 68Ga, 86Y, 90Y, 177Lu, 151Tb, 186Re, 188Re, 64Cu, 67Cu, 55Со, 57Со, 43Sc, 44Sc, 47Sc, 225Ac, 213Bi, 212Bi, 212Pb, 227Th, 153Sm, 166Ho, 152Gd, 153Gd, 157Gd или 166Dy.
23. Фармацевтическая композиция, обладающая способностью селективно связываться с мембраной простат-специфического антигена (ПСА), содержащая соединение по любому из пп. 1-19 или меченый радиоактивной меткой комплекс по пп. 21, 22 в безопасном и эффективном количестве и фармацевтически приемлемый носитель и/или эксципиент.
24. Набор, содержащий соединение по любому из пп. 1-19, или его фармацевтически приемлемую соль, или меченый радиоактивной меткой комплекс, меченый радиоактивной меткой комплекс по пп. 21, 22 или фармацевтическую композицию по п. 23, которые обладают способностью селективно связываться с мембраной простат-специфического антигена (ПСА).
25. Применение соединения по любому из пп. 1-19, меченого радиоактивной меткой комплекса по пп. 21, 22, фармацевтической композиции по п. 23 или набора по п. 24 в качестве лекарственного и/или диагностического средства для выявления ПСА-экспрессирующих таргетных клеток и тканей, а также для лечения и диагностики рака.
26. Применение соединения по любому из пп. 1-19, меченого радиоактивной меткой комплекса по пп. 21, 22, фармацевтической композиции по п. 23 или набора по п. 24 для определения присутствия клеток и/или тканей, экспрессирующих простат-специфический мембранный антиген (ПСА).
27. Применение соединения по любому из пп. 1-19, меченого радиоактивной меткой комплекса по пп. 21, 22, фармацевтической композиции по п. 23 или набора по п. 24 для диагностики, лечения и/или профилактики рака предстательной железы, рака поджелудочной железы, рака почек или рака мочевого пузыря.
28. Применение по любому из пп. 25-27, которое включает:
(a) введение пациенту указанного соединения, меченого радиоактивной меткой комплекса или фармацевтической композиции и
(b) получение рентгенологического изображения указанного пациента.
29. Применение по любому из пп. 25-28, где рентгенологическая визуализация включает позитронную эмиссионную томографию (PET) или однофотонную эмиссионную компьютерную томографию (SPECT).
30. Применение по любому из пп. 25-29, где указанная одна или более клетка или ткань включает (необязательно раковые) клетки или ткани предстательной железы, (необязательно раковые) клетки или ткани селезенки или (необязательно раковые) почечные клетки или ткани.
31. Применение по любому из пп. 25-29, где наличие ПСА-экспрессирующих клеток или тканей указывает на наличие опухолевых клеток предстательной железы, метастатических опухолевых клеток предстательной железы, опухолевых клеток почек, опухолевых клеток поджелудочной железы, опухолевых клеток мочевого пузыря и их комбинаций.
32. Способ in vitro определения присутствия клеток и/или тканей, экспрессирующих простат-специфический мембранный антиген (ПСА), включающий:
(a) контактирование указанных ПСА-экспрессирующих клеток и/или тканей с соединением по любому из пп. 1-19, меченым радиоактивной меткой комплексом по пп. 21, 22, фармацевтической композицией по п. 23 или набором по п. 24 и
(b) использование способов визуализации для выявления указанных клеток и/или тканей, необязательно рентгенологической визуализации.
33. Способ по п. 32, где рентгенологическая визуализация включает позитронную эмиссионную томографию (PET) или однофотонную эмиссионную компьютерную томографию (SPECT).
34. Способ по п. 32, где указанная одна или более клетка или ткань включает (необязательно раковые) клетки или ткани предстательной железы, (необязательно раковые) клетки или ткани селезенки или (необязательно раковые) почечные клетки или ткани.
35. Способ по любому из пп. 32-34, где наличие ПСА-экспрессирующих клеток или тканей указывает на наличие опухолевых клеток предстательной железы, метастатических опухолевых клеток предстательной железы, опухолевых клеток почек, опухолевых клеток поджелудочной железы, опухолевых клеток мочевого пузыря и их комбинаций.
36. Соединение любой из структурных формул
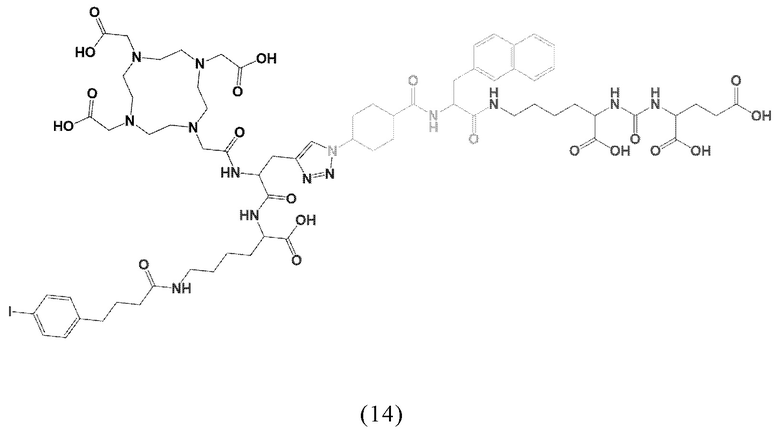
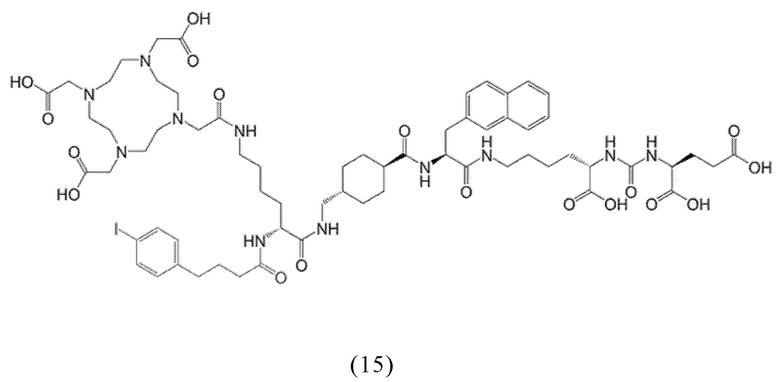
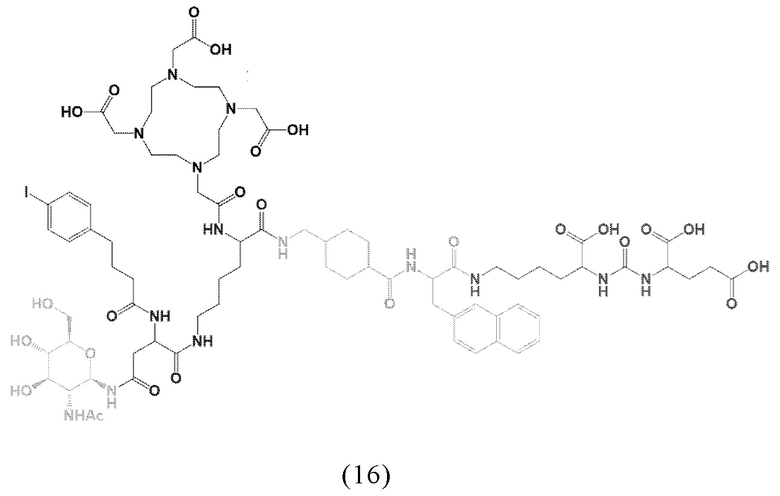
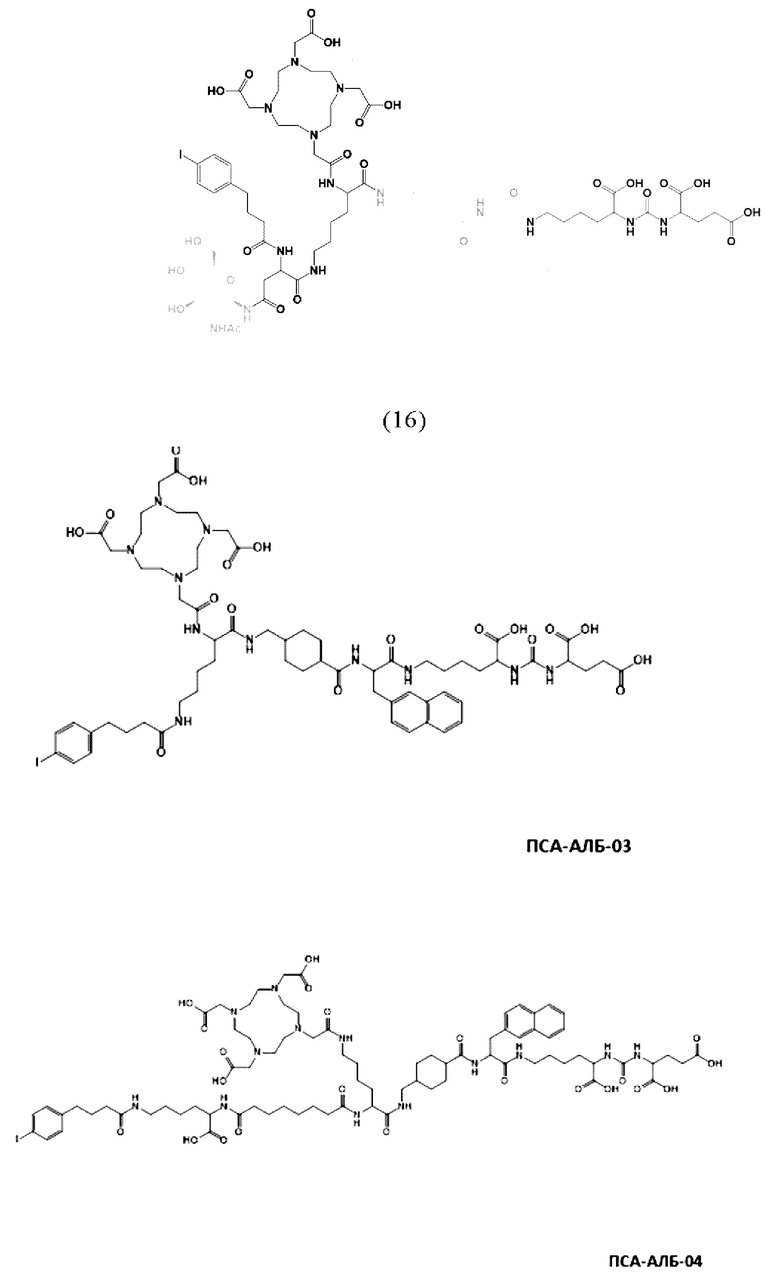

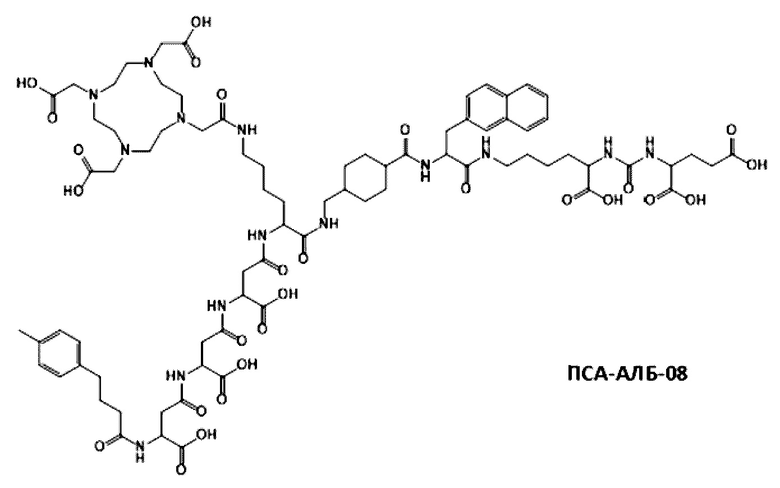
| C.J | |||
| CHOY et al | |||
| Кулисный парораспределительный механизм | 1920 |
|
SU177A1 |
| Контактный детектор | 1925 |
|
SU1928A1 |
| J.M | |||
| KELLY et al | |||
| Double Targeting Ligands with Modulated Pharmacokinetics for Endoradiotherapy of Prostate Cancer, JOURNAL OF | |||
Авторы
Даты
2022-12-28—Публикация
2018-05-24—Подача