ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет по заявке на патент США с серийным номером 62/679,348, поданной 1 июня 2018 г., и по заявке на патент США с серийным номером 62/753,485, поданной 31 октября 2018 г. Раскрытие этих более ранних заявок следует рассматривать как часть (которая включена посредством ссылки) описания настоящей заявки.
УРОВЕНЬ ТЕХНИКИ
1. ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Этот документ относится к способам и материалам, используемым для лечения рака. Например, этот документ относится к способам и материалам для использования Т-клеток с химерным антигенным рецептором, имеющими пониженные уровни экспрессии одного или более цитокинов (например, GM-CSF), в адоптивной клеточной терапии (например, терапии Т-клетками с химерным антигенным рецептором) для лечения страдающего раком млекопитающего (например, человека).
2. УРОВЕНЬ ТЕХНИКИ
В базовых клинических исследованиях по оценке безопасности и эффективности Т-клеток с химерным антигенным рецептором, направленным на CD19 (CART19), были получены беспрецедентные результаты, благодаря которым FDA недавно одобрил CART19 (Tisagenlecleucel) для лечения рецидивирующего рефрактерного острого лимфобластного лейкоза (ALL) и CART19 (Axi-Cel) для лечения диффузной крупноклеточной В-клеточной лимфомы (DLBCL). Применение CART клеточной терапии связано с токсичностью, приводящей к синдрому высвобождения цитокинов (CRS), и нейротоксичности. Кроме того, эффективность терапии CART клетками ограничена только 40% стойких ремиссий при лимфоме и 50-60% стойких ремиссий при остром лейкозе.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Этот документ относится к способам и материалам для получения Т-клеток (например, Т-клеток с химерным антигенным рецептором (CAR) (CART)), имеющих пониженный уровень экспрессии одного или более полипептидов-цитокинов (например, GM-CSF). Например, Т-клетка (например, CART) может быть сконструирована так, чтобы она имела пониженный уровень экспрессии полипептида GM-CSF (например, для использования в адаптивной клеточной терапии). В некоторых случаях Т-клетка (например, CART) может быть сконструирована путем нокаута (KO) нуклеиновой кислоты, кодирующей один или более полипептидов-цитокинов (например, полипептида GM-CSF), для уменьшения уровня экспрессии этих полипептидов-цитокинов (например, полипептида GM-CSF) в этой Т-клетке. В настоящем описании также представлены способы и материалы для применения Т-клеток (например, CART), имеющих пониженный уровень экспрессии одного или более цитокинов (например, полипептидов GM-CSF). Например, Т-клетки (например, CART), имеющие пониженный уровень полипептидов GM-CSF, можно вводить (например, при адоптивной клеточной терапии) страдающему раком млекопитающему для лечения этого млекопитающего.
Как показано в настоящем описании, GM-CSF KO CART продуцируют пониженные уровни GM-CSF и продолжают нормально функционировать как в моделях in vitro, так и in vivo. В настоящем описании также показано, что GM-CSF KO CART могут усиливать функцию клеток CART и противоопухолевую активность. Например, после GM-CSF можно наблюдать усиленную пролиферацию и противоопухолевую активность CART клеток. Антиген-специфическая пролиферация CART19 в присутствии моноцитов может быть увеличена in vitro после истощения GM-CSF. В ксенотрансплантатах, полученных от пациентов с ALL, CART19 клетки в комбинации с лензилумабом могут приводить к более надежному контролю заболевания, а в ксенотрансплантатах NALM6 GM-CSFk/o CART клетки могут быть более эффективными в борьбе с лейкозом. В некоторых случаях GM-CSF KO CART могут быть включены в адоптивную Т-клеточную терапию (например, терапию CART клетками) для лечения, например, страдающих раком млекопитающих без возникновения CRS и/или нейротоксичности. Например, GM-CSF KO CART могут быть включены в адоптивную Т-клеточную терапию (например, терапию CART клетками) для увеличения терапевтического окна после терапии CART клетками. В некоторых случаях одну конструкцию можно использовать как для введения CAR в клетку (например, Т-клетку), так и для снижения или нокаута экспрессии одного или более полипептидов-цитокинов в той же самой клетке.
В целом, один аспект настоящего изобретения относится к способу получения CAR T-клетки, имеющей пониженный уровень полипептидов-цитокинов. Способы могут включать или по существу состоять из введения конструкции нуклеиновой кислоты в Т-клетку ex vivo, причем конструкция нуклеиновой кислоты включает: а) нуклеиновую кислоту, кодирующую гидовую РНК (гРНК), комплементарную матричной РНК (мРНК) цитокина; b) нуклеиновую кислоту, кодирующую нуклеазу Cas, и с) нуклеиновую кислоту, кодирующую химерный антигенный рецептор. Полипептиды-цитокины могут включать полипептиды гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), полипептиды интерлейкина 6 (IL-6), полипептиды IL-1, полипептиды m-CSF и/или полипептиды MIP-1B. Полипептиды-цитокины могут быть полипептидами GM-CSF, а гРНК может включать последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 1. Нуклеаза Cas может быть нуклеазой Cas9. Нуклеиновая кислота, кодирующая CAR, может включать последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 2. Конструкция нуклеиновой кислоты может представлять собой вирусный вектор (например, лентивирусный вектор). CAR может нацеливаться на ассоциированный с опухолью антиген (например, CD 19). Этап введения может включать трансдукцию.
В другом аспекте этот документ относится к способам получения CAR Т-клетки, имеющей пониженный уровень полипептидов-цитокинов. Способы могут включать или по существу состоять из введения в Т-клетку ex vivo комплекса, который включает: а) гРНК, комплементарную мРНК цитокина; и b) нуклеазу Cas; и введения в Т-клетку ex vivo нуклеиновой кислоты, кодирующей CAR. Полипептиды-цитокины могут включать полипептиды GM-CSF и/или полипептиды IL-6. Полипептиды-цитокины могут быть полипептидами GM-CSF, и гРНК может включать последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 1. Нуклеаза Cas может быть нуклеазой Cas9. Нуклеиновая кислота, кодирующая CAR, может включать последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 2. Комплекс может представлять собой рибонуклеопротеин (РНП). CAR может нацеливаться на ассоциированный с опухолью антиген (например, CD19). Этапы введения могут включать электропорацию.
В другом аспекте этот документ относится к способам создания CAR Т-клетки, имеющей пониженный уровень полипептидов GM-CSF. Способы могут включать или по существу состоять из введения в Т-клетку ex vivo конструкции нуклеиновой кислоты, включающей: а) нуклеиновую кислоту, кодирующую гРНК, комплементарную мРНК GM-CSF; b) нуклеиновую кислоту, кодирующую нуклеазу Cas, и с) нуклеиновую кислоту, кодирующую CAR. гРНК может включать последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 1. Нуклеаза Cas может быть нуклеазой Cas9. Нуклеиновая кислота, кодирующая CAR, может включать последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 2. Конструкция нуклеиновой кислоты может представлять собой вирусный вектор (например, лентивирусный вектор). CAR может нацеливаться на ассоциированный с опухолью антиген (например, CD19). Этап введения может включать трансдукцию.
В другом аспекте этот документ относится к способы создания CAR Т-клетки, имеющей пониженный уровень полипептидов GM-CSF. Способы могут включать или по существу состоять из введения в Т-клетку ex vivo комплекса, включающего: а) гРНК, комплементарную мРНК GM-CSF; и b) нуклеазу Cas; и введения в Т-клетку ex vivo нуклеиновой кислоты, кодирующей CAR. гРНК может включать последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 1. Нуклеаза Cas может быть нуклеазой Cas9. Нуклеиновая кислота, кодирующая CAR, может включать последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 2. Комплекс может быть РНП. CAR может нацеливаться на ассоциированный с опухолью антиген (например, CD19). Этапы введения могут включать электропорацию.
В другом аспекте этот документ относится к способам лечения страдающего раком млекопитающего. Способы могут включать или по существу состоять из введения страдающему раком млекопитающему CAR Т-клеток, имеющих пониженный уровень полипептидов-цитокинов. Полипептиды-цитокины могут включать полипептиды GM-CSF и/или полипептиды IL-6. Полипептиды-цитокины могут быть полипептидами GM-CSF, и гРНК может включать последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 1. Млекопитающее может быть человеком. Рак может представлять собой лимфому (например, DLBCL). Рак может представлять собой лейкоз (например, ALL). CAR может нацеливаться на ассоциированный с опухолью антиген (например, CD19).
В другом аспекте этот документ относится к способам лечения страдающего раком млекопитающего. Способы могут включать или по существу состоять из введения страдающему раком млекопитающему CAR Т-клеток, имеющих пониженный уровень полипептидов GM-CSF. Млекопитающее может быть человеком. Рак может представлять собой лимфому (например, DLBCL). Рак может представлять собой лейкоз (например, ALL). CAR может нацеливаться на ассоциированный с опухолью антиген (например, CD19).
Если не указано иное, все технические и научные термины, используемые в настоящем описании, имеют то же значение, в котором их обычно понимают специалисты в области, к которой относится настоящее изобретение. Хотя для осуществления изобретения на практике могут использоваться способы и материалы, подобные или эквивалентные раскрытым в настоящем описании, ниже описаны подходящие способы и материалы. Все публикации, заявки на патенты, патенты и другие ссылки, упомянутые в настоящем описании, включены в описание во всей своей полноте посредством ссылки. В случае противоречия преимущественную силу имеет настоящее описание, включая определения. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения.
Более полное описание одного или более вариантов осуществления изобретения приведено ниже со ссылкой на прилагаемые чертежи. Другие признаки, цели и преимущества изобретения будут очевидны из описания и чертежей, а также из формулы изобретения.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 представлена схема примерного метода использования CRISPR для создания клетки с нокаутом GM-CSF (KO). Гидовая РНК (GACCTGCCTACAGACCCGCC; SEQ ID NO: 1), нацеленная на экзон 3 GM-CSF (также известный как колониестимулирующий фактор 2 (CSF2)), была синтезирована и клонирована в лентивирусную плазмиду (LV). Эту плазмиду LV использовали для трансдукции клеток 293T, и частицы лентивируса собирали через 24 часа и 48 часов и концентрировали. Для генерации клеток CART с нокаутом GM-CSF, Т-клетки стимулировали гранулами CD3/CD28 в день 0. В день 1 Т-клетки трансдуцировали CAR19-лентивирусными частицами и одновременно CRISPR/Cas9-лентивирусными частицами с нокаутом GMCSF. Т-клетки размножали в течение 8 дней, и затем собирали.
На фиг. 2А и 2В показана эффективность трансдукции CAR и нокаута GM-CSF. На фиг. 2А представлен график, показывающий, что эффективность нокаута с использованием CRISPR/Cas9-лентивируса с гидовой РНК, направленной на экзон 3 GM-CSF, составляет 24,1%. После размножения CART клетки собирали, выделяли ДНК, которую отправляли на секвенирование для сравнения с контрольными последовательностями. Полученная эффективность нокаута составила 24,1%. На фиг. 2В показаны результаты анализа методом проточной цитометрии, показывающие, что эффективность трансдукции CAR после трансдукции лентивирусом составила 73%. Анализ методом проточной цитометрии выполняли на 6-й день после трансдукции лентивирусом.
На фиг. 3 показано, что GM-CSF KO CART19 клетки продуцируют меньше GM-CSF по сравнению с CART клетками, и контрольные Т-клетки с нокаутом по GM-CSF продуцируют меньшее количество GM-CSF по сравнению с контрольными нетрансдуцированными Т-клетками (UTD). CART19, GM-CSF KO CART19, UTD или GM-CSF KO UTD культивировали вместе с CD19-положительной линией клеток NALM6 в соотношении 1:5, через 4 часа клетки собирали, пермеабилизировали и фиксировали; и выполняли внутриклеточное окрашивание на цитокины.
На фиг. 4 показано, что GM-CSF KO CART19 клетки размножаются более устойчиво по сравнению с CART19. После трансдукции Т-клеток вирусом наблюдали за кинетикой их размножения. Размножение GM-CSF KO CART19 происходило более стабильно, чем просто CART19.
На фиг. 5 показан пример последовательности нуклеиновой кислоты (SEQ ID NO: 2), кодирующей CAR, нацеленный на CD19 (CAR19).
На фиг. 6A-6D показано, что нейтрализация GM-CSF in vitro усиливает пролиферацию CAR-T-клеток в присутствии моноцитов и не нарушает эффекторную функцию CAR T-клеток. На фиг. 6A представлен график, показывающий, что лензилумаб нейтрализует GM-CSF, продуцируемый CAR T-клетками in vitro, по сравнению с обработкой изотипическим контролем, о чем свидетельствуют данные мультиплексного анализа, выполненного через 3 дня культивирования только с CART19 в среде или с CART19, культивированными совместно с NALM6, n=2 эксперимента, 2 повтора на эксперимент; показан репрезентативный эксперимент, ***p <0,001 между лензилумабом и обработкой контрольным изотипом, t-тест, среднее ±SEM. На фиг. 6B представлен график, показывающий, что обработка GM-CSF нейтрализующими антителами не подавляла способность CAR T-клеток к пролиферации, определенную анализом пролиферации живых CD3 клеток, меченных CSFE, методом проточной цитометрии, n=2 эксперимента, 2 повтора на эксперимент; показан репрезентативный эксперимент через 3 дня, ns (незначимое) p> 0,05 между лензилумабом и обработкой контрольным изотипом, t-тест, среднее значение ±SEM. Только: только CART19 в среде, MOLM13: CART19+MOLM13, PMA/ION: CART19+5 нг/мл PMA/0,1 мкг/мл ION, NALM6: CART19+NALM6. На фиг. 6C представлен график, показывающий, что лензилумаб увеличивал пролиферацию CART19 по сравнению с изотипическим контролем, обработанным CART19, при совместном культивировании с моноцитами, n=3 биологических реплик (повторений эксперимента) через 3 дня, 2 повтора на биологическую реплику, ****p<0,0001, среднее значение ±SEM. На фиг. 6D представлены графики, показывающие, что лечение лензилумабом не подавляло цитотоксичность CART19 или нетрансдуцированных Т-клеток (UTD) при культивировании с NALM6, n=2 эксперимента, 2 повтора на эксперимент, изображен репрезентативный эксперимент через 48 часов, ns p>0,05 между лензилумабом и лечением изотипическим контролем, t-тест, среднее значение ±SEM.
На фиг. 7A-7E показано, что нейтрализация GM-CSF in vivo усиливает противоопухолевую активность CAR-T-клеток в моделях ксенотрансплантатов. На фиг. 7A представлена экспериментальная схема, показывающая, что мышам NSG вводили CD19+люцифераза+ клеточную линию NALM6 (1×106 клеток на мышь IV). Через 4-6 дней мышей визуализировали, рандомизировали и на следующий день получали 1-1,5×106 CAR-T19 или эквивалентное количество общих контрольных клеток UTD либо с лензилумабом, либо с контрольным IgG (10 мг/кг, вводили IP ежедневно в течение 10 дней, начиная со дня инъекции CAR-T). За мышами наблюдали с помощью серийной биолюминесцентной визуализации для оценки тяжести (бремени) заболевания, начиная с 7-го дня после инъекции CAR T-клеток, и наблюдали за общей выживаемостью. Заборы крови из хвостовой вены производили через 7-8 дней после инъекции CAR T-клеток. На фиг. 7B представлен график, показывающий, что лензилумаб нейтрализует in vivo сывороточный GM-CSF, продуцируемый CAR-T, по сравнению с обработкой контрольным изотипом, согласно результатам однодуплексного анализа GM-CSF, n=2 эксперимента, 7-8 мышей на группу, репрезентативный эксперимент, сыворотка на 8-ой день после инъекции CAR T-клеток/UTD, ***p<0,001 между лензилумабом и обработкой контрольным изотипом, t-тест, среднее значение ±SEM. На фиг. 7C представлен график, показывающий, что CAR-T, обработанные лензилумабом in vivo, в равной степени эффективны для контроля опухолевой нагрузки по сравнению с CAR-T, обработанными изотипическим контролем, в модели ксенотрансплантата с высокой опухолевой нагрузкой по ALL, день 7 после инъекции CAR-T, n=2 эксперимента, 7-8 мышей в группе, изображен репрезентативный эксперимент, ***p<0,001, *p<0,05, ns p>0,05, t-тест, среднее значение ±SEM. На фиг. 7D представлена экспериментальная схема, показывающая, что мышам NSG вводили бласты, полученные от пациентов с ALL (1×106 клеток на мышь внутривенно). У мышей непрерывно брали кровь, и когда количество CD19+ клеток стало >1/мкл, мышей рандомизировали для получения 5×106 CART19 (эффективность трансдукции составила примерно 50%) или клеток UTD либо с лензилумабом, либо с контрольным IgG (10 мг/кг, вводили IP ежедневно в течение 10 дней, начиная со дня инъекции CAR-T). У мышей постоянно брали кровь из хвостовой вены для оценки тяжести заболевания, начиная с 14-го дня после инъекции CAR-T-клеток, и наблюдали за общей выживаемостью. На фиг. 7E представлен график, показывающий, что лечение лензилумабом с терапией CAR T-клетками приводит к более устойчивому контролю опухолевой нагрузки с течением времени в модели ксенотрансплантата первичного острого лимфобластного лейкоза (ALL) по сравнению с лечением изотипическим контролем с терапией CAR T-клетками, 6 мышей на группу, **р<0,01, *p<0,05, ns p>0,05, t-тест, среднее значение ±SEM.
На фиг. 8 представлен график, показывающий, что мыши, обработанные лензилумабом+CAR T-клетками, имеют сравнимую выживаемость по сравнению с мышами, обработанными изотипическим контролем+CAR T-клетками, в модели ксенотрансплантата с высокой опухолевой нагрузкой по ALL. n=2 эксперимента, 7-8 мышей в группе, изображен репрезентативный эксперимент, ****p<0,0001, ***p<0,001, *p<0,05, логарифмический ранг.
На фиг.9 представлен график, показывающий репрезентативную последовательность TIDE для проверки изменения генома в CAR T-клетках с нокаутом GM-CSF методом CRISPR-Cas9. n=2 эксперимента, изображен репрезентативный эксперимент.
На фиг. 10A-10E показано, что CAR T-клетки с нокаутом GM-CSF с помощью CRISPR демонстрируют сниженную экспрессию GM-CSF, аналогичную уровням ключевых цитокинов, и повышенную противоопухолевую активность. На фиг. 10A представлены графики, показывающие, что CRISPR Cas9 GMCSFk/o CAR-T демонстрируют сниженный уровень продуцирования GMCSF по сравнению с CART19 дикого типа, но продуцирование других цитокинов и дегрануляция не ингибируются разрушением гена GM-CSF, n=3 эксперимента, 2 повтора на эксперимент, ***p<0,001, *p<0,05, ns p>0,05 при сравнении GM-CSFk/o CAR-T и CAR-T, t-тест, среднее значение ±SEM. На фиг. 10В представлен график, показывающий, что GM-CSFk/o CAR-T имеют пониженное содержание человеческого GM-CSF in vivo в сыворотке крови по сравнению с обработкой CAR-T, по данным множественного регрессионного анализа, 5-6 мышей на группу (4-6 раз взятие образцов крови, через 8 дней после введения CART), ****p<0,0001, ***p<0,001 между GM-CSFk/o CAR-T-клетками и CAR-T-клетками дикого типа, t-тест, среднее значение ±SEM. На фиг. 10C представлен график, показывающий, что GM-CSFk/o CART19 увеличивает in vivo общую выживаемость по сравнению с CART19 дикого типа в модели ксенотрансплантата с высокой опухолевой нагрузкой по ALL, 5-6 мышей на группу, **p<0,01, лог-ранг. На фиг. 10D и 10E представлены тепловые карты, показывающие человеческие (D) и мышиные (E) цитокины из мультиплексного теста сыворотки, отличные от человеческого GM-CSF; показано отсутствие статистических различий между GM-CSFk/o CAR T-клетками и CAR T-клетками дикого типа; снижение экспрессии GM-CSF не оказывает негативного влияния на важные Т-клеточные цитокины, 5-6 мышей на группу (4-6 раз взятие образцов крови), ****p<0,0001, t-тест.
На фиг.11 представлен график, показывающий, что CAR T-клетки нокаутом GM-CSF in vivo демонстрируют немного улучшенный контроль опухолевой нагрузки по ALL по сравнению с CAR-T в модели ксенотрансплантата с рецидивом опухоли с высокой опухолевой нагрузкой. Дни после инъекции CAR-T отложены по оси абсцисс, 5-6 мышей на группу (в группе UTD на 13 день остались 2), изображен репрезентативный эксперимент, ****p<0,0001, *p<0,05, двухфакторный ANOVA, среднее значение ±SEM.
На фиг. 12A-12D показана модель ксенотрансплантата, полученного от пациента, для оценки нейротоксичности и синдрома высвобождения цитокинов. На фиг. 12А представлена экспериментальная схема, показывающая, что мышам вводили 1-3×106 первичных бластов, полученных из периферической крови пациентов с первичной ALL. Приживление трансплантатов у мышей наблюдали в течение 10-13 недель путем забора крови из хвостовой вены. Когда количество CD19+ клеток в сыворотке достигло >10 клеток/мкл, мышам вводили CART19 (2-5×106 клеток) и начинали 10 дневную терапию антителами, как указано. Мышей ежедневно взвешивали в качестве показателя физического состояния. МРТ головного мозга мышей выполняли через 5-6 дней после инъекции CART19, для оценки уровня цитокинов брали образцы крови из хвостовой вены, и анализ Т-клеток выполняли через 4-11 дней после инъекции CART19, 2 независимых эксперимента. На фиг. 12В представлен график, показывающий, что комбинация нейтрализации GM-CSF с CART19 столь же эффективна в контроле нагрузки ALL CD19+ клетками, как и антитела контрольного изотипа в комбинации с CART19, репрезентативный эксперимент, 3 мыши на группу, 11 дней после инъекции CART19, *p<0,05 между нейтрализацией GM-CSF+CART19 и изотипическим контролем+CART19, t-тест, среднее значение ±SEM. На фиг. 12C показано, что МРТ головного мозга с CART19 терапией демонстрирует усиление T1, что свидетельствует о нарушении гематоэнцефалического барьера и возможном отеке. 3 мыши в группе, через 5-6 дней после инъекции CART19, репрезентативное изображение. На фиг. 12D представлены графики, показывающие, что ксенотрансплантаты первичной ALL с высокой опухолевой нагрузкой, обработанные CART19, демонстрируют инфильтрацию мозга человеческими CD3 клетками по сравнению с необработанными контролями PDX. 3 мыши на группу, репрезентативное изображение.
На фиг. 13A-13D показано, что нейтрализация GM-CSF in vivo уменьшает синдром высвобождения цитокинов после терапии CART19 в модели ксенотрансплантата. На фиг. 13A представлен график, показывающий, что лензилумаб и антитело к мышиному GM-CSF предотвращают потерю веса, вызванную CRS, по сравнению с мышами, получавшими CART19 и антитела контрольного изотипа, 3 мыши на группу, двухфакторный ANOVA, среднее значение ±SEM. На фиг. 13B представлен график, показывающий, что человеческий GM-CSF был нейтрализован в ксенотрансплантатах, полученных от пациентов, получавших лензилумаб и антитело, нейтрализующее мышиный GM-CSF, 3 мыши на группу, ***p<0,001, *p<0,05, t-тест, среднее значение ±SEM. На фиг. 13C представлена тепловая карта, показывающая, что человеческие цитокины (сыворотка, собранная через 11 дней после инъекции CART19) демонстрируют увеличение цитокинов, типичное для CRS после обработки CART19. Нейтрализация GM-CSF приводит к значительному снижению уровней нескольких цитокинов по сравнению с мышами, получавшими CART19 и антитела контрольного изотипа, включая несколько миелоид-ассоциированных цитокинов, как указано на панели, 3 мыши на группу, сыворотка через 11 дней после инъекции CART19, ***p<0,001, **p<0,01, *p<0,05, сравнение мышей, обработанных антителом, нейтрализующим GM-CSF, с мышами, обработанными изотипическим контролем, которые получали терапию CAR T-клетками, t-тест. На фиг. 13D представлена тепловая карта, показывающая, что мышиные цитокины (сыворотка, собранная через 11 дней после инъекции CART 19) демонстрируют увеличение, типичное для CRS после обработки CART19. Нейтрализация GM-CSF приводит к значительному снижению нескольких цитокинов по сравнению с обработкой CART19 с контрольными антителами, включая несколько цитокинов, дифференцирующих миелоиды, как указано на панели, 3 мыши на группу, сыворотка через 11 дней после инъекции CART19, *p<0,05 при сравнении мышей, обработанных антителом, нейтрализующим GM-CSF, с мышами, обработанными изотипическим контролем, которые получали терапию CAR T-клетками, t-тест.
На фиг. 14A-14D показано, что нейтрализация GM-CSF in vivo уменьшает нейротоксичность после терапии CART19 в модели ксенотрансплантата. На фиг. 14A и 14B показано, что МРТ с усиленным гадолинием гиперинтенсивным сигналом на T1 (куб. Мм) показала, что нейтрализация GM-CSF помогла уменьшить воспаление мозга, нарушение гематоэнцефалического барьера и возможный отек по сравнению с репрезентативными изображениями изотипического контроля (A), (B) 3 мыши на группу, **p<0,01, *p<0,05, однофакторный ANOVA, среднее значение ±SD. На фиг. 14C представлен график, показывающий, что человеческие CD3 Т-клетки присутствовали в мозге после лечения терапией CART19. Нейтрализация GM-CSF привела к снижению инфильтрации CD3 в головном мозге, определенному методом проточной цитометрии в полушариях головного мозга, 3 мыши на группу, среднее значение ±SEM. На фиг. 14D представлен график, показывающий, что согласно данным анализа полушариев мозга методом проточной цитометрии, количество ярких CD11b+ макрофагов уменьшено в мозге мышей, получавших нейтрализацию GM-CSF во время терапии CAR-T, по сравнению с изотипическим контролем во время терапии CAR-T, 3 мыши на группу, среднее значение ± SEM.
На фиг. 15A-15B показано в качестве примера создание GM-CSFk/o CART19 клеток. Изображена схема эксперимента. На фиг. 15A показано место нацеливания последовательности гРНК в CSF2 (GACCTGCCTACAGACCCGCC; SEQ ID NO: 11) для создания GM-CSFk/o CART19. На фиг. 15B показаны последовательности праймеров (TGACTACAGAGAGGCACAGA (SEQ ID NO: 12) и TCACCTCTGACCTCATTAACC (SEQ ID NO: 13)) и последовательность гРНК (GACCTGCCTACAGACCCGCC; SEQ ID NO: 7), используемая для создания GM-CSFk/o CART19. Для создания GM-CSFk/o CART19 клеток гРНК клонировали в Cas9 лентивирусный вектор под контролем промотора U6 и использовали для продуцирования лентивируса. Т-клетки, полученные от нормальных доноров, стимулировали CD3/CD28 гранулами и через 24 часа дважды трансдуцировали CAR19 вирусом и CRISPR/Cas9 вирусом. Магнитные CD3/CD28 гранулы удаляли в день +6, и GM-CSFk/o CART19 клетки или контрольные CART19 клетки криоконсервировали на 8 день.
На фиг. 16 представлена блок-схема процедур, использованных при секвенировании РНК. Двоичное представление данных было преобразовано в fastq формат с помощью программного обеспечения Illumina bcl2fastq. Адаптерные последовательности удаляли с помощью Trimmomatic, и FastQC использовали для проверки качества. Последние эталонные геномы человека (GRCh38) и мыши (GRCm38) загружали из NCBI. Генерировали индексные файлы генома с помощью STAR30, и считывания парных концевых фрагментов картировали на геном для каждого условия. HTSeq использовали для вычисления количества событий экспрессии для каждого гена, а DeSeq2 использовали для вычисления дифференциальной экспрессии. Генную онтологию оценивали с помощью Enrichr.
На фиг. 17A-17B показано, что при стимуляции на Т-клетках и CART клетках активируются рецепторы GM-CSF. На фиг. 17A показаны измерения CSF2RA (CD116) и CSF2RB (CD131) на Т-клетках по сравнению с Т-клетками в состоянии покоя (отрицательный контроль) во время 8-дневного протокола размножения Т-клеток с использованием CD3/CD28 гранул. Экспрессия CSF2RA и CSF2RB увеличилась после начальной стимуляции, достигала пика на 3-й день и немного снижалась после уменьшения веса на 6-й день. На фиг. 17B показаны измерения CSF2RA (CD 116) и CSF2RB (CD131) на CART19 и UTD клетках по сравнению с контролем в течение 8-дневного продуцирования CART. Экспрессия немного снизилась в день 1 и достигла пика в день 3.
На фиг. 18 показано, что взаимодействие GM-CSF с рецептором CSF2 зависит от бета-цепи (CSF2RB). Экспрессия фосфорилированного белка Stat5 увеличивалась в присутствии облученных Nalm6 и блокады CSF2RA, но снижалась в присутствии GM-CSF и блокады CSF2RB. FAS находится ниже рецептора CSF2 (см., например, Takesono et al., Journal of Cell Science 115:3039-3048 (2002)), и его экспрессия немного снижается в присутствии блокады GM-CSF вместе с облученными Nalm6, но не блокады CSF2RA или CSF2RB.
На фиг. 19A-19C показаны различия транскриптомов между GM-CSFk/o CART19 и CART19 на 8-й день продуцирования CART. На фиг. 19A показано 236 генов, экспрессия которых сильно различались (скорректированное значение p<0,05 по Бенджамини-Хохбергу). На фиг. 19В показаны гены, экспрессия которых была сильно подавлена в GM-CSFk/o CART19 по сравнению с CART19. На графике вулкана (volkano) показано увеличение генов с сильно подавленной экспрессией между GM-CSFk/o CART19 и CART19. На фиг. 19C показано, что нокаут GM-CSF в CART19 нормализовал экспрессию гена.
На фиг. 20A-20C показан пример метода точного редактирования гена CSF2 с использованием системы CRISPR-Cas9. На фиг. 20А показан ожидаемый сайт разрезания в CSF2 CRISPR гРНК 1 (SEQ ID NO: 7) (на 3 п.н. выше PAM) по сравнению с фактическим сайтом разрезания (на 6 п.н. выше PAM) (верхняя панель). Показаны (нижняя панель) эталонная последовательность (SEQ ID NO: 1), схема делеции (SEQ ID NO: 8) и схема вставки (SEQ ID NO: 9), а также частота делеции и вставки в основании 132074828 хромосомы 5 в каждой биологической реплике CART19. На фиг. 20B показаны подсчеты однонуклеотидных вариантов (SNV) и инсерций/делеций (indel) в условиях нокаута CRISPR по сравнению с их контролями (Т-клетки и клетки CART19). На фиг. 20С показаны общие варианты, обнаруженные в CRISPR-отредактированных клетках по сравнению с соответствующим им контролем (CART19 или Т-клетки). Единичный SNP на пересечении является делецией в гене CSF2 (фиг. 20A, нижняя панель).
На фиг. 21 представлены графики, показывающие, что блокада GM-CSF в присутствии макрофагов M2 значительной степени усиливает размножение CART19 при стимуляции CD19 по сравнению с лечением изотипическим контролем. **p<0,005.
ПОДРОБНОЕ ОПИСАНИЕ
Предлагаются методы и материалы для создания Т-клеток (например, Т-клеток с химерным антигенным рецептором (CAR) (CART)), имеющих пониженный уровень экспрессии одного или более полипептидов-цитокинов (например, полипептидов GM-CSF). В некоторых случаях Т-клетка (например, CART) может быть сконструирована для нокаута (KO) нуклеиновой кислоты, кодирующей полипептид GM-CSF, чтобы снизить экспрессию полипептида GM-CSF в этой Т-клетке (например, по сравнению с Т-клеткой, которая не сконструирована для KO нуклеиновой кислоты, кодирующей полипептид GM-CSF). Т-клетка, сконструированная для KO нуклеиновой кислоты, кодирующей полипептид GM-CSF, также может называться GM-CSF KO T-клеткой. В некоторых случаях способы и материалы, представленные в настоящем описании, можно использовать для модуляции миелоидных клеток. В некоторых случаях способы и материалы, представленные в настоящем описании, могут использоваться для истощения миелоидных клеток. В некоторых случаях способы и материалы, представленные в настоящем описании, можно использовать для повышения эффективности Т-клеток (например, CART).
Т-клетки (например, CART), представленные в настоящем описании, могут быть сконструированы таким образом, чтобы они имели пониженный уровень экспрессии любого подходящего полипептида-цитокина или комбинации полипептидов-цитокинов. Например, Т-клетка (например, CART), представленная в настоящем описании, может быть сконструирована таким образом, чтобы она имела пониженный уровень экспрессии полипептида GM-CSF, полипептида интерлейкина 6 (IL-6), G-CSF, полипептида гамма-интерферона (IFN-g), полипептида IL-1B, полипептида IL-10, полипептида моноцитарного хемоаттрактантного белка 1 (MCP-1), полипептида интерфероном гамма индуцированного монокина (MIG), полипептида воспалительного белка макрофагов (MIP) (например, полипептида MIP-1β), полипептида фактора некроза опухоли альфа (TNF-α), полипептида IL-2, полипептида перфорина или любой их комбинации. Например, Т-клетка может быть сконструирована таким образом, чтобы она имела пониженный уровень экспрессии полипептидов GM-CSF и IL-6.
Термин «пониженный уровень», используемый в настоящем описании в отношении уровня экспрессии цитокина (например, GM-CSF), относится к любому уровню, который ниже, чем эталонный уровень экспрессии этого цитокина (например, GM-CSF). Термин «эталонный уровень», используемый в настоящем описании в отношении цитокина (например, GM-CSF), относится к уровню этого цитокина (например, GM-CSF), обычно наблюдаемому в образце (например, контрольном образце), полученном от одного или более млекопитающих (например, людей), который не сконструирован таким образом, чтобы он имел пониженный уровень экспрессии этого цитокина (например, полипептидов GM-CSF) согласно настоящему описанию. Контрольные образцы могут включать, без ограничения, Т-клетки, которые являются Т-клетками дикого типа (например, Т-клетки, которые не являются GM-SCF KO Т-клетками). В некоторых случаях пониженный уровень экспрессии полипептида-цитокина (например, полипептида GM-CSF) может представлять собой недетектируемый уровень этого цитокина (например, GM-CSF). В некоторых случаях пониженный уровень экспрессии полипептидов GM-CSF может быть подавленным уровнем GM-CSF.
В некоторых случаях Т-клетка, имеющая (например, сконструированная так, чтобы она имела) сниженный уровень экспрессии одного или более полипептидов-цитокинов, такая как GM-CSF KO Т-клетка, может сохранять нормальные функции Т-клеток, такие как дегрануляция Т-клеток и высвобождение цитокинов (например, по сравнению с CART, которая не сконструирована для снижения уровня экспрессии этого цитокина (например, полипептидов GM-CSF) согласно настоящему описанию).
В некоторых случаях Т-клетка, имеющая (например, сконструированная так, чтобы она имела) пониженный уровень полипептидов GM-CSF (например, GM-CSF KO Т-клетка), может иметь усиленную функцию CART, такую как противоопухолевая активность, пролиферация, килинг (уничтожение) клеток, продуцирование цитокинов, склонность к истощению, антигенспецифические эффекторные функции, устойчивость и дифференцировка (например, по сравнению с CART, которая не сконструирована таким образом, чтобы она имела пониженный уровень полипептидов GM-CSF согласно настоящему описанию).
В некоторых случаях Т-клетка, имеющая (например, сконструированная так, чтобы она имела) сниженный уровень полипептидов GM-CSF (например, GM-CSF KO Т-клетка), может иметь улучшенную способность к пролиферации (например, по сравнению с CART, которая не сконструирована таким образом, чтобы она имела пониженный уровень полипептидов GM-CSF согласно настоящему описанию).
T-клетка, имеющая (например, сконструированная так, чтобы она имела) сниженный уровень экспрессии одного или более цитокинов (например, полипептида GM-CSF), такая как GM-CSF KO T-клетка, может быть любой подходящей T-клеткой. Т-клетка может быть наивной Т-клеткой. Примеры Т-клеток, которые могут быть сконструированы так, чтобы они имели пониженный уровень экспрессии одного или более цитокинов согласно настоящему описанию, включают, без ограничения, цитотоксические Т-клетки (например, CD4+ CTL и/или CD8+ CTL). Например, Т-клетка, которая может быть сконструирована так, чтобы она имела пониженный уровень полипептидов GM-CSF согласно настоящему описанию, может представлять собой CART. В некоторых случаях одна или более Т-клеток могут быть получены от млекопитающего (например, млекопитающего, страдающего раком). Например, Т-клетки могут быть получены от млекопитающего, подлежащего лечению с помощью раскрытых в настоящем описании материалов и способов.
T-клетка, имеющая (например, сконструированная так, чтобы она имела) сниженный уровень экспрессии одного или более полипептидов-цитокинов (например, полипептида GM-CSF), такая как GM-CSF KO T-клетка, может быть получена любым подходящим методом. В некоторых случаях Т-клетка (например, CART) может быть сконструирована для KO нуклеиновой кислоты, кодирующей полипептид GM-CSF, для снижения экспрессии полипептида GM-CSF в этой Т-клетке.
В некоторых случаях, когда Т-клетка (например, CART) сконструирована для KO нуклеиновой кислоты, кодирующей цитокин (например, полипептид GM-CSF), для снижения экспрессии этого полипептида-цитокина в этой Т-клетке можно использовать любой подходящий метод для КО нуклеиновой кислоты, кодирующей этот цитокин. Примеры методов нокаута, которые могут быть применены к последовательности нуклеиновой кислоты, кодирующей полипептид-цитокин (например, полипептид GM-CSF), включают, без ограничения, редактирование генов, гомологичную рекомбинацию, негомологичное соединение концов и соединение концов на основе микрогомологии. Например, для КО нуклеиновой кислоты, кодирующей полипептид GM-CSF, может быть использовано редактирование гена (например, с помощью сконструированных нуклеаз). Нуклеазы, пригодные для редактирования генома, включают, без ограничения, CRISPR-ассоциированные (Cas) нуклеазы, цинк-пальцевые нуклеазы (ZFN), эффекторные нуклеазы, подобные активатору транскрипции (TALE), и хоминг эндонуклеазы (HE; также называемые мегануклеазами).
В некоторых случаях для KO нуклеиновой кислоты, кодирующей полипептид-цитокин (например, полипептид GM-CSF) может использоваться (например, может быть введена в одну или более Т-клеток) кластерные короткие палиндромные повторовы с регулярными интервалами (CRISPR)/Cas (см., например, фиг. 1 и пример 1). Система CRISPR/Cas, используемая для КО нуклеиновой кислоты, кодирующей полипептид-цитокин (например, полипептид GM-CSF), может включать любую подходящую гидовую РНК (гРНК). В некоторых случаях гРНК может быть комплементарной нуклеиновой кислоте, кодирующей полипептид GM-CSF (например, мРНК GM-CSF). Примеры гРНК, специфичных для нуклеиновой кислоты, кодирующей полипептид GM-CSF, включают, без ограничения,
GACCTGCCTACAGACCCGCC (SEQ ID NO: 1), GCAGTGCTGCTTGTAGTGGC (SEQ ID NO: 10), TCAGGAGACGCCGGGCCTCC (SEQ ID NO: 3), CAGCAGCAGTGTCTCTACTC (SEQ ID NO: 4), CTCAGAAATGTTTGACCTCC (SEQ ID NO: 5) и GGCCGGTCTCACTCCTGGAC (SEQ ID NO: 6). В некоторых случаях компонент гРНК системы CRISPR/Cas, сконструированный для KO нуклеиновой кислоты, кодирующей полипептид GM-CSF, может включать последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 1.
Система CRISPR/Cas, используемая для KO нуклеиновой кислоты, кодирующей полипептид-цитокин (например, полипептид GM-CSF), может включать любую подходящую нуклеазу Cas. Примеры нуклеаз Cas включают, без ограничения, Cas1, Cas2, Cas3, Cas9, Cas10 и Cpf1. В некоторых случаях компонент Cas системы CRISPR/Cas, предназначенный для KO нуклеиновой кислоты, кодирующей полипептид-цитокин (например, полипептид GM-CSF), может быть нуклеазой Cas9. Например, нуклеаза Cas9 раскрытой в настоящем описании системы CRISPR/Cas9 может представлять собой lentiCRISPRv2 (см., например, Shalem et al., 2014 Science 343:84-87; и Sanjana et al., 2014 Nature methods 11:783-784).
Компоненты системы CRISPR/Cas (например, гРНК и нуклеаза Cas), используемые для KO нуклеиновой кислоты, кодирующей полипептид-цитокин (например, полипептид GM-CSF), могут быть введены в одну или более Т-клеток (например, CART) в любом подходящем формате. В некоторых случаях компонент системы CRISPR/Cas может быть введен в одну или более Т-клеток в виде нуклеиновой кислоты, кодирующей гРНК, и/или нуклеиновой кислоты, кодирующей нуклеазу Cas. Например, нуклеиновая кислота, кодирующая по меньшей мере одну гРНК (например, последовательность гРНК, специфичную для нуклеиновой кислоты, кодирующей полипептид GM-CSF), и нуклеиновая кислота по меньшей мере одной нуклеазы Cas (например, нуклеазы Cas9) могут быть введены в одну или более Т-клеток. В некоторых случаях компонент системы CRISPR/Cas может быть введен в одну или более Т-клеток в виде гРНК и/или в виде нуклеазы Cas. Например, в одну или более Т-клеток могут быть введены по меньшей мере одна гРНК (например, последовательность гРНК, специфичная для нуклеиновой кислоты, кодирующей полипептид GM-CSF) и по меньшей мере одна нуклеаза Cas (например, нуклеаза Cas9).
В некоторых случаях, когда компоненты системы CRISPR/Cas (например, гРНК и нуклеаза Cas) вводятся в одну или более Т-клеток в виде нуклеиновой кислоты, кодирующей эти компоненты (например, нуклеиновая кислота, кодирующая гРНК, и нуклеиновая кислота, кодирующая нуклеазу Cas), нуклеиновая кислота может иметь любую подходящую форму. Например, нуклеиновая кислота может представлять собой конструкцию (например, экспрессионную конструкцию). Нуклеиновая кислота, кодирующая по меньшей мере одну гРНК, и нуклеиновая кислота, кодирующая по меньшей мере одну нуклеазу Cas, могут находиться в отдельных конструкциях нуклеиновых кислот или в одной конструкции нуклеиновой кислоты. В некоторых случаях нуклеиновая кислота, кодирующая по меньшей мере одну гРНК, и нуклеиновая кислота, кодирующая по меньшей мере одну нуклеазу Cas, могут находиться в одной конструкции нуклеиновой кислоты. Конструкция нуклеиновой кислоты может быть конструкцией нуклеиновой кислоты любого подходящего типа. Примеры конструкций нуклеиновых кислот, которые можно использовать для экспрессии по меньшей мере одной гРНК и/или по меньшей мере одной нуклеазы Cas, включают, без ограничения, экспрессионные плазмиды и вирусные векторы (например, лентивирусные векторы). В случаях, когда нуклеиновая кислота, кодирующая по меньшей мере одну гРНК, и нуклеиновая кислота, кодирующая по меньшей мере одну нуклеазу Cas, находятся в разных конструкциях нуклеиновых кислот, конструкции нуклеиновых кислот могут быть конструкциями одного и того же типа или конструкциями разных типов. В некоторых случаях нуклеиновая кислота, кодирующая по меньшей мере одну последовательность гРНК, специфичную для нуклеиновой кислоты, кодирующей полипептид-цитокин (например, полипептид GM-CSF), и нуклеиновая кислота, кодирующая по меньшей мере одну нуклеазу Cas, могут находиться в одном лентивирусном векторе. Например, лентивирусный вектор, кодирующий по меньшей мере одну последовательность гРНК, специфичную для нуклеиновой кислоты, кодирующей полипептид-цитокин (например, полипептид GM-CSF), кодирующий по меньшей мере одну гРНК, включающую последовательность, приведенную в SEQ ID NO: 1, и кодирующий по меньшей мере одну нуклеазу Cas9, может быть использован для конструирования ex vivo Т-клеток со сниженным уровнем экспрессии этого цитокина (например, полипептида GM-CSF).
В некоторых случаях компоненты системы CRISPR/Cas (например, гРНК и нуклеаза Cas) могут быть введены непосредственно в одну или более Т-клеток (например, в виде гРНК и/или нуклеазы Cas). гРНК и нуклеаза Cas могут быть введены в одну или более Т-клеток по отдельности или вместе. В случаях, когда гРНК и нуклеаза Cas вводятся в одну или более Т-клеток вместе, гРНК и нуклеаза Cas могут находиться в комплексе. Когда гРНК и нуклеаза Cas находятся в комплексе, гРНК и нуклеаза Cas могут быть присоединенными ковалентно или нековалентно. В некоторых случаях комплекс, включающий гРНК и нуклеазу Cas, также может включать один или более дополнительных компонентов. Примеры комплексов, которые могут включать компоненты системы CRISPR/Cas (например, гРНК и нуклеазу Cas), включают, без ограничения, рибонуклеопротеины (РНП) и эффекторные комплексы (например, содержащие РНК CRISPR (crRNA, крРНК) и нуклеазу Cas). Например, в РНП может быть включена по меньшей мере одна гРНК и по меньшей мере одна нуклеаза Cas. В некоторых случаях РНП может включать гРНК и нуклеазы Cas в соотношении от примерно 1:1 до примерно 10:1 (например, от примерно 1:1 до примерно 10:1, от примерно 2:1 до примерно 10:1, от примерно 3:1 до примерно 10:1, от примерно 5:1 до примерно 10:1, от примерно 8:1 до примерно 10:1, от примерно 1:1 до примерно 9:1, от примерно 1:1 до примерно 7:1, от примерно 1:1 до примерно 5:1, от примерно 1:1 до примерно 4:1, от примерно 1:1 до примерно 3:1, от примерно 1:1 до примерно 2:1, от примерно 2:1 до примерно 8:1, от примерно 3:1 до примерно 6:1, от примерно 4:1 до примерно 5:1 или от примерно 5:1 до примерно 7:1). Например, РНП может включать гРНК и нуклеазы Cas в соотношении примерно 1:1. Например, РНП может включать гРНК и нуклеазы Cas в соотношении примерно 2:1. В некоторых случаях для ex vivo конструирования Т-клеток для получения пониженного уровня полипептидов GM-CSF может использоваться РНП, включающая по меньшей мере одну последовательность гРНК, специфичную для нуклеиновой кислоты, кодирующей полипептид GM-CSF (например, кодирующую по меньшей мере одну гРНК, включая последовательность, приведенную в SEQ ID NO: 1), и по меньшей мере одну нуклеазу Cas9.
Компоненты системы CRISPR/Cas (например, гРНК и нуклеаза Cas), используемые для КО нуклеиновой кислоты, кодирующей полипептид-цитокин (например, полипептид GM-CSF), могут быть введены в одну или более Т-клеток (например, CART) любым подходящим способом. Метод введения компонентов системы CRISPR/Cas в Т-клетку может быть физическим методом. Метод введения компонентов системы CRISPR/Cas в Т-клетку может представлять собой химический метод. Метод введения компонентов системы CRISPR/Cas в Т-клетку может быть методом на основе частиц. Примеры методов, которые можно использовать для введения компонентов системы CRISPR/Cas в одну или более Т-клеток, включают, без ограничения, электропорацию, трансфекцию (например, липофекцию), трансдукцию (например, трансдукцию, опосредованную вирусным вектором), микроинъекцию и нуклеофекцию. В некоторых случаях, когда компоненты системы CRISPR/Cas вводятся в одну или более Т-клеток в виде нуклеиновой кислоты, кодирующей компоненты, такая нуклеиновая кислота, кодирующая компоненты, может быть трансдуцирована в одну или более Т-клеток. Например, Т-клетки (например, Т-клетки ex vivo) могут быть трансдуцированы лентивирусным вектором, кодирующим по меньшей мере одну последовательность гРНК, специфичную для нуклеиновой кислоты, кодирующей полипептид GM-CSF (например, кодирующий по меньшей мере одну гРНК, включая последовательность, приведенную в SEQ ID NO: 1), и по меньшей мере одну нуклеазу Cas9. В некоторых случаях, когда компоненты системы CRISPR/Cas вводятся непосредственно в одну или более Т-клеток, такие компоненты могут быть электропорированы в одну или более Т-клеток. Например, в Т-клетки (например, Т-клетки ex vivo) может быть электропорирована РНП, включающая по меньшей мере одну последовательность гРНК, специфичную для нуклеиновой кислоты, кодирующей полипептид GM-CSF (например, кодирующая по меньшей мере одну гРНК, включая последовательность, приведенную в SEQ ID NO: 1), и по меньшей мере одну нуклеазу Cas9. В некоторых случаях компоненты системы CRISPR/Cas можно вводить ex vivo в одну или более Т-клеток. Например, конструирование ex vivo Т-клеток с пониженным уровнем полипептидов GM-CSF может включать трансдукцию выделенных Т-клеток лентивирусным вектором, кодирующим компоненты системы CRISPR/Cas. Например, ex vivo конструирование Т-клеток, имеющих пониженные уровни полипептидов GM-CSF, может включать электропорацию комплекса, включающего компоненты системы CRISPR/Cas, в выделенные Т-клетки. В случаях, когда Т-клетки сконструированы ex vivo для получения пониженного уровня полипептидов GM-CSF, Т-клетки могут быть получены из любого подходящего источника (например, млекопитающего, такого как млекопитающее, подлежащего лечению, или млекопитающего-донора, или клеточной линии).
В некоторых случаях Т-клетка (например, CART) может быть обработана одним или более ингибиторами экспрессии полипептида GM-CSF или активности полипептида GM-CSF для снижения экспрессии полипептида GM-CSF в этой Т-клетке (например, по сравнению с Т-клеткой, которая не была обработана одним или более ингибиторами экспрессии полипептида GM-CSF или активности полипептида GM-CSF). Ингибитор экспрессии полипептида GM-CSF или активности полипептида GM-CSF может быть любым подходящим ингибитором. Примеры ингибиторов экспрессии полипептида GM-CSF или активности полипептида GM-CSF включают, без ограничения, молекулы нуклеиновой кислоты, предназначенные для индукции РНК-интерференции (например, молекулу миРНК или молекулу шРНК), антисмысловые молекулы, микроРНК, блокаду рецептора и антитела (например, антагонистические антитела и нейтрализующие антитела).
T-клетка, имеющая (например, сконструированная так, чтобы она имела) пониженный уровень экспрессии одного или более цитокинов (например, GM-CSF KO T-клетка), может экспрессировать (например, может быть сконструирована так, чтобы она экспрессировала) любой подходящий рецептор антигена. В некоторых случаях рецептор антигена может быть рецептором гетерологичного антигена. В некоторых случаях рецептор антигена может быть CAR. В некоторых случаях рецептор антигена может быть рецептором опухолевого антигена (например, опухолеспецифического антигена). Например, Т-клетка может быть сконструирована для экспрессии рецептора опухолеспецифического антигена, который нацелен на опухолеспецифический антиген (например, опухолеспецифический антиген клеточной поверхности), экспрессируемый раковой клеткой у страдающего раком млекопитающего. Примеры антигенов, которые могут распознаваться рецептором антигена, экспрессируемым на Т-клетке, имеющей пониженный уровень экспрессии полипептида-цитокина (например, полипептида GM-CSF) согласно настоящему описанию, включают, без ограничения, кластер дифференцировки 19 (CD19), муцин 1 (MUC-1), рецептор 2 эпидермального фактора роста человека (HER-2), рецептор эстрогена (ER), рецептор эпидермального фактора роста (EGFR), альфа-фетопротеин (AFP), карциноэмбриональный антиген (CEA), CA-125, эпителиальный опухолевый антиген (ETA), ассоциированный с меланомой антиген (MAGE), CD33, CD 123, CLL-1, E-кадгерин, рецептор фолиевой кислоты альфа, рецептор фолиевой кислоты бета, IL13R, EGFRviii, CD22, CD20, легкая цепь каппа, легкая цепь лямбда, десмопрессин, CD44v, CD45, CD30, CD5, CD7, CD2, CD38, BCMA, CD138, FAP, CS-1 и C-met. Например, Т-клетка, имеющая пониженный уровень полипептидов GM-CSF, может быть сконструирована для экспрессии антигенного рецептора, нацеленного на CD19. Типичная последовательность нуклеиновой кислоты, кодирующая CAR, нацеленный на CD19 (CAR19), показана на фиг. 5.
Для экспрессии рецептора антигена на Т-клетке, имеющей (например, сконструированной так, чтобы она имела) пониженный уровень экспрессии одного или более полипептидов-цитокинов (например, GM-CSF KO Т-клетка) может быть использован любой подходящий метод. Например, нуклеиновая кислота, кодирующая рецептор антигена, может быть введена в одну или более Т-клеток. В некоторых случаях для введения нуклеиновой кислоты, кодирующей рецептор антигена, может использоваться вирусная трансдукция в неделящуюся клетку. Нуклеиновую кислоту, кодирующую рецептор антигена, можно ввести в Т-клетку любым подходящим способом. В некоторых случаях нуклеиновая кислота, кодирующая рецептор антигена, может быть введена в Т-клетку путем трансдукции (например, вирусной трансдукции с использованием ретровирусного вектора, такого как лентивирусный вектор) или трансфекции. В некоторых случаях нуклеиновая кислота, кодирующая рецептор антигена, может быть введена ex vivo в одну или более Т-клеток. Например, ex vivo конструирование Т-клеток, экспрессирующих рецептор антигена, может включать трансдукцию выделенных Т-клеток лентивирусным вектором, кодирующим рецептор антигена. В случаях, когда Т-клетки сконструированы ex vivo для экспрессии рецептора антигена, Т-клетки могут быть получены из любого подходящего источника (например, из млекопитающего, такого как млекопитающее, подлежащего лечению, или из млекопитающего-донора, или из клеточной линии).
В некоторых случаях, когда Т-клетка, имеющая (например, сконструированная так, чтобы она имела) пониженный уровень экспрессии одного или более полипептидов-цитокинов (например, GM-CSF KO Т-клетка), также экспрессирует (например, сконструирована для экспрессии) рецептор антигена, такая Т-клетка может быть сконструирована так, чтобы она имела пониженный уровень экспрессии этого цитокина, и может быть сконструирована для экспрессии рецептора антигена любым подходящим методом. В некоторых случаях Т-клетка может быть сначала сконструирована так, чтобы она имела пониженный уровень экспрессии полипептида-цитокина (например, полипептида GM-CSF), а затем сконструирована так, чтобы она экспрессировала рецептор антигена, или наоборот. В некоторых случаях Т-клетка может быть одновременно сконструирована для получения пониженного уровня экспрессии одного или более полипептидов-цитокинов (например, полипептида GM-CSF) и для экспрессии рецептора антигена. Например, в одну или более Т-клеток могут быть одновременно введены одна или более нуклеиновых кислот, используемых для снижения уровня экспрессии полипептида-цитокина, такого как полипептид GM-CSF (например, лентивирусный вектор, кодирующий по меньшей мере одну последовательность гРНК, специфичную для нуклеиновой кислоты, кодирующей этот цитокин, и по меньшей мере одну нуклеазу Cas9 или нуклеиновую кислоту, кодирующую по меньшей мере один олигонуклеотид, комплементарный мРНК этого цитокина), и одна или более нуклеиновых кислот, кодирующих рецептор антигена (например, CAR). Одна или более нуклеиновых кислот, используемых для снижения уровня экспрессии полипептида цитокина (например, полипептида GM-CSF), и одна или более нуклеиновых кислот, кодирующих рецептор антигена, могут быть введены в одну или более Т-клеток в отдельных конструкциях нуклеиновых кислот или в одной конструкция нуклеиновой кислоты. В некоторых случаях одна или более нуклеиновых кислот, используемых для снижения уровня экспрессии полипептида-цитокина (например, полипептида GM-CSF), и одна или более нуклеиновых кислот, кодирующих рецептор антигена, могут быть введены в одну или более Т-клеток в одной конструкции нуклеиновой кислоты. В некоторых случаях одна или более нуклеиновых кислот, используемых для снижения уровня экспрессии полипептида-цитокина (например, полипептида GM-CSF), и одна или более нуклеиновых кислот, кодирующих рецептор антигена, могут быть введены ex vivo в одну или более Т-клеток. В случаях, когда Т-клетки сконструированы ex vivo для снижения уровней экспрессии одного или более полипептидов-цитокинов (например, полипептида GM-CSF) и для экспрессии рецептора антигена, Т-клетки могут быть полученным из любого подходящего источника (например, млекопитающего, такого как млекопитающее, подлежащее лечению, или млекопитающего-донора, или клеточной линии).
В некоторых случаях Т-клетка, имеющая (например, сконструированная так, чтобы она имела) пониженный уровень экспрессии одного или более полипептидов-цитокинов (например, GM-CSF KO Т-клетка), может быть стимулирована. Т-клетку можно стимулировать одновременно с получением пониженного уровня одного или более полипептидов-цитокинов или независимо от получения пониженного уровня одного или более полипептидов-цитокинов. Например, одна или более Т-клеток, имеющих пониженный уровень полипептидов GM-CSF, используемых в адоптивной клеточной терапии, могут быть сначала стимулированы, а затем могут быть сконструированы таким образом, чтобы они имели пониженный уровень экспрессии полипептидов GM-CSF, или наоборот. В некоторых случаях одна или более Т-клеток, имеющих пониженный уровень экспрессии полипептида-цитокина (например, полипептида GM-CSF), используемых в адоптивной клеточной терапии, могут быть сначала стимулированы и затем могут быть сконструированы так, чтобы они имели пониженный уровень этого полипептида-цитокина. Т-лимфоциты можно стимулировать любым подходящим методом. Например, Т-клетка может быть стимулирована путем контактирования Т-клетки с одним или более полипептидами CD. Примеры полипептидов CD, которые можно использовать для стимуляции Т-клеток, включают, без ограничения, CD3, CD28, индуцибельный костимулятор Т-клеток (ICOS), CD137, CD2, OX40 и CD27. В некоторых случаях Т-клетка может быть стимулирована CD3 и CD28 перед введением в Т-клетку компонентов системы CRISPR/Cas (например, гРНК и/или нуклеазы Cas) для KO нуклеиновой кислоты, кодирующей один или более цитокинов-полипептидов (например, полипептид GM-CSF).
Также предоставлены методы и материалы, используемые для лечения рака. Например, можно вводить одну или более Т-клеток, имеющих (например, сконструированных так, чтобы они имели) пониженный уровень экспрессии полипептида-цитокина (например, GM-CSF KO Т-клетки) (например, в адоптивной клеточной терапии, такой как CART терапия) млекопитающему (например, человеку), страдающему раком, для лечения этого млекопитающего. В некоторых случаях способы лечения страдающего раком млекопитающего согласно настоящему описанию, могут уменьшать количество раковых клеток (например, раковых клеток, экспрессирующих опухолевый антиген) у млекопитающего. В некоторых случаях раскрытые в настоящем описании способы лечения млекопитающего, страдающего раком, позволяют уменьшать размер одной или более опухолей (например, опухолей, экспрессирующих опухолевый антиген) у млекопитающего.
В некоторых случаях введение млекопитающему Т-клеток, имеющих (например, сконструированных так, чтобы они имели) пониженный уровень экспрессии полипептида цитокина (например, GM-CSF KO Т-клетки), не приводит к CRS. Например, введение млекопитающему Т-клеток, имеющих пониженный уровень полипептидов GM-CSF, не приводит к высвобождению цитокинов, ассоциированных с CRS (например, CRS-критических цитокинов). Примеры цитокинов, ассоциированных с CRS, включают, без ограничения, IL-6, G-CSF, IFN-g, IL-1B, IL-10, MCP-1, MIG, MIP, MIP 1b, TNF-a, IL-2 и перфорин.
В некоторых случаях введение млекопитающему Т-клеток, имеющих (например, сконструированных так, чтобы они имели) пониженный уровень экспрессии полипептида-цитокина (например, GM-CSF KO Т-клетки), не приводит к нейротоксичности. Например, введение млекопитающему Т-клеток, имеющих пониженный уровень полипептидов GM-CSF, не приводит к дифференцировке и/или активации лейкоцитов, дифференцировка и/или активация которых связана с нейротоксичностью. Примеры лейкоцитов, дифференцировка и/или активация которых связана с нейротоксичностью, включают, без ограничения, моноциты, макрофаги, Т-клетки, дендритные клетки, микроглию, астроциты и нейтрофилы.
Любое подходящее млекопитающее (например, человек), страдающее раком, можно лечить согласно настоящему описанию. Примеры млекопитающих, которых можно лечить согласно настоящему описанию, включают, без ограничения, людей, приматов (таких как обезьяны), собак, кошек, лошадей, коров, свиней, овец, мышей и крыс. Например, человека, страдающего раком, можно лечить одной или более Т-клетками, имеющими (например, сконструированными так, чтобы они имели) пониженный уровень экспрессии полипептида-цитокина (например, полипептида GM-CSF), например, адоптивной T-клеточной терапией, такой как CART клеточная терапия, с использованием описанных способов и материалов.
При лечении млекопитающего (например, человека), страдающего раком, согласно настоящему описанию, рак может быть любым подходящим раком. В некоторых случаях рак, который лечат согласно настоящему описанию, может быть солидной опухолью. В некоторых случаях рак, который лечат согласно настоящему описанию, может быть гематологическим раком. В некоторых случаях рак, который лечат согласно настоящему описанию, может быть первичным раком. В некоторых случаях рак, который лечат согласно настоящему описанию, может быть метастатическим раком. В некоторых случаях рак, который лечат согласно настоящему описанию, может быть рефрактерным раком. В некоторых случаях рак, который лечат согласно настоящему описанию, может быть рецидивирующим раком. В некоторых случаях рак, который лечат согласно настоящему описанию, может экспрессировать ассоциированный с опухолью антиген (например, антигенное вещество, продуцируемое раковой клеткой). Примеры рака, который можно лечить согласно настоящему описанию, включают, без ограничения, В-клеточный рак (например, диффузную крупноклеточную В-клеточную лимфому (DLBCL) и В-клеточный лейкоз), острый лимфобластный лейкоз (ALL), хронический лимфоцитарный лейкоз (CLL), фолликулярную лимфому, лимфому из клеток мантийной зоны, неходжкинскую лимфому, лимфому Ходжкина, острый миелоидный лейкоз (AML), множественную миелому, рак головы и шеи, саркомы, рак груди, злокачественные новообразования желудочно-кишечного тракта, рак мочевого пузыря, рак уротелия, рак почек, рак легких, рак простаты, рак яичников, рак шейки матки, рак половых органов (например, рак мужских половых органов и рак женских половых органов) и рак костей. Например, одна или более Т-клеток, имеющих (например, сконструированных так, чтобы они имели) пониженный уровень полипептидов GM-CSF (например, GM-CSF KO Т-клетки), могут быть использованы для лечения млекопитающего, имеющего DLBCL. Например, одна или более Т-клеток, имеющих (например, сконструированных так, чтобы они имели) пониженный уровень полипептидов GM-CSF (например, GM-CSF KO Т-клетки), могут быть использованы для лечения млекопитающего, имеющего ALL.
Для идентификации млекопитающего, страдающего раком, можно использовать любой подходящий метод. Например, для идентификации млекопитающих (например, людей), страдающих раком, можно использовать методы визуализации и биопсии.
После идентификации рака (например, DLBCL или ALL) млекопитающему можно ввести одну или более Т-клеток, имеющих (например, сконструированных так, чтобы они имели) пониженный уровень экспрессии полипептида-цитокина (например, GM-CSF KO Т-клетки) согласно настоящему описанию.
Например, одна или более Т-клеток, имеющих (например, сконструированных так, чтобы они имели) пониженный уровень экспрессии полипептида-цитокина (например, GM-CSF KO Т-клетки), могут быть использованы в адоптивной Т-клеточной терапии (например, CART клеточной терапии) для лечения млекопитающего, страдающего раком. Например, одна или более Т-клеток, имеющих пониженный уровень полипептидов GM-CSF, могут быть использованы в адоптивной Т-клеточной терапии (например, CART клеточной терапии), нацеленной на любой подходящий антиген в организме млекопитающего (например, млекопитающего, страдающего раком). В некоторых случаях антиген может быть ассоциированным с опухолью антигеном (например, антигенным веществом, продуцируемым раковой клеткой). Примеры ассоциированных с опухолью антигенов, на которые может быть нацелена адоптивная Т-клеточная терапия, представленная в настоящем описании, включают, без ограничения, CD19 (ассоциированный с DLBCL, ALL и CLL), AFP (ассоциированный с опухолями зародышевых клеток и/или гепатоцеллюлярной карциномой), CEA (ассоциированный с раком кишечника, раком легких и/или раком груди), CA-125 (ассоциированный с раком яичников), MUC-1 (ассоциированный с раком груди), ETA (ассоциированный с раком груди), MAGE (ассоциированный со злокачественной меланомой), CD33 (ассоциированный с AML), CD123 (ассоциированный с AML), CLL-1 (ассоциированный с AML), E-кадгерин (ассоциированный с эпителиальными опухолями), альфа-рецептор фолиевой кислоты (ассоциированный с раком яичников), бета рецептор фолиевой кислоты (ассоциированный с раком яичников и AML), IL13R (ассоциированный с раком мозга), EGFRviii (ассоциированный с раком мозга), CD22 (ассоциированный с В-клеточным раком), CD20 (ассоциированный с В-клеточными раковыми заболеваниями), легкая каппа-цепь (ассоциированная с B-клеточным раком), легкая лямбда-цепь (ассоциированная с B-клеточным раком), CD44v (ассоциированный с AML), CD45 (ассоциированный с гематологическим раком), CD30 (ассоциированный с лимфомами Ходжкина и T-клеточными лимфомами), CD5 (ассоциированный с Т-клеточными лимфомами), CD7 (ассоциированный с Т-клеточными лимфомами), CD2 (ассоциированный с Т-клеточными лимфомами), CD38 (ассоциированный с множественными миеломами и AML), BCMA (ассоциированный с множественными миеломами), CD138 (ассоциированный с множественными миеломами и AML), FAP (ассоциированный с солидными опухолями), CS-1 (ассоциированный с множественной миеломой) и c-Met (ассоциированный с раком груди). Например, одна или более Т-клеток, имеющих пониженный уровень полипептидов GM-CSF, могут использоваться в CART клеточной терапии, нацеленной на CD19 (например, CART19 клеточной терапии), для лечения рака согласно настоящему описанию.
В некоторых случаях одна или более Т-клеток, имеющих (например, сконструированных так, чтобы они имели) пониженный уровень экспрессии полипептида-цитокина (например, GM-CSF KO Т-клетки), могут быть использованы в адоптивной Т-клеточной терапии (например, CART клеточной терапии) для лечения млекопитающего, страдающего заболеванием или расстройством, отличным от рака. Например, одна или более Т-клеток, имеющих пониженный уровень полипептидов GM-CSF, могут быть использованы в адоптивной Т-клеточной терапии (например, CART клеточной терапии), нацеленной на любой подходящий ассоциированный с заболеванием антиген (например, антигенное вещество, продуцируемое клеткой, пораженной определенным заболеванием) в организме млекопитающего. Примеры ассоциированных с заболеванием антигенов, на которые может быть нацелена адоптивная Т-клеточная терапия, представленная в настоящем описании, включают, без ограничения, десмопрессин (ассоциированный с аутоиммунными кожными заболеваниями).
В некоторых случаях одна или более Т-клеток, имеющих (например, сконструированных так, чтобы они имели) пониженный уровень экспрессии полипептида-цитокина (например, GM-CSF KO Т-клетки), используемых в адоптивной Т-клеточной терапии (например, CART клеточной терапии), можно вводить млекопитающему, страдающему раком, в качестве комбинированной терапии с одним или более дополнительными агентами, используемыми для лечения рака. Например, одна или более Т-клеток, имеющих пониженный уровень полипептидов GM-CSF, используемых в адоптивной клеточной терапии, могут быть введены млекопитающему в комбинации с одним или более противораковыми методами лечения (например, хирургическим вмешательством, лучевой терапией, химиотерапией (например, с алкилирующими агентами, такими как бусульфан), таргетной терапией (например, с агентами, ингибирующими GM-CSF, такими как лензилумаб), гормональной терапией, ингибиторами ангиогенеза, иммунодепрессантами (например, агентами, ингибирующими интерлейкин-6, такими как тоцилизумаб)) и/или одним или более методами лечения CRS (например, с руксолитинибом и ибрутинибом). В случаях, когда одна или более Т-клеток, имеющих пониженный уровень полипептидов GM-CSF, используемых в адоптивной клеточной терапии, используются с дополнительными агентами для лечения рака, один или более дополнительных агентов можно вводить одновременно или независимо. В некоторых случаях одна или более Т-клеток, имеющих пониженный уровень полипептидов GM-CSF, используемых в адоптивной клеточной терапии, могут быть введены первыми, а один или более дополнительных агентов - вторыми, или наоборот.
Далее изобретение описано в приведенных ниже примерах, которые не ограничивают объем изобретения, описанного в формуле изобретения.
ПРИМЕРЫ
Пример 1: Получения дефицитных по цитокинам CART-клеткок для увеличения терапевтического индекса CART-клеточной терапии
В этом примере описано создание клеток CART19 с нокаутом GM-CSF (GM-CSF KO) и показано, что полученные в результате GM-CSF KO CART19 клетки функционируют нормально и имеют повышенный уровень размножения.
План эксперимента:
CAR19 использовали в ксенотрансплантатах В-клеточного лейкоза. Эти плазмиды использовали для упаковки и получения лентивирусов согласно настоящему описанию. В качестве мышиной модели использовали две модели:
1. Модели ксенотрансплантата: Мышам NSG подкожно прививали CD19-положительные, положительные по люциферазе клетки линии NALM6. Приживление подтверждали биолюминесцентной визуализацией. Мышам вводили PBMC человека внутривенно, и внутрь опухоли вводили лентивирусные частицы. Генерацию CART клеток измеряли методом проточной цитометрии. Оценивали перемещение CART к участкам опухоли, и противоопухолевый ответ измеряли с помощью биолюминесцентной визуализации в качестве меры тяжести (бремени) заболевания.
2. Мышей с гуманизированной иммунной системой (HIS) получали из лаборатории Джексона. Этим мышам вводили фетальные клетки CD34+, когда они были новорожденными, и вследствие этого у них развился человеческий гемопоэз. Этим мышам прививали CD19+ клеточную линию NALM6, как описано ранее. Аналогично, генерировали CART19 in vivo посредством внутриопухолевой инъекции лентивирусных частиц. Затем измеряли активность CART19 клеток в отношении килинга NALM6 и сравнивали с полученными ex vivo CART19 клетками, трансдуцированными лентивирусом (в настоящее время используемыми в клинике).
Материалы и методы:
Создание CAR плазмиды:
Анти-CD19 клон FMC63 синтезировали de novo в каркасе CAR с помощью 4IBB и CD3-дзета, а затем клонировали в каркас лентивируса третьего поколения.
Для создания контрольных CART19 клеток нормальные донорные Т-клетки подвергали отрицательному отбору с помощью набора для Т-клеток и размножали ex vivo, используя анти-CD3/CD28 гранулы Dynabeads (Invitrogen, которые добавляли в первый день культивирования). Т-клетки трансдуцировали лентивирусным супернатантом через один день после стимуляции с множественностью заражения (MOI) = 3. Анти-CD3/CD28 Dynabead удаляли на 6 день, и Т-клетки выращивали в Т-клеточной среде (среда X-vivo 15, 5% человеческая сыворотка, пенициллин, стрептомицин и глутамин) в течение 15 дней, а затем подвергали криоконсервации для будущих экспериментов. Перед проведением всех экспериментов Т-клетки оттаивали и оставляли на ночь при 37°C.
Создание CART клеток с нокаутом GM-CSF:
Клетки с нокаутом GM-CSF CART создавали с помощью системы CRISR-Cas9 двумя методами:
1. Создавали гРНК и клонирована в лентивирусный вектор, кодирующий Cas9 и гРНК. Во время размножения Т-клеток эти клетки трансдуцировали указанным выше лентивирусом в день 1, в тот же день одновременно с CAR19 лентивирусными частицами. Клетки размножали в течение 8 дней, а затем собирали, выделяли ДНК и секвенировали для оценки эффективности нокаута. Эти клетки замораживали и использовали для будущих экспериментов in vitro или in vivo. Кодирующая последовательность нуклеиновой кислоты показана на фиг. 5.
2. мРНК создавали из гРНК и использовали для нокаута GM-CSF. Для этого гРНК смешивали с РНП в соотношении 1:1, и затем Т-клетки подвергали электропорации в день 3 после стимуляции гранулами CD3/CD28. Клетки размножали в течение 8 дней, и затем собирали, выделяли ДНК и секвенировали для оценки эффективности нокаута. Эти клетки криоконсервировали и использовали для будущих экспериментов in vitro или in vivo.
Клетки
Клеточную линию NALM6 получали из ATCC и поддерживали в среде RIO (среда RPMI, 10% фетальная сыворотка теленка, пенициллин и стрептомицин). Как указано, в некоторых экспериментах использовали клетки NALM6, трансдуцированные люциферазой-GFP под контролем промотора EFla. Деидентифицированные первичные образцы ALL человека получали из биобанка клиники Мэйо (Mayo). Все образцы получали после информированного письменного согласия. Для всех функциональных исследований клетки размораживали по меньшей мере за 12 часов перед анализом и оставляли на ночь при 37°C.
Анализ методом проточной цитометрии
Античеловеческие антитела приобретали у компаний BioLegend, eBioscience или BD Biosciences. Клетки выделяли из культуры in vitro или получали из животных, один раз промывали PBS с добавлением 2% фетальной телячьей сыворотки и окрашивали при 4°C после блокады Fc рецепторов. Для количественного определения клеток использовали гранулы Countbright (Invitrogen) в соответствии с инструкциями производителя (Invitrogen). Во всех анализах представляющую интерес популяцию регистрировали на основе характеристик прямого и бокового рассеяния с последующим гейтированием по синглетным частицам, и живые клетки регистрировали с помощью Live Dead Aqua (Invitrogen). Поверхностную экспрессию анти-CD19 CAR определяли окрашиванием, используя конъюгированные с Alexa Fluor 647 козьим антителом к мышиному F(ab')2 от Jackson Immunoresearch.
Анализы функции Т-клеток:
Дегрануляция Т-клеток и анализ внутриклеточных цитокинов:
Вкратце, Т-клетки инкубировали с клетками-мишенями в соотношении 1:5. После окрашивания на экспрессию CAR; во время инкубации добавляли CD107a, CD28, CD49d и монензин. Через 4 часа клетки собирали и окрашивали в отношении экспрессии CAR, CD3 и набор для окрашивания Live Dead (Invitrogen). Клетки фиксировали и пермеабилизировали (FIX&PERM® Cell Fixation&Cell Permeabilization Kit, Life technologies), а затем выполняли окрашивание внутриклеточных цитокинов.
Анализы пролиферации:
Т-клетки промывали и ресуспендировали с плотностью 1×107/мл в 100 мкл PBS и метили 100 мкл CFSE 2,5 мкМ (Life Technologies) в течение 5 минут при 37°C. Затем реакцию гасили холодным R10, и клетки промывали три раза. Мишени облучали в дозе 100 Гр. Т-клетки инкубировали в соотношении 1:1 с облученными клетками-мишенями в течение 120 часов. Затем клетки собирали, окрашивали на CD3, CAR и с помощью набора Live Dead aqua (Invitrogen), и перед проведением анализа методом проточной цитометрии добавляли гранулы Countbright (Invitrogen).
Анализы цитотоксичности:
Для анализа цитотоксичности использовали клетки NALM6-Luc или первичные образцы ALL, меченые CFSE (Invitrogen). Вкратце, мишени инкубировали при указанных соотношениях с эффекторными Т-клетками в течение 4, 16, 24, 48 и/или 72 часов. Киллинг рассчитывали либо с помощью биолюминесцентной визуализации на камере Xenogen IVIS-200 Spectrum, либо с помощью проточной цитометрии. В последнем случае клетки собирали; гранулы Countbright и 7-AAD (Invitrogen) добавляли перед анализом. Оставшиеся живые клетки-мишени представляли собой CFSE+ 7-AAD-.
Измерение секретируемых цитокинов:
Эффекторные клетки и клетки-мишени инкубировали при соотношении 1:1 в среде для Т-клеток в течение 24 или 72 часов, как указано. Супернатант собирали и анализировали с помощью массива 30-plex Luminex в соответствии с протоколом производителя (Invitrogen).
Результаты
GM-CSF KO CART клетки создавали с помощью системы CRISR-Cas9. Во время размножения Т-клеток эти клетки трансдуцировали (день 1) лентивирусом, кодирующим гРНК и Cas9, и лентивирусом, кодирующим CAR19. Клетки размножали в течение 8 дней. Через 8 дней Т-клетки собирали, выделяли ДНК, и выделенную ДНК секвенировали для оценки эффективности нокаута. См., например, фиг. 1. Т-клетки показали эффективность нокаута 24,1% (фиг. 2A), и эффективность трансдукции CAR составила 73% (фиг. 2B).
Для оценки клеточных эффекторных функций GM-CSF KO CART клеток CART19, GM-CSF KO CART 19, UTD или GM-CSF KO UTD клетки культивировали совместно с CD19-положительной клеточной линией NALM6 в соотношении 1:5. Через 4 часа клетки собирали, пермеабилизировали, фиксировали и окрашивали на цитокины (фиг. 3).
Для оценки пролиферации GM-CSF KO CART клеток наблюдали за кинетикой размножения после трансдукции Т-клеток. GM-CSF KO CART клетки размножались лучше, чем клетки, трансдуцированные только CART19 (фиг. 4).
Эти результаты демонстрируют, что CART с нокаутом GM-CSF могут усиливать функцию CART клеток и противоопухолевую активность. Эти результаты также демонстрируют, что блокада GMCSF в комбинации с CART19 не влияет на эффекторные функции CART клеток.
Пример 2: Истощение по GM-CSF во время CART терапии уменьшает синдром высвобождения цитокинов и нейротоксичность и может усиливать функцию CART клеток
В этом примере исследовали истощение колониестимулирующего фактора гранулоцитов и макрофагов (GM-CSF) и миелоидных клеток в качестве потенциальной стратегии управления токсичностью, ассоциированной с CART клетками. Было обнаружено, что блокада GM-CSF нейтрализующим антителом не подавляет функцию CART in vitro или in vivo. Пролиферация CART клеток усиливалась in vitro, и CART клетки обеспечивали более эффективный контроль лейкоза в ксенотрансплантатах, полученных от пациентов, после истощения GM-CSF. Кроме того, в модели ксенотрансплантата первичного острого лимфобластного лейкоза для оценки CRS и NT блокада GM-CSF приводила к снижению инфильтрации миелоидных клеток и Т-клеток в головном мозге и уменьшала развитие CRS и NT. Наконец, CART клетки с нокаутом GM-CSF, получали путем повреждения гена GM-CSF с помощью системы CRISPR/cas9 во время генерации CART клеток. GM-CSFk/o CART клетки продолжали нормально функционировать и приводили к усилению противоопухолевой активности in vivo. Это свидетельствует о том, что нейтрализация GM-CSF позволяет устранить нейротоксичность и CRS, а также может улучшить функции CART клеток.
Материалы и методы
Клеточные линии и первичные клетки
NALM6 и MOLM13 приобретали в ATCC, Manassa, VA, USA, трансдуцировали лентивирусом люцифераза-ZsGreen (addgene) и сортировали до достижения 100% чистоты. Выделенные клетки культивировали в RIO (RPMI, 10% FCS об./об., 1% пенициллин и стрептавидин об./об.). Первичные клетки получали из биобанка Mayo Clinic для пациентов с острым лейкозом в соответствии с протоколом, утвержденным институциональным наблюдательным советом. Использование рекомбинантной ДНК в лаборатории было одобрено институциональным комитетом по биобезопасности (IBC).
Первичные Т-клетки и CART клетки
Мононуклеарные клетки периферической крови (PBMC) выделяли из деидентифицированных аферезных контейнеров донорской крови согласно протоколу FICOLL (см., например, Dietz et al, 2006 Transfusion 46:2083-2089). Т-клетки подвергали отрицательному отбору с магнитными гранулами (технологии Stemcell), и моноциты подвергали положительному отбору с CD14+ магнитными гранулами (технологии Stemcell). Первичные клетки культивировали в среде X-Vivo 15 с 5% человеческой сывороткой, пенициллином, стрептомицином и глутамаксом. Направленные на CD19 клетки CART получали путем трансдукции нормальных донорских Т-клеток лентивирусом, как описано ниже. Конструкции CAR19 второго поколения синтезировали do novo (IDT) и клонировали в лентивирус третьего поколения под контролем промотора EF-1α. CD19-направленный одноцепочечный вариабельный фрагмент получали из клона FMC63. Конструкцию CAR, костимулированную 4IBB (FMC63-41BBz) второго поколения, синтезировали и использовали в этих экспериментах. Лентивирусные частицы получали путем временной трансфекции плазмиды в клетки, продуцирующие вирус 293T, в присутствии липофектамина 3000, VSV-G и упаковывающих плазмид. Т-клетки, полученные от нормальных доноров, стимулировали стимулирующими CD3/CD28 гранулами (StemCell) в соотношении 1:3, и затем трансдуцировали лентивирусными частицами через 24 часа после стимуляции с множественностью заражения 3,0. Магнитные гранулы удаляли на 6-й день, и CART клетки собирали и криоконсервировали на 8-й день для будущих экспериментов. CART клетки оттаивали и оставляли в среде для Т-клеток за 12 часов до их применения в экспериментах.
Генерация GM-CSFk/o CART клеток:
Гидовую РНК (гРНК), нацеленную на экзон 3 человеческого GM-CSF, отбирали путем скрининга гРНК, которые, как ранее сообщалось, обладают высокой эффективностью в отношении человеческого GM-CSF.25. Эту гРНК вводили в CAS9 лентивирусную конструкцию третьего поколения (lentiCRISPRv2), контролируемую промотором U6 (GenScript, Township, NJ, USA). Лентивирусные частицы, кодирующие эту конструкцию, получали, как описано выше. Т-клетки подвергали двойной трансдукции CAR19 лентивирусами и GM-CSFgRNA-lentiCRISPRv2 через 24 часа после стимуляции CD3/CD28 гранулами. Затем продолжали размножение CAR-T-клеток, как описано выше. Для анализа эффективности нацеливания на GM-CSF геномную ДНК экстрагировали из GM-CSFk/o CART19 клеток с помощью мини-набора PureLink Genomic DNA Mini (Invitrogen, Carlsbad, CA, USA). Представляющую интерес ДНК амплифицировали методом ПЦР с использованием Choice Taq Blue Mastermix (Thomas Scientific, Minneapolis, MN, USA) и экстрагировали из геля с помощью набора для экстракции геля QIAquick (Qiagen, Germantown, MD, USA) для определения редактирования. ПЦР-ампликоны отправляли на секвенирование Eurofins (Louisville, KY, USA), и вычисляли частоту модификации аллелей с помощью программного обеспечения TIDE (Отслеживание индел мутаций посредством разложения), доступного на tide.nki.nl. На фиг. 15 показаны последовательность гРНК, последовательности праймеров и схема генерации GM-CSFk/o CART19.
GM-CSF нейтрализующие антитела и изотипические контроли
Лензилумаб (Humanigen, Brisbane, CA) представляет собой гуманизированное антитело, которое нейтрализует человеческий GM-CSF. Для экспериментов in vitro использовали лензилумаб или изотипический контроль в количестве 10 мкг/мл. Для экспериментов in vivo вводили 10 мг/кг лензилумаба или изотипического контроля, и график, путь и частота введения указаны в отдельной экспериментальной схеме. В некоторых экспериментах также использовали нейтрализующее антитело к мышиному GM-CSF (10 мг/кг), как указано в схеме эксперимента.
Эксперименты по изучению функции Т-клеток
Анализы цитокинов выполняли через 24 или 72 часа после совместного культивирования CART клеток с мишенями в соотношении 1:1, как указано. Выполняли анализ GM-CSF в режиме одного продукта человеческого GM-CSF на реакцию (singleplex) (Millipore), 30 продуктов человеческого GM-CSF (Millipore) или 30 продуктов мышиного GM-CSF (Millipore) на реакцию в супернатанте, собранном в этих экспериментах, как указано. Анализ выполняли, используя тест с гранулами методом проточной цитометрии или Luminex; анализ внутриклеточных цитокинов и анализы дегрануляции Т-клеток выполняли после инкубации CART клеток с мишенями при соотношении 1:5 в течение 4 часов при 37°C, в присутствии монензина, hCD49d и hCD28. Через 4 часа клетки собирали и проводили внутриклеточное окрашивание после окрашивания поверхности с последующей фиксацией и пермеализацией (FIX & PERM Cell Fixation & Cell Permeabilization Kit, Life Technologies). Для анализов пролиферации CFSE-меченные (Life Technologies) эффекторные клетки (CART19) и облученные клетки-мишени совместно культивировали в соотношении 1:1. В некоторых экспериментах к совместной культуре добавляли CD14+ моноциты в соотношении 1:1:1, как указано. Клетки совместно культивировали в течение 3-5 дней, как указано в конкретном эксперименте, а затем клетки собирали и проводили окрашивание поверхности анти-hCD3 и Live/Dead Aqua. PMA/иономицин использовали в качестве положительного неспецифического стимулятора Т-клеток в различных концентрациях, как указано в конкретных экспериментах. Для анализа киллинга CD19+люцифераза+ ALL клеточную линию NALM6 или CD19-люцифераза+ контрольные клетки MOLM13 инкубировали при указанных соотношениях с эффекторными Т-клетками в течение 24 или 48 часов, как указано в конкретном эксперименте. Величину киллинга вычисляли, используя биолюминесцентную визуализацию с помощью камеры Xenogen IVIS-200 Spectrum (PerkinElmer, Hopkinton, MA, USA), в виде меры оставшихся живых клеток. Образцы обрабатывали 1 мкл D-люциферина (30 мкг/мл) на 100 мкл образца за 10 минут до визуализации.
Многопараметрическая проточная цитометрия
Античеловеческие антитела приобретали у Biolegend, eBioscience или BD Biosciences. Клетки выделяли из культуры in vitro или из периферической крови животных (после лизиса ACK), дважды промывали фосфатно-солевым буфером с добавлением 2% фетальной телячьей сыворотки и окрашивали при 4°C. Для количественного определения клеток использовали гранулы Countbright (Invitrogen) в соответствии с инструкциями производителя (Invitrogen). Во всех анализах представляющую интерес популяцию регистрировали на основе характеристик прямого и бокового рассеяния с последующим гейтированием по синглетным частицам, и живые клетки регистрировали с помощью Live Dead Aqua (Invitrogen). Поверхностную экспрессию CAR определяли окрашиванием козьим антителом к мышиному F(ab')2. Проточную цитометрию выполняли на четырехлазерном анализаторе Canto II (BD Biosciences). Все анализы выполняли с помощью FlowJo X10.0.7r2.
Ксеногенные мышиные модели
Самцов и самок мышей NOD-SCID-IL2rγ-/- (NSG) в возрасте 8-12 недель разводили и ухаживали за ними в отделении сравнительной медицины в клинике Mayo в соответствии с протоколом разведения, одобренным Комитетом по уходу и использованию институциональных животных (IACUC). Мышей содержали в огороженных пространствах для животных, одобренных институциональным комитетом по биобезопасности для экспериментов на уровне BSL2+.
Ксенотрансплантаты клеточной линии NALM6
CD19+люцифераза+ ALL клеточную линию NALM6 использовали для создания ксенотрансплантатов ALL. Эти эксперименты с ксенотрансплантатом были одобрены другим протоколом IACUC. В данном случае 1×106 клеток вводили внутривенно путем инъекции в хвостовую вену. Через шесть дней после инъекции мышей подвергали биолюминесцентной визуализации с помощью камеры Xenogen IVIS-200 Spectrum, чтобы подтвердить приживление. Визуализацию выполняли после внутрибрюшинной инъекции 10 мкл/г D-люциферина (15 мг/мл). Затем мышей рандомизировали на основе биолюминесцентного изображения для назначения разных режимов лечения, как указано в конкретных экспериментах. Обычно вводили 1-2×106 клеток CART или UTD-клеток, и точные дозы указаны в подробном описании эксперимента. Еженедельную визуализацию выполняли для оценки и контроля тяжести заболевания. Образцы крови из хвостовой вены брали через 7-10 дней после инъекции CART клеток для оценки размножения Т-клеток, а после этого по мере необходимости. Периферическую кровь мышей лизировали, используя лизирующий буфер ACK (Thermofisher), которую затем использовали в анализе методом проточной цитометрии. Биолюминесцентные изображения получали с помощью камеры Xenogen IVIS-200 Spectrum (PerkinElmer, Hopkinton, MA, USA) и анализировали с помощью программного обеспечения Living Image версии 4.4 (Caliper LifeSciences, PerkinElmer). Терапия мышей, получавших антитела, включала введение антител (10 мг/кг лензилумаба или изотипического контроля) внутрибрюшинно в течение 10 дней.
Первичные ксенотрансплантаты ALL, полученные от пациента
Для создания первичных ксенотрансплантатов ALL мышам NSG сначала вводили 30 мг/кг бусульфана внутрибрюшинно. На следующий день мышам вводили 2×106 первичных бластов, полученных из периферической крови пациентов с рецидивирующим рефрактерным ALL. За приживлением трансплантатов у мышей наблюдали в течение 4-6 недель, и при постоянном наблюдении уровня CD19+ клеток в крови (>1 клетки/мкл) мышей рандомизовали для получения разных курсов обработки CART19 или UTD (1×106 клеток) в комбинации с терапией антителами или без нее (10 мг/кг лензилумаба или изотипического контроля IP в течение 10 дней, начиная со дня получения терапии CART клетками). Мышей периодически наблюдали на лейкемическую нагрузку путем взятия образцов крови из хвостовой вены.
Первичные ксенотрансплантаты ALL, полученные от пациентов, для CRS/NT
Как и в описанных выше экспериментах, мышам внутрибрюшинно вводили 30 мг/кг бусульфана. На следующий день им вводили 1-2×106 первичных бластов, полученных из периферической крови пациентов с рецидивирующим рефрактерным ALL. Приживление трансплантатов у мышей наблюдали в течение 4-6 недель, и когда уровень CD19+ клеток становился высоким (>10 клеток/мкл), им вводили CART19 (2-5×106 клеток) и начинали терапию антителами в течение 10 дней, как указано при описании конкретных экспериментов. Мышей ежедневно взвешивали для оценки их физического состояния. МРТ мышей по Брайану выполняли через 5-6 дней после введения CART и через 4-11 дней после инъекции CART из хвостовой вены брали образцы крови. МРТ изображения головного мозга анализировали с помощью Azalyze.
Получение МРТ
Для получения изображений для оценки проницаемости сосудов центральной нервной системы (ЦНС) использовали систему МРТ для мелких животных Bruker Avance II 7 Tesla с вертикальным отверстием для мелких животных (Bruker Biospin). Анестезию осуществляли путем ингаляции, которую поддерживали, используя 3-4% изофлуран. Частоту дыхания контролировали во время сеансов сбора данных с помощью системы мониторинга жизненно важных функций, совместимой с МРТ (модель 1030; SA Instruments, Stony Brook, NY). Мышам вводили внутрибрюшинную инъекцию гадолиния в дозе 100 мг/кг в зависимости от веса, и после стандартной 15 минутной задержки использовали T1-взвешенную последовательность на основе спин-эхо для сбора объемных данных (время повторения=150 мс, время эхо-сигнала=8 мс, поле зрения: 32 мм x 19,2 мм x 19,2 мм, матрица: 160×96 x 96; количество средних значений=1) для получения T1-взвешенных изображений. Изменения МРТ, усиленные гадолинием, свидетельствовали о нарушении гематоэнцефалического барьера. Волюметрический анализ выполняли с помощью пакета программного обеспечения Analyze, разработанного отделом Biomedical Imaging Resource в клинике Mayo.
РНК-секвенирование в ткани мозга мыши
РНК выделяли с помощью набора miRNeasy Micro (Qiagen, Gaithersburg, MD, USA) и обрабатывали набором ДНКаз, не содержащим РНКаз (Qiagen, Gaithersburg, MD, USA). РНК-секвенирование выполняли на Illumina HTSeq 4000 (Illumina, San Diego, CA, USA) с помощью Genome Analysis Core в клинике Mayo. Двоичное представление данных было преобразовано в fastq формат с помощью программного обеспечения Illumina bcl2fastq. Адаптерные последовательности удаляли с помощью Trimmomatic, и FastQC использовали для проверки качества. Последние эталонные геномы человека (GRCh38) и мыши (GRCm38) загружали из NCBI. Генерировали индексные файлы генома с помощью STAR30, и считывания парных концевых фрагментов картировали на геном для каждого условия. HTSeq использовали для вычисления количества событий экспрессии для каждого гена, а DeSeq2 использовали для вычисления дифференциальной экспрессии. Генную онтологию оценивали с помощью Enrichr. На фиг. 16 показаны этапы, описанные выше. Данные о секвенировании РНК доступны на сайте Gene Expression Omnibus под номером доступа GSE121591.
Статистика
Для анализа данных использовали Prism Graph Pad и Microsoft Excel. Высокие концентрации цитокинов на тепловой карте были нормализованы до «1», а низкие концентрации были нормализованы до «0» с помощью Prism. Статистические тесты описаны в подписях к фигурам.
Результаты
Нейтрализация GM-CSF in vitro усиливает пролиферацию CAR-T-клеток в присутствии моноцитов и не нарушает эффекторную функцию CAR-T-клеток.
При использовании нейтрализации GM-CSF после терапии CAR-T-клетками в качестве стратегии для предотвращения CRS и NT она не должна подавлять эффективность CAR-T-клеток. Таким образом, первоначальные эксперименты были направлены на изучение влияния нейтрализации GM-CSF на эффекторные функции CAR-T-клеток. В этих экспериментах CART19 клетки культивировали совместно с CD19+ ALL клеточной линией NALM6 или без нее в присутствии лензилумаба (нейтрализующее антитело GM-CSF) или изотипического контроля (IgG). Было установлено, что лензилумаб, но не контрольное антитело IgG, действительно способен полностью нейтрализовать GM-CSF (фиг. 6A), но не ингибировать специфическую пролиферацию антигена CAR-T-клеток (фиг. 6B). Когда клетки CART19 культивировали совместно с линией клеток CD19+ NALM6 в присутствии моноцитов, лензилумаб в комбинации с CART19 демонстрировал экспоненциальное увеличение антигенспецифической пролиферации CART19 по сравнению с CART19 плюс изотипический контрольный IgG (P<0,0001, фиг. 6C). Для исследования специфической цитотоксичности CAR-T либо CART19, либо контрольные Т-клетки UTD культивировали с люцифераза+CD19+ линией клеток NALM6, которые затем обрабатывали либо контрольным изотипом антитела, либо антителом, нейтрализующим GM-CSF (фиг. 1D). Обработка антителом, нейтрализующим GM-CSF, не подавляла способность CAR-T клеток убивать клетки-мишени NALM6 (фиг. 6D). В целом эти результаты показывают, что лензилумаб не ингибирует функцию CAR-T-клеток in vitro и усиливает пролиферацию CART19 клеток в присутствии моноцитов, предполагая, что нейтрализация GM-CSF может повысить эффективность, опосредованную CAR-T-клетками.
Нейтрализация GM-CSF in vivo усиливает противоопухолевую активность CAR-T-клеток в моделях ксенотрансплантатов.
Чтобы подтвердить, что истощение GM-CSF не подавляет эффекторные функции CART19, было изучено GM-CSF-нейтрализующее влияние лензилумаба на противоопухолевую активность CART19 на моделях ксенотрансплантатов. Во-первых, была использована модель рецидива, предназначенная для тщательного изучения влияния нейтрализации GM-CSF на противоопухолевую активность CART19 клеток. Мышам NSG инъецировали l×106 люцифераза+ NALM6 клетки и затем визуализировали через 6 дней, что обеспечило достаточно времени для достижения у мышей очень высокой опухолевой нагрузки. Мышей рандомизировали на группы, получающие однократную инъекцию CART19 или UTD клеток и антитело контрольного изотипа или лензилумаб в течение 10 дней (фиг. 7A). Анализ GM-CSF в сыворотке, собранной через 8 дней после инъекции CART19, показал, что лензилумаб успешно нейтрализует GM-CSF на фоне терапии CART19 (фиг. 7B). Биолюминесцентная визуализация через неделю после инъекции CART19 показала, что CART19 в комбинации с лензилумабом эффективно контролировали лейкоз в этой модели рецидива с высокой опухолевой нагрузкой и значительно лучше, чем контрольные клетки UTD (фиг. 7C). Лечение CART19 в комбинации с лензилумабом обеспечило сильную противоопухолевую активность и улучшенную общую выживаемость, аналогично CART19 с контрольным антителом, несмотря на нейтрализацию уровней GM-CSF, что указывает на то, что GM-CSF не ухудшает in vivo активность CAR T-клеток (фиг. 8). Во-вторых, эти эксперименты выполняли на модели ксенотрансплантата, полученной от пациента с первичным ALL, в присутствии PBMC человека, поскольку эта модель является более подходящей гетерогенной моделью. После режима кондиционирования химиотерапии бусульфаном мышам вводили бласты, полученные от пациентов с рецидивом ALL. Приживление у мышей наблюдали в течение нескольких недель путем непрерывного забора образцов крови из хвостовой вены, и когда уровень CD19+ бластов в крови стал >1/мкл, мышей рандомизировали для назначения лечения CART19 или UTD в комбинации с PBMC либо с лензилумабом плюс антимышиное антитело, нейтрализующее GM-CSF, либо с антителами IgG изотипического контроля, начиная со дня инъекции CART19 в течение 10 дней (фиг. 7D). В этой модели ксенотрансплантата первичного ALL нейтрализация GM-CSF в комбинации с терапией CART19 привела к значительному улучшению контроля лейкоза, который сохранялся в течение более 35 дней после введения CART19, по сравнению с CART19 плюс изотипический контроль (фиг. 7E). Это позволяет предположить, что нейтрализация GM-CSF может играть роль в уменьшении рецидивов и увеличении продолжительности полных ответов после клеточной терапии CART19.
CAR-T клетки с нокаутом GM-CSF с помощью CRISPR демонстрируют пониженную экспрессию GM-CSF, аналогичные уровни ключевых цитокинов и повышенную противоопухолевую активность.
Чтобы с уверенностью исключить любую критическую роль GM-CSF в функционировании CAR T-клеток, при создании CAR T-клеток повреждали ген GM-CSF с помощью гРНК, которая, согласно сообщениям, является высокоэффективной, которую клонировали в лентивирусный остов CRISPR. Используя эту гРНК, была достигнута примерно 60% эффективность нокаута в клетках CART19 (фиг. 9). Когда CAR T-клетки стимулировали CD19+ клеточной линией NALM6, GM-CSFk/o CAR T-клетки вырабатывали статистически значимо более низкий уровень GM-CSF по сравнению с CART19 с локусом GM-CSF дикого типа («клетки CART19 дикого типа»). Нокаут GM-CSF в CAR T-клетках не нарушал продуцирования других ключевых цитокинов T-клеток, включая IFN-γ, IL-2 или антиген-специфическую дегрануляцию CAR T-клеток (CD107a) (фиг. 10A), но привел к снижению уровня экспрессии GM-CSF (фиг. 10B). Чтобы подтвердить, что клетки GM-CSFk/o CAR-T продолжают нормально функционировать, была протестирована их эффективность in vivo на модели ксенотрансплантата с рецидивирующим ALL с высокой опухолевой нагрузкой (как описано на фиг. 7A). В этой модели ксенотрансплантата использование GM-CSFk/o CART19 вместо CART19 дикого типа привело к заметному снижению сывороточных уровней человеческого GM-CSF через 7 дней после обработки CART19 (фиг. 10B). Данные биолюминесцентного изображения позволяют предположить, что клетки GM-CSFk/o CART19 обеспечивают усиленный лейкемический контроль по сравнению с CART19 в этой модели (фиг. 11). Важно отметить, что клетки GM-CSFk/o CART19 продемонстрировали значительное улучшение общей выживаемости по сравнению с клетками CART19 дикого типа (фиг. 10). За исключением GM-CSF, не было обнаружено никаких статистически значимых изменений ни в цитокинах человека (фиг. 10D), ни в цитокинах мыши (фиг. 10E). Вместе эти результаты подтверждают данные, приведенные на фиг. 6 и 7, что указывает на то, что истощение GM-CSF не оказывает отрицательного влияния на цитокины, которые имеют решающее значение для функциональной эффективности CAR-T. Кроме того, результаты на фиг. 10 показывают, что GM-CSFk/o CART могут представлять терапевтический вариант для «встроенного» контроля GM-CSF в качестве модификации во время производства CAR-T-клеток.
Модель ксенотрансплантата опухоли пациента для оценки нейротоксичности и синдрома высвобождения цитокинов
В этой модели кондиционированным мышам NSG прививали первичные бласты ALL и наблюдали за приживлением в течение нескольких недель до достижения высокой опухолевой нагрузки (фиг. 12A). Когда уровень CD19+ бластов в периферической крови достиг уровня >10/мкл, мышей рандомизировали для назначения разных видов терапии, как указано (фиг. 12A). Лечение CART19 (с контрольными антителами IgG или нейтрализующими антителами к GM-CSF) успешно искоренило заболевание (фиг. 12B). В течение 4-6 дней после лечения CART19 у мышей начинали развиваться моторная слабость, сутулость и прогрессирующая потеря веса: симптомы которые соответствуют CRS и NT. Это было связано с тем, что в сыворотке через 4-11 дней после инъекции CART19 увеличились уровни ключевых цитокинов аналогично тому, как это наблюдается при CRS у человека после терапии CAR T-клетками (включая человеческие GM-CSF, TNF-α, IFN-γ, IL-10, IL-12, IL-13, IL-2, IL-3, IP-10, MDC, MCP-1, MIP-1α, MIP-1β и мышиные IL-6, GM-CSF, IL-4, IL-9, IP-10, MCP-1 и MIG). У этих мышей, получавших CART19, также развилась NT, о чем свидетельствовали анализы МРТ головного мозга, выявившие аномальное повышение T1, указывающее на нарушение гематоэнцефалического барьера и, возможно, отек мозга (фиг. 12D), вместе с анализом проточной цитометрии полученных образцов мозга, показавшим инфильтрацию человеческих CART19 клеток (фиг. 12E). Кроме того, анализ РНК-секвенирования срезов мозга мышей, у которых развились эти признаки NT, показал значительную активацию генов, регулирующих Т-клеточный рецептор, рецепторы цитокинов, активацию иммунной системы Т-клеток, транспорт Т-клеток и дифференцировку Т-клеток и миелоидных клеток (таблица 1).
Таблица 1. Таблица канонических путей, измененных в головном мозге мышей с ксенотрансплантатами опухоли пациента после обработки клетками CART19.
Нейтрализация GM-CSF in vivo облегчает синдром высвобождения цитокинов и нейротоксичность после CART19 терапии в модели ксенотрансплантата.
Используя модель ксенотрансплантата, полученного от пациента, для оценки NT и CRS, показанную на фиг. 4A, изучали влияние нейтрализации GM-CSF на токсичность CART19. Чтобы исключить сопутствующий эффект мышиного GM-CSF, мышам вводили CART19 клетки в комбинации с 10-дневной терапией антителами к GM-CSF (10 мг/кг лензилумаба и 10 мг/кг антитела, нейтрализующего мышиный GM-CSF) или антителами изотипического контроля. Терапия нейтрализующими антителами GM-CSF предотвращала потерю веса, индуцированную CRS, после терапии CART19 (фиг. 13A). Анализ цитокинов через 11 дней после CART19 клеточной терапии показал, что человеческий GM-CSF был нейтрализован антителом (фиг. 13B). Кроме того, нейтрализация GM-CSF привела к значительному снижению количества нескольких человеческих (IP-10, IL-3, IL-2, IL-IRa, IL-12p40, VEGF, GM-CSF) (фиг. 5C) и мышиных (MIG, MCP-1, KC, IP-10) (фиг. 13D) цитокинов. Белок, индуцированный гамма-интерфероном (IP-10, CXCL10), помимо других типов клеток, вырабатывается моноцитами и служит хемоаттрактантом для многих типов клеток, включая моноциты, макрофаги и Т-клетки. IL-3 играет роль в дифференцировке миелоидных предшественников. IL-2 является ключевым цитокином Т-клеток. Антагонист рецептора интерлейкина-1 (IL-IRa) ингибирует IL-1. (IL-1 продуцируется макрофагами и представляет собой семейство критических воспалительных цитокинов.) IL-12p40 является субъединицей IL-12, которая продуцируется, помимо других типов клеток, макрофагами и может способствовать дифференцировке Th1. Фактор роста эндотелия сосудов (VEGF) способствует образованию кровеносных сосудов. Монокин, индуцированный интерфероном гамма (MIG, CXCL9), представляет собой хемоаттрактант Т-клеток. Моноцитарный хемоаттрактантный белок 1 (MCP-1, CCL2) привлекает моноциты, Т-клетки и дендритные клетки. KC (CXCL1) вырабатывается макрофагами, помимо других типов клеток, и привлекает миелоидные клетки, такие как нейтрофилы. После нейтрализации GM-CSF также наблюдалась тенденция к снижению ряда других цитокинов человека и мышей. Это предполагает, что GM-CSF играет роль в нисходящей активности нескольких цитокинов, которые играют важную роль в каскаде, приводящем к CRS и NT.
МРТ головного мозга через 5 дней после лечения CAR19 показала, что нейтрализация GM-CSF снижает повышение уровня T1, меры воспаления головного мозга, нарушение гематоэнцефалического барьера и, возможно, отек, по сравнению с CART19 плюс контрольные антитела. МРТ-изображения после нейтрализации GM-CSF (с помощью лензилумаба и антитела к мышиному GM-CSF) были аналогичны сканам до начала лечения, что позволяет предположить, что нейтрализация GM-CSF способствовала эффективному устранению NT, связанной с терапией CART19 (фиг. 14A, B). В случае использования человеческих бластов ALL и человеческих CART19 в этой модели ксенотрансплантата, полученного от пациента, нейтрализация GM-CSF после CART19 обеспечила снижение нейровоспаления на 59% по сравнению с CART19 плюс изотипический контроль (фиг. 14B). Это является важным открытием, и впервые было продемонстрировано in vivo, что NT, вызванная CART19, может быть эффективно устранена. После терапии CART19 в мозге присутствовали человеческие CD3 Т-клетки, определенные с помощью проточной цитометрии, и при нейтрализации GM-CSF наблюдалась тенденция к снижению количества CD3 Т-клеток в головном мозге (фиг. 14C). Наконец, в мозге мышей, получивших нейтрализацию GM-CSF во время CAR T-клеточной терапии, наблюдалась тенденция к снижению CD11b+ ярких макрофагов по сравнению с контрольным изотипом, вводимым во время CAR-T терапии (фиг. 14D), что позволяет предположить, что нейтрализация GM-CSF помогает уменьшить количество макрофагов в головном мозге.
Пример 3: взаимодействие GM-CSF с рецепторами GM-CSF
Материалы и методы
Анализ рецепторов GM-CSF (CSF2R)
Размножение Т-клеток. Изолированные Т-клетки стимулировали CD3/CD28 гранулами. Экспрессию CSF2 рецепторов CSF2RA (CD116) и CSF2RB (CD 131) измеряли проточной цитометрией в дни 0, 1, 3, 6 и 8. Покоящиеся Т-клетки использовали в качестве отрицательного контроля.
Получение CART. Получали CART19, и экспрессию CSF2RA (CD116) и CSF2RB (CD131) измеряли с помощью проточной цитометрии в дни 0, 1, 3 и 6. Покоящиеся Т-клетки использовали в качестве отрицательного контроля, а клеточную линию Nalm6 использовали в качестве положительного контроля.
Вестерн-блоттинг
CART19/UTD клетки и облученные клетки Nalm6 культивировали совместно в соотношении 1:1. К клеткам добавляли антитела в дозе 10 мкг/мл. Условиями культивирования были следующими: UTD, CART19, блокада CART19+GM-CSF, блокада CART19+CSF2RA и блокада CART19+CSF2RB. Эти условия тестировали с контрольной средой относительно стимуляции Nalm6.
После культивирования клеток с антителами в течение 24 часов CART19 выделяли с помощью микрогранул. Чистоту CART19 (98-100%) подтверждали методом проточной цитометрии. Клетки собирали центрифугированием, и из клеток выделяли полипептиды для использования в вестерн-блоттинге.
Полученные результаты
При стимуляции экспрессия GM-CSF рецепторов усиливались на Т-клетках и CART клетках. Уровни рецепторов GM-CSF CSF2RA (CD116) и CSF2RB (CD131) на Т-клетках измеряли и сравнивали с уровнями CSF2RA (CD116) и CSF2RB (CD131) на покоящихся Т-клетках (отрицательный контроль) согласно протоколу 8-дневного размножения Т-клеток. Экспрессия CSF2RA и CSF2RB увеличивалась после начальной стимуляции, достигала максимума на 3-й день и немного снижалась после уменьшения количества гранул на 6-й день (фиг. 17A). Также измеряли уровни CSF2RA (CD116) и CSF2RB (CD131) на CART19 и UTD клетках и сравнивали с уровнями CSF2RA (CD116) и CSF2RB (CD131) на контрольных клетках во время 8-дневного продуцирования CART. Экспрессия немного снизилась в день 1, но достигла пика в день 3 (фиг. 17B).
Взаимодействие GM-CSF с рецептором CSF2 зависит от бета-цепи (CSF2RB). Экспрессия фосфорилированного Stat5 и фосфорилированного белка Jak2 увеличивалась в присутствии облученных Nalm6 и при блокаде CSF2RA, но снижалась в присутствии GM-CSF и при блокаде CSF2RB (фиг.18). FAS находится ниже рецептора CSF2, и его экспрессия немного снижается в присутствии Nalm6 с блокадой GM-CSF, но не в присутствии CSF2RA или при блокаде CSF2RB (фиг.18).
Эти результаты демонстрируют, что CSF2R может экспрессироваться на активированных Т-клетках и CART клетках. Эти результаты также демонстрируют, что нейтрализация GM-CSF может ингибировать p-STAT5. Подобное ингибирование наблюдалось при блокировании бета-рецептора GM-CSF, что позволяет предположить, что передача сигналов управляется взаимодействием между GM-CSF и бета рецептором GM-CSF на активированных клетках CART.
Пример 4: транскрипция клеток GM-CSF и CART19
Материалы и методы
РНК-секвенирование
Выделение РНК и РНК-секвенирование. Общую РНК выделяли из трех биологических реплик (нормальные доноры 105, 115 и 116) для нетрансдуцированных Т-клеток, CART19 и GM-CSFk/o CART19 с помощью набора miRNeasy Micro (QIAGEN) и обрабатывали набором ДНКаз без РНКазы (QIAGEN). РНК-секвенирование с парными концевыми фрагментами выполняли на Illumina HTSeq 4000 с помощью Genome Analysis Core в клинике Mayo.
Качество. Двоичное представление данных было преобразовано в fastq формат с помощью программного обеспечения Illumina bcl2fastq. Адаптерные последовательности удаляли с помощью Trimmomatic, и FastQC использовали для проверки качества.
Выравнивание. Последние эталонные геномы человека загружали из NCBI (HG38). Генерировали индексные файлы генома с помощью STAR, и считывания парных концевых фрагментов картировали на геном для каждого условия.
Дифференциальная экспрессия. HTSeq использовали для вычисления количества событий экспрессии для каждого гена, а DeSeq2 использовали для вычисления дифференциальной экспрессии. Условия с менее чем 10 полными транскриптами отфильтровывали. Скорректированное значение p между GM-CSFk/o CART19 и CART19 вычисляли с помощью метода Бенджамини-Хохберга.
Результаты
РНК-секвенирование использовали для идентификации различий в транскриптомах между GM-CSFk/o CART19 клетками и CART19 клетками на 8-й день продуцирования CART. Было идентифицировано 236 генов со значимой дифференциальной экспрессией согласно скорректированному значении p по Бенджамини-Хохбергу <0,05 (фиг. 19A). Были идентифицированы три разных паттерна экспрессии генов: гены, экспрессия которых увеличилась в GM-CSFk/o CART19 клетках по сравнению с CART19 клетками и UTD клетками (фиг. 19A, вверху); гены, экспрессия которых была подавлена в GM-CSFk/o CART19 клетках по сравнению с CART19 клетками и UTD клетками (фигура 19A, в середине); и гены, экспрессия которых GM-CSFk/o CART19 клетках была нормализована до уровня UTD клеток по сравнению с CART19 клетками (фиг. 19A, внизу). Среди генов со средним профилем идентифицирован FAS, который является частью пути Tec-киназы и отвечает за индукцию апоптоза. Также были идентифицированы гены, которые были значимо подавлены в GM-CSFk/o CART19 клетках по сравнению с CART19 клетками (фиг. 19B). Примечательно, что нокаут GM-CSF в CART19 клетках нормализовал измененную экспрессию генов, наблюдаемую в CART19 клетках (фиг. 19C). Анализ основных компонентов показал, что общий паттерн экспрессии генов в GM-CSFk/o CART19 клетках больше похож на таковой в UTD клетках, чем в CART19 клетках.
Эти результаты свидетельствуют о том, что GM-CSFk/o клетки могут иметь отчетливый паттерн экспрессии генов с увеличением подавленных генов в GM-CSFk/o CART19 клетках.
Пример 5: редактирование GM-CSF с помощью системы CRISPR-Cas9
Материалы и методы
Секвенирование всего экзома (WES)
Обработка образцов. ДНК выделяли из трех биологических репликат: нетрансдуцированных Т-клеток, GM-CSFk/o Т-клеток, CART19 клеток и GM-CSFk/o CART19 клеток с использованием мини-набора для ДНК PureLink Genomic. Выделенную ДНК отправляли в клинику Mayo в центр Medical Genome Facility Genome Analysis Core для выполнения WES. Образцы секвенировали на Illumina HiSeq 4000.
Первичный анализ. Первичный анализ выполняли в Core путем преобразования двоичного представления данных в формат fastq с помощью программного обеспечения Illumina bcl2fastq.
Вторичный анализ. Файлы fastq сопоставляли с эталонным геномом человека HG38 с помощью алгоритма выравнивания BWA-Mem. Вторичный анализ выполняли в отделе биомедицинской статистики и информатики с помощью программного обеспечения анализа генома ToolKit (GATK) для вызова вариантов и генерации необработанных данных VCF.
Нецелевые кандидаты. Специально разработанный код SAS 9.4 использовали для поиска различий в редактировании между образцами. Сначала протестировали конкретное редактирование в гене-мишени CSF2. Затем сравнивали варианты, обнаруженные в условиях GM-CSFk/o, но не в их контролях (нетрансдуцированные Т-клетки и CART19), за исключением вариантов, которые были присущи геному индивидуума (присутствовали в нетрансдуцированных Т-клетках). Затем для этих списков были сгенерированы перекрестные ссылки, и кандидаты-результаты редактирования CRISPR/Cas9 классифицировали на: только Т-клетки, только CART19 или как Т-клетки, так и CART19. Частоты альтернативных аллелей <10%, SNP с глубиной считывания <10 и образцы, не прошедшие фильтр качества (анализ VQSQRT), были исключены. Выполнено с помощью пакета VennDiagram в R.
Прогнозы нецелевых кандидатов. Для прогнозирования редактирования нецелевых кандидатов использовали три разных инструмента: Cas-OFFinder, CRISTA и CCTop. 15632 прогноза, сгенерированных с помощью Cas-OFFinder (параметры запроса последовательности: ≤6 несовпадений, размер ДНК/РНК выпетливаний <2), включали все прогнозы, полученные с помощью CRISTA или CCTop. Таким образом, для анализа использовали только прогнозы Cas-OFFinder. Кандидаты-результаты редактирования CRISPR/Cas9 сравнивали с прогнозами нецелевых кандидатов CAS-OFFinder путем сопоставления положения, содержащего изменение, и хромосомы.
Геномная представленность. Отредактированный список кандидатов CRISPR/Cas9 сопоставляли с ранее созданными данными РНК-секвенирования в тех же биологических репликах. Список кандидатов также был отфильтрован по геномной представленности, согласно 1000 Genomes Project (частота аллелей <1% считалась редкой).
Проверка гипотезы. Количество однонуклеотидных вариантов (замен) или инделей (вставок или делеций) в нетрансдуцированных Т-клетках сравнивали с нокаутными Т-клетками, количество в клетках CART19 сравнивали с количеством в нокаутных CART19 клетках, а количество во всех контролях сравнивали с количеством во всех нокаутных клетках. Различия в однонуклеотидных вариантах и инделях изображали на скрипичной диаграмме (violin plot) с помощью GraphPad Prism версии 8.1.1 для Windows. Поскольку выборки являются зависимыми, был использован знаковый ранговый критерий Вилкоксона.
Полученные результаты
WES использовали для определения точных мест CRISPR-Cas9 редактирования гена CSF2. Предполагалось, что CSF2 CRISPR гРНК 1 (SEQ ID NO: 7) будет иметь разрезанный участок на 3 п.н. выше участка PAM (фиг. 20A, верхняя панель). Было определено, что фактический участок разрезания находится на 6 п.н. выше участка PAM и может приводить к вставкам и делециям в основании 132074828 схемы 5 хромосомы (фиг. 20A, нижняя панель). Разница в участке разрезания Cas9 может быть связана с соседним участком PAM на обратной цепи. Частота вставок и делеций в каждой биологической копии CART19 показана на фиг. 20A, нижняя панель.
Было идентифицировано количество единичных нуклеотидный вариантов (SNV) и количество вставок/делеций (indel) в условиях нокаута с помощью CRISPR по сравнению с их контролями (Т-клетки и клетки CART19) (фиг. 20B). Между группами не было обнаружено значительных различий (знаковый ранговый критерий Вилкоксона, p-значение=0,16).
Также было идентифицировано представление общих вариантов, обнаруженных в клетках, отредактированных CRISPR, по сравнению с их соответствующим контролем (CART19 или Т-клетки). SNP были предварительно отфильтрованы по представленности в геноме популяции (менее 1% в 1000 Genomes Project) и на наличие во всех трех биологических репликах. 0,004% (4) SNP были обнаружены только в клетках CART19, 0,006% (5) SNP были обнаружены только в T-клетках, 0,0001% (1) SNP были обнаружены как в клетках CART19, так и в T-клетках, и 99% (12 439) SNP были отфильтрованы (фиг. 20C). SNP, присутствующая как в T-клетках, так и в клетках CART19 (пересечение на фиг. 20C), идентифицирована как делеция в гене CSF2, показанном на нижней панели фиг. 20A.
Эти результаты демонстрируют, что в результате редактирования CSF2 был получен только один результат редактирования, который соответствовал прогнозам нецелевых кандидатов CasOFFinder, и что повреждение GM-CSF в клетках CART19 с помощью системы CRISPR/Cas9 является безопасным методом нокаута GM-CSF.
Пример 6: дифференцировка моноцитов GM-CSF и CART19
Материалы и методы
Выделяли PBMC, и моноциты отделяли с помощью набора для выделения моноцитов Classical Monocyte Isolation (Miltenyi Biotec). Затем моноциты дифференцировали в макрофаги M1 или макрофаги M2 с помощью набора CellXVivo Human M1 or M2 Macrophage Differentiation Kit (R&D Systems).
Клетки CART19, Nalm6 и макрофаги M1 или макрофаги M2 совместно культивировали в соотношении 1:1:1. Клетки собирали на 3 день и окрашивали на CD3 и Live Dead aqua (Invitrogen). Гранулы Countbright (Invitrogen) добавляли перед анализом методом проточной цитометрии для определения абсолютного количества.
Полученные результаты
Нейтрализация GM-CSF в присутствии макрофагов M1 не оказывала статистически значимого изменения на размножение CART19 при стимуляции CD19; однако наблюдалась тенденция к усилению пролиферации CAR-T клеток с нейтрализацией GM-CSF. Блокада GM-CSF статистически значимо увеличивала пролиферацию CART19 при стимуляции CD19 в присутствии макрофагов M2 (фиг. 21).
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Следует понимать, что хотя изобретение было подробно описано, вышеприведенное описание предназначено для иллюстрации, а не для ограничения объема изобретения, который определяется объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации входят в объем приведенной ниже формулы изобретения.
--->
СПИСКИ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Mayo Foundation for Medical Education and Research
<120> МАТЕРИАЛЫ И СПОСОБЫ ЛЕЧЕНИЯ РАКА
<130> 07039-1804WO1
<150> US 62/753,485
<151> 2018-10-31
<150> US 62/679,348
<151> 2018-06-01
<160> 13
<170> PatentIn version 3.5
<210> 1
<211> 20
<212> ДНК
<213> искусственная
<220>
<223> гидовая РНК, нацеленная на нуклеиновую кислоту GM-CSF
<400> 1
gacctgccta cagacccgcc 20
<210> 2
<211> 1458
<212> ДНК
<213> искусственная
<220>
<223> нуклеиновая кислота, кодирующая химерный антигенный рецептор,
нацеленный на CD19
(CAR19)
<400> 2
atggccttac cagtgaccgc cttgctcctg ccgctggcct tgctgctcca cgccgccagg 60
ccggacatcc agatgacaca gactacatcc tccctgtctg cctctctggg agacagagtc 120
accatcagtt gcagggcaag tcaggacatt agtaaatatt taaattggta tcagcagaaa 180
ccagatggaa ctgttaaact cctgatctac catacatcaa gattacactc aggagtccca 240
tcaaggttca gtggcagtgg gtctggaaca gattattctc tcaccattag caacctggag 300
caagaagata ttgccactta cttttgccaa cagggtaata cgcttccgta cacgttcgga 360
ggggggacca agctggagat cacaggtggc ggtggctcgg gcggtggtgg gtcgggtggc 420
ggcggatctg aggtgaaact gcaggagtca ggacctggcc tggtggcgcc ctcacagagc 480
ctgtccgtca catgcactgt ctcaggggtc tcattacccg actatggtgt aagctggatt 540
cgccagcctc cacgaaaggg tctggagtgg ctgggagtaa tatggggtag tgaaaccaca 600
tactataatt cagctctcaa atccagactg accatcatca aggacaactc caagagccaa 660
gttttcttaa aaatgaacag tctgcaaact gatgacacag ccatttacta ctgtgccaaa 720
cattattact acggtggtag ctatgctatg gactactggg gccaaggaac ctcagtcacc 780
gtctcctcaa ccacgacgcc agcgccgcga ccaccaacac cggcgcccac catcgcgtcg 840
cagcccctgt ccctgcgccc agaggcgtgc cggccagcgg cggggggcgc agtgcacacg 900
agggggctgg acttcgcctg tgatatctac atctgggcgc ccttggccgg gacttgtggg 960
gtccttctcc tgtcactggt tatcaccctt tactgcaaac ggggcagaaa gaaactcctg 1020
tatatattca aacaaccatt tatgagacca gtacaaacta ctcaagagga agatggctgt 1080
agctgccgat ttccagaaga agaagaagga ggatgtgaac tgagagtgaa gttcagcagg 1140
agcgcagacg cccccgcgta caagcagggc cagaaccagc tctataacga gctcaatcta 1200
ggacgaagag aggagtacga tgttttggac aagagacgtg gccgggaccc tgagatgggg 1260
ggaaagccga gaaggaagaa ccctcaggaa ggcctgtaca atgaactgca gaaagataag 1320
atggcggagg cctacagtga gattgggatg aaaggcgagc gccggagggg caaggggcac 1380
gatggccttt accagggtct cagtacagcc accaaggaca cctacgacgc ccttcacatg 1440
caggccctgc cccctcgc 1458
<210> 3
<211> 20
<212> ДНК
<213> искусственная
<220>
<223> гидовая РНК, нацеленная на нуклеиновую кислоту GM-CSF
<400> 3
tcaggagacg ccgggcctcc 20
<210> 4
<211> 20
<212> ДНК
<213> искусственная
<220>
<223> гидовая РНК, нацеленная на нуклеиновую кислоту GM-CSF
<400> 4
cagcagcagt gtctctactc 20
<210> 5
<211> 20
<212> ДНК
<213> искусственная
<220>
<223> гидовая РНК, нацеленная на нуклеиновую кислоту GM-CSF
<400> 5
ctcagaaatg tttgacctcc 20
<210> 6
<211> 20
<212> ДНК
<213> искусственная
<220>
<223> гидовая РНК, нацеленная на нуклеиновую кислоту GM-CSF
<400> 6
ggccggtctc actcctggac 20
<210> 7
<211> 23
<212> ДНК
<213> искусственная
<220>
<223> гидовая РНК, нацеленная на нуклеиновую кислоту гена CSF2
<400> 7
gacctgccta cagacccgcc tgg 23
<210> 8
<211> 19
<212> ДНК
<213> искусственная
<220>
<223> нуклеиновая кислота CSF2, имеющая делецию, вызванную системой
CRISPR/Cas
<400> 8
gacctgccta cagaccgcc 19
<210> 9
<211> 21
<212> ДНК
<213> искусственная
<220>
<223> нуклеиновая кислота CSF2, имеющая вставку, вызванную системой
CRISPR/Cas
<400> 9
gacctgccta cagaccccgc c 21
<210> 10
<211> 20
<212> ДНК
<213> искусственная
<220>
<223> гидовая РНК, нацеленная на нуклеиновую кислоту GM-CSF
<400> 10
gcagtgctgc ttgtagtggc 20
<210> 11
<211> 26
<212> ДНК
<213> искусственная
<220>
<223> гидовая РНК, нацеленная на нуклеиновую кислоту гена CSF2
<400> 11
ccgacctgcc tacagacccg cctgga 26
<210> 12
<211> 20
<212> ДНК
<213> искусственная
<220>
<223> синтетический праймер
<400> 12
tgactacaga gaggcacaga 20
<210> 13
<211> 21
<212> ДНК
<213> искусственная
<220>
<223> синтетический праймер
<400> 13
tcacctctga cctcattaac c 21
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО РЕЦЕПТОРА АНТИГЕНА ПРОТИВ CD19 | 2015 |
|
RU2718542C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ЭКСПРЕССИРУЮЩИХ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР КЛЕТОК | 2015 |
|
RU2751362C2 |
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО РЕЦЕПТОРА АНТИГЕНА ПРОТИВ CD19 | 2015 |
|
RU2815417C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ ГУМАНИЗИРОВАННОГО АНТИ-CD19 ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА | 2014 |
|
RU2711975C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ИММУНОТЕРАПИИ | 2014 |
|
RU2680010C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ИММУНОТЕРАПИИ | 2014 |
|
RU2798348C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА К CD33 | 2015 |
|
RU2747384C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ИНГИБИРОВАНИЯ ИСТОЩЕНИЯ Т-КЛЕТОК | 2018 |
|
RU2804282C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ РЕКОМБИНАНТНЫЙ РЕЦЕПТОР, И РОДСТВЕННЫЕ КОМПОЗИЦИИ | 2019 |
|
RU2835579C2 |
| СПОСОБЫ ТЕРАПИИ НА ОСНОВЕ CAR Т-КЛЕТОК С ПОВЫШЕННОЙ ЭФФЕКТИВНОСТЬЮ | 2016 |
|
RU2788131C2 |



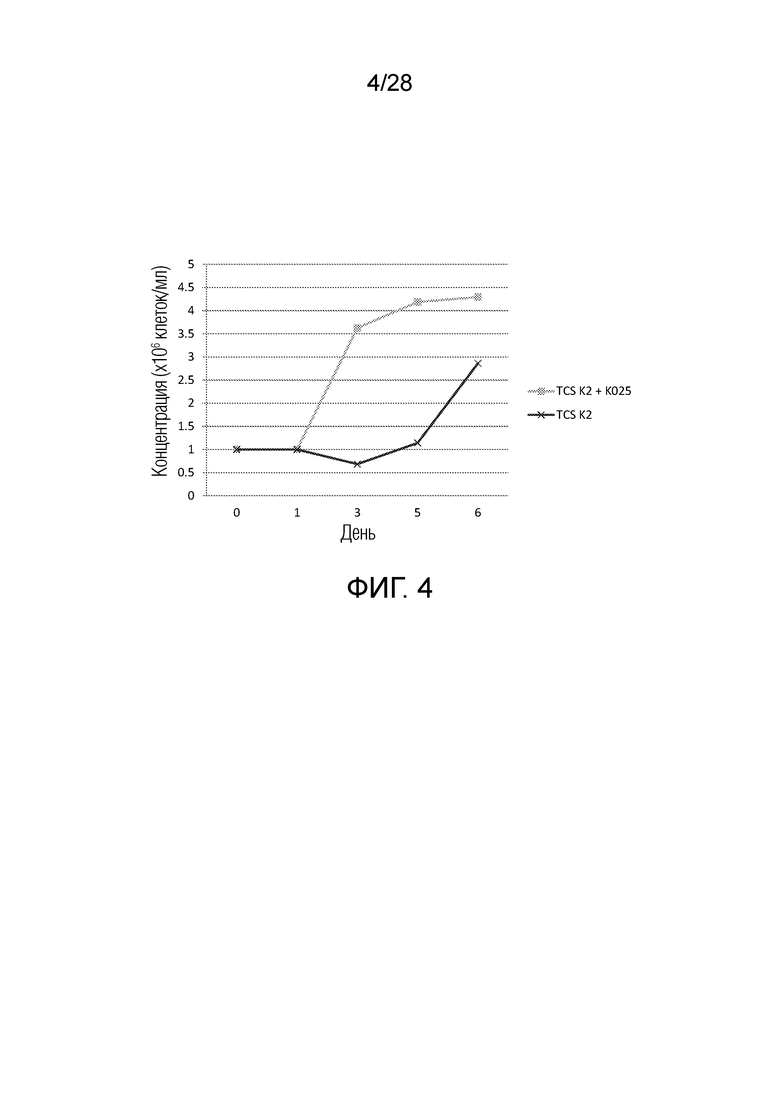









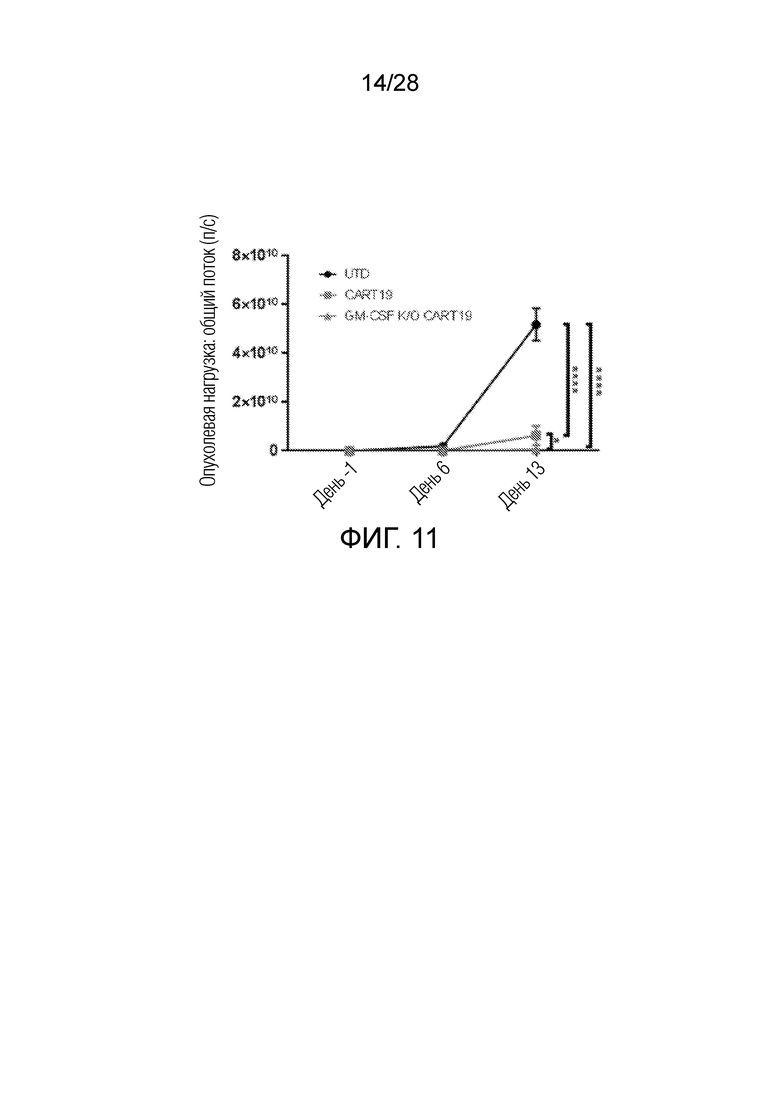



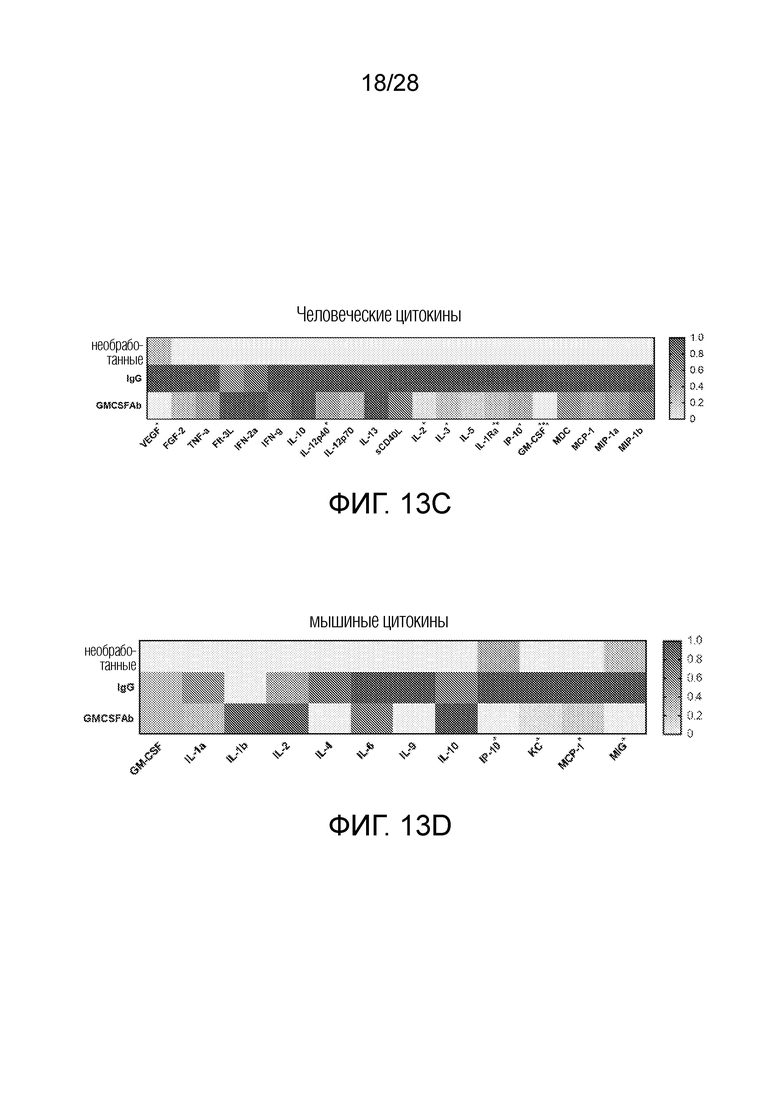


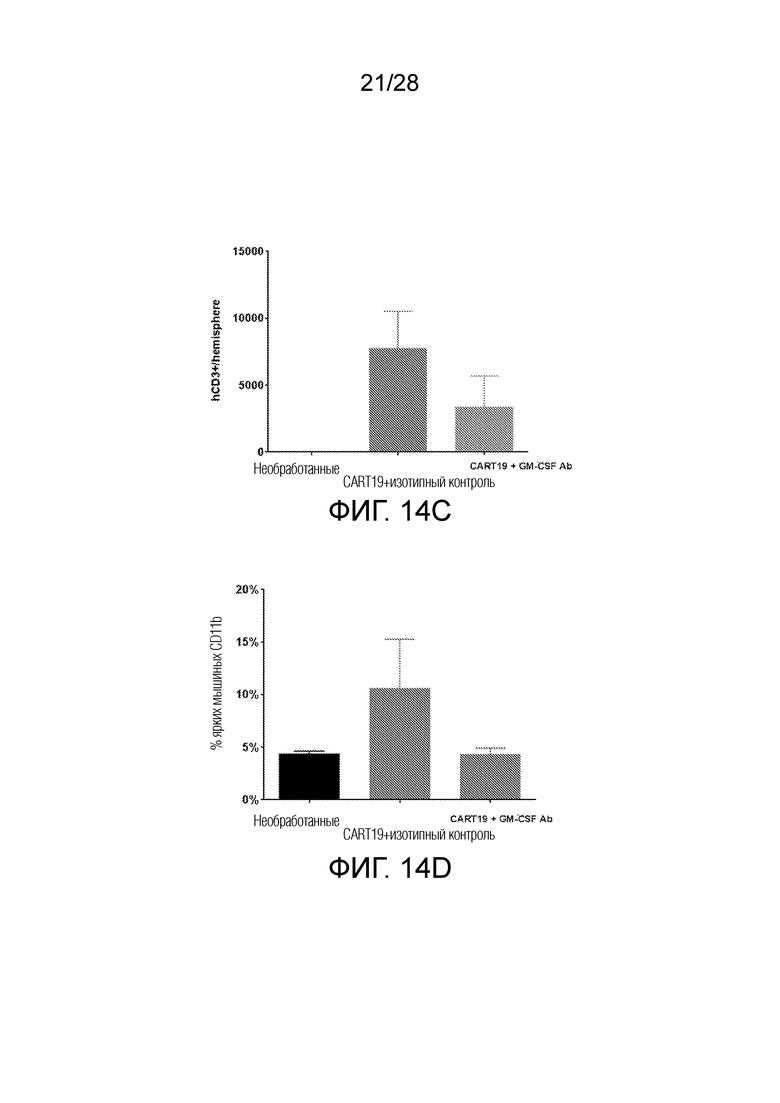
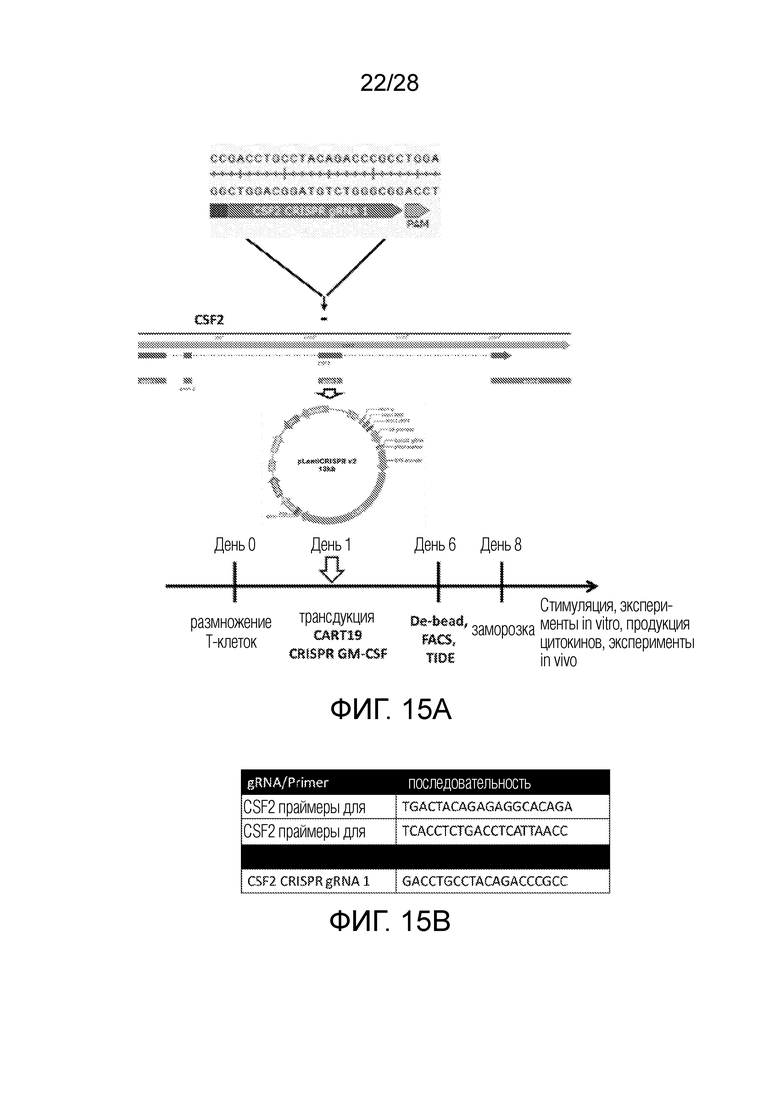
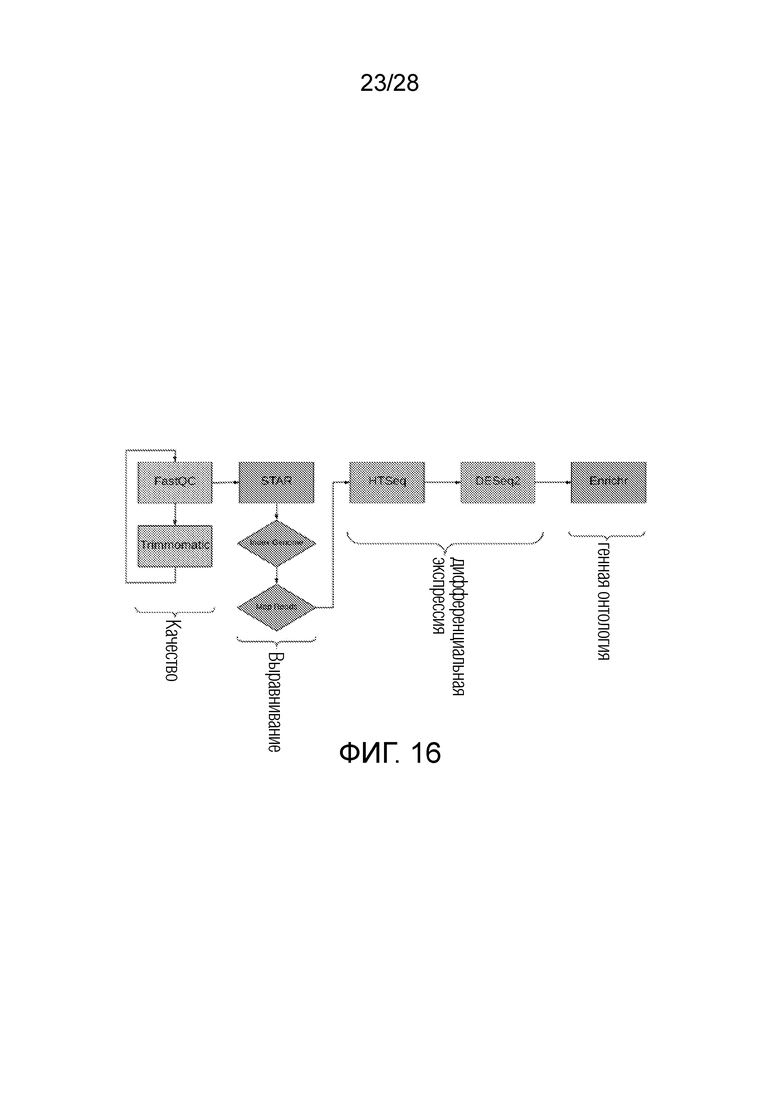
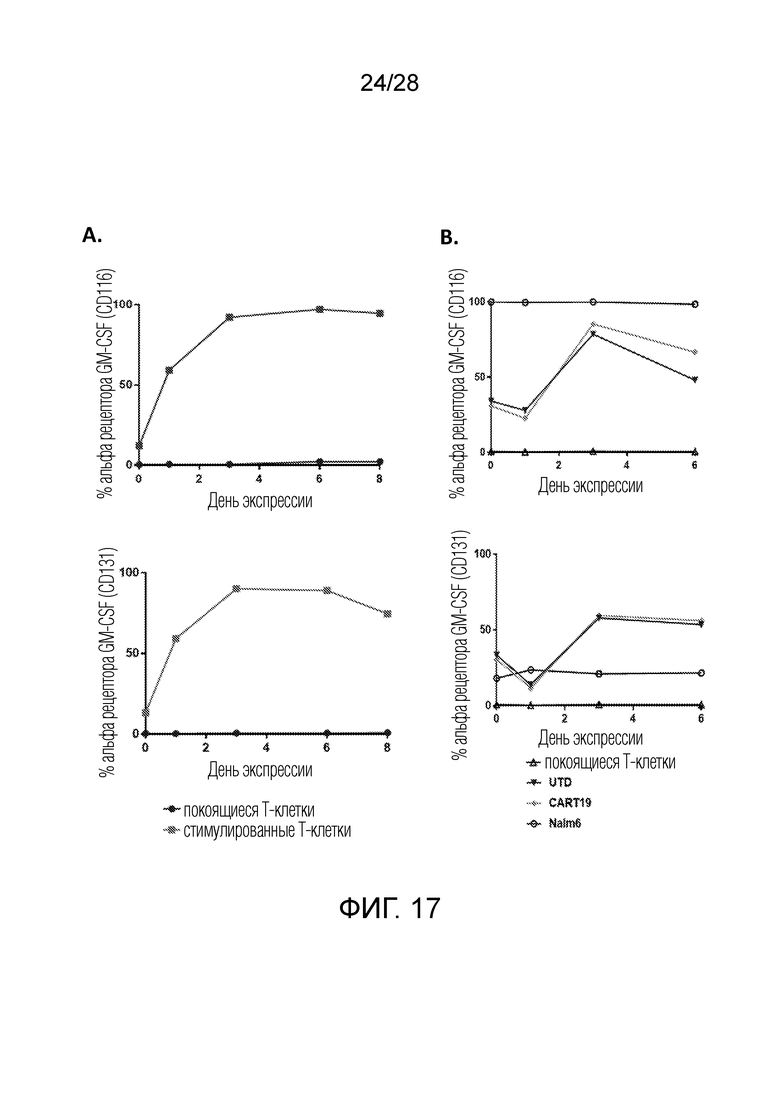




Изобретение относится к области биотехнологии, в частности к способу получения Т-клетки с химерным антигенным рецептором, имеющей пониженный уровень полипептидов гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF). Также раскрыт способ улучшения Т-клеточных эффекторных функций Т-клетки с химерным антигенным рецептором. Изобретение эффективно для лечения страдающего раком млекопитающего. 5 н. и 12 з.п. ф-лы, 21 ил., 1 табл., 6 пр.
1. Способ получения Т-клетки с химерным антигенным рецептором, имеющей пониженный уровень полипептидов гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), включающий:
введение конструкции нуклеиновой кислоты в Т-клетку ex vivo, причем указанная конструкция нуклеиновой кислоты включает: а) нуклеиновую кислоту, кодирующую гидовую РНК, причем указанная гидовая РНК комплементарна матричной РНК GM-CSF и причем указанная гидовая РНК содержит последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 1; b) нуклеиновую кислоту, кодирующую нуклеазу Cas, и с) нуклеиновую кислоту, кодирующую указанный химерный антигенный рецептор,
причем указанная нуклеиновая кислота, кодирующая указанный химерный антигенный рецептор, включает последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 2, и причем химерный антигенный рецептор нацелен на ассоциированный с опухолью антиген CD19.
2. Способ по п. 1, в котором указанная нуклеаза Cas представляет собой нуклеазу Cas9.
3. Способ по п. 1 или 2, в котором указанная конструкция нуклеиновой кислоты представляет собой вирусный вектор.
4. Способ по п. 3, в котором указанный вирусный вектор представляет собой лентивирусный вектор.
5. Способ по любому из пп. 1-4, в котором указанная стадия введения включает трансдукцию.
6. Способ получения Т-клетки с химерным антигенным рецептором, имеющей пониженный уровень полипептидов гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), включающий:
введение комплекса в Т-клетку ex vivo, где указанный комплекс включает: а) гидовую РНК, причем указанная гидовая РНК комплементарна матричной РНК GM-CSF и причем указанная гидовая РНК содержит последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 1; и b) нуклеазу Cas; и
введение в указанную Т-клетку ex vivo нуклеиновой кислоты, кодирующей указанный химерный антигенный рецептор,
причем указанная нуклеиновая кислота, кодирующая указанный химерный антигенный рецептор, включает последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 2, и причем химерный антигенный рецептор нацелен на ассоциированный с опухолью антиген CD19.
7. Способ по п. 6, в котором указанная нуклеаза Cas представляет собой нуклеазу Cas9.
8. Способ по п. 6 или 7, в котором указанный комплекс представляет собой рибонуклеопротеин.
9. Способ по любому из пп. 6-8, в котором указанные стадии введения включают электропорацию.
10. Способ лечения страдающего раком млекопитающего, включающий введение указанному млекопитающему Т-клеток с химерным антигенным рецептором, имеющих пониженный уровень полипептидов гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), где Т-клетки с химерным антигенным рецептором получены введением конструкции нуклеиновой кислоты в Т-клетку ex vivo, причем указанная конструкция нуклеиновой кислоты включает: а) нуклеиновую кислоту, кодирующую гидовую РНК, причем указанная гидовая РНК комплементарна матричной РНК GM-CSF и причем указанная гидовая РНК содержит последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 1; b) нуклеиновую кислоту, кодирующую нуклеазу Cas, и с) нуклеиновую кислоту, кодирующую указанный химерный антигенный рецептор,
причем указанная нуклеиновая кислота, кодирующая указанный химерный антигенный рецептор, включает последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 2, и причем химерный антигенный рецептор нацелен на ассоциированный с опухолью антиген CD19.
11. Способ по п. 10, в котором указанное млекопитающее является человеком.
12. Способ по п. 10 или 11, в котором указанный рак представляет собой лимфому.
13. Способ по п. 12, в котором указанная лимфома представляет собой диффузную крупноклеточную В-клеточную лимфому.
14. Способ по п. 10 или 11, в котором указанный рак представляет собой лейкоз.
15. Способ по п. 14, в котором указанный лейкоз представляет собой острый лимфобластный лейкоз.
16. Способ улучшения Т-клеточных эффекторных функций Т-клетки с химерным антигенным рецептором, включающий:
введение конструкции нуклеиновой кислоты в Т-клетку ex vivo, причем указанная конструкция нуклеиновой кислоты включает: а) нуклеиновую кислоту, кодирующую гидовую РНК, причем указанная гидовая РНК комплементарна матричной РНК GM-CSF и причем указанная гидовая РНК содержит последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 1; b) нуклеиновую кислоту, кодирующую нуклеазу Cas, и с) нуклеиновую кислоту, кодирующую указанный химерный антигенный рецептор,
причем указанная нуклеиновая кислота, кодирующая указанный химерный антигенный рецептор, включает последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 2, и причем химерный антигенный рецептор нацелен на ассоциированный с опухолью антиген CD19.
17. Способ улучшения Т-клеточных эффекторных функций Т-клетки с химерным антигенным рецептором, включающий:
введение комплекса в Т-клетку ex vivo, причем указанный комплекс включает: а) гидовую РНК, причем указанная гидовая РНК комплементарна матричной РНК GM-CSF и причем указанная гидовая РНК содержит последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 1; и b) нуклеазу Cas; и
введение в указанную Т-клетку ex vivo нуклеиновой кислоты, кодирующей указанный химерный антигенный рецептор,
причем указанная нуклеиновая кислота, кодирующая указанный химерный антигенный рецептор, включает последовательность нуклеиновой кислоты, приведенную в SEQ ID NO: 2, и причем химерный антигенный рецептор нацелен на ассоциированный с опухолью антиген CD19.
| WO2015066262 A1, 07.05.2015 | |||
| WO2014011984 A1, 12.07.2013 | |||
| STEPHAN A | |||
| GRUPP et al., Chimeric Antigen Receptor-Modified T Cells for Acute Lymphoid Leukemia, N Engl J Med, 2013, 368(16), pp | |||
| Сигнальное устройство к трамвайному вагону | 1924 |
|
SU1509A1 |
| RU2016143381 A, 11.05.2018. | |||
Авторы
Даты
2023-01-12—Публикация
2019-05-31—Подача