Изобретение относится к микробиологии и биотехнологии и может быть использовано в химической, пищевой, ферментационной, фармацевтической промышленности; в отраслях, связанных с переработкой крахмала.
Ферменты применяются в различных областях, таких как производство продуктов питания, корма для животных, моющие средства, косметика, пивоварение и текстильная промышленность, бумажная промышленность, фармацевтика, а также в качестве инструментов для научных исследований и разработок.
Амилазы относятся к одному из классов широко применяемых в настоящее время гидролитических ферментов. Амилаза катализирует расщепление крахмала до глюкозы и ее олигомеров. Гидролитические амилазы можно разделить на две широкие категории: эндоамилазы, которые гидролизуют внутреннюю часть молекулы крахмала, и экзоамилазы, которые последовательно расщепляют крахмал с нередуцирующих концов [1].
Альфа-амилаза обнаружена в растениях и животных, а также у микроорганизмов, принадлежащих к археям и бактериям. Однако в промышленности находят применение ферменты только грибного и бактериального происхождения. Бактерии видов Bacillus subtilis, В. licheniformis, В. amyloliquefaciens, В. cereus и В. megaterium и грибы, таких родов как: Aspergillus, Penicillium, Rhizopus, Saccharomycopsis, Candida, Cephalosporium и Neurospora являются основными микроорганизмами, продуцирующими амилазу [2].
Амилазы имеют потенциальное применение в большом количестве промышленных процессов, таких как детергентная, пищевая, ферментационная и фармацевтическая промышленность. Термостабильные щелочные ферменты представляют особый интерес для применения в промышленности. Преимущества использования в промышленных процессах амилаз, устойчивых широком диапазоне показателя кислотно-основных свойств раствора (рН) и температуры, заключаются в снижении риска загрязнения, исходящего от мезофильных микроорганизмов, увеличении скорости диффузии и растворимости субстрата, активности в присутствии денатурирующего агента, а также в работоспособности в широком диапазоне температур и рН. Многие термофильные микроорганизмы обладают генами, кодирующими ферменты гидролиза крахмала, в своих геномах, даже несмотря на то, что они живут в средах, где крахмал встречается редко. Термофильные бактерии являются надежными источниками термостабильных амилаз [3].
Требования к оптимальному функционированию амилаз в основном касаются рН среды, устойчивости к окислению, устойчивости к хелатирующим агентам и температуре. Бактериальные альфа-амилазы имеют более высокие оптимальные температуры, по сравнению с альфа-амилазами, выделенными из грибов.
Бактерии Bacillus sp. широко используются для производства термостабильной альфа-амилазы для различных промышленных применений. Бактерии В. subtilis, В. stearothermophilus, В. licheniformis и В. amyloliquefaciens известны как хорошие продуценты термостабильной альфа-амилазы и они широко используются для коммерческого производства данного фермента для различных приложений.
Актуальной задачей на сегодняшний день является поиск новых штаммов бактерий, обладающих способностью продуцировать альфа-амилазу, обладающую стабильностью при высоких температурах и в широком диапазоне показателя кислотно-основных свойств раствора (рН).
Известен штамм бактерий Bacillus sp. Ferdowsicous, продуцирующий ацидофильную альфа-амилазу с мол. массой 53 кДа, стабильной в диапазоне рН от 3,5 до 7,0 с оптимальной температурой для активности около 70°С. Активность фермента снижалась за счет ионов Zn2+ и EDTA, ингибировалась Hg2+, в то время как Ва2+, Fe2+, Na+, Mg2+, K+, Са2+, PMSF, Triton Х-100 и бета-меркаптоэтанол повышали ее активность примерно на 15% [4].
Известен штамм бактерий Bacillus subtilis KIBGE-HAS, продуцирующий внеклеточную альфа-амилазу, обладающую относительно высокой термостабильностью (сохранял 62% своей активности при 70°С в течение 15 минут). Ионы металлов, таких как Mn2+, Са2+, Со2+, K+, Mg2+ и Fe3+, активировали фермент, в то время как Hg2+, Ва2+, Cu2+, Na+и Al3+ сильно ингибировали активность. В присутствии анионного детергента SDS и неионогенного детергента Triton Х-100, активность фермента была в 2,9 и 1,8 раза выше, чем в контроле, соответственно, а неионогенные детергенты Tween 20 и Tween 80 проявляли незначительное ингибирующее действие на активность фермента [5].
Известен штамм бактерий Bacillus tequilensisaa RG-01, который показал максимальную продукцию альфа-амилазы (8100 Ед/мл) в присутствии ионов крахмала, пептона и Са2+ при 55°С, рН 7,0 в течение 24 часов инкубации. Фермент был стабилен в присутствии н-додекана, изооктана, н-декана, ксилола, толуола, н-гексана, н-бутанола и циклогексана, соответственно. Присутствие бензола, метанола и этанола незначительно снижало стабильность амилазы соответственно. Фермент продемонстрировал 100% активность при 55°С и рН 7,0 с устойчивостью 119% и 127% при 55°С и рН 7,0, соответственно. Фермент также был стабильным в присутствии детергентов SDS, Tween 40, Tween 60 и Tween 80 (1%). Только ТритонХ-100 показал умеренное ингибирующее действие (5%) на активность амилазы [6].
Известен штамм бактерий Bacillus mojavensis SA, продуцирующий термостабильную альфа-амилазу, которая продемонстрировала оптимум значений рН и температуры (9,0 и 55°С). Фермент показал высокую стабильность в широком диапазоне рН и температуры. Кроме того, неочищенный фермент был относительно стабилен по отношению к неионогенным (Tween 20, Tween 80 и Тритон Х-100) и анионным (SDS) поверхностно-активным веществам, а также к окислителям. Также, неочищенный фермент показал отличную стабильность по отношению к различным твердым и жидким моющим средствам [7].
Известен штамм алкалифильных бактерий Bacillus cereus SP-CH11, выделенный из отложений озера Chilika Lake, Odisha, который продемонстрировал интенсивный рост и продукцию альфа-амилазы при рН 10. Очищенный фермент альфа-амилаза АА11 был высокостабильным при рН 9.0, сохраняя при этом 88-100% функциональной жизнеспособности в диапазоне температур от 35-65°С. Фермент был стабильным с порошкообразными и жидкими детергентами [8].
Известен штамм бактерий Bacillus cohnii US 147, продуцирующий альфа-амилазу, проявляющую активность при кислом и щелочном рН и проявляющую максимальную активность в отношении крахмала при рН 9 и 70°С. Фермент был стабилен при рН 9 в течение 72 часов и сохранял половину своей активности после инкубации при 70°С в течение 150 минут. Частичное ингибирование фермента (15%, 25%, 23%, 20% и 22%) было получено с помощью 1 мМ SDS, 1 мМ NaBO3, 1 мМ Н2О2, 1 мМ Zn2+ и 5 мМ этилендиаминтетрауксусной кислоты (ЭДТА), соответственно. Амилаза восстанавливала свою первоначальную активность при добавлении 10 мМ Са2+ к 5 мМ EDTA [9].
Известен штамм Bacillus licheniformis АТСС9945а, продуцирующий высокоэффективную альфа-амилазу, расщепляющую сырой крахмал. Очищенный фермент имел оптимальный рН 6,5 и оптимальную температуру 90°С. Очищенная альфа-амилаза в присутствии CaCl2 сохраняла 55% своей активности через 6 ч инкубации при 70°С, ионы Ni2+ и Са2+ слегка стимулировали, a Hg2+ полностью ингибировала активность альфа-амилазы. В отличие от термостабильной альфа-амилазы, термолабильная альфа-амилаза Bacillus licheniformis АТСС9945а активна и стабильна при температурах выше 90°С. Кроме того, реакционная способность термолабильной альфа-амилазы намного меньше зависит от присутствия ионов Са2+ и от применяемого рН, чем ее термостабильный аналог [10].
Наиболее близким к заявляемому штамму - прототипом, является штамм Bacillus sp. A3-15, выделенный из образцов компоста, который продуцирует термостабильную альфа-амилазу. Фермент частичной очистки показал оптимальную активность при рН 11,0 и температуре 70°С. Фермент был высокоактивен (95%) в щелочном диапазоне рН (10,0-11,5), и был почти полностью активен при температурах до 100°С. Активность фермента усиливалась в присутствии 5 мМ CaCl2 (130%) и ингибировалась 5 мМ ZnCl2, NaCl, Na-сульфидом, EDTA, PMSF (3 мМ), мочевиной (8М) и SDS (1%). Фермент был стабильным приблизительно на 70% при рН 10,0-11,0 и 60°С в течение 24 часов [11].
Недостатком этого штамма является то, что продуцируемый им фермент ингибируется ионами щелочноземельных металлов, так, например, при 5 мМ концентрации хлорида натрия данный фермент уже частично ингибируется.
Задачей изобретения является получение бактериального штамма -продуцента металл независимой высокоактивной альфа-амилазы, стабильной в широком диапазоне температуры (30-90°С) и широком диапазоне значений рН (6,5-11), устойчивой к присутствию в среде высоких концентраций ионов металлов, за исключением Fe, Mn и Mg.
Технический результат: расширение ассортимента штаммов - продуцентов альфа-амилазы, устойчивой к присутствию в среде высоких концентраций ионов металлов, стабильной в широком диапазоне температуры и значений рН среды, а также упрощение условий культивирования штамма.
Поставленная задача достигается получением умеренно термофильного штамма Bacillus licheniformis 47018, обладающего способностью продуцировать металл независимую высокоактивную альфа-амилазу, устойчивую к присутствию в среде высоких концентраций ионов металлов, стабильную в широком диапазоне температуры и значений рН среды.
Штамм бактерий Bacillus licheniformis 47018 выделен из природного материала - образца воды и грунта источника Термофильный на Восточном термальном поле кальдеры вулкана Узон, Камчатка, в результате целенаправленного поиска.
Полученный штамм бактерий Bacillus licheniformis 47018 депонирован во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) под регистрационным номером В-14248.
Штамм Bacillus licheniformis 47018 характеризуется следующими признаками.
Культурально-морфологические признаки: грамположительные палочки 1×3-4 мкм, растут на средах LB-бульон, LB-агар, среде Пфеннига и других минеральных средах с крахмалом. При росте на агаризованной среде LB образует круглые колонии кремового цвета. Профиль колоний выпуклый, размеры варьируют от 4 до 5 мм.
Физиолого-биохимические признаки: аэроб или факультативный анаэроб, термотолерантен. Оптимальная температура роста 55°С. Растет в пределах рН среды от 6.0 до 10.0 с оптимумом 7.0. Штамм характеризуется способностью использовать крахмал, пептон и др.
Штамм не обладает инфекционным и общетоксическим действием.
Штамм является непатогенным и не включен в списки, приведенные в санитарных правилах СП 1.3.2322-08; штамм не несет опасных генетических конструкций.
Штамм идентифицирован на основании анализа последовательности полного генома.
Хранение штамма осуществляют на среде LB или Пфеннига с глицерином при температуре -70°С.
Для культивирования штамма применяют среды следующего состава: Среда LB (г/л): хлорид натрия - (5.0) 10.0; триптон - 10.0; дрожжевой экстракт - 5.0.
Среда Пфеннига (г/л): KH2PO4 - 0.5; NH4Cl - 0.5; MgSO4 х 7H2O - 0.5; KCl - 0.5; NaCl - 0.5; CaCl2 х 2H2O - 0.05; NaHCO3 - 1.5, крахмал - 1.5.
Активность фермента, устойчивость фермента к ионам металлов, термо- и рН-стабильность, температурный оптимум и оптимум рН доказаны экспериментальными методами.
Активность фермента определялась с использованием крахмала в качестве субстрата методом Фишера-Штейна [12].
Предлагаемый штамм бактерий Bacillus licheniformis 47018, обладающий амилолитическими свойствами, имеет ряд преимуществ перед известными штаммами, заключающихся в следующем.
1. Предлагаемый штамм продуцирует металл независимую высоко активную альфа-амилазу, пригодную к использованию в химической промышленности и отраслях, связанных с переработкой крахмала.
2. Штамм бактерий Bacillus licheniformis 47018 продуцирует альфа-амилазу, стабильную в широком диапазоне температуры (30-90°С) и рН среды (6,5-11), устойчивую к присутствию в среде высоких концентраций ионов металлов, за исключением (Fe, Mn и Mg), что позволяет применять данный штамм и фермент в различных областях, таких как производство продуктов питания, корма для животных, моющие средства, косметика, пивоварение и текстильная промышленность, бумажная промышленность, фармацевтика, а также в качестве инструментов для научных исследований и разработок.
3. Штамм Bacillus licheniformis 47018 является термотолерантным и алкалифильным. Культура демонстрирует интенсивный рост в диапазоне температур: от 32 до 60°С и рН 7-10, что позволяет использовать данный штамм в производстве.
4. Штамм бактерий Bacillus licheniformis 47018 не требует сложных условий культивирования, поскольку потребляет различные, в том числе крахмалсодержащие субстраты.
Поскольку предлагаемый штамм получен впервые, и фермент, выделенный из него, характеризуется уникальным комплексом свойств, можно сделать вывод о соответствии предлагаемого штамма критериям изобретения «новизна» и «изобретательский уровень».
Изобретение иллюстрируется примерами конкретного выполнения.
Пример 1.
Продуктивность штамма Bacillus licheniformis 47018 в зависимости от стадии роста культуры.
От 100 мл жидкой культуры Bacillus licheniformis 47018, выращенной на среде Пфеннига с добавлением 1% крахмала, отбирали 1,5 мл суспензии, осаждали клетки центрифугированием при 3000 g. Анализ содержания белка в культуральной жидкости определяли по Брэдфорду [13] с использованием набора «Quick Start Bradford 1xDye Reagent», согласно инструкции производителя.
Результаты измерения содержания белка в культуральной жидкости приведены в Таблице 1.
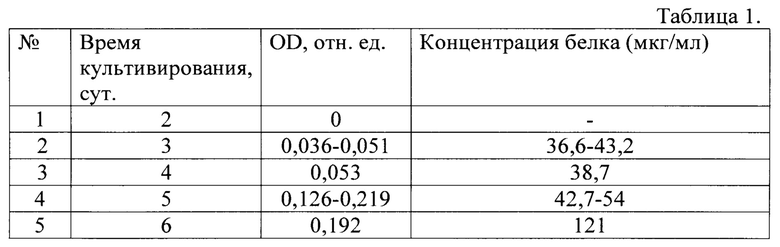
Из таблицы 1 видно, что на 2-е сутки культивирования содержание белка в культуральной жидкости резко возрастает и далее продолжает увеличиваться, достигая максимума на 5-е сутки.
Пример 2.
Оценка амилолитической активности штамма Bacillus licheniformis 47018.
Для выявления амилолитической активности использовали плотную питательную среду - картофельный агар. Исследуемые микроорганизмы высевали штрихом на чашки Петри с картофельным агаром и инкубировали в термостате при температуре (37±1)°С в течение суток. По окончании инкубирования выросшие культуры в чашках заливали 5 мл раствора Люголя и в течение 5 мин наблюдали за появлением прозрачных зон вокруг посевов. Среда, содержащая крахмал, окрашивалась в синий цвет.
В результате определения амилолитической активности Bacillus licheniformis 47018 установлена зона гидролиза крахмала - 8-12 мм. Штамм Bacillus licheniformis 47018 обладает ярко выраженными амилолитическими свойствами.
Пример 3.
Оценка активности альфа-амилазы штамма Bacillus licheniformis 47018.
Амилазную активность фермента определяли в культуральной жидкости (КЖ) Bacillus licheniformis 47018 по стандартным протоколам на спектрофотометре и выражали в МЕ/мг белка. Активность амилазы определяли путем измерения высвобождения редуцирующего сахара из растворимого крахмала. Ферментативную реакцию проводили по Фишеру-Штейну в течение 5 минут [12]. Оптическую плотность (OD) полученного окрашенного раствора измеряли при 546 нм по отношению к контролю. Анализ ферментов во всех случаях проводили в трех повторах и результаты являются средними по трем определениям. Калибровка проведена по мальтозе. Одна единица ферментативной активности определяется как количество фермента, необходимое для высвобождения одного мкмоль мальтозы в минуту в условиях анализа. Концентрацию белка в КЖ определяли по Брэдфорду с использованием набора «Quick Start Bradford 1xDye Reagent», согласно инструкции производителя [13].
Сущность метода заключается в восстановлении 3,5-динитросалициловой кислоты (ДНСК) до 3-амино-5-нитросалициловой кислоты, обладающей красно-оранжевой окраской, интенсивность которой определяют колориметрически при длине волны 546 нм. Для данной методики отбирался супернатант, полученный путем центрифугирования (центрифугирование проводили при 4000 g в течение 10 минут при 5°С) клеточной культуры бактерий. Полученный супернатант в дальнейшем смешивался с 1% раствором крахмала в соответствующем буфере и инкубировался в течении 5-20 минут, после чего к реакционной смеси добавлялось два объема 1% ДНСК. Полученная смесь в дальнейшем прогревалась при 95°С в течение 10 мин, после чего смесь охлаждалась до комнатной температуры.
При использовании спектрофотометра ПЭ-5400УФ оптическую плотность регистрировали в кюветах с толщиной поглощающего свет слоя 10 мм против контрольных проб на реактивы и субстрат.
Результаты определения ферментативной активности амилазы в культуральной жидкости (КЖ) штамма Bacillus licheniformis 47018 представлены в таблице 2.

Таким образом, активность амилазы Bacillus licheniformis 47018 составила 2472 МЕ/мг белка в КЖ, и 185000 МЕ/мг белка после хроматографической очистки на DEAE-целлюлозе.
Пример 4.
Влияние ионов металлов на ферментативную активность амилазы Bacillus licheniformis 47018
Для определения влияния ионов металлов на активность амилазы штамма Bacillus licheniformis 47018 был использован трис-глициновый буфер рН 9,4. Раствор субстрата - 1% крахмал в 50 мМ трис-глициновом буфере рН 9,4. Ферментативную реакцию по Фишеру-Штейну проводили при 60°С в течение 40 минут. Для оценки влияния ионов использовали 12,5 мМ (концентрация в реакционной среде) растворы соответствующих солей. Растворы солей изготавливались в 50 мМ трис-глициновом буфере рН 9,4.
Влияние ионов металлов в концентрации 12,5 мМ (концентрация в реакционной среде) на активность амилазы приведено в таблице 3.
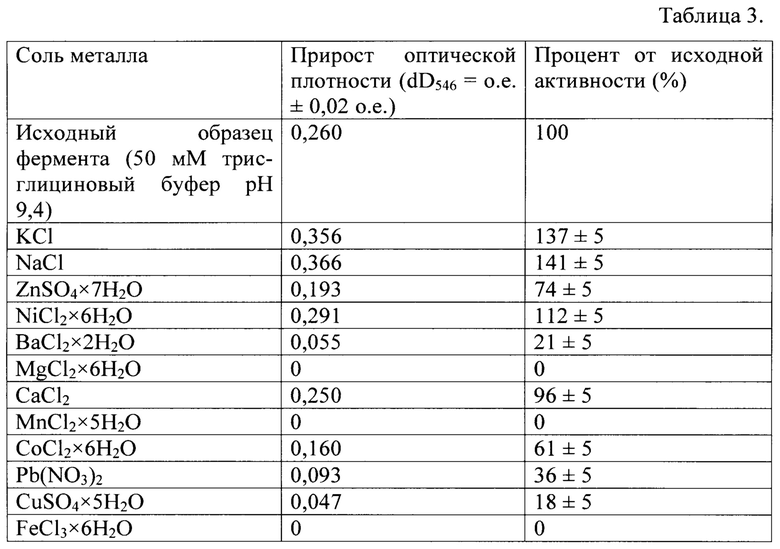
Активность фермента возрастает в присутствии K, Na и Ni. Полностью подавляют активность альфа-амилазы ионы Fe, Mn и Mg.
Пример 5.
Определение зависимости активности альфа-амилазы штамма Bacillus licheniformis 47018 от рН среды.
Рабочий диапазон рН альфа-амилазы Bacillus licheniformis 47018 определяли при температуре 30°С. Для определения активности фермента при различных значениях рН среды использовали соответствующие буферные растворы.
Для приготовления субстрата для определения рН оптимума фермента 2% водный раствор крахмала разбавлялся в 2 раза соответствующим буферным раствором с необходимым значением рН. При оценке рабочего диапазона рН использовались следующие буферные растворы: для рН 6,0-7,0 использовали 50 мМ калий-фосфатный буферный раствор, для рН 7,5-11,0 использовали 50 мМ трис-глициновый буферный раствор. Реакционную смесь выдерживали при 30°С в течение 1 часа. Все анализы были выполнены, по крайней мере, в трех повторах, и результаты были представлены в процентах относительной активности (фиг. 1). Процедура анализа проводилась следующим образом:
250 мкл субстрата в соответствующем буферном растворе прогревался в течение 5 минут при 50°С в водяном термостате с перемешиванием, далее к прогретому раствору субстрата добавлялся равный объем буферного раствора ферментного препарата (в минус контроль добавляли равный объем буферного раствора не содержащего фермента). Ферментативную реакцию проводили в течение 10 минут при 50°С, реакцию останавливали добавлением 750 мкл 1% раствора ДНСК.
Опытные и контрольные пробы выдерживали до проявления окраски в течение 10 минут на кипящей водяной бане. Оптическую плотность измеряли при λ=546 нм.
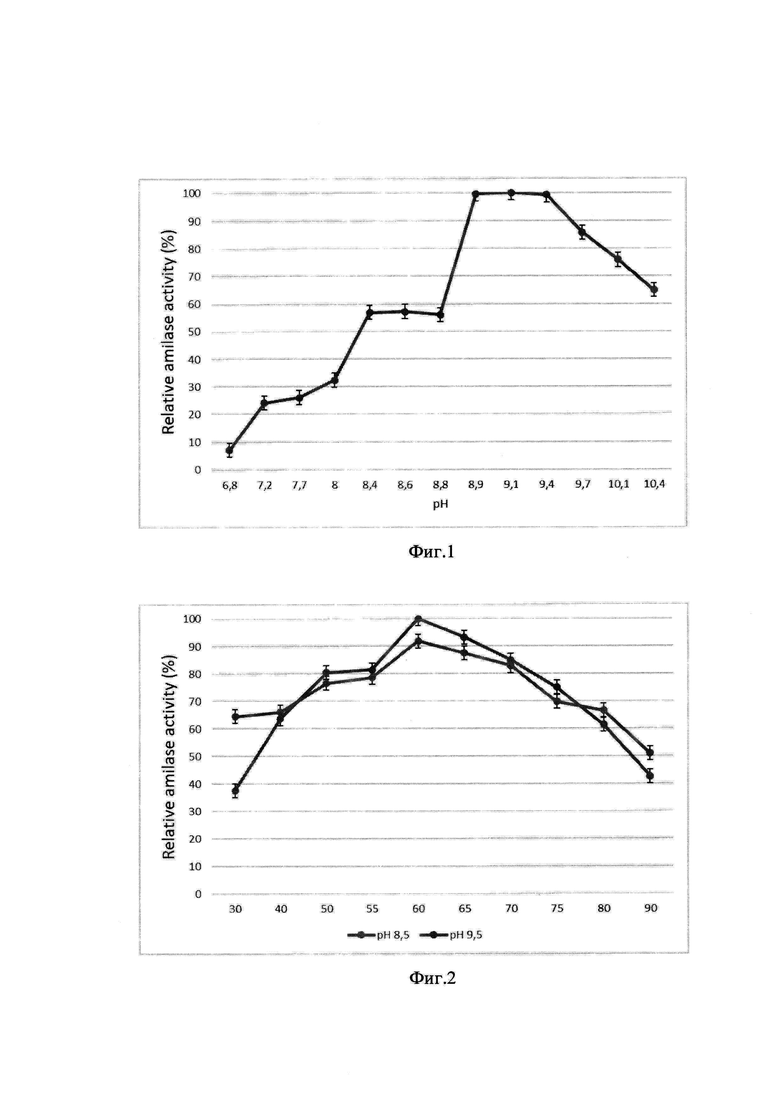
На фиг. 1 представлена зависимость активности амилазы от рН среды реакционной смеси при 30°С. Максимальную активность в эксперименте принимали за 100%, остальные результаты выражали в процентах от максимального значения. Максимальные значения амилолитической активности фермента наблюдались в диапазоне рН 8,9-9,4.
Пример 6.
Определение температурного диапазона активности альфа-амилазы штамма Bacillus licheniformis 47018.
Для определения температурного диапазона активности амилазы штамма Bacillus licheniformis 47018 в качестве субстрата использовали 1% раствор крахмала в 50 мМ трис-HCl буфере с рН 8,5 и 50 мМ трис-глициновом буфере рН 9,5.
На фиг. 2 представлена зависимость активности фермента при разных рН в зависимости от температурного режима хода ферментативной реакции. Максимальную активность в эксперименте принимали за 100%, остальные результаты выражали в процентах от максимального значения.
При обоих значениях рН фермент сохраняет более 50% активности в температурном диапазоне от 40 до 80°С. При температуре 90°С фермент сохраняет 50% активности при рН 9,5 и 40% при рН 8,5. При рН 8,5 при 30°С амилаза теряет 60% активности, в то время как при рН 9,5 60% активности фермента сохраняется. При обоих значениях рН фермент имеет максимальную активность при 60°С.
Таким образом, получен штамм Bacillus licheniformis 47018, продуцирующий металл независимую высокоактивную альфа-амилазу, устойчивую к присутствию в среде высоких концентраций ионов металлов, стабильную в широком диапазоне температуры (30-90°С) и значений рН среды (6,5-11).
Источники информации
1. Rani Gupta, Paresh Gigras, Harapriya Mohapatra, Vineet Kumar Goswami, Bhavna Chauhan, Microbial O±-amylases: a biotechnological perspective // Process Biochemistry, Volume 38, Issue 11, 2003, P. 1599-1616.
2. Marc J.E.C van der Maarel, Bart van der Veen, Joost C.M Uitdehaag, Hans Leemhuis, Dijkhuizen L. Properties and applications of starch-converting enzymes of the alpha-amylase family // Journal of Biotechnology, Volume 94, Issue 2,2002, P. 137-155.
3. Irfan M., Nadeem M., Syed Q., Baig S. Production of thermo-stable α-amylase from Bacillus sp. in solid state fermentation // Journal of Applied Science Research. 2011; 7(5):607-617.
4. Asoodeh A., Chamani J., Lagzian M. A novel thermostable, acidophilic alpha-amylase from a new thermophilic "Bacillus sp. Ferdowsicous" isolated from Ferdows hot mineral spring in Iran: Purification and biochemical characterization // Int. J. Biol. Macromol. - 2010. - Vol. 46, №3. - P. 289-97
5. Bano S., Ul Qader S.A., Aman A., Azhar A. Partial purification and some properties of alpha-amylase from Bacillus subtilis KIBGE-HAS // Indian J. Biochem. Biophys. - 2009. - Vol. 46, №5. - P. 401-404
6. Tiwari S., Shukla N., Mishra P., Gaur R. Enhanced production and characterization of a solvent stable amylase from solvent tolerant Bacillus tequilensis RG-01: thermostable and surfactant resistant // Scientific World Journal - 2014:972763
7. Hammami A., Fakhfakh N., Abdelhedi O., Nasri M., Bayoudh A. Proteolytic and amylolytic enzymes from a newly isolated Bacillus mojavensis SA: Characterization and applications as laundry detergent additive and in leather processing // Int. J. Biol. Macromol. - 2018. - Vol. 108. - P. 56-68
8. Priyadarshini S., Pradhan S.K., Ray P. Production, characterization and application of thermostable, alkaline α-amylase (AA11) from Bacillus cereus strain SP-CH11 isolated from Chilika Lake // Int. J. Biol. Macromol. - 2020. - Vol. 145. - P. 804-812
9. Ghorbel R.E., Maktouf S., Massoud E.B., Bejar S., Chaabouni S.E. New thermostable amylase from Bacillus cohnii US147 with a broad pH applicability // Appl. Biochem. Biotechnol. - 2009. - Vol. 157, №1. - P. 50-60
10. Bozic N., Ruiz J., Lopez-Santin J., Vujcic V. Production and properties of the highly efficient raw starch digesting α-amylase from a Bacillus licheniformis ATCC9945a // Biochem. Eng. J. - 2011. - Vol. 53, №2. - P. 203-209
11. Arikan B. Highly thermostable, thermophilic, alkaline, SDS and chelator resistant amylase from a thermophilic Bacillus sp. isolate A3-15 // Bioresour. Technol. - 2008. - Vol. 99, №8. - P. 3071-6
12. Fischer E.H., Stein E.A. (1960) The Enzymes, 2nd ed., Boyer, P.D., Lardy, H., Myrback, K. (eds.), Vol. 4, pp. 313-343, Academic Press, New York
13. Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Anal Biochem. 1976 May 7; 72:248-54.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ БАКТЕРИЙ BACILLUS LICHENIFORMIS - ПРОДУЦЕНТ КОМПЛЕКСА ТЕРМОСТАБИЛЬНЫХ АМИЛОЛИТИЧЕСКИХ И ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ | 1998 |
|
RU2177995C2 |
| ШТАММ БАКТЕРИЙ BACILLUS LICHENIFORMIS ВКМ В-2396 D - ПРОДУЦЕНТ ТЕРМОСТАБИЛЬНОЙ АЛЬФА-АМИЛАЗЫ | 2006 |
|
RU2324734C1 |
| ВАРИАНТЫ АЛЬФА-АМИЛАЗЫ | 2000 |
|
RU2231547C2 |
| Штамм бактерий BacILLUS амYLоLIQUеFасIеNS-продуцент @ -амилазы BacILLUS LIснеNIFоRмIS | 1991 |
|
SU1788966A3 |
| СПОСОБ ВЫДЕЛЕНИЯ И СЕЛЕКЦИИ БАКТЕРИЙ-ПРОДУЦЕНТОВ ЦИКЛОДЕКСТРИНГЛЮКАНОТРАНСФЕРАЗЫ, ШТАММ БАКТЕРИЙ BACILLUS CIRCULANS B-65 NCAIM (P) 001277 (B-65) - ПРОДУЦЕНТ ВНЕКЛЕТОЧНОЙ ЦИКЛОДЕКСТРИНТРАНСФЕРАЗЫ, ЦИКЛОДЕКСТРИНГЛЮКАНОТРАНСФЕРАЗА, ПОЛУЧЕННАЯ ИЗ НЕГО, И ЕГО ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ЦИКЛОДЕКСТРИНА | 2000 |
|
RU2244742C2 |
| ШТАММ Bacillus amyloliquefaciens - ПРОДУЦЕНТ АЛЬФА-АМИЛАЗЫ Bacillus amyloliquefaciens | 2010 |
|
RU2455352C1 |
| ВАРИАНТЫ АЛЬФА-АМИЛАЗЫ BACILLUS LICHENIFORMIS С ПОВЫШЕННОЙ ТЕРМОСТАБИЛЬНОСТЬЮ И/ИЛИ СНИЖЕННОЙ КАЛЬЦИЕВОЙ ЗАВИСИМОСТЬЮ | 2008 |
|
RU2469087C2 |
| ВАРИАНТЫ АЛЬФА-АМИЛАЗЫ TS-23 С ИЗМЕНЕННЫМИ СВОЙСТВАМИ | 2009 |
|
RU2526516C2 |
| Трансформант Ogataea haglerorum - продуцент термостабильной α-амилазы | 2022 |
|
RU2795707C1 |
| Рекомбинантная плазмида pUSB2-AmQ, обеспечивающая синтез белка альфа-амилазы Bacillus amyloliquefaciens, и штамм Bacillus subtilis/pUSB2-AmQ - продуцент белка альфа-амилазы Bacillus amyloliquefaciens | 2020 |
|
RU2747627C1 |
Изобретение относится к микробиологии и биотехнологии. Предложен штамм бактерий Bacillus licheniformis 47018, депонированный в ВКПМ под регистрационным номером ВКМВ В-14248 и являющийся продуцентом термостабильной альфа-амилазы. Изобретение обеспечивает расширение ассортимента штаммов-продуцентов альфа-амилазы. 2 ил., 3 табл., 6 пр.
Штамм Bacillus licheniformis 47018, депонированный под регистрационным номером ВКПМ В-14248, обладающий способностью продуцировать термостабильную альфа-амилазу.
| ARIKAN B | |||
| Highly thermostable, thermophilic, alkaline, SDS and chelator resistant amylase from a thermophilic Bacillus sp | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Bioresour Technol | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| ШТАММ БАКТЕРИЙ BACILLUS LICHENIFORMIS ВКМ В-2396 D - ПРОДУЦЕНТ ТЕРМОСТАБИЛЬНОЙ АЛЬФА-АМИЛАЗЫ | 2006 |
|
RU2324734C1 |
| ШТАММ БАКТЕРИЙ BACILLUS LICHENIFORMIS - ПРОДУЦЕНТ КОМПЛЕКСА ТЕРМОСТАБИЛЬНЫХ АМИЛОЛИТИЧЕСКИХ И ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ | 1998 |
|
RU2177995C2 |
| CN 101514327 A, 26.08.2009. | |||
Авторы
Даты
2023-01-25—Публикация
2022-10-18—Подача