Для определения цефалоспоринов в литературе предложено использовать масс-спектрометрию (плазма, моча), жидкостную хроматографию (биосреды), спектрофлуориметрию (цефалексин в плазме крови). Для суммарного определения антибиотиков предложен пьезоэлектрический иммуносенсор, на поверхности сенсора нанесена подложка на основе самоорганизующихся монослоев тиолов 11-меркаптоундеканола и 2-амино-5-меркапто-1,3,4-триазола, на которую иммобилизуют тетрациклин-белковый конъюгат, к пробе добавляют фиксированное количество поликлональных антител к тетрациклинам и выдерживают в течение 2-3 мин до образования иммунокомплекса, вводят в ячейку для детектирования в фосфатном буферном растворе с рН 7,1-7,2. Регистрируют изменение частоты колебания сенсора в результате взаимодействия несвязавшихся антител с тетрациклин-белковым конъюгатом на поверхности электродов сенсора. Аналитический сигнал обратно пропорционален суммарной концентрации тетрациклинов в анализируемой пробе, концентрацию определяют по градуировочному графику, регенерацию рецепторного покрытия осуществляют нанесением на поверхность 0,1 М раствор гидрохлорида диэтиламина. Изобретение обеспечивает снижение предела обнаружения тетрациклинов и увеличение чувствительности определения с высокой достоверностью результатов, уменьшение времени анализа, расширение диапазона линейного определения, и проведение измерений с возможностью регенерации сенсора в течение 30 циклов измерения [патент РФ №2687742 «Способ определения тетрациклинов с помощью пьезоэлектрического сенсора» приоритет от 29.12.2017. Авторы: Ермолаева Т.Н., Фарафонова О.В.].
В настоящее время для определения группы тетрациклина применяют методы: биологические, микробиологические.
Способ характеризуется тем, что используют в качестве тест-культуры споры Bacillus stearothermophilus штамма КК-ВКМ В-2130Д-облигатного термофильного спорообразующего микроорганизма с оптимальной температурой роста 55-60°С, факультативного анаэроба, высокочувствительного ко всем широко применяемым антибиотикам, или споры других термофильных бактерий. Исследуемый материал титруется в пластинах для иммуноферментного анализа в цветной питательной среде с индикатором. В лунки добавляют споры тест-культуры, содержащей 107 спор/мл. Посевы инкубируют при 55-60°С. Посторонняя микрофлора не растет при этой температуре. Отсутствие изменения цвета среды указывает на наличие антибиотика в исследуемом материале. Посторонняя микрофлора не растет при этой температуре. Отсутствие изменения цвета среды указывает на наличие антибиотика в исследуемом материале. [Патент РФ 2188421 Леви М.И., Сучков Ю.Г. «Способ экспрессного определения антибиотиков биологическим методом» приоритет от 19.05.2000. Авторы: Леви М.И., Сучков Ю.Г.] Способ ненадежен, обеспечивает не достаточно высокую чувствительность определения.
Fagbamila I. Antimicrobial screening of commercial eggs and determination of tetracycline residue using two microbiological methods / I. Fagbamila, J. Kabir, P. Abdu, G. Omeiza, P. Ankeli, S. Ngulukun, M. Muhammad, J. Umoh // International Journal of Poultry Science. - 2010. - V. 9 (10). - P. 959-962; Khismatoullin R. Modification of microbiological detection of tetracycline in honey / R. Khismatoullin, R. Kuzyaev, Ya. Lyapunov, E. Elovikova // APIACTA. - 2003. - V. 38. - P. 246-248; Kirbis A. Microbiological screening method for detection of aminoglycosides, b-lactames, macrolides, tetracyclines and quinolones in meat samples / A. Kirbis // Slov Vet Res. - 2007. - V. 44 (1/2). - P. 8-11], недостатком таких методов является невысокая чувствительность (предел обнаружения равен 30-40 мкг/кг), хотя эти тесты считаются быстрыми, они занимают 3-24 часа для работы в инкубаторе, бактериальные штаммы, должны постоянно контролироваться, чтобы убедиться, что они не стали устойчивыми к тетрациклинам, интерпретация результатов теста весьма субъективна и может привести к ложным отрицательным или положительным результатам. Высоко-эффективной жидкостной хроматографии [Ahmadi F. Determination of tetracyclines in meat using two phases freezing extraction method and HPLC-DAD / Ahmadi F., Shahbazi Y., Karami N. // Food Analytical Methods. - 2015. - Volume 8, Issue 7, pp 1883-1891; Moats W.A. Rapid HPLC Determination of Tetracycline Antibiotics in Milk / W.A. Moats, R. Harik-Khan // J. Agric. Food Chem. - 1995. - V. 43 (4). - P. 931-934; Zhou J. Multiresidue determination of tetracycline antibiotics in propolis by using HPLC-UV detection with ultrasonic-assisted extraction and twostep solid phase extraction / J. Zhou, X. Xue, Yi Li, J. Zhang, F. Chen, L. Wu, L. Chen, J. Zhao // Food Chemistry. - 2009. - V. 115. - Is. 3. - P. 1074-1080; Moats W.A. Determination of tetracycline antibiotics in beef and pork tissues using ion-paired liquid chromatography / W.A. Moats // J. Agric Food Chem. - 2000. - V. 48(6). - P. 2244-2248; Pena A. Determination of tetracycline antibiotic residues in edible swine tissues by liguid chromatography with spectrofluorometric detection and confirmation by mass spectrometry / A. Pena, CM. Lino, R. Alonso, D. Barcelo // J. Agric. Food Chem. - 2007. - V. 55 (13). - P. 4973-4979; A.R. Shalaby Validation of HPLC method for determination of tetracycline residues in chicken meat and liver / A.R. Shalaby, Nadia A. Salama, S.H. Abou-Raya, Wafaa H. Emam, F.M. Mehaya // Food Chemistry. - V. 124, I. 4, 2011, P. 1660-1666]. Недостатки: длительность и достаточно сложная процедура пробоподготовки с применением твердофазной экстракции и степень извлечения продуктов порядка 80%.
Для определения цефалоспоринов: (цефазолин) в литературе предложено использовать масс-спектрометрию (плазма и моча), жидкостную хроматографию (биосреды), спектрофлуориметрию (цефалексин в плазме крови, моче), диффузию в агар (цефотаксим в сыворотке и околораневых тканях), ионную хроматографию - цефтриаксон (в крови и тканях здоровых крыс), высокоэффективную жидкостную хроматографию (ВЭЖХ) (сыворотка крови, моча) [Кулапина Е.Г., Баринова О.В., Кулапина О.И. и др. Современные методы определения антибиотиков в биологических и лекарственных средах. // Антибиотики и химиотерапия, 2009. - Т.54. - №9-10. - С. 53]. Многие из этих методов требуют дорогостоящего оборудования, реактивов, высококвалифицированных операторов, отличающихся длительностью и не применимы в клинических и биохимических лабораториях для экспресс-контроля за содержанием антибиотиков.
Для определения антибиотиков в фармацевтических формах и биологических жидкостях наиболее перспективным является использование потенциометрические методы с применением различных сенсоров, например ионселективных электродов (ИСЭ) с различными типами электродноактивных соединений (ЭАС). Метод отличается экспрессностью, селективностью, простотой, экономичностью и доступностью оборудования.
Разработаны потенциометрические сенсоры на основе ионных ассоциатов цефуроксима с катионами тетраалкил аммония. Сенсоры обеспечивают широкий диапазон определяемых содержаний антибиотиков 1⋅10-4 (8⋅10-5) - 1⋅10-2 М; предел обнаружения антибиотиков составляет 10-5 (10-6). (О.И. Кулапина, М.С. Михайлова, Е.Г. Кулапина Ионометрическое определение цефуроксима и цефуроксим аксетила в биологических и лекарственных средах // Известия Саратовского ун-та. Сер. Химия. Экология. 2013. Т. 15. вып. 3. С. 40-45. Недостатком данной мембраны является узкий интервал определяемых концентраций, высокий предел обнаружения цефуроксима не позволяет применять электрод для определения антибиотика в биосредах, где содержатся более низкие концентрации цефураксима, а также узкий спектр его применения.
Известен также способ определения цефазолина в биологических средах с применением ионселективных электродов (О.И. Кулапина, В.В. Барагузина, Н.В.Скобликова Определение цефазолина в биологических средах с применением ионселективных электродов // Химико-фармацевтический журнал. 2008. Т. 42, №8. С. 41-44). Оценено соотношение компонентов в ионном ассоциате, растворимость, термическая устойчивость до 70 градусов. Показано, что зависимость ЭДС от концентрации цефазолина выполняется в интервале 1⋅10-1 - 1⋅10-5 моль; угловой коэффициент электродных функций составляет 56±2 мВ/декаду. Однако не определен коэффициент селективности к многим антибиотикам, имеющим такие же функциональные группировки как у цефазолина.
В данной работе [«Планирование эксперимента в оптимизации синтеза ванкомицин-селективных "исскуственных рецепторов» Автор: Е.Н. Музыка // Технiчнi науки Scientific Journal «ScienceRise» №3/2(3)2014. УДК 66.DOI: 10.15587/2313-8416.2014.27623] использован хемометрический подход "планирование эксперимента", реализованный с помощью прикладного программного пакета MODDE 9.0, для оптимизации параметров синтеза ванкомицин-селективных наночастиц ("искусственных рецепторов" на базе молекулярно импринтированных полимеров) на автоматическом реакторе с целью получения их максимального количественного выхода.
Использование в современных сенсорах природных рецепторов, как правило, обеспечивает удовлетворительные аналитические характеристики, однако проблемой является их дороговизна и нестабильность. Использование технологии, известной как молекулярный ипринтинг, способно решить или снизить остроту озвученных выше проблем. Молекулярно импригнированные полимеры (МИПы), или полимеры с молекулярными отпечатками, могут быть дешевой альтернативой природным рецепторам. Получаются «искусственные рецепторы» (на базе МИПов) в результате молекулярного импринтинга - сополимеризации функционального и сшивающего мономеров в присутствии молекул-шаблонов или импринт-молекул. К настоящему времени для синтеза МИПов наиболее широко используется метод полимеризации в массе (bulk polymerization)
Недостатки: полученные полимеры имеют много ограничений, в том числе высокий уровень неспецифического связывания и плохой доступности сайта для шаблона молекул и, следовательно, не используются в коммерческих анализах.
Наиболее близким к предлагаемому техническому решению(прототип)
Состав мембраны и устройство электродов для определения одного из антибиотиков цефалоспориновой группы, а именно, цефуроксима в лекарственных средах, описанное в статье авторов:
J.L.F.C Lima, M.C.B.S.M Montenegro, M.G.F Sales. Cefuroxime selective electrodes for batch and FIA determinations in pharmaceutical preparations. Journal of Pharmaceutical and Biomedical Analysis, V. 18, I. 1-2, 1998, P. 93-103, https://doi.org/l0.1016/S0731-7085(98)00162-9.
Сконструированы и оценены различные селективные электроды для определения цефуроксима без внутреннего раствора сравнения, содержащие ПВХ-мембраны.
Мембрана выполнена с использованием в качестве ЭАС - цефураксим бис(трифенилфосфоранилиден)аммония и цефуроксимтетраоктиламмония, в качестве пластификатора - ди-(2-этилгексил)овый эфир себациновой кислоты и 2-нитрофенилоктилового эфира, в качестве добавки - 4-третоктилфенила. Для данных электродов линейный предел определяемых концентраций цефуроксима составил 2.8⋅10-4 и 1.3⋅10-4 М, крутизна - 50.4 мВ/декаду сроком службы около 4-5 месяцев, кислотность 3.5 рН, создавали введением фосфатного буферного раствора. Относительное стандартное отклонение <3,0%.
Недостатком данной мембраны является отсутствие исследования селективности антибиотиков цефалоспоринового ряда, с идентичными функционально-аналитическими группировками как у цефураксима к цефуроксим-селективному электроду. Кроме того, характерен высокий предел обнаружения цефуроксима, а именно 2.8×10-4 и 1.3×10-4 М что не позволяет применять электрод для определения антибиотика в биосредах, где содержатся более низкие концентрации антибиотика.
Задачей изобретения является создание мембраны ионоселективного электрода (ИСЭ) для экспрессного определения цефалоспоринового антибиотика, в частности цефтриаксона в лекарственных и биологических средах (в т.ч. крови, моче, жидкости ротовой полости) и создание на основе полученной мембраны цефтриаксон-селективного электрода для определения цефтриаксона, учитывая его применение в качестве основного антибиотика в лечении ковида-19, а также с целью фармакокинетических исследований.
Технология изготовления цефтриаксон-селективного (Ceftr-СЭ) электрода проводили следующим образом: водный раствор цефтриаксона с концентрацией 1⋅10-2 М объемом 50 мл смешивали с 100 мл хлороформного раствора октадециламина (ОДА) такой же концентрации. Затем раствор перемешивали при комнатной температуре в течение 3-4 часов в колбе с магнитной мешалкой (фиг. 1), после, отбирали хлороформный слой и упаривали (на водяной бане при температуре 50-60°С) до полного улетучивания хлороформа вплоть до образования белого кристаллического осадка (фиг. 2). Осадок растворяли в этаноле и проводили перекристаллизацию, разбавляя дистиллированной водой (фиг. 3). Очищенный осадок (ионный ассоциат) в качестве ЭАС (ионофор) растворяли в диоктилсебаценате (ди-(2-этилгексил)овый эфир себациновой кислоты), выполняющий роль пластификатора, туда же вводили поливинилхлорид (ПВХ), тетрагидрофуран и перемешивали до полного растворения. Затем отбирали 3,8 мл полученной мембранной композиции, заливали в стеклянные кольца диаметром 22-28 мм и получали тонкие мембраны после полного испарения тетрагидрофурана (ТГФ). Во избежание быстрого испарения последнего, чашки накрывали бумагой и сверху стеклом (фиг. 4). Мембраны клеили к торцам поливинилхлоридных трубок, нанося 13% ПВХ в циклогексаноне (ЦТ) в три слоя с промежутками 20 мин. (фиг. 5). Ceftr-СЭ вымачивали в сантимолярных растворах цефтриаксона, предварительно заполнив сантимолярными растворами смеси Ceftr и KCI. Калибровку разработанного электрода проводили, помещая индикаторный и электрод сравнения в заранее приготовленные стандартные растворы Ceftr различных концентраций (фиг. 6).
Независимо от природы сенсора возникающий на нем потенциал подчиняется уравнению Нернста:
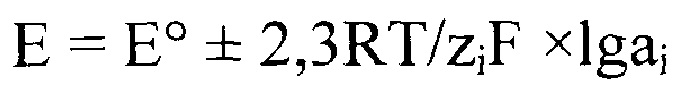
где Ео - стандартный потенциал редокс-системы; R - универсальная газовая постоянная, равная 8.312 Дж/ моль×К; Т - абсолютная температура, К; zi - валентность иона; F - постоянная Фарадея, равная 96485 Кл/моль; ах - активность соответственно окисленной и восстановленной форм редокс системы. Величина 2,3RT/ziF называется крутизной электродной функции и обозначается обычно как S; ai=cif (ci - концентрация определяемого иона; f - коэффициент активности иона).
Потенциометрические исследования проводили с помощью 8-Канальной компьютеризованной системы сбора потенциометрических данных на базе ПК, Экотест-120 и коммутатора КМ-8 (НПП «ЭКОНИКС», Москва, Россия); (Фиг. 7.) Для отделения белковых компонентов из смешанной слюны использовали центрифугу Wirowka MPW-6.
Техническим результатом является сокращение времени определения, снижении предела обнаружения цефтриаксона в присутствии ряда анионов и некоторых антибиотиков цефалоспоринового ряда, а также увеличение диапазона определяемых концентраций с оптимизацией метрологических характеристик.
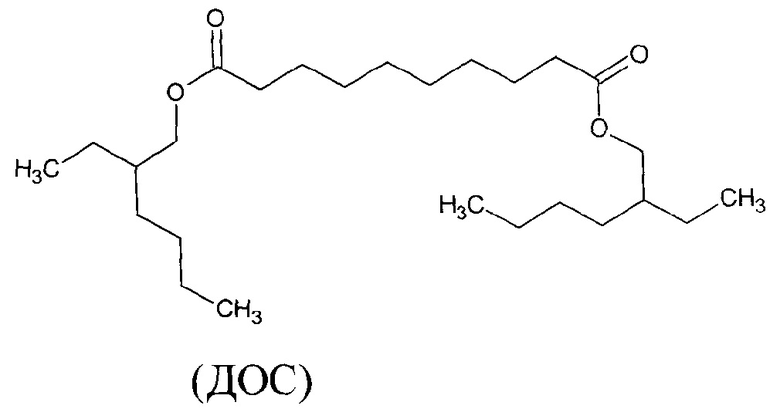
Указанный технический результат достигается тем, что в качестве электродноактивного соединения (ЭАС) использован липофильный катион-октадециламина (ОДА) и липофильный анион-цефтриаксона (Ceftr) для состава мембраны использовали ионный ассоциат : цефтриаксон (Ceftr) и октадециламин (ОДА), в соотношении 1:2; пластификатором служил диоктилсебацинат (ДОС), растворители: тетрагидрофуран и циклогексанон (ЦГ), со следующим соотношением компонентов в масс. %:
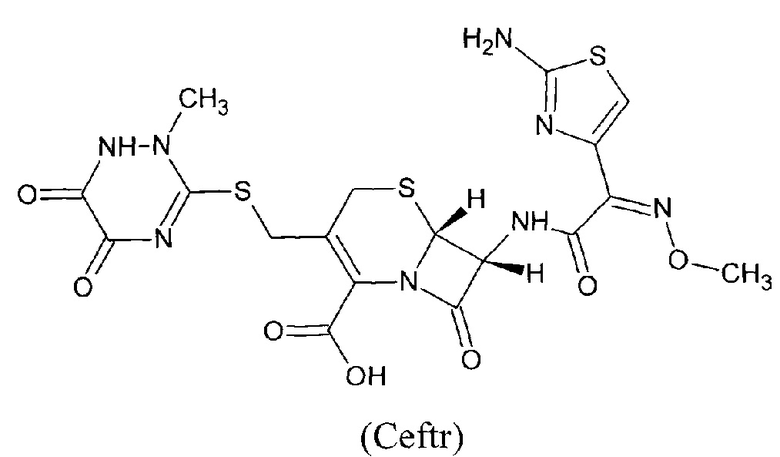
Цефтриаксон (Ceftr) - цефалоспориновый антибиотик III поколения. Коммерческое название препарата «Цефтриаксон», фирмы производители: 1) «Вертекс Экспорте», Индия; 2) ОАО «Биосинтез», Москва. Форма выпуска: порошок для приготовления раствора для инъекций по 1,0 г в стеклянных флаконах.

(ОДА) (Октадециламин, ЧДА, ТУ 6-09-07-230-74, Вектон, Санкт-Петербург, Россия);
Ионный ассоциат образовывался по схеме:
Октадециламин растворяли в хлороформе и смешивали с водным раствором цефтриаксона с концентрациями 1⋅10-2 М. Переносили данный раствор в колбу, смесь встряхивали на магнитной мешалке в течение 3-4 часов. Образовавшийся хлороформный слой отделяли от водной фазы в предварительно взвешенный бюкс. Испаряли хлороформ на водяной бане при температуре 50-60°С (во избежание разложения электродноактивного компонента) до образования белого кристаллического осадка. С целью получения чистого осадка провели перекристаллизацию, растворив его в чистом этаноле и разбавляя дистиллированной водой. Очищенный ионный ассоциат в качестве ЭАК использовали для получения мембран. Далее по вышеизложенному получали пленочные мембраны цефтриаксон-селективного электрода, используя в качестве пластификатора - диоктилсебацинат (ДОС) и растворителя - тетрагидрофуран (ТГФ). Ниже представлено уравнение ионного обмена:
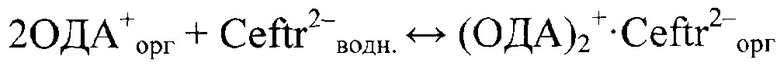
Составы исследуемых мембран представлены в таблице 1.
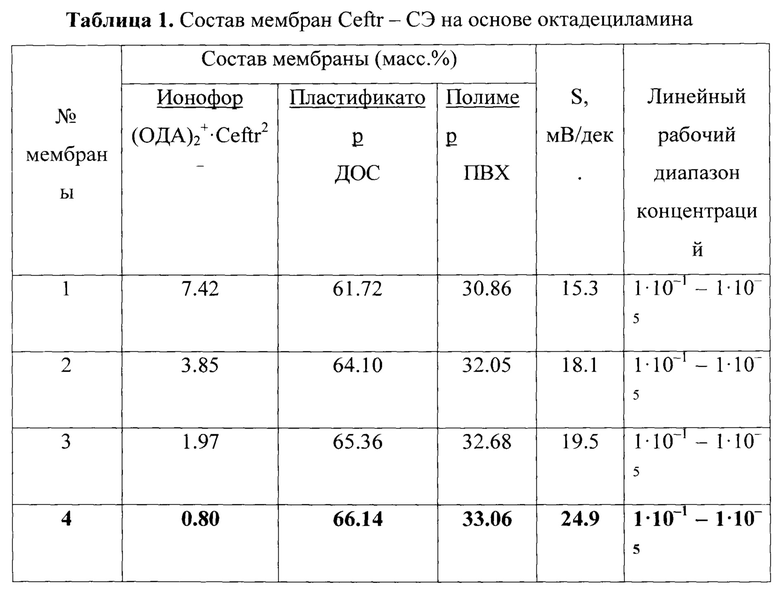
Дальнейшие исследования проведены с электродом состава мембраны масс. %: (ОДА)2+⋅Ceftr2- (0.80), ДОС (66.14), ПВХ (33.06) и крутизной электродной функции, максимально близка к теоретическому значению для двухзарядного иона 24.9 мВ/дек.
Высокая липофильность ионофора ПВХ-пластифицированной мембраны ограничивает его выход в раствор, что способствует полноте электродной функции, а также длительным срокам жизни ИСЭ. Величину липофильности рассчитывали с помощью программы ACD/ChemSketch, которая для октадециламина соответствует 8.4±0.2.
Изучена селективность цефтриаксон-селективного электрода к некоторым анионам и антибиотикам цефалоспаринового ряда. Селективность Ceftr-СЭ на основе ионного ассоциата к важнейшим неорганическим катионам: К+, Na+, Са2+ показала, что данные катионы и некоторые антибиотики цефалоспаринового ряда (цефазолин, цефуроксим, цефалексин не мешают определению цефтриаксона, а среди анионов незначительно влияли иодиды, остальные анионы не оказывали мешающего влияния.
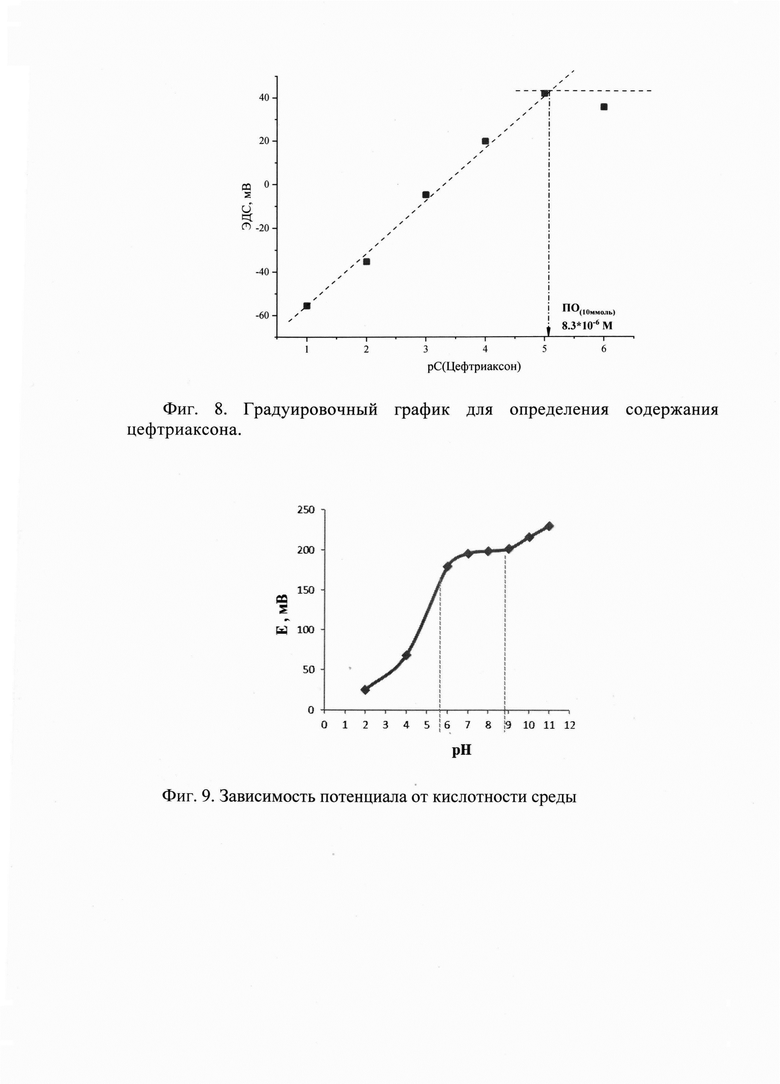
Полученная мембрана обеспечивает широкий диапазон определяемых содержаний антибиотика, а именно 1⋅10-1 - 1⋅10-5 М. При этом выявленные в результате проведенных экспериментов высокие свойства используемого в мембране ЭАС обеспечивает низкий предел обнаружения цефтриаксона, а именно 8.3⋅10-6 М. Это позволяет использовать электрод как для определения цефтриаксона в биологических жидкостях, где концентрация определяемого очень низка, так и для анализа лекарственных препаратов на основе цефтриаксона, а также для изучения фармакокинетики антибиотика. В результате угловой коэффициент электродных функций в растворах цефтриаксона составляет 24.9 мВ/дек (Фиг. 8.).
Таким образом полученная мембрана ИСЭ расширяет функциональные возможности экспрессного определения цефтриаксона в биологических жидкостях, в лекарственных формах за счет широкого интервала определяемых концентраций и достижения постоянного значения потенциала в течение одной минуты.
Установлена зависимость потенциала мембраны Ceftr - СЭ от кислотности раствора (Фиг. 9.).
При рН 6-9 потенциал Ceftr - СЭ имеет максимальную растворимость и данный интервал принят за рН функционирования электрода. Основные электрохимические характеристики (крутизна электродной функции, линейный диапазон, предел обнаружения и время отклика) представлены в таблице 2.

| название | год | авторы | номер документа |
|---|---|---|---|
| Экспресс-способ определения цефтриаксона в плазме крови и смешанной слюне больных COVID-19 | 2021 |
|
RU2771851C1 |
| МЕМБРАНА ИОНОСЕЛЕКТИВНОГО ЭЛЕКТРОДА ДЛЯ ОПРЕДЕЛЕНИЯ ЦЕФАЛОСПОРИНОВЫХ АНТИБИОТИКОВ В ЛЕКАРСТВЕННЫХ И БИОЛОГИЧЕСКИХ СРЕДАХ | 2011 |
|
RU2469304C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ТЕТРАЦИКЛИНОВ С ПОМОЩЬЮ ПЬЕЗОЭЛЕКТРИЧЕСКОГО СЕНСОРА | 2017 |
|
RU2687742C1 |
| Кадмий-селективный электрод | 2019 |
|
RU2712920C1 |
| МЕМБРАНА ИОНОСЕЛЕКТИВНОГО ЭЛЕКТРОДА ДЛЯ ОПРЕДЕЛЕНИЯ ИОННЫХ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ В СТОЧНЫХ ВОДАХ И СИНТЕТИЧЕСКИХ МОЮЩИХ СРЕДСТВАХ | 2013 |
|
RU2531130C1 |
| ИОНОСЕЛЕКТИВНАЯ МЕМБРАНА ДЛЯ ОПРЕДЕЛЕНИЯ ИОННЫХ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ | 2013 |
|
RU2546045C1 |
| Состав мембраны химического сенсора на ионы стронция | 2022 |
|
RU2787466C1 |
| Состав мембраны ионоселективного электрода для определения 2,4-динитрофенола | 1980 |
|
SU935777A1 |
| СОСТАВ МЕМБРАНЫ ИОНОСЕЛЕКТИВНОГО ЭЛЕКТРОДА ДЛЯ ОПРЕДЕЛЕНИЯ ИОНОВ КАДМИЯ | 2010 |
|
RU2428683C1 |
| Способ качественного и количественного определения антибиотиков тетрациклинового и пенициллинового ряда в молоке и молочных изделиях | 2020 |
|
RU2739074C1 |


Изобретение относится к электрохимическим методам анализа и может быть использовано в контрольно-аналитических лабораториях, клинических лабораториях для определения концентрации цефтриаксона (Ceftr), антибиотика цефалоспоринового ряда, в биосистемах (сыворотке крови, слюне, моче и т.д.) с целью регулирования введения оптимальных доз антибиотика при лечении различных инфекционных заболеваний, а также при исследовании фармакокинетики. Оптимизацию состава мембраны ионселективного электрода осуществляли за счет изменения массовых соотношений компонентов мембран. Сущность: состав мембраны ионселективного электрода для определения Ceftr содержит электродноактивный компонент (ЭАК), пластификатор - диоктилсебацинат (ДОС), поливинилхлорид (ПВХ), при этом в качестве ЭАК используют ионный ассоциат (Ceftr)2⋅ОДА и состав имеет следующее соотношение компонентов: ЭАК-0.80, ДОС-66.14, ПВХ-33.06. Технический результат: сокращение времени определения, снижении предела обнаружения цефтриаксона в присутствии ряда анионов и некоторых антибиотиков цефалоспоринового ряда, а также увеличение диапазона определяемых концентраций с оптимизацией метрологических характеристик. 9 ил., 2 табл.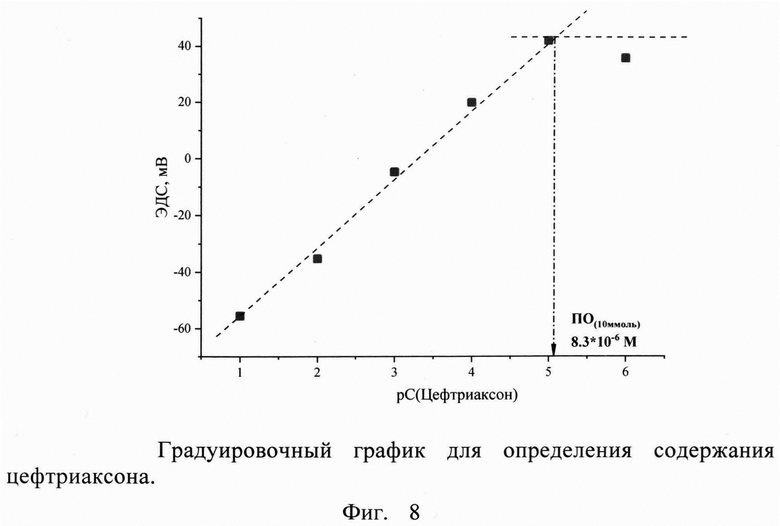
Состав мембраны ионселективного электрода для ионометрического определения цефтриаксона в биологических жидкостях, включающий электродноактивное соединение, отличающийся тем, что в качестве электродноактивного соединения использован ионный ассоциат липофильный катион октадециламмония и липофильный анион цефтриаксона с соотношением 2:1, (ОДА)2+⋅Ceftr2- и в мас.% (ОДА)2+⋅Ceftr2- (0.80), ДОС (66.14), ПВХ (33.06).
| МЕМБРАНА ИОНОСЕЛЕКТИВНОГО ЭЛЕКТРОДА ДЛЯ ОПРЕДЕЛЕНИЯ ФОСФАТ-ИОНОВ В РАСТВОРАХ | 2019 |
|
RU2716884C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АМИНОГЛИКОЗИТНЫХ АНТИБИОТИКОВ В ЛЕКАРСТВЕННЫХ И БИОЛОГИЧЕСКИХ СРЕДАХ | 2003 |
|
RU2235995C1 |
| МЕМБРАНА ИОНОСЕЛЕКТИВНОГО ЭЛЕКТРОДА ДЛЯ ОПРЕДЕЛЕНИЯ ЦЕФАЛОСПОРИНОВЫХ АНТИБИОТИКОВ В ЛЕКАРСТВЕННЫХ И БИОЛОГИЧЕСКИХ СРЕДАХ | 2011 |
|
RU2469304C1 |
| WO 2021062476 A1, 08.04.2021 | |||
| CN 107667288 A, 06.02.2018 | |||
| Устройство для гальванического нанесения покрытий на цилиндрические поверхности деталей | 1985 |
|
SU1289916A1 |
| Безъязычная А | |||
| А., Шорманов В | |||
| К., Сипливая Л | |||
| Е | |||
| Определение цефтриаксона в биологическом материале //Человек и его здоровье | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Сепаратор-центрофуга с периодическим выпуском продуктов | 1922 |
|
SU128A1 |
Авторы
Даты
2023-01-30—Публикация
2022-02-14—Подача