Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтической композиции, включающей вариант РН20 человеческой гиалуронидазы, обладающий повышенной ферментативной активностью и термостабильностью, и одно или несколько лекарственных средств, а также способ лечения заболевания с их помощью.
Фармацевтическая композиция согласно настоящему изобретению предпочтительно может использоваться для подкожной инъекции.
Предшествующий уровень техники
Лекарства, которые следует вводить в высокой дозе или в нескольких дозах, особенно лекарственные препараты на основе антител и т.п., обычно вводят посредством внутривенной инъекции, и такая инъекция занимает около 90 минут или более, при этом внутривенная инъекция должна сопровождаться дополнительной процедурой подготовки, таким образом создаются неудобства и для пациента, и для врачей, и для медицинского персонала, и возникают дополнительные расходы. Напротив, подкожная инъекция имеет то преимущество, что позволяет осуществлять немедленное введение, но скорость абсорбции является относительно низкой по сравнению с внутривенной инъекцией, и когда объем инъекции составляет 3-5 мл или более, она может вызвать отек и боль в месте введения, поскольку абсорбция происходит медленно. По этой причине подкожная инъекция белковых терапевтических агентов обычно ограничивается инъекцией раствора в небольшом количестве 2 мл или менее. Однако при подкожном введении (или подкожной инъекции) гиалуронидазы вместе с терапевтическим препаратом гиалуроновая кислота, распределенная во внеклеточном матриксе, гидролизуется под действием гиалуронидазы, и таким образом, вязкость подкожной области снижается, а проницаемость для вещества повышается, и, следовательно, высокая доза или несколько доз лекарства могут быть легко доставлены в организм.
У человека существует шесть типов генов гиалуронидазы: Hyal1, Hyal2, Hyal3, Hyal4, HyalPS1 и PH20/SPAM1. Hyal1 и Hyal2 экспрессируются в большинстве тканей, а PH20/SPAM1 (далее обозначаемая как PH20) экспрессируется в клеточной мембране сперматозоидов и акросомной мембране. HyalPS1 не экспрессируется, поскольку является псевдогеном. PH20 - это фермент (EC 3.2.1.35), который расщепляет β-1,4 связи между N-ацетилглюкозамином и глюкуроновой кислотой, которые являются сахарами, составляющими гиалуроновую кислоту. Гиалуронидаза человека PH20 имеет оптимальный pH 5,5, но проявляет некоторую активность даже при pH 7-8, тогда как другие гиалуронидазы человека, включая Hyal1, имеют оптимальный pH 3-4 и очень слабую активность при pH 7- 8. Значение рН в подкожных участках у человека составляет около 7,4, что является практически нейтральным, и таким образом, среди различных типов гиалуронидаз PH20 широко применяется в клинической практике. Примеры клинического использования PH20 включают подкожную инъекцию терапевтического агента на основе антител, использование в качестве глазного релаксанта и анестезирующей добавки в офтальмологической хирургии, использование для увеличения доступа противоракового терапевтического агента к опухолевым клеткам путем гидролиза гиалуроновой кислоты во внеклеточном матриксе опухолевых клеток, и применение для ускорения резорбции жидкостей организма и крови, которые чрезмерно присутствуют в тканях.
Между тем, в настоящее время коммерческая PH20 находится в форме, экстрагированной из семенников крупного рогатого скота или овец. Ее примеры включают Amphadase® (бычья гиалуронидаза) и Vitrase® (овечья гиалуронидаза).
Гиалуронидаза из бычьих семенников (BTH) образуется путем удаления сигнального пептида и 56 аминокислот на С-конце из бычьей гиалуронидазы PH20 дикого типа при посттрансляционной модификации. BTH также является гликопротеином и имеет содержание маннозы 5% и содержание глюкозамина 2,2%, исходя из общего состава, включая аминокислоты (Borders and Raftery, 1968). Когда гиалуронидазу животного происхождения повторно вводят в организм человека в высокой дозе, может формироваться нейтрализующее антитело, а другие биоматериалы животного происхождения, содержащиеся в виде примесей в препаратах PH20, могут вызывать аллергическую реакцию. В частности, использование PH20, экстрагированной из тканей крупного рогатого скота, ограничено из-за опасности коровьего бешенства. Чтобы преодолеть эти проблемы, были проведены исследования рекомбинантных человеческих белков PH20.
Сообщалось, что рекомбинантные человеческие белки PH20 были экспрессированы в дрожжах (P. pastoris), клетках насекомых DS-2, клетках животных и т.п. (Chen et al., 2016, Hofinger et al., 2007). Рекомбинантные белки PH20, продуцируемые в клетках насекомых и дрожжах, отличаются от PH20 человека с точки зрения характера N-гликозилирования при посттрансляционной модификации.
Среди гиалуронидаз были идентифицированы белковые структуры Hyal1 (PDB ID: 2PE4) (Chao et al., 2007) и гиалуронидазы пчелиного яда (PDB ID: 1FCQ, 1FCU, 1FCV). Hyal1 состоит из двух доменов, каталитического домена и EGF-подобного домена, а каталитический домен имеет форму (β/α)8, в которой каждая из альфа-спирали и бета-цепи, которые характеризуют вторичную структуру белка, повторяется восемь раз (Chao et al., 2007). EGF-подобный домен полностью консервативен в вариантах, в которых C-конец Hyal1 по-разному подвергается сплайсингу. Аминокислотные последовательности Hyal1 и PH20 идентичны на 35,1%, а третичная структура белка PH20 еще не установлена.
В исследовании структурно-функциональной взаимосвязи человеческого белка PH20 было обнаружено, что C-концевая область PH20 важна для экспрессии белка и ферментативной активности, и, в частности, сообщалось, что терминация C-конца аминокислотами 477-483 важна для ферментативной экспрессии и активности (Frost, 2007). Активность полноразмерного белка PH20 (аминокислоты 1-509) или варианта pH20, имеющего усеченный С-конец в положении 467, составляла всего 10% или менее от активности варианта pH20, имеющего усеченный С-конец в одном сайте среди положений 477-483 (Frost, 2007). Halozyme Therapeutics разработала rHuPH20 (аминокислоты 36-482), который представляет собой рекомбинантный белок, где С-конец зрелого белка PH20 расщеплен по Y482 (Bookbinder et al., 2006; Frost, 2007).
Между тем, хотя исследования по разработке различных терапевтических препаратов в виде подкожных инъекций с использованием PH20 человека продолжаются, проблема низкой стабильности PH20 человека как такового все еще остается нерешенной.
На основе этого предшествующего уровня техники авторы настоящего изобретения подтвердили, что варианты PH20 человека, включающие одну или несколько замен аминокислотных остатков в области альфа-спирали 8 (от S347 до C381) и в области линкера (от A333 до R346) между альфа-спиралью 7 и альфа-спиралью 8 в аминокислотной последовательности гиалуронидазы PH20 дикого типа, и где удалены некоторые аминокислоты, расположенные на N-конце и/или C-конце PH20, имели очень высокую ферментативную активность и термостабильность, и поэтому подали заявку на патент (PCT/KR 2019/009215).
Авторы настоящей заявки также подтвердили, что варианты PH20 в соответствии с настоящим изобретением могут применяться к фармацевтическим композициям или составам, включающим лекарственные средства, например, лекарственные препараты на основе антител, в частности, высокодозированные антитела против HER2 или антитела против иммунных контрольных точек, и, соответственно, фармацевтические композиции и составы в соответствии с настоящим изобретением, включающие варианты PH20 вместе с лекарствами, такими как антитела против HER2 или антитела против иммунных контрольных точек, могут быть использованы для подкожной инъекции, а активность лекарств, таких как лекарственные препараты на основе антител и варианты PH20, очень стабильна и может сохраняться в течение длительного времени, завершая, таким образом, настоящее изобретение.
Изложение сущности изобретения
Техническая проблема, решаемая изобретением
Таким образом, настоящее изобретение было сделано с учетом вышеуказанных проблем, и целью настоящего изобретения является обеспечение новой фармацевтической композиции, включающей вариант PH20, обладающий повышенной ферментативной активностью и термостабильностью, и лекарственное средство, где термостабильность и активность лекарства и варианта PH20 может сохраняться в течение длительного времени; особенно фармацевтической композиции, которую можно использовать для подкожной инъекции.
Другой целью настоящего изобретения является обеспечение способа лечения заболевания, включающего применение фармацевтической композиции в соответствии с настоящим изобретением у субъекта, нуждающегося в лечении.
Техническое решение
В соответствии с настоящим изобретением вышеуказанные и другие цели могут быть достигнуты путем обеспечения фармацевтической композиции, включающей (а) лекарственное средство и (b) вариант PH20.
Вариант PH20, содержащийся в фармацевтической композиции согласно настоящему изобретению, может включать одну или несколько замен аминокислотных остатков, выбранных из группы, состоящей из S343E, M345T, K349E, L353A, L354I, N356E и I361T в человеческом белке PH20 дикого типа, имеющем аминокислотную последовательность SEQ ID NO: 1, и может дополнительно включать замену (замены) аминокислотного остатка в одной или нескольких областях, выбранных из области альфа-спирали 8 (от S347 до C381) и/или линкерной области (от A333 до R346) между альфа-спиралью 7 и альфа-спиралью 8, где некоторые аминокислотные остатки, расположенные на N-конце и/или C-конце, избирательно удаляются.
Фармацевтическая композиция согласно настоящему изобретению может дополнительно включать одну или несколько добавок, выбранных из фармацевтически приемлемых добавок, в частности буфер, стабилизатор и поверхностно-активное вещество.
Фармацевтическая композиция согласно настоящему изобретению может использоваться в форме инъекционного препарата для подкожного введения.
Описание чертежей
Вышеупомянутые и другие цели, характеристики и другие преимущества настоящего изобретения будут более понятны из следующего подробного описания, взятого вместе с прилагаемыми чертежами, на которых:
Фигура 1A иллюстрирует хроматограммы от эксклюзионной хроматографии трастузумаба в испытании на стабильность в жестких условиях при 45°C, а Фигура 1B иллюстрирует изменение чистоты мономерного белка трастузумаба в зависимости от состава в испытании на стабильность в жестких условиях при 45°C;
Фигура 2 иллюстрирует результаты измерения температур агрегации белков для композиций, включающих трастузумаб и новый вариант PH20 HP46;
Фигура 3А представляет собой хроматограмму слабого катионообменного обмена (WCX) трастузумаба в испытании на стабильность в жестких условиях при 45°C, фигура 3B иллюстрирует изменения (%) относительных количеств кислых вариантов в композициях в испытании на стабильность в жестких условиях при 45°C, фигура 3C иллюстрирует изменения (%) относительных количеств главных пиков для композиций в испытании на стабильность в жестких условиях при 45°C, а фигура 3D иллюстрирует изменения (%) относительных количеств основных вариантов в композициях в испытании на стабильность в жестких условиях при 45°C;
Фигура 4 иллюстрирует изменения чистоты мономерного белка трастузумаба в композициях 5-7 в испытании на стабильность в жестких условиях при 45°C;
Фигура 5A иллюстрирует изменения (%) относительных количеств кислых вариантов в композициях 5-7 в испытании на стабильность в жестких условиях при 45°C, фигура 5B иллюстрирует изменения (%) относительных количеств главных пиков в композициях 5, 6 и 7 в испытании на стабильность в жестких условиях при 45°C, а фигура 5C иллюстрирует изменения (%) относительных количеств основных вариантов в композициях 5, 6 и 7 в испытании на стабильность в жестких условиях при 45°C;
Фигура 6A иллюстрирует результаты измерения остаточной ферментативной активности препарата герцептина для подкожного введения (Herceptin SC), трастузумаба + PH20 дикого типа (HW2) и трастузумаба + PH20 варианта HP46 в день 0 и день 1 в испытании на стабильность в жестких условиях при 40°C, а фигура 6B иллюстрирует результаты измерения остаточной ферментативной активности композиции герцептина для подкожного введения, трастузумаба + PH20 дикого типа (HW2) и трастузумаба + PH20 варианта HP46 в день 0 и день 1 в испытании на стабильность в жестких условиях при 45°C;
Фигура 7 иллюстрирует результаты анализа посредством эксклюзионной хроматографии композиций 8-10 в испытании на стабильность в жестких условиях при 40°C в течение 14 дней;
Фигура 8A иллюстрирует результаты анализа изменений размера белковых частиц композиций 8-10 с использованием оборудования DLS, а фигура 8B иллюстрирует результаты измерения температур агрегации белков;
Фигура 9A иллюстрирует хроматограмму слабого катионного обмена (WCX) композиции 8 в испытании на стабильность в жестких условиях при 40°C, фигура 9B иллюстрирует изменения (%) относительных количеств кислотных вариантов в составах 8-10 в испытании на стабильность в жестких условиях при 40°C, фигура 9C иллюстрирует изменения (%) относительных количеств главных пиков для композиций 8-10 в испытании на стабильность в жестких условиях при 40°C, а фигура 9D иллюстрирует изменения (%) относительных количеств основных вариантов в композициях 8-10 в испытании на стабильность в жестких условиях при 40°C;
Фигура 10 иллюстрирует изменения (%) относительной ферментативной активности композиций 8-10 в испытании на стабильность в жестких условиях при 40°C;
Фигура 11 иллюстрирует изменения чистоты мономеров трастузумаба в композициях 11-13 в испытании на стабильность в жестких условиях при 40°C;
Фигура 12A иллюстрирует хроматограмму слабого катионного обмена (WCX) композиции 11 в испытании на стабильность в жестких условиях при 40°C, фигура 12B иллюстрирует изменения (%) относительных количеств кислых вариантов в композициях 11-13 в испытании на стабильность в жестких условиях при 40°C, фигура 12C иллюстрирует изменения (%)относительных количеств главных пиков в композициях 11-13 в испытании на стабильность в жестких условиях при 40°C, а фигура 12D иллюстрирует изменения (%) относительных количеств основных вариантов в композициях 11-13 в испытании на стабильность в жестких условиях при 40°C;
Фигура 13 иллюстрирует изменения (%) относительной ферментативной активности композиций 11-13 в испытании на стабильность в жестких условиях при 40°C;
Фигура 14 иллюстрирует изменения чистоты мономеров ритуксимаба в композициях 14-16 в испытании на стабильность в жестких условиях при 40°C;
Фигура 15 иллюстрирует изменения относительной ферментативной активности композиций 14-16 в испытании на стабильность в жестких условиях при 40°C;
Фигура 16 иллюстрирует изменения относительной ферментативной активности композиций 17 и 18 в испытании на стабильность в жестких условиях при 40°C;
Фигура 17 иллюстрирует результаты анализа методом эксклюзионной хроматографии композиций 19-22 при 40°C;
Фигура 18 иллюстрирует изменения относительной ферментативной активности композиций 19-22 в испытании на стабильность в жестких условиях при 40°C;
Фигура 19 иллюстрирует изменения ферментативной активности в зависимости от изменений pH для рекомбинантных человеческих PH20 и HP46; и
Фигура 20 иллюстрирует результаты анализа фармакокинетики препарата герцептина для подкожного введения (Herceptin SC) и биологически подобного кандидата герцептина (трастузумаб + HP46; Herceptin SC BS) у 9-недельных крыс Спрег-Доули, где герцептин и биологически подобный кандидат Герцептина вводили по 18 мг/кг каждого, и композиция для подкожного введения содержала 100 единиц rHuPH20 и 100 единиц HP46 (при pH 5,3).
Подробное описание и примерные варианты осуществления
Если не указано иное, все используемые в настоящей заявке технические и научные термины имеют то же значение, которое понятно рядовым специалистом в области техники, к которой относится изобретение. В целом, номенклатура, используемая в настоящей заявке, хорошо известна и широко используется в данной области техники.
Вариант осуществления настоящего изобретения относится к фармацевтической композиции, включающей (а) лекарственное средство и (b) вариант PH20, и фармацевтическая композиция в соответствии с настоящим изобретением может использоваться для профилактики или лечения заболевания, и предпочтительно применяется для подкожного введения.
Вариант PH20 человека, включенный в фармацевтическую композицию согласно настоящему изобретению, имеет некоторые замены аминокислотных остатков в области, соответствующей области альфа-спирали и/или линкерной области, предпочтительно области альфа-спирали 8 (от S347 до C381), и/или линкерной области (от A333 до R346) между альфа-спиралью 7 и альфа-спиралью 8, более предпочтительно аминокислотной области между T341 и N363, и наиболее предпочтительно от T341 до I361, от L342 до I361, от S343 до I361, от I344 до I361, M345-I361 или M345-N363 в аминокислотной последовательности PH20 дикого типа (имеющей аминокислотную последовательность SEQ ID NO: 1), предпочтительно зрелого белка PH20 дикого типа (имеющего последовательность, состоящую из L36-S490 в аминокислотной последовательности SEQ ID NO: 1).
В настоящем изобретении «зрелый белок PH20 дикого типа» относится к белку, содержащему аминокислотные остатки от L36 до S490 из SEQ ID NO: 1, в которых отсутствуют от M1 до T35, которые образуют сигнальный пептид, и от A491 до L509, которые не связаны с основной функцией PH20 в аминокислотной последовательности PH20 дикого типа, имеющего последовательность SEQ ID NO: 1.
Таблица 1. Аминокислотная последовательность PH20 дикого типа (SEQ ID NO: 1)

В частности, вариант PH20 или его фрагмент, включенный в фармацевтическую композицию согласно настоящему изобретению, содержит одну или несколько мутаций, предпочтительно замен аминокислотных остатков, выбранных из группы, состоящей из S343E, M345T, K349E, L353A, L354I, N356E и I361T, и наиболее предпочтительно замены одной или нескольких аминокислотных остатков, выбранных из группы, состоящей из L354I и N356E, в PH20 дикого типа, имеющем последовательность SEQ ID NO: 1.
В настоящем изобретении термин «вариант PH20» предназначен для включения мутации некоторых аминокислотных остатков, предпочтительно замены аминокислотных остатков в последовательности PH20 человека дикого типа, а также делеции некоторых аминокислотных остатков на N-конце и/или C-конце вместе с такой заменой аминокислотных остатков, и используется по существу в том же значении, что и выражение «вариант PH20 или его фрагмент».
Авторы настоящего изобретения проверили новые варианты PH20 или их фрагменты с повышенной ферментативной активностью и термостабильностью по сравнению с PH20 дикого типа, обеспеченные посредством предыдущих исследований, основанных на экспериментальных результатах, в которых ферментативная активность и температура агрегации белка (Tagg) при нейтральном pH увеличиваются, когда аминокислотные последовательности области альфа-спирали 8 и линкерной области между альфа-спиралью 7 и альфа-спиралью 8 человеческого PH20 частично заменяют аминокислотными последовательностями области альфа-спирали 8 и линкерной области между альфа-спиралью 7 и альфа-спиралью 8 Hyal1 с высокой гидрофильностью.
Соответственно, вариант PH20, включенный в фармацевтическую композицию согласно настоящему изобретению, включает замены одного или нескольких аминокислотных остатков, выбранных из группы, состоящей из S343E, M345T, K349E, L353A, L354I, N356E и I361T, предпочтительно замены одного или нескольких аминокислотных остатков, выбранных из группы, состоящей из L354I и N356E, в аминокислотной последовательности PH20 дикого типа (имеющего аминокислотную последовательность SEQ ID NO: 1), предпочтительно зрелого белка PH20 дикого типа (имеющего последовательность, состоящую из L36-S490 в аминокислотной последовательности SEQ ID NO: 1),
в котором заменены один или несколько аминокислотных остатков в области, соответствующей области альфа-спирали и/или линкерной области, предпочтительно в области альфа-спирали 8 (от S347 до C381) и/или линкерной области (от A333 до R346) между альфа-спиралью 7 и альфа-спиралью 8, более предпочтительно в аминокислотной области, соответствующей T341-N363, T341-I361, L342-I361, S343-I361, I344-I361, M345-I361 или M345-N363.
В частности, в варианте PH20, включенном в фармацевтическую композицию согласно настоящему изобретению, область альфа-спирали 8 (от S347 до C381) и/или линкерная область (от A333 до R346) альфа-спирали 7 и альфа-спирали 8 из PH20 дикого типа, предпочтительно зрелого PH20 дикого типа, может быть замещена несколькими аминокислотными остатками в аминокислотной последовательности, соответствующей области Hyal1, имеющей последовательность SEQ ID NO: 51 (см. Таблицы 2 и 3), но настоящее изобретение этим не ограничивается.
Таблица 2. Аминокислотная последовательность Hyal1 дикого типа (SEQ ID NO: 51).

Более конкретно, вариант PH20 или его фрагмент, включенный в фармацевтическую композицию согласно настоящему изобретению, предпочтительно включает замену аминокислотного остатка L354I и/или N356E в аминокислотной последовательности PH20 дикого типа, предпочтительно зрелого PH20 дикого типа,
и предпочтительно дополнительно включает замену аминокислотного остатка в одном или нескольких положениях, выбранных из T341 до N363, особенно в одном или нескольких положениях, выбранных из группы, состоящей из T341, L342, S343, I344, M345, S347, M348, K349, L352, L353, D355, E359, I361 и N363, но настоящее изобретение этим не ограничивается, и
более предпочтительно, дополнительно включает одну или несколько замен аминокислотных остатков, выбранных из группы, состоящей из T341S, L342W, S343E, I344N, M345T, S347T, M348K, K349E, L352Q, L353A, D355K, E359D, I361T и N363G, но настоящее изобретение этим не ограничивается.
Предпочтительно вариант PH20 или его фрагмент, включенный в фармацевтическую композицию согласно настоящему изобретению, может включать замену аминокислотного остатка, выбранную из M345T, S347T, M348K, K349E, L352Q, L353A, L354I, D355K, N356E, E359D и I361T,
и может дополнительно включать замену одного или нескольких аминокислотных остатков, выбранных из группы, состоящей из T341S, L342W, S343E, I344N и N363G, но настоящее изобретение этим не ограничивается.
Более предпочтительно вариант PH20 или его фрагмент, включенный в фармацевтическую композицию согласно настоящему изобретению, может включать, без ограничения, любую замену, выбранную из следующих групп:
(а) T341S, L342W, S343E, I344N, M345T, S347T, M348K, K349E, L352Q, L353A, L354I, D355K, N356E, E359D и I361T;
(b) L342W, S343E, I344N, M345T, S347T, M348K, K349E, L352Q, L353A, L354I, D355K, N356E, E359D и I361T;
(c) M345T, S347T, M348K, K349E, L352Q, L353A, L354I, D355K, N356E, E359D и I361T;
(d) M345T, S347T, M348K, K349E, L352Q, L353A, L354I, D355K, N356E, E359D, I361T и N363G;
(e) I344N, M345T, S347T, M348K, K349E, L352Q, L353A, L354I, D355K, N356E, E359D и I361T; и
(f) S343E, I344N, M345T, S347T, M348K, K349E, L352Q, L353A, L354I, D355K, N356E, E359D и I361T.
В настоящем описании выражение, которое описывается однобуквенным кодом аминокислотного остатка вместе с числами, таким как «S347», означает аминокислотный остаток в соответствующем положении в аминокислотной последовательности SEQ ID NO: 1.
Например, «S347» означает, что аминокислотный остаток в положении 347 в аминокислотной последовательности SEQ ID NO: 1 представляет собой серин. Кроме того, «S347T» означает, что серин в положении 347 SEQ ID NO: 1 заменен на треонин.
Вариант PH20, включенный в фармацевтическую композицию согласно настоящему изобретению, интерпретируется как включающий варианты, в которых аминокислотный остаток в определенном положении аминокислотного остатка подвергнут консервативной замене.
Используемый в настоящей заявке термин «консервативная замена» относится к модификациям варианта PH20, которые включают замену одной или нескольких аминокислот аминокислотами, имеющими аналогичные биохимические свойства, которые не вызывают потери биологической или биохимической функции соответствующего варианта PH20.
«Консервативная аминокислотная замена» представляет собой замену, при которой аминокислотный остаток заменяется аминокислотным остатком, имеющим аналогичную боковую цепь. Семейства аминокислотных остатков, имеющих аналогичные боковые цепи, определены и хорошо известны в данной области техники. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин и гистидин), аминокислоты с кислыми боковыми цепями (например, аспарагиновую кислоту и глутаминовую кислоту), аминокислоты с незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин и цистеин), аминокислоты с неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин и триптофан), аминокислоты с бета-разветвленными боковыми цепями (например, треонин, валин и изолейцин) и аминокислоты с ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан и гистидин).
Ожидается, что вариант PH20, включенный в фармацевтическую композицию в соответствии с настоящим описанием, все еще сохранит свою активность, несмотря на наличие консервативных аминокислотных замен.
Кроме того, вариант PH20 или его фрагмент, включенный в фармацевтическую композицию согласно настоящему изобретению, интерпретируется как включающий варианты PH20 или их фрагменты, имеющие по существу такую же функцию и/или эффект, что и варианты PH20 или их фрагменты в соответствии с настоящим изобретением, и имеющий гомологию аминокислотной последовательности по меньшей мере 80% или 85%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95% и наиболее предпочтительно по меньшей мере 99% с вариантом PH20 или его фрагментом в соответствии с настоящим изобретением.
Варианты PH20 согласно настоящему изобретению имеют повышенные уровни экспрессии в клетках животных и повышенный уровень рефолдинга белка, тем самым повышая термостабильность по сравнению со зрелым белком PH20 дикого типа. Кроме того, ферментативная активность вариантов PH20 превышала или была сходной с активностью зрелого PH20 дикого типа, несмотря на повышение термостабильности.
Между тем, известно, что, когда некоторые аминокислоты на С-конце зрелого белка РН20 дикого типа, такие как S490, дополнительно отщепляются, ферментативная активность снижается, но варианты PH20 в соответствии с настоящим описанием показали повышенную термостабильность, и повышенную или аналогичную ферментативную активность по сравнению со зрелым PH20 дикого типа, даже если С-конец зрелого PH20 дикого типа имеет дополнительно отщепленную последовательность. Кроме того, варианты PH20 сохраняли свою ферментативную активность, когда до пяти аминокислотных остатков отщеплялись от N-концевых аминокислот, что указывает на то, что остатки, начинающиеся с P41 N-конца, играли важную роль в экспрессии белка и ферментативной активности.
Соответственно, вариант PH20, включенный в фармацевтическую композицию согласно настоящему изобретению, включает некоторые замены аминокислотных остатков в области альфа-спирали 8 (от S347 до C381) и/или в линкерной области (от A333 до R346) между альфа-спиралью 7 и альфа-спиралью 8 PH20 дикого типа и, кроме того, включает делеции некоторых аминокислотных остатков на C-конце и/или N-конце, но настоящее описание этим не ограничивается.
В одном варианте осуществления вариант PH20, включенный в фармацевтическую композицию согласно настоящему изобретению, может включать некоторые делеции аминокислотных остатков на N-конце, возникающие в результате расщепления перед аминокислотным остатком, выбранным из группы, состоящей из M1-P42 на N-конце аминокислотной последовательности SEQ ID NO: 1, предпочтительно перед аминокислотным остатком L36, N37, F38, R39, A40, P41 или P42, и/или делеции некоторых аминокислотных остатков на С-конце в результате расщепления после аминокислотного остатка, выбранного из группы, состоящей из V455-W509 на С-конце, предпочтительно после аминокислотного остатка, выбранного из группы, состоящей из V455-S490, и наиболее предпочтительно после аминокислотного остатка V455, C458, D461, C464, I465, D466, A467, F468, K470, P471, P472, M473, E474, T475, E476, P478, I480, Y482, A484, P486, T488 или S490.
Выражение «расщепление перед L36, N37, F38, R39, A40, P41 или P42 на N-конце» означает, соответственно, что все аминокислотные остатки от M1 до T35 непосредственно перед L36, все аминокислотные остатки от M1 до L36 непосредственно перед N37, все аминокислотные остатки от M1 до N37 непосредственно перед F38, все аминокислотные остатки от M1 до F38 непосредственно перед R39, все аминокислотные остатки от M1 до R39 непосредственно перед A40, все аминокислотные остатки от M1 до A40 непосредственно перед P41 или все аминокислотные остатки от M1 до P41 непосредственно перед P42 в аминокислотной последовательности SEQ ID NO: 1 отщепляются и удаляются. Выражение «расщепление перед M1 на N-конце SEQ ID NO: 1» означает, что на N-конце расщепления не происходит.
Кроме того, выражение «расщепление после V455, C458, D461, C464, I465, D466, A467, F468, K470, P471, P472, M473, E474, T475, E476, P478, I480, Y482, A484, P486, T488, или S490 на C-конце» означает расщепление и удаление аминокислотного остатка, следующего за V455, C458, D461, C464, I465, D466, A467, F468, K470, P472, M473, E474, T475, E476, P478, I480, Y482, A484, P486, T488 или S490, соответственно, в последовательности SEQ ID NO: 1. Например, расщепление после S490 означает расщепление между S490 и A491.
Предпочтительно вариант PH20 человека, включенный в фармацевтическую композицию согласно настоящему раскрытию, может иметь аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей SEQ ID NO: 5-50, более предпочтительно аминокислотной последовательности SEQ ID NO: 44, но настоящее изобретение этим не ограничивается. В вариантах PH20, сконструированных в конкретных вариантах осуществления согласно настоящему изобретению, последовательности замещенных или расщепленных аминокислот показаны в Таблице 4 ниже.















































Между тем, в предыдущих исследованиях сообщалось, что ферментативная активность PH20 дикого типа изменяется в зависимости от положений расщепления аминокислотных остатков, расположенных на С-конце. Однако в настоящем описании конкретная альфа-спираль, образующая вторичную структуру PH20, была заменена альфа-спиралью другой гиалуронидазы человека, с конструированием вариантов PH20, имеющих более высокую стабильность, чем PH20 дикого типа, и в этих вариантах взаимодействие между замещенным доменом альфа-спирали и другими вторичными структурами PH20 демонстрируют характер, отличный от характера PH20 дикого типа, так что варианты имеют определенный уровень ферментативной активности или более высокий, независимо от положения расщепления на С-конце.
Кроме того, в настоящем описании были предприняты попытки увеличить экспрессию рекомбинантного белка PH20 путем использования сигнального пептида других белков, демонстрирующих высокие уровни экспрессии белка в клетках животных, вместо исходного сигнального пептида PH20 человека.
Таким образом, в другом варианте осуществления вариант PH20, включенный в фармацевтическую композицию согласно настоящему изобретению, может включать на своем N-конце сигнальный пептид, полученный из гиалуронидазы-1 человека (Hyal1), гормона роста человека или сывороточного альбумина человека вместо сигнального пептида PH20 дикого типа, который состоит из M1-T35, и предпочтительно может включать, как показано в Таблице 5, сигнальный пептид, производный от гормона роста человека, имеющий аминокислотную последовательность MATGSRTSLLLAFGLLCLPWLQEGSA в соответствии с SEQ ID NO: 2, сигнальный пептид, производный от человеческого сывороточного альбумина, имеющий аминокислотную последовательность MKWVTFISLLFLFSSAYS согласно SEQ ID NO: 3, или сигнальный пептид, производный от Hyal1 человека, имеющий аминокислотную последовательность MAAHLLPICALFLTLLDMAQG согласно SEQ ID NO: 4, но настоящее изобретение этим не ограничивается.
Среди вариантов PH20, включенных в фармацевтическую композицию согласно настоящему изобретению, вариант, имеющий 6xHis-метку, прикрепленную к С-концу, был обозначен как HM, а вариант без 6xHis-метки был обозначен как HP. Кроме того, зрелый белок PH20 дикого типа (L36-S490) с 6xHis-меткой, прикрепленной к его C-концу, был обозначен как WT, а зрелый PH20 дикого типа (L36-Y482) без 6xHis-метки и в котором C-конец отщеплен после Y482, был обозначен как HW2.
HP46 (SEQ ID NO: 44) представляет собой вариант PH20 человека, полученный путем моделирования структуры белка с использованием Hyal1 (PDB ID: 2PE4) (Chao et al., 2007), который представляет собой гиалуронидазу человека с известной третичной структурой белка, с последующей заменой аминокислотной последовательности альфа-спирали 8 и линкерной области между альфа-спиралью 7 и альфа-спиралью 8 на аминокислотную последовательность Hyal1, и с расщеплением N-конца на F38 и расщеплением C-конца после F468. В частности, альфа-спираль 8 расположена вне третичной структуры белка PH20 и меньше взаимодействует с соседними альфа-спиралями или бета-цепями, чем другие альфа-спирали. Как правило, ферментативная активность и термостабильность имеют компромиссное соотношение между ними, и таким образом, чем выше термостабильность белка, тем ниже ферментативная активность, тогда как, когда ферментативная активность увеличивается из-за улучшения гибкости структуры белка, термостабильность имеет тенденцию к снижению. Однако удельная активность HP46, измеренная турбидиметрическим анализом при pH 7,0, составляла примерно 46 Ед./мкг, что, по оценкам, примерно в два раза выше, чем у PH20 дикого типа, где активность составила примерно 23 Ед./мкг.
Термостабильность белка может быть оценена на основе температуры плавления Tm, при которой денатурируется 50% третичной структуры белка, и температуры агрегации Tagg, при которой происходит агрегация между белками. Как правило, температура агрегации белка обычно ниже, чем его температура плавления. Альфа-спираль 8 Hyal1 проявляет большую гидрофильность, чем альфа-спираль 8 PH20. Замещенная альфа-спираль 8 Hyal1 увеличивает гидрофильность поверхности белка HP46, тем самым вызывая эффект задержки агрегации между белками, который происходит из-за гидрофобных взаимодействий, и, таким образом, температура агрегации составляет 51°C, что, как наблюдается, является увеличением на 4,5°C по сравнению с температурой агрегации PH20 дикого типа, которая составляет 46,5°C.
HP46 представляет собой вариант, в котором аминокислотные остатки в альфа-спирали 8 и линкерной области между альфа-спиралью 7 и альфа-спиралью 8 замещены, при этом T341 заменен на серин. Когда аминокислотный остаток 341 представляет собой треонин, активность фермента аналогична активности PH20 дикого типа, но при замене серином активность фермента увеличивается примерно в 2 раза, и было подтверждено, что даже в анализе на гелевом субстрате полученный вариант гидролизовал гиалуроновую кислоту в 5-6 раз больше, чем PH20 дикого типа. Анализ на геле в качестве субстрата включает процессы денатурации и рефолдинга белка, что означает, что рефолдинг третичной структуры белка и восстановление HP46 усиливаются по сравнению с PH20 дикого типа.
Количество варианта PH20 в фармацевтической композиции согласно настоящему изобретению составляет по меньшей мере 50 Ед./мл, предпочтительно в диапазоне от 100 Ед./мл до 20000 Ед./мл, более предпочтительно в диапазоне примерно от 150 Ед./мл до 18000 Ед./мл, еще более предпочтительно в диапазоне от 1000 Ед./мл до 16000 Ед./мл, и наиболее предпочтительно в диапазоне от 1500 Ед./мл до 12000 Ед./мл.
Примеры лекарственного средства, включенного в фармацевтическую композицию согласно настоящему изобретению, включают, без ограничения, белковые лекарственные средства, лекарственные средства на основе антител, малых молекул, аптамеров, препараты на основе РНК-интерференции, антисмысловых олигонуклеотидов и клеточных терапевтических агентов, таких как химерный антигенный рецептор (CAR)-T или CAR-естественный киллер (NK), и можно использовать не только коммерчески доступные в настоящее время лекарства, но и лекарства, проходящие клинические испытания или находящиеся в стадии разработки.
В качестве лекарственного средства предпочтительно можно использовать белковое лекарственное средство или лекарственное средство на основе антител.
«Белковое лекарственное средство», включенное в фармацевтическую композицию в соответствии с настоящим изобретением, представляет собой лекарственное средство, которое состоит из аминокислот, и таким образом, проявляет лечебный или профилактический эффект посредством активности белка, представляет собой лекарственное средство, состоящее из иного белка, чем лекарственное средство на основе антител, и может быть выбрано из группы, состоящей из цитокина, терапевтического фермента, гормона, растворимого рецептора и его гибридного белка, инсулина или его аналога, костного морфогенетического белка (BMP), эритропоэтина и сывороточного белка, но настоящее описание этим не ограничивается.
Цитокин, включенный в фармацевтическую композицию согласно настоящему изобретению, может быть выбран из группы, состоящей из интерферона, интерлейкина, колониестимулирующего фактора (CSF), фактора некроза опухоли (TNF) и фактора роста ткани (TGF), но настоящее изобретение этим не ограничивается.
Терапевтический фермент может включать β-глюкоцереброзидазу и агалсидазу-β, но не ограничивается ими.
Растворимый рецептор, включенный в фармацевтическую композицию согласно настоящему изобретению, представляет собой внеклеточный домен рецептора, а его гибридный белок представляет собой белок, в котором Fc-область или подобная область из антитела слита с растворимым рецептором. Растворимый рецептор представляет собой растворимую форму рецептора, с которой связывается ассоциированный с заболеванием лиганд, и его примеры включают форму, в которой область Fc слита с растворимым рецептором TNF-α (например, продукт, содержащий ингредиент этанерцепт, и аналогичные формы), форму, в которой область Fc слита с растворимым рецептором VEGF (продукт, содержащий ингредиент алефацепт и аналогичные ему формы), форму, в которой область Fc слита с CTLA-4 (например, продукт, содержащий ингредиент абатацепт или белатацепт и аналогичные им формы), форму, в которой область Fc слита с растворимым рецептором интерлейкина 1 (например, продукт, содержащий ингредиент рилонацепт и аналогичные ему формы), и форму, в которой область Fc слита с растворимым рецептором LFA3 (например, продукт, содержащий ингредиент алефацепт и аналогичные ему формы), но настоящее изобретение этим не ограничивается.
Гормон, включенный в фармацевтическую композицию согласно настоящему изобретению, относится к гормону, вводимому в организм, или его аналогу для лечения или профилактики заболеваний, вызванных дефицитом гормона и т.п., и их примеры включают гормон роста человека, эстроген и прогестерон, но не ограничиваются ими.
Белок сывороточного происхождения, включенный в фармацевтическую композицию согласно настоящему изобретению, представляет собой белок, присутствующий в плазме, и включает как белки, экстрагированные из плазмы, так и продуцируемые рекомбинантные белки, и их примеры могут включать фибриноген, фактор фон Виллебранда, альбумин, тромбин, фактор II (FII), фактор V (FV), фактор VII (FVII), фактор IX (FIX), фактор X (FX) и фактор XI (FXI), но не ограничиваются ими.
Лекарственное средство на основе антител, включенное в фармацевтическую композицию согласно настоящему изобретению, может быть лекарственным средством из моноклонального антитела или лекарственным средством из поликлонального антитела.
Лекарственное средство из моноклонального антитела согласно настоящему изобретению представляет собой белок, содержащий моноклональное антитело и фрагмент моноклонального антитела, которые способны специфически связываться с антигеном, ассоциированным с конкретным заболеванием. Моноклональное антитело также включает биспецифическое антитело, а белок, содержащий моноклональное антитело или его фрагмент, концептуально включает конъюгат антитело-лекарственное средство (ADC).
Примеры антигена, относящегося к конкретному заболеванию, включают 4-1BB, интегрин, бета-амилоид, ангиопоэтин (ангиопоэтин 1 или 2), аналог ангиопоэтина 3, В-клеточный активирующий фактор (BAFF), B7-H3, комплемент 5, CCR4, CD3, CD4, CD6, CD11a, CD19, CD20, CD22, CD30, CD33, CD38, CD52, CD62, CD79b, CD80, CGRP, клаудин-18, фактор комплемента D, CTLA4, DLL3, рецептор EGF, фактор гемофилии, рецептор Fc, FGF23, фолатный рецептор, GD2, GM-CSF, HER2, HER3, рецептор интерферона, гамма-интерферон, IgE, рецептор IGF-1, интерлейкин 1, рецептор интерлейкина 2, рецептор интерлейкина 4, интерлейкин 5, рецептор интерлейкина 5, интерлейкин 6, рецептор интерлейкина 6, интерлейкин 7, интерлейкин 12/23, интерлейкин 13, интерлейкин 17A, рецептор интерлейкина 17A, рецептор интерлейкина 31, рецептор интерлейкина 36, LAG3, LFA3, LAG3, LFA3, PVSK9, PD-1, PD-L1, RANK-L, SLAMF7, тканевой фактор, TNF, VEGF, рецептор VEGF и фактор фон Виллебранда (vWF), но настоящее изобретение этим не ограничивается.
Ниже перечислены, без ограничения, белки, включая моноклональные антитела или фрагменты моноклональных антител против антигенов, связанных с конкретным заболеванием:
утомилумаб как антитело против 4-1BB;
натализумаб, этролизумаб, ведолизумаб и бимагрумаб в качестве антител против интегрина;
бапинейзумаб, кренезумаб, соланезумаб, адуканумаб и гантенерумаб в качестве антител против бета-амилоида;
антитела против ангиопоэтина, такие как AMG780 против ангиопоэтина 1 и 2, MEDI 3617 и несвакумаб против ангиопоэтина 2 и вануцизумаб, который является биспецифическим антителом против ангиопоэтина 2 и VEGF;
эвинакумаб как антитело против аналога ангиопоэтина 3;
табалумаб, ланалумаб и белимумаб в качестве антител против фактора активации В-клеток (BAFF);
омбуртамаб как антитело против B7-H3;
равулизумаб и экулизумаб как антитела против комплемента 5;
могамулизумаб как антитело против CCR4;
отеликсизумаб, теплизумаб и муромонаб как антитела против CD3, тебентафусп как биспецифическое антитело против GP100 и CD3, блинатумомаб как биспецифическое антитело против CD19 и CD3, и REGN1979 как биспецифическое антитело против CD20 и CD3;
ибализумаб и занолимумаб как антитела против CD4;
итолизумаб как антитело против CD6;
эфализумаб как антитело против CD11a;
инебилизумаб, тафаситамаб и лонкастуксимаб тезирин, который представляет собой ADC, в качестве антител против CD19;
окрелизумаб, ублитуксимаб, обинутузумаб, офатумумаб, ритуксимаб, тозитумомаб и ибритумомаб тиуксетан, который представляет собой ADC, в качестве антител против CD20;
эпратузумаб, инотузумаб озогамицин, который представляет собой ADC, и моксетумомаб пасудотокс в качестве антител против CD22;
брентуксимаб ведотин в качестве ADC против CD30;
вадастуксимаб, талирин и гемтузумаб озогамицин в качестве ADC против CD33;
даратумумаб и изатуксимаб в качестве антител против CD38;
алемтузумаб как антитело против CD52;
кризанлизумаб как антитело против CD62;
полатузумаб ведотин в качестве ADC против CD79b;
галиксимаб как антитело против CD80;
эптинезумаб, фреманезумаб, галканезумаб и эренумаб в качестве антител против CGRP;
золбетуксимаб как антитело против клаудина-18;
лампализумаб как антитело против фактора комплемента D;
тремелимумаб, залифрелимаб и ипилимумаб в качестве антител против CTLA4;
ровалпитузумаб тезирин в качестве ADC против DLL3;
цетуксимаб, депатуксизумаб, залутумумаб, нецитумумаб и панитумумаб в качестве антител против рецептора EGF;
эмицизумаб как биспецифическое антитело против фактора коагуляции IX и фактора коагуляции X, которые являются факторами гемофилии;
нипокалимаб и розаноликсизумаб как антитела против рецептора Fc;
буросумаб как антитело против FGF23;
фарлетузумаб как антитело против фолатного рецептора и мирветуксимаб соравтанзин как ADC против фолатного рецептора;
динутуксимаб и накситамаб как антитела против GD2;
отилимаб как антитело против GM-CSF;
маргетуксимаб, пертузумаб и трастузумаб в качестве антител против HER2 и трастузумаб дерукстекан, трастузумаб эмтанзин и трастузумаб дуокармазин в качестве ADC против HER2;
патритумаб как антитело против HER3;
анифролумаб как антитело против рецептора интерферона;
эмапалумаб как антитело против гамма-интерферона;
лигелизумаб и омализумаб как антитела против IgE;
далотузумаб, фигитумумаб и тепротумумаб в качестве антител против рецептора IGF-1;
гебокизумаб и канакинумаб как антитела против интерлейкина 1;
даклизумаб и базиликсимаб как антитела против рецептора интерлейкина 2;
дупилумаб как антитело против рецептора интерлейкина 4;
меполизумаб и реслизумаб как антитела против интерлейкина 5;
бенрализумаб как антитело против рецептора интерлейкина 5;
клазакизумаб, олокизумаб, сирукумаб и силтуксимаб в качестве антител против интерлейкина 6;
сарилумаб, сатрализумаб, тоцилизумаб и REGN88 в качестве антител против рецептора интерлейкина 6;
секукинумаб как антитело против интерлейкина 7;
устекинумаб и бриакинумаб как антитела против интерлейкина 12/23;
лебрикизумаб и тралокинумаб как антитела против интерлейкина 13;
иксекизумаб и бимекизумаб как антитела против интерлейкина 17А;
бродалумаб как антитело против рецептора интерлейкина 17А;
бразикумаб, гуселкумаб, рисанкизумаб, тилдракизумаб и мирикизумаб в качестве антител против интерлейкин 23;
немолизумаб как антитело против рецептора интерлейкина 31;
спезолимаб как антитело против рецептора интерлейкина 36;
релатлимаб как антитело против LAG3;
нарсоплимаб как антитело против NASP2;
фасинумаб и танезумаб как антитела против NGF;
алирокумаб, эволокумаб и бокоцизумаб в качестве антител против PVSK9;
ламбролизумаб, балстилимаб, камрелизумаб, цемиплимаб, достарлимаб, пролголимаб, шинтилимаб, спартализумаб, тислелизумаб, пембролизумаб и ниволумаб в качестве антител против PD-1;
атезолизумаб, авелумаб, энвафолимаб и дурвалумаб в качестве антител против PD-L1 и бинтрафусп альфа в качестве биспецифических антител против TGF бета и PD-L1;
деносумаб как антитело против RANK-L;
элотузумаб как антитело против SLAMF7;
концизумаб и марстацимаб как антитела против тканевого фактора;
антитела против TNF, в частности TNFα, включая инфликсимаб, адалимумаб, голимумаб, фрагмент антитела цертолизумаб пегол и озорализумаб, который является биспецифическим антителом против TNF и альбумина;
антитела против VEGF, включая бролуцизумаб, ранибизумаб, бевацизумаб и фарицимаб, которые являются биспецифическими антителами против VEGF и Ang2;
рамуцирумаб как антитело против рецептора VEGF; и
каплацизумаб как антитело против vWF.
Между тем, сверхэкспрессия рецептора 2 эпидермального фактора роста человека (HER2), которая способствует делению клеток, наблюдается примерно у 20-25% пациентов с раком молочной железы, и рак молочной железы при сверхэкспрессии HER2-рецептора быстро прогрессирует, является агрессивным и имеет низкий ответ на химиотерапию по сравнению с раком молочной железы с низким уровнем экспрессии HER2, и, следовательно, его прогноз является неблагоприятным. Трастузумаб, который представляет собой лекарственное средство на основе моноклонального антитела, нацеленного на HER2, специфически связывается с HER2 на поверхности сверхэкспрессирующих HER2 раковых клеток, подавляя передачу сигнала репликации и пролиферации клеток, тем самым замедляя прогрессирование опухоли. Трастузумаб был одобрен Управлением по контролю за продуктами питания и лекарствами США (FDA) в 1998 году для лечения рака молочной железы в США, а в 2003 году - Управлением по контролю за продуктами питания и лекарствами Кореи (KFDA). С тех пор эффективность трастузумаба была также признана при раке желудка со сверхэкспрессией HER2, и поэтому его использовали в качестве терапевтического агента при раке желудка.
Состав герцептина для внутривенной инъекции компании Roche (коммерческое название: Herceptin) состоит из 440 мг трастузумаба в качестве основного ингредиента, и лиофилизированный трастузумаб смешивают с физиологическим раствором и вводят внутривенно. С другой стороны, состав трастузумаба для подкожной инъекции (коммерческое название Herceptin SC) представляет собой жидкий состав объемом 5 мл и содержит 600 мг (120 мг/мл) трастузумаба в качестве основного ингредиента, и включает в качестве добавок 20 мМ гистидина (pH 5,5), 210 мМ трегалозы, 10 мМ метионина, 0,04% полисорбата 20 и 10000 единиц rHuPH20 (2000 Ед./мл, 0,004%, 40 мкг/мл).
Срок годности препаратов герцептина для подкожного введения составляет 21 месяц. Композиция трастузумаба для внутривенного введения находится в лиофилизированной форме и имеет срок хранения 30 месяцев, а композиция трастузумаба для подкожного введения находится в жидкой форме и имеет короткий срок хранения, составляющий 21 месяц. По этой причине можно определить, что стабильность одного или более из трастузумаба и рекомбинантной гиалуронидазы человека PH20 в жидких препаратах ограничена.
В этом контексте в настоящем изобретении, с учетом характеристик варианта PH20 согласно настоящему изобретению, где по сравнению с гиалуронидазой человека дикого типа PH20 и рекомбинантным PH20 человека, доступным от Halozyme, вариант PH20 не только имеет повышенную ферментативную активность, но также имеет высокую измеренную температуру агрегации белка, таким образом демонстрируя повышенную термостабильность, срок хранения препарата для подкожной инъекции установлен на длительный период, предпочтительно 21 месяц или более.
Содержание лекарственного антитела в фармацевтической композиции согласно настоящему изобретению может находиться в диапазоне от 5 мг/мл до 500 мг/мл, предпочтительно от 20 мг/мл до 200 мг/мл, более предпочтительно от 100 мг/мл до 150 мг/мл, и наиболее предпочтительно 120±18 мг/мл, например, приблизительно 110 мг/мл, приблизительно 120 мг/мл или приблизительно 130 мг/мл.
Поликлональное антитело, включенное в фармацевтическую композицию согласно настоящему изобретению, предпочтительно представляет собой сывороточное антитело, экстрагированное из сыворотки, такое как иммуноглобулин, но не ограничивается этим.
В случае низкомолекулярного соединения любое лекарство, которое требует быстрого действия для профилактики или лечения, может использоваться без ограничений. Например, можно использовать обезболивающие на основе морфина (Thomas et al., 2009). Кроме того, при использовании в качестве терапевтического средства при некрозе тканей, вызванном противораковыми препаратами, низкомолекулярное соединение можно использовать отдельно или в комбинации с антидотными препаратами, такими как алкалоиды барвинка и таксаны (Kreidieh et al., 2016).
Фармацевтическая композиция согласно настоящему изобретению может дополнительно включать один или несколько компонентов, выбранных из группы, состоящей из буфера, стабилизатора и поверхностно-активного вещества.
Буфер, включенный в композицию в соответствии с настоящим изобретением, можно использовать без ограничения, при условии, что он обеспечивает достижение pH от 4 до 8, предпочтительно от 5 до 7, и буфер предпочтительно представляет собой один или несколько буферов, выбранных из группы, состоящей из малата, формиата, цитрата, ацетата, пропионата, пиридина, пиперазина, какодилата, сукцината, 2-(N-морфолино)этансульфоновой кислоты (MES), гистидина, Трис, бис-Трис, фосфата, этаноламина, карбоната, пиперазин-N,N'-бис(2-этансульфоновой кислоты) (PIPES), имидазола, бис-Трис пропана, N,N-бис(2-гидроксиэтил)-2-аминоэтансульфоновой кислоты (BES), 3-(N-морфолино)пропансульфоновой кислоты) (MOPS), гидроксиэтилпиперазинэтансульфоновой кислоты (HEPES), пирофосфата и триэтаноламина, более предпочтительно гистидиновый буфер, например L-гистидин/HCl, но не ограничивается этим.
Концентрация буфера может находиться в диапазоне от 0,001 до 200 мМ, предпочтительно от 1 мМ до 50 мМ, более предпочтительно от 5 мМ до 40 мМ и наиболее предпочтительно от 10 мМ до 30 мМ.
Стабилизаторы в композиции согласно настоящему изобретению можно использовать без ограничения, если они обычно используются в данной области для стабилизации белков, и предпочтительно стабилизаторы могут быть, например, одним или несколькими стабилизаторами, выбранными из группы состоящий из углеводов, сахаров или их гидратов, сахароспиртов или их гидратов, и аминокислот.
Углеводы, сахара или сахароспирты, используемые в качестве стабилизатора, могут быть одним или несколькими, выбранными из группы, состоящей из трегалозы или ее гидратов, сахарозы, сахарина, глицерина, эритритола, треитола, ксилитола, арабитола, рибитола, маннитола, сорбитола, галактитола, фуцитола, идитола, инозитола, волемитола, изомальта, мальтитола, полиглицитола, циклодекстрина, гидроксилпропилциклодекстрина и глюкозы, но не ограничиваются ими.
Аминокислота может быть одной или несколькими аминокислотами, выбранными из группы, состоящей из глутамина, глутаминовой кислоты, глицина, лизина, лизилизина, лейцина, метионина, валина, серина, селенометионина, цитруллина, аргинина, аспарагина, аспарагиновой кислоты, орнитина, изолейцина, таурина, теанина, треонина, триптофана, тирозина, фенилаланина, пролина, пирролизина, гистидина и аланина, но не ограничиваются ими.
Концентрация сахаров или сахароспиртов, используемых в качестве стабилизатора в фармацевтической композиции в соответствии с настоящим описанием, может находиться в диапазоне от 0,001 мМ до 500 мМ, предпочтительно от 100 мМ до 300 мМ, более предпочтительно от 150 мМ до 250 мМ и наиболее предпочтительно от 180 мМ до 230 мМ и, в частности, может составлять около 210 мМ.
Кроме того, концентрация аминокислот, используемых в качестве стабилизатора в фармацевтической композиции согласно настоящему изобретению, может находиться в диапазоне от 1 мМ до 100 мМ, предпочтительно от 3 мМ до 30 мМ, более предпочтительно от 5 мМ до 25 мМ и наиболее предпочтительно от 7 мМ до 20 мМ, и в частности, может находиться в диапазоне от 8 мМ до 15 мМ.
Композиция согласно изобретению может дополнительно включать поверхностно-активное вещество.
Предпочтительно поверхностно-активное вещество может быть неионным поверхностно-активным веществом, таким как сложный эфир полиоксиэтилен-сорбитана и жирной кислоты (полисорбат или Твин), полиэтилен-полипропиленгликоль, полиоксиэтиленстеарат, полиоксиэтиленалкиловые эфиры, например, монолауриловый эфир полиоксиэтилена, алкилфенилполиоэтиленовый эфир [Тритон-X], и сополимер полиоксиэтилена-полиоксипропилена [Полоксамер и Плюроник] и додецилсульфат натрия (SDS), но не ограничивается этим.
Более предпочтительно можно использовать полисорбат. Полисорбат может представлять собой полисорбат 20 или полисорбат 80, но не ограничивается этим.
Концентрация неионного поверхностно-активного вещества в фармацевтической композиции согласно настоящему изобретению может находиться в диапазоне от 0,0000001% (масс./об.) до 0,5% (масс./об.), предпочтительно от 0,000001% (масс./об.) до 0,4% (масс./об.), более предпочтительно от 0,00001% (масс./об.) до 0,3% (масс./об.) и наиболее предпочтительно от 0,001% (масс./об.) до 0,2% (масс./об.).
В одном варианте осуществления фармацевтическая композиция согласно настоящему изобретению может включать 50-350 мг/мл антитела, например, антитела против HER2 или антитела против иммунной контрольной точки, гистидиновый буфер, обеспечивающий pH 5,5±2,0; 10-400 мМ α,α-трегалозы, 1-50 мМ метионина и от 0,0000001% (масс./об.) до 0,5% (масс./об.) полисорбата.
В более конкретном варианте осуществления фармацевтическая композиция согласно настоящему изобретению может включать 120 мг/мл антитела против HER2 или антитела против иммунной контрольной точки, 20 мМ гистидинового буфера, который обеспечивает pH 5,5 ± 2,0; 210 мМ α,α-трегалозы, 10 мМ метионина и 2000 Ед./мл варианта PH20, и может дополнительно включать от 0,005% (масс./об.) до 0,1% (масс./об.) полисорбата.
Фармацевтическая композиция согласно настоящему изобретению может применяться посредством внутривенного введения, подкожного введения, внутримышечного введения, интраперитонеального введения, эндотелиального введения, местного введения, интраназального введения, внутрилегочного введения, интраректального введения и т.п., и подкожное введение предпочтительно осуществляют посредством подкожной инъекции; и наиболее предпочтительно использовать фармацевтическую композицию в качестве инъекционного препарата для подкожного введения.
Таким образом, другой вариант осуществления настоящего изобретения обеспечивает состав, включающий фармацевтическую композицию согласно настоящему изобретению, предпочтительно состав для подкожной инъекции.
Инъекционный состав для подкожной инъекции может быть предоставлен в форме, готовой к инъекции без дополнительного процесса разбавления, и может быть обеспечен помещенным в предварительно заполненный шприц, стеклянную ампулу или пластиковый контейнер.
Настоящее изобретение также относится к способу лечения заболевания с использованием фармацевтической композиции или препарата в соответствии с настоящим изобретением.
Заболевание, которое можно лечить с использованием фармацевтической композиции или состава согласно настоящему изобретению, конкретно не ограничено, и нет никаких ограничений, если это заболевание, которое можно лечить с помощью лекарственного средства, используемого в комбинации с вариантом PH20 согласно настоящему изобретению.
Заболевание, которое можно лечить с использованием фармацевтической композиции или состава в соответствии с настоящим описанием, может представлять собой рак или аутоиммунное заболевание, но не ограничивается этим.
Рак или карцинома, которые можно лечить фармацевтической композицией или составом в соответствии с настоящим изобретением, особо не ограничивается и включает как солидные раковые заболевания, так и гемобластозы. Примеры таких видов рака включают рак кожи, такой как меланома, рак печени, гепатоцеллюлярную карциному, рак желудка, рак молочной железы, рак легких, рак яичников, рак бронхов, рак носоглотки, рак гортани, рак поджелудочной железы, рак мочевого пузыря, колоректальный рак, рак толстой кишки, рак шейки матки, опухоль головного мозга, рак простаты, рак костей, рак щитовидной железы, рак паращитовидной железы, рак почки, рак пищевода, рак желчных путей, рак яичек, рак прямой кишки, рак головы и шеи, рак шейки матки, рак мочеточника, остеосаркому, нейробластому, фибросаркому, рабдомиосаркому, астроцитому, нейробластому и глиому, но не ограничиваются ими. Предпочтительно рак, который можно лечить с использованием фармацевтической композиции или состава по настоящему изобретению, может быть выбран из группы, состоящей из рака желудка, колоректального рака, рака молочной железы, рака легких и рака почки, но не ограничивается этим.
Аутоиммунные заболевания, которые можно лечить фармацевтической композицией или составом в соответствии с настоящим изобретением, включают ревматоидный артрит, астму, псориаз, рассеянный склероз, аллергический ринит, болезнь Крона, язвенный колит, системную эритематозную волчанку, диабет I типа, воспалительное заболевание кишечника (ВЗК) и атопический дерматит, но не ограничиваются этим.
Настоящее изобретение также обеспечивает способ лечения заболевания, включающий применение фармацевтической композиции или состава согласно настоящему изобретению у субъекта, нуждающегося в лечении, и настоящее изобретение дополнительно обеспечивает применение фармацевтической композиции или состава согласно настоящему изобретению для лечения болезни.
Если здесь не определено иное, технические термины и научные термины, используемые в настоящем описании, имеют значения, обычно понятные специалистам в данной области техники. Кроме того, будут опущены повторяющиеся описания той же технической конфигурации и работы, что и в предшествующем уровне техники.
В дальнейшем настоящее изобретение будет описано более подробно со ссылкой на следующие примеры. Эти примеры предоставлены только для иллюстративных целей, и для специалистов в данной области техники будет очевидно, что эти примеры не следует истолковывать как ограничивающие объем настоящего изобретения.
Примеры
Пример 1. Разработка композиции
Были приготовлены четыре композиции трастузумаба для подкожного введения, как показано в Таблице 6. Ко позиции 1-4 в целом содержат 120 мг/мл трастузумаба и состоят из 20 мМ гистидина/гистидин-HCl (pH 5,5), 210 мМ трегалозы, 10 мМ метионина и варианта PH20. Разница между композициями 1-4 заключается в концентрации неионного поверхностно-активного вещества, где композиция 1 содержит 0% полисорбата 20, композиция 2 содержит 0,005% полисорбата 20, состав 3 композиция содержит 0,04% полисорбата 20, и композиция 4 содержит 0,1% полисорбата 20.
Пример 2. Анализ с помощью спектрофотометра
Композиции с 1 по 4 оставляли на 14 дней при 45°C, и изменения концентрации белка анализировали с использованием спектрофотометра, произведенного Beckman. Каждый образец разбавляли дистиллированной водой так, чтобы концентрация образца составляла 0,4 мг/мл, а затем измеряли поглощение белка при 280 нм с помощью спектрофотометра. В испытании на стабильность в жестких условиях, то есть при 45°C в течение 14 дней, не было значительного изменения концентрации белка в композициях 1-4. Однако активность гиалуронидазы быстро снижалась при 45°C, и таким образом, в настоящем примере ферментативную активность не измеряли (см. фиг.6).
Пример 3. Исследование соотношения мономеров трастузумаба в каждой композиции с использованием эксклюзионной хроматографии
Для анализа методом эксклюзионной хроматографии использовали систему ВЭЖХ от Shimadzu Prominence, и колонку TSK-gel G3000SWXL (7,8 × 300 мм, 5 мкм) и предколонку TSK (6,0 × 4,0 мм, 7 мкм). В качестве подвижной фазы использовали 0,2 М фосфат калия (pH 6,2), содержащий 0,25 М хлорид калия. Анализ выполняли в течение 35 минут в режиме изократического разделения при скорости потока 0,5 мл/мин. Образец разбавляли аналитическим растворителем так, чтобы конечная концентрация составляла 10 мг/мл, и после введения 20 мкл в колонку для ВЭЖХ регистрировали поглощение при 280 нм элюата колонки. Рассчитывали соотношение мономеров трастузумаба на хроматограмме ВЭЖХ и строили график.
При проведении гель-хроматографического анализа в испытании на стабильность в жестких условиях, то есть при 45°C в течение 14 дней, композиции 1-4 показали аналогичные закономерности изменений. Основными изменениями было увеличение продуктов разложения с высокой молекулярной массой (HMW) и с низкой молекулярной массой (LMW) и уменьшение содержания мономера (около 1,5%), и не было существенной разницы в зависимости от состава. В заключение следует отметить, что в результате проведения анализа методом эксклюзионной хроматографии в испытании на стабильность в жестких условиях, то есть при 45°C, не было значительных различий в профилях стабильности между композициями в зависимости от концентрации полисорбата 20 (0-0,1% (масс./об.)) (см. фиг.1).
Пример 4. Измерение температуры агрегации белков композиций, содержащих трастузумаб и HP46
Динамическое рассеяние света (DLS) используется для анализа денатурационных свойств белков, связанных с нагреванием. В настоящем эксперименте изменение размера белковой молекулы в соответствии с изменением температуры было измерено и использовано для расчета температуры агрегации белка. Для анализа DLS использовали прибор Zetasizer-nano-ZS от Malvern, и кварцевую кювету (ZEN2112). В процессе анализа температуру повышали с 25°C до 85°C с интервалом в 1°C, и образец разбавляли до 1 мг/мл с использованием каждого буфера для композиций, а затем 150 мкл образца добавляли в кювету для анализа.
Температура агрегации в композиции 1, не содержащей полисорбат 20, составила 74°C, а температура агрегации в композициях 2-4 составила 76°C (см. фиг.2).
Пример 5. Анализ с помощью WCX-хроматографии композиций, содержащих трастузумаб и HP46
Для хроматографического анализа WCX использовали систему ВЭЖХ, доступную от Shimadzu Prominence, а в качестве колонок - колонку TSKgel CM-STAT (4,6 x 100 мм, 7 мкм), и предколонку TSKgel CMSTAT (3,2 мм, внутренний диаметр x 1,5 см) и т.п. Подвижная фаза A представляла собой 10 мМ фосфат натрия (pH 7,5), а подвижная фаза B - 10 мМ фосфат натрия (pH 7,2), содержащий 0,1 M NaCl. Анализ проводили в течение 55 минут с линейным градиентом концентрации 0-30% подвижной фазы B при скорости потока 0,8 мл/мин. Образец разбавляли подвижной фазой А так, чтобы конечная концентрация составляла 1,0 мг/мл, 80 мкл образца вводили в ВЭЖХ, а затем регистрировали поглощение колоночного элюата при 280 нм. Рассчитывали соотношение мономеров трастузумаба на хроматограмме ВЭЖХ и строили график.
Композиции 1-4 показали аналогичный характер изменений, когда анализ WCX выполняли в испытании на стабильность в жестких условиях, то есть при 45°C в течение 14 дней. Конкретные изменения включают увеличение относительного содержания кислых вариантов (изменение примерно на 30% за 14 дней), уменьшение относительного содержания главного пика (изменение примерно на 44% за 14 дней) и увеличение относительного содержания основных вариантов (изменение примерно на 15% за 14 дней), и не было значительной разницы в зависимости от состава. В заключение, в анализе WCX в испытании на стабильность в жестких условиях, то есть при 45°C, стабильность белка в соответствии с полисорбатом 20 (0-0,1%) была аналогичной (см. фиг.3).
Пример 6. Разработка композиций
Готовили три типа композиций трастузумаба для подкожного введения, как описано в таблице 7. Композиции с 5 по 7 в целом включали 120 мг/мл трастузумаба, 20 мМ гистидин/гистидин-HCl (pH 5,5), 210 мМ трегалозы, 10 мМ метионина и HP46. Разница между композициями 5-7 заключается в ингредиенте - стабилизаторе 3: композиция 5 - 0,04% полисорбат 20, композиция 6 - 50 мМ Лиз-Лиз, и композиция 3 - глицин.
Пример 7. Анализ с помощью спектрофотометра
Композиции 5-7 оставляли на 14 дней при 45°C, и изменения концентрации белка анализировали с использованием спектрофотометра, произведенного Beckman. Каждый образец разбавляли дистиллированной водой так, чтобы концентрация образца составляла 0,4 мг/мл, а затем измеряли поглощение белка при 280 нм с помощью спектрофотометра. В испытании на стабильность в жестких условиях, то есть при 45°C в течение 14 дней, не было значительного изменения концентрации белка в композициях 5-7. Однако активность гиалуронидазы быстро снижалась при 45°C, и поэтому в настоящем примере ферментативную активность не измеряли (см. фиг.6).
Пример 8. Исследование соотношения мономеров трастузумаба в каждой композиции с использованием эксклюзионной хроматографии
Для анализа методом эксклюзионной хроматографии использовали систему ВЭЖХ от Shimadzu Prominence, с использованием колонки TSK-gel G3000SWXL (7,8 × 300 мм, 5 мкм) и предколонки TSK (6,0 × 4,0 мм, 7 мкм). В качестве подвижной фазы использовали 0,2 М фосфат калия (pH 6,2), содержащий 0,25 М хлорид калия. Применяли режим изократического разделения при скорости потока 0,5 мл/мин в течение 35 минут. Образец разбавляли аналитическим растворителем так, чтобы конечная концентрация составляла 10 мг/мл, и после введения 20 мкл образца в колонку для ВЭЖХ измеряли оптическую плотность при 280 нм. Рассчитывали соотношение мономеров трастузумаба на хроматограмме ВЭЖХ и строили график.
Когда гель-хроматографический анализ выполняли в испытании на стабильность в жестких условиях, то есть при 45°C в течение 14 дней, композиции 5-7 показали аналогичные закономерности изменений. Основными изменениями были увеличение высокомолекулярных (HMW) и низкомолекулярных (LMW) примесей и уменьшение содержания мономера (около 1,5%), и не было существенной разницы в зависимости от состава. В заключение, в результате проведения гель-хроматографического анализа в испытании на стабильность в жестких условиях, то есть при 45°C, аналогичная стабильность белка была показана в композициях с 0,04% полисорбата 20, 50 мМ Лиз-Лиз и 50 мМ глицина. (см. фиг.4).
Пример 9. WCX-хроматографический анализ композиций, содержащих трастузумаб и HP46
Для хроматографического анализа WCX использовали систему ВЭЖХ от Shimadzu Prominence, и в качестве колонок использовали TSK-gel CM-STAT (4,6 x 100 мм, 7 мкм), предколонку TSK-gel CMSTAT (3,2 мм, внутренний диаметр x 1,5 см) и т.п. Подвижная фаза A представляла собой 10 мМ фосфат натрия (pH 7,5), а подвижная фаза B - 10 мМ фосфат натрия (pH 7,2), содержащий 0,1 M NaCl. Анализ выполняли в течение 55 минут с применением режима разделения с линейным градиентом концентрации 0-30% при скорости потока 0,8 мл/мин. Образец разбавляли подвижной фазой А так, чтобы конечная концентрация составляла 1,0 мг/мл, 80 мкл образца вводили в ВЭЖХ, а затем регистрировали поглощение при 280 нм. Рассчитывали соотношение мономеров трастузумаба на хроматограмме ВЭЖХ и строили график.
Композиции 5-7 показали аналогичный характер изменений, когда анализ WCX выполняли в испытании на стабильность в жестких условиях, то есть при 45°C в течение 14 дней. Конкретные изменения включают увеличение относительного содержания кислых вариантов (изменение примерно на 30% за 14 дней), уменьшение относительного содержания главного пика (изменение примерно на 44% за 14 дней) и увеличение относительного содержания основных вариантов. (изменение примерно на 15% за 14 дней), и не было значительной разницы в зависимости от состава. В заключение, в результате выполнения анализа WCX в испытании на стабильность в жестких условиях, то есть при 45°C, аналогичная стабильность белка была показана в композициях с 0,04% полисорбата 20, 50 мМ Лиз-Лиз и 50 мМ глицина (см. фиг.5).
Пример 10. Оценка стабильности HP46 в соответствии с температурами 40°C и 45°C в композициях трастузумаба и HP46 для подкожного введения
Для оценки стабильности HP46 в композициях для подкожного введения из трастузумаба смешивали трастузумаб (120 мг/мл) и PH20 (2000 Ед./мл). В это время использованный буфер содержал 20 мМ гистидина (pH 5,5), 210 мМ трегалозу, 10 мМ метионина и 0,04% полисорбата 20. Ферментативную активность контрольного образца измеряли в день 0, и экспериментальные образцы оставляли при 40°C или 45°C в течение 1 дня, а затем измеряли ферментативную активность каждого образца.
Каждый из препаратов из герцептина для подкожного введения, трастузумаб + HW2 и трастузумаб + HP46 оставляли при 40°C на 1 день, а затем измеряли активность гиалуронидазы, и в результате соответствующие образцы показали активность 51%, 47% и 94%, что указывает на то, что HP46 имел наибольшую термостабильность при 40°C (см. фиг.6). Далее, препараты герцептин для подкожного введения, трастузумаб + HW2 и трастузумаб + HP46 оставляли при 45°C в течение 1 дня, а затем измеряли активность гиалуронидазы, и в результате герцептин для подкожного введения и трастузумаб + HW2 не проявляли ферментативной активности, но ферментативная активность препарата трастузумаб + HP46 сохранялась (см. фиг.6).
Пример 11. Разработка композиций
Готовили три препарата трастузумаба для подкожного введения, как показано в Таблице 8. Композиции 8-10 в целом содержали 120 мг/мл трастузумаба, 20 мМ гистидин/гистидин-HCl (pH 5,5); 210 мМ трегалозы, 10 мМ метионина и вариант PH20. Разница между композициями 8-10 заключается в концентрации неионного поверхностно-активного вещества, где композиция 8 содержит 0% полисорбата 20, композиция 9 - 0,005% полисорбата 20, и композиция 10 - 0,04% полисорбата 20.
Пример 12. Анализ с использованием спектрофотометра
Композиции с 8 по 10 оставляли на 14 дней при 40°C, и изменения концентрации белка анализировали с использованием спектрофотометра, произведенного Beckman. Каждый образец разбавляли дистиллированной водой так, чтобы концентрация образца составляла 0,4 мг/мл, а затем измеряли поглощение белка при 280 нм с помощью спектрофотометра. В испытании на стабильность в жестких условиях, то есть при 40°C в течение 14 дней, не было значительного изменения концентрации белка в композициях 8-10.
Пример 13. Анализ соотношения мономеров трастузумаба в каждой композиции с использованием эксклюзионной хроматографии
Для анализа методом эксклюзионной хроматографии использовали систему ВЭЖХ, доступную от Shimadzu Prominence, и в качестве колонок использовали TSK-gel G3000SWXL (7,8 × 300 мм, 5 мкм) и предколонку TSK (6,0 × 4,0 мм, 7 мкм). В качестве подвижной фазы использовали 0,2 М фосфат калия (pH 6,2), содержащий 0,25 М хлорид калия. Анализ выполняли в течение 35 минут в режиме изократического разделения при скорости потока 0,5 мл/мин. Образец разбавляли аналитическим растворителем так, чтобы конечная концентрация составляла 10 мг/мл, и после введения 20 мкл образца в колонку для ВЭЖХ измеряли оптическую плотность при 280 нм. Рассчитывали соотношение мономеров трастузумаба на хроматограмме ВЭЖХ и строили график.
Когда гель-хроматографический анализ выполняли в испытании на стабильность в жестких условиях, то есть при 40°C в течение 14 дней, композиции 8-10 показали аналогичные закономерности изменений. Основные изменения заключались в увеличении количества продуктов разложения с высокой молекулярной массой (HMW) и с низкой молекулярной массой (LMW), и снижении содержания мономера (примерно менее 1,0%), и не было существенной разницы в зависимости от состава. В заключение, в результате проведения анализа методом эксклюзионной хроматографии в испытании на стабильность в жестких условиях, то есть при 40°C, не было значительных различий в профилях стабильности между композициями в зависимости от концентрации (0-0,04%) полисорбата 20 (см. фиг.7).
Пример 14. Измерение температуры агрегации белков для композиций, содержащих трастузумаб и HP46
Динамическое рассеяние света (DLS) используется для анализа денатурационных свойств белков, связанных с нагреванием в области белковых лекарств. В настоящем эксперименте изменение размера белковой молекулы в соответствии с изменением температуры было измерено и использовано для расчета температуры агрегации белка. Для анализа DLS использовали прибор Zetasizer-nano-ZS от Malvern, и кварцевую кювету (ZEN2112). В процессе анализа температуру повышали с 25°C до 85°C с интервалом в 1°C, и образец разбавляли до 1 мг/мл с использованием каждого буфера для композиции, а затем 150 мкл образца добавляли в кювету для анализа.
Температура агрегации в композиции 8, не содержащей полисорбат 20, составила 78,3°C, композиция 9 показала температуру агрегации 77,3°C, а композиция 10 показала температуру агрегации 77,7°C. В примере 13 не было показано никаких изменений в соотношении мономеров в белке, несмотря на то, что он не содержал полисорбат 20, и в результате сравнения случая отсутствия полисорбата 20 со случаем, когда он содержал полисорбат 20, было подтверждено, что не было никакой разницы в агрегации между белками. Эти результаты показывают, что минимальное количество полисорбата 20 не обязательно требуется для препаратов трастузумаба для подкожного введения (см. фиг.8).
Пример 15. WCX-хроматографический анализ композиций, содержащих трастузумаб и HP46
Для хроматографического анализа WCX использовали систему ВЭЖХ от Shimadzu Prominence, а в качестве колонок использовали колонку TSKgel CM-STAT (4,6 x 100 мм, 7 мкм), предколонку TSKgel CMSTAT (3,2 мм, внутренний диаметр x 1,5 см) и т.п. Подвижная фаза A представляет собой 10 мМ фосфат натрия (pH 7,5), а подвижная фаза B - 10 мМ фосфат натрия (pH 7,2), содержащий 0,1 M NaCl. Анализ проводили в течение 55 минут с линейным градиентом концентрации 0-30% подвижной фазы B при скорости потока 0,8 мл/мин. Образец разбавляли подвижной фазой А так, чтобы конечная концентрация составляла 1,0 мг/мл, 80 мкл образца вводили в ВЭЖХ, а затем регистрировали поглощение колоночного элюата при 280 нм. Рассчитывали соотношение мономеров трастузумаба на хроматограмме ВЭЖХ и строили график.
Композиции с 8 по 10 показали аналогичный характер изменений, когда анализ WCX выполняли в испытании на стабильность в жестких условиях, то есть при 40°C в течение 14 дней. Конкретные изменения включают увеличение относительного содержания кислых вариантов (изменение примерно на 10% за 14 дней), уменьшение относительного содержания главного пика (изменение примерно на 40% за 14 дней) и увеличение относительного содержания основных вариантов (изменение примерно 300% за 14 дней), и не было значительной разницы в зависимости от состава. В заключение, при анализе WCX в испытании на стабильность в жестких условиях, то есть при 40°C стабильность белка при разных содержаниях полисорбата 20 (0-0,04%) была аналогичной (см. фиг.9).
Пример 16. Анализ ферментативной активности композиций, содержащих трастузумаб и HP46
Турбидиметрический анализ для измерения ферментативной активности - это метод измерения по абсорбции степени, в которой агрегат образуется за счет связывания остаточной гиалуроновой кислоты с подкисленным альбумином (BSA), и когда гиалуроновая кислота гидролизуется с помощью PH20, степень связывания с альбумин снижается, что приводит к снижению абсорбции. BTH (Sigma) в качестве стандартизованного продукта разбавляли до 1 Ед./м, 2 Ед./мл, 5 Ед./мл, 7,5 Ед./мл, 10 Ед./мл, 15 Ед./мл, 20 Ед./мл, 30 Ед./мл, 50 Ед./мл и 60 Ед./мл в соответствующих пробирках. Очищенные образцы варианта PH20 разводили буфером для разбавления ферментов (20 мМ Трис-HCl, pH 7,0, 77 мМ NaCl, 0,01% (масс./об.) бычьего сывороточного альбумина) до 100X, 300X, 600X, 1200X и 2400X в соответствующих пробирках. В свежих пробирках раствор гиалуронидазы с концентрацией 3 мг/мл разбавляли в 10 раз до концентрации 0,3 мг/мл, так чтобы объем каждой пробирки составил 180 мкл. 60 мкл образца, содержащего гиалуронидазу, добавляли к разбавленному раствору гиалуроновой кислоты, смешивали с ним и оставляли для реакции при 37°C в течение 45 минут. После завершения реакции 50 мкл прореагировавшего фермента и 250 мкл кислого раствора альбумина добавляли в каждую лунку 96-луночного планшета и встряхивали в течение 10 минут, а затем измеряли поглощение при 600 нм с помощью спектрофотометра.
В результате выполнения анализа активности в испытании на стабильность в жестких условиях, то есть при 40°C в течение 14 дней, было подтверждено, что чем выше концентрация полисорбата 20, тем больше снижение активности с течением времени (см. фиг.10).
Пример 17. Разработка композиции
Были приготовлены три композиции трастузумаба для подкожного введения, как показано в таблице 9. Композиции с 11 по 13 в целом содержали 120 мг/мл трастузумаба, 20 мМ гистидин/гистидин-HCl (pH 5,5), 210 мМ трегалозы, 10 мМ метионина и вариант PH20. Разница между композициями 11-13 заключается в концентрации неионного поверхностно-активного вещества, где композиция 11 содержит 0% полисорбата 80, композиция 12 - 0,005% полисорбата 80 и композиция 13 - 0,04% полисорбата 80.
Когда гель-хроматографический анализ выполняли в испытании на стабильность в жестких условиях, то есть при 40°C в течение 14 дней, композиции с 11 по 13 демонстрировали аналогичные модели изменений. Основные изменения заключались в увеличении количества продуктов разложения с высокой молекулярной массой (HMW) и с низкой молекулярной массой (LMW) и снижении содержания мономера (примерно менее 1,0%), и не было существенной разницы в зависимости от состава. В заключение, в результате проведения гель-хроматографического анализа в испытании на стабильность в жестких условиях, то есть при 40°C, не было существенной разницы в профилях стабильности между композициями в зависимости от концентрации (0-0,04%) полисорбата 80 (см. фиг.11).
Пример 18. WCX-хроматографический анализ композиций, содержащих трастузумаб и HP46
Для хроматографического анализа WCX использовали систему ВЭЖХ от Shimadzu Prominence, колонку TSKgel CM-STAT (4,6 x 100 мм, 7 мкм) и предколонку TSKgel CMSTAT (3,2 мм, внутренний диаметр x 1,5 см), и т.п. Подвижная фаза A представляла собой 10 мМ фосфат натрия (pH 7,5), а подвижная фаза B - 10 мМ фосфат натрия (pH 7,2), содержащий 0,1 M NaCl. Анализ проводили в течение 55 минут с линейным градиентом концентрации 0-30% подвижной фазы B при скорости потока 0,8 мл/мин. Образец разбавляли подвижной фазой А так, чтобы конечная концентрация составляла 1,0 мг/мл, 80 мкл образца вводили в ВЭЖХ, а затем регистрировали поглощение колоночного элюата при 280 нм. Рассчитывали соотношение мономеров трастузумаба на хроматограмме ВЭЖХ и строили график.
Композиции с 11 по 13 показали аналогичный характер изменений, когда анализ WCX выполняли в испытании на стабильность в жестких условиях, то есть при 40°C в течение 14 дней. Конкретные изменения включают увеличение относительного содержания кислых вариантов (изменение примерно на 10% за 14 дней), уменьшение относительного содержания главного пика (изменение примерно на 40% за 14 дней) и увеличение относительного содержания основных вариантов (изменение примерно 300% за 14 дней), и не было значительной разницы в зависимости от состава. В заключение, в анализе WCX в испытании на стабильность в жестких условиях, то есть при 40°C, стабильность белка в зависимости от содержания полисорбата 80 (0-0,04%) была аналогичной (см. фиг.12).
Пример 19. Анализ ферментативной активности композиций, содержащих трастузумаб и HP46
Турбидиметрический анализ для измерения ферментативной активности - это метод измерения по степени абсорбции, где агрегаты образуются за счет связывания остаточной гиалуроновой кислоты с подкисленным альбумином (BSA), и когда гиалуроновая кислота гидролизуется с помощью PH20, степень связывания с альбумином снижается, что приводит к снижению абсорбции. BTH (Sigma) в качестве стандартизованного продукта разбавляли до 1 Ед./мл, 2 Ед./мл, 5 Ед./мл, 7,5 Ед./мл, 10 Ед./мл, 15 Ед./мл, 20 Ед./мл, 30 Ед./мл, 50 Ед./мл и 60 Ед./мл, добавляя в соответствующие пробирки. Очищенные образцы белка разводили буфером для разбавления ферментов (20 мМ Трис-HCl, pH 7,0, 77 мМ NaCl, 0,01% (масс./об.) бычьего сывороточного альбумина) до 100X, 300X, 600X, 1200X и 2400X в соответствующих пробирках. В свежих пробирках раствор гиалуронидазы с концентрацией 3 мг/мл разбавляли в 10 раз до концентрации 0,3 мг/мл, так чтобы объем каждой пробирки составлял 180 мкл. 60 мкл образца, содержащего гиалуронидазу, добавляли к разбавленному раствору гиалуроновой кислоты, смешивали с ним и оставляли реагировать при 37°C в течение 45 минут. После завершения реакции 50 мкл прореагировавшего фермента и 250 мкл кислого раствора альбумина добавляли в каждую лунку 96-луночного планшета и встряхивали в течение 10 минут, а затем измеряли поглощение при 600 нм с помощью спектрофотометра.
В результате выполнения анализа активности в испытании на стабильность в жестких условиях, то есть при 40°C в течение 14 дней, было подтверждено, что чем выше была концентрация полисорбата 80, тем более выраженным было снижение активности с течением времени (см. фиг.13).
Пример 20. Разработка композиции
Были приготовлены три типа композиций ритуксимаба, как описано в Таблице 10. Композиции с 14 по 16 в целом включали 120 мг/мл ритуксимаба, 20 мМ гистидин/гистидин-HCl (pH 5,5), 210 мМ трегалозы, 10 мМ метионина и вариант PH20. Разница между композициями 14-16 заключается в концентрации неионного поверхностно-активного вещества: композиция 14 - 0% полисорбата 80, композиция 15 - 0,005% полисорбата 80 и композиция 16 - 0,06% полисорбата 80.
Когда гель-хроматографический анализ проводили в испытании на стабильность в жестких условиях, то есть при 40°C в течение 7 дней, композиции 14-16 показали аналогичный характер изменений. Основными изменениями были увеличение продуктов разложения с высокой молекулярной массой (HMW) и с низкой молекулярной массой (LMW) и уменьшение содержания мономера (менее примерно 1,0%), и не было значительной разницы в зависимости от состава. В заключение следует отметить, что в результате проведения гель-хроматографического анализа в испытании на стабильность в жестких условиях, то есть при 40°C, не было значительных различий в профилях стабильности между композициями в зависимости от концентрации (0-0,06%) полисорбата. 80 (см. фиг.14).
Пример 21. Анализ ферментативной активности композиций, содержащих ритуксимаб и HP46
Турбидиметрический анализ для измерения ферментативной активности - это метод измерения по абсорбции степени, в которой агрегат образуется за счет связывания остаточной гиалуроновой кислоты с подкисленным альбумином (BSA), и когда гиалуроновая кислота гидролизуется с помощью PH20, степень связывания с альбумином уменьшается, что приводит к снижению абсорбции. BTH (Sigma) в качестве стандартизованного продукта разбавляли до 1 Ед./мл, 2 Ед./мл, 5 Ед./мл, 7,5 Ед./мл, 10 Ед./мл, 15 Ед./мл, 20 Ед./мл, 30 Ед./мл, 50 Ед./мл и 60 Ед./мл в соответствующих пробирках. Очищенные образцы белка разводили буфером для разбавления ферментов (20 мМ Трис-HCl, pH 7,0, 77 мМ NaCl, 0,01% (масс./об.) бычьего сывороточного альбумина) до 100X, 300X, 600X, 1200X и 2400X в соответствующих пробирках. В свежих пробирках раствор гиалуронидазы с концентрацией 3 мг/мл разбавляли в 10 раз до концентрации 0,3 мг/мл, так чтобы объем каждой пробирки составил 180 мкл. 60 мкл образца, содержащего гиалуронидазу, добавляли к разбавленному раствору гиалуроновой кислоты, смешивали с ним и оставляли реагировать при 37°C в течение 45 минут. После завершения реакции 50 мкл прореагировавшего фермента и 250 мкл кислого раствора альбумина добавляли в каждую лунку 96-луночного планшета и встряхивали в течение 10 минут, а затем измеряли поглощение при 600 нм с помощью спектрофотометра.
В результате выполнения анализа активности в испытании на стабильность в жестких условиях, то есть при 40°C в течение 7 дней, было подтверждено, что чем выше концентрация полисорбата 80, тем более выражено снижение активности с течением времени (см. фиг.15).
Пример 22. Анализ ферментативной активности в композициях из коммерческих продуктов, не содержащих полисорбат
Готовили два типа коммерческих композиций ритуксимаба, как описано в Таблице 11. Композиция 17 представляет собой коммерческий буфер для составов для подкожных инъекций, а Композиция 18 представляет собой коммерческий буфер для составов для внутривенных инъекций. Композиции 17 и 18 содержали вариант PH20 и ритуксимаб в концентрации 120 мг/мл и 100 мг/мл, соответственно, но не содержали полисорбат 80, в отличие от составов коммерческих продуктов.
Турбидиметрический анализ для измерения ферментативной активности - это метод измерения по абсорбции степени, в которой агрегат образуется за счет связывания остаточной гиалуроновой кислоты с подкисленным альбумином (BSA), и когда гиалуроновая кислота гидролизуется с помощью PH20, степень связывания с альбумином снижается, что приводит к снижению абсорбции. BTH (Sigma) в качестве стандартизованного продукта разбавляли до 1 Ед./мл, 2 Ед./мл, 5 Ед./мл, 7,5 Ед./мл, 10 Ед./мл, 15 Ед./мл, 20 Ед./мл, 30 Ед./мл, 50 Ед./мл и 60 Ед./мл в соответствующих пробирках. Очищенные образцы белка разводили буфером для разбавления ферментов (20 мМ Трис-HCl, pH 7,0, 77 мМ NaCl, 0,01% (масс./об.) бычьего сывороточного альбумина) до 100X, 300X, 600X, 1200X и 2400X в соответствующих пробирках. В свежих пробирках раствор гиалуронидазы с концентрацией 3 мг/мл разбавляли в 10 раз до концентрации 0,3 мг/мл, так чтобы объем каждой пробирки составил 180 мкл. 60 мкл образца, содержащего гиалуронидазу, добавляли к разбавленному раствору гиалуроновой кислоты, смешивали с ним и оставляли реагировать при 37°C в течение 45 минут. После завершения реакции 50 мкл прореагировавшего фермента и 250 мкл кислого раствора альбумина добавляли в каждую лунку 96-луночного планшета и встряхивали в течение 10 минут, а затем измеряли поглощение при 600 нм с помощью спектрофотометра.
В результате выполнения анализа активности в испытании на стабильность в жестких условиях, то есть при 40°C в течение 6 дней, было подтверждено, что высокая активность сохраняется даже в композициях, не содержащих полисорбат 80, и в частности, в композиции 18 сохраняется высокая активность (см. фиг.16).
Пример 23. Разработка композиции
Четыре типа композиций пембролизумаба готовили, как описано в Таблице 12. Композиции 19, 20 и 21 в целом включают 25 мг/мл пембролизумаба, 10 мМ гистидина (pH 5,5), 7% сахарозы, 10 мМ метионина и вариант PH20. Разница между композициями 19-21 заключается в концентрации неионного поверхностно-активного вещества: композиция 19 - 0% полисорбата 80, композиция 20 - 0,005% полисорбата 80 и композиция 21 - 0,02% полисорбата 80. Композиция 22 содержит 25 мг/мл пембролизумаба и состоит из 10 мМ гистидина (pH 5,5), 210 мМ трегалозы, 10 мМ метионина, 0,02% полисорбата 80 и варианта PH20.
Пример 24. Анализ с помощью спектрофотометра
Композиции 19, 20, 21 и 22 оставляли на 7 дней при 40°C, и изменения концентрации белка анализировали с использованием спектрофотометра, произведенного Beckman. Каждый образец разбавляли дистиллированной водой так, чтобы концентрация образца составила 0,4 мг/мл, а затем измеряли поглощение белка при 280 нм с помощью спектрофотометра.
В испытании на стабильность в жестких условиях, то есть при 40°C в течение 7 дней, не было значительного изменения концентрации белка в композициях 19-22.
Пример 25. Исследование соотношения мономеров пембролизумаба в каждой композиции с использованием эксклюзионной хроматографии
Для анализа методом эксклюзионной хроматографии использовали систему ВЭЖХ от Shimadzu Prominence, и использовали колонку TSK-gel G3000SWXL (7,8 × 300 мм, 5 мкм) и предколонку TSK (6,0 × 4,0 мм, 7 мкм). В качестве подвижной фазы использовали 0,2 М фосфат калия (pH 6,2), содержащий 0,25 М хлорид калия. Анализ выполняли в течение 35 минут в режиме изократического разделения при скорости потока 0,5 мл/мин. Образец разбавляли аналитическим растворителем так, чтобы конечная концентрация составила 10 мг/мл, и после введения 20 мкл образца в колонку для ВЭЖХ измеряли оптическую плотность элюата колонки при 280 нм. Рассчитывали соотношение мономеров пембролизумаба на хроматограмме ВЭЖХ и строили график.
Когда гель-хроматографический анализ выполняли в испытании на стабильность в жестких условиях, то есть при 40°C в течение 7 дней, композиции 19, 20, 21 и 22 показали аналогичные закономерности изменений. Не было существенной разницы в зависимости от состава в характере изменения высокомолекулярных (HMW) и низкомолекулярных (LMW) продуктов разложения. В заключение, в результате проведения анализа методом эксклюзионной хроматографии в испытании на стабильность в жестких условиях, то есть при 40°C, композиции 19, 20, 21 и 22 не показали каких-либо значительных различий, а также не было никакой разницы в зависимости от типа сахара (см. фиг.17). Эти результаты соответствовали результатам в случаях трастузумаба и ритуксимаба в предыдущих примерах.
Пример 26. Измерение ферментативной активности композиций, содержащих пембролизумаб и HP46
Турбидиметрический анализ для измерения ферментативной активности - это метод измерения по абсорбции степени, при которой агрегат образуется путем связывания остаточной гиалуроновой кислоты с подкисленным альбумином (БСА), и когда гиалуроновая кислота гидролизуется с помощью PH20, степень связывания с альбумином снижается, что приводит к снижению абсорбции. BTH (Sigma) в качестве стандартизованного продукта разбавляли до 1 Ед./мл, 2 Ед./мл, 5 Ед./мл, 7,5 Ед./мл, 10 Ед./мл, 15 Ед./мл, 20 Ед./мл, 30 Ед./мл, 50 Ед./мл и 60 Ед./мл в соответствующих пробирках. Очищенные образцы белка разводили буфером для разбавления ферментов (20 мМ Трис-HCl, pH 7,0, 77 мМ NaCl, 0,01% (масс./об.) бычьего сывороточного альбумина) до 100X, 300X, 600X, 1200X и 2400X в соответствующих пробирках. В свежих пробирках раствор гиалуронидазы с концентрацией 3 мг/мл разбавляли в 10 раз до концентрации 0,3 мг/мл, так чтобы объем каждой пробирки составлял 180 мкл. 60 мкл образца, содержащего фермент, добавляли к разбавленному раствору гиалуроновой кислоты, смешивали с ним и оставляли реагировать при 37°C в течение 45 минут. После завершения реакции 50 мкл прореагировавшего фермента и 250 мкл кислого раствора альбумина добавляли в каждую лунку 96-луночного планшета и встряхивали в течение 10 минут, а затем измеряли поглощение при 600 нм с помощью спектрофотометра.
В результате выполнения анализа активности в испытании на стабильность в жестких условиях, то есть при 40°C в течение 7 дней, было подтверждено, что по мере увеличения концентрации полисорбата 80 снижение активности с течением времени было несколько увеличено. Было также подтверждено, что при включении того же количества полисорбата 80 снижение активности было менее выражено в композиции, содержащей трегалозу, чем в композиции, содержащей сахарозу (см. фиг.18).
Пример 27. Профили pH-активности HP46 и HW2 дикого типа
Для эксперимента по подтверждению профилей pH-активности HP46 и HW2 дикого типа использовали метод микротурбидиметрического анализа. Буфер гиалуроновой кислоты для растворения гиалуроновой кислоты в качестве субстрата и ферментный буфер для разбавления фермента готовили для каждого значения pH.
Всего готовили три 96-луночных планшета для реакции между ферментом и субстратом и обозначали как A, B и C, и проводили эксперимент.
Буфер гиалуроновой кислоты с pH 4,0, 4,5 или 5,0 готовили с использованием 20 мМ уксусной кислоты и 70 мМ NaCl, а раствор гиалуроновой кислоты с pH 5,5; 6,0; 6,5; 7,0 или 8,0 готовили с использованием 20 мМ фосфата натрия и 70 мМ NaCl. 20 мг гиалуроновой кислоты растворяли в 10 мл каждого из приготовленных буферов гиалуроновой кислоты, чтобы приготовить конечный раствор субстрата гиалуроновой кислоты, который затем разбавляли каждым буфером гиалуроновой кислоты, приготовленным в соответствии с pH, чтобы получить 500 мкл раствора с концентрацией 0,1 мг/мл, 0,25 мг/мл, 0,45 мг/мл или 0,7 мг/мл, и 100 мкл каждого раствора распределяли в каждую лунку 96-луночного планшета, обозначенного как планшет A. Буферы гиалуроновой кислоты, разведенные и приготовленные в соответствии с концентрацией, использовали в качестве калибровочных кривых для измерения концентрации гиалуроновой кислоты.
Ферментный буфер с pH 4,0, рН 4,5 или рН 5,0 готовили с использованием 20 мМ уксусной кислоты, 0,01% (масс./об.) BSA, 70 мМ NaCl, и ферментный буфер с pH 5,5, рН 6,0, рН 6,5, рН 7,0 или рН 8,0 готовили с использованием 20 мМ фосфата натрия, 0,01% (масс./об.) БСА и 70 мМ NaCl.
Ферменты HP46 и HW2 дикого типа разбавляли ферментным буфером, приготовленным в соответствии с pH, до 10 Ед./мл, и 50 мкл полученного раствора распределяли в каждую лунку 96-луночного планшета, обозначенного как B.
50 мкл образца переносили из каждой лунки 96-луночного планшета, обозначенного как A, в каждую лунку 96-луночного планшета, обозначенного как B, с последующим проведением реакции в инкубаторе с встряхиванием при 37°C в течение 45 минут. За 15 минут до завершения реакции 200 мкл кислого раствора альбумина вносили в каждую лунку 96-луночного планшета, обозначенного как C, и когда реакция ферментативного субстрата завершалась, 40 мкл образца переносили из каждой лунки 96-луночного планшета, обозначенного как B, в каждую лунку 96-луночного планшета, обозначенного как C, с последующим продолжением реакции в течение 20 минут. Через 20 минут измеряли оптическую плотность при 600 нм, рассчитывали количество гиалуроновой кислоты, оставшейся после реакции с ферментативным субстратом, и определяли профили активности ферментов в зависимости от pH (см. фиг.19).
Пример 28. Анализ фармакокинетики с использованием композиции герцептина для подкожного введения и трастузумаба и HP46 на крысах Спрег-Доули
Чтобы проверить, проявляет ли композиция трастузумаба и HP46 для подкожного введения те же фармакокинетические свойства, что и композиция герцептина для подкожного введения, был проведен эксперимент с использованием 9-недельных крыс Спрег-Доули. Доза вводимого герцептина и трастузумаба составила 18 мг/кг массы тела крысы, количество rHuPH20, включенного в композицию герцептина для подкожного введения, составило 100 Ед, а количество HP46 также составило 100 Ед. В фармакокинетическом анализе трастузумаб и HP46 показали такую же площадь под кривой (AUC), что и у композиции герцептина для подкожного введения (см. фиг.20).
Промышленная применимость
Фармацевтическая композиция согласно настоящему изобретению может использоваться для подкожного введения, и она также очень стабильна, и активность вариантов PH20 вместе с лекарственным средством, предпочтительно лекарственным средством на основе антител или подобным, может сохраняться в течение длительного времени. Таким образом, фармацевтическая композиция может способствовать снижению не только стоимости производства препаратов для подкожных инъекций, но также и медицинских затрат, и она очень эффективна с точки зрения удобства для пациентов.
Хотя предпочтительные варианты осуществления настоящего изобретения были раскрыты в иллюстративных целях, специалисты в данной области техники поймут, что возможны различные модификации, добавления и замены без отклонения от объема и сущности изобретения, раскрытых в прилагаемой формуле изобретения.
Ссылки


--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> АЛТЕОГЕН, ИНК.
<120> ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ВАРИАНТ РН20
ГИАЛУРОНИДАЗЫ ЧЕЛОВЕКА,
И ЛЕКАРСТВЕННОЕ СРЕДСТВО, ДЛЯ ПОДКОЖНОГО ВВЕДЕНИЯ
<130> 4240-536
<150> PCT/KR2020/003975
<151> 2020-03-24
<150> KR 10-2019-0033880
<151> 2019-03-25
<160> 51
<170> PatentIn version 3.5
<210> 1
<211> 509
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 1
Met Gly Val Leu Lys Phe Lys His Ile Phe Phe Arg Ser Phe Val Lys
1 5 10 15
Ser Ser Gly Val Ser Gln Ile Val Phe Thr Phe Leu Leu Ile Pro Cys
20 25 30
Cys Leu Thr Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro
35 40 45
Phe Leu Trp Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe
50 55 60
Asp Glu Pro Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg
65 70 75 80
Ile Asn Ala Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu
85 90 95
Gly Tyr Tyr Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly
100 105 110
Gly Ile Pro Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys
115 120 125
Lys Asp Ile Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val
130 135 140
Ile Asp Trp Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro
145 150 155 160
Lys Asp Val Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn
165 170 175
Val Gln Leu Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe
180 185 190
Glu Lys Ala Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys
195 200 205
Leu Leu Arg Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys
210 215 220
Tyr Asn His His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn
225 230 235 240
Val Glu Ile Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser
245 250 255
Thr Ala Leu Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val
260 265 270
Ala Ala Thr Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val
275 280 285
Ser Lys Ile Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr
290 295 300
Arg Ile Val Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu
305 310 315 320
Leu Val Tyr Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile
325 330 335
Val Ile Trp Gly Thr Leu Ser Ile Met Arg Ser Met Lys Ser Cys Leu
340 345 350
Leu Leu Asp Asn Tyr Met Glu Thr Ile Leu Asn Pro Tyr Ile Ile Asn
355 360 365
Val Thr Leu Ala Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln
370 375 380
Gly Val Cys Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu
385 390 395 400
Asn Pro Asp Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr
405 410 415
Val Arg Gly Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys
420 425 430
Phe Tyr Cys Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp
435 440 445
Val Lys Asp Thr Asp Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys
450 455 460
Ile Asp Ala Phe Leu Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile
465 470 475 480
Phe Tyr Asn Ala Ser Pro Ser Thr Leu Ser Ala Thr Met Phe Ile Val
485 490 495
Ser Ile Leu Phe Leu Ile Ile Ser Ser Val Ala Ser Leu
500 505
<210> 2
<211> 26
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 2
Met Ala Thr Gly Ser Arg Thr Ser Leu Leu Leu Ala Phe Gly Leu Leu
1 5 10 15
Cys Leu Pro Trp Leu Gln Glu Gly Ser Ala
20 25
<210> 3
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 3
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser
<210> 4
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 4
Met Ala Ala His Leu Leu Pro Ile Cys Ala Leu Phe Leu Thr Leu Leu
1 5 10 15
Asp Met Ala Gln Gly
20
<210> 5
<211> 455
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 5
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Gly Thr Leu Ser Ile Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Gly Pro Tyr Ile Ile Asn Val Thr Leu
325 330 335
Ala Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala
420 425 430
Phe Leu Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn
435 440 445
Ala Ser Pro Ser Thr Leu Ser
450 455
<210> 6
<211> 455
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 6
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Gly Thr Leu Ser Ile Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Asn Pro Phe Ile Leu Asn Val Thr Ser
325 330 335
Gly Ala Leu Leu Cys Ser Gln Ala Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala
420 425 430
Phe Leu Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn
435 440 445
Ala Ser Pro Ser Thr Leu Ser
450 455
<210> 7
<211> 455
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 7
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Gly Thr Leu Ser Ile Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Gly Pro Phe Ile Leu Asn Val Thr Ser
325 330 335
Gly Ala Leu Leu Cys Ser Gln Ala Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala
420 425 430
Phe Leu Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn
435 440 445
Ala Ser Pro Ser Thr Leu Ser
450 455
<210> 8
<211> 455
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 8
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Val Ser Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Gly Pro Tyr Ile Ile Asn Val Thr Leu
325 330 335
Ala Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala
420 425 430
Phe Leu Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn
435 440 445
Ala Ser Pro Ser Thr Leu Ser
450 455
<210> 9
<211> 455
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 9
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Gly Thr Leu Ser Ile Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu
325 330 335
Ala Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala
420 425 430
Phe Leu Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn
435 440 445
Ala Ser Pro Ser Thr Leu Ser
450 455
<210> 10
<211> 455
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 10
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Val Ser Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu
325 330 335
Ala Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala
420 425 430
Phe Leu Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn
435 440 445
Ala Ser Pro Ser Thr Leu Ser
450 455
<210> 11
<211> 455
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 11
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Gly Thr Leu Ser Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu
325 330 335
Ala Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala
420 425 430
Phe Leu Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn
435 440 445
Ala Ser Pro Ser Thr Leu Ser
450 455
<210> 12
<211> 455
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 12
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Gly Thr Leu Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu
325 330 335
Ala Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala
420 425 430
Phe Leu Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn
435 440 445
Ala Ser Pro Ser Thr Leu Ser
450 455
<210> 13
<211> 455
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 13
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Gly Thr Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu
325 330 335
Ala Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala
420 425 430
Phe Leu Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn
435 440 445
Ala Ser Pro Ser Thr Leu Ser
450 455
<210> 14
<211> 455
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 14
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Gly Thr Leu Ser Ile Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Asn Pro Phe Ile Leu Asn Val Thr Leu
325 330 335
Ala Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala
420 425 430
Phe Leu Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn
435 440 445
Ala Ser Pro Ser Thr Leu Ser
450 455
<210> 15
<211> 455
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 15
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Gly Thr Leu Ser Ile Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Asn Pro Phe Ile Leu Asn Val Thr Ser
325 330 335
Gly Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala
420 425 430
Phe Leu Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn
435 440 445
Ala Ser Pro Ser Thr Leu Ser
450 455
<210> 16
<211> 453
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 16
Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp
1 5 10 15
Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp
20 25 30
Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly
35 40 45
Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr
50 55 60
Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys
65 70 75 80
Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe
85 90 95
Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu
100 105 110
Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys
115 120 125
Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu
130 135 140
Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys
145 150 155 160
Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn
165 170 175
His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr
180 185 190
Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg
195 200 205
Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro
210 215 220
Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr
225 230 235 240
Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp
245 250 255
Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr
260 265 270
Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe
275 280 285
Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr
290 295 300
Leu Ser Ile Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr
305 310 315 320
Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala
325 330 335
Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg
340 345 350
Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe
355 360 365
Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro
370 375 380
Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys
385 390 395 400
Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp
405 410 415
Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu
420 425 430
Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn Ala Ser
435 440 445
Pro Ser Thr Leu Ser
450
<210> 17
<211> 430
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 17
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Gly Thr Leu Ser Ile Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu
325 330 335
Ala Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile
420 425 430
<210> 18
<211> 433
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 18
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Gly Thr Leu Ser Ile Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu
325 330 335
Ala Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala
420 425 430
Phe
<210> 19
<211> 436
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 19
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Gly Thr Leu Ser Ile Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu
325 330 335
Ala Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala
420 425 430
Phe Leu Lys Pro
435
<210> 20
<211> 452
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 20
Phe Arg Gly Pro Leu Leu Pro Asn Arg Pro Phe Leu Trp Ala Trp Asn
1 5 10 15
Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp Met
20 25 30
Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly Gln
35 40 45
Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr Ile
50 55 60
Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys Ile
65 70 75 80
Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe Tyr
85 90 95
Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu Trp
100 105 110
Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys Asn
115 120 125
Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu Thr
130 135 140
Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys Asp
145 150 155 160
Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn His
165 170 175
Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr Lys
180 185 190
Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg Asn
195 200 205
Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro Ser
210 215 220
Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr Val
225 230 235 240
Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp Ala
245 250 255
Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr Asp
260 265 270
Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe Gly
275 280 285
Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr Leu
290 295 300
Ser Ile Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr Met
305 310 315 320
Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala Lys
325 330 335
Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg Lys
340 345 350
Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe Ala
355 360 365
Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro Thr
370 375 380
Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys Tyr
385 390 395 400
Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp Ala
405 410 415
Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu Lys
420 425 430
Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn Ala Ser Pro
435 440 445
Ser Thr Leu Ser
450
<210> 21
<211> 452
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 21
Phe Arg Gly Pro Leu Leu Pro Asn Arg Pro Phe Thr Thr Val Trp Asn
1 5 10 15
Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp Met
20 25 30
Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly Gln
35 40 45
Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr Ile
50 55 60
Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys Ile
65 70 75 80
Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe Tyr
85 90 95
Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu Trp
100 105 110
Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys Asn
115 120 125
Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu Thr
130 135 140
Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys Asp
145 150 155 160
Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn His
165 170 175
Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr Lys
180 185 190
Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg Asn
195 200 205
Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro Ser
210 215 220
Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr Val
225 230 235 240
Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp Ala
245 250 255
Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr Asp
260 265 270
Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe Gly
275 280 285
Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr Leu
290 295 300
Ser Ile Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr Met
305 310 315 320
Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala Lys
325 330 335
Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg Lys
340 345 350
Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe Ala
355 360 365
Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro Thr
370 375 380
Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys Tyr
385 390 395 400
Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp Ala
405 410 415
Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu Lys
420 425 430
Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn Ala Ser Pro
435 440 445
Ser Thr Leu Ser
450
<210> 22
<211> 433
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 22
Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp
1 5 10 15
Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp
20 25 30
Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly
35 40 45
Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr
50 55 60
Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys
65 70 75 80
Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe
85 90 95
Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu
100 105 110
Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys
115 120 125
Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu
130 135 140
Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys
145 150 155 160
Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn
165 170 175
His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr
180 185 190
Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg
195 200 205
Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro
210 215 220
Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr
225 230 235 240
Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp
245 250 255
Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr
260 265 270
Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe
275 280 285
Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr
290 295 300
Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr
305 310 315 320
Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala
325 330 335
Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg
340 345 350
Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe
355 360 365
Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro
370 375 380
Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys
385 390 395 400
Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp
405 410 415
Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu
420 425 430
Lys
<210> 23
<211> 431
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 23
Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp
1 5 10 15
Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp
20 25 30
Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly
35 40 45
Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr
50 55 60
Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys
65 70 75 80
Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe
85 90 95
Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu
100 105 110
Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys
115 120 125
Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu
130 135 140
Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys
145 150 155 160
Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn
165 170 175
His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr
180 185 190
Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg
195 200 205
Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro
210 215 220
Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr
225 230 235 240
Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp
245 250 255
Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr
260 265 270
Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe
275 280 285
Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr
290 295 300
Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr
305 310 315 320
Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala
325 330 335
Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg
340 345 350
Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe
355 360 365
Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro
370 375 380
Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys
385 390 395 400
Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp
405 410 415
Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe
420 425 430
<210> 24
<211> 455
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 24
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Gly Ser Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu
325 330 335
Ala Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala
420 425 430
Phe Leu Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn
435 440 445
Ala Ser Pro Ser Thr Leu Ser
450 455
<210> 25
<211> 451
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 25
Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp Asn Ala
1 5 10 15
Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp Met Ser
20 25 30
Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly Gln Gly
35 40 45
Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr Ile Asp
50 55 60
Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys Ile Ser
65 70 75 80
Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe Tyr Met
85 90 95
Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu Trp Arg
100 105 110
Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys Asn Arg
115 120 125
Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu Thr Glu
130 135 140
Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys Asp Phe
145 150 155 160
Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn His Leu
165 170 175
Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr Lys Lys
180 185 190
Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg Asn Asp
195 200 205
Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro Ser Ile
210 215 220
Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr Val Arg
225 230 235 240
Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp Ala Lys
245 250 255
Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr Asp Gln
260 265 270
Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe Gly Glu
275 280 285
Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr Leu Ser
290 295 300
Ile Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr Met Asp
305 310 315 320
Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala Lys Met
325 330 335
Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg Lys Asn
340 345 350
Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe Ala Ile
355 360 365
Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro Thr Leu
370 375 380
Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys Tyr Ser
385 390 395 400
Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp Ala Val
405 410 415
Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu Lys Pro
420 425 430
Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn Ala Ser Pro Ser
435 440 445
Thr Leu Ser
450
<210> 26
<211> 449
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 26
Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp Asn Ala Pro Ser
1 5 10 15
Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp Met Ser Leu Phe
20 25 30
Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly Gln Gly Val Thr
35 40 45
Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr Ile Asp Ser Ile
50 55 60
Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys Ile Ser Leu Gln
65 70 75 80
Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe Tyr Met Pro Val
85 90 95
Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu Trp Arg Pro Thr
100 105 110
Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys Asn Arg Ser Ile
115 120 125
Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu Thr Glu Ala Thr
130 135 140
Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys Asp Phe Leu Val
145 150 155 160
Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn His Leu Trp Gly
165 170 175
Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr Lys Lys Pro Gly
180 185 190
Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg Asn Asp Asp Leu
195 200 205
Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro Ser Ile Tyr Leu
210 215 220
Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr Val Arg Asn Arg
225 230 235 240
Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp Ala Lys Ser Pro
245 250 255
Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr Asp Gln Val Leu
260 265 270
Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe Gly Glu Thr Val
275 280 285
Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr Leu Ser Ile Thr
290 295 300
Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr Met Asp Thr Thr
305 310 315 320
Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala Lys Met Cys Ser
325 330 335
Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg Lys Asn Trp Asn
340 345 350
Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe Ala Ile Gln Leu
355 360 365
Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro Thr Leu Glu Asp
370 375 380
Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys Tyr Ser Thr Leu
385 390 395 400
Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp Ala Val Asp Val
405 410 415
Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu Lys Pro Pro Met
420 425 430
Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn Ala Ser Pro Ser Thr Leu
435 440 445
Ser
<210> 27
<211> 432
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 27
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Gly Thr Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu
325 330 335
Ala Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala
420 425 430
<210> 28
<211> 429
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 28
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Gly Thr Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu
325 330 335
Ala Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys
420 425
<210> 29
<211> 426
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 29
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Gly Thr Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu
325 330 335
Ala Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val Asp Val Cys Ile Ala Asp
420 425
<210> 30
<211> 423
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 30
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Gly Thr Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu
325 330 335
Ala Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val Asp Val Cys
420
<210> 31
<211> 420
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 31
Leu Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp
1 5 10 15
Ala Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro
20 25 30
Leu Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala
35 40 45
Thr Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr
50 55 60
Pro Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro
65 70 75 80
Gln Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile
85 90 95
Thr Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp
100 105 110
Glu Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val
115 120 125
Tyr Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu
130 135 140
Ser Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala
145 150 155 160
Gly Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg
165 170 175
Pro Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His
180 185 190
His Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile
195 200 205
Lys Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu
210 215 220
Tyr Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr
225 230 235 240
Leu Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile
245 250 255
Pro Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val
260 265 270
Phe Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr
275 280 285
Thr Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp
290 295 300
Gly Thr Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys
305 310 315 320
Glu Tyr Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu
325 330 335
Ala Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys
340 345 350
Ile Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp
355 360 365
Asn Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly
370 375 380
Lys Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys
385 390 395 400
Ser Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp
405 410 415
Thr Asp Ala Val
420
<210> 32
<211> 433
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 32
Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp
1 5 10 15
Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp
20 25 30
Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly
35 40 45
Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr
50 55 60
Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys
65 70 75 80
Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe
85 90 95
Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu
100 105 110
Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys
115 120 125
Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu
130 135 140
Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys
145 150 155 160
Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn
165 170 175
His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr
180 185 190
Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg
195 200 205
Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro
210 215 220
Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr
225 230 235 240
Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp
245 250 255
Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr
260 265 270
Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe
275 280 285
Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Ser
290 295 300
Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr
305 310 315 320
Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala
325 330 335
Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg
340 345 350
Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe
355 360 365
Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro
370 375 380
Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys
385 390 395 400
Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp
405 410 415
Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu
420 425 430
Lys
<210> 33
<211> 435
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 33
Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp
1 5 10 15
Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp
20 25 30
Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly
35 40 45
Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr
50 55 60
Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys
65 70 75 80
Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe
85 90 95
Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu
100 105 110
Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys
115 120 125
Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu
130 135 140
Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys
145 150 155 160
Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn
165 170 175
His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr
180 185 190
Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg
195 200 205
Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro
210 215 220
Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr
225 230 235 240
Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp
245 250 255
Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr
260 265 270
Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe
275 280 285
Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr
290 295 300
Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr
305 310 315 320
Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala
325 330 335
Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg
340 345 350
Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe
355 360 365
Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro
370 375 380
Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys
385 390 395 400
Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp
405 410 415
Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu
420 425 430
Lys Pro Pro
435
<210> 34
<211> 436
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 34
Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp
1 5 10 15
Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp
20 25 30
Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly
35 40 45
Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr
50 55 60
Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys
65 70 75 80
Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe
85 90 95
Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu
100 105 110
Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys
115 120 125
Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu
130 135 140
Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys
145 150 155 160
Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn
165 170 175
His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr
180 185 190
Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg
195 200 205
Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro
210 215 220
Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr
225 230 235 240
Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp
245 250 255
Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr
260 265 270
Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe
275 280 285
Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr
290 295 300
Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr
305 310 315 320
Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala
325 330 335
Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg
340 345 350
Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe
355 360 365
Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro
370 375 380
Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys
385 390 395 400
Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp
405 410 415
Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu
420 425 430
Lys Pro Pro Met
435
<210> 35
<211> 437
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 35
Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp
1 5 10 15
Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp
20 25 30
Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly
35 40 45
Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr
50 55 60
Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys
65 70 75 80
Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe
85 90 95
Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu
100 105 110
Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys
115 120 125
Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu
130 135 140
Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys
145 150 155 160
Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn
165 170 175
His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr
180 185 190
Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg
195 200 205
Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro
210 215 220
Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr
225 230 235 240
Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp
245 250 255
Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr
260 265 270
Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe
275 280 285
Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr
290 295 300
Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr
305 310 315 320
Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala
325 330 335
Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg
340 345 350
Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe
355 360 365
Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro
370 375 380
Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys
385 390 395 400
Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp
405 410 415
Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu
420 425 430
Lys Pro Pro Met Glu
435
<210> 36
<211> 438
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 36
Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp
1 5 10 15
Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp
20 25 30
Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly
35 40 45
Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr
50 55 60
Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys
65 70 75 80
Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe
85 90 95
Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu
100 105 110
Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys
115 120 125
Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu
130 135 140
Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys
145 150 155 160
Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn
165 170 175
His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr
180 185 190
Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg
195 200 205
Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro
210 215 220
Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr
225 230 235 240
Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp
245 250 255
Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr
260 265 270
Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe
275 280 285
Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr
290 295 300
Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr
305 310 315 320
Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala
325 330 335
Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg
340 345 350
Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe
355 360 365
Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro
370 375 380
Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys
385 390 395 400
Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp
405 410 415
Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu
420 425 430
Lys Pro Pro Met Glu Thr
435
<210> 37
<211> 439
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 37
Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp
1 5 10 15
Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp
20 25 30
Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly
35 40 45
Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr
50 55 60
Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys
65 70 75 80
Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe
85 90 95
Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu
100 105 110
Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys
115 120 125
Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu
130 135 140
Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys
145 150 155 160
Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn
165 170 175
His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr
180 185 190
Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg
195 200 205
Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro
210 215 220
Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr
225 230 235 240
Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp
245 250 255
Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr
260 265 270
Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe
275 280 285
Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr
290 295 300
Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr
305 310 315 320
Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala
325 330 335
Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg
340 345 350
Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe
355 360 365
Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro
370 375 380
Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys
385 390 395 400
Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp
405 410 415
Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu
420 425 430
Lys Pro Pro Met Glu Thr Glu
435
<210> 38
<211> 454
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 38
Asn Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala
1 5 10 15
Trp Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu
20 25 30
Asp Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr
35 40 45
Gly Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro
50 55 60
Tyr Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln
65 70 75 80
Lys Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr
85 90 95
Phe Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu
100 105 110
Glu Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr
115 120 125
Lys Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser
130 135 140
Leu Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly
145 150 155 160
Lys Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro
165 170 175
Asn His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His
180 185 190
Tyr Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys
195 200 205
Arg Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr
210 215 220
Pro Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu
225 230 235 240
Tyr Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro
245 250 255
Asp Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe
260 265 270
Thr Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr
275 280 285
Phe Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly
290 295 300
Thr Leu Ser Ile Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu
305 310 315 320
Tyr Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala
325 330 335
Ala Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile
340 345 350
Arg Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn
355 360 365
Phe Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys
370 375 380
Pro Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser
385 390 395 400
Cys Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr
405 410 415
Asp Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe
420 425 430
Leu Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn Ala
435 440 445
Ser Pro Ser Thr Leu Ser
450
<210> 39
<211> 452
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 39
Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp Asn
1 5 10 15
Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp Met
20 25 30
Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly Gln
35 40 45
Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr Ile
50 55 60
Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys Ile
65 70 75 80
Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe Tyr
85 90 95
Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu Trp
100 105 110
Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys Asn
115 120 125
Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu Thr
130 135 140
Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys Asp
145 150 155 160
Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn His
165 170 175
Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr Lys
180 185 190
Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg Asn
195 200 205
Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro Ser
210 215 220
Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr Val
225 230 235 240
Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp Ala
245 250 255
Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr Asp
260 265 270
Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe Gly
275 280 285
Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr Leu
290 295 300
Ser Ile Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr Met
305 310 315 320
Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala Lys
325 330 335
Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg Lys
340 345 350
Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe Ala
355 360 365
Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro Thr
370 375 380
Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys Tyr
385 390 395 400
Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp Ala
405 410 415
Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu Lys
420 425 430
Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn Ala Ser Pro
435 440 445
Ser Thr Leu Ser
450
<210> 40
<211> 450
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 40
Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp Asn Ala Pro
1 5 10 15
Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp Met Ser Leu
20 25 30
Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly Gln Gly Val
35 40 45
Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr Ile Asp Ser
50 55 60
Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys Ile Ser Leu
65 70 75 80
Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe Tyr Met Pro
85 90 95
Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu Trp Arg Pro
100 105 110
Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys Asn Arg Ser
115 120 125
Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu Thr Glu Ala
130 135 140
Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys Asp Phe Leu
145 150 155 160
Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn His Leu Trp
165 170 175
Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr Lys Lys Pro
180 185 190
Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg Asn Asp Asp
195 200 205
Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro Ser Ile Tyr
210 215 220
Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr Val Arg Asn
225 230 235 240
Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp Ala Lys Ser
245 250 255
Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr Asp Gln Val
260 265 270
Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe Gly Glu Thr
275 280 285
Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr Leu Ser Ile
290 295 300
Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr Met Asp Thr
305 310 315 320
Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala Lys Met Cys
325 330 335
Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg Lys Asn Trp
340 345 350
Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe Ala Ile Gln
355 360 365
Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro Thr Leu Glu
370 375 380
Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys Tyr Ser Thr
385 390 395 400
Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp Ala Val Asp
405 410 415
Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu Lys Pro Pro
420 425 430
Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn Ala Ser Pro Ser Thr
435 440 445
Leu Ser
450
<210> 41
<211> 428
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 41
Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp
1 5 10 15
Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp
20 25 30
Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly
35 40 45
Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr
50 55 60
Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys
65 70 75 80
Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe
85 90 95
Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu
100 105 110
Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys
115 120 125
Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu
130 135 140
Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys
145 150 155 160
Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn
165 170 175
His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr
180 185 190
Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg
195 200 205
Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro
210 215 220
Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr
225 230 235 240
Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp
245 250 255
Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr
260 265 270
Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe
275 280 285
Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Ser
290 295 300
Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr
305 310 315 320
Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala
325 330 335
Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg
340 345 350
Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe
355 360 365
Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro
370 375 380
Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys
385 390 395 400
Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp
405 410 415
Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile
420 425
<210> 42
<211> 429
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 42
Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp
1 5 10 15
Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp
20 25 30
Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly
35 40 45
Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr
50 55 60
Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys
65 70 75 80
Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe
85 90 95
Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu
100 105 110
Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys
115 120 125
Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu
130 135 140
Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys
145 150 155 160
Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn
165 170 175
His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr
180 185 190
Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg
195 200 205
Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro
210 215 220
Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr
225 230 235 240
Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp
245 250 255
Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr
260 265 270
Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe
275 280 285
Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Ser
290 295 300
Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr
305 310 315 320
Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala
325 330 335
Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg
340 345 350
Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe
355 360 365
Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro
370 375 380
Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys
385 390 395 400
Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp
405 410 415
Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp
420 425
<210> 43
<211> 430
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 43
Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp
1 5 10 15
Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp
20 25 30
Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly
35 40 45
Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr
50 55 60
Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys
65 70 75 80
Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe
85 90 95
Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu
100 105 110
Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys
115 120 125
Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu
130 135 140
Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys
145 150 155 160
Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn
165 170 175
His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr
180 185 190
Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg
195 200 205
Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro
210 215 220
Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr
225 230 235 240
Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp
245 250 255
Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr
260 265 270
Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe
275 280 285
Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Ser
290 295 300
Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr
305 310 315 320
Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala
325 330 335
Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg
340 345 350
Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe
355 360 365
Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro
370 375 380
Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys
385 390 395 400
Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp
405 410 415
Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala
420 425 430
<210> 44
<211> 431
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 44
Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp
1 5 10 15
Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp
20 25 30
Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly
35 40 45
Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr
50 55 60
Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys
65 70 75 80
Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe
85 90 95
Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu
100 105 110
Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys
115 120 125
Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu
130 135 140
Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys
145 150 155 160
Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn
165 170 175
His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr
180 185 190
Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg
195 200 205
Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro
210 215 220
Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr
225 230 235 240
Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp
245 250 255
Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr
260 265 270
Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe
275 280 285
Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Ser
290 295 300
Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr
305 310 315 320
Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala
325 330 335
Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg
340 345 350
Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe
355 360 365
Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro
370 375 380
Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys
385 390 395 400
Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp
405 410 415
Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe
420 425 430
<210> 45
<211> 441
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 45
Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp
1 5 10 15
Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp
20 25 30
Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly
35 40 45
Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr
50 55 60
Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys
65 70 75 80
Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe
85 90 95
Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu
100 105 110
Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys
115 120 125
Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu
130 135 140
Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys
145 150 155 160
Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn
165 170 175
His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr
180 185 190
Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg
195 200 205
Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro
210 215 220
Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr
225 230 235 240
Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp
245 250 255
Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr
260 265 270
Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe
275 280 285
Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr
290 295 300
Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr
305 310 315 320
Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala
325 330 335
Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg
340 345 350
Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe
355 360 365
Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro
370 375 380
Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys
385 390 395 400
Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp
405 410 415
Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu
420 425 430
Lys Pro Pro Met Glu Thr Glu Glu Pro
435 440
<210> 46
<211> 443
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 46
Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp
1 5 10 15
Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp
20 25 30
Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly
35 40 45
Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr
50 55 60
Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys
65 70 75 80
Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe
85 90 95
Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu
100 105 110
Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys
115 120 125
Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu
130 135 140
Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys
145 150 155 160
Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn
165 170 175
His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr
180 185 190
Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg
195 200 205
Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro
210 215 220
Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr
225 230 235 240
Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp
245 250 255
Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr
260 265 270
Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe
275 280 285
Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr
290 295 300
Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr
305 310 315 320
Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala
325 330 335
Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg
340 345 350
Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe
355 360 365
Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro
370 375 380
Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys
385 390 395 400
Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp
405 410 415
Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu
420 425 430
Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile
435 440
<210> 47
<211> 445
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 47
Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp
1 5 10 15
Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp
20 25 30
Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly
35 40 45
Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr
50 55 60
Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys
65 70 75 80
Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe
85 90 95
Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu
100 105 110
Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys
115 120 125
Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu
130 135 140
Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys
145 150 155 160
Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn
165 170 175
His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr
180 185 190
Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg
195 200 205
Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro
210 215 220
Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr
225 230 235 240
Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp
245 250 255
Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr
260 265 270
Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe
275 280 285
Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr
290 295 300
Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr
305 310 315 320
Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala
325 330 335
Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg
340 345 350
Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe
355 360 365
Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro
370 375 380
Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys
385 390 395 400
Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp
405 410 415
Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu
420 425 430
Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr
435 440 445
<210> 48
<211> 447
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 48
Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp
1 5 10 15
Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp
20 25 30
Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly
35 40 45
Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr
50 55 60
Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys
65 70 75 80
Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe
85 90 95
Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu
100 105 110
Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys
115 120 125
Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu
130 135 140
Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys
145 150 155 160
Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn
165 170 175
His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr
180 185 190
Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg
195 200 205
Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro
210 215 220
Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr
225 230 235 240
Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp
245 250 255
Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr
260 265 270
Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe
275 280 285
Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr
290 295 300
Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr
305 310 315 320
Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala
325 330 335
Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg
340 345 350
Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe
355 360 365
Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro
370 375 380
Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys
385 390 395 400
Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp
405 410 415
Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu
420 425 430
Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn Ala
435 440 445
<210> 49
<211> 449
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 49
Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp
1 5 10 15
Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp
20 25 30
Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly
35 40 45
Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr
50 55 60
Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys
65 70 75 80
Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe
85 90 95
Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu
100 105 110
Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys
115 120 125
Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu
130 135 140
Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys
145 150 155 160
Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn
165 170 175
His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr
180 185 190
Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg
195 200 205
Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro
210 215 220
Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr
225 230 235 240
Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp
245 250 255
Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr
260 265 270
Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe
275 280 285
Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr
290 295 300
Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr
305 310 315 320
Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala
325 330 335
Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg
340 345 350
Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe
355 360 365
Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro
370 375 380
Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys
385 390 395 400
Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp
405 410 415
Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu
420 425 430
Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn Ala Ser
435 440 445
Pro
<210> 50
<211> 451
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 50
Phe Arg Ala Pro Pro Val Ile Pro Asn Val Pro Phe Leu Trp Ala Trp
1 5 10 15
Asn Ala Pro Ser Glu Phe Cys Leu Gly Lys Phe Asp Glu Pro Leu Asp
20 25 30
Met Ser Leu Phe Ser Phe Ile Gly Ser Pro Arg Ile Asn Ala Thr Gly
35 40 45
Gln Gly Val Thr Ile Phe Tyr Val Asp Arg Leu Gly Tyr Tyr Pro Tyr
50 55 60
Ile Asp Ser Ile Thr Gly Val Thr Val Asn Gly Gly Ile Pro Gln Lys
65 70 75 80
Ile Ser Leu Gln Asp His Leu Asp Lys Ala Lys Lys Asp Ile Thr Phe
85 90 95
Tyr Met Pro Val Asp Asn Leu Gly Met Ala Val Ile Asp Trp Glu Glu
100 105 110
Trp Arg Pro Thr Trp Ala Arg Asn Trp Lys Pro Lys Asp Val Tyr Lys
115 120 125
Asn Arg Ser Ile Glu Leu Val Gln Gln Gln Asn Val Gln Leu Ser Leu
130 135 140
Thr Glu Ala Thr Glu Lys Ala Lys Gln Glu Phe Glu Lys Ala Gly Lys
145 150 155 160
Asp Phe Leu Val Glu Thr Ile Lys Leu Gly Lys Leu Leu Arg Pro Asn
165 170 175
His Leu Trp Gly Tyr Tyr Leu Phe Pro Asp Cys Tyr Asn His His Tyr
180 185 190
Lys Lys Pro Gly Tyr Asn Gly Ser Cys Phe Asn Val Glu Ile Lys Arg
195 200 205
Asn Asp Asp Leu Ser Trp Leu Trp Asn Glu Ser Thr Ala Leu Tyr Pro
210 215 220
Ser Ile Tyr Leu Asn Thr Gln Gln Ser Pro Val Ala Ala Thr Leu Tyr
225 230 235 240
Val Arg Asn Arg Val Arg Glu Ala Ile Arg Val Ser Lys Ile Pro Asp
245 250 255
Ala Lys Ser Pro Leu Pro Val Phe Ala Tyr Thr Arg Ile Val Phe Thr
260 265 270
Asp Gln Val Leu Lys Phe Leu Ser Gln Asp Glu Leu Val Tyr Thr Phe
275 280 285
Gly Glu Thr Val Ala Leu Gly Ala Ser Gly Ile Val Ile Trp Gly Thr
290 295 300
Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile Lys Glu Tyr
305 310 315 320
Met Asp Thr Thr Leu Asn Pro Tyr Ile Ile Asn Val Thr Leu Ala Ala
325 330 335
Lys Met Cys Ser Gln Val Leu Cys Gln Glu Gln Gly Val Cys Ile Arg
340 345 350
Lys Asn Trp Asn Ser Ser Asp Tyr Leu His Leu Asn Pro Asp Asn Phe
355 360 365
Ala Ile Gln Leu Glu Lys Gly Gly Lys Phe Thr Val Arg Gly Lys Pro
370 375 380
Thr Leu Glu Asp Leu Glu Gln Phe Ser Glu Lys Phe Tyr Cys Ser Cys
385 390 395 400
Tyr Ser Thr Leu Ser Cys Lys Glu Lys Ala Asp Val Lys Asp Thr Asp
405 410 415
Ala Val Asp Val Cys Ile Ala Asp Gly Val Cys Ile Asp Ala Phe Leu
420 425 430
Lys Pro Pro Met Glu Thr Glu Glu Pro Gln Ile Phe Tyr Asn Ala Ser
435 440 445
Pro Ser Thr
450
<210> 51
<211> 435
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 51
Met Ala Ala His Leu Leu Pro Ile Cys Ala Leu Phe Leu Thr Leu Leu
1 5 10 15
Asp Met Ala Gln Gly Phe Arg Gly Pro Leu Leu Pro Asn Arg Pro Phe
20 25 30
Thr Thr Val Trp Asn Ala Asn Thr Gln Trp Cys Leu Glu Arg His Gly
35 40 45
Val Asp Val Asp Val Ser Val Phe Asp Val Val Ala Asn Pro Gly Gln
50 55 60
Thr Phe Arg Gly Pro Asp Met Thr Ile Phe Tyr Ser Ser Gln Leu Gly
65 70 75 80
Thr Tyr Pro Tyr Tyr Thr Pro Thr Gly Glu Pro Val Phe Gly Gly Leu
85 90 95
Pro Gln Asn Ala Ser Leu Ile Ala His Leu Ala Arg Thr Phe Gln Asp
100 105 110
Ile Leu Ala Ala Ile Pro Ala Pro Asp Phe Ser Gly Leu Ala Val Ile
115 120 125
Asp Trp Glu Ala Trp Arg Pro Arg Trp Ala Phe Asn Trp Asp Thr Lys
130 135 140
Asp Ile Tyr Arg Gln Arg Ser Arg Ala Leu Val Gln Ala Gln His Pro
145 150 155 160
Asp Trp Pro Ala Pro Gln Val Glu Ala Val Ala Gln Asp Gln Phe Gln
165 170 175
Gly Ala Ala Arg Ala Trp Met Ala Gly Thr Leu Gln Leu Gly Arg Ala
180 185 190
Leu Arg Pro Arg Gly Leu Trp Gly Phe Tyr Gly Phe Pro Asp Cys Tyr
195 200 205
Asn Tyr Asp Phe Leu Ser Pro Asn Tyr Thr Gly Gln Cys Pro Ser Gly
210 215 220
Ile Arg Ala Gln Asn Asp Gln Leu Gly Trp Leu Trp Gly Gln Ser Arg
225 230 235 240
Ala Leu Tyr Pro Ser Ile Tyr Met Pro Ala Val Leu Glu Gly Thr Gly
245 250 255
Lys Ser Gln Met Tyr Val Gln His Arg Val Ala Glu Ala Phe Arg Val
260 265 270
Ala Val Ala Ala Gly Asp Pro Asn Leu Pro Val Leu Pro Tyr Val Gln
275 280 285
Ile Phe Tyr Asp Thr Thr Asn His Phe Leu Pro Leu Asp Glu Leu Glu
290 295 300
His Ser Leu Gly Glu Ser Ala Ala Gln Gly Ala Ala Gly Val Val Leu
305 310 315 320
Trp Val Ser Trp Glu Asn Thr Arg Thr Lys Glu Ser Cys Gln Ala Ile
325 330 335
Lys Glu Tyr Met Asp Thr Thr Leu Gly Pro Phe Ile Leu Asn Val Thr
340 345 350
Ser Gly Ala Leu Leu Cys Ser Gln Ala Leu Cys Ser Gly His Gly Arg
355 360 365
Cys Val Arg Arg Thr Ser His Pro Lys Ala Leu Leu Leu Leu Asn Pro
370 375 380
Ala Ser Phe Ser Ile Gln Leu Thr Pro Gly Gly Gly Pro Leu Ser Leu
385 390 395 400
Arg Gly Ala Leu Ser Leu Glu Asp Gln Ala Gln Met Ala Val Glu Phe
405 410 415
Lys Cys Arg Cys Tyr Pro Gly Trp Gln Ala Pro Trp Cys Glu Arg Lys
420 425 430
Ser Met Trp
435
<---
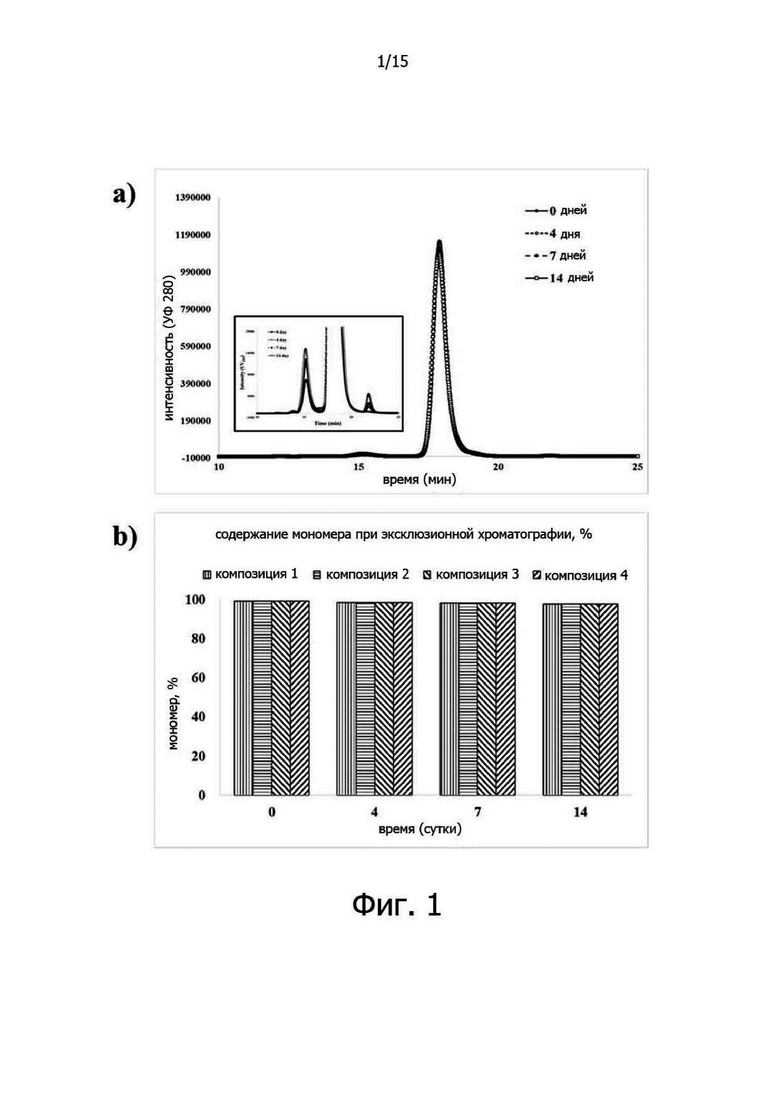
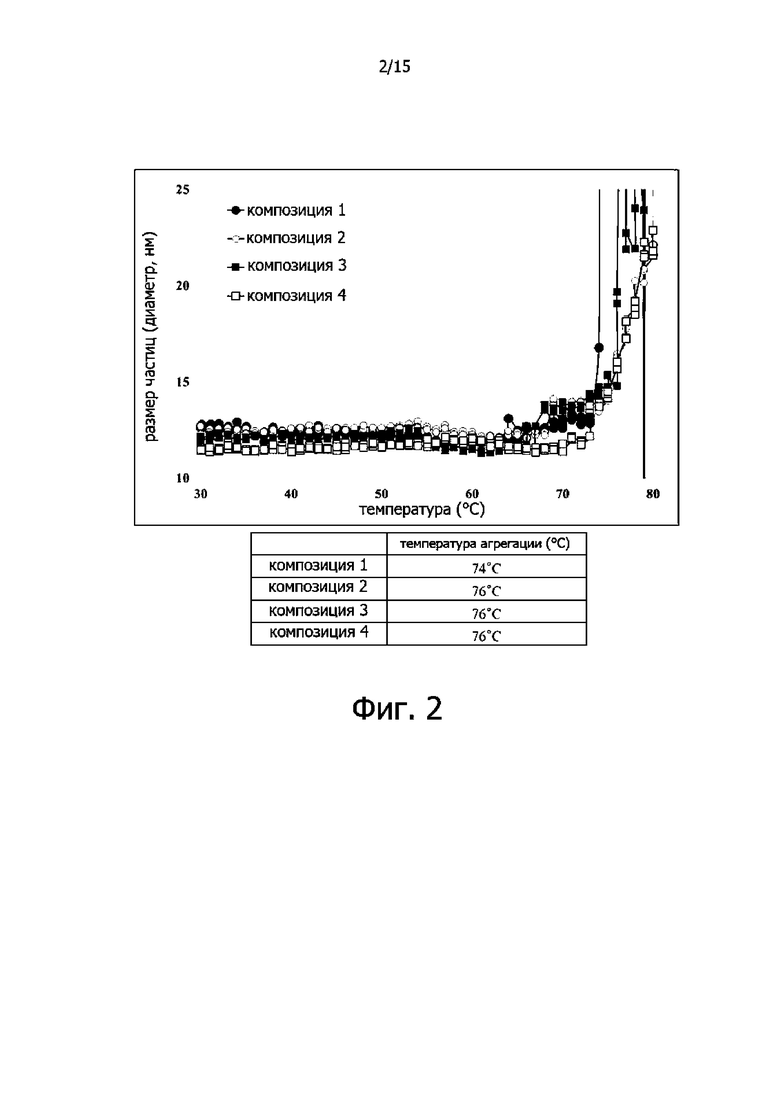
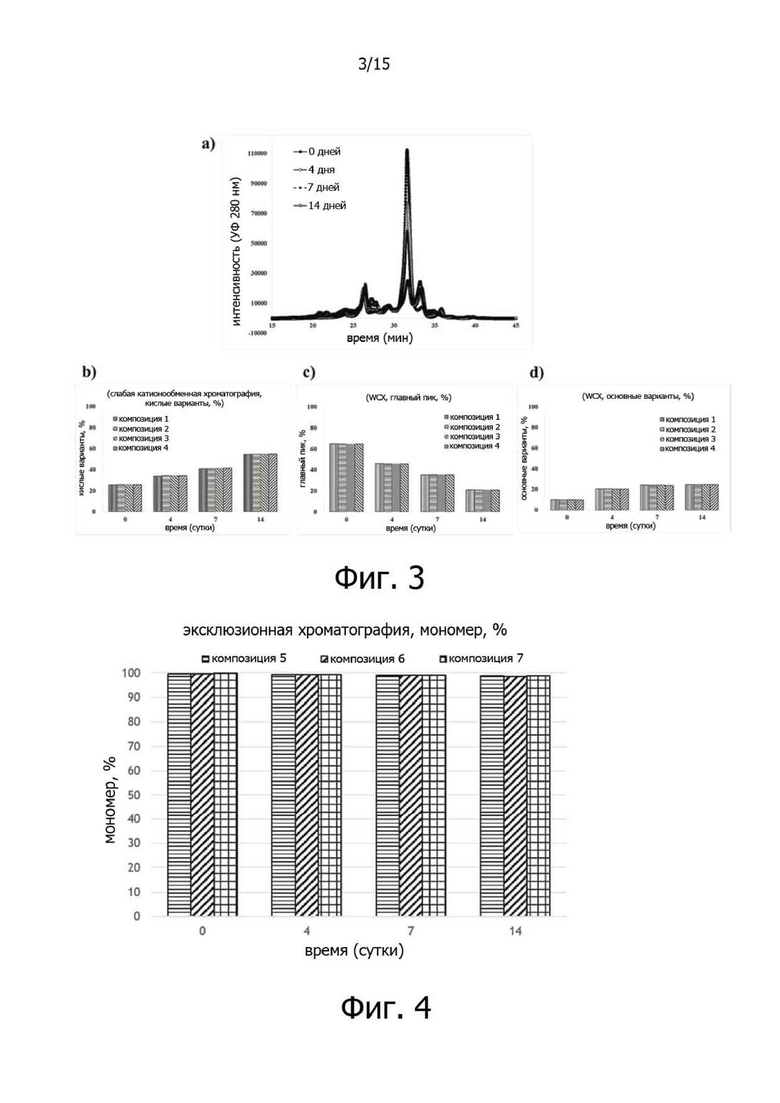
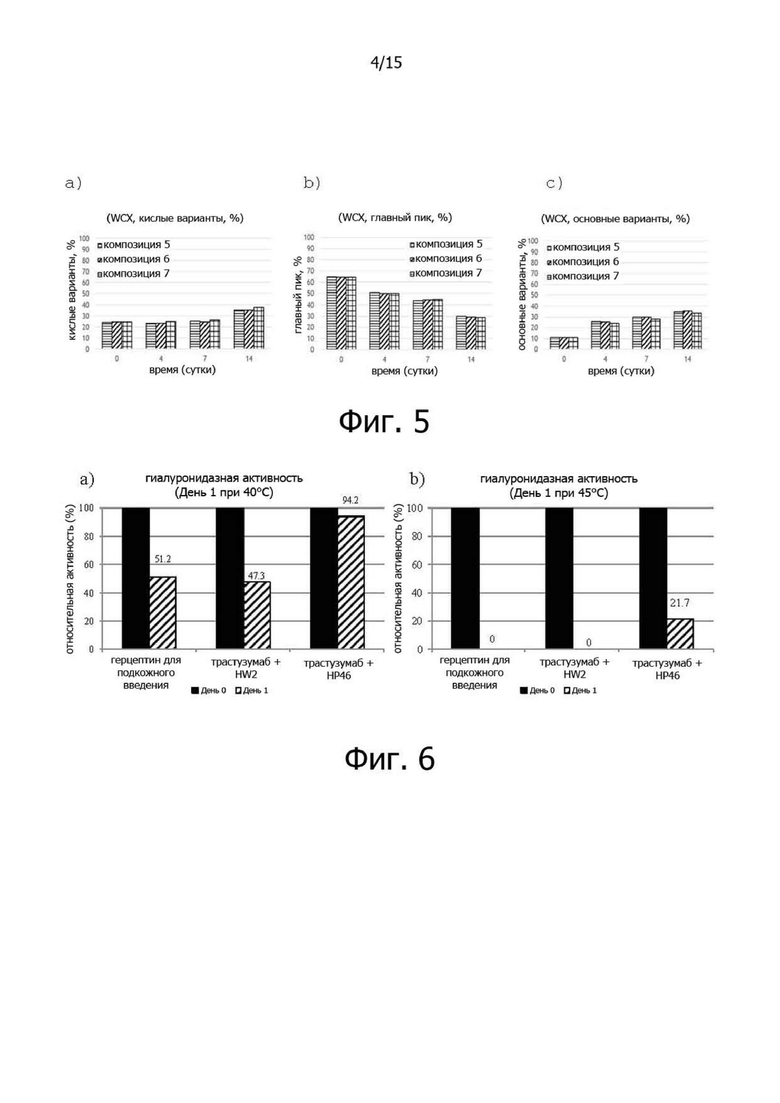
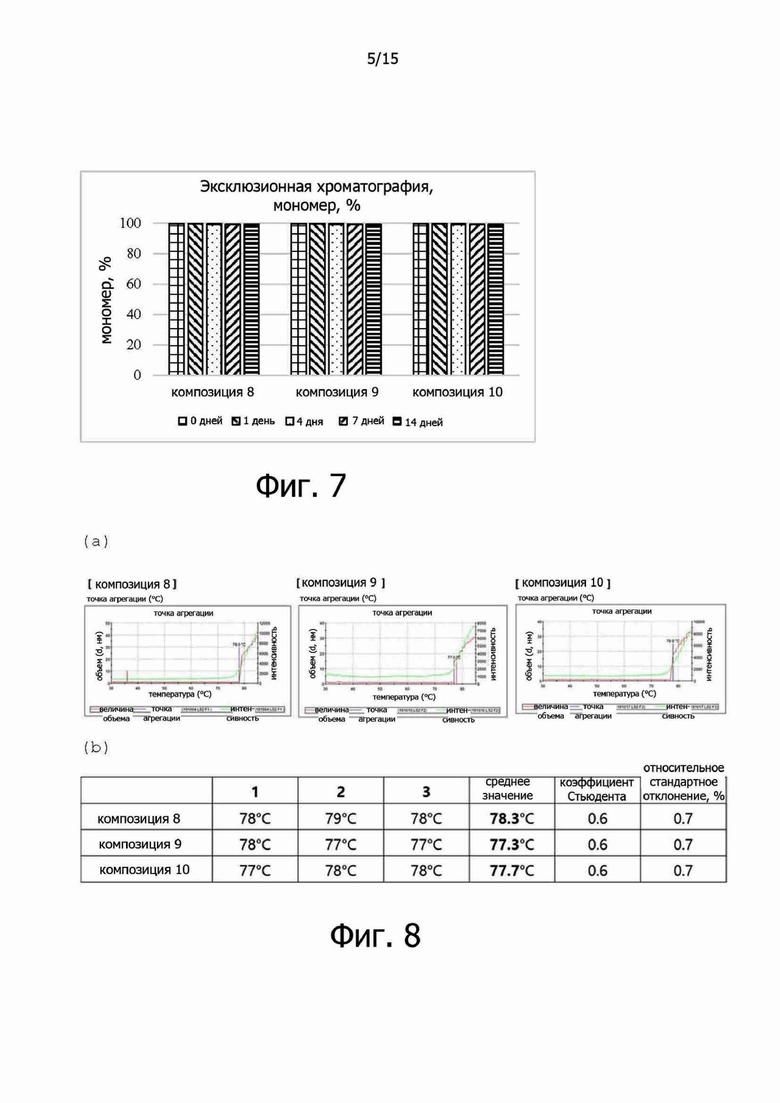
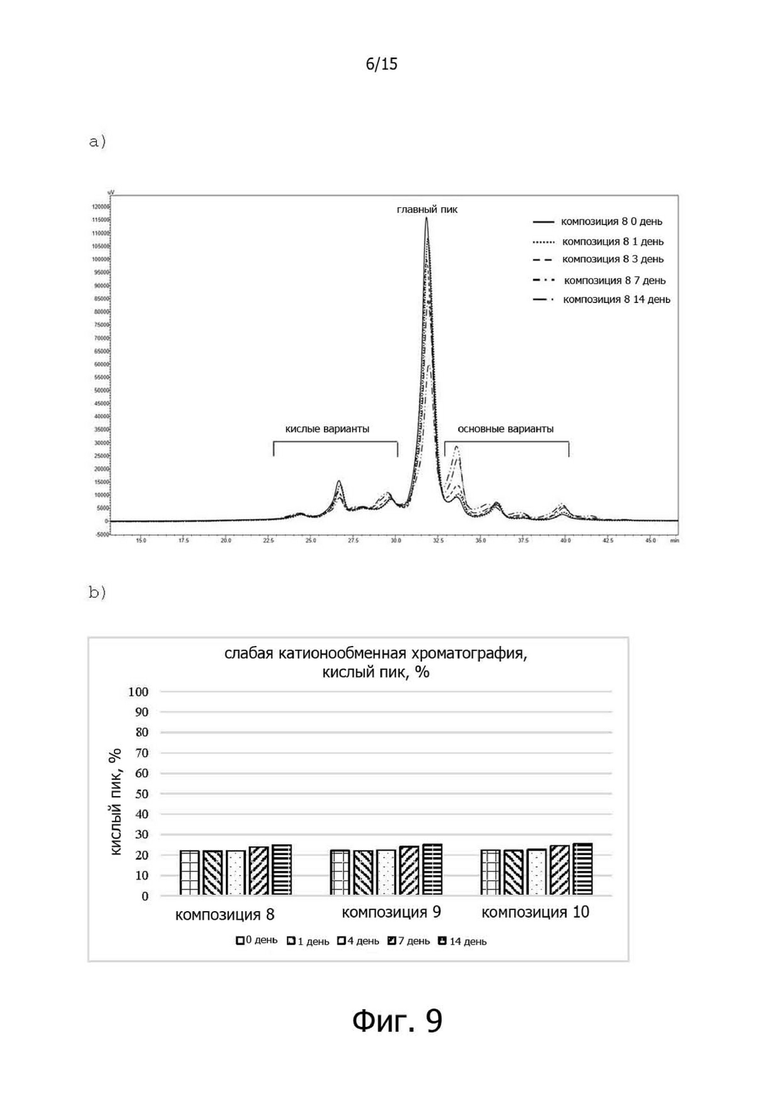
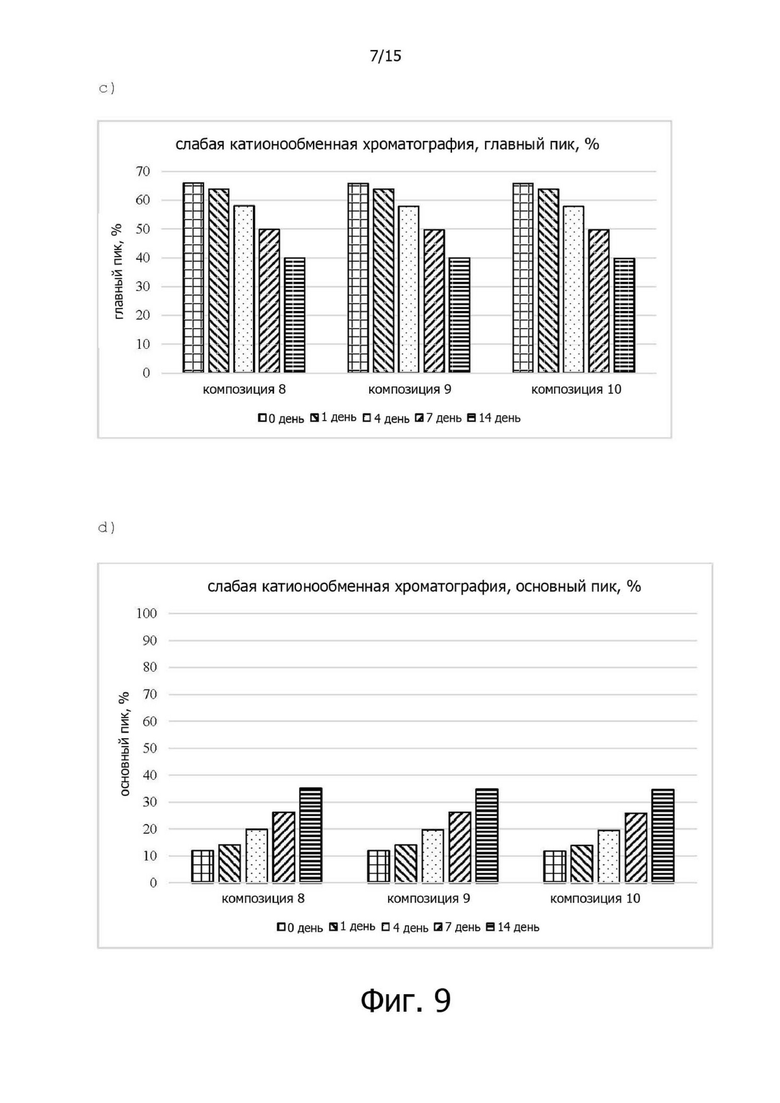
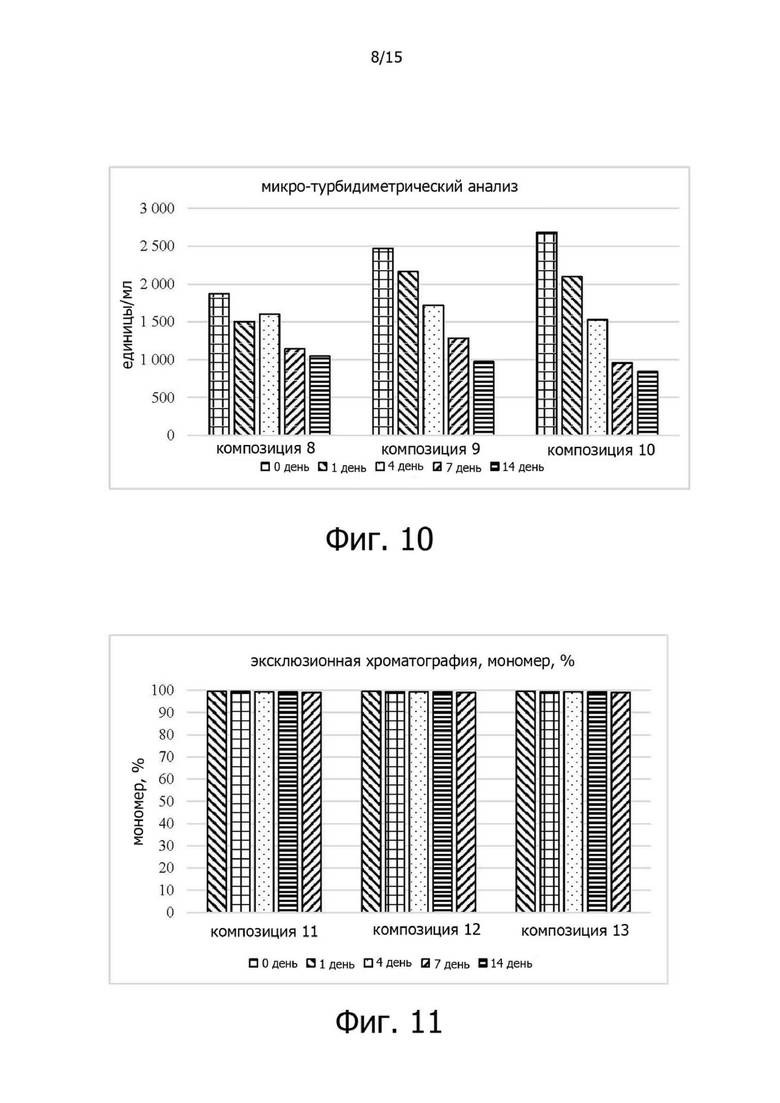
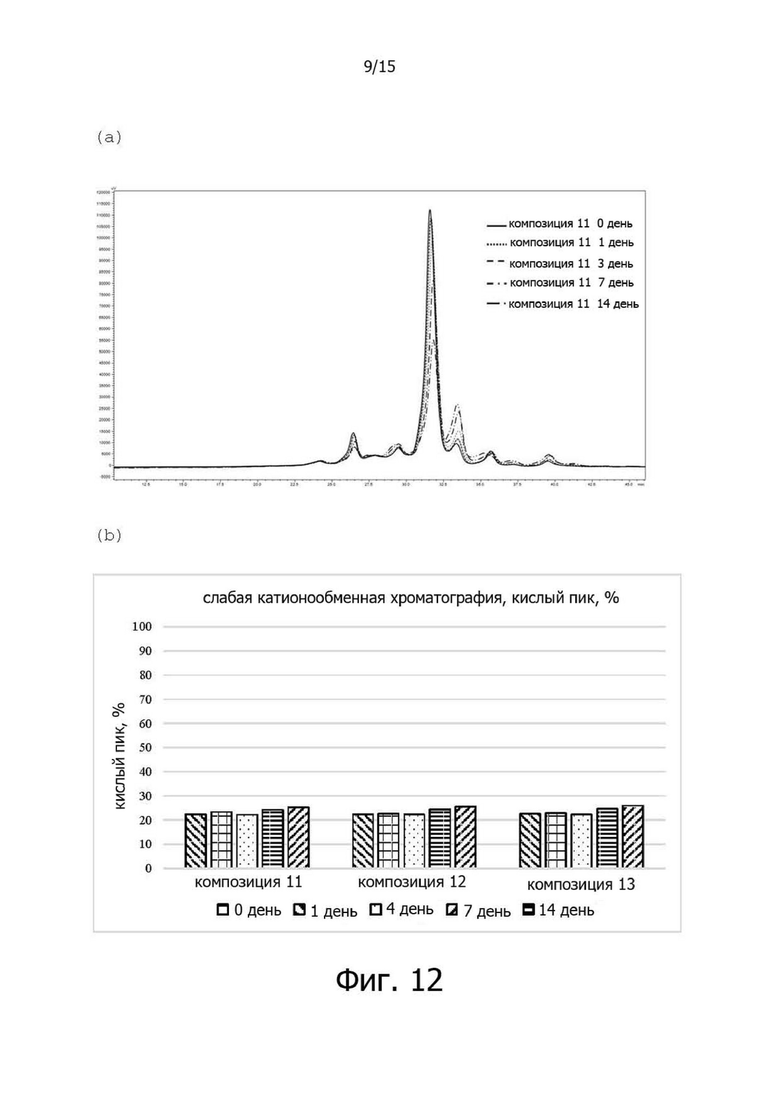
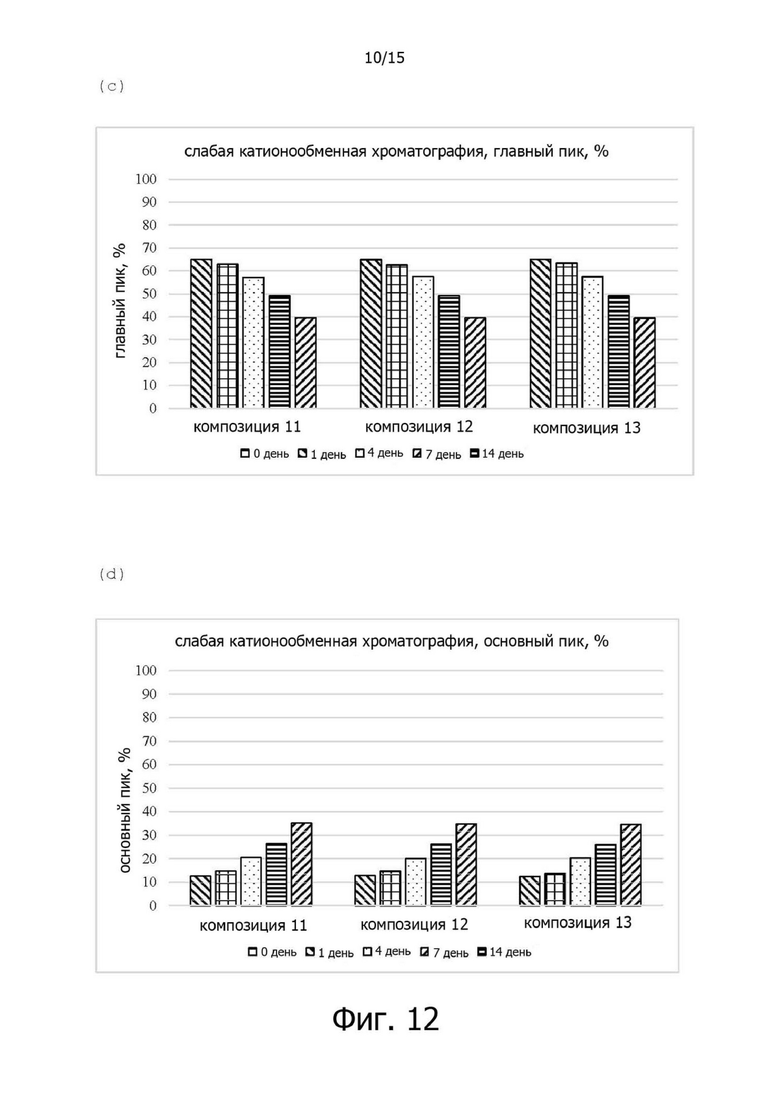
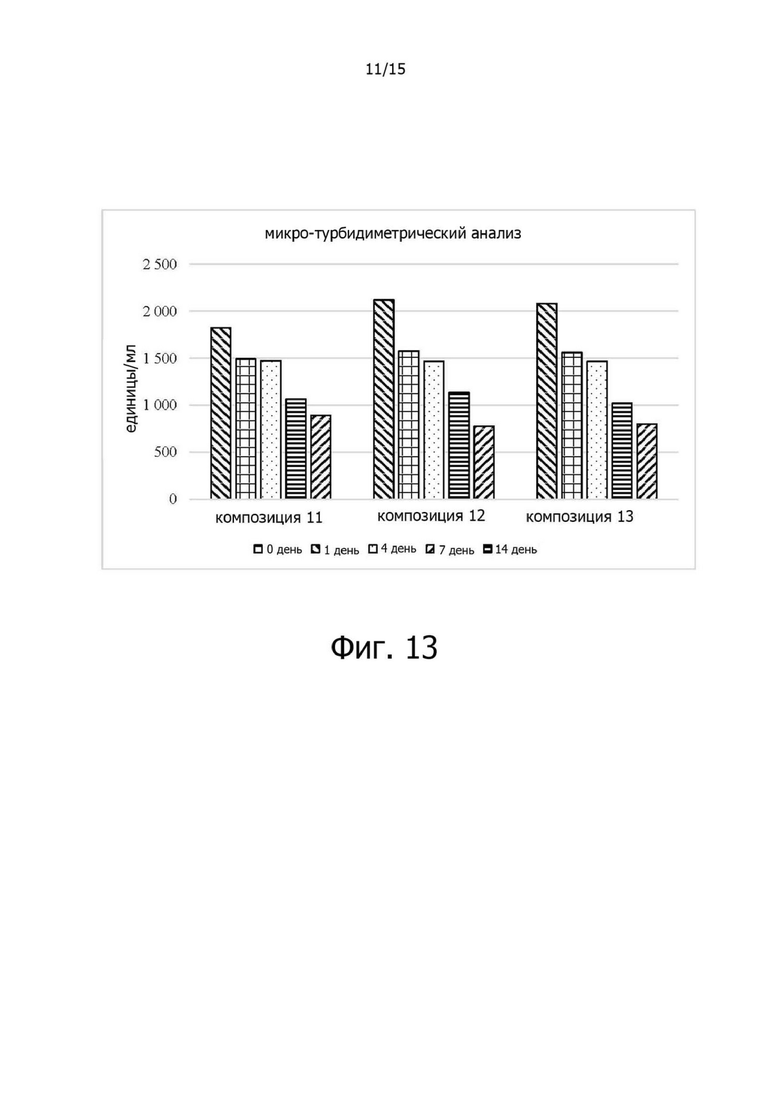
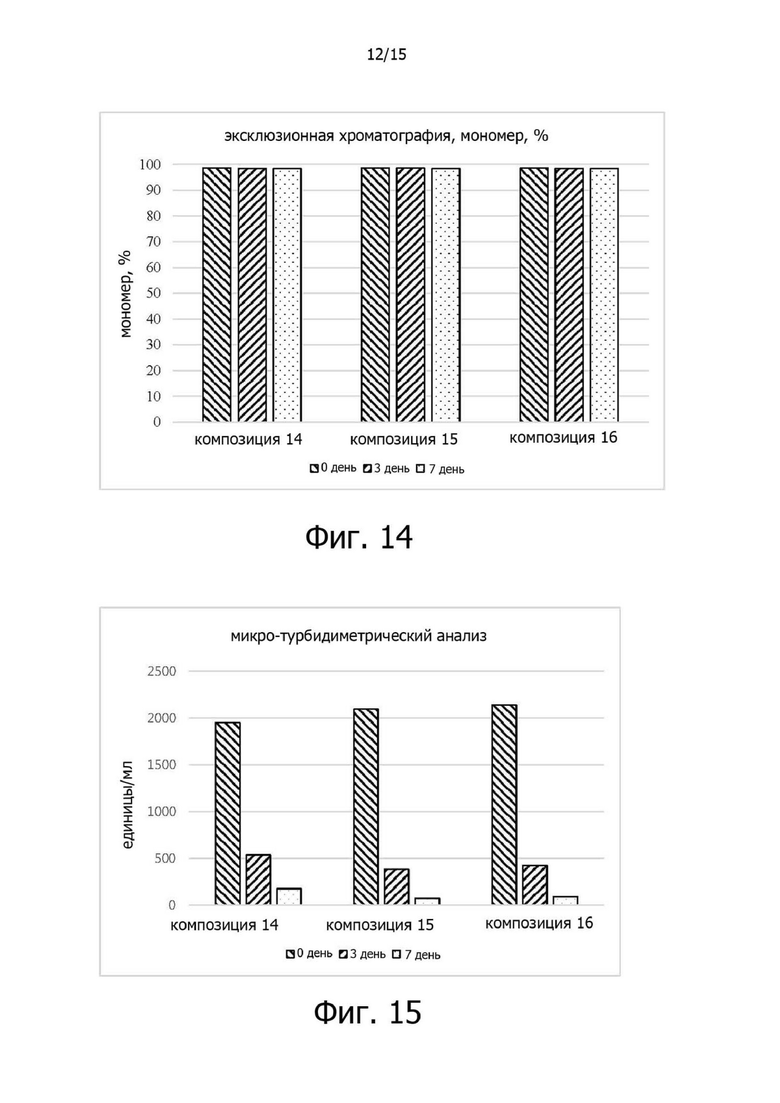
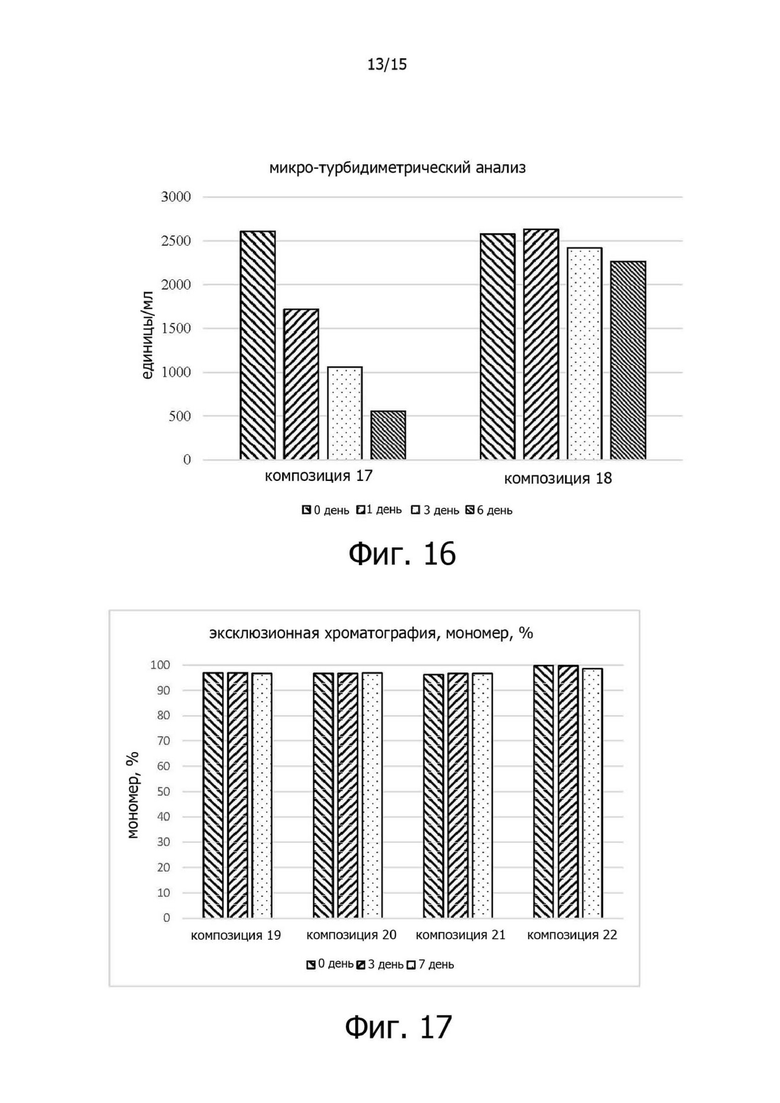

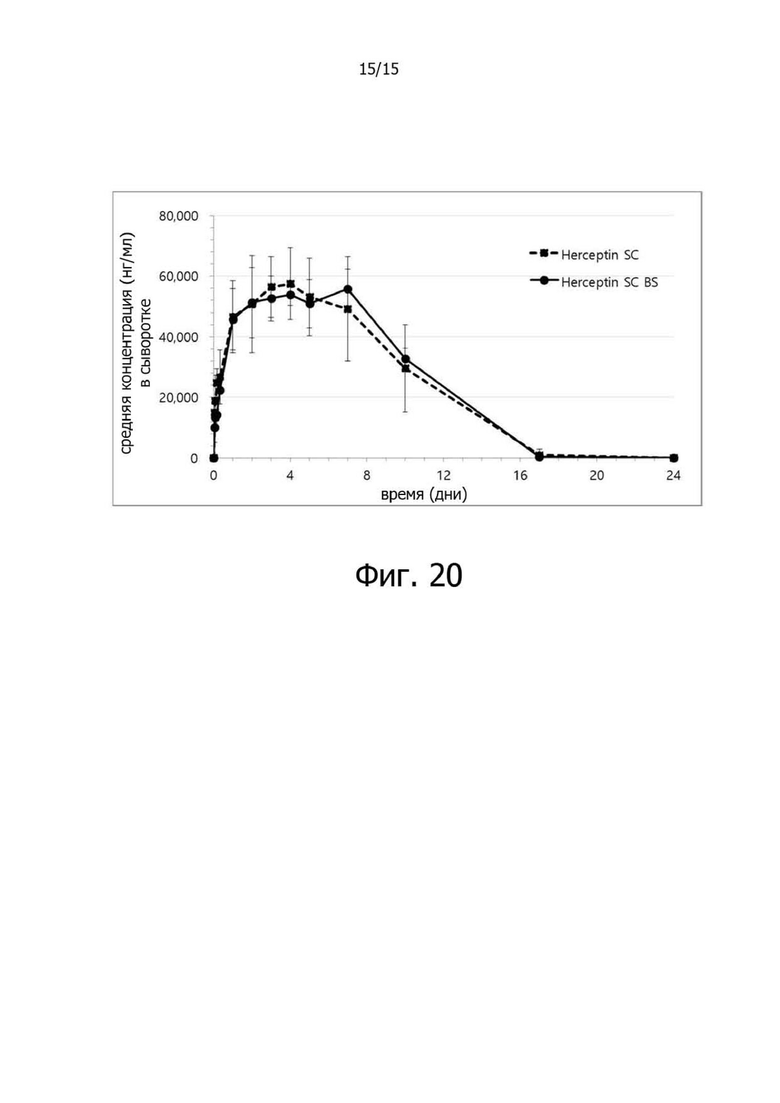
Изобретение относится к биотехнологии и представляет собой применение варианта PH20, содержащего одну или несколько замен аминокислотных остатков, выбранных из группы, состоящей из S343E, M345T, K349E, L353A, L354I, N356E и I361T, в PH20 дикого типа, имеющем аминокислотную последовательность SEQ ID NO: 1, для получения термостабильной в течение длительного времени фармацевтической композиции, включающей: (а) лекарственное средство; и (b) указанный вариант PH20, и где лекарственное средство не является пембролизумабом. Изобретение позволяет получать термостабильные композиции, содержащие вариант PH20. 6 н. и 20 з.п. ф-лы, 20 ил., 12 табл., 28 пр.
1. Применение варианта PH20, содержащего одну или несколько замен аминокислотных остатков, выбранных из группы, состоящей из S343E, M345T, K349E, L353A, L354I, N356E и I361T, в PH20 дикого типа, имеющем аминокислотную последовательность SEQ ID NO: 1, для получения термостабильной в течение длительного времени фармацевтической композиции, включающей: (а) лекарственное средство; и (b) указанный вариант PH20, и где лекарственное средство не является пембролизумабом.
2. Применение по п. 1, где вариант РН20 содержит одну или несколько замен аминокислотных остатков, выбранных из группы, состоящей из L354I и N356E.
3. Применение варианта PH20, содержащего замену(ы) аминокислотных остатков L354I и/или N356E в PH20 дикого типа, имеющего аминокислотную последовательность SEQ ID NO: 1, и дополнительно включающего замену(ы) аминокислотных остатков в одном или дополнительных положениях, выбранных из группы, состоящей из T341, L342, S343, I344, M345, S347, M348, K349, L352, L353, D355, E359, I361 и N363, в PH20 дикого типа, имеющем аминокислотную последовательность SEQ ID NO: 1, для получения термостабильной в течение длительного времени фармацевтической композиции, включающей: (а) лекарственное средство; и (b) указанный вариант PH20.
4. Применение варианта PH20, содержащего замену(ы) аминокислотных остатков L354I и/или N356E в PH20 дикого типа, имеющего аминокислотную последовательность SEQ ID NO: 1, и дополнительно включающего замену(ы) аминокислотных остатков в одном или более положениях, выбранных из группы, состоящей из T341S, L342W, S343E, I344N, M345T, S347T, M348K, K349E, L352Q, L353A, D355K, E359D, I361T и N363G, в PH20 дикого типа, имеющем аминокислотную последовательность SEQ ID NO: 1, для получения термостабильной в течение длительного времени фармацевтической композиции, включающей: (а) лекарственное средство; и (b) указанный вариант PH20.
5. Применение по п. 3, где вариант PH20 содержит замены аминокислотных остатков M345T, S347T, M348K, K349E, L352Q, L353A, L354I, D355K, N356E, E359D и I361T.
6. Применение по п. 3, где вариант PH20 содержит одну или несколько замен аминокислотных остатков, выбранных из группы, состоящей из T341S, L342W, S343E, I344N и N363G.
7. Применение по п. 4, где вариант PH20 содержит замены аминокислотных остатков, указанные в любой из следующих групп:
(a) T341S, L342W, S343E, I344N, M345T, S347T, M348K, K349E, L352Q, L353A, L354I, D355K, N356E, E359D и I361T;
(b) L342W, S343E, I344N, M345T, S347T, M348K, K349E, L352Q, L353A, L354I, D355K, N356E, E359D и I361T;
(c) M345T, S347T, M348K, K349E, L352Q, L353A, L354I, D355K, N356E, E359D и I361T;
(d) M345T, S347T, M348K, K349E, L352Q, L353A, L354I, D355K, N356E, E359D, I361T и N363G;
(e) I344N, M345T, S347T, M348K, K349E, L352Q, L353A, L354I, D355K, N356E, E359D и I361T; и
(f) S343E, I344N, M345T, S347T, M348K, K349E, L352Q, L353A, L354I, D355K, N356E, E359D и I361T.
8. Применение варианта PH20, содержащего одну или несколько замен аминокислотных остатков, выбранных из группы, состоящей из S343E, M345T, K349E, L353A, L354I, N356E и I361T, в PH20 дикого типа, имеющем аминокислотную последовательность SEQ ID NO: 1, где сигнальный пептид SEQ ID NO: 1 заменен на сигнальный пептид, полученный из человеческой гиалуронидазы-1 (Hyal1), человеческого гормона роста или человеческого сывороточного альбумина на N-конце варианта PH20 для получения термостабильной в течение длительного времени фармацевтической композиции, включающей: (а) лекарственное средство; и (b) указанный вариант PH20.
9. Применение по п. 8, где в варианте PH20 один или несколько аминокислотных остатков удаляют путем расщепления перед аминокислотным остатком L36, N37, F38, R39, A40, P41 или P42 на N-конце.
10. Применение по п. 8, где в варианте PH20 один или несколько аминокислотных остатков удаляют путем расщепления после аминокислотного остатка, выбранного из группы, состоящей из V455-S490, на С-конце.
11. Применение по п. 10, где в варианте PH20 один или несколько аминокислотных остатков удаляют путем расщепления после аминокислотного остатка V455, C458, D461, C464, I465, D466, A467, F468, K470, P471, P472, M473, E474, T475, E476, P478, I480, Y482, A484, P486, T488 или S490 на С-конце.
12. Применение варианта PH20, включающего аминокислотную последовательность, выбранную из аминокислотных последовательностей SEQ ID NO: 5 - SEQ ID NO: 50, для получения термостабильной в течение длительного времени фармацевтической композиции, включающей: (a) лекарственное средство; и (b) указанный вариант PH20.
13. Применение по п. 12, где вариант PH20 имеет последовательность SEQ ID NO: 44.
14. Применение по п. 1, где лекарственное средство представляет собой белковое лекарственное средство, антитело, небольшую молекулу, аптамер, РНКи, антисмысловой или клеточный терапевтический агент.
15. Применение по п. 14, где лекарственное средство представляет собой антитело, растворимый рецептор или их Fc-слитый белок.
16. Применение по п. 15, где антитело связывается с одним или несколькими антигенами, выбранными из группы, состоящей из 4-1BB, интегрина, бета-амилоида, ангиопоэтина, аналога 3 ангиопоэтина, фактора активации B-клеток (BAFF), B7-H3, комплемента 5, CCR4, CD3, CD4, CD6, CD11a, CD19, CD20, CD22, CD30, CD33, CD38, CD52, CD62, CD79b, CD80, CGRP, клаудина-18, фактора комплемента D, CTLA4 , DLL3, рецептора EGF, фактора гемофилии, Fc-рецептора, FGF23, фолатного рецептора, GD2, GM-CSF, HER2, HER3, рецептора интерферона, гамма-интерферона, IgE, рецептора IGF-1, интерлейкина 1, рецептора интерлейкина 2, рецептора интерлейкина 4, интерлейкина 5, рецептора интерлейкина 5, интерлейкина 6, рецептора интерлейкина 6, интерлейкина 7, интерлейкина 12/23, интерлейкина 13, интерлейкина 17A, рецептора интерлейкина 17А, рецептора интерлейкина 31, рецептора интерлейкина 36, LAG3, LFA3, NGF, PVSK9 PD-1, PD-L1, RANK-L, SLAMF7, тканевого фактора, TNF, VEGF и vWF.
17. Применение по п. 16, где антитело представляет собой одно или несколько антител, выбранных из группы, состоящей из утомилумаба, натализумаба, этролизумаба, ведолизумаба, бимагрумаба, бапинейзумаба, кренезумаба, соланезумаба, адуканумаба, гантенерумаба, AMI 361780, несвакумаба, вануцизумаба, эвинакумаба, табалумаба, ланалумаба, белимумаба, омбуртамаба, равулизумаба, экулизумаба, могамулизумаба, отеликсизумаба, теплизумаба, муромонаба, тебентафуспа, блинатумомаба, REGN1979, ибализумаба, занолимумаба, итолизумаба, эфализумаба, инебилизумаба, тафаситумаба, лонкастуксимаба тезирина, окрелизумаба, ублитуксимаба, обинутузумаба, офатумумаба, ритуксимаба, тозитумомаба, ибритумомаба тиуксетана, эпратузумаба, инотузумаба озогамицина, моксетумомаба пасудотокса, брентуксимаба ведотина, вадастуксимаба талирина, гемтузумаба озогамицина, даратумумаба, изатуксимаба, алемтузумаба, кризанлизумаба, полатузумаба ведотина, галиксимаба, эптинезумаба, фреманезумаба, галканезумаба, эренумаба, золбетуксимаба, лампализумаба, тремелимумаба, залифрелимаба, ипилимумаба, ровалпитузумаба тезирина, цетуксимаба, депатуксизумаба, залутумумаба, нецитумумаба, панитумумаба, эмицизумаба, нипокалимаба, розаноликсизумаба, буросумаба, фарлетузумаба, мирветуксимаба соравтанзина, динутуксимаба, накситамаба, отилимаба, маргетуксимаба, пертузумаба, трастузумаба, трастузумаба дерутексана, трастузумаба эмтанзина, трастузумаба дуокармазина, патритумаба, анифролумаба, эмапалумаба, лигелизумаба, омализумаба, далотузумаба, фигитумумаба, тепротумумаба, гебокизумаба, канакинумаба, даклизумаба, базиликсимаба, дупилумаба, меполизумаба, реслизумаба, бенрализумаба, клазакизумаба, олокизумаба, сирукумаба, силтуксимаба, сарилумаба, сатрализумаба, тоцилизумаба, REGN88, секукинумаба, устекинумаба, бриакинумаба, лебрикизумаба, тралокинумаба, иксекизумаба, бимекизумаба, бродалумаба, бразикумаба, гуселкумаба, рисанкизумаба, тилдракизумаба, мирикизумаба, немолизумаба, спесолимаба, релатлимаба, нарсоплимаба, фасинумаба, танезумаба, алирокумаба, эволокумаба, бокоцизумаба, ламбролизумаба, балстилимаба, камрелизумаба, цемиплимаба, достарлимаба, пролголимаба, синтилимаба, спартализумаба, тислелизумаба, пембролизумаба, ниволумаба, атезолизумаба, авелумаба, энвафолимаба, дурвалумаба, бинтрафуспа альфа, деносумаба, элотузумаба, концизумаба, марстацимаба, инфликсимаба, адалимумаба, голимумаба, цертолизумаба пегола, озорализумаба, бролуцизумаба, ранибизумаба, бевацизумаба, фарицимаба, рамуцирумаба и каплацизумаба.
18. Применение по п. 15, где растворимый рецептор или растворимый рецептор, включенный в Fc-слитый белок из растворимого рецептора, выбран из группы, состоящей из растворимого рецептора TNF-α, растворимого рецептора VEGF, CTLA-4, растворимого рецептора интерлейкина 1 и растворимого рецептора LFA3.
19. Применение по п. 18, где Fc-слитый белок из растворимого рецептора выбран из группы, состоящей из этанерцепта, афлиберцепта, абатацепта, белатацепта, рилонацепта и алефацепта.
20. Применение по п. 1, где фармацевтическая композиция дополнительно содержит один или несколько компонентов, выбранных из группы, состоящей из буфера, стабилизатора и поверхностно-активного вещества.
21. Применение по п. 20, где буфер содержит одно или несколько веществ, выбранных из группы, состоящей из малата, формиата, цитрата, ацетата, пропионата, пиридина, пиперазина, какодилата, сукцината, 2-(N-морфолино) этансульфоновой кислоты (MES), гистидина, Трис, бис-Трис, фосфата, этаноламина, карбоната, пиперазин-N,N'-бис(2-этансульфоновой кислоты) (PIPES), имидазола, Бис-Трис пропана, N,N-бис(2-гидроксиэтил)-2-аминоэтансульфоновой кислоты (BES), 3-(N-морфолино)пропансульфоновой кислоты (MOPS), гидроксиэтил-пиперазинэтансульфоновой кислоты (HEPES), пирофосфата и триэтаноламина;
стабилизатор включает одно или несколько веществ, выбранных из группы, состоящей из углеводов, сахаров или их гидратов, сахароспиртов или их гидратов и аминокислоты; и
поверхностно-активное вещество включает одно или несколько неионных поверхностно-активных веществ, выбранных из группы, состоящей из сложного эфира полиоксиэтилен-сорбитана и жирной кислоты, полиэтилен-полипропиленгликоля, полиоксиэтилен-стеарата, простых полиоксиэтиленалкиловых эфиров, сополимера полиоксиэтилена-полиоксипропилена, и додецилсульфата натрия (SDS).
22. Применение по п. 21, где углеводы, сахара или сахароспирты включают один или несколько компонентов, выбранных из группы, состоящей из трегалозы или ее гидратов, сахарозы, сахарина, глицерина, эритритола, треитола, ксилитола, арабитола, рибитола, маннитола, сорбитола, галактитола, фуцитола, идитола, инозитола, волемитола, изомальта, мальтитола, полиглицитола, циклодекстрина, гидроксилпропилциклодекстрина и глюкозы; и
аминокислота включает одну или несколько аминокислот, выбранных из группы, состоящей из глутамина, глутаминовой кислоты, глицина, лизина, лизиллизина, лейцина, метионина, валина, серина, селенометионина, цитруллина, аргинина, аспарагина, аспарагиновой кислоты, орнитина, изолейцина, таурина, теанина, треонина, триптофана, тирозина, фенилаланина, пролина, пирролизина, гистидина и аланина.
23. Применение по п. 20, где фармацевтическая композиция содержит гистидиновый буфер, обеспечивающий рН 5,5 ± 2,0, трегалозу и метионин.
24. Применение по п. 20, где фармацевтическая композиция содержит гистидиновый буфер, обеспечивающий рН 5,5 ± 2,0, трегалозу, метионин и полисорбат.
25. Применение по п. 24, где фармацевтическая композиция содержит гистидиновый буфер, обеспечивающий pH 5,5±2,0, 10-400 мМ α,α-трегалозу, 1-50 мМ метионин и от 0,0000001% (масс./об.) до 0,5% (масс./об.) полисорбата.
26. Применение варианта PH20, выбранного из группы, состоящей из:
варианта PH20, включающего одну или несколько замен аминокислотных остатков, выбранных из группы, состоящей из S343E, M345T, K349E, L353A, L354I, N356E и I361T, в PH20 дикого типа, имеющего аминокислотную последовательность SEQ ID NO: 1;
варианта PH20, включающего замену(ы) аминокислотных остатков L354I и/или N356E в PH20 дикого типа, имеющего аминокислотную последовательность SEQ ID NO: 1, и дополнительно включающего замену(ы) аминокислотных остатков в одном или нескольких положениях, выбранных из группы, состоящей из T341, L342, S343, I344, M345, S347, M348, K349, L352, L353, D355, E359, I361 и N363, в PH20 дикого типа, имеющем аминокислотную последовательность SEQ ID NO: 1;
варианта PH20, включающего замену(ы) аминокислотных остатков L354I и/или N356E в PH20 дикого типа, имеющего аминокислотную последовательность SEQ ID NO: 1, и дополнительно включающий замену(ы) аминокислотных остатков в одном или нескольких выбранных положениях из группы, состоящей из T341S, L342W, S343E, I344N, M345T, S347T, M348K, K349E, L352Q, L353A, D355K, E359D, I361T и N363G, в PH20 дикого типа, имеющего аминокислотную последовательность SEQ ID NO: 1;
варианта PH20, включающего одну или несколько замен аминокислотных остатков, выбранных из группы, состоящей из S343E, M345T, K349E, L353A, L354I, N356E и I361T, в PH20 дикого типа, имеющем аминокислотную последовательность SEQ ID NO: 1, где сигнальный пептид SEQ ID NO: 1 заменен на сигнальный пептид, полученный из человеческой гиалуронидазы-1 (Hyal1), человеческого гормона роста или человеческого сывороточного альбумина на N-конце варианта PH20; и
варианта PH20, включающего аминокислотную последовательность, выбранную из аминокислотных последовательностей от SEQ ID NO: 5 до SEQ ID NO: 50,
для получения термостабильного в течение длительного времени состава для подкожных инъекций.
| WO 2013102144 A8, 29.08.2013 | |||
| US 9447401 B2, 20.09.2016 | |||
| MULLER S | |||
| et al., Spliceosomal peptide P140 for immunotherapy of systemic lupus erythematosus: results of an early phase II clinical trial, Arthritis & Rheumatism: Official Journal of the American College of Rheumatology, 2008, V | |||
| Способ окисления боковых цепей ароматических углеводородов и их производных в кислоты и альдегиды | 1921 |
|
SU58A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Способ и устройство для гидравлической доставки ископаемых | 1932 |
|
SU30252A1 |
Авторы
Даты
2024-01-09—Публикация
2020-03-24—Подача