Изобретение относится к экспериментальной фармакологии и может применяться при изучении и поиске лекарственных субстанций противопаркинсонической направленности.
Аналогами предложенного способа на сегодняшний день являются модели болезни Паркинсона на лабораторных животных. Модели классифицируют по способу создания как токсические и генетические. Генетические модели основаны на "нокауте" (прекращении экспрессии) или сверхэкспрессии какого-либо гена. Широкого применения генетические модели не нашли, так как при их применении используются молекулярно-генетические методы воздействия на лабораторных животных, требующие больших затрат. При этом генетические модели более сложны при создании, чем токсические и хуже воспроизводят клиническую картину болезни Паркинсона. На данный момент достоверно не выявлено связи нарушения в работе какого-либо конкретного гена и клинических проявлений болезни Паркинсона.
Токсические модели основаны на применении какого-либо вещества (токсина), которое при попадании в организм само или в виде метаболитов способно вызывать гибель нейронов (нейродегенерацию) базальных ядер и, тем самым, воспроизводить клиническую картину болезни Паркинсона. Предложенную модель болезни Паркинсона на лабораторных животных с помощью ингибиторов везикулярных переносчиков моноаминов можно классифицировать как токсическую.
Согласно «Руководству по проведению доклинических исследований лекарственных средств» (Миронов А.Н., Бунатян Н.Д., 2012 г.) и «Руководству по экспериментальному (доклиническому) изучению новых фармакологических веществ» (под ред. Хабриева Р.У., 2005 г.) наиболее точно отражающей клинические проявления болезни Паркинсона является токсическая ротеноновая модель. Длительность создания модели составляет 21 сутки, после курса введения препаратов снижение двигательной и поведенческой активности у лабораторных животных наблюдается до 3 раз. Но, несмотря на признание ротеноновой модели болезни Паркинсона на лабораторных животных как наиболее точно воспроизводящей клиническую картину заболевания она не отвечает на главный вопрос: как запускается процесс нейродегенерации при болезни Паркинсона. На сегодняшний день в мире патогенез болезни Паркинсона остается неизвестным. Четко известно лишь, что нейроны черной субстанции подвергаются нейродегенерации, а в сохранившихся телах нейронов можно идентифицировать скопления белка, называемые тельцами Леви. Причина нейродегенерации доподлинно неизвестна. Исходя из последних данных известно, что часто в основе гибели клетки, в том числе и нервной лежит окислительный стресс. Также известно, что моноамины, например, дофамин, накапливаясь в цитоплазме клетки подвергаются разрушению ферментами вследствие чего образуются ароматические альдегиды и кислоты. Данные соединения могут активно вступать в реакцию с кислородом с образованием свободных радикалов, накопление которых может быть губительно для клетки.
Техническим результатом предложенного способа является раскрытие связи между клинической картиной болезни Паркинсона и нарушением функции везикулярных переносчиков моноаминов 2 типа. Модель, основанная на воздействии (блокаде) именно на везикулярные переносчики моноаминов является оригинальной разработкой.
Длительность создания модели у интактных лабораторных животных: 2 суток. Необходимое минимальное количество препарата для создания модели у интактных лабораторных животных: 12 мг. Снижение двигательной активности в тестах у лабораторных животных после создания модели: не менее, чем в 5 раз. Снижение исследовательской активности в тестах у лабораторных животных после создания модели: не менее, чем в 5 раз.
При создании модели было выполнено гистологическое подтверждение гибели нейронов черной субстанции, что подтверждает направленность действия ингибиторов везикулярных переносчиков моноаминов.
По сравнению с аналогами экспериментальная модель болезни Паркинсона на лабораторных животных с помощью ингибиторов везикулярных переносчиков моноаминов 2 типа способна лучше отражать клиническую картину болезни Паркинсона, поскольку имеет направленный, а не общетоксический механизм действия.
Оригинальная экспериментальная модель позволит более точно воспроизводить патологические процессы при болезни Паркинсона, что в будущем может создать условия для разработки принципиально нового класса препаратов антипаркинсонической направленности действия.
Оригинальная модель может быть получена в условиях виварного комплекса.
Для ее воспроизведения необходимы интактные лабораторные животные (мыши), ингибиторы везикулярных переносчиков моноаминов 2 типа в дозировке эквивалентной 12 мг тетрабеназина на 1 животное, растворитель (полиэтиленгликоль-300 или аналог).
Набор инструментов и СИЗ для подкожного введения препарата животному с соблюдением правил асептики и антисептики. При однократном подкожном ведении препарата в указанной дозировке на следующий день у лабораторных животных развивается клиническая картина болезни Паркинсона.
Сведения, подтверждающие возможность получения указанного технического результата: были получены при проведении экспериментов с оценкой двигательных и поведенческих тестов у лабораторных животных при создании оригинальной модели. Эксперимент был одобрен локальным Этическим комитетом ФГБОУ ВО «СГМУ» Минздрава России. Лабораторные животные были разделены на контрольные и опытные группы. Также было проведено лабораторное подтверждение результатов эксперимента. С достигнутым уровнем значимости р<0.05 опытные группы лабораторных животных показывали снижение двигательной и поведенческой активности а также экстрапирамидные нарушения (наиболее характерные в неврологии для паркинсонизм-ассоциированных состояний).
В таблице 1 приведены данные теста «открытое поле» у интактных лабораторных животных, разделенных на опытную и контрольную группы. Данные свидетельствуют о том, что различия между группами лабораторных животных в день начала эксперимента были статистически незначимы.
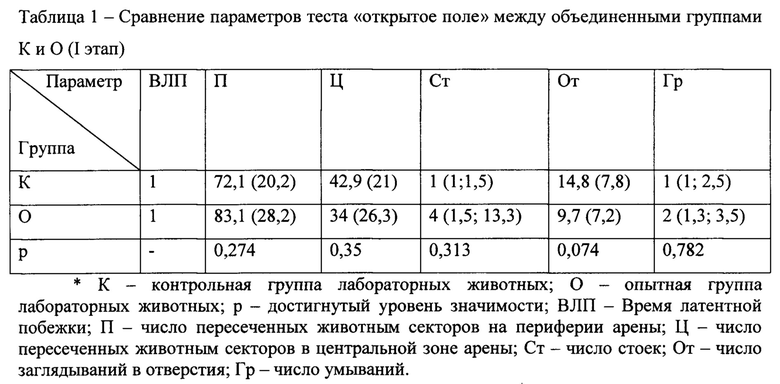
В таблице 2 приведены результаты теста «открытое поле» у лабораторных животных контрольной и опытной группы. Лабораторным животным из этой опытной группы вводили ротенон.


Результаты сравнения групп ОР и К по тесту «поза лектора» представлены в таблице 3.
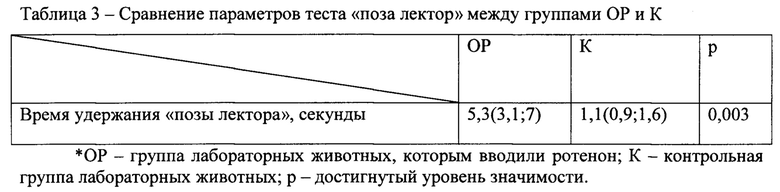
Данные свидетельствуют об удачно воспроизведенной токсической модели болезни Паркинсона на лабораторных животных (с использованием ротенона).
Также было проведено сравнение групп лабораторных животных, которым вводился ингибитор везикулярных переносчиков моноаминов 2 типа (тетрабеназин) с контрольной группой и опытной группой, получавшей ротенон. Наиболее интересны результаты сравнения опытных групп ротеноновой модели и экспериментальной. Данные представлены в таблицах 4 и 5.
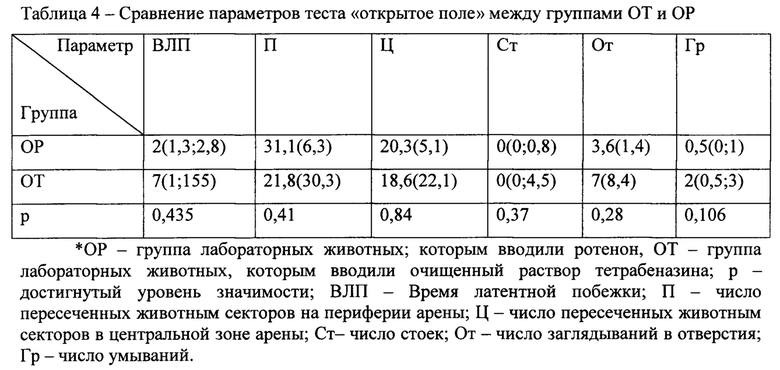
Результаты сравнения групп ОР и ОТ по тесту «поза лектора» представлены в таблице 5.
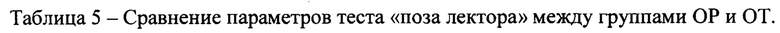

Данные свидетельствуют о том, что различия между группами ОР и ОТ2 на III этапе эксперимента статистически незначимы, кроме параметра времени удержания «позы лектора» (р=0,033). Интересно, что у животных из группы ОТ имеются более грубые экстрапирамидные нарушения, чем у животных группы ОР.
На чертеже 1 изображен тест «Открытое поле» для оценки двигательных и поведенческих способностей лабораторных животных (мышей)
На чертеже 2 изображена мышь, проходящая тест «Поза лектора» в установке для оценки каталепсии.
На чертеже 3 изображен срез головного мозга лабораторных животных опытной и контрольной групп в области черной субстанции. Фотография сделана с помощью камеры Levenhuk М35 BASE. Увеличение окуляра х10, Увеличение объектива х40
Таким образом, группа животных ОТ может служить примером удачно созданной новой экспериментальной модели болезни Паркинсона на лабораторных животных с применением ингибиторов везикулярных переносчиков моноаминов 2 типа.
Использованная литература:
1. Alexander Р.K., Lie Y., Jones G. et al.// Management Impact of Imaging Brain Vesicular Monoamine Transporter Type 2 in Clinically Uncertain Parkinsonian Syndrome with 18F-AV133 and PET // J Nucl Med. 2017 Nov; 58(11): P. 1815-1820. doi: 10.2967/jnumed. 116.189019. Epub 2017 May 10.
2. Bender A. 1., Krishnan K.J., Morris С.M. // High levels of mitochondrial DNA deletions in substantia nigra neurons in aging and Parkinson disease. // Nat Genet. 2006 May; 38(5):515-7. Epub 2006 Apr 9.
3. Ching-Chi Chiu, Tu-Hsueh Yeh, Szu-Chia Lai et al. // Neuroprotective effects of aldehyde dehydrogenase 2 activation in rotenone-induced cellular and animal models of parkinsonism // P. 3; Exp Neurol. 2015 January; 263: 244-253.
doi: 10.1016/j.expneurol.2014.09.016.
4.  et al. // Immune processes in the pathogenesis of Parkinson's disease - a potential role for microglia and nitric oxide // P 166, Med Sci Monit, 2002; 8(8): RA165-177.
et al. // Immune processes in the pathogenesis of Parkinson's disease - a potential role for microglia and nitric oxide // P 166, Med Sci Monit, 2002; 8(8): RA165-177.
5. David S. Goldstein, Patti Sullivan, Adele Cooney et al. // Rotenone Decreases Intracellular Aldehyde Dehydrogenase Activity: Implications for the Pathogenesis of Parkinson Disease // P. 2 J Neurochem. 2015 April; 133(1): 14-25.
doi: 10.1111/jnc.13042.
6. Eiden L., Weihe E., Schafer M. et al. // The vesicular amine transporter family (SLC18): amine/proton antiporters required for vesicular accumulation and regulated exocytotic secretion of monoamines and acetylcholine // European journal of physiology. 2004. №447(5). P. 636-640.
7. Eiden L., Weihe E. // VMAT2: a dynamic regulator of brain monoaminergic neuronal function interacting with drugs of abuse // Annals of the New York Academy of Sciences. 2011. №1216. P. 86-98.
8. Falck В.; Hillarp N. // On The Cellular Localization Of Catechol Amines In The Brain // Acta Anatomica (Basel). 1959. №38(3). P. 277-279.
9. Hall F.S.; Itokawa K.; Schmitt A et al. // Decreased vesicular monoamine transporter 2 (VMAT2) and dopamine transporter (DAT) function in knockout mice affects aging of dopaminergic systems // Neuropharmacology. 2014 Jan; 76(00).
10. Johnson M.E., Bobrovskaya L. An update on the rotenone models of Parkinson's disease: their ability to reproduce the features of clinical disease and model gene-environment interactions. Neurotoxicology. 2015 Jan; 46: P. 101-16.
11.  et al. // The Role of Dopamine and Its Dysfunction as a Consequence of Oxidative Stress. // Oxid Med Cell Longev. 2016; 2016:9730467. doi: 10.1155/2016/9730467. Epub 2015 Dec 6.
et al. // The Role of Dopamine and Its Dysfunction as a Consequence of Oxidative Stress. // Oxid Med Cell Longev. 2016; 2016:9730467. doi: 10.1155/2016/9730467. Epub 2015 Dec 6.
12. Masahiko Watabe; Toshio Nakaki // Mitochondrial Complex I Inhibitor Rotenone Inhibits and Redistributes Vesicular Monoamine Transporter 2 via Nitration in Human Dopaminergic SH-SY5Y Cells // Molecular Pharmacology October 2008, 74 (4) 933-940; doi: https://doi.org/10.1124/mol. 108.048546.
13. Pifl C, Rajput A., Reither H. et al. // Is Parkinson's Disease a Vesicular Dopamine Storage Disorder? Evidence from a Study in Isolated Synaptic Vesicles of Human and Nonhuman Primate Striatum // Journal of Neuroscience. 2014. №34(24). P. 8210-8218.
14. Shulman J., De Jager P., Feany M. // Parkinson's disease: genetics and pathogenesis // Annual Review of Pathology. 2011. №6. P. 193-222.
15. Wimalasena K. // Vesicular monoamine transporters: structure-function, pharmacology, and medicinal chemistry // Medecial research reviews. 2011. №31 (4). P. 483-519.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕРАПЕВТИЧЕСКИЕ АГЕНТЫ ДЛЯ ПРИМЕНЕНИЯ В ПРОФИЛАКТИКЕ И/ИЛИ ЛЕЧЕНИИ ГИПЕРКИНЕТИЧЕСКИХ ДВИГАТЕЛЬНЫХ РАССТРОЙСТВ | 2014 |
|
RU2685502C2 |
| СПОСОБ КОРРЕКЦИИ ОКСИДАТИВНОГО СТАТУСА ПРИ БОЛЕЗНИ ПАРКИНСОНА В ЭКСПЕРИМЕНТЕ | 2023 |
|
RU2800859C1 |
| АНАЛОГИ ЦИСТАМИНА, ПРИМЕНЯЕМЫЕ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2012 |
|
RU2630583C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2024 |
|
RU2839611C1 |
| СПОСОБ РАННЕЙ ДИАГНОСТИКИ БОЛЕЗНИ ПАРКИНСОНА | 2019 |
|
RU2722666C1 |
| Способ коррекции тремора в эксперименте | 2018 |
|
RU2678977C1 |
| N-АЛКИЛ-ТРОПИНЫ И N-АЛКИЛ-НОРТРОПИНЫ С н-ЛИТИЧЕСКОЙ, ПРОТИВОПАРКИНСОНИЧЕСКОЙ, ПРОТИВОЭПИЛЕПТИЧЕСКОЙ, АНАЛЬГЕЗИРУЮЩЕЙ И АНТИДЕПРЕССИВНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2597616C2 |
| Способ получения средства, способного блокировать развитие экспериментального паркинсонизма | 2017 |
|
RU2675697C2 |
| ЛЕЧЕНИЕ НЕВРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2017 |
|
RU2755997C2 |
| Применение клеток штамма Lactobacillus fermentum U-21 для предотвращения патологических изменений в тканях, вызванных оксидативным стрессом | 2019 |
|
RU2757118C2 |


Изобретение относится к экспериментальной фармакологии, а именно к способу создания экспериментальной модели болезни Паркинсона. Для этого мышам однократно подкожно вводят ингибитор везикулярных переносчиков моноаминов 2 типа тетрабеназин в дозировке 12 мг на 1 животное. Изобретение позволяет более точно воспроизводить патологические процессы при болезни Паркинсона, что в будущем может создать условия для разработки принципиально нового класса препаратов антипаркинсонической направленности действия. 3 ил., 5 табл.
Способ создания экспериментальной модели болезни Паркинсона у лабораторных животных, заключающийся в однократном подкожном введении интактным лабораторным животным - мышам ингибитора везикулярных переносчиков моноаминов 2 типа тетрабеназина в дозировке 12 мг на 1 животное.
| Способ моделирования паркинсонического синдрома | 1985 |
|
SU1298793A1 |
| Способ моделирования паркинсонизма | 1987 |
|
SU1506471A1 |
| КОЗИНА Е.А | |||
| и др | |||
| ХРОНИЧЕСКИЕ МОДЕЛИ ДОКЛИНИЧЕСКОЙ И РАННЕЙ КЛИНИЧЕСКОЙ СТАДИЙ БОЛЕЗНИ ПАРКИНСОНА НА МЫШАХ / НЕЙРОХИМИЯ, 2016, том 33, N 3, стр | |||
| Камневыбирательная машина | 1921 |
|
SU222A1 |
| CHANDLER C | |||
| et al | |||
| Modeling long-term health and economic implications of new treatment strategies for Parkinson’s disease: an individual | |||
Авторы
Даты
2023-02-10—Публикация
2022-03-01—Подача