Настоящее изобретение относится к соединениям, пригодным для предупреждения и/или лечения РНК-вирусной инфекции и наиболее предпочтительно РНК-вирусной инфекции, вызванной РНК-вирусами, относящимися к группе IV или V классификации вирусов по Балтимору.
Настоящее изобретение дополнительно относится к некоторым новым соединениям, в частности, пригодным для предупреждения и/или лечения РНК-вирусной инфекции и наиболее предпочтительно РНК-вирусной инфекции, вызванной РНК-вирусами, относящимися к группе IV или V классификации вирусов по Балтимору.
Оно дополнительно относится к фармацевтическим композициям, содержащим указанные новые соединения, и к способам химического синтеза для их производства.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Во всем мире вирусы являются одними из основных возбудителей заболеваний. В целом вирусы определяют как небольшие неживые инфекционные агенты, которые реплицируются только внутри живых клеток, поскольку они не обладают полностью автономным механизмом репликации. Как правило, несмотря на разнообразие формы и размера, они состоят из вирусной частицы (известной как «вирион»), образованной из белковой оболочки, включающей по меньшей мере одну молекулу нуклеиновой кислоты и необязательно, в зависимости от типа вируса, один или более белков или нуклеопротеинов.
В связи с тем, что вирусы не обладают полностью автономным механизмом репликации, для репликации и выработки своих многочисленных копий им необходим механизм и метаболизм пораженной клетки или организма-хозяина.
Общепризнанно, что жизненный цикл вирусов, хотя цикл их репликации значительно варьируется от одного биологического вида к другому, включает шесть основных стадий: прикрепление, проникновение, удаление оболочки, репликацию, сборку и высвобождение.
В зависимости от природы целевого вируса разработаны терапевтические молекулы, которые могут вмешиваться в один или более из этих механизмов.
Из этих механизмов в стадию репликации вовлечено не только умножение вирусного генома, но также и синтез мессенджер-РНК вируса, вирусного белка и модулирование механизма транскрипции или трансляции хозяина. Тем не менее также очевидно, что эту стадию репликации в значительной степени характеризует тип генома (однонитевой, двунитевой, РНК, ДНК…). Например, сборка большинства ДНК-вирусов осуществляется в ядре, при этом большинство РНК-вирусов развивается только в цитоплазме. Также накапливается все больше данных, что однонитевые РНК-вирусы, такие как вирус гриппа, используют механизм сплайсинга и созревания РНК хозяина.
В соответствии с и с учетом значения данного типа генома на стадии репликации была разработана классификация вирусов по Балтимору. На основании этой классификации вирусы распределяют на семейства (или «группы») в зависимости от типа генома. Настоящая классификация вирусов по данным 2018 г. содержит семь различных групп:
- Группа I: двунитевые ДНК-вирусы (днДНК);
- Группа II: однонитевые ДНК-вирусы (онДНК);
- Группа III: двунитевые РНК-вирусы (днРНК);
- Группа IV: (+)-нитевые РНК-вирусы или РНК-вирусы с нитью положительной полярности ((+)онРНК);
- Группа V: (-)-нитевые РНК-вирусы или РНК-вирусы с нитью отрицательной полярности ((-)онРНК);
- Группа VI: однонитевые РНК-вирусы, имеющие промежуточные ДНК (онРНК-ОТ);
- Группа VII: двунитевые ДНК-вирусы, имеющие промежуточные РНК (днРНК-ОТ).
В соответствии с этой классификацией вирусы, принадлежащие к группе VI, в строгом смысле не являются РНК-вирусами. По тем же причинам вирусы, принадлежащие к группе VII, в строгом смысле не являются ДНК-вирусами. Одним из хорошо изученных примеров семейств вирусов, относящихся к группе VI, является семейство Retroviridae (ретровирусы), включающее вирус иммунодефицита человека (ВИЧ). Одним из хорошо изученных примеров семейств вирусов, относящихся к группе VII, является семейство Hepadnaviridae, включающее вирус гепатита B (HBV).
В качестве типового примера вирусов, относящихся к группе IV, можно указать Picornaviruses (который представляет собой семейство вирусов, включающее хорошо известные вирусы, такие как вирус гепатита A, энтеровирусы, риновирусы, полиовирус и вирус ящура), вирус SARS (вирус атипичной пневмонии), вирус гепатита C, вирус желтой лихорадки и вирус краснухи. Семейство Togaviridae также относится к группе IV, и известным родом этого семейства являются альфавирусы, включающие вирус чикунгунья. Flaviridae также представляет собой семейство, относящееся к группе IV, включающее известный вирус, передаваемый комарами, т. е. вирус Денге.
В качестве представителя вирусов, относящихся к группе V, можно указать семейство вирусов Filoviridae, включающее вирус лихорадки Эбола, семейство Paramyxoviridae, включающее респираторно-синцитиальный вирус (RSV), семейство Rhabdoviridae, семейство Orthomyxoviridae, включающее вирус гриппа A, вирус гриппа B и вирус гриппа C.
Группы в пределах семейств вирусов, которые, в частности, рассматриваются в рамках настоящего изобретения, включают РНК-вирусы, особенно однонитевые РНК-вирусы и более конкретно РНК-вирусы, относящиеся к группе IV и к группе V классификации вирусов по Балтимору.
Существует несколько методов лечения заболеваний, вызванных РНК-вирусными инфекциями, в частности однонитевыми РНК-вирусами и более конкретно РНК-вирусными инфекциями из вирусов, относящихся к группе IV и V классификации вирусов по Балтимору. Лечение сосредоточено на облегчении симптомов. Таким образом, все еще существует необходимость в идентификации новых антивирусных лекарственных препаратов для лечения РНК-вирусных инфекций, таких как инфекции, вызванные РНК-вирусами из групп IV и V, в частности низкомолекулярных химических молекул.
ОПРЕДЕЛЕНИЯ
Используемый в настоящем документе термин «пациент» относится либо к животному, такому как ценное животное, предназначенное для целей разведения, содержания в качестве компаньона или сохранения вида, либо предпочтительно к человеку или ребенку, пораженному или имеющему потенциальную возможность поражения одним или более заболеваний или состояний, описанных в настоящем документе.
В частности, используемый в настоящей заявке термин «пациент» относится к млекопитающему, такому как грызун, кошка, собака, примат или человек; предпочтительно указанный субъект представляет собой человека, а также распространяется на птиц.
Идентификация тех пациентов, которым необходимо лечение описанных в настоящем документе заболеваний и состояний, полностью находится в рамках компетенции и знаний специалистов в данной области техники. Ветеринарный врач или терапевт, являющийся специалистом в данной области техники, может легко определить пациентов, которым необходимо такое лечение, с помощью клинических тестов, физикального обследования, сбора медицинского/семейного анамнеза или биологических или диагностических тестов.
В контексте изобретения используемый в настоящем документе термин «лечение» или «терапия» означает реверсирование, облегчение, ингибирование прогрессирования или предупреждение заболевания, являющегося результатом РНК-вирусной инфекции и более конкретно инфицирования РНК-вирусами из группы IV или V, или одного или более симптомов такого заболевания.
Используемый в настоящем документе термин «эффективное количество» относится к количеству соединения по настоящему изобретению, эффективному для предупреждения, снижения, устранения, лечения или контроля симптомов описанных в настоящем документе заболеваний и состояний, т. е. РНК-вирусной инфекции и более конкретно РНК-вирусной инфекции из группы IV или V. Термин «контроль» предназначен для обозначения всех процессов, при которых может происходить замедление, прерывание, остановка или прекращение прогрессирования описанных в настоящем документе заболеваний и состояний, но необязательно указывает на полное устранение всех симптомов заболевания и состояния, а также предусматривает включение профилактического лечения.
Термин «эффективное количество» включает как «профилактически эффективное количество», так и «терапевтически эффективное количество».
Используемый в настоящем документе термин «предупреждение» означает снижение риска начала или замедление возникновения данного явления, а именно, в настоящем изобретении, заболевания являющегося результатом РНК-вирусной инфекции и более конкретно инфицирования РНК-вирусами из группы IV или V.
Используемый в настоящем документе термин «предупреждение» также включает «снижение вероятности возникновения» или «снижение вероятности повторного возникновения».
Термин «профилактически эффективное количество» относится к концентрации соединения по данному изобретению, эффективной при ингибировании, предупреждении, уменьшении вероятности заболевания, вызванного РНК-вирусами и более конкретно РНК-вирусом из группы IV или V классификации вирусов по Балтимору, либо при предупреждении РНК-вирусной инфекции и в частности инфицирования РНК-вирусом из группы IV или V, либо при предупреждении отсроченного начала заболевания, вызванного РНК-вирусами и более конкретно РНК-вирусом из группы IV или V, при введении до инфекции, т.е. до, во время и/или через незначительное время после периода контакта с РНК-вирусом и в частности РНК-вирусом из группы IV или V.
Аналогичным образом термин «терапевтически эффективное количество» относится к концентрации соединения, эффективной в лечении РНК-вирусной инфекции, например приводящей к снижению РНК-вирусной инфекции после обследования в случае введения после наступления инфекции.
Используемый в настоящем документе термин «фармацевтически приемлемый» относится к таким соединениям, материалам, эксципиентам, композициям или лекарственным формам, которые в рамках обоснованного медицинского суждения подходят для контакта с тканями человека и животных, не вызывая избыточной токсичности, раздражения, аллергических реакций или других проблематичных осложнений, соразмерно с рациональным соотношением польза/риск.
Используемый в настоящем документе термин «вирусная инфекция или связанное состояние» относится к состоянию инфицирования, связанного с вирусом, более конкретно указанный вирус имеет РНК-геном, и в частности с РНК-вирусом, относящимся к группе IV или V классификации вирусов по Балтимору. Вирусы могут быть дополнительно классифицированы на отдельные семейства, порядки и роды.
Для ссылки содержание цитируемой в настоящем документе публикации “Baltimore classification” дополнительно относится к ссылкам на таксономию вирусов, приведенным в базе данных 2017 г. Международного комитета по таксономии вирусов (International Committee of Taxonomy of Viruses, ICTV), выпущенной онлайн в электронном виде 12 марта 2018 г. на сайте http://ictvonline.org/virusTaxonomy.asp. Эта таксономия полностью включена в настоящий документ.
В частности, изобретением рассматриваются альфавирусы, относящиеся к группе IV РНК-вирусов и к семейству Togaviridae, которые могут быть определены как однонитевые РНК-вирусы с нитью положительной полярности или (+)онРНК-вирусы. В соответствии с таксономией вирусов 2017 г. их порядок определяют как «не назначенный». Семейство Togaviridae включает роды Alphavirus и Rubivirus.
Примеры рассматриваемых изобретением альфавирусов включают: вирус леса Барма, вирус чикунгунья, вирус Майаро, вирус о'Нъонг-Нъонг, вирус Росс-Ривер, вирус леса Семлинки, вирус Уна, вирус восточного энцефаломиелита лошадей, вирус Тонате, вирус венесуэльского энцефаломиелита лошадей и вирус западного энцефаломиелита лошадей.
Наиболее предпочтительно альфавирусная инфекция или состояние, связанное с альфавирусом, в соответствии с изобретением представляет собой вирусную инфекцию чикунгунья или состояние, связанное с вирусом чикунгунья.
Более конкретно вирус чикунгунья (CHIKV) представляет собой РНК-вирус, относящийся к роду альфавирусов, который, в свою очередь, относится к семейству Togaviridae, т. е. к группе IV классификации вирусов по Балтимору. Чикунгунья представляет собой вирусное заболевание, передаваемое комарами, впервые описанное в период вспышки в южной Танзании в 1952 г. CHIKV представляет собой однонитевый РНК-вирус с нитью положительной полярности, имеющий оболочку, длина генома которого составляет приблизительно 12 кб. Геном CHIKV организован следующим образом: 5'-кэп-nsPl-nsP2-nsP3-nsP4-(область сшивки)-C-E3-E2-6k-El-поли(A)-3', и первые четыре белка в нем (nsPl-4) представляют собой неструктурные белки, а структурными белками являются капсид (C) и белки оболочки (E). Различия между отдельными серотипами среди CHIKV, выделенными в Африке, Азии и на островах Индийского океана, отсутствуют. На основании филогенетического анализа, основанного на последовательностях гена El, CHIKV можно сгруппировать в три генотипа (линии): азиатский, восточно-центрально-южноафриканский (east/central/south African, ECSA) и западноафриканский. Азиатский генотип отличается от ECSA и западноафриканского генотипов на уровне -5 % и -15 % нуклеотидов соответственно. Африканские генотипы (ECSA по сравнению с западноафриканским) были дивергентными на -15 %. Аминокислотная идентичность между тремя генотипами варьировалась от 95,2 до 99,8 %.
Вирус чикунгунья может вызывать вспышки, сопровождающиеся тяжелым течением заболевания.
Чикунгунья представляет собой вирусное заболевание, которое передается человеку от инфицированных комаров. В крупных вспышках чикунгуньи были задействованы оба вида Ae. aegypti и Ae. albopictus. Если Ae. aegypti ограничивается тропиками и субтропиками, Ae. albopictus также встречается в регионах с умеренными и даже холодными температурами. За последние десятилетия Ae. albopictus распространился из Азии и заселил области Африки, Европы и Америки.
Инкубационный период после инфицирования вирусом чикунгунья длится в среднем 2-4 дня, после чего возникают симптомы заболевания. Из таких симптомов можно отметить лихорадку и сильную боль в суставах. Другие симптомы включают мышечную боль, головную боль, тошноту, боль в спине, общую слабость, миалгию и сыпь. Могут также встречаться тяжелые клинические проявления инфекции чикунгунья, например, геморрагическая лихорадка, конъюнктивит, светобоязнь, гепатит, стоматит. Также описаны неврологические проявления, такие как энцефалит, фебрильные судороги, менингеальные симптомы и острая энцефалопатия.
Боль в суставах часто вызывает слабость и может варьироваться по продолжительности.
Близость мест размножения комаров к населенным пунктам является значимым фактором риска чикунгуньи.
Вирус чикунгунья распространен главным образом в Африке, Индии и Юго-Восточной Азии. За последние десятилетия комары-переносчики вируса чикунгунья распространились в Европе и Америке. В 2007 г. передача заболевания впервые зарегистрирована при локализованной вспышке в Северо-Восточной Италии. С тех пор были зарегистрированы вспышки во Франции и Хорватии.
Изобретением также рассматриваются вирусы Денге, которые представлены различными серотипами и относятся к группе IV РНК-вирусов и к семейству Flaviviridae и могут быть определены как однонитевые РНК-вирусы с нитью положительной полярности или (+)онРНК-вирусы. Более конкретно вирус Денге представляет собой (+)онРНК-вирус, относящийся к группе IV классификации вирусов по Балтимору. Он входит в состав рода Flavivirus, принадлежащего к семейству Flaviviridae. Другими вирусами, относящимися к семейству Flaviviridae, являются вирус гепатита C и вирус желтой лихорадки.
Изобретением также конкретно рассмотрены вирусы порядка Mononegavirales. Порядок Mononegavirales включает вирусы, относящиеся к группе V классификации вирусов по Балтимору. По данным на 2018 г. этот порядок включает главным образом следующие семейства вирусов: Bornaviridae, Mymonaviridae, Filoviridae, Nyamiviridae, Paramyxoviridae, Pneumoviridae, Rhabdoviridae и Sunviridae.
Респираторно-синцитиальный вирус человека (HRSV) представляет собой синцитиальный вирус, который вызывает инфекции дыхательных путей. Он является основным возбудителем инфекций нижних дыхательных путей и причиной посещений клиники в младенчестве и в детстве. Вирус HRSV, в частности, рассмотрен изобретением и относится к группе V РНК-вирусов. Более конкретно вирус RSV представляет собой (-)онРНК-вирус, относящийся к группе V классификации вирусов по Балтимору. Он представляет собой пневмовирус, который входит в состав семейства Paramyxoviridae, которое относится к порядку Mononegavirales. Другие вирусы порядка Mononegavirales, конкретно рассмотренные изобретением, включают: вирус кори, вирус эпидемического паротита, вирус Нипах, вирус бешенства и вирус парагриппа человека (который включает HPIV-1, HPIV-2, HPIV-3 и HPIV-4). Следует отметить, что подсемейство Paramyxovirinae традиционно было включено в семейство Paramyxoviridae со ссылкой на таксономию порядка Mononegavirales, обновленную в 2016 г.
Роды вирусов, конкретно рассмотренные в пределах семейства Paramyxoviridae, включают: род Aquaparamyxovirus, Avulavirus, Ferlavirus, Henipavirus, Morbillivirus, Respirovirus и Rubulavirus.
Изобретением также конкретно рассмотрены вирусы семейства Orthomyxoviridae. В соответствии с таксономией вирусов 2017 г. семейство Orthomyxoviridae относится к порядку «не назначенный». Роды вирусов, конкретно рассмотренные в пределах семейства Orthomyxoviridae, включают: Alphainfluenzavirus, Betainfluenzavirus, Deltainfluenzavirus, Gammainfluenzavirus, Isavirus, Quaranjavirus и Thogotovirus.
Изобретением могут быть, в частности, рассмотрены вирус гриппа A, вирус гриппа B, вирус гриппа C, которые относятся к группе V РНК-вирусов и к семейству Orthomyxoviridae, и могут быть определены как однонитевые РНК-вирусы с нитью отрицательной полярности или (-)онРНК-вирусы. К порядку Orthomyxoviridae также относятся изавирус и тоготовирус.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы изобретения неожиданно обнаружили, что соединения арил-N-арила наделены широким спектром активности против РНК-вирусов и более конкретно однонитевых РНК-вирусов, относящихся к группе IV или V классификации вирусов по Балтимору. Группы IV и V включают соответственно (+)онРНК-вирусы и (-)онРНК-вирусы; которые также называют однонитевыми РНК-вирусами с нитью положительной полярности и однонитевыми РНК-вирусами с нитью отрицательной полярности.
Для ссылки содержание «классификации вирусов по Балтимору» рассмотрено в свете классификации и номенклатуры вирусов, описанной в 10-м отчете по таксономии вирусов, датированном 2017 г.
В настоящем документе раскрыто соединение формулы (I)
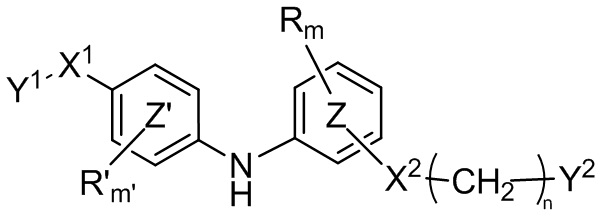 (I),
(I),
где:
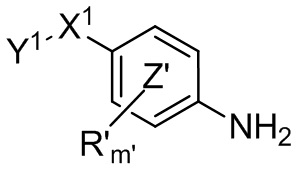
кольцо  и кольцо
и кольцо  независимо означают фениленовую или пиридиленовую группу,
независимо означают фениленовую или пиридиленовую группу,
где группа  находится в мета- или пара-положении на кольце
находится в мета- или пара-положении на кольце  , в частности в мета-положении, по отношению к группе -NH-,
, в частности в мета-положении, по отношению к группе -NH-,
X1 представляет собой алкениленовую группу, в частности этениленовую группу, группу -NH-CO-, группу -CO-NH-, группу -CRaRbO-,
Y1 представляет собой арильную группу, выбранную из 2-пиридильной группы или пиримидинильной группы, где один из атомов азота пиримидинильной группы находится в орто-положении по отношению к X1,
или альтернативно X1-Y1 представляет собой группу (A) формулы
 (A),
(A),
X2 представляет собой группу -CO-NH-, группу -NH-CO-NH-, группу -OCH2-, группу -NH-CO- или группу -SO2-NH-,
n равно 0, 1, 2 или 3,
m и m' независимо равны 0, 1 или 2,
Y2 представляет собой атом водорода, гидроксильную группу или группу -CR1R2R3, где R1, R2 и R3 независимо представляют собой атом водорода, атом фтора или (C1-C4)алкильную группу, при этом подразумевается, что не более чем один из R1, R2 и R3 представляет собой атом водорода, или R1 и R2 образуют вместе с несущим их атомом углерода (C3-C8)циклоалкильную группу, где указанная (C3-C8)циклоалкильная группа необязательно замещена одной или двумя (C1-C4)алкильными группами, атомом галогена или (C1-C4)алкоксигруппой, и указанная (C3-C8)циклоалкильная группа необязательно прервана атомом кислорода на указанном R1 и/или R2,
R и R' независимо представляют собой атом галогена, (C1-C4)алкильную группу, (C3-C6)циклоалкильную группу, (C1-C5)алкоксигруппу, группу -SO2-NRaRb, группу -SO3H, группу -OH, группу -O-SO2-ORc или группу -O-P(=O)-(ORc)(ORd),
Ra, Rb, Rc и Rd независимо представляют собой атом водорода или (C1-C4)алкильную группу,
при условии, что, когда X1 представляет собой группу -CRaRbO-, Y1 может дополнительно представлять собой 3-пиридильную, 4-пиридильную или фенильную группу, необязательно замещенную одним или двумя заместителями, выбранными из атома галогена, (C1-C4)алкильной группы, цианогруппы, (C1-C5)алкоксигруппы, трифторметильной группы, трифторметоксигруппы, группы -SO2-NRaRb, группы -SO3H, группы -OH, группы -O-SO2-ORc или группы -O-P(=O)-(ORc)(ORd),
или любая из его фармацевтически приемлемых солей
для применения в лечении и/или предупреждении РНК-вирусной инфекции, вызванной РНК-вирусом, относящимися к группе IV или V классификации вирусов по Балтимору, и в частности вирусной инфекции чикунгунья, вирусной инфекции Денге, , вирусной инфекции гриппа или вирусной инфекции RSV, или состояния, связанного с вирусом.
В соответствии с первым аспектом настоящее изобретение относится к соединению формулы (Ic)
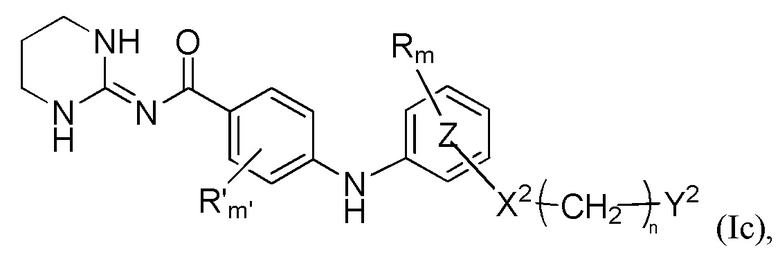
где
Y1, R, R', Ra, Rb, m, m', кольцо  , кольцо
, кольцо  , X2, n и Y2 являются такими, как определено выше для формулы (I),
, X2, n и Y2 являются такими, как определено выше для формулы (I),
или к любой из его фармацевтически приемлемых солей.
Еще в соответствии с указанным первым аспектом настоящее изобретение дополнительно относится к соединениям формулы (Ic), где группа  находится в мета- или пара-положении и предпочтительно в мета-положении на кольце
находится в мета- или пара-положении и предпочтительно в мета-положении на кольце  по отношению к группе -NH-,
по отношению к группе -NH-,
m равно 0, n равно 0, 1, 2 или 3,
Y1 представляет собой пиридильную или фенильную группу, необязательно замещенную одним или двумя заместителями, выбранными из атома галогена, (C1-C4)алкильной группы и цианогруппы, (C1-C5)алкоксигруппы, трифторметильной группы, трифторметоксигруппы, группы -SO2-NRaRb, группы -SO3H, группы -OH, группы -O-SO2-ORc или группы -O-P(=O)-(ORc)(ORd),
Y2 представляет собой атом водорода, гидроксильную группу или группу -CR1R2R3, где R1, R2 и R3 независимо представляют собой атом водорода или (C1-C2)алкильную группу, при этом подразумевается, что не более чем один из R1, R2 и R3 представляет собой атом водорода, или R1 и R2 образуют вместе с несущим их атомом углерода (C3-C6)циклоалкильную группу, где указанная (C3-C6)циклоалкильная группа необязательно замещена одним или двумя атомами галогена, и указанная (C3-C6)циклоалкильная группа необязательно прервана атомом кислорода на указанном R1 и/или R2,
или к любой из их фармацевтически приемлемых солей.
В соответствии со вторым аспектом настоящее изобретение относится к соединениям формулы (Ic), как определено выше, для применения в лечении и/или предупреждении РНК-вирусной инфекции, вызванной РНК-вирусами, относящимися к группе IV или V классификации вирусов по Балтимору, и в частности вирусной инфекции чикунгунья, вирусной инфекции Денге, вирусной инфекции гриппа или вирусной инфекции RSV, или состояния, связанного с вирусом.
В соответствии с третьим аспектом настоящее изобретение относится к соединению формулы (Ic):
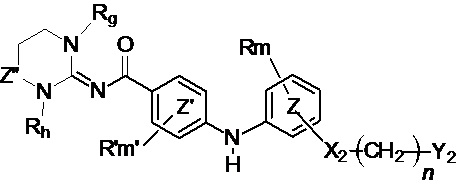 (Ic),
(Ic),
где:
кольцо  и кольцо
и кольцо  независимо означают фениленовую или пиридиленовую группу,
независимо означают фениленовую или пиридиленовую группу,
Z” представляет собой группу -CH2- или группу -CO-,
Rg и Rh независимо представляют собой атом водорода или (C1-C4)алкильную группу,
X2 представляет собой
группу -CO-NRk-, где Rk представляет собой атом водорода или метильную группу,
группу -NH-CO-NH-,
группу -OCH2-,
группу -CH(OH)-,
группу –NH-CO-
группу -O-,
группу -O-(CH2)s-O-, где s равно 2 или 3,
группу -CO-,
группу -SO2-,
двухвалентное 5-членное гетероароматическое кольцо, содержащее 1, 2, 3 или 4 гетероатома, такое как триазол, имидазол, тетразол или оксадиазол,
-NH-SO2-,
группу -NH-
или
группу -SO2-NH-,
n равно 0, 1, 2 или 3,
m и m' независимо равны 0, 1 или 2,
Y2 представляет собой
атом водорода,
атом галогена,
гидроксильную группу,
(C1-C4)алкоксигруппу,
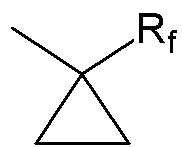 , где Rf представляет собой (C1-C4)алкильную группу, цианогруппу,
, где Rf представляет собой (C1-C4)алкильную группу, цианогруппу,
группу 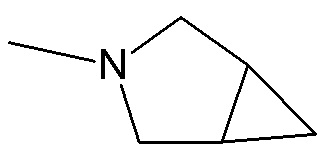 ,
,
группу 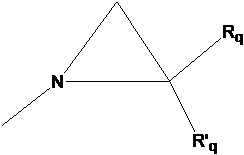 , где Rq и R'q независимо представляют собой атом водорода или метильную группу,
, где Rq и R'q независимо представляют собой атом водорода или метильную группу,
морфолинильную группу, необязательно замещенную (C1-C4)алкильной группой,
пиперазинильную группу,
пиперидинильную группу,
или
группу -CR1R2R3, в которой R1, R2 и R3 независимо представляют собой атом водорода, атом фтора или (C1-C4)алкильную группу, необязательно замещенную трифторметильной группой и/или необязательно замещенную гидроксильной группой, при этом подразумевается, что не более чем один из R1, R2 и R3 представляет собой атом водорода, или R1 и R2 образуют вместе с несущим их атомом углерода (C3-C8)циклоалкильную группу, где указанная (C3-C8)циклоалкильная группа необязательно замещена одной или двумя (C1-C4)алкильными группами, атомом галогена, гидрокси или (C1-C4)алкоксигруппой, и указанная (C3-C8)циклоалкильная группа необязательно прервана одним или двумя атомами кислорода на указанном R1 и/или R2,
R и R' независимо представляют собой
(C1-C4)алкильную группу, необязательно прерванную группой -SO2- или группой -SO-,
(C3-C6)циклоалкильную группу,
трифторметильную группу
атом галогена,
(C1-C5)алкоксигруппу,
группу -SO2-NRaRb,
группу -SO3H,
группу -OH-,
группу -O-SO2-ORc,
группу -O-P(=O)-(ORc)(ORd),
Ra, Rb, Rc и Rd независимо представляют собой атом водорода или (C1-C4)алкильную группу,
или к любой из его фармацевтически приемлемых солей.
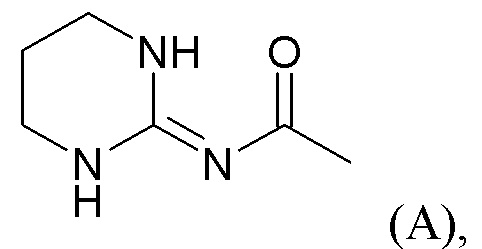
Иными словами, 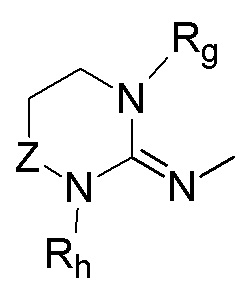 представляет собой группу A формулы
представляет собой группу A формулы 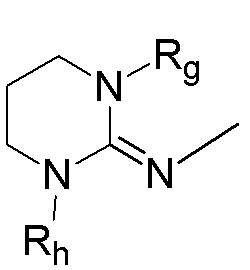 (A) или группу B формулы
(A) или группу B формулы 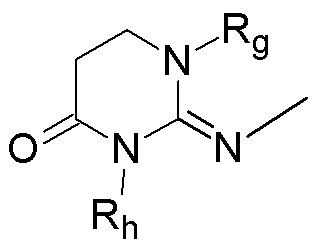 (B).
(B).
В соответствии с четвертым аспектом настоящее изобретение относится к соединению формулы (Ic), как определено выше, или к любой из его фармацевтически приемлемых солей, и к любому из соединений (19)-(31) и (91)-(181), как определено в настоящем документе ниже, для применения в качестве лекарственного средства.
В соответствии с пятым аспектом настоящее изобретение относится к соединению формулы (Ic), как определено выше, для применения в лечении и/или предупреждении РНК-вирусной инфекции, вызванной РНК-вирусом, относящимся к группе IV или V классификации вирусов по Балтимору, и в частности вирусной инфекции чикунгунья, вирусной инфекции Денге, вирусной инфекции гриппа или вирусной инфекции RSV, или состояния, связанного с вирусом.
Указанные выше соединения (I) и (Ic) особенно пригодны для лечения и/или предупреждения вирусной инфекции или связанного состояния, в частности РНК-вирусной инфекции, вызванной РНК-вирусами, относящимися к группе IV или V классификации вирусов по Балтимору, и наиболее предпочтительно вирусной инфекции чикунгунья, вирусной инфекции Денге, вирусной инфекции гриппа или вирусной инфекции RSV, или состояния, связанного с вирусом.
Указанные выше соединения даже более конкретно пригодны для лечения и/или предупреждения вирусной инфекции чикунгунья, или вирусной инфекции RSV, или связанного с вирусом состояния, наиболее особенно вирусной инфекции RSV.
В настоящем документе ниже будут описаны дополнительные аспекты настоящего изобретения, такие как применение новых соединений формулы (Ic) в качестве лекарственного средства, фармацевтические композиции и способ синтеза.
В соответствии с конкретным вариантом осуществления изобретения объект настоящего документа состоит в описании соединения формулы (I), как определено выше, где алкениленовая группа представляет собой (E)-алкениленовую группу,
m и m' независимо равны 0 или 1,
Y2 представляет собой группу -CR1R2R3, где R1, R2 и R3 независимо представляют собой атом водорода, атом фтора или (C1-C2)алкильную группу, при этом подразумевается, что не более чем один из R1, R2 и R3 представляет собой атом водорода, или R1 и R2 образуют вместе с несущим их атомом углерода (C3-C6)циклоалкильную группу, где указанная (C3-C6)циклоалкильная группа необязательно замещена одним или двумя атомами галогена, и указанная (C3-C6)циклоалкильная группа необязательно прервана атомом кислорода на указанном R1 и/или R2,
R и R' независимо представляют собой атом галогена, (C1-C2)алкильную группу, (C3-C6)циклоалкильную группу или (C1-C2)алкоксигруппу,
или любой из его фармацевтически приемлемых солей
для применения в лечении и/или предупреждении РНК-вирусной инфекции, вызванной РНК-вирусом, относящимся к группе IV или V классификации вирусов по Балтимору, и в частности вирусной инфекции чикунгунья, вирусной инфекции Денге, вирусной инфекции гриппа или вирусной инфекции RSV, или состояния, связанного с вирусом.
В соответствии с дополнительным вариантом осуществления настоящее изобретение относится к соединению формулы (I):
 (I),
(I),
где:
кольцо  и кольцо
и кольцо  независимо означают фениленовую или пиридиленовую группу,
независимо означают фениленовую или пиридиленовую группу,
где группа  находится в мета- или пара-положении на кольце
находится в мета- или пара-положении на кольце  по отношению к группе -NH-,
по отношению к группе -NH-,
X1 представляет собой алкениленовую группу, группу -NH-CO-, группу -CO-NH-, группу -CRaRbO-,
Y1 представляет собой арильную группу, выбранную из 2-пиридильной группы и пиримидинильной группы, где один из атомов азота пиримидинильной группы находится в орто-положении по отношению к X1,
или альтернативно X1-Y1 представляет собой группу (A) формулы
X2 представляет собой группу -CO-NH-, группу -NH-CO-NH-, группу -OCH2-, группу -NH-CO- или группу -SO2-NH-,
n равно 0, 1, 2 или 3,
m и m' независимо равны 0, 1 или 2,
Y2 представляет собой атом водорода, гидроксильную группу или группу -CR1R2R3, где R1, R2 и R3 независимо представляют собой атом водорода, атом фтора или (C1-C4)алкильную группу, при этом подразумевается, что не более чем один из R1, R2 и R3 представляет собой атом водорода, или R1 и R2 образуют вместе с несущим их атомом углерода (C3-C8)циклоалкильную группу, где указанная (C3-C8)циклоалкильная группа необязательно замещена одной или двумя (C1-C4)алкильными группами, атомом галогена или (C1-C4)алкоксигруппой, и указанная (C3-C8)циклоалкильная группа необязательно прервана атомом кислорода на указанном R1 и/или R2,
R и R' независимо представляют собой атом галогена, (C1-C4)алкильную группу, (C3-C6)циклоалкильную группу, (C1-C5)алкоксигруппу, группу -SO2-NRaRb, группу -SO3H, группу -OH, группу -O-SO2-ORc или группу -O-P(=O)-(ORc)(ORd),
Ra, Rb, Rc и Rd независимо представляют собой атом водорода или (C1-C4)алкильную группу,
при условии, что, когда X1 представляет собой группу -CRaRbO-, Y1 может дополнительно представлять собой 3-пиридильную, 4-пиридильную или фенильную группу, необязательно замещенную одним или двумя заместителями, выбранными из атома галогена, (C1-C4)алкильной группы, цианогруппы, (C1-C5)алкоксигруппы, трифторметильной группы, трифторметоксигруппы, группы -SO2-NRaRb, группы -SO3H, группы -OH, группы -O-SO2-ORc или группы -O-P(=O)-(ORc)(ORd),
и при условии, что, когда Y1-X1 представляет собой 2-пиридилэтениленовую группу, X2 представляет собой группу -CO-NH-, а Y2 представляет собой группу -CR1R2R3, где R1, R2 и R3 независимо представляют собой атом водорода или (C1-C4)алкильную группу, а m' отличается от 0,
или любой из его фармацевтически приемлемых солей
для применения в лечении и/или предупреждении РНК-вирусной инфекции, вызванной РНК-вирусом, относящимся к группе IV или V классификации вирусов по Балтимору.
В соответствии с конкретным вариантом осуществления изобретения дополнительный объект настоящего изобретения состоит в соединении формулы (Ic)
где
R, R', m, m', кольцо  , X2, n и Y2 являются такими, как определено выше,
, X2, n и Y2 являются такими, как определено выше,
или любой из его фармацевтически приемлемых солей
для применения в лечении и/или предупреждении РНК-вирусной инфекции, вызванной РНК-вирусом, относящимся к группе IV или V классификации вирусов по Балтимору, и в частности вирусной инфекции чикунгунья, вирусной инфекции Денге, вирусной инфекции гриппа или вирусной инфекции RSV, или состояния, связанного с вирусом.
Еще в соответствии с указанным конкретным вариантом осуществления настоящее изобретение дополнительно относится к соединениям формулы (Ic), как определено выше, где
m равно 0, m' равно 0 или 1,
X2 представляет собой группу -CO-NH- или группу -SO2-NH-,
Y2 представляет собой группу -CR1R2R3, где R1, R2 и R3 независимо представляют собой атом водорода или (C1-C2)алкильную группу, при этом подразумевается, что не более чем один из R1, R2 и R3 представляет собой атом водорода, или R1 и R2 образуют вместе с несущим их атомом углерода (C3-C6)циклоалкильную группу,
или любой из его фармацевтически приемлемых солей
для применения в лечении и/или предупреждении РНК-вирусной инфекции, вызванной РНК-вирусом, относящимся к группе IV или V классификации вирусов по Балтимору, и в частности вирусной инфекции чикунгунья, вирусной инфекции Денге, вирусной инфекции гриппа или вирусной инфекции RSV, или состояния, связанного с вирусом.
В соответствии с конкретным вариантом осуществления настоящее изобретение относится к соединению формулы (Ic), как определено выше, где
кольцо  и кольцо
и кольцо  оба представляют собой фениленовую группу, или кольцо
оба представляют собой фениленовую группу, или кольцо  представляет собой пиридиленовую группу и кольцо
представляет собой пиридиленовую группу и кольцо  представляет собой фениленовую группу,
представляет собой фениленовую группу,
или к любой из его фармацевтически приемлемых солей.
В другом варианте осуществления настоящее изобретение относится к соединению формулы (Ic), как определено выше, где
m и m' независимо равны 0 или 1,
Y2 представляет собой группу -CR1R2R3, где R1, R2 и R3 независимо представляют собой атом водорода, атом фтора или (C1-C2)алкильную группу, при этом подразумевается, что не более чем один из R1, R2 и R3 представляет собой атом водорода, или R1 и R2 образуют вместе с несущим их атомом углерода (C3-C6)циклоалкильную группу, где указанная (C3-C6)циклоалкильная группа необязательно замещена одним или двумя атомами галогена, и указанная (C3-C6)циклоалкильная группа необязательно прервана атомом кислорода на указанном R1 и/или R2,
R и R' независимо представляют собой атом галогена, (C1-C2)алкильную группу, (C3-C6)циклоалкильную группу или (C1-C2)алкоксигруппу,
или к любой из его фармацевтически приемлемых солей.
В другом варианте осуществления настоящее изобретение относится к соединению формулы (Ic), где
Rg представляет собой атом водорода, а Rh представляет собой атом водорода или (C1-C4)алкильную группу, такую как метильная группа,
или к любой из его фармацевтически приемлемых солей.
В другом варианте осуществления настоящее изобретение относится к соединению формулы (Ic), где
X2 представляет собой
группу -CO-NRk-, где Rk представляет собой атом водорода или метильную группу,
группу -NH-CO-
группу -O-,
группу -CO-,
группу -CH(OH)-,
группу -SO2-,
группу -NH-,
двухвалентное 5-членное гетероароматическое кольцо, содержащее 1, 2, 3 или 4 гетероатома, такое как триазол, имидазол, тетразол или оксадиазол,
-NH-SO2-,
или
группу -SO2-NH-,
или к любой из его фармацевтически приемлемых солей.
В другом варианте осуществления настоящее изобретение относится к соединению формулы (Ic), где
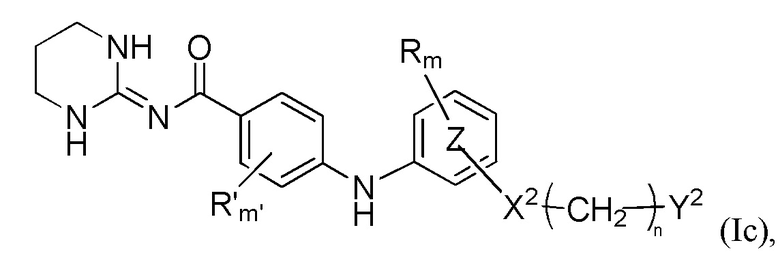
Y2 представляет собой
атом водорода,
атом галогена,
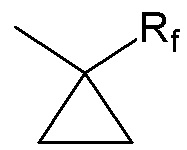 , где Rf представляет собой (C1-C4)алкильную группу, цианогруппу,
, где Rf представляет собой (C1-C4)алкильную группу, цианогруппу,
группу 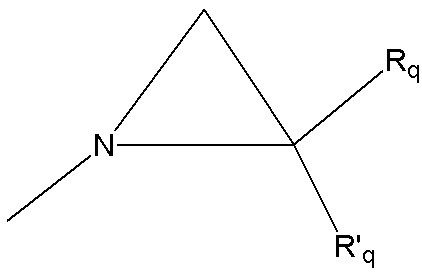 , где Rq и R'q независимо представляют собой атом водорода или метильную группу,
, где Rq и R'q независимо представляют собой атом водорода или метильную группу,
морфолинильную группу, необязательно замещенную (C1-C4)алкильной группой,
группу  ,
,
(C1-C4)алкоксигруппу
или
группу -CR1R2R3, где R1, R2 и R3 независимо представляют собой атом водорода, атом фтора или (C1-C4)алкильную группу, необязательно замещенную трифторметильной группой, необязательно замещенную гидроксильной группой, при этом подразумевается, что не более чем один из R1, R2 и R3 представляет собой атом водорода, или R1 и R2 образуют вместе с несущим их атомом углерода (C3-C8)циклоалкильную группу, где указанная (C3-C8)циклоалкильная группа необязательно замещена одной или двумя (C1-C4)алкильными группами, атомом галогена, гидрокси или (C1-C4)алкоксигруппой, и указанная (C3-C8)циклоалкильная группа необязательно прервана одним или двумя атомами кислорода на указанном R1 и/или R2,
или к любой из его фармацевтически приемлемых солей.
В другом варианте осуществления настоящее изобретение относится к соединению формулы (Ic), где
R и R' независимо представляют собой
(C1-C4)алкильную группу, необязательно прерванную группой -SO2- или группой -SO-,
(C3-C6)циклоалкильную группу,
трифторметильную группу или
атом галогена,
или к любой из его фармацевтически приемлемых солей.
В другом варианте осуществления настоящее изобретение относится к соединению формулы (Ic), где
кольцо  и кольцо
и кольцо  оба представляют собой фениленовую группу, или кольцо
оба представляют собой фениленовую группу, или кольцо  представляет собой пиридиленовую группу и кольцо
представляет собой пиридиленовую группу и кольцо  представляет собой фениленовую группу,
представляет собой фениленовую группу,
m равно 0 или 1, n равно 0 или 1,
X2 представляет собой
группу -CO-NH-,
группу -CO-N(CH3)-,
группу -NH-CO-,
группу -O- или
группу -CO-,
группу -NH-SO2-,
группу -CH(OH)-,
группу -SO2-,
двухвалентный триазол,
двухвалентный имидазол,
двухвалентный тетразол,
двухвалентный оксадиазол,
группу -NH-,
Y2 представляет собой
водород,
морфолинильную группу, необязательно замещенную (C1-C4)алкильной группой,
группу  ,
,
группу  , где Rq и R'q независимо представляют собой атом водорода или метильную группу,
, где Rq и R'q независимо представляют собой атом водорода или метильную группу,
 , где Rf представляет собой (C1-C4)алкильную группу, цианогруппу,
, где Rf представляет собой (C1-C4)алкильную группу, цианогруппу,
(C1-C4)алкоксигруппу
или
группу -CR1R2R3, где R1, R2 и R3 независимо представляют собой атом водорода, атом фтора или (C1-C4)алкильную группу, необязательно замещенную трифторметильной группой, необязательно замещенную гидроксильной группой, при этом подразумевается, что не более чем один из R1, R2 и R3 представляет собой атом водорода, или R1 и R2 образуют вместе с несущим их атомом углерода (C3-C8)циклоалкильную группу, где указанная (C3-C8)циклоалкильная группа необязательно замещена одной или двумя (C1-C4)алкильными группами, атомом галогена, гидрокси или (C1-C4)алкоксигруппой, и указанная (C3-C8)циклоалкильная группа необязательно прервана одним или двумя атомами кислорода на указанном R1 и/или R2,
и
R и R' независимо представляют собой
(C1-C4)алкильную группу,
(C3-C6)циклоалкильную группу, такую как циклопропил,
трифторметильную группу или
атом галогена,
или к любой из его фармацевтически приемлемых солей.
В другом варианте осуществления настоящее изобретение относится к соединению формулы (Ic), где
кольцо  и кольцо
и кольцо  оба представляют собой фениленовую группу,
оба представляют собой фениленовую группу,
m равно 0, n равно 1,
X2 представляет собой
группу -CO-NH- или
группу -O-,
Y2 представляет собой
группу -CR1R2R3, где R1, R2 и R3 независимо представляют собой атом водорода или (C1-C4)алкильную группу, при этом подразумевается, что не более чем один из R1, R2 и R3 представляет собой атом водорода, например изопропильную группу, или R1 и R2 образуют вместе с несущим их атомом углерода (C3-C8)циклоалкильную группу, такую как циклопропил,
и
R' представляет собой
(C1-C4)алкильную группу, такую как трет-бутильная группа, или
(C3-C6)циклоалкильную группу, такую как циклопропил,
или к любой из его фармацевтически приемлемых солей.
Любая комбинация описанных выше вариантов осуществления для R, R', m, m', кольца  , кольца
, кольца  , X1, X2, n, Y1, Y2 друг с другом составляет часть настоящего изобретения.
, X1, X2, n, Y1, Y2 друг с другом составляет часть настоящего изобретения.
В соответствии с предпочтительным вариантом осуществления настоящего изобретения соединение формулы (Ic) выбрано из:
- (19) 4-((3-(N-(2-циклопентилэтил)сульфамоил)фенил)амино)-N-(тетрагидропиримидин-2(1H)-илиден)бензамида,
- (20) N-(циклопентилметил)-3-((4-((тетрагидропиримидин-2(1H)-илиден)карбамоил)фенил)амино)бензамида,
- (21) N-((3-метилоксетан-3-ил)метил)-3-((4-((тетрагидропиримидин-2(1H)-илиден)карбамоил)фенил)амино)бензамида,
- (22) N-(2-циклопентилэтил)-3-((4-((тетрагидропиримидин-2(1H)-илиден)карбамоил)фенил)амино)бензамида,
- (23) N-изопентил-3-((4-((тетрагидропиримидин-2(1H)-илиден)карбамоил)фенил)амино)бензамида,
- (24) N-(2-циклогексилэтил)-3-((4-((тетрагидропиримидин-2(1H)-илиден)карбамоил)фенил)амино)бензамида,
- (25) N-(2-циклопропилэтил)-3-((4-((тетрагидропиримидин-2(1H)-илиден)карбамоил)фенил)амино)бензамида,
- (26) N-(2-циклобутилэтил)-3-((4-((тетрагидропиримидин-2(1H)-илиден)карбамоил)фенил)амино)бензамида,
- (27) 4-((3-(изопентилкарбамоил)фенил)амино)-3-метил-N-(тетрагидропиримидин-2(1H)-илиден)бензамида,
- (28) 4-((3-((2-циклопентилэтил)карбамоил)фенил)амино)-3-метил-N-(тетрагидропиримидин-2(1H)-илиден)бензамида,
- (29) 4-((3-(N-(3-метилбутил)сульфамоил)фенил)амино)-N-(тетрагидропиримидин-2(1H)-илиден)бензамида,
- (30) 4-((3-(N-(1-метилбутил)сульфамоил)фенил)амино)-N-(тетрагидропиримидин-2(1H)-илиден)бензамида,
- (31) 3-метил-4-((3-(N-(2-циклопентилэтил)сульфамоил)фенил)амино)-N-(тетрагидропиримидин-2(1H)-илиден)бензамида,
- (91) 4-{[2-хлор-3-(3-метилморфолин-4-карбонил)фенил]амино}-3-циклопропил-N- [(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида,
- (92) 4-{[2-хлор-3-(2-метилморфолин-4-карбонил)фенил]амино}-3-циклопропил-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида,
- (93) 4-({2-хлор-3-[(1,4-диоксан-2-ил)метокси]фенил}амино)-3-циклопропил-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида,
- (94) 3-трет-бутил-4-{[3-(3-метилбутансульфонамидо)фенил]амино}-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида,
- (95) 4-{[2-хлор-3-(морфолин-4-карбонил)фенил]амино}-3-циклопропил-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида,
- (96) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({2-метил-3-[(3-метилбутил)карбамоил]фенил}амино)бензамида,
- (97) 4-{[3-(3-циклогексилпропокси)фенил]амино}-3-циклопропил-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида,
- (98) 3-трет-бутил-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]-4-({3-[(пропан-2-ил)карбамоил]фенил}амино)бензамида,
- (99) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[(1-метилциклопропил)карбамоил]фенил}амино)бензамида,
- (100) 3-трет-бутил-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]-4-({2-[(пропан-2-ил)карбамоил]фенил}амино)бензамида,
- (101) 4-({3-[(бутан-2-ил)карбамоил]фенил}амино)-3-циклопропил-N-(1,3-диазинан-2-илиден)бензамида,
- (102) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[(пропан-2-ил)карбамоил]фенил}амино)бензамида,
- (103) 4-{[3-(4-циклогексил-1-гидроксибутил)фенил]амино}-3-циклопропил-N-(1,3-диазинан-2-илиден)бензамида,
- (104) N-(1,3-диазинан-2-илиден)-4-({3-[(3-метилбутил)карбамоил]фенил}амино)-3-(трифторметил)бензамида,
- (105) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[(4-метилпентил)карбамоил]фенил}амино)бензамида,
- (106) 4-{[2-(3-циклогексилпропансульфонил)фенил]амино}-3-циклопропил-N-(1,3-диазинан-2-илиден)бензамида,
- (107) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[(5-метилгексил)карбамоил]фенил}амино)бензамида,
- (108) 3-циклопропил-N-[(2E)-1-метил-1,3-диазинан-2-илиден]-4-({3-[(пропан-2-ил)карбамоил]фенил}амино)бензамида,
- (109) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[(1,1,1-трифторпропан-2-ил)карбамоил]фенил}амино)бензамида,
- (110) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[(пентан-3-ил)карбамоил]фенил}амино)бензамида,
- (111) N-(2-циклогексилэтил)-2-({4-[(1,3-диазинан-2-илиден)карбамоил]-2-(трифторметил)фенил}амино)пиридин-4-карбоксамида,
- (112) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-{[3-(дифторметокси)фенил]амино}бензамида,
- (113) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[(3-метилбутил)карбамоил]фенил}амино)бензамида,
- (114) 3-циклопропил-4-{[3-(циклопропилкарбамоил)фенил]амино}-N-(1,3-диазинан-2-илиден)бензамида,
- (115) 4-{[3-(3-циклогексилпропокси)фенил]амино}-3-циклопропил-N-(1,3-диазинан-2-илиден)бензамида,
- (116) 3-циклопропил-4-{[3-(2-метилпропанамидо)фенил]амино}-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида,
- (117) 4-{[3-(циклогексилкарбамоил)фенил]амино}-3-циклопропил-N-(1,3-диазинан-2-илиден)бензамида,
- (118) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[метил(3-метилбутил)карбамоил]фенил}амино)бензамида,
- (119) 4-({3-[4-(циклогексилметил)-1H-1,2,3-триазол-1-ил]фенил}амино)-3-циклопропил-N-(1,3-диазинан-2-илиден)бензамида,
- (120) 3-циклопропил-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]-4-({3-[(пропан-2-ил)карбамоил]фенил}амино)бензамида,
- (121) 3-циклопропил-4-({3-[(1-метилциклопропил)карбамоил]фенил}амино)-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида,
- (122) 3-циклопропил-4-{[2-циклопропил-3-(2-метилпропанамидо)фенил]амино}-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида,
- (123) 4-{[3-(трет-бутилкарбамоил)фенил]амино}-3-циклопропил-N-(1,3-диазинан-2-илиден)бензамида,
- (124) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-{[3-(2,2,2-трифторэтокси)фенил]амино}бензамида,
- (125) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-{[3-(2,2-дифторэтокси)фенил]амино}бензамида,
- (126) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-[(3-{[2-(оксан-4-ил)этил]карбамоил}фенил)амино]бензамида,
- (127) 4-{[3-(циклогексилметокси)фенил]амино}-3-циклопропил-N-(1,3-диазинан-2-илиден)бензамида,
- (128) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-{[2-метил-3-(4-метилпентанамидо)фенил]амино}бензамида,
- (129) 4-[(3-циклобутоксифенил)амино]-3-циклопропил-N-(1,3-диазинан-2-илиден)бензамида,
- (130) 4-{[3-(2-циклогексилэтокси)фенил]амино}-3-циклопропил-N-(1,3-диазинан-2-илиден)бензамида,
- (131) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[(2-метилпропил)карбамоил]фенил}амино)бензамида,
- (132) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[(4-метилпентил)окси]фенил}амино)бензамида,
- (133) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[(2,2,2-трифторэтил)карбамоил]фенил}амино)бензамида,
- (134) 3-циклопропил-4-({3-[(оксан-3-ил)метокси]фенил}амино)-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида,
- (135) 4-[(3-амино-2-метилфенил)амино]-3-циклопропил-N-(1,3-диазинан-2-илиден)бензамида,
- (136) 4-[(3-{3-азабицикло[3.1.0]гексан-3-карбонил}фенил)амино]-3-циклопропил-N-(1,3-диазинан-2-илиден)бензамида,
- (137) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-{[3-(трифторметокси)фенил]амино}бензамида,
- (138) N-(2-циклогексилэтил)-4-({2-циклопропил-4-[(1,3-диазинан-2-илиден)карбамоил]фенил}амино)пиридин-2-карбоксамида,
- (139) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[2-(пропан-2-илокси)этокси]фенил}амино)бензамида,
- (140) 4-{[3-(4-циклогексилбутокси)фенил]амино}-3-циклопропил-N-(1,3-диазинан-2-илиден)бензамида,
- (141) 4-{[3-(5-хлор-1H-имидазол-2-ил)-2-метилфенил]амино}-3-циклопропил-N-(1,3-диазинан-2-илиден)бензамида,
- (142) 4-{[3-(5-хлор-1H-имидазол-2-ил)-2-метилфенил]амино}-3-циклопропил-N-(1,3-диазинан-2-илиден)бензамида,
- (143) 4-{[3-(3-циклогексилпропансульфонил)фенил]амино}-3-циклопропил-N-(1,3-диазинан-2-илиден)бензамида,
- (144) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-{[3-(оксетан-3-илокси)фенил]амино}бензамида,
- (145) 3-циклопропил-4-{[3-(циклопропилкарбамоил)фенил]амино}-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида,
- (146) 3-циклопропил-4-({3-[(оксан-4-ил)метокси]фенил}амино)-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида,
- (147) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({2-[(3-метилбутил)карбамоил]фенил}амино)бензамида,
- (148) 4-{[3-(3-циклогексилпропанамидо)-4-фторфенил]амино}-N-(1,3-диазинан-2-илиден)-3-(трифторметил)бензамида,
- (149) 4-({3-[2-(3-циклогексилпропил)-2H-1,2,3,4-тетразол-5-ил]фенил}амино)-3-циклопропил-N-(1,3-диазинан-2-илиден)бензамида,
- (150) 3-циклопропил-4-({3-[2-(1,4-диоксан-2-ил)этокси]фенил}амино)-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида,
- (151) 3-циклопропил-4-({3-[(оксан-2-ил)метокси]фенил}амино)-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида,
- (152) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[(3,3-дифторциклобутил)карбамоил]фенил}амино)бензамида,
- (153) 4-{[3-(3-циклогексилпропанамидо)фенил]амино}-N-(1,3-диазинан-2-илиден)-3-метилбензамида,
- (154) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-{[3-(2,2-диметилазиридин-1-карбонил)фенил]амино}бензамида,
- (155) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[(оксолан-3-ил)карбамоил]фенил}амино)бензамида,
- (156) 4-{[3-(3-циклогексилпропокси)фенил]амино}-N-(1,3-диазинан-2-илиден)-3-метилбензамида,
- (157) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[(оксан-4-ил)карбамоил]фенил}амино)бензамида,
- (158) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-{[3-(морфолин-4-карбонил)фенил]амино}бензамида,
- (159) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({2-[(3,3,3-трифторпропил)карбамоил]фенил}амино)бензамида,
- (160) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[2-(2-метоксиэтил)-2H-1,2,3,4-тетразол-5-ил]фенил}амино)бензамида,
- (161) 3-циклопропил-4-({3-[(1,4-диоксан-2-ил)метокси]фенил}амино)-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида,
- (162) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-{[3-(2-метилазиридин-1-карбонил)фенил]амино}бензамида,
- (163) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-{[3-(диметилкарбамоил)фенил]амино}бензамида,
- (164) 3-циклопропил-4-{[3-(морфолин-4-карбонил)фенил]амино}-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида,
- (165) 4-({3-[(1-цианоциклопропил)карбамоил]-2-метилфенил}амино)-3-циклопропил-N-(1,3-диазинан-2-илиден)бензамида,
- (166) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[(оксетан-3-ил)карбамоил]фенил}амино)бензамида,
- (167) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-{[3-(4-метилпиперазин-1-карбонил)фенил]амино}бензамида,
- (168) 4-({3-[(1-метилциклопропил)карбамоил]фенил}амино)-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]-3-(пропан-2-сульфонил)бензамида,
- (169) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-{[4-метил-3-(4-метилпентанамидо)фенил]амино}бензамида,
- (170) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({4-метил-3-[(3-метилбутил)карбамоил]фенил}амино)бензамида,
- (171) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[1-(2-метоксиэтил)-1H-1,2,3,4-тетразол-5-ил]фенил}амино)бензамида,
- (172) 4-({3-[(1-цианоциклопропил)карбамоил]фенил}амино)-3-циклопропил-N-(1,3-диазинан-2-илиден)бензамида,
- (173) 4-({3-[(1-метилциклопропил)карбамоил]фенил}амино)-3-(2-метилпропан-2-сульфонил)-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида,
- (174) 4-({3-[(1-метилциклопропил)карбамоил]фенил}амино)-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]-3-(пропан-2-сульфинил)бензамида,
- (175) 3-метил-4-{[3-(морфолин-4-карбонил)фенил]амино}-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида,
- (176) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[(1-гидроксипропан-2-ил)карбамоил]фенил}амино)бензамида,
- (177) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[(3-гидроксициклобутил)карбамоил]фенил}амино)бензамида,
- (178) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-{[3-(пиперазин-1-карбонил)фенил]амино}бензамида,
- (179) 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-({3-[(пиперидин-4-ил)метокси]фенил}амино)бензамида,
- (180) N-(1,3-диазинан-2-илиден)-3-метил-4-[(3-{[3-(морфолин-4-ил)пропил]карбамоил}фенил)амино]бензамида,
- (181) 3-метансульфонил-4-({3-[(1-метилциклопропил)карбамоил]фенил}амино)-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида
и их фармацевтически приемлемых солей.
Настоящее изобретение, таким образом, распространяется на соединения (19)-(31) и (91)-(181) и их фармацевтически приемлемые соли, такие как гидробромид, тартрат, цитрат, трифторацетат, аскорбат, гидрохлорид, тозилат, трифлат, малеат, мезилат, формиат, ацетат и фумарат.
В соответствии с другим аспектом объект настоящего изобретения относится к соединениям (19)-(31) и (91)-(181) или к любой из их фармацевтически приемлемых солей для применения в качестве лекарственного средства.
В соответствии с другим аспектом объект настоящего изобретения относится к соединению формулы (Ic), как определено выше, или к любой из его фармацевтически приемлемых солей и к любому из соединений (19)-(31) и (91)-(181) или к любой из его фармацевтически приемлемых солей для применения в качестве агента для предупреждения, ингибирования или лечения РНК-вирусной инфекции, вызванной РНК-вирусом, относящимся к группе IV или V классификации вирусов по Балтимору.
Соединения (27), (28), (91)-(166) или любая из их фармацевтических приемлемых солей могут быть особенно пригодны для предупреждения, ингибирования или лечения инфекции RSV.
Соединения (22), (23), (24), (26), (27) и (28) или любая из их фармацевтических приемлемых солей могут быть особенно пригодны для предупреждения, ингибирования или лечения инфекции чикунгунья.
Соединения по изобретению могут существовать в форме свободных оснований или солей присоединения с фармацевтически приемлемыми кислотами.
«Его фармацевтически приемлемая соль» относится к солям, образованным из солей присоединения кислоты, образованных с неорганическими кислотами (например, с хлористоводородной кислотой, бромистоводородной кислотой, серной кислотой, фосфорной кислотой, азотной кислотой и т. п.), а также к солям, образованным с органическими кислотами, такими как уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, яблочная кислота, фумаровая кислота, малеиновая кислота, аскорбиновая кислота, бензойная кислота, дубильная кислота, памовая кислота, альгиновая кислота, полиглутаминовая кислота, нафталинсульфоновая кислота, нафталиндисульфоновая кислота и полигалактуроновая кислота.
Подходящие физиологически приемлемые соли присоединения кислоты соединений формулы (Ic) включают гидробромид, тартрат, цитрат, трифторацетат, аскорбат, гидрохлорид, тозилат, трифлат, малеат, мезилат, формиат, ацетат и фумарат.
Соединения формулы (Ic) и любое из соединений (19)-(31) и (91)-(181) или любые из их фармацевтически приемлемых солей могут образовывать сольваты или гидраты, и изобретение включает все такие сольваты и гидраты.
Соединения формулы (Ic) могут быть также представлены в виде таутомерных форм и составляют часть изобретения. Термины «гидраты» и «сольваты» упрощенно означают, что соединения (Ic) в соответствии с изобретением могут находиться в форме гидрата или сольвата, т. е. объединены или ассоциированы с одной или более молекул воды или растворителя. Такие соединения имеют лишь одну химическую характеристику, которая может быть применена ко всем органическим соединениям этого типа.
В контексте настоящего изобретения термин:
- «галоген» понимают как означающий хлор, фтор, бром или иод, и в частности он обозначает хлор, фтор или бром,
- «(C1-Cx)алкил» при использовании в настоящем документе соответственно относится к C1-Cx нормальному, вторичному или третичному насыщенному углеводороду, например (C1-C6)алкилу. Примерами являются без ограничений метил, этил, 1-пропил, 2-пропил, бутил, пентил,
- «алкенилен» означает двухвалентную (C1-Cx)алкильную группу, содержащую двойную связь, и более конкретно этениленовую группу, также известную как винилен или 1,2-этендиил,
- «(C3-C6)циклоалкил» при использовании в настоящем документе относится к циклическому насыщенному углеводороду. Примерами являются без ограничений циклопропил, циклобутил, циклопентил, циклогексил,
- «(C1-Cx)алкокси» при использовании в настоящем документе относится к O-(C1-Cx)алкильному фрагменту, в котором алкил является таким, как определено выше, например (C1-C6)алкокси. Примерами являются без ограничений метокси, этокси, 1-пропокси, 2-пропокси, бутокси, пентокси,
- «арил» при использовании в настоящем документе относится к моноциклической ароматической группе, содержащей 6 атомов углерода и содержащей от 0 до 2 гетероатомов, таких как атомы азота, кислорода или серы, и в частности атом азота. В качестве примеров арильных групп можно упомянуть без ограничений фенил, пиридин, пиримидин, пиридазин, пиразин и т. п. В рамках настоящего изобретения арил предпочтительно представляет собой фенил, пиридазин, пиразин, пиридин, такой как 2-пиридин или 3-пиридин, и пиримидин. Арил даже более предпочтительно представляет собой фенил и пиридин, такой как 2-пиридин или 3-пиридин.
- «двухвалентное 5-членное гетероароматическое кольцо, содержащее 1, 2, 3 или 4 гетероатома», при использовании в настоящем документе означает двухвалентное кольцо, состоящее из ароматического кольца, содержащего 5 цепей и 1, 2, 3 или 4 гетероатома, выбранных из атомов азота и кислорода. В одном варианте осуществления изобретения оно содержит по меньшей мере 1 гетероатом и предпочтительно по меньшей мере один атом азота. В другом варианте осуществления изобретения оно содержит по меньшей мере 2 гетероатома и предпочтительно по меньшей мере один атом азота. В соответствии с дополнительным вариантом осуществления изобретения оно содержит 2, 3 или 4 атома азота, предпочтительно 3 атома азота. В соответствии с еще одним дополнительным вариантом осуществления оно содержит один атом азота и один атом кислорода или два атома азота и один атом кислорода. Примерами являются без ограничений двухвалентный триазол, такой как 1,2,3- или 1,2,4-триазолы, оксадиазолы, такие как 1,2,4-оксадиазол или 1,2,3-оксадиазол, и двухвалентные диазолы, такие как двухвалентный диазол и двухвалентный имидазол. В соответствии с предпочтительным вариантом осуществления изобретения такое двухвалентное 5-членное гетероароматическое кольцо, содержащее 2 или 3 гетероатома, представляет собой двухвалентный триазол.
Соединения формулы (Ic) могут содержать один или более асимметрических атомов углерода. Они могут, таким образом, существовать в форме энантиомеров или диастереоизомеров. Эти энантиомеры, диастереоизомеры и их смеси, включая рацемические смеси, находятся в пределах объема настоящего изобретения.
Соединения по настоящему изобретению могут быть получены традиционными способами органического синтеза, практикуемыми специалистами в данной области техники. Изображенные ниже общие последовательности реакций представляют общий способ, пригодный для получения соединений по настоящему изобретению, и не предусматривают ограничения ими объема или полезности изобретения.
Соединения общей формулы (I) и (Ic) могут быть получены в соответствии со схемой 1 ниже.
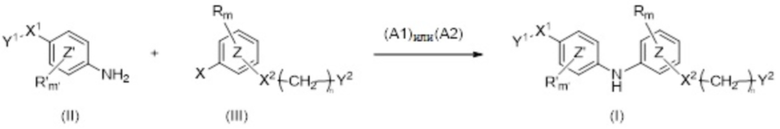
Схема 1.
Синтез основан на реакции сочетания, исходным соединением в котором является галогенароматическое соединение формулы (III), где R, R', m, m', кольцо  , кольцо
, кольцо  , X1, X2, n, Y1, Y2 являются такими, как определено выше, а X представляет собой атом хлора, атом иода или атом брома.
, X1, X2, n, Y1, Y2 являются такими, как определено выше, а X представляет собой атом хлора, атом иода или атом брома.
В соответствии с одним вариантом осуществления изобретения методику (A1) можно преимущественно использовать, когда группа находится в мета- или пара-положении на кольце
находится в мета- или пара-положении на кольце  по отношению к группе -NH-.
по отношению к группе -NH-.
В соответствии с путем синтеза (A1) соединение формулы (III) можно помещать в протонный растворитель, такой как трет-бутанол. Затем можно добавлять соединение формулы (II), например, в молярном отношении в диапазоне от 1 до 1,5 по отношению к соединению формулы (III), в присутствии неорганического основания, такого как Cs2CO3 или K2CO3, например, в молярном отношении в диапазоне от 1 до 5 также по отношению к соединению формулы (III), в присутствии дифосфина, такого как Xantphos (4,5-бис(дифенилфосфино)-9,9-диметилксантен), или X-Phos (2-дициклогексилфосфино-2',4',6'-триизопропилдифенил), или рац-BINAP (рац-(2,2'-бис(дифенилфосфино)-1,1'-бинафтил)), в частности, в количестве в диапазоне от 2 моль % до 15 моль % относительно общего количества соединения формулы (III), и в присутствии металлорганического катализатора, такого как Pd(OAc)2, или Pd2dba3, или BrettPhos Pd G3, в количестве в диапазоне от 2 моль % до 25 моль % относительно общего количества соединения формулы (III). Затем реакционную смесь можно нагревать при температуре в диапазоне от 80 до 130°C, например при 90°C, и перемешивать в течение времени, находящегося в диапазоне от 15 до 25 часов, например в течение 20 часов, в атмосфере инертного газа и, например, аргона. Реакционную смесь можно концентрировать при пониженном давлении, и остаток можно разбавлять органическим растворителем, таким как этилацетат. Органическую фазу можно промывать водой, декантировать, высушивать над сульфатом магния, фильтровать, а затем концентрировать при пониженном давлении с получением соединения формулы (I) и (Ic).
В соответствии с одним вариантом осуществления изобретения методику (A2) можно преимущественно использовать, когда группа находится в орто-положении на кольце
находится в орто-положении на кольце  по отношению к группе -NH-.
по отношению к группе -NH-.
В соответствии с методикой (A2) соединение формулы (II) можно помещать в полярный апротонный растворитель, такой как диметилсульфоксид. Затем можно добавлять соединение формулы (III), например, в молярном отношении в диапазоне от 1 до 1,5 по отношению к соединению формулы (II), в присутствии неорганического основания, такого как Cs2CO3 или K2CO3, например, в молярном отношении в диапазоне от 1 до 5 также по отношению к соединению формулы (II), в присутствии лиганда, такого как L-пролин, в частности, в количестве в диапазоне от 2 моль % до 25 моль % относительно общего количества соединения формулы (II), и в присутствии металлорганического катализатора, такого как CuI, в количестве в диапазоне от 2 моль % до 25 моль % относительно общего количества соединения формулы (II). Затем реакционную смесь можно нагревать при температуре в диапазоне от 80 до 130°C, например при 90°C, и перемешивать в течение времени, находящегося в диапазоне от 15 до 25 часов, например в течение 20 часов, в атмосфере инертного газа и, например, аргона. Реакционную смесь можно разбавлять органическим растворителем, таким как этилацетат. Органическую фазу можно промывать водой, декантировать, высушивать над сульфатом магния, фильтровать, а затем концентрировать при пониженном давлении с получением соединения формулы (I) и (Ic).
Исходные соединения формулы (II), (III) доступны или могут быть получены в соответствии со способами, известными специалистам в данной области техники.
Соответственно, в настоящем документе дополнительно описан способ синтеза для производства новых соединений формулы (I) и (Ic), как определено выше, включающий по меньшей мере стадию сочетания соединения формулы (II)
 (II)
(II)
с соединением формулы (III)
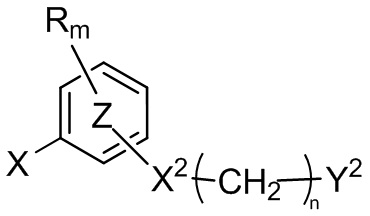 (III),
(III),
где X1, Y1, R, R', m, m', кольцо  , кольцо
, кольцо  , X2, Y2 являются такими, как определено выше, а X представляет собой атом хлора, атом иода или атом брома, в присутствии неорганического основания и лиганда и в присутствии металлорганического катализатора с получением соединения формулы (I) и (Ic).
, X2, Y2 являются такими, как определено выше, а X представляет собой атом хлора, атом иода или атом брома, в присутствии неорганического основания и лиганда и в присутствии металлорганического катализатора с получением соединения формулы (I) и (Ic).
Соединения общей формулы (Ic) могут быть получены в соответствии со схемой 1' ниже.
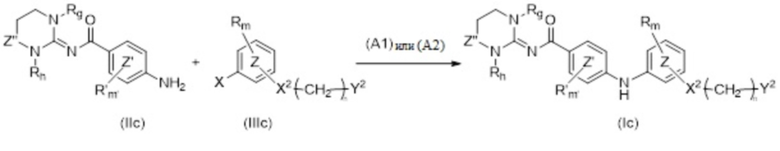
Схема 1'.
Более конкретно настоящее изобретение относится к способу синтеза для производства соединений формулы (Ic), как определено выше, включающему по меньшей мере стадию сочетания соединения формулы (IIc)
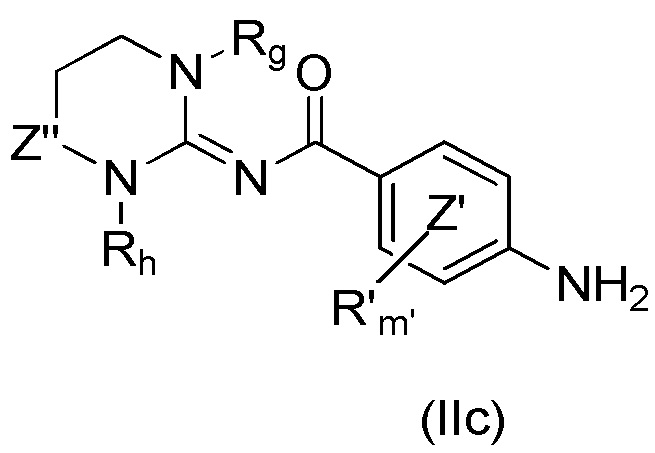
с соединением формулы (IIIc)
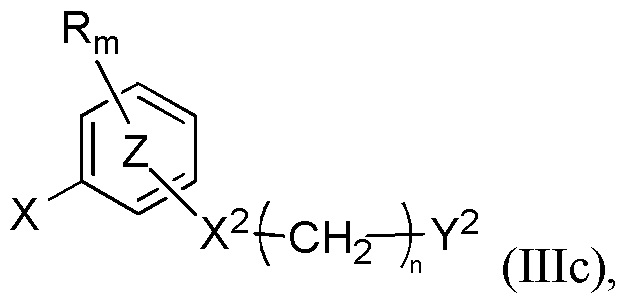
где R, R', m, m', кольцо  , кольцо
, кольцо  , X2, Y2, Rh, Rg и Z” являются такими, как определено выше, а X представляет собой атом хлора, атом иода или атом брома, в присутствии неорганического основания и лиганда и в присутствии металлорганического катализатора с получением соединения формулы (Ic).
, X2, Y2, Rh, Rg и Z” являются такими, как определено выше, а X представляет собой атом хлора, атом иода или атом брома, в присутствии неорганического основания и лиганда и в присутствии металлорганического катализатора с получением соединения формулы (Ic).
Более конкретно соединения формулы (IIc) при использовании для получения соединений формулы (Ic) с Z'' = CH2 могут быть получены в соответствии со схемой 4 ниже.
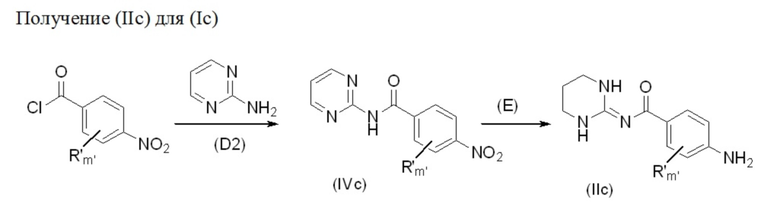
Схема 4.
Промежуточные соединения формул (IIc) и (IVc) пригодны для получения соединений формулы (Ic) в соответствии с изобретением.
В соответствии с путем синтеза (D2) аминопиримидин можно помещать в полярный апротонный растворитель, такой как дихлорметан. Затем можно добавлять производное нитробензоилхлорида, например, в молярном отношении в диапазоне от 1 до 1,5 по отношению к аминопиримидину, в присутствии органического основания, такого как N,N-диизопропилэтиламин или триэтиламин, например, в молярном отношении в диапазоне от 1 до 2 также по отношению к аминопиримидину, в присутствии нуклеофильного катализатора, такого как диметиламинопиридин, например, в молярном отношении в диапазоне от 0,1 до 1 также по отношению к аминопиримидину. Затем реакционную смесь можно перемешивать при комнатной температуре в течение времени, находящегося в диапазоне от 5 до 20 часов, например в течение 18 часов, в атмосфере инертного газа и, например, аргона. Органическую фазу можно промывать водой, и полученный в результате осадок можно фильтровать, промывать водой и дихлорметаном и высушивать под вакуумом в течение ночи с получением соединения формулы (IVc).
В соответствии с путем синтеза (E) соединение формулы (IVc) и 10% Pd/C в отношении в диапазоне от 2 % до 10 % относительно количества бензамида можно помещать в протонный растворитель, такой как этанол. Затем реакционную смесь можно перемешивать при комнатной температуре в течение времени, находящегося в диапазоне от 5 до 20 часов, например в течение 16 часов, в атмосфере H2. Затем реакционную смесь можно фильтровать, и фильтрат можно концентрировать при пониженном давлении с получением соединения формулы (IIc).
В соответствии с одним вариантом осуществления изобретения в том случае, когда Z'' представляет собой группу -CO-, для получения соединений формулы (Ic) можно следовать другому пути синтеза, изображенному на схеме X ниже.
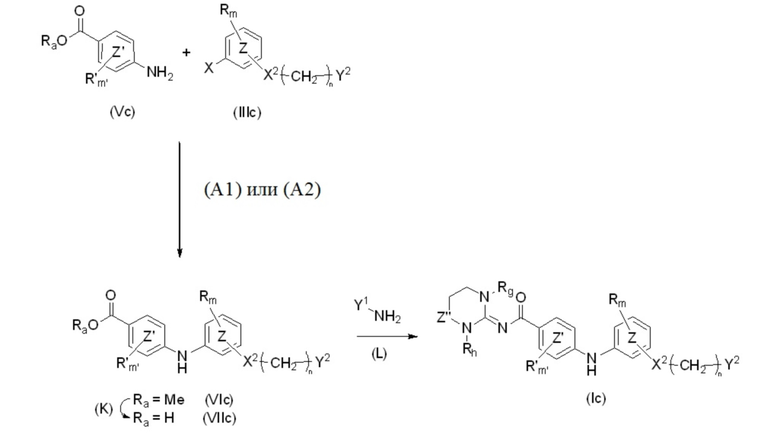
Схема X.
Синтез начинают с реакции сочетания галогенароматического соединения формулы (IIIc) с производным анилина (Vc), где R, R', Ra, m, m', X1, X2, n, Y1, Y2, Z, Z', Z'' являются такими, как определено выше, а X представляет собой атом хлора, атом иода или атом брома, следуя методике (A1) или (A2).
В соответствии с методикой (K) соединение формулы (VIc) можно помещать в протонный растворитель, такой как метанол, и добавлять 2 M водный раствор NaOH в отношении в диапазоне от 3 до 10 эквивалентов. Затем реакционную смесь можно нагревать при температуре в диапазоне от 50 до 90°C, например при 80°C, и перемешивать в течение времени, находящегося в диапазоне от 1 до 24 часов, например в течение 3 часов. Эту смесь можно концентрировать при пониженном давлении и после добавления 2 М водного раствора HCl экстрагировать органическим растворителем, таким как дихлорметан. Затем объединенные органические фазы можно высушивать над сульфатом магния, фильтровать и концентрировать при пониженном давлении с получением соединения формулы (VIIc).
В соответствии с методикой (L) соединение формулы (VIIc) и карбонилдиимидазол (CDI) в отношении в диапазоне от 1,0 до 3 эквивалентов, например 1,2 эквивалента, можно помещать в безводный полярный растворитель, такой как N,N-диметилформамид. Затем реакционную смесь можно перемешивать при комнатной температуре в течение времени, находящегося в диапазоне от 1 до 3 часов, например в течение 1 часа. Затем можно добавлять производное амина Y1-NH2, например, в молярном отношении в диапазоне от 1 до 2,5 по отношению к соединению (VIIc) в присутствии органического основания, такого как триэтиламин или N,N-диизопропилэтиламин, например, в молярном отношении в диапазоне от 2 до 5 также по отношению к соединению (VIIc). Затем реакционную смесь можно нагревать при температуре в диапазоне от 50 до 9°C, например при 75 °C, и перемешивать в течение времени, находящегося в диапазоне от 1 до 24 часов, например в течение 16 часов. Реакционную смесь можно гасить путем добавления насыщенного водного раствора бикарбоната натрия и экстрагировать смесь органическим растворителем, таким как этилацетат. Затем объединенные органические фазы можно высушивать над сульфатом магния, фильтровать и концентрировать при пониженном давлении с получением соединения формулы (Ic).
Химические структуры и спектроскопические данные некоторых соединений формулы (Ic) по изобретению проиллюстрированы соответственно в следующих таблице I и таблице II.
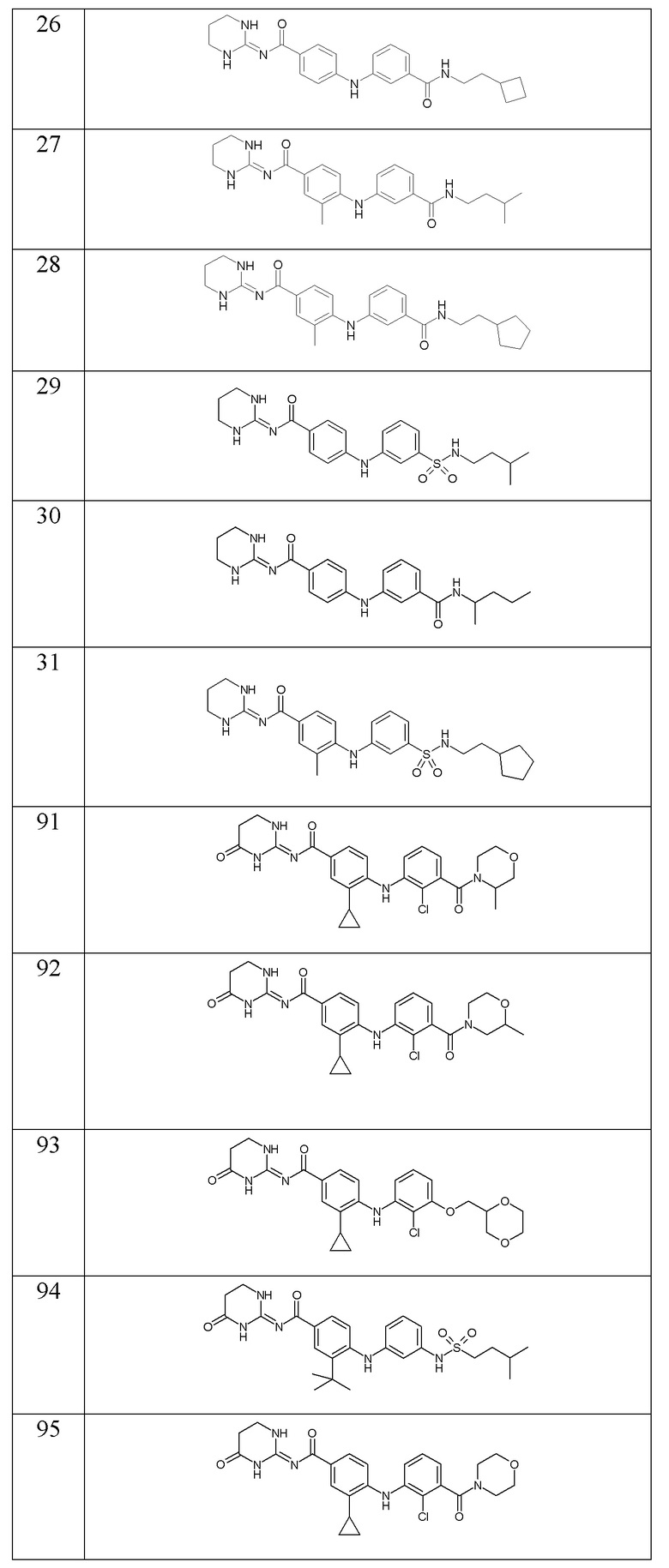
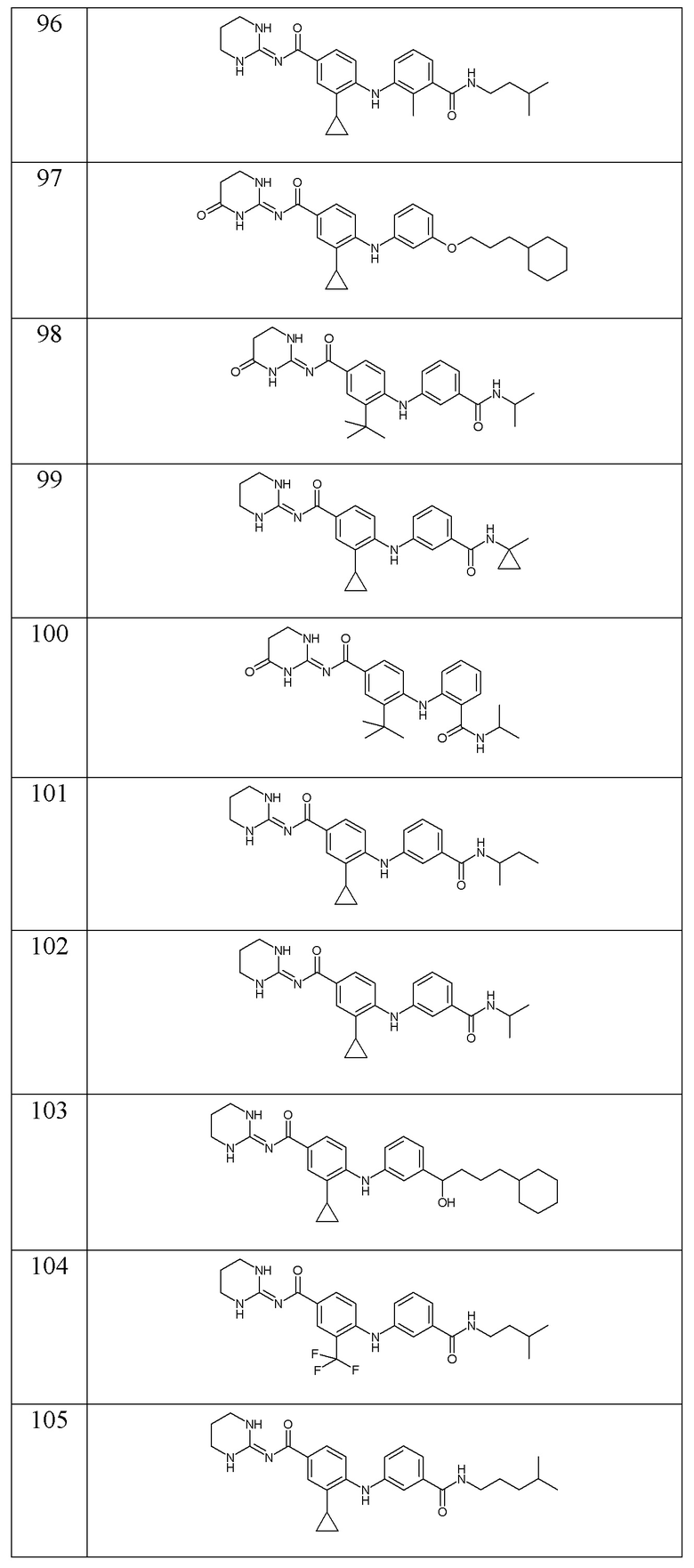
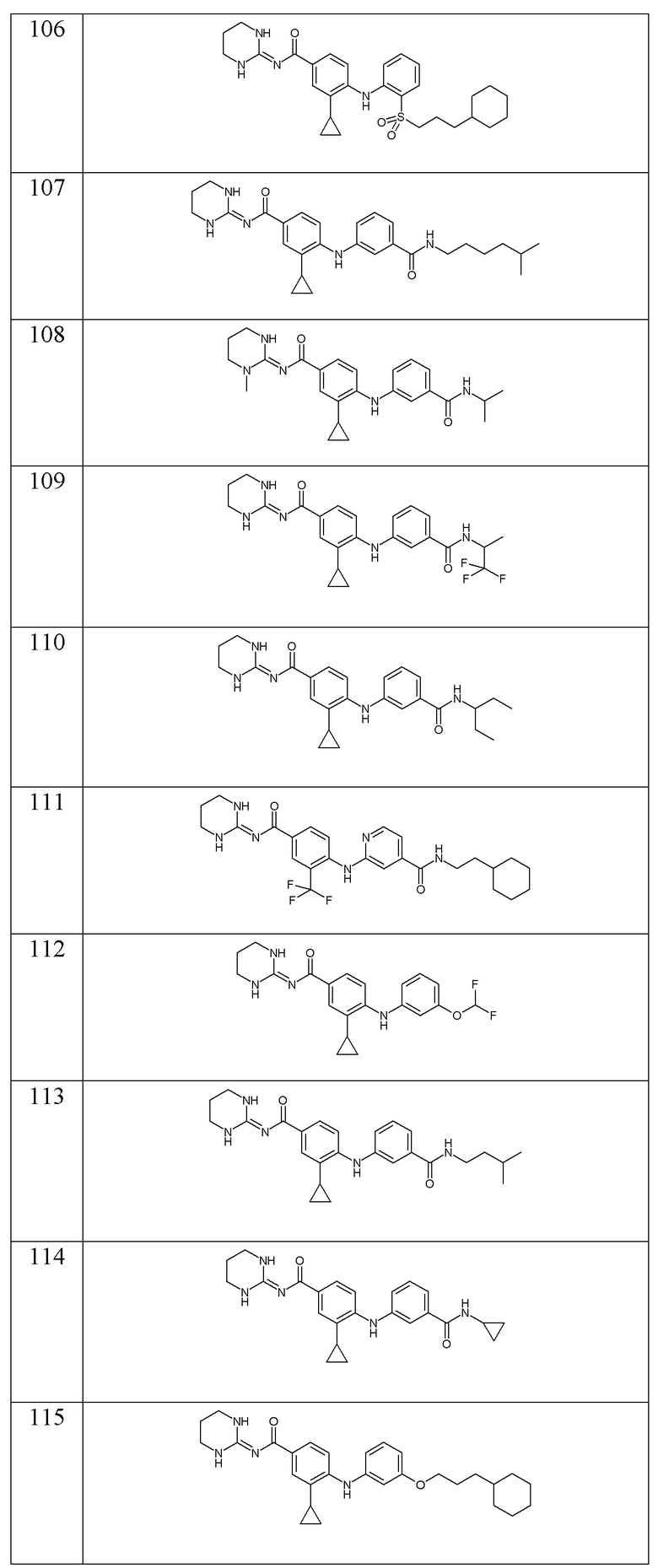
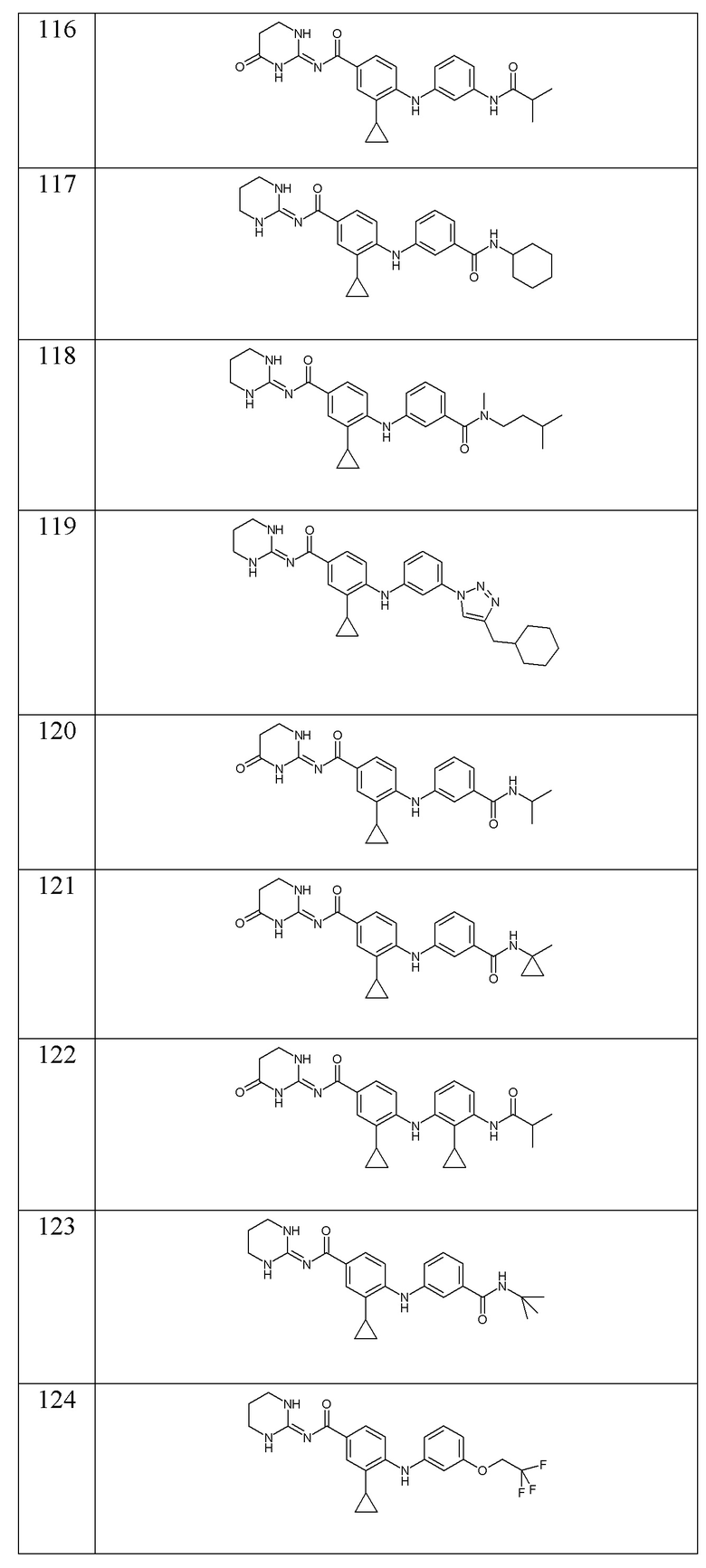
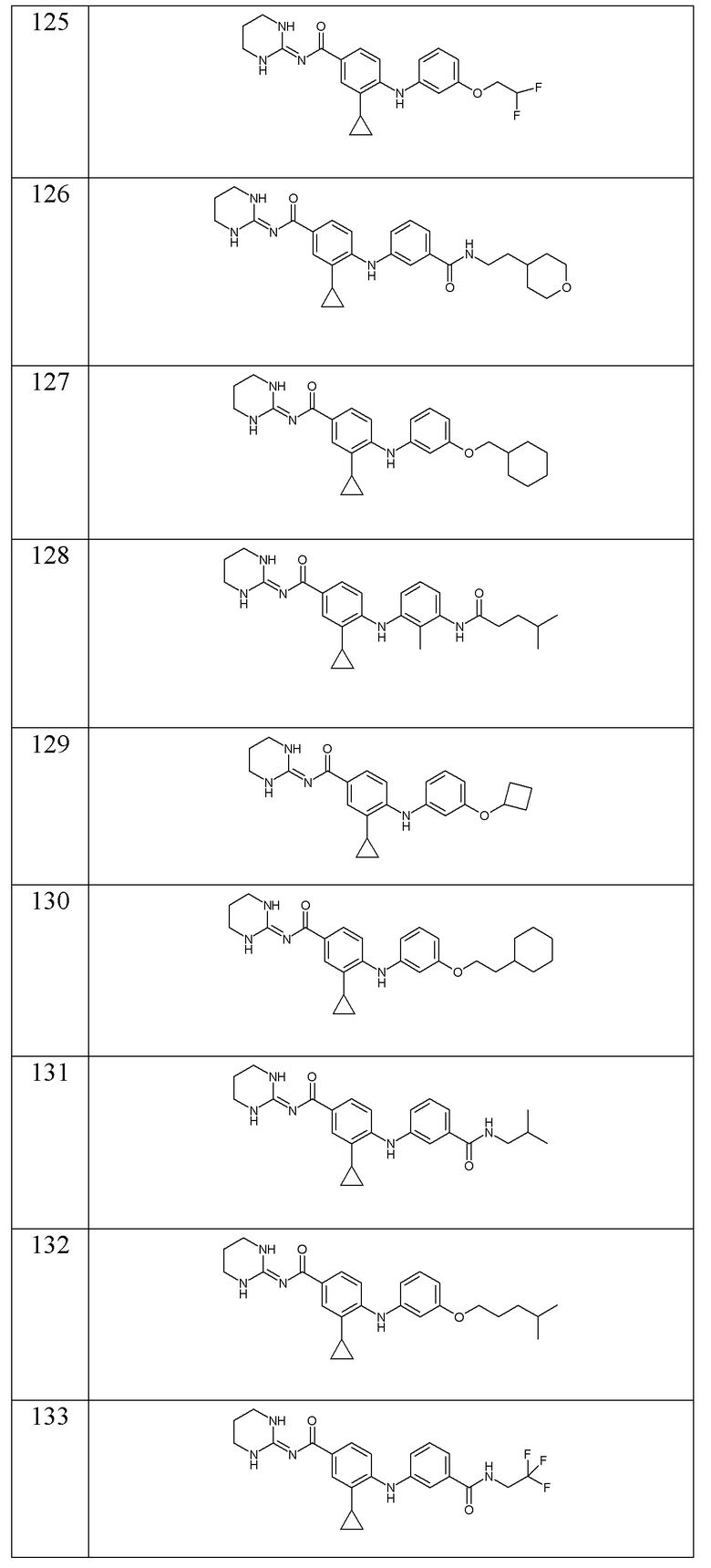
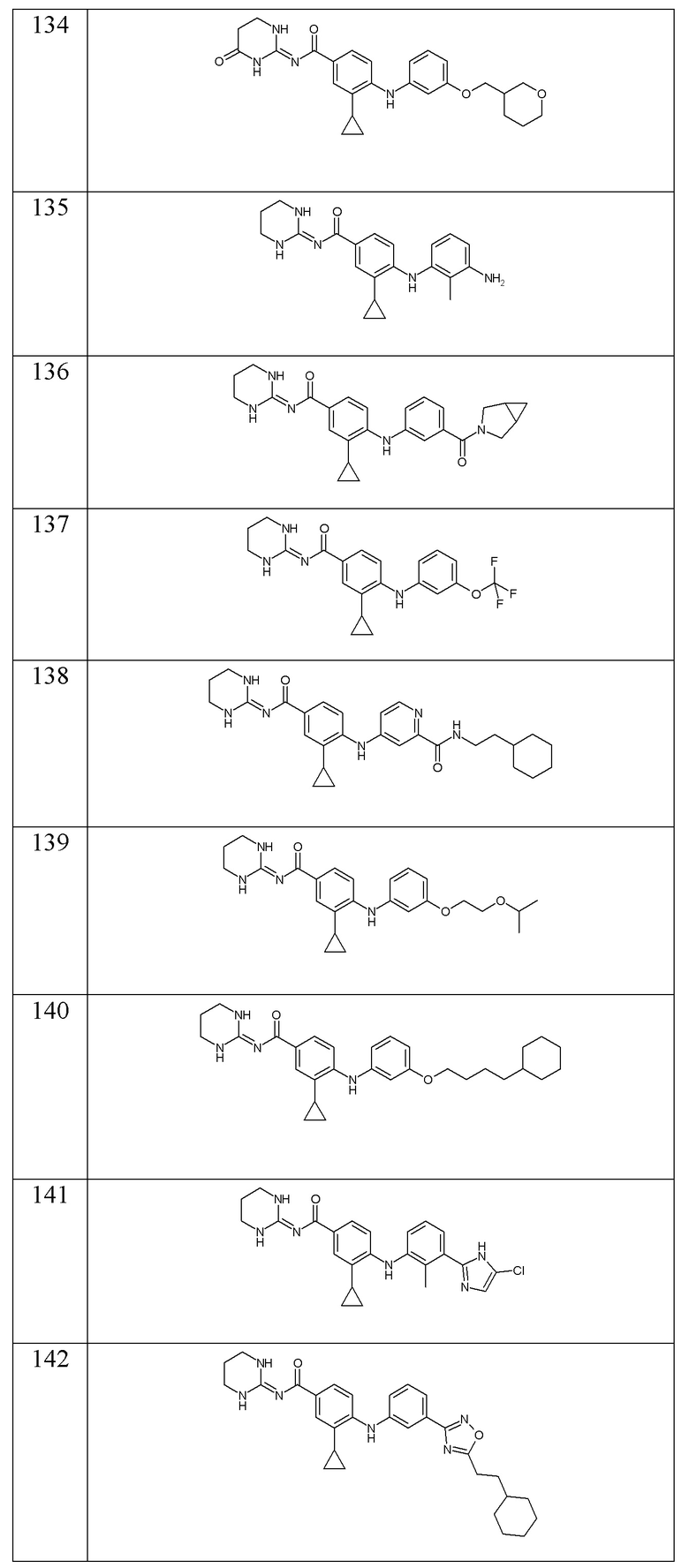
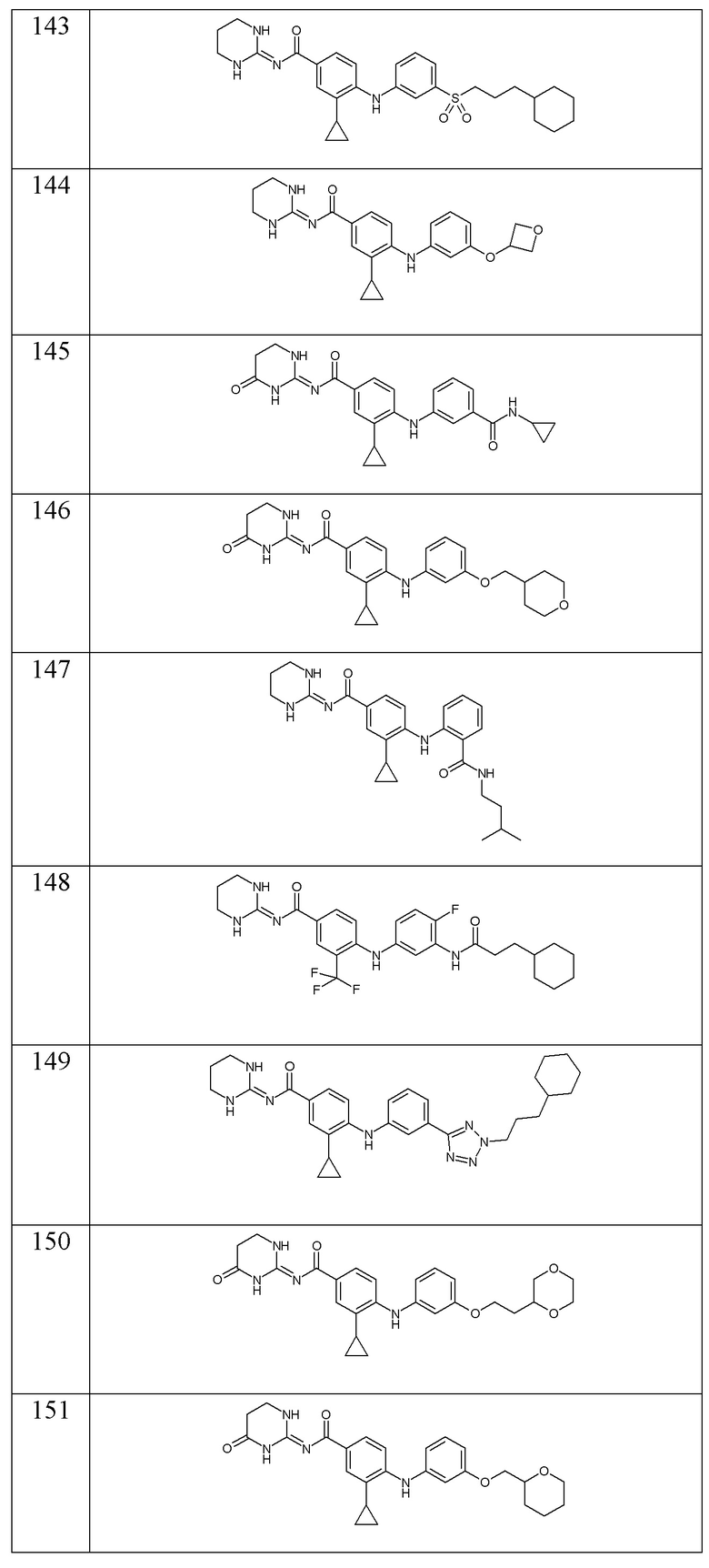
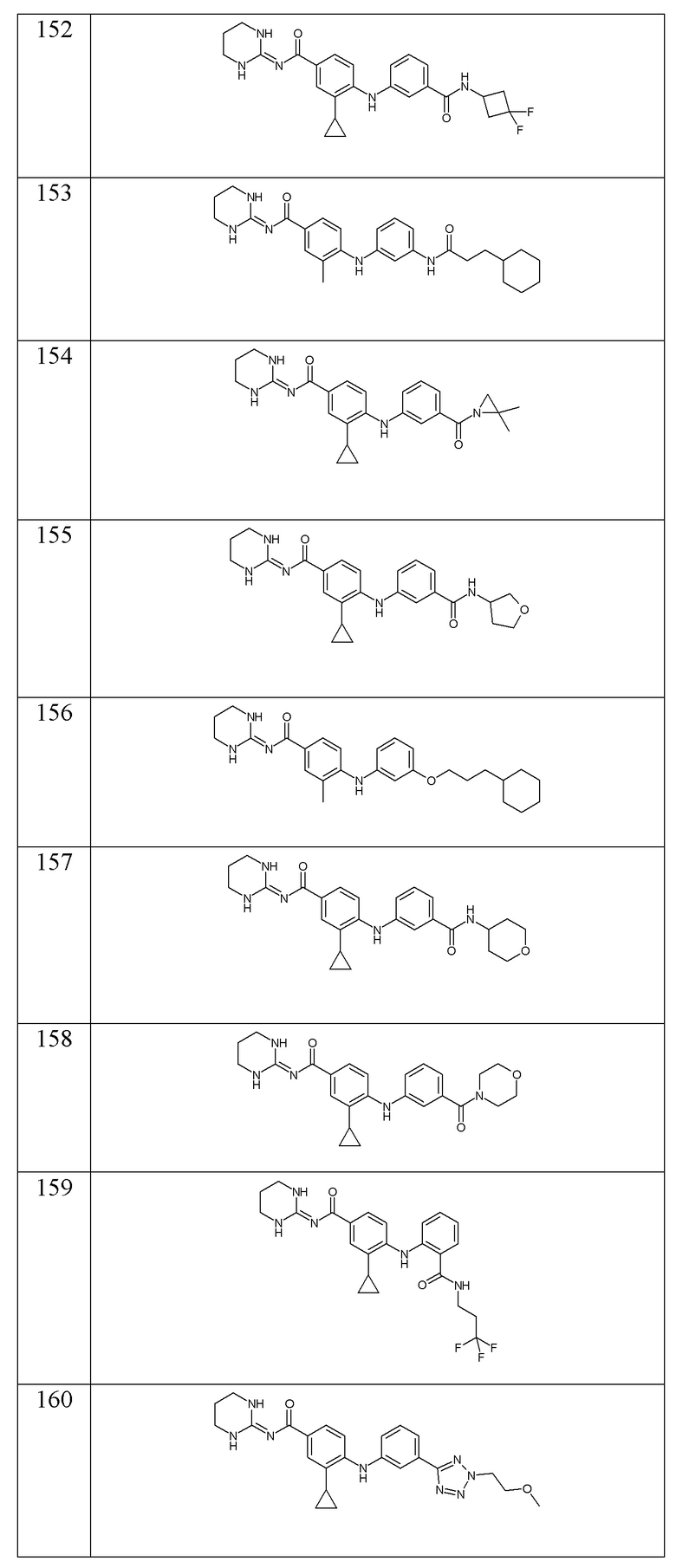
Таблица II
[M+H]+ = 470,3
[M+H]+ = 420,4
[M+H]+ = 422,3
13C ЯМР (75 МГц, d6-ДМСО) δ 175.0, 166.6, 159.1, 145.8, 143.1, 136.5, 131.1, 130.4, 129.6, 120.5, 119.7, 119.4, 116.9, 115.1, 38.6, 37.9, 35.9, 32.7, 25.2, 20.5
[M+H]+ = 434,0
[M+H]+ = 448,4
[M+H]+ = 406,4
[M+H]+ = 420,4
[M+H]+ = 422,4
[M+H]+ = 448,4
[M+H]+ = 444,3
[M+H]+ = 408,4
[M+H]+ = 484,4
[M+H]+ = 510,0
[M+H]+ = 510,0
[M+H]+ = 498,9
[M+H]+ = 514,0
[M+H]+ = 495,9
[M+H]+ = 462,4
13C ЯМР (151 МГц, ДМСО) δ 160.0, 157.6, 146.3, 144.8, 131.0, 130.2, 128.0, 115.7, 111.4, 107.5, 105.4, 68.0, 37.2, 36.8, 33.7, 33.3, 30.5, 26.6, 26.5, 26.3, 11.5, 7.6
[M+H]+ = 489,1
13C ЯМР (151 МГц, ДМСО) δ 177.4, 170.2, 166.1, 157.8, 147.1, 145.0, 144.0, 136.5, 133.5, 129.1, 128.7, 128.1, 126.6, 118.5, 117.3, 115.5, 41.3, 36.8, 35.2, 30.9, 30.5, 22.8
[M+H]+ = 450,1
[M+H]+ = 432,2
[M+H]+ = 450,3
[M+H]+ = 434,3
13C ЯМР (151 МГц, ДМСО) δ 175.1, 166.1, 159.2, 144.6, 144.5, 136.5, 132.6, 131.8, 129.2, 127.3, 127.0, 120.4, 119.0, 117.3, 116.7, 41.3, 38.5, 22.8, 20.4, 11.6, 7.8
[M+H]+ = 450,1
[M+H]+ = 489,4
[M+H]+ = 476,2
[M+H]+ = 462,4
[M+H]+ = 523,3
[M+H]+ = 476,4
[M+H]+ = 434,1
[M+H]+ = 474,2
[M+H]+ = 448,2
[M+H]+ = 517,2
[M+H]+ = 401,3
[M+H]+ = 448,4
[M+H]+ = 418,2
[M+H]+ = 475,5
[M+H]+ = 434,0
[M+H]+ = 460,2
[M+H]+ = 462,2
[M+H]+ = 498,5
13C ЯМР (151 МГц, ДМСО) δ 170.2, 165.9, 157.6, 146.3, 143.6, 136.5, 131.0, 129.2, 128.0, 128.0, 121.6, 119.9, 118.4, 115.4, 41.4, 36.8, 30.5, 22.8, 11.6, 7.6
[M+H]+ = 434,2
[M+H]+ = 446,3
[M+H]+ = 474,1
[M+H]+ = 434,3
[M+H]+ = 433,2
[M+H]+ = 415,2
[M+H]+ = 490,2
[M+H]+ = 447,3
[M+H]+ = 462,4
[M+H]+ = 405,3
[M+H]+ = 461,3
[M+H]+ = 434,4
13C ЯМР (151 МГц, ДМСО) δ 160.0, 145.7, 144.7, 131.7, 130.1, 127.2, 126.9, 116.9, 110.5, 106.7, 104.3, 67.9, 38.5, 35.2, 27.7, 27.1, 22.9, 20.4, 11.5, 7.8
[M+H]+ = 435,5
[M+H]+ = 460,2
[M+H]+ = 463,3
[M+H]+ = 364,3
[M+H]+ = 444,2
[M+H]+ = 419,3
[M+H]+ = 489,6
[M+H]+ = 437,3
[M+H]+ = 489,4
[M+H]+ = 449,3
[M+H]+ = 360,3
[M+H]+ = 523,3
[M+H]+ = 407,2
[M+H]+ = 432,3
[M+H]+ = 463,0
[M+H]+ = 448,4
[M+H]+ = 534,2
[M+H]+ = 527,5
[M+H]+ = 479,0
[M+H]+ = 463,1
[M+H]+ = 468,2
[M+H]+ = 462,5
[M+H]+ = 432,0
[M+H]+ = 448,2
[M+H]+ = 462,2
[M+H]+ = 448,3
[M+H]+ = 474,3
[M+H]+ = 461,4
[M+H]+ = 465,0
[M+H]+ = 417,8
[M+H]+ = 406,3
[M+H]+ = 462,0
[M+H]+ = 457,3
[M+H]+ = 434,3
[M+H]+ = 461,3
[M+H]+ = 512,2
[M+H]+ = 462,4
[M+H]+ = 462,4
[M+H]+ = 461,4
[M+H]+ = 443,3
[M+H]+ = 526,3
[M+H]+ = 496,2
[M+H]+ = 436,0
[M+H]+ = 436,2
транс-изомер: 1H ЯМР (500 МГц, ДМСО-d6) δ ppm 0.50 - 0.65 (m, 2 H), 0.88 - 0.97 (m, 2 H), 1.81 (quin, J = 5.7 Гц, 2 H), 1.90 - 2.01 (m, 1 H), 2.13 (ddd, J = 12.6, 8.0, 4.7 Гц, 2 H), 2.20 - 2.30 (m, 2 H), 3.24 - 3.29 (m, 4 H), 4.23 - 4.34 (m, 1 H), 4.36 - 4.46 (m, 1 H), 4.99 (d, J = 5.2 Гц, 1 H), 7.09 (d, J = 8.2 Гц, 1 H), 7.13 - 7.20 (m, 1 H), 7.25 - 7.34 (m, 2 H), 7.48 - 7.55 (m, 1 H), 7.69 (d, J = 1.6 Гц, 1 H), 7.71 - 7.80 (m, 2 H), 8.48 (d, J = 7.1 Гц, 1 H), 8.77 (s, 2 H).
цис-изомер: 1H ЯМР (500 МГц, ДМСО-d6) δ ppm 0.50 - 0.65 (m, 2 H), 0.88 - 0.97 (m, 2 H), 1.81 (quin, J = 5.7 Гц, 2 H), 1.84 - 1.92 (m, 2 H), 1.90 - 2.01 (m, 1 H), 2.51 - 2.56 (m, 2 H), 3.24 - 3.29 (m, 4 H), 3.79 - 3.92 (m, 2 H), 5.07 (d, J = 5.5 Гц, 1 H), 7.09 (d, J = 8.2 Гц, 1 H), 7.13 - 7.20 (m, 1 H), 7.25 - 7.34 (m, 2 H), 7.48 - 7.55 (m, 1 H), 7.69 (d, J = 1.6 Гц, 1 H), 7.71 - 7.80 (m, 2 H), 8.46 (d, J = 7.4 Гц, 1 H), 8.77 (s, 2 H)
[M+H]+ = 448,2
[M+H]+ = 447,3
[M+H]+ = 448,3
[M+H]+ = 479,4
[M+H]+ = 484,2
Следующие примеры приведены в качестве иллюстрации и никоим образом не ограничивают объем изобретения.
Следующие примеры подробно иллюстрируют получение некоторых соединений в соответствии с изобретением. Структуры полученных продуктов подтверждены ЯМР спектрами.
ПРИМЕРЫ
Пример 1: соединение (22) в таблице I
В соответствии с путем (D2) реакционную смесь 2-аминопиримидина (2,0 г, 21,0 ммоль, 1,0 экв.), 4-нитробензоилхлорида (4,68 г, 25,2 ммоль, 1,2 экв.), N,N-диизопропилэтиламина (5,21 мл, 31,5 ммоль, 1,5 экв.) и диметиламинопиридина (2,6 г, 21,0 ммоль, 1 экв.) в дихлорметане (45 мл) перемешивали при комнатной температуре в течение 18 часов в инертной атмосфере аргона. После промывания органической фазы водой полученный в результате сформированный осадок фильтровали, промывали диэтиловым эфиром и высушивали при пониженном давлении с получением 4-нитро-N-(пиримидин-2-ил)бензамида (2,0 г, 39 %).
1H ЯМР (300 МГц, d6-ДМСО) δ 11.39 (s, 1H), 8.76 (d, J = 4.8 Гц, 2H), 8.34 (d, J = 8.8 Гц, 2H), 8.16 (d, J = 8.8 Гц, 2H), 7.30 (t, J = 4.8 Гц, 1H).
В соответствии с путем (E) 4-нитро-N-(пиримидин-2-ил)бензамид (1 г, 4,1 ммоль, 1 экв.) и 10% Pd/C (2,2 г) помещали в EtOH (20,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов в атмосфере H2. Затем реакционную смесь фильтровали на целите, промывали EtOH, и фильтрат концентрировали при пониженном давлении. Полученный в результате остаток очищали колоночной хроматографией на силикагеле с получением 4-амино-N-(тетрагидропиримидин-2(1H)-илиден)бензамида (580 мг, 65 %).
1H ЯМР (300 МГц, d6-ДМСО) δ 8.77 (s, 2H), 7.75 (d, J = 8.5 Гц, 2H), 6.48 (d, J = 8.5 Гц, 2H), 5.50 (s, 2H), 3.28 (t, J = 5.7 Гц, 4H), 1.86 - 1.76 (m, 2H).
2-Циклопентилэтан-1-амина гидрохлорид (3,0 г, 19,1 ммоль, 1,1 экв.) помещали в 3 н. водный раствор NaOH (13 мл) и добавляли к раствору дихлорметан (3,2 мл). Реакционную смесь охлаждали до 0°C на ледяной бане и добавляли по каплям раствор 3-бромбензоилхлорида (2,3 мл, 17,4 ммоль, 1 экв.) в дихлорметане (5,5 мл). Затем реакционную смесь перемешивали при комнатной температуре в течение 18 часов в инертной атмосфере аргона. После декантации органическую фазу промывали насыщенным водным раствором хлорида натрия, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением 3-бром-N-(2-циклопентилэтил)бензамида (4,6 г, 89 %).
1H ЯМР (300 МГц, CDCl3) δ 7.89 (t, J = 1.7 Гц, 1H), 7.67 (d, J = 7.9 Гц, 1H), 7.62 (d, J = 7.9 Гц, 1H), 7.30 (t, J = 7.9 Гц, 1H), 6.07 (s, 1H), 3.46 (dd, J = 7.4, 5.9 Гц, 2H), 1.90 - 1.76 (m, 3H), 1.67 - 1.52 (m, 6H), 1.20 - 1.09 (m, 2H).
В соответствии с путем (A1) реакционную смесь 3-бром-N-(2-циклопентилэтил)бензамида (296 мг, 1,0 ммоль, 1 экв.), 4-амино-N-(тетрагидропиримидин-2(1H)-илиден)бензамида (218 мг, 1,0 ммоль, 1 экв.), Pd2(dba)3 (92 мг, 0,1 ммоль, 10 моль%), XPhos (95 мг, 0,2 ммоль, 20 моль%) и K2CO3 (553 мг, 4,0 ммоль, 4 экв.) в t-BuOH (4 мл) нагревали в микроволновом реакторе при 120°C в течение 60 минут. Затем реакционную смесь концентрировали при пониженном давлении, и полученный в результате остаток разбавляли этилацетатом. Органическую фазу промывали водой, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Полученный в результате остаток очищали колоночной хроматографией на силикагеле с получением N-(2-циклопентилэтил)-3-({4-[(тетрагидропиримидин-2(1H)-илиден)карбамоил]фенил}амино)бензамида (22) (240 мг, 55 %).
1H ЯМР (300 МГц, d6-ДМСО) δ 8.77 (s, 2H), 8.55 (s, 1H), 8.37 (t, J = 5.6 Гц, 1H), 7.93 (d, J = 8.7 Гц, 2H), 7.59 (s, 1H), 7.37 - 7.29 (m, 2H), 7.27 - 7.21 (m, 1H), 7.02 (d, J = 8.7 Гц, 2H), 3.51 - 3.39 (m, 1H), 3.29 - 3.22 (m, 6H), 1.84 - 1.75 (m, 5H), 1.58 - 1.47 (m, 7H).
13C ЯМР (75 МГц, d6-ДМСО) δ 175.0, 166.6, 159.1, 145.8, 143.1, 136.5, 131.1, 130.4, 129.6, 120.5, 119.7, 119.4, 116.9, 115.1, 38.6, 37.9, 35.9, 32.7, 25.2, 20.5
[M+H]+ = 434,0
Пример 2: соединение (97) в таблице I
3-Бромфенол (701 мг, 3,97 ммоль, 1,2 экв.) помещали в N,N-диметилформамид (4 мл) с Cs2CO3 (1,3 г, 3,97 ммоль, 1,2 экв.). После добавления (3-бромпропил)циклогексана (715 мг, 3,31 ммоль, 1 экв.) реакционную смесь перемешивали при комнатной температуре в течение 16 часов в инертной атмосфере аргона. К реакционной смеси добавляли насыщенный водный раствор NaHCO3 и экстрагировали ее этилацетатом. Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный в результате остаток очищали колоночной хроматографией на силикагеле с получением 1-бром-3-(3-циклогексилпропокси)бензола (882 мг, 90 %).
1H ЯМР (500 МГц, d6-ДМСО) δ 7.22 (t, J = 8.1 Гц, 1H), 7.14 - 7.08 (m, 2H), 6.93 (dd, J = 8.3, 2.3 Гц, 1H), 3.95 (t, J = 6.5 Гц, 2H), 1.68 (tt, J = 15.1, 9.2 Гц, 7H), 1.32 - 1.06 (m, 6H), 0.92 - 0.82 (m, 2H).
В соответствии с методикой (A1) реакционную смесь 1-бром-3-(3-циклогексилпропокси)бензола (547 мг, 1,84 ммоль, 1,1 экв.), метил-4-амино-3-циклопропил-бензоата (320 мг, 1,67 ммоль, 1 экв.), BrettPhos Pd G3 (31,9 мг, 33,5 мкмоль, 2 моль%) и Cs2CO3 (818 мг, 2,51 ммоль, 1,5 экв.) в безводном ДМФ (8 мл) дегазировали N2 и нагревали при 80°C в течение 75 минут в инертной атмосфере. Реакционную смесь охлаждали до комнатной температуры, фильтровали через слой целита и промывали слой EtOAc. Затем к фильтрату добавляли насыщенный водный раствор хлорида натрия и экстрагировали смесь EtOAc. Объединенные органические фазы высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Полученный в результате остаток очищали колоночной хроматографией на силикагеле с получением метил-4-{[3-(3-циклогексилпропокси)фенил]амино}-3-циклопропилбензоата (1,35 г, 80 %).
1H ЯМР (400 МГц, ДМСО-d6) δ 7.82 (s, 1H), 7.66 (dd, J = 8.5, 2.0 Гц, 1H), 7.54 (d, J = 2.0 Гц, 1H), 7.24 - 7.14 (m, 2H), 6.76 (d, J = 7.9 Гц, 1H), 6.73 (t, J = 2.1 Гц, 1H), 6.56 (dd, J = 8.1, 2.2 Гц, 1H), 3.92 (t, J = 6.5 Гц, 2H), 3.78 (s, 3H), 1.94 (ddd, J = 13.8, 8.3, 5.4 Гц, 1H), 1.75 - 1.58 (m, 7H), 1.35 - 1.08 (m, 6H), 1.04 - 0.94 (m, 2H), 0.88 (q, J = 10.0, 9.3 Гц, 2H), 0.65 - 0.56 (m, 2H).
В соответствии с методикой (K) метил-4-{[3-(3-циклогексилпропокси)фенил]амино}-3-циклопропилбензоат (575 мг, 1,34 ммоль, 1 экв.) помещали в метанол (10 мл) и добавляли 2 M водный раствор NaOH (4,7 мл, 9,4 ммоль, 7 экв.). Реакционную смесь нагревали при 80°C и перемешивали в течение 3 часов. Концентрировали ее при пониженном давлении и после добавления 2 M водного раствора HCl (7 мл, 14 ммоль, 10,5 экв.) экстрагировали дихлорметаном. Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением 4-{[3-(3-циклогексилпропокси)фенил]амино}-3-циклопропилбензойной кислоты (540 мг, 97 %).
1H ЯМР (400 МГц, ДМСО-d6) δ 12.37 (s, 1H), 7.76 (s, 1H), 7.64 (dd, J = 8.5, 2.0 Гц, 1H), 7.52 (d, J = 1.9 Гц, 1H), 7.18 (t, J = 8.6 Гц, 2H), 6.74 (d, J = 7.9 Гц, 1H), 6.71 (d, J = 2.1 Гц, 1H), 6.53 (dd, J = 8.1, 2.1 Гц, 1H), 3.91 (t, J = 6.5 Гц, 2H), 1.94 (ddd, J = 13.6, 8.4, 5.4 Гц, 1H), 1.75 - 1.58 (m, 7H), 1.35 - 1.09 (m, 6H), 0.98 (dd, J = 4.0, 2.0 Гц, 2H), 0.88 (q, J = 10.1, 9.3 Гц, 2H), 0.65 - 0.56 (m, 2H).
В соответствии с методикой (L) реакционную смесь 4-{[3-(3-циклогексилпропокси)фенил]амино}-3-циклопропилбензойной кислоты (100 мг, 241 мкмоль, 1 экв.) и CDI (47,0 мг, 290 мкмоль, 1,2 экв.) в безводном ДМФ (1,0 мл) перемешивали при комнатной температуре в течение 1 часа. Затем смесь добавляли к раствору бета-алаклеатинина гидрохлорида (72,2 мг, 483 мкмоль, 2 экв.) и диизопропилэтиламина (DIPEA) (126 мкл, 724 мкмоль, 3 экв.) в безводном ДМФ (1,0 мл), и полученную в результате смесь нагревали при 75°C и перемешивали в течение 16 часов. Затем реакционную смесь охлаждали до комнатной температуры, гасили насыщенным водным раствором бикарбоната натрия и экстрагировали EtOAc. Затем объединенные органические слои промывали насыщенным водным раствором хлорида натрия, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Полученный в результате остаток очищали колоночной хроматографией на силикагеле с получением 4-{[3-(3-циклогексилпропокси)фенил]амино}-3-циклопропил-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида (97) (75,0 мг, 62 %).
1H ЯМР (400 МГц, d6-DMSO) δ 10.78 (s, 1H), 10.15 (s, 1H), 7.85 - 7.77 (m, 2H), 7.67 (s, 1H), 7.15 (t, J = 8.4 Гц, 2H), 6.70 (d, J = 7.9 Гц, 1H), 6.67 (t, J = 2.1 Гц, 1H), 6.47 (dd, J = 8.1, 2.1 Гц, 1H), 3.90 (t, J = 6.5 Гц, 2H), 3.54 (t, J = 7.0 Гц, 2H), 2.61 (t, J = 7.0 Гц, 2H), 1.94 (ddd, J = 13.7, 8.4, 5.5 Гц, 1H), 1.69 (t, J = 14.5 Гц, 7H), 1.34 - 1.08 (m, 6H), 1.02 - 0.81 (m, 4H), 0.61 (q, J = 5.8 Гц, 2H).
13C ЯМР (151 МГц, d6-ДМСО) δ 160.0, 157.6, 146.3, 144.8, 131.0, 130.2, 128.0, 115.7, 111.4, 107.5, 105.4, 68.0, 37.2, 36.8, 33.7, 33.3, 30.5, 26.6, 26.5, 26.3, 11.5, 7.6
[M+H]+ = 489,1
Пример 3: соединение (98) в таблице I
К раствору 3-бромбензойной кислоты (2,00 г, 9,95 ммоль, 1 экв.) и изопропиламина (940 мкл, 10,9 ммоль, 1,1 экв.) в безводном ДМФ (10 мл) добавляли 1-1Н-1,2,3-триазолопиридиний-3-оксид-гексафторфосфат (HATU) (3,78 г, 9,95 ммоль, 1 экв.) и DIPEA (2,60 мл, 114,9 ммоль, 1,5 экв.), а затем перемешивали реакционную смесь при комнатной температуре в течение ночи. Реакционную смесь гасили 1 M водным раствором хлористоводородной кислоты и экстрагировали EtOAc. Затем объединенные органические слои высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Полученный в результате остаток очищали колоночной хроматографией на силикагеле с получением 3-бром-N-изопропилбензамида (1,88 г, 76 %).
1H ЯМР (400 МГц, d6-ДМСО) δ 8.34 (d, J = 7.4 Гц, 1H), 8.03 (s, 1H), 7.85 (d, J = 7.8 Гц, 1H), 7.75 - 7.68 (m, 1H), 7.43 (t, J = 7.9 Гц, 1H), 4.17 - 4.00 (m, J = 6.7 Гц, 1H), 1.17 (d, J = 6.6 Гц, 6H).
В соответствии с путем (A1) реакционную смесь 3-бром-N-изопропилбензамида (197 мг, 0,796 ммоль, 1,1 экв.), метил-4-амино-3-трет-бутил-бензоата (150 мг, 0,724 ммоль, 1 экв.), Pd(OAc)2 (4,9 мг, 0,022 мкмоль, 3 моль%), рац-BINAP (9,0 мг, 0,015 ммоль, 2 моль%) и K2CO3 (300 мг, 2,17 ммоль, 3 экв.) в безводном толуоле (3 мл) дегазировали N2 и нагревали при 110°C в течение 75 минут в инертной атмосфере. Реакционную смесь охлаждали до комнатной температуры, фильтровали через слой целита и промывали слой EtOAc. Затем к фильтрату добавляли насыщенный водный раствор хлорида натрия и экстрагировали смесь EtOAc. Объединенные органические фазы высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Полученный в результате остаток очищали колоночной хроматографией на силикагеле с получением метил-3-трет-бутил-4-{[3-(изопропилкарбамоил)фенил]амино}бензоата (163 мг, 60 %).
1H ЯМР (400 МГц, d6-ДМСО) δ 8.09 (d, J = 7.8 Гц, 1H), 8.01 (d, J = 2.0 Гц, 1H), 7.74 (dd, J = 8.3, 1.9 Гц, 1H), 7.39 (s, 1H), 7.33 - 7.22 (m, 3H), 7.17 (d, J = 8.4 Гц, 1H), 6.98 (d, J = 7.6 Гц, 1H), 4.07 (dq, J = 13.4, 6.6 Гц, 1H), 3.83 (s, 3H), 1.42 (s, 9H), 1.15 (d, J = 6.6 Гц, 6H).
В соответствии с методикой (K) метил-3-трет-бутил-4-{[3-(изопропилкарбамоил)фенил]амино}бензоат (160 мг, 0,434 ммоль, 1 экв.) помещали в метанол (2 мл) и добавляли 2 M водный раствор NaOH (1,3 мл, 2,61 ммоль, 6 экв.). Реакционную смесь нагревали при 80 °C и перемешивали в течение 3 часов. Затем концентрировали ее при пониженном давлении и после добавления 2 M водного раствора HCl (10 экв.) экстрагировали дихлорметаном. Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением 3-трет-бутил-4-{[3-(изопропилкарбамоил)фенил]амино}бензойной кислоты (142 мг, 90 %).
1H ЯМР (400 МГц, d6-ДМСО) δ 12.64 (s, 1H), 8.07 (d, J = 7.7 Гц, 1H), 8.02 (s, 1H), 7.73 (d, J = 8.4 Гц, 1H), 7.35 (s, 1H), 7.27 - 7.19 (m, 3H), 7.16 (d, J = 8.2 Гц, 1H), 6.94 (d, J = 6.5 Гц, 1H), 4.14 - 3.99 (m, 1H), 1.42 (s, 9H), 1.15 (d, J = 6.6 Гц, 6H).
В соответствии с методикой (L) реакционную смесь 3-трет-бутил-4-{[3-(изопропилкарбамоил)фенил]амино}бензойной кислоты (65,0 мг, 180 мкмоль, 1 экв.) и CDI (35,0 мг, 216 мкмоль, 1,2 экв.) в безводном ДМФ (1,0 мл) перемешивали при комнатной температуре в течение 1 часа. Затем смесь добавляли к раствору бета-алаклеатинина гидрохлорида (53,8 мг, 359 мкмоль, 2 экв.) и DIPEA (93,9 мкл, 539 мкмоль, 3 экв.) в безводном ДМФ (1,0 мл) и полученную в результате смесь нагревали при 75°C и перемешивали в течение 16 часов. Затем реакционную смесь охлаждали до комнатной температуры, гасили насыщенным водным раствором бикарбоната натрия и экстрагировали EtOAc. Затем объединенные органические слои промывали насыщенным водным раствором хлорида натрия, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Полученный в результате остаток очищали колоночной хроматографией на силикагеле с получением 3-трет-бутил-4-{[3-(изопропилкарбамоил)фенил]амино}-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида (98) (37,0 мг, 45 %).
1H ЯМР (400 МГц, d6-ДМСО) δ 10.83 (s, 1H), 10.21 (s, 1H), 8.27 (d, J = 1.8 Гц, 1H), 8.04 (d, J = 7.8 Гц, 1H), 7.90 (dd, J = 8.2, 1.8 Гц, 1H), 7.29 (s, 1H), 7.18 (s, 3H), 7.13 (d, J = 8.2 Гц, 1H), 6.90 - 6.82 (m, 1H), 4.06 (dq, J = 13.3, 6.6 Гц, 1H), 3.56 (t, J = 7.0 Гц, 2H), 2.63 (t, J = 7.0 Гц, 2H), 1.41 (s, 9H), 1.14 (d, J = 6.6 Гц, 6H).
13C ЯМР (151 МГц, d6-ДМСО) δ 177.4, 170.2, 166.1, 157.8, 147.1, 145.0, 144.0, 136.5, 133.5, 129.1, 128.7, 128.1, 126.6, 118.5, 117.3, 115.5, 41.3, 36.8, 35.2, 30.9, 30.5, 22.8
[M+H]+ = 450,1
Пример 4: соединение (102) в таблице I
В соответствии с путем (A1) реакционную смесь 3-бром-N-изопропилбензамида (135 мг, 0,547 ммоль, 1,1 экв.), метил-4-амино-3-циклопропил-бензоата (100 мг, 0,497 ммоль, 1 экв.), BrettPhos Pd G3 (23,7 мг, 24,8 мкмоль, 5 моль%) и Cs2CO3 (243 мг, 0,745 ммоль, 1,5 экв.) в безводном ДМФ (2 мл) дегазировали N2 и нагревали при 80°C в течение 75 минут в инертной атмосфере. Реакционную смесь охлаждали до комнатной температуры, фильтровали через слой целита и промывали слой EtOAc. Затем к фильтрату добавляли насыщенный водный раствор хлорида натрия и экстрагировали смесь EtOAc. Объединенные органические фазы высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Полученный в результате остаток очищали колоночной хроматографией на силикагеле с получением метил-3-циклопропил-4-{[3-(изопропилкарбамоил)фенил]амино}бензоата (131 мг, 71 %).
1H ЯМР (400 МГц, d6-ДМСО) δ 8.17 (d, J = 7.8 Гц, 1H), 8.01 (s, 1H), 7.67 (dd, J = 8.8, 1.9 Гц, 2H), 7.55 (d, J = 2.0 Гц, 1H), 7.47 (dt, J = 7.6, 1.3 Гц, 1H), 7.38 (t, J = 7.8 Гц, 1H), 7.31 (ddd, J = 7.9, 2.1, 1.1 Гц, 1H), 7.12 (d, J = 8.5 Гц, 1H), 4.09 (dq, J = 13.3, 6.6 Гц, 1H), 3.79 (s, 3H), 1.96 (tt, J = 8.3, 5.6 Гц, 1H), 1.16 (d, J = 6.6 Гц, 6H), 1.04 - 0.95 (m, 2H), 0.65 - 0.57 (m, 2H).
В соответствии с методикой (K) метил-3-циклопропил-4-{[3-(изопропилкарбамоил)фенил]амино}бензоат (130 мг, 0,350 ммоль, 1 экв.) помещали в метанол (2 мл) и добавляли 2 M водный раствор NaOH (0,88 мл, 1,75 ммоль, 5 экв.). Реакционную смесь нагревали при 80°C и перемешивали в течение 3 часов. Затем концентрировали ее при пониженном давлении и после добавления 2 M водного раствора HCl (10 экв.) экстрагировали дихлорметаном. Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением 3-циклопропил-4-{[3-(изопропилкарбамоил)фенил]амино}бензойной кислоты (115 мг, 92 %).
1H ЯМР (400 МГц, d6-ДМСО) δ 12.38 (s, 1H), 8.16 (d, J = 7.8 Гц, 1H), 7.96 (s, 1H), 7.69 - 7.61 (m, 2H), 7.54 (d, J = 2.0 Гц, 1H), 7.44 (dt, J = 7.6, 1.3 Гц, 1H), 7.37 (t, J = 7.7 Гц, 1H), 7.29 (ddd, J = 7.9, 2.1, 1.1 Гц, 1H), 7.12 (d, J = 8.5 Гц, 1H), 4.09 (dq, J = 13.2, 6.6 Гц, 1H), 1.96 (tt, J = 8.3, 5.4 Гц, 1H), 1.16 (d, J = 6.6 Гц, 6H), 1.03 - 0.92 (m, 2H), 0.68 - 0.57 (m, 2H).
В соответствии с методикой (L) реакционную смесь 3-циклопропил-4-{[3-(изопропилкарбамоил)фенил]амино}бензойной кислоты (82,0 мг, 230 мкмоль, 1 экв.) и CDI (44,8 мг, 276 мкмоль, 1,2 экв.) в безводном ДМФ (1,0 мл) перемешивали при комнатной температуре в течение 1 часа. Затем смесь добавляли к раствору 1,4,5,6-тетрагидропиримидин-2-амина гидрохлорида (65,7 мг, 460 мкмоль, 2 экв.) и DIPEA (120 мкл, 691 мкмоль, 3 экв.) в безводном ДМФ (1,0 мл), и полученную в результате смесь нагревали при 75°C и перемешивали в течение 16 часов. Затем реакционную смесь охлаждали до комнатной температуры, гасили насыщенным водным раствором бикарбоната натрия и экстрагировали EtOAc. Затем объединенные органические слои промывали насыщенным водным раствором хлорида натрия, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Полученный в результате остаток очищали колоночной хроматографией на силикагеле, а затем препаративной ВЭЖХ (высокоэффективная жидкостная хроматография) с получением 3-циклопропил-N-(1,3-диазинан-2-илиден)-4-{[3-(изопропилкарбамоил)фенил]амино}бензамида (102) (17,8 мг, 18 %).
1H ЯМР (400 МГц, d6-DMSO) δ 10.79 (s, 1H), 10.16 (s, 1H), 8.14 (d, J = 7.8 Гц, 1H), 7.87 (s, 1H), 7.82 (d, J = 8.1 Гц, 2H), 7.60 (t, J = 1.8 Гц, 1H), 7.38 (dt, J = 7.6, 1.4 Гц, 1H), 7.33 (t, J = 7.7 Гц, 1H), 7.28 - 7.21 (m, 1H), 7.12 (d, J = 8.3 Гц, 1H), 4.08 (dp, J = 13.7, 6.9 Гц, 1H), 3.54 (t, J = 7.0 Гц, 2H), 2.62 (t, J = 7.0 Гц, 2H), 1.96 (tt, J = 8.4, 5.6 Гц, 1H), 1.16 (d, J = 6.6 Гц, 6H), 1.02 - 0.92 (m, 2H), 0.67 - 0.58 (m, 2H).
13C ЯМР (151 МГц, d6-ДМСО) δ 170.2, 165.9, 157.6, 146.3, 143.6, 136.5, 131.0, 129.2, 128.0, 128.0, 121.6, 119.9, 118.4, 115.4, 41.4, 36.8, 30.5, 22.8, 11.6, 7.6
[M+H]+ = 434,2
Пример 5: соединение (120) в таблице I
В соответствии с методикой (L) реакционную смесь 3-циклопропил-4-{[3-(изопропилкарбамоил)фенил]амино}бензойной кислоты (50,0 мг, 148 мкмоль, 1 экв.) и CDI (28,8 мг, 177 мкмоль, 1,2 экв.) в безводном ДМФ (1,0 мл) перемешивали при комнатной температуре в течение 1 часа. Затем смесь добавляли к раствору бета-алаклеатинина гидрохлорида (44,2 мг, 296 мкмоль, 2 экв.) и DIPEA (77,2 мкл, 443 мкмоль, 3 экв.) в безводном ДМФ (1,0 мл), и полученную в результате смесь нагревали при 75°C и перемешивали в течение 16 часов. Затем реакционную смесь охлаждали до комнатной температуры, гасили насыщенным водным раствором бикарбоната натрия и экстрагировали EtOAc. Затем объединенные органические слои промывали насыщенным водным раствором хлорида натрия, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Полученный в результате остаток очищали колоночной хроматографией на силикагеле с получением 3-циклопропил-4-{[3-(изопропилкарбамоил)фенил]амино}-N-[(2E)-4-оксо-1,3-диазинан-2-илиден]бензамида (120) (30,0 мг, 45 %).
1H ЯМР (400 МГц, d6-ДМСО) δ 8.79 (s, 2H), 8.12 (d, J = 7.6 Гц, 1H), 7.75 (d, J = 7.6 Гц, 2H), 7.68 (s, 1H), 7.54 (s, 1H), 7.31 (s, 2H), 7.18 (s, 1H), 7.10 (d, J = 8.3 Гц, 1H), 4.14 - 4.02 (m, 1H), 3.29 (s, 4H), 2.00 - 1.91 (m, 1H), 1.83 (s, 2H), 1.15 (d, J = 6.6 Гц, 6H), 0.95 (d, J = 7.4 Гц, 2H), 0.59 (d, J = 4.2 Гц, 2H).
13C ЯМР (151 МГц, d6-ДМСО) δ 175.1, 166.1, 159.2, 144.6, 144.5, 136.5, 132.6, 131.8, 129.2, 127.3, 127.0, 120.4, 119.0, 117.3, 116.7, 41.3, 38.5, 22.8, 20.4, 11.6, 7.8
[M+H]+ = 420,3
Фармакологические данные
Пример 6: Вирус чикунгунья
Соединения по изобретению были подвергнуты фармакологическим тестам, в которых продемонстрирована их применимость в качестве действующих веществ в терапии и, в частности, для предупреждения, ингибирования или лечения вирусной инфекции чикунгунья.
МАТЕРИАЛ И МЕТОДЫ
Ингибирование продуцирования вируса чикунгунья (CHIKV) в инфицированной клеточной линии HEK293T.
Способность соединений к ингибированию вирусной репликации оценивали в эксперименте, в котором инфицированные клетки обрабатывали соединениями формулы (Ic) в концентрации 1 мкМ. В качестве положительного контроля ингибирования вируса чикунгунья использовали рибавирин. Параллельно проводили оценку токсичности соединений.
• Амплификация клеток
Клетки эмбриональной почки человека 293T (HEK293T, CRL-11268) выдерживали в модифицированной Дульбекко среде Игла (DMEM, 31966-021, Thermo Fisher Scientific) с добавлением 10 % фетальной бычьей сыворотки (ФБС), пенициллина и стрептомицина. После удаления среды клетки промывали солевым раствором без Ca2+ и Mg2+ для удаления всех следов сыворотки. После отсасывания отмывочного раствора клетки диссоциировали 0,25 % раствором трипсина-ЭДТА и инкубировали 30 с по меньшей мере в инкубаторе на 37°C. Концентрацию клеточной суспензии определяли с помощью автоматического счетчика клеток (EVE, NanoEntek) и при необходимости доводили до 0,33 × 106 клеток/мл средой DMEM с добавлением 10 % ФБС.
• Приготовление соединений
100 мкл клеточной суспензии распределяли в черном планшете для визуализации ViewPlate-96 Black (6005182, PerkinElmer) и в прозрачном 96-луночном планшете для клеточных культур (655180, Greiner bio-one). После инкубации в течение 24 ч при 37°C при 5% CO2 добавляли соединения в надлежащей концентрации.
• Скрининг при 1 мкМ
Готовили промежуточное разведение с ДМСО (D8418, Sigma) в концентрации 2 мМ в 96-луночном микропланшете с V-образным дном лунок из исходного раствора:
Смешивают 1 мкл 50 мМ исходной библиотеки в 25 мкл ДМСО (диметилсульфоксид).
Смешивают 2 мкл 25 мМ исходной библиотеки в 25 мкл ДМСО.
• Определение значений IC50
Готовили промежуточное разведение с ДМСО (D8418, Sigma) в концентрации 25 мМ в 96-луночном микропланшете с V-образным дном лунок из исходного раствора:
Смешивают 2 мкл 50 мМ исходной библиотеки в 2 мкл ДМСО.
Выполняют серийное разведение в 2 мкл ДМСО 13 раз до достижения 0,0015 мМ. Продолжают, как описано в таблице III:
Таблица III
Как для скрининга, так и для определения IC50 добавляли по 1 мкл каждого раствора в лунки объемом 1 мл основного 96-луночного планшета Masterblock (Greiner bio-one, 780261), содержащие 1 мл среды DMEM. В качестве положительного контроля добавляли 5 мкл 80 мМ раствора рибавирина (R9644, Sigma) к 1 мл среды DMEM. С другой стороны, ДМСО использовали в качестве отрицательного контроля.
• Инфицирование
Клетки инфицировали 30 мкл штамма CHIKV, выделенного при вспышке в Реюньоне (LR2006-OPY1), с модификацией за счет вставки гена зеленого флуоресцентного белка (GFP) в 5' (CHIK 5'LR) (Tsetsarkin K, Higgs S, McGee CE, De Lamballerie X, Charrel RN, Vanlandingham DL. Infectious Clones of Chikungunya Virus (La Réunion-Isolate - Ref-SKU: 001N-EVA249 (PMID: 17187566), доступна по следующему адресу: https://www.european-virus-archive.com/nucleic-acid/chikv-lr-5gfp-infectious-clone) for Vector Competence Studies. Vector Borne Zoonotic Dis. 2006; 6(4)). Этот модифицированный вирус использовали для инфицирования клеток при множественности инфекции (MOI) равной 0,1. Штамм LR2006-OPY1 CHIKV (CHIKV-LR) получали из Всемирного центра по справочной информации и исследованиям арбовирусов при медицинском факультете Техасского университета, г. Галвестон, штат Техас, США. Этот штамм первоначально был выделен из сыворотки крови французского пациента с лихорадкой, вернувшегося с острова Реюньон.
• Лизис клеток
После 22 ч при 37 °C в атмосфере 5% CO2 среду удаляли, и клетки промывали, как описано выше. К клеткам добавляли 60 мкл буферного раствора RIPA (50 мМ Трис-HCl pH 8, 100 мМ NaCl, 1 мМ MgCl₂, 1 % Тритон X-100) и инкубировали в течение по меньшей мере 20 мин, после чего считывали сигнал флуоресценции. Для нормализации флуоресцентного сигнала по количеству белка использовали реактив для количественного определения белков Pierce 660 нм (22660, Thermo scientific).
Для проверки токсичности соединений использовали тест-систему пролиферации клеток CellTiter 96® AQueous One Solution Cell Proliferation Assay (MTS) (G3581, Promega). Добавляли 20 мкл раствора MTS и спустя один час считывали оптическую плотность при 492 нм.
Результаты
- Выполняли первый раунд экспериментов, в котором результаты выражали в виде процента ингибирования, который рассчитывали следующим образом на следующих стадиях:
1. Интенсивность флуоресценции (FI)/оптическая плотность 660 нм (A660) = A
Это отношение позволяет соотнести инфекцию (вирус с GFP) с количеством белка.
2. A' = A - фоновый шум на планшете с неинфицированными клетками,
3. B = интенсивность флуоресценции (FI)/оптическая плотность 660 нм (A660) планшетов с инфицированными, но необработанными клетками,
4. Затем отношение C = A'/B преобразуют в процент инфекции после обработки по сравнению с необработанным образцом и впоследствии в процент инфекции. Например, значение 100 в приведенной ниже таблице IV означает, что после обработки сигнал, свойственный флуоресценции GFP, устраняется, что соответствует отсутствию инфекции.
5. C' = 100 - C
Это значение соответствует проценту ингибирования.
Следующая таблица IV включает указанное значение C' для некоторых соединений, рассчитанное, как описано выше, представляющее собой среднее значение 2 экспериментов, и соответствующее стандартное отклонение.
Некоторые значения исходно были выше 100. В этих случаях значение снижали до 100. Это означает, что некоторые молекулы также оказывают влияние на жизнеспособность клеток. Иными словами, значение A может быть ниже фонового шума.
Кроме того, для каждого показателя тест выполняли с использованием рибавирина в качестве контроля. Значение процента ингибирования проверяли с учетом 100 %.
Таблица IV
Пр.
- Выполняли второй раунд экспериментов с получением результатов в виде значений IC50.
Значения IC50 находятся в диапазоне от 0,1 нМ до 1 мкМ, в частности, от 0,5 до 500 нМ и еще более конкретно от 1 до 400 нМ, например от 1 до 200 нМ. Например, соединения 22, 23 и 24 имеют значения IC50 в диапазоне от 100 до 400 нМ.
Вывод
На основании описанных выше результатов можно сделать вывод, что соединения формулы (Ic) являются подходящими химическими соединениями для лечения и/или предупреждения РНК-вирусных инфекций, вызванных РНК-вирусами группы IV, более конкретно альфавирусных инфекций и наиболее конкретно вирусных инфекций чикунгунья.
Пример 7: Вирус RSV
Соединения по изобретению были подвергнуты фармакологическим тестам, в которых продемонстрирована их применимость в качестве действующих веществ в терапии и, в частности, для предупреждения, ингибирования или лечения вирусной инфекции RSV.
МАТЕРИАЛ И МЕТОДЫ
Протокол скрининга антивирусных соединений в отношении ингибирования RSV и цитотоксичности с использованием тест-системы Viral ToxGlo
Клетки HEp-2 выдерживали в минимальной эссенциальной среде Игла (EMEM), сбалансированной солями Эрла (BSS - сбалансированный солевой раствор) таким образом, чтобы она содержала 2 мМ L-глутамина, 10 % фетальной бычьей сыворотки, 100 Ед./мл пенициллина и 100 мкг/мл стрептомицина. В целях скринингового анализа клетки выращивали до 90 % конфлюэнтности, трипсинизировали и выделяли. Трипсин нейтрализовали средой для культивирования клеток и клетки центрифугировали при 150 x g в течение 5 минут, после чего отбрасывали супернатант и ресуспендировали осадок клеток в аналитической среде (EMEM, сбалансированной солями Эрла (BSS), таким образом, чтобы она содержала 2 мМ L-глутамина, 2 % фетальной бычьей сыворотки, 100 Ед./мл пенициллина и 100 мкг/мл стрептомицина). Клетки высевали в белые планшеты для клеточных культур с прозрачным дном при плотности 1,5×104 клеток/лунка в 50 мкл и 4×103 клеток/лунка в 25 мкл для 96-луночных планшетов и 384-луночных планшетов соответственно. В контрольную колонку для определения среда/фон добавляли только аналитическую среду. Планшеты с клетками помещали в увлажненную камеру и инкубировали в течение ночи при 37°C/5% CO2. После инкубации в течение ночи проверяли конфлюэнтность и здоровый внешний вид клеток.
Концентрацию исследуемых веществ доводили до 10-кратной тестовой концентрации при максимальной концентрации ДМСО 10 % (максимальная конечная аналитическая концентрация составляет 1 % ДМСО) и добавляли в планшеты с клетками в объемах 10 мкл для 96-луночных планшетов и 5 мкл для 384-луночных планшетов. В лунки для контроля клеток и контроля вирусов добавляли только растворитель исследуемого вещества. Вирус или аналитическую среду добавляли в лунки для тестирования цитотоксичности и лунки для контроля среда/фон сразу после исследуемых веществ при MOI равном 0,5, 40 или 20 мкл для 96-луночных и 384-луночных планшетов соответственно. Для приготовления суспензии вируса исходные замороженные культуры RSV A2 размораживали и разводили до требуемой концентрации в бляшкообразующих единицах в аналитической среде на льду.
Планшеты с клетками дополнительно инкубировали внутри увлажненной камеры в течение периода инкубации 72 ч при 37°C/5%CO2. После этого периода инкубации клетки наблюдали под микроскопом для проверки характерного цитопатического эффекта вируса в лунках для контроля вируса и здоровых клеток в лунках для контроля клеток. После доведения планшетов до комнатной температуры в каждую лунку 384/96-луночных планшетов добавляли 20/40 мкл реактива Viral ToxGlo (Promega). Планшеты инкубировали при комнатной температуре в защищенном от света месте на штативе для планшетов в течение 20 минут, после чего измеряли люминесценцию на спектрофотометре (Biotek Synergy HTX).
Ингибирование RSV рассчитывали в процентах ингибирования цитопатического эффекта относительно лунок для контроля вируса, а цитотоксичность рассчитывали в процентах выживших клеток относительно лунок для контроля клеток. Это позволило рассчитать значения EC50 для каждого исследуемого вещества в случае идентификации ингибирования вируса или ответа на цитотоксичную дозу. Были установлены значения EC50 в диапазоне от 0,001 мкМ до 2,5 мкМ и более конкретно для соединений 27, 28, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 161, 162, 163, 164, 165 и 166.
Таблица V
Вывод
На основании описанных выше результатов можно сделать вывод, что соединения формулы (Ic) являются подходящими химическими соединениями для лечения и/или предупреждения РНК-вирусных инфекций, вызванных РНК-вирусами группы V, более конкретно пневмовирусных инфекций и наиболее конкретно вирусных инфекций RSV.
Настоящее изобретение дополнительно относится к фармацевтической композиции, содержащей по меньшей мере одно новое соединение, как определено выше, или любую из его фармацевтически приемлемых солей, или по меньшей мере любое из соединений (19)-(31) и (91)-(181), как определено выше, или любую из его фармацевтически приемлемых солей, а также по меньшей мере один фармацевтически приемлемый эксципиент.
Фармацевтические композиции по изобретению могут содержать одно или более соединений по изобретению в любой описанной в настоящем документе форме.
Еще один дополнительный объект настоящего изобретения состоит в применении по меньшей мере одного соединения формулы (Ic), как определено выше, и соединений (19)-(31) и (91)-(181), как определено выше, или одной из их фармацевтически приемлемых солей в соответствии с настоящим изобретением для получения лекарственного препарата для предупреждения или лечения у субъекта РНК-вирусной инфекции, вызванной РНК-вирусом из группы IV или группы V в соответствии с классификацией вирусов по Балтимору, и, например, инфекции чикунгунья, инфекции Денге, инфекции гриппа или инфекции RSV.
Таким образом, настоящее изобретение относится к одному соединению формулы (Ic), как определено выше, и к соединениям (19)-(31) и (91)-(181) или одной из их приемлемых солей в качестве агента для ингибирования, предупреждения или лечения РНК-вирусной инфекции и наиболее предпочтительно инфекции, вызванной РНК-вирусом из группы IV или V, и, например, инфекции чикунгунья, инфекции Денге, инфекции гриппа или инфекции RSV.
В соответствии с конкретным вариантом осуществления изобретения лечение является непрерывным или периодическим.
«Непрерывное лечение» означает долгосрочное лечение, которое можно осуществлять с различной частотой введения препарата, например, один раз в сутки ежедневно, один раз в три дня, один раз в неделю, или один раз в две недели, или один раз в месяц.
В соответствии с одним вариантом осуществления изобретения соединение формулы (Ic) или любую из его фармацевтически приемлемых солей вводят в дозе, варьирующейся от 0,1 до 1000 мг, в частности, варьирующейся от 0,1 до 10 мг, или, например, варьирующейся от 10 до 200 мг, или, например, варьирующейся от 200 до 1000 мг.
Другой объект изобретения относится к терапевтическому способу лечения и/или предупреждения у субъекта РНК-вирусной инфекции, и наиболее предпочтительно РНК-вирусной инфекции, вызванной вирусом, относящимся к группе IV или V классификации вирусов по Балтимору, включающему введение терапевтически эффективного количества соединения формулы (Ic), соединений (19)-(31) и (91)-(181), как определено выше, или любой из их приемлемых солей.
В конкретном варианте осуществления в изобретении предложено применение соединения формулы (Ic) в соответствии с изобретением, или его фармацевтически приемлемой соли, или его фармацевтически активного производного или способ в соответствии с изобретением, в котором соединение формулы (Ic) предназначено для введения в комбинации с совместным агентом, пригодным в лечении указанной РНК-вирусной инфекции, и наиболее предпочтительно указанной инфекции, вызванной РНК-вирусом из группы IV или V, и, например, инфекции чикунгунья, инфекции Денге, инфекции гриппа или инфекции RSV.
Соединения можно вводить в соответствии с любым способом введения, таким как, например, внутримышечный, внутривенный, интраназальный или пероральный путь и т. д.
Соединения по настоящему изобретению в соответствующих случаях можно вводить в виде пролекарств, таких как сложные эфиры, соединений, к которым относится изобретение. «Пролекарство» означает соединение, которое может быть преобразовано in vivo посредством метаболизма (например, посредством гидролиза, восстановления или окисления) в соединение по настоящему изобретению. Например, сложноэфирное пролекарство соединения по настоящему изобретению может быть преобразовано в исходную молекулу посредством гидролиза in vivo. Подходящими сложными эфирами соединений по настоящему изобретению являются, например, ацетаты, цитраты, лактаты, тартраты, малонаты, оксалаты, салицилаты, пропионаты, сукцинаты, фумараты, малеаты, метилен-бис-β-гидроксинафтоаты, гентизаты, изетионаты, ди-пара-толуоилтартраты, метансульфонаты, этансульфонаты, бензолсульфонаты, пара-толуолсульфонаты, циклогексилсульфаматы и хинаты. Примерами сложноэфирных пролекарств являются такие, как описано в работе F. J. Leinweber, Drug Metab. Res., 1987, 18, 379. Подразумевают, что используемые в настоящем документе ссылки на соединения по настоящему изобретению также включают любые формы пролекарств или метаболитов.
Композиция по изобретению может дополнительно включать одну или более добавок, таких как разбавители, эксципиенты, стабилизаторы и консерванты. Такие добавки хорошо известны специалистам в данной области техники и раскрыты, в частности, в документах Ullmann's Encyclopedia of Industrial Chemistry, 6th Ed. (различные редакторы, 1989-1998, Marcel Dekker) и Pharmaceutical Dosage Forms and Drug Delivery Systems (ANSEL et al., 1994, WILLIAMS & WILKINS).
Вышеуказанные эксципиенты выбраны в соответствии с лекарственной формой и желаемым способом введения.
В соответствии с другим вариантом осуществления изобретения фармацевтически приемлемые композиции по данному изобретению можно вводить людям и другим животным перорально, ректально, парентерально, интрацистернально, интравагинально, интраперитонеально, местным путем (например, в виде порошков, мазей или капель), трансбуккально, например, в виде перорального или назального спрея, и т. п. в зависимости от тяжести подлежащей лечению инфекции.
Композиции по настоящему изобретению можно вводить перорально, парентерально, посредством ингаляционного спрея, местным путем, ректально, назально, трансбуккально, вагинально или посредством имплантируемого резервуара. Используемый в настоящем документе термин «парентеральный» включает методики подкожных, внутривенных, внутримышечных, внутрисуставных, интрасиновиальных, интрастернальных, подоболочечных, внутрипеченочных, внутриочаговых и интракраниальных инъекций и инфузий. Предпочтительно композиции вводят перорально, интраперитонеально или внутривенно. Стерильные инъекционные формы композиций по данному изобретению могут представлять собой водные или масляные суспензии. Эти суспензии можно готовить в соответствии с методиками, известными в данной области техники, с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильный инъекционный препарат может также представлять собой стерильный инъекционный раствор или суспензию в нетоксичном разбавителе или растворителе, приемлемом для парентерального введения, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые можно использовать, находятся вода, раствор Рингера и изотонический раствор хлорида натрия. В дополнение к этому в качестве растворителя или суспензионной среды традиционно используют стерильные нелетучие масла.
Композиции по данному изобретению можно вводить любым способом, включающим без ограничений пероральное, парентеральное, подъязычное, трансдермальное, вагинальное, ректальное, трансмукозальное, местное, интраназальное посредством ингаляции, трансбуккальное или интраназальное введение или их комбинации. Парентеральное введение включает без ограничений внутривенное, внутриартериальное, интраперитонеальное, подкожное, внутримышечное, подоболочечное и внутрисуставное введение. Композиции по данному изобретению можно также вводить в форме имплантата, позволяющего медленное высвобождение композиций, а также путем медленной контролируемой в/в (внутривенно) инфузии.
Например, соединение формулы (Ic) может быть представлено в любой фармацевтической форме, которая подходит для энтерального или парентерального введения, в сочетании с соответствующими эксципиентами, например, в форме таблеток без покрытия или с покрытием, твердых желатиновых капсул, капсул с мягкой оболочкой и других капсул, суппозиториев, либо в питьевой форме, такой как суспензии, сиропы, либо в виде инъекционных растворов или суспензий, в дозах, обеспечивающих ежедневное введение от 0,1 до 1000 мг действующего вещества.
В конкретном варианте осуществления соединение формулы (Ic) в соответствии с изобретением вводят перорально.
Пероральный путь введения особенно предпочтителен в аспекте профилактики или лечения по изобретению.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФЕНИЛ/ПИРИДИЛ-N-ФЕНИЛ/ПИРИДИЛЬНЫЕ ПРОИЗВОДНЫЕ ДЛЯ ЛЕЧЕНИЯ РНК-ВИРУСНОЙ ИНФЕКЦИИ | 2019 |
|
RU2803216C2 |
| АРИЛ-N-АРИЛЬНЫЕ ПРОИЗВОДНЫЕ ДЛЯ ЛЕЧЕНИЯ РНК-ВИРУСНОЙ ИНФЕКЦИИ | 2020 |
|
RU2821414C2 |
| АРИЛ-N-АРИЛЬНЫЕ ПРОИЗВОДНЫЕ ДЛЯ ЛЕЧЕНИЯ РНК-ВИРУСНОЙ ИНФЕКЦИИ | 2019 |
|
RU2815493C2 |
| ПРОИЗВОДНЫЕ ФЕНИЛ-N-ХИНОЛИНА ДЛЯ ЛЕЧЕНИЯ РНК-ВИРУСНОЙ ИНФЕКЦИИ | 2019 |
|
RU2805064C2 |
| ПРОИЗВОДНЫЕ ИНДОЛИН-2-ОНА В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ | 2013 |
|
RU2627706C2 |
| Соединения, полезные в качестве пестицидов, и промежуточные соединения, композиции и способы, связанные с ними | 2016 |
|
RU2821715C2 |
| ПРОИЗВОДНЫЕ ХИНОЛИН-2-ОНА В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ C-KIT | 2016 |
|
RU2754858C2 |
| МОЛЕКУЛЫ С ПЕСТИЦИДНОЙ ФУНКЦИЕЙ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, КОМПОЗИЦИИ И СПОСОБЫ, СВЯЗАННЫЕ С НИМИ | 2016 |
|
RU2742119C2 |
| ПРОИЗВОДНОЕ БИАРИЛА, МЕТОД ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2768830C2 |
| СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К PDE9A, И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2788147C2 |
Изобретение относится к соединению формулы (Ic) или любой из его фармацевтически приемлемых солей, которые могут найти применение для лечения и/или предупреждения РНК-вирусной инфекции, вызванной РНК-вирусом, относящимся к группе IV или V классификации вирусов по Балтимору, выбранным из вирусов RSV (респираторно-синцитиальный вирус) и чикунгунья. В соединении формулы (Ic) кольцо  и кольцо
и кольцо  оба представляют собой фениленовую группу или кольцо
оба представляют собой фениленовую группу или кольцо  представляет собой пиридиленовую группу, а кольцо
представляет собой пиридиленовую группу, а кольцо  представляет собой фениленовую группу; Z” представляет собой –CH2– или –CO–; Rg представляет собой водород, а Rh представляет собой водород или (C1–C4)алкил; X2 представляет –CO–NRk–, где Rk представляет собой водород или метил; –OCH2–, –CH(OH)–, -NH-CO–, –O–, –O–(CH2)s–O–, где s равно 2 или 3, –CO–, –SO2–, 5-членное гетероароматическое кольцо, содержащее 1, 2, 3 или 4 гетероатома, такое как триазол, имидазол, тетразол или оксадиазол, –NH–SO2–, –NH– или –SO2–NH–; n равно 0, 1, 2 или 3, m и m’ независимо равны 0, 1 или 2; Y2 представляет собой водород, галоген, гидроксильную группу, (C1–C4)алкокси и т.д.; R представляет собой (C1–C4)алкил, (C3-C6)циклоалкил, галоген; R’ представляет собой (C1–C4)алкил, необязательно прерванный –SO2– или –SO–, (C3-C6)циклоалкил или трифторметильную группу. Изобретение относится также к применению соединения формулы (Ic) для лечения и/или предупреждения вышеуказанных РНК-вирусных инфекций. Изобретение относится также к фармацевтической композиции, содержащей указанное соединение, и способу синтеза для производства соединения формулы (Ic). 4 н. и 5 з. п. ф-лы, 5 табл., 7 пр.
представляет собой фениленовую группу; Z” представляет собой –CH2– или –CO–; Rg представляет собой водород, а Rh представляет собой водород или (C1–C4)алкил; X2 представляет –CO–NRk–, где Rk представляет собой водород или метил; –OCH2–, –CH(OH)–, -NH-CO–, –O–, –O–(CH2)s–O–, где s равно 2 или 3, –CO–, –SO2–, 5-членное гетероароматическое кольцо, содержащее 1, 2, 3 или 4 гетероатома, такое как триазол, имидазол, тетразол или оксадиазол, –NH–SO2–, –NH– или –SO2–NH–; n равно 0, 1, 2 или 3, m и m’ независимо равны 0, 1 или 2; Y2 представляет собой водород, галоген, гидроксильную группу, (C1–C4)алкокси и т.д.; R представляет собой (C1–C4)алкил, (C3-C6)циклоалкил, галоген; R’ представляет собой (C1–C4)алкил, необязательно прерванный –SO2– или –SO–, (C3-C6)циклоалкил или трифторметильную группу. Изобретение относится также к применению соединения формулы (Ic) для лечения и/или предупреждения вышеуказанных РНК-вирусных инфекций. Изобретение относится также к фармацевтической композиции, содержащей указанное соединение, и способу синтеза для производства соединения формулы (Ic). 4 н. и 5 з. п. ф-лы, 5 табл., 7 пр.
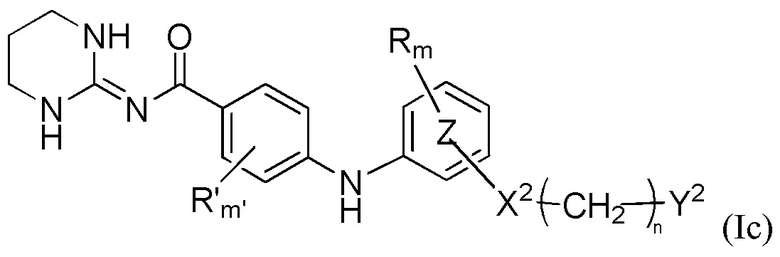
1. Соединение формулы (Ic):
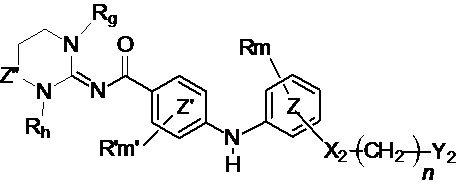 (Ic),
(Ic),
где:
кольцо  и кольцо
и кольцо  оба представляют собой фениленовую группу или кольцо
оба представляют собой фениленовую группу или кольцо  представляет собой пиридиленовую группу, а кольцо
представляет собой пиридиленовую группу, а кольцо  представляет собой фениленовую группу,
представляет собой фениленовую группу,
Z” представляет собой группу –CH2– или группу –CO–,
Rg представляет собой атом водорода, а Rh представляет собой атом водорода или (C1–C4)алкильную группу, такую как метильная группа,
X2 представляет собой
группу –CO–NRk–, где Rk представляет собой атом водорода или метильную группу,
группу –OCH2–,
группу –CH(OH)–,
группу -NH-CO–,
группу –O–,
группу –O–(CH2)s–O–, где s равно 2 или 3,
группу –CO–,
группу –SO2–,
двухвалентное 5-членное гетероароматическое кольцо, содержащее 1, 2, 3 или 4 гетероатома, такое как триазол, имидазол, тетразол или оксадиазол,
–NH–SO2–,
группу –NH–
или
группу –SO2–NH–,
n равно 0, 1, 2 или 3,
m и m’ независимо равны 0, 1 или 2,
Y2 представляет собой
атом водорода,
атом галогена,
гидроксильную группу,
(C1–C4)алкоксигруппу,
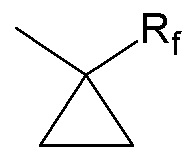 , где Rf представляет собой (C1–C4)алкильную группу, цианогруппу,
, где Rf представляет собой (C1–C4)алкильную группу, цианогруппу,
группу  ,
,
группу 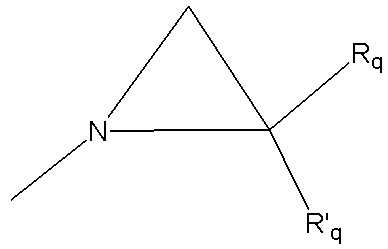 , где Rq и R’q независимо представляют собой атом водорода или метильную группу,
, где Rq и R’q независимо представляют собой атом водорода или метильную группу,
морфолинильную группу, необязательно замещенную (C1–C4)алкильной группой,
пиперазинильную группу,
пиперидинильную группу
или
группу –CR1R2R3, где R1, R2 и R3 независимо представляют собой атом водорода, атом фтора или (C1-C4)алкильную группу, необязательно замещенную трифторметильной группой и/или необязательно замещенную гидроксильной группой, при этом подразумевается, что не более чем один из R1, R2 и R3 представляет собой атом водорода, или R1 и R2 образуют вместе с несущим их атомом углерода (C3-C8)циклоалкильную группу, где указанная (C3-C8)циклоалкильная группа необязательно замещена одной или двумя (C1-C4)алкильными группами, атомом галогена или гидроксигруппой и указанная (C3-C8)циклоалкильная группа необязательно прервана одним или двумя атомами кислорода на указанном R1 и/или R2,
R представляет собой (C1–C4)алкильную группу, (C3-C6)циклоалкильную группу или атом галогена,
R’ представляет собой (C1–C4)алкильную группу, необязательно прерванную группой –SO2– или группой –SO–, (C3-C6)циклоалкильную группу или трифторметильную группу,
или любая из его фармацевтически приемлемых солей.
2. Соединение формулы (Ic) по п. 1, где
X2 представляет собой
группу –CO–NRk–, где Rk представляет собой атом водорода или метильную группу,
группу -NH-CO–,
группу –O–,
группу –CO–,
группу –CH(OH)–,
группу –SO2–,
группу –NH–,
двухвалентное 5-членное гетероароматическое кольцо, содержащее 1, 2, 3 или 4 гетероатома, такое как триазол, имидазол, тетразол или оксадиазол,
–NH–SO2–
или
группу –SO2–NH–,
или любая из его фармацевтически приемлемых солей.
3. Соединение формулы (Ic) по п. 1 или 2, где
Y2 представляет собой
атом водорода,
атом галогена,
 , где Rf представляет собой (C1–C4)алкильную группу, цианогруппу,
, где Rf представляет собой (C1–C4)алкильную группу, цианогруппу,
группу  , где Rq и R’q независимо представляют собой атом водорода или метильную группу,
, где Rq и R’q независимо представляют собой атом водорода или метильную группу,
морфолинильную группу, необязательно замещенную (C1–C4)алкильной группой,
группу  ,
,
(C1–C4)алкоксигруппу
или
группу –CR1R2R3, где R1, R2 и R3 независимо представляют собой атом водорода, атом фтора или (C1-C4)алкильную группу, необязательно замещенную трифторметильной группой, необязательно замещенную гидроксильной группой, при этом подразумевается, что не более чем один из R1, R2 и R3 представляет собой атом водорода, или R1 и R2 образуют вместе с несущим их атомом углерода (C3-C8)циклоалкильную группу, где указанная (C3-C8)циклоалкильная группа необязательно замещена одной или двумя (C1-C4)алкильными группами, атомом галогена или гидрокси и указанная (C3-C8)циклоалкильная группа необязательно прервана одним или двумя атомами кислорода на указанном R1 и/или R2,
или любая из его фармацевтически приемлемых солей.
4. Соединение формулы (Ic) по любому из пп. 1–3, где кольцо  и кольцо
и кольцо  оба представляют собой фениленовую группу или кольцо
оба представляют собой фениленовую группу или кольцо  представляет собой пиридиленовую группу и кольцо
представляет собой пиридиленовую группу и кольцо  представляет собой фениленовую группу,
представляет собой фениленовую группу,
m равно 0 или 1, n равно 0 или 1,
X2 представляет собой
группу –CO–NH–,
группу –CO-N(CH3)–,
группу –NH-CO–,
группу –O– или
группу –CO–,
группу –NH–SO2–,
группу –CH(OH)–,
группу –SO2–,
двухвалентный триазол,
двухвалентный имидазол,
двухвалентный тетразол,
двухвалентный оксадиазол,
группу –NH–,
Y2 представляет собой
атом водорода,
морфолинильную группу, необязательно замещенную (C1–C4)алкильной группой,
группу  ,
,
группу  , где Rq и R’q независимо представляют собой атом водорода или метильную группу,
, где Rq и R’q независимо представляют собой атом водорода или метильную группу,
 , где Rf представляет собой (C1–C4)алкильную группу, цианогруппу,
, где Rf представляет собой (C1–C4)алкильную группу, цианогруппу,
(C1–C4)алкоксигруппу
или
группу –CR1R2R3, где R1, R2 и R3 независимо представляют собой атом водорода, атом фтора или (C1-C4)алкильную группу, необязательно замещенную трифторметильной группой, необязательно замещенную гидроксильной группой, при этом подразумевается, что не более чем один из R1, R2 и R3 представляет собой атом водорода, или R1 и R2 образуют вместе с несущим их атомом углерода (C3-C8)циклоалкильную группу, где указанная (C3-C8)циклоалкильная группа необязательно замещена одной или двумя (C1-C4)алкильными группами, атомом галогена или гидрокси и указанная (C3-C8)циклоалкильная группа необязательно прервана одним или двумя атомами кислорода на указанном R1 и/или R2,
и
R представляет собой (C1–C4)алкильную группу, (C3-C6)циклоалкильную группу, такую как циклопропил, или атом галогена,
R’ представляет собой (C1–C4)алкильную группу, (C3-C6)циклоалкильную группу, такую как циклопропил, или трифторметильную группу,
или любая из его фармацевтически приемлемых солей.
5. Соединение формулы (Ic) по любому из пп. 1–4, где
кольцо  и кольцо
и кольцо  оба представляют собой фениленовую группу,
оба представляют собой фениленовую группу,
m равно 0, n равно 1,
X2 представляет собой
группу –CO–NH– или
группу –O–,
Y2 представляет собой
группу –CR1R2R3, где R1, R2 и R3 независимо представляют собой атом водорода или (C1–C4)алкильную группу, при этом подразумевается, что не более чем один из R1, R2 и R3 представляет собой атом водорода, например, изопропильную группу, или R1 и R2 образуют вместе с несущим их атомом углерода (C3–C8)циклоалкильную группу, такую как циклопропил,
и
R’ представляет собой
(C1–C4)алкильную группу, такую как трет-бутильная группа, или
(C3-C6)циклоалкильную группу, такую как циклопропил,
или любая из его фармацевтически приемлемых солей.
6. Соединение формулы (Ic) по п. 1, выбранное из
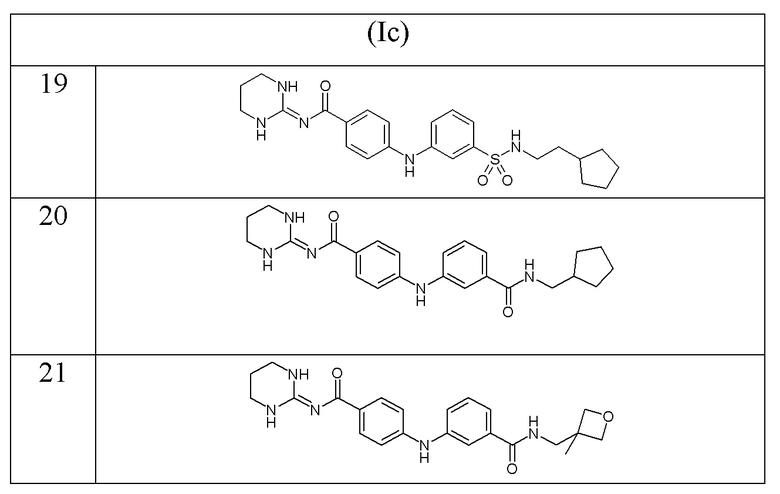
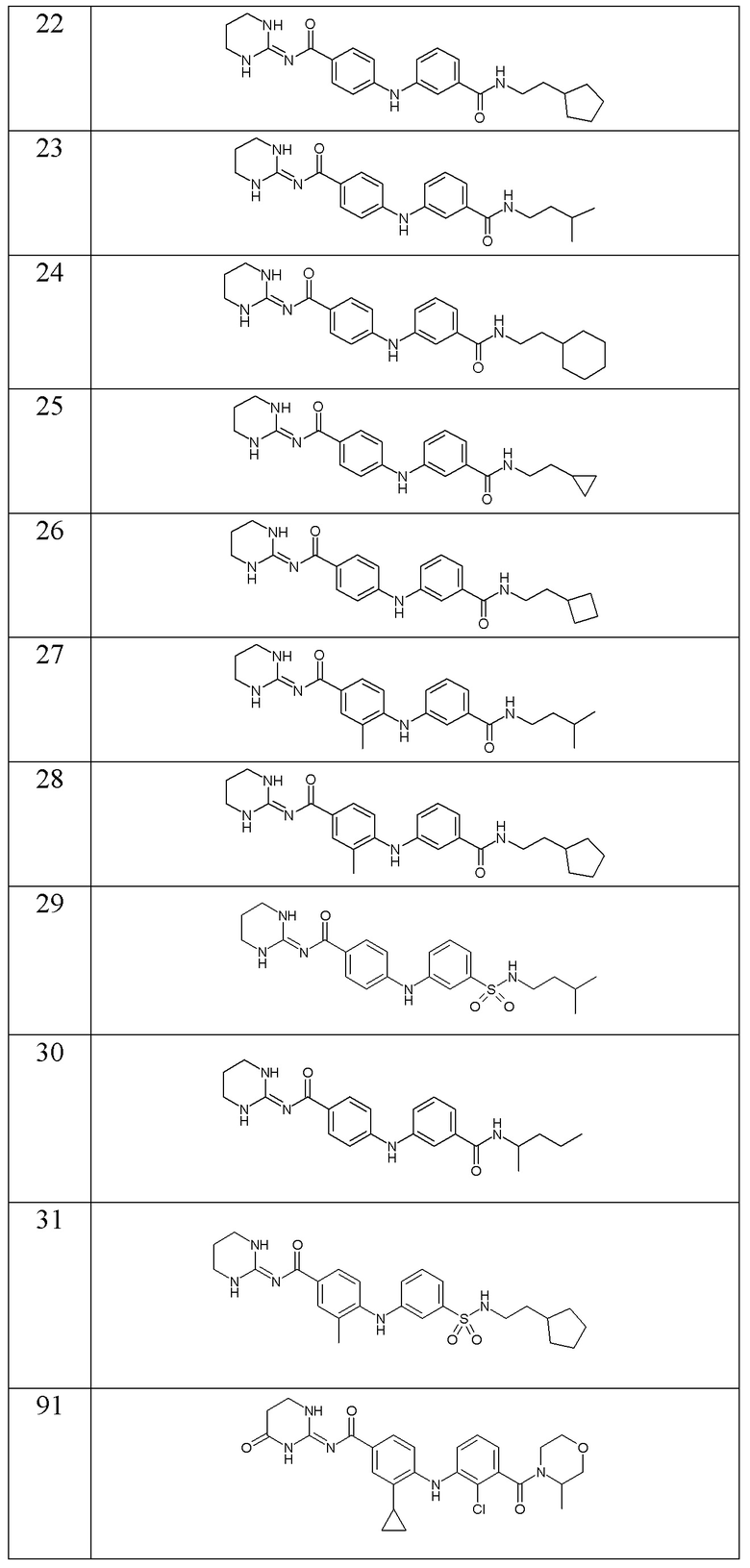
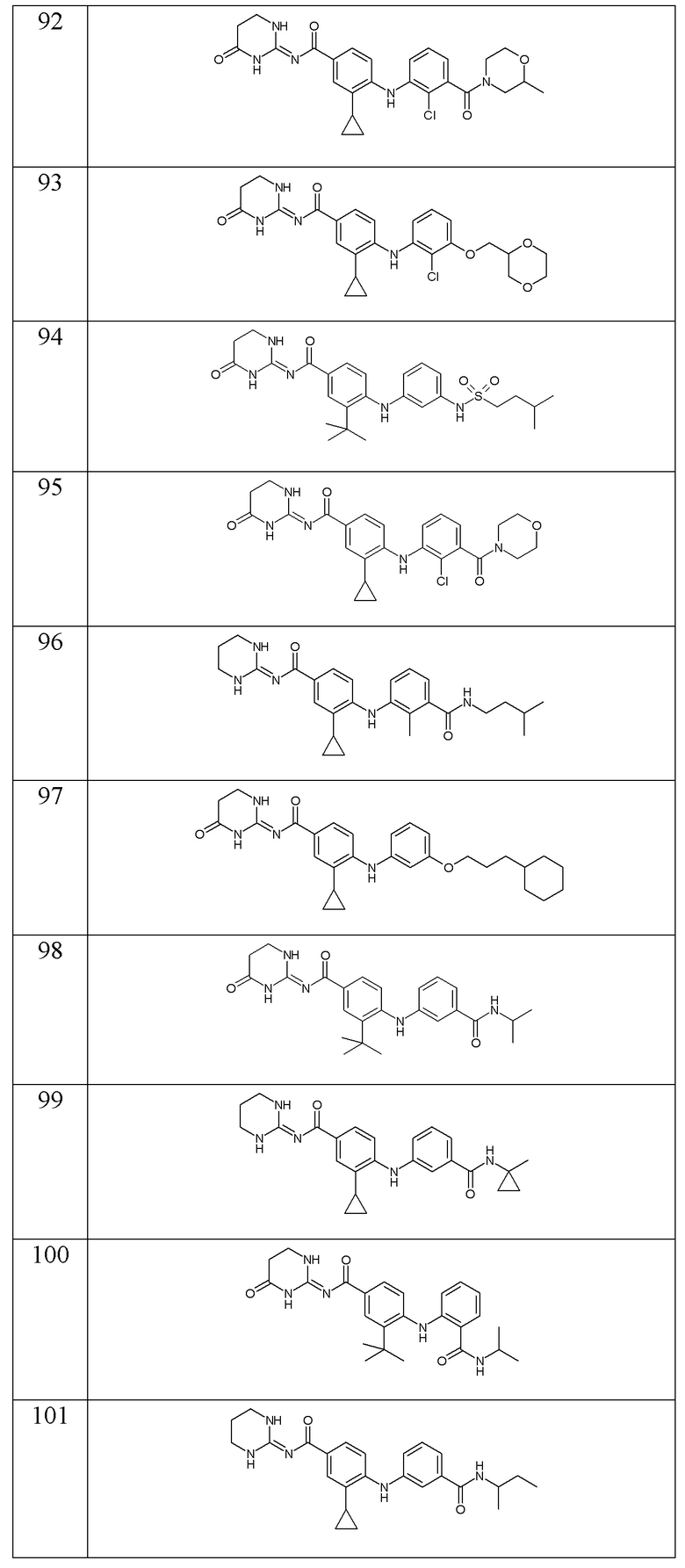
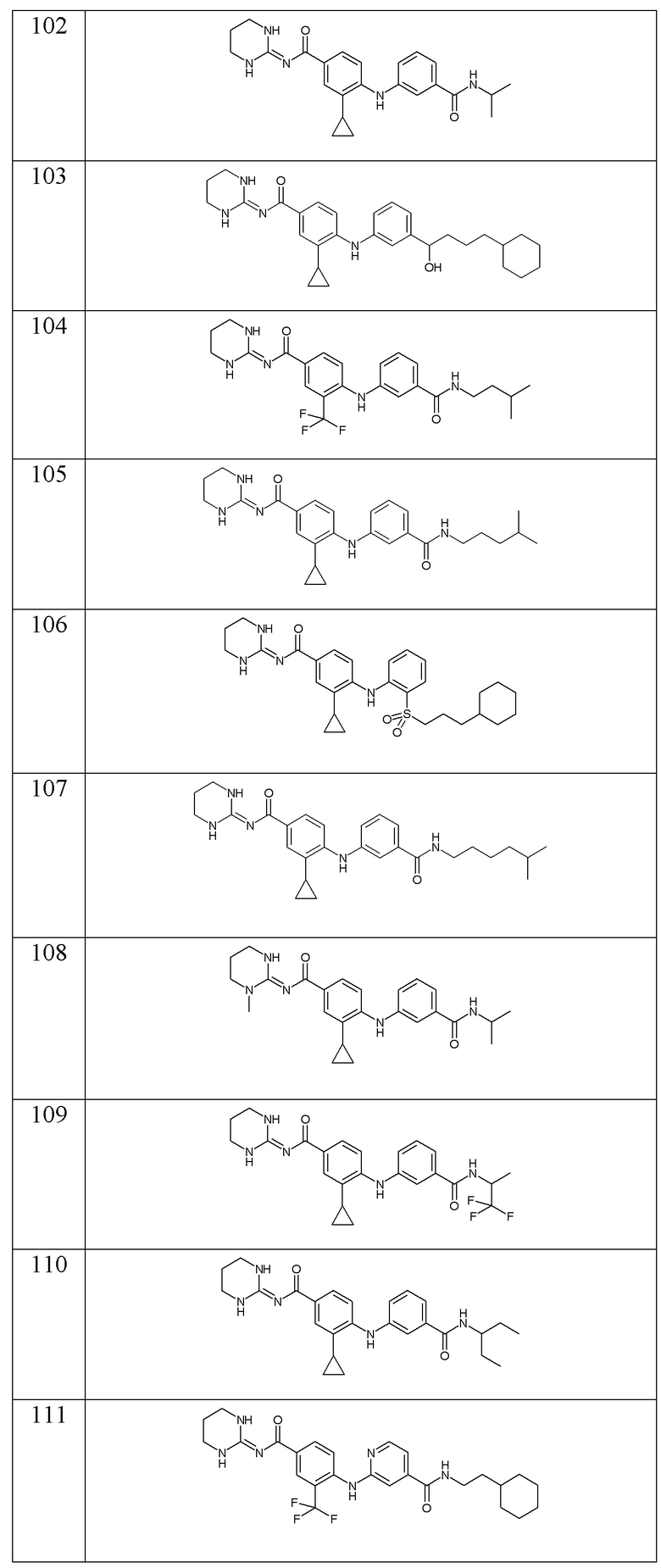
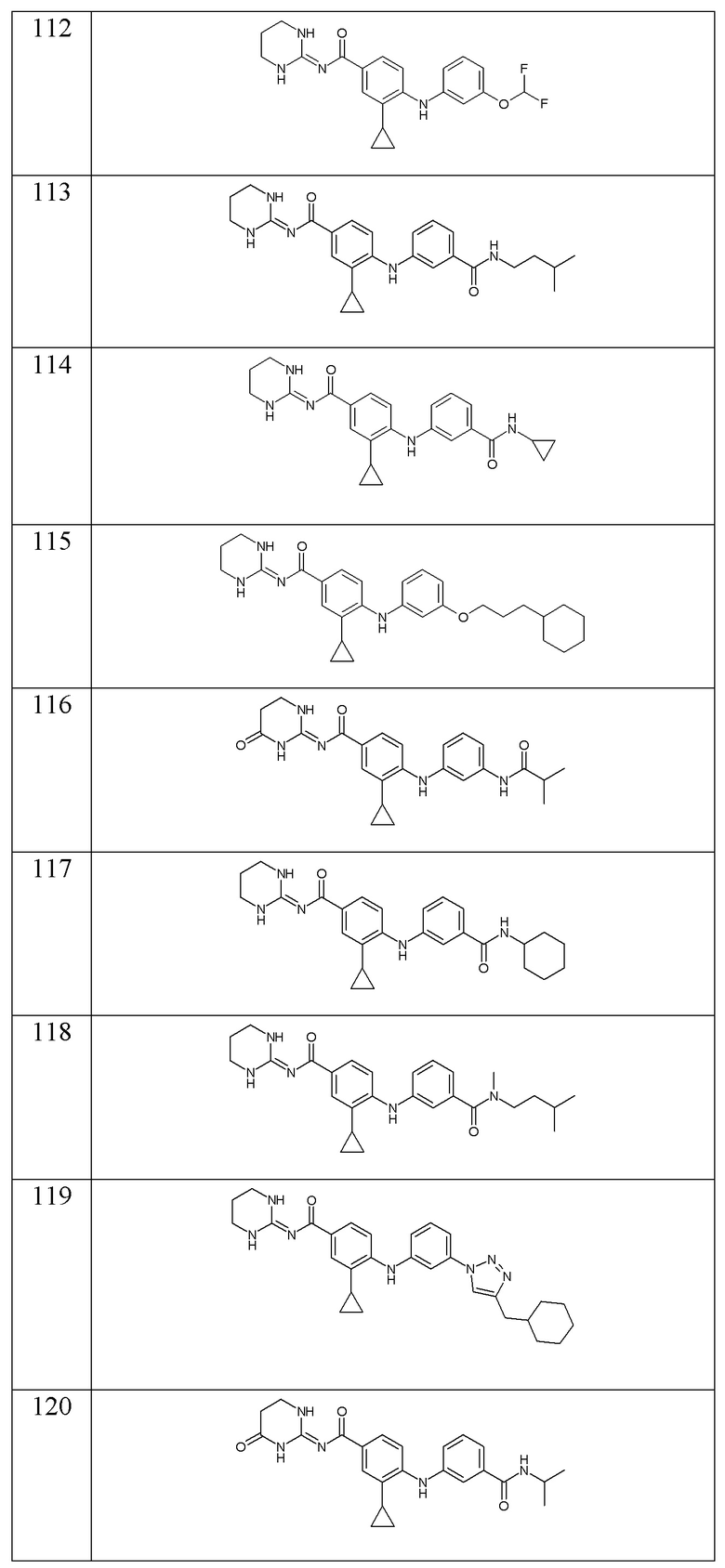
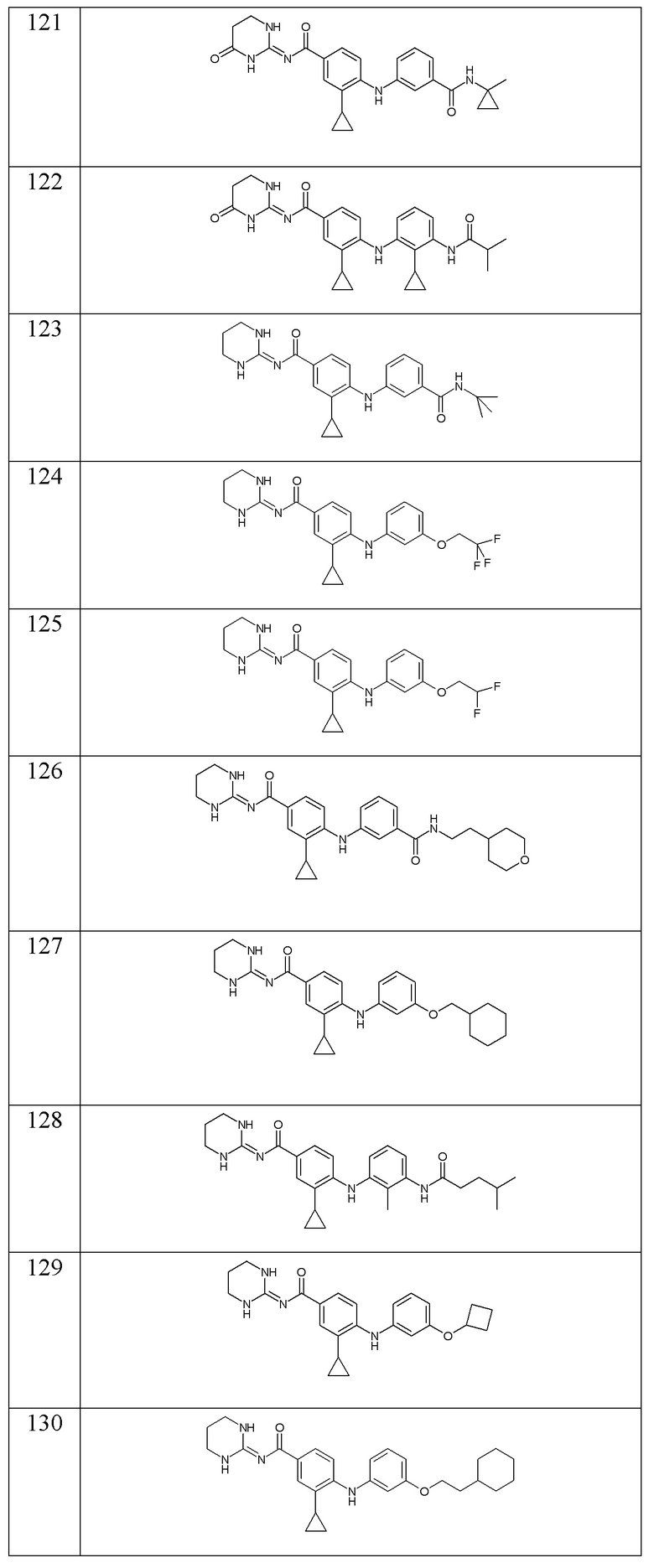
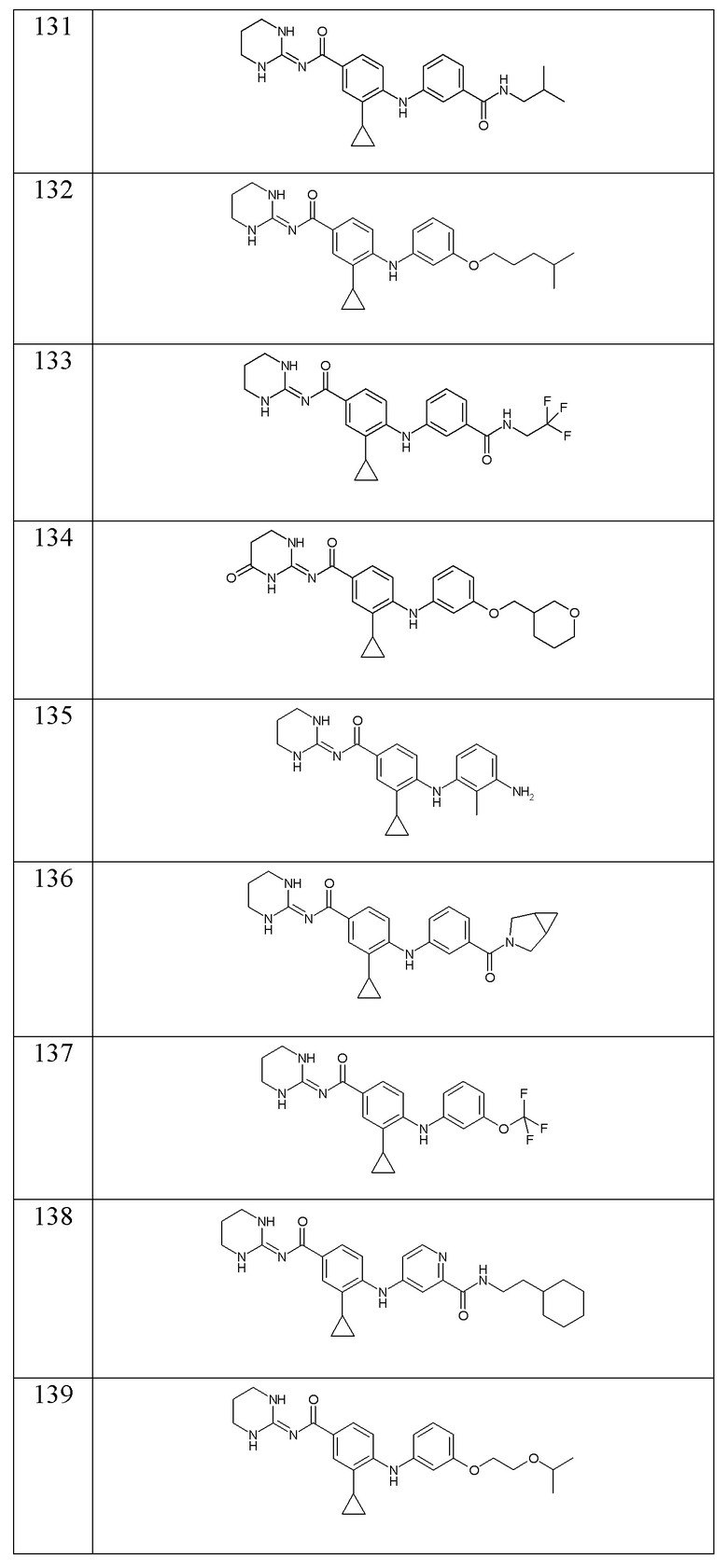
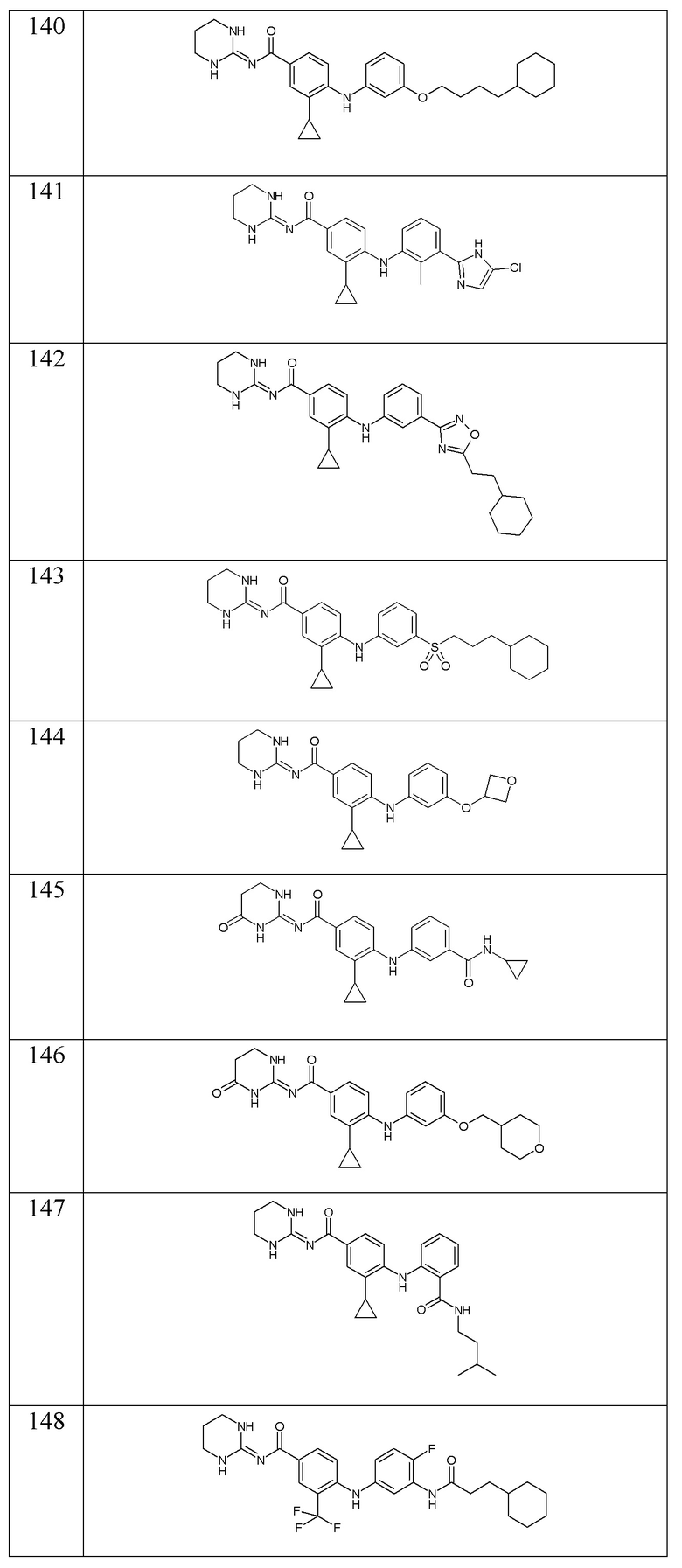
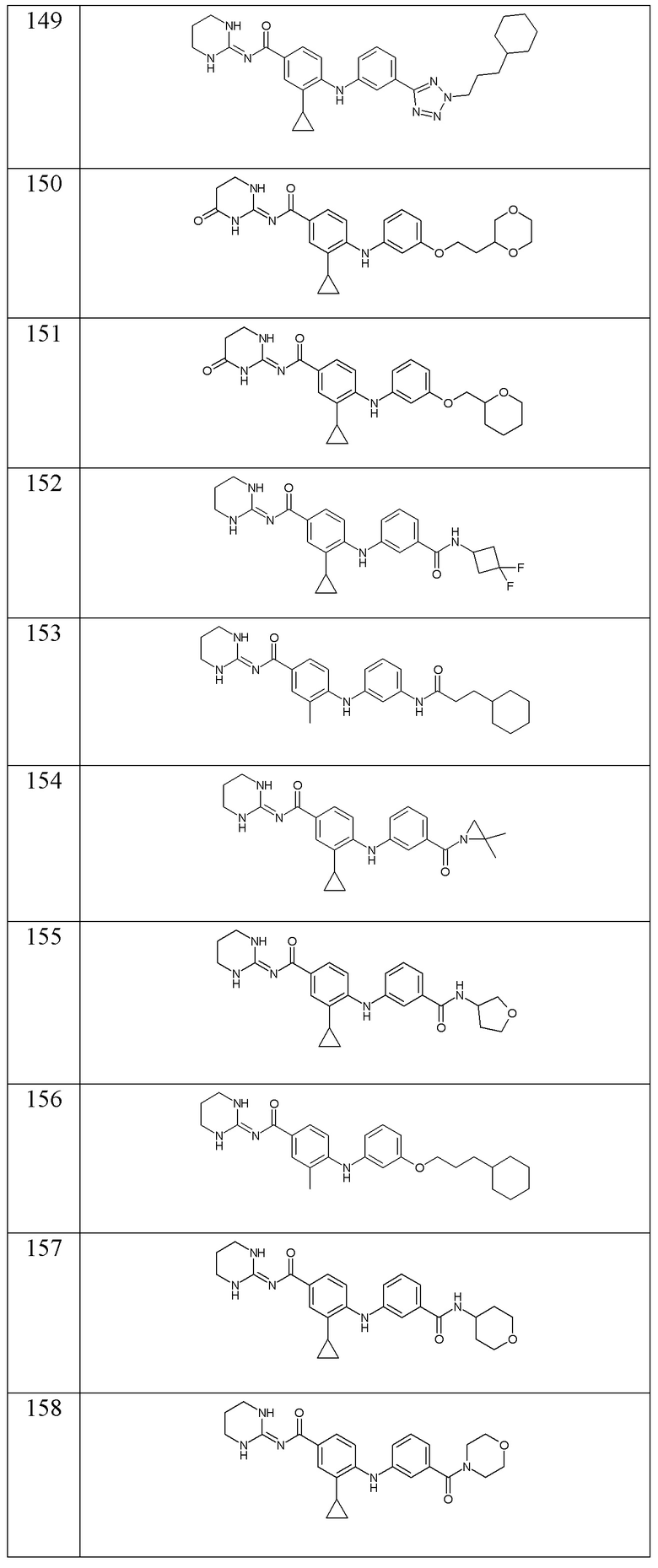
или любая из его фармацевтически приемлемых солей.
7. Применение соединения формулы (Ic) по любому из пп. 1–5 или любой из его фармацевтически приемлемых солей, или любого из соединений (19)–(31) и (91)–(181), как определено в п. 6, или любой из его фармацевтически приемлемых солей для лечения и/или предупреждения РНК-вирусной инфекции, вызванной РНК-вирусом, относящимся к группе IV или V классификации вирусов по Балтимору, выбранным из вирусов RSV (респираторно-синцитиальный вирус) и чикунгунья.
8. Фармацевтическая композиция для лечения и/или предупреждения РНК-вирусной инфекции, вызванной РНК-вирусом, относящимся к группе IV или V классификации вирусов по Балтимору, выбранным из вирусов RSV и чикунгунья, содержащая по меньшей мере одно соединение, как определено в любом из пп. 1–5, или любую из его фармацевтически приемлемых солей, или по меньшей мере любое из соединений (19)–(31) и (91)–(181), как определено в п. 6, или любую из его фармацевтически приемлемых солей и также по меньшей мере один фармацевтически приемлемый эксципиент.
9. Способ синтеза для производства соединения формулы (Ic), как определено в любом из пп. 1–5, или любой из его фармацевтически приемлемых солей, или соединения, как определено в п. 6, или любой из его фармацевтически приемлемых солей, включающий по меньшей мере стадию сочетания соединения формулы (IIc)
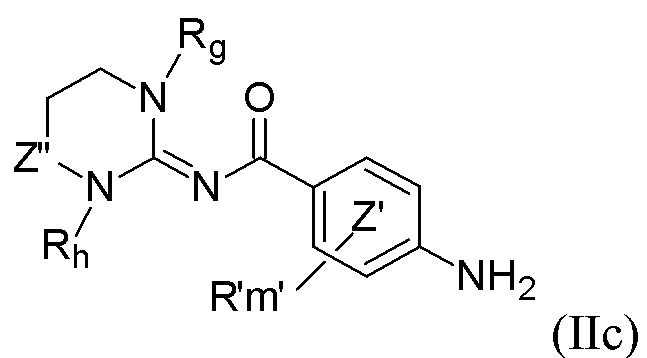
с соединением формулы (IIIc)
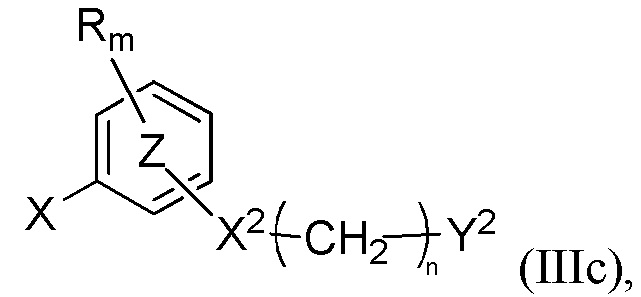
где R, R’, m, m’, кольцо  , кольцо
, кольцо  , X2, Y2, Rh, Rg и Z” являются такими, как определено в п. 1, X представляет собой атом хлора, атом иода или атом брома,
, X2, Y2, Rh, Rg и Z” являются такими, как определено в п. 1, X представляет собой атом хлора, атом иода или атом брома,
в присутствии неорганического основания и дифосфина и в присутствии металлорганического катализатора с получением соединения формулы (Ic), как определено в любом из пп. 1–5, или любой из его фармацевтически приемлемых солей, или соединения, как определено в п. 6, или любой из его фармацевтически приемлемых солей.
| WO 2012131656 A2, 04.10.2012 | |||
| WO 2009087238 A2, 16.07.2009 | |||
| WO 2004084901 A1, 07.10.2004 | |||
| RU 2008129807 A, 20.02.2010. |
Авторы
Даты
2023-02-28—Публикация
2019-07-09—Подача