Изобретение относится к способам получения биополимерных матриц на основе коллагена, используемых в регенеративной медицине при создании эквивалентов кожи. Также изобретение может использоваться в косметической промышленности.
Коллаген - один из наиболее распространенных природных материалов, на основе которых получают скаффолды [1].
Разработка скаффолдов и эквивалентов кожи на их основе связано, прежде всего, с необходимостью повышения эффективности лечения ожогов, хронических ран, а также реэпителизации больших площадей поврежденного кожного покрова при хирургических операциях [2]. Наиболее распространенным методом создания модели кожи invitro является использование гидрогелей, служащих каркасом для дермальных фибробластов, которые затем культивируются совместно с кератиноцитами на поверхности. Коллаген I типа часто служит в качестве гидрогелевого материала, а клетки дермальных фибробластов обычно распределяются внутри коллагенового геля для имитации дермального слоя [3, 4].
Многие косметические коллагенсодержащие продукты были разработаны для повышения эластичности кожи, а также для укрепления ногтей и волос [5, 6]. Одно из свойств коллагена, определяющее его широкое использование в качестве сырья в косметике, постулируется его способностью, а точнее, способностью продуктов его распада, стимулировать выработку собственного коллагена кожей.
Коллаген входит в состав многих кремов, гелей, масок, шампуней в качестве питательного и увлажняющего ингредиента. Эффективность вышеперечисленных косметических средств в основном обусловлена тем, что коллаген образует пленку, которая уменьшает трансэпидермальную потерю воды, тем самым увеличивая содержание влаги в роговом слое кожи [7, 8].
В настоящее время в научной литературе отечественными и зарубежными авторами представлен ряд методов по получению коллагена из из различного сырья. Данные методы также отличаются скоростью изготовления конечного продукта, его концентрации, а также необходимыми при этом материалами и оборудованием [9, 10, 11, 12, 13].
Так, например известен способ получения коллагена (патент RU 2273489) из костной ткани, включающий очистку, обработку ферментом папаином и раствором щелочи, нейтрализацию, обезжиривание, деминерализацию и высушивание, отличающийся тем, что после очистки кость распиливают на пластины толщиной от 0,1 до 2,0 см, промывают раствором 0,1 М фосфатного буфера с рН 5,8-6,0, переваривают в растворе активированного 0,125-0,325% папаина при 60°С в течение 24 ч, пластины промывают 5-ю объемами воды при 60°С, обрабатывают при комнатной температуре в течение 10-24 ч раствором 0,4 Н щелочи, отмывают проточной водой, обрабатывают 3%-ной перекисью водорода в течение 4 ч, затем обезжиривают в смеси этанол: хлороформ в соотношении 1:2, меняя раствор на новый не менее 2 раз, проводят декальцинацию в 0,5-1,0 Н соляной кислоте, отмывают водой очищенной, затем этанолом и высушивают при комнатной температуре, фасуют и стерилизуют радиационным облучением.
Недостатком данного способа является использование при получении коллагена ферментов, что увеличивает стоимость методики и приводит к разрушению функциональных участков молекулы коллагена.
Известен способ получения коллагена из отходов кожевенного производства, включающий промывку водой, гидротермообработку, золение и нейтрализацию, отличающийся тем, что перед термообработкой проводят обессоливание 0,1-0,5%-ным раствором серной кислоты, а гидротермообработку осуществляют в течение 10-15 мин в 2-3%-ном пероксиде водорода, золение в течение 8-10 ч раствором едкого натра 2,0-2,5%-ной концентрации, с последующей промывкой в проточной воде, нейтрализацией среды ледяной уксусной кислотой до рН 7,0, измельчением, гомогенизацией и консервацией.
Недостаток данного способа заключается в большом количестве стадий обработки сырья, а свойства полученного коллагена не позволяют применять его в тканевой инженерии, так как молекулы коллагена при этом образуют ненативную структуру.
Коллаген I типа также получают из сухожилий крысиных хвостов кислотной экстракцией. Так, например, Timpson Р. с соавторами в работе «Organotypic collagen I assay: a malleable platform to assess cell behaviour in a 3-dimensional context* в ходе экстракции предлагает использовать сверхцентрифугу с величиной центробежного ускорения до 30000 g. Однако при этом образуется конечный продукт ввиде плотного геля беловатого цвета с неподходящими физическими свойствами для создания кожных эквивалентов.
Другой автор Сафонова Л.А., с соавторами в работе «Пленки на основе фиброина шелка для заживления полнослойной раны кожи у крыс» предлагает проводить экстракцию сухожилий в уксусной кислоте на протяжении 3-х месяцев, в результате чего концентрация конечного продукта будет составлять 9 мг/мл. Однако установлено, что для создания кожных эквивалентов на основе дермальных фибробластов оптимальная концентрация коллагена должна составлять 1,5-2 мг/мл. При этом коллаген должен быть в состоянии геля.
Целью настоящего изобретения является упрощения методики получения коллагена из сухожилий крысиных хвостов. Указанная цель достигается путем сокращения времени экстракции сухожилий в уксусной кислоте до 30 дней. Также вместо диализа полученный раствор коллагена сначала полимеризуется, а потом уже вымачивали 3 раза по 30 минут в воде. Промывание полученного геля вместо диализа дает сокращение времени получения конечного продукта и упрощения методики.
Коллаген первого типа выделяли из сухожилий крысиных хвостов, для этого их предварительно очищали от загрязнений при помощи хозяйственного мыла и погружали в 70% этанол на 30 минут. После этого делали срез поперек хвоста в его основании, для более удобного очищения, производили надрез с помощью скальпеля вдоль хвоста по всей длине, и удаляли кожу хвоста. С помощью скальпеля и пинцета, аккуратно придерживая основание хвоста, извлекали сухожилия. После чего сухожилия экстрагировали в уксусной кислоте, на 1 г сухожилий брали 250 мл уксусной кислоты. Время экстракции сухожилий в 0,5 М уксусной кислоте нами было сокращено до 30 дней при температурном режиме 4°С и ежедневном помешивании раствора в течение 5 минут с помощью стеклянной палочки. По окончании времени экстракции полученный раствор центрифугировали в течении 10 минут при 5000 g и отделяли от не растворившихся сухожилий. Концентрацию раствора рассчитывали, выпарив в суховоздушном термостате водную фракцию и взвесив образовавшийся осадок. Раствор коллагена можно считать приемлемым, при концентрации коллагена не ниже 1 мг/мл (обычно получается 1,5-3,0 мг/мл).
Для приготовления геля брали полученный ранее раствор коллагена. К 3 мл коллагена добавляли 10-кратную среду М 199 в объеме 0,8 мл и добавляли концентрированный раствор аммиака (о.ч. гост 2414780) до доведения рН до 7,0-7,2. Кислотность раствора можно легко определить по среде М 199, содержащей краситель феноловый красный, цвет которого меняется в зависимости от рН. Необходимый цвет раствора - алый красный. Коллаген полимеризовался в течении 5 минут.
Далее полученный гель промывали в стерильной дистиллированной воде: вымачивали 3 раза по 30 минут. Полученный коллагеновый гель не обладал уксусным запахом, не растворялся в спирте и воде. Хорошо держал заданную форму и имеет прозрачную однородную структуру (Фиг. 1-2).
Пример. Для оценки стерильности полученного образца коллагена использовали агар Мюллера-Хилтона. Образец засевали методом сплошного посева (метод «газона») по три повторности, в заранее подготовленные чашки Петри с уже застывшей питательной средой. Так же в эксперименте присутствовали контрольные чашки Петри. Чашки инкубировали при температурном режиме 37°С в течении 72 часов. По истечении времени проводили оценку общей бактериальной обсемененности образца коллагена путем визуального осмотра чашек Петри на наличие роста колоний на питательной среде. При оценке общей бактериальной обсемененности раствора коллагена было выявлено отсутствие роста микроорганизмов на питательной среде.
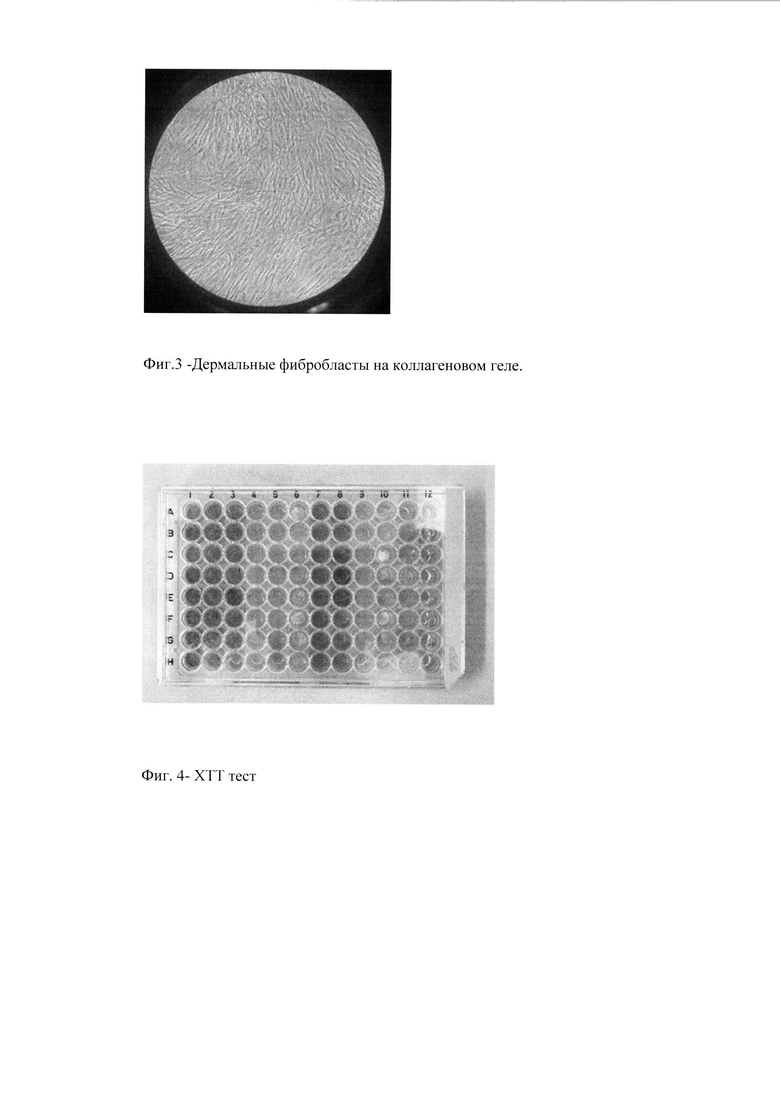
Пример 2. Цитотоксичность полученного коллагенового геля оценивали двумя способами. Первый способ заключался в том, что фибробласты высаживались на коллагеновый гель и культивировались несколько дней. Далее подвергались окрашиванию трипановым синим и подсчитывалось количество мертвых клеток. Данное исследование показало, что полученный коллагеновый гель не обладает токсичностью (Фиг. 3).
Также проводили ХТТ тест на токсичность. При проведении ХТТ-теста было выявлено преобладание показателей в контрольной группе (р<0,01), что можно объяснить условиями эксперимента и способностью клеток легко прикрепляться к пластику. Но в исследованной группе клетки оставались жизнеспособными на протяжении 9 дней. Проводили ХТТ тест на 3, 6 и 9 день. За 9 дней оптическая плотность в лунках с коллагеновым гелем оставалась постоянной, что указывает на нетоксичность полученного геля (Фиг. 4).
Список литературы:
[1] Glowacki J., Mizuno S. Collagen scaffolds for tissue engineering // Biopolymers: Original Research on Biomolecules. - 2008. - T. 89. - №. 5. - C. 338-344.
[2] Добровольская И.П. и др. 2016 Полимерные матрицы для тканевой инженерии. Полимеры. 12(2) 74-84.
[3] Reis R.L. et al. 2008 Natural-based polymers for biomedical applications. Elsevier. 8(1) 127-32.
[4] Avila Rodriguez M.I. et al 2018 Collagen: A review on its sources and potential cosmetic applications. Journal of Cosmetic Dermatology. 17(1) 20-26.
[5] Avila Rodriguez M.I., Rodriguez Barroso L.G., Sanchez M.L. Collagen: A review on its sources and potential cosmetic applications // Journal of Cosmetic Dermatology. - 2018. - Т. 17. - №. 1. - C. 20-26.
[6] Udhayakumar S. et al. Novel fibrous collagen-based cream accelerates fibroblast growth for wound healing applications: in vitro and in vivo evaluation // Biomaterials science. - 2017. - T. 5. - №. 9. - C. 1868-1883.
[7] Antipova L.V. et al. Obtaining, identification and comparative analysis of fish collagen with analogues of animal origin // Fundamental research. - 2015. - T. 8. - №. 1. - C. 9-13.
[8] Baumann L., Kaufman J., Saghari S. Collagen fillers // Dermatologic therapy. - 2006. - Т. 19. - №. 3. - C. 134-140.
[9] Сироткина M.Ю., Дарвиш Д.M., Нащекина Ю.А. Выделение коллагенов разных типов и формирование композитных матриц на их основе // Неделя науки-2019. - 2019. - С. 245-245.
[10] Сироткина М.Ю., Дарвиш Д.М, Нащекина Ю.А. Культивирование клеток роговицы на модифицированных коллагеновых пленках // Гены и Клетки. - 2020. - Т. 15. - №. S3. - С. 113-114.
[11] Швед Ю.А. Культивирование клеток кожи, предназначенных для заместительной терапии, на полимерных пленках:дис. - Институт цитологии Российской академии наук, 2008.
[12] Timpson P., Mcghee E.J., Erami Z., et al. 2011 Organotypic collagen I assay: a malleable platform to assess cell behaviour in a 3-dimensional context. Journalofvisualizedexperiments. 56(2) 78-83.
[13] 2 Сафонова Л.A. 2016 Пленки на основе фиброина шелка для заживления полнослойной раны кожи у крыс. Вестник трансплантологии и искусственных органов. 18(3) 80-83.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ производства коллаген-ламининового матрикса для заживления язв, ожогов и ран кожи человека | 2018 |
|
RU2736480C2 |
| КОЛЛАГЕНСОДЕРЖАЩИЙ ГИДРОГЕЛЬ ИЗ ОПОРНЫХ И СОЕДИНИТЕЛЬНЫХ ТКАНЕЙ ЧЕЛОВЕКА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2024 |
|
RU2836935C1 |
| КОЛЛАГЕНСОДЕРЖАЩИЙ ГИДРОГЕЛЬ ИЗ КОСТНОЙ ТКАНИ ЧЕЛОВЕКА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2024 |
|
RU2836308C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОЛЛАГЕНА ДЛЯ ЛЕЧЕНИЯ ПАТОЛОГИЙ ТКАНЕЙ ОРГАНИЗМА | 2002 |
|
RU2214827C1 |
| СПОСОБ ЛЕЧЕНИЯ СОСТОЯНИЯ РОТОВОЙ ПОЛОСТИ БОЛЬНОГО (ВАРИАНТЫ) | 2007 |
|
RU2498808C9 |
| КОСМЕТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ СОЕДИНЕНИЕ С АКТИВНОСТЬЮ, СТИМУЛИРУЮЩЕЙ ПРОДУЦИРОВАНИЕ ИНТЕРЛЕЙКИНА-6 | 1999 |
|
RU2207139C2 |
| ЭКВИВАЛЕНТ КОЖИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2342164C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ВЛИЯНИЯ МЕДИЦИНСКОЙ ПИЯВКИ НА СТИМУЛЯЦИЮ РОСТА НЕРВНЫХ ВОЛОКОН В КУЛЬТУРЕ ТКАНИ | 1996 |
|
RU2144698C1 |
| ЖЕЛАТИНИРУЮЩИЙ КОЛЛАГЕН И СРЕДСТВО ДЛЯ ЕГО ПРИГОТОВЛЕНИЯ | 2012 |
|
RU2613716C2 |
| СПОСОБ ВЫДЕЛЕНИЯ И КУЛЬТИВИРОВАНИЯ АУТОЛОГИЧНЫХ ДЕРМАЛЬНЫХ ФИБРОБЛАСТОВ ДЛЯ СТИМУЛЯЦИИ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ И ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ | 2008 |
|
RU2382077C1 |

Изобретение относится к биотехнологии. Предложен способ получения коллагенового геля, включающий выделение коллагена 1 типа из сухожилий крысиных хвостов. При этом извлеченные из крысиных хвостов сухожилия экстрагируют в 0,5 М уксусной кислоте в течение 30 дней при температуре 4°С. Полученный раствор центрифугируют в течение 10 мин при 5000 g и отделяют раствор коллагена от нерастворившихся сухожилий, при концентрации коллагена в растворе не ниже 1 мг/мл. В чашку Петри вносят 3 мл полученного коллагенового раствора, в который добавляют 0,8 мл 10-кратной среды М 199 и концентрированный раствор аммиака до доведения рН до 7,0-7,2 и выдерживают в течение 5 мин. Полученный в результате коллагеновый гель промывают дистиллированной водой. Изобретение обеспечивает получение коллагенового геля, обладающего плотной структурой. 4 ил., 2 пр.
Способ получения коллагенового геля, включающий выделение коллагена 1 типа из сухожилий крысиных хвостов, отличающийся тем что извлеченные из крысиных хвостов сухожилия экстрагируют в 0,5 М уксусной кислоте в течение 30 дней при температуре 4°С при ежедневном помешивании раствора в течение 5 мин, затем полученный раствор центрифугируют в течение 10 мин при 5000 g и отделяют раствор коллагена от нерастворившихся сухожилий, при концентрации коллагена в растворе не ниже 1 мг/мл, далее в чашку Петри вносят 3 мл полученного коллагенового раствора, в который добавляют 0,8 мл 10-кратной среды М 199 и концентрированный раствор аммиака до доведения рН до 7,0-7,2 и выдерживают в течение 5 мин, полученный в результате коллагеновый гель промывают в стерильной дистиллированной воде 3 раза в течение 30 мин.
| Способ производства коллаген-ламининового матрикса для заживления язв, ожогов и ран кожи человека | 2018 |
|
RU2736480C2 |
| RU 2059383 C1, 10.05.1996 | |||
| СПОСОБ ПОЛУЧЕНИЯ КОЛЛАГЕНОВЫХ ВОЛОКОН ИЗ КОЛЛАГЕНСОДЕРЖАЩИХ ТКАНЕЙ ЖИВОТНЫХ | 1990 |
|
RU2007926C1 |
| CN 103966294 A, 06.08.2014 | |||
| CN 109810187 A, 28.05.2019 | |||
| CN 102586372 A, 18.07.2012. | |||
Авторы
Даты
2023-03-07—Публикация
2021-12-27—Подача