Изобретение относится к области биотехнологии и может быть использовано для изготовления олигонуклеотидных, белковых, углеводных биологических микрочипов (микроматриц), предназначенных для выявления генетических и белковых маркеров в многофакторном анализе на твердой поверхности, активированной биополимером - хитозаном.
Для изготовления ДНК-, белковых и углеводных микроматриц используются полимерные гидрогели [1, 2]. Существенным недостатком трехмерных гидрогелевых микрочипов является низкая скорость диффузии биологических молекул внутрь объема геля, требующая многочасовой экспозиции, что практически нивелирует преимущество, полученное в результате неспецифической иммобилизации молекул.
У двумерных микрочипов биологические молекулы адсорбированы на поверхности или ковалентно связаны с подложкой и непосредственно контактируют с исследуемым материалом, что существенно сокращает время анализа и упрощает технологию изготовления микрочипа.
Неспецифическое связывание биологических молекул методом адсорбции (например, при использовании нитроцеллюлозных мембран) обеспечивает непрочное связывание молекул с поверхностью, что ведет к их вымыванию в процессе анализа и снижению чувствительности.
Для ковалентного связывания биологических молекул поверхность подложки микрочипа подвергают химической модификации для введения функциональных групп, что обеспечивает прочное связывание биологических молекул с поверхностью носителя.
Для изготовления ДНК-, белковых и углеводных микроматриц путем ковалентного связывания функциональных групп биологических молекул используются модифицированные поверхности активированные кремнийорганическими соединениями - силанами с эпокси-, амино- и альдегидными группами [3, 4]. Кремнийорганические соединения и способ их изготовления характеризуются высокой себестоимостью. При этом ковалентное связывание происходит, в ряде случаев, за счет присутствия в биологических молекулах аминогрупп. Белковые молекулы в своей структуре имеют экспонированные амино- и карбоксильные группы, поэтому они не требуют дополнительной модификации. Для ковалентного связывания олигонуклеотидов и углеводных (липополисахаридных (ЛПС)) молекул требуется их модификация с ведением функциональной аминогруппы [5].
В то же время, известно, что биополимер хитозан обладает высокой липополисахаридсвязывающей активностью и высокой сорбционной емкостью [6-8]. Хитозан представляет собой N-деацетилированное производное природного полисахарида хитина, получаемое в результате отщепления ацетильной группы. Хитозан является линейным сополимером N-ацетил-D-глюкозамина и D-глюкозамина, имеющим дополнительную реакционноспособную функциональную аминогруппу. Хитозан образует с молекулами ЛПС стабильный комплекс. Взаимодействие между ЛПС и хитозаном происходит при участии положительно заряженных аминогрупп хитозана и отрицательно заряженных фосфатных и карбоксильных групп липида А и олигосахарида кора ЛПС [7, 8]. Кроме того, хитозан обладает низкой себестоимостью, является биоразлагаемым и экологически чистым биополимером.
Описан способ изготовления гидрофобного стекла, покрытого хитозаном, не предназначенного для иммобилизации биологических молекул [Патент РФ №2494984]. Известен способ изготовления подложек, покрытых хитозаном, где в качестве подложки выступают целлюлозосодержащие материалы - бумага, картон и др., также не предназначенные для иммобилизации биологических молекул [Заявка на изобретение №2013158317]. Описан способ изготовления стекла, покрытого хитозаном, для изготовления, так называемых, «клеточных» биочипов для анализа единичных соматических клеток [9]. При этом хитозан иммобилизуется на поверхности стекла с использованием гидроксилов, а сам хитозан активируется поли(этиленгликоль) диглицидиловым эфиром. Известен способ изготовления планарного оптического сенсора на основе инертного носителя (стекла), покрытого наночастицами металлов и микропористым хитозаном, модифицированного л-акцепторным соединением, способным распознавать полиароматические гетероциклические серосодержащие соединения в нефтепродуктах [Патент РФ №2572801].
Также известен способ изготовления планарного оптического сенсора на основе инертного носителя (стекла), покрытого наночастицами металлов и мелкопористым полиэлектролитом, в частности, хитозаном [Заявка на изобретение №2016148003]. Сенсор предназначен для анализа белковых молекул, находящихся в жидкой пробе, методом спектроскопии комбинационного рассеяния.
Задачей изобретения является разработка более простого и экономичного способа изготовления биологических (ДНК-, белковых и углеводных) микроматриц.
Технический результат заявляемого изобретения заключается в упрощении технологии изготовления биологических (ДНК-, белковых и углеводных) микроматриц, снижении себестоимости, увеличении экспрессности, селективности и чувствительности выявления генетических и белковых маркеров в многофакторном анализе.
Технический результат достигается способом изготовления биологических микроматриц, который предусматривает: изготовление двумерных микрочипов на основе инертной подложки (стекла), которую активируют в растворе 1% хитозана с молекулярной массой 38 кДа в 1,5% уксусной кислоте; инкубацию в течение 5-10 мин при комнатной температуре; последующую отмывку дистиллированной водой в течение 5 мин при комнатной температуре, высушивание на воздухе и дальнейшее нанесение биологических молекул на активированную хитозаном подложку методом контактной печати с использованием миниплоттера, причем каждый образец биологических молекул, разведенных в соотношении 1:1 в соответствующем буфере для печати, наносят на поверхность в трех повторах в виде 12-16 идентичных зон на одном слайде.
Активация инертной подложки хитозаном обеспечивает одновременно ковалентное связывание и адсорбцию биологических молекул различной природы (нуклеиновых кислот, белков, углеводов, липидов) без дополнительных этапов их модификации аминогруппами и активации хитозана. Повышение экспрессности анализа достигается за счет использования двумерной конструкции микроматриц. Количественно повышение чувствительности анализа связано с увеличением значений «сигнал/фон». Повышение значения «сигнал» достигается за счет прочного ковалентного связывания биологических молекул с хитозаном. Снижение значения «фон» достигается за счет прозрачности хитозана в области длин волн 300-800 нм детекции биологических молекул меченых флуоресцирующими красителями. Повышение селективности связано за счет использования специфических биологических молекул.
Новизна заявляемого изобретения заключается в том, что для изготовления ДНК-, белковых и углеводных микроматриц используется инертная подложка, покрытая хитозаном.
Осуществление изобретения:
Пример 1. Изготовление ДНК-микроматриц
Препараты олигонуклеотидных зондов к специфическим генам Yersinia pestis 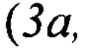
 в концентрации 100 пмоль/мкл суспендируют в буфере (3М бетаин, 4х SSPE-буфер, 0,05% твин-20) в соотношении 1:1, наносят на поверхность микрочипа, активированного хитозаном, в объеме 2-3 нл. Иммобилизацию биологических молекул осуществляют при температуре 80°С в течение 20 мин.
в концентрации 100 пмоль/мкл суспендируют в буфере (3М бетаин, 4х SSPE-буфер, 0,05% твин-20) в соотношении 1:1, наносят на поверхность микрочипа, активированного хитозаном, в объеме 2-3 нл. Иммобилизацию биологических молекул осуществляют при температуре 80°С в течение 20 мин.
Перед этапом ДНК-ДНК-гибридизации осуществляют предварительную блокировку поверхности ДНК-чипов. Для этого в лунки инкубационной камеры вносят по 100 мкл блокирующего раствора. Блокировку проводят на термошейкере при температуре 42°С в течение 30 мин при скорости вращения платформы 200 об/мин. Затем, содержимое из лунок аккуратно, не касаясь зоны эррея, отбирают с помощью вакуумного отсасывателя. Для промывки в лунки добавляют по 100 мкл отмывочного раствора 1, инкубируют при температуре 42°С в течение 5 мин при скорости вращения платформы 250 об/мин. Затем, содержимое из лунок аккуратно, не касаясь зоны эррея, отбирают с помощью вакуумного отсасывателя.
Флуоресцентно меченые ПЦР-продукты, полученные на этапе амплификации, в объеме 10 мкл смешивают с гибридизационным буфером в объеме 70 мкл, прогревают в твердотельном термостате при температуре 95°С в течение 5 мин. В лунки инкубационной камеры вносят по 80 мкл прогретой гибридизационной смеси и инкубируют на термошейкере при температуре 42°С в течение 1,5-2 ч при скорости вращения платформы 200 об/мин. Затем, содержимое из лунок аккуратно, не касаясь зоны эррея, отбирают с помощью вакуумного отсасывателя. Стекла отмывают отмывочным раствором 1 при температуре 42°С в течение 3 мин при скорости вращения платформы 250 об/мин, путем добавления в каждую лунку по 100 мкл отмывочного раствора. Содержимое лунок аккуратно отбирают с помощью вакуумного отсасывателя. Затем, стекла отмывают отмывочным раствором при температуре 42°С в течение 2 мин при скорости вращения платформы 250 об/мин, путем добавления в каждую лунку по 100 мкл отмывочного раствора. Содержимое лунок аккуратно отбирают с помощью вакуумного отсасывателя. Далее стекла вынимают из рамок, ополаскивают дистиллированной водой, высушивают путем центрифугирования при 1000 об/мин в течение 1 мин. Регистрацию и учет результатов осуществляют с помощью флуоресцентного сканера. По результатам анализа уровень значений «сигнал/фон» с использованием подложки активированной хитозаном в 1,5 раза выше, чем при использовании аминомодифицированной подложки и в 20 раз, чем при использовании эпоксимодифицированной подложки.
На фиг.1 флуоресцентные профили результатов анализа выявления генетических маркеров Yersinia pestis. 1 - буфер для печати (отрицательный контроль), 2 - олигонуклеотидный зонд 3а, 3 - олигонуклеотидный зонд 45, 4 - олигонуклеотидный зонд irp2, 5 - олигонуклеотидный зонд pla, 6 - олигонуклеотидный зонд cafl, 7 - олигонуклеотидный зонд lcrV. А - аминомодифицированное стекло, Б - эпоксимодифицированное стекло, В - хитозанмодифицированное стекло.
Пример 2. Изготовление белковых и углеводных (липополисахаридных) микроматриц и их использование
Препараты биологических молекул белковой (холероген-анатоксин) и углеводной природы (O139, O1 Огава, O1 Инаба) Vibrio cholerae в концентрации 1 мг/мл суспендируют в буфере (1х фосфатно-солевой буфер (ФСБ), 5% глицерин, 0,01% твин-20) в соотношении 1:1, наносят на поверхность микрочипа, активированного хитозаном, в объеме 2-3 нл. Иммобилизацию биологических молекул осуществляют при температуре 60°С в течение 20 мин.
Исследуемые сыворотки вносят в лунки реакционных ячеек микроматриц, инкубируют на термошейкере при температуре 37°С в течение 1 ч со скоростью вращения платформы 300 об/мин. После инкубации стекла отмывают троекратно ФСБ и вносят конъюгаты антивидовых флуоресцирующих антител против IgG, IgM. Стекла инкубируют при температуре 37°С в течение 1 ч, отмывают троекратно ФСБ и высушивают центрифугированием при 1000 об/мин в течение 1 мин. Регистрацию и учет результатов осуществляют с помощью флуоресцентного сканера. По результатам анализа уровень значений «сигнал/фон» с использованием подложки активированной хитозаном в 2 раза выше, чем при использовании аминомодифицированной подложки и в 10 раз, чем при использовании альдегидмодифицированной подложки.
На фиг.2 Флуоресцентные профили результатов анализа выявления специфических антител в сыворотке диагностической холерной 01. 8- буфер для печати (отрицательный контроль), 9 - O139-антиген, 10 - O1-антиген Огава, 11 - O1-антиген Инаба, 12 - холероген-анатоксин. А - аминомодифицированное стекло, Б -альдегидмодифицированное стекло, В - хитозанмодифицированное стекло.
Таким образом, применение для изготовления биологических микроматриц хитозанмодифицированных стекол в качестве подложки обеспечивает повышение уровня значений «сигнал/фон» в 1,5-2 раза по сравнению с коммерческой амминомодифицированной подложкой, в 10 раз - по сравнению с альдегидмодифицированной подложкой, в 20 раз - по сравнению с эпиксимодифицированной подложкой.
Источники информации
1. Грядунов Д.А. Гидрогелевые биочипы - инструменты многопараметрического анализа маркеров бактериальных, вирусных и растительных геномов: автореф. дис. … д-ра биол. наук: 03.01.03 / Грядунов Дмитрий Михайлович. - Москва, 2017. 315 с.
2. Михайлович В.М. Идентификация инфекционных агентов, генетических детерминант патогенное™ и лекарственной устойчивости микроорганизмов и вирусов на биологических микрочипах: автореф. дис.... д-ра биол. наук: 03.00.03, 03.00.07 / Михайлович Владимир Михайлович. - Москва, 2009. 53 с.
3. Wingren С, Borrebaeck С.А.К. Antibody-based microarrays // Methods Mol Biol. 2009; 509: 57-84. doi: 10.1007/978-1 -59745-372-1_5.
4. Schena, M. Microarray Biochip Technology // Eaton Publishing Company/Biotechniques Books. - 2000. - ISBN: 1881299376. - 298 p.
5. Parthasarathy N., Saksena R., Kovac P. [et al.] Application of carbohydrate microarray technology for the detection of Burkholderia pseudomallei, Bacillus anthracis and Francisella tularensis antibodies // Carbohydr Res. - 2008. - V. 343, N 16. - P. 2783-2788.
6. Горбач В.И., Давыдова В.Н., Володько А.В. [и др.] Сорбция липополисахаридов цеолитами модифицированными хитозаном // Актуальные вопросы биологической физики и химии. - 2016. - N 1-2. - С. 60-64.
7. Давыдова В.Н., Набережных Г.А., Ермак И.М. [и др.] Определение констант связывания липополисахаридов различной структуры с хитозаном // Биохимия. - 2006. - Т. 71, N 3. - С. 417-425.
8. Набережных Г.А., Горбач В.И., Лихацкая Г.Н. [и др.] Взаимодействие хитозанов и N-ацилированных производных хитозанов с липополисахаридами грамотрицательных бактерий // Биохимия. - 2008. - Т. 73, N 4. - С. 530-541.
9. Ferrara V., Zito G., Arrabito G. [et al.] Aqueous Processed Biopolymer Interfaces for Single-Cell Microarrays // ACS Biomater Sci Eng. - 2020 May 11;6(5):3174-3186. doi: 10.1021/acsbiomaterials.9b01871. Epub 2020 Apr 17.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИОЛОГИЧЕСКИЙ МИКРОЧИП ДЛЯ ВЫЯВЛЕНИЯ И МНОГОПАРАМЕТРИЧЕСКОГО АНАЛИЗА ПРОТИВОХОЛЕРНЫХ АНТИТЕЛ | 2013 |
|
RU2528099C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДНК-ЧИПОВ (ВАРИАНТЫ) | 2005 |
|
RU2315114C2 |
| НАБОРЫ ОЛИГОНУКЛЕОТИДОВ-ПРАЙМЕРОВ И ЗОНДОВ, БИОЛОГИЧЕСКИЙ МИКРОЧИП И ТЕСТ-СИСТЕМА ДЛЯ ИДЕНТИФИКАЦИИ И ТИПИРОВАНИЯ ВИРУСА ГРИППА А И В С ИХ ИСПОЛЬЗОВАНИЕМ | 2013 |
|
RU2538168C2 |
| НАБОР ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ И ЗОНДОВ ДЛЯ ГЕНОТИПИРОВАНИЯ ПОЛИМОРФНЫХ ЛОКУСОВ ДНК, АССОЦИИРОВАННЫХ С РИСКОМ РАЗВИТИЯ СПОРАДИЧЕСКОЙ ФОРМЫ БОЛЕЗНИ АЛЬЦГЕЙМЕРА В РОССИЙСКИХ ПОПУЛЯЦИЯХ | 2014 |
|
RU2600874C2 |
| НАБОР ОЛИГОНУКЛЕОТИДОВ-ПРАЙМЕРОВ, БИОЧИП И СПОСОБ ВИДОВОЙ ИДЕНТИФИКАЦИИ ОРТОПОКС- И ГЕРПЕСВИРУСОВ, ПАТОГЕННЫХ ДЛЯ ЧЕЛОВЕКА | 2006 |
|
RU2318875C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОСОРБЕНТА | 2003 |
|
RU2253871C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДНК-ЧИПОВ | 2003 |
|
RU2236467C1 |
| СПОСОБ ИДЕНТИФИКАЦИИ РНК ВИРУСОВ ГРИППА А И В С ОДНОВРЕМЕННЫМ ОПРЕДЕЛЕНИЕМ ВАРИАНТОВ ГЕМАГГЛЮТИНИНА И НЕЙРАМИНИДАЗЫ ВИРУСА ГРИППА А, ИДЕНТИФИКАЦИЕЙ ГЕНЕТИЧЕСКИХ МАРКЕРОВ ПАТОГЕННОСТИ И УСТОЙЧИВОСТИ К ПРОТИВОГРИППОЗНЫМ ПРЕПАРАТАМ НА БИОЛОГИЧЕСКИХ МИКРОЧИПАХ, БИОЧИП, НАБОР ОЛИГОНУКЛЕОТИДНЫХ ЗОНДОВ, ИСПОЛЬЗУЕМЫЕ В СПОСОБЕ | 2015 |
|
RU2603000C1 |
| СПОСОБ ВЫБОРА ДНК-ЗОНДОВ ДЛЯ МИКРОЧИПОВОЙ ДИАГНОСТИКИ, БИОЧИП И СПОСОБ ТИПИРОВАНИЯ ГЕНА НЕЙРАМИНИДАЗЫ И ГЕМАГГЛЮТИНИНА ВИРУСА ГРИППА А | 2010 |
|
RU2470076C2 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ АНАЛИЗА ВЗАИМОДЕЙСТВИЙ БИОЛОГИЧЕСКИХ МОЛЕКУЛ НА БИОЛОГИЧЕСКОМ МИКРОЧИПЕ НА ОСНОВЕ ФЛУОРЕСЦЕНЦИИ АМИНОКИСЛОТНЫХ ОСТАТКОВ ТРИПТОФАНА | 2014 |
|
RU2588816C2 |

Изобретение относится к области биотехнологии. Описан способ изготовления биологических микроматриц для выявления генетических и белковых маркеров на инертной подложке активированной 1% раствором хитозана м.м. 38 кДа в 1,5% уксусной кислоте с последующей отмывкой в дистиллированной воде, высушиванием и дальнейшим нанесением биологических молекул. Изобретение может быть использовано для изготовления олигонуклеотидных, белковых, углеводных биологических микрочипов (микроматриц), предназначенных для выявления генетических и белковых маркеров в многофакторном анализе на твердой поверхности активированной биополимером - хитозаном. 2 ил., 2 пр.
Способ изготовления биологических микроматриц для выявления генетических и белковых маркеров, предусматривающий изготовление двумерных микрочипов на основе инертной подложки (стекла), которую активируют в растворе 1% хитозана с молекулярной массой 38 кДа в 1,5% уксусной кислоте, инкубацию в течение 5-10 мин при комнатной температуре, последующую отмывку дистиллированной водой в течение 5 мин при комнатной температуре и высушивание на воздухе с последующим нанесением биологических молекул на активированную хитозаном подложку методом контактной печати с использованием миниплоттера, причем каждый образец биологических молекул, разведенных в соотношении 1:1 в соответствующем буфере для печати, наносят на поверхность в трех повторах в виде 12-16 идентичных зон на одном слайде.
| СПОСОБ ИДЕНТИФИКАЦИИ ПРОТИВООПУХОЛЕВЫХ ЦЕЛЕВЫХ ФЕРМЕНТОВ | 2002 |
|
RU2319482C2 |
| US 20100332430 A1, 30.12.2010 | |||
| Молекулярные маркеры - инструмент исследования генетического разнообразия, найдено в интернет 08.12.2022, размещено https://www.fao.org/3/a1250r/a1250r17.pdf 21.01.2019. | |||
Авторы
Даты
2023-03-22—Публикация
2022-06-28—Подача