Изобретение относится к области клинической лабораторной диагностики, биотехнологии и медицины, в частности к иммунохимическому анализу препаратов крови человека на наличие специфических противохолерных антител, и может найти применение в лабораторной диагностике холеры, а именно при серологическом обследовании людей на холеру.
В настоящее время для выявления противохолерных антител у больных, переболевших, вибриононосителей и вакцинированных людей используется развернутая реакция агглютинации исследуемых сывороток крови человека с трехчасовой бульонной культурой Vibrio cholerae, выделенной в данном очаге или с тестовыми штаммами холерных вибрионов сероваров Огава, Инаба и O139 серогруппы [1]. Время анализа при этом составляет 18 ч. Длительное время анализа, субъективность учета результатов ставят актуальной задачу создания тест-систем нового поколения, обеспечивающих высокую производительность анализа, получение ответа в более короткие сроки, сокращение объема исследуемого образца.
В настоящее время существенное развитие получила технология анализа сложных биологических систем с помощью биологических микрочипов (биочипов). В биологических микрочипах, в отличие от традиционных серологических методов, реализуется возможность одновременного параллельного анализа исследуемого образца по многим параметрам, то есть проведение многопараметрического анализа на наличие антител различной специфичности. Это значительно увеличивает эффективность анализа, снижает требуемое количество исследуемого материала, позволяет миниатюризировать проведение исследований, повысить достоверность результатов и автоматизировать этапы проведения анализа.
Раздельное выявление антител различной специфичности важно при проведении эпидемиологического расследования случаев холеры. Определение антител к холерному токсину в сыворотке крови людей позволяет сделать заключение об эпидемической значимости штаммов холерных вибрионов, циркулирующих в очаге холеры.
Рядом авторов для идентификации и внутривидового типирования возбудителей инфекционных болезней разработаны биологические микрочипы на основе олигонуклеотидных зондов - так называемые «ДНК-чипы» [2-5]. Однако ДНК-чипы, при отсутствии выделения возбудителя, в том числе на фоне лечения антибиотиками, не позволяют оценить динамику развития инфекционного процесса, провести ретроспективную диагностику холеры, определить состояние гуморального иммунитета у вакцинированных людей.
Для проведения иммунологического анализа применяют белковые микрочипы или иммуночипы. Белковые микрочипы делят на двумерные (белки иммобилизуются на поверхности носителя) и трехмерные (белки иммобилизуются внутри носителя) [6].
Известны трехмерный биологический микрочип на основе полиакриламидного гидрогеля для проведения множественного параллельного иммунологического анализа соединений, сформированный полимеризацией гидрогелевых элементов заданного объема на поверхности микрочипа [7], и способ обнаружения биологических токсинов с использованием гидрогелевого микрочипа [8]. Гидрогелевые биологические микрочипы позволяют проводить множественный иммунологический анализ широкого круга низкомолекулярных и высокомолекулярных соединений. Существенным недостатком трехмерных микрочипов является низкая скорость диффузии молекул пробы внутри объема гидрогеля, требующая многочасовой экспозиции, что практически нивелирует преимущество, полученное в результате увеличения пространственной плотности пробы. Кроме того, описанные биологические микрочипы предназначены для анализа одной пробы.
Известны двумерные микрочипы для определения антигенов бактерий [9], выявления в сыворотке крови человека антител к ряду инфекционных агентов: вирусу гепатита С [10, 11], ВИЧ-инфекции [12], возбудителю сифилиса [13], боррелиоза [14], TORCH-инфекциям [15]. У двумерных микрочипов белки адсорбированы или ковалентно связаны с подложкой и непосредственно контактируют с исследуемым материалом, что существенно сокращает время анализа и упрощает технологию изготовления микрочипа. Для ковалентного связывания белков поверхность носителя подвергают химической модификации для введения амино-, альдегид- или эпоксигрупп [6], что обеспечивает прочное связывание белков с поверхностью подложки.
Наиболее близкой по технической сущности является диагностическая тест-система в формате двумерного иммуночипа для серологической диагностики сифилиса [16]. Диагностическая тест-система в формате иммуночипа для серологической дифференциальной диагностики сифилиса состоит из иммуносорбента с иммобилизованными на нем раздельно антигенами возбудителя сифилиса Treponema pallidum, конъюгата и реактивов, необходимых для выявления комплекса антиген-антитело. Однако данная тест-система, позволяющая одновременно и дифференциально выявлять антитела к Treponema pallidum разных классов, не предназначена для выявления противохолерных антител.
Технической задачей настоящего изобретения является разработка биологического микрочипа, позволяющего выявлять в короткие сроки противохолерные антитела к антигенам возбудителя холеры O1 серогруппы сероваров Огава и Инаба, O139 серогруппы и холерному токсину.
Техническим результатом является повышение эффективности и сокращение времени серодиагностики холеры у человека, увеличение информативности за счет определения классов иммуноглобулинов, что позволяет устанавливать сроки заболевания. Дополнительным результатом является повышение биологической безопасности серологической диагностики холеры за счет использования чистых растворимых антигенов.
Технический результат достигается тем, что биологический микрочип содержит массив дискретно нанесенных и иммобилизованных на поверхности подложки O-антигенов V. cholerae и холерного токсина, по меньшей мере, в двух повторах, сгруппированных в отдельные зоны для проведения параллельного иммунологического анализа нескольких образцов. Поверхность подложки активирована альдегид-, эпокси- или аминогруппами. Для выявления противохолерных антител используют O-антигены V. cholerae O1 серогруппы сероваров Огава и Инаба и O139 серогруппы.
Описание конструкции биологического микрочипа.
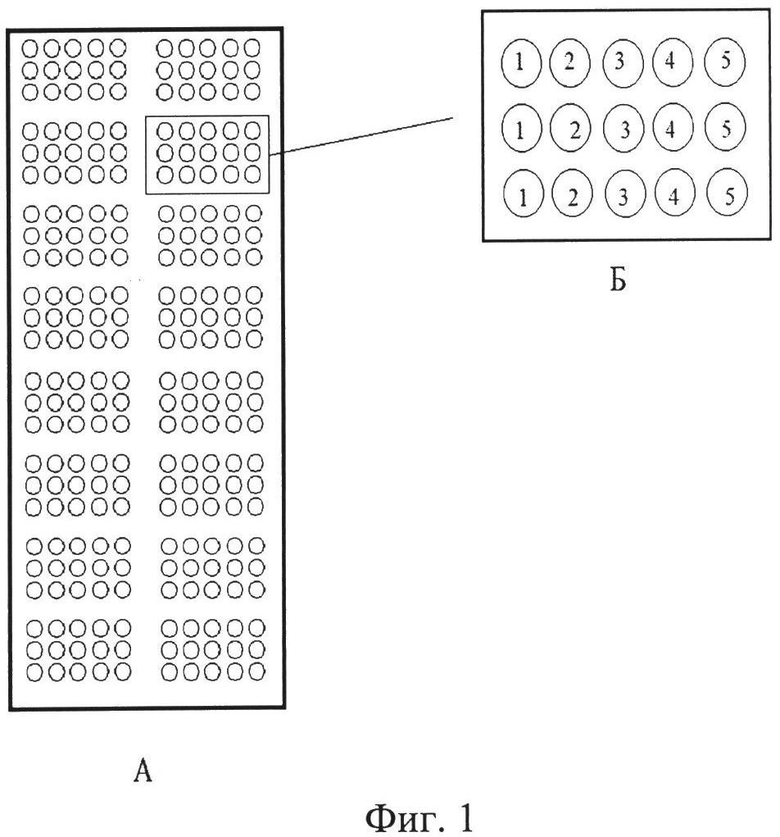
Биологический микрочип представляет собой подложку, в качестве которой можно использовать предметное стекло по ГОСТ 9284-75 [17] размером 25x75x1 мм, активированное альдегид-, эпокси- или аминогруппами. В качестве специфических антигенов при изготовлении микрочипа используют препараты растворимых O-антигенов V. cholerae O1 серогруппы серовара Огава, O1 серогруппы серовара Инаба, 0139 серогруппы, полученные в соответствии с патентом РФ №2143280 [18] и препарат холерного токсина, полученный в соответствии с патентом РФ №2456996 [19]. Антигены наносят на активированное стекло методом контактной печати с помощью миниплоттера. Антигены разводят в буфере для печати до конечной концентрации 0,5-1 мг/мл и сорбируют в трех повторах на активированных стеклах. Каждому антигену соответствует индивидуальное пятно диаметром 0,3 мм. При печати набор антигенов группируют в виде 16 идентичных зон на одном стекле с расстоянием 9 мм между центрами зон (Фиг.1) и расстоянием между пятнами 0,8-1 мм, обеспечивающими высокую плотность расположения антигенов на единицу площади поверхности подложки. Иммобилизацию антигенов проводят в течение 1 ч при температуре 37°C. Свободные сайты связывания поверхности стекла блокируют 0,5% раствором бычьего сывороточного альбумина (БСА) в фосфатно-солевом буфере в течение 1 ч при температуре 25°C. Затем стекло высушивают центрифугированием в течение 1 мин при скорости вращения ротора 1000 об/мин. Стекла с иммобилизованными антигенами хранят при температуре 4°C до их использования. Максимальный срок хранения 6 мес.
Краткое описание чертежей.
На Фиг.1 представлена общая схема расположения антигенов на микрочипе (А), состоящего из 16-ти идентичных зон (Б) и схема расположения антигенов в одной зоне. Каждая зона предназначена для анализа одного образца. Цифрами обозначены виды иммобилизуемых антигенов: 1 - антиген V. cholerae O1 серовара Огава, 2 - антиген V. cholerae O1 серовара Инаба, 3 - антиген V. cholerae O139 серогруппы, 4 - холерный токсин, 5 - отрицательный контроль (буфер для печати).
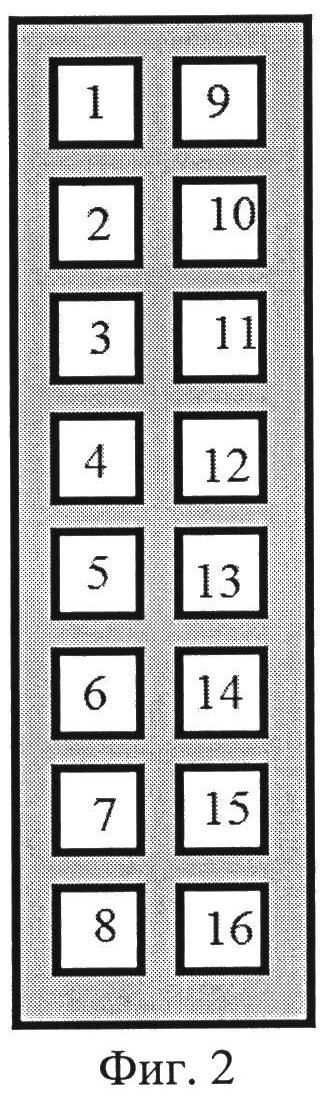
На Фиг.2 представлено схематическое изображение трафарета. Цифрами обозначены номера ячеек. Размеры трафарета: 75x25,4 мм, размеры ячеек: 7x7x4 мм.
На Фиг.3 приведен пример положительного результата при наличии в исследуемом материале антител к V. cholerae O1 серогруппы серовара Огава (А), V. cholerae O1 серогруппы серовара Инаба (Б), V. cholerae O139 серогруппы (В), холерному токсину (Г).
Примеры использования биологического микрочипа.
Пример 1. Выявление и многопараметрический анализ противохолерных антител класса G/M в сыворотке крови человека при проведении оперативной диагностики холеры (без определения титра специфических антител)
Перед постановкой анализа сверху на сконструированный биологический микрочип накладывают и плотно зажимают в специальной рамке трафарет. Трафарет содержит 16 ячеек квадратной формы (Фиг.2), соответствующих 16 зонам на биологическом микрочипе (Фиг.1А). При наложении трафарета на биологический микрочип каждая ячейка совмещается с соответствующей зоной. В каждую ячейку вносят по 98 мкл буферного раствора для отмывки микрочипа от несвязавшегося БСА и инкубируют на шейкере для иммуноплашетов с вращением платформы 500 об/мин при температуре 37°C в течение 2-3 мин. После инкубации содержимое из ячеек аккуратно отбирают с помощью вакуумного отсасывателя, не повреждая центральное поле ячейки, соответствующее расположению массива биологических молекул. Затем в каждую ячейку вносят по 90 мкл буферного раствора для разведения образцов. С 1 по 14 ячейки биологического микрочипа вносят по 2 мкл исследуемых сывороток, в 15 ячейку вносят 2 мкл положительного контроля (положительная сыворотка человека), в 16 ячейку - 2 мкл буфера для разведения образцов (отрицательный контроль). Биологические микрочипы накрывают крышкой и инкубируют на шейкере для иммунопланшетов с вращением платформы 500 об/мин при температуре 37°C в течение 30 мин. Содержимое из ячеек аккуратно отбирают с помощью вакуумного отсасывателя. Микрочипы промывают два раза буферным раствором для отмывки, вносят в каждую ячейку по 100 мкл буферного раствора и инкубируют на шейкере для иммунопланшетов с вращением платформы 500 об/мин при температуре 37°C в течение 2-3 мин. В каждую ячейку вносят по 100 мкл конъюгата, содержащего антитела против иммуноглобулинов класса G/M человека, меченные флуоресцентным красителем, имеющим максимум поглощения при длине волны 532 нм или 635 нм, в рабочем разведении. Микрочипы накрывают крышкой и инкубируют на шейкере для иммунопланшетов с вращением платформы 500 об/мин при температуре 37°C в течение 30 мин. Содержимое из ячеек аккуратно отбирают с помощью вакуумного отсасывателя. Микрочипы промывают два раза буферным раствором для отмывки, внося в каждую лунку по 100 мкл буферного раствора, и инкубируют на шейкере для иммунопланшетов с вращением платформы 500 об/мин при температуре 37°C в течение 2-3 мин. Снимают трафарет с микрочипа. Микрочип промывают дистиллированной водой и высушивают центрифугированием в течение 1 мин при скорости 1000 об/мин. После проведения анализа микрочипы сканируют на флуоресцентном сканере при длине волны 532 нм или 635 нм. Для анализа используют среднее значение интенсивности флуоресценции в пределах области печати для каждой точки массива. Определяют место локализации точек отрицательного контроля для каждого исследуемого образца. Определяют значение интенсивности флуоресценции для каждой точки массива. Положительным считают результат при превышении интенсивности флуоресценции точки массива в 2,5 раза интенсивности флуоресценции точек отрицательного контроля. Результат анализа считают валидным при наличии положительного результата в ячейке положительного контроля, при отрицательном результате в ячейке отрицательного контроля. Образец считают положительным на наличие антител к V. cholerae O1 серогруппы серовара Огава при положительном результате не менее чем в двух повторах в первом столбце массива (Фиг.3А). Образец считают положительным на наличие антител к V. cholerae O1 серогруппы серовара Инаба при положительном результате не менее чем в двух повторах во втором столбце массива (Фиг.3Б). Образец считают положительным на наличие антител к V. cholerae O139 серогруппы при положительном результате не менее чем в двух повторах в третьем столбце массива (Фиг.3В). Образец считают положительным на наличие антител к холерному токсину V. cholerae при положительном результате не менее чем в двух повторах в четвертом столбце массива (Фиг.3Г). Время анализа составляет 1,5 ч.
Пример 2. Выявление и многопараметрический анализ противохолерных антител в сыворотке крови человека при проведении ретроспективной диагностики холеры (с определением титра и класса специфических антител)
Перед постановкой анализа сверху на биологический микрочип накладывают и плотно зажимают в специальной рамке трафарет. В каждую ячейку вносят по 100 мкл буферного раствора для отмывки микрочипа и инкубируют на шейкере для иммуноплашетов с вращением платформы 500 об/мин при температуре 37°C в течение 2-3 мин. После инкубации содержимое из ячеек аккуратно отбирают с помощью вакуумного отсасывателя, не повреждая центральное поле ячейки, соответствующее расположению массива биологических молекул. Исследуемую сыворотку разводят в лунках 96-луночного планшета в буферном растворе для разведения образцов в разведении от 1:20 до 1:1280 в двух повторностях. Для этого в первую лунку 96-луночного планшета вносят 190 мкл буферного раствора для разведения образцов, со второй по седьмую лунки вносят по 100 мкл буферного раствора для разведения образцов. В первую лунку вносят 10 мкл исследуемой сыворотки (конечное разведение 1:20) и титруют двукратно по 100 мкл до седьмой лунки (конечное разведение 1:1280). Процедуру повторяют в других 7-ми лунках 96-луночного планшета. Содержимое каждой лунки в объеме 100 мкл переносят в ячейки биологического микрочипа. В оставшиеся свободными две лунки вносят положительный и отрицательный контроль. Биологические микрочипы накрывают крышкой и инкубируют на шейкере для иммунопланшетов с вращением платформы 500 об/мин при температуре 37°C в течение 30 мин. Содержимое из ячеек аккуратно отбирают с помощью вакуумного отсасывателя. Микрочипы промывают два раза буферным раствором для отмывки микрочипа, внося в каждую ячейку по 100 мкл раствора и инкубируют на шейкере с вращением платформы 500 об/мин при температуре 37°C в течение 2-3 мин. С 1 по 8 ячейки микрочипа вносят в рабочем разведении по 100 мкл конъюгата, содержащего антитела против иммуноглобулинов класса G человека, меченные флуоресцентным красителем, с 9 по 16 ячейки микрочипа вносят в рабочем разведении по 100 мкл конъюгата, содержащего антитела против иммуноглобулинов класса M человека, меченные флуоресцентным красителем. Микрочипы накрывают крышкой и инкубируют на шейкере для иммунопланшетов с вращением платформы 500 об/мин при температуре 37°C в течение 30 мин. Содержимое из ячеек аккуратно отбирают с помощью вакуумного отсасывателя. Микрочипы промывают два раза буферным раствором для отмывки, внося в каждую лунку по 100 мкл буферного раствора, и инкубируют на шейкере для иммунопланшетов с вращением платформы 500 об/мин при температуре 37°C в течение 2-3 мин. Дальнейшую процедуру анализа и учет результатов осуществляют аналогично примеру 1. Определение титра и класса иммуноглобулинов проводят на основании положительных результатов с соответствующими антивидовыми конъюгатами. За титр специфической активности принимают максимальное разведение исследуемого образца, при котором наблюдается положительный результат. Время анализа составляет 2 ч.
Таким образом, применение биологических микрочипов позволяет повысить эффективность проведения серологического исследования и сократить время его проведения за счет одновременного параллельного анализа нескольких образцов сыворотки крови человека на наличие противохолерных антител к широкому спектру антигенов возбудителя холеры различной специфичности с определением иммуноглобулинов класса G и M. Использование биочипа обеспечивает достоверность результатов анализа, стандартизацию и автоматизацию проведения исследований. При проведении исследования с использованием заявляемого биочипа требуется минимальный объем исследуемого материала.
Источники информации
1. Лабораторная диагностика холеры: Методические указания МУК 4.2.2218-07. М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора; 2007.
2. Jin Da-Zhi, Xu Xiao-Jing, Chen Su-Hong, Wen Si-Yuan, Ma Xue-En, Zhang Zheng et al. Detection and identification of enterohemorrhagic Escherichia coli 0157:H7 and Vibrio choleras 0139 using oligonucleotide microarray. Infectious Agents and Cancer. 2007; 2: 23-33.
3. Panicker G., Call D.R., Krug M.J. Bej A.K. Detection of Pathogenic Vibrio spp.In Shellfish by Using Multiplex PCR and DNA Microarrays. Appl. and Environmental Microbiology. 2004; 70 (12): 7436-7444.
4. Vora G.J., Meador C.E., Bird M.M., Bopp C.A., Andreadis J.D., Stenger D.A. Microarray-based detection of genetic heterogeneity, antimicrobial resistance, and the viable but nonculturable state in human pathogenic Vibrio spp.PNAS. 2005; 102 (52): 19109-19114.
5. Pang В., Yan М., Cui Z., Ye X., Diao В., Ren Y. et al. Genetic Diversity of Toxigenic and Nontoxigenic Vibrio cholerae Serogroups 01 and 0139 Revealed by Array-Based Comparative Genomic Hybridization. J. Bacteriology. 2007; 189 (13): 4837-4849.
6. Wingren С, Borrebaeck CA. Antibody-based microarrays. Methods Mol Biol. 2009:509:57-84.
7. Пат. 2363955, Российская Федерация, МПК G01N 33/543. Биологический микрочип для множественного параллельного иммунологического анализа соединений и способы иммуноанализа, в которых он используется / Дарий Е.Л., Дементьева Е.И., Бутвиловская В.И., Рубина А.Ю., Стомахин А.А., Савватеева Е.Н., Заседателев А.С.; заявитель и патентообладатель Учреждение Российской академии наук Институт Молекулярной Биологии им. В.А. Энгельгардта РАН (ИМБ РАН). - №2007112882/15; заявл. 28.12.2004; опубл. 10.08.2009, Бюл. №22. - 68 с.: ил.
8. Пат. 2320994, Российская Федерация, МПК G01N 33/53. Способ количественного обнаружения биологических токсинов / Дементьева Е.И., Дюкова В.И., Заседателев А.С., Рубина А.Ю., Стомахин А.А., Несмеянов В.А., Гришин Е.В.; заявитель и патентообладатель Институт Молекулярной Биологии им. В.А. Энгельгардта Российской академии наук. Институт биоорганической химии им. M.M. Шемякина и Ю.А. Овчинникова Российской академии наук. - №2006125158/15; заявл. 24.11.2004; опубл. 27.03.2008, Бюл. №9. - 19 с.: ил.
9. Пат. 2451083, Российская Федерация, МПК C12Q 1/00, G01N 33/53, G01N 33/533. Способ определения антигенов бактерий / Афонюшкин В.П., Титова М.А., Филипенко М.Л., Юшков Ю.Г., Шкиль Н.А., Троменшлегер И.Н.; заявитель и патентообладатель Учреждение Российской академии наук Институт химической биологии и фундаментальной медицины Сибирского отделения РАН (ИХБФМ СО РАН), Государственное научное учреждение Институт экспериментальной ветеринарии Сибири и Дальнего Востока Россельхозакадемии (ГНУ ИЭВСиДВ). - №2010150438/10; заявл. 08.12.2010; опубл. 20.05.2012, Бюл. №14. - 8 с.
10. Потапова А.А., Чеканова Т.А., Маркелов М.Л., Пудова Е.А., Кирдяшкина Н.П., Шипулин Г.А. и др. Верификационные возможности иммуночипов при выявлении в иммуноферментных тест-системах антител только к неструктурному протеину NS3 вируса гепатита С. Российский иммунологический журнал. 2012; 6 (15), 1:
11. Манзенюк И.Н., Шипулин Г.А., Алексеева Ю.А., Браславская С.И., Сперанская А.С., Чеканова Т.А. и др. Разработка иммуночипа для раздельной детекции антител к вирусу гепатита С. Клиническая лабораторная диагностика. 2008; 6: 25-30.
12. Чеканова Т.А., Маркелов М.Л., Манзенюк И.Н., Шипулин Г.А. Новый скрининговый и подтверждающий тест для серологической диагностики ВИЧ-инфекции в формате иммуночипа. Клиническая лабораторная диагностика. 2008; 9: 3.
13. Смердова М.А., Маркелов М.Л., Судьина А.Е., Шишова А.В., Гущин А.Е., Шипулин Г.А. Иммуночип для серодиагностики сифилиса. 2-й Всерос. Конгресс дерматовенерологов. С-Пб, 2007.
14. Смердова М. А., Маркелов М. Л., Манзенюк И. Н., Карань Л. С., Судьина А. Е., Шишова А. В. и др. Серологическая диагностика иксодового клещевого боррелиоза в новом формате иммуночипа. Клиническая лабораторная диагностика. 2008; 9: 4.
15. Чеканова Т.А., Пудова Е.А., Маркелов М.Л., Кирдяшкина Н.П., Гоптарь И.А., Шипулина О.Ю. и др. Разработка диагностической тест-системы в формате иммуночипа для серологической диагностики и мониторинга возбудителей внутриутробных инфекций, объединенных в группу TORCH. VII Всерос. Научно-практ. конф. с международным участием «Молекулярная диагностика 2010».
16. Пат. 2397178, Российская Федерация, МПК C07K 14/20, G01N 33/543, G01N 33/571. Диагностическая тест-система в формате иммуночипа и способ серологической дифференциальной диагностики сифилиса / Маркелов М.Л., Чеканова Т.А., Шипулин Г.А.; заявитель и патентообладатель Федеральное государственное учреждение науки "Центральный научно-исследовательский институт эпидемиологии" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека. Общество с ограниченной ответственностью «ИнтерЛабСервис». - 2009106931/13; заявл. 27.02.2009; опубл. 20.08.2010, Бюл. №23. - 21 с.: ил.
17. ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия. Введен 01.01.1977.
18. Пат. 2143280, Российская Федерация, МПК A61K 39/106. Способ получения O-антигена холерного очищенного / Громова О.В., Джапаридзе М.Н., Дятлов И.А., Елисеев Ю.Ю., Киреев М.Н., Космаенко О.М.; заявитель и патентообладатель Федеральное государственное учреждение Российский научно-исследовательский противочумный институт "Микроб" Министерства здравоохранения РФ. - 99110357/13; заявл. 26.05.1999; опубл. 27.12.1999.
19. Пат. 2456996, Российская Федерация, МПК A61K 39/00, C07K 14/28, C12P 21/00, C12R 1/6. Способ получения очищенной В-субъединицы холерного токсина из рекомбинантного штамма Vibrio cholerae I. Захарова Т.Л., Киреев М.Н., Ливанова Л.Ф., Заднова С.П., Смирнова Н.И.; заявитель и патентообладатель Федеральное государственное учреждение здравоохранения "Российский научно-исследовательский противочумный институт "Микроб" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека ("РосНИПЧИ "Микроб"). - 2011123073/10; заявл. 07.06.2011; опубл. 27.07.2012, Бюл. №21. -7 с.: ил.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПЛЕКСНАЯ ГЕНО- И ИММУНОДИАГНОСТИЧЕСКАЯ ТЕСТ-СИСТЕМА ДЛЯ ИДЕНТИФИКАЦИИ ХОЛЕРНЫХ ВИБРИОНОВ О1 И О139 СЕРОГРУПП И ОЦЕНКИ ИХ ВИРУЛЕНТНОСТИ | 2009 |
|
RU2404257C1 |
| АВИРУЛЕНТНЫЙ ШТАММ БАКТЕРИЙ Vibrio cholerae KM 263 БИОВАРА ЭЛЬТОР СЕРОВАРА ИНАБА - ПРОДУЦЕНТ ПРОТЕКТИВНОГО О1 АНТИГЕНА | 2010 |
|
RU2425867C1 |
| АВИРУЛЕНТНЫЙ ШТАММ БАКТЕРИЙ Vibrio cholerae КМ 262 БИОВАРА ЭЛЬТОР СЕРОВАРА ОГАВА - ПРОДУЦЕНТ ПРОТЕКТИВНОГО О1 АНТИГЕНА | 2010 |
|
RU2425868C1 |
| Штамм культивируемых гибридных клеток животных Mus. musculus - продуцент моноклональных антител к мембранному белку, общему для типичных и атипичных холерных вибрионов 01 серогруппы | 2022 |
|
RU2785463C1 |
| Способ профилактики холеры с использованием везикул для моделирования противохолерного иммунитета у экспериментальных животных | 2022 |
|
RU2792160C1 |
| Набор штаммов бактерий для обучения вопросам микробиологии и методам лабораторной диагностики холеры | 2019 |
|
RU2743454C1 |
| Способ получения моноклонального пероксидазного конъюгата для идентификации типичных и атипичных штаммов Vibrio cholerae O1, включая и R-варианты в дот-ИФА | 2022 |
|
RU2800470C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ Mus. musculus L - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К О-АНТИГЕНУ ХОЛЕРНЫХ ВИБРИОНОВ О1 СЕРОГРУППЫ | 2010 |
|
RU2425874C1 |
| ШТАММ БАКТЕРИЙ VIBRIO CHOLERAE 2414 КЛАССИЧЕСКОГО БИОВАРА СЕРОВАРА ОГАВА - ПРОДУЦЕНТ ХОЛЕРНОГО ТОКСИНА И ТОКСИНКОРЕГУЛИРУЕМЫХ ПИЛЕЙ АДГЕЗИИ | 2000 |
|
RU2169187C1 |
| ОРАЛЬНАЯ ХИМИЧЕСКАЯ ВАКЦИНА ПРОТИВ ХОЛЕРЫ | 2000 |
|
RU2159128C1 |

Изобретение относится к области медицины, в частности к клинической лабораторной диагностике. Предложен биологический микрочип для выявления и многопараметрического анализа противохолерных антител в сыворотке крови человека, содержащий массив дискретно нанесенных и иммобилизованных на поверхности подложки O-антигенов V. cholerae и холерного токсина, сгруппированных в отдельные зоны. Изобретение обеспечивает проведение параллельного иммунологического анализа нескольких образцов сыворотки крови человека на наличие противохолерных антител к широкому спектру антигенов возбудителя холеры с определением иммуноглобулинов класса G и M за короткое время. 2 з.п. ф-лы, 3 ил., 2 пр.
1. Биологический микрочип для выявления и многопараметрического анализа противохолерных антител в сыворотке крови человека, характеризующийся тем, что содержит массив дискретно нанесенных и иммобилизованных на поверхности подложки O-антигенов V. cholerae и холерного токсина, сгруппированных в отдельные зоны для проведения параллельного иммунологического анализа нескольких образцов.
2. Биологический микрочип по п.1, отличающийся тем, что подложка активирована альдегид-, эпокси- или аминогруппами.
3. Биологический микрочип по п.1, отличающийся тем, что на подложку наносят O-антигены V. cholerae O1 серогруппы сероваров Огава и Инаба и O139 серогруппы.
| Серологические методы в диагностике холеры | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Методические указания | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
Авторы
Даты
2014-09-10—Публикация
2013-06-25—Подача