ОБЛАСТЬ ТЕХНИКИ
[0001]
Настоящее изобретение относится к лекарственному средству для лечения или профилактики заболевания, в котором задействован Na канал, в частности, SCN9A (Nav 1.7), которое включает новое соединение, имеющее бензимидазольный скелет, или его фармацевтически приемлемую соль в качестве активного ингредиента. Более конкретно, оно относится к лекарственному средству для лечения или профилактики заболевания, такого как нейропатическая боль, ноцицептивная боль, воспалительная боль, нейропатия малых волокон, эритромелалгия, пароксизмальное экстремальное болевое расстройство, дизурия и рассеянный склероз.
УРОВЕНЬ ТЕХНИКИ
[0002]
Известно, что порообразующая α субъединица потенциал–зависимого Na канала включает в настоящее время 9 видов. Недавно было засвидетельствовано, что эта субъединица, в частности, Nav 1.7, широко задействованы в трансдукции сигналов острой и хронической боли.
[0003]
SCN9A (Nav 1.7) является тетродотоксин (TTX)–чувствительным Na каналом, локализованным в периферическом сенсорном нерве или симпатическом нерве, также упоминающимся как NENA или PN1. Физиологически канал Nav 1.7 функционирует, усиливая сигнал боли (т.е., генерируя генераторный потенциал) на конце сенсорного нерва. В области генных исследований было выявлено, что человек, чей ген SCN9A мутирует с потерей функции, демонстрирует врожденную нечувствительность к боли. Наоборот, было замечено, что у пациентов, страдающих тяжелым орфанным заболеванием, таким как эритромелалгия и пароксизмальное экстремальное болевое расстройство, ген SCN9A мутирует с усилением функции. Кроме того, сообщалось, что приблизительно у 30% пациентов, страдающих нейропатией малых волокон, имеется генетический полиморфизм с усилением функции Nav 1.7 (Непатентная Литература 1). И было предположено, что функция канала Nav 1.7 непосредственно задействована в повышенной возбудимости нейрона DRG у пациентов, страдающих от боли, поскольку уровень экспрессии и активность нейрона DRG возрастают в модели животных, страдающих от хронической боли, и нейропатическая боль и воспалительная боль уменьшаются в эксперименте с нокаутом (Непатентная Литература 2).
[0004]
В Патентной Литературе 1 раскрыто производное бензимидазола, представленное следующей формулой (A), но соединение имеет 2–(4–циклопропилпиридин–2–ил)амино)изоникотинонитрил в качестве существенной частичной структуры, отличающейся от соединения согласно настоящему изобретению. И изобретение, описанное в Патентной Литературе 1, направлено на ингибитор тирозин киназы Syk, таким образом, в Патентной Литературе 1 вообще не раскрыто настоящее изобретение.
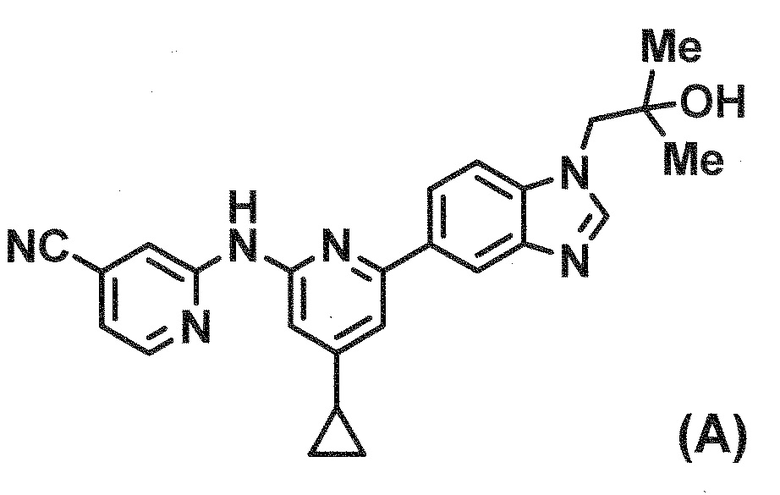
[0005]
В Патентной Литературе 2 раскрыто производное бензимидазола, представленное следующей формулой (B), которое относится к ингибиторам Nav 1.7, но это соединение имеет 2–(бензимидазол–1–ил)ацетамид в качестве существенной частичной структуры, отличающейся от соединения согласно настоящему изобретению.
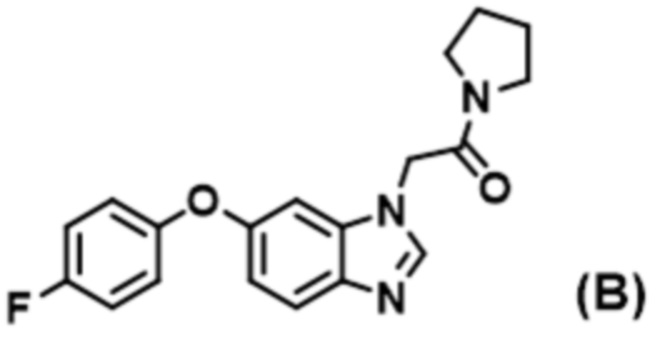
УРОВЕНЬ ТЕХНИКИ
[Патентная Литература]
[0006]
[Патентная литература 1] WO 2012/057262
[Патентная литература 2] WO 2016/117647
[Непатентная Литература]
[0007]
[Непатентная литература 1] Nat Rev Neurosci. 14: 49, 2013
[Непатентная литература 2] Nat Commun. 3: 791, 2012
Сущность изобретения
[0008]
(Техническая задача)
Цель настоящего изобретения может состоять в получении лекарственного средства для лечения или профилактики заболевания, в котором задействован Nav 1.7, в частности, такого как нейропатическая боль, ноцицептивная боль, воспалительная боль, нейропатия малых волокон, эритромелалгия, пароксизмальное экстремальное болевое расстройство, дизурия и рассеянный склероз.
[0009]
(Решение задачи)
Авторы настоящего изобретения провели интенсивные исследования в попытке решить вышеупомянутую задачу и обнаружили, что соединение, имеющее упомянутое ниже бензимидазольное кольцо, или его фармацевтически приемлемая соль может ингибировать изменение мембранного потенциала или сам ток ионов Na через Na канал в экспрессирующей ген Nav 1.7 клетка, т.е., это соединение или его фармацевтически приемлемая соль являются блокатором, имеющим ингибирующую активность в отношении Nav 1.7. Кроме того, авторы настоящего изобретения обнаружили, что это производное может быть использовано в качестве лекарственного средства для лечения или профилактики заболевания, такого как нейропатическая боль, ноцицептивная боль, воспалительная боль, нейропатия малых волокон, эритромелалгия и пароксизмальное экстремальное болевое расстройство, осуществив завершение настоящего изобретения. Соответственно, настоящее изобретение может обеспечить бензимидазольное соединение, представленное следующей формулой (I) (в дальнейшем также называемое «соединением, представленным формулой (I)» или «соединением формулы (I)»), или его фармацевтически приемлемую соль, или бензимидазольное соединение, представленное следующей формулой (I’) (в дальнейшем также называемое «соединением, представленным формулой (I’)» или «соединением формулы (I’)»), или его фармацевтически приемлемую соль (в дальнейшем также называемую «соединением согласно настоящему изобретению»).
[0010]
Настоящее изобретение может быть показано следующим образом.
(Пункт 1)
Соединение формулы (I):
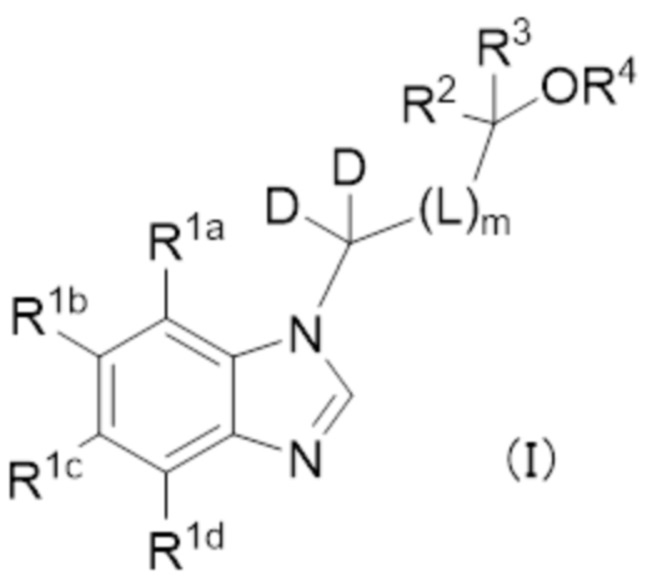
или его фармацевтически приемлемая соль, в которой
R1a, R1b, R1c, и R1d независимо обозначают водород, галоген, циано, C1–4 алкил, C1–4 алкокси, C1–4 алкиламино (причем алкил и алкильная группа в алкокси и алкиламино могут быть независимо замещены 1–5 заместителями, выбранными независимо из группы, состоящей из галогена, гидроксильной группы, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и 3–7–членного неароматического гетероциклила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В), C3–7 циклоалкил, C3–7 циклоалкокси, C3–7 циклоалкиламино (причем циклоалкил и циклоалкильная группа в циклоалкокси и циклоалкиламино могут быть независимо замещены 1–5 заместителями, выбранными независимо из группы, состоящей из галогена, гидроксильной группы, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В), C6–10 арил, C6–10 арилокси, 5–12–членный гетероарил, или 5–12–членный гетероарилокси (причем арил и арильная группа в арилокси и гетероарил и гетероарильная группа в гетероарилокси могут быть независимо замещены 1–5 заместителями, выбранными независимо из группы, состоящей из галогена, циано, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, 3–7–членного неароматического гетероциклила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C1–4 алкилтио, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, и C1–4 алкилсульфонила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A), при условии, что по меньшей мере один из R1a, R1b, R1c и R1d обозначает вышеупомянутый C6–10 арил, C6–10 арилокси, 5–12–членный гетероарил или 5–12–членный гетероарилокси,
R2 и R3 независимо обозначают водород, C1–6 алкил (который может быть независимо замещен 1–5 заместителями, выбранными независимо из группы, состоящей из циано, галогена, гидроксильной группы, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В) или C3–10 циклоалкил,
R4 обозначает водород, C1–6 алкил (который может быть замещен 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, гидроксильной группы, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и 3–7–членного неароматического гетероциклила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В) или C3–7 циклоалкил (который может быть независимо замещен 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, гидроксильной группы, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В),
m=0, 1 или 2,
L обозначает CR7R8 при условии, что, когда m равен 2, каждый CR7R8 независимо является тем же или отличающимся,
R7 и R8 независимо обозначают водород, гидроксильную группу, C1–4 алкил, C1–4 алкокси (причем алкил и алкильная группа в алкокси могут быть независимо замещены 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, гидроксильной группы, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и 3–7–членного неароматического гетероциклила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В), C3–7 циклоалкил или C3–7 циклоалкокси (причем циклоалкил и циклоалкильная группа в циклоалкокси могут быть независимо замещены 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, гидроксильной группы, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В), или
в R2, R3 и –OR4, R2 и R3 могут вместе с атомом углерода, к которому они присоединены, образовывать следующую группу формулы (II) с –OR4
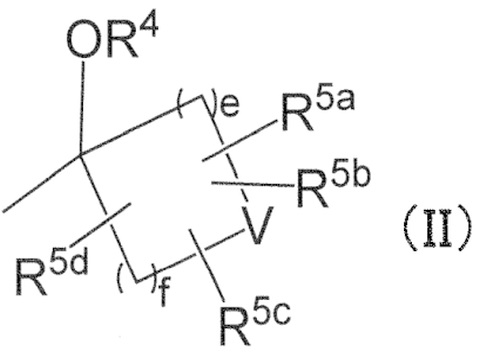
в формуле (II),
e и f независимо обозначают 1, 2 или 3,
R4 имеет определенное выше значение,
V обозначает простую связь или атом кислорода,
R5a, R5b, R5c, и R5d независимо обозначают водород, галоген, гидроксильную группу, C1–4 алкил или C1–4 алкокси, причем алкил и алкильная группа в алкокси могут быть независимо замещены 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, гидроксильной группы, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и 3–7–членного неароматического гетероциклила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В,
Группа заместителей A является независимо галогеном, гидроксильной группой, C1–4 алкокси, C3–7 циклоалкилом или C3–7 циклоалкокси,
Группа заместителей В является независимо галогеном, гидроксильной группой, C1–4 алкилом, C1–4 алкокси, C3–7 циклоалкилом или C3–7 циклоалкокси, и далее
любой 1–6 атомов водорода в соединении формулы (I) могут быть заменены атомами дейтерия.
[0011]
(Пункт 1–1)
Соединение формулы (I’):
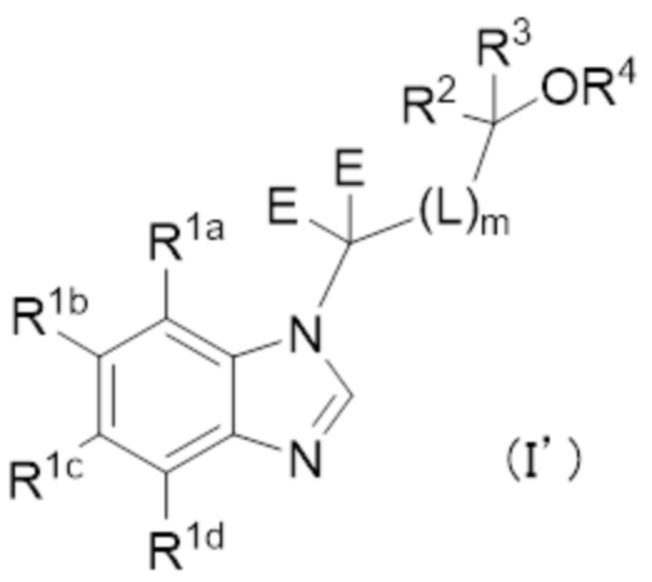
или его фармацевтически приемлемая соль, в которой
E обозначает водород,
R1a, R1b, R1c и R1d независимо обозначают водород, галоген, циано, C1–4 алкил, C1–4 алкокси, C1–4 алкиламино (причем алкил и алкильная группа в алкокси и алкиламино могут быть независимо замещены 1–5 заместителями, выбранными независимо из группы, состоящей из галогена, гидроксильной группы, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и 3–7–членного неароматического гетероциклила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В), C3–7 циклоалкил, C3–7 циклоалкокси, C3–7 циклоалкиламино (причем циклоалкил и циклоалкильная группа в циклоалкокси и циклоалкиламино могут быть независимо замещены 1–5 заместителями, выбранными независимо из группы, состоящей из галогена, гидроксильной группы, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В), C6–10 арил, C6–10 арилокси, 5–12–членный гетероарил или 5–12–членный гетероарилокси (причем арил и арильная группа в арилокси, и гетероарил и гетероарильная группа в гетероарилокси могут быть независимо замещены 1–5 заместителями, выбранными независимо из группы, состоящей из галогена, циано, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, 3–7–членного неароматического гетероциклила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C1–4 алкилтио, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, и C1–4 алкилсульфонила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A), при условии, что по меньшей мере один из R1a, R1b, R1c и R1d обозначает вышеупомянутый C6–10 арил, C6–10 арилокси, 5–12–членный гетероарил или 5–12–членный гетероарилокси,
R2 и R3 независимо обозначают водород, C1–6 алкил (который может быть независимо замещен 1–5 заместителями, выбранными независимо из группы, состоящей из циано, галогена, гидроксильной группы, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В) или C3–10 циклоалкил,
R4 обозначает водород, C1–6 алкил (который может быть замещен 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, гидроксильной группы, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и 3–7–членного неароматического гетероциклила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В) или C3–7 циклоалкил (который может быть независимо замещен 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, гидроксильной группы, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В),
m=0, 1 или 2,
L обозначает CR7R8 при условии, что, когда m равняется 2, каждый CR7R8 независимо является тем же или отличающимся,
R7 и R8 независимо обозначают водород, гидроксильную группу, C1–4 алкил, C1–4 алкокси (причем алкил и алкильная группа в алкокси могут быть независимо замещены 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, гидроксильной группы, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и 3–7–членного неароматического гетероциклила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В), C3–7 циклоалкила или C3–7 циклоалкокси (причем циклоалкил и циклоалкильная группа в циклоалкокси могут быть независимо замещены 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, гидроксильной группы, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В), или
в R2, R3 и –OR4, R2 и R3 могут вместе с атомом углерода, к которому они присоединены, образовывать следующую группу формулы (II) с –OR4

в формуле (II),
e и f независимо обозначают 1, 2 или 3,
R4 имеет определенное выше значение,
V обозначает простую связь или атом кислорода,
R5a, R5b, R5c и R5d независимо обозначают водород, галоген, гидроксильную группу, C1–4 алкил или C1–4 алкокси, причем алкил и алкильная группа в алкокси могут быть независимо замещены 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, гидроксильной группы, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и 3–7–членного неароматического гетероциклила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В,
Группа заместителей A является независимо галогеном, гидроксильной группой, C1–4 алкокси, C3–7 циклоалкилом или C3–7 циклоалкокси,
Группа заместителей В является независимо галогеном, гидроксильной группой, C1–4 алкилом, C1–4 алкокси, C3–7 циклоалкилом или C3–7 циклоалкокси, при условии, что
любой 1–8 атомов водорода в соединении формулы (I’) заменены атомами дейтерия.
[0012]
(Пункт 1–2)
Соединение по Пункту 1 или Пункту 1–1 или его фармацевтически приемлемая соль, при условии, что следующие соединения, имеющие атом дейтерия вместо определенного ранее атома водорода, исключены:
6–[6–хлор–2–(морфолин–4–ил)пиримидин–4–ил]–1–(2–метоксиэтил)–1H–бензимидазол,
2–[5–(3,5–диметил–1,2–оксазол–4–ил)–1H–бензимидазол–1–ил]этанол,
2–{5–[5–(тетрагидрофуран–3–ил)–4H–1,2,4–триазол–3–ил]–1H–бензимидазол–1–ил}этанол,
2–{5–[3–(2–метоксиэтил)–1–(2,2,2–трифтороэтил)–1H–1,2,4–триазол–5–ил]–1H–бензимидазол–1–ил}этанол,
2–{5–[3–метил–1–(1–метилпиперидин–4–ил)–1H–1,2,4–триазол–5–ил]–1H–бензимидазол–1–ил}этанол,
2–бутил–6–[1–(2–гидроксиэтил)–1H–бензимидазол–6–ил]–3,4–дигидропирроло[1,2–a]пиразин–1(2H)–он,
6–[1–(2–гидроксиэтил)–1H–бензимидазол–6–ил]–2–(3–метилбутил)–3,4–дигидропирроло[1,2–a]пиразин–1(2H)–он,
2–{5–[1–(2–гидроксиэтил)–1H–бензимидазол–5–ил]–1H–1,2,4–триазол–1–ил}этанол,
6–(2–хлорфенил)–1–(2–гидроксиэтил)–1H–бензимидазол–7–карбонитрил,
2–хлор–6–{7–фтор–1–[(1S,3S)–3–метоксициклогексил]–1H–бензимидазол–5–ил}–9–(тетрагидро–2H–пиран–2–ил)–9H–пурин, и
2–{5–[2–(тетрагидрофуран–3–ил)–1H–имидазол–1–ил]–1H–бензимидазол–1–ил}этанол.
[0013]
(Пункт 2)
Соединение по Пункту 1 или его фармацевтически приемлемая соль, в которых
R1a, R1b, R1c и R1d независимо обозначают водород, галоген, циано, C1–4 алкил, C1–4 алкокси (причем алкил и алкильная группа в алкокси могут быть независимо замещены 1–3 одинаковыми или разными атомами галогена), C6–10 арил, C6–10 арилокси, 5–12–членный гетероарил или 5–12–членный гетероарилокси (причем арил и арильная группа в арилокси и гетероарил и гетероарильная группа в гетероарилокси могут быть независимо замещены 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, циано, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, и C1–4 алкилсульфонила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A).
[0014]
(Пункт 3)
Соединение по Пункту 1 или 2 или его фармацевтически приемлемая соль, в которых
R1a, R1b, R1c и R1d независимо обозначают водород, C6–10 арил, C6–10 арилокси, 5–12–членный гетероарил или 5–12–членный гетероарилокси, причем арил и арильная группа в арилокси и гетероарил и гетероарильная группа в гетероарилокси могут быть независимо замещены 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, и C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A.
[0015]
(Пункт 4)
Соединение по любому из Пунктов 1–3 или его фармацевтически приемлемая соль, в которых R1a и R1d обозначают водород.
[0016]
(Пункт 5)
Соединение по любому из Пунктов 1–4 или его фармацевтически приемлемая соль, в которых
R1b или R1c обозначают C6–10 арил, C6–10 арилокси, 5–12–членный гетероарил или 5–12–членный гетероарилокси (причем арил и арильная группа в арилокси и гетероарил и гетероарильная группа в гетероарилокси могут быть независимо замещены 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, и C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A).
[0017]
(Пункт 6)
Соединение по любому из Пунктов 1–5 или его фармацевтически приемлемая соль, в которых R1a, R1c и R1d обозначают водород.
[0018]
(Пункт 7)
Соединение по любому из Пунктов 1–6 или его фармацевтически приемлемая соль, в которых
R1b обозначает C6–10 арил, C6–10 арилокси, 5–12–членный гетероарил или 5–12–членный гетероарилокси (причем арил и арильная группа в арилокси и гетероарил и гетероарильная группа в гетероарилокси могут быть независимо замещены 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, и C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A).
[0019]
(Пункт 8)
Соединение по любому из Пунктов 1–7 или его фармацевтически приемлемая соль, в которых
R2 и R3 независимо обозначают водород или C1–6 алкил, который может быть независимо замещен 1–5 заместителями, выбранными независимо из группы, состоящей из циано, галогена, гидроксильной группы и C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, при уловии, что оба из R2 и R3 не обозначают водород, или
R2 и R3 может вместе с атомом углерода, к которому они присоединены, образовывать следующую группу формулы (IIa) с –OR4
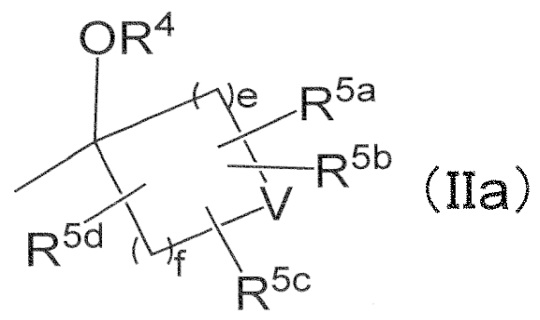
в формуле (IIa),
e и f независимо обозначают 1 или 2,
R4 и V имеют значения, определенные в Пункте 1, и
R5a, R5b, R5c, и R5d независимо обозначают водород или галоген.
[0020]
(Пункт 9)
Соединение по любому из Пунктов 1–8 или его фармацевтически приемлемая соль, в которых
R2 и R3 независимо обозначают C1–6 алкил, в случае необходимости замещенный 1–5 одинаковыми или разными атомами галогена, или
R2 и R3 могут вместе с атомом углерода, к которому они присоединены, образовывать следующую группу формулы (IIb) с –OR4
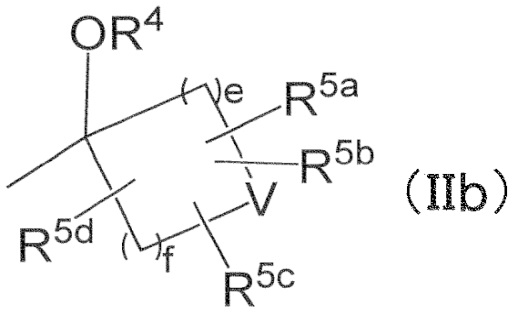
в формуле (IIb),
e и f обозначают 1,
R4 обозначает водород,
V обозначает атом кислорода,
R5a, R5b, R5c, и R5d независимо обозначают водород или галоген.
[0021]
(Пункт 10)
Соединение по любому из Пунктов 1–9 или его фармацевтически приемлемая соль, в которых
R2 и R3 независимо обозначают водород или C1–6 алкил, в случае необходимости замещенный 1–5 одинаковыми или разными атомами галогена, и R2 и R3 вместе с атомом углерода, к которому они присоединены, не образуют кольцо.
[0022]
(Пункт 11)
Соединение по любому из Пунктов 1–9 или его фармацевтически приемлемая соль, в которых
R2 и R3 могут вместе с атомом углерода, к которому они присоединены, образовывать следующую группу формулы (IIb) с –OR4

в формуле (IIb),
e и f обозначают 1,
R4 обозначает водород,
V обозначает атом кислорода,
R5a, R5b, R5c и R5d независимо обозначают водород или галоген.
[0023]
(Пункт 12)
Соединение по любому из Пунктов 1–11 или его фармацевтически приемлемая соль, в которых
R4 обозначает водород, C1–4 алкил, в случае необходимости замещенный 1–3 одинаковыми или разными атомами галогена, или C3–7 циклоалкил, который может быть замещен 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, гидроксильной группы и C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A.
[0024]
(Пункт 13)
Соединение по любому из Пунктов 1–12 или его фармацевтически приемлемая соль, в которых R4 обозначает водород.
[0025]
(Пункт 14)
Соединение по любому из Пунктов 1–13 или его фармацевтически приемлемая соль, в которых
R7 и R8 независимо обозначают водород или C1–4 алкил, который может быть замещен 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, гидроксильной группы, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и 3–7–членного неароматического гетероциклила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и
m=0 или 1.
[0026]
(Пункт 15)
Соединение по любому из Пунктов 1–14 или его фармацевтически приемлемая соль, в которых R7 и R8 обозначают водород, и m=0 или 1.
[0027]
(Пункт 16)
Соединение по Пункту 1 или его фармацевтически приемлемая соль, выбранные из следующих соединений:
Пример 1: 6–(4–фторфенокси)–1H–бензимидазол–1–ил]–2–метил(1,1–2H2)пропан–2–ол,
Пример 2: 2–метил–1–(6–{[5–(трифторметил)пиридин–2–ил]окси}–1H–бензимидазол–1–ил)(1,1–2H2)пропан–2–ол,
Пример 3: 4–[6–(4–хлорфенокси)–1H–бензимидазол–1–ил]–2–метил(4,4–2H2)бутан–2–ол,
Пример 4: 3–[{6–[4–(трифторметокси)фенокси]–1H–бензимидазол–1–ил}(2H2)метил]оксетан–3–ол, и
Пример 5: 3–[{6–[2–метокси–4–(трифторметил)фенил]–1H–бензимидазол–1–ил}(2H2)метил]оксетан–3–ол.
[0028]
(Пункт 17)
Соединение по Пункту 1 или его фармацевтически приемлемая соль, выбранные из следующих соединений:
Пример 1: 6–(4–фторфенокси)–1H–бензимидазол–1–ил]–2–метил(1,1–2H2)пропан–2–ол,
Пример 2: 2–метил–1–(6–{[5–(трифторметил)пиридин–2–ил]окси}–1H–бензимидазол–1–ил)(1,1–2H2)пропан–2–ол, и
Пример 3: 4–[6–(4–хлорфенокси)–1H–бензимидазол–1–ил]–2–метил(4,4–2H2)бутан–2–ол.
[0029]
(Пункт 18)
Соединение по Пункту 1 или его фармацевтически приемлемая соль, выбранные из следующих соединений:
Пример 4: 3–[{6–[4–(трифторметокси)фенокси]–1H–бензимидазол–1–ил}(2H2)метил]оксетан–3–ол, и
Пример 5: 3–[{6–[2–метокси–4–(трифторметил)фенил]–1H–бензимидазол–1–ил}(2H2)метил]оксетан–3–ол.
[0030]
(Пункт 19)
Фармацевтическая комбинация, включающая Соединение по любому из Пунктов 1–18 или его фармацевтически приемлемую соль.
[0031]
(Пункт 20)
Лекарственное средство для лечения заболевания, задействующего Nav 1.7 (SCN9A), включающее Соединение по любому из Пунктов 1–18 или его фармацевтически приемлемую соль в качестве активного ингредиента.
[0032]
(Пункт 21)
Лекарственное средство для лечения нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии малых волокон, эритромелалгии, пароксизмального экстремального болевого расстройства, дизурии или рассеянного склероза, включающее Соединение по любому из Пунктов 1–18 или его фармацевтически приемлемую соль в качестве активного ингредиента.
[0033]
(Пункт 22)
Фармацевтическая комбинация, включающая Соединение по любому из Пунктов 1–18 или его фармацевтически приемлемую соль и по меньшей мере одно лекарственное средство, выбранное из группы, состоящей из противоэпилептического средства, антидепрессанта, наркотического анальгетика, противовоспалительного средства, ингибитора редуктазы и лекарственного средства, являющегося производным простагландина.
[0034]
(Пункт 23)
Применение соединения по любому из Пунктов 1–18 или его фармацевтически приемлемой соли в получении лекарственного средства для лечения нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии малых волокон, эритромелалгии, пароксизмального экстремального болевого расстройства, дизурии или рассеянного склероза.
[0035]
(Пункт 24)
Способ лечения нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии малых волокон, эритромелалгии, пароксизмального экстремального болевого расстройства, дизурии или рассеянного склероза, включающий введение терапевтически эффективного количества соединения по любому из Пунктов 1–18 или его фармацевтически приемлемой соли нуждающемуся в этом млекопитающему.
[0036]
(Пункт 25)
Варианты осуществления по Пунктам 2–24, в которых соединения, определенные в Пунктах 2–24, не включают соединения, исключенные в Пункте 1–2.
[0037]
(Эффект Изобретения)
Настоящее изобретение относится к блокатору Nav 1.7, включающему новое бензимидазольное соединение или его фармацевтически приемлемую соль. Соединения согласно настоящему изобретению могут быть использованы в качестве лекарственного средства для лечения или профилактики заболевания, задействующего Nav 1.7 (SCN9A), а именно, эти соединения применимы к пациенту, страдающему от нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии малых волокон, эритромелалгии, пароксизмального экстремального болевого расстройства и т.п. Кроме того, настоящее изобретение обеспечивает превосходное метаболически стабильное соединение путем введения атома дейтерия в определенном положении(ях) соединения.
Описание вариантов осуществления
[0038]
В дальнейшем настоящее изобретение объясняется подробно. В описании число атомов углерода в определении «заместителей» может указывать, например, «C1–6». Конкретное определение «C1–6 алкил» означает алкильную группу, имеющую от 1 до 6 атомов углерода. В настоящем описании группа заместителя, не сопровождающаяся словами «в случае необходимости замещенный» или «замещенный», подразумевает «незамещенную» группу заместителя. Например, «C1–6 алкил» означает «незамещенный C1–6 алкил».
[0039]
Группы заместителей в настоящем описании могут иногда быть выражены без термина «группа». В случае, если «в случае необходимости замещенный» используется в определении групп заместителя, число замещающих групп не ограничено, при условии, что замещения доступны, т.е., это один или более. Это означает, что возможное число замещающих групп является доступным для замещения числом на атомах углерода или атомах углерода–азота в группе заместителя, которые приемлемы для замещения. Если не указано иное, определение каждой группы заместителей также распространяется на случай частичного включения группы заместителя или случай группы заместителей, замещающей другую группу заместителя.
[0040]
Если не указано иное, связывающий участок групп заместителя не ограничен, при условии, что этот сайт доступен для связывания.
[0041]
«Галоген» включает, например, фтор, хлор, бром и йод, предпочтительно фтор и хлор.
[0042]
«C1–2 алкил» означает группу насыщенного углеводорода, имеющую 1–2 атома углерода, «C1–3 алкил» означает насыщенную углеводородную группу с прямой или разветвленной цепью, имеющую 1–3 атома углерода, «C1–4 алкил» означает насыщенную углеводородную группу с прямой или разветвленной цепью, имеющую 1–4 атома углерода, и «C1–6 алкил» означает насыщенную углеводородную группу с прямой или разветвленной цепью, имеющую 1–6 атомов углерода. «C1–2 алкил» включает, например, метил и этил; «C1–3 алкил» включает, например, пропил и изопропил, помимо вышеупомянутого алкила; «C1–4 алкил» включает, например, бутил, изобутил, втор–бутил и трет–бутил, помимо вышеупомянутого алкила; и «C1–6 алкил» включает, например, пентил, изопентил, неопентил, 1–этилпропил, гексил и его структурный изомер, помимо вышеупомянутого алкила. Предпочтительные примеры «C1–6 алкила» или «C1–4 алкила» включают «C1–3 алкил», и более предпочтительно метил и этил.
[0043]
«C3–7 циклоалкил» означает неароматическую циклическую углеводородную группу (т.е., насыщенную углеводородную группу и частично ненасыщенную углеводородную группу), имеющую от 3 до 7 атомов углерода, и «C3–10 циклоалкил» означает неароматическую циклическую углеводородную группу (т.е., насыщенную углеводородную группу и частично ненасыщенную углеводородную группу), имеющую от 3 до 10 атомов углерода. «C3–7 циклоалкил» и «C3–10 циклоалкил» также включают соединенный мостиковой связью. «C3–7 циклоалкил» включает, например, циклопропил, циклобутил, циклопентил, циклогексил, циклопентенил, циклогексенил и циклогептил. «C3–10 циклоалкил» включает, например, циклооктил и адамантил, помимо вышеупомянутого, предпочтительно, «C3–7 циклоалкил».
[0044]
«C3–7 циклоалкил» и «C3–10 циклоалкил» также включают бициклическое конденсированное кольцо, в котором «C3–7 циклоалкил» и «C3–10 циклоалкил» конденсированы с бензолом или 5– или 6–членным кольцом, имеющим один гетероатом, выбранным из атома азота, серы или кислорода, или два или более (например, от 2 до 4) одинаковых или разных гетероатомов (например, «5– или 6–членный моноциклический гетероарил», упомянутый ниже, и 5– или 6–членное кольцо в «3–7–членном неароматическом гетероциклиле», упомянутом ниже), соответственно. Примеры бициклического конденсированного кольца включают группы следующих формул.
[0045]
«C6–10 арил», используемый здесь, означает ароматическую углеводородную группу, имеющую от 6 до 10 атомов углерода, предпочтительно фенил. «C6–10 арил» включает, например, фенил, 1–нафтил и 2–нафтил.
[0046]
«C6–10 арил» также включает конденсированное кольцо, в котором «фенил» конденсирован с 5– или 6–членным кольцом, имеющим один гетероатом, выбранный из атома азота, серы или кислорода, или два или более (например, от 2 до 4) одинаковых или разных гетероатомов (например, «5– или 6–членный моноциклический гетероарил», упомянутый ниже, и 5– или 6–членный кольцо в «3–7–членном неароматическом гетероциклиле», упомянутом ниже), или 5–7–членное циклоалкильное кольцо (например, циклопентан, циклогексан и циклогептан). Примеры конденсированного кольца включают группы следующих формул.
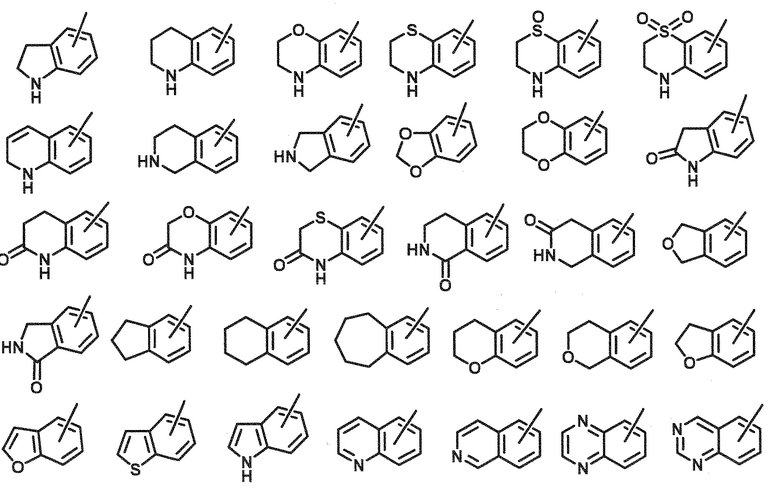
[0047]
«5–12–членный гетероарил» означает 5–12–членный моно– или поли–циклический ароматический радикал, имеющий один гетероатом, выбранный из атома азота, серы или кислорода, или два или более (например, от 2 до 4) одинаковых или разных гетероатомов, помимо атомов углерода, в качестве кольцевых атомов, предпочтительно, «5–или 6–членный моноциклический гетероарил». «5– или 6–членный моноциклический гетероарил» означает 5– или 6–членный моноциклический ароматический радикал в «5–12–членном гетероариле».
[0048]
Мульти–циклический гетероарил в «5–12–членном гетероариле» включает, например, конденсированное кольцо, в котором два одинаковых или разных моноциклических гетероарилов конденсированы, или моноциклический гетероарил и ароматическое кольцо (например, бензол) или неароматическое кольцо (например, циклогексан) конденсированы.
«5–12–членный гетероарил» включают, например, группы формул, показанных ниже. Предпочтительно, «5–12–членный гетероарил» включают пиразолил, имидазолил, пиридил, пиримидинил, пиразинил и пиридазинил. Другой вариант осуществления включает, предпочтительно, бензофуранил, в котором связывающий участок находится на гетероарильном (фуран) кольце, пиридил, пиримидинил, пиразинил и пиридазинил. Примеры «5– или 6–членного моноциклического гетероарила» включают моноциклические группы из групп следующих формул.
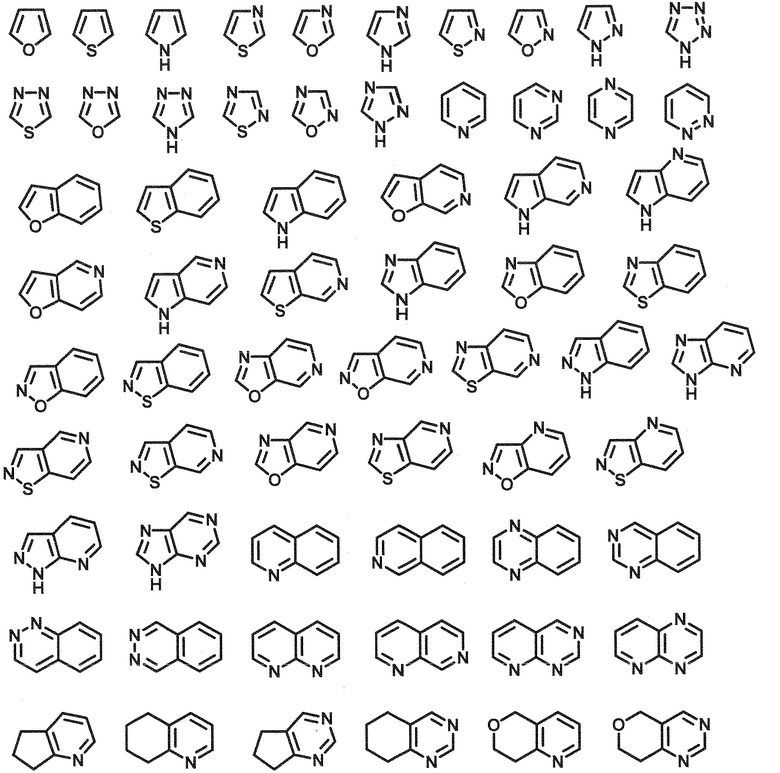
[0049]
«3–7–членный неароматический гетероциклил» означает 3–7–членную циклическую группу, имеющую один гетероатом, выбранный из атома азота, кислорода или серы, или два или более (например, от 2 до 4, предпочтительно от 2 до 3) одинаковых или разных гетероатомов, помимо атомов углерода, в качестве кольцевых атомов. Гетероциклил является неароматическим, который может быть насыщенным или частично ненасыщенным. Предпочтительным является насыщенный гетероциклил, более предпочтительно 5– или 6–членный насыщенный гетероциклил. «3–7–членный неароматический гетероциклил» включает, например, оксетанил, азетидинил, пиранил, тетрагидрофурил, пирролидинил, пиразолидинил, имидазолидинил, пиперидинил, морфолинил, тиоморфолинил, диоксотиоморфолинил, гексаметилениминил, оксазолидинил, тиазолидинил, имидазолидинил, оксоимидазолидинил, диоксоимидазолидинил, оксо–оксазолидинил, диоксо–оксазолидинил, диоксотиазолидинил, тетрагидропиранил и тетрагидропиридинил, и предпочтительно пиранил, тетрагидрофурил, пирролидинил, пиперидинил и морфолинил.
[0050]
«3–7–членный неароматический гетероциклил» также включает конденсированное кольцо, в котором 3–7–членный неароматический гетероциклил конденсирован с бензолом или 6–членным гетероарилом (например, пиридином, пиримидином или пиридазином). Примеры этого включают дигидроиндолил, дигидроизоиндолил, дигидропуринил, дигидротиазолoпиримидинил, дигидробензодиоксанил, изоиндолинил, индазолил, пирролопиридинил, тетрагидрохинолинил, декагидрохинолинил, тетрагидроизохинолинил, декагидроизохинолинил, тетрагидронафтиридинил и тетрагидропиридоазепинил.
[0051]
«C1–2 алкокси» означает оксигруппу, замещенную вышеупомянутым «C1–2 алкилом», и «C1–4 алкокси» означает оксигруппу, замещенную вышеупомянутым «C1–4 алкилом». «C1–2 алкокси» включает, например, метокси и этокси, и «C1–4 алкокси» включает, например, пропокси, изопропокси, бутокси, изобутокси, втор–бутокси и трет–бутокси, помимо вышеупомянутых примеров. Предпочтительно, «C1–4 алкокси» включает метокси, этокси и изопропокси.
[0052]
«C3–7 циклоалкокси» означает оксигруппу, замещенную вышеупомянутым «C3–7 циклоалкилом». «C3–7 циклоалкокси» включает, например, циклопропилокси, циклобутилокси, циклопентилокси и циклогексилокси, и предпочтительно циклогексилокси. «C5–6 циклоалкокси» означает циклоалкокси, имеющий 5 или 6 атомов углерода в «C3–7 циклоалкокси».
[0053]
«C6–10 арилокси» означает оксигруппу, замещенную вышеупомянутым «C6–10 арилом». «C6–10 арилокси» включает, например, фенилокси и нафтилокси, и предпочтительно фенилокси.
[0054]
«5–12–членный гетероарилокси» означают оксигруппу, замещенную вышеупомянутым «5–12–членным гетероарилом». «5–12–членный гетероарилокси» включают, например, пиридилокси, имидазолилокси и фурилокси, и предпочтительно пиридилокси.
[0055]
«C1–4 алкиламино» означает аминогруппу, замещенную одним или двумя из вышеупомянутого «C1–4 алкила». «C1–4 алкиламино» включает, например, метиламино, этиламино, пропиламино, изопропиламино, бутиламино, изобутиламино, диметиламино, диэтиламино и этилметиламино, и предпочтительно метиламино и диметиламино.
[0056]
«C3–7 циклоалкиламино» означает аминогруппу, замещенную одним или двумя из вышеупомянутого «C3–7 циклоалкила». «C3–7 циклоалкиламино» включает, например, циклопропиламино, циклобутиламино, циклопентиламино, циклогексиламино и дициклопропиламино, и предпочтительно циклогексиламино.
[0057]
«C1–4 алкилсульфонил» означает сульфонильную группу, замещенную вышеупомянутым «C1–4 алкилом». «C1–4 алкилсульфонил» включает, например, метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил и бутилсульфонил, и предпочтительно метилсульфонил.
[0058]
«C1–4 алкилтио» означает тиогруппу, замещенную вышеупомянутым «C1–4 алкилом». «C1–4 алкилтио» включает, например, метилтио, этилтио, пропилтио, изопропилтио и бутилтио, и предпочтительно метилтио.
[0059]
«Любой 1–6 атомов водорода в соединении формулы (I) могут быть заменены атомами дейтерия», или «любой 1–8 атомов водорода в соединении формулы (I’) заменены атомами дейтерия», означает, что атомы водорода в соединении формулы (I) или (I’) заменены атомами дейтерия, а также атомы водорода в вышеупомянутом C1–6 алкиле, C1–6 алкокси, C3–7 циклоалкиле, C3–7 циклоалкокси, 3–7–членном неароматическом гетероциклиле, C6–10 ариле, C6–10 арилокси, 5–12–членном гетероариле, 5–12–членном гетероарилокси, C1–4 алкилтио или C1–4 алкилсульфониле заменены атомами дейтерия. Например, это включает (2H3)метил, (2H5)этил, (2H3)метокси, (2H5)фенил, (2H5)фенокси и т.д.
[0060]
Для более подробного раскрытия соединения по изобретению вышеупомянутой формулы (I) или (I’), каждый символ, использованный в формуле (I) или (I’), дополнительно объясняется ниже посредством предпочтительных примеров.
[0061]
В варианте осуществления, R1a, R1b, R1c и R1d независимо обозначают водород, дейтерий, галоген, циано, C1–4 алкил, C1–4 алкокси, C1–4 алкиламино (причем алкил и алкильная группа в алкокси и алкиламино могут быть независимо замещены 1–3 заместителями, выбранными независимо из группы, состоящей из дейтерия, галогена, гидроксильной группы, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и 3–7–членного неароматического гетероциклила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В), C3–7 циклоалкил, C3–7 циклоалкокси, C3–7 циклоалкиламино (причем циклоалкил и циклоалкильная группа в циклоалкокси и циклоалкиламино могут быть независимо замещены 1–3 заместителями, выбранными независимо из группы, состоящей из дейтерия, галогена, гидроксильной группы, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В), C6–10 арил, C6–10 арилокси, 5–12–членный гетероарил или 5–12–членный гетероарилокси (причем арил и арильная группа в арилокси и гетероарил и гетероарильная группа в гетероарилокси могут быть независимо замещены 1–3 заместителями, выбранными независимо из группы, состоящей из дейтерия, галогена, циано, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A и дейтерия, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A и дейтерия, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В и дейтерия, C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В и дейтерия, 3–7–членного неароматического гетероциклила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В и дейтерия, C1–4 алкилтио, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A и дейтерия, и C1–4 алкилсульфонила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A и дейтерия). При условии, что по меньшей мере один из R1a, R1b, R1c и R1d обозначает вышеупомянутый C6–10 арил, C6–10 арилокси, 5–12–членный гетероарил или 5–12–членный гетероарилокси.
[0062]
В другом варианте осуществления, R1a, R1b, R1c и R1d независимо обозначают водород, галоген, циано, C1–4 алкил, C1–4 алкокси (причем алкил и алкильная группа в алкокси могут быть независимо замещены 1–3 одинаковыми или разными атомами галогена), C6–10 арил, C6–10 арилокси, 5–12–членный гетероарил или 5–12–членный гетероарилокси (причем арил и арильная группа в арилокси и гетероарил и гетероарильная группа в гетероарилокси могут быть независимо замещены 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, циано, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, и C1–4 алкилсульфонила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A). При условии, что по меньшей мере один из R1a, R1b, R1c и R1d обозначает вышеупомянутый C6–10 арил, C6–10 арилокси, 5–12–членный гетероарил или 5–12–членный гетероарилокси.
[0063]
В другом варианте осуществления среди R1a, R1b, R1c и R1d, R1a и R1d обозначают водород; и R1b и R1c независимо обозначают водород, C6–10 арил, C6–10 арилокси, 5–12–членный гетероарил или 5–12–членный гетероарилокси (причем арил и арильная группа в арилокси и гетероарил и гетероарильная группа в гетероарилокси могут быть независимо замещены 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, и C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A). При условии, что оба из R1b и R1c не обозначают водород.
[0064]
В другом варианте осуществления среди R1a, R1b, R1c и R1d, R1a и R1d обозначают водород; и любой из R1b и R1c обозначает C6–10 арил, C6–10 арилокси, 5–12–членный гетероарил или 5–12–членный гетероарилокси (причем арил и арильная группа в арилокси и гетероарил и гетероарильная группа в гетероарилокси могут быть независимо замещены 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, и C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A), и другой является водородом.
[0065]
В другом варианте осуществления среди R1a, R1b, R1c и R1d, R1a, R1c и R1d обозначают водород, и R1b обозначает C6–10 арил, C6–10 арилокси, 5–12–членный гетероарил или 5–12–членный гетероарилокси (причем арил и арильная группа в арилокси и гетероарил и гетероарильная группа в гетероарилокси могут быть независимо замещены 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, и C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A).
[0066]
Предпочтительные примеры R1a, R1b, R1c и R1d включают водород, дейтерий, фтор, хлор, метил, (2H3)метил, этил, (2H5)этил, изопропил, изобутил, циклопропил, циклопентил, циклогексил, метокси, (2H3)метокси, этокси, фенил, (2H5)фенил, 2–фторфенил, 3–фторфенил, 4–фторфенил, 4–(трифторметил)фенил, 4–(трифторметил)–(2,3,5,6–2H4)фенил, 5–(трифторметил)пиридин–2–ил, фенокси, (2H5)фенокси, 3–фторфенокси, 4–фторфенокси, 3,4–дифторфенокси, 3,5–дифторфенокси, 4–хлорфенокси, 4–метилфенокси, 4–(трифторметил)фенокси, 4–метоксифенокси, 4–(трифторметокси)фенокси, 4–цианофенокси, 4–(метилсульфонил)фенокси, (5–метилпиридин–2–ил)окси, (5–(трифторметил)пиридин–2–ил)окси, (5–фторпиридин–2–ил)окси, 2–метокси–4–(трифторметил)фенил, 2–фтор–4–(трифторметил)фенил, 2–хлор–4–(трифторметил)фенил, 4–(трифторметокси)фенил, (5–хлорпиридин–2–ил)окси, 2,4–дихлорфенил, 2–хлор–4–фторфенокси, 4–хлор–2–фторфенокси и 2,4–дихлорфенокси.
[0067]
Более предпочтительные примеры R1a, R1b, R1c и R1d включают водород, фтор, 4–(трифторметил)фенил, 5–(трифторметил)пиридин–2–ил, 3–фторфенокси, 4–фторфенокси, 4–хлорфенокси, 4–метилфенокси, 4–(трифторметил)фенокси, 4–(трифторметокси)фенокси, (5–метилпиридин–2–ил)окси, (5–(трифторметил)пиридин–2–ил)окси, 2–метокси–4–(трифторметил)фенил, 4–(трифторметокси)фенил и (5–хлорпиридин–2–ил)окси.
[0068]
Еще более предпочтительные примеры R1a, R1b, R1c и R1d включают водород, 4–(трифторметил)фенил, 5–(трифторметил)пиридин–2–ил, 4–фторфенокси, 4–хлорфенокси, 4–(трифторметил)фенокси, 4–(трифторметокси)фенокси, (5–(трифторметил)пиридин–2–ил)окси, 2–метокси–4–(трифторметил)фенил, 4–(трифторметокси)фенил и (5–хлорпиридин–2–ил)окси.
[0069]
В качестве предпочтительной комбинации R1a, R1b, R1c и R1d; R1a, R1c и R1d обозначают водород; R1b обозначает 4–(трифторметил)фенил, 5–(трифторметил)пиридин–2–ил, 4–фторфенокси, 4–хлорфенокси, 4–(трифторметил)фенокси, 4–(трифторметокси)фенокси, (5–(трифторметил)пиридин–2–ил)окси, 2–метокси–4–(трифторметил)фенил, 4–(трифторметокси)фенил или (5–хлорпиридин–2–ил)окси.
[0070]
Предпочтительно, R2 и R3 независимо обозначают водород, дейтерий или C1–6 алкил, который может быть независимо замещен 1–5 заместителями, выбранными независимо из группы, состоящей из дейтерия, циано, галогена, гидроксильной группы и C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A; предпочтительно водород или C1–6 алкил, в случае необходимости замещенный 1–5 атомами галогена.
[0071]
Предпочтительно, R2 и R3 обозначают, например, водород, дейтерий, метил, (2H3)метил, этил, (2H5)этил, изопропил, изобутил, трифторметил, циклопропил, циклопентил и циклогексил; более предпочтительно водород, метил и этил.
[0072]
Кроме того, в другом предпочтительном варианте осуществления, R2 и R3 включает следующую группу формулы (II) с –OR4, которая формируется путем комбинации вместе R2 и R3 с атомом углерода, к которому они присоединены, с образованием кольца.

[0073]
В указанной формуле (II),
предпочтительно, e и f независимо обозначают 1 или 2,
предпочтительно, V обозначает простую связь или атом кислорода.
[0074]
Предпочтительно, R5a, R5b, R5c и R5d независимо обозначают водород или галоген.
[0075]
Предпочтительно, R4 включает водород, дейтерий, C1–4 алкил (который может быть замещен 1–3 заместителями, выбранными независимо из группы, состоящей из одинаковых или разных атомов галогена и дейтерия) и C3–7 циклоалкил (который может быть независимо замещен 1–3 заместителями, выбранными независимо из группы, состоящей из дейтерия, галогена, гидроксильной группы и C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A); более предпочтительно водород.
[0076]
Предпочтительно, R4 включает, например, водород, дейтерий, метил, (2H3)метил, этил, (2H5)этил, пропил, изопропил, циклопропил, циклобутил, циклопентил, и циклогексил; более предпочтительно водород, изопропил и циклопентил; еще более предпочтительно водород.
[0077]
Предпочтительно, m=0 или 1, более предпочтительно 0.
[0078]
L обозначает CR7R8, при условии, что, когда m обозначает 2, каждый CR7R8 независимо является тем же или отличающимся.
[0079]
Предпочтительно, R7 и R8 включают независимо водород, дейтерий и C1–4 алкил, который может быть независимо замещен 1–3 заместителями, выбранными независимо из группы, состоящей из дейтерия, галогена, гидроксильной группы, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и 3–7–членного неароматического гетероциклила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В; более предпочтительно водород.
[0080]
Предпочтительно, R7 и R8 включают, например, водород, дейтерий, метил, (2H3)метил, этил и (2H5)этил; более предпочтительно водород.
[0081]
Предпочтительно, Группа заместителей A включает дейтерий, фтор, хлор, гидроксильную группу, C1–2 алкокси и C5–6 циклоалкокси; более предпочтительно фтор, гидроксильную группу и C1–2 алкокси.
[0082]
Предпочтительно, Группа заместителей В включает дейтерий, фтор, хлор, гидроксильную группу, C1–2 алкил, C1–2 алкокси и C5–6 циклоалкокси; более предпочтительно фтор, гидроксильную группу, C1–2 алкил и C1–2 алкокси.
[0083]
В качестве предпочтительной комбинации двух E в формуле (I’), оба или любой обозначает дейтерий; более предпочтительно оба обозначают дейтерий.
[0084]
Один вариант соединения формулы (I) или (I’) включает следующее:
соединение или его фармацевтически приемлемая соль, в которых
R1a, R1b, R1c и R1d независимо обозначают водород, дейтерий, C6–10 арил, C6–10 арилокси, 5–12–членный гетероарил или 5–12–членный гетероарилокси, причем арил и арильная группа в арилокси и гетероарил и гетероарильная группа в гетероарилокси могут быть независимо замещены 1–3 заместителями, выбранными независимо из группы, состоящей из дейтерия, галогена, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A и дейтерия, и C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A и дейтерия, при условии, что по меньшей мере один из R1a, R1b, R1c и R1d обозначает указанный C6–10 арил, C6–10 арилокси, 5–12–членный гетероарил или 5–12–членный гетероарилокси,
R2 и R3 независимо обозначают водород, дейтерий или C1–6 алкил, который может быть независимо замещен 1–5 заместителями, выбранными независимо из группы, состоящей из дейтерия, циано, галогена, гидроксильной группы и C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, при условии, что оба из R2 и R3 не обозначают водород, или
R2 и R3 может вместе с атомом углерода, к которому они присоединены, образовывать кольцо, т.е., следующую группу формулы (IIa) с –OR4

в формуле (IIa),
e и f независимо обозначают 1 или 2,
R4 обозначает водород, дейтерий, C1–6 алкил (который может быть замещен 1–3 заместителями, выбранными независимо из группы, состоящей из дейтерия, галогена, гидроксильной группы, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и 3–7–членного неароматического гетероциклила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В) или C3–7 циклоалкил (который может быть независимо замещен 1–3 заместителями, выбранными независимо из группы, состоящей из дейтерия, галогена, гидроксильной группы, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В),
V обозначает простую связь или атом кислорода, и
R5a, R5b, R5c и R5d независимо обозначают водород, дейтерий или галоген,
R4 обозначает водород, дейтерий, C1–4 алкил (который может быть замещен 1–3 заместителями, выбранными независимо из группы, состоящей из галогена и дейтерия) или C3–7 циклоалкил (который может быть замещен 1–3 заместителями, выбранными независимо из группы, состоящей из дейтерия, галогена, гидроксильной группы и C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A),
m=0 или 1,
L обозначает CR7R8,
R7 и R8 независимо обозначают водород, дейтерий или C1–4 алкил, который может быть независимо замещен 1–3 заместителями, выбранными независимо из группы, состоящей из дейтерия, галогена, гидроксильной группы, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, и 3–7–членного неароматического гетероциклила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В,
далее, что касается соединения формулы (I’), оба или любой из E обозначает дейтерий.
[0085]
Другой вариант соединения формулы (I) или (I’) включает следующее:
соединение или его фармацевтически приемлемая соль, в которых
R1a и R1d обозначают водород,
по меньшей мере один из R1b и R1c обозначает C6–10 арил, C6–10 арилокси, 5–12–членный гетероарил или 5–12–членный гетероарилокси, причем арил и арильная группа в арилокси и гетероарил и гетероарильная группа в гетероарилокси могут быть независимо замещены 1–3 заместителями, выбранными независимо из группы, состоящей из галогена, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, и C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A,
R2 и R3 независимо обозначают C1–6 алкил, в случае необходимости замещенный 1–5 одинаковыми или разными атомами галогена, или
R2 и R3 может вместе с атомом углерода, к которому они присоединены, образовывать кольцо, т.е., следующую группу формулы (IIb) с –OR4

в формуле (IIb),
e и f обозначают 1,
R4 обозначает водород,
V обозначает атом кислорода,
R5a, R5b, R5c и R5d независимо обозначают водород или галоген,
R4 обозначает водород,
m=0 или 1,
L обозначает CR7R8,
R7 и R8 независимо обозначают водород или C1–4 алкил, который может быть замещен 1–3 одинаковыми или разными атомами галогена,
далее, что касается соединения формулы (I), любой 1–6 атомов водорода заменены дейтерием,
что касается соединения формулы (I’), любой 1–8 атомов водорода заменены дейтерием.
[0086]
Другой вариант соединения формулы (I) или (I’) включает следующее:
соединение или его фармацевтически приемлемая соль, в которых
R1a и R1d обозначают водород, любой из R1b и R1c обозначает фенил, 2–фторфенил, 3–фторфенил, 4–фторфенил, 4–(трифторметил)фенил, 5–(трифторметил)пиридин–2–ил, фенокси, 3–фторфенокси, 3,4–дифторфенокси, 3,5–дифторфенокси, 4–хлорфенокси, 4–(трифторметил)фенокси, 4–(трифторметокси)фенокси, 4–цианофенокси, 4–(метилсульфонил)фенокси, (5–метилпиридин–2–ил)окси, (5–(трифторметил)пиридин–2–ил)окси, (5–фторпиридин–2–ил)окси, 2–метокси–4–(трифторметил)фенил, 2–фтор–4–(трифторметил)фенил, 2–хлор–4–(трифторметил)фенил, 4–(трифторметокси)фенил, (5–хлорпиридин–2–ил)окси, 2,4–дихлорфенил, 2–хлор–4–фторфенокси, 4–хлор–2–фторфенокси или 2,4–дихлорфенокси, и другой является водородом,
оба из R2 и R3 обозначают метил, или
R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют следующую группу формулы (IIc) с –OR4
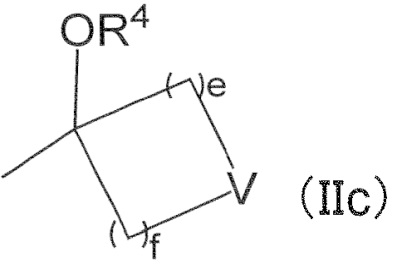
в формуле (IIc) e и f обозначают 1, R4 обозначает водород, V обозначает простую связь или атом кислорода,
m=0,
далее, что касается соединения формулы (I’), E является дейтерием.
[0087]
Способы получения соединений согласно настоящему изобретению описаны ниже. Соединение (I) или (I’) согласно настоящему изобретению может быть получено, например, согласно Способам 1–5, показанным ниже. В следующих способах любые атомы водорода помимо E в каждом соединении могут быть в случае необходимости заменены дейтерием, если возможно.
[0088]
Способ 1:
Соединение формулы (I) или (I’), в которой R1b обозначает ORa, т.е., Соединение (S–5), или его фармацевтически приемлемая соль, может быть получено, например, согласно следующему способу.
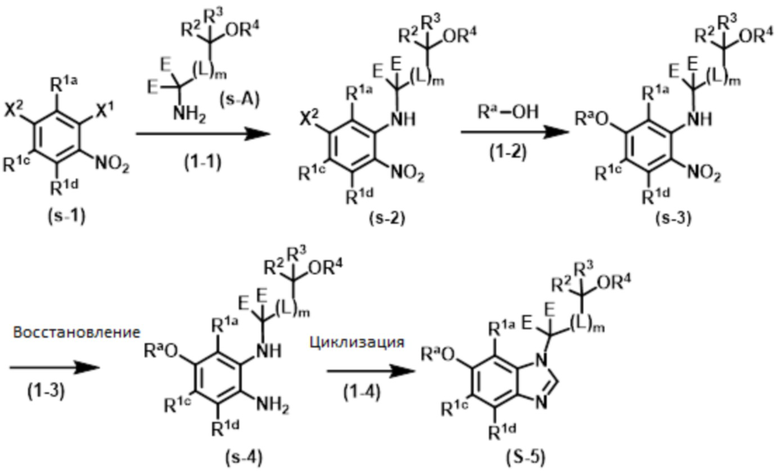
В указанной схеме E являются одинаковыми или разными и обозначают водород или дейтерий; R1a, R1c, R1d, R2, R3, R4, L и m имеют значения, определенные в Пункте 1; RaO– обозначает R1b, который выбран из C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C6–10 арилокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, или 5–12–членного гетероарилокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В; и X1 и X2 независимо обозначают уходящую группу, такую как галоген, трифторметансульфонилокси и метансульфонилокси.
[0089]
Стадия (1–1):
Эта стадия является способом получения соединения нитроанилина (s–2) реакцией соединения нитробензола (s–1) и соединения амина (s–A). Основание, используемое здесь, включает неорганическое основание, такое как гидроксид натрия, гидроксид калия, карбонат калия и карбонат цезия, и органическое основание, такое как триэтиламин и диизопропилэтиламин. Когда соединение амина используется в большом избытке, нет необходимости использовать такое основание. Растворитель, используемый здесь, включает простые эфиры, такие как THF, 1,2–диметоксиэтан, и 1,4–диоксан; DMF; NMP; ацетонитрил; и т.п. время реакции составляет обычно от приблизительно 10 минут до приблизительно 10 часов, и температура реакции составляет от 0ºC до температуры кипения растворителя, используемого здесь.
[0090]
Стадия (1–2):
Эта стадия является способом получения соединения нитроанилина (s–3) путем реакции соединения (s–2) и соединения, имеющего гидроксильную группу. Основание, используемое здесь, включает гидроксид натрия, гидроксид калия, карбонат калия, карбонат цезия, гидрид натрия и т.п. Растворитель, используемый здесь, включает простые эфиры, такие как THF, 1,2–диметоксиэтан и 1,4–диоксан; DMF; NMP; и ацетонитрил. Время реакции составляет обычно от приблизительно 10 минут до приблизительно 10 часов, и температура реакции составляет от 0ºC до температуры кипения растворителя, используемого здесь.
[0091]
Стадия (1–3):
Эта стадия является способом получения соединения фенилендиамина (s–4) путем восстановления соединения (s–3). Условия реакции на этой стадии включают обычно используемые уссловия для восстановления нитрогруппы, например, каталитического восстановления в гидрирующих условиях с палладием на углероде и т.д.; металлическое восстановление с цинком, железом и т.д.; и восстановление гидрида с литий–алюминийгидридом и т.д. Растворитель, используемый в этом восстановлении, включает различные растворители, обычно используемые при каждом условии восстановления. В случае каталитического восстановления он включает метанол, этанол, THF и этилацетат; в случае металлического восстановления он включает THF, уксусную кислоту, метанол и этанол; и в случае восстановления гидрида он включает диэтиловый эфир и THF. Время реакции обычно составляет от 10 минут до 24 часов, и температура реакции составляет от 0ºC до температуры кипения растворителя, используемого здесь.
[0092]
Стадия (1–4):
Эта стадия является способом получения Соединения (S–5) путем реакции соединения (s–4) и муравьиной кислоты или эквивалента муравьиной кислоты для циклизации. Эквивалент муравьиной кислоты включает ортоформиаты, такие как метил ортоформиат и этил ортоформиат. На этой стадии может использоваться катализатор, который включает органическую кислоту, такую как муравьиная кислота и уксусная кислота, и кислоту Льюиса, такую как иттербий трифлат. Растворитель, используемый здесь, включает спирты, такие как метанол и этанол. Также возможно использовать как растворитель муравьиную кислоту, ортоформиат и т.п., которые упомянуты выше как реагенты. Время реакции обычно составляет от 10 минут до 24 часов, и температура реакции является температурой от комнатной до температуры кипения растворителя, используемого здесь.
[0093]
Стадия (1–1) и Стадия (1–2) могут быть осуществлены последовательно; например, к смеси после завершения реакции Стадии (1–1) реагенты, которые будут использоваться на Стадии (1–2), могут быть добавлены для получения соединения (s–3), в которое два заместителя вводят за одну стадию. Время реакции последовательных реакций обычно составляет от 20 минут до 20 часов.
[0094]
Способ 2:
Соединение нитроанилина формулы (s–3) может быть также получено, например, согласно следующему способу.
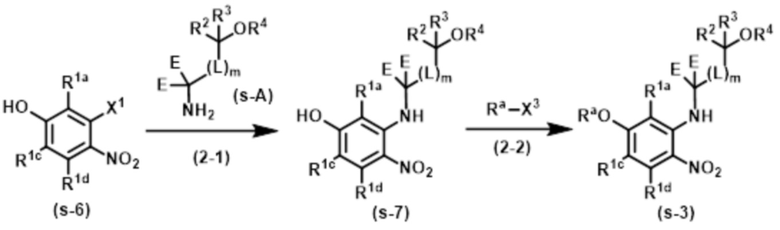
В указанной схеме E являются одинаковыми или разными и обозначают водород или дейтерий; R1a, R1c, R1d, R2, R3, R4, L и m имеют значения, определенные в Пункте 1; RaO– обозначает R1b, который выбран из C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C6–10 арилокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, или 5–12–членного гетероарилокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В; и X1 и X3 независимо обозначают уходящую группу, такую как галоген, трифторметансульфонилокси и метансульфонилокси.
[0095]
Стадия (2–1):
Эта стадия является способом получения соединения аминофенола формулы (s–7) из соединения фенола формулы (s–6) таким же образом, как на Стадии (1–1).
[0096]
Стадия (2–2):
Эта стадия является способом получения соединения нитроанилина формулы (s–3) путем реакции соединения формулы (s–7) с Ra–X3. Основание, используемое здесь, включает гидроксид натрия, гидроксид калия, карбонат калия, карбонат цезия и гидрид натрия. Растворитель, используемый здесь, включает простые эфиры, такие как THF, 1,2–диметоксиэтан и 1,4–диоксан; DMF; NMP; ацетонитрил; и т.п. время реакции обычно составляет от приблизительно 10 минут до приблизительно 10 часов, и температура реакции составляет от 0ºC до температуры кипения растворителя, используемого здесь.
[0097]
Стадия (2–1) и Стадия (2–2) могут быть осуществлены последовательно; например, к смеси после заверешения реакции Стадии (2–1) реагенты, которые будут использоваться на Стадии (2–2), могут быть добавлены для получения соединения (s–3), в которое два заместителя вводят за одну стадию. Время реакции последовательных реакций обычно составляет от 20 минут до 20 часов.
[0098]
Способ 3:
Соединение формулы (I) или (I’), в котором R1b обозначает ORa, т.е., Соединение (S–5), или его фармацевтически приемлемая соль, может быть также получено, например, согласно следующему способу.
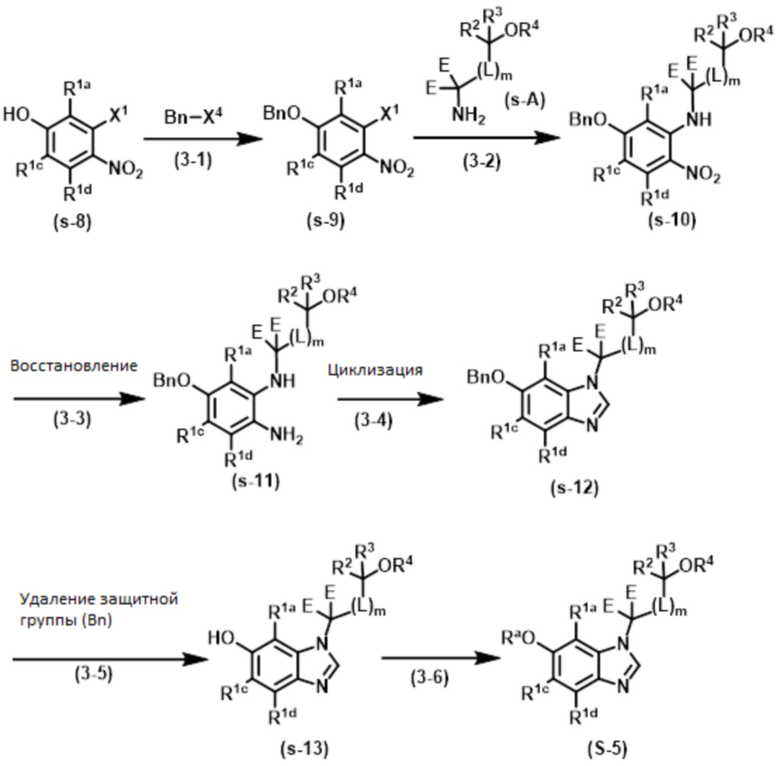
В указанной схеме E являются одинаковыми или разными и обозначают водород или дейтерий; R1a, R1c, R1d, R2, R3, R4, L и m имеют значения, определенные в Пункте 1; Rа имеет значение, определенное выше; X1 и X4 независимо обозначают уходящую группу, такую как галоген, трифторметансульфонилокси и метансульфонилокси. Bn обозначает бензильную группу, которая может охватывать защитную группу, которая может быть удалена, как бензильная группа, например, замещенная бензильная группа, раскрытая в Protective Groups in Organic Synthesis.
[0099]
Стадия (3–1):
Эта стадия является способом получения соединения простого эфира формулы (s–9) путем реакции соединения фенола формулы (s–8) с Bn–X4, например, в присутствии основания. Основание, используемое здесь, включает карбонат натрия, карбонат калия, карбонат цезия и гидрид натрия. Bn–X4 включает бензилхлорид и бензил бромид. В случае необходимости, йодид натрия, йодид калия, тетрабутиламмоний йодид, тетрабутиламмоний гидросульфат и т.д. может быть добавлен к реакции. Растворитель, используемый здесь, включает ацетон, ацетонитрил, THF, диэтиловый эфир, 1,4–диоксан, 1,2–диметоксиэтан, DMF и NMP. Время реакции обычно составляет от 30 минут до 24 часов, и температура реакции составляет от 0ºC до температуры кипения растворителя, используемого здесь. Кроме того, соединение формулы (s–9) может быть получено из соединения формулы (s–8) согласно способу (условия), описанному в Protective Groups in Organic Synthesis и т.п.
[0100]
Стадия (3–2):
Эта стадия является способом получения соединения нитроанилина формулы (s–10) из соединения формулы (s–9) таким же образом как на Стадии (1–1).
[0101]
Стадия (3–3):
Эта стадия является способом получения соединения фенилендиамина формулы (s–11) путем селективного восстановления нитрогруппы в соединении формулы (s–10). Условия реакции на этой стадии включают каталитическое восстановление с серой–токсичной платиной–углеродом и т.д. в гидрирующих условиях; металлическое восстановление с цинком, железом, оловом, и т.д.; восстановление гидрида с литий–алюминийгидридом, и т.д. Растворитель, используемый в этом восстановлении, включает различные растворители, обычно используемые в каждых условиях восстановления. В случае каталитического восстановления он включает метанол, этанол, THF и этилацетат; в случае металлического восстановления он включает THF, уксусную кислоту, метанол и этанол; и в случае восстановления гидрида он включает диэтиловый эфир и THF. Время реакции обычно составляет от 10 минут до 24 часов, и температура реакции составляет от 0ºC до температуры кипения растворителя, используемого здесь.
[0102]
Стадия (3–4):
Эта стадия является способом получения соединения бензимидазола формулы (s–12) из соединения формулы (s–11) таким же образом, как на Стадии (1–4).
[0103]
Стадия (3–5):
Эта стадия является способом получения соединения гидроксибензимидазола формулы (s–13) путем удаления защитной группы гидроксильной группы в соединении формулы (s–12), например, каталитическим восстановлением в гидрирующих условиях. Катализатор, используемый здесь, включает гетерогенные катализаторы, такие как палладий на углероде. Гидрирующие условия означают «в атмосфере водорода» или «в присутствии муравьиной кислоты, формиата аммония и т.д.». Растворитель, используемый здесь, включает метанол, этанол, THF и этилацетат. Время реакции обычно составляет от 30 минут до 24 часов, и температура реакции составляет от 0ºC до температуры кипения растворителя, используемого здесь. Кроме того, соединение формулы (s–13) может быть получено из соединения формулы (s–12) в способе (условия), описанном в Protective Groups in Organic Synthesis и т.д.
[0104]
Стадия (3–6):
Эта стадия является способом получения соединения формулы (s–5) из соединения формулы (s–13), который включает два условия реакции, но не ограничен ими.
1) Условия реакции с использованием основания включают следующую стадию: соединение формулы (s–5) получают путем реакции соединения формулы (s–13) и Ra–X5 (где Ra обозначает C1–4 алкил, в случае необходимости замещенный 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкил, в случае необходимости замещенный 1–3 заместителями, выбранными независимо из Группы заместителей В, C6–10 арил, в случае необходимости замещенный 1–3 заместителями, выбранными независимо из Группы заместителей В, или 5–12–членный гетероарил, в случае необходимости замещенный 1–3 заместителями, выбранными независимо из Группы заместителей В, которые определены в R1b, и X5 имеет значения, определенные в указанном X1) таким же образом, как на Стадии (2–2).
2) Условия реакции с использованием катализатора и основания включают реакцию с боронатным соединением или галогеновым соединением, имеющим группу Ra. Катализатор, используемый здесь, включает ацетат меди (II), йодид меди (I) и оксид меди (II). Основание, используемое здесь, включает карбонат калия, карбонат цезия, гидроксид калия и триэтиламин. Растворитель, используемый здесь, включает хлороформ, 1,4–диоксан, DMF, DMSO и NMP. Время реакции обычно составляет от 30 минут до 24 часов, и температура реакции является температурой от комнатной до температуры кипения растворителя, используемого здесь.
[0105]
Соединение формулы (I) или (I’), в которой один или более R1a, R1b, R1c и R1d обозначают ORa, или его фармацевтически приемлемая соль, может быть также получено таким же образом, как описано выше.
[0106]
Способ 4:
Соединение формулы (I) или (I’), в которой R1b обозначает Rb (арил или гетероарил), т.е., Соединение (S–16) или его фармацевтически приемлемая соль может быть получено, например, согласно следующему способу.
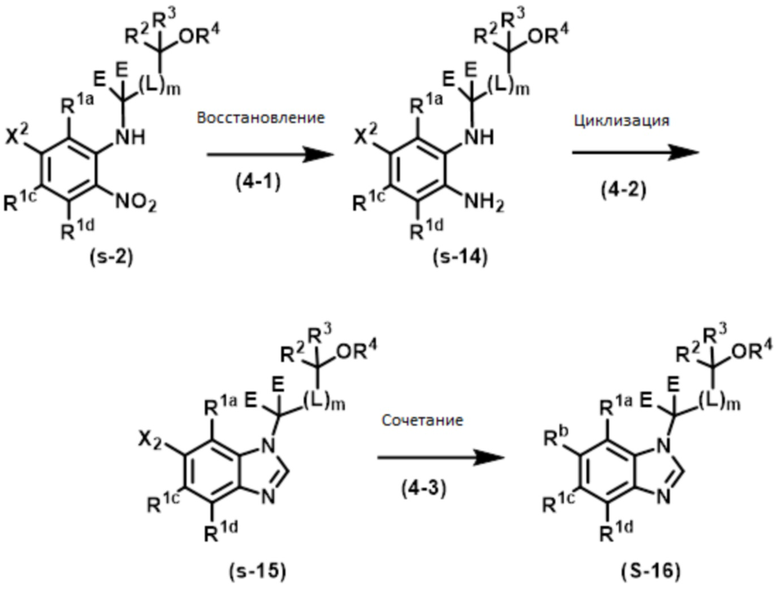
В указанной схеме E являются одинаковыми или разными и обозначают водород или дейтерий; R1a, R1c, R1d, R2, R3, R4, L и m имеют значения, определенные в Пункте 1; X2 имеет определенное выше значение; и Rb обозначает C6–10 арил или 5–12–членный гетероарил, причем арил и гетероарил могут быть независимо замещены 1–5 заместителями, выбранными независимо из группы, состоящей из галогена, циано, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, C3–7 циклоалкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C3–7 циклоалкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, 3–7–членного неароматического гетероциклила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей В, C1–4 алкилтио, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, и C1–4 алкилсульфонила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A.
[0107]
Стадия (4–1):
Эта стадия является способом получения соединения фенилендиамина формулы (s–14) путем селективного восстановления нитрогруппы в соединении нитроанилина формулы (s–2). Условия реакции на этой стадии включают каталитическое восстановление с серой–токсичной платиной–углеродом и т.д. в гидрирующих условиях; металлическое восстановление с цинком, железом, оловом и т.д.; восстановление гидрида с литий–алюминийгидридом и т.д. Растворитель, используемый в этом восстановлении, включает различные растворители, обычно используемые в каждом условии восстановления. В случае каталитического восстановления он включает метанол, этанол, THF и этилацетат; в случае металлического восстановления он включает THF, уксусную кислоту, метанол и этанол; и в случае восстановления гидрида он включает диэтиловый эфир и THF. Время реакции обычно составляет от 10 минут до 24 часов, и температура реакции составляет от 0ºC до температуры кипения растворителя, используемого здесь.
[0108]
Стадия (4–2):
Эта стадия является способом получения соединения бензимидазола формулы (s–15) из соединения формулы (s–14) таким же образом, как на Стадии (1–4).
[0109]
Стадия (4–3):
Эта стадия является способом получения соединения формулы (S–16) путем реакции соединения формулы (s–15) и бороновой кислоты или боронатного соединения, имеющего группу Rb, в присутствии основания и катализатора. Например, эта стадия является реакцией сочетания Suzuki. Основание, используемое здесь, включает карбонат натрия, карбонат калия, карбонат цезия и трикалий фосфат. Катализатор, используемый здесь, включает ацетат палладия, тетракис(трифенилфосфин)палладий и трис(дибензилиденацетон)дипалладий. Растворитель, используемый здесь, включает 1,4–диоксан, толуол и 1,2–диметоксиэтан. Время реакции обычно составляет от 30 минут до 24 часов, и температура реакции является температурой от комнатной до температуры кипения растворителя, используемого здесь.
[0110]
Соединение формулы (I), в которой один или более R1a, R1b, R1c, и R1d обозначает Rb, или его фармацевтически приемлемая соль, может быть также получено таким же образом, как описано выше.
[0111]
Способ 5:
Соединение формулы (I) или (I’), в которой R1b обозначает Rb, т.е., Соединение (S–16) или его фармацевтически приемлемая соль может быть также получено, например, согласно следующему способу.
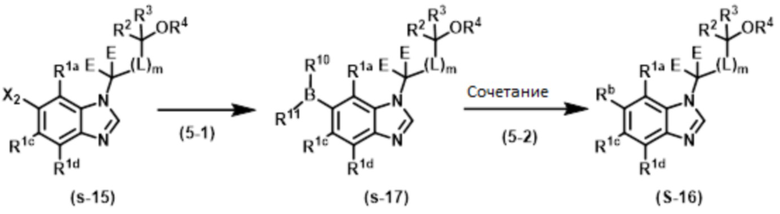
В указанной схеме E являются одинаковыми или разными и обозначают водород или дейтерий; R1a, R1c, R1d, R2, R3, R4, L и m имеют значения, определенные в Пункте 1; Rb и X2 имеют значения, определенные выше; и R10 и R11 независимо обозначают в случае необходимости замещенный C1–4 алкил, в случае необходимости замещенный C1–4 алкокси, в случае необходимости замещенный C1–4 диалкиламино, в случае необходимости замещенный C6–10 арил, в случае необходимости замещенный C6–10 арилокси, в случае необходимости замещенный 5–12–членный гетероарил, в случае необходимости замененный 5–12–членный гетероарилокси или гидроксильную группу. Предпочтительно, R10R11B– включает следующие структуры, но не ограничен ими.
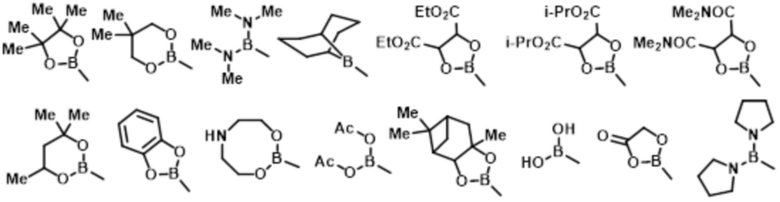
[0112]
Стадия (5–1):
Эта стадия является способом получения боронатного соединения формулы (s–17) путем реакции соединения формулы (s–15) и диборонов, таких как бис(пинаколято)диборон в присутствии катализатора и основания. Катализатор, используемый здесь, включает [1,1’–бис(дифенилфосфино)ферроцен]дихлорпалладий, тетракис(трифенилфосфин)палладий, трис(дибензилиденацетон)дипалладий и дихлорбис(трифенилфосфин)палладий. Основание, используемое здесь, включает ацетат калия, трикалий фосфат и карбонат калия. Растворитель, используемый здесь, включает 1,4–диоксан, толуол и 1,2–диметоксиэтан. Время реакции обычно составляет от 1 часа до 48 часов, и температура реакции является температурой от комнатной до температуры кипения растворителя, используемого здесь.
[0113]
Стадия (5–2):
Эта стадия является способом получения соединения формулы (S–16) путем реакции боронатного соединения формулы (s–17) и галогенида или трифлатного соединения, имеющего группу Rb (Rb–X6 (X6: атом галогена) или CF3SO2O–Rb и т.д.) в присутствии катализатора и основания. Например, эта стадия является реакцией сочетания Suzuki. Основание, используемое здесь, включает карбонат натрия, карбонат калия, карбонат цезия и трикалий фосфат. Катализатор, используемый здесь, включает ацетат палладия, тетракис(трифенилфосфин)палладий и трис(дибензилиденацетон)дипалладий. Растворитель, используемый здесь, включает 1,4–диоксан, толуол и 1,2–диметоксиэтан. Время реакции обычно составляет от 30 минут до 48 часов, и температура реакции является температурой от комнатной до температуры кипения растворителя, используемого здесь.
[0114]
Соединение формулы (I), в которой один или более R1a, R1b, R1c и R1d обозначает Rb, или его фармацевтически приемлемая соль, может быть также получено таким же образом, как описано выше.
[0115]
Способ 6:
Соединение формулы (I) или (I’), в которой R4 обозначает R4a (алкил или циклоалкил), т.е., Соединение (S–19) или его фармацевтически приемлемая соль может быть получено, например, согласно следующему способу.
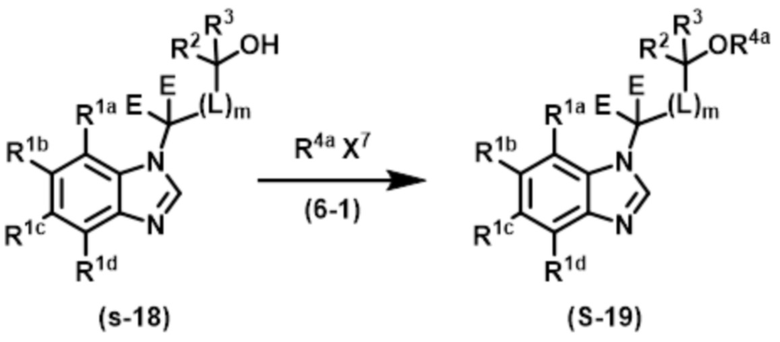
В указанной схеме E являются одинаковыми или разными и обозначают водород или дейтерий; R1a, R1b, R1c, R1d, R2, R3, L и m имеют значения, определенные в Пункте 1; X7 имеет то же определение, как указанное X1; и R4a совпадает с R4, при условии, что водород исключен.
[0116]
Стадия (6–1):
Эта стадия является способом получения соединения формулы (S–19) путем реакции спиртового соединения (s–18), которое является соединением формулы (I), в которой R4 обозначает водород, и например, соединения R4aX7 в присутствии основания. Основание, используемое здесь, включает гидрид натрия, гидрид калия, гидрид лития, н–бутиллитий и трет–бутоксид калия. Растворитель, используемый здесь, включает простые эфиры, такие как диэтиловый эфир и THF, DMF, NMP и DMSO. Время реакции обычно составляет от 10 минут до 24 часов, и температура реакции составляет от 0ºC до температуры кипения растворителя, используемого здесь.
[0117]
Указанное восстановление нитрогруппы (Стадия (1–3), Стадия (3–3), Стадия (4–1)) и последующая циклизация (Стадия (1–4), Стадия (3–4), Стадия (4–2)) могут быть осуществлены последовательно для циклизации за одну стадию, например, муравьиная кислота или эквивалент муравьиной кислоты, такой как ортоформиат, может быть добавлена к восстановительной реакции (s–3), (s–10) или (s–2) для получения (S–5), (s–12) или (s–15). Время реакции последовательных реакций обычно составляет от 10 минут до 12 часов, и температура реакции является температурой от комнатной до температуры кипения растворителя, используемого здесь.
[0118]
Способ 7:
В указанных соединениях амина (s–A) соединение (s–B), в котором оба E являются дейтерием, или химически приемлемая соль, может быть получено, например, согласно следующему способу.
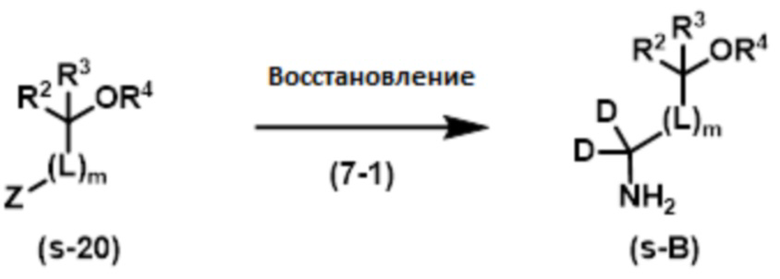
В указанной схеме, R2, R3, R4, L и m имеют значения, определенные в Пункте 1, Z обозначает циангруппу, карбамоильную группу и т.п.
[0119]
Стадия (7–1):
Эта стадия является способом получения соединения амина формулы (s–B) восстановительным добавлением дейтерия к соединению формулы (s–20), который включает два условия реакции, но не ограничен ими.
1) Условия реакции с исспользованием восстанавливающего агента включают стадия реакции соединения формулы (s–20) с дейтеризованным восстанавливающим агентом. Дейтеризованный восстанавливающий агент включает натрий бордейтерид и литий алюминий дейтерид. Растворитель, используемый здесь, включает метанол, простой эфир и THF. Время реакции обычно составляет от 30 минут до 10 часов, и температура реакции составляет от 0ºC до температуры кипения растворителя, используемого здесь.
2) Условия реакции с использованием катализатора включают стадию каталитического восстановления соединения формулы (s–20) в условиях дейтерирования. Условия дейтерирования означают «в атмосфере дейтерия», «в атмосфере дейтерия под давлением» и т.д. Катализатор, используемый здесь, включает гидроксид палладия на углероде и оксид платины. Растворитель, используемый здесь, включает метанол, этанол, THF и этилацетат. Время реакции обычно составляет от 1 часа до 24 часов, и температура реакции является температурой от комнатной до температуры кипения растворителя, используемого здесь.
[0120]
Кроме того, соединение амина формулы (s–B) может быть также получено, например, с использованием дейтеризованного исходного материала. Такой дейтеризованный исходный материал включает лицин–2,2–2H2.
[0121]
Комнатная температура в указанных способах означает более конкретно от 10ºC до 30ºC.
[0122]
Исходные материалы и промежуточные соединения в указанных способах являются известными соединениями или могут быть получены из известных соединений согласно известному способу. В случае, если любая функциональная группа, отличная от целевого сайта реакции, может вступать в реакцию или может быть неподходящей в указанных способах, функциональная группа, отличная от целевого сайта реакции, может быть защищена для реакции, и защитная группа может быть отщеплена с получением желаемого соединения после завершения реакции. Защитная группа, используемая здесь, включает, например, стандартную защитную группу, раскрытую в указанном Protective Groups in Organic Synthesis и т.п. В частности, защитная группа для аминогруппы включает, например, этоксикарбонил, трет–бутоксикарбонил, ацетил, бензил и т.п.; и защитная группа для гидроксильной группы включает, например, три–низший алкилсилил, ацетил, бензил и т.п.
[0123]
Введение и отщепление защитных групп могут быть осуществлены стандартным способом, известным в органической химии (например, см. указанный Protective Groups in Organic Synthesis), или подобным способом.
[0124]
Путем подходящего изменения функциональной группы (групп) в промежуточном соединении или конечном продукте в указанных способах также возможно получить различные соединения, определенные в настоящем изобретении. Превращение функциональной группы (групп) может быть осуществлено согласно стандартному способу (например, Comprehensive Organic Transformations, R. C. Larock (1989)).
[0125]
Промежуточные соединения и желаемые соединения в указанных способах могут быть выделены/очищены очисткой, обычно используемой в синтетической органической химии, например, нейтрализацией, фильтрацией, экстракцией, промывкой, высушиванием, концентрацией, перекристаллизацией, различными хроматографиями и т.д. Некоторые промежуточные соединения могут использоваться на следующей стадии без какой–либо очистки.
Оптические изомеры согласно настоящему изобретению могут быть выделены с использованием известного способа разделения на подходящей стадии, например, разделения оптически активной колонкой и фракционированной кристаллизацией. И это осуществимо с использованием оптически активного исходного материала.
Соединения согласно настоящему изобретению могут иногда быть оптическим изомером, стереоизомером, таутомером, таким как кето–енольное соединение и/или геометрический изомер, следовательно, они включают все возможные изомеры, включая указанные изомеры и их смесь.
[0126]
Соединения согласно настоящему изобретению могут также включать соединение формулы (I) или (I’), его пролекарство и его фармацевтически приемлемую соль, помимо указанных изомеров. И соединения согласно настоящему изобретению или их фармацевтически приемлемые соли могут быть в форме аддукта с водой или каждым растворителем, следовательно, они также включают такие аддукты. Кроме того, соединения согласно настоящему изобретению могут также включать различные варианты кристаллов и соединений, в которых часть или все атомы, составляющие соединения, заменены другим изотопом (например, с заменой 12C на 14C).
[0127]
Термин «пролекарство соединения формулы (I) или (I’)», используемый здесь, означает соединение, которое может быть преобразовано в соединение формулы (I) или (I’) путем реакции с ферментом, желудочным соком и т.д. в физиологических условиях, т.е., соединение, которое может ферментативно окисляться, восстанавливаться, гидролизоваться или иначе преобразовываться в соединение формулы (I) или (I’), и соединение, которое может гидролизоваться желудочным соком и т.п. с превращением в соединение формулы (I) или (I’).
[0128]
«Фармацевтически приемлемая соль», используемая здесь, включает, например, соль присоединения с основанием или соль присоединения с кислотой. Соль присоединения с основанием включает, например, соль щелочного металла, такую как соль калия и соль натрия; соль щелочноземельного металла, такую как соль кальция и соль магния; водорастворимую соль присоединения с амином, такую как аммониевую соль и N–метилглюкамин (меглумин); и низшую алканоламмониевую соль органического амина. Соль присоединения с кислотой включает, например, гидрохлорид, гидробромид, гидройодид, нитрат, сульфат, бисульфат, фосфат, ацетат, лактат, цитрат, тартрат, битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, п–толуолсульфонат и памоат[1,1’–метилен–бис–(2–гидрокси–3–нафтоат)].
[0129]
Соли соединения по изобретению могут быть получены, например, следующим образом. Например, когда соединение по изобретению получено в форме соли, его соль может быть получена путем прямой очистки его. соединение по изобретению получено в свободной форме, его соль может быть получена путем растворения или суспендирования его в подходящем органическом растворителе, добавления к нему возможной кислоты или основания и затем обработки полученной смеси обычным образом.
[0130]
Соединение формулы (I) или (I’), полученное указанными способами, может быть выделено/очищено стандартным образом, таким как экстракция, колоночная хроматография, перекристаллизация и повторное осаждение. Растворитель для экстракции, используемый здесь, включает, например, диэтиловый эфир, этилацетат, хлороформ, дихлорметан, толуол и т.п. Очистка колоночной хроматографией может быть осуществлена обработкой кислотой, основанием или различными химическими веществами на силикагеле, оксиде алюминия и т.п. Элюент, используемый здесь, включает, например, гексан/этилацетат, гексан/хлороформ, этилацетат/метанол, хлороформ/метанол, ацетонитрил/вода, метанол/вода и т.п.
[0131]
Новые соединения согласно настоящему изобретению или их фармацевтически приемлемые соли, имеющие бензимидазольное кольцо, имеют свойство ингибирования Nav 1.7, и таким образом, могут использоваться в качестве лекарственного средства для лечения или предотвращения боли, в которой задействован периферический нерв, такой как C–волокна и Aδ–волокна, спонтанной боли, такой как онемение, острая боль, тупая боль, колящая боль и стреляющая боль, нейропатической боли, сопровождаемой гипералгезией, такой как механическая стимуляция и холодовая стимуляция или аллодиния, ноцицептивной боли, воспалительной боли, нейропатия малых волокон, эритромелалгии, пароксизмального экстремального болевого расстройства и т.д. Нейропатическая боль включает, например, диабетическую нейропатию, постгерпетическую невралгию, вызванную химиотерапией нейропатию, раковую боль, повреждение сенсорного нерва, нанесенное вирусной инфекцией при синдроме иммунодефицита человека, тройничную невралгию, комплексный регионарный болевой синдром, симпатическую рефлекторную дистрофию, невралгию после операции на пояснице, фантомную боль, боль после повреждения спинного мозга, персистирующую послеоперационную боль, воспалительную демиелинизирующую полирадикулопатию, алкогольную нейропатию, периферическую нейропатию, связанную с ущемлением органа, ятрогенную нейропатию, внезапное сенсонейронное нарушение, нейропатию, вызванную вызванная плохим питанием, пострадиационную нейропатию, радикулопатию, токсическую периферическую нейропатию, травматическую периферическую нейропатию, разрыв плечевого сплетения, языкоглоточную невралгию, аутоиммунную нейропатию и хронический синдром конского хвоста. Ноцицептивная боль или воспалительная боль включают боль в области поясницы, боль в животе, хронический ревматоидный артрит, боль, вызванную остеоартритом, миалгию, острую послеоперационную боль, боль при переломе, боль после ожогового повреждения и т.п. Кроме того, соединения по изобретению или их фармацевтически приемлемые соли могут также использоваться в качестве лекарственного средства для лечения или предотвращения дизурии. Дизурия включает частое мочеиспускание, боль в мочевом пузыре, вызванную гиперплазией предстательной железы и т.п. Кроме того, соединения по изобретению или их фармацевтически приемлемые соли могут также использоваться в качестве лекарственного средства для лечения или предотвращения атаксии, развившейся в результате подавления патологической утраты нервов в мозжечке при рассеянном склерозе. Кроме того, соединения по изобретению или их фармацевтически приемлемые соли могут быть лекарственным средством, не имеющим побочных эффектов на уровне сердца или центральной нервной системы, которые являются проблемой существующих видов лечении, поскольку они имеют селективную ингибирующую активность по отношению к Nav 1.7.
[0132]
Соединения по изобретению могут быть введены перорально, парентерально или ректально, и суточная доза может варьировать в зависимости от соединения, способа введения, состояния/возраста пациента и т.д. Для перорального введения, например, соединения по изобретению могут обычно вводиться в дозировке приблизительно от 0,01 до 1000 мг, предпочтительно приблизительно от 0,1 до 500 мг в день на килограмм массы тела человека или млекопитающего и от одного раза до нескольких раз. Для парентерального введения, такого как внутривенная инъекция, например, соединения по изобретению могут обычно вводиться в дозировке приблизительно от 0,01 до 300 мг, предпочтительно приблизительно от 1 до 100 мг на килограмм массы тела человека или млекопитающего.
[0133]
Соединения по изобретению могут вводиться перорально или парентерально непосредственно или в форме подходящего состава, включающего их. Состав может быть, например, таблеткой, капсулой, порошком, гранулой, жидкостью, суспензией, инъекцией, пластырем, гелевым пластырем и т.п., но не ограничивается этим. Состав может быть получен с фармацевтически приемлемыми добавками известными средствами. Добавки могут быть выбраны для любой цели, включая эксципиент, разрыхлитель, связующее, флюидизирующий агент, лубрикант, вещество покрытия, ожижающий агент, солюбилизирующий агент, загуститель, диспергатор, стабилизатор, подсластитель, ароматизатор и т.п. В чатсности, они включают, например, лактозу, маннит, микрокристаллическую целлюлозу, низкозамещенную гидроксипропилцеллюлозу, кукурузный крахмал, частично предварительно желатинированный крахмал, кармеллозу кальция, кроскармеллозу натрия, гидроксипропилцеллюлозу, гидроксипропил метилцеллюлозу, поливиниловый спирт, стеарат магния, стеарил фумарат натрия, полиэтиленгликоль, пропиленгликоль, оксид титана, тальк и т.п.
[0134]
Соединения по изобретению и их фармацевтически приемлемая соль могут использоваться в комбинации с, например, нестероидным противовоспалительным средством, таким как целекоксиб, вольтарен, ибупрофен, локсопрофен, ацетоаминофен, диклофенак и дексаметазон, и опиоидным анальгетиком, таким как трамадол, морфий и оксикодон, для усиления его действия. Кроме того, соединения по изобретению и их фармацевтически приемлемая соль могут также использоваться в комбинации с противоэпилептическим агентом (таким как прегабалин и карбамазепин), ингибитором альдоза редуктазы (таким как эпалрестат), лекарственным средством, являющимся производным простагландина (таким как лимапрост альфадекс), антидепрессантом (таким как амитриптилин и дулоксетин), противосудорожным агентом, транквилизатором, агонистом рецептора допамина, антипаркинсоническим агентом, гормональным препаратом, лекарственным средством против мигрени, антагонистом β адренергического рецептора, лекарственным средством для лечения деменции, лекарственным средством для лечения расстройства настроения и т.п. Предпочтительные лекарственные средства, используемые в комбинации с соединением по изобретению и его фармацевтически приемлемой солью, включают противоэпилептический агент, такой как прегабалин и карбамазепин, антидепрессант, такой как амитриптилин и дулоксетин, наркотический анальгетик, такой как морфий, оксикодон и трамадол, противовоспалительное средство, такое как ацетоаминофен, диклофенак и дексаметазон, ингибитор альдоза редуктазы, такой как эпалрестат, и производное простагландина, такое как лимапрост альфадекс. Для уменьшения побочных эффектов, соединения по изобретению и их фармацевтически приемлемая соль могут использоваться в комбинации с противорвотным лекарственным средством и снотворным лекарственным средством. Интервал введения соединения по изобретению и сопутствующего ему лекарственного средства не ограничен, т.е., сопутствующее лекарство может быть введено в то же время, что и соединение по изобретению, или в подходящем интервале. Или соединение по изобретению и сопутствующее ему лекарственное средство могут быть составлено в комбинированное лекарственное средство. Доза комбинированного лекарственного средства может быть соответственно определена на основе стандарта его клинически используемой дозы. Отношение комбинации соединения по изобретению и сопутствующего ему лекарственного средства может быть соответственно определено на основе рассматриваемого пациента, пути введения, заболевания, патологии, сопутствующего лекарственного средства и т.д. Например, когда рассматриваемый пациент является человеком, сопутствующее лекарственное средство может использоваться в количестве от 0,01 до 1000 весовых частей на часть соединения по изобретению.
ПРИМЕРЫ
[0135]
Настоящее изобретение объясняется более подробно в следующем разделе посредством Справочных примеров, Сравнительных примеров, Примеров и Тестов; однако технический объем настоящего изобретения не ограничен такими Примерами и т.п. Хроматография на силикагеле, используемая в Справочном примере, Сравнительных примерах и Примерах, представляет собой колоночную хроматографию на силикагеле или колоночную хроматографию на аминосиликагеле производства CORPORATION YAMAZEN. Каждое соединение было идентифицировано со спектром протонного ядерного магнитного резонанса (1H–ЯМР). 1H–ЯМР был измерен с помощью JNM–ECS400 (JEOL).
[0136]
Если не указано иное, исходные материалы, реагенты реакции и растворители, используемые здесь, были коммерчески доступными продуктами или были получены согласно известным способам.
[0137]
В Способах, Справочных примерах, Сравнительных примерах, Примерах и Тестах, сокращения, показанные ниже, могут иногда использоваться для упрощения настоящего описания. Ме: метил, THF: тетрагидрофуран, DMF: N, N–диметилформамид, NMP: N–метил–2–пирролидинон, DMSO: диметилсульфоксид, HEPES: 2–[4–(2–гидроксиэтил)–1–пиперазинил]этансульфоновая кислота, EGTA: O, O’–бис(2–аминоэтил)этиленгликоль–N, N,N',N'–тетраацетат, NADPH: никотинамид аденин динуклеотид фосфат, LC: жидкостная хроматография, MS: массовая спектрография, ЯМР: ядерный магнитный резонанс, D: дейтерий, 2H: дейтерий, J: константа сочетания, с: синглет, д: дублет, т: триплет, дд: дублет дублетов, м: мультиплет, ушир.: уширенный.
[0138]
Справочный пример 1: Получение 1–амино–2–метил(1,1– 2H2)пропан–2–ол моногидрохлорид (Соединение 5)
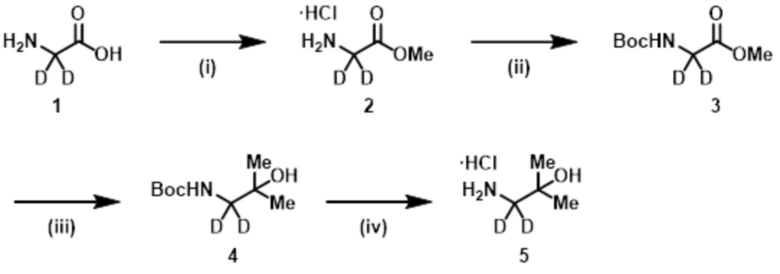
[0139]
Стадия (i):
К смеси глицин–2,2–2H2 (Соединение 1, 5,0 г) и метанола (75 мл) при 0°C добавляли тионилхлорид (7,4 мл), и смесь перемешивали при 50°C в течение 4 часов. Реакционный раствор охлаждали до комнатной температуры и концентрировали в вакууме, и остаток азеотропно высушивали метанолом. Полученный остаток промывали из суспензии этилацетатом, получая Соединение 2 (8,2 г).
[0140]
Стадия (ii):
К смеси Соединения 2 (8,0 г) и THF (75 мл) добавляли триэтиламин (19,2 мл) и ди–трет–бутил бикарбонат (13,7 г), и смесь перемешивали при 50°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и фильтровали, и фильтрат концентрировали в вакууме. Остаток растворяли в этилацетате, и раствор промывали водным раствором бикарбоната натрия и водой. Органический слой высушивали над сульфатом натрия и затем концентрировали в вакууме, получая Соединение 3 в форме сырого продукта (11,3 г).
[0141]
Стадия (iii):
К раствору сырого продукта Соединения 3 (11,2 г) в THF (78 мл) добавляли раствор метилмагний бромид/диэтиловый эфир (3,0 моль/л, 78 мл) по каплям при 0°C за 3 часа, и смесь перемешивали при комнатной температуре в течение еще 3 часов. Водный раствор хлорида аммония и этилацетат добавляли к реакционной смеси для разделения слоев. Органический слой промывали водой и высушивали над сульфатом натрия и затем концентрировали в вакууме, получая Соединение 4 в форме сырого продукта (10,7 г).
[0142]
Стадия (iv):
К раствору сырого продукта Соединения 4 (10,6 г) в этилацетате (25 мл) добавляли раствор 4 моль/л соляная кислота/этилацетат (50 мл), и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционный раствор концентрировали в вакууме, и остаток азеотропно высушивали метанолом с получением 1–амино–2–метил(1,1–2H2)пропан–2–ола (Соединение 5) в форме сырого продукта (7,0 г).
[0143]
Справочный пример 2: Получение 1–амино–2–метил(1,1– 2H2)пропан–2–ола (Соединение 7)
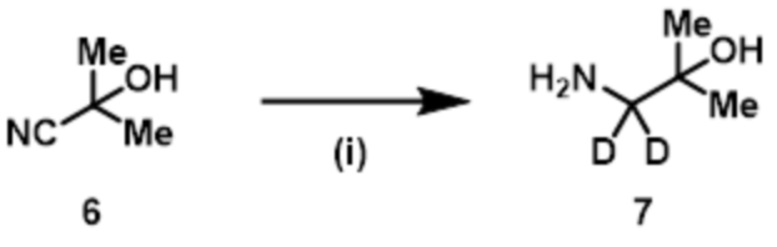
[0144]
Стадия (i):
К смеси литий алюминий дейтерида (1,0 г) и THF (20 мл) добавляли раствор ацетон цианогидрина (Соединение 6, 1,0 г) в THF (10 мл) по каплям в 0°C более чем 30 минут, и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционному раствору добавляли декагидрат сульфата натрия (6,0 г), и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали через Целит, и затем фильтрат концентрировали в вакууме с получением 1–амино–2–метил(1,1–2H2)пропан–2–ола (Соединение 7) в форме сырого продукта (0,9 г).
[0145]
Также Соединение 7 может быть получено с 2–метил–2–гидроксипропионамидом (Соединение 8) и литий алюминий дейтеридом подобным образом.
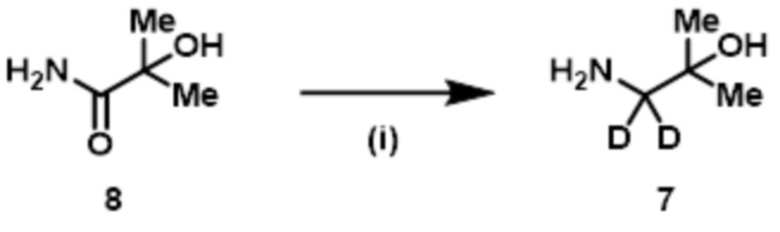
[0146]
Справочный пример 3: Получение 4–амино–2–метил(4,4– 2H2)бутан–2–ола (Соединение 11)
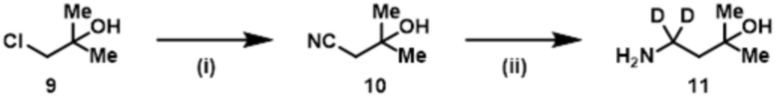
Стадия (i):
К смеси 1–хлор–2–метил–пропан–2–ола (Соединение 9, 523 мг), этанола (10 мл) и дистиллированной воды (2,0 мл) добавляли цианид натрия (283 мг), и смесь перемешивали при нагревании с обратным холодильником в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду для разделения слоев. Органический слой высушивали над сульфатом натрия и концентрировали в вакууме, получая Соединение 10 (250 мг).
[0147]
Стадия (ii):
К смеси литий алюминий дейтерида (159 мг) и THF (10 мл) добавляли раствор Соединения 10 (1,0 г) в THF (5,0 мл) по каплям при 0°C, и смесь перемешивали при комнатной температуре в течение еще 3 часов. К реакционному раствору добавляли декагидрат сульфата натрия (6,0 г), и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали через Целит, и затем фильтрат концентрировали в вакууме с получением 4–амино–2–метил(4,4–2H2)бутан–2–ола (Соединение 11) в форме сырого продукта (240 мг).
[0148]
Справочный пример 4: Получение 3–[амино( 2H2)метил]оксетан–3–ола (Соединение 14)
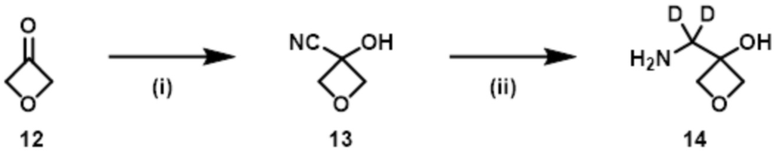
Стадия (i):
Смесь оксетан–3–она (Соединение 12, 464 мг), перхлората лития (685 мг) и триметилсилил цианида (1,0 мл) перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли хлороформ, и смесь фильтровали. Затем органический слой промывали водой, высушивали над сульфатом натрия и затем концентрировали в вакууме, получая Соединение 13 в форме сырого продукта (808 мг).
[0149]
Стадия (ii):
К суспензии литий алюминий дейтерида (297 мг) и THF (10 мл) добавляли раствор Соединения 13 (808 мг) в THF (10 мл) по каплям при 0°C, и смесь перемешивали при комнатной температуре в течение 5 часов. К реакционному раствору добавляли декагидрат сульфата натрия (2,0 г), и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали через Целит, и фильтрат концентрировали в вакууме с получением 3–[амино(2H2)метил]оксетан–3–ол (Соединение 14) в форме сырого продукта (632 мг).
[0150]
Справочный пример 5: Получение 6–(4–фторфенокси)–1H–бензимидазола (Соединение 18)
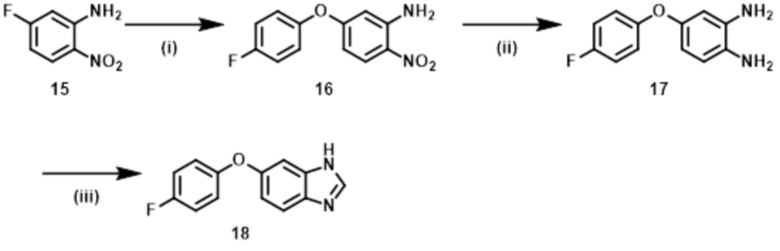
[0151]
Стадия (i):
Смесь 5–фтор–2–нитроанилина (Соединение 15, 100 мг), карбоната цезия (313 мг), 4–фторфенола (86 мг), и NMP (1,0 мл) перемешивали при 100°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и затем концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: гексан/этилацетат=1/1), получая Соединение 16 (124 мг).
[0152]
Стадия (ii):
Смесь Соединения 16 (124 мг), палладия на углероде (120 мг) и THF (5,0 мл) перемешивали в атмосфере водорода при комнатной температуре в течение 2 часов. Реакционный раствор фильтровали через Целит, и фильтрат концентрировали в вакууме, получая Соединение 17 (106 мг).
[0153]
Стадия (iii):
Смесь Соединения 17 (106 мг), моногидрата п–толуолсульфоновой кислоты (10 мг), триметил ортоформиата (0,3 мл) и метанола (5,0 мл) перемешивали при комнатной температуре в течение 2 часов и затем при 50°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: хлороформ/метанол=20/1) с получением 6–(4–фторфенокси)–1H–бензимидазола (Соединение 18, 82 мг).
[0154]
Справочный пример 6: Получение 6–{[5–(трифторметил)пиридин–2–ил]окси}–1H–бензимидазола (Соединение 21)
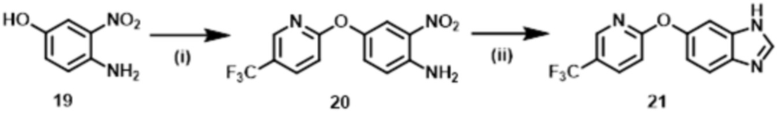
[0155]
Стадия (i):
Смесь 4–амино–3–нитрофенола (Соединение 19, 200 мг), карбоната цезия (458 мг), 2–фтор–5–(трифторметил)пиридина (130 мкл) и NMP (2,0 мл) перемешивали при комнатной температуре в течение 6 часов. Этилацетат и воду добавляли к реакционной смеси для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и затем концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: хлороформ/метанол=20/1), получая Соединение 20 (320 мг).
[0156]
Стадия (ii):
К раствору Соединения 20 (320 мг) в метаноле (6,0 мл) добавляли муравьиную кислоту (0,4 мл), триметил ортоформиат (3,0 мл) и порошок цинка (354 мг), и смесь перемешивали при 60°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли водный раствор бикарбоната натрия и этилацетат. Смесь фильтровали через Целит, и фильтрат разделяли на слои. Органический слой высушивали над сульфатом натрия и концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: хлороформ/метанол=30/1) с получением 6–{[5–(трифторметил)пиридин–2–ил]окси}–1H–бензимидазола (Соединение 21, 135 мг).
[0157]
Справочный пример 7: Получение 6–(4–хлорфенокси)–1H–бензимидазола (Соединение 24)
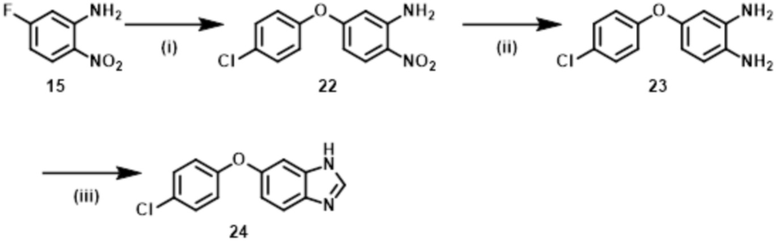
[0158]
Стадия (i):
Смесь 5–фтор–2–нитроанилина (Соединение 15, 100 мг), карбоната цезия (313 мг), 4–хлорфенола (99 мг) и NMP (1,0 мл) перемешивали при 100°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и затем концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: гексан/этилацетат=1/1), получая Соединение 22 (136 мг).
[0159]
Стадия (ii):
Смесь Соединения 22 (136 мг), сульфида платины на углероде (130 мг) и THF (5,0 мл) перемешивали в атмосфере водорода при комнатной температуре в течение 6 часов. Реакционный раствор фильтровали через Целит и концентрировали в вакууме, получая Соединение 23 (120 мг).
[0160]
Стадия (iii):
Смесь Соединения 23 (120 мг), моногидрата п–толуолсульфоновой кислоты (10 мг), триметил ортоформиата (0,3 мл) и метанола (5,0 мл) перемешивали при комнатной температуре в течение 2 часов и затем при 50°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: хлороформ/метанол=20/1) с получением 6–(4–хлорфенокси)–1H–бензимидазола (Соединение 24, 88 мг).
[0161]
Справочный пример 8: Получение 6–[4–(трифторметокси)фенокси]–1H–бензимидазола (Соединение 27)
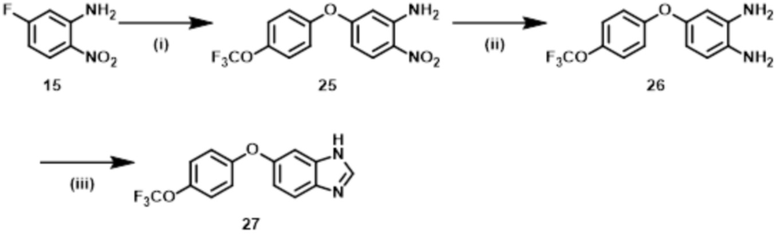
[0162]
Стадия (i):
Смесь 5–фтор–2–нитроанилина (Соединение 15, 100 мг), карбоната цезия (313 мг), 4–(трифторметокси)фенола (99 мкл) и NMP (1,0 мл) перемешивали при 100°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и затем концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: гексан/этилацетат=1/1), получая Соединение 25 (175 мг).
[0163]
Стадия (ii):
Смесь Соединения 25 (175 мг), палладия на углероде (150 мг) и THF (5,0 мл) перемешивали в атмосфере водорода при комнатной температуре в течение 6 часов. Реакционный раствор фильтровали через Целит и концентрировали в вакууме, получая Соединение 26 (152 мг).
[0164]
Стадия (iii):
Смесь Соединения 26 (120 мг), моногидрата п–толуолсульфоновой кислоты (10 мг), триметил ортоформиата (0,3 мл) и метанола (5,0 мл) перемешивали при комнатной температуре в течение 2 часов и затем при 50°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: хлороформ/метанол=20/1) с получением 6–[4–(трифторметокси)фенокси]–1H–бензимидазола (Соединение 27, 124 мг).
[0165]
Справочный пример 9: Получение 6–[2–метокси–4–(трифторметил)фенил]–1H–бензимидазола (Соединение 29)
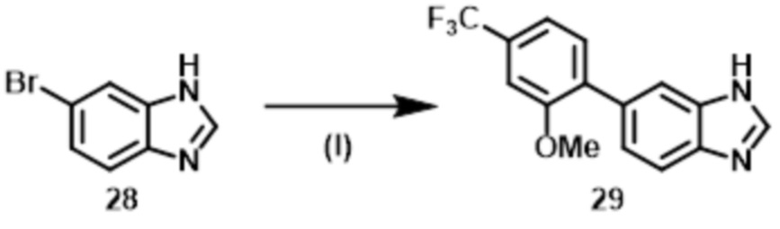
[0166]
Стадия (i):
Смесь 6–бромбензимидазола (Соединение 28, 100 мг), 2–метокси–4–(трифторметил)фенилбороновой кислоты (167 мг), тетракис(трифенилфосфин)палладия (26 мг), карбоната калия (210 мг), 1,4–диоксана (2,0 мл) и дистиллированной воды (0,5 мл) перемешивали при 100°C в течение 1 часа. Реакционный раствор охлаждали до комнатной температуры, загружали на силикагель и очищали колоночной хроматографией на силикагеле (элюирующий раствор: хлороформ/метанол=20/1) с получением 6–[2–метокси–4–(трифторметил)фенил]–1H–бензимидазола (Соединение 29, 86 мг).
[0167]
Сравнительный пример 1: Получение 1–[6–(4–фторфенокси)–1H–бензимидазол–1–ил]–2–метилпропан–2–ол
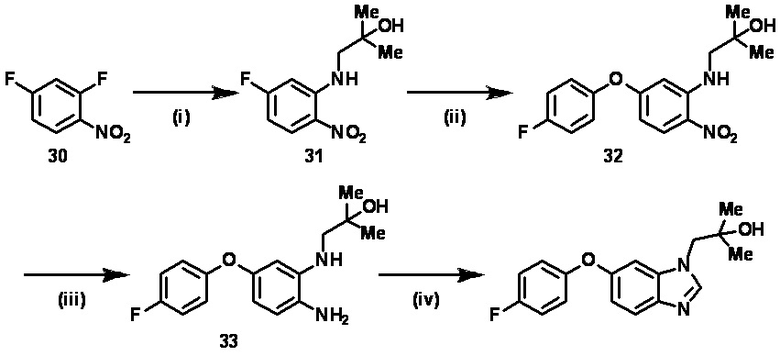
[0168]
Стадия (i):
Смесь 2,4–дифтор–1–нитробензола (Соединение 30, 1,6 г), 1–амино–2–метилпропан–2–ола (1,0 г), диизопропилэтиламина (5,2 мл), и DMF (50 мл) перемешивали при 60°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли воду, этилацетат и гексан для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и затем концентрировали в вакууме, получая Соединение 31 в форме сырого продукта.
[0169]
Стадия (ii):
Смесь сырого продукта Соединения 31, 4–фторфенола (1,7 г), карбоната цезия (6,5 г) и NMP (25 мл) перемешивали при 100°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли воду, этилацетат и гексан для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и затем концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: гексан/этилацетат=3/1), получая Соединение 32 (3,1 г).
[0170]
Стадия (iii):
Смесь Соединения 32 (3,1 г), формиата аммония (3,0 г), палладия на углероде (0,30 г) и метанола (47 мл) перемешивали при 50°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, фильтровали через Целит и концентрировали в вакууме. Насыщенный водный раствор бикарбоната натрия и этилацетат добавляли к остатку для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и затем концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: хлороформ/метанол=99/1), получая Соединение 33 (2,7 г).
[0171]
Стадия (iv):
Смесь Соединения 33 (600 мг), триметил ортоформиата (1,7 мл) и моногидрата п–толуолсульфоновой кислоты (79 мг) перемешивали при 60°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и добавляли насыщенный водный раствор бикарбоната натрия и этилацетат для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и затем концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: хлороформ/метанол=95/5) с получением 1–[6–(4–фторфенокси)–1H–бензимидазол–1–ил]–2–метилпропан–2–ола (410 мг).
1H–ЯМР (DMSO–d6) δ: 1,06 (6H, с), 4,08 (2H, с), 4,72 (1H, с), 6,87 (1H, m), 6,96–6,99 (2H, м), 7,17 (2H, м), 7,39 (1H, м), 7,62 (1H, м), 8,09 (1H, с).
[0172]
Сравнительный пример 2: Получение 2–метил–1–(6–{[5–(трифторметил)пиридин–2–ил]окси}–1H–бензимидазол–1–ил)пропан–2–ола
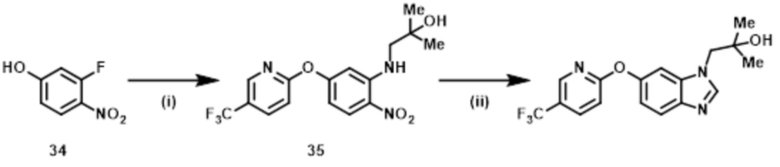
[0173]
Стадия (i):
Смесь 3–фтор–4–нитрофенола (Соединение 34, 1,0 г), диизопропилэтиламина (2,1 г), 1–амино–2–метилпропан–2–ола (0,7 г) и NMP (16 мл) перемешивали при 100°C в течение 4 часов. К реакционной смеси добавляли карбонат цезия (3,1 г) и 2–фтор–5–(трифторметил)пиридин (1,4 г), и смесь перемешивали при 100°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли воду, этилацетат и гексан для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и затем концентрировали в вакууме. Полученный остаток промывали из суспензии гексаном/этилацетатом (= 9/1), получая Соединение 35 (1,5 г).
[0174]
Стадия (ii):
К раствору Соединения 35 (500 мг) в метаноле (7,0 мл) добавляли муравьиную кислоту (0,5 мл), триметил ортоформиат (3,7 мл) и цинк (440 мг), и смесь перемешивали при 70°C в течение 2 часов. Реакционный раствор охлаждали до комнатной температуры и фильтровали через Целит. Фильтрат концентрировали в вакууме, и этилацетат и водный раствор соли Рошеля добавляли к остатку для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и концентрировали в вакууме. Полученный остаток перекристаллизовывали гексаном/этилацетатом (= 1: 5), получая 2–метил–1–(6–{[5–(трифторметил)пиридин–2–ил]окси}–1H–бензимидазол–1–ил)пропан–2–ол (330 мг).
1H–ЯМР (DMSO–d6) δ: 1,07 (6H, с), 4,11 (2H, с), 4,73 (1H, с), 7,00 (1H, м), 7,18 (1H, м), 7,56 (1H, м), 7,66 (1H, м), 8,13 (1H, с), 8,20 (1H, м), 8,54 (1H, м).
[0175]
Сравнительный пример 3: Получение 4–[6–(4–хлорфенокси)–1H–бензимидазол–1–ил]–2–метилбутан–2–ола
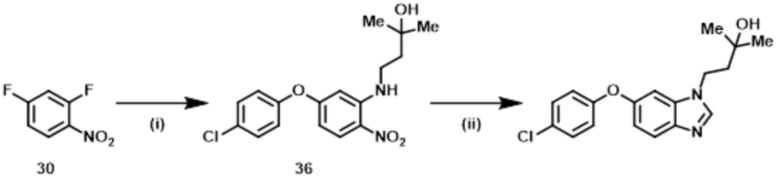
[0176]
Стадия (i):
Смесь 2,4–дифтор–1–нитробензола (Соединение 30, 200 мг), 4–амино–2–метилбутан–2–ола (136 мг), диизопропилэтиламина (263 мкл) и NMP (2,0 мл) перемешивали при 110°C в течение 30 минут. К реакционной смеси добавляли карбонат цезия (819 мг) и 4–хлорфенол (186 мг), и смесь перемешивали при 150°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и затем концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: гексан/этилацетат=1/1), получая Соединение 36 (350 мг).
[0177]
Стадия (ii):
К раствору Соединения 36 (350 мг) в метаноле (5,0 мл) добавляли муравьиную кислоту (0,4 мл), триметил ортоформиат (2,8 мл) и порошок цинка (326 мг), и смесь перемешивали при 60°C в течение 3 часов. Реакционный раствор охлаждали до комнатной температуры и фильтровали через Целит и концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: хлороформ/метанол=20/1).
Полученный сырой продукт перекристаллизовывали гексаном/этилацетатом (= 1: 1), получая 4–[6–(4–хлорфенокси)–1H–бензимидазол–1–ил]–2–метилбутан–2–ол (237 мг).
1H–ЯМР (CDCl3) δ: 1,30 (6H, с), 1,99–2,03 (2H, м), 4,28–4,32 (2H, м), 6,90–6,91 (2H, м), 6,98 (1H, дд, J=8,5, 2,4 Гц), 7,07 (1H, d, J=2,4 Гц), 7,26–7,27 (2H, м), 7,75 (1H, d, J=9,2 Гц), 8,12 (1H, с ушир.).
[0178]
Сравнительный пример 4: Получение 3–({6–[4–(трифторметокси)фенокси]–1H–бензимидазол–1–ил} метил)оксетан–3–ол
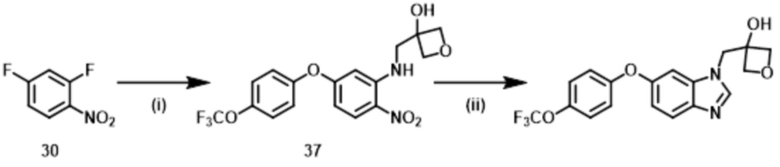
[0179]
Стадия (i):
Смесь 2,4–дифтор–1–нитробензола (Соединение 30, 17,1 г), 3–(аминометил)оксетан–3–ола (11,7 г), диизопропилэтиламина (24,2 мл) и NMP (110 мл) перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли карбонат цезия (45,6 г) и 4–(трифторметокси)фенол (14,6 мл), и смесь перемешивали при 120°C в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и затем концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: этилацетат). Сырой продукт промывали из суспензии гексаном/этилацетатом (= 3/1), получая Соединение 37 (10,2 г).
[0180]
Стадия (ii):
К раствору Соединения 37 (659 мг) в метаноле (8,0 мл) добавляли муравьиную кислоту (0,6 мл), триметил ортоформиат (4,5 мл) и порошок цинка (538 мг), и смесь перемешивали при 60°C в течение 2 часов. Реакционный раствор охлаждали до комнатной температуры, фильтровали через Целит и концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: хлороформ/метанол=20/1). Сырой продукт промывали из суспензии гексаном/этилацетатом (= 1: 1), получая 3–({6–[4–(трифторметокси)фенокси]–1H–бензимидазол–1–ил} метил)оксетан–3–ол (306 мг).
1H–ЯМР (CDCl3) δ: 3,82 (1H, с ушир.), 4,49 (2H, с), 4,55–4,63 (4–й, м), 6,92–6,96 (3H, м), 7,14 (2H, д, J=8,6 Гц), 7,20 (1H, д, J=1,8 Гц), 7,62 (1H, д, J=8,6 Гц), 7,94 (1H, с).
[0181]
Сравнительный пример 5: Получение 3–({6–[2–метокси–4–(трифторметил)фенил]–1H–бензимидазол–1–ил} метил)оксетан–3–ола
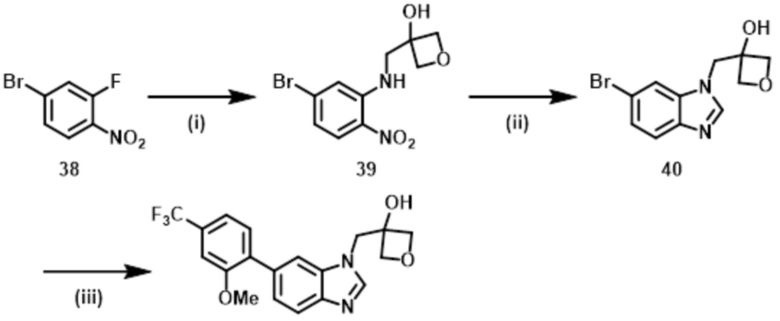
[0182]
Стадия (i):
Смесь 4–бром–2–фтор–1–нитробензола (Соединение 38, 26,2 г), 3–(аминометил)оксетан–3–ола (12,3 г), диизопропилэтиламина (31,2 мл) и NMP (180 мл) перемешивали при 100°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и затем концентрировали в вакууме. Полученный остаток промывали из суспензии гексаном/хлороформом (= 3/2), получая Соединение 39 (29,8 г).
[0183]
Стадия (ii):
К раствору Соединения 39 (22,0 г) в метаноле (200 мл) добавляли муравьиную кислоту (27,8 мл), триметил ортоформиат (120 мл) и порошок цинка (15,7 г), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор фильтровали через Целит и концентрировали в вакууме. Этилацетат и водный раствор соли Рошеля добавляли к полученному остатку для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и концентрировали в вакууме. Полученный остаток промывали из суспензии гептан/2–пропанол (= 4/3), получая Соединение 40 (19,1 г).
[0184]
Стадия (iii):
Смесь Соединения 40 (13,9 г), 2–метокси–4–(трифторметил)фенилбороновой кислоты (16,2 г), тетракис(трифенилфосфин)палладия (5,7 г), карбоната калия (20,4 г), 1,2–диметоксиэтана (180 мл) и дистиллированной воды (60 мл), перемешивали при 80°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и затем концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: хлороформ/метанол=20/1). Полученный сырой продукт перекристаллизовывали смесью гептан/2–пропанол (= 2/1) с получением 3–({6–[2–метокси–4–(трифторметил)фенил]–1H–бензимидазол–1–ил}метил)оксетан–3–ола (10,60 г).
1H–ЯМР (DMSO–d6) δ: 3,84 (3H, с), 4,42 (2H, д, J=6,7 Гц), 4,54 (2H, д, J=6,7 Гц), 4,59 (2H, с), 6,22 (1H, с), 7,33 (1H, дд, J=8,2, 1,5 Гц), 7,37–7,41 (2H, м), 7,55 (1H, д, J=7,9 Гц), 7,66 (1H, д, J=8,5 Гц), 7,84 (1H, с), 8,28 (1H, с).
[0185]
Пример 1: получение 1–[6–(4–фторфенокси)–1H–бензимидазол–1–ил]–2–метил(1,1–2H2)пропан–2–ол
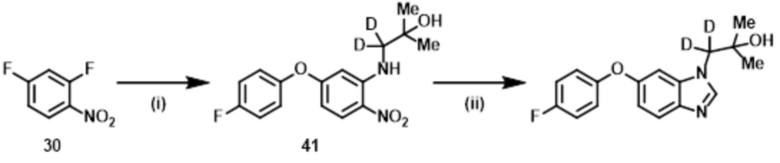
[0186]
Стадия (i):
Смесь 2,4–дифтор–1–нитробензола (Соединение 30, 1,1 г), сырого продукта Соединения 5 (Справочный пример 1) (1,2 г), диизопропилэтиламина (2,8 мл) и NMP (12 мл) перемешивали при комнатной температуре в течение 1 часа. Карбонат цезия (3,2–граммовый) и 4–фторфенол (1,0 г) добавляли к реакционной смеси, и смесь перемешивали при 100°C в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и затем концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: гексан/этилацетат=1/1), получая Соединение 41 в форме сырого продукта (2,7 г).
[0187]
Стадия (ii):
К раствору сырого продукта Соединения 41 (2,7 г) в метаноле (30 мл) добавляли муравьиную кислоту (2,5 мл), триметил ортоформиат (14,6 мл) и порошок цинка (2,2 г), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор фильтровали через Целит и концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: хлороформ/метанол=20/1). Сырой продукт промывали из суспензии гексаном/этилацетатом (= 1: 1), получая 1–[6–(4–фторфенокси)–1H–бензимидазол–1–ил]–2–метил(1,1–2H2)пропан–2–ол (960 мг).
1H–ЯМР (DMSO–d6) δ: 1,06 (6H, с), 4,72 (1H, с), 6,87 (1H, дд, J=8,5, 2,4 Гц), 6,96–7,00 (2H, м), 7,14–7,20 (2H, м), 7,39 (1H, д, J=2,4 Гц), 7,62 (1H, д, J=8,5 Гц), 8,08 (1H, с).
[0188]
Пример 2: получение 2–метил–1–(6–{[5–(трифторметил)пиридин–2–ил]окси}–1H–бензимидазол–1–ил)(1,1–2H2)пропан–2–ола
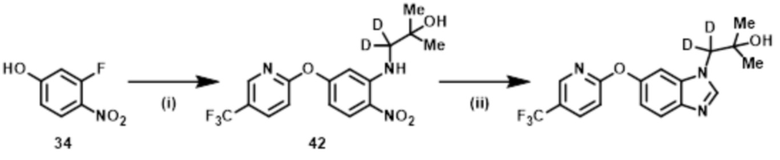
[0189]
Стадия (i):
Смесь 3–фтор–4–нитрофенола (Соединение 34, 2,1 г), сырого продукта Соединения 5 (Справочный пример 1) (2,0 г), диизопропилэтиламина (8,0 мл) и NMP (25 мл) перемешивали при 110°C в течение 4 часов. К реакционному раствору добавляли карбонат цезия (6,4 г) и 2–фтор–5–(трифторметил)пиридин (2,0 мл), и смесь перемешивали при 110°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и затем концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: гексан/этилацетат=1/1), получая Соединение 42 (3,7 г).
[0190]
Стадия (ii):
К раствору Соединения 42 (1,5 г) в метаноле (20 мл) добавляли муравьиную кислоту (1,5 мл), триметил ортоформиат (11,0 мл) и порошок цинка (1,3 г), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор фильтровали через Целит и концентрировали в вакууме. Этилацетат и водный раствор соли Рошеля добавляли к остатку для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и затем концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: хлороформ/метанол=20/1). Полученный сырой продукт перекристаллизовывали смесью гептан/2–пропанол (= 1/1) с получением 2–метил–1–(6–{[5–(трифторметил)пиридин–2–ил]окси}–1H–бензимидазол–1–ил)(1,1–2H2)пропан–2–ола (650 мг).
1H–ЯМР (DMSO–d6) δ: 1,07 (6H, с), 4,72 (1H, с), 7,00 (1H, дд, J=8,5, 2,4 Гц), 7,17 (1H, д, J=9,2 Гц), 7,56 (1H, д, J=2,4 Гц), 7,65 (1H, д, J=8,5 Гц), 8,13 (1H, с), 8,20 (1H, дд, J=9,2, 2,4 Гц), 8,55 (1H, д, J=2,4 Гц).
[0191]
Пример 3: получение 4–[6–(4–хлорфенокси)–1H–бензимидазол–1–ил]–2–метил(4,4–2H2)бутан–2–ола
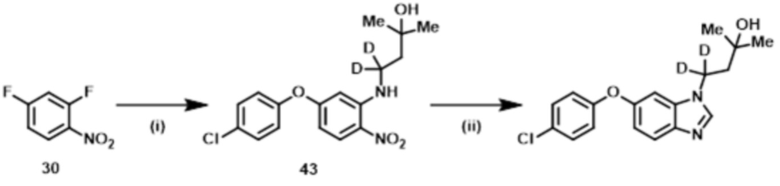
[0192]
Стадия (i):
Смесь 2,4–дифтор–1–нитробензола (Соединение 30, 149 мг), сырого продукта Соединения 11 (Справочный пример 3) (235 мг), диизопропилэтиламина (212 мкл) и NMP (2,0 мл) перемешивали при комнатной температуре в течение 1 часа. Карбонат цезия (457 мг) и 4–хлорфенол (156 мг) добавляли к реакционной смеси, и смесь перемешивали при 150°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: гексан/этилацетат=1/1), получая Соединение 43 (276 мг).
[0193]
Стадия (ii):
К раствору Соединения 43 (276 мг) в метаноле (4,0 мл) добавляли муравьиную кислоту (0,3 мл), триметил ортоформиат (1,7 мл) и порошок цинка (256 мг), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор фильтровали через Целит и концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: хлороформ/метанол=20/1). Сырой продукт промывали из суспензии гексаном/этилацетатом (= 1: 1), получая 4–[6–(4–хлорфенокси)–1H–бензимидазол–1–ил]–2–метил(4,4–2H2)бутан–2–ол (186 мг).
1H–ЯМР (DMSO–d6) δ: 1,13 (6H, с), 1,84 (2H, с), 4,47 (1H, с), 6,91 (1H, дд, J=8,5, 2,4 Гц), 6,95–6,99 (2H, м), 7,33 (1H, д, J=2,4 Гц), 7,36–7,41 (2H, м), 7,66 (1H, д, J=8,5 Гц), 8,23 (1H, с).
[0194]
Пример 4: получение 3–[{6–[4–(трифторметокси)фенокси]–1H–бензимидазол–1–ил}(2H2)метил]оксетан–3–ола
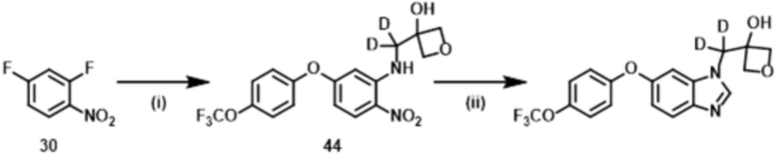
[0195]
Стадия (i):
Смесь 2,4–дифтор–1–нитробензола (Соединение 30, 261 мг), сырого продукта Соединения 14 (Справочный пример 4) (632 мг), диизопропилэтиламина (372 мкл) и NMP (3,0 мл) перемешивали при комнатной температуре в течение 2 часов. Карбонат цезия (801 мг) и 4–(трифторметокси)фенол (317 мкл) добавляли к реакционной смеси, и смесь перемешивали при 120°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат и воду. Органический слой промывали водой, высушивали над сульфатом натрия и концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: хлороформ/метанол=20/1), получая Соединение 44 (353 мг).
[0196]
Стадия (ii):
К раствору Соединения 44 (353 мг) в метаноле (4,0 мл) добавляли муравьиную кислоту (0,3 мл), триметил ортоформиат (1,9 мл) и порошок цинка (287 мг), и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор фильтровали через Целит и концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: хлороформ/метанол=20/1). Сырой продукт промывали из суспензии гексаном/этилацетатом (= 1: 1), получая 3–[{6–[4–(трифторметокси)фенокси]–1H–бензимидазол–1–ил}(2H2)метил]оксетан–3–ол (206 мг).
1H–ЯМР (DMSO–d6) δ: 4,37–4,49 (4H, м), 6,18 (1H, с), 6,94 (1H, дд, J=8,5, 2,4 Гц), 7,02–7,06 (2H, м), 7,34 (2H, д, J=9,1 Гц), 7,48 (1H, д, J=2,4 Гц), 7,65 (1H, д, J=8,5 Гц), 8,26 (1H, с).
[0197]
Пример 5: получение 3–[{6–[2–метокси–4–(трифторметил)фенил]–1H–бензимидазол–1–ил}(2H2)метил]оксетан–3–ола
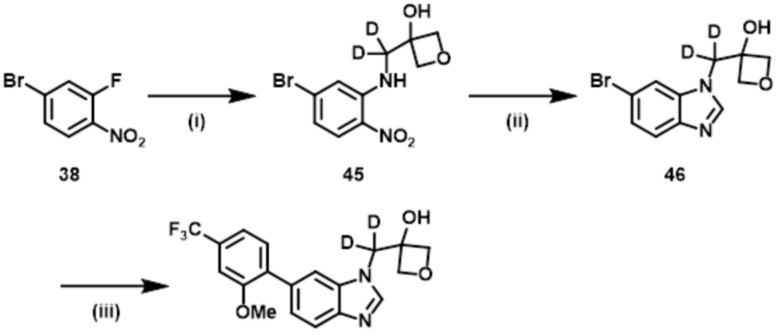
[0198]
Стадия (i):
Смесь 4–бром–2–фтор–1–нитробензола (Соединение 38, 228 мг), сырого продукта Соединения 14 (Справочный пример 4) (770 мг), диизопропилэтиламина (272 мкл) и NMP (2,0 мл) перемешивали при комнатной температуре в течение 3 часов. Этилацетат и воду добавляли к реакционной смеси для разделения слоев. Органический слой промывали водой, высушивали над сульфатом натрия и концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: хлороформ/метанол=20/1), получая Соединение 45 (275 мг).
[0199]
Стадия (ii):
К раствору Соединения 45 (275 мг) в метаноле (9,0 мл) добавляли муравьиную кислоту (0,3 мл), триметил ортоформиат (2,0 мл) и порошок цинка (295 мг), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор фильтровали через Целит и концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле (элюирующий раствор: хлороформ/метанол=20/1), получая Соединение 46 (184 мг).
[0200]
Стадия (iii):
Смесь Соединения 46 (184 мг), 2–метокси–4–(трифторметил)фенилбороновой кислоты (213 мг), тетракис(трифенилфосфин)палладия (75 мг), карбоната калия (268 мг), 1,4–диоксана (4,5 мл) и дистиллированной воды (1,5 мл), перемешивали при 100°C в течение 2 часов. Реакционный раствор охлаждали до комнатной температуры, загружали на силикагель и очищали колоночной хроматографией на силикагеле (элюирующий раствор: хлороформ/метанол=20/1). Полученный сырой продукт промывали из суспензии гексаном/этилацетатом (= 1/1) с получением 3–[{6–[2–метокси–4–(трифторметил)фенил]–1H–бензимидазол–1–ил}(2H2)метил]оксетан–3–ола (153 мг).
1H–ЯМР (DMSO–d6) δ: 3,84 (3H, с), 4,41–4,55 (4H, м), 6,22 (1H, с), 7,33 (1H, дд, J=8,5, 1,8 Гц), 7,37–7,41 (2H, м), 7,55 (1H, д, J=7,9 Гц), 7,66 (1H, д, J=8,5 Гц), 7,84 (1H, д, J=1,2 Гц), 8,28 (1H, с).
[0201]
Тест 1: Измерение тока ионов Na в экспрессирующей ген потенциалзависимого Na канала клетке
Ток Nav 1.7 измеряли в автоматизированном тесте фиксации потенциала с помощью клеток, стабильно экспрессирующих человеческий SCN9A.
[0202]
Клетки, стабильно экспрессирующие человеческий SCN9A
Индуцированные тетрациклином клетки, стабильно экспрессирующие SCN9A, были получены от ChanTest Corporation. Клетки пассировали в среде Хэма F–12, содержащей 10%–ю эмбриональную бычью сыворотку, 100 единиц/мл пенициллина–стрептомицина, 0,01 мг/мл бластицидина и 0,4 мг/мл зеоцина. За день до измерения среду заменяли средой Хэма F–12, содержащей 1 мкг/мл тетрациклина, 100 мкмоль/л бутирата натрия, 10%–ю эмбриональную бычью сыворотку и 100 единиц/мл пенициллина–стрептомицина. На следующий день ток ионов Na измеряли автоматизированным тестом фиксации потенциала.
[0203]
Электрофизиологическое измерение тока ионов Na
Ток ионов Na измеряли автоматизированным тестом фиксации потенциала с использованием следующего внеклеточного раствора и внутриклеточного раствора.
[0204]
Внеклеточный раствор (ммоль/л): NaCl 130, MgCl2 2, CaCl2 2, CdCl2 0,1, NiCl2 0,1, Тетраэтиламмоний–Cl 18, 4–аминопиридин 1, HEPES 10, (pH 7,4 с помощью NaOH)
[0205]
Внутриклеточный раствор (ммоль/л): CsF 120, EGTA 10, NaCl 15, HEPES 10, (pH 7,2 с помощью CsOH)
[0206]
Контроль стимулирующего импульса и получение данных осуществляли с использованием усилителя EPC10 и программного обеспечения Patch Master Software (HEKA). Данные собирали при 10 кГц и отфильтровывали через фильтр нижних частот при 3 кГц. Все измерения осуществляли при комнатной температуре. Исходный потенциал был установлен на потенциале, инактивирующем каналов 50% Nav 1.7 (приблизительно –60 мВ), и деполяризующий импульс 20 миллисекунд (+10 мВ) давали один раз. Степень ингибирования тестируемых соединений вычисляли на основе результатов клеток, максимальный ток которых составлял 500 Па или более при подаче импульса деполяризации и чей цельноклеточный параметр не значительно варьировал до конца получения данных. Степень ингибирования тестируемых соединений в отношении тока ионов Na вычисляли согласно следующей вычислительной формуле с пиковым значением тока, сгенерированным на основе импульса деполяризации.
Степень ингибирования тока ионов Na (%) = 100 x [(Значение пикового тока в отсутствие Тестируемого Соединения) – (Значение пикового тока в присутствии Тестируемого Соединения)] / (Значение пикового тока в отсутствие Тестируемого Соединения)
[0207]
Результат:
Оценивали степень ингибирования тока ионов Na для соединений из Примеров 1–5. Результаты показали, что соединения согласно настоящему изобретению показывают ингибирующее действие в отношении Nav 1.7. Степень ингибирования (%), при которой концентрация каждого соединения составляет 10 мкмоль/л, показана в следующей таблице.
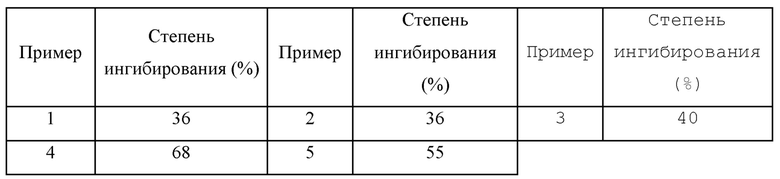
[0208]
Анализ 2: Оценка аналгезирующего эффекта на модели стрептозотоцин–индуцированной диабетической периферической нейропатической боли
Используя некоторые типичные соединения среди соединений согласно настоящему изобретению, ингибирующее действие в отношении нейропатической боли определяли посредством оценки аналгезирующего эффекта на крысиной модели стрептозотоцин (STZ)–индуцированной диабетической периферической нейропатии.
Животная модель заболевания была получена посредством частично модифицированного способа Fox et al. (Pain 81, 307–316, 1999). STZ вводили внутрибрюшинно самцам крыс Wistar в возрасте 9 недель в количестве 45 мг/кг массы тела для получения модели животных, страдающей диабетической периферической нейропатией.
Аналгезирующий эффект оценивали в тесте фон Фрэя. В частности, механическую чувствительность измеряли путем применения нитей (нити фон Фрэя) на плантарную поверхность задней лапы животного, и затем пороги реакции (50%–е пороги отдергивания лапы) на механическую стимуляцию определяли при помощи формулы на основе Chaplan et al. (Journal of Neuroscience Methods 53, 55–63, 1994).
В предварительном исследовании уже было подтверждено, что пороги реакции задней лапы животного заметно уменьшались на 21–й день или позже после введения STZ, следовательно, оценку аналгезирующего эффекта с помощью тестируемых соединений делали в любой день между 21–м днем и 30–м днем после введения STZ. За один и два дня перед оценкой тестируемых соединений, пороги реакции измеряли для получения среднего числа, и среднее значение использовали в качестве референсного значения, полученного перед введением тестируемых соединений.
Для уменьшения вариативности усредненных значений среди тестируемых групп и измеренных значений в каждой группе, животных разделяли на 4–5 групп.
В тесте для оценки качества тестируемых соединений пороги реакции измеряли после введения каждого тестируемого соединения. За один час до измерения порогов реакции, каждое тестируемое соединение перорально вводили в количестве 3 мг/кг массы тела. Сила аналгезирующего эффекта каждого тестируемого соединения выражается как увеличение ширины (g) порогов реакции, которое получают формулой вычисления (порог реакции, полученный после введения тестируемого соединения) – (порог реакции, полученный до введения тестируемого соединения).
[0209]
Результат:
Увеличение ширины порога реакции для соединения Примера 2 составляла 5,0 г. Увеличение ширины в группе введения растворителя в настоящем тесте составляла 0,1 г.
Указанный результат показывает, что соединения согласно настоящему изобретению демонстрируют хорошие аналгезирующие эффекты, когда соединения перорально вводят в крысиной модели диабетической периферической нейропатии.
[0210]
Анализ 3: Тестирование метаболической стабильности в микросоме печени
К раствору, полученному путем смешивания 4 мкл микросомы печени человека или крысы (производства Xenotech, 20 мг/мл), 100 мкл 100 мМ фосфатного буферного раствора (pH 7,4) и 74 мкл ультрачистой воды добавляли 2 мкл 1 мкМ раствора тестируемого соединения в DMSO и дополнительные 40 мкл 10 мМ водного раствора NADPH (производства Oriental Yeast Co., ltd.), и затем смесь инкубировали при 37°C в течение 30 минут. После инкубации 50 мкл реакционного раствора добавляли к метанолу для остановки метаболической реакции. Раствор после остановки реакции центрифугировали при 4°C и 4500 об/мин в течение 5 минут, и супернатант отфильтровывали. 100 мкл супернатанта смешивали с 100 мкл 10 мМ водного раствора ацетата аммония, и смесь анализировали с помощью LC (Shimadzu, NexeraX2) – MS (AB Sciex, TripleTOF5600) для определения количества соответствующего продукта метаболита в смеси.
[0211]
Результат:
Что касается соединений, полученных в Сравнительных примерах 1–3 и Примерах 1–3, были протестированы соответствующие продукты метаболита (Справочный пример 5–7). Результаты показали, что скорость генерации продукта метаболита соединения каждого из Примеров была ниже, чем в случае соединения каждого Сравнительного примера. Каждая скорость генерации каждого продукта метаболита (пмоль/мин/мг белка) показана в следующей таблице.
[0212]
Анализ 4: Крыса фармакокинетическое исследование
Тестируемое соединение суспендировали в 0,5% водном растворе метилцеллюлозы, который вводили самцу крысы (Crl: CD (SD)) в дозе 3 мг/5 мл/кг. Взятие крови осуществляли через 0,25, 0,5, 1, 2, 4, 6 и 24 часа после введения. Взятие крови (каждый раз по 0,4 мл) осуществляли шприцем, содержащим 4 мкл HEPARIN NOVO. Собранную кровь переносили в холодную пробирку для центрифугирования и центрифугировали при 4°C при 3000 об/мин х 10 минут для получения плазмы. К 50 мкл полученной плазмы добавляли метанол, и смесь перемешивали миксером Vortex и затем центрифугировали при 4°C приблизительно при 9100 х g в течение 5 минут. 150 мкл супернатанта смешивали с 300 мкл воды, и смесь центрифугировали при 4°C приблизительно при 1800 х g в течение 5 минут. Супернатант анализировали с помощью LC (Shimadzu, ряд) – MS (AB Sciex, API4000) для определения количества соответствующего продукта метаболита.
[0213]
Результат:
Что касается соединений, полученных в Сравнительных примерах 2 и 3 и Примерах 2 и 3, тестировали каждую концентрацию продуктов метаболита после введения самцу крысы. Результаты показали, что экспонирование соответствующего продукта метаболита (Справочный пример 6 и 7) соединения каждого Примера было меньше, чем в случае соединения каждого Сравнительного примера. Каждый фармакокинетический параметр продуктов метаболита показан в следующей таблице, в которой Cmax обозначает максимальную плазменную концентрацию, и AUC обозначает область под кривой концентрация в плазме – время от 0 до 24 часов.
(ng/mL)
(ng/h/mL)
Промышленная применимость
[0214]
Соединения согласно настоящему изобретению могут использоваться в качестве лекарственного средства для лечения заболевания, в котором задействован Nav 1.7, например, нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии малых волокон, эритромелалгии, пароксизмального экстремального болевого расстройства, дизурии и рассеянного склероза. Таким образом соединения согласно настоящему изобретению могут быть очень полезными фармацевтическими средствами.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВОЕ СОЕДИНЕНИЕ БЕНЗИМИДАЗОЛОНА И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2803938C2 |
| СОЕДИНЕНИЕ, НАЦЕЛЕННОЕ НА БЕЛОК И ЕГО ДЕГРАДАЦИЮ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2829459C1 |
| N1-(4-(5-(ЦИКЛОПРОПИЛМЕТИЛ)-1-МЕТИЛ-1H-ПИРАЗОЛ-4-ИЛ)ПИРИДИН-2-ИЛ)ЦИКЛОГЕКСАН-1,4-ДИАМИНОВЫЕ ПРОИЗВОДНЫЕ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ СK1 И/ИЛИ IRAK1 ДЛЯ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2761457C2 |
| ИНГИБИТОР CD73, МЕТОД ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2787428C1 |
| ЗАМЕЩЕННЫЕ ПИРРОЛО [2,3-b] ПИРИДИН И ПИРАЗОЛО [3,4-b] ПИРИДИНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2020 |
|
RU2824583C2 |
| ДЕЙТЕРИРОВАННЫЕ БЕНЗИЛБЕНЗОЛЬНЫЕ ПРОИЗВОДНЫЕ И СПОСОБЫ ПРИМЕНЕНИЯ | 2009 |
|
RU2509773C2 |
| ИНГИБИТОР, ПРЕДСТАВЛЯЮЩИЙ СОБОЙ ПРОИЗВОДНОЕ ПИРИДАЗИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2807611C2 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ СЕЛЕКТИВНЫХ ИНГИБИТОРОВ КИСЛОТНОЙ ПОМПЫ | 2007 |
|
RU2412188C2 |
| ЦЕФАЛОСПОРИНОВОЕ АНТИБАКТЕРИАЛЬНОЕ СОЕДИНЕНИЕ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2021 |
|
RU2831014C1 |
| FGFR И ЕГО ИНГИБИТОР МУТАЦИЙ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2811207C1 |
Изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли, фармацевтической композиции и лекарственному средству на его основе для лечения заболевания, в котором задействован Nav 1.7 (SCN9A), выбранного из нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии малых волокон, эритромелалгии, пароксизмального экстремального болевого расстройства, дизурии или рассеянного склероза, а также способу лечения таких заболеваний с его использованием. В общей формуле (I) R1a, R1c и R1d обозначают водород, R1b означает C6 арил, C6 арилокси или 6-членный гетероарилокси, причем арил и арильная группа в арилокси и гетероарильная группа в гетероарилокси могут быть независимо замещены 1-2 заместителями, выбранными независимо из группы, состоящей из галогена, C1-4 алкила, в случае необходимости замещенного 1-3 заместителями, выбранными независимо из Группы заместителей A, и C1–4 алкокси, в случае необходимости замещенного 1-3 заместителями, выбранными независимо из Группы заместителей A; R4 обозначает водород, m=0 или 1, L обозначает CR7R8, R7 и R8 обозначают водород; или R2 и R3 обозначают метил или вместе с атомом углерода, к которому они присоединены, образуют группу формулы (II) с -OR4; в формуле (II) e и f обозначают 1, R4 имеет определенное выше значение, V обозначает атом кислорода, R5a, R5b, R5c и R5d обозначают водород, Группа заместителей A является независимо галогеном, и любые 1-6 атомов водорода в соединении формулы (I) могут быть заменены атомами дейтерия. 6 н. и 5 з.п. ф-лы, 5 пр.
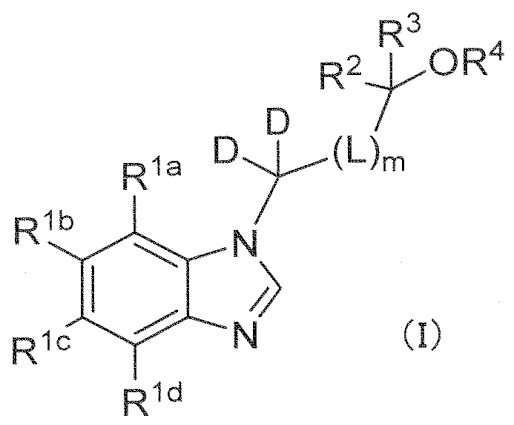
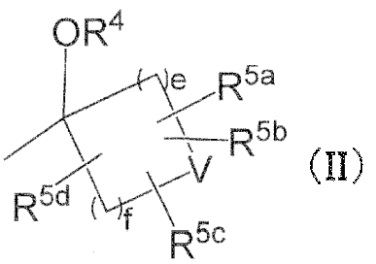
1. Соединение формулы (I)
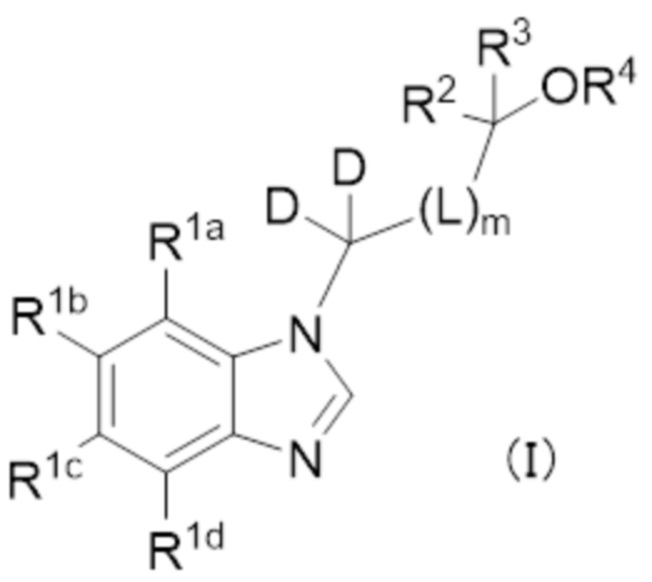
или его фармацевтически приемлемая соль, где
R1a, R1c и R1d обозначают водород,
R1b означает C6 арил, C6 арилокси или 6–членный гетероарилокси, причем арил и арильная группа в арилокси и гетероарильная группа в гетероарилокси могут быть независимо замещены 1–2 заместителями, выбранными независимо из группы, состоящей из галогена, C1–4 алкила, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A, и C1–4 алкокси, в случае необходимости замещенного 1–3 заместителями, выбранными независимо из Группы заместителей A;
R4 обозначает водород,
m=0 или 1,
L обозначает CR7R8,
R7 и R8 обозначают водород, или
R2 и R3 обозначают метил или вместе с атомом углерода, к которому они присоединены, образуют следующую группу формулы (II) с –OR4
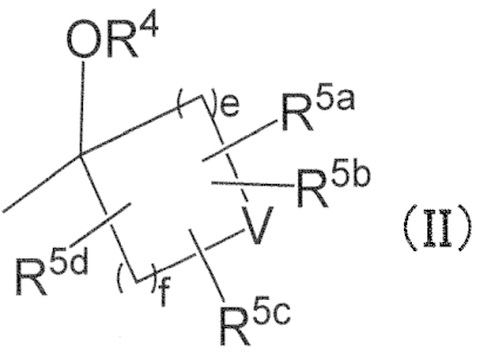
в формуле (II) e и f обозначают 1,
R4 имеет определенное выше значение,
V обозначает атом кислорода,
R5a, R5b, R5c и R5d обозначают водород,
Группа заместителей A является независимо галогеном,
и любые 1–6 атомов водорода в соединении формулы (I) могут быть заменены атомами дейтерия.
2. Соединение по п. 1 или его фармацевтически приемлемая соль, где
R2 и R3 обозначают метил.
3. Соединение по п. 1 или его фармацевтически приемлемая соль, где
R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют следующую группу формулы (IIb) с –OR4
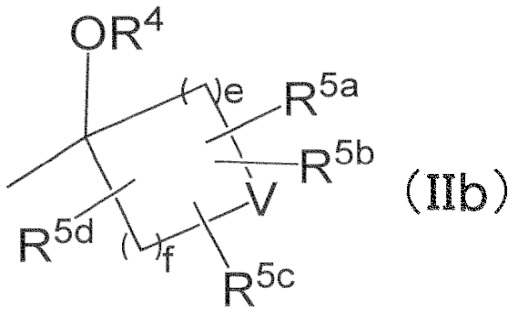
в формуле (IIb) e и f обозначают 1,
R4 обозначает водород,
V обозначает атом кислорода,
R5a, R5b, R5c и R5d обозначают водород.
4. Соединение по п.1 или его фармацевтически приемлемая соль, выбранное из следующих соединений:
1-[6–(4–фторфенокси)–1H–бензимидазол–1–ил]–2–метил(1,1–2H2)пропан–2–ол,
2–метил–1–(6–{[5–(трифторметил)пиридин–2–ил]окси}–1H–бензимидазол–1–ил)(1,1–2H2)пропан–2–ол,
4–[6–(4–хлорфенокси)–1H–бензимидазол–1–ил]–2–метил(4,4–2H2)бутан–2–ол,
3–[{6–[4–(трифторметокси)фенокси]–1H–бензимидазол–1–ил}(2H2)метил]оксетан–3–ол и
3–[{6–[2–метокси–4–(трифторметил)фенил]–1H–бензимидазол–1–ил}(2H2)метил]оксетан–3–ол.
5. Соединение по п.1 или его фармацевтически приемлемая соль, выбранное из следующих соединений:
1-[6–(4–фторфенокси)–1H–бензимидазол–1–ил]–2–метил(1,1–2H2)пропан–2–ол,
2–метил–1–(6–{[5–(трифторметил)пиридин–2–ил]окси}–1H–бензимидазол–1–ил)(1,1–2H2)пропан–2–ол и
4–[6–(4–хлорфенокси)–1H–бензимидазол–1–ил]–2–метил(4,4–2H2)бутан–2–ол.
6. Соединение по п.1 или его фармацевтически приемлемая соль, выбранное из следующих соединений:
3–[{6–[4–(трифторметокси)фенокси]–1H–бензимидазол–1–ил}(2H2)метил]оксетан–3–ол и
3–[{6–[2–метокси–4–(трифторметил)фенил]–1H–бензимидазол–1–ил}(2H2)метил]оксетан–3–ол.
7. Фармацевтическая композиция для лечения заболевания, в котором задействован Nav 1.7 (SCN9A), содержащая терапевтически эффективное количество соединения по любому из пп. 1–6 или его фармацевтически приемлемой соли и фармацевтически приемлемые добавки.
8. Лекарственное средство для лечения заболевания, в котором задействован Nav 1.7 (SCN9A), содержащее терапевтически эффективное количество соединения по любому из пп. 1–6 или его фармацевтически приемлемой соли в качестве активного ингредиента.
9. Лекарственное средство для лечения заболевания, в котором задействован Nav 1.7 (SCN9A), выбранного из нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии малых волокон, эритромелалгии, пароксизмального экстремального болевого расстройства, дизурии или рассеянного склероза, содержащее терапевтически эффективное количество соединения по любому из пп. 1–6 или его фармацевтически приемлемой соли в качестве активного ингредиента.
10. Применение соединения по любому из пп. 1–6 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения заболевания, в котором задействован Nav 1.7 (SCN9A), выбранного из нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии малых волокон, эритромелалгии, пароксизмального экстремального болевого расстройства, дизурии или рассеянного склероза.
11. Способ лечения заболевания, в котором задействован Nav 1.7 (SCN9A), выбранного из нейропатической боли, ноцицептивной боли, воспалительной боли, нейропатии малых волокон, эритромелалгии, пароксизмального экстремального болевого расстройства, дизурии или рассеянного склероза, включающий введение терапевтически эффективного количества соединения по любому из пп. 1–6 или его фармацевтически приемлемой соли нуждающемуся в этом млекопитающему.
| Токарный резец | 1924 |
|
SU2016A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| JP 2014114221 A, 26.06.2014 | |||
| ПРОИЗВОДНЫЕ АРИЛАМИДОВ В КАЧЕСТВЕ БЛОКАТОРОВ TTX-S | 2011 |
|
RU2535671C1 |
Авторы
Даты
2023-09-27—Публикация
2018-03-14—Подача