Область техники
Изобретение относится к химической технологии, а именно к способу утилизации и переработки электродных материалов химических источников тока, включая, но не ограничиваясь, литий-, натрий-, калий- ионными аккумуляторами и может быть использовано для получения вторичных материальных ресурсов.
Уровень техники
Развитие различных областей науки и техники связано с появлением ряда портативных устройств, использование которых невозможно без применения химических источников тока (ХИТ), в том числе аккумуляторных батарей (аккумуляторов). В силу ряда фундаментальных особенностей (наличие дефектов кристаллической структуры, частичная аморфизация соединений, образование изолирующих слоёв, состоящих из продуктов разложения электролита) подавляющее большинство электродных материалов демонстрируют ухудшение их рабочих характеристик, в частности, снижение электрохимической емкости аккумулятора. Этот факт делает крайне актуальной задачу утилизации значительного количества ХИТ, утративших способность выполнять свои функции. Кроме того, постоянно растущее потребление ХИТ различных габаритов и форм-факторов неминуемо приведёт к образованию значительного количества отходов, содержащих токсичные элементы. В то же время использованные аккумуляторы, в частности их электродные ленты, можно рассматривать как обогащённое сырье, пригодное для вовлечения во вторичный оборот.
Общепринятая классификация методов переработки отходов ХИТ включает в себя следующие группы методов [Harper G. et al. Recycling lithium-ion batteries from electric vehicles //Nature. – 2019. – Т. 575. – №. 7781. – С. 75-86; Steward D., Mayyas A., Mann M. Economics and challenges of Li-ion battery recycling from end-of-life vehicles //Procedia Manufacturing. – 2019. – Т. 33. – С. 272-279; Valio J. et al. Critical review on Li ion battery recycling technologies. – 2017.]:
Гидрометаллургические методы. Данный набор методик подразумевает выделение требуемых элементов/компонентов из руд, концентратов и вторичных ресурсов производства с помощью водных растворов химических реагентов. Методы такого рода применяются для переработки материалов использованных аккумуляторов всех типов. Основными реагентами являются серная, соляная и азотная кислоты, водный раствор аммиака (NH3·H2O), растворы гидроксидов натрия (NaOH) и калия (KOH).
Примером реализации метода, относящегося к данной группе, является технология, описанная в патенте US 7820317 B2.
Недостатком данного способа утилизации материалов ХИТ является то, что использование концентрированной серной кислоты приводит к неизбежному выделению в атмосферу соединений серы, использование аммиака сопряжено с трудностями, связанными с его летучестью и проблематичностью регенерации.
Ещё одним примером применения гидрометаллургических методов является решение, описанное в документе CN 112225260 A. Процесс, описанный в изобретении, предлагается применять только для литий-ионных аккумуляторов (далее – ЛИА), материалом катода которого является чистый оксид лития-кобальта LiCoO2.
Пирометаллургические методы. Метод пирометаллургической переработки заключается в высокотемпературном восстановлении соединений, входящих в состав ХИТ. Преимуществом данной группы методов является отсутствие необходимости предварительной подготовки сырья.
Конечными продуктами пирометаллургического процесса являются сплавы металлов, шлак и газы. Сплавы подвергают дальнейшей обработке, в том числе гидрометаллургическими методами, что обеспечивает разделение искомых компонентов/элементов. Шлак, в общем случае, может содержать такие металлы как алюминий, марганец, литий, которые также можно выделить в виде индивидуальных соединений и применить в последующем синтезе электродных материалов ХИТ.
При сжигании отработанных ХИТ выделяется дополнительное количество теплоты за счёт сгорания полимерного сепаратора, органических составляющих электролита, полимерных составляющих корпуса ХИТ, что снижает энергоёмкость процесса. Технологические стадии данного метода исключают возможность селективного выделения составляющих электролита, полимерных составляющих ХИТ.
Известны изобретения, описывающие реализацию пирометаллургического метода, в частности US8840702, EP1589121 B1, WO2018073145, WO2021104620 A1.
Недостатками металлургических подходов являются: (i) образование токсичных газов при окислении составляющих электролита, в том числе, но не ограничиваясь HF, PO3F [Tanaka F. et al. Dehydrofluorination behavior of poly (vinylidene fluoride) during thermal treatment using calcium carbonate //Thermochimica Acta. – 2021. – Т. 702. – С. 178977; Jie Y. et al. Gas evolution characterization and phase transformation during thermal treatment of cathode plates from spent LiFePO4 batteries //Thermochimica Acta. – 2020. – Т. 684. – С. 178483.]; (ii) необходимость сжигания большого количества полимерных фракций, которые могут быть также вовлечены во вторичный оборот. Методы применяются для переработки отработанных ЛИА с целью выделения наиболее ценных компонентов: кобальта и никеля в виде солей или индивидуальных металлов.
Механические методы (методы прямого выделения, методы прямого рециклинга). В основе группы методов лежит механическая разборка отработанного ХИТ с последующим отделением материалов отрицательного и положительного электродов и их использованием в аналогичной ячейке. В подавляющем большинстве случаев предварительная сортировка и разборка отработанного ХИТ может быть осуществлена только вручную, что связано со значительными отличиями различных ХИТ между собой, в первую очередь в материалах положительного электрода, а также значительными отличиями в форм-факторах ячеек различных производителей. Данная группа методов нашла нишевое применение, их доля на рынке мала [Harper, G., Sommerville, R., Kendrick, E., Driscoll, L., Slater, P., Stolkin, R., Walton, A., Christensen, P., Heidrich, O., Lambert, S., Abbott, A., Ryder, K., Gaines, L., Anderson, P. (2019). Recycling lithium-ion batteries from electric vehicles. Nature, 575(7781), 75-86.].
Из близких с точки зрения химии работ, связанных с реализацией такого рода процессов (процессов вскрытия), можно отметить следующие публикации. В [Nakamoto, K., Kano, Y., Kitajou, A., & Okada, S. (2016). Electrolyte dependence of the performance of a Na2FeP2O7//NaTi2(PO4)3 rechargeable aqueous sodium-ion battery. Journal of Power Sources, 327, 327-332.] H2O2 (30 масс. %) в смеси с концентрированной HCl была использована для вскрытия пробы соединения NaTi2(PO4)3 для дальнейшего проведения элементного химического анализа, однако, данная смесь реагентов была применена для крайне малых количеств веществ.
Известны способы извлечения ванадия из необогащённого сырья, например [SU256261 или RU2080403 C1. Методика включает в себя следующие стадии: дробление, магнитная сепарация, измельчение, смешивание с известняком (CaCO3), окислительный обжиг, выщелачивание огарка с последующим гидролитическим осаждением и получение пасты технического оксида ванадия (V). Недостатком данного метода применительно к многокомпонентным системам, используемым в МИА, является неизбежное формирование устойчивых соединений, содержащих ванадий в степенях окисления 4+ и/или 5+ и фосфат- и/или пирофосфат-анион, например, VOPO4, (VO)2P2O7. Кроме того, обжиг в случае фторсодержащих соединений будет неминуемо приводить к образованию токсичных газов, в том числе, но не ограничиваясь, HF. Отметим также, что подавляющее большинство описанных на данный момент изобретений, связанных с извлечением ванадия из природного сырья слабо применимы к оксо- и полианионным соединениям, используемым в МИА, в силу указанных выше причин.
Таким образом, разработка новых методов переработки материалов ХИТ, в том числе связанных с уменьшением энергозатрат, уменьшением количества выбросов токсичных газов, снижением количества использования едких кислот и щелочей является необходимой и по сей день. Кроме того, разработка такого рода методов является важной составляющей формирования экономики замкнутого цикла.
Раскрытие изобретения
Задачей настоящего изобретения является разработка методики переработки соединений ванадия и/или титана, используемых в металл-ионных аккумуляторах (далее – МИА), в частности, литий-, натрий-, калий-ионных (далее – ЛИА, НИА, КИА, соответственно).
Поставленная задача решается при осуществлении предлагаемого способа переработки электродного материала металл-ионного аккумулятора, причем металл-ионный аккумулятор включает токосъёмник с нанесенным на него электродным материалом, а активный компонент электродного материала характеризуется составом AnVy(PO4)m(FxOz), где:
- n, m, y – действительные числа, причем n = 1-3, y = 1-2, m = 1-3;
- x и z – действительные числа, причем x = 0-3, z = 0-3 и x+z ≤ 3;
- катион A представляет собой Li, Na или K,
включающий следующие стадии:
а) механическое отделение электродного материала от токосъемника металл-ионного аккумулятора;
б) растворение электродного материала в сернокислом водном растворе пероксида водорода, и/или растворе неорганической соли-окислителя в кислой или щелочной среде, и/или растворе органического комплексообразующего реагента в кислой или щелочной среде, при температуре 20-95°C;
в) выделение оксидов и/или солей ванадия, в том числе гидратированных;
г) химическое связывание анионов в нерастворимые соединения путем добавления растворимой соли щелочноземельного металла.
В частных вариантах воплощения изобретения между стадиями а) и б) проводится отжиг использованного электродного материала при температурах 100-800°C.
В частных вариантах воплощения изобретения между стадиями а) и б) проводится предварительное промывание использованного электродного материала слабокислым раствором с pH 5÷6.9 или слабощелочным раствором с pH 7.1÷9.
В частных вариантах воплощения изобретения неорганическая соль-окислитель на стадии б) представляет собой AClO3, AClO, ANO3, ANO2, A2S2O8, или AHSO5, где А представляет собой Li, Na, K или NH4.
В частных вариантах воплощения изобретения органический комплексообразующий реагент на стадии б) представляет собой карбоксилат, амин или тиол.
В частных вариантах воплощения изобретения выделение соединений ванадия на стадии в) осуществляют путем изменения pH и температуры раствора. Более конкретно, изменение рН осуществляются посредством добавления концентрированной серной кислоты.
В частных вариантах воплощения изобретения выделение соединений ванадия на стадии в) осуществляют путем использования соединения, содержащего анионы, которые приводят к образованию нерастворимых соединений при добавлении к солям ванадия. В частных вариантах воплощения изобретения выделение соединений ванадия на стадии в) осуществляют путем использования замены водного растворителя на органический растворитель с меньшей полярностью.
В частных вариантах воплощения изобретения раствор, полученный на стадии б), очищают фильтрацией, декантацией и/или центрифугированием. Более конкретно, водным растворителем является вода. В некоторых вариантах воплощения изобретения, органический растворитель с меньшей полярностью представляет собой спирт, эфир, углеводород или сульфосодержащий растворитель.
В частных вариантах воплощения изобретения соль щелочноземельного металла на стадии г) представляет собой соль кальция, магния, стронция, бария или их смесь.
В частных вариантах воплощения изобретения токосъёмник представляет собой алюминиевую, титановую, никелевую или медную фольгу.
В частных вариантах воплощения изобретения активный компонент электродного материала характеризуется составом Na3V2(PO4)2F3, LiVPO4F, KVPO4F, LiVOPO4, NaVOPO4, KVOPO4 или Na3V2(PO4)3.
В частных вариантах воплощения изобретения стадия а) осуществляется в инертной атмосфере.
Поставленная задача также решается при осуществлении способа переработки электродного материала металл-ионного аккумулятора, причем металл-ионный аккумулятор включает токосъёмник, с нанесенным на него электродным материалом, а активный компонент электродного материала характеризуется составом AnTiyOx, где:
- n, x, y – действительные числа, причем n = 1-4, y = 1-5, x = 3-12,
- катион A представляет собой Li, Na или K,
или составом AnTiy(PO4)m(F1-xOx), где:
- n, m, y – действительные числа, причем n = 1-3, y = 1-2, m = 1-3, x = 0-1,
- катион A представляет собой Li, Na или K;
включающий следующие стадии:
а) механическое отделение электродного материала от токосъемника металл-ионного аккумулятора;
б) растворение электродного материала в водном растворе кислоты и пероксида водорода;
в) выделение диоксида титана (TiO2), его гидратированной формы и/или устойчивых солей титана;
г) химическое связывание катионов A в виде солей или комплексных соединений.
В частных вариантах воплощения изобретения устойчивые соли титана на стадии в) представляют собой TiOSO4, TiOSO4⋅H2O, TiOSO4⋅2H2O.
В частных вариантах воплощения изобретения между стадиями а) и б) или между стадиями в) и г) проводится отжиг использованных электродных материалов при температурах 100-800°C.
В частных вариантах воплощения изобретения между стадиями а) и б) проводится предварительное промывание использованных электродных материалов слабокислыми раствором с pH 5÷6.9 или слабощелочными раствором с pH 7.1÷9.
В частных вариантах воплощения изобретения на стадии б) кислота представляет собой соляную, серную, азотную или фосфорную кислоту, или их смесь.
В частных вариантах воплощения изобретения выделение однофазного диоксида титана (TiO2) или устойчивых солей титана на стадии в) осуществляют путем изменения pH и температуры раствора.
В частных вариантах воплощения изобретения выделение однофазного диоксида титана (TiO2) или устойчивых солей титана на стадии в) осуществляют путем использования соединения, содержащего анионы, образующие нерастворимые соединения при добавлении к солям титана.
В частных вариантах воплощения изобретения выделение однофазного диоксида титана (TiO2) или устойчивых солей титана на стадии в) осуществляют путем использования замены водного растворителя на органический растворитель с меньшей полярностью. Более конкретно водным растворителем является вода. В некоторых вариантах воплощения изобретения органический растворитель с меньшей полярностью представляет собой спирт, алкан или сульфосодержащий растворитель.
В частных вариантах воплощения изобретения активный компонент электродного материала характеризуется составом Li4Ti5O12.
В частных вариантах воплощения изобретения стадия а) осуществляется в инертной или сухой атмосфере.
В частных вариантах воплощения изобретения стадия г) осуществляется при охлаждении до 0-10 °С.
В частных вариантах воплощения изобретения токосъёмник представляет собой алюминиевую, титановую, никелевую или медную фольгу.
В результате осуществления изобретения достигаются следующие технические результаты:
- разработаны эффективные методики переработки титан- и ванадийсодержащих электродных материалов МИА, утративших способность выполнять свои функции (отработавшие заявленное количество циклов, с производственным браком, с истекшим сроком службы);
- разработанные способы по изобретению обеспечивают высокую степень извлечения ванадия или титана, а именно более 80 % масс. в пересчете на исходное вещество;
- разработанные способы по изобретению снижают количества используемых едких кислот и щелочей, а также энергозатраты;
- разработанные способы по изобретению, характеризуются тем, что конечные растворы, образовавшиеся в результате осуществления способов, могут быть утилизированы вместе со сточными водами, то есть способы по изобретению являются экологичными и безопасными для окружающей среды;
- разработанные способа расширяет арсенал доступных средств для переработки металл-ионных аккумуляторов и их компонентов.
Подробное раскрытие изобретения
Определения (термины)
Для лучшего понимания настоящего изобретения ниже приведены некоторые термины, использованные в настоящем описании изобретения. Следующие определения применяются в данном документе, если иное не указано явно.
В описании данного изобретения термины «включает» и «включающий» интерпретируются как означающие «включает, помимо всего прочего». Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из».
Термин «и/или» означает один, несколько или все перечисленные элементы.
Также здесь перечисление числовых диапазонов по конечным точкам включает все числа, входящие в этот диапазон.
Термин «необязательный» или «необязательно» или «опциональный» или «опционально», используемый в данном документе, означает, что описываемое впоследствии событие или обстоятельство может, но не обязательно, произойти, и что описание включает случаи, когда событие или обстоятельство происходит, и случаи, в которых оно не происходит.
Термин «pH», используемый в данном документе, означает физическую величину равную десятичному логарифму величины активности ионов водорода с отрицательным знаком. Значение данной величины указывает на кислотность или щелочность среды. В нейтральных водных растворах pH ~ 7; в кислотных – pH < 7; в щелочных – pH > 7.
Электродные материалы металл-ионного аккумулятора в настоящем документе представляют собой композитные смеси, состоящие из:
- активного материала (фосфата, оксофосфата, фторидофосфата, оксофторида или сложного оксида ванадия) с общей формулой AnVy(PO4)m(FxOz) (причем (FxOz) – это отдельные элементы F и O, которые входят в общий структурный каркас соединения, в частности в некоторых вариантах воплощения изобретения соединение представляет собой чистый фторид, тогда x = 3, z = 0 (например, Na3V2(PO4)2F3), в некоторых других вариантах воплощения изобретения соединение представляет собой оксофторид, тогда x=1, z=2 (например, Na3V2(PO4)2O2F), а также может представлять собой твердый раствор (например, Na3V2(PO4)2O1,67F1,33), где n, m, y – действительные числа, причем n = 1-3, y = 1-2, m = 1-3, x и z – действительные числа, причем x = 0-3, z = 0-3 и x+z ≤ 3), катион A представляет собой Li, Na или K, или их смеси; или с общей формулой AnTiyOx, где n, x, y – действительные числа, причем n = 1-4, y = 1-5, x = 3-12, катион A представляет собой Li, Na или K, или их смеси; или с общей формулой AnTiy(PO4)m(F1-xOx), где n, m, x, y – действительные числа, причем n = 1-3, y = 1-2, m = 1-3, x = 0-1, катион A представляет собой катион Li, Na или K, или их смеси;
- проводящей добавки (ацетиленовая сажа, одностенные или многостенные углеродные нанотрубки, графен, оксид графена, проводящие полимерные соединения или их смесь);
- связующего (поливинлидендифторид, полиакрилонитрил, полиакриламид, карбоксиметилцеллюлоза, политетрафторэтилен и др.).
Содержание проводящей добавки варьируется от 0.5 до 15% масс., содержание связующего от 1 до 15% масс, содержание активного материала от 70 до 98.5 % масс. Композитный электродный материал (далее «электродный материал») нанесен на токосъемник, представляющий собой алюминиевую, титановую, никелевую или медную фольгу толщиной 2-100 мкм, в т.ч. перфорированную с диаметром пор до 1 мм и/или фольгу с углеродным покрытием. Композитный электродный материал, нанесенный на токосъемник, именуется электродом.
В контексте настоящего изобретения термин «инертная атмосфера» подразумевает атмосферу газа (например, аргон, азот) и/или их смеси, которые не реагируют с веществами и/или продуктами их разложения, составляющими исходный материал.
Термин «сухая атмосфера» подразумевает атмосферу воздуха с относительной влажностью менее 15%.
Краткое описание чертежей.
Фигура 1. Схема переработки электродных материалов МИА на основе ванадия и титана утративших способность выполнять свои функции (отработавшие заявленное количество циклов, с производственным браком, с истекшим сроком службы).
Осуществление изобретения
Ячейка МИА, содержащая электроды с активным катодным материалом и анодным материалом или металлическим противоэлектродом (Li, Na, K), механически разбирается, причем разборка может проводиться как в сухой атмосфере, так и в инертной, в зависимости от типа активного материала и исходного состояния ячейки. Далее производится извлечение электродов с нанесённым электродным материалом, содержащим ванадий и/или титан. Электрод помещают в деионизованную воду на 1 час при температуре 20-95 °С. Далее проводят отделение электродного материала от токосъемника. Отделённый электродный материал обрабатывают соответствующим(и) раствором(ами) смеси реагентов и по необходимости нагревают в течение определённого времени. Итоговые соединения ванадия и титана (продукты переработки) отделяют от маточного раствора декантацией и/или фильтрацией.
Предлагаемые способы по изобретению иллюстрируются следующими примерами.
Пример 1.
Для переработки продуктов деградации катодного материала (катодный материал, проработавший в аккумуляторе некоторое количество циклов, удельная электрохимическая емкость которого упала более, чем на 30%, по сравнению с исходной) НИА, Na3V2(PO4)2F3, электродный материал отделяется от фольги токосъемника и обрабатывается в сернокислом растворе хлората натрия. Полученный раствор очищается от загрязнений органических соединений (как правило, поливинилиденфторид или другое органическое связующее) и остатков углеродных проводящих добавок (как правило, сажи) фильтрацией. Процесс окисления катионов ванадия хлоратом натрия описывается следующей химической реакцией:
6Na3V2(PO4)2F3 + 4NaClO3 + 17H2SO4 + 12H2O → 6(VO2)2SO4 + 11NaHSO4 + 18HF + 4HCl + H3PO4 + 11NaH2PO4
Далее к фильтрату прикапывается концентрированная серная кислота до получения раствора с pH 1.5, в результате чего выпадает оранжевый осадок гидрата пентаоксида ванадия переменного состава (V2O5·nH2O, n = 0.1 – 3.3), который удаляется фильтрацией. К оставшемуся раствору добавляется избыток раствора хлорида кальция, что вызывает выпадение осадка, который представляет собой смесь CaF2, CaSO4 и Ca3(PO4)2 – аналогов природных минералов флюорита, гипса и фосфорита, соответственно, что может быть подтверждено по данным рентгенофазового анализа. После извлечения всех вышеуказанных соединений в растворе остаются ионы Na+, Ca2+ и Cl-, которые являются компонентами водопроводной воды. Конечный раствор может быть утилизирован вместе с бытовыми сточными водами. При необходимости гидратированный V2O5·nH2O может быть превращен в безводный V2O5 прокаливанием на воздухе при 300°C. Степень извлечения ванадия оценивалась по методу локального рентгеноспектрального микроанализа (далее - ЛРСМА) и составляла более 87% в пересчете на массу чистого катодного материала (без углеродных добавок и органического связующего). Определение содержания остаточных фторид ионов в растворе может быть проведено при помощи метода ионометрии и находится в рамках допустимых значений для водопроводной воды (не более 1.2 мг/л).
Пример 2.
Продукты деградации катодного материала Na3V2(PO4)3 перерабатывают по схеме, описанной в примере 1, за исключением того, что внесение избытка раствора хлорида кальция приводит к образованию осадка, состоящего из смеси CaSO4 и Ca3(PO4)2. Степень извлечения ванадия оценивалась по методу ЛРСМА и составляла более 83% в пересчете на массу чистого катодного материала (без углеродных добавок и органического связующего).
Пример 3.
Для переработки Na3V2(PO4)2F3 после длительного циклирования электродный материал отделяется от токосъемника и обрабатывается в сернокислом растворе перекиси водорода (концентрация от 3 до 15% масс.) на воздухе до достижения pH менее 2. Происходит химическая реакция с образованием катиона пероксованадия, водный раствор которого имеет насыщенно-красную окраску:
2Na3V2(PO4)2F3 + 5H2SO4 + 8H2O2 → 2(VO3)2SO4 + 3NaHSO4 + 6HF + 3NaH2PO4 + 4H2O
Полученный раствор отделяется от остатков сажи фильтрацией. Степень растворения катодного материала оценивалась путем взвешивания высушенных остатков и составляла более 98% в пересчете на массу чистого катодного материала (без углеродных добавок и органического связующего). Из полученного раствора при помощи нагревания-кипения выделяют осадок V2O5·nH2O. В основе данной химической реакции лежит нестабильность соединения (VO3)2SO4, которое при нагревании разрушается с образованием катиона ванадина. В свою очередь, данный катион в сильнокислой среде превращается в осадок V2O5·nH2O. Фазовый состав осадка может быть подтвержден методом рентгеновской дифракции. Оставшиеся в растворе фторид, сульфат и фосфат анионы могут быть выделены в виде осадков CaF2, CaSO4 и Ca3(PO4)2 соответственно добавлением избытка хлорида кальция. Степень извлечения ванадия оценивалась по методу ЛРСМА и составляла более 80% в пересчете на массу чистого катодного материала (без углеродных добавок и органического связующего).
Пример 4.
Продукты деградации катодного материала Na3V2(PO4)3 утилизируют по схеме, описанной в примере 3, за исключением того, что при добавлении избытка раствора хлорида кальция, в осадок выпадают CaSO4 и Ca3(PO4)2. Степень извлечения ванадия оценивалась по методу ЛРСМА и составляла более 84% в пересчете на массу чистого катодного материала (без углеродных добавок и органического связующего).
Пример 5.
Na3V2(PO4)2F3 и/или Na3V2(PO4)3 на первом шаге обрабатывается по схеме, аналогичной приведённой в примере 3, за исключением того, что раствор, образующийся после добавления серной кислоты с перекисью водорода и кипячения (что приводит к образованию в кислой среде ванадат-аниона, VO3-), обрабатывают аминами и/или их сернокислыми солями (в том числе, но не ограничиваясь, диизододециламин, три-н-октиламин), с последующим выделением аминных комплексов. Указанный процесс описывается схемой реакции:
(R1R2NR3)H·HSO4 + VO3- = (R1N(R2)2H)VO3 + HSO4-,
где R1, R2 = (C2H5)C4H9CH-CH2-CH(C2H5)-CH2)-, R3 = H в случае диизододециламина;
R1, R2, R3 = (CH2)7CH3 в случае три-н-октиламина.
Степень извлечения ванадия оценивалась по методу ЛРСМА и составляла более 91% в пересчете на массу чистого катодного материала (без углеродных добавок и органического связующего).
Пример 6.
Для переработки анодного электродного материала ЛИА, Li4Ti5O12 (с существенной необратимой потерей емкости в результате длительного циклирования), электродный материал отделяется от токосъемника и обрабатывается концентрированным раствором соляной кислоты в присутствии пероксида водорода (3% масс.). Реакция описывается следующим уравнением:
Li4Ti5O12 + 4HCl → 5TiO2↓ + 4LiCl + 2H2O
Белый осадок диоксида титана выделяется с помощью фильтрования. Остатки сажи и органического связующего выжигаются в кислороде. К фильтрату добавляется близкое к стехиометрическому количество карбоната натрия и охлаждается до 0-10 °С, что приводит к осаждению карбоната лития. Процесс повторяют трижды с целью получения более чистого продукта. Реакция описывается следующим уравнением:
LiCl + Na2CO3 = Li2CO3↓ + NaCl
Степень извлечения титана оценивалась по методу ЛРСМА и составляла более 80% в пересчете на массу чистого анодного материала (без углеродных добавок и органического связующего).
Пример 7.
Продукты деградации электродного материала Li4Ti5O12 перерабатывают по схеме, описанной в примере 6, за исключением того, не используется соляная кислота, а добавляется более концентрированный раствор пероксида водорода (15% масс.), который провоцирует образование растворимых пероксо-комплексов титана, что ускоряет процесс растворения. Образование комплексов сопровождается появлением красно-коричневой окраски жидкой фазы и описывается уравнением:
TiO2+ + 2H2O2 = [Ti(O2)]2+ + 2H2O.
Степень извлечения титана оценивалась по методу ЛРСМА и составляла более 80% в пересчете на массу чистого анодного материала (без углеродных добавок и органического связующего).
Пример 8.
Продукты деградации электродного материала ЛИА, LiVPO4F обрабатывают, используя набор реагентов, описанный в примере 3. Полученный раствор очищают от загрязнений органических соединений и остатков сажи декантацией. В присутствии фторид-анионов образуется малорастворимый фторид лития, который отделяется центрифугированием или декантацией. Соединения ванадия выделяют по схеме, указанной в примере 3. Чистота полученных продуктов может быть подтверждена при помощи метода элементного анализа (АЭС, ЛРСМА, МС).
Степень извлечения ванадия оценивалась по методу ЛРСМА и составляла более 89% в пересчете на массу чистого катодного материала (без углеродных добавок и органического связующего).
Пример 9.
Продукты деградации электродного материала МИА, KVPO4F обрабатывают, используя набор реагентов, описанный в примере 3, за исключением того, что вместо сульфата/фосфата натрия в жидкой фазе находится сульфат/фосфат калия. Полученный раствор очищается от загрязнений органических соединений и остатков сажи декантацией. Степень растворения активного материала оценивалась путем взвешивания высушенных остатков и составляла более 96% в пересчете на массу чистого катодного материала (без углеродных добавок и органического связующего). Соединения ванадия отделяются по схеме, указанной в примере 3. К оставшемуся раствору добавляется избыток раствора хлорида кальция, что вызывает выпадение осадка, который представляет собой смесь CaF2, CaSO4 и Ca3(PO4)2 – аналогов природных минералов флюорита, гипса и фосфорита, соответственно, что может быть подтверждено по данным рентгенофазового анализа. После извлечения всех вышеуказанных соединений в растворе остаются ионы K+, Ca2+ и Cl-, которые являются компонентами водопроводной воды. Конечный раствор может быть утилизирован вместе с бытовыми сточными водами.
Степень извлечения ванадия оценивалась по методу ЛРСМА и составляла более 83% в пересчете на массу чистого катодного материала (без углеродных добавок и органического связующего).
Пример 10.
Продукты деградации электродного материала ЛИА, LiVOPO4 обрабатывают, используя набор реагентов, описанный в примере 3, за исключением того, что в конечном растворе отсутствуют фторид-анионы. Полученный раствор очищается от загрязнений органических соединений и остатков сажи декантацией. Соединения ванадия отделяют по схеме, указанной в примере 3. К остатку добавляют близкое к стехиометрическому количество карбоната натрия и охлаждают до 0-10 °С, что приводит к осаждению карбоната лития. Фазовый состав осадка может быть подтвержден методом рентгеновской дифракции. Процесс повторяют трижды с целью получения более чистого продукта. Степень извлечения ванадия оценивалась по методу ЛРСМА и составляла более 90% в пересчете на массу чистого катодного материала (без углеродных добавок и органического связующего).
Пример 11.
Продукты деградации электродного материала НИА, NaVOPO4, обрабатывают, используя набор реагентов, описанный в примере 3, за исключением того, что в конечном растворе отсутствуют фторид-анионы. Полученный раствор очищают от органических соединений и остатков сажи декантацией. Соединения ванадия отделяются по схеме, указанной в примере 3. После извлечения всех вышеуказанных соединений в растворе остаются ионы Na+, Ca2+ и Cl-, которые являются компонентами водопроводной воды. Конечный раствор может быть утилизирован вместе с бытовыми сточными водами.
Степень извлечения ванадия оценивалась по методу ЛРСМА и составляла более 85% в пересчете на массу чистого катодного материала (без углеродных добавок и органического связующего).
Пример 12.
Продукты деградации электродного материала МИА, KVOPO4 обрабатывают, используя набор реагентов, описанный в примере 3, за исключением того, что в конечном растворе отсутствуют фторид-анионы. Полученный раствор очищается от загрязнений органических соединений и остатков сажи декантацией. Соединения ванадия отделяются по схеме, указанной в примере 3. После извлечения всех вышеуказанных соединений в растворе остаются ионы K+, Ca2+ и Cl-, которые являются компонентами водопроводной воды. Конечный раствор может быть утилизирован вместе с бытовыми сточными водами. Степень извлечения ванадия оценивалась по методу ЛРСМА и составляла более 85% в пересчете на массу чистого катодного материала (без углеродных добавок и органического связующего).
Пример 13.
Na3(VO1−xPO4)2F1+2x (0≤ x ≤ 1) обрабатывают, используя набор реагентов, описанный в примере 3, за исключением того, что в конечном растворе содержится в меньшее количество фторид-анионов, точное количество которых определяется величиной x общей формулы. Оставшиеся в растворе ионы сульфата, фтора и фосфата могут быть выделены в виде осадка CaF2, CaSO4 и Ca3(PO4)2 добавлением избытка хлорида кальция. Чистота полученных продуктом может быть подтверждена при помощи метода элементного анализа (АЭС, ЛРСМА, МС).
Несмотря на то, что изобретение описано со ссылкой на раскрываемые варианты воплощения, для специалистов в данной области должно быть очевидно, что конкретные подробно описанные эксперименты приведены лишь в целях иллюстрирования настоящего изобретения и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения. Должно быть понятно, что возможно осуществление различных модификаций без отступления от сути настоящего изобретения.

Изобретение относится к области электротехники, а именно к способам утилизации и переработки электродных материалов химических источников тока, включая, но не ограничиваясь, литий-, натрий-, калий-ионными аккумуляторами, и может быть использовано для получения вторичных материальных ресурсов. Повышение эффективности переработки титан и ванадийсодержащих электродных материалов путем повышения степени извлечения ванадия или титана, а именно более 80 % масс. в пересчете на исходное вещество, является техническим результатом изобретения, который достигается за счет того, что в качестве вторичных материалов перерабатывают составы AnVy(PO4)m(FxOz), где A – Li, Na, K, AnTiyOx, где A – Li, Na, K, AnTiy(PO4)m(F1-xOx), где A – Li, Na, K, путем механического отделения электродного материала от токосъемника металл-ионного аккумулятора, растворения электродного материала в сернокислом растворе пероксида водорода, и/или растворе неорганической соли в кислой или щелочной среде, и/или растворе органического комплексообразующего реагента в кислой или щелочной среде при температуре 20-95°C, выделения оксидов и/или солей ванадия, в том числе гидратированных, и химического связывания анионов в нерастворимые соединения путем добавления растворимой соли щелочноземельного металла. Предложенный способ снижает количества используемых едких кислот и щелочей, энергозатраты, а также характеризуется экологичностью и безопасностью для окружающей среды. 2 н. и 28 з.п. ф-лы, 1 ил., 13 пр. 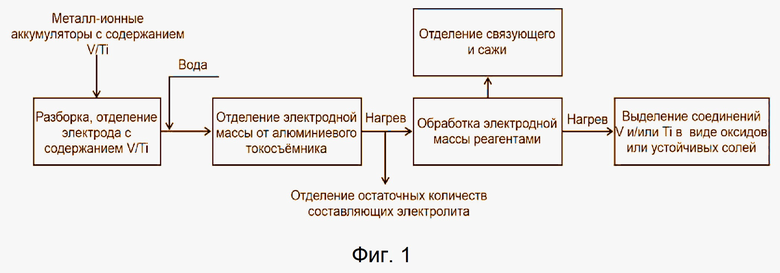
1. Способ переработки электродного материала металл-ионного аккумулятора, причем металл-ионный аккумулятор включает токосъёмник, с нанесенным на него электродным материалом, где активный компонент электродного материала характеризуется составом AnVy(PO4)m(FxOz), где:
- n, m, y – действительные числа, причем n=1-3, y=1-2, m=1-3;
- x и z – действительные числа, причем x=0-3, z=0-3 и x+z≤3;
- катион A представляет собой Li, Na или K,
включающий следующие стадии:
а) механическое отделение электродного материала от токосъемника металл-ионного аккумулятора;
б) растворение электродного материала в сернокислом водном растворе пероксида водорода, и/или растворе неорганической соли-окислителя в кислой или щелочной среде, и/или растворе органического комплексообразующего реагента в кислой или щелочной среде при температуре 20-95°C;
в) выделение оксидов и/или солей ванадия, в том числе гидратированных;
г) химическое связывание анионов в нерастворимые соединения путем добавления растворимой соли щелочноземельного металла.
2. Способ по п. 1, характеризующийся тем, что между стадиями а) и б) проводится отжиг использованного электродного материала при температурах 100-800°C.
3. Способ по п. 1, характеризующийся тем, что между стадиями а) и б) проводится предварительное промывание использованного электродного материала слабокислым раствором с pH 5÷6.9 или слабощелочным раствором с pH 7.1÷9.
4. Способ по п. 1, в котором неорганическая соль-окислитель на стадии б) представляет собой AClO3, AClO, ANO3, ANO2, A2S2O8 или AHSO5, где А представляет собой Li, Na, K или NH4.
5. Способ по п. 1, в котором органический комплексообразующий реагент на стадии б) представляет собой карбоксилат, амин или тиол.
6. Способ по п. 1, в котором выделение соединений ванадия на стадии в) осуществляют путем изменения pH и температуры раствора.
7. Способ по п. 6, в котором изменение рН осуществляются посредством добавления концентрированной серной кислоты.
8. Способ по п. 1, в котором выделение соединений ванадия на стадии в) осуществляют путем использования соединения, содержащего анионы, которые приводят к образованию нерастворимых соединений при добавлении к солям ванадия.
9. Способ по п. 1, в котором выделение соединений ванадия на стадии в) осуществляют путем использования замены водного растворителя на органический растворитель с меньшей полярностью.
10. Способ по п. 1, в котором раствор, полученный на стадии б), очищают фильтрацией, декантацией и/или центрифугированием.
11. Способ по п. 9, в котором водным растворителем является вода.
12. Способ по п. 9, в котором органический растворитель с меньшей полярностью представляет собой спирт, эфир, углеводород или сульфосодержащий растворитель.
13. Способ по п. 1, в котором соль щелочноземельного металла на стадии г) представляет собой соль кальция, магния, стронция, бария или их смесь.
14. Способ по п. 1, в котором токосъёмник представляет собой алюминиевую, титановую, никелевую или медную фольгу.
15. Способ по п. 1, в котором активный компонент электродного материала характеризуется составом Na3V2(PO4)2F3, LiVPO4F, KVPO4F, LiVOPO4, NaVOPO4, KVOPO4 или Na3V2(PO4)3.
16. Способ по п. 1, в котором стадия а) осуществляется в инертной атмосфере.
17. Способ переработки электродного материала металл-ионного аккумулятора, причем металл-ионный аккумулятор включает токосъёмник, с нанесенным на него электродным материалом, а активный компонент электродного материала характеризуется составом AnTiyOx, где:
- n, x, y – действительные числа, причем n=1-4, y=1-5, x=3-12,
- катион A представляет собой Li, Na или K,
или составом AnTiy(PO4)m(F1-xOx), где:
- n, m, y – действительные числа, причем n=1-3, y=1-2, m=1-3, x=0-1,
- катион A представляет собой Li, Na или K;
включающий следующие стадии:
а) механическое отделение электродного материала от токосъемника металл-ионного аккумулятора;
б) растворение электродного материала в водном растворе кислоты и пероксида водорода;
в) выделение диоксида титана (TiO2), его гидратированной формы и/или устойчивых солей титана;
г) химическое связывание катионов A в виде солей или комплексных соединений.
18. Способ по п. 17, в котором устойчивые соли титана на стадии в) представляют собой TiOSO4, TiOSO4⋅H2O, TiOSO4⋅2H2O.
19. Способ по п. 17, отличающийся тем, что между стадиями а) и б) или между стадиями в) и г) проводится отжиг использованных электродных материалов при температурах 100-800°C.
20. Способ по п. 17, отличающийся тем, что между стадиями а) и б) проводится предварительное промывание использованных электродных материалов слабокислыми раствором с pH 5÷6.9 или слабощелочными раствором с pH 7.1÷9.
21. Способ по п. 17, в котором на стадии б) кислота представляет собой соляную, серную, азотную или фосфорную кислоту или их смесь.
22. Способ по п. 17, в котором выделение однофазного диоксида титана (TiO2) или устойчивых солей титана на стадии в) осуществляют путем изменения pH и температуры раствора.
23. Способ по п. 17, в котором выделение однофазного диоксида титана (TiO2) или устойчивых солей титана на стадии в) осуществляют путем использования соединения, содержащего анионы, образующие нерастворимые соединения при добавлении к солям титана.
24. Способ по п. 17, в котором выделение однофазного диоксида титана (TiO2) или устойчивых солей титана на стадии в) осуществляют путем использования замены водного растворителя на органический растворитель с меньшей полярностью.
25. Способ по п. 24, в котором водным растворителем является вода.
26. Способ по п. 24, в котором органический растворитель с меньшей полярностью представляет собой спирт, алкан или сульфосодержащий растворитель.
27. Способ по п. 17, в котором активный компонент электродного материала характеризуется составом Li4Ti5O12.
28. Способ по п. 17, в котором стадия а) осуществляется в инертной или сухой атмосфере.
29. Способ по п. 17, в котором стадия г) осуществляется при охлаждении до 0-10°С.
30. Способ по п. 17, в котором токосъёмник представляет собой алюминиевую, титановую, никелевую или медную фольгу.
| CN 112290019 A, 29.01.2021 | |||
| CN 110828801 A, 21.02.2020 | |||
| СПОСОБ ВОССТАНОВЛЕНИЯ ОКСИДНОГО ТВЕРДОГО ЭЛЕКТРОЛИТА С ИСХОДНОЙ ФАЗОЙ, СПОСОБ ПРОИЗВОДСТВА ЛИТИЕВОЙ БАТАРЕИ И ЭКОЛОГИЧНАЯ БАТАРЕЯ ИЗ НЕГО | 2020 |
|
RU2741877C1 |
| US 8840702 B2, 23.09.2014 | |||
| JP 2012186150 A, 27.09.2012 | |||
| US 7820317 B2, 26.10.2010 | |||
| JP 2016085953 A, 19.05.2016 | |||
| СПОСОБ ИЗВЛЕЧЕНИЯ ВАНАДИЯ ИЗ ВАНАДИЙСОДЕРЖАЩЕГО СЫРЬЯ | 1995 |
|
RU2080403C1 |
Авторы
Даты
2023-03-28—Публикация
2022-12-07—Подача