Область техники
Настоящее изобретение относится к применению конъюгата антитело-лекарственное средство для лечения злокачественной опухоли или других заболеваний и, в частности, к применению специального гидрофильного кислотного стабилизированного участка соединения при получении конъюгата антитело-лекарственное средство для повышения стабильности лекарственного средства в плазме при одновременном значительном улучшении фармакокинетики (PK).
Уровень техники
Конъюгаты антитело-лекарственное средство (ADC) представляют собой класс новых направленных лекарственных средств, которые обычно состоят из трех компонентов: антитело или антитело-подобный лиганд, низкомолекулярное лекарственное средство и линкер, который связывает антитело с лекарственным средством. В конъюгатах антитело-лекарственное средство используется специфическое распознавание определенных антигенов антителами для транспортировки молекул лекарственного средства к месту вблизи клеток-мишеней и высвобождение их эффективно для обеспечения терапевтического эффекта. В августе 2011 года Управление США по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило новый ADC от Seattle Genetics, AdecteisTM, для лечения лимфомы Ходжкина, а также анапластической крупноклеточной лимфомы (ALCL), и клиническое применение продемонстрировало безопасность и эффективность этого класса лекарственных средств.
Для конъюгатов антитело-лекарственное средство в целях обеспечения эффективного присоединения молекулы лекарственного средства к антителу, конъюгаты, в настоящее время входящие на стадию клинических испытаний, как правило, связаны через линкеры по остаткам лизина на поверхности лиганда или с остатками цистеина (полученными посредством частичного восстановления межцепочечных дисульфидных связей) в шарнирной области антитела. Однако присутствие большого количества остатков лизина (более 80) на поверхности антитела и неселективная природа присоединения приводит к неопределенности в отношении количества и присоединений и участков, что в свою очередь приводит к отсутствию однородности конъюгатов антитело-лекарственное средство. Присоединение к сульфгидрилу может эффективно снижать проблему плохого качественного состава продукта, и малеинимид, выступающий в качестве линкера, может быстро и в высокой степени селективно образовывать простые тиоэфирные продукты с сульфгидрильными группами антител в мягких условиях.
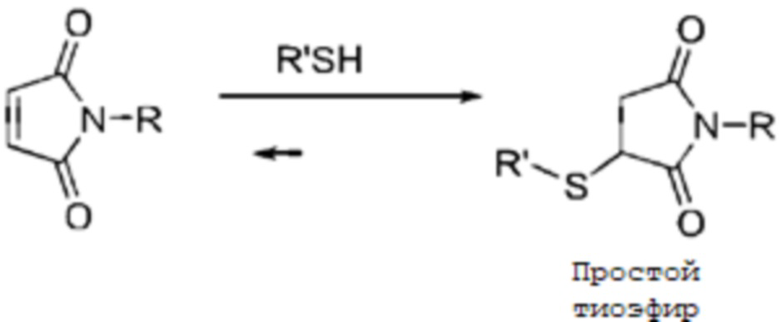
Однако растущее количество исследований показало что присоединение сукцинимида к сульфгидрилу является обратимым процессом (обратная реакция Майкла), и, когда продукт присоединения попадает в плазму, можно отчетливо наблюдать обмен продукта присоединения с сульфгидрильной группой альбумина, что приводит к высвобождению молекулы лекарственного средства, вследствие присутствия большого количества белков, содержащих свободные сульфгидрильные группы, в плазме. Высвобождение молекулы лекарственного средства с одной стороны вызывает токсические побочные эффекты, в то время как с другой стороны снижает эффективность конъюгата антитело-лекарственное средство. (См. Shen, et al. "Conjugation site modulate the vivo stability and therapeutic activity of antibody-drug conjugates" Nature Biotech (2012) 30:184-189; Baldwin & Kiick, Bioconj. Chem 2011, 22, 1946-1953; Alley, et al. Bioconjugate Chem. 2008, 19, 759-765.)
Многие исследователи провели опубликованные испытания с целью повышения стабильности конъюгатов антитело-лекарственное средство в плазме и снижения обратной реакции Майкла на сульфгидрильной группе. Было описано, что циклический простой тиоэфирный продукт присоединения, образованный малеинимидом и сульфгидрилом, может претерпевать гидролиз в водной среде с образованием простого тиоэфирного продукта с открытым кольцом. В отличие от циклических сульфидных продуктов присоединения сульфидные продукты с открытым кольцом остаются стабильными в плазме и более не обмениваются с другими сульфгидрильными группами. Таким образом, обмена сульфгидрильными группами можно эффективно избежать, если конъюгат антитело-лекарственное средство конвертируется в структуру с открытым кольцом до его попадания в организм.
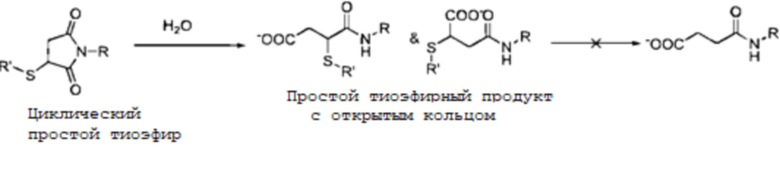
На скорость реакции присоединения с открытием кольца влияет множество факторов, включая pH и температуру реакции, а также структуру, подвергаемую реакции, и, вследствие чувствительности антител к pH и температуре, быстрое открытие кольца при pH и температуре, которые может переносить антитело, является наилучшим выбором, осуществимым посредством оптимизации структуры линкера. В патенте WO2016025752 описан способ, в котором сильная группа, притягивающая электроны, вносится снаружи сукцинимидного кольца, где указанный способ использует поглощение электронов для снижения обмена простыми тиоэфирными продуктами присоединения с альбумином; однако следствием присутствия указанной притягивающей электроны группы определенно является то, что связь сукцинимида и лекарственного средства трудно сохранить в естественных условиях и сукцинимид, несущий сильную притягивающую электроны группу, является в высокой степени чувствительным к гидролизу кольца, после чего он более не способен претерпевать дальнейшее присоединение к простому тиоэфиру.
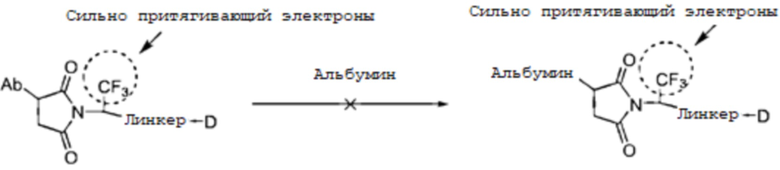
В патенте Seattle Genetics (США) № US20130309256 описан линкер, который вносит основную группу и притягивающую электроны группу рядом с сукцинимидом, где скорость обмена продукта присоединения с альбумином может быть эффективно снижена вследствие эффекта основной группы, значительно повышая стабильность в плазме. Как известно, pH плазмы человека является слабо основным и, хотя включение основных групп может способствовать открытию сукцинимидного кольца, повышение гидрофобности всей молекулы становится более трудным. Это явление убедительно подтверждено в последующем патенте Seattle Genetics WO2015057699. После включения стабилизированного участка присоединения, несущего основную группу, в молекулу-мишень, авторы настоящего изобретения открыли, что вся молекула конъюгата антитело-лекарственное средство все еще быстро деградировала у мышей с более высокой нагрузкой лекарственным средством вследствие гидрофобности (см. патент № WO2015057699, стр.225), и для улучшения описанной выше ситуации авторы изобретения были вынуждены внести комплексную структуру полиэтиленгликоля в боковую цепь молекулы для улучшения агрегации молекулы (см. патент № WO2015057699).
В дополнение к снижению обмена с альбумином и повышению стабильности в плазме, другим важным фактором, который должен учитываться при конструировании конъюгата антитело-лекарственное средство, является количество лекарственного средства, которое может быть доставлено на нацеливающий агент (т.е. количество цитотоксического средства, присоединенное к каждому нацеливающему агенту (например, каждое антитело)), которое называют нагрузкой лекарственным средством. Было предположено, что более высокая нагрузка лекарственным средством обеспечивает лучшую эффективность, чем более низкая нагрузка лекарственным средством (например, нагрузка 8 элементами должна демонстрировать лучшую эффективность in vivo и in vitro, чем нагрузка 4 элементами). Обоснованием этой теории является то, что конъюгаты с более высокой нагрузкой лекарственным средством будут доставлять больше лекарственного средства (цитотоксического средства) к клеткам-мишеням. Результаты, полученные in vitro, также подтвердили, что конъюгаты с более высокой нагрузкой лекарственным средством демонстрируют более высокую активность против клеточных линий vitro. Однако определенные последующие испытания показали, что эту гипотезу еще аналогично предстоит подтвердить in vivo в моделях на животных. В литературе описано, что конъюгаты с нагрузкой 4 элементами и 8 элементами лекарственного средства ауристатина имеют неожиданно сходную активность в модели на мышах, и не наблюдали более высокой эффективности при нагрузке 8 элементами лекарственного средства. См. Hamblett, et al., Clinical Cancer Res. 10: 7063-70 (2004). Hamblett et al. выявили причины вышеупомянутого экспериментального явления и далее описали, что в моделях на животных ADC с более высокой нагрузкой выводятся из кровотока быстрее. Это более быстрое выведение указывает на тенденцию к тому, что конъюгаты с более высокой нагрузкой имеют более нестабильную PK по сравнению с конъюгатами с более низкой нагрузкой. Кроме того, конъюгаты с более высокой нагрузкой демонстрируют более низкую MTD у мышей и, таким образом, имеют более узкий терапевтический индекс. Напротив, было описано, что ADC с нагрузкой, равной двум, в искусственно модифицированном участке на моноклональном антителе, имеет те же или лучшие свойства PK и терапевтические индексы, чем некоторые из ADC с нагрузкой четырьмя элементами. См. отчеты, опубликованные Junutula, et al., Clinical Cancer Res. 16: 4769 (2010).
Увеличение нагрузки лекарственным средством теоретически увеличивает количество лекарственного средства, которое несет одно антитело к клетке-мишени, однако вследствие гидрофобности лекарственного средства, гидрофобность ADC будет возрастать по мере увеличения количества лекарственного средства, вызывая агрегацию ADC в организме и снижение терапевтического индекса. Альтернативные способы преодоления тенденции к демонстрации ADC с более высокой нагрузкой менее желательных свойств PK включают добавление солюбилизирующих групп к структуре ADC. Например, к линкеру можно добавлять полимер полиэтиленгликоля или другой растворимый в воде полимер (например, область между участками связывания лекарственного средства и антитела) для преодоления тенденции ADC к агрегации. Например, несмотря на тот факт, что Seattle Genetics разработали возможность стабилизировать участки присоединения посредством включения основных групп, все еще существует необходимость в улучшении PK молекул лекарственного средства при высоких нагрузках путем, например, внесения боковой цепи ПЭГ в конъюгат участок присоединения-лекарственное средство. Однако добавление солюбилизирующих групп повышает сложность процесса получения, используемого для таких конъюгатов.
Таким образом, в области новых ADC, используемых для смягчения вредоносных эффектов высокого соотношения лекарственного средства и антитела (DAR), срочно необходим новый подход, который может одновременно преодолеть повышение стабильности в плазме, вызываемое обменом сукцинимидом между сульфгидрилами, также одновременно улучшая фармакокинетические свойства конъюгатов антитело-лекарственное средство с высоким DAR. Кислотный стабилизированный участок присоединения в соответствии с настоящим изобретением поразительно удовлетворяет обоим из приведенных выше требований.
Сущность изобретения
Настоящее изобретение направлено на предоставления специального гидрофильного кислотного стабилизированного конъюгата участок присоединения-лекарственное средство. При проведении экспериментов авторы настоящего изобретения неожиданно обнаружили, что, в отличие от внесения основных групп, описанных в US20130309256, внесения кислотной аминокислоты или олигопептидного элемента снижает сульфгидрилный обмен конъюгата сукцинимида и антитела при сохранении высокой степени стабильности в плазме крови. Также было экспериментально продемонстрировано, что сконструированный конъюгат демонстрирует сходный уровень гидрофобности с неконъюгированным нацеливающим реагентом вследствие включения одной или нескольких аминокислот, таким образом, сохраняя фармакокинетические (PK) свойства, сходные со свойствами неконъюгированного нацеливающего реагента in vivo. Таким образом, присутствие кислотного стабилизированного участка присоединения вносит вклад в эффективность лекарственного средства через два описанных выше каскада, которые вместе повышают стабильность лекарственного средства в плазме и улучшают фармакокинетику лекарственного средства (PK).
Введение кислотного стабилизированного участка соединения также позволяет конъюгату иметь более высокую нагрузку лекарственным средством (т.е. более высокое количество гидрофильных участков присоединения лекарственного средства на нацеливающий реагент) по сравнению с конъюгатами с более низкой нагрузкой лекарственным средством при сохранении желаемых свойств PK и демонстрации такой же или лучшей активности in vivo. (Например, конъюгат с нагрузкой 4 элементами или 8 элементами может иметь те же или лучшие свойства PK, чем его аналоги с нагрузкой 2 элементами 4 элементами, соответственно; такие конъюгаты с нагрузкой 4 элементами или 8 элементами могут иметь те же или лучшие свойства PK, чем их аналоги с нагрузкой 2 элементами или 4 элементами, соответственно).
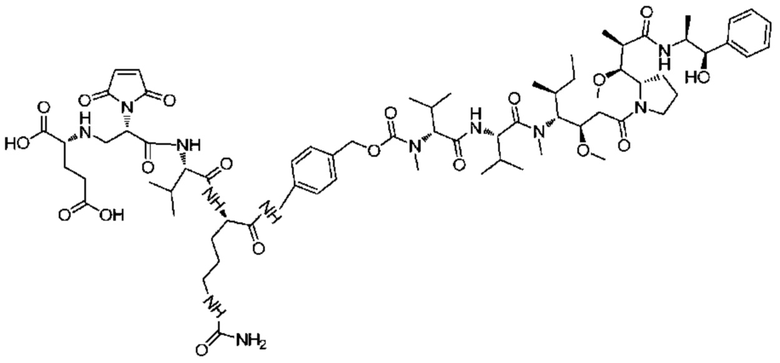
В частности, настоящее изобретение относится конъюгату антитело-лекарственное средство или его фармацевтически приемлемой соли, как показано в формуле I:
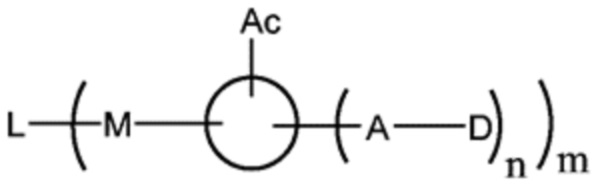
где:
L соответствует антителу, фрагменту антитела или белку;
M соответствует сукцинимиду или гидролизованному сукцинимиду;
Ac соответствует фрагменту, состоящему из аминогруппы или кислотной группы, или олигопептиду, состоящему из множества аминокислот, где аминочасть присоединена к показанному кольцу;
D соответствует лекарственной части;
A соответствует линкерной части;
Кольцо указывает на каркас, соответствующий замещенному или незамещенному C1-8 алкилидену, C1-8 гетероалкилидену, C6-10 арилидену или C4-10 гетероарилидену.
m соответствует целому числу от 1 до 20, и n соответствует 1 или 2.
Предпочтительно, указанное антитело соответствует антителу к рецептору клеточной поверхности или ассоциированному с опухолью антигену.
Предпочтительно, Ac соответствует аминокислотному элементу или кислотному олигопептиду, кислотная группа Ac выбрана из одного или нескольких из группы, включающей группу карбоновой кислоты, фосфорной кислоты, фосфористой кислоты или сульфоновой кислоты.
Более предпочтительно, Ac предпочтительно соответствует природной аминокислоте или неприродной аминокислоте, имеющей изоэлектрическую точку 7,0 или менее, или олигопептиду, состоящему из них.
В некоторых предпочтительных примерах олигопептидный элемент предпочтительно состоит из 2-5 аминокислот.
В некоторых предпочтительных примерах A соответствует расщепляемому линкеру или не расщепляемому линкеру.
В некоторых предпочтительных примерах указанное лекарственное средство соответствует цитотоксическому лекарственному средству, лекарственному средству для лечения аутоиммунного заболевания и противовоспалительному лекарственному средству.
Более предпочтительно, лекарственное средство D выбрано из группы, включающей лекарственные средства на основе майтанзина, лекарственные средства на основе аустралина, лекарственные средства на основе бензодипиррола, лекарственные средства на основе пирролозодиазола, аманитин и его производные и соединения камптотецина.
В некоторых предпочтительных примерах A имеет следующую формулу:
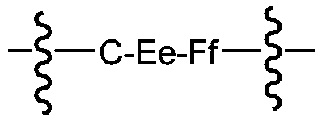
где C соответствует необязательному удлиняемому элементу на конце, E соответствует необязательному расщепляющемуся элементу, F соответствует спейсерному элементу и подстрочные e и f соответствуют 0 или 1. Волнистая линия указывает на точку соединения между кислотным самостабилизрованным участком присоединения и лекарственным элементом.
В некоторых предпочтительных примерах кольцо соответствует группе C1-8 алкилена или группе C1-8 гетероалкилена.
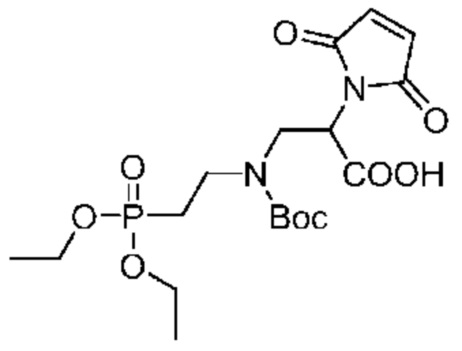
Более предпочтительно, кольцо соответствует группе C1-3 алкилена;
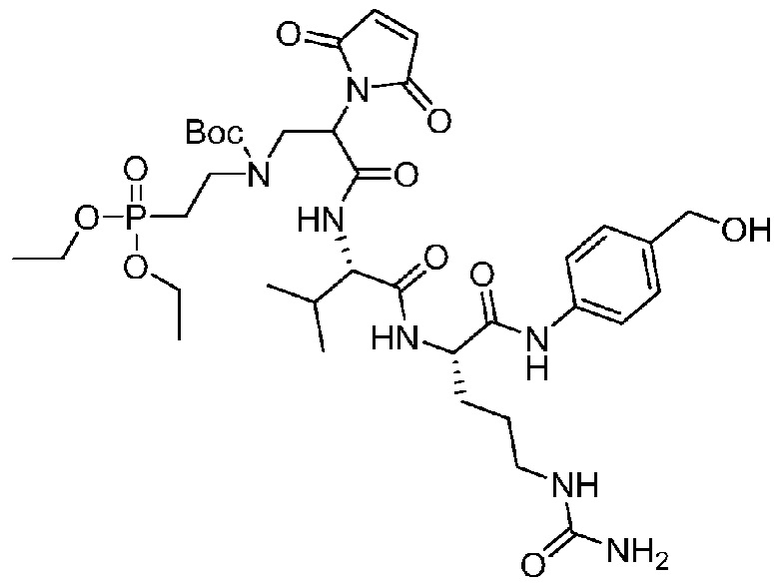
В некоторых предпочтительных примерах Ac выбран из группы, включающей (D/L) глицин, (D/L) аланин, (D/L) лейцин, (D/L) изолейцин, (D/L) валин, (D/L) фенилаланин, (D/L) пролин, (D/L) триптофан, (D/L) серин, (D/L) тирозин, (D/L) цистеин, (D/L) метионин, (D/L) аспарагин, (D/L) глутамин, (D/L) треонин, (D/L) аспарагиновую кислоту, (D/L) глутаминовую кислоту, или соединения следующих структурных формул:
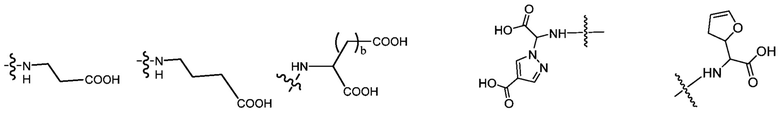
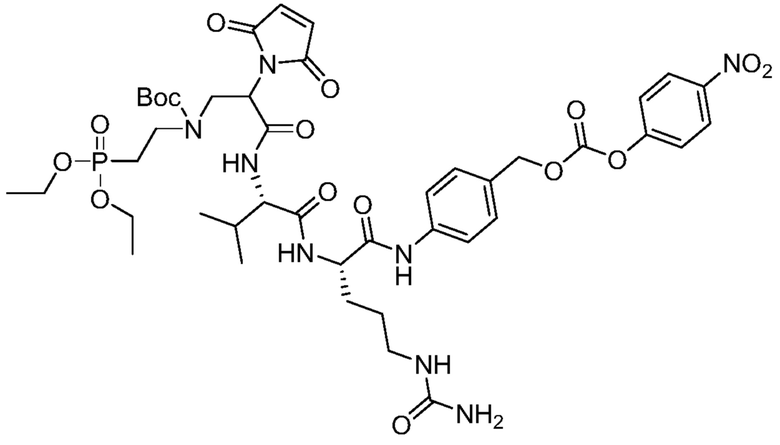
где волнистая линия указывает на участок присоединения к каркасу и R соответствует произвольному линкерному фрагменту между аминогруппой и фосфатной группой.
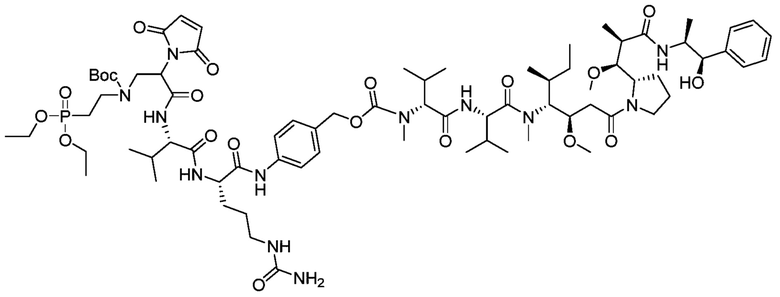
Другой аспект настоящего изобретения относится к соединению участок присоединения-лекарственное средство, имеющему следующую структуру:
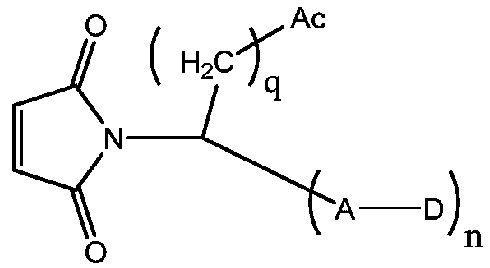
Ac соответствует аминокислотному элементу с изоэлектрической точкой менее 7;
D соответствует части в виде лекарственного средства;
A соответствует линкерной части;
q соответствует целому числу в диапазоне от 1 до 8, и n соответствует 1 или 2.
Настоящее изобретение относится конъюгату антитело-лекарственное средство или его фармацевтически приемлемой соли, а также к фармацевтической композиции с фармацевтически приемлемым разбавителем, носителем или эксципиентом.
Конъюгат антитело-лекарственное средство или его фармацевтически приемлемую соль используют для получения лекарственных средств для лечения злокачественной опухоли, иммунного заболевания и воспаления.
Описание чертежей
На фиг.1 показаны результаты анализа MS-TOF, полученные для соединения 11.
На фиг.2A представлены результаты анализа SEC-ВЭЖХ, полученные для H-11.
Фигура 2B представлены результаты анализа SEC-ВЭЖХ, полученные для H-20.
Фигура 2C представлены результаты анализа SEC-ВЭЖХ, полученные для H-29.
Фигура 2D представлены результаты анализа SEC-ВЭЖХ, полученные для H-39.
Фигура 2E представлены результаты анализа SEC-ВЭЖХ, полученные для H-41.
Фигура 2F представлены результаты анализа SEC-ВЭЖХ, полученные для H-43.
Фигура 2G представлены результаты анализа SEC-ВЭЖХ, полученные для MC-VC-PAB-MMAE.
Фигура 2H представлены результаты анализа SEC-ВЭЖХ, полученные для DPR-VC-PAB-MMAE.
На фиг.3 представлены результаты испытания стабильности in vivo для неконъюгированных антител, ADC с кислотными стабилизированными участками присоединения и контрольных ADC.
На фиг.4 представлены результаты хроматографии HIC для ADC с кислотными стабилизированными участками присоединения и контрольного ADC.
На фиг.5 представлены результаты эффективности in vivo для ADC с кислотными стабилизированными участками присоединения и контрольного ADC.
На фиг.6 представлен график, демонстрирующий результаты эксперимента, полученные для примера 56.
Конкретные варианты осуществления
После широкой и тщательной научно-исследовательской разработки авторы настоящего изобретения неожиданно обнаружили, что конъюгаты антитело-лекарственное средство, имеющие кислотный стабилизированный участок присоединения, демонстрируют лучшую стабильность в плазме и являются более гидрофильными, чем общепринятые конъюгаты антитело-лекарственное средство, и что конъюгированные структуры могут выдерживать более высокую нагрузку при сохранении желаемых фармакокинетических свойств структур при низкой нагрузке. Более высокая нагрузка лекарственным средством приводит к лучшей активности и терапевтической эффективности.
В частности, конъюгат антитело-лекарственное средство, имеющий кислотный стабилизированный участок присоединения, предусматриваемый настоящим изобретением, имеет малеинимидный элемент, который при связывании с сульфгидрильной группой антитела и с участием стабилизирующей кислотной группы гидролизует кольцо, и полученная структура не претерпевает обмен с другими сульфгидрил-содержащими макромолекулами в плазме, таким образом, препятствуя высвобождению молекулы лекарственного средства.
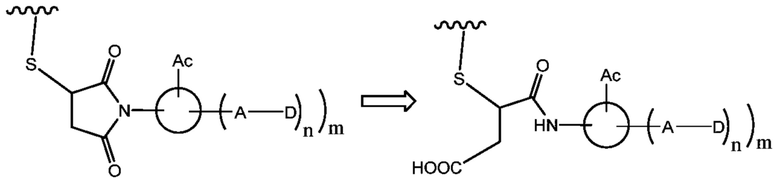
В то же время, присутствие одной или нескольких гидрофильных кислотных групп приводит к образованию структуры с открытым кольцом, которая является более гидрофильной, чем конъюгат антитело-лекарственное средство, тем самым предотвращая такие проблемы, как снижение активности вследствие повышения нагрузки лекарственным средством.
Полученный конъюгат антитело-лекарственное средство можно использовать для того, чтобы обеспечить достижение лекарственным средством популяции клеток-мишеней, такой как группа опухолевых клеток. Конъюгат антитело-лекарственное средство специфически связывается с поверхностными белками клеток, и образовавшиеся конъюгаты случайным образом подвергаются эндоцитозу. В клетке лекарственное средство высвобождается в форме активного лекарственное вещества, обеспечивая один или несколько эффектов. Антитела включают химерные антитела, гуманизированные антитела, антитела человека; фрагменты антитела, которые могут связываться с антигенами; слитые белки Fc антител; или белки. Пригодные лекарственные средства представляют собой высокоактивные лекарственные средства, включая, но не ограничиваясь ими, майтанзиноиды, ауристатины, калихеамицины, доксорубицины, антибиотики на основе бензодипирролов (дуокармицины и CC-1065), димеры пирролобензодиазепина (PBDS), гоитрогены, камптотецин и производные, такие как SN38, иринотекан и икситекан.
Подробное описание патента.
Сокращенные обозначения и определения
Если нет иных указаний, приведенные ниже термины и выражения, используемые в настоящем описании, имеют следующие значения. Когда в настоящем описании используется торговое наименование, если контекст не указывает на иное, торговое наименование включает состав продукта, дженерическое лекарственное средство и активный фармацевтический ингредиент указанного продукта с торговым наименованием.
Термин "алкилен" относится к двухвалентной неразветвленной насыщенной углеводородной группе с 1-20 атомами углерода, включая группы в диапазоне от 1 до 10 атомов углерода. Примеры алкиленовых групп включают, но не ограничиваются ими, метилен (-CH2-), этилен (-CH2-CH2-), н-пропилен, н-бутилен, н-пентилен, н-гексилен и т.д. Если нет иных указаний, термин "арил" относится к полиненасыщенной, как правило, ароматической гидроксильной группе, которая может быть моноциклической или конденсированной, или к ковалентно связанному полицикличекому кольцу (с количеством колец вплоть до трех). Термин "гетероарил" относится к арильной группе (или кольцу), содержащей 1-5 гетероатомов, выбранных из группы, включающей N, O и S, где атомы азота и серы необязательно могут быть окисленными, и атомы азота необязательно могут подвергаться четвертичному аммонированию. Гетероарильная группа может быть присоединена к остальной части молекулы через гетероатом. Неограничивающие примеры арильных групп включают: фенил, нафтил и дифенил, в то время как неограничивающие примеры гетероарильных групп включают: пиридил, пиридазинил, пиразинил, пиримидинил (пиримидинил), триазинил, хинолинил, хиноксалинил, хиназолинил, мисолинил, фталазинил, бензотриазинил, пуринил, бензимидазолил, бензопиразолил, бензотриазолил, бензотриазолил, изобензофуранил, изоиндолил, индолил, бензотриазинил, тиенопиридинил, тиенопиримидинил, пиримидинил, имидазопиридин, бензотиазолил, бензофуранил, бензотиенил, индолил, хинолинил, изохинолинил, изотиазолил, пиразолил, индолил, тиридинил, имидазолил, триазолил, тетразолил, оксазолил, изоксазолил, тиадиазолил, пирролил, тиазолил, фуранил, тиенил и т.д. В случае описания как "замещенные", заместители ароматической и гетероароматической систем, описанные выше, выбраны из приемлемых заместителей, как указано ниже.
Как указано в настоящем патенте, группа арилидена относится к наличию двух ковалентно связанных структур в вышеупомянутой арильной структуре в орто-, мета- или пара-положении.
Если в настоящем описании нет иных указаний, заместители, состоящие из углеводородных групп (включая группы, обычно указываемые как алкилиден, алкенил, алкинил и циклоалкил), могут соответствуют множеству различных групп, выбранных из следующей группы: -галоген, -OR', -NR'R", -SR', -SiR'R "R"', -OC(O)R', -C(O)R', -CO2R', -CONR'R", -OC(O)NR'R", -NR"C(O)R', -NR'-C(O)NR"R"', -NR"C(O)2R', -NH-C(NH2)=NH, -NR'C(NH2)=NH, -NH-C(NH2)=NR', -S(O)R', -S(O)2R', -S(O)2NR'R", -NR'S(O)2R", -CN и -NO2, с количеством заместителей в диапазоне от 0 до (2m'+1), где m' представляет собой общее количество атомов углерода в группе. Каждый из R', R" и R"' независимо соответствует атому водорода, незамещенному C1-8 алкилу, незамещенному арилу, арилу, замещенному 1-3 атомами галогена, незамещенному C1-8 алкилу, C1-8 алкокси или C1-8 тиоалкокси, или незамещенной арил-C1-4 алкильной группе. Когда R' и R" связаны с одним и тем же атомом азота, они могут образовывать кольца из 3, 4, 5, 6 или 7 элементов с указанным атомом азота. Например, -NR'R" включает 1-пирролидинил и 4-морфолинил.
Как используют в рамках изобретения, "производное" соединения относится к веществу, которое имеет химическую структуру, сходную со структурой соответствующего соединения, но которое также содержит по меньшей мере одну химическую группу, которая не присутствует в соединении и/или лишена по меньшей мере одной химической группы, которая присутствует в соединении. Соединение, с которым сравнивают производное, называют "исходным" соединением. Как правило, "производное" можно получать из исходного соединения посредством одной или нескольких стадий химических реакций.
Антитела, фрагменты антител и белки
В вариантах осуществления настоящего изобретения антитела, фрагменты антител и белковые элементы соответствуют нацеливающим средствам, которые специфически связываются с элементом-мишенью. Антитела, как описано в контексте настоящего изобретения, способны специфически связываться с клеточными компонентами или с другими представляющими интерес молекулами-мишенями. В некоторых аспектах элемент антитела доставляет элемент лекарственного средства к конкретной популяции клеток-мишеней, с которыми взаимодействует элемент лиганда. Лиганды могут включать, но не ограничиваются ими, белки, полипептиды и пептиды, а также не белки, такие как сахара. Подходящие элементы лигандов включают, например, антитела, такие как полноразмерные (полные) антитела, а также их антигенсвязывающие фрагменты. В вариантах осуществления, где элемент лиганда представляет собой не антительный нацеливающий реагент, он может соответствовать пептиду или полипептиду, или не белковой молекуле. Примеры таких нацеливающих реагентов включают интерфероны, лимфокины, гормоны, факторы роста и колониестимулирующие факторы, витамины, молекулы транспорта питательных веществ, или любую другую связывающуюся с клеткой молекулу или вещество. В некоторых вариантах осуществления линкер ковалентно связан с атомом серы на лиганде. В некоторых аспектах атом серы представляет собой атом серы остатка цистеина, который образует межцепочечную дисульфидную связь антитела. В другом аспекте атом серы представляет собой атом серы остатка цистеина, который внесен в элемент лиганда и который образует межцепочечную дисульфидную связь антитела. В другом аспекте атом серы представляет собой атом серы остатка цистеина, который внесен в элемент лиганда (например, посредством сайт-направленного мутагенеза или химической реакции). В других аспектах атом серы, с которым связан линкер, выбран из атома серы остатка цистеина, который образует межцепочечную дисульфидную связь антитела, или фронтального остатка цистеина, который внесен в элемент лиганда (например, посредством сайт-направленного мутагенеза или химической реакции). В некоторых вариантах осуществления используют систему нумерации в соответствии с индексом EU, определяемую согласно Kabat (Kabat E.A., et al., (1991) Sequences of proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242).
Как используют в настоящем патенте, "антитело" или "элемент антитела" включает, в пределах его объема, любую часть структуры антитела. Этот элемент может связываться, реактивно ассоциировать с или образовывать комплекс с рецептором, антигеном или другим элементом рецептора-мишени, принадлежащем клеточной популяции. Антитело может представлять собой любой белок или подобную белку молекулу, которые связывают, образуют комплекс или реагируют с частью популяции клеток, на которую направлено лечение или биологическая модификация.
Антитела, используемые в рамках настоящего патента, включают поликлональные антитела и моноклональные антитела, где указанные поликлональные антитела представляют собой гетерогенные группы молекул антител, происходящие из сыворотки иммунного животного. Моноклональные антитела включают, но не ограничиваются ими, моноклональные антитела мыши и человека, гуманизированные моноклональные антитела или химерные моноклональные антитела, и антитела, происходящие из других видов. Моноклональные антитела человека можно получать любым из способов, известных в данной области (например, Teng, et al. 1983, proc. Nat1. Acad. Sci. USA. 80: 7308-7312; Olsson, et al. 1982, Methan, Enzymol 92: 3-16).
Антитело, которое содержится в конъюгате антитело-лекарственное средство, описанном в настоящем патенте, предпочтительно должно сохранять способность связывать антиген, которую оно имело в его первоначальном диком состоянии. Таким образом, антитело, как описано в контексте настоящего изобретения, способно, предпочтительно исключительно, связываться с соответствующим антигеном. Антигены в рамках настоящего изобретения включают, например, ассоциированные с опухолью антигены (TAA), рецепторные белки клеточной поверхности и другие молекулы клеточной поверхности, регуляторы выживания клеток, регуляторы пролиферации клеток, молекулы, ассоциированные с ростом и дифференцировкой тканей (когда известно или спрогнозировано, что они являются функциональными), лимфокины, цитокины, молекулы, вовлеченные в регуляцию циркуляции клеток, молекулы, вовлеченные ангиогенез, и молекулы, ассоциированные с ангиогенезом (когда известно или спрогнозировано, что они являются функциональными). Ассоциированные с опухолью факторы могут соответствовать факторам кластеров дифференцировки (например, белкам CD).
Антитела, описанные в настоящем описании для применения в конъюгате антитело-лекарственное средство, включают, но не ограничиваются ими, антитела, нацеленные на рецепторы клеточной поверхности, и антитела, нацеленные на ассоциированные с опухолью антигены. Такие ассоциированные с опухолью антигены хорошо известны специалистам в данной области и могут быть получены с использованием способов получения антител и информации, которая хорошо известна специалистам в данной области. Для разработки эффективных мишеней клеточного уровня, которые можно использовать для диагностики и лечения злокачественной опухоли, исследователи предприняли попытку идентифицировать трансмембранные или другие ассоциированные с опухолью пептиды. Эти мишени специфически экспрессируются на поверхности одной или нескольких злокачественных клеток с малой экспрессией или отсутствием экспрессии на поверхности одной или нескольких незлокачественных клеток. Как правило, такие ассоциированные с опухолью полипептиды сверхэкспрессируются в большей степени на поверхности злокачественных клеток по сравнению с поверхностью незлокачественных клеток. Идентификация таких ассоциированных с опухолью факторов имеет потенциал к значительному повышению специфичности терапии злокачественной опухоли на основе антител.
Белки или пептиды, используемые в контексте настоящего патента для получения конъюгата антитело-лекарственное средство, могут представлять собой любой произвольный пептид или белок, который обладает аффинностью в отношении эпитопа или соответствующего рецептора, и они не обязательно должны принадлежать к семейству иммуноглобулинов. Эти пептиды можно выделять способами, сходными со способами, используемыми для фагового дисплея антител (Szardenings, J Recept Signal Transduct Res. 2003: 23(4): 307-49). Применение пептидов из таких случайных пептидных библиотек может быть сходным с применением антител и фрагментов антител. Пептидные или белковые связывающие молекулы могут быть связаны или соединены с макромолекулой или другим материалом, включая, но не ограничиваясь ими, альбумин, полимеры, липосомы, наночастицы или дендримеры, при условии, что указанное связывание позволяет пептиду или белку сохранять его специфичность связывания антигена.
Ассоциированные с опухолью антигены включают антигены, которые хорошо известны специалистам в данной области. Последовательности нуклеиновых кислот и белков, соответствующие ассоциированным с опухолью антигенам, могут быть найдены в общедоступных базах данных, таких как Genbank. Ассоциированные с опухолью антигены, предназначенные для нацеливания посредством антител, включают все варианты аминокислотной последовательности и гомологи, обладающие по меньшей мере 70%, 80%, 85%, 90% или 95% гомологией с последовательностью, указанной в доступной литературе, или имеющие биологические свойства и характеристики, которые идентичны последовательности ассоциированного с опухолью антигена, указанной в литературе.
Термин "ингибирование" или "ингибирование посредством" относится к снижению или полному устранению поддающегося определению количества.
Термин "злокачественная опухоль" относится к физиологическому состоянию или заболеванию, характеризующемуся нерегулируемым клеточным ростом. "Опухоль" включает злокачественные клетки.
Термин "аутоиммунное заболевание" относится к заболеванию или нарушению в результате нацеливания на собственные ткани или белки индивидуума.
Как используют в рамках изобретения, выражение "фармацевтически приемлемая соль" относится к фармацевтически приемлемой органической или неорганической соли соединения (например, лекарственного средства, конъюгата лекарственное средство-участок соединения или конъюгата лиганд-участок соединения-лекарственное средство). Указанное соединение может содержать по меньшей мере одну амино или карбоксильную группу и, таким образом, может образовывать соль аддукта с соответствующей кислотой или основанием. Иллюстративные примеры солей включают, но не ограничиваются ими: сульфат, трифторацетат, цитрат, ацетат, оксалат, хлорид, бромид, йодид, нитрат, гидросульфат, фосфат, кислый фосфат, соли изоникотиновой кислоты, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, водород тартрат, аскорбат, салицилат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, соли калия, соли натрия и т.д. Кроме того, фармацевтически приемлемые соли имеют более одного заряженного атома в их структуре. Существуют примеры, когда множество заряженных атомов, которые являются частью фармацевтически приемлемой соли, могут быть уравновешены во многих случаях. Например, фармацевтически приемлемая соль может иметь один или несколько заряженных атомов и/или один или несколько уравновешивающих атомов.
Предпочтительные лекарственные средства относятся к: цитотоксическим лекарственным средствам, используемым в терапии злокачественной опухоли, включая, но не ограничиваясь ими, майтанзин или майтанзиноиды, аналоги доластатина 10, кахимицины, доксорубицины, антибиотики на основе бензодипиррола (дуокармицины, CC-1065 и т.д.), пирроло[2,1-c][1,4]бензодиазепины (PBD) или димеры PBD и их производные, аманитин или его производные и соединения камптотецина, включая камптотецин, гидроксикамптотецин, SN-38, иктикам, иринотекан и т.д.
С другой стороны, пригодные лекарственные средства не ограничиваются упомянутыми выше категориями, а скорее включают все лекарственные средства, которые можно использовать в конъюгате антитело-лекарственное средство.
В некоторых вариантах осуществления изобретение также включает радиоизотопы, присоединенные через кислотный самостабилизированный участок присоединения. Они включают, но не ограничиваются ими: 3H, 11C, 18F, 32P, 35S, 64Cu, 68Ga, 86Y, 99Tc, 111In, 123I, 125I, 131I, 133Xe, 177Lu, 211At и 213Bi.
Исходя из механизма высвобождения лекарственного средства в клетку, как используют в рамках изобретения, "линкеры" или "линкеры конъюгата антитело-лекарственное средство" могут быть разделены на две категории: не расщепляющиеся линкеры и расщепляющиеся линкеры.
Для конъюгатов антитело-лекарственное средство, содержащих не расщепляющийся линкер, механизм высвобождения лекарственного средства является следующим: после связывания конъюгата с антигеном и эндоцитоза антитело ферментативно отщепляется в лизосоме с высвобождением активной молекулы, состоящей из низкомолекулярного лекарственного средства, линкера и аминокислотного остатка антитела. Конечное изменение молекулярной структуры лекарственного средства не снижает его цитотоксичность, однако, поскольку активная молекула заряжена (вследствие аминокислотных остатков), она не способна проникать в соседние клетки. Таким образом, указанное активное лекарственное вещество не будет способно уничтожить соседние с опухолью клетки, которые не экспрессируют антиген-мишень (антиген-негативные клетки) (известно как "эффект свидетеля") (Ducry, et al. 2010, Bioconjugate Chem. 21: 5-13).
Расщепляющийся линкер, в соответствии с названием, может разрушаться и высвобождать активное лекарственное вещество (само низкомолекулярное лекарственное средство) в клетке-мишени. Расщепляющиеся линкеры могут быть разделены на два основных класса: химически нестабильные линкеры и ферментативно нестабильные линкеры.
Химически нестабильные линкеры могут селективно разрушаться вследствие различий в свойствах плазмы и цитоплазмы. Такие свойства включают pH, концентрацию глутатиона и т.д.
В некоторых вариантах осуществления настоящего патента линкер соответствует pH-чувствительному линкеру, также обычно называемому чувствительным к кислоте линкером. Такие линкеры являются относительно стабильными в нейтральной среде крови (pH 7,3-7,5), но гидролизуются в слабокислой среде эндосом (pH 5,0-6,5) и лизосом (pH 4,5-5,0). В большинстве конъюгатов антитело-лекарственное средство первого поколения используются эти типы линкеров, причем их примеры включают гидразоны, карбонаты, ацетали и кетали. Вследствие ограниченной стабильности в плазме чувствительных к кислотам линкеров, конъюгаты антитело-лекарственное средство на основе таких линкеров, как правило, имеют короткое время полужизни (2-3 суток). Это короткое время полужизни в некоторой степени ограничивает применение pH-чувствительных линкеров в последнем поколении конъюгатов антитело-лекарственное средство.
Глутатион-чувствительные линкеры также известны как дисульфидные линкеры. Соответствующий механизм высвобождения лекарственного средства основан на различии между высокой внутриклеточной концентрацией глутатиона (миллимолярный диапазон) и относительно низкой концентрацией глутатиона (микромолярный диапазон), встречающейся в крови. Это особенно справедливо для опухолевых клеток, где низкое содержание кислорода приводит к увеличению активности редуктазы, и, таким образом, к более высоким уровням глутатиона. Дисульфидные связи являются термодинамически стабильными и, таким образом, демонстрируют высокую стабильность в плазме.
Фермент-нестабильные линкеры, такие как пептидные линкеры, позволяют лучший контроль высвобождения лекарственного средства. Пептидные линкеры могут эффективно расщепляться лизосомальными протеазами, такими как катепсин B или фибронектин (повышенные уровни этих ферментов встречаются в некоторых опухолевых тканях). Полагают, что эта пептидная связь является в высокой степени стабильной в плазме вследствие неподходящего внеклеточного pH, а также присутствия сывороточных ингибиторов протеаз, которые приводят к тому, что протеазы обычно неактивны. Учитывая высокую стабильность в плазме, а также благоприятную селективность и эффективность внутриклеточного разрушения, фермент-нестабильные линкеры широко используются в качестве расщепляющихся линкеров для конъюгатов антитело-лекарственное средство. Типичные фермент-нестабильные линкеры включают Val-Cit(vc), Phe-Lys и другие.
Спейсерный элемент обычно находится между расщепляющимся линкером и активным лекарственным средством, или сам по себе является частью расщепляемого линкера. Механизм действия спейсерного элемента является следующим: когда расщепляемый линкер расщепляется в подходящих условиях, спейсерный элемент претерпевает структурную перестройку, таким образом, высвобождая активное лекарственное вещество, с которым он связан. Обычно такие спейсерные элемент включают п-аминобензиловые спирты (PAB) и β-глюкурониды, замещенные или незамещенные этилендиамины и т.д.
В настоящем патенте могут использоваться следующие сокращенные обозначения, которые следует понимать как имеющие следующие фиксированные значения: Boc: трет-бутоксикарбонил; DCC: дициклогексилкарбодиимид; DCM: дихлорметан; DIPEA: диизопропилкарбодиимид; DMF: N, N-диметилформамид; DMAP: 4-(N, N-диметиламино)пиридин; HATU: (1-[бис(диметиламино)метилен]-1H-1,2,3-триазолo[4,5-b]пиридиния 3-оксида гексафторфосфат; ВЭЖХ: высокоэффективная жидкостная хроматография; ПЭГ: полиэтиленгликоль; TFA: трифторуксусная кислота; THF: тетрагидрофуран; PBS: фосфатный буферный раствор (pH 7,0-7,5).
Фармацевтически приемлемые эксципиенты включают любой носитель, разбавитель, адъювант или эксципиент, такие как консерванты и антиоксиданты, наполнители, разрыхлители, смачивающее вещества, эмульгаторы, суспендирующие вещества, растворители, диспергенты, покрывающие агенты, противомикробные и противогрибковые средства, замедляющие всасывание средства и т.д. Применение таких сред и веществ с фармацевтически активными веществами хорошо известно в данной области. Кроме случаев несовместимости между какой-либо общепринятой средой или реагентом с активным ингредиентом, их применение в терапевтических композициях также предусматривается. В качестве подходящей формы терапевтической комбинации также в указанную композицию могут быть включены дополнительные активные ингредиенты.
Основными преимуществами настоящего изобретения являются следующие:
1. Конъюгат антитело-лекарственное средство, имеющий кислотный стабилизированный участок присоединения, предусматриваемый настоящим изобретением, может существенно снижать скорость обмена с сульфгидрильными группами альбумина in vivo, значительно повышая стабильность в плазме.
2. Вследствие включения кислотной группы, кислотный стабилизированный участок присоединения, предусматриваемый настоящим изобретением, демонстрируют лучшую растворимость в воде на молекулярном уровне, эффективно улучшая свойства PK соответствующего конъюгата антитело-лекарственное средство, который демонстрирует лучшую эффективность in vivo.
3. Конъюгат антитело-лекарственное средство, имеющий кислотный стабилизированный участок присоединения, предусматриваемый настоящим изобретением, не только обеспечивает увеличенную стабильность плазме, он также улучшает свойства PK конечного конъюгата, и эти преимущества способны полностью удовлетворять потребности в более высокой нагрузке лекарственным средством, снижая агрегацию конъюгата антитело-лекарственное средство при высокой нагрузке лекарственным средством, и также одновременно достигая лучшей эффективности по сравнению с более низкой нагрузкой лекарственным средством.
В следующем разделе изобретение описано более подробно применительно к конкретным примерам, и следует понимать, что указанные примеры используются только для иллюстрации изобретения и не предназначены для ограничения объема изобретения. Способы тестирования, для которых не указаны конкретные условия в примерах ниже, в основном проводили в обычных условиях или в условиях, рекомендованных изготовителем. Если нет иных указаний, все проценты, доли, соотношения или части приведены в расчете на массу. Если не определено иначе, подразумевается, что все профессиональные и научные термины, используемые в приведенном ниже тексте, имеют значения, в основном понятные специалистам в данной области. Кроме того, в способах по настоящему изобретению можно использовать любые способы и материалы, сходные или эквивалентные описанным способам и материалам. Предпочтительные способы и материалы, описанные в тексте ниже, приведены только для целей демонстрации.
Общие методики, используемые в приведенных ниже вариантах осуществления изобретения, являются следующими:
Общая методика A
После предварительной очистки в молекулах антител с долей мономера более 95% проводили замену на фосфатный буфер, содержавший EDTA в концентрации 10 мг/мл, с использованием центрифужной пробирки для ультрафильтрации. Добавляли TCEP в молярном количестве, в 10 раз превышающем количество антитела, и полученной реакции позволяли протекать в течение восьми часов. Дисульфидные связи между цепями антитела раскрывались, и проводили определение количества свободных сульфгидрильных групп с использованием способа Эллмана для установления того, все ли дисульфидные связи раскрылись. Далее добавляли груз в молярном количестве, в 10 раз превышающем количество антитела, и полученной реакции позволяли протекать в течение восьми часов. После завершения реакции использовали центрифужную пробирку для ультрафильтрации с пороговым значением молекулярной массы 30 кДа для замены раствора на PBS, и не связавшийся груз удаляли.
Общая методика B
Исследование фармакокинетики
Способ ELISA для выявления антител в сыворотке: нанесение антитела (2 мкг/мл) проводили при 4°C в течение ночи, а затем проводили промывание посредством PBST, которое повторяли три раза, и блокирование 1% BSA+PBST при 37°C в течение одного часа; образцы сыворотки инкубировали и промывали PBST три раза; антитела для детекции (моноклональное антитело или поликлональное антитело против Fc [меченное HRP]) инкубировали при 37°C в течение одного часа, промывали три раза PBST и проявляли TMB, после чего использовали 2 M H2SO4 для завершения реакции и проводили измерения с использованием устройства для считывания микропланшетов.
Общая методика C
Анализ с использованием хроматографии гидрофобного взаимодействия (HIC)
Анализ ADC проводили с использованием хроматографии гидрофобного взаимодействия (HIC). Элюирование проводили с использованием 0-100% подвижной фазы B (MPB), где подвижная фаза A (MPA) состояла из 1,5 M сульфата аммония и 0,025 M фосфата натрия, и MPB состояла из 0,025 M фосфата натрия и 25% изопропанола. Объем загрузки образца составлял приблизительно 20 мкг и градиентное элюирование проводили в течение 15 минут. Для детекции использовали УФ 280 нм, и, чем более сильным был образец, транспортирующий воду, тем позднее был пик.
Общая методика D
Испытания стабильности в плазме
Фиксированное количество образца ADC добавляли к плазме человека, из которой уже был удален IgG человека, причем каждую пробирку с ADC получали в трех экземплярах; далее проводили инкубацию на водяной бане при 37°C в течение 0 часов и 72 часов, после чего образец ADC удаляли и в каждую пробирку добавляли 100 мкл белка A (MabSelect SuReTM LX партия:#10221479GE, промытого PBS); затем позволяли происходить адсорбции при встряхивании на вертикальном смесителе в течение двух часов, а затем проводили промывание и элюирование с получением инкубированного ADC; затем стабильность каждого инкубированного образца ADC в плазме определяли посредством ОФ-ВЭЖХ.
Общая методика E: Сайт-специфическое присоединение ADC
После предварительной очистки для молекул антител с долей мономера более 95% проводили замену буфера на фосфатный буфер, содержавший EDTA в концентрации 10 мг/мл, с использованием центрифужной пробирки для ультрафильтрации. Добавляли TCEP в молярном количестве, в 10 раз превышающем количество антитела, и полученной реакции позволяли протекать в течение двух часов. С использованием центрифужной пробирки для ультрафильтрации для замены раствора на фосфатный буфер при pH 6,5, добавляли DHAA в молярном количестве, в 10 раз превышающем количество антитела, и конечной реакции позволяли протекать в течение двух часов. Далее добавляли груз в молярном количестве, в 3 раза превышающем количество антитела, и полученной реакции позволяли протекать в течение четырех часов. После завершения реакции центрифужную пробирку для ультрафильтрации с пороговым значением молекулярной массы 30 кДа использовали для замены раствора на PBS и не связанный груз удаляли с получением ADC с сайт-специфическим присоединением (DAR=2).
Пример 1
Получение соединения 1
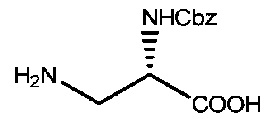
50 г (S)-N-бензилоксикарбонил-N'-трет-бутоксикарбонил-2,3-диаминопропионовой кислоты растворяли в 500 мл дихлорметана, после чего добавляли 50 мл трифторуксусной кислоты и реакционный раствор перемешивали при комнатной температуре в течение ночи. После завершения реакции реакционный раствор концентрировали до сухого состояния при пониженном давлении, после чего добавляли этилацетат для растворения полученного твердого вещества с последующим добавлением гексана и перемешиванием для преципитации твердых веществ, которые фильтровали и сушили с получением твердого продукта массой 21 г. LC-MS m/z (ES+): 239,1 (M+H)+
Пример 2
Получение соединения 2
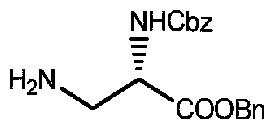
200 мл бензилового спирта добавляли в реакционную колбу и медленно капельно добавляли тионилхлорид (6,69 мл, 92,4 ммоль) на водяной бане; после завершения капельного добавления проводили перемешивание в течение одного часа с последующим периодическим добавлением соединения 1 (20 г, 84 ммоль) и после завершения добавления смесь перемешивали при комнатной температуре в течение ночи. После завершения реакции бензиловый спирт отгоняли посредством масляного насоса при пониженном давлении, и полученный остаток подвергали разделению с использованием колоночной хроматографии на силикагеле (элюент: дихлорметан:метанол=150:1) с получением 22 г продукта. LC-MS m/z (ES+): 329,1 (M+H)+.
Пример 3
Получение соединения 3
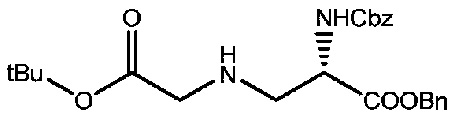
Соединение 2 (10 г, 30,4 ммоль) растворяли в 150 мл ацетонитрила, добавляли диизопропилэтиламин (DIEA, 4,72 мл, 36,58 ммоль) и капельно добавляли трет-бутил-бромацетат (4,75 г, 24,4 ммоль) на ледяной бане; после капельного добавления реакции позволяли протекать в течение 30 минут, а затем реакционную смесь помещали в условия комнатной температуры для дальнейшей реакции, после чего проводили мониторинг посредством TLC (проявитель: DCM: MeOH=10:1). После завершения реакции раствор концентрировали при пониженном давлении и полученный остаток подвергали разделению с использованием колоночной хроматографии на силикагеле (элюент: дихлорметан:метанол=100:1) с получением 5,9 г продукта. LC-MS m/z (ES+): 443,3 (M+H)+.
Пример 4
Получение соединения 4
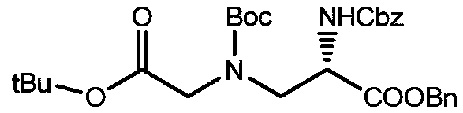
Соединение 3 (5,9 г, 13,3 ммоль), 30 мл 1,4-диоксана и 30 мл воды добавляли в реакционную колбу, а затем добавляли DIEA (3,3 мл, 20 ммоль) и капельно добавляли Boc-ангидрид (14,5 г, 66,7 ммоль) при комнатной температуре; полученный реакционный раствор был желтым, и реакции позволяли протекать при комнатной температуре в течение приблизительно 3-4 часов после капельного добавления, после чего проводили мониторинг посредством TLC (проявитель: DCM:MeOH=30:1). После завершения реакции диоксан удаляли посредством концентрирования при пониженном давлении и добавляли DCM для проведения экстракции с последующим концентрированием при пониженном давлении с получением неочищенного желтого маслянистого продукта; его затем подвергали разделению с использованием колоночной хроматографии на силикагеле (элюент: дихлорметан:метанол=300:1) с получением 6,6 г продукта. LC-MS m/z (ES+): 443,3 (M+H)+-Boc, 543,2 (M+H)+.
Пример 5
Получение соединения 5
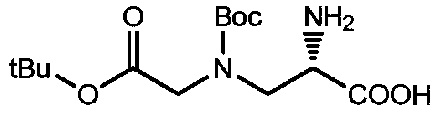
6,6 г соединения 4 растворяли в 50 мл метанола, добавляли 1,32 г 5% Pd/C и проводили замену газообразного водорода от двух до трех раз пока смесь реагировала при комнатной температуре, и проводили мониторинг посредством TLC (проявитель: DCM:MeOH=5:1). После завершения реакции реакционный раствор фильтровали и концентрировали при пониженном давлении при 40°C с получением 4,4 г продукта, который использовали непосредственно в следующей реакции.
Пример 6
Получение соединения 6
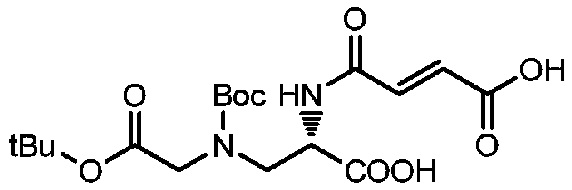
Соединение 5 (4,4 г, 13,8 ммоль) растворяли в 40 мл ледяной уксусной кислоты, добавляли малеиновый ангидрид (2,71 г, 27,6 ммоль) и реакции позволяли протекать при перемешивании при комнатной температуре. Мониторинг реакции проводили посредством TLC (DCM:MeOH=3:1). После завершения реакции реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали с использованием жидкой фазы ВЭЖХ.
(Колонка: YMC-C18, 100 мм×450 мм, 10 мкм, ацетонитрил/вода (0,2% TFA), скорость потока 200 мл/мин, детекция при λ=215 нм)
Растворитель A: 0,2% TFA в вводе
Растворитель B: Ацетонитрил
Градиент: от 0 до 10 мин, 90%A, от 10 до 25 мин, от 90 до 45%A, от 25 до 55 мин, от 45 до 40%A
Фракцию с временем удержания 43 мин собирали и лиофилизировали с получением 1,51 г белого твердого вещества. LC-MS m/z (ES+): 317,9 (M+H)+-Boc, 417,9 (M+H)+.
Пример 7
Получение соединения 7
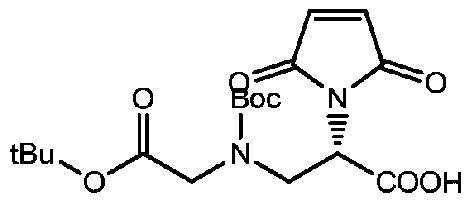
Соединение 6 (1,2 г, 2,88 ммоль) растворяли в 25 мл сухого толуола и 2,5 мл раствора DMA, и добавляли триэтиламин (1,2 мл, 8,65 ммоль) (можно добавлять несколько сухих молекулярных сит), проводили замену газообразного азота и смесь нагревали до 120°C, в то время как проводили мониторинг реакции посредством TLC (проявитель: DCM:MeOH=3:1). После завершения реакции раствор концентрировали при пониженном давлении с использованием масляного насоса, и полученный остаток подвергали разделению с использованием колоночной хроматографии на силикагеле (элюент: дихлорметан:метанол от 20:1 до 10:1) с получением 700 мг продукта. LC-MS m/z (ES+): 299,2 (M+H)+-Boc, 399,3 (M+H)+.
Пример 8
Получение соединения 8
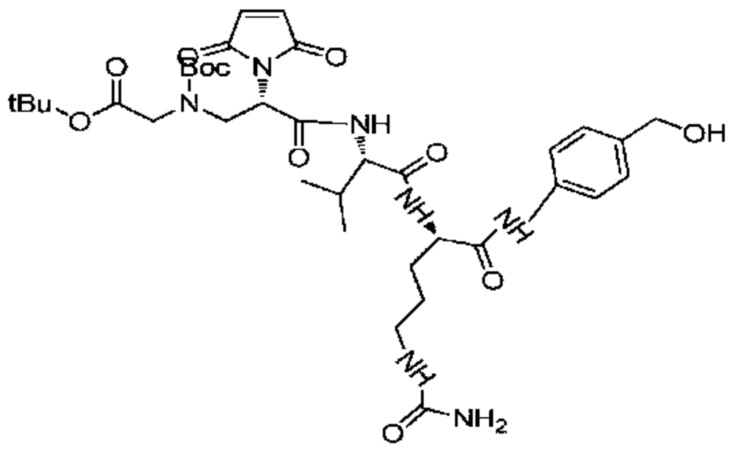
700 мг (1,7 ммоль) соединения 7 растворяли в 3,5 мл DMF, после чего добавляли 531 мг (2,11 ммоль) EEDQ и 733 мг (1,93 ммоль) Val-Cit-PABOH и реакции позволяли протекать при комнатной температуре. Проводили мониторинг посредством TLC (проявитель: DCM: MeOH=5:1). После завершения реакции раствор концентрировали при пониженном давлении с использованием масляного насоса при 45°C, и полученный остаток подвергали разделению с использованием колоночной хроматографии на силикагеле (элюент: дихлорметан:метанол от 50:1 до 20:1) с получением 520 мг продукта. LC-MS m/z (ES+): 660,3 (M+H)+-Boc, 760,4 (M+H)+.
Пример 9
Получение соединения 9
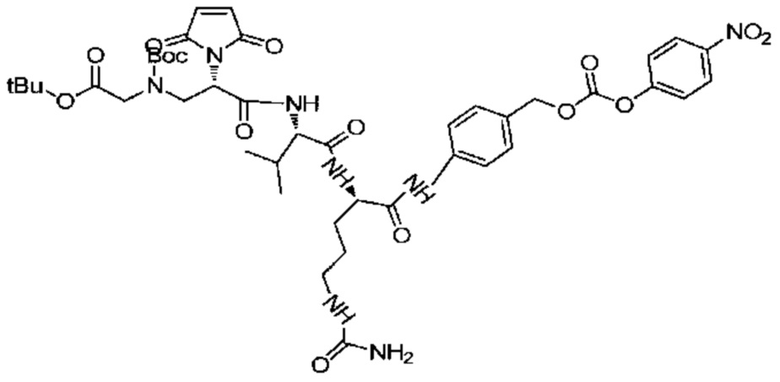
520 мг (0,685 ммоль) соединения 8 и 1,04 г (3,42 ммоль) NCP последовательно добавляли в реакционную колбу, добавляли 10 мл DMF для растворения твердых веществ и добавляли 0,33 мл (2,05 ммоль) DIEA, после чего реакции позволяли протекать при комнатной температуре. Проводили мониторинг посредством TLC (проявитель: DCM:MeOH=5:1). После завершения реакции раствор концентрировали при пониженном давлении с использованием масляного насоса при 45°C, и полученный остаток подвергали разделению с использованием колоночной хроматографии на силикагеле (элюент: дихлорметан:метанол=30:1) с получением 530 мг продукта. LC-MS m/z (ES+): 825,3 (M+H)+-Boc, 925,2 (M+H)+.
Пример 10
Получение соединения 10
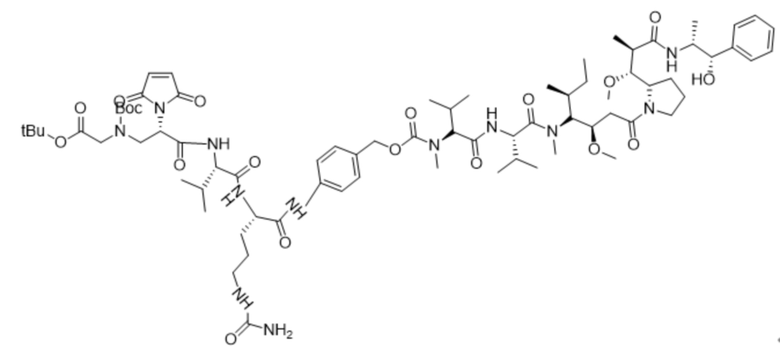
530 мг (0,57 ммоль) соединения 9 и 13,5 мг (0,1 моль) HOBT растворяли в 5 мл DMF, добавляли 0,17 мл (1,04 ммоль) DIEA и после активации при комнатной температуре в течение 1 ч, добавляли 373 мг (0,52 ммоль) MMAE, и раствору позволяли реагировать в течение ночи при комнатной температуре. Мониторинг посредством ВЭЖХ показал, что исходный материал MMAE полностью вступал в реакцию. Очистку проводили с использованием жидкой фазы ВЭЖХ.
(Колонка: YMC-C18, 50 мм × 450 мм, 10 мкм, ацетонитрил/вода (0,2% TFA), скорость потока 50 мл/мин, детекция при λ=205 нм)
Растворитель A: 0,2% TFA в воде
Растворитель B: Ацетонитрил
Градиент: 0-10 мин, 90%A, 10-25 мин, 90-45%A, 25-55 мин, 45-40%A
Фракцию с временем удержания 34 мин собирали и лиофилизировали с получением 200 мг продукта; LC-MS m/z (ES+): 1503,2 (M+H)+.
Пример 11
Получение соединения 11
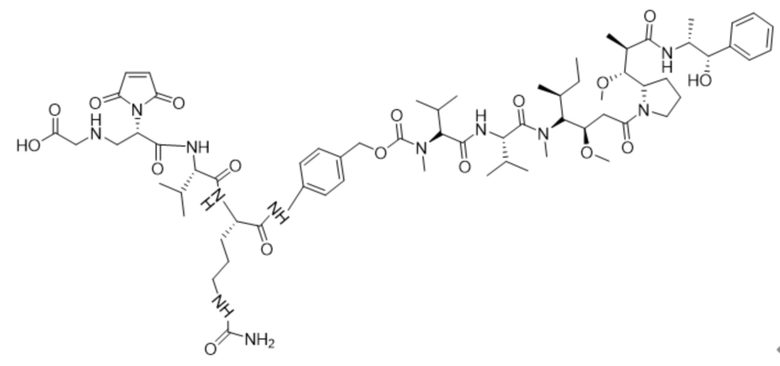
70 мг соединения 10 растворяли в 10 мл сухого дихлорметана, добавляли 4 мл трифторуксусной кислоты и реакции позволяли протекать при комнатной температуре в течение одного часа, а затем проводили очистку посредством ВЭЖХ.
(Колонка: YMC-C18, 30 мм×450 мм, 10 мкм, ацетонитрил/вода (0,2% TFA), скорость потока 25 мл/мин, детекция при λ=205 нм)
Растворитель A: 0,2% TFA в воде
Растворитель B: Ацетонитрил
Градиент: 0-10 мин, 95%A, 10-30 мин, 95-80%A, 30-50 мин, 80-50%A.
Фракцию с временем удержания 33 мин собирали и лиофилизировали с получением 34 мг продукта; LC-MS m/z (ES+): 1347,8 (M+H)+.
Пример 12
Получение соединения 12
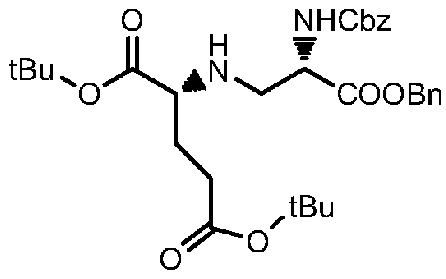
Ди-трет-бутил-L-глутамат (8 г, 30,8 ммоль) растворяли в 150 мл ацетонитрила, добавляли DIEA (6 мл, 37 ммоль), и капельно добавляли бензиловый эфир 2-бром-N-(бензилоксикарбонил)-L-аланина (10,2 г, 26,1 ммоль) на ледяной бане; после капельного добавления реакции позволяли протекать в течение 40 минут реакционный раствор помещали в условия комнатной температуры и позволяли ему реагировать при одновременном проведении мониторинга посредством TLC (проявитель: DCM:MeOH=10:1). После завершения реакции раствор концентрировали при пониженном давлении, и полученный остаток подвергали разделению с использованием колоночной хроматографии на силикагеле (элюент: дихлорметан:метанол=100:1) с получением 8,1 г продукта. LC-MS m/z (ES+): 571,2 (M+H)+.
Пример 13
Получение соединения 13
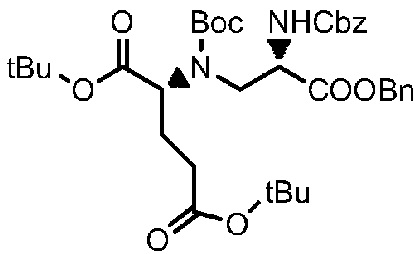
8,1 г соединения 12 (14,2 ммоль), 50 мл 1,4-диоксана и 50 мл воды добавляли в реакционную колбу, а затем добавляли 3,5 мл DIEA (21,3 ммоль) и капельно добавляли 14,5 г Boc-ангидрида (66,7 ммоль) при комнатной температуре; полученный реакционный раствор был желтым, и реакции позволяли протекать до завершения при комнатной температуре, и в это время проводили мониторинг посредством TLC (проявитель: DCM: MeOH=30:1). После завершения реакции диоксан удаляли посредством концентрирования при пониженном давлении и добавляли DCM для проведения экстракции с последующим концентрированием при пониженном давлении с получением неочищенного желтого маслянистого продукта; затем его подвергали разделению с использованием колоночной хроматографии на силикагеле (элюент: дихлорметан:метанол=300:1) с получением 8,55 г продукта. LC-MS m/z (ES+): 471,1 (M+H)+-Boc, 571,3 (M+H)+.
Пример 14
Получение соединения 14
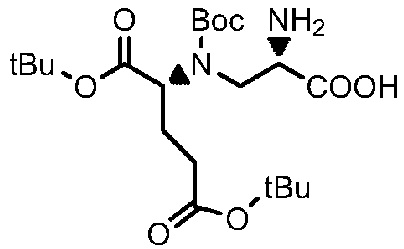
8,5 г соединения 13 растворяли в 70 мл метанола, добавляли 1,7 г 5% Pd/C и проводили замену газообразного водорода от двух до трех раз, в то время как смесь подвергали реакции при комнатной температуре и проводили мониторинг посредством TLC (проявитель: DCM:MeOH=5:1). После завершения реакции реакционный раствор фильтровали и концентрировали при пониженном давлении при 40°C с получением 5 г продукта, который непосредственно использовали в следующей реакции.
Пример 15
Получение соединения 15
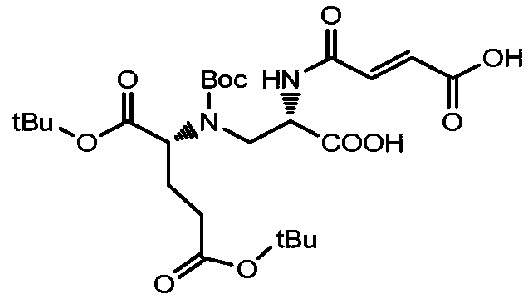
5 г (11,2 ммоль) соединения 14 растворяли в 40 мл ледяной уксусной кислоты, добавляли 2,19 г (22,4 ммоль) малеинового ангидрида и реакции позволяли протекать при перемешивании при комнатной температуре. Проводили мониторинг реакции посредством TLC (DCM: MeOH=3:1). После завершения реакции реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали с использованием жидкой фазы ВЭЖХ.
(Колонка: YMC-C18, 100 мм × 450 мм, 10 мкм, ацетонитрил/вода (0,2% TFA), скорость потока 200 мл/мин, детекция при λ=215 нм)
Растворитель A: 0,2% TFA в воде
Растворитель B: Ацетонитрил
Градиент: 0-10 мин, 90%A, 10-25 мин, 90-45%A, 25-55 мин, 45-40%A.
Фракцию с временем удержания 48 мин собирали и лиофилизировали с получением 2,3 г продукта. LC-MS m/z (ES+): 445,2 (M+H)+-Boc, 545,3 (M+H)+.
Пример 16
Получение соединения 16
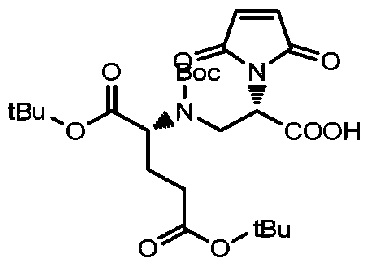
2 г соединения 15 (2,88 ммоль) растворяли в 25 мл сухого толуола и 2,5 мл раствора DMA и добавляли 1,58 мл триэтиламина (11,4 ммоль), проводили замену газообразного азота и смесь нагревали до 120°C в то время как проводили мониторинг реакции посредством TLC (проявитель: DCM: MeOH=3:1). После завершения реакции раствор концентрировали при пониженном давлении с использованием масляного насоса и полученный остаток подвергали разделению с использованием колоночной хроматографии на силикагеле (элюент: дихлорметан:метанол от 20:1 до 10:1) с получением 1,19 г продукта; LC-MS m/z (ES+): 427,1 (M+H)+-Boc, 527,3 (M+H)+.
Пример 17
Получение соединения 17
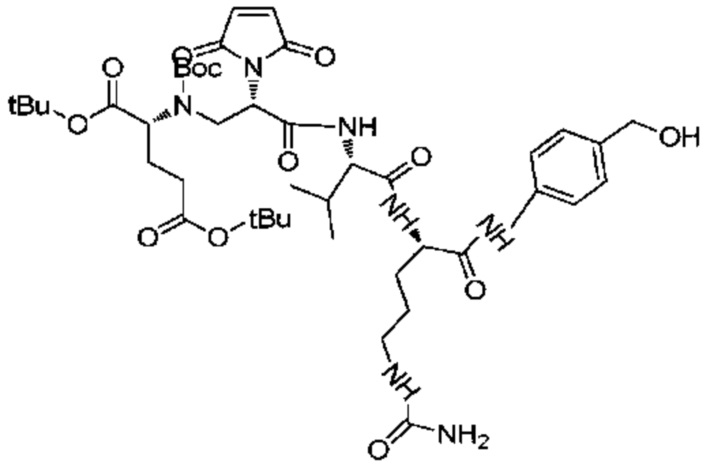
1,19 г (1,7 ммоль) соединения 16 растворяли в 3,5 мл DMF, после чего добавляли 531 мг (2,11 ммоль) EEDQ и 733 мг (1,93 ммоль) Val-Cit-PABOH и реакции позволяли протекать при комнатной температуре. Проводили мониторинг посредством TLC (проявитель: DCM:MeOH=5:1). После завершения реакции раствор концентрировали при пониженном давлении с использованием масляного насоса при 45°C, и полученный остаток подвергали разделению с использованием колоночной хроматографии на силикагеле (элюент: дихлорметан:метанол от 50:1 до 25:1) с получением 753 мг продукта. LC-MS m/z (ES+): 788,5 (M+H)+-Boc, 888,4 (M+H)+.
Пример 18
Получение соединения 18
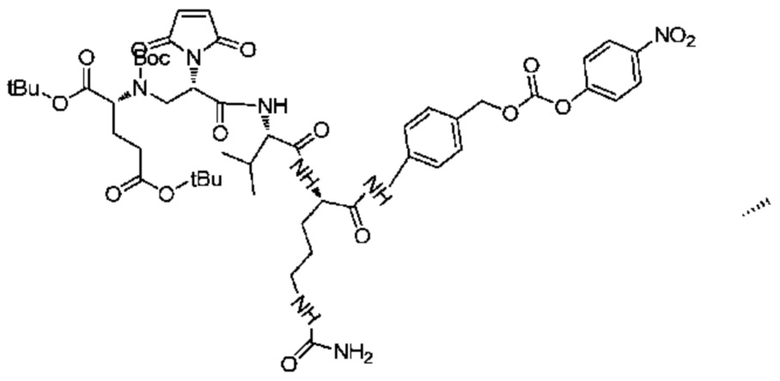
753 мг (0,849 ммоль) соединения 17 и 1,28 г (4,24 ммоль) NCP последовательно добавляли в реакционную колбу, добавляли 15 мл DMF для растворения твердых веществ и добавляли 0,35 мл (2,55 ммоль) DIEA, после чего реакции позволяли протекать при комнатной температуре. Проводили мониторинг посредством TLC (проявитель: DCM:MeOH=5:1). После завершения реакции раствор концентрировали при пониженном давлении с использованием масляного насоса при 45°C, и полученный остаток подвергали разделению с использованием колоночной хроматографии на силикагеле (элюент: дихлорметан:метанол=25:1) с получением 762 мг продукта. LC-MS m/z (ES+): 1053,6 (M+H)+.
Пример 19
Получение соединения 19
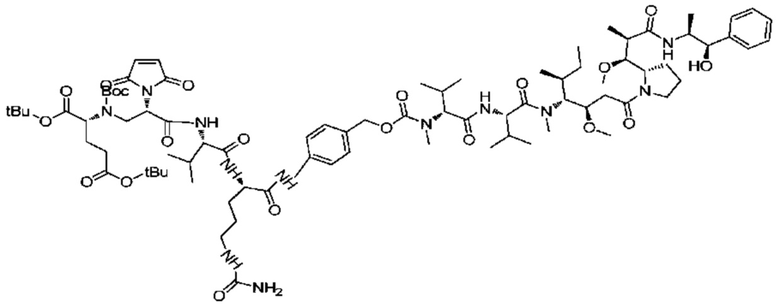
762 мг (0,71 ммоль) соединения 18 и 13,5 мг (0,1 моль) HOBT растворяли в 8 мл DMF, добавляли 0,23 мл (1,42 ммоль) DIEA и после активации при комнатной температуре в течение 1 ч добавляли 463 мг (0,645 ммоль) MMAE и раствору позволяли реагировать в течение ночи при комнатной температуре. Мониторинг посредством ВЭЖХ показал, что исходный материал MMAE полностью вступал в реакцию. Проводили очистку с использованием жидкой фазы ВЭЖХ.
(Колонка: YMC-C18, 100 мм×450 мм, 10 мкм, ацетонитрил/вода (0,2% TFA), скорость потока 200 мл/мин, детекция при λ=215 нм)
Растворитель A: 0,2% TFA в воде
Растворитель B: Ацетонитрил
Градиент: 0-10 мин, 90%A, 10-25 мин, 90-45%A, 25-55 мин, 45-40%A
Фракцию с временем удержания 30 мин собирали и лиофилизировали с получением 300 мг продукта. LC-MS m/z (ES+): 1631,6 (M+H)+.
Пример 20
Получение соединения 20
100 мг соединения 19 растворяли в 10 мл сухого дихлорметана, добавляли 4 мл трифторуксусной кислоты и реакции позволяли протекать при комнатной температуре в течение одного часа, а затем проводили очистку посредством ВЭЖХ.
(Колонка: YMC-C18, 30 мм × 450 мм, 10 мкм, ацетонитрил/вода (0,2% TFA), скорость потока 25 мл/мин, детекция при λ=215 нм)
Растворитель A: 0,2% TFA в воде
Растворитель B: Ацетонитрил
Градиент: 0-10 мин, 95%A, 10-25 мин, 95-80%A, 25-55 мин, 80-55%A
Фракцию с временем удержания 30 мин собирали и лиофилизировали с получением 45 мг продукта. LC-MS m/z (ES+): 1419,1 (M+H)+.
Примеры 21-29
Синтез соединений 21-29
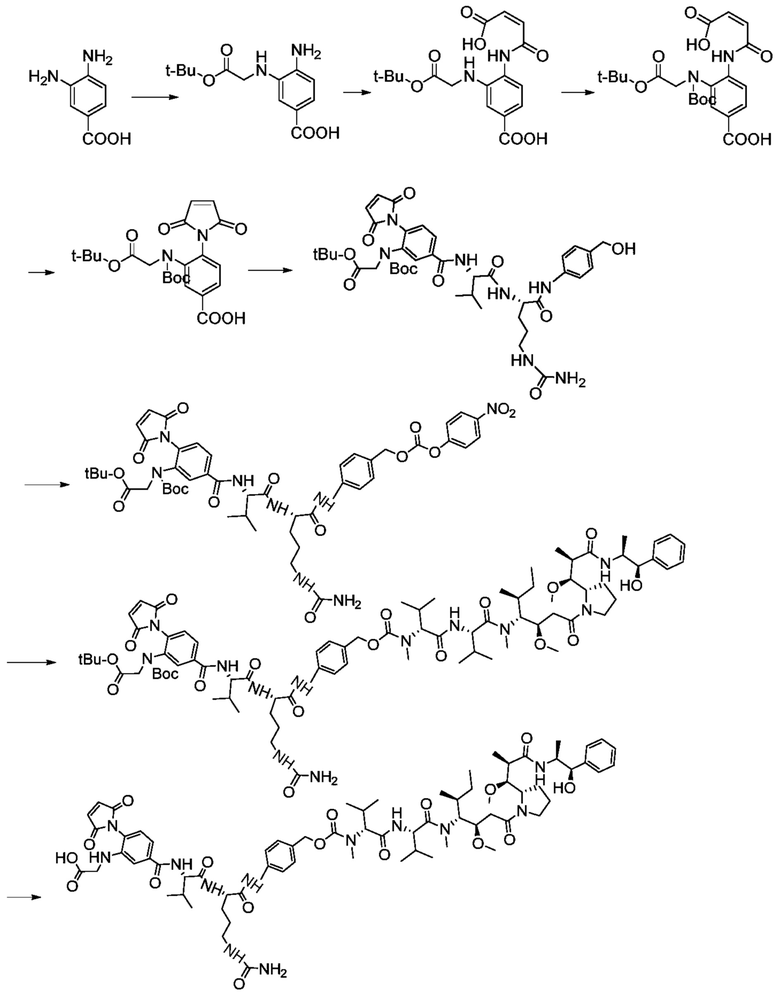
Пример 21
Получение соединения 21
15 г 3-нитро-4-аминобензойную кислоту растворяли в 100 мл метанола, добавляли 3 г 5% Pd/C и проводили гидрогенизацию при атмосферном давлении в течение пяти часов, а затем проводили фильтрацию; полученный остаток на фильтре промывали два раза метанолом, далее концентрировали до сухого состояния при комнатной температуре в высоком вакууме и непосредственно использовали в следующей реакции без дальнейшей очистки.
Пример 22
Получение соединения 22
3,4-диаминобензойную кислоту (10 г, 65,7 ммоль) растворяли в 100 мл DMF, добавляли порошковый карбонат калия (13,6 г, 98,55 моль) и йодид калия (2,2 г, 1,31 ммоль), и капельно добавляли трет-бромуксусную кислоту в газообразном азоте, после чего капельно добавляли бутиловый эфир (12,8 г, 65,7 моль), в то время как реакции позволяли протекать при комнатной температуре. Проводили мониторинг посредством TLC (проявитель: DCM: MeOH=10:1). После завершения реакции добавляли воду, проводили экстракцию этилацетатом, и экстракт комбинировали с органической фазой; после этого проводили промывание насыщенным рассолом, а затем сушку безводным сульфатом натрия и фильтрацию, и раствор концентрировали при пониженном давлении, и полученный остаток подвергали разделению с использованием очистки посредством колоночной хроматографии на силикагеле (элюент: дихлорметан:метанол=от 150:1 до 100:1) с получением 3,46 г продукта. LC-MS m/z (ES+): 267,4 (M+H)+; 1H-ЯМР: 7,51-7,53, дд, 1H: 7,44-7,45, д, 1H: 6,66-6,69, д, 1H; 4,69, с, 2H: 1,49, с, 9H.
Пример 23
Получение соединения 23
3 г (11,2 ммоль) соединения 22, 15 мл ледяной уксусной кислоты и малеиновый ангидрид (0,55 г, 5,6 ммоль) добавляли в реакционную колбу, и полученной реакционной смеси позволяли протекать при комнатной температуре и проводили мониторинг посредством ВЭЖХ. После завершения реакции проводили концентрирование при пониженном давлении для удаления ледяной уксусной кислоты, и проводили очистку. (Колонка: YMC-C18, 100 мм×450 мм, 10 мкм, ацетонитрил/вода (0,2% TFA), скорость потока 200 мл/мин, детекция при λ=214 нм)
Растворитель A: 0,2% TFA в воде
Растворитель B: Ацетонитрил
Градиент: 0-5 мин 80%A, 5-35 мин, 80-65%A, 35-45 мин, 65-60%A, фракцию, демонстрирующую время удержания 37-42 мин, собирали и лиофилизировали с получением 2 г продукта. LC-MS m/z (ES+): 365,4 (M+H)+, 309,3 (M+H)+-tBu. 1H-ЯМР: 10,48, с, 1H; 7,41-7,44, дд, 1H; 7,35-7,36, д, 1H; 6,92, с, 2H; 6,70-6,72, д, 1H; 4,68, с, 2H; 1,42, с, 9H.
Пример 24
Получение соединения 24
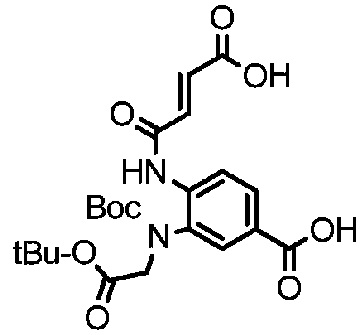
Соединение 23 (2 г, 5,49 ммоль) растворяли в 30 мл THF, и добавляли Boc-ангидрид (1,44 г, 6,59 ммоль), DMAP (1,32 г, 10,9 ммоль) и DIEA (1,8 мл, 10,98 ммоль) и реакции позволяли протекать при комнатной температуре. Проводили мониторинг посредством TLC (проявитель: DCM: MeOH=10:1). После завершения реакции раствор подвергали разделению с использованием колоночной хроматографии на силикагеле (элюент: дихлорметан:метанол=от 100:1 до 20:1) с получением 2,2 г продукта. LC-MS m/z (ES+); 365,4(M+H)+-Boc 1H-ЯМР : 10,50, с, 1H; 7,46-7,48, дд, 1H; 7,41-7,42, д, 1H; 6,95, с, 2H; 6,73-6,75, д, 1H; 4,69, с, 2H; 1,48, с, 9H; 1,40, с, 9H.
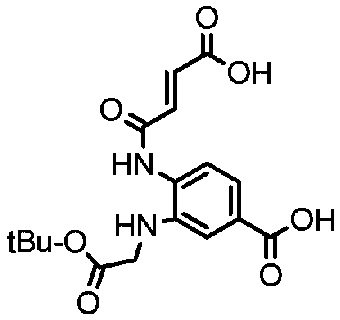
Пример 25
Получение соединения 25
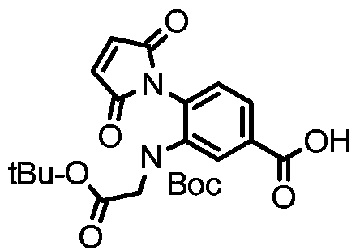
2 г (4,31 ммоль) соединения 24 растворяли в 15 мл толуола и добавляли 2 мл DMA, триэтиламина (1,2 мл, 8,62 ммоль) и результирующей реакции позволяли протекать при 120°C. Проводили мониторинг реакции посредством TLC (DCM:MeOH=10:1). После завершения реакции раствор концентрировали при пониженном давлении, и полученный остаток подвергали разделению с использованием очистки посредством колоночной хроматографии на силикагеле (элюент: дихлорметан:метанол от 100:1 до 50:1) с получением 1,63 г продукта; LC-MS m/z (ES+): 347,4 (M+H)+-Boc 1H-ЯМР : 7,50-7,51, дд, 1H; 7,43-7,44, д, 1H; 6,97, с, 2H; 6,75-6,77, д, 1H; 4,67, с, 2H; 1,48, с, 9H; 1,40, с, 9H.
Пример 26
Получение соединения 26
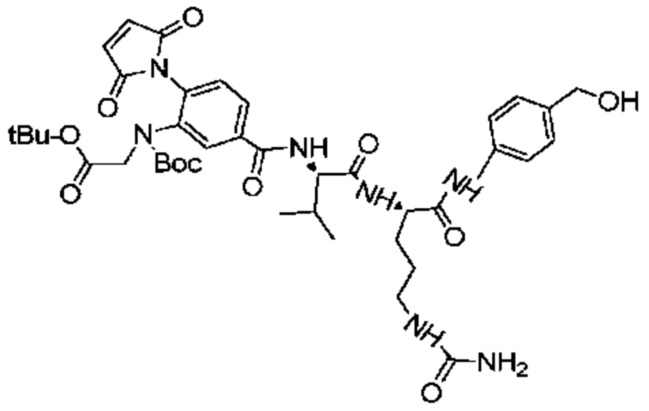
1,6 г (3,58 ммоль) соединения 25 растворяли в 10 мл DMF, после чего добавляли 1,77 г (7,17 ммоль) EEDQ и 2,98 г (7,89 ммоль) Val-Cit-PABOH, и реакции позволяли протекать при комнатной температуре. Проводили мониторинг посредством TLC (проявитель: DCM:MeOH=10:1). После завершения реакции раствор концентрировали при пониженном давлении с использованием масляного насоса при 45°C, и полученный остаток подвергали разделению с использованием колоночной хроматографии на силикагеле (элюент: дихлорметан:метанол от 100:1 до 25:1) с получением 2,1 г продукта. LC-MS m/z (ES+): 709,8 (M+H)+-Boc, 809,7 (M+H)+.
Пример 27
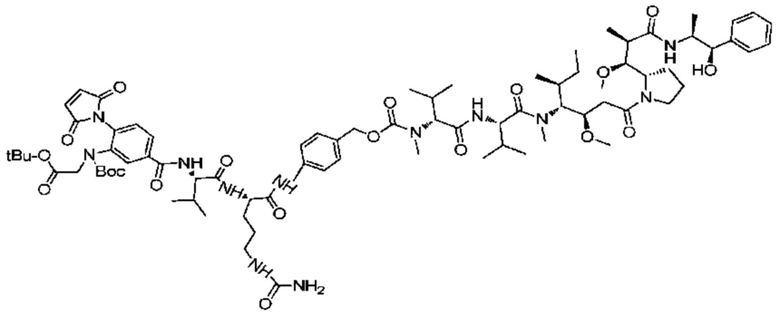
Получение соединения 27
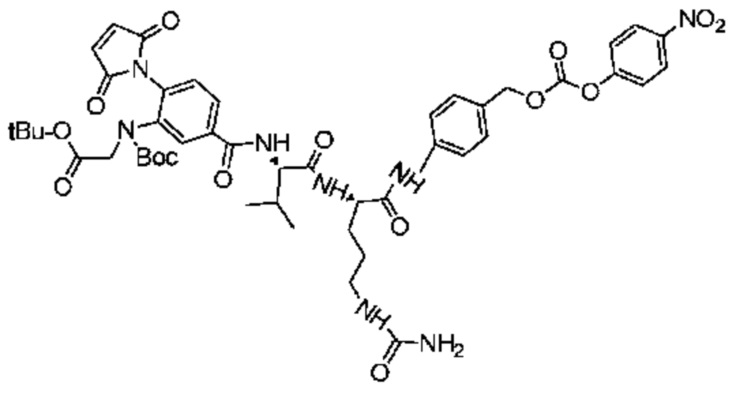
2 г (2,47 ммоль) соединения 26 и 3,71 г (12,3 ммоль) NCP последовательно добавляли в реакционную колбу, добавляли 20 мл DMF для растворения твердых веществ и добавляли 1,2 мл (7,41 ммоль) DIEA, после чего реакции позволяли протекать при комнатной температуре. Проводили мониторинг посредством TLC (проявитель: DCM: MeOH=15:1). После завершения реакции раствор концентрировали при пониженном давлении с использованием масляного насоса при 45°C, и полученный остаток подвергали разделению с использованием колоночной хроматографии на силикагеле (элюент: дихлорметан:метанол=100:1) с получением 2,1 г продукта. LC-MS m/z (ES+): 973,3 (M+H)+.
Пример 28
Получение соединения 28
1 г (1 ммоль) соединения 27 и 13,5 мг (0,1 моль) HOBT растворяли в 8 мл DMF, добавляли 0,33 мл (2 ммоль) DIEA, и после активации при комнатной температуре в течение 1 ч добавляли 646 мг (0,9 ммоль) MMAE, и раствору позволяли реагировать в течение ночи при комнатной температуре. Мониторинг посредством ВЭЖХ показал, что исходный материал MMAE полностью вступал в реакцию. Очистку проводили с использованием жидкой фазы ВЭЖХ.
(Колонка: YMC-C18, 100 мм×450 мм, 10 мкм, ацетонитрил/вода (0,2% TFA), скорость потока 200 мл/мин, детекция при λ=214 нм)
Растворитель A: 0,2% TFA в воде
Растворитель B: Ацетонитрил
Градиент: 0-10 мин, 90%A, 10-25 мин, 90-45%A, 25-55 мин, 45-40%A.
Фракцию с временем удержания 30 мин собирали и лиофилизировали с получением 560 мг продукта. LC-MS m/z (ES+): 1551,7 (M+H)+.
Пример 29
Получение соединения 29
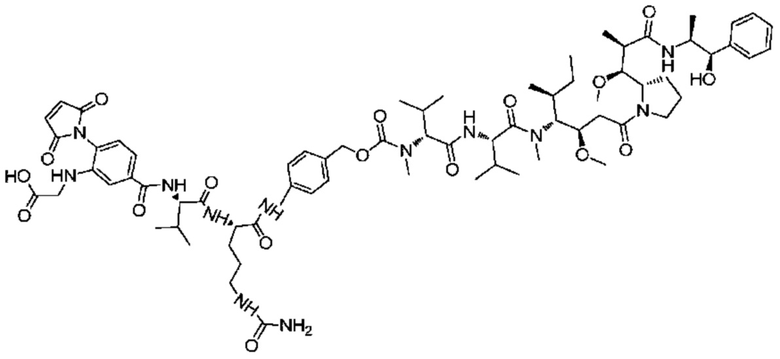
100 мг соединения 28 растворяли в 10 мл сухого дихлорметана, добавляли 4 мл трифторуксусной кислоты и реакции позволяли протекать при комнатной температуре в течение двух часов, а затем проводили очистку посредством ВЭЖХ.
(Колонка: YMC-C18, 30 мм × 450 мм, 10 мкм, ацетонитрил/вода (0,2% TFA), скорость потока 25 мл/мин, детекция при λ=214 нм)
Растворитель A: 0,2% TFA в воде
Растворитель B: Ацетонитрил
Градиент: 0-10 мин, 95%A, 10-25 мин, 95-80%A, 25-55 мин, 80-55%A
Фракцию с временем удержания 30 мин собирали и лиофилизировали с получением 45 мг продукта. LC-MS m/z (ES+): 1395,7 (M+H)+.
Примеры 30-39
Синтез соединений 30-39
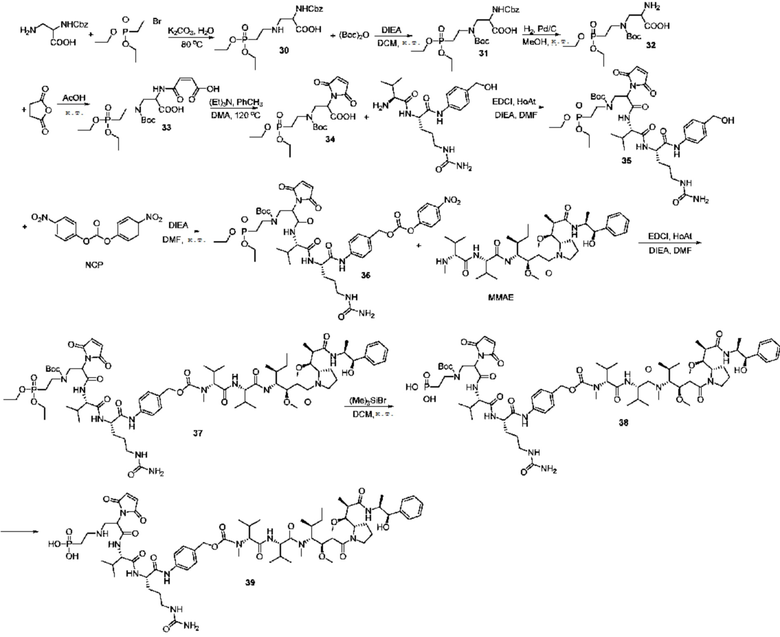
Пример 30
Получение соединения 30
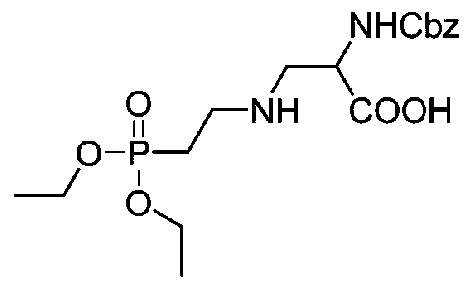
С использованием 500-мл круглодонной колбы, карбонат калия (24,7 г, 179,24 ммоль) растворяли в 220 мл чистой воды, после чего добавляли (S)-3-амино-2-(бензилоксикарбониламино)пропионовую кислоту (16 г, 67,16 ммоль) и смесь перемешивали практически до полного растворения; далее добавляли 2-бромэтилдиэтилфосфат (10,98 г, 44,81 ммоль) и после завершения добавления смесь помещали на масляную баню при 80°C и перемешивали в течение шести часов до завершения реакции. Реакционную жидкость очищали с использованием жидкой фазы ВЭЖХ. (Колонка: YMC-C18, 100 мм×450 мм, 10 мкм, ацетонитрил/вода (0,2% TFA), скорость потока 200 мл/мин, детекция при λ=214 нм)
Растворитель A: 0,2% TFA в воде
Растворитель B: Ацетонитрил
Градиент: 0-10 мин, 5-15%B, 10-15 мин, 15%B, 15-25 мин, 15-20%B, 25-50 мин, 20-30%B, 50-55 мин, 30-50%B, 55-65 мин, 50-90%B. Фракцию с временем удержания 42-49 мин собирали и лиофилизировали с получением 8,38 г бесцветного маслянистого продукта с выходом 46,5%. Данные 1H-ЯМР (CDCl3, 400 МГц): 7,39-7,28 (м, 5H), 6,54-6,41 (м, 1H), 5,12-5,01 (м, 2H), 4,63-4,53 (м, 1H), 4,16-4,03 (м,4H), 3,48-3,36 (м,2H), 3,35-3,25 (м, 2H), 2,35-2,23 (м,2H), 1,29 (t, J=6,8Hz, 6H); LCMS[M+H]+ m/z 403,3 (вычислено для C17H27N2O7P, 402,16).
Пример 31
Получение соединения 31
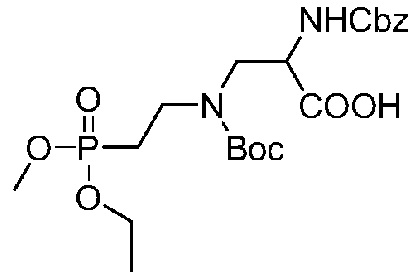
В 100-мл колбе с тремя горлышками соединение 30 (8,3 г, 20,85 ммоль) растворяли с использованием 50 мл растворителя дихлорметана и раствор помещали в низкотемпературный реактор, установленный на 0°C, в атмосфере газообразного азота, после чего капельно добавляли основание DIEA (6,7 г, 52,11 ммоль) при перемешивании и капельно добавляли Boc-ангидрид (5,0 г, 22,935 ммоль) в течение получаса; после завершения капельного добавления смесь помещали в условия комнатной температуры и перемешивали в течение 2 часов, и проводили мониторинг посредством TLC до завершения реакции (проявитель: DCM:MeOH=4:1). Последующая обработка: в реакционный раствор добавляли воду для промывания его три раза, органическую фазу сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, и полученный остаток очищали посредством ВЭЖХ. (Колонка: YMC-C18, 100 мм 450 мм, 10 мкм, ацетонитрил/вода (0,2% TFA), скорость потока 200 мл/мин, детекция при λ=214 нм)
Растворитель A: 0,2% TFA в воде
Растворитель B: Ацетонитрил
Градиент: 0 мин, 40%B, 0-10 мин, 40%B, 10-20 мин, 40-45%B, 20-30 мин, 45%B, 30-45 мин, 45-80%B, 45-50 мин, 80-95%B. Фракцию с временем удержания 26-29,5 мин собирали и лиофилизировали с получением 4,02 г бесцветной маслянистой жидкости с выходом 38,3%. Данные 1H-ЯМР (CDCl3, 400 МГц):7,36-7,28 (м, 5H), 5,09 (с, 2H), 4,63-4,43 (м, 1H), 4..14-4,01 (м, 4H), 3,92-3,65 (м, 2H), 3,61-3,29 (м, 2H), 2,34-1,95 (м,2H), 1,45 (с,9H), 1,36-1,22 (м, 6H); LCMS[M+H]+m/z 503,4 (вычислено для C22H35N2O9P, 502,21).
Пример 32
Получение соединения 32
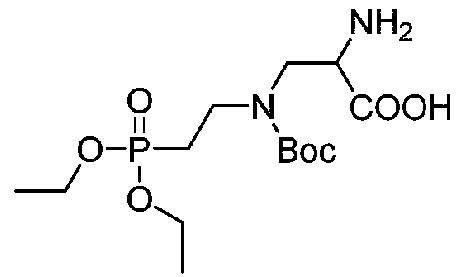
В 150-мл круглодонной колбе 50 мл метанола использовали для растворения соединения 31 (4,0 г, 8,0 ммоль) после чего добавляли 800 мг Pd/C (содержащего 5% Pd) и заменяли газообразный водород, после чего реакционный раствор перемешивали при комнатной температуре в течение четырех часов; проводили мониторинг посредством TLC (проявитель: DCM:MeOH=4:1) до завершения реакции и реакцию останавливали. Фильтрацию через органическую мембрану использовали для удаления палладия на угле и проводили концентрирование при пониженном давлении с получением остатка, который прямо использовали на следующей стадии без необходимости в какой-либо очистке. LCMS[M+H]+m/z 369,4 (вычислено для C14H29N2O7P, 368,17).
Пример 33
Получение соединения 33
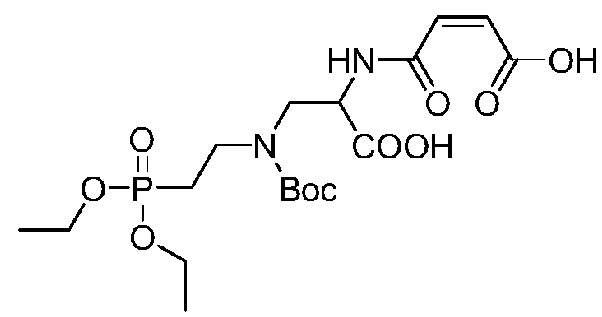
В 100-мл круглодонную колбу добавляли 30 мл ледяной уксусной кислоты для растворения неочищенного соединения 32, после чего добавляли малеиновый ангидрид (1,57 г, 16,0 ммоль) при перемешивании и реакции позволяли протекать при перемешивании при комнатной температуре в течение ночи. Реакцию останавливали на следующие сутки и ледяную уксусную кислоту удаляли посредством концентрирования при пониженном давлении с использованием масляного насоса при 45°C; затем полученный остаток очищали посредством ВЭЖХ. (Колонка: YMC-C18, 100 мм × 450 мм, 10 мкм, ацетонитрил/вода (0,2% TFA), скорость потока 200 мл/мин, детекция при λ=214 нм)
Растворитель A: 0,2% TFA в воде
Растворитель B: Ацетонитрил
Градиент: 0 мин, 5%B, 0-10 мин, 5-15%B, 10-20 мин, 15-30%B, 20-35 мин, 30-55%B, 35-45 мин, 55%B, 45-55 мин, 55-80%B, 55-60 мин, 80-98%B. Фракцию с временем удержания 25-26,5 мин собирали и лиофилизировали с получением 3,35 г маслянистого вещества с выходом за две стадии 90%. Данные 1H-ЯМР (CDCl3, 400 МГц): 6,40 (д, J=12Hz, 1H), 6,35 (д, J=12Hz, 1H), 4,96 to 4,82 (м,1H), 4,19-3,99 (м, 4H), 3,98-3,61 (м, 2H), 3,60-3,36 (м, 2H), 2,22-2,00 (м, 2H), 1,45 (с, 9H), 1,33 (т, J=7,0Hz, 3H), 1,32 (т, J=7,0Hz, 3H); LCMS[M+H]+m/z 467,3 (вычислено для C18H31N2O10P, 466,17).
Пример 34
Получение соединения 34
В 100-мл круглодонной колбе соединение 33 (3,3 г, 7,07 ммоль) растворяли 40 мл толуола и 4 мл DMA при перемешивании, после чего добавляли триэтиламин (2,1 г, 21,2 ммоль) и устанавливали водосборник и обратный холодильник, и реакции позволяли протекать в условиях кипячения с обратным холодильником и перемешивания при 120°C в течение 3 часов до тех пор, пока мониторинг TLC не продемонстрировал, что реакция завершилась (проявитель: DCM:MeOH=4:1). Последующая обработка: реакционный раствор концентрировали при пониженном давлении при 45°C для удаления толуола и полученный остаток очищали посредством ВЭЖХ. (Колонка: YMC-C18, 100 мм×450 мм, 10 мкм, ацетонитрил/вода (0,2% TFA), скорость потока 200 мл/мин, детекция при λ=214 нм)
Растворитель A: 0,2% TFA в воде
Растворитель B: Ацетонитрил
Градиент: 0 мин, 5%B, 0-10 мин, 5-15%B, 10-20 мин, 15-30%B, 20-35 мин, 30-55%B, 35-45 мин, 55%B, 45-55 мин, 55-80%B, 55-60 мин, 80-98%B. Фракцию с временем удержания 27-29 мин собирали и лиофилизировали с получением 2,12 г белого порошкового твердого вещества (которое быстро впитывало влагу из воздуха и становилось вязким маслом), с выходом 67%. LCMS[M+H]+m/z 449,3 (вычислено для C18H29N2O9P, 448,16).
Пример 35
Получение соединения 35
100-мл круглодонную колбу, содержавшую соединение 34 (2,1 г, 4,69 ммоль), осушали с использованием масляного насоса, добавляли 20 мл сухого DMF и полученную перемешивали до полного растворения; далее добавляли DIEA (1,8 г, 14,07 ммоль), а затем EDCI (1,81 г, 9,38 ммоль) и HoAt (1,28 г, 9,38 ммоль), и активированное соединение перемешивали при комнатной температуре в течение пяти с половиной часов, после чего добавляли соединение 6 (2,66 г, 7,03 ммоль) и реакции позволяли протекать при комнатной температуре в течение ночи, а затем ее останавливали на следующие сутки. Последующая обработка: растворитель DMF удаляли посредством концентрирования при пониженном давлении при 45°C с использованием масляного насоса и полученный остаток очищали с использованием колоночной хроматографии (элюент: дихлорметан:метанол=от 20:1 до 10:1 до 5:1) с получением 1,01 г белого порошкового твердого вещества с выходом 26,6%. LCMS[M+H]+m/z 810,4 (вычислено для C36H56N7O12P, 809,37).
Пример 36
Получение соединения 36
В 50-мл круглодонной колбе 15 мл сухого DMF использовали для растворения соединения 35 (1,0 г, 1,24 ммоль) при перемешивании, после чего добавляли DIEA (961 мг, 7,44 ммоль) и NPC (1,88 г, 6,2 ммоль) и реакционной смеси позволяли реагировать при комнатной температуре в течение ночи при перемешивании; на следующее утро мониторинг посредством TLC продемонстрировал, что реакция завершилась (проявитель: дихлорметан:метанол=5:1) и реакцию останавливали. Последующая обработка: реакционный раствор концентрировали при пониженном давлении с использованием масляного насоса при 45°C, и полученный остаток очищали посредством тонкослойной хроматографии (проявитель: дихлорметан:метанол=6:1) с получением 1,02 г белого порошкового твердого вещества с выходом 84,5%. LCMS[M+H]+m/z 975,3 (вычислено для C43H59N8O16P, 974,38).
Пример 37
Получение соединения 37
В 100-мл круглодонной колбе 10 мл сухого DMF использовали для растворения соединения 36 (1,0 г, 1,03 ммоль), после чего добавляли HoBt (28 мг, 0,21 ммоль) и DIEA (266 мг, 2,06 ммоль), и результирующей реакции позволяли протекать при перемешивании в течение получаса; далее добавляли MMAE (740 мг, 1,03 ммоль) и реакции позволяли протекать в течение ночи при комнатной температуре. Последующая обработка: реакционный раствор очищали посредством жидкофазной препаративной хроматографии. (Колонка: YMC-C18, 50 мм×450 мм, 10 мкм, ацетонитрил/вода (0,2% TFA), скорость потока 50 мл/мин, детекция при λ=214 нм)
Растворитель A: 0,2% TFA в воде
Растворитель B: Ацетонитрил
Градиент: 0 мин, 5%B, 0-10 мин, 5-15%B, 10-20 мин, 15-30%B, 20-35 мин, 30-55%B, 35-45 мин, 55-70%B, 45-55 мин, 70%B, 55-60 мин, 70-98%B.
Фракцию с временем удержания 38-40 мин собирали и лиофилизировали с получением 320 мг белого порошкового твердого вещества с выходом 20%. LCMS[M+H]+m/z 1553,8 (вычислено для C76H121N12O20P, 1552,85).
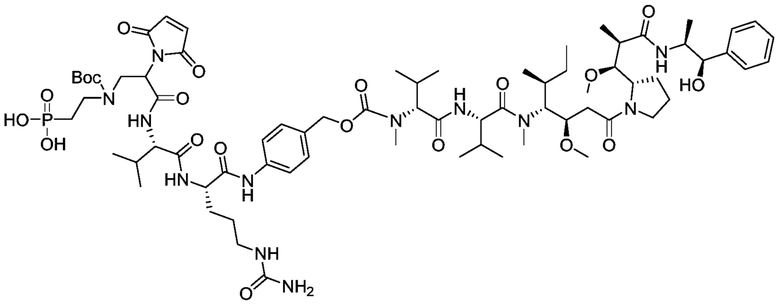
Пример 38
Получение соединения 38
Соединение 37 (260 мг, 0,17 ммоль) растворяли в 25-мл круглодонной колбе с использованием 5 мл дистиллированного дихлорметана, после чего добавляли бромтриметилсилан (78 мг, 0,51 ммоль) на ледяной бане в газообразном азоте; реакции позволяли протекать в течение ночи при комнатной температуре при перемешивании и на следующее утро добавляли 1 мл метанола, после чего реакции позволяли протекать при перемешивании при комнатной температуре в течение одного часа и жидкофазный анализ использовали для подтверждения того, что соединение 37 полностью прореагировало. Последующая обработка: реакционный раствор концентрировали при пониженном давлении и полученный остаток очищали посредством ВЭЖХ. (Колонка: YMC-C18, 30 мм × 450 мм, 10 мкм, ацетонитрил/вода (0,2% TFA), скорость потока 25 мл/мин, детекция при λ=214 нм)
Растворитель A: 0,2% TFA в воде
Растворитель B: Ацетонитрил
Градиент: 0 мин, 5%B, 0-10 мин, 5-15%B, 10-20 мин, 15-30%B, 20-35 мин, 30-55%B, 35-45 мин, 55-70%B, 45-55 мин, 70%B, 55-60 мин, 70-98%B.
Фракцию с временем удержания 20-23 мин собирали и лиофилизировали с получением 140 мг белого порошкового твердого вещества с выходом 55%.
Пример 39
Получение соединения 39
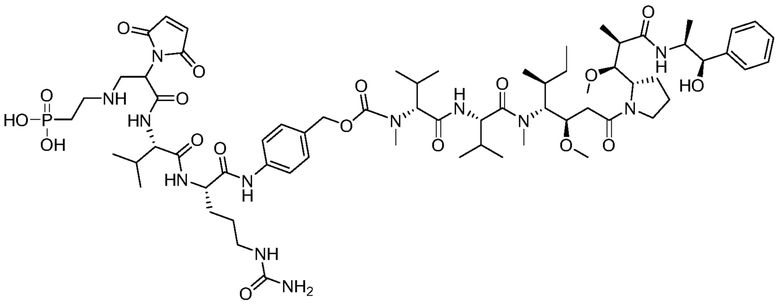
В 25-мл круглодонной колбе 2 мл дихлорметана использовали для растворения соединения 38 (120 мг, 0,08 ммоль) при перемешивании, после чего капельно добавляли 800 микролитров трифторуксусной кислоты на ледяной бане; после капельного добавления реакционный раствор помещали в условия комнатной температуры и реакции позволяли протекать при перемешивании в течение одного часа до завершения реакции. Последующая обработка: реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали посредством ВЭЖХ. (Колонка: YMC-C18, 30 мм×450 мм, 10 мкм, ацетонитрил/вода (0,2% TFA), скорость потока 25 мл/мин, детекция при λ=214 нм)
Растворитель A: 0,2% TFA в воде
Растворитель B: Ацетонитрил
Градиент: 0 мин, 5%B, 0-10 мин, 5-15%B, 10-20 мин, 15-30%B, 20-35 мин, 30-55%B, 35-45 мин, 55-70%B, 45-55 мин, 70%B, 55-60 мин, 70-98%B.
Фракцию с временем удержания 18-19,5 мин собирали и лиофилизировали с получением 55 мг белого порошкового твердого вещества с выходом 49%. LC-MS m/z (ES+): 1397,8 (M+H)+.
Пример 40
Получение соединения 40
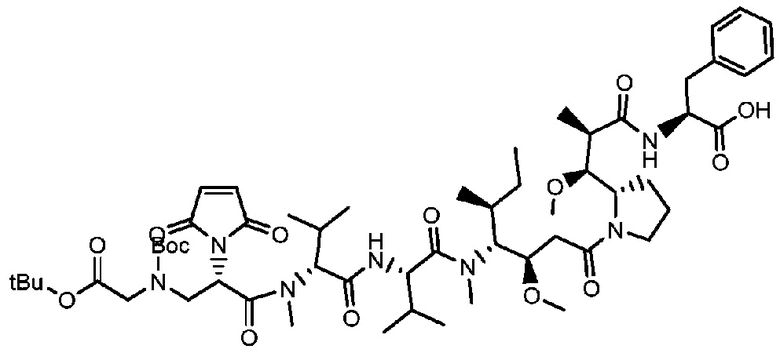
Соединение 7 (332 мг, 0,836 ммоль) растворяли в сухом дихлорметане, добавляли пентафторфенол (184 мг, 1 ммоль) и дициклогексилкарбодиимид (2 ммоль) и проводили перемешивание при комнатной температуре в течение трех часов до устранения соединения 7. Добавляли MMAF (460 мг, 0,585 ммоль) и диизопропилэтиламин (DIEA, 0,27 мл, 1,67 ммоль) и растворяли в 15 мл сухого раствора дихлорметана и полученной реакции позволяли протекать при комнатной температуре в течение четырех часов в газообразном азоте. Раствор концентрировали при пониженном давлении и полученный остаток подвергали разделению с использованием колоночной хроматографии на силикагеле (элюент: дихлорметан:метанол=50:1) с получением 290 мг продукта. LC-MS m/z (ES+): 1168,8 (M+H)+.
Пример 41
Получение соединения 41
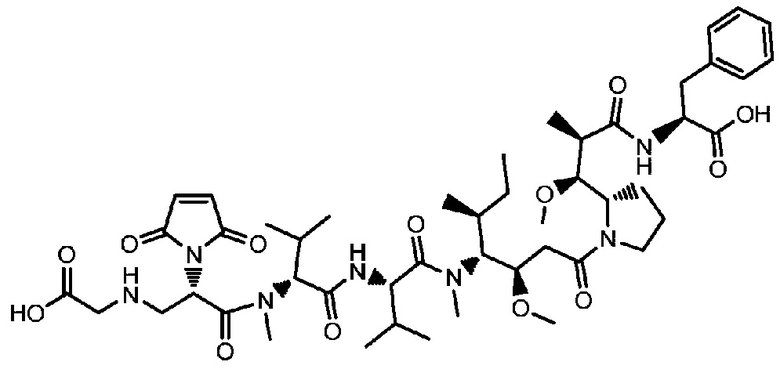
100 мг соединения 39 растворяли в 10 мл сухого дихлорметана, добавляли 4 мл трифторуксусной кислоты и реакции позволяли протекать при комнатной температуре в течение двух, а затем проводили очистку посредством ВЭЖХ.
(Колонка: YMC-C18, 30 мм × 450 мм, 10 мкм, ацетонитрил/вода (0,2% TFA), скорость потока 25 мл/мин, детекция при λ=215 нм)
Растворитель A: 0,2% TFA в воде
Растворитель B: Ацетонитрил
Градиент: 0-10 мин, 95%A, 10-25 мин, 95-70%A, 25-55 мин, 70-40%A.
Фракцию с временем удержания 33 мин собирали и лиофилизировали с получением 50 мг продукта. LC-MS m/z (ES+): 956,6 (M+H)+.
Пример 42
Получение соединения 42
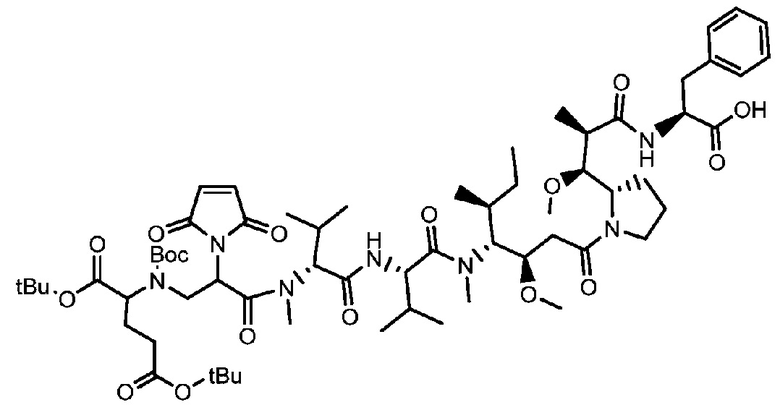
Соединение 16 (400 мг, 0,76 ммоль) растворяли в сухом дихлорметане, добавляли пентафторфенол (184 мг, 1 ммоль) и дициклогексилкарбодиимид (2 ммоль) и проводили перемешивание при комнатной температуре в течение четырех часов до устранения соединения 16. Добавляли MMAF (389 мг, 0,49 ммоль) и диизопропилэтиламин (DIEA, 0,25 мл, 1,52 ммоль) и растворяли в 15 мл сухого дихлорметана и итоговой реакции позволяли протекать при комнатной температуре в течение четырех часов в газообразном азоте. Раствор концентрировали при пониженном давлении и полученный остаток подвергали разделению с использованием колоночной хроматографии на силикагеле (элюент: дихлорметан:метанол=50:1) с получением 330 мг продукта. LC-MS m/z (ES+): 1296,8 (M+H)+.
Пример 43
Получение соединения 43
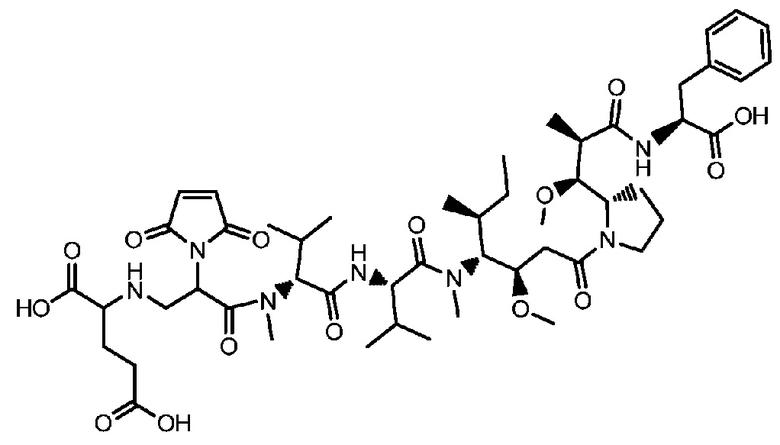
100 мг соединения 41 растворяли в 10 мл сухого дихлорметана, добавляли 4 мл трифторуксусной кислоты добавляли и реакции позволяли протекать при комнатной температуре в течение двух часов с последующей очисткой посредством ВЭЖХ.
(Колонка: YMC-C18, 30 мм × 450 мм, 10 мкм, ацетонитрил/вода (0,2% TFA), скорость потока 25 мл/мин, детекция при λ=215 нм)
Растворитель A: 0,2% TFA в воде
Растворитель B: Ацетонитрил
Градиент: 0-10 мин, 95%A, 10-25 мин, 95-70%A, 25-55 мин, 70-40%A
Фракцию с временем удержания 30 мин собирали и лиофилизировали с получением 48 мг продукта. LC-MS m/z (ES+): 1028,5 (M+H)+.
Пример 44
Конъюгат антитело-лекарственное средство H-11 получали согласно общему способу B, и обращено-фазовая ВЭЖХ продемонстрировала, что средняя величина соотношения лекарственное средство/антитело (DAR) составляла 7,2.
Пример 45
Конъюгат антитело-лекарственное средство H-20 получали согласно общему способу B, и обращено-фазовая ВЭЖХ продемонстрировала, что средняя величина соотношения лекарственное средство/антитело (DAR) составляла 7,2.
Пример 46
Конъюгат антитело-лекарственное средство H-29 получали согласно общему способу B, и обращено-фазовая ВЭЖХ продемонстрировала, что средняя величина соотношения лекарственное средство/антитело (DAR) составляла 6,8.
Пример 47
Конъюгат антитело-лекарственное средство H-39 получали согласно общему способу B, и обращено-фазовая ВЭЖХ продемонстрировала, что средняя величина соотношения лекарственное средство/антитело (DAR) составляла 7,0.
Пример 48
Конъюгат антитело-лекарственное средство H-41 получали согласно общему способу B, и обращено-фазовая ВЭЖХ продемонстрировала, что средняя величина соотношения лекарственное средство/антитело (DAR) составляла 7,5.
Пример 49
Конъюгат антитело-лекарственное средство H-43 получали согласно общему способу B, и обращено-фазовая ВЭЖХ продемонстрировала, что средняя величина соотношения лекарственное средство/антитело (DAR) составляла 7,7.
Пример 50
Синтез продолжали с получением следующих линкеров лекарственное средство-участок соединения:
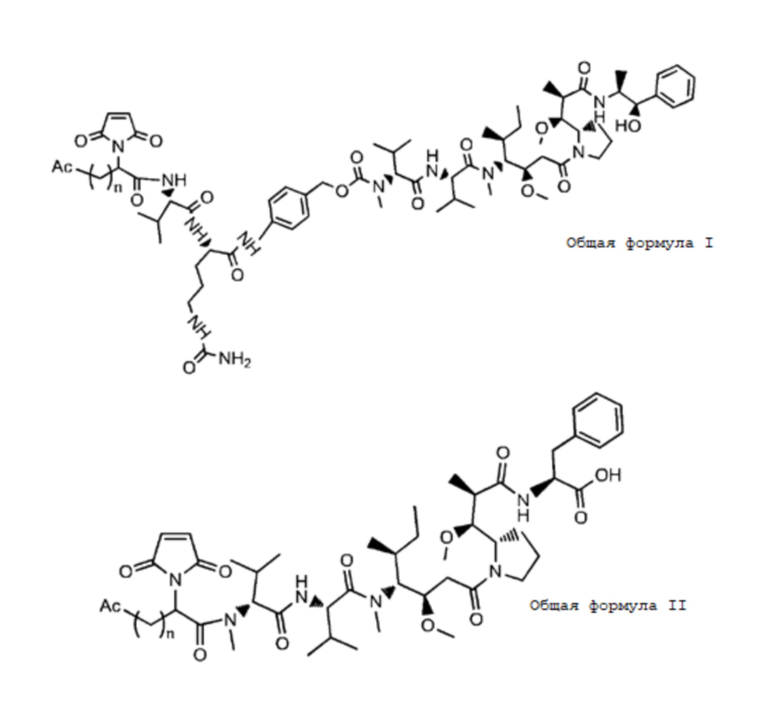
где Ac обозначает неосновную аминокислоту или олигопептид, и аминогруппа в аминокислоте соединена с алкильной группой;
n=1,2, 3...;
В таблице 1 ниже обобщенно представлен синтез и характеристики участков присоединения лекарственного средства, содержащих различные аминокислоты и олигопептиды. В таблице в первой колонке слева представлен номер соединения, во второй колонке представлен класс аминокислоты, в третьей колонке представлена величина n, в четвертой колонке представлен общий способ синтеза и в пятой и шестой колонках показана вычисленная масса соединения лекарственное средство-участок присоединения и масса при определении при определении посредством масс-спектрометрии.
Таблица 1
Сокращенные обозначения:
Gly: L-глицин, Ala: L-аланин, Phe: L-фенилаланин, Trp: L-тирозин, Asp: L-аспарагиновая кислота, Ser: L-серин, Val: L- Валин
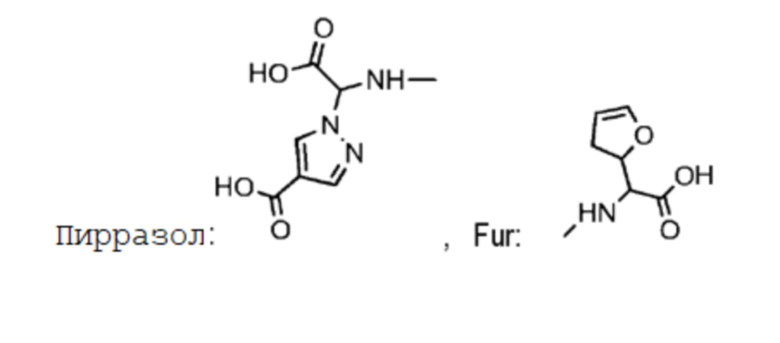
Примеры 52-56
Для оценки стабильности, гидрофильности и фармакологической активности ADC, полученных с использованием кислотного самостабилизирующегося участка присоединения, авторы настоящего изобретения получили соединения лекарственное средство-участок присоединения с кислотными стабилизирующими участками присоединения согласно примерам. Все эти соединения имели кислотный стабилизированный участок присоединения, который был соединен с цитотоксическим лекарственным средством MMAE или MMAF через расщепляющийся или не расщепляющийся линкер. В качестве сравнения типичное не самостабилизирующееся соединение лекарственное средство-участок присоединения (далее обозначаемое как MC-VC-PAB-MMAE) получали способами, приведенными в литературе, и получали соединение лекарственное средство-участок присоединения, имеющее основный самостабилизирующийся участок присоединения, как описано в данном патенте (далее обозначаемый как DPR-VC-PAB-MMAE).
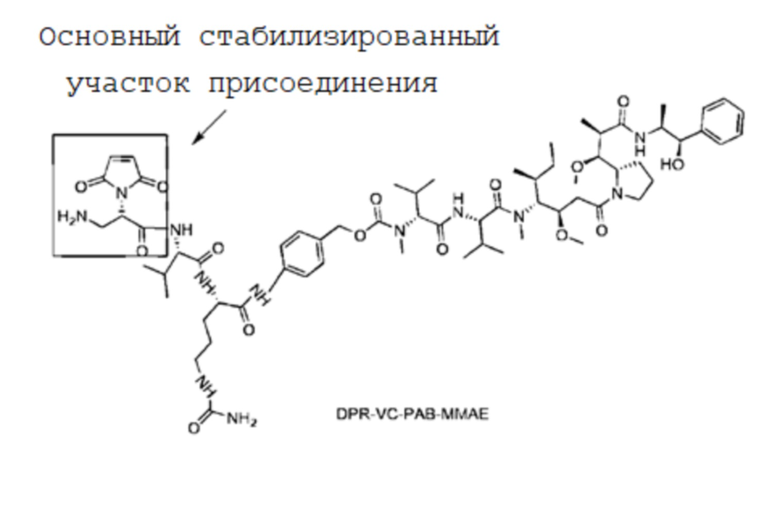
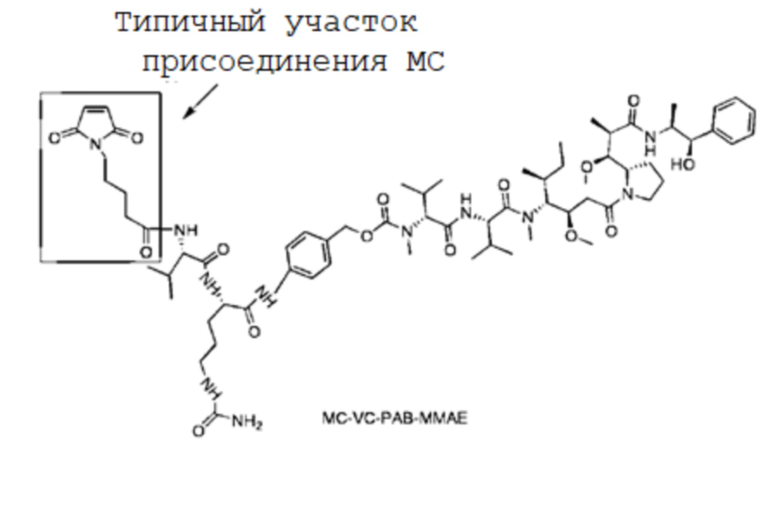
Пример 52: Стабильность в плазме in vitro
Результаты исследований стабильности в плазме, проведенные согласно способом, описанным общей методике D, были такими, как показано в таблице ниже: ADC с кислотными стабилизированными участками присоединения практически не утрачивают лекарственное средство в ходе инкубации в плазме, в то время как типичный ADC с участком присоединения MC продемонстрировал очень значительное снижение DAR после инкубации в течение 72 часов. Результаты эксперимента демонстрируют, что кислотный стабилизированный участок присоединения может значительно повышать стабильность ADC в плазме.
Пример 53: Детекция посредством SEC-ВЭЖХ
Образцы ADC, полученные посредством конъюгации, центрифугировали при 14000 об/мин в течение пяти минут, и проводили взятие супернатанта для анализа.
Устройство: Waters e2695 (2489UV/Vis)
Хроматография колонка: TSKgel G3000SWXL (7,8×300 мм, 5 мкм)
Подвижная фаза: A: 50 мМ PB, 300 мМ NaCl, 200 мМ Arg, 5% IPA, pH 6,5
Подвижную фазу A подвергали изократическому элюированию в течение 30 минут; скорость потока: 0,714 мл/мин, температура колонки: 25°C, длина волны детекции: 280 нм.
Степень агрегации каждого ADC определяли посредством SEC-ВЭЖХ и графики пиков SEC-ВЭЖХ представлены на фиг.2A-2H; соответствующие данные обобщенно представлены в таблице ниже, где уровень мономера значительно возрастал и степень агрегации значительно снижалась в ADC, которые включали кислотный стабилизированный участок присоединения.
Пример 54
Эксперименты PK на мышах in vivo
Свойства PK для ADC (с нагрузкой 8) определяли с использованием модели на мышах. Лекарственное средство вводили посредством однократной внутривенной инъекции в хвост в дозе 2 мг/кг, и концентрацию тотальных антител (тотальные Ab) в крови оценивали в соответствии с общей методикой B; результаты представлены на фиг.3. Результаты эксперимента показывают, что в модели на мышах ADC с кислотным стабилизированным участком присоединения продемонстрировал значительно улучшенные свойства PK с концентрацией тотальных антител, поддерживаемой в течение более длительного периода времени.
Пример 55
Анализ с использованием хроматографии гидрофобного взаимодействия (HIC)
После полного восстановления IgG1-антитела до 8 тиолов на антитело согласно общей методике A, соответствующие конъюгаты антитело-лекарственное средство получали посредством неспецифического связывания. ADC с кислотными стабилизированными участками присоединения и ADC с общепринятыми участками присоединения (т.е. MC-VC-PAB-MMAE) с восемью элементами лекарственного средства на антитело далее разделяли и очищали посредством хроматографии гидрофобного взаимодействия и хроматографию (HIC) гидрофобного взаимодействия использовали для проведения анализа ADC согласно общей методике C. ADC с большей гидрофобностью и более высокими соотношениями лекарственное средство/молекула элюировались с более длительным временем удержания. Результаты представлены на фиг.4: ADC с кислотными участками присоединения продемонстрировали относительно короткое время удержания в HIC, причем конъюгат антитела MC-VC-PAB-MMAE демонстрировал наиболее длительное время удержания. Результаты эксперимента демонстрируют, что молекулы ADC, обладающие кислотным стабилизированным участком присоединения, демонстрируют лучшую гидрофильность.
Пример 56
Эксперименты по определению эффективности лекарственного средства in vivo (анализ клеточной пролиферации)
Клетки аденокарценомы поджелудочной железы человека (BxPc3) культивировали in vitro и инокулировали подкожно в бок мышей BALB/c с инокулируемым количеством клеток 5×106 и после вырастания опухолей до 100-200 мм3, животных распределяли на группы и им вводили однократную дозу ADC 3 мг/кг (инъецируемую через хвостовую вену) в то время как также получали контрольную группу носителя; мышей подвергали регулярному взвешиванию и измерению объема опухоли, и эффективность лекарственного средства в отношении модели BxPc3 оценивали путем исследования эффективности подавления опухоли посредством ADC, а также других индикаторов. Результаты эксперимента представлены на фиг.5 и 6. Результаты показывают, что ADC, обладающие кислотным стабилизированным участком присоединения, демонстрируют сходную эффективность с Dpr-MC-VC-PAB-MMAE при DAR=2, и значительно лучше, чем Mc-VC-PAB-MMAE, в этом отношении. При высокой нагрузке лекарственным средством DAR=8, те же ADC продемонстрировали высокую эффективность в модели с подкожным трансплантатом опухоли BxPc3 на мышах.
| название | год | авторы | номер документа |
|---|---|---|---|
| Бифункциональные цитотоксические агенты | 2015 |
|
RU2669807C2 |
| КОНЪЮГАТЫ ПРОИЗВОДНОГО АНТРАЦИКЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВЫХ СОЕДИНЕНИЙ | 2009 |
|
RU2523419C2 |
| МОНОМЕТИЛВАЛИНОВЫЕ СОЕДИНЕНИЯ, СПОСОБНЫЕ ОБРАЗОВЫВАТЬ КОНЪЮГАТЫ С ЛИГАНДАМИ | 2004 |
|
RU2448117C2 |
| КОНЪЮГАТ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО, НАЦЕЛИВАЮЩИЙСЯ НА TROP2, И СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2822663C1 |
| КОВАЛЕНТНЫЕ ЛИНКЕРЫ В КОНЪЮГАТАХ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2016 |
|
RU2698727C1 |
| НЕЛИНЕЙНЫЕ САМОРАСЩЕПЛЯЮЩИЕСЯ ЛИНКЕРЫ И ИХ КОНЪЮГАТЫ | 2017 |
|
RU2755899C2 |
| КОНЪЮГАТ АМАНТИНА С АНТИТЕЛОМ | 2018 |
|
RU2809116C2 |
| КОНЪЮГАТ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО, ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ ДЛЯ ЕГО ПОЛУЧЕНИЯ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2800137C1 |
| КОНЪЮГАТ АНТИТЕЛА С АМАТОКСИНОМ НЕПРИРОДНОГО ТИПА | 2018 |
|
RU2840926C2 |
| КОНЪЮГАТЫ ЛИГАНДА С НЕСКОЛЬКИМИ ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ | 2006 |
|
RU2470668C2 |
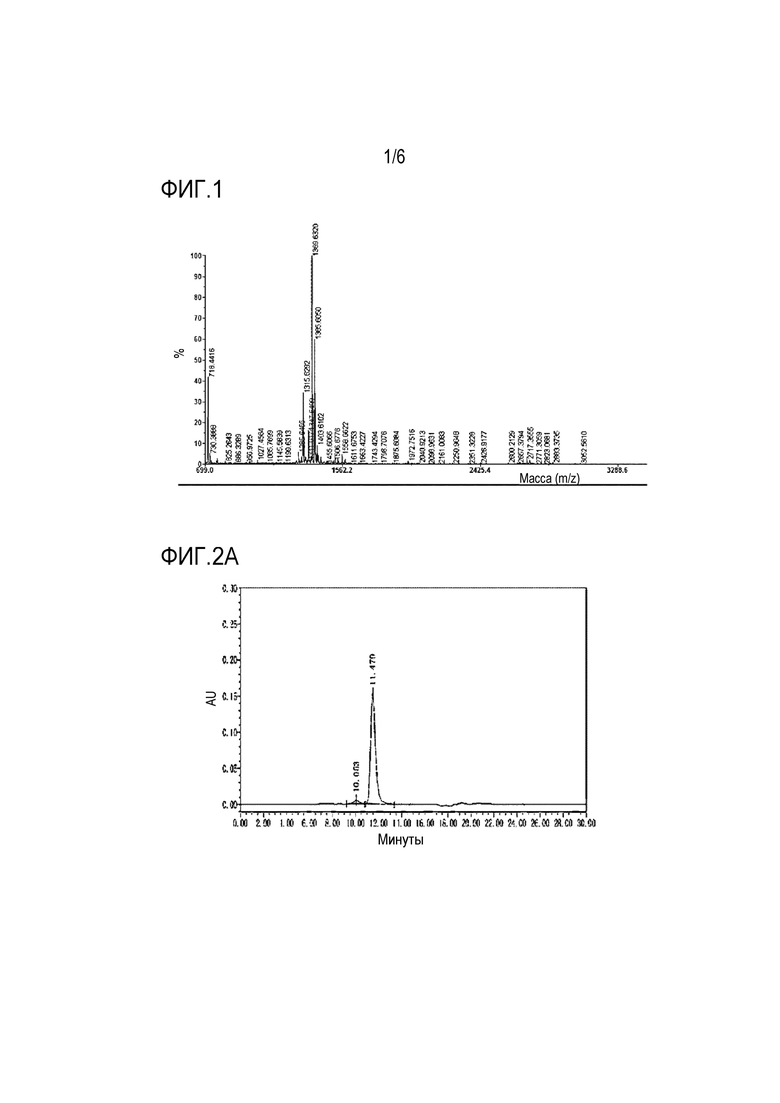
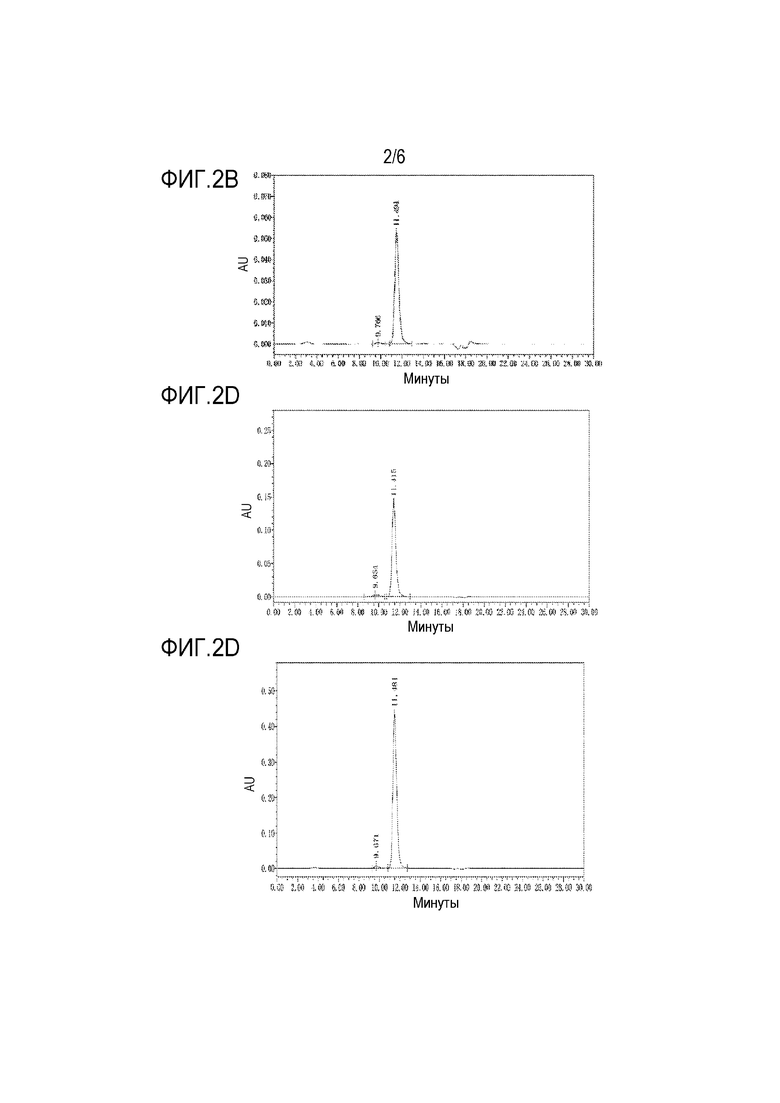
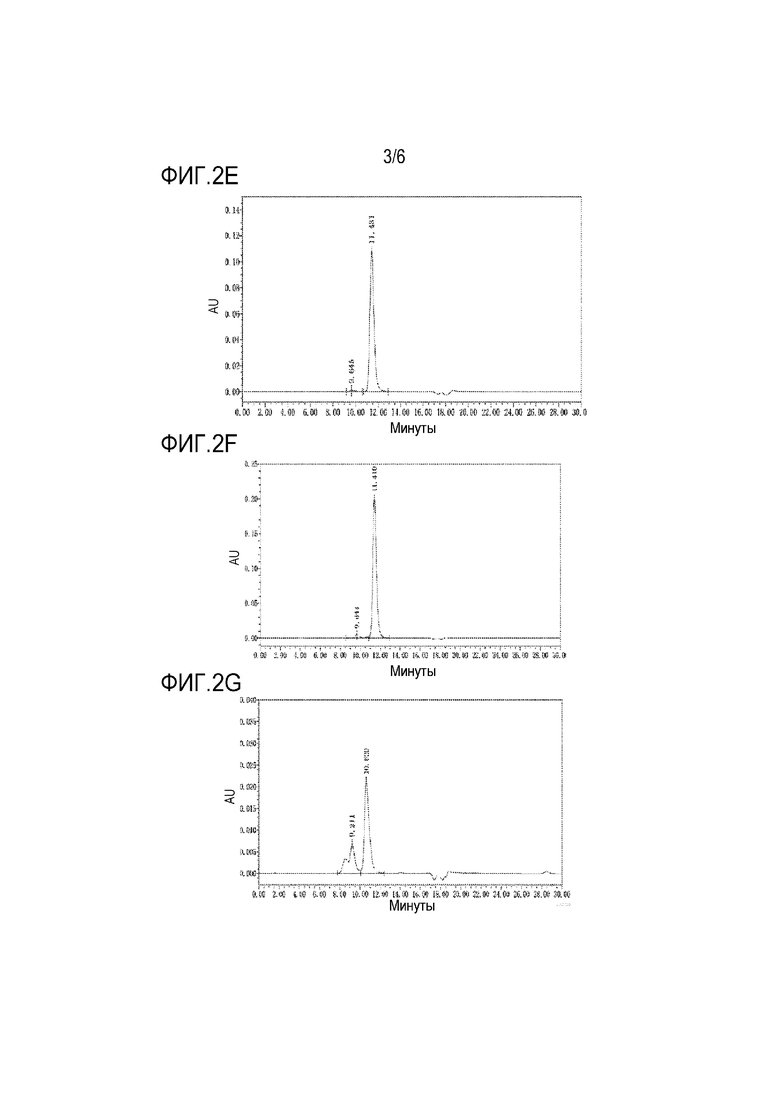
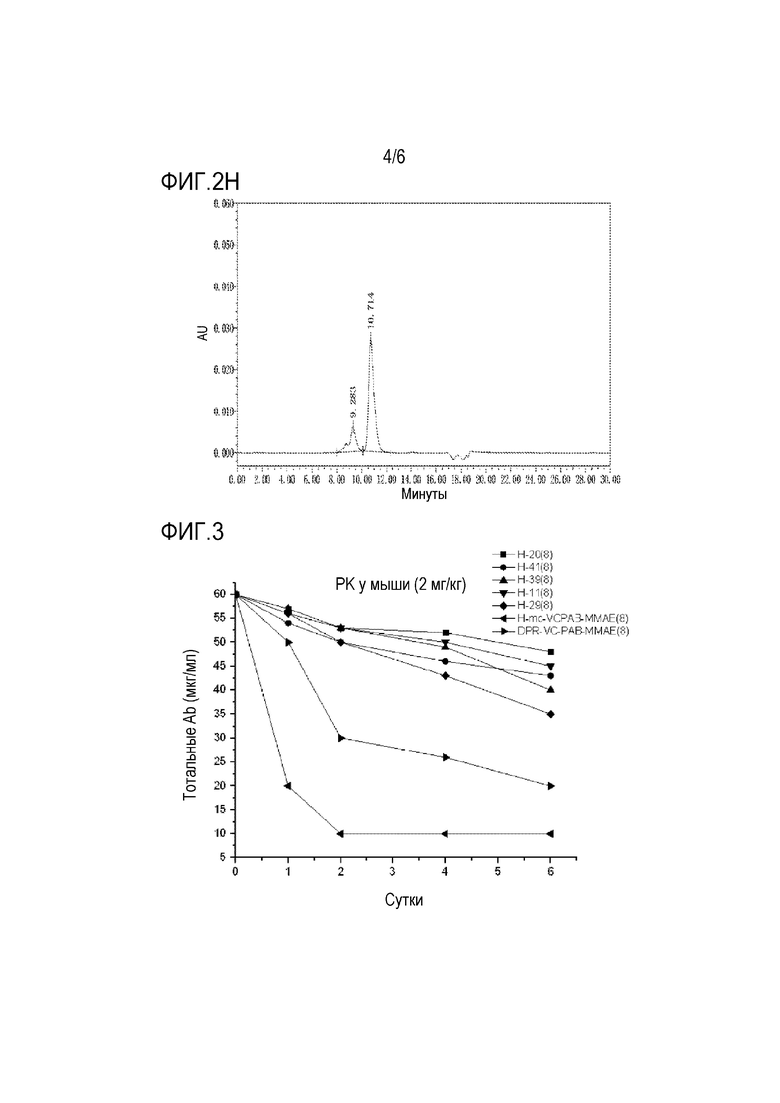
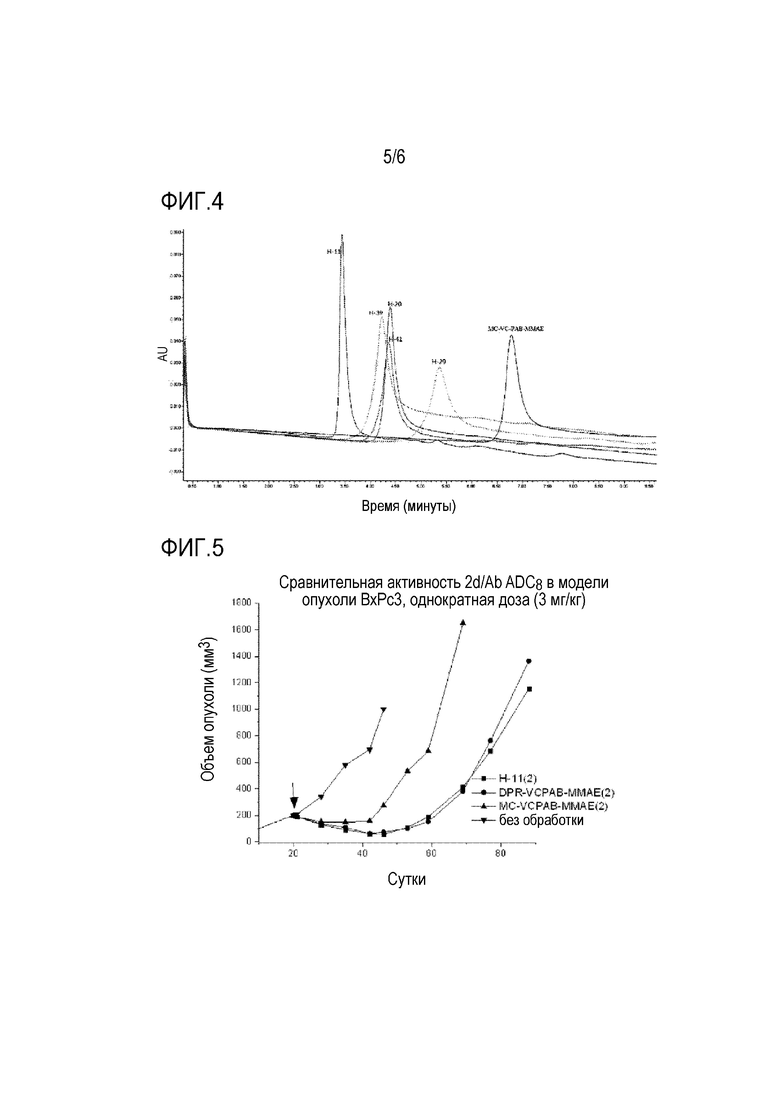
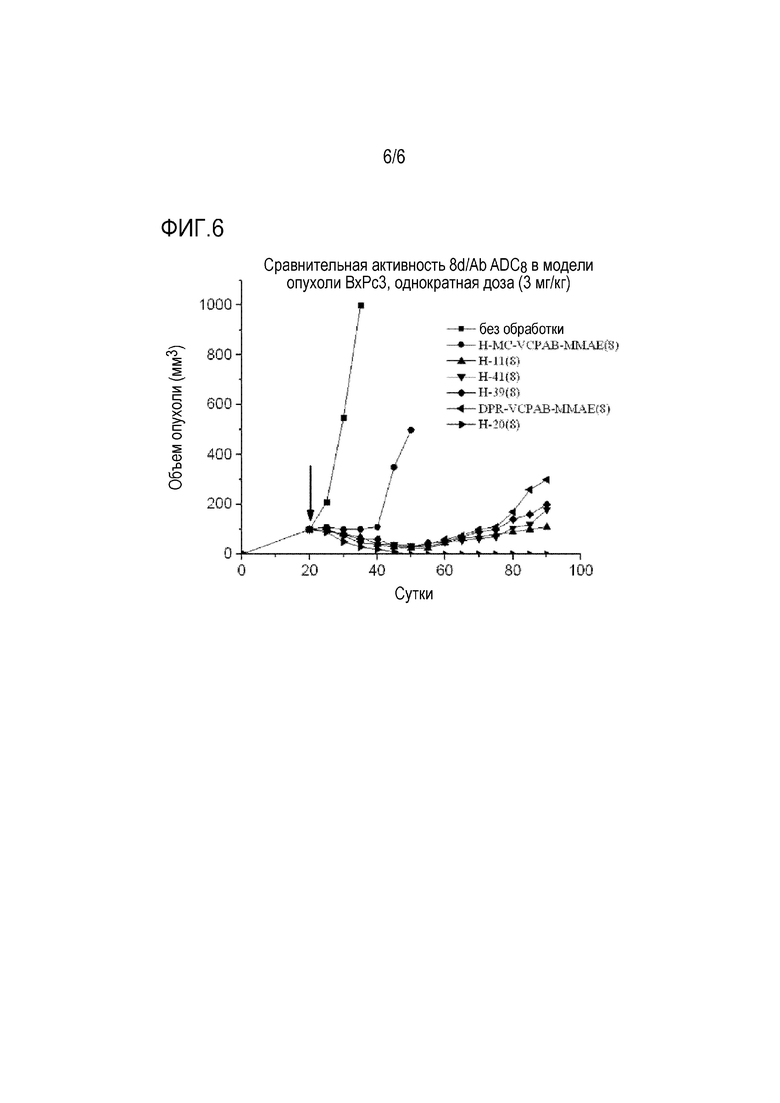
Изобретение относится к конъюгату лекарственного средства, имеющему гидрофильный кислотный стабилизированный участок соединения. По сравнению с конъюгатом, имеющим более низкую нагрузку лекарственным средством, вследствие внесения кислотного стабилизированного участка соединения, конъюгат по настоящему изобретению может иметь более высокую нагрузку лекарственным средством (т.е. каждый заданный реагент имеет больше гидрофильных участков присоединения), имеет желаемые свойства фармакокинетики. 3 н. и 12 з.п. ф-лы, 13 ил., 1 табл., 56 пр.
1. Конъюгат антитело-лекарственное средство или его фармацевтически приемлемая соль, как показано в формуле I:
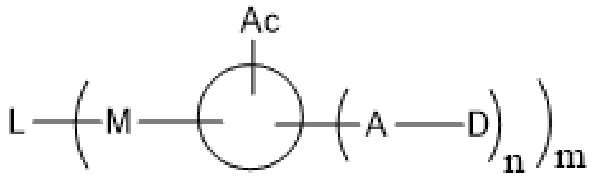 ,
,
I
где:
кольцо соответствует каркасу, где каркас содержит группу C1-8 алкилидена или группу C6-10 арилидена;
L представляет собой антитело, фрагмент антитела или функциональный белок для нацеливания;
M представляет собой сукцинимидную группу или сукцинимидную группу с открытым посредством гидролиза кольцом;
Ac представляет собой фрагмент, состоящий по меньшей мере из одной аминогруппы и по меньшей мере одной кислотной группы, или олигопептидную группу, состоящую из множества аминокислотных звеньев; где Ac соединен с каркасом через аминогруппу;
D представляет собой цитотоксическое лекарственное средство, лекарственное средство для лечения аутоиммунного заболевания или противовоспалительное лекарственное средство;
A представляет собой расщепляемый линкер или нерасщепляемый линкер;
m представляет собой целое число, выбранное из 1-20; и
n равен 1 или 2.
2. Конъюгат антитело-лекарственное средство или его фармацевтически приемлемая соль по п.1, где указанное антитело соответствует антителу к рецептору клеточной поверхности или ассоциированному с опухолью антигену.
3. Конъюгат антитело-лекарственное средство или его фармацевтически приемлемая соль по п.1, где кислотный элемент Ac выбран из группы, состоящей из групп карбоновой кислоты, фосфорной кислоты, фосфористого эфира и сульфоновой кислоты.
4. Конъюгат антитело-лекарственное средство или его фармацевтически приемлемая соль по п.1, где Ac включает кислотную аминокислотную группу или кислотную олигопептидную группу.
5. Конъюгат антитело-лекарственное средство или его фармацевтически приемлемая соль по п.4, где указанная олигопептидная группа включает 2-5 природных аминокислотных элементов, 2-5 неприродных аминокислотных элементов или 2-5 природных и неприродных аминокислотных элементов.
6. Конъюгат антитело-лекарственное средство или его фармацевтически приемлемая соль по п.1, где группа арилидена выбрана из группы, состоящей из фенила, нафтила или дифенила.
7. Конъюгат антитело-лекарственное средство или его фармацевтически приемлемая соль по п.1, где элемент лекарственного средства D выбран из группы, состоящей из лекарственных средств на основе майтанзина, лекарственных средств на основе ауристатина, лекарственных средств на основе бензодипиррола, лекарственных средств на основе пирролозодиазола, соединений аманитина и камптотецина, их фармацевтически приемлемых солей или их производных.
8. Конъюгат антитело-лекарственное средство или его фармацевтически приемлемая соль по п.1, где A имеет структуру, как показано в следующей формуле:
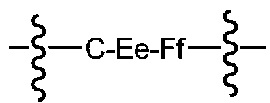 ,
,
где C обозначает удлиняемый элемент на конце, E обозначает расщепляемый элемент, F обозначает спейсерный элемент, каждый из подстрочных e и f независимо представляет собой 0 или 1, волнистая линия слева обозначает участок присоединения к каркасу, и волнистая линия справа обозначает участок присоединения к элементу лекарственного средства.
9. Конъюгат антитело-лекарственное средство или его фармацевтически приемлемая соль по п.8, где E устроен так, чтобы он отщеплялся от элемента лекарственного средства D или спейсерного элемента F ассоциированной с опухолью протеазой или в кислых значениях pH.
10. Конъюгат антитело-лекарственное средство или его фармацевтически приемлемая соль по п.8, где F выбран из группы, состоящей из п-аминобензилового спирта, элементов этилендиамина и их производных.
11. Конъюгат антитело-лекарственное средство или его фармацевтически приемлемая соль по п.6, где каркас включает C1-8 алкилиден.
12. Конъюгат антитело-лекарственное средство или его фармацевтически приемлемая соль по п.11, где каркас включает C1-3 алкилиден.
13. Конъюгат антитело-лекарственное средство или его фармацевтически приемлемая соль по п.1, где Ac выбран из группы, состоящей из (D/L) глицина, (D/L) аланина, (D/L) лейцина, (D/L) изолейцина, (D/L) валина, (D/L) фенилаланина, (D/L) пролина, (D/L) триптофана, (D/L) серина, (D/L) тирозина, (D/L) цистеина, (D/L) метионина, (D/L) аспарагина, (D/L) глутамина, (D/L) треонина, (D/L) аспарагиновой кислоты, (D/L) глутаминовой кислоты или соединений следующих структурных формул:
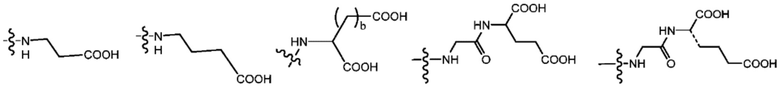
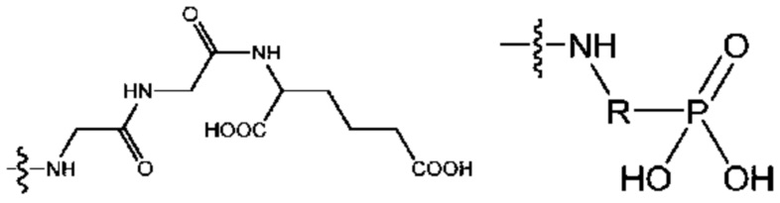 или
или 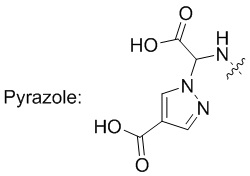
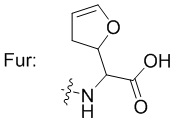 ,
,
где волнистая линия обозначает участок связывания с каркасом и R обозначает любую структуру между аминогруппой и фосфатной группой.
14. Фрагмент соединения с лекарственным средством, имеющий следующую структуру:
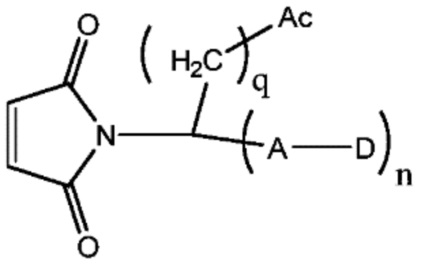 ,
,
где Ac представляет собой фрагмент, состоящий по меньшей мере из одной аминогруппы и по меньшей мере одной кислотной группы, или олигопептидную группу, состоящую из множества аминокислотных звеньев; где Ac соединен с гидрокарбильной группой через аминогруппу;
D представляет собой цитотоксическое лекарственное средство, лекарственное средство для лечения аутоиммунного заболевания или противовоспалительное лекарственное средство;
A представляет расщепляемый линкер или не расщепляемый линкер;
q представляет собой целое число в диапазоне от 1 до 8, и
n равен 1 или 2.
15. Применение конъюгата антитело-лекарственное средство или его фармацевтически приемлемой соли по п.1 для приготовления лекарственного средства для лечения злокачественной опухоли, иммунного заболевания или воспаления.
| WO 2016147031 A2, 22.09.2016 | |||
| EA 201691650 A1, 28.014.2017 | |||
| EA 201490095 A1, 30.05.2014 | |||
| WO 2004010957 A2, 05.02.2004. |
Авторы
Даты
2023-03-29—Публикация
2018-06-15—Подача